Новые циклические углеводородные соединения для лечения заболеваний - RU2524949C2
Код документа: RU2524949C2
Чертежи

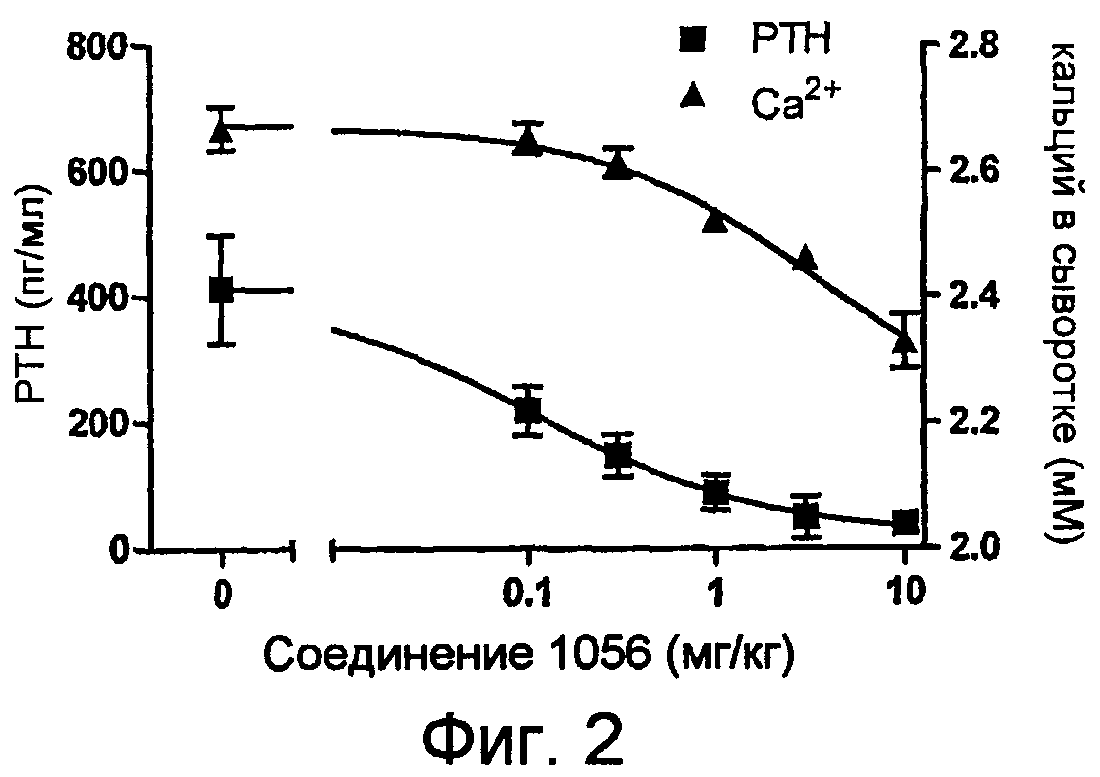


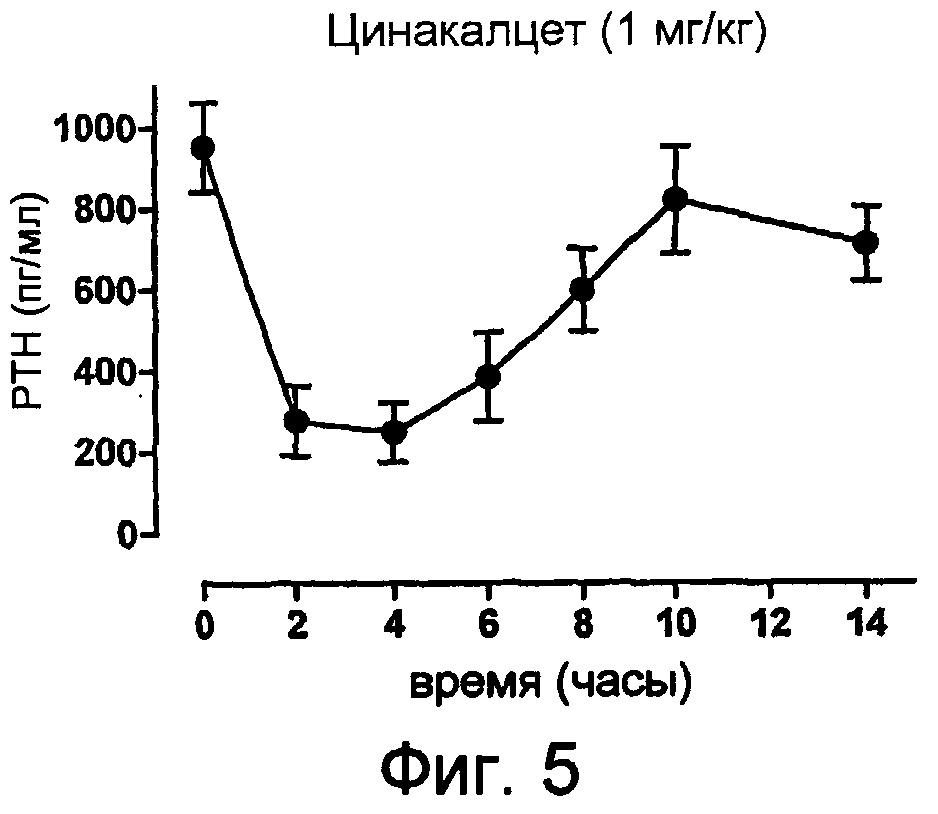
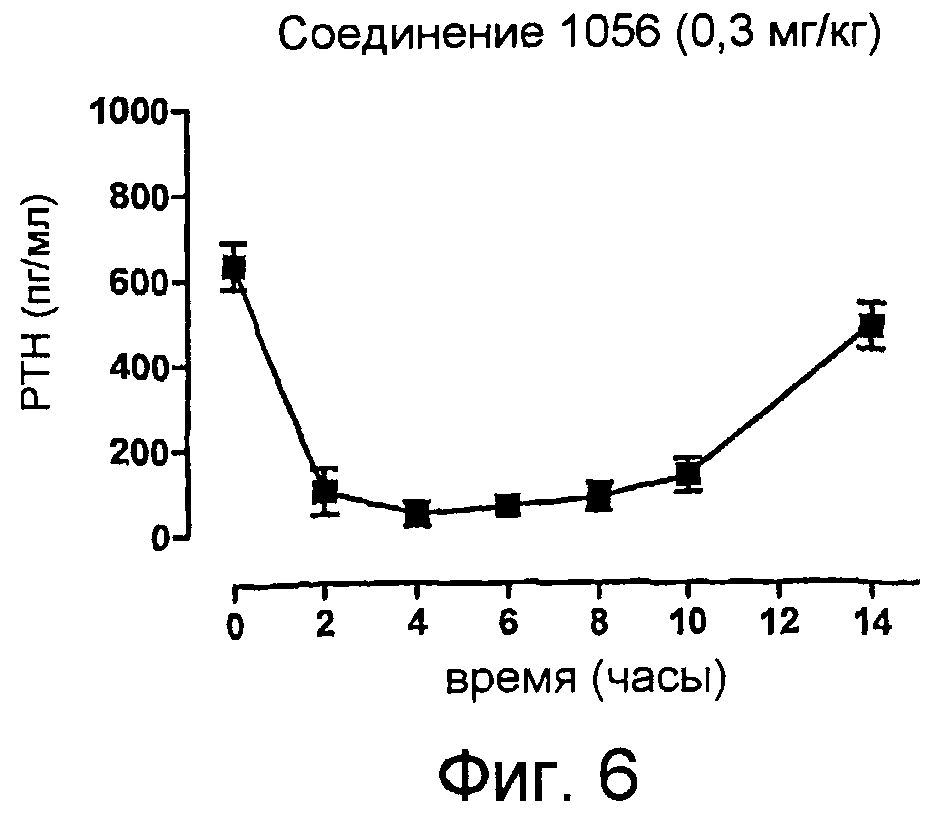
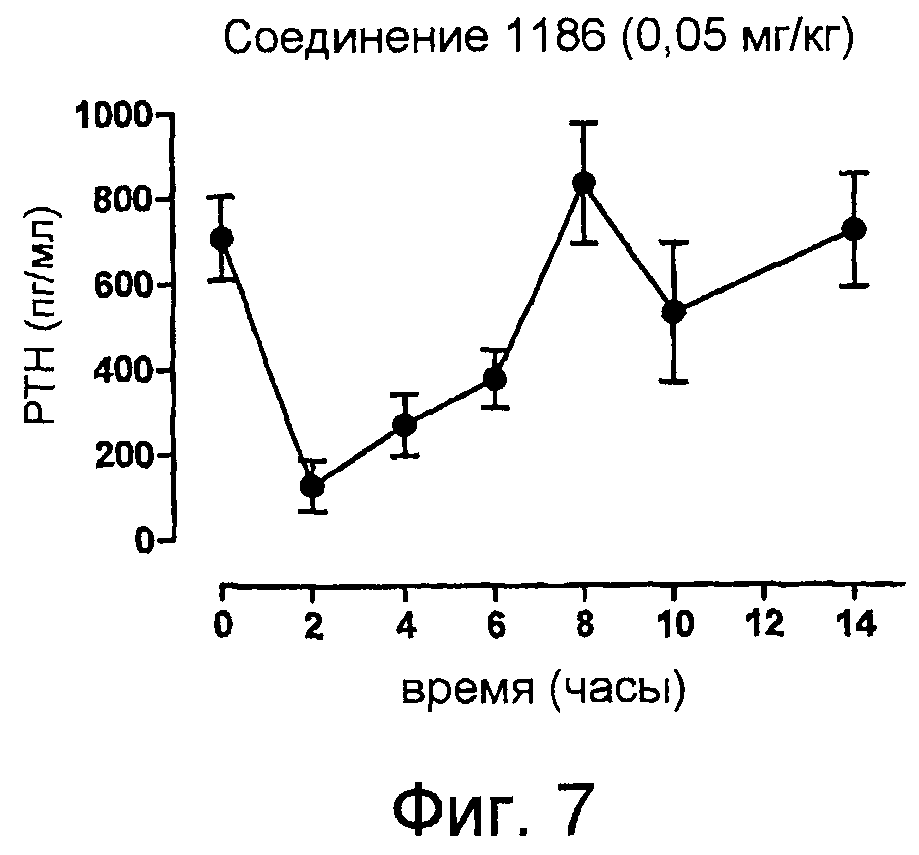

Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым циклическим углеводородным соединениям и их производным, способам их получения, к указанным соединениям для применения в качестве лекарственного средства, к указанным соединениям для применения в терапии, к фармацевтическим композициям, содержащим указанные соединения, к способам лечения заболеваний указанными соединениями и к применению указанных соединений для производства лекарственных средств.
УРОВЕНЬ ТЕХНИКИ
Восприимчивый к кальцию рецептор (CaSR) является связанным с G-белком рецептором (GPCR), который подает сигналы путем активации фосфолипазы C, повышая уровни инозит 1,4,5-трифосфата и цитозольного кальция. CaSR принадлежит к подсемейству C надсемейства GPCR, которое также включает рецепторы глутамата, гамма-аминомасляной кислоты (GABA), феромонов и одорантов, которые все обладают очень большим внеклеточным доменом. Этот домен несет сильный отрицательный заряд и принимает участие в связывании кальция и других положительно заряженных молекул. CaSR обнаружен в околощитовидных железах, но идентифицирован также в головном мозге, кишечнике, гипофизе, щитовидных железах, костной ткани и почках. В околощитовидных железах CaSR активируется при небольшом увеличении внеклеточного ионизированного кальция, который ингибирует высвобождение гормона околощитовидной железы (PTH), находящегося на хранении во внутриклеточных гранулах [Brown, E. M. Calcium-Sensing Receptor. Primer of the Metabolic Bone Diseases and Disorders of Mineral Metabolism, Fifth Edition, 2003 by American Society for Bone and Mineral Research, Chapter 17, p. 111.; Drueke, T. E. Nephrol Dial Transplant (2004) 19, v20-v26].
В дополнение к эндогенным лигандам разработаны малые молекулярные аллостерические активаторы CaSR ("кальцимиметики") [Urena, P.; Frazao, J. M. Calcimimetic agents: Review and perspectives. Kidney International (2003), 63, pp. s91-s96; Soudijn, W. et al. Allosteric modulation of G protein-coupled receptors: perspectives and recent developments. DDT (2004), 9, 752-758].
Сайт связывания известных кальцимиметиков, вероятно, находится в седьмом транс-мембранном домене рецептора [Petrel, C. et al. Journal of Biological Chemistry (2004), 279, 18990-18997].
Кальцимиметики, как уже было показано, являются коммерчески применимыми для лечения гиперпаратиреоза (HPT): Кальцимиметическое соединение Cinacalcet® [Balfour, J. A. B. et al. Drugs (2005) 65(2), 271-281; Linberg et. al. J. Am. Soc. Nephrol (2005), 16, 800-807, Clinical Therapeutics (2005), 27(11), 1725-1751] недавно допущено для лечения вторичного HPT у пациентов с хроническим заболеванием почек при диализе и для лечения первичного HPT у пациентов, страдающих раком околощитовидной железы.
Таким образом, подтверждение концепции активаторов чувствительного к кальцию рецептора (CaSR) у людей получено, и клиническая значимость уже хорошо установлена. При хроническом заболевании почек гипокальциемия является результатом нарушения обращения почечного фосфора и пониженного образования l,25(OH)2-VitD. В ответ усиливается секреция PTH, результатом чего является состояние, называемое как вторичный HPT. Первичный HPT является гиперкальциемическим расстройством, которое происходит из-за избыточной секреции PTH, обычно вызываемой аденомой околощитовидной железы или первичной гиперплазией околощитовидной железы. Другие кальцимиметические соединения были описаны, например, в WO 94/018959, W098/001417, WO05/065050, WO03/099814, WO03/099776, WOOO/21910, WO01/34562, WO01/090069, WO97/41090, US 6001884, WO96/12697, EP1203761, WO95/11221, WO93/04373, EP1281702, WO02/12181, WO04/069793, US 2004242602, WO04/106296 и WO05/115975.
Кальцимиметическая активность соответствует способности производить или вызывать биологические ответные реакции, наблюдаемые через изменения в концентрации внеклеточных ионов кальция (Ca2+)e и внеклеточных ионов магния (Mg2+)e.
Ионы (Caz+)e и (Mg2+)e играют важную роль в организме, так как они регулируют гомеостаз кальция, от которого зависят жизненно важные функции организма. Так, гипо- и гиперкальциемия, то есть состояния, при которых содержание ионов (Ca2+)e ниже или выше средней пороговой величины, оказывают значительное влияние на многие функции, такие как сердечная, почечная или кишечная функции. Они глубоко затрагивают центральную нервную систему [Chattopadhyay et al. Endocr. Review, (1998)].
Рецепторы CaSR являются белками, которые чувствительны к ионам (Ca2+)e и (Mg2+)e, и присутствуют в околощитовидной и щитовидной железах, почках, кишечнике, легких, костных клетках, головном мозге, спинном мозге, гипофизе, желудке и кератиноцитах [Brown et al., Nature, (1993); Ruat et al., Proc. Natl. Acad. Sci., USA, (1995); Brown et al., Ann. Rev, Med., (1998)]. Эти белки кодируются одним геном, выделенным из различных видов животных. Они принадлежат к семейству связанных с G-белком рецепторов с семью транс-мембранными доменами и обнаруживают структурные гомологии с метаботропными глутаматными рецепторами, GABA рецепторами и гипотетическими феромоновыми и вкусовыми рецепторами. Активирующие или ингибирующие мутации генов у людей ответственны за чрезвычайно серьезные генетические заболевания, которые вызывают гипокальциемию или гиперкальциемию [Pollack et al., Cell, (1993); Pollack et al., Nature Genetic, (1994); Brown et al., Ann. Rev. Med., (1998)]. Функции, связанные с экспрессией указанных белков в тканях, еще не все известны и являются предметом значительной исследовательской деятельности, особенно в отношении рецепторов CaSR, присутствующих в околощитовидных и щитовидных железах, почках, кишечнике, спинном мозге, головном мозге и костных клетках.
В околощитовидной железе рецепторы CaSR модулируют секрецию паратироидного гормона (PTH), который является главным регулятором гомеостаза кальция: увеличение содержания ионов (Ca2+)e в сыворотке будет активировать рецепторы CaSR, присутствующие на клетках околощитовидной железы, и снижать секрецию гормона PTH.
Комплементарная ДНК, кодирующая крысиный CaSR, выделена из библиотеки крысиной стриарной кДНК [Ruat et al., Proc. Natl. Acad. Sci., (1995)]. Этот рецептор идентичен, в смысле его аминокислотной последовательности, рецепторам, экспрессированным в других тканях. Подвергнутые трансфекции клетки яичника китайского хомячка (CHO), экспрессирующие крысиный CaSR (CHO(CaSR)), были охарактеризованы, и химические сигналы (вторичные мессенджеры), индуцируемые активацией указанного рецептора, были проанализированы. Так, был разработан биохимический тест для измерения аккумулирования меченных тритием инозит фосфатов, [3H]IP, в ответ на активацию рецептора [Ruat et al., J. Biol. Chem., (1996); Ferry et al., Biochem. Biophys. Res. Common., (1997)].
Было показано, что ионы Ca2+ и Mg2+, а также ионы Ba2+ в пределах миллимолярных концентраций стимулируют рецепторы CaSR. Активация рецепторов CaSR могла бы быть индуцирована в головном мозге β-амилоидными пептидами, которые вовлекаются в нейродегенеративные заболевания, такие как болезнь Альцгеймера [Ye et al., J. Neurosci. Res. (1997)].
Нарушение активности CaSR связано с биологическими расстройствами, такими как первичный и вторичный гиперпаратиреоз, остеопороз, сердечно-сосудистые, желудочно-кишечные, эндокринные и нейродегенеративные заболевания или некоторые виды злокачественных новообразований, при которых содержание ионов (Ca2+)e является аномально высоким.
Вторичный гиперпаратиреоз наблюдается при хронической почечной недостаточности и характеризуется гиперплазией околощитовидных желез и повышением содержания циркулирующего PTH. Почечная недостаточность сопровождается также почечной остеодистрофией, например, фиброзным генерализованным оститом, остеомаляцией, адинамическим костным заболеванием или остеопорозом. Расстройства характеризуются или высоким, или низким обновлением костной ткани.
Остеопороз является многофакторным заболеванием, которое зависит, в частности, от возраста и пола. Очень сильно затрагивая менопаузальных женщин, остеопороз становится все возрастающей проблемой для пожилых мужчин, и на данный момент не существует действительно удовлетворительных способов лечения. Его социальная значимость может становиться даже тяжелее с годами, особенно в нашем европейском обществе, где предполагаемая продолжительность жизни становится больше. Остеопороз в настоящее время лечат эстрогенами, кальцитонином или бифосфонатами, которые предотвращают резорбцию кости без стимуляции роста кости. Более поздние данные демонстрируют, что периодические увеличения содержания PTH или его производных эффективны при лечении остеопороза и делают возможным воссоздание кости путем стимуляции образования кости [Whitfield et al., Drugs & Aging, (1999), Whitfield et al., Calc. Tissue Int., (1999)]. Этот новый терапевтический подход к лечению остеопороза выглядит весьма привлекательным, хотя большие проблемы связаны с применением гормона PTH, такие как введение путем инъекции, а также появление опухолей, наблюдаемое в последнее время при широких клинических исследованиях у людей. Периодическая секреция эндогенного PTH может быть достигнута блокированием чувствительного к кальцию рецептора. Блокирование секреции PTH агонистами CaSR может сопровождаться быстрым возрастанием уровня PTH (эффект отдачи), который является впоследствии полезным при лечении остеопороза.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к новым циклическим углеводородным соединениям, имеющим эффекты модулирования чувствительного к кальцию рецептора (CaSR). Неожиданно было обнаружено, что циклические углеводородные соединения по данному изобретению являются модуляторами, например, активаторами или агонистами, чувствительного к кальцию рецептора человека (CaSR) и поэтому могут быть применимы при лечении или профилактике некоторых заболеваний или физиологических расстройств с вовлечением модуляции активности CaSR.
Циклические углеводородные соединения по данному изобретению могут, например, быть применимыми при лечении осложнений, связанных с хроническим почечным заболеванием, таким как гиперпаратиреоз, например, первичный и/или вторичный гиперпаратиреоз или третичный гиперпаратиреоз. Другие осложнения, связанные с хроническим почечнымй заболеванием, анемия, сердечно-сосудистые болезни, связанная с подоцитами дисфункция, такая как протеинурия, атрофия почечных канальцев или подоцитопения, и соединения по данному изобретению, как считают, также оказывают полезное действие при указанных заболеваниях. Циклические углеводородные соединения по данному изобретению к тому же могут быть применимы для промотирования остеогенеза и лечения или профилактики остеопороза, такого как индуцированный стероидами, сенильный и пост-климактерический остеопороз, остеомаляции и родственных нарушений костной ткани или для предотвращения потери костной массы после трансплантации почки или при спасательной операции удаления околощитовидных желез.
В настоящее время считают, что циклические углеводородные соединения по данному изобретению могут иметь полезные фармакокинетические или фармакодинамические свойства, такие как биодоступность при пероральном введении, по сравнению с известными структурно родственными соединениями.
Соответственно, данное изобретение относится к соединению общей формулы I
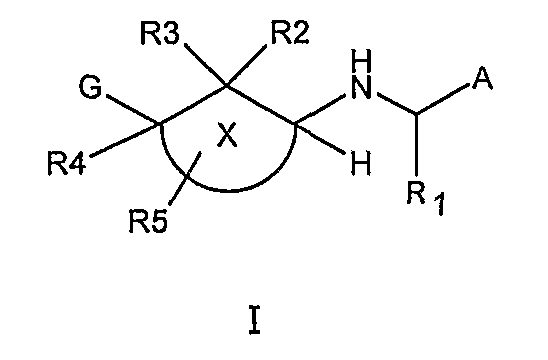
где группа
A представляет С1-10 гетероарил, С6-14 арил или C6-10гетероциклоалкиларил,каждый из которых необязательно замещен одним или несколькими, одинаковыми или разными заместителями, такими как галоген, гидрокси, меркапто, трифторметил, циано, карбокси, -NH2, -C(О)MHZ, нитро, оксо, -S(О)2NH2, C1-4алкил, C2-4алкенил, C2-4алкинил, C1-4гидроксиалкил, C1-6галогеналкил, C1-4алкокси, C1-4 алкоксикарбонил, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-4алкоксикарбамоил, C1-4аминокарбонил, C1-4алкилтио, C3-8циклоалкил, C3-8циклоалкенил, C1-6амино, иминометил, C1-4аминосульфонил, C1-4аминокарбонилокси, C1-4алкилсульфониламино, гидроксииминометил, C1-4алкилкарбониламино, C1-4алкилсульфонил, C1-6гетероциклоалкил, C1-6гетероциклоалкенил, C1-10гетероарил или C6-14арил,
где указанные C1-4алкил, C2-4алкенил, C2-4алкинил, C1-4гидроксиалкил, C1-6галогеналкил, C1-4алкокси, C1-4алкоксикарбонил, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-4алкоксикарбамоил, C1-4аминокарбонил, C1-4алкилтио, C3-6 циклоалкил, C3-6циклоалкенил, C1-6амино, иминометил, C1-4аминосульфонил, C1-4аминокарбонилокси, C1-4алкилсульфониламино, гидроксииминометил, C1-4алкилкарбониламино, C1-4алкилсульфонил, C1-6гетероциклоалкил, C1-6гетероциклоалкенил, C1-10гетероарил или C6-14арил
необязательно дополнительно замещены одним или несколькими, одинаковыми или разными заместителями, выбранными из галогена, гидрокси, -NH2, меркапто, трифторметила, циано, карбокси, -C(О)NH2, нитро, оксо, -S(О)2NH2, C1-4алкила, C1-6галогеналкила, C1-3алкокси или C1-3гидроксиалкила;
R1 представляет C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гидроксиалкил, C1-6галогеналкил, C1-6алкиламино, C3-6циклоалкил или C1-6гетероциклоалкил,
каждый из которых необязательно замещен одним или несколькими, одинаковыми или разными заместителями, выбранными из галогена, гидрокси, меркапто, трифторметила, циано, карбокси, NH2, -C(O)NH2, нитро, оксо, C1-3алкила, C2-4алкенила, C1-3гидроксиалкила, C1-3галогеналкила, C1-4алкокси, C1-4алкоксикарбонила или C1-4амино;
R2и R3 независимо друг от друга представляют водород, циано, галоген, карбокси, -C(O)NH2, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гидроксиалкил, C1-6галогеналкил, аминоС1-6алкил, C3-6циклоалкил, C1-6гетероциклоалкил, C1-6алкокси, C1-6аминокарбонил, C6-10арилоксикарбонил, C1-6амино, C6-10ариламино, C1-4алкоксикарбониламино, C1-4алкилкарбониламино, C2-4алкенилкарбониламино, c3-6циклоалкилкарбониламино или C1-6гетероциклоалкилкарбониламино,
где указанные -C(O)NH2, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гидроксиалкил, C1-6галогеналкил, аминоC1-6алкил, C3-6циклоалкил, C1-6гетероциклоалкил, C1-6алкокси, C1-6аминокарбонил, C6-10арилоксикарбонил, C1-6амино, C6-10ариламино, C1-4алкоксикарбониламино, C1-4алкилкарбониламино, C2-4алкенилкарбониламино, C3-6циклоалкилкарбониламино или C1-6гетероциклоалкилкарбониламино
являются необязательно замещенными одним или несколькими, одинаковыми или разными заместителями, представленными такими, как галоген, гидрокси, меркапто, трифторметил, циано, карбокси, -NH2, -C(O)NH2, нитро, C1-3алкил, C2-4алкенил, C1-3гидроксиалкил, C1-3галогеналкил, C1-4алкокси, C1-4алкоксикарбонил или C1-4амино;
R4 представляет водород, галоген, гидрокси, карбокси, -NH2, -C(О)NH2, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гидроксиалкил, C1-6галогеналкил, аминоC1-6алкил, C3-6циклоалкил, C1-6гетероциклоалкил, C1-6алкокси, C1-6алкоксикарбонил, C1-6аминокарбонил, C6-10арилоксикарбонил, C1-10гетероарилоксикарбонил, C1-6амино, C6-10ариламино, C1-10гетероариламино, C6-10арилC1-6амино, C1-4алкоксикарбониламино, C1-4алкилкарбониламино, C2-4алкенилкарбониламино, C3-6циклоалкилкарбониламино или C1-6гетероциклоалкилкарбониламино,
где указанные -C(O)NH2, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гидроксиалкил, C1-6галогеналкил, аминоC1-6алкил, C3-6циклоалкил, C1-6гетероциклоалкил, C1-6алкокси, C1-6алкоксикарбонил, C1-6аминокарбонил, C6-10арилоксикарбонил, C1-10гетероарилоксикарбонил, C1-6амино, C6-10ариламино, C1-10гетероариламино, C6-10арилC1-6амино, C1-4алкоксикарбониламино, C1-4алкилкарбониламино, C2-4алкенилкарбониламино, C3-6циклоалкилкарбониламино или C1-6гетероциклоалкилкарбониламино
являются необязательно замещенными одним или несколькими, одинаковыми или разными заместителями, представленными галогеном, гидрокси, меркапто, трифторметилом, циано, карбокси, -NH2, гидроксииминометилом, -C(O)NH2, нитро, C1-3алкилом, C2-4алкенилом, C1-3гидроксиалкилом, C1-3галогеналкилом, C1-4алкокси, C1-4алкоксикарбонилом или C1-4амино;
каждый R5 представляет независимо один или несколько одинаковых или разных заместителей, представленных такими, как водород, галоген, гидрокси, карбокси, -NH2, -C(O)NH2, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гидроксиалкил, C1-6галогеналкил, C3-6циклоалкил, C1-6гетероциклоалкил, C1-6алкокси, C1-4алкоксикарбонил, C1-6аминокарбонил, C6-10арилоксикарбонил, C1-10гетероарилоксикарбонил, C1-6амино, C6-10арил, C6-10ариламино, C1-10гетероариламино, C6-10арилкарбониламино, C1-4алкоксикарбониламино, C6-10арилсульфониламино, C1-4алкилкарбониламино, C2-4алкенилкарбониламино, C3-6циклоалкилкарбониламино или C1-6гетероциклоалкилкарбониламино,
где указанные C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гидроксиалкил, C1-6галогеналкил, C3-6циклоалкил, C1-6гетероциклоалкил, C1-6алкокси, C1-4алкоксикарбонил, C1-6аминокарбонил, C6-10арилоксикарбонил, C1-10гетероарилоксикарбонил, C1-6амино, C6-10арил, C6-10ариламино, C1-10гетероариламино, C6-10арилкарбониламино, C1-4алкоксикарбониламино, C6-10арилсульфониламино, C1-4алкилкарбониламино, C2-4алкенилкарбониламино, C3-6циклоалкилкарбониламино или C1-6гетероциклоалкилкарбониламино
являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями, выбранными из галогена, гидрокси, меркапто, циано, трифторметила, карбокси, -NH2, -C(O)NH2, нитро, оксо, C1-3алкила, C2-4алкенила, C1-3гидроксиалкила, C1-3галогеналкила, C1-4алкокси, C1-4алкоксикарбонила, иминометила или гидроксииминометила;
G представляет водород, -C(О)H, -C(О)NH2, -О-C(О)NH2, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гидроксиалкил, C1-6галогеналкил, C1-6амино, C3-8циклоалкил, C1-6гетероциклоалкил, C1-6гетероциклоалкенил, C3-8циклоалкенил, C6-14арил, C1-10гетероарил, C6-10ариламино, гидроксиаминокарбонил, C6-10ариламинокарбонил, C1-4аминокарбонил, C1-6гетероциклоалкилкарбонил, C1-10гетероариламинокарбонил, C6-10арилсульфониламинокарбонил, C6-14арилокси, C1-10гетероарилокси, C1-4алкокси, C1-4алкоксикарбонил, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-6аминокарбонилокси, C1-10гетероариламино, C1-3алкилкарбониламино, C6-10арилкарбониламино, C3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино, C1-6гетероциклоалкилкарбониламино или уреидо,
где указанные -C(О)H, -C(О)NH2, -О-C(О)NH2, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6гидроксиалкил, C1-6галогеналкил, C1-6амино, C3-8циклоалкил, C1-6гетероциклоалкил, C1-6гетероциклоалкенил, C3-8циклоалкенил, C6-14арил, C1-10гетероарил, C6-10ариламино, гидроксиаминокарбонил, C6-10ариламинокарбонил, C1-4аминокарбонил, C1-6гетероциклоалкилкарбонил, C1-10гетероариламинокарбонил, C6-10арилсульфониламинокарбонил, C6-14арилокси, C1-10гетероарилокси, C1-4алкокси, C1-4алкоксикарбонил, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-6аминокарбонилокси, C1-10гетероариламино, C1-3алкилкарбониламино, C6-10арилкарбониламино, C3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино, C1-6гетероциклоалкилкарбониламино или уреидо
являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями, представленными такими, как галоген, циано, карбокси, -NH2, C1-6амино, иминометил, гидроксииминометил, амидино, гидрокси, меркапто, -C(O)H, -C(O)NH2, нитро, оксо, трифторметил, C1-6алкил, C2-4алкенил, C2-4алкинил, C1-4гидроксиалкил, аминоC1-3алкил, C1-6галогеналкил, C1-4алкокси, C1-4алкоксикарбонил, C1-4алкилкарбонил, C1-4аминокарбонил, гидроксиаминокарбонил, C3-6циклоалкиламинокарбонил, C1-6гетероциклоалкиламинокарбонил, C3-6циклоалкил, C3-6циклоалкенил, C1-6циклоалкиламино, C1-6гетероциклоалкил, C1-6гетероциклоалкенил, C1-6гетероциклоалкилкарбонил, C6-14арил, карбоксиC6-10арил, C1-6гетероарил, C1-6гетероариламинокарбонил, -S(O)2NH2, C1-6уреидо, C1-6тиоуреидо, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-6гетероциклоалкилокси, C1-4алкилтио, C1-4аминосульфонил, C1-4аминокарбонилокси, C1-4алкилсульфониламино, C6-10ариламино, C6-10ариламинокарбонил, C6-10арилоксикарбонил, C1-4алкоксикарбамоил, C6-10арилкарбониламино, C6-10арилсульфониламино, C1-4алкилкарбониламино, C1-4алкенилкарбониламино, C3-6циклоалкенилкарбониламино, C3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино, C1-6гетероциклоалкилкарбониламино, C1-4алкилсульфонил, C1-6гетероциклоалкилсульфонил или C1-3алкилсульфониламинокарбонил,
где указанные карбокси, C1-6амино, иминометил, гидроксииминометил, -C(O)NH2, C1-6алкил, C2-4алкенил, C2-4алкинил, C1-4гидроксиалкил, аминоC1-3алкил, C1-6галогеналкил, C1-4алкокси, C1-4алкоксикарбонил, C1-4алкилкарбонил, C1-4аминокарбонил, гидроксиаминокарбонил, C3-6циклоалкиламинокарбонил, C1-6гетероциклоалкиламинокарбонил, C3-6циклоалкил, C3-6циклоалкенил, C1-6циклоалкиламино, C1-6гетероциклоалкил, C1-6гетероциклоалкенил, C1-6гетероциклоалкилкарбонил, C6-14арил, карбоксиC6-10арил, C1-6гетероарил, C1-6гетероариламинокарбонил, -S(O)2NH2, C1-6уреидо, C1-6тиоуреидо, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-6гетероциклоалкилокси, C1-4алкилтио, C1-4аминосульфонил, C1-4аминокарбонилокси, C1-4алкилсульфониламино, C6-10ариламино, C6-10ариламинокарбонил, C6-10арилоксикарбонил, C1-4алкоксикарбамоил, C6-10арилкарбониламино, C6-10арилсульфониламино, C1-4алкилкарбониламино, C1-4алкенилкарбониламино, C3-6циклоалкенилкарбониламино, C3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино, C1-6гетероциклоалкилкарбониламино, C1-4алкилсульфонил, C1-6гетероциклоалкилсульфонил или C1-3алкилсульфониламинокарбонил,
являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями, выбранными из таких, как гидрокси, -NH2, C1-6амино, иминометил, гидроксииминометил, карбокси, трифторметил, галоген, оксо, меркапто, циано, -C(О)NH2, нитро, C1-6алкил, C2-4алкенил, C2-4алкинил, C1-4гидроксиалкил, C1-6галогеналкил, C1-3алкокси, C1-4алкоксикарбонил, C1-4алкилкарбонил, C3-8циклоалкил, C3-8циклоалкенил, C1-6гетероциклоалкил, C6-12арил, C1-10гетероарил, C1-3алкоксиC6-10арил, C1-10гетероциклоалкиларил, C1-6гетероциклоалкенил, -S(О)2NH2, -S(O)2OH, -S(О)2CH3, C1-6уреидо, C1-6тиоуреидо, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-4алкоксикарбамоил, C1-4аминокарбонил, C1-6гетероциклоалкилкарбонил, C1-4алкилтио, C1-4аминосульфонил, C1-4аминокарбонилокси, C1-4алкилсульфониламино, C6-14арилсульфонил, C6-10арилсульфониламино, гидроксииминометил, C1-4алкилкарбониламино или C1-4алкилсульфонил,
где указанные -C(О)NH2, C1-6амино, C1-6алкил, C2-4алкенил, C2-4алкинил, C1-4гидроксиалкил, C1-6галогеналкил, C1-3алкокси, C1-4алкоксикарбонил, C3-8циклоалкил, C3-8циклоалкенил, C1-6гетероциклоалкил, C6-12арил, C1-10гетероарил, C1-3алкоксиC6-10арил, C1-10гетероциклоалкиларил, C1-6гетероциклоалкенил, -S(О)2NH2, -S(O)2OH, C1-6уреидо, C1-6тиоуреидо, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-4алкоксикарбамоил, C1-4аминокарбонил, C1-6гетероциклоалкилкарбонил, C1-4алкилтио, C1-4аминосульфонил, C1-4аминокарбонилокси, C1-4алкилсульфониламино, C6-14арилсульфонил, C6-10арилсульфониламино, гидроксииминометил, C1-4алкилкарбониламино или C1-4алкилсульфонил
являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями, выбранными из таких, как гидрокси, оксо, циано, галоген, трифторметил, C1-3алкокси, C1-3алкоксиC1-3алкокси, C1-6амино, меркапто, карбокси, -C(О)NH2, нитро, C1-6алкил, C1-3гидроксиалкил, C1-4алкоксикарбонил, C1-3алкилкарбониламино, C1-6гетероциклоалкил, C6-12арил, C1-6гетероарил, -S(O)2NH2или -S(О)2OH;
или G вместе с R4 образует оксогруппу;
при условии, что соединение не является таким, как
N-циклопентил-α-метилбензолметанамин,
N-циклогексил-α-метилбензолметанамин,
3-[3-[(1-фенилэтил)амино]циклогексил]фенол,
2-[3-[3-[(1-фенилэтил)амино]циклогексил]фенокси]этиловый сложный эфир уксусной кислоты,
N-[3-(3-метоксифенил)циклогексил]-α-метил-2-нафталинметанамин,
N-[3-(3-метоксифенил)циклогексил]-α-метилбензолметанамин,
N-циклогексил-α-метил-1-нафталинметанамин,
3-метокси-α-метил-N-(2-фенилциклогексил)бензолметанамин,
3-метокси-α-метил-N-(3-фенилциклогексил)бензолметанамин,
3-метокси-α-метил-N-(4-фенилциклогексил)бензолметанамин,
4-хлор-N-циклогексил-α-метилбензолметанамин,
N-(1-фенилэтил)циклогептанамин,
или его фармацевтически приемлемой соли, сольвату или in vivoгидролизуемому сложному эфиру.
В другом аспекте данное изобретение относится к соединению формулы I, которое описано здесь, для применения в качестве лекарственного средства в терапии.
В еще одном аспекте данное изобретение относится к соединению формулы I, которое описано здесь, или такому соединению, как
N-циклопентил-α-метилбензолметанамин,
N-циклогексил-α-метилбензолметанамин,
3-[3-[(1-фенилэтил)амино]циклогексил]фенол,
2-[3-[3-[(1-фенилэтил)амино]циклогексил]фенокси], этиловый сложный эфир, уксусная кислота,
N-[3-(3-метоксифенил)циклогексил]-α-метил-2-нафталинметанамин,
N-[3-(3-метоксифенил)циклогексил]-α-метилбензолметанамин,
N-циклогексил-α-метил-1-нафталинметанамин,
4-хлор-N-циклогексил-α-метилбензолметанамин или
N-(1-фенилэтил)циклогептанамин,
для применения при лечении, облегчении или профилактике физиологических расстройств или заболеваний, связанных с нарушениями активности CaSR, таких как гиперпаратиреоз.
В дополнительном аспекте изобретение относится к применению соединения общей формулы I, которое описано здесь, или такого соединения, как
N-циклопентил-α-метилбензолметанамин,
N-циклогексил-α-метилбензолметанамин,
3-[3-[(1-фенилэтил)амино]циклогексил]фенол,
2-[3-[3-[(1-фенилэтил)амино]циклогексил]фенокси], этиловый сложный эфир, уксусная кислота,
N-[3-(3-метоксифенил)циклогексил]-α-метил-2-нафталинметанамин,
N-[3-(3-метоксифенил)циклогексил]-α-метилбензолметанамин,
N-циклогексил-α-метил-1-нафталинметанамин,
4-хлор-N-циклогексил-α-метилбензолметанамин или
N-(1-фенилэтил)циклогептанамин,
для производства лекарственного средства для профилактики, лечения или облегчения физиологических расстройств или заболеваний, связанных с нарушениями активности CaSR, таких как гиперпаратиреоз.
В еще одном аспекте изобретение относится к фармацевтической композиции, содержащей соединение формулы I, которое описано здесь, или его фармацевтически приемлемую соль, сольват или гидролизуемый in vivo сложный эфир вместе с фармацевтически приемлемым эксципиентом или носителем.
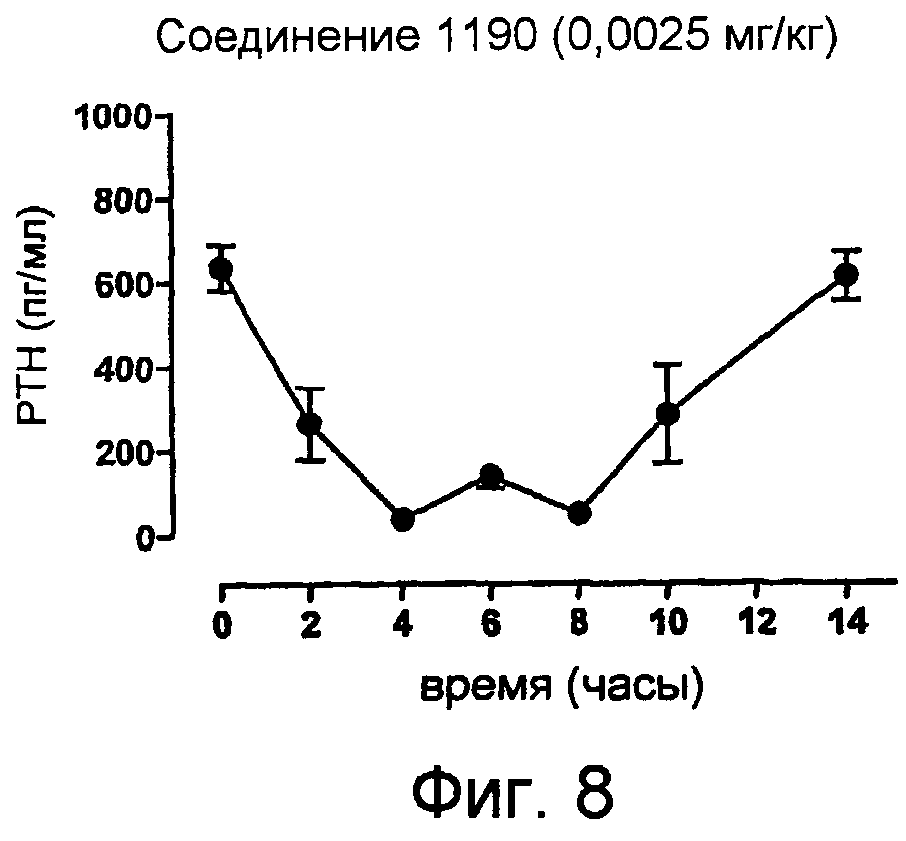
В еще одном аспекте изобретение относится к способу профилактики, лечения или облегчения карциномы околощитовидной железы, аденомы околощитовидной железы, первичной гиперплазии околощитовидной железы, сердечной, почечной или кишечной дисфункций, заболеваний центральной нервной системы, хронической почечной недостаточности, хронического заболевания почек, первичного гиперпаратиреоза, вторичного гиперпаратиреоза, третичного гиперпаратиреоза, анемии, сердечно-сосудистых заболеваний, фиброзного генерализованного остита, адинамического заболевания кости, остеопороза, вызванного стероидом остеопороза, сенильного остеопороза, пост-климактерического остеопороза, остеомаляции и родственных костных нарушений, потери костной массы после трансплантации почки, желудочно-кишечных заболеваний, эндокринных и нейродегенеративных заболеваний, рака, болезни Альцгеймера, гиперкальциемии или заболевания костей, связанные с заболеванием почек, включающему введение пациенту, нуждающемуся в этом, эффективного количества соединения общей формулы I, которое описано здесь, необязательно в сочетании или с добавлением активного стерина витамина-D или производного витамина-D, такого как 1-α-гидроксихолекальциферол, эргокальциферол, холекальциферол, 25-гидроксихолекальциферол, 1-α-25-дигидроксихолекальциферол, или в сочетании или с добавлением фосфатных связующих, эстрогенов, кальцитонина или бифосфонатов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Термин "циклоалкил" предназначается для обозначения насыщенного циклоалканового радикала, содержащего 3-8 атомов углерода, например 4-7 или 3-6 атомов углерода, например 4-6 или предпочтительно 5-6 атомов углерода, такого как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
Термин

Термин "циклоалкенил" предназначается для обозначения моно- или ди-ненасыщенного неароматического циклического углеводородного радикала, содержащего 3-8 атомов углерода, например, 4-7, например, 3-6 атомов углерода, например, 4-6 или предпочтительно 5-6 атомов углерода, такого как циклобутенил, циклопентенил или циклогексенил.
Термин "гетероциклоалкил" предназначается для охвата циклоалкильного радикала, который определен выше, содержащего 1-7 атомов углерода, например, 1-6 атомов углерода, в частности 4-, 5- или 6-членного кольца, содержащего 2-5 атомов углерода и 1-5 гетероатомов (выбранных из O, S и N), например, 3-5 атомов углерода и 1-3 гетероатома, предпочтительно 4-5 атомов углерода и 1-2 гетероатома, выбранных из O, S или N, такого как морфолино, морфолинил, пирролидинил, оксопирролидинил, пиперидино, азетидинил, тетрагидрофурил, тетрагидропиранил, оксотетрагидрофурил, оксооксазолидинил, оксетанил, диоксоимидазолидинил, пиперидил или пиперазинил.
Термин "гетероциклоалкенил" предназначается для обозначения циклоалкенильного радикала, который определен выше, содержащего 1-7 атомов углерода, например, 1-6 атомов углерода, в частности 5- или 6-членного кольца, содержащего 1-5 атомов углерода и 1-5 гетероатомов (выбранных из O, Sи N), например, 3-5 атомов углерода и 1-3 гетероатома, предпочтительно 4-5 атомов углерода и 1-2 гетероатома, выбранных из O, S или N.
Термин "гетероциклоалкилокси" предназначается для охвата радикала формулы -OR, где R представляет гетероциклоалкил, который определен выше, например, оксодигидрофурилокси.
Термин "гетероциклоалкиларил" предназначается для охвата радикалов гетероциклоалкильного кольца (колец), в частности 5- или 6-членного кольца, содержащего 1-5 атомов углерода и 1-4 гетероатома, выбранных из О, N или S, например, 1-5 атомов углерода и 1-3 гетероатома, предпочтительно 2-5 атомов углерода и 1-2 гетероатома, причем гетероциклоалкильное кольцо конденсировано или аннелировано с одним или несколькими ароматическими карбоциклическими кольцами, содержащими 6-10 атомов углерода, такими как фенил или нафтил.
Термин "арил" предназначается для обозначения радикала ароматического карбоциклического кольца (колец), содержащего 6-20 атомов углерода, например 6-14 атомов углерода, предпочтительно 6-10 атомов углерода, в частности 6-членных колец, необязательно конденсированных или аннелированных карбоциклических колец по меньшей мере с одним ароматическим кольцом, таким как фенил, нафтил, 1-нафтил или инданил.
Термин "гетероарил" предназначается для обозначения радикалов гетероциклического ароматического кольца (колец), содержащего 1-4 гетероатома (выбранных из O, S и N) и 1-10 атомов углерода, например 1-3 гетероатома и 1-6 атомов углерода, например 1-3 гетероатома и 2-5 атомов углерода, например 1-2 гетероатома и 3-5 атомов углерода, предпочтительно 5- или 6-членных колец с 1-3 гетероатомами, выбранными из O, S и N, и 2-5 атомами углерода или 1-3 гетероатомами и 2-4 атомами углерода, таких как пиридил, тиазолил, имидазолил, изоксадиазолил, [l,2,4]оксадиазолил, оксазолил, пиразолил, индолил, тиенил, фурил, 1-бензо[b]тиофенил, 2,3-дигидробензо[1,4]диоксинил или 2,3-дигидробензофурил.
Термин "галоген" предназначается для обозначения заместителя из 7-ой главной группы периодической системы элементов, предпочтительно это фтор, хлор, йод или бром.
В данном контексте термин "алкил" предназначается для обозначения радикала, образующегося, когда один атом водорода удаляют из углеводорода. Указанный алкил содержит 1-6, предпочтительно 1-4 или 1-3, например 2-4 или 1-2 атома углерода. Термин включает подклассы нормального алкила (н-алкил), вторичного и третичного алкила, таких как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил или изогексил.
Термин "алкенил" предназначается для обозначения моно-, ди- или три-ненасыщенного углеводородного радикала, содержащего 2-6 атомов углерода, в частности 2-4 атома углерода, например 2-3 атома углерода, такого как винил, аллил, пропенил, бутенил, пентенил или гексенил.
Термин "алкинил" предназначается для обозначения углеводородного радикала, содержащего 1-4 тройные связи C-C, например, 1, 2 или 3 тройные связи и 2-6 атомов углерода, алкановую цепь, обычно содержащую 2-5 атомов углерода, в частности 2-4 атома углерода, например 2-3 атома углерода, такого как этинил, пропинил, бутинил или пентинил.
Термин "гидроксиалкил" предназначается для обозначения алкильного радикала, который определен выше, где один, два, три или более атомов водорода замещены гидрокси, такого как гидроксиметил, гидроксиэтил, гидроксипропил, гидроксибутил и т.п.
Термин "галогеналкил" предназначается для обозначения алкильного радикала, который определен выше, где один, два, три или более атомов водорода замещены галогеном, одним и тем же или разными, такими как йод, хлор, бром и/или фтор, такого как фторэтил, дифторэтил, дифторметил или трифторметил.
Термин "аминоалкил" предназначен для обозначения алкильного радикала, который определен выше, где один или два атома водорода замещены -NH2, такого как аминометил, аминоэтил или аминопропил.
Термин "аминокарбонил" предназначается для обозначения радикала формулы -C(О)-NRR', где R и R' независимо представляют водород, алкил, циклоалкил или алкенил, которые указаны выше, такого как аминокарбонил, метиламинокарбонил, этиламинокарбонил, пропиламинокарбонил, трет-бутиламинокарбонил, циклопропиламинокарбонил, изопропиламинокарбонил, втор-бутиламинокарбонил, метилэтиламинокарбонил, диметиламинокарбонил или диэтиламинокарбонил.
Термин "алкилкарбонил" предназначается для обозначения радикала формулы -C(O)-R, где R представляет алкил, который указан выше, такого как метилкарбонил, этилкарбонил.
Термин "алкокси" предназначается для обозначения радикала формулы -OR, где R представляет алкил или алкенил, которые указаны выше, такого как метокси, этокси, н-пропокси, изопропокси, бутокси, трет-бутокси и т.д.
Термин "алкоксиалкокси" предназначается для обозначения радикала формулы -OR-OR, где R представляет алкил или алкенил, которые указаны выше, такого как метоксиметокси, метоксиэтокси, этоксиметокси, этоксиэтокси и т.д.
Термин "алкоксикарбонил" предназначается для обозначения радикала формулы -C(O)-O-R, где R представляет алкил, который указан выше, такого как метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изопропоксикарбонил, трет-бутоксикарбонил и т.д.
Термин "алкилкарбонилокси" предназначается для обозначения радикала формулы -О-C(O)-R, где R представляет алкил, который указан выше, такого как метилкарбонилокси или этилкарбонилокси.
Термин "алкоксикарбамоил" предназначается для обозначения радикала формулы -C(O)NR'-O-R, где R' представляет водород или алкил, который указан выше, и R представляет алкил, который указан выше, такого как метоксикарбамоил, трет-бутоксикарбамоил.
Термин "амино" предназначается для обозначения радикала формулы -NRR', где R и R' независимо представляют водород, алкил или алкенил, которые указаны выше, такого как -NH2, метиламино, этиламино, пропиламино, диметиламино, диэтиламино, изопропиламино, втор-бутиламино, трет-бутиламино или этилметиламино.
Термин "циклоалкиламино" предназначается для обозначения радикала формулы -NRR', где R представляет водород или алкил и R' представляет циклоалкил, который указан выше, такого как циклопропиламино.
Термин "ариламино" предназначается для обозначения радикала формулы -NRR', где R представляет водород или алкил, который указан выше, и R' представляет арил, который указан выше, такого как фениламино или инданиламино.
Термин "алкоксиарил" предназначается для обозначения радикала формулы -Ar-O-R, где Ar представляет арил, который указан выше, и R представляет алкил, который указан выше, такого как метоксифенил или этоксифенил.
Термин "карбоксиарил" предназначается для обозначения радикала формулы -Ar-C(O)OH, где Ar представляет арил, который указан выше, такого как карбоксифенил.
Термин "гетероариламино" предназначается для обозначения радикала формулы -NRR', где R представляет водород или алкил, который указан выше, и R' представляет гетероарил, который указан выше.
Термин "гетероциклоалкилкарбонил" предназначается для обозначения радикала формулы -C(O)-R, где R представляет гетероциклоалкил, который указан выше, такого как пиперидилкарбонил, морфолинокарбонил, морфолинилкарбонил, пиперазинилкарбонил, пирролидинилкарбонил, оксопирролидинилкарбонил, пиперидинокарбонил или азетидинилкарбонил.
Термин "аминокарбонил" предназначается для обозначения радикала формулы -C(O)-NR'2, где каждый R' независимо представляет водород, алкил, алкенил или циклоалкил, которые указаны выше, такого как карбамоил, метиламинокарбонил, этиламинокарбонил, диметиламинокарбонил, диэтиламинокарбонил, этилметиламинокарбонил, метилэтиламинокарбонил, пропиламинокарбонил, изопропиламинокарбонил, бутиламинокарбонил, втор-бутиламинокарбонил, трет-бутиламинокарбонил, циклопропиламинокарбонил или циклогексиламинокарбонил.
Термин "гидроксиаминокарбонил" предназначается для обозначения радикала формулы -C(O)-NR'-OH, где R' независимо представляет водород или алкил, который указан выше.
Термин "ариламинокарбонил" предназначается для обозначения радикала формулы -C(О)-NR'-арил, где R' независимо представляет водород или алкил, который указан выше, и арил является таким, как указано выше, такого как фениламинокарбонил, инданиламинокарбонил.
Термин "гетероариламинокарбонил" предназначается для обозначения радикала формулы -C(О)-NR'-гетероарил, где R' независимо представляет водород или алкил, который указан выше, и гетероарил является таким, как указано выше, такого как пиразолиламинокарбонил, пиридиламинокарбонил.
Термин "циклоалкиламинокарбонил" предназначается для обозначения радикала формулы -C(O)-NR'-циклоалкил, где R' независимо представляет водород или алкил, который указан выше, и циклоалкил является таким, как указано выше, такого как циклопропиламинокарбонил, циклобутиламинокарбонил, циклопентиламинокарбонил или циклогексиламинокарбонил.
Термин "гетероциклоалкиламинокарбонил" предназначается для обозначения радикала формулы -C(O)-NR'-гетероциклоалкил, где R' независимо представляет водород или алкил, который указан выше, и гетероциклоалкил является таким, как указано выше, такого как тетрагидрофуриламинокарбонил или оксотетрагидрофуриламинокарбонил.
Термин "алкилсульфониламинокарбонил" предназначается для обозначения радикала формулы -C(O)-NR'-S(О)2-R, где R' независимо представляет водород, алкил или циклоалкил, которые указаны выше, и R представляет алкил, который указан выше, такого как метилсульфониламинокарбонил.
Термин "арилокси" предназначается для обозначения радикала формулы -O-R, где R представляет арил, который указан выше, такого как фенилокси.
Термин "арилоксикарбонил" предназначается для обозначения радикала формулы -C(O)-O-R, где R представляет арил, который указан выше, такого как фенилоксикарбонил.
Термин "гетероарилокси" предназначается для обозначения радикала формулы -O-R, где R представляет гетероарил, который указан выше.
Термин "гетероарилоксикарбонил" предназначается для обозначения радикала формулы -C(O)-O-R, где R представляет гетероарил, который указан выше.
Термин "алкилтио" предназначается для обозначения радикала формулы -S-R, где R представляет алкил, который указан выше.
Термин "иминометил" предназначается для обозначения радикала -CH=NH.
Термин "гидроксииминометил" предназначается для обозначения радикала -CH=N-(OH).
Термин "аминосульфонил" предназначается для обозначения радикала формулы -S(О)2-NR2, где каждый R независимо представляет водород или алкил, который указан выше, такого как этиламиносульфонил.
Термин "алкилсульфонил" предназначается для обозначения радикала формулы -S(O)2-R, где R представляет алкил, который указан выше.
Термин "арилсульфонил" предназначается для обозначения радикала формулы -S(О)2-R, где R представляет арил, который указан выше, такого как фенилсульфонил.
Термин "гетероциклоалкилсульфонил" предназначается для обозначения радикала формулы -S(O)2-R, где R представляет гетероциклоалкил, который указан выше, такого как морфолинсульфонил.
Термин "аминокарбонилокси" предназначается для обозначения радикала формулы -O-C(O)-NRR', где R и R' независимо представляют водород или алкил, который указан выше.
Термин "алкилкарбониламино" предназначается для обозначения радикала формулы -NR'-C(O)-R, где R' представляет водород или алкил, который указан выше, и R представляет алкил, который указан выше, такого как метилкарбониламино.
Термин "алкоксикарбониламино" предназначается для обозначения радикала формулы -NR'-C(O)-О-R, где R' представляет водород или алкил, который указан выше, и R представляет алкил, который указан выше.
Термин "алкилсульфониламино" предназначается для обозначения радикала формулы -NR'-S(O)2-R, где R представляет алкил, который указан выше, и R' представляет водород или алкил, который указан выше, такого как метилсульфониламино, этилсульфониламино, пропилсульфониламино или бутилсульфониламино.
Термин "арилсульфониламино" предназначается для обозначения радикала формулы -NR'-S(O)2-R, где R представляет арил, который указан выше, и R' представляет водород или алкил, который указан выше, такого как фенилсульфониламино.
Термин "алкоксисульфонилокси" предназначается для обозначения радикала формулы -O-S(O)2-О-R, где R представляет алкил, который указан выше.
Термин "арилсульфониламинокарбонил" предназначается для обозначения радикала формулы -C(O)-NR'-S(O)2-R, где R представляет арил, который указан выше, и R' представляет водород или алкил, который указан выше, такого как фенилсульфониламинокарбонил.
Термин "арилкарбониламино" предназначается для обозначения радикала формулы -NR'-C(O)-R, где R' представляет водород или алкил, который указан выше, и R представляет арил, который указан выше, такого как фенилкарбониламино.
Термин "алкенилкарбониламино" предназначается для обозначения радикала формулы -NR'-C(O)-R, где R' представляет водород или алкил, который указан выше, и R представляет алкенил, который указан выше.
Термин "циклоалкилкарбониламино" предназначается для обозначения радикала формулы -NR'-C(О)-R, где R' представляет водород или алкил, который указан выше, и R представляет циклоалкил, который указан выше.
Термин "циклоалкенилкарбониламино" предназначается для обозначения радикала формулы -NR'-C(O)-R, где R' представляет водород или алкил, который указан выше, и R представляет циклоалкенил, который указан выше.
Термин "гетероциклоалкилкарбониламино" предназначается для обозначения радикала формулы -NR'-C(О)-R, где R' представляет водород или алкил, который указан выше, и R представляет гетероциклоалкил, который указан выше.
Термин "уреидо" предназначается для обозначения радикала формулы "-NR'-C(O)-NH-R, где R' представляет водород или алкил, который указан выше, и R представляет водород, алкил, алкенил, алкинил, циклоалкил или арил, которые указаны выше.
Термин "тиоуреидо" предназначается для обозначения радикала формулы "-NR'-C(S)-NH-R, где R' представляет водород или алкил, который указан выше, и R представляет водород, алкил или циклоалкил, которые указаны выше.
Термин "фармацевтически приемлемая соль" предназначается для обозначения солей, полученных путем реакции соединения формулы I с соответствующей неорганической или органической кислотой, такой как хлористоводородная, бромистоводородная, йодистоводородная, серная, азотная, фосфорная, муравьиная, уксусная, 2,2-дихлоруксусная, холиновая, адипиновая, аскорбиновая, L-аспарагиновая, L-глутаминовая, галактаровая, молочная, малеиновая, L-яблочная, фталевая, лимонная, пропионовая, бензойная, глутаровая, глюконовая, D-глюкуроновая, метансульфоновая, салициловая, янтарная, малоновая, виннокаменная, бензолсульфоновая, этан-1,2-дисульфоновая, 2-гидроксиэтансульфоновая кислота, толуолсульфоновая, сульфаминовая или фумаровая кислота. Фармацевтически приемлемые соли соединения формулы I могут быть также получены путем реакции с соответствующим основанием, таким как гидроксид натрия, гидроксид калия, гидроксид магния, гидроксид кальция, аммоний или подходящие нетоксичные амины, такие как низшие алкиламины, например триэтиламин, гидрокси-низшие алкиламины, например 2-гидроксиэтиламин, бис-(2-гидроксиэтил)амин, циклоалкиламины, например дициклогексиламин, или бензиламины, например N,N'-дибензилэтилен-диамин и дибензиламин, или L-аргинин или L-лизин.
Термин "сольват" предназначается для обозначения соединений, образованных при взаимодействии соединения, например, соединения формулы I, и растворителя, например, спирта, глицерина или воды, где указанные соединения находятся в твердой форме. Когда вода является растворителем, указанные соединения упоминаются как гидрат.
Термин "фармацевтически приемлемый гидролизуемый in vivo сложный эфир" предназначается для обозначения легко гидролизуемых in vivo сложных эфиров, т.е. гидролизуемых in vivo сложных эфиров соединения формулы I, таких как алканоилоксиалкиловый, аралканоилоксиалкиловый, ароилоксиалкиловый, например, ацетоксиметиловый, пивалоилоксиметиловый, бензоилоксиметиловый сложные эфиры, и соответствующих 1'-оксиэтиловых производных или алкоксикарбонилоксиалкиловых сложных эфиров, например, метоксикарбонилоксиметиловых сложных эфиров и этоксикарбонилоксиметиловых сложных эфиров и соответствующих 1'-оксиэтиловых производных, или лактониловых сложных эфиров, например, фталидиловых сложных эфиров, или диалкиламиноалкиловых сложных эфиров, например, диметиламиноэтиловых сложных эфиров. Такие сложные эфиры могут быть получены традиционными способами, известными специалистам в этой области, такими как способ, раскрытый в патенте Великобритании № 1490852, включенном в данное описание ссылкой.
Соединения формулы I могут содержать асимметрично замещенные (хиральные) атомы углерода и углерод-углеродные двойные связи, которые могут обеспечивать существование изомерных форм, например, энантиомеров, диастереомеров и геометрических изомеров. Данное изобретение включает все такие изомеры, или в чистой форме, или в виде их смесей. Чистые стереоизомерные формы соединений и промежуточных соединений по данному изобретению могут быть получены путем применения процедур, известных в технике. Диастереомеры могут быть разделены способами физического разделения, такими как селективная кристаллизация и хроматографические методы, например, жидкостная хроматография с использованием хиральных стационарных фаз. Энантиомеры могут быть отделены друг от друга селективной кристаллизацией их диастереомерных солей с оптически активными кислотами. В качестве варианта энантиомеры могут быть разделены хроматографическими методами с использованием хиральных стационарных фаз. Указанные чистые стереоизомерные формы могут быть также получены из соответствующих чистых стереоизомерных форм соответствующих исходных материалов при условии, что реакция протекает стереоселективно или стереоспецифически. Предпочтительно, если желателен конкретный стереоизомер, синтезировать указанное соединение стереоселективными или стереоспецифическими способами получения. Эти способы предусматривают преимущественное применение хирально чистых исходных материалов. Подобным образом, чистые геометрические изомеры могут быть получены из соответствующих чистых геометрических изомеров соответствующих исходных материалов. Смесь геометрических изомеров будет обычно проявлять различные физические свойства, и поэтому они могут быть разделены стандартными хроматографическими методами, хорошо известными в технике.
Данное изобретение дополнительно относится к пролекарствам соединения общей формулы I, таким как сложные эфиры, простые эфиры, комплексы или другие производные, которые подвержены биотрансформации in vivo до проявления их фармакологических эффектов.
Соединения формулы I могут быть получены в кристаллической форме либо непосредственно путем концентрирования из органического растворителя, либо путем кристаллизации или перекристаллизации из органического растворителя или смеси указанного растворителя и совместно действующего растворителя, который может быть органическим или неорганическим, таким как вода. Кристаллы могут быть выделены в форме, по существу не содержащей растворителя, или как сольват, такой как гидрат. Изобретение охватывает все кристаллические модификации и формы, а также их смеси.
Варианты осуществления
В одном варианте осуществления данного изобретения соединение I представляет:

В одном варианте осуществления данного изобретения группа


В другом варианте осуществления данного изобретения R2 и R3 представляют водород.
В другом варианте осуществления данного изобретения A представляет 1-нафтил.
В другом варианте осуществления данного изобретения G представляет -C(O)R6, где R6 представляет -NH2, C1-6амино, гидрокси, меркапто, -C(O)NH2, трифторметил, карбокси, C1-6алкил, C2-4алкенил, C2-4алкинил, C1-4гидроксиалкил, C1-6галогеналкил, C1-4алкокси, C1-4алкоксикарбонил, C1-4аминокарбонил, C3-6циклоалкил, C3-6циклоалкенил, C1-6гетероциклоалкенил, C3-6циклоалкиламино, C1-6гетероциклоалкил, C1-6гетероциклоалкилкарбонил, C6-14арил, C1-6гетероарил, C6-10ариламино, карбокси C6-10арил, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-4алкилтио, C1-4аминокарбонилокси, C1-4алкилсульфониламино, C1-4алкилкарбониламино, C1-4алкенилкарбониламино, C3-6циклоалкенилкарбониламино, C3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино, C6-10арилкарбониламино или C6-10арилсульфониламино,
где указанные C1-6амино, C1-6алкил, C2-4алкенил, C2-4алкинил, C1-4гидроксиалкил, C1-6галогеналкил, C1-4алкокси, C1-4алкоксикарбонил, C1-4аминокарбонил, C3-6циклоалкил, C3-6циклоалкенил, C1-6гетероциклоалкенил, C3-6циклоалкиламино, C1-6гетероциклоалкил, C1-6гетероциклоалкилкарбонил, C6-14арил, C1-6гетероарил, C6-10ариламино, карбоксиC6-10арил, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-4алкилтио, C1-4аминокарбонилокси, C1-4алкилсульфониламино, C1-4алкилкарбониламино, C1-4алкенилкарбониламино, C3-6циклоалкенилкарбониламино, C3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино, C6-10арилкарбониламино или C6-10арилсульфониламино могут быть дополнительно необязательно замещенными одним или несколькими одинаковыми или разными заместителями, такими как гидрокси, галоген, C1-4алкил, C1-3алкокси, C1-4алкоксикарбонил, C1-6гетероциклоалкил, C6-12арил или оксо,
где указанные C1-4алкил, C1-3алкокси, C1-4алкоксикарбонил, C1-6гетероциклоалкил или C6-12арил являются необязательно дополнительно замещенными трифторметилом, галогеном, C1-4алкилом, C1-3алкокси или C1-4алкоксикарбонилом.
В еще одном варианте осуществления данного изобретения G представляет -C(O)NH2, С1-4аминокарбонил, C4-5гетероциклоалкилкарбонил, C6-10ариламинокарбонил, C6-10арилсульфониламинокарбонил,
где указанные С1-4аминокарбонил, C4-5гетероциклоалкилкарбонил, C6-10ариламинокарбонил, C6-10арилсульфониламинокарбонил являются необязательно замещенными одним или несколькими, одинаковыми или разными заместителями, выбранными из оксо, гидрокси, С1-4алкила, С1-3алкокси, С1-3алкоксикарбонила, C4-5гетероциклоалкила, C6-10арила,
где указанные С1-4алкил, С1-3алкокси, С1-3алкоксикарбонил, C4-5гетероциклоалкил или C6-10арил являются необязательно замещенными одним или несколькими, одинаковыми или разными заместителями, такими как галоген, трифторметил, С1-3алкокси или С1-3алкоксикарбонил.
В еще одном варианте осуществления данного изобретения G представляет метилпиперазинилкарбонил, циклопропиламинокарбонил, изопропиламинокарбонил, пропиламинокарбонил, морфолинокарбонил, диметиламинокарбонил, изобутиламинокарбонил, этиламинокарбонил, N-метокси-N-метиламинокарбонил, метоксикарбонилметиленаминокарбонил, метоксиэтиленаминокарбонил, этоксикарбонилфениленаминокарбонил, диметилморфолинокарбонил, морфолинопропиламинокарбонил, этоксикарбонилпиперидинокарбонил, хлорбензиламинокарбонил, фенилгидроксиэтиламинокарбонил, этоксикарбонилэтиленаминокарбонил, трифторметилфениленпиперазинилкарбонил, гидроксиинданиламинокарбонил, фенилметоксикарбонилметиленаминокарбонил, метоксиэтиленпиперазинилкарбонил, трифторбензиламинокарбонил, метоксикарбонилбензиламинокарбонил, метилфениленсульфониламинокарбонил или карбоксифенилметиленаминокарбонил.
В еще одном варианте осуществления данного изобретения G представляет фенил, необязательно замещенный одним или несколькими, одинаковыми или разными заместителями, выбранными из таких, как -C(O)H, -C(O)NH2, гидрокси, галоген, циано, нитро, амидино, карбокси, трифторметил, С1-6алкил, C2-4алкенил, C2-4алкинил, С1-4гидроксиалкил, С1-6амино, аминоС1-3алкил, иминометил, гидроксииминометил, С1-6галогеналкил, С1-4алкокси, С1-4алкоксикарбонил, С1-3алкоксикарбамоил, С1-4аминокарбонил, С1-3алкилсульфониламинокарбонил, гидроксиаминокарбонил, С1-6гетероциклоалкилокси, С1-6гетероциклоалкиламинокарбонил, C3-6циклоалкиламинокарбонил, С6-10ариламинокарбонил, С1-10гетероариламинокарбонил, C3-6циклоалкил, С1-6гетероциклоалкил, С1-6гетероциклоалкенил, С1-6гетероциклоалкилкарбонил, С1-4алкилкарбонилокси, С1-4алкоксикарбонилокси, С1-4алкоксисульфонилокси, С1-4алкилтио, C3-6циклоалкенил, С1-4аминосульфонил, С1-4аминокарбонилокси, С1-4алкилсульфониламино, С1-10гетероарил, C6-10ариламино, C6-10арилоксикарбонил, C6-10арилкарбониламино, C6-10арилсульфониламино, С1-4алкилкарбониламино, С1-4алкенилкарбониламино, C3-6циклоалкенилкарбониламино, C3-6циклоалкилкарбониламино, С1-4алкоксикарбониламино, С1-6гетероциклоалкилкарбониламино, С1-4алкилсульфонил или С1-4гетероциклоалкилсульфонил,
где указанные C(О)NH2, С1-6алкил, C2-4алкенил, C2-4алкинил, С1-4гидроксиалкил, С1-6амино, аминоС1-3алкил, иминометил, гидроксииминометил, С1-6галогеналкил, С1-4алкокси, С1-4алкоксикарбонил, С1-3алкоксикарбамоил, С1-4аминокарбонил, С1-3алкилсульфониламинокарбонил, гидроксиаминокарбонил, С1-6гетероциклоалкилокси, С1-6гетероциклоалкиламинокарбонил, C3-6циклоалкиламинокарбонил, С6-10ариламинокарбонил, С1-10гетероариламинокарбонил, C3-6циклоалкил, С1-6гетероциклоалкил, С1-6гетероциклоалкенил, С1-6гетероциклоалкилкарбонил, С1-4алкилкарбонилокси, С1-4алкоксикарбонилокси, С1-4алкоксисульфонилокси, С1-4алкилтио, C3-6циклоалкенил, С1-4аминосульфонил, С1-4аминокарбонилокси, С1-4алкилсульфониламино, С1-10гетероарил, C6-10ариламино, C6-10арилоксикарбонил, C6-10арилкарбониламино, C6-10арилсульфониламино, С1-4алкилкарбониламино, С1-4алкенилкарбониламино, C3-6циклоалкенилкарбониламино, C3-6циклоалкилкарбониламино, С1-4алкоксикарбониламино, С1-6гетероциклоалкилкарбониламино, С1-4алкилсульфонил или С1-4гетероциклоалкилсульфонил
являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями, выбранными из группы, состоящей из таких заместителей, как гидрокси, -NH2, С1-6амино, иминометил, гидроксииминометил, карбокси, трифторметил, галоген, оксо, меркапто, циано, -C(O)NH2, нитро, С1-6алкил, C2-4алкенил, C2-4алкинил, С1-4гидроксиалкил, С1-6галогеналкил, С1-3алкокси, С1-4алкоксикарбонил, С1-6гетероциклоалкилкарбонил, C3-6циклоалкил, C3-6циклоалкенил, С1-6гетероциклоалкил, C6-12арил, С1-10гетероарил, С1-3алкоксиC6-10арил, С1-10гетероциклоалкиларил, С1-6гетероциклоалкенил, -S(O)2NH2, -S(O)2OH, С1-6уреидо, С1-6тиоуреидо, С1-4алкилкарбонилокси, С1-4алкоксикарбонилокси, С1-4алкоксисульфонилокси, С1-4алкоксикарбамоил, С1-4аминокарбонил, С1-4алкилтио, С1-4аминосульфонил, С1-4аминокарбонилокси, С1-4алкилсульфониламино; C6-12арилсульфонил, C6-10арилсульфониламино, С1-4алкилкарбониламино или С1-4алкилсульфонил,
где указанные C3-6циклоалкил, С1-6алкил, С1-3алкокси, С1-4алкоксикарбонил, С1-6гетероциклоалкил, C6-10арил или С1-10гетероарил могут быть дополнительно замещенными карбокси, галогеном, гидрокси, циано, С1-6гетероциклоалкилом, одним или несколькими С1-6алкилами, С1-3алкокси, С1-3алкоксиС1-3алкокси, С1-4алкоксикарбонилами, С1-3гидроксиалкилами или C6-10арилами.
В еще одном варианте осуществления данного изобретения G представляет фенил, замещенный одним или несколькими одинаковыми или разными заместителями, выбранными из таких, как циано, карбокси, -C(O)H, -C(O)NH2, гидроксил, галоген, амидино, иминометил, гидроксииминометил, С1-6алкил, C2-4алкинил, аминоС1-3алкил, С1-3алкокси, С1-3алкоксикарбонил, С1-4алкоксикарбамоил, С1-3аминокарбонил, С3-6циклоалкил, С1-6гетероциклоалкил, С1-6гетероциклоалкилкарбонил, С1-6гетероциклоалкилокси, C1-3аминокарбонилокси, С1-10гетероарил, C6-10ариламино, C6-10арилоксикарбонил, С1-3алкилсульфониламинокарбонил, гидроксиаминокарбонил, С1-3алкилсульфонил, С1-6гетероциклоалкилсульфонил, С1-6гетероциклоалкиламинокарбонил, C3-6циклоалкиламинокарбонил, С6-10ариламинокарбонил, С1-3аминосульфонил, С1-10гетероариламинокарбонил, С1-3алкилкарбониламино, С1-3алкилсульфониламино или С6-10арилсульфониламино,
каждый из которых является необязательно замещенным одним или несколькими одинаковыми или разными заместителями, выбранными из таких групп, как гидрокси, -NH2, С1-3амино, иминометил, карбокси, трифторметил, циано, фтор, хлор, йод, оксо, меркапто, С1-4алкил, С1-3гидроксиалкил, С1-2алкокси, С1-4алкоксикарбонил, C3-6циклоалкил, C3-6гетероциклоалкил, С1-6гетероциклоалкилкарбонил, С6-10арил, С1-10гетероарил, С1-2алкоксиС6-10арил, С1-3алкилсульфониламино, -S(О)2OH или С1-3алкилкарбониламино,
где указанные C3-6циклоалкил, С1-4алкил, С1-2алкокси, С1-4алкоксикарбонил, С1-6гетероциклоалкил, C6-10арил или С1-10гетероарил являются необязательно дополнительно замещенными карбокси, галогеном, гидрокси, циано, С1-6гетероциклоалкилом, одним или несколькими С1-6алкилами, С1-3алкокси, С1-3алкоксиС1-3алкокси, С1-4алкоксикарбонилами, С1-3гидроксиалкилами или C6-10арилами, такими как гидроксиметилпирролидинилкарбонил, этиламинокарбонил, диметиламиноэтилметиламинокарбонил, пирролидинилиминометил, амидино, аминогидроксииминометил, метоксикарбонил, этоксикарбонил, гидроксиэтиламинокарбонил, N-гидроксиэтил-N-метиламинокарбонил, N-гидроксиметил-N-пропиламинокарбонил, бисгидроксиэтиламинокарбонил, дигидрокси-трет-бутиламинокарбонил, N-гидроксиэтил-N-этиламинокарбонил, цианоэтиламинокарбонил, морфолиноэтиламинокарбонил, фторэтиламинокарбонил, дифторэтиламинокарбонил, метоксикарбонилэтиламинокарбонил, N-пиридилметил-N-метиламинокарбонил, бензилоксикарбамоил, метилкарбониламиноэтиламинокарбонил, йодфениленоксикарбонил, метоксиэтиламинокарбонил, меркаптоэтиламинокарбонил, этоксикарбонилметиламинокарбонил, сульфоэтиламинокарбонил, диметиламинокарбонил, диметиламиноэтиламинокарбонил, диметиламинопропиламинокарбонил, пиперидинокарбонил, метилпиперазинилкарбонил, гидроксиэтилпиперазинилкарбонил, морфолинокарбонил, гидроксипиперидинокарбонил, имидазолилпропиламинокарбонил, карбоксиметиламинокарбонил, трет-бутоксикарбонилметоксикарбонилэтиламинокарбонил, трет-бутоксикарбонилкарбоксиэтиламинокарбонил, метоксикарбонилфенилэтиламинокарбонил, карбоксифенилэтиламинокарбонил, метоксикарбонилиндолилэтиламинокарбонил, карбоксииндолилэтиламинокарбонил, N-этоксикарбонилметил-N-циклогексиламинокарбонил, диэтоксикарбонилметиламинокарбонил, трет-бутоксикарбонилгидроксиэтиламинокарбонил, карбоксипиридиламинокарбонил, карбоксифениламинокарбонил, метоксиэтоксикарбонилфениламинокарбонил, N,N-дикарбоксиметиламинокарбонил, карбоксициклопентилметиламинокарбонил, карбоксиэтиламинокарбонил, карбоксиметилциклогексиламинокарбонил, этилкарбоксициклопропиламинокарбонил, карбоксициклопропиламинокарбонил, карбоксиизопропиламинокарбонил, карбоксиазетидинилкарбонил, N-метил-N-карбоксиметиламинокарбонил, карбоксипропиламинокарбонил, этоксикарбонилпиперидилкарбонил, карбоксипиперидилкарбонил, N-карбоксиметил-N-циклогексиламинокарбонил, оксотетрагидрофуриламинокарбонил, цианометиламинокарбонил, цианопиразоламинокарбонил, фенилметоксикарбонилгидроксиэтиламинокарбонил, метоксикарбонилгидроксиэтиламинокарбонил, этоксикарбонилгидроксиэтиламинокарбонил, карбоксигидроксиэтиламинокарбонил, карбоксигидроксипропиламинокарбонил, трет-бутоксиаминокарбонил, метоксиаминокарбонил, тетрагидрофурилметоксиаминокарбонил, N-метокси-N-метиламинокарбонил, фенилметоксиаминокарбонил, гидроксиаминокарбонил, морфолинокарбонилметоксиаминокарбонил, метилсульфониламинокарбонил, метоксикарбонилгидроксипирролидинилкарбонил, карбоксигидроксипирролидинилкарбонил, этоксикарбонилметокси, метоксикарбонилэтил, карбоксиметокси или карбоксиэтил.
В одном варианте осуществления, когда G представляет фенил, являющийся дополнительно замещенным, заместитель присоединен к кольцу фенилена в мета- или параположении по отношению к месту присоединения фенильного кольца к циклоалкилу, представленному формулой
В другом варианте осуществления, когда G представляет фенил, являющийся дополнительно замещенным, заместитель присоединен к кольцу фенилена в ортоположении по отношению к месту, где фенильное кольцо присоединено к циклоалкилу, представленному формулой

В еще одном варианте осуществления данного изобретения G представляет С1-10гетероарил или С1-6гетероциклоалкил, и где указанный С1-10гетероарил или С1-6гетероциклоалкил является необязательно замещенным карбокси, С1-6алкилом, C6-10арилом, С1-3алкоксикарбонилом, которые могут быть дополнительно необязательно замещенными трифторметилом, галогеном, С1-3алкилом, С1-3алкокси, С1-10гетероарилом, где С1-10гетероарил дополнительно может быть замещенным С1-3алкилом или оксо, таким как фторфенилен[1,2,4]оксадиазолил, фенил[1,2,4]оксадиазолил, изопропил[1,2,4]оксадиазолил, трифторметилфенилен[1,2,4]оксадиазолил, метил[1,2,4]оксадиазолил, метилтиазолилметилен[1,2,4]оксадиазолил, пропил[1,2,4]оксадиазолил, оксопиридинилметилен[1,2,4]оксадиазолил, метоксифенилен[1,2,4]оксадиазолил, метилкарбоксиимидазолил, этоксикарбонилтиенил, этоксикарбонилфурил, пиридил, карбокситиенил или карбоксифурил.
В еще одном варианте осуществления данного изобретения G представляет фениламино или фенилокси, необязательно замещенный циано, карбокси, С1-4алкоксикарбонилом или трифторметилом.
В еще одном варианте осуществления данного изобретения A представляет 1-нафтил, 2-нафтил или фенил, каждый из которых является необязательно замещенным, как указано выше для замещения C6-14арила, представляющего A.
В еще одном варианте осуществления данного изобретения R4 представляет водород, гидрокси, галоген или С1-6 алкил.
В еще одном варианте осуществления данного изобретения R5 представляет водород или С1-6 алкил.
В еще одном варианте осуществления данного изобретения R2, R3, R4 и R5 представляют водород.
В еще одном варианте осуществления данного изобретения R1 представляет метил, этил или н-пропил, необязательно замещенный галогеном или гидрокси, такой как метил.
В еще одном варианте осуществления данное изобретение относится к соединениям общей формулы I, где G представляет C6-10арил, С1-3аминокарбонилC6-10арил или С1-4алкилC6-10арил, необязательно замещенный карбокси, С1-3алкокси или С1-3алкоксикарбонилом, A представляет 1-нафтил, R2, R3, R4 и R5 представляют водород и R1 представляет метил.
Конкретные примеры соединений формулы I могут быть выбраны из группы, состоящей из следующих соединений:
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота (соединение 1000),
циклобутил-((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1001),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, диметиламид (соединение 1002),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, амид (соединение 1003),
(4-метилпиперазин-1-ил)[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон, гидрохлорид (соединение 1004),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, циклопропиламид (соединение 1005),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, изопропиламид (соединение 1006),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, пропиламид (соединение 1007),
морфолин-4-ил-[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон (соединение 1008),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, трет-бутиламид (соединение 1009),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, этиламид (соединение 1010),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, метокси-метил-амид, гидрохлорид (соединение 1011),
[3-(3-изопропил-[1,2,4]оксадиазол-5-ил)циклобутил]((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1012),
((R)-1-нафталин-1-илэтил){3-[3-(3-трифторметилфенил)[1,2,4]оксадиазол-5-ил]циклобутил}амин, гидрохлорид (соединение 1013),
[3-(3-метил[1,2,4]оксадиазол-5-ил)циклобутил]((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1014),
((R)-1-нафталин-1-илэтил)[3-(3-фенил[1,2,4]оксадиазол-5-ил)циклобутил]амин, гидрохлорид (соединение 1015),
((R)-1-нафталин-1-илэтил){3-[3-(4-трифторметилфенил)[1,2,4]оксадиазол-5-ил]циклобутил}амин, гидрохлорид (соединение 1016),
{3-[3-(4-метоксифенил)[1,2,4]оксадиазол-5-ил]циклобутил)-((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1017),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, 4-хлорбензиламид (соединение 1018),
{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}уксусная кислота, метиловый сложный эфир (соединение 1019),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, (2-метоксиэтил)амид (соединение 1020),
4-{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}бензойная кислота, этиловый сложный эфир (соединение 1021),
(2,6-диметилморфолин-4-ил)[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон (соединение 1022),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, (3-морфолин-4-илпропил)амид (соединение 1023),
1-[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]пиперидин-4-карбоновая кислота, этиловый сложный эфир (соединение 1024),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, (2-гидрокси-2-фенилэтил)амид (соединение 1025),
3-{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}пропионовая кислота, этиловый сложный эфир (соединение 1026),
[3-((R)-1-нафталин-1-илэтиламино)циклобутил][4-(3-трифторметилфенил)пиперазин-1-ил]метанон (соединение 1027),
{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}фенилуксусная кислота, метиловый сложный эфир (соединение 1028),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, (2-гидроксииндан-1-ил)амид (соединение 1029),
[4-(2-метоксиэтил)пиперазин-1-ил][3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон (соединение 1030),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, 2,3,6-трифторбензиламид (соединение 1031),
3-({[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}метил)бензойная кислота, метиловый сложный эфир (соединение 1032),
4-({[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}метил)бензойная кислота, метиловый сложный эфир (соединение 1033),
{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}фенилуксусная кислота (соединение 1034),
((R)-1-нафталин-1-илэтил)(3-фенилциклобутил)амин (соединение 1035 и соединение 1036),
{3-[3-(4-фторфенил)[1,2,4]оксадиазол-5-ил]циклопентил}-((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1037),
((R)-1-нафталин-1-илэтил)-[3-(3-фенил-[1,2,4]оксадиазол-5-ил)циклопентил]амин, гидрохлорид (соединение 1038),
[3-(3-изопропил-[1,2,4]оксадиазол-5-ил)циклопентил]-((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1039),
((R)-1-нафталин-1-илэтил)-{3-[3-(4-трифторметилфенил)[1,2,4]оксадиазол-5-ил]циклопентил}амин, гидрохлорид (соединение 1040),
[3-(3-метил-[1,2,4]оксадиазол-5-ил)циклопентил]((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1041),
{3-[3-(5-метилтиазол-2-илметил)-[1,2,4]оксадиазол-5-ил]циклопентил}((R)-1-нафталин-1-илэтил)амин (соединение 1042),
((R)-1-нафталин-1-илэтил)[3-(3-пропил[1,2,4]оксадиазол-5-ил)циклопентил]амин, гидрохлорид (соединение 1043a и 1043b),
1-{5-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]-[1,2,4]оксадиазол-3-илметил}-1H-пиридин-2-он, гидрохлорид (соединение 1044),
{3-[3-(4-метоксифенил)[1,2,4]оксадиазол-5-ил]циклопентил}((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1045),
3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновая кислота, амид (соединение 1046),
4-метил-N-[3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбонил]бензолсульфонамид (соединение 1047a, соединение 1047b, соединение 1047c и соединение 1047d),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрил (соединения 1048/1049/1050),
N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1051),
N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1052),
N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1053a и соединение 1053b),
{3-[4-(иминопирролидин-1-илметил)фенил]циклогексил}((R)-1-нафталин-1-илэтил)амин (соединение 1054),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1055),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединение 1056),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, (соединение 1057),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, (соединение 1058, 1058a),
3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, этиловый сложный эфир (соединение 1059),
N-(2-гидроксиэтил)-3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1060),
3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, (соединения 1061/1062),
((R)-1-нафталин-1-илэтил)-(3(S)-фенилциклогексил)амин (соединение 1063),
((R)-1-нафталин-1-илэтил)-(3(R)-фенилциклогексил)амин (соединение 1064),
N-((R)-1-нафталин-1-илэтил)-N'-фенилциклогексан-l,3-диамин (соединение 1065),
N-((R)-1-нафталин-1-илэтил)-N'-(3-трифторметилфенил)циклогексан-l,3-диамин (соединение 1066),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексиламино]бензонитрил (соединение 1067),
(3-морфолин-4-илциклогексил)((R)-1-нафталин-1-илэтил)амин (соединение 1068),
((R)-1-нафталин-1-илэтил)-(3-пиридин-2-илциклогексил)амин (соединения 1069/1070),
5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]тиофен-2-карбоновая кислота, этиловый сложный эфир (соединение 1071),
5-[3-((R)-1-нафталин~1-илэтиламино)циклогексил]тиофен-2-карбоновая кислота (соединение 1072),
5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фуран-2-карбоновая кислота, этиловый сложный эфир (соединение 1073),
5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фуран-2-карбоновая кислота (соединение 1074a, соединение 1074b и соединение 1074c),
{3-[3-(4-фторфенил)[1,2,4]оксадиазол-5-ил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1075),
((R)-1-нафталин-1-илэтил){3-[3-(4-трифторметилфенил)[1,2,4]оксадиазол-5-ил]циклогексил}амин (соединение 1076),
((R)-1-нафталин-1-илэтил)[3-(3-фенил-[1,2,4]оксадиазол-5-ил)циклогексил]амин (соединение 1077),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1078),
N-бензилокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1079),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 4-йодфениловый сложный эфир (соединение 1080),
2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}этансульфоновая кислота (соединение 1081),
N-((R)-1-гидроксиметилпропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1082),
N-((S)-1-гидроксиметилпропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1083),
N-(2-цианоэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1084),
N-(2-морфолин-4-илэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1085),
N-(2-фторэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1086),
N-(2,2-дифторэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1087),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1088),
N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-пиридин-4-илметилбензамид (соединение 1089),
N-(2-диметиламиноэтил)-N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1090),
(2-гидроксиметилпирролидин-1-ил){4-[3-(1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1091),
N-(2-ацетиламиноэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1092),
N-этил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1093),
N-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1094),
N-(2-гидрокси-1-гидроксиметил-1-метилэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1095),
N-(2-метоксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1096),
N-(2-меркаптоэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1097),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}уксусная кислота, этиловый сложный эфир (соединение 1098),
N,N-диметил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1099),
N-(2-гидроксиэтил)N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1100),
N-этил-N-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1101),
N,N-бис-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1102),
N-(2-диметиламиноэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1103),
N-(3-диметиламинопропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1104),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пиперидин-1-илметанон (соединение 1105),
(4-метилпиперазин-1-ил){4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1106),
[4-(2-гидроксиэтил)пиперазин-1-ил]{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1107),
морфолин-4-ил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1108),
(4-гидроксипиперидин-1-ил){4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1109),
N-(3-имидазол-1-илпропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1110),
3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновая кислота (соединение 1111),
{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино)уксусная кислота (соединение 1115),
(S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}янтарная кислота, 4-трет-бутиловый сложный эфир, 1-метиловый сложный эфир (соединение 1116),
(S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}янтарная кислота, 4-трет-бутиловый сложный эфир (соединение 1117),
(R)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовая кислота, метиловый сложный эфир (соединение 1118),
(R)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовая кислота (соединение 1119),
(S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовая кислота, метиловый сложный эфир (соединение 1120),
(S)-2-[4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовая кислота, гидрохлорид (соединение 1121),
(S)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1122),
(S)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота (соединение 1123),
(R)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1124),
(R)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота (соединение 1125),
(циклогексил-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота, этиловый сложный эфир (соединение 1126),
2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}малоновая кислота, диэтиловый сложный эфир (соединение 1127),
(S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, трет-бутиловый сложный эфир (соединение 1128),
5-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}никотиновая кислота (соединение 1129),
4-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}бензойная кислота (соединение 1130),
4-метокси-3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}бензойная кислота, метиловый сложный эфир, гидрохлорид (соединение 1131),
2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}бензойная кислота, гидрохлорид (соединение 1132),
(карбоксиметил-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота, гидрохлорид (соединение 1133),
1-({4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}метил)циклопентанкарбоновая кислота (соединение 1134),
1-({4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклопентанкарбоновая кислота, гидрохлорид (соединение 1135),
3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, гидрохлорид (соединение 1136),
(1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклогексил)уксусная кислота, гидрохлорид (соединение 1137),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклопропанкарбоновая кислота, этиловый сложный эфир (соединение 1138),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклопропанкарбоновая кислота (соединение 1139),
1-({4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}метил)циклопропанкарбоновая кислота (соединение 1140),
2-метил-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота (соединение 1141),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}азетидин-3-карбоновая кислота (соединение 1142),
(метил-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота (соединение 1143),
4-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}масляная кислота (соединение 1144),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пиперидин-4-карбоновая кислота, этиловый сложный эфир (соединение 1145),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пиперидин-4-карбоновая кислота (соединение 1146),
(циклогексил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота, этиловый сложный эфир (соединение 1147),
(циклогексил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота (соединение 1148),
4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-((R)-2-оксотетрагидрофуран-3-ил)бензамид (соединение 1149),
N-цианометил-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1150),
N-(4-циано-1H-пиразол-3-ил)-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1151),
(R)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, бензиловый сложный эфир (соединение 1152),
(S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, бензиловый сложный эфир (соединение 1153),
(S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1154),
(R)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1155),
(S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, этиловый сложный эфир, гидрохлорид (соединение 1156),
3-гидрокси-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, гидрохлорид (соединение 1157),
(R)-4-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}масляная кислота (соединение 1158),
N-трет-бутокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид, формиат (соединение 1159),
N-трет-бутокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид, формиат (соединение 1160),
N-метокси~4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид, формиат (соединение 1161),
N-метокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид; формиат (соединение 1162),
4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-(тетрагидрофуран-3-илметокси)бензамид (соединение 1163),
4-[3-(R)-1-нафталин-1-илэтиламино)циклогексил]-N-(тетрагидрофуран-3-илметокси)бензамид (соединение 1164),
N-метокси-N-метил-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид, бисформиат (соединение 1165),
N-метокси-N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1166),
N-бензилокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1167),
N-бензилокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1168),
N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1169),
N-гидрокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1170),
N-(2-морфолин-4-ил-2-оксоэтокси)-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1171),
N-(2-морфолин-4-ил-2-оксоэтокси)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1172),
N-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}метансульфонамид (соединение 1173),
4R-гидрокси-1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пирролидин-2S-карбоновая кислота, метиловый сложный эфир (соединение 1174),
4R-гидрокси-1-{4-[(1S,3S)-3-(R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пирролидин-2S-карбоновая кислота (соединение 1175),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}метансульфонамид, гидрохлорид (соединение 1176),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, этиловый сложный эфир (соединение 1177/1178),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, этиловый сложный эфир (соединение 1179/1180),
3-{4-[(3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, метиловый сложный эфир (соединения 1181/1182/1183/1184),
{4-[3-(R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1185),
{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1186),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1187),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1188),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1189),
3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, гидрохлорид (соединение 1190),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1191),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1192),
{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, этиловый сложный эфир (соединения 1193/1194/1195/1196),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, этиловый сложный эфир (соединения 1197/1198/1198/1200),
{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, гидрохлорид (соединение 1201),
{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1202),
{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1203),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, гидрохлорид (соединение 1204),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1205),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1206),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1207),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, гидрохлорид (соединение 1208),
[3-(4-йодфенил)циклогексил]((R)-1-нафталин-1-илэтил)амин (соединение 1209),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пирролидин-2-он (соединение 1210),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}оксазолидин-2-он (соединение 1211),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}ацетамид (соединение 1212),
4-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}тетрагидропиран-4-ол (соединение 1213),
[3-(4-имидазол-1-илфенил)циклогексил]((R)-1-нафталин-1-илэтил)амин (соединение 1214),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}циклопентанол (соединение 1215),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}этанон (соединение 1216),
4-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}тетрагидропиран-4-ол, гидрохлорид (соединение 1217),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанол (соединение 1218),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}циклобутанол (соединение 1219),
2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}малоновая кислота, диэтиловый сложный эфир (соединение 1220),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}уксусная кислота, этиловый сложный эфир (соединение 1221),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}уксусная кислота (соединение 1222),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}оксетан-3-ол (соединение 1223),
{3-[4-(3-фтор-оксетан-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1224),
{3-[4-(3-амино-3-метилбут-1-инил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1225),
{3-[4-(5-циклопропил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1226),
{3-[4-(5-циклопентил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1227),
{3-[4-(5-метил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1228),
{3-[4-(5-изопропил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1229),
{3-[4-(5-трет-бутил[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1230),
{3-[4-(5-циклогексил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1231),
(3-{4-[5-(3-метилбутил)-[1,2,4]оксадиазол-3-ил]фенил}циклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1232),
5-(3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}-[1,2,4]оксадиазол-5-илметил)имидазолидин-2,4-дион (соединение 1233),
(3-{4-[5-(4-метилоксазол-5-ил)-[1,2,4]оксадиазол-3-ил]фенил}циклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1234),
(3-{4-[5-(2,5-диметилоксазол-4-ил)-[1,2,4]оксадиазол-3-ил]фенил}циклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1235),
2-метил-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионитрил (соединение 1236/1237),
2-метил-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионовая кислота (соединение 1238),
2-метил-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионовая кислота (соединение 1239),
[3-(4-метансульфонилфенил)циклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1240),
2-фтор-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, метиловый сложный эфир (соединение 1241),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанол (соединение 1242),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}метансульфонамид (соединение 1243),
{3-[4-(морфолин-4-сульфонил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединения 1244/1245),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}ацетамид (соединения 1246/1247),
3-фтор-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, метиловый сложный эфир (соединение 1248),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метансульфонамид (соединения 1249/1250),
N-{3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метансульфонамид (соединение 1251),
N-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензолсульфонамид (соединения 1252/1253),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионовая кислота (соединение 1254),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенокси}уксусная кислота (соединение 1255),
[3-(4-метансульфонилфенил)циклопентил]-((R)-1-нафталин-1-илэтил)амин (соединения 1256/1257),
N-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}метансульфонамид (соединения 1258/1259),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}ацетамид (соединения 1260/1261),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензил}ацетамид (соединения 1262/1263),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензил}метансульфонамид (соединения 1264/1265),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}метансульфонамид (соединения 1266/1267),
[3-(4-метансульфонилфенил)циклогептил]-((R)-1-нафталин-1-илэтил)амин (соединение 1268),
2-фтор-4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]бензойная кислота, метиловый сложный эфир (соединение 1269),
N-{3-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}метансульфонамид (соединение 1270),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}ацетамид (соединения 1271/1272),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]бензил}ацетамид (соединения 1273/1274),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]бензил}метансульфонамид (соединения 1275/1276),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенокси}уксусная кислота, этиловый сложный эфир (соединение 1277),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}пропионовая кислота, метиловый сложный эфир (соединения 1278/1279),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}метансульфонамид (соединения 1280/1281),
{3-[4-(морфолин-4-сульфонил)фенил]циклогептил}-((R)-1-нафталин-1-илэтил)амин (соединение 1282),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}метанол (соединение 1283),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, метиловый сложный эфир (соединение 1284),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, этиловый сложный эфир (соединение 1285),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2-морфолин-4-илэтиловый сложный эфир, дигидрохлорид (соединение 1286),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2-(2-метоксиэтокси)этиловый сложный эфир, гидрохлорид (соединение 1287),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2-[2-(2-метоксиэтокси)этокси]этиловый сложный эфир, гидрохлорид (соединение 1288),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2-[2-(2-этоксиэтокси)этокси]этиловый сложный эфир, гидрохлорид (соединение 1289),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2,3-дигидроксипропиловый сложный эфир, гидрохлорид (соединение 1290),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, тетрагидрофуран-2-илметиловый сложный эфир, гидрохлорид (соединение 1291),
4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенол (соединение 1292),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}масляная кислота, этиловый сложный эфир (соединение 1293),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}масляная кислота (соединение 1294),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовая кислота (соединение 1295),
3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}дигидрофуран-2-он (соединение 1296),
(S)-{3R-[4-(2-этоксиэтокси)фенил]циклопентил}-((R)-1-нафталин-1-илэтил)амин (соединение 1297),
3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовая кислота, этиловый сложный эфир (соединение 1298),
4-(4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]феноксиметил}бензонитрил (соединение 1299),
(S)-((R)-1-нафталин-1-илэтил)-{3R-[4-(пиридин-3-илметокси)фенил]циклопентил}амин (соединение 1300),
(S)-((R)-1-нафталин-1-илэтил)-{3R-[4-(2-пиразол-1-илэтокси)фенил]циклопентил}амин (соединение 1301),
(S)-(3R-{4-[2-(1H-индол-3-ил)этокси]фенил}циклопентил)-((R)-1-нафталин-1-илэтил)амин (соединение 1302),
2-метил-2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовая кислота, гидрохлорид (соединение 1303),
4-гидрокси-2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}масляная кислота (соединение 1304),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовая кислота, гидрохлорид (соединение 1305),
{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}фенилуксусная кислота, гидрохлорид (соединение 1306),
2-метил-1-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропан-2-ол (соединение 1307),
3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]феноксиметил}пентан-3-ол (соединение 1308),
диметил-карбаминовая кислота 4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фениловый сложный эфир (соединение 1309),
3-этил-1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пентан-3-ол (соединение 1310),
2-метил-4-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}бутан-2-ол (соединение 1311),
3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропан-1,2-диол (соединение 1312),
(2-фторфенил)-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, гидрохлорид (соединение 1313),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}этанол, формиат (соединение 1314),
(1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}пирролидин-2-ил)метанол (соединение 1315),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}пирролидин-3-ол (соединение 1316),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}пиперидин-3-карбоновая кислота, этиловый сложный эфир (соединение 1317),
[3-(4-{[метил(тетрагидрофуран-2-илметил)амино]метил}фенил)циклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1318),
3-(4-{(1S,3S)-3-[(R)-1-(4-фтор-3-метоксифенил)этиламино]циклопентил}фенил)пропионовая кислота, этиловый сложный эфир (соединение 1319),
3-(4-{(1S,3S)-3-[(R)-1-(3-цианофенил)этиламино]циклопентил}фенил)пропионовая кислота, этиловый сложный эфир (соединение 1320),
3-{4-[(1S,3S)-3-((R)-1-бензо[b]тиофен-3-илэтиламино)циклопентил]фенил}пропионовая кислота, этиловый сложный эфир (соединение 1321),
3-(4-{(1S,3S)-3-[(R)-1-(2,3-дигидробензо[1,4]диоксин-6-ил)этиламино]циклопентил}фенил)пропионовая кислота, этиловый сложный эфир (соединение 1322),
3-{4-[(1S,3S)-3-((R)-1-фенилэтиламино)циклопентил]фенил}пропионовая кислота, этиловый сложный эфир (соединение 1323),
3-(4-{(1S,3S)-3-[(R)-1-(2,3-дигидробензофуран-5-ил)этиламино]циклопентил}фенил)пропионовая кислота, этиловый сложный эфир (соединение 1324),
3-(4-{(1S,3S)-3-[(R)-1-(1H-индол-7-ил)этиламино]циклопентил}фенил)пропионовая кислота, гидроформиат (соединение 1325),
3-(4-{(1S,3S)-3-[(R)-1-(2,3-дигидробензо[1,4]диоксин-5-ил)этиламино]циклопентил}фенил)пропионовая кислота, гидроформиат (соединение 1326),
3-(4-{(1S,3S)-3-[(R)-1-(1H-индол-4-ил)этиламино]циклопентил}фенил)пропионовая кислота, гидроформиат (соединение 1327),
3-(4-{(1S,3S)-3-[(R)-1-(3-цианофенил)этиламино]циклопентил}фенил)пропионовая кислота, гидроформиат (соединение 1328),
3-(4-{(1S,3S)-3-[(R)-1-(3-пирролидин-1-илфенил)этиламино]циклопентил}фенил)пропионовая кислота, гидроформиат (соединение 1329),
3-(4-{(1S,3S)-3-[(R)-1-(2,3-дигидробензофуран-5-ил)этиламино]циклопентил}фенил)пропионовая кислота, гидроформиат (соединение 1330),
3-(4-{(1S,3S)-3-[(R)-1-(2,3-дигидробензо[1,4]диоксин-6-ил)этиламино]циклопентил}фенил)пропионовая кислота (соединение 1331),
3-(4-{(1S,3S)-3-[(R)-1-(4-фтор-3-метокси-1-илфенил)этиламино]циклопентил}фенил)пропионовая кислота (соединение 1332),
3-{4-[(1S,3S)-3-((R)-1-бензо[b]тиофен-3-илэтиламино)циклопентил]фенил}пропионовая кислота, гидрохлорид (соединение 1333),
3-{4-[(1S,3S)-3-((R)-1-фенилэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1334),
4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензойная кислота, этиловый сложный эфир (соединение 1335/1336),
4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензойная кислота, (соединение 1337),
4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензойная кислота, (соединение 1338),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1339),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензоил}пиперидин-4-карбоновая кислота, гидрохлорид (соединение 1340),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензоиламино}пропионовая кислота, гидрохлорид (соединение 1341),
4-[3-((R)-1-нафталин-1-илэтиламино)циклопентилокси]бензойная кислота, метиловый сложный эфир (соединение 1342),
4-[3R-((R)-1-нафталин-1-илэтиламино)циклопентилокси]бензойная кислота, формиат (соединение 1343),
5-метил-3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]-3H-имидазол-4-карбоновая кислота (соединение 1344),
(3S,4S-дифенилциклопентил)-((R)-1-нафталин-1-илэтил)амин (соединение 1345),
5-(4-этоксифенил-2-пропилциклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1346),
[2-(4-фторфенил)-5-((R)-1-нафталин-1-илэтиламино)циклопентил]уксусная кислота, гидрохлорид (соединение 1347) или
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропан-1-ол (соединение 1348).
Конкретные примеры промежуточных соединений для получения соединений формулы I могут быть выбраны из группы, состоящей из следующих соединений:
3-[3-(3-трифторметилфенил)-[1,2,4]оксадиазол-5-ил]циклобутанон (соединение 1112),
4-метил-N-(3-оксоциклопентанкарбонил)бензолсульфонамид (соединение 1113),
3-(3-трифторметилфенил)аминоциклогексанон (соединение 1114),
3-((R)-1-нафталин-1-илэтиламино)циклогексанкарбоновая кислота (приготовление 4),
3-(4-йодфенил)циклогексан-1-он (приготовление 5),
4-(3-оксоциклогексил)бензальдегид (приготовление 7),
3-[4-((1S)-3-оксоциклопентил)фенил]пропионовая кислота, этиловый сложный эфир (приготовление 8),
3-[4-((1S,3R)-3-ацетоксициклопентил)фенил]пропионовая кислота, этиловый сложный эфир (приготовление 9),
3-[4-((1S,3R)-3-гидроксициклопентил)фенил]пропионовая кислота, этиловый сложный эфир (приготовление 10),
3-[4-((1S,3R)-3-метансульфонилоксициклопентил)фенил]пропионовая кислота, этиловый сложный эфир (приготовление 11),
4-((1S,4S)-4-ацетоксициклопент-2-енилокси)бензойная кислота, метиловый сложный эфир (приготовление 13),
4-((1S,4S)-4-гидроксициклопент-2~енилокси)бензойная кислота, метиловый сложный эфир (приготовление 14),
4-((1S,4R)-4-хлорциклопент-2-енилокси)бензойная кислота, метиловый сложный эфир (приготовление 15),
4-[(1S,4S)-4-((R)-1-нафталин-1-илэтиламино)циклопент-2-енилокси]бензойная кислота, метиловый сложный эфир (приготовление 16),
3-((1S,4S)-4-ацетоксициклопент-2-енил)-5-метил-3H-имидазол-4-карбоновая кислота, этиловый сложный эфир (приготовление 17),
3-((1S,4S)-4-гидроксициклопент-2-енил)-5-метил-3H-имидазол-4-карбоновая кислота, этиловый сложный эфир (приготовление 18),
3-((1S,4R)-4-хлорциклопент-2-енил)-5-метил-3H-имидазол-4-карбоновая кислота, этиловый сложный эфир (приготовление 19) или
5-метил-3-[(1S,4S)-4-((R)-1-нафталин-1-илэтиламино)циклопент-2-енил]-3H-имидазол-4-карбоновая кислота, этиловый сложный эфир (приготовление 20).
Фармацевтические композиции
Для применения в терапии соединения по данному изобретению обычно находятся в форме фармацевтической композиции. Поэтому изобретение относится к фармацевтической композиции, как для ветеринарии (включая млекопитающих, таких как лошади, крупный рогатый скот, овцы, свиньи, собаки и кошки), так и для медицинского применения для людей, композиция содержит соединение формулы I, необязательно вместе с одним или несколькими другими терапевтически активными соединениями вместе с фармацевтически приемлемым эксципиентом или носителем. Эксципиент должен быть "приемлемым" в смысле совместимости с другими ингредиентами композиции и безвредности для его реципиента.
Удобно, когда содержание активного ингредиента 0,05-99,9% по массе композиции, например, 0,5-90%, такое как 5-85%, такое как 15-45%, предпочтительно 20-30%.
Фармацевтические композиции по изобретению могут быть в единичной дозированной форме, такой как таблетки, пилюли, капсулы, порошки, гранулы, эликсиры, сиропы, эмульсии, ампулы, суппозитории или парентеральные растворы или суспензии, для перорального, парентерального, глазного, чрескожного, внутрисуставного, местного, легочного, назального, защечного или ректального введения или введения каким-либо другим способом, подходящим для композиции соединений, используемой в нефрологии и в соответствии с принятой практикой, как это раскрыто в Remington: The Science and Practice of Pharmacy, 21st ed., 2005, Lippincott Williams & Wilkins. В композиции по изобретению активный компонент может быть представлен в количестве от около 0,01 до около 99%, таком как от 0,1% до около 10% по массе композиции.
Для перорального введения в форме таблетки или капсулы соединение формулы I может быть подходяще объединено с нетоксичным орально и фармацевтически приемлемым носителем, таким как этанол, глицерин, вода или тому подобное. Кроме того, соответствующие связующие, лубриканты, дезинтегрирующие агенты, ароматизирующие агенты и красители могут быть добавлены к смеси подобающим образом. Подходящие связующие включают, например, лактозу, глюкозу, крахмал, желатин, камедь акации, трагакантовую камедь, альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски или тому подобное. Лубриканты включают, например, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия или тому подобное. Дезинтегрирующие агенты включают, например, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь или тому подобное. Дополнительные эксципиенты для капсул включают макроголы или липиды.
Для приготовления твердых композиций, таких как таблетки, активное соединение формулы I смешивают с одним или несколькими эксципиентами, такими как указанные выше, и другими фармацевтическими разбавителями, такими как вода, чтобы получить твердую предварительную композицию, содержащую гомогенную смесь соединения формулы I. Термин "гомогенная" следует понимать как означающий, что соединение формулы I равномерно диспергировано по всей композиции, так что композиция легко может быть разделена на равно эффективные единичные дозированные формы, такие как таблетки или капсулы. Предварительная композиция может быть затем разделена на единичные дозированные формы, содержащие от около 0,05 до около 1000 мг, в частности от около 0,1 до около 500 мг, например, 10-200 мг, такие как 30-180 мг, такие как 20-50 мг активного соединения по изобретению.
В форме единичной дозы соединение может быть введено один или несколько раз в сутки с соответствующими интервалами всегда в зависимости, однако, от состояния пациента и в соответствии с предписанием, сделанным лечащим врачем. Обычно единичная доза композиции содержит между 0,1 мг и 1000 мг, предпочтительно между 1 мг и 100 мг, например, 5-50 мг соединения формулы I.
Подходящая дозировка соединения по изобретению будет зависеть, наряду с прочим, от возраста и состояния пациента, тяжести болезни, требующей лечения, и других факторов, хорошо известных практикующему врачу. Соединение может быть введено или перорально, или парентерально, или местно согласно различным режимам дозирования, например, с суточными или недельными интервалами. Как правило, единичная доза будет находиться в пределах от 0,01 до 400 мг/кг массы тела. Соединение может быть введено как болюс (т.е. полную суточную дозу вводят за один раз) или отдельными дозами два или более раз в сутки.
Если лечение предусматривает введение другого терапевтически активного соединения, рекомендуется навести справки по поводу применимых дозировок указанных соединений в Goodman's The Pharmacological Basis of Therapeutics, 9th Ed., J.G. Hardman and L.E. Limbird (Eds.), VcGraw-Hill 1995. Введение соединения по данному изобретению с одним или несколькими другими активными соединениями может быть или одновременным, или последовательным.
Жидкие композиции либо для перорального, либо для парентерального введения соединения по изобретению включают, например, водные растворы, сиропы, водные или масляные суспензии и эмульсию с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают синтетические или натуральные камеди, такие как трагакант, альгинат, камедь акации, декстран, натриевая соль карбоксиметилцеллюлозы, желатин, метилцеллюлоза или поливинилпирролидон.
Для парентерального введения, например, внутримышечной, интраперитонеальной, подкожной или внутривенной инъекцией или вливанием, фармацевтическая композиция предпочтительно содержит соединение формулы I, растворенное или солюбилизированное в соответствующем фармацевтически приемлемом растворителе. Для парентерального введения композиция по изобретению может включать стерильный водный или неводный растворитель, в частности воду, изотонический солевой раствор, изотонический раствор глюкозы, буферный раствор или другой растворитель, обычно используемый для парентерального введения терапевтически активных веществ. Композиция может быть стерилизована, например, фильтрованием через задерживающий бактерии фильтр, добавлением стерилизующего агента к композиции, облучением композиции или нагреванием композиции. В качестве варианта, соединение по изобретению может быть предоставлено в виде стерильного твердого препарата, например, высушенного вымораживанием порошка, который растворяют в стерильном растворителе непосредственно перед применением.
Композиция, предназначенная для парентерального введения, дополнительно может содержать традиционные добавки, такие как стабилизаторы, буферы или консерванты, например, антиоксиданты, такие как метилгидроксибензоат, или тому подобное.
Композиции для ректального введения могут быть в форме суппозитория, содержащего активный ингредиент и носитель, такой как какао-масло, или в форме клизмы.
Композиции, подходящие для внутрисуставного введения, могут быть в форме стерильного водного препарата активного ингредиента, который может быть в микрокристаллической форме, например, в форме водной микрокристаллической суспензии. Липосомные композиции или биоразлагаемые полимерные системы также могут быть использованы для предоставления активного ингредиента как для внутрисуставного, так и для глазного введения.
Композиции, подходящие для местного введения, включая лечение глаз, включают жидкие и полужидкие препараты, такие как жидкие мази, лосьоны, гели, аппликанты, эмульсии типа масло в воде или вода в масле, такие как кремы, мази или пасты; или растворы или суспензии, такие как капли. Для местного введения соединение формулы I обычно может присутствовать в количестве от 0,01 до 20% по массе композиции, например, от 0,1% до около 10%, но может также присутствовать в количестве вплоть до около 50% композиции. Композиции для лечения глаз предпочтительно могут дополнительно содержать циклодекстрин.
Композиции, предназначенные для введения в носовую или защечную полость или для ингаляции, включают порошок, самоиспускаемые или распыляемые композиции, такие как аэрозоли и пульверизаторы. Такие композиции могут содержать соединение формулы I в количестве 0,01-20%, например, 2%, по массе композиции.
Композиция дополнительно может содержать один или несколько других активных компонентов, обычно используемых при лечении физиологических расстройств или заболеваний, связанных с нарушениями активности CaSR, таких как гиперпаратиреоз.
Подходящая дозировка соединения по изобретению будет зависеть, наряду с прочим, от возраста и состояния пациента, тяжести заболевания, требующего лечения, и других факторов, хорошо известных практикующему врачу. Соединение может быть введено перорально, парентерально или местно согласно различным режимам дозирования, например, ежедневно или с недельными интервалами. Как правило, единичная доза будет находиться в пределах от 0,01 до 400 мг/кг массы тела. Соединение может быть введено как болюс (т.е. полную суточную дозу вводят за один раз) или разделенными дозами два или более раз в сутки.
Фармакологические методы
Восприимчивый к кальцию рецептор (CaSR) и его применение для идентификации или скрининга кальцимиметических соединений описаны в ЕР 637237, ЕР 1296142, ЕР 1100826, ЕР 1335978 и ЕР 1594446.
In vitro и in vivo методы испытания соединений по данному изобретению хорошо установлены и могут быть найдены в ссылках, перечисленных выше, или, например, в Journal of Biological Chemistry (2004), 279(8), 7254-7263 или в US 5858684 и цитируемых там ссылках.
Биологическая проба для анализа активности in vitro
Проба исследует функциональную способность соединения действовать в качестве биологического позитивного модулятора на CaSR человека. Активацию рецептора, экспрессированного на клетках СНО-К1, определяют через путь G альфа q, активацию фосфолипазы С и накопление внутриклеточного инозитфосфата (IP), как описано ранее [Sandrine Ferry, Bruno Chatel, Robert H. Dodd, Christine Lair, Danielle Gully, Jean-Pierre Maffrand, and Martial Ruat, Effects of Divalent Cations and of a Calcimimetic on Adrenocorticotropic Hormone Release in Pituitary Tumor Cells. Biochemical and biophysical research communications 238, 866-873 (1997)]. CaSR человека стабильно экпрессируют на клоне клеток СНО-К1, стимулируют базовым уровнем кальция и провоцируют испытуемым соединением. Уровень IP1 определяют с помощью набора IP-One htrf (Cisbio, France). Клетки СНО-К1, не подвергнутые трансфекции с применением CaSR, недостаточны, чтобы вызвать ответную реакцию IP1 на стимуляцию кальцием и/или соединением.
Клонирование гена CaSR человека
ORF, кодирующий CaSR человека, (банк генов: NM_000388) приобретали у Invirtro Corp., USA, и после этого клонировали в экспрессирующем векторе млекопитающего pCDA3.1.
Генерация клеточной линии, экспрессирующей CaSR
Клетки СНО-К1 подвергали трансфекции с применением липофектамина, согласно протоколу производителя (400000 клеток/лунка высевали в 6-луночный планшет и спустя 24 часа подвергали трансфекции с применением 2 мкг ДНК и 5 мкл липофектамина). Спустя еще 24 часа клетки отделяли, высевали и подвергали воздействию 1 мг/мл G-418. После 7 суток роста отдельные клоны собирали, экспрессию CaSR оценивали с помощью антитела 5С10 против CaSR, клоны с наивысшей экспрессией отбирали и испытывали на функциональную ответную реакцию. Предпочтительный клон непрерывно культивировали согласно стандартным процедурам, описанным в протоколах АТСС (Американской коллекции типичных культур) для СНО-К1, с добавлением 500 мкг/мл G-418.
Как указано выше, соединения, описанные в данной заявке на изобретение, являются модуляторами активности CaSR. CaSR может быть найден в околощитовидной железе, щитовидной железе, костных клетках, желудке, легких, почках, гипофизе, головном мозге, гипоталамусе, обонятельных полях гиппокампа. Соединения по данному изобретению могут быть предпочтительно более селективными, при их применении, по отношению к рецепторам околощитовидной железы по сравнению с рецепторами щитовидной железы.
Соединения по данному изобретению и содержащие их фармацевтические композиции могут быть использованы как медицинский продукт, в частности, для лечения физиологических расстройств или заболеваний, связанных с нарушениями активности CaSR. Еще более конкретно, эти физиологические расстройства или заболевания типа, включающего первичный и вторичный гиперпаратиреоз, остеопороз, сердечно-сосудистые, желудочно-кишечные, эндокринные или нейродегенеративные заболевания или некоторые виды рака, при которых содержание ионов (Са2+)е является аномально высоким. Вторичный гиперпаратиреоз особенно часто наблюдается при хронической почечной недостаточности.
Следующие способы получения и неограничивающие примеры даны для того, чтобы дать возможность специалисту понять и осуществить изобретение.
Примеры, описанные более подробно в следующих неограничивающих примерах, не предназначены так или иначе ограничивать объем заявленного изобретения, но рассматриваются просто как иллюстративные и типичные.
Способы получения
Соединения общей формулы I могут быть получены разными путями, известными специалистам в области органического синтеза. Соединения общей формулы I могут быть синтезированы с применением способов, описанных в общих чертах ниже, наряду со способами, известными в области органической химии, или их вариантами, как это понятно специалистам в этой области. Предпочтительные способы включают те, которые описаны ниже, но не ограничиваются только ими.
Соединения формулы I могут быть получены путем методик и процедур, легко доступных специалисту, например путем следующих процедур, которые показаны на следующих схемах. Реакции осуществляют в растворителях, соответствующих используемым реагентам и материалам и подходящих для осуществляемых преобразований. Кроме того, в описанных ниже способах синтеза, как это должно быть понятно, все предлагаемые условия реакции, включая выбор растворителя, атмосферу реакции, температуру реакции, длительность эксперимента и процедуры обработки, выбирают так, чтобы это были условия нормы для той реакции, которые должны быть вполне очевидными для специалиста. Специалисту в области органического синтеза понятно, что функциональные группы, присутствующие на различных частях исходных молекул, в реакции должны быть совместимыми с предлагаемыми реагентами и реакциями. Не все соединения формулы I в данном классе могут быть совместимыми с некоторыми условиями реакции, требующимися в некоторых описанных способах. Такие ограничения к заместителям, которые являются совместимыми с условиями реакции, будут вполне очевидны специалисту, и могут быть использованы альтернативные способы.
Схемы, описанные в данном разделе, не предназначены для ограничения объема изобретения, так или иначе. Все заместители, если не указано иное, предварительно определены. Реагенты и исходные материалы или доступны от коммерческих поставщиков, или их получают способами, известными обычному специалисту, следуя процедурам, объясняемым в ссылках, таких как Feiser and Feiser's Reagent for Organic Synthesis, Volumes 1-22 (John Willey and Sons, 2004); Rodd's Chemistry of Carbon Compounds, Volumes 1-5 and Supplements (Elselvier Science Publishers, 2000); Organic Reactions, Volumes 1-64 (John Willey and Sons, 2004); March's Advanced Organic Chemistry (John Willey and Sons, 5th Edition) and Larock's Comprehensive Organic Transformations (VCH Publishers Inc., 1999). Эти схемы просто поясняют некоторые способы, которыми могут быть синтезированы соединения по изобретению, и различные модификации указанных схем могут быть сделаны и предложены в распоряжение специалиста в области техники, имеющей отношение к данному раскрытию. Исходные материалы и промежуточные соединения реакций могут быть выделены и очищены, если желательно, с применением традиционных технических приемов, включая, но без ограничения указанным, фильтрование, перегонку, кристаллизацию, хроматографию и тому подобное. Такие материалы могут быть охарактеризованы с применением обычных средств, включая физические константы и спектральные данные.
Соединения общей формулы I могут быть получены восстановительным аминированием между циклическим кетоном общей формулы II и амином общей формулы III. Реакция между кетоном II и амином III может быть проведена или путем восстановительного аминирования в одном реакторе, или с выделением имина с последующим восстановлением.

a. Образование промежуточного соединения иминия IV может быть промотировано добавлением протонной или апротонной кислоты, такой как, но без ограничения, уксусная кислота и Ti(Oi-Pr)4, соответственно. Восстановителем может быть, но без ограничения, Na(CN)BH3, NaBH4, Na(OAc)3BH (для других неограничивающих условий смотри Org. React. 2002, 59, 1-714 и цитированные там ссылки).
b. Образование имина промотируют или кислотами Льюиса, такими как TiCl4, ZnCl2, AlCl3, или основаниями, такими как пиридин, возможно в присутствии осушающего агента, такого как TiCl4, или молекулярного сита (смотри Comprehensive Organic Functionnal Group Transformations 3, 403 (1995) Pergamon).
c. Восстановление может быть осуществлено гидрированием в присутствии катализатора, такого как Pd/C, Pt/C или хиральный комплекс родия, чтобы осуществить реакцию стереоселективным образом, или путем переноса гидрида от восстановителя, такого как BH3, NaBH4, NaBH3CN, LiAlH4, L-селектрид (смотри Larock R. C. Comprehensive Organic Transformations 1989, VCH; Comprehensive Organic Functionnal Croup Transformations 2, 268-269 (2005) Pergamon и цитированные там ссылки).
Соединения общей формулы I могут быть также получены путем алкилирования амина III.

LG = уходящая группа (leaving group)
d. Когда LG означает уходящую группу, такую как хлорид, бромид, йодид, тозилат или трифлат, алкилирование проводят в присутствии основания, такого как NEt3, DIPEA, NaH, NaOH, KOH, карбонаты, в соответствующем растворителе, таком как DMF, пиридин, DMSO, CH3CN, ацетон, толуол. В качестве варианта может рассматриваться также реакция со спиртом (LG=OH). Такую реакцию, подобную реакции Митсунобу, осуществляют в присутствии фосфина, такого как PBu3, PPh3 и тому подобного, азодикарбоксилата или азокарбоксамида в апротонном растворителе, обычно THF. С этой целью амин III защищают/активируют как карбамат или сульфонамид. Полученное соединение освобождают от защитной группы, используя стандартные условия (Protective Groups in Organic Synthesis, T.W. Greene and P.G.M. Wuts, John Wiley and Sons, 3rd Edition 1999 и цитируемые там ссылки), чтобы получить соединение I.
Кетон II может быть получен различными способами:

LG=OH
e. Спирт Va может быть окислен, чтобы получить соединение II. Окисление может быть осуществлено многими различными реагентами. Некоторыми из них являются H2Cr2O7, Al2O3, MnO2, перйодинаны, DMSO в сочетании с DCC, уксусный ангидрид, оксалилхлорид и тому подобное.
Заместители G могут быть введены различными путями:
Циклоалкеноны могут быть использованы в качестве исходных материалов.

f. Реакция сочетания с арил/гетероарил галогенидом или псевдогалогенидом, таким как трифлат, в присутствии источника палладия, такого как Pd(OAc)2, PdCl2(PPh3)2, основания, такого как NEt3, K2CO3, NaHCO3, возможно с фосфином, таким как PPh3, P(o-Tol)3, 1,3-бис(дифенилфосфино)пропан (dppp), возможно в присутствии соли, подобной NBu4Cl, AgNO3, в растворителе, таком как DMF или ацетонитрил. В качестве варианта, может быть проведено декарбоксилирующее сочетание Heck-типа с применением арил/гетероарил карбоновой кислоты (Org. Lett. 2004, 6, 433).
g. Хемоспецифическое восстановление двойной связи может быть проведено в соответствующих условиях. Источником водорода может быть H2, вода, сложные эфиры Hantzsch. Катализаторы на основе металла, такие как Pd/C, Pd(PPh3)4, PdCl2 на носителе, катализаторы на основе Rh, Co, Cu, Ir могут быть использованы. Стереоселективность может быть достигнута добавлением хирального вспомогательного вещества, такого как, но без ограничения перечисленными, энантиомерно чистые производные бинафтол фосфата/валин, имидазолидинон иминий, бидентатные фосфины.
В качестве варианта циклоалкеноны могут быть подвергнуты 1,4-присоединению.
h. Реакция с арил/гетероарил металлом, в которой металлом может служить Li, галогенид Mg, триалкилолово, бороновая кислота, возможно в присутствии комплекса металла, такого как PdCl2, Pd(OAc)2, Pd(PPh3)4, (acac)Rh(CO)2, Ni(acac)2, (COD)Rh(1,4-дигидрохинон)BF4, с лигандом, обычно на основе фосфина, таким как PBu3, PPh3, 1,3-бис(дифенилфосфино)пропан (dppp), 1,3-гидрохинон или 1,4-гидрохинон, в растворителях, таких как DMF, THF, вода, толуол, диоксан, диметоксиэтан. В присутствии хирального лиганда в качестве чистого энантиомера, такого как BINAP, фосфорамидит, Me-DuPHOS и тому подобного, реакция может быть осуществлена стереоселективно.
1,4-Присоединение гетероатомных нуклеофилов ведет к соединениям общей формулы I. Реакция может быть катализирована реагентами, такими как, но без ограничения, NEt3, ScCl3, CAN, RuCl3, PtCl4, в растворителях типа CH2Cl2, CH3CN, DMF, толуол.
Циклоалкан-l,3-дионы могут быть использованы в качестве исходных материалов.
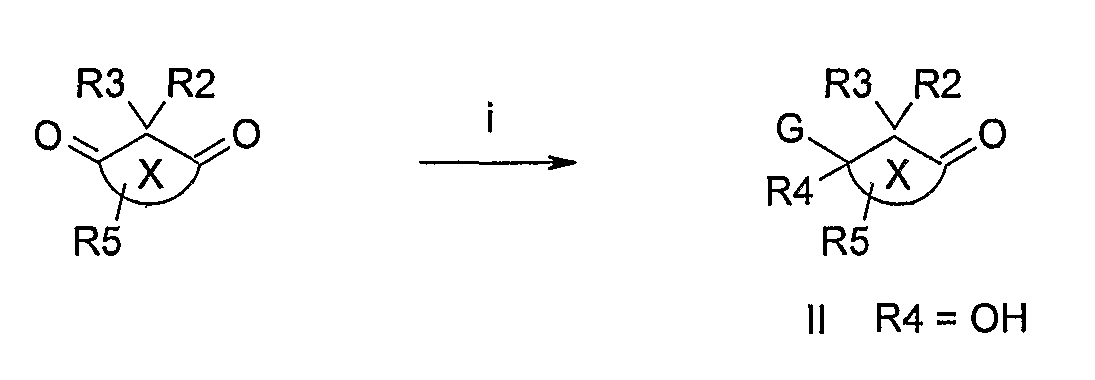
i. Присоединение металлорганических соединений, таких как GLi или GMgHal (Hal=Cl, Br) дает кетоспирт II (R4=OH). В качестве варианта, присоединение GBr при катализе индием может приводить к аналогичным кетоспиртам II (R4 = OH).

j. Замещение уходящей группы (LG), такой как хлорид, бромид, йодид, тозилат или трифлат, нуклеофилом, таким как амин или спирт, необязательно в присутствии основания, такого как NEt3, NaH, NaOH, KOH, карбонаты, в соответствующем растворителе, таком как DMF, пиридин, DMSO, CH3CN, ацетон, толуол.
Циклоалкан-3-он карбоксилаты (II, G=CO-Q) являются исходными материалами для различных соединений общей формулы I, где карбоксильная группа превращается в амиды или гетероциклы. Некоторые неограничивающие примеры приведены ниже.

k. Амид может быть образован с использованием амина и карбоновой кислоты (II, G=COOH) в присутствии агентов сочетания, таких как 1,1'-карбонилдиимидазол (CDI), дифенилфосфиновый хлорид (DPP-Cl), бензотриазолилокситрипирролидинофосфониЙ гексафторфосфат (PyBOP), бензотриазол-1-илокси-трис(диметиламино)фосфоний гексафторфосфат (BOP), пентафторфенил дифенилфосфинат (fdpp), N-[(диметиламино)-1Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-N-метилметанаминий гексафторфосфат N-оксид (HATU), бромтрипирролидинофосфоний гексафторфосфат (PyBroP), N,N'-дициклогексилкарбодиимид (DCC) или 1-этил-3-(3-диметиламинопропил)карбодиимид, гидрохлорид (EDCL). Реакция может быть осуществлена в растворителях, таких как диэтиловый простой эфир, дихлорметан, 1,2-дихлорэтан, тетрагидрофуран, 1-метил-2-пирролидинон, диметилсульфоксид или диметилформамид. Реакции обычно проводят в присутствии основания, такого как NEt3, DIPEA, коллидин или Bu3N, и предпочтительно в присутствии активатора, такого как HOBt (например, где HOBt используют для усовершенствования скоростей реакций, смотри Windridge, G. C.; Jorgensen, E. C. JACS 1971, 93, 6318) или HOAt.
Амид может быть также образован при взаимодействии амина III и хлорангидридом карбоновой кислоты (II, G = COCl). Хлорангидрид карбоновой кислоты может быть получен при взаимодействии карбоновой кислоты (II, G=COOH) с хлорирующими агентами, такими как тионилхлорид или оксалилхлорид.
I. Карбоксильная группа может быть превращена в оксазолы путем реакции с 1,2-аминоспиртами, 1,2-аминокетонами или 1,2-гидроксикетонами в присутствии источника азота, такого как NH4OAc, обычно через образование амида (смотри условие k) с последующей циклодегидратацией с применением реагентов, таких как полифосфорная кислота, п-толуолсульфоновая кислота, DBU/CBrCl3 или DDQ, в растворителях, таких как CCl4, CH2Cl2, THF, диоксан или DMF.
m. Превращение в 1,2,4-оксадиазол может быть осуществлено путем реакции с N-гидроксиамидинами в условиях образования амидной связи (смотри k) с последующей циклодегидратацией в присутствии дегидратирующих агентов, таких как CDI. В качестве варианта, взаимодействие сложных эфиров карбоновых кислот (II, G=COOMe или COOEt) с N-гидроксиамидинами в присутствии основания, такого как K2CO3, ведет к 1,2,4-оксадиазолу. Если N-гидроксиамидины коммерчески недоступны, они могут быть получены путем реакции N-гидроксиламингидрохлорида с нитрилами в присутствии основания, такого как K2CO3, NaHCO3, NEt3, KOH или MeONa.
Если необходимы специфические картины замещения на карбоцикле, может быть предусмотрен синтез самих карбоциклов. Многие общепринятые способы доступны, среди них реакции Дильса-Альдера, формирование колец по Робинсону, восстановление ароматических соединений по Birch, реакция Pauson-Khand, циклопропанирование 1-метоксициклоалкена с последующим расширением кольца, перегруппировка фуранов. Чтобы получить полный перечень, смотри всесторонние работы по органическому синтезу, цитируемые ранее в этом разделе.
Соединение общей формулы I может быть получено из другого соединения общей формулы I посредством взаимопревращения функциональных групп, хорошо известного специалисту в области органического синтеза. То есть, любая группа из R1-R5 или заместитель на G или на A могут быть превращены в другую функциональную группу. Этими взаимопревращениями могут быть, но без ограничения указанным, восстановление нитрила до амина, гидролиз нитрила до амида или до кислоты или гидролиз сложного эфира.
Многие общепринятые способы, описанные выше, могут быть использованы в различном порядке, когда это является подходящим.
ПРИМЕРЫ
Общее
Для спектра1H ядерного магнитного резонанса (ЯМР) (300 МГц) и13C ЯМР (75,6 МГц) величины химических сдвигов (δ) (в м.д.) приведены для растворов диметил-d6 сульфоксида (DMSO-d6) или CDCl3 по отношению к внутреннему тетраметилсилановому стандарту (δ=0). Величина мультиплета, будь то определенная (дублет (д), триплет (т), квартет (к)), или нет (м), дана при аппроксимированной средней точке, если диапазон не указан, (ш.с) обозначает широкий синглет. Масс-спектр ES получали на тройном квадрупольном масс-спектрометре VG Quattro II (Micromass, Manchester, UK), работающем в режиме либо положительного, либо отрицательного электрораспыления с конусным напряжением 30 В. Используемой микроволновой печью была модель Initiator™ от Biotage. Органические растворители использовали безводные, если не указано иное. Флэш-хроматографию проводили на силикагеле от Fluka Chemie GmbH, Switzerland. Используемыми картриджами для фазового разделения были Chromabond® от Macherey-Nagel GmbH.
Химикаты, если не указано иное, были из коммерческих источников, например, Aldrich, Maybridge Chemical, Fluka или ABCR.
Сокращения
LC/MS Способ A
Аналитическую HPLC/MS осуществляли на Dionex APS-системе с аналитическим насосом P680A и масс-спектрометром Thermo MSQ Plus (режим ионизации: ES+/ES-). Колонка: Waters XTerra C-18, 150 мм×4,6 мм, 5 мкм; подвижная фаза: A = вода (0,1% муравьиная кислота) и B = ацетонитрил (0,1% муравьиная кислота); расход = 1,0 мл/мин; способ (10 мин): способ линейного изменения градиента от 10% B до 100% за 6,6 минуты и оставление при 100% B на следующие 1,5 минуты.
LC/MS Способ B
Аналитическую HPLC/MS проводили на Waters 2795 Alliance-системе с аналитическим насосом Waters 996 DAD и масс-спектрометром Waters ZQ (режим ионизации: ES+/ES-). Колонка: Waters Waters XBridge RP18 3,0×50 мм, 5 мкм; подвижная фаза: A = H2O + 0,05% HCOOH и B = CH3CN + 0,05% HCOOH; расход = 1,0 мл/мин; способ (8 мин): способ линейного изменения градиента от 5% B до 95% B за 6 минут и оставления при 95% B еще на 1 минуту. Время удерживания на UV хроматограмме (RT) дано в минутах.
Общая процедура A
К раствору кетона (1 экв.) в 1,2-дихлорэтане (0,38 M) добавляли амин (1 экв.), ледяную AcOH (1 экв.) и NaBH(OAc)3 (1,4 экв.). Смесь перемешивали при к.т. в течение ночи, фильтровали и концентрировали в вакууме. При необходимости очистку осуществляли путем флэш-хроматографии с непрерывным градиентом.
Пример 1: Циклобутил-((R)-1-нафталин~1-илэтил)амин, гидрохлорид (соединение 1001)
Следовали общей процедуре A, используя циклобутанон (488 мг, 1,2 экв.) и (+)-(R)-1-нафталин-1-илэтиламин (1 г). Раствор перемешивали в течение 10 мин перед добавлением молекулярных сит 3Å, ледяной AcOH и NaBH(OAc)3. После удаления растворителя остаток забирали в MeCN (20 мл) и обрабатывали водн. 2 н. NaOH (10 мл), фильтровали и концентрировали в вакууме. Остаток растворяли в EtOAc, промывали водой, фильтровали и концентрировали в вакууме. Хроматография (EtOAc-MeOH 100:0 до 80:20) давала указанное в заголовке соединение.13C ЯМР (75,5 МГц, DMSO) δ: 134,58, 133,71, 130,61, 129,29, 129,25, 127,27, 126,48, 125,86, 125,06, 122,82, 50,43, 50,16, 26,90, 20,63, 15,19.
Общая процедура B
К раствору или суспензии кислоты (1 экв.) в DMF (1M) в атмосфере аргона добавляли CDI (1,2 экв.). Смесь перемешивали при к.т. в течение 3 ч перед добавлением амина (6 экв.). DIPEA (6 экв.) добавляли, если амин был приготовлен как гидрохлорид. Перемешивание продолжали в течение ночи при к.т. DMF удаляли в вакууме. При необходимости очистку осуществляли путем флэш-хроматографии с непрерывным градиентом.
Приготовление 1: 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота (соединение 1000)
К раствору 3-оксо-1-циклобутанкарбоновой кислоты (4,0 г) в 1,2-дихлорэтане (180 мл) добавляли (+)-(R)-1-нафталин-1-илэтиламин (6,0 г), ледяную AcOH (1 экв., 2,1 мл) и NaBH(OAc)3 (1,5 экв., 11,1 г). Смесь перемешивали при к.т. в течение 48 ч перед удалением растворителя. Остаток обрабатывали 1 н. NaOH (ca 100 мл) и pH доводили до 7 добавлением 4 н. HCl. Маслянистый осадок экстрагировали EtOAc. Твердое вещество, образовавшееся после экстракции, отфильтровывали и промывали EtOAc, чтобы получить указанное в заголовке соединение.
Пример 2: диметиламид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1002)

Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 100 мг) и гидрохлорид диметиламина (181 мг). Хроматография (CH2Cl2-MeOH/1% NEt3 100:0 до 70:30) давала указанное в заголовке соединение в виде масла (смесь 2 изомеров).13C ЯМР (75,5 МГц, DMSO) главный изомер δ: 174,53, 140,84, 133,98, 131,12, 129,02, 127,40, 125,87, 125,69, 125,36, 123,06, 122,79, 51,12, 49,31, 36,71, 35,48, 33,38, 32,84, 31,59, 23,35.
Пример 3: амид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1003)

Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 155 мг) и водн. NH3 (2,5 мл). Хроматография (CH2Cl2-MeOH 90:10 до 70:30) давала указанное в заголовке соединение. LC-MS (способ B): RT = 1,53, [M+H]+ = 269,3, [M-H]- = 267,4.
Пример 4: гидрохлорид (4-метилпиперазин-1-ил)-[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанона (соединение 1004)

Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 100 мг) и N-метилпиперазин (3 экв.) Экстрактивную обработку (EtOAc и вода) осуществляли перед хроматографией (CHZCl2-MeOH 95:5 до 70:30). Полученное масло обрабатывали HCl. Осадок отфильтровывали, получая указанное в заголовке соединение. LC-MS (способ B): RT = 1,37, [M+H]+ = 352,3.
Пример 5: циклопропиламид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1005)

Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 100 мг) и циклопропиламин. Хроматография (CH2Cl2-MeOH/1% NEt3 100:0 до 70:30) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,2, [M+H]+ = 309,3.
Пример 6: изопропиламид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1006)
Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 100 мг) и изопропиламин. Хроматография (CH2Cl2-MeOH/1% NEt3 100:0 до 70:30) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,3, [M+H]+ = 311,3.
Пример 7: пропиламид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1007)

Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 100 мг) и пропиламин. Хроматография (CH2Cl2-MeOH/1% NEt3 100:0 до 70:30) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,3, [M+H]+ = 311,1.
Пример 8: морфолин-4-ил-[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон (соединение 1008)
Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 100 мг) и морфолин. Хроматография (CH2Cl2-MeOH/1% NEt3 100:0 до 70:30) давала указанное в заголовке соединение в виде масла. LC-MS (способ B): RT = 2,16, [M+H]+ = 339,3.
Пример 9: трет-бутиламид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1009)
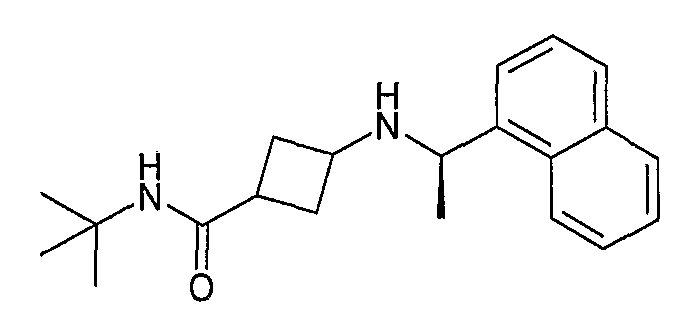
Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 100 мг) и трет-бутиламин. Хроматография (CH2Cl2-MeOH/1% NEt3 100:0 до 70:30) давала указанное в заголовке соединение в виде масла. LC-MS (способ B): RT = 2,6, [M+H]+ = 325,3.
Пример 10: этиламид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1010)

Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 100 мг) и этиламин. Хроматография (CH2Cl2-MeOH/1% NEt3 100:0 до 70:30) давала указанное в заголовке соединение в виде масла. LC-MS (способ B): RT = 2,13, [M+H]+ = 297,2.
Пример 11: гидрохлорид метоксиметиламида 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1011)

Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 100 мг) и гидрохлорид N,O-диметилгидроксиламина. Хроматография (CH2Cl2-MeOH/1% NEt3 100:0 до 70:30) давала указанное в заголовке соединение в виде масла. LC-MS (способ B): RT = 2,17/2,31, [M+H]+ = 313,2.
Общая процедура C
К раствору или суспензии кислоты (1 экв.) в DMF (1M) в атмосфере аргона добавляли CDI (1,2 экв.). Смесь перемешивали при к.т. в течение x ч перед добавлением N-гидроксиамидина (1,2 экв.). Перемешивание продолжали при к.т. в течение y ч. CDI (1,2 экв.) добавляли и смесь нагревали до 115°C в течение 1,5 ч. Смесь охлаждали до к.т., промывали водой, NaHCO3 и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. При необходимости очистку осуществляли путем флэш-хроматографии с непрерывным градиентом.
Пример 12: гидрохлорид [3-(3-изопропил-[1,2,4]оксадиазол-5-ил)циклобутил]-((R)-1-нафталин-1-илэтил)амина (соединение 1012)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 150 мг) и N'-гидрокси-2-метилпропанимидамид (x = 3 ч, y = 48 ч). Хроматография (PE-EtOAc 100:0 до 40:60) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Светложелтый осадок отфильтровывали и сушили в вакууме,получая указанное в заголовке соединение.13C ЯМР (150,9 МГц, DMSO) δ: 180,68, 174,28, 133,70, 133,25, 130,19, 129,05, 128,86, 126,90, 126,13, 125,43, 124,68, 122,45, 50,23, 48,16, 39,97, 30,09, 25,92, 25,72, 20,09.
Пример 13: гидрохлорид ((R)-1-нафталин-1-илэтил)-{3-[3-(3-трифторметилфенил)-[1,2,4]оксадиазол-5-ил]циклобутил}амина (соединение 1013)

Следовали общей процедуре С, используя 3-оксо-1-циклобутанкарбоновую кислоту (1,41 г, 12,4 ммоль) и 3-трифторметил-N-гидроксибензамидин (x = 1 ч, y = 17 ч). Хроматография (PE-EtOAc 80:20 до 70:30) давала 3-[3-(3-трифторметилфенил)-[1,2,4]оксадиазол-5-ил]циклобутанон (соединение 1112).
Следовали общей процедуре А, используя 3-[3-(3-трифторметилфенил)-[1,2,4]оксадиазол-5-ил]циклобутанон (690 мг) и (+)-(R)-1-нафталин-1-илэтиламин. Смесь обрабатывали следующим образом. К реакционной смеси добавляли Et2O. Органическую фазу промывали водн. NaOH (1 н.), водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме. Хроматография (PE-EtOAc 80:20 до 60:40) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O и растирании. Бесцветный осадок отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение. LC-MS(способ B): RT = 3,28, [M+H]+=438,2.
Пример 14: гидрохлорид [3-(3-метил-[1,2,4]оксадиазол-5-ил)циклобутил]-((R)-1-нафталин-1-илэтил)амина (соединение 1014)
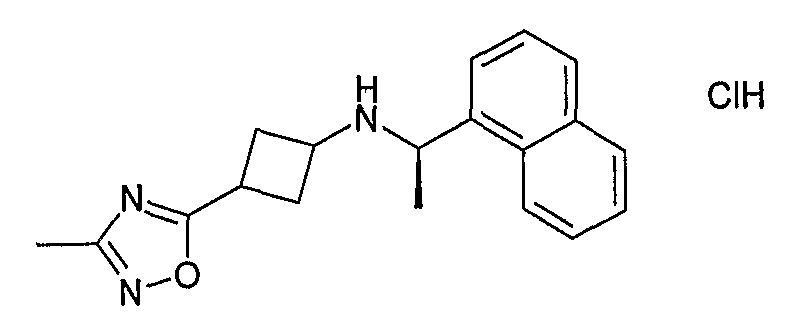
Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 150 мг) и N'-гидроксиэтанимидамид (x = 2 ч, y = 48 ч). Хроматография (PE-EtOAc 100:0 до 40:60) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O и растирании. Светложелтый осадок отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение. LC-MS (способ B): RT = 2,31, [M+H]+ = 308,2.
Пример 15: гидрохлорид ((R)-1-нафталин-1-илэтил)-[3-(3-фенил-[1,2,4]оксадиазол-5-ил)циклобутил]амина (соединение 1015)
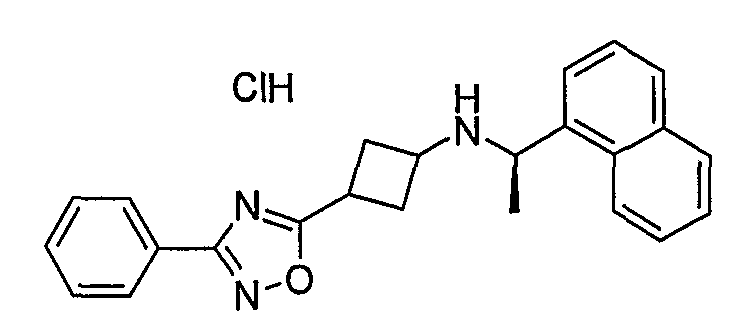
Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 150 мг) и бензамидоксим (x = 2 ч, y = 22 ч). Хроматография (PE-EtOAc 100:0 до 50:50) давала светложелтое масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Осадок отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение. LC-MS (способ B): RT = 3,04, [M+H]+ = 370,3.
Пример 16: гидрохлорид ((R)-1-нафталин-1-илэтил)-{3-[3-(4-трифторметилфенил)-[1,2,4]оксадиазол-5-ил]циклобутил}амина (соединение 1016)
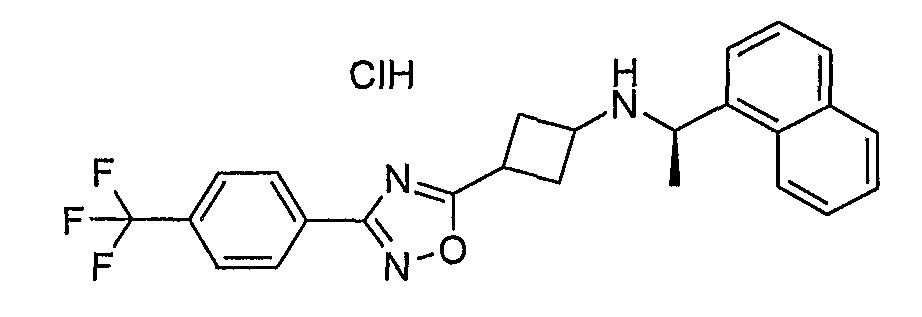
Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 150 мг) и 4-трифторметилбензамидоксим (x = 2 ч, y = 22 ч). Хроматография (PE-EtOAc 100:0 до 50:50) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Осадок отфильтровывали и сушили в вакууме,получая указанное в заголовке соединение. LC-MS (способ B): RT = 3,52, [M+H]+ = 438,2.
Пример 17: гидрохлорид {3-[3-(4-метоксифенил)-[1,2,4]оксадиазол-5-ил]циклобутил}-((R)-1-нафталин-1-илэтил)амина (соединение 1017)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновую кислоту (приготовление 1, 150 мг) и 4-метоксибензамидоксим (x = 1 ч, y = 22 ч). Хроматография (PE-EtOAc 100:0 до 40:60) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Осадок отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение. LC-MS (способ B): RT = 3,14, [M + H]+ = 400,3.
Приготовление 2: 3-Оксоциклобутанкарбонилхлорид
Оксалилхлорид (1,5 экв.) добавляли по каплям к раствору 3-оксоциклобутанкарбоновой кислоты (56 ммоль) в CH2Cl2 и DMF (1 капля) в атмосфере аргона. Раствор перемешивали при к.т. в течение 30 мин, потом концентрировали в вакууме,получая сырой 3-оксоциклобутанкарбонилхлорид, используемый без дополнительной очистки.
Общая процедура D
К раствору хлорангидрида кислоты (приготовление 2, 1,2 ммоль) в 1,2-дихлорэтане (0,5 мл) добавляли амин (1,2 ммоль) как CH2Cl2-раствор (1 мл) и NEt3 (1,5 экв.). Смесь взбалтывали при к.т. в течение ночи. 0,5 M водной HCl (0,5 мл) добавляли и смесь взбалтывали при к.т. в течение 2 ч. Фильтрование через картридж для разделения фаз давало органическую фазу, которую концентрировали в вакууме, получая сырой амид, используемый без дополнительной очистки.
К раствору амида (1,2 ммоль) в 1,2-дихлорэтане (1 мл) добавляли (+)-(R)-1-нафталин-1-илэтиламин (1 экв.) и ледяную AcOH (2 экв.). Смесь взбалтывали в течение 2 ч перед добавлением NaHB(OAc)3 (1,5 экв.). Взбалтывание продолжали при к.т. в течение ночи перед фильтрованием и концентрированием в вакууме. Остаток растворяли в DMSO (1 мл). 0,1 мл этого раствора очищали препаративной HPLC-MS, повторно анализировали путем HPLC-MS, способ A.
Пример 18: 4-хлорбензиламид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1018)

Следовали общей процедуре D, используя 4-хлорбензиламин, получая указанное в заголовке соединение в виде смеси 2 изомеров почти в равных количествах. LC/MS (СПОСОБ A): (m/z) 393,1 (MH+); RT (UV) = 5,11 мин.1H ЯМР (500 МГц, DMSO) δH 8,26 (т, 1H), 8,14-8,20 (м, 1H), 7,91 (д, 1H), 7,78 (д, 1H), 7,67 (т, 1H), 7,42-7,56 (м, 3H), 7,33 (дд, 2H), 7,19 (дд, 2H), 4,49-4,64 (м, 1H), 4,18 (дд, 1H), 2,80-3,03 (м, 2H), 1,79-2,24 (м, 4H), 1,36 (д, 3H) (один СН скрыт сигналом воды). LC-MS (способ B): RT 5,11, [M+H]+=393,1.
Пример 19: метиловый сложный эфир {[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}уксусной кислоты (соединение 1019)
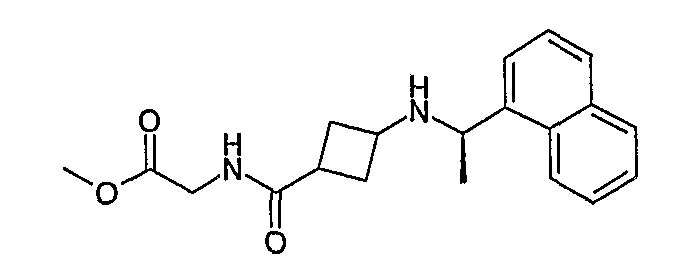
Следовали общей процедуре D, используя гидрохлорид метилового сложного эфира 2-аминоуксусной кислоты. LC-MS (способ B): RT = 4,32, [M+H]+ = 341,0.
Пример 20: (2-метоксиэтил)амид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1020)

Следовали общей процедуре D, используя 2-метоксиэтиламин. LC-MS (способ B): RT = 4,12, [M + H]+ = 327,1.
Пример 21: этиловый сложный эфир 4-{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}бензойной кислоты (соединение 1021)
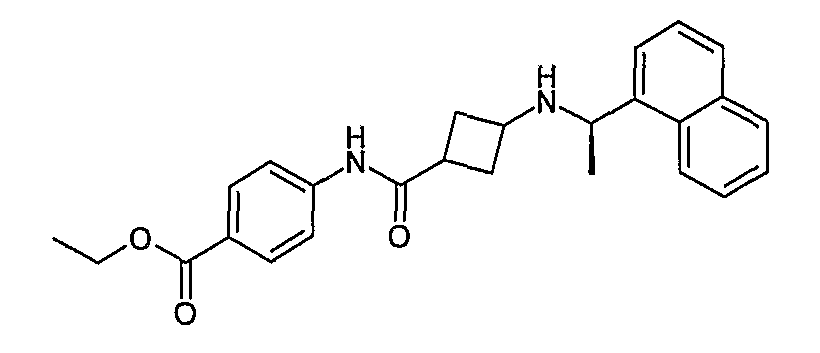
Следовали общей процедуре D, используя этиловый сложный эфир 4-аминобензойной кислоты. LC-MS (способ B): RT = 5,12, [M+H]+ = 417,2.
Пример 22: (2,6-диметилморфолин-4-ил)[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон (соединение 1022)

Следовали общей процедуре D, используя 2,6-диметилморфолин. LC-MS (способ B): RT = 4,56, [M+H]+ = 367,1.
Пример 23: (3-морфолин-4-илпропил)амид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1023)
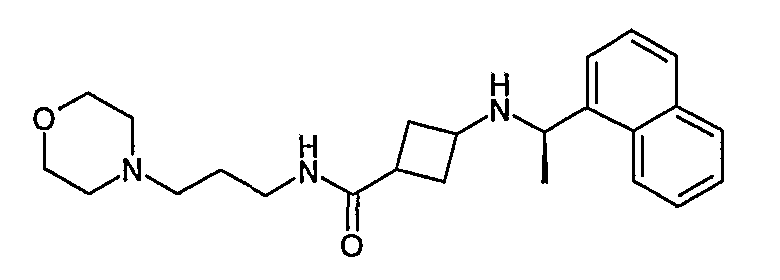
Следовали общей процедуре D, используя 1-морфолино-3-аминопропан. LC-MS (способ B): RT = 3,54, [M+H]+ = 396,2.
Пример 24: этиловый сложный эфир 1-[3-((R)-1-нафталин~1-илэтиламино)циклобутанкарбонил]пиперидин-4-карбоновой кислоты (соединение 1024)

Следовали общей процедуре D, используя этиловый сложный эфир пиперидин-4-карбоновой кислоты. LC-MS (способ B): RT = 4,81, [M+H]+ = 409,2.
Пример 25: (2-гидрокси-2-фенилэтил)амид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1025)

Следовали общей процедуре D, используя 2-гидрокси-2-фенилэтиламин. LC-MS (способ B): RT = 4,59, [M+H]+ = 389,1.
Пример 26: этиловый сложный эфир 3-{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}пропионовой кислоты (соединение 1026)

Следовали общей процедуре D, используя гидрохлорид этилового сложного эфира 3-аминопропионовой кислоты. LC-MS (способ B): RT = 4,57, [M+H]+ = 369,1.
Пример 27: [3-((R)-1-нафталин-1-илэтиламино)циклобутил][4-(3-трифторметилфенил)пиперазин-1-ил]метанон (соединение 1027)

Следовали общей процедуре D, используя 4-(3-трифторметилфенил)пиперазин. LC-MS (способ B): RT = 5,56, [M+H]+ = 482,1.
Пример 28: метиловый сложный эфир {[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}фенилуксусной кислоты (соединение 1028)

Следовали общей процедуре D, используя гидрохлорид метилового сложного эфира (R)(-)-2-фенилглицина. LC-MS (способ B): RT = 4,86, [M+H]+ = 417,1.
Пример 29: (2-гидроксииндан-1-ил)амид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1029)
Следовали общей процедуре D, используя (1S,2R)-(-)-цис-1-амино-2-инданол. LC-MS (способ B): RT = 4,67, [M+H]+ = 401,2.
Пример 30: [4-(2-метоксиэтил)пиперазин-1-ил]-[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон (соединение 1030)
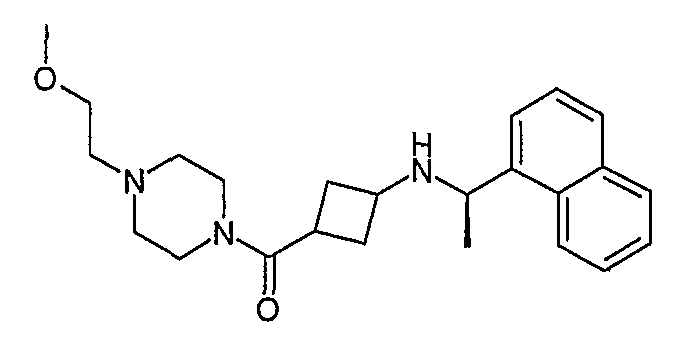
Следовали общей процедуре D, используя 4-(2-метоксиэтил)пиперазин. LC-MS (способ B): RT = 3,52, [M+H]+ = 396,2.
Пример 31: 2,3,6-трифторбензиламид 3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновой кислоты (соединение 1031)

Следовали общей процедуре D, используя 2,3,6-трифторбензиламин. LC-MS (способ B): RT = 4,99, [M+H]+ = 413,1.
Пример 32: метиловый сложный эфир 3-({[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}метил)бензойной кислоты (соединение 1032)

Следовали общей процедуре D, используя гидрохлорид метилового сложного эфира 3-аминометилбензойной кислоты. LC-MS (способ B): RT = 4,81, [M+H]+ = 417,1.
Пример 33: метиловый сложный эфир 4-({[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}метил)бензойной кислоты (соединение 1033)

Следовали общей процедуре D, используя метиловый сложный эфир 4-аминометилбензойной кислоты. LC-MS (способ B): RT = 4,79, [M+H]+ = 417,1.
Пример 34: {[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}фенилуксусная кислота (соединение 1034)

К раствору метилового сложного эфира {[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}фенилуксусной кислоты (пр. 28, 1,2 ммоль) в MeOH (1 мл) добавляли воду (0,3 мл) и LiOH (10 экв.). Смесь взбалтывали при к.т. в течение ночи. Водную HCl (4 н.) добавляли до pH=5. Растворитель декантировали и остальное масло промывали EtOAc, сушили в вакуумеи очищали препаративной HPLC-MS. LC-MS (способ B): RT = 2,47, [M+H]+ = 403,3, [M-H]-= 401,4.
Пример 35: ((R)-1-нафталин-1-илэтил)-(3-фенилциклобутил)амин (соединение 1035 и соединение 1036)
Следовали общей процедуре А, используя 3-фенилциклобутанон (1,0 г)и (+)-(R)-1-нафталин-1-илэтиламин. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:80:20) давала указанное в заголовке соединение (соединение 1035) и указанное в заголовке соединение (соединение 1036). LC-MS (способ B): соединение 1035: RT = 2,22, [M+H]+ = 302,2; соединение 1036: RT = 2,28, [M+H]+ = 302,2.
Приготовление 3: 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновая кислота (соединение 1111)
К раствору 3-оксо-1-циклопентанкарбоновой кислоты (5,3 г) в 1,2-дихлорэтане (100 мл) добавляли (+)-(R)-1-нафталин-1-илэтиламин (7,1 г), ледяную AcOH (1 экв., 2,4 мл) и NaBH(OAc)3 (1,5 экв., 13,1 г). Смесь перемешивали при к.т. в течение 4 ч перед удалением растворителя. Остаток обрабатывали насыщенным водным NaHCO3, pH доводили до 7 добавлением ледяной AcOH. Экстракцию (5 раз) осуществляли с EtOAc. Объединенные экстракты сушили над MgSO4, фильтровали и концентрировали в вакууме,получая масло, которое после растирания в EtOAc осаждалось. Фильтрование давало указанное в заголовке соединение.
pH водной фазы доводили до 6 добавлением 4 н. HCl, после отстаивания происходило осаждение. Фильтрования давали дополнительно указанное в заголовке соединение.
Пример 36: гидрохлорид {3-[3-(4-фторфенил)-[1,2,4]оксадиазол-5-ил]циклопентил}-((R)-1-нафталин-1-илэтил)амина (соединение 1037)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 205 мг) и N'-гидрокси-(4-фторфенил)имидамид (x = 24 ч, y =5 ч). Хроматография (PE-EtOAc 100:0 до 40:60) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Светложелтый осадок отфильтровывали и сушили в вакууме,получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δH: 10,22 (с, 1H), 9,60 (с, 1H), 8,34 (д, 1H), 7,91-8,14 (м, 6H), 7,54-7,73 (м, 3H), 7,30-7,47 (м, 2H), 5,36 (к, 1H), 3,74-3,93 (м, 1H), 3,50-3,69 (м, 1H), 2,21-2,44 (м, 3H), 1,95-2,18 (м, 2H), 1,78-1,90 (м, 1H), 1,75 (д, 3H).
Пример 37: гидрохлорид ((R)-1-нафталин-1-илэтил)-[3-(3-фенил-[1,2,4]оксадиазол-5-ил)циклопентил]амина (соединение 1038)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 205 мг) и бензамидоксим (x = 24 ч, y = 5 ч). Хроматография (PE-EtOAc 100:0 до 40:60) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Светложелтый осадок отфильтровывали и сушили в вакууме,получая указанное в заголовке соединение. LC-MS (способ B): RT = 2,94, [M+H]+ = 384,2.
Пример 38: гидрохлорид [3-(3-изопропил-[1,2,4]оксадиазол-5-ил)циклопентил]-((R)-1-нафталин-1-илэтил)амина (соединение 1039)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 194 мг) и N'-гидрокси-2-метилпропанимидамид (x = 24 ч, y = 4 ч). Хроматография (PE-EtOAc 100:0 до 40:60) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Светложелтый осадок отфильтровывали и сушили в вакууме,получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) свободный амин δH 8,22-8,35 (м, 1H), 7,87-7,97 (м, 1H), 7,68-7,82 (дд, 2H), 7,44-7,59 (м, 3H), 4,64 (к, 1H), 3,45-3,66 (м, 1H), 3,04-3,19 (м, 1H), 2,88-3,03 (м, 1H), 2,34 (ш.с, 1H), 2,00-2,25 (м, 2H), 1,41-1,95 (м, 5H), 1,37 (д, 3H), 1,19 (д, 6H).
Пример 39: гидрохлорид ((R)-1-нафталин-1-илэтил)-{3-[3-(4-трифторметилфенил)-[1,2,4]оксадиазол-5-ил]циклопентил}амина (соединение 1040)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 195 мг) и N'-гидрокси-(4-трифторметилфенил)имидамид (x = 24 ч, y = 4 ч). Хроматография (PE-EtOAc 100:0 до 40:60) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Бесцветный осадок отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение. LC-MS (способ B): RT = 3,21, [M+H]+ = 452,1.
Пример 40: гидрохлорид [3-(3-метил-[1,2,4]оксадиазол-5-ил)циклопентил]-((R)-1-нафталин-1-илэтил)амина (соединение 1041)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 190 мг) и N'-гидроксиацетамидин (x = 1 ч, y = 20 ч). Хроматография (PE-EtOAc 100:0 до 40:60) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Осадок отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δH 10,26 (с, 1H), 9,45 (с, 1H), 8,31 (д, 1H), 7,90-8,12 (м, 3H), 7,50-7,70 (м, 3H), 5,35 (к, 1H), 3,63-3,81 (м, 1H), 3,44-3,62 (м, 1H), 2,00-2,33 (м, 4H), 2,24 (с, 3H), 1,90 (с, 1H), 1,73 (д, 3H), 1,65-1,79 (м, 1H).
Пример 41: {3-[3-(5-метилтиазол-2-илметил)-[1,2,4]оксадиазол-5-ил]циклопентил}-((R)-1-нафталин-1-илэтил)амин (соединение 1042)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 190 мг) и N-гидрокси-2-(5-метилтиазол-2-ил)ацетамидин (x = 4 ч, y = 20 ч). Хроматография (PE-EtOAc 100:0 до 30:70, затем CH2Cl2-MeOH 98:2 до 80:20) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,68, [M+H]+ = 419.
Пример 42: гидрохлорид ((R)-1-нафталин-1-илэтил)-[3-(3-пропил-[1,2,4]оксадиазол-5-ил)циклопентил]амина (соединение 1043a и 1043b)
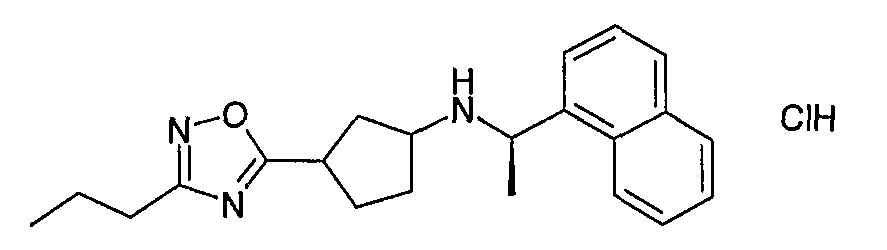
Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 190 мг) и N'-гидроксибутирамидин (x = 4 ч, y = 20 ч). Хроматография (PE-EtOAc 100:0 до 30:70) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении EtzO. Осадок отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение как 2 изомера.13C ЯМР (75,5 МГц, DMSO) главный изомер δ: 183,03, 170,02, 142,44, 133,85, 131,34, 129,01, 126,95, 126,09, 125,98, 125,62, 123,35, 56,50, 51,48, 37,54, 34,81, 33,20, 29,43, 27,43, 24,64, 20,10, 13,74.
Пример 43: гидрохлорид 1-{5-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]-[1,2,4]оксадиазол-3-илметил}-1H-пиридин-2-она (соединение 1044)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 190 мг) и N~гидрокси-2-(2-оксо-2H-пиридин-1-ил)ацетамидин (x = 5 ч, y = 19 ч). Хроматография (PE-EtOAc 60:40 до 0:100, затем CHCl3-MeOH 100:0 до 90:10) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Осадок отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение. LC-MS (способ B): RT = 2,23, [M+H]+ = 415,3.
Пример 44: гидрохлорид {3-[3-(4-метоксифенил)-[1,2,4]оксадиазол-5-ил]циклопентил}-((R)-1-нафталин-1-илэтил)амина (соединение 1045)

Следовали общей процедуре С, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 190 мг) и N'-гидрокси-(4-метоксифенил)имидамид (x = 4 ч, y = 20 ч). Хроматография (PE-EtOAc 100:0 до 30:70, затем CH2Cl2-MeOH 90:10 до 70:30) давала масло, которое обрабатывали 4 н. HCl в диоксане. Осаждение происходило при добавлении Et2O. Осадок отфильтровывали и сушили в вакууме, получая указанное в заголовке соединение. LC-MS (способ B): RT = 3,11, [M+H]+ = 414,1.
Пример 45: амид 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновой кислоты (соединение 1046)
Следовали общей процедуре В, используя 3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновую кислоту (приготовление 3, 155 мг) и водн. NH3 (2,5 мл). Хроматография (CH2Cl2-MeOH 90:10 до 70:30) давала указанное в заголовке соединение. LC-MS (способ B): RT = 1,93, [M+H]+ = 283,2.
Пример 46: 4-метил-N-[3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбонил]бензолсульфонамид (соединение 1047a, соединение 1047b, соединение 1047c и соединение 1047d)
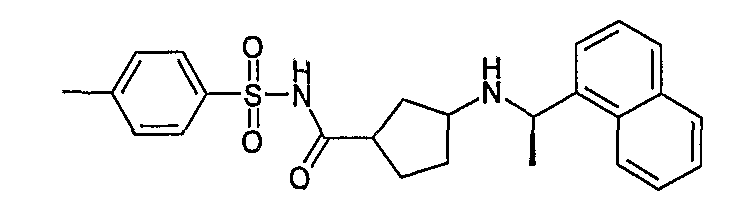
К перемешиваемой смеси 3-оксоциклопентанкарбоновой кислоты (1,2 г) и NEt3 (1,56 мл) в THF (50 мл) в атмосфере аргона добавляли по каплям 4-метилбензолсульфонилизоцианат (1,71 мл). Перемешивание продолжали при к.т. в течение 1 ч перед добавлением N,N'-диметил-1,3-пропандиамина. Перемешивание продолжали при к.т. в течение 10 мин. Смесь разбавляли EtOAc, промывали водной HCl (1 M) и насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая 4-метил-N-(3-оксоциклопентанкарбонил)бензолсульфонамид (соединение 1113), используемый без дополнительной очистки. Следовали общей процедуре А, используя 4-метил-N-(3-оксоциклопентанкарбонил)бензолсульфонамид (1,9 г) и (+)-(R)-1-нафталин-1-илэтиламин при времени реакции 4 ч. Смесь разбавляли CH2Cl2, промывали насыщенным водным NaHCO3 и насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме,получая желтую пену. Пену обрабатывали горячим EtOH. Осадок, образовавшийся после охлаждения, отфильтровывали, промывали EtOH, получая указанное в заголовке соединение в виде белого порошка. LC-MS (способ B): RT (4 изомера) = 3,02, 3,10, 3,37, 4,10, [M+H]+ = 437,4, [M-H]- = 435,4.
Пример 47: 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрил (соединения 1048/1049/1050)
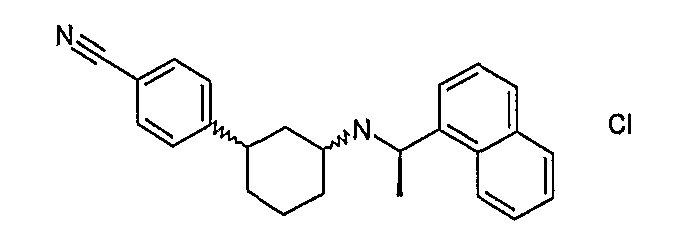
Следовали общей процедуре А, используя 3-(4-цианофенил)циклогексанон (5 г) и (+)-(R)-1-нафталин-1-илэтиламин (3,7 мл). Хроматография (гептан-EtOAc 100:0 до 0:100) давала указанное в заголовке соединение в виде твердого вещества (фракция A), указанное в заголовке соединение в виде масла (фракция B) и указанное в заголовке соединение в виде масла (фракция C). Фракции A и B содержали единственные диастереомеры: соединение 1048 и соединение 1049, соответственно. Фракция C содержала смесь 2 диастереомеров: соединение 1050. Соединение 104813C ЯМР (75,5 МГц, DMSO) δ: 153,24, 142,40, 133,48, 132,00, 130,84, 128,62, 127,76, 126,46, 125,64, 125,55, 125,17, 123,07, 122,97, 118,92, 108,37, 51,09, 50,03, 38,25, 37,30, 32,69, 28,86, 24,59, 20,15. Соединение 104913C ЯМР (75,5 МГц, DMSO) δ: 153,25, 142,12, 133,43, 132,09, 130,87, 128,60, 127,96, 126,46, 125,67, 125,54, 125,17, 122,97, 122,85, 118,97, 108,42, 50,17, 49,28, 37,07, 36,17, 32,84, 30,61, 24,38, 20,39. Соединение 1050 (2 изомера ca. 2:1)13C ЯМР (75 МГц, DMSO) δ: 152,65, 152,58, 142,13, 141,99, 133,46, 133,44, 132,20, 130,79, 130,76, 128,61, 128,59, 127,80, 126,50, 125,71, 125,67, 125,60, 125,19, 122,94, 122,87, 122,83, 122,72, 118,92, 108,65, 108,63, 53,79, 53,62, 49,30, 49,16, 42,67, 42,41, 40,71, 39,96, 33,25, 33,07, 32,15, 24,74, 24,49, 24,33.
Общая процедура E
К раствору нитрила (1 экв.) в EtOH (0,12 M) добавляли K2CO3 (12 экв.) и гидрохлорид гидроксиламина (7 экв.). Смесь перемешивали при температуре кипения с возвращением флегмы в течение ночи. После фильтрования осадок на фильтре экстрагировали горячим EtOH. Объединенные экстракты концентрировали в вакууме.При необходимости очистку осуществляли путем флэш-хроматографии с непрерывным градиентом.
Пример 48: N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1051)

Следовали общей процедуре Е, используя 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрил (пр. 47, фракция A, 500 мг) и гидрохлорид гидроксиламина. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:80:20) давала указанное в заголовке соединение в виде бесцветного твердого вещества.13C ЯМР (75,5 МГц, DMSO) δ: 150,76, 148,10, 142,43, 133,47, 130,84, 130,69, 128,60, 126,42, 126,25, 125,61, 125,55, 125,16, 123,09, 122,96, 51,01, 50,14, 38,72, 36,78, 33,14, 29,04, 24,59, 20,30.
Пример 49: N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1052)

Следовали общей процедуре Е, используя 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрил (пр. 47, фракция B, 500 мг) и гидрохлорид гидроксиламина. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:50:50) давала указанное в заголовке соединение в виде желтого масла.13C ЯМР (75,5 МГц, DMSO) δ: 167,78, 150,81, 148,11, 142,13, 133,43, 130,86, 130,81, 128,60, 127,44, 126,44, 125,66, 125,54, 125,29, 125,15, 122,99, 122,83, 50,19, 49,38, 36,58, 33,38, 30,78, 24,42, 20,55.
Пример 50: N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1053a и соединение 1053b)

Следовали общей процедуре Е, используя 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрил (пр. 47, фракция C, 100 мг) и гидрохлорид гидроксиламина. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:90:10) давала указанное в заголовке соединение.13C ЯМР (75,5 МГц, DMSO) δ: 168,18, 151,20, 151,20, 148,10, 148,04, 142,76, 142,66, 133,88, 131,42, 131,23, 129,04, 127,94, 126,87, 126,71, 126,04, 125,77, 125,60, 123,32, 123,24, 123,17, 54,37, 54,23, 49,65, 42,88, 42,61, 41,83, 40,98, 34,04, 32,83, 25,33, 25,09, 24,88 (2 изомера почти в равных количествах).
Пример 51: {3-[4-(иминопирролидин-1-илметил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1054)

К раствору 4-[3-(R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрила (пр. 47, фракция A, 150 мг) в MeOH (1,5 мл) в атмосфере аргона добавляли N-ацетилцистеин (7 экв.) и пирролидин (7,4 экв.). Смесь перемешивали при 70°C в течение 4 дней. MeoH удаляли ввакууме.Остаток забирали в воду и экстрагировали CH2Cl2 (4 раза). Объединенные экстракты концентрировали в вакуумеи очищали путем флэш-хроматографии с непрерывным градиентом (CH2Cl2-MeOH 100:0 до 50:50), получая указанное в заголовке соединение. LC-MS (способ B): RT = 2,01, [M+H]+ = 426,3.
Пример 52: 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1055)
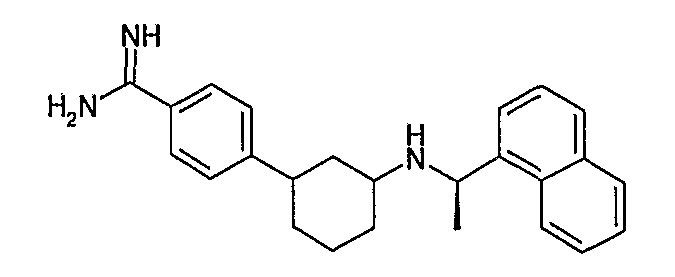
К раствору N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидина (пр. 48, 200 мг) в EtOAc (10 мл) добавляли SnCl2.2H2O (3 экв.) Смесь перемешивали при температуре кипения с возвращением флегмы в течение ночи. После охлаждения до к.т. смесь разбавляли EtOAc и промывали водным насыщенным NaHCO3. Органическую фазу подвергали хроматографии (PE-EtOAc 100:0 до 0:100 до EtOAc-MeOH 90:10), получая указанное в заголовке соединение. LC-MS (способ B): RT = 1,92, [M+H]+ = 372,3.
Общая процедура F
К раствору бензонитрила в MeOH (0,09 M, y мл) добавляли 28% водн. NaOH (y/2 мл). Смесь нагревали до кипения с возвращением флегмы в течение ночи. MeOH удаляли при пониженном давлении. Остаток забирали в воду и добавляли 4 н. водн. HCl до pH=5. Осадок собирали, промывали водой и сушили в вакууме.
Пример 53: 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединение 1056)
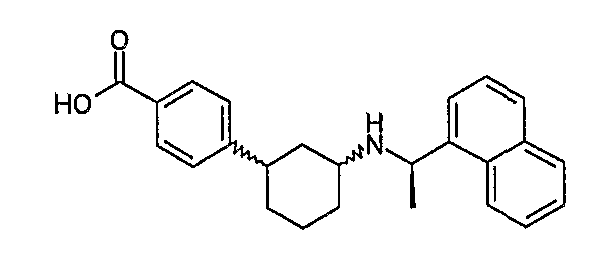
Следовали общей процедуре F, используя 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрил (пр. 47, фракция A, 3,5 г), получая соответствующую кислоту.13C ЯМР (75,5 МГц, DMSO) δ: 167,33, 152,18, 142,11, 133,49, 130,83, 129,16, 128,72, 128,62, 126,66, 126,54, 125,68, 125,57, 125,20, 123,19, 122,96, 51,12, 50,24, 38,38, 37,04, 32,81, 28,90, 24,45, 20,22.
Пример 54: 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединение 1057)

Следовали общей процедуре F, используя 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрил (пр. 47, фракция B, 0,8 г), получая соответствующую кислоту.13C ЯМР (75,5 МГц, DMSO) δ: 167,27, 151,71, 140,47, 133,43, 130,73, 129,26, 128,68, 128,54, 126,93, 126,85, 125,96, 125,55, 125,36, 123,33, 122,71, 50,10, 49,71, 36,63, 35,45, 32,55, 30,15, 23,72, 20,29.
Пример 55: 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединение 1058)

Следовали общей процедуре F, используя 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрил (пр. 47, фракция C, 1,0 г), получая соответствующие кислоты.13C ЯМР (75 МГц, DMSO) δ: 167,37, 150,91, 150,88, 133,37, 130,44, 130,38, 129,39, 129,36, 129,34, 128,73, 128,70, 127,42, 127,38, 126,63, 126,58, 126,24, 126,14, 125,55, 125,51, 123,58, 123,48, 122,65, 122,57, 53,96, 53,79, 49,04, 48,95, 42,04, 41,89, 38,71, 38,19, 32,87, 31,30, 30,20, 24,32, 24,11, 22,72.
Пример 55a: 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединение 1058a)
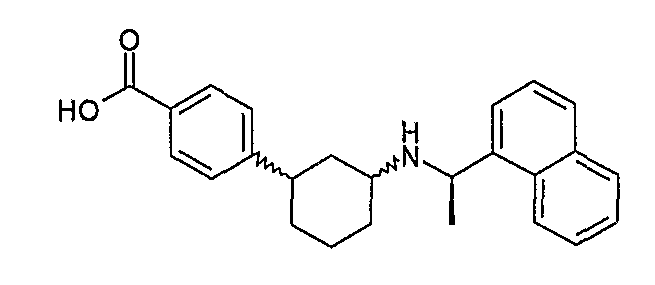
1H ЯМР (300 МГц, DMSO) δ 8,38-8,21 (м, 1H), 7,95-7,87 (м, 1H), 7,82 (д, 2H), 7,75 (дд, 2H), 7,57-7,39 (м, 3H), 7,30 (д, 2H), 4,72 (дд, 1H), 3,17-3,06 (м, 1H), 2,82 (м, 1H), 1,91-1,68 (м, 3H), 1,66-1,27 (м, 8H).
Пример 56: этиловый сложный эфир 3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1059)

Следовали общей процедуре А, используя этиловый сложный эфир 3-(3-оксоциклогексил)бензойной кислоты (10 г) и (+)-(R)-1-нафталин-1-илэтиламин (6 мл). Хроматография (гептан-EtOAc 100:0 до 0:100) давала указанное в заголовке соединение в виде смеси изомеров. LC-MS (способ B): RT = 2,81, [M+H]+ = 402,2.
Пример 57: N-(2-гидроксиэтил)3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1060)
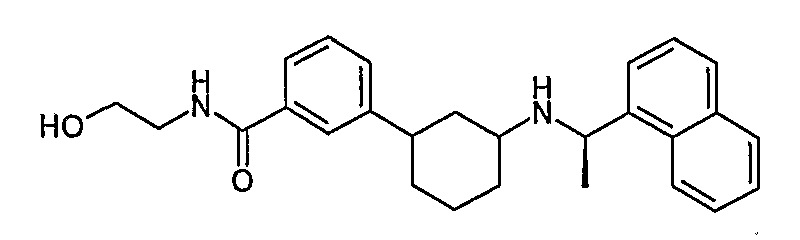
К раствору этилового сложного эфира 3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (пр. 56, 2,15 г) в безводном MeCN (25 мл) в атмосфере аргона добавляли этаноламин (15 экв.) и K2CO3. Смесь перемешивали при температуре кипения с возвращением флегмы в течение 2 дней. MeCN удаляли в вакууме.Остаток забирали в EtOAc, промывали водой, сушили над MgSO4, фильтровали и концентрировали ввакууме.Хроматография (PE-EtOAc-MeOH 10:90:0 до 0:100:0 до 0:80:20) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,13, [M+H]+ = 417,2, [M-H]- = 415,4.
Пример 58: 3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединения 1061/1062)
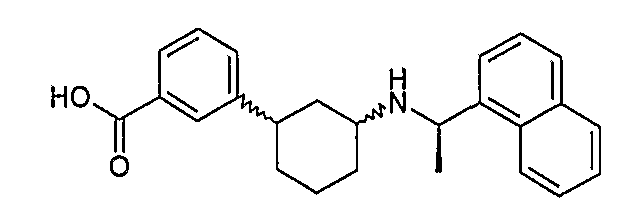
К раствору этилового сложного эфира 3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (10,4 г) в MeOH (200 мл) добавляли 2 н. водн. NaOH (100 мл). Раствор перемешивали при к.т. в течение ночи и концентрировали в вакууме.Остаток забирали в воду (150 мл) и 4 н. водн. HCl (ca 50 мл) добавляли по каплям до pH=7 и осадок сохраняли. Кислоту фильтровали, промывали водой и сушили в вакууме,получая указанное в заголовке соединение в виде смеси изомеров. 100 мг очищали препаративной хиральной HPLC, получая указанное в заголовке соединение (фракция A, соединение 1061) и указанное в заголовке соединение (фракция B, соединение 1062), каждое как единственный изомер. Препаративную хиральную HPLC осуществляли на колонке Chiralpak AD-H 250×10 мм, 5 мкм при 25°C, УФ детектирование при 280 нм. Изократическое разделение со смесью н-гептан:2-пропанол:NEt3:CH3COOH (85:15:0,1:0,1); расход = 3,0 мл/мин.
Соединение 1061: RT=13,4 мин;13C ЯМР (75,5 МГц, DMSO) δ: 168,11, 147,83, 141,93, 133,86, 131,89, 131,45, 131,24, 129,06, 128,72, 128,00, 127,11, 127,08, 126,20, 125,97, 125,66, 123,55, 123,22, 50,71, 50,07, 37,01, 36,83, 33,62, 30,81, 24,56, 20,89. Соединение 1062: RT=15,3 мин;13C ЯМР (75,5 МГц, DMSO) δ:
168,58, 147,67, 142,50, 133,89, 133,22, 131,30, 130,75, 129,05, 128,39, 127,86, 127,01, 126,94, 126,11 , 125,99, 125,60, 123,47, 123,31, 51,04, 50,29, 39,23, 37,31, 33,60, 29,15, 24,80, 20,68.
Пример 59: ((R)-1-нафталин-1-илэтил)-(3(S)-фенилциклогексил)амин (соединение 1063)

Следовали общей процедуре А, используя (S)-3-фенилциклогексанон (100 мг) и (R)-(+)-1-нафталин-1-илэтиламин. Хроматография (гептан-EtOAc 85:15 до 0:100) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,42, [M+H]+ = 330,3.
Пример 60: ((R)-1-нафталин-1-илэтил)-(3(R)-фенилциклогексил)амин (соединение 1064)

Следовали общей процедуре А, используя (R)-3-фенилциклогексанон (100 мг) и (R)-(+)-1-нафталин-1-илэтиламин. Хроматография (гептан-EtOAc 90:10 до 0:100) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,31, [M+H]+ = 330,3.
Общая процедура G
К смеси амина (1 экв.), циклоалк-2-ен-1-она (1,2 экв.) и PEG2000 (4 г на 10 ммоль амина) при 60°C добавляли RuCl3 (3%). Смесь перемешивали при 60°C в течение ночи. После охлаждения до к.т. добавляли Et2O (20 мл на 10 ммоль). Смесь выдерживали в холодильнике в течение 30 мин перед фильтрованием осадка. Твердое вещество экстрагировали Et2O (3 раза). Объединенные экстракты промывали водой, сушили над Na2SO4, фильтровали и концентрировали в вакууме.При необходимости очистку осуществляли путем флэш-хроматографии с непрерывным градиентом.
Пример 61: N-((R)-1-нафталин-1-илэтил)-N'-фенилциклогексан-l,3-диамин (соединение 1065)

Следовали общей процедуре G, используя анилин (0,91 мл) и циклогекс-2-ен-1-он. Хроматография (CH2Cl2-MeOH 100:0 до 85:15) давала 3-фениламиноциклогексанон.
Следовали процедуре А, используя 3-фениламиноциклогексанон (41 мг) и (+)-(R)-1-нафталин-1-илэтиламин. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:90:10) давала указанное в заголовке соединение в виде смеси 2 изомеров в соотношении 1:3.13C ЯМР (75,5 МГц, DMSO) δ: 147,94, 142,31, 133,44, 130,77, 128,76, 128,65, 128,58, 126,37, 125,62, 125,59, 125,52, 125,12, 122,93, 122,83, 115,01, 114,88, 112,20, 50,22, 49,80, 49,59, 49,38, 46,15, 46,01, 37,77, 36,15, 31,78, 31,71, 29,97, 24,51, 24,34, 19,60, 19,26.
Пример 62: N-((R)-1-нафталин-1-илэтил)-N'-(3-трифторметилфенил)циклогексан-l,3-диамин (соединение 1066)

Следовали общей процедуре G, используя 3-трифторметиланилин (1,61 г) и циклогекс-2-ен-1-он. Хроматография (PE-EtOAc 100:0 до 0:100) давала 3-(3-трифторметилфенил)аминоциклогексанон (соединение 1114).
Следовали процедуре А, используя 3-(3-трифторметилфенил)аминоциклогексанон (125 мг) и (+)-(R)-1-нафталин-1-илэтиламин. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:90:10) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,94, [M+H]+ = 413,2.
Пример 63: 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексиламино]бензонитрил (соединение 1067)

Следовали общей процедуре G, используя 4-аминобензонитрил (1,18 г) и циклогекс-2-ен-1-он. Хроматография (PE-EtOAc 100:0 до 0:100) давала 4-(3-оксоциклогексиламино)бензонитрил.
Следовали процедуре А, используя 4-(3-оксоциклогексиламино)бензонитрил (145 мг) и (+)-(R)-1-нафталин-1-илэтиламин. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:90:10) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,56, [M+H]+ = 370,2.
Пример 64: (3-морфолин-4-илциклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1068)

К перемешиваемой смеси морфолина (3,7 мл) и циклогекс-2-ен-1-она (3,4 мл) в воде (50 мл) добавляли Cu(OAc)2.H2O (350 мг). Смесь перемешивали при к.т. в течение 15 ч и фильтровали. Фильтрат экстрагировали EtOAc. Объединенные экстракты промывали водой и насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме, получая смесь 1:1 циклогекс-2-ен-1-она и 3-морфолин-4-илциклогексанона, используемую без дополнительной очистки.
Следовали общей процедуре А, используя 3-морфолин-4-илциклогексанон (1 г, 50% чистота, 5,4 ммоль) и (+)-(R)-1-нафталин-1-илэтиламин. Хроматография (EtOAc) давала указанное в заголовке соединение в виде темножелтого масла (смесь 2 изомеров ca 1:1).13C ЯМР (75,5 МГц, DMSO) δ: 142,28, 142,05, 133,47, 133,39, 130,92, 130,86, 128,58, 126,42, 126,38, 125,61, 125,57, 125,51, 125,45, 125,12, 123,21, 123,07, 122,97, 122,72, 66,41, 66,30, 57,86, 57,78, 50,54, 49,54, 49,45, 49,35, 49,19, 48,46, 34,44, 32,62, 30,84, 27,75, 27,64, 24,43, 19,68, 19,48.
Пример 65: ((R)-1-нафталин-1-илэтил)-(3-пиридин-2-илциклогексил)амин (соединения 1069/1070)

Следовали общей процедуре А, используя 3-(2-пиридинил)циклогексанон (1 г) и (+)-(R)-1-нафталин-1-илэтиламин. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:85:15) давала указанное в заголовке соединение в виде смеси 2 изомеров (фракция A, соединение 1069) и указанное в заголовке соединение в виде смеси 2 изомеров (фракция B, соединение 1070) в соотношении 1:1. Соединение 1069, главный изомер13C ЯМР (75,5 МГц, DMSO) δ: 165,48, 148,61, 142,04, 136,19, 133,47, 130,90, 128,62, 126,49, 125,69, 125,56, 125,18, 123,02, 122,93, 121,17, 120,95, 50,37, 49,48, 39,02, 37,25, 31,80, 28,94, 24,35, 20,03. Соединение 107013C ЯМР (75,5 МГц, DMSO) δ: 165,47, 165,39, 149,12, 142,64, 142,57, 136,83, 133,90, 133,88, 131,23, 129,02, 126,89, 126,08, 126,04, 125,60, 123,38, 123,33, 123,24, 123,18, 121,61, 121,46, 121,40, 54,20, 54,06, 49,80, 49,62, 45,16, 44,86, 34,01, 32,86, 32,52, 32,45, 25,16, 24,86, 24,81.
Пример 66: этиловый сложный эфир 5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]тиофен-2-карбоновой кислоты (соединение 1071)
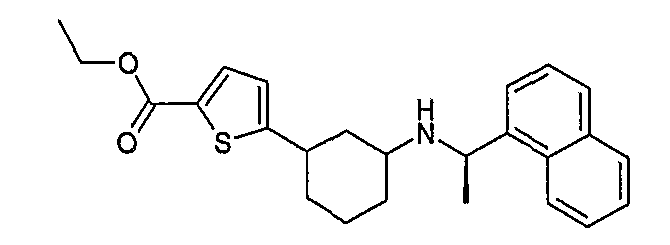
Следовали общей процедуре А, используя этиловый сложный эфир 5-(3-оксоциклогексил)тиофен-2-карбоновой кислоты (1 г) и (+)-(R)-1-нафталин-1-илэтиламин. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:90:10) давала указанное в заголовке соединение в виде смеси 3 изомеров (фракция A) и 0,9 г указанного в заголовке соединения в виде смеси 3 изомеров (фракция B). LC-MS (способ B): RT = 2,98, [M+H]* = 408,2.
Пример 67: 5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]тиофен-2-карбоновая кислота (соединение 1072)

К раствору этилового сложного эфира 5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]тиофен-2-карбоновой кислоты (фракция A 0,6 г) в MeOH (30 мл) и воды (10 мл) добавляли LiOH (5 экв.). Раствор перемешивали при температуре кипения с возвращением флегмы в течение 2 ч. MeOH удаляли в вакуумеи добавляли 4 н. водную HCl, пока существовал осадок. Твердое вещество отфильтровывали, промывали водой и сушили в вакууме, получая указанное в заголовке соединение.13C ЯМР (150,9 МГц, DMSO) δ: Главный изомер: 163,41, 157,15, 140,77, 140,77, 133,43, 131,63, 130,71, 128,67, 126,84, 125,88, 125,54, 125,32, 123,38, 123,21, 122,76, 50,23, 49,74, 38,46, 33,49, 33,43, 28,64, 23,83, 19,87.
Пример 68: этиловый сложный эфир 5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фуран-2-карбоновой кислоты (соединение 1073)

Следовали общей процедуре А, используя этиловый сложный эфир 5-(3-оксоциклогексил)фуран-2-карбоновой кислоты (1 г) и (+)-(R)-1-нафталин-1-илэтиламин. Хроматография (PE-EtOAc-MeOH 100:0:0 до 0:100:0 до 0:90:10) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,85, [M+H]+ = 392,3.
Пример 69: 5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фуран-2-карбоновая кислота (соединение 1074a, соединение 1074b и соединение 1074c)
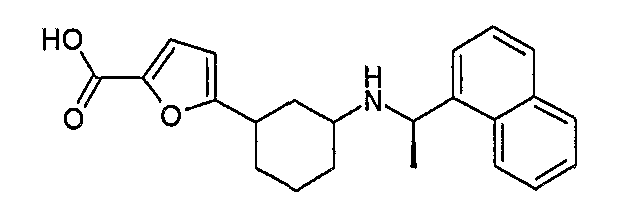
К раствору этилового сложного эфира 5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фуран-2-карбоновой кислоты (1,4 г) в MeOH (75 мл) и воде (25 мл) добавляли LiOH (5 экв.). Раствор перемешивали при температуре кипения с возвращением флегмы в течение 2 ч. MeOH удаляли в вакууме и добавляли 4 н. водную HCl до кислотного pH. Соединение экстрагировали EtOAc. Объединенные экстракты сушили над MgSO4, фильтровали и концентрировали в вакууме, получая указанное в заголовке соединение в виде не совсем белого твердого вещества. 3 изомера13C ЯМР (150,9 МГц, DMSO) δ: 162,64, 162,55, 162,15, 160,16, 160,10, 159,94, 145,27, 144,84, 144,79, 133,40, 130,69, 130,63, 130,49, 130,46, 128,74, 128,70, 128,67, 127,34, 127,29, 126,99, 126,89, 126,20, 126,14, 126,02, 125,95, 125,63, 125,58, 125,51, 125,38, 125,34, 123,40, 123,29, 123,14, 122,74, 122,71, 122,62, 117,11, 116,96, 116,82, 106,11, 106,07, 105,59, 105,56, 53,25, 52,95, 49,83, 49,66, 49,32, 49,16, 36,00, 35,56, 35,43, 34,98, 33,02, 31,64, 31,49, 31,40, 30,51, 30,35, 30,15, 29,60, 28,73, 23,70, 23,57, 23,47, 22,93, 22,87, 20,00, 19,68.
Общая процедура H
К раствору или суспензии кислоты (1 экв.) в DMF (1 M) в атмосфере аргона добавляли HOBt (1,2 экв.), EDAC (1,3 экв.), 4-метилморфолин (2 экв.) и N-гидроксиамидин (1,2 экв.). Смесь перемешивали при к.т. в течение ночи. CDI (1,1 экв.) добавляли и смесь подвергали микроволновому облучению (10 мин, 150°C). Смесь охлаждали до к.т., добавляли EtOAc, промывали водой и насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали в вакууме.При необходимости очистку осуществляли путем флэш-хроматографии с непрерывным градиентом.
Приготовление 4: 3-((R)-1-нафталин-1-илэтиламино)циклогексанкарбоновая кислота
К раствору 3-оксо-1-циклогексанкарбоновой кислоты (1,8 г) в 1,2-дихлорэтане (60 мл) добавляли (+)-(R)-1-нафталин-1-илэтиламин (2,2 г), ледяную AcOH (1 экв., 0,75 мл) и NaBH(OAc)3 (1,5 экв., 4,1 г). Смесь перемешивали при к.т. в течение 48 ч перед удалением растворителя. Остаток обрабатывали 1 н. NaOH (ca 100 мл) и pH доводили до 7 добавлением 4 н. HCl. Смесь доводили до кипения с возвращением флегмы. Твердое вещество, полученное при охлаждении, отфильтровывали и промывали кипящим EtOH, получая указанное в заголовке соединение в виде тонкоизмельченного порошка. Фильтрат концентрировали ввакууме. Остаток растворяли в горячем MeCN и небольшом количестве MeOH. Твердое вещество, полученное при охлаждении, отфильтровывали и промывали MeCN, получая указанное в заголовке соединение.
Пример 70: {3-[3-(4-фторфенил)-[1,2,4]оксадиазол-5-ил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1075)

Следовали общей процедуре Н, используя 3-((R)-1-нафталин-1-илэтиламино)циклогексанкарбоновую кислоту (приготовление 4, 110 мг) и 4-фтор-N-гидроксибензамидин. Хроматография (PE-EtOAc 100:0 до 0:100) давала указанное в заголовке соединение.13C ЯМР (75,5 МГц, DMSO) δ: 183,55, 166,86, 164,24 (1JCF=249,1 Гц), 142,45, 133,92, 131,30, 129,87, 129,75, 129,06, 126,91, 126,05 (3JCF=9,8 Гц), 125,60, 123,31, 123,28, 116,68 (2JCF=21,9 Гц), 50,33, 49,29, 35,45, 31,69, 30,00, 29,29, 24,78, 20,24.
Пример 71: ((R)-1-нафталин-1-илэтил)-{3-[3-(4-трифторметилфенил)-[1,2,4]оксадиазол-5-ил]циклогексил}амин (соединение 1076)
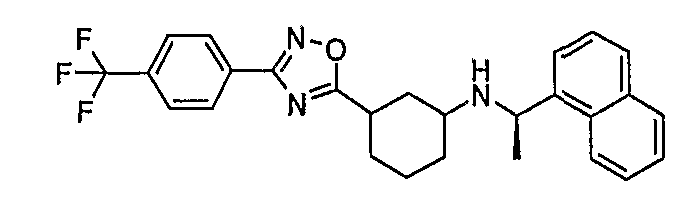
Следовали общей процедуре Н, используя 3-((R)-1-нафталин-1-илэтиламино)циклогексанкарбоновую кислоту (приготовление 4, 110 мг) и 4-трифторметил-N-гидроксибензамидин. Хроматография (PE-EtOAc 100:0 до 40:60) давала указанное в заголовке соединение. LC-MS (способ B): RT = 3,23, [M+H]+ = 466,2.
Пример 72: ((R)-1-нафталин-1-илэтил)-[3-(3-фенил-[1,2,4]оксадиазол-5-ил)циклогексил]амин (соединение 1077)
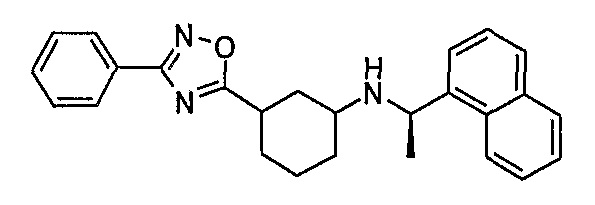
Следовали общей процедуре Н, используя 3-((R)-1-нафталин-1-илэтиламино)циклогексанкарбоновую кислоту (приготовление 4, 110 мг) и N-гидроксибензамидин. Хроматография (PE-EtOAc 100:0 до 40:60) давала указанное в заголовке соединение. LC-MS (способ B): RT = 2,93, [M+H]+ = 398,2.
Пример 73: 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1078)

К раствору 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (пр. 53, 1,1 г) в DMF (40 мл) добавляли CDI (0,6 г). Смесь перемешивали при к.т. в течение 2 ч перед добавлением водн. NH3 (8 мл). Смесь перемешивали при к.т. в течение ночи. Добавляли Et2O и воду. После экстракции органическую фазу промывали водой и насыщенным раствором соли, сушили над MgSO4, фильтровали и концентрировали в вакууме, получая указанное в заголовке соединение в виде пены. LC-MS (способ B): RT = 2,46, [M+H]+ = 373,3.
Пример 74: N-бензилокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1079)

Следовали общей процедуре В, используя 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойную кислоту (пр. 53, 0,27 ммоль) и гидрохлорид О-бензилгидроксиламина. Хроматография (PE-EtOAc 50:50 до 33:67) давала указанное в заголовке соединение. LC-MS (способ B): RT = 3,03, [M+H]+ = 479,4.
Пример 75: 4-йодфениловый сложный эфир 4-[3-((R)-1-нафталин~1-илэтиламино)циклогексил]бензойной кислоты (соединение 1080)

К раствору 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (пр. 53, 0,4 г) в DMF (10 мл) добавляли CDI (0,21 г, 1,2 экв.). Раствор перемешивали при к.т. в течение 1 ч перед добавлением 4-йодфенола (0,33 г, 1,4 экв.) и K2CO3 (1,5 экв.). Перемешивание продолжали при к.т. в течение 2 ч. Добавляли воду и соединение экстрагировали EtOAc. Органическую фазу промывали водой (3 раза) и насыщенным раствором соли, концентрировали в вакуумеи очищали хроматографией (гептан-EtOAc 100:0 до 60:40), получая указанное в заголовке соединение в виде масла. LC-MS (способ B): RT = 4,15, [M+H]+= 576,3.
Общая процедура I
К раствору 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (пр. 53, 1,6 г) в DMF (16 мл) добавляли CDI (0,83 г). Раствор перемешивали при к.т. в течение 4,5 ч, 0,3 мл этого раствора добавляли к амину (2 экв.). Если амин был приготовлен как гидрохлорид, добавляли DIPEA (1 экв.). Смесь взбалтывали при к.т. в течение 3 дней, фильтровали и очищали препаративной HPLC-MS (повторно анализировали путем LC/MS, способ A).
Пример 76: 2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}этансульфоновая кислота (соединение 1081)

Следовали общей процедуре I, используя 2-аминоэтансульфоновую кислоту.1H ЯМР (600 МГц, DMSO) δH 8,86 (ш.с, 2H), 8,44 (т, 1H), 8,34 (д, 1H), 7,92-8,07 (м, 2H), 7,80-7,90 (м, 1H), 7,68 (д, 2H), 7,54-7,66 (м, 3H), 7,22 (д, 2H), 5,47 (ш.с, 1H), 3,52 (м, 2H), 3,13-3,23 (м, 1H), 3,02-3,11 (м, 1H), 2,68 (т, 2H), 1,73-2,02 (м, 5H), 1,42-1,71 (м, 6H), LC-MS (способ A): RT=4,14, [M+H]+=480,8, [M-H]-=478,7.
Пример 77: N-((R)-1-гидроксиметилпропил)4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1082)

Следовали общей процедуре I, используя (R)-2-амино-1-бутанол. LC-MS (способ A): RT = 3,99, [M+H]+ = 444,8.
Пример 78: N-((S)-1-гидроксиметилпропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1083)

Следовали общей процедуре I, используя (S)-2-амино-1-бутанол. LC-MS (способ A): RT = 3,99, [M+H]+ = 444,8.
Пример 79: N-(2-цианоэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1084)
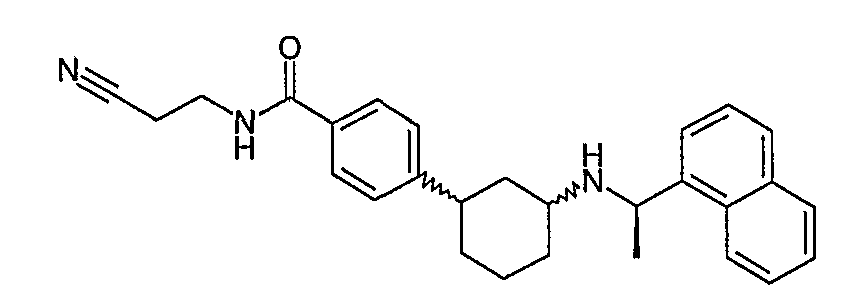
Следовали общей процедуре I, используя 2-цианоэтиламин. LC-MS (способ A): RT = 4,01, [M+H]+= 426,4.
Пример 80: N-(2-морфолин-4-илэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1085)

Следовали общей процедуре I, используя 2-морфолин-4-илэтиламин. LC-MS (способ A): RT = 3,49, [M+H]+ = 486,1.
Пример 81: N-(2-фторэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1086)

Следовали общей процедуре I, используя гидрохлорид 2-фторэтиламина. LC-MS (способ A): RT = 4,04, [M+H]+ = 418,8.
Пример 82: N-(2,2-дифторэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1087)

Следовали общей процедуре I, используя 2,2-дифторэтиламин. LC-MS (способ A): RT = 4,16, [M+H]+= 437,1.
Пример 83: метиловый сложный эфир 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1088)

Следовали общей процедуре I, используя гидрохлорид метилового сложного эфира 3-аминопропионовой кислоты.13C ЯМР (151 МГц, DMSO) δ 171,72, 166,11, 163,16, 150,02, 133,46, 131,78, 130,69, 128,73, 127,08, 126,45, 126,03, 125,57, 125,46, 123,49, 122,81, 51,32, 50,90, 50,69, 37,20, 36,63, 35,36, 33,53, 32,48, 28,18, 23,59, 20,01, LC-MS (способ A): RT = 4,07, [M+H]+=459,0.
Пример 84: N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-пиридин-4-илметилбензамид (соединение 1089)

Следовали общей процедуре I, используя метилпиридин-4-илметиламин. LC-MS (способ A): RT = 3,64, [M+H]+ = 477,9.
Пример 85: N-(2-диметиламиноэтил)-N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1090)

Следовали общей процедуре I, используя N,N,N'-триметилэтилендиамин. LC-MS (способ A): RT = 3,49, [M+H]+ = 458,2, [M-H]- = 456,0.
Пример 86: (2-гидроксиметилпирролидин-1-ил)-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1091)

Следовали общей процедуре I, используя (S)-пирролидин-2-илметанол. LC-MS (способ A): RT = 3,99, [M+H]+ = 456,8.
Пример 87: N-(2-ацетиламиноэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1092)

Следовали общей процедуре I, используя N-(2-аминоэтил)ацетамид. LC-MS (способ A): RT = 3,86, [M+H]+ = 458,2.
Пример 88: N-этил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1093)

Следовали общей процедуре I, используя гидрохлорид этиламина. LC-MS (способ A): RT = 3,97, [M+H]+ = 400,8.
Пример 89: N-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1094)

Следовали общей процедуре I, используя 2-гидроксиэтиламин. LC-MS (способ A): RT = 3,82, [M + H]+ = 417,4.
Пример 90: N-(2-гидрокси-1-гидроксиметил-1-метилэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1095)
Следовали общей процедуре I, используя 2-амино-2-метилпропан-1,3-диол. LC-MS (способ A): RT = 3,86, [M+H]+ = 460,9.
Пример 91: N-(2-метоксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1096)

Следовали общей процедуре I, используя 2-метоксиэтиламин. LC-MS (способ A): RT = 3,99, [M+H]+ = 430,8.
Пример 92: N-(2-меркаптоэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1097)

Следовали общей процедуре I, используя 2-меркаптоэтиламин. LC-MS (способ A): RT = 4,11, [M+H]+ =432,0.
Пример 93: этиловый сложный эфир {4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}уксусной кислоты (соединение 1098)
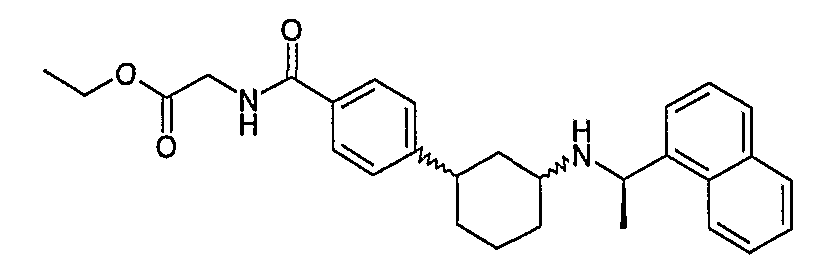
Следовали общей процедуре I, используя гидрохлорид этилового сложного эфира аминоуксусной кислоты.1H ЯМР (600 МГц, DMSO) δ 8,80 (т, 1H), 8,35 (д, 1H), 7,93 (д, 1H), 7,77 (дд, 2H), 7,70 (д, 2H), 7,55-7,47 (м, 3H), 7,11 (д, 2H), 4,73-4,65 (м, 1H), 4,11 (к, 2H), 3,96 (д, 2H), 3,02 (т, 1H), 2,88 (с, 1H), 1,92-1,82 (м, 1H), 1,80-1,70 (м, 2H), 1,67-1,60 (м, 1H), 1,54-1,37 (м, 6H), 1,34-1,26 (м, 1H), 1,20 (т, 3H), LC-MS (способ A): RT = 4,12, [M+H]+= 458,9
Пример 94: N,N-диметил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1099)

Следовали общей процедуре I, используя диметиламин. LC-MS (способ A): RT = 4,02, [M+H]+ = 400,8, [M-H]- = 399,3.
Пример 95: N-(2-гидроксиэтил)-N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1100)
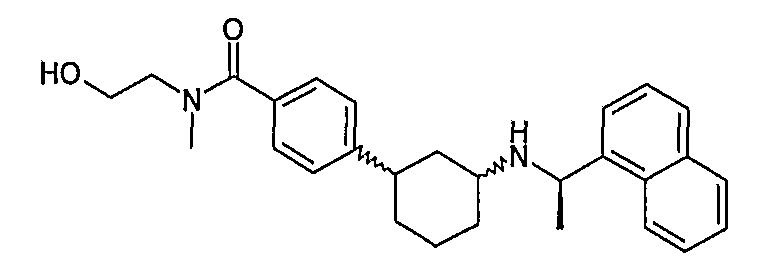
Следовали общей процедуре I, используя 2-метиламиноэтанол. LC-MS (способ A): RT = 3,87, [M+H]+ = 431,4.
Пример 96: N-этил-N-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1101)

Следовали общей процедуре I, используя 2-этиламиноэтанол. LC-MS (способ A): RT = 3,96, [M+H]+ = 444,9.
Пример 97: N,N-бис-(2-гидроксиэтил)-4-[3-((R)-1-нафталин~1-илэтиламино)циклогексил]бензамид (соединение 1102)

Следовали общей процедуре I, используя диэтаноламин. LC-MS (способ A): RT = 3,79, [M+H]+ =460,9.
Пример 98: N-(2-диметиламиноэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1103)

Следовали общей процедуре I, используя N,N-(2-диметиламиноэтил)амин. LC-MS (способ A): RT = 3,47, [M+H]+ = 444,2.
Пример 99: N-(3-диметиламинопропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1104)
Следовали общей процедуре I, используя N,N-(3-диметиламинопропил)амин. LC-MS (способ A): RT = 3,49, [M+H]+ = 358,0.
Пример 100: {4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пиперидин-1-илметанон (соединение 1105)

Следовали общей процедуре I, используя пиперидин. LC-MS (способ A): RT = 4,27, [M+H]+ = 441,1.
Пример 101: (4-метилпиперазин-1-ил)-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1106)

Следовали общей процедуре I, используя 4-метилпиперазин. LC-MS (способ A): RT = 3,46, [M+H]+ = 456,2, [M-H]- = 454,0.
Пример 102: [4-(2-гидроксиэтил)пиперазин-1-ил]-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1107)
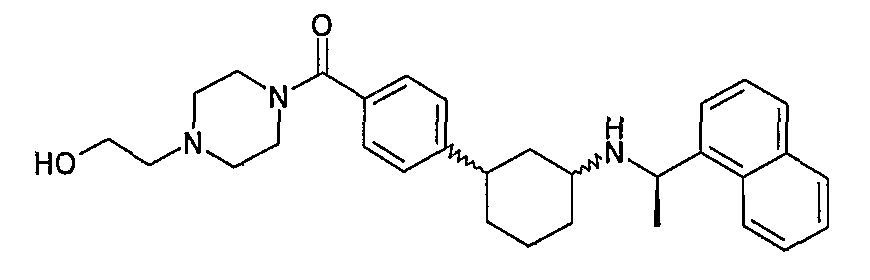
Следовали общей процедуре I, используя 2-гидроксиэтил)пиперазин. LC-MS (способ A): RT = 3,44, [M+H]+ = 486,1.
Пример 103: морфолин-4-ил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1108)

Следовали общей процедуре I, используя морфолин. LC-MS (способ A): RT = 4,02, [M+H]+ = 443,3.
Пример 104: (4-гидроксипиперидин-1-ил)-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1109)

Следовали общей процедуре I, используя пиперидин-4-ол. LC-MS (способ A): RT = 3,87, [M+H]+ = 456,9.
Пример 105: N-(3-имидазол-1-илпропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1110)

Следовали общей процедуре I, используя 3-имидазол-1-илпропиламин. LC-MS (способ A): RT = 3,51, [M+H]+ = 481,3.
Общая процедура J
К раствору/суспензии сложного эфира (6,5 ммоль) в MeOH (30 мл) и воде (10 мл) добавляли LiOH (5-8 экв.). После взбалтывания/перемешивания в течение 4 ч реакционную смесь слегка концентрировали в вакууме и еще добавляли воду. Продукт осаждали добавлением 4 н. водн. HCl при перемешивании до pH 5 (чтобы получить нейтральное соединение) или до pH 1-2 (чтобы получить соль гидрохлорид). Осадки собирали фильтрованием. Если осаждение не происходило, смесь экстрагировали DCM, органические экстракты концентрировали в вакууме, остаток растворяли в DMSO и/или DMF, и продукт очищали препаративной HPLC-MS, повторно анализировали путем LC/MS (способ B).
Пример 106: {4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}уксусная кислота (соединение 1115)

Следовали общей процедуре J, используя этиловый сложный эфир {4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}уксусной кислоты (соединение 1098).13C ЯМР (151 МГц, DMSO) δ 171,29, 166,16, 149,98, 133,41, 131,32, 130,61, 128,71, 127,29, 127,14, 126,48, 126,10, 125,53, 125,49, 123,58, 122,72, 50,78, 41,12, 36,76, 36,50, 32,26, 27,88, 23,25, 19,91.
Пример 107: 4-трет-бутиловый сложный эфир, 1-метиловый сложный эфир (S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}янтарной кислоты (соединение 1116)

Следовали общей процедуре I, используя гидрохлорид 4-трет-бутилового 1-метилового сложного эфира 1-аспарагиновой кислоты.13C ЯМР (151 МГц, DMSO) δ 171,28, 169,04, 165,91, 151,20, 142,43, 133,45, 130,89, 130,80, 128,58, 127,17, 126,49, 126,39, 125,60, 125,53, 125,14, 123,08, 122,95, 80,25, 52,04, 51,12, 50,16, 49,15, 38,54, 36,92, 36,81, 32,98, 28,95, 27,53, 24,62, 20,21.
Пример 108: 4-трет-бутиловый сложный эфир (S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}янтарной кислоты (соединение 1117)

Следовали общей процедуре J, используя 4-трет-бутиловый сложный эфир 1-метиловый сложный эфир 2-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоиламино}янтарной кислоты (соединение 1116).13C ЯМР (151 МГц, DMSO) δ 172,79, 169,88, 165,42, 150,58, 141,95, 133,45, 131,72, 130,79, 128,61, 126,97, 126,54, 126,44, 125,68, 125,55, 125,20, 123,16, 122,91, 79,56, 51,01, 50,21, 50,18, 38,29, 37,80, 36,83, 32,89, 28,79, 27,59, 24,38, 20,18.
Пример 109: метиловый сложный эфир (R)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенил-пропионовой кислоты (соединение 1118)

Следовали общей процедуре I, используя гидрохлорид метилового сложного эфира D-фенилаланина.13C ЯМР (151 МГц, DMSO) δ 172,14, 166,19, 151,07, 142,42, 137,65, 133,44, 130,94, 130,80, 128,93, 128,58, 128,11, 127,20, 126,41 (два перекрываемых сигнала), 126,34, 125,61, 125,53, 125,14, 123,07, 122,94, 54,07, 51,80, 51,06, 50,11, 38,56, 36,91, 36,07, 32,94, 28,93, 24,61, 20,20.
Пример 110: (R)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовая кислота (соединение 1119)
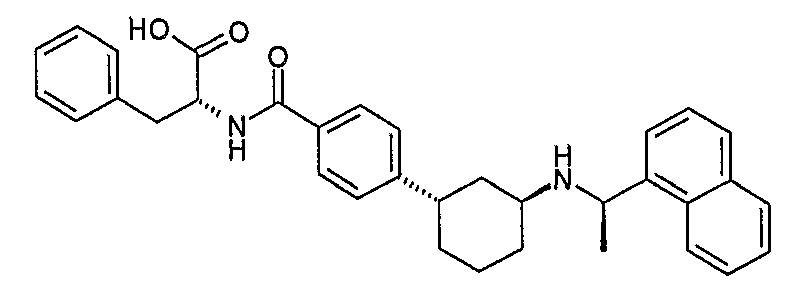
Следовали общей процедуре J, используя метиловый сложный эфир 2-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовой кислоты (соединение 1118) и LiOH.13C ЯМР (151 МГц, DMSO) δ 172,53, 164,74, 150,30, 142,39, 139,34, 133,44, 132,53, 130,81, 129,40, 128,57, 127,47, 126,50, 126,46, 126,40, 125,60, 125,54, 125,43, 125,14, 123,06, 122,94, 55,49, 50,98, 50,05, 38,64, 37,00, 36,84, 32,94, 28,90, 24,57, 20,21.
Пример 111: метиловый сложный эфир (S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовой кислоты (соединение 1120)

Следовали общей процедуре I, используя гидрохлорид метилового сложного эфира 1-фенилаланина.13C ЯМР (75 МГц, DMSO) δ 172,12, 166,17, 151,06, 142,33, 137,64, 133,45, 130,95, 130,80, 128,92, 128,58, 128,11, 127,20, 126,42, 126,34, 125,60, 125,52, 125,15, 123,09, 122,94, 54,06, 51,79, 51,07, 50,17, 38,43, 36,91, 36,09, 32,99, 28,94, 24,54, 20,20.
Пример 112: гидрохлорид (S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3~фенилпропионовой кислоты (соединение 1121)

Следовали общей процедуре J, используя метиловый сложный эфир 2-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовой кислоты (соединение 1120).13C ЯМР (151 МГц, DMSO) δ 173,05, 165,96, 148,84, 138,22, 133,31, 131,49, 130,29, 129,35, 128,96, 128,84, 128,18, 128,01, 127,29, 126,71, 126,42, 126,16, 125,85, 125,48, 124,57, 122,39, 54,14, 51,40, 50,43, 36,28, 36,11, 35,86, 31,35, 26,28, 21,73, 19,47.
Пример 113: метиловый сложный эфир (S)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1122)

Следовали общей процедуре I, используя гидрохлорид метилового сложного эфира L-триптофана.13C ЯМР (151 МГц, DMSO) δ 172,49, 166,18, 151,06, 142,42, 135,97, 133,44, 130,98, 130,80, 128,58, 127,24, 126,94, 126,39, 125,60, 125,53, 125,14, 123,50, 123,07, 122,94, 120,86, 118,30, 117,88, 111,35, 109,88, 53,60, 51,76, 51,08, 50,14, 38,50, 36,92, 33,02, 28,93, 26,48, 24,60, 20,20.
Пример 114: (S)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота (соединение 1123)

Следовали общей процедуре J, используя метиловый сложный эфир 3-(1H-индол-3-ил)-2-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1122).13C ЯМР (151 МГц, DMSO) δ 172,45, 164,74, 150,15, 142,39, 135,66, 133,44, 132,79, 130,80, 128,58, 128,18, 127,24, 126,50, 126,38, 125,59, 125,54, 125,13, 123,15, 123,07, 122,94, 120,16, 118,67, 117,60, 111,57, 110,77, 55,29, 51,02, 50,09, 38,58, 36,83, 33,00, 28,92, 27,07, 24,57, 20,21.
Пример 115: метиловый сложный эфир (R)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1124)

Следовали общей процедуре I, используя гидрохлорид метилового сложного эфира D-триптофана.13C ЯМР (151 МГц, DMSO) δ 172,48, 166,21, 151,04, 142,41, 135,98, 133,44, 130,99, 130,80, 128,58, 127,24, 126,95, 126,38, 125,60, 125,53, 125,14, 123,50, 123,07, 122,94, 120,86, 118,30, 117,89, 111,35, 109,90, 53,63, 51,76, 51,07, 50,12, 38,55, 36,91, 32,97, 28,93, 26,48, 24,60, 20,21.
Пример 116: (R)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота (соединение 1125)

Следовали общей процедуре J, используя метиловый сложный эфир 3-(1H-индол-3-ил)-2-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1124).13C ЯМР (151 МГц, DMSO) δ 172,04, 165,45, 150,47, 142,31, 135,83, 133,44, 132,05, 130,80, 128,58, 127,60, 126,86, 126,42, 126,35, 125,61, 125,53, 125,14, 123,24, 123,07, 122,93, 120,49, 118,33, 117,92, 111,04, 54,47, 50,95, 50,08, 38,54, 36,84, 32,96, 28,87, 26,88, 24,54, 20,20.
Общая процедура I-1:
К раствору 4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1056, 35 мг) в DMF (1 мл) добавляли HATU (1,2 экв.) и DIPEA (2 экв.). Раствор перемешивали при к.т. в течение 2 ч, затем добавляли к амину (2 экв.). Если амин был приготовлен как гидрохлорид, добавляли DIPEA (2 экв.). Смесь взбалтывали при к.т. в течение ночи, фильтровали и очищали препаративной HPLC-MS (повторно анализировали путем LC/MS, способ A).
Общая процедура I-2:
Подобна процедуре I, за исключением того, что соединение 1057 (Пример 54) используют вместо соединения 1056.
Общая процедура I-3
К раствору или суспензии 4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1056) в DMF (1 M) в атмосфере аргона добавляли HOBt (1,1 экв.), EDAC (1 экв.), 4-метилморфолин (1 экв.) и амин (1 экв.). Смесь перемешивали при к.т. в течение ночи. DMF удаляли в вакууме и очистку осуществляли флэш-хроматографией с непрерывным градиентом.
Пример 117: этиловый сложный эфир (циклогексил-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусной кислоты (соединение 1126).

Следовали общей процедуре I-2, используя этиловый сложный эфир N-циклогексилглицина.1H ЯМР (500 МГц, DMSO, T=400 K) δ 8,31 (д, 1H), 7,87 (д, 1H), 7,74 (д, 1H), 7,69 (д, 1H), 7,50-7,42 (м, 3H), 7,20 (дд, 4H), 4,81-4,67 (м, 1H), 4,09 (к, 2H), 3,99 (с, 2H), 3,76-3,63 (м, 1H), 3,08 (т, 1H), 2,97-2,87 (м, 1H), 1,90-1,83 (м, 1H), 1,81-1,67 (м, 6H), 1,65-1,37 (м, 11H), 1,18 (т, 3H), 1,14-1,02 (м, 3H), LC-MS (способ A): RT=5,47, [M+H]+=541,3.
Пример 118: диэтиловый сложный эфир 2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}малоновой кислоты (соединение 1127)
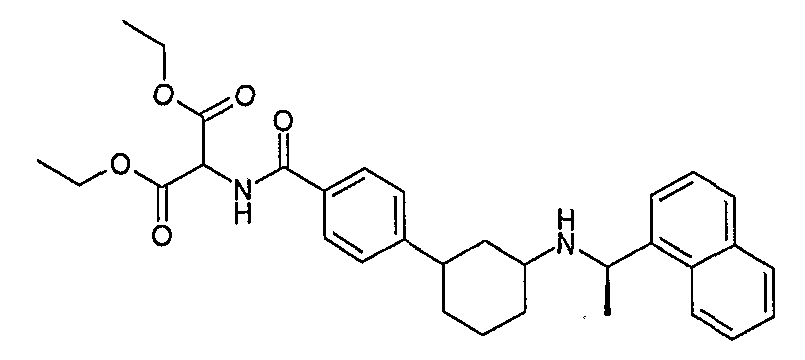
Следовали общей процедуре I-2, используя гидрохлорид диэтил аминомалоната.1H ЯМР (500 МГц, DMSO) δ 8,45 (с, 1H), 8,28 (д, 1H), 7,90 (д, 1H), 7,79 (д, 1H), 7,76-7,69 (м, 3H), 7,55-7,44 (м, 3H), 7,25 (д, 2H), 5,25 (д, 1H), 4,98-4,78 (м, 1H), 4,27-4,14 (м, 4H), 3,18-3,08 (м, 1H), 3,05-2,97 (м, 1H), 1,88 (м, 1H), 1,61 (м, 10H), 1,23 (т, 6H).
Пример 119: трет-бутиловый сложный эфир (S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1128)

Следовали общей процедуре I-3, используя гидрохлорид трет-бутилового сложного эфира L-серина.13C ЯМР (151 МГц, DMSO) δ 169,55, 166,25, 150,81, 133,45, 131,32, 130,78, 128,61, 127,22, 126,55, 126,42, 125,68, 125,54, 125,20, 123,15, 122,92, 80,43, 61,20, 56,10, 51,06, 50,28, 38,33, 36,86, 32,88, 28,80, 27,61, 24,40, 20,17.
Пример 120: 5-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}никотиновая кислота (соединение 1129)
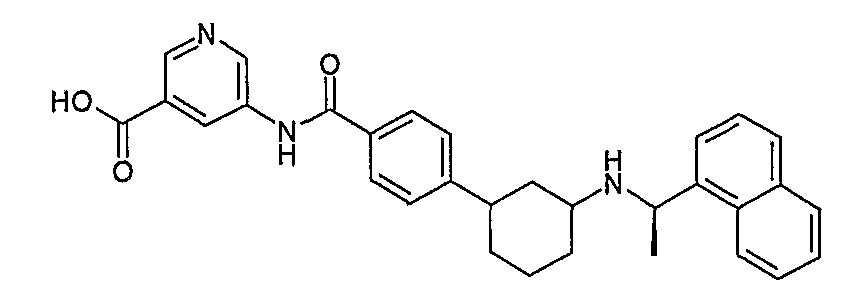
Следовали общей процедуре I-1, используя этиловый сложный эфир 5-аминоникотиновой кислоты.1H ЯМР (600 МГц, DMSO) δ 9,12 (д, 1H), 8,79 (д, 1H), 8,74-8,70 (м, 1H), 8,36 (д, 1H), 7,94 (д, 1H), 7,85 (д, 2H), 7,80 (дд, 2H), 7,57-7,48 (м, 3H), 7,22 (д, 2H), 4,86-4,76 (м, 1H), 3,12-3,04 (м, 1H), 2,97-2,90 (м, 1H), 1,95-1,30 (м, 11H).
Пример 121: 4-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}бензойная кислота (соединение 1130)

Следовали общей процедуре I-1, используя этиловый сложный эфир 4-аминобензойной кислоты. Промежуточный этиловый сложный эфир гидролизовали, следуя общей процедуре J, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 10,41 (с, 1H), 8,35 (д, 1H), 7,97-7,88 (м, 5H), 7,86-7,77 (м, 4H), 7,59-7,50 (м, 3H), 7,22 (д, 2H), 4,84 (ш.с, 1H), 3,11-3,04 (м, 1H), 3,02-2,92 (м, 1H), 1,92-1,32 (м, 11H).
Пример 122: гидрохлорид метилового сложного эфира 4-метокси-3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}бензойной кислоты (соединение 1131)

Следовали общей процедуре I-1, используя метил 3-амино-4-метоксибензоат. Продукт растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок отфильтровывали, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 9,48 (с, 1H), 8,85 (м, 2H), 8,42 (д, 1H), 8,35 (д, 1H), 8,03 (т, 2H), 7,89 (д, 3H), 7,83 (дд, 1H), 7,69-7,59 (м, 3H), 7,31 (д, 2H), 7,23 (д, 1H), 5,55 (с, 1H), 3,93 (с, 3H), 3,84 (с, 3H), 3,30-3,22 (м, 1H), 3,16-3,07 (м, 1H), 2,04-1,77 (м, 5H), 1,72 (д, 3H), 1,70-1,60 (м, 2H), 1,56-1,49 (м, 1H).
Пример 123: гидрохлорид 2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}бензойной кислоты (соединение 1132)

Следовали общей процедуре I-1, используя метил 2-аминобензоат. Промежуточный метиловый сложный эфир гидролизовали, следуя общей процедуре J, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 8,69 (д, 1H), 8,35 (д, 1H), 8,06 (дд, 1H), 8,00 (дд, 2H), 7,90 (д, 3H), 7,67-7,62 (м, 2H), 7,59 (т, 1H), 7,56-7,49 (м, 1H), 7,34 (д, 2H), 7,12 (т, 1H), 5,53-5,34 (м, 1H), 3,24-3,18 (м, 1H), 3,18-3,11 (м, 1H), 2,00-1,76 (м, 5H), 1,73-1,48 (м, 6H).
Пример 124: гидрохлорид (карбоксиметил-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусной кислоты (соединение 1133)
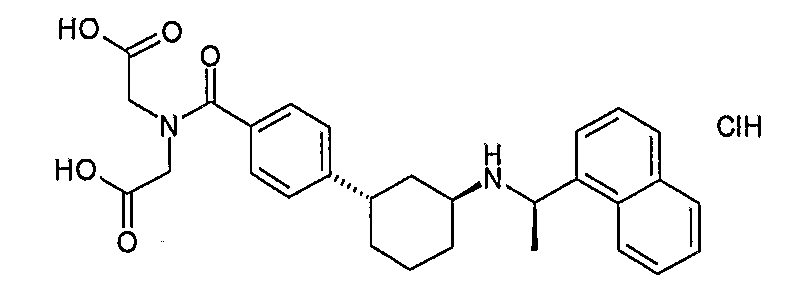
Следовали общей процедуре I-1, используя диэтилиминодиацетат. Промежуточный диэтиловый сложный эфир гидролизовали, следуя общей процедуре J,получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 8,34 (д, 1H), 8,00 (д, 1H), 7,96 (д, 1H), 7,84 (д, 1H), 7,62 (т, 2H), 7,58 (т, 1H), 7,24 (д, 2H), 7,17 (д, 2H), 5,36 (с, 1H), 4,00 (с, 2H), 3,79 (с, 2H), 3,18-3,13 (м, 1H), 3,06-2,99 (м, 1H), 1,92-1,74 (м, 5H), 1,65 (д, 3H), 1,60-1,46 (м, 3H).
Пример 125: 1-({4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}метил)циклопентанкарбоновая кислота (соединение 1134)

Следовали общей процедуре I-1, используя этил 1-(аминометил)циклопентанкарбоксилат. Промежуточный этиловый сложный эфир гидролизовали, следуя общей процедуре J, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 8,34 (д, 1H), 8,15 (д, 1H), 7,93 (д, 1H), 7,77 (дд, 2H), 7,64 (д, 2H), 7,55-7,48 (м, 3H), 7,10 (д, 2H), 4,70 (к, 1H), 3,48 (д, 2H), 3,06-2,98 (м, 1H), 2,89-2,85 (м, 1H), 1,95-1,82 (м, 3H), 1,81-1,70 (м, 2H), 1,68-1,46 (м, 10H), 1,46-1,36 (м, 1H), 1,44 (д, 3H), 1,35-1,26 (м, 1H).
Пример 126: гидрохлорид 1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклопентанкарбоновой кислоты (соединение 1135)
Следовали общей процедуре I-1, используя гидрохлорид метил 1-амино-1-циклопентан-карбоксилата. Промежуточный метиловый сложный эфир гидролизовали, следуя общей процедуре J, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 11,93 (ш.с, 1H), 8,88 (с, 2H), 8,42 (с, 1H), 8,34 (д, 1H), 8,01 (дд, 2H), 7,89 (д, 1H), 7,77 (д, 2H), 7,69-7,63 (м, 2H), 7,61 (т, 1H), 7,23 (д, 2H), 5,54 (ш.с, 1H), 3,27-3,20 (м, 1H), 3,12-3,05 (м, 1H), 2,18-2,09 (м, 2H), 2,06-1,57 (м, 16H), 1,54-1,46 (м, 1H).
Пример 127: гидрохлорид 3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1136)

Следовали общей процедуре J, используя метиловый сложный эфир 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1088).1H ЯМР (600 МГц, DMSO) δ 9,47 (ш.с, 1H), 8,46 (т, 1H), 8,35 (д, 1H), 7,97 (д, 1H), 7,89 (д, 1H), 7,72 (д, 2H), 7,60-7,52 (м, 3H), 7,18 (д, 2H), 5,15 (ш.с, 1H), 3,45 (дд, 2H), 3,20-3,11 (м, 1H), 3,06-2,98 (м, 1H), 2,54-2,48 (м, 2H)(перекрываемый DMSO сигнал), 2,00-1,81 (м, 3H), 1,79-1,58 (м, 5H), 1,57-1,36 (м, 3H).
Пример 128: гидрохлорид (1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклогексил)уксусной кислоты (соединение 1137)

Следовали общей процедуре I-1, используя метиловый сложный эфир (1-амино-циклогексил)уксусной кислоты. Промежуточный метиловый сложный эфир гидролизовали, следуя общей процедуре J, чтобы получить указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 12,94-10,67 (ш.с, 1H), 8,83 (с, 2H), 8,34 (д, 1H), 8,02 (дд, 2H), 7,89 (д, 1H), 7,70 (д, 2H), 7,68-7,64 (м, 2H), 7,61 (т, 1H), 7,47 (с, 1H), 7,20 (д, 2H), 5,59-5,50 (м, 1H), 3,30-3,20 (м, 1H), 3,11-3,03 (м, 1H), 2,75 (с, 2H), 2,32 (м, 2H), 2,02-1,86 (м, 3H), 1,85-1,74 (м, 2H), 1,72 (д, 3H), 1,68-1,57 (м, 2H), 1,57-1,41 (м, 8H), 1,30-1,20 (м, 1H).
Пример 129: этиловый сложный эфир 1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино]циклопропанкарбоновой кислоты (соединение 1138)

Следовали общей процедуре I, используя гидрохлорид этилового сложного эфира 1-аминоциклопропан-1-карбоновой кислоты.13C ЯМР (151 МГц, DMSO) δ 172,07, 167,00, 151,01, 142,43, 133,45, 131,26, 130,81, 128,59, 127,16, 126,40, 125,60, 125,54, 125,15, 123,08, 122,95, 60,43, 60,13, 51,10, 50,17, 38,57, 36,92, 33,25, 33,00, 28,96, 24,62, 20,22, 17,49, 16,62, 13,98.
Пример 130: 1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклопропанкарбоновая кислота (соединение 1139)

Следовали общей процедуре J, используя этиловый сложный эфир 1-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклопропанкарбоновой кислоты (соединение 1138).13C ЯМР (151 МГц, DMSO) δ 174,06, 167,01, 150,30, 133,58, 131,68, 130,79, 128,88, 127,45, 127,41, 126,59, 126,53, 126,24, 125,71, 125,63, 123,77, 122,91, 51,00, 50,89, 36,68, 33,34, 33,15, 32,56, 28,15, 23,60, 20,10, 17,01, 16,57.
Пример 131: 1-({4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}метил)циклопропанкарбоновая кислота (соединение 1140)

Следовали общей процедуре I-1, используя этиловый сложный эфир 1-(аминометил)циклопропанкарбоновой кислоты. Промежуточный этиловый сложный эфир гидролизовали, следуя общей процедуреJ, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 8,35 (д, 1H), 8,21 (т, 1H), 7,93 (д, 1H), 7,80 (д, 1H), 7,77 (д, 1H), 7,67 (д, 2H), 7,52 (дк, 3H), 7,10 (д, 2H), 4,76 (ш.с, 1H), 3,52 (д, 2H), 3,06-2,97 (м, 1H), 2,93-2,87 (м, 1H), 1,91-1,81 (м, 1H), 1,80-1,70 (м, 2H), 1,69-1,62 (м, 1H), 1,58-1,38 (м, 6H), 1,37-1,28 (м, 1H), 1,02 (к, 2H), 0,89 (дд, 2H).
Пример 132: 2-метил-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота (соединение 1141)
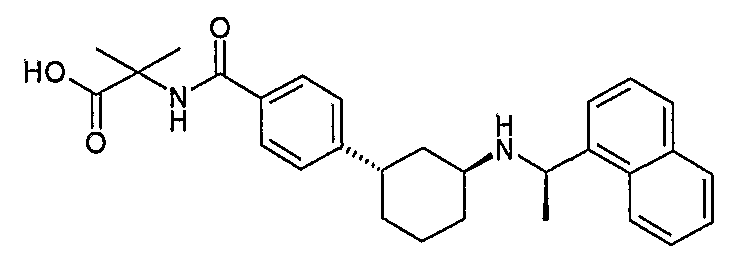
Следовали общей процедуре I-1, используя гидрохлорид метилового сложного эфира 2-метилаланина. Промежуточный метиловый сложный эфир гидролизовали, следуя общей процедуре J, получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δ 8,35 (д, 1H), 8,31 (с, 1H), 7,98-7,89 (м, 1H), 7,82 (дд, 2H), 7,69 (д, 2H), 7,59-7,46 (м, 3H), 7,11 (д, 2H), 4,83 (к, 1H), 3,13-2,99 (м, 1H), 2,97-2,88 (м, 1H), 1,97-1,21 (м, 8H), 1,50 (д, 3H), 1,44 (с, 6H).
Пример 133: 1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}азетидин-3-карбоновая кислота (соединение 1142)

Следовали общей процедуре I-1, используя гидрохлорид метилового сложного эфира 3-азетидинкарбоновой кислоты. Промежуточный метиловый сложный эфир гидролизовали, следуя общей процедуреJ, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 8,34 (д, 1H), 7,97-7,91 (м, 1H), 7,81 (д, 1H), 7,77 (д, 1H), 7,53 (м, 3H), 7,48 (д, 2H), 7,13 (д, 2H), 4,82 (ш.с, 1H), 4,43 (м, 1H), 4,31 (м, 1H), 4,19 (м, 1H), 4,04 (м, 1H), 3,43 (м, 1H), 3,02 (м, 1H), 2,90 (м, 1H), 1,90-1,65 (м, 4H), 1,61-1,30 (м, 7H).
Пример 134: (метил-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота (соединение 1143)

Следовали общей процедуре I-1, используя гидрохлорид этилового сложного эфира н-метилглицина. Промежуточный этиловый сложный эфир гидролизовали, следуя общей процедуреJ, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 8,34 (д, 1H), 7,94 (д, 1H), 7,82 (д, 1H), 7,79-7,74 (м, 1H), 7,57-7,48 (м, 3H), 7,27 (д, 1H), 7,12 (дт, 3H), 4,91-4,76 (ш.с, 1H), 4,11 (с, 1H), 3,89 (с, 1H), 3,06-2,98 (м, 1H), 2,97-2,90 (м, 4H), 1,91-1,67 (м, 4H), 1,63-1,53 (м, 1H), 1,53-1,40 (м, 5H), 1,40-1,30 (м, 1H).
Пример 135: 4-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}масляная кислота (соединение 1144)
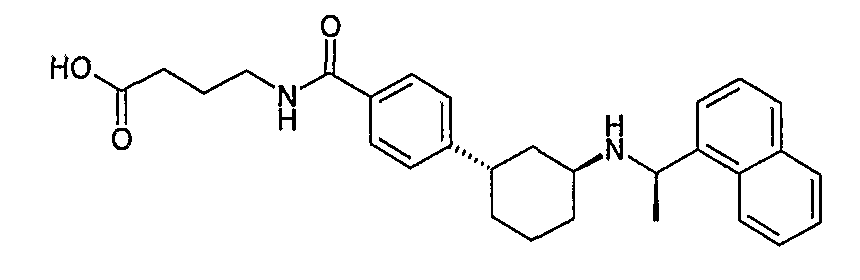
Следовали общей процедуре I-1, используя гидрохлорид этил 4-аминобутирата. Промежуточный этиловый сложный эфир гидролизовали, следуя общей процедуреJ, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 8,35 (т, 2H), 7,97-7,91 (м, 1H), 7,81 (д, 1H), 7,77 (д, 1H), 7,68 (д, 2H), 7,53 (м, 3H), 7,10 (д, 2H), 4,79 (с, 1H), 3,24 (дд, 2H), 3,02 (т, 1H), 2,92 (с, 1H), 2,25 (т, 2H), 1,73 (т, 2H), 1,92-1,63 (м, 4H), 1,60-1,29 (м, 7H).
Пример 136: этиловый сложный эфир 1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пиперидин-4-карбоновой кислоты (соединение 1145)
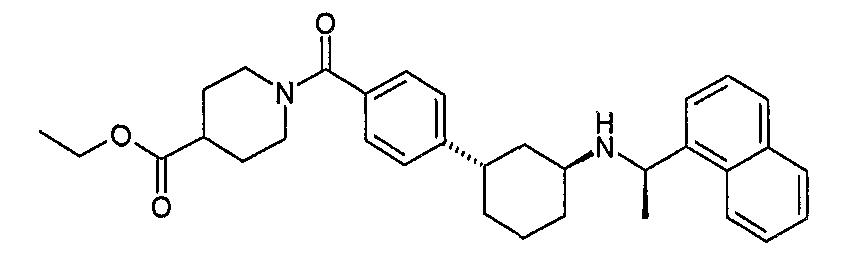
Следовали общей процедуре I-1, используя этиловый сложный эфир 4-пиперидинкарбоновой кислоты.13C ЯМР (126 МГц, DMSO) δ 173,69, 169,04, 148,70, 142,38, 133,45, 133,30, 130,83, 128,57, 126,60, 126,51, 126,40, 125,60, 125,52, 125,13, 123,04, 122,93, 59,87, 50,93, 50,00, 46,26, 39,92, 38,67, 36,85, 32,98, 28,93, 27,84, 24,50, 20,24, 13,96.
Пример 137: 1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пиперидин-4-карбоновая кислота (соединение 1146)
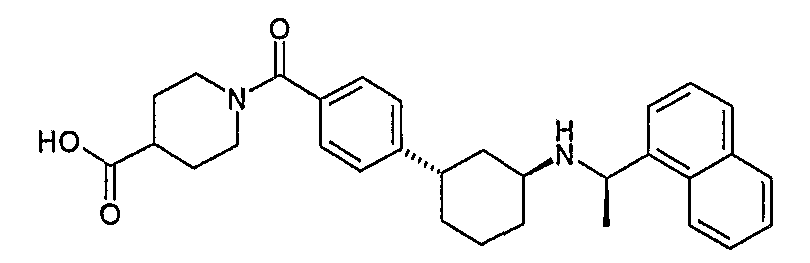
Следовали общей процедуре J, используя этиловый сложный эфир 1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пиперидин-4-карбоновой кислоты (соединение 1145).1H ЯМР (600 МГц, DMSO) δ 12,21 (ш.с, 1H), 9,37 (д, 2H), 8,35 (д, 1H), 8,13 (д, 1H), 7,99 (дд, 2H), 7,69-7,54 (м, 3H), 7,25 (дд, 4H), 5,50 (с, 1H), 4,43-4,18 (м, 1H), 3,60-3,41 (м, 1H), 3,24-3,12 (м, 2H), 3,11-2,79 (м, 2H), 2,57-2,47 (м, 1H), 2,11-1,69 (м, 10H), 1,68-1,38 (м, 5H).
Пример 138: этиловый сложный эфир (циклогексил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусной кислоты (соединение 1147)

К раствору 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (пр. 54, 20 мг) в 400 мкл DMF добавляли диизопропилэтиламин (3 экв.) и гексафторфосфат бром-трис-пирролидино-фосфония (PyBroP, 1 экв.). Раствор охлаждали на бане со льдом и добавляли этиловый сложный эфир N-циклогексилглицина (3 экв.), а затем 1-гидрокси-7-азабензотриазол (HOAt, 3 экв.). После взбалтывания в течение ночи при к.т. реакционную смесь разбавляли водным NaHCO3 и экстрагировали дихлорметаном. Органические экстракты концентрировали в вакууме и очищали путем HPLC-MS.1H ЯМР (500 МГц, DMSO) δ 8,25 (д, 1H), 7,98 (с, 2H), 7,82 (с, 1H), 7,59 (с, 3H), 7,12 (т, 4H), 5,51-5,31 (м, 1H), 4,10 (к, 2H), 3,99 (с, 2H), 3,69-3,57 (м, 1H), 3,36-3,22 (м, 1H), 3,20-3,10 (м, 1H), 2,10-1,95 (м, 2H), 1,86-1,64 (м, 12H), 1,56-1,38 (м, 4H), 1,19 (т, 3H), 1,13-0,98 (м, 3H).
Пример 139: (циклогексил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота (соединение 1148)

Следовали общей процедуре J, используя этиловый сложный эфир (циклогексил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусной кислоты (соединение 1147). LC-MS (способ B): RT = 3,23, [M+H]+ = 513,5.
Пример 140: 4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-((R)-2-оксотетрагидрофуран-3-ил)бензамид (соединение 1149)

Следовали общей процедуре I, используя гидрохлорид (R)-(+)-2-амино-4-бутиролактона.13C ЯМР (75 МГц, DMSO) δ 175,25, 165,82, 151,24, 142,45, 133,46, 130,82, 130,77, 128,58, 127,08, 126,54, 126,41, 125,59, 125,53, 125,14, 123,10, 122,97, 65,21, 51,16, 50,20, 48,23, 38,56, 36,92, 32,93, 29,01, 27,90, 24,60, 20,23.
Пример 141: N-цианометил-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1150)
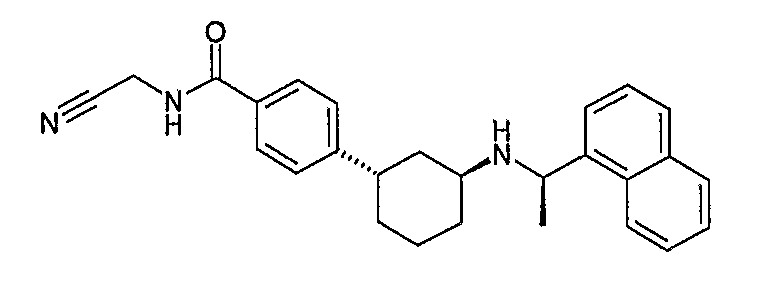
Следовали общей процедуре I, используя гидрохлорид аминоацетонитрила.1H ЯМР (300 МГц, DMSO) δ 9,08 (т, 1H), 8,35 (д, 1H), 7,97-7,87 (м, 1H), 7,84-7,66 (м, 4H), 7,58-7,43 (м, 3H), 7,13 (д, 2H), 4,66 (с, 1H), 4,29 (д, 2H), 3,12-2,96 (м, 1H), 2,94-2,82 (м, 1H), 1,95-1,21 (м, 12H).
Пример 142: N-(4-циано-1H-пиразол-3-ил)-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1151)
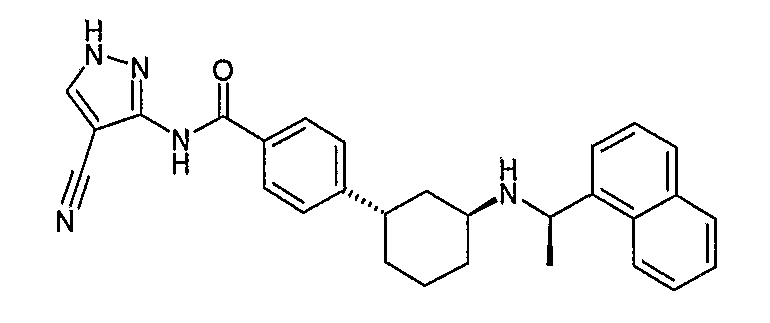
Следовали общей процедуре I, используя 4-циано-5-аминопиразол.1H ЯМР (300 МГц, DMSO) δ 8,35 (д, 1H), 8,02 (с, 1H), 7,96-7,70 (м, 6H), 7,56-7,43 (м, 3H), 7,22-7,10 (м, 2H), 4,65 (к, 1H), 3,14-2,98 (м, 1H), 2,90-2,81 (м, 1H), 2,23 (ш.с, 1H), 1,97-1,20 (м, 11H).
Пример 143: бензиловый сложный эфир (R)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1152)

Следовали общей процедуре I-3, используя гидрохлорид бензилового сложного эфира D-серина.1H ЯМР (600 МГц, DMSO) δ 8,47 (д, 1H), 8,35 (д, 1H), 7,92 (д, 1H), 7,76 (дд, 2H), 7,73 (д, 2H), 7,55-7,46 (м, 3H), 7,40-7,29 (м, 5H), 7,11 (д, 2H), 5,15 (дд, 2H), 5,07 (т, 1H), 4,70-4,62 (м, 1H), 4,57 (дд, 1H), 3,86-3,78 (м, 2H), 3,03 (т, 1H), 2,87 (с, 1H), 2,22 (ш.с, 1H), 1,93-1,82 (м, 1H), 1,82-1,70 (м, 2H), 1,63 (д, 1H), 1,54-1,35 (м, 6H), 1,29 (т, 1H).
Пример 144: бензиловый сложный эфир (S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1153)

Следовали общей процедуре I-3, используя гидрохлорид бензилового сложного эфира L-серина.1H ЯМР (600 МГц, DMSO) δ 8,47 (д, 1H), 8,35 (д, 1H), 7,92 (д, 1H), 7,77 (дд, 2H), 7,73 (д, 2H), 7,55-7,46 (м, 3H), 7,39-7,29 (м, 5H), 7,12 (д, 2H), 5,15 (дд, 2H), 5,07 (т, 1H), 4,66 (ш.с, 1H), 4,57 (дт, 1H), 3,86-3,78 (м, 2H), 3,03 (т, 1H), 2,91-2,83 (м, 1H), 2,22 (ш.с, 1H), 1,94-1,83 (м, 1H), 1,81-1,70 (м, 2H), 1,67-1,59 (м, 1H), 1,53-1,24 (м, 7H).
Пример 145: метиловый сложный эфир (S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1154)

Следовали общей процедуре I-3, используя гидрохлорид метилового сложного эфира L-серина.13C ЯМР (126 МГц, DMSO) δ 171,12, 166,38, 151,16, 142,39, 133,58, 131,16, 130,92, 128,71, 127,39, 126,58, 126,55, 125,75, 125,65, 125,29, 123,24, 123,06, 61,09, 55,58, 51,84, 51,24, 50,36, 38,55, 37,03, 33,07, 29,06, 24,62, 20,32.
Пример 146: метиловый сложный эфир (R)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1155)

Следовали общей процедуре I-3, используя гидрохлорид метилового сложного эфира D-серина.1H ЯМР (600 МГц, DMSO) δ 8,43 (д, 1H), 8,35 (д, 1H), 7,93 (д, 1H), 7,77 (дд, 2H), 7,74 (д, 2H), 7,56-7,46 (м, 3H), 7,12 (д, 2H), 5,05 (т, 1H), 4,69 (с, 1H), 4,51 (дд, 1H), 3,78 (т, 2H), 3,64 (с, 3H), 3,03 (м, 1H), 2,88 (с, 1H), 1,93-1,83 (м, 1H), 1,82-1,70 (м, 2H), 1,68-1,60 (м, 1H), 1,54-1,46 (м, 2H), 1,46-1,35 (м, 1H), 1,44 (д, 3H), 1,35-1,25 (м, 1H).
Пример 147: гидрохлорид этилового сложного эфира (S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1156)
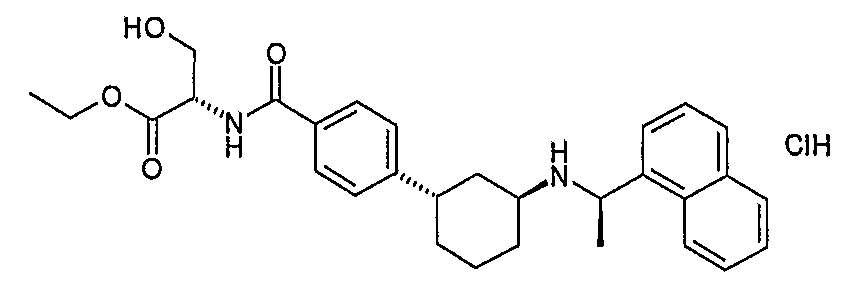
Следовали общей процедуре I-3, используя гидрохлорид этилового сложного эфира L-серина. Продукт растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок отфильтровывали, получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δ 9,42 (с, 2H), 8,51 (д, 1H), 8,35 (д, 1H), 8,15 (д, 1H), 7,99 (т, 2H), 7,84 (д, 2H), 7,61 (дт, 13,5, 3H), 7,28 (д, 2H), 5,57-5,43 (м, 1H), 5,24-4,99 (ш.с, 1H), 4,48 (дд, 1H), 4,11 (к, 2H), 3,80 (д, 2H), 3,31-3,08 (м, 2H), 2,10-1,36 (м, 12H), 1,19 (т, 3H).
Пример 148: гидрохлорид 3-гидрокси-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1157)

трет-Бутиловый сложный эфир (S)-3-гидрокси-2-{4-[(1S,3S)-3-(1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовой кислоты (соединение 1128, 150 мг) суспендировали в 5 мл HCl (4 M в диоксане) и перемешивали в течение ночи при комнатной температуре. Диэтиловый простой эфир добавляли к реакционной смеси и полученный таким образом осадок отфильтровывали, промывали дополнительным количеством простого эфира и сушили.13C ЯМР (151 МГц, DMSO) δ 171,84, 166,00, 148,26, 133,82, 133,34, 131,63, 130,23, 129,77, 128,94, 127,50, 127,02, 126,43, 126,14, 125,52, 124,61, 122,30, 61,04, 55,58, 51,97, 48,48, 35,74, 33,44, 30,97, 25,84, 20,79, 19,32.
Пример 149: (R)-4-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}масляная кислота (соединение 1158)

Следовали общей процедуре J, используя 4-[3-(1-нафталин-1-илэтиламино)циклогексил]-N-(2-оксотетрагидрофуран-3-ил)бензамид (соединение 1149).13C ЯМР (75 МГц, DMSO) δ 173,97, 166,15, 150,61, 141,77, 133,45, 131,49, 130,77, 128,61, 127,16, 126,60, 126,39, 125,70, 125,53, 125,21, 123,18, 122,90, 57,67, 51,01, 50,27, 50,12, 38,18, 36,83, 33,79, 32,87, 28,76, 24,28, 20,16.
Пример 150: формиат N-трет-бутокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамида (соединение 1159)

Следовали общей процедуре I, используя гидрохлорид O-(трет-бутил)гидроксиламина.13C ЯМР (151 МГц, DMSO) δ 165,88, 163,70, 150,90, 142,24, 133,44, 130,78, 130,22, 128,59, 127,10, 126,50, 126,45, 125,63, 125,53, 125,16, 123,09, 122,92, 80,68, 51,00, 50,13, 38,43, 36,93, 32,99, 28,86, 26,39, 24,52, 20,18.
Пример 151: формиат N-трет-бутокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамида (соединение 1160)

Следовали общей процедуре I-2, используя гидрохлорид О-(трет-бутил)гидроксиламина.13C ЯМР (151 МГц, DMSO) δ 165,89, 163,24, 150,59, 141,24, 133,38, 130,75, 130,31, 128,62, 127,20, 126,66, 125,80, 125,52, 125,24, 123,09, 122,71, 80,70, 50,03, 49,49, 36,60, 35,95, 32,93, 30,31, 26,40, 24,01, 20,33.
Пример 152: формиат N-метокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамида (соединение 1161)

Следовали общей процедуре I, используя гидрохлорид O-метилгидроксиламина.13C ЯМР (75 МГц, DMSO) δ 163,56, 150,81, 141,06, 133,57, 130,84, 129,75, 128,77, 126,99, 126,72, 125,97, 125,65, 125,44, 123,44, 122,96, 63,18, 51,10, 50,60, 37,77, 36,87, 32,69, 28,59, 24,02, 20,18.
Пример 153: формиат N-метокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамида (соединение 1162)
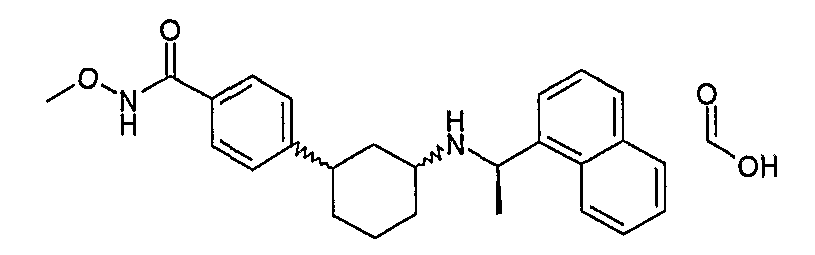
Следовали общей процедуре I-2, используя гидрохлорид O-метилгидроксиламина.13C ЯМР (151 МГц, DMSO) δ 163,43, 150,64, 140,70, 133,38, 130,71, 129,65, 128,65, 126,94, 126,83, 126,76, 125,89, 125,52, 125,31, 123,21, 122,69, 63,08, 50,05, 49,62, 36,52, 35,63, 32,71, 30,11, 23,77, 20,27.
Пример 154: 4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-(тетрагидрофуран-3-илметокси)бензамид (соединение 1163)

Следовали общей процедуре I, используя О-(тетрагидрофуран-3-илметил)гидроксиламин (WO 2005054179).13C ЯМР (75 МГц, DMSO) δ 163,30, 150,95, 141,75, 133,47, 130,78, 129,63, 128,63, 126,89, 126,61, 125,73, 125,54, 125,24, 123,19, 122,91, 77,10, 69,88, 66,72, 51,05, 50,33, 38,13, 37,28, 36,88, 32,78, 28,78, 28,37, 24,27, 20,15.
Пример 155: 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-(тетрагидрофуран-3-илметокси)бензамид (соединение 1164)

Следовали общей процедуре I-2, используя O-(тетрагидрофуран-3-илметил)гидроксиламин (WO 2005054179). LC-MS (способ B): RT = 2,49, [M+H]+ = 473,3.
Пример 156: бис-формиат N-метокси-N-метил-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамида (соединение 1165)

Следовали общей процедуре I, используя гидрохлорид N,O-диметилгидроксиламина.1H ЯМР (300 МГц, DMSO) δ 8,34 (д, 1H), 8,20 (с, 2H), 7,97-7,88 (м, 1H), 7,76 (т, 2H), 7,57-7,39 (м, 5H), 7,09 (д, 8,2, 2H), 4,69 (к, 1H), 3,53 (с, 3H), 3,22 (с, 3H), 3,09-2,95 (м, 1H), 2,91-2,82 (м, 1H), 1,95-1,60 (м, 4H), 1,57-1,21 (м, 7H).
Пример 157: N-метокси-N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1166)

Следовали общей процедуре I-2, используя гидрохлорид N,O-диметилгидроксиламина.1H ЯМР (300 МГц, DMSO) δ 8,34-8,27 (м, 1H), 7,96-7,88 (м, 1H), 7,76 (дд, 2H), 7,56-7,43 (м, 5H), 7,24 (д, 2H), 4,77 (к, 1H), 3,54 (с, 3H), 3,23 (с, 3H), 3,17-3,06 (м, 1H), 2,87-2,80 (м, 1H), 1,90-1,34 (м, 11H).
Пример 158: N-бензилокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1167)

Следовали общей процедуре I, используя гидрохлорид О-бензил-гидроксиламина.13C ЯМР (75 МГц, DMSO) δ 163,90, 151,07, 141,88, 136,04, 133,57, 130,89, 129,74, 128,86, 128,73, 128,30, 128,25, 127,03, 126,71, 125,82, 125,65, 125,33, 123,31, 123,01, 76,92, 51,15, 50,40, 38,26, 36,98, 32,89, 28,87, 24,39, 20,26.
Пример 159: N-бензилокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1168)

Следовали общей процедуре I-2, используя гидрохлорид O-бензилгидроксиламина.13C ЯМР (75 МГц, DMSO) δ 163,71, 150,20, 139,74, 135,94, 133,41, 130,66, 129,73, 128,78, 128,71, 128,21, 128,17, 127,14, 127,01, 126,72, 126,07, 125,53, 125,43, 123,46, 122,63, 76,83, 50,05, 49,89, 36,39, 35,08, 32,39, 29,79, 23,35, 20,18.
Пример 160: N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1169)

К раствору N-бензилокси-4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензамида (соединение 1168, 17 мг) в 700 мкл добавляли 2 мг палладия на углероде (10%) и смесь гидрогенизировали при энергичном перемешивании в течение ночи при к.т. Катализатор отфильтровывали через целит и фильтрат концентрировали в вакууме. Продукт очищали путем HPLC.1H ЯМР (600 МГц, DMSO) δ 8,32 (д, 1H), 8,19 (с, 1H), 7,92 (дд, 1H), 7,78 (д, 1H), 7,74 (д, 1H), 7,56 (д, 2H), 7,53-7,46 (м, 3H), 7,20 (д, 2H), 4,75 (к, 1H), 3,11-3,05 (м, 1H), 2,83 (ш.с, 1H), 1,86-1,73 (м, 3H), 1,62-1,55 (м, 1H), 1,51-1,35 (м, 7H).
Пример 161: N-гидрокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1170)

4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойную кислоту (соединение 1056, 50 мг) суспендировали в смеси 1:1 DMF и THF (каждого по 150 мкл) и охлаждали до -20°C. Добавляли N-метилморфолин (16 мкл) и изобутилхлорформиат (18 мкл). Реакционную смесь выдерживали при -20°C в течение двух дней, после чего добавляли О-(триметилсилил)гидроксиламин (26 мкл). Смесь медленно нагревали до к.т. при перемешивании в течение 3 часов и затем гасили этилацетатом и KH2PO4. Водную фазу экстрагировали 6 раз этилацетатом. Объединенные органические экстракты концентрировали в вакууме и очищали хроматографией.13C ЯМР (75 МГц, DMSO) δ 164,14, 150,60, 142,39, 133,46, 130,81, 130,09, 128,58, 126,67, 126,50, 126,42, 125,60, 125,53, 125,14, 123,08, 122,94, 51,06, 50,13, 38,58, 36,90, 32,94, 28,97, 24,55, 20,22.
Пример 162: N-(2-морфолин-4-ил-2-оксоэтокси)-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1171)

Следовали общей процедуре I, используя хлорид 4-[2-(аммониоокси)ацетил]морфолина.13C ЯМР (151 МГц, DMSO) δ 165,43, 163,31, 151,10, 141,54, 133,44, 130,74, 129,15, 128,63, 126,99, 126,67, 126,61, 125,75, 125,53, 125,26, 123,19, 122,88, 73,30, 66,00, 65,86, 50,98, 50,32, 45,03, 41,42, 37,99, 36,84, 32,71, 28,64, 24,19, 20,10.
Пример 163: N-(2-морфолин-4-ил-2-оксоэтокси)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1172)

Следовали общей процедуре I-2, используя хлорид 4-[2-(аммониоокси)ацетил]морфолина.13C ЯМР (75 МГц, DMSO) δ 165,46, 163,35, 150,94, 141,00, 133,40, 130,74, 129,24, 128,64, 127,08, 126,77, 125,84, 125,52, 125,28, 123,14, 122,72, 73,32, 66,02, 65,89, 50,09, 49,57, 45,07, 41,45, 36,60, 35,85, 32,79, 30,23, 23,87, 20,30.
Пример 164: N-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}метансульфонамид (соединение 1173)

Следовали общей процедуре I, используя метансульфонамид.1H ЯМР (300 МГц, DMSO) δ 8,34 (д, 1H), 8,03-7,76 (м, 5H), 7,65-7,50 (м, 3H), 7,08 (д, 2H), 5,30-5,17 (м, 1H), 3,16-2,96 (м, 2H), 2,90 (с, 3H), 1,92-1,68 (м, 5H), 1,67-1,40 (м, 6H).
Пример 165: метиловый сложный эфир 4R-гидрокси-1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пирролидин-2S-карбоновой кислоты (соединение 1174)

Следовали общей процедуре I, используя гидрохлорид метилового сложного эфира L-гидроксипролина.1H ЯМР (600 МГц, DMSO) δ 8,35 (д, 1H), 7,93 (д, 1H), 7,78 (дд, 2H), 7,56-7,47 (м, 3H), 7,39 (д, 2H), 7,11 (д, 2H), 5,07 (с, 1H), 4,74 (с, 1H), 4,58-4,52 (м, 1H), 3,73 (дд, 1H), 3,66 (с, 3H), 3,29 (с, 1H), 3,02 (т, 1H), 2,89 (с, 1H), 2,18 (дд, 1H), 1,98-1,91 (м, 1H), 1,90-1,82 (м, 1H), 1,80-1,71 (м, 2H), 1,69-1,63 (м, 1H), 1,58-1,38 (м, 6H), 1,37-1,27 (м, 1H), LC/MS (способ B): RT = 2,42, [M+H]+= 501,5.
Пример 166: 4R-гидрокси-1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пирролидин-2S-карбоновая кислота (соединение 1175)

Следовали общей процедуре J, используя метиловый сложный эфир 4-гидрокси-1-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоил}пирролидин-2-карбоновой кислоты (соединение 1174).1H ЯМР (600 МГц, DMSO) δ 8,35 (д, 1H), 7,92 (д, 1H), 7,77 (дд, 2H), 7,55-7,46 (м, 3H), 7,38 (д, 2H), 7,10 (д, 2H), 5,02 (ш.с, 1H), 4,70 (к, 1H), 4,50-4,43 (м, 1H), 4,27-4,23 (м, 1H), 3,70 (дд, 1H), 3,28 (д, 1H), 3,06-2,97 (м, 1H), 2,89-2,83 (м, 1H), 2,21-2,15 (м, 1H), 1,97-1,82 (м, 2H), 1,80-1,71 (м, 2H), 1,68-1,62 (м, 1H), 1,54-1,35 (м, 6H), 1,34-1,25 (м, 1H).
Пример 167: гидрохлорид N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}метансульфонамида (соединение 1176)

Следовали общей процедуре I-2, используя метансульфонамид. Продукт растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок отфильтровывали, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 9,70-8,62 (м, 1H), 8,33 (д, 1H), 8,04-7,70 (м, 5H), 7,64-7,50 (м, 3H), 7,04 (с, 2H), 5,49-4,87 (м, 1H), 3,14-2,98 (м, 2H), 2,86 (с, 3H), 1,94-1,85 (м, 1H), 1,82-1,47 (м, 9H), 1,46-1,34 (м, 1H).
Общая процедура K
К раствору арилбороновой кислоты (4,6 ммоль) и [(1,4-гидрохинон)родий(COD)]BF4 (Son et al., J. Am. Chem. Soc. 2005, 127, 12238) (2 мол.%) в смеси вода/диметоксиэтан (1:1, 20 мл, дегазированная) добавляли циклопентенон (4,6 ммоль) и LiOH (8 мол.%). Смесь нагревали до 50°C и перемешивали в течение ночи. Добавляли дополнительную воду и смесь экстрагировали дихлорметаном. Органическую фазу отделяли, сушили и концентрировали в вакууме до коричневого масла. Это сырое промежуточное соединение повторно растворяли в 40 мл дихлорэтана. После добавления (+)-(R)-1-нафталин-1-илэтиламина (4,6 ммоль) и NaBH(OAc)3 (1,7 экв.) реакционную смесь перемешивали в течение ночи при к.т. Смесь разбавляли дихлорметаном, промывали водным NaHCO3, водой и насыщенным раствором соли. Органическую фазу сушили, концентрировали в вакууме и очищали на силикагеле до бесцветного масла. Диастереоизомеры разделяли хиральной HPLC.
Пример 168: этиловый сложный эфир {4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединения 1177/1178/1179/1180)

Следовали общей процедуре К, используя 4-(2-этокси-2-оксоэтокси)фенилбороновую кислоту. Четыре полученных диастереоизомера разделяли с помощью хиральной HPLC на колонке Chiralpak AD-H 250×20 мм, 5 мкм при 25°C, УФ обнаружение при 280 нм. Изократическое разделение со смесью N-гептан:этанол:NEt3:CH3COOH (75:25:0,1:0,1); расход = 7,0 мл/мин. Соединение 1177: RT = 11,05.13C ЯМР (151 МГц, DMSO) δ 168,78, 155,62, 141,94, 138,53, 133,42, 130,87, 128,59, 127,74, 126,50, 125,67, 125,56, 125,18, 123,01, 122,91, 114,14, 64,60, 60,47, 56,58, 51,18, 42,82, 42,06, 32,52, 32,14, 24,24, 13,96. Соединение 1178: RT = 12,77.13C ЯМР (151 МГц, DMSO) δ 168,77, 155,55, 142,09, 138,62, 133,39, 130,95, 128,58, 127,70, 126,49, 125,65, 125,57, 125,17, 122,95, 122,93, 114,14, 64,59, 60,46, 55,97, 51,02, 42,08, 40,44, 33,65, 33,23, 24,15, 13,95. Соединение 1179: RT = 18,35.13C ЯМР (151 МГц, DMSO) δ 168,75, 155,54, 142,03, 138,60, 133,39, 130,83, 128,59, 127,63, 126,54, 125,67, 125,54, 125,19, 123,01, 122,89, 114,14, 64,57, 60,45, 56,16, 50,81, 42,00, 41,33, 33,30, 32,93, 24,05, 13,93. Соединение 1180: RT = 23,96.13C ЯМР (151 МГц, DMSO) δ 168,91, 155,77, 141,97, 138,42, 133,53, 130,96, 128,75, 127,82, 126,80, 125,87, 125,69, 125,37, 123,20, 123,01, 114,28, 64,72, 60,60, 56,62, 51,37, 42,66, 42,05, 32,30, 31,84, 24,09, 14,09.
Пример 169: метиловый сложный эфир 3-{4-[(3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединения 1181/1182/1183/1184)

Следовали общей процедуре К, используя 4-(2-метоксикарбонилэтил)фенилбороновую кислоту. Четыре полученных диастереомера разделяли препаративной хиральной HPLC на колонке Chiralpak AD-H 250×20 мм, 5 мкм при 25°C, УФ обнаружение при 280 нм. Изократическое разделение со смесью N-гептан:2-пропанол:NEt3:CH3COOH (75:25:0,1:0,1); расход = 7,0 мл/мин. Соединение 1181: RT = 7,74.13C ЯМР (126 МГц, DMSO) δ 172,59, 143,57, 142,01, 137,65, 133,41, 130,87, 128,57, 127,92, 126,80, 126,47, 125,63, 125,54, 125,15, 122,99, 122,90, 56,66, 51,21, 51,15, 43,23, 41,97, 34,84, 32,59, 31,99, 29,73, 24,23. Соединение 1182: RT = 8,75.13C ЯМР (126 МГц, DMSO) δ 172,59, 143,70, 142,08, 137,57, 133,40, 130,95, 128,56, 127,92, 126,77, 126,47, 125,62, 125,55, 125,15, 122,95, 122,93, 56,07, 51,14, 51,07, 42,50, 40,37, 34,82, 33,68, 33,06, 29,71, 24,13. Соединение 1183: RT = 11,47.13C ЯМР (126 МГц, DMSO) δ 172,58, 143,74, 142,15, 137,56, 133,40, 130,86, 128,58, 127,92, 126,71, 126,47, 125,62, 125,53, 125,15, 122,99, 122,92, 56,30, 51,14, 50,92, 42,42, 41,31, 34,79, 33,14, 33,06, 29,69, 24,14. Соединение 1184: RT = 15,95.13C ЯМР (126 МГц, DMSO) δ 172,60, 143,44, 141,96, 137,66, 133,40, 130,88, 128,58, 127,92, 126,76, 126,50, 125,63, 125,54, 125,15, 122,99, 122,91, 56,63, 51,34, 51,15, 42,96, 42,24, 34,81, 32,06, 31,86, 29,72, 24,12.
Пример 170: {4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1185)

Следовали общей процедуре J, используя этиловый сложный эфир {4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1178).13C ЯМР (75 МГц, DMSO) δ 171,24, 156,64, 137,18, 136,14, 133,30, 130,49, 128,74, 127,83, 127,45, 126,43, 125,68, 125,53, 123,96, 122,44, 113,96, 66,07, 55,36, 50,31, 42,31, 37,78, 33,41, 31,62, 21,55.
Пример 171: {4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1186)

Следовали общей процедуре J, используя этиловый сложный эфир {4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1180).13C ЯМР (151 МГц, DMSO) δ 170,60, 156,80, 141,57, 136,68, 133,37, 130,84, 128,59, 127,26, 126,57, 125,70, 125,55, 125,19, 123,06, 122,85, 114,01, 67,44, 56,46, 51,22, 42,56, 42,24, 32,23, 31,56, 23,97.
Пример 172: {4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1187)

Следовали общей процедуре J, используя этиловый сложный эфир {4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1177).13C ЯМР (75 МГц, DMSO) δ 171,08, 156,66, 136,78, 136,00, 133,35, 130,36, 128,78, 127,89, 127,48, 126,50, 125,73, 125,53, 123,89, 122,37, 114,06, 65,94, 55,64, 50,45, 42,84, 32,02, 29,87, 21,92 (один алифатический сигнал невидимый).
Пример 173: {4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1188)

Следовали общей процедуре J, используя этиловый сложный эфир {4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1179).13C ЯМРR (151 МГц, DMSO) δ 170,47, 156,25, 136,56, 133,51, 130,39, 129,03, 128,77, 127,82, 126,95, 126,18, 125,69, 124,37, 122,57, 114,29, 64,79, 55,73, 50,52, 42,20, 37,68, 33,44, 30,61, 21,02 (один ароматический сигнал невидимый).
Пример 174: 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1189)

Следовали общей процедуре J, используя метиловый сложный эфир 3-{4-[(3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1181).13C ЯМР (151 МГц, DMSO) δ 173,70, 142,32, 138,38, 133,37, 130,49, 128,73, 128,01, 127,68, 126,75, 126,32, 125,64, 125,54, 123,72, 122,60, 56,03, 50,85, 43,18, 35,25, 31,87, 30,49, 29,85, 22,43 (два сигнала невидимые).
Пример 175: гидрохлорид 3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1190)

Следовали общей процедуре J, используя метиловый сложный эфир 3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1183).13C ЯМР (151 МГц, DMSO) δ 173,64, 141,55, 138,53, 133,88, 133,34, 130,17, 128,91, 128,88, 128,10, 126,96, 126,73, 126,11, 125,53, 124,62, 122,36, 55,50, 50,35, 42,42, 36,83, 35,13, 33,11, 30,01, 29,78, 20,48.
Пример 176: 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1191)

Следовали общей процедуре J, используя метиловый сложный эфир 3-{4-[(3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1182).13C ЯМР (75 МГц, DMSO) δ 173,69, 143,29, 141,05, 138,04, 133,38, 130,84, 128,60, 127,94, 126,78, 126,71, 125,78, 125,54, 125,27, 123,14, 122,85, 56,00, 50,99, 42,49, 39,89, 35,25, 33,25, 33,06, 29,84, 23,58.
Пример 177: 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1192)

Следовали общей процедуре J, используя метиловый сложный эфир 3-{4-[(3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1184).13C ЯМР (151 МГц, DMSO) δ 173,72, 142,67, 139,63, 138,24, 133,36, 130,64, 128,67, 127,99, 127,19, 126,69, 126,03, 125,53, 125,45, 123,40, 122,74, 56,27, 51,09, 42,92, 40,90, 35,24, 31,90, 30,70, 29,85, 22,88.
Пример 178: этиловый сложный эфир {3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединения 1193/1194/1195/1196)

Следовали общей процедуре К, используя 3-(2-этокси-2-оксоэтокси)фенилбороновую кислоту. Смесь четырех диастереомеров:1H ЯМР (300 МГц, DMSO) δ 8,29 (д, 1H), 7,91 (дд, 1H), 7,75 (дд, 2H), 7,58-7,42 (м, 3H), 7,21-7,08 (м, 1H), 6,88-6,62 (м, 3H), 4,74-4,68 (м, 2H), 4,70-4,58 (м, 1H), 4,21-4,08 (м, 2H), 3,40-2,74 (м, 2H), 2,34-1,30 (м, 9H), 1,26-1,13 (м, 3H). Четыре диастереоизомера разделяли путем препаративной хиральной HPLC на колонке Chiralpak AD-H 250×20 мм, 5 мкм при 25°C, УФ обнаружение при 280 нм. Изократическое разделение со смесью 2-пропанол:гептан:NEt3:CH3COOH (90:10:0,1:0,1); расход = 17,0 мл/мин. Диастереомер 1 (соединение 1193): RT = 21,65. Диастереомер 2 (соединение 1194): RT = 24,65. Диастереомер 3 (соединение 1195): RT = 45,89. Диастереомер 4 (соединение 1196): RT = 52,85.
Пример 179: этиловый сложный эфир 3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединения 1197/1198/1198/1200)


Следовали общей процедуре К, используя 3-(2-этоксикарбонилэтил)фенилбороновую кислоту. Смесь 4 диастереомеров:1H ЯМР (300 МГц, DMSO) δ 8,34-8,24 (м, 1H), 7,96-7,86 (м, 1H), 7,75 (дд, 2H), 7,58-7,43 (м, 3H), 7,20-6,92 (м, 4H), 4,71-4,59 (м, 1H), 4,08-3,95 (м, 2H), 3,36-2,93 (м, 2H), 2,87-2,71 (м, 2H), 2,63-2,51 (м, 2H), 2,32-1,32 (м, 9H), 1,20-1,07 (м, 3H). Четыре диастереомера разделяли препаративной хиральной HPLC на колонке Chiralpak AD-H 250×20 мм, 5 мкм при 25°C, УФ обнаружение при 280 нм. Изократическое разделение со смесью н-гептан:этанол:NEt3:CH3COOH (80:20:0,1:0,1); расход = 17,0 мл/мин. Диастереомер 1 (соединение 1197): RT = 7,38. Диастереомер 2 (соединение 1198): RT = 9,09. Диастереомер 3 (соединение 1199): RT = 10,01. Диастереомер 4 (соединение 1200): RT = 14,56.
Пример 180: гидрохлорид {3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1201)

Следовали общей процедуре J, используя этиловый сложный эфир {3-[3-(1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1196).1H ЯМР (300 МГц, DMSO) δ 10,25-9,81 (м, 1H), 9,55-9,21 (м, 1H), 8,30 (д, 1H), 8,10-7,95 (м, 3H), 7,68-7,54 (м, 3H), 7,15 (т, 1H), 6,78-6,65 (м, 3H), 5,39-5,27 (м, 1H), 4,60 (с, 2H), 3,74-3,63 (м, 1H), 3,59-3,42 (м, 1H), 2,52-2,34 (м, 1H), 2,23-2,12 (м, 1H), 2,10-1,98 (м, 1H), 1,90-1,68 (м, 5H), 1,59-1,42 (м, 1H).
Пример 181: {3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1202)

Следовали общей процедуре J, используя этиловый сложный эфир {3-[3-(1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1193).1H ЯМР (300 МГц, DMSO) δ 8,27 (д, 1H), 7,95 (д, 1H), 7,84 (т, 2H), 7,61-7,47 (м, 3H), 7,09 (т, 1H), 6,70-6,59 (м, 3H), 4,93 (к, 1H), 4,42 (с, 2H), 3,32-3,08 (м, 2H), 2,05-1,61 (м, 5H), 1,56-1,30 (м, 4H).
Пример 182: {3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1203)
Следовали общей процедуре J, используя этиловый сложный эфир {3-[3-(1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1194).1H ЯМР (300 МГц, DMSO) δ 8,26 (д, 1H), 7,98-7,91 (м, 1H), 7,83 (т, 2H), 7,60-7,47 (м, 3H), 7,10 (т, 1H), 6,79-6,70 (м, 2H), 6,69-6,61 (м, 1H), 4,92 (к, 1H), 4,42 (с, 2H), 3,20-3,06 (м, 1H), 2,86-2,71 (м, 1H), 2,23-2,09 (м, 1H), 1,90-1,43 (м, 8H).
Пример 184: гидрохлорид 3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1204)

Следовали общей процедуре J, используя этиловый сложный эфир {3-[3-(1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1195).1H ЯМР (300 МГц, DMSO) δ 10,14 (ш.с, 1H), 9,51 (ш.с, 1H), 8,30 (д, 1H), 8,09-7,95 (м, 3H), 7,70-7,53 (м, 3H), 7,20 (т, 1H), 6,91-6,80 (м, 2H), 6,77-6,68 (м, 1H), 5,40-5,23 (м, 1H), 4,64 (с, 2H), 3,61-3,39 (м, 1H), 2,96-2,76 (м, 1H), 2,23-1,78 (м, 6H), 1,72 (д, 3H).
Пример 183: 3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1205)
Следовали общей процедуре J, используя этиловый сложный эфир 3-{3-[3-(1-нафталин~1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1199).1H ЯМР (300 МГц, DMSO) δ 8,40-8,23 (м, 1H), 7,99-7,86 (м, 1H), 7,85-7,67 (м, 2H), 7,61-7,41 (м, 3H), 7,21-6,85 (м, 4H), 4,76-4,57 (м, 1H), 3,28-3,06 (м, 2H), 2,85-2,65 (м, 2H), 2,13-1,29 (м, 9H).
Пример 185: 3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1206)

Следовали общей процедуре J, используя этиловый сложный эфир 3-{3-[3-(1-нафталин-1-илэтиламино)циклопентил]фенил}-пропионовой кислоты (соединение 1197)1H ЯМР (300 МГц, DMSO) δ 8,29 (д, 1H), 7,96-7,87 (м, 1H), 7,76 (дд, 2H), 7,56-7,43 (м, 3H), 7,20-6,95 (м, 4H), 4,67 (к, 1H), 3,08-2,94 (м, 1H), 2,78 (т, 3H), 2,54-2,45 (м, 2H), 2,22-2,08 (м, 1H), 1,92-1,31 (м, 8H).
Пример 186: 3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1207)

Следовали общей процедуре J, используя этиловый сложный эфир 3-{3-[3-(1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1198).1H ЯМР (300 МГц, DMSO) δ 8,29 (д, 1H), 7,92 (дд, 1H), 7,79 (д, 1H), 7,73 (д, 1H), 7,57-7,43 (м, 3H), 7,17-7,07 (м, 1H), 7,04-6,92 (м, 3H), 4,69 (к, 1H), 3,27-3,07 (м, 2H), 2,74 (т, 2H), 2,50-2,41 (м, 2H), 2,08-1,84 (м, 3H), 1,64-1,28 (м, 6H).
Пример 187: гидрохлорид 3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1208)
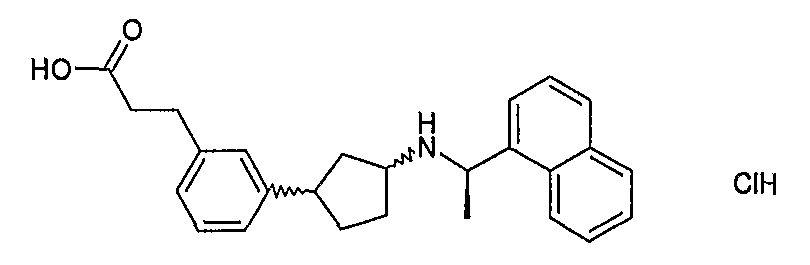
Следовали общей процедуре J, используя этиловый сложный эфир 3-{3-[3-(1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1200). Продукт растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок отфильтровывали, получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δ 12,11 (ш.с, 1H), 10,15 (ш.с, 1H), 9,46 (ш.с, 1H), 8,30 (д, 1H), 8,10-7,96 (м, 3H), 7,69-7,56 (м, 3H), 7,20 (т, 1H), 7,10-7,01 (м, 3H), 5,32 (с, 1H), 3,69 (дд, 1H), 3,55-3,41 (м, 2H), 3,00-2,85 (м, 1H), 2,78 (т, 2H), 2,50 (дд, 1H), 2,23-1,68 (м, 8H).
Приготовление 5: 3-(4-йодфенил)циклогексан-1-он.

К раствору 1,4-дийодбензола (1,0 г, 3,0 ммоль) в 6 мл сухого THF добавляли хлорид изопропилмагния (2 M в THF) при -30°C. Реакционную смесь перемешивали в течение 1 часа при -20°C. Тем временем LiCl (26 мг, 0,61 ммоль), CuI (58 мг, 0,30 ммоль) и TMSCl (329 мг, 3,0 ммоль) добавляли к раствору 2-циклогексен-1-она (291 мг, 3,0 ммоль) в сухом THF (3 мл) и полученный раствор добавляли к раствору Гриньяра. Реакционную смесь перемешивали еще час при -20°C, затем медленно нагревали до к.т. в течение часа и наконец гасили насыщенным NH4Cl (водн.) и экстрагировали диэтиловым простым эфиром. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (PE-EtOAc 100:0 до 80:20), получая указанное в заголовке соединение.
Пример 188: [3-(4-йодфенил)циклогексил]-(1-нафталин-1-илэтил)амин (соединение 1209)
К раствору 3-(4-йодфенил)циклогексан-1-она (приготовление 5) (5,0 г, 16,7 ммоль) в 15 мл сухого DCE добавляли AcOH (1,20 г, 20 ммоль), NaBH(OAc)3 (4,96 г, 23,4 ммоль) и (+)-(R)-1-нафталин-1-илэтиламин (2,85 г, 16,7 ммоль) и смесь перемешивали в течение ночи при к.т. После добавления NaHCO3 смесь экстрагировали этилацетатом. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (PE-EtOAc 100:0 до 75:25), получая две фракции, каждая состояла преимущественно из одного диастереомера. Менее полярная фракция была образована указанным в заголовке соединением.13C ЯМР (75 МГц, DMSO) δ 147,07, 142,36, 136,65, 133,43, 130,79, 129,09, 128,56, 126,39, 125,56, 125,49, 125,10, 123,03, 122,91, 90,81, 51,00, 50,04, 38,58, 36,51, 32,97, 28,90, 24,52, 20,18.
Пример 189: 1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пирролидин-2-он (соединение 1210)

3-(4-Йодфенил)циклогексан-1-он (соединение 1209) (150 мг, 0,33 ммоль), 2-пирролидон (0,40 ммоль), глицин (5 мг, 0,07 ммоль), K3PO4 (176 мг, 0,83 ммоль) и CuI (3 мг, 0,017 ммоль) суспендировали в 3 мл сухого диоксана и нагревали в микроволновой печи при 130°C в течение 8 часов. Смесь экстрагировали этилацетатом и органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаточное масло очищали хроматографией, получая указанное в заголовке соединение в виде твердого вещества.13C ЯМР (75 МГц, DMSO) δ 173,34, 142,88, 142,38, 137,15, 133,45, 130,83, 128,58, 126,59, 126,39, 125,59, 125,53, 125,12, 123,05, 122,92, 119,25, 50,87, 50,04, 47,97, 38,82, 36,38, 33,38, 32,12, 28,95, 24,53, 20,28, 17,33.
Пример 190: 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}оксазолидин-2-он (соединение 1211)

3-(4-Йодфенил)циклогексан-1-он (соединение 1209) (150 мг, 0,33 ммоль), 2-оксазолидинон (0,40 ммоль, 1,2 экв.), глицин (5 мг, 0,07 ммоль), K3PO4 (176 мг, 0,83 ммоль) и CuI (3 мг, 0,017 ммоль) суспендировали в 3 мл сухого диоксана в атмосфере аргона и нагревали при 120°C в течение 35 часов. Смесь экстрагировали этилацетатом и органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаточное масло очищали хроматографией, получая указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, DMSO) δ 154,80, 142,50, 142,34, 136,04, 133,44, 130,82, 128,56, 126,83, 126,38, 125,56, 125,50, 125,09, 123,02, 122,90, 117,87, 61,26, 50,88, 50,03, 44,67, 38,80, 36,28, 33,37, 28,93, 24,49, 20,26.
Пример 191: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}ацетамид (соединение 1212)

3-(4-Йодфенил)циклогексан-1-он (соединение 1209) (150 мг, 0,33 ммоль), ацетамид (0,40 ммоль, 1,2 экв.), глицин (5 мг, 0,07 ммоль), K3PO4 (176 мг, 0,83 ммоль) и CuI (3 мг, 0,017 ммоль) суспендировали в 3 мл сухого диоксана в атмосфере аргона и нагревали при 120°C в течение 35 часов. Смесь экстрагировали этилацетатом и органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаточное масло очищали хроматографией, получая указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, DMSO) δ 167,85, 142,41, 141,95, 136,86, 133,49, 130,87, 128,60, 126,61, 126,42, 125,60, 125,55, 125,13, 123,08, 122,95, 118,87, 50,95, 50,11, 38,92, 36,40, 33,44, 29,02, 24,55, 23,82, 20,35.
Пример 192: 4-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}тетрагидропиран-4-ол (соединение 1213)

К раствору 3-(4-йодфенил)циклогексан-1-она (соединение 1209) (455 мг, 1 ммоль) в сухом THF (5 мл) добавляли хлорид изопропилмагния (1 мл 2 M раствора в THF) при -10°C и полученную смесь перемешивали при -10°C - 0°C в течение 4 часов. Раствор тетрагидро-4H-пиран-4-она (150 мг, 1,5 ммоль) в 0,5 мл сухого THF добавляли и реакционную смесь перемешивали еще один час при 0°C и при к.т. в течение ночи. После гашения с помощью NH4Cl смесь экстрагировали этилацетатом, затем сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Хроматография (EtOAc) давала указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, DMSO) δ 146,84, 145,25, 142,40, 133,46, 130,83, 128,58, 126,40, 126,07, 125,59, 125,54, 125,13, 124,42, 123,04, 122,93, 68,67, 63,07, 50,87, 50,06, 38,89, 38,31, 36,53, 33,30, 29,02, 24,50, 20,31.
Пример 193: [3-(4-имидазол-1-илфенил)циклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1214)
3-(4-Йодфенил)циклогексан-1-он (соединение 1209) (150 мг, 0,33 ммоль), имидазол (0,40 ммоль, 1,2 экв.), глицин (5 мг, 0,07 ммоль), K3PO4 (176 мг, 0,83 ммоль) и CuI (3 мг, 0,017 ммоль) суспендировали в 3 мл сухого диоксана в атмосфере аргона и нагревали при 120°C в течение 35 часов. Смесь экстрагировали этилацетатом и органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаточное масло очищали хроматографией, получая указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, DMSO) δ 146,12, 142,37, 135,32, 134,58, 133,44, 130,82, 129,55, 128,58, 127,83, 126,41, 125,59, 125,52, 125,12, 123,02, 122,91, 120,17, 117,92, 50,91, 50,03, 38,68, 36,49, 33,23, 28,89, 24,52, 20,23.
Пример 194: 1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}циклопентанол (соединение 1215)
К раствору 3-(4-йодфенил)циклогексан-1-она (соединение 1209) (125 мг, 0,27 ммоль) в сухом THF (4 мл) добавляли хлорид изопропилмагния (0,27 мл 2 M раствора в THF) при -20°C и смесь перемешивали при -20°C - -10°C в течение 2 часов, после чего добавляли циклопентанон (34 мг, 0,41 ммоль) в 0,2 мл THF. Смесь перемешивали при той же температуре еще 30 мин, затем медленно нагревали до к.т. в течение ночи. После гашения водным NH4Cl смесь экстрагировали этилацетатом, и органические фазы сушили, фильтровали и концентрировали при пониженном давлении. Хроматография (EtOAc-PE) давала указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, DMSO) δ 145,51, 144,83, 142,35, 133,44, 130,82, 128,57, 126,39, 125,81, 125,57, 125,51, 125,10, 124,86, 123,02, 122,90, 81,17, 50,85, 50,05, 41,48, 41,45, 38,88, 36,53, 33,36, 29,01, 24,48, 23,51, 20,30.
Пример 194: 1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}этанон (соединение 1216)

К раствору 3-(4-йодфенил)циклогексан-1-она (соединение 1209) (200 мг, 0,44 ммоль) в сухом THF (5 мл) добавляли хлорид изопропилмагния (2 M в THF) при -30°C. После перемешивания в течение 45 мин при -30°C → -15°C добавляли раствор N-метокси-N-метилацетамида (49 мг, 0,48 ммоль) в THF (2 мл). Реакционную смесь перемешивали следующие 30 мин при -20°C-15°C и затем нагревали до 0°C в течение 15 мин. Реакционную смесь гасили с помощью NH4Cl (водн.) и экстрагировали этилацетатом. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Хроматография (PE-EtOAc 100:0 до 50:50) давала указанное в заголовке соединение.13C ЯМР (75 МГц, DMSO) δ 197,29, 152,96, 142,37, 134,49, 133,45, 130,80, 128,58, 128,09, 126,82, 126,43, 125,60, 125,52, 125,14, 123,08, 122,93, 51,06, 50,11, 38,38, 37,09, 32,81, 28,92, 26,46, 24,52, 20,16.
Пример 195: гидрохлорид 4-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}тетрагидропиран-4-ола (соединение 1217)
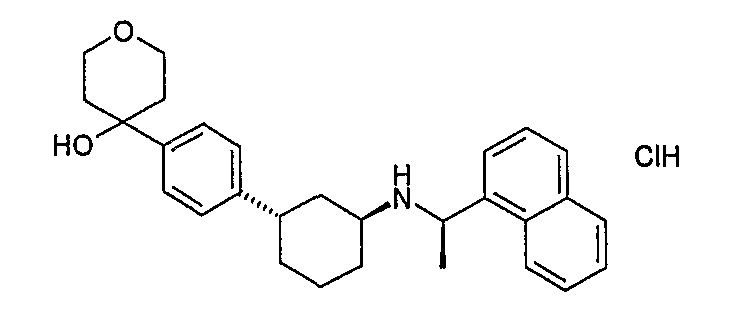
4-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]фенил}тетрагидро-пиран-4-ол (соединение 1213) растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение.13C ЯМР (75 МГц, DMSO) δ 147,31, 142,53, 133,86, 133,35, 130,24, 128,93, 128,87, 127,00, 126,09, 125,50, 124,67, 122,31, 68,72, 63,05, 51,97, 50,25, 38,29, 35,33, 33,63, 31,08, 26,00, 20,73, 19,34.
Пример 196: {4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанол (соединение 1218)

К раствору 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1056) (0,50 г, 1,34 ммоль) в сухом THF (5 мл) добавляли комплекс боран-THF (1 M в THF, 5,35 ммоль) при -78°C. Реакционную смесь медленно нагревали до 0°C в течение 1,5 часов и затем отстаивали при к.т. в течение ночи. После охлаждения на бане со льдом смесь гасили водой, разбавляли водным NaHCO3 и экстрагировали диэтиловым простым эфиром. Объединенные органические экстракты сушили над MgSO4 и концентрировали при пониженном давлении. Хроматография (EtOAc-PE 1:1) давала указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, MeOH) δ 147,33, 142,64, 139,93, 135,58, 132,69, 130,06, 128,25, 128,10, 127,88, 126,94, 126,66, 126,42, 124,36, 123,81, 65,12, 52,01, 51,93, 39,65, 38,69, 34,52, 30,84, 24,26, 21,78.
Пример 197: 1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}циклобутанол (соединение 1219)
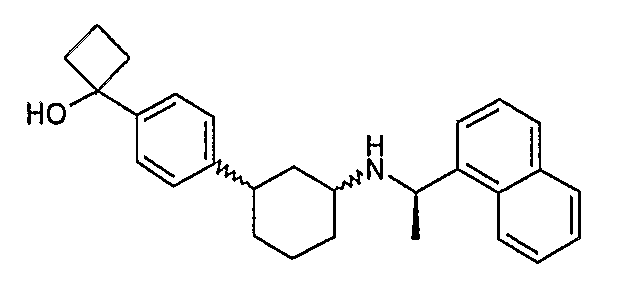
К раствору 3-(4-йодфенил)циклогексан-1-она (соединение 1209) (250 мг, 0,55 ммоль) в сухом THF (1 мл) в атмосфере аргона при -78°C добавляли n-BuLi (0,37 мл, 1,6 M в THF). Полученный красный раствор перемешивали в течение 2 мин при той же температуре и затем добавляли по каплям циклобутанон (45 мкл, 0,60 ммоль). Сразу светложелтый раствор перемешивали при -78°C в течение 10 мин перед гашением с помощью 1,2 M KH2PO4 (водн.). Смесь экстрагировали этилацетатом, и органические фазы сушили и концентрировали в вакууме. Хроматография (EtOAc-PE 1:1) давала указанное в заголовке соединение.13C ЯМР (75 МГц, DMSO) δ 145,25, 144,81, 142,39, 133,44, 130,82, 128,57, 126,39, 126,03, 125,59, 125,53, 125,12, 124,60, 123,04, 122,92, 74,88, 50,86, 50,05, 38,88, 37,05, 36,58, 33,33, 29,01, 24,51, 20,30, 12,59.
Пример 198: диэтиловый сложный эфир 2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}малоновой кислоты (соединение 1220)

3-(4-Йодфенил)циклогексан-1-он (соединение 1209) (0,80 г, 1,76 ммоль), диэтиловый сложный эфир малоновой кислоты (0,56 г, 3,52 ммоль), CsCO3 (0,86 г, 2,64 ммоль), CuI (33 мг, 0,18 ммоль) и 2-гидроксибифенил (60 мг, 0,35 ммоль) смешивали в сухом THF (5 мл) в атмосфере аргона и нагревали при 100°C в течение 8 дней. Смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Хроматография (PE-EtOAc 100:0 до 50:50) давала указанное в заголовке соединение в виде твердого вещества, которое подвергали перекристаллизации в этаноле.13C ЯМР (75 МГц, DMSO) δ 167,91, 147,02, 142,35, 133,44, 130,82, 130,05, 128,88, 128,55, 126,56, 126,39, 125,58, 125,51, 125,11, 123,02, 122,92, 61,10, 56,27, 50,92, 50,02, 38,78, 36,63, 33,11, 28,91, 24,48, 20,25, 13,74.
Пример 199: этиловый сложный эфир {4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}уксусной кислоты (соединение 1221)
К раствору диэтилового сложного эфира 2-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]фенил}малоновой кислоты (соединение 1220) (100 мг, 0,20 ммоль) в DMSO (5 мл) добавляли воду (3,6 мг, 0,20 ммоль) и LiCl (17 мг, 0,41 ммоль). Полученную смесь нагревали при 150°C в течение ночи, разбавляли водой и экстрагировали EtOAc. Органическую фазу промывали насыщенным раствором соли, сушили над Na2SO4 и концентрировали при пониженном давлении. Хроматография (PE-EtOAc 50:50) давала указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, DMSO) δ 171,14, 145,78, 142,40, 133,45, 131,40, 130,83, 128,89, 128,57, 126,53, 126,39, 125,59, 125,53, 125,12, 123,05, 122,93, 60,06, 50,91, 50,05, 39,81, 38,89, 36,59, 33,27, 28,96, 24,52, 20,29, 13,98.
Пример 200: {4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}уксусная кислота (соединение 1222)

Раствор этилового сложного эфира {4-[3-(1-нафталин-1-илэтиламино)циклогексил]фенил}уксусной кислоты (соединение 1221) (400 мг) в метаноле (5 мл) обрабатывали 2 M NaOH в метаноле и перемешивали в течение 1 дня при к.т. Метанол удаляли при пониженном давлении. Остаточную водную фазу подкисляли 4 M водным HCl и экстрагировали этилацетатом. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Хроматография (MeOH-CH2Cl2 20:80) давала указанное в заголовке соединение в виде твердого вещества.13C ЯМР (75 МГц, DMSO) δ 172,72, 144,65, 133,42, 132,24, 130,63, 129,05, 128,70, 127,24, 126,41, 126,07, 125,52, 125,45, 123,63, 122,71, 50,69, 40,27, 37,09, 36,18, 32,57, 27,93, 23,24, 19,97.
Пример 201: 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}оксетан-3-ол (соединение 1223)

К раствору 3-(4-йодфенил)циклогексан-1-она (соединение 1209) (3,7 г, 8,1 ммоль) в сухом THF (25 мл) в атмосфере аргона добавляли хлорид изопропилмагния (8,1 мл 2 M раствора в THF) при -30°C - -40°C. Реакционную смесь нагревали до -10°C-0°C и перемешивали этой температуре в течение 5 часов, в это время добавляли раствор 3-оксетанона (0,50 г, 6,9 ммоль) в THF (3 мл). Перемешивание продолжали следующие 2 часа при той же температуре. Реакционную смесь, наконец, медленно нагревали до к.т. в течение ночи, гасили с помощью NH4Cl и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Хроматография (CHCl3-MeOH 100:0 до 95:5) давала указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, DMSO) δ 146,09, 142,40, 141,30, 133,47, 130,83, 128,59, 126,41, 126,34, 125,59, 125,54, 125,13, 124,31, 123,07, 122,94, 85,13, 73,78, 50,96, 50,13, 38,89, 36,62, 33,27, 29,03, 24,53, 20,31.
Пример 202: {3-[4-(3-фтороксетан-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1224)

К раствору 3-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]фенил}оксетан-3-ола в CH2Cl2 (соединение 1223) (5 мл) добавляли трифторид диэтиламиносеры (0,21 мл). Смесь перемешивали в течение ½ часа, гасили NaHCO3 и экстрагировали CH2Cl2. Органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Хроматография (MeOH-CH2Cl2 1:99) давала указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, DMSO) δ 148,01, 142,39, 134,93, 134,62, 133,47, 130,83, 128,59, 126,88, 126,42, 125,61, 125,54, 125,14, 124,45, 124,35, 123,07, 122,94, 97,01, 94,31, 81,42, 81,08, 50,98, 50,09, 38,71, 36,73, 33,11, 28,97, 24,53, 20,25.
Пример 203: {3-[4-(3-амино-3-метилбут-1-инил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1225)

К раствору 3-(4-йодфенил)циклогексан-1-она (соединение 1209) (150 мг, 0,33 ммоль) в диэтиламине (3 мл, дегазированный барботированием аргона через раствор в течение 5 мин) добавляли PdCl2(Ph3P)2 (15 мг) и CuI (8 мг). Смесь дегазировали аргоном еще 5 мин, охлаждали до 0°C и добавляли 2-метил-3-бутин-2-ил-амин (137 мг, 1,65 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 мин и при к.т. в течение 1 часа и экстрагировали EtOAc. Органическую фазу сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Хроматография (EtOAc) давала указанное в заголовке соединение в виде масла.13C ЯМР (126 МГц, CDCl3) δ 146,47, 141,93, 133,09, 130,37, 130,17, 127,84, 125,90, 125,82, 124,69, 124,31, 122,61, 122,41, 119,69, 78,93, 51,09, 49,97, 44,76, 39,10, 37,90, 36,30, 32,16, 31,32, 29,36, 23,45, 19,73.
Общая процедура L
Хлорид кислоты (41 мкмоль), N-гидрокси-4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1051, 49 мкмоль) и CDI (45 мкмоль) в 150 мкл DMF взбалтывали при к.т. в течение ночи. Дополнительный CDI (45 мкмоль) в 50 мкл DMF добавляли и реакционную смесь нагревали при 115°C в течение ночи. Продукт очищали препаративной HPLC.
Пример 204: {3-[4-(5-циклопропил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1226)

Следовали общей процедуре L, используя циклопропанкарбонилхлорид.1H ЯМР (600 МГц, DMSO) δ 8,35 (д, 1H), 7,93 (д, 1H), 7,83-7,74 (м, 4H), 7,56-7,47 (м, 3H), 7,18 (д, 2H), 4,74 (с, 1H), 3,08-3,00 (м, 1H), 2,93-2,86 (м, 1H), 2,41-2,35 (м, 1H), 1,93-1,82 (м, 1H), 1,81-1,72 (м, 2H), 1,70-1,63 (м, 1H), 1,56-1,39 (м, 6H), 1,36-1,24 (м, 3H), 1,20-1,14 (м, 2H).
Пример 205: {3-[4-(5-циклопентил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1227)

Следовали общей процедуре L, используя циклопентанкарбонилхлорид.1H ЯМР (600 МГц, DMSO) δ 8,36 (д, 1H), 7,93 (д, 1H), 7,82 (д, 2H), 7,80 (д, 1H), 7,76 (д, 1H), 7,55-7,48 (м, 3H), 7,20 (д, 2H), 4,74 (с, 1H), 3,47 (дт, 1H), 3,08-3,01 (м, 1H), 2,92-2,87 (м, 1H), 2,16-2,09 (м, 2H), 1,92-1,83 (м, 3H), 1,81-1,72 (м, 4H), 1,72-1,63 (м, 3H), 1,56-1,40 (м, 6H), 1,37-1,28 (м, 1H).
Пример 206: {3-[4-(5-метил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1228)
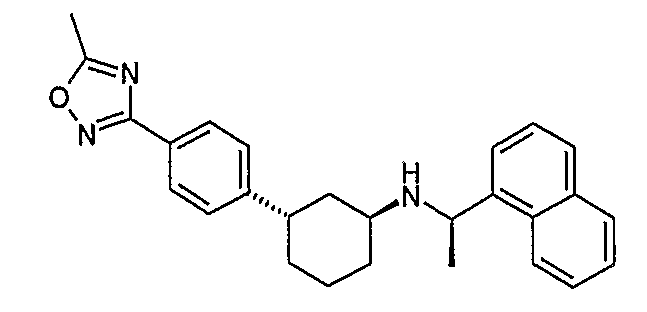
Следовали общей процедуре L, используя ацетилхлорид.1H ЯМР (600 МГц, DMSO) δ 8,36 (д, 1H), 7,93 (д, 1H), 7,82 (д, 2H), 7,79 (д, 1H), 7,76 (д, 1H), 7,56-7,47 (м, 3H), 7,19 (д, 2H), 4,71 (с, 1H), 3,08-3,00 (м, 1H), 2,91-2,84 (м, 1H), 2,64 (с, 3H), 1,93-1,83 (м, 1H), 1,81-1,61 (м, 3H), 1,56-1,37 (м, 6H), 1,35-1,27 (м, 1H).
Пример 207: {3-[4-(5-изoпропил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1229)
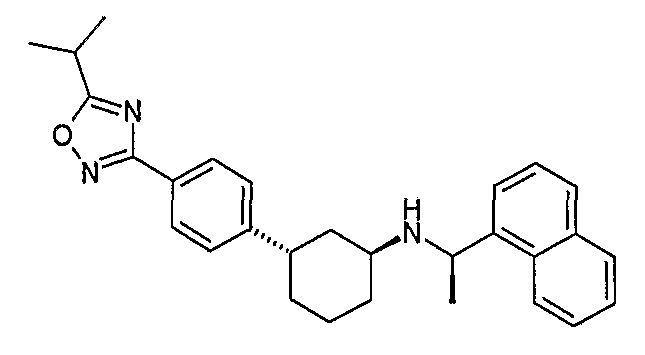
Следовали общей процедуре L, используя изобутирилхлорид.1H ЯМР (600 МГц, DMSO) δ 8,36 (д, 1H), 7,93 (д, 1H), 7,83 (д, 2H), 7,77 (д, 1H), 7,76 (д, 1H), 7,56-7,47 (м, 3H), 7,19 (д, 2H), 4,74-4,66 (м, 1H), 3,34 (м, 1H перекрываемый сигналом воды), 3,08-3,01 (м, 1H), 2,91-2,86 (м, 1H), 1,93-1,83 (м, 1H), 1,82-1,73 (м, 2H), 1,70-1,64 (м, 1H), 1,44 (д, 3H), 1,55-1,26 (м, 4H), 1,37 (д, 6H).
Пример 208: {3-[4-(5-трет-бутил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1230)

Следовали общей процедуре L, используя 2,2-диметилпропионилхлорид.1H ЯМР (600 МГц, DMSO) δ 8,36 (д, 1H), 7,93 (д, 1H), 7,83 (д, 2H), 7,79 (д, 1H), 7,76 (д, 1H), 7,56-7,47 (м, 3H), 7,20 (д, 2H), 4,70 (с, 1H), 3,08-3,01 (м, 1H), 2,91-2,85 (м, 1H), 1,94-1,83 (м, 1H), 1,81-1,73 (м, 2H), 1,70-1,63 (м, 1H), 1,57-1,38 (м, 6H), 1,44 (с, 9H), 1,36-1,26 (м, 1H).
Пример 209: {3-[4-(5-циклогексил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1231)

Следовали общей процедуре L, используя циклогексанкарбонилхлорид.1H ЯМР (600 МГц, DMSO) δ 8,36 (д, 1H), 7,93 (д, 1H), 7,82 (д, 2H), 7,79 (д, 1H), 7,76 (д, 1H), 7,56-7,47 (м, 3H), 7,19 (д, 2H), 4,72 (к, 1H), 3,13-3,01 (м, 2H), 2,91-2,86 (м, 1H), 2,10-2,02 (м, 2H), 1,93-1,83 (м, 1H), 1,81-1,72 (м, 4H), 1,70-1,56 (м, 4H), 1,55-1,36 (м, 8H), 1,35-1,23 (м, 2H).
Пример 210: (3-{4-[5-(3-метилбутил)-[1,2,4]оксадиазол-3-ил]фенил}циклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1232)
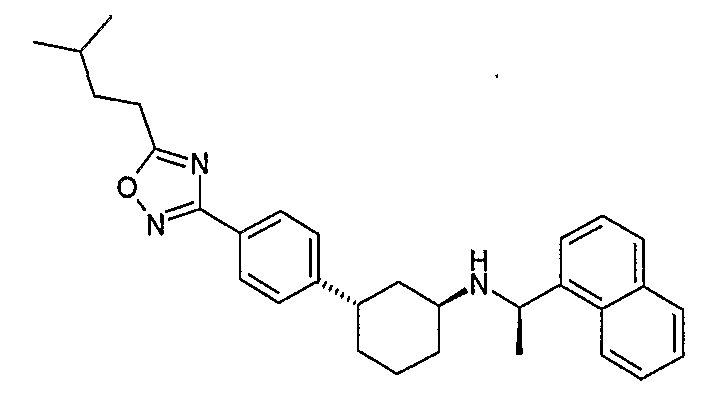
Следовали общей процедуре L, используя 4-метилпентаноилхлорид.1H ЯМР (600 МГц, DMSO) δ 8,36 (д, 1H), 7,93 (д, 1H), 7,83 (д, 2H), 7,80 (д, 1H), 7,77 (д, 1H), 7,56-7,48 (м, 3H), 7,20 (д, 2H), 4,77-4,71 (м, 1H), 3,08-3,01 (м, 1H), 3,00-2,96 (м, 2H), 2,92-2,88 (м, 1H), 1,92-1,83 (м, 1H), 1,82-1,73 (м, 2H), 1,71-1,58 (м, 4H), 1,57-1,40 (м, 6H), 1,37-1,29 (м, 1H), 0,92 (д, 6H).
Пример 211: 5-(3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}-[1,2,4]оксадиазол-5-илметил)имидазолидин-2,4-дион (соединение 1233)

Следовали общей процедуре L, используя (2,5-диоксоимидазолидин-4-ил)ацетилхлорид.1H ЯМР (600 МГц, DMSO) δ 10,83 (ш.с, 1H), 8,36 (д, 1H), 8,05 (д, 1H), 7,94 (дд, 1H), 7,83 (д, 2H), 7,80 (д, 1H), 7,77 (д, 1H), 7,56-7,48 (м, 3H), 7,21 (д, 2H), 4,74 (к, 1H), 4,59-4,56 (м, 1H), 3,43 (дд, 1H), 3,38 (дд, 1H), 3,08-3,02 (м, 1H), 2,92-2,88 (м, 1H), 1,93-1,83 (м, 1H), 1,82-1,73 (м, 2H), 1,71-1,65 (м, 1H), 1,58-1,40 (м, 6H), 1,36-1,29 (м, 1H).
Пример 212: (3-{4-[5-(4-метилоксазол-5-ил)-[1,2,4]оксадиазол-3-ил]фенил}циклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1234)

Следовали общей процедуре L, используя 4-метилоксазол-5-карбонилхлорид.1H ЯМР (600 МГц, DMSO) δ 8,75 (с, 1H), 8,36 (д, 1H), 7,97-7,89 (м, 3H), 7,79 (д, 1H), 7,77 (д, 1H), 7,56-7,48 (м, 3H), 7,25 (д, 2H), 4,75-4,69 (м, 1H), 3,11-3,04 (м, 1H), 2,92-2,87 (м, 1H), 2,58 (с, 3H), 1,89 (дд, 1H), 1,78 (с, 2H), 1,68 (д, 1H), 1,57-1,40 (м, 6H), 1,32 (т, 1H).
Пример 213: (3-{4-[5-(2,5-диметилоксазол-4-ил)-[1,2,4]оксадиазол-3-ил]фенил}циклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1235)
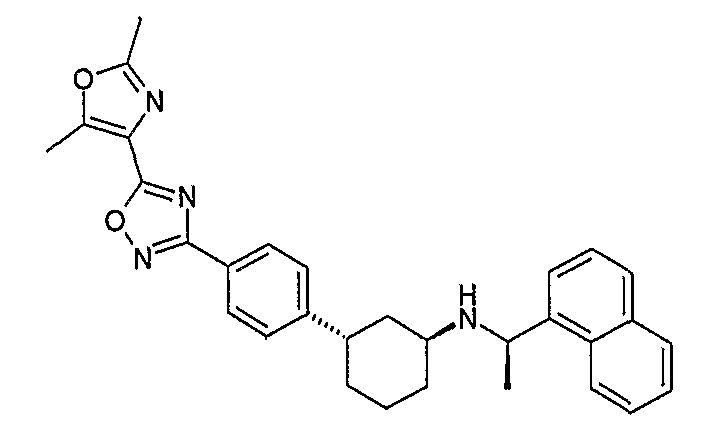
Следовали общей процедуре L, используя 2,5-диметилоксазол-4-карбонилхлорид.1H ЯМР (600 МГц, DMSO) δ 8,36 (д, 1H), 7,94 (дд, 1H), 7,90 (д, 2H), 7,79 (д, 1H), 7,77 (д, 1H), 7,56-7,48 (м, 3H), 7,23 (д, 2H), 4,71 (к, 1H), 3,11-3,02 (м, 1H), 2,91-2,86 (м, 1H), 2,73 (с, 3H), 2,49 (с, 3H), 1,94-1,84 (м, 1H), 1,82-1,74 (м, 2H), 1,71-1,65 (м, 1H), 1,57-1,40 (м, 6H), 1,36-1,27 (м, 1H).
Общая процедура M
К раствору циклоалкенона (400 мкмоль) в 400 мкл DME добавляли бороновую кислоту (480 мкмоль, 1,2 экв.), (COD)Rh(1,4-дигидрохинон)BF4 (1 мол.%) в 100 мклDME и LiOH (4 мол.%) в 600 мкл воды. После взбалтывания смеси в течение ночи при 50°C растворитель удаляли в вакууме. Сырой промежуточный кетон растворяли в DCE, содержащем уксусную кислоту (1,2 экв.). (+)-(R)-1-нафталин-1-илэтиламин (1 экв.) в DCE добавляли с последующим добавлением NaBH(OAc)3 (1,2 экв.) Смесь взбалтывали в течение ночи при к.т., фильтровали и растворители удаляли в вакууме. Остаток повторно растворяли в 750 мкл DMSO и очищали путем HPLC.
Пример 214: 2-метил-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионитрил (соединение 1236/1237)

Следовали общей процедуре М, используя 4-(2-цианопропан-2-ил)фенилбороновую кислоту и 2-циклогексен-1-он. Указанные в заголовке соединения очищали хроматографией на 20 г силикагеля с градиентом от 0 до 60% EtOAc в н-гептане, расход 30 мл/мин. Соединение 1236 (1 изомер, менее полярный, RT ~11 мин).13C ЯМР (75 МГц, DMSO) δ 146,84, 142,38, 138,59, 133,47, 130,84, 128,60, 127,05, 126,42, 125,62, 125,54, 125,15, 124,80, 124,69, 123,04, 122,94, 50,88, 49,99, 38,75, 36,56, 36,17, 33,17, 28,94, 28,26, 24,52, 20,25. Соединение 1237 (1 изомер, более полярный, RT ~13 мин):13C ЯМР (75 МГц, DMSO) δ 146,76, 142,14, 138,61, 133,39, 130,84, 128,55, 127,18, 126,39, 125,62, 125,50, 125,10, 124,85, 124,66, 122,92, 122,80, 50,11, 49,30, 36,44, 36,28, 36,15, 33,36, 30,74, 28,24, 24,40, 20,50.
Пример 215: 2-метил-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионовая кислота (соединение 1238)

К раствору 2-метил-2-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]фенил}пропионитрила (соединение 1236) в MeOH (0,09 M, y мл) добавляли 28% водн. NaOH (y/2 мл). Смесь нагревали до кипения с возвращением флегмы в течение 3 дней. MeOH удаляли при пониженном давлении. Остаток забирали в воду и добавляли 4 н. водн. HCl до pH=5. Осадок собирали, промывали водой и сушили в вакууме,получая указанное в заголовке соединение.13C ЯМР (126 МГц, DMSO) δ 177,53, 145,26, 142,13, 133,45, 130,83, 128,58, 126,44, 126,38, 125,63, 125,53, 125,22, 125,15, 123,03, 122,92, 50,77, 49,95, 45,22, 38,78, 36,48, 33,22, 28,88, 26,29, 24,40, 20,25.
Пример 216: 2-метил-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионовая кислота (соединение 1239)

К раствору 2-метил-2-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]фенил}пропионитрила (соединение 1237) в MeOH (0,09 M, y мл) добавляли 28% водн. NaOH (y/2 мл). Смесь нагревали до кипения с возвращением флегмы в течение 3 дней. MeOH удаляли при пониженном давлении. Остаток забирали в воду и добавляли 4 н. водн. HCl до pH=5. Осадок собирали, промывали водой и сушили в вакууме, получая указанное в заголовке соединение.1H ЯМР (600 МГц, DMSO) δ 8,31 (д, 1H), 7,94 (д, 1H), 7,85-7,73 (м, 2H), 7,52 (т, 3H), 7,22-6,99 (м, 4H), 5,10-4,53 (м, 1H), 3,05 (ш.т, 1H), 2,84 (ш.с, 1H), 1,90-1,26 (м, 17H).
Пример 217: [3-(4-метансульфонилфенил)циклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1240)
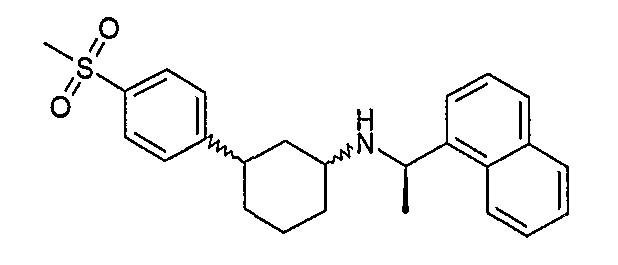
Следовали общей процедуре М, используя 4-(метансульфонил)бензолбороновую кислоту и 2-циклогексен-1-он. Соединение 1240 (1 изомер): LC-MS (способ B): RT = 4,14, [M+H]+ = 408,1.1H ЯМР (600 МГц, DMSO) δ 8,30 (д, 1H), 7,96-7,88 (м, 1H), 7,80 (д, 2H), 7,77 (д, 1H), 7,72 (д, 1H), 7,55-7,44 (м, 5H), 4,71 (к, 1H), 3,18 (с, 3H), 3,23-3,15 (м, 1H), 2,82 (с, 1H), 1,86-1,73 (м, 3H), 1,64-1,56 (м, 1H), 1,51-1,34 (м, 7H).
Пример 218: метиловый сложный эфир 2-фтор-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1241)
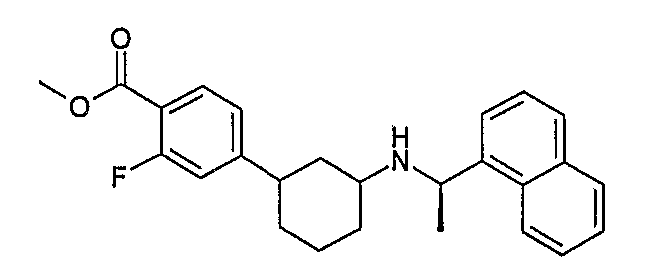
Следовали общей процедуре М, используя 3-фтор-4-(метоксикарбонил)бензолбороновую кислоту и 2-циклогексен-1-он. Соединение 1241: (1 изомер): LC-MS (способ B): RT = 4,44, [M+H]+ = 406,1.1H ЯМР (600 МГц, DMSO) δ 8,30 (д, 1H), 7,93-7,89 (м, 1H), 7,77 (дт, 2H), 7,72 (д, 1H), 7,52-7,45 (м, 3H), 7,18 (дд, 2H), 4,71 (к, 1H), 3,83 (с, 3H), 3,17 (т, 2H), 2,81 (с, 1H), 1,85-1,72 (м, 3H), 1,58 (д, 1H), 1,50-1,32 (м, 7H).
Пример 219: {4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанол (соединение 1242)

Следовали общей процедуре М, используя 4-(гидроксиметил)фенилбороновую кислоту и 2-циклогексен-1-он. LC-MS (способ B): RT = 4,21, [M+H]+ = 360,2 (смесь 2 изомеров).
Пример 220: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}метансульфонамид (соединение 1243)

Следовали общей процедуре М, используя (4-метансульфониламинометилфенил)бороновую кислоту и 2-циклогексен-1-он. Соединение 1243 (1 изомер): LC-MS (способ B): RT = 4,27, [M+H]+ = 437,1.1H ЯМР (600 МГц, DMSO) δ 8,34 (д, 1H), 7,92 (дд, 1H), 7,77 (дд, 2H), 7,55-7,47 (м, 3H), 7,44 (т, 1H), 7,16 (д, 2H), 7,01 (д, 2H), 4,69 (к, 1H), 4,06 (д, 2H), 2,99-2,91 (м, 1H), 2,88-2,80 (м, 4H), 1,90-1,80 (м, 1H), 1,73 (дд, 2H), 1,65-1,60 (м, 1H), 1,51-1,25 (м, 7H).
Пример 221: {3-[4-(морфолин-4-сульфонил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1244/1245)

Следовали общей процедуре М, используя 4-N-морфолинилсульфонилфенилбороновую кислоту и 2-циклогексен-1-он. Соединение 1244 (смесь 2 изомеров): LC-MS (способ B): RT = 4,32, [M+H]+ = 479,2. Соединение 1245 (смесь 2 изомеров): LC-MS (способ B): RT = 4,36, [M+H]+ = 479,1.
Пример 222: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}ацетамид (соединения 1246/1247)

Следовали общей процедуре М, используя (4-ацетамидометилфенил)бороновую кислоту и 2-циклогексен-1-он. Соединение 1246 (смесь 2 изомеров): LC-MS (способ B): RT = 4,09, [M+H]+ = 401,1, [M+HCOO]- = 445,2. Соединение 1247 (смесь 3 изомеров): LC-MS (способ B): RT = 4,12, [M+H]+ = 401,1, [M+HCOO]- = 445,0.
Пример 223: метиловый сложный эфир 3-фтор-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1248)

Следовали общей процедуре М, используя 2-фтор-4-метоксикарбонилфенилбороновую кислоту и 2-циклогексен-1-он. Соединение 1248 (смесь 2 изомеров): LC-MS (способ B): RT = 4,56, [M+H]+ = 406,0.
Пример 224: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метансульфонамид (соединение 1249/1250)

Следовали общей процедуре М, используя 4-(метансульфониламино)фенилбороновую кислоту и 2-циклогексен-1-он. Соединение 1249 (смесь 2 изомеров): LC-MS (способ B): RT = 4,24, [M+H]+ = 423,1, [M-H]- = 421,1. Соединение 1250 (смесь 2 изомеров): LC-MS (способ B): RT = 4,34, [M+H]+ = 423,2, [M-H]- = 421,0.
Пример 225: N-{3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метансульфонамид (соединение 1251)
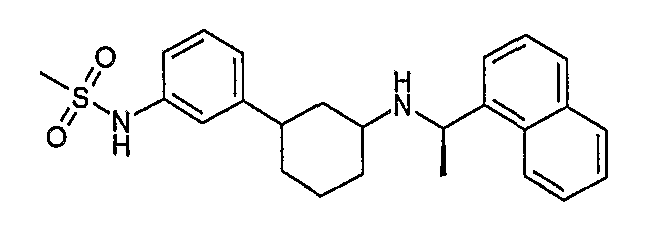
Следовали общей процедуре М, используя 3-(метилсульфониламино)фенилбороновую кислоту и 2-циклогексен-1-он. Соединение 1251 (смесь 2 изомеров): LC-MS (способ B): RT = 4,29, [M+H]+ = 423,1, [M-H]- = 421,0.
Пример 226: N-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензолсульфонамид (соединения 1252/1253)

Следовали общей процедуре М, используя 4-(2-гидроксиэтилсульфамоил)фенилбороновую кислоту и 2-циклогексен-1-он. Соединение 1252 (смесь 2 изомеров): LC-MS (способ B): RT = 4,11, [M+H]+ = 453,1, [M-H]- = 451,0. Соединение 1253 (смесь 4 изомеров): LC-MS (способ B): RT = 4,22, [M+H]+ = 453,1, [M-H]+ = 451,0.
Пример 227: 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионовая кислота (соединение 1254)
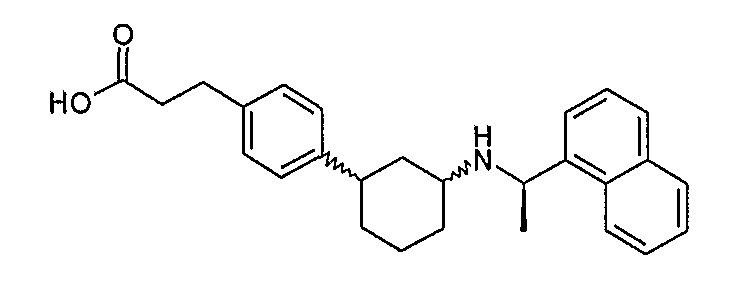
Следовали общей процедуре М, используя 2-метоксикарбонилэтилфенилбороновую кислоту и 2-циклогексенон. Промежуточный сложный эфир гидролизовали, следуя общей процедуреJ. Препаративная HPLC давала указанное в заголовке соединение в виде масла и как единственный изомер. LC-MS (способ B): RT = 4,32, [M+H]+ = 402,1.1H ЯМР (600 МГц, DMSO) δ 8,28 (д, 1H), 7,91 (д, 1H), 7,77 (д, 1H), 7,71 (д, 1H), 7,53-7,45 (м, 3H), 7,15-7,00 (м, 4H), 4,75-4,66 (м, 1H), 3,05-2,96 (м, 1H), 2,87-2,72 (м, 3H), 1,84-1,67 (м, 3H), 1,62-1,54 (м, 1H), 1,47-1,31 (м, 7H), (2 атома водорода невидимы под сигналом воды при 3,2-3,6 м.д.)
Пример 228: {4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенокси}уксусная кислота (соединение 1255)

Следовали общей процедуре М, используя 4-(2-этокси-2-оксоэтокси)бензолбороновую кислоту и 2-циклогексенон. Промежуточный сложный эфир гидролизовали, следуя общей процедуре J. Препаративная HPLC давала указанное в заголовке соединение в виде масла и как единственный изомер. LC-MS (способ B): RT = 4,22, [M+H]+ = 404,1.1H ЯМР (600 МГц, DMSO) δ 8,29 (д, 1H), 7,92 (д, 1H), 7,78 (д, 1H), 7,76-7,71 (м, 1H), 7,54-7,46 (м, 3H), 7,17-6,99 (м, 2H), 6,87-6,64 (м, 2H), 4,79-4,70 (м, 1H), 3,06-2,94 (м, 1H), 2,87-2,77 (м, 1H), 1,84-1,67 (м, 3H), 1,62-1,54 (м, 1H), 1,50-1,31 (м, 7H).
Пример 229: [3-(4-метансульфонилфенил)циклопентил]-((R)-1-нафталин-1-илэтил)амин (соединения 1256/1257)

Следовали общей процедуре М, используя 4-(метансульфонил)бензолбороновую кислоту и 2-циклопентен-1-он. Соединение 1256 (смесь 2 изомеров): LC-MS (способ B): RT = 4,22, [M+H]+ = 394,1. Соединение 1257 (смесь 3 изомеров): LC-MS (способ B): RT = 4,24, [M+H]+ = 394,1.
Пример 230: N-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}метансульфонамид (соединения 1258/1259)

Следовали общей процедуре М, используя 3-(метилсульфониламино)фенилбороновую кислоту и 2-циклопентен-1-он. Соединение 1258 (смесь 2 изомеров): LC-MS (способ B): RT = 4,27, [M+H]+ = 409,1, [M-H]+ = 407,0. Соединение 1259 (смесь 3 изомеров): LC-MS (способ B): RT = 4,29, [M+H]+ = 409,1, [M-H]+ = 407,1.
Пример 231: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}ацетамид (соединения 1260/1261)
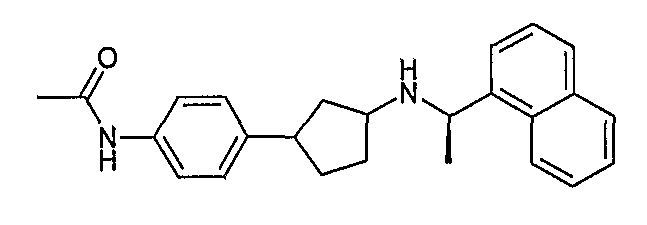
Следовали общей процедуре М, используя 4-ацетамидофенилбороновую кислоту и 2-циклопентен-1-он. Соединение 1260 (смесь 2 изомеров): LC-MS (способ B): RT = 4,16, [M+H]+ = 373,2, [M+HCOO]- = 417,1. Соединение 1261 (смесь изомеров): LC-MS (способ B): RT = 4,19, [M+H]+ = 373,2, [M+HCOO]- = 417,1.
Пример 232: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензил}ацетамид (соединение 1262/1263)

Следовали общей процедуре М, используя (4-ацетамидометилфенил)бороновую кислоту и 2-циклопентен-1-он. Соединение 1262 (смесь 2 изомеров): LC-MS (способ B): RT = 4,12, [M+H]+ = 387,1, [M+HCOO]- = 431,0. Соединение 1263 (смесь 4 изомеров): LC-MS (способ B): RT = 4,14, [M+H]+ = 387,1, [M+HCOO]- = 431,0.
Пример 233: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензил}метансульфонамид (соединения 1264/1265)
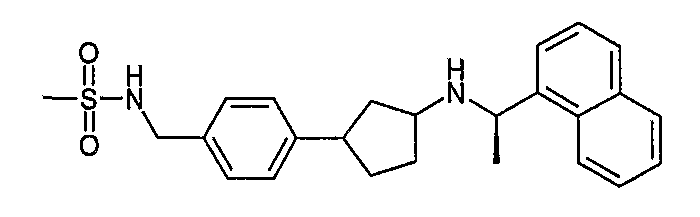
Следовали общей процедуре М, используя (4-метансульфониламинометилфенил)бороновую кислоту и 2-циклопентен-1-он. Соединение 1264 (смесь 2 изомеров): LC-MS (способ B): RT = 4,24, [M+H]+ = 423,1, [M+HCOO]- = 467,0. Соединение 1265 (смесь 4 изомеров): LC-MS (способ B): RT = 4,27, [M+H]+ = 423,1, [M+HCOO]- = 467,0.
Пример 234: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}метансульфонамид (соединения 1266/1267)

Следовали общей процедуре М, используя 4-(метансульфониламино)фенилбороновую кислоту и 2-циклопентен-1-он. Соединение 1266 (смесь 2 изомеров): LC-MS (способ B): RT = 4,26, [M+H]+ = 409,0, [M-H]+ = 407,0. Соединение 1267 (смесь 3 изомеров): LC-MS (способ B): RT = 4,27, [M+H]+ = 409,0, [M-H]+ = 406,9.
Пример 235: [3-(4-метансульфонилфенил)циклогептил]-((R)-1-нафталин-1-илэтил)амин (соединение 1268)
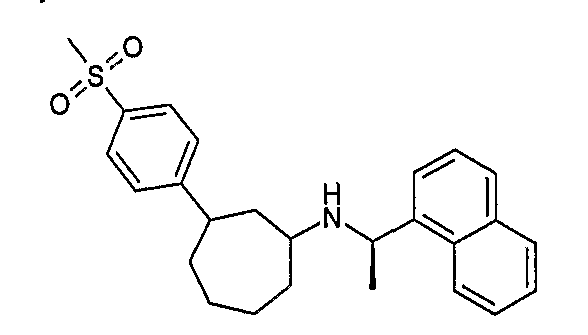
Следовали общей процедуре М, используя 4-(метансульфонил)бензолбороновую кислоту и 2-циклогептен-1-он. Соединение 1268 (смесь изомеров): LC-MS (способ B): RT = 4,34, [M+H]+ = 422,1.
Пример 236: метиловый сложный эфир 2-фтор-4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]бензойной кислоты (соединение 1269)

Следовали общей процедуре М, используя 3-фтор-4-(метоксикарбонил)бензолбороновую кислоту и 2-циклогептен-1-он. Соединение 1269 (смесь изомеров): LC-MS (способ B): RT = 4,57, [M+H]+ = 420,1.
Пример 237: N-{3-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}метансульфонамид (соединение 1270)
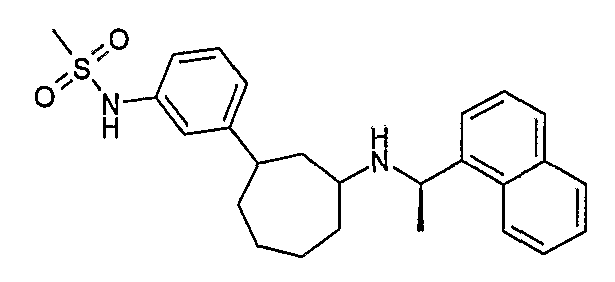
Следовали общей процедуре М, используя 3-(метилсульфониламино)фенилбороновую кислоту и 2-циклогептен-1-он, Соединение 1270 (смесь изомеров): LC-MS (способ B): RT = 4,41, [M+H]+ = 437,1, [M-H]+ = 435,0.
Пример 238: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}ацетамид (соединения 1271/1272)

Следовали общей процедуре М, используя 4-ацетамидофенилбороновую кислоту и 2-циклогептен-1-он. Соединение 1271 (смесь изомеров): LC-MS (способ B): RT = 4,27, [M+H]+ = 401,1, [M+HCOO]- = 445,2. Соединение 1272 (смесь изомеров): LC-MS (способ B): RT = 4,32, [M+H]+ = 401,2, [M+HCOO]- = 445,2.
Пример 239: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]бензил}ацетамид (соединения 1273/1274)

Следовали общей процедуре М, используя (4-ацетамидометилфенил)бороновую кислоту и 2-циклогептен-1-он. Соединение 1273 (смесь 2 изомеров): LC-MS (способ B): RT = 4,24, [M+H]+ = 415,2, [M+HCOO]- = 459,1. Соединение 1274 (смесь 2 изомеров): LC-MS (способ B): RT = 4,26, [M+H]+ = 415,2, [M+HCOO]- = 459,2.
Пример 240: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]бензил}метансульфонамид (соединения 1275/1276)

Следовали общей процедуре М, используя (4-метансульфониламинометилфенил)бороновую кислоту и 2-циклогептен-1-он. Соединение 1275 (смесь изомеров): LC-MS (способ B): RT = 4,37, [M+H]+ = 451,1, [M+HCOO]- = 495,2. Соединение 1276 (смесь изомеров): LC-MS (способ B): RT = 4,39, [M+H]+ = 451,1, [M+HCOO]- = 495,0.
Пример 241: этиловый сложный эфир {4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенокси}уксусной кислоты (соединение 1277)

Следовали общей процедуре М, используя 4-(2-этокси-2~оксоэтокси)фенилбороновую кислоту и 2-циклогептен-1-он. Соединение 1277 (смесь 2 изомеров): LC-MS (способ B): RT = 4,66, [M+H]+ = 446,2.
Пример 242: метиловый сложный эфир 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}пропионовой кислоты (соединения 1278/1279)

Следовали общей процедуре М, используя 4-(2-метоксикарбонилэтил)фенилбороновую кислоту и 2-циклогептен-1-он. Соединение 1278 (смесь 2 изомеров): LC-MS (способ B): RT = 4,66, [M+H]+ = 430,2. Соединение 1279 (смесь 3 изомеров): LC-MS (способ B): RT = 4,66, [M+H]+ = 430,1.
Пример 243: N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}метансульфонамид (соединения 1280/1281)

Следовали общей процедуре М, используя 4-(метансульфониламино)фенилбороновую кислоту и 2-циклогептен-1-он. Соединение 1280 (смесь изомеров): LC-MS (способ B): RT = 4,36, [M+H]+ = 437,1, [M-H]- = 434,9. Соединение 1281 (смесь изомеров): LC-MS (способ B): RT = 4,37, [M+H]+ = 437,1, [M-H]- = 434,9.
Пример 244: {3-[4-(морфолин-4-сульфонил)фенил]циклогептил}-((R)-1-нафталин-1-илэтил)амин (соединение 1282)

Следовали общей процедуре М, используя 4-(4-морфолинилсульфонил)фенилбороновую кислоту и 2-циклогептен-1-он. Соединение 1282 (смесь изомеров): LC-MS (способ B): RT = 4,47, [M+H]+ = 493,2.
Пример 245: {4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}метанол (соединение 1283)

Следовали общей процедуре М, используя 4-(гидроксиметил)фенилбороновую кислоту и 2-циклогептен-1-он. Соединение 1283 (смесь изомеров): LC-MS (способ B): RT = 4,32, [M+H]+ = 374,2.
Общая процедура N
К раствору 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1056, 1,5 ммоль) в 6 мл сухого DMF добавляли CDI (1,8 ммоль). После перемешивания раствора в течение 4 часов при к.т. добавляли спирт (22 ммоль, 15 экв.), и перемешивание продолжали в течение ночи при к.т. Растворитель удаляли при пониженном давлении, и остаток очищали хроматографией.
Пример 246: метиловый сложный эфир 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1284)
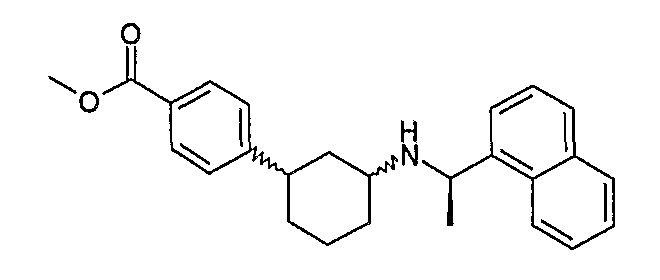
Следовали общей процедуре N, используя метанол. Хроматография (CH2Cl2-MeOH 100:0 до 95:5) давала указанное в заголовке соединение.13C ЯМР (75 МГц, DMSO) δ 166,13, 153,14, 147,17, 142,50, 133,54, 130,88, 129,04, 128,64, 126,99, 126,48, 125,66, 125,60, 125,20, 123,16, 123,03, 51,86, 51,24, 50,22, 38,57, 37,15, 32,82, 29,04, 24,64, 20,26.
Пример 247: этиловый сложный эфир 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1285)

Следовали общей процедуре N, используя этанол. Хроматография (CH2Cl2-MeOH 100:0 до 97:3) давала указанное в заголовке соединение в виде масла.13C ЯМР (75 МГц, DMSO) δ 165,58, 153,03, 142,44, 133,50, 130,85, 128,97, 128,60, 127,26, 126,90, 126,44, 125,61, 125,55, 125,16, 123,11, 122,98, 60,35, 51,16, 50,15, 38,51, 37,12, 32,85, 28,98, 24,59, 20,21, 14,10.
Пример 248: дигидрохлорид 2-морфолин-4-илэтилового сложного эфира 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1286)

Следовали общей процедуре N, используя N-(2-гидроксиэтил)морфолин. Хроматография (CH2Cl2-MeOH 100:0 до 97:3) давала масло, которое растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение.13C ЯМР (75 МГц, DMSO) δ 165,07, 150,89, 133,85, 133,32, 130,24, 129,60, 128,92, 128,84, 126,99, 126,89, 126,09, 125,50, 124,80, 122,29, 63,07, 58,87, 54,40, 51,88, 51,25, 50,42, 35,91, 33,45, 30,81, 25,66, 20,94, 19,28.
Пример 249: гидрохлорид 2-(2-метоксиэтокси)этилового сложного эфира 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1287)

Следовали общей процедуре N, используя монометиловый простой эфир диэтиленгликоля. Хроматография (CH2Cl2-MeOH 100:0 до 80:20) давала масло, которое растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δ 9,54 (ш.м, 2H), 8,35 (д, 1H), 8,20 (д, 1H), 8,03-7,94 (м, 2H), 7,85 (д, 2H), 7,60 (дт, 3H), 7,32 (д, 2H), 5,56-5,42 (м, 1H), 4,41-4,34 (м, 2H), 3,78-3,70 (м, 2H), 3,59 (дд, 2H), 3,46 (дд, 2H), 3,36-3,26 (м, 1H), 3,24 (с, 3H), 3,19-3,07 (м, 1H), 2,12-1,37 (м, 11H).
Пример 250: гидрохлорид 2-[2-(2-метоксиэтокси)этокси]этилового сложного эфира 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1288)

Следовали общей процедуре N, используя монометиловый простой эфир триэтиленгликоля. Хроматография (CH2Cl2-MeOH 100:0 до 80:20) давала масло, которое растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δ 9,48 (с, 2H), 8,35 (д, 1H), 8,17 (д, 1H), 7,99 (т, 2H), 7,86 (д, 2H), 7,62 (дд, 3H), 7,31 (д, 2H), 5,57-5,42 (м, 1H), 4,42-4,33 (м, 2H), 3,78-3,70 (м, 2H), 3,62-3,56 (м, 2H), 3,55-3,47 (м, 4H), 3,45-3,36 (м, 2H), 3,33-3,26 (м, 1H), 3,20 (с, 3H), 3,18-3,08 (м, 1H), 2,11-1,37 (м, 11H).
Пример 251: гидрохлорид 2-[2-(2-этоксиэтокси)этокси]этилового сложного эфира 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1289)
Следовали общей процедуре N, используя моноэтиловый простой эфир триэтиленгликоля. Хроматография (CH2Cl2-MeOH 100:0 до 80:20) давала масло, которое растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δ 9,47 (ш.с, 2H), 8,34 (д, 1H), 8,15 (д, 1H), 7,99 (т, 2H), 7,86 (д, 2H), 7,61 (дд, 3H), 7,31 (д, 2H), 5,48 (ш.с, 1H), 4,43-4,33 (м, 2H), 3,79-3,70 (м, 2H), 3,63-3,57 (м, 2H), 3,56-3,47 (м, 4H), 3,46-3,21 (м, 5H), 3,20-3,09 (м, 1H), 2,09-1,37 (м, 11H), 1,05 (т, 3H).
Пример 252: гидрохлорид 2,3-дигидроксипропилового сложного эфира 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1290)
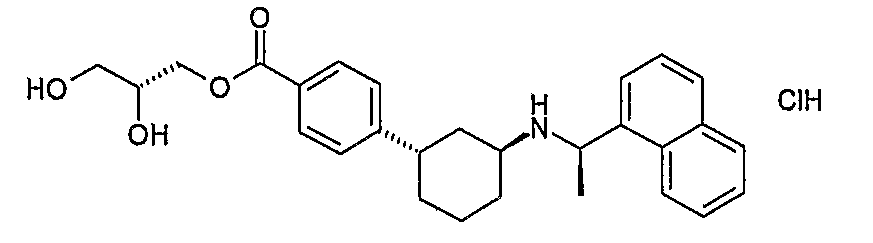
Следовали общей процедуре N, используя D-α,β-изопропилиден глицерин. Промежуточный ацетонид очищали хроматографией (CH2Cl2-MeOH 100:0 до 80:20), получая масло, которое растворяли в EtOAc и обрабатывали HCl в диоксане (4 M). После добавления диэтилового простого эфира осадок фильтровали, получая указанное в заголовке соединение.13C ЯМР (75 МГц, DMSO) δ 165,53, 150,34, 133,82, 133,32, 130,24, 129,28, 128,91, 127,63, 127,01, 126,88, 126,09, 125,49, 124,70, 122,28, 69,28, 66,11, 62,51, 51,93, 50,42, 35,89, 33,40, 30,81, 25,80, 20,83, 19,29.
Пример 253: гидрохлорид тетрагидрофуран-2-илметилового сложного эфира 4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойной кислоты (соединение 1291)
Следовали общей процедуре N, используя тетрагидрофурфуриловый спирт. Хроматография (CH2Cl2-MeOH 100:0 до 80:20) давала масло, которое растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δ 9,45 (ш.с, 2H), 8,35 (д, 1H), 8,16 (д, 1H), 7,99 (т, 2H), 7,85 (д, 2H), 7,61 (дт, 3H), 7,32 (д, 2H), 5,56-5,42 (м, 1H), 4,31-4,10 (м, 3H), 3,79 (дт, 1H), 3,73-3,63 (м, 1H), 3,36-3,21 (м, 1H), 3,20-3,08 (м, 1H), 2,12-1,37 (м, 15H).
Общая процедура O
[Rh(R-BINAP)(nbd)]BF4 или [Rh(S-BINAP)(nbd)]BF4, (Tani, K.; Yamagata, T.; Akutagawa, S.; Kumobayashi, H.; Taketomi, T.; Takaya, H.; Miyashita, A.; Noyori, R.; Otsuka, S. J. Am. Chem. Soc. 1984,106, 5208) (0,03 ммоль) и арилбороновую кислоту (1,5 ммоль) добавляли в колбу на 25 мл, содержащую магнитную стержневую мешалку и мембранный клапан. Колбу промывали аргоном и загружали в нее водный 1,4-диоксан (6/1, 3 мл). Затем добавляли триэтиламин (1,5 ммоль) и 2-циклопентен-1-он (1,0 ммоль). Смесь перемешивали в течение 6 ч при 25°C. Добавляли насыщенный раствор соли, и смесь экстрагировали этилацетатом. При необходимости продукт очищали хроматографией на силикагеле.
Приготовление 6: 3R-(4-гидроксифенил)циклопентанон
Следовали общей процедуре О, используя 4-гидроксифенилбороновую кислоту и [Rh(R-BINAP)(nbd)]BF4.1H ЯМР (300 МГц, DMSO) δ 9,19 (с, 1H), 7,10 (д, 2H), 6,70 (д, 2H), 3,33-3,19 (м, 1H), 2,44 (д, 1H), 2,34-2,14 (м, 4H), 1,91-1,76 (м, 1H).
Пример 254: 4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенол (соединение 1292)

Следовали общей процедуре А, используя 3-(4-гидроксифенил)циклопентанон (приготовление 6). Два полученных диастереомера разделяли препаративной хиральной HPLC на колонке Chiralpak AD-H 250×20 мм, 5 мкм при 25°C, УФ-детектирование при 280 нм. Изократическое разделение со смесью н-гептан:этанол:NEt3:CH3COOH (75:25:0,1:0,1); расход = 17,0 мл/мин. Соединение 1292: RT = 17,15.1H ЯМР (300 МГц, DMSO) δ 8,34-8,24 (м, 1H), 7,96-7,87 (м, 1H), 7,82-7,68 (м, 2H), 7,57-7,43 (м, 3H), 7,03-6,94 (м, 2H), 6,67-6,59 (м, 2H), 4,67 (к, 1H), 3,05-2,93 (м, 1H), 2,80-2,66 (м, 1H), 2,13-1,99 (м, 1H), 1,88-1,52 (м, 4H), 1,41-1,22 (м, 4H).
Общая процедура P:
4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенол (соединение 1292) (0,1 ммоль) взвешивали в сосуде и растворяли в 1 мл ацетонитрила. К этому раствору добавляли алкилбромид или карбамоилхлорид (0,12-0,15 ммоль) и K2CO3(0,15-0,2 ммоль). Сосуд герметизировали и реакционную смесь нагревали до 80°C и перемешивали в течение 16 часов. Превращение отслеживали LC/MS. Реакционную смесь фильтровали через прокладку целита и концентрировали в вакууме. Сырой продукт очищали препаративной HPLC.
Пример 255: этиловый сложный эфир 2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}масляной кислоты (соединение 1293)

Следовали общей процедуре Р, используя этиловый сложный эфир 2-бромбутановой кислоты в качестве алкилбромида. Смесь 2 изомеров.1H ЯМР (300 МГц, DMSO) δ 8,33-8,25 (м, 1H), 7,91 (дд, 1H), 7,77 (д, 1H), 7,72 (д, 1H), 7,56-7,44 (м, 3H), 7,11 (д, 2H), 6,75 (д, 2H), 4,71-4,61 (м, 2H), 4,13 (к, 2H), 3,05-2,93 (м, 1H), 2,85-2,70 (м, 1H), 2,17-2,01 (м, 1H), 1,93-1,55 (м, 7H), 1,41-1,26 (м, 4H), 1,18 (т, 3H), 0,96 (т, 3H).
Пример 256: 2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}масляная кислота (соединение 1294)

Следовали общей процедуре J, используя этиловый сложный эфир 2-{4-[3-(1-нафталин-1-илэтиламино)циклопентил]фенокси}масляной кислоты. Смесь 2 изомеров.1H ЯМР (300 МГц, DMSO) δ 8,25 (д, 1H), 8,00-7,93 (м, 1H), 7,87 (т, 2H), 7,63-7,48 (м, 3H), 7,09-7,00 (м, 1H), 6,97 (д, 1H), 6,75 (дд, 2H), 5,12-4,98 (м, 1H), 4,42-4,33 (м, 1H), 3,22-3,06 (м, 1H), 2,83-2,65 (м, 1H), 2,22-2,06 (м, 1H), 2,03-1,42 (м, 10H), 0,97 (т, 3H).
Пример 257: 2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовая кислота (соединение 1295)

Следовали общей процедуре Р, используя этил 2-бромпропионат в качестве алкилбромида. Промежуточный сложный эфир гидролизовали, следуя общей процедуреJ. Смесь 2 изомеров.1H ЯМР (300 МГц, DMSO) δ 8,24 (д, 1H), 8,02-7,74 (м, 3H), 7,63-7,44 (м, 3H), 7,00 (дд, 2H), 6,82-6,64 (м, 2H), 5,05-4,88 (м, 1H), 4,60-4,44 (м, 1H), 3,15-2,96 (м, 1H), 2,82-2,63 (м, 1H), 2,20-2,02 (м, 1H), 1,96-1,28 (м, 11H).
Пример 258: 3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}дигидрофуран-2-он (соединение 1296)
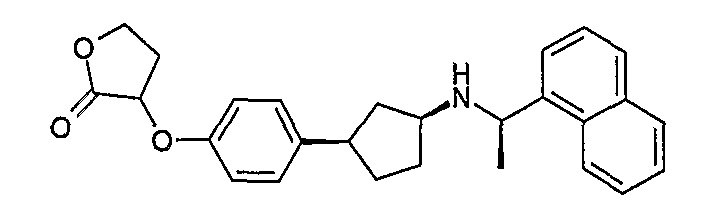
Следовали общей процедуре Р, используя α-бром-бутиролактон в качестве алкилбромида. Смесь 2 изомеров.1H ЯМР (300 МГц, DMSO) δ 8,29 (д, 1H), 7,95 (дд, 1H), 7,85 (д, 1H), 7,80-7,75 (м, 1H), 7,62-7,47 (м, 3H), 7,21-7,11 (м, 2H), 6,99-6,90 (м, 2H), 5,26 (дд, 1H), 4,87 (к, 1H), 4,42 (тд, 1H), 4,34-4,22 (м, 1H), 3,17 (дк, 1H), 2,92-2,67 (м, 2H), 2,21 (ддт, 2H), 1,96-1,60 (м, 4H), 1,55-1,40 (м, 4H).
Пример 259: (S)-{3R-[4-(2-этоксиэтокси)фенил]циклопентил}-((R)-1-нафталин-1-илэтил)амин (соединение 1297)

Следовали общей процедуре Р, используя 2-этоксиэтилбромид в качестве алкилбромида.1H ЯМР (300 МГц, DMSO) δ 8,33-8,25 (м, 1H), 7,98-7,92 (м, 1H), 7,85 (д, 1H), 7,82-7,76 (м, 1H), 7,60-7,48 (м, 3H), 7,15-7,07 (м, 2H), 6,87-6,79 (м, 2H), 4,89 (к, 1H), 4,02 (дд, 2H), 3,70-3,63 (м, 2H), 3,48 (к, 2H), 3,24-3,11 (м, 1H), 2,89-2,72 (м, 1H), 2,24-2,13 (м, 1H), 1,92-1,59 (м, 4H), 1,55-1,41 (м, 4H), 1,12 (т, 3H).
Пример 260: этиловый сложный эфир 3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовой кислоты (соединение 1298)

Следовали общей процедуре Р, используя этил 3-бромпропионат в качестве алкилбромида.1H ЯМР (300 МГц, DMSO) δ 8,29 (д, 1H), 7,94 (дд, 1H), 7,82 (д, 1H), 7,77-7,72 (м, 1H), 7,59-7,47 (м, 3H), 7,11 (д, 2H), 6,82 (д, 2H), 4,79 (к, 1H), 4,14 (т, 2H), 4,09 (к, 3H), 3,17-3,04 (м, 1H), 2,88-2,76 (м, 1H), 2,73 (т, 2H), 2,21-2,08 (м, 1H), 1,92-1,57 (м, 4H), 1,49-1,34 (м, 4H), 1,18 (т, 3H).
Пример 261: 4-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]феноксиметил}бензонитрил (соединение 1299)

Следовали общей процедуре Р, используя 4-цианобензилбромид в качестве алкилбромида.1H ЯМР (300 МГц, DMSO) δ 8,29 (д, 1H), 7,93 (дд, 1H), 7,89-7,78 (м, 3H), 7,75 (д, 1H), 7,62 (д, 2H), 7,58-7,46 (м, 3H), 7,13 (д, 2H), 6,90 (д, 2H), 5,18 (с, 2H), 4,78 (к, 1H), 3,16-3,03 (м, 1H), 2,89-2,71 (м, 1H), 2,19-2,07 (м, 1H), 1,91-1,57 (м, 4H), 1,47-1,33 (м, 4H).
Пример 262: (S)-((R)-1-нафталин-1-илэтил)-{3R-[4-(пиридин-3-илметокси)фенил]циклопентил}амин (соединение 1300)

Следовали общей процедуре Р, используя гидробромид 3-(бромметил)пиридина в качестве алкилбромида.1H ЯМР (300 МГц, DMSO) δ 8,65 (д, 1H), 8,53 (дд, 1H), 8,29 (д, 1H), 7,97-7,90 (м, 1H), 7,88-7,79 (м, 2H), 7,75 (д, 1H), 7,59-7,47 (м, 3H), 7,44-7,38 (м, 1H), 7,14 (д, 2H), 6,93 (д, 2H), 5,10 (с, 2H), 4,79 (к, 1H), 3,16-3,04 (м, 1H), 2,89-2,71 (м, 1H), 2,21-2,08 (м, 1H), 1,91-1,56 (м, 4H), 1,48-1,34 (м, 4H).
Пример 263: (S)-((R)-1-нафталин-1-илэтил)-{3R-[4-(2-пиразол-1-илэтокси)фенил]циклопентил}амин (соединение 1301)

Следовали общей процедуре Р, используя 1-(2-бромэтил)-1H-пиразол в качестве алкилбромида.1H ЯМР (300 МГц, DMSO) δ 8,28 (д, 1H), 7,94 (дд, 1H), 7,82 (д, 1H), 7,75 (дд, 2H), 7,59-7,47 (м, 3H), 7,46-7,43 (м, 1H), 7,10 (д, 2H), 6,79 (д, 2H), 6,23 (т, 1H), 4,81 (к, 1H), 4,46 (т, 2H), 4,27 (т, 2H), 3,19-3,05 (м, 1H), 2,88-2,70 (м, 1H), 2,21-2,08 (м, 1H), 1,92-1,55 (м, 4H), 1,49-1,32 (м, 4H).
Пример 264: (S)-(3R-{4-[2-(1H-индол-3-ил)этокси]фенил}циклопентил)-((R)-1-нафталин-1-илэтил)амин (соединение 1302)

Следовали общей процедуре Р, используя 3-(2-бромэтил)индол в качестве алкилбромида.1H ЯМР (300 МГц, DMSO) δ 10,86 (с, 1H), 8,29 (д, 1H), 7,97-7,91 (м, 1H), 7,82 (д, 1H), 7,75 (д, 1H), 7,61-7,46 (м, 4H), 7,34 (д, 1H), 7,23 (д, 1H), 7,15-6,94 (м, 4H), 6,85 (д, 2H), 4,81 (к, 1H), 4,16 (т, 2H), 3,17-3,06 (м, 3H), 2,88-2,71 (м, 1H), 2,21-2,09 (м, 1H), 1,92-1,56 (м, 4H), 1,49-1,35 (м, 4H).
Пример 265: гидрохлорид 2-метил-2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовой кислоты (соединение 1303)

Следовали общей процедуре Р, используя этил 2-бром-2-метилпропионат в качестве алкилбромида. Промежуточный сложный эфир гидролизовали, следуя общей процедуреJ, до нейтральной кислоты. Нейтральную кислоту растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение.1H ЯМР (300 МГц, DMSO) δ 12,96 (ш.с, 1H), 10,18-10,02 (ш.с, 1H), 9,49-9,33 (ш.с, 1H), 8,30 (д, 1H), 8,08-7,94 (м, 3H), 7,69-7,54 (м, 3H), 7,12 (д, 2H), 6,75 (д, 2H), 5,38-5,24 (м, 1H), 3,53-3,43 (м, 1H), 2,98-2,79 (м, 1H), 2,46-2,32 (м, 1H), 2,20-2,04 (м, 1H), 1,97-1,65 (м, 7H), 1,47 (с, 6H).
Пример 266: 4-гидрокси-2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}масляная кислота (соединение 1304)

Следовали общей процедуре J, используя 3-{4-[3-(1-нафталин-1-илэтиламино)циклопентил]фенокси}дигидрофуран-2-он (соединение 1296). Смесь 2 изомеров.1H ЯМР (300 МГц, DMSO) δ 8,24 (д, 1H), 8,02-7,94 (м, 1H), 7,93-7,82 (м, 2H), 7,63-7,49 (м, 3H), 7,08-6,90 (м, 2H), 6,80-6,67 (м, 2H), 5,16-5,02 (м, 1H), 4,58-4,47 (м, 1H), 3,66-3,50 (м, 2H), 3,22-3,08 (м, 2H), 2,83-2,65 (м, 1H), 2,22-1,84 (м, 4H), 1,81-1,44 (м, 7H).
Пример 267: гидрохлорид 2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовой кислоты (соединение 1305)

Следовали общей процедуре Р, используя этил 2-бромпропионат в качестве алкилбромида. Промежуточный сложный эфир гидролизовали, следуя общей процедуреJ, до нейтральной кислоты. Нейтральную кислоту растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение в виде смеси двух изомеров.1H ЯМР (300 МГц, DMSO) δ 9,65 (ш.с, 1H), 9,27 (ш.с, 1H), 8,30 (д, 1H), 8,02 (т, 2H), 7,93 (д, 1H), 7,71-7,56 (м, 3H), 7,13 (д, 2H), 6,80 (д, 2H), 5,40-5,25 (м, 1H), 4,83-4,71 (м, 1H), 3,63-3,45 (м, 1H), 2,92 (с, 1H), 2,53-2,35 (м, 1H), 2,14-1,85 (м, 3H), 1,73 (т, 5H), 1,47 (д, 3H).
Пример 268: гидрохлорид {4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}фенилуксусной кислоты (соединение 1306)

Следовали общей процедуре Р, используя этил бромфенилацетат в качестве алкилбромида. Промежуточный сложный эфир гидролизовали, используя общую процедуру J. Продукт растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение в виде смеси 2 изомеров.1H ЯМР (300 МГц, DMSO) δ 9,65 (ш.с, 1H), 9,27 (ш.с, 1H), 8,30 (д, 1H), 8,07-7,97 (м, 2H), 7,93 (д, 1H), 7,70-7,56 (м, 3H), 7,13 (д, 2H), 6,80 (д, 2H), 5,39-5,26 (м, 1H), 4,75 (к, 1H), 3,62-3,47 (м, 1H), 2,92 (с, 1H), 2,51-2,36 (м, 1H), 2,13-1,85 (м, 3H), 1,80-1,63 (м, 5H), 1,47 (д, 3H).
Пример 269: 2-метил-1-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропан-2-ол (соединение 1307)
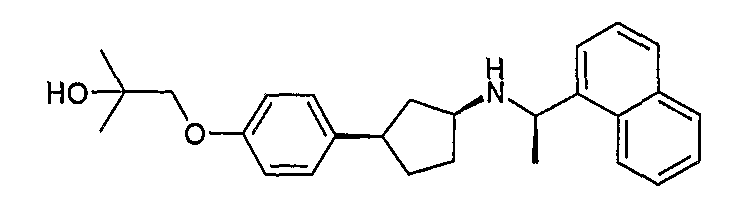
К раствору этилового сложного эфира {4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1180) (150 мг, 360 мкмоль) в сухом THF (2 мл) добавляли бромид метилмагния (3,0 M в THF, 0,6 мл) при -78°C. После перемешивания в течение 5 часов при -78°C - -40°C реакционную смесь гасили водным NaHCO3 и экстрагировали этилацетатом. Органическую фазу концентрировали в вакууме и очищали HPLC, получая указанное в заголовке соединение.13C ЯМР (75 МГц, DMSO) δ 157,00, 141,09, 137,34, 133,38, 130,78, 128,60, 127,59, 126,74, 125,76, 125,53, 125,25, 123,13, 122,83, 114,20, 76,07, 68,52, 56,45, 51,23, 42,52, 41,92, 32,12, 31,41, 26,53, 23,65.
Пример 270: 3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]феноксиметил}пентан-3-ол (соединение 1308)

К раствору этилового сложного эфира {4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1180) (150 мг, 360 мкмоль) в сухом THF (2 мл) добавляли бромид этилмагния (1,0 M в THF, 718 мкл) при -78°C. После перемешивания в течение 2,5 часов при этой температуре дополнительный бромид этилмагния добавляли (360 мкл) и реакционную смесь перемешивали еще час перед гашением водным NaHCO3 и экстрагированием этилацетатом. Органическую фазу концентрировали в вакууме и очищали HPLC, получая указанное в заголовке соединение.13C ЯМР (75 МГц, DMSO) δ 156,92, 142,08, 137,61, 133,39, 130,88, 128,56, 127,60, 126,44, 125,59, 125,53, 125,12, 122,96, 122,91, 114,14, 72,12, 71,80, 56,60, 51,34, 42,54, 42,47, 32,21, 31,89, 28,68, 24,18, 7,40.
Пример 271: 4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фениловый сложный эфир диметилкарбаминовой кислоты (соединение 1309)

Следовали общей процедуре Р, используя N,N-диметилкарбамоилхлорид.1H ЯМР (300 МГц, DMSO) δ 8,30 (д, 1H), 7,91 (дд, 1H), 7,75 (дд, 2H), 7,57-7,43 (м, 3H), 7,21 (д, 2H), 6,97 (д, 2H), 4,67 (к, 1H), 3,02 (с, 3H), 2,89 (с, 4H), 2,18-2,06 (м, 1H), 1,93-1,58 (м, 4H), 1,47-1,30 (м, 4H). Сигнал (1H), вероятно, невидим под сигналом воды при 3,32 м.д.
Пример 272: 3-этил-1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пентан-3-ол (соединение 1310)

К раствору метилового сложного эфира 3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1183) (150 мг) в сухом THF (2 мл) медленно добавляли бромид этилмагния (1,8 мл 1,0 M раствора в THF) при -78°C. Реакционную смесь перемешивали в течение 5 часов при медленном нагревании до -40°C. Этилацетат добавляли к смеси, и продукт очищали HPLC.1H ЯМР (300 МГц, DMSO) δ 8,30 (д, 1H), 7,97-7,89 (м, 1H), 7,81 (д, 1H), 7,75 (д, 1H), 7,59-7,46 (м, 3H), 7,03 (с, 4H), 4,75 (к, 1H), 3,27-3,10 (м, 2H), 2,50-2,38 (м, 2H), 2,09-1,79 (м, 3H), 1,70-1,46 (м, 4H), 1,45-1,30 (м, 8H), 0,79 (т, 6H).
Пример 273: 2-метил-4-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}бутан-2-ол (соединение 1311)

К раствору метилового сложного эфира 3-{4-[(3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1183) (150 мг) в сухом THF (2 мл) добавляли бромид метилмагния (0,6 мл 3M раствора в THF) при -78°C. Реакционную смесь перемешивали в течение 5 часов при медленном нагревании до -40°C. Этилацетат (0,5 мл) добавляли и смесь очищали HPLC, получая указанное в заголовке соединение.13C ЯМР (75 МГц, DMSO) δ 142,76, 141,00, 140,11, 133,40, 130,77, 128,63, 127,90, 126,81, 126,63, 125,81, 125,54, 125,29, 123,19, 122,84, 68,54, 56,20, 50,83, 45,71, 42,42, 40,71, 33,17, 32,65, 29,68, 29,17, 23,61.
Пример 274: 3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропан-1,2-диол (соединение 1312)

Следовали общей процедуре Р, используя 3-бром-пропан-1,2-диол в качестве алкилбромида. Соединение 1312 (смесь 2 изомеров): LC-MS (способ A): RT = 2,44, [M+H]+ = 406,5.
Пример 275: гидрохлорид (2-фторфенил)-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1313)
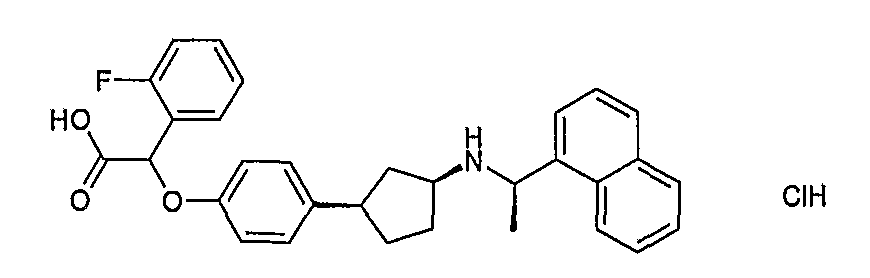
Следовали общей процедуре Р, используя метиловый сложный эфир бром-(2-фторфенил)уксусной кислоты в качестве алкилбромида. Промежуточный сложный эфир гидролизовали, следуя общей процедуреJ, до нейтральной кислоты. Нейтральную кислоту растворяли в этилацетате и обрабатывали HCl в диоксане (4 M) и диэтиловым простым эфиром. Осадок фильтровали, получая указанное в заголовке соединение в виде смеси 2 изомеров.1H ЯМР (300 МГц, DMSO) δ 8,29 (д, 1H), 8,12 (д, 1H), 8,04-7,94 (м, 2H), 7,67-7,50 (м, 4H), 7,48-7,36 (м, 1H), 7,30-7,19 (м, 2H), 7,14 (д, 2H), 6,88 (д, 2H), 5,89 (с, 1H), 5,35-5,22 (м, 1H), 4,53-4,42 (м, 1H), 2,94-2,79 (м, 1H), 2,41-2,09 (м, 2H), 1,91-1,67 (м, 7H).
Пример 276: формиат 2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}этанола (соединение 1314)

К раствору этилового сложного эфира {4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусной кислоты (соединение 1180) (180 мг) в сухом диэтиловом простом эфире (3 мл) добавляли LiAlH4 (0,52 мл 1 M раствора в THF) при 0°C. Через 30 мин реакционную смесь гасили водой и очищали препаративной HPLC, получая указанное в заголовке соединение в виде масла.1H ЯМР (300 МГц, DMSO) δ 8,33-8,24 (м, 2H), 7,98-7,92 (м, 1H), 7,85 (д, 1H), 7,78 (д, 1H), 7,61-7,48 (м, 3H), 7,11 (д, 2H), 6,82 (д, 2H), 4,88 (к, 1H), 3,93 (т, 2H), 3,69 (т, 2H), 3,23-3,11 (м, 1H), 2,88-2,73 (м, 1H), 2,19 (дт, 1H), 1,92-1,59 (м, 4H), 1,55-1,40 (м, 4H).
Приготовление 7: 4-(3-оксоциклогексил)бензальдегид
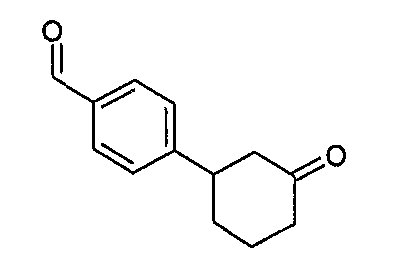
Следовали общей процедуре К, используя 4-формилфенилбороновую кислоту.13C ЯМР (75 МГц, DMSO) δ 209,52, 192,53, 151,70, 134,67, 129,75, 127,46, 47,42, 43,72, 40,32, 31,66, 24,80.
Общая процедура Q
К раствору 4-(3-оксоциклогексил)бензальдегида (0,082 ммоль) в DCE (1 мл) добавляли амин (165 мкл 0,5 мМ раствора в DCE) и NaBH(OAc)3 (0,24 ммоль, 3 экв.). После взбалтывания реакционной смеси в течение ночи при к.т. добавляли (+)-(R)-1-нафталин-1-илэтиламин (0,090 ммоль) в 0,5 мл DCE, и взбалтывание продолжали в течение ночи при к.т. Растворители удаляли в вакууме. Остаток повторно растворяли в DMSO и очищали препаративной HPLC.
Пример 277: (1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}пирролидин-2-ил)метанол (соединение 1315)
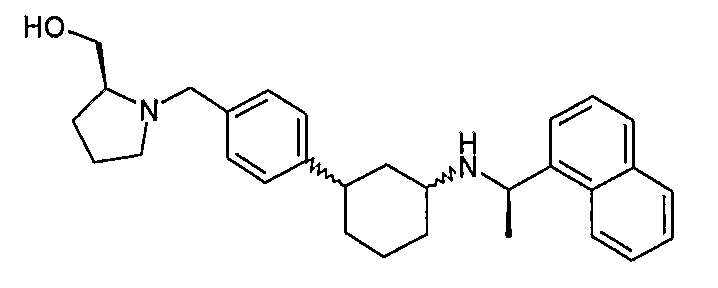
Следовали общей процедуре Q, используя (S)-(+)-2-(гидроксиметил)пирролидин. LC-MS (способ B): RT = 3,67, [M+HCOO]- = 487,3.
Пример 278: 1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}пирролидин-3-ол (соединение 1316)

Следовали общей процедуре Q, используя (R)-3-гидроксипирролидин. LC-MS (способ B): RT = 3,67, [M+H]+ = 429,2.
Пример 279: этиловый сложный эфир 1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}пиперидин-3-карбоновой кислоты (соединение 1317)

Следовали общей процедуре Q, используя этиловый сложный эфир пиперидин-3-карбоновой кислоты. LC-MS (способ B): RT = 3,86, [M+H]+ = 499,3.
Пример 280: [3-(4-{[метил-(тетрагидрофуран-2-илметил)амино]метил}фенил)циклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1318)
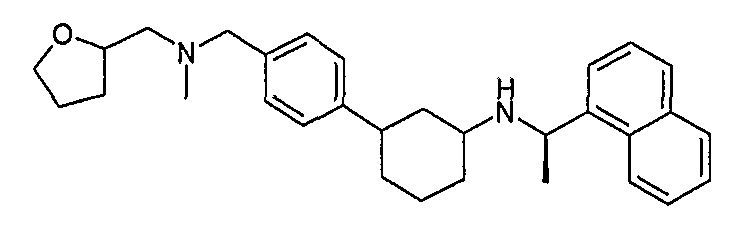
Следовали общей процедуре Q, используя N-метилтетрагидрофурфуриламин. LC-MS (способ B): RT = 3,76, [M+H]+ = 457,3.
Приготовление 8: этиловый сложный эфир 3-[4-((1S)-3-оксоциклопентил)фенил]пропионовой кислоты
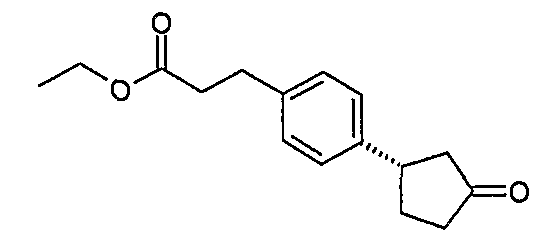
Следовали общей процедуре О, используя [4-(2-этоксикарбонилэтил)фенил]бороновую кислоту и [Rh(S-BINAP)(nbd)]BF4.1H ЯМР (300 МГц, DMSO) δ 7,26-7,20 (м, 2H), 7,19-7,13 (м, 2H), 4,04 (к, 2H), 3,43-3,24 (м, 1H), 2,82 (т, 2H), 2,63-2,45 (м, 3H), 2,35-2,21 (м, 4H), 1,96-1,77 (м, 1H), 1,15 (т, 3H).
Приготовление 9: этиловый сложный эфир 3-[4-((1S,3R)-3-ацетоксициклопентил)фенил]пропионовой кислоты

К раствору этилового сложного эфира 3-[4-(3-оксоциклопентил)фенил]пропионовой кислоты (приготовление 8) (26,2 г, 100 ммоль) в этаноле (300 мл) добавляли NaBH4 (5,7 г, 151 ммоль) порциями. Смесь перемешивали при к.т. в течение 1 часа, и затем растворитель удаляли в вакууме. К остатку добавляли воду, и смесь экстрагировали несколько раз дихлорметаном. Объединенные органические экстракты сушили над MgSO4 и концентрировали в вакууме. К сырому циклопентанолу (25,7 г, 98,0 ммоль) в сухом н-гексане (340 мл) добавляли винилацетат (340 мл, 50 экв.), молекулярные сита (4Å) and PPL (липаза из свиной поджелудочной железы, EC 3.1.1.3, 30,1 ед./мг, 20 г). Смесь перемешивали в атмосфере аргона в течение 2 часов, фильтровали через целит и концентрировали при пониженном давлении. Хроматография (EtOAc-PE 0:100 до 50:50) и собирание менее полярных фракций давало указанное в заголовке соединение в виде масла.1H ЯМР (300 МГц, DMSO) δ 7,20-7,09 (м, 4H), 5,16-5,06 (м, 1H), 4,04 (к, 2H), 3,09-2,94 (м, 1H), 2,80 (т, 2H), 2,58 (т, 2H), 2,52-2,39 (м, 1H), 2,04-1,51 (м, 8H), 1,15 (т, 3H).
Приготовление 10: этиловый сложный эфир 3-[4-((1S,3R)-3-гидроксициклопентил)фенил]пропионовой кислоты

К раствору этилового сложного эфира 3-[4-(3-ацетоксициклопентил)фенил]пропионовой кислоты (приготовление 9) (23,1 г, 75,9 ммоль) в сухом этаноле (1,1 л) в атмосфере аргона добавляли K2CO3 (31,5 г, 228 ммоль). Смесь нагревали при 50-60°C в течение 3 часов, затем фильтровали через целит и концентрировали при пониженном давлении. Остаток суспендировали в воде и экстрагировали дихлорметаном. Органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой продукт использовали без дополнительной очистки.1H ЯМР (300 МГц, DMSO) δ 7,17 (д, 2H), 7,11 (д, 2H), 4,61-4,56 (м, 1H), 4,24-4,14 (м, 1H), 4,04 (к, 2H), 2,99-2,85 (м, 1H), 2,80 (т, 2H), 2,57 (т, 2H), 2,32-2,19 (м, 1H), 1,96-1,58 (м, 4H), 1,52-1,38 (м, 1H), 1,20-1,10 (м, 3H).
Приготовление 11: этиловый сложный эфир 3-[4-((1S,3R)-3-метансульфонилоксициклопентил)фенил]пропионовой кислоты
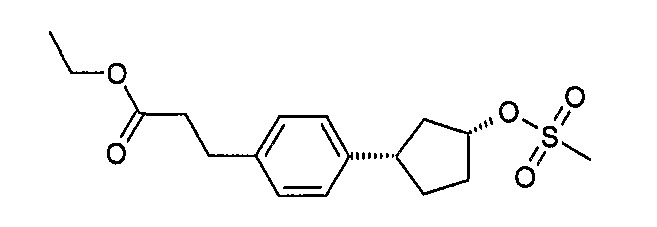
К раствору этилового сложного эфира 3-[4-(3-гидроксициклопентил)фенил]пропионовой кислоты (приготовление 10) (3,16 г, 12,1 ммоль) в сухом CH2Cl2 (30 мл) в атмосфере аргона добавляли NEt3 (3,66 г, 36,1 ммоль) и метансульфонилхлорид (1,38 г, 24,1 ммоль) при 0°C. После перемешивания полученного раствора в течение 1 часа при 0°C реакционную смесь гасили водой и экстрагировали CH2Cl2. Органическую фазу сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Сырой продукт использовали сразу же без дополнительной очистки.1H ЯМР (300 МГц, DMSO) δ 7,21-7,09 (м, 4H), 5,22-5,13 (м, 1H), 4,04 (к, 2H), 3,17 (с, 3H), 3,13-2,93 (м, 1H), 2,81 (т, 2H), 2,63-2,52 (м, 3H), 2,08-1,93 (м, 3H), 1,86-1,61 (м, 2H), 1,15 (т, 3H).
Общая процедура R
К суспензии этилового сложного эфира 3-[4-(3-метансульфонилоксициклопентил)фенил]пропионовой кислоты (приготовление 11) (1,20 ммоль) в пропионитриле (3 мл) добавляли K2CO3 (3,6 ммоль) и амин (1,20 ммоль) и реакционную смесь нагревали при 80°C в течение ночи. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Продукт очищали препаративной HPLC, 10 → 80% этилацетат в гексанах.
Пример 281: этиловый сложный эфир 3-(4-{(1S,3S)-3-[(R)-1-(4-фтор-3-метоксифенил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1319)

Следовали общей процедуре R, используя 1-(4-фтор-3-метоксифенил)этиламин.1H ЯМР (300 МГц, DMSO) δ 7,22 (дд, 1H), 7,10 (м, 5H), 6,94 (м, 1H), 4,03 (к, 2H), 3,85 (м, 4H), 3,15 (м, 2H), 2,78 (т, 2H), 2,56 (т, 2H), 1,99 (м, 2H), 1,78 (м, 1H), 1,70-1,35 (м, 3H), 1,30 (д, 3H), 1,14 (т, 3H).
Пример 282: этиловый сложный эфир 3-(4-{(1S,3S)-3-[(R)-1-(3-цианофенил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1320)

Следовали общей процедуре R, используя 1-(3-цианофенил)этиламин.1H ЯМР (300 МГц, DMSO) δ 7,82 (с, 1H), 7,69 (м, 2H), 7,52 (т, 1H), 7,07 (м, 4H), 4,03 (к, 2H), 3,82 (к, 1H), 3,15 (м, 1H), 2,98 (м, 1H), 2,78 (т, 2H), 2,55 (т, 2H), 2,01 (м, 1H), 1,91 (м, 1H), 1,70 (ддд, 1H), 1,57 (м, 1H), 1,45 (м, 2H), 1,25 (д, 3H), 1,14 (т, 3H).
Пример 283: этиловый сложный эфир 3-{4-[(1S,3S)-3-((R)-1-бензо[b]тиофен-3-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1321)

Следовали общей процедуре R, используя 1-бензо[b]тиофен-3-илэтиламин.1H ЯМР (300 МГц, DMSO) δ 8,03 (дд, 1H), 7,97 (дд, 1H), 7,65 (с, 1H), 7,38 (м, 2H), 7,08 (м, 4H), 4,36 (к, 1H), 4,03 (к, 2H), 3,28 (м, 1H), 3,17 (м, 1H), 2,77 (т, 2H), 2,55 (т, 2H), 2,00 (м, 2H), 1,84 (м, 1H), 1,59 (м, 2H), 1,45 (д, 3H), 1,40 (м, 1H), 1,14 (т, 3H).
Пример 284: этиловый сложный эфир 3-(4-{(1S,3S)-3-[1-((R)-2,3-дигидробензо[1,4]диоксин-6-ил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1322)

Следовали общей процедуре R, используя 1-(2,3-дигидробензо[1,4]диоксин-6-ил)этиламин.1H ЯМР (300 МГц, DMSO) δ 7,09 (2, 4H), 6,92 (с, 1H), 6,85 (д, 1H), 6,80 (д, 1H), 4,22 (с, 4H), 4,03 (к, 2H), 3,84 (к, 1H), 3,15 (м, 2H), 2,78 (т, 2H), 2,56 (т, 2H), 2,00 (м, 2H), 1,85 (м, 1H), 1,68 (м, 1H), 1,56 (м, 1H), 1,45 (м, 1H), 1,30 (д, 3H), 1,14 (т, 3H),
Пример 285: этиловый сложный эфир 3-{4-[(1S,3S)-3-((R)-1-фенилэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1323)

Следовали общей процедуре R, используя 1-фенилэтиламин.1H ЯМР (300 МГц, DMSO) δ 7,3 (м, 4H), 7,22 (тт, 1H), 7,07 (дд, 4H), 4,03 (к, 2H), 3,82 (к, 1H), 3,15 (м, 1H), 3,05 (м, 1H), 2,77 (т, 2H), 2,55 (т, 2H), 2,01 (м, 1H), 1,93 (м, 1H), 1,76 (м, 1H), 1,65-1,35 (м, 3H), 1,29 (д, 3H), 1,14 (т, 3H).
Пример 286: этиловый сложный эфир 3-(4-{(1S,3S)-3-[(R)-1-(2,3-дигидробензофуран-5-ил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1324)
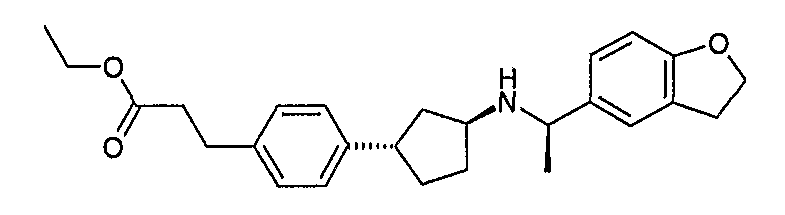
Следовали общей процедуре R, используя 1-(2,3-дигидробензофуран-5-ил)этиламин.1H ЯМР (300 МГц, DMSO) δ 7,18 (д, 1H), 7,06 (м, 5H), 6,65 (д, 1H), 4,47 (т, 2H), 4,03 (к, 2H), 3,66 (к, 1H), 3,14 (м, 3H), 3,00 (м, 1H), 2,78 (т, 2H), 2,56 (т, 2H), 2,01 (м, 1H), 1,89 (м, 1H), 1,70 (м, 1H), 1,57 (м, 1H), 1,44 (м, 2H), 1,21 (д, 3H), 1,14 (т, 3H).
Пример 287: гидроформиат 3-(4-{1S,3S)-3-[(R)-1-(1H-индол-7-ил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1325)
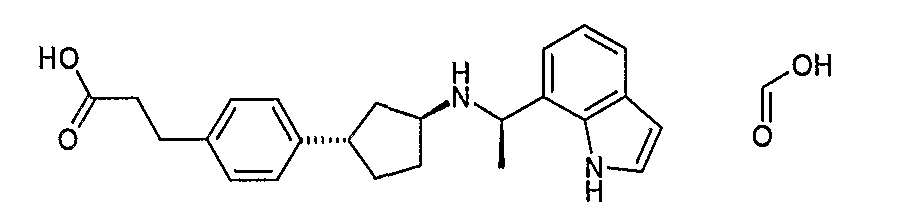
Следовали общей процедуре J, используя этил 3-(4-{3-[1-(1H~индол-7-ил)этиламино]циклопентил}фенил)пропионат.1H ЯМР (300 МГц, DMSO) δ 11,20 (с, 1H), 8,32 (с, 1H), 7,46 (д, 1H), 7,35 (м, 1H), 7,20 (д, 1H), 7,08 (д, 2H), 7,04 (д, 2H), 7,01 (т, 1H), 6,45 (дд, 1H), 4,54 (дд, 1H), 3,23 (м, 1H), 3,18 (м, 1H), 2,74 (т, 2H), 2,46 (т, 2H), 2,02 (м, 1H), 1,94 (м, 2H), 1,68 (м, 2H), 1,49 (д, 3H), 1,42 (д, 1H).
Пример 288: гидроформиат 3-(4-{(1S,3S)-3-[(R)-1-(2,3-дигидробензо[1,4]диоксин-5-ил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1326)
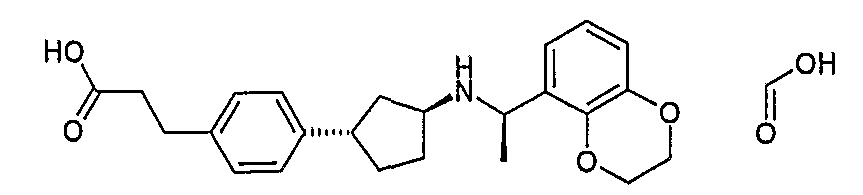
Следовали общей процедуре J, используя этил 3-(4-{3-[1-(2,3-дигидробензо[1,4]диоксин-5-ил)этиламино]циклопентил}фенил)пропионат.1H ЯМР (300 МГц, DMSO) δ 8,25 (с, 1H), 7,11 (д, 2H), 7,08 (д, 2H), 7,00 (дд, 1H), 6,83 (дд, 1H), 6,76 (дд, 1H), 4,28 (м, 2H), 4,23 (м, 2H), 3,20 (м, 1H), 3,16 (м, 1H), 2,75 (м, 2H), 2,47 (м, 2H), 2,02 (м, 1H), 1,96 (м, 1H), 1,88 (м, 1H), 1,71 (м, 1H), 1,59 (м, 1H), 1,46 (м, 1H), 1,33 (д, 3H).
Пример 289: гидроформиат 3-(4-{(1S,3S)-3-[(R)-1-(1H-индол-4-ил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1327)
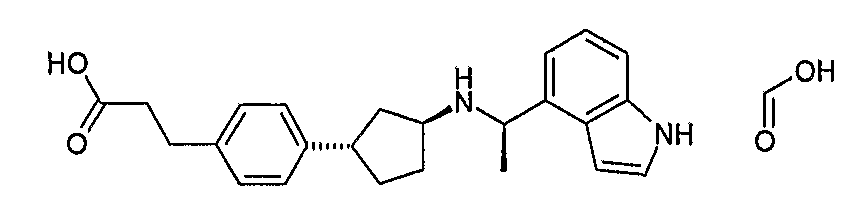
Следовали общей процедуре J, используя этил 3-(4-{3-[1-(1H-индол-4-ил)этиламино]циклопентил}фенил)пропионат.1H ЯМР (300 МГц, DMSO) δ 11,28 (с, 1H), 8,33 (с, 1H), 7,39 (м, 1H), 7,37 (д, 1H), 7,24 (д, 1H),7,14 (м, 1H), 7,09 (д, 2H), 7,05 (д, 2H), 6,71 (м, 1H), 4,61 (к, 1H), 3,28 (м, 1H), 3,23 (м, 1H), 2,75 (т, 2H), 2,47 (т, 2H), 2,00 (м, 3H), 1,83 (м, 1H), 1,74 (м, 1H), 1,59 (д, 3H), 1,41 (м, 1H).
Пример 290: гидроформиат 3-(4-{(1S,3S)-3-[(R)-1-(3-цианофенил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1328)
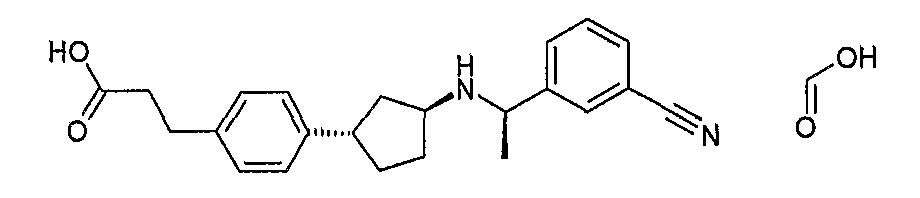
Следовали общей процедуре J, используя этил 3-(4-{3-[1-(3-цианофенил)этиламино]циклопентил}фенил)пропионат.1H ЯМР (300 МГц, DMSO) δ 8,18 (с, 1H), 7,86 (с, 1H), 7,74 (с, 1H), 7,71 (д, 1H), 7,55 (т, 1H), 7,09 (д, 2H), 7,06 (д, 2H), 3,92 (к, 1H), 3,15 (м, 1H), 3,04 (м, 1H), 2,74 (т, 2H), 2,48 (т, 2H), 2,02 (м, 1H), 1,94 (м, 1H), 1,75 (м, 1H), 1,62 (м, 1H), 1,52 (м, 1H), 1,43 (м, 1H), 1,30 (д, 3H).
Пример 291: гидроформиат 3-(4-{(1S,3S)-3-[(R)-1-(3-пирролидин-1-илфенил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1329)

Следовали общей процедуре J, используя этил 3-(4-{3-[1-(3-пирролидин-1-илфенил)этиламино]циклопентил}фенил)пропионат.1H ЯМР (300 МГц, DMSO) δ 8,26 (2, 1H), 7,07 (м, 4H), 6,60 (д, 1H), 6,55 (с, 1H), 6,40 (д, 1H), 3,77 (с, 1H), 3,21 (м, 4H), 3,15 (м, 1H), 3,11 (м, 1H), 2,74 (т, 2H), 2,47 (т, 2H), 2,01 (м, 1H), 1,94 (м, 5H), 1,79 (м, 1H), 1,64 (м, 1H), 1,53 (м, 1H), 1,43 (м, 1H), 1,29 (д, 3H).
Пример 292: гидроформиат 3-(4-{(1S,3S)-3-[(R)-1-(2,3-дигидробензофуран-5-ил)этиламино]циклопентил}фенил)пропионовой кислоты (соединение 1330)

Следовали общей процедуре J, используя этил 3-(4-{3-[1-(2,3-дигидробензофуран-5-ил)этиламино]циклопентил}фенил)пропионат.1H ЯМР (300 МГц, DMSO) δ 8,23 (с, 1H), 7,24 (с, 1H), 7,08 (м, 5H), 6,69 (м, 1H), 4,49 (м, 2H), 3,79 (м, 1H), 3,16 (м, 3H), 3,09 (м, 1H), 2,75 (т, 2H), 2,47 (т, 2H), 2,00 (м, 1H), 1,95 (м, 1H), 1,77 (м, 1H), 1,63 (м, 1H), 1,52 (м, 1H), 1,44 (м, 1H), 1,27 (д, 3H).
Пример 293: 3-(4-{(1S,3S)-3-[(R)-1-(2,3-дигидробензо[1,4]диоксин-6-ил)этиламино]циклопентил}фенил)пропионовая кислота (соединение 1331)

Следовали общей процедуре J, используя этил 3-(4-{3-[1-(2,3-дигидробензо[1,4]диоксин-6-ил)этиламино]циклопентил}фенил)пропионат.1H ЯМР (300 МГц, DMSO) δ 7,10 (м, 5H), 6,99 (д, 1H), 6,87 (д, 1H), 4,24 (м, 4H), 4,09 (м, 1H), 3,26 (м, 2H), 2,76 (т, 2H), 2,48 (т, 2H), 2,04 (м, 3H), 1,78 (м, 2H), 1,47 (м, 4H).
Пример 294: 3-(4-{(1S,3S)-3-[(R)-1-(4-фтор-3-метокси-1-илфенил)этиламино]циклопентил}фенил)пропионовая кислота (соединение 1332)
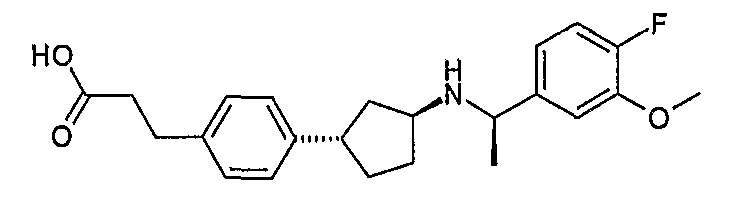
Следовали общей процедуре J, используя этил 3-(4-{3-[1-(4-фтор-3-метокси-1-илфенил)этиламино]циклопентил}фенил)пропионат.1H ЯМР (300 МГц, DMSO) δ 7,33 (д, 1H), 7,17 (дд, 1H), 7,08 (дд, 4H), 6,99 (м, 1H), 3,99 (м, 1H), 3,84 (с, 3H), 3,19 (м, 2H), 2,75 (т, 2H), 2,18 (т, 2H), 2,01 (м, 2H), 1,89 (м, 1H), 1,68 (м, 1H), 1,62 (м, 1H), 1,44 (м, 1H), 1,38 (д, 3H).
Пример 295: гидрохлорид 3-{4-[(1S,3S)-3-((R)-1-бензо[b]тиофен-3-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1333)

Следовали общей процедуре J, используя этил 3-{4-[3-(1-бензо[b]тиофен-3-илэтиламино)циклопентил]фенил}пропионат.1H ЯМР (300 МГц, DMSO) δ 8,29 (с, 1H), 8,12 (д, 1H), 8,07 (д, 1H), 7,47 (ддд, 2H), 7,10 (дд, 4H), 4,94 (к, 1H), 3,52 (м, 1H), 3,31 (м, 1H), 2,19 (т, 2H), 2,47 (т, 2H), 2,24 (м, 1H), 2,05 (м, 2H), 1,96 (м, 1H), 1,87 (м, 1H), 1,73 (д, 3H), 1,47 (м, 1H).
Пример 296: 3-{4-[(1S,3S)-3-((R)-1-фенилэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1334)

Следовали общей процедуре J, используя этил 3-{4-[3-(1-фенилэтиламино)циклопентил]фенил}пропионат.1H ЯМР (300 МГц, DMSO) δ 7,94 (д, 2H), 7,37 (т, 2H), 7,29 (т, 1H), 7,09 (дд, 4H), 3,99 (м, 1H), 3,17 (м, 2H), 2,75 (т, 2H), 2,47 (т, 2H), 2,02 (м, 2H), 1,84 (м, 1H), 1,69 (м, 1H), 1,60 (м, 1H), 1,44 (м, 1H), 1,37 (ш.с, 3H).
Приготовление 12: этиловый сложный эфир 4-(3S-оксоциклопентил)бензойной кислоты
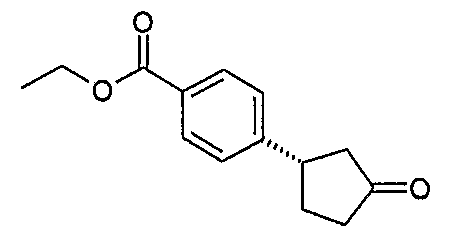
Следовали общей процедуре О, используя 4-этоксикарбонилфенилбороновую кислоту и [Rh(S-BINAP)(nbd)]BF4.1H ЯМР (300 МГц, CDCI3) δ 8,05-7,98 (м, 2H), 7,36-7,29 (м, 2H), 4,38 (к, 2H), 3,55-3,40 (м, 1H), 2,75-2,63 (м, 1H), 2,55-2,41 (м, 2H), 2,41-2,25 (м, 2H), 2,08-1,92 (м, 1H), 1,39 (т, 3H).
Пример 297: этиловый сложный эфир 4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензойной кислоты (соединение 1335/1336)

Следовали общей процедуре А, используя этиловый сложный эфир 4-(3S-оксоциклопентил)бензойной кислоты (приготовление 12) и (+)-(R)-1-нафталин-1-илэтиламин. Полученные два диастереомера разделяли препаративной хиральной HPLC на колонке Chiralpak AD-H 250×20 мм, 5 мкм при 25°C, УФ-детектирование при 280 нм. Изократическое разделение со смесью н-гептан:этаанол:NEt3:CH3COOH (75:15:0,1:0,1); расход = 17,0 мл/мин. Соединение 1335: RT = 8,82.1H ЯМР (300 МГц, DMSO) δ 8,29 (д, 1H), 7,95-7,89 (м, 1H), 7,86 (д, 2H), 7,82-7,70 (м, 2H), 7,55-7,44 (м, 3H), 7,39 (д, 2H), 4,65 (к, 1H), 4,29 (к, 2H), 3,11-2,88 (м, 2H), 2,41-2,27 (м, 1H), 2,26-2,14 (м, 1H), 1,98-1,42 (м, 5H), 1,37 (д, 3H), 1,31 (т, 3H). Соединение 1336: RT = 12,04.1H ЯМР (300 МГц, DMSO) δ 8,30 (д, 1H), 7,95-7,88 (м, 1H), 7,85-7,69 (м, 4H), 7,56-7,45 (м, 3H), 7,28 (д, 2H), 4,64 (к, 1H), 4,27 (т, 2H), 3,35-3,23 (м, 1H), 3,21-3,11 (м, 1H), 2,33-2,20 (м, 1H), 2,17-2,02 (м, 1H), 1,98-1,79 (м, 2H), 1,71-1,41 (м, 3H), 1,38 (д, 3H), 1,29 (т, 3H).
Пример 298: 4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензойная кислота (соединение 1337)
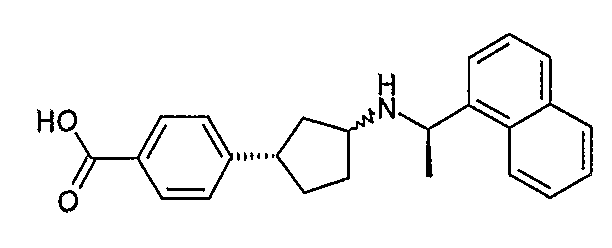
Следовали общей процедуре J, используя этиловый сложный эфир 4-[3-(1-нафталин-1-илэтиламино)циклопентил]бензойной кислоты (соединение 1335).1H ЯМР (500 МГц, DMSO) δ 8,30 (д, 1H), 8,24 (с, 1H), 7,94 (д, 1H), 7,82 (т, 3H), 7,76 (д, 1H), 7,52 (дт, 3H), 7,28 (д, 2H), 4,80 (к, 1H), 3,37-3,28 (м, 1H), 3,25-3,19 (м, 1H), 2,16-2,09 (м, 1H), 2,08-1,95 (м, 2H), 1,66-1,58 (м, 1H), 1,56-1,41 (м, 5H).
Пример 299: 4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензойная кислота (соединение 1338)

Следовали общей процедуре J, используя этиловый сложный эфир 4-[3-(1-нафталин-1-илэтиламино)циклопентил]бензойной кислоты (соединение 1336).1H ЯМР (500 МГц, DMSO) δ 8,31 (д, 1H), 8,23 (с, 1H), 7,94 (д, 1H), 7,85-7,79 (м, 3H), 7,77 (д, 1H), 7,58-7,50 (м, 3H), 7,26 (д, 2H), 4,81 (к, 1H), 3,35-3,23 (м, 2H), 2,13-2,05 (м, 1H), 1,97-1,89 (м, 2H), 1,76-1,63 (м, 2H), 1,52-1,42 (м, 4H).
Пример 300: метиловый сложный эфир 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензоиламино}пропионовой кислоты (соединение 1339)

К раствору 4-[3-(1-нафталин-1-илэтиламино)циклопентил]бензойной кислоты (соединение 1338) (100 мг) в DMF (1 мл) добавляли CDI (53 мг) и DIPEA (33 мг). После перемешивания раствора при к.т. в течение 4,5 ч добавляли гидрохлорид метилового сложного эфира β-аланина (105 мг). Смесь перемешивали в течение ночи, фильтровали и очищали препаративной HPLC-MS (повторно анализировали путем LC/MS, способ A).1H ЯМР (300 МГц, DMSO) δ 8,41 (т, 1H), 8,30 (д, 1H), 7,95-7,87 (м, 1H), 7,81-7,64 (м, 4H), 7,57-7,45 (м, 3H), 7,21 (д, 2H), 4,65 (к, 1H), 3,59 (с, 3H), 3,46 (дд, 2H), 3,32-3,11 (м, 2H), 2,57 (т, 2H), 2,28 (ш.с, 1H), 2,15-2,01 (м, 1H), 1,98-1,77 (м, 2H), 1,70-1,41 (м, 3H), 1,38 (д, 3H).
Пример 301: гидрохлорид 1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензоил}пиперидин-4-карбоновой кислоты (соединение 1340)

Раствор 4-[3-(1-нафталин-1-илэтиламино)циклопентил]бензойной кислоты (соединение 1338) (104 мг, 0,29 ммоль), CDI (56 мг, 0,35 ммоль) и DIPEA (50 мкл, 0,29 ммоль) в сухом DMF (2 мл) перемешивали при к.т. в течение ночи. Добавляли этиловый сложный эфир пиперидин-4-карбоновой кислоты (168 мг, 0,87 ммоль) и полученную суспензию перемешивали при к.т. в течение 3 дней. Реакционную смесь фильтровали, повторно суспендировали в DMSO и очищали препаративной HPLC.
Промежуточный этиловый сложный эфир гидролизовали до указанного в заголовке соединения, следуя общей процедуреJ.13C ЯМР (151 МГц, DMSO) δ 175,38, 168,84, 145,41, 133,95, 133,83, 133,33, 130,15, 128,90, 128,86, 126,96, 126,83, 126,78, 126,10, 125,54, 124,70, 122,35, 55,41, 50,32, 46,38, 42,61, 39,99, 36,66, 32,97, 29,96, 28,14, 20,50.
Пример 302: гидрохлорид 3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензоиламино}пропионовой кислоты (соединение 1341)

Следовали общей процедуре J, используя метиловый сложный эфир 3-{4-[3-(1-нафталин-1-илэтиламино)циклопентил]бензоиламино}пропионовой кислоты (соединение 1339).1H ЯМР (600 МГц, DMSO) δ 10,08 (ш.с, 2H), 8,48 (т, 1H), 8,33 (д, 1H), 8,05 (д, 1H), 8,01 (д, 1H), 7,96 (д, 1H), 7,74 (д, 2H), 7,60 (дт, 3H), 7,25 (д, 2H), 5,28-5,18 (м, 1H), 3,50-3,35 (м, 4H), 2,53-2,48 (м, 2H), 2,28-2,19 (м, 1H), 2,11-2,04 (м, 1H), 2,00-1,86 (м, 3H), 1,69 (д, 3H), 1,52-1,43 (м, 1H).
Приготовление 13: метиловый сложный эфир 4-((1S,4S)-4-ацетоксициклопент-2-енилокси)бензойной кислоты

Метиловый сложный эфир 4-гидроксибензойной кислоты (6 ммоль), (1R,4S)-цис-4-ацетокси-2-циклопентен-1-ол (4 ммоль) и трифенилфосфин (4,8 ммоль) помещали в колбу в атмосфере аргона. Сухой THF (15 мл) добавляли через мембранный клапан, и полученный раствор охлаждали до 0°C. DIAD добавляли по каплям, неразбавленный, в течение 20 мин. Реакционную смесь оставляли на ночь. THF удаляли в вакууме, и остаток забирали в MTBE, 10 мл, и разбавляли до двойного объема PE. После отстаивания в течение 2 часов на холоде осадок трифенилфосфиноксида удаляли на фильтре. Фильтрат концентрировали в вакууме и очищали хроматографией с градиентом от 0 до 20% EtOAc в гептане.
Приготовление 14: метиловый сложный эфир 4-((1S,4S)-4-гидроксициклопент-2-енилокси)бензойной кислоты

Метиловый сложный эфир 4-(4-ацетоксициклопент-2-енилокси)бензойной кислоты (приготовление 13) (3 ммоль) и карбонат калия (3 ммоль) помещали в колбу в атмосфере аргона. Добавляли сухой метанол (15 мл) и полученную суспензию нагревали при температуре кипения с возвращением флегмы в течение 1 часа, когда TLC показывала полное превращение вещества. Реакционную смесь концентрировали в вакууме и очищали хроматографией с градиентом от 0 до 90% EtOAc в гептане.13C ЯМР (75 МГц, CDCl3) δ 166,86, 161,87, 139,76, 133,01, 131,68, 122,64, 114,79, 81,73, 76,01, 51,88, 41,04.
Приготовление 15: метиловый сложный эфир 4-((1S,4R)-4-хлорциклопент-2-енилокси)бензойной кислоты
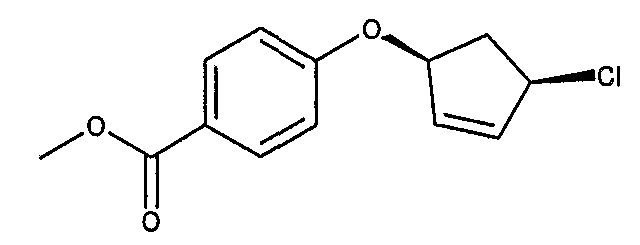
Метиловый сложный эфир 4-(4-гидроксициклопент-2-енилокси)бензойной кислоты (приготовление 14) (2 ммоль), тозилхлорид (2,5 ммоль) и DMAP (200 мкмоль) помещали в сосуд. DCM (1 мл) добавляли через мембранный клапан с последующим добавлением триэтиламина (250 мкмоль). Реакционную смесь оставляли при к.т. на ночь. Реакционную смесь концентрировали в вакууме и очищали хроматографией с градиентом от 0 до 60% EtOAc в гептане.13C ЯМР (75 МГц, CDCl3) δ 166,75, 161,50, 137,52, 132,48, 131,70, 122,95, 114,87, 80,52, 59,82, 51,89, 41,61.
Приготовление 16: метиловый сложный эфир 4-[(1S,4S)-4-((R)-1-нафталин-1-илэтиламино)циклопент-2-енилокси]бензойной кислоты

Метиловый сложный эфир 4-(4-хлорциклопент-2-енилокси)бензойной кислоты (приготовление 15) (630 мкмоль), (+)-(R)-1-нафталин-1-илэтиламин (630 мкмоль) и карбонат калия (630 мкмоль) помещали в сосуд. Добавляли сухой DMF (1 мл) и полученную суспензию нагревали при 50°C в течение 72 часов. Реакционную смесь разбавляли водой (25 мл) и экстрагировали дважды этилацетатом. Экстракт сушили, концентрировали в вакууме и очищали хроматографией с градиентом от 0 до 40% EtOAc в гептане.13C ЯМР (75 МГц, CDCl3) δ 166,82, 161,93, 140,94, 134,00, 131,64, 131,57, 131,24, 130,32, 129,03, 127,38, 125,86, 125,67, 125,37, 123,23, 122,79, 122,35, 114,76, 81,98, 61,10, 52,01, 51,79, 39,23, 24,10.
Пример 303: метиловый сложный эфир 4-[(1R,3R)-3-((R)-1-нафталин-1-илэтиламино)циклопентилокси]бензойной кислоты (соединение 1342)
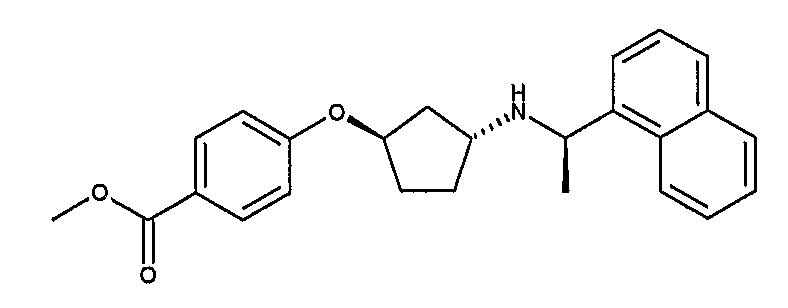
Метиловый сложный эфир 4-[4-(1-нафталин-1-илэтиламино)циклопент-2-енилокси]бензойной кислоты (приготовление 16) разбавляли до 0,05 M в изопропаноле. Этот раствор пропускали через аппарат для гидрогенизации H-Cube при давлении водорода 1 атм. и расходе 1 мл/мин над 10% Pd на углероде. Продукт концентрировали и очищали хроматографией с градиентом от 0 до 40% EtOAc в гептане.13C ЯМР (75 МГц, CDCl3) δ 166,91, 161,78, 141,58, 133,99, 131,57, 131,50, 131,23, 129,00, 127,22, 125,81, 125,63, 125,35, 122,85, 122,79, 122,15, 114,92, 78,33, 56,02, 52,09, 51,78, 40,71, 31,86, 31,06, 24,03.
Пример 304: формиат 4-[(1R,3R)-3-((R)-1-нафталин-1-илэтиламино)циклопентилокси]бензойной кислоты (соединение 1343)

Следовали общей процедуре J, используя метиловый сложный эфир 4-[3-(1-нафталин-1-илэтиламино)циклопентилокси]бензойной кислоты (соединение 1342).13C ЯМР (75 МГц, DMSO) δ 167,01, 163,75, 160,88, 140,56, 133,38, 131,14, 130,68, 128,63, 126,96, 125,87, 125,52, 125,34, 123,19, 122,97, 122,81, 114,79, 77,87, 55,23, 51,22, 38,71, 30,41, 30,36, 23,33.
Приготовление 17: этиловый сложный эфир 3-((1S,4S)-4-ацетоксициклопент-2-енил)-5-метил-3H-имидазол-4-карбоновой кислоты

Этиловый сложный эфир 5-метил-1H-имидазол-4-карбоновой кислоты (6 ммоль), (1R,4S)-цис-4-ацетокси-2-циклопентен-1-ол (4 ммоль) и трифенилфосфин (4,8 ммоль) помещали в колбу в атмосфере аргона. Сухой THF (15 мл) добавляли через мембранный клапан и полученный раствор охлаждали до 0°C. DIAD добавляли по каплям, неразбавленный, в течение 20 мин. Реакционную смесь оставляли на ночь, THF удаляли в вакууме и остаток забирали в MTBE, 10 мл, и разбавляли до двойного объема PE. После отстаивания в течение 2 часов на холоде осадок трифенилфосфиноксида удаляли на фильтре. Фильтрат концентрировали в вакууме и очищали хроматографией с градиентом от 0 до 20% EtOAc в гептане.1H ЯМР (300 МГц, CDCl3) δ 7,43 (с, 1H), 6,28 (м, 1H), 6,17 (м, 2H), 5,83 (м, 1H), 4,34 (к, 2H), 2,58 (ддд, 1H), 2,49 (с, 3H), 2,16 (ддд, 1H), 2,05 (с, 3H), 1,39 (т, 3H).
Приготовление 18: этиловый сложный эфир 3-((1S,4S)-4-гидроксициклопент-2-енил)-5-метил-3H-имидазол-4-карбоновой кислоты

Этиловый сложный эфир 3-(4-ацетоксициклопент-2-енил)-5-метил-3H-имидазол-4-карбоновой кислоты (приготовление 17) (3 ммоль) и карбонат калия (3 ммоль) помещали в колбу в атмосфере аргона. Сухой метанол (15 мл) добавляли и полученную суспензию нагревали при температуре кипения с возвращением флегмы в течение 1 часа, когда TLC показывала полное превращение вещества. Реакционную смесь концентрировали в вакууме и очищали хроматографией с градиентом от 0 до 90% EtOAc в гептане.1H ЯМР (300 МГц, CDCl3) δ 7,41 (с, 1H), 6,28 (м, 1H), 6,12 (м, 1H), 6,04 (м, 1H), 5,08 (м, 1H), 4,34 (к, 2H), 3,62 (ш.с, 1H), 2,47 (с, 3H), 2,42 (м, 1H)м, 2,14 (м, 1H), 1,39 (т, 3H).
Приготовление 19: этиловый сложный эфир 3-((1S,4R)-4-хлорциклопент-2-енил)-5-метил-3H-имидазол-4-карбоновой кислоты

Этиловый сложный эфир 3-(4-ацетоксициклопент-2-енил)-5-метил-3H-имидазол-4-карбоновой кислоты (приготовление 18) (2 ммоль), тозилхлорид (2,5 ммоль) и DMAP (200 мкмоль) помещали в сосуд. DCM (1 мл) добавляли через мембранный клапан с последующим добавлением триэтиламина (250 мкмоль). Реакционную смесь оставляли при к.т. на ночь. Реакционную смесь концентрировали в вакууме и очищали хроматографией с градиентом от 0 до 60% EtOAc в гептане.1H ЯМР (300 МГц, CDCl3) δ 7,61 (с, 1H), 6,29 (м, 1H), 6,09 (м, 1H), 6,01 (м, 1H), 4,95 (м, 1H), 4,34 (к, 2H), 3,20 (м, 1H), 2,48 (с, 3H), 2,15 (м, 1H), 1,38 (т, 3H).
Приготовление 20: этиловый сложный эфир 5-метил-3-[(1S,4S)-4-((R)-1-нафталин-1-илэтиламино)циклопент-2-енил]-3H-имидазол-4-карбоновой кислоты

Этиловый сложный эфир 3-(4-хлорциклопент-2-енил)-5-метил-3H-имидазол-4-карбоновой кислоты (приготовление 19) (630 ммоль), (+)-(R)-1-нафталин-1-илэтиламин (630 мкмоль) и карбонат калия (630 мкмоль) помещали в сосуд. Сухой DMF (1 мл) добавляли и полученную суспензию нагревали при 50°C в течение 72 часов. Реакционную смесь разбавляли водой (25 мл) и экстрагировали дважды этилацетатом. Экстракт сушили, концентрировали в вакууме и очищали хроматографией с градиентом от 0 до 40% EtOAc в гептане.1H ЯМР (300 МГц, CDCl3) δ 8,19 (д, 1H), 7,85 (д, 1H), 7,71 (м, 2H), 7,47 (м, 3H), 7,30 (с, 1H), 6,16 (м, 1H), 6,04 (м, 1H), 5,88 (м, 1H), 4,74 (к, 1H), 4,33 (к, 2H), 3,94 (м, 1H), 2,45 (с, 3H), 2,35 (м, 1H), 2,05 (м, 1H), 1,48 (д, 3H), 1,38 (т, 3H).
Пример 305: 5-метил-3-[(1R,3R)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]-3H-имидазол-4-карбоновая кислота (соединение 1344)

Стадия 1:
Этиловый сложный эфир 5-метил-3-[4-(1-нафталин-1-илэтиламино)циклопент-2-енил]-3H-имидазол-4-карбоновой кислоты (приготовление 20) разбавляли до 0,05 M в изопропаноле. Этот раствор пропускали через аппарат для гидрогенизации H-Cube при давлении водорода 1 атм. и расходе 1 мл/мин над 10% Pd на углероде. Продукт концентрировали и очищали хроматографией с градиентом от 0 до 40% EtOAc в гептане, получая этиловый сложный эфир 5-метил-3-[3-(1-нафталин-1-илэтиламино)циклопентил]-3H-имидазол-4-карбоновой кислоты.
Стадия 2:
Следовали общей процедуре J, используя этиловый сложный эфир 5-метил-3-[3-(1-нафталин-1-илэтиламино)циклопентил]-3H-имидазол-4-карбоновой кислоты.1H ЯМР (300 МГц, DMSO) δ 8,27 (м, 1H), 7,95 (м, 1H), 7,86 (м, 1H), 7,78 (м, 1H), 7,71 (м, 1H), 7,54 (м, 3H), 5,43 (м, 1H), 4,87 (м, 1H), 3,37 (м, 1H), 2,31 (с, 3H), 2,20 (м, 2H), 2,05-1,55 (м, 4H), 1,49 (д, 3H).
Пример 306: (3S,4S-дифенилциклопентил)-((R)-1-нафталин-1-илэтил)амин (соединение 1345)
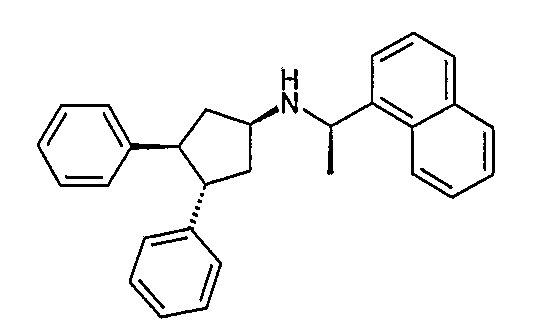
Следовали общей процедуре А, используя 3S,4S-дифенилциклопентанон и (+)-(R)-1-нафталин-1-илэтиламин.1H ЯМР (300 МГц, CDCl3) δ 8,19 (д, 1H), 7,91-7,84 (м, 1H), 7,76 (д, 1H), 7,72-7,64 (м, 1H), 7,55-7,42 (м, 3H), 7,23-6,97 (м, 10H), 4,84-4,73 (м, 1H), 3,48-3,28 (м, 2H), 3,05-2,92 (м, 1H), 2,52-2,38 (м, 1H), 2,17-2,00 (м, 2H), 1,89-1,70 (м, 1H), 1,54 (д, 3H).
Пример 307: 5-(4-этоксифенил)-2-пропилциклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1346)

Раствор 3-(4-этоксифенил)6-пропилциклогекс-2-енона (100 мг) в изопропаноле (8 мл) гидрогенизировали в H-CUBE (катализатор: Pd/C, расход: 1 мл/мин, давление H2: 1 бар, и размер контура: 5 мл). Конъюгированные двойные связи гидрогенизировали за 2 прогона (~80% превращение). Выпаривание изопропанола имело результатом бесцветное масло, которое растворяли в ацетонитриле (3 мл). (R)-1-нафталин-1-илэтиламин и NaBH(OAc)3добавляли и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь экстрагировали EtOAc/NaHCO3 водн. Органическую фазу сушили (MgSO4) и выпаривали после фильтрования. Масло растворяли в метаноле и очищали препаративной HPLC-MS. LC/MS (способ B): RT = 3,72, [M+H]+ = 416,6.
Пример 308: гидрохлорид [2-(4-фторфенил)-5-((R)-1-нафталин-1-илэтиламино)циклопентил]уксусной кислоты (соединение 1347)
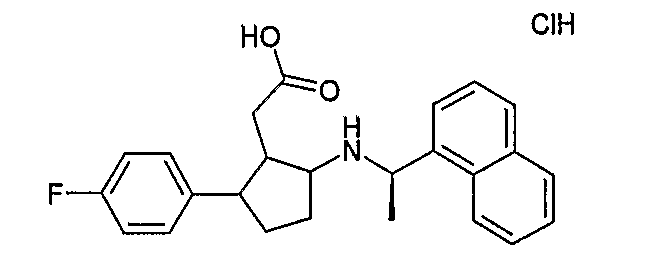
Смесь [2-(4-фторфенил)-5-оксоциклопент-1-енил]уксусной кислоты и 10% Pd/C в метаноле оставляли в атмосфере H2 на 3 дня. Реакционную смесь фильтровали через целит и выпаривали до масла. Масло растворяли в ацетонитриле. (R)-1-нафталин-1-илэтиламин и NaBH(OAc)3 добавляли и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь экстрагировали EtOAc/NaHCO3 водн. Органическую фазу изолировали, сушили (MgSO4) и выпаривали после фильтрования. Масло растворяли в метаноле и очищали препаративной HPLC-MS, получая желательный продукт. Желательный продукт растворяли в ацетонитриле. Добавляли HCl в диоксане (1 экв.), и осаждалась соль с HCl продукта (указанное в заголовке соединение), и продукт собирали фильтрованием.1H ЯМР (300 МГц, DMSO) δ 12,37 (ш.с, 1H), 9,71 (ш.с, 2H), 8,28 (д, 1H), 8,09-7,96 (м, 3H), 7,69-7,56 (м, 3H), 7,38-7,28 (м, 2H), 7,12 (т, 2H), 5,43-5,29 (м, 1H), 3,87-3,73 (м, 1H), 2,86-2,71 (м, 1H), 2,58-2,45 (м, 1H), 2,44-2,36 (м, 2H), 2,14-1,83 (м, 4H), 1,75 (д, 3H).
Пример 309: 3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропан-1-ол (соединение 1348)

К раствору метилового сложного эфира 3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовой кислоты (соединение 1183) (215 мг, 0,54 ммоль) в сухом диэтиловом простом эфире (3 мл) добавляли LiAlH4 (0,62 мл 1 M раствора в THF) при 0°C. Через 30 мин реакционную смесь гасили водой и очищали препаративной HPLC, получая указанное в заголовке соединение в виде масла.1H ЯМР (300 МГц, DMSO) δ 8,30 (д, 1H), 7,95-7,87 (м, 1H), 7,80-7,68 (м, 2H), 7,57-7,44 (м, 3H), 7,03 (с, 4H), 4,64 (к, 1H), 4,42 (т, 1H), 3,46-3,29 (м, 2H), 3,24-3,08 (м, 2H), 2,59-2,47 (м, 2H), 2,35-1,30 (м, 11H).
Пример 310:Функциональный анализ цельных клеток
В день анализа клетки собирали и повторно суспендировали до 13.106 клеток/мл в стимулирующем буфере (содержащем: Hepes l0 мМ, MgCl2 0,5 мМ, KCl 4,2 мМ, NaCl 146 мМ, глюкозу 5,5 мМ, LiCl 50 мМ при pH 7,4). Пять мкл клеточного раствора переносили пипеткой в лунку (белый 384-луночный планшет, Perkin Elmer Optiplate) с последующим добавлением 5 мкл соединения, разведенного в содержащем Ca2+ буфере (до конечной концентрации 2 мМ). После стимуляции соединением в течение 1 часа при 37°C добавляли 10 мкл реагентов для анализа IP-One и проводили инкубирование в течение следующего 1 часа при комнатной температуре. И наконец, планшет считывали с помощью Perkin Elmer EnVision, согласно протоколу, поставляемому производителем набора для анализа IP-One. Отношение FRET рассчитывали путем деления эмиссионного сигнала при 665 нм на сигнал при 615 нм.
Молярные концентрации соединения, которые давали 50% от максимально возможного агонистического отклика (величина IC50), рассчитывают согласно уравнению общей сигмоидальной кривой с наклоном Хилла от a до d (уравнение 1). Эта модель описывает сигмоидальную кривую с согласуемой базисной линией, a. Уравнение может быть применено для приведения в соответствие кривых, где отклик является или увеличивающимся, или снижающимся, с учетом независимой переменной, X.
Уравнение 1. y = (a - d)/(1 + (x/c)Λb) + d
Параметры:
x = концентрация испытуемого соединения
y = отклик (%)
a = минимальный отклик, когда концентрация соединения приближается к 0
d = максимальный отклик, когда концентрация испытуемого соединения возрастающая
c = IC50 для кривой
b = коэффициент Хилла или наклон кривой
Данные испытания соединений по данному изобретению показывают, что соединения по данному изобретению являются сильными модуляторами CaSR, что делает их потенциально применимыми для лечения заболеваний, относящихся к почкам или костям. Смотри таблицу 1 ниже.
Пример 311:Скрининг ингибирования P450 2D6
Анализ обеспечивает быстрый отбор потенциальных ингибиторов каталитической активности P450 2D6 человека при использовании рекомбинантной P450 2D6 человека. Определение IC50 проводят дважды при восьми концентрациях.
Инкубирования проводили в 96-луночных титрационных микропланшетах на основе метода, описанного BD Biosciences. В первую лунку каждого ряда добавляли регенерирующую систему NADPH и испытуемое соединение. Во вторую лунку и во все остальные лунки добавляли регенерирующую систему NADPH и ацетонитрил (конечная концентрация 2%). Конечная аналитическая концентрация регенерирующей системы NADPH была 8,2 мкМ NADP+, 0,41 мМ глюкоза-6-фосфата, 0,41 мМ гексагидрата хлорида магния и 0,4 ед./мл дегидрогеназы глюкоза-6-фосфата и 0,01 мг/мл контрольного клеточного мембранного белка насекомых. Раствор испытуемого соединения последовательно разбавляли 1:3 в восьми лунках. Конечная концентрация испытуемых соединений была в пределах от 100 мкМ до 45,7 нМ в восьми рядах. Лунки 9 и 10 не содержали испытуемого соединения (только регенерирующую систему NADPH и смесь фермент/субстрат) и лунки 11 и 12 использовали в качестве контролей фоновой флуоресценции (фермент и субстрат добавляли после прекращения реакции). Планшет затем подвергали предварительной инкубации при 37°С в течение 10 мин и реакцию инициировали добавлением предварительно нагретой смеси фермент/субстрат. Аналитическая концентрация смеси фермент/субстрат была 100 мМ фосфата калия, pH 7,4, 1,5 пмоль рекомбинантной P450 CYP2D6 человека и 1,5 мкМ флуоресцентного субстрата 3-[2-(N,N диэтил-N-метиламино)этил]-7-метокси-4-метилкумарина (AMMC). Анализ проводили в двух экземплярах в конечном объеме 200 мкл на лунку. Реакции прекращали через 30 мин добавлением смеси 4:1 ацетонитрил:0,5 M раствор Трис основания. Хинидин использовали в качестве положительного контроля, 0,5 мкМ как наивысшая концентрация. Флуоресценцию на лунку измеряли с помощью аппарата для прочтения флуоресценции планшета (возбуждение: 390 нм, эмиссия: 460 нм). Величины IC50 рассчитывали.
Данные испытания соединений по данному изобретению показывают, что соединения по данному изобретению обнаруживают слабое ингибирование или отсутствие ингибирования в отношении P450 2D6 (величина pIC50 ниже 6). Смотри таблицу 2 ниже.
Пример 312:Профилирование соединения по данному изобретению на нецелевых сопряженных рецепторах G-белка
Соединение по данному изобретению наряду с Цинакалцет направляли в CEREP для функционального испытания на клеточных мембранных рецепторах. Все эксперименты проводили на рецепторах человека, которые экспрессировали в клетках млекопитающего. ECSO (агонизм) и IC50 (антагонизм) рассчитывали по 6-точечной кривой с концентрациями в пределах 0,01-100 мМ.
Результаты функционального скрининга на клеточной основе показали, что соединение по данному изобретению было значительно менее сильным на рецепторе опиата (МОР), рецепторе серотонина 5-HT1A и транспортере усвоения норэпинефрина по сравнению с Цинакалцет.
Пример 313:Профилирование соединений по данному изобретению на относящихся к сердцу ионных каналах in vitro
Соединения по данному изобретению испытывали in vitro на трех сердечных ионных каналах, которые ответственны за три главных компонента потенциала сердечной деятельности. Этими каналами являются:
1. Клонированные hERG калиевые каналы (кодированные геном KCNH2 и экспрессированные в эмбриональной почке человека, HEK293, клетки), ответственные за IКг
2. Клонированный hNavl.5 натриевый канал (кодированный геном SCN5A человека и экспрессированный в клетках HEK293), ответственный INa, быстрый ток натрия
3. Клонированные кальциевые каналы L-типа (hCavl.2, кодированные геном CACNA1C человека в клетках CHO), ответственные за ICa,L; высокий пороговый ток кальция.
Эффект соединения по данному изобретению оценивали в ChanTest Corporation, Ion Channel Company, Cleveland, Ohio, USA. Соединение испытывали при комнатной температуре, используя PatchXpress 7000A (Molecular Devices) на каналах, перечисленных выше, и оценивали при 0,01, 0,1, 1, 10 и 100 мкМ с каждой концентрацией, испытанной в 2-6 клетках (n ≥ 2) в течение 5 мин. Действие соединения на hNavl.5 определяли, применяя повторяющуюся стимуляцию 5 Гц в течение 5 мин.
Величины IC50 для испытуемого соединения были >100 мкМ в анализе каналов hERG и hCavl.2. Никакого зависимого от применения ингибирования не наблюдали при концентрирациях вплоть до 100 мкМ на канале hNav1.5. Результаты положительных контролей (E-4031 для hERG, лидокаин для hNav1.5 и нифедипин для hCav1.2) подтвердили чувствительность системы испытания. Вообще, не обнаружили никакого значительного воздействия на три сердечных ионных канала, которые ответственны за три главных компонента потенциала сердечной деятельности.
Пример 314:In vivo испытание на нормальных крысах
Различные соединения вводили нормальным самцам крыс Sprague Dawley, чтобы исследовать фармакологическое воздействие на уровни содержания в сыворотке суммарного кальция и гормона околощитовидной железы (PTH). Эксперименты проводили путем перорального введения одной дозы соответствующих соединений при сравнении с животными, которым вводили носитель, или животными, которые получали конкурентное соединение Цинакалцет.
В качестве стандарта, группе из шести животных давали перорально 1 мг/кг соединения в виде суспензии в 1% метилцеллюлозе и спустя два часа отбирали кровь ретроглазничным кровопусканием под анестезией, и измеряли уровни содержания в сыворотке кальция и РТН. Процентное подавление PTH и кальция, соответственно, в сравнении с животными, получавшими носитель, показано в таблице 3.
В некоторых случаях крысам вводили перорально различные дозы данного соединения в 1% метилцеллюлозе (шесть крыс/доза), и кровь отбирали ретроглазничным кровопусканием спустя два часа. Кривые изменения в ответ на дозу для подавления уровней содержания сывороточного РТН и сывороточного кальция указанными соединениями приведены на фигурах 1-4. Используя программное обеспечение GraphPad Prism® 5, рассчитывали величины ED50 для Цинакалцет, соединения 1056, соединения 1186 и соединения 1190, что касается подавления PTH, они были 0,9 мг/кг, 0,1 мг/кг, 0,04 мг/кг и 0,002 мг/кг, соответственно.
При испытании некоторых соединений крысам делали кровопускание в различные моменты времени после перорального введения (шесть крыс/момент времени), и подавление уровней содержания сывороточного PTH наблюдали со временем. Результаты показаны на фигурах 5-8.
Пример 315:In vivo испытание с применением модели 5/6 нефрэктомии на крысах.
Понижающее воздействие различных соединений на сывороточный PTH исследовали in vivo на крысиной модели 5/6 нефрэктомии, которая является общепринятой животной моделью гиперпаратиреоза.
Две трети левой почки крысы (Sprague Dawley, возраст по меньшей мере 8 недель) удаляли хирургически с последующим удалением правой почки через неделю. Сразу после этой процедуры диету грызуна изменяли от стандартной диеты (Altromin, 0,9% Ca2+, 0,7% Pi) до диеты с высоким содержанием фосфора (Altromin, 0,9% Ca2+, 1,2% Pi) и животных наблюдали 3 недели, в течение которых у них развился тяжелый вторичный гиперпаратиреоз.
После иницирования болезни кровь отбирали ретроглазничным кровопусканием и мочу собирали, используя метаболические клетки. Сывороточный PTH, кальций, фосфор, альбумин, креатинин и BUN, а также креатинин и альбумин в моче измеряли. Крыс затем распределяли на группы различной обработки (9-12 крыс/группа) на основе полученных результатов. Одна группа нормальных крыс без хирургии служила в качестве контроля ("контроль"), и одну группу крыс, подвергнутых нефрэктомии, получавших носитель (1% метилцеллюлоза), использовали в качестве другого контроля ("5/6 NEPX"). Все другие группы получали перорально испытуемое соединение в различных дозах раз в день в течение двух недель, и указанные параметры отслеживали еженедельно.
Как показано на фигуре 9, эффект понижения РТН испытуемыми соединениями был подтвержден. Рассчитанные величины ED50 для Цинакалцет, соединения 1056, соединения 1186 и соединения 1190 были приблизительно 20 мг/кг, 2 мг/кг, 0,3 мг/кг и 0,01 мг/кг, соответственно.
Реферат
Изобретение относится к новым циклическим соединениям общей формулы I, которые обладают свойствами модулятора CaSR. Соединения могут найти применение при лечении, облегчении или профилактике физиологических расстройств или заболеваний, связанных с нарушениями активности CaSR, таких как гиперпаратиреоз, и других заболеваний. В общей формуле Iгруппапредставляет циклоалкил, содержащий 4-7 атомов углерода, необязательно замещенный одним или несколькими, одинаковыми или разными заместителями, выбранными из R, R, Rили R; А представляет 1-нафтил; Rпредставляет метил, этил или н-пропил, каждый из которых необязательно замещен одним или несколькими, одинаковыми или разными заместителями, выбранными из галогена и гидрокси; Rи Rпредставляют водород; Rпредставляет водород, галоген, гидрокси или Cалкил; каждый Rпредставляет независимо один или несколько одинаковых или разных заместителей, представленных водородом или Cалкилом; G представляет -С(O)NH, Сциклоалкил, Cгетероциклоалкил, Cгетероциклоалкенил, Сциклоалкенил, Сарил, Cгетероарил, Сариламино, гидроксиаминокарбонил, Сариламинокарбонил, Cаминокарбонил, Cгетероциклоалкилкарбонил, Cгетероариламинокарбонил, Сарилсульфониламинокарбонил, Сарилокси, или Cалкоксикарбонил, где указанные заместители являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями. Другие значения радикалов указаны в формуле изобретения. 7 н. и 16 з.п. ф-лы, 9 ил., 3 табл., 315 пр.
Формула

где
группа

А представляет 1-нафтил;
R1 представляет метил, этил или н-пропил,
каждый из которых необязательно замещен одним или несколькими, одинаковыми или разными заместителями, выбранными из галогена и гидрокси;
R2 и R3 представляют водород;
R4 представляет водород, галоген, гидрокси или C1-6 алкил;
каждый R5 представляет независимо один или несколько одинаковых или разных заместителей, представленных водородом или C1-6 алкилом;
G представляет -С(O)NH2, С3-8циклоалкил, C1-6гетероциклоалкил, C1-6гетероциклоалкенил, С3-8циклоалкенил, С6-14арил, C1-10гетероарил,
С6-10ариламино, гидроксиаминокарбонил, С6-10ариламинокарбонил,
C1-4аминокарбонил, C1-6гетероциклоалкилкарбонил,
C1-10гетероариламинокарбонил,
С6-10арилсульфониламинокарбонил, С6-14арилокси, или
C1-4 алкоксикарбонил,
где указанные -C(O)NH2, С3-8циклоалкил, C1-6 гетероциклоалкил, C1-6гетероциклоалкенил, С3-8циклоалкенил, С6-14арил, C1-10гетероарил, С6-10ариламино, гидроксиаминокарбонил, С6-10 ариламинокарбонил, C1-4аминокарбонил, C1-6гетероциклоалкилкарбонил, C1-10гетероариламинокарбонил, С6-10арилсульфониламинокарбонил, С6-14 арилокси, C1-4алкоксикарбонил
являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями, представленными такими, как галоген, циано, карбокси, -NH2, моно- или ди(C1-6алкил) амино, иминометил, гидроксииминометил, амидино, гидрокси, меркапто, -С(O)Н, -C(O)NH2, нитро, оксо, трифторметил, C1-6алкил, С2-4алкенил, С2-4алкинил, C1-4 гидроксиалкил, аминоС1-3алкил, C1-6галогеналкил, C1-4алкокси, C1-4 алкоксикарбонил, C1-4алкилкарбонил, C1-4аминокарбонил, гидроксиаминокарбонил, С3-6циклоалкиламинокарбонил, C1-6 гетероциклоалкиламинокарбонил, С3-6циклоалкил, С3-6циклоалкенил, C1-6 циклоалкиламино, C1-6гетероциклоалкил, C1-6гетероциклоалкенил, C1-6 гетероциклоалкилкарбонил, С6-14арил, карбоксиС6-10арил, C1-6гетероарил, C1-6гетероариламинокарбонил, -S(O)2NH2, C1-6уреидо, C1-6тиоуреидо, C1-4 алкилкарбонилокси, C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-6гетероциклоалкилокси, C1-4алкилтио, C1-4аминосульфонил,
C1-4аминокарбонилокси, C1-4алкилсульфониламино, С6-10ариламино,
С6-10ариламинокарбонил, С6-10арилоксикарбонил, C1-4алкоксикарбамоил,
С6-10арилкарбониламино, С6-10арилсульфониламино, C1-4алкилкарбониламино, C1-4 алкенилкарбониламино, С3-6циклоалкенилкарбониламино,
С3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино,
C1-6гетероциклоалкилкарбониламино, C1-4алкилсульфонил,
C1-6гетероциклоалкилсульфонил или
C1-3алкилсульфониламинокарбонил,
где указанные карбокси, моно- или ди(C1-6алкил)амино, иминометил, гидроксииминометил, -C(O)NH2, C1-6алкил, С2-4алкенил, С2-4алкинил,
C1-4гидроксиалкил, аминоС1-3алкил, C1-6галогеналкил, C1-4алкокси,
C1-4алкоксикарбонил, C1-4алкилкарбонил, C1-4аминокарбонил, гидроксиаминокарбонил, С3-6циклоалкиламинокарбонил,
C1-6гетероциклоалкиламинокарбонил, С3-6циклоалкил,
С3-6циклоалкенил, C1-6циклоалкиламино, C1-6гетероциклоалкил,
C1-6гетероциклоалкенил, C1-6 гетероциклоалкилкарбонил, С6-14арил, карбоксиС6-10арил, C1-6гетероарил, C1-6гетероариламинокарбонил,
-S(O)2NH2, C1-6уреидо, C1-6тиоуреидо, C1-4алкилкарбонилокси,
C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси,
C1-6гетероциклоалкилокси, C1-4алкилтио, C1-4аминосульфонил,
C1-4аминокарбонилокси, C1-4алкилсульфониламино, С6-10 ариламино, С6-10ариламинокарбонил, С6-10арилоксикарбонил, C1-4алкоксикарбамоил,
С6-10арилкарбониламино, С6-10арилсульфониламино,
C1-4алкилкарбониламино, C1-4алкенилкарбониламино,
С3-6циклоалкенилкарбониламино, С3-6циклоалкилкарбониламино,
C1-4алкоксикарбониламино, C1-6гетероциклоалкилкарбониламино,
C1-4алкилсульфонил, C1-6гетероциклоалкилсульфонил или
C1-3алкилсульфониламинокарбонил
являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями, выбранными из таких, как гидрокси, -NH2, моно- или ди-(С1-6алкил)C1-6амино, иминометил, гидроксииминометил, карбокси, трифторметил, галоген, оксо, меркапто, циано, -С(O)NH2, нитро, C1-6алкил, С2-4алкенил, С2-4алкинил, C1-4гидроксиалкил,
C1-6галогеналкил, C1-3алкокси, C1-4алкоксикарбонил,
C1-4алкилкарбонил, С3-8циклоалкил, С3-8циклоалкенил,
C1-6гетероциклоалкил, С6-12арил, C1-10гетероарил, C1-3алкоксиС6-10 арил, C1-10гетероциклоалкиларил, C1-6гетероциклоалкенил, -S(O)2NH2,
-S(O)2OH, -S(O)2СН3, C1-6уреидо, C1-6тиоуреидо,
C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси,
C1-4алкоксисульфонилокси, C1-4алкоксикарбамоил,
C1-4аминокарбонил, C1-6гетероциклоалкилкарбонил, C1-4алкилтио,
C1-4аминосульфонил, C1-4аминокарбонилокси,
C1-4алкилсульфониламино, С6-14арилсульфонил,
С6-10арилсульфониламино, гидроксииминометил,
C1-4алкилкарбониламино или C1-4алкилсульфонил,
где указанные -C(O)NH2, моно- или ди(C1-6алкил)амино, C1-6алкил, С2-4алкенил,
С2-4 алкинил, C1-4гидроксиалкил, C1-6галогеналкил, C1-3алкокси,
C1-4алкоксикарбонил, С3-8циклоалкил, С3-8циклоалкенил,
C1-6гетероциклоалкил, C6-12арил, C1-10гетероарил, C1-3алкоксиС6-10 арил, C1-10гетероциклоалкиларил, C1-6гетероциклоалкенил, -S(O)2NH2, S(O)2OH, C1-6уреидо, C1-6тиоуреидо, C1-4алкилкарбонилокси,
C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси,
C1-4алкоксикарбамоил, C1-4аминокарбонил,
C1-6 гетероциклоалкилкарбонил, C1-4алкилтио, C1-4аминосульфонил, C1-4аминокарбонилокси, C1-4алкилсульфониламино, С6-14арилсульфонил,
С6-10арилсульфониламино, гидроксииминометил,
C1-4алкилкарбониламино или C1-4алкилсульфонил
являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями, выбранными из таких, как гидрокси, оксо, циано, галоген, трифторметил,
C1-3алкокси, C1-3алкокси C1-3алкокси, моно- или ди-(С1-6 алкил)амино, меркапто, карбокси, -C(O)NH2, нитро, C1-6алкил, C1-3гидроксиалкил, C1-4 алкоксикарбонил, C1-3алкилкарбониламино, C1-6гетероциклоалкил, С6-12арил, C1-6гетероарил, -S(O)2NH2, -S(O)2OH;
или G вместе с R4 образует оксогруппу;
при условии, что соединение не является таким, как
N-(3,5-бис(трифторметил)бензил)-3-((1-(нафтален-1-ил)этил)амино)циклопентанкарбоксамид,
или его фармацевтически приемлемая соль или in vivo гидролизуемый сложный эфир.
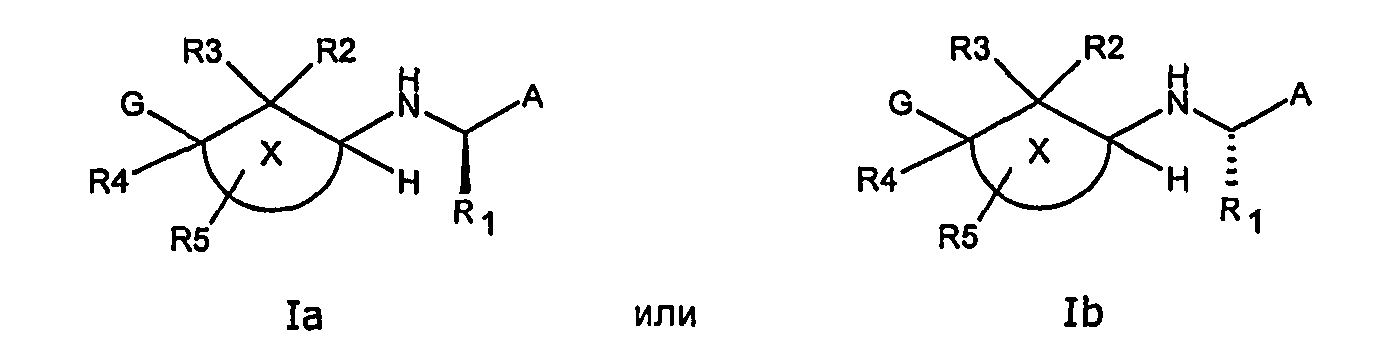


C1-4гидроксиалкил, C1-6галогеналкил, C1-4алкокси, C1-4алкоксикарбонил, C1-4аминокарбонил, С3-6циклоалкил, С3-6циклоалкенил,
C1-6гетероциклоалкенил, С3-6циклоалкиламино, C1-6гетероциклоалкил,
C1-6гетероциклоалкилкарбонил, С6-14арил, C1-6гетероарил, С6-10ариламино, карбокси C6-10арил, C1-4алкилкарбонилокси, C1-4алкоксикарбонилокси,
C1-4алкоксисульфонилокси, C1-4алкилтио, C1-4аминокарбонилокси,
C1-4алкилсульфониламино, C1-4алкилкарбониламино,
C1-4алкенилкарбониламино, С3-6циклоалкенилкарбониламино,
С3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино,
С6-10арилкарбониламино или С6-10арилсульфониламино,
где указанные моно- или ди-(С1-6 алкил)амино, C1-6алкил, С2-4алкенил, С2-4алкинил, C1-4гидроксиалкил, C1-6галогеналкил, C1-4алкокси,
C1-4алкоксикарбонил, C1-4аминокарбонил, С3-6циклоалкил,
С3-6циклоалкенил, C1-6гетероциклоалкенил, С3-6циклоалкиламино,
C1-6гетероциклоалкил, C1-6гетероциклоалкилкарбонил, С6-14арил,
C1-6гетероарил, С6-10ариламино, карбоксиС6-10арил,
C1-4алкилкарбонилокси,C1-4алкоксикарбонилокси,
C1-4алкоксисульфонилокси, C1-4алкилтио, C1-4аминокарбонилокси,
C1-4алкилсульфониламино, C1-4алкилкарбониламино,
C1-4алкенилкарбониламино, С3-6циклоалкенилкарбониламино,
С3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино,
С6-10арилкарбониламино или С6-10арилсульфониламино могут быть дополнительно необязательно замещенными одним или несколькими одинаковыми или разными заместителями, такими как гидрокси, галоген, C1-4алкил, C1-3алкокси, C1-4алкоксикарбонил, C1-6гетероциклоалкил, С6-12арил или оксо,
где указанные C1-4алкил, C1-3алкокси, C1-4алкоксикарбонил,
C1-6гетероциклоалкил или С6-12арил являются необязательно дополнительно замещенными трифторметилом, галогеном, C1-4алкилом, C1-3алкокси или C1-4алкоксикарбонилом.
где указанные C1-4аминокарбонил, C4-5гетероциклоалкилкарбонил, С6-10ариламинокарбонил, С6-10арилсульфониламинокарбонил являются необязательно замещенными одним или несколькими, одинаковыми или разными заместителями, выбранными из оксо, гидрокси, C1-4алкила,
C1-3алкокси, C1-3алкоксикарбонила, C4-5гетероциклоалкила, С6-10 арила,
где указанные C1-4алкил, C1-3алкокси, C1-3алкоксикарбонил, С4-5гетероциклоалкил или С6-10арил являются необязательно замещенными одним или несколькими, одинаковыми или разными заместителями, такими как галоген, трифторметил, C1-3алкокси или C1-3алкоксикарбонил.
C1-6алкил, С2-4алкенил, С2-4алкинил, C1-4гидроксиалкил, C1-6амино, аминоС1-3алкил, иминометил, гидроксииминометил, C1-6галогеналкил, C1-4алкокси, C1-4алкоксикарбонил, C1-3алкоксикарбамоил,
C1-4аминокарбонил, C1-3алкилсульфониламинокарбонил, гидроксиаминокарбонил, C1-6гетероциклоалкилокси,
C1-6гетероциклоалкиламинокарбонил, С3-6циклоалкиламинокарбонил, С6-10ариламинокарбонил, C1-10гетероариламинокарбонил, С3-6циклоалкил,
C1-6гетероциклоалкил, C1-6гетероциклоалкенил,
C1-6гетероциклоалкилкарбонил, C1-4алкилкарбонилокси,
C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-4алкилтио, С3-6циклоалкенил, C1-4аминосульфонил, C1-4аминокарбонилокси,
C1-4алкилсульфониламино, C1-10гетероарил, С6-10ариламино,
С6-10арилоксикарбонил, С6-10арилкарбониламино,
С6-10арилсульфониламино, C1-4алкилкарбониламино,
C1-4алкенилкарбониламино, С3-6циклоалкенилкарбониламино,
С3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино,
C1-6гетероциклоалкилкарбониламино, C1-4алкилсульфонил или
C1-4гетероциклоалкилсульфонил,
где указанные C(O)NH2, C1-6алкил, С2-4алкенил, С2-4алкинил,
C1-4гидроксиалкил, C1-6амино, аминоС1-3алкил, иминометил, гидроксииминометил, C1-6галогеналкил, C1-4алкокси,
C1-4алкоксикарбонил, C1-3алкоксикарбамоил, C1-4аминокарбонил,
C1-3алкилсульфониламинокарбонил, гидроксиаминокарбонил,
C1-6гетероциклоалкилокси, C1-6гетероциклоалкиламинокарбонил,
С3-6циклоалкиламинокарбонил, С6-10ариламинокарбонил,
C1-10гетероариламинокарбонил, С3-6циклоалкил,
C1-6гетероциклоалкил, C1-6гетероциклоалкенил,
C1-6гетероциклоалкилкарбонил, C1-4алкилкарбонилокси,
C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси, C1-4алкилтио, С3-6циклоалкенил, C1-4аминосульфонил, C1-4аминокарбонилокси,
C1-4алкилсульфониламино, C1-10гетероарил, С6-10ариламино,
С6-10арилоксикарбонил, С6-10арилкарбониламино,
С6-10арилсульфониламино, C1-4алкилкарбониламино,
C1-4алкенилкарбониламино, С3-6циклоалкенилкарбониламино,
С3-6циклоалкилкарбониламино, C1-4алкоксикарбониламино,
C1-6гетероциклоалкилкарбониламино, C1-4алкилсульфонил или
C1-4гетероциклоалкилсульфонил
являются необязательно дополнительно замещенными одним или несколькими, одинаковыми или разными заместителями, выбранными из группы, состоящей из таких заместителей, как гидрокси, -NH2,
моно- или ди-(С1-6 алкил)амино, иминометил, гидроксииминометил, карбокси, трифторметил, галоген, оксо, меркапто, циано, -C(O)NH2, нитро,
C1-6алкил, С2-4алкенил, С2-4алкинил, C1-4гидроксиалкил,
C1-6галогеналкил, C1-3алкокси, C1-4алкоксикарбонил,
C1-6гетероциклоалкилкарбонил, С3-6циклоалкил, С3-6циклоалкенил,
C1-6гетероциклоалкил, C6-12арил, C1-10гетероарил, C1-3алкоксиС6-10 арил, C1-10гетероциклоалкиларил, C1-6гетероциклоалкенил, -S(O)2NH2, S(O)2OH, C1-6уреидо, C1-6тиоуреидо, C1-4алкилкарбонилокси,
C1-4алкоксикарбонилокси, C1-4алкоксисульфонилокси,
C1-4алкоксикарбамоил, C1-4аминокарбонил, C1-4алкилтио,
C1-4аминосульфонил, C1-4аминокарбонилокси,
C1-4алкилсульфониламино; C6-12арилсульфонил,
С6-10арилсульфониламино, C1-4алкилкарбониламино или
C1-4 алкилсульфонил,
где указанные С3-8циклоалкил, C1-6алкил, C1-3алкокси,
C1-4алкоксикарбонил, C1-6гетероциклоалкил, С6-10арил или
C1-10гетероарил могут быть дополнительно замещенными карбокси, галогеном, гидрокси, циано, C1-6гетероциклоалкилом, одним или несколькими C1-6алкилами, C1-3алкокси, С1-3алкоксиС1-3алкокси, C1-4алкоксикарбонилами, C1-3гидроксиалкилами или С6-10арилами.
C1-6алкил, С2-4алкинил, аминоС1-3алкил, C1-3алкокси,
C1-3алкоксикарбонил, C1-4алкоксикарбамоил, C1-3аминокарбонил,
С3-6циклоалкил, C1-6гетероциклоалкил,
C1-6гетероциклоалкилкарбонил, C1-6гетероциклоалкилокси,
C1-3аминокарбонилокси, C1-10гетероарил, С6-10ариламино,
С6-10арилоксикарбонил,C1-3алкилсульфониламинокарбонил, гидроксиаминокарбонил, C1-3алкилсульфонил,
C1-6гетероциклоалкилсульфонил,
C1-6гетероциклоалкиламинокарбонил, С3-6циклоалкиламинокарбонил, С6-10ариламинокарбонил, C1-3аминосульфонил,
C1-10гетероариламинокарбонил, C1-3алкилкарбониламино,
C1-3алкилсульфониламино или С6-10арилсульфониламино,
каждый из которых является необязательно замещенным одним или несколькими одинаковыми или разными заместителями, выбранными из таких, как гидрокси, -NH2, моно- или ди-(С1-6 алкил)амино, иминометил, карбокси, трифторметил, циано, фтор, хлор, йод, оксо, меркапто, C1-4 алкил,
C1-3гидроксиалкил, C1-3алкокси, C1-4алкоксикарбонил,
С3-6циклоалкил, С3-6гетероциклоалкил,
C1-6гетероциклоалкилкарбонил, С6-10арил, C1-10гетероарил,
C1-3алкоксиС6-10арил, C1-3алкилсульфониламино, -S(O)2OH или
C1-3алкилкарбониламино,
где указанные С3-6циклоалкил, C1-4алкил, C1-2алкокси,
C1-4алкоксикарбонил, C1-6гетероциклоалкил, С6-10арил или
C1-10гетероарил являются необязательно дополнительно замещенными карбокси, галогеном, гидрокси, циано, C1-6гетероциклоалкилом, одним или несколькими C1-6алкилами, C1-3алкокси, C1-3алкоксиС1-3алкокси, C1-4алкоксикарбонилами, C1-3гидроксиалкилами или С6-10арилами.

C1-3аминокарбонилС6-10арил или C1-4алкилС6-10арил, необязательно замещенный карбокси, C1-3алкокси или C1-3алкоксикарбонилом, R4 и R5 представляют водород и R1 представляет метил.
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота (соединение 1000),
циклобутил-((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1001),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, диметиламид (соединение 1002),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, амид (соединение 1003),
(4-метилпиперазин-1-ил)[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон, гидрохлорид (соединение 1004),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, циклопропиламид (соединение 1005),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, изопропиламид (соединение 1006),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, пропиламид (соединение 1007),
морфолин-4-ил-[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон (соединение 1008),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, трет-бутиламид (соединение 1009),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, этиламид (соединение 1010),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, метокси-метил-амид, гидрохлорид (соединение 1011),
[3-(3-изопропил-[1,2,4]оксадиазол-5-ил)циклобутил]((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1012),
((R)-1-нафталин-1-илэтил){3-[3-(3-трифторметилфенил)[1,2,4]оксадиазол-5-ил]циклобутил}амин, гидрохлорид (соединение 1013),
[3-(3-метил[1,2,4]оксадиазол-5-ил)циклобутил]((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1014),
((R)-1-нафталин-1-илэтил)[3-(3-фенил[1,2,4]оксадиазол-5-ил)циклобутил]амин, гидрохлорид (соединение 1015),
((R)-1-нафталин-1-илэтил){3-[3-(4-трифторметилфенил)[1,2,4]оксадиазол-5-ил]циклобутил}амин, гидрохлорид (соединение 1016),
{3-[3-(4-метоксифенил)[1,2,4]оксадиазол-5-ил]циклобутил)-((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1017),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, 4-хлорбензиламид (соединение 1018),
{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}уксусная кислота, метиловый сложный эфир (соединение 1019),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, (2-метоксиэтил)амид (соединение 1020),
4-{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}бензойная кислота, этиловый сложный эфир (соединение 1021),
(2,6-диметилморфолин-4-ил)[3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон (соединение 1022),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, (3-морфолин-4-илпропил)амид (соединение 1023),
1-[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]пиперидин-4-карбоновая кислота, этиловый сложный эфир (соединение 1024),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, (2-гидрокси-2-фенилэтил)амид (соединение 1025),
3-{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}пропионовая кислота, этиловый сложный эфир (соединение 1026),
[3-((R)-1-нафталин-1-илэтиламино)циклобутил][4-(3-трифторметилфенил)пиперазин-1-ил]метанон (соединение 1027),
{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}фенилуксусная кислота, метиловый сложный эфир (соединение 1028),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, (2-гидроксииндан-1-ил)амид (соединение 1029),
[4-(2-метоксиэтил)пиперазин-1-ил][3-((R)-1-нафталин-1-илэтиламино)циклобутил]метанон (соединение 1030),
3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбоновая кислота, 2,3,6-трифторбензиламид (соединение 1031),
3-({[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}метил)бензойная кислота, метиловый сложный эфир (соединение 1032),
4-({[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}метил)бензойная кислота, метиловый сложный эфир (соединение 1033),
{[3-((R)-1-нафталин-1-илэтиламино)циклобутанкарбонил]амино}фенилуксусная кислота (соединение 1034),
((R)-1-нафталин-1-илэтил)(3-фенилциклобутил)амин (соединение 1035 и соединение 1036),
{3-[3-(4-фторфенил)[1,2,4]оксадиазол-5-ил]циклопентил}-((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1037),
((R)-1-нафталин-1-илэтил)-[3-(3-фенил-[1,2,4]оксадиазол-5-ил)циклопентил]амин, гидрохлорид (соединение 1038),
[3-(3-изопропил-[1,2,4]оксадиазол-5-ил)циклопентил]-((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1039),
((R)-1-нафталин-1-илэтил)-{3-[3-(4-трифторметилфенил)[1,2,4]оксадиазол-5-ил]циклопентил}амин, гидрохлорид (соединение 1040),
[3-(3-метил-[1,2,4]оксадиазол-5-ил)циклопентил]((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1041),
{3-[3-(5-метилтиазол-2-илметил)-[1,2,4]оксадиазол-5-ил]циклопентил}((R)-1-нафталин-1-илэтил)амин (соединение 1042),
((R)-1-нафталин-1-илэтил)[3-(3-пропил[1,2,4]оксадиазол-5-ил)циклопентил]амин, гидрохлорид (соединение 1043а и 1043b),
1-{5-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]-[1,2,4]оксадиазол-3-илметил}-1Н-пиридин-2-он, гидрохлорид (соединение 1044),
{3-[3-(4-метоксифенил)[1,2,4]оксадиазол-5-ил]циклопентил}((R)-1-нафталин-1-илэтил)амин, гидрохлорид (соединение 1045),
3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновая кислота, амид (соединение 1046),
4-метил-N-[3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбонил]бензолсульфонамид (соединение 1047а, соединение 1047b, соединение 1047с и соединение 1047d),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензонитрил (соединения 1048/1049/1050),
N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1051),
N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1052),
N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1053а и соединение 1053b),
{3-[4-(иминопирролидин-1-илметил)фенил]циклогексил}((R)-1-нафталин-1-илэтил)амин (соединение 1054),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамидин (соединение 1055),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединение 1056),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединение 1057),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединение 1058, 1058а),
3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, этиловый сложный эфир (соединение 1059),
N-(2-гидроксиэтил)-3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1060),
3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота (соединения 1061/1062),
((R)-1-нафталин-1-илэтил)-(3(S)-фенилциклогексил)амин (соединение 1063),
((R)-1-нафталин-1-илэтил)-(3(R)-фенилциклогексил)амин (соединение 1064),
N-((R)-1-нафталин-1-илэтил)-N'-фенилциклогексан-1,3-диамин (соединение 1065),
N-((R)-1-нафталин-1-илэтил)-N'-(3-трифторметилфенил)циклогексан-1,3-диамин (соединение 1066),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексиламино]бензонитрил (соединение 1067),
(3-морфолин-4-илциклогексил)((R)-1-нафталин-1-илэтил)амин (соединение 1068),
((R)-1-нафталин-1-илэтил)-(3-пиридин-2-илциклогексил)амин (соединения 1069/1070),
5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]тиофен-2-карбоновая кислота, этиловый сложный эфир (соединение 1071),
5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]тиофен-2-карбоновая кислота (соединение 1072),
5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фуран-2-карбоновая кислота, этиловый сложный эфир (соединение 1073),
5-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фуран-2-карбоновая кислота (соединение 1074а, соединение 1074b и соединение 1074с),
{3-[3-(4-фторфенил)[1,2,4]оксадиазол-5-ил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1075),
((R)-1-нафталин-1-илэтил){3-[3-(4-трифторметилфенил)[1,2,4]оксадиазол-5-ил]циклогексил}амин (соединение 1076),
((R)-1-нафталин-1-илэтил)[3-(3-фенил-[1,2,4]оксадиазол-5-ил)циклогексил]амин (соединение 1077),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1078),
N-бензилокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1079),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 4-йодфениловый сложный эфир (соединение 1080),
2-{4-[3-((R)-1-нафталин-1-илэтиламино) циклогексил]бензоиламино}этансульфоновая кислота (соединение 1081),
N-((R)-1-гидроксиметилпропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1082),
N-((S)-1-гидроксиметилпропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1083),
N-(2-цианоэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1084),
N-(2-морфолин-4-илэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1085),
N-(2-фторэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1086),
N-(2,2-дифторэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1087),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1088),
N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-пиридин-4-илметилбензамид (соединение 1089),
N-(2-диметиламиноэтил)-N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1090),
(2-гидроксиметилпирролидин-1-ил){4-[3-(1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1091),
N-(2-ацетиламиноэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1092),
N-этил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1093),
N-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1094),
N-(2-гидрокси-1-гидроксиметил-1-метилэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1095),
N-(2-метоксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино) циклогексил] бензамид (соединение 1096),
N-(2-меркаптоэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1097),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}уксусная кислота, этиловый сложный эфир (соединение 1098),
N,N-диметил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1099),
N-(2-гидроксиэтил)N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1100),
N-этил-N-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1101),
N,N-бис-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1102),
N-(2-диметиламиноэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1103),
N-(3-диметиламинопропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1104),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пиперидин-1-илметанон (соединение 1105),
(4-метилпиперазин-1-ил){4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1106),
[4-(2-гидроксиэтил)пиперазин-1-ил]{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1107),
морфолин-4-ил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1108),
(4-гидроксипиперидин-1-ил){4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанон (соединение 1109),
N-(3-имидазол-1-илпропил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1110),
3-((R)-1-нафталин-1-илэтиламино)циклопентанкарбоновая кислота (соединение 1111),
{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино)уксусная кислота (соединение 1115),
(S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}янтарная кислота, 4-трет-бутиловый сложный эфир, 1-метиловый сложный эфир (соединение 1116),
(S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}янтарная кислота, 4-трет-бутиловый сложный эфир (соединение 1117),
(R)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовая кислота, метиловый сложный эфир (соединение 1118),
(R)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовая кислота (соединение 1119),
(S)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовая кислота, метиловый сложный эфир (соединение 1120),
(S)-2-[4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}-3-фенилпропионовая кислота, гидрохлорид (соединение 1121),
(S)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1122),
(S)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота (соединение 1123),
(R)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1124),
(R)-3-(1H-индол-3-ил)-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота (соединение 1125),
(циклогексил-{4-[3-(1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота, этиловый сложный эфир (соединение 1126),
2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}малоновая кислота, диэтиловый сложный эфир (соединение 1127),
(S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, трет-бутиловый сложный эфир (соединение 1128),
5-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}никотиновая кислота (соединение 1129),
4-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}бензойная кислота (соединение 1130),
4-метокси-3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}бензойная кислота, метиловый сложный эфир, гидрохлорид (соединение 1131),
2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}бензойная кислота, гидрохлорид (соединение 1132),
(карбоксиметил-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота, гидрохлорид (соединение 1133),
1-({4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}метил)циклопентанкарбоновая кислота (соединение 1134),
1-({4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклопентанкарбоновая кислота, гидрохлорид (соединение 1135),
3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, гидрохлорид (соединение 1136),
(1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклогексил)уксусная кислота, гидрохлорид (соединение 1137),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклопропанкарбоновая кислота, этиловый сложный эфир (соединение 1138),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}циклопропанкарбоновая кислота (соединение 1139),
1-({4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}метил)циклопропанкарбоновая кислота (соединение 1140),
2-метил-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота (соединение 1141),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}азетидин-3-карбоновая кислота (соединение 1142),
(метил-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота (соединение 1143),
4-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}масляная кислота (соединение 1144),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пиперидин-4-карбоновая кислота, этиловый сложный эфир (соединение 1145),
1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пиперидин-4-карбоновая кислота (соединение 1146),
(циклогексил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота, этиловый сложный эфир (соединение 1147),
(циклогексил-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}амино)уксусная кислота (соединение 1148),
4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-((R)-2-оксотетрагидрофуран-3-ил)бензамид (соединение 1149),
N-цианометил-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1150),
N-(4-циано-1Н-пиразол-3-ил)-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1151),
(R)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, бензиловый сложный эфир (соединение 1152),
(S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, бензиловый сложный эфир (соединение 1153),
(S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1154),
(R)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1155),
(S)-3-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, этиловый сложный эфир, гидрохлорид (соединение 1156),
3-гидрокси-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}пропионовая кислота, гидрохлорид (соединение 1157),
(R)-4-гидрокси-2-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоиламино}масляная кислота (соединение 1158),
N-трет-бутокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид, формиат (соединение 1159),
N-трет-бутокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид, формиат (соединение 1160),
N-метокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино) циклогексил]бензамид, формиат (соединение 1161),
N-метокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид; формиат (соединение 1162),
4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]-N-(тетрагидрофуран-3-илметокси)бензамид (соединение 1163),
4-[3-(R)-1-нафталин-1-илэтиламино)циклогексил]-N-(тетрагидрофуран-3-илметокси)бензамид (соединение 1164),
N-метокси-N-метил-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид, бисформиат (соединение 1165),
N-метокси-N-метил-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1166),
N-бензилокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1167),
N-бензилокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1168),
N-гидрокси-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1169),
N-гидрокси-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1170),
N-(2-морфолин-4-ил-2-оксоэтокси)-4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1171),
N-(2-морфолин-4-ил-2-оксоэтокси)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензамид (соединение 1172),
N-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}метансульфонамид (соединение 1173),
4R-гидрокси-1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пирролидин-2S-карбоновая кислота, метиловый сложный эфир (соединение 1174),
4R-гидрокси-1-{4-[(1S,3S)-3-(R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}пирролидин-2S-карбоновая кислота (соединение 1175),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензоил}метансульфонамид, гидрохлорид (соединение 1176),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, этиловый сложный эфир (соединение 1177/1178),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, этиловый сложный эфир (соединение 1179/1180),
3-{4-[(3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, метиловый сложный эфир (соединения 1181/1182/1183/1184),
{4-[3-(R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1185),
{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1186),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1187),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1188),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1189),
3-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, гидрохлорид (соединение 1190),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1191),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1192),
{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, этиловый сложный эфир (соединения 1193/1194/1195/1196),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, этиловый сложный эфир (соединения 1197/1198/1198/1200),
{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, гидрохлорид (соединение 1201),
{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1202),
{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота (соединение 1203),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, гидрохлорид (соединение 1204),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1205),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1206),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота (соединение 1207),
3-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропионовая кислота, гидрохлорид (соединение 1208),
[3-(4-йодфенил)циклогексил]((R)-1-нафталин-1-илэтил)амин (соединение 1209),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пирролидин-2-он (соединение 1210),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}оксазолидин-2-он (соединение 1211),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}ацетамид (соединение 1212),
4-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}тетрагидропиран-4-ол (соединение 1213),
[3-(4-имидазол-1-илфенил)циклогексил]((R)-1-нафталин-1-илэтил)амин (соединение 1214),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}циклопентанол (соединение 1215),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}этанон (соединение 1216),
4-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}тетрагидропиран-4-ол, гидрохлорид (соединение 1217),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанол (соединение 1218),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}циклобутанол (соединение 1219),
2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}малоновая кислота, диэтиловый сложный эфир (соединение 1220),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}уксусная кислота, этиловый сложный эфир (соединение 1221),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}уксусная кислота (соединение 1222),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}оксетан-3-ол (соединение 1223),
{3-[4-(3-фтор-оксетан-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1224),
{3-[4-(3-амино-3-метилбут-1-инил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1225),
{3-[4-(5-циклопропил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1226),
{3-[4-(5-циклопентил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1227),
{3-[4-(5-метил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1228),
{3-[4-(5-изопропил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1229),
{3-[4-(5-трет-бутил[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединение 1230),
{3-[4-(5-циклогексил-[1,2,4]оксадиазол-3-ил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин(соединение 1231),
(3-{4-[5-(3-метилбутил)-[1,2,4]оксадиазол-3-ил]фенил}циклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1232),
5-(3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}-[1,2,4]оксадиазол-5-илметил)имидазолидин-2,4-дион (соединение 1233),
(3-{4-[5-(4-метилоксазол-5-ил)-[1,2,4]оксадиазол-3-ил]фенил}циклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1234),
(3-{4-[5-(2,5-диметилоксазол-4-ил)-[1,2,4]оксадиазол-3-ил]фенил}циклогексил)-((R)-1-нафталин-1-илэтил)амин (соединение 1235),
2-метил-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионитрил (соединение 1236/1237),
2-метил-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионовая кислота (соединение 1238),
2-метил-2-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионовая кислота (соединение 1239),
[3-(4-метансульфонилфенил)циклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1240),
2-фтор-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, метиловый сложный эфир (соединение 1241),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метанол (соединение 1242),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}метансульфонамид (соединение 1243),
{3-[4-(морфолин-4-сульфонил)фенил]циклогексил}-((R)-1-нафталин-1-илэтил)амин (соединения 1244/1245),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}ацетамид (соединения 1246/1247),
3-фтор-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, метиловый сложный эфир (соединение 1248),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метансульфонамид (соединения 1249/1250),
N-{3-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}метансульфонамид (соединение 1251),
N-(2-гидроксиэтил)-4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензолсульфонамид (соединения 1252/1253),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенил}пропионовая кислота (соединение 1254),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]фенокси}уксусная кислота (соединение 1255),
[3-(4-метансульфонилфенил)циклопентил]-((R)-1-нафталин-1-илэтил)амин (соединения 1256/1257),
N-{3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}метансульфонамид (соединения 1258/1259),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}ацетамид (соединения 1260/1261),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензил}ацетамид (соединения 1262/1263),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензил}метансульфонамид (соединения 1264/1265),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}метансульфонамид (соединения 1266/1267),
[3-(4-метансульфонилфенил)циклогептил]-((R)-1-нафталин-1-илэтил)амин (соединение 1268),
2-фтор-4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]бензойная кислота, метиловый сложный эфир (соединение 1269),
N-{3-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}метансульфонамид (соединение 1270),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}ацетамид (соединения 1271/1272),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]бензил}ацетамид (соединения 1273/1274),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]бензил}метансульфонамид (соединения 1275/1276),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенокси}уксусная кислота, этиловый сложный эфир (соединение 1277),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}пропионовая кислота, метиловый сложный эфир (соединения 1278/1279),
N-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}метансульфонамид (соединения 1280/1281),
{3-[4-(морфолин-4-сульфонил)фенил]циклогептил}-((R)-1-нафталин-1-илэтил)амин (соединение 1282),
{4-[3-((R)-1-нафталин-1-илэтиламино)циклогептил]фенил}метанол (соединение 1283),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, метиловый сложный эфир (соединение 1284),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, этиловый сложный эфир (соединение 1285),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2-морфолин-4-илэтиловый сложный эфир, дигидрохлорид (соединение 1286),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2-(2-метоксиэтокси)этиловый сложный эфир, гидрохлорид (соединение 1287),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2-[2-(2-метоксиэтокси)этокси]этиловый сложный эфир, гидрохлорид (соединение 1288),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2-[2-(2-этоксиэтокси)этокси]этиловый сложный эфир, гидрохлорид (соединение 1289),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, 2,3-дигидроксипропиловый сложный эфир, гидрохлорид (соединение 1290),
4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензойная кислота, тетрагидрофуран-2-илметиловый сложный эфир, гидрохлорид (соединение 1291),
4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенол (соединение 1292),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}масляная кислота, этиловый сложный эфир (соединение 1293),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}масляная кислота (соединение 1294),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовая кислота (соединение 1295),
3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}дигидрофуран-2-он (соединение 1296),
(S)-{3R-[4-(2-этоксиэтокси)фенил]циклопентил}-((R)-1-нафталин-1-илэтил)амин (соединение 1297),
3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовая кислота, этиловый сложный эфир (соединение 1298),
4-(4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]феноксиметил}бензонитрил (соединение 1299),
(S)-((R)-1-нафталин-1-илэтил)-{3R-[4-(пиридин-3-илметокси)фенил]циклопентил}амин (соединение 1300),
(S)-((R)-1-нафталин-1-илэтил)-{3R-[4-(2-пиразол-1-илэтокси)фенил]циклопентил}амин (соединение 1301),
(S)-(3R-{4-[2-(1Н-индол-3-ил)этокси]фенил}циклопентил)-((R)-1-нафталин-1-илэтил)амин (соединение 1302),
2-метил-2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовая кислота, гидрохлорид (соединение 1303),
4-гидрокси-2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}масляная кислота (соединение 1304),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропионовая кислота, гидрохлорид (соединение 1305),
{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}фенилуксусная кислота, гидрохлорид (соединение 1306),
2-метил-1-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропан-2-ол (соединение 1307),
3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]феноксиметил}пентан-3-ол (соединение 1308),
диметил-карбаминовая кислота 4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фениловый сложный эфир (соединение 1309),
3-этил-1-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пентан-3-ол (соединение 1310),
2-метил-4-{4-[(1S,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}бутан-2-ол (соединение 1311),
3-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}пропан-1,2-диол (соединение 1312),
(2-фторфенил)-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}уксусная кислота, гидрохлорид (соединение 1313),
2-{4-[(1R,3S)-3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенокси}этанол, формиат (соединение 1314),
(1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}пирролидин-2-ил)метанол (соединение 1315),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}пирролидин-3-ол (соединение 1316),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклогексил]бензил}пиперидин-3-карбоновая кислота, этиловый сложный эфир (соединение 1317),
[3-(4-{[метил(тетрагидрофуран-2-илметил)амино]метил}фенил)циклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1318),
4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензойная кислота, этиловый сложный эфир (соединение 1335/1336),
4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензойная кислота (соединение 1337),
4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензойная кислота (соединение 1338),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензоиламино}пропионовая кислота, метиловый сложный эфир (соединение 1339),
1-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензоил}пиперидин-4-карбоновая кислота, гидрохлорид (соединение 1340),
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]бензоиламино}пропионовая кислота, гидрохлорид (соединение 1341),
4-[3-((R)-1-нафталин-1-илэтиламино)циклопентилокси]бензойная кислота, метиловый сложный эфир (соединение 1342),
4-[3R-((R)-1-нафталин-1-илэтиламино)циклопентилокси]бензойная кислота, формиат (соединение 1343),
5-метил-3-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]-3Н-имидазол-4-карбоновая кислота (соединение 1344),
5-(4-этоксифенил-2-пропилциклогексил]-((R)-1-нафталин-1-илэтил)амин (соединение 1346)
или
3-{4-[3-((R)-1-нафталин-1-илэтиламино)циклопентил]фенил}пропан-1-ол (соединение 1348).
3-[3-(3-трифторметилфенил)-[1,2,4]оксадиазол-5-ил]циклобутанон (соединение 1112),
4-метил-N-(3-оксоциклопентанкарбонил)бензолсульфонамид (соединение 1113),
3-(3-трифторметилфенил)амино-циклогексанон (соединение 1114),
3-((R)-1-нафталин-1-илэтиламино)циклогексанкарбоновая кислота (приготовление 4),
3-(4-йодфенил)циклогексан-1-он (приготовление 5),
4-(3-оксоциклогексил)бензальдегид (приготовление 7),
3-[4-((1S)-3-оксоциклопентил)фенил]пропионовая кислота, этиловый сложный эфир (приготовление 8),
3-[4-((1S,3R)-3-ацетоксициклопентил)фенил]пропионовая кислота, этиловый сложный эфир (приготовление 9),
3-[4-((1S,3R)-3-гидроксициклопентил)фенил]пропионовая кислота, этиловый сложный эфир (приготовление 10),
3-[4-((1S,3R)-3-метансульфонилоксициклопентил)фенил]пропионовая кислота, этиловый сложный эфир (приготовление 11),
4-((1S,4S)-4-ацетоксициклопент-2-енилокси)бензойная кислота, метиловый сложный эфир (приготовление 13),
4-((1S,4S)-4-гидроксициклопент-2-енилокси)бензойная кислота, метиловый сложный эфир (приготовление 14),
4-((1S,4R)-4-хлорциклопент-2-енилокси)бензойная кислота, метиловый сложный эфир (приготовление 15),
4-[(1S,4S)-4-((R)-1-нафталин-1-илэтиламино)циклопент-2-енилокси]бензойная кислота, метиловый сложный эфир (приготовление 16),
3-((1S,4S)-4-ацетоксициклопент-2-енил)-5-метил-3Н-имидазол-4-карбоновая кислота, этиловый сложный эфир (приготовление 17),
3-((1S,4S)-4-гидроксициклопент-2-енил)-5-метил-3Н-имидазол-4-карбоновая кислота, этиловый сложный эфир (приготовление 18),
3-((1S,4R)-4-хлорциклопент-2-енил)-5-метил-3Н-имидазол-4-карбоновая кислота, этиловый сложный эфир (приготовление 19) или
5-метил-3-[(1S,4S)-4-((R)-1-нафталин-1-илэтиламино)циклопент-2-енил]-3Н-имидазол-4-карбоновая кислота, этиловый сложный эфир (приготовление 20).

Комментарии