Кислотно-аддитивные нитратные соли соединений и фармацевтическая композиция - RU2254330C2
Код документа: RU2254330C2
Описание
Настоящее изобретение относится к соединениям или фармацевтическим композициям на их основе для общего и местного использования, которые применяются для лечения патологий дыхательной системы с или без инфекционной этиопатогенной основы, в частности хронических легочных заболеваний (хронические закупоривающие легочные заболевания (ХЗЛЗ)), таких как астма, бронхит, эмфизема, тромбоэмболия, с уменьшенными побочными действиями по сравнению с лекарственными средствами, используемыми в настоящее время для лечения этих патологий.
Из предшествующего уровня техники известно, что для лечения этих патологий основными используемыми продуктами являются сальбутамол, сальметерол и т.д. Смотри, например, книгу "Textbook of Therapeutics - Drugs and Disease Management - 6th Edition 1996", стр. 685. Эти лекарственные средства эффективны, но имеют недостатки, поскольку вызывают побочные действия, в частности в отношении сердечно-сосудистого аппарата. Вышеуказанные препараты должны вводиться с предосторожностями пациентам, страдающим сердечно-сосудистыми патологиями.
Другими продуктами, используемыми при этих патологиях, или коадъювантами других лекарственных средств являются, например, амброксол и бромгексин, введение которых сопровождается также наличием побочных действий в желудочно-кишечном аппарате, таких как жжение и желудочная чувствительность.
Ощущалась необходимость в наличии доступных соединений и фармацевтических композиций на их основе, эффективных при лечении респираторных системных патологий в сочетании с уменьшенными побочными действиями в отношении сердечно-сосудистого аппарата и/или желудочно-кишечного аппарата.
Заявитель неожиданно и с удивлением обнаружил специфические соединения и композиции на их основе, решающие вышеуказанную техническую проблему.
Объектом настоящего изобретения являются нитратные соли соединений или их фармацевтические композиции, используемые для лечения респираторных системных патологий, в частности хронических легочных заболеваний (хронические закупоривающие легочные заболевания (ХЗЛЗ)), таких как астма, бронхит, эмфизема, тромбоэмболия, инфекционные легочные заболевания, причем вышеупомянутые соединения характеризуются тем, что они содержат по крайней мере одну реакционную группу, способную образовывать соли с азотной кислотой, и вышеупомянутые соединения выбирают из следующих:
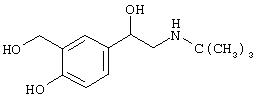
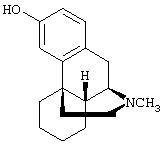
- сальбутамол, имеющий формулу (I)
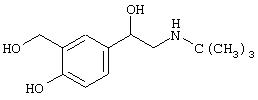
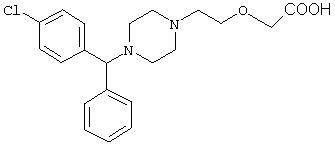
- цетиризин, имеющий формулу (II)
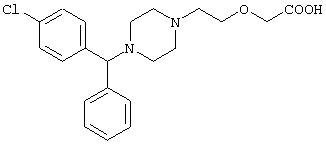
- лоратадин, имеющий формулу (III)
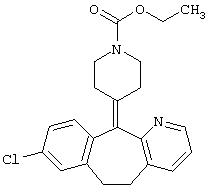
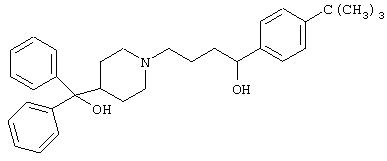
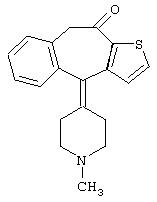
- терфенадин, имеющий формулу (IV)
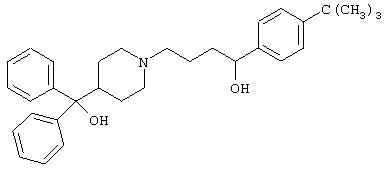
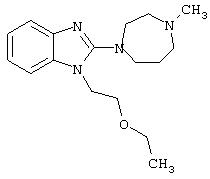
- эмедастин, имеющий формулу (V)
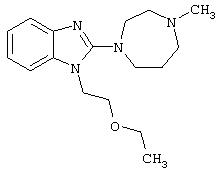
- кетотифен, имеющий формулу (VI)
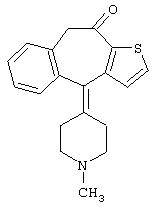
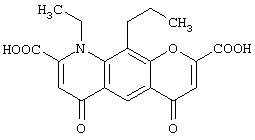
- недокромил, имеющий формулу (VII)
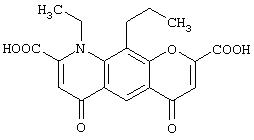
- амброксол, имеющий формулу (VIII)
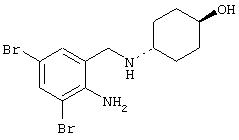
- декстрометорфан, имеющий формулу (X)
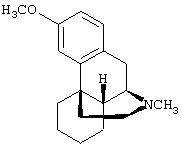
- декстрорфан, имеющий формулу (XI)
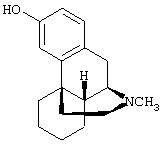
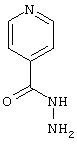
- изониазид, имеющий формулу (XIII)
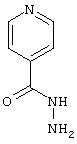
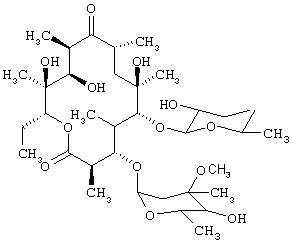
- эритромицин, имеющий формулу (XIV)
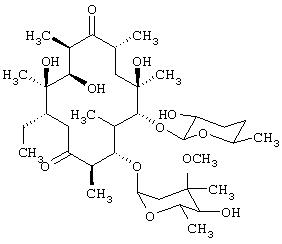
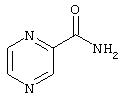
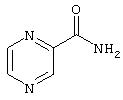
- пиразинамид, имеющий формулу (XVI)
Предпочтительными соединениями являются сальбутамол, также известный как альбутерол, цетиризин, эмедастин, амброксол.
Нитратные соли согласно настоящему изобретению могут быть получены также при использовании вышеупомянутых соединений, которые содержат одну или более групп -ONO2, ковалентно присоединенных к молекуле посредством одного из следующих бивалентных связывающих мостиков:
- YO, где Y означает C1-C20 алкилен, линейный, или разветвленный, или замещенный, или незамещенный циклоалкилен из 5-7 атомов углерода;
- Y1, выбранный из:
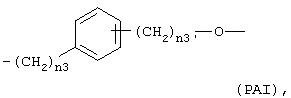
где n3 означает целое число от 0 до 3 и n3' означает целое число от 1 до 3;
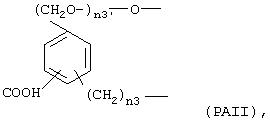
где n3 и n3' имеют вышеуказанные значения;
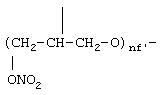
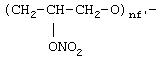
где nf' означает целое число от 1 до 6:
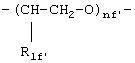
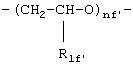
где R1f=H, СН3 и nf' является таким, как указано выше.
Эти соединения, содержащие группу -ONO2, ковалентно связанную с молекулой посредством одного из вышеуказанных бивалентных связывающих мостиков, получают, как описано в патентной заявке WO 95/30641 на имя заявителя, приведенной здесь в качестве ссылки.
В композициях согласно настоящему изобретению также могут использоваться один или более изомеров (включая оптические изомеры) вышеописанных соединений, если они имеются.
Примерами изомеров являются цис-, транс-, оптические изомеры d и L или рацемические, энантиомеры. В основном одна изомерная форма имеет более высокую активность по сравнению с другой, например, D форма по сравнению с L формой или наоборот.
Соли согласно настоящему изобретению содержат, по крайней мере, один моль нитратных ионов/ моль предшественника. Предпочтительно соотношение между молями нитратных ионов и молями предшественника равно единице; соли с более высоким молярным соотношением могут быть получены, когда в молекуле имеются другие основные аминогруппы, способные образовать ионную связь с нитратным анионом.
Из солей настоящего изобретения могут быть получены соответствующие фармацевтические композиции в соответствии с известными методиками в данной области техники с использованием обычных наполнителей; смотри, например, книгу «Remington's Pharmaceutical Sciences 15a Ed.».
Предшественники солей, соответствующие вышеупомянутым классам, могут быть получены согласно способам, описанным в Merck Index 14a Ed., приведенном здесь в качестве ссылки.
Соли настоящего изобретения получают согласно одному из следующих способов.
Если предшественник, который используется для получения соли, доступен как свободное основание или как соответствующая соль, которые растворимы в органическом растворителе, который предпочтительно не содержит гидроксильных групп в молекуле, например, в ацетонитриле, этилацетате, тетрагидрофуране и т.д., соль получают растворением этого вещества или его соли в вышеупомянутом растворителе при концентрации, предпочтительно равной или выше, чем 10% мас./об., и затем добавлением требуемого количества концентрированной азотной кислоты, предпочтительно разведенной перед добавлением в том же растворителе, использованном прежде для растворения соединения, предпочтительно охлаждая смесь во время и после вышеупомянутого добавления до температур в диапазоне 20-0°С, извлекая полученный продукт фильтрацией и необязательно промывая это твердое вещество тем же охлажденным растворителем.
Когда предшественник или его пригодные соли слегка растворимы в вышеупомянутом растворителе, к вышеуказанному растворителю добавляется гидроксилированный растворитель для улучшения растворимости. Примерами такого гидроксилированного растворителя являются метиловый спирт, этиловый спирт и вода. Осаждение может быть ускорено путем разбавления неполярным растворителем после добавления азотной кислоты.
Когда предшественник образует соль с галогенидом водорода, можно получить соль с азотной кислотой, добавляя нитрат серебра к раствору галогенида в вышеупомянутом растворителе. После отфильтровывания галогенида серебра раствор концентрируют и охлаждают для выделения нитратной соли путем осаждения.
Когда исходным продуктом является соль предшественника, где анион отличен от хлорида, предпочтительно, однако, обрабатывать водный раствор вышеупомянутой соли насыщенным раствором карбоната или бикарбоната натрия или калия или разбавленным раствором гидроксида натрия или калия, затем экстрагировать водную фазу подходящим органическим растворителем (например, галогенированными растворителями, сложными эфирами, простыми эфирами), обезвоживать и затем выпаривать органический растворитель, растворять таким образом полученный остаток в вышеупомянутых растворителях, которые не содержат гидроксильных групп, например, в ацетонитриле, или в смеси вышеупомянутого растворителя с гидроксилированным растворителем и затем следовать вышеупомянутым описанным способам получения.
Соли и композиции согласно настоящему изобретению могут быть использованы для общего введения, например, они могут вводиться пероральным способом, как отхаркивающие средства; внутримышечным, внутривенным способом и т.д.; или они могут использоваться для местного введения, например, как аэрозоли, или для местного применения. В основном соли согласно настоящему изобретению могут использоваться для тех же терапевтических применений, что и их предшественники.
Нитратные соли настоящего изобретения имеют повышенную общую безвредность по сравнению с предшественниками.
Вводимые дозы являются обычными дозами предшественников; однако, поскольку продукты настоящего изобретения показывают более высокую терапевтическую эффективность по сравнению с предшественниками, они могут также использоваться в дозах, превышающих дозы предшественников, не вызывая при этом побочных действий.
Продукты настоящего изобретения могут использоваться также как токолитические средства (спазмолитические средства), например, как спазмолитические средства для маточной мускулатуры, спазмолитические средства для кишечной мускулатуры; как антигистаминные средства (антиаллергические средства), например, для глаз; как средства против кашля, как антибактериальные средства для инфекционных респираторных заболеваний. Они могут вводиться общим или местным путем, как указано выше, или также в форме глазных композиций, таких как примочки для глаз, и т.д.
Следующие примеры приведены только с целью проиллюстрировать данное изобретение, и они не ограничивают его.
Пример 1
Получение нитратной соли амброксола.
Раствор амброксола (4 г, 20,6 ммолей) получают, растворяя его в смеси ацетонитрила (30 мл) и тетрагидрофурана (10 мл). При низкой температуре (4°С) добавляют азотную кислоту, разведенную в ацетонитриле (3,5 мл берут из раствора, полученного добавлением ацетонитрила к 2,7 мл 65% азотной кислоты и доведением ацетонитрилом до конечного объема 10 мл). Через 30 минут медленно добавляют этиловый эфир (100 мл) при той же температуре (+4°С). Сформировавшийся осадок отфильтровывают, промывают этиловым спиртом и высушивают под вакуумом. Получают белое аморфное кристаллическое вещество, которое по результатам элементного анализа соответствует нитратной соли амброксола:
Пример 2
Получение нитратной соли сальбутамола
Начиная с раствора сальбутамола (4 г, 16,7 ммолей) в ацетонитриле (30 мл) и тетрагидрофуране (10 мл) и используя 4 мл раствора азотной кислоты в ацетонитриле и такую же процедуру, как в Примере 1, получают аморфное твердое вещество, которое по результатам элементного анализа соответствует нитратной соли сальбутамола:
ФАРМАКОЛОГИЧЕСКИЕ ТЕСТЫ
Пример 3
Исследование острой токсичности солей изобретения
Продукты вводили в виде суспензии 2% карбоксиметилцеллюлозы группам из 10 мышей каждая.
Острую токсичность соли оценивали оральным введением однократных доз соединений группам из 10 крыс каждая, увеличив дозу до 100 мг/кг.
За животными вели наблюдения в течение 14 дней, отмечая летальные исходы и появление токсических симптомов.
Также и при введении дозы 100 мг/кг не было отмечено признаков токсичности.
Пример 4
Изучение воздействия сальбутамола и нитрата сальбутамола на экспериментальный бронхостеноз у морских свинок.
Животных готовили согласно способу, описанному Del Soldato и соавт., J.Pharmacol. Methods, 5, 279, 1981, для исследования кардиореспираторной активности. Каждая группа состояла из восьми животных. Животным внутривенно вводили 0,1 мл физиологического раствора капсаицина (1 мкг/кг). В течение общего количества времени 15 минут, начиная с 5 минут перед инъекцией капсаицина до 10 минут после, каждой группе вводили внутривенным вливанием сальбутамол (0,3 нмоля/мин) или соответствующую нитратную соль (0,3 нмоля/мин) или растворитель.
Изменение дыхательного объема воздуха до и после введения капсаицина измеряли аппаратом Konzett, модифицированным, как описано в вышеупомянутой ссылке Del Soldato, соединенным с полиграфической системой.
Частоту сердечных сокращений определяли электрокардиографическим оборудованием согласно стандартным способам. Результаты представлены в Таблице I. Среднее значение сердечных сокращений после введения растворителя составляло 188±7 ударов в минуту. Отклики выражали в процентах по отношению к контролю.
Как показано в Таблице I, нитратные соли сальбутамола так же эффективны в ингибировании бронхостеноза, вызванного капсаицином, как сальбутамол, но соли более толерантны (не вызывают тахикардии) по сравнению с сальбутамолом.
Пример 5.
Получение нитратной соли цетиризина.
Соль получают добавлением к раствору цетиризина (2 г, 5,14 ммолей) в смеси растворителей, полученной из ацетонитрила (10 мл) и тетрагидрофурана (5 мл), 1,23 мл раствора азотной кислоты в ацетонитриле, описанной в Примере 1. Получают аморфное твердое вещество, которое по результатам элементного анализа соответствует нитратной соли цетиризина:
Пример 6
Получение нитратной соли лоратидина
Соль получают добавлением к раствору лоратидина (1 г, 2,61 ммолей) в смеси растворителей, полученной из ацетонитрила (7 мл) и тетрагидрофурана (3 мл), 0,63 мл раствора азотной кислоты в ацетонитриле, описанной в Примере 1. Получают аморфное твердое вещество, которое по результатам элементного анализа соответствует нитратной соли лоратидина:
Пример 7
Получение нитратной соли терфенадина
Соль получают добавлением к раствору терфенадина (1,5 г, 3,18 ммолей) в смеси растворителей, полученной из ацетонитрила (15 мл) и тетрагидрофурана (5 мл), 0,76 мл раствора азотной кислоты в ацетонитриле, описанной в Примере 1. Получают аморфное твердое вещество, которое по результатам элементного анализа соответствует нитратной соли терфенадина:
Пример 8
Получение нитратной соли эмедастина
Соль получают добавлением к раствору эмедастина (2 г, 5,47 ммолей) в смеси растворителей, полученной из ацетонитрила (10 мл) и тетрагидрофурана (7 мл), 0,7 мл раствора азотной кислоты в ацетонитриле, описанной в Примере 1. Получают аморфное твердое вещество, которое по результатам элементного анализа соответствует нитратной соли эмедастина:
Пример 9
Получение нитратной соли декстрометорфана
Соль получают добавлением нитрата серебра (0,96 г, 5,68 ммолей) к раствору гидробромида декстрометорфана (2 г, 5,68 ммолей) в ацетонитриле (20 мл). Раствор перемешивают при комнатной температуре в течение 30 минут. Фильтрование приводит к удалению осадка гидробромида серебра. К прозрачному раствору добавляют этиловый эфир (110 мл). Формируется осадок, который затем фильтруют, промывают этиловым эфиром и высушивают под вакуумом. Полученное твердое вещество по данным элементного анализа соответствует нитратной соли декстрометорфана:
Пример 10
Получение нитратной соли кетотифена
Соль получают добавлением к раствору кетотифена (1 г, 3,23 ммолей) в смеси растворителей, полученной из ацетонитрила (10 мл) и тетрагадрофурана (5 мл), 0,78 мл раствора азотной кислоты в ацетонитриле, описанного в Примере 1. Полученное твердое вещество по данным элементного анализа соответствует нитратной соли кетотифена:
Пример 11
Получение нитратной соли недокромила
Соль получают добавлением к раствору недокромила (1 г, 2,69 ммолей) в смеси растворителей, полученной из ацетонитрила (7 мл) и тетрагидрофурана (5 мл), 0,64 мл раствора азотной кислоты в ацетонитриле, описанного в Примере 1. Полученное твердое вещество по данным элементного анализа соответствует нитратной соли недокромила:
Пример 12
Получение нитратной соли декстрорфана
Соль получают добавлением нитрата серебра (0,50 г, 2,96 ммолей) к раствору гидробромида декстрорфана (1 г, 2,96 ммолей) в ацетонитриле (17 мл). Затем раствор перемешивают при комнатной температуре в течение 30 минут. Фильтрование приводит к удалению осадка гидробромида серебра. К прозрачному раствору добавляют этиловый эфир (100 мл). Формируется осадок, который затем фильтруют, промывают этиловым эфиром и высушивают под вакуумом. Полученное твердое вещество по данным элементного анализа соответствует нитратной соли декстрорфана:
ФАРМАКОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Пример 13
Антигистаминная активность нитрата цетиризина и гидрохлорида цетиризина у морских свинок - изучение на экспериментальном бронхостенозе.
Животных подготавливают согласно способу Del Soldato и соавт., J.Pharmacol. Methods, 5, 279, 1981 для исследования кардиореспираторной активности. Животным вводили внутривенно 0,1 мл физиологического раствора с гистамином (2 мкг/кг). Формировали три группы, каждая группа состояла из 8 животных. Внутривенно вводили нитрат цетиризина, гидрохлорид цетиризина или только растворитель дозой 77 мкмолей/мкг.
Изменение дыхательного объема воздуха до и после введения капсаицина измеряли аппаратом Konzett, модифицированным как в вышеупомянутой ссылке Del Soldato, соединенным с полиграфической системой.
Ниже в Таблице II реакция животных для каждой обработанной группы выражена как значение в процентах по отношение к контролю.
Как показано в Таблице II, нитрат цетиризина обладает улучшенной антигистаминной активностью по сравнению с гидрохлоридом цетиризина.
Пример 14
Противокашлевая активность гидрохлорида декстрометорфана, нитрата декстрометорфана, гидрохлорида декстрорфана и нитрата декстрорфана, исследованная на морских свинках
Морских свинок (масса: 430±20) обрабатывали, как описано Вrаgа и соавт. Al. Arzneim. Forsch./ Drug Res.43, 550, 1993.
В этом фармакологическом эксперименте были сформированы 5 групп по 8 животных в каждой. Одну группу не обрабатывали, и она являлась контрольной группой.
Каждое животное помещали в цилиндрический стеклянный контейнер, имеющий одну трубку, проходящую через каждую из двух круглых плоских поверхностей. Вышеупомянутая трубка предназначалась соответственно для ввода и вывода аэрозоля. Выходящая трубка соединялась с полиграфической системой.
Аэрозоль получали из раствора 7,5 мас.% лимонной кислоты в воде.
Колебания воздуха внутри стеклянного контейнера регистрировались до и после приступа кашля, вызванного аэрозолем. Через час внутрибрюшинно вводили гидрохлорид декстрометорфана, нитрат декстрометорфана, гидрохлорид декстрорфана и нитрат декстрорфана в физиологическом растворе дозой 110 микромолей/кг. Через 30 минут после инъекции животных обрабатывали аэрозолем. Затем регистрировали число приступов кашля в течение 10 минут. Ниже в Таблице III представлены средние результаты, полученные для каждой обработанной группы, по отношению к контрольной группе, которая принята за 100%.
Как показано в Таблице, нитраты декстрометорфана и декстрорфана являются более эффективными противокашлевыми агентами, чем соответствующие гидрохлориды.
Пример 15
Муколитическая активность нитрата амброксола и гидрохлорида амброксола у мышей
Муколитическую активность у самцов мышей оценивали согласно способу Engler и Zselenyi, J.Pharm. Methods 11, 151, 1984. С помощью этого способа определяют количество фенолового красного в трахеальной секреции. Животным предварительно вводили внутрибрюшинно дозу 500 мг/кг красителя, растворенного в физиологическом растворе. 3 группы мышей (массой 18±2 г) по 10 животных в каждой обрабатывали внутрибрюшинно красителем. Одна группа являлась контрольной группой. Каждая из двух обработанных групп за 10 минут до вышеупомянутой инъекции получала посредством внутрибрюшинной инъекции 264 микромоля/кг нитрата амброксола или гидрохлорида амброксола соответственно. Через 30 минут после инъекции фенолового красного животных умерщвляли. Трахею освобождали от окружающих тканей, рассекали и промывали в течение 30 минут в 3 мл физиологического раствора. Затем добавляли 0,1 мл 1 М гидроксида натрия к физиологическому раствору. Промывки центрифугировали в течение 15 минут при 3000 об/мин. Проводили спектрофотометрический анализ на супернатанте для того, чтобы определить концентрацию фенолового красного в физиологическом растворе. Муколитическую активность определяли как % изменения оптической плотности образца по сравнению с контрольной группой, предполагаемой за 100%. В Таблице IV приведены полученные результаты.
В Таблице показано, что муколитическая активность нитрата амброксола выше, чем у соответствующего гидрохлорида.
Пример 16
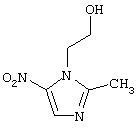
Получение нитратной соли метронидазола
Соль получают добавлением к раствору метронидазола (1 г, 5,84 ммолей) в смеси растворителей, полученной из ацетонитрила (8 мл) и тетрагидрофурана (5 мл), 1,40 мл раствора азотной кислоты в ацетонитриле, описанного в Примере 1. Полученное твердое вещество по данным элементного анализа соответствует нитратной соли метронидазола:
Пример 17
Получение нитратной соли изониазида
Соль получают добавлением к раствору изониазида (2 г, 14,58 ммолей) в смеси растворителей, полученной из ацетонитрила (20 мл) и тетрагидрофурана (10 мл), 3,50 мл раствора азотной кислоты в ацетонитриле, описанного в Примере 1. Полученное твердое вещество по данным элементного анализа соответствует нитратной соли изониазида:
Пример 18
Получение нитратной соли эритромицина
Соль получают добавлением к раствору эритромицина (2 г, 2,72 ммолей) в смеси растворителей, полученной из ацетонитрила (23 мл) и тетрагидрофурана (17 мл), 0, 65 мл раствора азотной кислоты в ацетонитриле, описанного в Примере 1. По. лученное твердое вещество по данным элементного анализа соответствует нитратной соли эритромицина:
Пример 19
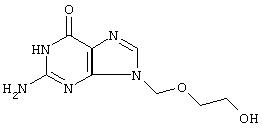
Получение нитратной соли ацикловира
Соль получают добавлением к раствору ацикловира (1 г, 4,44 ммолей) в смеси растворителей, полученной из ацетонитрила (10 мл) и тетрагидрофурана (10 мл), 1,06 мл раствора азотной кислоты в ацетонитриле, описанного в Примере 1. Полученное твердое вещество по данным элементного анализа соответствует нитратной соли ацикловира:
Пример 20
Получение нитратной соли пиразинамида
Соль получают добавлением к раствору пиразинамида (1 г, 8,12 ммолей) в смеси растворителей, полученной из ацетонитрила (10 мл) и тетрагидрофурана (10 мл), 1, 95 мл раствора азотной кислоты в ацетонитриле, описанного в Примере 1. Полученное твердое вещество по данным элементного анализа соответствует нитратной соли пиразинамида:
Пример 21
Синтез нитрата 2-(2-метил-5-нитроимидазол-1ил) этил эфира 4-(нитроокси)бутановой кислоты.
A) синтез2-(2-метил-5-нитроимидазол-1ил)этил эфира 4-бромбутановой кислоты.
К раствору метронидазола (7,5 г, 43,82 ммолей) в СНСl3 (75 мл) и ДМФ (93 мл) добавляют 4-броммасляную кислоту (6,1 г, 36,51 ммолей), DDC (8,3 г, 40,16 ммолей). DMAP (0,4 г, 3,65 молей). После перемешивания смеси в течение 24 часов при комнатной температуре органическую фазу промывают водой, высушивают сульфатом натрия и выпаривают при пониженном давлении.
Остаток очищают хроматографией на силикагеле, элюируя метиленхлоридом/ ацетоном (об/об 9/1), получая 2-(2-метил-5-нитроимидазол-1ил) этил эфир 4-бромбутановой кислоты.
(6,5 г, 20,3 ммолей). Выход 55%.
B) Синтез 2-(2-метил-5-нитроимидазол-1ил)этил эфира 4-(нитроокси)бутановой кислоты.
К раствору 2-(2-метил-5-нитроимидазол-1 ил) этил эфира 4-бромбутановой кислоты (6,4 г, 20,05 ммолей) в безводном ацетонитриле (170 мл) добавляют нитрат серебра (5,11 г. 30,07 ммолей). Смесь нагревают при 40°С в течение 48 часов в темноте.
Смесь фильтруют, и фильтрат промывают водой, высушивают сульфатом натрия и выпаривают в вакууме. Остаток очищают хроматографией на силикагеле, эюируя метиленхлоридом/ ацетоном (об/об 9/1), получая 2-(2-метил-5-нитроимидазол-1ил) этил эфир 4-(нитроокси)бутановой кислоты (3,68 г, 12,17 молей) в виде масла.
Выход 60%.
1Н ЯМР (ДМсО) м.д.: 8,08 (1Н, с); 4,55 (2Н, т); 4,43 (2Н, т); 2,51 (3Н, с); 2,40 (2Н, т); 1,91 (2Н, тт).
C) Синтез нитрата 2-(2-метил-5-нитроимидазол-1ил) этил эфира 4-(нитроокси)бутановой кислоты.
К раствору 2-(2-метил-5-нитроимидазол-1ил) этил эфира 4-(нитроокси)бутановой кислоты (3,68 г, 12,17 ммолей) в CH2Cl2 (80 мл) добавляют HNО3 (13 ммолей). После перемешивания в течение 1 часа при комнатной температуре растворитель выпаривают при пониженной температуре и остаток растворяют в ТГФ (75 мл), затем добавляют нитрат серебра (2 г, 12,17 ммолей). Смесь перемешивают в течение 1 ч при комнатной температуре, суспензию фильтруют и осадок промывают ТГФ, высушивают, получая нитрат 2-(2-метил-5-нитроимидазол-1ил) этил эфира 4-(нитроокси)бутановой кислоты (4 г) в виде твердого вещества. Выход 90%.

Реферат
Изобретение относится к новым кислотно-аддитивным нитратным солям соединений, выбранных из сальбутамола, цетиризина, лоратадина терфенадина, эмедастина, кетотифена, недокромила, амброксола, декстрометорфана, декстрорфана, изониазида, эритромицина, пиразинамида, сальбутамола, цетиризина, лоратадина. Указанные соли могут быть использованы для лечения патологий респираторной системы и обладают при этом противоаллергическим, противоастматическим действием, а также могут быть использованы для глазных применений. При этом указанные соли имеют меньшее побочное действие на сердечно-сосудистую и/или желудочно-кишечную системы, чем их несолевые аналоги. Предложены также фармацевтические композиции для получения лекарственных средств для лечения патологий респираторной системы, содержащие вышеуказанные соли или нитратные соли метронидазола или ацикловира. 2 н. и 4 з.п. ф-лы, 5 табл.
Формула

Комментарии