R (+)-n-пропаргил-1-аминоиндан и его фармацевтически пригодные кислотно-аддитивные соли и фармацевтическая композиция, обладающая ингибирующей b-форму фермента моноаминооксидазы активностью - RU2001614C1
Код документа: RU2001614C1
Чертежи





Описание
§
Изобретение относится к области избирательных необратимых ингибиторов фер мента моноэминооксидазы (далее будет называться МАО) и R{+) энантиомера N- пропаргил-1-аминоиндэна (далее будет называться PAI), который является иэгира- тельным необратимым ингибитором В-фор- мы моноаминооксидазного фермента (далее будет называться МЛО-В) Изобретение относится также к фармацевтическим композициям, содержащим R(-)PAI который может найти применение для печения болезни Паркинсона, расстройства памяти и слабоумия типа болезни Алцгеймера (DAT), депрессии и гиперфункционального синдрома у детей.
Болезнь Паркинсона, как шипоко изест- но, является результатом деградации предсинаптических допэминэргических нейронов в головном мозге с последующим снижением количества нейропереносящего допамина. который выделяется Таким образом , неправильное выделение допамина приводит к симптоматическим нарушениям регуляции произвольно сокращающихся мышц или болезни Паркинсона.
Ранее уже существовали различные процедуры для лечения болезни Паркинсона . в настоящее время широко используется , например, ввод l-Допа г-месте с декарбоксилазным ингибитором таким как L-карбидопа или бензеразид Декарбок- силазный ингибитор защищает молекулу L-Допа от периферичес чого декапбокси- лирования и таким образом гчрантируот поглощение L-Допа оставшимися допами- нзргическими нейронами в полосатом теле головного мозга. В данном случае L-Допа превращается в допамин. давая в результате повышенные концентрации допамина в этих нейронах. В ответ нэ физиологические импульсы нейроны способны, такиг.-. , выделять более высокие каличества допя- мина. концентрация которых приближается к нормальным требуемые концентрациям Таким образом, такое лечение устраняет симптомы заболеваний и приводит к хорошему состоянию больного
Однако лечение препаратом L Допз имеет свои недостатки, одним из которых является то, что эффективность оптимальна лишь е течение первых нескольких лет после начала лечения. После начального периода реакция на препарат снижается и имеют место обратные побочные эффекты, включая дискинезию, переменчиьос1ь эффективности в течение дня (повышенный- пониженный эффект), и психиатрические симптомы, такие как состояния дизор гч тд- ции во времени, паранойя и галлюцинации.
Этот ослабляющий эффект при лечении L- Допя обусловлен рядом факторов, включая естественное прогрессирование заболевания , альтернацию допаминовых рецепторов вследствие повышенного продуцирования допэмина или пониженных концентраций метаболитов допамина и фармакокинетиче- ские проблемы поглощения L-Допа.
Для того чтобы устранить недостатки лечения препаратом L-Допа. были предложены различные способы лечения, в которых L-Допа комбинируется с ингибиторами МАО с целью снижения метаболического распада свежеобразованного допамина. МАО существует в двух известных формах МАО-А и МАО-В. которые обладают избирательностью для различных субстратов и ингибиторов. Так, например, МАО-В более эффективно метаболизирует субстраты такие как 2-фенилэтиламин. и он избирательно и необратимо ингибируется С-)-де4 енилом
Однако следует подчеркнуть, что комбинация L-Допэ с ингибитором как МАО-А, так и МАО-В нежелательно приводит к обратным побочным действиям, связанным с по- ВЫШРННОЙ концентрацией катехоламинов по всей центральной нервной системе. Кро- |ис того, полное ингибировэние МАО также HI-желательно, поскольку оно усиливает депствие симпатомиметических аминов, таких как тирамин. приводящих к так называемому сырному эффекту
Поскольку МАО-В, как было показано, является преобладающей формой МАО в головном мозге, то избирательные ингибиторы этой формы могут рассматриваться как возможный путь снижения разложения допамина с. одной стороны, вместе со снижением до минимума системных эффектов общего ингибировэния МАО, с другой стороны .
Один из этих избирательных МАО-В ингибиторов (-)-депренил, был тщательно изучен и использован как МАО-В ингибитор для усиленно обработки препаратом L-Допа. Э ги обработка (-)-депренилом обычном благоприятна она не вызывает сырного эффекта при дозах, приводящих почти к полному ингибированию МАО-В, Кроме того введение (-)-депренипэ в комбинации со смешанным ингибитором L-Допа и декар- боксил-ззы в организм пациентов с болезнью Поркинсона приводит к повышению акинезии и к общей функциональной емкости , а также к устранению изменений типа повышения-снижения .
Гасим образом (-)-депренил повышает и удлиняет эффект L-Допа и позволяет снизить дозу L-Допа, в результате чего ограни- чиваюся обратные эффекты лечения L-Допэ.
Однако (-)-депренил сам имеет нежелательные побочные действия, которые включают активацию уже имеющейся язвы желудка и возможные гипертонические явления . Кроме того, (-)-депренил является амфетаминовым производным и метаболи- зируется. давая в результате амфетамин и метамфетамины, которые могут привести к нежелательным побочным действиям, вы- зыванным этими веществами, например к повышенной частоте сердцебиения.
Известны и другие соединения, которые являются избирательными необратимыми ингибиторами МАО-В, но которые не имеют нежелательных действий, связанных с (-)-депренилом. Одно такое соединение, а именно г -пропаргил-1-аминоидан. HCI (рацемический PAI.HCI)(патенты Великобритании N 1003686) и № 1037014 и патент США № 3513244). Это сильнодействующий избирательный необратимый ингибитор МАО-В, не метаболизируется до амфетаминов и не дает нежелательных симпатомиметических эффектов.
В сопоставительных испытаниях на животных рацемический PAI показал значительное преимущество по сравнению с (-)-депренилом, так, например, рацемический PAI не приводит к значительной тахикардии , не повышает кровяное давление (эффекты, создаваемые дозами 5 мг/кг (-)- депренила) и не приводит к сокращению моргательной мембраны и к увеличению частоты сердцебиения при дозах вплоть до 5 мг/кг (эффекты, вызванные (г)-депренилом при дозах более 0,5 мг/кг). Кроме того, рацемический PAI.HCI не вызывает усиления действия тирамина на сердечно-сосудистую систему.
Целью изобретения является разделение рацемических PAI соединений и получение энантиомера с ингибирующей активностью МАО-В.
Поскольку депренил имеет такую же структуру, так и PAI, и поскольку, как известно , (-)-энантиомер депренила, то есть (- депренил значительно более фармацевтически активен, чем (+)-этантиомер. то лишь (-) этан- тиомер PAI будет являться активным МАО-В ингибитором.
Однако в противоположность этим эффектам при разделении энантиомеров было найдено, что согласно изобретению (+}-PAI энантиомер является фактически активным МАО-В ингибитором, в то время как (-) энантиомер обладает чрезвычайно низкой МАО- В ингибирующей активностью. Кроме того, (+)PAI энантиомер обладает значительно более высокой степенью избирательности для МАО-В ингибирования, чем соответствующая рацемическая форма, и может таким образом иметь менее нежелательные по- 5 бочные действия при лечении указанных заболеваний . Эти выводы основаны на экспериментах, проводимых в условиях ин виво и ин витро.
Было показано, что (+)-PAI имеет право0 вращающую R абсолютную конфигурацию. Это было впервые обнаружено на основании структурной аналогии с депренилом и амфетаминами.
Отмечена также высокая степень сте5 реоизбирательности фармакологического действия между R (+)-PAI и S (-)энантиоме- ром. Соединение R (+}-PAI примерно на четыре порядка величины более активно, чем S (-)энантиомер в соотношении МАО-В инги0 бирования. Это отношение значительно больше, чем то. которое наблюдается между двумя депрениловыми энантиомерами. Кроме того, при осуществлении некоторых физиологических испытаний (+) депренил
5 показал такую же или даже еще более высокую активность, чем (-)энантиомер.
М-Метил-Ы-пропаргил-1-аминоиндал (MPAI) является более сильным ингибитором действия МАО, но с более низкой изби0 рательностью к МАО-В, чем к А. В этом случае обнаружено лишь небольшое различие относительных активностей двух разделяемых энантиомеров, что еще более подчеркивает замечательный эффект для
5 случая R (+)-PAI (см.табл.1 А).
Соединение R (+)-PAI. отвечающее данному изобретению, обладает способностью восстанавливать память, благодаря чему оно может использоваться для лечения за0 болеваний, связанных с потерей памяти, слабоумием и особенно полезны для лечения болезни Алцгеймера, для лечения депрессии и гиперактивного синдрома у детей.
5Изобретение охватывает новое соединение R (+)-энантиомер М-пропаргил-1-ами- ноиндана R (+)PAIJ формулы I
50
N-CH2-C CH н
и его кислотно аддитивные соли, пригодные для фармацевтического использования. Изобретение охватывает также приготовление препарата R (+JPAI, фармацевтических композиций, содержащих соединение R (+)PAI вместе с подходящими носителями, и использование R (+)PAI для лечения людей с болезнью Паркинсона, с потерей памяти,
слабоумием типа болезни Алцгеймера и гиперактивным синдромом. R (-t)PAI может быть получен путем оптического разделения рацемических смесей R и S-энантио- мера PAI. Такое разделение может осуществляться общепринятым способом разделения. Это разделение может осуществляться , например, путем препаративной хроматографии в хиральной колонке Другим примером возможного способа разделения является получение диастерео- изомерных солей с хиральной кислотой, такой как винная кислота, яблочная кислота, миндальная кислота или М-эцетиловые производные аминокислот, такие как N-аце- тиллейцин, с последующей перекристаллизацией для выделения диастереопзомерной соли желаемого R энантиомера.
Рацемическая смесь R и S энлнтиоме- ров PAI может быть получена как например, описано в патентах Великобритании № 1003676 и N 1037014. Рацемическая смесь PAI может быть получена также в результат э химического взаимодействия 1-хлориндана или 1-броминдана с пропаргиламином. Как другой возможный вариант, рацемат может быть получен путем химического взаимодействия nponapiиламина с Ч-индунонсм с образованием соответствующего имина; с последующим восстановленирм /глеродо- азотной двойной связи имина соответствующим агентом, таким как боргидоид натрия.
Согласно изобретению, R энантномер PAI может быть получен также ; епосредст- венно из оптически активного R-энантиоме- ра 1-аминоиндана путем реакции с пропаргилбромидом или пропаргилхлори- дом в присутствии органического или неорганического основания и при желании в присутствии подходящего растворителя,
Подходящими органическими или неорганическими основаниями для использования в указанной реакции являются, например, тризтиламин. пиридин, карбонаты или бикарбонаты щелочною металла и т.д. Если реакция протекает в присутствии растворителя, то этим растпоритетем может быть, например, толуол, метиленхло- рид и ацетонитрил. Предпочтительным способом получения указанного соединения является реакция между R-1-ами- ноинданом и пропаргилхлоридом с использованием с использованием бикарбоната калия как оснований иацегонитрила как растворителя.
Указанная реакция 1-аминоиндинз обычно приводит к образованию смеси непрореагировавшего первичного амина, желаемого вторичного амина и третичного
амина N N-биспропэргилэмина. Желаемый вторичный амин то есть М-пропаргил-1- аминоиндон, может быть выделен изданной смеси общепринятым способом разделения . таким как хроматография, отгонка, избирательная экстракция и т.д.
Исходный материал R-1-аминоиндан может быть получен известными способами (Европейский патент N 235590).
0R-1-Аминоиндан может быть также получен путем разделения рацемической смеси R и S энантиомеров, например путем образования диастереоизомерных солей с хиральными кислотами, или другими изве5 стными способами.
Как другой возможный вариант, исходный материал R-1-аминоиндан может быть получен путем реакции 1-инданона с оптически активным амином с последующим
0 восстановлением углеродо-азотной двойной связи полученного имина путем гидрогенизации над подходящим катализатором. таким как палладий на угле, окиси платины, никель Рэкел и т.д. Подходящими оптически
5 активными аминами являются, например, один иг, антиподов фенетиламина или сложного эфира аминокислоты, такой как валин или фенилаланин. Далее бензиловая N-C связь может быть расщеплена путем гидро0 тонизации в условиях неинтенсивного перемешивания .
Другим способом получения R-1-амино- индана яявляется гидрогенизация оксимо- вых простых эфиров индан-1-она, где
5 алкильная группа эфира имеет оптически чистый хиральный центр. Согласно другому возможному варианту, нехиральное производное индан-1-она, содержащее углеро- до-азотную двойную связь, например
0 амин или оксим, может быть восстановлено восстановителем хирального соединения , таким как комплексное соединение гидрид лития-алюминия и эфедрин. Для получения фармацевтически пригодных
5 кгслотно-аддитивных солей соединения R (+)РА1 свободное основание может химически взаимодействовать с желаемыми кислотами в присутствии подходящего растворителя подходяща ми способами. Аналогичным обра0 зом кислотно-аддитивная соль может быть превращена в форму свободного основания известным образом.
Согласно изобретению, соединение R (+)РА1 может быть приготовлено в форме
5 композиции. Такие композиции могут включать соединения R (+)PAI или его кислотно аддитивные фармацевтически пригодные соли вместе с фармацевтически пригодными носителями и/или эксцепиентами. Например , эти композиции могут быть
приготовлены в виде Форм для приема орально, парэнтерально, через прямую кишку или трансдермально. Подходящими формами препарата для орального ввода являются таблетки, спрессованные или с нанесенными покрытиями пилюли, драже, лепешки , твердые или мягкие желатиновые капсулы, предъяэычные таблетки, сиропы и суспензии; для парэнтерального ввода согласно данному изобретению предусматриваются ампулы или флаконы, содержащие водный или не водный раствор или эмульсию; для ввода через прямую кишку предусматриваются свечи с гидрофильными или гидрофобными носителями; и для локального нанесения в виде мазей и для трансдер- мального ввода предусматриваются специальные средства ввода, известные в данной области
Указанные композиции могут использоваться как таковые для лечения болезни Паркинсона. заболевания Алцгеймера или депрессии, или же в случае болезни Паркинсона они могут использоваться в сочетании с обычными процедурами лечения препаратом L-Допа.
Предпочтительные дозы активного ингредиента , то есть соединений R-PAI в указанных композициях находятся в следующих пределах: для орального ввода или ввода в виде свечей. 2-20 мг на единичную дозу, вводимую ежедневно, и более предпочтительно 5-10 мг на единичную дозу , вводимую ежедневно, для инъекционно вводимых препаратов 1-10 мг/мл на единичную дозу, вводимую ежедневно, и более предпочтительно 2-5 мг/мл на единичную дозу, вводимую ежедневно
На фиг. 1-3 показано графическое воспроизведение результатов согласно примеру 19; на фиг. 4-11 - то же, по примеру 20; на фиг. 12-15 - то же, согласно примеру 21; на фиг. 16 - то же согласно примеру 22.
Пример 1. Рацемический хлоргидрат N-пропаргил-1-аминоиндан а
Рацемический 1-аминоиндан (10,0 г) и 10,4 г карбоната калия вводят в 75 мл ацето- нитрила. Полученная суспензия нагревается до 60°С и вводятся по каплям 4,5 г пропаргилхлорида.
Смесь перемешивается при 60°С в течение 16 ч. после наибольшая часть летучих веществ удаляется путем отгонки в вакууме. Остаток от отгонки распределяется между 10%-ным вводным раствором гидрата окиси натрия и метиленхлоридом. Органическая фаза высушивается, растворитель удаляется путем отгонки Остаточный продукт подвергается испарительной хроматографии на силикагеле с использованием для элюирования смеси 40% этилацетат и 60% гексана. Фракции, содержащие желаемое соединение в виде свободного основания, соединяются и элюант вытесняется простым 5 эфиром. Эфирный раствор обрабатывается газообразной HCI, образующийся осадок извлекается путем Фильтрации с отсосом и перекристзллизовывается из изо- пропанола с образованием 7.3 г желаемого
0 конечного соединения с т-рой плавления 182-184°С
Данные хроматографического и спектроскопического анализа соответствуют опубликованным в литературе данным
5 (США № 3513244) и аутентиому образцу.
ЯМР((3, ): 2,45 (2Н, м), 2,60 (1Н, т), 2.90(1Н,м), 3,45(1 Н,м),3,70(2Н,д), 4,95(Ж. т), 7,5 (4Н, м) ч/млн.
Пример 2. Хлоргидрат 5-(-)-М-Пропэр0 гил-эминоиидана.
Указанное желаемое соединение в форме свободного основания извлекается путем разделения рацемической смеси свободного основания из примера 1 на Хи5 рацеле OJ (целлюлозо-трис пара-метилбен- зоат) в колонке препаративной жидкостной хроматографии высокого разрешения при элюировании смесью 10% изопропанола/ /90% гексана и с извлечением первого элю0 ированного основного пика. Полученное масло превращается в конечное желаемое соединение (хлоргидрат) путем обработки 10%-ного диэтилэфирного раствора данного масла газообразным HCI. полученный
5 осадок извлекается путем фильтрации с отсосом
-29,2 (1%, этианол). Т-ра плавления 182-184°С Другие данные хроматографического и спектроскопического анализа
0 идентичны данным для хлоргидратной соли соединения из примера 1.
Пример 3. Хлоргидрат Я-(+)-М-Про- паргил-1-аминоиндана.
Конечное желаемое соединение получа5 ют таким же образом, как описано в примере 2, с той разницей, что извлекается второй элюированный пик из колонки препаративной жидкостной хроматографии высокого разрешения
0 «Ь +29,1° (0,8%, этанол), т-ра плавления 179-181°С. Другие данные хроматографического и спектроскопического анализа идентичны этим данным для хлоргидратной соли соединения из примера 1.
5П р и м е р 4. Хлоргидрат R-{+)-N-nponapгил-1-аминоиндана .
R-(-)- 1-аминоиндан (12,4 г) и 12.9 г карбоната калия вводят в 95 мл ацетонитрила. Полученная суспензия нагревается до 60°С
и вводится по каплям 5,6 г пропэргилхлори- да. Смесь перемешивается при 60°С в течение 16 ч. после чего наибольшая часть летучих удаляется путем отгонки в вакууме. Остаточный продукт отгонки распределяется между 10%-ным водным раствором гидрата окиси натрия и метиленхлоридом.
Органическая фаза высушивается и растворитель удаляется в вакууме, полученный в остатке продукт подвергается испарительной хроматографии на силикагеле при элю- ировании смесью 40% этилацетага (60%) гексана. Фракции, содержащие свободное основание конечного желаемого соединения , соединяются, растворитель сытесняет- ся простым эфиром. Эфирный раствор обрабатывается газообразным HCI и полученный осадок извлекается путем фильтрации с отсосом и пеоекристзллизо- вывается из изопропанола. в результате получается 6,8 г конечного желаемого соединения , т-ра плавления 183-135°С. « о +30,90 (2%. этанол). Данные спектрального анализа идентичны данным для соединения из примера 1.
Пример 5. Хлоргидрат S-(-)-N-nponap- гил-1 -аминоиндэна
Данное желаемое соединение получают способом, описанным в примере 4, с той разницей, что в качестве исходного материала используется 5-()-1-амичг 11ндэн Данный продукт имеет значение -30,3 (2%. этанол), т-ра плавления составляет 183- 185°С. Данные спектрального анализа идентичны этим данным для соединения из примера 1.
Пример 6. Ди(Я-{-|)-Ы-пропаргил-1- аминоиндан) L-тартарат.
В раствор L-тартаровой кислоты (4 А г) в 48 мл кипящего метанола вводят раствор Р-(+)-Ы-пропаргил-1-аминоинданового свободного основания (5.0 г) в метаноле (48 мл). Раствор нагревается с обратим оподиль- ником и в него вводится 284 мл трет-бутил- метилового простого эфира в 20 мин. Смесь нагревается дополнит ьно в течение 30 мин, охлаждается, слученный осажденный продукт извпекаето.ч путем фильтрации с отсосом, в результате полу1«а- ется 6,7 г конечного желаемого соединения
Т-ра плавления 175-177°С.
(1,5, НаО) +34,3; Данные элементарного анализа Рассчитано для C28H320eN2, %: С 68,26 Н 6.56, N 5 Г9 Найдено , %: С 68,76: Н 6,57: N 5,61
Пример 7 Хлоргидрат . метпл- М-пропаргил-1-аминоичдэна
Р-(+)-Ы-пропаргил-1 -аминоиндан о форме свободного основания из примера 4 (1.2 г), карбонат калия {0,97 г) и метилиодид (1 0 вводят в 15 мл ацетона, полученная суспензия нагревается с обратным холодильником в атмосфере азота в течение 8 ч, После этого летучие вещества удаляются
при пониженном давлении, остаточный продукт распределяется между 10%-ным водным раствором гидрата окиси натрия (30 мл) и метиленхлоридом (30 мл). Органическая фаза высушивается и растворитель удаляется а вакууме. Остаток этого удаления подвергается испарительному хроматогра- Фическсму разделению на силикагеле с элю- ированием смесью 40% этилацетата /60% гексана. Фракции, содержащие конечное
желаемое соединение в форме свободного основания, соединяются и растворитель вытесняется простым диэтиловым эфиром. Эфирный раствор обрабатывается газооб- разчым HCI, летучие вещества удаляются в
ьэкууме и остаточный продукт перекристал- лизовывается из изопропанола, в результате получается 400 мг конечного желаемого соединения в виде белого кристаллического твердого вещества с т-рой плавления 134136°С а о +31,40 (этанол), ЯСР (д CDCb): 2.55(2Н.м.).2.7(1Н,ц|.с):2.8(ЗН.с):3.0(1Н, м), 3 4 (1 Н, м); 3,9 (2Н, ш.с.); 5,05 (1Н. м); 7,7 f44, м ч/млн.
П р и м е р 8. Хлоргидрат 3-(-)-М-метилГ пропаргил-1-аминоинданз.
Указанное желаемое соединение получается так же. как и в примере 7, с той разницей, то в качестве исходного материала используется 5-(-)-Ы-пропаргил-1-аминоиндан (в форме свободного основания) из примера 5 Все данные физического и спектрального анализа данного конечного соединения идентичны данным соединения из примера 7, за исключением того, что
- 3-1,9° (этанол).
Пример 9. Таблеточная композиция,
NT
Хлоргидрзт R (+)-N-nponap- гил-1-аминоиндана5,0
Предварительно желатинизироьаиный крахмал47,0
Водная лактоза66,0
Микрокристаллическая целлюлоза20,0
Гликолягнатриевого
крахмала3,0
Т г Льк1,5
Стезрат магния0,7
Очищенная вода, вводимая согласно
требованию для гранулирования.
Пример 10. Таблеточная композиция, мг:
Хлоргидрат R(+)-N-nponapгил-1 аминоиндана1,0
Водная лактоза50,0
Предварительно желатинированный крахмал36.0 Микрокристаллическая целлюлоза14,0 Гликолят натрийкрахмала 2,2 Тальк1,0 Стеарат магния 0,5 Очищенная вода, вводимая согласно ребованию для гранулирования.
Пример 11, Капсульнэя композиция, г:
Хлоргидрат R(+)-N-nponap- гил-1-аминоиндана5.0
Предварительно желатинированный крахмал10,0 Крахмал 44,0 Микрокристаллическая целлюлоза 25.0 Этилцеллюлоза 1.0 Тальк 1.5 Очищенная вода, вводимая согласно ребованию для гранулирования.
Пример 12 Инъекционная композиия , мг:
Хлоргидрат R(+)-N-nponap- гил-1-аминоиндана5.0
Безводная декстроза41,0
HCI, вводимый до величины рН 5 Очищенная вода, вводимая согласно ребованию для 1 мл
Пример 13 Инъекционная композиия , мг:
Хлоргидрат R(+)-N-nponap- гил-1-аминоиндана1,0
Хлорид натрия6,9
HCI, вводимый до величины рН 5 Очищенная вода, вводимая согласно ребованию для 1 мл.
Пример 14. Инъекционная композиия , мг:
Хлоргидрат Р(+)-М-пропаргил- 1-аминоиндана2.0
Хлорид натрия8.9
HCI, вводимый до величины рН 5 Очищенная вода, вводимая согласо треованию для 1 мл.
Пример 15. Сиропная композиция, г:
Хлоргидрат R(+)-N-nponap- гил-1-аминоиндана5,0
Сахароза2250.0
Натрийсахарин.5,0
Метилпарабен6,0
Пропилпарабен1.0
Вкусовое вещество20.0
Глицерин USP500
Спирт 95%-ный, USP200
Очищенная вода согласно требованию о 5 мл.
П р и м ер 16. Подъязычные таблетки.
0
5
Хлоргидрат R(+)-N-nponsp- гил- 1-аминоиндана Микрокристаллическая целлюлоза Водная лактоза Предварительно желатинированный крахмал Повидон Окрашивающее вещество
2.5
20,0 5:0
3.0 0,3
Незначительное количество То же
Вкусовое вещество Подслащивающий ягент Тальк0,3
Смешивают эксципиенты и активный ингредиент и осуществляют гранулирова- 0 ние вместе с этанольным раствором Пови- дона. После сушки и взвешивания осуществляется перемешивание с тальком и прессование.
Пример 17. Подъязычные таблетки 5 PAI. мг:
Хлоргидрат R(+)-N-nponap- гил-1-аминоиндана5,0
Микрокристаллическая целлюлоза15.0
0Предварительно желатинированный крахмал12.0
Этилцеллюлоза0,3
Тальк0,3
Очищенная вода, вводимая согласно 5 требованию для гранулирования.
Пример 18. Таблеточная композиция, мг:
Хлоргидрат R(+)-N-nponap- гил-1-аминоиндана5,0
0 Леводопа (-)-3-3,4-диоксифенилаланин100 ,0
Карбидопэ25,0
Предварительно желатинированный крахмал24,0 5 Крахмал 40.0 Микрокристаллическая целлюлоза 49.5 Краситель D и С желтый № 10 0.5 Краситель D и С желтый № 6 0,02 0 Спирт USP, вводимый по согласно требованию для гранулирования.
Приведенные ниже примеры, таблицы и рисунки относятся к биологическим экспериментам осуществляемым согласно изо- 5 бретению.
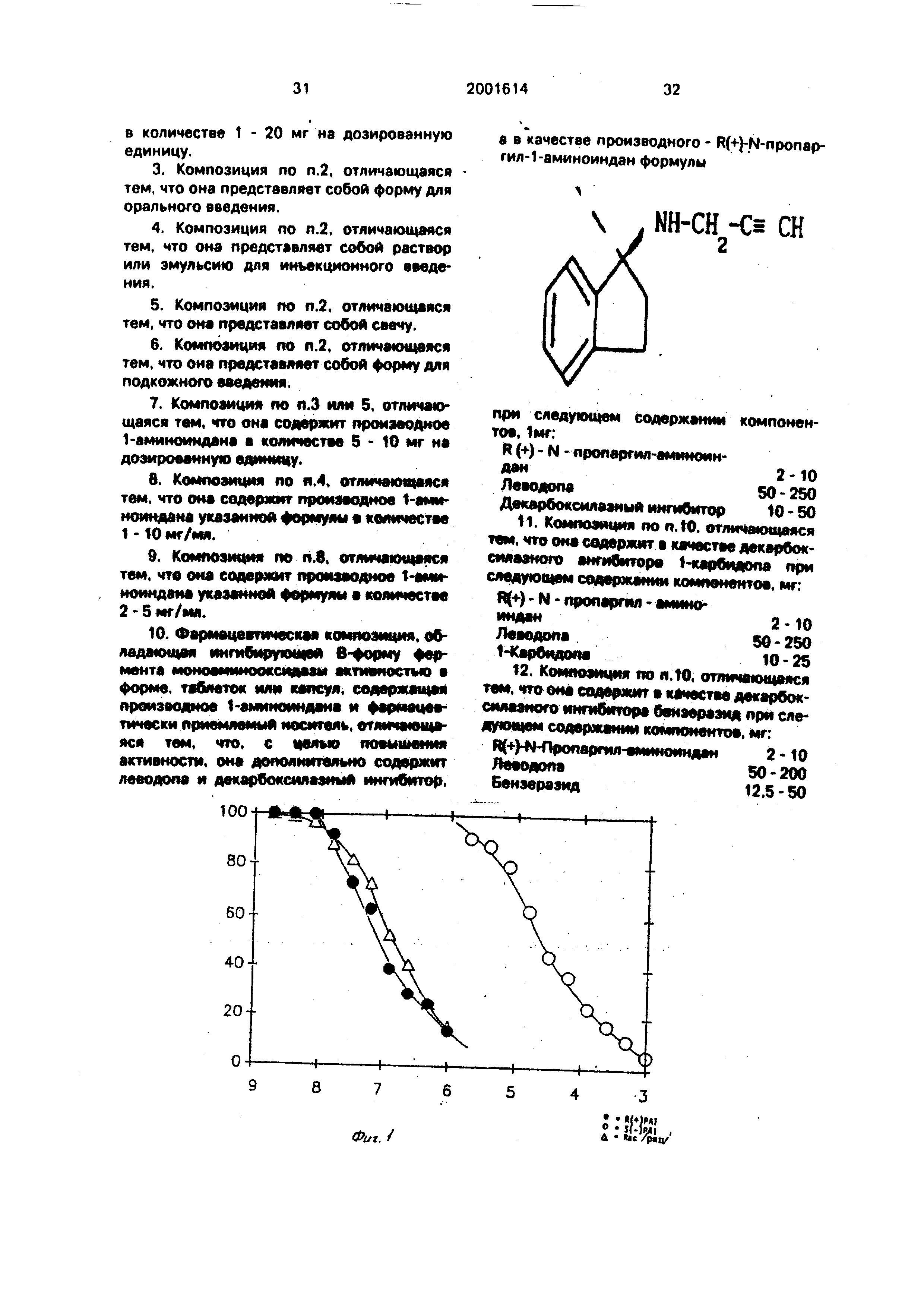
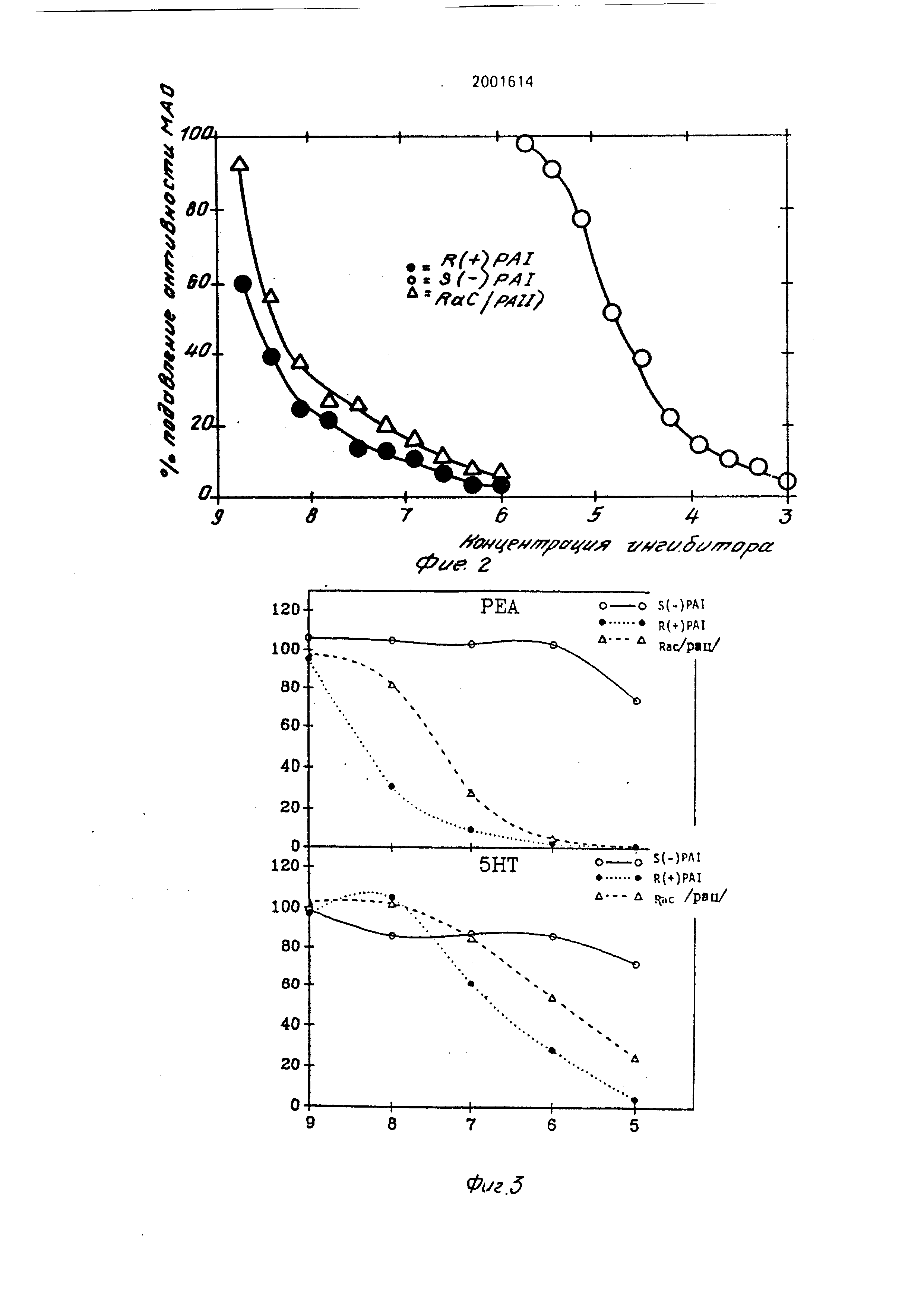
Пример 19. Ангибирование действия МАО в условиях.ин витро. Процедура эксперимента .
Источником фермента МАО является го- могенат головного мозга крысы в 0,3 мол
сахароза, которая центрифугируется с ускорением 600д в течение 15 мин. Поверхностный слой разбавляется примерно о 0,05 мол. буферном растворе фосфата и предварительно инкубируется с последовательными разбавлениями соединений общей формулы I: R (+}-PAI, S (-)-PAI и рацемическим -PAI в течение 20 мин при 37 С, Затем вводятся моченые С субстраты (2-фенилэтиламин, далее будет называться PEA; 5 окситрип- тамин, далее будет называться 5-НТ), и инкубирование продолжается еще в течение 20 мин (PEA) или в течение 30-45 мин (5-НТ). Используемые концентрации субстрата составляют 50 мкмол (PEA) и 1 ммол (5-НТ). В случае PEA концентрация фермента выбирается таким образом, чтобы в оде проге- кания, реакции метаболиэировалось не более чем 10% субстрата. Затем реакция прекращается путем ввода транилципро- мина(до конечной концентрации 1 ммол), и инкубат фильтруется через небольшую колонку с Амберлитом СС-50, доводится до буферного раствора с величиной рН 6,3. Колонка промывается 1,5 мл воды, элюаты сливаются, методом жидкостной сцинтил- ляционной спектрометрии определяется степень оэдиакгивности Постл ку ами- ноеые субстраты полностью сохраняются в колонке, радиоактивное ь ЭАКХНГЭ пел-а- зывает продуцирование нейтральных и кислотных метаболитов, обоо уемы кз: результат действия МАО. Дейг-епе МАО в образце выражается как процент ксстроп,- нойактивности при огсутотоь1/ ингибиторов после вычитании соответствующих ний холостой пробы Тякое действие которое определяется с использованием PEA как субстрата, относится г №АОР, действие , которое определяется с использованием 5-НТ, относится к МАО-А
Результаты
Изучается по отдельности в ycvoei i ин витро ингибирующее действие R (t-/-PAI, S {-)-РА1 и рацемических PAI С тр- ин мий формулы I, и результаты типичных np. д«нных экспериментов показаны нл фиг. } и 2. Весь эксперимент повторяете -ри ,/азг Концентрация ингибитора, дают о 50%- ное ингибирование метаболизма у(5о, тз (1С-50) рассчитывается по крш-ыг п.гиОи рования, и представлена в таГ)/1 1 i i -лил данных видно, что.
(a)R (+)-РА в два раза активное рацемата для ингибирования МАО-В;
(b)R (+)-РА1 в 29 раз активнее дл:- инги- бирования МАО-В, чем МАО-А,
(c)S (-)-PAI составляет лишь 1/Ь СЮО от активности R (+)-PAI для ингиоипс,,эчия МАО-В и проявляет небольшую или совсем
не проявляет избирательности между МАО- В и МАО-/В та.ш 1А представлены результаты этого же эксперимента с использованием
К(т)и S(-)MPA1 (М-метил-Ы-пропаргил-1-ами- моиндана) Каждый из энантиомеров MPAI менее избирателей между ингибированием МАО-В и МАО-А, чем R (+)PAI. Кроме того, R (-)MPAI лишь в пять раз более антивен, чем
S (-)МР L отношении ингибирования МАО- 6 ь противоположность R (+)PAI, который примррно в 7000 раз более активен, чем S (-)РА в данном испытании.
Проводились также некоторые эксперименты с кортикальными тканями человеческого головного мозга, взятыми через 6 ч посла смерти, обработанными как описано више. Резу ,таты такого эксперимента приведены на Фиг 3 (где R(+)PAI, S(-)PA и рацег .ическии PAI соединения - это соединения. эквивалентные формуле 1.
П р и м е р 20. Ингибирование действия МАО в условиях ин виво: неотложное лечение Процедура эксперимента.
Крьсы (самцы разности SpragueDawley ) массой 250±20 г обрабатываются o;4n/iv и чнаншомеров или рацемической ормо 1 РА| ./сем внугрибрюшинной инъекции (ip,t или орального ввода путем подачи
epc j зпн/4 (рс) и обсзглэоливаются соот- с ic через 1 ч или через 2 ч, опреде- лл отсч действие МАО в головном мозге и в ,им указанным способом. Коли- (.°сгео бел d при каждом инкубированииопр«дйляетс- методом Folin-Lowry, активность Фермента рассчитывается как нмол метабо- лиэирован| ого субстрата на час инкубации для мг белка. Действие МАО в тка- linx ЖИБО.НЫХ, обработанных ингибиторами , выражается как процент ферментного дсйг а группе контрольных животных, с введенным носителем (вода для орального p r 0;j4, п П , ный солевой раствор для внут- pii6ootu 4o:/i инъекции, Ip) и которые умерL MT-iMrO i ак указано. Ре л /чл&ты.
Ни ОДНР из дозировэннь х концентра- . испг.льзуемых с лекарствами иигибито- рами, н давала каких-либо явных
n Ms r ,шй к поведении.
.. -маты представлены на фиг. 4-11. После ргутрибрюшинного ввода соединение R (t-)-PA давало 90%-ное ингибирова- ниг действия МАО-В при дозе 0,5 мг/кг. Та
же сама доза давала лишь 20%-ное инги- бированиь действие МАО-А. В случае орального ирода та же доза R (+)-PAI давала 80%-лое инп-бирование МАО-В без замет- iioso инги прЗВУНИЯ МАО-А. В основном получены о/ 1наксвые результаты для ингибирования печеночного МАО как и для мозгового МАО. Обеспечиваемое указанными дозами 50%-ное ингибироеание МАО-А и МАО-В (1С-50) рассчитывалось по кривым ингибирования и показано в табл. 2. Эти данные показывают:
(а)что ингибирующее действие соединения R (+)-РА1 на МАО сохраняется в организме крыс в условиях ин виво,
(б)что в условиях ин виво сохраняется избирательность ингибирования МАО-В, а не МАО-А соединением R (+)-РА1,
(c)что в условиях ин виво сохраняется значительно более высокая активность действия (+)-энантиомера по сравнению с (-)- энантиомером,
(d)что данные соединения эффективно поглощаются после их орального ввода в организм,
(e)что данные соединения эффективно проходят через гематоэнцефалический барьер и эффективно ингибируют МАО мозга . Тот факт, что R (+J-PAI примерно в два раза активнее рацемического соединения в отношении ингибирования МАО-В является показателем чрезвычайно низкой активности S(-)-PAI в отношении ингибирования МАО-В.
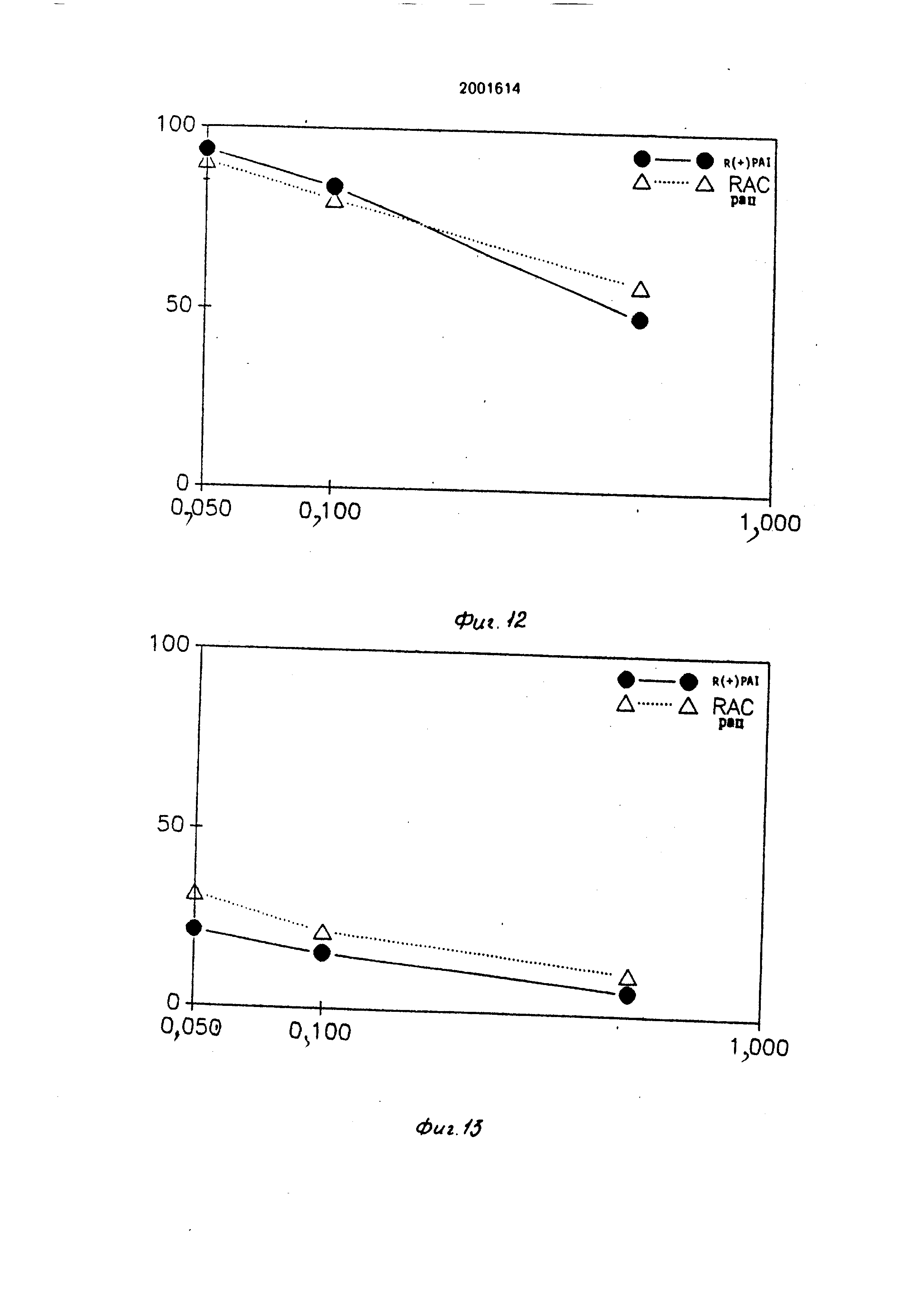
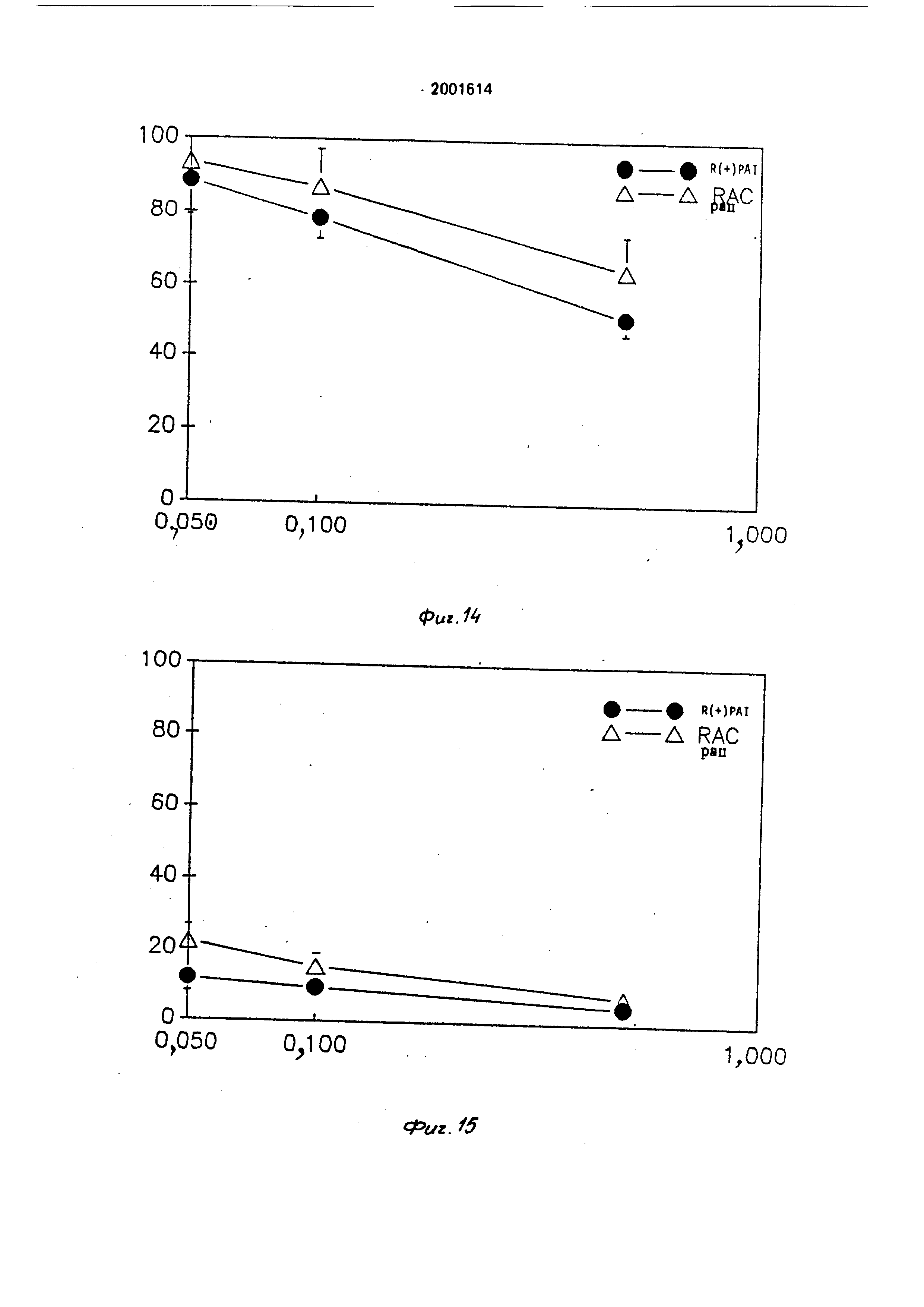
Пример 21. Ингибированиедействия МАО в условиях ин длительное лечение .
Процедура эксперимента.
Крысы (те же. что в примере 20: по 4 животных на каждую дозированную порцию ) подвергаются обработке соединением R{+)-PAI или рацемической формой тремя дозированными порциями (0.05: 0,1 и 0,5 мг/кг) путем орального ввода, по одной дозе в день в течение 21 дня. затем их обезглавливают через 2 ч после ввода последней дозированной порции. Действие МАО типов А и В определяется в головном мозге и в печени как описано в примере 20
Результаты.
Соединение R(+)-PAI. вводимое дозой 0,1 мг/кг. ежедневно дает хорошую степень избирательного ингибирования МАО, составляющую более чем 80% для МАО-В в головном мозге и 20% и менее для МАО-А в головном мозге. При более высокой дозе, составляющей 0,5 мг/кг в день, МАО-А все еще ингибруется менее чем на 50% (фиг. 12 и 13). Печеночный МАО показывает аналогичную степень избирательного ингибирования (фиг. 14 и 15). Соединение R(+)-PAI также является более сильным, чем рацемический , форма ингибитора примерно в два раза.
В случае МАО головного мозга: R(+)-PAI имеет более высокую степень избирательного ингибирующего действия на МАО-В, чем рацемическая форма соединения.
Эти результаты показывают, что после длительного лечения данными соединениями избирательность ингибирования МАО-В может сохраняться. Как и в случае других необратимых ингибиторов, степень рования фермента больше при длительных лечениях, чем после ввода единичной дозы
0 лекарства. Соединение R(+)-PAI имеет более высокую степень избирательности ингибирования МАО-В головного мозга, чем рацемическое соединение.
Пример 22. Необратимый характер
5 ингибирования МАО.
Процедура эксперимента. В организм крыс, по четыре крысы в каждой группе, вводится одиночная доза соединения R(+)-PAI (1 мг/кг), животные умер0 щвляются через 2. 6, 18, 24, 48 и 72 ч. Действие МАО-В определяется на всех тканях головного мозга, как описано выше. Результаты. Результаты представлены на фиг. 16.
5 Максимальное ингибирование МАО-В достигается через 6 ч после инъекции. Действие МАО доходит лишь до 30% контрольного действия через 72 ч после инъекции . Данный эксперимент показывает не0 обратимый характер ингибирования МАО соединением R(+)-PAI.
Пример 23. Усиление сосудосуживающего эффекта тирамина у находящихся в сознании крыс. Процедура эксперимента.
5 В организм крыс вводится смесь пен- тобарбиталя (30 мг/кг) и хлоральгидрате (1200 мг/кг) путем внутрибрюшинной инъекции . Левая сонная артерия и яремная вена каннюлируются посредством тонкой
0 полиэтиленовой трубки (сонная артерия) или тонкой трубки из силиконовой резины, подсоединенной к полиэтиленовой трубке (вена), периферический конец которой подводится под кожу к фиксирующей точке
5 позади шеи. Трубка заполняется гепарини- зироеанным солевым раствором.закупоривается тонким стальным стержнем. Животные подвергаются обработке 20 мг хлорамфеникола путем внутримышечной
0 инъекции и затем им дают выздороветь после этой операции в течение ночи. На следующий день крыс помещают в емкость с высокими стенками для возможности их свободного передвижения. Артериальный
5 катетер подсоединяется к датчику давления через наполненную солевым раствором по- . лиэтиленовую трубку длиной 100 см с узким отверстием, венный катетер подсоединяется к шприцу (1 мл) через трубку такой же длины, которая вместе со шприцем содержит раствор хлоргидрата тирамина в физиологическом растворе (1 мг/мл)
После периода уравновешивания, составляющего 30-40 мин осуществляются инъекции тирамина (50 или 100 мкг) и за- меряются значения кровяного давления Продолжительность времени между инъекциями составляет не менее чем 15 мин после доведения кровяного давления до контрольных показателей Устанавливают- ся контрольные сосудосуживающие реакции , затем путем внутрибргошинной инъекции вводится один из препарата реакции на терамин повторяются в течение следующих 4 ч Находится площадь под кри- вой реакции на кровяное давление и определяется отношение этой площади после обработки к этой площади до обработки с использованием среднего значения 3-4 показаний , полученных с контрольный пери- од, и через 1-3 ч после инъекции данных соединений.
Результаты
Результаты представлены в табл 3 Соединение R(+)-PAI, вводимое дозой 1 мг/кг (которое вызывает полное ингибирование МАО-В в головном мозге и в печени), не вызывает эначитеаьного усилена сссудо суживающей реакции на тирамии Пр более высокой дозе соединения R{H-PM, составляющей 5 мг/кг (которая приводит к более сильному ингибированию МАО-В в головном моаге и в периферических ках), наблюдается значительное ус.- сосудосуживающей реакции на тирам i 1 ко торая по своей силе зизлогична реакции 1 . ту же дозу депренила, и меньше, чем peai ция на хлоргилин (при дозе, которся ингиб.- рует действие МАО-А в печени более чем ма 85%.
Из данного эксперимента мож о сделать вывод, что соединение R(-«}-PA но вызывает усиления сосудосуживающего эффекта тирамина при дозах, которые эффективно гнги- бируют МАО-В
Пример 24 Подавление индуциро ванной МРТР допаминергичрской током ности посредством R(+)-PA
1 Метил-4-фенил-1 2 3,6-гетрлгидропи- ридин (МРТР) является нейроточсином ко- торый повреждает нигростриагн о / CTJMH- нергические нейроны у мчнь х млекопитающих животных вкл ОЧПР мм ьой, и создает синдром паркинсонизма у .лов - ка и приматов Критически вэж н 1 ный этап механизма нейротокси псы заключает в себе конверсию в его токсической метаболит 1-мегил-4- енилпи- ридиновый ион (MPP-I-) Эта реакция котялч зируется ферментом МАО-В и по ыеи
вероятности протекает за пределами допа- минерпг-ес/их нейронов, а именно в ней- роглие Известно, что МРТР является как субсгртюм так и необратимым ингибитором МАО-В Предварительная обработка экспериментальных животных ингибиторами МАО-Б такими как депренил или парги- лин предотвращает и защищает от вызванного МРТР повреждения нигростри- агных нейронов, поскольку блокируется окислитольнап конверсия МРТР в МРР+. Одна из основных существующих гипотез предпо/iaiaeT, что прогрессирующее вырождение нигростриатов у пациентов с болезнью Паркинсона может быть обусловлено воздействием образующихся вокружа- юших условиях экзогенных типа МРТР нейротоксинов, В таком случае имеется дополнительное веское показание начала сис- томоги ILCKOTO лечения ингибитором МАО-В см заботевония Паркинсона на очень ранней (, гэдми в надежде, что этот препарат нейграппзуот повреждающие эффекты таких путагивных МРТР-типа токсинов и таким образом приостановит или снизит скорое,ь прогрессирования заболеваний Успешное действие препарата, ингибиру- юшеги лАО-В, обусловлено его способно- стью Олькирозать ьызванное МРТР потрем. нигростриатных допаминер- in-tecmx. нейронов в условиях ин виво. м( проведено испытание (-) и (+) энантиомироо PAI на их способность пред- GTipauiaTb или ослаблять вызванные MDTn i пощения стриарного допамина у
МЬ Ц.СЙ
эксперимента.
Мыши разновидности черной породы ( 57 (мы г ой 20-25 г) подвергаются инъекции МРТР hU (30 мг/кг) растворов в дистилли- ровчннпй веде, (подкожный ввод)или одним лишо нгс.аелем, или через час после пред- B4piiT тьной обработки изомерами (-) или (- Р/к| 2 5 мг/кг, внутрибрюшинный ввод) и/к-, Д1 п,,унилом (5 мг/кг, внутрибрюшин- HOJ i en ci 6 дней их обезглавливают. Уда- Л(ют головной мозг, полосатое тело i иД -л ьот на охлажденной льдом стеклян- , и iCTHHG и замораживают на сухом
ЬДУ
. полосатого тела гомогенизиругся 0 ч мол хлорной кислотен лишенные C iKi i -чп гсоти, содержащие диоксибен- и . в качестве внутреннего стандарта, at j,uir. 1руЮ|СЯ на допамин и его основной метаболит -- 3,4-диокси-фенилуксус- ную кигяпу (ДОРАС) методом жидкостной хрома ог о 1фии высокого разрешения с оЫгр/ч онием электрохимическим методов
Се . /н таты
В табл. 4 представлены результаты данного эксперимента. Обработка одним лишь МРТР приводит к образованию характерного стриатного допамина (DA) и к истощениям DOPAC. Обработка (-) и (+) энантиомерами PAI или (-) депренилом не влияет на концентрации стриатного DA. Предварительная обработка (-) изомером PAI не влияет на вызванные МРТР концентрации DA и DOPAC в полосатом теле. (+) - изомер PAI, введенный до МРТР, полностью исключает снижение концентраций DA и DOPAC вызванных токсином, в полосатом теле. Придозе2,5мг/кгон по силе действия равен (-) депренилу (5 мг/кг) в отношении его защитного эффекта.
Указанные значения для DA и DOPAC выражены как средние величины ±сред.отн.отд: число крыс (п) в каждой группе равно 7-11.
Данные результаты показывают, что R(+)-PAI является прекрасным МАО-В ингибитором в условиях ин виво и особенно эффективен при лечении болезни Паркинсона.
Хотя данное изобретение описывается со ссылкой на изложенные примеры и отно- сящиеся к ним рисунки и таблицы, они не являются ограничением изобретения. Возможны различные модификации и различные области применения данного изобретения , например, соединения формулы I могут быть комбинированы синергетиче- ские с альфа-токоферолом (производное витамина Е) для лечения болезни Паркинсона.
Пример 25. Влияние энантиомеров PAI на вызванное амфетамином стереотип- мое поведение у постаревших крыс.
Амфетамин, как известно, индуцирует стереотипное поведение за счет мобилизации эндогенного допамина. Амфетамин не метаболизируется МАО-В. Ингибироаание МАО-В посредством эффективного ингибитора и ввод амфетамина вызывает выделение допамина, который не подвергается раздрожению ингибированным МАО-В. Так, увеличение сипантического допамина происходит после ввода амфетамина и эффективного МАО-В ингибитора, приводящего к увеличению стереотипного поведения - усиления амфетаминового эффекта. Оценка этого поведения дается в соответствии с числом латеральных головных вращений в течение одной минуты.
Процедура эксперимента.
Испытываемое соединение вводится дозой 0,5 мг/кг/день в питьевой воде за 24 ч до начала гипоксии (92% азота + 8% кислорода в течение б ч). После этого вводится амфетамин путем подкожной иньекции дозой 0,5 мг/кг, спустя 45 мин подсчитывается латеральные головные движения.
Результаты данных экспериментов показаны в табл. 5.
Данные в скобках показывают число подвергнутых испытанию животных Р 0,001 по отношению к необработанной подвергнутой кислородному голоданию группе или необработанной контрольной группе соответственно.
Результаты, приведенные в табл. 5, показывает , что (+)PAI вызывает значительное усиление вызванного амфетамином стереотипного поведения как у поврежденных кислородным голоданием, так и у контрольных крыс. (-)РА в этом отношении совершенно неактивно. Такое поведение в условиях ин виво подтверждает результаты предыдущих биохимических исследований в том, что (+)PAI является активным ингибитором МАО-В в головном мозге, в то время как (-)PAI в этом отношении является неактивным .
Пример 26. Влияние R(+)-PAI на улучшение или восстановление памяти.
Новорожденных крысят подвергают кратковременному зпиз.одическому кислородному голоданию и затем наблюдают их рост обычным путем с длительным повреждением их памяти. Это повреждение памяти проявляется в ухудшении поведения при испытании на устранение пассивности. Если лекарство эффективно, оно увеличивает скрытый период реакции до вхождения в темный отсек или камеру, в которой ранее осуществлялась электросудорожная терапия на испытываемых крысах. Скрытый период максимальной реакции составляет 300с.
Процедура эксперимента.
Молодых крыс подвергают послеродовому кислородному голоданию как описано в примере 27. Соединение R(+)PAI или S(-)PAI вводится согласно одной из следующих процедур.
Процедура А:
В организм кормящей матери вводится доза любого изомера 1-1,5 мг/кг/день в питьевой воде до окончания грудного кормления через 21 день. После этого в откормленных грудным молоком крысят вводят ту же дозу в течение 20 дней. Обработка завершается на 40 день, испытание осуществляется на 60-й день, то есть через 20 дней после ввода последней дозы лекарства.
Процедура В:
Доза препарата снижения до 0,5 мг/кг/ день, вводится в организм кормящей матери до окончания грудного кормления на 21 день, затем в молодых крысят вводят непосредственно дозу препарата до 60 дня, после чего начинается испытание.
Испытание на устранение пассивности
Аппаратура состоит из световой камеры , связанной с темной камерой и скользящей дверцей, разделяющей эти две камеры. Предварительно крысу помещают в свето- еую камеру на 30 с, затем дверцу открывают . Крыса перемещается в темную камеру с замедлением, которое регистрируется. При входе крысы в темный отсек дверца закрывается и на 3 с ей сообщается электроим- пульс 0.3 мА в ступню.
Сохранение (памяти) определяется через 48 ч путем повторения испытания и регистрации задержки перехода из световой камеры в темную камеру до произвольного максимального значения 300 с.
Результаты данных экспериментов представлены в табл. 6
Приведенные значения показывают задержку времени (в секундах) вхождения крысы в темную камеру, в которой испытываемая крыса сначала подвергнута электросудорожному воздействию.
Экспериментальные результаты показывают , что (+)PAI, но не (-)PAI эффективно я улучшении памяти поврежденных кислородным голоданием и контрольных крыс Лекарства, проявляющие активность в дачном испытании, могут быть полезны для лечения различных расстройств памяти слабоумия и особенно старческого сппбо умия типа болезни Алцгеймера
Пример 27 Воияние R(+)PAI на вызванный кислородным голоданием -и- перактивный синдром у молодых крыс
Крыс подвергают кислородному ЮЛОДР- нию и затем они растут в нормальных условиях , проявляя при этом повышенную двигательную активность на открытом пространстве в возрасте от 10 до 42 дней
Изучали влияния R (1РА1 и S (-)А1 на гиперактивный синдром
Процедура эксперимента
Крысят на первый день после гожченип подвергают кислородному голоданию и/ помещают в стеклянную камеру и подвергают воздействию 100% азота а течение 96
мин Их реанимируют путем периодического мягкого массажа грудной клетки и затем их снова оозвращают к матери Контрольные крысы подвергают такой же обработке, но с использованием воздуха вместо азота. R HPAI или S (-)PAI (0.5 мг/кг/день) вводится е организм кормящих крыс вместе с питьевой водой, это соединение вместе с грудным молоком переносится в организм крысят.
Передвижение определяется в шести полностью компьютиризироеанных клетках (28 см х 28 см) путем регистрации числа перекрестных проходов в течение заданного периода времени Пересечение сетки инфракрасных лучей с интервалами 4 см инициирует электрические импульсы, которые подаются счетчику. Регистрация двигательной чктивности осуществляются на крысятах в возрасте 15 и 20 дней в течение 15 мин
Результаты эксперимента представлены е табл 7
Приведенные числовые значения показывают чисто пересечений сетки инфракрасных лучей в клетке активности в течение 15 мин
э Р 0 001 по сравнению с подвергнутой кислородному голоданию необработанной группой.
b Р 0 05 по сравнению с подвергнутой кислородному голоданию необработанной группой
с Р 0 05 по сравнению с контрольной
руППОЙ
Данные результаты показывают, что систематическое лечение препаратом R (+)РА1 дозой 0.5 мг/кг, вводимой в кормящих матерей и поступающей в организм питающегося грудным молоком детеныша, значительно улучшает синдром гиперактивности, Следовательно R (-t-)PAI является лекарством, которое может использоваться для лечения сиидромц гиперактивности у детей.
(56) Патент Великобритании № 1037014.
л С 2 (, 1463














Реферат
Использование: в качеаве ингибиторов В-формы фермента моноаминооксидазы Продукт - Р{+)-Ы-пропаргют-1-аминоиндак его фармацевтически пригодные кислотно-аддитивные соли, для хлоргидрата. тт 184 - 185°С. а)+30.90 Реагент 1:Р-{-)-1-аминоиндан Реагент 2: пропар- гилхлорид Условия реакции: в среде ацетонтрила в присутствии К СО иомпозция содержащая Р(+ЬМ-тфстартол-Ь-а11Иноиндам в количестве 1 - 20 мг на дозу и фармацевтически приемлемый носитель в форме для орального введения инъекционного раствора, эмульсии свечи. 16 ил, 7 табл.

Формула



Комментарии