Система и способ сбора образца нуклеиновой кислоты - RU2654666C2
Код документа: RU2654666C2
Чертежи






Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет предварительной заявки US 61/827244, озаглавленной «Система и способ сбора образца нуклеиновой кислоты» (System and method for collecting a sample of nucleic acid) и поданной 24 мая 2013 г., которая во всей своей полноте включена в материалы настоящего описания посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
Существующие в настоящее время системы и способы сбора, экстракции и обнаружения нуклеиновой кислоты в исследуемых биологических образцах, как правило, оказываются чрезмерно сложными, требуют множество этапов с квалифицированным техническим персоналом и не являются оптимизированными для обработки образцов, имеющих большие объемы, или для предотвращения перекрестного загрязнения при обработке образцов и стабилизации для транспортировки.
Разнообразные текучие среды организма, такие как кровь, плазма, сыворотка, спинномозговая жидкость (СМЖ), плевральный выпот, перитонеальный выпот, моча и т.д., содержат короткоцепочечные фрагменты нуклеиновых кислот (НА), а именно внеклеточные нуклеиновые кислоты (вкНК) или циркулирующие нуклеиновые кислоты (цНК). Измененные нуклеиновые кислоты, образующиеся эндогенно из опухоли или «экзогенно» из плода или патогенной инфекции внутри организма могут присутствовать как вкНК в периферической крови в очень низких концентрациях, и их можно обнаруживать, а затем отличать от нормальных вкНК хозяина. Экстракция этих вкНК в достаточном количестве из исследуемой плазмы или сыворотки требует обработки относительно большого объема текучей среды, что вызывает неизбежные технические проблемы определения условий клинической диагностики. Соответственно, в данной области существует потребность в новых способах решения таких проблем.
Примеры таких способов обнаружения, например, туберкулеза, описывает рассматриваемая опубликованная международная патентная заявка PCT WO 2012/135815, составленная автором настоящего описания и включенная в настоящее описание посредством ссылки. Однако такое исследование может оказаться полезным в тех регионах мира, в которых отсутствует быстрый доступ к дорогостоящему технологическому оборудованию, используемому для анализа образцов. Соответственно, в технике существует потребность в системе сбора образцов и способах, которые позволяют улавливать нуклеиновые кислоты в достаточных количествах из большого объема биологических образцов, чтобы осуществлять последующий анализ, предотвращать загрязнение от окружающей среды и операторов, а также предохранять и перемещать нуклеиновую кислоту, таким образом, что нуклеиновые кислоты можно собирать в помещении медицинского учреждения с использованием относительно недорогостоящего оборудования, а затем транспортировать в стабилизированной форме в центральное учреждение для дополнительной обработки и исследований.
Известны разнообразные способы экстракции, подходящие для выделения циркулирующих ДНК или РНК из больших объемов биологических текучих сред, такие как способы, которые описывает, например, «Справочник по циркулирующим нуклеиновым кислотам QIAamp®» компании Qiagen (второе издание, февраль 2011 г.), и усовершенствованный способ экстракции с центрифужной колонкой, описанный в патенте US 5234809 компании Boom Technology. Патент US 5346994 описывает технологический способ экстракции органическими жидкостями с использованием фенола и хлороформа. Оба эти способа можно использовать для экстракции больших объемов, например, из образцов плазма или сыворотки, но органические реагенты отличаются токсичностью, которая ограничивает их применение.
Патенты US 7897378 и US 8158349 описывают устройства и способ очистки или выделения нуклеиновых кислот из образцов большого объема с использованием систем, включающих пару соответствующих полых элементов, через которые образцы пропускаются в приемник для сбора, причем нуклеиновые кислоты прикрепляются связующим материалом в одном из этих полых элементов. Полый элемент, в котором находится удерживаемый образец, перемещается в первый приемный приемник для промывания, а затем очищенные или выделенные нуклеиновые кислоты элюируются и собираются во втором приемном приемнике для последующего анализа.
В качестве примера, патент US 5234809 компании Boom, включенный в настоящее описание посредством ссылки, описывает способ выделения нуклеиновых кислот, который является подходящим для множества разнообразных применений. Этот патент описывает способ выделения нуклеиновых кислот из содержащих нуклеиновые кислоты исходных материалов посредством инкубации вышеупомянутого исходного материала с хаотропным (вызывающим диссоциацию) буферным раствором и связывающей ДНК твердой фазой. Хаотропный буферный раствор одновременно осуществляет, если это необходимо, лизис исходного материала и прикрепление нуклеиновых кислот к твердой фазе.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Согласно одному аспекту настоящего изобретения предлагаются способ и система для обработки биологического образца. Обработка, упомянутая в настоящем описании, включает в себя этыпы разложения, связывания, промывания, стабилизации и элюирования биомолекул биологического образца.
Согласно одному варианту осуществления предлагается система для сбора образца нуклеиновой кислоты, содержащая приемник, образующий внутренний объем, съемную крышку для приемника, имеющую соединительный интерфейс в сообщении по текучей среде с отверстием для соединения с образцом, фильтрационную колонку, выполненную с возможностью съемного присоединения к соединительному интерфейсу крышки приемника, контейнер для сбора образца и транспортировочный контейнер. Съемная крышка для приемника имеет внутреннюю сторону, обращенную к внутреннему объему приемника и внешнюю сторону, обращенную от внутреннего объема. Крышка имеет вентиляционное отверстие в сообщение между внутренней стороной и внешней стороной, и отверстие для соединения с образцом в сообщении между внутренней стороной и внешней стороной. Отверстие для соединения с образцом имеет первый блокировочный компонент для высвобождаемого блокирования отверстия для соединения с образцом с взаимодействующим вторым блокировочным компонентом. Соединительный интерфейс в сообщении по текучей среде с отверстием для соединения с образцом располагается на внутренней стороне крышки. Фильтрационная колонка имеет открытый первый конец, открытый второй конец и расположенный между ними внутренний канал, содержащий субстрат для сбора нуклеиновой кислоты. Контейнер для сбора образца содержит второй блокировочный компонент, выполненный с возможностью присоединения к первому блокировочному компоненту отверстия для соединения с образцом в крышке приемника. Транспортировочный контейнер имеет открытый конец и образует объем, выполненный с возможностью вмещения фильтрационной колонки. Транспортировочный контейнер выполнен с возможностью высвобождаемого зацепления с фильтрационной колонкой для ее отсоединения от соединительного интерфейса крышки приемника. Транспортировочный контейнер дополнительно содержит съемное покрытие для временной запечатывания фильтрационной колонки внутри транспортировочного контейнера. Согласно некоторым вариантам осуществления, транспортировочный контейнер содержит влагопоглотитель.
Субстрат фильтрационной колонки может содержать фильтр, опорный стеклоцемент, расположенный по ходу потока после фильтра и удерживающее кольцо, расположенное по ходу потока перед фильтром. Блокировочные компоненты отверстия для соединения с образцом могут содержать фитинг с фиксатором Люэра (Luer). Согласно некоторым вариантам осуществления, система может дополнительно содержать вакуумную камеру, имеющую внутренний участок, который выполнен с возможностью присоединения к источнику вакуума, и внешний участок, имеющий одну или более ячеек, причем каждая ячейка выполнена с возможностью приема одного из приемников с одним или более отверстиями для соединения с вакуумом в сообщении с внутренним участком камеры и выполнена с возможностью присоединения к вентиляционному отверстию приемника посредством гибкого трубопровода.
Согласно некоторым вариантам осуществления, фильтрационная колонка и крышка приемника функционально соединяются посредством резьбового интерфейса. Фильтрационная колонка может иметь первый элемент, такой как первый выступ, расположенный на ее внешней поверхности, выполненный с возможностью высвобождаемого зацепления посредством взаимодействующего второго элемента, такого как второй выступ, расположенный на внутренней поверхности транспортировочного контейнера так, что второй элемент передает усилие первому элементу, когда крутящее усилие приложено к фильтрационной колонке в направлении отвинчивания фильтрационной колонки в ее резьбовом соединении с крышкой приемника.
Система может дополнительно содержать трехходовой клапан, имеющий первое отверстие, выполненное с возможностью присоединения к отверстию для соединения с образцом в крышке приемника, второе отверстие, выполненное с возможностью присоединения к контейнеру для сбора образца, и третье отверстие, выполненное с возможностью присоединения к источнику текучей среды, в котором содержится текучая среда для обработки образца после его сбора. Один или более контейнеров с текучей средой, такой как промывочная текучая среда, например, этанол, могут присоединяться к третьему отверстию.
Контейнер для сбора образца может содержать шприц, и трехходовой клапан может содержать обратный клапан, выполненный с возможностью обеспечения исключительно потока из контейнера для сбора образца в приемник, когда существует положительное относительное давление между контейнером для сбора образца и приемником, и обеспечения исключительно потока из источника текучей среды в контейнер для сбора образца, когда существует отрицательное относительное давление между контейнером для сбора образца и источником текучей среды.
Согласно следующему аспекту настоящего изобретения, предлагается стерильная съемная крышка для приемника, имеющая внутреннюю сторону, обращенную к внутреннему объему приемника, и внешнюю сторону, противоположную внутренней стороне, при этом крышка содержит вентиляционное отверстие в сообщении между внутренней стороной и внешней стороной, и отверстие для соединения с образцом в сообщении между внутренней стороной и внешней стороной, причем отверстие для соединения с образцом содержит первый блокировочный компонент для высвобождаемого блокирования отверстия для соединения с образцом с взаимодействующим вторым блокировочным компонентом, причем внутренняя сторона крышки содержит соединительный интерфейс в сообщении по текучей среде с отверстием для соединения с образцом. Стерильная фильтрационная колонка может съемно присоединяться к соединительному интерфейсу крышки приемника, причем данная фильтрационная колонка имеет открытый первый конец, открытый второй конец и расположенный между ними внутренний канал, содержащий субстрат для сбора нуклеиновой кислоты.
Согласно следующему аспекту настоящего изобретения, предлагается Способ для сбора образца нуклеиновой кислоты, включающий в себя этапы на которых: (a) изготавливают систему сбора образца, которая описана в настоящем описании; (b) собирают объем содержащей образец текучей среды в контейнер для сбора образца; (c) присоединяют контейнер для сбора образца к приемнику посредством отверстия для сбора образца; (d) пропускают объем содержащей образец текучей среды из контейнера для сбора образца через фильтрационную колонку, в результате чего образец собирается на субстрате, а остаток собирается в приемнике; (e) помещают открытый конец транспортировочного контейнера над фильтрационной колонкой, зацепляют фильтрационную колонку с транспортировочным контейнером и отсоединяют фильтрационную колонку от крышки приемника; и (f) временно запечатывают транспортировочный контейнер съемным покрытием. Содержащая образец текучая среда может содержать, например, лизат, содержащий собранный экстракт текучей среды организма пациента. В том случае, если контейнер для сбора образца содержит шприц, этап пропускания объема через фильтрационную колонку может включать в себя этап, на котором прикладывают давления вручную к поршню шприца, согласно одному варианту осуществления, или присоединяют вентиляционное отверстие крышки приемника к источнику вакуума, а затем прикладывают отрицательное давление к фильтрационной колонке с использованием источника вакуума, согласно другому варианту осуществления.
Согласно определенным вариантам осуществления, собранный образец на субстрате можно дополнительно обрабатывать после этапа(d) посредством пропускания одного или более объемов текучей среды, такой как дегидратирующая промывочная текучая среда, например, этанол, через фильтрационную колонку перед осуществлением этапа (e). Кроме того, в транспортировочном контейнере может содержаться влагопоглотитель. Образец, обезвоженный и поддерживаемый в сухом состоянии посредством влагопоглотителя, можно транспортировать в нерегулируемых климатических условиях окружающей среды, и он может сохранять устойчивость вплоть до 4 недель перед дополнительной обработкой после завершения этапа (f). Такой способ может оказаться особенно полезным для обработки нуклеиновых кислот, собранных в имеющих минимальное оборудование медицинских учреждениях, таких как небольшие, удаленные и/или расположенные на периферии клиники, и для транспортировки собранных образцов в имеющую лучшее оборудование центральную лабораторию для дополнительного анализа собранных образцов в целях обнаружения заболевания, например, для обнаружения латентного туберкулеза.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1A иллюстрирует вид сверху примерной крышки приемника согласно варианту осуществления одного аспекта настоящего изобретения.
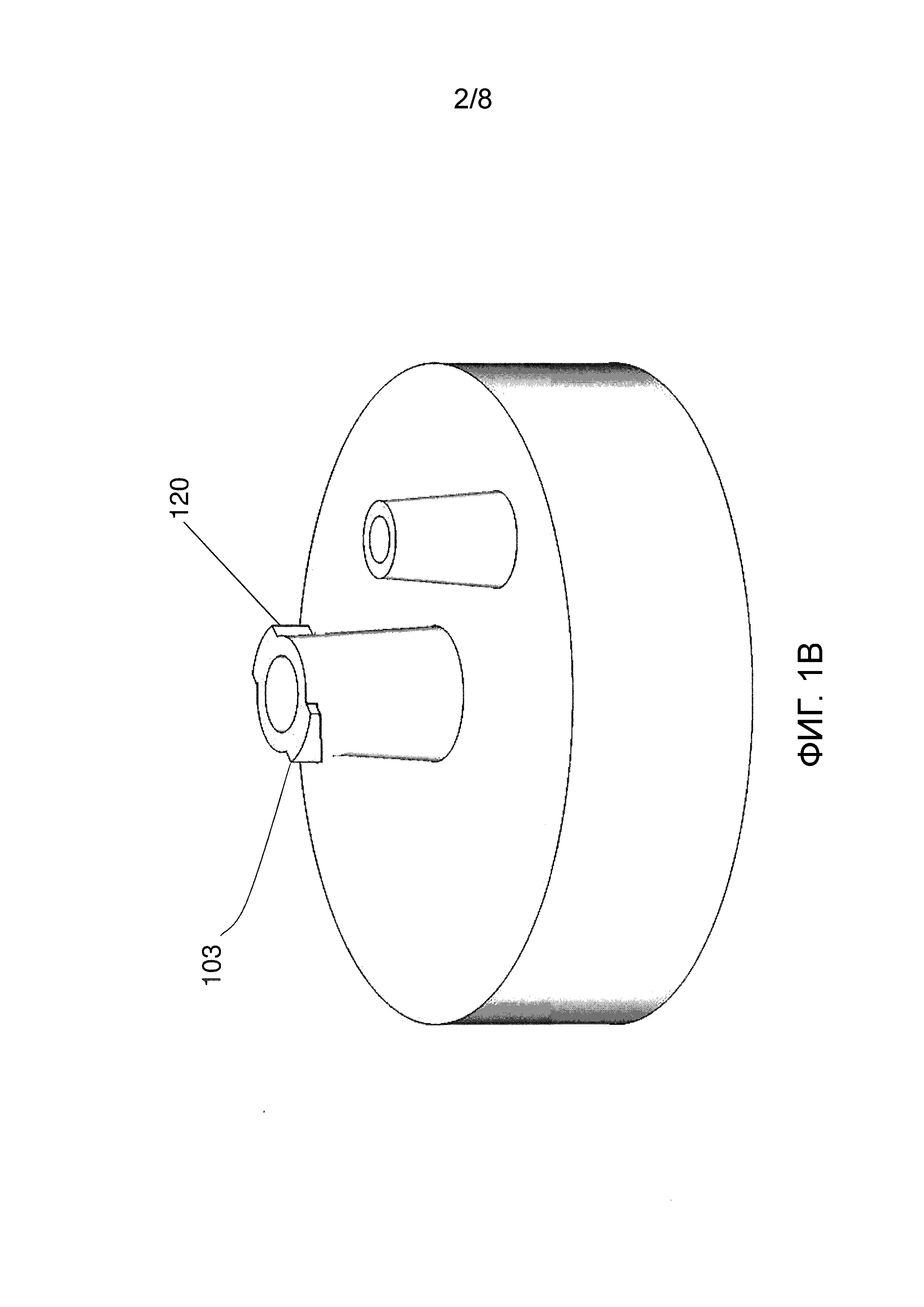
Фиг.1B иллюстрирует общий вид сбоку примерной крышки приемника на фиг.1A.
Фиг.1C иллюстрирует вид поперечного сечения примерной крышки приемника на фиг.1A.
Фиг.2A иллюстрирует примерную фильтрационную колонку для присоединения к примерной крышке приемника на фиг.1.
Фиг.2B иллюстрирует поперечное сечение примерной фильтрационной колонки на фиг.2A.
Фиг.3 иллюстрирует вид в разборе фильтрационной колонки на фиг.2A и крышки приемника на фиг.1, показывая их соединение друг с другом.
Фиг.4 иллюстрирует крышку приемника на фиг.1A, прикрепленную к примерному приемнику.
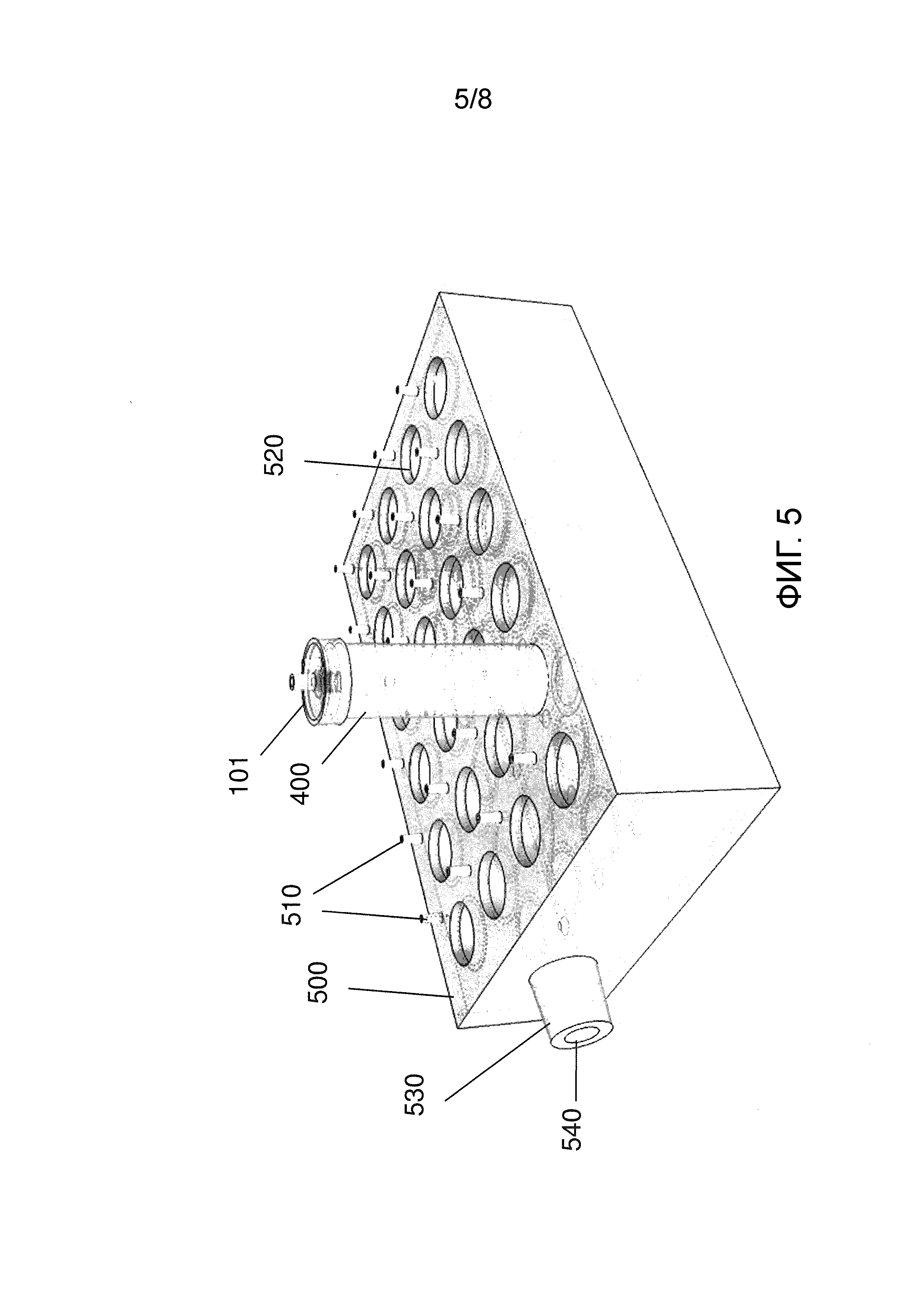
Фиг.5 иллюстрирует примерную конструкцию вакуумной камеры для содержания множества примерных приемников на фиг.4.
Фиг.6A иллюстрирует нижний участок примерного транспортировочного контейнера.
Фиг.6B иллюстрирует, как примерный транспортировочный контейнер на фиг.6A помещается над примерной фильтрационной колонкой для ее отвинчивания от примерной крышки приемника на фиг.1A.
Фиг.6C иллюстрирует изображение поперечного сечения верхний участок примерного транспортировочного контейнера.
Фиг.6D иллюстрирует изображение нижнего участка поперечного сечения примерного транспортировочного контейнера на фиг.6A, который запечатывает верхний участок примерного транспортировочного контейнера на фиг.6C.
Фиг.6E иллюстрирует общее изображение запечатанного транспортировочного контейнера на фиг.6D.
Фиг.7A иллюстрирует лизирующий контейнер, содержащий лизирующий раствор в водной форме.
Фиг.7B иллюстрирует лизирующий контейнер на фиг.7A, содержащий лизирующий раствор в высушенной форме.
Фиг.8A иллюстрирует кривые амплификации количественной полимеразной цепной реакции с обратной транскрипцией (ОТ-кПЦР) и количественной полимеразной цепной реакции (кПЦР) для фрагментов гена человека B2M, PPIA и гена TB IS6110 парами праймеров HB2M11, HPPIA11 и IS6110 для экстрактов плазмы человека от доноров, включая контрольную здоровую группу (КЗ) и группу с латентной туберкулезной инфекцией (ЛТБИ), соответственно.
Фиг.8B иллюстрирует кривые плавления ампликонов для фрагментов гена человека B2M, PPIA и гена TB IS6110 парами праймеров HB2M11, HPPIA11 и IS6110 для экстрактов плазмы человека от доноров групп КЗ и ЛТБИ, соответственно.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Согласно одному аспекту настоящего изобретения, предлагается система для сбора образца нуклеиновой кислоты. Примерная система содержит приемник, такой как приемник 400 на фиг.4, который образует внутренний объем. Хотя здесь представлена примерная геометрия, настоящее изобретение не ограничивается какими-либо конкретными размерами и формами приемника. Приемник имеет съемную крышку 101, такую как крышка согласно примерному варианту осуществления, которая проиллюстрирована на фиг.1A-1C и имеет внутреннюю сторону 107, обращенную к внутреннему объему приемника, и внешнюю сторону 102, обращенную от внутреннего объема. Фиг.1A иллюстрирует внешнюю сторону крышки. Крышка имеет вентиляционное отверстие 105, такое как имеющее охватываемое конусное соединение Люэра в сообщении между внутренней стороной и внешней стороной через канал 106, и отверстие 103 для соединения с образцом в сообщении между внутренней стороной и внешней стороной через канал 104. Отверстие для соединения с образцом содержит первый блокировочный компонент, такой как винтовое соединение 120 Люэра, чтобы запирать с возможностью высвобождения отверстие для соединения с образцом с взаимодействующим вторым блокировочным компонентом транспортировочного контейнера для образца (не проиллюстрировано), такому как шприц. Оба отверстия 120 и 105 можно легко открывать или закрывать, используя имеющие соединения Люэра крышки или пробки (не проиллюстрировано). Когда направленное вниз давление прилагается к поршню шприца, присоединенного к отверстию 120 для обеспечения движения жидкости, отверстие 105 открывается, позволяя вытесненному воздуху выходить из приемника 400. Когда для обеспечения движения жидкости используется вакуум от присоединенного источника (который также может представлять собой шприц), отверстие 105 присоединяется к этому источнику вакуума. Внутренняя сторона крышки содержит соединительный интерфейс 108 в сообщении по текучей среде с отверстием 103 для соединения с образцом. Крышка может иметь внутреннюю резьбу 110, посредством которой крышка навинчивается на приемник, имеющий наружную резьбу (не проиллюстрировано), хотя можно использовать любое функциональное соединение между крышкой и приемником.
Фильтрационная колонка, внутри которой находится твердофазная экстракционная матрица, такая как мембрана на основе геля диоксида кремния, спеченный пористый стеклоцемент или стекловолоконная фильтровальная бумага, такая как примерная фильтрационная колонка 200, которая проиллюстрирована на фиг.2A и 2B, выполнена с возможностью для съемного присоединения к соединительному интерфейсу крышки приемника. Например, как проиллюстрировано на фиг.1C, соединительный интерфейс 108 может иметь внутреннюю резьбу 109, которая совмещается с наружной резьбой 220 на фильтрационной колонке 200. Фильтрационная колонка имеет открытые концы 202 и 204 и расположенный между ними внутренний канал 206, в котором содержится субстрат 212 для сбора нуклеиновой кислоты. Фильтрационная колонка может также называться термином «полый элемент», потому что она выполнена с возможностью пропускания через нее текучей среды без удерживания в ней текучей среды так, как текучая среда удерживается в приемнике или сосуде. Субстрат фильтрационной колонки 212 может прилегать к пористому стеклоцементу 214, и удерживающее кольцо 210 может создавать фрикционное соединение с внутренним участком колонки для удерживания субстрата и стеклоцемента в положении, прилегающем к шейке фильтрационной колонки.
Субстрат 212 может содержать связывающую матрицу колонки, представляющую собой твердую матрицу, которая позволяет текучей среде проходить через матрицу. Согласно определенным аспектам, матрица имеет высокую пористость, так, чтобы максимально увеличивалась площадь поверхности, на которую воздействуют буферные растворы, и в результате этого максимально увеличивается емкость матрицы. Матрица может быть выполнена из разнообразных материалов. Согласно определенным конкретным вариантам осуществления, связующая матрица может представлять собой материал на основе диоксида кремния (состоящий, главным образом, из SiO2), такой как стекловолокно, кварцевые шарики, силикагель, спеченный пористый стеклоцемент и т.д. Известны многочисленные промышленные источники матрицы на основе диоксида кремния, такие как, например, стекловолоконные фильтры типов GF/A, GF/B, GF/C, GF/D и GF/F, которые производит компания Whatman (штат Нью-Джерси, США). Такие фильтры известны, в частности, для использования в очистке молекул нуклеиновых кислот. Согласно другим вариантам осуществления, можно использовать разнообразные твердые матрицы, такие как ионообменные, аффинные и поверхностно модифицированные матрицы, подходящие для экстракции и разделения определенных биомолекул. Связующая матрица может представлять собой любой материал, в который могут быть внедрены частицы или волокна материала, связывающего нуклеиновые кислоты. Матричный материал, как правило, является проницаемым для жидкостей так, что образец может проходить через матрицу, и при этом нуклеиновые кислоты вступают в контакт и связываются материалом, связывающим нуклеиновые кислоты, а другие компоненты образца могут выходить из матрицы. Связующая матрица может содержать любой несущий материал известный в технике, включающий материалы, выбранные из группы, которые составляют силикатные материалы, силикагель, стекло, цеолит, оксид алюминия, диоксид титана, диоксид циркония, каолин, гелеобразный диоксид кремния, магнитные частицы, спеченный пористый стеклоцемент, а также керамические или полимерные несущие материалы. Связывающий нуклеиновые кислоты материал может представлять собой любой материал, который связывает нуклеиновые кислоты (образуя, как правило, нековалентные связи) в определенных условиях, причем другие вещества в образце не связываются в данных условиях. Как правило, связывание нуклеиновых кислот является обратимым, и, таким образом, нуклеиновые кислоты могут впоследствии повторно элюироваться с материала посредством изменения условий.
Согласно одному варианту осуществления, колонка 200 может быть аналогичной по своей геометрической форме колонке Mobicol, которую поставляет компания Boca Scientific (штат Флорида, США), или она может представлять собой специально модифицированную или специально изготовленную разновидность этой колонки. Конструкцию, имеющую такую геометрическую форму, можно подвергать центрифугированию на микроцентрифуге, а также можно изготавливать образцы большого объема, которые легко обрабатываются посредством шприца. Пористый стеклоцемент 214 может содержать инертную пластмассу, имеющую поры с размерами от 10 до 90 мкм. Твердая экстракционная матрица (субстрат) может содержать фильтровальную бумагу GF/D от компании Whatman (штат Нью-Джерси, США), такую как бумага, получаемая вырезанием из фильтровальной бумаги дисков, размер которых соответствует внутреннему диаметру колонки. Два или более слоев фильтр дисков можно помещать поверх стеклоцемента. Опорное кольцо от компании Ring-Store (штат Вашингтон, США), такое как кольцо, изготовленное из политетрафторэтилена (PTFE), такого как тефлон (Teflon®), или пластмассы, такой как полиэтилен (PE) или полипропилен (PP), можно помещать поверх фильтровальных дисков (как видно на фиг.2A) для предотвращения движения фильтровальных дисков.
Открыватель и транспортировочный контейнер, такой как примерный контейнер 650, который проиллюстрирован в полностью собранной конфигурации на фиг.6E, содержит нижний участок 600 и ответный ей верхний участок 610. Соответствующие нижний участок и верхний участок образуют объем, выполненный с возможностью вмещения фильтрационной колонки в целях транспортировки. Нижний участок 600 транспортировочного контейнера имеет открытый верх и выполнен с возможностью высвобождаемого зацепления с фильтрационной колонкой для ее отсоединения от соединительного интерфейса крышки приемника. Например, фильтрационная колонка может иметь выступ 222 проиллюстрированный на фиг.2A, который соединяется с выемкой 602 на фиг.6A. Закрытый транспортировочный контейнер запечатывается по отношению к окружающей среде, что предотвращает загрязнение и увлажнение, которые могут вызывать ускоренное разложение (гидролиз) нуклеиновой кислоты, в частности, РНК. Закрытый транспортировочный контейнер может дополнительно содержать предварительно упакованный в него влагопоглотитель, который создает или сохраняет состояние сухости (обезвоживание), такой как гель диоксида кремния в форме гранул или шариков, такой как влагопоглотитель 612 в верхнем участке контейнера, проиллюстрированной на фиг.6C и 6D. Положение влагопоглотителя может также находиться в нижнем участке контейнера и не ограничивается какой-либо определенной позицией или конфигурацией. Влагопоглотитель может содержать любой подходящий материал, известный в уровне техники для создания и сохранения обезвоживания, в том числе, но не ограничиваясь этим, монтмориллонитовая глина, хлорид лития, активированный оксид алюминия, алюмосиликат щелочного металла, брикеты DQ11, силикагель, молекулярное сито, сульфат кальция или оксид кальция. Влагопоглотитель может содержать индикатор влаги, цвет которого постепенно изменяется, когда он переходит из безводного (сухого) в гидратированное (влажное) состояние, такой как известный индикатор для некоторых видов силикагеля.
Хотя проиллюстрировано отверстие для соединения с образцом, имеющее фитинг с фиксатором Люэра, выступающий из внешней стороны крышки, настоящее изобретение не ограничивается блокировочным соединением какого-либо определенного типа или какой-либо определенной конфигурацией отверстия для соединения с образцом. Хотя какой-либо тип блокировочного соединения между отверстием для соединения с образцом и контейнером для образца является предпочтительным, может присутствовать блокирование с высвобождением любого типа. Контейнер для переноса образцов не проиллюстрирован на чертеже, но может представлять собой стандартный шприц, имеющий соответствующий фитинг с фиксатором Люэра. Таким образом, согласно примерному способу, шприц соединяется с крышкой приемника, и поршень шприца нажимается, воздействуя на раствор, который содержит нуклеиновую кислоту в присутствии связующих реагентов, таких как хаотропные реагенты, а также спирт и пропускается через фильтрационную колонку. Таким образом, нуклеиновая кислота удерживается на фильтре 212, в то время как фильтрат проходит в приемник 400. Как отмечено выше, поршень шприца можно нажимать вручную, когда отверстие 105 является открытым, или можно присоединять источник вакуума к отверстию 105 таким образом, что вакуум вызывает нажатие поршня шприца, чтобы раствор выходил из шприца.
Хаотропные реагенты являются хорошо известными в уровне техники как вещества, которые изменяют вторичную, третичную и/или четвертичную структуру белков или нуклеиновых кислот, но не влияют по меньшей мере на их первичную структуру. Соответствующие примеры представляют собой тиоцианат гуанидиния, гидрохлорид гуанидиния, NaI, KI, тиоцианат натрия или сочетания этих веществ. Хаотропные реагенты нарушают упорядоченную структуру жидкой воды и заставляют ДНК или РНК из этого водного раствора прикрепляться к поверхности стекла. В некоторых условиях включение спирта, такого как этанол или изопропиловый спирт, способствует связыванию НК с поверхностью. Вещества, такие как NaCl, KCl или CaCl2, могут присутствовать в растворе, чтобы модифицировать ионную силу. Свойство связывания ДНК и РНК в хаотропных условиях со стеклянными поверхностями используется для выделения их из раствора, содержащего другие биологические материалы. Связывание со стеклянной поверхностью является обратимым так, что, например, если концентрация хаотропных реагентов уменьшается, или хаотропные реагенты полностью удаляются, то ДНК или РНК можно повторно элюировать.
Таким образом, система для сбора образца может дополнительно содержать вакуумную камеру 500, такую как камера, проиллюстрированная на фиг.5. Вакуумная камера выполнена с возможностью присоединения к источнику вакуума, например, через соединительное отверстие 530, которое находится в сообщении с внутренним объемом вакуумной камеры посредством канала 540. Внешняя поверхность вакуумной камеры 500 имеет множество ячеек 520, причем каждая ячейка выполнена с возможностью для приема одного из приемников 400. Многочисленные отверстия для соединения с вакуумом 510 находятся в сообщении с внутренним участком камеры и выполнены с возможностью присоединения к вентиляционному отверстию 105 крышки приемника 101 посредством гибкого трубопровода (не проиллюстрировано). Таким образом, например, многочисленные ячейки могут быть заполнены приемниками, причем каждая крышка приемника присоединяется к одному из вакуумных отверстий 510, и, вакуум, таким образом, обеспечивает, что содержащая образец текучая среда в многочисленных транспортировочных контейнерах образцов фильтруется через множество фильтрационных колонок и попадает во множество приемников. Хотя проиллюстрирована вакуумная камера, имеющая множество ячеек, вакуумная камера может иметь только одну ячейку, или больше или меньше ячеек, чем проиллюстрировано на чертеже. Вакуумные отверстия на вакуумной камере могут иметь съемные крышки или клапаны так, что камера может использоваться с меньшим числом, чем все вакуумные отверстия, присоединенные к приемникам в ячейках для приемников.
Система для сбора образца может дополнительно содержать лизирующий контейнер (фиг.7A и 7B), содержащий предварительно изготовленные лизирующие реагенты, и первый шприц, которым переносится жидкий образец (сыворотка, плазма) в лизирующий контейнер, и второй шприц, которым переносится лизат в экстракционное устройство. Каждый шприц предпочтительно содержит металлическую или пластмассовую иглу, которая является безопасной (затупленной) и имеет достаточную длину, чтобы достигать нижний участок соответствующего контейнера, из которого текучая среда извлекается с использованием данного шприца, а также имеет достаточно большой внутренний диаметр (ID) для обеспечения относительно быстрого потока жидкости. Лизирующие реагенты могут содержать, например, по меньшей мере следующие: неионное поверхностно-активное вещество, такое как Triton X-100 или BJ58, или сочетание неионного поверхностно-активного вещества и анионного поверхностно-активного вещества, такого как лауроилсаркозинат натрия, протеаза, такая как протеиназа K, соль или хаотропный реагент, такой как хлорид лития, гуанидин, тиоцианат гуанидиния, мочевина, восстанавливающий реагент, такой как дитиотреитол (DTT), хелатообразующее вещество, такое как этилендиаминтетрауксусная кислота (EDTA), и буферное вещество, такое как трис(гидроксиметил)аминометан (Tris). Хорошо известные гуанидин и тиоцианат гуанидиния проявляют сильную ингибиторную активность по отношению к дезоксирибонуклеазе и рибонуклеазе в молярной концентрации. Лизирующие реагенты могут присутствовать в растворе или в высушенной (дегидратированной) форме, полученной, например, посредством лиофилизации (сублимационной сушки), или образовывать покрытие посредством распыления внутри лизирующего контейнера.
Образцы, представляющие собой водные текучие среды, такие как кровь, плазма, сыворотка, мокрота, слюна, моча, спинномозговая жидкость (СМЖ), плевральный выпот, перитонеальный выпот, синовиальная жидкость и т.д., можно непосредственно или с дополнительной водой вводить в лизирующий контейнер, используя пипетку или транспортировочный контейнер для образцов, такой как первый шприц, имеющий относительно длинную иглу (обсуждается выше, но не проиллюстрировано на чертеже). Когда водная текучая среда вводится в лизирующий контейнер, образец текучей среды смешивается с лизирующим раствором или повторно гидратирует высушенные лизирующие реагенты, образуя смесь полного образца и лизирующего буферного раствора. Предпочтительные образцы представляют собой плазма или сыворотка, и предпочтительные объемы собранной плазмы или сыворотки находятся в интервале от 1 до 20 мл, предпочтительнее по меньшей мере 2 мл, еще предпочтительнее от 2 до 10 мл и наиболее предпочтительно от 2 до 5 мл.
Другие образцы в высоковязкой форме или в полутвердой и твердой формах, такие как гной, клеточные суспензии и ткани, можно вводить в лизирующий контейнер с дополнительной водой в таком количестве, которое требуется для повторной гидратации высушенных лизирующих реагентов для поддерживания оптимального соотношения объема образца и лизирующего раствора.
Инкубация в процесс лизиса может ускоряться при повышенных температурах (составляющих более чем температура окружающей среды или комнатная температура) посредством помещения лизирующего контейнера в ванну с горячей водой или нагревательный блок. Повышенная температура для лизиса может составлять, например, от 50 до 65°C, когда в качестве лизирующего фермента присутствует протеиназа K. Период инкубации для завершения лизиса образца, как правило, находится в интервале от 5 мин до 4 ч или предпочтительнее в интервале от 10 до30 мин, но настоящее изобретение не ограничивается каким-либо конкретным периодом инкубации.
При завершении лизиса образца после короткого периода инкубации связующий и экстрагирующий раствор можно вводить в лизирующий контейнер, используя пипетку или шприц или осуществляя выливание из содержащего связующий и экстрагирующий раствор контейнера (не проиллюстрировано).
Полная смесь, содержащая лизирующие, связующие и экстрагирующие водный образец текучие среды, переносится в приемник через транспортировочный контейнер для образца, такой как шприц (не проиллюстрировано), для экстракционной обработки. Приемник служит в качестве контейнера для сбора отходов, в котором собираются все жидкие отходы от осуществляемых процессов экстракции и промывания.
Согласно предпочтительному варианту осуществления, после экстракции собранный образец можно подвергать дополнительной обработке, осуществляя следующие этапы:
1. Промывание промывочным буферным раствором для удаления загрязнений из биологических образцов и очистки солей от экстрагирующего и лизирующего буферного раствора, которые могли бы в других условиях препятствовать или задерживать последующие приложения. Согласно предпочтительному варианту осуществления, относительно большой объем можно использоваться на единственном этапе промывания. Предпочтительный объем может находиться в интервале от 1 до 10 мл, предпочтительнее от 1 до 5 мл или наиболее предпочтительно от 2 до 4 мл. С другой стороны, в стандартных процедурах обычно осуществляются два этапа промывания с использованием двух различных промывочных буферных растворов, причем объемы каждого из них составляют, как правило, менее чем 1 мл вследствие ограничений размера колонки, которые определяются размером центрифуги.
2. Промывание неводным дегидратитрующим веществом, представляющим собой, например, 100% этанол (предпочтительно) или 100% ацетон, для дополнительной очистки от примесей и дегидратации матрицы. Здесь также относительно большой объем используется для дегидратации матрицы в целях сохранения цНК. Предпочтительный объем этанола или ацетона в качестве промывочной жидкости находится в интервале от 1 до 10 мл, предпочтительнее по меньшей мере 2 мл или наиболее предпочтительно от 2 до 6 мл. С другой стороны, и в этом случае стандартные процедуры обычно осуществляют, используя менее чем 1 мл жидкости вследствие вышеупомянутых ограничений размера. В некоторых традиционных процедурах могут совершенно не использоваться этанол, ацетон или другие дегидратирующие промывочные жидкости.
Хотя на чертеже проиллюстрированы выступ на фильтрационной колонке и соответствующая выемка на транспортировочном контейнере, может присутствовать любой элемент, расположенный на фильтрационной колонке, выполненный с возможностью высвобождаемого зацепления с взаимодействующими вторым элементом, расположенным на транспортировочном контейнере и способным передавать достаточное усилие фильтрационной колонке для отвинчивания ее резьбового интерфейса с крышкой приемника. Аналогичным образом, хотя проиллюстрировано резьбовой интерфейс между фильтрационной колонкой и крышкой приемника, может использоваться блокировочное соединение любого типа, и во взаимодействующих элементах такой системы может использоваться любой тип взаимодействия между транспортировочным контейнером и фильтрационной колонкой для отсоединения фильтрационной колонки от крышки предпочтительно в стерильных условиях.
Система для сбора образца может иметь трехходовой клапан, расположенный между транспортировочным контейнером для образца и отверстие для сбора образцов на крышке приемника. Такой трехходовой клапан может иметь первое отверстие, выполненное с возможностью присоединения к отверстию для соединения с образцом в крышке приемника, второе отверстие, выполненное с возможностью присоединения к транспортировочному контейнеру, и третье отверстие, выполненное с возможностью присоединения к источнику текучей среды, содержащему текучую среду, такую как промывочная текучая среда, содержащая этанол, для обработки образца после его сбора. Набор для сбора нуклеиновой кислоты может содержать текучую среду в таком количестве, которое требуется для обеспечения желательного уровня промывания, стабилизации или обработки другого типа. Согласно одному варианту осуществления, контейнер для сбора образца может содержать шприц, и трехходовой клапан может содержать обратный клапан, выполненный с возможностью пропускания исключительно потока из транспортировочного контейнера в приемник, когда существует положительное относительное давление между транспортировочным контейнером для образца и приемником, и пропускания исключительно потока из источника текучей среды в транспортировочный контейнер, когда существует отрицательное относительное давление между транспортировочным контейнером для образца и источником текучей среды. Таким образом, когда нажимается поршень шприца, текучая среда выпускается через фильтрационную колонку, а когда поршень шприца вытягивается, текучая среда из присоединенного источника текучей среды наполняет шприц. Соответственно, повторные движения, включающие нажатие, вытягивание и нажатие шприца могут приводить к тому, выпускается исходный образец, промывочная текучая среда втягивается в шприц, и промывочная текучая среда выпускается в приемник. Таким образом, повторное нажатие и вытягивание поршня можно осуществлять как этапы промывания в таком количестве, которое может быть желательным.
Фильтрационные колонки могут иметь такой размер для расположения внутри держателя образца (не проиллюстрировано), выполненного с возможностью приема множества фильтрационных колонок и установки на центрифуге в целях совместного одновременного центрифугирования множества фильтрационных колонок, например, но не ограничиваясь этим, размер, приспособленный для 96-ячеечного формата для полуавтоматической или полностью автоматической обработки и загрузки.
Система для сбора образца может продаваться как часть набора, содержащего один или несколько предметов, требуемых для осуществления исследования определенного типа, таких как, но не ограничиваясь этим, следующие предметы: интерфейс для получения образца текучей среды пациента (такое как игла и шприц, которым извлекается кровь, сыворотка, плазма или другая текучая среда организма), лизирующий раствор для разложения клеток или частиц в образце текучей среды, лизирующий контейнер для содержания образца вместе с лизирующим раствором в течение желательного периода времени, транспортировочный контейнер для образца (такой как шприц или другой трубчатый контейнер), который описан выше, для совмещения с приемником, который описан выше, крышка приемника с установленной в ней фильтрационной колонкой, которая описана выше, любая текучая среда для промывания или обработки другого типа, которая требуется в целях подготовки или стабилизации образца для транспортировки, а также транспортировочный контейнер, который описан выше.
Согласно другим вариантам осуществления, различные части могут продаваться отдельно. В идеальном случае, для исследований большинства типов и, в частности, для описанного выше способа обнаружения туберкулеза все части, которые вступают в контакт с образцом или содержащей образец текучей средой с момента получения образца пациента до момента осаждения нуклеиновой кислоты на субстрате в фильтрационной колонке, должны быть стерильными и не загрязненными нуклеиновыми кислотами из любых других источников, таких как, например, оператор или окружающая среда, а также должно отсутствовать загрязнение повсеместно существующими дезоксирибонуклеазами и рибонуклеазами, которые быстро разлагают нуклеиновую кислоту. Разнообразные контейнеры, шприцы и приемники, которые обсуждаются в настоящем документе, могут представлять собой стандартные компоненты, хорошо известные в области медицинских лабораторных исследований. Однако новая крышка приемника с присоединенной фильтрационной колонкой специально предназначается для данной конкретной системы сбора образца.
Таким образом, следующий аспект настоящего изобретения может содержать стерильную съемную крышку для приемника, причем данная крышка имеет внутреннюю сторону, обращенную к внутреннему объему приемника, и внешнюю сторону, противоположную внутренней стороне, крышка содержит вентиляционное отверстие в сообщении между внутренней стороной и внешней стороной, и отверстие для соединения с образцом в сообщении между внутренней стороной и внешней стороной, причем отверстие для соединения с образцом содержит первый блокировочный компонент, который запирает с высвобождением отверстие для соединения с образцом с взаимодействующим вторым блокировочным компонентом, внутренняя сторона крышки содержит соединительный интерфейс в сообщении по текучей среде с отверстием для соединения с образцом. Съемная крышка, которая описана выше, может продаваться отдельно или, согласно другому варианту осуществления, в комплекте со стерильной фильтрационной колонкой, которая описана в настоящем описании, съемно присоединяемой к соединительному интерфейсу крышки приемника.
Все части системы, которая описана в настоящем описании, могут быть выполнены любым способом, известным в уровне техники, таким как инжекционное формование термопластических материалов. Предпочтительные термопластические материалы представляют собой полиэтилен (PE), полипропилен (PP) и полиэтилентерефталат (PET), но настоящее изобретение не ограничивается каким-либо определенным материалом или способом изготовления.
Примерный способ использования системы, которая описывается в настоящем описании, может включать в себя осуществление следующих этапов:
(a) сбор объема содержащей образец текучей среды, который можно обрабатывать и инкубировать в контейнере с лизирующим буферным раствором и связующим буферным раствором, содержащим хаотропные реагенты, соли и осаждающее вещество, такое как спирт, чтобы высвобождать нуклеиновые кислоты из комплексов, клеток или других частиц в биологическом образце; неочищенный лизат можно транспортировать в транспортировочном контейнере для образцов (таком как шприц), или этап сбора образца может осуществляться в подходящем транспортировочном контейнере для образца;
(b) присоединение транспортировочного контейнера для образца к приемнику через отверстие для сбора образца;
(c) пропускание объема содержащей образец текучей среды из транспортировочного контейнера для образца через фильтрационную колонку, в результате чего нуклеиновая кислота собирается в неочищенном лизированном образце на субстрате, а остаток собирается в приемнике;
(d) промывание связывающей нуклеиновую кислоту фильтрующей матрицы в колонке промывочными буферными растворами;
(e) дегидратация (а также одновременное дополнительное промывание и обессоливание) связывающей нуклеиновую кислоту матрицы посредством пропускания через колонку объема растворителя, предпочтительно 100% этанола или ацетона;
(f) помещение нижнего участка транспортировочного контейнера над фильтрационной колонкой, соединение фильтрационной колонки с транспортировочным контейнером и отсоединение фильтрационной колонки от крышки приемника;
(g) временное запечатывание транспортировочного контейнера посредством соединения верхнего участка транспортировочного контейнера и нижнего участка транспортировочного контейнера. Запечатанный транспортировочный контейнер предпочтительно имеет карман, содержащий абсорбирующее влагу вещество (влагопоглотитель), такой как гель диоксида кремния в форме гранул или шариков.
В отличие от молекул ДНК, которые являются относительно устойчивыми, молекулы РНК являются более подверженными разложению вследствие способности 2'- гидроксильных групп вблизи фосфодиэфирных связей в РНК выступать в качестве внутримолекулярных нуклеофилов в процессах гидролиза, катализируемых основаниями и ферментами.
Этап промывания (d) может включать в себя этап обработки собранного образца на субстрате посредством пропускания одного или более объемов текучей среды для обработки через фильтрационную колонку. Например, обработка может включать в себя этап стабилизации образца нуклеиновой кислоты для транспортировки, такую как промывание образца промывочной текучей средой, например, текучей средой, содержащей этанол. Согласно одному варианту осуществления, в котором транспортировочный контейнер для образца содержит шприц, способ пропускания объема через фильтрационную колонку может включать в себя этап приложения давления вручную к поршню шприца. Согласно другому варианту осуществления, в котором транспортировочный контейнер для образца содержит шприц, способ пропускания объема через фильтрационную колонку может включать в себя этап присоединения вентиляционного отверстия крышки приемника к источнику вакуума, а затем приложения отрицательного давления к фильтрационной колонке с использованием источника вакуума. Такой способ может осуществляться посредством помещения приемника в одну из ячеек вакуумной камеры, которая проиллюстрирована на фиг.5, и присоединения вентиляционного отверстия крышки приемника к соседнему вакуумному отверстию. После подготовки для последующего анализа нуклеиновых кислот связанная на субстрате нуклеиновая кислота в фильтрующей колонке высвобождается и элюируется из фильтрационной колонки, например, посредством добавления небольшого количества элюируюшего буферного раствора или чистой воды на фильтр (твердую матрицу) в целях высвобождения связанной нуклеиновой кислоты, и элюат собирается в другом небольшом контейнере посредством приложения давления к колонке или предпочтительно посредством центрифугирования.
Не ограничиваясь каким-либо конкретным применением, вышеупомянутая система для сбора образца может оказаться особенно пригодной для использования в сочетании со способом обнаружения туберкулеза, как описывается далее в настоящем описании. Однако данная система и способ могут оказаться особенно полезными в сочетании с любым способом, в котором используется сбор вкНК для диагностики, таким как способы ранней диагностики генетических внутриутробных заболеваний плода, диагностики опухолей и инфекций в глубоких тканях, таких как латентная туберкулезная инфекция (ЛТБИ). Таким образом, данная система и способ могут оказаться особенно полезными в сочетании с любыми способами, основанными на исследовании материалов НК, которые содержат изменения информации НК, определяемые в организме хозяина. Система и способы, которые описаны в настоящем описании, являются особенно пригодными для использования в областях, в которых большое значение имеют выделение и сохранение. Для обнаружения вкНК в низких концентрациях в крови требуется образец относительно большого объема (2-5-10 мл), потому что при добавлении реагентов суммарный объем часто достигает уровня от 20 до 50 мл, и такой большой объем трудно обрабатывать в ручном или автоматическом режиме, используя ранее существовавшие процессы. РНК представляет собой проблемы вследствие своей низкой устойчивости. Соответственно, данный способ и система являются особенно хорошо пригодными для процессов, основанных на обнаружении низких концентраций вкНК, в частности РНК, в текучих средах организма.
ПРИМЕРЫ
Пример 1. Изготовление устройства для экстракции в ручном режиме (MOE)
Изготавливали прототип фильтрационной колонки 200, которая проиллюстрирована на фиг.4.
Фильтрационная колонка Mobicol от компании Boca Scientific (штат Флорида, США) содержала пористый стеклоцемент в качестве фильтра 214, установленного в колонку. Имеющую подходящий размер абсорбционную матрицу 212 в форме диска вырезали из стекловолоконной фильтровальной бумаги типа GF/D от компании Whatman (штат Нью-Джерси, США) и помещали поверх пористого фильтра, а затем тефлоновое упорное кольцо 216 от компании The O-Ring Store (theoringstore.com) плотно устанавливали поверх диска абсорбционной матрицы, чтобы фиксировать сборку. Крышку, имеющую винтовое соединение Люэра на верхнем участке, навинчивали и запечатывали на фильтрационной колонке. На крышку с присоединенной фильтрационной колонкой затем навинчивали и запечатывали пустую пластмассовую одноразовую центрифужную пробирку объемом 50 мл. Все устройство, которое описано выше, далее называется в настоящем описании термином «устройство для экстракции в ручном режиме» (MOE - Mannyally-Operated Extraction). На имеющую наконечник Люэра крышку с присоединенной ниже фильтрационной колонкой MOE навинчивали и запечатывали пластмассовую одноразовую центрифужную пробирку объемом 50 мл. Многочисленные фильтрующие устройства MOE, которые используются в следующих примерах, можно изготавливать таким же способом.
Пример 2. Экстракция внеклеточных нуклеиновых кислот из телячьей сыворотки
В данном эксперименте имеющаяся в продаже замороженная телячья сыворотка (ТС) использовалась как экспериментальный модельный биоматериал, поскольку она представляет собой экономичный и достаточный источник, в котором содержатся имеющие природное происхождение бычьи внеклеточные нуклеиновые кислоты. Интерпретация количественных результатов исследования данной ТС в отношении обнаруженных последовательностей нуклеиновых кислот должна ограничиваться данной партией. Используемая ТС, а именно телячья сыворотка HyClone™ (номер по каталогу SH30072.03), поставлялась компанией Fisher Scientific (штат Массачусетс, США). После доставки ТС размораживали при комнатной температуре в процессе встряхивания. После полного размораживания ТС разделяли на аликвоты и повторно замораживали до использования. В целях соответствия все аликвоты ТС размораживали при комнатной температуре один раз только непосредственно перед использованием.
Содержащиеся в телячьей сыворотке вкНК экстрагировали, используя набор QIAamp для экстракции циркулирующих Нуклеиновых кислот (номер по каталогу 55114) от компании Qiagen (штат Калифорния, США), согласно инструкциям производителя, в качестве сравнения. Для исследования и сравнения изобретенное устройство и процедуру в полностью ручном режиме экстракции (фильтрационные колонки MOE) использовали вместо колонок Qiagen Mini (колонки QM), содержащихся в наборе. Кроме того, в процессе использования фильтрационной колонки MOE процедуры экстракции и промывания осуществляли, используя пластмассовые одноразовые шприцы, имеющие наконечник Люэра и присоединенные к крышкам с винтовым соединением Люэра на колонке MOE и работая вручную, в то время как в процессе использования колонки Qiagen Mini жидкости переносили посредством пипетки, а процедуры экстракции и промывания осуществляли посредством вакуумного коллектора QIAvac 24 Plus от компании Qiagen (штат Калифорния, США), присоединенного к электрическому вакуумному насосу, согласно содержащейся в наборе инструкции для пользователя.
Четыре аликвоты размороженной ТС (объемом 2 мл каждая) помещали в центрифужные пробирки объемом 50 мл (маркированные как QM и MOE, соответственно), содержащие лизирующий буферный раствор ACL и протеиназу K и инкубировали при 60°C в течение 30 минут. Подходящее количество связующего буферного раствора ACB, содержащего изопропанол, добавляли в каждую пробирку в соответствии с указаниями в инструкции для пользователя. Суммарный объем лизатной смеси составлял приблизительно 8 мл.
Чтобы сравнить результаты, полученные с использованием двух различных экстракционных колонок, по 2 мкл раствора ТБ-ДНК (1,5⋅106 копий/мкл), содержащего короткую двухцепочечную ДНК (60 пар нуклеотидов), добавляли в одну из пробирок QM и MOE, маркированные как QM-TB и MOE-TB, соответственно. Раствор ТБ-ДНК изготавливали с ампликоном полимеразной цепной реакции (ПЦР) фрагмента гена IS6110 из генома штамма h37Rv микобактериального туберкулеза. Двухцепочечная ДНК (дцДНК) добавлялась в ТС как инородная контрольную ДНК (экзогенная по отношению к хозяину). Таким образом, четыре пробирки маркировали как QM, QM+TB, MOE и MOE+TB соответственно.
Содержащую ACB лизатную смесь в пробирке QM переносили в удлинительную трубку, присоединяющую колонку QM к вакуумному коллектору. Процедуры экстракции и промывания с использованием содержащих изопропанол промывочных буферных растворов ACW1 и ACW2 осуществляли посредством пипетки и вакуумирования.
Содержащую ACB лизатную смесь в пробирке MOE втягивали в снабженный наконечником Люэра шприц объемом 20 мл с присоединенной длинной иглой. После этого иглу снимали, и шприц плотно привинчивали к соединительному устройству Люэра крышки 101 на центрифужной пробирке (400) объемом 50 мл. Лизатную смесь в шприце пропускали через связующую матрицу в фильтрационной колонке MOE посредством давления руки. Промывочные буферные растворы ACW1 и ACW2 также переносили и пропускали через фильтрационную колонку MOE, используя шприцы меньшего размера. Объем шприца, который используется согласно настоящему изобретению, должен быть достаточно большим, чтобы в результате этого при добавлении жидкой фазы, находящейся в шприце, оставался достаточный объем воздушной фазы для вытеснения в максимально возможной степени оставшейся жидкости, находящейся в фильтрующей матрице.
Абсорбированные фрагменты цНК в обеих колонках элюировали в 60 мкл буферного раствора AVE посредством центрифугирования при высокой скорости (15000 g). Элюаты использовали немедленно или хранили в замороженном виде.
Порции элюатов, содержащих экстрагированную внеклеточную матричную РНК (мРНК) подвергали обратной транскрипции, используя обратную транксриптазу вируса лейкемии мышей Молони (Moloney) M-MLV (номер по каталогу M170) от компании Promega (штат Висконсин, США) и случайные праймеры к комплементарной ДНК (кДНК), согласно протоколу производителя. Количественное определение вкДНК и вк-мРНК осуществляли методом количественной ПЦР в режиме реального времени, используя набор, содержащий смесь для кПЦР под наименованием SIBO™-SYBR, которую поставляет на продажу компания Occam Biolabs (штат Делавэр). Другие имеющиеся в продаже наборы для кПЦР под наименованием SYBR, такие как идеальная готовая смесь для анализа в режиме реального времени SYBR® Premix DimerEraser™ Perfect Real Time от компании Takara-Clontech (штат Калифорния, США), концентрированная смесь Power SYBR® Green PCR Master Mix от компании Life Technologies (штат Калифорния, США) и суперсмесь для ПЦР в режиме реального времени iQ™ SYBR® Green Supermix 2x Real-Time PCR Mix от компании Bio-Rad (штат Калифорния, США) могут также использоваться для этой цели. Пары праймеров, используемых для исследования методом кПЦР, перечислены в таблице 1. Эти праймеры, мишенями которых являются экзогенная последовательность гена микобактериального туберкулеза IS6110 и эндогенная последовательность митохондриального бычьего гена B. B. Taurus Nd2, предназначаются специально для амплификации коротких последовательностей ДНК. В исследовании методом ОТ-кПЦР прямые праймеры и обратные праймеры, мишенями которых являются различные последовательности обычно используемых конститутивных генов B2M (бета-2-микроглобулин), предназначаются в качестве комплементарных по отношению к различным экзонам, пересекающим интроны большого размера; таким образом, амплифицируются и обнаруживаются только короткие кДНК, которые подвергаются обратной транскрипции от мРНК, но не геномной ДНК.
Эти результаты показывают, что когда используются одинаковые буферные растворы, т.е. ACL, ACB, ACW1, ACW2 и AVE из набора циркулирующих НК QIAamp, как фильтрационная колонка MOE, где осуществляются ручные процедуры с использованием шприца в соответствии с вариант осуществления настоящего изобретения, так колонка Qiagen Mini, для работы которой используется вакуумный насос, имеют сопоставимую эффективность экстракции вкДНК и вкРНК. Результаты также показывают возможность использования фрагментов мРНК в периферическом кровообращении в качестве эндогенного сравнительного стандарта и контроля качества для биологического образца.
Пример 3
В данном примере использовали только фильтрационную колонку MOE со следующими буферными растворами и протоколом:
Буферные растворы:
Лизирующий буферный раствор (LB) содержит: 4 М тиоцианата гуанидиния (GITC), 8% Triton X-100, 100 мкл/мл LB протеиназы K Qiagen (номер по каталогу 19131) от компании Qiagen (штат Калифорния, США).
Связующий буферный раствор (BB) содержит: 3 M GITC, 40% изопропанола (IPA, конечная концентрация), тщательно перемешивается.
Промывочный буферный раствор (WB) содержит: 10 мМ Tris, 2 мМ EDTA, 10 мМ NaCl, 70% этанола, pH 7,0.
Элюирующий буферный раствор: буферный раствор Qiagen AVE (включен в набор циркулирующих нуклеиновых кислот QIAamp).
Протокол:
1. Лизис: поместить 2 мл размороженной ТС, используя шприц объемом 10 мл, снабженный длинной иглой, в пластмассовую центрифужную пробирку объемом 50 мл, содержащую 2 мл LB, тщательно перемешать с завихрением, инкубировать в термоблоке при 60°C в течение 30 мин. Охладить до комнатной температуры.
2. Связывание: поместить 10 мл BB в пробирку с лизатом образца, перемешать с завихрением, выдерживать при комнатной температуре в течение10 мин.
3. Связывание и экстракция: поместить все содержимое пробирки с лизатом объемом 50 мл в шприц объемом от 20 до 30 мл, снабженный наконечником Люэра и длинной иглой, продолжая до тех пор, пока в шприц не войдет приблизительно 5 мл воздуха, привинтить снабженный наконечником Люэра шприц к охватывающему соединительному интерфейсу Люэра на крышке собранного устройства MOE 400, которое плотно зафиксировано на штативе. Нажимать поршень шприца до тех пор, пока жидкость и воздух в шприце полностью не пройдут через фильтрационную колонку. Отходы собрать в пробирку объемом 50 мл устройства MOE. Эта процедура может занимать от 1 до 2 мин. Отвинтить шприц объемом 20 мл.
4. Поместить 4 мл раствора WB в снабженный наконечником Люэра шприц объемом 10 мл, нажать поршень, чтобы пропустить раствор WB через колонка. Отвинтить шприц объемом 10 мл.
5. Поместить 4 мл 100% этанола в шприц объемом 10 мл, нажать поршень, чтобы пропустить этанол через колонку.
6. Отвинтить крышку устройства MOE и отсоединить фильтрационную колонку от крышки. Вставить колонку в не содержащую рибонуклеазы и дезоксирибонуклеазы центрифужную микропробирку объемом от 1,5 до 2 мл, потоком воздуха полностью осушить колонку от остатков этанола.
7. Добавить 100 мкл элюирующего буферного раствора AVE непосредственно на абсорбирующую матрицу в фильтрационной колонке, навинтить крышку на фильтрационную колонку, чтобы предотвратить загрязнение в процессе работы. Выдерживать в течение от 10 до 30 мин для повторной гидратации и выпустить связанную НК из абсорбирующей матрицы.
8. Центрифугировать микропробирку с вставленной внутрь колонкой при скорости от 15000 до 20000 g в течение 3 мин. Собрать элюат для последующего использования или хранить его при температуре от -20 до -80°C.
В данном эксперименте в 6 центрифужных пробирок объемом 50 мл помещали по 2 мл раствора LB, а затем по 2 мл ТС. Кроме того, в каждую из лизирующих пробирок добавляли по 2 мкл десятикратно разбавленного раствора ТБ-ДНК (1,5⋅105 копий/мкл). После этого процедуру осуществляли согласно приведенному выше протоколу вплоть до этапа 6.
После этапа 6 шесть колонок MOE распределяли на три группы идентичных дубликатов (A и B), которые маркировали MOE-0 недель, MOE-2 недели и MOE-4 недели для каждой группы, что означает дополнительную обработку в течение 0 недель, 2 недель и 4 недель, соответственно.
Дополнительную обработку осуществляли следующим образом: колонки, маркированные MOE-0 недель, немедленно направляли на этап 7 описанной выше процедуры; колонки, маркированные MOE-2 недели и MOE-4 недели, выдерживали в новых центрифужных пробирках объемом 50 мл вместе с пакетиками силикагеля в качестве влагопоглотителя, представляющие собой абсорбирующие пакетики Minipax® (номер по каталогу Z163554) массой 0,5 г от компании Sigma-Aldrich (штат Миссури, США). Пробирки объемом 50 мл плотно закрывали и обертывали листками парафиновой пленки Parafilm от компании VWR (штат Пенсильвания, США) для обеспечения полного запечатывания. Пробирки, запечатанные с находящимися внутри фильтрационными колонками, выдерживали при комнатной температуре в течение 2 недель (MOE-2 недели) и 4 недель (MOE-4 недели), соответственно. После окончания соответствующего периода пробирки двух групп открывали, и фильтрационные колонки направляли на этап 7 описанной выше процедуры.
После этапа 8 все элюаты анализировали методом кПЦР и ОТ-кПЦР, как описано в примере 2. Результаты проиллюстрированы в таблице 3.
При сопоставлении значений порога насыщения (Ct) образцов, элюированных из колонок немедленно, и образцов, элюированных после выдерживания при комнатной температуре в течение 2 недель и 4 недель, неожиданно было обнаружено, что во всех из различных частицах фрагментов вкНК, исследованных методами кПЦР и ОТ-кПЦР, количество и, таким образом, была почти одинаковой целостность (возможность амплификации). Напротив, когда фильтрационные колонки после этапа 7 выдерживали в условиях нормальной влажности и комнатной температуры в течение более дней, абсорбированные вкНК, в частности, частицы РНК, разлагались и не могли амплифицироваться (данные не проиллюстрированы).
Этот неожиданно обнаруженный факт означает, что после экстракции абсорбированные вкНК, в частности, чувствительные вкРНК на фильтрующей матрице, могут стабилизироваться и хорошо сохраняться при комнатной температуре. Большой объем этанола (в данном случае 4 мл), который промывает пористую абсорбционную матрицу, а также сохраняет абсорбированный НК в дегидратированном состоянии в замкнутых условиях в присутствии влагопоглотителя, эффективно защищая РНК от разложения. Простая экономичная обработка абсорбированной НК представляет собой легкий способ обработки, хранения и транспортировки биологических образцов.
Пример 4. Обнаружение специфических для патогенов последовательностей нуклеиновых кислот в периферической крови человека
Свежую периферическую кровь человека получали от двух взрослых человек (здоровый человек в качестве контроля и человек с подозреваемой латентной туберкулезной инфекции, КЗ и ЛТБИ, соответственно). Человек с ЛТБИ определяется как проявляющий положительную кожную реакцию на очищенный от белков среды туберкулин (PPD), если он проживает в стране с низким уровнем туберкулезной инфекции в течение 25 лет, но в течение двух последних лет имел опыт контакта с носителем туберкулеза в стране с высоким уровнем туберкулезной инфекции. В течение двух последних лет человек подвергался исследованию методом рентгеновской компьютерной томографии три раза, исследованию мазка мокроты четыре раза и исследованию туберкулезной культуры три раза. Во всех данных исследованиях получены отрицательные результаты, но кожная реакция на очищенный от белков среды туберкулин (PPD) превращалась из отрицательной в положительную (1,8 см). У человека не было симптомов, характеризующих туберкулез. Профессиональный медик предположительно определил этого человека как имеющего ЛТБИ. Хорошо известны некоторые основные препятствия в диагностике ЛТБИ; в частности, не существует способов получения прямого доказательства бактериальной инфекции в организме с использованием современной технологии. В данном случае не были использованы никакие другие дополнительные исследования в целях диагностики ЛТБИ.
Плазму отделяли от цельной крови посредством центрифугирования (2000 g, 10 мин). Экстракцию цНК осуществляли, используя такую же процедуру, как в примере 3. Фрагменты эндогенных цНК человека в плазме обнаруживали и количественно анализировали методами кПЦР и ОТ-кПЦР, используя 3 пары праймеров, которые представляют собой обычно используемые конститутивные гены B2M (бета-2-микроглобулин) и PPIA (пептидилпролилизомераза A, или циклофилин A), и ND4 (дегидрогеназная субъединица 4 NADH в митохондриальной ДНК), а также TB IS6110-65, для обнаружения специфичных к туберкулезе фрагментов ДНК в периферической крови человека с подозреваемой ЛТБИ.
Праймеры, используемые в примере 4, проиллюстрированы в таблице 4.
Результаты проиллюстрированы в таблице 5 и на фиг.8.
Хотя настоящее изобретение проиллюстрировано и описано в данном описании со ссылкой на конкретные варианты осуществления, не предусматривается ограничение настоящего изобретения представленными характеристиками. Напротив, можно производить разнообразные модификации этих характеристик в пределах объема и серии эквивалентов формулы изобретения и без отклонения от идеи настоящего изобретения.
Реферат
Группа изобретений относится к области биохимии. Предложена система и способ для сбора нуклеиновой кислоты из образца текучей среды организма, а также стерильная съемная крышка для приемника для сбора отходов. Система содержит приемник, съемную крышку для приемника с вентиляционным отверстием и отверстием для соединения с образцом текучей среды организма, фильтрационную колонку, контейнер для сбора образца текучей среды организма и выполненный с возможностью вмещения фильтрационной колонки транспортировочный контейнер. Способ включает обеспечения образца текучей среды организма в контейнере, присоединение контейнера к приемнику, пропускание данного образца из контейнера через фильтрационную колонку, помещение транспортировочного контейнера над фильтрационной колонкой, зацепление фильтрационной колонки с транспортировочным контейнером и отсоединение фильтрационной колонки от крышки приемника. Изобретения обеспечивают обработку большего объёма образца текучих сред организма и обнаружение низких концентраций внеклеточных нуклеиновых кислот в образце текучих сред организма. 3 н. и 36 з.п. ф-лы, 17 ил., 5 табл., 4 пр.
Формула
Документы, цитированные в отчёте о поиске
Устройство и способ экстракции нуклеиновых кислот

Комментарии