Нитратные соли гипотензивных лекарственных средств - RU2235097C2
Код документа: RU2235097C2
Описание
Настоящее изобретение относится к соединениям и композициям на их основе, используемым в терапии гипертензии и профилактике. Более конкретно, настоящее изобретение относится к использованию вышеупомянутых гипотензивных средств для общего и местного использования, в частности для сердечно-сосудистой области. Более конкретно, настоящее изобретение относится к новым гипотензивным соединениям, имеющим улучшенные характеристики.
Известные из предшествующего уровня техники соединения, используемые в лечении гипертензии, в основном имеют ограниченную эффективность. Лечение гипертензии обычно проводят введением пациенту гипотензивных средств в сочетании с другими лекарственными препаратами, активными в отношении сосудистой системы, такими как, например, кальций-антагонисты, диуретики, бета-блокаторы, АСЕ-ингибиторы (ингибиторы ангиотензин-конвертирующего фермента). Например, гипотензивные антагонисты ангиотензина (например, лозартан), кальций-антагонисты (дигидропиридины), диуретики (например, производные тиазида), прямые и непрямые сосудорасширяющие средства (например, миноксидил, запринаст) не способны при использовании в одиночку обеспечить успешную терапию.
Кроме того, необходимо обратить внимание на то, что некоторые гипотензивные средства вызывают побочные эффекты в отношении дыхательного аппарата, такие как бронхостеноз, одышка. Например, гипотензивные средства, используемые при лечении стенокардии и сердечной аритмии, например тимолол и пропанолол, дают вышеупомянутые побочные явления.
Другие гипотензивные средства вызывают расширение кровеносных сосудов через ингибирование фосфодиэстераз и вызывают побочные эффекты в различных аппаратах (желудочно-кишечном, сердечно-сосудистом, глазном и т.д.). Например, это относится к препаратам силденафилу и запринасту.
Ощущалась потребность в доступных композициях, активных при лечении гипертензивной патологии для общего и местного использования, в частности для сердечно-сосудистой области, с улучшенным терапевтическим профилем. Кроме того, в частности, ощущалась необходимость в доступных гипотензивных лекарственных средствах, имеющих бета-блокирующее или антифосфодиэстеразное действие с уменьшенными побочными эффектами.
Заявитель неожиданно и с удивлением обнаружил соединения и фармацевтические композиции, пригодные для лечения гипертензивных патологий, для общего и местного применения, в частности для сердечно-сосудистой области, с улучшенным терапевтическим профилем и не вызывающие побочные явления, характерные для известных гипотензивных лекарственных средств.
Объектом настоящего изобретения являются нитратные соли соединений, имеющих гипотензивную активность, или фармацевтические композиции на их основе для общего и местного применения, в частности используемые в сердечно-сосудистой области, причем вышеупомянутые соединения отличаются тем, что они содержат, по крайней мере, одну химически активную группу, способную образовывать соль, и вышеупомянутые соединения выбирают из следующих классов:
Класс (A1b):


RA1 - -О с R - свободной валентностью образуют вместе с атомом углерода в 5 положении кетонную группу,
RA1 вместе с R

R
R
R

R
R
R
R
R
R
R
Класс (А1с):

известный как вальзартан;
Класс (А2):
предшественниками этого класса являются следующие соединения:
1(2Н)-фталазинонгидразон (гидралазин); 6-(1-пиперидинил)-2, 4-пиримидиндиамин-3-оксид (миноксидил); 1-[[3-(4,7-дигидро-1-метил-7-оксо-3-пропил-1Н-пиразол[4, 3-d]пиримидин-5-ил)-4-этоксифенил]сульфонил]-4-метилпиперазин (силденафил), 2-(2-пропилоксифенил)-8-азапурин-6-он (запринаст);
Класс (A3):

R
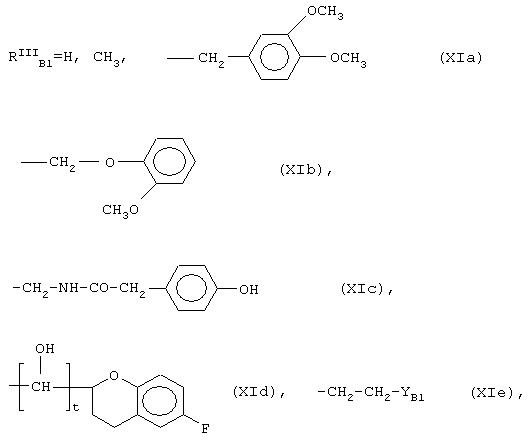
В формуле (XId) t=0,1.
В формуле (XIe) YB1 может иметь следующие значения:

в формуле (XIf) Z=Н, -ОСН3;
в формуле (A3):
XB1 - -O-, -S-;
n и m равны или отличны друг от друга и составляют 0, 1;



в формуле (XIp):
S1 - Н, CN, ОСН3, СН3, -СН2-СН3, -O-CH2-CONH-CH3, -СОСН3, -СО-(СН2)2-СН3, -O-CH2 -CH=CH2, -СН2-СН=СН2, циклопентил или

S2 - Н, СН3, Сl, -SОСН3, -CONH2;
S1 с S2 и атомами углерода во 2 и 3 положениях ароматического кольца из шести атомов углерода вышеупомянутого радикала (XIp) образуют следующее кольцо:

где:
[(*) атом, расположенный рядом с ароматическим кольцом формулы XIpVII] В - -СН2-, -NH-, -СН=СН-,(*)-СО-СН2-;
А - -О-,(*)-СН2-СH(ОН)-,(*)-О-СН2;(*)-S-CH2-, -CН2-СН2-, -СН2-,
когда А является третичным углеродным атомом и одновременно W1 означает свободную валентность, тогда образуется двойная связь -СН=СН- между А и углеродным атомом 1' положении,
когда А в кольце, состоящем из пяти атомов углерода (XIpVII), является третичным атомом углерода, содержащим такой заместитель, что он вместе с атомом углерода в 1' положении и с одним из двух радикалов W1 и W2, причем другой радикал является свободной валентностью, образует ароматическое кольцо, имеющее шесть атомов углерода, согласно следующей формуле:

W1 - Н, свободная валентность, когда W1 является свободной валентностью и А означает третичный атом углерода, как определено выше, образуется двойная связь между А и атомом углерода в 1' положении,
W1 вместе с W2, атомом углерода в 1' положении и заместителем А образует ароматическое кольцо, имеющее шесть атомов углерода;
W2 - свободная валентность, Н, ОН, -СН3, -ONO2, -О, который вместе с W1 - свободной валентностью и атомом углерода в 1' положении образует кетонную группу,
W2 вместе с W1, атомом углерода в 1’ положении и заместителем А образует ароматическое кольцо, имеющее шесть атомов углерода;
S3 - Н, F, Cl, ОН, NO2, -CH2-CO-NH2, -(CH2)2-ОСН3, -NH-СОСН3, -СН2-О-CH2-CH2-O-СН(СН3)2, -СН2-СН2-СООСН3, -NH-CO-N(C2 H5)2. -NН-СО-(СН2)2-СН3, -NH-SO2-СН2, -NН-СО-NН-[циклогексил], -СН2-СН2-O-СН2 -[циклопропил];
S4 - Н, Cl, -СН2-СН2-,
который вместе с атомами углерода в 1 и в 6 положении ароматического кольца того же радикала (ХIр) и с R

S4 является третичным атомом,
который с атомами углерода в 1 и 6 положении ароматического кольца радикала (ХIр) и со
следующими компонентами формулы (A3): атомом углерода - |C|n- (n=1), радикалом XB1, равным кислороду (m=1), и R

R
R
другие соединения, принадлежащие к этому классу, являются следующими:
2-гидрокси-5-[1-гидрокси-2-[(1-метил-3-фенилпропил)амино]этил]бензамид (лабеталол), 1-(4-амино-6,7-диметокси-2-хиназолинил)-4-[(тетрагидро-2-фуранил)карбонил]пиперазин (теразосин), 1 -(4-амино-6,7-диметокси-2-хиназолинил)-4-(2-фуранилкарбонил)пиперазин (празосин);
Класс (А4):
следующие группы соединений относятся к этому классу:
(А4а):
β -[(2-метилпропокси)метил]-N-фенил-N-(фенилметил)-1-пирролидин-этанамин (бепридил), (2S-цис)-3-(ацетилокси)-8-хлор-5-[2-(диметиламино)этил]-2, 3-дигидро-2-(4-метоксифенил)-1,5-бензотиазепин-4(5Н)-он (клентиазем), (2S-цис)-3-(ацетилокси)-5-[2-(диметиламино)этил]-2,3-дигидро-2-(4-метоксифенил)-1,5-бензотиазепин-4(5Н)-он (дилтиазем), γ -фенил-N-(1-фенилэтил)бензолпропанамин (фендилин), α -[3-[[2-(3,4-диметоксифенил)этил]метиламино]пропил]-3,4,5-триметокси-α-(1-метилэтил)бензолацетонитрил (галлопамил), (1S-цис)метоксиуксусная кислота-2-[2[[3-(1Н-бензимидазол-2-ил)пропил]метиламино]этил]-6-фтор-1,2,3,4-тетрагидро-1-(1-метилэтил)-2-нафталиновый эфир (мибефрадил), N-(1-метил-2-фенилэтил)-γ -фенилбензолпропанамин (прениламин), (R)-2-[2-[3-[[2-(1,3-бензодиоксол-5-илокси)-этил]метиламино]пропокси]-5-метоксифенил]-4-метил-2Н-1,4-бензотиазин-3(4Н)-он (семотиадил), N-(1, 1-диметилэтил)-α-метил-γ -фенилбензолпропанамин (теродилин), α-[3-[[2-(3,4-диметоксифенил)этил]метиламино]пропил]-3,4-диметокси-α-(1-метилэтил)-бензолацетонитрил (верапамил);
(А4b):
3-этил-5-метиловый эфир 2-[(2-аминоэтокси)метил]-4-(2-хлорфенил)-1,4-дигидро-6-метил-3,5-пиридиндикарбоновой кислоты (амлодипин), метил-2-оксопропиловый эфир 1,4-дигидро-2,6-диметил-4-(2-нитрофенил)-3, 5-пиридинди-карбоновой кислоты (аранидипин), метил-1-(фенилметил)-3-пирролидиниловый эфир [S-(R*, R*)]-1, 4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридиндикар-боновой кислоты (барнидипин), метил-1-(фенилметил)-3-пиперидиниловй эфир (R*, R*)-±-1,4-дигидро-2, 6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты (бенидипин), 2-метоксиэтил-3-фенил-2-пропениловый эфир (Е)-±-1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты (цильнидипин), 2-[фенил(фенилметил)амино]этиловый эфир 5-(5,5-диметил-1,3, 2-диоксафосфоринан-2-ил)-1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3-пиридинкарбоновой кислоты Р-оксид (эфонидипин), 2-[[(4-фторфенил)-метил]-метиламино]этил-1-метилэтиловый эфир ±-4-(1, 3-бензодиоксол-4-ил)-1,4-дигидро-2,6-диметил-3,5-пиридиндикарбоновой кислоты (эльгодипин), этилметиловый эфир 4-(2, 3-дихлорфенил)-1,4-дигидро-2,6-диметил-3,5-пиридиндикарбоновой кислоты (фелодипин), 5-метил-3-(1-метил)этиловый эфир 4-(4-бензофуразанил)-1,4-дигидро-2,6-диметил-3,5-пиридиндикарбоновой кислоты (исрадипин), диэтиловый эфир (Е)-4-[2-[3-(1,1-диметилэтокси)-3-оксо-1-пропенил]фенил]-1, 4-дигидро-2,6-диметил-3,5-пиридиндикарбоновой кислоты (лацидипин), 2-[(3,3-дифенилпропил)метиламино]-1, 1-диметилэтилметиловый эфир 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты (лерканидипин), 2-[4-(дифенилметил)-1-пиперазинил]-этилметиловый эфир 1,4-дигидро-2, 6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты (манидипин), метил-2-[метил(фенилметил)-амино]этиловый эфир 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты (никардипин), диметиловый эфир 1,4-дигидро-2,6-диметил-4-(2-нитрофенил)-3, 5-пиридиндикарбоновой кислоты (нифедипин), 3-метил-5-(1-метилэтил)эфир 2-циано-1,4-дигидро-6-метил-4-(3-нитрофенил)-3, 5-пиридиндикарбоновой кислоты (нильвадипин), 2-метоксиэтил-1-метилэтиловый эфир 1, 4-дигадро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты (нимодипин), метил-2-метилпропиловый эфир 1, 4-дигидро-2,6-диметил-4-(2-нитрофенил)-3,5-пиридиндикарбоновой кислоты (низольдипин), этилметиловый эфир 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты (нитрендипин);
(А4с):
1-(дифенилметил)-4-(3-фенил-2-пропенил)пиперазин (циннаризин), (Е)-1-[бис(4-фторфенил)метил]-4-(3-фенил-2-пропенил)пиперазин (флунаризин), 4-[4, 4-бис(4-фторфенил)бутил]-N-(2,6-диметилфенил)-1-пиперазинацетамид (лидофлазин), 1-[бис(4-фторфенил)метил]-4-[(2,3,4-триметоксифенил)метил]пиперазин (ломеризин);
(A4d):
N, N-диметил-3-[[1-(фенилметил)-циклогептил]окси]-1-пропанамин (бенцик-лан), 1-[2-[2-(диэтиламино)этокси]фенил]-3-фенил-1-пропанон (этафенон), 3, 4-диметокси-N-метил-N-[3-[4-[[2-(1-метилэтил)-1-индолизинил]сульфонил]фенокси]-пропил]бензолэтанамин (фантофарон);
Класс (А7):
следующие группы соединений принадлежат к этому классу:
(А7а):
6-хлор-3,4-дигидро-3-[(2-пропенилтио)метил]-2Н-1,2, 4-бензотиадиазин-7-сульфонамид-1,1-диоксид (альтиазид), 3, 4-дигидро-3-(фенилметил)-6-(трифтор-метил)-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (бендрофлуметиазид), 6-хлор-3-[[(фенилметил)тио]метил]-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (бензтиазид), 6-хлор-3,4-дигидро-3-(фенилметил)-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (бензилгидрохлортиазид), 6-хлор-3,4-дигидро-3-(2-метилропил)-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1, 1-диоксид (бутиазид), 6-хлор-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (хлортиазид), 2-хлор-5-(2,3-дигидро-1-гидрокси-3-оксо-1Н-изоиндол-1-ил)бензебесульфонамид (хлорталидон), 6-хлор-3-(циклопентилметил)-3,4-дигидро-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (ииклопентиазид), 3-бицикло[2.2.1]-гепт-5-ен-2-ил-6-хлор-3,4-дигидро-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1, 1-диоксид (циклотиазид), 6-хлор-3,4-дигидро-3-[[(2,2,2-трифторэтил)тио]метил]-2Н-1,2, 4-бензотиадиазин-7-сульфонамид-1,1-диоксид (эпитиазид), 6-хлор-3-этил-3,4-дигидро-2Н-1,2, 4-бензо-тиадиазин-7-сульфонамид-1,1-диоксид (этиазид), 7-хлор-1,2,3, 4-тетрагидро-4-оксо-2-фенил-6-хиназолинсульфонамид (фенхизон), 3-(аминосульфонил)-4-хлор-N-(2, 3-дигидро-2-метил-1Н-индол-1-ил)бензамид (индапамид), 6-хлор-3,4-дигидро-2Н-1,2, 4-бензотиадиазин-7-сульфонамид-1,1-диоксид (гидрохлортиазид), 3,4-дигидро-6-(трифторметил)-2Н-1,2, 4-бензотиадиазин-7-сульфонамид-1,1 -диоксид (гидрофлуметиазид), 6-хлор-3-(хлорметил)-3, 4-дигидро-2-метил-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (метиклотиазид), 3, 4-дигидро-6-метил-2Н-1-бензотиопиран-7-сульфонамид-1,1-диоксид (метикран), 7-хлор-1,2,3, 4-тетрагидро-2-метил-3-(2-метилфенил)-4-оксо-6-хиназолинсульфонамид (метолазон), 6-хлор-3-[(4-фторфенил)-метил]-3,4-дигидро-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (парафлутизид), 6-хлор-3, 4-дигидро-2-метил-3-[[(2,2,2-трифторэтил)тио]-метил]-2Н-1,2, 4-бензотиадиазин-7-сульфонамид-1,1-диоксид (политиазид), 7-хлор-2-этил-1,2,3,4-тетрагидро-4-оксо-6-хиназолинсульфонамид (хинетазон), 6-хлор-3,4-дигидро-3-трихлорметил-2Н-1,2, 4-бензотиадиазин-7-сульфонамид-1,1 -диоксид (теклотиазид), 6-хлор-3-(дихлорметил)-3,4-дигидро-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (трихлорметиазид);
(А7b):
3,7-дигидро-1,3-диметил-7-(4-морфолинилметил)-1Н-пурин-2,6-дион(7-морфолинометилтеофиллин), 3,7-дигидро-1-(2-гидроксипропил)-3, 7-диметил-1Н-пурин-2,6-дион (протеобромин), 3,7-дигидро-3, 7-диметил-1Н-пурин-2,6-дион (теобромин);
(А7с):
6-амино-3-этил-1-(2-пропенил)-2,4-(1Н, 3Н)-пиримидиндион (аминометрадин), 6-амино-3-метил-1-(2-метил-2-пропенил)-2,4-(1Н, 3Н)-пиримидиндион (амизометрадин);
(A7d):
N-фенил-1,3,5-триазин-2,4-диамин (аманозин), 3, 5-диамино-N-(аминоиминометил)-6-хлорпиразинкарбоксамид (амилорид), N-(4-хлорфенил)-1,3,5-триазин-2,4-диамин (хлоразанил), этиловый эфир [3-метил-4-оксо-5-(1-пиперидинил)-2-тиазолидинилиден]уксусной кислоты (этозолин), 6-гидразино-3-пиридазинкарбоксамид (гидракарбазин), 5-амино-2[1-(3,4-дихлорфенил)этил]-2,4-дигидро-3Н-пиразол-3-он (музолимин), 2-(2,2-дициклогексилэтил)пиперидин (пергекселин), 6-фенил-2,4,7-птеридинтриамин (триамтерен), 3-(аминосульфонил)-5-(бутиламино)-4-фенокси-бензойная кислота (буметанид), 5-(аминосульфонил)-4-хлор-2-[(2-фуранилметил)-амино]бензойная кислота (фуросемид), N-[[(1-метилэтил)амино]карбонил]-4-[(3-метилфенил)амино]-3-пиридинсульфонамид (торасемид);
Класс (А8): Апоморфин.
Предпочтительными соединениями (A1b) класса являются
следующие: когда XA1=(IXa), RA1- СН2OН, R
Предпочтительными соединениями (А2) класса являются следующие:
1-[[3-(4, 7-дигидро-1-метил-7-оксо-3-пропил-1Н-пиразол[4,3-d-пиримидин-5-ил)-4-этоксифенил]сульфонил]-4-метилпиперазин (силденафил), 2-(2-пропилоксифенил)-8-азапурин-6-он (запринаст).
Предпочтительными соединениями (A3) класса являются следующие:
когда R
как в атенололе, но с R
как в атенололе, но с S3=S2=S4- Н, S1- -СН2-СН=СН2, это остаток альпренолола;
как в атенололе, но с S1- СОСН3, S3- -NН-СО-(СН2)2-СН3, S2=S4- H, это остаток ацебутолола;
как в атенололе, но с S3- -СН2-СН2-O-СН2-(циклопропил), это остаток бетаксолола;
как в атенололе, но с S3- -СН2-O-СН2-СН2-O-СН(СН3)2, это остаток бисопролола;
как в альпренололе, но с S1=(XIpII) и R
как в буфетололе, но с S1- -CN, это остаток бинитролола;
как в буфетололе, но с S1- Н, S4- Cl, S2- CH3, это остаток бупранолола;
как в буфетололе, но с S1 - -СО-(СН2)2-СН3, S3- F, это остаток бутофилолола;
как в атенололе, но с R
как в буфетололе, но с R
как в буфетололе, но с S3- -NH-CO-N(C2H5)2, S1- -СО-СН3, это остаток целипролола;
как в буфетололе, но с S1- -O-СН2-СОNН-СН3, это остаток цетамолола;
как в бупранололе, но с S2- Cl, это остаток хлоранолола;
как в атенололе, но с S3- -СН2-СН2-СООСН3, это остаток эсмолола;
как в атенололе, но с R
как в
картеололе, но в R
как в картеололе, но с R
как в атенололе, но с S3- -(СН2)2-ОСН3, это остаток метопролола;
как в картеололе, но в R
как в атенололе, но с S3- NO2, это остаток нифеналола;
как в мепиндололе, но в R
как в альпренололе, но с S1- -O-СН2-СН=СН2, это остаток окспренолола;
как в буфетололе, но с S1 - циклопентил, это остаток пенбутолола;
как в мепиндололе, но с W2- H, это остаток пиндолола;
как в атенололе, но с S3- -NH-СОСН3, это остаток практолола;
как в буфетололе, но с S1- H, S3- -NН-СО-NН-(циклогексил), это остаток талинолола;
как в нипрадилоле, но с R
как в тертатололе, но
с R
как в буфетололе, но с R
как в буфетололе, но с S1=S2- СН3, это остаток ксибенолола;
как в ксибенололе, но с R
как в толипрололе, но с R
как в каразололе, но с R
когда в
формуле (A3) R
как в буфетололе, но с R
когда в формуле (A3) m=n=0 и R
как в атенололе, но с R
как
в бутидрине, но с R
как в бевантололе, но с S2- Н, S1- CN, R
как в бутидрине, но с R
как в пронеталоле, но с m=1 и XB1- -О-, и R
как в пронеталоле, но с R
как в дилевалоле, но с S2- SOCH3, и в пара положении к другому ароматическому кольцу (формула XIf) Z - -ОСН3, это остаток сульфиналола;
когда в формуле (A3) R
2-гидрокси-5-[1-гидрокси-2-[(1-метил-3-фенилпропил)амино]этил]бензамид (лабеталол), 1-(4-амино-6, 7-диметокси-2-хиназолинил)-4-[(тетрагидро-2-фуранил)-карбонил]пиперазин (теразосин), 1-(4-амино-6, 7-диметокси-2-хиназолинил)-4-(2-фуранилкарбонил)пиперазин (празосин), бензонитрил, 2-[2-гидрокси-3-[[2-(1Н-индол-3-ил)-1,1-диметилэтил]амино]пропокси (буциндолол).
В классе (А4) предпочтительны следующие соединения:
(А4a):
(2S-цис)-3-(ацетилокси)-5-[2-(диметиламино)этил]-2,3-дигидро-2-(4-метоксифенил)-1,5-бензотиазепин-4(5Н)-он (дилтиазем), α-[3-[[2-(3,4-диметоксифенил)этил]метиламино]пропил]-3, 4-диметокси-α-(1-метилэтил)-бензолацетонитрил (верапамил);
(А4b):
3-этил-5-метиловый эфир 2-[(2-аминоэтокси)метил]-4-(2-хлорфенил)-1,4-дигидро-6-метил-3, 5-пиридиндикарбоновой кислоты (амлодипин), этилметиловый эфир 4-(2,3-дихлорфенил)-1,4-дигидро-2,6-диметил-3,5-пиридиндикарбоновой кислоты (фелодипин), 5-метил-3-(1-метил)этиловый эфир 4-(4-бензофуразанил)-1,4-дигидро-2,6-диметил-3,5-пиридиндикарбоновой кислоты (исрадипин), лерканидипин, метил-2[метил(фенилметил)амино]этиловый эфир 1, 4-дигидро-2,6-диметил-4-(3-нитрофенил)-3, 5-пиридиндикарбоновой кислоты (никардипин), диметиловый эфир 1,4-дигидро-2,6-диметил-4-(2-нитрофенил)-3,5-пиридиндикарбоновой кислоты (нифедипин), 2-метоксиэтил-1-метилэтиловый эфир 1,4-дигидро-2, 6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты (нимодипин), метил-2-метилпропиловый эфир 1,4-дигидро-2,6-диметил-4-(2-нитрофенил)-3, 5-пиридиндикарбоновой кислоты (нисолдипин), этилметиловый эфир 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридиндикарбоновой кислоты (нитрендипин);
(А4с):
(Е)-1-[бис(4-фторфенил)метил]-4-(3-фенил-2-пропенил)пиперазин (флунаризин).
В классе (А7) предпочтительными соединениями являются следующие:
(А7а):
6-хлор-2Н-1,2,4-бензотиадиазин-7-сульфонамид-1,1-диоксид (хлортиазид), 2-хлор-5-(2,3-дигидро-1-гидрокси-3-оксо-1Н-изоиндол-1-ил)бензебесульфонамид (хлорталидон), 6-хлор-3,4-дигидро-2Н-1,2, 4-бензотиадиазин-7-сульфонамид-1,1-диоксид (гидрохлортиазид), 3-(аминосульфонил)-4-хлор-N-(2,3-дигидро-2-метил-1Н-индол-1-ил)бензамид (индапамид), 7-хлор-1,2,3, 4-тетрагидро-2-метил-3-(2-метилфенил)-4-оксо-6-хиназолинсульфонамид (метолазон), 7-хлор-2-этил-1,2,3,4-тетрагидро-4-оксо-6-хиназолинсульфонамид (хинетазон);
(A7d):
3, 5-диамино-N-(аминоиминометил)-6-хлорпиразинкарбоксамид (амилорид), 6-фенил-2,4,7-птеридинтриамин (триамтерен), 3-(аминосульфонил)-5-(бутиламино)-4-феноксибензойная кислота (буметанид), 5-(аминосульфонил)-4-хлор-2-[(2-фуранилметил)амино]бензойная кислота (фуросемид), N-[[(1-метилэтил)амино]-карбонил]-4-[(3-метилфенил)амино]-3-пиридинсульфонамид (торасемид).
Особенно предпочтительными соединениями согласно настоящему изобретению являются следующие:
Класс (A1b): лозартан;
Класс (А2): силденафил, запринаст;
Класс (A3): атенолол, лабеталол, тимолол, празосин, теразосин, пропанолол;
Класс (А4): никардипин, нифедипин, нимодипин;
Класс (А7) хлортиазид, амилорид, фуросемид.
Предшественники солей вышеупомянутых классов получают согласно способам, описанным в "The Merck Index 12a Ed." (1996). Способ получения запринаста описан в патенте Германии 2162096. Способ получения буциндолола описан в патенте Великобритании 2001633.
В композициях согласно настоящему изобретению также могут использоваться изомеры соединений, принадлежащих к вышеупомянутым классам. Примерами изомеров являются цис-, транс-, оптические изомеры D и L или рацемические соединения, энантиомеры. В основном одна изомерная форма проявляет большую активность по сравнению с другой, например D-форма по сравнению с L-формой или наоборот.
Соли соединений, принадлежащих к этим двум классам, содержат, по крайней мере, моль нитрат иона/моль соединения. Предпочтительно, чтобы соотношение между молями нитратных ионов и предшественником равнялось единице. Соли, имеющие более высокие молярные соотношения, получают, когда в молекуле существуют другие аминогруппы, достаточно основные, чтобы образовывать соли.
Из солей настоящего изобретения формируют соответствующие фармацевтические композиции согласно хорошо известным в данной области методикам совместно с обычными наполнителями; смотри, например, том "Remington's Pharmaceutical Sciences 15a Ed."
Доза солей изобретения в их фармацевтических композициях является одинаковой и в основном она ниже, чем доза их предшественников из вышеупомянутых классов.
Соли настоящего изобретения получают согласно одному из следующих способов.
Когда вещество, способное образовывать соль, доступно как свободное основание или как соответствующая соль, растворимая в органическом растворителе, который предпочтительно не содержит гидроксильных групп, например в ацетонитриле, этилацетате, тетрагидрофуране и т.д., соль получают растворением этого вещества в растворителе при концентрации, предпочтительно равной или выше, чем 10 мас./об.%, добавлением количества концентрированной азотной кислоты, соответствующего молям солеобразующих аминогрупп, присутствующих в веществе. Азотную кислоту предпочтительно разводят в том же растворителе. Предпочтительно во время и после добавления смесь охлаждают до температур 20-0°С. Продукт в основном получают фильтрацией и промывают растворителем.
Когда, наоборот, вещество не очень растворимо или доступно как не очень растворимая соль в вышеупомянутых растворителях, могут использоваться соответствующие смеси с гидроксилированными растворителями. Примерами таких растворителей являются метиловый спирт, этиловый спирт и вода. Осаждение может быть ускорено путем разбавления таким образом полученной смеси, после добавления азотной кислоты, неполярным растворителем.
Когда исходный продукт образует соль с соляной кислотой, можно получить соль с азотной кислотой, добавляя нитрат серебра непосредственно к раствору соединения. После отфильтровывания хлорида серебра раствор концентрируют и охлаждают для выделения нитратной соли.
Когда исходным продуктом является соль, можно высвобождать соответствующее основание обработкой насыщенным раствором карбоната или бикарбоната натрия или калия или разбавленным раствором гидроксида натрия или калия. Основание затем экстрагируют подходящим органическим растворителем (например, галогенированными растворителями, сложными эфирами, простыми эфирами), который затем обезвоживают. Органический растворитель выпаривают и затем действуют согласно предшествующим способам получения, растворяя основание в ацетонитриле или в других вышеупомянутых растворителях.
Нитратные соли можно также получать, используя предшественники вышеописанных классов, содержащие в молекуле связь в виде -ONО2 группы, посредством связывающего мостика, полученного как описано в Европейском патенте 759899 на имя заявителя.
Следующие примеры приведены только в иллюстративных целях, и они не являются ограничивающими.
Пример 1
Получение нитрата тимолола.
К насыщенному водному раствору бикарбоната натрия (100 мл) добавляют малеат тимолола (7 г). Смесь экстрагируют этилацетатом (300 мл). Органическую фазу высушивают сульфатом натрия и затем выпаривают под вакуумом, получая соответствующее основание тимолола (4,9 г), которое растворяют в ацетонитриле (25 мл). Этот раствор, охлажденный льдом, обрабатывают 65% раствором азотной кислоты (1, 08 мл) в ацетонитриле (5 мл) и через 30 минут перемешивания на холоде обрабатывают этиловым эфиром (100 мл) для получения твердого вещества, которое фильтруют, промывают этиловым эфиром и высушивают под вакуумом. Получают 4,6 г нитрата тимолола с температурой плавления 115-116°С.
1Н-ЯМР (D2О) м.д.: 4.34 (1Н, m), 3.76 (4Н, t), 3.39 (4Н, t), 3.23 (2Н, m), 3.04 (2Н, m), 1.29 (9H, s).
Элементный анализ (C13H25N5О6S):
рассчитано (%): С 41,15; H 6,64; N 18,46; S 8,45;
обнаружено (%): С 41,24; Н 6,61; N 18,38; S 8,31;
Пример 2
Получение нитрата пропранолола.
К насыщенному водному раствору бикарбоната натрия (70 мл) добавляют гидрохлорид пропранолола (5 г). Смесь экстрагируют этилацетатом (250 мл). Органическую фазу высушивают сульфатом натрия и затем выпаривают под вакуумом, получая соответствующее основание пропранолола (4,2 г), которое растворяют в ацетонитриле/тетрагидрофуране 5/2 (70 мл). Этот раствор, охлажденный льдом, обрабатывают 65% раствором азотной кислоты (1,13 мл) в ацетонитриле (10 мл) и через 30 минут перемешивания на холоде обрабатывают этиловым эфиром (50 мл) для получения твердого вещества, которое фильтруют, промывают этиловым эфиром и высушивают под вакуумом. Получают 5,1 г нитрата пропранолола с температурой плавления 127-130°С.
1Н-ЯМР (D2О) м.д.: 8.15 (1Н, m), 7.80 (1Н, m), 7.48-7.32 (4Н, m), 6.86 (1Н, d), 4.32 (1Н, m), 4.13 (2Н, d), 3.36 (1H, m), 3,22 (2Н, d), 1.24 (6Н, d).
Элементный анализ (C16H22N2O5):
рассчитано (%): С 59,62; Н 6,88; N 8,69;
обнаружено (%): С 59,99; Н 6,97; N 8,65.
Пример 3
Получение нитрата силденафила.
Раствор силденафила (7,7 г, 16,3 ммолей) в смеси с ацетонитрилом (100 мл) и тетрагидрофураном (40 мл) обрабатывают 65% азотной кислотой (1,13 мл), растворенной в ацетонитриле (10 мл). Через 30 минут при +4°С раствор концентрируют в маленьком объеме путем выпаривания при пониженном давлении и медленно добавляют этиловый эфир (100 мл). Полученный осадок фильтруют, промывают этиловым эфиром и высушивают под вакуумом. Получают белое аморфное твердое вещество (6,5 г).
Элементный анализ (C22H31N7O7S):
рассчитано (%): С 49,15; Н 5,81; N 18,24; S 5,96;
обнаружено (%): С 49,34; Н 5,75; N 18,38; S 6,00.
Пример 4
Получение соли валсартана.
Раствор валсартана (3,48 г, 8 ммолей) получают растворением в смеси ацетонитрила (30 мл) и тетрагидрофурана (10 мл). Азотную кислоту, разведенную в ацетонитриле, добавляют на холоде (берут 2 мл раствора, полученного добавлением 2,7 мл 65% азотной кислоты в ацетонитрил и доведением до конечного объема 10 мл). Через 30 минут медленно добавляют этиловый эфир (100 мл) при поддержании температуры +4° С. Сформировавшийся осадок фильтруют, промывают этиловьм эфиром и высушивают под вакуумом. Получают белое аморфное твердое вещество (3,1 г).
Элементный анализ (C24 H30N6O6):
рассчитано (%): С 57,82; Н 6,07; N 16,86;
обнаружено (%): С 58,02; Н 6,02; N 16,77.
Пример 5
Получение нитрата гидралазина.
Гидрохлорид гидралазина (3 г) добавляют к водному раствору карбоната калия (50 мл). Затем проводят экстракцию этилацетатом (80 мл). Органическую фазу промывают водой, высушивают сульфатом натрия и выпаривают под вакуумом. Остаток (1 г, 6,25 ммолей) растворяют в смеси ацетонитрила (30 мл) и метанола (20 мл). Раствор охлаждают до +4°С и добавляют 65% раствор азотной кислоты (0,6 г, 6,24 ммоля) в ацетонитриле (10 мл). Образуется белый осадок, который фильтруют и высушивают под вакуумом (1 г, темп. пл. 237-243°С).
Элементный анализ (C8H9N5O3):
рассчитано (%): С 43,05; Н 4,06; N 31,38;
обнаружено (%): С 43,32; Н 4,03; N 31, 22.
Пример 6
Получение нитрата никардипина.
Раствор гидрохлорида никардипина (0,1 г, 0,194 ммолей) в ацетонитриле (20 мл) обрабатывают в темноте нитратом серебра (0,33 г, 0,194 ммоля). При перемешивании при комнатной температуре в течение 30 минут образуется осадок в виде твердого белого вещества. Его фильтруют, концентрируют до половины объема при уменьшенном давлении, охлаждают до +4°С и обрабатывают этиловым спиртом. Осадок фильтруют. Высушивают. Получают желтое твердое вещество (0,5 г, темп. пл. 193-198°С).
Элементный анализ (C26H30N4O9):
рассчитано (%): С 57,56; Н 5,57; N 10,33;
обнаружено (%): С 57,44; Н 5,63; N 10, 44.
Пример 7
Получение нитрата верапамила.
Раствор гидрохлорида верапамила (3,44 г, 7 ммолей) в смеси ацетонитрила (50 мл) и тетрагидрофурана (15 мл) обрабатывают в темноте нитратом серебра (1,19 г, 7 ммолей). Раствор перемешивают при комнатной температуре в течение часа. Осадок образуется медленно, и его отфильтровывают в конце. Раствор концентрируют до половины объема, охлаждают до +4°С и сформировавшийся осадок фильтруют. После высушивания получают белое аморфное твердое вещество (2,8 г).
Элементный анализ (C27H39N3O7):
рассчитано (%): С 62,65; Н 7,59; N 8,12;
обнаружено (%): С 62,48; Н 7,68; N 8,11.
Пример 8
Получение нитрата амилорида.
Раствор гидрохлорида амилорида (2 г, 7,5 ммолей) в метаноле (100 мл) обрабатывают нитратом серебра в темноте (1,28 г, 7,5 ммолей). Быстро образуется осадок. Раствор оставляют перемешиваться в течение 30 минут при комнатной температуре. В конечном счете твердое вещество отфильтровывают и раствор концентрируют при уменьшенном давлении до половины начального объема. Раствор обрабатывают этиловым эфиром (50 мл) и после охлаждения до +4°С фильтруют полученное твердое вещество. После высушивания твердое вещество отделяют (0,8 г, темп. пл. >280°С).
Элементный анализ (C6H9ClN8O4):
рассчитано (%): С 24,63; Н 3,10; N 38,29; Cl 12,11;
обнаружено (%): С 24,75; Н 3,03; N 38,19; Cl 12,24.
Пример 9
Изучение влияния пропранолола, нитрата пропранолола, тимола и нитрата тимола на экспериментальный бронхостеноз у морских свинок.
Соединения дозой 10 мг/кг и соответствующий носитель вводили морским свинкам (группы из 6 животных каждая) внутрибрюшинно в течение трех дней подряд.
Животных готовили согласно способу Del Soldato и соавт., J. Pharmacol. Methods, 5, 279, 1981. Через 45 минут 0,1 мл физиологического раствора капсаицина (1 мкг/кг) вводили животным внутривенно. Изменение дыхательного объема воздуха до и после введения капсаицина измеряли посредством аппарата Konzett, модифицированного как описано в вышеупомянутой ссылке, соединенного с полиграфической системой.
Результаты воздействия соединений и их соответствующих нитратов на экспериментальный бронхостеноз, вызванный у морских свинок инъекцией капсаицина, представлены в Таблице I.

Пример 10
Фармакологическая активность нитрата силденафила по сравнению с силденафилом.
Соединения вводили в физиологическом растворе. Контрольную группу обрабатывали только носителем (физиологическим раствором).
Сосудорасширяющую активность нитрата силденафила определяли, используя экспериментальную модель сужения простатических отводящих сосудов, вызванного электрической стимуляцией, ниже чем максимальная (D.A. Taylor и соавт., J. Pharmacol. Exp. Ther. 224, 40-45 1983), у крыс, обработанных Nw-нитро-L-аргининметиловым эфиром (L-NAME), как описано Ribeiro и соавт., Hypertension, 20, 298, 1992. Взрослые самцы крыс Wistar (235-284 г) в течение 6 недель получали L-NAME в питьевой воде с концентрацией 60-70 мг/100 мл, что эквивалентно ежедневной дозе 60 мг/кг. Эти животные получали в течение пяти дней подкожно ежедневную дозу 10 мг/кг нитрата силденафила, силденафила или носителя соответственно. Через час после последней обработки животных умерщвляли и извлекали простатическую часть отводящего сосуда, погружали ее в физиологический раствор и сужали трансмуральной стимуляцией (95% максимальной стимуляции, 0,2 Гц).
Уменьшение реакции нейрогенного сужения, которое получали через 5 минут после добавления тестируемого вещества при концентрации 10-6 М, принимали за меру сосудорасширяющей активности (см. Таблицу II).

Из этой таблицы очевидно, что миорелаксирующая активность нитратной соли выше, чем у предшественника, взятого в качестве ссылочного соединения.
Также изучали эффект релаксации кавернозной артерии и кавернозных тел человека (сосудорасширяющий эффект на периферическом уровне). Применяли методику, описанную R.G. Hempelmann и соавт., European Journal of Pharmagology 276, 277-280 (1995), используя пещеристые ткани, полученные от пациентов, подвергшихся хирургической операции. Кавернозные артерии выделяли и очищали от окружающей соединительной ткани. Получали сегменты длиной около 2 мм и их помещали в миограф.
После построения экспериментальной кривой диаметр/напряжение образцы приводили к диаметру, соответствующему 90% от диаметра, достигнутого при транслюминальном давлении 100 мм рт.ст.; после периода стабилизации в течение 60 мин сокращение вызывали адреналином 3·10-6 М. Через 15 минут добавляли дозу каждого тестируемого соединения, соответствующую 10-6 М, и записывали процент релаксации. Результаты приведены в Таблице III.
Вторые серии экспериментов проводили согласно такому же протоколу на выделенных полосках 3×3×5 мм кавернозной ткани, изометрически суспендированных в ванночках для выделенных органов, при напряжении 5-10 mN. Результаты приведены в Таблице IV.


В обеих экспериментальных моделях очевиден релаксирующий эффект для сокращения, вызванного адреналином, достигнутый как обработкой силденафилом, так и донором оксида азота SIN-1. Производное согласно настоящему изобретению оказывает более высокое фармакологическое действие, чем предшественник силденафил и SIN-1.
Пример 11
Изучение гипотензивной и антиангиотензивной активности нитрата лозартана по сравнению с лозартаном.
Соединения вводили в физиологическом растворе. Контрольную группу обрабатывали только носителем (физиологическим раствором).
Ингибирующее действие нитрата лозартана на артериальную гипертензию проверяли, используя две экспериментальные модели: артериальную гипертензию, вызванную L-NAME (смотри предшествующий пример), и мышечное сокращение, вызванное ангиотензином II. В первом эксперименте взрослые самцы крыс Wistar (235-284 г) получали в течение 6 недель питьевую воду, содержащую L-NAME с концентрацией 60-70 мг/100 мл, что эквивалентно ежедневной дозе примерно 60 мг/кг. Животные получали в течение пяти дней подкожно ежедневную дозу 10 мг/кг нитрата лозартана, лозартана или носителя соответственно. Через час после последней обработки определяли системное артериальное давление каудальным путем, как описано Zatz, Lab. Anim. Sci., 42, 198, 1990.
Во втором эксперименте (сокращение, вызванное ангиотензином II) способ, описанный Р.С. Wong и соавт., Hypertension, 13, 489-497, 1989, заключался в следующем. Сегменты подвздошной кишки, выделенной из морских свинок (300-350 г), погружали в физиологический раствор, содержащий ангиотензин II (10 мкг/мл), ангиотензин II + нитрат лозартана 10-6 М и ангиотензин II + лозартан 10-6 М соответственно. Результаты представлены в Таблице V.

Из таблицы видно, что ингибирующее влияние нитратной соли на гипертензию, вызванную L-NAME, больше, чем влияние предшественника, используемого в качестве ссылочного соединения. Оба продукта эффективны в отношении миорелаксирующей активности, так как они ингибируют сокращение, вызванное ангиотензином II, но соединение согласно настоящему изобретению проявляет больше эффективности.
Пример 12
Изучение гипотензивной и сосудорасширяющей активности нитрата миноксидила по сравнению с миноксидилом.
Соединения вводили в физиологическом растворе. Контрольную группу обрабатывали только носителем (физиологическим раствором).
Ингибирующее действие нитрата миноксидила на артериальную гипертензию определяли, используя две экспериментальные модели: артериальную гипертензию, вызванную L-NAME (смотри Пример 10), и сосудистое сужение, вызванное электростимуляцией. В первом фармакологическом эксперименте крыс обрабатывали как описано в фармакологическом эксперименте с L-NAME Примера 11. Во втором эксперименте (сужение, вызванное ангиотензином II) способ, описанный Taylor (смотри Пример 10), проводился как описано выше. Брали простатическую часть выделенного семенного протока крыс (200-220 г) и погружали в физиологический раствор при 37°С и затем сужали трансмуральной стимуляцией (95% максимальной стимуляции, 0,2 Гц).
Сосудорасширяющую активность выражали как уменьшение нейрогенной реакции сужения, определенной в течение 5 минут после добавления тестируемого соединения с концентрацией 10-6 М (см. Таблицу VI).

Как очевидно из Таблицы VI, ингибирующее воздействие нитрата миноксидила на гипертензию, вызванную L-NAME, больше, чем у соединения, используемого в качестве ссылки. Что касается сосудорасширяющей активности, оба продукта эффективны в ингибировании сужения сосудов, вызванного электростимуляцией.
Пример 13
Изучение гипотензивной и бета-адренолитической активности нитрата тимолола по сравнению с тимололом.
Использовали две экспериментальные модели: артериальную гипертензию, вызванную L-NAME, и инотропно-положительный эффект, вызванный изопреналином.
В первом эксперименте гипотензивную активность изучали согласно экспериментальной модели, описанной в Примере 11.
Во втором эксперименте способ, описанный Grodzinski и соавт., Arch. Int. Phramacodyn, 191, 133-141, 1971, заключался в следующем. Кусочки левых предсердий из морских свинок (300-350 г) выдерживали при 32°С в физиологическом растворе, где концентрация ионов кальция была 1/3 ниже, и стимулировали изопреналином (1=мкг/мл). Бета-адренолитическую активность выражали как уменьшение инотропно-положительного эффекта (увеличение сокращения сердечной мышцы), следующее за добавлением исследуемого соединения с концентрацией 10-6 М (см. Таблицу VII).

Из Таблицы VII очевидно, что ингибирующее воздействие нитрата тимолола на гипертензию, вызванную L-NAME, выше, чем у тимолола. Что касается адренолитической активности, оба эти продукта эффективны в ингибировании инотропно-положительного эффекта, вызванного изопреналином, но соединение настоящего изобретения проявляет большую эффективность.
Пример 14
Изучение гипотензивной и кальций-антагонистической активности нитрата никардипина по сравнению с никардипином.
Использовали две экспериментальные модели: артериальную гипертензию, вызванную L-NAME, и мышечное сокращение, вызванное хлоридом кальция.
В первом эксперименте гипотензивную активность изучали согласно экспериментальной модели, описанной в Примере 11.
Во втором эксперименте адаптированная экспериментальная модель представляла собой сужение подвздошной кишки, вызванное хлоридом кальция, согласно способу, описанному M.J. Spedding, J. Pharmacology 83, 211-220, 1984. Сегменты подвздошной кишки, извлеченной из морских свинок (300-500 г), выдерживали при 37°С в физиологическом растворе, не содержащем ионов кальция, и затем стимулировали добавлением хлорида кальция (конечная концентрация 20 мкг/мл). Кальций-антагонистическую активность определяли как уменьшение сужения подвздошной кишки, последовавшее после добавления каждого из тестируемых соединений с концентрацией 10-6 М (см. Таблицу VIII).

Из Таблице ясно, что ингибирующее воздействие нитратной соли на гипертензию, вызванную L-NAME, больше, чем воздействие предшественника никардипина. Что касается кальций-антагонистической активности, эти соединения оба эффективны в ингибировании сужающего кальцийзависимого эффекта, хотя в различной степени.
Пример 15
Изучение на крысах гипотензивной и диуретической активности нитрата амилорида по сравнению с амилоридом.
Фармакологический профиль амилорида определяли, используя следующие экспериментальные модели: артериальную гипертензию, вызваную L-NAME, и диуретический эффект.
В первом эксперименте гипотензивную активность изучали согласно экспериментальной модели, описанной в Примере 11.
Во втором эксперименте диуретический эффект изучали согласно способу, описанному W.L. Lipschwitz и соавт. J. Pharmacol. Exp. Ther., 79, 97-110, 1943. 3 группы по 6 крыс в каждой (200-220 г) выдерживались в клетках для изучения метаболизма у экспериментальных животных и получали питьевую дистиллированную воду (25 мл/кг, через рот). Каждой группе затем подкожно вводили нитрат амилорида (10 мг/кг), амилорид (10 мг/кг) или носитель соответственно. Объем мочи собирали в течение 6 часов после введения лекарства и измеряли в мл. Диуретический эффект выражали как процент собранного объема мочи по отношению к объему мочи группы, обработанной носителем (см. Таблицу IX).

Как очевидно из Таблицы IX, ингибирующее воздействие нитрата амилорида на гипертензию, вызванную L-NAME, превосходит воздействие амилорида. Что касается сосудорасширяющей активности, оба соединения проявляют похожую диуретическую активность.
Пример 16
Изучение острой токсичности солей азотной кислоты силденафила и запринаста.
Оба продукта вводили в 2% суспензии карбоксиметилцеллюлозы.
Острую токсичность вышеупомянутых солей оценивали оральным введением увеличенных доз соединений в группы из 10 крыс каждая. Каждой группе вводили одну дозу.
За животными вели наблюдения в течение 14 дней. Оценивали смертельные случаи и любую токсическую симптоматологию.
Даже после введения дозы 50 мг/кг не было отмечено признаков токсичности. Все животные остались живы.
Пример 17
Изучение желудочной токсичности солей азотной кислоты силденафила и запринаста в сравнении с их предшественниками.
5 групп самцов крыс Sprague-Dawley (n=10) голодали в течение 24 часов. Затем 4 группы соответственно обрабатывали внутрибрюшинно силденафилом, запринастом и нитратами этих вышеупомянутых лекарств. Одну группу не обрабатывали и принимали ее за контрольную. Через 30 минут животным через рот давали 1 мл 50% этанола в воде.
Через час животных умерщвляли. Удаляли желудок и исследовали макроскопически желудочные ткани. Данное обследование проводил исследователь, не подозревающий о том, какой обработке подвергались крысы перед умерщвлением. Наличие повреждений проверяли, как описано Gretzer и соавт. (Br. J. Pharmacol. 123, 927, 1998).
Результаты представлены в Таблице X. В этой Таблице желудочная токсичность дана как % числа крыс в группе, у которых были обнаружены желудочные повреждения.

Как видно из Таблицы, в группах крыс, обработанных силденафилом и запринастом, желудочная патология ухудшилась по сравнению с контролями. Желудочная токсичность соответствующих нитратов вышеупомянутых лекарственных средств ниже, чем в контрольной группе.
Пример 18
Получение нитрата пергексилина.
65% азотную кислоту (0,75 мл) добавляют в раствор пергексилина (3,02 г, 10,9 ммолей) в ацетонитриле и метаноле (10 мл), охлажденный до 0°С.
Полученный раствор перемешивают магнитной мешалкой в течение 30 минут при 0°С, затем при комнатной температуре в течение 30 минут. Растворитель выпаривают при пониженном давлении и сырой продукт суспендируют в этиловом эфире и затем фильтруют.
Продукт (3,09 г) получают в виде белого твердого вещества, имеющего темп. плавления 151-155°С.
Элементный анализ:
рассчитано (%): C 67, 00%; H 10,65%; N 8,26%;
обнаружено (%): C 67,05%; H 10,79%; N 8,40%.
Пример 19
Получение нитрата апоморфина.
Нитрат серебра (2,72 г, 16 ммолей) добавляют к раствору гидрохлорида апоморфина (5 г, 16 ммолей) в ацетонитриле (70 мл) и смесь перемешивают в темноте в атмосфере азота в течение 30 минут. Хлорид серебра фильтруют и раствор разбавляют диэтиловым эфиром. Сформировавшийся осадок отфильтровывают, промывают диэтиловым эфиром и высушивают под вакуумом, получая 4,3 г.
С, Н, N анализ
рассчитано (%): C 61,81; H 5,49; N 8,48;
обнаружено (%): C 61,84; H 5,45; N 8,51.
Пример 20
Получение нитрата запринаста.
0,5 мл раствора 65% азотной кислоты/ацетонитрила (2,7 мл/7,3 мл) добавляют при 0°С к раствору запринаста (0,5 г, 1,84 ммолей) в ацетонитриле (10 мл) и полученную смесь перемешивают в темноте в атмосфере азота в течение 30 минут. Затем раствор разбавляют диэтиловым эфиром и сформировавшийся осадок фильтруют, промывают диэтиловым эфиром и высушивают под вакуумом (0,4 г).
С, Н, N анализ
рассчитано (%): С 46,71; Н 4,22; N 25,14;
обнаружено (%): С 46,68; Н 4,26; N 25,11.
Пример 21
Синтез нитратной соли атенолола.

К раствору атенолола (5 г, 18,77 моля) в метаноле (35 мл), охлажденному до 0°С, по каплям добавляют 65% азотную кислоту (1,3 мл).
Смесь перемешивают при 0°С в течение 30 мин. Добавляют н-гексан (20 мл). Осадок фильтруют и промывают н-гексаном.
Получают продукт (3 г) в виде белого твердого вещества. Темп. пл. 123-127°С.
Элементный анализ:
рассчитано (%): C 51,05; H 7,03; N 12,73;
обнаружено (%): C 51,10; H 7,02; N 12,73.
Реферат
Изобретение относится к органической химии и может найти применение в медицине. Описываются нитратные соли соединений, выбранных из следующих классов: Класс (A3): 1-изопропиламино-3-(1-нафтилокси)-2-пропанолол (пропанолол), (S)-1-(трет-бутиламино)-3-(4-морфолино-1,2,5-тиадиазолил-3-окси)-2-пропанол (тимолол), 4-(2-окси-3-изопропиламинопропокси) фенил-ацетамид (атенолол), Класс (А2): 1-[[3-(4, 7-дигидро-1-метил-7-оксо-3-пропил-1Н-пиразол[4,3-d]пиримидин-5-ил)-4-этоксифенил]сульфонил]-4-метилпиперазин (силденафил), 1(2Н)-фталазинонгидразон (гидралазин), 2-(2-пропилоксифенил)-8-азапурин-6-он (запринаст), 6-(1-пиперидинил)-2,4-пиримидиндиамин-3-оксид (миноксидил), Класс (А1с): (S)-N-валерил-N-[2'-(1Н-тетразол-5-ил)бифенил-4-илметил]валин (валсартан), Класс (А4b): метил-2-[метил(фенилметил)-амино]этиловый эфир 1,4-дигидро-2,6-диметил-4-(3-нитрофенил)-3,5-пиридинкарбоновой кислоты (никардипин), Класс (А4а): α-[3-[[2-(3, 4-диметоксифенил)-этил]метиламино]пропил]-3,4-диметокси-α-(1-метилэтил)бензолацетонитрил (верапамил), Класс (А7d): 3,5-диамино-N-(аминоиминометил)-6-хлорпиразинкарбоксамид (амилорид), 2-(2, 2-дициклогексилэтил)пиперидин (пергексилин), Класс (A1b): 2-н.бутил-4-хлор-5-оксиметил-1-[2'-(тетразол-5-ил)бифенил-4-ил]имидазол (лозартан) и нитрат 3,4-дигидроксиапоморфина (апоморфин). Также описываются фармацевтические композиции нитратных солей по п.1, обладающие гипотензивной активностью. Технический результат - получены новые соли соединений, обладающие полезными биологическими свойствами. 2 с. и 6 з.п. ф-лы, 10 табл.

Комментарии