Замещенные сульфонамиды, замещенные циклические амины в качестве промежуточных соединений для получения замещенных сульфонамидов и фармацевтическая композиция, проявляющая антагонистическую активность к рецепторам тромбоксана а*002 - RU2096404C1
Код документа: RU2096404C1
Чертежи































Описание
Изобретение относится к области синтеза новых биологических соединений.
В частности, изобретение относится к новым замещенным сульфонамидам, к промежуточным соединениям синтеза этих соединений и к фармкомпозициям на основе новых замещенных сульфонамидов, которые могут быть использованы при нарушениях, в которых участвует тромбоксан A2.
Известно, что экзогенная или высвобождаемая из фосфолипидов под действием фосфолипазы A2 арахидоновая кислота превращается в эндоперекиси (простагландин G2 (PGG2) а затем в простагландин-H2 (PHG2)) с помощью циклооксигеназы. Тромбоксансинтетаза катализирует затем превращение PHG2 в тромбоксан A2 (TXA2). Известно также, что тромбоксан A2 способен в очень малых концентрациях вызывать серьезные биологические нарушения, такие как тромбоз, вазоконстрикцию, бронхоконстрикцию, нарушение целостности сосудистой стенки; считается так же, что он участвует в некоторых заболеваниях сосудистой и дыхательной систем. Эти патофизиологические процессы протекают с участием рецепторов, которые могут связываться с тромбоксаном A2, а также с эндоперекисями PGG2/PGH2.
Метод ингибирования эффектов тромбоксана A2, а также использование избирательных антагонистов рецепторов TXA2/PGH2 и многочисленных веществ, действующих по механизму ингибирования, описаны в литературе (например, патенты США 4443477 и 4861913.
Патент США 4443477 описывает сульфонамидобензолкарбоксильные кислоты, которые ингибируют агрегацию тромбоцитов, снижают
сывороточные липиды и обладают следующей
общей
структурой:

где R является атомом водорода или низшим алкильным радикалом, R1 является алкильным или арильным радикалом, аралкилом или аралкенилом, арильная группа может быть иногда в каждом случае замещена одной или несколькими из следующих групп: гидроксил, галоген, трифторметил, низший алкил или алкоксил или ацил, карбоксил или алкоксикарбонил; n это 1, 2 или 3, а W является связью или алифатической углеводородной цепочкой, линейной или не линейной, содержащей двойные связи или насыщенной, а также соли сложных эфиров и физиологически приемлемые амиды.
Патент США 4861913 описывает бициклические
сульфонамидные производные, ингибиторы
тромбоцитарной агрегации, вызванной тромбоксаном A2, ингибиторы вазо- и бронхоконстрикции, обладающие следующей общей структурой:

где R1 является атомом водорода или низшей алкильной группой;
R2 является алкильным радикалом или ариловым остатком в ряде случаев замещенным, или аралкиловым остатком, или гетероциклом;
R3 означает атом водорода или метильную группу;
X алкиленовая или алкениленовая группа в ряде случаев замещенная атомом фтора и возможно содержащая кислород или серу и/или фениленовую группу;
Y представлен алкиленовой или алкениленовой цепочкой или атомом кислорода или серой;
m 0 или 1;
n 0, 1 или 2.
Задача изобретения разработка новых соединений, которые расширили бы ассортимент антитромбозных и
антисосудосуживаюших средств, связанных с
действием тромбоксана A2. Эта задача решается с помощью новых замещенных сульфонамидов формулы I:

в которой R1 представляет собой фенил, который может быть замещен одним, двумя или пятью атомами галогена, трифторметилом, трифторметокси, гидроксилом, амино, пиано, нитро, ацетамидо, фенилом, C1-C7-алкилом, C3-C6-циклоалкилом, C1-C7-алкокси, C1 -C7- алкилтио, ацетилом, или R1 выбран из ряда нафтила, который может быть замещен диметиламином, хинолила, фурила, тиснила, который может быть замещен галогеном; или R1 означает C1-C7 алкилсульфинил, C1-C7 алкилсульфонил;
R2 и R3 являются различными и один из них представляет W, а другой атом водорода, C1-C7 -алкил, причем W представляет собой группу:

где Z кислород, -CH3- или связь,
q 0, 1, 2;
A COOH, PO3H2, SO3H, COOR7, где R7 представляет собой щелочной металл, C1-C7-алкил, или A представляет собой карбоксиэтилоксо-, 4,5-дигидро-3-оксо-2Н-пиридазин-6-ил, 4-морфолинилоксо, диэтиламиноэтоксикарбонил, ацетил; гидроксил, тетразолил;
R4, R5, R6 водород, C1-C7-алкил;
Y представляет собой -CH2-, -(CH2)2-, -(CH2)3-, -(CH2)4-, -CH2-O-CH2-,

n 0 или 1,
а также их натриевых солей, сложных эфиров или амидов.
Соединения указанной структуры не описаны в литературе. Соединения формулы I обладают антагонистической активностью к тромбоксану A2, т.е. препятствуют образованию тромбов и сужению сосудов, вызванных действием TXA2, которая иллюстрируется результатами описанных ниже тестов.
Соединения согласно изобретению, в которых R3 означает W, а R2 отличен oт W, имеют ассиметрический атом углерода в циклоалкильной группе, и могут находиться в рацемической форме или в форме цис- или транс-изомеров.
Соединения формулы I могут быть получены с использованием реакции сульфонирования циклических аминов.
В частности, амин формулы II подвергают взаимодействию с хлоридом арилсульфонила или гетероарилсульфонила в следующих молярных соотношениях II/R1-SO2Cl от 1: 0,5 до 1:5, преимущественно 1:0,95 1:1,05 и получают целевой продукт.

В формулах (II) и (I) радикалы R1-R6, Y и n имеют указанное выше значение. Когда R2 или R3 означают W, содержащий A, имеющее значение CO2H, то карбоксил в ряде случаев защищается в виде сложного эфира низшим алкоксильным радикалом. Когда W содержит A, имеющий значение низший ацил, q равное 0, карбонильная функциональная группа блокируется классической защитной группой, такой как диметилацеталь, 1, 3-диоксан, 5,5-диметил-1,3-диоксан.
Реакция сульфонирования осуществляется в присутствии основания, такого как триэтиламин, пиридин, карбонат калия, едкий натр, едкий калий или бутиллитий, при молярном соотношении (II) и основание, равном от 1:1 до 1:5, чаще 1:1,2 1:2,2, в инертном по отношению к реакции растворе, таком как вода, бензол, тетрагидрофуран, этиловый эфир или дихлорметан, или смесь эфир-дихлорметан в следующих объемных пропорциях 1:1 1:30, чаще от 1:2 до 1:15. Температура реакции заключается между -78o C и температурой рефлюкса растворителя или смеси растворителей, преимущественно между -20oC и температурой рефлюкса растворителя или смеси растворителей, в течение промежутка времени, равного 2-72 часа, преимущественно от 2 до 16 часов.
Амины, используемые в процессе синтеза соединений (I), могут образовываться многими путями в зависимости от заместителей,
имеющихся в молекуле:

т. е. либо восстановлением оксима (IIa), например, путем каталитической гидрогенизации под давлением в смеси этанол-раствор аммиака; либо разрывом сульфонамидной связи соединений формулы (I), например, при помощи основания, такого как натрийсодержащий нафталин в растворе типа 1,2-диметоксиэтан; либо восстановлением нитрила (IIb), например, каталитической гидрогенизацией под давлением в метанол-аммиачной смеси или восстановлением при помощи LiAlH4 в эфире, тетрагидрофуране или толуоле при температуре между -30oC и температурой кипения растворителя, в частности между 0oC и рефлюксом растворителя. В формулах (I), (II), (IIa) и (IIb), заместители R1-6, а также символы Y и n имеют значения, описанные выше.
Нитрилы формулы (IIb) получают алкилированием нитрила (IIc) с
помощью галогенсодержащего соединения R2-X:

где X это атом галогена, заместители R2-6 и Y имеют значения, указанные выше. Реакция протекает в присутствии основания, такого как бутиллитий, литий диизопропиламид или амид натрия, в растворе, таком как диэтиловый эфир или тетрагидрофуран в присутствии гексаметилфосфорамида или N, N-диметилимидазолидинона, при температуре между -78oC и рефлюксом растворителя или смеси растворителей, в течение промежутка времени от 4 до 24 часов.
Для веществ формулы (IIb), где R2 означает радикал W, который содержит функцию первичного спирта, то последний защищают группой, позволяющей осуществлять реакцию алкилирования, например, лабильной защитной группой, такой как силильные радикалы, в частности -SiMe3. Защитная группа устраняется затем обработкой кислотой в водной среде или использованием фторидов (например, фторид тетрабутиламмония) в тетрагидрофуране, при температуре, заключающейся между -20oC и 150oC, преимущественно при 25o C. Полученный нитрил-спирт (IIb) затем восстанавливают до аминоспирта II, используемого в процессе сульфонирования. После сульфонирования получают соединение (I), имеющее функцию первичного спирта, которую при необходимости превращают в карбоксильную функцию. Окисление спиртовой функции осуществляют, например, методом Джойса [CrO3/H2SO4] в таком растворителе, как ацетон, при температурах от -78oC до 30oC, чаще от -20oC до 20oC, в течение 1-96 часов, преимущественно между 2 и 16 часами.
Соединения формулы (I), в которых R3 обозначает W, получают в виде стереохимически чистых цис- и транс-изомеров, если реакцию осуществляют со стереохимически чистым цис- или транс-амином, или с рацемическим амином в виде смеси изомеров цис- и транс-, с последующим разделением изомеров селективной рекристаллизацией или хроматографическим методом. Смеси изомеров и чистые продукты анализируются жидкостной хроматографией высокого разрешения или ультрафиолетовым спектром.
Промежуточные вещества в синтезе соединений формулы (I), в частности вещества формулы (IIb), в которой R2 или R3 обозначают W, являющийся радикалом Ar или -CH2-Ar в частности, когда Ar представлен фенильным радикалом, могут быть превращены в соединения формулы (I), в которой W будет содержать карбоксильную кислотную функцию. Так, ацилированием по Фриделю-Крафтсу получают параацилированные производные, которые затем окисляют до сложных эфиров, затем их омыляют с получением карбоновой кислоты (I). Реакция Фриделя-Крафтса заключается во взаимодействии галогенидов ацила, таких как ацетилхлорид, этил-З-хлороформилпропионат, или ангидридов (янтарный ангидрид), в присутствии кислоты Льюиса (SnCl4, TiCl4, AlCl3) в растворителе типа дихлорметан или 1,2-дихлорэтан, при температуре от -78oC до рефлюкса растворителя, преимущественно между -30oC и рефлюксом растворителя, в течение 4-30 часов. Используется молярный избыток кислоты Льюиса от 1,1 до 11 эквивалентов, в частности 3, 3-7 эквивалентов, а также молярный избыток галогенидов ацила или ангидрида, от 1,1 до 4 эквивалентов, в частности 1,2- 2,2 эквивалента.
Все ацилированные вещества можно превратить в
сложные эфиры путем окисления нитратом
таллия (Tl(NO3)3) или тетраацетатом свинца в
присутствии метанола и кислоты Льюиса, такой как перхлорная кислота или эфирная вытяжка
трифторида бора, в таком растворителе, как
дихлорметан, бензол, толуол,
-Z-Ar-CO-CH3 _
______→ -Z-Ar-CH2
-CO-O-CH3
или непосредственно в
метаноле, между -50oC и температурой кипения растворителя,
преимущественно между 20oC и рефлюксом растворителя, в течение
5-40 часов. Используется молярный избыток кислоты
Льюиса, 1,1-11 эквивалентов. Нитратный комплекс монмориллонита таллия K-10
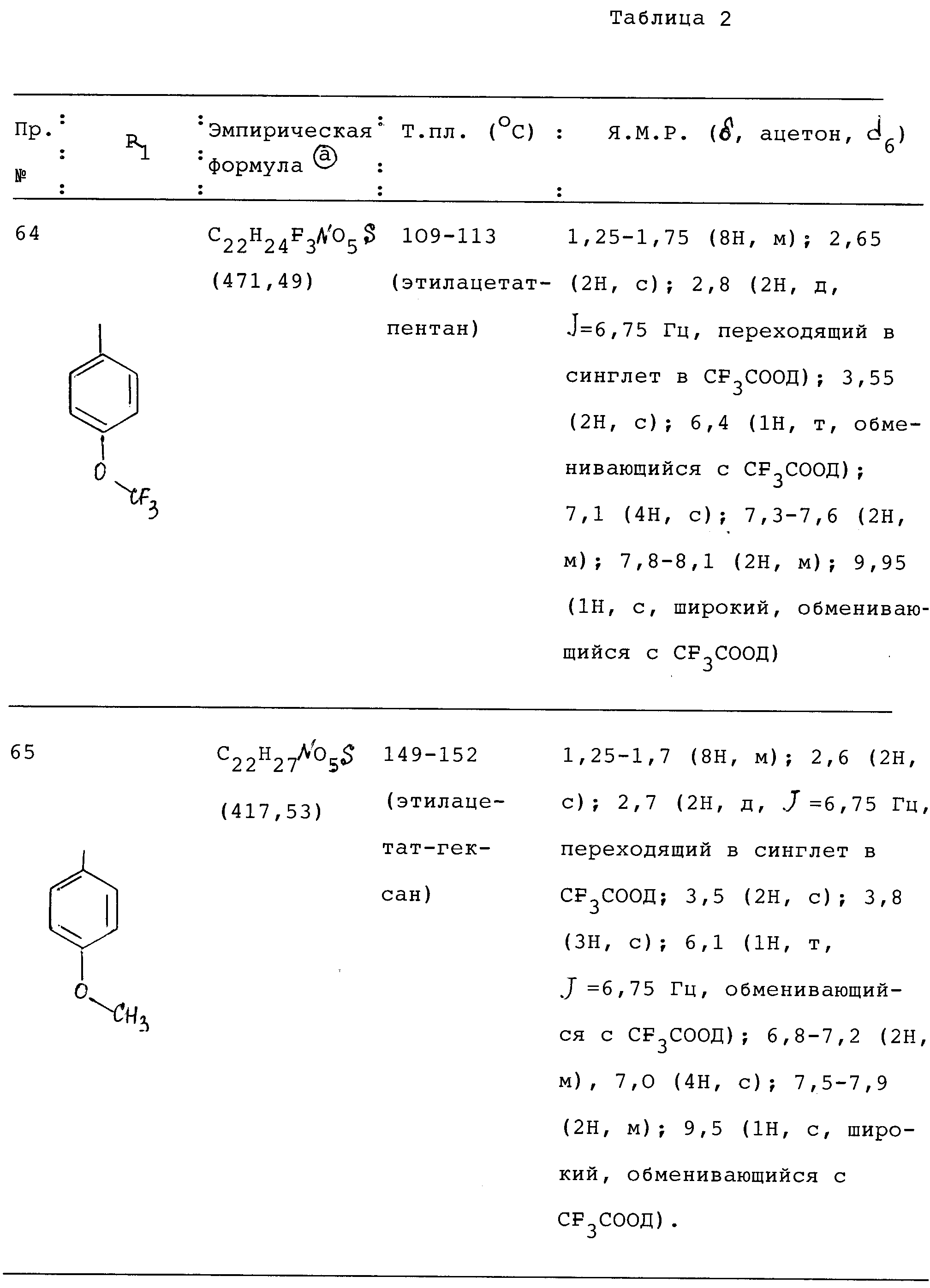
может быть использован вместе T1(NO3)3 в тех же
условиях и пропорциях, но в отсутствии перхлорной
кислоты.
Сложные метиловые эфиры омыляют в классических условиях эквивалентным количеством или молярным избытком основания (едкий натр, едкий калий, гидроксид лития или бикарбонат натрия).

в воде или в водноспиртовой смеси (метанол, этанол), в присутствии или отсутствии тетрагидрафурана, при температуре от 0oC до рефлюкса растворителя или смеси растворителей, преимущественно от 30oC до рефлюкса растворителя или смеси растворителей. Изобретение относится также к замещенным циклическим аминам формулы II:
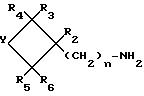
где R2 и R3 являются различными и один из них является W, а другой водород, C1-C7-алкил, W представляет собой группу
(CH2)q-A
где Z является -CH2- или связью, q1, 2.
А является -COOH, C1-C7-алкоксикарбонилом,
гидроксилом, тетрагидропиранилокси;
R4, R5,
R6 являются атомом водорода, C1-C7-алкилом;
Y является группой -(CH2
)3-, -CH2-O-CH2-

в качестве промежуточных соединений для получения замещенных сульфонамидов формулы I.
Антагонистическая активность к TXA2 иллюстрируется тестами на антитромботическую и сосудосуживающую активность.
(А) Ингибирование агрегации тромбоцитов, вызванной U46619, аналогом стабильного TXA2 (9,11 дидеокси-11 α, 9 a - эпоксиметанопростагландина F2 a ).
Антагонистическая к TXA2 активность демонстрируется в тесте агрегации тромбоцитов, описанном ест Born J.V.R. (Nature 1962) 194, 927-929) на тромбоцитах морской свинки. Тесты определяют концентрацию соединения, которая на 50% ингибирует агрегацию, вызванную U46619. Активность соединений настоящего изобретения представлена в таблицах IV-IVc.
(В) Ингибирование вазоконстрикции аорты крысы, вызванной U46619.
Взрослых крыс весом примерно 300 г умервщляют, быстро изымают грудную аорту. Фрагмент длиной примерно 1 см вырезают в виде спирали, затем помещают в кювету, содержащую 20 мл питательной среды (Krebs-Henseleit), находящуюся при температуре 37oC и насыщенную кислородом (O2 95% CO2 5%). Сокращения регистрируют измерением изотонического напряжения. После 45 мин выдерживания добавляют в питательную среду аналог TXA2 (U46619: 142 пМ) и регистрируют супермаксимальные сокращения. Ровный участок значений обычно достигают спустя 10 мин после контакта, который продолжается не более 25 мин. Между каждым сокращением осуществляют выдержку 30 мин и несколько промывок. Соединения вводят 10 мин спустя после введения U46619 и оставляют на 15 мин, в конце которых замеряют ингибирование. Измерения проводят для каждого из изучаемых веществ минимум на 3 аортах и определяют ингибирующую концентрацию 50 (Cl50). Активность соединений представлена в таблицах IVa-IVb.
Соединения настоящего изобретения обладают так же гипохолестерол-размельчающей активностью благодаря действию на биосинтез холестерола путем, например, ингибирования HMGCoA- редуктазы.
Соединения настоящего изобретения обладают также активностью, направленной против осложнений, связанных с диабетической патологией, такой как нефропатия, нейропатия, ретинопатия, катаракты, связанные с аккумуляцией сорбитола. Соединения препятствуют синтезу сорбитола посредством ингибирования альдоз-редуктазы.
Соединения согласно изобретению характеризуются отсутствием токсичности. Например, для соединения, описанного в примере 20, летальная доза 50, определенная на крысах при внутривенном введении, превышает 150 кг/кг.
Изобретение относится также к фармацевтической композиции, проявляющей антагонистическую активность к рецепторам тромбоксана A2, содержащей в качестве активного начала соединение формулы I в эффективном количестве и фармацевтические добавки.
Композиции могут выпускаться, например, в виде таблеток, липосомных форм, микро- и нанокапсул, таблеток в оболочке, растворов, инъекционных растворов, свечей, аэрозолей или кремов (паст) В качестве фармацевтических добавок используются микрокристаллическая целлюлоза, лактоза, поливидон, натриевый гликолят крахмала, тальк, стеарат магния. Для липосомальных форм, микро- и нанокапсул используются полиалкилцианоакрилаты, фосфолипиды. Для оболочки таблеток может быть использована гидрокси- пропилметилцеллюлоза, различные акриловые полимеры, пропиленгликоль и диоксид титана. Препараты орального применения могут содержать искусственные отдушки и подслащивающие вещества, например сахар, аспартам. Получение инъекционных растворов заключается в добавлении воды, содержащей агенты стабилизации, растворяющие агенты, например, хлорид натрия, маннитол и сорбитол и/или буферные растворы, необходимые для инъекционных растворов. Для свечей могут использоваться такие инертные вещества, как полусинтетические глицериды. Приготовление кремов (паст) заключается в добавлении поверхностно-активных неионных агентов. Для аэрозолей могут быть использованы вещества с микронизирующими свойствами в сочетании с поверхностно-активными агентами, например триолеат сорбитана, в газе-носителе CFC 11 и 12.
Следующие примеры иллюстрируют изобретение. В данных Ядерного магнитного резонанса (ЯМР) использованы следующие сокращения: "с" для синглета, "д" для дуплета, "т" для триплета, "к" для квадриплета и "м" для комплексного массива; химические смещения d выражены в ppm. Анализ жидкостной хроматографией высокого разрешения Ж.Х.В.Р.) осуществлялся на колонке Сферисорб 5 mм, длина 15 см, диаметр 0,46 см, природа которой уточнена следующими сокращениями: оксид кремния, ODS-2- для обратной фазы C-18 "end-capped". Используемая в кремниевой колонке мобильная фаза является смесью гексан-этилацетат в пропорциях каждый раз уточняющихся; на колонке ODS-2 используют смесь метанол-вода-уксусная кислота (57: 43: 0, 01). Скорость равна 1 мл/мин, анализ осуществляется спектрофотометрией при 254 им. Время удерживания, Tyg, выражается в минутах.
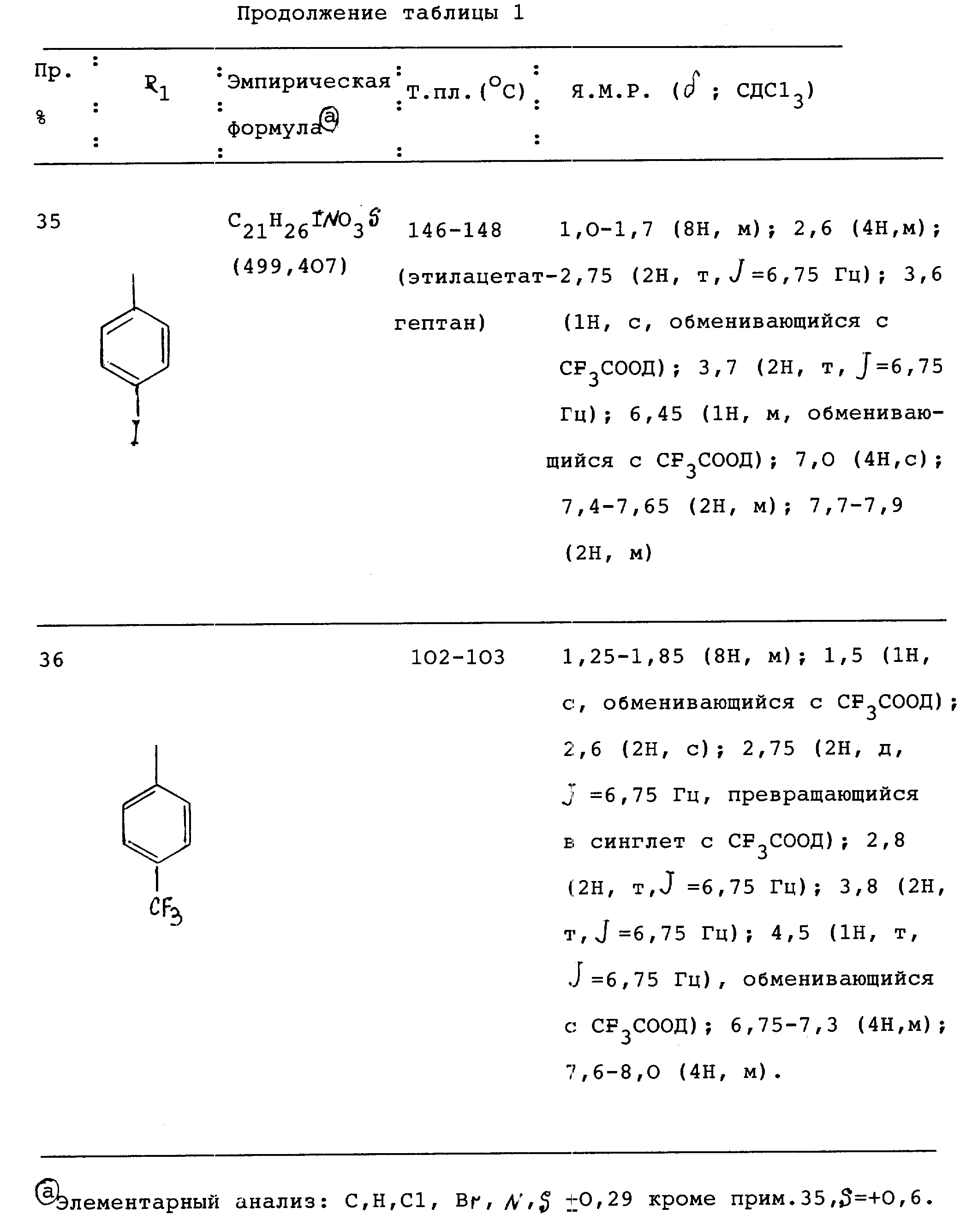
Пример 1. Транс-4-[[2-[[(4 -хлорфенил)сульфонил]амино]циклопентил] метил]бензолуксусная кислота.
а) Этиловый эфир 4-/(2-гидроксииминоциклопентил)метил/ бензолуксусной кислоты.
Суспензию из 10 г (0,04 моль) 4-/(2-гидроксииминоциклопентил)метил/ бензолуксусной кислоты в 70 мл абсолютного этанола насыщают газообразным HCl при температуре реакционной среды примерно 10oC, поддерживаемой баней лед + соль. После насыщения полученный раствор перемешивают при комнатной температуре в течение 1 часа, затем концентрируют досуха в вакууме. Извлеченный в этилацетате остаток последовательно промывают насыщенным раствором NaHCO3 и H2O. Органическую фазу высушивают на Na2SO4 и выпаривают, получают 11,05 г (выход 99,5%) вязкого коричневого масла, частично кристаллизованного, которое используется без дальнейшей очистки.
ИК (пленка) n (N-OH) 3250 см-1; (C=O) 1725 см-1.
ЯМР (CDCl3): d1,2 (3Н, т, J=6,75 Гц); 1,6-3,2 (9Н, м); 3,5 (2Н, с); 4,1 (2Н, к, J= 6,75 Гц); 7,1 (4Н, с); 9,0 (2Н, с, широкий, обменивающийся на CF3COOD).
Возможен другой метод: в реакторе, над сепаратором Дина-Старка, выдерживают в рефлюксе в течение 6 часов смесь из 5,8 г 4-/(2-гидроксииминоциклопентил)метил/ бензолуксусной кислоты, 4,1 мл этанола 98o и 2 кап. H2SO4 конц. В 20 мл толуола. После охлаждения толуол промывается раствором NaHCO3, затем водой. Органическая фаза высушивается на Na2 SO4 и концентрируется. Получившийся продукт представлен в виде желтого масла.
б) Этиловый
эфир 4-/(2-Аминоциклопентил)метил/бензолуксусной кислоты (цис + транс)
В
автоклаве в раствор из 75,1 г (0,27 моль) этилового эфира
4-[(2-гидроксииминоциклопентил)метил] бензолуксусной кислоты
в 800 мл абсолютного этанола, насыщенного NH3, вводят примерно 37,5 г
никеля Ренея в воде. Смесь взбалтывается при давлении 80
атм. Водорода при 80oC в течение 4 часов. После
охлаждения катализатор фильтруют и промывают этанолом. Фильтрат концентрируют при
пониженном давлении, получают 69,3 г (выход 98,3%)
оранжевого масла, которое кристаллизуется, но используется без
дальнейшей очистки.
ИК (пленка) n (NH2) 3300 см-1; (C=O) 1715 см-1.
ЯМР (CDCl3): d1,2 (3Н, т, J=6,75 Гц); 1,5 (2Н, м); 1,6-3, 25 (10H, м, из которых 2H обмениваются на CF3CO2D); 3, 55 (2H, с); 4,1 (2H, кJ=6,75 Гц); 7,1 (4H, с).
Это соединение может также быть получено гидрогенизацией под небольшим давлением водорода (3 атм.) при 25oC.
в) Этиловый эфир 4-[[(4-хлорфенил)сульфонил]амино]циклопентил] метил] бензолуксусной кислоты (цис + транс).
Смесь из 2,25 г (8,6 моль) амина, приготовленного в примере 16, 1,45 мл (10, 3 ммоль) триэтиламина и 70 мл CH2Cl2, находящуюся при 10oC с помощью бани лед-вода. Раствор из 1,9 г (9 ммоль) 4-хлорбензолсульфонилхлорида в 5 мл эфира прикалывается в течение 3 мин. Доводят до комнатной температуры и перемешивают 2 часа. Затем выливают на 150 г ледяной воды и подкисляют до pH 1 с помощью HCl 6Н. Декантируют CH2Cl2 и экстрагируют снова с помощью 100 мл CH2Cl2. Собранные органические фазы промывают водой, затем высушивают на Na2SO4 и концентрируют. Полученное желтое масло очищают флеш-хроматографией на кремниевой колонке со смесью гексан-этилацетат 5/1, и получают 3,35 г (выход 89,3%) бледно-желтого масла, которое медленно кристаллизуется.
ИК (пленка): n (NH)=3250 см-1; (C=O)=1725 см-1; (SO2) 1320 см-1; (SO2)= 1150 см-1.
ЯМР: (CDCl3): d 1,2 (3H, т, J=6,75 Гц); 1,15-1,9 (6H, м); 1,9-3,9 (4H, м); 3,6 (2H, с); 4,15 (2H, к, J=6,75 Гц); 5,4 (1H, дд, J=8,25 Гц, обмениваемых с D2O); 7,0 (4H, м); 7,4 (2H, м); 7,8 (2H, м).
Ж. Х. В. Р. (оксид кремния; гексан-этилацетат 8:1): Tyg=14,1 (42%); 16,0 (58%).
Транс-4-[[2-[[2-[[(4-хлорфенил)сульфонил] амино] циклопентил] метил]бензолуксусная кислота
К
раствору из 95,25 г (0,218 моль) сложного этилового эфира, приготовленного в примере 1в, и 1200 мл
этанола 98 добавляют 24,4 г (0,435 моль) КОН, растворенного в 360 мл воды. Смесь перемешивают 3
часа
при 40oC. Этанол выпаривают под пониженным давлением. Извлеченный водой остаток
промывают этилацетатом. Водную фазу подкисляют на холоде до pH 1, с помощью HCl 6Н. Образованный
осадок
извлекают этилацетатом.
Органическую фазу промывают водой до нейтральности, высушивают над Na2SO4, затем концентрируют в вакууме. Получают 75,9 г твердого пастообразного продукта, который рекристаллизуют 4 раза в этилацетате, и получают 11 г белых песчинок трансизомер (выход 12,4%). Т.пл. 164-165oC. Обработка маточных растворов позволяет извлечь 1,2 г продукта той же чистоты. (Общий выход 13,9%).
Анализ: C20
H22ClNO4S (M=407,912)
Рассчитано, C 58,89; H 5,44; Cl 8,69;
N 3,43; S
7,86.
Получено, C 58,75; H 5,30; Cl 8,74; N 3,47; C 7,73.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1690 см-1; (SO2)=1320-1; (SO2)=1150 см-1.
ЯМР (ацетон-d6): d 1,15-1,19 (6Н, м); 1, 9-2,05 (1Н, м); 2,3 (1H, м, JH-Нспар. 13 Гц; 2,8 (1H, м, JH-Нспар. 13 Гц); 3,3 (1H, м, JCH-NH=7,8 Гц); 3,6 (2H, с); 6,7 (1H, д, JNH-CH=7,8 Гц, обменивающийся с CF3COOD); 7,0-7,1 (2H, м); 7,15-7,25 (2H, м); 7,55-7,65 (2H, м); 7,8-7,9 (2H, м); 10,55 (1H, меняющийся с CF3COOD).
Ж. Х. В. Р. (ODS-2); Tyg.30, 15 (100%). Перед рекристаллизацией Tyg.27,0; 30,0. Эти пики одинаковой активности соответствуют изомерам цис и транс.
Пример 2. Транс-4-[[2-[[(4-хлорфенил)сульфонил]амино]циклопентил] метил] бензолацетат натрия.
К суспензии из 3,9 г (9,6 моль) транс-4-[[2-[[(4-хлорфенил) сульфонил] амино] циклопентил] метил] бензолуксусной кислоты в 50 мл дистиллированной воды добавляют 0,38 г (9,6 моль) NaOH, растворенной в 30 мл дистиллированной воды. Смесь нагревают в водяной бане при 50oC до полного растворения, затем фильтруют и оставляют на несколько часов в холодильнике. Полученный белый осадок фильтруют, промывают дистиллированной водой. Остаточную воду удаляют азеотропной дистилляцией с толуолом. Полученный продукт рекристаллизуют в дистиллированной воде. Получают целевое соединение в виде твердого белого продукта. (Выход 57,0%). Т.пл. 212-214o C.
Aнализ: C20H21ClNNa04S (М=429,894)
Рассчитано, C 55,88; H 4,92; Cl 8,25; N 3,26; Na 5,35;
S 7,46.
Получено, C 55,67; H 5,02; Cl 8,31; N 3,16; Na 5,50; S 6,99.
ИК (KBr) n (NH)=3260 см-1; (SO2)=1315 см-1 (SO2 )=1140 см-1.
ЯМР (ДМСО-d6) d 0,7-1,6 (6H, м); 1,6-2,4 (3H, м); 2,6-3,7 (2H, м, из которых 1H обменивается на CD3COOD); 3,2 (2H, с); 6,7-7,35 (4H, м), 7,6-8,1 (4H, м).
Ж.Х.В.Р. (ODS-2): единственный пик имеет TYg, идентичное продукту примера 1г.
Пример 3. Цис-4-[[2-[[(4-хлорфенил)сульфонил]амино]циклопентил] метил] бензолуксусная кислота.
Из маточных растворов после первой кристаллизации продукта по примеру 1г и путем высаливания транс-изомера из смеси этилацетата с гексаном выделяют 1,1 г чистого цис-изомера в виде твердого белого продукта, т.пл. 142-145oC.
Aанализ: C20H22
ClNO4S (M=407, 912)
Рассчитано, C 58,89; H 5,
44; Cl 8,69; N 3,43; S 7,86.
Получено, C 58,80; H 5,56; Cl 8,90; N 3,41; S 7,70.
ИК (KBr): n (NH)=3230 см-1; (C=O)=1690 см-1; (SO2 )=1315 см-1; (SO2)=1150 см-1.
ЯМР (ацетон d6) d1,15-1,85 (6H, м); 2,05-2,25 (1H, м); 2,35 (1H, м); 2,8 (1H, м); 3,6 (2H, с); 3,7 (1H, м, JCH-NH=8,7 Гц); 6,6 (1H, д, JNH-CH8,7 Гц, обмениваемый на CD3COOD); 7,0-7,1 (2H, м); 7,15-7,25 (2H, м); 7,6-7, 7 (2H, м); 7,85-7,95 (2H, м); 9,5-10,4 (1H, с широкий, обмениваемый на CF3COOD).
Ж.Х.В.Р. (ODS-2): Tyg.25,2 (99,4% изомер цис); 28,2 (0,6% изомер транс).
Пример 4. Транс-4-[[2-[[(4-фторфенил)сульфонил]амино]циклопентил] метил] бензолуксусная кислота.
a) Этиловый эфир 4-[[2-[[(4-фторфенил)сульфонил]амино]циклопентил] метил]бензолуксусной
кислоты
(цис + транс)
Действуя как в примере 1в, но исходя из 5,9 г (22,6 ммоль)
этилового эфира 4-/(2-аминоциклопентил)метил/бензолуксусной кислоты, приготовленного в примере 16, и 4,6 г (23,
6
ммоль) 4-фторбензолсульфонилхлорида в присутствии 3,7 мл (26,7 ммоль) триэтиламина в
190 мл смеси дихлорметан-простой эфир (8,5: 1); перемешивают 16 часов при комнатной температуре. Очищают
хроматографией на кремниевой колонке со смесью гексан-этилацетат (4:1) и получают 5,1 г (выход
53,7%) целевого продукта в виде желтого масла.
ИК (пленка); n (NH)3250 см-1; (C=O)=1715 см-1; (SO2)=1325 см-1; (SO2)= 1150 см-1.
ЯМР (CDCl3) d1,3 (3Н, т, J=6,75 Гц); 1,0-1,9 (6Н, м); 1,9-3,5 (4Н, м); 3,6 (2Н, д); 4,15 (2Н, к, J=6,75 Гц); 5,2 (1Н, дд, J=8,25 Гц, обмениваемый с CF3COOD); 6,8-7,4 (4Н, м); 7,5-8,0 (4Н, м).
Ж. Х. В. Р. (оксид кремния; гексан-этилацетат 4:1) Tyg.6,05 (41,8%); 6,6 (58,2%).
б) Транс-4-[[2-[[(4-фторфенил)сульфонил]амино]циклопентил] метил]бензолуксусная кислота.
Работают согласно примеру 1г, но исходя из 4,5 г (10,7 ммоль) сложного этилового эфира, полученного на вышеуказанной стадии а) и 1,2 г (21,4 ммоль) КОН в водно-спиртовой смеси. После нескольких перекристаллизацией из смеси гексан-этилацетат, получают 0,3 г (выход 7,1%) твердого целевого продукта белого цвета. Т.пл. 145-148oC.
Элементный анализ: C20N22FNO4S (М=391,457)
Расcчитано, C 61,37; H 5,66; F 4,85; N 3,58; S
8,19.
Получено, C 61,37; H 5,67; F 4,93; N 3,57; S 8,24.
ИК (KBr): n (NH)=3250 см-1; (C=O) 1685 см-1 ; (SO2)= 1320 см-1; (SO2)= 1150 см-1.
ЯМР (DMCO d6): d0,8-1,6 (6Н, м); 1,6-2,4 (3Н, м); 2, 4-3,7 (2Н, м, из которых 1Н обменивается с CF3CO2D); 3,5 (2Н, с); 6,8-7,3 (4Н, м); 7,4-8,1 (5Н, м, из которых 1Н обменивается с CF3CO2D).
Ж.Х.В.Р. (ODS-2): Tyg=17,1 (0, 9% цис изомер); 18,8 (99,1% транс изомер).
Пример 5. Транс-4-[[2-[[(4-хлорфенил)сульфонил]амино]циклопентил] метил] бензолуксусная кислота.
а) N-(2-бромциклопентил)-4-хлорбензолсульфонамид.
20-ный раствор едкого натра (270 мл, 1,80 моль) прикапывают в течение 30 мин к смеси из 128 (0,67 моль) 4-хлорбензолсульфонамида и 400 г (2,5 моль) брома при сильном перемешивании. Во время прикапывания температуру поддерживают на уровне 5oC с помощью водно-ледяной бани. Реакционную среду затем перемешивают 30 мин при комнатной температуре, затем отфильтровывают образовавшийся желто-оранжевый осадок. После промывания водой получают твердое желтое вещество, плавящееся при 104-108oC. (Т.пл. 102o C по Baxter R.P. И Chattaway F.D. J. Chem. Soc (1915), 1814-23).
Его извлекают при помощи 600 мл теплого хлороформа. Остаточную воду декантируют. Эту хлороформную фазу прикапывают в течение 45 мин к 235 мл (2,67 моль) циклопентана, находящегося при температуре 5oC. Полученный раствор перемешивают 22 часа при комнатной температуре, затем промывают водой, высушивают на Na2SO4 и концентрируют при пониженном давлении. Остаток очищается перекристаллизацией из смеси этилацетата и гексана. Получают 140,2 г твердого целевого продукта белого цвета (выход 62%). Т.пл. 113-118oC.
ИК (KBr): n (NH)=3240 см-1.
ЯМР (CDCl3): d1,25-2,5 (6Н, м); 3,7 (1Н, м); 4,1 (1Н, м), 5,3 (1Н, д, J= 6,75 Гц, обмениваемый с CF3COOD;); 7, 35-7,7 (2Н, м); 7,7-8,05 (2Н, м).
б) 6-/(4-Хлорфенил)сульфонил/-6-азабицикло[3.1.0]гексан.
Суспензию из 140 г (0,413 моль) продукта, приготовленного на предыдущей стадии а), в 670 мл этанола нагревают до растворения. После чего быстро добавляют 20-ный раствор едкого натра (80,5 мл, 0,537 моль). Реакционную среду доводят до комнатной температуры при помешивании, затем концентрируют досуха под пониженным давлением. Извлеченный этилацетатом остаток промывают водой, высушивают на сульфате натрия, концентрируют в вакууме. Остаток очищают хроматографией на кремниевой колонке (элюант: гексан/ этилацетат 9/1), и получают 54 г твердого продукта белого цвета (выход=50,8%). Т.пл. 75-76oC.
ИК (KBr): n (SO2)=1310 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3): d1,3-2,3 (6Н, м); 3,4 (2Н, с); 7,3-7,6 (2Н, м) 7,7-8,0 (2Н, м).
в) Транс-4-хлор-N-[2-[(фенил)метил]циклопентил]-бензолсульфонамид.
К раствору из 0,27 моль фенилметилмагнийхлорида (приготовленного из 6,7 г магниевой стружки и 31,5 мл хлорметилбензола в 105 мл безводного простого эфира) в токе азота при 0oC по каплям прибавляют 35,3 г (0,137 моль) продукта, приготовленного на предыдущей стадии в), растворенного в 300 мл безводного эфира. Реакционную среду перемешивают 20 час при 20oC. После охлаждения до 0oC избыток магний-органического соединения удаляют добавлением 210 мл насыщенного раствора хлорида аммония. После растворения белого неорганического осадка, образующегося при помощи воды, насыщенной NaCl, 2 раза экстрагируют этилацетатом. Органическая фаза промывается водой, высушивается на сульфате натрия и концентрируется, получают масло, которое после порошкования в гексане дает 30,5 г (выход 63,7%) твердого белого, используемого без дальнейшей очистки. Т.пл. 66-68oC.
ИК (KBr): n (NH)=3260 см-1; (SO2)=1320 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3): d0,9-2,3 (7Н, м); 2,35-2,95 (2Н, м); 3,2 (1Н, м); 4,9 (1Н, д, J=6,75 Гц, обменивающийся CF3COOD); 6,8-7,5 (7Н, м); 7,6-7,9 (2Н, м).
г) Транс-N-[2-[4-ацетитфенил)метил]циклопентил]4-хлоробензолсульфонамид.
К смеси из 30,5 г (87 ммоль) соединения, приготовленного на предыдущей стадии, и 690 мл дихлорметана, находящегося при температуре от -30 до -20oC, добавляют 15 г (191 ммоль) ацетилхлорида, затем порциями в течение 1 часа 46,4 г (348 ммоль) безводного хлорида алюминия. Реакционную среду оранжевого цвета выдерживают при -30oC в течение 3,5 часов, затем выливают на смесь лед + HCl конц. и экстрагируют в дихлорметане. Органическую фазу промывают водой, высушивают на сульфате натрия и концентрируют. Полученный остаток очищают хроматографией на кремниевой колонке (элюант: гексан-этилацетат 10/1, затем 2/1) и получают 14,8 г (выход 43,5%) целевого продукта в виде масла оранжево-коричневого цвета.
ИК (пленка) n (NH)=3250 см-1; (C=O)=1660 см-1; (SO2)=1320 см-1; (SO2)= 1150 см-1.
ЯМР (CDCl3): d0,8-2,1 (7Н, м); 2,1-2,95 (2Н, м); 2,55 (3Н, с), 3,2 (1Н, м); 5,2 (1Н, д, J=8,25 Гц, обменивающийся с CF3COOD); 6,8-8,0 (8Н, м).
д) Метиловый эфир транс-4-[[2-[[(4-хлорфенил)сульфонил]амино]циклопентил] метил]бензолуксусной кислоты.
К смеси из 14,8 г (38 ммоль) продукта, приготовленного на предыдущей стадии г), 18 мл метанола и 90 мл дихлорметана, находящейся при температуре 0oC в токе азота, добавляют по каплям 18,7 мл (152 ммоль) эфирной вытяжки фторида бора. Эту смесь перемешивают 15 мин при комнатной температуре, затем за один раз в токе азота выливают в суспензию из 17,5 г (39,5 ммоль) тетраацетата свинца в 105 мл бензола, находящуюся при 10oC. Реакционную среду оранжевого цвета перемешивают 22 часа при комнатной температуре, затем выливают на лед и экстрагируют в дихлорметане. Органическую фазу промывают водой, высушивают на сульфате натрия, концентрируют, и получают маслообразный продукт, который после растирания в гексане дает 13,2 г (выход 82,5%) твердого целевого продукта бежевого цвета, используемого без дальнейшей очистки. Т.пл. 80oC.
ИК (KBr): n (NH)=3200 см-1; (C=O)=1690 см-1; (SO2)1320 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3): d 0, 9-2,2 (7Н, м); 2,3-2,9 (2Н, м); 3,0-3,4 (1Н, м); 3,6 (2Н, с); 3,65 (3Н, с); 5,0 (1Н, д, J=8,25 Гц, обменивающийся с CF3COOD ); 6,8-7,25 (4Н, м); 7,3-7,5 (2Н, м); 7,6-7,9 (2Н, м).
Ж.Х.В.Р. (оксид кремния, гексан-этилацетат 8:1): Tyg. 190 (1 пик).
е) Транс-4-[[2-[[(4-хлорфенил)сульфонил]амино]циклопентил] метил]бензолуксусная кислота.
Смесь 3,5 г (62,5 ммоль) КОН в виде таблеток, растворенной в 120 мл воды, и 13,2 г (31 ммоль) продукта, приготовленного на предыдущей стадии е), растворенного в 300 мл этанола, перемешивают при 40oC в течение 2 часов. Этанол затем концентрируют при пониженном давлении, и остаточную водную фазу промывают эфиром. После подкисления водной фазы получают бежевый остаток, который после обесцвечивания растительной сажей и перекристаллизации в толуоле, а потом в этилацетате, получают 4,6 г (выход 36,5%) целевого продукта в виде белых чешуек, обладающего всеми физическими, спектральными и хроматографическими характеристиками, какие описаны в примере 1г.
Пример 6. Транс-4[[2-[[(фенил)сульфонил]амино]циклопентил] метил]бензолуксусная кислота.
а) 6-(Фенилсульфонил)-6-азабицикло[3.1.0]гексан.
Раствор 93 г (0,306 моль) N-(DL-транс-2-бромциклопентил)-бензолсульфонамида, 610 мл ацетона и 61 мл 30-ой щелочи натрия нагревают с рефлюксом 2 мин, затем перемешивают 16 часов при комнатной температуре. После концентрирования при пониженном давлении остаток извлекают водой и экстрагируют эфиром. Органическую фазу промывают водой и высушивают на сульфате натрия, затем концентрируют в вакууме и получают 67, 5 г (выход 99,0) целевого продукта в виде масла светло-желтого цвета, используемого без дальнейшей очистки. Фракцию этого продукта очищают хроматографией на окиси кремния (смесь гексан-этилацетат, 2/1) для получения бесцветного масла. Т.кип.0,5= 137 139oC.
Элементный
анализ: C11H13NO2S (М=223,29)
Рассчитано, C 59,
17; H 5,87; N 6,27; S 24,36.
Получено, C 59,47; H 5,88; N 6,16; S 14,37.
ИК (пленка): n (SO2)=1310 см-1; (SO2=1150 см-1 .
ЯМР (CDCl3): d1,0-2,35 (6Н, м); 3,4 (2Н, с); 7,25- 7,75 (3Н, м); 7, 75-8,2 (2Н, м).
б) Транс-N-[2-[(фенил)метил]циклопентил]-бензолсульфонамид.
Работают согласно методике примера 5в, но исходя из 1,65 моль фенилметилмагнийхлорида и 184,3 г (0,825 моль) продукта, полученного на предыдущей стадии, в 2250 мл безводного простого эфира. Получают 249,8 г (выход 96,0%) твердого вещества белого цвета, используемого без дальнейшей очистки. Т.пл. 89-91oC. Порцию этого продукта перекристаллизовывают 2 раза из смеси гексан-этилацетат для получения целевого твердого продукта белого цвета. Т.пл. 96-98oC.
Элементный анализ C18H21NO2S (М=315,43)
Рассчитано, C 68,54; H 6,71; N 4,44; S 10,16.
Получено, C 68,69; H 6,74; N 4,33; S 10, 13.
ИК (KBr): n (NH)=3210 см-1; (SO2)=1310 см-1 ; (SO2)=1140 см-1.
ЯМР (CDCl3): d 1,0-2,3 (7Н, м); 2, 3-2,8 (2Н, м); 3,1-3,5 (1Н, м); 4,9 (1Н, д, J= 7,5 Гц, обменивающийся с CF3COOD ); 6, 85-7,35 (5Н, м); 7,4-7,65 (3Н, м); 7,7-8,0 (2Н, м).
в) Транс-N-[2-[(4-ацетилфенил)метил]циклопентил]-бензолсульфонамид.
Работают согласно примеру 5 г), но исходя из 13,2 г (41,8 ммоль) продукта, приготовленного на предыдущей стадии, 6,5 мл (91,9 ммоль) ацетилхлорида, 22,3 г (167 ммоль) безводного хлорида алюминия в 330 мл 1,2-дихлорэтана. Перемешивание осуществляют 4,5 часа при температуре -20oC. Очистку осуществляют хроматографией на кремниевой колонке (элюант: гексан этилацетат 2/1), и получают 13,2 г (выход 88,6%) твердого продукта бледно-желтого цвета, т.пл. 78oC, используемого без дальнейшей очистки. После перекристаллизации в смеси гексан-этилацетат, получают целевой твердый продукт белого цвета с желтым оттенком, плавящийся при 90-92oC.
Элементный анализ:
C20H23NO3S (М=357,468)
Рассчитано, C 67,20; H 6,49; N 3,92; S 8,97.
Получено, C 67,40; H 6,34; N 3,97; S 9,29.
ИК (пленка): n (NH)=3250 см-1; (C=O)=1660 см-1; (SO2)= 1315 см-1; (SO2)= 1150 см-1.
ЯМР (CDCl3): d0,75-1,9 (7Н, м); 1, 9-2,9 (2Н, м); 2,5 (3Н, с), 2,95-3,4 (1Н, м); 5,35 (1Н, д, J=8,25 Гц, обменивающийся с CF3COOD); 6,7-7,25 (2Н, м); 7,35-8,1 (7Н, м).
г) Метиловый эфир транс-4-[[2-[[(фенил)сульфонил]амино]циклопентил] метил]бензолуксусной кислоты.
К смеси из 12,9 г (36 ммоль) продукта, приготовленного на предыдущей стадии, 110 мл метанола и 18 мл 70-ной перхлорной кислоты вводят порциями 19,2 г (43,2 ммоль) нитрата таллия, тригидрата. После 25-часового перемешивания при комнатной температуре, образовавшийся осадок фильтруют и промывают метанолом. Фильтрат разбавляют водой и экстрагируют дихлорметаном. Органическую фазу промывают водой, высушивают на сульфате натрия и концентрируют при пониженном давлении. Остаток очищают хроматографией на кремниевой колонке (элюант: гексан/этилацетат 2/1) и получают 7,4 г (выход 53,2%) твердого продукта бежевого цвета. Т.пл. 88-90oC.
ИК (KBr): n (NH)=3205 см-1; (C=O)=1695 см-1; (SO2)=1320 см-1; (SO2) 1150 см-1.
ЯМР (CDCl3, ) d1,0-2,2 (7Н, м); 2,2-2,9 (2Н, м); 3,0-3,4 (1Н, м), 3,5 (2Н, с); 3,6 (3Н, с); 5,05 (1Н, д, J=7,5 Гц, обменивающийся на CF3COOD); 6,75-7,25 (4Н, м); 7,3-7,6 (3Н, м); 7,65-7,9 (2Н, м).
Идентичный продукт получают путем окисления соединения по примеру 6в тетраацетатом свинца в условиях, описанных в примере 5д, с последующей очисткой хроматографией на кремниевой колонке. Дополнительная перекристаллизация в смеси гексан-этилацетат дает твердый продукт белого цвета; т.пл. 91-93oC.
Элементный анализ:
C21H25NO4S (М=387,
494)
Рассчитано, C 65,09; H 6,50; N 3,61; S 8,27.
Получено, C 65,18; H 6,53; N 3,58; S 8,20.
д) Транс-4-[[2-[[(фенил)сульфонил]амино]циклопентил] метил]бензолуксусная кислота.
Получают как в примере 5е, но исходя из 4,6 г (11,9 ммоль) соединения, полученного на предыдущей стадии, и 1,3 г (23,2 ммоль) КОН в смеси этанол-вода. После перекристаллизации в толуоле получают 3,4 г (выход 77,3%) мелкого твердого продукта белого цвета. Т.пл. 118-120oC.
Элементный анализ: C20H23
NO4S (М=373,467)
Рассчитано, C 64,32; H 6,21; N 3,75; S 8,58.
Получено, C 64,67; H 6,18; N 3,74; S 8,
69
ИК(KBr): n (NH)=3250 см-1; (C=O)=1680
см-1; (SO2)=1315 см-1; (SO2)=1145 см-1.
ЯМР (DMCO d6): d0,75-1,7 (7Н, м); 1,7-2,3 (2Н, м); 3,1-3,35 (1Н, м); 3,5 (2Н, с); 6,65-7,4 (4Н, м); 7,4-8,1 (6Н, м, из которых 1Н обменивается на CF3COOD); 12,2 (1Н, с, обменивающийся на CF3 COOD).
Ж.Х.В.Р. (ODS-2): Tyg.17,65 (единственный пик).
Пример 7. Транс-4-[[2-[[(4-метилфенил)сульфонил]амино]циклопентил] бензолуксусная кислота.
а) Транс-4-метил-N-[2-[(фенил)метил]циклопентил] бензолсульфонамид.
Получают как в примере 5в, но исходя из 0,3 моль фенилметилмагнийхлорида и 35 г (0,14,7 моль) 6-[(4-метилфенил)сульфонил]-6-азабицикло[3.1.0]гексана в виде твердого вещества в 500 мл безводного эфира. Получают 40,1 г (выход 83,0%) твердого продукта белого цвета, используемого без дальнейшей очистки. Т.пл. 73-78oC.
ИК (KBr): n
(NH)=3240
см-1; (SO2)=1320 см-1; (SO2)=1140 см-1;
ЯМР (CDCl3
): d0,75-2,85 (9Н, м); 2,4 (3Н, с); 3,0-3,45 (1Н, м); 5,1 (1Н, д,
J= 7,5 Гц,
обменивающийся на CF3COOD); 6,75- 7,4 (7Н, м); 7,55-7,9 (2Н, м).
б) Транс-N-[2-[(4-ацетилфенил)метил]циклопентил]-4- метилбензолсульфонамид.
Получают как в примере 5 г, но исходя из 10 г (30,3 ммоль) соединения, приготовленного в примере 7а, 4,7 мл (66 ммоль) ацетилхлорида, 16,2 г (122 ммоль) безводного хлорида алюминия, в 240 мл дихлорметана. Перемешивание осуществляют 5 час при -30/-20oC. Очистку осуществляют хроматографией на кремниевой колонке (элюант: гексан-этилацетат 4/1). Получают 4,7 г (выход 42,0%) продукта в виде масла, частично кристаллизованного.
ИК (пленка) n (NH)=3250 см-1; (C=O)=1660 см-1; (SO2)=1320 см-1; (SO2)= 1140 см-1.
ЯМР (CDCl3): d0,65-3,6 (10Н, м); 2,4 (3Н, с)2,55 (3Н, с); 5,3 (1Н, д, J= 7,5 Гц, обменивающийся на CF3COOD); 6,9-7,4 (4Н, м); 7,55- 8,05 (4Н, м).
в) Метиловый эфир транс-4-[[2-[(4-метилфенил)сульфонил]амино]циклопентил] метил]бензолуксусной кислоты.
Получают как в примере 5д, но исходя из 4,7 г (12,6 ммоль) соединения, полученного на предыдущей стадии, 6 мл метанола, 6,2 мл (50,4 ммоль) эфирной вытяжки трифторида бора в 30 мл дихлорметана, затем из 5,8 г (13,1 ммоль) тетраацетата свинца в 35 мл бензола. Осуществляют очистку хроматографией на кремниевой колонке (элюант: гексан-этилацетат 4/1) и получают 2,7 г (выход 54,0%) светло-желтого масла.
ИК (пленка): n (NH)=3240 см-1; (C=O)=1710 см-1, (SO2)=1310 см-1; (SO2 )= 1140 см-1.
ЯМР (CDCl3): d0,9-3,4 (10Н, м); 2,4 (3Н, с); 3, 6 (2Н, с); 3,7 (3Н, с); 4,8 (1Н, д. J=7 Гц, обменивающийся на CF3COOD); 6,8-7,4 (6Н, м); 7,6-7,85 (2Н, м).
г) Транс-4-[[2-[[(4-метилфенил)сульфонил]амино]циклопентил] метил]бензолуксусная кислота.
Получают как в примере 5е, но исходя из 2,7 Г (6,7
ммоль) соединения, приготовленного на предыдущей стадии, и 0,75 г (13,4 ммоль) КОН в виде таблеток в
смеси этанол-вода.
Перекристаллизацией в толуоле получают 0,6 г (выход 23,1%) твердого белого
вещества. Т.пл. 134-135oC. Элементный анализ: C21H25NO4S
(М=387,494)
Рассчитано, C 65,09; H 6,50; N 3,61; S 8,27.
Получено, C 65, 53; H 6,55; N 3,61; S 8,17.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1690 см-1; (SO2)=1320 см-1; (SO2)=1145 см-1.
ЯМР (DMCO d6) d1,0-2,25 (8Н, м); 2,4 (3Н, с); 2,75-3,4 (2Н, м), 3,5 (2Н, с); 6,8-8,
0 (6Н, м); 8,0-8,5
(3Н, м, из которых 1Н обменивается на CF3COOD); 12,3 (1Н, с,
широкий, обменивающийся на CF3COOD )
Ж.Х.В.Р. (ODS-2): Tyg.33,5 (единственный пик).
Пример 8. Этиловый эфир транс-4-[[2- [[(4-xлорфенил)сульфонил]амино] циклопентил]метил]бензолуксусной кислоты.
а) Этиловый эфир транс-4-[(2-аминоциклопентил)метил]бензолуксусной кислоты.
0,5 г (21 ммоль) натрия прибавляют к смеси из 2, 6 г (21 ммоль) нафталина и 20 мл 1,2-диметоксиэтана в токе азота. После перемешивания в течение 1 час при 20oC прикапывают в течение 1 часа при комнатной температуре раствор из 2 г (5,2 ммоль) метилового эфира транс-4-[[2-[[(фенил)сульфонил]амино]циклопентил] метил] бензолуксусной кислоты в 20 мл 1,2-диметоксиэтана. После перемешивания в течение 1 час при 20oC прикалывают 40 мл воды, затем промывают этилацетатом. Водную фазу, подкисленную разбавленной HCl, промывают этилацетатом, затем концентрируют досуха при пониженном давлении. Остаток поглощают 50 мл абсолютного спирта и полученную белую суспензию насыщают при 0oC газообразной HCl. После перемешивания в течение 16 часов при 20o C реакционную среду концентрируют при пониженном давлении, поглощают водой, подщелачивают NH4OH и экстрагируют этилацетатом. Эту органическую фазу после промывания водой, насыщенной NaCl, высушивают на сульфате натрия, концентрируют и получают 0,5 г (выход 39,3%) частично кристаллизованного коричневого масла, используемого без дальнейшей очистки.
ИК (пленка) n (NH)=3330 см-1; (C=O)=1710 см-1.
ЯМР (CDCl3) d1,2 (3Н, т, J=6,75 Гц); 1,4-3,2 (12Н, м, 2Н, обменивающихся на D2O); 3,55 (2Н, с); 4,1 (2Н, к, J=6,75 Гц); 7,1 (4Н, с).
б) Этиловый эфир транс-4-[[2-[[(4-хлорфенил)сульфонил]амино]циклопентил] метил]бензолуксусной кислоты.
Получают как в примере 1в, но исходя из 0,5 г (1,9 ммоль) продукта, приготовленного на предыдущей стадии, 0,25 г (2,5 ммоль) триэтиламина в 20 мл дихлорметана и 0,4 г (1,9 ммоль) хлорида 4-хлорбензолсульфонила в 15 мл эфира. Перемешивают 20 часов при 20o C. Получают 0,6 г (выход 72,3%) густого масла.
ИК (пленка) n (NH)=3260 см-1; (C=O)1720 см-1; (SO2)= 1325 см-1, (SO2)= 1150 см-1.
ЯМР (CDCl3): d1,2 (3Н, т, J=6,75 Гц);
1,2-3,4 (10Н, м); 3,55 (2Н, с); 4,1 (2Н, к, J=6,75 Гц); 4,9 (1Н, д, J=7,5 Гц, обменивающийся
на D2O); 6,
8-7,25 (4Н, м); 7,3-7,5 (2Н, м); 7,6-7,85 (2Н, м)
Пример 9.
4-[2-[[(4-хлорфенил)сульфонил]амино] циклопентилокси]бензолуксусная кислота.
а) Этиловый эфир 4-[2-[[(4-хлорфенил)сульфонил]амино] циклопентилокси] бензолуксусной кислоты.
Смесь из 2,5 г (15 ммоль) метилового эфира 4-гидроксибензолуксусной кислоты, 4 г (30 ммоль) K2 CO3 и 30 мл ВМФ доводят до 80oC. Туда по каплям добавляют раствор из 5 г (14,8 ммоль) N-(2-бромциклопентил)-4-хлорбензолсульфонамида, полученного в примере 5а, в 50 мл ВМФ. Перемешивают 5 часов при 80oC. После охлаждения появившийся твердый продукт фильтруют и промывают этилацетатом. Фильтрат разбавляют водой и экстрагируют этилацетатом. Органическую фазу промывают водой, высушивают на сульфате натрия, концентрируют при пониженном давлении. Остаток очищают хроматографией на кремниевой колонке (элюант: гексан/этилацетат 1/1) и получают 6,2 г (выход 99, 5%) продукта в виде желтой жидкости.
ИК (пленка): n (NH)=3250 см-1; (C=O)=1710 см-1; (SO2)=1320 см-1 (SO2)= 1150 см-1 .
ЯМР (CDCl3): d1,0-2,35 (6Н, м); 2,75-3, 4 (1Н, м); 3,55 (2Н, с); 3,7 (3Н, с); 4,5-4,9 (1Н, м); 5,2-5,7 (1Н, м, обменивающийся на CF3COOD); 6,5-7,6 (6Н, м); 7, 6-7,95 (2Н, м).
б) 4-[2-[[(4-хлорфенил)сульфонил] амино] циклопентилокси]бензолуксусная кислота.
Получают как в примере 1г, но исходя из 6,2 г (14,6ммоль) продукта, приготовленного выше, в 60 мл этанола и 1,6 г (28,6 ммоль) КОН в 15 мл воды. После перекристаллизации в толуоле получают 1,6 г (выход 27,1%) мелкого твердого продукта белого цвета. Т.пл. 136-139oC.
Анализ C19H20
ClNO5S (М=409, 884)
Рассчитано, C 55,68; H 4,92; Cl 8,65; N 3,42; S 7,82.
Получено, C 55,80; H 5,01; Cl 8,95; N 3,37; S 7,94.
ИК(KBr): n (NH)=3280 см-1; (C=O)=1690 см-1; (SO2=1315 см-1; (SO2)=1140 см-1 .
ЯМР (ацетон d6) d1,1-2,35 (6Н, м); 3,
2-3,8 (1Н, м), 3,5 (2Н, с); 4,3-4,65 (1Н, м); 6,0-6,9 (3Н, м), из которых 1Н обменивается CF3COOD ); 7,0-7,25 (2Н, м); 7,
3-7,6 (2Н, м); 7,
7-7,9 (2Н, м); 10,0-10,9 (1Н, с, широкий,
обменивающийся с CF3COOD
Ж.Х.В.Р. (ODS-2): Tyg.24,08 (единственный пик).
Пример 10. Транс-4-[2-[[(4-хлорфенил)сульфонил]амино]циклогексил] бензолуксусная кислота.
а) Транс-N-[2-(4-ацетилфенил)циклогексил]-4-хлорбензолсульфонамид.
К смеси, находящейся при 0oC, из 4,0 г (12 ммоль) транс-4-хлор-N-(2-фенилциклогексил)бензолсульфонамида (приготовленного по Das P.C. и соавт. Indian J. Chem. (1974), 12, 1139-40), 80 мл безводного дихлорметана и 2,4 г (31 ммоль) ацетилхлорида прибавляют фракциями 5,3 г (40 ммоль) хлорида алюминия. Спустя 4 часа при 0oC реакционную среду выливают на смесь лед-HCl, затем экстрагируют дихлорметаном. Органическую фазу промывают водой до нейтральности, высушивают на сульфате натрия и концентрируют. Остаток очищают хроматографией на кремниевой колонке (элюант: гексан/этилацетат 4/1). Получают 2 г бесцветного масла (выход 42, 5%).
ИК (пленка) n (NH)=3260 см-1; (C=O)=1655 см-1; (SO2)=1315 см-1; (SO2)= 1150 см-1.
ЯМР (CDCl3): d0,7-2,45 (8Н, м); 2,6 (3Н, с); 2,75-3,75 (2Н, м); 4,8 (На, д, J= 7,5 Гц, обменивающийся с CF3COOD); 6,8-7,1 (2Н, м); 7,1-7,4 (4Н, м); 7,5-7,8 (2Н, м).
б) Метиловый эфир транс-4-[2-[[(4-хлорфенил)сульфонил]амино]циклогексил] -бензолуксусной кислоты.
К смеси 4,7 г (12 ммоль) транс-N-[2-(4-ацетилфенил)циклогексил]-4-хлорбензолсульфонамида и 40 мл метанола прикапывают при комнатной температуре 6,1 мл (100 ммоль) 70-ной перхлорной кислоты, затем порциями 6,4 г (14,4 ммоль) нитрата таллия (III). Полученную реакционную среду перемешивают 48 часов при комнатной температуре. После фильтрации и промывки метанолом образующегося белого осадка, фильтрат помещают в воду и экстрагируют дихлорметаном. Органическую фазу промывают водой, высушивают на сульфате натрия, затем концентрируют и получают 4 г бесцветного масла (выход 79,0%). Это масло кристаллизуется в эфире после растирания с получением белых кристаллов. Т.пл. 107-110oC.
ИК (KBr): n (NH)=3260 см-1; (C=O)=1705 см-1; (SO2)=1315 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3) d1,0-3,4 (10Н, м); 3,55 (2Н, с); 3,7 (3Н, с); 4,15-4,5 (1Н, м, обменивающийся с CF3COOD); 6,6-7,15 (4Н, м); 7, 2 (4Н, с).
c) Транс-4-[2-[[(4-хлорфенил)сульфонил]амино]циклогексил]-бензолуксусная кислота.
Смесь из 1,8 г (4,3 ммоль) метилового эфира транс-4-[2-[[(4-хлорфенил)сульфонил] амино] циклогексил] бензолуксусной кислоты, 18 мл этанола, 18 мл воды и 0,5 г (8,5 ммоль) КОН в таблетках нагревают 4 часа при 40oC при помешивании. Этанол затем удаляют при пониженном давлении. Остаток разбавляют водой, промывают эфиром и подкисляют на холоду с помощью 5 мл концентрированной HCl. Сформированный осадок центрифугируют, промывают водой и высушивают в термостате при 50oC в течение ночи. Продукт очищают двумя перекристаллизациями из смеси гексан-этилацетат и получают 0,8 г ( выход 7,0%) твердого белого вещества. Т.пл. 147-149oC.
Элементный анализ: C20H22ClNO4S (М=407, 91)
Рассчитано, C 58,89; H 5,44; Cl 8,69; N 3,43; S 7,86.
Получено, C 59,12; H 5,35; Cl 8,86; N 3,36; S 8,20.
ИК (KBr) n (NH)=3170 см-1; (C=O)=1700 см-1; (SO2)=1300 см-1; (SO2 )=1140 см-1.
ЯМР (DMSO d6): d0,8-2,3 (9Н, м); 2,75-3,4 (1Н, м); 3,45 (2Н, с); 6,9 (4Н, с); 7,3 (4Н, с); 7,6 (1Н, д, J=8,25 Гц, обменивающийся с CF3 COOD); 12, 15 (1Н, с, обменивающийся с CF3COOD).
Пример 11. Транс-4[[2-[[(4-хлорфенил)сульфонил]амино]циклогексил] метил] бензолуксусная кислота.
a) Этиловый эфир 4-[(2-гидроксииминоциклогексил)метил] бензолуксусной кислоты.
Работают согласно примеру 1а, но исходя из 16,4 г (62,7 ммоль) 4-[(2-гидроксииминоциклогексил)метил] бензолуксусной кислоты (приготовленной по Fekada A. И сотр. J. Med. Chem. (1984) 27, 212-6) в 320 мл этанола (выход 90,6%).
ИК (пленка) n (NH)=3220 см-1; (C=O)=1715 см-1.
ЯМР (CDCl3) d 1,25 (3Н, т, J=7,1 Гц); 1,1-3,4 (12Н, м, из которых 1Н обменивается с CF3COOD); 3,6 (2Н, с); 4,15 (2Н, к, J=7,1 Гц); 7,1 (4Н, м).
б) Этиловый эфир 4-[(2-аминоциклогексил)метил] бензолуксусной кислоты (цис+транс).
Работают согласно примеру 1б, но исходя из 15,5 г (56,7 ммоль) этилового эфира 4-[(2-гидроксииминоциклогексил)метил] бензолуксусной кислоты в этаноле, насыщенном аммиаком. После обработки выделяют 6,1 г (выход 39,1%) желто-зеленого масла, используемого без дальнейшей очистки.
ИК (пленка): n (NH2)=3360 см-1; (C=O)=1720 см-1.
ЯМР (CDCl3): d1,25 (3Н, т, J=7,1 Гц); 0,75-2,1 (11Н, м, из которых 2Н обмениваются с D2O); 2,1-2,75 (2Н, м); 2,8-3,4 (1Н, м); 3,6 (2Н, с); 4,15 (2Н, к, J=7,1 Гц); 7,1 (4Н, с).
в) Этиловый эфир 4-[[2-[[(4-хлорфенил)сульфонил]амино]циклогексил] метил]бензолуксусной кислоты (цис и транс).
Получают как в примере 1в, но исходя из 6,1 г (22 ммоль) этилового эфира 4-[(2-аминоциклогексил)метил] бензолуксусной кислоты, 2,7 г (26,5 ммоль) триэтиламина в 150 мл дихлорметана и 4,6 г (22 ммоль) хлорида 4-хлорбензолсульфонила в 50 мл эфира. Получают бесцветное масло (выход количественный), используемое без дальнейшей очистки.
ИК (пленка): n (NH)=3280 см-1; (C=O)=1710 см-1; (SO2)=1320 см-1 (SO2 )= 1150 см-1.
ЯМР (CDCl3) d1,25 (3Н, т, J=6,75 Гц); 0,6-2,75 (11H, м); 2,75-3,3 (1Н, м); 3,55 (2Н, с); 4,1 (2Н, к, J=6,75 Гц); 4,5-5,3 (1Н, м, обменивающийся с CF3COOD); 6,8-7,25 (4Н, м): 7,4 (2Н, м); 7,8 (2Н, м).
г) Транс-4-[[2-[[(4-хлорфенил)сульфонил] амино] циклогексил] метил]бензолуксусная кислота.
Получают как в примере 1г, но исходя из 9,9 г (22 ммоль) этилового эфира 4-[[2-[[(4-хлорфенил)сульфонил] амино]циклогексил] метил]бензолуксусной кислоты, 2,5 г (44 ммоль) КОН в таблетках в 212 мл смеси этанол-вода (1:1). После пяти перекристаллизаций в изопропаноле получают 0,9 г (выход 9,7%) твердого белого вещества. Т.пл. 166-168oC.
Элементный анализ:
C21
H24ClNO4S (М=421,94)
Рассчитано, C
59,78; H 5,73; Cl 8,4; N 3,32; S 7,60.
Получено, C 59,71; H 5,55; Cl 8,07; N 3,31; S 7,31.
ИК (KBr): n (NH)=3270 см-1; (C=O)=1690 см-1; (SO2)=1310 см-1; (SO2)=1140 см-1.
ЯМР (DMCO d6): d0,65-2,2 (10Н, м); 2,6-3,4 (3Н, м, из которых 1H обменивается с CF3COOD); 3, 5 (2Н, с); 6,8-7,3 (4Н, м); 7,5-8,0 (4Н, м); 12,0 (1Н, с, широкий, обменивающийся с CF3COOD).
Ж.Х.В.Р. (ODS-2). Tyg.15,6.
Перед перекристаллизацией Tyg.12, 7; 15,6; эти 2 пика одинаковой интенсивности соответствуют изомерам цис и транс.
Пример 12. 4-[1-[[[(4-хлорфенил)сульфонил] амино] метил] циклопропил] бензолуксусная кислота.
а) 1-(4-ацетилфенил)циклопропанкарбонитрил.
Раствор 5 г (31,4 ммоль) 4-ацетилбензолацетонитрила (приготовленного по Rorig K. J. Am. Chem. Soc. (1953) 75, 5381-3) в 10 мл ДМСО прикалывают при комнатной температуре в суспензию 3,4 г (около 78,5 ммоль) гидрида натрия (55-60 -ный в минеральном масле) в 60 мл DMCO в токе азота. После 45 мин перемешивания при комнатной температуре по каплям добавляют 8,85 г (47,1 ммоль) 1,2-дибромэтана, растворенного в 10 мл DMCO, поддерживая температуру ниже 50oC при помощи бани с ледяной водой. После 16 час перемешивания при комнатной температуре реакционную среду выливают на 300 мл льда-воды. Образовавшийся осадок центрифугируют, промывают водой и высушивают в вакууме, затем очищают перекристаллизацией из смеси этилацетата и гексана, и получают 3,7 г (выход 64,0%) твердого вещества серо-фиолетового цвета. Т. пл. 74oC.
ИК (KBr): n(C≡N) (C=N)2210 см-1 (C=O)=1660 см-1.
ЯМР (CDCl3): δ1,3-1,65 (2Н, м); 1, 75-2, 0 (2Н, м); 2,6 (3Н, с); 7,15-7,5 (2Н, м); 7,75-8,1 (2Н, м).
б) Метиловый эфир 4-(1-цианоциклопропил)бензолуксусной кислоты.
К смеси из 3,7 г (20 ммоль) продукта, полученного на предыдущей стадии, 6,5 мл (160 ммоль) метанола и 35 мл дихлорметана в токе азота прибавляют по каплям при комнатной температуре 9,8 мл (80 ммоль) эфирной вытяжки трифтората бора, затем 9,75 г (22 ммоль) тетраацетата свинца, суспензированного в 55 мл бензола. После перемешивания реакционной среды 17 часов при комнатной температуре ее выливают на 150 мл смеси воды со льдом. Экстракцию осуществляют дихлорметаном. Органическую фазу затем промывают раствором, насыщенным NaHCO3, затем водой до нейтральности, затем высушивают на сульфате натрия. После концентрации в вакууме получают 3,85 г (выход 89,5%) жидкого оранжевого масла, используемого без дальнейшей очистки.
ИК (пленка) n(C≡N) (C=N)=2010 см-1; (C=O)=1725 см-1.
ЯМР (CDCl3): δ1,2-1,55 (2Н, м); 1,55-1,9 (2Н, м); 3,6 (2Н, с); 3,65 (3Н, с); 7,2 (4Н, с).
в) Метиловый эфир 4-[1-(Аминометил)циклопропил]бензолуксусной кислоты.
Смесь 2,75 г (12,8 ммоль) соединения, полученного на стадии б), 8,4 мл жидкого аммиака, 80 мл метанола и 1 г никеля Ренея, промытого метанолом, гидрогенируют при давлении водорода 90 атм. При перемешивании и при комнатной температуре. Спустя 1,5 часа гидрогенизацию останавливают. После фильтрации и промывания катализатора фильтрат концентрируют при пониженном давлении и получают 2,8 г (выход количественный) желто-зеленого масла, используемого без дальнейшей очистки.
ИК (пленка): n (NH2)=3300 см-1; (C=O)=1740 см-1.
ЯМР (CDCl3): d0,5-1,4 (4Н, м); 1,5 (2H, с обменивающиеся с CF3COOD); 1,9 (2Н, с); 3,5 (2Н, с); 3,6 (3Н, с); 6,9-7,55 (4Н, м).
г) Метиловый эфир 4-[1-[[[(4-хлорфенил)сульфонил]амино]циклопропил] бензолуксусной кислоты.
Работают как в примере 1в, но исходя из 2,9 г (13,2 ммоль) соединения, полученного на предыдущей стадии, 2,2 мл (15,8 ммоль) триэтиламина в 70 мл дихлорметана и 2,8 г (13,2 ммоль) хлорида 4-хлорбензолсульфонила в 7,5 мл простого эфира. Реакционную среду перемешивают 2,5 дня при комнатной температуре. Продукт очищают флеш-хроматографией на кремниевой колонке со смесью гексан-этилацетат 4/1, затем 3/1, затем перекристаллизовывают из смеси гексан-этилацетат и получают 1,6 г (выход 30,8%) твердого вещества бежевого цвета. Т.пл. 88-89,5oC.
ИК (KBr): n (NH)=3280 см-1; (C=O)=1720 см-1 ; (SO2)=1330 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3): d0,8 (4Н, с); 3,1 (2Н, д, J=5 Гц, переходящий в синглет в CF3COOD ); 3,55 (2Н, с); 3,7 (3Н, с); 4,7 (1Н, т, J=6 Гц, обменивающийся с CF3COOD); 7,05 (4H, с); 7,2-7,75 (4Н, м).
д) 4-[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопропил]бензолуксусная кислота.
Смесь 1,6 г (4 ммоль) соединения, приготовленного на стадии г), 20 мл метанола, 0,5 г (8,9 ммоль) КОН в виде таблеток и 6,7 мл воды перемешивают в течение 2 часов при 40oC. После концентрации досуха при пониженном давлении остаток извлекают 40 мл воды, промывают этилацетатом и подкисляется HCl 5Н с получением бежевого осадка, который поглощают этилацетатом. Эту органическую фазу промывают водой, затем экстрагируют раствором, насыщенным NaHCO3. Полученную водную фазу подкисляют 5Н HCl. Получается белый мелкий осадок, который фильтруют, промывают водой и высушивают в течение ночи при 50oC. После 2 перекристаллизаций в смеси гексан-этилацетат получают 0,55 г (выход 36,7%) твердого белого вещества. Т.пл. 132-133oC.
Элементный анализ: C18H18ClNO4S (М=379, 858)
Рассчитано,
C 56,92; H 4,78; Cl 9,33; N 3,69; S 8,44.
Получено, C 56,64; H 4,73; Cl 9,45; N 3,55; S 8,37.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1680 см-1; (SO2)=1305 см-1; (SO2)=1150 см-1.
ЯМР (ацетон d6): d0,6-1,0 (4Н, м); 3,15 (2Н, д, J=6 Гц, переходящий в синглет с CF3 COOD); 3,6 (2H); 6,6 (1Н, J=6 Гц, заменяющихся с CF3COOD); 7,2 (4Н, с); 7,4-7,6 (2Н, м), 7,6-7,9 (2Н, м); 10,2-10,9 (1Н, с, широкий, обменивающийся с CF3COOD).
Пример 13. 4-[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклобутил]бензолуксусная кислота.
а) 1-Фенилциклобутанметанамин.
Суспензию LiAlH4 с концентрацией 13% в смеси толуол-ТГФ, имеющуюся в продаже (0,595 моль; 175 мл), разбавленную в токе азота с помощью 270 мл ТГФ, охлаждают до температуры 0oC. Прикапывают смесь 90 г (0,572 моль) 1-фенилциклобутанкарбонитрила с 800 мл ТГФ, в течение 20 мин. После прибавления температуру постепенно поднимают до температуры рефлюкса в течение 1 часа. После охлаждения до 5oC по каплям осторожно приливают 150 мл воды, 150 мл 10% NaOH, затем 560 мл воды. Экстрагируют этилацетатом после насыщения водной фазы NaCl. Органическую фазу экстрагируют 1Н раствором HCl. Водную фазу подщелачивают 30% NaOH и экстрагируют дихлорметаном, промывают водой, высушивают на сульфате натрия и концентрируют. Получают красноватую жидкость, очищаемую дистилляцией. Получают 68,65 г (выход 81, 3%) бесцветной жидкости. Т.кип. 84-92oC.
ИК (пленка): n (NH2)=3350 см-1.
ЯМР (CDCl3): d0,9 (2Н, с, обменивающиеся с CF3COOD); 1,65-2,5 (6Н, м); 2,9 (2Н, с); 6,8-7,7 (5Н, м).
б) 4-хлор-N-[[1-(фенил)циклобутил]метил] бензолсульфонамид.
Работают как в примере 1в, но исходя из 57 г (465 ммоль) 1-фенилциклобутанметанамина, полученного выше, 77,8 мл (558 ммоль) триэтиламина в 2600 мл дихлорметана и 98,2 г (465 ммоль) хлорида 4-хлорбензолсульфонила в 260 мл простого эфира. После перемешивания в течение 62 часов и обычной обработки получают 154,4 г (выход 98,8%) твердого пастообразного продукта, используемого без дальнейшей очистки. Т.пл. 107-108o C.
ИК (KBr) n (NH)3260 см-1 (SO2)=1325 см-1; (SO2)=1165 см-1.
ЯМР (CDCl3): d1,75-2,5 (6Н, м); 3,2 (2Н, д, J=6,75 Гц, превращающийся в синглет с CF3COOD); 4,15 (1Н, т, J= 6, 75 Гц, обменивающийся с CF3COOD; 6,65-7,7 (9Н, м).
в) N-[[1-(4-ацетилфенил)циклобутил]метил]-4-хлорбензолсульфонамид.
К смеси из 90 г (268 ммоль) соединения, полученного на стадии б), 52,6 мл (697 ммоль) ацетилхлорида в 1300 мл дихлорметана прибавляют в токе азота порциями за 5 мин 188 г (1407 ммоль) хлорида алюминия, поддерживая температуру -5oC. Затем перемешивают 4 часа при 5oC, потом 2 часа при 20oC. Реакционную среду после этого выливают на 1,5 кг льда, содержащего 250 мл концентрированной соляной кислоты. Экстрагируют дихлорметаном (2х500 мл), потом промывают до нейтральности водой, высушивают на сульфате натрия. После концентрации при пониженном давлении получают твердый остаток, который 2 раза перекристаллизовывают в этилацетате и получают 32,3 г (выход31,9%) продукта в виде бежевых иголок. Т.пл. 142-143oC.
ИК (KBr): n (NH)=3140 см-1; (C=O)=1655 см-1; (SO2)=1330 см-1; (SO2)=1155 см-1.
ЯМР (CDCl3): d1,5-2,65 (6Н, м); 2,5 (3Н, с); 3,2 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 4,55 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,8-7,85 (8Н, м).
г) Метиловый эфир 4-[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклобутил]бензолуксусной кислоты.
Работают как в примере 5д, но исходя из 5 г (13,2 ммоль) соединения, полученного на предыдущей стадии в), 5 мл метанола в 25 мл дихлорметана, 6,5 мл эфирной вытяжки трифторида бора и 6,2 г тетраацетата свинца в 35 мл бензола. Полученный продукт 4,05 г (выход 75,0%) после перекристаллизации в смеси гексан- этилацетат представляет собой твердое мелкозернистое белое вещество. Т.пл. 88-90oC.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1720 см-1; (SO2)=1325 см-1; (SO2)=1160 см-1.
ЯМР (CDCl3) d1,75-2,6 (6Н, м); 3,2 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3, 6 (2Н, с); 3,7 (3Н, с); 4,2 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,8-7,05 (2H, м); 7,05-7,25 (2H, м); 7, 25-7,5 (2Н, м); 7,5-7,8 (2Н, м).
д) 4-[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклобутил]бензолуксусная кислота.
Работают как в примере 12д, но исходя из 4г (9,8 ммоль) сложного эфира, полученного на предыдущей стадии г), 50 мл этанола, 1,1 г (19,6 ммоль) КОН и 16,5 мл воды. После экстракции продукт очищают флеш-хроматографией на кремниевой колонке (элюант CH2 Cl2 метанол 95/5) с последующей перекристаллизацией в смеси этил-ацетат-циклогексан. Получают 1,2 г (выход 31,1%) твердого белого вещества. Т.пл. 138-139oC.
Элементный анализ: C19
H20ClNO4S (М=393,88)
Рассчитано, C 57,94; H 5,12; Cl 9,00; N 3,56; S 8,14.
Получено, C 57,94; H 5,31; Cl 9, 05; N 3,62; S 8,17.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1680 см-1; (SO2)=1330 см-1; (SO2)=1160 см-1.
ЯМР (CDCl3): d 1,6-2,7 (6Н,
м); 3,2 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,6 (2Н, с); 4,3 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,8-7,1 (2Н,
м); 7,1-7,3 (2Н,
м); 7,3-7,5 (2Н, м); 7,
5-7,75 (2Н, м); 9,3-10,15 (1H, с широкий, обменивающийся с CF3COOD)
Пример 14. 4-[1-[[[(4-хлорфенил)сульфонил] амино] метил] циклопентил]
бензилуксусная
кислота.
а) 4-хлор-N-[[1-(фенил)циклопентил]метил] бензолсульфонамид.
Работают как в примере 1в, но исходя из 40,2 г (229 ммоль) 1-фенилциклопентанметанамина, 38,3 мл (275 ммоль) триэтиламина в 1300 мл дихлорметана и 49,3 г (233 ммоль) хлорида 4-хлорбензолсульфонила в 130 мл простого эфира в инертной атмосфере. После очистки хроматографией на кремниевой колонке со смесью гексан-этилацетат 9/1 получают 74 г (выход 92,3%) твердого пастообразного продукта в виде иголок. Т.пл. 88-91oC.
ИК (KBr):
n (NH)=3250 см-1; (SO2)=1340 см-1;
(SO2)=1170 см-1;
ЯМР (CDCl3): d1,5-2,4 (8Н, м); 3,0 (2Н, д, J=6,4 Гц, переходящий в
синглет с CF3COOD); 4,2 (1Н, т,
J=6,4 Гц, обменивающийся с
CF3COOD); 6,7-8,0 (9Н, м).
б) N-[[1-(4-ацетилфенил)циклопентил]метил]-4-хлорбензолсульфонамид.
Работают как в примере 13в, но исходя из 30 г (85,7 ммоль) соединения, полученного на предыдущем этапе, 16,8 мл (222,8 ммоль) ацетилхлорида в 500 мл дихлорметана и 60 г (450 ммоль) хлорида алюминия в инертной атмосфере. После очистки флеш-хроматографией на кремниевой колонке смесями гексан-этилацетата от 3/1 до 1/4, получают 12,9 г ( выход 8, 4%) твердого вещества белого цвета. Т.пл. 135-136,5oC.
ИК (KBr): n (NH)=3190 см-1; (C=O)=1655 см-1; (SO2)=1330 см-1; (SO2)=1150 см-1 .
ЯМР (CDCl3): d1,5-2,25 (8Н, м); 2,55 (3Н, с); 3,0 (2Н, д, J6,75 Гц, переходящий в синглет в CF3COOD); 4,4 (1Н, т, J=6,75 Гц, обменивающийся с CF3 COOD); 6,9-8,35 (8Н, м).
в) 4-Хлор-N-[[1-[4-[2-(морфолин-4-ил)-2-тиоксоэтил] фенил] циклопентил] метил]-бензолсульфонамид.
Смесь 7 г (17,9 ммоль) соединения, полученного на предыдущей стадии б), 1 г (31,2 ммоль) серы и 15 мл морфолина доводят до рефлюкса 16 часов. Реакционную среду затем выливают на 100 г льда. Экстракцию проводят этилацетатом (3х50 мл) после насыщения водной фазы NaCl. Органическую фазу промывают раствором 1H HCl (2х50 мл), потом водой, насыщенной NaCl до нейтрализации, затем высушивают на сульфате натрия и концентрируют при пониженном давлении. После очистки полученного остатка, флеш-хроматографией на кремниевой колонке в смеси гексан-этилацетат 2/1 с последующей перекристаллизацией в смеси гексан-этилацетат, выделяют 2,95 г (выход 33,5%) твердого бежевого вещества. Т.пл. 124-125oC.
ИК (KBr): n (NH)=3260 см-1; (SO2)=1335 см-1; (SO2)=1160 см-1.
ЯМР (CDCl3 ): d1, 3-2,1 (8Н, м); 2,95 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,3-4,5 (9Н, м, из которых 1H обменивается с CF3COOD); 4,3 (2Н, с); 6,85-7,85 (8Н, м).
г) 4-[1-[[[(4-Хлорфенил)сульфонил]амино]метил] циклопентил]бензолуксусная кислота.
Смесь 2,9 г (5,9 ммоль) соединения, полученного на предыдущей стадии в), 1,5 г (37,5 ммоль) едкого натра в виде таблеток и 37,5 мл воды доводят до рефлюкса в течение 15 часов. После охлаждения реакционную среду разбавляют с помощью примерно 65 мл воды со льдом, подкисляют 5Н HCl до pH 1, насыщают NaCl и экстрагируют этилацетатом (3х100 мл). Органическую фазу промывают водой, насыщенной NaCl до нейтральности, и высушивают на сульфате натрия с последующим концентрированием при пониженном давлении. Полученный остаток очищают флеш-хроматографией на кремниевой колонке смесью дихлорметана с метанолом 97/3, затем перекристаллизацией в циклогексане в присутствии растительного угля и получают 0,5 г (выход 20,8%) твердого белого вещества. Т.пл. 145-146,5oC.
Элементный анализ: C20H22ClNO4S (М=407,912)
Рассчитано,
C 58,89; H 5,44; Cl 8,69; N 3,43; S 7,76.
Получено, C 58,45; H 5,58; Cl 8,84; N 3,41; S 8,07.
ИК (KBr): n (NH)=3280 см-1; (C=O)=1695 см-1; (SO2)=1320 см-1; (SO2)=1150 см-1.
ЯМР (ацетон d6
): d1,3-2,25 (8Н, м); 3,05 (2Н, д, J=6,75 Гц, переходящий в синглет в
CF3COOD); 3,5 (2Н, с); 6,1 (1Н, т, J=6.75 Гц, обменивающийся с CF3COOD); 7,15 (4Н, с); 7,3-7,9 (4Н, м)
Пример 15. 4-[[1-[[[(Фенил)сульфонил]амино]метил]
циклопентил]метил]бензолуксусная кислота.
а) 1-[(Фенил)метил] циклопентанметанамин.
К суспензии 68,8 г (1,81 моль) LiAlH4 в 1350 мл безводного простого эфира в атмосфере азота, приливают по каплям в течение 1,5 часов, поддерживая температуру реакционной среды между 10 и 20oC, 279,9 г (1,51 моль) 1-[(фенил)метил] циклопентанкарбонитрила, (приготовленного по Campaigne E. Forsh R.A. J. Org. Chem. (1978), 43, 1044-50). После перемешивания при комнатной температуре в течение 18 часов избыток гидрида устраняется добавлением 344 мл воды. Органическую фазу высушивают на сульфате натрия и фильтруют. Фильтрат концентрируют при пониженном давлении и дистиллируют с получением 273,9 г (выход 95,8%) бесцветной жидкости. Т.кип. 122o C.
Элементный анализ: C13H19N /M=189,3/
Рассчитано, C 82,48; H 10,12; N 7,40.
Получено, C 82,23; H 9,98; N 7,39
ИК
(пленка): n
(NH2)=3370 см-1.
ЯМР (CDCl3): d0,75 (2Н, с широкий, обменивающиеся с D2O); 1, 0-2,0 (8Н, м); 2,4 (2Н, с); 2,6 (2Н, с); 7,05 (5Н, с).
б) N-[[1-[(фенил)метил]циклопентил]метил]-бензолсульфонамид.
Работают как в примере 1в, но исходя из 17,9 г (94,5 ммоль) амина, полученного на предыдущей стадии, 11,5 г (113 ммоль) триэтиламина в 360 мл дихлорметана и 16,7 г (94,5 ммоль) хлорида бензолсульфонила в 50 мл простого эфира. После 16 часов перемешивания при комнатной температуре и экстракции получают остаток, который растирают в гексане с получением 28,7 г (выход 92,2%) твердого белого вещества, используемого без дальнейшей очистки. Т.пл. 105-106oC.
ИК (KBr):
n
(NH)=3260 см-1; (SO2)=1315 см-1; (SO2)=1150 см-1
ЯМР (CDCl3) d1,
0-2,0 (8Н, м); 2,6 (2Н, с); 2,7 (2Н, д, J=6,75 Гц,
переходящий в синглет в CF3COOD); 5,1 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,7-7,3 (5Н, м); 7,3-7,7 (3Н, м); 7,7-8,0
(2Н, м)
в)
N-[[1-[(4-ацетилфенил)метил]циклопентил]метил] бензолсульфонамид.
Раствор из 28,7 г (87,1 ммоль) соединения, полученного на предыдущей стадии, и 500 мл дихлорметана поддерживают при температуре между -20 и -10oC. Tуда добавляют 15 г (191 ммоль) ацетилхлорида, потом порциями 46,4 г (348 ммоль) хлорида алюминия. После 4 часов перемешивания при той же температуре выливают на примерно 1,5 л смеси льда-воды-HCl. После экстракции дихлорметаном, промывки водой до нейтральности, высушивания на сульфате натрия концентрирования при пониженном давлении и растирания полученного остатка в гексане выделяют 28,6 г (выход 88,3%) твердого белого вещества, используемого без дальнейшей очистки. Т.пл. 88-89oC.
ИК (KBr):n (NH)=3250 см-1; (C=O)=1660 см-1; (SO2)=1330 см-1; (SO2)=1145 см-1.
ЯМР (CDCl3) d1,0-2,0 (8Н, м); 2,45-2,9 (7Н, м); 4,55-5, 2 (1Н, м, обменивающийся с CF3COOD); 6,75-8,0 (9Н, м).
г) Метиловый эфир 4-[[1-[[[(Фенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусной кислоты.
Работают как в примере 5д, но исходят из 28,6 г (76,9 ммоль) соединения, полученного на предыдущей стадии в), 35 мл метанола, 43,6 г (308 ммоль) эфирной вытяжки трифторида бора в 175 мл дихлорметана и 35,8 г (80,7 ммоль) тетраацетата свинца в 205 мл бензола. После трех перекристаллизаций в смеси гексан-этилацетат получают 6,3 г (выход 20,4%) твердого белого вещества. Т. пл. 129-130o C.
ЯМР (CDCl3): d0,8-2,1 (8Н, м); 2,6 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,55 (2Н); 3,65 (3Н); 4,9 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,7-8,0 (9Н, м).
ИК (KBr): n (NH)=3240 см-1; (C=O)=1700 см-1; (SO2)=1340 см-1; (SO2)=1150 см-1 .
д) 4-[[1-[[[(Фенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота.
Работают как в примере 5е, но исходя из 6, 3 г (15,7 ммоль) сложного эфира, полученного на предыдущей стадии г), 1,8 г (31,4 ммоль) КОН в виде таблеток, 63 мл этанола и 63 мл воды. После двух перекристаллизаций в смеси гексан-этилацетат получают 4,2 г (выход 65,7%) твердого белого вещества. Т. пл. 154-156oC.
Элементный анализ: C21H25NO4S (М=387,494)
Рассчитано, C
65,09; H 6,50; N 3,61;
S 8,27.
Получено, C 64,92; H 6,57; N 3,62; S 8,05.
ИК (пленка): n (NH)=3260 см-1; (C=O)*1690 см-1; (SO2)=1315 см-1; (SO2)= 1155 см-1.
ЯМР (DMCO d6): d0,8-1,75 (8Н, м); 2,4-2,85 (5H, м, из которых 1H обменивается с CF3COOD); 3,45 (2Н, с); 7,0 (4Н, с); 7, 4-8,0 (5H, м); 12,1 (1Н, с, обменивающийся с CF3COOD).
Пример 16. 4-[[1-[[[(4-Фторфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота).
а) 4-Фтор-N-[[-1-[(фенил)метил]циклопентил]метил] бензолсульфонамид.
Работают как в примере 1в, но исходя из 9,4 г (48,3 ммоль) 1-[(фенил)метил]циклопентанметанамина, полученного в примере 15а, 8,1 мл (57,9 ммоль) триэтиламина в 200 мл дихлорметана и 9,4 г (48,3 ммоль) хлорида 4-фторбензолсульфонила в 60 мл дихлорметана. После 3 дней перемешивания при комнатной температуре и экстракции получают остаток, который растирают в гексане и получают 15,2 г (выход 90,5%) твердого белого продукта, используемого без дальнейшей очистки. Т.пл. 115-117oC.
ИК (KBr) n (NH)=3260 см-1; (SO2)=1320 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3) d1,0-1,85 (8H, м); 2,6 (2Н, с); 2,7 (2Н, д, переходящий в синглет с CF3COOD); 5,6 (1Н, т, обменивающийся с CF3COOD) 6,75-8,0 (9Н, м).
б) N-[[1-[(4-ацетилфенил)метил]циклопентил]метил]-4-фторбензолсульфонамид.
К смеси из 15,2 г (43,7 ммоль) соединения, полученного на предыдущей стадии, 4,4 г (56,8 ммоль) ацетилхлорида и 290 мл дихлорметана, находящейся при 0oC, порциями прибавляют 19,2 г (144 ммоль) хлорида алюминия. После 3 часов перемешивания при 0oC выливают на смесь лед-HCl концентрированная. Экстрагируют дихлорметаном, экстракт затем промывают водой до нейтральности, высушивают на сульфате натрия, потом концентрируют при пониженном давлении и получают маслообразный продукт, который после растирания в гексане дает 9,7 г (выход 57,0%) мелкозернистого твердого белого вещества, используемого без дальнейшей очистки. Т.пл. 79-82oC.
ИК (KBr): n (NH)=3260 см-1; (C=O)=1670 см-1; (DO2)=1315 см-1; (SO2)=1160 см-1.
ЯМР (CDCl3): d 1,0-2,0 (8Н, м); 2,55 (3Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 2,7 (2Н, с); 5,1 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,85-7,4 (4Н, м); 7,6-8,0 (4Н, м).
в) Метиловый эфир 4-[[1-[[[(4-фторфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусной кислоты.
Работают как в примере 5д, но исходят из 9,7 г (24,9 ммоль) соединения, полученного на предыдущей стадии б), 11,3 мл метанола в 56 мл дихлорметана, 14,1 г (99,6 ммоль) эфирной вытяжки трифторида бора и 13,2 г (29,8 ммоль) тетраацетата свинца в 60 мл бензола. После перекристаллизации в этилацетате получают 6,1 г (выход 58,4%) твердого белого вещества. Т.пл. 138-140oC.
ИК (KBr): n (NH)=3240 см-1; (C=O)=1700 см-1; (SO2)=1340 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3): d1,0-1,9 (8Н, м); 2,6 (2Н, с); 2,'; (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 3,55 (2Н, с); 3,7 (3Н, с); 4,5 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,95-7,35 (6Н, м); 7,65-8,0 (2Н, м).
г)
4-[[1-[[[(4-Фторфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота
Работают согласно примеру 5е, но исходя из 6,1 г (14,5 ммоль) соединения, полученного на вышеуказанной
стадии в), в 61 мл этанола и 1,6 г (29 ммоль) КОН в виде таблеток в 61 мл воды. После двух перекристаллизаций в смеси гексан-этилацетат получают 1,9 г (выход 32,0%) твердого белого вещества. Т.пл.
151-154oC.
Анализ: C21H24FNO4S (М=405,484)
Рассчитано, C 62,20; H 5,97; F 4,69; N 3,45; S 7,91.
Получено, C 61,
94;
H 5,96; F 4,55; N 3,44; S 7,71
ИК (KBr): n (NH)=3260 см-1; (C=O)=1685 см-1; (SO2)=1310 см-1; (SO2)=1140 см-1.
ЯМР (ацетон d6): d1,1-1,8 (8Н, м); 2,65 (2Н, с); 2,75 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,6 (2H, с): 6,3 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,15 (4Н, с); 7,25-7,55 (2Н, м); 7,7-8,15 (2Н м); 10,55 (1Н, с широкий, обменивающийся с CF3COOD).
Пример 17. N-[[1-[(4-Ацетилфенил)метил]циклопентил]метил]-4-хлорбензолсульфонамид.
a) 4-хлор-N-[[1-[(фенил)метил]циклопентил]метил] бензолсульфонамид.
К раствору, состоящему из 268,2 г (1,416 моль) амина, полученного в примере 15а, 237 мл (1,700 моль) триэтиламина и 2500 мл сухого дихлорметана, при 0oC вводят порциями 298,8 г (1,416 моль) хлорида 4-хлорбензолсульфонила. Реакционную среду перемешивают 2,5 дня при комнатной температуре, затем выливают в 2,5 л воды, содержащей 1,5 моль HCl. Органическую фазу декантируют, промывают водой, высушивают на сульфате натрия и концентрируют при пониженном уменьшающемся давлении. После перекристаллизации в этилацетате получают 467,2 г (Rdt 90,7%) твердого белого вещества. Т.пл. 121-123oC.
Элементный анализ: C19H22ClNO2S (М=363,90)
Рассчитано, C 62,71; H 6,09; Cl 9,74; N 3,85; S 8,81.
Получено, C 62, 54; H 6,08; Cl 9,72; N 3,85; S 8,94.
ИК (KBr) n (NH)=3250 см-1; (SO2)=1315 см-1; (SO2)=1170 см-1
ЯМР (CDCl3
):
d1,0-1,9 (8Н, м); 2,6 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 5,0 (1H, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,8-7,3 (5Н, м); 7,3-7,5 (2Н, м); 7,
6-7,
9 (2Н, м).
б) N-[[1-[(4-ацетилфенил)метил]циклопентил]метил]-4-хлорбензолсульфонамид.
Соединение, полученное на предыдущей стадии (185,9 г; 511 ммоль), растворенное в 3000 мл безводного 1,2-дихлорэтана, поддерживают при -20oC при перемешивании. По каплям приливают 47,2 мл (664 ммоль) ацетилхлорида, затем порциями вводят 340,7 г (2555 ммоль) хлорида алюминия. Температуру повышают до -12oC. После 8 часов выдерживания при этой температуре смесь оставляют на 16 часов при -25oC. Реакционную среду затем выливают прямо на смесь из 5000 мл воды и 2000 мл концентрированной HCl. После декантирования органической фазы и экстракции 4 х 500 мл дихлорметана объединенные органические фазы промывают водой (1000 мл), 1Н едким натрем (2х1000 мл), потом водой до нейтральности. После высушивания на сульфате натрия и концентрирования получают коричневое масло, которое растирают с гексаном до кристаллизации. Получают твердое вещество розового цвета, которое центрифугируют и сушат (153,9 г, выход 74,2%) и которое используют без дальнейшей очистки. Т.пл. 97-102oC.
Одну фракцию очищают хроматографией на кремниевой колонке в дихлорметане, потом перекристаллизуют в смеси гексан-этилацетат и получают твердое белое вещество. Т.пл. 110-113oC.
Элементный
анализ: C21
H24ClNO3S (М=405,94)
Рассчитано, C 62,14; H 5,96; Cl 8,73; N 3,45; S 7,90.
Получено, C 62,13; H 5,90; Cl 8,81; N 3,45; S 8,17
ИК (KBr): n
(NH)=3200 см-1(C=O)=1660 см-1; (SO2)=1315 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3) d1,0-2,0 (8Н, м); 2,6 (3Н, с); 2,7 (2Н, с); 2,75 (2Н, д, J= 6,75 Гц, переходящий в синглет в CF3COOD); 5,25 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,6-8,0 (8Н, м).
Пример 18. Метиловый эфир 4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусной кислоты.
Работают как в примере 5д, но исходя из 30,8 г (75,8 ммоль) продукта, полученного в примере 17б, 34 мл метанола в 170 мл дихлорметана, 55,9 мл (455 ммоль) эфирной вытяжки трифторида бора и 50,4 г (114 ммоль) тетраацетата свинца в 200 мл дихлорметана. Продукт очищают перекристаллизацией в этилацетате и получают 21,2 г (выход 64,2%) твердого белого вещества. Т.пл. 154-156oC.
Элементный анализ: C22H26ClNO4
S (М=435,97)
Рассчитано, C 60,61; H 6,01; Cl 8,15; N 3,21; S 7,35.
Получено, C 60,79; H 6,24; Cl 8,21; N 3,42; S 7,37.
ИК (KBr): n (NH)=3230 см-1; (C=O)=1700 см-1; (SO2)=1330 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3): d1,0-2,0 (8Н, м); 2,6 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 3,55 (2Н, с); 3,7 (3Н, с); 4,4 (1Н, т, J= 6,75 Гц, обменивающийся с CF3COOD); 6,6-7,3 (4,11, м); 7,3-8,0 (4H, м).
Пример
19.
4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота
Смесь из 16,1 г (36,9 ммоль) соединения, полученного в примере 18, 4,1
г (73,8 ммоль) КОН в виде
таблеток,
236 мл метанола и 236 мл воды доводят до рефлюкса в течение 2 часов. После удаления метанола при пониженном давлении продукт извлекают водой, промывают этиловым
эфиром, подкисляют
разбавленной HCl.
Образовавшийся осадок центрифугируют, промывают водой и высушивают при 50oC. Получают 14,9 г (выход 96,1%) твердого белого вещества. Т.пл.
151-154oC.
Элементный
анализ: C21H24ClNO4S (М=421,939)
Рассчитано, C 59,87; H 5,73; Cl 8,40; N 3,32; S 7,60.
Получено, C 59,85; H 5,95; Cl 8, 72; N 3,21; S 7,96.
ИК (KBr): n (NH)=3270 см-1; (C=O)=1690 см-1; (SO2)=1315 см-1; (SO2)=1155 см-1.
ЯМР (ацетон d6
): d1,0-2,0 (8Н, м); 2,65 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,55 (2Н, с); 6,3 (1Н, т, J=6,75 Гц,
обменивающийся с CF3
COOD); 7,1 (4Н, с); 7,4-7,7
(2Н, м); 7,7-8,0 (2Н, м); 9,2 (1Н, с широкий, обменивающийся с CF3COOD)
Пример 20.
4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил]
циклопентил]метил]бензолацетат натрия.
Смесь из 0,4 г (0,95 ммоль) кислоты, полученной в примере 19, и 9,35 мл 0,1 н. раствора NaOH нагревают при 50oC в течение нескольких минут. После возвращения к комнатной температуре, последующей фильтрации производят концентрирование досуха под пониженным давлением. Остаток перекристаллизуют в смеси этанола и простого эфира и получают 0,3 г (выход 71,3%) твердого белого вещества. Т.пл. 218-222oC.
Элементный анализ: C21H23ClNNaO4S (М=443,92)
Рассчитано,
C 56,82; H 5,22; Cl 7,99; N 3,16; Na 5,
18; S 7,22.
Получено, C 57,10; H 5,30; Cl 8,16; N 3,18; Na 5,16; S 7,10.
ИК (KBr): n (NH)=3060 см-1; (C=O)=1570 см-1; (SO2)=1370 см-1; (SO2)=114 см-1.
ЯМР (DMCO d6): d1,1-1,75 (8Н, м); 2,3-2,8 (5Н, м, из которых 1H обменивается с CF3COOD); 3,2 (2Н, с); 6, 75-7,25 (411, м); 7,4-8,5 (4Н, м).
Пример 21.
4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]метил)бензолуксусная кислота
а)
4-Хлор-N-[[1-[[4-[2-(морфолин-4-ил)-2-тиоксоэтил] фенил]метил]циклопентил]
метил]бензолсульфонамид.
Смесь из 12,4 г (30,5 ммоль) соединения, полученного в примере 17б, 1,6 г (48,8 ммоль) серы и 200 мл морфолина, доводят до рефлюкса 30 часов, затем выливают на смесь лед-вода. Полученный осадок очищают хроматографией на кремниевой колонке смесью гексан-этилацетат 4/1, потом 2/1, после чего перекристаллизовывают в смеси гексан-этилацетат и получают 1,3 г (выход 8,4%) твердого белого вещества. Т.пл. 141-144oC. Из маточных растворов получают еще 2,7 г целевого продукта (общий выход 25,6%).
ИК (KBr): n (NH)3250 см-1.
ЯМР (CDCl3) ( d 1,0-1,75 (8Н, м); 2,3-2,9 (6Н, м); 3,0-3,4 (4Н, м); 3,55-3,9 (4Н, м); 5, 1 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,5-7,3 (4Н, м); 7,35-7,9 (4Н, м).
б) 4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота.
Смесь, состоящую из 2,7 г (5,3 ммоль) продукта, полученного в примере 21а, 1,3 г (33 моль) NaOH в виде таблеток и 33 мл воды, доводят до рефлюкса 24 часа. После охлаждения реакционную среду разбавляют водой и промывают простым эфиром, фильтруют и подкисляют на холоду концентрированной HCl. Образовавшийся осадок промывают водой, затем высушивают в вакууме при 80oC, перекристаллизовывают в смеси гексан-этилацетат и получают 0,4 г (выход 17,9% ) белого продукта, имеющего все физические, спектральные и хроматографические характеристики соединения, полученного в примере 19.
Пример 22. Комплекс транс-4-[[2-[[(4-хлорфенил)сульфонил]амино]циклопентил] метил]бензолацетата натрия и b -циклодекстрина (1:1).
К раствору, состоящему из 0,62 г (1,45 ммоль) транс-4-[[2-[[(4-хлорфенил)сульфонил]амино]циклопентил] метил]бензолацетата натрия, приготовленного в примере 2, и 60 мл дистиллированной воды, прибавляют теплую смесь из 1,65 г (1,45 ммоль) b -циклодекстрина и 60 мл дистиллированной воды. После 20 часов перемешивания при 20oC растворитель удаляют при пониженном давлении. Остаточную воду удаляют азеотропной перегонкой с толуолом при нормальном давлении. Толуол концентрируют при пониженном давлении и остаток высушивают 6 часов в вакууме. Получают 2 г (выход 90,9%) мелкозернистого твердого белого вещества. Т.пл. 265oC (окраска появляется после 210oC).
Элементный анализ: C62H91ClNNaO39S+H2O
(М=1582,881)
Рассчитано, C
47,05; H 5,92; Cl 2,24; N 0,88; Na 1,45; S 2,03.
Получено, C 47,05; H 5,97; Cl 2,10; N 0,83; Na 1,65; S 1,86.
ИК (KBr): n (OH)=3360 см-1 ; (C=O)=1570 см-1; (SO2)=1320 см-1; (SO2)=1155 см-1.
ЯМР (DMCO d6) d0,9-2,25 (9Н, м); 2,6-4, 05 (48Н, из которых 3Н обмениваются с CF3COOD); 4,1-4,6 (7Н, м, обменивающихся с CF3COOD); 4,7-5,0 (7Н, м); 5,65-6,3 (14Н, м, обменивающихся с CF3COOD); 6,7-7,1 (4Н, м); 7,4-7,9 (4Н, м).
Пример 23. Комплекс 4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолацетат натрия и b -декстрин (1:1).
Работают согласно примеру 22, но исходя из 0, 5 г (1,12 ммоль) 4-[[1-[[[(4-хлорфенил)сульфонил] амино] метил] циклопентил] метил] бензолацетата натрия, приготовленного в примере 20, в 50 мл дистиллированной воды и 1,28 г (1,12 ммоль) b -циклодекстрина, растворенного в 50 мл дистиллированной воды. Получают 1,5 г (выход 83%) мелкозернистого твердого белого вещества. Т.пл. 240-270oC.
Элементный анализ: C63H93ClNNaO39S + 0,75 C7H8 (толуол) (М=1648,031)
Рассчитано, C 49,74; H 6,05; Cl 2,15; N 0,85; Na 1,39; S 1,94.
Получено, C 49,50; H 6,07; Cl 2,25; N 1,07; Na 1,30; S 2,29.
ИК (KBr): n (OH)=3360 см-1; (C=O)=1570 см-1; (SO2)1320 см-1; (SO2)=1150 см-1.
ЯМР (DMCO d6) d1,0-1,6 (8Н, м); 2,3 (2Н, с); 2,5 (2Н, с); 2,75-4,0 (44H, м); 4,2-4,6 (7Н, м, обменивающиеся с CF3COOD); 4,
7-5,0 (7H, м); 5,75-6,4 (14H,
м,
обменивающиеся с CF3COOD); 6,75-7,25 (5Н, м, из которых 1H обмениваются с CF3COOD; 7,4-7,9 (4Н, м)
Пример 24.
4-[[1-[[[(4-метилфенил)сульфонил]амино]метил]
циклопентил]метил]бензолуксусная кислота
а) 4-Метил-N-[[1-[(фенил)метил]циклопентил]метил] бензолсульфонамид.
Работают согласно примеру 1в, но исходя из 9,4 г (48,3 ммоль) амина, полученного в примере 15а, из 5,9 г (57,9 ммоль) триэтиламина в 200 мл дихлорметана и из 9,2 г (48,3 ммоль) хлорида 4-метилбензолсульфонила в 60 мл дихлорметана. После 16 часов перемешивания при комнатной температуре и обработки получают 16,0 г (96,4%) твердого бежевого продукта, используемого без дальнейшей очистки. Т.пл. 124-126o C.
ИК (KBr): n (NH)=3280
см-1; (SO2)=1315 см-1; (SO2)=1160 см-1;
ЯМР (CDCl3) d 1,0-2,0 (8Н, м); 2,4 (3Н, с);
2,6 (2H, с); 2,7 (2Н, д), 4,5 (1Н, м,
обменивающийся с CF3COOD); 6,7-7,45 (7Н, м); 7,5-7,9 (2Н, м).
б) N-[[1-[(4-ацетилфенил)метил]циклопентил]метил]-4-метилбензолсульфонамид.
Работают согласно примеру 16б, но исходя из 16,0 г (46,5 ммоль) соединения, полученного в примере 24а, 4,3 мл (60,4 ммоль) ацетилхлорида в 280 мл дихлорметана и 20,5 г (153,7 ммоль) хлорида алюминия. После очистки хроматографией на кремниевой колонке со смесью гексан-этилацетат 2/1, потом 1/1 получают 10,7 г (выход 59,7%) мелкозернистого твердого белого вещества. Т. пл. 80-84oC.
ИК (KBr): n (NH)=3220 см-1; (C=O)=1650 см-1; (SO2)=1310 см-1; (SO2)=1140 см-1.
ЯМР (CDCl3) d1, 25-1,8 (8Н, м); 2,4 (3Н, с); 2,5-2,85 (7Н, м, из которых один дуплет переходит в синглет в CF3 COOD); 4,9 (1Н, м, обменивающийся с CF3COOD); 6,9-8,0 (8Н, м).
в)
Метиловый эфир
4-[[1[[[(4-метилфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусной кислоты
Работают согласно примеру 5д, но исходя из 10,7 (27,7 ммоль) соединения, полученного в
примере 24б, 12 мл
метанола, 13,6 мл (111 ммоль) эфирной вытяжки трифторида бора в 60 мл дихлорметана и 14,
7 г (33,2 ммоль) тетраацетата свинца в 75 мл бензола. После перекристаллизации в
этилацетате получают 2,5г
(выход 21,7% ) мелкозернистого твердого белого вещества. Т.пл. 148-151oC.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1710 см-1; (SO2)=1315 см-1; (SO2)=1155 см-1.
ЯМР (CDCl3) d1, 0-1,9 (8Н, м); 2,4 (3Н, с); 2,55 (2Н, с); 2,7 (2Н, д, J= 6,75 Гц, переходящий в синглет в CF3 COOD); 3,5 (2Н, с); 3,65 (3Н, с): 4,5 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,85-7,4 (6Н, м); 7,5-7,8 (2Н, м).
г)
4-[[1-[[[(4-метилфенил)сульфонил] амино] метил]
цикло] пентил]метил] бензолуксусная кислота
Работают согласно примеру 5е, но исходя из
2,5 г (6 ммоль) сложного эфира, приготовленного в
примере 24в, из 0,67 г (12 ммоль) КОН в виде таблеток,
25 мл этанола и 25 мл воды. После двух перекристаллизаций в смеси гексан-этилацетат, получают
1,2 г (выход 50,0%) мелкозернистого твердого
белого вещества. Т.пл. 164-166oC.
Элементный анализ: C22H27NO4S (М=401,521)
Рассчитано, C 65,81; H 6,78; N 3, 49; S 7,98.
Получено, C 65,97; H 6,88; N 3,46; S 8,25.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1690 см-1; (SO2)=1315 см-1 (SO2)=1150 см-1.
ЯМР (DMCO d6): d1, 0-1,75 (8Н, м); 2,4 (3Н, с); 2,4-2,8 (4H, м); 3,5 (2Н, с); 7,05 (4H, с); 7,2-8,0 (5Н, м, из которых 1H обменивается CF3COOD); 12,2 (1Н, с, обменивающийся с CF3COOD).
Пример 25. 4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил]
циклопентил]метил]бензойная кислота
а)
4-(хлорметил)бензолметанол.
Смесь из 50 г (293 ммоль) 4-хлорметилбензойной кислоты и 400 мл тетрагидрофурана добавляют по каплям к раствору, находящемуся при температуре 15oC, комплекс гидрида бора с диметилсульфидом (320 ммоль) в 410 мл тетрагидрофурана. Доводят до рефлюкса в течение 6 часов. После охлаждения прибавляют 400 мл воды и насыщают смесь карбонатом калия перед экстракцией этилацетатом. Органическую фазу промывают водой до нейтральности и высушивают на сульфате натрия, затем концентрируют при пониженном давлении, очищают дистилляцией и получают 35,95 г (выход 78,3%) бледно-желтой жидкости, которая быстро кристаллизуется.
Т.пл. 49-51oC. Т.кип.0,6 121oC.
ИК (KBr): n (OH)=3340 см-1.
ЯМР (CDCl3); d2, 25 (1Н, с, обменивающийся с CF3COOD); 4,55 (2Н, с); 4,6 (2H, с); 7,3 (4Н, с).
б) 1-(Хлорметил)-4-[(триметилсилилокси)метил]бензол.
К раствору, содержащему 35,95 г (230 ммоль) соединения, полученного на предыдущей стадии, и 370 мл безводного дихлорметана, находящемуся при 5oC, по каплям приливают 36,9 г ( 230 ммоль) 1,1,1,3,3, 3-гексаметилдисилазана, потом 23,3 г (230 ммоль) триэтиламина и, наконец, 24,6 г (230 ммоль) хлорида триметилсилила. Реакционную среду выдерживают при температуре 5oC 21 час, потом 7 часов при 20oC. Сформировавшийся белый осадок фильтруют на фриттированном стекле и промывают дихлорметаном. Фильтрат концентрируют досуха в вакууме при температуре 30oC и извлекают гексаном. Новый сформировавшийся осадок фильтруют на фриттированном стекле и промывают гексаном. После концентрирования фильтрат дистиллируют с получением 42,9 г (выход 81,5%) бесцветной жидкости. Т.кип.0,45 85-88oC.
ЯМР (CDCl3): d0,0 (9Н, с); 4, 4 (2Н, с); 4,5 (2Н, с); 7,1 (4Н, с).
в) 1-[[4-[(Триметилсилилокси)метил]фенил]метил]
циклопентанкарбонитрил
К смеси из 13,8 г (136 ммоль) диизопропиламина и 157
мл
тетрагидрофурана, охлажденной до -75oC, по каплям за 40 мин приливают 65,6 мл н-бутиллития в виде 1,
6М раствора в гексане, потом 10 г (105 ммоль) циклопентанкарбонитрила и, наконец, 26,
4
г (115 ммоль) соединения, полученного на предыдущей стадии. После этого реакционную среду перемешивают 2 часа при
-70oC, потом 16 часов при 20oC. Добавляют 100 мл воды и
декантируют органическую фазу, высушивают на сульфате натрия и концентрируют досуха в вакууме. Продукт очищают
дистилляцией с получением 14,1 г ( выход 46, 8%) густого бледно-желтого масла. Т.
кип.1,3 170oC.
ИК (пленка)n(C≡N) 2230 см-1.
ЯМР (CDCl3) δ0,0 (9Н, с); 1,3-2,25 (8Н, м); 2,7 (2Н, с); 4,5 (2Н, с); 7,1 (4Н, с).
г) 1-[[4-(гидроксиметил)фенил]метил] циклопентанкарбонитрил
К раствору из
13,2 г (45 ммоль) соединения, полученного на предыдущей стадии, и 50 мл
тетрагидрофурана, прибавляют 53,7 мл (53 ммоль) 1М раствора фторида тетрабутиламмония в тетрагидрофуране. После 15 мин
перемешивания, выливают на 800 мл воды, экстрагируют этилацетатом, экстракт
высушивают на сульфате натрия. Получившееся жидкое коричневое масло (выход количественный) используется без дальнейшей
очистки.
ИК (пленка) n (OH)=3370 см-1; ( (C≡ N)2200 см-1.
ЯМР (CDCl3): δ1,5-2,25 (8Н, м); 2,4 (1Н, с, обменивающийся с D2O); 2,8 (2Н, с); 4,55 (2Н, с); 7,2 (4Н, с).
д) 4-[[1-(Aаминометил)циклопентил]метил] бензолметанол.
Смесь из 6,4 (29,7 ммоль) соединения, полученного на предыдущей стадии, и 12,6 мл простого эфира приливают по каплям при комнатной температуре к 1,35 г (35,6 ммоль) LiAlH4, суспензированного в 35 мл простого эфира. Скорость прибавления регулируют таким образом, чтобы поддержать растворитель при рефлюксе. После прибавления реакционную среду перемешивают 18 часов при комнатной температуре, потом 5 часов при рефлюксе. Избыток гидрида удаляют 6,75 мл воды. Образующиеся минеральные соли фильтруют на сульфате натрия и промывают простым эфиром. Фильтрат концентрируют при пониженном давлении и получают 5 г (выход 76,7%) желтого масла, используемого без дальнейшей очистки.
ИК (пленка): n (NH)3350 см-1; (OH)=3300 см-1.
ЯМР (CDCl3): d0,9-2,1 (8Н, м); 2,3 (2Н, с); 2,5 (2Н, с); 2,6 (3Н, с, широкий, обменивающиеся с CF3COOD); 4,5 (2Н, с); 6,6-7,5 (4Н, м).
e) 4-хлор-N-[[1-[[4-(гидроксиметил)фенил]метил]циклопентил]
метил]бензолсульфонамид
Смесь из 1 г (4,6 ммоль) соединения,
полученного на предыдущей стадии, 0,55 г (5,5 ммоль) триэтиламина и 8 мл дихлорметана (сухого) выдерживают при -20oC.
Раствор из 0,96 г (4,6 ммоль) хлорида 4-хлорбензолсульфонила в 4 мл
эфира приливают за 15 мин. Перемешивают 2,5 часа при температуре между -20oC и -10oС, затем выливают на 50 мл
воды с 1 мл HCl (конц.). Экстрагируют дихлорметаном, экстракт
промывают до нейтральности, высушивают на сульфате натрия и концентрируют при пониженном давлении с получением твердого бежевого вещества.
Продукт очищают хроматографией на кремниевой колонке в
смеси
дихлорметан-метанол 95:5. Получают 0,8 г (выход 44,6%) твердого пастообразного вещества.
ИК (пленка) n (OH)=3460 см-1; (NH)=3270 см-1; (SO2 )=1315 см-1 (SO2)=1150 см-1.
ЯМР (CDCl3): d1,25-1,75 (8Н, м); 1,9 (1Н, с широкий, обменивающийся с CF3COOD); 2,6 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 4,6 (211, с); 4,85 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,0-7, 3 (4Н, м); 7,3-7,6 (2Н, м); 7,6-7,9 (2Н, м).
ж) 4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензойная кислота
К раствору, находящемуся при 0oC,
из 0,8 г (2,0 ммоль) соединения, полученного на
предыдущей
стадии в 17 мл ацетона, прибавляют 1,2 мл реактива Джойса (приготовленного прибавлением при 0oC смеси из 0,65 мл концентрированной
серной кислоты и 0,52 мл воды к 0,41 г (4,1
ммоль) оксида
хрома (VI), растворенного в 0,65 мл воды). После 4 часов перемешивания при комнатной температуре образовавшиеся соли фильтруют, промыв
ацетоном. Сконцентрированный досуха под
уменьшенным давлением
фильтрат, извлекают водой и экстрагируют эфиром. Эту органическую фазу затем экстрагируют 1н. едким натром. Подкисление этой водной фазы,
разбавленной HCl, позволяет получить
белый осадок, очищаемый
перекристаллизацией в смеси гексан-этилацетат с получением 0,35 г (выход 42,3%) твердого белого вещества. Т.пл. 184-189oC.
Элементный анализ: C20H22
ClNO4S (М=407,912)
Рассчитано, C 58,89; H 5,44; Cl 8,69; N 3,43; S 7,86.
Получено, C 59,02; H 5,34; Cl 8, 75; N 3,43; S 7,77.
ИК (KBr): n (NH)=3240 см-1; (C=O)=1675 см-1; (SO2)=1320 (SO2)=1150 см-1.
ЯМР (ацетон d6): d1,4-1,8 (8Н, м); 2,8 (2Н, д, J=6,75 Гц, превращающийся в синглет в CF3COOD); 2,9 (2Н, с); 6,5 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,2-8,2 (9Н, м, из которых 1H обменивается с CF3COOD).
Пример 26. 4-[[1-[[[(3,4-Дихлорфенил)сульфонил]амино]метил] циклопентил] метил]бензолуксусная кислота
а)
1-(Бромметил)-4-[2-(триметилсилилокси)этил]бензол
К раствору из
20,9 г (97,2 ммоль) 4-(бромметил)бензолэтанола (полученному по Plaue S. et Heissler D. Tetrahedron Lett. (1987), 28, 1401-4)
в
150 мл тетрагидрофурана, находящемуся при 5oC, приливают по
каплям 20,5 мл (97,2 ммоль) 1,1,1,3,3,3-гексаметилдисилазана, потом 13,55 мл (97,2 ммоль) триэтиламина и, наконец, 12,3 мл
(97,2
ммоль) хлорида триметилсилила. Реакционную среду перемешивают один час
при той же температуре, образовавшийся осадок фильтруют и промывают гексаном. Сконцентрированный досуха при пониженном
давлении
фильтрат очищают дистилляцией получают 16,8 г (выход 60,0%) бесцветной
жидкости. Т.кип.0,35 98-108oC.
ЯМР (CDCl3): d0,0 (9Н, с); 2,7 (2Н, т, J=6,75 Гц); 3,7 (2Н, т, J=6,75 Гц); 4,3 (2Н, с); 6,8-7,5 (4H, м).
б) 1-[[4-(2-Гидроксиэтил)фенил]метил] циклопентанкарбонитрил
К смеси из 38,9 мл (278 ммоль)
диизопропиламина и 320
мл тетрагидрофурана, охлажденной до -60oC,
последовательно по каплям приливают 174 мл 1,614 раствора н-бутиллития в гексане, разбавленном 50 мл тетрагидрофурана,
смесь из 24 г (252 ммоль)
циклопентанкарбонитрила и 50 мл тетрагидрофурана, 65
мл 1,3-диметилимидазолидинона и, наконец, 73,95 г (257 ммоль) соединения, полученного на предыдущей стадии. Температуру
повышают до 20o
C. Выдерживают 16 часов при 20oC, доводят
до рефлюкса в течение 13 часов. После охлаждения добавляют 1000 мл воды и перемешивают час при комнатной температуре,
после чего добавляют 35 мл
концентрированной HCl и перемешивают еще час.
Экстрагируют этилацетатом, экстракт промывают водой, высушивают на сульфате натрия, затем концентрируют под пониженным
давлением. Очистку осуществляют
дистилляцией, и получают 41,1 г (выход 71,1%)
продукта в виде желтого масла. Т.кип.0,3 175-185oC.
ИК (пленка) n (OH)=3410 см-1; ( (C≡N) )=2240 см-1.
ЯМР (CDCl3): δ1,25-2,25(8Н, м); 2,4 (1Н, с, обменивающийся с CF3COOD); 2,8 (2H, с); 2,8 (2H, т, J=6.75 Гц); 3,75 (2Н, т, J=6,75 Гц); 6, 65-7,5 (4Н, м).
в)
4-[[1-(аминометил)циклопентил]метил] бензолэтанол
При комнатной температуре по каплям приливают 7 г (30,5 ммоль)
соединения, полученного на предыдущей
стадии б), растворенного в 17 мл
простого эфира, к 7,7 мл коммерческого 13-ного раствора LiAlH4 (1,3 г, 33,55 ммоль) в смеси толуола и
тетрагидрофурана, разбавленного 7 мл эфира. После 14
часов перемешивания осторожно
прибавляют 120 мл воды, затем 100 мл эфира. Нерастворимые минеральные соли фильтруют. Простой эфир декантируют, а
водную фазу снова экстрагируют простым эфиром.
Соединенные органические фазы
промывают водой, высушивают на сульфате натрия, после чего концентрируют под уменьшенным давлением и получают целевой
амин, используемый без дальнейшей очистки.
ИК (пленка): n (NH2)=3360 см-1; (ОН)=3300 см-1.
ЯМР (CDCl3) d1,0-1,8 (8Н, м); 1,9 (3Н, с, обменивающийся с D2O), 2,4 (2Н, с); 2,6 (2Н, с); 2,8 (2Н, т, J=6,75 Гц); 3,8 (2Н, т, J=6,75 Гц); 6,7-7,4 (4Н, м).
г) 3,
4-Дихлор-N-[[1-[[4-(2-гидроксиэтил)фенил]метил]циклопентил] метил] бензолсульфонамид
Работают согласно примеру 1в,
но исходя из 3 г (12,8 ммоль) соединения, полученного на предыдущей стадии
в), в 50 мл дихлорметана, 2,15 мл (15,4 ммоль) триэтиламина и 3,15 г (12,8 ммоль) хлорида
3,4-дихлорбензолсульфонила в 10 мл
дихлорметана. После 16 часов перемешивания при комнатной температуре и
обработки продукт очищают хроматографией на кремниевой колонке смесью гексан-этилацетат 4: 1 и
получают 0,95 г (выход 16,7%)
кристаллизующегося желтого масла.
ИК (пленка) n (ОН)=3460 см-1; (NH)=3270 см-1; (SO2)=1330 см-1; (SO2)= 1160 см-1 .
ЯМР (CDCl3): d1,0-2,0 (9Н, м, из которых 1H обменивается с CF3COOD); 2,5 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 2,75 (2Н, т, J=6,75 Гц); 3,8 (2Н, т, J=6,75 Гц); 4,5 (1Н, т, J=6,75 Гц); обменивающийся с CF3COOD); 6,9 (4Н, c); 7,5 (2Н, м); 7,8 (1Н, м).
д)
4-[[1-[[[(3,4-Дихлорфенил)сульфонил]
амино]метил] циклопентил]метил] бензолуксусная кислота
Работают согласно примеру 25ж, но исходя из 0,9 г (2 ммоль) соединения, полученного на предыдущей
стадии г), в 20 мл ацетона и 1,85 мл
реактива Джойса (4 ммоль). После 2 перекристаллизаций в
смеси гексан-этилацетат получают 0,3 г (выход 32,2%) твердого белого вещества. Т.пл. 134-135o
C.
Элементный анализ:
C21H23Cl2NO4
S (М=456,384)
Рассчитано, C 55,27; H 5,08; Cl 15,54; N 3,07; S 7,02.
Получено, C 55,40; H 4,86; Cl 15,26; N 3,05; S 6, 92.
ИК (KBr): n (NH)3210 см-1; (C=O)=1680 см-1; (SO2)=1300 см-1; (SO2)=1140 см-1.
ЯМР (ацетон d6) d1,25-1,8 (8Н, м); 2,65 (2Н, с); 2,75 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 3,5 (2Н, с); 6,2-6,8 (2Н, м, из которых 1 триплет, J= 6,75 Гц, обменивающиеся с CF3COOD); 7,1 (4Н, с); 7,75 (2Н, м); 7,9 (1H, м).
Пример 27. 4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил]
циклобутил]метил]бензолуксусная кислота
а)
Циклобутанкарбонитрил
Раствор 80 г (799 ммоль)
циклобутанкарбоновой кислоты в 250 мл дихлорметана доводят до рефлюкса. По каплям постепенно
прибавляют 115,6 г (819 ммоль)
хлорсульфонилизоцианата. Нагревают при рефлюксе в течение часа после
завершения прибавления до полного превращения CO2. Реакционную среду охлаждают до 10oC. В нее прикалывают в
течение 15 мин 119,6 г (1638 ммоль) N,N-диметилформамида, затем
перемешивают 1/4 часа при комнатной температуре. Затем выливают на смесь лед-вода, затем экстрагируют
дихлорметаном. Органическую фазу
промывают водой, высушивают на сульфате натрия и концентрируют
в вакууме. После дистилляции остатка получают 43,5 г (выход 66,5%) бесцветной жидкости. Т.кип.15 50oC.
ИК (пленка): n ( (C≡N) )=2250 см-1.
ЯМР (CDCl3): δ1,5-2,7 (6Н, м); 2,7-3,4 (1Н, м)
б)
1-[(Фенил)метил]
циклобутанкарбонитрил.
К раствору, находящемуся при -30oC в атмосфере азота, состоящему из 82,3 мл (583 ммоль) N,N-диизопропиламина в 600 мл сухого тетрагидрофурана приливают по каплям 364,4 мл (583 ммоль) 1,6М раствора н-бутиллития в гексане, потом 83,4 мл 1,3-диметилимидазолидинона. Перемешивают 1/4 часа при - 60oC, затем снижают температуру до -75oC и добавляют по каплям смесь из 43,5 г (530 ммоль) соединения, полученного на предыдущей стадии, и 500 мл сухого тетрагидрофурана. Перемешивают 1 час при -75o C, потом прикапывают 67,1 г (530 ммоль) хлорида бензила. Перемешивают час при -75oC, потом выливают реакционную среду на смесь лед+ HCl концентрированная. Экстрагируют эфиром, экстракт затем промывают водой до нейтральности и высушивают на сульфате натрия. После удаления растворителя под уменьшенным давлением и дистилляции остатка получают 68,1 г (выход 75,9%) бесцветной жидкости, которая кристаллизуется при -20oC. Т.кип. 140oC.
ИК (пленка):
n(C≡N)2220 см-1
ЯМР δ1,75-2,6 (6Н, м); 2,9 (2Н, с); 7,2 (5Н,
с).
в) [1-[(фенил)метил]циклобутил] метанамин.
Работают согласно примеру 15а, но исходя из 18,3 г (482 ммоль) LiAlH4 в 450 мл эфира, 68,1 г (402 ммоль) соединения, полученного на предыдущей стадии б) в 170 мл эфира. После 2 часов перемешивания при комнатной температуре и последующей обработки получают 68,4 г (выход 97,1%) желтого масла, используемого без дальнейшей очистки.
ИК (пленка): n (NH2)3360 см-1 .
ЯМР (CDCl3): d1,25 (2Н, с, обменивающиеся на CF3 COOD); 1,8 (6Н, м); 2,6 (2Н, с); 2,7 (2H, с); 7,1 (5Н, с).
г) 4-хлор-N-[[1-[(фенил)метил]циклобутил]метил] бензолсульфонамид.
Работают согласно примеру 1в, но исходя из 10 г (57 ммоль) амина, полученного на предыдущей стадии в) в 100 мл дихлорметана с 7 г (68,4 ммоль) триэтиламина и 12,4 г (59,3 ммоль) хлорида 4-хлорбензолсульфонила. Получают твердый бежевый продукт, который используют без очистки (16,3 г; выход 81,9% ). Одну фракцию перекристаллизовывают в этилацетате, и получают твердый белый продукт. Т.пл. 144-148oC.
Элементный анализ: C18H20ClNO2S (М=349,
875)
Рассчитано, C 61,79; H 5,76; Cl 10,13; N 4,00; S 9,16.
Получено, C 61,52; H 6,01; Cl 10,34; N 4, 22; S 9,30.
ИК (KBr): n (NH)=3250 см-1;
(SO2)=1315 см-1; (SO2)=1150 см-1;
ЯМР (CDCl3) d1,5-2,2 (6Н, м); 2,7
(2Н, с); 2,8 (2Н,
д, J=6,75 Гц, переходящий в синглет в CF3COOD); 4,7 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,8-7,25 (5Н, м); 7,25-7,5 (2Н, м); 7,6-7,9 (2Н, м).
д)
N-[[1-[(4-ацетилфенил)метил]циклобутил]метил]-4-хлорбензолсульфонамид
Работают согласно примеру 16б, но исходя из 4 г (11,4 ммоль) соединения, полученного на предыдущей стадии
г) в 160 мл
дихлорметана с 1,2 г (14,8 ммоль) ацетилхлорида и 5 г (37,6 ммоль) хлорида алюминия. Очистку производят хроматографией на кремниевой колонке смесью гексан-этилацетат, получают 2,9 г
(выход 65,0%)
твердого бежевого продукта. Т.пл. 158-160oC.
Одну фракцию перекристаллизовывают в смеси этилацетат-гептан и получают белый продукт. Т.пл. 158-160o C.
Элементный анализ: C20H22ClNO3S + 0,6 H2O (М=402,722)
Рассчитано, C 59,65; H 5,81; Cl 8,80; N 3,48; S 7,96.
Получено, C 59,60; H 5,46; Cl 8, 88; N 3,58; S 8,26.
ИК (KBr): n (NH)=3270 см-1; (C=O)=1670 см-1; (SO2)=1320 см-1; (SO2)=1155
см-1
;
ЯМР (CDCl3): d1,35-2,2 (6Н, м); 2,55 (3Н, с); 2,8 (2Н, с); 2,9 (2Н, д, J= 6,75 Гц, переходящий в синглет в CF3COOD); 5,05 (1Н, т, J6,75 Гц,
обменивающийся с
CF3COOD); 7,0-8,0 (8Н, м).
е) Метиловый эфир 4-[[1-[[[(4-хлорфенил)сульфонил]метил]циклобутил] метил]бензолуксусной кислоты
Работают согласно
примеру 5д, но
исходя из 2,1
г (5,3 ммоль) соединения, полученного на предыдущей стадии д), 2,5 мл (58,3 ммоль) метанола в 50 мл дихлорметана с 5,2 мл (42,4 ммоль) эфирной вытяжки трифторида бора и 2,
6 г (5,6
ммоль) тетраацетата
свинца в 40 мл толуола. Осуществляют очистку перекристаллизацией в этилацетате и получают 0,9 г (выход 42,8%) твердого белого продукта. Т.пл. 135-137oC.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1715 см-1; (SO2)=1320 см-1. (SO2)=1160 см-1.
ЯМР (CDCl3) d1, 7-2,0 (6Н, м); 2,7 (2Н, с); 2,9 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 3,6 (2Н, с); 3,7 (3Н, с); 4,4 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,9-7,9 (8Н, м).
ж)
4-[[1-[[[(4-Хлорфенил)сульфонил] амино] метил] циклобутил]метил]бензолуксусная кислота
Работают согласно примеру 5е), но исходя из 0,9 г (2,1 ммоль) сложного эфира,
полученного на предыдущей
стадии е), из 40 мл этанола и 0,23 г (4,2 ммоль) гидроксида калия в виде таблеток, растворенного в 10 мл воды. После перекристаллизации в смеси этилацетат-гептан выделяют 0,
3 г (выход 34,9%) твердого
белого продукта. Т.пл. 168-170oC.
Элементный анализ: C20H22ClNO4S (М=407,912)
Рассчитано, C 58,89; H
5,
43; Cl 8,69; N 3,43; S 7,
86.
Получено, C 59,01; H 5,36; Cl 8,654 N 3,45; S 8,01.
ИК (KBr): n (NH)=3230 см-1; (C=O)=1720 см-1; (SO2 )=1315 см-1; (SO2)=1160 см-1.
ЯМР (DMCO d6): d1,3-2,1 (6Н, м); 2,6-2,8 (4Н, м); 3,45 (2Н, с); 7,05 (4Н, с); 7,5-7,95 (5Н, м, из которых 1H обменивается с CF3COOD; 11,9 (1Н, с широкий, обменивающийся с CF3COOD).
Пример 28. 4-Хлор-N-[[1-[[4-(2-гидроксиэтил)фенил]метилциклопентил]
метил]бензолсульфонамид
Работают
согласно примеру 25е, но исходя из 2,5 г ( 10, 7 ммоль) 4-[[1-(аминометил)циклопентил]метил] бензолэтанола, полученного в примере 26в, 1,3 г (12,8 ммоль)
триэтиламина в 20 мл дихлорметана и 2,1 г (9,8
ммоль) хлорида 4-хлорбензолсульфонила в 5 мл эфира. После обработки остаток очищают хроматографией на кремниевой колонке в смеси гексан-этилацетат 2/1
с
последующей
перекристаллизацией в
гексан-этилацетате для получения 0,4 г (выход 10%) твердого белого вещества. Т.пл. 131-132oC.
Элементный анализ: C21H26ClNO3S (М=407,
954)
Рассчитано, C 61,83; H 6,42; Cl 8,69; N 3,43; S 7,86.
Получено, C 61,91; H 6,44; Cl 8,79; N 3,53; S 8,03.
ИК (KBr): n (OH)=3530 см-1; (NH)=3250 см-1; (SO2)=1315 см-1; (SO2)=1155 см-1.
ЯМР (CDCl3) d1,2-1,8 (9Н, м, из которых 1H обменивается с CF3COOD); 2,6 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 2,8 (2Н, т, J=6,4 Гц); 3,8 (2Н, т, J=6,4 Гц); 4,4 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,0 (4Н, с); 7,25-7,55 (2Н, м); 7,55-7,9 (2Н, м).
Пример 29. 4-[1-[[[(4-Хлорфенил)сульфонил]амино] метил]циклогексил]бензолуксусная кислота
а)
2-[2-[4-(Бромметил)фенил]этокси]-З,4,5,6-тетрагидро-2H-пиран
Смесь из 16,9 г (78,5 ммоль) 4-бромметилбензолэтанола, приготовленного по Plaue S. et Heissler D. Tetrahedron Lett.
(1987) 28,
1401-4) 10,6 г (125 ммоль) 3,4-дигидро-2Н-пирана и 0,16 г паратолуолсульфоновой кислоты в 160 мл сухого этилового эфира, перемешивают 16 часов при комнатной температуре. Реакционную среду
затем
промывают раствором, насыщенным бикарбонатом натрия, потом водой, высушивают на сульфате натрия и концентрируют, получают 21,5 г (выход 91,5%) желтого масла, используемого без дальнейшей
очистки.
ЯМР (CDCl3) d1,25-2,0 (6Н, м); 2,9 (2Н, т, J=6,75 Гц); 3,25-4,15 (4Н, м); 4,45 (2Н, с); 4,55 (1Н, м); 7,2 (4Н, с).
б) 4-[2-[(3,4,5,
6-Тетрагидро-2Н-пиран-2-ил)окси]этил]бензолацетонитрил
21,5 г (71,8 ммоль) соединения, полученного на предыдущей стадии, добавляют к раствору из 3,9 г (79 ммоль) цианида натрия в 50 мл
диметилсульфоксида, доведенному до 115oC. Эту температуру поддерживают в течение 5 часов. После охлаждения выливают на H2O и экстрагируют эфиром. Органическую фазу промывают
водой, высушивают на сульфате натрия и концентрируют, затем очищают хроматографией на кремниевой колонке со смесью гексан-этилацетат (4: 1) и получают 9,3 г (выход 52,8%) бесцветного масла.
ИК (пленка): n ( (C≡N) )2255 см-1.
ЯМР (CDCl3): δ1,25-2,0 (6Н, м); 2,9 (2Н, т, J=6,75 Гц); 3,25-4,25 (4Н, м); 3,7 (2H, с); 4,5 (1Н, м); 7,2 (4Н, с).
в) 1-[4-[2-[(3,4,5,6-Тетрагидро-2Н-пиран-2-ил)окси]этил]фенил] циклогексанкарбонитрил
К суспензии, находящейся в атмосфере азота, из 3,8 г (94,7 ммоль) NaH (60
-ная в минеральном масле) в 125 мл сухого диметилсульфоксида, поддерживаемой при 20oC баней со льдом, постепенно по каплям прибавляют раствор 9,3 г (37,9 ммоль) соединения, полученного на
предыдущей стадии б) в 20 мл сухого диметилсульфоксида. После перемешивания в течение часа при комнатной температуре приливают смесь 13,1г (56,8 ммоль) 1,5-дибромпентана и 20 мл сухого
диметилсульфоксида. Реакционную среду перемешивают 40 часов при комнатной температуре, затем выливают на ледяную воду и экстрагируют эфиром. Органическую фазу промывают водой, высушивают на сульфате
натрия и очищают хроматографией на кремниевой колонке смесью гексан-этилацетат (1:1), получают 10,2 г (выход 85, 7%) желто-оранжевого масла.
ИК (пленка): n ( (C≡N) )=2250 см-1.
ЯМР (CDCl3): δ0,75-2,5 (16H, м); 2,85 (2Н, т, J=6,75 Гц); 3,2-4,1 (4Н, м); 4,5 (1Н, м); 7,0-7,5 (4Н, м).
г) 4-[1-(Аминометил)циклогексил] бензолэтанол.
Раствор 10,2 г (32,5 ммоль) соединения, полученного на предыдущем этапе в), в 20 мл сухого эфира добавляют к суспензии, находящейся в атмосфере азота, из 1,9 г (48,8 ммоль) LiAlH4 в 100 мл сухого эфира. Реакционную среду 5 часов доводят до рефлюкса. После охлаждения осторожно добавляют 9,5 мл воды, потом 100 мл эфира. Реакционную среду экстрагируют 1н. HCl. Эту водную фазу промывают эфиром, подщелачивают концентрированной NaOH, затем экстрагируют эфиром. Эфирную фазу промывают водой, высушивают на сульфате натрия и концентрируют с получением 5,9 г (выход 77,8%) желтого масла, используемого без дальнейшей очистки.
ИК (пленка): n (NH2)=3350 см-1; (ОН)=3320 см-1 .
ЯМР (CDCl3): d0,75-2,35 (13Н, м из которых 3Н обмениваются с D2/O); 2,6 (2Н, с); 2,8 (2Н, т, J=6,75 Гц); 3,8 (2Н, т, J=6,75 Гц); 7,15 (4Н, с).
д)
4-Хлор-N-[[1-[4-(2-гидроксиэтил)фенил]циклогексил]метил] бензолсульфонамид
К раствору 5,9 г (25,2 ммоль) соединения, полученного на предыдущей стадии г), 3,0 г (30,2 ммоль) триэтиламина
в
60
мл сухого CH2Cl2, находящемуся при -20oC, добавляют 5,2 г (24,7 ммоль) хлорида 4-хлорбензолсульфонила. После выдерживания 3 часа при -20oC,
реакционную
среду выливают в раствор разбавленной HCl, затем экстрагируют дихлорметаном. Органическую фазу промывают, высушивают на сульфате натрия и концентрируют с получением масла, которое
очищают
хроматографией на кремниевой колонке смесью гексан-этилацетат (1: 1). Получают 1,2 г (выход 11,6%) мелкозернистого твердого белого вещества. Т.пл. 110-111oC.
ИК (KBr): n (OH)=3450 см-1; (NH)=3080 см-1; (SO2)=1310 см-1; (SO2)=1140 см-1.
ЯМР (CDCl3): d0,75-2,25 (11H, м, из которых 1H обменивается с CF3COOD); 2,8 (2Н, т, J= 6,75 Гц); 2,9 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 3,8 (2Н, т, J=6,75 Гц); 4,1 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,1 (4Н, с); 7,3 (2Н, м); 7,55 (2Н, м).
е) 4-[1-[[[(4-Хлорфенил)сульфонил]амино]метил] циклогексил]бензолуксусная кислота
Работают
согласно примеру 25ж, исходя из 1,2 г (2,9 ммоль) соединения, полученного на предыдущей стадии д) в 120 мл ацетона и 2,8 мл (5,9 ммоль) реактива Джойса. Реакционную среду перемешивают 24 часа при
комнатной температуре. После двух перекристаллизаций в толуоле, получают 0,3 г (выход 25%) твердого белого вещества. Т.пл. 147-151oC.
Элементный анализ: C21
H24ClNO4S (М=421,939)
Рассчитано, C 59,78; H 5,73; Cl 8,40; N 3,32; S 7,60.
Получено, C 59,52; H 5,70; Cl 8,34; N 3,22; S 7,57.
ИК (KBr): n (NH)=3290 см-1; (C=O)=1700 см-1; (SO2)=1325 см-1; (SO2)=1160 см-1.
ЯМР (ДМСО d6): d1,0-2,2 (10Н, м); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 3,4 (1Н, м, обменивающийся с CF3COOD); 3,5 (2Н, с); 6,9-7,4 (4Н, м); 7,4-7,8 (4H, м); 12,2 (1Н, с широкий, обменивающийся с CF3COOD).
Пример 30. 4-[4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил] метил]фенил]-4-оксобутанойная кислота
а) Этиловый эфир
4-[4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]метил]фенил]-4-оксобутанойной кислоты
К смеси из 25,1 г (69 ммоль) соединения, полученного в примере 17а, 12,5 г (75,9 ммоль)
3-хлороформилпропаната этила и 130 мл дихлорметана, находящейся при 0oC, вводят порциями 27,6 г (207,0 ммоль) безводного хлорида алюминия. Реакционную среду перемешивают 2 часа при 0oC, потом 1 час при комнатной температуре, после чего выливается на смесь лед-концентрированная HCl. После рекуперации органической фазы водную фазу экстрагируют CH2Cl2.
Соединенные органические фазы промывают водой, высушивают на сульфате натрия и концентрируют с получением 30,9 г (выход 9%) твердой пасты, используемой без дальнейшей очистки. Т.пл. 100-104o
C.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1710 см-1; (C=O)=1690 см-1; (SO2)=1355 см-1; (SO2)=1170 см-1 .
ЯМР (CDCl3): d1,25 (3Н, т, J=6,75 Гц); 1,1-1,8 (8Н, м); 2,5- 2,9 (6Н, м, из которого 1 триплет, J=6 Гц); 3,25 (2Н, т, J=6 Гц); 4,1 (2H, к, J=6,75 Гц); 4,9 (1Н, м, обменивающиеся с CF3COOD); 7,0-7,25 (2Н, м); 7,3-7,6 (2Н, м); 7,6-7,9 (4Н, м).
б) 4-[4-[[-1[[[(4-Хлорфенил)сульфонил] амино] метил] циклопентил]метил]
фенил]-4-оксобутанойная кислота
К раствору 10 г (20,2 ммоль) соединения, полученного на предыдущей стадии, и 200 мл 96 этанола, прибавляют 2,2 г (39,2 ммоль) гидроксида калия, растворенного
в
100 мл воды. Смесь перемешивают 4
часа при 60oC, потом концентрируют досуха при пониженном давлении. Полученный твердый остаток извлекают водой, промывают этилацетатом, затем по каплям
приливают в раствор разбавленной HCl.
Сформировавшийся белый осадок фильтруют, центрифугируют и высушивают в вакууме. Продукт очищают хроматографией на кремниевой колонке в смеси дихлорметан-метанол
(19:1), потом дважды
перекристаллизовывают в толуоле. Получают 5,2 г (выход 55,9%) твердого белого вещества. Т.пл. 139-142oC.
Элементный анализ: C23H26ClNO3S
(М=463,975)
Рассчитано, C 59,54; H 5,65; Cl 7,64; N 3,02; S 6,91.
Получено, C 59,39; H 5,81; Cl 7,62; N 2,93; S 7,17.
ИК (KBr): n (NH)=3300 см-1; (C=O)=1690 см-1; (C=O)=1670 см-1; (SO2)=1330 см-1; (SO2)=1150 см-1.
ЯМР (ацетон d6): d1.25-1.7 (8Н, м); 2, 4-2,95 (4Н, м); 2,75 (2Н, д, J= 6,75 Гц, переходящий в синглет с CF3COOD); 3,3 (2Н, т, J=6 Гц); 6,4 (1Н, т, J=6,75 Гц), обменивающийся с CF3COOD); 7,0-7,95 (8Н, м); 10,25 (1Н, с, широкий, обменивающийся с CF3COOD).
Пример 31. 4-Хлор-N-[[1-[[4-(4,5-дигидро-3-оксо-2Н-пиридазин-6-ил)фенил] метил]циклопентил]метил]
бензолсульфонамид
К раствору
3 г (6,5 ммоль) соединения, полученного в примере 30б и 40 мл уксусной кислоты, прибавляют 1,8 г (35,9 ммоль) гидрата гидразина. Смесь перемешивают при рефлюксе
в течение 6 часов. После охлаждения
реакционную среду разбавляют водой, затем экстрагируют дихлорметаном. Органическую фазу промывают едким натром, потом водой, высушивают на сульфате натрия и
концентрируют досуха с получением бежевого
твердого вещества. Продукт очищают перекристаллизацией в хлороформе, потом в смеси хлороформ-гептан с получением 1,1 г (выход 37,9%) твердого белого
вещества. Т.пл. 187-188oC.
Элементный анализ: C23H26ClN3O3S + 0,5 CHCl3 (М=465,965)
Рассчитано, C 59,41; H
5,
63; Cl 8,75; N 9,02; S 6,88.
Получено, C 59,49; H 5,59; Cl 8,49; N 9,30; S 6,93.
ИК (KBr): n (NH)=3270 см-1; (C=O)=1670 см-1; (C=N)=1645 см-1; (SO2)=1335 см-1; (SO2)=1140 см-1.
ЯМР (ацетон d6+DMCO d6): d1,25-1,8 (8Н, м); 2,25-3,25 (9Н, м, из которых 1H обменивается с CF3 COOD); 7,0-7,3 (2H, м); 7,4- 7,7 (4Н, м); 7,7-8,0 (2Н, м); 10,3 (1Н, с, широкий, обменивающийся с CF3COOD).
Пример 32.
4-[[1-[[[(2-Хлорфенил)сульфонил]амино]метил]
циклопентил]метил]бензолуксусная кислота
а) 1-/(4-Ацетилфенил)метил/циклопентанкарбонитрил
К раствору 92,6 г (0,5 моль)
1-(фенилметил)циклопентанкарбонитрила (приготовленного по
Campaigne E. et Forsch R.A. J. Org. Chem. (1978) 43, 1044-50) в 2000 мл дихлорметана, поддерживаемому при -5oC, прибавляют 78,5 г
(1 моль) ацетилхлорида, потом порциями 200г (1,5 моль)
хлорида алюминия. В течение 2 часов поддерживают температуру -5oC, потом поднимают до комнатной температуры, перемешивая 16 часов.
Реакционную среду выливают на смесь лед-вода-HCl и
экстрагируют дихлорметаном. Органическую фазу промывают до нейтральности, высушивают на сульфате натрия и концентрируют до получения маслообразного
продукта красного цвета, в котором остается около
60% исходного продукта. Это масло вновь обрабатывают в 2000 мл дихлорметана, 78,5 г (1 моль) ацетилхлорида и 200 г (1,5 моль) хлорида алюминия при
рефлюксе в течение 4 часов. После охлаждения
реакционную среду выливают в смесь лед-вода-HCl, затем экстрагируют дихлорметаном. Органическую фазу высушивают на сульфате натрия и концентрируют до
получения масла темно-красного цвета, которую
очищают дистилляцией. Получают 76,5 г (выход 67,6%) желтого кристаллизующегося масла. Т.кип.0,4 120-160oC.
Фракцию этого продукта перекристаллизовывают в смеси этилацетат-гексан и получают твердое белого цвета вещество. Т.пл. 46-48oC.
Элементный анализ: C15H17NO
(М=227,305)
Рассчитано, C 79,26; H 7,
54; N 6,16.
Получено, C 79,59; H 7,61; N 6,14
ИК (KBr): n(C≡N)2200 см-1; (C=O)=1650 см-1.
ЯМР (CDCl3): δ1,5-2, 4 (8Н, м); 2,6 (3Н, с); 2,9 (2Н, с); 7,25-7,5 (2H, м); 7,75-8,0 (2Н, м).
б) Метиловый эфир
4-[(1-цианоциклопентил)метил]бензолуксусной кислоты
Работают согласно примеру 5д,
но исходя из 39,9 г (175,5 ммоль) продукта, полученного на предыдущей стадии, 126 мл метанола в 630 мл
дихлорметана, 99,6 г (702 ммоль) эфирной вытяжки трифторида бора и 81,6 г (184,2 ммоль)
тетраацетата свинца, растворенного в 200 мл дихлорметана. Получают 44,8 г (выход 99,2%) желтого масла,
используемого без дальнейшей очистки.
ИК (пленка): n(C≡N)2260 см-1; (C=O)=1715 см-1.
ЯМР (CDCl3): δ1,5-2,25 (8Н, м); 2, 8 (2Н, с); 3,6 (2Н, с); 3,65 (3Н, с); 7,15 (4Н, с).
в)
4-[[1-(Аминометил)циклопентил]метил] бензолэтанол
К суспензии, находящейся при 35oC в атмосфере азота,
из
12,5 г (332,9 ммоль) LiAlH4 в 242 мл тетрагидрофурана,
прибавляют 25,2 г (97,9 ммоль) соединения, полученного на предыдущей стадии б), растворенного в 121 мл тетрагидрофурана.
Реакционную
среду доводят до рефлюкса 6,5 часов. После охлаждения осторожно
приливают 68 мл воды, затем разбавляют этиловым эфиром и фильтруют образовавшийся осадок. Фильтрат разбавляют водой, потом
экстрагируют
эфиром. Органическую фазу, промытую водой, высушивают на
сульфате натрия и концентрируют. Полученное масло поглощают раствором HCl разбавленной, промывают эфиром. Эту водную фазу
подщелачивают
карбонатом натрия, экстрагируют дихлорметаном, экстракт затем
промывают водой и высушивают на сульфате натрия, после чего концентрируют. Получают 20,6 г (выход 90,1%) желтого масла,
используемого без
дальнейшей очистки. Порцию этого масла очищают хроматографией
на кремниевой колонке в смеси хлороформ-метанол (9:1), потом дистилляцией до получения бледно-желтого масла.
Т.кип.0,3
150-153oC.
Элементный анализ: C15H23NO (233, 355)
Рассчитано, C 77,21; H 9,94; N 6,00.
Получено, C 77, 13; H 9,99; N 6, 17.
Спектры U.R. и ЯМР Идентичны таковым, полученным в примере 26 в.
г) 2-Хлор-N-[[1-[[4-(2-гидроксизтил)фенил]метил]циклопентил]
метил]бензолсульфонамид
К
смеси из 3 г (12,9 ммоль) соединения, полученного на предыдущей стадии,
и 1,6 г (15,8 ммоль) триэтиламина в 30 мл сухого дихлорметана, находящейся при -15oC, прибавляют 2,6 г (12,3 ммоль)
хлорида 2-хлорбензолсульфонила, растворенного в 30 мл дихлорметана. После
3 часов перемешивания реакционной среды при 15oC ее выливают на смесь
лед-вода, затем экстрагируют дихлорметаном.
Органическую фазу промывают с помощью 1н. HCl, промывают водой, высушивают
на сульфате натрия и концентрируют. Получают твердое белое вещество,
используемое без дальнейшей очистки; 4,7 г (выход 90,
4%). Т.пл. 126-128oC.
Одну фракцию очищают перекристаллизацией в смеси этилацетат-гептан, с получением белого порошка. Т.пл. 127-129oC.
Элементный анализ: C21H26ClNO3S (М=407,954)
Рассчитано, C 61,83; H 6,42; Cl 8,69; N 3,43; S 7,86.
Получено, C 61,80; H 6,30; Cl 9,10; N 3,48; S 7,89.
ИК (KBr): n (ОН)=3570 см-1; (NH)=3300 см-1; (SO2)=1320 см-1; (S)2)=1160 см-1.
ЯМР (CDCl3): d1,25-1,9 (9Н, м, из которых 1H обменивается с CF3 COOD); 2,6 (2Н, с); 2,6 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 2,8 (2Н, т, J= 6,75 Гц); 3,8 (2H, т, J=6, 75 Гц); 4,8 (1Н, м, обменивающийся с CF3COOD); 7,1 (4Н, с); 7,25-7,6 (3Н, м); 7,8-8,2 (1Н, м).
д)
4-[[1-[[[(2-Хлорфенил)сульфонил] амино]метил]
циклопентил]метил]бензолуксусная кислота
Работают согласно примеру 25ж, но исходя из 4,2 г
(10,3 ммоль) соединения, полученного в примере 32г,
растворенного в 140 мл ацетона и 9,6 мл
реактива Джойса (20,5 ммоль). После двух перекристаллизаций в смеси этилацетат-гептан получают 0,9 г (выход
20,9%) белого порошка. Т.пл. 147-149o
C.
Элементный анализ:
C21H24ClNO4S (М=421,940)
Рассчитано, C 59,78; H 5,73; Cl 8,40; N 3,32;
S 7,60.
Получено, C 59,83; H 5,81; Cl 8,17; N 3,58; S 7,73.
ИК (KBr): n (NH)=3280 см-1; (C=O)=1690 см-1; (SO2)=1320 см-1; (SO2)=1155 см-1.
ЯМР (CDCl3): d1,
1-1,8 (8Н, м); 2,6 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 2,6 (2Н, с); 3,6 (2Н, с); 5,0 (1Н,
т, J=6,75 Гц, обменивающийся с CF3COOD); 6,5 (1Н, с, широкий,
обменивающийся с CF3COOD); 7,1 (4Н, с); 7,4-7,6 (3Н, м); 7,85-8,1 (1Н, м)
Примеры 33-51.
Соединения примеров 33-51:
3-хлор-N-[[1-[[4-(2-гидроксиэтил)фенил] метил]циклопентил] метил]бензолсульфонамид,
4-бром-N-[[1-[[4-(2-гидроксиэтил)фенил] метил]циклопентил]
метил]бензолсульфонамид,
N-[[1-[[4-(2-гидроксизтил)фенил] метил] циклопентил] метил]-4-иодобензолсульфонамид,
N-[[1-[[4-(2-гидроксизтил)фенил] метил] циклопентил]
метил]-4-трифторметилбензолсульфонамид,
N-[[1-[[4-(2-гидроксизтил)фенил] метил] циклопентил] метил]-3-трифторметилбензолсульфонамид,
4-циано-N-[[1-[[4-(2-гидроксизтил)фенил] метил]
циклопентил] метил]бензолсульфонамид,
N-[[1-[[4-(2-гидроксиэтил)фенил] метил] циклопентил] метил]-3-нитробензолсульфонамид,
2,
4-дихлор-N-[[1-[[4-(2-гидроксизтил)фенил]метил]циклопентил] метил]-бензолсульфонамид,
N-[[1-[[4-(2-гидроксизтил)фенил] метил] циклопентил] метил]-4-(1-метилэтил)-бензолсульфонамид,
4-(1,1-диметилэтил)-N-[[1-[[4-(2-гидроксиэтил)фенил] метил] циклопентил]
метил]бензолсульфонамид,
4-ацетил-N-[[1-[[4-(2-гидроксизтил)фенил] метил] циклопентил] метил]бензолсульфонамид,
N-[[1-[[4-(2-гидроксизтил)фенил] метил] циклопентил]
метил]-4-метилсульфонилбензолсульфонамид,
N-[[1-[[4-(2-гидроксиэтил)фенил] метил] циклопентил]
метил]-4-трифторметоксибензолсульфонамид,
N-[[1-[[4-(2-гидроксизтил)фенил] метил]
циклопентил] метил]-4-метоксибензолсульфонамид,
N-[[1-[[4-(2-гидроксиэтил)фенил] метил] циклопентил]
метил]-3-метилхинол-8-илсульфонамид,
N-[[1-[[4-(2-гидроксиэтил)фенил]метил]циклопентил] метил]тиен-2-ил-сульфонамид,
5-хлор-N-[[1-[[4-(2-гидроксизтил)фенил] метил] циклопентил]
метил]тиен-2-илсульфонамид,
N-[[1-[[4-(2-гидроксиэтил)фенил] метил] циклопентил] метил]-имидазол-4-илсульфонамид,
N-[[1-[[4-(2-гидроксизтил)фенил] метил] циклопентил]
метил]фур-2-илсульфонамид,
были получены
по примеру 32 г и их характеристики даны в табл.1
Примеры 52-70.
Были получены также следующие соединения согласно условиям
примера 25ж:
4-[[1-[[[(3-хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота,
4-[[1-[[[(4-бромфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная
кислота,
4-[[1-[[[(4-иодфенил)сульфонил] амино]метил] циклопентил]метил]бензолуксусная кислота,
4-[[1-[[[(4-трифторметилфенил)сульфонил] амино]метил]цикло]пентил]метил]
бензолуксусная кислота,
4-[[1-[[[(3-трифторметилфенил)сульфонил] амино] метил]циклопентил]метил] бензолуксусная кислота,
4-[[1-[[[(4-цианофенил)сульфонил] амино] метил]
циклопентил]метил]бензолуксусная
кислота,
4-[[1-[[[(3-нитрофенил)сульфонил] амино] метил] циклопентил]метил]бензолуксусная кислота,
4-[[1-[[[2,4-дихлорфенил)сульфонил]амино]метил]
циклопентил]метил]бензолуксусная
кислота,
4-[[1-[[[4-(1-метилэтил)фенил] сульфонил]амино]метил] циклопентил]метил] бензолуксусная кислота,
4-[[1-[[[[4-(1,1-диметилэтил)фенил]
сульфонил] амино] метил]циклопентил]
метил]бензолуксусная кислота,
4-[[1-[[[(4-ацетилфенил)сульфонил] амино]метил] циклопентил]метил]бензолуксусная кислота,
4-[[1-[[[(4-метилсульфонилфенил)сульфонил] амино]
метил]циклопентил]метил]бензолуксусная кислота,
4-[[1-[[[(4-трифторметоксифенил)сульфонил] амино] метил]циклопентил]метил]бензолуксусная
кислота,
4-[[1-(4-метоксифенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота,
4-[[1-[[[(3-метилхинол-8-ил)сульфонил] амино] метил] циклопентил] метил]
бензолуксусная кислота,
4-[[1-[[[(тиен-2-ил)сульфонил] амино] метил]циклопентил] метил]бензолуксусная кислота,
4-[[1-[[[(5-хлоротиен-2-ил)сульфонил]амино]метил]циклопентил]
метил]бензолуксусная кислота,
4-[[1-[[[(имидазол-4-ил)сульфонил] амино]метил]циклопентил] метил]бензолуксусная кислота,
4-[[1-[[[(фур-2-ил)сульфонил] амино] метил] циклопентил]
метил]бензолуксусная кислота.
Характеристики этих соединений даны в табл.2.
Пример 71. 4-[[1-[[[(4-Гидроксифенил)сульфонил]амино]метил] циклопентил]
метил]бензолуксусная кислота
Раствор 3,6 г
(8,6 ммоль) продукта, полученного в примере 65, в 40 мл 1,2-дихлорэтана прибавляют по каплям в смесь, находящуюся в атмосфере азота, состоящую из 10,
7 г (34,2 ммоль) комплекса трибромида бора с
диметилсульфидом и 40 мл 1,2-дихлорэтана. Реакционную среду доводят до рефлюкса в течение 10 часов. Вновь прибавляют 10 г (32 ммоль) комплекса трибромид
бора-диметилсульфид и снова доводят до
рефлюкса в течение 7 часов. После охлаждения реакционную среду выливают на смесь лед+вода и экстрагируют дихлорметаном. Органическую фазу промывают раствором
NaHCO3, которую затем
подкисляют HCl и экстрагируют CH2Cl2. Органическую фазу высушивают на сульфате натрия и концентрируют. Остаток очищают хроматографией на
кремниевой колонке в смеси
дихлорметан-метанол (от 98: 2 до 95:5), потом перекристаллизацией в смеси этилацетат-толуол, потом этилацетатом до получения 0,15 г (выход 4,3%) мелкого белого порошка.
Т.пл. 132-135o
C.
Элементный анализ: C21H25NO5S (М=403, 492)
Рассчитано, C 62,51; H 6,25; N 3,47; S 7,95.
Получено,
C 62,47 H 6,20 N 3,38
S 8,
05
ИК (KBr): n (NH)=3280 см-1; (C=O)=1680 см-1; (SO2)=1305 см-1; (SO2)=1145 см-1.
ЯМР (DMCO d6): d1,1-1,6 (8Н, м); 2,3-2,7 (4Н, м); 3,1 (1Н, м, обменивающийся с CF3COOD); 3,45 (2Н, с); 4,0 (1H, с, широкий, обменивающийся с CF3COOD); 6,7-7,2 (4Н, м); 7,4-7,65 (4Н, м); 11,0 (1Н, с, широкий, обменивающийся CF3COOD).
Пример 72. 4-[[1-[[[(4-Хлорфенил)сульфониламино]метил] циклопропил]метил]бензолуксусная кислота
а)
1-(Фенилметил)
циклопропанкарбонитрил.
К смеси, находящейся в атмосфере азота, из 26,3 г (260 ммоль) диизопропиламина и 300 мл тетрагидрофурана, охлажденного до -75oC, по каплям прибавляют 125 мл (200 ммоль) н-бутиллития в виде 1,6М раствора в гексане, потом 13,4 г (200 ммоль) торгового циклопропанкарбонитрила и 25,3 г (200 ммоль) хлорида бензила. Реакционную среду перемешивают 2 часа при -70oC, потом 2 дня при 20oC. Прибавляют 4 мл воды, промывают реакционную среду водой, насыщенной NaCl. Органическую фазу высушивают на сульфате натрия и концентрируют до получения коричневой жидкости, которую очищают дистилляцией. Получают 16,8 г (выход 53,5%) бесцветной жидкости. Т.кип13 140-148oC.
Новая дистилляция дает бесцветную жидкость. Т.кип.0,3 64-68oC.
Элементный анализ: C11H11N (М=157,215)
Рассчитано, C 84,04; H 7,05; N 8,
91.
Получено, C 83,98; H 7,04; N 8,86.
ИК (пленка): n(C=N)=2230 см-1.
ЯМР (CDCl3): d0,7-1,0 (2Н, м); 1,1-1,4 (2Н, м); 2,7 (2Н, с); 7,2 (5Н, с).
б) [1-(Фенилметил)циклопропил] метанамин.
Работает как в примере 15а, но исходя из 98 г (623 ммоль) соединения, полученного на предыдущей стадии, 28, 4 г (740 ммоль) LiAlH4 в 800 мл эфира. После дистилляции получают 82,3 г (выход 81,9%) бесцветной жидкости. Т.кип.0,3 75oC.
Элементный анализ:
C11H15N (М=161,246)
Рассчитано, C 81,94; H 9,38; N 8,69.
Получено, C 82,05; H 9,61; N 8,45.
ИК (пленка): n (NH2)=3360 см-1.
ЯМР (CDCl3): d0,25-0,5 (4Н, м); 1,0 (2Н, с, обменивающиеся с D2); 2,4 (2Н, с); 2,65 (2H, с); 7,2 (5Н, с).
в)
4-хлор-N-[[1-(фенилметил)циклопропил]метил] бензолсульфонамид
Работают согласно примеру 1в, но исходя из 80,3 г (498 ммоль) соединения, полученного на предыдущей стадии б), 60,5 г (598
ммоль)
триэтиламина, 105 г (497 ммоль) хлорида 4-хлорбензолсульфонила в 875 мл дихлорметана. После перекристаллизации в смеси этилацетат-гексан получают 145,8 г (выход 87,2%) белого порошка. Т.пл.
105,7-106,
4oC.
Элементный анализ: C17H18ClNO2S (М=335,848)
Рассчитано, C 60,80; H 5,40; Cl 10,56; N 4,17; S 9,55.
Получено, C 61,10; H 5,53; Cl 10,72; N 4,34; S 9,36.
ИК (KBr): n (NH)=3220 см-1; (SO2)=1315 см-1; (SO2)=1145 см-1 .
ЯМР (CDCl3): d0,3-0,6 (4Н, м); 2,6 (2Н, с); 2,7 (2Н, д, J=6 Гц, переходящий в синглет в CF3COOD); 4,9 (1Н, т, J=6 Гц, обменивающийся с CF3COOD); 6, 9-7,3 (5Н, м); 7,3-7,5 (2Н, м); 7,6-7,9 (2Н, м).
г) N-[[1-[(4-Ацетилфенил)метил] циклопропил] метил]-4-хлорбензолсульфонамид
Работают согласно примеру 17б, но исходя из 10
г (29,7
ммоль) соединения,
полученного на предыдущей стадии в), 3,0 г ацетилхлорида (38,4 ммоль) и 19,8 г (148,5 ммоль) хлорида алюминия в 200 мл 1,2-дихлорзтана. После очистки хроматографией на
кремниевой
колонке со смесью
этилацетат-гексан получают 3 г (выход 23,2%) твердого пастообразного вещества.
ИК (KBr): n (NH)=3280 см-1; (C=O)=1870 см-1; (SO2 )=1155 см-1 .
ЯМР (CDCl3): d0-0,1 (4Н, м); 2,6 (3Н, с); 2,65-2,8 (4Н, м); 4,7 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,7-8,0
(8Н,
д)
Метиловый эфир
4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопропил]метил]бензолуксусной кислоты
Работают согласно примеру 5д, но исходя из 3 г (7,9 ммоль) соединения,
полученного на
предыдущей стадии
г), 3,6 мл метанола, 6,7 г (47,6 ммоль) эфирной вытяжки трифторида бора, 5,3 г (11,9 ммоль) тетраацетата свинца в 52 мл дихлорметана. После очистки на кремниевой
колонке
хроматографией смесью
гексан-этилацетат, получают 1,5 г (выход 43,7%) твердого белого вещества. Т. пл. 97,2-99,6oC.
ИК (KBr): n (NH)=3260 см-1; (C=O)=1710 см-1; (SO2) 1315 см-1 (SO2)=1155 см-1.
ЯМР (CDCl3): d0,25-0,5 (4Н, м); 2,5 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,55 (2Н, с); 3,65 (3Н, с); 4,65 (1H, т, J=6 Гц, обменивающийся с CF3COOD); 6,75-7,2 (4Н, м); 7,25-7,5 (2Н, м); 7,5-7,8 (2Н, м).
e)
4-[[1-[[[(4-Хлорфенил)сульфонил] амино]метил] циклопропил]метил]бензолуксусная кислота
Смесь из 1,4 г (3,4 ммоль) сложного эфира, полученного на предыдущей стадии д), 22 мл
метанола, 0,38 г
(9,5 ммоль) гидроксида натрия в таблетках и 22 мл воды, доводят до рефлюкса 1,5 часа. После охлаждения, концентрирования досуха и извлечения водой промывают эфиром и подкисляют
водную фазу HCl.
Сформировавшийся белый осадок промывают водой, затем высушивают в вакууме при 80oC. Полученное твердое вещество очищают перекристаллизацией в смеси этилацетат-гексан до
получения 0,7 г
(выход 51,8%) белого порошка. Т.пл. 160,3-162,4oC.
Элементный анализ: C19H20ClNO4S (М=393,885)
Рассчитано, C 57,
94; H 5,12; Cl 9,
00; N 3,56; S 8,14.
Получено, C 58,07; H 4,96; Cl 8,74; N 3,69; S 7,74.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1695 см-1; (SO2)=1315 см-1; (SO2)=1145 см-1.
ЯМР (ацетон d6): d0,4-0,6 (4Н, м); 2,65 (2H, с); 2,75 (2Н, д, J=6 Гц, переходящий в синглет в CF3COOD); 3, 6 (2Н, с); 6,55 (1Н, т, J=6 Гц, обменивающийся с CF3COOD); 6,9-7,2 (4Н, м); 7,4-7,9 (411, м); 10,5 (1Н, с, широкий, обменивающийся с CF3COOD).
Пример 73.
4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил] циклопептил]метил]бензолуксусная кислота
а) 1-(Фенилметил) циклогептанкарбонитрил.
Работают согласно примеру 27б, но исходя из 195 ммоль диизопропиламина лития (25,6 г (252,9 ммоль) диизопропиламина, обработанного 122 мл (195 ммоль) 1,6 М Н-бутиллития в гексане) в 300 мл сухого тетрагидрофурана, 24 г (195 ммоль) торгового циклогептанкарбонитрила и 24,6 г (195 ммоль) хлорида бензила. После дистилляции получают 23,2 г (выход 55,8%) желтой вязкой жидкости. Т.кип.16 197oC.
ИК (пленка): n(C≡N)2225 см-1.
ЯМР (CDCl3): δ1,25-2,25 (12Н, м); 2,75 (2Н, с); 7,2 (5Н, с).
б)
1-[(4-Ацетилфенил)метил]циклогептанкарбонитрил
Работают согласно примеру 32а, но исходя из 23г (107,8 ммоль) соединения, полученного на предыдущей стадии, 17 г (216,5 ммоль) ацетилхлорида и
43,1 г (323,2 ммоль) хлорида алюминия, в 500 мл дихлорметана. После дистилляции получают 17,5 г ( выход 63,6%) очень густого бледно-желтого масла. Т. кип.0,55 178oC.
ИК (пленка): n(C≡N)2220 см-1; (C=O)=1670 см-1.
ЯМР (CDCl3): δ 1,25-2,25 (12Н, м), 2,5 (3Н, с); 2,8 (2Н, с); 7,15-7,5 (2Н, м); 7,7-8,0 (2Н, м).
В) 1-[[-4-(2,5,5-триметил-1,3-диоксан-2-ил)фенил] метил]циклогептанкарбонитрил
Смесь из 5 г (19,6 ммоль) соединения, полученного на предыдущей стадии б), 3,
3
г (31,7 ммоль) 2,2-диметил-1,3-пропандиола, 0,1 г (0,6 ммоль) паратолуолсульфоновой кислоты и 20 мл толуола доводят до рефлюкса 8 часов в баллоне, находящемся над сепаратором "Дин Старк" для
удаления
воды, образующейся в ходе реакции. После концентрации досуха реакционную среду извлекают CH2Cl2, промывают водой и высушивают на сульфате натрия. После концентрации
получают 5,6
г (выход 83,8% ) светло-коричневого масла, которое медленно кристаллизуется и которое используют без дальнейшей очистки.
ИК (пленка): n(C≡N)2225 см-1
ЯМР
(CDCl3): δ0,6 (3Н, с); 1,25 (3Н, с); 1,5 (3Н, с); 1,4-2,4 (12H, м); 2,8 (2Н, с); 3,4 (4Н, с); 7,3 (4Н, с).
г) 1-[[4-(2,55-Триметил-1,
3-диоксан-2-ил)фенил] метил]
циклогептанметанамин
Работают согласно примеру 15а, но исходя из 5,5 г (16,1 ммоль) соединения, полученного на предыдущей стадии в), 0,73 г (19,2 ммоль)
LiAlH4 в 70 мл безводного
эфира. Получают 4,9 (выход 88,1%) оранжевого масла, используемого без дальнейшей очистки.
ИК (пленка): n (NH2)=3360 см-1 .
ЯМР (CDCl3 ): d0,6 (3Н, с); 1,3 (3Н, с); 1,2-1,9 (17Н, м), из которых 2Н обмениваются с D2); 2,4 (2Н, с); 2,6 (2Н, с); 3,4 (4Н, с); 6,9-7,6 (4Н, м).
д) 4-Хлор-N-[[1-[[4-(2,5,
5-триметил-1,3-диоксан-2-ил)фенил]метил]циклогептил]метил] бензолсульфонамид
Работают согласно примеру 1в, но исходя из 4,8 г (13,9 ммоль) соединения,
полученного на предыдущей стадии г) 1,7
г (16,8 ммоль) триэтиламина, 2,9 г (13,7 ммоль) хлорида 4-хлорбензолсульфонила в 25 мл сухого дихлорметана. После 23 часов перемешивания при комнатной
температуре, обычной обработке и очистки
хроматографией на кремниевой колонке со смесью этилацетат-гексан (4: 1), получают 4,4 г (выход 61,7%) твердого пастообразного вещества.
ИК (KBr): n (NH)=3270 см-1; (SO2)=1320 см-1; (SO2)=1155 см-1.
ЯМР (CDCl3): d0,8 (3Н, с); 1,2 (3Н, с); 1,1-1,8 (15Н, м); 2,5 (2Н, с); 2,6 (2H, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,3 (4Н, с); 4,3 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,8-7,9 (8Н, м).
е)
N-[[1-[(4-ацетилфенил)метил] циклогептил]
метил]-4-хлорбензолсульфонамид
Смесь из 1 г (1,9 ммоль) соединения, полученного на предыдущей стадии д), 1,5 мл 10,7н. HCl, 0,9 мл воды и 5 мл
изопропанола доводят до рефлюкса в течение 4
часов. После охлаждения и концентрации досуха остаток извлекают водой и экстрагируют дихлорметаном. Органическую фазу, высушенную на сульфате натрия,
концентрируют и очищают хроматографией на
кремниевой колонке в смеси этилацетат-гексан (5: 1) до получения 0,6 г (выход 72,3%) твердого белого пастообразного вещества.
ИК (KBr): n (NH)=3270 см-1; (C=O)=1660 см-1;(SO2)=1315 см-1; (SO2)=1175 см-1.
ЯМР (CDCl3): d1,0-1,6 (12Н, м); 2,5 (3Н, с); 2,6 (2Н, с); 2,65 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 4,9 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,0-7,25 (2Н, м); 7,3-7,6 (2Н, м); 7,65-7,9 (4Н, м).
ж) Метиловый эфир
4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклогептил]метил]бензолуксусной кислоты
Работают согласно примеру 5д, но исходя из 2,2 г (5,1
ммоль)
соединения, полученного на предыдущей стадии
е), 2,3 мл метанола, 4,3 г (30 ммоль) эфирной вытяжки трифторида бора, 3,4 г (7,7 ммоль) тетраацетата свинца в 50 мл сухого дихлорметана. Получают
2,2 г
(выход 93,6%) твердого белого вещества,
используемого без дальнейшей очистки. Т.пл.158,1-160,9oC.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1705 см-1; (SO2)=1345 см-1; (SO2)=1155 см-1.
ЯМР (CDCl3): d1,2-1,6 (12Н, м); 2,5 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,6 (2Н, с); 3,7 (3Н, с); 4, 45 (4Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,8-7,3 (4Н, м); 7,35-7,6 (2Н, м); 7,65-7,9 (2Н, м).
з)
4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил]
циклогептил]метил]бензолуксусная кислота
Работают согласно примеру 72е, но исходя из 2 г (4,3 ммоль) соединения, полученного на предыдущей
стадии
ж), 28 мл метанола, 0,48 г (12 ммоль)
гидроксида натрия в таблетках и 28 мл воды. После 2 перекристаллизаций в смеси этилацетат-гексан получают 0,3 г (выход 15,5% ) белого порошка. Т.пл. 127,
8-129,
6oC.
Элементный анализ: C23H28ClNO4S (М=449,992)
Рассчитано, C 61,39; H 6,27; Cl 7,88; N 3,11; S 7,12.
Получено, C 61,70; H 6,27; Cl 7,94; N 3,16; S 6,98.
ИК (KBr): n (NH)=3210 см-1; (C=O)=1690 см-1; (SO2)=1315 см-1; (SO2)=1150 см-1.
ЯМР (ацетон
d6) d1,25-1,6 (12Н, м); 2,6 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,55 (2Н, с); 6,3 (1Н, т, J=6,75 Гц,
обменивающийся с CF3COOD); 7,1 (4Н,
с); 7,4-7,9 (4Н, м); 10,25 (1Н, с, широкий, обменивающийся с CF3COOD)
Пример 74.
4-Хлор-N-[[1-[[4-[2-(морфолин-4-ил)-2-оксоэтил]фенил]метил] циклопентил]метил] бензолсульфонамид
а) Хлорид 4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусной
кислоты
Смесь из 17,1 г (40,5 ммоль) соединения, полученного в примере 19, и 171 мл (2360 ммоль)
хлорида тионила доводят до рефлюкса в течение 4 часов. После охлаждения и концентрации
получают твердое желтое вещество, которое промывают гептаном, после чего центрифугируют и получают 17,0 г (выход
95,3%) твердого желтого вещества, используемого без дальнейшей очистки. Т.пл.
90-95oC.
ИК (KBr): n (NH)=3270 см-1; (C=O)=1775 см-1; (SO2 )=1325 см-1; (SO2)=1155 см-1.
ЯМР (CDCl3): d1,15-1,9 (8Н, м); 2,6 (2Н, с); 2,6-2,9 (2Н, м, переходящий в синглет в CF3COOD); 4,1 (2Н, с); 4,8 (1Н, м, обменивающийся с CF3COOD); 7,1 (4Н, с); 7,3-7, 6 (2Н, м); 7,65-8,0 (2Н, м).
в)
4-Хлор-N-[[1-[[4-[2-(морфолин-4-ил)-2-оксоэтил]фенил]-метил]циклопентил]метил]-бензолсульфонамид
Раствор 2,7 г (6,1 ммоль) соединения,
полученного на предыдущей стадии, в 27 мл дихлорметана
прибавляют по каплям к раствору, состоящему из 1,6 г (18,3 ммоль) морфолина и 160 мл дихлорметана. После 22 часов перемешивания при комнатной
температуре, реакционную среду выливают на смесь вода-HCl
и экстрагируют дихлорметаном. Органическую фазу, промытую водой и высушенную на сульфате натрия, концентрируют в вакууме. Остаток
перекристаллизовывают в смеси этилацетат-гексан с получением 0,7 г
(выход 23,3%) твердого белого вещества. Т.пл. 157-159oC.
Элементный анализ: C25H31
ClN2O4S (М=491,046)
Рассчитано, C 61,
15; H 6,36; Cl 7,22; N 5,70; S 6,53.
Получено, C 61,35; H 6,50; Cl 7,25; N 5,79; S 6,90.
ИК (KBr): n (NH)=3160 см-1; (C=O)=1630 см-1; (SO2)=1325 см-1; (SO2)=1160 см-1.
ЯМР (CDCl3): d1,15-1,75 (8Н, м); 2,55 (2Н, с); 2,65 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,25-3,75 (10Н, м); 4,5 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,0 (4Н, с); 7,25-7,5 (2Н, м); 7,6-7,8 (2Н, м).
Пример 75. 4
-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил] метил]бензолацетамид
Смесь из 3,1 г (7,1 ммоль) хлорида кислоты, полученного в
примере
74а, и 70 мл 22% -го водного аммиачного
раствора (d=0,91) перемешивают 3 дня при комнатной температуре. Образовавшийся остаток фильтруют, промывают водой и высушивают при 50oC.
После 2
перекристаллизаций в этилацетате получают 1,
0 г (выход 33,3%) твердого белого вещества. Т.пл. 151-153oC.
Элементный анализ: C21H25ClN2
O3S (М=420,95)
Рассчитано, C
59,92; H 5,99; Cl 8,42; N 6,65; S 7,62.
Получено, C 59,62; H 5,96; Cl 8,38; N 6,67; S 7,58.
ИК (KBr): n (NH2)=3440 см-1; (NH)=3190 см-1; (C=O)=1660 см-1; (SO2)=1320 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3 + DMCO d6): d1,25-1,8 (8Н, м); 2, 5-2,8 (4Н, м); 3,45 (2Н, с); 6,4 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,5-7,0 (2Н, с, широкий, обменивающиеся с CF3 COOD); 7,1 (4Н, с); 7,35-7,55 (2Н, м); 7,6-7,9 (2Н, м).
Пример 76. 3-[[2-[4-[[1-[[[(4-Хлорфенил)сульфонил] амино]метил]
циклопентил]метил]фенил]-1-оксоэтил]амино]пропанойная
кислота
а) Этиловый эфир
3-[[2-[4-[[1-[[[(4-хлорфенил)сульфонил] амино]метил] циклопентил]метил]фенил]-1-оксоэтил]амино]пропанойной
кислоты
На смесь из 2,4 г (15 ммоль) хлоргидрата
этилового эфира 3-аминопропанойной
кислоты, 3,3 г (33 ммоль) триэтиламина и 150 мл дихлорметана выливают 6,6 г (15 ммоль) хлорида кислоты,
полученного в примере 74а, растворенного в 80 мл
дихлорметана. После 24 часов перемешивания при
комнатной температуре реакционную среду выливают на смесь вода-HCl. Органическую фазу декантируют,
промывают раствором разбавленной HCl, потом раствором
NaHCO3 и водой, затем высушивают на
сульфате натрия. После концентрирования полученный остаток очищают хроматографией на колонке
окиси кремния смесью этилацетат-гексан (2: 1) и получают 3,
0 г (выход 38,4%) мелкого твердого белого
вещества. Т.пл. 128-130oC.
ИК (KBr): n (NH)=3375 см-1; (C=O)=3200 см-1; (C=O)=1720 см-1; (C=O)=1650 см-1; (SO2)=1320 см-1; (SO2)=1160 см-1.
ЯМР (CDCl3): d1,2 (3Н, т, J=6,75 Гц); 1,35-1,8 (8H, м); 2,5 (2Н, т, J= 6,75 Гц); 2,6 (2Н, с); 2,75 (2Н, д, J=6,75 Гц), переходящий в синглет в CF3COOD); 3,4 (2Н, т, J=6,75 Гц); 3,5 (2Н, с); 4,1 (2Н, к, J=6,75 Гц); 4,7 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,0 (1Н, с, широкий, обменивающийся с CF3COOD); 7,1 (4Н, с); 7,35-7,6 (2Н, м); 7,7-7,9 (2Н, м).
б) 3-[[2-[4-[[1-[[[(4-Хлорфенил)сульфонил]
амино]метил]
циклопентил]метил]фенил]-1-оксоэтил]амино]пропанойная кислота
Работают согласно примеру 5е, но исходя из 0,3 г (5,75
ммоль) соединения, полученного на предыдущей стадии, 0,65 г
(11,5 ммоль)
КОН в таблетках, 30 мл этанола и 30 мл воды. После 2 перекристаллизаций в этилацетате получают 1,7 г (выход 60,7%) твердого
белого вещества. Т.пл. 148-150oC.
Элементный
состав: C24H29ClN2O5S (М=493,018)
Рассчитано, C 58,47; H 5,93; Cl 7,19;
N 5,68; S 6,50.
Получено, C 58,22; H 5,91; Cl 7,30; N 5,64; S 6,58.
ИК (KBr): n (NH)=3400 см-1; (NH)3240 см-1; (C=O)=1705 см-1; (C=O)=1610 см-1; (SO2)=1325 см-1; (SO2 )=1160 см-1.
ЯМР (DMCO d6): d1,1-1,8 (8Н, м); 2,25-2,9 (6Н, м); 3,2 (2Н, т,
J=6,75 Гц); 3,3 (2Н, с); 7,1 (4Н, с); 7,5-8,5 (6Н, м, из которых 2Н
обмениваются с
CF3COOD); 12,2 (1Н, с, обменивающийся с CF3COOD)
Пример 77. Этиловый эфир
4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусной
кислоты
Смесь из 4,4 г (10 ммоль) хлорида кислоты, полученной в примере 74а, 1,2 г (12 ммоль) триэтиламина в 50
мл абсолютного этанола, перемешивают 16 часов при комнатной температуре,
концентрируют досуха,
извлекают водой и экстрагируют эфиром. Органическую фазу промывают водой, потом раствором NaHCO3, высушивают на сульфате натрия и концентрируют. Остаток очищают
хроматографией на кремниевой
колонке смесью гексан-этилацетат (1:1), потом перекристаллизовывают в смеси гексан-этилацетат и
получают 0,1 г (выход 2,2%) твердого белого вещества. Т.пл. 117- 119oC.
Элементный анализ: C23H28ClNO4S (М=449,993)
Рассчитано,
C 61,39; H 6,27; Cl 7,88; N 3,11; S 7,12.
Получено, C 61, 30; H 6,27; Cl 7,90; N 3,27; S 7,16.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1700 см-1; (SO2)=1320 см-1; (SO2)=1155 см-1 .
ЯМР (CDCl3): d1,25 (3Н, т, J=6,75 Гц); 1,3-1,8 (8Н, м); 2,55 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3COOD); 3,55 (2Н, с); 4,15 (2Н, к, J= 6, 75 Гц); 4,7 (1Н, т, J=6,75 Гц), обменивающийся с CF3COOD); 6,8-7,25 (4Н, м); 7,3-7,5 (2Н, м); 7,6-7,85 (2Н, м).
Пример 78. Этиловый эфир
4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил]
циклопентил]метил]бензолуксусной кислоты
Раствор 2,1 г (5 ммоль) кислоты, полученной в примере 19,
в 210 мл абсолютного этанола, насыщают с
помощью газообразного HCl, потом доводят до
рефлюкса 5 часов. После охлаждения и концентрации досуха, полученный твердый белый извлекают эфиром, промывают
водой, высушивают на сульфате натрия и
концентрируют. После 2 перекристаллизаций в смеси
гексан-этилацетат получают 1,4 г (выход 62,2%) твердого белого вещества, спектральные характеристики которого
идентичны таковым продукта, полученного
в примере 77. Т.пл. 117-119oC.
Пример 79. 4-[[1-[[[(4-Хлорфенил)сульфонил] амино] метил] циклопентил]
метил]бензолацетат-2-(диэтиламино)этила
К суспензии,
состоящей из 4,4 г (10 ммоль) соединения, полученного в
примере 20, в 200 мл изопропанола прибавляют 1,4 г (10,3 ммоль торгового
(2-хлорэтил)-диэтиламина. Доводят до рефлюкса 4 часа. После охлаждения
и фильтрации нерастворенного продукта концентрируют
реакционную среду. Остаток извлекают эфиром и промывают водой, высушивают
на сульфате натрия и концентрируют. Полученное масло
перекристаллизовывают в гексане до получения 0,4 г (выход 7,7%) твердого
белого вещества. Т.пл. 80-81oC.
Элементный
анализ: C27H37ClN2
O4S М=521,116
Рассчитано, C 62,23; H 7,16; Cl 6,80; N 5,38;
S 6,15.
Получено, C 62,08; H 7,32; Cl 6,80; N 5,27; S 5,84.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1690 см-1; (SO2)=1335 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3): d0,95 (6Н, т, J=7,5 Гц); 1,2-1,75 (8Н, м); 2,5 (2Н, с); 2,6 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3 COOD); 2,6 (6Н, м); 3,55 (2Н, с), 4,1 (2Н, т, J=6,0 Гц); 4,75 (1Н, т,7=6,75 Гц, обменивающийся с CF3COOD); 6,8-7,3 (4Н, м); 7,35-7,55 (2Н, м); 7,6-7,9 (2Н, м).
Пример 80.
4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил]
циклопентил]метил]бензолметансульфоновая кислота
а)
4-Хлор-N-[[1-[[4-(хлорметил)фенил]метил]циклопентил]метил]бензолсульфонамид
К смеси,
находящейся в атмосфере азота, содержащей
46,7 г (118,5 ммоль) спирта, полученного в примере 25е, 9,1 г
(115,5 ммоль) пиридина, высушенного на КОН, и 467 мл сухого дихлорметана, прибавляют по каплям
за 3 часа раствор 33 мл (452,4 ммоль)
тионилхлорида и 230 мл сухого дихлорметана. После 2 часов
перемешивания при комнатной температуре реакционную среду медленно выливают в водный раствор NaHCO3 при сильном помешивании.
Экстрагирование осуществляют дихлорметаном, экстракт затем
промывают разбавленным раствором HCl, затем водой и высушивают на сульфате натрия, затем концентрируют.
Остаток очищают хроматографией на
кремниевой колонке, затем перекристаллизацией в смеси
этилацетат-гексан с получением 33,5 г (выход 68,7%) белого порошка. Т.пл. 124-126oC.
ИК (KBr): n (NH)=3270 см-1; (SO2)=1315 см-1; (SO2)=1155 см-1
ЯМР (CDCl3): d1,25-1,8 (8Н, м); 2,6 (2Н, с); 2,7 (2Н, д, J=6,75
Гц, переходящий в синглет с
CF3COOD); 4,5 (3Н, м, из которых 1H
обменивается с CF3COOD); 6,9-7,3 (4Н, м); 7,3-7,55 (2H, м); 7,6-7,9 (2Н, м).
б)
4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолметансульфоновая
кислота
К раствору, содержащему 5 г (12 ммоль) соединения, полученного на предыдущей стадии, 45 мл воды
и
125 мл ацетона, доведенному до рефлюкса, по каплям прибавляют раствор из 1,5 г
сульфита натрия и 45 мл воды. Рефлюкс поддерживают 7 часов после прибавления. После охлаждения реакционную среду
подкисляют с помощью 70 мл 4н. HCl и доводят до рефлюкса 1,25 часа. После охлаждения и
разбавления 100 мл воды удаляют нерастворившееся вещество. Фильтрат концентрируют досуха и извлекают этанолом,
чтобы удалить нерастворенное вещество. Этаноловый фильтрат концентрируют, очищают
хроматографией на кремниевой колонке смесью дихлорметан-метанол (95:5), потом перекристаллизацией в изопропаноле и
получают 1,1 г ( выход 20,0%) белого порошка. Т.пл. 200-230oC.
Элементный анализ: C20H24ClNO5S (М=477,812)
Рассчитано, C 50,27; H
5,53; Cl 7,42; N 2,93; S 13,42.
Получено, C 50,63; H 5,15; Cl 7,17; N 2,73; S 12,98.
ИК (KBr): n (NH)=3280 см-1; (SO2)=1330 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3 +DMCO d6): d1,25-1,75 (8Н, м); 2,3-2,8 (4Н, м); 3,9 (2Н, с); 6,8-7,6 (8Н, м, из которых 2Н обмениваются с CF3COOD); 7,6-7,8 (2Н, м).
Пример 81.
4-Хлор-N-[1-[[[4-[(1Н-тетразол-5-ил)метил]фенил]метил]циклопентил]метил] бензолсульфонамид
а)
4-Хлор-N-[[1-[[4-(цианометил)фенил]
метил]циклопентил] метил]бензолсульфонамид
Смесь,
находящуюся в атмосфере азота, из 8,0 г (19,4 ммоль) соединения, полученного в примере 80а, 1,45 г (29
ммоль) цианида натрия и 50 мл 96o этанола доводят до рефлюкса 3,25 часа. После
концентрации досуха и извлечения водой экстрагируют CH2Cl2. Органическую фазу
промывают водой, насыщенной NaCl, высушивают на
сульфате натрия и концентрируют. Остаток
перекристаллизовывают в смеси этилацетат-гексан до получения 4,2 г (выход 53,8%) мелкого твердого белого
вещества. Т.пл. 128-131oC.
Порцию этого твердого вещества очищают хроматографией на кремниевой колонке в смеси этилацетат-гексан (1: 3) и получают белый порошок. Т.пл. 134,2-134,9oC.
Элементный
анализ: C21H23ClN2O2S (М=402,94)
Рассчитано, C 62,60; H 5,75; Cl 8,80; N 6,95; S 7,96.
Получено, C 62,55; H 5,71; Cl 8,86; N 7,05; S 7,90.
ИК (KBr): n (NH)=3260 см-1; (C=N)=2260 см-1; (SO2)=1320 см-1; (S)2)=1150 см-1.
ЯМР (CDCl3): d1,0-1,9 (8Н, м); 2,6 (2Н, с); 2,7 (2Н, д, J=6,0 Гц, переходящий в синглет с CF3COOD); 3,65 (2Н, с); 5,0 (1Н, т, J=6,0 Гц, обменивающийся с CF3COOD; 7,0 (4Н, с); 7,25-7, 55 (2Н, м); 7,6-7,9 (2Н, м).
б) 4-Хлор-N-[1-[[[4-[(1Н-тетразол-5-ил)метил]фенил]метил]циклопентил]метил]
бензолсульфонамид
Смесь, находящуюся в атмосфере азота, из 4,1 г (10,
1 ммоль) соединения, полученного
на предыдущей стадии, 2,0 г (30,8 ммоль) нитрида натрия, 2,15 г (15,6 ммоль)
хлоргидрата триэтиламина и 100 мл 1-метилпирролидин-2-она, высушенного на сите, нагревают
8 часов при 150oC.
После охлаждения реакционную среду концентрируют досуха, извлекают 2н.
раствором NaOH, промывают эфиром, подкисляют 5н. HCl. Образующийся пастообразный осадок извлекают
этилацетатом, промывают водой,
насыщенной NaCl, и высушивают на сульфате натрия. После
концентрирования полученный остаток очищают хроматографией на кремниевой колонке в смеси дихлорметан-метанол
(98:2). Получают твердое бежевое
вещество, которое после 2 перекристаллизаций в этаноле
дает 1 г (выход 22,2%) белого порошка. Т.пл. 183-185oC.
Элементный анализ: C21H24ClN5O2S + 1/4 H2O (М=450,47)
Рассчитано, C 55,99; H 5,48; Cl 7,87; N 15,55; S 7,11.
Получено, C 56,03; H 5,67; Cl 7,91; N 15,52; S 7,26.
ИК (KBr): n (NH2)=3305 см-1;
(SO2)=1300 см-1; (SO2)=1145 см-1
ЯМР (DMCO d6) d1,
25-1,65 (8Н, м); 2,4-2,
7 (5Н, м, из которых 1H обменивается с CF3COOD); 4,
2 (2Н, с); 7,0 (4Н, с); 7,3-7,95 (5Н, м, из которых 1H обменивается с CF3COOD).
Пример
82.
4-Амино-N-[1-[[[4-(1Н-тетразол-5-ил)метил]фенил]метил]циклопентил]метил]
бензолсульфонамид
Получен во время реакции для получения соединения примера 81б и выделен путем хроматографической
очистки этого соединения. Повторная хроматография на кремниевой колонке в
смеси дихлорметан-метанол (98:2) с последующей перекристаллизацией в этаноле дает 0,1 г (выход 2,3%) белого порошка. Т.пл.
204-205oC.
Элементный анализ: C21
H26N6O2S (М=426,539)
Рассчитано, C 59,13; H 6,14; N 19,70; S 7,52.
Получено, C 59,18; H 6,04; N 19,75; S 7,35.
ИК (KBr): n (NH2)=3460 см-1; (NH2)=3360 см-1; (NH)=3260 см-1; (SO2)=1300 см-1; (SO2)=1145 см-1.
ЯМР (ацетон d6 DMCO d6) d1,3-1,6 (8Н, м); 2,4-2,7 (5Н, м, из которых 1Н обменивается с CF3 COOD); 4,2 (2Н, с); 6,45-6,8 (4Н, м, из которых 2Н обмениваются с CF3COOD); 7,1 (4Н, с); 7,25-7,65 (3Н, из которых 1H обменивается с CF3COOD).
Пример 83.
[[4-[[1-[[[(4-хлорфенил)сульфонил]амино]метил] циклопентил]
метил]фенил]метил]фосфоновая кислота
а) Диэтиловый эфир[[4-[[1-[[[(4-хлорфенил)сульфонил] амино]метил]
циклопентил]метил]фенил]метил]фосфоновой кислоты
Смесь в атмосфере азота из 5
г (12,1 ммоль) соединения, полученного в примере 80а, и 32 мл триэтилфосфита нагревают 5 часов при 140o
C. После охлаждения образовавшийся осадок фильтруют, промывают эфиром и высушивают
на воздухе с получением 4,8 г (выход 77,2%) белого порошка, используемого без дальнейшей очистки. Т.пл.
127-132oC.
ИК (KBr): n (NH)=3140 см-1; (SO2 )=1330 см-1; (SO2)=1165 см-1.
ЯМР (CDCl3): d1, 25 (6Н, т, J=6,75 Гц); 1,3-1,75 (8Н, м,); 2,6 (2Н, с); 2,7 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 3,1 (2Н, д, J=21,75 Гц); 4,0 (4Н, дк, J1=6,75 Гц J2=6, 75 Гц), 5,2 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,8-7,3 (4Н, м); 7,3-7, 6 (2Н, м); 7,65-7,95 (2Н, м).
б) [[4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил]
циклопентил]метил]фенил]метил]фосфоновая кислота
Смесь из 4,8 г (9,3 ммоль) соединения,
полученного на предыдущей стадии, 9 мл 10,7н. HCl и 6 мл уксусной кислоты, доводят до рефлюкса 2 часа.
После охлаждения ее разбавляют 25 мл воды, экстрагируют дихлорметаном. Органическую фазу
высушивают на сульфате натрия, концентрируют и получают пастообразный остаток, очищаемый хроматографией на
колонке со смесью дихлорметан-метанол (9:1). Получают в основном моноэфирное соединение,
которое подвергают обработке в тех же условиях (10,7н. HCl, уксусная кислота) с рефлюксом в течение 10 часов.
После охлаждения и разбавления водой экстракции CH2Cl2, промывания
органической фазы водой, высушивания и концентрирования получают твердое пастообразное вещество, которое
перекристаллизовывают в смеси толуол-гептан-ацетоне, потом в смеси этилацетат-изопропиловый
эфир с получением 1,2 г (выход 28,2%) мелкой белой пудры. Т.пл. 100oC (разл.).
Элементный анализ: C20H25ClNO5PS (М=457,909)
Рассчитано, C 52,46; H 5,50; Cl 7,74; N 3,06; P 6,76; S 7,00.
Получено, C 52,17; H 5,67; Cl 7,
47;
N 3,01; P 6,70; S 7,16
ИК (KBr): n (NH)=3280 см-1; (SO2)=1320 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3): d1, 0-1,7 (8Н, м); 2,25-2,6 (4Н, м); 2,6-3,0 (2Н, м); 5,0-5,5 (1Н, м, обменивающийся с CF3COOD); 6,6-8,0 (10Н, из которых 2Н обмениваются с CF3COOD).
Пример 84.
4-[[1-[[[(4-Метилсульфинилфенил)сульфонил]амино]
метил]циклопентил]метил]бензолуксусная кислота
а) N-[[1-[[4-(2-Гидроксиэтил)фенил] метил] циклопентил] метил]-4-метилтиобензолсульфонамид
Работают как в примере 32г, но исходя из 3 г
(12,9 ммоль) соединения, полученного в примере 32в, 1,6 г (15,8 ммоль) триэтиламина и 2,8 г (12,5 ммоль) хлорида 4-метилтиобензолсульфонила,
(приготовленного по Burton H. et Hu P. F. J. Chem. Soc.
(1948), 604-5) в 60 мл сухого дихлорметана. Получают 4,3 г (выход 80,1%) твердого белого вещества, используемого без дальнейшей очистки. Т.пл.
131-134oC.
Фракцию перекристаллизовывают в этилацетате и получают продукт, плавящийся при Т.пл. 149,5-151,5oC.
ИК (KBr): n (OH)=3480 см-1; (NH)=3180 см-1; (SO2)=1300 см-1; (SO2)=1150 см-1.
ЯМР (CDCl3) d1,25-1,85 (9Н, м из которых 1H обменивается
с D2); 2,5 (3Н, с); 2,55 (2Н, с);
2,7 (2Н, д, J=6,75 Гц, переходящий в синглет в D2); 2,8 (2Н, т, J= 6,75 Гц); 3,8 (2Н, т, J=6,75 Гц); 4,4 (1Н, м, обменивающийся с D2
),
7,0 (4Н, с); 7,1-7,4 (2Н, м); 7,5-7,8
(2Н, м);
б) 4-[[1-[[[(4-метилсульфинилфенид)сульфонил] амино] метил]циклопентил] метил]бензолуксусная кислота
Работают согласно примеру 25ж,
но
исходя из 2,1 г (5 ммоль) соединения,
полученного на предыдущей стадии, растворенного в 70 мл ацетона, и 4,7 мл (10,0 ммоль) реактива Джойса. После очистки хроматографией на кремниевой колонке в
смеси
этилацетат-метанол (4:1) и
перекристаллизации в этилацетате получают 0,1 г (выход 4,2%) твердого белого вещества. Т.пл. 135-136oC.
Элементный анализ: C22
H27NO5S +
1/4 C4H8O2 (этилацетат) (М=471,614)
Рассчитано, C 58,58; H 6,20; N 2,97; S 13,60.
Получено, C 58,53; H 6,25; N 2,73; S 13,63.
ИК (KBr): n (NH)=3150 см-1; (C=O)=1710 см-1; (SO2)=1325 (SO2)=1165 см-1.
ЯМР (CDCl3 + DMCO d6 ): d1,25-1,6 (8Н, м); 2,45-2,70 (5Н, м, из которых 1H обменивается с CF3COOD); 2,75 (3Н, с); 3,5 (2Н, с); 7,0 (4Н, с); 7,4-8,0 (5Н, м, из которых 1H обменивается с CF3COOD).
Пример 85. 4-[[1-[[[(4-Ацетамидофенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота
а) 1-[[4-[2-[(3,4,5,
6-Тетрагидро-2Н-пиран-2-ил)окси] этил]
фенил]метил]
циклопентанкарбонитрил
К смеси из 46,1 г (201 ммоль) спирта, полученного в примере 26б, 0,1 г паратолуолсульфоновой кислоты и 205 мл
сухого эфира, находящейся при 10oC,
прибавляют 21,2 г (246,1 ммоль) 3,4-дигидро-2Н-пирана. Затем перемешивают 16 часов при комнатной температуре. Реакционную среду после этого
концентрируют в вакууме для получения коричневого масла
(выход количественный), используемого без дальнейшей очистки.
ИК (пленка): n(C≡N)2240 см-1.
б) 1-[[4-[2-[(3,4,5,6-Тетрагидро-2H-пиран-2-ил)окси]
этил] фенил]метил] циклопентанметанамин
К суспензии, находящейся в атмосфере азота и при комнатной температуре, 17,1 г (450,6 ммоль)
LiAlH4 в 300 мл сухого тетрагидрофурана
прибавляют по каплям 64,25 г (205 ммоль) соединения, полученного на предыдущей стадии, растворенного в 400 мл сухого тетрагидрофурана. Доводят среду
до рефлюкса в течение 4 часов, затем охлаждают до
0oC и прибавляют медленно 85,5 мл воды, затем 100 мл эфира. Образовавшийся осадок фильтруют на сульфате натрия и промывают эфиром. После
концентрирования фильтрата получают 66,8 г (выход
количественный) желтого масла, используемого без дальнейшей очистки.
ИК (пленка): ν (NH2)=3390 см-1.
ЯМР (CDCl3): d1,15 (2Н, с, обменивающиеся с CF3COOD); 1,3-2,25 (14Н, м); 2,4 (2Н, с); 2,6 (2Н, с); 2,8 (2Н, т, J=6,75 Гц); 3,35-4,05 (4Н, м); 4,55 (1Н, м); 7,0 (4Н, с).
в)
4-Ацетамид-N-[[1-[[4-[2-[(3,4,5,6-тетрагидро-2Н-пиран-2-ил)окси]этил] фенил]метил]циклопентил] метил] бензолсульфонамид
Работают как описано в примере 1в, но исходя
из 10 г (31,5 ммоль)
соединения, полученного на предыдущей стадии б), в 190 мл дихлорметана, 3,75 г (37,1 ммоль) триэтиламина и 7,25 г (31,0 ммоль) хлорида 4-ацетамидобензолсульфонила в 110 мл N,
N-диметилформамида.
После
16 часов перемешивания при комнатной температуре и обычной обработки очищают хроматографией на кремниевой колонке смесью дихлорметан-метанол (19:1) с получением 10,7 г (
выход 66,0%) бежевого
масла,
которое кристаллизуется. Т.пл. 100oC.
ИК (KBr): n (NH)=3310 см-1; (NH)=3190 см-1; (SO2)=1660 см-1; (SO2 )=1310 см-1; (SO2)=115 см-1.
ЯМР (CDCl3): d1,2-1,8 (14Н, м); 2,2 (3Н, с); 2,6 (2Н, с); 2,5-2,8 (4Н, м); 3,3-4,0 (4Н, м); 4, 6 (1Н, м); 5,1 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,0 (4Н, с); 7,7 (4Н, с); 7,8 (1Н, с, обменивающийся с CF3COOD).
г)
4-Ацетамид-N-[[1-[[4-(2-гидроксизтил)фенил)метил]циклопентил]
метил] бензолсульфонамид
Смесь из 6,3 г (12,2 ммоль) соединения, полученного на предыдущей стадии, 60 мл метанола и 0,7 г смолы
Амберлит 1R-120 (плюс), перемешивают 16 часов при комнатной
температуре. После фильтрации и концентрации получают масло, которое после перетирания в гексане дает 3,6 г (выход 69,2%) твердой пасты.
Т.пл. 177-180oC.
ИК (KBr); n (OH)=3560 см-1; (NH)=3270 см-1; (C=O)=1670 см-1; (SO2)=1310 см-1; (SO2 )=1150см-1.
д)
4-[[1-[[[(4-Ацетамидофенил)сульфонил]амино]метил] циклопентил]метил] бензолуксусная кислота
Работают как в примере 25ж, но исходя из 3,6 г (8,4
ммоль) соединения, полученного на предыдущей
стадии, в 150 мл ацетона и 8,8 мл (17,6 ммоль) реактива Джойса. После очистки хроматографией на кремниевой колонке в смеси дихлорметан-метанол (9:1) и
перекристаллизации в смеси ацетон-гексан получают
0,5 г (выход 13,5%) мелкого твердого белого продукта. Т.пл. 174-176oC.
Элементный анализ: C23H28
N2O5S (М=444,546)
Рассчитано, C 62,14; H 6,35; N 6,30; S 7,21.
Получено, C 61,91; H 6,32; N 6,63; S 7,32.
ИК (KBr): n (NH)=3340 см-1; (NH)=3220 см-1; (C=O)=1690 см-1; (C=O)=1660 см-1; (SO2)=1310 см-1; (SO2)=1145 см-1.
ЯМР (ацетон d6 + DMCO d6): d1,2-1,7 (8Н, м); 2,1 (3Н, с); 2,65 (2Н, с); 2,65 (2Н, д, J=6 Гц, переходящий в синглет в CF3COOD); 3,5 (2Н, с); 6,7 (1Н, т, J=6 Гц, обменивающийся с CF3COOD): 7,1 (4Н, с); 7,8 (4Н, с); 9, 8 (1Н, с, широкий, обменивающийся с CF3COOD); 11,55 (1Н, с, широкий, обменивающийся с CF3COOD).
Этот же продукт можно получить и работая согласно примеру 25ж из 10,7 г (20,8 ммоль) продукта, полученного в примере 85в, в 350 мл ацетона и 26 мл (52 ммоль) реактива Джойса. После очистки хроматографией на кремниевой колонке в смеси дихлорметан-метанол (9:1), получают 3,7 г (выход 40,2%) твердого бледно-желтого вещества. Т.пл. 172-173oC.
Пример 86.
4-[[1-[[[(4-Аминофенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная
кислота
Смесь из 3,7 г (8,3 ммоль) соединения, полученного на предыдущей стадии, 11,2 мл (112 ммоль) 10н.
водного гидроксида натрия и 50 мл воды, доводят до рефлюкса 2 часа. После охлаждения
и разбавления 50 мл воды фильтруют нерастворившееся вещество и промывают 100 мл эфира. Водную фазу подкисляют
разбавленной HCl до pH 6 и получают осадок, после перекристаллизации которого в этаноле,
этанол-гексане, потом в этаноле получают 0,3 г (выход 9,0%) твердого бежевого вещества. Т.пл. 175-176oC.
Элементный анализ: C21H26N2O4S (М=402,509)
Рассчитано, C 62,66; H 6,51; N 6,96; S 7,97.
Получено, C 62, 43; H 6,76; N 7,26; S 8,05.
ИК (KBr): n (NH2)= 3450 см-1 и 3370 см-1; (NH)=3260 см-1; (C=O)=1685 см-1; (SO2 )=1300 см-1; (SO2)=1145 см-1.
ЯМР (DMCO d6): d1,2-1,7 (8Н, м); 2,35-2,7 (4Н, м); 3,0-3,5 (1Н, м, обменивающийся с CF3COOD); 3, 45 (2Н, с); 5,8 (1Н, с, широкий, обменивающийся с CF3COOD); 6,45-6,7 (2Н, м); 6,8-7,25 (6, м, из которых 2Н обменивается с CF3COOD); 7,3-7,55 (2Н, м).
Пример
87.
4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил] циклогексил]метил]бензолуксусная кислота
а)
1-[[4-(2-гидроксиэтил)фенил]метил] циклогексанкарбонитрил
К смеси, находящейся в
атмосфере
азота, из 5,6 г (54,9 ммоль) диизопропиламина и 92 мл сухого тетрагидрофурана, охлажденной до
-40oC, по каплям прибавляют 34,2 мл (54,7 ммоль) 1,6М раствора н-бутиллития в
гексане, потом 8,
2 г 1,3-диметилимидазолидин-2-она. После этого охлаждают до -78oC и перемешивают
1/4 часа перед прибавлением 5,45 г (50 ммоль) торгового циклогексанкарбонитрила,
растворенного в 82 мл
сухого тетрагидрофурана. После 1 часа перемешивания при -78oC прибавляют 14,3 г (50
ммоль) соединения, полученного в примере 26а. В течение 3 часов выдерживают среду
при -78oC,
затем температуру поднимают и перемешивают 19 часов при комнатной температуре. Прибавляют воду,
подкисляют HCl и перемешивают еще 1 час, затем разбавляют водой и экстрагируют
реакционную среду
эфиром. Органическую фазу промывают водой, высушивают на сульфате натрия и концентрируют. Полученную
жидкость очищают дистилляцией с получением 7,5 г (выход 61,6%) желтой жидкости.
Т. кип.0,
5 130-180oC.
ИК (пленка): n (OH)=3440 см-1; (CN)=2230 см-1.
ЯМР (CDCl3): d0,9-2,1 (10Н, м); 1,6 (1Н, с, обменивающийся с CF3COOD); 2,75 (2Н, с); 2,8 (2Н, т, J=6,75 Гц); 3,8 (2Н, т, J=6,75 Гц); 7,1 (4Н, с).
б) 4[[1-(Аминометил)циклогексил]метил] бензолэтанол
Работают
согласно примеру 32в, но исходя из 2,5 г (67,8 ммоль) LiAlH4 в 50 мл сухого тетрагидрофурана и 7,5 г (30,8
ммоль) продукта, полученного на предыдущей стадии, растворенного в 60
мл сухого
тетрагидрофурана. После очистки хроматографией на кремниевой колонке в метаноле получают 5,1 г (выход 67,1%) желтого
масла.
ИК (пленка): n (NH2)=3375 см-1; и 3300 см-1; (ОН)=3300 см-1.
ЯМР (CDCl3): d1,0-1,75 (13Н, м, из которых 3H обмениваются с D2O); 2,4 (2H, с); 2,5 (2Н, с); 2,8 (2Н, т, J=6,75 Гц); 3,8 (2Н, т, J=6,75 Гц); 7,0 (4Н, с).
в) 4-Хлор-N-[[1-[[4-(2-гидроксиэтил)фенил] метил]
циклогексил] метил] бензолсульфонамид
Работают согласно примеру
32г, но исходя из
5,1 г (20,6 ммоль) соединения, полученного на предыдущей стадии б), в 71 мл сухого дихлорметана, 2,5 г (24,7
ммоль) триэтиламина и 4,2 г (19,7 ммоль) хлорида
4-хлорбензолсульфонила. Получают 6,3 г
(выход 75,9%) твердого белого вещества, используемого без дальнейшей очистки. Т.пл. 178-182oC.
Фракцию очищают перекристаллизацией в смеси этанол-ДМФ, потом в этаноле, что дает твердый белый продукт. Т.пл. 179-182oC.
Элементный анализ: C22H28ClNO3S (М=421,983)
Рассчитано, C 62,62; H 6,69; Cl 8,40; N
3,32; S 7,60.
Получено, C 62,71; H 6,59; Cl 8,39; N 3,22; S 7,40.
ИК (KBr): n (OH)=3515 см-1; (NH)=3220 см-1; (SO2)=1300 см-1; (SO2)=1145 см-1.
ЯМР (DMCO d6): d0,75-1,6 (10Н, м); 2,3-2, 8 (6Н, м); 3,3 (1Н, с, обменивающийся с CF3COOD); 3,6 (2Н, т, J=6,75 Гц); 4,5 (1H, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,9 (4Н, с); 7,3-8,0 (4Н, м).
г)
4-[[1-[[[(4-Хлорфенил)сульфонил]
амино]метил] циклогексил]метил]бензолуксусная
кислота
Работают согласно примеру 25ж, но исходя из 5,9 г (14,0 ммоль) соединения, полученного на предыдущей
стадии, растворенного в 190 мл
ацетона, и 12,8 мл (28 ммоль) реактива Джойса.
После перекристаллизации в смеси этилацетат-этанол, получают 1,5 г (выход 24,6%) твердого белого вещества. Т.пл.
191-194oC.
Элементный анализ: C22H26
ClNO4S (М=435,966)
Рассчитано, C 60,61; H 6,01; Cl 8,13; N 3,21; S 7,35.
Получено, C 60,63; H 6,17; Cl 8,21; N 3, 31; S 7,55.
ИК (KBr): n (NH)=3270 см-1; (C=O)=1700 см-1; (SO2)=1310 см-1; (SO2)=1155 см-1.
ЯМР (DMCO d6): d0,8-1,7 (10Н, м); 2, 3-2,75 (4Н, м); 3,5 (2Н, с); 7,0 (4Н, с); 7,3-8,0 (5Н, м, из которых 1Н обменивается с CF3COOD); 12,1 (1Н, с, обменивающийся с CF3 COOD).
Пример 88.
4-[[4-[[[(4-хлорфенил)сульфонил] амино]метил] тетрагидропиран-4-ил]метил]бензолуксусная кислота
a)
4-[[4-(2-Гидроксиэтил)фенил]метил]тетрагидропиран-4-карбонитрил
Работают согласно
примеру 87а, но исходя из 6,3 г (62,2 ммоль) диизопропиламина в 104 мл тетрагидрофурана, 38,7 мл (62,0
ммоль)
1,614 раствора н-бутиллития в гексане, 9,3 г 1,3-диметилимидазолидин-2-она, 8,8 г ( 56,7
ммоль) 2,3,5,6-тетрагидро-4Н-пиран-4-карбонитрила (приготовленного по Gibson C. S. et Johnson J.D.A.
J. Chem.
Soc. (1930) 2525-30) в 93 мл тетрагидрофурана и 17,7 г (62 ммоль) соединения, полученного
в примере 26а. После очистки хроматографией на кремниевой колонке в смеси гексан-этилацетат (1:1)
получают 10,
5 г (выход 75,5%) масла.
ИК (пленка): n (OH)=3400 см-1; (C=N)=2220 см-1.
ЯМР (CDCl3): d1,55 (1Н, с, обменивающийся с D2O); 1,6-1,9 (4Н, м); 2,8 (2Н, с); 2,8 (2Н, т, J=6,75 Гц); 3,4-4,2 (6Н, м); 7,1 (4Н, с).
б) 4-[[4-(Аминометил)тетрагидропиран-4-ил]метил]бензолэтанол
Работают
согласно примеру 32в,
но исходя из 3,45 г (94,3 ммоль) LiAlH4 в 80 мл сухого
тетрагидрофурана и 10,5 г (42,8 ммоль) соединения, полученного на предыдущей стадии, растворенного в 80 мл
сухого тетрагидрофурана.
Получают 7,1 г (выход 66,3%) масла, используемого без дальнейшей
очистки.
ИК (пленка): n (HN2)=3370 и 3290 см-1; (ОН)=3360 см-1.
ЯМР (CDCl3): d1,0-2,0 (4Н, м); 1,65 (3Н, с, обменивающиеся с D2O); 2,5 (2Н, с); 2,6 (2Н, с); 2,8 (2Н, т, J=6,75 Гц); 3,45-4,0 (6Н, м); 7,0 (4Н, с).
в)
4-Хлор-N-[[4-[[4-(2-гидроксиэтил)фенил]метил]тетрагидропиран-4-ил]метил]бензолсульфонамид
Работают согласно примеру 32г, но исходя из 7,1 г (28,4 ммоль) соединения,
полученного на предыдущей
стадии, в 100 мл сухого дихлорметана, 3,4 г (33,9 ммоль) триэтиламина и 5,75 г (27,2 ммоль) хлорида 4-хлорбензолсульфонила. Получают 5,4 г (выход 46,8%) твердого белого
вещества, используемого без
дальнейшей очистки. Т.пл. 178-180oC.
Одну фракцию очищают перекристаллизацией в смеси этилацетат-этанол, затем в этилацетате и получают твердое белое вещество. Т.пл. 180-181oC.
Элементный анализ: C21H26ClNO4S (М=423,955)
Рассчитано, C 59,49; H 6,18; Cl 8,36; N 3,
30; S 7,56
Получено, C
59,56; H 6,22; Cl 8,50; N 3,26; S 7,29.
ИК (KBr): n (ОН)3540 см-1 (NH)=3260 см-1 (SO2)1305 см-1 (SO2)=1145 см-1.
ЯМР (DMCO d6д): d1,0-1,5 (4Н, м); 2,3-2,85 (6Н, м); 3,25-3,8 (6Н, м); 4,0 (1Н, с, широкий, обменивающийся с CF3COOD); 6,9 (4Н, с); 7,35-7,95 (5Н, м, из которых 1H обменивается с CF3COOD).
г) 4-[[4-[[[(4-Хлорфенил)сульфонил] амино] метил] тетрагидропиран-4-ил] метил]бензолуксусная кислота
Работают как в примере 25ж, но
исходя
из 4,9 г (11,5 ммоль) соединения, полученного на предыдущей стадии, растворенного в 150 мл ацетона и 10,5 мл (22,9 ммоль) реактива Джойса. После
перекристаллизации в этилацетате, получают 0,5
г (выход
9,9%) твердого белого вещества. Т.пл. 179-180oC. Элементный анализ: C21H24ClNO5S (М=437,938)
Рассчитано, C 57,60; H 5,52; Cl 8,10; N З,20;
S 7,
32.
Получено, C 57,88; H 5,41; Cl 8,24; N 3,40; S 7,06.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1685 см-1; (SO2)=1310 см-1; (SO2)=1155 см-1.
ЯМР (DMCO d6): d1,1-1,5 (4Н, м); 2,45-2,8 (4Н, м); 3,3 (1Н, обменивающийся с CF3COOD); 3,4-3,75 (6Н, м); 7,0 (4Н, с); 7, 5-8,0 (4Н, м); 12,1 (1Н, с, широкий, обменивающийся с CF3COOD).
Пример 89.
4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил]-3,3-диметилциклобутил]метил]бензолуксусная
кислота
а) 3,3-Диметил-1-[[4-(2-гидроксизтил)фенил]метил] циклобутанкарбонитрил
Работают
согласно примеру 72а, но исходя из 3,2 г (32 ммоль) диизопропиламина в 34 мл сухого
тетрагидрофурана, 20 мл (38,4 ммоль) 1,614 раствора н-бутиллития в гексане, 2,9 г (26,5 ммоль) 3,
3-диметилциклобутанкарбонитрила (приготовленного по Brannock K.C. et coll. J. Org. Chem. (1964) 29,
801-12) в 30 мл сухого тетрагидрофурана и 11,4 г (39,7 ммоль) соединения, полученного в примере
26а в 10 мл сухого тетрагидрофурана. После перекристаллизации в смеси гексан-этилацетат получают 5,0 г
(выход 77,5%) твердого вещества. Т. пл. 51-54oC.
ИК (KBr): n (ОН)=3390 см-1; (C=N)=2250 см-1.
ЯМР (CDCl3): d 1,05 (3Н, с): 1,2 (3Н, с); 1,7 (1Н, с, обменивающийся с D2O); 2,1 (4Н, м); 2,8 (4Н, м); 3, 8 (2Н, т, J=6 Гц); 6,9-7,4 (4Н, м).
б) 4-[[1-(Аминометил)-3,
3-диметилциклобутил]метил]бензолэтанол
Работают согласно примеру 25л, но исходя из 5,5 г (145 ммоль) LiAlH4 и 28,1 г (97 ммоль) соединения, полученного на предыдущей стадии, в 300
мл сухого эфира. Получают 16 г (выход 66,7%) светло-желтого масла, используемого без дальнейшей очистки.
ИК (пленка): n (ОН)=3300 см-1; (NH2)=3370 и 3280 см-1.
ЯМР (CDCl3): d1,0 (3Н, с); 1,05 (3Н, с); 1,5-1,85 (7Н, м, из которых 3Н обменивается с D2O); 2,6 (2Н, т, J=6,0 Гц); 2,6- 3,0 (4H, м); 3,8 (2Н, т, J= 6, 0 Гц); 6,85-7,4 (4Н, м).
в) 4-Хлор-N-[[3,
3-диметил-1-[[4-(2-гидроксиэтил)фенил]метил]циклобутил] метил]бензолсульфонамид
Работают согласно примеру 32г, но исходя из 8,0 г
(32,
3 ммоль) соединения, полученного на предыдущей стадии,
3,9 г (38,8 ммоль) триэтиламина, 6,7 г (31,6 ммоль) хлорида 4-хлорбензолсульфонила в 150 мл сухого дихлорметана. После очистки
хроматографией на
колонке из оксида кремния в смеси гексан-этилацетат
(1: 1), получают 3,8 г (выход 27,8%) твердого белого продукта. Т. пл. 90-92oC.
ИК (KBr): n (OH)=3470 см-1; (HN)=3160 см-1; (SO2)=1320 см-1; (SO2)=1145 см-1.
ЯМР (CDCl3): d1,0 (6Н, с); 1,5-1,85 (5Н, м, из которых 1H обменивается с CF3COOD); 2,7 (2Н, с); 2,8 (2Н, т, J=6 Гц); 2,85 (2Н, д, J=5 Гц); 3,8 (2Н, т, J= 6 Гц); 4,65 (1Н, т, J=6 Гц, обменивающийся с CF3COOD); 7,0 (4Н, с); 7, 3-8,0 (4H, м).
г) 4-[[1-[[[(4-Хлорфенил)сульфонил]
амино]метил]-3,3-диметилциклобутил] метил]бензолуксусная кислота
Работают согласно примеру 25ж, но исходя из 3,5 г (8,3
ммоль)
соединения, полученного на предыдущей стадии, растворенного в
83 мл ацетона, и 8,3 мл (16,6 ммоль) реактива Джойса. После перекристаллизации в толуоле получают 1,3 г (выход 35,9%) твердого
белого
вещества. Т.пл. 140-142oC.
Элементный анализ: C22H26ClNO4S (М=435,96)
Рассчитано, C 60,61; H 6,01; Cl 8,13; N 3,21; S 7,
35.
Получено, C 60,71; H 6,21; Cl 8,20; N З,18; S 7,30.
ИК (KBr): n (NH)=3270 см-1; (C=O)=1695 см-1; (SO2)=1325 см-1; (SO2 )=1160 см-1.
ЯМР (DMCO d6): d0,9 (3Н, с); 1,0 (3Н, с); 1,6 (4Н, с); 2,55-2,8 (4Н, м); 3,45 (2Н, с); 7,0 (4Н, с); 7,35-7,9 (5Н, м, из которых 1H обменивается с CF3COOD); 12,1 (1Н, с.широкий, обменивающийся с CF3COOD).
Пример 90. 4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил]-2,2,3,
3-тетраметилциклоприпил]метил]
бензолуксусная кислота
а)
1[[4-(2-Гидроксиэтил)фенил] метил]-2,2,3,3-тетраметилциклопропанкарбонитрил
Работают согласно примеру 87а, но исходя из 19,7
г (195 ммоль) диизопропиламина,
122 мл (195 ммоль) 1,6М раствора
н-бутиллития в гексане, 45 мл 1,3-диметилимидазолидин-2-она, 21,8 г 2,2,3,3-тетраметилциклопропанкарбонитрила, (приготовленного по
патенту FR 2,479,192), 51,9 г (180,5
ммоль) соединения, полученного
в примере 26а, в 295 мл тетрагидрофурана. После дистилляции получают 20 г (выход 44,0%) густого желтого масла. Т.кип.0,8
185-205oC.
ИК (пленка): n (OH)=3420 см-1; (C=N)=2230 см-1.
ЯМР (CDCl3): d 1,1 (6Н, с); 1,3 (6Н, с); 2,1 (1Н, с, обменивающийся с CF3COOD); 2,75 (2Н, т, J=6,75 Гц); 2,8 (2Н, с); 3,75 (2H, т, J=6,75 Гц); 7,1 (4Н, с).
б) 4-[[1-(Аминометил)-2,2,3,
3-тетраметилциклопропил]метил]бензолэтанол
Работают согласно примеру 13а, но
исходя из 30 мл (101
ммоль) LiAlH4 в виде торгового 13%-ного раствора в смеси тетрагидрофуран-толуол,
20 г (77,7 ммоль) нитрила, полученного на предыдущей стадии, и 130 мл сухого
тетрагидрофурана. После
дистилляции получают 13,2 г ( выход 65,0%) очень густой оранжевой жидкости, которая
кристаллизуется. Т.кип.0,3 190-220oC. Т.пл. 103-106oC
(этилацетат)
ИК
(KBr): n (ОН)=3380 см-1; (NH2)=3380 см-1.
ЯМР (CDCl3): d 0,75-1,4 (12H, м); 1,7 (3Н, с, обменивающиеся с CF3COOD); 2,5-3,2 (6Н, м); 3,75 (2Н, т, J=6,75 Гц); 6,75-7,3 (4Н, м).
в)
4-Хлор-N-[[1-[[4-(2-гидроксиэтил)фенил] метил] -2,2,3,3-тетраметилциклопропил]метил] бензолсульфонамид
Работают согласно
примеру 32г, но исходя из 3,8 г (14,5 ммоль) соединения, полученного
на предыдущей стадии, 2,4 мл (17,4 ммоль) триэтиламина и 3 г (14,25 ммоль) хлорида 4-хлорбензолсульфонила в
65 мл сухого
дихлорметана. После перекристаллизации в этилацетате получают 4,2 г (выход 66,
7%) мелкого твердого белого вещества. Т.пл. 158-160oC.
Одну фракцию очищают фильтрацией на кремниевой колонке в смеси гексан-этилацетат, потом перекристаллизацией в той же смеси. Получают твердое белое вещество. Т.пл. 162-163oC.
Элементный анализ:
C23
H30ClNO3S (М=436,01)
Рассчитано, C 63,36; H 6,94;
Cl 8,13; N 3,2; S 7,35.
Получено, C 63,49; H 6,88; Cl 8,28; N 3,19; S 7,16.
ИК (KBr): n (NH)=3440 см-1; (ОН)=3140 см-1; (SO2)=1310 см-1; (SO2)=1145 см-1.
ЯМР (ацетон d6): d0,85-1,2 (12Н, м); 2,55-3,0 (6Н, м); 3,6 (1Н, с, обменивающийся с CF3COOD); 3,7 (2Н, т, J=6,75 Гц); 5,95 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 6,75-7,1 (4Н, м); 7,25-7, 75 (4Н, м).
г) 4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил]-2,2,3,
З-тетраметилциклопропил]метил] бензолуксусная кислота
Работают согласно примеру 25ж, но исходя из 3,5 г (8
ммоль)
соединения, полученного на предыдущей стадии, 7,6 мл (16 ммоль) реактива
Джойса в 80 мл ацетона. После очистки хроматографией на кремниевой колонке смесью толуол-этилацетат (от 4:0 до 4:1) с
последующей перекристаллизацией в толуоле получают 1,8 г (выход 50,0%) твердого
белого вещества. Т.пл. 176-178oC.
Элементный анализ: C23H28ClNO4S (М=449,993)
Рассчитано, C 61,39; H 6,27; Cl 7,88; N 3,11; S 7,
12.
Получено, C 61,68; H 6,00; Cl 8,02; N 3,28; S 7,05.
ИК (KBr): n (NH)=3290 см-1; (C=O)=1700 см-1; (SO2)=1340 см-1; (SO2)=1160 см-1.
ЯМР (ацетон d6): d0,9-1,25 (12Н, м),2,8 (2Н, с) 2,9 (2Н, g, J=5,25 Гц превращается в синглет с CF3COOD); 3,55 (2Н,с)6,0 (1Н, J=5,25 Гц; заменяем с CF3COOD) 6,75-7,3 (4H, м); 7,3-7,9 (4H, м) 10,5 (1H, с широкий, заменяем с CF3 COOD).
Пример 91.
4-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил]-4-оксоциклогексил]метил]бензолуксусная кислота
а) 4-[[(1,1-Диметилэтил)дифенилсилил]окси]
циклогексанкарбонитрил
К раствору,
находящемуся при 10oC в атмосфере азота, 11 г по (87,8 ммоль) 4-гидроксициклогексанкарбонитрила (приготовленного по Praefcke K. et Schmidt D.
Z.
Naturforsch (1980) 35b, 1451-4) в 50 мл N,
N-диметилформамида прибавляют по каплям 26,6 г (96,8 ммоль) хлорида 1,1-диметилэтилдифенилсилила, потом порциями 13,1 г (190 ммоль) имидазола. Оставляют
на 3
дня при комнатной температуре и
перемешивании, затем выливают реакционную среду в воду, насыщенную NaCl. Экстрагируют смесью гексан-эфир (1:1). Органическую фазу промывают 1н. раствором HCl,
потом
водой, насыщенной NaCl, потом
высушивают и концентрируют. Остаток очищают хроматографией на кремниевой колонке в дихлорметане и получают 26,5 г (выход 85,9%) густого бесцветного масла.
ИК (пленка): n (C=N)=2240 см-1.
ЯМР (CDCl3) d0,7 (9Н, с); 0,9-1,90 (8Н, м); 2,1 (1Н, м); 3,35 (1Н, м); 6,8-7,45 (10Н, м).
б) 4-[[(1,
1-Диметилэтил)дифенилсилил]окси]-1-[[4-(2-гидроксизтил)фенил] метил] циклогексанкарбонитрил
Работают согласно примеру 87а, но исходя из 17,5 г (173 ммоль) диизопропиламина, 88,5 мл (145
ммоль) 1,614 раствора н-бутиллития в гексане, 20,6 г 1,3-диметилимидазолидин-2-она, 42,4 г (120 ммоль) соединения, полученного на предыдущей стадии, в 38 г (132 ммоль) галогенида, полученного в
примере 26а, в 180 мл сухого тетрагидрофурана. После очистки на кремниевой колонке в смеси гексан-этилацетат (от 7:1 до 4:1) получают 12,7 г (выход 22,4%) твердого белого пастообразного вещества.
ИК (KBr): n (OH)=3400 см-1; (C=N)=2240 см-1.
ЯМР (CDCl3): d1,0 (9Н, с); 1,5 (1Н, с, обменивающийся с CF3COOD); 1,5-2,0 (8Н,
м); 2,7 (2Н, с); 2,8 (2Н, т, J=6,75 Гц); 3,6 (1Н, м); 3,8 (2H, т, J=6,75 Гц); 7,0 (4Н, с); 7,2-7,75 (10Н, м)
в) 4-[[1-(Аминометил)-4-гидроксициклогексил]метил]бензолэтанол
Работают
согласно примеру 32в, но при комнатной температуре, исходя из 1 г (26,3 ммоль) LiAlH4, из 5 г (10,6 ммоль) соединения, полученного на предыдущей стадии, в 60 мл сухого тетрагидрофурана.
После обработки водной HCl и обычной обработки получают 2,3 г ( выход 82,1%) густого масла, которое медленно кристаллизуется.
ИК (пленка) n (ОН)=3350 см-1.
ЯМР (DMCO d6): d0,9-1,8 (10Н, м, из которых 2Н обменивается с CF3COOD); 2,25-2,9 (6Н, м); 3,05-3,7 (3Н, м, из которых 2Н обмениваются с CF3COOD); 3,55 (2Н, т, J=6,75 Гц); 7,0 (4Н, с).
г) 4-Хлор-N-[[4-гидрокси-1-[[4-(2-гидроксиэтил)фенил]метил]циклогексил] метил]бензолсульфонамид
Работают согласно примеру 32г, но исходя из 1,8
г (6,8
ммоль) соединения, полученного на предыдущей стадии, 0,9 г (8,9 ммоль) триэтиламина, 1,3 г (6,3 ммоль) хлорида 4-хлорбензолсульфонила в 100 мл сухого дихлорметана и 20 мл эфира. Получают 1,1
г (выход
36,7% ) белого порошка, используемого без дальнейшей очистки. Т.пл. 171-174oC.
ИК (KBr): n (NH)=3500 см-1; (ОН)=3400 см-1; (SО2 )=1310 см-1; (SO2)=1140 см-1.
ЯМР (ацетон d6 + DMCO d6): d1,0-1,9 (8Н, м); 2,6-2,9 (6Н, м); 3,25-3,8 (6Н, из которых 3Н обмениваются с CF3СООН); 7,0 (4Н, с); 7,4-8,0 (4Н, м).
д) 4-[[1-[[[(4-Xлорфенил)сульфонил]амино]метил]-4-оксоциклогексил]метил] бензолуксусная кислота
Работают
согласно примеру
25ж, но исходя из 1,1 г (2,5 ммоль) соединения, полученного на предыдущей стадии, из 4,7 мл (5 ммоль) реактива Джойса в 30 мл ацетона. После хроматографии на кремниевой колонке в
смеси
дихлорметан-метанол (95: 5) получают 0,3 г (выход 26,5%) мелкой белой пудры. Т.пл. 205-210oC (разл.)
Элементный анализ: C22H24ClNO5S (М=449,
949)
Рассчитано, C 58,73; H 5,38; Cl 7,88; N 3,11; S 7,13.
Получено, C 58,60; H 5,71; Cl 8,09; N 2,98; S 6,93.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1680 см-1; (C=O)=1690 см-1; (SO2)=1310 см-1; (SO2)=1160 см-1.
ЯМР (DMCO d6): d1,5-1,9 (4Н, м); 2,
1-2,45 (4Н, м);
2,6- 2,95 (4Н, м); 3,3 (1Н, м, обменивающийся с CF3COOD); 3,5 (2Н, с); 7,0 (4Н, с); 7,5-8,0 (4Н, м); 12,1 (1Н, с,широкий, обменивающийся с CF3COOD)
Пример 92.
2-[[1-[[[(4-Xлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота
а) 2-(Бромметил)бензолуксусная кислота
Раствор из 10 г (66,6 ммоль) торговой
2-метилбензолуксусной кислоты в 100 мл четыреххлористого углерода доводят до рефлюкса под УФ-лампой. За 2 часа по каплям приливают раствор, состоящий из 13,8 г (86,6 ммоль) брома и 33 мл
четыреххлористого углерода. Рефлюкс поддерживают в течение 1 часа после окончания прибавления, концентрируют досуха. Остаток перекристаллизовывают в четыреххлористом углероде, потом в смеси
гексан/этилацетат и получают 5 г (выход 32,9%) твердого белого вещества. Т.пл. 129-132oC.
ИК (KBr): n (C=O)=1675 см-1.
ЯМР (CDCl3 + DMCO d6): d3,7 (2Н, с); 4,55 (2Н, с); 7,2 (4Н, с); 10,75 (1Н, с, широкий, обменивающийся с CF3COOD).
б) 2-(Бромметил)бензолэтанол
Работают согласно
примеру 25а, но исходя из 1,8 г (24 ммоль) комплекса гидрида бора-диметилсульфида и 5 г (21,8 ммоль) соединения, полученного на предыдущей стадии, в 50 мл тетрагидрофурана. Получают 3,5 г (выход 74,
6%) бледно-желтого масла, используемого без дальнейшей очистки.
ИК (пленка): n (OH)=3350 см-1.
ЯМР (CDCl3): d1,2 (2Н, т, J=6,75 Гц); 3,4 (1Н, с, обменивающийся с D2O); 3,85 (2Н, т, J=6,75 Гц); 4,5 (2Н, с); 7,2 (4Н, с).
в) 1-[(Бромметил)-2-[2-(триметилсилилокси)этил]бензол
Работают согласно примеру 26а,
но
исходя из 47,3 г (220 ммоль) соединения, полученного на предыдущей стадии 35,5 г (220 ммоль) 1,1,1,3,3,3-гексаметилдисилазана, 22,25 г (220 ммоль) триэтиламина и 23,9 г (220 ммоль) хлорида
триметилсилила в 475 мл тетрагидрофурана. После дистилляции получают 42,5 г (выход 67,3%) бесцветной жидкости. Т.кип.0,7 98-102oC.
ЯМР (CDCl3): d0,0 (9Н, с); 2,9 (2Н, т, J=6,75 Гц); 3,8 (2Н, т, J=6,75 Гц); 4,5 (2Н, с); 6,9-7,6 (4Н, м).
г) 1-[[2-(2-Гидроксиэтил)фенил]метил] циклопентанкарбонитрил
Работают согласно
примеру
87а, но исходя из 7,8 г (77 ммоль) диизопропиламина, 48,2 мл, 1,6М раствора н-бутиллития в гексане, 6,7 г (70 ммоль) торгового циклопентанкарбонитрила, 18 мл 1,3-диметилимидазолидин-2-она,
20,5 г (71,
4 ммоль) соединения, полученного на предыдущей стадии, в 120 мл тетрагидрофурана. После дистилляции получают 8,8 г (выход 55,0%) вязкой бежевой жидкости. Т-кип.0,4 165oC.
ИК (пленка): n (ОН)=3360 см-1; (С=N)=2215 см-1.
ЯМР (CDCl3) d1,4-2,25 (8Н, м); 2,8 (1Н, с, обменивающийся с D2O); 3,0 (4Н, с); 3, 8 (2Н, т, J=6,75 Гц); 7,15 (4Н, м).
д) 2-[[1-(Аминометил)циклопентил]метил] бензолэтанол
Работают согласно примеру 15а, но исходя из 1,8 г (45,6 ммоль)
LiAlH4, 8,
8
г (38 ммоль) соединения, полученного на предыдущей стадии, в 50 мл эфира. Получают 3,3 г (выход 37,2%) густого бледно-желтого масла, используемого без дальнейшей очистки.
ИК (пленка): n (NH2)=3360 и 3290 см-1.
ЯМР (CDCl3): d 1,25-1,75 (8Н, м); 2,05 (3Н, с, обменивающиеся с D2); 2,5 (2Н, с); 2, 75 (2Н, с); 2,9 (2Н, т, J=6, 75 Гц); 3,8 (2Н, т, J=6,75 Гц); 7,2 (4Н, с).
е) 4-Хлор-N-[[1-[[2-(2-гидроксиэтил)фенил]метил]циклопентил] метил]бензолсульфонамид
Работают
согласно примеру 32г,
но исходя из
3 г (12,8 ммоль) соединения, полученного на предыдущей стадии, 1,6 г (16,2 ммоль) триэтиламина и 2,65 г (12,5 ммоль) хлорида 4-хлорбензолсульфонила в 80 мл сухого
дихлорметана. После
очистки
хроматографией на кремниевой колонке в смеси дихлорметан-метанол (98:2) получают 2,3 г (выход 45,1%) твердого пастообразного вещества.
ИК (пленка): n (NH)=3420 см-1 ; (ОН)=3120 см-1; (SO2)=1290 см-1; (SO2)= 1125 см-1.
ЯМР (CDCl3): d1,25-1,75 (8Н, м); 2, 5-3,1 (7Н, м, из которых 1H обменивается с CF3COOD); 3,8 (2Н, т, J=6,75 Гц); 5,7 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,0-7,3 (4Н, м); 7,8-8,0 (4Н, м).
ж)
2-[[1-[[[4-Хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота
Работают согласно примеру 25ж, но исходя из 2,3 г (5,6 ммоль) соединения, полученного на предыдущей
стадии,
5,3 мл (11,2 ммоль) реактива Джойса в 70 мл ацетона. После хроматографии на кремниевой колонке в смеси дихлорметан-метанол (98:2) и перекристаллизации в изопропиловом эфире получают 0,2 г
(выход 8,
5%) твердого белого вещества. Т.пл. 124-126oC.
Элементный анализ: C21H24ClNO4S (М=421,95)
Рассчитано, C 59,78; H 5,73;
Cl 8,40; N
3,32; S 7,60.
Получено, C 60,09; H 5,80; Cl 8,45; N 3,38; S 7,30.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1715 см-1; (SO2 )=1290 см-1; (SO2)=1145 см-1.
ЯМР (CDCl3): d1,3-1,75 (8Н, м); 2,7 (2Н, с); 2,8 (2Н, д, J=6,75 Гц, переходящий в синглет в CF3 COOD); 3, 7 (2Н, с); 5,3 (1Н, т, J=6,75 Гц, обменивающийся с CF3COOD); 7,0-7,3 (4Н, м); 7,3-7,8 (4Н, м); 9,6 (1Н, с, широкий, обменивающийся с CF3COOD).
Пример
93.
3-[[1-[[[(4-Хлорфенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота
а) 3-(Бромметил)бензолуксусная кислота
Работают согласно примеру 92а, но исходя из 89 г
(590
ммоль) торговой 3-метилбензолуксусной кислоты, 123 г (767 ммоль) брома в 1200 мл тетрахлорида углерода. После охлаждения получают белый осадок, который центрифугируют. Следующую порцию получают,
прибавляя 1 л гексана в фильтрат. Два собранных осадка составляют 40,5 г (выход 30,0%) продукта, используемого без дальнейшей очистки. Т.пл. 92-94oC.
ИК (KBr): n
(C=O)=1680
см-1,
ЯМР (CDCl3): d3,65 (2Н, с); 4,5 (2Н, с); 7,25 (4Н, с; 10,4 (1Н, с, широкий, обменивающийся с CF3COOD).
б)
3-(Бромметил)бензолэтанол
Работают согласно примеру 25а, но исходя из 46,7 г (204 ммоль) соединения, полученного на предыдущей стадии, 17 г (224,4 ммоль) комплекса гидрида
бора-диметилсульфида в виде 2М раствора в
толуоле, в 500 мл сухого тетрагидрофурана. Получают 40 г (выход 93,0%) бледно-желтого твердого вещества, используемого без дальнейшей очистки.
ИК (KBr): n (ОН)3350 см-1
ЯМР (CDCl3): d1,7 (1Н, с, обменивающийся с D2O); 2,6 (2Н, т, J=6,75 Гц); 3,85 (2Н, т, J=6,75 Гц); 4,45 (2Н, с); 7,2 (4Н,
с).
в)
1-Бромметил-3-[2-(триметилсилилокси)этил]бензил
Работают согласно примеру 26а, но исходя из 40 г (186 ммоль) соединения, полученного на предыдущей стадии, 30 г (186
ммоль) 1,1,1,3,3,
3-гексаметилдизилазана, 18,8 г (186 ммоль) триэтиламина и 20,2 г (186 ммоль) хлорида триметилсилила в 400 мл сухого тетрагидрофурана. После дистилляции получают 45,5 г (выход 85,2%)
бесцветной
жидкости. Т.кип. 98-104oC.
ЯМР (CDCl3): d0,0 (9Н, с); 2,75 (2Н, т, J=6,75 Гц); 3,7 (2H, т, J=6,75 Гц); 4,4 (2Н, с); 6,9-7,45 (4Н, м).
г)
1-[[3-(2-Гидроксиэтил)фенил]метил] циклопентанкарбонитрил
Работают согласно примеру 87а, но исходя из 7,8 г (77 ммоль) диизопропиламина, 48,2 мл 1,614 раствора н-бутиллития в
гексане, 6,
7 г
(70 ммоль) торгового циклопентанкарбонитрила, 18 мл 1,3-диметилимидазолидин-2-она, 20,5 г (71,4 ммоль) соединения, полученного на предыдущей стадии, в 110 мл сухого тетрагидрофурана.
После
дистилляции
получают 9,6 г ( выход 60,0%) вязкой жидкости. Т-кип.0,4 160oC.
ИК (пленка): n (OH)=3420 см-1; (C=N)=2215 см-1.
ЯМР (CDCl3): d1,5-2,15 (8Н, м); 2,4 (1Н, с, обменивающийся с D2O); 2,85 (2Н, с); 2,85 (2Н, т, J=6,75 Гц); 3,8 (2Н, т, J=6,75 Гц); 7,0-7,3 (4Н, м).
д)
3-[[1-(Аминометил)циклопентил]метил] бензолэтанол
Работают согласно примеру 15а, но исходя из 1,9 г (50,4 ммоль) LiAlH4, 9,6 г (42 ммоль) соединения, полученного на предыдущей
стадии, в 55 мл эфира. Получают 5,0 г (выход 51,0%) жидкой бесцветной пасты, используемой без дальнейшей очистки.
ИК (пленка): n (NH2)=3350 и 3300 см-1.
ЯМР (CDCl3): d 1,25-1,75 (8Н, м); 1,85 (3Н, с, обменивающиеся с D2O); 2,45 (2Н, с); 2,6 (2Н, с); 3,1 (2Н, т, J=6,75 Гц); 3,8 (2Н, т, J=6,75 Гц); 6,8-7,4 (4Н, м).
е) 4-Хлор-N-[[1-[[3-(2-гидроксиэтил)фенил]метил]циклопентил] метил]бензолсульфонамид
Работают согласно примеру 32г, но исходя из 5 г (21,4 ммоль) соединения, полученного на
предыдущей стадии, из 2,7 г (26,7 ммоль) триэтиламина и 4,4 г (20,8 ммоль) хлорида 4-хлорбензолсульфонила в 110 мл сухого дихлорметана. После очистки хроматографией на кремниевой колонке в смеси
дихлорметан-метанол (98:2) получают 3,5 г (выход 42,5%) твердого пастообразного вещества.
ИК (пленка): n (ОН)=3450 см-1; (NH)=3290 см-1; (SO2)=1320 см-1; (SO2)= 1150 см-1.
ЯМР (CDCl3): d 1,1-1,9 (9Н, м, из которых 1H обменивается с D2O); 2,6 (2Н, с); 2,5-3,0 (4Н, м); 3,8 (2Н, т, J=6,75 Гц); 5,1 (1Н, т, J=6,75 Гц, обменивающийся с D2O); 6,75-7,2 (4H, м); 7,3-7,5 (2Н, м); 7,6-7,9 (2Н, м).
ж) 3-[[1-[[[(4-Хлорфенил)сульфонил] амино]метил]
циклопентил]метил]бензолуксусная кислота
Работают согласно примеру 25ж, но исходя из 3,5 г (8,6 ммоль) соединения, полученного на предыдущей стадии, 8,6 мл (17,2 ммоль) реактива Джойса в
110
мл ацетона. После очистки и последующей (перекристаллизации в смеси изопропиловый эфир-этанол получают 1,4 г (выход 52,8%) твердого белого вещества. Т.пл. 139-140oC.
Элементный анализ: C21H24ClNO4S (М=421,939%)
Рассчитано, C 59,78; H 5,73; Cl 8,40; N 3,32; S 7,60.
Получено, C 59,63; H 5,87; Cl 8,38; N 3, 31; S 7,76.
ИК (KBr): n3270 см-1; (C=O)=1680 см-1; (SO2)=1315 см-1; (SO2)=1140 см-1.
ЯМР (CDCl3+DMCO d6): d1,1-1,7 (8Н, м); 2,4-2,75 (4Н, м); 3,5 (2Н, с); 6,9-7,2 (4Н, м); 7,2-7,6 (3Н, м, из которых 1H обменивается с CF3COOD); 7,7-8,0 (2Н, м); 9,6 (1Н, с, широкий,
обменивающийся с CF3COOD)
Примеры 94-102.
Соединения примеров 94-102:
4-[[1-[[[(4-гексилфенил)сульфонил] амино] метил] циклопентил]метил]бензолуксусная
кислота,
4-[[1-[[[(4-нитрофенил)сульфонил]амино]метил] циклопентил]метил]бензолуксусная кислота,
4-[[1-[[[(нафтален-1-ил)сульфонил] амино]метил]циклопентил] метил]бензолуксусная
кислота,
4-[[1-[[[(4-гексилоксифенил)сульфонил] амино] метил] циклопентил]метил] бензолуксусная кислота,
4-[[1-[[[(2-фторфенил)сульфонил] амино]метил]
циклопентил]метил]бензолуксусная кислота,
4-[[1-[[[(4-циклогексилфенил)сульфонил] амино] метил] циклопентил]метил] бензолуксусная кислота,
4-[[1-[[[(пентафторфенил)сульфонил]
амино]метил]циклопентил]метил]бензолуксусная кислота,
4-[[1-[[[(1,1'-бифенил-4-ил)сульфонил] амино] метил] циклопентил] метил] бензолуксусная кислота,
4-[[1-[[[(нафтален-2-ил)сульфонил] амино]метил]циклопентил] метил]бензолуксусная кислота,
были приготовлены в 2 стадии из 1-[[4-[2-[(3,4,5,6-тетрагидро-2Н-пиран-2-ил)окси] этил] фенил]
метил]
циклопентано] метанамина, полученного в примере 85б:
а) cульфонирование согласно примеру 1в при помощи соответствующего сульфохлорида;
в) окисление Джонса согласно примеру
25ж.
Характеристики полученных веществ (A=COOH) и промежуточных веществ (A= CH2О-THP)* даны в табл.3.
Пример 103.
4-[[1-[[[(4-Mетилтиофенил)сульфонил]амино]метил]
циклопентил]метил]бензолуксусная кислота
а) N-[[1-(фенилметил)циклопентил]метил]ацетамид.
К смеси из 22,7 г (120 ммоль) амина, полученного в примере 15а, и 82 мл пиридина, прибавляют по каплям 9,85 г (126 ммоль) ацетилхлорида, поддерживая температуру 30oC. Затем доводят до рефлюкса в течение 3/4 часа. После охлаждения выливают на смесь лед-концентрированная HCl, экстрагируют дихлорметаном. Органическую фазу промывают водой, высушивают на сульфате натрия, затем концентрируют, очищают дистилляцией и получают 23,8 г (выход 85,6%) желтого густого масла, которое кристаллизуется. Т.кип.1200-210oC. Т.пл. 70-72oC (этилацетат-пентан).
ИК (пленка): n (NH)=3300 см-1; (C=O)=1630 см-1.
ЯМР (CDCl3): d1,25-1,75 (8Н, м); 1,8 (3Н, с); 2,6 (2Н, с); 3,1 (2Н, д, J= 6 Гц, переходящий в синглет в CF3 COOD); 5,5 (1Н, м, обменивающийся с CF3COOD); 7,15 (5Н, с).
б) N-[[1-[4(-ацетилфенил)метил]циклопентил]метил] ацетамид
К смеси, находящейся в атмосфере
азота при
температуре -10oC из 183,2 г (0,792 моль)
соединения, полученного на предыдущей стадии, 80,5 г (1,03 моль) ацетилхлорида и 3 л дихлорметана прибавляют порциями 316,8 г (2,376
моль) хлорида
алюминия. Температуре дают подняться до комнатной и
перемешивают 20 часов, после чего выливают на смесь лед-концентрированная HCl. Экстрагируют дихлорметаном. Органическую фазу
промывают водой,
насыщенной NaHCO3, затем водой, высушивают на
сульфате натрия и концентрируют; очищают перекристаллизацией в этилацетате и получают 177,9 г (выход 82,2%) твердого желтого
вещества. Т.пл.
136,7-138,7oC.
ИК (KBr): n
(NH)=3270 см-1; (C=O)=1655 см-1; (C=O)=1615 см-1
ЯМР (CDCl3): d1,25-1,75
(8Н, м); 1,9 (3Н,
с); 2,5 (3Н, с); 2,65 (2Н, с); 3,1 (2Н, д, J=6 Гц,
переходящий в синглет в CF3COOD); 5,6 (1Н, м, обменивающийся с CF3COOD); 7,1-7,35 (2Н, м); 7,7-8,0 (2Н,
м).
в) Метиловый эфир
4-[[1-(N-ацетиламино)метил]циклопентил]метил] бензолуксусной кислоты
Работают согласно примеру 5д, но исходя из 177,9 г (0,651 моль) соединения,
полученного на предыдущей
стадии, 290 мл
метанола, 409 г (2,88 моль) эфирной вытяжки трифторида бора, 433 г (0,976 моль) тетраацетата свинца в дихлорметане. Получают 195,6 г (выход 99,0%) твердого
бежевого вещества,
используемого без
дальнейшей очистки. Т.пл. 99oC.
ИК (KBr): n (NH)=3280 см-1; (C=O)=1700 см-1; (C=O)=1610 см-1.
ЯМР (CDCl3): d1, 25-1,75 (8Н, м); 1,9 (3Н, с); 2,6 (2Н, с); 3,1 (2Н, д, J= 6 Гц, переходящий в синглет в CF3COOD); 3,6 (2Н, с); 3,7 (3Н, с); 5,35 (1Н, м, обменивающийся с CF3COOD); 7,15 (4Н, с).
г) 4-[[1-(Аминометил)циклопентил]метил] бензолуксусная кислота
Смесь из 2,5 г (8,2 ммоль) соединения, полученного на
предыдущей стадии, и 60 мл
(110 ммоль) NaOH 1,83н.
доводят до рефлюкса в течение 7 часов. После охлаждения реакционную среду промывают эфиром, после чего подкисляется до pH 6 с помощью 10н. HCl.
Сформировавшийся осадок
фильтруют, промывают холодной
водой. Фильтрат концентрируют до объема 30 мл и оставляют на ночь при 4oC с получением нового осадка, который, в свою очередь,
фильтруют и промывают водой.
Собранные осадки высушивают в
вакууме при 110oC и получают 1,7 г (выход 85,0) белого порошка, используемого без дальнейшей очистки. Т.пл. 218oC
(разл.).
ЯМР (CF3COOD): d1,25-2,1 (8Н, м); 2,6 (2Н, с); 3,2 (2Н, м); 3,8 (2Н, с); 7,25 (4Н, с).
д) Метиловый эфир 4-[[1-(аминометил)циклопентил]метил]
бензолуксусной кислоты
Работают согласно примеру 1а, но
исходя из 9,9 г (46 ммоль) соединения, полученного на предыдущей стадии в 60 мл метанола. Получают 8,7 г (выход 82,8%) густой
коричневой жидкости. Т.кип.0,5
150-200oC.
ИК (пленка): n (NH2)=3375 см-1; (C=O)=1720 см-1.
ЯМР (CDCl3): d1,25 (2Н, с, обменивающиеся с CF3COOD); 1,25-1,75 (8Н, м); 2,45 (2Н, с); 2,6 (2Н, с); 3,6 (2Н, с); 3,65 (3Н, с); 7,1 (4Н, с).
е) Метиловый
4-[[1-[[[(4-метилтиофенил)сульфонил]амино]метил]
циклопентил]метил]бензолуксусной кислоты
Работают согласно примеру 32г, но исходя из 4 г (16 ммоль) соединения, полученного на предыдущей
стадии, 1,9 г (18,8 ммоль) триэтиламина, 3,55 г (15,
9 ммоль) хлорида 4-(метилтио)бензолсульфонила
(приготовленного по Burton H. et Hu P.F. J. Chem. Soc. (1948) 604-5) в 70 мл сухого дихлорметана.
После перекристаллизации в смеси этилацетат-гексан
получают 4,1 г ( выход 56,9%) твердого
бледно-желтого вещества. Т.пл. 109-114oC.
ИК (KBr): n (NH)=3280 см-1; (C=O)=1705 см-1; (SO2)=1320 см-1; (SO2)=1155 см-1.
ЯМР (CDCl3) d1,25-1,75 (8Н, м); 2,5 (3Н, с); 2,6 (2Н, с); 2,7 (2Н, д, J= б,75 Гц, переходящий в синглет в D2O); 3,5 (2Н, с); 3,7 (3Н, с); 4,6 (1Н, т, J=6,75 Гц, обменивающийся с D2O); 6,9-7,4 (6Н, м); 7,55-7 8 (2Н, м).
ж)
4-[[1-[[[(4-Метилтиофенил)сульфонил] амино]метил]
циклопентил]метил] бензолуксусная
кислота
Работают согласно примеру 1г, но исходя из 4,1 г (9,2 ммоль) соединения, полученного на
предыдущей стадии, 0,8 г КОН в таблетках, 60 мл этанола и 60
мл воды. После перекристаллизации
в толуоле, потом в смеси этилацетат-гексан, получают 0,7 г (выход 17,6%) мелкого твердого белого
вещества. T.пл. 138-139oC.
Элементный
анализ: C22H27
NO4S (М=433,59)
Рассчитано, C 60,94; H 6,28; N 3,23; S 14,79.
Получено, C 60,58; H 6,35; N 3,18; S 15,05.
ИК (KBr): n (NH)=3270 см-1; (C=O)=1715 см-1; (SO2)=1305 см-1; (SO2 )=1150 см-1.
ЯМР (CDCl3): d1,25-1,75 (8Н, м); 2,5 (3Н, с); 2,5-2,8 (4Н, м); 3,6 (2Н, с); 5,0 (1Н, т, J=6,0 Гц, обменивающийся с D2O); 6,85-7,4 (6Н, м); 7,6-7,9 (2Н, м); 9,5 (1Н, с, широкий, обменивающийся с D2O).
Пример 104.
4-[[1-[[[[5-(Диметиламино)нафталин-1-ил]сульфонил]амино]метил]циклопентил]
метил]бензолуксусная кислота
а) Метиловый эфир
4-[[1-[[[[5-(диметиламино)нафталин-1-ил]сульфонил]амино]метил]циклопентил] метил]бензолуксусной кислоты
Работают согласно примеру 32г,
но исходя из 2,8 г (10,7 ммоль) соединения, полученного
в примере 103д, 1,3 г (12,8 ммоль) триэтиламина, 2,8 г (10,5 ммоль) торгового хлорида 5-(диметиламино)нафтанлинсульфонила в 56 мл сухого
дихлорметана. После очистки хроматографией на кремниевой
колонке в смеси гексан-этилацетат (1:1) и последующей перекристаллизации в смеси гексан-этилацетат получают 0,9 г ( выход 19,5%) твердого
желтого вещества. Т. пл. 124-126oC.
ИК (KBr): n (NH)3300 см-1; (C=O)=1705 см-1; (SO2)=1315 см-1; (SO2)=1115 см-1.
ЯМР (CDCl3): d1, 05-1,6 (8Н, м); 2,5 (2Н, с); 2,6 (2Н, д, J=6,75 Гц, переходящий в синглет с CF3COOD); 2,9 (6Н, с); 3,5 (2Н, с); 3,7 (3Н, с); 4,65 (1Н, т, J= 6,75 Гц, обменивающийся с CF3COOD); 6,75-7,75 (7Н, м); 8,1-8,7 (3Н, м).
б) 4-[[1-[[[[5-(Диметиламино)нафталин-1-ил]сульфонил]амино]метил]циклопентил]
метил]бензолуксусная кислота
Работают согласно примеру 1г,
но исходя из 0,
9 г (2,1 ммоль) соединения, полученного на предыдущей стадии, 0,18 г (3,1 ммоль) КОН в таблетках, 90 мл воды и 90
мл этанола. После перекристаллизации в ацетоне получают 0,2 г ( выход
20,0%) твердого
желтого вещества. Т.пл. 178-181oC.
Элементный анализ: C27H32
N2O4S (М=480,621)
Рассчитано, C 67,47; H 6,
71; N 5,83; S 6,
67.
Получено, C 67,40; H 6,93; N 5,90; S 6,56.
ИК (KBr): n (NH)=3300 см-1; (С=O)=1680 см-1; (SO2)=1310 см-1; (SO2)=1150 см-1.
ЯМР (DMCO d6): d1,1-1,55 (8Н, м); 2,3-2,7 (4Н,
м); 2,8 (6Н, с); 3,4 (2Н, с); 6,9 (4H, с); 7,15-8,6 (7Н, м, из которых 1H
обменивается с
CF3COOD); 12,1 (1Н, с, широкий, обменивающийся с CF3COOD)
Пример 105.
4-[[1-[[[(4-Хлор-2-фторфенил)сульфонил]амино]метил]
циклопентил]метил]бензолуксусная кислота
а) Хлорид 4-хлор-2-фторбензолсульфонила.
В смесь, находящуюся при -10o C, из 75 мл HCl 10н. и 22 мл уксусной кислоты прибавляют 32,5 г (223 ммоль) торгового 4-хлор-2-фторанилина, потом 16,7 г (241 ммоль) нитрита натрия, растворенного в 26 мл воды. Эту реакционную среду добавляют фракциями к раствору, находящемуся при 10oC, 220 мл уксусной кислоты, насыщенной SO2 и содержащей 5,5 г (56,3 ммоль) хлорида меди (I). Оставляют перемешивая на 1/2 часа при комнатной температуре, а затем выливают на смесь лед-вода и экстрагируют эфиром. Органическую фазу промывают раствором, насыщенным NaHCO3, сушат на сульфате натрия и концентрируют. После дистилляции получают 44,5 г (выход 87,1%) бледно-желтой кристаллизующейся жидкости. Т.кип.0,1 81oC. Т.пл. 36-38oC.
Элементный
анализ: C6H3Cl2FO2S
(М=229,052)
Рассчитано, C
31,46; H 1,32; Cl 30,96; F 8,29; S 14,00.
Получено, C 31,51; H 1,09; Cl 31,12; F 8, 29; S 13,88.
ИК (пленка): n (SO2 )=1375 см-1; SO2 )=1175 см-1.
ЯМР (CDCl3): d7,1-7,5 (2Н, м); 7,7-8,1 (1Н, м).
б) 4-[[1-[[[(4-Xлор-2-фторфенил)сульфонил]
амино]метил]
циклопентил]метил]бензолуксусная кислота
Смесь из 3 г (10 ммоль) соединения, полученного в примере 103в, 5,6 г
(140 ммоль) NaOH в таблетках и 72 мл воды, доводят до рефлюкса в
течение 4
часов. После охлаждения до 40oC прибавляют 2,3 г (10 ммоль) соединения, полученного на предыдущей стадии, затем,
перемешивая, оставляют на 16 часов при комнатной температуре.
Вновь
прибавляют 0,46 г (2 ммоль) соединения, полученного на предыдущей стадии, и перемешивают еще 6 часов при комнатной температуре.
Затем реакционную среду промывают эфиром и подкисляют HCl.
Полученный
осадок центрифугируют, промывают водой и высушивают, после чего очищают хроматографией на кремниевой колонке в этилацетате с
последующей перекристаллизацией в смеси этилацетат-гексан и
получают 0,8 г
(выход 18,2%) твердого белого вещества. Т.пл. 151-153oC.
Элементный анализ: C21H23ClFNO4S (М=439,929)
Рассчитано,
C 57,33; H 5,27;
Cl 8,06; F 4,32; N 3,18; S 7,29.
Получено, C 57,50; H 5,16; Cl 8,13; F 4,40; N 3,21; S 7,26.
ИК (KBr): n (NH)=3310 см-1; (C=O)=1690 см-1; (SO2)=1335 см-1; (SO2)=1155 см-1.
ЯМР (ацетон d6 ): d1,3-1,75 (8Н, м); 2,7 (2H, с); 2,8 (2Н, д, J=6 Гц, переходящий в синглет в CF3COOD); 3,6 (2Н, с); 6,6 (1% т, J=6 Гц, обменивающийся с CF3COOD); 7,2 (4Н, с); 7,3-8,0 (3Н, м); 10,5 (1Н, с, широкий, обменивающийся с CF3 COOD).
Пример 106. 4-[[1-[[[(Xинол-8-ил)сульфонил]амино]метил]циклопентил] метил]бензолуксусная кислота
Работают
согласно примеру 105б, но исходя из 3,0 г (10 ммоль)
соединения, полученного в
примере 103в, 4,8 г (120 ммоль) NaOH, 2,3 г (10 ммоль) хлорида (хинол-8-ил)сульфонила в 21 мл воды. После 3
перекристаллизаций в смеси этанол-вода получают 1,1 г (выход 25,
0%) мелких тонких иголок
белого цвета. Т.пл.>320oC (разл. начиная с 200oC).
Элементный
анализ: C24H26N2O4S
(М=438,542)
Рассчитано, C 65,73; H 5,98; N 6,39; S 7,31.
Получено, C 65,77; H 6,02; N 6,23; S 7,39.
ИК (KBr): n (NH)=3250 см-1; (C=O)=1705 см-1; (SO2)=1300 см-1; (SO2)=1130 см-1.
ЯМР (DMCO d6):
d1,1-1,6 (8Н, м); 2,4-2,7 (4Н, м); 3,45 (2Н, с); 7,0 (4Н, с); 7,0
(1Н, м,
обменивающийся с CF3COOD); 7,5-7,9 (2Н, м); 8,2-8,6 (3Н, м); 9,05 (1Н, м); 11,8 (1Н, с, широкий, обменивающийся с
CF3COOD)
Пример 107.
4-[[1-[[[(4-Бромфенил)сульфонил]амино]метил] циклобутил]метил]бензолуксусная кислота
а) N-[[1-(Фенилметил)циклобутил]метил]ацетамид.
Работают согласно примеру 103а из 55,8 г (318 ммоль) амина, полученного в примере 27в, 26,2 г (333,8 ммоль) ацетилхлорида в 200 мл пиридина. После растирания с гексаном получают 59,4 г (выход 86, 0%) твердого пастообразного вещества. Т.пл. 74-76oC.
ИК (KBr): n (NH)=3310 см-1; (C=O)=1620 см-1.
ЯМР (CDCl3): d1,5-2,0 (9Н, м); 2,7 (2Н, с); 3,25 (2Н, д, J=6 Гц, переходящий в синглет в CF3COOD); 5,4 (1Н, м, обменивающийся с CF3COOD); 7,2 (5Н, с).
б) N-[[1-[(4-Ацетилфенил)метил]циклобутил]метил] ацетамид.
Работают согласно примеру 103б, но исходя из 59 г (271 ммоль) соединения, полученного на предыдущей стадии, 27,5 г (350 ммоль) ацетилхлорида и 108 г (813 ммоль) хлорида алюминия в 1000 мл дихлорметана. После перекристаллизации в толуоле получают 55,6 г (выход 79,4%) твердого желтого вещества. Т.пл. 106-110o C.
ИК (KBr): n (NH)3310 см-1; (C=O)=1660 см-1; (C=O)=1625 см-1.
ЯМР (CDCl3): d1,6-2,1 (6Н, м); 1,95 (3Н, с); 2,55 (3Н, с); 2,75 (2Н, с); 3,25 (2Н, д, J=6 Гц, переходящий в синглет в CF3COOD); 5,7 (1Н, м, обменивающийся с CF3COOD); 7,05-7,4 (2Н, м); 7,7-8,0 (2Н, м).
в) Метиловый
эфир 4-[[1-[(N-ацетил-амино)метил]циклобутил]метил] бензолуксусной
кислоты
Работают согласно примеру 5д, но исходя из 55,6 г (214 ммоль) соединения, полученного на предыдущей стадии, 101 мл
метанола, 91,1 г (643 ммоль) эфирной вытяжки трифторида бора и 113,
8
г (257 ммоль) тетраацетата свинца в 1090 мл дихлорметана. После дистилляции получают 18,4 г (выход 29,7%) густой
кристаллизующейся желтой жидкости. Т.кип.0,4 205oC. Т.пл.
62-65oC.
ИК (KBr): n (NH)=3290 см-1; (C=O)=1720 см-1; (C=O)=1620 см-1.
ЯМР (CDCl3): d1,6-2,1 (9Н, м); 2,7 (2Н, с); 3,25 (2Н, д, J=6 Гц, переходящий в синглет в CF3COOD); 3,6 (2Н, с); 3,7 (3Н, с); 5,45 (1Н, м, обменивающийся с CF3COOD); 7,1 (4Н, с).
г)
4-[[1-(Аминометил)циклобутил]метил] бензолуксусная кислота
Работают согласно примеру 103 г, но исходя из 4,9 г (16,9
ммоль) соединения, полученного на предыдущей стадии и 4 г (100 ммоль)
NaOH
в 35,5 мл воды. Получают 3,3 г (выход 84,6%) твердого белого вещества, используемого без дальнейшей очистки. Т.пл. более
255oC.
ЯМР (DMCO d6 + CF3 COOD): d1,7-2,1 (6Н, м); 2,7-2,95 (4Н, м); 3,5 (2Н, с); 7,2 (4Н, с).
д)
4-[[1-[[[(4-Бромфенил)сульфонил]амино]метил] циклобутил]метил]бензолуксусная кислота
К смеси
из 3,3 г
(14 ммоль) соединения, полученного на предыдущей стадии, и 3,9 г (28 ммоль) карбоната
калия в 400 мл воды прибавляют 3,8 г (14,9 ммоль) хлорида 4-бромбензолсульфонила. После чего реакционную
среду
доводят до рефлюкса в течение 1 час.
После охлаждения, промывания эфиром, последующего подкисления до pH 1 с помощью разбавленной HCl получают осадок, который очищают перекристаллизацией в этилацетате для получения 3,3 г (выход 52,4%) твердого белого вещества. Т.пл. 180oC-182oC.
Элементный анализ: C20H22
BrNO4S (M=452,363)
Рассчитано, C 53,10; H 4,90; Br 17,66; N 3,10; S 7,
09.
Получено, C 53,09; H 5,01; Br 17,61; N З,11; S 7,19.
ИК (KBr): n (NH)=3240 см-1; (C=O)=1710 см-1; (SO2)=1315 см-1; (SO2)=1155 см-1.
ЯМР (ацетон d6): d1,55-2,15 (6Н, м); 2, 8 (2Н, с); 2,9 (2Н, д, J=6 Гц, переходящий в синглет в CF3COOD); 3,6 (2Н, с); 6, 45 (1Н, т, J=6 Гц, обменивающийся с CF3COOD); 7,2 (4Н, с); 7,8 (4Н, с); 10,9 (1Н, с, широкий, обменивающийся с CF3COOD).
Пример 108. Биологическая активность.
Соединения примеров 1-107 были протестированы на тромбоцитарную агрегацию морских свинок, а также на сокращение аорты крысы, как было описано выше. Результаты представлены в табл. 4.
В таблицах, если указано, что CI50 выше 1 мкМ, это значит, что CI50
составляет от 1 мкМ до 20 мкМ, если -CI50 выше 20 мкМ,
то указанное значение ниже 100 мкМ и, следовательно, выражается неравенством:
20 мкМ
Для иллюстрации препаративных форм
фармкомпозиций ниже приведены два примера рецептур, относящихся соответственно к желатиновой капсуле и к таблетке, содержащим в качестве
активного начала одно из соединений изобретения:
Капсула,
Активное начало 18
Лактоза 55
Микрокристаллическая целлюлоза 16
Стеарат магния 1
Таблетка,
Активное начало 25
Лактоза 65
Поливинилпирролидон 5
Крахмал 4
Стеарат магния 1с
Реферат
Использование: в качестве лекарственного средства. Сущность изобретения: продукт - замещенные сульфонамиды:

Формула

где R1 представляет собой фенил, который может быть замещен одним, двумя или пятью атомами галогена, трифторметилом, трифторметокси, гидроксилом, амино, циано, нитро, ацетамидо фенилом, С1 С7-алкилом, С3 С6-циклоалкилом, C1 С7-алкокси, С1 - С7-алкилтио, ацетилом, или R1 выбран из ряда нафтила, который может быть замещен диметиламином, хинолила, фурила, тиенила, который может быть замещен галогеном, или R1 C1 C7-алкил-сульфинил, С1 С7-алкилсульфонил; R2 и R3 являются различными и один из них представляет W, а другой атом водорода, С1 - С7-алкил;
W представляет собой группу:

где Z кислород, CH2, связь;
q 0, 1, 2;
A COOH, PO3H2, SO3H, COOR7,
где R7 представляет собой щелочной металл, С1 - С7-алкил или A представляет собой карбоксиэтилоксо-, 4,5-дигидро-3-оксо-2Н-пиридазин-6-ил, 4-морфолинилоксо-, диэтиламино-этоксикарбонил, ацетил, гидроксил, тетразолил;
R4, R5, R6 водород, С1 С7 алкил;
Y представляет собой -CH2-, -/CH2/2-, -/CH2/3- -/CH2/4-, -CH2-O-CH2-,


n 0 или 1,
а также их натриевые соли, сложные эфиры или амиды.

где R2 и R3 являются различными и один из них является W, а другой водород, С1 С7-алкил;
W представляет собой группу

где Z является -CH2- или связью;
q 1, 2;
A является COOH, C1 C7 -алкоксикарбонилом, гидроксилом, тетрагидропиранилокси;
R4, R5, R6 являются атомами водорода, С1 - С7-алкилом;
Y является группой -/CH2/2-, -CH2-O-CH2-

n 0 или 1
в качестве промежуточных соединений для получения замещенных сульфонамидов по п.1.

Комментарии