Устройство для проведения полимеразной цепной реакции с однонаправленным раздвижным средством - RU2666925C1
Код документа: RU2666925C1
Чертежи

Описание
Область техники, к которой относится изобретение
Объектом данного изобретения является ПЦР-устройство, содержащее термоблок ПЦР, включающий в себя непрерывно и последовательно расположенные нагреватели, и ПЦР-чип, включающий в себя непрерывно и последовательно расположенные реакционные камеры, а также способ выполнения ПЦР с помощью указанного устройства.
Уровень техники
Полимеразная цепная реакция (далее везде "ПЦР") представляет собой технологию, при которой производится последовательное копирование определенного фрагмента матричных нуклеиновых кислот путем многократного нагревания и охлаждения данного определенного фрагмента с целью усиления нуклеиновых кислот, содержащих данный фрагмент в геометрической прогрессии; данная технология широко применялась в генетической инженерии, в различных областях медицины, и т.д., в целях анализа и диагностики. В последнее время для успешного выполнения ПЦР были разработаны различные устройства.
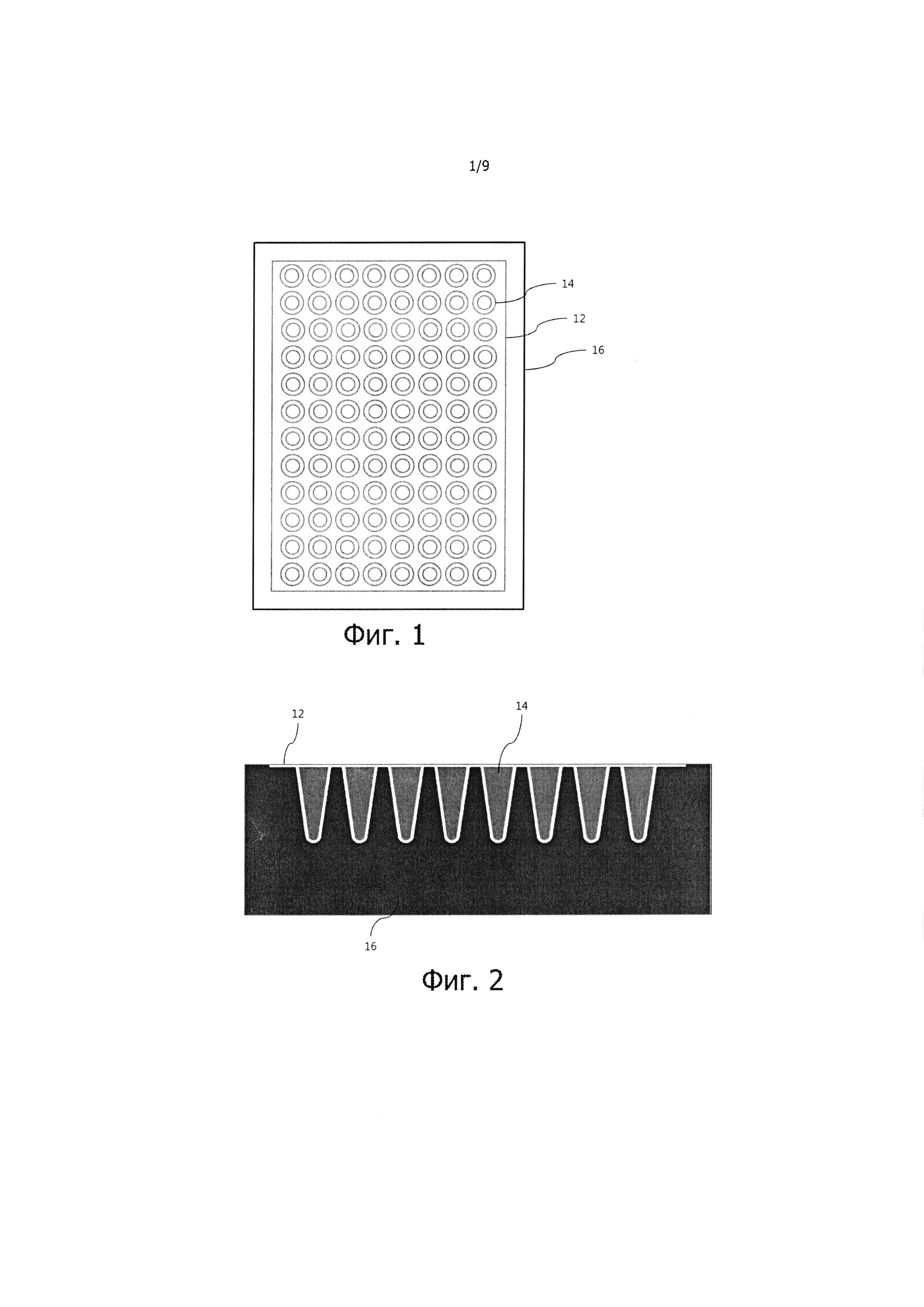
Обычное устройство для проведения ПЦР включает в себя реакционную емкость с пробирками, в которые впрыскивают раствор пробы, содержащий матричные нуклеиновые кислоты; реакционную емкость помещают в общий нагреватель. Для проведения ПЦР реакционную емкость подвергают многократному нагреву и охлаждению (см. фиг. 1 и 2). Такое ПЦР-устройство обладает преимуществом, которое заключается в простоте конструкции, поскольку наличие лишь одного общего нагревателя позволяет увеличить плотность проб просто потому, что в нем можно установить множество образцов. Однако такое ПЦР-устройство имеет ряд недостатков, а именно, ему нужна сложная электросхема для точного регулирования температуры, нужно много проб, поскольку реакционная емкость пробирочного типа имеет большие размеры, и время ПЦР в целом увеличивается за счет многократного нагревания и охлаждения общего нагревателя.
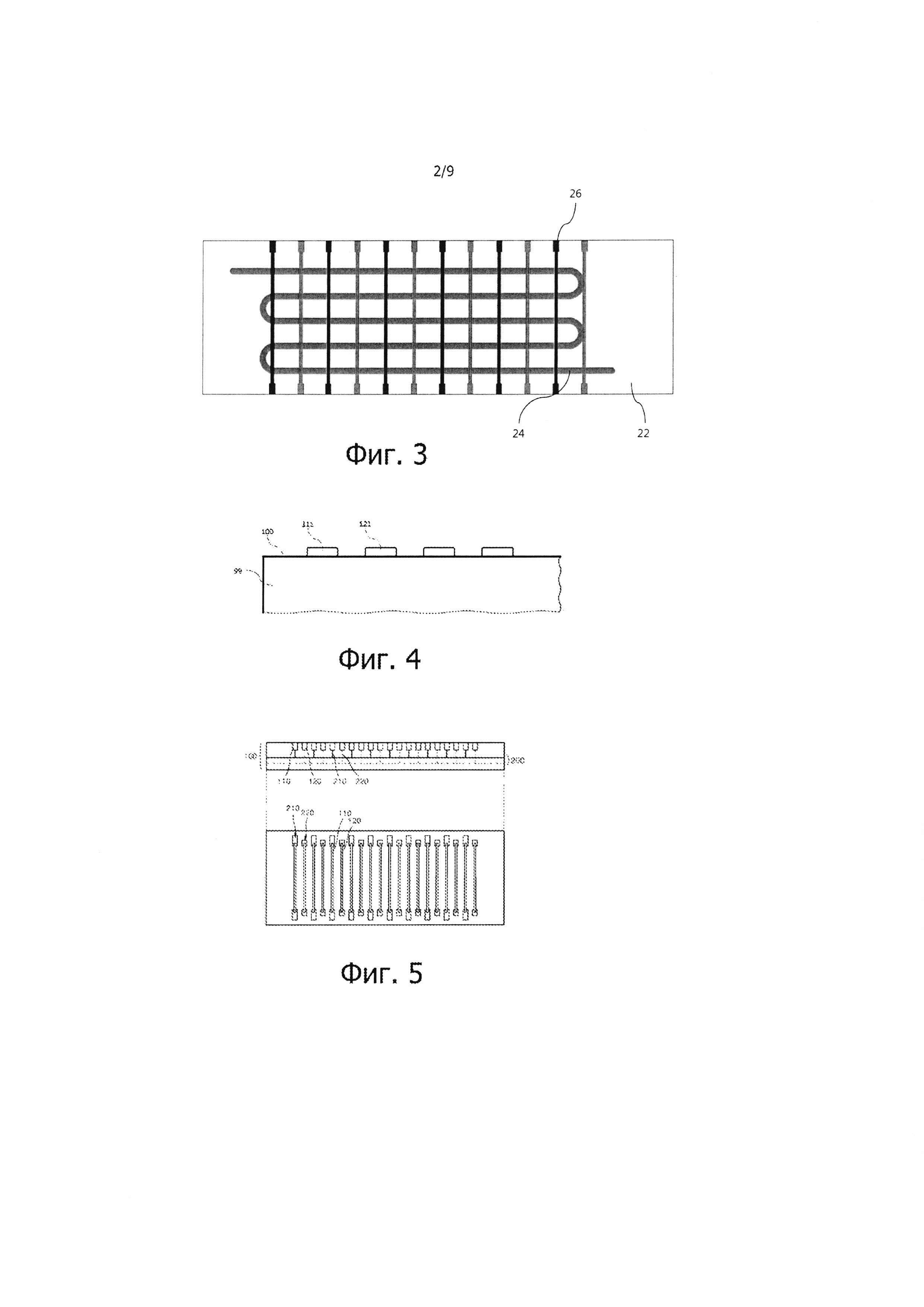
В еще одном типе обычного ПЦР-устройства устанавливают несколько нагревателей, которые имеют разные температуры ПЦР, и ПЦР осуществляется таким образом, что раствор пробы, содержащий нуклеиновые кислоты, протекает по одному и тому же каналу, проходя через нагреватели (см. фиг. 3). Преимущество такого ПЦР-устройства заключается в коротком времени ПЦР, поскольку наличие нескольких нагревателей с различными температурами ПЦР уменьшает необходимость многократного повторного нагрева и охлаждения нагревателей. Однако такое ПЦР-устройство обладает и рядом недостатков, которые заключаются в следующем: несмотря на то, что благодаря применению нескольких нагревателей, электросхема может быть достаточной простой, конструкция в целом может быть довольно сложной, поскольку длинный единый канал должен проходить как через высокотемпературные нагреватели, так и через низкотемпературные нагреватели; трудно загружать множество проб; и требуется отдельный регулятор для регулирования расхода раствора пробы с нуклеиновыми кислотами, проходящего через нагреватели по единому каналу, так что увеличение плотности пробы и устройства является затруднительным.
В последнее время были предложены эффективные способы усовершенствования ПЦР-устройств, а также способы, способные повысить производительность ПЦР-устройств и улучшить распознавание процесса ПЦР в реальном масштабе времени путем обработки многих проб в одном процессе ПЦР с помощью увеличения плотности и пропускной способности посредством сокращения времени ПЦР. Но в данном случае все равно требуется технология точного регулирования и установки температуры установленных в ряд нагревателей, без необходимости повторного нагревания и охлаждения, технология передачи партий проб, таким образом, чтобы ПЦР можно было проводить на пробах одновременно с помощью нагревателей на заданной температуре, и ПЦР-устройства, в которых используется вышеописанная технология, все еще востребованы.
Раскрытие сущности изобретения
Техническая проблема
Таким образом, настоящее изобретение было сделано в попытке решить вышеуказанные проблемы, имеющие место в известном уровне техники, и целью настоящего изобретения является создание ПЦР-устройства, способного значительно уменьшить продолжительность ПЦР, повысить выход ПЦР и увеличить количество проб, измеряемых и анализируемых в реальном масштабе времени.
Техническое решение
Для достижения вышеуказанных целей настоящим изобретением предлагается ПЦР-устройство, содержащее: термоблоки ПЦР, содержащие два или более нагревателя, последовательно расположенных на верхней поверхности подложки на расстоянии друг от друга; ПЦР-чип пластинчатого типа, содержащий две или более реакционные камеры, последовательно расположенные таким образом, что места их расположения совпадают с местами расположения двух или более нагревателей, расположенных на термоблоках ПЦР при вхождении в контакт с термоблоками ПЦР; и однонаправленное раздвижное средство, перемещающееся посредством скольжения, сохраняя при этом контакт между ПЦР-чипом и термоблоками ПЦР в состоянии, в котором установлен ПЦР-чип, обеспечивающее последовательный термический контакт между двумя или более реакционными камерами, повторно расположенными от одного до другого края ПЦР-чипа, с двумя или более нагревателями, повторно расположенными от одного до другого края термоблока ПЦР.
Согласно одному из возможных вариантов реализации настоящего изобретения, In one вариант реализации изобретения согласно настоящему изобретению, расположенные по соседству друг с другом нагреватели из двух или более нагревателей отличаются друг от друга по температуре.
Два или более нагревателя размещены таким образом, что первая циркуляция ПЦР происходит в нагревателе, расположенном на одной стороне термоблока ПЦР, а финальная циркуляция происходит в нагревателе, расположенном на другой стороне термоблока ПЦР.
Две или более реакционные камеры ПЦР-чипа расположены и размещены на расстоянии друг от друга в направлении скольжения ПЦР-чипа или в вертикальном направлении, перпендикулярном направлению скольжения, или выполнены в виде реакционных камер канального типа, непрерывно проходящих в вертикальном направлении, перпендикулярном направлению скольжения ПЦР-чипа.
Реакционная камера ПЦР-чипа выполнена в виде полости с общим входом/выходом или в виде канала с раздельными входом и выходом.
ПЦР-устройство дополнительно содержит: источник света для подачи света к реакционным камерам ПЦР-чипа; и световой детектор, служащий для восприятия света, излучаемого областью реакции ПЦР.
Источник света или световой детектор повторно расположены в пространствах между соседними нагревателями ПЦР-термостата и перемещаются, повторяя траекторию движения ПЦР-чипа.
ПЦР-чип содержит электрод обнаружения для восприятия электрохимических сигналов, генерируемых соединением амплифицированных нуклеиновых кислот и редокс-индикатора в реакционной камере. ПЦР-устройство дополнительно содержит модуль измерения электрохимических сигналов, электрически соединенный с электродом обнаружения, служащий для измерения электрохимических сигналов, генерируемых внутри реакционной камеры ПЦР-чипа в реальном масштабе времени.
ПЦР-чип содержит: фиксирующий слой, сформированный в одной области внутренней поверхности реакционной камеры и подверженный поверхностной обработке, с датчиком захвата, способным комплементарно соединяться с одной областью амплифицированных целевых нуклеиновых кислот; электрод обнаружения, выполненный в другой области реакционной камеры, для обнаружения электрохимических сигналов; и композиты с металлическими наночастицами и сигнальные датчики, соединенные с металлическими наночастицами, таким образом, чтобы комплементарно соединяться с другой областью амплифицированных целевых нуклеиновых кислот. Кроме того, ПЦР-устройство дополнительно содержит модуль измерения электрохимических сигналов, электрически соединенный с электродом обнаружения, служащий для измерения электрохимических сигналов, генерируемых внутри реакционной камеры реакционного блока ПЦР.
ПЦР-устройство дополнительно содержит блок хранения чипов, в котором находится определенное количество ПЦР-чипов, соединенных с возможностью управления, таким образом, что первый ПЦР-чип последовательно вступает в термический контакт с термоблоками ПЦР, а затем второй ПЦР-чип вступает в термический контакт с термоблоками ПЦР.
Преимущества изобретения/технический результат
Согласно одному из возможных вариантов реализации настоящего изобретения, предлагаемое ПЦР-устройство обеспечивает возможность быстрого и точного проведения ПЦР с помощью термоблока с повторно расположенными на нем нагревателями, предотвращающего распределение в радиальном направлении тепла, генерируемого отдельными нагревателями, и возникающего вследствие этого неоднородного перекрытия температур между соседними нагревателями, чем обеспечивается повышение выхода ПЦР и возможность использования общих средств регулирования температуры, что обеспечивает миниатюризацию и интеграцию устройства. Кроме того, предлагаемое ПЦР-устройство обеспечивает возможность одновременной и быстрой амплификации большого количества проб нуклеиновых кислот с помощью ПЦР-термостата с повторно расположенными нагревателями и реакционного блока ПЦР пластинчатого типа, а также возможность измерения последовательно генерируемых оптических или электрохимических сигналов с целью контроля процесса амплификации нуклеиновых кислот в реальном масштабе времени.
Краткое описание чертежей
Фиг. 1 – вид в плане обычного термоблока ПЦР-устройства, имеющего общий нагреватель и реакционную емкость ПЦР пробирочного типа, установленную на термоблоке ПЦР-устройства, а на фиг. 2 представлен вид в боковом разрезе обычного термоблока ПЦР и обычной реакционной камеры ПЦР.
Фиг. 3 – вид в плане обычного термоблока ПЦР с множеством нагревателей, и реакционной емкости типа единого канала, установленного на термоблоке ПЦР.
Фиг. 4 – термоблок ПЦР 100, включающий в себя по меньшей мере два нагревателя 111 и 121, систематически установленные на верхней поверхности подложки 99 на некотором расстоянии друг от друга, согласно предпочтительному варианту реализации настоящего изобретения.
Фиг. 5 – изображение, демонстрирующее расположение нагревателей в термоблоке ПЦР 100, согласно предпочтительному варианту реализации настоящего изобретения.
Фиг. 6 – изображение, демонстрирующее устройство с ПЦР-чипом 900 и по меньшей мере двумя реакционными камерами 910, установленными внутри ПЦР-чипа, согласно предпочтительному варианту реализации настоящего изобретения.
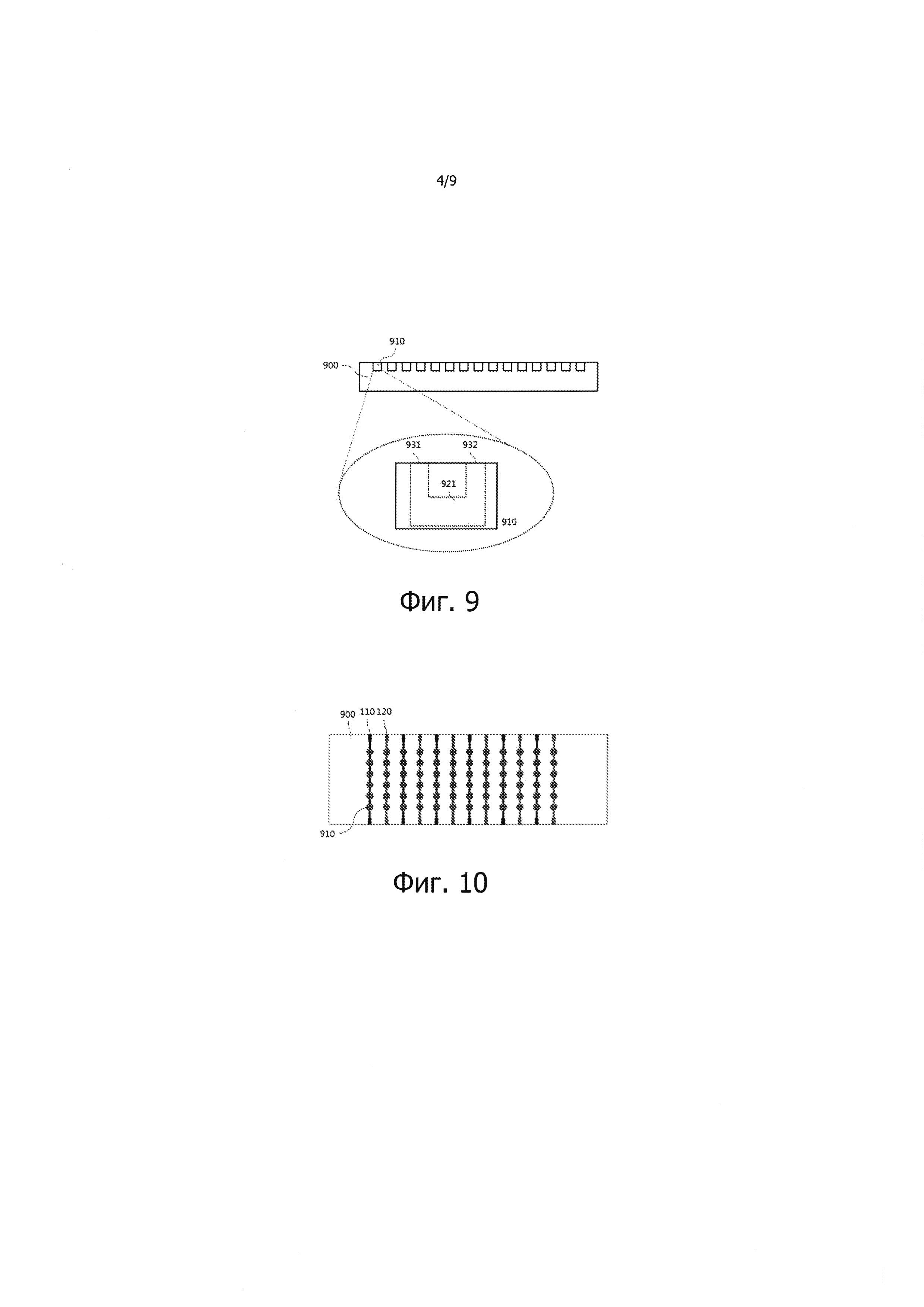
Фиг. 7 - 9 – изображения, показывающие ПЦР-чипы 900 различных типов, согласно предпочтительному варианту реализации настоящего изобретения.
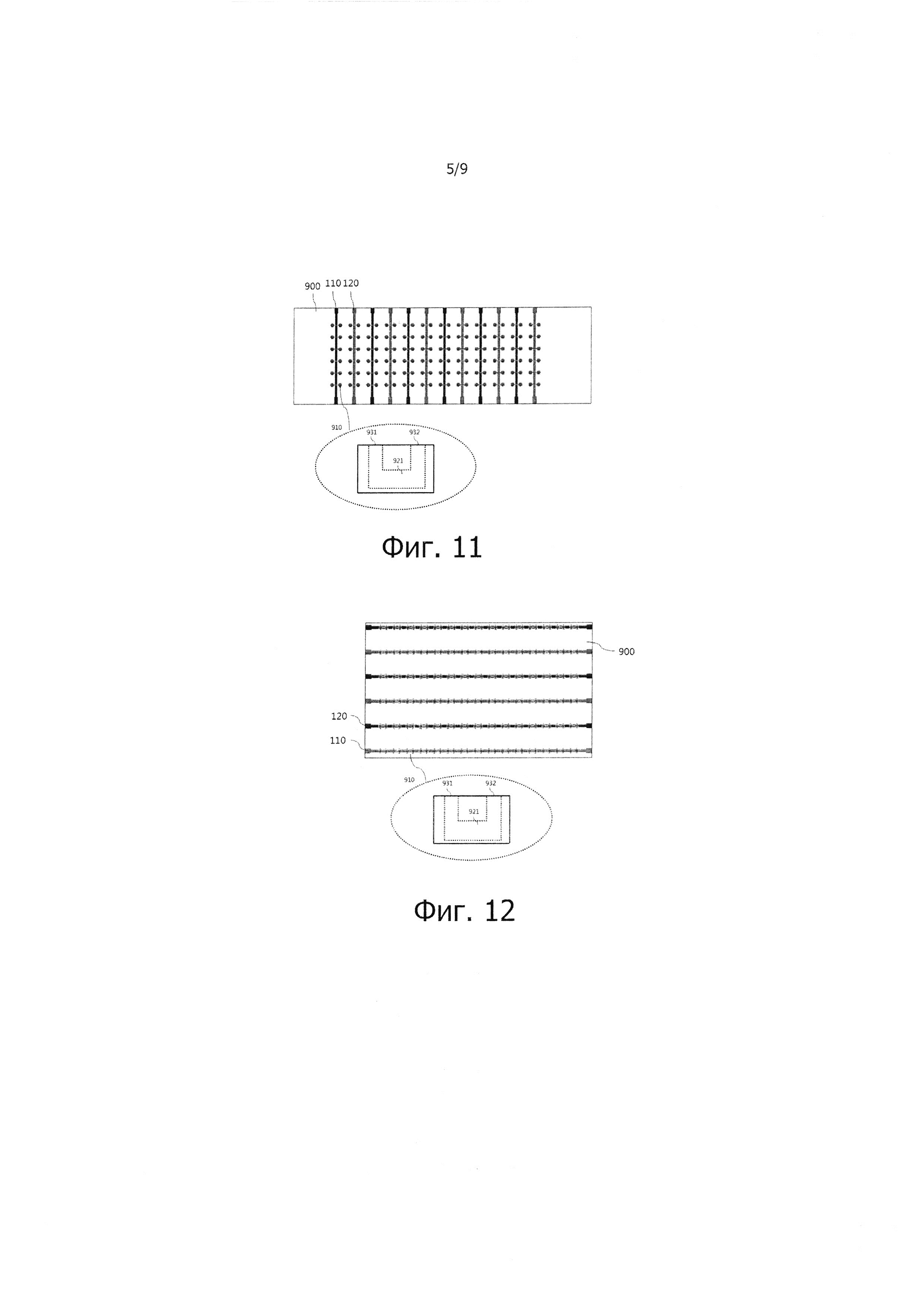
Фиг. 10 - 12 – изображения, демонстрирующее состояние, в котором ПЦР-чипы 900 различных типов и термоблок ПЦР входят в контакт друг с другом.
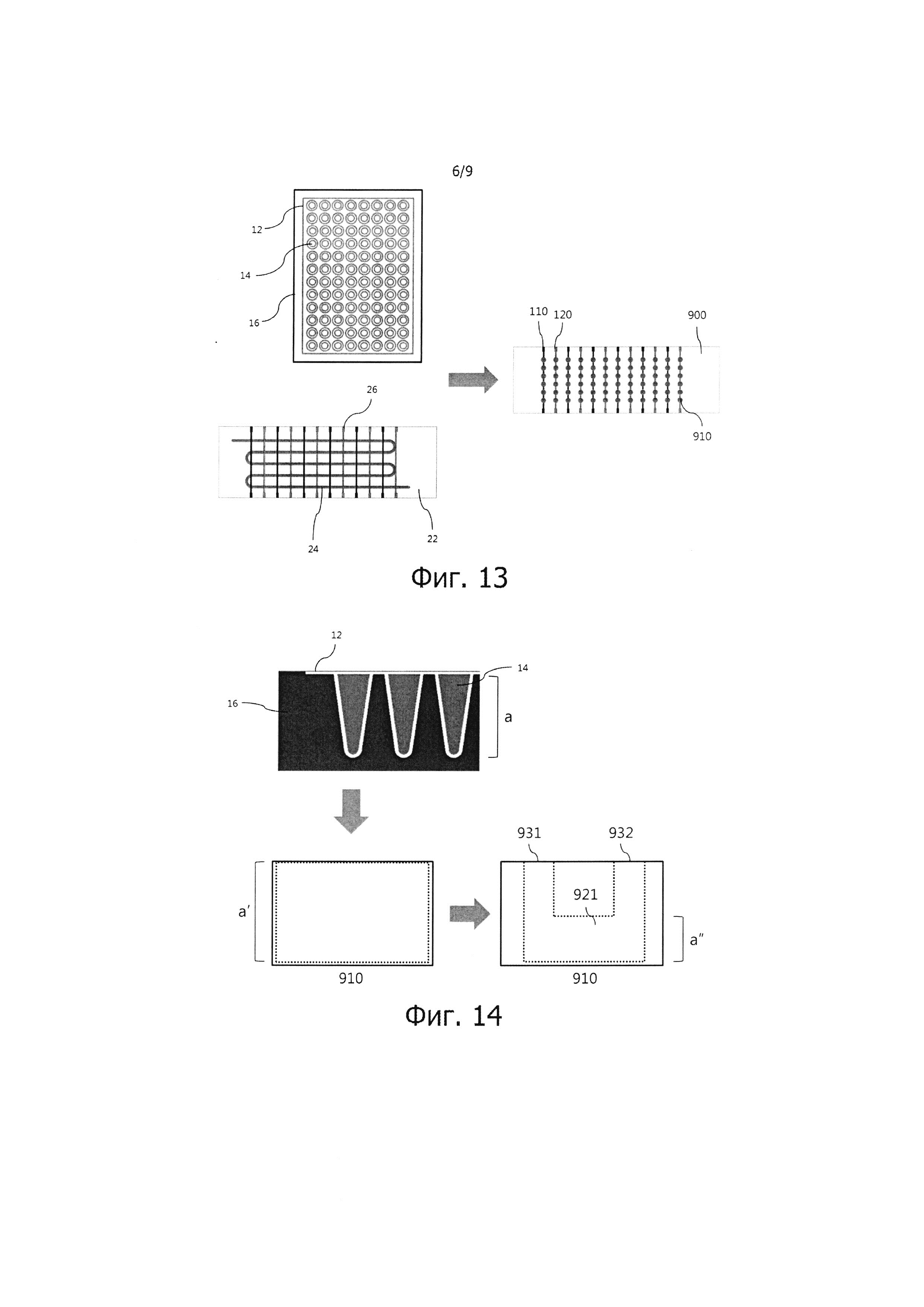
Фиг. 13 и 14 – сравнение ПЦР-чипа согласно предпочтительному варианту реализации настоящего изобретения с обычными реакционными емкостями ПЦР пробирочного типа и с единым каналом.
Фиг. 15 – изображение, демонстрирующее однонаправленное раздвижное средство и принцип проведения ПЦР с помощью данного однонаправленного раздвижного средства согласно предпочтительному варианту реализации настоящего изобретения.
Фиг. 16 - 18 – изображения, демонстрирующие способ проведения ПЦР в реальном масштабе времени в различных ПЦР-устройствах согласно предпочтительному варианту реализации настоящего изобретения.
Фиг. 19 – блок хранения чипов, соединенный с ПЦР-устройством.
Фиг. 20 – фотография электрофореза, демонстрирующая результаты ПЦР-теста на ПЦР-устройстве.
Наилучший вариант реализации изобретения
Ниже приводится описание различных возможных вариантов реализации настоящего изобретения со ссылками на прилагаемые чертежи. Приведенное ниже описание приводится только в качестве примера, для упрощения понимания принципов изобретения, и рассматриваемые примеры никоим образом не ограничивают объем правовой охраны настоящего изобретения.
Согласно варианту реализации настоящего изобретения, ПЦР (полимеразная цепная реакция) представляет собой тип реакции усиления нуклеиновых кислот, имеющих определенную последовательность. Так, например, для усиления ДНК (дезоксирибонуклеиновых кислот) определенной последовательности, в ПЦР-устройстве проводятся: этап денатурации, при котором раствор пробы ПЦР, содержащий двунитиевые ДНК, как матричные нуклеиновые кислоты, и реагент, нагревается до заданной температуры, например, около 95°C, и двунитиевые ДНК разделяются на однонитиевые ДНК; этап отжига, на котором вводится олигонуклеотидный праймер с последовательностью, являющейся комплементарной относительно усиливаемой последовательности ДНК, и охлаждается до заданной температуры, например, до 55°C, вместе с разделенной однонитиевой ДНК, и праймер затем связывается с определенной последовательностью однонитиевой ДНК, образуя частичную структуру "ДНК-праймер"; и этап экстензии (амплификации), на котором раствор выдерживается при определенной температуре, например, при 72°C, после этапа отжига, в результате чего на базе праймера и частичной структуры "ДНК-праймер" с помощью ДНК-полимеразы образуется двунитиевая ДНК. В данном случае, вышеупомянутые три этапа повторно осуществляются 20-40 раз, чтобы обеспечить экспоненциальную амплификацию ДНК с определенной последовательностью. В некоторых случаях, этапы отжига и экстензии (или амплификации) на ПЦР-устройстве выполняются одновременно, и в таком случае ПЦР-устройство осуществляет два этапа, а именно, этап денатурации и этап отжига и экстензии, таким образом, заканчивая первый цикл. Таким образом ПЦР-термостат и ПЦР-устройство, в состав которого входит данный термостат согласно варианту реализации настоящего изобретения, содержит модули, с помощью которых выполняются вышеупомянутые этапы. Предполагается, что подробно не описываемые здесь модули раскрывались ранее для обычных технологий проведения ПЦР или обеспечиваются здесь в пределах очевидного объема настоящего изобретения.
На фиг. 4 показан термоблок ПЦР 100, включающий в себя по меньшей мере два нагревателя 111 и 121, последовательно установленные на верхней поверхности подложки 99 на некотором расстоянии друг от друга, согласно предпочтительному варианту реализации настоящего изобретения.
Как видно из фиг. 4, термоблок 100 согласно предпочтительному варианту реализации настоящего изобретения содержит по меньшей мере два нагревателя 111 и 121, последовательно установленные на верхней поверхности термоблока ПЦР с целью обеспечения подвода тепла к раствору ПЦР. Термоблок ПЦР 100 представляет собой модуль для поддержания заданной температуры, и содержит контактную поверхность с областью реакции ПЦР по меньшей мере на одной поверхности, для подвода тепла к раствору ПЦР, а именно, пробе и реагенту для проведения ПЦР, за счет теплового контакта, чтобы можно было провести ПЦР. Физические или химические свойства подложки 99 не изменяются при повышении температуры нагревателей 111 и 121, установленных на её поверхности, причем подложка выполнена из материала, препятствующего возникновению теплообмена между двумя или несколькими нагревателями. Например, подложка 99 может быть выполнена из материала типа пластика, стекла или силикона, и при необходимости может быть выполнена прозрачной или полупрозрачной. Для обеспечения компактности и интеграции устройства, ПЦР-термостат 100, как правило, изготовляют из тонкой пластины толщиной приблизительно от 50 нм до 1 мм, предпочтительно, около 250 мкм. Однако толщина ПЦР-термостата 100 не ограничивается приведенными выше величинами.
На верхней поверхности ПЦР-термостата 100 на расстоянии друг от друга последовательно установлены два или несколько нагревателей, например, размещенные таким образом, что первая циркуляция ПЦР происходит в нагревателе, расположенном на одной стороне термоблока ПЦР, а финальная циркуляция заканчивается в нагревателе, расположенном на другой стороне термоблока ПЦР. Далее, ПЦР-термостат 100 может иметь различные формы для эффективного подвода тепла к области реакции ПЦР, например, может быть выполнен в форме пластины, канала или стойки, обеспечивающей повышение отношения площади поверхности к объему.
Нагреватели 111 и 121 представляют собой кондуктивные нагревательные элементы, смонтированные на подложке 99, и могут быть выполнены из нагревателей, в которых используется нагрев джоулевым теплом, или термоэлементов, создающих электротермический эффект Пельтье. В то же время, расположенные рядом нагреватели из вышеупомянутых двух или более нагревателей термоблока ПЦР 100 могут иметь другую температуру, и профиль распределения температур между соседними нагревателями может повторяться комбинацией определенного количества нагревателей. Например, температура первого нагревателя составляет 95°C, второго нагревателя 55°C, и третьего нагревателя 72°C, и такой температурный профиль может повторяться 10, 20, 30 или 40 раз. Как вариант, первый нагреватель может быть нагрет до 95°C, температура второго может составлять 72°C, и температура третьего также 72°C, и такой температурный профиль может повторяться 10, 20, 30 или 40 раз. Таким образом, два или более нагревателя ПЦР-термостата 100 размещены таким образом, что первая циркуляция ПЦР происходит в нагревателе (с температурой 95°C), расположенном на одной стороне термоблока ПЦР, а финальная циркуляция происходит в нагревателе (с температурой 72°C), расположенном на другой стороне термоблока ПЦР.
Нагреватели 111 и 121 функционально соединены с различными блоками питания и регулирования для поддержания заданной температуры, а также с датчиками, контролирующими температуры нагревателей. С целью обеспечения постоянного поддержания внутренних температур нагревателей 111 и 121, электроды этих элементов, т.е. электроды нагревателей размещены симметрично в направлениях вверх-вниз и/или влево-вправо относительно центральных точек поверхностей данных нагревателей. Кроме того, для обеспечения быстрой передачи тепла и высокой теплопроводности нагреватели 111 и 121 изготовлены из одного или нескольких материалов, выбираемых из группы, в состав которой входят хром, алюминий, медь, железо, серебро и углерод, или из композиционных материалов на базе вышеуказанных. Однако материалы для изготовления нагревателей не ограничиваются указанными выше. Помимо этого, нагреватели 111 и 121 могут изготовляться из одного или нескольких материалов, выбираемых из группы, в состав которой входят теплопроводные наночастицы, содержащие светопроницаемые нагревательные элементы, например, оксидный полупроводник и материал с добавками, выбираемыми из группы, в состав которой входят In, Sb, Al, Ga, C и Sn, которые добавляют к оксидному полупроводнику, оксиду индия и олова, проводящему полимеру, углеродной нанотрубке и графену.
В случае, если два нагревателя 111 и 121 установлены на ПЦР-термостате 100 дважды, чтобы осуществлять два этапа ПЦР, т.е. этап денатурации и этап отжига/экстензии, продолжительность ПЦР меньше продолжительности, которая требуется для проведения ПЦР, состоящей из трех этапов, а именно, денатурации, отжига и экстензии. Кроме того, поскольку количество нагревателей уменьшено, это обеспечивает дополнительные преимущества, заключающиеся в упрощении конструкции и повышении её прочности. При проведении ПЦР с помощью трех этапов температура этапа денатурации составляет приблизительно от 85°C до 105°C, предпочтительно, 95°C, температура этапа отжига составляет от 40°C до 60°C, предпочтительно, 50°C, и температура этапа экстензии составляет от 50°C до 80°C, предпочтительно, 72°C. При проведении ПЦР с помощью двух этапов температура этапа денатурации составляет приблизительно от 85°C до 105°C, предпочтительно, 95°C, и температура этапа отжига/экстензии составляет 50°C до 80°C, предпочтительно, 72°C. Однако разумеется, указанные температуры и диапазоны температур ПЦР могут корректироваться в известных пределах.
Как было указано выше, два или более нагревателя 111 и 121, поддерживающих заданные температуры, последовательно установлены на верхней поверхности ПЦР-термостата 100 на расстоянии друг от друга, таким образом, увеличивая скорость нагрева. В обычном устройстве с общим нагревателем скорость нагрева составляет от 3°C до 7°C в секунду. Однако для варианта реализации настоящего изобретения с последовательно установленными нагревателями скорость нагрева в пространстве между нагревателями составляет порядка от 20°C до 40°C в секунду, что обеспечивает уменьшение времени ПЦР. В варианте реализации с последовательно установленными нагревателями можно точно контролировать температуры этапов денатурации, отжига и экстензии (или этапов денатурации и отжига/экстензии), а также можно поддерживать заданные температуры или диапазоны температур только в областях, на которые поступает тепло от нагревателей. Кроме того, на ПЦР-термостате 100 последовательно установлены различные количества нагревателей 10 и 20, что дает возможность получать разные продолжительности цикла ПЦР. Например, при ПЦР, проводимом в 10 циклов, последовательно устанавливаются 20 или 30 нагревателей. Иными словами, в соответствии с заданным количеством циклов ПЦР, на ПЦР-термостате 100 нагреватели можно последовательно устанавливать 10, 20, 30, 40 или 50 раз.
На фиг. 5 показан ПЦР-термостат 100 согласно настоящему изобретению с блоком питания 200, обеспечивающим подачу питания на нагреватели, последовательно установленные на ПЦР-термостате 100. Более подробно, в верхней части Фиг. 5 показан вид в вертикальном разрезе ПЦР-термостата 100, а в нижней части Фиг. 5 представлен вид в плане ПЦР-термостата 100. Как видно из фиг. 5, ПЦР-термостат 100 содержит 20 последовательно установленных нагревателей. Блок питания 200 представляет собой модуль, обеспечивающий подачу питания на ПЦР-термостат 100 от источника питания с целью нагрева ПЦР-термостата 100; этот модуль содержит также первый и второй распределенные проволочные элементы 210 и 220, служащие для подачи питания на нагреватели 110 и 120. Например, как показано на фиг. 5, первый распределенный проволочный элемент 210 ПЦР-термостата 100 служит для подачи питания на первые нагреватели 110, а второй распределенный проволочный элемент 220 ПЦР-термостата 100 служит для подачи питания на вторые нагреватели 120. Если первые нагреватели 110 поддерживают температуру этапа денатурации ПЦР, например, температуру от 85°C до 105°C, и вторые нагреватели 120 поддерживают температуру этапа отжига/экстензии ПЦР, например, температуру от 50°C до 80°C, первый распределенный проволочный элемент 210 получает питание для поддержания температуры этапа денатурации ПЦР от блока питания 200, и второй распределенный проволочный элемент 220 получает питание для поддержания температуры этапа отжиг/экстензии ПЦР от блока питания 200. Первый распределенный проволочный элемент 210 и второй распределенный проволочный элемент 220 выполнены из электропроводного материала, такого как золото, серебро, медь и т.д., но могут выполняться также и из других материалов. Источник питания представляет собой модуль, обеспечивающий подачу питания на блок питания 200, и он соединен, соответственно, с первым распределенным проволочным элементом 210 и вторым распределенным проволочным элементом 220 блока питания 200. При проведении ПЦР, например, первый порт электропитания источников питания 400 электрически соединен с первым распределенным проволочным элементом 210, а второй порт электропитания источников питания 400 электрически соединен со вторым распределенным проволочным элементом 220. Затем, при поступлении от пользователя команды на проведение ПЦР, источник питания начинает подачу питания на первый распределенный проволочный элемент 210 и второй распределенный проволочный элемент 220, в результате чего происходит быстрый нагрев первого нагревателя и второго нагревателя ПЦР-термостата 100. Если температуры нагревателей достигают заданных значений, источник питания регулирует количество питания, подаваемого для поддержания заданных температур нагревателей.
На фиг. 6 приведено изображение, демонстрирующее устройство с ПЦР-чипом 900 и по меньшей мере двумя реакционными камерами 910, установленными внутри ПЦР-чипа, согласно предпочтительному варианту реализации настоящего изобретения, и на фиг. 7 - 9 показаны ПЦР-чипы 900 различных типов согласно предпочтительному варианту реализации настоящего изобретения.
Как видно из фиг. 6, ПЦР-чип 900 согласно предпочтительному варианту реализации настоящего изобретения, выполненный в форме пластины, контактирует с верхней поверхностью термоблока ПЦР 100, содержащего нагреватели 110 и 120, и содержит две или более реакционные камеры 910 и 920, последовательно установленные, таким образом, чтобы при контакте их расположение соответствовало расположению двух или более нагревателей 110 и 120, установленных на термоблоке ПЦР 100. Как было указано выше, на фиг. 7 - 9 показаны ПЦР-чипы 900 различных типов согласно предпочтительному варианту реализации настоящего изобретения.
Реакционная камера представляет собой полость, в которую вводится раствор пробы ПЦР, содержащий двунитиевые ДНК как матричные нуклеиновые кислоты и реагент для амплификации определенных последовательностей ДНК (дезоксирибонуклеиновых кислот). В одном из возможных вариантов реализации настоящего изобретения, реакционная камера входит в область нагревателя в термоблоке ПЦР 100, когда входит в термический контакт с термоблоком ПЦР 100 для выполнения ПЦР. В то же время, ПЦР-чип, как правило, выполняется в виде пластины, так что тепло равномерно передается к реакционным камерам, когда ПЦР-чип входит в термический контакт с термоблоком ПЦР 100.
Как видно из фиг. 7, на выполненном в форме пластины чипе последовательно установлены по меньшей мере две реакционные камеры 910. Далее, реакционные камеры 910 могут быть расположены как в продольном направлении, так и в вертикальном направлении, т.е. в направлении, перпендикулярном продольному. В данном случае реакционные камеры 910 могут содержать как одинаковые, так и разные пробы ПЦР и реагенты, и в данном случае, на одном ПЦР-чипе 900 выполняются ПЦР по меньшей мере с двумя или с разными пробами.
Как показано на фиг. 8, две или более реакционные камеры 910 пластинчатой формы последовательно размещены и могут быть выполнены в виде канала, непрерывно проходящего в вертикальном направлении, перпендикулярном продольному направлению чипа. В данном случае реакционные камеры 910 могут содержать как одинаковые, так и разные пробы ПЦР и реагенты, и в данном случае, на одном ПЦР-чипе 900 выполняются ПЦР по меньшей мере с двумя или с разными пробами.
Кроме того, реакционные камеры 910 ПЦР-чипа 900, изображенные на фиг. 7 и 8, выполнены в виде полостей с объединенным входом и выходом. Однако, как показано на фиг. 9, реакционная камера 910 ПЦР-чипа 900 может иметь отдельные вход и выход канального типа, когда вход 931 и выход 932 выполнены отдельными и соединены друг с другом единым каналом 921. Обычный ПЦР-чип пластинчатого типа с множеством полостей имеет низкое отношение поверхности к объему и требует длительного времени ПЦР вследствие большого объема проб. И, наоборот, ПЦР-чип с реакционными камерами с отдельными входами и выходами канального типа, согласно предпочтительному варианту реализации настоящего изобретения, имеет высокое отношение поверхности к объему, что обеспечивает значительное уменьшение времени ПЦР. Величину высоты канала внутри реакционной камеры можно выбирать в диапазоне от 0,01 мкм до 5 мм, однако, предпочтительней выбирать меньшие значения высоты канала, чтобы получать более высокие отношения поверхности к объему.
ПЦР-чип 900 согласно предпочтительному варианту реализации настоящего изобретения содержит: первую пластину, контактирующую с термоблоком ПЦР 100; вторую пластину, установленную на первой пластине и содержащую две или более реакционные камеры, и третью пластину, установленную на второй пластине и содержащую вход и выход для одной или нескольких реакционных камер. Как было указано выше, ПЦР-чип 900 выполнен в виде ламинированной пластины, что обеспечивает простоту технологии производства и низкие производственные затраты, а также увеличивает поверхность теплообмена с термоблоком ПЦР 100. ПЦР-чип 900 может быть выполнен из различны материалов, предпочтительно, из тонкой пластиковой пленки. Кроме того, ПЦР-чип 900 изготовляется из светопрозрачного материала, и если он используется для оптических измерений ПЦР в реальном масштабе времени, таких как флуоресцентные, фосфоресцентные или люминесцентные измерения, раман-спектроскопия, поверхностно усиленное рамановское рассеяние и поверхностный плазмонный резонанс, реакционный блок ПЦР 300, предпочтительно, изготовляется из светопрозрачного материала.
Первую пластину приклеивают или прикрепляют к термоблоку ПЦР 100, и на неё поступает тепло от термоблока ПЦР 100. Первую пластину изготовляют из различных материалов, предпочтительно, из материала, выбираемого из группы, включающей в себя полидиметилсилоксан (ПДМС), циклоолефиновый сополимер (ЦОС), полиметилметакрилат (ПММА), поликарбонат (ПК), полипропиленкарбонат (ППК), полиэфирсульфон (ПЭС), полиэтилентерефталат (ПЭТ), а также комбинации указанных материалов. Затем, на верхнюю поверхность первой пластины 310 наносят гидрофильное вещество (не показано) для обеспечения мягкого проведения ПЦР. После нанесения гидрофильного вещества на поверхности первой пластины 310 образуется единый слой данного гидрофильного вещества. Гидрофильное вещество может включать в себя различные вещества, предпочтительно, содержит материал, выбираемый из группы, в состав которой входят карбоксильная группа (-COOH), аминогруппа (-NH2), гидроксильная группа (-OH) и сульфонная группа (-SH). Обработка поверхности гидрофильным веществом производится по технологии, известной в уровне техники.
Сверху первой пластины 310 помещают вторую пластину. Вторая пластина содержит две или более реакционные камеры. Соответственно, целевой раствор пробы, подлежащий амплификации, вводится в две или более реакционные камеры, и затем проводится ПЦР. Далее, вторая пластина 320 изготовляется из различных материалов, предпочтительно, из термопластичной смолы или термореактивной смолы, выбираемых из группы, включающей в полиметилметакрилат (ПММА), поликарбонат (ПК), циклоолефиновый сополимер (ЦОС), полиамид (PA), полиэтилен (ПЭ), полипропилен (ПП), полифениленэфир (ПФЭ), полистирол (ПС), полиоксиметилен (ПОМ), полиэфирэфиркетон (ПЭЭК), политетрафторэтилен (ПТФЭ), поливинилхлорид (ПВХ), поливинилиденфторид (ПВДФ), полибутилентерефталат (ПБТ), фторированный этиленпропилен (ФЭП), перфторалкоксиалкан (ПФА), а также комбинации вышеуказанных материалов. Кроме того, вторая пластина имеет различную толщину, предпочтительно, от 0,01 мкм до 5 мм. Реакционные камеры могут иметь различные величины ширины и длины, предпочтительно, ширину от 0,001 мм до 10 мм, и длину от 1 мм до 400 мм. Кроме того, внутренняя стенка второй пластины покрывают материалом силановой группы, альбумином сыворотки КРС (BSA) и т.р., с целью предотвращения поглощения протеина данной поверхностью. Обработка поверхности данным материалом производится по технологии, известной в уровне техники.
Сверху второй пластины помещают третью пластину. Третья пластина содержит вход, выполненный в одной области данной пластины на каждой реакционной камере, выполненной на второй пластине, и выход, выполненный в другой области данной пластины на каждой реакционной камере. Вход – это участок, в который вводится целевой раствор пробы, содержащий нуклеиновые кислоты, подлежащие амплификации. Выход – это участок, через который выводится целевой раствор пробы по окончании ПЦР. Как указывалось выше, вход и выход могут быть выполненными объединенными или отдельными, и внутренние поверхности входа и выхода последовательно соединены с внутренними поверхностями двух или более реакционных камер второй пластины. Третью пластину изготовляют из различных материалов, предпочтительно, из материала, выбираемого из группы, включающей в себя полидиметилсилоксан (ПДМС), циклоолефиновый сополимер (ЦОС), полиметилметакрилат (ПММА), поликарбонат (ПК), полипропиленкарбонат (ППК), полиэфирсульфон (ПЭС), полиэтилентерефталат (ПЭТ), а также комбинации указанных материалов. Далее, вход имеет различные размеры, предпочтительно, его диаметр составляет от 0,001 мм до 10 мм. Далее, выход имеет различные размеры, предпочтительно, его диаметр составляет от 0,001 мм до 10 мм. Кроме того, на входе и выходе предусмотрены закрывающие средства для предотвращения утечки целевого раствора пробы в двух или более реакционных камерах при проведении ПЦР для данного раствора. Закрывающие средства могут иметь различные формы, размеры, и могут быть выполнены из разных материалов. Кроме того, третья пластина имеет различную толщину, предпочтительно, от 0,001 мм до 10 мм.
ПЦР-чип 900 можно легко изготовить с помощью способа, включающего в себя следующие операции: обеспечение третьей пластины, имеющей вход и выход, сформированные посредством механической обработки; формирование двух или более реакционных камер на участках, положение которых соответствует расположению входа и выхода третьей пластины, на пластине, размер которой соответствует размеру нижней поверхности третьей пластины, посредством механической обработки, с целью создания второй пластины; формирование поверхности, содержащей гидрофильное вещество на верхней поверхности пластины, размер которой соответствует размеру нижней поверхности второй пластины, посредством обработки поверхности, с целью создания первой пластины; и приклеивание нижней поверхности третьей пластины к верхней поверхности второй пластины, и приклеивание нижней поверхности второй пластины к верхней поверхности первой пластины.
Вход и выход третьей пластины и двух или более реакционных камер второй пластины формируют с помощью способа механической обработки, выбираемого из группы, в состав которой входят инжекционная формовка, горячее тиснение, литье и лазерная абляция. Кроме того, нанесение гидрофильного вещества на поверхность первой пластины осуществляется с помощью способа, выбираемого из группы, в состав которой входят кислородная и аргоновая плазменная обработка, обработка коронным разрядом и покрытие поверхностно-активным веществом (ПАВ), а обработка гидрофильного вещества производится с помощью известных способов. Кроме того, приклеивание нижней поверхности третьей пластины к верхней поверхности второй пластины, а также приклеивание нижней поверхности второй пластины к верхней поверхности первой пластины осуществляется с помощью термоклея, ультразвуковой сварки, склеивания растворителем, сварки нагретой пластиной, ультрафиолетового склеивания и склеивания под давлением, производимого по известной технологии. Кроме того, в зазоры между третьей пластиной и второй пластиной, а также между второй пластиной и первой пластиной могут вводиться двусторонние адгезивы, термопластичная смола или термореактивная смола.
На фиг. 10 - 12 показано состояние, в котором ПЦР-чипы 900 различных типов и термоблок ПЦР контактируют друг с другом.
Как показано на фиг. 10, ПЦР-чип 900 содержит реакционные камеры 910 типа полости с объединенными входом и выходом, причем данные реакционные камеры 910 размещены таким образом, что их расположение соответствует расположению нагревателей 110 и 120 термоблока ПЦР. Как видно из фиг. 11, ПЦР-чип 900 содержит реакционные камеры 910 с раздельными входом и выходом, причем данные реакционные камеры 910 размещены таким образом, что их расположение соответствует расположению нагревателей 110 и 120 термоблока ПЦР в вертикальном направлении. На фиг. 12 показан ПЦР-чип 900, содержащий реакционные камеры 910 с раздельными входом и выходом, причем данные реакционные камеры 910 размещены таким образом, что их расположение соответствует расположению нагревателей 110 и 120 термоблока ПЦР в горизонтальном направлении.
Применение ПЦР-чипа согласно варианту реализации настоящего изобретения повышает компактность ПЦР-устройства по сравнению с обычной реакционной емкостью ПЦР и способствует более эффективному выполнению ПЦР. Как видно из фиг. 13, ПЦР-чип согласно настоящему изобретению обеспечивает возможность одновременного проведения ПЦР на большем количестве проб различных типов, чем обычная реакционная емкость ПЦР пробирочного типа с общим нагревателем, что значительно сокращает время проведения ПЦР и существенно уменьшает размеры емкости. Кроме того, ПЦР-чип согласно настоящему изобретению может одновременно проводить ПЦР на большем количестве проб различных типов, чем обычная реакционная емкость ПЦР одноканального типа со множеством нагревателей, что уменьшает время проведения ПЦР для партии проб и значительно повышает плотность ПЦР-устройства, поскольку ПЦР-чип согласно настоящему изобретению не нуждается в модуле регулирования расхода для канала. На фиг. 14 показан еще один возможный вариант реализации настоящего изобретения, обеспечивающий минимизацию объема проб благодаря миниатюризации ПЦР-чипа и увеличение поверхности термического контакта между нагревателем, а именно, термоблоком, и пробами, с целью обеспечения более высокого отношения поверхности к объему (a
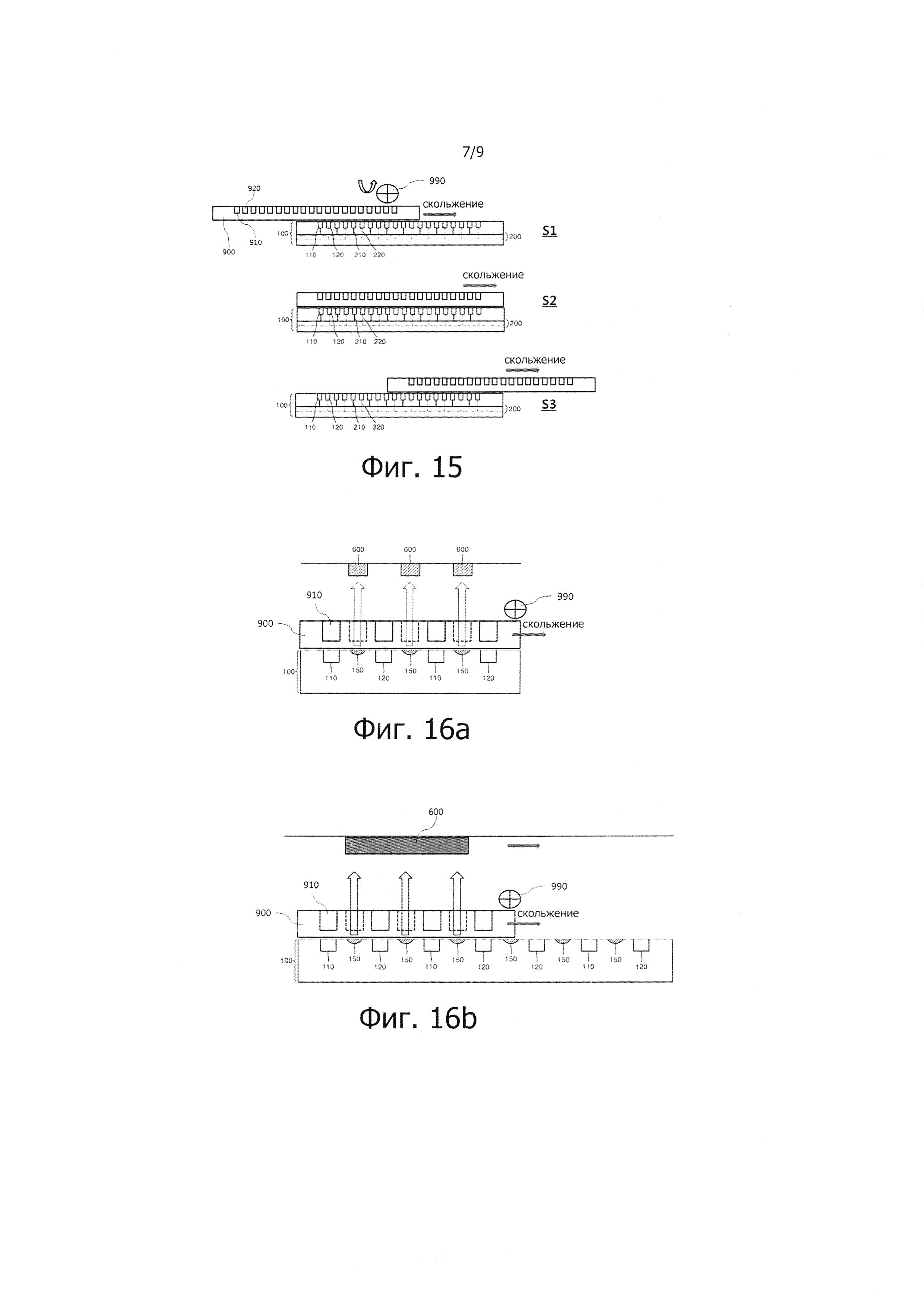
На фиг. 15 изображено однонаправленное раздвижное средство и принцип проведения ПЦР с помощью данного однонаправленного раздвижного средства согласно предпочтительному варианту реализации настоящего изобретения.
На фиг. 15 показаны этапы (S1 - S3) проведения ПЦР с помощью ПЦР-устройства, содержащего термоблок ПЦР 100, блок питания 200, ПЦР-чип 900 и однонаправленное раздвижное средство 990. Однонаправленное раздвижное средство 990 перемещается путем скольжения, сохраняя при этом контакт между ПЦР-чипом 900 и термоблоком ПЦР 100 в состоянии, в котором установлен ПЦР-чип 900. При скольжении однонаправленного раздвижного средства имеет место последовательный термический контакт между двумя или более реакционными камерами 910, последовательно установленными от одного до другого края ПЦР-чипа 900, с двумя или более нагревателями 110 и 120, расположенными от одного до другого края термоблока ПЦР 100.
На первом этапе приготовляют раствор ПЦР, содержащий целевые двунитиевые ДНК, олигонуклеотидный праймер, содержащий подлежащую амплификации комплементарную последовательность, ДНК-полимеразу, дезоксирибонуклеозид-трифосфаты (dNTP) и буферный раствор ПЦР. Затем раствор ПЦР вводят в реакционные камеры ПЦР-чипа 900, после чего герметично закрывают данные реакционные камеры. После этого производят подсоединение блока питания 200, а именно, первый проволочный элемент 210 и второй проволочный элемент 220 соединяют с источником питания. Затем производят нагрев первого нагревателя 110 и второго нагревателя 120 с помощью первого проволочного элемента 210 и второго проволочного элемента 220, и поддерживают температуру проведения ПЦР, а именно, 95°C, для этапа денатурации ПЦР, в случае первого нагревателя 110, и температуру 72°C для этапа отжига/экстензии ПЦР в случае второго нагревателя 120.
На этапах S1 - S3 две или более реакционные камеры 910 ПЦР-чипа 900 могут содержать одни и те же или разные ПЦР- пробы и реагенты, а нагреватели 110 и 120 последовательно установлены на термоблоке ПЦР 100, таким образом, чтобы выполнять два этапа ПЦР путем подачи питания от блока питания 200, т.е. таким образом, что первый нагреватель 110 будет поддерживать температуру 95°C для этапа денатурации, второй нагреватель 120 будет поддерживать температуру 72°C для этапа отжига/экстензии, причем указанные температуры 95°C и 72°C последовательно поддерживаются 20 нагревателями.
В начале этапа S1 однонаправленное раздвижное средство 990 обеспечивает контакт ПЦР-чипа 900 с одним краем термоблока ПЦР 100, после чего ПЦР-чип 900 начинает скользить. Иными словами, первая реакционная камера 910 правого края ПЦР-чипа 900 входит в термический контакт с первым нагревателем 110 левого края термоблока ПЦР 100, и начинается этап денатурации ПЦР.
На этапе S2 однонаправленное раздвижное средство 990 обеспечивает непрерывное скольжение ПЦР-чипа 900 при сохранении контакта с верхней поверхностью термоблока 100, с целью последовательного выполнения ПЦР. Например, при скольжении ПЦР-чипа 900 первая реакционная камера 910 правого края ПЦР-чипа 900 вступает в термический контакт со вторым нагревателем 120 левой стороны термоблока 100 для выполнения этапа отжига/экстензии, а вторая реакционная камера 920 правого края ПЦР-чипа 900 вступает в термический контакт с первым нагревателем 110 левого края термоблока ПЦР 100 для выполнения этапа денатурации, таким образом, что ПЦР-чип 900 последовательно выполняет ПЦР путем обеспечения повторных термических контактов между реакционными камерами, последовательно установленными на правой стороне ПЦР-чипа 900, и нагревателями, последовательно установленными на левой стороне термоблока ПЦР 100.
На этапе S3 ПЦР-чип 900 с помощью однонаправленного раздвижного средства 990 скользит по верхней поверхности термоблока 100, сохраняя с ней непрерывный контакт, и затем завершает ПЦР. Например, реакционная камера левой стороны ПЦР-чипа 900 вступает в термический контакт с нагревателем на правой стороне термоблока 100 для выполнения этапа отжига/экстензии, завершая, таким образом, последовательное проведение ПЦР.
Разумеется, после выполнения этапов S1 и S2, однонаправленное раздвижное средство 990 может повторять выполнение этапов S1 - S3 путем скольжения в обратном направлении после завершения скольжения в направлении вперед. Таким образом, ПЦР-устройство согласно варианту реализации настоящего изобретения может быстро осуществлять ПЦР при сохранении термического контакта между термоблоком ПЦР и ПЦР-чипом, содержащим камеру ПЦР, без применения различных усложненных модулей, обеспечивая миниатюризацию и интеграцию устройства.
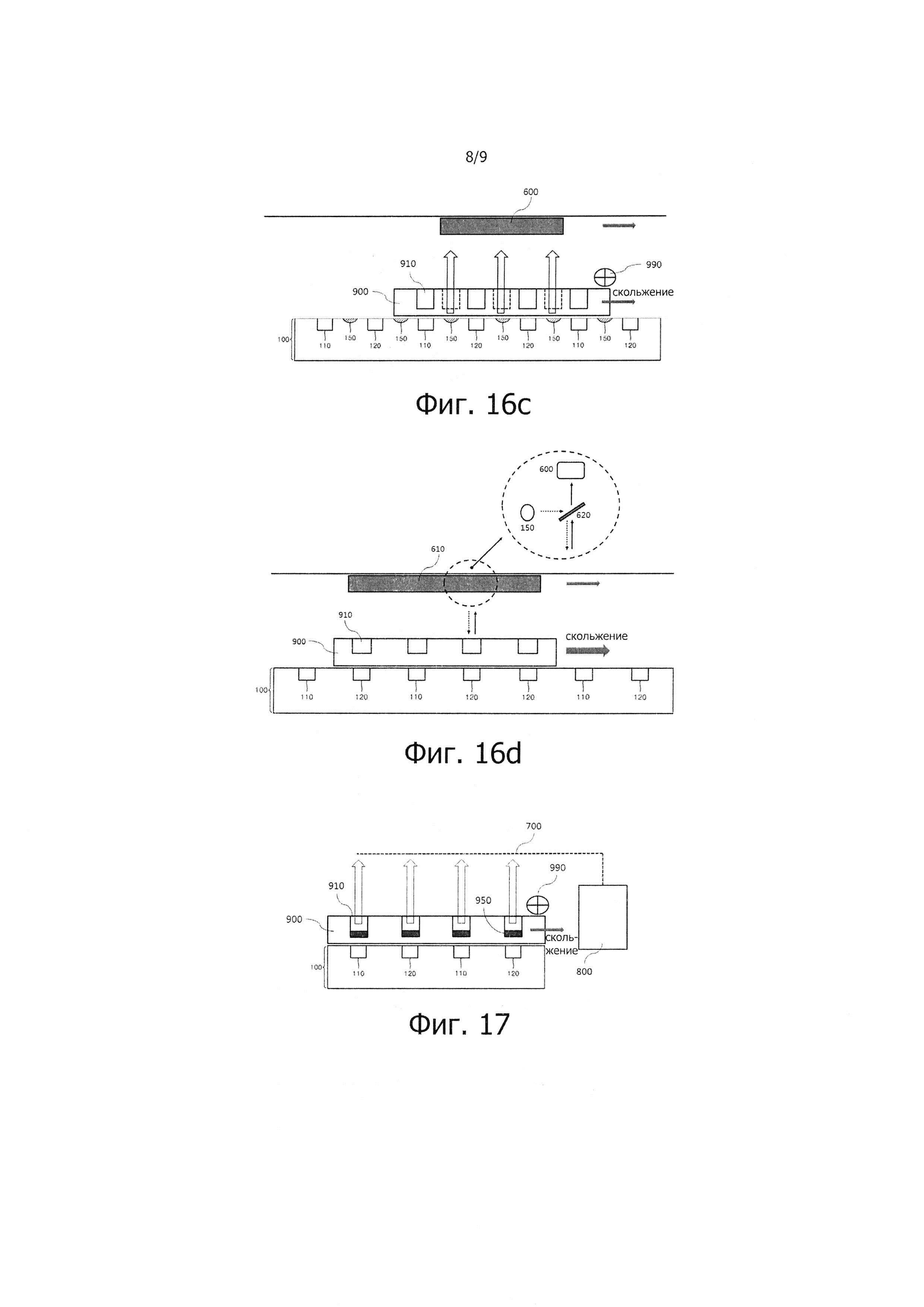
На фиг. 16 - 18 изображен способ проведения ПЦР в реальном масштабе времени с помощью различных ПЦР-устройств согласно предпочтительным вариантам реализации настоящего изобретения.
На фиг. 16a - 16d изображен способ проведения ПЦР в реальном масштабе времени с помощью ПЦР-устройства согласно возможному варианту реализации настоящего изобретения. ПЦР-устройство содержит оптический модуль для измерения в реальном масштабе времени амплификации нуклеиновых кислот, происходящей в реакционной камере 910 ПЦР-чипа 900. Оптический модуль содержит: источник света 150 подачи света к реакционной камере 910 ПЦР-чипа 900 и световой детектор 600 для приема излучения, получаемого из ПЦР-чипа 900. Для измерения амплификации нуклеиновых кислот в реальном масштабе времени с помощью оптического модуля в целевой раствор пробы добавляют флуоресцентное вещество, которое испускает световое излучение определенной волны в зависимости от продуктов, генерируемых в результате ПЦР, создавая тем самым оптические сигналы, которые можно измерять и анализировать. Источник света 150 выбирают из группы, в состав которой входят ртутная дуговая лампа, ксеноновая дуговая лампа, лампа с вольфрамовыми электродами, металлогалогенная лампа, металлогалогенидное волокно и светоизлучающие диоды (СИД). Кроме того, источник света 150 создает излучение с длиной волны приблизительно от 200 до 1300 нм, или может представлять собой многоволновой источник, включающий в себя несколько источников света или фильтры. Кроме того, световой детектор 600 выбирают из группы, в состав которой входят прибор с зарядовой связью (ПЗС), прибор с зарядовой инжекцией (ПЗИ), детектор на КМОП-структурах (КМОП) и фотоумножительная трубка (ФУТ). В одном из возможных вариантов реализации настоящего изобретения, источник света 150 и световой детектор 600 могут соединяться с возможностью управления с различными модулями для повышения эффективности обнаружения. Например, источник света 150 может также содержать или может быть соединен с возможностью управления с одним или несколькими оптическими полосовыми фильтрами, пропускающими лишь свет диапазона длин волн, испускаемый флуоресцентным веществом. В таком случае, источник света 150 или световой детектор 600 могут также содержать или могут быть соединены с возможностью управления с замещающим элементом, способным совмещать длину возбужденной волны и длину волны излучения, создаваемого флуоресцентным веществом, друг с другом, в одном или нескольких оптических полосовых фильтрах. Кроме того, источник света 150 может также содержать или может быть соединен с возможностью управления со светоизлучающим диодом (СИД), используя одну или несколько длин волн для возбуждения одного или нескольких флуоресцентных веществ. В таком случае, источник света 150 может также содержать или может быть соединен с возможностью управления с замещающим элементом, способным совмещать длину возбужденной волны и длину волны излучения, создаваемого одним или несколькими флуоресцентными веществами, друг с другом, в светодиодном источнике света.
Как видно из фиг. 16a, ПЦР-устройство содержит: ПЦР-чип 900, выполненный из светопрозрачного материала, источник света 150, расположенный между первым нагревателем 110 и вторым нагревателем 120 термоблока ПЦР 100, и световой детектор 600 для обнаружения оптического сигнала, подаваемого источником света 150. Более подробно, раствор ПЦР, содержащий целевой раствор пробы скользит, перемещаясь на участки, соответствующие верхнему участку первого нагревателя 110 и участку, соответствующему верхнему участку второго нагревателя 120 в каждой реакционной камере 910, выполняя, таким образом, этап денатурации ПЦР и этап отжига/экстензии ПЦР. В данном случае, целевой раствор пробы перемещается на участок, соответствующий верхнему участку источника света 150 между первым нагревателем 110 и вторым нагревателем 120 и между блоками нагревателей, каждый из которых содержит первый нагреватель 110 и второй нагреватель 120. Когда содержащая целевой раствор пробы реакционная камера 910 перемещается на расстояние, соответствующее верхнему участку источника света 150, ПЦР-чип 900 перемещается медленно или на мгновение останавливается, будучи управляемый однонаправленным раздвижным средством 990. После этого источник света 150 начинает излучать свет, излучаемый свет проходит ПЦР-чип 900, точнее, реакционную камеру 910, и затем световой детектор 600 измеряет и анализирует оптический сигнал, сгенерированный за счет амплификации нуклеиновых кислот в реакционной камере 910. Таким образом, во время циклов ПЦР в реальном масштабе времени осуществляется измерение результатов реакции амплификации нуклеиновых кислот, соединенных с флуоресцентным веществом, в реакционных каналах 303, что позволяет замерять и анализировать количество целевых ДНК в реальном масштабе времени.
В отличие от ПЦР-устройства, показанного на фиг. 16a, ПЦР-устройство, изображенное на фиг. 16b - 16c, содержит: ПЦР-чип 900, изготовленный из прозрачно-отражающего материала, таким образом, что верхний слой изготовлен из светопрозрачного материала, а нижний слой выполнен из непрозрачного материала; источник света 150, установленный между первым нагревателем 110 и вторым нагревателем 120 термоблока ПЦР; и световой детектор 600, который перемещается в соответствии с перемещением ПЦР-чипа 900 для обнаружения оптического сигнала, генерируемого источником света 150. В данном случае, разумеется, световой детектор 600 неподвижен, но источник света 150 может перемещаться, повторяя траекторию движения ПЦР-чипа 900. Показанное на фиг. 16d ПЦР-устройство содержит: ПЦР-чип 900, изготовленный из прозрачно-отражающего материала, таким образом, что верхний слой выполнен из светопрозрачного материала, а нижний слой выполнен из непрозрачного материала; и оптический модуль 610, который перемещается, повторяя траекторию движения ПЦР-чипа 900, и в котором размещены источник света 150, световой детектор 600 для обнаружения оптического сигнала, генерируемого источником света 150, и дихроическое зеркало 620, передающее свет, сгенерированный источником 150, на реакционную камеру 600 ПЦР-чипа 900, и передающее свет, полученный от реакционной камеры 910, на световой детектор 600.
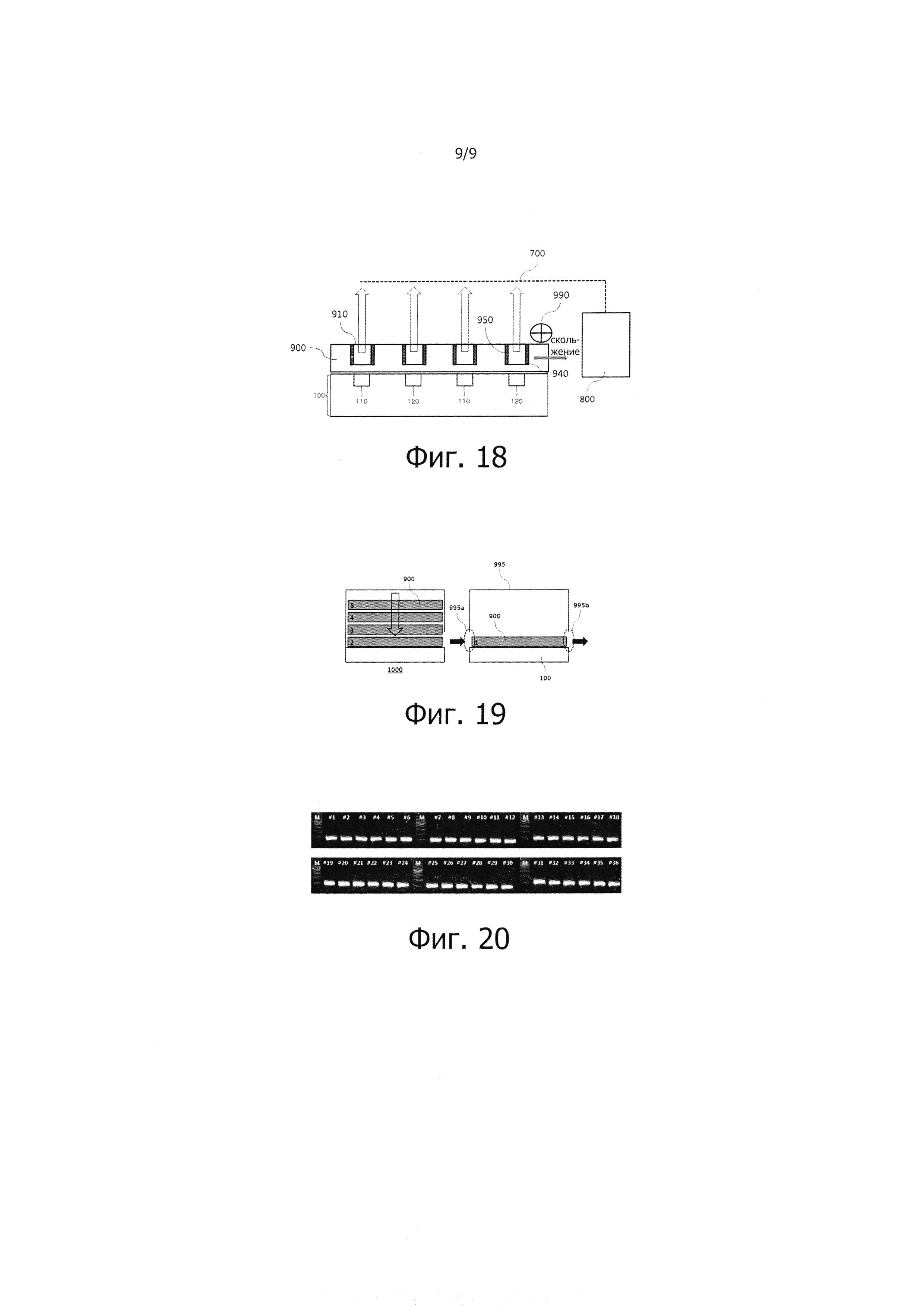
На фиг. 17 изображен способ проведения ПЦР в реальном масштабе времени с помощью ПЦР-устройства согласно еще одному возможному варианту реализации настоящего изобретения. Данное ПЦР-устройство содержит термоблок ПЦР 100, ПЦР-чип 900, однонаправленное раздвижное средство 990 и электрохимический модуль для выполнения измерений в реальном масштабе времени. Более подробно, ПЦР-чип 900 содержит электрод обнаружения 950 для обнаружения электрохимического сигнала, генерируемого соединением амплифицируемых нуклеиновых кислот и редокс-индикаторов внутри реакционной камеры 910.
Электрохимический модуль представляет собой модуль, который осуществляет электрохимические измерения в реальном масштабе времени амплификации нуклеиновых кислот, происходящей внутри реакционной камеры 910 ПЦР-чипа 900. Для достижения указанной цели электрохимический модуль может быть выполнен несколькими способами, но предпочтительно, как показано на фиг. 17, он содержит: электрод обнаружения 950 для обнаружения электрохимического сигнала, генерируемого соединением амплифицируемых нуклеиновых кислот и редокс-индикаторов внутри реакционной камеры 910 ПЦР-чипа 900; электрическое средство соединения 700, связанное с электродом обнаружения 950; и модуль 800 для измерения электрохимического сигнала, поступающего по электрическому средству соединения 700.
Редокс-индикатор химически реагирует (связывается) с амплифицированными нуклеиновыми кислотами и генерирует электрохимические сигналы, которые последовательно обнаруживаются и измеряются в соответствии с непрерывной амплификацией нуклеиновых кислот. Например, двунитиевая ДНК, как правило, имеет отрицательный заряд, и если редокс-индикатор имеет положительный заряд, амплифицированные нуклеиновые кислоты вступают в реакцию с редокс-индикатором в соответствии с непрерывной амплификацией нуклеиновых кислот, генерируя поддающиеся обнаружению сигналы за счет изменения общей величины заряда. Соответственно, электрохимические сигналы генерируются за счет изменения общей величины силы тока, вызываемого соединением отрицательного заряда амплифицированных нуклеиновых кислот и положительного заряда редокс-индикатора, и редокс-индикатор может быть катиноидом среди ионизированных продуктов ионной связи. Более подробно, субстанция ионной связи является метиленовой синью, а редокс-индикатор является катиноидом среди ионизированных продуктов метиленовой сини. Если метиленовая синь C16H18N3SCl· 3H2O растворяется в растворителе, она становится ионизированной до C16H18N3S < + > и Cl <-> и приобретает положительный заряд за счет серы S. Двунитиевая ДНК состоит из сахара, основания и фосфата, и фосфат, как правило, имеет отрицательный заряд. Соответственно, двунитиевая ДНК имеет отрицательный заряд. Положительный ион метиленовой сини реагирует с фосфатом ДНК, так что очевидная скорость диффузии метиленовой сини, соединенной с двунитиевой ДНК, уменьшается больше, чем у метиленовой сини, так что пиковое значение тока уменьшается. В ходе циклов ПЦР, соответственно, двунитиевая ДНК амплифицируется, и количество метиленовой сини, связанной с двунитиевой ДНК, увеличивается, что приводит к уменьшению пикового значения тока, так что количество амплифицированных нуклеиновых кислот можно измерить в реальном масштабе времени с помощью электрических сигналов, генерируемых химическим соединением амплифицируемых в реальном масштабе времени продуктов ПЦР с метиленовой синью.
Электрод обнаружения 950 может быть выполнен из различных материалов, способных обнаруживать электрохимический сигнал, генерируемый за счет соединения амплифицированных нуклеиновых кислот с редокс-индикатором внутри реакционной камеры 910. Например, электрод обнаружения 950 может быть выполнен из одного или нескольких материалов, выбираемых из группы, в которую входят Au, Co, Pt, Ag, углеродная нанотрубка, графен и углерод. Кроме того, электрод обнаружения 950 может быть выполнен в различных формах и стандартах с целью обеспечения максимальной эффективности. Например, электрод обнаружения выполняется в виде двухэлектродного модуля, содержащего рабочий электрод, на котором происходит соединение амплифицированных нуклеиновых кислот с редокс-индикатором, и электрод сравнения, на котором соединение амплифицированных нуклеиновых кислот с редокс-индикатором не происходит, так что он используется в качестве базы для сравнения потенциала электродов. Электрод обнаружения также может быть выполнен в виде трехэлектродного модуля, содержащего рабочий электрод, электрод сравнения и противоэлектрод, по которому проходит ток, генерируемый на рабочем электроде. Если электрод обнаружения 950 выполняется в виде вышеупомянутого многоэлектронного модуля, это обеспечивает повышение чувствительности электрохимических сигналов, генерируемых в реакционной камере, а также простоту обнаружения и измерения генерируемых сигналов.
Модуль 800 измерения электрохимических сигналов электрически соединен с соединительным портом держателя (не показан) ПЦР-чипа 900 электрическим соединительным средством 700 типа электропровода. Соответственно, электрохимические сигналы, последовательно генерируемые в ходе последовательной амплификации нуклеиновых кислот внутри реакционной камеры 910 ПЦР-чипа 900, последовательно обнаруживаются с помощью электрода обнаружения 950 ПЦР-чипа 900, и обнаруженные сигналы измеряются и обрабатываются или анализируются в модуле 800 измерения электрохимических сигналов с помощью электрического соединительного средства 700. В качестве модуля 800 измерения электрохимических сигналов могут использоваться различные устройства, предпочтительно, выбираемые из группы, включающей в себя приборы анодной вольтамперометрии с предварительным накоплением (АВПН), хроноамперометрии (ХА), циклической вольтамперометрии, квадратно-волновой вольтамперометрия (КВВ), дифференциальной импульсной вольтамперометрии (ДИВ), и импеданс.
Как показано на фиг. 17, реальномасштабное ПЦР-устройство способно измерять и анализировать амплификацию нуклеиновых кислот в ходе ПЦР в реальном масштабе времени. В данном случае, в отличие от первого рассмотренного варианта реализации ПЦР-устройства согласно настоящему изобретению, нет необходимости вводить флуоресцентное вещество в раствор ПЦР. Например, при скольжении ПЦР-чипа 900, раствор пробы ПЦР и реагента последовательно проходят участки, соответствующие верхней части первого нагревателя 110 и участки, соответствующие верхней части второго нагревателя 120 в реакционной камере 910, выполняя, таким образом, этап денатурации ПЦР и этап отжига/экстензии ПЦР. В данном случае, амплифицированные нуклеиновые кислоты медленно проходят или на мгновение останавливаются в каждом положении между первым нагревателем 110 и вторым нагревателем 120, что обеспечивается управлением однонаправленного раздвижного средства 990. После этого, электрохимические сигналы, генерируемые за счет соединения амплифицированных нуклеиновых кислот с редокс-индикатором, последовательно обнаруживаются в реальном масштабе времени и измеряются с помощью электрода обнаружения 950. Во время циклов ПЦР в реальном масштабе времени осуществляется измерение результатов реакции амплификации нуклеиновых кислот, соединенных с флуоресцентным веществом, в реакционной камере 910 (без флуоресцентного вещества и системы обнаружения светового излучения), что позволяет замерять и анализировать количество целевых ДНК в реальном масштабе времени.
На фиг. 18 изображен способ проведения ПЦР в реальном масштабе времени с помощью ПЦР-устройства согласно еще одному возможному варианту реализации настоящего изобретения. Данное ПЦР-устройство содержит термоблок ПЦР 100, ПЦР-чип 900, однонаправленное раздвижное средство 990 и электрохимический модуль для выполнения измерений в реальном масштабе времени. Более подробно, ПЦР-чип 900 содержит: фиксирующий слой 940, нанесенный на одну область внутренней поверхности реакционной камеры 910 и подверженный поверхностной обработке, с датчиком захвата, способным комплементарно соединяться с одной областью амплифицированных целевых нуклеиновых кислот; и электрод обнаружения 950, выполненный в другой области реакционной камеры 910, для обнаружения электрохимических сигналов. Реакционная камера может содержать композиты с металлическими наночастицами и сигнальные датчики, соединенные с металлическими наночастицами, таким образом, чтобы комплементарно соединяться с другой областью амплифицированных целевых нуклеиновых кислот.
Электрохимический модуль может включать в себя модуль, осуществляющий электрохимические измерения в реальном масштабе времени амплификации нуклеиновых кислот, происходящей внутри реакционной камеры 910 ПЦР-чипа 900. Для достижения указанной цели электрохимический модуль может быть выполнен несколькими способами, но предпочтительно, он содержит: фиксирующий слой 940, нанесенный на одну область внутренней поверхности реакционной камеры 910 и подверженный поверхностной обработке, с датчиком захвата, способным комплементарно соединяться с одной областью амплифицированных целевых нуклеиновых кислот; электрод обнаружения 950, выполненный в другой области внутренней поверхности реакционной камеры 910, для обнаружения электрохимических сигналов; электрическое соединительное средство 700, соединенное с электродом обнаружения 950; и модуль 800 измерения электрохимических сигналов для измерения обнаруженных сигналов с помощью электрического соединительного средства 700. В рассматриваемом примере, реакционная камера 910 может содержать композиты с металлическими наночастицами и сигнальные датчики, соединенные с металлическими наночастицами, таким образом, чтобы комплементарно соединяться с другой областью амплифицированных целевых нуклеиновых кислот.
Фиксирующий слой 940 и электрод обнаружения 950 расположены в разных местах реакционной камеры 910, и, предпочтительно, обращены друг к другу в направлениях вверх-вниз или влево-вправо. Кроме того, реакционная камера 910 содержит встроенные в неё композиты, содержащие металлические наночастицы, и сигнальные датчики, соединенные с металлическими наночастицами, таким образом, чтобы комплементарно соединяться с другой областью амплифицированных целевых нуклеиновых кислот. В данном случае, композиты заранее присутствует в реакционной камере 910 перед вводом ПЦР-пробы, содержащей матричные нуклеиновые кислоты, и наоборот, они вводятся в реакционную камеру 910 в состоянии содержания в реагентах ПЦР, таких как праймер и полимераза. Фиксирующий слой 940 выполняется из различных материалов, таких как силикон, пластик, стекло и металлические материалы, чтобы зонд захвата откладывался и проявлялся на его поверхности. Перед проявлением зонда захвата поверхность фиксирующего слоя сначала подвергают обработке материалом типа аминогруппы (NH3+), альдегидной группы (-COH) и карбоксильной группы (-COOH). Зонд захвата комплементарно соединяется с одной частью (областью) амплифицированных целевых нуклеиновых кислот и образует композиты за счет соединения с металлическими наночастицами. Металлические наночастицы изготовляют из различных металлов, предпочтительно, из одного или нескольких материалов, выбираемых из группы, в состав которой входят Zn, Cd, Pb, Cu, Ga, In, Au, Cr, Mn, Fe, Co, Ni, Cs, Ba, Cd, Hg, As, Se, Sn, Sb, Bi и Ag. Сигнальный зонд комплементарно соединяется с одной областью амплифицированных целевых нуклеиновых кислот, и в этом случае, область амплифицированных целевых нуклеиновых кислот, комплементарно связанная с сигнальным зондом, отличается от области амплифицированных целевых нуклеиновых кислот, комплементарно связанной с зондом захвата. Соответственно, зонд захвата и сигнальный зонд могут комплементарно связываться с амплифицированными целевыми нуклеиновыми кислотами. Если в ходе ПЦР целевые нуклеиновые кислоты амплифицируются в реакционной камере 910, т.е. если амплифицированные целевые нуклеиновые кислоты комплементарно связаны с зондом захвата, нанесенным на поверхность фиксирующего слоя 940, а также комплементарно связаны с сигнальным зондом, соединенным с металлическими наночастицами, это позволяет металлическим частицам собираться в области рядом с фиксирующим слоем 940. В результате, металлические наночастицы не доходят до электрода обнаружения 950, что вызывает изменение (понижение) тока между металлическими наночастицами и электродом обнаружения 950, в результате чего образуются различимые электрохимические сигналы, соответствующие степени амплификации целевых ДНК. С другой стороны, амплифицированные целевые нуклеиновые кислоты, зонд захвата и сигнальный зонд формируются из однонитевых ДНК.
Электрод обнаружения 950 расположен по меньшей мере в одной области реакционной камеры 910 для обнаружения электрохимических сигналов, генерируемых внутри реакционной камеры 910. Для обнаружения электрохимических сигналов электрод обнаружения 950 выполняют из различных материалов, например, из одного или нескольких материалов, выбираемых из группы, в которую входят Au, Co, Pt, Ag, углеродная нанотрубка, графен и углерод. Кроме того, электрод обнаружения 950 может иметь различные формы и конструкции, обеспечивающие эффективное обнаружение электрохимических сигналов, генерируемых внутри реакционной камеры 910, например, может быть выполнен в виде изготовленной из металлического материала пластины, расположенной вдоль внутренней поверхности реакционной камеры 910. Кроме того, электрохимические сигналы измеряются модулем измерения электрохимических сигналов, и модуль измерения электрохимических сигналов предоставляется в различных формах. Предпочтительно, в качестве модуля 800 измерения электрохимических сигналов могут использоваться различные устройства, выбираемые из группы, включающей в себя приборы анодной вольтамперометрии с предварительным накоплением (АВПН), хроноамперометрии (ХА), циклической вольтамперометрии, квадратно-волновой вольтамперометрия (КВВ), дифференциальной импульсной вольтамперометрии (ДИВ) и импеданс. Генерирование электрохимических сигналов происходит в результате изменений тока, вызываемых комплементарным соединением амплифицированных целевых нуклеиновых кислот с зондом захвата и сигнальным зондом. Процесс, при котором происходит генерирование электрохимических сигналов в ПЦР-устройстве согласно настоящему изобретению, выглядит следующим образом. На первом этапе, перед началом ПЦР, зонд захвата, нанесенный на поверхность фиксирующего слоя, и композиты (сигнальный зонд-металлические наночастицы), содержащие сигнальный зонд и металлические наночастицы, находятся в своем исходном состоянии; на втором этапе происходит генерирование изменений тока (сигналов) вследствие реакций восстановления или окисления, протекающих между рабочим электродом и металлическими наночастицами; и на третьем этапе, после начала ПЦР, происходит соединение амплифицированных целевых нуклеиновых кислот с зондом захвата и сигнальным зондом композитов, что вызывает уменьшение изменений тока (сигналов). Более подробно, если на металлических наночастицах композитов происходит понижение напряжения, металлические наночастицы собираются на поверхности рядом с рабочим электродом, образуя, таким образом, обогащенный слой при восстановлении. Затем, если напряжение прикладывается к рабочему электроду, восстановленные металлические наночастицы окисляются (происходит их снятие), в результате чего генерируются изменения тока (сигналы), и эти изменения тока можно легко измерить по значениям напряжения, на которые указывают пики тока окисления. В этом случае, значения изменений тока, то есть электрохимические сигналы, генерируемые внутри реакционной камеры 910, включают в себя количество изменений целевых нуклеиновых кислот (целевых ДНК). Кроме того, значения напряжений, при которых происходит окисление металлических наночастиц, являются различными, в зависимости от типа металлических наночастиц, и при использовании металлических наночастиц двух типов одновременно можно обнаруживать сигналы для двух или более проб. После этого, если проводится ПЦР, целевая ДНК амплифицируется из матричной ДНК, и амплифицированные целевые нуклеиновые кислоты комплементарно связываются (гибридная целевая ДНК) с зондом захвата и сигнальным зондом композитов (сигнальный зонд-металлические наночастицы), что запрещает аккумулирование металлических наночастиц композитов и понижение значений тока. По мере увеличения циклов ПЦР, количество амплифицированных целевых нуклеиновых кислот также увеличивается, чтобы обеспечить возможность комплементарного соединения (гибридной целевой ДНК) с зондом захвата и сигнальным зондом создаваемых композитов, в результате чего величины тока еще больше понижаются. Соответственно, уменьшения изменений тока, т.е. электрохимических сигналов, обнаруживается и измеряется, обеспечивая возможность проведения ПЦР в реальном масштабе времени.
Электрод обнаружения 950 может быть выполнен различными способами. Например, электрод обнаружения 950 выполняется в виде двухэлектродного модуля, содержащего рабочий электрод 950a, на котором происходят реакции окисления или восстановления, и электрод сравнения 950b, на котором реакции окисления или восстановления не происходят. Как видно из фиг. 16, электрод обнаружения 950 выполнен в виде трехэлектродного модуля, содержащего рабочий электрод 950a, электрод сравнения 950b и противоэлектрод 950c для регулировки баланса электродов, генерируемого из рабочего электрода 950a. Если электрод обнаружения 950 выполняется в виде вышеупомянутого многоэлектронного модуля, это обеспечивает повышение чувствительности электрохимических сигналов, генерируемых в реакционной камере, а также простоту обнаружения и измерения генерируемых сигналов.
Как показано на фиг. 18, модуль 800 измерения электрохимических сигналов электрически соединен с соединительным портом держателя ПЦР-чипа 900 электрическим соединительным средством 700 типа электропровода. Соответственно, электрохимические сигналы, последовательно генерируемые в ходе последовательной амплификации нуклеиновых кислот внутри реакционной камеры 910 ПЦР-чипа 900, последовательно обнаруживаются с помощью электрода обнаружения 950 ПЦР-чипа 900, и обнаруженные сигналы измеряются и обрабатываются или анализируются в модуле 800 измерения электрохимических сигналов с помощью соединительного порта держателя чипа и электрического соединительного средства 700. В качестве модуля 800 измерения электрохимических сигналов могут использоваться различные устройства, предпочтительно, выбираемые из группы, включающей в себя приборы анодной вольтамперометрии с предварительным накоплением (АВПН), хроноамперометрии (ХА), циклической вольтамперометрии, квадратно-волновой вольтамперометрия (КВВ), дифференциальной импульсной вольтамперометрии (ДИВ), и импеданс.
Как видно из фиг. 18, при проведении ПЦР в ПЦР-устройстве согласно варианту реализации настоящего изобретения, процесс амплификации нуклеиновых кислот можно измерить и проанализировать в реальном масштабе времени. В данном случае, в отличие от первого рассмотренного варианта реализации ПЦР-устройства согласно настоящему изобретению, нет необходимости вводить флуоресцентное вещество в раствор ПЦР. Например, при скольжении ПЦР-чипа 900, раствор пробы ПЦР и реагента последовательно проходят участки, соответствующие верхней части первого нагревателя 110 и участки, соответствующие верхней части второго нагревателя 120 в реакционной камере 910, выполняя, таким образом, этап денатурации ПЦР и этап отжига/экстензии ПЦР. В данном случае, амплифицированные нуклеиновые кислоты медленно проходят или на мгновение останавливаются в каждом положении между первым нагревателем 110 и вторым нагревателем 120, что обеспечивается управлением однонаправленного раздвижного средства 990. После этого, электрохимические сигналы (изменение тока), генерируемые за счет комплементарного соединения амплифицированных нуклеиновых кислот с зондом захвата и сигнальным зондом композитов, последовательно обнаруживаются и измеряются в реальном масштабе времени с помощью электрода обнаружения 950. Во время циклов ПЦР в реальном масштабе времени осуществляется измерение результатов реакции амплификации нуклеиновых кислот, соединенных с флуоресцентным веществом, в реакционной камере 910 (без флуоресцентного вещества и системы обнаружения светового излучения), что позволяет замерять и анализировать количество целевых ДНК в реальном масштабе времени.
На фиг. 19 показан блок 1000 хранения чипов, соединенный с ПЦР-устройством.
Как видно из фиг. 19, ПЦР-устройство может также содержать блок 1000 хранения чипов для размещения в нем определенного количества ПЦР-чипов 900 с номерами 1, 2, 3, 4 и 5, которые соединены друг с другом с возможностью управления, таким образом, что первый ПЦР-чип 900 с номером 1 последовательно вступает в термический контакт с термоблоками ПЦР 100, а затем второй ПЦР-чип 900 с номером 2 вступает в контакт с термоблоками ПЦР 100. Блок 1000 хранения чипов содержит определенное количество ПЦР-чипов 900 с номерами 1, 2, 3, 4 и 5. ПЦР-чипы, содержащиеся в блоке 1000 хранения чипов, могут содержать разные пробы, и в зависимости от располагаемого размера пространства, могут содержать более пяти проб, размещенных на ПЦР-чипах, как показано на фиг. 19. Например, после того, как термоблоки ПЦР 100 и первый ПЦР-чип 900 под номером 1 последовательно входят в контакт друг с другом, когда начинается первая ПЦР, первый ПЦР-чип 900 выдвигается наружу из выходного отверстия 995b блока 995, а затем открывается входное отверстие 995a блока 995. Второй ПЦР-чип 900 под номером 2, помещенный в блок 1000 хранения чипов с помощью средства привода (не показано), перемещается над термоблоком ПЦР 100, чтобы последовательно вступить в термический контакт с термоблоками ПЦР 100, таким образом, что начинается вторая ПЦР. В данном примере, перед тем, как второй ПЦР-чип 900 пройдет сквозь входное отверстие 995a, датчик, установленный на блоке 995, обнаруживает второй ПЦР-чип 900, так что внутренние условия блока 995, например, температура термоблоков ПЦР 100 и условия проведения реакции измерительного устройства ПЦР могут быть изменены. Описанная последовательность процессов повторяется до тех пор, пока не будет закончена ПЦР всех ПЦР-чипов, находящихся в блоке 1000 хранения чипов. ПЦР-устройство с таким блоком 1000 хранения чипов может осуществлять ПЦР на множестве проб и реагентов быстро и одновременно в последовательности.
На фиг. 20 показана фотография электрофореза, демонстрирующая результаты ПЦР-теста на ПЦР-устройстве.
Как видно из фиг. 20, результаты ПЦР, проводимой с использованием ПЦР-устройства согласно настоящему изобретению, подтверждаются. Буква "M", присутствующая на фотографии электрофореза, означает маркер размера, а числами обозначены номера проб для ПЦР. С помощью данного теста удалось подтвердить, что ПЦР можно одновременно проводить на множестве проб в течение короткого периода времени, а именно, в течение приблизительно 15 минут. Таким образом, ПЦР-устройство согласно настоящему изобретению может обеспечить значительное уменьшение размеров ПЦР-чипов, уменьшение объема используемых проб, значительное сокращение времени проведения ПЦР и возможность проведения ПЦР на целой партии проб, по сравнению с обычной реакционной емкостью ПЦР многолуночного типа с общим нагревателем или обычной реакционной емкостью ПЦР одноканального типа с несколькими нагревателями. Таким образом, ПЦР-устройство согласно настоящему изобретению дает возможность эффективно решать проблемы, характерные для ПЦР-устройств обычного типа.
Реферат
Изобретение относится к области биохимии. Предложено устройство для проведения полимеразной цепной реакции. ПЦР-устройство содержит последовательно соединенные термоблоки ПЦР, содержащий две или более реакционные камеры ПЦР-чип пластинчатого типа и однонаправленное раздвижное средство. Каждый термоблок ПЦР содержит два или более расположенных на верхней поверхности подложки нагревателя. Раздвижное средство обеспечивает последовательный термический контакт между двумя или более повторно расположенными от одного до другого края ПЦР-чипа реакционными камерами с двумя или более повторно расположенными от одного до другого края термоблока ПЦР нагревателями. Изобретение обеспечивает уменьшение продолжительности ПЦР, повышение выхода ПЦР и увеличение количества проб, измеряемых и анализируемых в реальном времени. 12 з.п. ф-лы, 23 ил.

Комментарии