Способ амплификации нуклеиновых кислот - RU2603253C2
Код документа: RU2603253C2
Чертежи
















Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу амплификации нуклеиновых кислот.
Предшествующий уровень техники
Способы амплификации нуклеиновых кислот известны в данной области техники. В описании патента США 4683202 раскрыт способ амплификации специфической нуклеиновокислотной последовательности, содержащейся в нуклеиновой кислоте или смеси нуклеиновых кислот, где каждая нуклеиновая кислота состоит из двух отдельных комплементарных цепей, равной или неравной длины. Способ включает: (а) обработку цепей двумя олигонуклеотидными праймерами для каждой нуклеотидной последовательности, которую нужно амплифицировать, в таких условиях, чтобы для каждой из амплифицируемых последовательностей синтезировался продукт удлинения каждого праймера, комплементарный каждой нуклеиновокислотной цепи, где указанные праймеры выбраны так, чтобы быть достаточно комплементарными различным цепям каждой специфической последовательности, так чтобы продукт удлинения, синтезированный из одного праймера, при отделении от своего комплемента, мог служить матрицей для синтеза продукта удлинения другого праймера; (b) отделение продуктов удлинения праймера от матриц, на которых их синтезировали, для получения одноцепочечных молекул; и (с) обработку одноцепочечных молекул, полученных на этапе (b), с праймерами с этапа (а) в условиях, в которых синтезируется продукт удлинения праймера, с применением каждой из отдельных цепей, полученных на этапе (b), в качестве матрицы. Этапы можно осуществлять последовательно или одновременно. Далее, этапы (b) и (с) можно повторять до тех пор, пока не будет достигнута необходимая степень амплификации последовательности. В случае, когда способ на этапах (а) и (с) выполняют с применением полимеразы, способ обычно обозначают как полимеразную цепную реакцию (ПЦР).
В международной патентной заявке WO 2007/143034 A1 раскрыты способы, предположительно пригодные для выполнения ПЦР. Способы могут включать применение оптического источника для обеспечения нагревания при ПЦР. Способы могут также включать применение поверхностного плазмонного резонанса или резонансного переноса энергии флуоресценции для обеспечения мониторинга ПЦР реакции в режиме реального времени. Способы могут включать иммобилизацию матрицы, праймера или полимеразы на такой поверхности, как золото, или другой поверхности, подходящей для поверхностного плазмонного резонанса.
Заявка на патент US 2002/0061588 A1 раскрывает способы обеспечения локального и направленного ответа нуклеиновых кислот на внешний сигнал. Сигнал действует исключительно на одну или несколько специфических, локализованных частей нуклеиновой кислоты. В соответствии с изобретением, сигнал может изменять свойства специфической нуклеиновой кислоты, и таким образом, модифицировать ее функции. Таким образом, изобретение обеспечивает способы, контролирующие структуру и функцию нуклеиновой кислоты в биологическом образце, без влияния на другие части образца. В одном варианте осуществления модулятор переносит тепло к нуклеиновой кислоте или части нуклеиновой кислоты, что приводит, например, к дестабилизации внутри- или межмолекулярных связей и к повреждению структуры и стабильности нуклеиновой кислоты. Предпочтительные модуляторы включают металлические наночастицы, полупроводниковые наночастицы, магнитные наночастицы, оксидные наночастицы и хромофоры. Также предполагается применение этих способов в сочетании с ПЦР. В частности, предполагается контролировать ПЦР с модулятором.
Заявка на патент US 2003/0143604 A1 относится к применению детектирующих зондов на основе наночастиц с целью мониторинга реакций амплификации, в частности ПЦР. А именно, заявка относится к применению конъюгатов наночастиц и олигонуклеотидов, обработанных защитным агентом, таким как бычий сывороточный альбумин, для количественного или качественного определения целевого полинуклеотида. В заявке раскрывается амплификация и детекция нуклеиновой кислоты с применением праймеров на золотых наночастицах. На первом этапе нуклеиновокислотную мишень денатурируют в присутствии золотых наночастиц, функционализированных праймерами. На втором этапе золотые наночастицы и олигонуклеотиды, прикрепленные к ним, гибридизуют с нуклеиновокислотной мишенью, и получают копию комплементарной последовательности ДНК, начиная от нуклеиновокислотных праймеров, прикрепленных к наночастицам. Первый и второй этапы повторяют, и выявляют оптический сигнал, генерируемый при связывании амплифицированных комплементарных зондов на основе наночастицами.
Проблема, решаемая настоящим изобретением
Проблемой, лежащей в основе настоящего изобретения, является обеспечение усовершенствованного способа амплификации нуклеиновых кислот.
Решение в соответствии с настоящим изобретением
Проблему решают посредством способа, характеризующегося признаками из пункта 1. Способ служит для амплификации нуклеиновых кислот, в котором в объеме реакционной смеси наночастицы переносят тепло к окружающей среде посредством возбуждения.
Объем реакционной среды является объемом, в котором осуществляют способ в соответствии с настоящим изобретением. Объем может определяться сосудом для реакции. Объем реакционной смеси содержит образец. Образец содержит жидкость, предпочтительно воду. Нуклеиновые кислоты, которые могут быть амплифицированы посредством способа, могут содержаться в образце.
Наночастицы в соответствии с настоящим изобретением предпочтительно являются частицами, которые, благодаря своему размеру, демонстрируют особые оптические свойства, в частности, характерные спектры поглощения или рассеяния, которые не наблюдаются или не являются различимыми в основном материале. Предпочтительно, наночастицы имеют диаметр от 2 до 500 нм, более предпочтительно от 3 до 300 нм, и наиболее предпочтительно от 5 до 200 нм. Предпочтительные наночастицы имеют диаметр от 7 до 150 нм. Наночастицы могут быть сферическими, однако, возможны также не-глобулярные формы, например, удлиненные наночастицы (наностержни). В предпочтительном варианте осуществления изобретения наночастицы содержат по меньшей мере один полупроводник или один металл, предпочтительно благородный металл, например, золото или серебро. В одном варианте осуществления наночастица состоит из металла полностью, в другом варианте осуществления металл образует только одну часть наночастицы, например, ее оболочку. Предпочтительная наночастица может быть наночастицей типа ядро-оболочка. Предпочтительная наночастица может иметь поры на своей поверхности, где поры могут быть заняты атомами или молекулами с размером и зарядом, определенным свойствами пор, особо предпочтительно, такие атомы или молекулы адсорбируются на наночастице только тогда, когда наночастица располагается в растворе. В соответствии с настоящим изобретением, наночастица также содержит атомы и молекулы, адсорбированные на поверхности. Благодаря абсорбции материала или плазмонному резонансу, предпочтительные наночастицы пригодны для поглощения оптической энергии.
Когда посредством возбуждения наночастицы тепло переносится от наночастицы к окружающей среде, это означает, в соответствии с настоящим изобретением, что энергия переносится к наночастице, когда наночастица нагревает окружающую ее среду посредством переноса энергии. При этом предпочтительно, посредством возбуждения, непосредственная окружающая среда нагревается сильнее, чем остальная среда, окружающая наночастицы. Как правило, наночастицы вначале нагреваются посредством возбуждения, в затем переносят тепло в окружающую среду. Также возможно, что посредством возбуждения наночастиц тепло переносится к окружающей среде без предварительного нагревания самих наночастиц. Предпочтительно, среда, окружающая наночастицы, является сферическим объемом, который имеет диаметр от равного до превышающего в 100 раз диаметр наночастицы, расположенной в центре объема; более предпочтительно, объем превышает в 10 раз, наиболее предпочтительно в 4 раза, и предпочтительно менее чем в 2 раза диаметр наночастицы, расположенной в его центре.
Предпочтительно, при возбуждении наночастиц среда, окружающая наночастицы, нагревается локально. Особенно быстрые изменения температуры возможны, если нагреваемый объем является только долей от всего объема. С одной стороны, высокая разница объема может быть получена всего лишь с малым количеством потребляемой энергии. С другой стороны, быстрое охлаждение нагреваемого объема возможно, если достаточно большой источник с холодной температурой присутствует в облучаемом объеме, так чтобы после облучения наночастиц окружающая их среда охлаждалась. Это может быть достигнуто путем достаточно сильного облучения наночастиц (для достижения необходимого повышения температуры) и в течение достаточного короткого времени (чтобы нагрев оставался локализованным).
Таким образом, имеется локальное нагревание в соответствии с настоящим изобретением, если интервал «t» возбуждения в индивидуальном облучаемом объеме (например, фокусе лазера) выбран более коротким или равным критическому интервалу возбуждения «t1». Таким образом, «t1» является временем, которое необходимо теплу для диффузии от одной наночастицы к следующей на среднем расстоянии наночастиц, умноженном на коэффициент пересчета «s1», если «|х|» является средним расстоянием наночастицы, а термодиффузия среды между наночастицами равна «D», то t1 получаем как t1=(s1*|x|)2/D, где термодиффузия D, как правило, имеет значение D=10-7 м2/с в водном растворе.
Коэффициент пересчета s1 является мерой того, насколько далеко распространяется тепловой фронт частицы по интервалу возбуждения. Повышение температуры, вызванное возбужденной наночастицей на расстоянии нескольких диаметров наночастицы, является лишь малой долей максимального повышения температуры на поверхности частицы. В одном варианте осуществления изобретения наложение тепловых фронтов небольшого числа наночастиц допустимо в том смысле, что для определения критического интервала возбуждения t1 в соответствии с вышеприведенным уравнением, применяют коэффициент пересчета более 1. В другом варианте осуществления изобретения не допускается наложения фронтов на протяжении интервала возбуждения (соответствует явно локальному нагреванию) в том смысле, что для определения критического интервала возбуждения t1 в соответствии с вышеприведенным уравнением, применяют коэффициент пересчета s1, меньший или равный 1. Для определения локального нагревания в соответствии с настоящим изобретением, предпочтительно s1=100, предпочтительно s1=30, предпочтительно s1=10, предпочтительно s1=7, предпочтительно s1=3, и наиболее предпочтительно s1=1, предпочтительно s1=0,7, предпочтительно s1=0,3.
Значения s1>1 могут быть предпочтительными в тех случаях (среди прочих), при которых облучаемый объем демонстрирует большое относительное удлинение (например, в фокусе умеренно сфокусированного лазерного пучка), так чтобы сравнительно много наночастиц располагалось на поверхности облучаемого объема, и таким образом, меньше нагретых наночастиц присутствовало в окружающей их среде, и происходил значительный вынос тепла из облучаемого объема, так чтобы вкладом нагревания отдаленных соседних объектов можно было пренебречь в течение продолжительного периода времени.
Это означает, что например, при концентрации наночастиц 1 нМ, приводящей к среднему расстоянию наночастиц |х|=1,2 мкм, в соответствии с настоящим изобретением, локальное нагревание имеет место, если интервал возбуждения остается более коротким, чем t1=14 мкс (коэффициент пересчета выбран как s1=1, D=10-7 м2/с). Предполагается, что когда выбран t>t1, то тепло, выделяемое наночастицами, может (при облучении) покрывать расстояние путем диффузии, которое больше среднего расстояния частицы, что в итоге ведет к наложению тепловых фронтов многих наночастиц, так что происходит повышение температуры во всем объеме между наночастицами; повышение температуры в облучаемом объеме пространственно будет тем более однородным, чем более длительно осуществляется нагревание, поскольку влияние на распределение температуры вокруг наночастицы оказывают не только ближайшие наночастицы, но также удаленные соседние частицы.
Если объем реакционной смеси облучают с излучением, поглощаемым наночастицами, в течение времени, большего, чем t1, то нагревание обозначают как общее.
Общее нагревание в соответствии с настоящим изобретением можно, например, осуществлять путем нагревания объема реакции с внешней стороны элементом Пельтье или резистивным нагревателем. Общее нагревание можно также осуществлять, например, путем облучения объема реакции с излучением, поглощаемой водой в большей степени или в равной степени, чем наночастицами. Таким образом, термин «повышение температуры» означает разницу температуры в одном участке в момент времени наблюдения немедленно после возбуждения, и температуры в том же самом участке непосредственно перед возбуждением.
Общее нагревание и локальное нагревание можно проводить одновременно.
Известные способы для амплификации нуклеиновых кислот включают один или несколько этапов, в которых по меньшей мере части образца необходимо нагреть.
Изобретение делает возможным способ амплификации нуклеиновых кислот, в котором нужно нагревать не весь объем реакции. Напротив, можно нагревать только конкретные части объема реакционной смеси посредством возбуждения наночастиц. Предпочтительно, таким способом можно нагревать только те части объема реакции, которые нужно нагревать для амплификации нуклеиновых кислот. Таким образом, чувствительные к нагреванию части образца могут быть сохранены. Локальное нагревание может быть более быстрым, чем общее нагревание всего объема реакции, если можно перенести меньше энергии. Таким образом, предпочтительно, изобретение обеспечивает возможность осуществления способа амплификации нуклеиновых кислот, более быстрого и требующего меньше энергии.
Предпочтительные варианты осуществления настоящего изобретения
Нуклеиновая кислота может быть амплифицирована, в частности, путем полимеразной цепной реакции (ПЦР). ПЦР проводят в объеме реакционной смеси. Объем реакционной смеси содержит одну нуклеиновую кислоту, подлежащую амплификации, которую называют оригиналом. Оригинал является одноцепочечным. В объеме реакционной смеси оригинал может формировать двойную цепь вместе со своей комплементарной цепью, которую называют комплементом. Если оригинал и комплемент присутствуют в виде двойной цепи, эта двойная цепь должна быть денатурирована на первом этапе, т.е. двойная цепь должна быть расщеплена на две одинарных цепи. Плавление является другим термином для денатурации. Денатурация происходит при температуре, которую называют температурой денатурации. Объем реакционной смеси дополнительно содержит по меньшей мере два олигонуклеотида, которые называют праймерами. Один из праймеров называют прямым праймером, а другой - обратным праймером. Прямой праймер комплементарен к 3′-концу оригинала. Обратный праймер комплементарен к 3′-концу комплемента. На втором этапе прямой праймер гибридизуется с оригиналом, а обратный праймер гибридизуется с комплементом. Гибридизацию праймеров с комплементарными частями оригинала или комплемента, соответственно, называют отжигом. Второй этап осуществляют при температуре, которую называют температурой отжига. Объем реакционной смеси дополнительно содержит ДНК полимеразу. На третьем этапе ДНК-полимераза синтезирует копию комплемента, начиная от прямого праймера. Начиная от обратного праймера, ДНК-полимераза синтезирует копию оригинала. Посредством синтеза, копию комплемента гибридизуется с оригиналом, а копию комплемента гибридизуется с комплементом. Третий этап называют элонгацией, и проводят при температуре, называемой температурой элонгации. После этого первый, второй и третий этап повторяют циклически, до достижения необходимой степени амплификации, когда копия оригинала является оригиналом, а копия комплемента является комплементом. Если оригинал располагается на одинарной цепи ДНК, которая длинней оригинала, то ПЦР образует копии не только оригинала, но также копии указанной одинарной цепи ДНК, которые длиннее в 3′ направлении и содержат оригинал. Соответственно, в этом случае ПЦР не только производит копии комплемента, но также копии одинарной цепи ДНК, комплементарные указанной одинарной цепи ДНК, где копии длиннее в 3′ направлении и содержат комплемент.
Поскольку различные этапы ПЦР могут проходить при разной температуре, может быть необходимо выполнить один или несколько этапов нагревания, и если это применяется, этапов охлаждения во время или между этапами ПЦР, при которых этапы нагревания и охлаждения объема реакции или его частей нагревают или охлаждают, соответственно. Предпочтительно, нагревание на этапе нагревания или по меньшей мере одном из этапов нагревания обеспечивают по меньшей мере отчасти путем возбуждения наночастиц, и нагревание предпочтительно является локальным нагреванием.
При ПЦР температуру денатурации предпочтительно выбирают так, чтобы одинарные цепи ДНК плавились, но в то же время ДНК полимераза существенно не повреждалась. Типичным значением температуры денатурации является, например, 95°С. Обычно оптимальная температура отжига зависит от последовательности и длины праймеров. Как правило, праймеры конструируют для температуры отжига от 50°С до 65°С. Оптимальная температура элонгации, как правило, зависит от используемой ДНК-полимеразы. Например, при использовании Taq полимеразы, как правило, выбирают температуру элонгации 72°С.
Гибридизация в контексте настоящего изобретения означает формирование двойной цепи из двух одинарных цепей, каждая из которых может состоять из нуклеиновой кислоты и/или олигонуклеотида. При подходящих условиях реакции, гибридизация, как правило, приводит к самому низкому энергетическому состоянию, которое может быть достигнуто путем связывания двух одинарных цепей друг с другом. Это означает, другими словами, что при подходящих условиях две одинарные цепи связываются друг с другом так, чтобы для последовательностей из двух одинарных цепей получалась наибольшая возможная комплементарность.
Когда нуклеиновая кислота А частично комплементарна нуклеиновой кислоте В, это означает, что одна часть нуклеиновой кислоты А комплементарна одной части нуклеиновой кислоты В.
Возбуждение наночастиц предпочтительно осуществляют путем изменения поля, более предпочтительно, путем изменения электромагнитного поля, наиболее предпочтительно, оптически. Предпочтительно, возбуждение происходит в диапазоне от дальней инфракрасной области до дальней ультрафиолетовой области спектра (в диапазоне длин волн от 100 нм до 30 мкм), более предпочтительно в диапазоне от ближней инфракрасной области до ближней ультрафиолетовой области (в диапазоне длин волн от 200 нм до 3 мкм), наиболее предпочтительно в видимом световом диапазоне (в диапазоне от 400 нм до 800 нм). По сравнению с обычным общим нагреванием сосуда для реакции с внешней стороны, это может обеспечивать преимущество в том, что не требуется преодоления термоизоляции стенки сосуда для реакции, поскольку энергию переносят непосредственно на наночастицы. Таким образом, можно достичь более быстрого нагревания необходимых частей образца.
В предпочтительном варианте осуществления изобретения наночастицы возбуждают лазером. Более предпочтительно, лазерный свет имеет частоту, возбуждающую поверхностный плазмонный резонанс наночастиц. Лазер может подавать свет непрерывно или в виде импульсного света. Лазер может, например, быть газовым лазером, диодным лазером или твердотельным лазером с диодной накачкой. Интервал времени, в котором лазер возбуждает наночастицы в облучаемом диапазоне, предпочтительно находится в области от пикосекунд до секунд, более предпочтительно от наносекунд до секунд, и наиболее предпочтительно от 10 наносекунд до 500 микросекунд. Предпочтительно, интервал возбуждения короче, чем среднее время, необходимое для диффузии нагревания, возникающего в среде, окружающей наночастицы, по среднему расстоянию наночастицы, так чтобы в среднем не было существенного наложения тепловых фронтов соседних частиц. Более предпочтительно, интервал возбуждения выбран для падения повышения температуры вокруг каждой облученной наночастицы, в среднем, менее чем до половины от ее максимума на расстоянии 20 диаметров наночастицы, более предпочтительно, на расстоянии 2 диаметров наночастицы, и наиболее предпочтительно, на расстоянии 1 диаметра наночастицы. В одном варианте осуществления короткий период облучения лазером на объем является предпочтительным, так чтобы дегибридизованная одинарная цепь ДНК могла только диффундировать от наночастицы менее чем на 100 нм, более предпочтительно, менее чем на 20 нм во время денатурации. Таким образом, вероятность связывания дегибридизованной одинарной цепи ДНК с олигонуклеотидом на той же самой наночастице является высокой. То может приводить к ускорению способа в соответствии с настоящим изобретением. В предпочтительном варианте осуществления концентрация наночастиц, конъюгированных с праймером, составляет менее 10 нМ, в то время как интервал возбуждения составляет от 1 нсек до 10 мксек, более предпочтительно от 10 нсек до 1 мксек, и наиболее предпочтительно от 15 нсек до 300 нсек. Интервал возбуждения предпочтительно выбирают так, чтобы он не был значительно ниже 1 нсек; иначе период нагревания двойной цепи ДНК является недостаточным для достаточного разделения одинарных цепей, содержащихся в ней, путем диффузии, так чтобы не происходило немедленной регибридизации друг с другом.
Коэффициент заполнения является отношением интервала возбуждения к продолжительности ПЦР цикла. Коэффициент заполнения предпочтительно выбирают так, чтобы он был достаточно большим для возбуждения, приводящего и достаточной денатурации двойных цепей ДНК путем локального нагревания. В то же самое время коэффициент заполнения выбирают так, чтобы среднее повышение температуры всего образца сохранялось достаточно малым, чтобы избежать нарушений гибридизации, элонгации и денатурации. Предпочтительно, коэффициент заполнения для облучаемого объема составляет менее 50%, более предпочтительно менее 20%, и наиболее предпочтительно, менее 1%. Коэффициент заполнения облучаемого объема предпочтительно составляет более 10-12, более предпочтительно более 10-10, более предпочтительно более 10-9, и наиболее предпочтительно более 10-8. Плотность поверхностной энергии, при которой наночастицы возбуждаются, предпочтительно составляет от 20 Вт/мм2 до 1000 кВт/мм2, более предпочтительно от 100 Вт/мм2 до 100 кВт/мм2, и наиболее предпочтительно от 260 Вт/мм2 до 10 кВт/мм2.
В другом предпочтительном варианте осуществления энергия лазерного света переносится к наночастицам благодаря абсорбции материалом. Свет, используемый для возбуждения наночастиц, может также возникать, например, из термического радиатора, например, импульсной лампы. В другом предпочтительном варианте осуществления изобретения, наночастицы возбуждаются посредством изменения электромагнитного поля или электромагнитных волн, которые индуцируют вихревые токи в наночастицах. Надлежащим образом сконструированные наночастицы также могут возбуждаться посредством ультразвука.
Термин «олигонуклеотид» в контексте настоящего изобретения предпочтительно включает не только (дезокси)олигорибонуклеотиды, но также олигонуклеотиды, которые содержат один или несколько нуклеотидных аналогов с модификациями в их каркасе (например, метилфосфонаты, фосфотиоаты или пептидо-нуклеиновые кислоты [ПНК]), в частности, на сахаре из каркаса (например, 2′-O-алкил производные, 3′- и/или 5′-аминорибозы, запертые нуклеиновые кислоты [ЗНК], гекситовые нуклеиновые кислоты, морфолиновые, гликольные нуклеиновые кислоты (ГНК), треозную нуклеиновую кислоту (ТНК) или трицикло-ДНК, в этом отношении смотри публикацию D. Renneberg and С.J. Leumann, озаглавленную «Watson-Crick base-pairing properties of Tricyclo-DNA», J. Am. Chem. Soc., 2002, Vol. 124, pages 5993-6002, соответствующее содержание которой является частью настоящего описания посредством ссылки), или содержат аналоги оснований, например, 7-деазапурин или универсальные основания, такие как нитроиндол, или модифицированные натуральные основания, такие как N4-этилцитозин. В одном варианте осуществления изобретения олигонуклеотиды являются конъюгатами или химерами с не-нуклеозидными аналогами, например, ПНК. В одном варианте осуществления олигонуклеотиды содержат, в одном или нескольких положениях, не-нуклеозидные единицы, такие как спейсеры, например, гексаэтиленгликоль или Cn-спейсеры, где n составляет от 3 до 6. До степени, до которой олигонуклеотиды содержат модификации, их выбирают так, чтобы гибридизация с натуральными образцами ДНК/РНК была также возможна с модификацией. Предпочтительные модификации влияют на характеристики плавления, предпочтительно температуру плавления, в частности, чтобы отличить гибриды, имеющие различные степени комплементарности их аминокислот (различение по несоответствию). Предпочтительные модификации включают ЛНК, 8-аза-7-деаза-пурин, 5-пропинилурацил, 5-пропинилцитозин и/или абазические разрывы в олигонуклеотиде. Другими модификациями в соответствии с настоящим изобретением являются, например, модификации с биотином, тиолом и молекулами - донорами и акцепторами флюоресценции.
В предпочтительном варианте осуществления настоящего изобретения наночастицы конъюгированы с олигонуклеотидами. Таким образом, наночастицы формируют конъюгаты наночастицы и олигонуклеотида. Таким способом можно добиться того, чтобы олигонуклеотиды, являющиеся частью способа в соответствии с настоящим изобретением, можно было специфически нагревать посредством возбуждения наночастиц, без нагревания объема реакции в целом. В особо предпочтительном варианте осуществления наночастицы конъюгированы с праймерами. Более предпочтительно, наночастицы конъюгированы с прямыми и обратными праймерами ПЦР. В предпочтительном варианте осуществления изобретения один вид конъюгатов наночастиц и олигонуклеотида содержит прикрепленные прямые праймеры, но не обратные праймеры; другой вид содержит прикрепленные обратные праймеры, но не прямые праймеры.
В другом предпочтительном варианте осуществления один вид конъюгатов наночастиц и олигонуклеотидов конъюгирован и с прямыми, и с обратными праймерами. В этом варианте осуществления новая одинарная цепь ДНК, комплементарная оригиналу, синтезируется в ПЦР, начиная от прямого праймера на наночастице. Эта новая одинарная цепь ДНК конъюгирована с наночастицей, поскольку новая одинарная цепь ДНК содержит прямой праймер. Немедленно после синтеза новая одинарная цепь ДНК формирует двойную цепь с оригиналом. На последующем этапе денатурации новая одинарная цепь ДНК отделяется от оригинала. При температуре отжига новая одинарная цепь ДНК гибридизуется с обратным праймером, который расположен на поверхности наночастицы, так что образуется петля. Для гибридизации с обратным праймером на той же самой наночастице необходимо пересечь только короткое расстояние. Для достижения гибридизации с обратным праймером на другой наночастице при предпочтительных концентрациях наночастицы, в среднем нужно пересечь большее расстояние. Так, в одном варианте осуществления предпочтительно отжиг достигается более быстро, и ПЦР может скорее завершиться.
В предпочтительном варианте осуществления изобретения наночастицы соединяются в праймерами таким образом, чтобы присутствовали ковалентные связи с более чем одним тиолом между праймерами и наночастицами. Как правило, буферные растворы для ПЦР содержат дитиотреитол, который дестабилизирует тиольную связь между золотыми наночастицами и праймерами, и который может, в особенности при термической нагрузке, например, при денатурации, приводить к отсоединению праймеров от наночастиц. Ковалентные связи более чем с одним тиолом между праймерами и наночастицами могут уменьшать отсоединение праймеров, и таким образом, повышать эффективность ПЦР.
В предпочтительном варианте осуществления применяют обратные последовательности, которые могут связываться с такими олигонуклеотидами, которые отсоединяются от наночастиц, с которыми они были ранее соединены. Обратные последовательности являются олигонуклеотидами. В таком способе может случаться, что олигонуклеотиды, которые конъюгированы с наночастицами, отсоединяются от указанных наночастиц и становятся свободными. В случае, когда указанные свободные нуклеотиды являются праймерами в соответствии с настоящим изобретением, эти свободные праймеры могут связываться с оригиналом или комплементом. Поскольку свободные праймеры не связываются с наночастицами, свободные праймеры не могут дегибридизоваться от оригинала или комплемента, соответственно, при возбуждении наночастиц. Таким образом, эффективность и чувствительность способа снижается. Обратные последовательности являются по меньшей мере отчасти комплементарными свободным олигонуклеотидам, и связываются с ними с достаточной аффинностью для ограничения функции свободных олигонуклеотидов. Таким способом можно повысить эффективность и чувствительность способа. В особо предпочтительном варианте осуществления способа количество обратных последовательностей, достаточное для блокирования свободных праймеров, добавляют в образец непосредственно перед добавлением оригинала. В то же самое время указанное количество является достаточно малым, чтобы наночастицы проявляли достаточно большое число не-блокированных праймеров. Это возможно, если число праймеров на наночастицах превышает число свободных праймеров.
В предпочтительном варианте осуществления заполняющие молекулы присоединены к наночастицам. Заполняющие молекулы предотвращают нежелательную агрегацию наночастиц в образце. Заряд наночастиц можно модулировать с применением заполняющих молекул. Таким образом, концентрацию соли, которая присутствует в среде, окружающей наночастицы, можно приспособить так, чтобы ДНК-полимераза могла синтезироваться как можно быстрее, и чтобы, предпочтительно, способ можно было быстро выполнять. Заполняющие молекулы могут состоять из олигонуклеотидов, которые не являются праймерами, и которые предпочтительно короче праймеров. Заполняющие молекулы могут также, например, состоять из полимеров, например, таких как полиэтиленгликоль. В предпочтительном варианте осуществления заполняющие молекулы позволяют снизить число праймеров на наночастицах, и вместо этого применять больше заполняющих последовательностей, без существенного снижения эффективности способа.
В другом предпочтительном варианте осуществления способа отагонуклеотиды на наночастицах имеют спейсерную последовательность в качестве частичной последовательности. Спейсерная последовательность расположена на части олигонуклеотида поблизости от наночастицы. Таким образом, спейсерная последовательность служит для оставшейся части олигонуклеотида в качестве спейсера. В предпочтительном варианте осуществления олигонуклеотид содержит одну частичную последовательность, которая выполняет функцию праймера, и называется праймерной последовательностью, а также частичную последовательность, которая является спейсерной последовательностью. Поскольку праймерные последовательности отделены благодаря спейсерным последовательностям, нуклеиновые кислоты, которые нужно амплифицировать, и ДНК-полимеразы могут, предпочтительно, обеспечивать лучший доступ к праймерным последовательностям. В предпочтительном варианте осуществления копии оригинала и комплемента остаются прикрепленными к поверхности наночастиц через спейсерные последовательности. В особо предпочтительном варианте осуществления спейсерные последовательности содержат сайты рестрикции для рестрикции эндонуклеазами, так чтобы синтезированные копии можно было отделить от наночастиц. Это предпочтительно происходит после окончания способа; однако, это также может происходить во время осуществления способа. Таким образом, способ обеспечивает возможность получения копий нуклеиновых кислот, которые свободно присутствуют в образце. В предпочтительном варианте осуществления способа, спейсерные последовательности являются по меньшей мере такими же длинными, как заполняющие молекулы, так что праймерные последовательности не загораживаются заполняющими молекулами.
В предпочтительном варианте осуществления тепло, переносимое от наночастиц в окружающую среду посредством возбуждения наночастиц, является достаточным для дегибридизации олигонуклеотидов на поверхности наночастиц от нуклеиновых кислот, гибридизуемых на указанных олигонуклеотидах. В этом варианте осуществления наночастицы конъюгированы с олигонуклеотидами, и по меньшей мере часть указанных олигонуклеотидов гибридизована по меньшей мере с частично комплементарными нуклеиновыми кислотами. При возбуждении наночастиц термическая энергия переносится к окружающей воде, так что, предпочтительно, температура воды вокруг наночастиц является достаточной, дегибридизуя олигонуклеотиды от нуклеиновых кислот, связанных с ними. В особо предпочтительном варианте осуществления способ в соответствии с настоящим изобретением является ПЦР, а наночастицы конъюгированы с праймерами. При выполнении ПЦР предпочтительно образуются продукты ПЦР с двойной цепью, в каждом из которых одинарная цепь из продуктов ПЦР с двойной цепью конъюгированы с наночастицей. В одном варианте осуществления это предпочтительно для достижения температуры денатурации вокруг наночастиц посредством возбуждения наночастиц и для выполнения денатурации продуктов ПЦР с двойной цепью, без нагревания всего объема реакции. Таким образом, денатурацию можно ускорить, так чтобы ПЦР проходила быстрее. В другом предпочтительном варианте осуществления температура отжига и температура элонгации также достигаются посредством возбуждения наночастиц. Таким образом, предпочтительно, только малое количество энергии нужно перенести, при сравнении с нагреванием всего образца, для достижения температуры отжига и температуры элонгации. Более предпочтительно, денатурацию, отжиг и элонгацию ПЦР проводят без общего нагревания, но исключительно посредством местного нагревания путем возбуждения наночастиц. Таким образом, способ можно осуществлять без устройства для общего нагревания, так что требуется меньше нагревания для осуществления способа.
В другом предпочтительном варианте осуществления способ включает этап общего нагревания. При этом температура по меньшей мере на одном этапе достигается по меньшей мере отчасти путем общего нагревания. В более предпочтительном варианте осуществления изобретения способ является ПЦР, и температура отжига достигается путем общего нагревания объема реакционной смеси. Наиболее предпочтительно, объем реакционной смеси полностью нагревают посредством способа полного нагревания до предварительно заданного температурного диапазона, в котором проводят отжиг. При этом температура элонгации и температура денатурации обеспечиваются посредством возбуждения наночастиц. Таким образом, предпочтительно, устройство, обеспечивающее общее нагревание, можно применять с простой конструкцией, поскольку нужно будет поддерживать только предварительно заданную температуру.
В другом предпочтительном варианте осуществления температура отжига и температура элонгации обеспечиваются путем общего нагревания, денатурация достигается исключительно путем возбуждения наночастиц. Таким образом, предпочтительно, чтобы устройство, обеспечивающее общее нагревание, производило температурный цикл с двумя различными температурами, и имело простую конструкцию. Как правило, элонгация и отжиг проходят в узком температурном диапазоне. Напротив, для достижения денатурации нужно только превысить определенную температуру. Таким образом, неоднородность возбуждения наночастиц для обеспечения денатурации является меньшей проблемой, чем регуляция температуры отжига и температуры элонгации. Таким образом, предпочтительный вариант осуществления, в котором возбуждение наночастиц служит исключительно для обеспечения денатурации, может технически применяться самым простым образом. Это особенно касается предпочтительного варианта осуществления, при котором температура отжига и температура элонгации могут быть очень близкими, например, когда температура отжига составляет 60°С, а температура элонгации составляет 72°С, так что общее нагревание необходимо только для небольшого повышения температуры.
В особо предпочтительном варианте осуществления температура отжига является той же самой, что и температура элонгации. В этом случае способ является ПЦР. Если температура отжига является равной температуре элонгации, температурный цикл только с двумя разными температурами необходим для выполнения ПЦР, что означает, что способ можно выполнять с простым режимом.
Предпочтительно, используемые температуры плавления праймеров и ДНК полимеразы выбраны так, что при температуре плавления используемая ДНК полимераза может все еще синтезировать ДНК с достаточной скоростью. В особо предпочтительном варианте осуществления температура элонгации, которая равна температуре отжига, достигается путем общего нагревания, а денатурация достигается посредством возбуждения наночастиц. Таким образом, устройство, обеспечивающее общее нагревание, можно применять простым способом, поскольку оно требует только сохранения одной температуры.
В предпочтительном варианте осуществления только часть наночастиц возбуждается только в одной точке во время выполнения способа. Для этого, например, средства возбуждения наночастиц можно сконструировать так, чтобы они возбуждали наночастицы в одной части объема реакционной смеси. В особо предпочтительном варианте осуществления наночастицы возбуждаются оптически с применением лазера и оптики, проводящей свет в объем реакционной смеси, сконструированной так, чтобы свет направлялся только в одну часть объема реакционной смеси. Часть наночастиц, которая возбуждается, предпочтительно меняется при осуществлении способа. Другими словами, первый набор наночастиц, который возбуждается в первый раз, не идентичен второму набору наночастиц, возбуждаемому во второй раз. В этом случае любое число наночастиц может присутствовать в первом наборе, и любое число наночастиц может присутствовать во втором наборе, пока первый и второй наборы не являются идентичными. Из двух указанных наборов один, например, может перекрываться с другим, так чтобы наборы формировали пересечение наборов. Один набор может, например, быть подгруппой из другого набора, так чтобы один набор содержал меньше наночастиц, чем другой набор. Два набора могут также быть моделированы так, чтобы они не формировали пересечения, так чтобы не было наночастиц, присутствующих и в первом наборе, и во втором наборе. Один из двух наборов может также пустым набором, так чтобы, например, в одно время наночастицы возбуждались, а в другое время не было возбужденных наночастиц. В предпочтительном варианте осуществления первый и второй набор по существу содержат одинаковое число наночастиц. Особо предпочтительно, в разное время лазер возбуждает различные фракции наночастиц. Таким образом, при выполнении способа можно применять лазер с меньшей мощностью, достаточной лишь для возбуждения фракции наночастиц. В особо предпочтительном варианте осуществления два или более лазера применяют для возбуждения различных частей наночастиц. Таким образом, предпочтительно, можно возбуждать различные фракции наночастиц, без необходимости оптического элемента, который направляет лазер на различные части объема реакционной смеси.
В другом предпочтительном варианте осуществления изобретения направленное движение образца относительно возбуждающего поля происходит так, что в различное время наночастицы в различных парциальных объемах образца возбуждаются. Более предпочтительно, возбуждающее поле является светом лазера. В наиболее предпочтительном варианте осуществления свет лазера направляется оптическим элементом для возбуждения наночастиц в различных парциальных объемах объема реакционной смеси в разное время. Оптический элемент может быть подвижным, например, оптический элемент может содержать подвижное зеркало, пространственный модулятор или акустико-оптический модулятор. Сам лазер также может быть подвижным. Передвижение образца можно осуществлять путем перемещения сосуда для реакции, содержащего образец. В особо предпочтительном варианте осуществления лазерный пучок, а также сосуд для реакции передвигается. В другом предпочтительном варианте осуществления образец перемещается в объеме реакции так, что свет лазера охватывает различные парциальные объемы образца в различное время. Это может, например, достигаться путем перемешивания образца в объеме реакционной смеси, например, путем применения магнитной мешалки. Объем реакционной смеси может, например, принимать удлиненную форму, например, форму канала или трубки. Образец может, например, передвигаться через канал с образцом, пропускающий лазерный пучок в одном или нескольких местах. Предпочтительно, образец протекает через канал и проходит n положений, в каждом из которых один лазерный пучок направляется на образец в канале; благодаря линейному потоку образца через n лазерных пучков, проводится ПЦР из n циклов. Таким образом, можно осуществлять способ с малым количеством передвижных частей. Путем применения канала возможна миниатюризация, например, в виде лаборатории на чипе. Предпочтительно, лазерный пучок вызывает денатурацию, в то время как температура элонгации и температура отжига достигаются путем общего нагревания. Особо предпочтительно, чтобы температура элонгации была равной температуре отжига, так чтобы только одна температура сохранялась при общем нагревании. Таким образом, можно выполнять способ в соответствии с настоящим изобретением с минимальными усилиями.
В предпочтительном варианте осуществления, в способе применяют термолабильную ДНК-полимеразу. В этом случае, если возбуждение наночастиц применяют для денатурации, можно избежать воздействия высоких температур на весь объем реакционной смеси. Скорее, можно нагревать исключительно среду, непосредственно окружающую наночастицы, до температуры денатурации. Таким образом, ДНК-полимеразы, которые не располагаются в среде, непосредственно окружающей наночастицы, не подвергаются воздействию высоких температур. Таким образом, можно применять ДНК-полимеразы, являющиеся не термостабильными, а термолабильными. Путем включения термолабильных ДНК-полимераз, доступен большой выбор ДНК-полимераз для способа в соответствии с настоящим изобретением. Благодаря большому выбору ДНК-полимераз, условия реакции можно варьировать в широком диапазоне, в то же самое время поддерживая достаточную активность используемой ДНК-полимеразы. Чтобы амплифицируемые нуклеиновые кислоты могли связываться с отрицательно заряженными нуклеотидами на наночастицах, может быть необходимо применять вещества, в особенности соли, в образце при концентрации, которая может оказывать отрицательное влияние на работу термостабильной ДНК-полимеразы, что снижает эффективность способа. Больший выбор ДНК-полимераз, в частности тех, что обладают толерантностью к высокой концентрации соли, может привести к повышению эффективности способа. Частью из большого выбора ДНК-полимераз являются малые ДНК-полимеразы, например, такие как фрагмент Кленова и Phi29. В тесной близости с наночастицами большие, термостабильные ДНК-полимеразы могут проявлять стерическое ограничение из-за прикрепленных и возможно, уже элонгированных праймеров. В результате возможно, что ДНК-полимераза не будет обеспечивать копируемой нуклеиновой кислоты, или ДНК-полимераза будет прерываться до синтеза полной копии оригинала или комплемента, что вызывает снижение эффективности способа. Таким образом, большой выбор ДНК-полимераз обеспечивает повышение эффективности возможного способа. Благодаря большому выбору ДНК-полимераз, предпочтительно, также могут быть использованы более дешевые ферменты. ДНК-полимеразы, которые не расположены в среде, непосредственно окружающей наночастицы, подвергаются небольшой степени термоиндуцированной инактивации. Таким образом, в способе предпочтительно можно применять небольшое количество ДНК-полимеразы.
В предпочтительном варианте осуществления изобретения, растворимые праймеры, а также праймеры на наночастицах присутствуют в объеме реакционной смеси. Растворимые праймеры не конъюгированы с наночастицами, но растворены в образце. Предпочтительно, растворимые праймеры меньше, чем конъюгаты наночастиц и праймеров, и таким образом, могут присутствовать в большей концентрации, чем конъюгаты наночастиц и праймеров. Благодаря этому, растворимые праймеры могут иметь лучший и более быстрый доступ к длинным двухцепочечным нуклеиновым кислотам, например, таким как геномная ДНК. В особо предпочтительном варианте осуществления на первом этапе способа длинные двухцепочечные нуклеиновые кислоты денатурируют путем общего нагревания во всем объеме реакции, после чего растворимые праймеры гибридизуют с нуклеиновыми кислотами. ПЦР вначале проходит один или несколько циклов общего нагревания, при которых ДНК-полимераза синтезирует необходимые короткие копии длинных двухцепочечных нуклеиновых кислот. Затем ПЦР продолжают, также с применением локального нагревания посредством возбуждения наночастиц.
В предпочтительном варианте осуществления изобретения диффузию частиц конъюгатов наночастиц и праймеров можно амплифицировать с применением оптических полей. Посредством оптических вихревых полей (в соответствии с Silvia Albaladejo et al., Nano Letters, 2009, volume 9, issue 10, pages 3527-3531, соответствующее содержание которого является частью настоящего раскрытия, включенной посредством ссылки), в которых наночастицы возбуждаются, или посредством оптических сил (в соответствии с Arthur Ashkin et al., Proc. Natl. Acad. Sci., 1997, volume 94, issue 10, pages 4853-4860, соответствующее содержание которого является частью настоящего раскрытия, включенной посредством ссылки), которые воздействуют на наночастицы, можно повысить диффузию наночастиц. Таким образом, предпочтительно, может происходить более быстрая гибридизация нуклеиновых кислот, которые нужно амплифицировать, с праймерами на наночастицах, при данной концентрации наночастиц. Это можно применять для достижения ускорения способа в соответствии с настоящим изобретением.
В одном варианте осуществления настоящего изобретения, концентрацию продуктов реакции амплификации можно определить с тестовыми зондами. Тестовые зонды являются наночастицами, содержащими олигонуклеотиды с тестовыми последовательностями на их поверхностях. В предпочтительном варианте осуществления способа, олигонуклеотиды из тестовых зондов имеют спейсерную последовательность в качестве частичной последовательности. Спейсерная последовательности располагается на стороне олигонуклеотида, близкой к наночастице. Таким образом, спейсерная последовательность служит в качестве оставшейся части олигонуклеотида в качестве спейсера. В предпочтительном варианте осуществления олигонуклеотид из тестовых зондов содержит как частичную последовательность, которая называется тестовой последовательностью, так и частичную последовательность, которая является спейсерной последовательностью. В предпочтительном варианте осуществления тестовые зонды содержат заполняющие молекулы, прикрепленные к ним. Тестовые последовательности могут гибридизоваться с продуктами реакции амплификации. При этом тестовые последовательности являются по меньшей мере частично комплементарными продуктам реакции амплификации. В предпочтительном варианте осуществления первые наночастицы конъюгированы с прямыми праймерами. В присутствии оригинала и ДНК полимеразы, прямые праймеры удлиняются так, что создаются комплементы, которые связываются с первыми наночастицами через прямые праймеры. При этом комплемент состоит из прямого праймера и удлиненной последовательности, которая создана путем удлинения прямого праймера. Особо предпочтительно, ПЦР проводят с применением растворенных и/или конъюгированных с наночастицами обратных праймеров, так что при экспоненциальной амплификации предпочтительно образуется большое число копий оригинала и комплемента, конъюгированного с наночастицами. Наиболее предпочтительно, первые наночастицы содержат на их поверхности и прямые, и обратные праймеры. На факультативном промежуточном этапе оригиналы, и возможно, их копии денатурируют из комплемента посредством локального или общего нагревания. Первые наночастицы затем объединяют с тестовыми зондами, если этого не делали раньше. Тестовые последовательности из тестовых зондов комплементарны удлиненным последовательностям, так что тестовые зонды могут связываться с удлиненными прямыми праймерами на первых наночастицах через тестовые последовательности. При подходящих условиях реакции соединение первых наночастиц и тестовых зондов имеет место в степени, в которой присутствуют наночастицы, связанные с комплементом. Это означает, что если не образуются удлиненные последовательности, не соединяются тестовые зонды и наночастицы. Более предпочтительно, условия реакции амплификации и детекции в соответствии с изобретением с применением тестовых зондов выбирают так, чтобы степень соединения первых наночастиц с тестовыми зондами позволяла сделать вывод о том, какая концентрация оригинала присутствовала в образце до амплификации. При соединении первых наночастиц с тестовыми зондами, может возникнуть измеряемое изменение, например, сдвиг в длинноволновую область или расширение плазмонного резонанса в спектре поглощения. В особо предпочтительном варианте осуществления измеряемое изменение, которое происходит при соединении тестовых зондов и наночастиц, пропорционально концентрации оригинала в образце перед амплификацией. Таким образом, предпочтительно, можно применять простые инструменты для проверки концентрации.
В другом предпочтительном варианте осуществления способ включает прямые праймеры, которые конъюгированы с первыми наночастицами и обратными праймерами, которые свободны и/или связаны с наночастицами. Особо предпочтительно, чтобы наночастицы содержали и прямые, и обратные праймеры на поверхности. На первом этапе ДНК-полимераза удлиняет прямые праймеры к комплементам, связанным с наночастицей, в присутствии оригинала. На втором этапе, начиная от обратных праймеров, которые связаны с комплементом, связанным с наночастицей, синтезируются копии оригинала.
После этого первые наночастицы объединяют с тестовыми зондами, если этого не делали раньше. В этом варианте осуществления тестовые последовательности комплементарны прямым праймерам. Если прямые праймеры не удлинены, то тестовые зонды могут хорошо связываться с первыми наночастицами. Если прямые праймеры удлинены, то связывание тестовых образцов с прямыми праймерами ингибируется из-за стерического ограничения. Если вновь синтезированные копии оригинала гибридизуются с удлиненным прямым праймером, то связывание тестовой последовательности с удлиненным прямым праймером предотвращается. Таким образом, степень соединения между первыми наночастицами и тестовыми зондами снижается до степени, в которой синтезируются продукты амплификации, т.е. комплементы и копии оригинала. При выборе надлежащих условий реакции концентрацию оригинала можно определить так, чтобы измеряемое изменение было тем меньше, чем больше оригинала присутствовало в образце перед амплификацией. Измеряемое изменение может, например, быть сдвигом в длинноволновую область, или расширением плазмонного резонанса в спектре поглощения. Таким образом, предпочтительно, можно разработать простой тест, позволяющий определять концентрации специфических нуклеиновых кислот.
Изобретение обеспечивает усовершенствованный способ амплификации нуклеиновых кислот.
Краткое описание фигур
Фигура 1 является схематическим изображением наночастиц в соответствии с настоящим изобретением, конъюгированных с заполняющими молекулами, спейсерными последовательностями и праймерными последовательностями.
Фигура 2 является другим схематическим изображением наночастиц в соответствии с настоящим изобретением, конъюгированных с заполняющими молекулами, спейсерными последовательностями и праймерными последовательностями.
Фигура 3 является схематическим изображением установки для выполнения способа в соответствии с изобретением с лазером, двумерным зеркальным сканером и образцом.
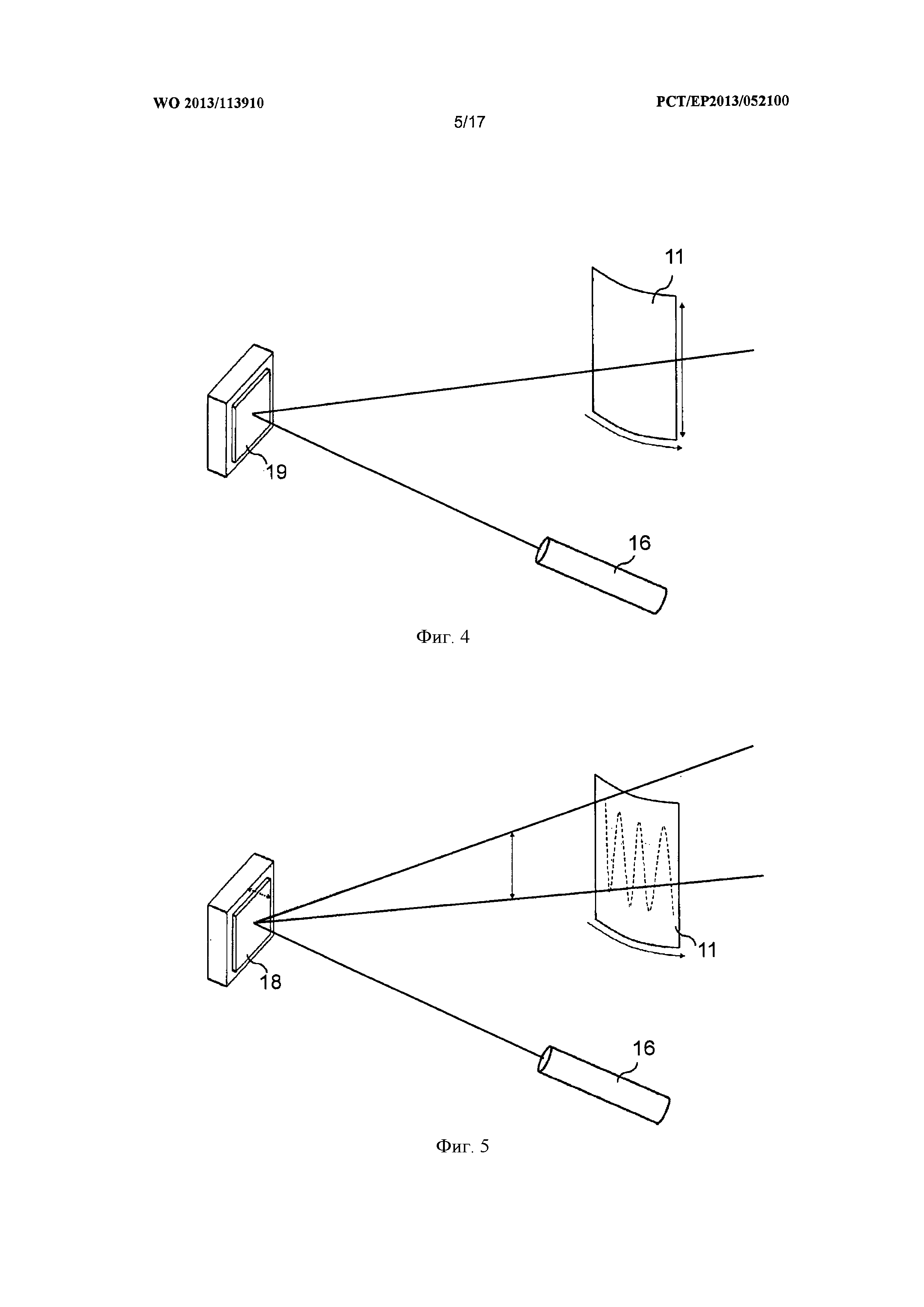
Фигура 4 является схематическим изображением еще одной установки для проведения способа в соответствии с изобретением с лазером, зеркалом и образцом, который передвигают относительно лазерного пучка.
Фигура 5 является схематическим изображением еще одной установки для выполнения способа в соответствии с изобретением, с лазером, одномерным зеркальным сканером и образцом, перемещаемым в одном измерении.
Фигура 6 является схематическим изображением наночастиц в соответствии с изобретением, и тестовых зондов в соответствии с настоящим изобретением, для позитивной детекции ДНК.
Фигура 7 является схематическим изображением еще одной установки для проведения способа в соответствии с настоящим изобретением, с лазером, двумерным зеркальным сканером и трубкой для образцов в водяной бане.
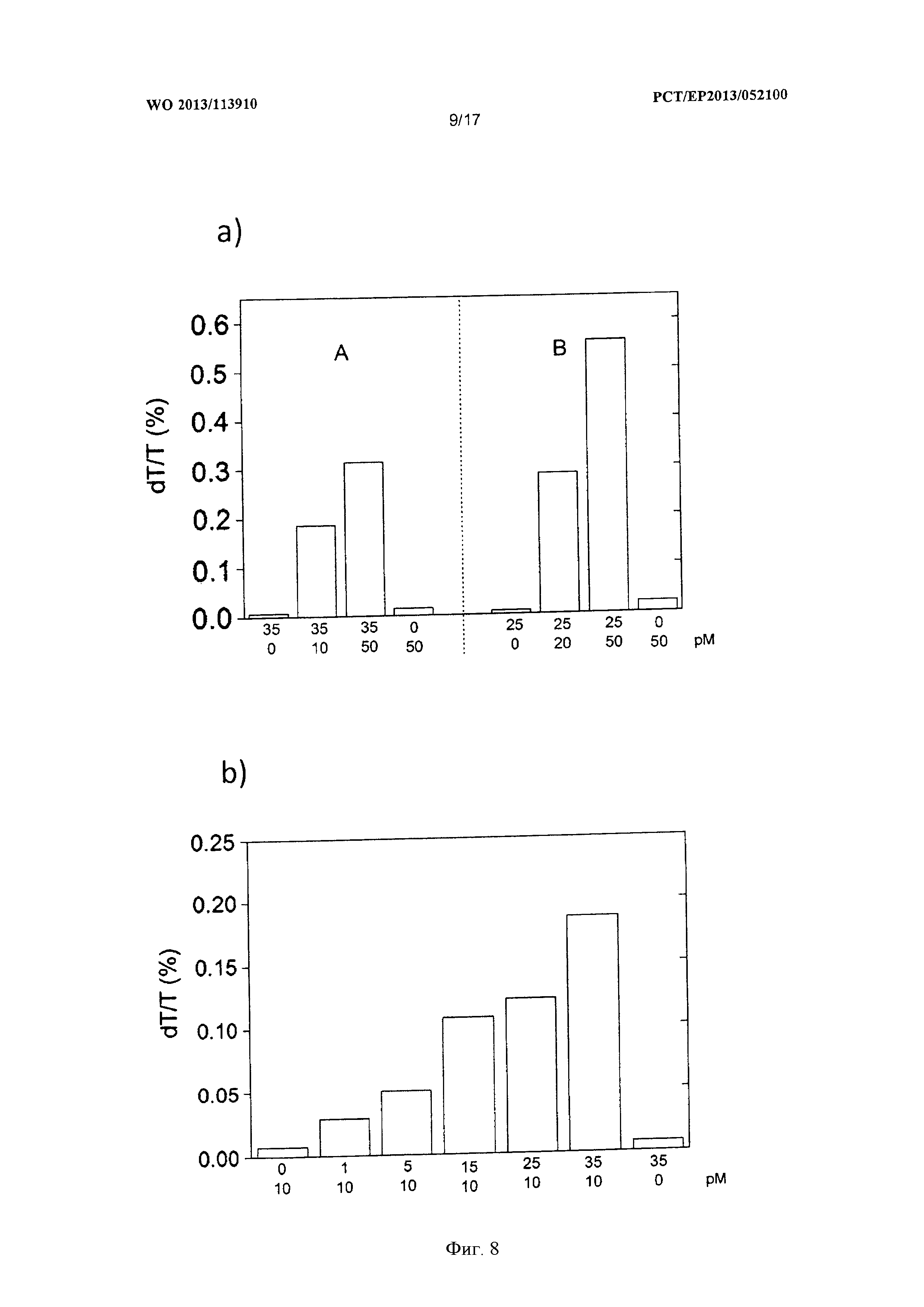
Фигура 8 демонстрирует на двух диаграммах результаты реакций амплификации с общим и локальным нагреванием с тестовыми зондами для позитивной детекции ДНК.
Фигура 9 является схематическим изображением наночастиц в соответствии с настоящим изобретением, и тестовых зондов в соответствии с настоящим изобретением, для негативной детекции ДНК.
Фигура 10 демонстрирует на двух диаграммах результаты реакций амплификации с общим и локальным нагреванием с тестовыми зондами для негативной детекции ДНК.
Фигура 11 показывает на диаграмме результаты реакций амплификации с не-термостабильным фрагментом Кленова.
Фигура 12 показывает на диаграмме результаты реакций амплификации с фиксированным и движущимся лазерным пучком.
Фигура 13 является схематическим изображением установки для выполнения способа в соответствии с изобретением с источником света, преломляющим элементом и передвижной трубкой для образцов.
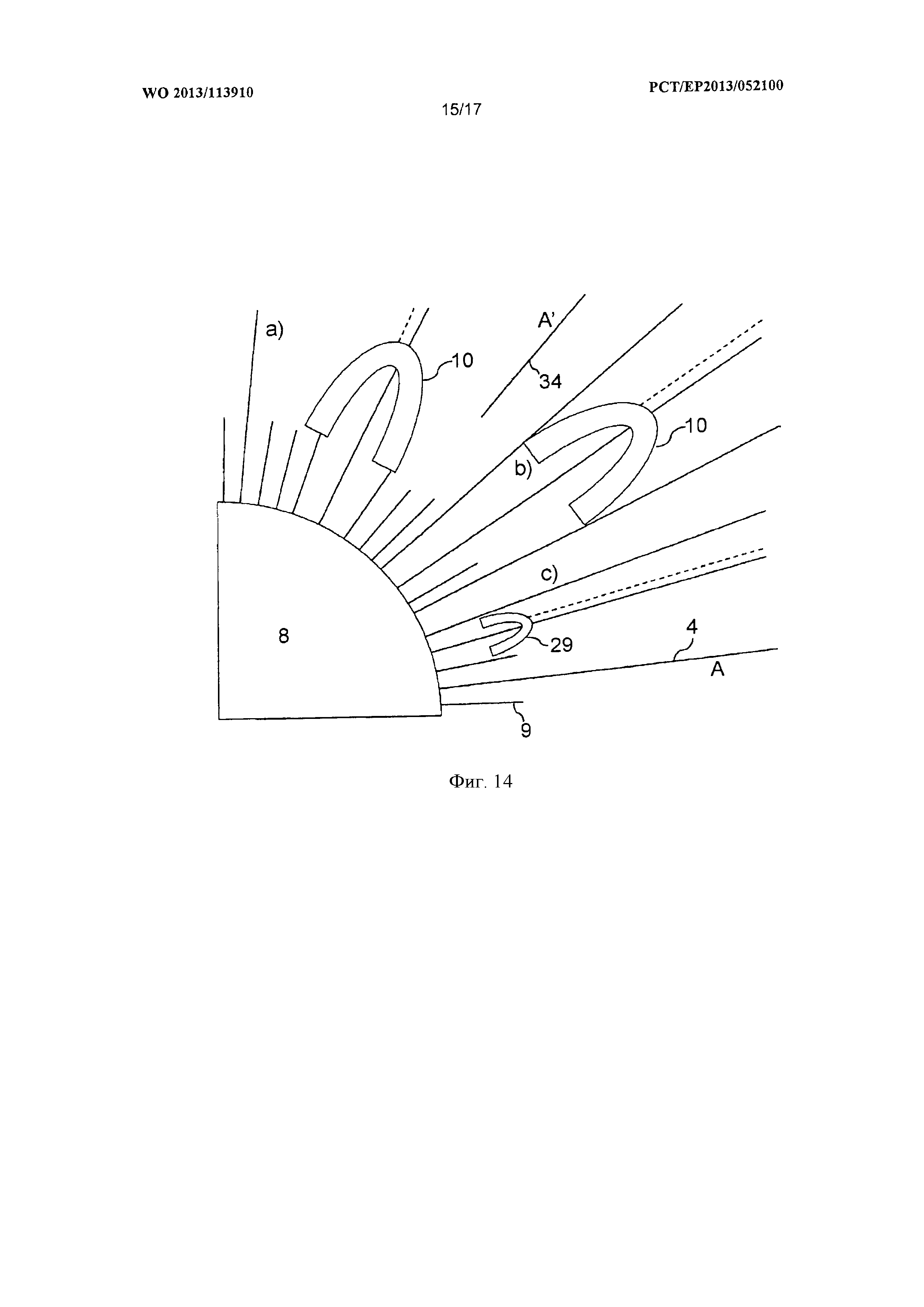
Фигура 14 является схематическим изображением секции наночастицы в соответствии с изобретением с заполняющими молекулами, олигонуклеотидами и ДНК-полимеразами.
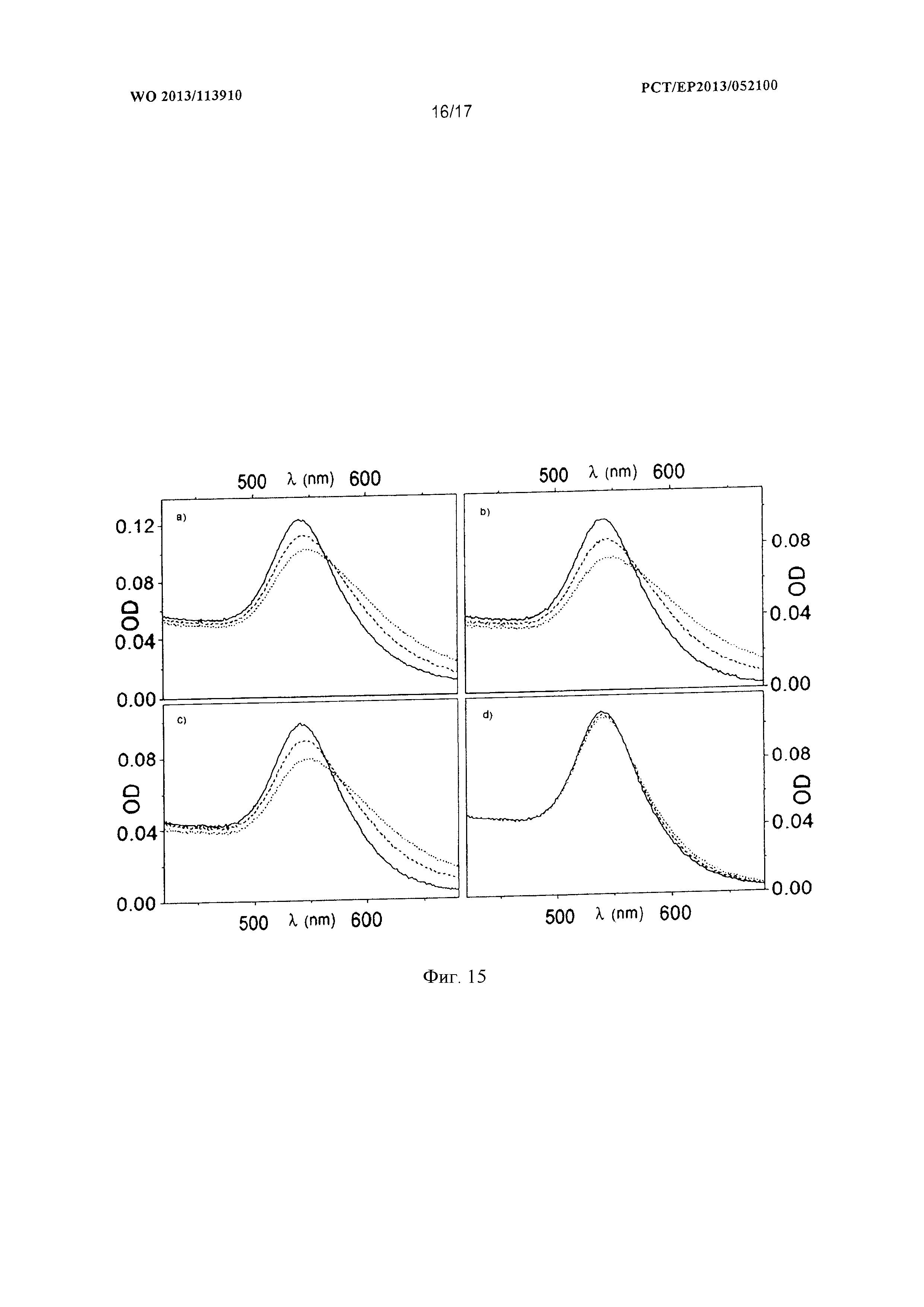
Фигура 15 показывает на четырех диаграммах результаты реакции амплификации с тестовыми зондами для негативной детекции ДНК.
Фигура 16 является схематическим изображением первого лазера для возбуждения наночастиц в трубке для образцов, и второго лазера и фотодиода для измерения пропускания образца.
Подробное описание изобретения в соответствии с некоторыми вариантами осуществления
На фигуре 1 представлен вариант осуществления способа в соответствии с настоящим изобретением для амплификации нуклеиновой кислоты 1, который осуществляется путем ПЦР. Объем реакционной смеси 2 содержит первые наночастицы 3. Первые наночастицы 3 демонстрируют олигонуклеотиды 4 на их поверхности, как видно на фигуре 1а. Один вид олигонуклеотидов 4 содержит в качестве частичной последовательности праймерную последовательность 5 с последовательностью А, и в качестве дополнительной, факультативной последовательности спейсерную последовательность 6S. Праймерная последовательность 5 определяется как последовательность праймера 7. Спейсерная последовательность 6S служит для того, чтобы сохранять праймерную последовательности 5 достаточно далеко от поверхности наночастицы 8 для связывания амплифицируемой нуклеиновой кислоты 1 с праймерной последовательностью 5 с лучшей эффективностью, и для лучшего доступа ДНК полимеразы 10 к праймерной последовательности 5. Олигонуклеотиды 4 с праймерной последовательностью 5А присоединены, например, посредством тиоловой связи к поверхности первой наночастицы так, чтобы 3′-конец был обращен от первой наночастицы 3. Факультативно, другой вид олигонуклеотидов 4 может присутствовать на поверхности первых наночастиц 3; это заполняющие молекулы 9F. С помощью заполняющих молекул 9, заряд наночастиц 8 можно модулировать так, чтобы избежать нежелательной агрегации наночастиц 8. Кроме того, заполняющие молекулы 9 могут повысить расстояние праймерных последовательностей 5 друг от друга на поверхности наночастиц 8 так, чтобы амплифицируемые нуклеиновые кислоты 1 и ДНК-полимераза 10 могли получить лучший доступ к праймерным последовательностям 5. Это может повысить эффективность способа. Спейсерная последовательность 6 предпочтительно является по меньшей мере такой же длинной, как заполняющая молекула 9, так чтобы, предпочтительно, праймерные последовательности 5 выступали за заполняющие молекулы 9.
Образец 11 присутствует в объеме реакционной смеси 2, где образец 11 содержит первые наночастицы 3 с фигуры 1a c праймерными последовательностями 5, спейсерными последовательностями 6 и заполняющими молекулами 9, и в дополнение к ним, дНТФ и ДНК-полимеразы 10. Нуклеиновая кислота 1, подлежащая детекции, может присутствовать в образце 11. В этом варианте осуществления нуклеиновая кислота 1, подлежащая детекции, является одинарной цепью ДНК, которую также называют оригиналом 12, и содержит частичную последовательность А′, а также частичную последовательность В′. Оригинал 12 может также содержать другие частичные последовательности, например, как выдающиеся на 5′ или 3′ - конце или между двумя частичными последовательностями А′ и В′. На фигуре 1b, оригинал 12 связывается с его частичной последовательностью А′ с праймерной последовательностью 5А на поверхности первой наночастицы 3. На фигуре 1с показано, что ДНК-полимераза 10 связывается с оригиналом 12 и с праймерной последовательностью 5А, гибридизованной с оригиналом 12. Затем ДНК-полимераза 10 осуществляет синтез на этапе элонгации, который показан на фигуре 1d, начиная от 3′-конца праймерной последовательности 5А нуклеиновой кислоты 1, комплементарной оригиналу 12, где нуклеиновая кислота называется комплементом 13 и соединяется со спейсерной последовательностью 6 на поверхности первой наночастицы 3. На фигуре 1e первая наночастица 3 затем облучается светом, который поглощается первой наночастицей 3 за счет ее плазмонных или материальных свойств, и преобразуется в тепло. Тепло, переносимое в среду, окружающую первую наночастипу 3, и в область оригинала 12 и вновь синтезированного компонента 13, гибридизованного с оригиналом 12, достаточно для денатурации оригинала 12 от комплемента 13. Оригинал 12 вновь освобождается, как показано на фигуре 1f, так что он может связаться с другой праймерной последовательностью 5, и другие комплементы 13, связанные с наночастицей, могут синтезироваться в дополнительных циклах способа. Таким способом, обеспечивается линейное повышение концентрации комплементов 13 с повышением числа циклов. Этапы способа, описанного на фигуре 1g и 1h, подробно описаны далее.
На фигуре 2 показан вариант осуществления способа в соответствии с настоящим изобретением, в котором наночастицы 8 расположены в образце 11. Наночастицы 8 показывают заполняющие молекулы 9F на своей поверхности. Далее, наночастицы 8 конъюгированы с олигонуклеотидами 4. Первый вид олигонуклеотидов 4 состоит спейсерной последовательности 6S и праймерной последовательности 5А. Второй вид олигонуклеотидов 4 состоит из спейсерной последовательности 6S и праймерной последовательности 5В′. В этом варианте осуществления оригинал 12, который нужно амплифицировать, является одноцепочечной молекулой ДНК с частичными последовательностями А, С, В (не показаны). Начиная от праймерной последовательности В′ на поверхности наночастицы 8, ДНК-полимераза 10 синтезирует цепь, комплементарную оригиналу 12, так что, как показано на фигуре 2а, одинарная цепь ДНК с последовательностью S, В′, С, и А′ располагается на наночастице 8. В то же самое время, на фигуре 2а можно видеть, что ДНК полимераза синтезирует копию оригинала 12, начиная от праймерной последовательности 5А, соединенной со спейсерной последовательностью 6S на поверхности наночастицы 8. Как показано стрелкой на фигуре 2а, копия оригинала 12, присоединенная к наночастице 8, гибридизуется с ее частичной последовательностью В к праймерной последовательности 5В′ на поверхности той же самой наночастицы 8. Вторая стрелка на фигуре 2а показывает, что комплемент 13, синтезируемый на поверхности наночастицы 8, гибридизуется с его частичной последовательностью А′ с праймерной последовательностью 5А на поверхности той же самой наночастицы 8. Результат двух указанных гибридизаций показан на фигуре 2b. При этом оригинал 12, а также комплемент 13 образует петлю на поверхности наночастицы 8. На фигуре 2с показано, что цепь, комплементарная оригиналу 12, синтезируется, начиная от праймера 7Β′, где цепь соединяется с поверхностью наночастицы 8 через спейсерную последовательность 6S. Другая ДНК полимераза синтезирует копию оригинала 12, начиная от праймерной последовательности 5А, где копия также соединяется с поверхностью наночастицы 8 через спейсерную последовательность 6. Результат этих двух синтезов показан на фигуре 2d. В этом варианте осуществления прямой праймер 14, также как и обратный праймер 15, расположены на одной и той же наночастице 8. Таким образом, вновь синтезированная цепь ДНК может гибридизоваться обратно к праймеру 7 на той же самой наночастице 8. Это может приводить к ускорению способа в соответствии с изобретением, поскольку вновь синтезированная цепь ДНК не должна далеко перемещаться для встречи с комплементарным праймером. Скорее, вновь синтезированная цепь ДНК может связываться особенно быстро с комплементарным праймером 7 на поверхности той же самой наночастицы 8, что облегчается особенно высокой местной концентрацией праймера 7 на наночастице 8. После возбуждения наночастицы 8 на фигуре 2d, например, лазером 16, копии оригинала 12 и копии комплемента, каждые из которых прикреплены к поверхности наночастицы 8 через спейсерные последовательности 6, дегибридизуются. После этого копия оригинала 12, прикрепленная к наночастице 8, может гибридизоваться с комплементом 13, прикрепленным к поверхности другой, идентичной наночастицы 8. Посредством гибридизации наночастицы 8 соединяются, так что происходит измеряемое изменение. Измеряемое изменение может, например, заключаться в изменении цвета образца 11. Вариант осуществления способа в соответствии с настоящим изобретением, показанный на фигурах 2а-2е, обеспечивает возможность простого анализа, который служит для детекции оригинала 12.
На фигуре 3 представлена установка, пригодная для осуществления способа в соответствии с настоящим изобретением. Установка содержит источник света 17, который в данном случае применяется в виде лазера 16, и двумерный зеркальный сканер 18, который может направлять свет от лазера 16 до образца 11. Двумерный зеркальный сканер 18 может преломлять лазер в двух направлениях. В этой установке денатурация в образце 11 происходить путем фокусирования лазерного пучка на часть образца 11. Во время способа лазерный пучок преломляется так, что попадает на разные части образца 11. В примере, показанном на фигуре 3, лазерный пучок преломляется зеркальным сканером 18 так, что лазерный пучок передвигается через объем реакции 2, в котором находится образец 11, ряд за рядом. На фигуре 3 путь, прошедший лазерным пучком в образце 11, показан пунктирной линией. Благодаря тому, что за любое время на протяжении способа возбуждаются только части образца 11, можно применять лазеры 16 с меньшей мощностью выходного сигнала. Поскольку возбуждение в течение микросекунд достаточно для денатурации ДНК с помощью оптикотермически нагретых наночастиц 8, типичный диаметр фокуса лазера 16 примерно от 10 до 100 мкм позволяет лазерному пучку сканировать образец 11 со скоростью примерно от 10 до 100 м/с, что приводит к денатурации ДНК в каждой точке, пройденной лазером. Это обеспечивает очень быстрое сканирование больших объемов образца. Полное сканирование площади 1 см2 занимает, например, всего 128 мс при диаметре фокуса 78 мкм и 128 рядах при расстоянии между рядами 78 мкм и длине ряда 1 см при скорости сканирующего лазерного пучка 10 м/с. Предпочтительно, это существенно короче, чем обычно требует этап денатурации с применением общего нагревания. Оптические элементы, например, такие как зеркальный сканер 18, показанный на фигуре 3, и так называемые F-тета-линзы могут достигать хорошей однородности качества фокуса и размера по всему сканируемому образцу. В качестве альтернативы лазера с непрерывным испусканием 16, можно применять импульсный лазер 16 или термический радиатор.
На фигуре 4 показана установка для осуществления способа в соответствии с настоящим изобретением, в которой лазер 16 и зеркало 19 фиксированы, а лазерный пучок от лазера 16 направлен к образцу 11 с применением зеркала 19. При этом образец 11 расположен так, что может передвигаться в двух измерениях, так что путем перемещения образца 11 весь образец 11 или большие части образца 11 могут достигаться фокусом лазера 16.
На Фигура 5 приведена установка для осуществления способа в соответствии с изобретением, в которой лазер 16 является фиксированным, а зеркальный сканер 18 может отклонять лазерный пучок 16 в одном направлении. Образец И расположен так, что может передвигаться в одном направлении так, что при перемещении зеркального сканера 18 и образца 11 весь образец 11 или большие части образца 11 могут достигаться лазерным пучком. Одна возможность детекции нуклеиновой кислоты 1 путем ПЦР в соответствии с настоящим изобретением показана на фигуре 6. При этом первые наночастицы 3, которые демонстрируют заполняющие молекулы 9F и первые олигонуклеотиды 20 на своей поверхности, расположены в образце. Первые олигонуклеотиды 20 состоят из частичной последовательности 6S и праймерной последовательности 5А, как показано на фигуре 6а. Если оригинал 12 с частичными последовательностями А′ и В′ присутствует в образце 11, то оригинал 12 гибридизуется с комплементарной праймерной последовательностью 5А на одной из первых наночастиц 3. ДНК полимераза 10 синтезирует комплемент 13 с частичными последовательностями А и В, начиная от праймерной последовательности 5А, так что комплемент 13 соединяется с поверхностью первой наночастицы 3 через спейсерную последовательность 6S, как показано на фигуре 6с. На следующем этапе тестовые зонды 21, показанные на фигуре 6d, добавляют в образец. Тестовые зонды 21 являются вторыми наночастицами 22, которые демонстрируют заполняющие молекулы 9 и вторые нуклеотиды 23 на их поверхности. Вторые олигонуклеотиды 23 содержат спейсерную последовательность 6S и тестовую последовательность 5В′. Тестовая последовательность 5В′ может гибридизоваться с комплементарной частичной последовательностью В комплемента 13 на поверхности первой наночастицы 3, как показано на фигуре 6f. Таким образом, первые наночастицы 3 и вторые наночастицы 22 соединяются так, что может произойти измеряемое изменение. Если оригинал 12 не присутствует в образце 11, то не создается комплемента 13 на поверхности первой наночастицы 3, как видно на фигуре 6b. Поскольку нет комплемента 13 на первых наночастицах 3, первые наночастицы 3 и вторые наночастицы 22 не могут соединяться друг с другом, и не происходит измеряемое изменение. В данном варианте осуществления последовательность В′ является комплементарной последовательности В; последовательность В′ может также быть комплементарной частям последовательности А. Спейсерная последовательность 6S на первых наночастицах 3 идентична спейсерной последовательности 6S на вторых наночастицах 22. Однако в другом варианте осуществления можно применять различные спейсерные последовательности 6 на первых наночастицах 3 и вторых наночастицах 22. Кроме того, можно применять несколько различных спейсерных последовательностей 6 на одном и том же виде наночастиц 8. Буферные условия и условия гибридизации, например, температуру, концентрацию соли, концентрацию наночастиц, концентрацию дополнительных буферных добавок, рН предпочтительно выбирают так, чтобы гибридизация, соединяющая первые наночастицы 3 со вторыми наночастицами 23, могла возникать только после завершения удлинения праймерной последовательности 5А на первых наночастицах 3. Соединение первых наночастиц 3 со вторыми наночастицами 22 можно, например, выявить в виде сдвига в длинноволновую область и расширения плазмонного резонанса в спектре поглощения. Соединение может также быть выявлено, например, путем измерения изменения пропускания при одной или нескольких длинах волн после оптикотермического возбуждения наночастиц 8 и результирующей денатурации нуклеиновых кислот 1, которая соединяет первые наночастицы 3 со вторыми наночастицами 22. Тестовые зонды 21 могут быть введены в специальный буферный раствор для гибридизации, к которому по меньшей мере часть образца 11, содержащего первые наночастицы 3, добавляют после этапа способа, на котором обеспечивают синтез комплемента 13. Тестовые зонды 21 могут, вместе с первыми наночастицами 3, присутствовать в образце непосредственно перед началом способа. В этом случае тестовые зонды 21 могут быть пассивированы так, чтобы они не действовали в качестве праймера 7. Пассивация тестовых зондов 21 может заключаться в выборе праймерной последовательности 5 на тестовых зондах 21 таким образом, чтобы не происходило гибридизации указанной праймерной последовательности 5 с оригиналом 12 при температуре отжига во время ПЦР, то только после последующего снижения температуры. Пассивация тестовых зондов 21 может быть обеспечена путем присоединения второго олигонуклеотида 23, содержащего частичные последовательности оригинала 12 на 3′-конце вторых наночастиц 22 так, чтобы ДНК-полимераза 10 не могла удлинять второй олигонуклеотид 23. В этом случае вторые олигонуклеотиды 23 могут быть свободными на их 5′-конце, или соединены со вторыми наночастицами 22. Тестовые зонды 21 могут также быть пассивированы путем основной модификации, например, с дидезоксицитозином (дцЦ) на свободном конце второго олигонуклеотида 23, что предотвращает элонгацию.
В варианте осуществления способа, показанном на фигуре 6, первые наночастицы 3, изготовленные из золота и с диаметром 60 нм, функционализируют олигонуклеотидами 4 (в соответствии с J. Hurst et al., Anal. Chem., 78(24), 8313-8318, 2006, соответствующее содержание которого образует часть настоящего раскрытия посредством ссылки). При этом применяют одну часть олигонуклеотида 4ID1, и в качестве заполняющей молекулы 9, четыре части олигонуклеотида 4ID2. После функционализации и шести этапов отмывания, первые наночастицы 3 присутствуют в ФБР растворе (20 мМ ФБР, 10 мМ NaCl, 0,01% Твин 20, 0,01% азида, 1 мМ ЭДТУК, рН 7,5) при концентрации 200 мкл. Реакцию амплификацию проводят в общем объеме 10 мкл в 200 мкл пробирках для образцов 24 (5 мкл DreamTaq PCR Mastermix 2х (Fermentas), 0,1 мкл NaCl 5 M, 0,1 мкл MgCl2 250 мМ, 0,1 мкл MgSO4 250 мМ, 1 мкл функционализированных первых частиц 200 пМ, 1 мкл олигонуклеотида 4 ID3 (в качестве оригинала 12, подлежащего амплификации, где концентрация определяемого оригинала находится в общем объеме 10 мкл, например, 0 пМ, 10 пМ, 20 пМ или 50 пМ) растворяли в воде с 100 нМ олигонуклеотида 4 ID4 (олигонуклеотид 4 ID4 служит для насыщения поверхностей, например, при хранении оригинала 12 перед реакцией), 2,7 мкл воды). Как показано на фигуре 7, пробирки с образцами 24 доводили до температуры 65°С в стеклянной кювете 25 в водяной бане 26, где указанная температура является температурой отжига, а также температурой элонгации. Водяная баня 26 служит, в дополнение к сохранению правильной температуры, также для лучшей стыковки лазера 16 на неплоской поверхности пробирок с образцом 24. Вода в водяной бане 26 обеспечивает уменьшение разницы в показателях преломления между наружной стороной пробирок с образцом 24 и их внутренней стороной, заполненной реакционной смесью для ПЦР; таким образом, подавляется преломление лазерного пучка и итоговое отрицательное влияние на качество фокуса и четкость. Таким образом, предпочтительно, улучшается стыковка лазера 16. Лазер 16, который служит для возбуждения наночастиц, является лазером с удвоением частоты генерации с диодной накачкой: Nd:YAg лазером (Coherent Verdi V10), сфокусированным в пробирки для образцов 24 в водяной бане 26 (фокальный диаметр примерно 20 мкм) с мощностью на выходе 1,5 Вт с F-тета-линзой (Jenoptik, фокусное расстояние 100 мм) сзади зеркального сканера 18 (Cambridge technologies, Pro Series 1). Зеркальный сканер позволяет передвигать фокус построчно через пробирки с образцом 24, как уже показано на фигуре 3, и таким образом, вовлекает весь объем ПЦР в оптикотермическую амплификацию. На образцовую пробирку 24 сканируется 400 рядов с фокусом на расстоянии примерно 12 мкм со скоростью ряда в пробирках для образцов 24 примерно 2 м/с. Это соответствует одному циклу в первой пробирке для образцов 24. Затем все другие пробирки для образцов сканируют одну за другой, так что каждая пробирка для образцов 24 проходит один цикл. После времени ожидания 40 с после сканирования первой пробирки с образцом 24, начинают следующий цикл, и повторяют, пока каждая пробирка для образцов 24 не пройдет 25 циклов. В качестве начальной концентрации оригинала 12 в первой пробирке для образцов 24 выбирают 0 пМ, во второй пробирке для образцов 24-20 пМ, а в третьей пробирке для образцов - 50 пМ. Для отрицательного контроля четвертую пробирку с образцом 24 вставляют в водяную баню 26, которая также содержит оригинал 12 в концентрации 50 пМ, но не подвергается воздействию лазерного пучка. После того, как первая, вторая и третья пробирки для образцов 24 проходят 25 циклов, все четыре пробирки для образцов 24 извлекают из водяной бани 26. Для оценки влияния лазерных циклов и концентрации оригинала применяют тестовый зонд 21, который способен к исключительной гибридизации с тестовыми последовательностями, продуцируемыми путем удлинения праймеров, связанных с наночастицами, при выбранном буферном растворе и условиях гибридизации. При этом удлинение праймера 7 комплементарно оригиналу 12, как показано на фигуре 6с. Для получения тестовых зондов 21, вторые наночастицы 22, изготовленные из золота и с диаметром 16 нм, функционализируют с олигонуклеотидами 4 (в соответствии с J. Hurst, выше). Здесь применяют одну часть олигонуклеотида 4 ID5 и, в качестве заполняющей молекулы 9, четыре части олигонуклеотидов 4 ID2. После функционализации и шести этапов отмывания, вторые наночастицы 22 присутствуют в ФБР растворе (20 мМ ФБР, 10 мМ NaCl, 0,01% Твин 20, 0,01% азида, 1 мМ ЭДТУК, рН 7,5) при концентрации 200 пМ. Для гибридизации олигонуклеотида 4 на первых наночастицах 3 с олигонуклеотидом 4 на вторых наночастицах 22 используют модифицированный фосфатный буферный раствор (13 мМ ФБР, 200 мМ NaCl, 0,02% Твин 20, 1 мМ ЭДТУК, 20 мМ цитрата натрия, 1 мкг/мл ПВП10, рН 7,5). 10 мкл раствора для гибридизации содержит 2,25 мкл модифицированного фосфатного буферного раствора, 3 мкл формамида, 2 мкл NaCl 5М, 0,25 мкл 200 пМ раствора тестового зонда и 2,5 мкл соответствующего ПЦР раствора от оптикотермической амплификации, содержащего первые наночастицы 3. Если в пробирке для образцов присутствует достаточное количество оригинала 12 с последовательностью ID3, то олигонуклеотид 4 с последовательностью ID1 на поверхности первой наночастицы 3 удлинен и способен к гибридизации с олигонуклеотидом 4 с последовательностью ID5 тестового зонда, как показано на фигуре 6f. Гибридизацию проводят с применением оптикотермического возбуждения наночастиц 8 (в соответствии с ЕР 2162549, связанное содержание которого образует часть настоящего раскрытия посредством ссылки). С этой целью по пробиркам с образцом 24, как показано на фигуре 16, воздействуют импульсами от первого лазера 27 (продолжительность импульса 50 мкс, длина волны 532 нм, пиковая мощность примерно 700 мВт, диаметр фокуса примерно 30 мкм). Таким образом, наночастицы 8 нагреваются оптикотермическим путем и переносят тепло в окружающую их среду. Если первые наночастицы 3 и вторые наночастицы 22 соединены благодаря гибридизации олигонуклеотидов 4, как показано на фигуре 6f, они разделяются за счет лазерного импульса. Это можно выявить с применением второго лазера 28 (длина волны 630 нм, мощность 5 мВ, непрерывно), как показано на фигуре 16; фокус второго лазера (диаметром 30 мкм) налагается на фокус первого лазера 27, который предпочтительно применяется исключительно для дегибридизации, фокус второго лазера выявляет поглощение до и после импульса первого лазера 27. Оптический путь, на котором изменение поглощения индуцируется оптикотермически и измеряется, составляет примерно 2 мм. Интенсивность света второго лазера 28, передаваемая этим лазером, измеряется на фотодиоде 35. Оптикотермически индуцированное изменение пропускания определяют по разнице потока на фотодиоде до и после импульса, где изменение пропускания обеспечивается путем дегибридизации удлиненных первых олигонуклеотидов 20 и вторых олигонуклеотидов 23 между наночастицами 8 и последующей диффузии наночастиц друг от друга.
На фигуре 8а показано относительное изменение пропускания, вызванное лазерным импульсом первого лазера 27 и итоговой дегибридизацией олигонуклеотидов 4 между первыми наночастицами 3 и вторыми наночастицами 22; относительное изменение пропускания является мерой наличия связей золото-ДНК-золото в пробирках с образцом 24. Под диаграммой на фигуре 8а число завершенных циклов показано в первом ряду. Во втором ряду, расположенном под первым рядом, концентрация оригинала 12 в пробирке с образцом 24 перед выполнением амплификации показана в пМ. На правой стороне диаграммы на фигуре 8а в секции В первая, вторая и третья пробирки для образцов 24 показаны слева направо, в каждой из них завершено 25 оптикотермических циклов; в дополнение к этому показана четвертая пробирка для образцов, в которой не проводилось какой-либо оптикотермической обработки. Можно ясно видеть, что измеренное изменение пропускания является индикатором повышения связей золото-ДНК-золото при увеличении концентрации оригинала 12 перед амплификацией, когда завершено 25 циклов. Для первой пробирки для образцов 24 без оригинала 12 и четвертой пробирки для образцов 24 без оптикотермической обработки наблюдалось лишь небольшое изменение пропускания. Это показывает, что не происходит удлинения праймерных последовательностей 5 на первых наночастицах 3, и таким образом, невозможно связывание с тестовым зондом. Только после завершения оптикотермических циклов и в присутствии оригинала можно добиться удлинения праймерных последовательностей 5 на первых наночастицах 3, обеспечиваемого ДНК-полимеразой 10, что приводит к соединению первых наночастиц 3 со вторыми наночастицами 22, и наконец, к изменению пропускания в результате оптикотермически индуцированного разделения наночастиц 8.
По сравнению с этим, на фигуре 8а на секции А на левой стороне показан результат соответствующего эксперимента, при котором не происходит локального нагревания ДНК посредством оптикотермического возбуждения наночастиц 8, но осуществляют общее нагревание объема реакционной смеси 2 в обычном термоциклере (Labnet Multi Gene II). Слева направо показаны пробирки для образцов 24 от первой до четвертой, содержание которых является идентичным тому, что использовалось в экспериментах в предыдущем параграфе. Первую, вторую и третью пробирку для образцов 24 подвергали классическому протоколу ПЦР (93°С в течение 1 сек, 53°С в течение 20 сек, 35 циклов). Как и в случае оптикотермического нагревания, можно наблюдать, что чем больше оригинала 12 присутствует в каждой пробирке для образцов 24 перед амплификацией, тем большее определяется изменение пропускания, создаваемое лазерным импульсом, и итоговая дегибридизация ДНК между первой наночастицей 3 и второй наночастицей 22, где изменение пропускания является мерой присутствия связей золото-ДНК-золото в растворе. Четвертую пробирку для образцов 24, содержавшую 50 пМ оригинала 12, не подвергали циклическому нагреванию, и она почти не показывала изменения пропускания. В этом случае праймерные последовательности 5 на первых наночастицах 3 не удлинялись до достаточной степени.
На фигуре 8b показан подобный эксперимент по общему нагреванию всего объема реакционной смеси 2, однако, концентрация оригинала 12 в пробирках для образцов 24 является постоянным, 10 пМ, перед амплификацией (второй ряд под диаграммой), в то время как число циклов повышается (первый ряд под диаграммой). Таким образом, ясно видно, что при повышении числа циклов, увеличивается измеряемое изменение пропускания являющееся явным признаком того, что увеличивается содержание праймера 7, удлиненного на первых наночастицах, тем больше циклов завершено, и таким образом, это является явным признаком того, что измеряемый сигнал вызван завершением элонгации олигонуклеотидов 4 на первых наночастицах 3 ДНК-полимеразой 10.
В одном варианте осуществления способа свободный обратный праймер 15, который связывается с 3′-концом комплемента, применяют после элонгации праймерной последовательности 5 на поверхности 4 первых наночастиц 3, во время которой происходит удлинение комплемента 13, связанного с наночастицей. На фигуре 1g показано, что комплемент 13 с уже синтезированными частичными последовательностями А и В, присоединенный к поверхности первой наночастицы 3 через спейсерную последовательность 6, гибридизуется с праймером 7В′, который ранее свободно присутствовал в образце 11. При этом праймер 7 имеет последовательность В′ и соединен с частичной последовательностью В на комплементе 13. Начиная от праймера 7 с последовательностью В′, ДНК-полимераза синтезирует копию оригинала 12. На фигуре 1g также показано, что оригинал 12 связан с другой праймерной последовательностью 5А на поверхности первой наночастицы 3, и ДНК-полимераза 10 синтезирует другой комплемент, начиная от праймерной последовательности 5А. Оригинал 12, копия оригинала 12 и два комплемента 13, соединенные с первой наночастицей, показаны на фигуре 1h. Последующая денатурация посредством возбуждения первых наночастиц 3 приводит к освобождению оригинала 12 и его копии. При этом оригинал 12, а также его копия может служить в качестве матрицы для амплификации на последующих этапах способа. После периода ожидания, который может быть необходим для гибридизации оригинала 12 и копий оригинала 12 с праймерными последовательностями 5А на первых наночастицах 3, и свободных праймеров В′ с праймерными последовательностями 5, уже удлиненными на первых наночастицах 3, следующий цикл способа может быть выполнен с другим возбуждением первых наночастиц 3. Предпочтительно, этот цикл повторяют, пока достаточное количество удлиненных праймерных последовательностей 5 присутствует на первых наночастицах 3 и/или достаточное количество копий оригинала 12 присутствует на образце 11 для обеспечения проверки выполнения амплификации, или, соответственно, присутствия оригинала 12 в образце. С применением свободного праймера 7В′, как показано на фигуре 1g и 1h, возможна экспоненциальная амплификация оригинала 12. На фигуре 1a-1f достигается только линейная амплификация комплемента, связанного с наночастицей 13, без свободного праймера 7. Денатурация ДНК в одном варианте осуществления может происходить менее чем за одну миллисекунду. Даже после 40 циклов денатурация ДНК и последующее охлаждение до температуры элонгации требует лишь нескольких миллисекунд в целом в этом варианте осуществления. Это означает, что продолжительность способа в соответствии с настоящим изобретением не определяется техническими ограничениями, такими как скорость нагревания и охлаждения обычных термоциклеров. Кроме того, устраняется время термализации в объеме реакции 2, поскольку тепло уже производится в среде, окружающей наночастицы, и температурное равновесие достигается в пределах наносекунд. Таким образом, можно существенно ускорить ПЦР.
Одна возможность проверки амплификации показана на фигуре 9. На фигурах 9а и 9с показана экспоненциальная амплификация с применением растворенного обратного праймера 7В′, как уже показано на фигуре 1a-1h. После этого тестовые зонды 21 добавляли к образцу 11. В этом варианте осуществления тестовые зонды 21 состоят из вторых наночастиц 22, которые функционализированы на их поверхности факультативными заполняющими молекулами 9, и тестовой последовательности А′, как показано на фигуре 9d. Факультативно, спейсерную последовательность 6S, которая не обязательно идентична спейсерной последовательности 6S на первых наночастицах 3 с фигуры 1 или фигуры 9а, можно поместить между тестовой последовательностью А1 и поверхностью вторых наночастиц 22. Тестовая последовательность А′ комплементарна по меньшей мере части праймерной последовательности 5А на первых наночастицах 3. Тестовая последовательность А′ конкурирует за праймерную последовательность 5А с копиями оригинала 12, содержащими частичную последовательность А′, произведенную в способе на фигуре 1a-1h. Это означает, что если много копий оригинала 12 присутствует, то праймерные последовательности 5А на поверхности первых наночастиц 3 уже заняты частичными последовательностями А′ из копий оригинала 12. В этом случае праймерные последовательности 5А не могут гибридизоваться, или могут гибридизоваться лишь до ограниченной степени с тестовыми зондами А′ на вторых наночастицах 22. Таким образом, первые наночастицы 3 не соединяются, или соединяются только до ограниченной степени со вторыми наночастицами 22. Как показано на фигуре 9с, удлиненные праймерные последовательности 5А на первых наночастицах 3 гибридизуются с оригиналом 12 и его копиями, и таким образом, формируют жесткую двухцепочечную ДНК, которая может вызывать стерическое ограничение; из-за этого также предотвращается соединение первых наночастиц 3 со вторыми наночастицами 22, когда присутствует большое число копий оригинала 12. При отсутствии или в присутствии малого количества оригинала 12 и копий оригинала 12, первые наночастицы 3 преимущественно присутствуют с незанятыми праймерными последовательностями 5А, как показано на фигуре 9b. Когда добавляют тестовые зонды 21, второй нуклеотид 23А′ гибридизуется с незанятыми праймерными последовательностями 5А на первых наночастицах 3. Из-за этого первые наночастицы соединяются со вторыми наночастицами 22, как показано на фигуре 9е. В этом варианте осуществления, чем слабее степень соединения первых наночастиц 3 со вторыми наночастицами 22, тем больше копий оригинала 12 продуцируется в реакции амплификации, что зависит от концентрации оригинала 12 в начале реакции амплификации. Условия буферных растворов и гибридизации (например, температура, концентрация соли, концентрация наночастиц, концентрация дополнительных буферных добавок, рН) выбирают так, чтобы после завершения специфического удлинения праймерной последовательности 5А и завершения синтеза копий оригинала 12 супрессия гибридизации праймерных последовательностей 5А со вторым олигонуклеотидом 23А′ была как можно более эффективной. В то же самое время указанные условия реакции выбирают так, чтобы при отсутствии амплификации достигалась эффективная гибридизация праймерных последовательностей 5А со вторыми олигонуклеотидами 23А′. Соединение первых наночастиц 3 со вторыми наночастицами 22, полученными при гибридизации, можно проверить, например, с помощью сдвига в длинноволновую область спектра или плазмонного резонанса в спектре поглощения, или путем измерения изменения пропускания при одной или нескольких длинах волн после оптикотермического возбуждения наночастиц 8 и результирующей денатурации ДНК, связанной с наночастицами. Альтернативно, проверку или количественное определение копий оригинала 12, произведенных в данном способе, можно проводить, например, путем ПЦР, ПЦР в режиме реального времени, количественной ПЦР в режиме реального времени, гель-электрофореза, или с применением зондов, меченых красителем.
В одном варианте способа, показанного на фигуре 9, первые наночастицы 3, изготовленные из золота и имеющие диаметр 60 нм, функционализированы олигонуклеотидом 4, как уже показано в варианте осуществления на фигуре 6, однако отношение олигонуклеотида 4 ID1 к олигонуклеотиду 4 ID2 на фигуре 9 составляет 1:9. После функционализации и шести этапов отмывания первые наночастицы 3 присутствуют в концентрации 200 пМ в ФБР (20 мм ФБР, 10 мМ NaCl, 0,01% Твин 20, 0,01% азида, 1 мМ ЭДТУК, рН 7,5). Реакцию амплификации проводили в общем объеме 10 мкл в 200 мкл пробирках для образцов 24 (5 мкл DreamTaq PCR Mastermix 2х (Fermentas), 0,1 мкл NaCl 5 M, 0,1 мкл MgCl2 250 мМ, 0,1 мкл MgSO4 250 мМ, 1 мкл функционализированной первой наночастицы 3 200 пМ, 1 мкл обратного праймера ID6 500 нМ, 1 мкл олигонуклеотида 4 ID3 (в качестве оригинала 12, подлежащего амплификации, где концентрация оригинала 12, определяемая в общем объеме 10 мкл, составляет, например, 0 пМ или 10 пМ), растворенных в воде с 100 нМ олигонуклеотида 4 ID4 (здесь олигонуклеотид 4 ID4 служит для насыщения поверхностей, например, при хранении оригинала 12 перед реакцией), 1,7 мкл воды). Пробирки для образцов 24 хранили при температуре 54°С в стеклянной кювете 25 в водяной бане 26, как показано на фигуре 7.
При этом 54°С является температурой отжига, а также температурой элонгации. Водяная баня 26 служит, в дополнение к контролю температуры, также для лучшего сцепления лазера 16 с неплоской поверхностью пробирок для образцов 25. Вода в водяной бане 26 обеспечивает разницу коэффициента преломления между наружной и внутренней стороной пробирки с образцом 24, заполненной смесью для ПЦР для восстановления, и таким образом, подавляет отражение лазерного пучка и результирующее отрицательное влияние на качество и остроту фокуса. Таким образом, предпочтительно, улучшается сцепление лазера 16. Лазер 16, который служит для возбуждения наночастиц 8, является лазером с удвоением частоты генерации с диодной накачкой: Nd:YAg лазером (Coherent Verdi V10), сфокусированным с мощностью на выходе 3 Вт с F-тета-линзой (Jenoptik, фокусное расстояние 100 мм) сзади зеркального сканера 18 в пробирки для образцов 24 в водяной бане 26. Зеркальный сканер 18 позволяет передвигать фокус построчно через пробирки с образцом 24, как показано на фигуре 3, и таким образом, вовлекает весь объем реакции 2 в оптикотермическую амплификацию. На образцовую пробирку 24 сканируется 400 рядов с фокусом на расстоянии примерно 12 мкм со скоростью ряда в пробирках для образцов 24 примерно 2 м/с. Это соответствует одному циклу в первой пробирке для образцов 24. Затем все другие пробирки для образцов сканируют одну за другой, так что каждая пробирка для образцов 24 проходит один цикл. После времени ожидания 40 с после сканирования первой пробирки с образцом 24, начинают следующий цикл, и повторяют, пока каждая пробирка для образцов 24 не пройдет предварительно заданное число циклов. Оценивали 7 пробирок для образцов 24, которые показаны на фигуре 10а слева направо. Первая и вторая пробирки для образцов 24 не содержали оригинала 12. В третьей - седьмой пробирках для образцов 24 присутствовало 10 пМ оригинала 12 в исходной концентрации. В качестве контроля первую и третью пробирки для образцов 24 не подвергали оптикотермической обработке. Четвертую пробирку для образцов 24 подвергали воздействию 5 циклов оптикотермической обработки, пятую пробирку для образцов 24-15 циклов, а шестую пробирку для образцов 24-25 циклов. Вторую и седьмую пробирки для образцов 24 подвергали воздействию максимального числа из 35 циклов оптикотермической обработки. Все пробирки для образцов 24 находились в водяной бане 26 в течение одного и того же времени, различалось только оптикотермическое возбуждение. После того, как седьмая и восьмая пробирка для образцов 24 завершали все 35 циклов, все семь пробирок для образцов 24 извлекали из водяной бани 26. Одним преимуществом способа является то, что он не требует больших усилий, можно обрабатывать различные образцы 11 с разным числом циклов, что можно применять, например, при параллельных количественных ПЦР.
Тестовый зонд 21 служит для определения влияния лазерных циклов и концентрации оригинала 12, при которой тестовый зонд 21 может, с выбранным праймером и условиями гибридизации, предпочтительно гибридизоваться с первой наночастицей 3, функционализированной с праймерными последовательностями 5, где наночастицы не блокированы комплементарными копиями оригинала 12, полученными в реакции амплификации. Это соответствует тестовому зонду 21, как показано на фигуре 9. Для получения тестового зонда 21 вторые наночастицы 22, изготовленные из золота и имеющие диаметр 60 нм, функционализируют олигонуклеотидами 4 (в соответствии с J. Hurst, выше). При этом применяют четыре части олигонуклеотида 4 ID2 и одну часть олигонуклеотида 4 ID7. После функционализации и шести этапов отмывки вторые наночастицы 22 присутствовали в концентрации 200 пМ в ФБР буферном растворе (20 мМ ФБР, 10 мМ NaCl, 0,01% Твин 20, 0,01% азида, 1 мМ ЭДТУК, рН 7,5). Для гибридизации использовали модифицированный фосфатный буферный раствор (13 мМ ФБР, 200 мМ NaCl, 0.02% Твин 20, 1 мМ ЭДТУК, 20 мМ цитрат натрия, 1 мкг/мл ПВП10, рН 7,5). 10 мкл раствора для гибридизации содержали 5,75 мкл модифицированного фосфатного буферного раствора, 1,5 мкл формамида, 0,25 мкл 200 пМ раствора тестового зонда и 2,5 мкл соответствующего ПЦР раствора от реакции оптикотермической амплификации, содержащего первые наночастицы 3. Детекцию связывания первых наночастиц 3 и вторых наночастиц 22 осуществляли путем оптикотермического возбуждения наночастиц 8, как описано на фигуре 8а. На фигуре 10а показано изменение пропускания, вызванное лазерным импульсом и результирующей дегибридизацией ДНК между первыми наночастицами и вторыми наночастицами 22, где изменение пропускания является мерой присутствия связей золото-ДНК-золото в образце 11. На фигуре 10 на левой стороне в секции А показаны первая и вторая пробирки для образцов 24, не содержащие оригинала, где в первой пробирке для образцов 24 нет завершенных циклов, а во второй пробирке для образцов 24 завершено 35 оптикотермических циклов. Обе пробирки для образцов показали высокое измеренное изменение пропускания в качестве индикатора высокого уровня связей золото-ДНК-золото. Без оригинала 12 различное число завершенных циклов не оказывало влияния на измеренное изменение пропускания или да уровень связей золото-ДНК-золото; это обусловлено отсутствием оригинала 12 для амплификации, и таким образом, отсутствия блокирования праймерных последовательностей 5 копиями оригинала 12.
На фигуре 10а на правой стороне на секции В показаны пробирки для образцов 24 с третьей по седьмую, с повышенным числом оптикотермических циклов в реакции амплификации при исходной концентрации оригинала 12 10 пМ. Здесь видно, что изменение пропускания, измеряемое в качестве индикатора связей золото-ДНК-золото, существенно снижается при повышении числа завершенных оптикотермических циклов. Это показывает, что чем больше копий оригинала 12 производится, тем больше циклов завершается. При этом примечательно, что при исходной концентрации оригинала 12 10 пМ, вдвое больше первых наночастиц 3, чем оригиналов 12, присутствует в образце 11. Каждая первая наночастица 3, как правило, несет от 1000 до 10000 праймерных последовательностей 5. Таким образом, при исходной концентрации оригинала 12 блокируется примерно 1 на 2000 праймерных последовательностей 5, что не приводит к существенному подавлению связей золото-ДНК-золото между первыми наночастицами 3 и вторыми наночастицами 22. Эффективная супрессия связей золото-ДНК-золото, как показано на фигуре 10а, с повышением числа оптикотермических циклов, возможна только при значительной амплификации низкой исходной концентрации оригинала 12.
На фигуре 10b показан альтернативный способ детекции концентрации копий оригинала 12 после реакции амплификации. При этом образцы 11 из семи пробирок для образцов 24 с фигуры 10а вначале разбавляли в 50 раз водой, а затем проводили ПЦР в режиме реального времени, обеспечивающую количественное определение копий оригинала. При этом использовали раствор для ПЦР в режиме реального времени, где 10 мкл содержали 5 мкл Phusion Blood буферного раствора для ПЦР (содержащего дНТФ и MgCl4; Biozym), 0,2 мкл Phusion Blood полимеразы, 1 мкл SybrGreen I (10x Roche), 1 мкл праймера ID5 5 мкМ и 1 мкл праймера ID8 5 мкМ, 0,8 мкл Н2О и 1 мкл разбавленного в 50 раз образца 11. Для ПЦР в режиме реального времени вначале проводили денатурацию при 98°С в течение 1 минуты, затем выполняли 40 циклов, каждый из которых занимал 1 секунду при 98°С, 5 секунд при 66°С и 1 секунду при 72°С. Флуоресценцию SybrGreen I измеряли в конце каждой фазы отжига при 66°С. Для ПЦР в режиме реального времени использовали Stratagene Мх3005Р от Agilent Technologies. На вертикальной оси на фигуре 10b показан пороговый цикл (значение Ct) ПЦР в режиме реального времени, при которой копии оригинала достигали предварительно заданной концентрации в первое время. Чем выше концентрация копий оригинала 12 в начале ПЦР в режиме реального времени, тем меньше пороговый цикл. Результаты на фигуре 10b подтверждают результаты с 10а: чем больше оптикотермических циклов завершено при данной исходной концентрации оригинала 12, тем выше число копий оригинала 12 после реакции амплификации.
Предпочтительно, при оптикотермической денатурации только небольшие парциальное объемы образца 11 нагревают так, чтобы также можно было применять не-термостабильные ДНК-полимеразы 10. В одном варианте осуществления фрагмент Кленова 29, который не-термостабилен, применяли в качестве ДНК-полимеразы. Фрагмент Кленова 29 обладает тем преимуществом, что он более устойчив к соли при реакции амплификации. Таким образом, предпочтительно можно выбрать лучшие условия реакции при реакциях детекции с первыми наночастицами 3 и вторыми наночастицами 22, что обеспечивает лучшую специфичность и чувствительность реакции детекции. В дополнение к этому, фрагмент Кленова 29 обладает тем преимуществом, что при 76 кДа он меньше типично применяемой Taq ДНК-полимеразы с 95 кДа. Таким образом, при тесной близости наночастиц 8, функционализированных с олигонуклеотидами 4, фрагмент Кленова 29 проявляет меньшее стерическое ограничение, чем Taq ДНК-полимераза 10. Далее, фрагмент Кленова 29 обладает тем преимуществом, что его оптимальная температура элонгации составляет 37°С. Элонгация при 37°С обладает тем преимуществом, что наночастицы 8 испытывают меньшую тепловую деформацию, и таким образом, необходимы более низкие требования к стабильности наночастиц 8; в то же самое время, имеется большая гибкость в применении солей, потенциально дестабилизирующих наночастицы. В этом варианте осуществления, в котором фрагмент Кленова 29 применяли для амплификации, первые наночастицы 3, изготовленные из золота, с диаметром 60 нм функционализировали вначале по аналогии со способом, использованным на фигуре 1. Затем применяли более короткую праймерную последовательность 5 ID9, поскольку при более низкой температуре отжига и более высоких концентрациях можно достичь более высокой специфичности гибридизации с оригиналом 12. Отношение количеств олигонуклеотида 4 ID9 и олигонуклеотида 4 ID2 составляет 1:9. После функционализации и шести этапов отмывания первые наночастицы 3 присутствовали в концентрации 200 пМ в ФБР (20 мМ ФБР, 10 мМ NaCl, 0,01% Твин 20, 0,01% азида, 1 мМ ЭДТУК, рН 7,5). Реакцию амплификации проводили в 10 мкл смеси для ПЦР в 100 мкл пробирках для образцов (1 мкл 10х буферного раствора для реакции для фрагмента Кленова экзо- (не содержащего дНТФ и полимеразы; Fermentas), 0,2 мкл фрагмента Кленова экзо- (Fermentas), 1 мкл дНТФ, каждый 2,5 мМ (Fermentas), 0,2 мкл NaCl 5М, 0,2 мкл MgCl2 250 мМ, 0,2 мкл MgSO4 250 мМ, 1 мкл первых наночастиц 3 в концентрации 200 пМ, 1 мкл обратного праймера ID6 500 нМ, 1 мкл олигонуклеотида ID3 в качестве оригинала 12 (здесь оригинал 12 присутствовал в ПЦР смеси при концентрации, например, 0 пМ, 10 пМ или 20 пМ), 4,2 мкл воды). Количества соли, используемые здесь, существенно выше, чем в примере с фигуры 10. С ДНК-полимеразой 10 с фигуры 10 невозможна достаточная амплификация при этих концентрациях соли. Как показано на фигуре 7, температуру пробирок для образцов 24 контролировали при 37°С в стеклянной кювете 25 в водяной бане 26. Температура 37°С здесь является температурой отжига, а также температурой элонгации. Лазер 16 служит для возбуждения первых наночастиц 3 и является лазером с удвоением частоты генерации с диодной накачкой: Nd:YAg лазером (Coherent Verdi V10), сфокусированным на пробирки для образцов 24 в водяной бане 26 с мощностью на выходе 1,5 Вт с F-тета-линзой (Jenoptik, фокусное расстояние 100 мм) сзади зеркального сканера 18 (Cambridge Technologies, Pro Series 1). Зеркальный сканер 18 позволяет передвигать фокус построчно через пробирки с образцом 24, как показано на фигуре 3, и таким образом, вовлекает весь объем реакции 2 в оптикотермическую амплификацию. На образцовую пробирку 24 сканируется 1000 рядов с фокусом на расстоянии примерно 5 мкм со скоростью ряда в пробирках для образцов 24 примерно 5 м/с. Это соответствует одному циклу в первой пробирке для образцов 24. Затем все другие пробирки для образцов сканировали одну за другой, так что каждая пробирка для образцов 24 проходила один цикл. После периода ожидания 40 сек после сканирования первой пробирки с образцом 24, начинали следующий цикл, и повторяли, пока каждая пробирка для образцов 24 не пройдет в целом 35 циклов. Слева направо на фигуре 11, в первые три пробирки для образцов 24 вносили указанную смесь для ПЦР, содержащую фрагмент Кленова 29 и дНТФ. Пробирки для образцов 24 с четвертой по шестую содержали фрагмент Кленова 29, но не содержали дНТФ, а пробирки для образцов 24 с седьмую по девятую содержали дНТФ, но не содержали фрагмент Кленова 29. Пробирки для образцов первая, четвертая и седьмая не содержали оригинала 12; пробирки вторая, пятая и восьмая содержали 10 пМ оригинала 12, а пробирки третья, шестая и девятая содержали 20 пМ оригинала 12, как показано в ряду под диаграммой на фигуре 11. После того, как все пробирки для образцов 24 завершают 35 циклов, их извлекали из водяной бани 26. Тестовый зонд 21, соответствующий одному из фигуры 9, применяли при анализе реакции амплификации. Для гибридизации с тестовым зондом 21 применяли модифицированный фосфатный буферный раствор (13 мМ ФБР, 200 мМ NaCl, 0,02% Твин 20, 1 мМ ЭДТУК, 20 мМ цитрата натрия, 1 мкг/мл ПВП10, рН 7,5). 10 мкл раствора для гибридизации содержали 3,35 мкл модифицированного фосфатного буферного раствора, 3,3 мкл формамида, 0,6 мкл NaCl 5М, 0,25 мкл 200 пМ раствора тестового зонда и 2,5 мкл соответствующего ПЦР раствора после амплификации).
Проверку соединения первых наночастиц 3 и тестовых зондов 21 проводили путем оптикотермического возбуждения наночастиц 8. На фигуре 11 показано изменение пропускания, вызванное лазерным импульсом и результирующей дегибридизацией ДНК между наночастицами 8, являющееся мерой присутствия связей золото-ДНК-золото в растворе; концентрация оригинала 12 до реакции показана под диаграммой. На левой стороне на фигуре 11 в секции А показаны результаты для пробирок для образцов 24 с первой по третью, содержащих компоненты фрагмент Кленова 29 и дНТФ, необходимые для ПЦР. Здесь видно, что при повышении числа копий оригинала 12 изменение пропускания, измеряемое в качестве индикатора для оценки связей золото-ДНК-золото, снижается. Не-термостабильный фрагмент Кленова 29 может проводить амплификацию оригинала 12 в этом варианте осуществления, даже при том, что он не переносит высоких температур. Поскольку в представленной реакции оптикотермической амплификации образец 11 нагревается только локально, фрагмент Кленова 29 подвергается только небольшой тепловой деформации, и может амплифицировать оригинал 12 на протяжении многих циклов без разрушения. На фигуре 11 на средней части в секции В показаны результаты для пробирок для образцов 24 от четвертой до шестой, не содержащих дНТФ. Здесь не отмечено существенного изменения пропускания при любых использованных концентрациях оригинала 12. Это означает, что не происходит амплификации. На секции С на фигуре 11 справа показаны результаты для пробирок для образцов 24 с седьмую по девятую, не содержащих фрагмента Кленова 29. Здесь также не происходило амплификации. Этот пример показывает, что не-термостабильный фрагмент Кленова 29 можно также применять при выполнении реакции амплификации.
В варианте осуществления, приведенном на фигуре 12, показана оптикотермическая амплификация, зависящая от передвижения лазерного пучка через объем реакции 2. При этом выбраны концентрации оригинала 0, 1, 5, 20 и 50 пМ в 100 мкл пробирках для образцов 24, как показано в ряду ниже диаграммы на фигуре 12. Температуру пробирок для образцов 24 контролировали до 60°С в стеклянной кювете 25 в водяной бане 26, как показано на фигуре 7, при этом 60°С является температурой отжига, а также температурой элонгации. Оптикотермическое нагревание осуществляли лазером 16, который является лазером с удвоением частоты генерации с диодной накачкой: Nd:YAg лазером (Coherent Verdi V10), сфокусированным в пробирки для образцов 24 в водяной бане 26 с мощностью на выходе 3 Вт с F-тета-линзой (Jenoptik, фокусное расстояние 100 мм) сзади зеркального сканера 18 (Cambridge technologies, Pro Series 1). На фигуре 12 показано на левой стороне в секции А пять пробирок для образцов 24 с повышенными концентрациями оригинала 12, каждую из которых возбуждали оптикотермически в течение одной секунды, где лазерный фокус оставался на середине объема реакции 2 без перемещения. После того, как первую пробирку для образцов 24 облучали таким способом в течение одной секунды, ее не облучали в течение 40 секунд. Это соответствовало одному циклу в первой пробирке для образцов 24. Во время периода ожидания 40 сек, оставшиеся пробирки для образцов 24 завершали первый цикл. Циклы повторяли 35 раз в целом. Детекцию гибридизации между наночастицами 8, содержащими праймерные последовательности 5, и тестовыми зондами 21 проводили посредством оптикотермического возбуждения наночастиц 8, как уже показано на фигуре 10. Как показано на фигуре 12 на левой стороне в секции А, без движения лазерного фокуса не наблюдалось влияния концентрации оригинала 12 на изменение пропускания. Это показывает, что не происходило существенной амплификации оригинала 12. Это обусловлено тем, что лишь малая фракция от всего объема реакции 2 находилась в фокусе, и только наночастицы 8 в этом парциальном объеме принимали участие в реакции. На правой стороне фигуры 12 в секции В показаны пять пробирок для образцов 24 с повышающимися концентрациями оригинала 12 слева направо, где каждая из пробирок для образцов 24 возбуждалась в течение 1 секунды, где кроме того, лазерный фокус передвигался через объем реакции 2. Таким способом, как уже показано на фигуре 3, весь объем реакции сканировался ряд за рядом, и таким образом, вовлекался в оптикотермическую реакцию. В каждой пробирке для образцов 24 сканировано 1000 рядов на расстоянии примерно 5 мкм с фокусом при скорости ряда в пробирке для образцов 24 примерно 5 м/с. Это соответствует одному циклу в первой пробирке для образцов 24. Затем следующие пробирки для образцов 24 сканировали одну за другой, пока не сканировали все пять пробирок для образцов 24. После периода ожидания 40 сек после сканирования первой пробирки для образцов 24, начинали следующий цикл, и таким образом, повторяли его 35 раз. На фигуре 12 на правой стороне в секции В видно, что при повышении концентрации оригинала 12 снижается измеренное изменение пропускания. Это является указанием на снижение количества связей золото-ДНК-золото. Только при передвижении фокуса и при неизменной лазерной мощности и продолжительности облучения происходит амплификация, поскольку перемещение фокуса вовлекает большую часть наночастиц 8 в образце 11 в реакции амплификации.
На фигуре 13 представлен аппарат для осуществления способа в соответствии с настоящим изобретением, где источник света 17 направляет лазерный пучок через факультативный первый объектив 30 на преломляющий элемент 32, например, зеркало, и через факультативный второй объектив 31 на пробирку для образцов 24. При этом пробирка для образцов 24 установлена на вращаемый блок 33 вместе с дополнительными пробирками для образцов 24, так что путем вращения блока 33 можно облучать различные пробирки для образцов 24 в разное время. Таким образом, предпочтительно, можно возбуждать большое число наночастиц 8, присутствующих в пробирках для образцов 24, даже с источником света 17 с низкой мощностью.
На фигуре 14 показана секция наночастицы 8 в соответствии с настоящим изобретением, содержащая заполняющие молекулы 9 и олигонуклеотиды 4 на своей поверхности. Обычные ДНК полимеразы 10 синтезируют комплементарную цепь (штриховая линия) вдоль олигонуклеотидов 4. Во время этого большие обычные ДНК-полимеразы 10 испытывают стерическое ограничение из-за заполняющих молекул на фигуре 14а. На фигуре 14b, ДНК-полимеразы 10 испытывают стерическое ограничение из-за соседних олигонуклеотидов 4. Стерическое ограничение на фигуре 14а и 14b может приводить к преждевременному разрыву вновь синтезированной цепи. Фрагмент Кленова 29 на фигуре 14с, поскольку он меньше обычных ДНК-полимераз 10, достигается через заполняющие молекулы 9 и олигонуклеотиды 4, и таким образом, может завершать синтез новой цепи до конца. Даже если фрагмент Кленова не может пройти через заполняющие молекулы, фрагмент Кленова 29 может ближе достичь стерически ограничивающих заполняющих молекул 9 с его активным центром, таким образом, потенциальный разрыв вновь синтезированной цепи произойдет позднее. Таким образом, меньшие полимеразы обеспечивают более эффективное применение праймерных последовательностей близко к поверхности частицы. Кроме того, локально вырабатываемое тепло можно применять особо эффективно для этапа денатурации в тесной близости от поверхности наночастицы. Кроме этого, показана обратная последовательность 34 с последовательностью А′. Обратная последовательность 34 комплементарна олигонуклеотиду 4 с последовательностью А на наночастице 8, и служит для нейтрализации олигонуклеотидов 4 с последовательностью А, которая непреднамеренно отсоединяется от наночастиц 8, так что олигонуклеотиды 4 не могут действовать в качестве свободных праймеров 7.
В одном варианте осуществления на фигуре 15 показана оптикотермическая амплификация с применением конъюгатов наночастицы и олигонуклеотида, где ковалентная связь между наночастицами 3 и праймерными последовательностями 5 выполняется с помощью двух тиолов. В связи с этим, первые наночастицы 3, изготовленные из золота с диаметром 60 нм, функционализировали с олигонуклеотидами 4 (в соответствии с J. Hurst, выше). При этом применяли олигонуклеотиды 4 ID10 (IDT Technologies, Inc.), которые, по сравнению с олигонуклеотидом ID1, несут дитиол вместо тиола на их 5-конце. После функционализации и шести этапов отмывания, первые наночастицы 3 присутствовали в концентрации 200 пМ в ФБР (20 мМ ФБР, 10 мМ NaCl, 0,01% Твин 20, 0,01% азида, 1 мМ ЭДТУК, рН 7,5). Реакцию амплификации проводили в общем объеме 10 мкл в 200 мкл пробирках для образцов 24 (5 мкл DreamTaq PCR Mastermix 2х (Fermentas), 0,1 мкл NaCl 5 M, 0,1 мкл MgCl2 250 мМ, 0,1 мкл MgSO4 250 мМ, 1 мкл функционализированньгх первых частиц 200 пМ, 1 мкл обратного праймера ID6 500 нМ, 1 мкл олигонуклеотида 4 ID3 (в качестве оригинала 12, подлежащего амплификации), растворенного при концентрации 0 или 200 пМ, соответственно, в воде со 100 нМ олигонуклеотида 4 ID4 (здесь олигонуклеотид 4 ID4 служит для насыщения поверхностей, например, при хранении оригинала 12 перед реакцией), 1,7 мкл воды. Как показано на фигуре 7, температуру пробирок для образцов 24 контролировали до 60°С в стеклянной кювете 25 в водяной бане 26, которая является температурой отжига, а также температурой элонгации. Первые две пробирки для образцов 24 вносили в водяную баню в качестве отрицательного контроля, но на них не воздействовали лазерным пучком. Исходные концентрации оригинала 12 выбраны 0 пМ в первой пробирке для образцов 24 и 20 пМ во второй пробирке для образцов 24. Третью и четвертую пробирку для образцов обрабатывали оптикотермически. Оптикотермическое нагревание проводили посредством лазера 16, который является лазером с удвоением частоты генерации с диодной накачкой, Nd:YAg лазером (Coherent Verdi V10), сфокусированным в пробирки для образцов 24 в водяной бане 26 с мощностью на выходе 3 Вт с F-тета-линзой (Jenoptik, фокусное расстояние 100 мм) сзади зеркального сканера 18 (Cambridge technologies, Pro Series 1). Для каждой пробирки с образцами 24 сканировали 500 рядов с расстоянием примерно 10 мкм с фокусом при скорости ряда в пробирке для образцов примерно 5 м/с. Это соответствовало одному циклу в третьей пробирке для образцов 24. Затем четвертую пробирку для образцов 24 сканировали так, чтобы в третьей и четвертой пробирке для образцов был завершен один цикл. После периода ожидания 40 секунд после сканирования третьей пробирки для образцов 24 начинали следующий цикл, и повторяли, пока в каждой из третьей и четвертой пробирке для образцов не будет завершено 35 циклов. В качестве исходной концентрации оригинала 12 выбрано 0 пМ для третьей пробирки для образцов 24 и 20 пМ для четвертой пробирки для образцов 24. После завершения 35 циклов в третьей и четвертой пробирке для образцов, все четыре пробирки для образцов 24 извлекали из водяной бани 26. Тестовый зонд служил для оценки эффекта лазерных циклов и концентрации оригинала 12, где тестовый зонд 21 предпочтительно способен к гибридизации при условиях праймера и гибридизации, выбранных первых наночастиц, функционализированных праймерными последовательностями 5, где первые наночастицы 3 не блокированы комплементарными копиями оригинала 12, которые продуцированы в реакции амплификации. Это соответствует тестовому зонду 21, как показано на фигуре 9. Получение тестового зонда 21 и условия гибридизации уже описаны на фигуре 10. Диаграммы на фигуре 15 показывают спектры поглощения раствора для гибридизации, которые содержат тестовый зонд 21, а также соответствующий раствор для ПЦР от реакции оптикометрической амплификации, содержащий первые наночастицы 3. Спектры регистрировали в кварцевой кювете с длиной оптического пути 3 мм со спектрометром Varian Cary 50. На диаграмме сплошная линия показывает спектр поглощения немедленно после смешивания раствора для ПЦР и реакции оптикотермической амплификации, содержащего первые наночастицы 3 с тестовым зондом 21; пунктирной линией показана регистрация спустя 6 минут после гибридизации, а точками - спустя 12 минут гибридизации. На фигуре 15а показаны спектры во время гибридизации тестового зонда 21 с наночастицами 8 из продукта ПЦР из первой пробирки для образцов, не содержащей оригинала 12 перед реакцией амплификации и не подвергавшейся оптикотермической обработке. Явный сдвиг в длинноволновую область спектра и расширение плазмонного резонанса наночастиц 3 наблюдается при повышении времени, когда происходит гибридизация между тестовыми пробами 21 и праймерными последовательностями 5 на первых наночастицах 3. Сопоставимую гибридизацию можно также видеть на фигуре 15b, где показана гибридизация тестового зонда 21 с наночастицами 8 из продукта ПЦР из второй пробирки для образцов, содержавшей 20 пМ оригинала перед реакцией амплификации и не подвергавшейся оптикотермической обработке. Сопоставимую гибридизацию можно также видеть на фигуре 15с, где показана гибридизация тестового зонда 21 с наночастицами 8 из продукта ПЦР из третьей пробирки для образца, не содержащей оригинала 12 перед реакцией амплификации, но подвергнутой оптикотермической обработке. Гибридизация на фигуре 15с показывает, что праймерные последовательности 5 остаются связанными с первыми наночастицами 3 после оптикотермической обработки. Только на фигуре 15d, где показана гибридизация тестового зонда 21 с наночастицами 8 из продукта ПЦР из четвертой пробирки для образцов, содержащей 20 пМ оригинала 12 перед реакцией амплификации и подвергнутой оптикотермической обработке, почти не наблюдалось изменения спектров поглощения при повышении времени гибридизации. Только в последнем случае продуцировалось достаточное число копий оригинала 12 во время реакции амплификации, где копии блокировали праймерные последовательности 5 на первых наночастицах 3 и таким образом, предотвращали гибридизацию с тестовыми зондами 21. Этот пример показывает, что реакция оптикотермической амплификации также осуществляется, если праймерные последовательности 5 ковалентно связаны с дитиолами на поверхности первых наночастиц 3, и что спектры поглощения для определения концентрации копий оригинала 12 можно применять после реакции амплификации.
Признаки, раскрытые в настоящем описании, формуле изобретения и чертежах, могут применяться по отдельности, а также в любой комбинации для реализации изобретения в его различных вариантах осуществления.
Список обозначений
1 - нуклеиновая кислота; 2 - объем реакционной смеси; 3 - первые наночастицы; 4 - олигонуклеотид; 5 - праймерная последовательность; 6 - спейсерная последовательность; 7 - праймер; 8 - наночастица; 9 - заполняющая молекула; 10 - ДНК-полимераза; 11 - образец; 12 - оригинал; 13 - комплемент; 14 - прямой праймер; 15 - обратный праймер; 16 - лазер; 17 - источник света; 18 - зеркальный сканер; 19 - зеркало; 20 - первый олигонуклеотид; 21 - тестовый зонд; 22 - вторая наночастица; 23 - второй олигонуклеотид; 24 - пробирка для образцов; 25 - стеклянная кювета; 26 - водяная баня; 27 - первый лазер; 28 - второй лазер; 29 - фрагмент Кленова; 30 - первый объектив; 31 - второй объектив; 32 - преломляющий элемент; 33 - вращаемый блок; 34 - обратная последовательность; 35 - фотодиод.
Реферат
Изобретение относится к области биотехнологии. Описан способ амплификации нуклеиновых кислот, в котором наночастицы в объеме реакционной смеси переносят тепло в окружающую их среду посредством возбуждения. При этом при возбуждении наночастиц среда, окружающая наночастицы, нагревается локально. 15 з.п. ф-лы, 16 ил.
Формула
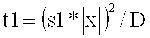

Документы, цитированные в отчёте о поиске
Детекция нуклеиновых кислот способом, основанным на связывании мишенеспецифичного гибрида

Комментарии