Генетические локусы, связанные с устойчивостью к пыльной головне у маиса - RU2562864C2
Код документа: RU2562864C2
Чертежи


















































































































































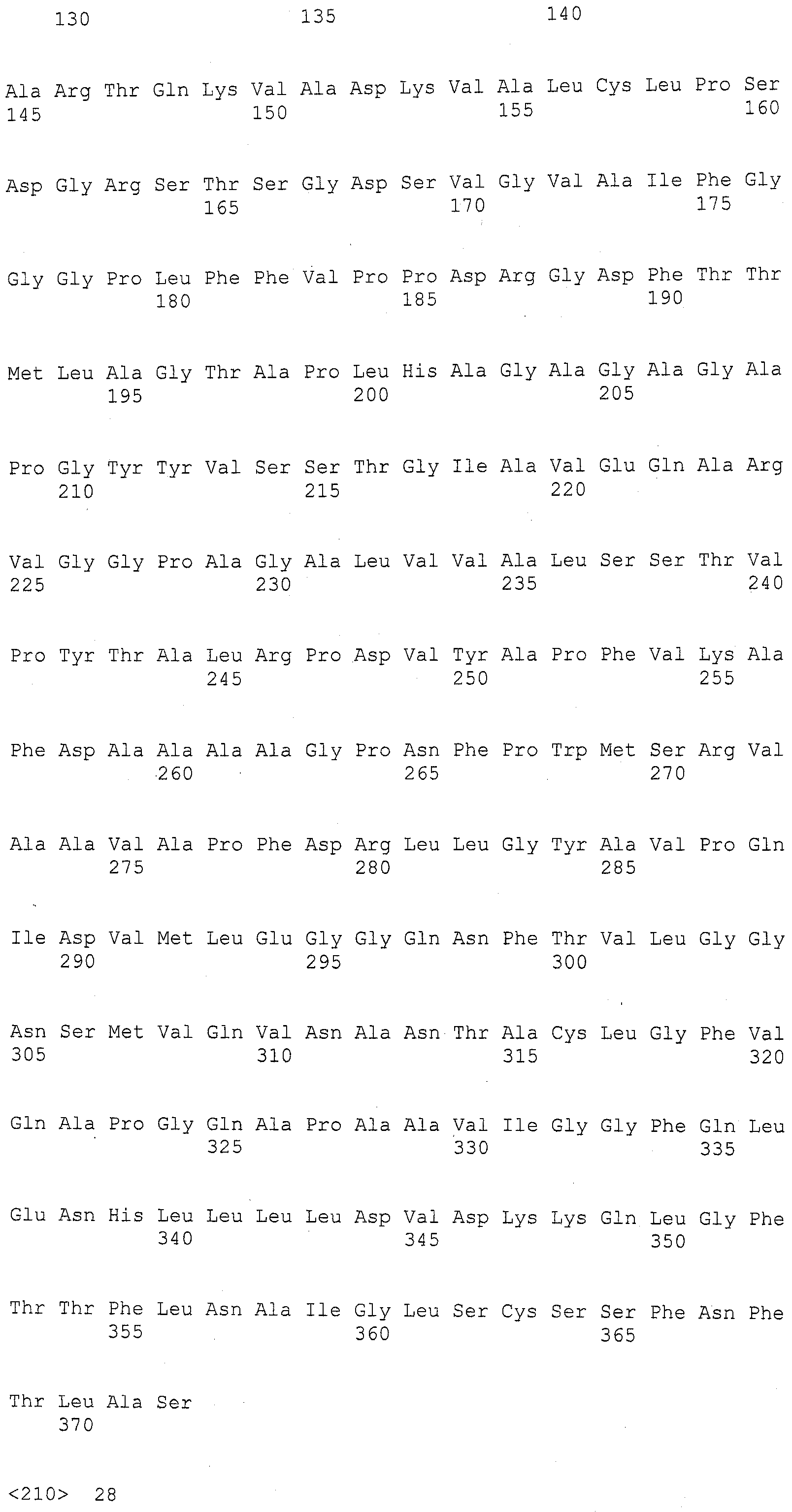

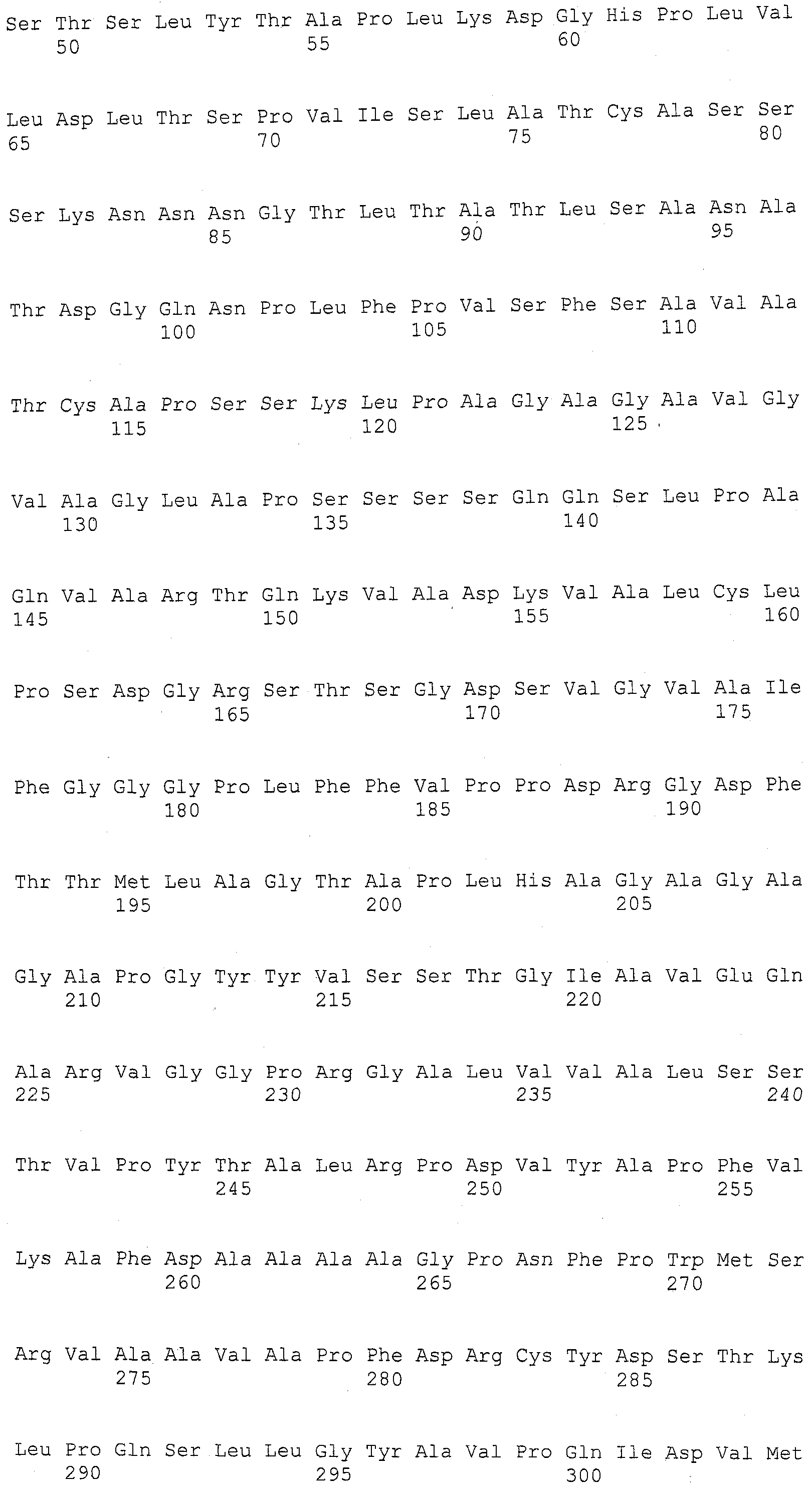




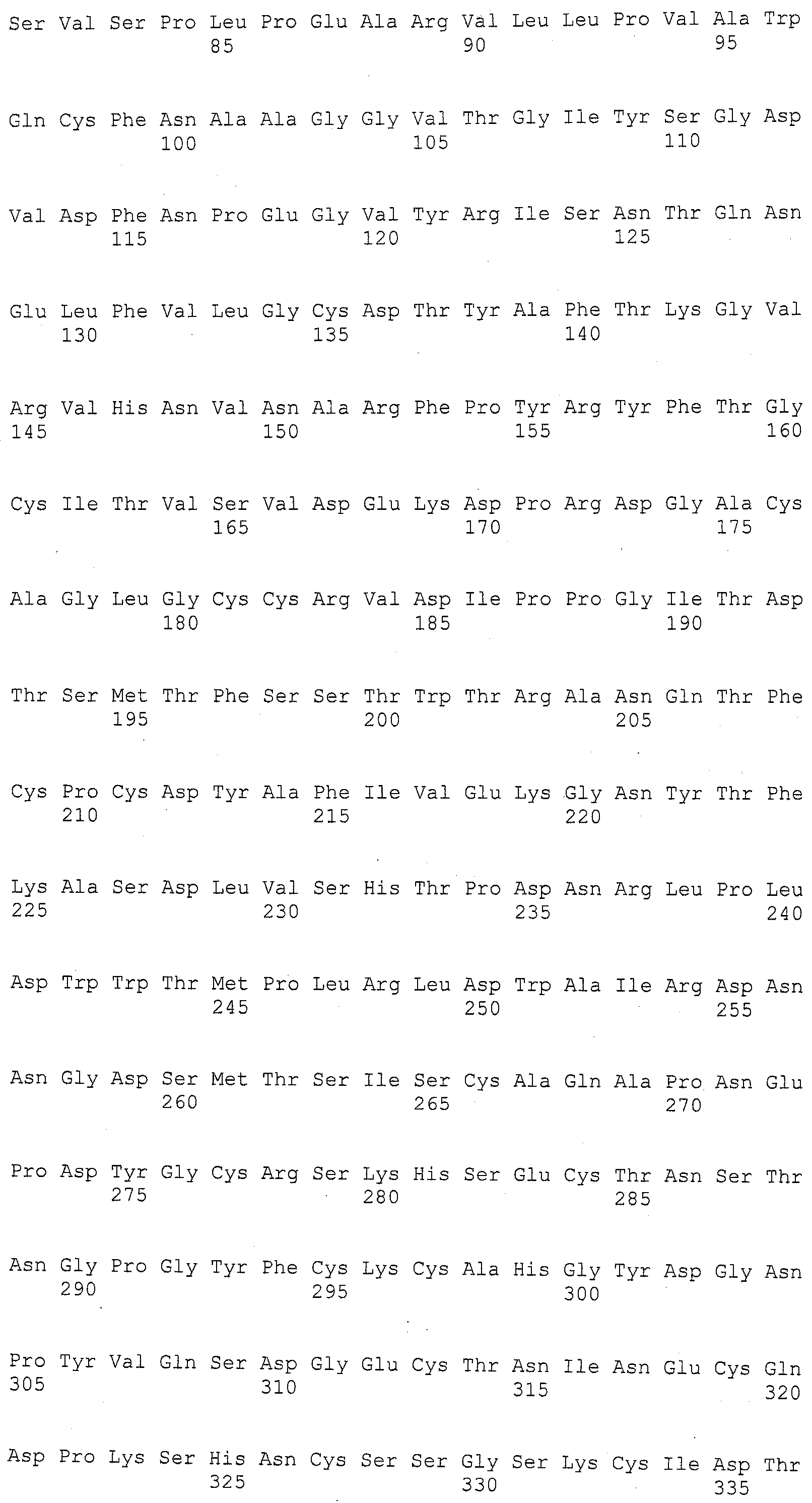
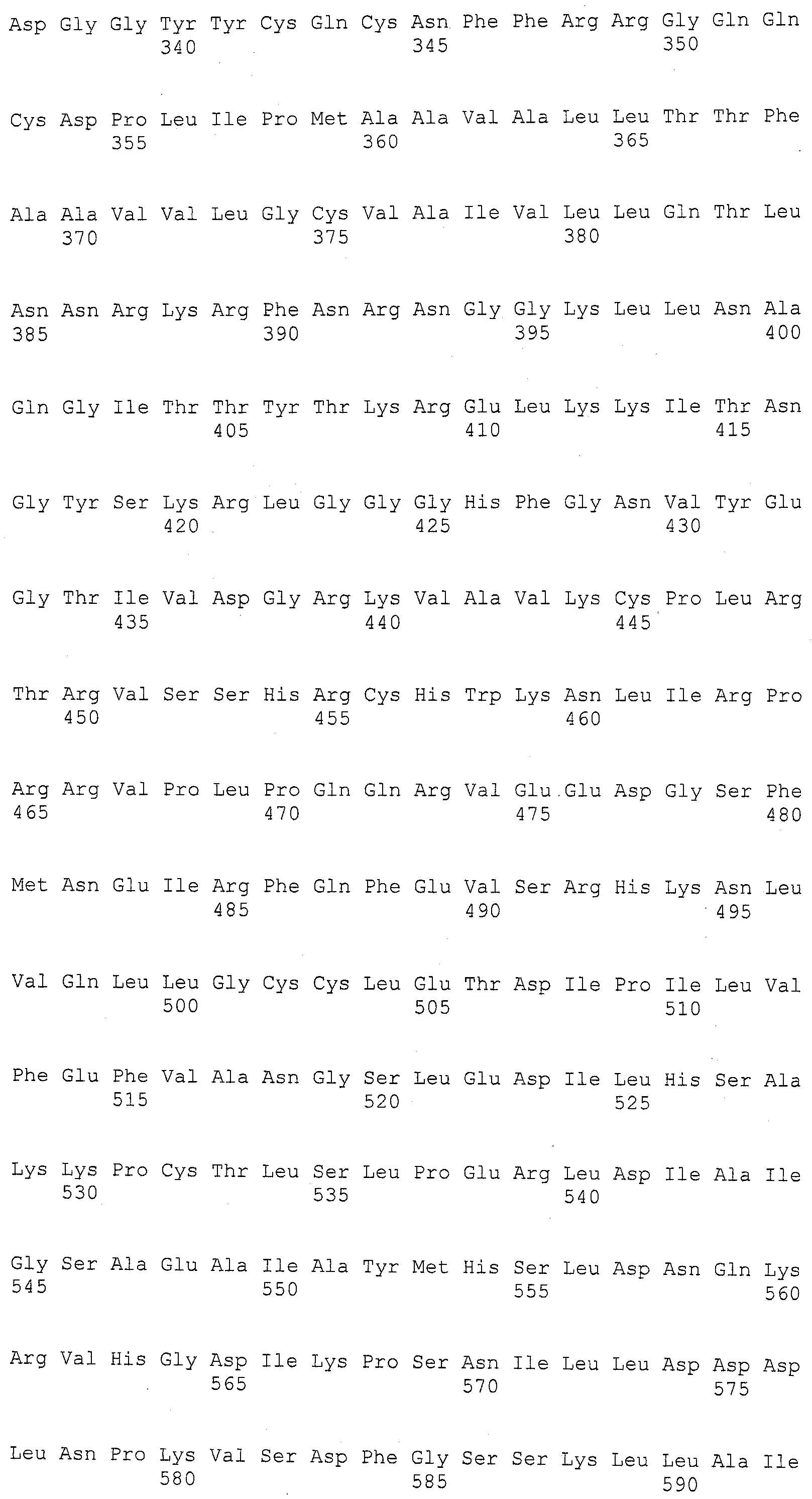







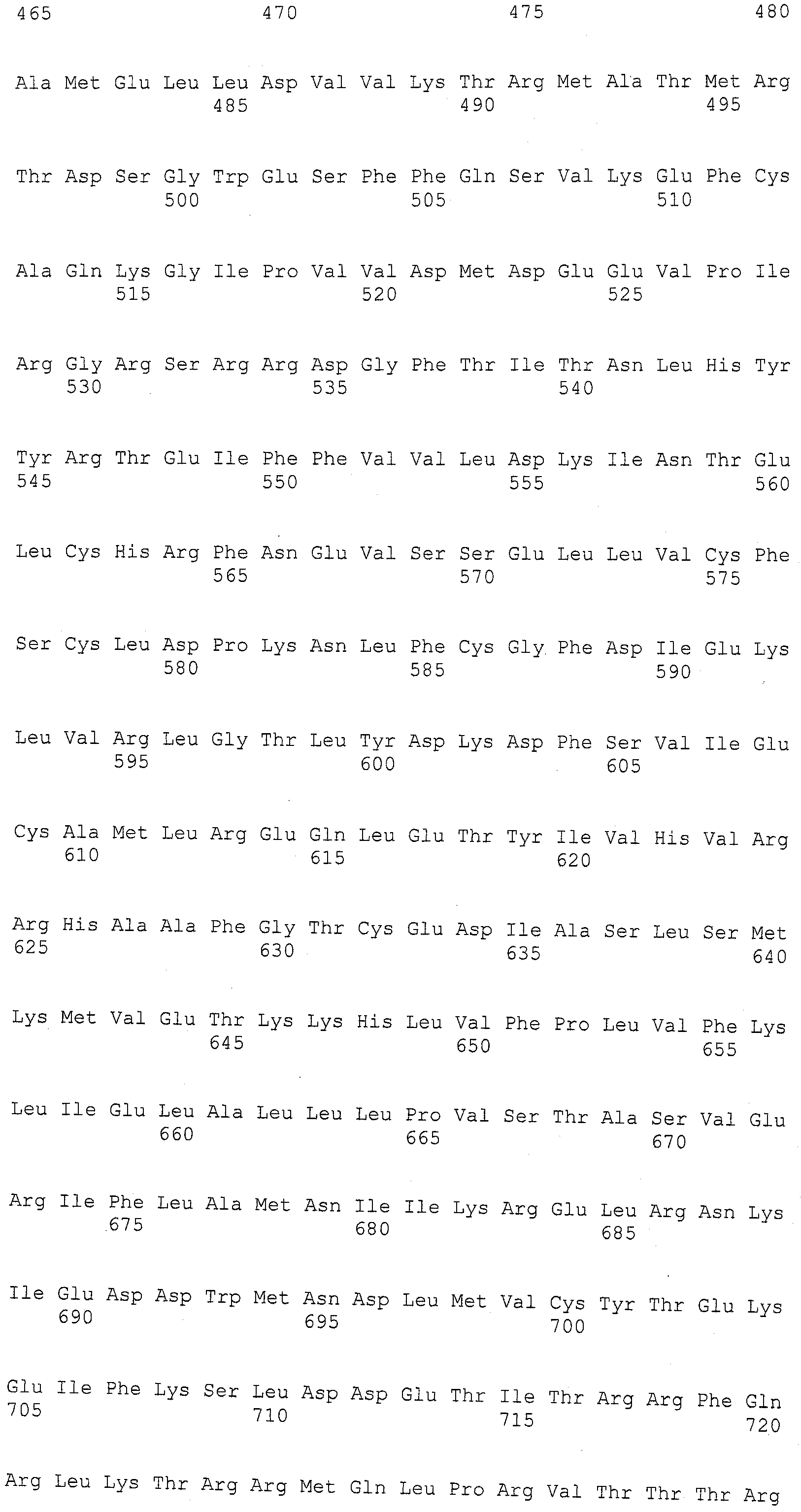





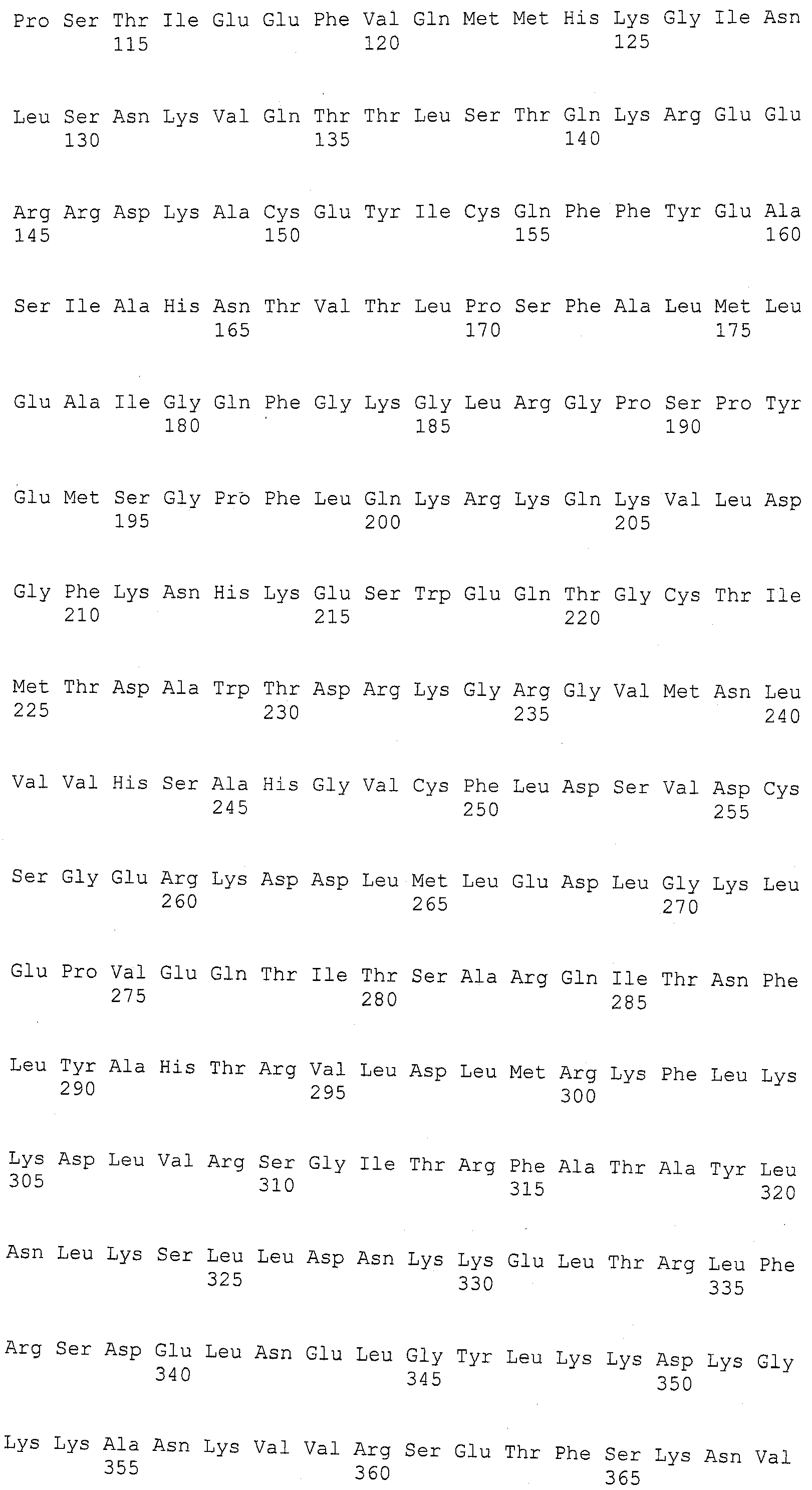
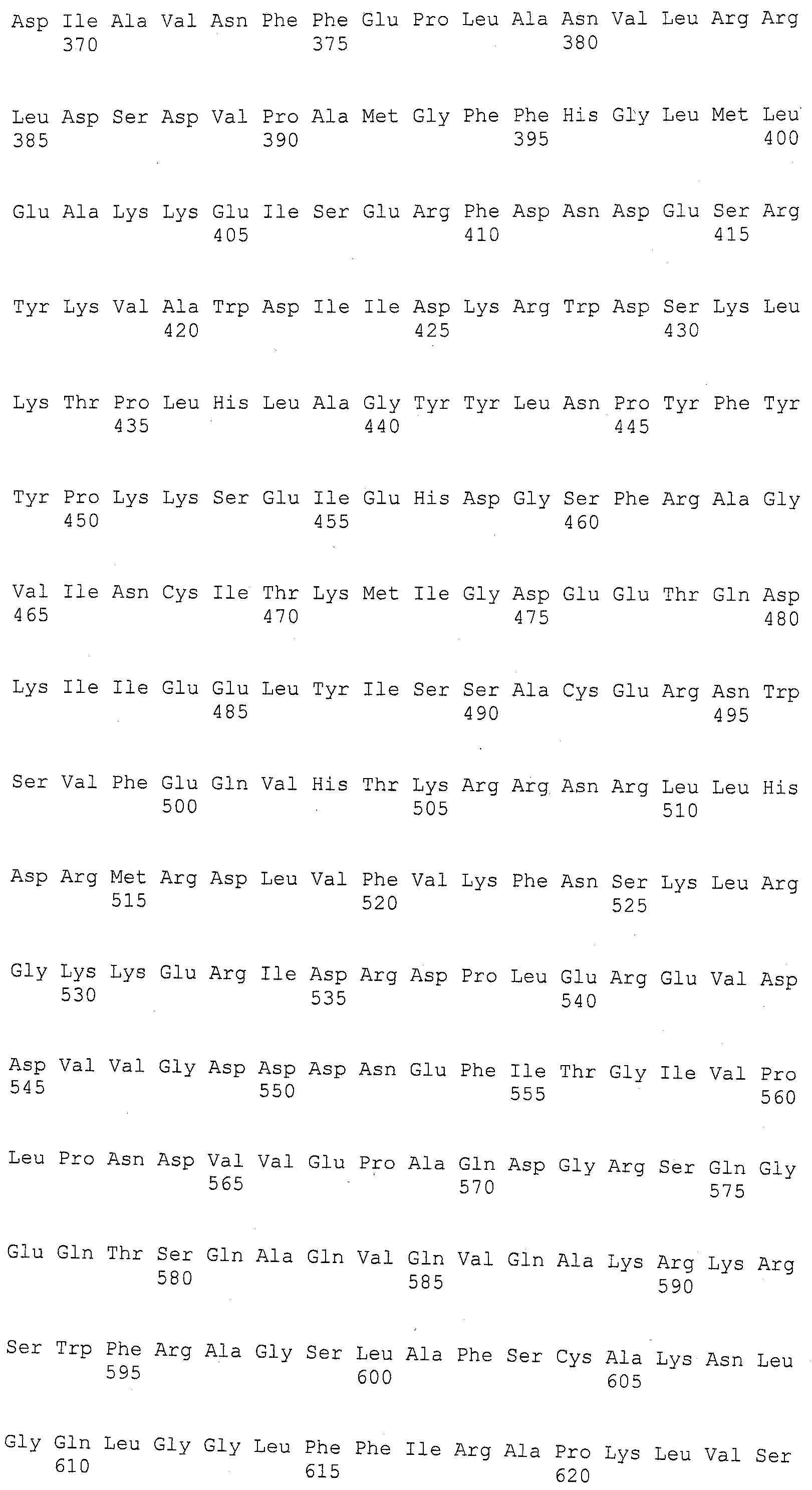




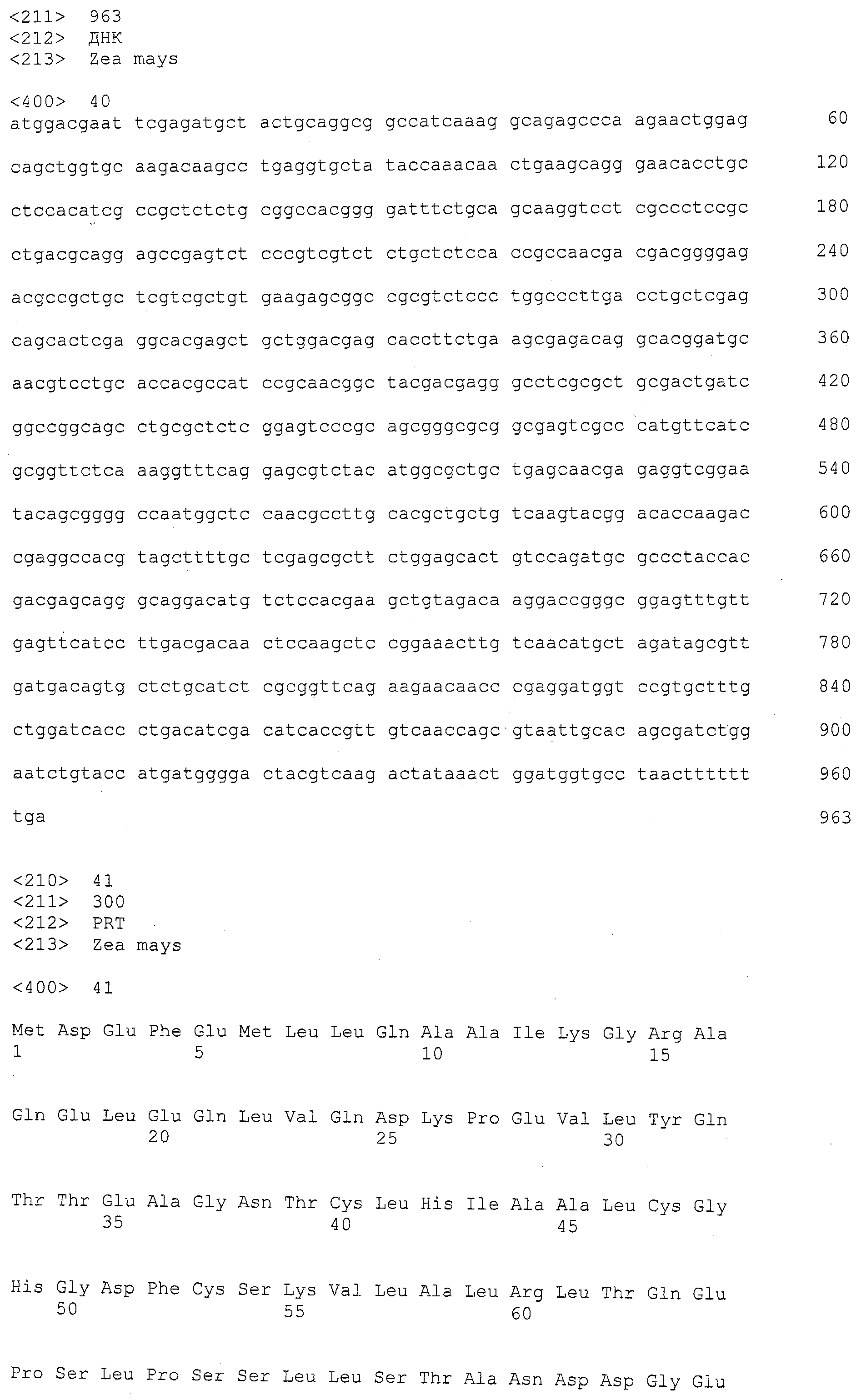


























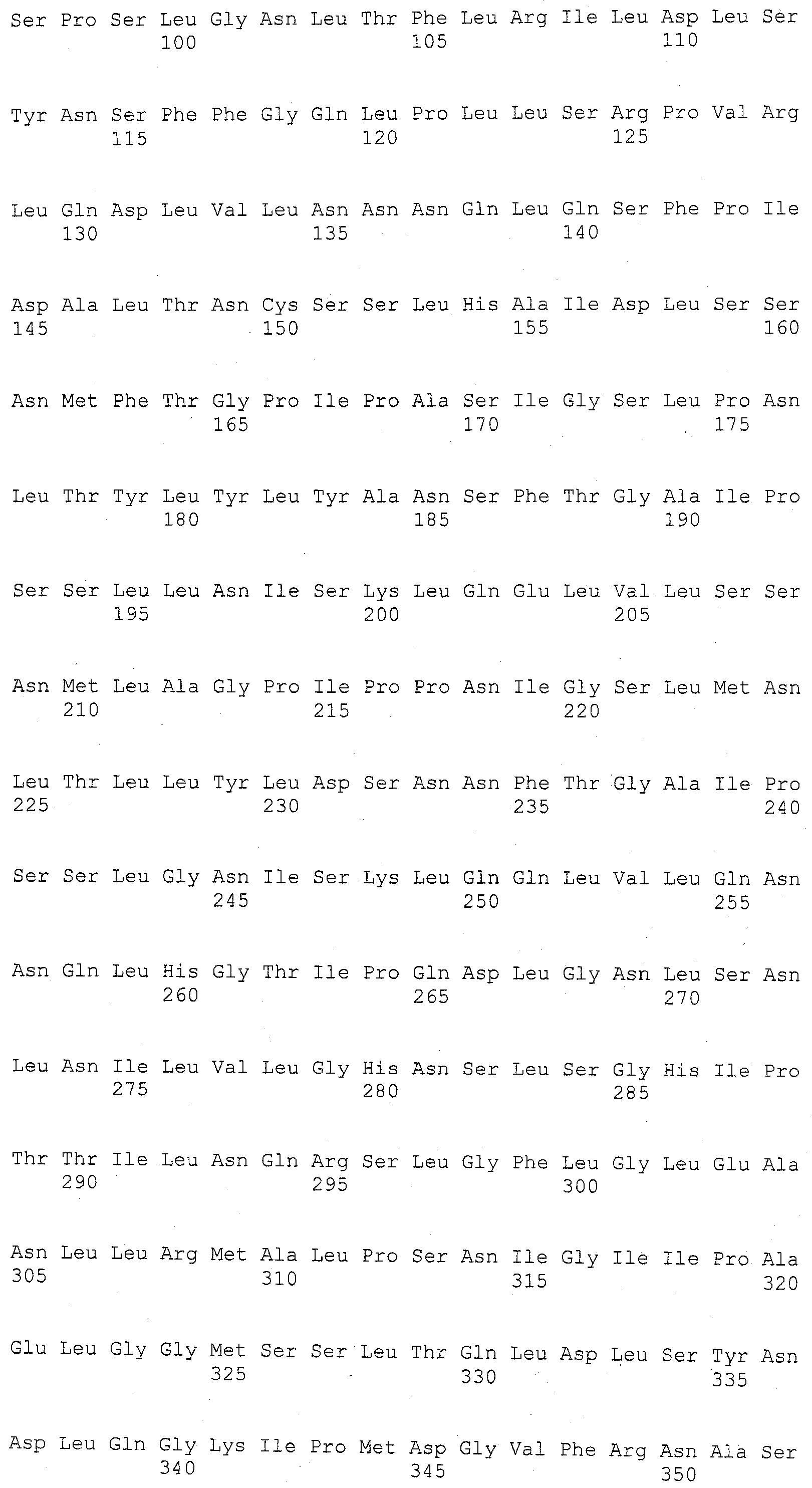
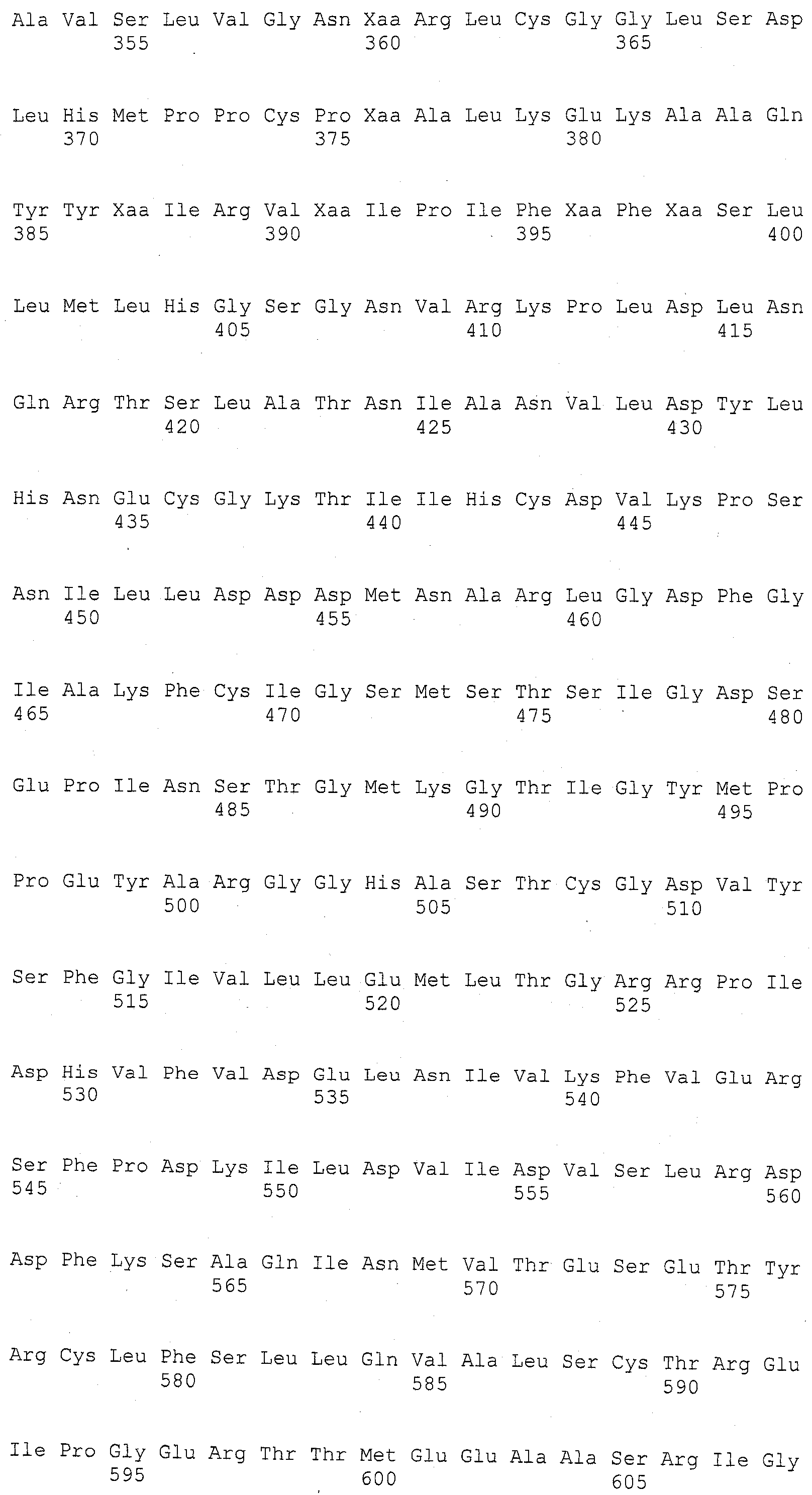




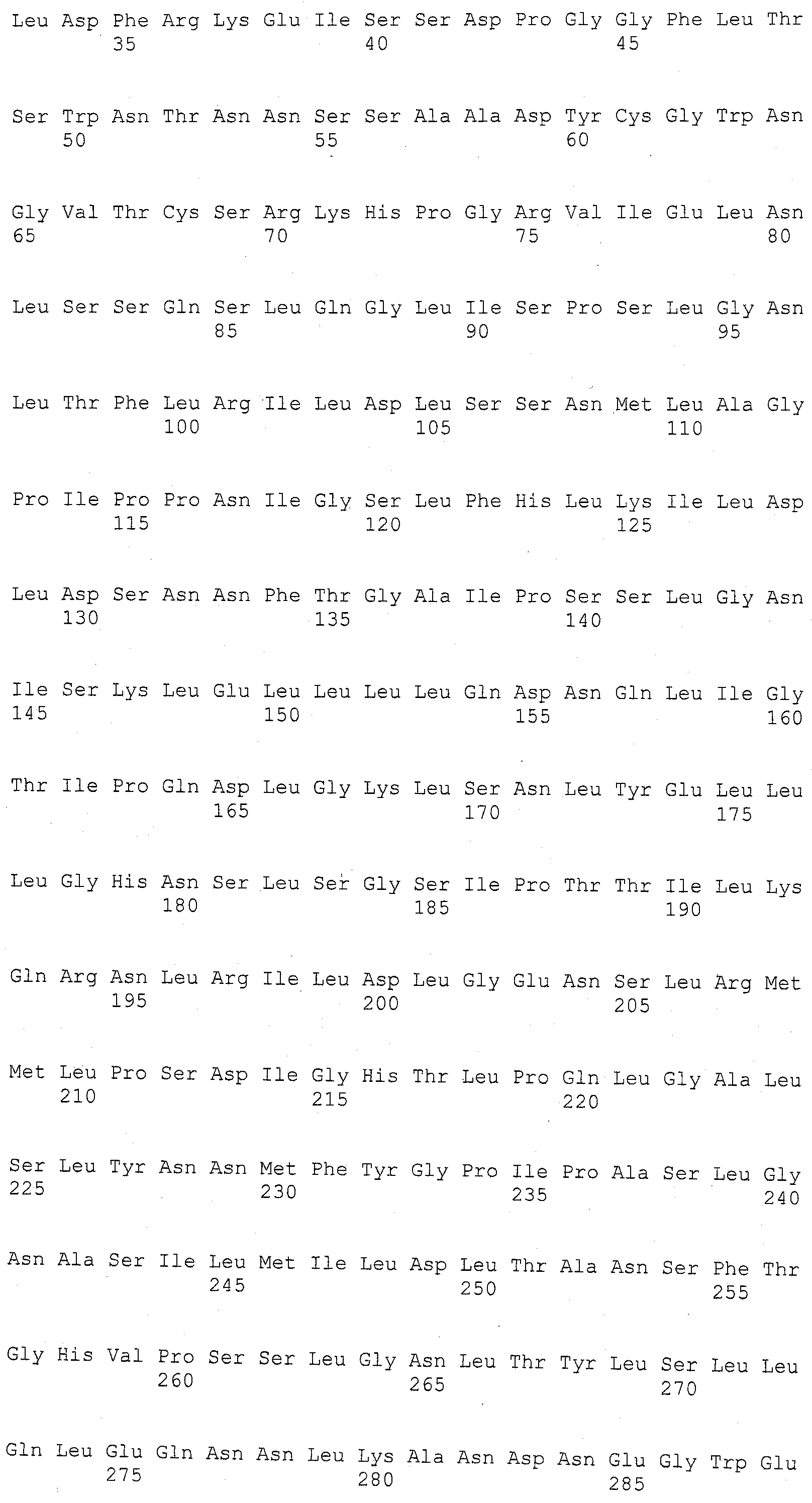


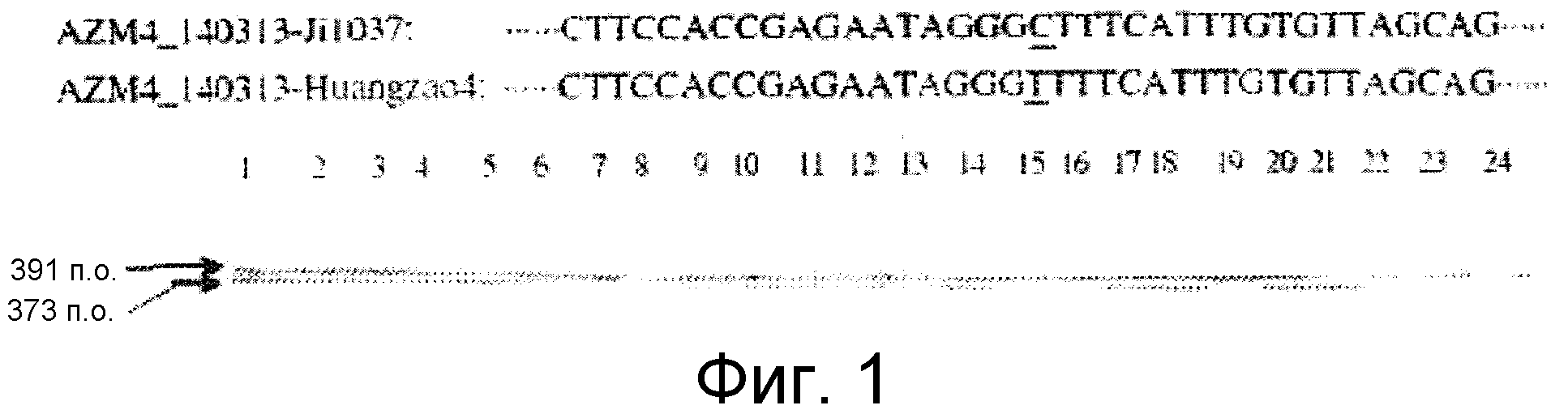


Описание
Данная заявка заявляет приоритет предварительной заявки США № 61/090704, поданной 21 августа 2008 года, содержание которой включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к композициям и способам, пригодным для увеличения устойчивости к пыльной головне у маиса.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Пыльная головня представляет собой передающееся через почву и системное заболевание у маиса (Frederiksen 1977), вызываемое хозяин-специфическим грибом Sphacelotheca reiliana (Kühn)Clint. Телиоспоры из сорусов, погруженных в почву, являются первичным источником инфекции, и могут сохраняться три года в почве без потери какой-либо инфицирующей способности (Wu et al. 1981). Гриб инфицирует рассаду через корни или колеоптили во время и после прорастания семян (Krüger 1962). При инфицировании чувствительного сорта растения продолжают нормальный вегетативный рост, но некоторые могут останавливать рост (Matyac and Kommedahl 1985a). При созревании сорусы замещают початки или метелки инфицированных растений, приводя к тому, что урожай с растения маиса почти отсутствует. Соотношение инфицированных растений на инфицированном поле может составлять количество до 80% (Frederiksen1977). Jin (2000) сообщал, что частота этой болезни варьировала от 7,0% до 35,0%, иногда даже достигая 62,0%, возникая в результате культивирования чувствительных культурных сортов. В Северном Китае пыльная головня вызывает потерю урожая до 0,3 миллионов тонн ежегодно (Bai et al. 1994). Сообщалось, что маис в Южной Европе, Северной Америке и Азии также серьезно страдает от этой болезни (Xu et al. 1999). Принимая во внимание как экономические, так и экологические элементы, культивирование устойчивых сортов является эффективным путем контроля эпидемий пыльной головни. Селекция на гены множественной устойчивости/QTL (локусы количественного признака) против пыльной головни в элитных сортах маиса будет перспективным путем для улучшения устойчивости против этой болезни.
В настоящее время многие исследователи изучили генетические модели, обсуждая устойчивость против пыльной головни. Mei et al.(1982) сообщал, что устойчивость против пыльной головни контролировалась частично доминантными ядерными генами, не обнаруживая различия в реципрокальных скрещиваниях. Ma et al. (1983) сообщал, что устойчивость маиса к пыльной головне является количественным признаком, на который влияют гены частичной устойчивости и их неаллельными взаимодействиями. Stromberg et al.(1984) открыл, что F1 популяция показывала промежуточную заболеваемость между резистентным и чувствительным родителями. Ali и Baggett (1990) сообщали, что аддитивные и доминантные генетические действия являются преобладающими при различных обработках. Bernardo et al. (1992) изучал генетический эффект гена(ов) устойчивости путем использования усредненного анализа поколений, подтверждая то, что аддитивный эффект является очевидным, тогда как доминантный и эпистатический эффекты являются слабыми. Shi et al. (2005) сообщал, что помимо аддитивного эффекта, сверхдоминирование также играет ключевую роль в устойчивости против пыльной головни. Очевидно, что устойчивость против пыльной головни у маиса может включать ряд генетических элементов и действовать комплексным путем.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Обеспечиваются композиции и способы для определения и селекции растений маиса с увеличенной устойчивостью к пыльной головне.
В первом варианте осуществления данное изобретение касается выделенного полинуклеотида, включающего полинуклеотид, выбранный из группы, состоящей из
(a) по меньшей мере одной нуклеотидной последовательности, кодирующей полипептид, придающий или улучшающий устойчивость к пыльной головне, выбранной из группы, состоящей из SEQ ID NO:27, 32, 35, 38, 41, 44, 105, 108, 111, 113 и 116;
(b) по меньшей мере одной нуклеотидной последовательности, способной кодировать полипептид, придающий или усиливающий устойчивость к пыльной головне, выбранной из группы, состоящей из SEQ ID NO:25, 26, 30, 31, 34, 36, 37, 39, 40, 42, 43, 45, 104, 106, 107, 109, 110, 112, 114, 115 и 117; и
(c) комплементарной к нуклеотидной последовательности части (a) или (b), где комплементарная и нуклеотидная последовательность состоят из одинакового числа нуклеотидов и являются 100% комплементарными.
Во втором варианте осуществления данное изобретение касается вектора, содержащего заявленный выделенный полинуклеотид.
В третьем варианте осуществления данное изобретение касается рекомбинантного ДНК-конструкта, содержащего изолированный полинуклеотид данного изобретения, функционально связанный с по меньшей мере одной регуляторной последовательностью.
В четвертом варианте осуществления данное изобретение касается клетки маиса, содержащей рекомбинантный ДНК-конструкт или изолированный полинуклеотид данного изобретения.
В пятом варианте осуществления данное изобретение касается способа получения растения маиса, включающего трансформацию клетки растения с рекомбинантным ДНК-конструктом данного изобретения и регенерацию растения из трансформированной клетки растения.
В шестом варианте осуществления данное изобретение касается растения маиса, содержащего рекомбинантный ДНК-конструкт данного изобретения.
В седьмом варианте осуществления данное изобретение касается семени маиса, содержащего рекомбинантный ДНК-конструкт данного изобретения.
В восьмом варианте осуществления данное изобретение касается способа обеспечения или улучшения устойчивости к пыльной головне, включающего трансформацию растения с рекомбинантным ДНК-конструктом данного изобретения, таким образом придавая или улучшая устойчивость к пыльной головне.
В девятом варианте осуществления данное изобретение касается способа определения присутствия или отсутствия полинуклеотида данного изобретения в растении маиса, включающего по меньшей мере один из следующего:
(a) выделение молекул нуклеиновой кислоты из указанного растения маиса и амплификация последовательностей, гомологичных с полинуклеотидом данного изобретения, или
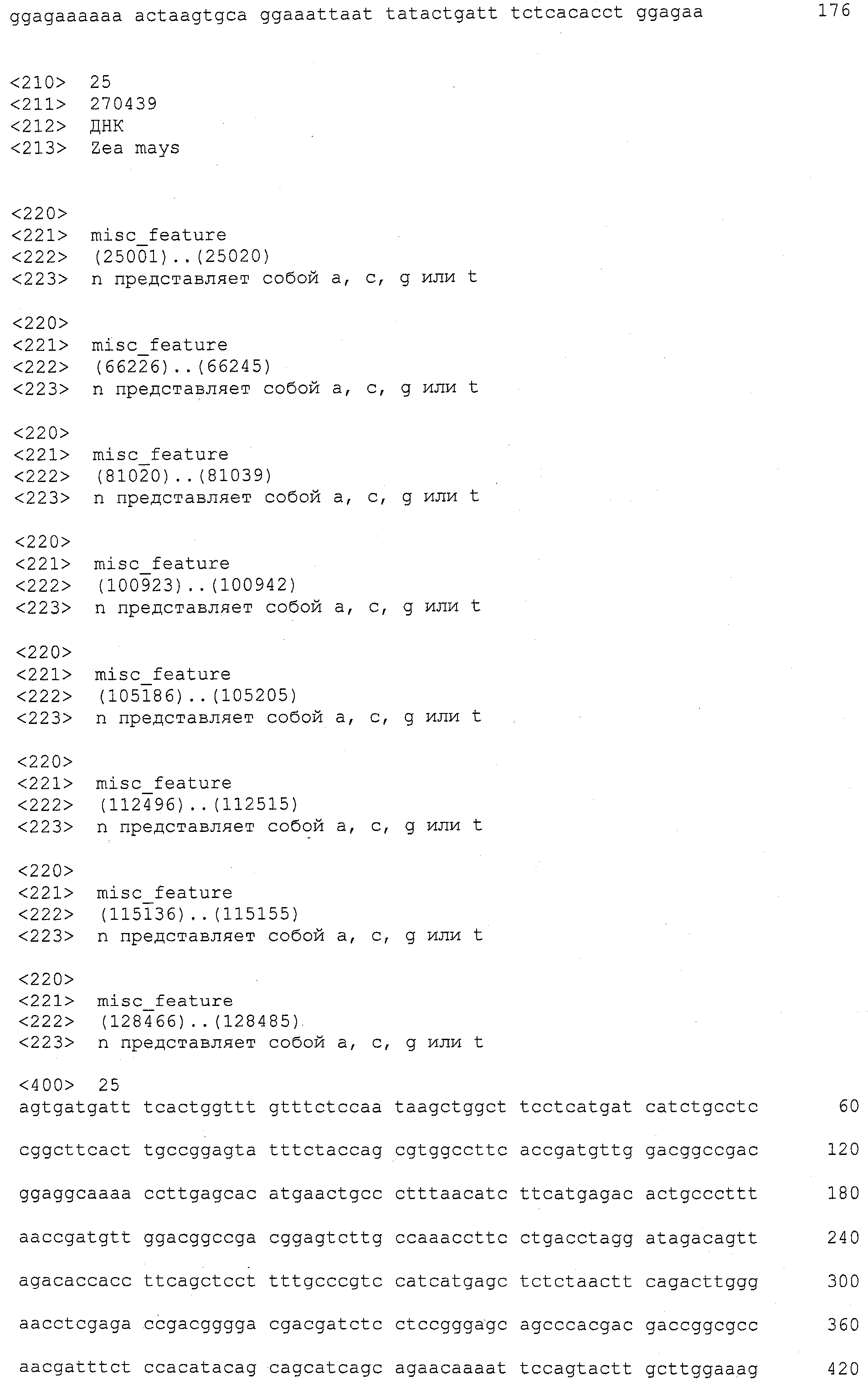
(b) выделение молекул нуклеиновой кислоты из указанных растений маиса и проведение Саузерн-гибридизации, или
(c) выделение белков из указанного растения маиса и проведение вестерн-блоттинга, используя антитела к белку, или
(d) выделение белков из указанного растения маиса и проведение анализа ELISA, используя антитела к белку, или
(e) демонстрация присутствия последовательностей мРНК, полученных от мРНК транскрипта и присущих только локусу устойчивости к пыльной головне,
таким образом, определяя присутствие полинуклеотида данного изобретения в указанном растении маиса.
В десятом варианте осуществления данное изобретение касается способа определения присутствия или отсутствия локуса устойчивости к пыльной головне в растении маиса, включающего по меньшей мере один из следующего:
(a) выделение молекул нуклеиновой кислоты из указанного растения маиса и амплификация последовательностей, присущих только полинуклеотиду данного изобретения, или
(b) выделение белков из указанного растения маиса и проведение вестерн-блоттинга, используя антитела к белку, или
(c) выделение белков из указанного растения маиса и проведение анализа ELISA, используя антитела к белку, или
(d) демонстрация присутствия мРНК последовательностей, полученных от мРНК транскрипта и присущих только локусу устойчивости к пыльной головне,
таким образом определяя присутствие локуса устойчивости к пыльной головне в указанном растении маиса.
В одиннадцатом варианте осуществления данное изобретение касается способа изменения уровня экспрессии белка, способного придавать устойчивость к пыльной головне клетке маиса, включающего
(a) трансформацию клетки маиса с рекомбинантным ДНК-конструктом данного изобретения и
(b) выращивание трансформированной клетки маиса при условиях, которые являются подходящими для экспрессии рекомбинантного ДНК-конструкта, где экспрессия рекомбинантного ДНК-конструкта приводит к продукции измененных уровней белка, способного придавать устойчивость к пыльной головне в трансформированной клетке маиса по сравнению с уровнями экспрессии в растении маиса дикого типа, имеющем устойчивость к пыльной головне.
В двенадцатом варианте осуществления данное изобретение касается способа изменения уровня экспрессии белка, способного придавать устойчивость к пыльной головне в клетке маиса, включающего
(a) трансформацию клетки маиса с рекомбинантным ДНК-конструктом данного изобретения; и
(b) выращивание трансформированной клетки маиса при условиях, которые являются подходящими для экспрессии рекомбинантного ДНК-конструкта, где экспрессия рекомбинантного ДНК-конструкта приводит к продукции увеличенных уровней белка, способного придавать устойчивость к пыльной головне в трансформированной клетке маиса по сравнению с уровнями экспрессии в растении маиса дикого типа, имеющем устойчивость к пыльной головне.
В тринадцатом варианте осуществления данное изобретение касается способа изменения уровня экспрессии белка, способного придавать устойчивость к пыльной головне в растении маиса, включающего
(a) трансформацию клетки растения маиса с рекомбинантным ДНК-конструктом данного изобретения; и
(b) регенерацию трансформированного растения маиса из трансформированной клетки растения маиса; и
(c) выращивание трансформированного растения маиса при условиях, которые являются подходящими для экспрессии рекомбинантного ДНК-конструкта, где экспрессия рекомбинантного ДНК-конструкта приводит к продукции измененных уровней белка, способного придавать устойчивость к пыльной головне в трансформированном растении маиса по сравнению с уровнями экспрессии в растении маиса дикого типа, имеющем устойчивость к пыльной головне.
В четырнадцатом варианте осуществления данное изобретение касается способа изменения уровня экспрессии белка, способного придавать устойчивость к пыльной головне в растении маиса, включающего
(a) трансформацию клетки растения маиса с рекомбинантным ДНК-конструктом данного изобретения; и
(b) регенерацию трансформированного растения маиса из трансформированной клетки растения маиса; и
(c) выращивание трансформированного растения маиса при условиях, которые являются подходящими для экспрессии рекомбинантного ДНК-конструкта, где экспрессия рекомбинантного ДНК-конструкта приводит к продукции измененных уровней белка, способного придавать устойчивость к пыльной головне в трансформированном растении маиса по сравнению с уровнями экспрессии в растении маиса дикого типа, имеющем устойчивость к пыльной головне.
В пятнадцатом варианте осуществления данное изобретение касается способа определения растения маиса, которое проявляет устойчивость к пыльной головне, где способ включает обнаружение в растении маиса генетического маркерного локуса, где
(a) генетический маркерный зонд, содержащий весь или часть генетического маркерного локуса, или комплементарный ему, гибридизируется при жестких условиях с bacm.pk071.j12, bacm.pk007.18, и bacm2.pk166.h1; и
(b) указанный генетический маркерный локус содержит по меньшей мере одну аллель, которая связана с устойчивостью к пыльной головне.
В шестнадцатом варианте осуществления данное изобретение касается способа определения растения маиса, которое проявляет устойчивость к пыльной головне, где способ включает обнаружение в идиоплазме растения маиса по меньшей мере одной аллели маркерного локуса, где
(a) маркерный локус находится в пределах 7 cM SSR148152, CAPS25082, STS171, SNP661 и STS1944; и
(b) по меньшей мере одна аллель связана с устойчивостью к пыльной головне.
В семнадцатом варианте осуществления данное изобретение касается способа определения растения маиса, которое проявляет устойчивость к пыльной головне, где способ включает обнаружение в идиоплазме растения маиса по меньшей мере одной аллели маркерного локуса, где
(a) маркерный локус расположен в хромосомном участке, который содержит и фланкирован umc1736 и umc2184, или в хромосомном участке, который содержит и фланкирован SSR148152/SNP661; и
(b) по меньшей мере одна аллель связана с устойчивостью к пыльной головне.
В восемнадцатом варианте осуществления данное изобретение касается способа селекции с использованием маркера, включающего
(a) получение первого растения маиса, имеющего по меньшей мере одну аллель маркерного локуса, где маркерный локус расположен в пределах 7 cM SSR148152, CAPS25082, STS171, SNP661 и STS1944 на доступной IBM генетической карте, и аллель связана с увеличенной устойчивостью к пыльной головне;
(b) скрещивание указанного первого растения маиса со вторым растением маиса;
(c) оценку потомства по отношению к по меньшей мере указанной аллели; и
(d) отбор потомства растений маиса, которые обладают по меньшей мере указанной аллелью.
В девятнадцатом варианте осуществления данное изобретение касается способа селекции с использованием маркера, включающего
(a) получение первого растения маиса, имеющего по меньшей мере одну аллель маркерного локуса, где маркерный локус расположен в хромосомном участке, содержащем и фланкированном umc1736 и umc2184, и аллель связана с увеличенной устойчивостью к пыльной головне;
(b) скрещивание указанного первого растения маиса со вторым растением маиса;
(c) оценку потомства по отношению к по меньшей мере указанной аллели; и
(d) отбор потомства растений маиса, которые обладают по меньшей мере указанной аллелью.
В девятнадцатом варианте осуществления данное изобретение касается способа обнаружения локуса устойчивости к пыльной головне, включающего обнаружение присутствия по меньшей мере одной маркерной аллели, выбранной из группы, включающей MZA6393, 1M2-9, E6765-3, 2M4-1, 2M10-5, 2M11-3, 3M1-25 и STS148-1.
Также понятно, что в любом из упомянутых выше способов любая из описанных маркерных аллелей, связанных с устойчивостью к пыльной головне, может быть связана с любой второй маркерной аллелью. Такая вторая маркерная аллель будет также связана с устойчивостью к пыльной головне и будет пригодна в способах, описанных выше.
КРАТКОЕ ОПИСАНИЕ ФИГУР И СПИСКОВ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Данное изобретение можно понять более полно из следующего подробного описания и сопроводительных графических материалов и списка последовательностей, который образует часть этой заявки. Список последовательностей содержит однобуквенный код для условных обозначений нуклеотидной последовательности и трехбуквенные коды для аминокислот, как определено в соответствии с IUPAC-IUBMB стандартами, описанными в Nucleic Asids Research 13:3021-3030 (1985) и в Biochemical Journal 219 (No. 2): 345-373 (1984), которые включены сюда в их полноте посредством ссылки. Символы и формат, используемые для данной нуклеотидной и аминокислотной последовательности, согласуются с правилами, изложенными в 37 C.F.R. § 1,822.
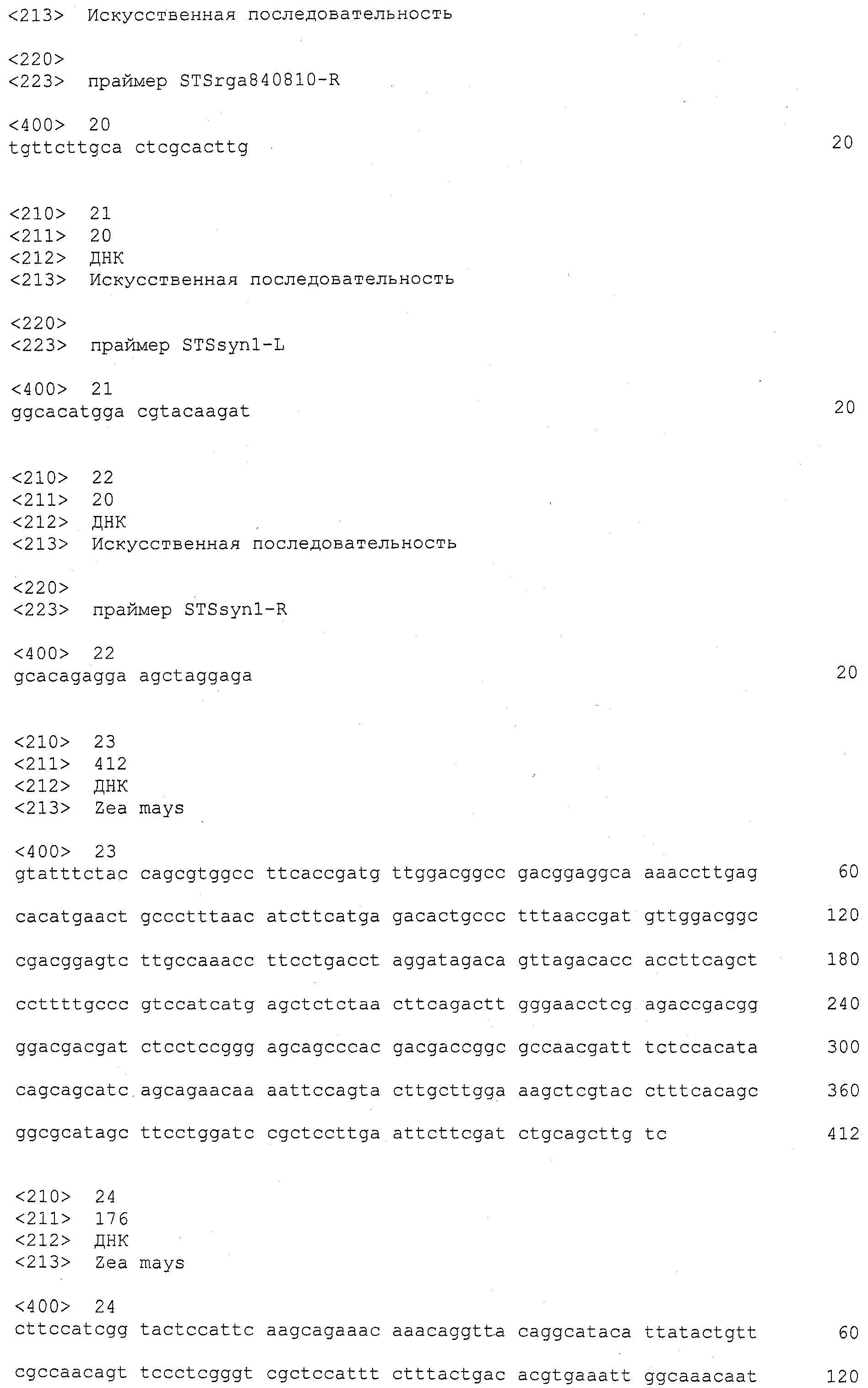
ФИГУРА 1. Создание SNP маркера (SNP140313) для AZM4_140313 (собранная Zea mays последовательность из TIGR) и его применение в генотипировании BC популяций. На AZM4_140313 локусе сайт SNP (подчеркнут) был определен на основании нуклеотидов С (аллель 1) и Т (аллель 2), соответствующие родительским линиям Ji1037 и Huangzhao4, соответственно. В первом раунде ПЦР амплификации пара нормальных праймеров (L-5'-CAGAGGCATTGAACAGGAAG-3' и R-5'-CTGCTATTCCACGAAGTGCT-3') была разработана для амплификации родительских линий BC1 особей. Во втором раунде ПЦР амплификации новая пара праймеров, включая левый праймер (snp L-5'-CTCTTCCACCGAGAATAGCG-3') с одним несовпадающим нуклеотидом С (жирный шрифт) и правым праймером (snp R-5'-CTGCTATTCCACGAAGTGCT-3') была разработана для амплификации разведенных ПРЦ продуктов из первого раунда. Получали HhaI сайт «GCGC» для аллеля 1, но не для аллеля 2 в полученных ПЦР продуктах. ПЦР продукты были обработаны HhaI и затем подвергались электрофорезу на 6% полиакриламидном геле. Полиморфные полосы наблюдались в двух родительских линиях, Ji1037 (линия 21, обработанная 373 п.о. полоса) и Huangzhao4 (линия 22, интактная 391 п.о. полоса) и среди ВС1 особей (линии 1-20). Линии 1-20 Случайно отобранные ВС1, особи, которые проявляют гомозиготу (1/1, одна полоса, имеющая тот же размер, что и Huangzhao4), либо гетерозиготу (1/2, две полосы, соответствующие Ji1037 и Huangzhao4, соответственно). Линия 21 HhaI-обработанные ПЦР продукты, амплифицированные из Ji1037, наблюдалась обработанная 373 п.о. полоса. Линия 22 HhaI-обработанные ПЦР продукты, амплифицированные из Huangzhao4, наблюдалась необработанная 391 п.о. полоса. Линия 23 Необработанные ПЦР продукты, амплифицированные из Ji1037. Линия 24 Необработанные ПЦР продукты, амплифицированные из Huangzhao4.
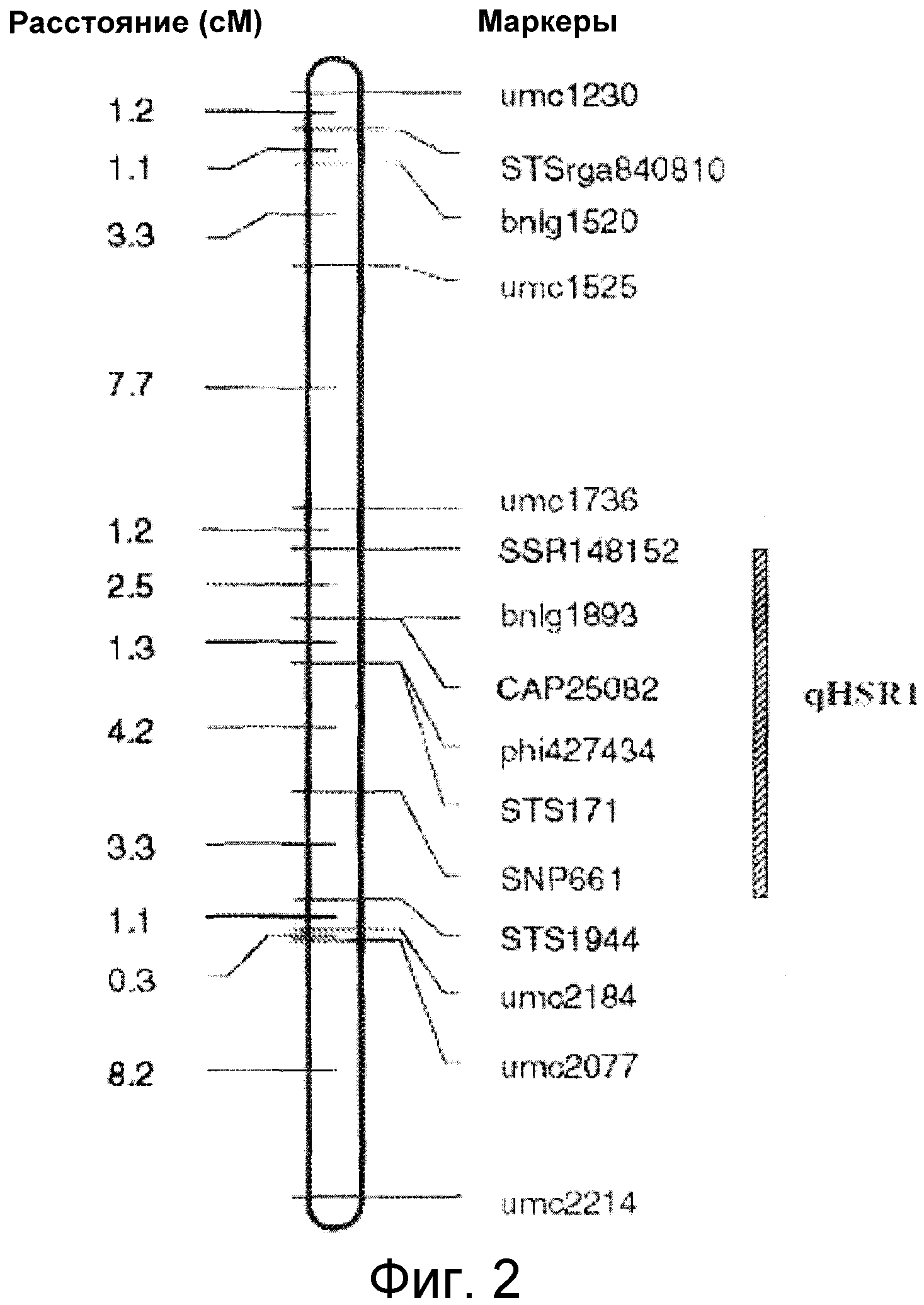
ФИГУРА 2. Генетическое картирование вновь созданных маркеров в bin2.09 области. Из девяти вновь созданных маркеров шесть маркеров были картированы на отрезке 2.09 с пятью маркерами (SSR148152, CAPS25082, STS171, SNP661 и STS1944) внутри и одним маркером (STSrga840810) за пределами qHSR1 области устойчивости. Основной QTL, qHSR1, ограничен в участке ~2 млн. п.о., фланкированном вновь созданными маркерами SSR148152 и SNP661.
ФИГУРА 3. Выравнивание гена ингибитора ксиланазы из Mo17 и B73. Mo17 последовательность обнаруживается в qHSR1, локусе, который придает устойчивость к пыльной головне у маиса. B73 является сортом маиса, чувствительным к пыльной головне.
ФИГУРА 4. Сравнительный рисунок Mo17, B73, и Huangzhao геномной структуры в qHSR области. Как B73, так и Huangzhao имеют делеции в области по сравнению с Mo17. Маркеры, упоминаемые в данном изобретении, показаны сверху. Указаны шесть генов, представляющих интерес: ген гидролазы, который присущ только Mo17; Ген 1, и белок с анкириновым повтором, обнаружен во всех трех линиях; Ген 2, который является ассоциированной с клеточной стенкой киназой, обнаруживается в Mo17 и B73; Ген 3 и Ген 4 относятся к LRR-Xa21-подобным киназам, которые присущи только Mo17; и Ген 5 представляет собой третью LRR-Xa21D-подобную киназу, полностью или частично обнаруживаемую во всех трех линиях. Mo17 составляет 172 т.п.н. (тысяча пар нуклеотидов) в длину в этой области и Huangzhao составляет 56 т.п.н. в длину.
Описания последовательностей и прилагаемый к нему список последовательностей согласуются с правилами, регулирующими раскрытия нуклеотидных и/или аминокислотных последовательностей в патентных заявках, как изложено в 37 C.F.R. §1.821-1.825. Список последовательностей содержит однобуквенный код для условных обозначений нуклеотидной последовательности и трехбуквенные коды для аминокислот, как определено в соответствии с IUPAC-IUBMB стандартами, описанными в Nucleic Acids Res. 13:3021-3030 (1985) и в Biochemical J. 219 (2):345-373 (1984), которые включены в настоящее описание посредством ссылки. Символы и формат, используемые для данных нуклеотидных и аминокислотных последовательностей согласуются с правилами, изложенными в 37 C.F.R. §1.822.
SEQ ID NO:1 представляет собой праймер амплификации CAPS25082-L.
SEQ ID NO:2 представляет собой праймер амплификации CAPS25082-R.
SEQ ID NO:3 представляет собой праймер амплификации SNP140313-L.
SEQ ID NO:4 представляет собой праймер амплификации SNP140313-R.
SEQ ID NO:5 представляет собой праймер амплификации SNP140313-snpL.
SEQ ID NO:6 представляет собой праймер амплификации SNP140313-snpR.
SEQ ID NO:7 представляет собой праймер амплификации SNP661-L.
SEQ ID NO:8 представляет собой праймер амплификации SNP661-R.
SEQ ID NO:9 представляет собой праймер амплификации SNP661-snpL.
SEQ ID NO:10 представляет собой праймер амплификации SNP661-snpR.
SEQ ID NO:11 представляет собой праймер амплификации STS1944-L.
SEQ ID NO:12 представляет собой праймер амплификации STS1944-R.
SEQ ID NO:13 представляет собой праймер амплификации STS171-L.
SEQ ID NO:14 представляет собой праймер амплификации STS171-R.
SEQ ID NO:15 представляет собой праймер амплификации SSR148152-L.
SEQ ID NO:16 представляет собой праймер амплификации SSR148152-R.
SEQ ID NO:17 представляет собой праймер амплификации STSrga3195-L.
SEQ ID NO:18 представляет собой праймер амплификации STSrga3195-R.
SEQ ID NO:19 представляет собой праймер амплификации STSrga840810-L.
SEQ ID NO:20 представляет собой праймер амплификации STSrga840810-R.
SEQ ID NO:21 представляет собой праймер амплификации STSsyn1-L.
SEQ ID NO:22 представляет собой праймер амплификации STSsyn1-R.
SEQ ID NO:23 представляет собой MZA6393 маркер (из bacm.pk071.j12.f), который определяет один конец ВАС контига, покрывающего qHSR1 локус. Huangzhao и В73 версии этой маркерной области обнаружены в SEQ ID NO:47 и 48, соответственно.
SEQ ID NO:24 представляет собой ST148-1 маркер из Мо17 версии ZMMBBc0478L09f, который определяет один конец ВАС контига, покрывающего qHSR1 локус. Huangzhao версия этой маркерной области может быть обнаружена в SEQ ID NO:49.
SEQ ID NO:25 представляет собой ВАС контиг, составленный из перекрывающихся клонов bacm.pk071.j12, bacm.pk007.18, и bacm2.pk166.h1, который покрывает qHSR1 локус.
SEQ ID NO:26 представляет собой последовательность нуклеиновой кислоты из Мо17, представляющую область, кодирующую ген, для гена ингибитора ксиланазы, содержащегося в qHRS1 локусе.
SEQ ID NO:27 представляет собой продукт трансляции SEQ ID NO:26.
SEQ ID NO:28 представляет собой последовательность нуклеиновой кислоты из B73, представляющую область, кодирующую ген, для гена ингибитора ксиланазы, содержащегося в области B73 генома, которая является синтетической по отношению к qHRS1 локусу.
SEQ ID NO:29 представляет собой продукт трансляции SEQ ID NO:28.
SEQ ID NO:30 представляет собой область геномной ДНК из Mo17, кодирующую ингибитор ксиланазы SEQ ID NO:26/27 и 3 т.п.н. по ходу транскрипции кодирующей области.
SEQ ID NO:31 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для гена белка киназы, ассоциированной с клеточной стенкой, содержащуюся в qHRS1 локусе.
SEQ ID NO:32 представляет собой продукт трансляции SEQ ID NO:31.
SEQ ID NO:33 представляет собой область геномной ДНК из Mo17, кодирующую белок ассоциированной с клеточной стенкой киназы SEQ ID NO:31/32 и 2,4 т.п.н. по ходу транскрипции кодирующей области.
SEQ ID NO:34 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для гена белка димеризации семейства HAT (PCO662117), содержащуюся в qHRS1 локусе.
SEQ ID NO:35 представляет собой продукт трансляции SEQ ID NO:34.
SEQ ID NO:36 представляет собой область геномной ДНК из Mo17, кодирующую ген белка димеризации семейства HAT SEQ ID NO:34/35 и 2,4 т.п.н. по ходу транскрипции кодирующей области.
SEQ ID NO:37 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для гена белка димеризации семейства HAT (PCO662162/PCO548849/PCO523172), содержащуюся в qHRS1 локусе.
SEQ ID NO:38 представляет собой продукт трансляции SEQ ID NO:37.
SEQ ID NO:39 представляет собой область геномной ДНК из Mo17, кодирующую ген белка димеризации семейства HAT SEQ ID NO:37/38 и 2,4 т.п.н. по ходу транскрипции кодирующей области.
SEQ ID NO:40 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для гена неохарактеризованного белка (PCO648231), содержащуюся в qHRS1 локусе.
SEQ ID NO:41 представляет собой продукт трансляции SEQ ID NO:40.
SEQ ID NO:42 представляет собой область геномной ДНК из Mo17, кодирующую ген неохарактеризованного белка SEQ ID NO:40/41 и 2,4 т.п.н. по ходу транскрипции кодирующей области.
SEQ ID NO:43 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для гена неохарактеризованного белка (61_24), содержащуюся в qHRS1 локусе.
SEQ ID NO:44 представляет собой продукт трансляции SEQ ID NO:43.
SEQ ID NO:45 представляет собой область геномной ДНК из Mo17, кодирующую ген неохарактеризованного белка SEQ ID NO:43/44 и 2,4 т.п.н. по ходу транскрипции кодирующей области.
SEQ ID NO:46 представляет собой последовательность нуклеиновой кислоты, кодирующую отдельную EST последовательность из Мо17, содержащуюся в qHRS1 локусе.
SEQ ID NO:47 представляет собой MZA6393 маркер из Huangzhao4.
SEQ ID NO:48 представляет собой MZA6393 маркер из В73.
SEQ ID NO:49 представляет собой STS 148-1 маркер из Huangzhao4.
SEQ ID NO:50 представляет собой праймер амплификации MZA6393L.
SEQ ID NO:51 представляет собой праймер амплификации MZA6393R.
SEQ ID NO:52 представляет собой праймер амплификации 1M2-9L.
SEQ ID NO:53 представляет собой праймер амплификации 1M2-9R.
SEQ ID NO:54 представляет собой 1М2-9 маркер из Мо17.
SEQ ID NO:55 представляет собой 1М2-9 маркер из Huangzhao4.
SEQ ID NO:56 представляет собой праймер амплификации Е6765-3L.
SEQ ID NO:57 представляет собой праймер амплификации Е6765-3R.
SEQ ID NO:58 представляет собой Е6765-3 маркер из Мо17.
SEQ ID NO:59 представляет собой праймер амплификации 2M4-1L.
SEQ ID NO:60 представляет собой праймер амплификации 2M4-1R.
SEQ ID NO:61 представляет собой 2M4-1 маркер из Mo17.
SEQ ID NO:62 представляет собой праймер амплификации 2M10-5L.
SEQ ID NO:63 представляет собой праймер амплификации 2M10-5R.
SEQ ID NO:64 представляет собой 2M10-5 маркер из Mo17.
SEQ ID NO:65 представляет собой праймер амплификации 2M11-3L.
SEQ ID NO:66 представляет собой праймер амплификации 2M11-3R.
SEQ ID NO:67 представляет собой 2M11-3 маркер из Mo17.
SEQ ID NO:68 представляет собой праймер амплификации 3M1-25L.
SEQ ID NO:69 представляет собой праймер амплификации 3M1-25R.
SEQ ID NO:70 представляет собой 3M1-25 маркер из Mo17.
SEQ ID NO:71 представляет собой 3M1-25 маркер из Huangzhao4.
SEQ ID NO:72 представляет собой праймер амплификации STS148-1L.
SEQ ID NO:73 представляет собой праймер амплификации STS148-1R.
SEQ ID NO:74 представляет собой праймер амплификации MZA15839-4-L.
SEQ ID NO:75 представляет собой праймер амплификации MZA15839-4-R.
SEQ ID NO:76 представляет собой праймер амплификации MZA18530-16-L.
SEQ ID NO:77 представляет собой праймер амплификации MZA18530-16-R.
SEQ ID NO:78 представляет собой праймер амплификации MZA5473-801-L.
SEQ ID NO:79 представляет собой праймер амплификации MZA5473-801-R.
SEQ ID NO:80 представляет собой праймер амплификации MZA16870-15-L.
SEQ ID NO:81 представляет собой праймер амплификации MZA16870-15-R.
SEQ ID NO:82 представляет собой праймер амплификации MZA4087-19-L.
SEQ ID NO:83 представляет собой праймер амплификации MZA4087-19-R.
SEQ ID NO:84 представляет собой праймер амплификации MZA158-30-L.
SEQ ID NO:85 представляет собой праймер амплификации MZA158-30-R.
SEQ ID NO:86 представляет собой праймер амплификации MZA15493-15-L.
SEQ ID NO:87 представляет собой праймер амплификации MZA15493-15-R.
SEQ ID NO:88 представляет собой праймер амплификации MZA9967-11-L.
SEQ ID NO:89 представляет собой праймер амплификации MZA9967-11-R.
SEQ ID NO:90 представляет собой праймер амплификации MZA1556-23-L.
SEQ ID NO:91 представляет собой праймер амплификации MZA1556-23-R.
SEQ ID NO:92 представляет собой праймер амплификации MZA1556-801-L.
SEQ ID NO:93 представляет собой праймер амплификации MZA1556-801-R.
SEQ ID NO:94 представляет собой праймер амплификации MZA17365-10-L.
SEQ ID NO:95 представляет собой праймер амплификации MZA17365-10-R.
SEQ ID NO:96 представляет собой праймер амплификации MZA17365-801-L.
SEQ ID NO:97 представляет собой праймер амплификации MZA17365-801-R.
SEQ ID NO:98 представляет собой праймер амплификации MZA14192-8-L.
SEQ ID NO:99 представляет собой праймер амплификации MZA14192-8-R.
SEQ ID NO:100 представляет собой праймер амплификации MZA15554-13-L.
SEQ ID NO:101 представляет собой праймер амплификации MZA15554-13-R.
SEQ ID NO:102 представляет собой праймер амплификации MZA4454-14-L.
SEQ ID NO:103 представляет собой праймер амплификации MZA4454-14-R.
SEQ ID NO:104 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для белка с анкириновым повтором (Ген 1 Фигура 4).
SEQ ID NO:105 представляет собой продукт трансляции SEQ ID NO:104.
SEQ ID NO:106 представляет собой область геномной ДНК из Mo17, кодирующую белок с анкириновым повтором.
SEQ ID NO:107 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для гидролазы.
SEQ ID NO:108 представляет собой продукт трансляции SEQ ID NO:107.
SEQ ID NO:109 представляет собой область геномной ДНК из Mo17, кодирующую гидролазу.
SEQ ID NO:110 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для кодирующей области LRR-Xa21-подобной киназы (Ген 3, Фигура 4).
SEQ ID NO:111 представляет собой продукт трансляции SEQ ID NO:110.
SEQ ID NO:112 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для кодирующей области LRR-Xa21-подобной киназы (Ген 4, Фигура 4).
SEQ ID NO:113 представляет собой продукт трансляции SEQ ID NO:112.
SEQ ID NO:114 представляет собой область геномной ДНК из Mo17, кодирующую LRR-Xa21-подобную киназу (Ген 4, Фигура 4).
SEQ ID NO:115 представляет собой последовательность нуклеиновой кислоты из Mo17, представляющую область, кодирующую ген, для LRR-Xa21D-подобной киназы (Ген 5, Фигура 4).
SEQ ID NO:116 представляет собой продукт трансляции SEQ ID NO:115.
SEQ ID NO:117 представляет собой область геномной ДНК из Mo17, кодирующую LRR-Xa21D-подобную киназу (Ген 5, Фигура 4).
ПОДРОБНОЕ ОПИСАНИЕ
Данное изобретение обеспечивает аллельные композиции у маиса и способы определения и селекции растений маиса с повышенной устойчивостью к пыльной головне. Также в объеме данного изобретения находятся аллельные композиции и способы, используемые для определения и для обратной селекции растений маиса, которые имеют пониженную устойчивость к пыльной головне. Следующие определения обеспечиваются как помощь для понимания данного изобретения.
Картирование локуса устойчивости к пыльной головне изложено в рукописи “Identification and fine-mapping of a major QTL conferring resistance against head smut in maize” Yongsheng Chen, Qing Chao, Guoqing Tan, Jing Zhao, Meijing Zhang, Qing Ji и Mingliang Xu. Рукопись прилагается как приложение к описанию.
Выражение “аллель” относится к одной из двух или более различных нуклеотидных последовательностей, которые находятся в определенном локусе. “Благоприятная аллель” - это аллель в конкретном локусе, которая придает или вносит вклад в агрономически желательный фенотип, например, повышенная устойчивость к пыльной головне, или альтернативно, представляет собой аллель, которая позволяет определить растения с пониженной устойчивостью к пыльной головне, которые можно извлечь из программы скрещивания или посевов (“обратная селекция”). Благоприятная аллель маркера представляет собой маркерную аллель, которая сегрегирует с благоприятным фенотипом или, альтернативно, сегрегирует с неблагоприятным фенотипом растения, следовательно, обеспечивая благоприятное действие для определения растений. Благоприятная аллельная форма хромосомного сегмента представляет собой хромосомный сегмент, который включает нуклеотидную последовательность, которая вносит вклад в превосходные агрономические показатели на одном или более генетических локусах, физически расположенных на хромосомном сегменте. “Частота аллели” относится к частоте (пропорции или процентному соотношению), с которой аллель представлена на локусе в особи, внутри линии или внутри популяции линий. Например, для аллели “A”, диплоидные особи генотипа “AA”, “Aa”, или “aa” имеют частоты аллели 1,0, 0,5, или 0,0, соответственно. Оценить частоту аллели внутри линии можно путем усреднения частот аллели образца особей из этой линии. Сходным образом, можно рассчитать частоту аллели в популяции линий путем усреднения частот аллели линий, которые создают данную популяцию. Для популяции с конечным числом особей или линий частота аллели может быть выражена как число особей или линий (или какой-либо иной определенной группы), содержащих аллель.
Аллель является “положительно” связанной с признаком, когда она связана с ним и когда присутствие аллели является индикатором того, что желательный признак или форма признака будет наблюдаться у растения, содержащего аллель. Аллель является “отрицательно” связанной с признаком, когда она связана с ним и когда присутствие аллели является индикатором того, что желательный признак или форма признака не будет наблюдаться у растения, содержащего аллель.
Особь является “гомозиготной” по локусу, если имеет только один тип аллели на локусе (например, диплоидный организм имеет копию одной и той же аллели на локусе для каждой из двух гомологичных хромосом). Организм является “гетерозиготным” по локусу, если более чем один тип аллели присутствует на этом локусе (например, диплоидная особь с одной копией каждой из двух различных аллелей). Выражение “гомогенность” обозначает, что члены группы имеют одинаковый генотип на одном или нескольких специфических локусах. В отличие от этого, выражение “гетерогенность” используется для обозначения того, что особи внутри группы отличаются по генотипу на одном или нескольких специфических локусах.
Как используется в данном документе, выражения “участок хромосомы” или “хромосомный сегмент” обозначают смежный линейный участок геномной ДНК, который расположен in planta (в полевых условиях) на отдельной хромосоме. Генетические элементы или гены, расположенные на отдельном участке хромосомы являются физически связанными. Размер участка хромосомы не является особым образом ограниченным. В некоторых аспектах генетические элементы, расположенные внутри отдельного участка хромосомы, являются генетически связанными, типично с генетическим расстоянием рекомбинации, например, менее чем или равным 20 cM, или альтернативно, менее чем или равным 10 cM. То есть, два генетических элемента внутри отдельного участка хромосомы подвергаются рекомбинации с частотой менее чем или равной 20% или 10%.
Выражение “скрещенный” или “скрещивание” означает слияние гамет через опыление для создания потомства (например, клеток, семян или растений). Выражение включает как половые скрещивания (опыление одного растения другим), так и самовоспроизводство (самоопыление, например, когда пыльца и семяпочка происходят от одного растения). “Топкросс анализ” представляет собой испытание по потомству, полученному путем скрещивания каждой родительской особи с тем же тестером, обычно гомозиготной линией. Родительская особь, которую необходимо проанализировать, может быть перекрестноопыляющимся сортом, кроссом или инбредной линией.
“Генетическая карта” - это описание взаимоотношений генетических сцеплений среди локусов на одной или нескольких хромосомах (или группах сцепления) внутри данного вида, как правило, представленная в форме диаграммы или таблицы. “Генетическое картирование” - это способ определения взаимоотношений сцеплений локусов посредством применения генетических маркеров, популяций, сегрегирующих для маркеров, и стандартных генетических принципов частоты рекомбинации. “Положение на генетической карте” представляет собой положение на генетической карте по отношению к окружающим генетическим маркерам на той же группе сцепления, где специфический маркер может быть обнаружен внутри данного вида. Если два различных маркера имеют одинаковое положение на генетической карте, то два маркера находятся в настолько непосредственной близости друг к другу, что рекомбинация происходит между ними с настолько низкой частотой, что она не определяется.
Порядок и генетические расстояния между генетическими маркерами могут иметь отличие от одной генетической карты к другой. Это происходит потому, что каждая генетическая карта представляет собой продукт картирования популяции, типов используемых маркеров и полиморфного потенциала каждого маркера между различными популяциями. Например, 10 cM на внутренне полученной генетической карте (которая здесь также называется “PHB” для Pioneer Hi-Bred) грубо эквивалентны 25-30 cM на IBM2 2005 доступной карте рамки ближайших соседей (карта с высоким разрешением доступна на maizeGDB). Однако, информация может быть соотнесена от одной карты к другой, используя основную рамку общих маркеров. Специалист в данной области может применить рамку общих маркеров для определения положений генетических маркеров и QTL на каждой отдельной генетической карте. Сравнение маркерных положений между внутренне полученной генетической картой и IBM2 генетической картой ближайших соседей можно увидеть в Таблице 3.
“Частота генетической рекомбинации” представляет собой частоту явления кроссинговера (рекомбинации) между двумя генетическими локусами. Частота рекомбинации может наблюдаться с помощью последующей сегрегации маркеров и/или признаков после мейоза. Частота генетической рекомбинации может быть выражена в сантиморганах (cM), где один cM представляет собой расстояние между двумя генетическими маркерами, которые показывают частоту рекомбинации в 1% (т.е. явление кроссинговера происходит между этими двумя маркерами один раз на каждые 100 клеточных делений).
Выражение “генотип” является генетической конституцией особи (или группы особей) на одном или нескольких генетических локусах, в противоположность наблюдаемому признаку (фенотипу). Генотип определяется аллелью(ями) одного или нескольких известных локусов, которые особь унаследовала от родителей. Выражение “генотип” может использоваться для обозначения генетической конституции особи на отдельном локусе, на множественных локусах или, в более общем смысле, выражение генотип может использоваться для обозначения генетической конституции особи для всех генов в его геноме.
“Идиоплазма” относится к генетическому материалу особи или от особи (например, растения), группы особей (например, линии растений, сорта или семейства), или клона, полученного от линии, сорта, вида или культуры. Идиоплазма может быть частью организма или клетки или может быть выделена из организма или клетки. В основном, идиоплазма обеспечивает генетический материал со специфическим молекулярным составом, который обеспечивает физическую основу для некоторых или всех наследственных свойств организма или клеточной культуры. Как используется в данном документе, идиоплазма включает клетки, семена или ткани, из которых могут вырасти новые растения, или части растения, такие как листья, стебли, пыльца или клетки, которые могут быть культивированы в целое растение.
“Гаплотип” представляет собой генотип особи на нескольких генетических локусах, т.е. комбинацию аллелей. Типично, генетические локусы, описанные гаплотипом, являются физически и генетически связанными, т.е. находятся на одинаковом хромосомном сегменте.
“Гибридизация” или “гибридизация нуклеиновой кислоты” относится к спариванию комплементарных РНК и ДНК цепей, а также к спариванию комплементарных ДНК отдельных цепей. “Жесткость” относится к условиям в отношении температуры, ионной силы и присутствия определенных органических растворителей, таких как формамид, при которых проводят гибридизации нуклеиновых кислот. В условиях высокой жесткости (высокая температура и низкое содержание соли) два фрагмента нуклеиновой кислоты будут спариваться, или “гибридизоваться”, только если имеет место высокая частота последовательностей комплементарных оснований между ними.
Выражение “интрогрессия” относится к передаче желательной аллели генетического локуса с одного генетического фона на другой. Например, интрогрессия желательной аллели на специфическом локусе может быть передана по меньшей мере одному потомству через половое скрещивание между двумя родителями одного вида, когда по меньшей мере один из родителей имеет желательную аллель в своем геноме. Альтернативно, например, передача аллели может происходить путем рекомбинации между двумя донорскими геномами, например, в сшитом протопласте, где по меньшей мере один из донорских протопластов имеет желательную аллель в своем геноме. Желательная аллель может быть, например, выбранной аллелью маркера, QTL, трансгена или подобного. В любом случае, потомство, содержащее желательную аллель, может быть повторно обратно скрещено с линией, имеющей желательную генетическую основу и выбранной по желательной аллели, для получения аллели, которая становится закрепленной в выбранном генетическом фоне.
“Линия” или “штамм” представляет собой группу особей одинакового происхождения, которая является, главным образом, инбредной до некоторой степени и которая, главным образом, является гомозиготной и гомогенной на большинстве локусах (изогенная или почти изогенная). “Сублиния” относится к инбредному подклассу потомков, которые являются генетически отличными от других сходных инбредных подклассов, которые происходят от одного предка.
“Линия предков” представляет собой родительскую линию, используемую как источник генов, например, для развития элитных линий. “Популяция предков” - это группа предков, которые внесли массу генетического разнообразия, которое использовалось для развития элитных линий. “Потомки” - это потомство предков, и может быть отделено от их предков с помощью многих поколений выведения. Например, элитные линии представляют собой потомков их предков. “Генеалогическая структура” определяет взаимосвязь между потомком и каждым предком, который привел к возникновению этого потомка. Генеалогическая структура может охватывать одно или несколько поколений, описывая взаимоотношения между потомком и его родителями, прародителями, прапрародителями и т.д.
“Элитная линия” или “элитный штамм” представляет собой агрономически превосходную линию, которая была получена в результате многих циклов скрещивания и селекции по превосходной агрономической характеристике. Различные элитные линии являются доступными и известны специалистам в данной области выведения маиса. “Элитная популяция” представляет собой набор элитных особей или линий, которые могут быть использованы, чтобы отражать уровень техники в терминах агрономически превосходных генотипов данного культурного вида, такого как маис. Сходным образом, “элитная идиоплазма” или элитный штамм идиоплазмы представляют собой агрономически превосходную идиоплазму, типично полученную от и/или способную приводить к созданию растения с превосходной агрономической характеристикой, например, существующей или вновь созданной элитной линии маиса.
“Доступная IBM генетическая карта” относится к любой из следующих карт: IBM, IBM2, IBM2 ближайшие соседи, IBM2 FPC0507, IBM2 2004 ближайшие соседи, IBM2 2005 ближайшие соседи, или IBM2 2005 ближайшие соседи рамки. Все IBM генетические карты основаны на B73 × Mo17 популяции, в которой потомство от первичного скрещивания было спарено случайным образом для получения множества поколений до создания рекомбинантных инбредных линий для картирования. Новейшие версии отражают добавление генетических и BAC картированных локусов, а также усиленную детализацию карты благодаря включению информации, полученной из других генетических карт.
В отличие от этого, “экзотический штамм маиса” или “экзотическая идиоплазма маиса” представляет собой штамм или идиоплазму, полученную от маиса, который не принадлежит доступной элитной линии маиса или штамму идиоплазмы. В контексте скрещивания двух растений маиса или штаммов идиоплазмы, экзотическая идиоплазма не является близко связанной по происхождению с элитной идиоплазмой, с которой скрещивается. Наиболее часто экзотическая идиоплазма не происходит ни от одной известной элитной линии маиса, но чаще является отобранной для введения новых генетических элементов (типично новых аллелей) в программу выведения.
Как используется в данном документе, выражение “сцепление” используется для описания степени, с которой один маркерный локус “связан с” другим маркерным локусом или каким-то другим локусом (например, локусом устойчивости к пыльной головне). Взаимоотношение сцепления между молекулярным маркером и фенотипом принимают за “вероятность” или “отрегулированную вероятность”. Значение вероятности (также известное как p-значение) представляет собой статистическую вероятность того, что конкретная комбинация фенотипа и присутствия или отсутствия конкретной маркерной аллели является случайной. Таким образом, чем ниже показатель вероятности, тем выше вероятность того, что фенотип и конкретный маркер будут косегрегировать. В некоторых аспектах показатель вероятности рассматривается как “достоверный” или “недостоверный”. В некоторых вариантах осуществления показатель вероятности 0,05 (p=0,05, или 5% вероятность) случайной выборки рассматривается как достоверный признак косегрегации. Однако приемлемой вероятностью может быть любая вероятность менее чем 50% (p=0,5). Например, достоверная вероятность может быть менее чем 0,25, менее чем 0,20, менее чем 0,15, менее чем 0,1, менее чем 0,05, менее чем 0,01 или менее чем 0,001.
В интервальном картировании сцепление между двумя маркерными локусами может быть вычислено, используя соотношения шансов (т.е. соотношение сцепления к отсутствию сцепления). Это соотношение более традиционно выражается как логарифм соотношений и называется значение логарифма соотношения шансов (LOD) или LOD показатель (Risch, Science 255:803-804 (1992)). LOD значение 3 между двумя маркерами обозначает, что сцепление является в 1000 раз более вероятным, чем отсутствие сцепления. Более низкие LOD значения, такие как 2,0 или 2,5, можно использовать для определения большего уровня сцепления.
“Сцепленные локусы” расположены в непосредственной близости так, чтобы мейотическая рекомбинация между парами гомологичных хромосом не происходила с высокой частотой (частота равна или меньше чем 10%) между двумя локусами, например, сцепленные локусы косегрегируют по меньшей мере приблизительно 90% времени, например, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,75% или более времени. Маркерные локусы являются особенно полезными, когда они показывают достоверную вероятность косегрегации (сцепления) с желательным признаком (например, повышенной устойчивости к пыльной головне). Например, в некоторых аспектах, эти маркеры можно назвать “сцепленными QTL маркерами”.
Сцепление может быть выражено как желательный предел или диапазон. Например, в некоторых вариантах осуществления любой маркер сцеплен (генетически и физически) с любым другим маркером, когда маркеры разделены менее чем 50, 40, 30, 25, 20 или 15 единиц карты (или cM). Дополнительно сцепление может быть описано разделением в размере 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 единиц карты (или cM). В некоторых аспектах предпочтительным является установить заключенный в скобки диапазон сцепления, например, между 10 и 20 cM, между 10 и 30 cM или между 10 и 40 cM.
Чем более тесно маркер сцеплен со вторым локусом, тем лучшим индикатором для второго локуса становится этот маркер. Таким образом, “близко сцепленные локусы”, такие как маркерный локус и второй локус показывают внутрилокусную частоту рекомбинации 10% или менее, или приблизительно 9% или менее, или приблизительно 8% или менее, или приблизительно 7% или менее, или приблизительно 6% или менее, или приблизительно 5% или менее, или приблизительно 4% или менее, или приблизительно 3% или менее, и или приблизительно 2% или менее. В других вариантах осуществления соответствующие локусы показывают частоту рекомбинации приблизительно 1% или менее, например, приблизительно 0,75% или менее, или приблизительно 0,5% или менее, или приблизительно 0,25% или менее. Два локуса, которые расположены на одной хромосоме, и на таком расстоянии, что рекомбинация между двумя локусами происходит с частотой менее чем 10% (например, приблизительно 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,75%, 0,5%, 0,25% или менее), также называются “близкими” друг к другу. Так как один cM - это расстояние между двумя генетическими маркерами, которые показывают 1% частоту рекомбинации, то любой маркер является близко сцепленным (генетически и физически) с любым другим маркером, который находится в непосредственной близости, например, на расстоянии, равном или менее чем 10 cM. Два близко сцепленных маркера на одной хромосоме могут располагаться на расстоянии, равном 9, 8, 7, 6, 5, 4, 3, 2, 1, 0,75, 0,5, 0,25, 0,1, 0,075, 0,05, 0,025, или 0,01 cM или менее друг от друга.
Когда речь идет о взаимоотношении между двумя генетическими элементами, такими как генетический элемент, который вносит вклад в повышенную устойчивость к пыльной головне и близкий маркер, сцепление в фазе “коньюгации” обозначает состояние, где “благоприятная” аллель на локусе силы стебля физически связана на той же нити хромосомы, что и “благоприятная” аллель соответствующего сцепленного маркерного локуса. В фазе конъюгации обе благоприятные аллели наследуются вместе потомством, которое наследует эту нить хромосомы. При сцеплении в фазе “расхождения” “благоприятная” аллель на локусе, представляющем интерес, физически сцеплена с “неблагоприятной” аллелью на близком маркерном локусе, и две “благоприятные” аллели не наследуются вместе (т.е. два локуса находятся “не в фазе” друг с другом).
Выражение “неравновесное сцепление” относится к неслучайной сегрегации генетических локусов или признаков (или обоих). В любом случае неравновесное сцепление подразумевает, что соответствующие локусы находятся в достаточной физической близости по длине хромосомы, чтобы они сегрегировали вместе с частотой, большей, чем случайная (т.е. неслучайной) (в случае косегрегирующих признаков, локусы, которые лежат в основе признаков, находятся в достаточной близости друг от друга). Маркеры, которые показывают неравновесное сцепление, рассматриваются как сцепленные. Сцепленные локусы косегрегируют более чем 50% времени, например, от приблизительно 51% до приблизительно 100% времени. Другими словами, два маркера, которые косегрегируют, имеют частоту рекомбинации менее чем 50% (и по определению, отделены на менее чем 50 cM на той же группе сцепления.). Как используется в данном документе, сцепление может быть между двумя маркерами, или альтернативно между маркером и фенотипом. Маркерный локус может быть “связан с” (сцеплен с) признаком, например, устойчивостью к пыльной головне. Степень сцепления молекулярного маркера с фенотипическим признаком измеряется, например, как статистическая вероятность косегрегации этого молекулярного маркера с фенотипом.
Неравновесное сцепление чаще всего оценивается с использованием критерия r2, который вычисляют, используя формулу, описанную Hill, W.G. and Robertson, A, Theor. Appl. Genet. 38:226-231(1968). Когда r2=1, полный LD существует между двумя маркерными локусами, означая, что маркеры не были разделены рекомбинацией и имеют одинаковую частоту аллели. Значения для r2 выше 1/3 определяют существенно сильный LD, пригодный для картирования (Ardlie et al., Nature Reviews Genetics 3:299-309 (2002)). Следовательно, аллели находятся в неравновесном сцеплении, когда r2 значения между парными маркерными локусами больше или равны 0,33, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9 или 1,0.
Как используется в данном документе, “равновесное сцепление” описывает ситуацию, где два маркера независимо сегрегируют, т.е. разделяются в потомстве случайным образом. Маркеры, которые показывают равновесное сцепление, рассматриваются как несцепленные (вне зависимости от того, лежат ли они на одной хромосоме).
“Локус” представляет собой хромосомную область, где расположен ген или маркер. Например, “генный локус” - это специфическое положение на хромосоме в геноме вида, где может быть найден специфический ген.
“Маис” и “кукуруза” используются здесь взаимозаменяемо.
Выражения “маркер”, “молекулярный маркер”, “маркерная нуклеиновая кислота” и “маркерный локус” относятся к нуклеотидной последовательности или ее кодируемому продукту (например, белку), которые используют как точку отсчета, когда определяют сцепленный локус. Маркер может быть получен от геномной нуклеотидной последовательности или от экспрессированных нуклеотидных последовательностей (например, от сплайсированной РНК или кДНК), или от кодируемого полипептида. Выражение также относится к последовательностям нуклеиновой кислоты, комплементарным или фланкирующим маркерные последовательности, таким как нуклеиновые кислоты, используемые в качестве зондов или пары праймеров, способные к амплификации маркерной последовательности.
“Маркерный зонд” - это последовательность нуклеиновой кислоты или молекула, которую можно использовать для определения присутствия маркерного локуса, например, зонд нуклеиновой кислоты, который является комплементарным последовательности маркерного локуса, посредством гибридизации нуклеиновой кислоты. Маркерные зонды, содержащие 30 или более смежных нуклеотидов маркерного локуса (“вся или часть” последовательности маркерного локуса), могут быть использованы для гибридизации нуклеиновой кислоты. Альтернативно, в некоторых аспектах, маркерный зонд относится к зонду любого типа, который способен различать (т.е. генотип) конкретный аллель, который присутствует на маркерном локусе. Нуклеиновые кислоты являются “комплементарными”, когда они, в частности, “гибридизуются”, или спариваются, в растворе, например, согласно правилам спаривания оснований Уотсона-Крика.
Маркеры с обозначением PHM представляют набор праймеров, которые амплифицируют специфические кусочки ДНК, здесь обозначенные как “ампликон”. Сравниваются нуклеотидные последовательности ампликонов из множественных линий маиса, и определяются полиморфизмы, или вариации. Полиморфизмы включают отдельные нуклеотидные полиморфизмы (SNP), простые повторы последовательности (SSR), вставка/делеции (вставки-делеции) и т.п.
“Маркерная аллель”, альтернативно “аллель маркерного локуса”, может относиться к одной из нескольких полиморфных нуклеотидных последовательностей, обнаруженных на маркерном локусе в популяции, которая является полиморфной по маркерному локусу. Альтернативно, маркерные аллели, обозначенные числом, представляют специфическую комбинацию аллелей, также имеющую название “гаплотип”, на информативных полиморфных сайтах этого специфического маркерного локуса. В некоторых аспектах обеспечиваются маркерные локусы, коррелирующие с устойчивостью к пыльной головне у маиса.
“Маркерный локус” - это локус, который можно использовать для отслеживания присутствия второго сцепленного локуса, например, сцепленного локуса, который кодирует или вносит вклад в выражение фенотипического признака. Например, маркерный локус можно использовать для контроля сегрегации аллелей на локусе, таком как QTL, которые генетически или физически сцеплены с маркерным локусом.
“Генетические маркеры” - это нуклеиновые кислоты, которые являются полиморфными в популяции, и маркерные аллели могут определяться и выделяться с помощью одного или более аналитических способов, например, RFLP, AFLP, изозим, SNP, SSR и подобные. Выражение также относится к последовательностям нуклеиновой кислоты, комплементарными геномным последовательностям, таким как нуклеиновые кислоты, используемые как зонды.
Маркеры, соответствующие генетическим полиморфизмам между членами популяции, можно определить способами, общепринятыми в данном уровне техники. Они включают, например, ДНК секвенирование, способы специфической для последовательностей амплификации на основании ПЦР, определения полиморфизмов длины рестрикционных фрагментов (RFLP), определение изозимных маркеров, определение полинуклеотидных полиморфизмов с помощью аллель-специфической гибридизации (ASH), определение амплифицированных вариабельных последовательностей растительного генома, определение самоподдерживающейся репликации последовательностей, определение простых повторов последовательностей (SSR), определение однонуклеотидных полиморфизмов (SNP) или определение полиморфизмов длины амплифицированных фрагментов (AFLP). Общепринятые способы также известны для определения маркерных экспрессирующихся последовательностей (EST) и SSR маркеров, полученных от EST последовательностей, и случайным образом амплифицированной полиморфной ДНК (RAPD).
“Устойчивость к пыльной головне” относится к способности растения маиса противостоять инфекции хозяин-специфического гриба Sphacelotheca reiliana (Kühn)Clint. Она включает, но не ограничивается следующим: сниженное образование сорусов, улучшенная жизненность растения, улучшенная функция метелки и улучшенный урожай кукурузы по сравнению с растениями маиса, которые не имеют локус устойчивости, описанный в данном документе.
Нуклеиновые кислоты и полипептиды вариантов осуществления находят применение в способах обеспечения или усиления грибковой устойчивости растения. Источник устойчивости может быть встречающимся в природе генетическим локусом устойчивости, который интрогрессируют посредством выведения в чувствительную популяцию маиса, которая не имеет локус устойчивости, или альтернативно, гены, придающие устойчивость, могут быть эктопически экспрессированы как трансгены, которые придают устойчивость, когда экспрессированы в чувствительной популяции. Соответственно, композиции и способы, раскрытые здесь, пригодны для защиты растений от грибковых патогенов. “Патогенная устойчивость”, “грибковая устойчивость” и “устойчивость к болезни” обозначают, что растение избегает симптомов болезни, которые являются результатом взаимодействий растение-патоген. То есть, патогены испытывают препятствие в том, чтобы вызывать болезни растений и связанные с болезнью симптомы, или, альтернативно, симптомы болезни, вызванные патогеном, минимизированы или уменьшены, такие как, например, снижение стресса и связанной потери урожая. Специалисту в данной области понятно, что композиции и способы, раскрытые здесь, могут использоваться с другими композициями и способами, доступными на данном уровне техники для защиты растений от нападения патогенов.
Следовательно, способы вариантов осуществления могут использоваться для защиты растений от болезни, особенно тех болезней, которые вызываются грибковыми патогенами растений. Как используется в данном документе, “грибковая устойчивость” относится к усиленной устойчивости или устойчивости к грибковому патогену по сравнению с таковой у растения дикого типа. Эффекты могут варьировать от небольшого увеличения в устойчивости к действиям грибкового патогена (например, частичное ингибирование) до полной устойчивости, так что растение не поддается воздействию в присутствии грибкового патогена. Повышенный уровень устойчивости против конкретного грибкового патогена или против более широкого спектра грибковых патогенов составляет “усиленную” или улучшенную грибковую устойчивость. Варианты осуществления данного изобретения также будут усиливать или улучшать устойчивость растения к грибковому патогену, так что устойчивость растения к грибковому патогену или патогенам будет повышаться. Выражение “усиливать” относится к следующему: улучшать, увеличивать, расширять, умножать, повышать, поднимать и подобному. В данном описании растения данного изобретения описываются как устойчивые к инфекции Sphacelotheca reiliana (Kühn)Clint или имеющие 'усиленную устойчивость' к инфекции Sphacelotheca reiliana (Kühn)Clint как результат локуса устойчивости к пыльной головне данного изобретения. Соответственно, они типично проявляют повышенную устойчивость к болезни по сравнению с эквивалентными растениями, которые являются чувствительными к инфекции Sphacelotheca reiliana (Kühn)Clint, так как у них отсутствует локус устойчивости к пыльной головне.
В конкретных аспектах способы для обеспечения или усиления грибковой устойчивости в растении включают встраивание в растение по меньшей мере одной кассеты экспрессии, где кассета экспрессии содержит нуклеотидную последовательность, кодирующую противогрибковый полипептид вариантов осуществления, функционально связанный с промотором, который направляет экспрессию в растении. Растение экспрессирует полипептид, таким образом придавая грибковую устойчивость всему растению или улучшая врожденный уровень устойчивости растения. В конкретных вариантах осуществления ген придает устойчивость к грибковому патогену, Sphacelotheca reiliana (Kühn)Clint.
Экспрессия противогрибкового полипептида вариантов осуществления может быть нацелена на специфические ткани растения, где устойчивость к патогену особенно важна, такие как, например, листья, корни, стебли или сосудистые ткани. Такая тканеспецифическая экспрессия может осуществляться предпочтительными для корня, предпочтительными для листа, предпочтительными для сосудистой ткани, предпочтительными для стебля или предпочтительными для семени промоторами.
“Нуклеотидная последовательность”, “полинуклеотид”, “последовательность нуклеиновой кислоты”, и “фрагмент нуклеиновой кислоты” используются взаимозаменяемо и относятся к полимеру РНК или ДНК, который является одно- или двухнитевым, необязательно содержащему синтетические, неприродные или измененные нуклеотидные основания. “Нуклеотид” - это мономерная единица, из которой построены ДНК или РНК полимеры, и содержит пуриновое или пиримидиновое основание, пентозу и группу фосфорной кислоты. Нуклеотиды (обычно находящиеся в их форме 5'-монофосфата) называются их однобуквенным обозначением следующим образом: “A” для аденилат или дезоксиаденилат (для РНК или ДНК, соответственно), “C” для цитидилата или дезоксицитидилата, “G” для гуанилата или дезоксигуанилата, “U” для уридилата, “T” для дезокситимидилата, “R” для пуринов (A или G), “Y” для пиримидинов (C или T), “K” для G или T, “H” для A или C, или T, “I” для инозина и “N” для любого нуклеотида.
Выражения “полипептид”, “пептид” и “белок” используются взаимозаменяемо здесь для обозначения полимера из аминокислотных остатков. Выражения относятся к аминокислотным полимерам, в которых один или более аминокислотных остатков представляют собой искусственный химический аналог, соответствующий встречающейся в природе аминокислоте, а также встречающихся в природе аминокислотных полимеров. Полипептиды вариантов осуществления могут быть получены либо из нуклеиновой кислоты, раскрытой в настоящем описании, либо применением стандартных методик молекулярной биологии. Например, укороченный белок вариантов осуществления может быть получен экспрессией рекомбинантной нуклеиновой кислоты вариантов осуществления в приемлемой клетке-хозяине, или альтернативно путем комбинации ex vivo процедур, таких как обработка протеазой и очищение.
Как используется в данном документе, выражения “кодирующий” или “кодируемый”, при использовании в контексте специфической нуклеиновой кислоты, означают, что нуклеиновая кислота содержит необходимую информацию для прямой трансляции нуклеотидной последовательности в специфический белок. Информация, которой кодируется белок, определяется применением кодонов. Нуклеиновая кислота, кодирующая белок, может содержать нетранслируемые последовательности (например, интроны) внутри транслируемых областей нуклеиновой кислоты или может не содержать такие промежуточные нетранслируемые последовательности (например, как в кДНК).
Варианты осуществления данного изобретения включают изолированные или, по сути, очищенные полинуклеотидные или белковые композиции. "Изолированный" или "очищенный" полинуклеотид или белок, или их биологически активная часть, является по сути или существенно свободной от компонентов, которые в норме сопровождают или взаимосвязаны с полинуклеотидом или белком, что обнаруживается в их встречающемся в природе окружении. Таким образом, изолированный или очищенный полинуклеотид или белок является, по сути, свободным от другого клеточного материала, или культуральной среды, когда его получают рекомбинантными техниками (например, ПЦР амплификацией), или по сути свободным от химических предшественников или других химических соединений, когда его синтезируют химическим путем. Оптимально, "изолированный" полинуклеотид является свободным от последовательностей (например, последовательностей, кодирующих белок), которые в естественных условиях ограничивают полинуклеотид (т.е. последовательности, расположенные на 5'- и 3'-концах полинуклеотида) в геномной ДНК организма, из которого происходит полинуклеотид. Например, в различных вариантах осуществления изолированный полинуклеотид может содержать менее чем приблизительно 5 т.п.н., приблизительно 4 т.п.н., приблизительно 3 т.п.н., приблизительно 2 т.п.н., приблизительно 1 т.п.н., приблизительно 0,5 т.п.н., или приблизительно 0,1 т.п.н. нуклеотидной последовательности, которая в естественных условиях ограничивает полинуклеотид в геномной ДНК клетки, из которой происходит полинуклеотид. Белок, который является, по сути, свободным от клеточного материала, включает композиции белка, имеющие менее чем приблизительно 30%, приблизительно 20%, приблизительно 10%, приблизительно 5%, или приблизительно 1% (на сухой вес) загрязняющего белка. Когда белок вариантов осуществления или его биологически активную часть получают рекомбинантно, то оптимально культуральная среда присутствует менее чем приблизительно 30%, приблизительно 20%, приблизительно 10%, приблизительно 5%, или приблизительно 1% (на сухой вес) химических предшественников или химических соединений, которые не являются белком, представляющим интерес.
Фрагменты и варианты раскрытых нуклеотидных последовательностей и белков, кодируемых таким образом, также включены в варианты осуществления. Под “фрагментом” подразумевается часть нуклеотидной последовательности или часть аминокислотной последовательности и, следовательно, белок, кодируемый таким образом. Фрагменты нуклеотидной последовательности могут кодировать белковые фрагменты, которые сохраняют биологическую активность нативного белка и, следовательно, имеют способность придавать грибковую устойчивость растению. Альтернативно, фрагменты нуклеотидной последовательности, которые являются пригодными в качестве зондов гибридизации, необязательно кодируют фрагментные белки, сохраняющие биологическую активность. Таким образом, фрагменты нуклеотидной последовательности, могут находиться в диапазоне от по меньшей мере приблизительно 15 нуклеотидов, приблизительно 50 нуклеотидов, приблизительно 100 нуклеотидов, и до полноразмерной нуклеотидной последовательности, кодирующей полипептиды вариантов осуществления.
Фрагмент нуклеотидной последовательности, который кодирует биологически активную часть полипептида вариантов осуществления, будет кодировать по меньшей мере приблизительно 15, приблизительно 25, приблизительно 30, приблизительно 40, или приблизительно 50 смежных аминокислот, или до полного числа аминокислот, присутствующих в полноразмерном полипептиде вариантов осуществления. Фрагментам нуклеотидной последовательности, которые пригодны в качестве зондов гибридизации или ПЦР праймеров, в целом, не нужно кодировать биологически активную часть белка.
Как используется в данном документе, “полноразмерная последовательность”, в отношении определенного полинуклеотида, означает присутствие целой последовательности нуклеиновой кислоты нативной последовательности. “Нативная последовательность” означает эндогенную последовательность, т.е. несконструированную последовательность, обнаруженную в геноме организма.
Таким образом, фрагмент нуклеотидной последовательности вариантов осуществления может кодировать биологически активную часть полипептида, или он может быть фрагментом, который может использоваться как зонд гибридизации или ПЦР праймер, используя способы, раскрытые ниже. Биологически активная часть антипатогенного полипептида может быть получена путем выделения части одной из нуклеотидных последовательностей вариантов осуществления, экспрессии кодируемой части белка и оценки способности кодируемой части белка придавать или усиливать грибковую устойчивость у растения. Молекулы нуклеиновой кислоты, которые являются фрагментами нуклеотидной последовательности вариантов осуществления, содержат по меньшей мере приблизительно 15, приблизительно 20, приблизительно 50, приблизительно 75, приблизительно 100 или приблизительно 150 нуклеотидов, или до числа нуклеотидов, присутствующих в полноразмерной нуклеотидной последовательности, раскрытой в настоящем описании.
Подразумевается, что "варианты" означают, по сути, сходные последовательности. Для полинуклеотидов, вариант содержит делецию и/или вставку одного или более нуклеотидов на одном или более внутренних сайтах внутри нативного полинуклеотида и/или замену одного или более нуклеотидов на одном или более сайтах в нативном полинуклеотиде. Как используется в данном документе, "нативный" полинуклеотид или полипептид содержит встречающуюся в природе нуклеотидную последовательность или аминокислотную последовательность, соответственно. Специалисту в данной области понятно, что варианты нуклеиновых кислот вариантов осуществления можно будет сконструировать так, чтобы сохранялась открытая рамка считывания. Для полинунуклеотидов консервативные варианты включают те последовательности, которые, из-за вырожденности генетического кода, кодируют аминокислотную последовательность одного из полипептидов вариантов осуществления. Встречающиеся в природе аллельные варианты, такие как эти, можно определить с применением общеизвестных методик молекулярной биологии, как например методиками полимеразной цепной реакции (ПЦР) и гибридизации, как изложено ниже. Полинуклеотидные варианты также включают синтетически полученные полинуклеотиды, такие как те, что получены, например, путем использования сайт-направленного мутагенеза, но которые все еще кодируют белок вариантов осуществления. В общем, варианты конкретного полинуклеотида вариантов осуществления будут иметь по меньшей мере приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или более идентичности последовательности к этому конкретному полинуклеотиду, как определяется программами выравнивания последовательностей и параметрами, описанными в данном описании.
Варианты конкретного полинуклеотида вариантов осуществления (т.е. эталонный полинуклеотид) могут также оцениваться путем сравнения процентной идентичности последовательностей между полипептидом, кодируемым вариантным полинуклеотидом, и полипептидом, кодируемым эталонным полинуклеотидом. Таким образом, например, раскрываются изолированные полинуклеотиды, которые кодируют полипептид с данной процентной идентичностью последовательностей с полипептидом SEQ ID NO: 3. Процентная идентичность последовательностей между любыми двумя полипептидами может быть вычислена с использованием программ и параметров выравнивания последовательностей, описанных в настоящем документе. В случае, когда любая данная пара полинуклеотидов вариантов осуществления оценивается путем сравнения процентной идентичности последовательностей, которую имеют два полипептида, которые они кодируют, процентная идентичность последовательностей между двумя кодируемыми полипептидами составляет по меньшей мере приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или более идентичности последовательности.
"Вариантный" белок обозначает белок, полученный от нативного белка путем делеции или вставки одной или нескольких аминокислот на одном или нескольких внутренних сайтах в нативном белке и/или замены одной или нескольких аминокислот на одном или нескольких сайтах в нативном белке. Вариантные белки, включенные в варианты осуществления, являются биологически активными, то есть они продолжают обладать желательной биологической активностью нативного белка, то есть, способностью придавать или усиливать устойчивость растения к грибковому патогену, как описано в данном документе. Такие варианты могут быть результатом, например, генетического полиморфизма в результате манипуляций, проведенных человеком. Биологически активные варианты нативного белка вариантов осуществления будут иметь по меньшей мере приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или более идентичность последовательностей с аминокислотной последовательностью для нативного белка, как определяется с помощью программ и параметров выравнивания последовательностей, описанных в настоящем документе. Биологически активный вариант белка вариантов осуществления может отличаться от такого белка на минимальное количество в приблизительно 1-15 аминокислотных остатков, на минимальное количество в приблизительно 1-10, такое как приблизительно 6-10, на минимальное количество в приблизительно 5, на минимальное количество в 4, 3, 2, или даже 1 аминокислотный остаток.
Белки вариантов осуществления можно изменить различными путями, включая аминокислотные замены, делеции, усечения и вставки. Способы для таких манипуляций являются общеизвестными в данном уровне техники. Например, варианты и фрагменты аминокислотной последовательности антипатогеннных белков можно получить путем мутаций в ДНК. Способы мутагенеза и полинуклеотидных изменений являются общеизвестными в данном уровне техники. См., например, Kunkel (1985) Proc. Natl. Acad. Sci. USA 82:488-492; Kunkel et al. (1987) Methods in Enzymol. 154:367-382; Патент США № 4873192; Walker and Gaastra, eds. (1983) Techniques in Molecular Biology (MacMillan Publishing Company, Нью-Йорк) и ссылки, цитируемые там. Руководство относительно приемлемых аминокислотных замен, которые не действуют на биологическую активность белка, представляющего интерес, можно найти в модели Dayhoff et al. (1978) Atlas of Protein Sequence and Structure (Natl. Biomed. Res. Found., Washington, D.C.), включенной в данное описание путем ссылки. Консервативные замены, такие как замещение одной аминокислоты на другую, имеющую подобные свойства, могут быть оптимальными.
Таким образом, гены и полинуклеотиды вариантов осуществления включают как встречающиеся в природе последовательности, так и мутантные формы. Подобным образом, белки вариантов осуществления включают как встречающиеся в природе белки, так и их вариации и модифицированные формы. Такие варианты будут продолжать обладать желательной способностью придавать или усиливать устойчивость растения к грибковому патогену. Очевидно, что мутации, которые будут сделаны в ДНК, кодирующей вариант, не должны перемещать последовательность из рамки считывания и оптимально не создавать комплементарные области, которые могут производить вторичную мРНК структуру. См. европейский патент № 0075444.
Не предполагается, что эти делеции, вставки и замены белковых последовательностей, включенные в данное описание, производят радикальные изменения в характеристиках белка. Однако, когда трудно предсказать точный эффект замены, делеции или вставки прежде чем сделать это, специалисту в данной области понятно, что эффект может быть оценен путем скрининга трансгенных растений, которые были трансформированы с вариантным белком, чтобы установить эффект на способность растения противостоять грибковой патогенной атаке.
Вариантные полинуклеотиды и белки также включают последовательности и белки, полученные от мутагенных или рекомбиногенных процедур, включая и не ограничиваясь процедурами, такими как перестановка в ДНК. Специалист в данной области может предусмотреть модификации, которые будут изменять диапазон патогенов, на которые отвечает белок. Благодаря такой процедуре одна или несколько различных последовательностей, кодирующих белок, могут использоваться для создания нового белка, обладающего желательными свойствами. Таким способом, библиотеки рекомбинантных полинуклеотидов создаются из популяции полинуклеотидов со связанной последовательностью, содержащих области последовательностей, которые имеют существенную идентичность последовательностей и могут быть гомологично рекомбинированы in vitro или invivo. Например, используя этот подход, мотивы последовательности, кодирующие домен, представляющий интерес, могут подвергнуться перестановке между геном белка вариантов осуществления и другими известными генами белка для получения нового гена, кодирующего белок с улучшенным свойством, представляющим интерес, таким как увеличенная способность придавать или усиливать устойчивость растения к грибковому патогену. Стратегии для такой перестановки в ДНК известны в данном уровне техники. См., например, Stemmer (1994) Proc. Natl. Acad. Sci. USA 91:10747-10751; Stemmer (1994) Nature 370:389-391; Crameri et al. (1997) Nature Biotech. 15:436-438; Moore et al. (1997) J. Mol. Biol. 272:336-347; Zhang et al.(1997) Proc. Natl. Acad. Sci. USA 94:4504-4509; Crameri et al. (1998) Nature 391:288-291; и патенты США № 5605793 и 5837458.
Полинуклеотиды вариантов осуществления могут использоваться для выделения соответствующих последовательностей из других организмов, конкретно других растений. Таким способом, способы, такие как ПЦР, гибридизация и подобные, можно использовать для определения таких последовательностей, основываясь на их гомологии последовательности с последовательностями, приведенными в данном описании. Последовательности, изолированные на основании идентичности последовательностей с целыми последовательностями, приведенными здесь, или их вариантами и фрагментами, включены в варианты осуществления. Такие последовательности включают последовательности, которые являются ортологами раскрытых последовательностей. "Ортологи" означают гены, полученные от общего гена-предков, и которые обнаруживаются в другом виде как результат видообразования. Гены, обнаруженные в другом виде, рассматриваются как ортологи, когда их нуклеотидные последовательности и/или их кодируемые белковые последовательности разделяют по меньшей мере приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или больше идентичности последовательностей. Функции ортологов часто являются высоко консервативными внутри вида. Таким образом, изолированные полинуклеотиды, которые кодируют белок, который придает или усиливает грибковую устойчивость растения к патогену и которые гибридизируются при жестких условиях с последовательностями, раскрытыми здесь, или с их вариантами или фрагментами, включены в варианты осуществления.
В подходе ПЦР олигонуклеотидные праймеры могут быть разработаны для применения в ПЦР реакциях для амлификации соответствующих ДНК последовательностей из кДНК или геномной ДНК, экстрагируемой из любого организма, представляющего интерес. Способы для конструирования ПЦР праймеров и ПЦР клонирования являются общедоступными в данном уровне техники и описаны в Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Plainview, Нью-Йорк). См. также Innis et al., eds. (1990) PCR Protocols: A Guide to Methods and Applications (Academic Press, Нью-Йорк); Innis and Gelfand, eds. (1995) PCR Strategies (Academic Press, Нью-Йорк); и Innis and Gelfand, eds. (1999) PCR Methods Manual (Academic Press, Нью-Йорк). Известные способы ПЦР включают и не ограничиваются способами, использующими спаренные праймеры, вложенные праймеры, отдельные специфические праймеры, вырожденные праймеры, ген-специфические праймеры, вектор-специфические праймеры, частично несовпадающие праймеры и подобные.
В методиках гибридизации весь или часть известного полинуклеотида используется как зонд, который селективно гибридизируется с другими соответствующими полинуклеотидами, присутствующими в популяции клонированных фрагментов геномной ДНК или кДНК фрагментов (т.е. геномной или кДНК библиотек) из выбранного организма. Зонды гибридизации могут быть фрагментами геномной ДНК, кДНК фрагментами, РНК фрагментами или другими олигонуклеотидами, и могут быть помечены обнаруживаемой группой, такой как32P, или любым другим обнаруживаемым маркером. Таким образом, например, зонды для гибридизации могут быть созданы путем мечения синтетических олигонуклеотидов, основанных на полинуклеотидах вариантов осуществления. Способы для получения зондов для гибридизации и для конструирования кДНК и геномных библиотек являются общеизвестными в данном уровне техники и раскрыты в Sambrook et al. (1989) выше.
Например, целый полинуклеотид, раскрытый здесь, или одна или несколько его частей, могут быть использованы в качестве зонда, способного, в частности, гибридизироваться с соответствующими полинуклеотидами и информационными РНК. Для достижения специфической гибридизации при разнообразных условиях такие зонды включают последовательности, которые являются уникальными и имеют оптимально по меньшей мере приблизительно 10 нуклеотидов в длину по меньшей мере приблизительно 15 нуклеотидов в длину или по меньшей мере приблизительно 20 нуклеотидов в длину. Такие зонды могут использоваться для амплификации соответствующих полинуклеотидов из выбранного организма с помощью ПЦР. Эта методика может использоваться для выделения дополнительных кодирующих последовательностей из желательного организма или в качестве диагностического анализа для определения присутствия кодирующих последовательностей в организме. Методики гибридизации включают гибридизационный скрининг ДНК библиотек, высеянных на планшеты (либо стерильные пятна, либо колонии; см., например, Sambrook et al. (1989) выше.
Гибридизация таких последовательностей может быть проведена при жестких условиях. Под "жесткими условиями" или "жесткими условиями гибридизации" подразумевают условия, при которых зонд будет гибридизироваться с последовательностью-мишенью с определяемо большей степенью, чем другие последовательности (например по меньшей мере в 2 раза больше, чем фон). Жесткие условия зависят от последовательности и будут различаться при различных обстоятельствах. Путем контролирования жесткости гибридизации и/или условий отмывки, последовательности-мишени, которые являются 100% комплементарными зонду, могут быть определены (гомологичное зондирование). Альтернативно, жесткие условия могут регулироваться так, чтобы допускать некоторое несовпадение в последовательностях, так чтобы определялись более низкие степени сходства (гетерологичное зондирование). В целом, зонд имеет менее чем приблизительно 1000 нуклеотидов в длину, оптимально менее чем 500 нуклеотидов в длину.
Типично, жесткие условия будут такими, при которых концентрация соли составляет менее чем приблизительно 1,5 M по концентрации ионов Na, типично приблизительно 0,01-1,0 M по концентрации ионов Na (или других солей) при pH 7,0-8,3 и температура составляет по меньшей мере приблизительно 30°C для коротких зондов (например, 10-50 нуклеотидов) и по меньшей мере приблизительно 60°C для длинных зондов (например, больше чем 50 нуклеотидов). Жесткие условия могут также быть достигнуты с добавлением дестабилизирующих агентов, таких как формамид. Примеры условий пониженной жесткости включают гибридизацию с буферным раствором 30-35% формамида, 1 M NaCl, 1% SDS (додецил сульфат натрия) при 37°C, и отмывку в 1X-2X SSC (20X SSC = 3,0 M NaCl/0,3 M тринатрия цитрат) при 50-55°C. Примеры условий умеренной жесткости включают гибридизацию в 40-45% формамида, 1,0 M NaCl, 1% SDS при 37°C, и отмывку в 0,5X-1X SSC при 55-60°C. Примеры условий высокой жесткости включают гибридизацию в 50% формамиде, 1 M NaCl, 1% SDS при 37°C, и конечную отмывку в 0,1X SSC при 60-65°C в течение по меньшей мере 30 минут. Необязательно, отмывочные буферы могут содержать от приблизительно 0,1% до приблизительно 1% SDS. Продолжительность гибридизации, в целом, составляет менее чем приблизительно 24 часов, обычно приблизительно 4 - приблизительно 12 часов. Продолжительность времени отмывки будет по меньшей мере отрезком времени, достаточным для достижения равновесия.
Специфичность типично является функцией постгибридизационных отмывок, причем решающими факторами являются ионная сила и температура конечного отмывочного раствора. Для ДНК-ДНК гибридов термическая точка плавления (Tm) может быть выведена из уравнения Meinkoth и Wahl (1984) Anal. Biochem. 138:267-284: Tm = 81,5°C + 16,6 (log M) + 0,41 (%GC) - 0,61 (% form) - 500/L; где M - это молярность одновалентных катионов, %GC - это процентное соотношение гуанозиновых и цитозиновых нуклеотидов в ДНК, % form - это процентное соотношение формамида в растворе гибридизации, и L - это длина гибрида в парах оснований. Tm - это температура (при определенной ионной силе и pH), при которой 50% комплементарной последовательности-мишени гибридизируется с точно совпадающим зондом. Tm снижается на приблизительно 1°C для каждого 1% несоответствия; таким образом, Tm, гибридизация, и/или условия отмывки могут быть отрегулированы для того, чтобы гибридизироваться с последовательностями желательной идентичности. Например, если последовательности с ≥90% идентичности являются искомыми, то Tm может быть понижена на 10°C. В общем, жесткие условия выбирают так, чтобы они были на приблизительно 5°C ниже, чем Tm для специфической последовательности и комплементарной ей при определенной ионной силе и pH. Однако особенно жесткие условия могут использовать гибридизацию и/или отмывку при 1, 2, 3 или 4°C ниже, чем Tm; умеренно жесткие условия могут использовать гибридизацию и/или отмывку при 6, 7, 8, 9 или 10°C ниже, чем Tm; условия пониженной жесткости могут использовать гибридизацию и/или отмывку при 11, 12, 13, 14, 15 или 20°C ниже, чем Tm. Используя уравнение, составы для гибридизации и отмывки и желательную Tm, специалистам в данной области техники понятно, что вариации в жесткости гибридизации и/или растворах отмывки по существу являются описанными. Если желательная степень несовпадения является результатом Tm менее чем 45°C (водный раствор) или 32°C (раствор формамида), то оптимальным является повысить SSC концентрацию, чтобы можно было использовать более высокую температуру. Широкое руководство по гибридизации нуклеиновых кислот можно найти в Tijssen (1993) Laboratory Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Acid Probes, Part I, Chapter 2 (Elsevier, New York); и Ausubel et al., eds. (1995) Current Protocols in Molecular Biology, Chapter 2 (Greene Publishing and Wiley-Interscience, New York). См. Sambrook et al. (1989) выше.
Различные процедуры могут быть использованы для проверки присутствия или отсутствия конкретной последовательности ДНК, РНК или белка. Они включают, например, саузерн-блоттинги, нозерн-блоттинги, вестерн-блоттинги и ELISA анализ. Методики, такие как приведенные, являются хорошо известными специалистам в данной области техники, и существует множество ссылок, которые обеспечивают детальные протоколы. Такие ссылки включают Sambrook et al. (1989) выше, и Crowther, J.R. (2001), The ELISA Guidebook, Humana Press, Totowa, NJ, США.
Следующие выражения применяются для описания взаимоотношений последовательностей между двумя или более полинуклеотидами или полипептидами: (a) "эталонная последовательность," (b) "окно сравнения," (c) "идентичность последовательности" и (d) "процентное соотношение идентичности последовательности."
(a) Как используется в данном документе, "эталонная последовательность" обозначает последовательность, используемую как основа для сравнения последовательностей. Эталонная последовательность может быть подклассом или целостностью определенной последовательности; например, как сегмент полноразмерной кДНК или генной последовательности, или полная кДНК или генная последовательность.
(b) Как используется в данном документе, "окно сравнения" ссылается на смежный и точно определенный сегмент полинуклеотидной последовательности, где полинуклеотидная последовательность в окне сравнения может содержать вставки или делеции (т.е. гэпы) по сравнению с эталонной последовательностью (которая не содержит вставок или делеций) для оптимального выравнивания двух полинуклеотидов. В общем, окно сравнения составляет по меньшей мере приблизительно 20 смежных нуклеотидов в длину и необязательно может быть приблизительно 30, приблизительно 40, приблизительно 50, приблизительно 100 или длиннее. Специалисты в данной области понимают, что для того, чтобы избежать высокой степени сходства с эталонной последовательностью из-за включения гэпов в полинуклеотидную последовательность, типично вводится штраф за гэп, и он вычитается из количества совпадений.
Способы выравнивания последовательностей для сравнения являются хорошо известными в данном уровне техники. Таким образом, определение процентной идентичности последовательностей между любыми двумя последовательностями можно провести, используя математический алгоритм. Неограничивающие примеры таких математических алгоритмов представляют собой алгоритм Myers и Miller (1988) CABIOS 4:11-17; алгоритм локального выравнивания Smith et al. (1981) Adv. Appl. Math. 2:482; алгоритм глобального выравнивания Needleman и Wunsch (1970) J. Mol. Biol. 48:443-453; способ поиска на локальное выравнивание Pearson и Lipman (1988) Proc. Natl. Acad. Sci. 85:2444-2448; алгоритм Karlin и Altschul (1990) Proc. Natl. Acad. Sci. USA 872264, модифицированный согласно Karlin и Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877.
Компьютерная реализация этих математических алгоритмов может быть использована для сравнения последовательностей для определения идентичности последовательностей. Такие реализации включают и не ограничиваются следующим: CLUSTAL в PC/Gene программе (доступна от Intelligenetics, Mountain View, Калифорния); программа ALIGN (Версия 2,0) и GAP, BESTFIT, BLAST, FASTA и TFASTA в GCG Wisconsin Genetics Software Package, Версия 10 (доступны от Accelrys Inc., 9685 Scranton Road, San Diego, California, USA). Выравнивания, используя эти программы, могут быть проведены с использованием параметров по умолчанию. Программа CLUSTAL хорошо описана Higgins et al. (1988) Gene 73:237-244 (1988); Higgins et al. (1989) CABIOS 5:151-153; Corpet et al. (1988) Nucleic Acids Res. 16:10881-90; Huang et al. (1992) CABIOS 8:155-65; и Pearson et al. (1994) Meth. Mol. Biol. 24:307-331. Программа ALIGN основывается на алгоритме Myers и Miller (1988) выше. PAM120 таблица весов остатков, штраф за продление гэпа 12 и штраф за открытие гэпа 4 могут использоваться с программой ALIGN, когда сравниваются аминокислотные последовательности. Программы BLAST Altschul et al. (1990) J. Mol. Biol. 215:403 основываются на алгоритме Karlin и Altschul (1990) выше. BLAST поиски нуклеотидов могут быть проведены BLASTN программой, суммарная оценка = 100, длина слова = 12, для получения нуклеотидных последовательностей, гомологичных нуклеотидной последовательности, кодирующей белок вариантов осуществления. BLAST поиски белка могут быть проведены BLASTX программой, суммарная оценка = 50, длина слова = 3, для получения аминокислотных последовательностей, гомологичных белку или полипептиду вариантов осуществления. Для получения выравниваний, содержащих гэпы для целей сравнения, Gapped BLAST (в BLAST 2.0) может быть использован, как описано в Altschul et al. (1997) Nucleic Acids Res. 25:3389. Альтернативно, PSI-BLAST (в BLAST 2.0) может быть использован для проведения повторяющегося поиска, который определяет дистанционные взаимоотношения между молекулами. См. Altschul et al. (1997) выше. При использовании BLAST, Gapped BLAST, PSI-BLAST, могут быть использованы параметры по умолчанию соответствующих программ (например, BLASTN для нуклеотидных последовательностей, BLASTX для белков). См. www.ncbi.nlm.nih.gov. Выравнивание может быть также проведено вручную путем осмотра.
Если не определено обратное, значения идентичности последовательностей/сходства, обеспеченные данным описанием, относятся к значению, полученному с использованием GAP Версии 10, применяя следующие параметры: % идентичности и % сходства для нуклеотидной последовательности, используя вес гэпа, равный 50 и вес продолжения, равный 3, и матрицу замен nwsgapdna.cmp; % идентичности и % сходства для аминокислотной последовательности, используя вес гэпа, равный 8, и вес продолжения, равный 2, и матрицу замен BLOSUM62; или любую эквивалентную им программу. Под "эквивалентной программой" подразумевается любая программа сравнения последовательностей, которая для любых двух анализируемых последовательностей создает выравнивание, имеющее совпадения идентичных нуклеотидных или аминокислотных остатков и идентичную процентную идентичность последовательностей по сравнению с соответствующим выравниванием, образованным GAP Версии 10.
GAP использует алгоритм Needleman и Wunsch (1970) J. Mol. Biol. 48:443-453, для обнаружения выравнивания двух полных последовательностей, которое делает максимальным число совпадений и минимизирует количество гэпов. GAP рассматривает все возможные выравнивания и положения гэпов и создает выравнивание с наибольшим числом совпавших оснований и наименьшими гэпами. Программа допускает предположение штрафа за открытие гэпа и штрафа за продолжение гэпа в единицах совпавших оснований. GAP должен извлекать пользу из числа штрафов за открытие гэпа совпадений для каждого гэпа, который он вводит. Если выбран штраф за продолжение гэпа больше, чем ноль, GAP должен к тому же извлечь пользу для каждого гэпа, введенного по длине из случаев открытия гэпа штраф за продолжение гэпа. Значения штрафа за открытие гэпа по умолчанию и значения штраф за продолжение гэпа по умолчанию в Версии 10 GCG Wisconsin Genetics Software Package для белковых последовательностей составляют 8 и 2, соответственно. Для нуклеотидных последовательностей штраф за открытие гэпа по умолчанию составляет 50, тогда как штраф за продолжение гэпа по умолчанию составляет 3. Штрафы за открытие гэпа и продолжение гэпа могут быть выражены как целое число, выбранное из группы целых чисел, содержащих от 0 до 200. Таким образом, например, штрафы за открытие гэпа и за продолжение гэпа могут быть 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65 или больше.
GAP представляет один член из семейства лучших выравниваний. Может существовать много членов этого семейства, и никакой другой член не имеет лучшего качества. GAP показывает четыре рисунка характеристики для выравниваний: Качество, Соотношение, Идентичность и Сходство. Качество - это показатель, увеличенный для того, чтобы выровнять последовательности. Соотношение - это качество, поделенное на число оснований в более коротком сегменте. Процент идентичности - это процент символов, которые действительно совпадают. Процент сходства - это процент символов, которые являются сходными. Символы, которые находятся напротив гэпов, пропускаются. Сходство оценивают, когда значение матрицы замен для пары символов составляет больше чем или равно 0,50, критическому уровню сходства. Матрица замен, используемая в Версии 10 GCG Wisconsin Genetics Software Package, представляет собой BLOSUM62 (см. Henikoff and Henikoff (1989) Proc. Natl. Acad. Sci. USA 89:10915).
(c) Как используется в данном документе, "идентичность последовательностей" или "идентичность" в контексте двух полинуклеотидов или полипептидных последовательностей относится к остаткам в двух последовательностях, которые являются одинаковыми, когда выравниваются для максимального соответствия через определенное окно сравнения. Когда процентное соотношение идентичности последовательностей используется в отношении белков, то оно означает, что положения остатков, которые не идентичны, часто отличаются по консервативным аминокислотным заменам, где аминокислотные остатки замещены на другие аминокислотные остатки со сходными химическими свойствами (например, заряд или гидрофобность) и, следовательно, не изменяют функциональных свойств молекулы. Когда последовательности отличаются в консервативных заменах, процентная идентичность последовательностей может быть отрегулирована в сторону увеличения для придания консервативной природы замене. Указывается, что последовательности, которые отличаются на такие консервативные замены, имеют "сходство последовательностей" или "сходство". Средства для проведения такой регулировки хорошо известны специалистам в данной области техники. Типично это включает оценивание консервативной замены как частичное, а не полное несовпадение, таким образом, повышая процентное соотношение идентичности последовательностей. Таким образом, например, если идентичная аминокислота представлена баллом 1 и неконсервативная замена представлена нулем, то консервативная замена представлена баллом между нулем и 1. Оценивание консервативных замен вычисляется, например, как реализация в программе PC/GENE (Intelligenetics, Mountain View, California).
(d) Как используется в данном документе, "процентное соотношение идентичности последовательностей" означает значение, определенное сравнением двух оптимально выровненных последовательностей через окно сравнения, где часть полинуклеотидной последовательности в окне сравнения может содержать вставки или делеции (т.е. гэпы) по сравнению с эталонной последовательностью (которая не содержит вставок или делеций) для оптимального выравнивания двух последовательностей. Процентное соотношение вычисляют путем определения числа положений, в которых идентичное основание нуклеиновой кислоты или аминокислотный остаток находятся в двух последовательностях для получения числа совпавших положений, поделив число совпавших положений на общее число положений в окне сравнения, и умножив результат на 100 для получения процентного соотношения идентичности последовательностей.
Применение выражения "полинуклеотид" не подразумевает ограничение вариантов осуществления до полинуклеотидов, содержащих ДНК. Специалистам в данной области техники понятно, что полинуклеотиды могут содержать рибонуклеотиды и комбинации рибонуклеотидов и дезоксирибонуклеотидов. Такие дезоксирибонуклеотиды и рибонуклеотиды включают как встречающиеся в природе молекулы, так и синтетические аналоги. Полинуклеотиды вариантов осуществления также включают все формы последовательностей, включая и не ограничиваясь следующим: однонитевые формы, двухнитевые формы и подобные.
Изолированные полинуклеотиды вариантов осуществления могут быть встроены в рекомбинантные ДНК-конструкты, способны входить и реплицироваться в клетке-хозяине. “Вектор” может быть таким конструктом, который включает систему репликации и последовательности, которые способны к транскрипции и трансляции полипептид-кодирующей последовательности в данной клетке-хозяине. Ряд векторов, подходящих для стабильной трансфекции растительных клеток или для приживаемости трансгенных растений, были описаны в, например, Pouwels et al., Cloning Vectors: A Laboratory Manual, 1985, supp. 1987; Weissbach and Weissbach, Methods for Plant Molecular Biology, Academic Press, 1989; и Flevin et al., Plant Molecular Biology Manual, Kluwer Academic Publishers, 1990. Типично, растительные векторы экспрессии включают, например, один или несколько клонированных растительных генов при транскрипционном контроле 5' и 3' регуляторных последовательностей и доминантный маркер селекции. Такие растительные векторы экспрессии также могут содержать промоторную регуляторную область (например, регуляторную область, контролирующую индуцируемую или конститутивную, регулируемую окружающей средой или экспериментально, или клеточно- или тканеспецифичную экспрессию), стартовый сайт инициации транскрипции, сайт связывания с рибосомой, сигнал процессинга РНК, сайт терминации транскрипции и/или сигнал полиаденилирования.
Выражения “рекомбинантный конструкт”, “кассета экспрессии”, “конструкт экспрессии”, “химерный конструкт”, “конструкт”, “рекомбинантный ДНК-конструкт” и “рекомбинантный ДНК фрагмент” используются взаимозаменяемо в данном описании и являются фрагментами нуклеиновой кислоты. Рекомбинантный конструкт содержит искусственную комбинацию фрагментов нуклеиновой кислоты, включая и не ограничиваясь регуляторной и кодирующей последовательностями, которые не обнаруживаются вместе в природе. Например, рекомбинантный ДНК-конструкт может содержать регуляторные последовательности и кодирующие последовательности, которые происходят из различных источников, или регуляторные последовательности и кодирующие последовательности, которые происходят из одного источника и располагаются способом, который отличается от того, который обнаруживается в природе. Такой конструкт может использоваться сам по себе или может использоваться в сочетании с вектором. Если используется вектор, то выбор вектора зависит от способа, который будет использоваться для трансформации клеток-хозяев, что хорошо известно специалистам данной области техники. Например, может быть использован плазмидный вектор. Специалисту в данной области техники хорошо знакомы генетические элементы, которые должны присутствовать на векторе для того, чтобы успешно трансформировать, отбирать и репродуцировать клетки-хозяева, содержащие любой из изолированных фрагментов нуклеиновой кислоты вариантов осуществления. Скрининг для получения линий, проявляющих желательный уровень экспрессии и структуру полинуклеотидов или Rcg1 локус, может быть осуществлен с помощью амплификации, саузерн-анализа ДНК, нозерн-анализа экспрессии мРНК, анализа иммуноблоттинга белковой экспрессии, фенотипического анализа и подобного.
Выражение “рекомбинантный ДНК-конструкт” относится к ДНК-конструкту, собранному из фрагментов нуклеиновой кислоты, полученных из различных источников. Типы и источники фрагментов нуклеиновой кислоты могут быть очень различны.
В некоторых вариантах осуществления дополнительно обеспечиваются кассеты экспрессии, содержащие промотор, функционально связанный с гетерологической нуклеотидной последовательностью вариантов осуществления. Кассеты экспрессии вариантов осуществления находят применение в образовании трансформированных растений, растительных клеток и микроорганизмов и в практических способах для индуцирования устойчивости растения к грибковому патогену, раскрытой здесь. Кассета экспрессии будет включать 5' и 3' регуляторные последовательности, функционально связанные с полинуклеотидом вариантов осуществления. "Функционально связанный" подразумевает функциональное связывание между двумя или более элементами. “Регуляторные последовательности” относятся к нуклеотидам, расположенным по ходу транскрипции (5' некодирующие последовательности), внутри или против хода транскрипции (3' некодирующие последовательности) кодирующей последовательности, и которые могут влиять на транскрипцию, РНК процессинг, стабильность или трансляцию связанной кодирующей последовательности. Регуляторные последовательности могут включать и не ограничиваются следующим: промоторы, лидерные последовательности трансляции, интроны и последовательности распознавания полиаденилирования. Например, действующее сцепление между полинуклеотидом, представляющим интерес, и регуляторной последовательностью (промотором, например) - это функциональная связь, которая позволяет осуществляться экспрессии полинуклеотида, представляющего интерес. Функционально связанные элементы могут быть смежными или несмежными. При использовании для обозначения соединения двух кодирующих белок областей, под функционально связанным подразумевают то, что кодирующие области находятся в той же рамке считывания. Кассета может дополнительно содержать по меньшей мере один дополнительный ген для котрансформации в организм. Альтернативно, дополнительный ген(ы) может обеспечиваться на множественных кассетах экспрессии. Такая кассета экспрессии обеспечивается с несколькими сайтами ресктрикции и/или сайтами рекомбинации для вставки полинуклеотида, который кодирует антипатогенный полипептид, который должен находиться под транскрипционной регуляцией регуляторных областей. Кассета экспрессии может дополнительно содержать гены селекции маркера.
Кассета экспрессии будет включать в 5'-3' направлении транскрипции область инициации транскрипции (т.е. промотор), область инициации трансляции, полинуклеотид вариантов осуществления, область терминации трансляции и, необязательно, участок терминации транскрипции, функционирующий в организме хозяина. Регуляторные области (т.е. промоторы, транскрипционные регуляторные области и трансляционные терминирующие области) и/или полинуклеотид вариантов осуществления могут быть нативными/аналогичными клетке-хозяину или друг другу. Альтернативно, регуляторные области и/или полинуклеотид вариантов осуществления могут быть гетерологичными клетке-хозяину или друг другу. Как используется в данном документе, “гетерологичный”, который относится к последовательности, представляет собой последовательность, которая происходит от чужого вида, или, если из того же вида, то, по сути, модифицирована от его нативной формы в композиции и/или геномном локусе путем преднамеренного вмешательства человека. Например, промотор, функционально связанный с гетерологичным полинуклеотидом, происходит от вида, отличного от вида, из которого получен полинуклеотид, или, если от того же/аналогичного вида, то один или оба являются, по сути, модифицированными от их оригинальной формы и/или геномного локуса, или промотор представляет собой не нативный промотор для функционально связанного полинуклеотида.
Необязательно включенная терминирующая область может быть нативной с областью инициации транскрипции, может быть нативной с функционально связанным полинуклеотидом, представляющим интерес, может быть нативной с растением-хозяином или может происходить из другого источника (т.е. чужого или гетерологичного) для промотора, полинуклеотида, представляющего интерес, хозяина или любой их комбинации. Подходящие терминирующие области доступны от Ti-плазмиды A. tumefaciens, такие как терминирующие области октопин синтазы и нопалин синтазы. См. также Guerineau et al. (1991) Mol. Gen. Genet. 262:141-144; Proudfoot (1991) Cell 64:671-674; Sanfacon et al. (1991) Genes Dev. 5:141-149; Mogen et al. (1990) Plant Cell 2:1261-1272; Munroe et al. (1990) Gene 91:151-158; Ballas et al. (1989) Nucleic Acids Res. 17:7891-7903; и Joshi et al. (1987) Nucleic Acids Res. 15:9627-9639. В конкретных вариантах осуществления используется терминатор гена ингибитора протеазы картофеля II (PinII). См., например, Keil et al. (1986) Nucl. Acids Res. 14:5641-5650; и An et al. (1989) Plant Cell 1:115-122, включенные в данное описание путем ссылки в их полноте.
Ряд промоторов может быть использован в практическом воплощении вариантов осуществления, включая нативный промотор полинуклеотидной последовательности, представляющей интерес. Промоторы могут быть выбраны на основании желательного результата. Широкий диапазон растительных промоторов описан в недавнем обзоре Potenza et al. (2004) In Vitro Cell Dev Biol - Plant 40:1-22, включенном в данное описание путем ссылки. Например, нуклеиновые кислоты могут быть скомбинированы с конститутивными, тканепредпочтительными, патоген-индуцируемыми или другими промоторами для экспрессии в растениях. Такие конститутивные промоторы включают, например, коровый промотор Rsyn7 промотора и другие конститутивные промоторы, раскрытые в WO 99/43838 и патенте США № 6072050; коровый CaMV 35S промотор (Odell et al. (1985) Nature 313:810-812); актин риса (McElroy et al. (1990) Plant Cell 2:163-171); убиквитин (Christensen et al. (1989) Plant Mol. Biol. 12:619-632 и Christensen et al. (1992) Plant Mol. Biol. 18:675-689); pEMU (Last et al. (1991) Theor. Appl. Genet. 81:581-588); MAS (Velten et al. (1984) EMBO J. 3:2723-2730); ALS промотор (патент США № 5659026) и подобные. Другие конститутивные промоторы включают, например, патенты США № 5608149; 5608144; 5604121; 5569597; 5466785; 5399680; 5268463; 5608142; и 6177611.
Иногда может быть благоприятным экспрессировать ген из индуцируемого промотора, конкретно из патоген-индуцируемого промотора. Такие промоторы включают те, которые происходят из связанных с патогенезом белков (PR белки), которые индуцируются после инфицирования патогеном; например, PR белки, SAR белки, бета-1,3-глюканаза, хитиназа и т.п. См., например, Redolfi et al. (1983) Neth. J. Plant Pathol. 89:245-254; Uknes et al. (1992) Plant Cell 4:645-656; и Van Loon (1985) Plant Mol. Virol. 4:111-116. См. также WO 99/43819, включенную в данное описание путем ссылки.
Представляют интерес промоторы, которые вызывают экспрессию белка локально на или возле сайта инфицирования патогеном. См., например, Marineau et al. (1987) Plant Mol. Biol. 9:335-342; Matton et al. (1989) Molecular Plant-Microbe Interactions 2:325-331; Somsisch et al. (1986) Proc. Natl. Acad. Sci. USA 83:2427-2430; Somsisch et al. (1988) Mol. Gen. Genet. 2:93-98; и Yang (1996) Proc. Natl. Acad. Sci. USA 93:14972-14977. См. также, Chen et al. (1996) Plant J. 10:955-966; Zhang et al. (1994) Proc. Natl. Acad. Sci. USA 91:2507-2511; Warner et al. (1993) Plant J. 3:191-201; Siebertz et al. (1989) Plant Cell 1:961-968; патент США № 5750386 (нематода-индуцируемый); и ссылки, цитируемые там. Особый интерес представляет индуцируемый промотор для PRms гена маиса, чья экспрессия индуцируется патогеном Fusarium moniliforme (см., например, Cordero et al. (1992) Physiol. Mol. Plant Path. 41:189-200).
Дополнительно, так как патогены проникают в растения через раны или повреждения насекомыми, индуцируемый раной промотор может быть использован в конструкциях вариантов осуществления. Такие раневые индуцируемые промоторы включают ген ингибитора протеиназы картофеля (pin II) (Ryan (1990) Ann. Rev. Phytopath. 28:425-449; Duan et al. (1996) Nature Biotechnology 14:494-498); wun1 и wun2, патент США № 5428148; win1 и win2 (Stanford et al. (1989) Mol. Gen. Genet. 215:200-208); системин (McGurl et al. (1992) Science 225:1570-1573); WIP1 (Rohmeier et al. (1993) Plant Mol. Biol. 22:783-792; Eckelkamp et al. (1993) FEBS Letters 323:73-76); MPI ген (Corderok et al. (1994) Plant J. 6(2):141-150); и подобные, включенные в данное описание путем ссылки.
Химически регулируемые промоторы могут быть использованы для модуляции экспрессии гена в растении посредством применения экзогеного химического регулятора. В зависимости от цели, промотор может быть химически индуцируемым промотором, где применение химического соединения индуцирует генную экспрессию, или химически репрессируемым промотором, где применение химического соединения репрессирует генную экспрессию. Химически индуцируемые промоторы известны в данном уровне техники и включают, и не ограничиваются следующим: In2-2 промотор маиса, который активируется бензолсульфонамидными гербицидными антидотами, GST промотор маиса, который активируется гидрофобными электрофильными соединениями, которые используются как предвсходовые гербициды, и PR-1a промотор табака, который активируется салициловой кислотой. Другие химически регулируемые промоторы, представляющие интерес, включают чувствительные к стероидам промоторы (см., например, индуцируемый глюкокортикоидом промотор в Schena et al. (1991) Proc. Natl. Acad. Sci. USA 88:10421-10425 и McNellis et al. (1998) Plant J. 14(2):247-257) и тетрациклин-индуцируемые и тетрациклин-репрессируемые промоторы (см., например, Gatz et al. (1991) Mol. Gen. Genet. 227:229-237 и патенты США № 5814618 и 5789156), включенные в данное описание путем ссылки.
Предпочтительные для ткани промоторы могут использоваться для нацеленной усиленной экспрессии полипептидов вариантов осуществления внутри конкретной ткани растения. Например, предпочтительный для ткани промотор может быть использован для экспрессии полипептида в растительной ткани, где устойчивость к болезни является особенно необходимой, такой как, например, корни, стебель или листья. Предпочтительные для ткани промоторы включают Yamamoto et al.(1997) Plant J. 12(2):255-265; Kawamata et al. (1997) Plant Cell Physiol. 38(7):792-803; Hansen et al. (1997) Mol. Gen Genet. 254(3):337-343; Russell et al. (1997) Transgenic Res. 6(2):157-168; Rinehart et al. (1996) Plant Physiol. 112(3):1331-1341; Van Camp et al. (1996) Plant Physiol. 112(2):525-535; Canevascini et al. (1996) Plant Physiol. 112(2):513-524; Yamamoto et al. (1994) Plant Cell Physiol. 35(5):773-778; Lam (1994) Results Probl. Cell Differ. 20:181-196; Orozco et al. (1993) Plant Mol Biol. 23(6):1129-1138; Matsuoka et al. (1993) Proc Natl. Acad. Sci. USA 90(20):9586-9590; и Guevara-Garcia et al. (1993) Plant J. 4(3):495-505. Такие промоторы могут быть модифицированы, при необходимости, для слабой экспрессии.
Предпочтительные для сосудистой ткани промоторы известны в данном уровне техники и включают те промоторы, которые селективно направляют белковую экспрессию в, например, ксилемную или флоэмную ткань. Предпочтительные для сосудистой ткани промоторы включают, и не ограничиваются следующим: промоторгенапруназингидролазы Prunus serotina (см., например, международную публикацию № WO 03/006651), а также те, которые можно найти в патентной заявке США № 10/109488.
Предпочтительные для стебля промоторы могут быть использованы для направления экспрессии полипептида вариантов осуществления. Примеры стебель-специфических промоторов включают промотор MS8-15 гена маиса (см., например, патент США № 5986174 и международную публикацию № WO 98/00533), и те, которые обнаружены в Graham et al. (1997) Plant Mol Biol 33(4): 729-735.
Предпочтительные для листа промоторы известны в данном уровне техники. См., например, Yamamoto et al. (1997) Plant J. 12(2):255-265; Kwon et al. (1994) Plant Physiol. 105:357-67; Yamamoto et al. (1994) Plant Cell Physiol. 35(5):773-778; Gotor et al. (1993) Plant J. 3:509-18; Orozco et al. (1993) Plant Mol. Biol. 23(6):1129-1138; и Matsuoka et al. (1993) Proc. Natl. Acad. Sci. USA 90(20):9586-9590.
Предпочтительные для корня промоторы известны и могут быть выбраны из многих доступных из литературных источников или изолированы de novo из различных совместимых видов. См., например, Hire et al. (1992) Plant Mol. Biol. 20(2):207-218 (предпочтительный для корня ген глютамин синтетазы сои); Keller и Baumgartner (1991) Plant Plant Cell 3(10):1051-1061 (предпочтительный для корня контролирующий элемент в GRP 1,8 гене фасоли обыкновенной); Sanger et al. (1990) Plant Mol. Biol. 14(3):433-443 (предпочтительный для корня промотор гена маннопин синтазы (MAS) Agrobacterium tumefaciens); и Miao et al. (1991) Plant Cell 3(1):11-22 (полноразмерный кДНК клон, кодирующий цитозольную глютамин синтетазу (GS), которая экспрессируется в корнях и корневых клубеньках сои). См. также Bogusz et al. (1990) Plant Cell 2(7):633-641, где описываются два корень-специфических промотора, изолированные из генов гемоглобина из азотфиксирующего небобового Parasponia andersonii и родственного не азотфиксирующего небобового Trema tomentosa. Промоторы этих генов сцеплены с репортерным геном β-глюкуронидазы и встроенные как в небобовое Nicotiana tabacum, так и бобовое Lotus corniculatus, и в обоих случаях сохраняется корень - специфическая промоторная активность. Leach и Aoyagi (1991) описывают их анализ промоторов высоко экспрессированных rolC и rolD корень-индуцирующих генов Agrobacterium rhizogenes (см. Plant Science (Limerick) 79(1):69-76). Они сделали вывод, что энхансер и предпочтительные для ткани ДНК детерминанты диссоциируют в этих промоторах. Teeri et al. (1989) использовал слияние генов с lacZ для демонстрации того, что Agrobacterium T-ДНК ген, кодирующий октопин синтазу, является особенно активным в эпидермисе корневого кончика и что TR2' ген является предпочтительным для корня в интактном растении и стимулируется ранением в листовой ткани, особенно желательной комбинацией характеристик для применения с инсектицидным или ларвицидным геном (см. EMBO J. 8(2):343-350). TR1' ген, слитый с nptII (неомицин фосфотрансфераза II), показывал сходные характеристики. Дополнительные предпочтительные для корня промоторы включают промотор VfENOD-GRP3 гена (Kuster et al. (1995) Plant Mol. Biol. 29(4):759-772); и rolB промотор (Capana et al. (1994) Plant Mol. Biol. 25(4):681-691. См. также патенты США № 5837876; 5750386; 5633363; 5459252; 5401836; 5110732 и 5023179.
“Предпочтительные для семени” промоторы включают как “семя-специфические” промоторы (те промоторы, которые активны во время семяобразования, такие как промоторы запасные белки семени), а также промоторы “прорастания семени” (те промоторы, которые активны во время прорастания семени). См. Thompson et al. (1989) BioEssays 10:108, включенный в данное описание путем ссылки. Такие предпочтительные для семени промоторы включают и не ограничиваются следующим: Cim1 (цитокинин-индуцируемое сообщение); cZ19B1 (19 кДа зеин маиса); milps (мио-инозитол-1-фосфатсинтаза) (см. WO 00/11177 и патент США № 6225529; включенные в данное описание путем ссылки). Гамма-зеин является предпочтительным эндосперм-специфическим промотором. Glob-1 является предпочтительным эмбриоспецифическим промотором. Для двудольных растений семя-специфические промоторы включают и не ограничиваются следующим: β-фазеолин фасоли, напин, β-конглицинин, соевый лектин, круциферин и подобные. Для однодольных растений семя-специфические промоторы включают и не ограничиваются следующим: 15 кДа зеин маиса, 22 кДа зеин, 27 кДа зеин, g-зеин, восковидный, морщинистый 1, морщинистый 2, глобулин 1 и т.п. См. также WO 00/12733, где раскрываются предпочтительные для семени промоторы из end1 и end2 генов; включенную в данное описание путем ссылки.
Известны дополнительные модификации последовательности для усиления генной экспрессии в клеточном хозяине. Они включают исключение последовательностей, кодирующих ложные сигналы полиаденилирования, сигналы сайта сплайсинга экзон-интрон, транспозон-подобные повторы и другие такие хорошо изученные последовательности, которые могут быть вредны для генной экспрессии. G-C содержание последовательности может быть отрегулировано до уровней средних для данного клеточного хозяина, что вычисляется на основе известных генов, экспрессируемых в клетке-хозяине. Если возможно, последовательность модифицируют для того, чтобы избежать предсказанных вторичных мРНК структур “шпилек”.
Кассеты экспрессии могут дополнительно содержать 5'-лидерные последовательности. Такие лидерные последовательности могут действовать, чтобы усиливать трансляцию. Трансляционные лидеры известны в данном уровне техники и включают лидеры пикорнавируса, например, EMCV лидер (Encephalomyocarditis 5' некодирующая область) (Elroy-Stein et al. (1989) Proc. Natl. Acad. Sci. USA 86:6126-6130); лидеры потивируса, например, TEV лидер (вирус гравировки табака) (Gallie et al. (1995) Gene 165(2):233-238), MDMV лидер (вирус карликовой мозаики маиса), и связывающий белок тяжелой цепи иммуноглобулина человека (BiP) (Macejak et al. (1991) Nature 353:90-94); нетранслирующий лидер из мРНК белка оболочки вируса мозаики люцерны (AMV РНК 4) (Jobling et al. (1987) Nature 325:622-625); лидер вируса мозаики табака (TMV) (Gallie et al. (1989) в Molecular Biology of РНК, ed. Cech (Liss, Нью-Йорк), pp. 237-256); и лидер вируса хлоротической крапчатости маиса (MCMV) (Lommel et al. (1991) Virology 81:382-385). См. также, Della-Cioppa et al. (1987) Plant Physiol. 84:965-968. Могут быть также использованы другие известные способы для усиления трансляции, например, интроны и подобные.
При получении кассеты экспрессии различными ДНК фрагментами могут управлять так, чтобы обеспечить ДНК последовательности в правильной ориентации и, в соответствующих случаях, в правильной рамке считывания. Для этой цели могут применяться адаптеры или линкеры для соединения ДНК фрагментов или другие манипуляции могут быть вовлечены в обеспечение подходящих сайтов рестрикции, удаления излишней ДНК, удаления сайтов рестрикции или подобного. Для этой цели могут быть включены in vitro мутагенез, репарация праймера, рестрикция, отжиг, повторные замены, например, транзиции и трансверсии.
Кассета экспрессии может также содержать ген маркера селекции для селекции трансформированных клеток. Гены маркеров селекции используются для селекции трансформированных клеток или тканей. Маркерные гены включают гены, кодирующие устойчивость к антибиотикам, такие как те, которые кодируют неомицин фосфотрансферазу II (NEO) и гигромицин фосфотрансферазу (HPT), а также гены, придающие устойчивость к гербицидным соединениям, таким как глюфозинат аммония, бромоксинил, имидазолиноны и 2,4-дихлорфеноксиацетат (2,4-D). Дополнительные маркеры селекции включают фенотипические маркеры, такие как β-галактозидаза и флуоресцентные белки, такие как зеленый флуоресцентный белок (GFP) (Su et al. (2004) Biotechnol Bioeng 85:610-9 и Fetter et al. (2004) Plant Cell 16:215-28), голубой флуоресцентный белок (CYP) (Bolte et al. (2004) J. Cell Science 117:943-54 и Kato et al. (2002) Plant Physiol 129:913-42), и желтый флуоресцентный белок (PhiYFP™ от Evrogen, см. Bolte et al. (2004) J. Cell Science 117:943-54). Для дополнительных маркеров селекции см., в общем, Yarranton (1992) Curr. Opin. Biotech. 3:506-511; Christopherson et al. (1992) Proc. Natl. Acad. Sci. USA 89:6314-6318; Yao et al. (1992) Cell 71:63-72; Reznikoff (1992) Mol. Microbiol. 6:2419-2422; Barkley et al. (1980) в The Operon, pp. 177-220; Hu et al. (1987) Cell 48:555-566; Brown et al. (1987) Cell 49:603-612; Figge et al. (1988) Cell 52:713-722; Deuschle et al. (1989) Proc. Natl. Acad. Aci. USA 86:5400-5404; Fuerst et al. (1989) Proc. Natl. Acad. Sci. USA 86:2549-2553; Deuschle et al. (1990) Science 248:480-483; Gossen (1993) Ph.D. Thesis, University of Heidelberg; Reines et al. (1993) Proc. Natl. Acad. Sci. USA 90:1917-1921; Labow et al. (1990) Mol. Cell. Biol. 10:3343-3356; Zambretti et al. (1992) Proc. Natl. Acad. Sci. USA 89:3952-3956; Baim et al. (1991) Proc. Natl. Acad. Sci. USA 88:5072-5076; Wyborski et al. (1991) Nucleic Acids Res. 19:4647-4653; Hillenand-Wissman (1989) Topics Mol. Struc. Biol. 10:143-162; Degenkolb et al. (1991) Antimicrob. Agents Chemother. 35:1591-1595; Kleinschnidt et al. (1988) Biochemistry 27:1094-1104; Bonin (1993) Ph.D. Thesis, University of Heidelberg; Gossen et al. (1992) Proc. Natl. Acad. Sci. USA 89:5547-5551; Oliva et al. (1992) Antimicrob. Agents Chemother. 36:913-919; Hlavka et al. (1985) Handbook of Experimental Pharmacology, Vol. 78 (Springer-Verlag, Berlin); Gill et al. (1988) Nature 334:721-724. Эти описания включены в данное описание путем ссылки.
Не подразумевается, что приведенный выше список генов маркеров селекции является ограничивающим. Любой ген маркера селекции может быть использован в вариантах осуществления.
В определенных вариантах осуществления последовательности нуклеиновой кислоты вариантов осуществления могут подвергаться стэкингу с любой комбинацией полинуклеотидных последовательностей, представляющих интерес, для того, чтобы создать растения с желательным фенотипом. Этот стэкинг может быть осуществлен путем комбинации генов внутри ДНК-конструкта, или путем скрещивания Rcg1 с другой линией, которая содержит эту комбинацию. Например, полинуклеотиды вариантов осуществления могут подвергаться стэкингу с любыми другими полинуклеотидами вариантов осуществления, или с другими генами. Образованные комбинации могут также включать множество копий любого одного из полинуклеотидов, представляющих интерес. Полинуклеотиды вариантов осуществления могут также подвергаться стэкингу с любым другим геном или комбинацией генов для получения растений с разнообразными комбинациями желательных признаков, включая и не ограничиваясь признаками, описанными для корма для животных, такие как гены высокого содержания масла (например, патент США № 6232529); сбалансированные аминокислоты (например, хордотионины (патенты США № 5990389; 5885801; 5885802 и 5703409); ячмень с высоким содержанием лизина (Williamson et al. (1987) Eur. J. Biochem. 165:99-106; и WO 98/20122); и белки с высоким содержанием метионина (Pedersen et al. (1986) J. Biol. Chem. 261:6279; Kirihara et al. (1988) Gene 71:359; и Musumura et al. (1989) Plant Mol. Biol. 12: 123)); повышенная перевариваемость (например, модифицированные запасные белки (заявка США № 10/053410, поданная 7 ноября 2001); и тиоредоксины (заявка США № 10/005429, поданная 3 декабря 2001)), описания которых включены в данное описание путем ссылки. Полинуклеотиды вариантов осуществления могут также подвергаться стэкингу с признаками, желательными для устойчивости к насекомым, болезням или гербицидам (например, Bacillus thuringiensis токсические белки (патенты США № 5366892; 5747450; 5737514; 5723756; 5593881; Geiser et al. (1986) Gene 48:109); лектины (Van Damme et al. (1994) Plant Mol. Biol. 24:825); гены дезинтосикации фумонизина (патент США № 5792931); гены авирулентности и устойчивости к болезни (Jones et al. (1994) Science 266:789; Martin et al. (1993) Science 262:1432; Mindrinos et al. (1994) Cell 78:1089); мутанты ацетолактат синтазы (ALS), которые приводят к гербицидной устойчивости, такие как S4 и/или Hra мутации; ингибиторы глютамин синтазы, такие как фосфинотрицин или basta (например, ген bar); и гликофосатная устойчивость (EPSPS гены, GAT гены, такие как те, что раскрыты в публикации патентной заявки США US2004/0082770, также WO02/36782 и WO03/092360)); и признаки, желательные для процессинга или продуктов процессинга, такие как высокое содержание масла (например, патент США № 6232529); модифицированные масла (например, гены жирнокислотной десатуразы (патент США № 5952544; WO 94/11516)); модифицированные крахмалы (например, ADPG пирофосфорилазы (AGPаза), крахмал синтазы (SS), ферменты разветвления крахмала (SBE) и ферменты деветвления крахмала (SDBE)); и полимеры или биопластмассы (например, патент США № 5602321; бета-кетотиолаза, полигидроксибутират синтаза и ацетоацетил-CoA редуктаза (Schubert et al. (1988) J. Bacteriol. 170:5837-5847) облегченная экспрессия полигидроксиалканоатов (PHAs)), описания которых включены в данное описание путем ссылки. Можно также комбинировать полинуклеотиды вариантов осуществления с полинуклеотидами, обеспечивающими агрономические признаки, такие как мужская стерильность (например, см. патент США № 5583210), сила стебля, время цветения или признаки трансформационной техники, такие как регуляция клеточного цикла или генное мечение (например, WO 99/61619; WO 00/17364; WO 99/25821), описания которых включены в данное описание путем ссылки.
Эти комбинации, полученные в результате стэкинга, могут быть созданы любым способом, включая и не ограничиваясь кроссбридингом растений любой подходящей или TopCross® методикой или генетической трансформацией. Если признаки подвергаются стэкингу путем генетической трансформации растений, то полинуклеотидные последовательности, представляющие интерес, могут комбинироваться в любое время и в любом порядке. Например, трансгенное растение, содержащее один или несколько желательных признаков, может быть использовано как мишень для встраивания дополнительных признаков путем дальнейшей трансформации. Признаки могут быть встроены одновременно в протоколе котрансформации с полинуклеотидами, представляющими интерес, обеспеченными любой комбинацией кассет трансформации. Например, если две последовательности будут встраиваться, то две последовательности могут содержаться в отдельных кассетах трансформации (транс) или содержаться в одной кассете трансформации (цис). Экспрессия последовательностей может направляться одинаковым промотором или разными промоторами. В определенных случаях может быть желательным встроить кассету трансформации, которая будет подавлять экспрессию полинуклеотида, представляющего интерес. Она может быть комбинирована с любой комбинацией других кассет супрессии или кассет сверхэкспрессии для образования желательной комбинации признаков в растении.
Способы вариантов осуществления могут включать, и не ограничиваются следующим: введение полипептида или полинуклеотида в растение. "Введение" подразумевает обеспечение растения полинуклеотидом. В некоторых вариантах осуществления полинуклеотид будет обеспечен таким образом, что последовательность обеспечивает доступ к внутреннему содержимому клетки растения, включая его возможную вставку в геном растения. Способы вариантов осуществления не зависят от конкретного способа введения последовательности в растение, за исключением того, что полинуклеотид обеспечивает доступ к внутреннему содержимому, по меньшей мере, одной клетки растения. Способы для введения полинуклеотидов в растения известны в данном уровне техники, включая и не ограничиваясь следующим: способы стабильной трансформации, способы транзиторной трансформации и опосредованные вирусом способы.
“Трансформация” относится к переносу фрагмента нуклеиновой кислоты в геном организма-хозяина, приводя к генетически стабильному наследованию. Организмы-хозяины, содержащие трансформированные фрагменты нуклеиновой кислоты, называются “трансгенные” организмы. “Клетка-хозяин” относится к клетке, в которой имеет место трансформация рекомбинантного ДНК-конструкта и может включать дрожжевую клетку, бактериальную клетку и растительную клетку. Примеры способов растительной трансформации включают Agrobacterium-опосредованную трансформацию (De Blaere et al., 1987, Meth. Enzymol. 143:277) и технологию трансформации ускорением частиц или посредством “генной пушки” (Klein et al., 1987, Nature (London) 327:70-73; патент США № 4945050), среди прочих.
"Стабильная трансформация" подразумевает то, что нуклеотидный конструкт, введенный в растение, интегрирует в геном растения и может быть унаследован его потомством. "Транзиторная трансформация" или “транзиторная экспрессия” подразумевает то, что полинуклеотид вводится в растение и не интегрирует в геном растения или полипептид вводится в растение.
Протоколы трансформации, а также протоколы введения полипептидов или полинуклеотидных последовательностей в растения могут изменяться в зависимости от типа растения или растительной клетки, т.е. однодольная или двудольная, которая является мишенью для трансформации. Подходящие способы введения полипептидов и полинуклеотидов в растительные клетки включают микроинъекцию (Crossway et al. (1986) Biotechniques 4:320-334), электропорацию (Riggs et al. (1986) Proc. Natl. Acad. Sci. USA 83:5602-5606, Agrobacterium-опосредованную трансформацию (патенты США № 5563055 и 5981840), направленный перенос гена (Paszkowski et al. (1984) EMBO J. 3:2717-2722), и баллистическое ускорение частиц (см., например, Sanford et al., патенты США № 4945050; 5879918; 5886244 и 5932782; Tomes et al. (1995) в Plant Cell, Tissue, and Organ Culture: Fundamental Methods, ред. Gamborg и Phillips (Springer-Verlag, Berlin); McCabe et al. (1988) Biotechnology 6:923-926); и Lec1 трансформацию (WO 00/28058). Также см., Weissinger et al. (1988) Ann. Rev. Genet. 22:421-477; Sanford et al. (1987) Particulate Science and Technology 5:27-37 (лук); Christou et al. (1988) Plant Physiol. 87:671-674 (соя); McCabe et al. (1988) Bio/Technology 6:923-926 (соя); Finer и McMullen (1991) In Vitro Cell Dev. Biol. 27P:175-182 (соя); Singh et al. (1998) Theor. Appl. Genet. 96:319-324 (соя); Datta et al. (1990) Biotechnology 8:736-740 (рис); Klein et al. (1988) Proc. Natl. Acad. Sci. USA 85:4305-4309 (маис); Klein et al. (1988) Biotechnology 6:559-563 (маис); патенты США № 5240855; 5322783 и 5324646; Klein et al. (1988) Plant Physiol. 91:440-444 (маис); Fromm et al. (1990) Biotechnology 8:833-839 (маис); Hooykaas-Van Slogteren et al. (1984) Nature (London) 311:763-764; патент США № 5736369 (зерновые); Bytebier et al. (1987) Proc. Natl. Acad. Sci. USA 84:5345-5349 (лилейные); De Wet et al. (1985) в The Experimental Manipulation of Ovule Tissues, ред. Chapman et al. (Longman, Нью-Йорк), pp. 197-209 (пыльца); Kaeppler et al. (1990) Plant Cell Reports 9:415-418 и Kaeppler et al. (1992) Theor. Appl. Genet. 84:560-566 (вискер-опосредованная трансформация); D'Halluin et al. (1992) Plant Cell 4:1495-1505 (электропорация); Li et al. (1993) Plant Cell Reports 12:250-255 и Christou и Ford (1995) Annals of Botany 75:407-413 (рис); Osjoda et al. (1996) Nature Biotechnology 14:745-750 (маис посредством Agrobacterium tumefaciens); все из которых включены в данное описание путем ссылки.
Способы известны в данном уровне техники для нацеленной вставки полинуклеотида в специфическое положение в растительный геном. В одном варианте осуществления вставка полинуклеотида в желательное геномное положение достигается с использованием системы сайт-специфической рекомбинации. См., например, WO99/25821, WO99/25854, WO99/25840, WO99/25855 и WO99/25853, которые включены в данное описание путем ссылки. Вкратце, полинуклеотид вариантов осуществления может содержаться в кассете переноса, фланкированной двумя неидентичными сайтами рекомбинации. Эта кассета переноса вводится в растение, стабильно встраивая в его геном сайт-мишень, который фланкирован двумя неидентичными сайтами рекомбинации, которые отвечают сайтам кассеты переноса. Обеспечивается соответствующая рекомбиназа и кассета переноса интегрирует в сайт-мишень. Полинуклеотид, представляющий интерес, таким образом, интегрирует в специфическое хромосомное положение в растительном геноме.
Клетки, которые были трансформированы, могут быть выращены в растения в соответствии с подходящими методами. См., например, McCormick et al. (1986) Plant Cell Reports 5:81-84. Эти растения могут быть затем выращены и либо опылены таким же трансформированным штаммом или различными штаммами, и определяют полученное потомство, имеющее конститутивную экспрессию желательной фенотипической характеристики. Два или более поколений могут быть выращены для того, чтобы гарантировать, что экспрессия желательной фенотипической характеристики стабильно поддерживается и наследуется и затем семена собирают, чтобы гарантировать, что экспрессия желательной фенотипической характеристики была достигнута. Таким способом, варианты осуществления обеспечивают трансформированное семя (также называемое “трансгенное семя”), имеющее нуклеотидный конструкт вариантов осуществления, например, кассету экспрессии вариантов осуществления, стабильно встроенный в их геном.
Как используется в данном документе, выражение “растение” может быть целым растением, любой его частью или клеточной или тканевой культурой, полученной из растения. Таким образом, выражение “растение” может относиться к любому из следующего: целые растения, растительные компоненты или органы (включая, но ограничиваясь следующим: зародыши, пыльца, семяпочки, семена, листья, цветы, ветки, фрукт, зерна, початки, стержни початков кукурузы, листовые обертки початков кукурузы, стебли, корни, корневые кончики, пыльники и подобные), растительные ткани, растительные клетки, растительные протопласты, растительные клеточные тканевые культуры, из которых растение маиса может быть регенировано, растительные каллюсы, кусты растений и семена растений. Растительная клетка - это клетка растения, или взятая непосредственно из семени или растения, или полученная посредством культивирования из клетки, полученной из растения. Под зерном подразумевают зрелое семя, производимое коммерческими производителями для целей, отличных от выращивания или репродукции вида. Потомство, варианты и мутанты регенерируемых растений также включены в объем вариантов осуществления, обеспечивая то, что эти части содержат введенные полинуклеотиды.
Варианты осуществления данного изобретения могут быть использованы для того, чтобы придавать или усиливать устойчивость растения к грибковому патогену или защищать от атаки грибкового патогена в растениях, особенно кукурузе (Zea mays). Будет осуществляться защита различных частей растения от атаки патогенов, включая и не ограничиваясь следующим: стебли, початки, листья, корни и метелки. Другие виды растения могут также представлять интерес в практическом применении вариантов осуществления данного изобретения, включая и не ограничиваясь следующим.
Выражения “фенотип”, или “фенотипический признак”, или “признак” относится к одному или более признакам организма. Фенотип может быть виден невооруженным глазом или любыми другими способами оценки, известными в данном уровне техники, например, микроскопия, биохимический анализ или электромеханическое исследование. В некоторых случаях фенотип напрямую контролируется отдельным геном или генетическим локусом, т.е. является “признаком, контролируемым одиночным геном”. В других случаях фенотип является результатом нескольких генов.
“Физическая карта” генома - это карта, показывающая линейный порядок идентифицируемых меток (включая гены, маркеры и т.п.) на хромосомной ДНК. Однако, в отличие от таковых на генетических картах, расстояния между метками являются абсолютными (например, измеренные в парах оснований или изолированных и перекрывающихся смежных генетических фрагментах) и не основываются на генетической рекомбинации.
У маиса определенное число BAC, или искусственных хромосом бактерий, каждая из которых содержит большую вставку геномной ДНК маиса, собиралось в контиги (перекрывающиеся смежные генетические фрагменты, или “смежные ДНК”). BAC может собираться в контиг, основываясь на выравнивании последовательностей, если BAC секвенируют, или посредством выравнивания его BAC фингерпринта с фингерпринтами других BAC в контиге. Сборки доступны общественности, используя геном Maize Genome Browser, который является общедоступным в интернете.
“Растение” может быть целым растением, любой его частью или клеточной или тканевой культурой, полученной из растения. Таким образом, выражение “растение” может относиться к любому из следующего: целые растения, растительные компоненты или органы (например, листья, стебли, корни и т.п.), растительные ткани, семена, растительные клетки и/или потомство этого. Растительная клетка - это клетка растения, взятая из растения или полученная путем культивирования из клетки, взятой из растения. Таким образом, выражение “растение маиса” включает целые растения маиса, клетки растения маиса, протопласт растения маиса, клеточную или тканевую культуру растения маиса, из которой растения маиса могут быть регенерированы, каллюсы растения маиса и клетки растения маиса, которые являются интактными в растениях маиса или части растений маиса, такие как семена маиса, стержни початков маиса, цветы маиса, семядоли маиса, листья маиса, стебли маиса, почки маиса, корни маиса, корневые кончики маиса и подобные.
Выражение “локус количественного признака” или “QTL” относится к области ДНК, которая связана с дифференциальной экспрессией фенотипического признака в по меньшей мере одном генетическом фоне, например, в по меньшей мере одной популяции для выведения. QTL близко сцеплены с геном или генами, которые лежат в основе искомого признака.
Перед описанием данного изобретения в деталях необходимо понять, что это изобретение не ограничивается конкретными вариантами осуществления. Также необходимо понимать, что терминология, используемая здесь, применяется с целью описания конкретных вариантов осуществления, и не подразумевается, что она является ограничивающей. Как используется в данном документе и в прилагаемой формуле изобретения, выражения в единственном числе и формы единственного числа, например, включают объекты во множественном числе, если только содержание точно не определяет обратное. Таким образом, например, ссылка на “растение” также включает несколько растений. В зависимости от контекста, применение выражения “растение” может также включать генетически сходное или идентичное потомство такого растения. Применение выражения “нуклеиновая кислота” необязательно включает множество копий такой молекулы нуклеиновой кислоты.
Обеспечиваются способы для определения растений маиса с повышенной устойчивостью к пыльной головне посредством генотипирования связанных маркерных локусов. Устойчивость к пыльной головне у маиса представляет собой агрономически важный признак, так как инфекция пыльной головней снижает урожай.
Достаточно давно было обнаружено, что специфические хромосомные локусы (или участки) могут быть картированы в геноме организма, которые коррелируют с конкретными количественными фенотипами, такими как устойчивость к пыльной головне. Такие локусы называются локусами количественного признака, или QTL. Селекционер растений может преимущественно применять молекулярные маркеры для определения желательных особей путем идентификации маркерных аллелей, которые показывают статистически достоверную вероятность косегрегации с желательным фенотипом, появляющуюся как неравновесное сцепление. Путем определения молекулярного маркера или кластеров молекулярных маркеров, которые косегрегируют с количественным признаком, селекционер, таким образом, определяет QTL. Путем определения и селекции маркерного аллеля (или желательных аллелей из множественных маркеров), который ассоциирует с желательным фенотипом, селекционер растений способен быстро отобрать желательный фенотип путем селекции по точному молекулярному маркерному аллелю (способ, называемый селекцией с использованием маркера, или MAS).
Разнообразные способы, хорошо известные в данной области техники, доступны для обнаружения молекулярных маркеров или кластеров молекулярных маркеров, которые косегрегируют с количественным признаком, таким как устойчивость к пыльной головне. Главная идея, лежащая в основе всех этих способов, состоит в определении маркеров, для которых альтернативные генотипы (или аллели) имеют достоверно разные усредненные фенотипы. Таким образом, производится сравнение среди маркерных локусов по величине различия среди альтернативных генотипов (или аллелей) или уровнем значимости этого различия. Делают вывод, что гены признака расположены вблизи маркера(ов), которые имеют наибольшее сопряженное генотипическое различие.
Два таких способа, используемых для определения QTL, представляют собой 1) структурированный анализ сопряженности на популяционной основе и 2) анализ сопряженности на генеалогической основе. В структурированном анализе сопряженности на популяционной основе линии получают от ранее существующих популяций с множественными основателями, например элитные генеалогические линии. Анализы сопряженностей на популяционной основе основываются на вырождении неравновесного сцепления (LD) и идее о том, что в неструктурированной популяции, только корреляции между QTL и маркерами, близко сцепленными с QTL, будут сохраняться после стольких многих поколений случайного спаривания. В действительности, большинство ранее существующих популяций имеют популяционную подструктуру. Таким образом, применение структурированного анализа сопряженностей помогает контролировать популяционную структуру путем распределения особей в популяции, используя данные, полученные от маркеров, случайно распределенных внутри генома, таким образом, минимизируя неравновесное состояние из-за популяционной структуры внутри отдельных популяций (также называемых субпопуляции). Фенотипические значения сравниваются с генотипами (аллелями) на каждом маркерном локусе для каждой линии в субпопуляции. Достоверное сопряжение маркер-признак обозначает непосредственную близость между маркерным локусом и одним или несколькими генетическими локусами, которые включены в экспрессию этого признака. В анализах сопряженностей на генеалогической основе, LD генерируется путем создания популяции из небольшого количества основателей. Например, в подходе интервального картирования (Lander и Botstein, Genetics 121:185-199 (1989), каждое из многих положений вдоль генетической карты (приблизительно с интервалами в 1 cM) анализируется на вероятность того, что QTL расположен в этом положении. Данные генотипа/фенотипа используются для вычисления для каждого анализируемого положения LOD показателя (логарифм соотношения шансов). Когда LOD показатель достигает критического порогового значения (здесь равного 2,5), существует достоверное основание для расположения QTL в этом положении на генетической карте (которое будет находиться между двумя конкретными маркерными локусами).
Маркеры, связанные с признаком устойчивости к пыльной головне, определяются здесь как маркерные аллели, связанные или с повышенной, или с пониженной устойчивостью к пыльной головне. Способы включают обнаружение присутствия по меньшей мере одной маркерной аллели, связанной или с повышенной, или с пониженной устойчивостью к пыльной головне в идиоплазме растения маиса.
Обычная мера сцепления - это частота, с которой признаки косегрегируют. Она может быть выражена как процентное соотношение косегрегации (частота рекомбинации) или в сантиморганах (cM). cM - это единица измерения частоты генетической рекомбинации. Один cM равен 1% шансу того, что признак на одном генетическом локусе будет отделен от признака на другом локусе благодаря кроссинговеру в одном поколении (означая, что признаки сегрегируют вместе 99% времени). Так как хромосомное расстояние является приблизительно пропорциональным частоте явлений кроссинговера между признаками, то существует приблизительное физическое расстояние, которое коррелирует с частотой рекомбинации. Например, у маиса, 1 cM коррелирует, в среднем, с приблизительно 2140000 пар оснований (2,14 млн. п.о.).
Маркерные локусы являются сами по себе признаками, и их можно оценить согласно стандартному анализу сцепления путем отслеживания маркерных локусов во время сегрегации. Таким образом, один cM равен 1% шансу того, что маркерный локус будет отделен от другого, вследствие кроссинговера в отдельном поколении.
Другие маркеры, сцепленные с QTL маркерами, могут использоваться для предсказания состояния устойчивости к пыльной головне в растении маиса. Это включает любой маркер внутри 50 cM генетического локуса. Чем ближе маркер расположен к QTL маркеру, тем более эффективно и предпочтительно этот маркер выступает в качестве индикатора на желательный признак. Близко сцепленные локусы проявляют внутрилокусную частоту кроссинговера приблизительно 10% или менее, предпочтительно приблизительно 9% или менее, еще более предпочтительно приблизительно 8% или менее, даже более предпочтительно приблизительно 7% или менее, еще более предпочтительно приблизительно 6% или менее, даже более предпочтительно приблизительно 5% или менее, еще более предпочтительно приблизительно 4% или менее, даже более предпочтительно приблизительно 3% или менее, и еще более предпочтительно приблизительно 2% или менее. В наиболее предпочтительных вариантах осуществления соответствующие локусы (например, маркерный локус и локус-мишень, такой как QTL) проявляют частоту рекомбинации приблизительно 1% или менее, например, приблизительно 0,75% или менее, более предпочтительно приблизительно 0,5% или менее, или даже более предпочтительно приблизительно 0,25% или менее. Таким образом, локусы составляют приблизительно 10 cM, 9 cM, 8 cM, 7 cM, 6 cM, 5 cM, 4 cM, 3 cM, 2 cM, 1 cM, 0,75 cM, 0,5 cM, 0,25 cM, 0,1 cM, 0,075 cM, 0,05 cM, 0,025 cM или 0,01 cM или менее отдельно. Другими словами, указывается, что два локуса, которые расположены на одной хромосоме и на таком расстоянии, что рекомбинация между двумя локусами происходит с частотой менее чем 10% (например, приблизительно 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 0,75%, 0,5%, 0,25%, 0,1%, 0,075%, 0,05%, 0,025% или 0,01% или менее), являются “близкими к” друг другу.
Хотя конкретные маркерные аллели могут показывать косегрегацию с фенотипом устойчивости к пыльной головне, важно отметить, что маркерный локус не обязательно является частью QTL локуса, ответственного за экспрессию фенотипа устойчивости к пыльной головне. Например, нет необходимости, чтобы маркерная полинуклеотидная последовательность была частью гена, который придает повышенную устойчивость к пыльной головне (например, была частью гена открытой рамки считывания). Сопряжение между специфической маркерной аллелью с фенотипом либо повышенной, либо пониженной устойчивости к пыльной головне происходит благодаря естественной фазе “конъюгации” сцепления между маркерной аллелью и QTL аллелью в линии предков маиса, от которой происходит QTL аллель. В результате, с повторяющейся рекомбинацией, события кроссинговера между маркером и QTL локусом могут изменить эту ориентацию. С этой целью благоприятная маркерная аллель может изменяться в зависимости от фазы сцепления, которая существует у устойчивого родителя, используемого для создания сегрегирующих популяций. Это не изменяет факт того, что генетический маркер может использоваться для контроля сегрегации фенотипа. Это изменяет только то, какая маркерная аллель рассматривается благоприятной в данной сегрегирующей популяции.
Разнообразные способы, хорошо известные в данном уровне техники, доступны для определения участков хромосомы. Границы таких участков хромосомы наносятся для того, чтобы включать маркеры, которые будут сцеплены с одним или более QTL. Другими словами, участок хромосомы наносится так, чтобы любой маркер, который лежит внутри участка (включая терминальные маркеры, которые обозначают границы участка), мог быть использован в качестве маркеров для устойчивости к пыльной головне. Каждый участок содержит по меньшей мере один QTL и, кроме того, может, конечно, содержать более чем один QTL. Непосредственная близость множества QTL в одном участке может запутывать корреляцию конкретного маркера с конкретным QTL, так как один маркер может демонстрировать сцепление с более чем одним QTL. Напротив, например, если два маркера в непосредственной близости показывают косегрегацию с желательным фенотипическим признаком, то иногда не ясно, определяет ли каждый из этих маркеров одинаковый QTL или два различных QTL. В любом случае знание того, как много QTL находится в конкретном участке не является необходимым, чтобы осуществить или практически применять данное изобретение.
Также обеспечиваются способы селекции с использованием маркера (MAS), в которых фенотипы выбираются на основании маркерных генотипов. Для проведения MAS нуклеиновая кислота, соответствующая маркерной аллели нуклеиновой кислоты, определяется в биологическом образце из растения, которое подлежит селекции. Это определение может иметь форму гибридизации зонда нуклеиновой кислоты с маркерной аллелью или его ампликоном, например, используя аллель-специфическую гибридизацию, Саузерн-анализ, нозерн-анализ, гибридизацию in situ, гибридизацию праймеров с последующей ПЦР амплификацией области маркера, ДНК секвенирование продукта ПЦР амплификации или подобное. Процедуры, используемые для определения маркерных аллелей, известны специалисту в данной области. После того как подтвердилось присутствие (или отсутствие) конкретной маркерной аллели в биологическом образце, растение отбирают и скрещивают со вторым растением, предпочтительно растением маиса из элитной линии. Растения потомства, полученные путем скрещивания, могут быть оценены по этой специфической маркерной аллели, и только те растения потомства, которые имеют желательную маркерную аллель, будут отобраны.
Селекционеры растения маиса надеются на получение комбинаций желательных генетических локусов, таких как те маркерные аллели, которые связаны с повышенной устойчивостью к пыльной головне, с генами для высокого урожая и другими желательными признаками для создания улучшенных сортов маиса. Скрининг больших количеств образцов с помощью немолекулярных способов (например, оценка признака в растениях маиса) может быть дорогостоящим, требующим затрат времени и недостоверным. Применение полиморфных маркеров, описанных в данном документе, когда они генетически сцеплены с локусами устойчивости к пыльной головне, обеспечивает эффективный способ селекции сортов с устойчивостью к пыльной головне в программах выведения. Например, одно из преимуществ селекций с использованием маркера в отношении полевых оценок на устойчивость к пыльной головне состоит в том, что MAS может быть выполнена в любое время года, несмотря на вегетационный период. Более того, эффекты окружающей среды в основном являются несущественными для селекции с использованием маркера.
Другое применение MAS в выведении растений - это содействие восстановлению рекуррентного родительского генотипа путем выведения с помощью возвратного скрещивания. Выведение с помощью возвратного скрещивания - это способ скрещивания потомства обратно с одним из его родителей или родительских линий. Возвратное скрещивание обычно выполняется с целью интрогрессии одного или нескольких локусов из родителя-донора (например, родителя, содержащего желательные маркерные локусы устойчивости к пыльной головне) в иным образом желательный генетический фон из рекуррентного родителя (например, линия маиса, дающая высокий урожай иным способом). Чем больше циклов возвратного скрещивания будет проведено, тем больше генетический вклад рекуррентного родителя в полученный интрогрессивный сорт. Это часто бывает необходимым, так как растения могут быть иным способом нежелательными, например, из-за их низкого урожая, низкой плодородности или подобного. В отличие от этого, штаммы, которые являются результатом интенсивных программ выведения, могут иметь превосходный урожай, плодородность или подобное, будучи всего лишь дефицитными по одному желательному признаку, такому как устойчивость к пыльной головне.
Одно применение MAS - это применение маркеров для повышения эффективности результата интрогрессии или возвратного скрещивания, направленного на введение QTL повышенной устойчивости к пыльной головне в желательный (типично дающий высокой урожай) фон. При возвратном скрещивании с применением маркера специфических маркеров (и с использованием QTL) из донорного источника, например, с элитным или экзотическим генетическим фоном, проводят селекцию среди потомства возвратного скрещивания по донорному признаку и затем используют повторяющееся возвратное скрещивание с элитной или экзотической линией для воспроизведения генома элитного/экзотического фона так много, насколько это возможно.
Наиболее предпочтительные QTL маркеры (или маркерные аллели) для MAS - это те, которые имеют наиболее сильную связь с признаком устойчивости к пыльной головне.
ПРИМЕРЫ
Следующие примеры предложены для иллюстрации, но не ограничения прилагаемой формулы изобретения. Понятно, что примеры и варианты осуществления, описанные в данном документе, представлены только для иллюстративных целей, и что специалисты в данной области техники определят различные реагенты или параметры, которые могут быть изменены без выхода за пределы сущности данного изобретения или объема прилагаемой формулы изобретения.
ПРИМЕР 1
Растительные материалы
Две инбредные линии, 'Ji1037' (родитель-донор) и 'Huangzhao4' (рекуррентный родитель), которые широко отличаются по устойчивости к хозяин-специфическому грибу Sphacelotheca reiliana Clint, использовались как родительские линии для создания всех популяций картирования в данном исследовании. Все растительные материалы, анализируемые в данном исследовании, были искусственно инокулированы S. reiliana Clint. 'Ji1037' показывает полную устойчивость к пыльной головне, и ни одной чувствительной особи не наблюдалось в полевых условиях; тогда как 'Huangzhao4', элитная китайская инбредная линия, является высоко чувствительной к пыльной головне с ~75% чувствительных особей в полевых условиях. В 2004 году BC1 популяцию, состоящую из 314 особей вместе с двумя родителями, выращивали на экспериментальной ферме Цзилиньской академии сельскохозяйственных наук, Gongzhulin. Каждая BC1 особь оценивалась по ее устойчивости против пыльной головни. Устойчивых BC1особей возвратно скрещивали с 'Huangzhao4' для образования BC1:2 семейств (BC2 популяция). В 2005 году ~20 растений из каждого BC1:2 семейства выращивали на отдельном участке для оценки их устойчивостей к пыльной головне. Рекомбинантные особи из BC2 популяций были идентифицированы и возвратно скрещены с 'Huangzhao4' для образования BC2:3 семейств или самоопылялись для получения BC2F2 семейств. В 2006 году приблизительно 80 особей из каждого 59 BC2:3и девять BC2F2 семейств выращивали на экспериментальной ферме Цзилинской академии сельскохозяйственных наук для исследования их устойчивостей к пыльной головне.
ПРИМЕР 2
Искусственная инокуляция и оценка устойчивости в полевых условиях
Сорусы, содержащие телиоспоры S. reliana были собраны с поля в предыдущий вегетационный период и сохранялись в бумажном пакете в сухом и хорошо вентилируемом окружении. До посева споры извлекали из сорусов, фильтровали и затем смешивали с почвой в соотношении 1:1000. Смесь почвы и телиоспор использовали для покрытия зерен маиса при посеве семян для проведения искусственной инокуляции. Растения в период созревания оценивали на присутствие/отсутствие соруса либо в початках, либо в метелках в качестве индикатора чувствительности/устойчивости.
Экстракция ДНК
Листовые ткани от растений возрастом один месяц собирали и размалывали в порошок в жидком азоте. Геномную ДНК экстрагировали, следуя способу, описанному Murray и Thompson (1980).
Генотипирование на SSR маркерах и создание карты сцепления
SSR маркеры вначале использовали для проверки их полиморфизмов между двумя родителями 'Ji1037' и 'Huangzhao4'. Только те SSR маркеры, которые показывали однозначно полиморфные полосы и равномерно распределенные среди десяти хромосом, использовали для генотипирования сегрегирующих популяций. ПЦР реакции проводили следующим образом: денатурация при 94°C в течение 2 минут, с последующими 35 циклами денатурации при 94°C в течение 30 секунд, отжиг при 58°C в течение 30 секунд, удлинения при 72°C в течение 30 секунд, и с конечным этапом удлинения при 72°C в течение 10 минут. Продукты ПЦР подвергались электрофорезу на 6% полиакриламидном геле, с последующим серебряным окрашиванием для визуализации.
BC1 особи общим числом 94 были случайно отобраны из BC1 поколения и проанализированы по их генотипам при использовании 113 полиморфных SSR маркеров. ПЦР полоса была обозначена как '2', если она была такой же, как у родителя-донора, и оценивалась как '1', если она была идентичной с таковой у рекуррентного родителя. Соотношение гомозигот (1/1) к гетерозиготам (1/2) в BC1 возвратно скрещенной популяции анализировали в отношении его соответствия 1:1 на каждом SSR маркере с помощью χ2 анализа. Генетические расстояния между SSR маркерами оценивались с помощью MAPMAKER/Exp версии 3,0b (Lincoln et al. 1992). Впрочем, некоторые маркеры на хромосоме 2 были генотипированы в разных шкалах популяций, и их генетические положения были отрегулированы с помощью интегральных данных в JoinMap программном обеспечении.
Анализ данных и QTL/ген картирование
Предполагаемые QTL, придающие устойчивость к пыльной головне, были определены согласно схеме III анализа на основе признака (Lebowitz et al. 1987). Вкратце, ожидалось, что BC1 особи с QTL устойчивости будут более устойчивыми к пыльной головне, чем те особи, у которых нет QTL устойчивости. Следовательно, маркерная аллель, прилегающая к QTL устойчивости в конъюгации, будет показывать более высокую частоту в устойчивой группе, чем в чувствительной группе. χ2 анализ четвертичных решеток (SAS 8.2 версия) использовался для анализа аллельных частотностей при использовании всех маркеров между устойчивыми и чувствительными группами для сканирования предполагаемого QTL сквозь весь геном. После этого ряд способов применялся для подтверждения основной QTL области и ее эффективности в устойчивости к пыльной головне. Во-первых, SSR маркеры в предполагаемой основной QTL области использовались для генотипирования всех BC1 особей для подтверждения присутствия основного QTL. Во-вторых, процентные соотношения инфицирования BC1 особей оценивали на основании их BC1:2 потомств для подтверждения предполагаемого основного QTL с помощью однофакторного дисперсионного анализа. В-третьих, предполагаемый QTL определяли среди десяти хромосом с помощью композиционного способа интервального картирования (программное обеспечение Windows QTL Cartographer Версия 2.0). В итоге, основной QTL был дополнительно подтвержден путем оценки его генетического эффекта в уменьшении заболеваемости.
ПРИМЕР 3
Образование область-специфических маркеров
Последовательности, доступные в основной QTL области устойчивости, включая заякоренные EST, IDP, RGA, BAC и BAC-концевые последовательности использовали для создания маркеров высокой плотности. Эти последовательности сравнивали с NCBI и MAGI базами данных посредством tBLASTn для получения возможных более длинных последовательностей. Праймер конструировали с использованием PRIMER5.0 программного обеспечения в соответствии со следующими параметрами: 20 нуклеотидов в длину, GC содержание 40%-60%, отсутствие вторичной структуры и отсутствие непрерывных участков отдельного нуклеотида.
Пары праймеров использовали для амплификации соответствующих сегментов от обоих родителей. Циклически повторяющиеся параметры были выставлены так же, как те, что описаны выше, за исключением температуры отжига, которую регулировали в соответствии с различными парами праймеров. Только те ампликоны с одинаковой или большей, чем предполагалось, вырезали из геля и очищали с помощью набора для гелевой экстракции (Qiagen GmbH, Hilden, Германия). Очищенные ПЦР продукты затем клонировали в вектор pGEM-T (Promega, Madison, США). В норме от трех до пяти положительных клонов для каждого ампликона выбирали для секвенирования для того, чтобы избежать какого-либо загрязнения или несовпадения. Последовательность ампликона вначале сравнивали с исходной последовательностью, из которой он был получен, чтобы убедиться, что получена правильная последовательность, и затем сравнение проводили для поиска расхождения последовательностей между двумя родителями с использованием DNAMAN программного обеспечения. InDels были пригодны для создания маркеров сайта, нацеленного на последовательность (STS); тогда как однонуклеотидный полиморфизм (SNP) может использоваться для создания либо SNP маркера, либо CAPS маркера (рестрикционный полиморфизм амплифицированной последовательности). CAPS маркер создается, если SNP относится к данному сайту рестрикции. При создании SNP маркера SNPpicker программа SeqVISTA программного обеспечения использовалась, чтобы увидеть, было ли возможным создать специфический сайт рестрикции путем введения несовпадающей пары оснований в праймер для изменения 'половина сайта' на 'полный сайт' для специфического сайта рестрикции, согласно способу, описанному Niu и Hu (2004).
Пары праймеров использовали для амплификации двух родителей для создания маркеров высокой плотности. Для STS маркеров полиморфные ПЦР полосы должны появиться после электрофореза на агарозном или полиакриламидном геле. Для этих CAPS и SNP маркеров полиморфные полосы могут наблюдаться на агарозном или полиакриламидном геле после обработки определенными рестрикционными эндонуклеазами.
ПРИМЕР 4
Тонкое картирование
Рекомбинантные особи из BC2 популяции отсеивались с помощью SSR маркеров в основной QTL области. Вследствие частичной пенетрантности по отношению к устойчивости к пыльной головне, было бы чрезвычайно рискованно делать вывод о том, несет или нет BC2 рекомбинант ген устойчивости, основываясь на характеристике отдельной особи. Следовательно, авторы приняли на вооружение более надежный способ оценки присутствия/отсутствия гена устойчивости для отдельного BC2рекомбинанта, основываясь как на генотипах, так и на фенотипах его потомства. Если не наблюдается ни одного гена устойчивости в донорной области для определенного BC2 рекомбинанта, то его потомство с донорными областями не будет отличаться от такового без донорных областей по устойчивости к пыльной головне. Напротив, если донорная область скрывает ген устойчивости, то потомство с донорными областями будет показывать достоверно более высокую устойчивость, чем таковое без донорных областей. Путем сравнения размеров вставок 'устойчивых' и 'неустойчивых' донорных областей можно выбрать участок, который скрывает ген устойчивости. Применяя вновь созданные маркеры высокой плотности, можно точно определить донорные области, содержащие ген устойчивости и, следовательно, сузить область устойчивости к очень короткому участку. При всех сравнениях достоверные различия оценивались на SAS программном обеспечении, используя χ2 анализ.
ПРИМЕР 5
Конструкция SSR карты сцепления
SSR маркеры общим количеством 700 проверяли на их полиморфизмы между 'Ji1037' и 'Huangzhao4'. Среди 347 полиморфных SSR маркеров, 113 маркеров, равномерно распределенных среди десяти хромосом, выбирали для генотипирования BC1 популяции картирования. Из этих 113 маркеров, 33 (29,2%) показывали смещение с P<0,05 или с P<0,01. В общем, маркеры, показывающие генетическое смещение, не имели никакого отрицательного влияния на определение QTL. Следовательно, карту сцепления конструировали с использованием всех 113 SSR маркеров. Карта составляла ~1753,4 cM в длину с одним маркером на каждые 14,6 cM в среднем.
ПРИМЕР 6
Картирование предполагаемых QTL
Согласно Схеме III TB анализа (Lebowitz et al. 1987), каждый из 113 SSR маркеров анализировали на его частоту при 1/2 (гетерозигота) и 1/1 (гомозигота) как в устойчивых, так и чувствительных группах. Достоверные систематические ошибки по частотам между устойчивыми и чувствительными группами наблюдались для тех маркеров, которые расположены на четырех хромосомных областях (отрезки 1,02/3, 2,08/9, 6,07 и 10,03/4), означая присутствие четырех предполагаемых QTL (Таблица 1). Например, маркеры на отрезке 2,09 не показывали смещения от 1:1 соотношений гетерозиготы к гомозиготе в целой BC1 популяции. Однако процентные соотношения гетерозиготы при использовании этих маркеров достоверно различаются между устойчивыми и чувствительными группами со значениями P<0,0001 (Таблица 1). Результат убедительно показывал присутствие основного QTL (называемого qHSR1) в этой области. Маркеры как на отрезке 10,03/4, так и отрезке 1,02/3 имели значения P<0,01 (Таблица 1), подразумевая присутствие предполагаемых QTL с меньшими эффектами в этих двух областях. Маркеры на отрезке 6,07 также показывали отклонение с P значениями <0,05 (Таблица 1), подразумевая присутствие возможного минорного QTL. К тому же было обнаружено, что только один маркер на отрезке 4,01 или отрезке 5,03 показывал отклонение по частоте между устойчивыми и чувствительными группами (Таблица 1), было, следовательно, тяжело судить о том, действительно ли QTL присутствует или нет в этих двух отрезках.
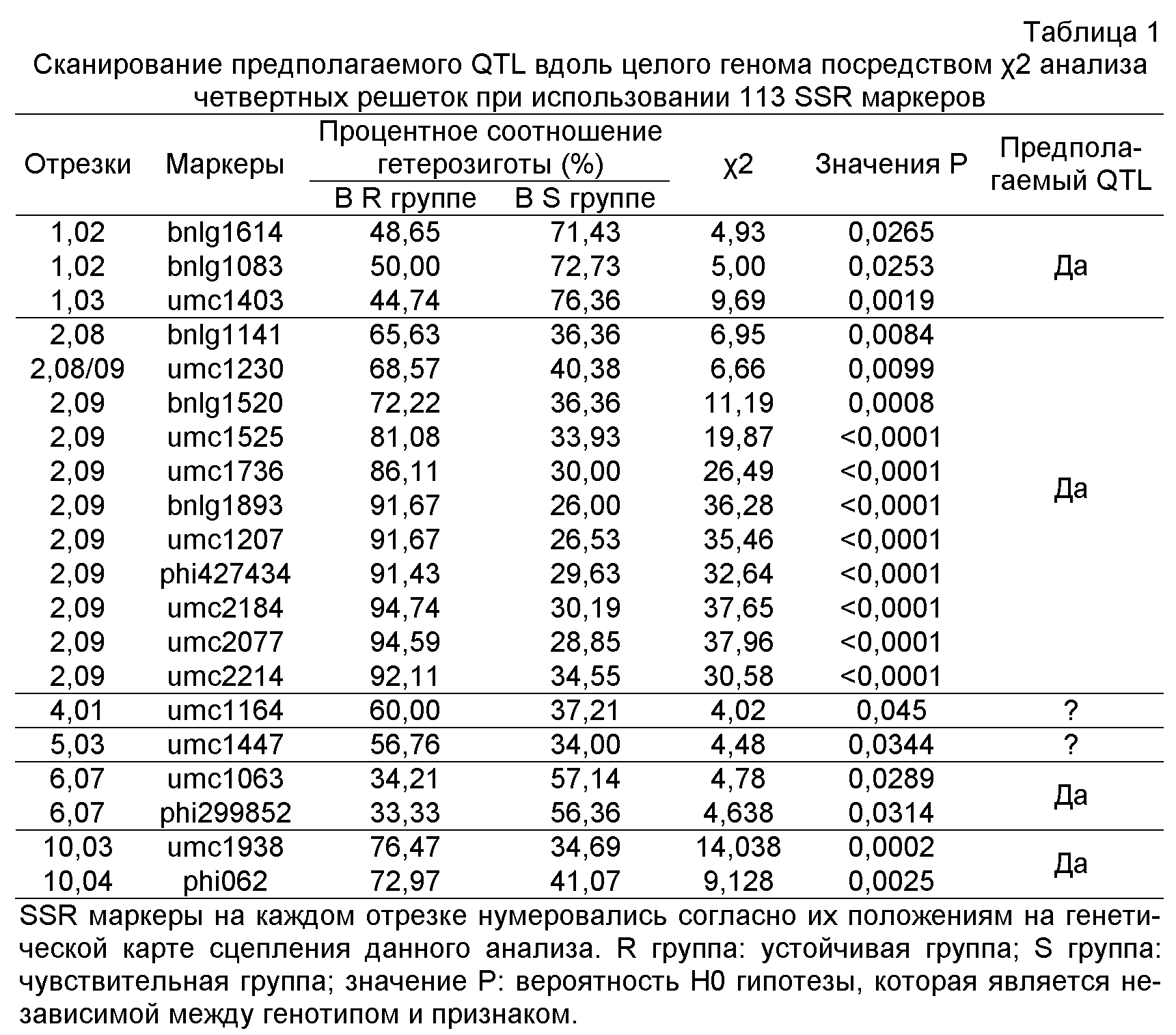
Процентные соотношения гетерозиготы (1/2) в отрезке 2,09 и отрезке 10,03/4 были достоверно более высокими в устойчивой группе, чем таковые в чувствительной группе, позволяя предположить, что аллели устойчивости были получены от родителя-донора 'Ji1037'. Напротив, гетерозиготы (1/2) в отрезке 1,02/3 и отрезке 6,07 имели более низкие процентные соотношения в устойчивой группе по сравнению с таковыми в чувствительной группе, обозначая, что аллели устойчивости были получены от чувствительного родителя 'Huangzhao 4'.
Сравнения четырех предполагаемых QTL в данном исследовании с таковыми, определенными другими группами, дали в результате два общих QTL. QTL в отрезке 1,02/3 в этом исследовании также сообщал Shi et al. (2005) и Lu и Brewbaker (1999). Основной QTL в отрезке 2,09 в нашем исследовании также был определен в исследовании Shi, в котором популяция картирования была получена от скрещивания 'Huangzhao4'×'Mo17' (Shi et al. 2005). Интересно, что одинаковая чувствительная линия 'Huangzhao4' и тесно связанная устойчивая линия 'Ji1037' ('Ji1037' была создана посредством скрещивания 'Mo17'/'Suwan') использовались для получения популяции картирования в данном исследовании. Это может объяснить, почему одинаковый основной QTL со сходным генетическим эффектом определялся в отрезке 2,09 в обоих исследованиях. Основной QTL в отрезке 2,09 является, следовательно, лучшим выбором для клонирования гена устойчивости и его селекции с использованием маркера для улучшения устойчивости маиса к пыльной головне.
ПРИМЕР 7
Подтверждение основного QTL
Для подтверждения присутствия основного QTL (qHSR1) в отрезке 2,09 и его генетического эффекта на устойчивость к пыльной головне, необходимо использовать маркеры для генотипирования всех BC1 особей. Восемь SSR маркеров в bin2,09, включая bnlg1520, umc1736, bnlg1893, umc1207, phi427434, umc2184, umc2077, и umc2214, использовались для генотипирования 118 устойчивых и 158 чувствительных BC1 растений. Из 118 устойчивых особей 107 (90,7%) были гетерозиготами/рекомбинантами и только 11 (9,3%) были гомозиготами при использовании восьми маркеров. Из 158 чувствительных особей, однако, только 60 (38%) были гетерозиготами/рекомбинантами и примерно 98 (62%) были гомозиготами. Эти результаты показывали, что донорная область в отрезке 2,09 может достоверно усиливать устойчивость маиса к пыльной головне, убедительно указывая на присутствие основного QTL в bin2,09. Следует отметить, что пыльная головня была очень опасной в 2004 из-за засухи во время фазы всходов. Чувствительный 'Huangzhao4' имел 86% чувствительных особей, по сравнению с ~75% в нормальный год.
К тому же общее количество 97 BC1:2 семейства было получено от устойчивых BC1 особей. Эти BC1:2 семейства были в диапазоне 5,9%~88,3% по заболеваемости. Однофакторный дисперсионный анализ провели путем анализа как заболеваемости, так и генотипа с каждым из восьми SSR маркеров в области отрезка 2,09. Результаты показывали, что эти восемь SSR маркеров сильно сцеплены с qHSR1 (Таблица 2).
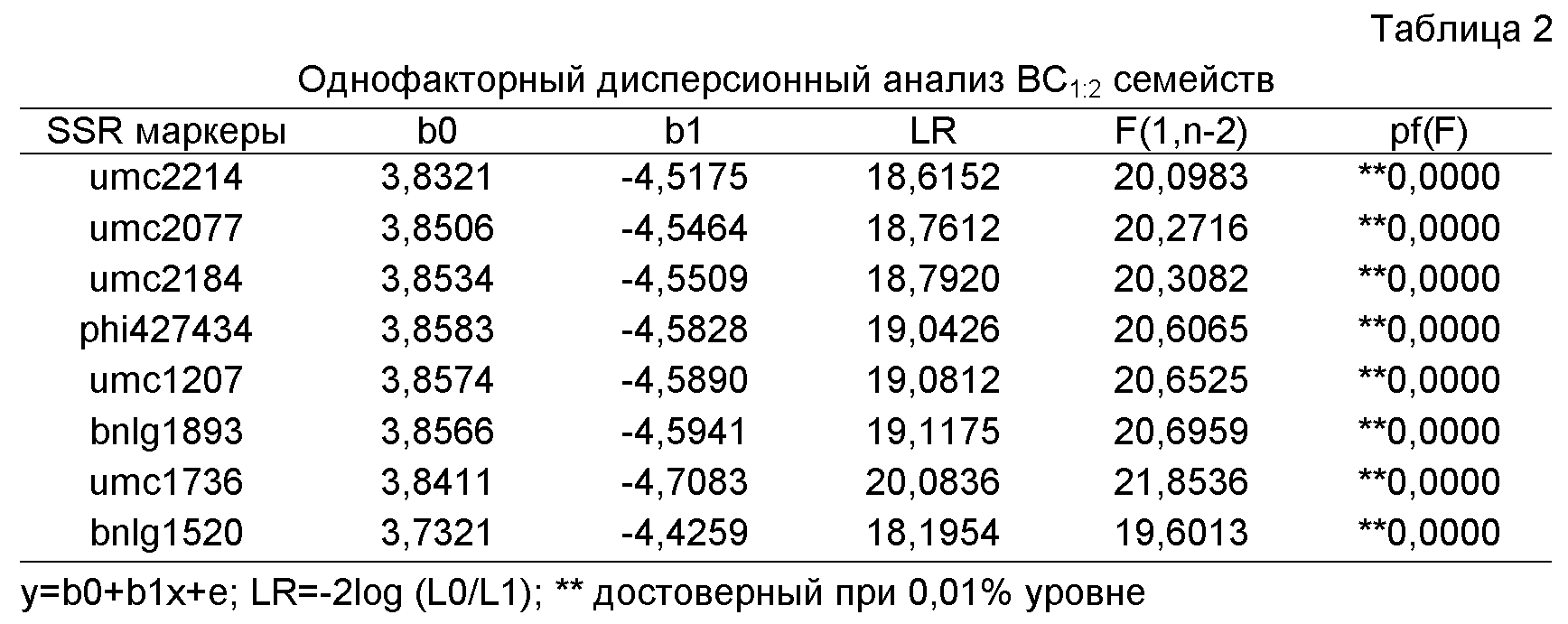
Кроме того, программное обеспечение WinQtlCart 2,0 (Statistical Genetics, Университет штата Северная Каролина, США) использовали для сканирования предполагаемых QTL вдоль целого генома с композиционным интервальным картированием (CIM). Основной QTL с LOD значением 11,8 определяли на отрезке 2,09, ограниченном SSR маркерами umc1736 и umc2184. QTL может объяснять ~30% фенотипической изменчивости.
ПРИМЕР 8
Создание новых маркеров в области отрезка 2,09
В исследовании заявителей пары праймеров общим числом 30 были разработаны на основании последовательностей, доступных в отрезке 2,09 для амплификации родительских линий. Три из 30 пар праймеров были непосредственно превращены в полиморфные STS/SSR маркеры. Два STS маркера, STS1944 и STSrga3195, были созданы из IDP1944 и RGA3195 (Zmtuc03-0811.3195), соответственно. SSR маркер SSR148152 был создан из BAC клона AC148152 (Таблица 3). Из оставшихся 27 пар праймеров 20 давали начало однозначным ампликонам, которые затем клонировали и секвенировали. Выравнивания последовательностей между двумя родительскими линиями показывали изменчивые степени нуклеотидных вариаций в отношении различных ампликонов. Не было обнаружено полиморфизма между двумя родительскими линиями для этих ампликонов, соответствующих двум заякоренным EST. Три SNP наблюдались для ампликонов, соответствующих трем последовательностям маиса (общая длина 2056 п.о. (пар оснований)), доставленных с TIGR веб-сайта. Ампликоны, соответствующие BAC-концевым последовательностям, проявляли более высокие дивергенции с SNP общим числом 18 в последовательности суммарной длиной 1251 п.о. Выравнивание последовательности для четырех основанных на RGA ампликонов давало в результате пять InDels и 26 SNP в кумулятивной 3711 п.о. последовательности. Выравнивание последовательностей для пяти основанных на IDP ампликонов, показало один InDel и 15 SNP в 2814 п.о. Синтения последовательности у риса также использовалась для создания маркеров и показывала только один InDel в 2088 п.о. Взятые вместе, семь InDel и 62 SNP были получены, давая в результате приблизительно один InDel на 1800 п.о. и один SNP на 200 п.о. в qHSR1 области. Основываясь на описанных выше полиморфизмах, дополнительные шесть маркеров были в конечном итоге созданы, включая два SNP маркера (SNP140313 и SNP661, созданные из AZM4_140313 и IDP661, соответственно), один CAPS маркер (CAPS25082, созданный из IDP25082) и три STS маркера (STS171, STSrga840810 и STSsyn1, созданные из IDP171, RGA BG840810, и синтетический ген риса LOC_Os07g07050, соответственно) (Таблица 3 и Фигура 1).
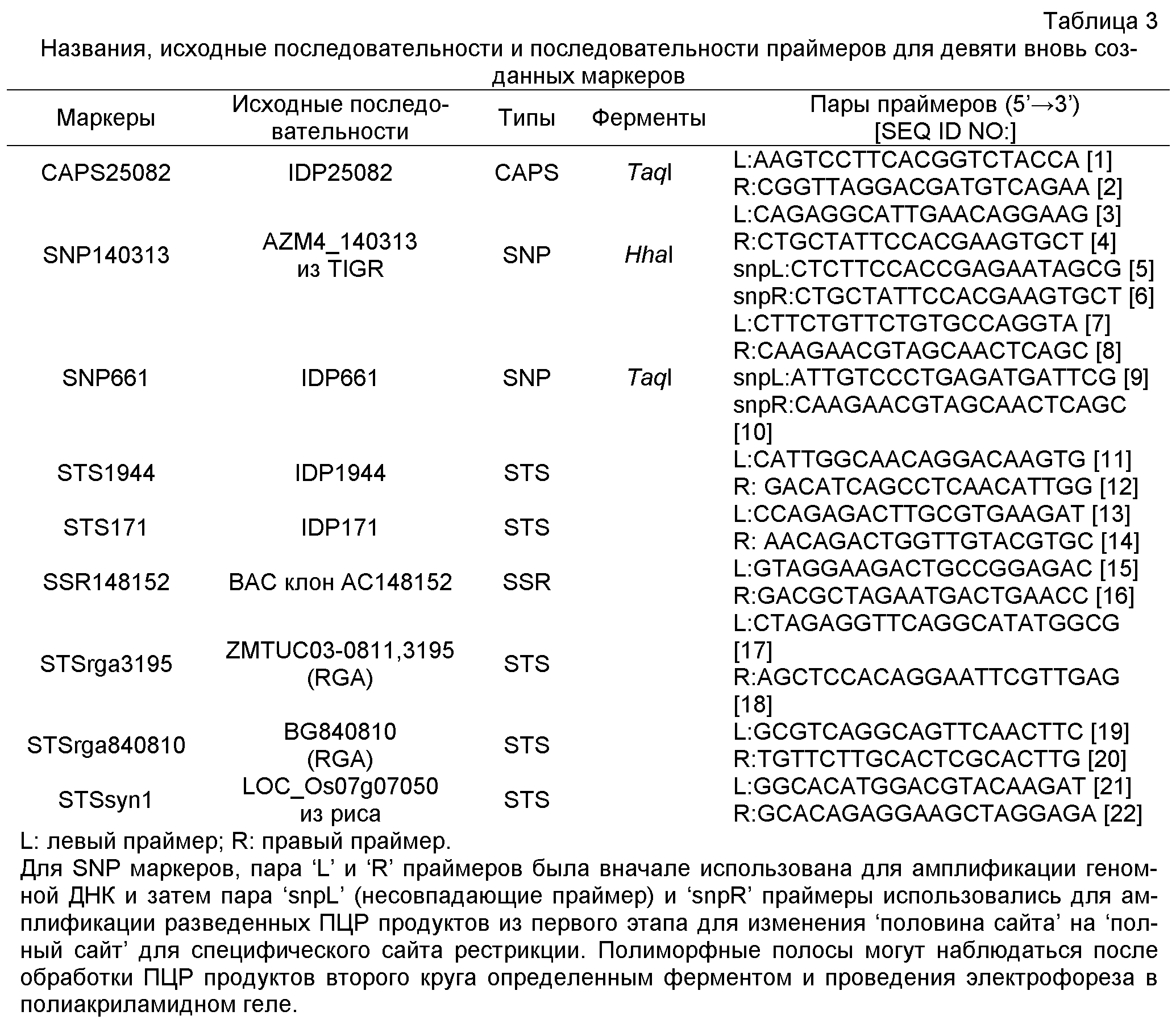
Из девяти вновь созданных маркеров SNP140313 и STSrga3195 были нанесены на карты условным обозначением 1, и STSsyn1 был нанесен на карту условным обозначением 5. Оставшиеся шесть маркеров были достоверно нанесены на карту в отрезке 2,09 с пятью маркерами (SSR148152, CAPS25082, STS171, SNP661 и STS1944) в и одним маркером (STSrga840810) за пределами qHSR1 области устойчивости. Вновь созданные маркеры будут значительно облегчать MAS и тонкое картирование гена устойчивости (Фигура 2).
ПРИМЕР 9
Фенотипическая оценка BC2 рекомбинантов и тонкое картирование основного QTL устойчивости
Основываясь на генотипах родительских BC2 рекомбинантов, заявители использовали маркеры STS171 и/или STS1944 для генотипирования всего потомства BC2 рекомбинантов. Процентное соотношение гетерозигот анализировали на их различие между устойчивыми и чувствительными группами с помощью χ2 анализа. Значение вероятности ≤0,05 (здесь заявители выставляли пороговое значение при p=0,05) обозначает достоверную корреляцию между фенотипом (устойчивостью) и генотипом (гетерозиготой), и родительский BC2 рекомбинант затем был выведен, чтобы нести донорную область устойчивости (Таблица 4). Например, предполагают, что BC2-64 скрывает qHSR1 из-за низкого P значения (<0,05) на STS1944 локусе. Для BC2-50, как STS1944, так и STS171 локусы показывали очень низкие P значения, определяя, что родительские BC2-50 должны скрывать qHSR1. Напротив, не наблюдалось достоверного различия (что показано высоким P значением) в процентных соотношениях гетерозиготы между устойчивыми и чувствительными группами для BC2-25, определяя отсутствие qHSR1 в донорной области. Взятые вместе, 11 BC2 рекомбинанты (BC2-64, BC2-50, BC2-65, BC2-27, BC2-19, BC2-46, BC2-66, BC2-60, BC2-43, BC2-37 и BC2-69), как предполагается, несут qHSR1 и рассматриваются как устойчивые BC2рекомбинанты; тогда как, пять BC2 рекомбинантов (BC2-67, BC2-68, BC2-49, BC2-25 и BC2-45), как предполагается, не скрывают qHSR1 и рассматриваются как чувствительные BC2рекомбинанты (Таблица 4).
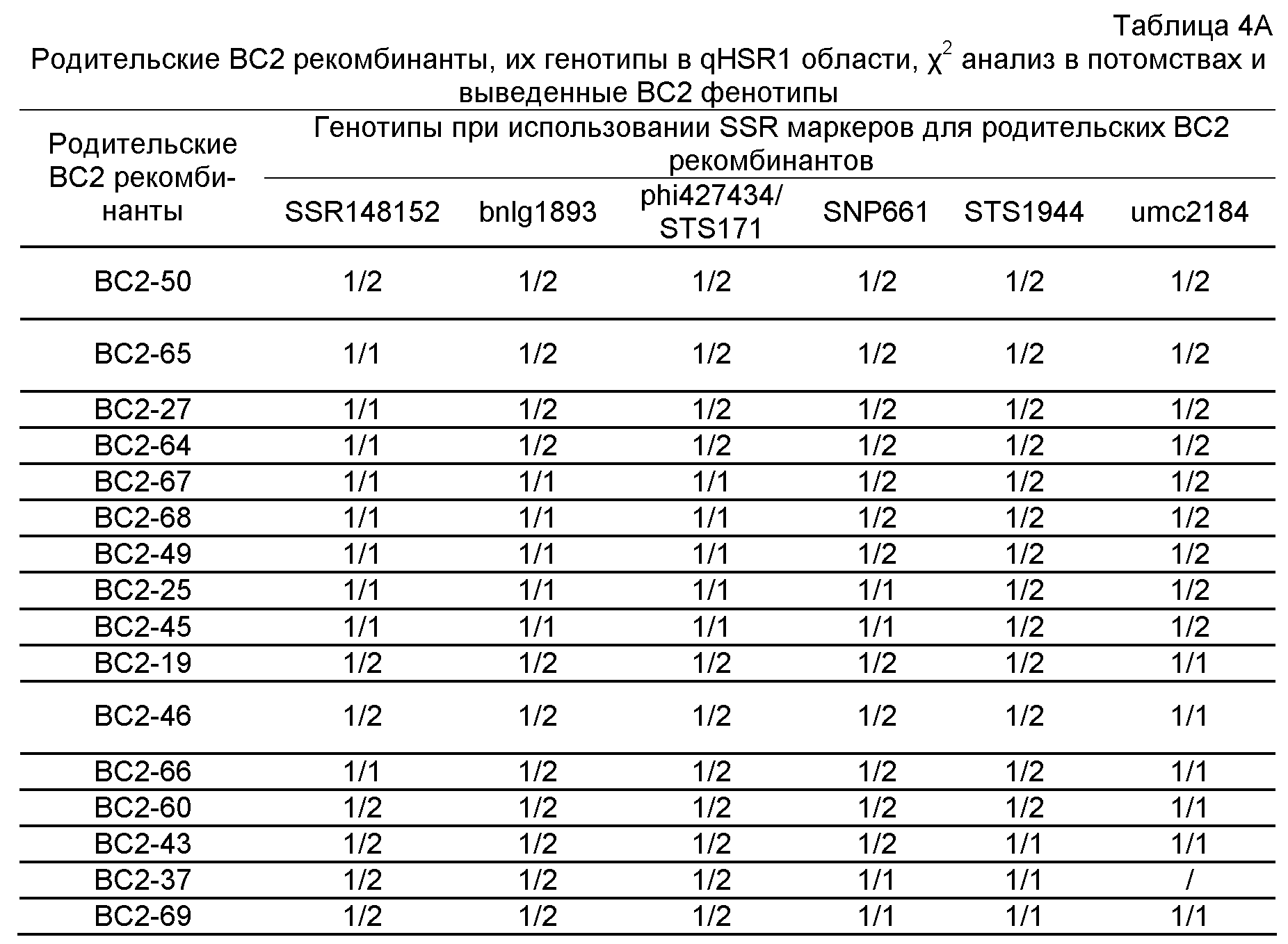
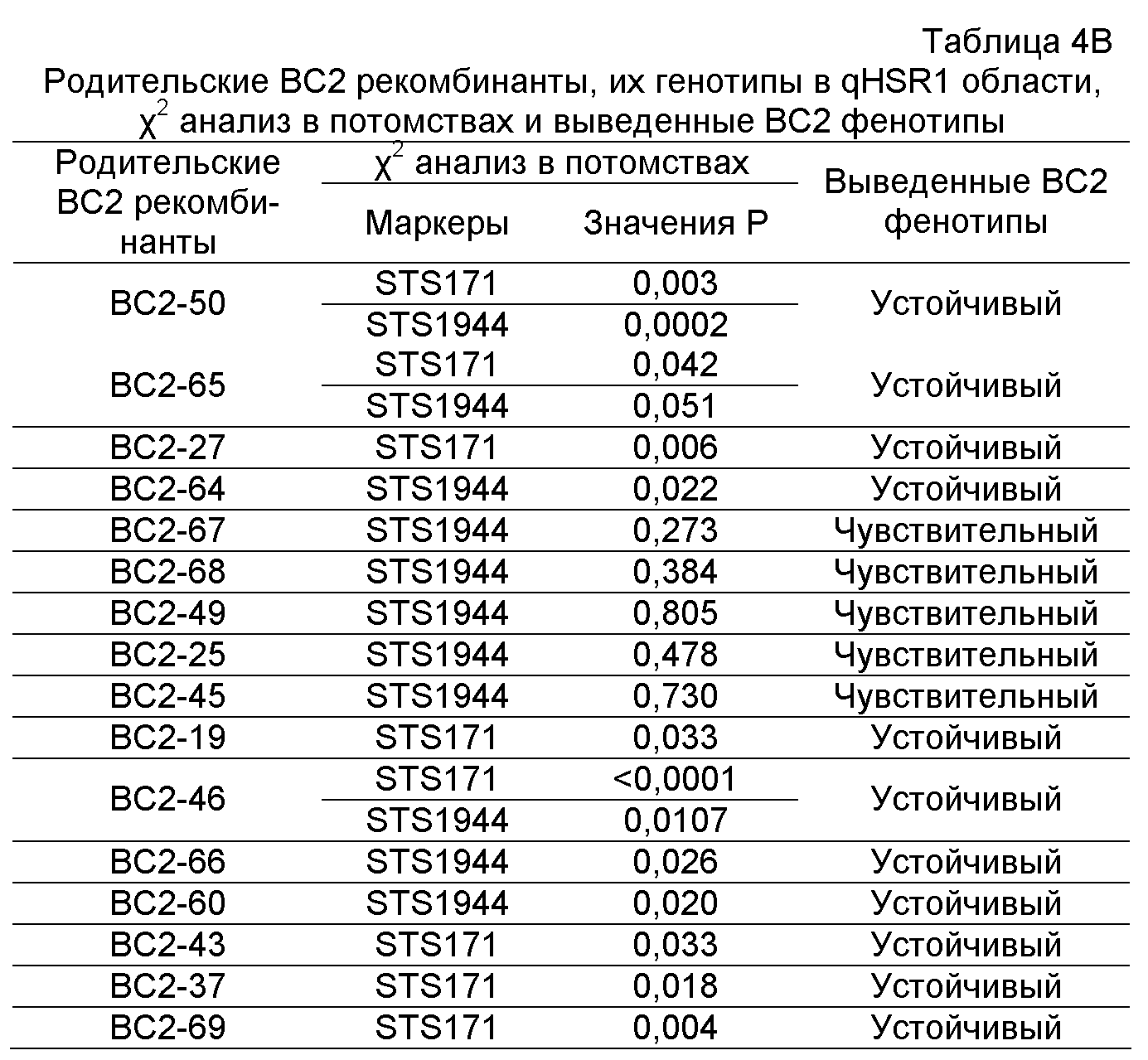
Основываясь на выведенных фенотипах, основная QTL область устойчивости может сузиться при сравнении донорных областей среди всех BC2 рекомбинантов (Таблица 4). BC2-50 имел гетерогенный генотип в qHSR1 области и показывал высокую устойчивость к пыльной головне со значением P<0,01. С левой стороны, три BC2 рекомбинанта (BC2-64, и BC2-65, и BC2-27) с их сайтами кроссинговера по ходу транскрипции bnlg1893 показывали устойчивость к пыльной головне; тогда как другие пять BC2 рекомбинантов с их сайтами кроссинговера против хода транскрипции STS171 (BC2-67, BC2-68 и BC2-49) или SNP 661 (BC2-25 и BC2-45) показывали чувствительность к пыльной головне. С правой стороны, все семь BC2 рекомбинантов показывали устойчивость к пыльной головне, и они имели сайты кроссинговера против хода транскрипции STS1944 (BC2-19, BC2-46, BC2-66 и BC2-60) или SNP661 (BC2-43) или STS171 (BC2-37 и BC2-69). Интересно, что один устойчивый BC2 рекомбинант, BC2-66, имел самую короткую донорную область между SSR148152 и umc2184 и эта донорная область, как предполагают, покрывает qHSR1. Можно сделать вывод из вышеописанного анализа, что основной QTL устойчивости (qHSR1) расположен на участке SSR148152/SNP661, который, как оценивают, равен ~2 млн. п.о., основываясь на физической карте, доступной в Университете Аризоны.
ПРИМЕР 10
Оценка генетического эффекта основного QTL
Теоретически, 93,75% генетического фона в BC2:3 потомстве было возвращено рекуррентному родителю 'Huangzhao4'. Из-за низкого фонового шума в BC2:3потомстве генетический эффект qHSR1 может быть точно оценен с помощью сравнения заболеваемости между двумя группами с/без qHSR1 внутри одного BC2:3 семейства. Особи общим числом 1524 из 24 BC2:3 семейств были проверены на присутствие/отсутствие qHSR1 с маркерами STS171 и STS1944. Заболеваемость оценивали для двух групп с/без qHSR1 в каждом BC2:3семействе. Как следствие, группа без qHSR1 показывала большую чувствительность, чем группа с qHSR1 в каждом BC2:3 семействе со средним различием 28,6%±10,8%. Другими словами, отдельная устойчивость qHSR1 может снижать заболеваемость на 28,6%±10,8% (Фигура 2).
Кроме BC2:3 потомства, BC2F2 потомство также использовали для оценки генетического эффекта qHSR1 в данном исследовании. BC2 популяция вначале была генотипирована с двумя маркерами bnlg1893 и umc2184, давая в результате 73 BC2 растения с qHSR1 и другие 31 BC2 растения без qHSR1. Все эти BC2 растения были самоопылены для получения соответствующих BC2F2 семейств. Как ожидалось, BC2F2 потомство, полученное от BC2 растений с qHSR1, показывало большую устойчивость, чем то, которое получено от BC2 растений без qHSR1. Из 529 BC2F2 особей, полученных от 31 BC2 растений без qHSR1, 204 (38,7%), как обнаружено, были чувствительными. В то же время 262 (19,3%) из 1358 BC2F2 особей, полученных от 73 BC2 растений с qHSR1, были чувствительными. В BC2F2 потомстве, полученном от BC2 растений с qHSR1, сегрегация происходила на qHSR1 локусе, давая в результате одну четвертую BC2F2 особей без qHSR1. Эти BC2F2 особи без qHSR1, как ожидалось, имеют одинаковую заболеваемость, как это оценивалось для 31 BC2F2 семейств без qHSR1 (38,7%). Для других трех четвертых BC2F2 особей с qHSR1 (одна четвертая гомозигот и половина гетерозигот) необходимо оценить их заболеваемость. Основываясь на объяснениях, приведенных выше, можно вывести уравнение 3/4X%+1/4*38,7%=19,3%; где 'X' представляет процентное соотношение инфицирования для таких BC2F2 особей с qHSR1. 'X', как вычислено, равнялся 12,8%. В кратком описании qHSR1 локус мог снижать заболеваемость на 25,9% в BC2F2 потомстве, от 38,7% (особи без qHSR1) до 12,8% (особи с qHSR1).
ПРИМЕР 11
Характеристика геномной последовательности qHSR1
Для того чтобы выделить ген, отвечающий за фенотип, обеспечиваемый qHSR1 локусом, BAC, содержащие область между маркерами MZA6393 (из bacm.pk071.j12.f SEQ ID NO:23) и маркером ST148 версии Mo17 ZMMBBc0478L09f (SEQ ID NO:24) были выделены из BAC библиотеки, полученной от устойчивой Mo17 линии. Эта библиотека была получена с использованием стандартных техник для получения геномной ДНК (Zhang et al. (1995) Plant Journal 7:175-184) с последующей частичной обработкой HindIII и лигированием выбранных по размеру фрагментов в модифицированную форму коммерчески доступного вектора pCC1BAC™ (Epicentre, Madison, США). После трансформации в EPI300™ E. coli клетки согласно инструкциям производителей (Epicentre, Madison, США), 125184 рекомбинантных клонов распределяли в 326 384-луночных микротитровальных планшетах. Эти клоны затем располагали по координатной сетке на нейлоновые фильтры (Hybond N+, Amersham Biosciences, Piscataway, США). Три перекрывающихся клона (bacm.pk071.j12, bacm.pk007.18 и bacm2.pk166.h1) идентифицировали и снимали характеристики.
Библиотека была зондирована с помощью перекрывающихся олигонуклеотидных зондов (пересекающие зонды; Ross et al. (1999) Screening large-insert libraries by hybridization, p. 5,6,1-5,6,52, в A. Boyl, ed. Current Protocols in Human Genetics. Wiley, Нью-Йорк), разработанных на основе последовательностей, обнаруженных в BAC последовательностях. BLAST поисковые анализы были выполнены для скрининга повторяющихся последовательностей и определения уникальных последовательностей для разработки зонда. Положение и расположение с интервалами зондов вдоль контига было подтверждено с помощью ПЦР. Для каждого зонда было разработано два 24-мерных олигомера самокомплементарных в пределах 8 п.о. Их отжиг давал в результате 40 п.о. пересекающих зонда, чьи два 16 п.о. липких конца были заполнены. Точные последовательности были различными, так как они были использованы как пересекающие зонды, а не просто ПЦР праймеры. Зонды для гибридизации были получены, как описано (Ross et al. (1999) выше), и фильтры, полученные путем нанесения координатной сетки BAC библиотеки, гибридизировали и отмывали, как описано (Ross et al. (1999) выше). Анализ на Phosphorimager использовали для определения сигналов гибридизации. После этого мембраны лишали зондов путем помещения их в только закипевший раствор 0,1X SSC и 0,1% SDS и, оставляя их охлаждаться до комнатной температуры в растворе в течение ночи.
BAC, которые давали положительный сигнал, выделяли из планшетов. Рестрикционное картирование, ПЦР эксперименты с праймерами, соответствующими маркерам, использовавшимся ранее, и последовательности, полученные с концов каждого BAC использовали для определения порядка BAC, покрывающих область, представляющую интерес. Три BAC, которые перекрывают целую область (bacm.pk071.j12, bacm.pk007.18 и bacm2.pk166.h1) отбирали для секвенирования. Эти BAC были секвенированы с использованием стандартных методик секвенирования методом дробовика и последовательности собраны с применением Phred/Phrap/Consed программного обеспечения (Ewing et al. (1998) Genome Research, 8:175-185). Собранная последовательность BAC клонов показана в SEQ ID NO:25.
После сборки последовательности, которые, как считается, находятся в области, ближайшей к локусу на основании данных картирования, были аннотированы, означая, что возможные кодирующие ген области и области, представляющие повторяющиеся элементы, были выведены. Кодирующие ген (генные) области искали с применением fGenesH пакета программного обеспечения (Softberry, Mount Kisco, Нью-Йорк, США). fGenesH предсказывал часть белка, которая когда подвергалась BLAST (BLASTx/nr), показывала частичную гомологию по аминокислотному уровню с частью белка риса, которая аннотирована как кодирующая для белка, который придает устойчивость к болезни у риса. Часть последовательности маиса, которая показывала гомологию с этим белком, находилась на конце смежного удлинения BAC консенсусной последовательности и оказывалась укороченной. Для того чтобы получить полное изображение гена в BAC маиса, аминокислотную последовательность риса использовали в tBLASTn анализе против всех других консенсусных последовательностей из одинакового клона BAC маиса. Это дало в результате определение консенсусной последовательности, представляющей 3' конец гена маиса. Однако центральная часть гена не была представлена в последовательностях, полученных таким образом. ПЦР праймеры были разработаны на основании 5' и 3' областей предполагаемого гена и использовались в ПЦР эксперименте с ДНК из исходного BAC маиса в качестве матрицы. Последовательность полученного ПЦР продукта содержала последовательность, соединенную мостиком с 5' и 3' фрагментами, выделенными ранее.
Некоторые открытые рамки считывания были определены в SEQ ID NO:25, включая ген ингибитора ксиланазы (SEQ ID NO:26/27), белок ассоциированной с клеточной стенкой киназы (SEQ ID NO:31/32), два гена белка димеризации HAT семейства (SEQ ID NO:34/35 и SEQ ID NO:37/38) и два неохарактеризованных белка (SEQ ID NO:40/41 и SEQ ID NO:43/44). Ген ингибитора ксиланазы показывает полиморфное различие по сравнению с ортологом, обнаруженным в B73. Mo17 ген является на 97,8% идентичным, при Clustal V выравнивании, с B73 геном, и содержит две делеции 2 и 10 аминокислот (см. Фигуру 3). Геномная ДНК область, включая 2,4 т.п.н. по ходу транскрипции ОРС (открытые рамки считывания, или ORF) из SEQ ID NO:43/44 показана в SEQ ID NO:45. Последовательность нуклеиновой кислоты, кодирующая дополнительный EST фрагмент из qHSR области, показана в SEQ ID NO:46.
Какой-либо один, любая комбинация или все из этих генов могут придавать или вносить вклад в устойчивость к пыльной головне на qHSR1 локусе. Ожидается, что полиморфизмы, связанные с Mo17, который является устойчивым к пыльной головне, будут диагностическими для последовательностей, которые определяют qHSR1.
ПРИМЕР 12
Возвратное скрещивание qHSR1 локуса в чувствительных линиях
Интрогрессию qHSR1 локуса инбредных линий проводили, чтобы подтвердить, что qHSR1 локус мог быть успешно возвратно скрещенным в инбредах, и что гибриды, полученные с инбредными линиями с qHSR1 локусом, будут иметь усиленную или полученную устойчивость к пыльной головне.
MO17 представляет собой инбредную линию с сильной устойчивостью к пыльной головне, но его слабые агрономические характеристики делают его слабым родителем-донором в отсутствие применения способов выведения с применением маркера, описанных в данном документе. Чтобы продемонстрировать фенотипическое значение qHSR1 локуса, локус интрогрессировали в 10 элитных инбредных линий, с дополнительными 25 инбредами, добавленными во второй и до BC3 стадии следующим образом. F1 популяцию, полученную от скрещивания между MO17 и элитными инбредными линиями, возвратно скрещивают еще один раз с рекуррентными родителями (элитными инбредами), получая в результате BC1 популяцию. Всходы высаживали в грунт, генотипировали маркерами по всему геному, отбирали (с помощью qHSR1 локуса и минимального MO17 фона) и возвратно скрещивали снова с рекуррентными инбредными линиями для создания BC2 популяции. BC2 семейства генотипировали и подвергали селекции снова на присутствие MO17 qHSR1 области. Положительные растения возвратно скрещивают с рекуррентными родительскими инбредами еще один раз для создания BC3 популяций. Семена из этих BC3 популяций высаживали и растения генотипировали. BC3 растения с или без области, представляющей интерес, самоопыляли для создания BC3S1 семейств. Эти семейства использовали для фенотипического сравнения (BC3S1 с или без области, представляющей интерес).
Для того чтобы наблюдать эффективность qHSR1 гена в гетерозиготной ситуации, такой как будет обнаружена в коммерческом гибриде, были проведены соответствующие тест-скрещивания. В частности, особи BC3S1 растений, гомозиготных по qHSR1 гену, а также растения, гомозиготные по чувствительной аллели, использовались для проведения тест-скрещиваний с выбранными инбредами.
В случае как BC3S1 линий, так и гибридов ожидаемые фенотипические различия определяют достоверное улучшение устойчивости к пыльной головне в линиях и гибридах, содержащих область, несущую qHSR1. Данные ясно показывают, что использование методик скрещивания для перенесения гена вариантов осуществления в другие линии, генетически способные применить ген, приводит к усиленной устойчивости к пыльной головне.
Как результат тонкого картирования расположения qHSR1 гена можно использовать любые два фланкирующих маркера, которые являются генетически сцепленными с qHSR1 геном для селекции по небольшой хромосомной области с кроссоверами как норзен, так и саузерн qHSR1 гена. Это имеет полезный результат в снижении замедления сцепления, которое может быть смешанным фактором, когда пытаются интрогрессировать специфический ген из неадаптированной идиоплазмы, такой как MO17, в элитную идиоплазму. Предпочтительно иметь близко сцепленные фланкирующие маркеры для селекции гена, и особенно предпочтительно иметь маркеры внутри самого гена. Это является улучшением применения отдельного маркера или отдаленных фланкирующих маркеров, поскольку с отдельным маркером или с отделенными фланкирующими маркерами сцепление, связанное с qHSR1, может быть разрушено, и путем селекции на такие маркеры более вероятно непреднамеренно выбрать растения без qHSR1 гена. Так как селекция с использованием маркера часто используется вместо фенотипической селекции, как только было подтверждено сопряжение маркер-признак, то неудачным результатом такой ошибки будет выбор растений, которые не являются устойчивыми к пыльной головне и выбраковка растений, который являются устойчивыми к пыльной головне. В этой связи маркеры внутри qHSR1 гена являются особенно пригодными, так как они будут, по определению, оставаться сцепленными с устойчивостью к пыльной головне, которая усилена или обеспечена геном. Дополнительно, маркеры внутри qHSR1 локуса также пригодны для сходной цели. Благодаря их такой непосредственной близости к qHSR1 гену, они с высокой вероятностью остаются сцепленными с qHSR1 геном. Как только произошла интрогрессия с qHSR1 геном, такие элитные инбреды могут использоваться как для получения гибридных семян и как донорный источник для дальнейшей интрогрессии qHSR1 гена в другие инбредные линии.
Таким образом, данные показывают, что инбредное потомство, превращенное с использованием MO17 в качестве донорного источника, сохраняет укороченный MO17 хромосомный участок. Инбреды, содержащие укороченный MO17 хромосомный участок, очень полезны в качестве донорных источников сами по себе, и не существует необходимости возвращаться к MO17 в качестве донорного источника. Используя выведение с применением маркера, как описано в данном документе, укороченный MO17 хромосомный участок может быть дополнительно уменьшен в размере, при необходимости, без опасения потери сцепления между маркерами и qHSR1 геном.
ПРИМЕР 13
Применение qHSR1 в качестве трансгена для создания устойчивых растений кукурузы
qHSR1 ген может быть экспрессирован также как трансген, позволяя модулировать его экспрессию в различных обстоятельствах. Следующие примеры показывают, как qHSR1 ген может быть экспрессирован различными путями для борьбы с различными болезнями или защиты различных частей растения, или просто для переноса qHSR1 гена в различные линии кукурузы в качестве трансгена, как альтернатива способу, описанному в Примере 12.
Пример 13a:
В этом примере qHSR1 ген-кандидат (ингибитор ксиланазы и другие аннотированные гены в QTL участке, как определено в Примере 11) экспрессируется, используя свой собственный промотор.
Для того чтобы трансформировать полные qHSR1 гены, включая промотор и кодирующие белок области, ДНК фрагменты, содержащие полную кодирующую область и область приблизительно 2 т.п.н. по ходу транскрипции амплифицировали с помощью ПЦР, используя BAC клон в качестве матричной ДНК. Для осуществления клонирования с использованием Gateway® Technology (Invitrogen, Carlsbad, США), attB сайты были встроены в ПЦР праймеры, и амплифицированный продукт клонировали в pDONR221 вектор с помощью Gateway® П.О. реакции рекомбинации. Полученный фрагмент, фланкированный attL сайтами, переносили с помощью Gateway® LR реакции рекомбинации в бинарный вектор. Конструкт ДНК затем использовали для трансформации кукурузы, как описано в Примере 14.
Пример 13b:
Для того чтобы экспрессировать qHSR1 гены (ингибитор ксиланазы и другие аннотированные гены в QTL участке, как определено в Примере 11) во всем растении на низком уровне, кодирующая область генов и их терминаторы располагаются позади промоторов либо гена актина риса (патенты США № 5641876 и № 5684239), либо F3.7 гена (патент США № 5850018). Для обеспечения клонирования с применением Gateway® Technology (Invitrogen, Carlsbad, США) attB сайты были встроены в ПЦР праймеры, которые использовались для амплификации qHSR1 генов, начиная с 35 п.о. по ходу транскрипции от его инициирующего кодона. NotI сайт добавляли к attB1 праймеру. Амплифицированный qHSR1 продукт клонировали в pDONR221 вектор с помощью Gateway® П.О. реакции рекомбинации (Invitrogen, Carlsbad, США). После клонирования полученный qHSR1 ген фланкировали attL сайтами, и он имел уникальный NotI сайт на 35 п.о. по ходу транскрипции инициирующего кодона. После этого промоторные фрагменты были амплифицированы с помощью ПЦР, используя праймеры, которые содержат NotI сайты. Каждый промотор сшивали с NotI сайтом qHSR1. На последнем этапе химерный генный конструкт перемещали с помощью Gateway® LR реакции рекомбинации (Invitrogen, Carlsbad, США) в бинарный вектор PHP20622. Он используется для трансформации кукурузы, как описано в Примере 14.
Пример 13c:
Для того чтобы экспрессировать qHSR1 гены (ингибитор ксиланазы и другие аннотированные гены в QTL участке, как определено в Примере 11) во всем растении на высоком уровне, кодирующую область генов и их терминаторы помещают позади промотора, 5' нетранслируемой области и интрона гена убиквитина маиса (Christensen et al. (1989) Plant Mol. Biol. 12:619-632; Christensen et al. (1992) Plant Mol. Biol. 18:675-689). Для того чтобы обеспечить клонирование с использованием Gateway® Technology (Invitrogen, Carlsbad, США), attB сайты встраивали в ПЦР праймеры, которые использовались для амплификации qHSR1 гена, начиная с 142 п.о. по ходу транскрипции инициирующего кодона. Амплифицированный продукт клонировали в pDONR221 (Invitrogen, Carlsbad, США) с использованием Gateway® П.О. реакции рекомбинации (Invitrogen, Carlsbad, США). После клонирования полученный qHSR1 ген фланкировали attL сайтами. На последнем этапе qHSR1 клон переносили с помощью Gateway® LR реакции рекомбинации (Invitrogen, Carlsbad, США) в вектор, который содержал промотор убиквитина маиса, 5' нетранслируемую область и первый интрон гена убиквитина, как описано Christensen et al. (выше) с последующим Gateway® ATTR1 и R2 сайтами для вставки qHSR1 гена, позади кассеты экспрессии убиквитина. Вектор также содержал маркерный ген, подходящий для трансформации кукурузы, поэтому полученная плазмида, несущая химерный ген (промотор убиквитина маиса -5' нетранслируемая область убиквитина - интрон убиквитина 1 - qHSR1), является подходящей для трансформации кукурузы, как описано в Примере 14.
Пример 13d:
Для того чтобы экспрессировать qHSR1 гены (ингибитор ксиланазы и другие аннотированные гены в QTL участке, как определено в Примере 11) на предпочтительном для корня, низком уровне экспрессии, кодирующую область генов и их терминаторы помещали позади предпочтительного для корня промотора, такого как следующие, но не ограничиваясь ими: NAS2 промотор маиса, Cyclo промотор маиса (заявка на патент США 2006/0156439, опубликованная 13 июля 2006), ROOTMET2 промотор маиса (WO05063998, опубликованная 14 июля 2005), CR1BIO промотор (WO06055487, опубликованная 26 мая 2006), CRWAQ81 (WO05035770, опубликованная 21 апреля 2005) и ZRP2.47 промотор маиса (NCBI номер доступа: U38790; GI № 1063664). Фрагмент, описанный в Примере 13b, содержащий qHSR1 кодирующую область, фланкированную attL сайтами, и содержащий уникальный NotI сайт 35 п.о. по ходу транскрипции инициирующего кодона qHSR1, использовали для обеспечения клонирования с применением Gateway® Technology (Invitrogen, Carlsbad, США). Промоторный фрагмент амплифицировали с помощью ПЦР, используя праймеры, которые содержат NotI сайты. Каждый промотор сшивали с NotI сайтом qHSR1. На последнем этапе химерный генный конструкт переносили с помощью Gateway® LR реакции рекомбинации (Invitrogen, Carlsbad, США) в бинарный вектор PHP20622. Он используется для трансформации кукурузы, как описано в Примере 14.
ПРИМЕР 14
Трансформация маиса, вызванная Agrobacterium, и регенерация трансгенных растений
Рекомбинантные ДНК-конструкты, полученные в Примере 6a-6d, использовались для получения трансгенных растений маиса следующим образом.
Маис трансформировали выбранными полинуклеотидными конструктами, описанными в Примере 13a и 13c с использованием способа Zhao (патент США № 5981840, и PCT патентная публикация WO98/32326). Вкратце, незрелые зародыши были выделены из маиса и зародыши приводили в контакт с суспензией Agrobacterium, где бактерии были способны перенести полинуклеотидный конструкт по меньшей мере одной клетке по меньшей мере одного из незрелых зародышей (этап 1: этап инфицирования). На этом этапе незрелые зародыши погружали в суспензию Agrobacterium для инициации инокуляции. Зародыши совместно культивировали некоторое время с Agrobacterium (этап 2: этап совместного культивирования). Незрелые зародыши культивировали на твердой среде после этапа инфицирования. После этого периода совместного культивирования проводили необязательный этап "покоя". На этом этапе покоя зародыши инкубировали в присутствии по меньшей мере одного антибиотика, который, как известно, ингибирует рост Agrobacterium без добавления селективного средства для растительных трансформантов (этап 3: этап покоя). Незрелые зародыши культивировали на твердой среде с антибиотиком, но без селективного средства, для удаления Agrobacterium и в течение фазы покоя для инфицированных клеток. Далее, инокулированные зародыши культивировали на среде, содержащей селективное средство, и извлекали растущий трансформированный каллюс (этап 4: этап селекции). Каллюс затем регенировали в растения (этап 5: этап регенерации), и каллюсы, выращенные на селективной среде, культивировали на твердой среде для регенерации растений.
ПРИМЕР 15
Оценка трансгенного растения
Трансгенные растения создаются, как описано в Примере 14 с использованием конструктов, описанных в Примерах 13a-13d, соответственно. Их оценивают по протоколам, описанным в Примере 9, на улучшение в устойчивости к пыльной головне.
ПРИМЕР 16
Анализ распределения qHSR1 гена в идиоплазме
и определение вариантов qHSR1 последовательности
После определения, секвенирования и тонкого картирования qHSR1 другие линии подвергаются скринингу по отношению к qHSR1 гену. Для определения присутствия qHSR1 гена в другой идиоплазме маиса комбинации ген-специфических праймеров используются для амплификации геномной ДНК из разнообразной выборки инбредных линий маиса с помощью полимеразной цепной реакции. Определяются инбредные линии с qHSR1 (MO17 аллель). Таким образом, в дополнение к использованию MO17 в качестве донорного источника, другие источники, содержащие qHSR1 ген, могут также использоваться как донорный источник.
Варианты qHSR1 гена также определяют и анализируют на однонуклеотидные полиморфизмы (SNP). Не все из аллельных вариантов qHSR1 гена определяли устойчивый фенотип. Инбредные линии с отчетливыми гаплотипами или аллели оценивали по их устойчивости к пыльной головне и определяли предполагаемые устойчивые аллельные варианты. Их эффективность в устойчивости к пыльной головне подтверждали в сегрегирующих популяциях (например, F2 популяции). SNP могут использоваться как маркеры для точного определения и отслеживания qHSR1 последовательности в программе выведения растений и для проведения различия между устойчивыми и чувствительными аллельными вариантами. Дополнительно, эти SNP указывают на то, что существуют вариантные последовательности, которые показывают устойчивый фенотип и могут быть использованы в способах и продуктах, раскрытых здесь.
ПРИМЕР 17
Дополнительный анализ распределения qHSR1 гена в идиоплазме и определение вариантов qHSR1 последовательностей
qHSR1 область была дополнительно определена как 172-т.п.о. участок в устойчивой родительской линии Ji1037 и 56-т.п.о. участок в чувствительной родительской линии Huangzhao4. Расхождение в размере вызвано делецией (116 т.п.о.) в Huangzhao4 по сравнению с Ji1037. Ключевые рекомбинанты, которые использовались для тонкого картирования, были повторно исследованы в отношении их устойчивостей к пыльной головне в Гончжулин в провинции Цзилинь и в зимней теплице на острове Хайнань, и показывают соответствующую устойчивость к пыльной головне.
Положительные Mo17 BAC клоны были отобраны на основании характеристики qHSR1 области. К тому же маркеры в qHSR1 области были использованы для скрининга Huangzhao4 BAC библиотеки. Минимальные мозаичные положительные BAC клоны подвергались секвенированию для получения широкого представления о qHSR1 области. Сравнительный обзор Mo17, B73 и Huangzhao4 инбредных линий показан на Фигуре 4. Были определены в общем шесть дополнительных предполагаемых генов, белок с анкириновым повтором (SEQ ID NO:104-106, кодирующая последовательность, трансляция белка и геномная ДНК, соответственно) был обнаружен во всех трех инбредных линиях, ген, кодирующий белок ассоциированной с клеточной стенкой киназы (SEQ ID NO:31-33), отсутствовал в Huangzhao4, ген, кодирующий гидролазу (SEQ ID NO:107-109), отсутствовал в B73 и Huangzhao4, два из трех белков Xa21-подобной киназы (SEQ ID NO:110-115) отсутствовали в Huangzhao 4, и третий белок Xa21-подобной киназы (SEQ ID NO:115-117) присутствует в по меньшей мере Mo17 и Huangzhao4.
ПРИМЕР 18
Характеристика генов кандидатов устойчивости в qHSR1 области
Три подхода было использовано для подтверждения генов кандидатов устойчивости: 1) исследование комплементарности, так как и Mo17, и B73 показывают некоторую устойчивость к пыльной головне, три совместно используемых гена (белок с анкириновым повтором, белок ассоциированной с клеточной стенкой киназы и Xa21D киназа), вероятно являются генами кандидатами, вносящими вклад в фенотип, все эти три гена субклонировали из положительных BAC клонов в вектор экспрессии, с последующей трансформацией в чувствительные инбредные линии; 2) методика РНК-интерференции, векторы для РНК-интерференции конструировали для всех шести предполагаемых генов в 172-т.п.о. области и затем трансформировали в Mo17 для нокаута предполагаемых генов один за одним, это позволяет определить те гены, которые вовлечены в устойчивость к пыльной головне; 3) сверхэкспрессия генов кандидатов в чувствительный линиях, конструкты сверхэкспрессии с каждым из шести отдельных генов кандидатов, сцепленных с сильными промоторами, конструировали и встраивали в чувствительные линии для определения того, является ли любой из этих отдельных генов кандидатов в qHSR1 области достаточным для придания устойчивости к пыльной головне.
ПРИМЕР 19
Образование маркеров в qHSR1 области, пригодных для селекции с использованием маркера
BAC последовательности, особенно те, которые кодируют последовательности, были в дальнейшем использованы для создания маркеров высокой плотности. В целом, восемь маркеров было создано в 172-т.п.о. области (Ji1037 qHSR1, которая является эквивалентной Mo17) (Таблица 5). Эти маркеры использовали для интеграции qHSR1 устойчивости в другие чувствительные инбредные линии посредством селекции с использованием маркера.

Генетический эффект qHSR1 области на устойчивость к пыльной головне был проанализирован с использованием одиннадцати BC4 популяций. Mo17 инбредная линия была скрещена с Ji853, 444, 4287, 98107, 99094, Chang7-2, V022, V4, 982, 8903 и 8902. qHSR1 область затем была возвратно скрещена для четырех поколений, используя маркеры, такие как MZA6393, 2M10-5, STS148-1, STS661 и E148-4, для селекции растений с qHSR1 областью. Эти BC4 популяции были фенотипированы в зимней теплице на острове Хайнань. Эти BC4 популяции содержали растения как с, так и без qHSR1 (Таблицы 6A и B). Растения без qHSR1 области рассматривались как контроли, чтобы указать на фоновую устойчивость различного генетического фона. Особи растений в BC4 популяциях были оценены по устойчивости к пыльной головне, и процентное соотношение устойчивых растений было вычислено для групп как с, так и без qHSR1 области. qHSR1 область сообщала повышение приблизительно на 25% в индексе устойчивости. Инбредная линия '4287' сама по себе имеет qHSR1 область и показывает устойчивость к пыльной головне, поэтому интеграция qHSR1 области в '4287' генетический фон имела минимальный эффект на устойчивость к пыльной головне.
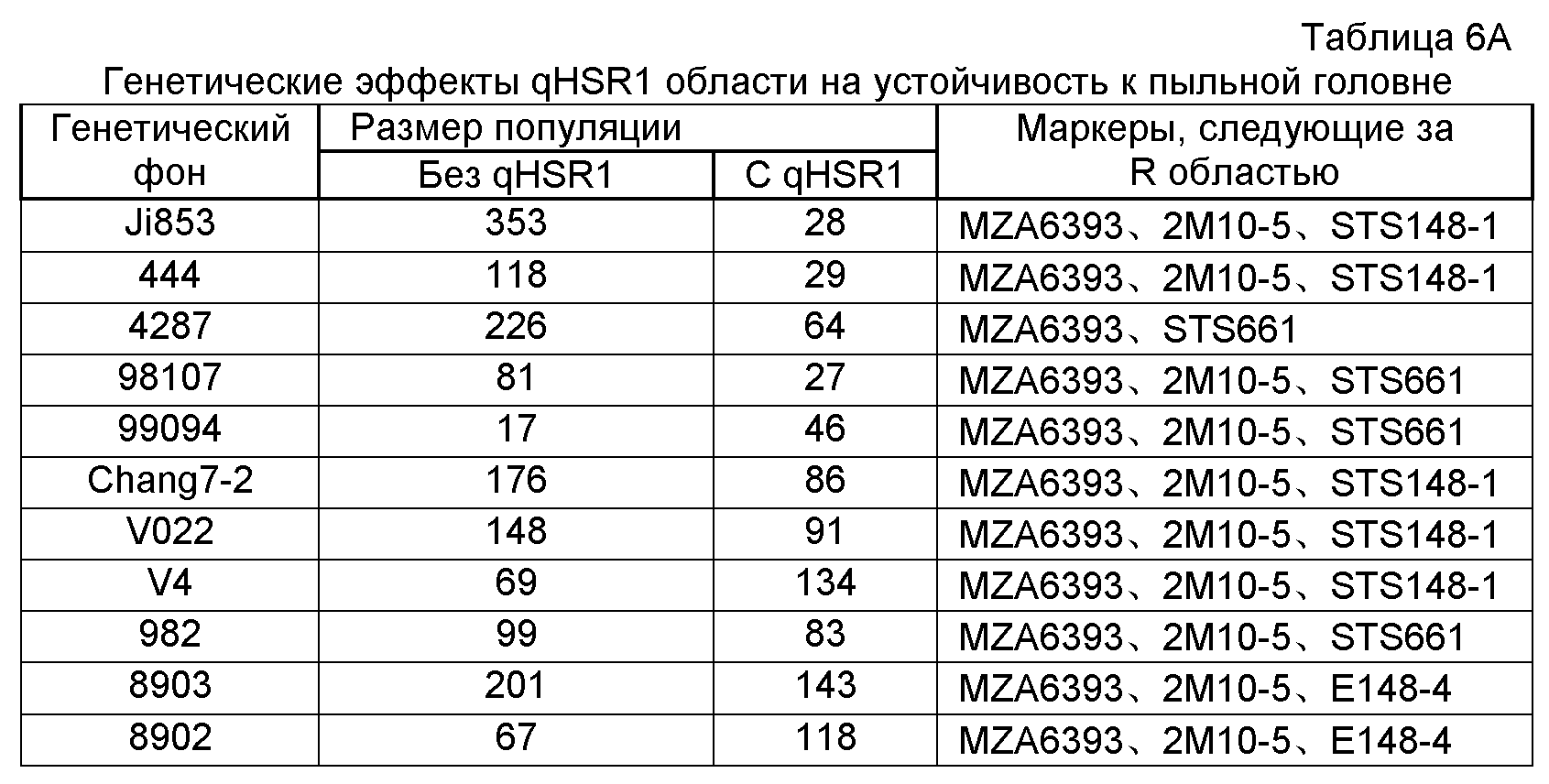
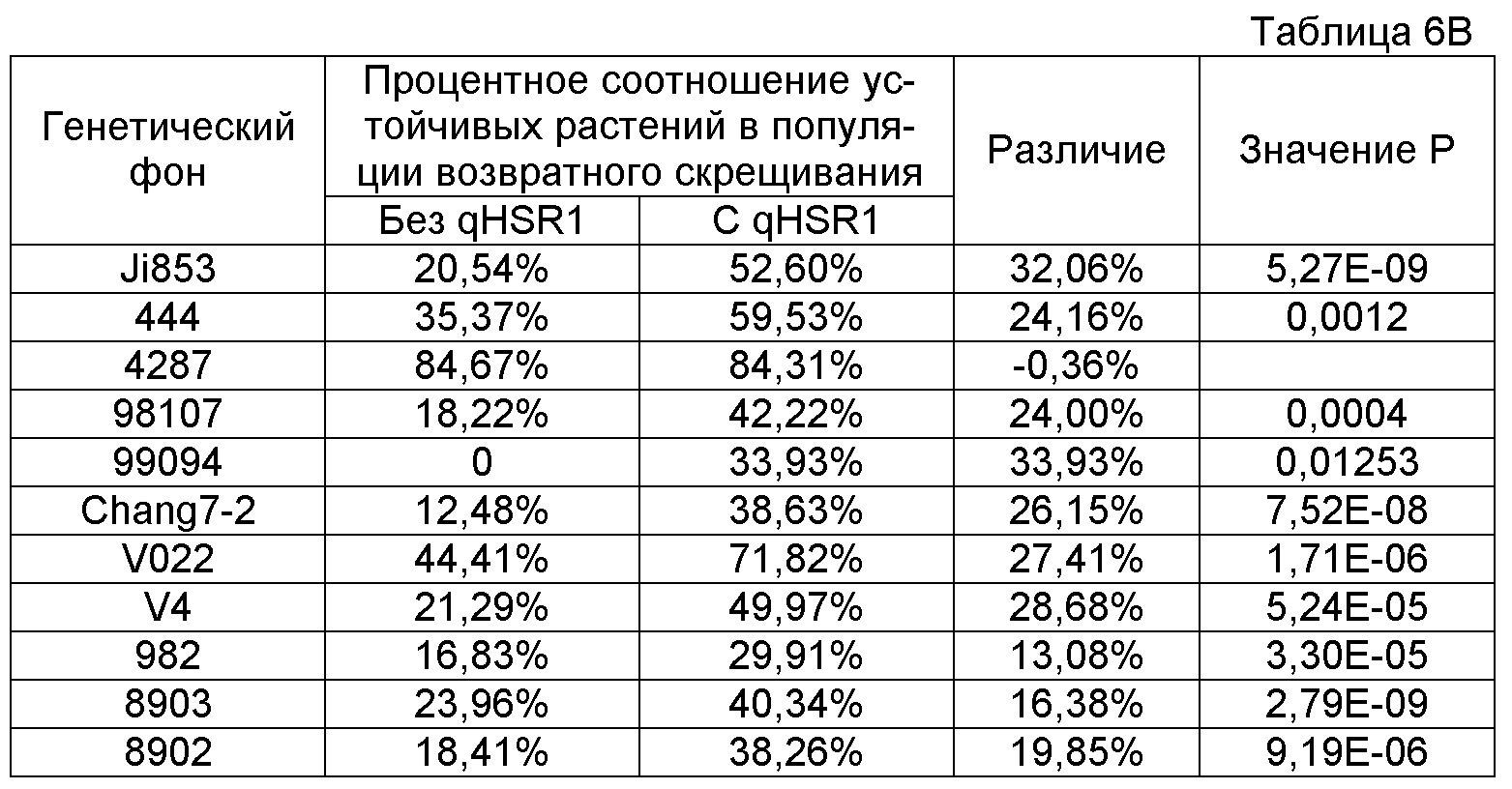
ПРИМЕР 20
Дополнительное образование маркеров в qHSR1 области, пригодных для селекции с использованием маркера
Линии интрогрессии для qHSR1 были созданы для селекционного материала и оценки qHSR1 эффективности в Северо-Западной Америке, Мексике и Китае. Тридцать пять пионерных инбредных линий (CN3K7 - это донорная линия; GRB1M, HNA9B, HN4CV, HNVS3, HNN4B, HNH9H, HNGFT, GR0RA, HFTWK и GRVNS представляют собой линии с нежестким стеблем для Китая; GR0P2, HEF3D, HF0SV, HFHHN, HN05F, HN088, HN0E1, HN8T0, HNNWJ и HNW4C представляют собой линии с нежестким стеблем для Северо-Западной Америки; EDGJ4, EDW1N, EDVNA, EDVS9, и EDV9Z представляют собой линии с жестким стеблем для Китая; и 2HC5H, 2H071, 4F1FM, 4F1VJ, 4FJNE, 7T9HV, 1ARMJ, 1AY0M, 1AGFC, и 1A1V3 представляют собой линии с жестким стеблем для Мексики) были скрещены с Mo17 для создания F1. SNP маркеры, такие как MZA15839-4, MZA18530-16, MZA5473-801, MZA16870-15, MZA4087-19, MZA158-30, MZA15493-15, MZA9967-11, MZA1556-23, MZA1556-801, MZA17365-10, MZA17365-801, MZA14192-8, MZA15554-13 и MZA4454-14, используются для селекции на qHSR1 область во время последовательных возвратных скрещиваний. 39-65 SNP маркеров на несцепленных хромосомных областях использовали в BC1 поколении для селекции против фона.
Линии были возвратно скрещены с BC1, BC2, BC3 или BC4 поколением и затем подверглись самоопылению. Растения, гомозиготные для qHSR1 области, определялись в самоопыленном поколении и затем скрещивались с приемлемым инбредом тест-скрещивания, таким как EF6WC или EF890 для NSS интрогрессий. BC линии тест-скрещивания затем оценивали по эффективности в местоположении, приемлемом для инбредной линии, таком как Северо-Западная Америка, Мексика или Китай. В каждом местоположении достаточное количество повторов и достаточный размер популяции использовались для оценки qHSR1 эффективности. Эквивалентный гибрид без QTL к пыльной головне также выращивали для сравнения. Если не ожидалось высокого уровня заболеваемости, то эксперимент был искусственно инокулирован патогеном пыльной головни для обеспечения высокого уровня заболеваемости.
Маркеры, которые пригодны для селекции с применением маркера для создания линий интрогрессии, показаны в Таблице 7. Восемь из этих маркеров (MZA6393, 1M2-9, E6765-3, 2M4-1, 2M10-5, 2M11-3, 3M1-25, и STS148-1) расположены внутри qHSR области. Маркеры в Таблице 7, которые расположены вне qHSR области, были созданы как специфические для Mo17, и, следовательно, сцеплены с qHSR областью. Не подразумевается, что эти маркеры, хотя они представлены для примера, являются полным списком всех пригодных маркеров. Многие маркеры, которые являются специфическими для qHSR области, могут быть созданы. К тому же любой маркер, который является сцепленным или связанным с одним из этих специфических маркеров, может быть пригоден в селекции с использованием маркера.
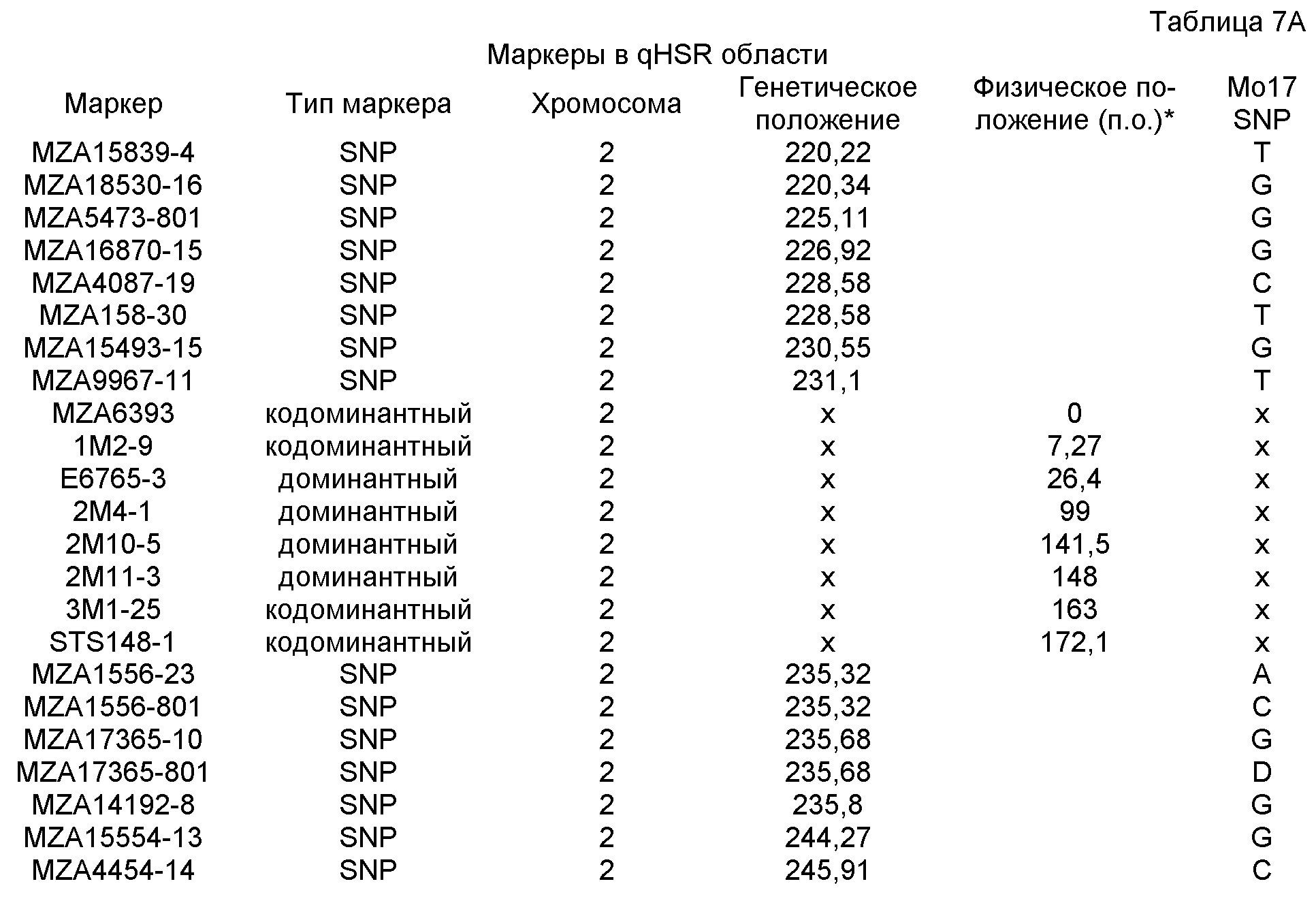

Реферат
Изобретение относится к области биохимии, в частности к способу определения присутствия или отсутствия локуса устойчивости к пыльной головне в растении маиса, а также к способу определения растения маиса, которое проявляет устойчивость к пыльной головне, где способ включает обнаружение в идиоплазме растения маиса, по меньшей мере, одной аллели маркерного локуса, расположенного на хромосомном участке хромосомы 2 маиса, включающем и фланкированном umc1736 и umc2184. Изобретение позволяет эффективно определять растение маиса, проявляющее устойчивость к пыльной головне. 2 н. и 3 з.п. ф-лы, 4 ил., 7 табл., 20 пр.
Формула
(a) выделение молекул нуклеиновой кислоты из указанного растения маиса и амплификацию последовательностей, присущих только полинуклеотиду, который придает устойчивость к пыльной головне, или
(b) выделение белков из указанного растения маиса и выполнение вестерн-блоттинга, используя антитела к белку, кодируемому указанным полинуклеотидом, или
(c) выделение белков из указанного растения маиса и выполнение анализа ELISA, используя антитела к белку, кодируемому указанным полинуклеотидом, или
(d) демонстрацию присутствия мРНК последовательностей, полученных от полинуклеотида и присущих только локусу устойчивости к пыльной головне на хромосоме 2 маиса,
где полинуклеотид, указанный в (a), (b), (c) и (d), выбирают из группы, состоящей из:
(i) по меньшей мере одной нуклеотидной последовательности, кодирующей полипептид, придающий или улучшающий устойчивость к пыльной головне, выбранной из группы, состоящей из SEQ ID NO: 27, 32, 35, 38, 41, 44, 105, 108, 111, 113 и 116;
(ii) по меньшей мере одной нуклеотидной последовательности, способной придавать или усиливать устойчивость к пыльной головне, выбранной из группы, состоящей из SEQ ID NO: 25, 26, 30, 31, 34, 36, 37, 39, 40, 42, 43, 45, 104, 106, 107, 109, 110, 112, 114, 115 и 117; и
(iii) комплементарной нуклеотидной последовательности к части (i) или (ii), где комплементарная и нуклеотидная последовательность содержат одинаковое число нуклеотидов и являются 100% комплементарными;
таким образом определяя присутствие или отсутствие локуса устойчивости к пыльной головне в указанном растении маиса.
(a) маркерный локус расположен на хромосомном участке хромосомы 2 маиса, включающем и фланкированном umc1736 и umc2184; и
(b) по меньшей мере одна аллель связана с устойчивостью к пыльной головне.
(a) получение растения маиса с по меньшей мере одной аллелью, связанной с повышенной устойчивостью к пыльной головне;
(b) скрещивание указанного растения маиса со вторым растением маиса;
(c) оценку потомства по меньшей мере по указанной аллели; и
(d) отбор потомства растений маиса, которое обладает по меньшей мере указанной аллелью.

Комментарии