Композиции и способы снижения уровня hs в ферментированных напитках - RU2476590C2
Код документа: RU2476590C2
Чертежи





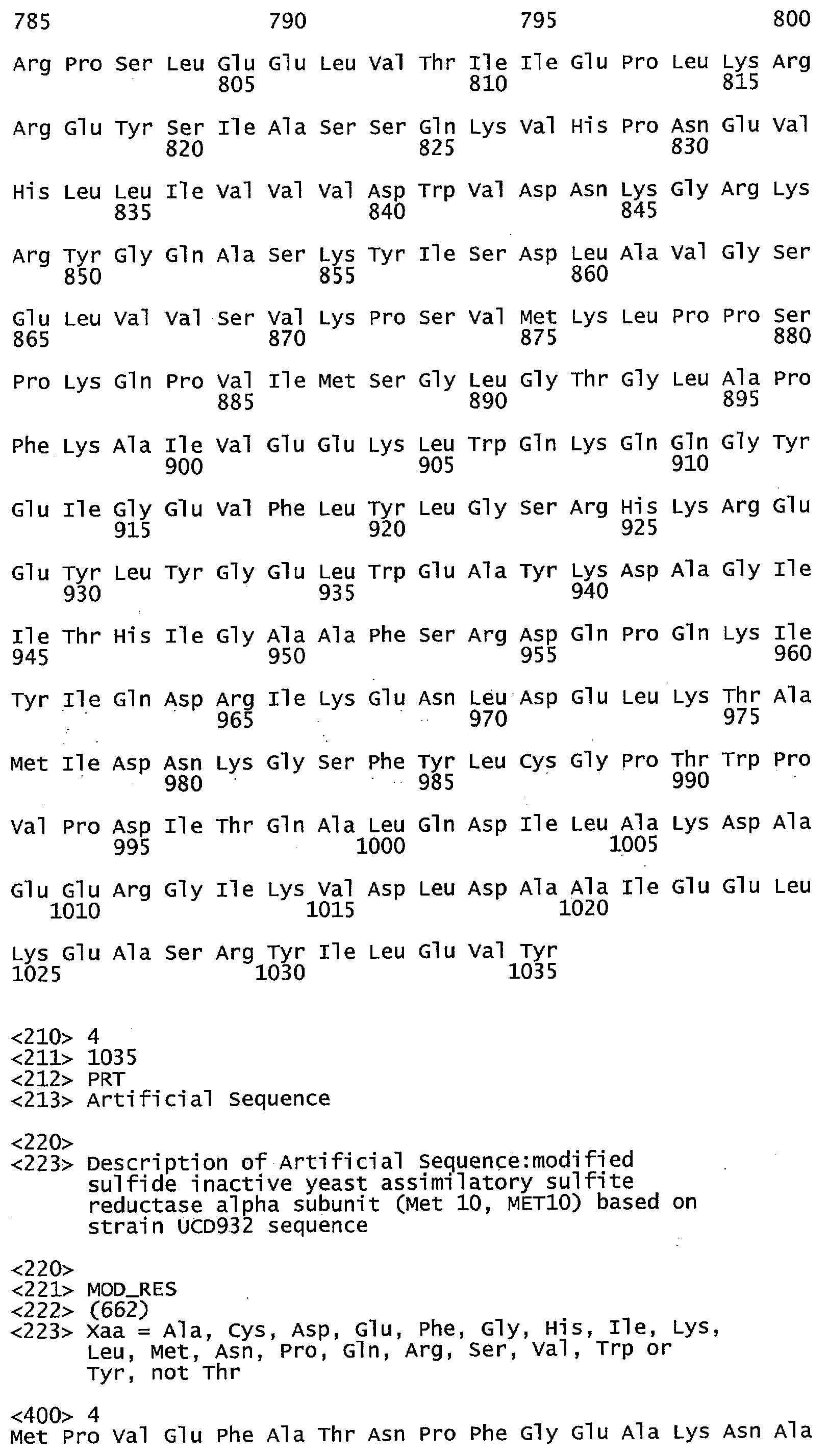


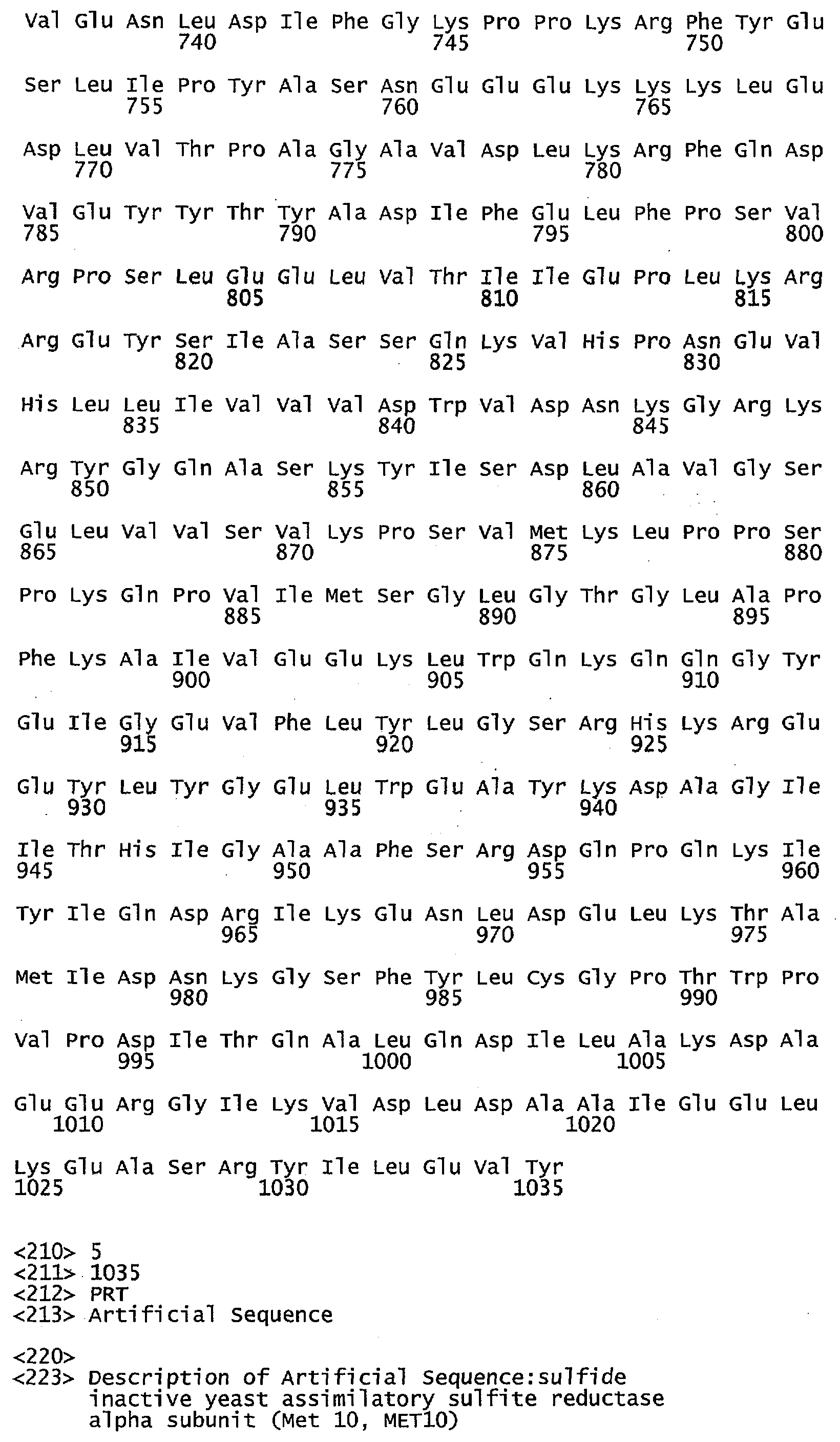





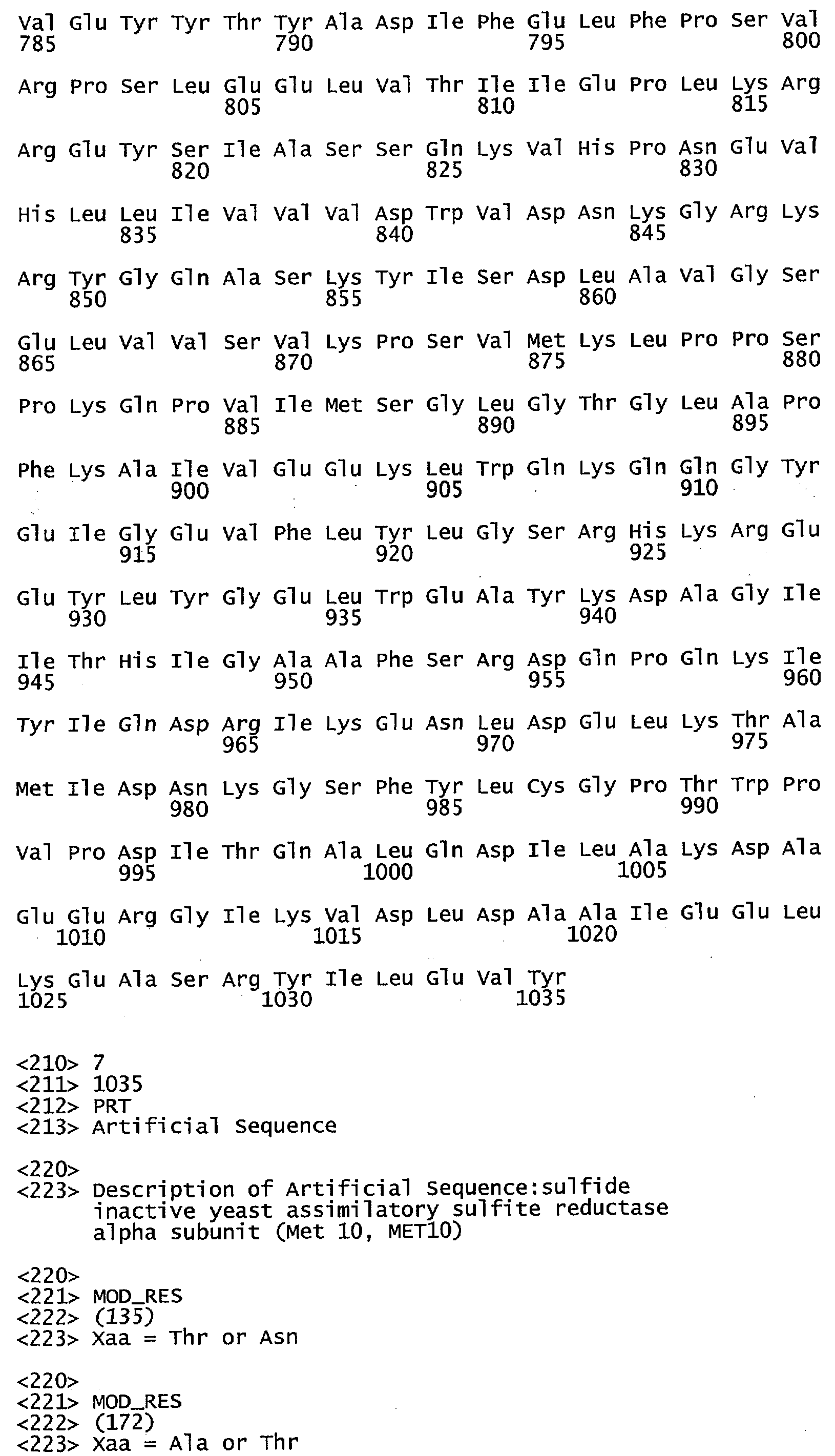


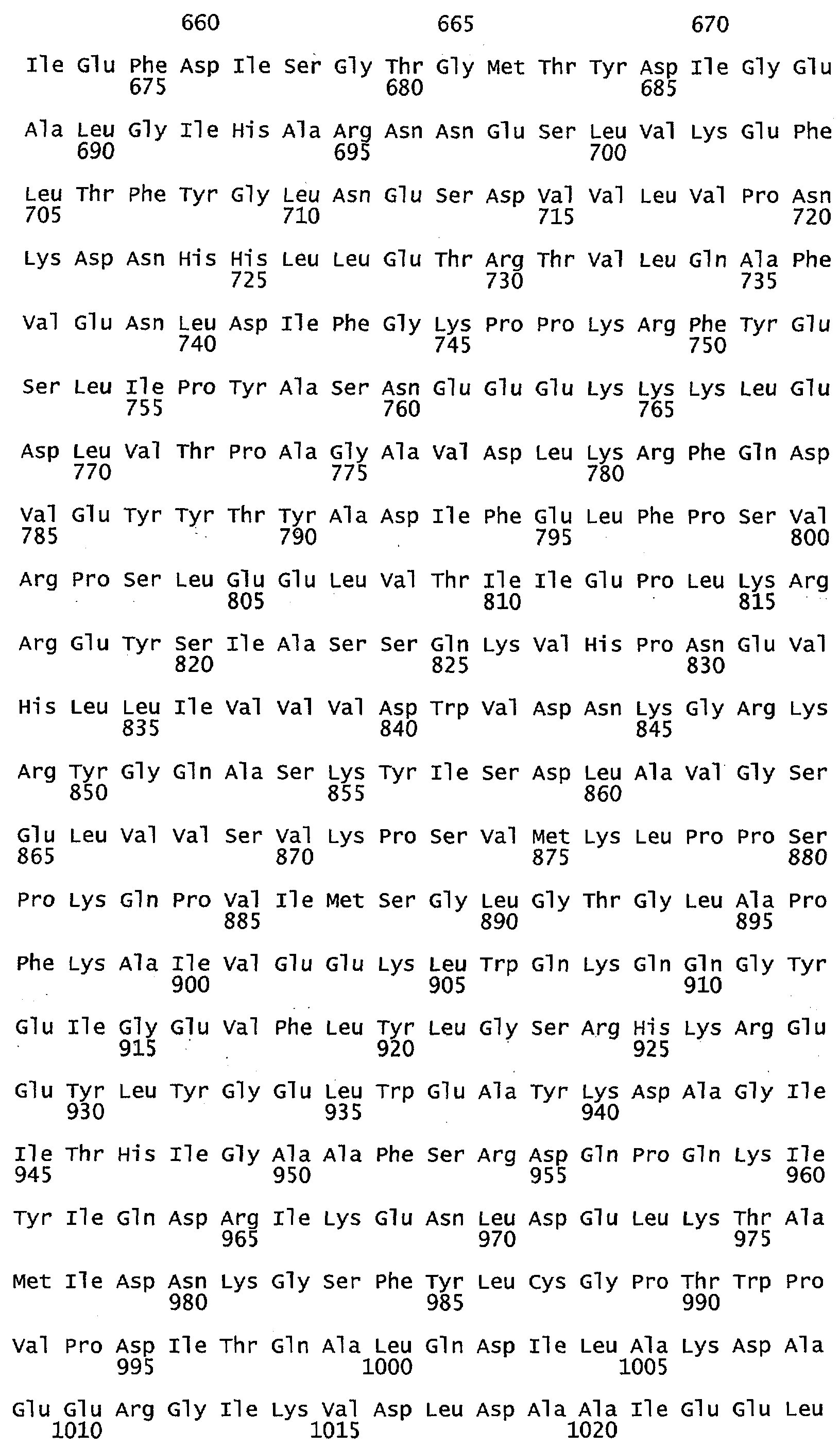









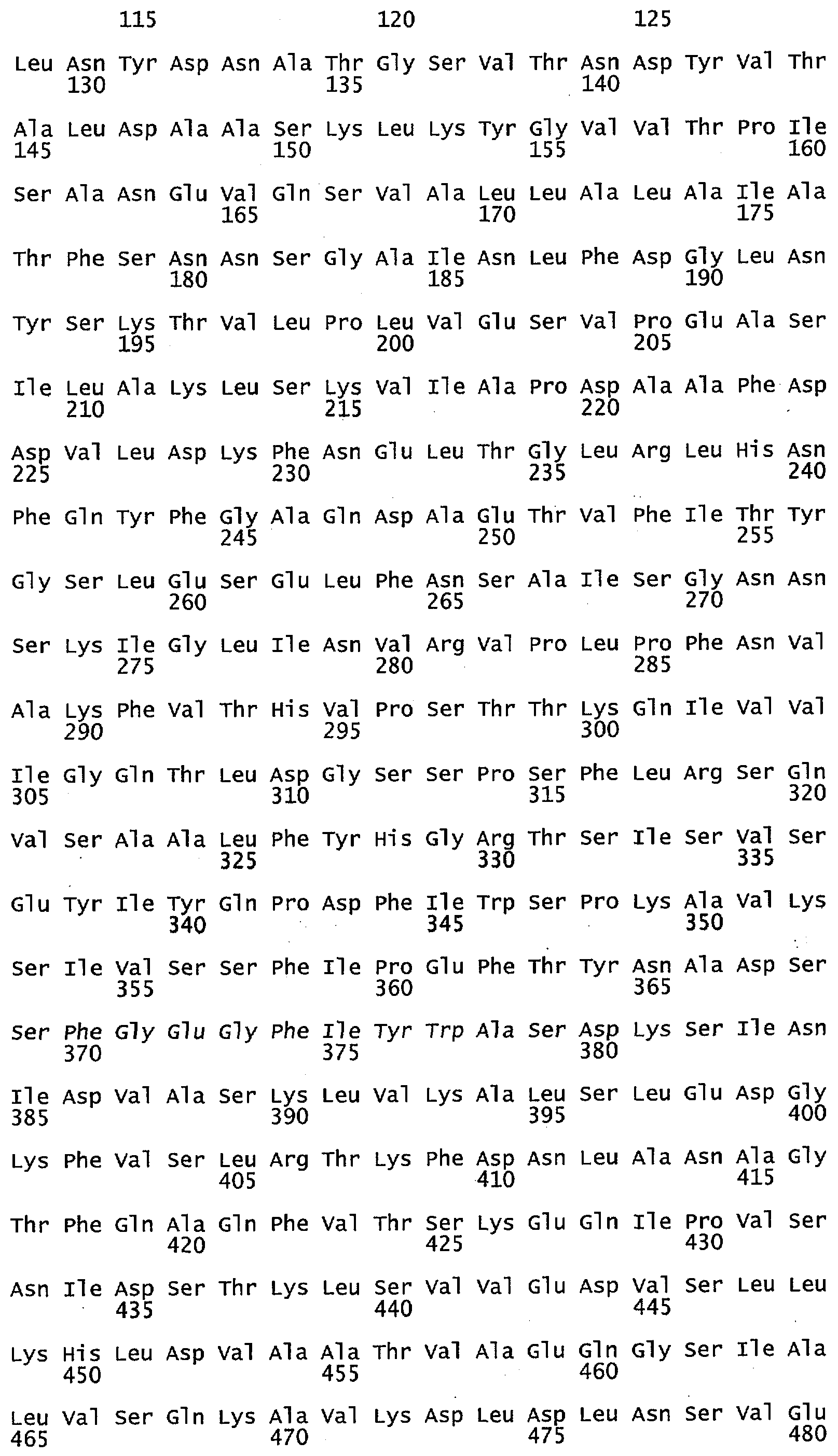


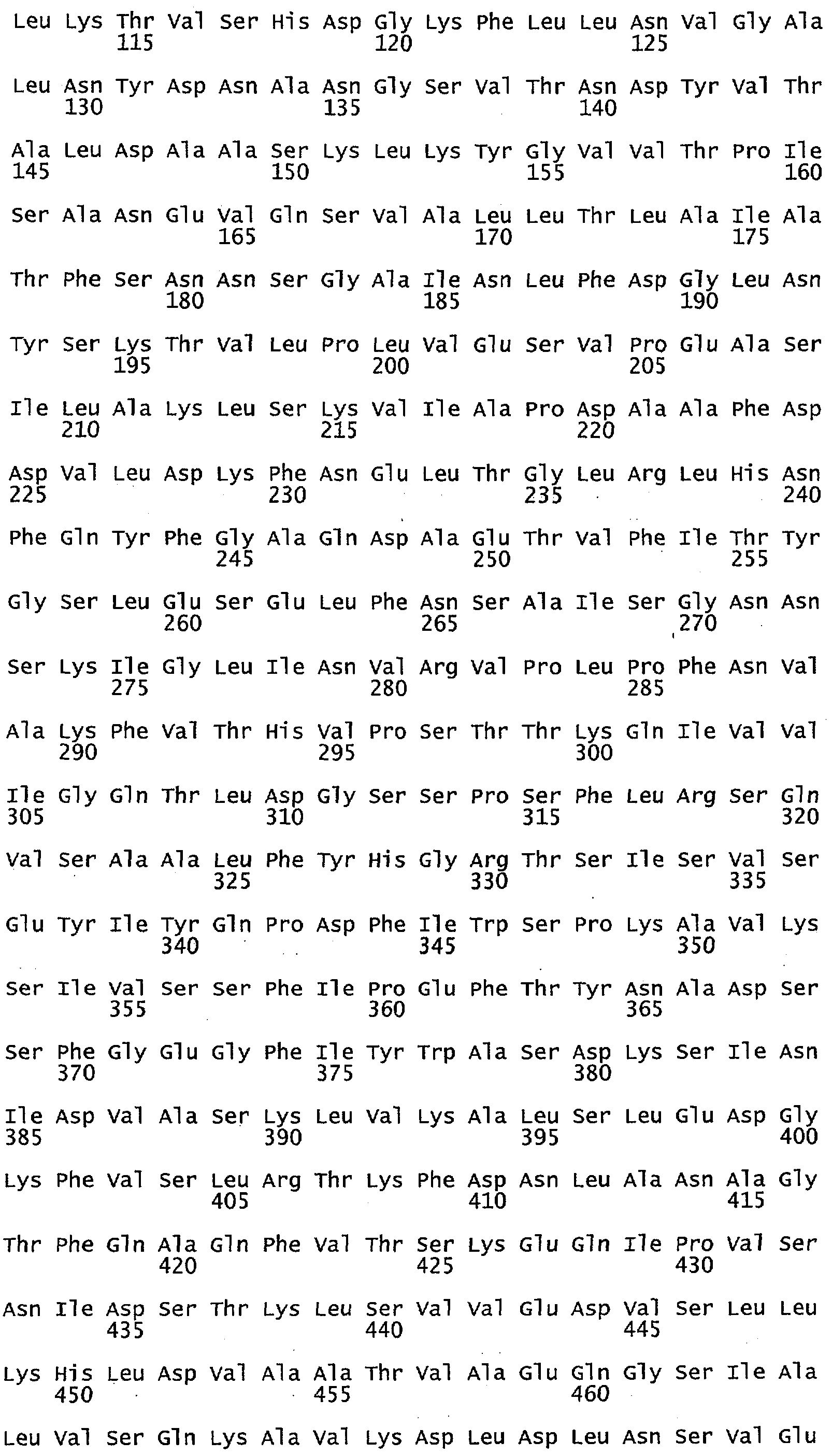

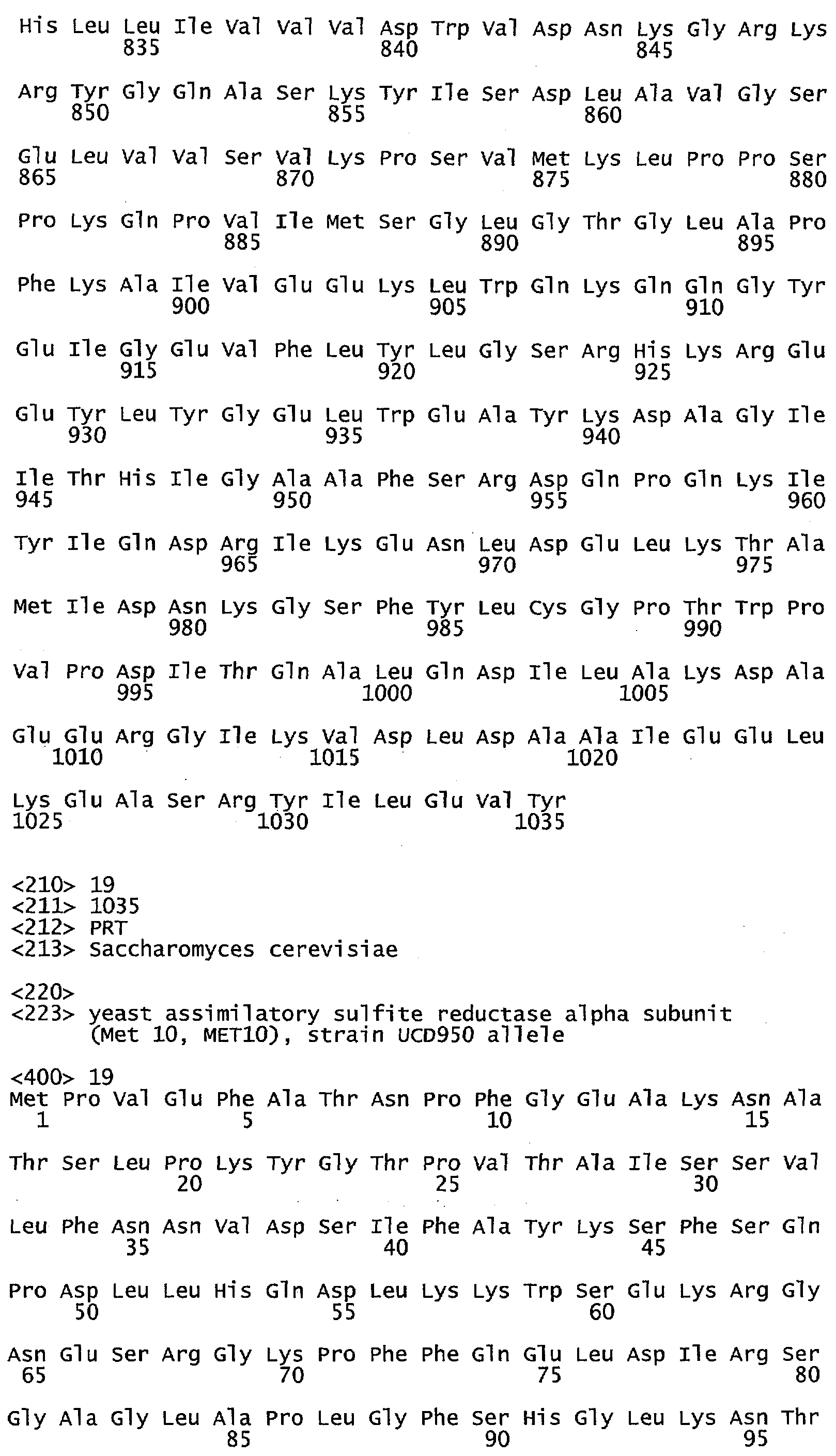
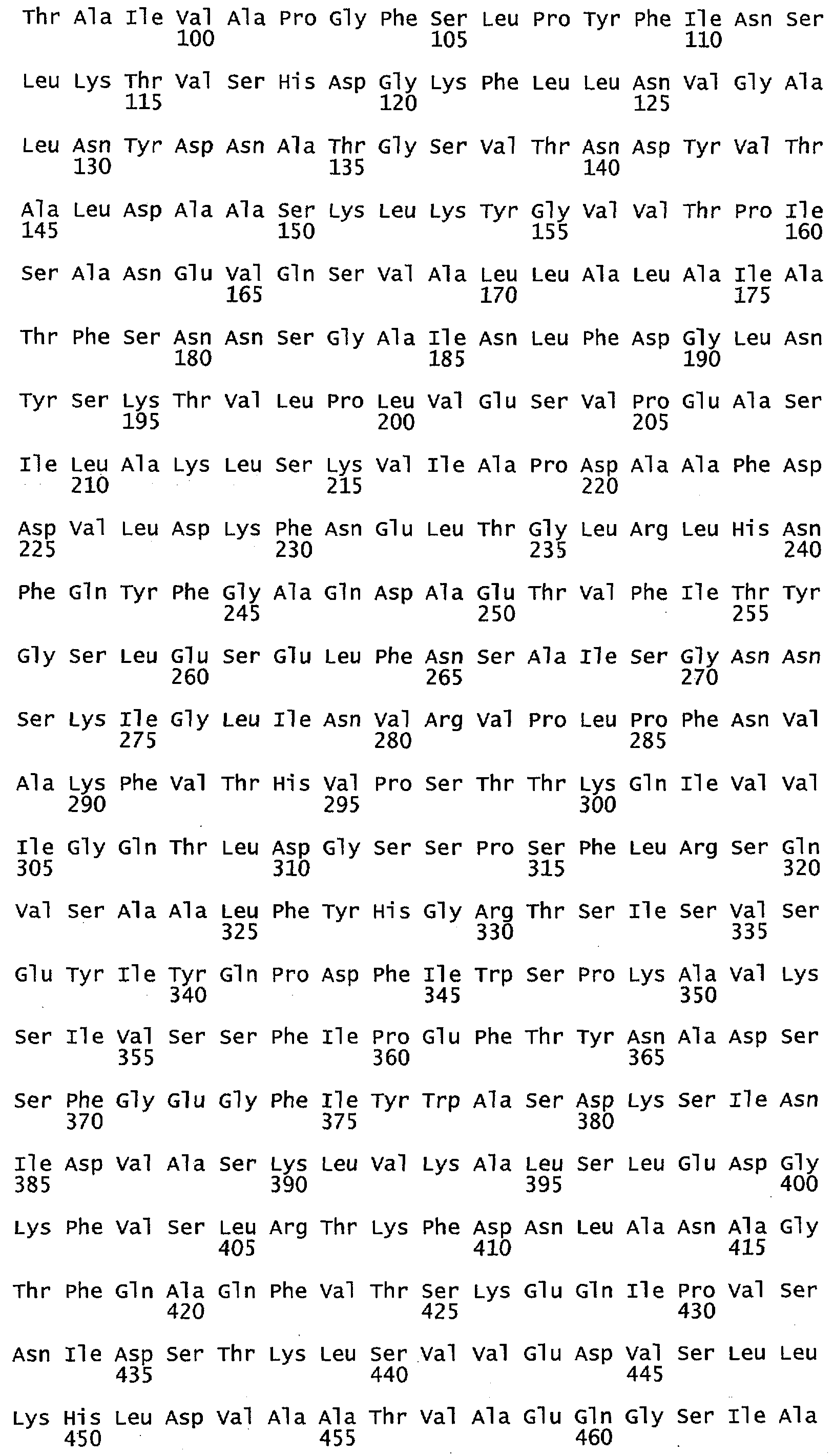
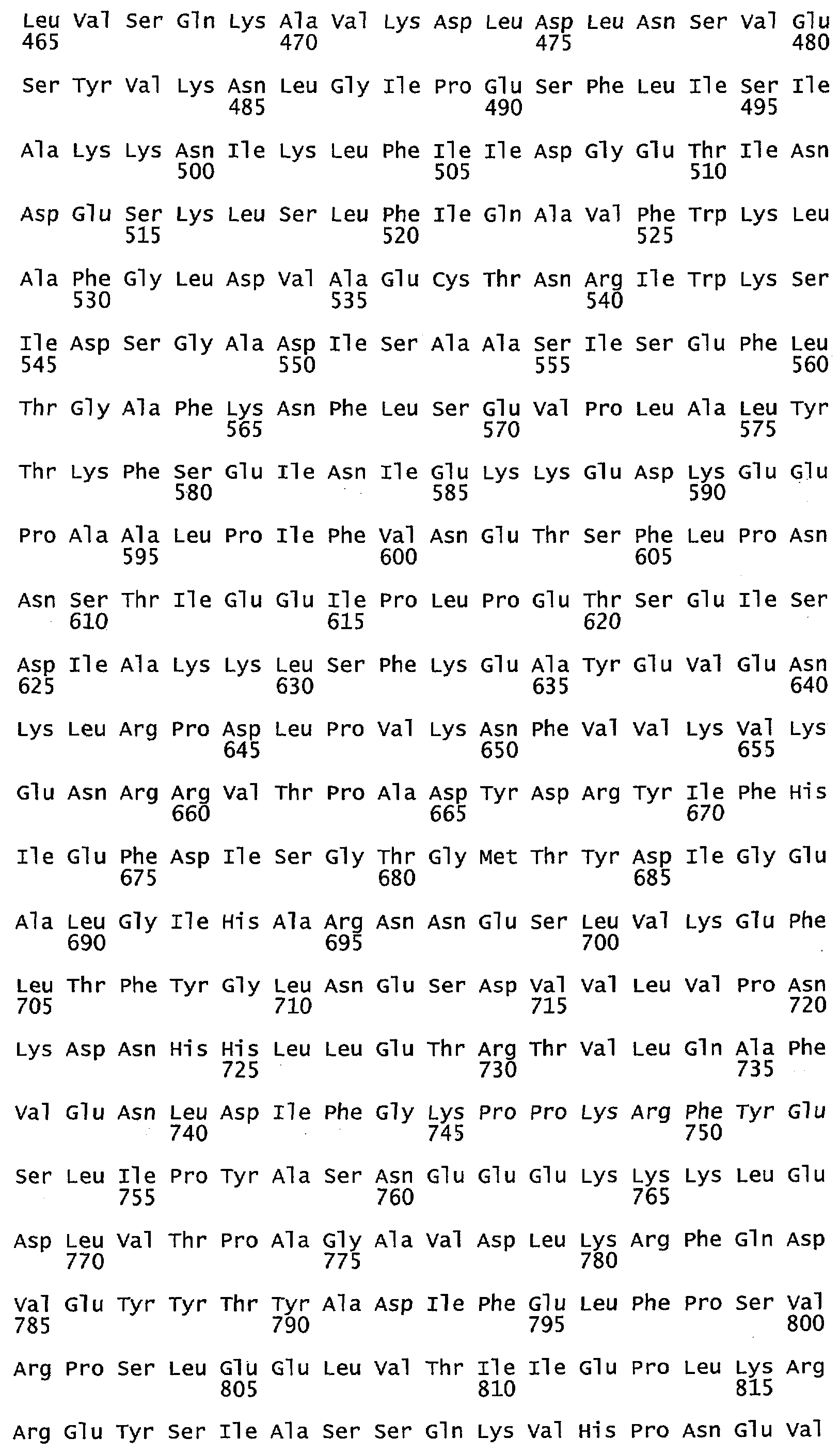








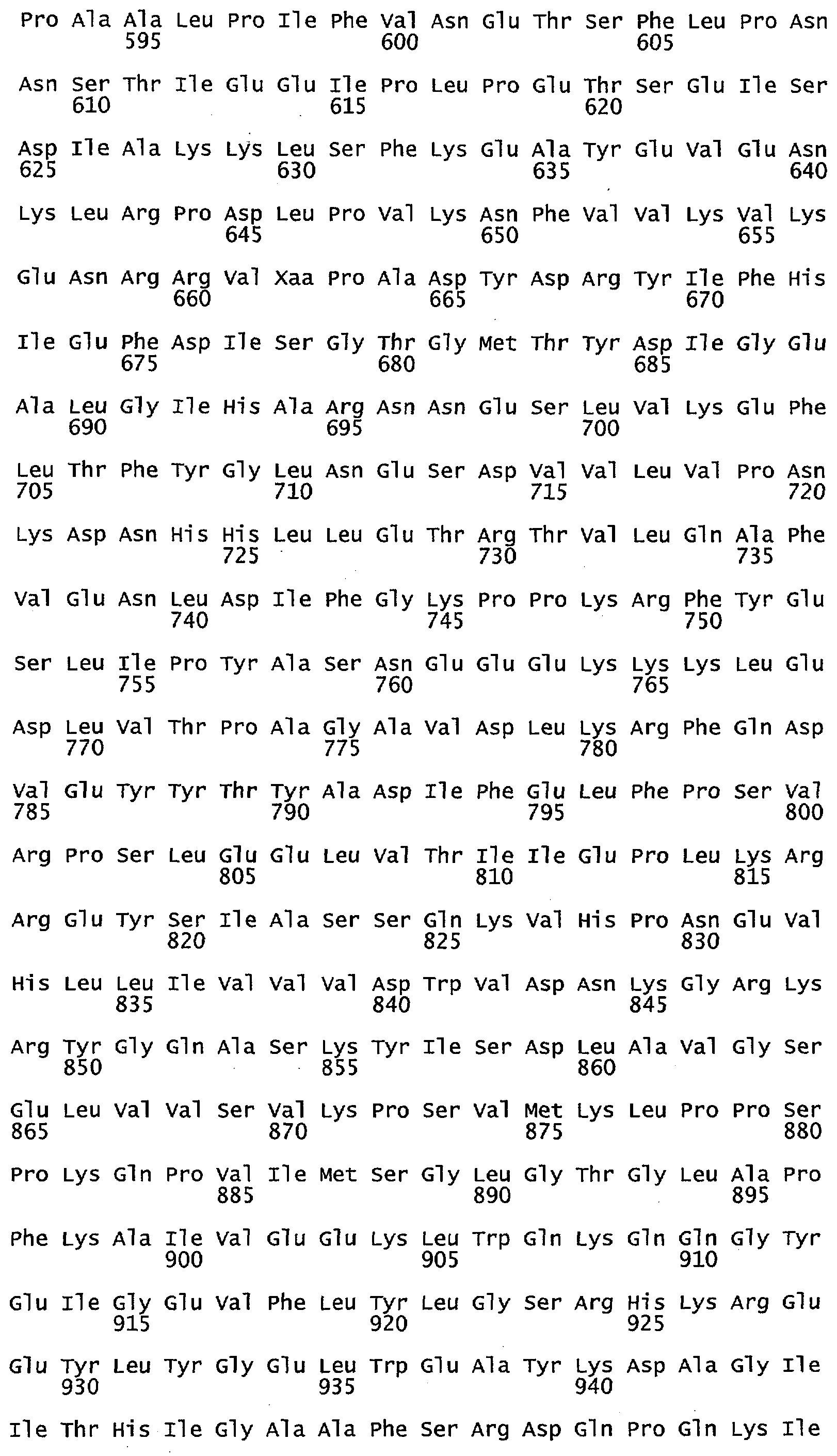

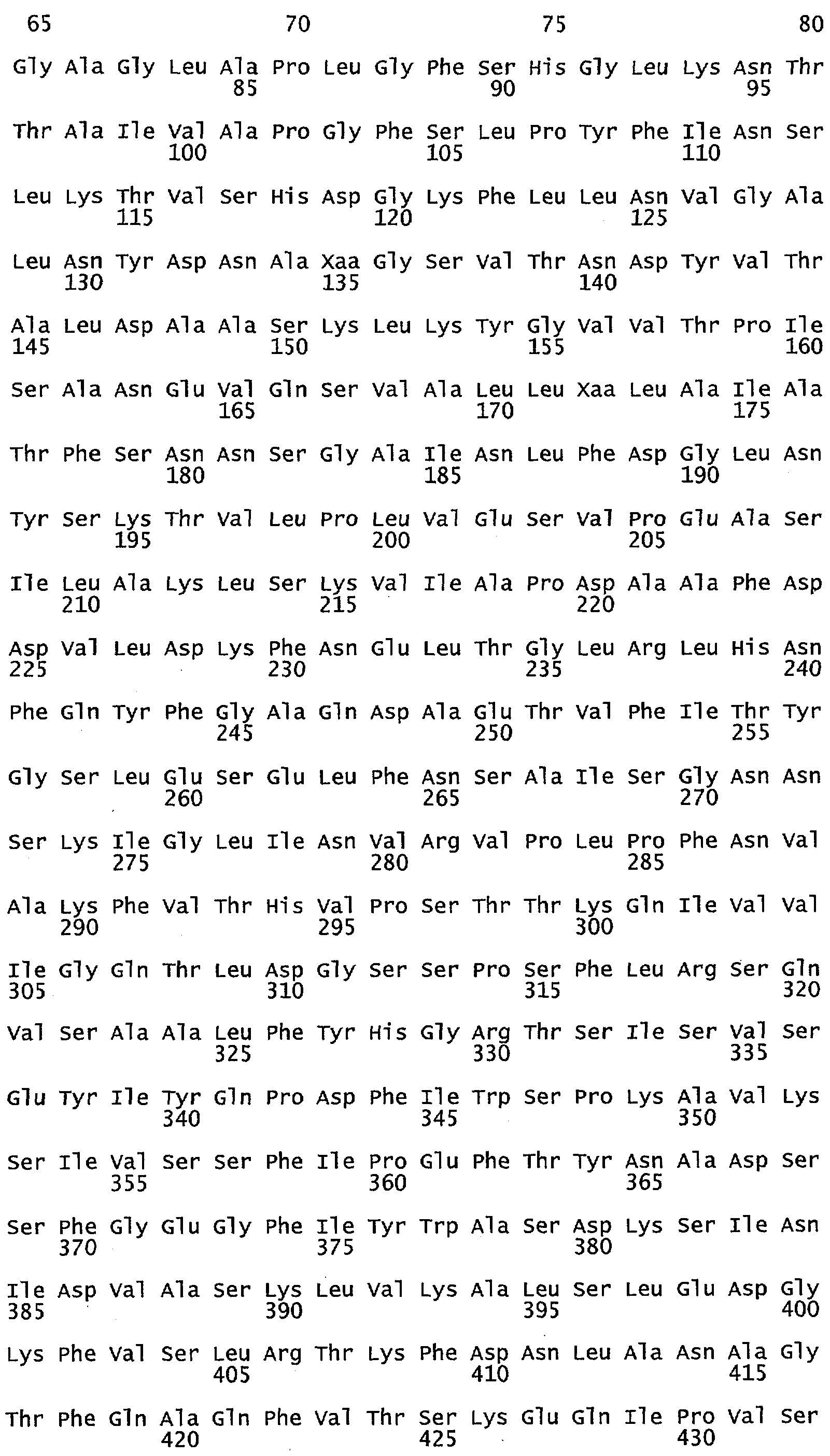











































Описание
Область техники, к которой относится изобретение
Настоящее изобретение обеспечивает композиции и способы снижения уровня H2S в ферментированных напитках.
Уровень техники
Образование летучих соединений серы, таких как сероводород (H2S), в процессе спиртового брожения является проблемой, которая наносит ущерб производству пива и виноделию. Сероводород (H2S) представляет собой нежелательный побочный продукт метаболического пути восстановления сульфатов (фигура 1). Он образуется в дрожжах Saccharomyces cerevisiae в условиях брожения. Образование H2S штаммами S. cerevisiae колеблется от 0 мкг/л до 290 мкг/л, что значительно выше порога чувствительности для человека, составляющего 11 нг/л (Amoore and Hautala 1983). Это нежелательное свойство сероводорода связано с тем, что он привносит в вина запах тухлых яиц, и с тем, что, хотя H2S является летучим соединением и может быть удален путем аэрации, он потенциально способен к образованию меркаптанов и тиолов, которые сохраняются в вине благодаря низкому значению рН (Thoukis 1962). Сами меркаптаны и тиолы обнаруживаются в ароматах чеснока или в упакованных в банку овощах и там, где можно контролировать содержание летучего H2S, удаление других нежелательных соединений серы технически сложно и приводит к удалению из вина других ароматных соединений.
Образование сероводорода Saccharomyces cerevisiae - проблема производства вина, пива и сакэ, убедительно подтвержденная документальными доказательствами (Acree et al. 1972, Eschenbruch et al. 1978, Giudici and Kunkee 1994, Jiranek et al. 1995, Rauhut and Kurbel 1994, Walker and Simpson 1993). Факторы питания, например уровень азота, витаминов и кофакторов (Giudici and Kunkee 1994, Jiranek et al. 1995), и факторы окружающей среды, например температура, рН, уровень элементарной серы (Rauhut and Kurbel 1994), присутствие диоксида серы (Stratford and Rose 1985) и уровень органических соединений, содержащих серу (Acree et al. 1972), связаны с образованием летучих соединений серы в ферментированных (то есть полученных с помощью брожения) напитках. Разницу в образовании летучих соединений серы также приписывали различиям в метаболизме штаммов дрожжей (Acree et al. 1972, Spiropoulos et al. 2000).
Существует, по меньшей мере, шесть различных типов поведения дрожжевого штамма в отношении образования сероводорода: 1) повышенный уровень во всех условиях; 2) сниженный уровень во всех условиях; 3) повышенное образование в условиях, которые ниже и выше порогового содержания азота; пониженное образование в пределах «окна» для содержания азота и увеличение содержания сульфидов при уровне азота ниже или выше этого «окна»; 4) повышенное образование в ответ на лимитирующий уровень микроэлементов независимо от содержания азота; 5) повышенное образование сульфидов только при лимитирующем уровне и азота, и микроэлементов; и 6) повышенное образование сульфидов при повышенной скорости брожения, которое может быть связано со скоростью брожения и выделения двуокиси углерода или с другим фактором, например с повышенной продукцией тепла (Spiropoulos 2000, Jiranek 1995, Giudici 1994, Linderholm 2006).
Существующим методом удаления сульфидов из вина является осветление с помощью меди. Добавление меди может приводить к катализу повреждающих изменений состава, а также к повышению содержания отходов, производимых винными заводами, которые требуют специальной обработки, в конечном итоге приводящей к более высоким затратам виноделов на производство и к более высоким ценам для потребителя. Кроме того, использование меди в качестве осветляющего агента может приводить к высокому остаточному уровню меди в вине. Торгово-налоговое бюро (The Trade and Tax Bureau) допускает остаточное содержание меди в вине на уровне 0,5 мг/л (смотри, например, веб-сайт regulations.justia.com/view/89060/). Виноделы, использующие медь для удаления сероводорода, должны затем принимать меры для снижения уровня меди в вине. Принимая во внимание неблагоприятные воздействия на здоровье, связанные с избыточным поглощением меди с пищей, в частности неврологические расстройства, такие как болезнь Альцгеймера, Всемирная организация здравоохранения рекомендовала пищевые ограничения при потреблении этого соединения (смотри, например, веб-сайт who.int/water_sanitation_health/dwq/chemicals/copper.pdf). Наличие коммерческих штаммов дрожжей, которые не способны продуцировать сероводород или которые продуцируют пониженный уровень сероводорода, устранит необходимость обработки вин медью.
Таким образом, в этой области техники существует потребность в композициях и способах снижения уровня H2S в ферментированных напитках. Настоящее изобретение удовлетворяет эти и другие потребности.
Раскрытие изобретения
Настоящее изобретение предоставляет композиции и способы снижения уровня H2S в ферментированных напитках.
Один аспект изобретения обеспечивает способы снижения и устранения уровня H2S в продукте или среде брожения. В некоторых воплощениях способы включают контакт продукта или среды брожения со штаммом дрожжей, клеткой дрожжей или культурой клеток дрожжей, включающих полинуклеотид, кодирующий модифицированный полипептид МЕТ10, который не катализирует выделение свободного сероводорода из сульфита (то есть «сульфид-неактивный» полипептид МЕТ10), в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином. В некоторых воплощениях полинуклеотид кодирует полипептид МЕТ10 с последовательностью SEQ ID NO:3, где Х в положении 662 не является треонином. В некоторых воплощениях полинуклеотид включает SEQ ID NO:1.
Что касается воплощений сульфид-неактивного полипептида МЕТ10, то в некоторых воплощениях аминокислотный остаток в положении 662 полипептида МЕТ10 не является треонином или серином. В некоторых воплощениях аминокислотный остаток в положении 662 полипептида МЕТ10 является Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr (SEQ ID NO:3). В некоторых воплощениях аминокислотный остаток в положении 662 полипептида МЕТ10 является Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Val, Trp или Tyr (SEQ ID NO:5). В некоторых воплощениях аминокислотный остаток в положении 662 выбирают из группы, состоящей из Lys, Arg, His, Gln и Asn (SEQ ID NO:6). В некоторых воплощениях аминокислотный остаток в положении 662 представляет собой Lys (SEQ ID NO:7).
В некоторых воплощениях сульфид-неактивный полипептид МЕТ10 или полинуклеотид МЕТ10 является дрожжевым МЕТ10. В некоторых воплощениях сульфид-неактивный полипептид МЕТ10 идентичен, по меньшей мере, примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше последовательности МЕТ10 SEQ ID NO:3 или SEQ ID NO:4, где X в положении 662 был описан выше в этом документе. В некоторых воплощениях полинуклеотид, кодирующий сульфид-неактивный полипептид МЕТ10, идентичен, по меньшей мере, примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше последовательности SEQ ID NO: 1.
В некоторых воплощениях клетка дрожжей также не экспрессирует сульфид-активный полипептид МЕТ10, способный превращать сульфит в сульфид. В некоторых воплощениях продукт брожения представляет собой вино, пиво или шампанское. В некоторых воплощениях среду брожения можно выбирать из группы, состоящей из муста (например, виноградного муста) и сусла.
Что касается воплощений клеток дрожжей, то в некоторых воплощениях штамм дрожжей может быть штаммом Saccharomyces cerevisiae. В некоторых воплощениях штамм дрожжей может быть любым доступным в продаже штаммом, применяемым для производства пива или вина, как было описано в этом документе. Часто родительский штамм или исходный штамм является продуцентом сероводорода, который превращают в штамм, не являющийся продуцентом, путем замены нуклеиновой кислоты, кодирующей сульфид-активный полипептид МЕТ10, на нуклеиновую кислоту, кодирующую сульфид-неактивный полипептид МЕТ10. Примеры винных штаммов S. cerevisiae включают без ограничения Prise de Mousse, Premier Cuveé, French Red, Montachet, Lallemand K1, Bordeaux, UCD522, UCD940, Ba25, Ba126, Ba137, Ba220, Bb23, Bb25, Ba30, Bb32, Bb19 и Bb22. Дополнительные воплощения клеток дрожжей представлены клетками, описанными в этом документе.
Другой аспект изобретения обеспечивает изолированные полинуклеотиды, включающие последовательность нуклеиновой кислоты, которая кодирует полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином. В некоторых воплощениях аминокислота в положении 662 полипептида МЕТ10 не является треонином или серином (SEQ ID NO:5). Воплощения сульфид-неактивного полипептида МЕТ10, кодируемого полинуклеотидами, представлены воплощениями, описанными в этом документе. В некоторых воплощениях изолированный полинуклеотид, кодирующий сульфид-неактивный полипептид МЕТ10, идентичен, по меньшей мере, примерно на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% последовательности SEQ ID NO:1. В некоторых воплощениях изолированный полинуклеотид включает последовательность нуклеиновой кислоты, представленную SEQ ID NO: 1, или последовательность, комплементарную ей.
В родственном аспекте изобретение обеспечивает экспрессионные кассеты и экспрессионные векторы, включающие полинуклеотид, кодирующий полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином (SEQ ID NO:3) и где полинуклеотид функционально связан с экспрессионной контролирующей последовательностью. Дополнительные воплощения сульфид-неактивного полипептида МЕТ10 представлены воплощениями, описанными в этом документе. Кроме того, предоставлены клетки хозяина, включающие экспрессионные векторы или экспрессионные кассеты. Клетки хозяина могут быть клетками дрожжей, например, клетками Saccharomyces cerevisiae. Дополнительные воплощения клеток дрожжей представлены клетками, описанными в этом документе. В некоторых воплощениях экспрессионная кассета или экспрессионный вектор включают промотор, который способствует экспрессии в клетке дрожжей.
В родственном аспекте изобретение обеспечивает улучшенные клетки дрожжей, которые не продуцируют сероводород в детектируемых количествах или вырабатывают сероводород на низком уровне, улучшенные клетки включают экзогенный полинуклеотид, кодирующий полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином (SEQ ID NO:3), где родительская клетка улучшенной клетки дрожжей продуцирует сероводород. В некоторых воплощениях аминокислота в положении 662 полипептида МЕТ10 не является треонином или серином (SEQ ID NO:5). Дополнительные воплощения сульфид-неактивных полипептидов МЕТ10 и клеток дрожжей представлены в этом документе.
В следующем аспекте изобретение обеспечивает улучшенные культуры клеток дрожжей, которые вырабатывают сероводород на низком уровне или не образуют сероводород в детектируемых количествах, улучшенная культура включает популяцию клеток дрожжей, включающих экзогенный полинуклеотид, кодирующий полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 полипептида МЕТ10 не является треонином (SEQ ID NO:3), где улучшенная культура клеток дрожжей не образует сероводорода или вырабатывает сероводород в сниженном количестве по сравнению с культурой родительских клеток. В некоторых воплощениях аминокислота в положении 662 полипептида МЕТ10 не является треонином или серином (SEQ ID NO:5). Дополнительные воплощения сульфид-неактивных полипептидов МЕТ10 и клеток дрожжей представлены в этом документе.
В другом аспекте изобретение обеспечивает способы получения улучшенной клетки дрожжей, которая не образуют сероводород в детектируемых количествах, способ включает замену эндогенной нуклеиновой кислоты, кодирующей сульфид-активный полипептид МЕТ10, на нуклеиновую кислоту, кодирующую сульфид-неактивный полипептид МЕТ10, путем введения в клетку, являющуюся родительской для улучшенной клетки дрожжей, экзогенного полинуклеотида, кодирующего сульфид-неактивный полипептид МЕТ10, который не катализирует превращение сульфита в сульфид, в котором аминокислота в положении 662 сульфид-неактивного полипептида МЕТ10 не является треонином (SEQ ID NO:3), где клетка, являющаяся родительской для улучшенной клетки дрожжей, продуцирует сероводород. В некоторых воплощениях аминокислота в положении 662 полипептида МЕТ10 не является треонином или серином (SEQ ID NO: 5). В некоторых воплощениях нуклеиновую кислоту, кодирующую сульфид-неактивный полипептид МЕТ10, вводят рекомбинантным способом. В некоторых воплощениях нуклеиновую кислоту, кодирующую сульфид-неактивный полипептид МЕТ10, вводят с помощью возвратного скрещивания. Дополнительные воплощения сульфид-неактивных полипептидов МЕТ10 и клеток дрожжей представлены в этом документе.
В другом аспекте изобретение обеспечивает продукты брожения, например вино, пиво, шампанское, не содержащие сероводород в детектируемых количествах или содержащие сниженный уровень сероводорода или его остаточные количества, где продукты брожения получают в соответствии со способами, описанными в этом документе.
Следующий аспект изобретения обеспечивает изолированные полинуклеотиды, способные распознавать последовательности, предоставленные в SEQ ID NO: 1, или последовательности, комплементарные им, и нуклеиновую кислоту, кодирующую MET10 дикого типа, экспрессионные векторы, включающие полинуклеотиды, функционально связанные с экспрессионной контролирующей последовательностью, и клетки хозяина (например, клетки Saccharomyces cerevisiae), включающие экспрессионный вектор.
Следующий аспект изобретения обеспечивает изолированные полинуклеотиды, включающие одну или более замен (например, по меньшей мере, две, три, четыре или более замен) в SEQ ID NO: 1, где одну или более замен выбирают из: А→С в положении 404, А→G в положении 514, А→G в положении 1278 и С→Т в положении 1532, G→А в положении 1768 и А→С в положении 1985, экспрессионные векторы, включающие полинуклеотиды, функционально связанные с экспрессионной контролирующей последовательностью, и клетки хозяина (например, клетки Saccharomyces cerevisiae), включающие экспрессионный вектор.
Другое воплощение изобретения обеспечивает изолированные полинуклеотиды, включающие одну или более замен (например, по меньшей мере, две, три, четыре или более замен) в SEQ ID NO:2, где одну или более замен выбирают из группы, состоящей из: С→А в положении 404, G→А в положении 514, G→А в положении 1278 и Т→С в положении 1532, А→G в положении 1768 и С→А в положении 1985, экспрессионные векторы, включающие полинуклеотиды, функционально связанные с экспрессионной контролирующей последовательностью, и клетки хозяина (например, клетки Saccharomyces cerevisiae), включающие экспрессионный вектор.
Краткое описание фигур
Фигура 1 показывает метаболический путь восстановления сульфатов. Анализ последовательностей, проведенный для генов, выделен полужирным шрифтом, количество обнаруженных аллелей показано в скобках; аллели, обнаруженные в UCD932, подчеркнуты пунктирными линиями.
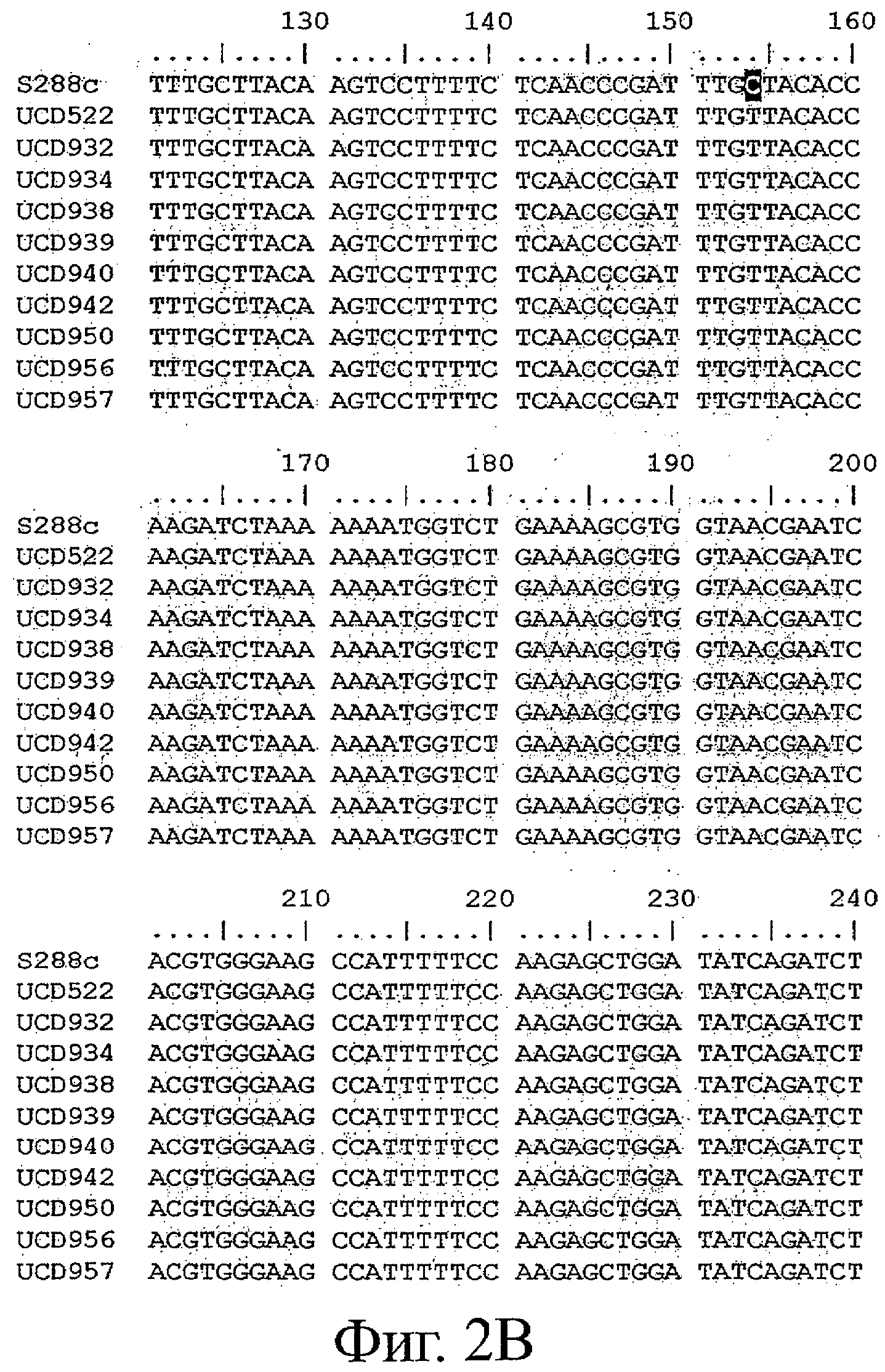
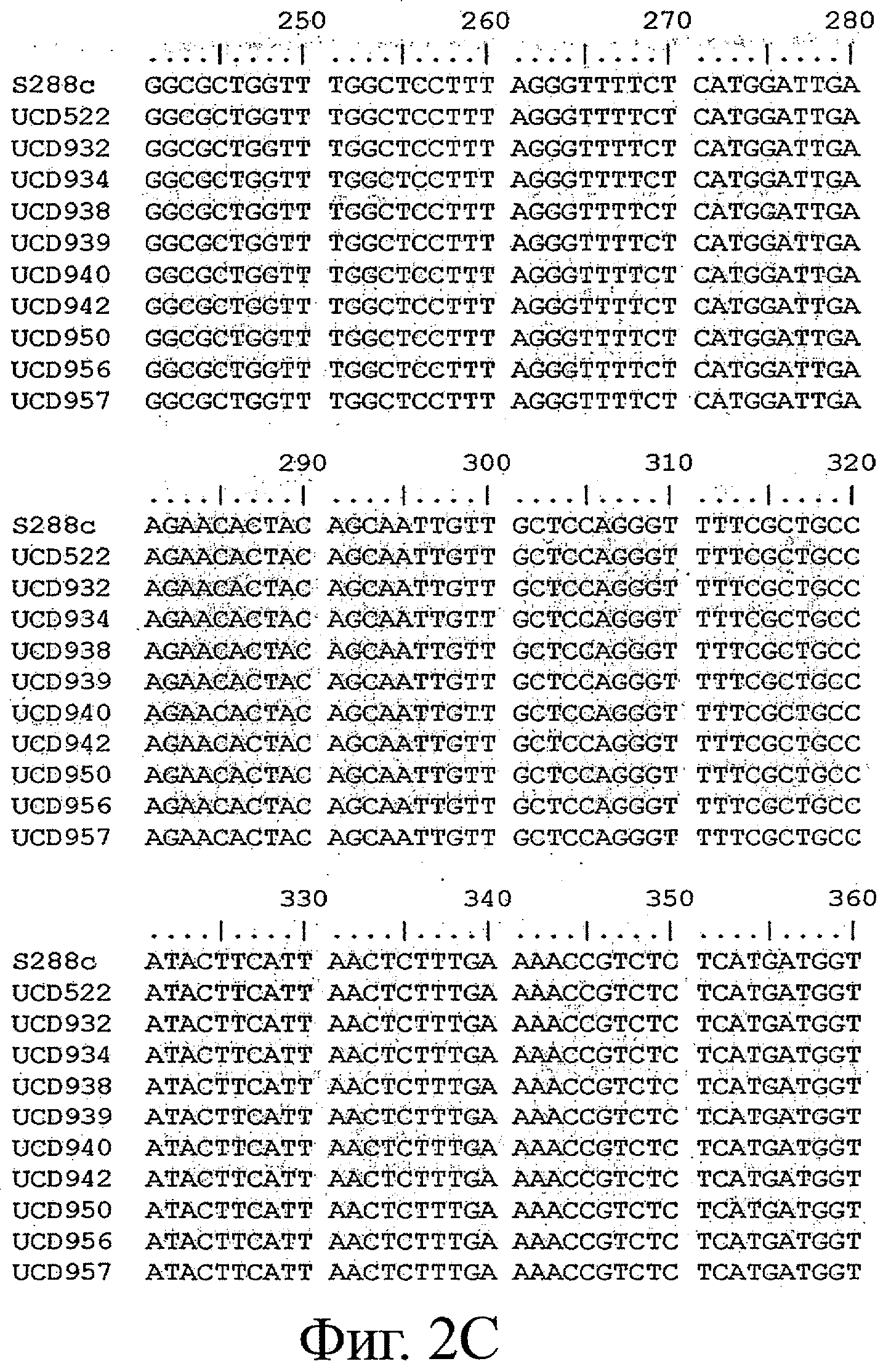
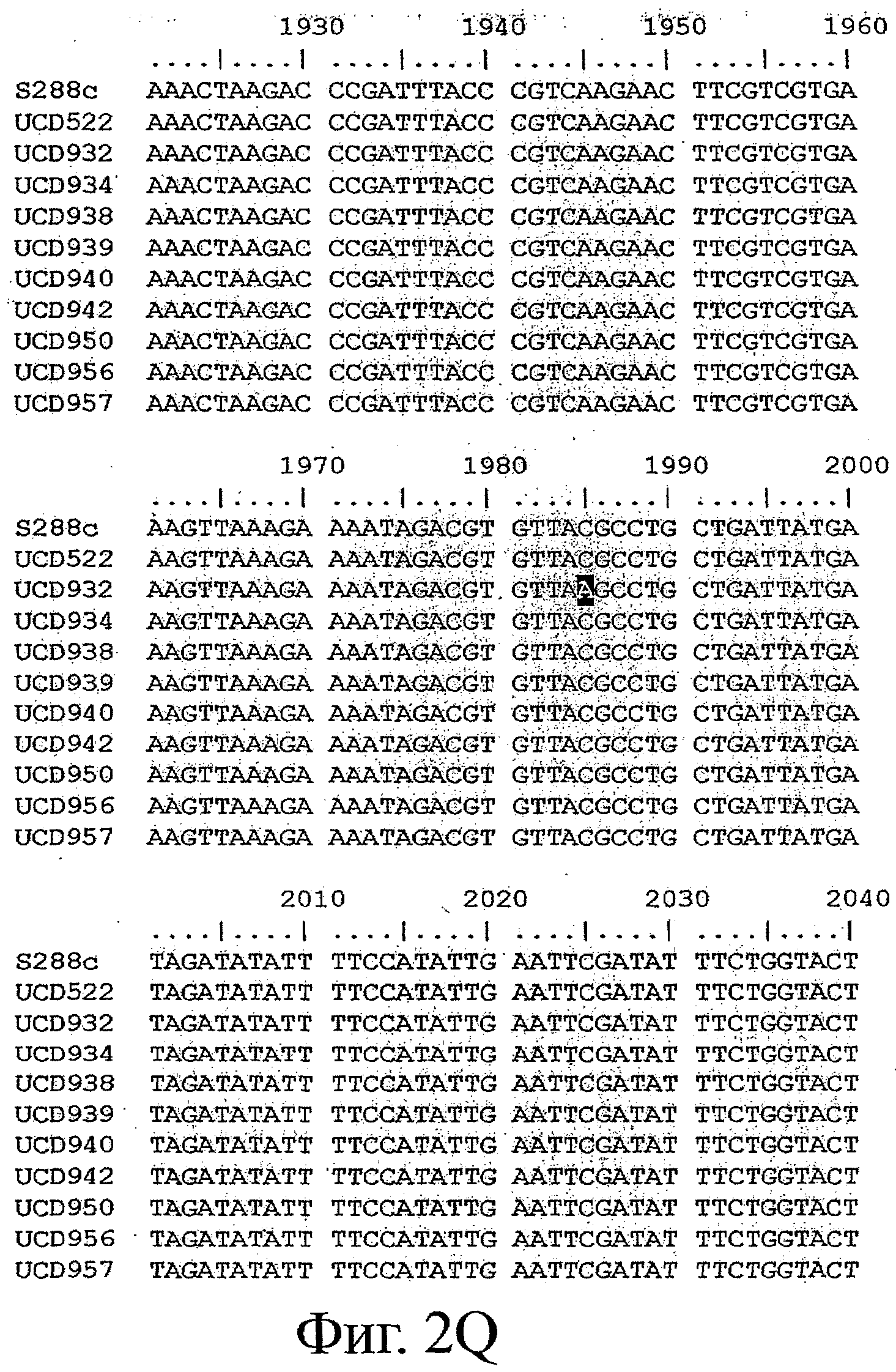
Фигуры 2A-2Z представляют выравнивание последовательности аллеля MET10 в различных штаммах Saccharomyces (SEQ ID NOS: 8, 9, 1, 10-14, 2, 15 и 16, соответственно). Выделены изменения в нуклеиновой кислоте, которые приводят к изменениям кодонов.
Фигура 3 иллюстрирует типичный метод обмена генов. MET10s = аллель S288C. MET10w = аллель винного штамма.
Фигура 4 иллюстрирует выравнивание аминокислотной последовательности гена МЕТ10 в различных штаммах Saccharomyces (S288C = SEQ ID NO: 17; UCD932 = SEQ ID NO: 18; UCD950 = SEQ ID NO: 19). Выделены различия в аминокислотах среди различных штаммов.
Фигура 5 иллюстрирует изменения в аминокислотах, окружающих остаток 662 в белке МЕТ10. Последовательности ДНК аллелей МЕТ10 из S288C (SEQ ID NO:20), UCD932 (SEQ ID NO:21) и UCD950 (SEQ ID NO:20), выровненные вблизи нуклеотида 1985 с ключевой мутацией, выделены цветом и полужирным шрифтом. Кодоны (SEQ ID NOS:22 и 23) и соответствующая аминокислотная последовательность (SEQ ID NO:24) (выделенная светло-серым цветом) показаны во вставке. Замена С на А приводит к соответствующей замене остатка треонина на лизин в положении 662 белка.
Фигура 6 иллюстрирует расположение аминокислотного остатка 662 по отношению к известным и предсказанным функциональным доменам белка МЕТ10. Изображена карта известных мотивов и доменов белка МЕТ10. Место измененного основания в положении 662 указано черной стрелкой. Мутация расположена в сульфитредуктазном домене белка. Данные из веб-сайта //db.yeastgenome.org/cgi- bin/protein/domainPage.pl?dbid=S000001926.
Фигура 7 иллюстрирует структурные особенности сульфитредуктазного домена и демонстрирует, как замена остатка треонина на лизин сказывается на структурных свойствах белка. Показаны структурные ленточные модели белка МЕТ10, основанные на предсказании структурной гомологии. Изображен только предсказанный сульфитредуктазный домен, расположенный от остатка лизина 633 до остатка тирозина 1035, с участком, находящимся вблизи остатка 662, увеличенным во вставке. В предсказанной структуре для UCD932 (фигура А) выделен лизин в положении 662, тогда как в предсказанной структуре для UCD950 (фигура В) выделен остаток треонина в положении 662.
Фигура 8 иллюстрирует выравнивание подпоследовательности белка МЕТ10 из некоторых видов дрожжей, важных для промышленного производства (UCD 932 МЕТ10 = SEQ ID NO:25; S288C МЕТ10 = SEQ ID NO:26; S. cerevisiae (carisbergensis) = SEQ ID NO:27; Kluyveromyces lactis = SEQ ID NO:28; Yarowwia lipolytica = SEQ ID NO:29; Schizosaccharomyces pombe = SEQ ID NO:30), для которых известны последовательности в сульфитредуктазном каталитическом участке. Консервативные аминокислотные остатки для всех выровненных видов показаны полужирным шрифтом. Аминокислотные остатки, консервативные в большинстве родственных видов, заштрихованы. Треонин в положении 662 или в мотиве (N/K)(R/K)R(V/L)TP(A/D/E)(D/N/E)Y(D/N)R(Y/N)IFH(I/V)EFD(I/L) (SEQ ID NO:31) консервативен в активном полипептиде МЕТ10 для всех выровненных видов дрожжей.
Краткое описание таблиц
В таблице 1 представлен перечень природных и промышленных штаммов дрожжей.
В таблице 2 представлен состав модифицированной среды Triple M (МММ).
В таблице 3 представлены результаты анализа природных изолятов дрожжей, выращенных на чашках с BiGGY и МММ.
В таблице 4 представлены дополнительные штаммы дрожжей.
В таблице 5 представлены последовательности ПЦР-праймеров для амплификации, в частности, MET10.
В таблице 6 представлены последовательности праймеров для секвенирования, в частности, МЕТ10.
В таблице 7 представлены результаты, обобщающие образование H2S штаммами дрожжей, трансформированными МЕТ10.
В таблице 8 представлены различия аминокислот в аллелях МЕТ10.
В таблице 9 представлены результаты, обобщающие данные по образованию H2S дополнительными штаммами дрожжей, трансформированными МЕТ10.
В таблице 10 представлены результаты, обобщающие данные по образованию H2S штаммами дрожжей, трансформированными МЕТ10.
В таблице 11 представлены результаты, обобщающие данные по образованию H2S штаммами дрожжей, трансформированными аллелями МЕТ10.
Осуществление изобретения
I. Введение
Настоящее изобретение обеспечивает композиции и способы снижения уровня H2S в ферментированных напитках. Изобретение частично основано на открытии того, что полипептид МЕТ10 с остатком аминокислоты в положении 662, которая не является треонином, не катализирует превращение сульфита в свободный или высвобождаемый сероводород. Это подтверждается с помощью экспрессии сульфид-неактивного полипептида МЕТ10 из аллели МЕТ10 в штамме дрожжей UCD932, в котором единственная нуклеотидная замена в положении 1985 гена МЕТ10 приводит к замене аминокислотного остатка треонина в положении 662 на лизин в каталитическом домене белка MET10.
II. Определения
Если не указано иным образом, все технические и научные термины, используемые в этом документе, обычно имеют то же самое значение, обычно приписываемое им специалистами среднего звена в области техники, к которой принадлежит это изобретение. Обычно терминология, используемая в этом документе, и лабораторные методы культивирования клеток, молекулярной генетики, органической химии и химии нуклеиновых кислот и гибридизации, описанные ниже, хорошо известны и традиционно применяются в этой области техники. Для синтеза нуклеиновых кислот и пептидов используют стандартные методики. Обычно энзиматические реакции и стадии очистки выполняют в соответствии с инструкциями производителей. Методики и способы обычно осуществляют в соответствии с общепринятыми методами этой области техники и различными общими ссылками (Sambrook and Russell, Molecular Cloning, A Laboratory Manual (3d ed., Cold Spring Harbor Laboratory Press 2001); Ausubel, et al., eds., Current Protocols in Molecular Biology (John Wiley & Sons 1987-2008)), которые предоставлены по всему документу. Терминология, используемая в этом документе, и лабораторные методы аналитической химии и органического синтеза, описанные ниже, хорошо известны и обычно применяются в этой области техники. Для химических синтезов и химических анализов используют стандартные методики или их модификации.
Термины «среды для брожения» или «среда для брожения», используемые в этом документе, относятся к не подвергшейся брожению смеси до добавления в нее дрожжей. Среды для брожения включают, например, мусты и сусло. Среды для брожения могут, кроме того, включать дополнительный источник сахаров (например, мед, тростниковый сахар, свекловичный сахар, кукурузный сахар, фруктозу, сахарозу или глюкозу); кислоту (например, лимонную кислоту, яблочную кислоту, винную кислоту и их смеси) и питательные вещества для дрожжей (например, диаммония фосфат или другой источник азота, витамины и т.п.).
Термин «муст», используемый в этом документе, относится к не подвергшейся брожению смеси фруктового сока, фрагментов стеблей, фруктовой кожуры, семян и/или мякоти, которую получают при дроблении фрукта. Можно использовать любые фрукты, содержащие ферментируемый сахар, такие как, например, виноград, яблоки, вишня, персики, нектарины, сливы, абрикосы, груши, хурма, ананасы, манго, киви, клубника, малина, голубика, бузина, ежевика, клюква, инжир и мушмула. Фрукты могут быть сушеными, прокипяченными, отварными или переработанными перед дроблением каким-либо другим способом. Муст может включать два или более фруктов.
Термин «сусло», используемый в этом документе, относится к не подвергшейся брожению жидкости, полученной с помощью растертых зерен и/или зерновой шелухи. Можно использовать любые зерна, содержащие ферментируемый сахар, такие как, например, ячмень, пшеница, рожь, рис, кукуруза и овес. Зерна могут быть обжаренными, хлопьевидными или переработанными перед дроблением каким-либо другим способом. Сусло можно получать из смеси, включающей два или более вида зерен.
Термины «Met10» и «МЕТ10», используемые в этом документе, относятся к α-субъединице ассимилирующей сульфитредуктазы Saccharomyces. Функционально полипептид МЕТ10 катализирует превращение сульфита в сульфид. Структурно полипептиды МЕТ10, в частности дрожжевые полипептиды МЕТ10, уже охарактеризованы. Полипептиды МЕТ10 содержат консервативный каталитический домен сульфитредуктазы в С-концевой части, а также домены, связывающие FAD и NAD. Центральная часть полипептида содержит пируват:ферредоксин-оксидоредуктазный домен. В сульфид-активных полипептидах МЕТ10, которые способны катализировать превращение сульфита в свободный или высвобождающийся сероводород, аминокислотный остаток в положении 662 является консервативным и обычно это треонин или иногда серин, в частности у дрожжей. Идентифицированные домены полипептидов МЕТ10 изображены на фигуре 6.
Используемый в этом документе термин «МЕТ10» относится к нуклеиновым кислотам и полипептидным полиморфным вариантам, аллелям, мутантам и межвидовым гомологам, которые: (1) имеют аминокислотную последовательность, которая демонстрирует более чем 80% идентичности аминокислотной последовательности, например 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% или более 99% идентичности аминокислотной последовательности, предпочтительно в пределах участка, состоящего, меньшей мере, из 25, 50, 100, 200, 500, 1000 или более аминокислот, или в полноразмерной молекуле, с референсной аминокислотной последовательностью, кодируемой нуклеиновой кислотой МЕТ10 (последовательность нуклеиновой кислоты дрожжевого МЕТ10 можно найти, например, в SEQ ID NO: 1, фигура 2, и в представленных ниже кодах доступа в GenBank); (2) связываются с антителами, например с поликлональными антителами, индуцированных иммуногеном, включающим аминокислотную последовательность полипептида МЕТ10 (например, кодируемого SEQ ID NO: 1), и его консервативно модифицированных вариантов; (3) специфически гибридизуются в жестких условиях гибридизации с антисмысловой цепью, соответствующей последовательности нуклеиновой кислоты, кодирующей белок МЕТ10 и его консервативно модифицированные варианты; (4) имеют последовательность нуклеиновой кислоты, которая демонстрирует более чем примерно 95%, предпочтительно более чем примерно 96%, 97%, 98%, 99% или более 99% идентичности нуклеотидной последовательности, предпочтительно в пределах, по меньшей мере, около 25, 50, 100, 200, 500, 1000 или более нуклеотидов, или в составе полноразмерной молекулы, с референсной последовательностью нуклеиновой кислоты МЕТ10. Нуклеиновые кислоты и белки изобретения включают как встречающиеся в природе, так и рекомбинантные молекулы. В некоторых воплощениях полипептиды МЕТ10 и полинуклеотиды МЕТ10 происходят из дрожжей.
Типичные аминокислотные и нуклеотидные последовательности МЕТ10 представлены в базе данных Genbank под кодами доступа EF058164, EF058165, EF058166, EF058167, EF058168, EF058169, EF058170, EF058171, EF058172, EF058173.
Используемый в этом документе термин «сульфид-активный МЕТ10» относится к полипептиду, который способен катализировать превращение сульфита в сероводород. У дрожжей сульфид-активный полипептид МЕТ10 может иметь остаток серина или треонина в положении аминокислоты 662. В штаммах дрожжей аминокислота в положении 662 у S. cerevisiae является консервативной в виде треонина или серина и находится в соответствующем мотиве каталитического участка сульфитредуктазы: (N/K)(R/K)R(V/L)TP(AD/E)(D/N/E)Y(D/N)R(Y/N)IFH(I/V)EFD(I/L) (SEQ ID NO:31). См. фигуру 8.
Используемый в этом документе термин «сульфид-неактивный МЕТ10» относится к полипептиду, который не катализирует превращение сульфита в свободный или высвобождающийся сероводород. У дрожжей сульфид-неактивный полипептид МЕТ10 не имеет треонина в положении аминокислоты 662 или в составе мотива (N/K)(R/K)R(V/L)XP(A/D/E)(D/N/E)Y(D/N)R(Y/N)IFH(I/V)EFD(I/L) (SEQ ID NO:32), то есть, где Х не является Т. В некоторых воплощениях сульфид-неактивный полипептид МЕТ10 не будет иметь остаток треонина или серина в положении аминокислоты 662. В некоторых воплощениях сульфид-неактивный полипептид МЕТ10 будет иметь Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Val, Trp или Tyr в положении 662 (SEQ ID NO:3).
В некоторых воплощениях аминокислотный остаток в положении 662 в сульфид-неактивном полипептиде МЕТ10 не имеет гидроксильной группы, например не является Thr, Ser или Tyr (SEQ ID NO:33). В некоторых воплощениях аминокислотный остаток в положении 662 в сульфид-неактивном полипептиде МЕТ10 представляет собой крупную или объемную аминокислоту, например, Lys, Arg, His, Gln, Asn, Glu, Asp, Ile, Leu, Val, Phe, Tyr или Trp (SEQ ID NO:34). В некоторых воплощениях аминокислотный остаток в положении 662 в сульфид-неактивном полипептиде МЕТ10 представляет собой основную или положительно заряженную аминокислоту, например, Lys, Arg, His, Gln или Asn (SEQ ID NO:6). В некоторых воплощениях аминокислотный остаток в положении 662 является Lys (SEQ ID NO:7).
Используемую в этом документе «экзогенную» последовательность нуклеиновой кислоты МЕТ10 или аминокислотную последовательность вводят в родительскую клетку дрожжей или в родительский штамм дрожжей при участии человека. Введение в клетку дрожжей экзогенной последовательности нуклеиновой кислоты или экзогенной аминокислотной последовательности может происходить любыми способами, известными в этой области техники, включающими рекомбинантные способы или классические способы селекции дрожжей (например, возвратное скрещивание).
Термины «нуклеиновая кислота» и «полинуклеотид» используют в этом документе равноценно для обозначения дезоксирибонуклеотидов или рибонуклеотидов и их полимеров или в одноцепочечной, или двухцепочечной форме. Термин охватывает нуклеиновые кислоты, содержащие известные аналоги нуклеотидов или модифицированные остатки или связи, входящие в остов молекулы, которые являются синтетическими, встречающимися в природе и не встречающимися в природе, которые имеют сходные связывающие свойства, что и референсная нуклеиновая кислота, и которые метаболизируются сходно с референсными нуклеотидами. Примеры таких аналогов включают, без ограничения, фосфоротиоаты, фосфорамидаты, метилфосфонаты, хиральные метилфосфонаты, 2-O-метилрибонуклеотиды, пептид-нуклеиновые кислоты (PNAs).
Если не указано специально, специфическая последовательность нуклеиновой кислоты также охватывает ее консервативно модифицированные варианты (например, замены вырожденных кодонов) и комплементарные последовательности, а также точно указанную последовательность. В частности, замены вырожденных кодонов могут быть достигнуты с помощью создания последовательностей, в которых третье положение одного или нескольких выбираемых (или всех) кодонов заменяют смешанным основанием и/или остатками дезоксиинозина (Batzer et al., Nucleic acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)). Термин «нуклеиновая кислота» используют равноценно с геном, кДНК, мРНК, олигонуклеотидом и полинуклеотидом.
Нуклеиновая кислота, «способная к распознаванию» означает полинуклеотид(ы), которые (1) специфически гибридизуются в жестких условиях гибридизации с антисмысловой цепью, соответствующей последовательности нуклеиновой кислоты, кодирующей белок МЕТ10 и ее консервативно модифицированные варианты; или (2) имеют последовательность нуклеиновой кислоты, которая демонстрирует более чем примерно 80%, 85%, 90%, 95%, предпочтительно более чем примерно 96%, 97%, 98%, 99% или более 99% идентичности нуклеотидной последовательности, предпочтительно в пределах участка, составляющего, по меньшей мере, около 25, 50, 100, 200, 500, 1000 или более нуклеотидов, с нуклеиновой кислотой МЕТ10.
Фраза «жесткие условия гибридизации» относится к условиям, в которых образец будет гибридизоваться с его целевой подпоследовательностью, обычно в комплексной смеси нуклеиновой кислоты, но не с другими последовательностями. Жесткие условия зависят от последовательностей и будут различными в различных обстоятельствах. Длинные последовательности специфически гибридизуются при более высоких температурах. Исчерпывающее руководство по гибридизации нуклеиновых кислот представлено в книге Tijssen, Techniques in Biochemistry and Molecular Biology - Hybridization with Nucleic Probes, «Overview of principles of hybridization and the strategy of nucleic acid assays» (1993). Обычно жесткие условия выбирают так, чтобы температура была на 5-10°С ниже, чем температурная точка плавления I для специфической последовательности при определенной ионной силе Ph. Tm представляет собой температуру (при определенной ионной силе Ph и концентрации нуклеиновой кислоты), при которой 50% образца, комплементарного по отношению к мишени, в равновесии гибридизуется с целевой последовательностью (так как целевые последовательности присутствуют в избытке, при температуре, равной Tm, в равновесии заняты 50%).
Жесткими являются условия, в которых концентрация солей составляет величину меньше чем примерно 1,0 М концентрация натрий-иона, обычно примерно от 0,01 до 1,0 М концентрации натрий-иона (или других солей) при рН от 7,0 до 8,3, и температура составляет, по меньшей мере, около 30°С для коротких образцов (например, от 10 до 50 нуклеотидов) и, по меньшей мере, около 60°С для длинных образцов (например, превышающих 50 нуклеотидов). Жесткие условия также могут достигаться при помощи добавления дестабилизирующих агентов, таких как формамид. Для селективной или специфической гибридизации положительный сигнал составляет величину, по меньшей мере, в два раза превышающую фон гибридизации, необязательно превышающую фон гибридизации в десять раз. Типичными жесткими условиями гибридизации могут быть следующие условия: 50%-ный формамид, 5×SSC и 1%-ный SDS, инкубация при 42°С; или 5×SSC, 1%-ный SDS, инкубация при 65°С с промыванием в 0,2×SSC и 0,1%-ном SDS при 65°С.
Нуклеиновые кислоты, которые не гибридизуются друг с другом в жестких условиях все еще являются в значительной степени идентичными, если полипептиды, которые они кодируют, являются в значительной степени идентичными. Это происходит, например, если копия нуклеиновой кислоты образуется с помощью максимальной вырожденности кодонов, допускаемой генетическим кодом. В таких случаях нуклеиновые кислоты обычно гибридизуются в умеренно жестких условиях гибридизации. Обычно «умеренно жесткие условия гибридизации» включают гибридизацию в буфере, содержащем 40%-ный формамид, 1 М NaCl, 1%-ный SDS при 37°С, и промывку в 1×SSC при 45°С. Положительная гибридизация, по меньшей мере, в два раза превышает фон. Специалисты среднего звена в этой области техники легко согласятся с тем, что для того, чтобы обеспечить условия сходной жесткости, можно применять альтернативные условия гибридизации и промывки.
Термины «изолированный», «очищенный» или «биологически чистый» относятся к веществу, которое в значительной степени или практически очищено от компонентов, которые в норме сопровождают его, если оно находится в своем нативном состоянии. Чистоту и гомогенность обычно определяют с помощью методов аналитической химии, таких как электрофорез в полиакриламидном геле или высокоэффективная жидкостная хроматография. Белок, который преобладает в препарате, является в значительной степени очищенным. В частности, изолированную нуклеиновую кислоту MET10 отделяют от открытых рамок считывания, которые фланкируют ген MET10 и кодируют белки, которые не являются MET10. Термин «очищенный» означает, что нуклеиновая кислота или белок в основном дают одну полосу в геле для электрофореза. В частности, это означает, что нуклеиновая кислота или белок, по меньшей мере, имеет 85%-ную чистоту, более предпочтительно, по меньшей мере, 95%-ную чистоту и наиболее предпочтительно, по меньшей мере, 99%-ную чистоту.
Термин «гетерологичный», который применяют в отношении частей нуклеиновой кислоты, указывает на то, что нуклеиновая кислота включает две или более подпоследовательностей, которые являются дивергентными относительно друг друга, которые могут возникать естественным путем в популяции через спонтанные мутации или перестройку генома, или могут быть введены искусственным путем. Например, нуклеиновая кислота, обычно получаемая рекомбинантно, имеет две или более последовательностей от неродственных генов, расположенных таким образом, чтобы создать новую функциональную нуклеиновую кислоту, например промотор из одного источника и кодирующий участок из другого источника. Аналогичным образом гетерологичный белок означает, что белок включает две или более подпоследовательностей, которые являются дивергентными или которые не находятся в тех же самых взаимоотношениях относительно друг друга в природе (например, слитый белок).
«Экспрессионный вектор» представляет собой конструкцию нуклеиновой кислоты, созданную рекомбинантным или синтетическим путем, с применением группы специфических элементов нуклеиновых кислот, которые дают возможность транскрипции специфической нуклеиновой кислоты в клетке хозяина. Экспрессионный вектор может быть частью плазмиды, вируса или фрагмента нуклеиновой кислоты. Обычно экспрессионный вектор включает транскрибируемую нуклеиновую кислоту, функционально связанную с промотором.
Термины «полипептид», «пептид» и «белок» применяют в этом документе равноценно в отношении полимера, состоящего из аминокислотных остатков. Термины применяют в отношении полимеров аминокислот, в которых один или более аминокислотный остаток является искусственным химическим миметиком соответствующей природной аминокислоты, а также полимера из природных аминокислот и полимера из аминокислот, не встречающихся в природе.
Термин «аминокислота» относится к природным и синтетическим аминокислотам, а также к аналогам аминокислот и миметикам аминокислот, которые функционируют таким же образом, что и природные аминокислоты. К природным относятся аминокислоты, которые кодируются генетическим кодом, а также аминокислоты, которые впоследствии модифицируются, например гидроксипролин, γ-карбоксиглутамат и O-фосфосерин. Аналоги аминокислот относятся к соединениям, которые имеют сходную основную химическую структуру, что и природная аминокислота, то есть углерод, который связан с водородом, карбоксильной группой, аминогруппой и R-группой, например гомосерин, норлейцин, метионинсульфоксид, метионинметилсульфоний. Такие аналоги имеют модифицированные R-группы (например, норлейцин) или модифицированные остовы пептидов, но сохраняют ту же самую основную химическую структуру как в природной аминокислоте. Миметики аминокислот относятся к химическим соединениям, которые имеют структуру, которая отличается от обычной химической структуры аминокислоты, но которые функционируют сходным образом с природной аминокислотой.
В этом документе аминокислоты могут быть названы либо с помощью общепринятых трехбуквенных обозначений, либо с помощью однобуквенных обозначений, рекомендованных Комиссией по биохимической номенклатуре IUPAC-IUB. Аналогичным образом, нуклеотиды могут быть названы с помощью их общепринятых однобуквенных кодов.
Термин «консервативно модифицированные варианты» применяют как к последовательностям аминокислот, так и нуклеиновых кислот. Что касается специфических последовательностей нуклеиновых кислот, то консервативно модифицированные варианты относятся к тем нуклеиновым кислотам, которые кодируют идентичные или в значительной степени идентичные аминокислотные последовательности, или, в случае если нуклеиновая кислота не кодирует аминокислотную последовательность, к последовательностям, идентичным в значительной степени. Из-за вырожденности генетического кода любой заданный белок кодируется значительным количеством функционально идентичных нуклеиновых кислот. Например, все кодоны GCA, GCC, GCG и GCU кодируют аминокислоту аланин. Таким образом, в каждом положении, в котором кодоном предусмотрен аланин, кодон может изменяться на любой из соответствующих кодонов без изменения кодируемого полипептида. Такие варианты нуклеиновых кислот являются «молчащими вариантами», которые представляют собой один вид модифицированных вариантов. Каждая последовательность нуклеиновых кислот в этом документе, которая кодирует полипептид, также включает любую возможную молчащую вариацию нуклеиновой кислоты. Специалисты в этой области техники признают, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который, как правило, является единственным кодоном для метионина, и TGG, который, как правило, является единственным кодоном для триптофана) может быть модифицирован так, чтобы произвести функционально идентичную молекулу. Таким образом, в каждой описанной последовательности подразумевают каждую молчащую вариацию нуклеиновой кислоты, которая кодирует полипептид.
Что касается аминокислотных последовательностей, то специалисты в этой области техники признают, что отдельные замены, делеции или вставки в последовательность нуклеиновых кислот, пептидов, полипептидов или белков, которые изменяют, добавляют или удаляют отдельную аминокислоту или небольшой процент аминокислот в кодируемой последовательности, представляют собой «консервативно модифицированный вариант», в котором изменение приводит к замене аминокислоты на химически похожую аминокислоту. Списки консервативных замен, обеспечивающих функционально схожие аминокислоты, известны в этой области техники. Такие консервативно модифицированные варианты представляют собой дополнения и не исключают полиморфные варианты, межвидовые гомологи и аллели изобретения.
Каждая из приведенных ниже восьми групп содержит аминокислоты, которые являются консервативными заменами друг друга:
1) аланин (А), глицин (G);
2) аспарагиновая кислота (D), глутаминовая кислота (Е);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (К);
5) изолейцин (I), лейцин (L), метионин (М), валин (V);
6) фенилаланин (F), тирозин (Y), триптофан (W);
7) серии (S), треонин (Т); и
8) цистеин (С), метионин (М) (см., например, Creighton, Proteins (1984)).
Термины «идентичный» или процент «идентичности» в контексте двух или более последовательностей нуклеиновых кислот или полипептидов относится к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или имеют указанный процент остатков аминокислот или нуклеотидов, которые являются одинаковыми (то есть имеют 60% идентичности, предпочтительно 65%, 70%, 75%, 80%, 85%, 90% или 95% идентичности с определенным участком последовательности SEQ ID NO:1) при сравнении и выравнивании для максимального соответствия в пределах окна сравнения, или предполагаемого участка, определенного с помощью одного из приведенных ниже алгоритмов сравнения последовательностей или с помощью выравнивания вручную и визуального просмотра. Такие последовательности затем называют «в значительной степени идентичными». Это определение также относится к последовательностям, комплементарным тестируемой последовательности. Предпочтительно, идентичность существует на участке, который по длине представлен, по меньшей мере, примерно 25 аминокислотами или нуклеотидами, или более предпочтительно на участке, который по длине представлен 50-100 аминокислотами или нуклеотидами.
Для сравнения последовательностей обычно одну последовательность рассматривают как исходную («референсную»), с которой сравнивают тестируемые последовательности. При использовании алгоритма для сравнения последовательностей тестируемую и исходную последовательность вводят в компьютер, при необходимости обозначают координаты подпоследовательностей и устанавливают параметры алгоритма для сравнения последовательностей. Можно использовать параметры программы по умолчанию или можно устанавливать альтернативные параметры. Алгоритм для сравнения последовательностей затем рассчитывает процент идентичности для тестируемых последовательностей относительно исходной последовательности на основе параметров программы. Для сравнения последовательности нуклеиновых кислот и белков с нуклеиновыми кислотами MET10 и белками применяют алгоритмы BLAST и BLAST 2.0 и параметры по умолчанию, которые будут обсуждены далее.
Термин «окно сравнения», используемый в этом документе, включает привязку к сегменту, представляющего собой какое-либо одно из множества смежных положений, выбираемых из группы, состоящей из от 20 до 600, обычно примерно от 50 до примерно 200, более часто примерно от 100 до примерно 150 положений, в которых последовательность можно сравнивать с исходной последовательностью из того же самого числа смежных положений после того, как две последовательности оптимально выровнены. Способы выравнивания последовательностей для сравнения хорошо известны в этой области техники. Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с помощью алгоритма локальных гомологий Smith & Waterman, Adv. Appl. Math. 2:482 (1981), с помощью алгоритма выравнивания гомологий Needleman & Wunsch, J. Mol. Biol. 48:443 (1970), с помощью метода поиска сходства Pearson & Lipman, Proc. Nat'l. Acad. Sci. USA 85:2444 (1988), с помощью компьютерного обеспечения этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программ Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI) или с помощью выравнивания вручную и визуального просмотра (смотри, например, Current Protocols in Molecular Biology (Ausubel et al., eds. 1995 supplement).
Предпочтительным примером алгоритма, который пригоден для определения процента идентичности последовательностей и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, которые описаны в работах Altschul et al., Nuc. Acids Res. 25:3389-3402 (1977) и Altschul et al., J. Mol. Biol. 215:403-410 (1990), соответственно. BLAST и BLAST 2.0 применяют с использованием параметров, описанных в этом документе, для определения процента идентичности последовательностей нуклеиновых кислот и белков изобретения. Программное обеспечение для проведения анализов BLAST находится в открытом доступе в Национальном центре биотехнологической информации (the National Center for Biotechnology Information) (см. веб-сайт ncbi.nlm.nih.gov/). Этот алгоритм, во-первых, включает идентификацию пар последовательностей с максимальным сходством (high scoring sequence pair, HSPs) с помощью идентификации «коротких слов» длиной W в запрашиваемой последовательности («query sequence»), которые либо совпадают, либо удовлетворяют некоторому положительно оцениваемому пороговому значению баллов Т при выравнивании со «словом» той же длины в последовательности из базы данных. Т рассматривается как пороговая величина веса выравнивания для соседних слов (Altschul et al., см. выше). Эти исходные совпадения соседних слов служат затравкой для начального поиска для нахождения более длинных HSPs, содержащих их. Совпадения слов расширяют в обоих направлениях вдоль каждой последовательности, по мере того как накопленный вес выравнивания может увеличиваться. Накопленный вес выравнивания рассчитывают для нуклеотидных последовательностей с помощью параметров М (премия за пару совпавших остатков; всегда >0) и N (штраф при несовпадении остатков; всегда <0). Чтобы рассчитать накопленный вес для аминокислотных последовательностей используют матрицу весов (scoring matrix). Продолжение поиска совпадений слов в каждом направлении прекращают, если: накопленный вес выравнивания снижается на величину Х от его максимально достигнутого значения; накопленный вес выравнивания приходит к нулю или становится отрицательным из-за накопления одного или нескольких остатков с негативным баллом; или если достигнут конец последовательности. Параметры алгоритма BLAST W, Т и Х определяют чувствительность и скорость выравнивания. Программа BLASTN (для нуклеотидных последовательностей) использует по умолчанию длину «слова» (W), равную 11, ожидаемое значение (Е), равное 10, М=5, N=-4, и сравнение обеих цепей. Для аминокислотных последовательностей программа BLASTP использует по умолчанию длину «слова» (W), равную 3, ожидаемое значение (Е), равное 10, и матрицу весов BLOSUM62 (смотри работу Henikoff & Henikoff, Proc. Natl. Acad. Sci. USA 89: 10915 (1989)), число выравниваний (В), равное 50, ожидание (Е), равное 10, М=5, N=-4, и сравнение обеих цепей).
Алгоритм BLAST также выполняет статистический анализ сходства между двумя последовательностями (см., например, Karlin & Altschul, Proc. Nat'l. Acad. Sci. USA 90:5873-5787 (1993)). Один показатель сходства, предоставляемый алгоритмом BLAST, представляет собой наименьшую сумму вероятностей (P(N)), которая является обозначением вероятности, с которой случайным образом будет возникать совпадение между двумя нуклеотидными или аминокислотными последовательностями. Например, нуклеиновую кислоту считают сходной с последовательностью сравнения, если наименьшая сумма вероятности при сравнении тестируемой нуклеиновой кислоты с нуклеиновой кислотой сравнения будет меньше чем примерно 0,2, более предпочтительно менее чем примерно 0,01 и наиболее предпочтительно менее чем примерно 0,001.
Указанием на то, что две последовательности нуклеиновых кислот или полипептидов в значительной степени идентичны, является то, что полипептид, кодируемый первой нуклеиновой кислотой, является иммунологически перекрестно-реактивным с антителами, полученными на полипептид, кодируемый второй нуклеиновой кислотой, как будет описано ниже. Таким образом, полипептид обычно является в значительной степени идентичным второму полипептиду, например, если два пептида различаются только консервативными заменами. Другим признаком того, что две последовательности нуклеиновых кислот в значительной степени идентичны, является то, что две молекулы или комплементарные им последовательности гибридизуются друг с другом в жестких условиях, описанных ниже. Еще одним указанием на то, что две последовательности нуклеиновых кислот в значительной степени идентичны, является то, что для амплификации последовательности можно использовать одинаковые праймеры.
Фраза «селективно (или специфически) гибридизуется с» относится к связыванию, образованию дуплекса или гибридизации молекулы только с определенной нуклеотидной последовательностью в жестких условиях гибридизации, если эта последовательность присутствует в сложной смеси (например, с клеточной или библиотечной ДНК или РНК).
Под «клеткой хозяина» имеют в виду клетку, которая содержит экспрессионный вектор и поддерживает репликацию или экспрессию экспрессионного вектора. Клетки хозяина могут быть, например, прокариотическими клетками, такими как Е. coli, или эукариотическими клетками, такими как дрожжи.
III. Нуклеиновые кислоты, кодирующие МЕТ10
А. Основные способы получения рекомбинантных ДНК
Это изобретение основано на методах, общепринятых в области рекомбинантной и классической генетики. Обычно терминология и лабораторные методы в технологии рекомбинантных ДНК, описанные ниже, хорошо известны и широко применяются в этой области техники. Для клонирования, выделения, амплификации и очистки ДНК и РНК применяют стандартные методы. Обычно ферментативные реакции, включающие ДНК-лигазу, ДНК-полимеразу, эндонуклеазы рестрикции и т.п., проводят в соответствии с инструкциями производителя. Основные материалы, раскрывающие общепринятые способы, применяемые в этом изобретении, включают Sambrook and Russell, Molecular Cloning, A Laboratory Manual (3d ed., Cold Spring Harbor Laboratory Press 2001); Ausubel et al., eds., Current Protocols in Molecular Biology (John Wiley & Sons 1987-2008); и Kriegler, Gene Transfer and Expression: A Laboratory Manual (1990).
Для нуклеиновых кислот размеры дают или в килобазах (kb), или в парах нуклеотидов (bp). Их рассчитывают на основании данных электрофореза в агарозном или акриламидном геле, данных по секвенированию нуклеиновых кислот или опубликованных последовательностей ДНК. Для белков размеры дают в килодальтонах (kDa) или в виде количества аминокислотных остатков. Размеры белков рассчитывают на основании данных гель-электрофореза, данных по секвенированию белков, из исходных аминокислотных последовательностей или из опубликованных белковых последовательностей.
Олигонуклеотиды, которые не являются коммерчески доступными, могут быть химически синтезированы с помощью твердофазного амидофосфитного триэфирного метода, впервые описанного Beaucage & Caruthers, Tetrahedron Letts. 22: 1859-1862 (1981), с использованием автоматического синтезатора, описанного в работе Van Devanter et al., Nucleic acids Res. 12:6159-6168 (1984). Очистка олигонуклеотидов представляет собой или нативный электрофорез в акриламидном геле или анионообменную HPLC, как описано в работе Pearson & Reamer, J. Chrom. 255:137-149 (1983).
Последовательность клонированных генов и синтетических олигонуклеотидов может быть подтверждена после клонирования с помощью, например, метода терминации цепи для секвенирования двухцепочечных матриц Wallace et al., Gene 16:21-26 (1981).
В. Способы клонирования для выделения нуклеотидных последовательностей, кодирующих МЕТ10
Как правило, последовательности нуклеиновых кислот, кодирующих МЕТ10, и родственные гомологи последовательностей нуклеиновых кислот клонируют из кДНК и библиотеки геномных ДНК или выделяют с помощью методов амплификации с применением олигонуклеотидных праймеров. Например, последовательности МЕТ10 обычно выделяют из библиотек нуклеиновых кислот (геномных или кДНК) с помощью гибридизации с образцом нуклеиновой кислоты, последовательность которой может происходить из SEQ ID NO: 1 или ее подпоследовательности. РНК и кДНК МЕТ10 можно выделить из любого штамма дрожжей.
Полиморфные варианты МЕТ10, аллели и межвидовые гомологи, которые в значительной степени идентичны МЕТ10, можно выделить с помощью образцов нуклеиновых кислот МЕТ10 и олигонуклеотидов в жестких условиях гибридизации путем скрининга библиотек. Альтернативно, для клонирования полиморфных вариантов МЕТ10, аллелей и межвидовых гомологов можно использовать экспрессионные библиотеки, обнаруживая экспрессированные гомологи иммунологически с помощью антисыворотки или очищенных антител, полученных к коровому домену МЕТ10, которые также распознают и селективно связываются с гомологом МЕТ10.
Для создания библиотеки кДНК можно очистить мРНК. МЕТ10 из любого штамма дрожжей. С помощью мРНК. затем создают кДНК, используя обратную транскриптазу, лигируют ее в рекомбинантный вектор и трансфицируют рекомбинантного хозяина для размножения, скрининга и клонирования. Способы создания и скрининга библиотек кДНК хорошо известны (смотри, например, Gubler & Hoffman, Gene 25:263-269 (1983); Sambrook et al., supra; Ausubel et al., supra).
Для геномной библиотеки ДНК экстрагируют из ткани и либо механически расщепляют, либо переваривают с помощью ферментов для получения фрагментов около 1-8 kb. С помощью градиентного центрифугирования удаляют фрагменты нежелательных размеров и создают конструкции в векторах на основе бактериофага лямбда. Эти векторы и фаг упаковывают in vitro. Рекомбинантный фаг анализируют с помощью гибридизации бляшек, как описано в работе Benton & Davis, Science 196:180-182 (1977). Гибридизацию колоний проводят, как в основном описано в работе Grunstein et al., PNAS USA, 72:3961-3965 (1975).
Альтернативный метод выделения нуклеиновых кислот МЕТ10 и их гомологов совмещает применение синтетических олигонуклеотидных праймеров и амплификацию РНК-вой или ДНК-вой матрицы (смотри U.S. Patents 4,683,195 и 4,683,202; PCR Protocols: A Guide to Methods and Applications (Innis et al., eds, 1990)). Для амплификации последовательностей нуклеиновых кислот МЕТ10 прямо из мРНК, кДНК, геномных библиотек или библиотек кДНК можно применять такие способы, как полимеразная цепная реакция (ПЦР) и лигазная цепная реакция (ЛЦР). Для амплификации гомологов МЕТ10 можно сконструировать вырожденные олигонуклеотиды с помощью последовательностей, предоставленных в этом документе. В праймеры можно ввести сайты эндонуклеазной рестрикции. Также могут быть полезными полимеразная цепная реакция или другие способы амплификации in vitro, например, чтобы клонировать последовательности нуклеиновых кислот, которые кодируют экспрессируемые белки, чтобы создать нуклеиновые кислоты для использования в качестве зондов для обнаружения мРНК, кодирующей MET10, в физиологических образцах, для секвенирования нуклеиновых кислот или для других целей. Гены, амплифицированные с помощью ПЦР-реакции, можно очистить из агарозных гелей и клонировать в подходящий вектор.
Чтобы амплифицировать и выделить ДНК или РНК MET10 можно также использовать методы амплификации с применением праймеров. Например, нуклеиновые кислоты, кодирующие MET10 или его фрагменты, можно получить с помощью амплификации библиотеки дрожжевых кДНК или методом обратной транскрипции из дрожжевой РНК с помощью изолированных пар праймеров нуклеиновых кислот, имеющих последовательности, представленные в таблице 5.
Эти праймеры можно применять, например, для амплификации либо полноразмерной последовательности или образца, состоящего от одной сотни до нескольких сотен нуклеотидов, которые затем используют для скрининга библиотеки кДНК полноразмерного МЕТ10.
Экспрессию гена МЕТ10 также можно проанализировать с помощью методов, известных в этой области техники, например, с помощью обратной транскрипции и амплификации мРНК, выделения суммарной РНК или полиА+РНК, нозерн-блоттинга, дот-блоттинга, гибридизации in situ, метода защиты от РНКазы, метода анализа на ДНК-микрочипах и т.п.
Чтобы сконструировать рекомбинантные гены МЕТ10 для применения в качестве зондов или для экспрессии белка, можно применять синтетические олигонуклеотиды. Этот метод осуществляют с помощью серии перекрывающихся олигонуклеотидов обычно длиной 40-120 bp, представляющих собой как смысловые, так и антисмысловые цепи гена. Эти ДНК-фрагменты затем подвергают отжигу, лигируют и клонируют. Альтернативно, можно применять методы амплификации с помощью очень точно определенных праймеров, чтобы копировать специфическую подпоследовательность гена МЕТ10. Специфическую подпоследовательность затем лигируют в экспрессионный вектор. Можно сделать химеры МЕТ10, которые будут объединять, например, часть МЕТ10 с частью гетерологичного МЕТ10 для получения химерного функционального МЕТ10.
Ген, кодирующий сульфид-неактивный полипептид МЕТ10, перед трансформацией в прокариотические или эукариотические клетки для репликации и/или экспрессии обычно клонируют в промежуточные векторы. Эти промежуточные векторы обычно являются прокариотическими векторами, например плазмидами или челночными векторами. Изолированные нуклеиновые кислоты, кодирующие сульфид-неактивные белки МЕТ10, включают последовательность нуклеиновых кислот, кодирующих сульфид-неактивный белок МЕТ10, и подпоследовательности, межвидовые гомологи, аллели и их полиморфные варианты. В некоторых воплощениях изолированная нуклеиновая кислота, кодирующая сульфид-неактивный белок МЕТ10, является последовательностью SEQ ID NO:1 или последовательностью, комплементарной ей.
С. Экспрессия сульфид-неактивного полипептида МЕТ10
Чтобы получить высокий уровень экспрессии клонированного гена, такого как молекулы кДНК, кодирующие сульфид-неактивный полипептид МЕТ10, обычно субклонируют последовательность нуклеиновой кислоты сульфид-неактивного МЕТ10 в экспрессионный вектор, который содержит сильный промотор для прямой транскрипции, терминатор транскрипции/трансляции и, в случае нуклеиновой кислоты, кодирующей белок, участок связывания рибосомы для инициации трансляции. Подходящие бактериальные промоторы хорошо известны в этой области техники и описаны, например, в работе Sambrook et al. and Ausubel et al. Бактериальные системы экспрессии для экспрессии сульфид-неактивного белка МЕТ10 доступны, например, в Е. coli. Bacillus sp. и Salmonella (Palva et al. Gene 22:229-235 (1983); Mosbach et al., Nature 302:543-545 (1983). Наборы для таких экспрессионных систем имеются в продаже. Эукариотические системы экспрессии для клеток млекопитающих, дрожжей и клеток насекомых хорошо известны в этой области техники и также имеются в продаже.
Промотор, используемый для прямой экспрессии гетерологичной нуклеиновой кислоты, зависит от конкретного применения. Промотор предпочтительно помещен примерно на том же расстоянии от гетерологичного участка начала транскрипции, что и от участка начала транскрипции в его естественном окружении. Как известно в этой области техники, однако, это расстояние можно в некоторой степени варьировать без потери функции промотора.
Кроме промотора экспрессионный вектор обычно содержит транскрипционную единицу или экспрессионную кассету, которая содержит все дополнительные элементы, небходимые для экспрессии нуклеиновой кислоты, кодирующей сульфид-неактивный МЕТ10 в клетках хозяина. Типовая экспрессионная кассета, таким образом, содержит промотор, функционально связанный с последовательностью нуклеиновой кислоты, кодирующей сульфид-неактивный МЕТ10, и элементы связи, необходимые для эффективного полиаденилирования транскрипта, участки связывания рибосом и терминации трансляции. Дополнительные элементы кассеты могут включать энхансеры и, если используют геномную ДНК в качестве структурного гена, интроны с функциональными донорными и акцепторными участками сплайсинга.
Кроме промоторной последовательности экспрессионная кассета должна также содержать участок терминации транскрипции, расположенный по ходу транскрипции после структурного гена, чтобы обеспечивать эффективную терминацию. Участок терминации может относиться к тому же самому гену, что и промоторная последовательность, или может относиться к различным генам.
Для транспорта генетической информации в клетку не особенно важно применять специфический экспрессионный вектор. Может быть использован любой из векторов, традиционно применяемых для экспрессии в эукариотических или прокариотических клетках. Стандартные бактериальные экспрессионные векторы включают плазмиды, такие как плазмиды на основе pBR322, pSKF, pET23D и слитые экспрессионные системы, такие как GST и LacZ. Также к рекомбинантным белкам могут быть добавлены эпитопные маркеры, чтобы обеспечить удобные способы выделения, например, c-myc.
Обычно в эукариотических экспрессионных векторах используют экспрессионные векторы, содержащие регуляторные элементы из вирусов эукариот, например векторы на основе SV40, векторы на основе вируса папилломы и векторы на основе вируса Эпштейна-Барра. Другие типичные примеры эукариотических векторов включают pMSG, pAV009/A+, рМТ010/А+, pMAMneo-5, векторы на основе бакуловируса pDSVE и любой другой вектор, обеспечивающий экспрессию белков под контролем раннего помотора SV40, позднего промотора SV40, металлотионеинового промотора, промотора вируса опухоли молочной железы мыши, промотора вируса саркомы Рауса, полиэдринового промотора или других промоторов, которые эффективны для экспрессии в эукариотических клетках.
Некоторые экспрессионные системы имеют маркеры, которые обеспечивают амплификацию генов, например тимидинкиназу, гидромицин-В-фосфотрансферазу и дигидрофолатредуктазу.
Элементы, которые обычно включают в экспрессионные векторы, также включают репликон, который функционирует в Е. coli, ген, кодирующий устойчивость к антибиотикам, чтобы обеспечить селекцию бактерий, которые содержат рекомбинантные плазмиды, и уникальные сайты рестрикции во вспомогательных участках плазмиды, чтобы обеспечить включение эукариотической последовательности. Выбор специфического гена устойчивости к антибиотикам не имеет существенного значения, и любой из множества генов устойчивости, известный в этой области техники, является подходящим для этой цели. При необходимости покариотические последовательности предпочтительно выбирают таким образом, чтобы они не мешали репликации ДНК в эукариотических клетках.
D. Клетки хозяина и способы их получения
Изобретение также обеспечивает клетки хозяина, которые не продуцируют сероводород или продуцируют сероводород на низком уровне и экспрессируют экзогенный сульфид-неактивный полипептид МЕТ10, как было описано в этом документе. Экзогенный полинуклеотид, кодирующий сульфид-неактивный полипептид МЕТ10, где аминокислота в положении 662 не является треонином или серином, вводят в родительскую клетку хозяина с помощью способов, известных в этой области техники, например, с помощью рекомбииантных или генетических способов скрещивания. В некоторых воплощениях клетки хозяина также не экспрессируют сульфид-активный полипептид МЕТ10, например, из-за того, что последовательность, кодирующую активный полипептид МЕТ10, подвергали нокауту и заменяли на последовательность, кодирующую сульфид-неактивный полипептид МЕТ10.
Клетки хозяина, которые продуцируют низкий, или уменьшенный, или сниженный уровень сероводорода, образуют 50% или менее H2S по сравнению с родительским штаммом до введения нуклеиновой кислоты, кодирующей сульфид-неактивный полипептид МЕТ10. В некоторых воплощениях клетки хозяина, которые продуцируют низкий или уменьшенный уровень сероводорода, образуют 40%, 30%, 25%, 20% или менее H2S по сравнению с родительским штаммом до введения нуклеиновой кислоты, кодирующей сульфид-неактивный полипептид МЕТ10.
Клетки хозяина могут быть, например, эукариотическими или прокариотическими. Клетки хозяина могут быть бактериальными клетками, клетками млекопитающих, дрожжей или насекомых. В некоторых воплощениях клетка хозяина является клеткой дрожжей, например, клеткой дрожжей S. cerevisiae, Kluyveromyces lactis, Yaro-wwia lipolytica или Schizosaccharomyces pombe. Клетки дрожжей, используемые при изготовлении ферментированных напитков, например вина, портвейна, мадеры, пива, шампанского и т.д. (например, «винные дрожжи», «пивные дрожжи,» «дрожжи для производства шампанского» и т.д.), применяют для введения нуклеиновой кислоты, кодирующей экзогенный сульфид-неактивный полипептид МЕТ10. Штаммы клеток дрожжей, применяющиеся при изготовлении ферментированных напитков, которые являются кандидатами для инактивации МЕТ10 (то есть те, которые являются продуцентами сероводорода), доступны в продаже из многих источников, включающих без ограничения, Lallemand (Lalvin) (Petaluma, СА; на веб-сайте lallemandwine.us/products/yeast_chart.php) Red Star (на веб-сайте www.redstaryeast.net/), White Labs (Boulder, CO; на веб-сайте whitelabs.com/yeastjsearch. html), Wyeast (Odell, OR; wyeast lab.com), Kitzinger's, J. Laffort, Vierka, Gervin, SB Active, Unican, Siebel Inst. и Fermentis (на веб-сайте fermentis.com/FO/EN/00-Home/10-10_home.asp). Смотри, например, на веб-сайте winemaking.jackkeller.net/strains.asp типичный список штаммов винных дрожжей и дрожжей для изготовления шампанского и на веб-сайте byo.com/referenceguide/yeaststrains/ - типичный список штаммов пивных дрожжей.
В некоторых воплощениях штамм клеток дрожжей представляет собой штамм S. cerevisiae. В некоторых воплощениях штамм клеток дрожжей S. cerevisiae является винными дрожжами, например, выбираемыми из Prise de Mousse, Premier Cuveé, French Red, Montachet, Lallemand K 1, Bordeaux, UCD522, UCD940, Ba25, Ba126, Ba137, Ba220, Bb23, Bb25, Ba30, Bb32, Bb19 и Bb22. Смотри, например, патент U.S. Patent No. 6,140,108, содержание которого включено в этот документ путем отсылки для всех целей. Дополнительные штаммы дрожжей, которые являются кандидатами для инактивации МЕТ10, то есть для введения нуклеиновой кислоты, кодирующей сульфид-неактивный полипептид МЕТ10, перечислены в таблицах 1, 3 и 4.
Для получения бактериальных клеточных линий и клеточных линий млекопитающих, дрожжей и насекомых, которые экспрессируют большие количества сульфид-неактивного белка МЕТ10, которые затем очищают с помощью стандартных методик, используют стандартные способы трансфекции (см., например, Colley et al., J. Biol. Chem. 264:17619-17622 (1989); Guide to Protein Purification, in Methods in Enzymology, vol.182 (Deutscher, ed., 1990)). Трансформацию эукариотических и прокариотических клеток проводят в соответствии со стандартными методиками (см., например, Morrison, J. Bact. 132:349-351 (1977); Clark-Curtiss & Curtiss, Methods in Enzymology 101:347-362 (Wu et al., eds, 1983).
Можно применять любой из хорошо известных способов введения чужеродной нуклеотидной последовательности в клетки хозяина. Они включают использование кальций-фосфатной трансфекции, полибрена, метода слияния протопластов, электропорации, липосом, микроинъекции, плазматических векторов, вирусных векторов и любых других хорошо известных способов введения клонированной геномной ДНК, кДНК, синтетической ДНК или другого чужеродного генетического материала в клетку хозяина (смотри, например, Sambrook et al., supra). Необходимо лишь, чтобы специфический генно-инженерный способ обеспечивал успешное введение, по меньшей мере, одного гена в клетку хозяина, способную экспрессировать сульфид-неактивный МЕТ10. Клетки хозяина, улучшенные для того, чтобы не продуцировать сероводород (то есть «нулевые» продуценты H2S), также обычно будут иметь нокаутный, замененный или мутированный активный МЕТ10. Например, нуклеиновую кислоту, кодирующую сульфид-активный МЕТ10 в родительском штамме, можно мутировать в кодоне (1984-1986 положения нуклеиновой кислоты), кодирующем аминокислоту в положении 662, таким образом, чтобы этот кодон не кодировал треонин (или серин). Методики гомологичной рекомбинации также найдут свое применение в замене нуклеиновой кислоты, кодирующей сульфид-активный полипептид MET10, на последовательность нуклеиновой кислоты, кодирующей сульфид-неактивный полипептид МЕТ10, как было описано в этом документе. Смотри, например, фигуру 3 и Baudin, et al., Nucleic acids Res (1993) 21(14):3329.
После того как экспрессионный вектор вводят в клетки, трансфицированные клетки культивируют в условиях, благоприятствующих экспрессии сульфид-неактивного МЕТ10, который извлекают из культуры с помощью стандартных методик, описанных ниже.
Экзогенная нуклеиновая кислота МЕТ10, кодирующая неактивный фермент, также может быть трансфицирована в новые исходные геномы (генетические «бэкграунды») с помощью классических дрожжевых генетических технологий выделения спор, скрещивания спор противоположного типа спаривания и получения конечных диплоидных штаммов. Чтобы выделить новый аллель МЕТ10 в «бэкграунде» различных штаммов, можно использовать несколько циклов генетического скрещивания. Для создания модифицированных штаммов нет необходимости применять рекомбинантные методы. Типичные способы введения нуклеиновой кислоты, кодирующей сульфид-неактивный полипептид МЕТ10 в дрожжевую клетку хозяина с помощью классических дрожжевых генетических технологий описаны, например, в патенте US №6,140,108.
Е. Очистка белка МЕТ10
Как встречающийся в природе, так и рекомбинантный белок МЕТ10 можно очистить для применения в функциональных анализах. Встречающиеся в природе белки МЕТ10 очищают, например, из дрожжей и любого другого источника гомолога МЕТ10. Рекомбинантный МЕТ10 очищают из любой подходящей экспрессионной системы.
МЕТ10 можно значительно очистить с помощью стандартных методик, включающих селективное осаждение с помощью таких веществ, как сульфат аммония; колоночную хроматографию, способы иммуноочистки и другие (смотри, например, Scopes, Protein Purification: Principles and Practice (1982); U.S. Patent No. 4,673,641; Ausubel et al., supra; Sambrook et al., supra).
При очистке рекомбинантного белка МЕТ10 можно применять многие методы. Например, белки, обладающие установленными свойствами молекулярной адгезии, можно обратимо слить с МЕТ10. МЕТ10 с подходящим лигандом можно селективно адсорбировать на колонке для очистки и затем снять с колонки в относительно чистой форме. Слитый белок затем удаляют ферментативно. В конечном итоге МЕТ10 можно очистить с помощью иммуноаффинных колонок.
IV. Определение способности штамма дрожжей продуцировать H2S путем установления последовательности нуклеиновой кислоты МЕТ10
В одном воплощении изобретение предоставляет способы определения, является ли специфический штамм дрожжей продуцентом H2S. В соответствии со способами изобретения аллель МЕТ10 штамма дрожжей анализируют и сравнивают с аллелями МЕТ10, раскрытыми в этом документе для того, чтобы определить является ли штамм дрожжей сильным или слабым продуцентом H2S или не способен продуцировать H2S. Определение наличия или отсутствия специфического аллеля МЕТ10 обычно проводят, анализируя образец нуклеиновой кислоты, который получают из анализируемых дрожжей (например, рода Saccharomyces). Часто образец нуклеиновой кислоты включает геномную ДНК. Также возможно анализировать образцы РНК на наличие аллелей МЕТ10.
Методы определения, предназначенные для оценки присутствия точечной мутации в нуклеиновых кислотах, включает способы, хорошо известные в области молекулярной генетики. Кроме того, многие способы включают амплификацию нуклеиновых кислот. В этой области техники предоставлены подробные инструкции для осуществления способов. Примеры ссылок включают такие руководства, как методы ПЦР: PRINCIPLES AND APPLICATIONS FOR DNA AMPLIFICATION (ed. H.A.Erlich, Freeman Press, NY, N.Y., 1992); PCR PROTOCOLS: A GUIDE TO METHODS AND APPLICATIONS (eds. Innis, et al., Academic Press, San Diego, Calif, 1990); CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, Ausubel, 1994-2008, Wiley Interscience, включая дополнительные уточнения включительно по апрель 2004 г.; Sambrook & Russell, Molecular Cloning, A Laboratory Manual (3rd Ed, 2001).
Способы обнаружения точечных мутаций, хорошо известные в этой области техники, часто содержат один из нескольких основных протоколов: гибридизацию с помощью олигонуклеотидов со специфической последовательностью, удлинение праймера, лигирование специфической последовательности, секвенирование или методы электрофоретического разделения, например анализ одноцепочечного конформационного полиморфизма (SSCP) и гетеродуплексный анализ. Примеры таких анализов включают 5'-нуклеазный анализ, управляемое матрицей включение окрашенных терминаторов, анализы аллель-специфичных олигонуклеотидов методом молекулярных маячков, анализ удлинения цепи на одно основание и оценка SNP с помощью пирофосфатного секвенирования в режиме реального времени. Анализ амплифицированной последовательности можно проводить с помощью различных методов, таких как технология микрочипов, анализ поляризации флуоресценции и масс-спектрометрия с помощью лазерной десорбции-ионизации в присутствии матрицы (MALDI). Чтобы обнаружить наличие мутаций МЕТ10, раскрытых в этом документе, в дополнение к этим часто используемым методам анализа образцов нуклеиновых кислот для обнаружения точечных мутаций можно использовать любой метод, известный в этой области техники.
Хотя в методах обычно применяют стадии ПЦР, также можно использовать другие протоколы амплификации. Подходящие способы амплификации включают лигазную цепную реакцию (смотри, например, Wu & Wallace, Genomics 4:560-569, 1988); анализ замещения цепи (смотри, например. Walker et al., Proc. Natl. Acad. Sci. USA 89:392-396, 1992; U.S. Pat. No. 5,455,166); и несколько систем амплификации, основанных на транскрипции, включающих способы, раскрытые в патентах U.S. Pat. Nos. 5,437,990; 5,409,818 и 5,399,491; систему амплификации, основанную на транскрипции (TAS) (Kwoh et al., Proc. Natl. Acad. Sci. USA 86: 1173-1177, 1989); и самоподдерживающуюся репликацию последовательностей (3SR) (Guatelli et al., Proc. Natl. Acad. Sci. USA 87: 1874-1878, 1990; WO 92/08800). Альтернативно, можно использовать способы, в которых амплифицируют образец до детектируемого уровня, такие как Qβ-репликазная амплификация (Kramer & Lizardi, Nature 339:401-402, 1989; Lomeli et al., Cim. Chem. 35: 1826-1831, 1989). Обзор известных способов амплификации можно найти, например, в работе Abramson and Myers, Current Opinion in Biotechnology 4:41-47, 1993.
В некоторых воплощениях аллель MET10 обнаруживают с помощью олигонуклеотидных праймеров и/или зондов. Олигонуклеотиды можно получить с помощью любого подходящего метода, включающего химический синтез. Олигонуклеотиды можно синтезировать, используя доступные в продаже реагенты и приборы. Альтернативно, их можно приобрести у коммерческих источников. Способы синтезирования олигонуклеотидов хорошо известны в этой области техники (смотри, например, Narang et al., Meth. Enzymol. 68:90-99, 1979; Brown et al., Meth. Enzymol. 68: 109-151, 1979; Beaucage et al., Tetrahedron Lett. 22: 1859-1862, 1981; и твердофазный метод, раскрытый в U.S. Pat. No. 4,458,066).
А. ПЦР-идентификация аллелей МЕТ10
В некоторых воплощениях для амплификации нуклеиновых кислот, кодирующих аллели МЕТ10, используют метод ПЦР. Общий обзор применяемой технологии можно найти в протоколах ПЦР: A Guide to Methods and Applications (Innis et al. eds. (1990)) и PCR Technology: Principles and Applications for DNA Amplification (Erlich, ed. (1992)). Кроме того, технология амплификации раскрыта в патентах US №№4,683,195 и 4,683,202.
ПЦР дает возможность копирования и результирующей амплификации целевой нуклеиновой кислоты, например нуклеиновой кислоты, кодирующей МЕТ10. Вкратце, целевую нуклеиновую кислоту, например ДНК из образца, включающего интересующие штаммы дрожжей, объединяют со смысловым и антисмысловым праймерами, dNTPs, ДНК-полимеразой и другими компонентами реакции. (См., Innis et al., supra.) Смысловой праймер можно подвергнуть отжигу с антисмысловой цепью интересующей последовательности ДНК. Антисмысловой праймер можно подвергнуть отжигу со смысловой цепью последовательности ДНК, расположенной по ходу транскрипции ниже участка, где смысловой праймер гибридизуется с целевой ДНК. В первом цикле амплификации ДНК-полимераза удлиняет антисмысловой и смысловой праймеры, которые отжигают с целевой нуклеиновой кислотой. Первые цепи синтезируются как длинные цепи смешанной длины. Во втором цикле амплификации антисмысловой и смысловой праймеры отжигают с исходной целевой нуклеиновой кислотой и комплементарными последовательностями длинных цепей. ДНК-полимераза затем удлиняет отожженные праймеры, чтобы образовать цепи определенной длины, которые комплементарны друг другу. Последующие циклы способствуют преимущественной амплификации молекул ДНК определенной длины.
Как правило, ПЦР и другие способы амплификации используют праймеры, которые отжигают с обоими концами интересующей ДНК. Например, нуклеиновые кислоты, кодирующие аллели МЕТ10 или их фрагменты, можно амплифицировать с помощью изолированной пары праймеров нуклеиновой кислоты, имеющих последовательности, представленные в таблице 5.
В. Обнаружение амплифицированных продуктов
Амплифицированные продукты могут быть обнаружены с помощью любых средств, известных в этой области техники, включая, например, анализ полиморфизма длины фрагментов рестрикции (RFLP); электрофорез в денатурирующем геле (смотри, например, Erlich, ed., PCR TECHNOLOGY, PRINCIPLES AND APPLICATIONS FOR DNA AMPLIFICATION, W.H. Freeman and Co, New York, 1992, Chapter 7), прямое секвенирование и анализ на основе HPLC. Подходящие способы секвенирования включают, например, методы дидезоксисеквенирования и определение последовательности методом Максама-Гилберта (смотри, например, Sambrook and Russell, supra). Подходящие анализы на основе HPLC включают, например, HPLC (dHPLC) в денатурирующих условиях, как описано, например, в работах Premstaller and Oefner, LC-GC Europe 1-9 (July 2002); Bennet et al., BMC Genetics 2: 17 (2001); Schrimi et al., Biotechniques 28(4):740 (2000); и Nairz et al., PNAS USA 99(16): 10575-10580 (2002); и масс-спектрометрию на основе электрораспылительной ионизации с использованием ион-парной обращенно-фазовой HPLC (ICEMS), как описано, например, в работе Oberacher et al., Hum. Mutat. 21(1):86 (2003). Другие способы характеристики точечных мутаций в аллелях MET10 включают, например, метод удлинения цепи на одно основание (см., например, Kobayashi et al., Mol. Cell. Probes, 9: 175-182, 1995); анализ одноцепочечного конформационного полиморфизма, как было описано, например, в работе Orita et al., Proc. Nat. Acad. Sci. 86, 2766-2770 (1989), гибридизацию с аллель-специфичными олигонуклеотидами (ASO) (например, Stoneking et al., Am. J. Hum. Genet. 48:70-382, 1991; Saiki et al., Nature 324, 163-166, 1986; EP 235,726 и WO 89/11548); и методы амплификации специфических последовательностей или удлинения праймеров, как описано, например, в патентах WO 93/22456; US №№5,137,806; 5,595,890; 5,639,611 и US №№4,851,331; 5'-нуклеазный анализ, как описано в патентах US №№5,210,015; 5,487,972 и 5,804,375; и в работе Holland et al., 1988, Proc. Natl. Acad. Sci. USA 88:7276-7280.
V. Способы снижения уровня H2S в ферментированных напитках
Штаммы дрожжей, включающие нуклеотидные последовательности MET10, раскрытые в этом документе, могут быть использованы для снижения уровня H2S в ферментированных напитках (например, в вине и пиве).
В соответствии со способами изобретения клетки дрожжей, трансформированные с помощью экзогенной последовательности нуклеиновой кислоты, кодирующей сульфид-неактивный полипептид MET10, как было описано в этом документе, приводят в контакт со средой брожения (например, мустом или суслом) и смесь инкубируют в течение подходящего времени (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 дней) в подходящем сосуде для первого брожения (например, в баке, бочке, кувшине, банке, ведре или полиэтиленовом контейнере) при температуре (например, около 70-75°F, т.е. 21-23°С), подходящей для прохождения брожения. Жидкость затем можно перенести в сосуд для второго брожения. Второй сосуд может быть закупоренным или незакупоренным, и содержимое сосуда инкубируют в течение подходящего времени (например, 2, 3, 4, 5, 6, 7 или 8 недель) при температуре (например, около 60-65°F, т.е. 16-18°С), подходящей для прохождения анаэробного брожения и выдержки. Жидкость затем переносят в третий сосуд для декаптирования (то есть для осветления). Третий сосуд закупоривают и оставляют для выпадения осадка в течение подходящего времени (например, 2, 3, 4, 5, 6, 7 или 8 недель). Декантирование можно повторить один, два, три или более раз перед розливом ферментированных напитков в бутылки. Нативный аллель MET10 может быть заменен или с помощью технологий рекомбинантных ДНК или путем скрещивания, используя классические стратегии селекции. Аллель UCD932 МЕТ10 дает колониям бесцветное окрашивание на агаре BiGGY, что позволяет следить за этим аллелем при генетическом скрещивании и проводить облегченный отбор при получении, чтобы продемонстрировать успешное внедрение штамма.
Если вино прозрачное и перед бутилированием полностью завершены брожение и выдержка, вино откачивают в винные бутылки и плотно закупоривают. Закрытые бутылки оставляют в вертикальном положении на 3-5 дней и затем перед взятием пробы хранят их на боку при температуре 55 градусов по Фаренгейту (13°С) в течение от 6 месяцев (белое вино) до года (красное вино). Если вино не соответствует ожидаемому качеству, его оставляют выдерживаться еще на один год или более.
Дрожжи могут быть трансформированы с помощью любого метода, известного в этой области техники, включая, метод Liac/SS carrier DNA/PEG, описанный в работах Gietz and Woods, Methods in Enzymology 350: 87-96 (2002); Agatep et al., Technical Trps Online Transformation of Saccharomyces cerevisiae by the lithium acetate/single-stranded carrier DNA/polyethylene glycol (LiAc/ss-DNA/PEG) protocol (1998); и дрожжевую двухгибридную систему, описанную в работе Gietz et al., Mol Cell Biochem 172:67-79 (1997). Способы получения клеток дрожжей, которые компетентны для трансформации, представлены, например, в работе Dohmen et al. (1991) Yeast 7: 691-692.
VI. Наборы
MET10 и его гомологи являются полезными инструментами для более специфичного и чувствительного установления штаммов дрожжей, которые являются слабыми продуцентами H2S. Например, для идентификации штаммов дрожжей, которые являются слабыми продуцентами H2S, используют нуклеиновые кислоты, которые специфически гибридизуются с нуклеиновыми кислотами МЕТ10, такими как зонды и праймеры МЕТ10 (например, представленные в таблице 5), нуклеиновые кислоты МЕТ10 (например, представленные на фигуре 2).
Изобретение также обеспечивает наборы и растворы для обнаружения аллелей МЕТ10, раскрытых в этом документе. Например, изобретение обеспечивает наборы, которые включают один или более реакционных сосудов, в которых находятся аликвоты некоторых или всех реакционных компонентов изобретения. Аликвоты могут быть в жидкой или высушенной форме. Реакционные сосуды могут включать контейнер для обработки образца или другие сосуды, которые обеспечивают возможность для удерживания, обработки и/или амплификации образцов в одном и том же сосуде. Такие наборы обеспечивают быстрое обнаружение продуктов амплификации изобретения в стандартных или портативных приборах для амплификации. Наборы могут также включать письменные инструкции для применения набора для амплификации и контроля за амплификацией целевого образца.
Наборы могут включать, например, реагенты для амплификации, включающие праймеры, достаточные для амплификации; по меньшей мере, один аллель МЕТ10 и, по меньшей мере, один зонд для амплификации и обнаружения полинуклеотидной последовательности. Кроме того, набор может включать нуклеотиды (например. А, С, G и Т), ДНК-полимеразу и подходящие буферы, соли и другие реагенты для того, чтобы способствовать реакции амплификации.
В некоторых воплощениях наборы включают сосуды, такие как контейнеры для обработки образца, полезные для быстрой амплификации образца, как описано в работах Belgrader, et al., Biosensors and Bioelectronics 14:849-852 (2000); Belgrader, et al., Science, 284:449-450 (1999); и Northrup, M.A., et al. «A New Generation of PCR Instruments and Nucleic Acid Concentration Systems» in PCR PROTOCOLS (Sninsky, JJ. et al. (eds.)) Academic, San Diego, Chapter 8 (1998)).
Примеры
Приведенные ниже примеры предназначены для иллюстрации, но не для ограничения заявленного изобретения.
Пример 1: Идентификация генов, влияющих на образование H2S
Для того чтобы лучше понять механизмы и метаболические пути, в которых образуется H2S, и чтобы усовершенствовать будущую стратегию предупредительных мер и управления процессом, был проведен скрининг набора штаммов дрожжей с делениями, включавшего 4827 мутантов, чтобы идентифицировать гены, влияющие на образование H2S. Был проведен скрининг коллекции нативных изолятов, используемых для брожения вина (Mortimer 1994), чтобы определить основу взаимосвязи окраски колоний и фактического образования H2S. Кроме того, коллекцию нулевых мутантов дрожжей, исходный штамм которых не являлся продуцентом H2S, подвергли скринингу на гены, при мутировании которых происходило усиление образования H2S. Также оценивали возможные аддитивные эффекты на образование H2S этими мутантами.
Материалы и методы
Штаммы дрожжей и условия культивирования. Штаммы дрожжей, применяемые в этом исследовании и для которых были получены результаты, перечислены в таблице 1. Штаммы дрожжей поддерживали и выращивали на среде пептон-декстроза-дрожжевой экстракт с 2%-ной глюкозой (YPD) (Sherman et al. 1974). Для поддержания штаммов с делениями, несущими маркер 0418R, использовали ту же самую среду (YPD) с генетицином (G418, 0,2 мг/мл).
ДНК и генетические манипуляции. Генетические манипуляции, включающие скрещивания, спорообразование и тетрадный анализ, проводили, используя стандартные процедуры (Gunthrie 1991). Делеций генов подтверждали с помощью ПЦР, используя прямой праймер, расположенный ближе по отношению к точке инициации транскрипции, и внутренний обратный праймер к маркеру повреждения KanMX - JKKanRE. Условия амплификации были следующими: 30 циклов при 94°С в течение 2 мин, при 92°С в течение 45 с, при 56°С в течение 30 с, при 72°С в течение 1 мин и последнее удлинение при 72°С в течение 7 мин. Последовательности праймеров перечислены в таблице 5.
Скрининг набора делеций и природных штаммов. Набор делеций (Open Biosystems, Huntsville, AL) и коллекцию природных изолятов отсортировывали на агаре BiGGY, на висмут-глюкоза-глицин-дрожжевом агаре (Nickerson 1953). Их также отсортировывали на синтетической среде с виноградным соком «Minimal Must Media» (МММ) (Spiropoulos et al. 2000) исходно с 123 мг азотного эквивалента/литр. Уровень азота создавали, используя 0,2 г L-аргинина/литр и 0,5 г аммония фосфата/литр.
Анализ образования сероводорода. Образование сероводорода оценивали с помощью свинцово-ацетатного метода (Spiropoulos et al. 2000; Gludici, P., and R.E. Kunkee, 1994). Образование сероводорода исходно обнаруживали с помощью бумажных полосок (2 х 10 см, 3 мм фильтровальная бумага Whatman), которые предварительно были обработаны 50 мкл 5%-ного раствора ацетата свинца и оставлены сохнуть при комнатной температуре. Полоски с ацетатом свинца свертывали пополам и помещали в культуральные пробирки объемом 50 мл с крышками, закрепляющими оба конца полоски, помещая среднюю часть полоски с ацетатом свинца в газовое окружение над жидкой средой. Образование сероводорода качественно измеряли по степени почернения полоски с ацетатом свинца. Это исследование было проведено Carrie Findleton в виде части ее диссертации на соискание ученой степени MS.
Все позитивные результаты подтверждали с помощью более чувствительного и полуколичественного метода. Полоску фильтровальной бумаги Whatman (1,5×8,0 см, 3 мм) скручивали и помещали в пластиковую пипетку, объемом на 1 мл, которая не является шаровой пипеткой, и обрабатывали 250 мкл 3%-ного раствора ацетата свинца. Бумагу оставляли сохнуть при комнатной температуре и пластиковую колонку с ацетатом свинца затем присоединяли к культуральной пробирке объемом 50 мл с помощью силиконовой пробки. Образование сероводорода измеряли в мм потемнения бумаги.
В последующих экспериментах для оценки образования H2S использовали уплотненные колонки с ацетатом свинца, в которых каждый мм потемнения на колонке соответствовал 4 мкг H2S/л. Колонки с ацетатом свинца были приобретены у фирмы Figasa International Inc. (Seoul, Korea).
Условия брожения. Чтобы идентифицировать штаммы дрожжей и условия питания, оказывающие воздействие на образование сероводорода, культуры дрожжей выращивали в 5 мл модифицированной среды Triple M Medium в культуральных пробирках объемом на 50 мл при 25°С на вибростоликах при 120 об/мин. Для получения семи композиций с различным содержанием азота и микроэлементов использовали или модифицировали исходную рецептуру синтетической среды на основе виноградного сока «Minimal Must Medium» (МММ) (Gludici et al. 1993). Чтобы регулировать концентрацию азота, комбинировали добавки аргинина, аммония фосфата и казаминовых аминокислот, а для контроля за концентрацией питательных веществ и витаминов регулировали добавление YNB (дрожжевая азотная основа без аминокислот и сульфата аммония). Модификации среды Triple M представлены в таблице 2.
Инокулят дрожжей получали из колоний дрожжей, высеянных на чашках. Эта процедура может приводить к некоторым различиям в количестве клеток при инокуляции, но была необходима из-за большого количества штаммов дрожжей, вовлеченных в процесс предварительного скрининга. Образование сероводорода оценивали через четыре дня по степени почернения полоски с ацетатом свинца. Штаммы, которые не росли в течение четырех дней, выращивали снова, чтобы убедиться в отсутствии других параметров, приводящих к отсутствию роста.
Для выбранных штаммов, представляющих интерес, образование сероводорода оценивали количественно с помощью колонок с ацетатом свинца. Для этой цели брожение проводили в колбах Эрленмейера объемом 500 мл, содержащим 300 мл МММ, с колонкой с ацетатом свинца, закрепленной в верхней части колбы в резиновой пробке. Для этой цели использовали 123 мг/л азота МММ, чтобы более точно имитировать условия низкого содержания азота в виноградном соке. Брожение начинали при плотности 1,33×105 клеток/мл с помощью инокуляции клеток на стационарной фазе роста из культуры, предварительно выращенной на среде Triple M Medium с одним и тем же составом. Брожение проводили в трех повторах, инкубировали при 25°С и 120 об/мин и следили в течение семи дней за потерей массы и почернением колонки с ацетатом свинца.
Скрининг набора делеций и природных изолятов на агаре BiGGY. Для оценки образования H2S штаммами с делециями и природными изолятами их вначале выращивали на чашках с агаром BiGGY и определяли цвет колоний. Колонии были бесцветными или окрашенными в светлый желтовато-коричневый, желтовато-коричневый (цвет набора делеций исходного штамма), светло-коричневый, коричневый или черный цвет (Linderholm et al. 2006). Из набора делеций четыре колонии были бесцветными, 258 были светлыми желтовато-коричневыми, 4478 были желтовато-коричневыми, 59 были светло-коричневыми, 28 были коричневыми и одна колония была черной, различаясь по цвету колоний от светлых до темных.
Скрининг природных и коммерчески доступных изолятов в синтетическом соке. Проводили скрининг тридцати природных изолятов в синтетической среде МММ на основе сока с содержанием азота 123 мг/л для оценки связи между образованием H2S и цветом колонии. Штаммы, не продуцирующие H2S (то есть UCD932, UCD713, UCD819, UCD938, UCD942, UCD954 и UCD956), имели цвет колоний, который изменялся от белого до светло-коричневого. Штаммы, продуцирующие H2S, варьировались от светлого желтовато-коричневого (3) до желтовато-коричневого (10), светло-коричневого (5), коричневого (5). Самые темные колонии (коричневые) продуцировали H2S в диапазоне 2-6 мм и располагались в средней части диапазона образования. Три самых сильных продуцента (свыше 10 мм) на агаре BiGGY были светлыми желтовато-коричневыми, желтовато-коричневыми и светло-коричневыми. Природные изоляты на агаре BiGGY и в среде МММ представлены в таблице 3.
Пример 2: Идентификация мутаций в аллеле МЕТ10 UCD932
Как показано выше в примере 1, UCD932 был идентифицирован как штамм дрожжей, который продуцирует от небольшого до недетектируемого уровня сероводорода в различных условиях окружающей среды. Этот штамм также образует бесцветные колонии на агаре BiGGY, что ассоциировано с низкой сульфитредуктазной активностью. Скрининг набора штаммов с делециями S. cerevisiae выбрал четыре возможные мутации, приводящие к белому окрашиванию колоний, и все они кодируют компоненты сульфитредуктазы. Генетическое скрещивание выявило, что фенотип у UCD932 с бесцветными колониями на BiGGY возникает из-за изменения в гене МЕТ10. Штамм с делецией в МЕТ10 был ауксотрофом по метионину, тогда как UCD932 не является ауксотрофом по метионину, что указывает на то, что сульфитредуктазная активность в клетке все еще сохраняется. Чтобы определить генетическую основу этой низкой способности к образованию сульфидов, были секвенированы МЕТ10 и некоторые другие гены, вовлеченные в сульфатредуктазный метаболический путь, для которых было предположено возможное участие в супрессии H2S у S. cerevisiae (Linderholm et al. 2006). Это позволило бы идентифицировать аллели, которые можно было бы заменить у винных штаммов, продуцирующих H2S, чтобы устранить нежелательные характеристики сульфидного обмена.
Материалы и методы
Штаммы дрожжей и условия культивирования. Штаммы дрожжей, используемые в этом исследовании, перечислены в таблице 4. Штаммы дрожжей поддерживали и выращивали на среде пептон-декстроза-дрожжевой экстракт с 2%-ной глюкозой (YPD) (Sherman et al. 1974). Для поддержания делеционных штаммов, несущих маркер G418R или HphMX, использовали ту же самую среду (YPD) с генетицином (G418, 0,2 мг/мл) или гигромицином (Hph, 0,3 мг/мл). Была приготовлена минимальная среда (YNB) с 0,67%-ной дрожжевой минимальной по азоту основой без аминокислот и дополненной, как было рекомендовано, казаминовыми кислотами (Sherman). Селективную, не содержащую метионин среду (-met) готовили так же, как YNB, но без метионина.
Скрининг набора делеций. Дрожжевой набор делеций (Open Biosystems, Huntsville, AL) отсортировывали на агаре BiGGY, на висмут-глюкоза-глицин-дрожжевом агаре (Nickerson 1953), дополненном казаминовыми кислотами (Sherman 1974). Каждый штамм высевали на чашку с агаром BiGGY и инкубировали при 30°С в течение 48 часов. Оценивали окрашивание полученных колоний.
Анализ последовательностей. Анализ последовательностей МЕТ10, НОМ2, НОМ6, SER33, MET}, MET5 и МЕТ8 проводили для 169 природных и промышленных штаммов дрожжей. Хромосомную ДНК экстрагировали из осадков клеток, разрушая клеточные стенки дрожжей и захватывая ДНК с помощью метода «smash and grab» (Hoffman and Winston 1987), а амплификацию генов проводили с помощью набора High Fidelity Platinum Taq (Invitrogen, Carlsbad, CA) и праймеров PCR-MET10-F/PCR-MET10-R для МЕТ10, HOM2-F/HOM2-R для НОМ2, HOM6-F/HOM6-R для НОМ6, SER33-F/SER33-R для SER33, MET1-F/MET1-R для MET1, MET5-F/MET5-R для MET5 и MET8-F/MET9-R для МЕТ8 (таблица 5). Условия амплификации были следующими: 30 циклов при 94°С в течение 1 мин, при 94°С в течение 30 с, при 50°С в течение 30 с, при 68°С в течение 4 мин и последнее удлинение при 68°С в течение 7 мин.

Все секвенирование было проведено в лаборатории секвенирования факультета биологических наук Калифорнийского университета в Дэвисе с помощью капиллярного электрофореза генетического анализатора ABI 3730 и реактивов набора ABI BigDye Terminator version 3.1 cycle sequencing (Foster City, CA), используемые праймеры перечислены в таблице 6. Данные по последовательностям редактировали и анализировали с помощью программы BioEdit sequence Alignment Editor (version 5.0.9; Nucleic Acids Symp, Ser. 41:95-98).

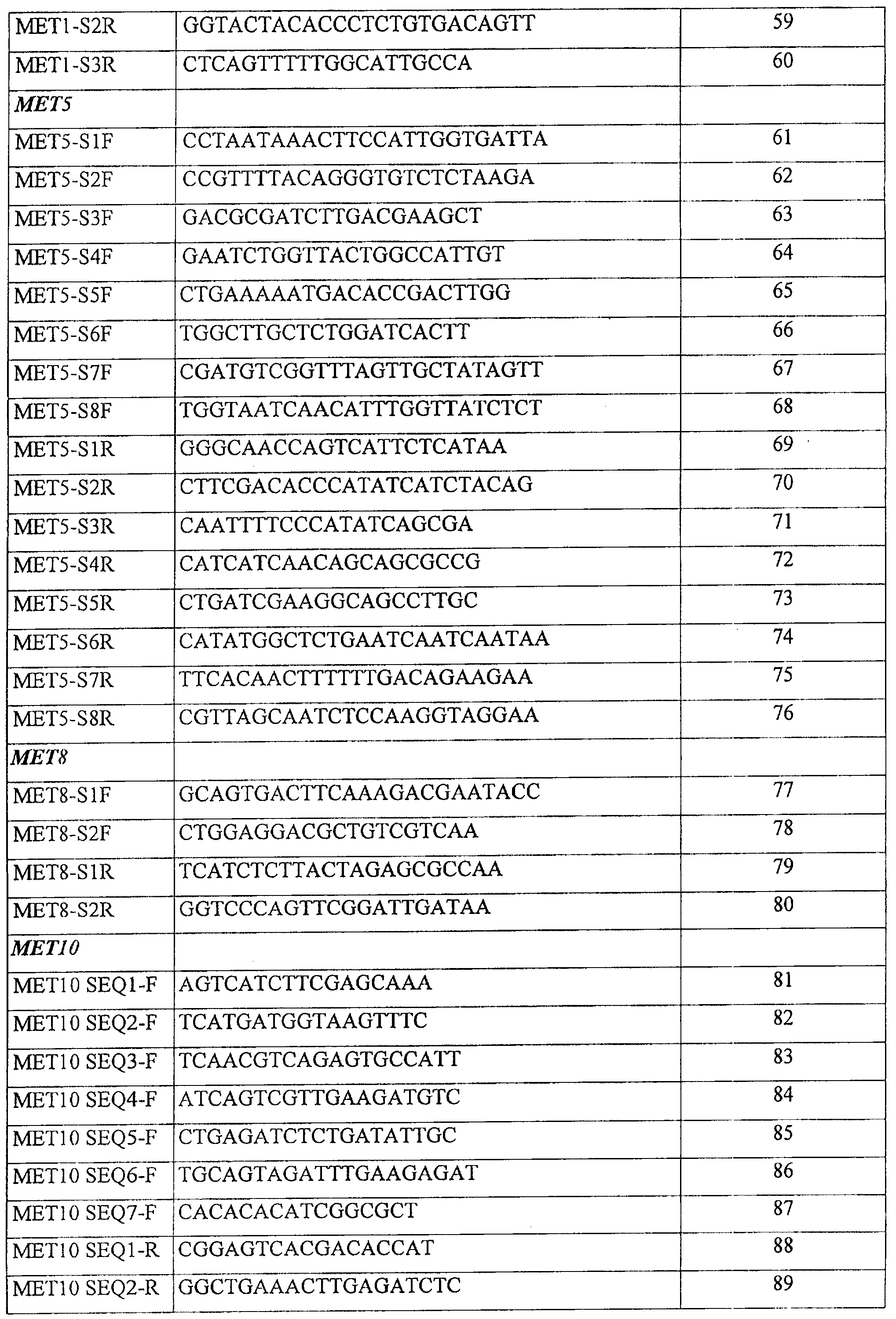

Номера кодов доступа для этих последовательностей в GenBank: UCD932 МЕТ10 (EF058164), UCD938 МЕТ10 (EF058165), UCD939 MET10 (EF058166), UCD940 МЕТ10 (EF058167), UCD942 MET10 (EF058168), UCD956 (EF058169), UCD522 МЕТ10 (EF058170), UCD957 МЕТ10 (EF058171), UCD934 MET10 (EF058172), UCD950 МЕТ10 (EF058173), UCD932 SER33 (EF058174), UCD939 SER33 (EF058175), UCD940 SER33 (EF058176), UCD956 SER33 (EF058177), UCD950 SER33 (EF058178), UCD932 НОМ6 (EF058179), UCD932 МЕТ1 (EF058180), UCD939 МЕТ1 (EF058181), UCD940 МЕТ1 (EF058182), UCD950 МЕТ1 (EF058183), UCD956 МЕТ1 (EF058184), UCD956 МЕТ5 (EF058185), UCD932 МЕТ5 (EF058186), UCD940 МЕТ5 (EF058187), UCD939 МЕТ5 (EF058188), UCD932 МЕТ8 (EF058189), UCD939 МЕТ8 (EF058190), UCD940 МЕТ8 (EF058191), UCD950 МЕТ8 (EF058192), UCD956 МЕТ8 (EF058193).
Генетические операции. Генетические операции, включающие скрещивание, спорообразование и тетрадный анализ, проводили с помощью стандартных процедур (Guthrie 1991).
Плазмиды, операции с ДНК и способы трансформации. В этом исследовании использовали плазмиды pAL51 (MET10S288C), pAL52 (MET10UCD932). Праймеры PCR-MET10-F/PCR-MET10-R (таблица 5), несущие сайты рестрикции BamHI и SacII, были сконструированы, чтобы амплифицировать МЕТ10 из хромосомной ДНК штамма дрожжей UCD932 и S288C (Invitrogen, Carlsbad, СА). Плазмиду pYC130 (Olesen et al. 2000), которая представляет собой центромерный вектор, несущий селективный маркер G418R, расщепляли с помощью BamHI и SacII (New England Biolabs, Ipswich, MA), чтобы обеспечить лигирование МЕТ10. Полученные плазмиды pAL51 (MET10S288C), pAL52 (MET10UCD932) использовали для трансформации.
Делеции гена МЕТ10 создавали с помощью методов, основанных на ПЦР, фигура 3 (Baudin 1993). Делеционную кассету, содержащую KanMX (дрожжевая коллекция делеций), с липкими концами некодирующих участков с каждой стороны МЕТ10 амплифицировали с помощью ПЦР, используя праймеры MET10-F-KO/MET10-R-KO, и линейный ПЦР-фрагмент трансформировали в дрожжевые диплоидные штаммы UCD522, UCD932, UCD939, UCD940 и UCD950. С помощью гомологичной рекомбинации одну интактную копию МЕТ10 заменяли на нокаутную кассету, создавая штаммы, несущие как интактную копию МЕТ10, так и маркер KanMX. Все штаммы, за исключением UCD522MET10/KanMX, затем образовывали споры и те, которые были гомологичны G418R, использовали в дальнейших экспериментах. Делеции гена подтверждали с помощью ПЦР, используя прямой праймер, расположенный ближе по отношению к точке инициации транскрипции, и внутренний обратный праймер к маркеру повреждения KanMX - JKKanRE.
Чтобы нокаутировать оставшуюся интактную копию МЕТ10 в UCD522 МЕТ10/KanMX, кассету HphMX амплифицировали из pYC140, линеаризованной с помощью BamHI (Hansen et al. 2003), используя праймеры МЕТ10-hphMX-F/MET10-hphMX-R, и линейный ПЦР-фрагмент трансформировали в ALY29. Отбирали ауксотрофную по метионину колонию, демонстрирующую присутствие как G418R, так и HphR, и делецию HphMX подтверждали с помощью ПЦР, используя прямой праймер, расположенный ближе по отношению к точке инициации транскрипции, и внутренний обратный праймер к маркеру повреждения HphMX - HYGROB CHK_R.
Обмен аллелями МЕТ10 также проводили с помощью метода на основе ПЦР (фигура 3) (Baudin 1993). Аллели МЕТ10 амплифицировали из S288C, UCD932, UCD939, UCD940, UCD950 и UCD522, используя праймеры MET10-F-KO/MET10-R-KO. Линейные ПЦР-фрагмеиты, амплифицированные из S288C и UCD932, затем трансформировали в ауксотрофные по метионину штаммы. Другие фрагменты трансформировали в индивидуальные штаммы для создания соответствующих контрольных штаммов.
Штаммы, демонстрирующие способность к росту на ауксотрофных по метионину чашках, отбирали и образовывали споры для создания штаммов, гомологичных по МЕТ10, в дальнейших экспериментах. S. cerevisiae трансформировали с помощью модифицированного литий-ацетатного метода Schiestl and Gietz (1989), a E.coli трансформировали с помощью метода, описанного Inoue et al. (Inoue et al. 1990). Для получения плазмид использовали E.coli INVaF' (Invitrogen, Carlsbad, СА). Для селекции трансформированных клеток E.coli использовали среду Луриа-Бертани (Miller 1972) с ампициллином.
Условия брожения. В экспериментах по брожению использовали синтетическую среду с виноградным соком «Minimal Must Media» (МММ) (Spiropoulos et al. 2000) с 208 мг азотных эквивалентов/литр. Уровень азота создавали, используя 0,2 г L-аргинина/литр и 0,5 г аммония фосфата/литр. Брожение начинали при плотности 1,33×105 клеток/мл с помощью инокуляции клеток на стационарной фазе роста из культуры, предварительно выращенной на исходной среде МММ. Брожение проводили в колбах Эрленмейера объемом 500 мл, содержащих 300 мл среды. Каждую колбу снабжали силиконовой пробкой с прикрепленной пробиркой с ацетатом свинца. Колбы инкубировали при 25°С при встряхивании при 120 об/мин. Брожение контролировали в течение семи дней, измеряя потерю массы как оценку образования CO2.
Результаты
Характеристика образования сероводорода делеционными штаммами. Для оценки образования H2S полным набором делеционных штаммов их вначале выращивали на чашках с агаром BiGGY и определяли цвет колоний. Колонии были бесцветными или окрашенными в светлый желтовато-коричневый, желтовато-коричневый (цвет исходного штамма), светло-коричневый, коричневый или черный цвет. Четыре колонии были бесцветными, 258 были светлыми желтовато-коричневыми, 4478 были желтовато-коричневыми, 59 были светло-коричневыми, 28 были коричневыми и одна колония была черной. Четыре делеции в штаммах, дающих бесцветные колонии, находились в MET10, МЕТ8, МЕТ5 или МЕТ1. Мы также обнаружили, что возможно НОМ2, НОМ6 и SER33 играют роль в подавлении образования сероводорода (Linderholm et al. 2006).
Идентификация гена, ответственного за белый цвет природного штамма. UCD932, природный штамм, полученный из Италии (Mortimer et al. 1994), на агаре BiGGY представляет собой бесцветный штамм, не продуцирующий H2S. Чтобы идентифицировать ген, ответственный за его бесцветный фенотип, его скрещивали с каждым бесцветным делеционным штаммом. Только один штамм не был комплементарен бесцветному фенотипу UCD932, YFR030W BY4742.
Если вектор, несущий копию МЕТ10 дикого типа, pAL51 (MET10S288C), трансформировали в UCD932, это приводило к получению штамма UCD932, образующего желтовато-коричневые колонии, но не приводило к образованию сульфидов (таблица 7). Это позволяет предположить, что более чем один ген, возможно в комбинации с МЕТ10, отвечает за фенотип UCD932 с низким уровнем образования H2S.
Анализ последовательности генов, вовлеченных в сульфатредуктазный метаболический путь. Ранее было показано, что UCD932 несет мутации в CYS4 и МЕТ6, оба гена кодируют ферменты, которые важны в сульфатредуктазном метаболическом пути (Linderholm et al. 2006). Однако введение аллелей дикого типа в «бэкграунд» штамма не изменяло характеристик слабой продукции H2S. Таким образом, представляло интерес идентифицировать, какие другие мутации в других генах метаболического пути может нести этот штамм. Несколько генов, вовлеченных в сульфатредуктазный метаболический путь, МЕТ10, НОМ2, НОМ6, SER33, МЕТ1, МЕТ5 и МЕТ8, были секвенированы из UCD932, а также из нескольких других природных и промышленных штаммов, которые различались по цвету на агаре BiGGY и по образованию H2S в синтетическом соке (Spiropoulos et al. 2000) для того, чтобы оценить генетическое разнообразие сульфатредуктазного пути (выравнивание последовательностей МЕТ10 из различных штаммов Saccharomyces представлено на фигуре 2). Аминокислотные различия МЕТ10р показаны в таблице 8.
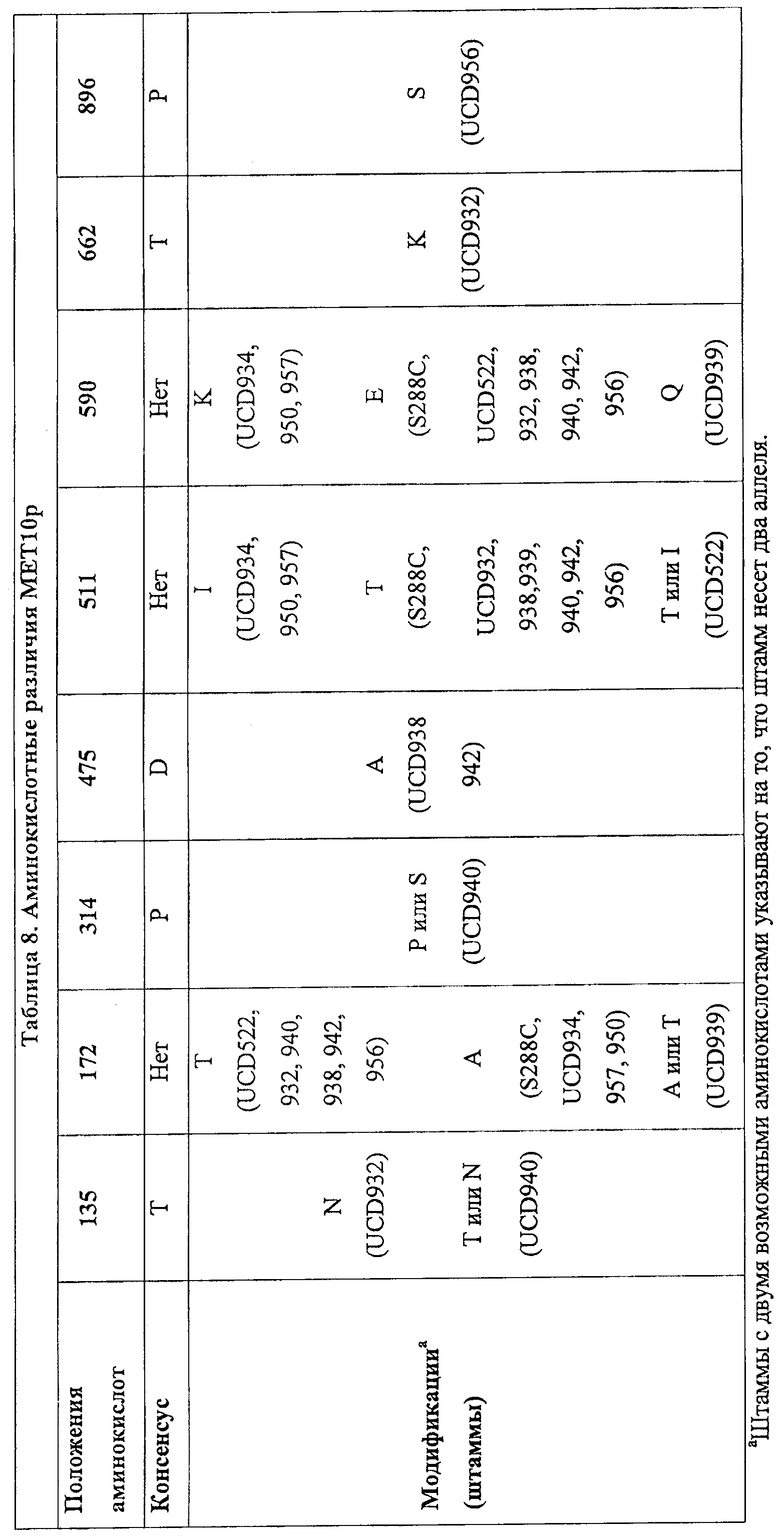
Анализ последовательности МЕТ10 (компонент фермента сульфитредуктазы) показало, что она не является консервативной среди штаммов дрожжей (таблица 9). Шесть аллелей, отличающихся от S288C, были обнаружены в десяти штаммах, которые были секвенированы. Их было трудно группировать по цвету на BiGGY и образованию H2S. UCD934, UCD957 и UCD950, желтовато-коричневые продуценты H2S, несли идентичный аллель. Желтовато-коричневые штаммы UCD938 и UCD942, не являющиеся продуцентами H2S, несли тот же самый аллель. UCD522 и UCD940, коричневые продуценты H2S, были гетерозиготными, но оба аллеля были идентичны аллелям, обнаруженным в других штаммах. Каждый из бесцветных штаммов UCD932 и UCD956, не являющихся продуцентами H2S, и UCD939, желтовато-коричневый продуцент H2S, несли различные аллели.
Было показано, что другие гены сульфатредуктазного метаболизма были более консервативными. В аминокислотной или ДНК-последовательности НОМ2 (кодирует аспартат-бета-полуальдегиддегидрогеназу) различий не было, обнаружены различия в одной аминокислоте в НОМ6 (кодирует гомосериндегидрогеназу) в UCD932, в одной аминокислоте в SER33 (кодирует 3-фосфоглицератдегидрогеназу) среди S288C и всех других винных штаммов и в нескольких аминокислотах в METl, MET5 и МЕТ8 (все компоненты фермента сульфитредуктазы).
Обмен аллелей МЕТ10. Генетическое разнообразие аллелей МЕТ10 и неявная корреляция между образованием H2S и окрашиванием колоний подтверждает гипотезу о том, что гены метаболического пути восстановления сульфатов могут отвечать за H2S-фенотип в винных штаммах, тогда как окрашивание на агаре BiGGY слабо коррелировало с образованием H2S при регистрации сульфитредутазной активности. В связи с этим оценивали влияние МЕТ10 на образование H2S у штаммов, продуцирующих H2S. Аллели МЕТ10 штаммов дрожжей, продуцирующих H2S, заменяли на аллель MET10UCD932 (фигура 3). Природные гены МЕТ10 в UCD950, UCD940, UCD939, UCD522 и UCD932 были удалены с помощью кассеты KanMX или HphMX, и затем кассеты KanMX или HphMX были заменены на аллель МЕТ10 из UCD932, S288C или их собственные аллели в качестве контроля. Все штаммы, несущие MET10UCD932, выбраживали с той же скоростью, что и родительские или контрольные штаммы, но переставали быть продуцентами H2S и были более светлыми на агаре BiGGY. Штаммы, несущие аллель или из S288C, или свой собственный аллель, сохраняли H2S-продуцирующий фенотип (таблица 9).
Штаммы UCD939, несущие аллель MET10UCD932, не становились вновь прототрофами в отношении метионина, в противоположность другим винным и коммерчески доступным изолятам. Это можно объяснить присутствием других мутаций в сульфатредуктазном метаболическом пути, которые несет этот штамм. UCD939 имеет две мутации в генах, кодирующих другие субъединицы в ферменте сульфитредуктазе. Добавление третьей мутации может снижать активность фермента сульфитредуктазы так, что снижается уровень сульфида, доступного для включения в серусодержащие аминокислоты, такие как метионин или цистеин. Поэтому штамм не способен расти без метионина. Также возможны эффекты накопления промежуточных токсичных продуктов, появляющихся на более ранних стадиях до сульфитредуктазы, так как подавление метаболизма сульфата снижалось при отсутствии серусодержащих аминокислот, таких как S-аденозилметионин. Однако штамм был жизнеспособным, если аллель МЕТ10 заменяли на его собственный аллель, цвет штамма на BiGGY изменялся от желтовато-коричневого до бесцветного, а образование H2S значительно снижалось.
UCD522, коммерческий винный штамм, характеризовался как анеуплоид (Bakalinsky and Snow 1990) из-за дисбаланса количества хромосом, приводящего к смерти клеток в результате спорообразования. Поэтому было необходимо отдельно разрушить оба аллеля (фигура 3), поскольку один аллель, противоположный нокаутному аллелю, после спорообразования штамма приобретет гомологичный нокаут, как было продемонстрировано для других штаммов. Аллель МЕТ10 трансформировали в нокаутные штаммы и затем были образованы споры, чтобы получить два штамма, которые были G418R/hphNTlR, и два штамма, которые несли аллель МЕТ10. Каждый штамм использовали в экспериментах, чтобы исследовать, есть ли какие-либо нарушения из-за генетических манипуляций (таблица 10). Штаммы полностью выбродили и вели себя в терминах образования H2S, как и ожидалось. Каждый из штаммов, несущих маркер лекарственной устойчивости, был ауксотрофом по метионину и не продуцировал H2S. Штаммы, несущие или аллель MET10S288C, или MET10UCD522, продуцировали H2S, штамм, несущий MET10UCD932 H2S не продуцировал.
Мы также заменили кассету KanMX в YFR030W BY4742 и UCD932 на аллель МЕТ10 из UCD950, и оба штамма были желтовато-коричневыми на агаре BiGGY, но ни один их них не был продуцентом H2S. Скрещивание между BY4742 или UCD932 и UCD950 показало, что существует, по меньшей мере, от четырех до пяти отдельных аллелей, вовлеченных в образование H2S.
Обсуждение
Одним из возможных объяснений обнаруженных различий в образовании сульфидов у S. cerevisiae, возникающих естественным образом, является возникновение генетических изменений экспрессии или активности ферментов в сульфатредуктазном метаболическом пути. Сульфатредуктазный путь демонстрирует сложное регулирование (Mountain et al. 1991), и увеличение одной ферментативной активности может быть забуферено изменениями в активности других белков, вовлеченных в этот путь.
Предшествующее исследование в нашей лаборатории обнаружило в природном штамме UCD932, который не является продуцентом H2S, несколько аллелей в сульфатредуктазном метаболическом пути. Однако мы показали, что эти специфические аллели сами по себе не отвечают за H2S-фенотип (Linderholm et al. 2006). В процессе скрининга коллекции делеций на подавление образования H2S мы обнаружили несколько других генов, участвующих в сульфатредуктазном метаболическом пути в этом качестве, НОМ2, НОМ6, SER33, МЕТ1, МЕТ5, МЕТ8 и МЕТ10 (Linderholm et al. 2006). Когда эти гены были секвенированы в UCD932 и других природных и промышленных штаммах дрожжей, которые различаются по образованию H2S, было выявлено, что UCD932 несет различные аллели в пяти из девяти генов, включая CYS4 и МЕТ6 (Linderholm et al. 2006). В коллекции секвенированных штаммов были обнаружены множественные аллели МЕТ10.
В этом исследовании было показано, что МЕТ10 играет важную роль в образовании H2S; хотя он сам по себе не определяет фенотип у UCD932, характеризующийся отсутствием образования H2S; он сильно отличается от H2S-фенотипа у других H2S-продуцирующих штаммов. В экспериментах, описанных выше, MET10UCD932 был успешно заменен на нативные аллели в трех H2S-продуцирующих штаммах, и это превратило их в штаммы, не продуцирующие H2S. Эти результаты имеют множество положительных последствий для производства вина вследствие возможности конструировать коммерческие штаммы с пониженным образованием серусодержащих соединений в любом генетическом «бэкграунде» путем переноса подходящих аллелей или прогнозировать параметры образования H2S для какого-либо штамма Saccharomyces cerevisiae. Оба метода были бы действительно простыми и полезными для виноделов.
Эксперименты по обмену MET10UCD932 в UCD939 были безуспешными; UCD939 MET10 был нежизнеспособным при культивировании на чашках, дефицитных по метионину. Однако это можно объяснить другими мутациями, которые он несет в сульфатредуктазном метаболическом пути. UCD939 несет две мутации в генах, кодирующих другие субъединицы в ферменте сульфатредуктазе, и хотя он не был ауксотрофом по метионину, добавление третьей мутации может резко снизить активность таким образом, что он становится ауксотрофом по метионину, так как последующие ферменты не могут повысить свою активность в достаточной степени, чтобы обеспечить компенсацию. Также может не реализовываться регулирование восстановления сульфата серусодержащими аминокислотами, так как штамм больше не может продуцировать метионин и могут накапливаться токсичные промежуточные соединения в реакциях, предшествующих сульфитредуктазным ферментам, что также делает штамм нежизнеспособным.
UCD522 можно охарактеризовать как анеуплоидный штамм (Bakalinsky and Snow 1990). При секвенировании гена МЕТ10 в UCD522 было обнаружено, что UCD522 является гетерозиготным штаммом, он несет два аллеля МЕТ10. Может быть несколько типов ассоциации между компонентами, которые приводят к невозможности генетической манипуляции с ними, как, например, в случае с другими штаммами. Если был делетирован только один из аллелей, то возможно, что между аллелями МЕТ10 или белками, которые он кодирует, образуется своего рода комплекс, который не позволяет им подходящим образом отделяться во время спорообразования. Однако если каждый из аллелей был заменен индивидуально, штамм был способен правильно образовывать споры. UCD522 MET10UCD932 образовывал споры, давая два штамма, которые представляли собой G418R/hphNT1R и были ауксотрофными по метионину, и два штамма, которые обладали лекарственной устойчивостью и несли аллель МЕТ10. Каждый штамм выбраживал полностью и его параметры образования H2S были такими, как и ожидалось.
Пример 3: Дополнительные характеристики аллеля MET10p в UCD 932
Как было продемонстрировано в примерах, приведенных выше, аллель МЕТ10, присутствующий в штамме дрожжей UCD 932, способен превращать штамм, продуцирующий высокий уровень сероводорода (H2S), в штамм, который не образует H2S в детектируемых количествах. Это было четко показано с высокопродуктивными штаммами UCD522 и UCD950, которые не образовывали детектируемые количества H2S в случае, если они несли аллель МЕТ10 из UCD932. Способность превращать штамм в слабый продуцент H2S имеет значение в любой отрасли производства, в которой используют дрожжи, включая производство вина, пивоварение и производство топливного этанола. Помимо существующей проблемы, когда конечный продукт приобретает сильный запах тухлых яиц, CO2, возникающий в процессе брожения часто является полезным побочным продуктом, который либо сам по себе имеет спрос в виде газа, либо используется в качестве газового двигателя для движения продукта (пивоварение). Поэтому предотвращение того, чтобы газ приобретал запах тухлых яиц, дает явные выгоды.
Предварительные эксперименты определили, что аллели МЕТ10 из UCD932 и UCD950 различаются по шести нуклеотидам, пять из этих замен приводят к изменениям в первичной последовательности белка (см. фигуру 2). Чтобы дополнительно охарактеризовать аллель МЕТ10 из UCD932, нативные аллели МЕТ10 клонировали в «челночный» вектор pUG6. Чтобы сделать точечные мутации, использовали набор The Quick Change PCR (смотри, например, Cormack, В. and Castano, I. (2002) Introduction of Point Mutations into Cloned Genes. Methods in Enzymology (350) 199-218). В раздельных реакциях этот метод использовали для того, чтобы превратить один различающийся нуклеотид в сходный нуклеотид другого аллеля. Например, UCD932 МЕТ10 имеет аденин в положении 404, тогда как UCD950 имеет цитозин. Было обнаружено, что замена цитозина в положении 1985 в UCD950 на аденин является необходимой и достаточной для потери образования сульфидов в «бэкграунде» UCD950. (таблица 11). Перевод аденина в аллеле UCD932 в цитозин в 950 устраняет способность белка UCD932 подавлять образование сульфидов (таблица 11). Таким образом, единственная замена треонина в положении 662 на остаток лизина приводит к созданию модифицированного белка МЕТ10, что ведет к уменьшению высвобождения сульфидов.
Пример 4: Аллельные различия в положении 1985 гена MET10 определяют образование сероводорода Saccharomyces cerevisiae
Аллель MET10 штамма UCD932 является причиной неспособности продуцировать сероводород (H2S) при использовании стратегии обмена аллелей для того, чтобы заменить нативный аллель коммерческих и природных изолятов винных дрожжей. Было обнаружено, что этот аллель содержит несколько замен пар оснований, приводящих к различиям в аминокислотной последовательности кодируемого белка. Эти аминокислотные изменения оценивали для того, чтобы определить какая (какие) из них оказывают влияние на способность к образованию H2S.
Для того чтобы идентифицировать точную мутацию или комбинацию мутаций, ответственных за эти сильные различия в образовании H2S, мы клонировали аллели МЕТ10 из UCD932 и UCD950 и методично превращали каждое различающееся основание в основание противоположного аллеля с помощью сайт-направленного мутагенеза. Полученные аллели были идентичны родительскому аллелю за исключением единичных замен оснований. Модифицированные аллели затем вставляли обратно в оба штамма и в качестве индикатора изменения восстановления сульфитов и возможного образования H2S использовали агар BiGGY. С помощью такого скрининга идентифицировали точечную мутацию в положении 1985, ответственную за изменение цвета колоний. Эти штаммы проверяли на способность к образованию H2S в двойных повторах в процессе мелкомасштабного брожения в синтетическом винном соке. 10 мл синтетической винной среды инокулировали соответствующими штаммами и определяли H2S с помощью колонок с ацетатом свинца после четырех дней брожения. Неизмененный аллель UCD950 МЕТ10 и аллель UCD932 с мутацией аллеля UCD950 в положении 1985 (932 МЕТ10 1985 А-С) приводили к образованию H2S, тогда как неизмененный аллель UCD932 МЕТ10 и аллель UCD950 с изменением UCD932 в положении 1985 (950 МЕТ10 1985 С-А) приводили к образованию H2S в недетектируемом количестве. Эти результаты указывают на то, что точечная мутация в положении 1985 является ключевым фактором, определяющим различие в образовании H2S этими аллелями. Эти результаты были усилены исследованием образования H2S, когда аллели с единичной мутацией поместили в два высокопродуктивных коммерческих штамма, UCD522 и UCD940, продуцирующих H2S. Оба эти штамма, продуцировали H2S с помощью аллеля 932 МЕТ10 1985 А-С, но, как было обнаружено, не продуцировали H2S с аллелем 950 МЕТ10 1985 С-А. Результаты суммированы в таблице 11, представленной выше.
Это исследование показало, что точечное изменение пары оснований в положении 1985 в аллеле МЕТ10 обуславливает образование сероводорода. Разница в нуклеотидах изменяет аминокислоту, кодируемую в положении 1985, таким образом, любые изменения в окружающей нуклеотидной последовательности, которые изменяют кодируемую аминокислоту, также вероятно будут устранять образование H2S. Треонин, присутствующий в высокопродуктивных аллелях, может служить регуляторной точкой, которая изменяет поток метаболического пути, также как аминокислотные остатки, содержащие фосфатную группу, могут регулироваться через фосфорилирование. Предсказано, что аминокислотный остаток 662 находится в сульфитредуктазном каталитическом домене (фигура 6). Анализ предполагаемой структуры белка с таким изменением (фигура 7) указывает на то, что общая структура белка остается неизмененной, но затрагивается локальная поверхность активного центра, окружающего этот измененный остаток. Таким образом, это изменение модифицирует структуру белка лишь в небольшой степени.
Следует понимать, что примеры и воплощения, описанные в этом документе, предназначены только в иллюстративных целях и что специалисты в этой области техники могут предположить на основании их различные модификации и изменения, которые должны быть включены в замысел и объем этой заявки и рамки прилагаемой формулы изобретения. Все публикации, номера кодов доступа, патенты и патентные заявки, процитированные в этом документе, включены сюда путем отсылки во всей своей полноте и для всех целей.



Реферат
Изобретение относится к области биотехнологии. Представлены варианты модифицированной клетки дрожжей. Каждый из вариантов продуцирует сероводород на сниженном уровне и включает экзогенный полинуклеотид, кодирующий полипептид MET10, который катализирует реакцию превращения сульфита в сульфид на сниженном уровне, где аминокислота в положении 662 полипептида MET10 представляет собой Аlа, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Asn, Gln, Arg, Val, Trp или Туr (SEQ ID NO:5). Описан экспрессирующий вектор, содержащий указанный экзогенный полинуклеотид. Описана культура указанных клеток. Предложен способ получения указанной клетки дрожжей, включающий замену эндогенного полинуклеотида, кодирующего сульфид-активный полипептид МЕТ10, на полинуклеотид, кодирующий МЕТ10 с указанной заменой в положении 662 SEQ ID NO:5, при этом родительская клетка дрожжей продуцирует сероводород. Описан способ снижения уровня HS в среде брожения, включающий контакт среды брожения с указанной выше клеткой дрожжей. Представлены среда брожения и продукт брожения, содержащие указанную клетку или культуру клеток. Изобретение позволяет снизить уровень НS в ферментационной среде при производстве ферментированных напитков. 10 н. и 46 з.п. ф-лы, 8 ил., 11 табл., 4 пр.

Комментарии