Система магнитного распознавания - RU2442169C2
Код документа: RU2442169C2
Чертежи








Описание
Настоящее изобретение относится к меткам магнитного распознавания, способным присоединять небольшие количества магнитного (или намагничиваемого) вещества к аналиту при помощи распознающего агента для этого аналита. Такие метки обладают значительными преимуществами в том, что они способны присоединить очень небольшой объем магнитного вещества к аналиту, так что аналит может подвергаться воздействию магнитных полей, даже в ограниченном пространстве, таком как в микрофлюидной системе. Наличие магнитного вещества делает возможным более сложное пространственное манипулирование аналитом, что особенно благоприятно в микрофлюидной системе. Изобретение также относится к продуктам, способам и применениям, имеющим отношение к таким меткам.
Хорошо известно, что магнитные «бусы» можно использовать для контроля за молекулами, которые вовлечены в способы тестирования (см., например, US 2006/084089). Как правило, такие бусы присоединяют к молекуле (такой как антитело), которая может распознавать аналит и связываться с ним. Магнитные свойства бус используют для управления или пространственного манипулирования аналитом, например для отделения аналита от других молекул в образце.
Однако магнитные бусы не подходят для всех систем. Совсем недавно появилась возможность работать со сверхмалыми количествами образца, используя микрофлюидные или нанофлюидные устройства. Такие устройства способны анализировать определенные вещества в очень маленьком образце, таком как капля крови от укола. Размеры каналов в таких устройствах зачастую могут быть слишком небольшими для того, чтобы удовлетворительно вмещать магнитные бусы, даже несмотря на то, что такие бусы можно сделать в микрометровом масштабе, либо из-за того, что они больше, чем каналы, либо из-за того, что они приводят к забиванию или закупорке каналов. Это описано подробнее на сайте www.deas.harvard.edu/projects/weitzlab/wyss.preprint.2006.pdf. Хотя небольшие бусы обладают большим отношением площади поверхности к объему (Таблица 1), особенно небольшие бусы или частицы могут испытывать стерическое затруднение, при котором присоединенный белок блокирует присоединение другого белка. Это становится особенно проблематичным из-за беспорядочной пространственной организации антител или других распознающих сущностей, демонстрируемой при их присоединении к частице. Это дополнительно усугубляется, так как при соединении белка с поверхностью магнитной бусины или частицы необходимая ориентация белка может быть неоптимальной (смотри Фиг. 3).
Предпринимались попытки связывания меньших магнитных частиц с белками, несмотря на то, что это пока не получило большого внимания для микрофлюидных и нанофлюидных целей. Например, опубликованная PCT-заявка WO 2006/104700 описывает магнитные белковые наносенсоры, которые можно использовать в матрицах для детектирования аналитов в жидком образце. В этой системе используют слитый белок, как правило, содержащий ген хвостового отростка фага T4, модифицированный для содержания дополнительных функциональных групп (например, лигандов пептидного дисплея), которые будут связывать парамагнитные наночастицы.
Подобным образом, WO 2004/083902 раскрывает зонды магнитных наночастиц для внутриклеточного магнитного отображения. Как правило, эти зонды формируют из самособирающихся покрывающих материалов, окружающих магнитный материал, таких как мицеллы, липосомы или дендримеры. Поверхность инкапсулированных магнитных частиц можно присоединить к доставляющему лиганду, такому как пептид. Аналогичная система раскрыта в патенте США 5958706, который относится к магнитным частицам, инкапсулированным внутри органической мембраны (такой как фосфолипидная мембрана) и присоединенным к белку мембраны. В работе Томоко Йосино и др. (Tomoko Yoshino et al.) “Efficient and stable display of functional proteins on bacterial magnetic particles using mms13 as a novel anchor molecule”, Applied and Environmental Microbiology, Jan. 2006, p. 465-471, раскрыт способ белкового отображения на бактериальных магнитных частицах. Магнитные частицы также покрывают липидной бислойной мембраной, и новый белок mms13 связывается с этими частицами.
Была проведена некоторая работа по вирусной инкапсуляции магнитных наночастиц. US 2006/0240456 раскрывает инкапсуляцию магнитного кобальта внутри белковой оболочки вирусного капсида бактериофага T7.
В отдельной разработке было открыто, что некоторые белки обладают способностью непосредственно связываться с ионами металлов. Мелдрум и др. (Meldrum F.C. et al.) сообщили о таких белках в Science, 257(5069) 522-3, 1992 “Magnetoferritin: in vitro synthesis of a novel magnetic protein”. Другая работа из этой области включает Martinez, J. S., et al. 2000. “Self-Assembling Amphiphilic Siderophores from Marine Bacteria.” Science 287 1245-47. Более отдаленная работа включает следующую: Zborowski et al. 1996. “Immunomagnetic isolation of magnetoferritin-labelled cells in a modified ferrograph.” Cytometry 24:251-259 раскрывает, что биотинилированные антитела к различным клеточным мишеням и биотинилированный магнетоферритин были соединены при помощи авидинового мостика.
Другие раскрытия в этой области включают: Inglis, et al. 2004. “Continuous microfluidic immunomagnetic cell separation.” Applied physics letters. 85 (21) 5093-5; Inglis et al. 2006. “Microfluidic high gradient magnetic cell separation.” Journal of Applied Physics 99; Lambert et al. 2005. “Evolution of the transferrin family: Conservation of residues associated with iron and anion binding.” Comparative Biochem and Physiol, (B) 142 129-141; Gider et al. 1995. “Classical and quantum magnetic phenomena in natural and artificial ferritin proteins.” Science. 268 77-80; Haukanes, B.I. and Kvam, C. 1993. “Application of magnetic beads in bioassays.” Biotechnology (N Y). 11 (1) 60-3; Olsvik, O. et al. 1994. “Magnetic separation techniques in diagnostic microbiology.” Clin Microbiol Rev. 7 (1) 43-54; Archer, M.J. et al. 2006, “Magnetic bead-based solid phase for selective extraction of genomic DNA.” Anal Biochem. doi:10.1016/j.ab.2006.05.005; Schneider, T. et al. 2006. “Continuous flow magnetic cell fractionation based on antigen expression level.” J Biochem Biophys Methods. 68 (1) 1-21; Ramadan, Q. et al. 2006, “An integrated microfluidic platform for magnetic microbeads separation and confinement.” Biosens Bioelectron. 21 (9) 1693-702; Cotter, M.J., et al. 2001. “A novel method for isolation of neutrophils from murine blood using negative immunomagnetic separation.” Am J Pathol. 159 (2) 473-81; http://www.newscientist.com/article.ns?id=dn3664; и Chang, C.C., et al. 2006, “Mn,Cd-metallothionein-2: a room temperature magnetic protein.” Biochem Biophys Res Commun. 340 (4) 1134-8. В этой последней статье манипулировали небольшим ионсвязывающим белком металлотионеином-2 (MT) для связывания кадмия и марганца вместо цинка, тем самым делая белок магнитным.
Другое предшествующее раскрытие включает: Odette et al. 1984, “Ferritin conjugates as specific magnetic labels.” Biophys. J. 45 1219-22; Yamamoto et al. 2002, “An iron-binding protein, Dpr, from Streptococcus mutans prevents iron-dependent hydroxyl radical formation in vitro.” J Bacteriol. 184 (11) 2931-9; и Ishikawa et al. 2003, “The iron-binding protein Dps confers hydrogen peroxide stress resistance to Campylobacter jejuni.” J Bacteriol. 185 (3) 1010-17.
CA 2521639 раскрывает применение ферритина для удаления загрязняющих ионов из раствора. Ферритин образует часть большей структуры, которая также содержит другие ионообменные вещества (например, порфирины или краун-эфир). Другие ионообменные вещества предназначены для удаления загрязнений, в то время как магнитные свойства ферритина используются для удаления этих веществ из раствора.
Патент Соединенных Штатов 7097841 раскрывает слитые с ферритином белки для применения в вакцинах, помимо других применений.
Несмотря на обширные открытия в области магнитных частиц и наночастиц, изложенные выше, существует постоянная потребность в более простых и эффективных метках магнитных частиц для применения в микрофлюидных и нанофлюидных системах.
Цель настоящего изобретения состоит в том, чтобы решить вышеописанные проблемы и улучшить известные продукты и способы, такие как охарактеризованные в общих чертах выше. Другая цель настоящего изобретения состоит в том, чтобы предложить улучшенную метку для аналита, которую можно было бы выгодно использовать, например, в микрофлюидном или нанофлюидном устройстве. Еще одна цель настоящего изобретения состоит в том, чтобы предложить способы, наборы и применения, в которых используются такие метки.
Таким образом, настоящее изобретение предлагает метку для аналита, которая присоединена к магнитному или намагничиваемому веществу, включающую:
(a) распознающую составляющую для присоединения метки к аналиту; и
(b) составляющую для связывания или инкапсулирования магнитного или намагничиваемого вещества;
причем эта составляющая для связывания или инкапсулирования магнитного или намагничиваемого вещества включает металлсвязывающий белок, полипептид или пептид.
Авторы изобретения неожиданно установили, что количества магнитного или намагничиваемого вещества, достаточно небольшие для того, чтобы быть пригодными для использования в микрофлюидных и/или нанофлюидных устройствах, можно присоединить к выбранному аналиту путем включения атомов или ионов металлов (или содержащих их соединений) в металлсвязывающий белок, полипептид или пептид, который присоединен к распознающему агенту, который, в свою очередь, может присоединяться к аналиту. Таким образом, метки по настоящему изобретению включают по меньшей мере две составляющие: распознающую составляющую для присоединения метки к желаемому аналиту и составляющую для связывания магнитного или намагничиваемого вещества. Эти метки просто очищать с использованием устоявшихся методик, таких как аффинная очистка или очистка в магнитном поле.
Когда распознающие составляющие являются одновалентными, они исключают проблемы, возникающие из-за перекрестного связывания с рецепторами на поверхностях клеток (в отличие от антител). Авторы изобретения также преодолели проблемы «забивания», встречающиеся в известных способах, путем присоединения белков-мишеней непосредственно (или опосредованно) к намагничиваемым белкам с использованием устоявшихся подходов молекулярной биологии.
Метки по настоящему изобретению обладают тем дополнительным преимуществом, что их можно намагничивать или размагничивать с использованием простых химических методик.
Особенно предпочтительным является то, что эти метки представляют собой слитые белки. В контексте настоящего изобретения слитый белок представляет собой белок, который был экспрессирован как рекомбинантный белок с единой целостностью. Слитые белки обладают рядом дополнительных преимуществ. Ориентация распознающего плеча слитого белка (например, scFv) в рамках изобретения будет контролироваться, и, соответственно, белок с большей вероятностью будет связываться со своей мишенью. Слитые белки также облегчают возможность включения множества распознающих составляющих в один слитый белок. Эти участки распознавания могут быть направлены на одну и ту же мишень или на различные мишени. Если присутствуют две или более распознающих составляющих, то можно задавать и контролировать пространственную организацию распознающих составляющих на магнитном веществе, уменьшая проблемы, вызываемые стерическим затруднением и случайным связыванием в случае с общепринятыми бусами. Тщательным разнесением каждой распознающей составляющей внутри слитого белка (например, путем включения спейсера нуклеиновых кислот в систему экспрессии) третичную структуру конечного белка можно контролировать для размещения распознающих составляющих в выбранных пространственно зонах по поверхности белка. Другим преимуществом использования слитых белков является то, что число распознающих составляющих внутри каждой метки может быть точно заданным и будет идентичным для каждой молекулы метки. Это контрастирует с общепринятыми средствами присоединения распознающих составляющих к магнитным бусам, где из-за случайного характера присоединения значительно более сложно точно задать число распознающих составляющих, и поэтому будет иметь место значительное варьирование по их числу, которые присоединены к каждой магнитной бусинке.
Под термином «присоединенный к» в настоящем контексте подразумевают, что присоединение представляет собой присоединение любого типа, включая специфическое и неспецифическое связывание, а также инкапсуляцию. Таким образом, составляющая для связывания магнитного или намагничиваемого вещества должна быть способна связывать или инкапсулировать (или как-то иначе присоединять специфическим или неспецифическим образом) вещество в форме частиц, или агрегатов, или им подобных. Эти частицы или агрегаты являются много меньшими, чем общепринятые магнитные бусы, как правило, имея менее чем 100000 атомов, ионов или молекул, более предпочтительно, менее чем 10000 атомов, ионов или молекул, а наиболее предпочтительно, менее чем 5000 атомов, ионов или молекул, в целом связанных или инкапсулированных с упомянутой (или каждой) составляющей. Наиболее предпочтительные вещества способны к связыванию до 3000 атомов, ионов или молекул и, в частности, приблизительно 2000 или менее, или 500 или менее таких частиц.
В одном конкретном примере, использованном в изобретении, металлическая компонента ферритина (белковая оболочка из 24 субъединиц) состоит из 8-нанометрового (8×10-9 м) неорганического ядра. Каждое ядро содержит приблизительно 2000 атомов Fe. В другом примере, Dpr, из мутантов Streptococcus (оболочка из 12-субъединиц), состоит из 9-нанометровой оболочки, содержащей 480 атомов Fe. В другом примере лактоферрин связывает 2 атома Fe и содержит железо, связанное с гемом (в противоположность ферритину, который связывает молекулы железа внутри своего ядра). Металлотионеин-2 (MT) связывает 7 двухвалентных переходных металлов. Ионы цинка внутри MT замещаются Mn2+ и Cd2+ с образованием магнитного белка при комнатной температуре. MT может быть модифицирован для включения еще одного или более дополнительных металлсвязывающих участков, что усиливает магнетизм Mn,Cd-белка MT.
В соответствии с этими окружениями связывания общий объем вещества, связанного с или инкапсулированного в одной составляющей, как правило, не превышает 1×105 нм3 (представляя собой частицу или агрегат вещества, имеющие средний диаметр примерно 58 нм или менее). Более предпочтительно, вещество может иметь общий объем не более 1×104 нм3 (представляя собой частицу или агрегат вещества, имеющие средний диаметр примерно 27 нм или менее). Еще более предпочтительно, вещество может иметь общий объем не более 1×103 нм3 (представляя собой частицу или агрегат вещества, имеющие средний диаметр примерно 13 нм или менее). Наиболее предпочтительно, вещество может иметь общий объем не более 100 нм3 (представляя собой частицу или агрегат вещества, имеющие средний диаметр примерно 6 нм или менее). Однако размер частиц можно определить по среднему диаметру как альтернативе объему. Таким образом, в настоящем изобретении также предпочтительно, чтобы средний диаметр связанных частиц составлял 50 нм или менее, 40 нм или менее, 30 нм или менее, 20 нм или менее или, наиболее предпочтительно, 10 нм или менее. В данном контексте «средний» означает сумму диаметров у данного числа частиц, деленную на число частиц.
Настоящее изобретение далее будет описано более подробно только в качестве примера со ссылкой на следующие фигуры:
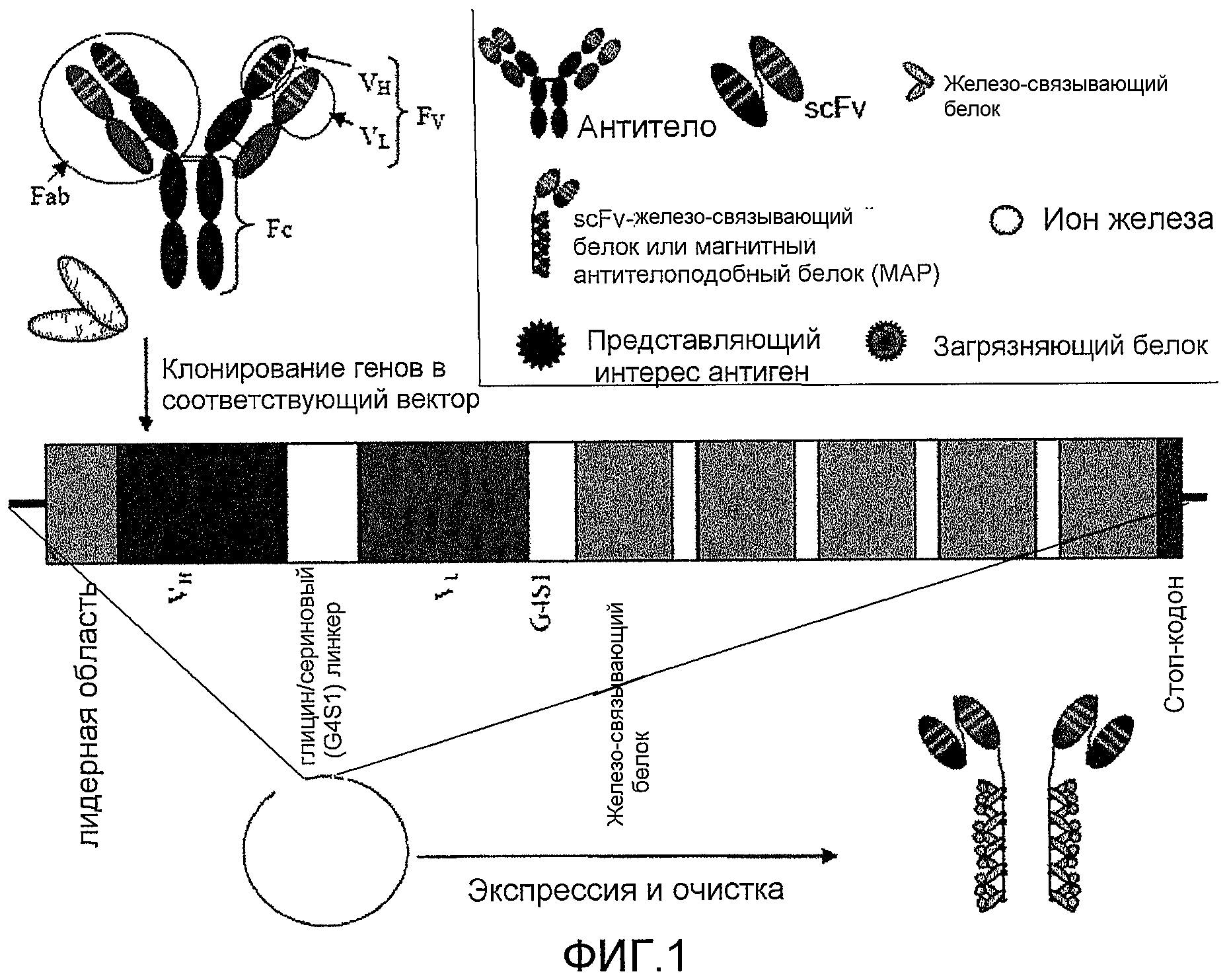
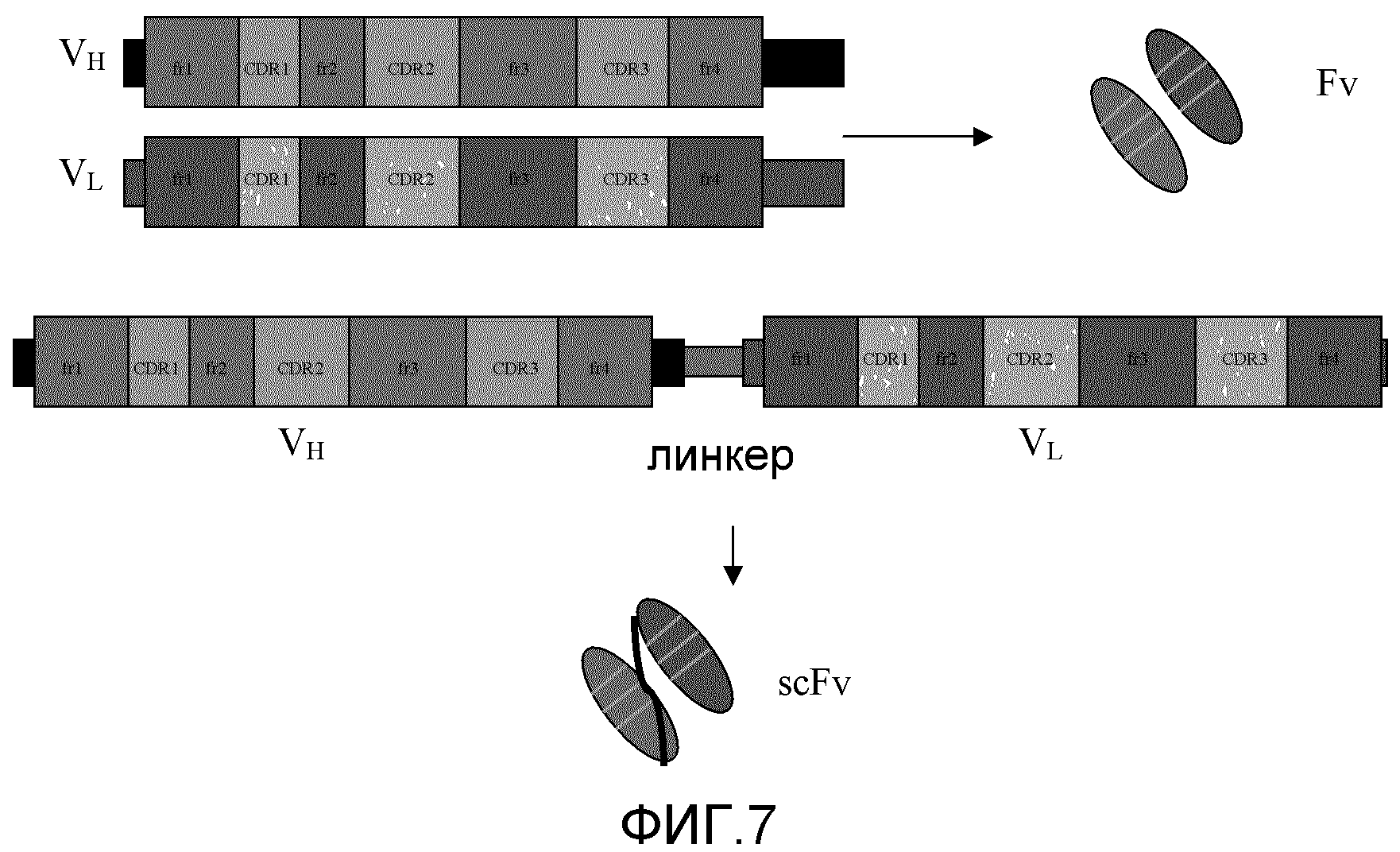
Фиг. 1: данная фигура демонстрирует, каким образом соответствующие гены клонируют в вектор с целью получения меток по настоящему изобретению. Число единиц намагничиваемого белка в конечной метке можно контролировать путем включения стольких копий соответствующего гена, сколько необходимо. В данный пример включены только гены для VH- и VL-областей антитела, так что в конечный предпочтительный химерный белок включена scFv-часть антитела, а не полное антитело.
VH- и VL-области можно клонировать путем амплификации соответствующих генов (матричной РНК), используя обратную транскрипцию с последующей полимеразной цепной реакцией (ПЦР) с клонов моноклональной гибридомы, или генных библиотек (фагового дисплея) в соответствующем экспрессионном векторе. Гены соединены при помощи серии небольших аминокислот (например, четыре остатка глицина и один остаток серина) для обеспечения корректного совмещения родственных друг другу полипептидов и образования участка связывания без помехи со стороны области линкера. Ген(ы) для намагничиваемого белка затем клонируют либо непосредственно после scFv, либо отделяют линкером из аминокислот, как описано выше. При необходимости с целью выделения слитого белка можно включить очистку при помощи тэг (такого как гексагистидин, глутатион-s-трансфераза, β-галактозидаза, гемаглютинин, зеленый флуоресцентный белок и т.д.). В конец гена слитого белка вставляют стоп-кодон, а затем - участок полиаденилирования. Если выбранный намагничиваемый белок состоит из многих субъединиц (такой как ферритин или Dpr), то предусматривается, что гены, кодирующие эти субъединицы, будут следовать за или предшествовать scFv. Также может быть целесообразным встроить гены scFv внутрь генов намагничиваемого белка, чтобы локализовать аминокислотную последовательность scFv на удобно расположенной части намагничиваемого белка, которая находится не на амино- или карбоксильном конце. Если выбран мономерный белок (такой как MT), множественные копии scFv и/или генов металлсвязывающих составляющих можно клонировать тандемно в экспрессионный вектор (как на Фиг. 1). Положение scFv и металлсвязывающих составляющих внутри экспрессированного слитого белка можно задать и контролировать по генетической последовательности. Что касается мультимерных белков, то может быть целесообразно встроить гены scFv внутрь генов намагничиваемого белка, чтобы локализовать аминокислотную последовательность scFv на удобно расположенной части намагничиваемого белка, которая находится не на амино- или карбоксильном конце. Затем вектор вводят в систему экспрессии, такую как линия клеток млекопитающего или насекомого, или в хозяина на основе дрожжей или бактерий для экспрессии. Слитый белок собирают соответствующими способами (седиментация, иммунопреципитация, аффинная очистка, жидкостная хроматография высокого давления или быстрого разрешения и т.д.). Очищенный слитый белок затем модифицируют, используя устоявшиеся способы намагничивания белков (Chang et al., Meldrum et al.).
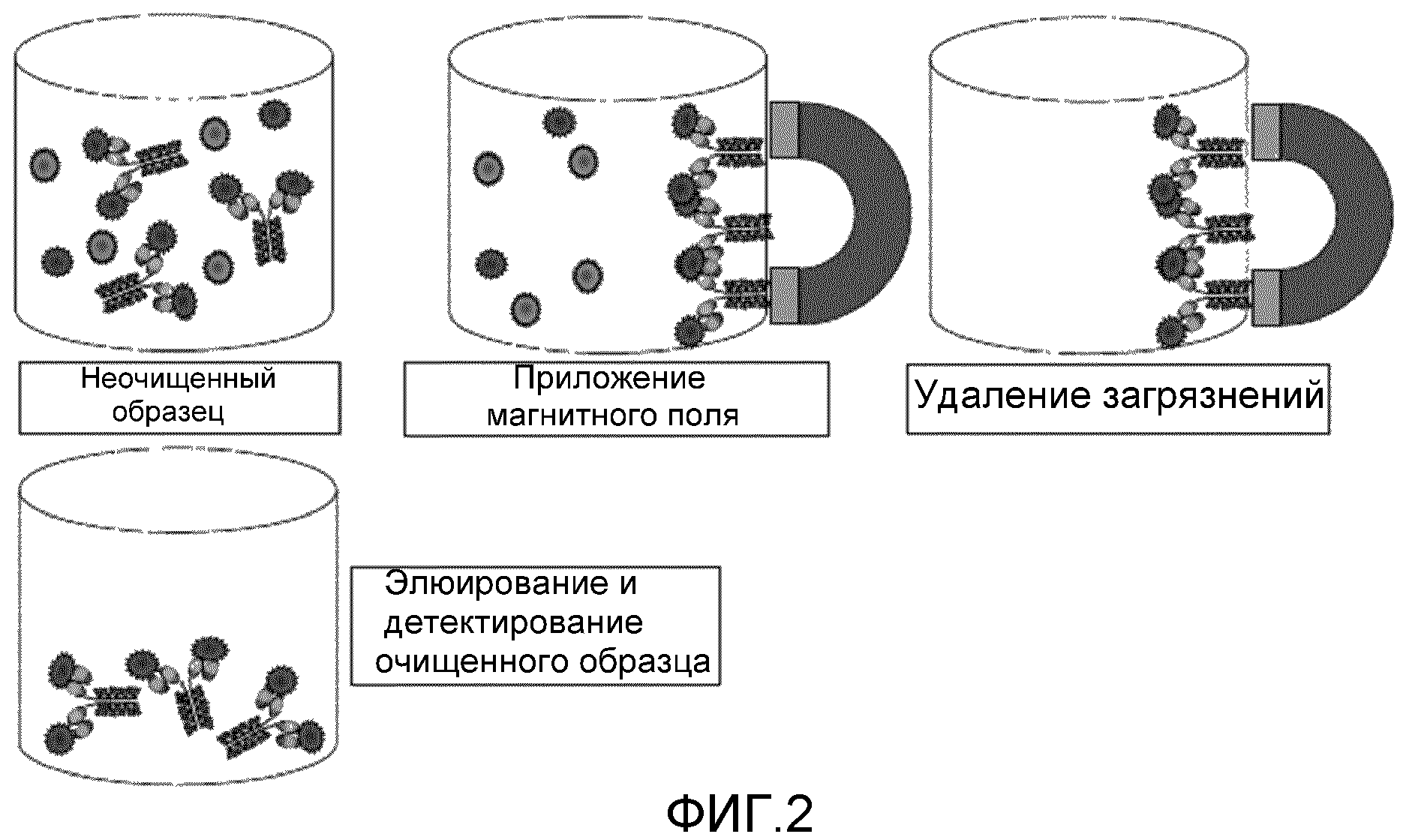
Фиг. 2: эта фигура схематически демонстрирует способ очистки с использованием меток по настоящему изобретению. Представляющий интерес аналит метят с использованием меток по настоящему изобретению, которые связаны с ионами. Магнитное поле прикладывают для предохранения связанного аналита от вымывания, в то время как все загрязнения удаляются. Остается очищенный образец, который можно анализировать (например, детектировать), если требуется.
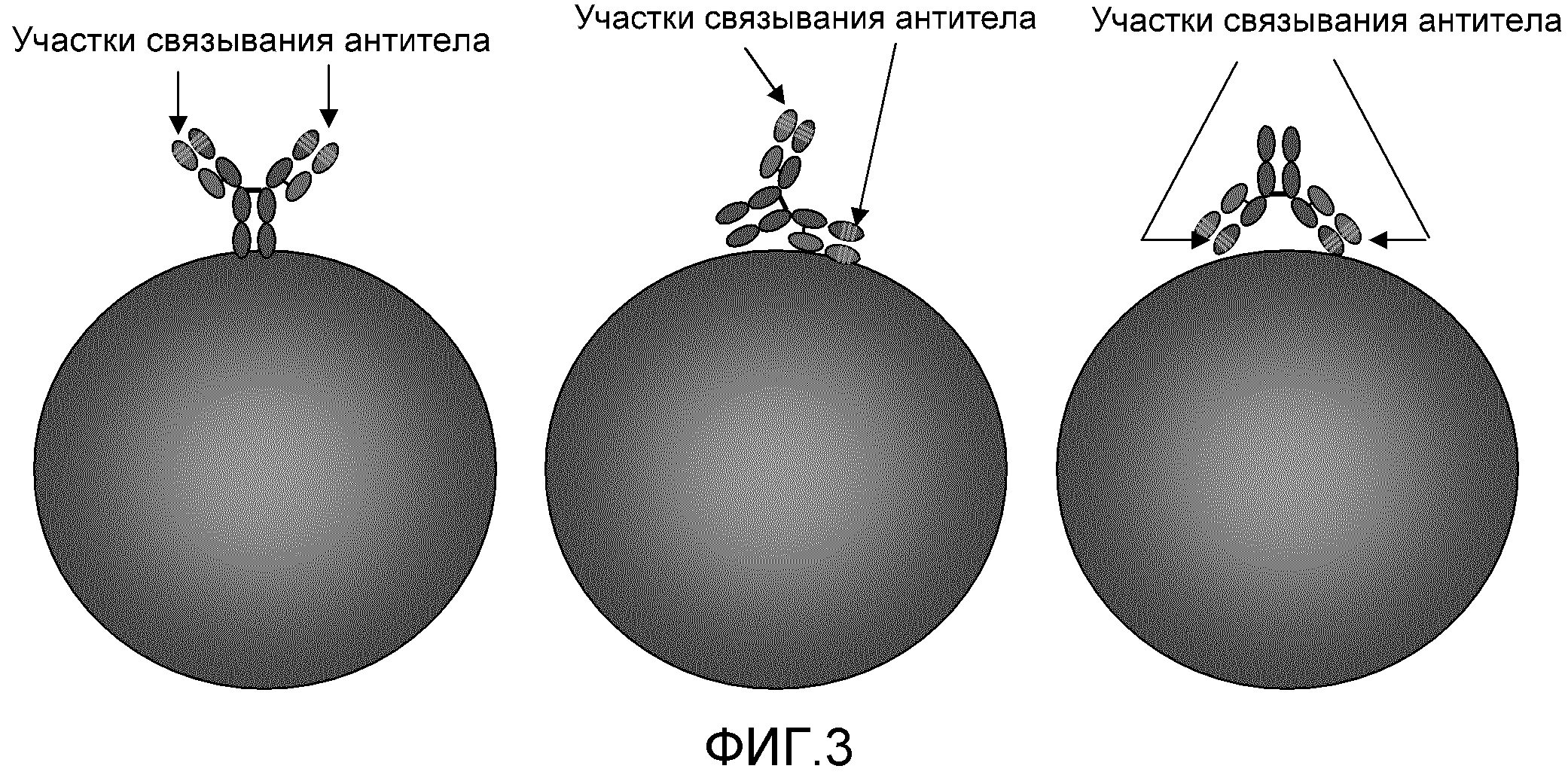
Фиг. 3: эта фигура демонстрирует, что поскольку доступные в настоящее время коммерческие покрытые антителами бусы производят путем ковалентного сопряжения антител с бусами, существует возможность неправильной ориентации антител, в связи с чем уменьшается эффективность связывания.
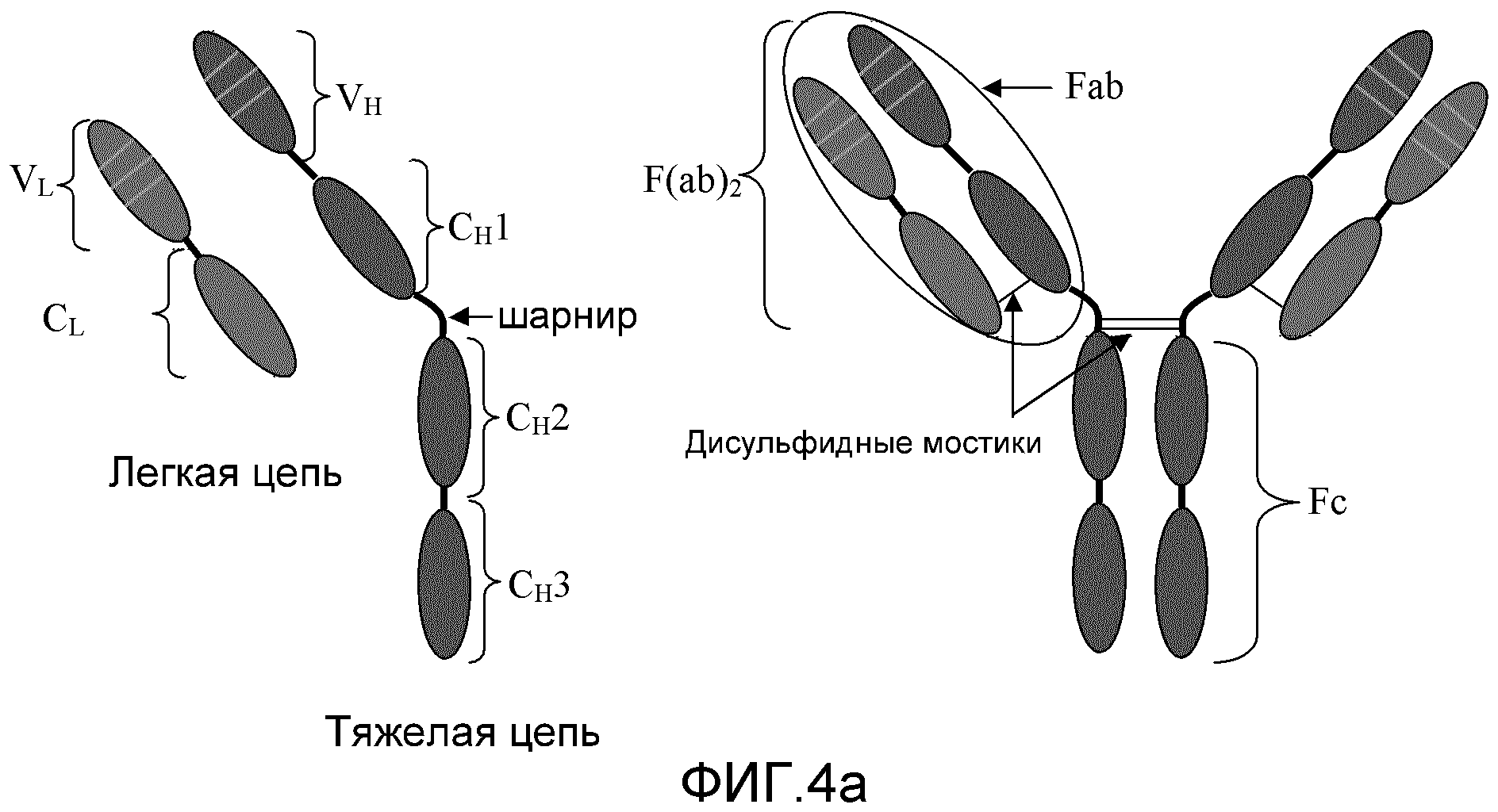
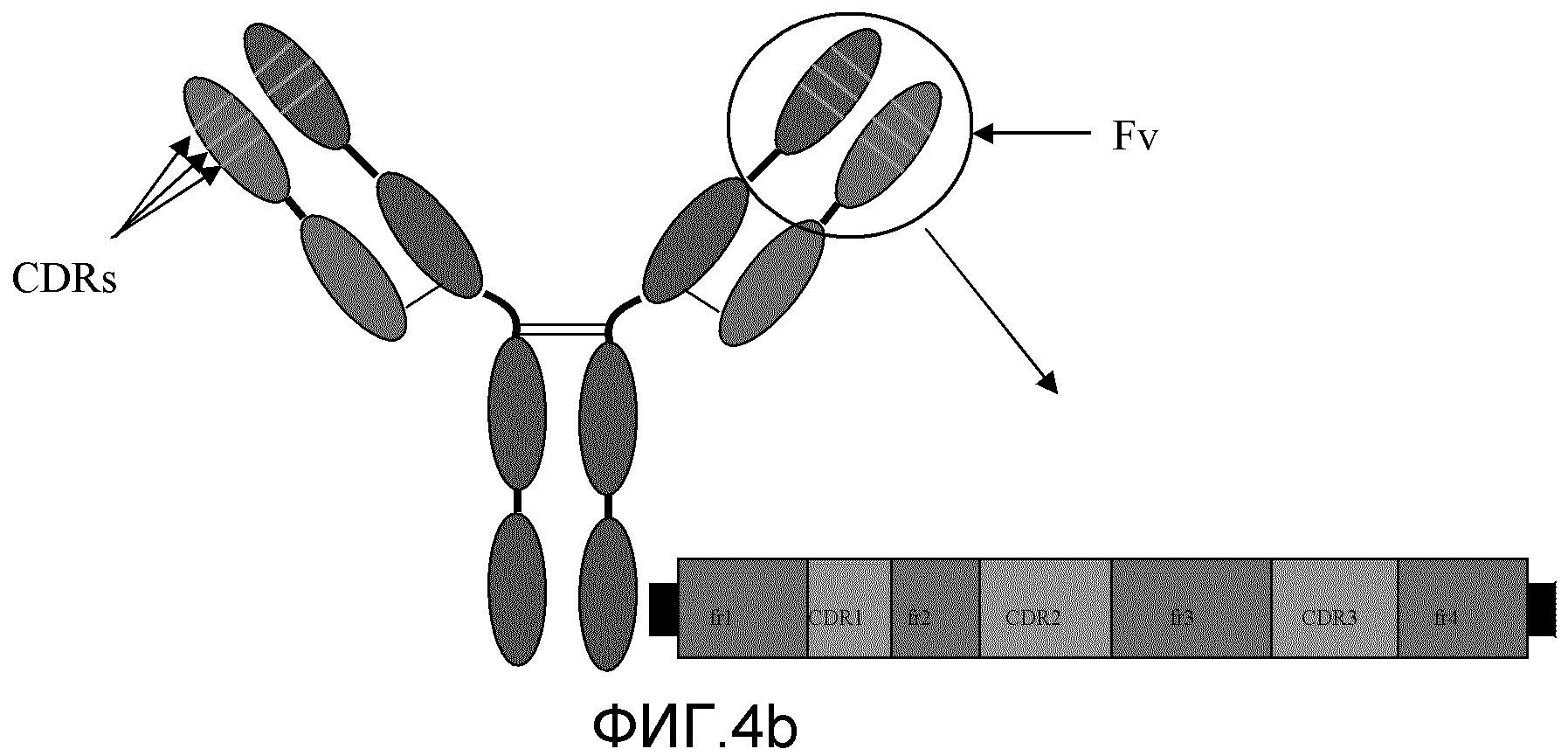
Фиг. 4a и 4b: эти фигуры схематически иллюстрируют упрощение структуры антител, таких как IgG. После протеазной обработки при помощи ферментов, таких как папаин, антитела расщепляются на 3 части близко к области шарнира. Поскольку часть антител с эффекторной функцией (шарнир, CH2 и CH3) относительно легко кристаллизовать для рентгенографического дифракционного анализа, эта часть стала известна как область кристаллизующегося фрагмента (Fc). Связывающиеся с антигеном части антител известны как фрагмент антитела (Fab). После ферментативного расщепления Fab-фрагменты можно соединить в области шарнира, вследствие чего образуется F(ab)2-фрагмент. Другие антитела могут отличаться по числу доменов в Fc-области и вариациями в области шарнира.
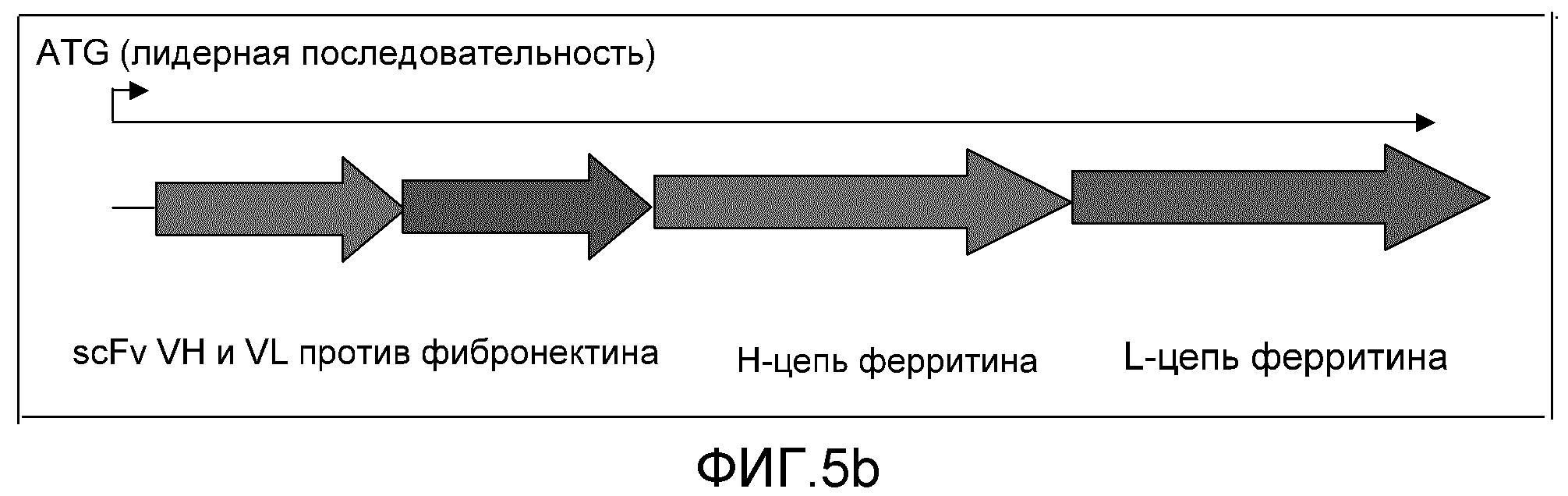
Фиг. 5a и 5b: эти фигуры демонстрируют конструирование слитого белка scFv-ферритин.
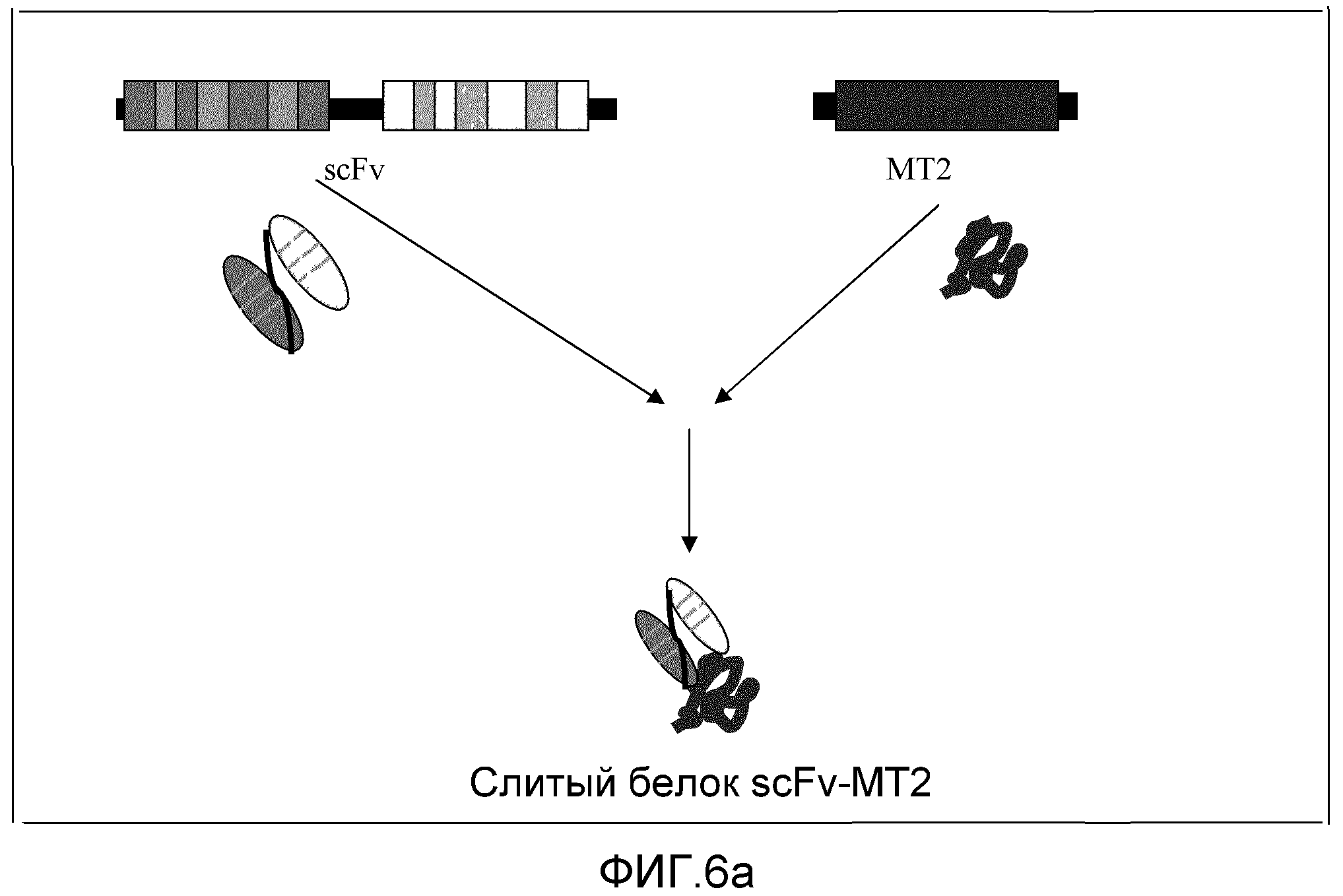
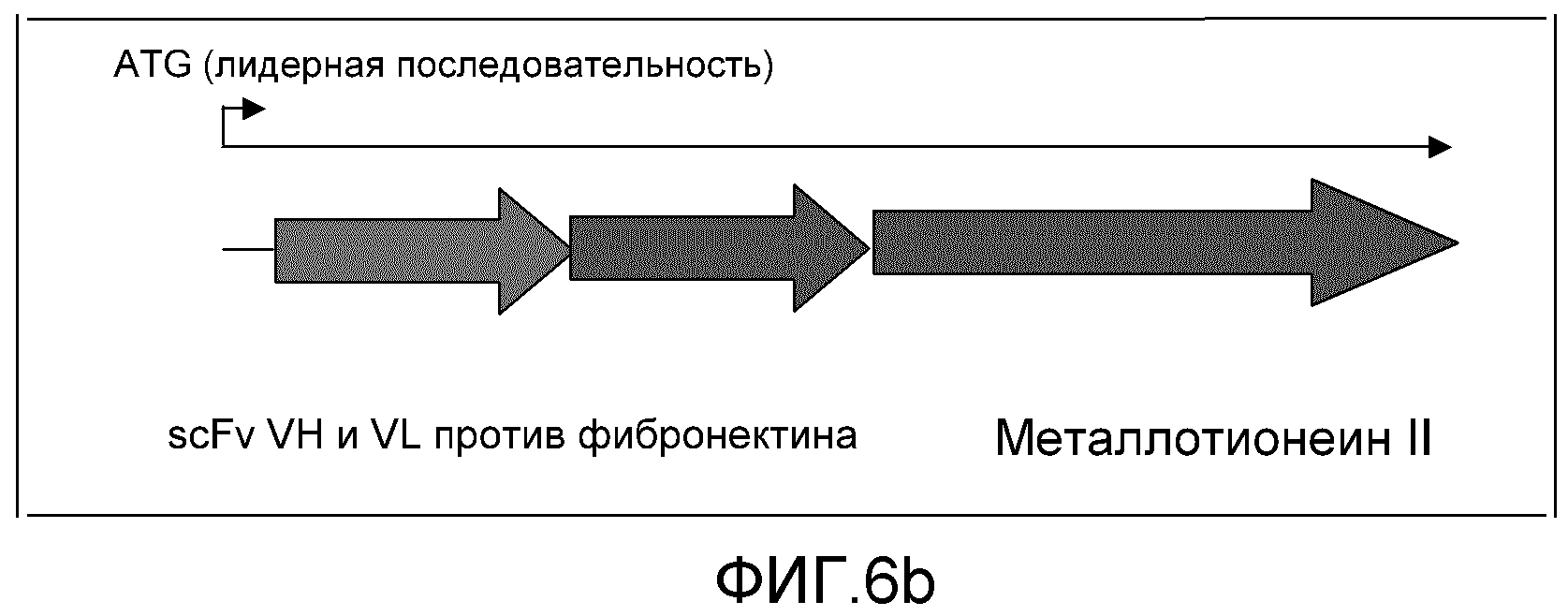
Фиг. 6a и 6b: эти фигуры демонстрируют конструирование слитого белка scFv-MT2.
Фиг. 7: эта фигура демонстрирует конструирование scFv-фрагмента.
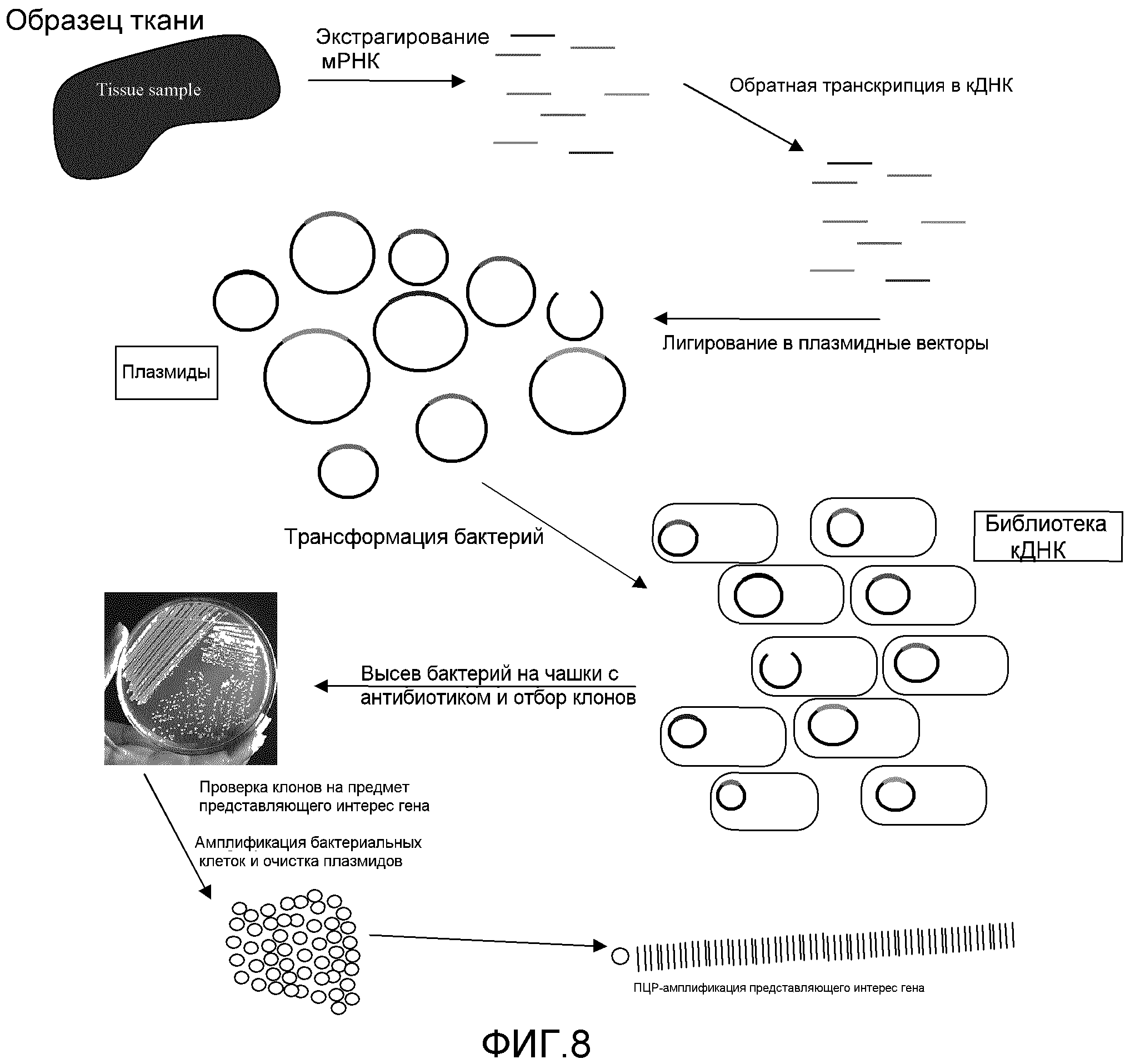
Фиг. 8: эта фигура демонстрирует конструирование кДНК-библиотеки. Для того чтобы сконструировать кДНК-библиотеку из образца ткани, мРНК экстрагируют, превращают в кДНК при помощи обратной транскрипции и лигируют в плазмидные векторы. Эти векторы затем используют для трансформации бактериальных клеток. Трансформированные клетки хранят замороженными до тех пор, пока они потребуются. Замороженные клетки можно размножать путем наращивания в соответствующей среде и очищать плазмиды. Представляющие интерес гены для дальнейшего анализа можно затем амплифицировать при помощи ПЦР с использованием специфических пар праймеров.
Фиг. 9a и 9b: эти фигуры демонстрируют ПЦР-ампликоны генов тяжелой (H) и легкой (L) цепи ферритина и частично перекрывающиеся ПЦР-продукты генов тяжелой и легкой цепи ферритина соответственно. Фиг. 9c демонстрирует результаты ПЦР с колоний, клоны 1, 3 и 4 были отобраны для секвенирования.
Фиг. 10a и 10b: эти фигуры показывают гель, демонстрирующий продукты ПЦР-амплификации scFv против фибронектина и полигена тяжелой и легкой цепи ферритина (помечено стрелкой), и гель, демонстрирующий перекрывающиеся ПЦР-продукты, соответственно.
Фиг. 11: эта фигура показывает гель, демонстрирующий результаты ПЦР-скрининга числа клонов, трансформированных плазмидами, которые были лигированы со слитыми конструкциями scFv:ферритин.
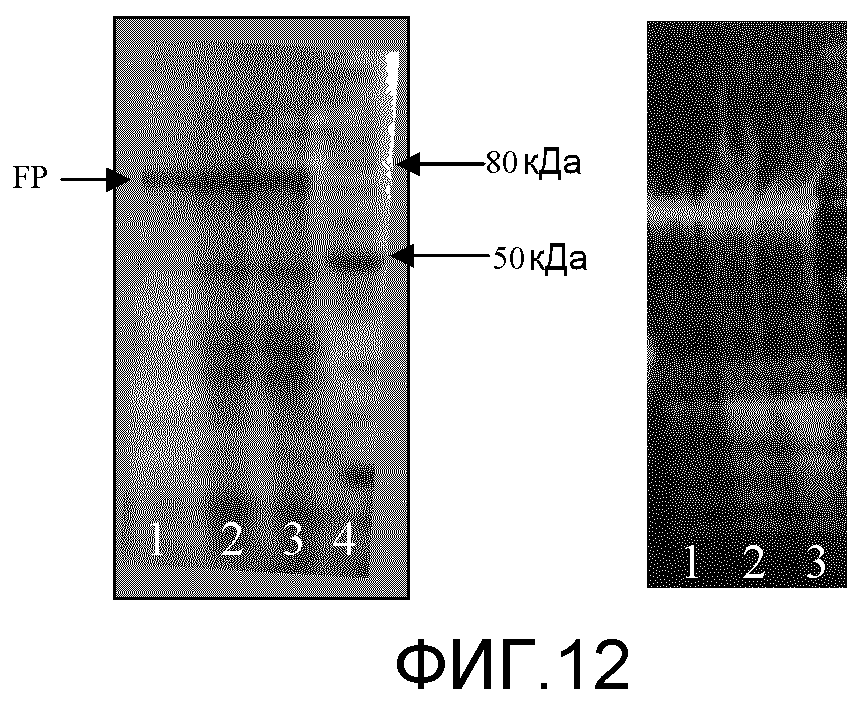
Фиг. 12: эта фигура демонстрирует окрашенный Кумасси синим гель и Вестерн-блот клеточных лизатов соответственно. Обозначения: 1. Ферритин 2 часа индукции; 2. Ферритин 3 часа индукции; 3. Ферритин 4 часа индукции; 4. Белковый маркер Benchmark (Invitrogen).
Фиг. 13: эта фигура показывает гель, демонстрирующий продукт ПЦР-амплификации MT2 из библиотеки печени человека.
Фиг. 14: эта фигура демонстрирует анализ колоний клонов, трансформированных плазмидой, содержащей конструкцию scFv:MT2.
Фиг. 15: эта фигура демонстрирует (соответственно) окрашенный Кумасси гель и Вестерн-блот scFv:MT2 (помечено стрелкой).
Фиг. 16: эта фигура демонстрирует фотографии окрашенного Кумасси синим геля и Вестерн-блот (соответственно) повторно растворенных слитых белков scFv:ферритин и scFv:MT2. Слитые белки обведены кружками - ферритин присутствует в дорожке 2 на обоих гелях и MT2 присутствует в дорожке 3 на обоих гелях. Белковый маркер молекулярных масс представлен в дорожке 1.
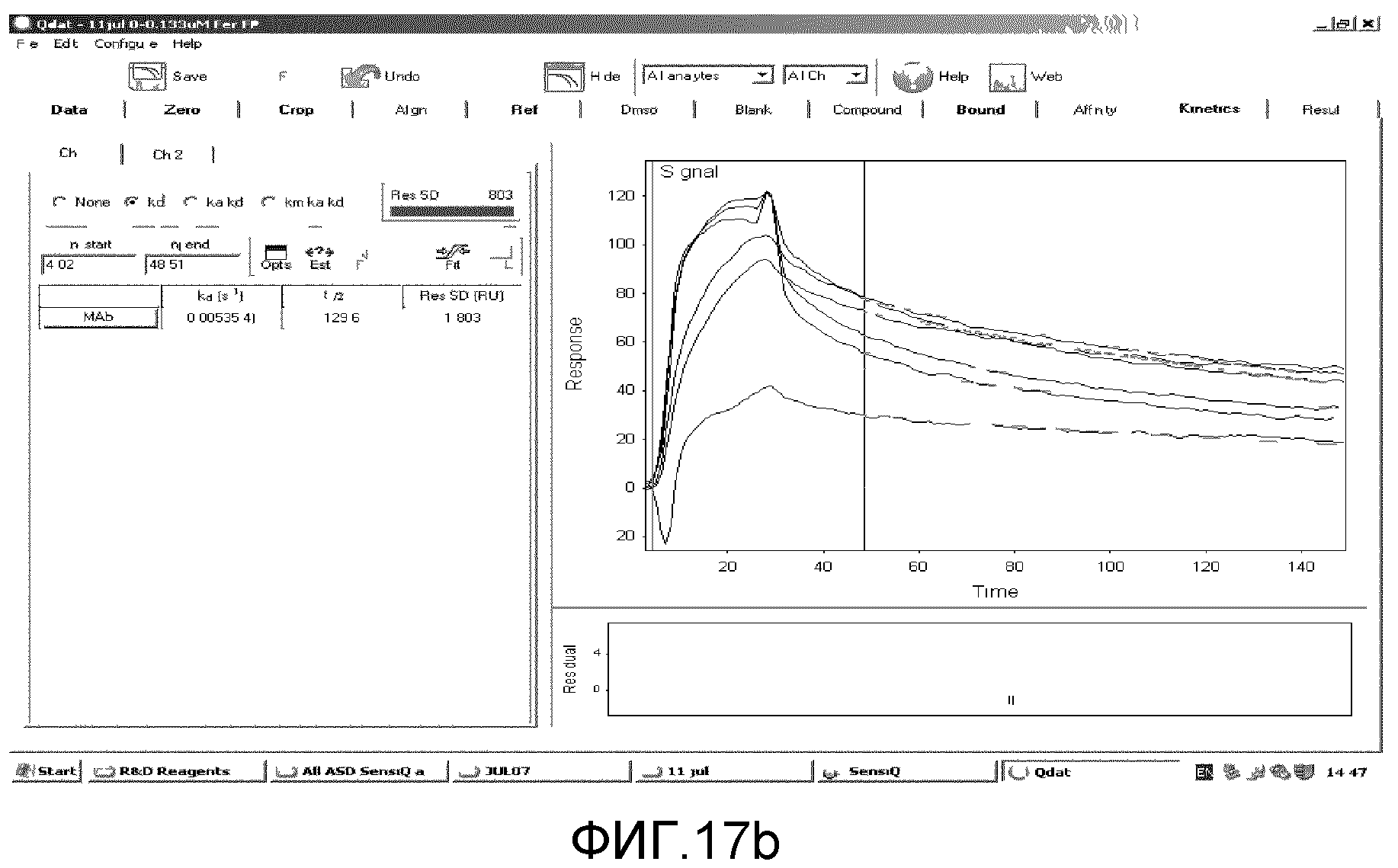
Фиг. 17a и 17b: эти фигуры демонстрируют наложенные сенсограммы SPR-анализа связывания слитых белков MT2 и ферритина соответственно.
Фиг. 18: эта фигура демонстрирует магнитный характер магнетоферритина, производимого для применения в настоящем изобретении.
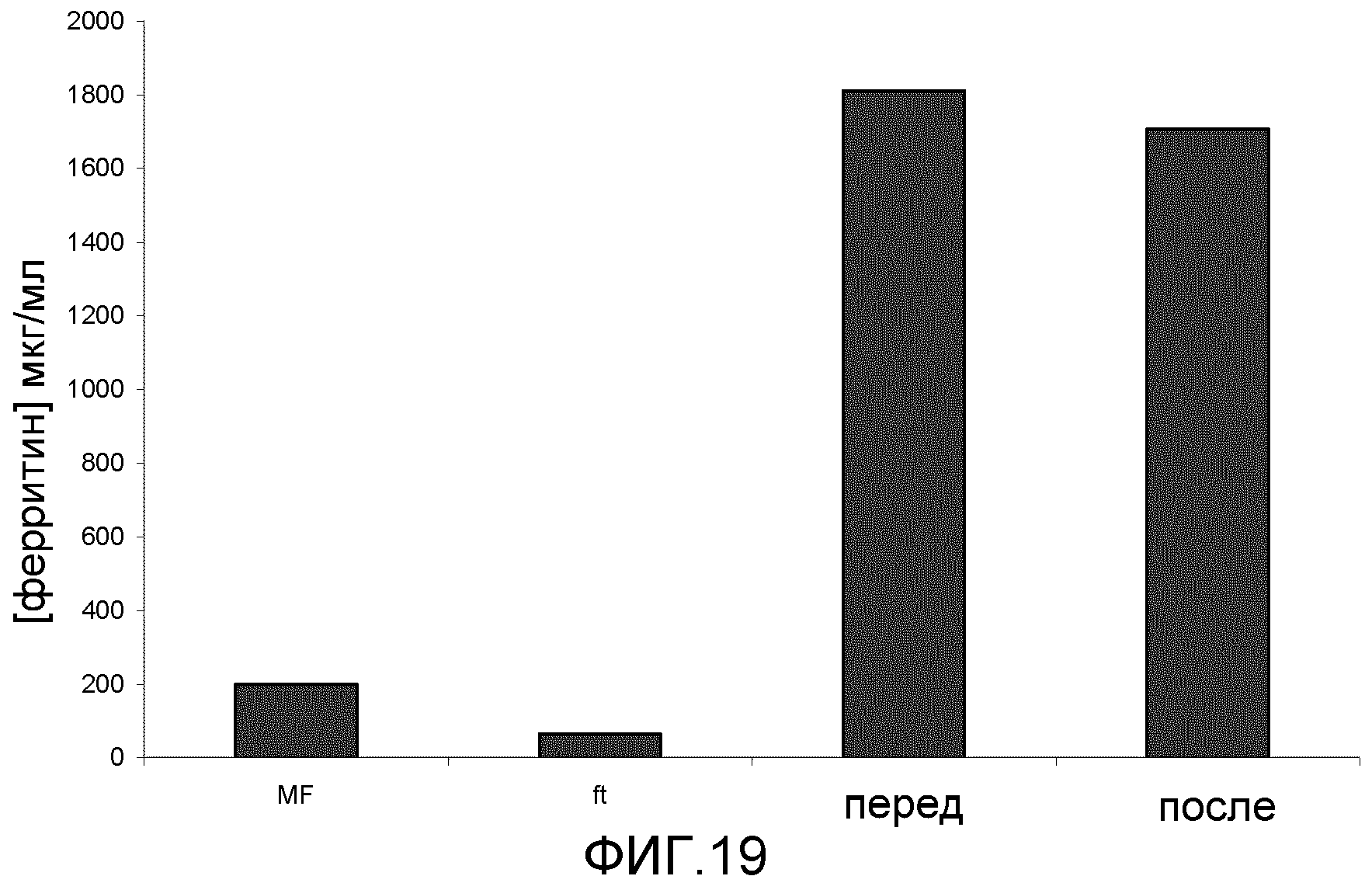
Фиг. 19: эта фигура демонстрирует концентрацию ферритина при производстве и концентрацию магнетоферритина. Обозначения: MF; Магнетоферритин: ft; фильтрат: Pre; концентрированный на колонке Macs® магнетоферритин перед диализом: post; концентрированный на колонке Macs® магнетоферритин после диализа.
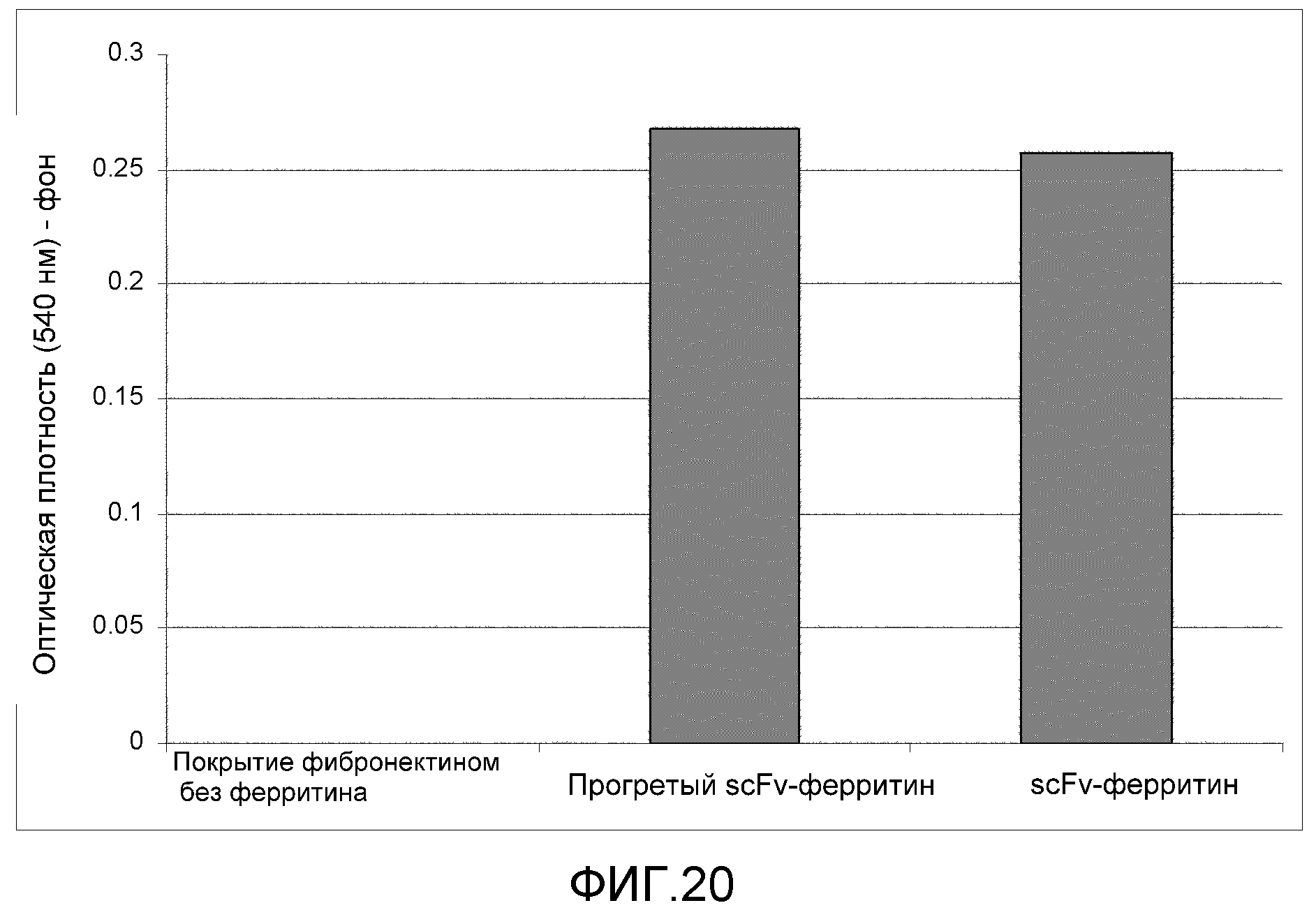
Фиг. 20: эта фигура демонстрирует связывание scFv:ферритин и прогретого scFv:ферритин с фибронектином.
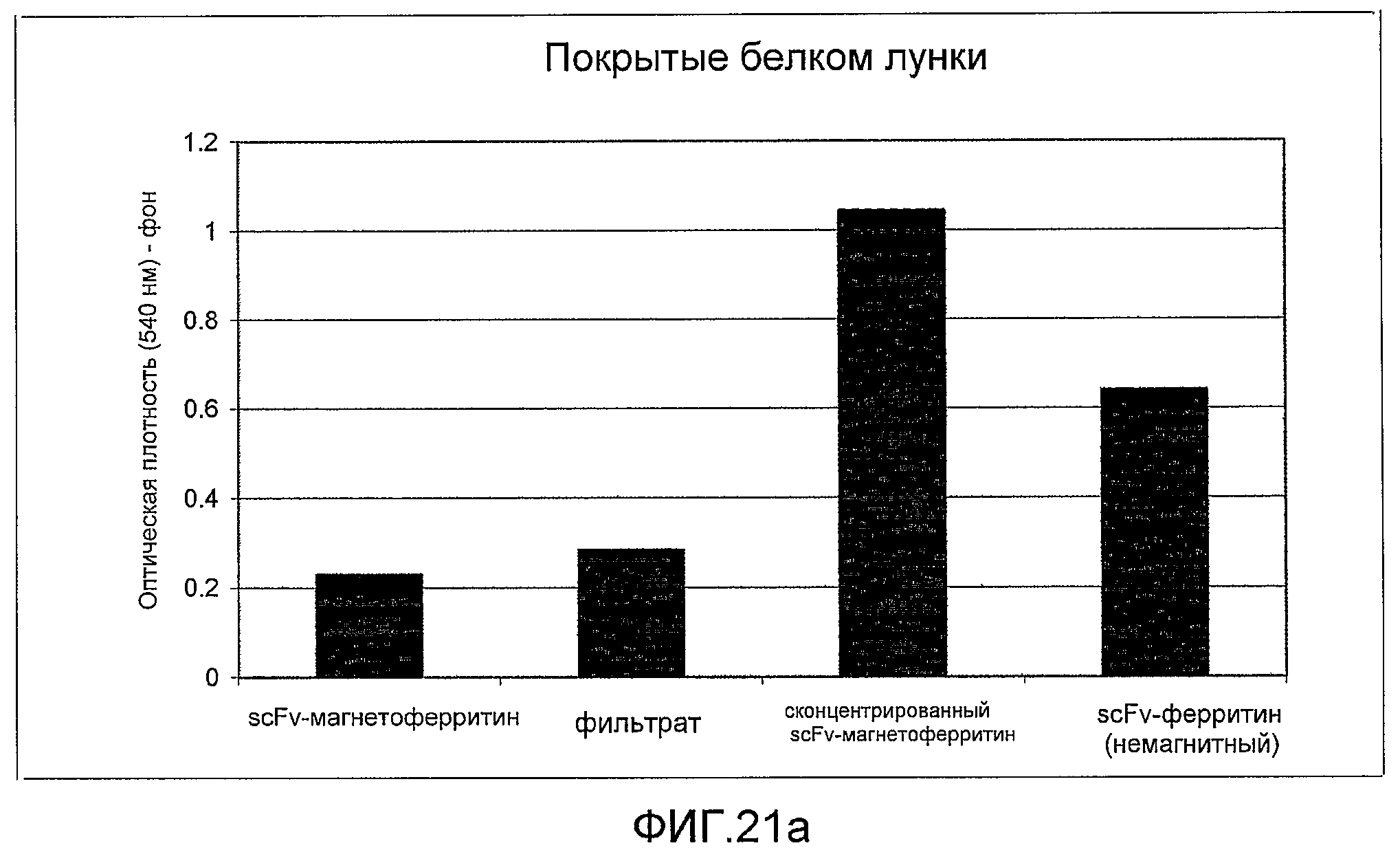
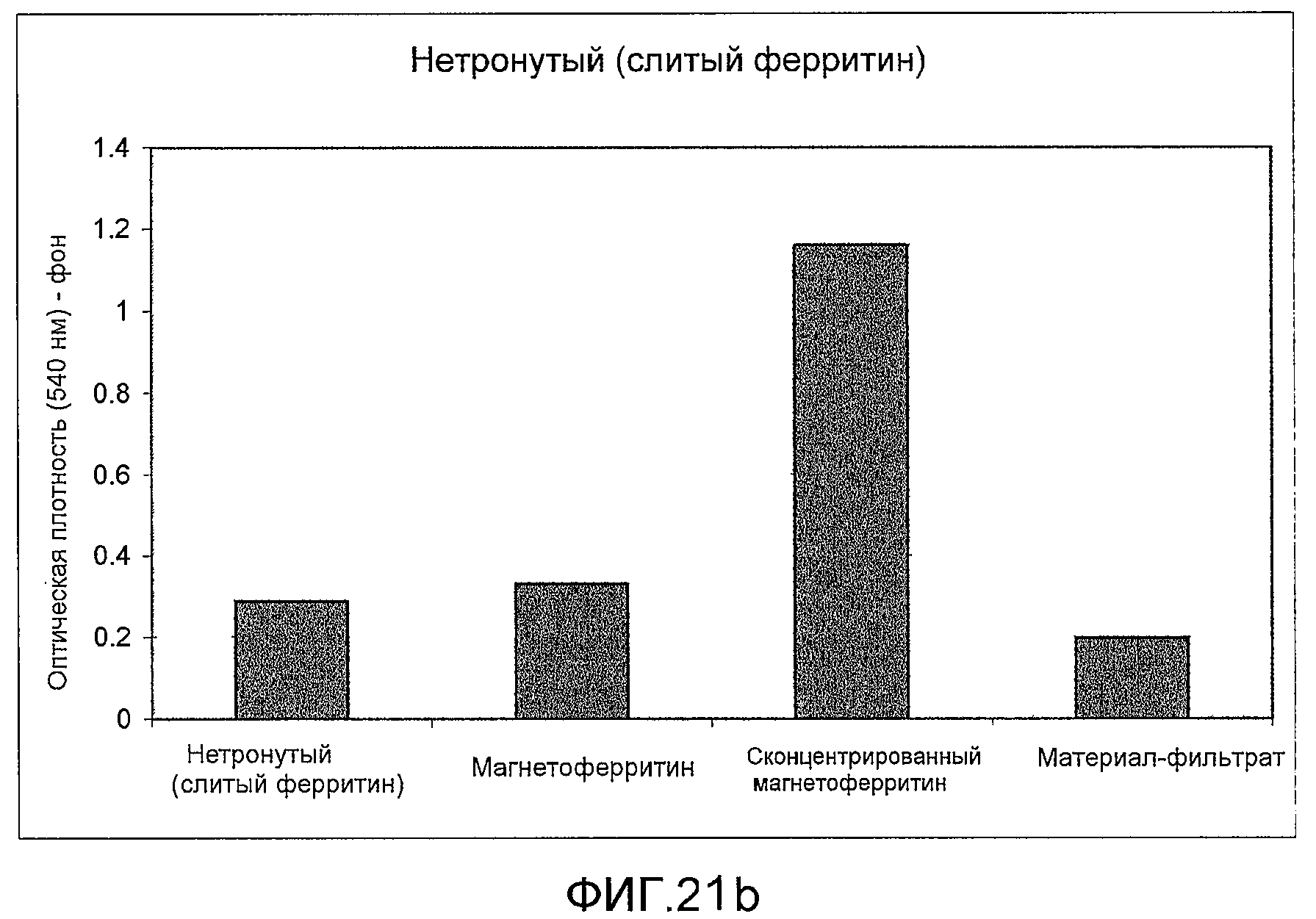
Фиг. 21a и 21b: эти фигуры демонстрируют измеренные значения оптической плотности, зарегистрированные при помощи прибора Varioskan Flash, на намагниченном слитом белке. После концентрирования белок по-прежнему распознается моноклональными антителами к ферритину (21a) и намагниченный слитый белок анти-фибронектин:ферритин сохраняет способность связывания со своим антигеном-мишенью (21b).
Составляющая для связывания магнитного или намагничиваемого вещества особо не ограничена, при условии, что она способна связывать это вещество и не мешает связыванию с аналитом. Составляющая для связывания магнитного или намагничиваемого вещества включает металлсвязывающий белок, полипептид или пептид (или металлсвязывающий домен такого белка, полипептида или пептида). Как правило, эта составляющая способна связываться с или связывается с одним или более атомами и/или ионами переходного металла и/или лантаноида или любым соединением, содержащим такие ионы. Такие ионы включают, но не ограничиваются ими, любые один или более ионов Fe, Co, Ni, Mn, Cr, Cu, Zn, Cd, Y, Gd, Dy или Eu.
В более предпочтительных вариантах осуществления изобретения упомянутые один или более ионов металла включают любой один или более из Fe2+, Fe3+, Co2+, Co3+, Mn2+, Mn3+, Mn4+, Cd2+ и Ni2+. Наиболее предпочтительными ионами для применения в настоящем изобретении являются ионы Fe2+ и Fe3+и Cd2+и Mn2+. Как правило, эти ионы связываются лактоферрином, трансферрином и ферритином в случае железа и металлотионеином-2 в случае кадмия и марганца. Связывание Fe2+ предпочтительно ускоряется при использовании кислых условий, в то время как связывание Fe3+ предпочтительно ускоряется при использовании нейтральных или щелочных условий.
В предпочтительных вариантах осуществления изобретения металлсвязывающая составляющая включает белок или металлсвязывающий домен белка, выбранный(ого) из лактоферрина, трансферрина, ферритина (апоферритина), металлотионеина (MT1 или MT2), белка, связывающего ионы трехвалентного железа (FBP, например, из Haemophilus influenzae), фратаксина и сидерофоров (очень небольших пептидов, функция которых состоит в транспорте железа через бактериальные мембраны).
В некоторых вариантах осуществления метки по изобретению могут включать множество составляющих для связывания магнитного или намагничиваемого вещества. Число таких составляющих можно контролировать так, чтобы контролировать магнитные свойства метки. Как правило, в таких вариантах осуществления метки могут включать от 2 до 100 таких составляющих, предпочтительно, от 2 до 50 таких составляющих, а наиболее предпочтительно, от 2 до 20 таких составляющих для связывания магнитного или намагничиваемого вещества. В конечном химерном белке каждая копия металлсвязывающего белка может для гибкости присоединяться к следующей линкерными последовательностями незаряженных аминокислот.
Также в изобретение включены наборы меток, причем каждая метка в наборе обладает отличным (уникальным) числом металлсвязывающих составляющих. Эти наборы меток выгодны потому, что они могут давать возможность обрабатывать множество аналитов из одного или более образцов одновременно.
Распознающая составляющая особо не ограничена, при условии, что она способна связывать представляющий интерес аналит. Как правило, аналиты, с которыми эта составляющая должна связываться, выбирают из биологической молекулы (натуральной или синтетической), возбудителя инфекции или компонента возбудителя инфекции (такого как вирус, или частица вируса, или компонент вируса), клетки или клеточного компонента, и небольшой молекулы, такой как эндогенная или экзогенная небольшая молекула (например, метаболит, или фармацевтический препарат, или лекарственное средство). В настоящем контексте небольшая молекула означает молекулярный химикат, такой как биологически активная молекула, который не является полимером или олигомером (в отличие от белка, нуклеиновой кислоты, полипептида или других биологических олигомеров и полимеров), таким как метаболит, фармацевтический препарат, лекарственное средство, углеводород, липид, жир или подобный. Как правило, небольшая молекула обладает массой 2000 Да или менее. Точнее, является предпочтительным, чтобы аналиты, с которыми эта составляющая должна связываться, включали вирус, или частицу вируса, или компонент вируса, белок, полипептид, гликопротеин, нуклеиновую кислоту, такую как ДНК или РНК, олигонуклеотид, метаболит, углеводород, такой как сложный углеводород, липид, жир или фармацевтический препарат или лекарственное средство. Эти аналиты включают остатки сахаров, производимые бактериями (например, сиаловая кислота), и сахаридные оболочки многих бактерий/вирусов, а также измененные сахара, присутствующие в некоторых опухолях на их гликопротеинах. Любые один или более из этих аналитов предпочтительны для применения в способах по настоящему изобретению.
Распознающая составляющая, которая способна связываться с вышеуказанными аналитами, сама по себе может являться любого типа веществом или молекулой, при условии, что она пригодна для связывания с представляющим интерес аналитом. Как правило, распознающую составляющую выбирают из антитела или фрагмента антитела, рецептора или фрагмента рецептора, белка, полипептида, пептидомиметика, нуклеиновой кислоты, олигонуклеотида и аптамера. В более предпочтительных вариантах осуществления изобретения распознающую составляющую выбирают из вариабельной полипептидной цепи антитела (Fv), рецептора T-клеток или фрагмента рецептора T-клеток, авидина и стрептавидина. Наиболее предпочтительно, распознающую составляющую выбирают из одной цепи вариабельной части антитела (sc-Fv).
Антитела представляют собой молекулы иммуноглобулинов, вовлеченные в распознавание чужеродных антигенов и экспрессируемые у позвоночных. Антитела продуцируются специализированным типом клеток, известным как В-лимфоцит или B-клетка. Индивидуальная B-клетка продуцирует только один вид антител, который нацелен на единственный эпитоп. При встрече B-клетки с антигеном она распознает, она делится и дифференцируется в продуцирующую антитела клетку (или плазматическую клетку).
Основная структура большинства антител состоит из четырех полипептидных цепей двух различных типов (Фиг. 4). Меньшая (легкая) цепь обладает молекулярной массой 25 килодальтонов (кДа), а большая (тяжелая) цепь - молекулярной массой 50-70 кДа. Легкие цепи имеют одну вариабельную (VL) и одну константную (CL) область. Тяжелые цепи имеют одну вариабельную (VH) и 3-4 константных (CH) области, в зависимости от класса антитела. Первая и вторая константные области на тяжелой цепи отделены шарнирной областью переменной длины. Две тяжелые цепи соединены вместе в шарнирной области через дисульфидные мостики. Области тяжелой цепи после шарнира также известны как Fc-область (кристаллизующийся фрагмент). Комплекс легкой цепи и тяжелой цепи до шарнира известен как область Fab (фрагмент антитела) с двумя участками связывания антител, вместе известными как область F(ab)2. Константные области тяжелой цепи способны связываться с другими компонентами иммунной системы, включая молекулы системы комплемента и рецепторы антител на клеточных поверхностях. Тяжелые и легкие цепи антител образуют комплекс, часто связанный дисульфидным мостиком, который вариабельным концом способен связываться с некоторым данным эпитопом (Фиг.4).
Вариабельные гены антител образуются путем мутации, соматической рекомбинации (также известной как перетасовка генов), генной конверсии и событий добавления нуклеотидов.
Антитела ScFv могут образовываться против огромного числа мишеней, включая:
1. Вирусы: Torrance et al. 2006. Oriented immobilisation of engineered single-chain antibodies to develop biosensors for virus detection. J Virol Methods. 134 (1-2) 164-70;
2. Вирус гепатита C: Gal-Tanamy et al. 2005. HCV NS3 serine protease-neutralizing single-chain antibodies isolated by a novel genetic screen. J Mol Biol. 347 (5):991-1003), and Li and Allain. 2005. Chimeric monoclonal antibodies to hypervariable region 1 of hepatitis C virus. J Gen Virol. 86 (6) 1709-16;
3. Злокачественные опухоли: Holliger and Hudson. Engineered antibody fragments and the rise of single domains. Nat Biotechnol. 23 (9) 1126-36,
и могут использоваться для различных применений, включая протеомику (Visintin et al. 2004. Intracellular antibodies for proteomics. J Immunol Methods. 290 (l-2):135-53).
Таким образом, в своих наиболее предпочтительных вариантах осуществления настоящее изобретение использует многосоставляющую метку, как правило, образованную из одного или более антигенсвязывающих плеч одного или более антител для распознавания одного или более аналитов и одной или более копий металлсвязывающего белка, присоединенного к антигенсвязывающему плечу. Как правило, используемый фрагмент антитела включает вариабельные области тяжелой и легкой цепей, VH и VL, соединенные гибким линкером с образованием одноцепочечного пептида (sc), обычно обозначаемого scFv. Когда обе составляющие в метке образованы из белка и/или полипептидов (т.е. метка включает химерный белок), метка может быть образована с использованием рекомбинантных методик, которые хорошо известны в данной области. Иллюстрация этого представлена на Фиг. 1. Однако, если любая из составляющих будет образована из других видов веществ, метки могут быть получены путем простого присоединения одного вещества к другому.
Таким образом, настоящее изобретение также предлагает способ образования охарактеризованной выше метки для аналита, включающий соединение вместе распознающей составляющей для присоединения метки к аналиту и составляющей для связывания магнитного или намагничиваемого вещества.
Далее, настоящим изобретением предлагается способ обработки образца, причем этот способ включает:
(a) контактирование образца с меткой для аналита, которая присоединена к магнитному или намагничиваемому веществу, включающей:
- распознающую составляющую для присоединения метки к аналиту; и
- составляющую для связывания или инкапсулирования магнитного или намагничиваемого вещества;
(b) подвергание метки магнитному полю для воздействия на метку;
(c) необязательно анализирование метки и/или аналита для получения информации об аналите, который может быть присоединен к метке,
при этом составляющая для связывания или инкапсулирования магнитного или намагничиваемого вещества включает металлсвязывающий белок, полипептид или пептид.
В одном предпочтительном примере вышеуказанного способа магнитное поле можно использовать для отделения, очистки и/или выделения метки и/или любого аналита, который может быть присоединен к метке, от/из одного или более дополнительных веществ в образце. В этом случае стадия анализа не существенна, поскольку цель очистки может быть достигнута без анализа. В других предпочтительных способах стадия анализа осуществляется и, как правило, включает детектирование наличия, отсутствия, идентичности и/или количества присоединенного к метке аналита.
Настоящее изобретение также предлагает применение охарактеризованной выше метки в способе очистки нуклеиновой кислоты, олигонуклеотида, белка, полипептида, возбудителя инфекции (например, вируса, частицы вируса или компонента вируса) или клетки. Метки предпочтительно используют в сэндвич-тестах, таких как тесты, проводимые в микрофлюидном устройстве и/или биосенсоре.
К тому же, настоящим изобретением предложено применение составляющей для связывания магнитного или намагничиваемого вещества, причем эта составляющая включает металлсвязывающий белок, полипептид или пептид, и при этом применение осуществляют с использованием микрофлюидного или нанофлюидного устройства.
Различные составляющие, включая металлсвязывающие белки, антитела и слитые белки, используемые в настоящем изобретении, далее будут описаны более подробно.
Два металлсвязывающих белка были определены в качестве хороших примеров для дальнейшей иллюстрации настоящего изобретения. Ими были ферритин и металлотионеин II (MT2). Предпочтительным является, чтобы слитые белки были образованы любым из этих металлсвязывающих белков, которые включают вариабельные домены антитела мыши, экспрессированного как единая цепь Fv (scFv), генетически слитые либо с ферритином, либо с металлотионеином II с образованием рекомбинантного белка.
Металлсвязывающие белки
Число описанных в литературе металлсвязывающих белков все время возрастает. Многие белки запасают железо (Fe) в виде фосфата метагидроксида трехвалентного железа или в виде гема, что усложняет способы намагничивания. Белки, такие как ферритин, способны запасать тысячи ионов железа внутри клеткоподобной структуры.
Поскольку эндогенное железо внутри ферритина не является парамагнитным, его, как правило, необходимо удалять и заменять парамагнитной формой без повреждения белка. Другие металлсвязывающие белки, такие как металлотионеин II (MT2), удерживают меньше ионов металла в неплотной решетчатой компоновке, и переместить и заменить эти ионы может быть проще, чем в случае с ферритином.
Ферритин
Ферритин представляет собой большой белок, диаметром 12 нм, с молекулярной массой 480 кДа. Белок содержит большую полость (диаметром 8 нм), которая заключает внутри себя железо. Полость образуется при самопроизвольной сборке 24 полипептидов ферритина, свернутых в четырехспиральные пучки, удерживаемые нековалентными связями. При физиологических условиях железо и кислород образуют нерастворимую ржавчину и растворимые радикалы. Растворимость ионов железа составляет 10-18 M. Ферритин обладает способностью запасать ионы железа внутри клеток с концентрацией 10-4M.
Аминокислотная последовательность и, следовательно, вторичная и третичная структуры ферритина консервативны у животных и растений. Последовательность отлична от последовательности, обнаруженной у бактерий; тем не менее, структура белка в бактериях не отличается. Ферритин играет существенную роль в выживании, так как исследования с использованием мутантных мышей с делетированными генами приводили к смерти эмбриона. Ферритин был также обнаружен у анаэробных бактерий.
Ферритин представляет собой большой многофункциональный белок с восьмью порами для транспорта Fe, 12 участками минеральной нуклеации и вплоть до 24 оксидазными участками, которые продуцируют минеральные предшественники из двухвалентного железа и кислорода. Два типа субъединиц (тяжелая цепь (H) и легкая цепь (L)) образуют ферритин у позвоночных, каждая с каталитически активным (H) или неактивным (L) оксидазными участками. Соотношение тяжелой и легкой цепей меняется в зависимости от потребностей. До 4000 атомов железа может быть локализовано в центре белка ферритина.
Железо, запасенное внутри ферритина, обычно находится в форме гидратированного ферригидрита оксида железа (5Fe2O3·9H2O). Можно заместить ферримагнитное ядро ферримагнитным оксидом железа, магнетитом (Fe3O4). Этого можно добиться удалением железа при помощи тиогликолевой кислоты с получением апоферритина. Раствор Fe(II) затем постепенно добавляют под аргоном или другим инертным газом с медленным, контролируемым окислением путем введения воздуха или альтернативного окислителя.
Металлотионеин II
Металлотионеины представляют собой внутриклеточные, низкомолекулярные, богатые цистеином белки. Эти белки обнаружены у всех эукариотов и обладают сильными металлсвязывающими и окислительно-восстановительными способностями. MT-1 и MT-2 быстро индуцируются в печени при помощи множества металлов, лекарственных средств и медиаторов воспаления. Функции MT-2 включают гомеостазис цинка (Zn), защиту от тяжелых металлов (особенно кадмия) и повреждения оксидантами и регулирование обмена веществ (метаболизма).
MT2 связывает семь двухвалентных переходных металлов с помощью двух металлсвязывающих кластеров на карбоксильном конце (α-домене) и аминоконце (β-домене). Двадцать остатков цистеина вовлечены в процесс связывания.
Chang et al. описывают способ замещения семи ионов цинка (Zn2+) ионами марганца (Mn2+) и кадмия (Cd2+). Было показано, что образующийся в результате белок проявлял магнитную петлю гистерезиса при комнатной температуре. Это могло бы потенциально означать, что белок является парамагнитным.
Toyama et al. сконструировали MT2 человека с введением дополнительного металлсвязывающего участка. Это потенциально могло бы усиливать парамагнитное функционирование MT2 и может быть использовано в настоящем изобретении.
Поскольку ферритин и MT2 потенциально могут быть намагничены, они предоставляют альтернативу доступным в настоящее время магнитным бусам. С использованием методик молекулярной биологии вариабельные области антител можно присоединить к генам, кодирующим ферритин или MT2, с получением магнитных антител наподобие белков (смотри Фиг. 5a и 5b). Это можно продемонстрировать с использованием доступных scFv, таких как гены scFv против фибронектина. Фибронектин обнаружен в соединительной ткани, на клеточных поверхностях и в плазме и других жидкостях организма. Сверхэкспрессия генов фибронектина была обнаружена в ряде карцином печени, и было показано, что этот белок вовлечен в заживление ран; поэтому диагностирование может иметь потенциальное «терапевтическо-диагностическое» значение. Таким образом, предпочтительный вариант осуществления настоящего изобретения заключается в использовании генов scFv против фибронектина и генов тяжелой и легкой цепи ферритина для образования большого, мультивалентного слитого белка. ScFv также может быть связан с геном MT2 человека с образованием меньшего слитого белка.
Применение генетически слитых распознающего и парамагнитного доменов на едином белке устраняет необходимость в химических конъюгациях и потенциальное нарушение функциональной активности белков, вызванное химическим манипулированием. ScFv или намагничиваемые домены могут быть при желании замещены с относительной легкостью.
ScFv может включать тяжелую и легкую цепи против фибронектина, соединенные короткой цепью остатков глицина и серина. Было обнаружено, что конструкции VH-линкер-VL устойчивы и поддерживают связывание, и вследствие этого они являются предпочтительными.
Lee et al. обнаружили, что генетическое слияние тяжелой цепи ферритина с аминоконцом легкой цепи значительно увеличивало цитоплазматическую растворимость рекомбинантного ферритина в E. coli. Этот подход можно также использовать в настоящем изобретении. Гены scFv и ферритина соединяют вместе при помощи короткой линкерной области, состоящей из остатка серина и четырех остатков глицина по тем же причинам, что отмечено выше для фрагментов scFv, т.е. поскольку эти остатки являются небольшими, гибкими и маловероятно мешающими другим существенным остаткам.
Ahn et al. обнаружили, что гены, слитые с C-концом тяжелых и легких цепей ферритина, вероятно, экспрессируются внутри молекулы ферритина, а не на поверхности. По этой причине, схема слитой конструкции scFv-ферритин предпочтительно содержит scFv на N-конце тяжелой цепи ферритина.
Антитела
При обсуждении антител, которые могут применяться в настоящем изобретении, будут использованы следующие сокращения.
CH - Константный домен тяжелой цепи антител
CL - Константный домен легкой цепи антител
CDR - Область, определяющая комплементарность (антител)
Fab - Одиночный распознающий фрагмент антител (после расщепления папаином), состоящий из вариабельных доменов и легкой константной цепи и CH1
F(ab)2 - Распознающий фрагмент антител (после расщепления папаином)
Fc - Кристаллизующийся фрагмент (после расщепления папаином) антител (обычно домены CH2 и CH3)
Fr - Каркасные области (вариабельной части антител)
Fv - Вариабельный фрагмент (антител)
Ig - Иммуноглобулин
MT - Металлотионеин
MT1 - Металлотионеин I
MT2 - Металлотионеин II
scFv - Одноцепочечный вариабельный фрагмент
VH - Вариабельный тяжелый домен антител
VL - Вариабельный легкий домен антител
Изобретение предусматривает магнитный антителоподобный химерный белок. Магнитный сегмент этого белка состоит из одной или более копий связывающих железо белков, как описано выше. Распознающее плечо белка состоит из фрагментов антитела или рецепторов, которые связывают представляющий интерес антиген, что будет более подробно обсуждаться ниже. Источник антител особо не ограничен, и антитела могут быть получены из любых видов, или из библиотек фагового дисплея, или из других рекомбинантных систем.
Типичная относящаяся к антителу часть белка по изобретению состоит из антигенсвязывающих участков моноклонального антитела IgG1 мыши, которое связывает фибронектин (упоминается далее как scFv-домен против фибронектина).
Антитела представляют собой иммуноглобулиновые белки, вовлеченные в специфический адаптивный иммунный ответ. Каждый иммуноглобулин имеет две различные роли. Одной ролью является связывание с антигеном, а другой - служить связующим звеном в иммунной (эффекторной) функции. Эти эффекторные функции включают связывание иммуноглобулина с тканью хозяина, иммунными клетками и другими иммунными белками. Антитела состоят из четырех полипептидных цепей (Фиг. 4). Две идентичные более длинные цепи (известные как тяжелые цепи) ковалентно соединены дисульфидными мостиками друг с другом в области, известной как шарнир. Каждая тяжелая цепь также ковалентно соединена при помощи дисульфидного мостика с идентичными более короткими цепями (известными как легкие цепи). Каждая полипептидная цепь содержит несколько доменов (обозначенных VL и CL для легкой цепи и VH, CH1, CH2 и CH3 на Фиг. 4), каждый из которых кодируется экзонами внутри гена. Каждый домен обладает молекулярной массой приблизительно 12,5 кДа. У людей существует пять основных классов антител, а именно IgG, IgA, IgM, IgD и IgE, и эти классы могут также иметь подклассы. Каждый класс антител обладает характерной эффекторной областью и, вследствие этого, различным образом модулирует иммунную систему. Антигенсвязывающий домен расположен на аминоконце иммуноглобулина в областях, известных как вариабельный тяжелый (VH) и вариабельный легкий (VL) домены. Эффекторные домены находятся в остальной части антитела (константных областях).
Иммунные системы позвоночных способны к распознаванию и связыванию миллионов антигенов. Это происходит отчасти благодаря замечательному антигенному разнообразию антител. Вариабельные домены антител кодируются наборами генов, которые могут перетасовываться для образования вариабельности. Кроме того, возникают дополнительные модификации генов, которые известны как соматические мутации. Районы антитела, которые находятся в непосредственном контакте с антигеном (распознающие последовательности), представляют собой наиболее вариабельные области. Эти области известны как области, определяющие комплементарность (CDRs). На каждой полипептидной цепи существует три таких области, и они представлены как более светлые линии на Фиг. 4b. Несмотря на то, что аминокислотные остатки между CDRs не контактируют непосредственно с антигеном, они являются наиважнейшими при образовании корректной структуры области связывания антигена. По этой причине они известны как каркасные области.
Антитела продуцируются в специальной клетке, известной как B-клетка. B-клетки на своей поверхности имеют антитело, которое обладает способностью связывать специфический антиген. Другими словами, одна B-клетка способна «узнавать» единственный антиген при помощи своих поверхностных антител. Когда это связанное с мембраной антитело встречает антиген, B-клетка претерпевает созревание, которое в конце концов приводит к делению и пролиферации клетки. Дочерние клетки исходной клетки (или клон, как известно) способны продуцировать растворимые (не связанные с мембраной) формы антитела той же специфичности, что и первоначальное, связанное с мембраной антитело. Все антитела, продуцированные этими дочерними клетками, известны как моноклональные антитела, поскольку эти клетки происходят от единственного клона.
Антитела для применения in vitro производят уже много лет. Первоначально поликлональная сыворотка из иммунизированных животных являлась простейшим способом получения антител. В 1975 пионерская работа Georges J.F. Köhler и Cesar Milstein из Кембриджского университета привела к разработке полученных в лаборатории моноклональных антител. Их работа включала слияние B-клетки из селезенки мыши с клеткой миеломы с образованием бессмертной линии B-клеток, известной как гибридома.
Антигенсвязывающие части антител можно использовать для выделения без константных областей. Это может найти некоторое применение, например, при конструировании антителоподобных молекул, лучше адаптированных для проникновения в твердые опухоли. Домены VH и VL можно экспрессировать в клетках как Fv-фрагмент. Альтернативно, эти два домена можно соединить при помощи короткой цепи из небольших аминокислот с образованием единого полипептида, известного как одноцепочечный Fv-фрагмент (scFv), который обладает молекулярной массой приблизительно 25 кДа (смотри Фиг. 7). Такой линкер состоит из ряда небольших аминокислот, таких как серин и глицин, которые не мешают связыванию и поддерживают области scFv.
Конструирование слитого белка
В настоящем изобретении слитые белки можно конструировать с использованием вариабельных областей из моноклонального IgG1-антитела мыши против фибронектина с образованием scFv-домена. Тяжелую и легкую цепи ферритина или ген MT2 можно использовать для образования магнитного домена антитела. Гены для вариабельных доменов антитела против фибронектина являются коммерчески доступными, и их, как правило, клонируют в плазмидный вектор для экспрессии в качестве scFv. ScFv можно транслировать в следующем порядке:
Инициирующий кодон ATG:лидерная последовательность (для экспрессии):тяжелая цепь:глицин-сериновый линкер:легкая цепь.
Конструирование плазмиды
Гены тяжелой и легкой цепей ферритина человека или MT2 человека можно получить из библиотеки человека, клонировать с использованием соответствующим образом спланированных праймеров и вставить в плазмидный вектор с scFv против фибронектина в 3'-конец легкой цепи антитела со стоп-кодоном на конце. Гены, слитые с 3'-концом тяжелой и легкой цепей ферритина, можно экспрессировать внутри молекулы ферритина, а не на поверхности. Соответственно, слитая конструкция scFv-ферритин содержит scFv на N-конце (соответствующем 5'-концу) тяжелой цепи ферритина. Слитые белки scFv с ферритином или MT2, как правило, содержат гистидиновый тэг (состоящий из шести остатков гистидина) на C-конце белка перед стоп-кодоном. Это позволяет детектировать белки в применениях, таких как Вестерн-блоттинг, и для потенциальной очистки с использованием металлоаффинных колонок (таких как никелевые колонки) или других тэгов (например, GST, β-галактозидаза, HA, GFP), если металлсвязывающие функции мешают. После получения плазмиды последовательности генов можно проверять для уверенности в том, что не было привнесено мутаций.
Фиг. 5b представляет собой схематическое изображение типичного слитого с ферритином белка. Тяжелая и легкая цепи scFv представлены первыми двумя стрелками соответственно.
Использованная последовательность SEQ ID 1 приведена ниже:
SEQ ID 1
LVQPGGSLRLSCAASGFTFSSFSMSWVRQAPGKGLEWVSSISGSSGTTYYADSVKGRFTI
SRDNSKNTLYLQMNSLRAEDTAVYYCAKPFPYFDYWGQGTLVTVSSGDgssggsggASTGEI
VLTQSPGTLSLSPGERATLSCRASQSYSSSFLAJVYQQKPGQAPRLLIYYASSRATGIPDRFS
GSGSGTDFTLTISRLEPEDFAVYYCQQTGRIPPTFGQGTKVEIKsgggMTTASTSQVRQN
YHQDSEAAINROINLELYASYVYLSMSYYFDRDDVALKNFAKYFLHOSHEEREHAE KLMKLONORGGRIFLODIKKPDCDDWESGLNAMECALHLEKNVNOSLLELHKLAT
DKNDPHLCDFIЭTИЛNEOVKAIKELGDHVTNLRKMGAPESGLAEYLFDKHTLGDS
DNESMSSQIRQNYSTDVEAAVNSLVNLYLQASYTYLSLGFYFDRDDVALEGVSHFFR
ELAEEKREGYERLLKMQNQRGGRALFQDIKKPAEDEWGKTPDAMKAAMALEKKL
NQALLDLHALGSARTDPHLCDFLETHFLDEEVKLIKKMGDHLTNLHRLGGPEAGLG
EYLFERLTLKHD
Тяжелая и легкая цепи scFv представлены курсивом в аминокислотной последовательности, тяжелая цепь подчеркнута. Выделенный жирным шрифтом текст в аминокислотной последовательности представляет CDR-области вариабельных доменов. Два глицин/сериновых линкера показаны строчными буквами, второй из которых примыкает к последовательностям тяжелой и легкой цепей ферритина в невыделенном тексте, последовательность тяжелой цепи опять же подчеркнута.
Фиг. 6b представляет собой схематическое изображение типичного слитого белка MT2. Последовательность представлена ниже с помощью SEQ ID 2:
SEQ ID 2
LVOPGGSLRLSCAASGFTFSSFSMSWVROAPGKGLEWVSSISGSSGTTYYADSVKGRFTI
SRDNSKNTLYLQMNSLRAEDTAVYYCAKPFPYFDYWGQGTLVTVSSGDgssggsggASTGEI
VLTQSPGTLSLSPGERATLSCRASQSVSSSFLAWYQQKPGQAPRLLIYYASSRATGIPDRFS
GSGSGTDFTLTISRLEPEDFAVYYCQQTGRIPPTFGQGTKVEIKsgggMDPNCSCAAGDS
CTCAGSCKCKECKCTSCKKSCCSCCPVGCAKCAQGCICKGASDKCSCCAPGSAGGS GGDSMAEVQLLE.
Последовательность scFv приведена курсивом, с подчеркнутой тяжелой цепью, выделенный жирным шрифтом текст высвечивает CDRs. Две линкерные последовательности приведены строчными буквами, со второй, примыкающей к последовательности металлотионеина, приведенной обычным текстом.
Слитые белки scFv-ферритин и scFv-MT2 можно экспрессировать в штаммах E. coli. Этого обычно добиваются путем трансформации компетентных клеток E. coli плазмидой, кодирующей один или другой из слитых белков. Экспрессирующие плазмиды, как правило, содержат элементы для бактериальной трансляции и экспрессии, а также энхансерные последовательности для усиления экспрессии.
Плазмида также предпочтительно содержит последовательность для устойчивости к антибиотику. Когда бактериальные клетки высевают на чашку Петри с агаризованной питательной средой, содержащей антибиотик, клетки, которые не содержат плазмиду, не будут делиться. Те клетки, которые содержат плазмиду, способны вырастать до отдельных колоний. Каждая клетка в такой колонии происходит из одной клетки или «клона» (поэтому такой процесс известен как клонирование).
Клоны можно отобрать с чашки Петри и выращивать в жидкой среде, содержащей антибиотик. Экспрессию слитого белка обычно инициируют путем добавления индуктора (такого как изопропил β-D-1-тиогалактопиранозид, или IPTG). Клетки можно инкубировать в течение ограниченного количества времени до сбора. Клетки можно лизировать с использованием мочевины и лизаты анализировать, например, при помощи SDS-PAGE и Вестерн-блоттинга.
Детекция белка и очистка
Профиль экспрессии белка в клонах можно проанализировать с использованием SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и Вестерн-блоттинга. В этих анализах белки химически денатурируют (путем разрушения S-S связей с использованием химических реактивов, таких как β-меркаптоэтанол, и/или путем добавления SDS, который устраняет внутримолекулярные электростатические заряды). Клеточные лизаты добавляют в карман до верха геля. Затем на гель подают электрический ток (постоянный ток, DC), и белки мигрируют через гель в соответствии со своими размерами. Затем белки визуализируют путем окрашивания геля красителем. Конкретные белки исследуют при помощи переноса разделенных белков на нитроцеллюлозную мембрану (опять же с использованием электрического тока). Специфические фермент-связанные антитела инкубируют на мембране, и для визуализации белков добавляют субстрат (колориметрический, люминесцентный или флуоресцентный реактив).
Как правило, размножают клон с наибольшим уровнем экспрессии и наращивают в большом объеме (1). Клетки индуцируют, как описано выше, и собирают.
Собранные клетки лизируют и белки очищают с использованием, например, металлоаффинной хроматографии. При необходимости можно использовать другие способы очистки, включая аффинные колонки с фибронектином.
Анализы характеристик белка
Анализ размера
Белки можно проанализировать по размеру с использованием методик анализа SDS-PAGE и Вестерн-блоттинга и хроматографии.
Поверхностный плазмонный резонанс
Связывание слитых белков с фибронектином можно проанализировать с использованием поверхностного плазмонного резонанса (SPR). SPR представляет собой методику, по которой можно измерять изменения показателя преломления света, когда молекула связывается с тонкой металлической пленкой. Фибронектин фиксируют на металлической поверхности SPR-чипа и слитым белком омывают поверхность чипа. Когда слитый белок связывается, кинетику связывания (ассоциацию, диссоциацию и аффинность) можно проанализировать с использованием SPR. Результаты, полученные с использованием SPR, обычно представляют в виде сенсограммы.
Связывание слитых белков можно также проанализировать при помощи ELISA. Анализы по определению связывания включают покрытие планшетов микротитрования фибронектином или антителами против ферритина. Несвязанные участки планшетов забивают с использованием бычьего сывороточного альбумина (BSA). Слитый белок затем инкубируют в планшетах. Планшеты затем промывают и инкубируют с антителами против ферритина и снова промывают. После этого в планшетах инкубируют связанные с ферментом антитела до того, как планшеты промывают перед добавлением субстрата.
Намагничивание ферритина и scFv-ферритина
Железо внутри ферритина не является парамагнитным. Как правило, железо существует в виде Fe (III). Для того чтобы получить парамагнитный ферритин, железо из ферритина (и, в конечном счете, из слитого белка) удаляют без повреждения белка; железо затем заменили парамагнитной формой (Fe (II)).
Существует несколько форм оксида железа, и не все эти формы в равной степени магнитны. Например, FeO, Fe2O3 и Fe3O4. Оксид железа (Fe3O4) или оксид железа (II,III), также известный как магнетит или магнитный железняк, представляет собой наиболее магнитную форму.
Характеризация слитых белков scFv-ферритина и scFv-MT2
Физическую характеризацию обработанных белков можно предпринять путем ряда методик, которые, как правило, включают сочетание электронной микроскопии, дифракции (рентгеновской и/или электронной) и мессбауэровской спектроскопии.
Далее изобретение будет описано более подробно, только в качестве примера, со ссылкой на следующие конкретные варианты осуществления.
ПРИМЕРЫ
ПРИМЕР 1 - Конструирование и изготовление слитых белков
Для того чтобы пояснить изобретение примерами, сконструировали слитые белки, используя коммерчески доступные антитела мыши против фибронектина. Были получены слитые белки, состоящие из scFv против фибронектина, генетически связанного короткими гибкими линкерами либо с MT2, либо с ферритином. Этот пример подробно описывает конструирование слитых белков, их характеризацию и выделение.
Конструирование слитых белков с ферритином или MT2 против фибронектина было основано на клонировании генов VH и VL антитела мыши против фибронектина в вектор. Оба гена были связаны короткими, гибкими линкерами, состоящими из небольших незаряженных аминокислот. Непосредственно на 3'-конце VL-гена другой короткий гибкий линкер обеспечивал присоединение либо генов ферритина, либо гена MT2. Оба слитых белка имели область с шестью гистидинами для очистки на колонках с никелем. Трансляция слитого белка прекращалась на стоп-кодоне, вставленном в 3'-конец гена легкой цепи ферритина или гена MT2. Плазмидный вектор, содержащий все эти элементы, использовали для трансформации бактерий для экспрессии.
Гены для ферритина и MT2 были получены из библиотек кДНК. Библиотеку кДНК создают путем получения мРНК из клеток или тканей, обратного транскрибирования РНК в кДНК с использованием фермента, известного как обратная транскриптаза, и клонирования каждой индивидуальной кДНК в плазмидный вектор (смотри Фиг. 8).
Создание слитого белка анти-фибронектин:ферритин
Предпосылки
Ферритин представляет собой белок диаметром 12 нм с молекулярной массой 480 кДа. Белок содержит большую полость (диаметром 8 нм), которая заключает внутри себя железо. Полость образуется при самопроизвольной сборке 24 полипептидов ферритина, свернутых в четырехспиральные пучки, удерживаемые нековалентными связями. Аминокислотная последовательность и, следовательно, вторичная и третичная структуры ферритина консервативны у животных и растений. Структура белка у бактерий та же, что и у эукариотов, хотя последовательность другая. У позвоночных ферритин образуют два типа субъединиц (тяжелая цепь (H) и легкая цепь (L)), каждая с каталитически активным (H) или неактивным (L) оксидазными участками. Соотношение тяжелой и легкой цепей меняется в зависимости от потребности. Аминокислотные последовательности тяжелой и легкой цепей ферритина, используемых при конструировании слитых белков, представляют собой следующие:
Тяжелая цепь ферритина (молекулярная масса 21096,5 Да):
MTTASTSQVRQNYHQDSEAAINRQINLELYASYVYLSMSYYFDRDDVALKNFAKYF
LHQSHEEREHAKIMKLQNQRGGMFLQDIKKPDCDDWESGLNAMECALHLEKNVN
QSLLELHKLATDKNDPHLCDFIЭTИЛNEQVKAIKELGDHVTNLRKMGAPESGLAEY
LFDKHTLGDSDNES
Легкая цепь ферритина (молекулярная масса 20019,6 Да):
MSSQIRQNYSTDVEAAVNSLVNLYLQASYTYLSLGFYFDRDDVALEGVSHFFRELAE
EKKEGYERLLKMQNQRGGRALFQDIKKPAEDEWGKTPDAMKAAMALEKKLNQAL
LDLHALGSARTDPHLCDFLETHFLDEEVKLIKKMGDHLTNLHRLGGPEAGLGEYLFE
RLTLKHD
Вместе с аминокислотными последовательностями scFv против фибронектина предсказанная последовательность единого полипептида слитого белка представляет собой (с линкерными последовательностями между генами тяжелой и легкой цепи антитела и между легкой цепью антитела и тяжелой цепью ферритина, выделенными строчными буквами):
LVQPGGSLRLSCAASGFTFSSFSMSWVRQAPGKGLEWVSSISGSSGTTYYADSVKGR FTSRDNSKNTLYLQMNSLRAEDTAVYYCAKPFPYFDYWGQGTLVTVSSGDgssggsgg ASTGEIVLTQSPGTLSLSPGERATLSCRASQSVSSSFLAWYQQKPGQAPRLLIYYASSR
ATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQTGRIPPTFGQGTKVEIKsgggMTT
ASTSQVRQNYHQDSEAAINRQINLELYASYVYLSMSYYFDRDDVALKNFAKYFLHQ
SHEEREHAKLMKLQNQRGGRIFLQDIKKPDCDDWESGLNAMECALHLEKNVNQSLL
ELHKLATDKNDPHLCDFIЭTИЛNEQVKAIKELGDHVTNLRKMGAPESGLAEYLFD
KHTLGDSDNESMSSQIRQNYSTDVEAAVNSLVNLYLQASYTYLSLGFYFDRDDVAL
EGVSHFFRELAEEKREGYERLLKMQNQRGGRALFQDIKKPAEDEWGKTPDAMKAA
MALEKKLNQALLDLHALGSARTDPHLCDFLETHFLDEEVKLIKKMGDHLTNLHRLG
GPEAGLGEYLFERLTLKHD
Молекулярная масса полипептидной компоненты составляла 65,550 кДа.
Совокупность генов слитых белков анти-фибронектин:ферритин
Гены тяжелой и легкой цепей ферритина были амплифицированы из библиотеки кДНК печени человека с использованием ПЦР (смотри Фиг. 9a). Продукты ПЦР были ожидаемого размера (~540 п.н.). Эти ПЦР-продукты лигировали с использованием ПЦР с перекрыванием (Фиг. 9b - продукт представляет собой продукт ожидаемого размера).
Перекрывающийся ПЦР-продукт был выделен из геля и лигирован в вектор секвенирования для анализа нуклеотидной последовательности. Это включало трансформацию бактерий вектором секвенирования, содержащим перекрывающиеся гены тяжелой и легкой цепи ферритина. Трансформированные бактерии затем высевали на содержащую антибиотик чашку Петри для отбора клонов. Клетки инкубировали в течение ночи до появления колоний. Индивидуальные колонии затем отбирали с чашки и выращивали в жидкой среде. Плазмиды из каждого клона выделяли и анализировали с использованием ПЦР (Фиг. 9c). Было обнаружено, что Клон 4 содержал ожидаемую последовательность. Поэтому ДНК из этого Клона была в дальнейшем использована во всей последующей работе.
Вариабельные гены тяжелых и легких цепей антитела мыши и человека против фибронектина были ПЦР-амплифицированы из моноклональной гибридомы. Эти гены были предварительно соединены гибкой линкерной областью с образованием scFv. Этот слитый ген scFv амплифицировали с использованием ПЦР. ДНК-гель этой амплификации можно видеть на Фиг. 10a рядом с перекрывающимся продуктом полигена ферритина. Соответствующие полосы вырезали из геля и очищали ДНК. Ее затем использовали в дальнейшей ПЦР с перекрыванием для соединения scFv и полигена ферритина (Фиг. 10b). Указанная стрелкой полоса соответствуют ожидаемому размеру для слитого scFv:ферритина. ЕЕ вырезали и очищали ДНК для дальнейшего использования.
Использованные для этого праймеры содержали последовательности, позволяющие эндонуклеазе (ферменты, обладающие способностью разрезать специфические последовательности двухцепочечной ДНК) рестрицировать ДНК для лигирования в плазмиду.
После очистки из геля ПЦР-продукт scFv:ферритин рестрицировали с использованием ферментов рестрикции (эндонуклеаз) BamH1 и EcoR1. Очищенные рестриктные продукты в дальнейшем клонировали в два экспрессирующих вектора: pRSET и pET26b. Клоны выделяли, как и ранее, и результаты ПЦР по идентификации положительных клонов можно видеть на Фиг. 11.
Колонии 3-5 и 7 из набора, содержащего плазмиду pRSET, и колонию 6 из набора, содержащего плазмиду pET26b, отобрали для анализа последовательности.
Полученные данные демонстрируют, что клоны pRSET 4 и 5 и клон pET26b 6 содержали конструкцию scFv:ферритин. Клон pRSET 4 использовали для экспрессии белка.
Экспрессия слитого белка scFv анти-фибронектина:ферритин
Для подтверждения экспрессии слитого белка нарастили три культуры по 5 мл в среде LB (среда Luria-Bertani: 10г триптона, 5г дрожжевого экстракта, 10г NaCl на литр). Клетки индуцировали для экспрессии белка при помощи IPTG (изопропил β-D-1-тиогалактопиранозид) при различных временах. Культуры затем лизировали в 8M мочевине и анализировали с использованием SDS-PAGE. Гели окрашивали с использованием Кумасси синего для определения содержания белка (результаты на Фиг. 12). Были проведены Вестерн-блоты с использованием антитела против полигистидина для специфической идентифицикации слитого белка (Фиг. 12).
Временные точки для индукции составляли 2, 3 и 4 часа после инокуляции.
Полосы, наблюдаемые на блоте, показали, что слитый белок экспрессировался и мог быть детектирован с использованием антитела против гистидинов. Этот полипептид составлял приблизительно 75-85 кДа в размере. Выход экспрессированного продукта был относительно высок, а сверхэкспрессия - очевидной, поскольку полосы слитого белка соответствуют очень темным полосам, наблюдаемым в окрашенном Кумасси синим геле. Индуцирование 3 часа после инокуляции давало относительно высокие уровни экспрессии и было использовано для последующей экспрессии.
Создание слитого белка анти-фибронектин:MT2
Предпосылки
Металлотионеины представляют собой внутриклеточные, низкомолекулярные, богатые цистеином белки. Эти белки обнаруживаются во всех эукариотах и обладают сильными металлсвязывающими и окислительно-восстановительными способностями. MT-1 и MT-2 быстро индуцируются в печени при помощи множества металлов, лекарственных средств и медиаторов воспаления. MT2 связывает семь двухвалентных переходных металлов с помощью двух металлсвязывающих кластеров на карбоксильном конце (α-домене) и аминоконце (β-домене). Двадцать остатков цистеина вовлечены в процесс связывания.
Последовательность MT2 представляет собой:
MDPNCSCAAGDSCTCAGSCKCKECKCTSCKKSCCSCCPVGCAKCAQGCICKGASDK CSCCAPGSAGGSGGDSMAEVQLLE
Вместе с аминокислотными последовательностями scFv против фибронектина предсказанная последовательность единого полипептида слитого белка представляет собой (с линкерными последовательностями между тяжелыми и легкими генами антитела и между легкой цепью антитела и тяжелой цепью MT2, выделенными строчными буквами):
LVQPGGSLRLSCAASGFTFSSFSMSWVRQAPGKGLEWVSSISGSSGTTYYADSVKGR
FTISRDNSKNTLYLQMNSLRAEDTAVYYCAKPFPYFD YWGQGTLVTVSSGDgssggsgg
ASTGEIVLTQSPGTLSLSPGERATLSCRASQSVSSSFLAWYQQKPGQAPRLLIYYASSR
ATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQTGRIPPTFGQGTKVEIKsgggMDP
NCSCAAGDSCTCAGSCKCKECKCTSCKKSCCSCCPVGCAKCAQGCICKGASDKCSC
CAPGSAGGSGGDSMAEVQLLE
Совокупность генов слитого белка анти-фибронектин:MT2
Гены металлотионеина II амплифицировали из библиотеки кДНК печени человека с использованием ПЦР (Фиг. 13). ПЦР-продукты были ожидаемого размера (~200 п.н.).
ПЦР-продукт рестрицировали с использованием фермента рестрикции Bgl II и лигировали в предварительно разрезанную плазмиду (вектор с фактором Xa).
ПЦР колоний выбранных клонов выявила полосы для всех выбранных клонов (Фиг. 14). Клоны 2, 4 и 9 были выбраны для анализа последовательности. Клон 9 использовали в дальнейшей работе.
Экспрессия слитого белка scFv анти-фибронектина:MT2
Для подтверждения экспрессии слитого белка scFv:MT2 три культуры по 5 мл наращивали в среде LB, индуцируя (IPTG) при различных временных точках, как и в случае со слитым с ферритином белком. Культуры лизировали в 8M мочевине и анализировали с использованием гелей SDS-PAGE, окрашенных Кумасси синим, и блотов с использованием антитела против гистидинов (Фиг. 15). Клетки, индуцированные 4 часа после инокуляции, продуцировали немного больше белка (дорожка 3 на обоих гелях). Эти условия роста использовали для последующей экспрессии белка.
Очистка слитых белков
Выделение растворимого белка проводили путем выделения, промывания и повторного растворения телец включения.
Протокол занимает приблизительно одну неделю до завершения. Фотографии окрашенного Кумасси синим геля и Вестерн-блот повторно растворенных слитых белков scFv:ферритин и scFv:MT2 можно видеть на Фиг. 16. Слитые белки обведены кружком - ферритин представлен в дорожке 2 на обоих гелях и MT2 представлен в дорожке 3 в обоих гелях. Белковый маркер молекулярных масс представлен в дорожке 1.
Из этого можно видеть, что слитые белки были успешно экспрессированы и сконцентрированы. Эти белки использовали в протоколах намагничивания и дальнейших экспериментах.
ПРИМЕР 2 - SPR-анализ
Препараты телец включения слитых белков анти-фибронектин с ферритином и MT2 использовали в тестах поверхностного плазмонного резонанса (SPR) с использованием прибора SensiQ (ICX Nomadics).
Для этих экспериментов пептид фибронектина присоединили к поверхности карбоксильного чипа. Препараты слитого белка затем смывали с чипа и определяли кинетику ассоциации (Ka) и диссоциации (Kd).
Образцы слитого белка для анализа
Шесть образцов каждого слитого белка (FP от Fusion Protein) с переменной концентрацией от 0,0013 до 0,133 мкМ получали в проточном буфере, как изложено ниже в Таблице 2 и Таблице 3.
Таблица 2 - Слитый с металлотионеином белок 75кДа:
40 мкл 100 мкг/мл 75кДа/360 мкл проточного буфера с образованием 400 мкл 10 мкг/мл (0,133 мкМ), затем:
Таблица 3 - Слитый с ферритином белок ED-B 270кДа:
144 мкл 100 мкг/мл 270 кДа/256 мкл проточного буфера с образованием 400 мкл 36 мкг/мл (0,133мкМ), затем:
Металлотионеин
Образец (Циклы 1-6) = 20 мкл 0,0013 - 0,133 мкМ слитого с металлотионеином белка
Прогон теста = MAb & Gly цикл теста (как описано выше)
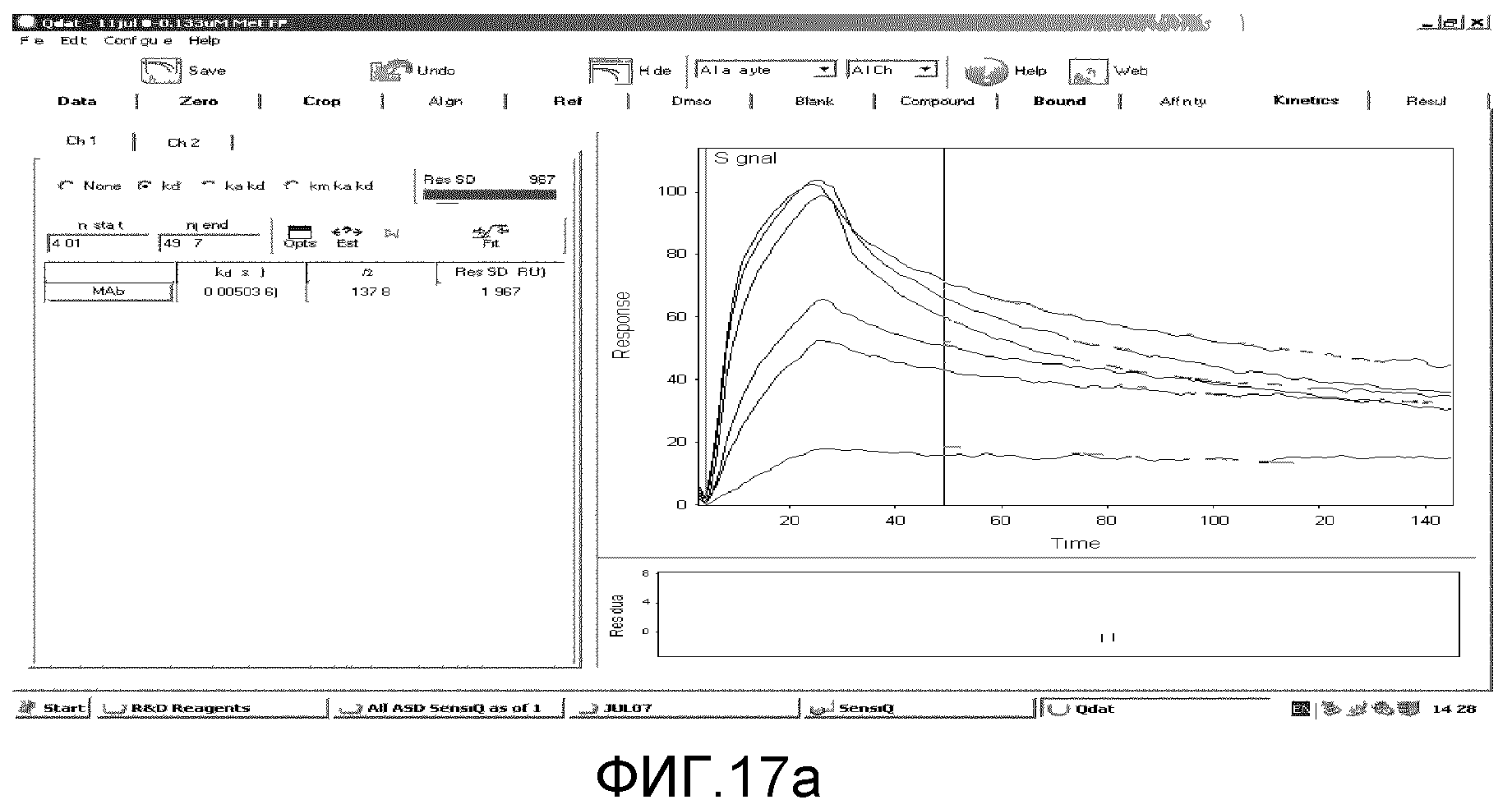
Сенсограммы вышеприведенных циклов накладывали с использованием программного обеспечения для анализа SensiQ Qdat и к полученным данным подгоняли модель для расчета кинетических параметров (Ka, Kd). Наилучшая оценка Kd была достигнута путем подгонки модели лишь к части данных по диссоциации. Результаты представлены на Фиг. 17a. Это относится к Kd 0,00503 с-1, дававшей Kd 2,289×10-9 M (Ka 2,197×106 M-1с-1).
Ферритин
Образец (Циклы 1-6)=20 мкл 0,0013-0,133 мкМ слитого с ферритином белка
Прогон теста=MAb & Gly цикл теста (как описано выше)
Сенсограммы вышеприведенных циклов накладывали с использованием программного обеспечения для анализа SensiQ Qdat и к полученным данным подгоняли модель для расчета кинетических параметров (Ka, Kd). Наилучшая оценка Kd была достигнута путем подгонки модели лишь к части данных по диссоциации. Результаты представлены на Фиг. 17b. Это относится к Kd 0,00535 с-1, дававшей Kd 6,538×10-10 M (Ka 8,183×106 M-1с-1).
Результаты
Из вышеприведенных экспериментальных данных было определено, что антиген дополнительного домена B фибронектина (aa 16-42) успешно покрывал чип SensiQ. Как ожидалось, и слитый с металлотионеином белок 75 кДа, и слитый с ферритином белок 270 кДа распознавали и связывались с антигеном специфическим образом. Оценили кинетические данные по взаимодействиям слитых белков с антигеном и обнаружили, что они похожи и находятся в ожидаемом диапазоне для обоих слитых белков, т.е. Kds в районе 10-9 M по сравнению с от 10-8 M до 10-10 M для большинства взаимодействий антитело / антиген.
Таким образом, значения, полученные с использованием этого прибора, предполагают аффинности связывания, хорошо сопоставимые с аффинностями связывания антител с относительно высокой аффинностью. Кроме того, полученные данные предполагают, что слитые белки обладают множественными участками связывания антигена. Это ожидалось для слитого с ферритином белка. Однако это было неожиданно для белка, слитого с MT2, и позволяет предположить, что слитый белок образует димеры или мультимерные белки более высокого порядка, которые могут увеличивать авидность связывания.
ПРИМЕР 3 - Намагничивание ферритина
Как правило, ферритин содержит гидратированный оксид железа (III). Для того чтобы получить парамагнитный ферритин, эти ионы заменяли магнетитом (Fe3O4), который обладает более сильными магнитными свойствами. Использованный для этого эксперимента способ включал добавление к апоферритину ионов железа и окисление этих ионов при контролируемых условиях.
Материалы
- Вода, очищенная обратным осмосом (RO-вода)
- Буфер с 50 мМ N-(1,1-диметил-2-гидроксиэтил)-3-амино-2-гидроксипропансульфоновой кислоты (AMPSO), pH 8,6 (Sigma A6659)
- Буфер с 0,1M ацетатом натрия, pH 4,5
- Забуференный фосфатом солевой раствор (PBS) 10 мМ фосфат, 140 мМ NaCl, pH 7,4
- Триметиламин-N-оксид (TMA) (Sigma 317594)
- 0,1M сульфат аммония-железа (II)
- Апоферритин селезенки лошади (Sigma A3641)
Способ
Триметиламин-N-оксид (TMA) нагревали в сушильном шкафу до 80°C в течение 30 минут для удаления Me3N перед охлаждением до комнатной температуры. 114 мг TMA добавляли к 15 мл RO-воды для получения 0,07M раствора. Растворы железа и TMA продували азотом (N2) в течение 15 минут перед использованием.
AMPSO-буфер (1 литр) деаэрировали при помощи N2 в течение часа. 3,0 мл апоферритина (66 мг/мл) добавляли к AMPSO-буферу и раствор деаэрировали в течение еще 30 минут. Раствор AMPSO/апоферритина в 1-литровом сосуде помещали в предварительно нагретую до 65°C водяную баню. Подающий N2 трубопровод удаляли из раствора и подвешивали над поверхностью раствора для поддержания раствора при анаэробных условиях. Первоначальное добавление сульфата аммония-железа удаляло любые оставшиеся ионы кислорода, которые могли быть в растворе.
Аликвоты буферов 0,1M сульфата аммония-железа и TMA добавляли каждые 15 минут следующим образом:
1ое добавление 600 мкл 0,1M сульфата аммония-железа
2ое добавление 600 мкл 0,1M сульфата аммония-железа и 400 мкл TMA
3е добавление 600 мкл 0,1M сульфата аммония-железа и 400 мкл TMA
4ое добавление 600 мкл 0,1M сульфата аммония-железа и 400 мкл TMA
5ое добавление 900 мкл 0,1M сульфата аммония-железа и 600 мкл TMA
6ое добавление 900 мкл 0,1M сульфата аммония-железа и 600 мкл TMA
7ое добавление 900 мкл 0,1M сульфата аммония-железа и 600 мкл TMA
8ое добавление 900 мкл 0,1M сульфата аммония-железа и 600 мкл TMA.
После последних добавлений Fe и TMA цвет раствора изменился с желтоватого до темно-коричневого с темными дисперсными частицами, распределенными повсюду. Здесь и далее этот раствор называют «магнетоферритиновым».
Магнетоферритиновый раствор инкубировали при комнатной температуре в течение ночи с сильным неодимовым кольцевым магнитом, удерживаемым напротив флакона. На следующий день к магниту притянулся темный твердый материал, как можно видеть на фотографиях Фиг. 18.
Концентрация магнетоферритина
Пять сотен миллилитров магнетоферритинового раствора пропускали через 5 колонок Macs® LS на магнитах (с приблизительно 100 мл магнетоферритина, пропускаемого через каждую колонку). Раствор, который протек через колонки (названный «фильтратом»), собирали в бутыли Duran. Собранный материал из каждой колонки элюировали при помощи 3 мл PBS, перемещая колонки от магнитов, добавляя 3 мл PBS и используя подающий плунжер, в результате чего было получено приблизительно 4,5 мл из каждой колонки. Приблизительно 1 мл хранили при 2-8°C для последующего анализа (обозначен «концентрированный магнетоферритин перед диализом»). Остаток элюированного раствора (~20 мл) диализовали (обозначен «концентрированный магнетоферритин после диализа») против 5 литров PBS при 4°C в течение ночи для удаления избытка Fe и TMA. Были отмечены изменения в цвете раствора. Первоначальный магнетоферритин был темно-коричневым, фильтрат - желтовато окрашенным, а материал, сконцентрированный на колонке Macs®, - от темно-коричневого до черного.
Диализные трубки (Medicell International Ltd. Молекулярная масса отсекания 12-14000 Дальтон ~15 см) инкубировали в RO-воде в течение десяти минут для размягчения трубки. Выделенный магнитом концентрированный магнетоферритин переносили в диализную трубку и инкубировали в 5 литрах PBS при 2-8°C с перемешиванием в течение ночи. Раствор PBS на следующий день меняли три раза с двухчасовыми интервалами с непрерывным диализом при 2-8°C.
Анализ магнетоферритина
Для того чтобы сравнить количество магнитного белка, выделенного с использованием магнита, был проведен твердофазный иммуноферментный анализ (ELISA).
Материалы
- Карбонатный буфер (0,159 г карбоната натрия и 0,3 г бикарбонат натрия в 100 мл RO-воды).
- Забуференный фосфатом солевой раствор (PBS) 10 мМ фосфат, 140 мМ NaCl, pH 7,4
- 1% бычий сывороточный альбумин (BSA (Celliance 82-045-2)) в PBS
- Апоферритин селезенки лошади (Sigma Aldrich A3641)
- Антитела кролика против ферритина лошади (Sigma Aldrich F6136)
- Антитела козла против кролика (Sigma A3687)
- Субстрат - жидкий стабильный фенолфталеинфосфат
- Стоп-раствор (212 г карбоната натрия, 110,5 г 3-(циклогексиламино)-1-пропансульфоновой кислоты (CAPS), 217 г этилендиаминтетрауксусной кислоты (EDTA), 80 г гидроксида натрия, вода до 5 литров)
- Планшет микротитрования Maxisorb (NUNC Cat: 468667)
Способ
Были сделаны разведения апоферритина (50 мкг/мл, 25 мкг/мл, 12,5 мкг/мл, 6,25 мкг/мл, 3,125 мкг/мл и 1,5625 мкг/мл) для количественного анализа магнетоферритина.
Магнетоферритин (неочищенный), концентрированный перед диализом, после диализа и фильтрат разводили в карбонатном буфере при следующих разведениях:
Разведения магнетоферритина, перед диализом и после диализа:
100, 200, 400, 800, 1600, 3200, 6400 и 12800-кратное разведение.
Фильтрат:
10, 20, 40, 80, 160, 320, 640 и 1280-кратное разведение.
100 мкл каждого раствора вводили в лунки планшета микротитрования в повторности. Карбонатный буфер (100 мкл) добавляли в две лунки в качестве отрицательного контроля. Планшет инкубировали в течение ночи при 4°C. На следующий день раствор стряхивали и лунки забивали с использованием 200 мкл 1% BSA при комнатной температуре в течение часа. После трехкратного промывания 300 мкл PBS на лунку лунки подсушивали шлепаньем перед добавлением 100 мкл 10 мкг/мл антител против ферритина лошади. Инкубировали в течение часа при комнатной температуре перед удалением и лунки промывали, как перед этим. AP-конъюгированные антитела против антител кролика разводили 1 к 3500 в PBS для получения концентрации 7,43 мкг/мл и инкубировали при комнатной температуре в течение часа. Конъюгат антител удаляли и лунки промывали, как перед этим. AP-субстрат (100 мкл) добавляли в каждую лунку и оставляли для развития в течение 15 минут перед добавлением стоп-раствора. Оптические плотности регистрировали с использованием прибора Varioskan Flash (Thermo Fisher).
Колонки Macs® фиксировали более чем 35-кратное количество магнетоферритина по сравнению с обнаруженным в фильтрате, что свидетельствует об успешном намагничивании белка.
Продуцирование апоферритина/деминерализация ферритина селезенки лошади
Материалы
- Буфер с 0,1M ацетатом натрия, pH 4,5
- Тиогликолевая кислота (Sigma T6750)
- Ферритин селезенки лошади (Sigma 96701)
- Забуференный фосфатом солевой раствор (PBS) 10 мМ фосфат, 140 мМ NaCl, pH 7,4
Способ
Диализные трубки смягчали в RO-воде в течение 10 минут. 10 мл буфера с 0,1M ацетатом натрия добавляли к 1 мл ферритина селезенки лошади (125 мг/мл) в диализной трубке, которую защелкивали с обоих концов. Диализный мешок переносили в буфер с 0,1M ацетатом натрия (~800 мл), через который в течение одного часа продували N2. К буферу добавляли тиогликолевую кислоту (2 мл) и продолжали продувать N2в течение двух часов. Добавляли снова 1 мл тиогликолевой кислоты к буферу с ацетатом натрия, после чего продували N2еще в течение тридцати минут. Буфер с ацетатом натрия (800 мл) сменили и продолжали продувание. Процедуру деминерализации повторяли до тех пор, пока раствор ферритина не обесцветился. Продувание N2 прекратили и раствор апоферритина диализовали против PBS (2 л) в течение 1 ч с перемешиванием. PBS сменили (3 литра) и раствор апоферритина диализовали в PBS при 2-8°C в течение ночи.
Результаты
Раствор ферритина во время процедуры изменил цвет со светло-коричневого до бесцветного, что свидетельствовало об удалении железа.
Анализ воздействия термической обработки на слитый белок анти-фибронектин:ферритин
Материалы
- Карбонатный буфер (0,159 г карбоната натрия, 0,3 г бикарбоната натрия в 100 мл воды)
- Забуференный фосфатом солевой раствор (PBS)
- 1% бычий сывороточный альбумин (BSA (Celliance 82-045-2)) в PBS
- Пептид фибронектина
- Слитый белок анти-фибронектин:ферритин (scFv:ферритин)
- Моноклональные антитела мыши против ферритина человека (Santa Cruz SC51887)
- Антитело против мыши со щелочной фосфатазой (Sigma A3562)
- Субстрат - жидкий стабильный фенолфталеинфосфат
- Стоп-раствор (212 г карбоната натрия, 110,5 г 3-(циклогексиламино)-1-пропансульфоновой кислоты (CAPS), 217 г этилендиаминтетрауксусной кислоты (EDTA), 80 г гидроксида натрия, вода до 5 литров)
- Планшет микротитрования Maxisorb (NUNC Cat: 468667)
Способ
100 мкл scFv:ферритин (из 100 мкг/мл) перенесли в тонкостенную ПЦР-пробирку и нагревали в амплификаторе при 60°C в течение 30 минут.
Лунки планшета микротитрования покрывали пептидом фибронектина (поставляемого в концентрации 1,5 мг/мл), разведенного в карбонатном буфере до 15 мкг/мл, и инкубировали в течение ночи при 4°C. Избыток раствора стряхивали и планшет забивали с использованием 1% BSA в PBS в течение 1 часа при комнатной температуре. Жидкость стряхивали и планшет промывали три раза с использованием PBS. Слитый белок scFv:ферритин и термически обработанный слитый белок scFv:ферритин добавляли в лунки в концентрации 33 мкг/мл (100 мкл каждого). Слитые с ферритином белки инкубировали в течение 2 часов при комнатной температуре перед удалением и лунки промывали, как перед этим. Антитела мыши против ферритина добавляли в концентрации 20 мкг/мл и добавляли в объеме 100 мкл в каждую лунку и инкубировали при комнатной температуре в течение часа. Жидкость удаляли и лунки промывали, как перед этим. Антитела козла против мыши, конъюгированные с AP, разводили (50 мкл + 950 мкл PBS) и добавляли в объеме 100 мкл во все лунки. Инкубировали при комнатной температуре в течение часа и удалили, как перед этим. Субстрат добавляли во все лунки и инкубировали при комнатной температуре в течение 45 минут и останавливали реакцию с использованием стоп-буфера. Оптические плотности регистрировали с использованием прибора Varioskan Flash (Thermo Fisher Electron).
Белок scFv:ферритин сохраняет способность связывания с фибронектином и остается детектируемым при помощи моноклональных антител против ферритина человека после нагревания до 60°C в течение 30 минут (Фиг. 20).
Деминерализация слитого белка анти-фибронектин:ферритин
Материалы
- Слитый белок анти-фибронектин:ферритин (scFv:ферритин).
- Буфер с 0,1M ацетатом натрия
- Тиогликолевая кислота (70% мас./мас. Sigma T6750)
- Забуференный фосфатом солевой раствор (PBS) 10 мМ фосфат, 140 мМ NaCl, pH 7,4
Способ
Слитый белок scFv:ферритин оттаивали с -20°C до комнатной температуры. Девять миллилитров со 100 мкг/мл распределяли в смягченные диализные трубки. Трубки, которые содержали слитый белок, промывали в общем 1 мл буфера с ацетатом натрия, который добавляли к 9 мл белка (для получения раствора 0,9 мг/мл). 800 мл буфера с ацетатом натрия продували N2 в течение 15 минут перед тем, как добавили в диализный мешок. Раствор затем продували в течение еще 2 часов. 2 мл тиогликолевой кислоты добавляли к буферу, который продолжали продувать с использованием N2. После дополнительных 2 часов добавляли еще 1 мл тиогликолевой кислоты. Буфер меняли (800 мл предварительно продутого буфера с ацетатом натрия, содержащего 3 мл тиогликолевой кислоты) и диализ продолжали под N2 в течение 1 часа. Диализный мешок затем переносили в 2 литра PBS при комнатной температуре (без N2), затем в течение ночи при 4°C в 3 литрах PBS. Этот деминерализованный слитый белок затем использовали для продуцирования парамагнитного слитого белка путем добавления железа и контролируемого окисления, как описано ниже.
Продуцирование магнитного scFv: ферритина
Материалы
- Вода, очищенная обратным осмосом (RO-вода)
- Буфер с 50 мМ N-(1,1-Диметил-2-гидроксиэтил)-3-амино-2-гидроксипропансульфоновой кислотой (AMPSO), pH 8,6 (Sigma A6659)
- буфер с 0,1M ацетатом натрия, pH 4,5
- Забуференный фосфатом солевой раствор (PBS) 10 мМ фосфат, 140 мМ NaCl, pH 7,4
- Триметиламин-N-оксид (TMA) (Sigma 317594)
- 0,1M сульфат аммония-железа (II)
Триметиламин-N-оксид (TMA) нагревали в сушильном шкафу до 80°C в течение 30 минут для удаления Me3N перед охлаждением до комнатной температуры. 114 мг TMA добавляли к 15 мл RO-воды для получения 0,07M раствора. Растворы железа и TMA продували N2 в течение 15 минут перед использованием.
Деминерализованный слитый белок, содержащийся внутри диализного мешка (подробности смотри выше), диализовали против 1 литра AMPSO-буфера в течение 2 часов при комнатной температуре с перемешиванием под азотом. Деминерализованный scFv:ферритин (~10 мл) переносили в коническую колбу. 18 мкл раствора железа добавляли к деминерализованному раствору белка, в то же время продувая N2 для устранения любого остаточного кислорода. Через 25 минут добавляли 15 мкл железа и 10 мкл TMA.
Следующие дополнительные количества буферов с железом и TMA затем добавляли с 15-минутными интервалами.
3е добавление: 30 мкл железа+20 мкл TMA
4ое добавление: 15 мкл железа+10 мкл TMA
5ое добавление: 15 мкл железа+l0 мкл TMA
6ое добавление: 15 мкл железа+10 мкл TMA.
Намагниченный белок пропускали через колонку Macs® LS. Фильтрат пропускали второй раз в попытке увеличить эффективность улавливания. Намагниченный белок элюировали из колонки, удаляя колонку от магнита и добавляя 1 мл PBS и используя плунжер (элюат приблиз. 2 мл). Это составляет двукратное разведение белка на колонке.
Элюированный белок и контроли наносили на планшет микротитрования для анализа, как подробно описано ниже.
Анализ слитого белка scFv:магнетоферритин методом ELISA
Для того чтобы установить, остается ли намагниченный слитый белок связыванным с моноклональными антителами против ферритина, проводили иммуноферментный твердофазный анализ.
Материалы
- Карбонатный буфер (0,159 г карбоната натрия, 0,3 г бикарбоната натрия в 100 мл воды), pH 9,6
- Забуференный фосфатом солевой раствор (PBS), 10 мМ фосфат, 140 мМ NaCl, pH 7,4
- Пептид фибронектина
- Слитый белок анти-фибронектин:ферритин (scFv:ферритин)
- Моноклональные антитела мыши против ферритина человека (Santa Cruz SC51887)
- Антитела против мыши со щелочной фосфатазой (Sigma A3562)
- Субстрат - жидкий стабильный фенолфталеинфосфат
- Стоп-раствор (212 г карбоната натрия, 110,5 г 3-(циклогексиламино)-1-пропансульфоновой кислоты (CAPS), 217 г этилендиаминтетрауксусной кислоты (EDTA), 80 г гидроксида натрия, вода до 5 литров)
- Планшет микротитрования Maxisorb (NUNC Cat: 468667)
Способ
Покрытые слитым белком лунки
Лунки покрывали scFv:ферритином (нетронутым), scFv:магнетоферритином, scFv:магнетоферритином, элюированным из колонки Macs®, и фильтратом в концентрации 1 к 3 в карбонатном буфере. Планшет инкубировали в течение выходных при 4°C. Избыток раствор стряхивали и планшет забивали с использованием 1% BSA в PBS в течение 1 часа при комнатной температуре. Жидкость стряхивали и планшет промывали три раза с использованием PBS (300 мкл/лунку для каждого промывания). Антитело мыши против ферритина добавляли в концентрации 20 мкг/мл и добавляли в объеме 100 мкл в каждую лунку и инкубировали при комнатной температуре в течение часа. Жидкость удаляли и лунки промывали, как перед этим. Антитела козла против мыши, конъюгированные с AP, разводили до 10 мкг/мл и добавляли в объеме 100 мкл во все лунки. Инкубировали при комнатной температуре в течение часа и удаляли, как перед этим. Субстрат добавляли во все лунки и инкубировали при комнатной температуре в течение часа и реакцию останавливали с использованием стоп-буфера. Оптические плотности регистрировали с использованием прибора Varioskan Flash (Thermo Fisher Electron) (смотри Фиг. 21a).
Покрытые фибронектином лунки
Лунки планшета микротитрования покрывали 100 мкл пептида фибронектина (поставляемого в концентрации 1,5 мг/мл), разведенного в карбонатном буфере до 15 мкг/мл. Планшеты инкубировали в течение ночи при 2-8°C. Избыток раствора стряхивали и лунки промывали три раза в 300 мкл PBS. Слитые белки scFv:ферритин добавляли аккуратно в соответствующие лунки (100 мкл) в повторности. Планшет затем инкубировали в течение часа при комнатной температуре. Раствор стряхивали и лунки промывали три раза в 300 мкл PBS. Антитела мыши против ферритина добавляли в концентрации 20 мкг/мл и добавляли в объеме 100 мкл в каждую лунку и инкубировали при комнатной температуре в течение часа. Жидкость удаляли и лунки промывали, как перед этим. Антитела козла против мыши, конъюгированные с AP, разводили до 10 мкл/мл и добавляли в объеме 100 мкл во все лунки. Инкубировали при комнатной температуре в течение часа и удаляли, как перед этим. Субстрат добавляли во все лунки и инкубировали при комнатной температуре в течение 45 минут и останавливали реакцию с использованием стоп-буфера. Оптические плотности регистрировали с использованием прибора Varioskan Flash (Thermo Fisher Electron) (смотри Фиг. 21b).
Колонки Macs® сконцентрировали намагниченный слитый белок, и он по-прежнему распознавался моноклональным антителом против ферритина, указывая на то, что слитый белок анти-фибронектин:ферритин был намагничен и сохранил структурную целостность. Эти данные также свидетельствуют, что намагниченный слитый белок анти-фибронектин:ферритин сохраняет способность связывания со своим антигеном-мишенью и, таким образом, демонстрирует бифункциональный одноцепочечный слитый белок, который является и намагничиваемым, и может избирательно связываться с мишенью.
ПРИМЕР 4 - Дополнительные Протоколы
Намагничивание слитого белка scFv-MT2
Слитые белки scFv-MT2 можно намагнитить путем замещения ионов цинка ионами марганца и кадмия. Способы выполнения этого можно при необходимости оптимизировать. Способы достижения этого включают обеднение цинком при помощи диализа с последующим замещением, также с использованием диализа с адаптациями опубликованных протоколов, если это необходимо.
Подробнее, эти протоколы являются следующими:
1. Растворить 5 мг MT2 в 5 мл буфера (4,5M мочевина, 10мМ трис-основание, 0,1M дитиотрейтол (DTT), 0,1% маннит и 0,5мМ Pefabloc, pH 11) для отмывки белка от ионов металла.
2. Диализовать в том же буфере в течение 1 часа.
3. Повторно свернуть белок при помощи диализа в буфере 1 (10мМ трис-основание, 2M мочевина, 0,1M DTT, 0,1% маннит, 0,5мкМ Pefabloc и 1мМ Cd2+/Mn2+, pH 11) в течение 72 часов.
4. Заменить диализный буфер буфером 2 (как описанный выше, но с мочевиной в концентрации 1M) и диализовать в течение 24 часов.
5. Заменить диализный буфер буфером, как описано выше, но не содержащем мочевины. Диализовать в течение 24 часов.
6. Заменить диализный буфер со стадии 5 буфером с pH 8,8. Диализовать в течение 24 часов.
7. Заменить диализный буфер со стадии 6 буфером, не содержащем маннита, и диализовать, как перед этим.
8. Заменить диализный буфер со стадии 7 буфером, не содержащем Cd2+/Mn2+, и диализовать в течение 24 часов.
Характеристики связывания можно определить, как описано выше в Примере 2 для слитого с ферритином белка.
Протокол исследования аналита в микрофлюидном устройстве с использованием слитого белка
Требуемое количество слитого белка смешивают с неочищенным образцом плазмы, содержащим представляющий интерес аналит, внутри микрофлюидного устройства.
Представляющий интерес аналит захватывается намагничиваемой стороной микрофлюидного устройства, тогда как примеси смываются. Магнит отключают и очищенный белок перемещают в систему детекции.
Реферат
Изобретение относится к меткам магнитного распознавания и касается метки для аналита, которая присоединена к магнитному или намагничиваемому веществу, включающей: (а) распознающую составляющую для присоединения метки к аналиту и (b) составляющую для связывания или инкапсулирования магнитного или намагничиваемого вещества; причем эта составляющая для связывания или инкапсулирования магнитного или намагничиваемого вещества включает металлсвязывающий белок или металлсвязывающий домен белка. Изобретение обеспечивает улучшенную метку для аналита, которую можно выгодно использовать, например, в микрофлюидном или нанофлюидном устройстве. 7 н. и 18 з.п. ф-лы, 21 ил., 3 табл.
Формула
(a) распознающую составляющую для присоединения метки к аналиту и
(b) составляющую для связывания или инкапсулирования магнитного или намагничиваемого вещества;
причем эта составляющая для связывания или инкапсулирования магнитного или намагничиваемого вещества включает металлсвязывающий белок или металлсвязывающий домен белка, выбранный(ого) из лактоферрина, трансферрина, ферритина, белка, связывающего трехвалентное железо, фратаксина, сидерофора, причем магнитное или намагничиваемое вещество включает один или более ионов из Fe, Со, Ni, Mn, Cr, Cu, Zn или Cd, причем аналит может подвергаться воздействию магнитных полей.
(a) контактирование образца с меткой для аналита, которая присоединена к магнитному или намагничиваемому веществу, причем эта метка включает:
- распознающую составляющую для присоединения метки к аналиту и
- составляющую для связывания или инкапсулирования магнитного или намагничиваемого вещества;
(b) подвергание метки магнитному полю для воздействия на метку;
(c) необязательное исследование метки и/или аналита для получения информации об аналите, который может быть присоединен к метке,
при этом составляющая для связывания или инкапсулирования магнитного или намагничиваемого вещества включает металлсвязывающий белок, полипептид или пептид, причем метка включает метку по любому из пп.1-12.
а) распознающую составляющую для присоединения метки к аналиту и
б) составляющую для связывания или инкапсулирования магнитного или намагничиваемого вещества;
причем эта составляющая для связывания или инкапсулирования магнитного или намагничиваемого вещества включает металлсвязывающий белок, полипептид или пептид, причем каждая метка набора обладает отличным (уникальным) числом металлсвязывающих составляющих, при этом каждая метка включает метку по любому из пп.1-12.
