Полипептидные варианты с измененной эффекторной функцией - RU2367667C2
Код документа: RU2367667C2
Чертежи













Описание
По настоящей заявке испрашивается приоритет предварительной заявки, рег.№ 60/603057, поданной 19 августа 2004, описание которой вводится в настоящее изобретение посредством ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к полипептидам, содержащим вариант Fc-области. Более конкретно, настоящее изобретение относится к содержащим Fc-область полипептидам, которые обладают эффекторной функцией, измененной в результате одной или нескольких аминокислотных модификаций, внесенных в их Fc-область.
Предшествующий уровень техники
Антитела представляют собой белки, обладающие специфичностью связывания с конкретным антигеном. Природными антителами обычно являются гетеротетрамерные гликопротеины размером приблизительно 150000 Дальтон, состоящие из двух одинаковых легких цепей (L) и двух одинаковых тяжелых цепей (Н). Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, при этом число дисульфидных связей между тяжелыми цепями иммуноглобулинов различных изотипов варьируется. Каждая тяжелая и легкая цепь также имеет соответствующим образом расположенные внутрицепьевые дисульфидные мостики. Каждая тяжелая цепь у одного своего конца имеет вариабельный домен (VН), за которым следует ряд константных доменов. Каждая легкая цепь у одного своего конца имеет вариабельный домен (VL), а у другого конца - константный домен, причем, константный домен легкой цепи соответствует первому константному домену тяжелой цепи, а вариабельный домен легкой цепи соответствует вариабельному домену тяжелой цепи. Очевидно, что конкретные аминокислотные остатки образуют пограничную область между вариабельными доменами легкой и тяжелой цепи.
Термин “вариабельный” означает, что некоторые части вариабельных доменов у различных антител очень отличаются по своим последовательностям и являются ответственными за специфическое связывание каждого конкретного антитела с конкретным антигеном. Однако такая вариабельность не одинаково распределяется по всем вариабельным доменам антител. Указанная вариабельность сконцентрирована в трех сегментах, называемых гипервариабельными областями (комплементарность-определяющими областями (CDR)), присутствующими в вариабельных доменах как легкой, так и тяжелой цепи. Более высококонсервативные части указанных вариабельных доменов называются каркасными областями (FR). Каждый вариабельный домен природных тяжелой и легкой цепей содержит четыре FR, что в значительной степени способствует формированию β-складчатой структуры, соединенной тремя CDR, образующими петли и соединяющими, а в некоторых случаях, составляющими части такой β-складчатой структуры. CDR в каждой цепи находятся в непосредственной близости друг от друга благодаря FR, а вместе с CDR другой цепи они образуют антигенсвязывающий сайт антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)).
Константные домены не принимают непосредственного участия в связывании антитела с антигеном, но обладают различными эффекторными функциями. Антитела или иммуноглобулины, в зависимости от аминокислотной последовательности константной области их тяжелых цепей, могут быть подразделены на различные классы. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, некоторые из которых могут быть дополнительно подразделены на подклассы (изотипы), например, IgG1, IgG2, IgG3 и IgG4; и IgA1 и IgA2. Константные области тяжелой цепи, которые соответствуют иммуноглобулинам различных классов, обозначаются α, δ, ε, γ и µ, соответственно. Известно, что из этих классов иммуноглобулинов человека только иммуноглобулины IgG1, IgG2, IgG3 и IgM человека активируют комплемент, причем IgG1 и IgG3 человека опосредуют ADCC более эффективно, чем IgG2 и IgG4.
Структура природного IgG1 схематически представлена на фиг.1, где показаны различные части молекулы природного антитела. В результате расщепления антител папаином образуются два одинаковых антигенсвязывающих фрагмента, называемые Fab-фрагментами, каждый из которых имеет один антигенсвязывающий сайт и один остаточный “Fc”-фрагмент, обозначение которого отражает его способность легко кристаллизоваться. Была определена кристаллическая структура Fc-области IgG человека (Deisenhofer, Biochemistry 20:2361-2370 (1981)). В молекулах IgG человека, Fc-область образуется в результате расщепления папаином на участке, расположенном у N-конца перед Cys226. Указанная Fc-область играет ключевую роль в осуществлении эффекторных функций антител.
Эффекторные функции антител
Эффекторные функции, опосредуемые Fc-областью антитела, могут быть подразделены на две категории: (1) эффекторные функции, которые действуют после связывания антитела с антигеном (такими функциями являются участие в каскаде реакций активации комплемента или лизис клеток, несущих Fc-рецептор (FcR)); и (2) эффекторные функции, осуществляемые независимо от связывания с антигеном (эти функции обеспечивают длительное присутствие антитела в кровотоке и способность этого антитела проникать через клеточные барьеры посредством трансцитоза). См. Ward & Ghetie, Therapeutic Immunology 2:77-94 (1995).
Хотя связывание антитела с требуемым антигеном дает нейтрализующий эффект, который может предупреждать связывание чужеродного антигена с его эндогенной мишенью (например, с рецептором или лигандом), однако, только одно такое связывание не может приводить к удалению этого чужеродного антигена. Для эффективной элиминации и/или деструкции чужеродных антигенов антитело должно обладать высокой аффинностью связывания с антигеном и эффективными эффекторными функциями.
Взаимодействие антител и комплексов “антитело-антиген” с клетками иммунной системы приводит к продуцированию различных ответов, включая антитело-зависимую клеточноопосредуемую цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC)(описанные в публикации Daeron, Annu. Rev. Immunol. 15:203-234 (1997); Ward & Ghetie, Therapeutic Immunol. 2:77-94 (1995), а также в публикации Ravetch & Kinet, Annu. Rev. Immunol. 9:457-492 (1991)).
Некоторые эффекторные функции антитела опосредуются Fc-рецепторами (FcR), которые связываются с Fc-областью антитела. FcR определяются их специфичностью к иммуноглобулинам различных изотипов; причем Fc-рецепторы для антител IgG обозначаются FcγR, для IgE - FcεR, а для IgA - FcαR и т.д. Были идентифицированы три подкласса FcγR: FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16). Поскольку FcγR каждого подкласса кодируется двумя или тремя генами, а альтернативный РНК-сплайсинг приводит к образованию множества транскриптов, то существует широкое разнообразие изоформ FcγR. Три гена, кодирующие рецепторы подкласса FcγRI (FcγRIA, FcγRIB и FcγRIC), образуют кластеры в области 1q21.1 длинного плеча хромосомы 1, а гены, кодирующие изоформы FcγRII (FcγRIIA, FcγRIIB и FcγRIIC), и два гена, кодирующие изоформы FcγRIII (FcγRIIIA и FcγRIIIB), образуют кластеры в области 1q22. Указанные FcR различных изотипов экспрессируются на клетках различных типов (см. публикацию Ravetch & Kinet, Annu. Rev. Immunol. 9:457-492 (1991)). Так, например, у человека, FcγRIIIB присутствует только на нейтрофилах, тогда как FcγRIIIA присутствует на макрофагах, моноцитах, природных клетках-киллерах (NK) и в субпопуляции Т-клеток.
По своей структуре, все FcγR являются членами суперсемейства иммуноглобулинов, имеющих IgG-связывающую α-цепь вместе с внеклеточной частью, состоящей из любых двух (FcγRI- и FcγRIII)- или трех (FcγRI)-Ig-подобных доменов. Кроме того, FcγRI и FcγRIII имеют дополнительные белковые цепи ((γ,ζ.), связанные с α-цепью, которая обеспечивает передачу сигнала. Эти рецепторы также различаются по своей аффинности связывания с IgG. FcγRI обладает высокой аффинностью связывания с IgG, Ka = 108 - 109 M-1 (Ravetch et al., Ann. Rev. Immunol. 19:275-290 (2001)) и может связываться с мономерным IgG. В противоположность этому, FcγRII и FcγRIII обладают относительно более слабой аффинностью связывания с мономерным IgG, Ka = 107 M-1 (Ravetch et al., Ann. Rev. Immunol. 19:275-290 (2001)), а поэтому они могут эффективно взаимодействовать только с мультимерными иммунными комплексами. FcγRII-рецепторами являются FcγRIIA (“активирующий рецептор”) и FcγRIIB (“ингибирующий рецептор”), которые имеют сходные аминокислотные последовательности, отличающиеся, главным образом, своими цитоплазматическими доменами. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене иммунорецепторный активирующий мотив на основе тирозина (ITAM). Ингибирующий рецептор FcγRIIВ содержит в своем цитоплазматическом домене иммунорецепторный ингибирующий мотив на основе тирозина (ITIM)(см. Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). NK-клетки имеют только FcγRIIIA, и связывание антител с FcγRIIIA приводит к сообщению этим NK-клеткам ADCC-активности.
У человека были обнаружены аллельные варианты нескольких FcγR человека. Было показано, что эти аллельные варианты обнаруживают различия в связывании с IgG человека и мыши, а различные исследования их взаимодействия выявили корреляцию клинических результатов с присутствием специфических аллельных форм (см. публикацию Lehrnbecher et al. Blood 94(12):4220-4232 (1999)). В нескольких исследованиях был проведен анализ двух форм FcγRIIA, R131 и Н131 и была оценена их взаимосвязь с клиническими результатами (Hatta et al., Genes and Immunity 1:53-60 (1999); Yap et al. Lupus 8:305-310 (1999) and Lorenz et al. European J. Immunogenetics 22:397-401 (1995)). В настоящее время было проведено исследование только двух аллельных форм FcγRIIIA, F158 и V158 (Lehrnbecher et al. см. выше; и Wu et al., J. Clin. Invest. 100(5):1059-1070 (1997)). Аллотип FcγRIIIA (Val158) взаимодействует с IgG человека лучше, чем аллотип FcγRIIIA (Phe158)(Shields et al., J. Biol. Chem. 276:6951-6604 (2001); Koene et al. Blood 90:1109-1114 (1997) and Wu et al., J. Clin. Invest. 100:1059-1070 (1997)).
Сайт связывания с FcγR у антител человека и мыши был ранее картирован по так называемой “нижней шарнирной области”, состоящей из остатков 233-239 (пронумерованных в соответствии с Европейской системой нумерации по Кэбату и др., как описано в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991)). Woof et al. Molec. Immunol. 23:319-330 (1986); Duncan et al., Nature 332:563 (1988); Canfield & Morrison, J. Exp. Med. 173:1483-1491 (1991); Chappel et al. Proc. Natl. Acad. Sci., USA, 88:9036-9040 (1991). Из остатков 233-239 остатки Р238 и S239 рассматриваются как остатки, которые, возможно, участвуют в связывании.
Другими рассматриваемыми ранее областями, которые могут связываться с FcγR, являются: G316-K338 (IgG человека) для FcγRI человека (оценка была проведена только путем сравнения последовательностей, при этом мутанты с заменами не анализировались)(Woof et al., Molec. Immunol. 23:319-330 (1986)); K274-R301 (IgG1 человека) для FcγRIII человека (пептидный анализ)(Sarmay et al. Molec. Immunol. 21:43-51 (1984)); Y407-R416 (IgG человека) для FcγRIII человека (пептидный анализ)(Gergely et al. Biochem. Soc. Trans. 12:739-743 (1984)), а также N297 и E318 (IgG2b мыши) для FcγRII мыши (Lund et al., Molec. Immunol. 29:53-59 (1992)). См. также Armour et al. Eur. J. Immunol. 29:2613-2624 (1999).
В патенте США № 6737056, Presta были описаны полипептидные варианты, обладающие повышенной или пониженной способностью связываться с FcR. См. также Shields et al., J. Biol. Chem. 9(2):6591-6604 (2001). Варианты Fc, связывающиеся с FcγR, также описаны в WO 2004/063351.
С1q и две сериновые протеазы, С1q и С1s, образуют комплекс С1, т.е. первый компонент пути комплемент-зависимой цитотоксичности (CDC). С1q представляет собой шестивалентную молекулу с молекулярной массой приблизительно 460000 Дальтон и имеет структуру, напоминающую “букет тюльпанов”, в которой шесть коллагеновых “стеблей” соединены с шестью верхними глобулярными областями. См. Burton & Woof, Advances in Immunol. 51:1-84 (1992). Для инициации каскада реакций активации комплемента необходимо, чтобы молекула С1q связывалась по меньшей мере с двумя молекулами из IgG1, IgG2 или IgG3 (существует мнение, что IgG4 не активирует комплемент), и только с одной молекулой IgМ, агрегированной с антигеном-мишенью. См. публикацию Ward & Ghetie, Therapeutic Immunology 2:77-94 (1995), стр. 80.
Исходя из результатов анализа химических модификаций и кристаллографических исследований (Burton et al. Nature, 288:338-344 (1980), было высказано предположение, что сайт связывания с субкомпонентом C1q комплемента на IgG охватывает последние две (С-концевые) β-цепи домена СН2. Позже, Бэтон (Molec. Immunol. 22(3):161-206 (1985)) высказал предположение, что область, содержащая аминокислотные остатки 318-337, может участвовать в связывании комплемента.
В публикации Duncan & Winter, Nature 332:738-40 (1988), где описан метод с применением сайт-направленного мутагенеза, сообщалось, что остатки Glu318, Lys320 и Lys322 образуют сайт связывания с C1q. Данные, представленные Duncan и Winter, были получены путем анализа на связывание изотипа IgG2a мыши с C1q морской свинки. Роль остатков Glu318, Lys320 и Lys322 в связывании с C1q подтверждалась способностью короткого синтетического пептида, содержащего эти остатки, ингибировать комплемент-опосредуемый лизис. Аналогичные результаты приводятся в патенте США № 5648260, выданном 15 июля 1997, и в патенте США № 5624821, выданном 29 апреля 1997.
Остаток Pro331 участвует в связывании с C1q, что подтверждал анализ на способность IgG человека нескольких подклассов осуществлять комплемент-опосредуемый лизис клеток. Замена остатка Ser331 остатком Pro331 в IgG4 сообщала им способность к активации комплемента (Tao et al., J. Exp. Med., 178:661-667 (1993); Brekke et al., Eur. J. Immunol., 24:2542-47 (1994)).
Исходя из сравнения данных, полученных группой специалистов, Winter и др., и данных представленных в работах Tao и др. и Brekke и др., Ward и Ghetie в своих обзорных статьях сделали вывод, что существуют по меньшей мере две другие области, участвующие в связывании с C1q, а именно одна область, присутствующая на β-цепи домена СН2, имеющего остатки Glu318, Lys320 и Lys322, и другая область, присутствующая на спирали, расположенной в непосредственной близости от той же самой β-цепи и содержащей ключевой аминокислотный остаток в положении 331.
В других работах было высказано предположение, что остатки Lys235 и Gly237 IgG1 человека, локализованные в нижней шарнирной области, играют ключевую роль в связывании и активации комплемента. См. Xu et al. J. Immunol. 150:152А (Реферат) (1993). В заявке WO94/29351, опубликованной 22 декабря, 1994, сообщалось, что аминокислотные остатки, необходимые для связывания IgG1 человека с C1q и FcR, расположены в N-концевой области домена СН2, т.е., остатки 231-238.
Кроме того, было высказано предположение о том, что способность IgG связываться с C1q и активировать каскад комплемента также зависит от присутствия, отсутствия или модификации углеводной части, расположенной между двумя доменами СН2 (которые обычно заякорены в положении Asn297). См. публикацию Ward & Ghetie, Therapeutic Immunology 2:77-94 (1995), стр.81.
Полипептидные варианты, имеющие модифицированные аминокислотные последовательности в Fc-области и обладающие повышенной или пониженной способностью связываться с C1q, описаны в патенте США № 6194551В1 и в заявке WO99/51642. Содержание этих патентных публикаций во всей своей полноте вводится в настоящее описание посредством ссылки. См. также публикацию Idusogie et al. J. Immunol. 164:4178-4184 (2000).
Другим типом Fc-рецептора является Fc-рецептор новорожденных (FcRn). По своей структуре, FcRn аналогичен главному комплексу гистосовместимости (МНС) и состоит из α-цепи, нековалентно связанной с β2-микроглобулином. Многие функции Fc-рецептора новорожденных, FcRn, описаны в публикации Ghetie & Ward (2000) Annu. Rev. Immunol. 18, 739-766. FcRn играет ключевую роль в гомеостазе IgG, основанном на рН-зависимом взаимодействии с Fc-областью антитела (Ghetie & Ward (2000) Annu. Rev. Immunol. 18, 739-766; Ghetie & Ward (1997) Immunol. Today 18, 592-598). Было обнаружено, что повышение аффинности комплекса Fc-FcRn при рН 6 и сохранение низкой аффинности при рН 7,4 приводит к увеличению времени полужизни антитела (Hinton et al. (2004) J. Biol. Chem. 279, 6213-6216). FcRn играет определенную роль в пассивном переносе иммуноглобулинов IgG от матери к ребенку и в регуляции уровней IgG в сыворотке. FcRn действует как рецептор “спасения”, связывается с подвергнутыми пиноцитозу IgG и переносит их в интактной форме вовнутрь клеток и во внеклеточное пространство, и тем самым предотвращает вступление этих IgG на путь гидролитического расщепления, как показано на фиг.6. Хотя механизмы, ответственные за “спасение” IgG, пока еще точно не известны, однако, считается, что несвязанные IgG имеют прямую тенденцию к протеолизу в лизосомах, тогда как связанные IgG проходят повторный цикл на клеточных поверхностях и высвобождаются. Такая регуляция происходит в эндотелиальных клетках, имеющихся во всех тканях взрослых людей. FcRn экспрессируются по меньшей мере в печени, в молочной железе и в тонком кишечнике взрослого человека.
FcRn связывается с IgG, однако, при тщательном исследовании взаимодействия FcRn с IgG было обнаружено, что в таком взаимодействии участвуют остатки, присутствующие в доменах СН2 и СН3, граничащих с Fc-областью IgG. Эти остатки взаимодействуют с остатками, локализованными, главным образом, в α2-домене FcRn.
В публикации Ghetie et al., Nature Biotechnology 15:637-640 (1997) описан неспецифический мутагенез остатков Thr252, Thr254 и Thr256 в Fcγ1 мыши, т.е. остатков, расположенных в непосредственной близости от сайта взаимодействия FcRn-IgG, который был проведен для исследования влияния этих мутаций на время полужизни вариантов фрагментов “шарнирная область-Fc” в сыворотке. Мутант с самой высокой аффинностью связывания с FcRn мыши имеет более длительное время полужизни в сыворотке, чем фрагмент дикого типа, несмотря на его меньшую скорость диссоциации из FcRn при рН 7,4.
В проведенных ранее исследованиях, Presta и его сотрудниками был осуществлен крупномасштабный аланин-сканирующий мутагенез (Shields et al., J. Biol. Chem. 276:6591-6604 (2001); Presta, патент США № 6737056), в результате которого были идентифицированы три Fc-варианта, N434A, E380A и Т307А, которые имели повышенную аффинность Fc:FcRn в 3,5 раз, в 2,2 раза и в 1,8 раз, соответственно. Мутант с тремя заменами имел аффинность по отношению к FcRn при рН 6, которая в 12 раз превышала аффинность антитела дикого типа.
С учетом структурной гомологии между Fc:FcRn человека и Fc-FcRn крысы, которая была оценена с помощью рентгеноструктурного анализа (Burnmeister et al., Nature 372:336-343 (1994); Burnmeister et al., Nature 372:379-383 (1994)), Dall'Acqua et al. (Journal of immunology, 169, 5171-5180 (2002); US2003/0190311), были предприняты попытки дальнейшего повышения уровня аффинности посредством фагового представления. Авторами этих публикаций были сконструированы четыре рандомизированных библиотеки Fc, каждая из которых имела 4 или 5 полностью рандомизированных остатков (т.е. она имела все возможные аминокислотные замены, и в результате было создано две библиотеки с вариабельностью 204 и две библиотеки с вариабельностью 205) и проводили отбор на связывание с FcRn мыши. При этом сообщалось, что попытки использования FcRn человека для скрининга этих библиотек оказались безуспешными. Хотя повышение аффинности связывания, идентифицированное с помощью фагового отбора с использованием FcRn мыши, также приводило к повышению аффинности связывания с FcRn человека, однако, как сообщалось, прямой фаговый отбор с использованием FcRn человека, проводимый описанными методами, оказался безуспешным (Dall'Acqua et al., 2002). С использованием этих библиотек были идентифицированы варианты с мутациями в положениях Н433, N434 и Y436, и в положениях М252, S254 и Т256. Было обнаружено, что два из этих вариантов, происходящих от данной библиотеки, а именно, Н433К+N434F+Y436H и M252Y+S254T+T256E, обладают в 10-20-раз более высокой аффинностью связывания с FcRn мыши и человека при рН 6,0. Комбинация этих мутаций приводит к 30-кратному увеличению аффинности связывания с FcRn мышии к 57-кратному увеличению аффинности связывания с FcRn человека. Однако эти варианты также обладают повышенной аффинностью при рН 7,4 и не имеют продолжительного времени полужизни у мышей. Эти результаты подтвердили мнение, что эффективный метаболический цикл IgG связан с рН-зависимой аффинностью. Также отсутствуют какие-либо данные относительно этих вариантов у приматов или у животных, трансгенных по FcRn человека.
В патентах США № 6277375, 6821505 и 6165745, Ward и сотрудниками были описаны иммуноглобулин-подобные домены, имеющие повышенное время полужизни в сыворотке и содержащие мутации в области Fc в положении 434. Полученный мутант N434Q обнаруживал, фактически, уменьшенное время полужизни. В заявке WO 98/23289, Israel и Simister, в общих чертах, обсуждается модификация остатка 434 путем добавления, замены или делеции этого остатка, осуществляемых для оценки влияния такой модификации на связывание, однако, в этой заявке нет каких-либо упоминаний о том, что этот остаток должен быть заменен или добавлен.
Кроме того, с учетом структурной гомологии между комплексом “Fc-FcRn крысы” (Burnmeister et al., 1997) и моделью пограничной области Fc-FcRn человека, Хинтон и др. (J.Biol.Chem. 279:6213-6216 (2004)) идентифицировали остатки Т250, L314 и М428 в IgG2a человека как остатки, которые могут играть важную роль в связывании с huFcRn. Ими также были идентифицированы мутации T250Q и М428L, которые приблизительно в 3-7 раз повышают аффинность связывания, соответственно, с FcRn человека при рН 6,0, и не оказывают какого-либо значимого влияния на связывание при рН 7,5. Сообщалось, что комбинированный вариант T250Q + M428L имеет в 28 раз большую аффинность связывания. Аналогичный уровень связывания наблюдался для FcRn макак-резусов. Фармакокинетические анализы показали, что у макак-резусов, антитело IgG2, содержащее эти две мутации, имеет в 1,9 раз большее время полувыведения (t=1/2β) из организма.
В настоящее время, получение антител, а в частности, терапевтических антител, обладающих улучшенной или модулированной эффекторной функцией, все еще остается актуальным. Одной из целей конструирования таких антител является увеличение времени полужизни указанных антител in vivo. Это может быть достигнуто путем модуляции взаимодействия такого антитела с Fc-рецептором новорожденных (FcRn). Настоящее изобретение удовлетворяет этим и другим требованиям.
Описание сущности изобретения
Настоящее изобретение относится к полипептидам, а в частности, к антителам, обладающим более высокой аффинностью связывания с FcRn и FcγRIII, чем полипептиды, имеющие Fc-область с нативной последовательностью/последовательностью дикого типа. Эти полипептиды и антитела, содержащие вариант Fc-области, имеют то преимущество, что они не разлагаются, а вместо этого сохраняются и поступают на повторный метаболический цикл. Увеличение времени полужизни в сыворотке может способствовать повышению времени воздействия антитела и снижению частоты введения Fc-содержащих полипептидов, таких как Ab и других антителосодержащих гибридных белков, таких как иммуноадгезины.
Настоящее изобретение относится к выделенному полипептиду, содержащему вариант Fc-области IgG, содержащий по меньшей мере одну замену аминокислоты Asn434 на Trp (N434W).
Вторым выделенным полипептидом является полипептид, содержащий вариант Fc-области IgG, содержащий по меньшей мере одну замену аминокислоты Asn434 на His (N434H).
Другим выделенным полипептидом согласно изобретению является полипептид, содержащий вариант Fc-области IgG, содержащий по меньшей мере одну замену аминокислоты Asn434 на Tyr (N434Y), где указанный полипептид не имеет других аминокислотных замен, выбранных из группы, состоящей из H433R, H433S, Y436H, Y436R, Y436T.
Еще одним полипептидом является выделенный полипептид, содержащий вариант Fc-области IgG, содержащий по меньшей мере одну замену аминокислоты Asn434 на Phe (N434F), где указанный полипептид не имеет других аминокислотных замен, выбранных из группы, состоящей из H433К, Y436H, M252Y, S254T или T256E.
Настоящее изобретение относится к полипептиду, содержащему вариант Fc-области IgG, где указанный вариант Fc-области IgG имеет аминокислотную замену, включающую, по существу, замену Asn434 на Tyr (N434Y), или состоящую из такой замены. Настоящее изобретение также относится к полипептиду, содержащему вариант Fc-области IgG, где указанный вариант Fc-области IgG имеет аминокислотную замену, включающую, по существу, замену Asn434 на Phe (N434F), или состоящую из такой замены.
В одном из вариантов изобретения, выделенным полипептидом в соответствии с любым из предыдущих вариантов является антитело. В другом варианте изобретения, указанным полипептидом является иммуноадгезин.
В предпочтительных вариантах изобретения, антитело IgG в соответствии с любым из предыдущих вариантов изобретения является антителом мыши или человека, а предпочтительно, человечека. IgG человека охватывает IgG человека любого изотипа, а именно, IgG1, IgG2, IgG3, IgG4. IgG мыши охватывает изотипы IgG1, IgG2a, IgG2b, IgG3. Предпочтительными терапевтическими антителами, применяемыми для лечения человека, являются гуманизованные, антитела человека или химерные антитела.
В ранее описанных полипептидах, которыми являются антитела, полипептид, содержащий вариант Fc-области, связывается с FcRn человека при рН 6,0 с более высокой аффинностью, чем полипептид, содержащий IgG с Fc-областью, имеющей нативную последовательность, и связывается с FcRn человека с меньшей аффинностью связывания при рН 7,4 или при рН 7,5, чем при рН 6,0. В предпочтительном варианте изобретения, аффинность связывания вартанта полипептида Fc с FcRn при рН 6,0 по меньшей мере в 4 раза, предпочтительно по меньшей мере в 7 раз, в 9 раз, еще более предпочтительно по меньшей мере в 20 раз превышает аффинность связывания нативной последовательности/природной последовательности Fc. Полипептиды в соответствии с предыдущими вариантами изобретения имеют более длительное время полужизни в сыворотке у приматов, а в частности, в сыворотке человека или собакоподобных обезьян, чем время полужизни полипептида, имеющего Fc-область с нативной последовательностью.
В другом своем аспекте, настоящее изобретение относится к выделенному полипептиду, содержащему вариант Fc-области IgG, содержащий по меньшей мере замену аминокислоты Lys334 на лейцин (K334L). В одном из вариантов изобретения, этот полипептид связывается с FcγRIII человека с более высокой аффинностью, а именно, с аффинностью, которая более чем в 3 раза превышает аффинность полипептида, имеющего Fc-область IgG с нативной последовательностью. Этот полипептид также, предпочтительно, обладает более высокой ADCC по сравнению с полипептидом, имеющим Fc-область IgG с нативной последовательностью.
Настоящее изобретение также относится к выделенному полипептиду, содержащему вариант Fc-области IgG, который обладает повышенной аффинностью связывания с FcRn человека при рН 6, но не обладает повышенной аффинностью связывания при рН 7,4, и который содержит по меньшей мере одну аминокислотную замену G385H, D312H или N315H.
В одном из вариантов изобретения, выделенным полипептидом в соответствии с любым из предыдущих вариантов является антитело. В другом варианте изобретения указанным полипептидом является иммуноадгезин.
В предпочтительных вариантах изобретения антитело IgG в соответствии с любым из предыдущих вариантов изобретения является антителом мыши или человека, а предпочтительно, человека. IgG человека охватывает IgG человека любого изотипа, а именно, IgG1, IgG2, IgG3, IgG4. IgG мыши охватывает изотипы IgG1, IgG2a, IgG2b, IgG3. Предпочтительными терапевтическими антителами, применяемыми для лечения человека, являются гуманизованные, человеческие или химерные антитела.
В частности, настоящее изобретение относится к антителам в соответствии с предыдущими вариантами изобретения, которые связываются с группой антигенов, состоящей из CD20, Her2, BR3, TNF, VEGF, IgE, CD11а. В конкретных вариантах изобретения, рекомбинантно продуцированные гуманизованные антитела, которые связываются с конкретными антигенами, содержат последовательности, представленные в SEQ ID NO и описанные в нижеследующем разделе, озаглавленном “Композиции антител”.
В предпочтительном варианте изобретения указанным CD20 является CD20 приматов. Конкретными вариантами CD20 являются CD20 человека и собакоподобных обезьян. В более конкретных вариантах изобретения, если указанное антитело связывается с CD20 человека, то такое антитело будет содержать последовательность VH SEQ ID NO:2 и L-цепь, содержащую последовательность VL SEQ ID NO:1, или полноразмерную последовательность L-цепи SEQ ID NO:26. В другом варианте изобретения CD20-связывающее антитело содержит последовательность VL С2В8, происходящую от SEQ ID NO:24, и последовательность VH, происходящую от SEQ ID NO:25, как показано на фиг.10. В других вариантах изобретения, выделенное гуманизованное антитело, связывающееся с CD20 человека, содержит последовательности VH и VL, описанные ниже в разделе “Гуманизованные варианты 2Н7”.
В более конкретных вариантах изобретения, если указанное антитело связывается с HER2, то такое антитело содержит последовательности VL и VН, выбранные из последовательности VL SEQ ID NO:3, связанной с последовательностью VН SEQ ID NO:4; и последовательности VL SEQ ID NO:5, связанной с последовательностью VН SEQ ID NO:6. Одно из специфических антител против HER2 содержит вариант Fc-области IgG, содержащий по меньшей мере одну аминокислотную замену Asn434 на His (N434H).
Кроме того, настоящее изобретение относится к выделенному анти-HER2 антителу, содержащему последовательность VL SEQ ID NO:5, последовательность VН SEQ ID NO:6 и вариант Fc-области IgG, содержащий по меньшей мере одну аминокислотную замену Asn434 на Ala (N434A).
В предпочтительных вариантах изобретения, последовательности VH и VL согласно изобретению присоединены к константной области IgG1 человека, последовательность которой представлена на фиг.4 и на фиг.5.
В одном из аспектов изобретения антитела в соответствии с предыдущими вариантами изобретения дополнительно содержат одну или несколько аминокислотных замен в Fc-области, которые сообщают указанному антителу, по сравнению с антителом, имеющим Fc-область с нативной последовательностью, одно или несколько свойств, выбранных из таких свойств, как повышенный уровень связывания с FcγR; повышенная ADCC; повышенная CDC; пониженная CDC; повышенная ADCC и CDC; повышенная ADCC, но пониженная CDC-функция; повышенный уровень связывания с FcRn; и более длительное время полужизни в сыворотке.
Антитело в соответствии с предыдущими вариантами изобретения может дополнительно содержать одну или несколько аминокислотных замен в Fc-области IgG в положениях остатков, выбранных из группы, состоящей из D265A, S298A/E333A/K334A, K334L, K322A, K326A, K326W, E380A и E380A/T307A, где указанные остатки пронумерованы в соответствии с Европейской нумерацией по Кэбату. Если указанный полипептид имеет аминокислотную замену K334L, то он может дополнительно иметь одну или несколько аминокислотных замен в Fc-области IgG в положениях остатков, выбранных из группы, состоящей из D265A, S298A/E333A, K322A, K326A, K326W, E380A и E380A/T307A.
Настоящее изобретение также относится к композиции, содержащей полипептид или антитело в соответствии с любым из предыдущих вариантов, и носитель, такой как фармацевтически приемлемый носитель.
В другом своем аспекте настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей полипептид в соответствии с любым одним из предыдущих вариантов. Настоящее изобретение также относится к экспрессионным векторам, кодирующим полипептиды, включая антитела согласно изобретению. Настоящее изобретение также относится к клетке-хозяину, содержащей нуклеиновую кислоту, кодирующую полипептид или антитело согласно изобретению. Клетками-хозяевами, экспрессирующими и продуцирующими указанный полипептид, являются клетки СНО или бактериальные клетки E.coli. Настоящее изобретение также относится к способу продуцирования полипептидов, антител и иммуноадгезинов согласно изобретению, включающему культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую указанный полипептид, и продуцирующей такой полипептид, и выделение указанного полипептида из клеточной культуры.
В еще одном своем аспекте настоящее изобретение относится к промышленному изделию, включающему контейнер и содержащуюся в нем композицию, где указанная композиция содержит полипептид или антитело в соответствии с любым из предыдущих вариантов. Указанное промышленное изделие может дополнительно содержать вкладыш, на котором указано, что указанная композиция может быть использована для лечения заболевания, при котором может быть показано применение указанного антитела.
Настоящее изобретение относится к способу лечения В-клеточной опухоли или злокачественного заболевания, характеризующихся экспрессией CD20 В-клетками, где указанный способ включает введение пациенту, страдающему опухолевым или злокачественным заболеванием, терапевтически эффективного количества CD20-связывающего антитела, а в частности, гуманизованного CD20-связывающего антитела в соответствии с вышеописанными вариантами. В конкретных вариантах изобретения В-клеточной опухолью является не-ходжкинская лимфома (НХЛ), мелкоклеточная лимфоцитарная (МЛ) НХЛ, лимфоцитарно-предоминантная болезнь Ходжкина (ЛПБХ), фолликулярные центроклеточные (ФЦК) лимфомы, острый лейкоцитарный лейкоз (ОЛЛ), хронический лимфоцитарный лейкоз (ХЛЛ) и ретикулоэндотелиоз.
В одном из своих вариантов настоящее изобретение относится к способу лечения хронического лимфоцитарного лейкоза, включающему введение пациенту, страдающему таким лейкозом, терапевтически эффективного количества антитела, содержащего вариант Fc-области IgG в соответствии с вышеуказанными вариантами и связывающегося с CD20 человека, где указанное антитело дополнительно имеет аминокислотную замену K326A или K326W.
В другом аспекте настоящее изобретение относится к способу ослабления симптомов В-клеточного регулируемого аутоиммунного заболевания, включающему введение пациенту, страдающему таким заболеванием, терапевтически эффективного количества CD20-связывающего антитела, содержащего вариант Fc-области IgG в соответствии с вышеуказанными вариантами. В конкретных вариантах изобретения аутоиммунное заболевание выбрано из группы, состоящей из ревматоидного артрита, юношеского ревматоидного артрита, системной красной волчанки (СКВ), болезни Вегенера, воспалительного заболевания кишечника, идиопатической тромбоцитопенической пурпуры (ИТП), тромботической тромбоцитопенической пурпуры (ТТП), аутоиммунной тромбоцитопении, рассеянного склероза, псориаза, IgA-нефропатии, IgM-полиневропатии, тяжелой миастении, васкулита, сахарного диабета, синдрома Рейно, синдрома Сьегрена и гломерулонефрита.
Настоящее изобретение также относится к другим способам лечения, таким как:
способ лечения расстройства, связанного с ангиогенезом, где указанный способ включает введение пациенту, страдающему таким расстройством, терапевтически эффективного количества VEGF-связывающего антитела, содержащего вариант Fc-области IgG в соответствии с описанными выше вариантами;
способ лечения HER2-экспрессирующей раковой опухоли, включающий введение пациенту, страдающему таким раковым заболеванием, терапевтически эффективного количества HER2-связывающего антитела, содержащего вариант Fc-области IgG в соответствии с описанными выше вариантами;
способ лечения LFA-1-опосредуемого расстройства, включающий введение пациенту, страдающему таким расстройством, терапевтически эффективного количества антитела, которое связывается с CD11a человека, и которое содержит вариант Fc-области IgG в соответствии с описанными выше вариантами;
способ лечения IgE-опосредуемого расстройства, включающий введение пациенту, страдающему таким расстройством, терапевтически эффективного количества антитела, связывающегося с IgE человека и содержащего вариант Fc-области IgG в соответствии с описанными выше вариантами.
В еще одном своем аспекте настоящее изобретение относится к способу скрининга полипептида, который обладает более высокой аффинностью связывания с FcRn при рН 6,0 и более низкой аффинностью связывания при рН 7,4. Предпочтительно, полипептид обладает более высокой аффинностью связывания с FcRn человека при рН 6,0, чем полипептид или антитело, имеющие Fc IgG с нативной последовательностью. Указанный способ включает экспрессию полипептида-кандидата на фаге; получение huFcRn, иммобилизованного на твердой матрице; связывание фаговых частиц с указанным FcRn на такой матрице; удаление несвязанных фаговых частиц путем проведения множества раундов промывок в условиях высокой жесткости для каждого раунда; и элюирование оставшегося связанного фага при рН 7,4.
Краткое описание графического материала
На фигуре 1 схематически представлены нативный IgG и его ферментативное расщепление с образованием различных фрагментов антитела. Дисульфидные связи представлены как связи S-S между доменами СН1 и CL и двумя доменами СН2. V означает вариабельный домен; С означает константный домен; L означает легкую цепь, а Н означает тяжелую цепь.
На фигурах 2А и 2В представлены аминокислотные последовательности VL (фиг.2А; SEQ ID NO:5) и VH (фиг.2В; SEQ ID NO:6) анти-Her2 антитела (Трастузумаба).
На фигурах 3А и 3В представлены последовательности легкой и тяжелой цепей специфических анти-IgE антител Е25, Е26, Е27 и Hu-901.
На фигуре 4 проиллюстрировано сопоставление последовательностей Fc-области IgG человека, имеющего нативную последовательность, humIgG1 (не-А и А-аллотипов; SEQ ID NO:29 и 30, соответственно), humIgG2 (SEQ ID NO:31), humIgG3 (SEQ ID NO:32) и humIgG4 (SEQ ID NO:33), где различия между этими последовательностями помечены звездочками.
На фигуре 5 проиллюстрировано сопоставление путем выравнивания Fc-областей IgG, имеющих нативную последовательность. Показаны также нативные последовательности Fc-области IgG человека, humIgG1 (не-А и А-аллотипы)(SEQ ID NO:29 и 30, соответственно), humIgG2 (SEQ ID NO:31), humIgG3 (SEQ ID NO:32) и humIgG4 (SEQ ID NO:33). Последовательность IgG1 человека не является А-аллотипом, и различия между этой последовательностью и последовательностью А-аллотипа (в положениях 356 и 358; Европейская система нумерации) показаны внизу под последовательностью IgG1 человека. Также представлены нативные последовательности Fc-области IgG мыши, murIgG1 (SEQ ID NO:34), murIgG2a (SEQ ID NO:35), murIgG2B (SEQ ID NO:36) и murIgG3 (SEQ ID NO:37).
На фигуре 6 проиллюстрирована роль FcRn в гомеостазе IgG. Овалы внутри везикул означают FcRn.
На фигуре 7 представлена последовательность модифицированного белка Fc IgG1 человека (W0437), используемого для фагового представления. Показана также последовательность зрелого белка (SEQ ID NO:38) растворимого Fc, но часть g3p M13, используемого для фагового представления, не показана. Первый остаток в последовательности зрелого белка, Ser, соответствует мутации второго Cys шарнирной области (С229), а последний остаток (Leu) находится в положении присоединения к g3p M13. Подчеркнутый остаток соответствует положению N434.
На фигуре 8 проиллюстрирован анализ на равновесное связывание продуцируемого в E.coli Fc дикого типа и варианта Fc с FcRn человека при рН 6,0, проведенный с помощью SPR (BIAcore).
На фигуре 9 проиллюстрирован ELISA-анализ на связывание вариантов IgG1 2H7 с FcRn человека. Варианты IgG1 человека получали путем временной трансфекции клеток млекопитающих и сравнивали с гуманизованным 4D5 (герцептином®) путем проведения анализа на связывание с FcRn при рН 6,0 или при рН 7,4. Показана также ассоциация (рН 6,0) и диссоциация (рН 7,4) покрытого нейтравидином и ПХ-конъюгированного FcRn-биотинилированного козьего антитела против F(ab')2 IgG человека.
На фигуре 10 представлены последовательности легкой цепи (SEQ ID NO:24) и тяжелой цепи (SEQ ID NO:25) антитела С2В8. Константные и Fc-области показаны в рамках, а за пределами этих рамок показаны вариабельные области.
На фигуре 11 проиллюстрирован ELISA-анализ на аффинное связывание вариантов 2Н7 с FcγRIII человека (V158).
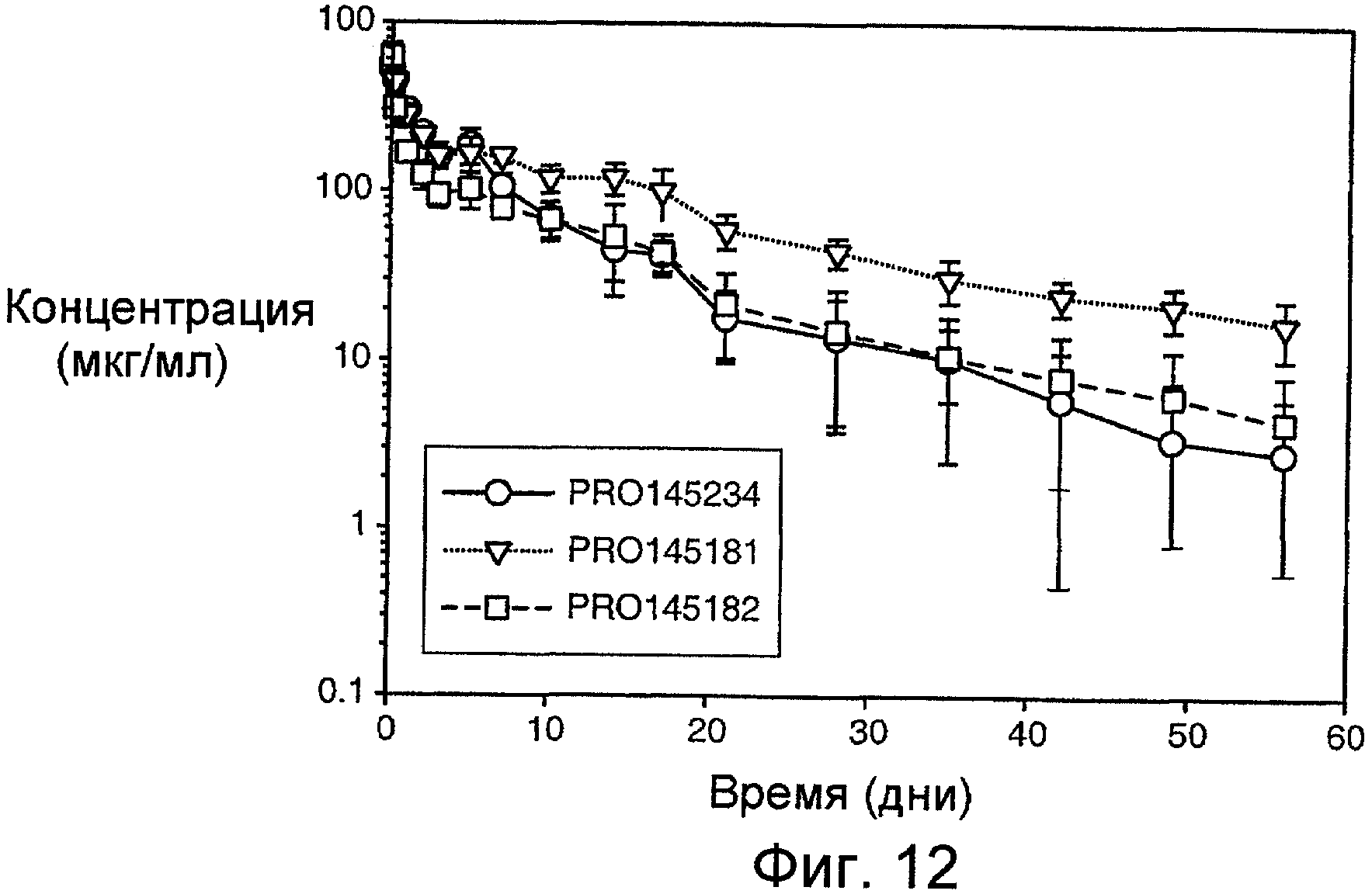
На фигуре 12 показан график временной зависимости концентрации PRO145234, PRO145181 и PRO145182 в сыворотке после их i.v.-введения собакоподобным обезьянам в виде разовой дозы, составляющей 20 мг/кг.
На фигуре 13 проиллюстрировано связывание герцептина и hu4D5(N434H) с FcRn человека при рН 6,0 и при рН 7,4, проанализированное с помощью ELISA.
Подробное описание предпочтительных вариантов изобретения
Важным компонентом гомеостаза IgG является метаболический цикл, опосредуемый рН-зависимым взаимодействием Fc-области с неонатальным рецептором клеточной поверхности, FcRn. Главной целью при конструировании антител является идентификация мутаций в Fc, повышающих аффинность комплекса Fc-FcRn при рН 6,0, с сохранением низкой аффинности при рН 7,4 (Ghetie et al., 1997). Кроме того, было бы крайне желательно минимизировать число мутаций, вводимых в Fc, во избежание возможного продуцирования иммунных ответов в виде вырабатывания антител против лекарственных средств у пациентов, подвергаемых лечению терапевтическими антителами, имеющими мутации в высококонсервативных константных доменах. Авторы настоящего изобретения идентифицировали одиночные аминокислотные мутации (N434W, N434Y и N434F; в настоящей заявке, для Fc-области IgG применяется Европейская система нумерации, описанная Кэбатом (Kabat, Sequences of Proteins of Immunological Interest (1991)), повышающие аффинность связывания Fc с FcRn человека, где указанный N434W-мутант имеет примерно в 170 раз более высокую аффинность связывания с Fc, при рН 6,0, и сохраняет низкую аффинность связывания с huFcRn при рН 7,4, при этом авторами настоящего изобретения был применен метод фагового представления и новый способ конструирования библиотек рандомизированных аминокислот.
Методы определения уровня связывания с FcRn известны специалистам (см. например, Ghetie, 1997, Hinton, 2004) и описаны в примерах. Уровень связывания с FcRn человека in vivo и время полужизни в сыворотке полипептидов, обладающих высокой аффинностью связывания с FcRn человека, могут быть проанализированы, например, в клеточных линиях трансгенных мышей или в трансфецированных клеточных линиях человека, экспрессирующих FcRn человека, или у приматов, которым вводили варианты полипептидов Fc. В отдельных вариантах изобретения указанный полипептид, а в частности, антитело согласно изобретению, имеющее вариант Fc-области IgG, обладает аффинностью связывания с FcRn человека, превышающей аффинность связывания с полипептидом, имеющим Fc IgG дикого типа по меньшей мере в 7 раз по меньшей мере в 9 раз, более предпочтительно по меньшей мере в 20 раз, еще более предпочтительно по меньшей мере в 40 раз, а наиболее предпочтительно по меньшей мере в 70-100 раз. В конкретном варианте изобретения, аффинность связывания с FcRn человека приблизительно в 70 раз превышает аффинность дикого типа.
Настоящее изобретение также относится к выделенному полипептиду, содержащему вариант Fc-области IgG, содержащий по меньшей мере одну аминокислотную замену Lys334 на лейцин (K334L). Этот полипептид связывается с FcγRIII человека с более высокой аффинностью, которая более чем в 3 раза превышает аффинность Fc IgG с нативной последовательностью. Эти полипептиды, по сравнению с полипептидами Fc IgG, имеющими нативную последовательность, предпочтительно, обладают повышенной ADCC в присутствии эффекторных клеток человека. Если указанным антителом является CD20-связывающее антитело, то ADCC-активность может быть протестирована у трансгенных мышей, экспрессирующих CD20 человека + СD16 (hCD20+/hCD16+Tg-мышей). Анализы на ADCC описаны, например, Presta, в патенте США № 6737056.
В одном из вариантов изобретения для аффинного связывания с FcRn, ЕС50 или вероятное значение Kd (при рН 6,0) указанного полипептида составляет ≤100 нМ, а более предпочтительно, ≤10 нМ. В одном из вариантов изобретения для повышенного аффинного связывания с FcγRIII (F158; т.е. низкоаффинный изотип), ЕС50 или вероятное значение Kd составляет ≤10 нМ, а для аффинного связывания с FcgRIII (V158; высокоаффинный), ЕС50 или вероятное значение Kd составляет ≤3 нМ.
В описании изобретения и в формуле изобретения, нумерация остатков в тяжелой цепи иммуноглобулина соответствует Европейской системе нумерации, описанной Кэбатом, как описано в публикации Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991), точное описание которой вводится в настоящую заявку посредством ссылки. Термин “EU-нумерация по Кэбату” означает Европейскую систему нумерации остатков антитела IgG1 человека.
Термин “родительский полипептид” означает полипептид, содержащий аминокислотную последовательность, в которой отсутствуют одна или несколько вариантов в Fc-области и которая обладает другой эффекторной функцией, отличающейся от эффекторной функции описанного здесь полипептидного варианта. Такой родительский полипептид может содержать Fc-область с нативной последовательностью или Fc-область с ранее присутствующими модификациями аминокислотной последовательности (такими как добавления, делеции и/или замены).
Термин “Fc-область” используется для определения C-концевой области тяжелой цепи иммуноглобулина, например, как показано на фиг.1. Такая “Fc-область” может представлять собой Fc-область с нативной последовательностью или вариант Fc-области. Хотя, границы Fc-области тяжелой цепи иммуноглобулина могут варьироваться, однако, Fc-область тяжелой цепи IgG человека обычно определяют как фрагмент, начинающийся от аминокислотного остатка в положении Cys226 или от остатка Pro230, и простирающийся до ее карбокси-конца. Fc-область иммуноглобулина обычно содержит два константных домена, СН2 и СН3, как показано, например, на фиг.1. Последний остаток, лизин, в тяжелой цепи IgG1 может, но необязательно, присутствовать как концевой остаток в Fc зрелого белка.
“Домен СН2” Fc-области IgG человека (также обозначаемый доменом “Cγ2”) обычно простирается примерно от аминокислоты 231 до аминокислоты 340. Уникальность домена СН2 состоит в том, что он не имеет непосредственной связи с другим доменом. Если сказать точнее, то две N-связанных разветвленных углеводных цепи располагаются между двумя доменами СН2 интактной молекулы нативного IgG. Было высказано предположение, что такой углевод может служить заменой паре “домен-домен” и может способствовать стабилизации домена СН2. См. Burton, Molec. Immunol. 22:161-206 (1985).
“Домен СН3” содержит фрагмент из остатков, простирающийся от С-конца до домена СН2 в Fc-области (т.е. он простирается приблизительно от аминокислотного остатка 341 до аминокислотного остатка 447 IgG).
“Функциональная Fc-область” обладает “эффекторной функцией” Fc-области с нативной последовательностью. Примерами “эффекторных функций” являются: связывание с C1q; комплемент-зависимая цитотоксичность; связывание с Fc-рецептором; антитело-зависимая клеточно-опосредуемая цитотоксичность (ADCC); фагоцитоз; негативная регуляция рецепторов клеточной поверхности (например, В-клеточного рецептора; BCR) и т.п. Для обеспечения таких эффекторных функций, обычно требуется, чтобы Fc-область была объединена со связывающим доменом (например, с вариабельным доменом антитела), и такие эффекторные функции могут быть проанализированы, например, различными описанными здесь методами.
“Fc-область с нативной последовательностью” содержит аминокислотную последовательность, идентичную природной аминокислотной последовательности Fc-области. Fc-области человека с нативной последовательностью представлены на фигурах 4 и 5 и включают Fc-область IgG1 человека с нативной последовательностью (не-А и А-аллотипы); Fc-область IgG2 человека с нативной последовательностью; Fc-область IgG3 человека с нативной последовательностью и Fc-область IgG4 человека с нативной последовательностью, а также их природные варианты. Fc-области мыши с нативной последовательностью представлены на фиг.5.
“Вариант Fc-области” содержит аминокислотную последовательность, отличающуюся от аминокислотной последовательности нативной Fc-области благодаря введению в эту область по меньшей мере одной “аминокислотной модификации”. Предпочтительно, чтобы такой вариант Fc-области, в отличие от Fc-области с нативной последовательностью или Fc-области родительского полипептида, имел по меньшей мере одну аминокислотную замену, например, примерно от одной до десяти аминокислотных замен, а предпочтительно, примерно от одной до пяти аминокислотных замен. Вариант Fc-области предпочтительно должен быть по меньшей мере примерно на 80%, более предпочтительно по меньшей мере примерно на 90%, а наиболее предпочтительно по меньшей мере примерно на 95% гомологичен Fc-области с нативной последовательностью и/или с Fc-областью родительского полипептида.
Термин “гомология” определен как процент остатков в модифицированной аминокислотной последовательности, которые являются идентичными после выравнивания последовательностей и введения пробелов, если это необходимо для достижения максимального процента гомологии. Методы и компьютерные программы для такого выравнивания хорошо известны специалистам. Одной из таких компьютерных программ является программа “Align 2”, разработанная фирмой Genentech Inc. и зарегистрированная в пользовательской документации в Ведомстве по копирайту США, United States Copyright Office, Washington, DC 20559, 10 декабря, 1991.
Термин “полипептид, содержащий Fc-область” означает полипептид, такой как антитело или иммуноадгезин (см. нижеследующие определения), содержащие Fc-область.
Используемые здесь термины “Fc-рецептор” или “FcR” означают рецептор, который связывается с Fc-областью антитела IgG. Предпочтительным FcR является FcR человека с нативной последовательностью. В одном из вариантов изобретения, термин “FcR” означает рецептор FcR, который охватывает рецепторы подклассов FcγRI, FcγRII и FcγRIII, включая аллельные варианты и альтернативно сплайсированные формы этих рецепторов. Рецепторы FcγRII включают FcγRIIA (“активирующий рецептор”) и FcγRIIB (“ингибирующий рецептор”), которые имеют аналогичные аминокислотные последовательности, отличающиеся, главным образом, в их цитоплазматических доменах. Активирующий рецептор FcγRIIA содержит в своем цитоплазматическом домене иммунорецепторный активирующий мотив на основе тирозина (ITAM). Ингибирующий рецептор FcγRIIВ содержит в своем цитоплазматическом домене иммунорецепторный ингибирующий мотив на основе тирозина (ITIM) (см. публикацию M. Daeron, Annu. Rev. Immunol. 15:203-234 (1997)). Этот термин включает аллотипы, такие как аллотипы FcγRIIIA: FcγRIIIA-Phe158, FcγRIIIA-VaII58, FcγRIIA-R131 и/или FcγRIIA-Н131. FcR описаны в публикациях Ravetch & Kinet, Annu. Rev. Immunol. 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994) и de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995). Используемый здесь термин “FcR” также охватывает и другие FcR, включая FcR, которые будут идентифицированы в будущем. Этот термин также включает неонатальный рецептор FcRn, ответственный за передачу материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) and Kim et al., J. Immunol. 24:249 (1994)).
“Антитело-зависимая клеточно-опосредуемая цитотоксичность” или “ADCC” означает форму цитотоксичности, при которой секретированный Ig, связанный с Fc-рецепторами (FcR), присутствующими на некоторых цитотоксических клетках (например, природных клетках-киллерах (NK), нейтрофилах и макрофагах), сообщает этим цитотоксическим эффекторным клеткам способность специфически связываться с антиген-содержащими клетками-мишенями, и, тем самым, уничтожать клетки-мишени, содержащие цитотоксины. Такие антитела “нейтрализуют” цитотоксические клетки и крайне необходимы для их уничтожения. Первичные клетки, опосредующие ADCC, а именно, NK-клетки, экспрессируют только FcγRIII, тогда как моноциты экспрессируют FcγRI, FcγRII и FcγRIII. Экспрессия FcR на гемопоэтических клетках систематизирована в таблице 3 на стр.464 публикации Ravetch & Kinet, Annu. Rev. Immunol. 9:457-92 (1991). Для оценки ADCC-активности представляющей интерес молекулы может быть проведен анализ на ADCC in vitro, такой как анализ, описанный в патентах США №№ 5500362 или 5821337. Эффекторными клетками, подходящими для таких анализов, являются мононуклеарные клетки периферической крови (МКПК) и природные клетки-киллеры (NK). Альтернативно или дополнительно, ADCC-активность представляющей интерес молекулы может быть оценена in vivo, например, у животного-модели, такого как животное, описанное в публикации Clynes et al. PNAS (USA) 95:652-656 (1998).
“Эффекторными клетками человека” являются лейкоциты, экспрессирующие один или несколько FcR, и обладающие эффекторными функциями. Предпочтительно, указанные клетки экспрессируют по меньшей мере FcγRIII и обладают эффекторной ADCC-функцией. Примерами лейкоцитов человека, опосредующих ADCC, являются мононуклеарные клетки периферической крови (МКПК), природные клетки-киллеры (NK), моноциты, цитотоксические Т-клетки и нейтрофилы, при этом предпочтительными являются МКПК и NK-клетки. Эффекторные клетки могут быть выделены из их природного источника, например, из описанных здесь клеток крови или МКПК.
“Комплемент-зависимая цитотоксичность” или “CDC” означает лизис клеток-мишеней в присутствии комплемента. Активация классического пути комплемента инициируется связыванием первого компонента системы комплемента (C1q) с антителами (соответствующего подкласса), которые связываются с их когнатным антигеном. Для оценки активации комплемента может быть проведен анализ на CDC, описанный, например, в публикации Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996).
Полипептид, имеющий вариант Fc-области IgG с “измененной” аффинностью связывания с FcR или ADCC-активностью, представляет собой полипептид, обладающий повышенной или пониженной активностью связывания с FcR (FcγR или FcRn) и/или ADCC-активностью по сравнению с активностями родительского полипептида или полипептида, содержащего Fc-область с нативной последовательностью. Fc-вариант, который “обладает повышенной аффинностью связывания” с FcR, связывается по меньшей мере с одним FcR с аффинностью, превышающей аффинность связывания родительского полипептида. Такая аффинность связывания, по сравнению с аффинностью связывания родительского полипептида, может быть увеличена примерно в 3 раза, а предпочтительно, примерно в 5, 10, 25, 50, 60, 100, 150, 200 или в 500 раз, или примерно на 25%-1000%. Полипептидный вариант, который “обладает пониженной аффинностью связывания” с FcR, связывается по меньшей мере с одним FcR c меньшей аффинностью, чем родительский полипептид. Аффинность связывания, по сравнению с аффинностью связывания родительского полипептида, может быть снижена примерно на 40% или ниже. Такие Fc-варианты, обладающие пониженной аффинностью связывания с FcR, могут иметь незначительную аффинность связывания с FcR, либо они могут иметь почти недетектируемую аффинность связывания с FcR, например, их аффинность связывания с FcR может составлять 0-20% от аффинности Fc-области нативного IgG, например, как определено в нижеследующих примерах.
Полипептид, имеющий вариант Fc-области, который связывается с FcR с “лучшей аффинностью” или с “более высокой аффинностью”, чем аффинность полипептида или родительского полипептида, имеющего IgG Fc c последовательностью дикого типа или с нативной последовательностью, представляет собой полипептид, который связывается с любым одним или несколькими из идентифицированных выше FcR со значительно более высокой аффинностью связывания, чем аффинность связывания родительского полипептида, содержащего нативную Fc, если количество полипептида с вариантом Fc и количество родительского полипептида в анализе на связывание является, в основном, одинаковым. Так, например, вариант полипептида Fc, обладающий повышенной аффинностью связывания с FcR, может обладать примерно в 2-300 раз, например, примерно в 3-170 раз большей аффинностью связывания с FcR по сравнению с аффинностью родительского полипептида, где указанную аффинность связывания с FcR определяют, например, как описано в нижеследующих примерах.
Полипептид, содержащий вариант Fc-области, который “обладает повышенной ADCC” или опосредует антитело-зависимую клеточно-опосредуемую цитотоксичность (ADCC) в присутствии эффекторных клеток человека более эффективно, чем полипептид, имеющий IgG Fc дикого типа, представляет собой полипептид, который обладает in vitro или in vivo значительно более высокой эффективностью опосредования ADCC, если используемое в анализе количество полипептида, имеющего вариант Fc-области, и количество полипептида, имеющего Fc-область дикого типа, является, по существу, одинаковым. В общих чертах, такие варианты могут быть идентифицированы путем проведения описанного здесь ADCC-анализа in vitro, однако, рассматриваются и другие анализы или методы определения ADCC-активности, например, у животного-модели и т.п. Предпочтительным вариантом является вариант, который примерно в 5-100 раз, например, примерно в 25-50 раз более эффективно опосредует ADCC по сравнению с Fc дикого типа.
Термин “аминокислотная модификация” означает изменение в предварительно определенной аминокислотной последовательности. Репрезентативными модификациями являются аминокислотные замены, инсерции и/или делеции. Предпочтительной аминокислотной модификацией, используемой в настоящем изобретении, является замена.
Термин “аминокислотная модификация в конкретном положении”, например, в Fc-области, означает замену или делецию конкретного остатка, или инсерцию по меньшей мере одного аминокислотного остатка, смежного с указанным конкретным остатком. Термин “инсерция смежного конкретного остатка” означает инсерцию в положении одного или двух остатков. Такая инсерция может быть введена со стороны N-конца или со стороны С-конца по отношению к конкретному остатку.
Термин “аминокислотная замена” означает замену по меньшей мере одного аминокислотного остатка, присутствующую в предварительно определенной аминокислотной последовательности, другим аминокислотным остатком-заместителем. Таким остатком-заместителем или остатками-заметителями могут быть “природные аминокислотные остатки” (т.е. кодируемые генетическим кодом) и эти остатки выбирают из группы, состоящей из аланина (Ala); аргинина (Arg); аспарагина (Asn); аспарагиновой кислоты (Asp); цистеина (Cys); глутамина (Gln); глутаминовой кислоты (Glu); глицина (Gly); гистидина (His); изолейцина (Ile); лейцина (Leu); лизина (Lys); метионина (Met); фенилаланина (Phe); пролина (Pro); серина (Ser); треонина (Thr); триптофана (Trp); тирозина (Tyr) и валина (Val). При этом, предпочтительно, чтобы замененный остаток не являлся цистеином. В определение используемого здесь термина “аминокислотная замена” входит также замена одним или несколькими не-природными аминокислотными остатками. Термин “не-природный аминокислотный остаток” означает остаток, не принадлежащий к перечисленным выше природным аминокислотным остаткам, и способный ковалентно связываться со смежным(ми) аминокислотным(ми) остатком(ами) в полипептидной цепи. Примерами не-природных аминокислотных остатков являются норлейцин, орнитин, норвалин, гомосерин и другие аналогичные аминокислотные остатки, такие как остатки, описанные в публикации Ellman et al., Meth. Enzym. 202:301-336 (1991). Для получения таких не-природных аминокислотных остатков могут быть проведены процедуры, описанные Noren et al. Science 244:182 (1989) и Ellman et al., см.выше. Вкратце, эти процедуры включают химическую активацию супрессорной тРНК с не-природным аминокислотным остатком, и последующей in vitro транскрипцией и трансляцией РНК.
Используемый в настоящем изобретении термин “консервативная” аминокислотная замена означает аминокислотные замены функционально эквивалентными аминокислотами. Консервативные аминокислотные замены приводят к образованию “молчащих” мутаций в аминокислотной последовательности полученного пептида. Так, например, одна или несколько аминокислот с одинаковой полярностью действуют как функциональные эквиваленты и образуют “молчащую” альтерацию в аминокислотной последовательности пептида. В общих чертах, замены аминокислот в пределах определенной группы могут рассматриваться как консервативные в отношении их структуры и функции. Однако специалисту в данной области известно, что роль конкретного остатка определяется его окружением в трехмерной структуре молекулы, в которой он присутствует. Так, например, остатки Cys могут присутствовать в окисленной (дисульфидной) форме, которая является менее полярной, чем восстановленная (тиоловая) форма. Длинноцепочечная алифатическая часть боковой цепи остатка Arg может быть решающим фактором в его структурной или функциональной роли, и эта часть может сохранять наибольшую консервативность при замене неполярным остатком, а не каким-либо другим основным остатком. Кроме того, следует отметить, что боковые цепи, содержащие ароматические группы остатков (Trp, Tyr и Phe), могут участвовать в ионо-ароматических или “катионных-π“- взаимодействиях. В этих случаях, замена одной из этих боковых цепей членом кислотной или незаряженной полярной группы, может быть консервативной в отношении их структуры и функции. Остатки, такие как Pro, Gly и Cys (в дисульфидной форме) могут оказывать непосредственное влияние на конформацию главной цепи, и в большинстве случаев, они не могут быть заменены так, чтобы это не приводило к нарушению структуры.
Термин “аминокислотная инсерция” означает введение по меньшей мере одной аминокислоты в предварительно определенную аминокислотную последовательность. Хотя инсерция обычно включает введение одного или двух аминокислотных остатков, однако, в настоящей заявке также рассматриваются и более крупные “пептидные инсерции”, например, инсерция примерно от трех до пяти или даже примерно до десяти аминокислотных остатков. Введенный(ые) остаток(тки) может(гут) быть природным(и) или не-природным(и) остатком(ами), как описано выше.
Термин “аминокислотная делеция” означает удаление по меньшей мере одного аминокислотного остатка из предварительно определенной аминокислотной последовательности.
Аминокислоты могут быть подразделены на группы по общим свойствам их боковых цепей (как описано в публикации A.L. Lehninger, Biochemistry, second ed., pp.73-75, Worth Publishers, New York (1975)):
(1) неполярные: Ala(A), Val(V), Ile(I), Pro(P), Phe(F), Trp(W), Met(M);
(2) незаряженные полярные: Gly(G), Ser(S), Thr(T), Cys(C), Tyr(Y), Asn(N), Gln(Q);
(3) кислотные: Asp(D), Glu(E);
(4) основные: Lys(K), Arg(R), His(H).
Альтернативно, природные остатки могут быть подразделены на группы по общим свойствам их боковых цепей:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
“Шарнирная область”, по существу, определена как фрагмент, простирающийся от Glu216 до Pro230 IgG1 человека (Burton, Molec. Immunol. 22:161-206 (1985)). Шарнирные области IgG других изотипов могут быть сопоставлены с последовательностью IgG1 путем введения первого и последнего цистеиновых остатков, образующих межцепьевые S-S-связи тяжелой цепи в одних и тех же положениях.
“Нижняя шарнирная область” Fc-области обычно определяется как фрагмент, состоящий из остатков, непосредственно примыкающих к шарнирной области у ее С-конца, т.е., остатков 233-239 Fc-области. В предшествующих работах, способность связываться с FcγR обычно приписывалась аминокислотным остаткам, находящимся в нижней шарнирной области Fc IgG.
“C1q” представляет собой полипептид, включающий сайт связывания с Fc-областью иммуноглобулина. C1q вместе с двумя сериновыми протеазами, C1r и C1s, образует комплекс С1, т.е., является первым компонентом пути комплемент-зависимой цитотоксичности (CDC). C1q человека может быть закуплен, например, у фирмы Quidel, San Diego, CA.
Термин “связывающий домен” означает область полипептида, связывающегося с другой молекулой. В случае FcR, такой связывающий домен может содержать часть его полипептидной цепи (например, его α-цепи), ответственной за связывание с Fc-областью. Одним из таких подходящих связывающих доменов является внеклеточный домен α-цепи FcR.
Термин “антитело” используется здесь в самом широком смысле, а в частности, охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они обладают нужной биологической активностью.
“Функциональные фрагменты” антител согласно изобретению содержат часть интактного антитела, в основном, включая антигенсвязывающую или вариабельную область интактного антитела или Fc-область антитела, которое сохраняет способность связываться с FcR. Примерами фрагментов антител являются линейные антитела, одноцепочечные молекулы антител и мультиспецифические антитела, образованные фрагментами антител.
Используемый здесь термин “моноклональное антитело” означает антитело, происходящее от популяции, по существу, гомогенных антител, т.е., отдельные антитела, входящие в состав такой популяции, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными и направлены против одного антигенного сайта. Кроме того, в противоположность стандартным препаратам, полученным на основе антител (поликлональных), которые обычно включают различные антитела против различных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Моноклональные антитела, помимо их специфичности, обладают преимуществами, заключающимися в том, что они могут быть синтезированы в гибридомной культуре, не содержащей примесей в виде других иммуноглобулинов. Термин “моноклональный” относится к типу антитела, происходящего, по существу, от гомогенной популяции антител, и не означает, что такое антитело должно быть получено каким-либо конкретным методом. Так, например, моноклональные антитела, используемые в соответствии с настоящим изобретением, могут быть получены гибридомным методом, впервые описанным Kohler et al., Nature 256:495 (1975), либо они могут быть получены методами рекомбинантных ДНК (см. например, патент США № 4816567). “Моноклональные антитела” могут быть также выделены из фаговых библиотек антител методами, описанными, например, Clackson et al., Nature, 325:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991).
Используемыми здесь моноклональными антителами, в частности, являются “химерные” антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям антител, происходящих от конкретного вида или принадлежащих к конкретному классу или подклассу, а остальная(ые) часть(и) идентична(ы) или гомологична(ы) соответствующим последовательностям антител, происходящих от другого вида или принадлежащих к другому классу или подклассу, а также фрагменты таких антител, при условии, что они обладают нужной биологической активностью (патент США № 4816567; Morrison et al., Proc. Natl. Acad. Sci., USA, 81:6851-6855 (1984)). Методы получения химерных антител известны специалистам.
“Гуманизованными” формами не-человеческих (например, мыши) антител являются химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), содержащие минимальное число последовательностей, происходящих от не-человеческого иммуноглобулина. По большей части, гуманизованными антителами являются иммуноглобулины человека (реципиентное антитело), в которых остатки, происходящие от гипервариабельной области (CDR) реципиента заменены остатками, происходящими от CDR животного, не являющегося человеком (донорного антитела), такого как мышь, крыса или кролик, и обладающими нужной специфичностью, аффинностью и емкостью. В некоторых случаях, остатки каркасной области (FR) Fv иммуноглобулина человека заменены соответствующими не-человеческими остатками. Кроме того, гуманизованные антитела могут содержать остатки, не присутствующие ни в реципиентном антителе, ни в “импортных” CDR или каркасных последовательностях. Эти модификации вводят для дополнительного улучшения и максимизации эффективности антитела. В общих чертах, гуманизованное антитело содержит, в основном по меньшей мере один, а обычно два вариабельных домена, в которых все или, в основном, все гипервариабельные петли соответствуют петлям не-человеческого иммуноглобулина, а все или почти все области FR являются областями, имеющими последовательность иммуноглобулина человека, хотя указанные области FR могут включать одну или несколько аминокислотных замен, повышающих аффинность связывания. Число этих аминокислотных замен в FR обычно не превышает 6 в Н-цепи и не превышает 3 в L-цепи. В оптимальном случае, гуманизованное антитело также содержит по меньшей мере часть константной области иммуноглобулина (Fc), обычно, иммуноглобулина человека. Подробное описание можно найти в публикации Jones et al., Nature, 321:522-525 (1986); Reichmann et al., Nature, 332:323-329 (1988) и Presta, Curr. Op. Struct. Biol., 2:593-596 (1992). Термин “гуманизованное антитело” включает приматизированное® антитело, антигенсвязывающая область которого происходит от антитела, продуцируемого, например, в результате иммунизации макак представляющим интерес антигеном. Методы получения гуманизованных антител известны специалистам.
Антитела человека могут быть также получены различными методами, известными специалистам, включая применение библиотек фагового представления. Hoogenboom & Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991). Для получения моноклональных антител человека могут быть также применены методы, описанные Cole et al. и Boerner et al. Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p.77 (1985); Boerner et al., J. Immunol. 147(1):86-95 (1991).
Используемый здесь термин “иммуноадгезин” означает антитело-подобные молекулы, обладающие специфичностью связывания с гетерологичным белком (“адгезином”) и эффекторными функциями константных доменов иммуноглобулина. По своей структуре, иммуноадгезины представляют собой гибридную аминокислотную последовательность, которая обладает нужной специфичностью связывания, не относящейся к распознаванию антигена, и которая содержит связывающий сайт антитела (т.е., оно является “гетерологичным”) и последовательность константного домена иммуноглобулина. Адгезиновая часть молекулы иммуноадгезина обычно представляет собой смежную аминокислотную последовательность, содержащую по меньшей мере сайт связывания с рецептором или лигандом. Последовательность константного домена иммуноглобулина в указанном иммуноадгезине может происходить от любого иммуноглобулина, такого как иммуноглобулины подтипов IgG1, IgG2, IgG3 или IgG4, IgA (включая IgA1 и IgA2), IgE, IgD или IgM. Так, например, подходящими иммуноадгезинами согласно изобретению являются полипептиды, содержащие BLyS-связывающие части рецептора BLyS, в котором отсутствуют трансмембранные или цитоплазматические последовательности. В одном из вариантов изобретения, внеклеточный домен BR3, TACI или BCMA присоединен к константному домену последовательности иммуноглобулина.
Термины “гибридный белок” и “гибридный полипептид” означают полипептид, имеющий две части, ковалентно связанные друг с другом, где каждой из этих частей являются полипептиды с различными свойствами. Таким свойством может быть биологическое свойство, такое как активность in vitro или in vivo. Указанным свойством может быть обычное химическое или физическое свойство, например, способность связываться с молекулой-мишенью, способность катализировать реакцию и т.п. Эти две части могут быть непосредственно присоединены друг к другу простой пептидной связью или посредством пептидного линкера, содержащего один или несколько аминокислотных остатков. Вообще говоря, эти две части и линкер могут быть связаны между собой с сохранением рамки считывания.
“Выделенными” полипептидами или антителами являются полипептиды или антитела, которые были идентифицированы и отделены от компонента и/или выделены из компонента их природной среды. Примесными компонентами его природной среды являются вещества, негативно влияющие на диагностическое или терапевтическое применение указанного полипептида или антитела, и такими веществами могут быть ферменты, гормоны и другие белковые или небелковые растворенные вещества. В предпочтительных вариантах изобретения, указанное антитело может быть очищено (1) более, чем на 95% по массе антитела, как было определено методом Лаури, а более предпочтительно, более, чем на 99% по массе антитела, (2) до степени, достаточной для получения по меньшей мере 15 остатков в N-концевой или внутренней аминокислотной последовательности, с использованием секвенатора с центрифужной чашкой, или (3) до гомогенности, как может быть определено с помощью электрофореза в ДСН-ПААГ в восстановительных или в невосстанавительных условиях путем окрашивания кумасси синим, или, предпочтительно, серебром. Термин “выделенное антитело” включает антитело in situ, присутствующее в рекомбинантных клетках, при условии, что в нем отсутствует по меньшей мере один компонент его природного окружения. Однако, обычно, выделенное антитело может быть получено по меньшей мере в одну стадию очистки.
Биологическая активность СD20-связывающих антител и гуманизованных CD20-связывающих антител согласно изобретению включает по меньшей мере способность указанного антитела связываться с CD20 человека, а более предпочтительно, с CD20 человека и других приматов (включая собакоподобных обезьян, макак-резусов и шимпанзе). Такие антитела связываются с CD20 при величине Kd, не превышающей 1×10-8, а предпочтительно, при величине Kd, не превышающей примерно 1×10-9, и обладают способностью уничтожать или удалять В-клетки in vivo, предпочтительно по меньшей мере на 20%, по сравнению с соответствующим негативным контролем, не обработанным таким антителом. Истощение В-клеток может происходить под действием одной или нескольких ADCC, CDC или других механизмов. В некоторых вариантах изобретения, относящихся к лечению заболеваний, для достижения указанных биологических функций, таких как ADCC, может оказаться желательным наличие, помимо прочих, специфических эффекторных функций или механизмов, при этом, некоторые варианты гуманизованного 2Н7 являются предпочтительными.
Термины “лечение” или “терапия” или “ослабление симптомов” означают терапевтическое лечение индивидуума, проводимое в целях уменьшения или ослабления симптомов подвергаемого лечению патологического состояния или расстройства. Лечение индивидуума, страдающего CD20-позитивным раковым заболеванием или аутоиммунным заболеванием, считается успешным, если после введения указанному индивидууму терапевтического количества CD20-связывающего антитела согласно изобретению в соответствии со способами настоящего изобретения, у данного индивидуума наблюдается детектируемое и/или заметное уменьшение или ослабление признаков и симптомов конкретного заболевания, или, если такие признаки и симптомы вообще отсутствуют. Так, например, при лечении рака, такими признаками являются: уменьшение числа раковых клеток или отсутствие раковых клеток; уменьшение размера опухоли; ингибирование (т.е., уменьшение до некоторой степени, а предпочтительно, уничтожение) метастазов опухоли; ингибирование, до некоторой степени, роста опухоли; увеличение периода ремиссии, и/или ослабление, до некоторой степени, одного или нескольких симптомов, связанных с конкретным раковым заболеванием; уменьшение заболеваемости и смертности, и улучшение качества жизни. Данный пациент может также ощущать ослабление признаков или симптомов заболевания. Лечение может также приводить к полному выздоровлению пациента, определяемому как исчезновение всех признаков рака, либо оно может давать частичный эффект, при котором размер опухоли снижается, предпочтительно, более, чем на 50%, а еще более предпочтительно, на 75%. Пациентом, страдающим данным заболеванием, также считается пациент, у которого наблюдается стабильное заболевание. В предпочтительном варианте изобретения, пациентами, страдающими раком, являются пациенты, у которых уже не наблюдается прогрессирование рака через один год, а предпочтительно, через 15 месяцев. Эти параметры оценки успешного лечения и положительной динамики заболевания могут быть легко установлены рутинными методами, известными врачам-специалистам в данной области.
Термин “терапевтически эффективное количество” означает количество антитела или лекарственного средства, эффективное для “лечения” заболевания или расстройства у индивидуума. В случае рака, терапевтически эффективное количество указанного лекарственного средства может снижать число раковых клеток; уменьшать размер опухоли; ингибировать (т.е., снижать до определенной степени, а предпочтительно, прекращать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е., снижать до определенной степени, а предпочтительно, прекращать) развитие метастазов опухоли; ингибировать, до некоторой степени, рост опухоли, и/или ослаблять, до некоторой степени, один или несколько симптомов, связанных с раком. См. приведенное ранее определение термина “лечение”. Лекарственное средство, до той степени, в которой оно может предупреждать рост раковых клеток и/или уничтожать имеющиеся раковые клетки, может быть цитостатическим и/или цитотоксическим.
Термин “непрерывное” введение, в отличие от однократного введения, означает длительное введение указанного(ых) средства(в), так, чтобы начальный терапевтический эффект (активность) поддерживался в течение более длительного периода времени. Термин “периодическое введение” означает введение, которое не проводится в течение длительного периода времени без перерыва, а носит циклический характер.
Используемый здесь термин “цитотоксическое средство” означает вещество, ингибирующее или предотвращающее функцию клеток и/или вызывающее деструкцию клеток. Этот термин включает радиоактивные изотопы (например,211At131I,125I,90Y,186Re,188Re,153Sm,212Bi,32Р и радиоактивные изотопы Lu), химиотерапевтические средства, например, метотрексат, адриамицин, винкаалкалоиды (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты, ферменты и их фрагменты, такие как нуклеолитические ферменты, антибиотики и токсины, такие как токсины в виде небольших молекул, или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты, и различные противоопухолевые или противораковые средства, описанные ниже. Ниже описаны и другие цитотоксические средства.
Используемый здесь термин “рост-ингибирующее средство” означает соединение или композицию, ингибирующие рост клеток, а в частности, рост CD20-экспрессирующих раковых клеток, либо in vitro, либо in vivo. Таким образом, средством, ингибирующим рост клеток, может быть средство, значительно снижающее процент PSCA-экспрессирующих клеток в фазе S. Примерами средств, ингибирующих рост клеток, являются средства, блокирующие прохождение клеточного цикла (в другой фазе, кроме фазы S), такие как средства, индуцирующие блокирование фазы G1 и фазы М. Классическими средствами, блокирующими фазу М, являются винкаалкалоиды (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как доксорубицин, эпирубицин, даунорубицин, этопозид и блеомицин. Средствами, блокирующими фазу G1, а также блокирующими переход в фазу S, являются, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлоретамин, цисплатин, метотрексат, 5-фторурацил и ara-C. Дополнительную информацию можно найти в публикации “The Molecular Basis of Cancer”, Mendelsohn & Israel, eds., в главе 1, озаглавленной “Cell cycle regulation, oncogenes and antineoplastic drugs”, Murakami et al. (WB Saunders: Philadelphia, 1995), а в частности, на стр.13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые лекарственные средства, изготавливаемые из дерева тиса. Доцетаксел (Таксотер®, Rhone-Poulenc Rorer), изготавливаемый из Европейского тиса, представляет собой полусинтетический аналог паклитаксела (Таксола®, Bristol-Myers Squibb). Паклитаксел и доцетаксел индуцируют сборку микротрубочек из тубулиновых димеров и стабилизируют микротрубочки путем предупреждения деполимеризации, что приводит к ингибированию митоза клеток.
“Химиотерапевтическое средство” представляет собой химическое соединение, используемое для лечения рака. Примерами химиотерапевтических средств являются алкилирующие агенты, такие как тиотепа и циклофосфамид (цитоксан®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая альтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; азотные аналоги горчичного газа, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, гидрохлорид оксида мехлоретамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урациловый аналог горчичного газа; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, калихеамицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин, эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, микофеноловая кислота, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексан, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин, 5-FU; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; антиадренергические средства, такие как аминоглютетимид, митотан, трилостан; заменитель фолиевой кислоты, такой как фролиновая кислота; ацеглатон; альдофосфамидный гликозид; аминолевулиновая кислота; амсакрин; бестрабуцил; бизантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; ацетат эллиптиния; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидамин; митогуазон; митоксантрон; мопидамнол; нитракрин; пентостатин; фенамет; пирарубицин; подофиллиновая кислота; 2-этилгидразид; прокарбизин; PSK®; разоксан; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2”-трихлортриэтиламин; уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (“Ara-C”); циклофосфамид; тиотепа; таксоиды, например, паклитаксел (Таксол®, Bristol-Myers Squibb Oncology, Princeton, N.J.) и доцетаксел (Таксотер®, Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; гемцитабин; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платина; этопозид (VP-16); ифосфамид; митомицин-С; митоксантрон; винкристин; винорелбин, навелбин; новантрон; тенипозид; дауномицин; аминоптерин; кселода; ибандронат; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДМФО); ретиноевая кислота; эсперамицины; капецитабин; и фармацевтически приемлемые соли, оксиды или производные всех вышеуказанных соединений. В определение этого термина также входят противогормональные средства, регулирующие или ингибирующие действие гормонов на опухоли, такие как антиэстрогены, включая, например, тамоксифен, ралоксифен, 4-(5)-имидазолы, ингибирующие ароматазу, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен Фарестон®; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; и фармацевтически приемлемые соли, оксиды или производные любого из вышеупомянутых соединений.
Используемый здесь термин “носители” включает фармацевтически приемлемые носители, наполнители или стабилизаторы, которые является нетоксичными для клеток или млекопитающих, обработанных указанными носителями в соответствующих дозах и концентрациях. В большинстве случаев, физиологически приемлемым носителем является водный рН-забуференный раствор. Примерами физиологически приемлемых носителей являются буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярный (содержащий менее, чем примерно, 10 остатков) полипептид; белки, такие как сывороточный альбумин, желатин, или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; спирты ряда сахаров, такие как маннит или сорбит; солеобразующие противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как твинТМ, полиэтиленгликоль (ПЭГ) и плюроникиТМ.
Термин “млекопитающее” означает любое животное, классифицированное как млекопитающее, включая, человека, домашних и сельскохозяйственных животных, животных, содержащихся в зоопарках, животных, участвующих в спортивных состязаниях или домашних питомцев, таких как собаки, лошади, кошки, коровы и т.п. Предпочтительным млекопитающим согласно изобретению является человек.
Композиции
В конкретных вариантах изобретения, антитела содержат последовательности V-домена или полноразмерные последовательности, представленные ниже, а также имеют Fc-мутации согласно изобретению, которые улучшают одну или несколько эффекторных функций Fc.
Полипептиды и антитела согласно изобретению могут также иметь и другие аминокислотные замены, которые, например, усиливают или ослабляют другие функции Fc или дополнительно улучшают эти функции Fc, повышают аффинность связывания с антигеном, повышают стабильность, изменяют характер гликозилирования или включают аллотипические варианты. Указанные антитела могут также содержать одну или несколько аминокислотных замен в Fc-области, которые будут сообщать антителу одно или несколько свойств, выбранных из повышенной аффинности связывания с FcγR, повышенной ADCC, повышенной CDС, пониженной CDС, улучшенной ADCC- и CDС-функции, повышенной ADCC-функции, но пониженной CDС-функции (например, для минимизации инфузионной реакции), повышенной аффинностью связывания с FcRn и увеличенного времени полужизни в сыворотке, по сравнению с полипептидом и антителами, имеющими Fc дикого типа. Такие активности могут быть измерены описанными здесь методами.
Другие аминокислотные модификации, улучшающие функцию Fc, можно найти в патенте США 6737056, описание которого вводится в настоящее изобретение посредством ссылки. Любые антитела согласно изобретению могут также иметь по меньшей мере одну аминокислотную замену в Fc-области, снижающую CDC-активность, например, они могут иметь по меньшей мере замену в положении К322А. См. патент США № 6528624В1 (Idusogie et al.). Мутациями, улучшающими ADCC- и CDC-функцию, являются S298A/E333A/K334A, также называемые в настоящем изобретении тройным Ala-мутантом. K334L повышает уровень связывания с CD16. К322А снижает CDC-активность; K326A или K326W повышают CDC-активность, а D265А снижает ADCC-активность. Варианты гликозилирования, усиливающие ADCC-функцию, описаны в заявке WO 03/035835, которая вводится в настоящее изобретение посредством ссылки. Стабилизирующими вариантами являются варианты, повышающие стабильность, например, в отношении окисления и дезамидирования.
Рекомбинантный гуманизованный вариант анти-HER2 антитела мыши 4D5 (huMAb4D5-8, rhuMAbHER2, трастузумаб или герцептин®, патент США № 5821337) является клинически активным у пациентов, страдающих раком молочной железы с HER2-сверхэкспрессирующими метастазами и прошедших интенсивную противораковую терапию (Baselga et al., J. Clin. Oncol. 14:737-744 (1996)). Антитело трастузумаб, на промышленное производство которого было получено разрешение, выданное 25 сентября 1998 Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств, может быть использовано для лечения пациентов, страдающих раком молочной железы с метастазами, сверхэкспрессирущими белок HER2.
Другие анти-HER2 антитела с различными свойствами описаны в публикациях Tagliabue et al., Int. J. Cancer 47:933-937 (1991); McKenzie et al., Oncogene 4:543-548 (1989); Maier et al., Cancer Res. 51:5361-5369 (1991); Bacus et al., Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al., PNAS (USA) 88:8691-8695 (1991); Bacus et al. Cancer Research 52:2580-2589 (1992); Xu et al., Int. J. Cancer 53:401-408 (1993); WO 94/00136; Kazprzyk et al. Cancer Research 52:2771-2776 (1992); Hancock et al., Cancer Res. 51:4575-4580 (1991); Shawver et al., Cancer Res. 54:1367-1373 (1994); Arteaga et al., Cancer Res. 54:3758-3765 (1994); Harwerth et al., J. Biol. Chem. 267:15160-15167 (1992); в патенте США № 5783186 и в публикации Klapper et al., Oncogene 14:2099-2109 (1997).
В одном из вариантов изобретения, анти-HER2 антитело содержит нижеследующие последовательности доменов VL и VH (CDR показаны жирным шрифтом):
VL гуманизованного варианта 2С4 антитела 574 (SEQ ID NO:3)

и VH гуманизованного варианта 2С4 антитела 574 (SEQ ID NO:4)

В другом варианте изобретения, анти-HER2 антитело трастузумаб содержит последовательности доменов VL (SEQ ID NO:5) и VH (SEQ ID NO:6), показанные на фигуре 2А и фигуре 2В.
В конкретных вариантах изобретения, анти-VEGF антитела согласно изобретению содержат нижеследующие последовательности:
В одном из вариантов изобретения, анти-VEGF антитело содержит последовательность VL (SEQ ID NO:7)

и
последовательность VH (SEQ ID NO:8)

В другом варианте изобретения, анти-VEGF антитело содержит последовательность VL (SEQ ID NO:9)

и
последовательность VН (SEQ ID NO:10)

В третьем варианте изобретения, анти-VEGF антитело содержит последовательность VL (SEQ ID NO:11)

и
последовательность VН (SEQ ID NO:12)

Гуманизованное анти-CD11a антитело эфализумаб или Raptiva® (патент США № 6037454), на промышленное производство которого было получено разрешение, выданное 27 октября 2003 Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств, может быть использовано для лечения пациентов, страдающих псориазом. В одном из своих вариантов, настоящее изобретение относится к антителу против CD11a человека, имеющему мутации в Fc-области согласно изобретению, улучшающие одну или несколько эффекторных функций Fc, где указанное антитело содержит VL- и VH-последовательности HuMHM24, представленные ниже:
Вариабельная область легкой цепи (SEQ ID NO:13):


Вариабельная область тяжелой цепи (SEQ ID NO:14):

Антитело против CD11а человека может содержать VH SEQ ID NO:14 и полноразмерную L-цепь HuMHM24, имеющую последовательность:

В конкретных вариантах изобретения, анти-IgE антитела, имеющие Fc-мутации согласно изобретению, которые улучшают одну или несколько эффекторных функций Fc, содержат по меньшей мере последовательности V-области анти-IgE антител Е25, Е26, Е27 и Hu-901, последовательности L- и H-цепи которых представлены на фигурах 3А и 3В. Последовательностями легкой цепи являются: L-цепь Е25 (SEQ ID NO:16); L-цепь E26 (SEQ ID NO:17); L-цепь Е27 (SEQ ID NO:18) и L-цепь Hu-901 (SEQ ID NO:19). Последовательностями тяжелой цепи являются: Н-цепь Е25 (SEQ ID NO:20); Н-цепь E26 (SEQ ID NO:21); Н-цепь Е27 (SEQ ID NO:22) и Н-цепь Hu-901 (SEQ ID NO:23). В анти-IgE антителах, представленных на фигурах 3А и 3В, VL-область заканчивается последовательностью VEIK (остаток 111 на фигуре 3А), а VH-область заканчивается последовательностью VTVSS (приблизительно в положении остатка #121 на фигуре 3В). Последовательностями VL антител Е25, Е26, Е27 и Hu-901 являются последовательности SEQ ID NO:47, SEQ ID NO:49, SEQ ID NO:51 и SEQ ID NO:53, соответственно. Последовательностями VH антител Е25, Е26, Е27 и Hu-901 являются последовательности SEQ ID NO:48, SEQ ID NO:50, SEQ ID NO:52 и SEQ ID NO:54, соответственно. В другом варианте изобретения, анти-IgE антитела, имеющие Fc-мутации согласно изобретению, содержат L-цепь, выбранную из L-цепей антител, последовательности которых представлены на фигуре 3А: L-цепи Е25 (SEQ ID NO:16); L-цепи Е26 (SEQ ID NO:17); L-цепи E27 (SEQ ID NO:18) и L-цепи Hu-901 (SEQ ID NO:19).
Примерами антител, которые связываются с антигеном CD20, являются: антитело “С2В8”, называемое в настоящее время “ритуксимабом” (RITUXAN®)(патент США № 5736137, полное описание которого вводится в настоящее изобретение посредством ссылки);90Y-меченное антитело 2В8 мыши, обозначаемое “Y2D8” или называемое “ибритумомаб Тиуксетан” ZEVALIN® (патент США № 5736137, полное описание которого вводится в настоящее изобретение посредством ссылки); IgG2a “В1” мыши, также называемое “Тозитумомабом”, и необязательно меченное131I, и называемое “антителом “131I-В1” (131I-меченный тозитумомаб, BEXXARTM)(патент США № 5595721, полное описание которого вводится в настоящее изобретение посредством ссылки); моноклональное антитело “1F5” мыши (Press et al., Blood 69(2):584-591 (1987) и его варианты, включая антитела с “каркасными пэтчами” или гуманизованное 1F5 (WO03/002607, Leung S.); депозит АТСС НВ-96450); 2Н7 мыши и химерное антитело 2Н7 (Clark et al., PNAS 82: 1766-1770 (1985); патент США № 5500362, полное описание которого вводится в настоящее изобретение посредством ссылки); гуманизованное 2Н7; huMax-CD20 (WO 04/035607, Genmab, Denmark); АМЕ-133 (Applied Molecular Evolution); антитело А20 или его варианты, такие как химерное или гуманизованное антитело А20 (сА20, hA20, соответственно)(US 2003/0219433, Immunomedics); и моноклональные антитела L27, G28-2, 93-1B3, B-C1 или NU-B2, обсуждаемые на Международном симпозиуме по типированию лейкоцитов (Valentine et al., Leukocyte Typing III (McMichael, Ed., p.440, Oxford University Press (1987)).
Используемые здесь термины “ритуксимаб” или “ритуксан” (RITUXAN®) означают генетически сконструированное химерное моноклональное антитело мыши/человека, направленное против антигена CD20 и обозначенное “C2B8” в патенте США № 5736137, полное описание которого вводится в настоящее изобретение посредством ссылки, включая фрагменты указанного антитела, которые сохраняют способность связываться с CD20. Последовательности легкой цепи (SEQ ID NO:24) и тяжелой цепи (SEQ ID NO:25) С2В8 представлены на фигуре 10. Представлены также последовательности VL и VН.
В конкретных вариантах изобретения, антителами, которые связываются с антигеном CD20, являются гуманизованное антитело 2Н7v.16 и его варианты, описанные ниже. Термин “гуманизованное антитело 2Н7v.16” означает интактное антитело или фрагмент антитела, содержащие последовательность вариабельной области легкой цепи:

и
последовательность вариабельной области тяжелой цепи:

Если гуманизованным антителом 2Н7v.16 является интактное антитело, то предпочтительно, чтобы оно содержало полноразмерную аминокислотную последовательность легкой цепи v16:
легкая цепь 2Н7v.16:

и полноразмерную аминокислотную последовательность тяжелой цепи:
тяжелая цепь 2Н7v.16:

V-область всех других вариантов, полученных на основе варианта 16, имеет аминокислотные последовательности v16, за исключением положений аминокислотных замен, указанных в нижеследующей таблице. Если это не указано ниже, то варианты 2Н7 имеют такую же L-цепь, как и цепь v16.
Каждый из вариантов 114, 115, 116, 138, 477 и 511 содержит последовательность VL:

Каждый из вариантов 96, 114, 115, 116, 138 и 477 содержит последовательность VH:

Вариантом предшествующего гуманизованного mAb 2H7 является вариант 2Н7v.31, имеющий последовательность VL (SEQ ID NO:1) и VH (SEQ ID NO:2), и последовательность L-цепи (SEQ ID NO:26), аналогичные последовательностям вышеуказанного варианта v16, где полноразмерная аминокислотная последовательность Н-цепи представлена ниже:
Н-цепь 2Н7v.31:

Другим вариантом гуманизованного антитела 2H7 является вариант 2Н7v.138, имеющий последовательность L-цепи SEQ ID NO:39 и последовательность Н-цепи SEQ ID NO:40, представленные ниже:
легкая цепь 2Н7v.138 (SEQ ID NO:39):

тяжелая цепь 2Н7v.138 (SEQ ID NO:40):


Гуманизованный вариант 2Н7v.477 имеет последовательность L-цепи SEQ ID NO:39 и последовательность Н-цепи SEQ ID NO:43 (с аминокислотной заменой N434W):

Другие варианты v138 имеют аминокислотную замену N434Y или N434F.
Вариант 2Н7v.114 имеет полноразмерную последовательность L-цепи SEQ ID NO:39 и полноразмерную аминокислотную последовательность Н-цепи:

Вариант 2Н7v.511 содержат VL SEQ ID NO:41, представленную выше, и VH SEQ ID NO:45:

и VH SEQ ID NO:45:

2Н7.v511 имеет представленную выше последовательность легкой цепи SEQ ID NO:39 и последовательность тяжелой цепи:

Настоящее изобретение также относится к анти-BR3 антителам, содержащим замену в положении N434 ароматическими остатками F, Y, H или S.
Способы осуществления изобретения
Настоящее изобретение также относится к способу скрининга полипептида, обладающего высокой аффинностью связывания с FcRn при рН 6,0, и более низкой аффинностью связывания при рН 7,4, чем при рН 6,0, как описано в примерах. Указанный способ включает экспрессию полипептида-кандидата на фаге, получение huFcRn, иммобилизованного на твердой матрице, связывание фаговых частиц с указанным FcRn на такой матрице, удаление несвязанных фаговых частиц путем проведения множества раундов промывок в условиях возрастающей жесткости для каждого раунда, и элюирование оставшегося связанного фага при рН 7,4. Как описано в примере 1, условия возрастающей жесткости не означают увеличение числа и/или времени проведения промывок. Элюированный фаг может быть размножен, и из этого фага может быть выделен полипептид. В одном из вариантов изобретения, указанным полипептидом является полипептид, содержащий Fc IgG, такой как антитело или иммуноадгезин.
Получение антител
Моноклональные антитела
Моноклональные антитела могут быть получены с применением гибридомной технологии, впервые описанной Kohler et al. Nature, 256:495 (1975), либо они могут быть получены методами рекомбинантных ДНК (патент США № 4816567).
В гибридомном методе, мышь или другое подходящее животное-хозяин, такое как хомячок, иммунизируют как описано выше, для вырабатывания у них лимфоцитов, продуцирующих или способных продуцировать антитела, специфически связывающиеся с белком, используемым для иммунизации. Альтернативно, лимфоциты могут быть введены методом иммунизации in vitro. После иммунизации, лимфоциты выделяют и подвергают, а затем подвергают слиянию с миеломной клеточной линией с использованием подходящего агента для слияния, такого как полиэтиленгликоль, в результате чего образуются гибридомные клетки (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)).
Полученные таким образом гибридомные клетки высевают и культивируют в подходящей культуральной среде, которая, предпочтительно, содержит одно или несколько веществ, ингибирующих рост или выживание не-слитых родительских миеломных клеток (также называемых партнерами по слиянию). Так, например, если родительские миеломные клетки не содержат фермента гипоксантин-гуанин-фосфорибозилтрансферазы (HGPRT или HPRT), то селективная культуральная среда для получения гибридом обычно включает гипоксантин, аминоптерин и тимидин (среда НАТ), то есть, вещества, предупреждающие рост HGPRT-дефицитных клеток.
Предпочтительными миеломными клетками-партнерами по слиянию являются клетки, которые способны подвергаться эффективному слиянию, поддерживать стабильное продуцирование высоких уровней антител выбранными антитело-продуцирующими клетками и являются чувствительными к селективной среде, которая позволяет дифференцировать слитые клетки от неслитых родительских клеток. Предпочтительными миеломными клеточными линиями являются миеломные линии мыши, такие как клеточные линии, происходящие от клеток МОРС-21 и МРС-11 опухолей мыши, которые могут быть получены из Института исследований по распределению клеток им. Солка (Salk Institute Cell Distribution Center, San Diego, California USA), и клеток SP-2 и их производных, например, клеток Х63-Ag8-653, имеющихся в Американской коллекции типовых культур, Rockville, Maryland USA. Для продуцирования моноклональных антител человека также используются миеломные клеточные линии человека и гетеромиеломные клеточные линии “мышь-человек” (Kozbor J. Immunol., 133:3001 (1984) & Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp.51-63 (Marcel Dekker, Inc., New York, 1987)).
Культуральную среду для роста гибридомных клеток анализируют на продуцирование моноклональных антител против данного антигена. Специфичность связывания моноклональных антител, продуцируемых гибридомными клетками, определяют, предпочтительно, путем иммунопреципитации или путем проведения in vitro анализа на связывание, такого как радиоиммуноанализ (РИА) или твердофазный иммунноферментный анализ (ELISA).
Аффинность связывания моноклонального антитела может быть, например, определена с помощью анализа Скэтчарда, описанного Munson et al., Anal. Biochem., 107:220 (1980).
После идентификации гибридомных клеток, которые продуцируют антитела с нужной специфичностью, аффинностью и/или активностью, клоны могут быть субклонированы путем проведения процедур лимитирующего разведения и культивированы стандартными методами (Goding, Monoclonal Antibodies: Principles and Practice, pp.59-103 (Academic Press, 1986)). Подходящими культуральными средами, предназначенными для достижения данной цели, являются, например, среда D-MEM или RPMI-1640. Кроме того, гибридомные клетки могут быть выращены in vivo в качестве асцитных опухолей у животных, например, путем i.p. инъекции этих клеток мышам.
Моноклональные антитела, секретированные субклонами, соответствующим образом выделяют из культуральной среды, асцитной жидкости или сыворотки путем проведения стандартных процедур очистки антител, таких как, например, аффинная хроматография (например, на белке А или на G-белке-Сефарозе), или ионообменная хроматография, хроматография на гидроксиапатитах, гель-электрофорез, диализ и т.п.
ДНК, кодирующая моноклональные антитела, может быть легко выделена и секвенирована в соответствии со стандартными процедурами (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антител мыши). Предпочтительным источником такой ДНК служат гибридомные клетки. После выделения, эта ДНК может быть встроена в экспрессионные векторы, которые затем трансфецируют в клетки-хозяева, такие как клетки E.coli, обезьяньи клетки СОS, клетки яичника китайского хомячка (СНО) или миеломные клетки, которые, в иных случаях, не продуцируют белок антитела, в результате чего, в этих рекомбинантных клетках-хозяевах синтезируются моноклональные антитела. Обсуждение рекомбинантной экспрессии антитело-кодирующей ДНК в бактериях можно найти в статьях Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) и Plückthun, Immunol. Revs., 130:151-188 (1992).
В другом варианте изобретения, моноклональные антитела или фрагменты антител могут быть выделены из фаговой библиотеки антител, созданной методами, описанными McCafferty et al., Nature, 348:552-554 (1990). В работе Clackson et al. Nature, 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991) описано выделение антител мышей и человека, соответственно, с использованием фаговых библиотек. В более поздних публикациях описано продуцирование высокоаффинных (порядка нМ) антител человека посредством перестановки цепей антитела (Marks et al. Bio/Technology, 10:779-783 (1992)), а также путем комбинированного инфицирования и рекомбинации in vivo, применяемой в качестве стратегии для конструирования очень больших фаговых библиотек (Waterhouse et al. Nucl. Acids. Res. 21:2265-2266 (1993)). Таким образом, эти методы являются приемлемой альтернативой традиционной гибридомной технологии, применяемой для выделения моноклональных антител.
ДНК, кодирующая антитело, может быть модифицирована так, чтобы она продуцировала полипептиды химерного или гибридного антитела, например, путем замены последовательности, кодирующей константные домены тяжелой цепи и легкой цепи (СН и СL) антитела человека, гомологичными последовательностями антител мыши(патент США № 4816567 и Morrison et al. Proc. Natl. Acad. Sci. USA 81:6851 (1984)), или путем присоединения иммуноглобулин-кодирующей последовательности ко всей или части кодирующей последовательности не-иммуноглобулинового полипептида (гетерологичного полипептида). Такие не-иммуноглобулиновые полипептидные последовательности могут быть заменены константными доменами антитела, либо они могут быть заменены вариабельными доменами одного антигенсвязывающего сайта антитела для создания химерного двухвалентного антитела, содержащего один антигенсвязывающий сайт, обладающий специфичностью к одному антигену, и другой антигенсвязывающий сайт, обладающий специфичностью к другому антигену.
Гуманизованные антитела
Методы гуманизации не-человеческих антител описаны в литературе. Предпочтительно, гуманизованное антитело имеет один или несколько введенных в него аминокислотных остатков, происходящих от источника, не относящегося к человеку. Эти не-человеческие аминокислотные остатки часто называют “импортными” остатками, которые обычно берут из “импортного” вариабельного домена. Такая гуманизация может быть осуществлена, в основном, методом Винтера (Winter) и сотрудниками (Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoyen et al., Science 239:1534-1536 (1988)), путем замены соответствующих последовательностей антитела человека последовательностями гипервариабельной области. В соответствии с этим, такие “гуманизованные” антитела представляют собой химерные антитела (патент США № 4816567), в которых, в основном, меньшая часть, по сравнению с интактным вариабельным доменом антитела человека, заменена соответствующей последовательностью от не-человеческого антитела. Фактически, гуманизованные антитела обычно представляют собой антитела человека, в которых некоторые остатки гипервариабельной области и, возможно, некоторые остатки FR заменены остатками, происходящими от аналогичных сайтов антител грызунов.
Для снижения антигенности и НАМА-ответа (вырабатывания антимышиного антитела человека) при создании гуманизованных антител, необходимых для терапевтического введения человеку, очень важно выбрать вариабельные домены как легкой, так и тяжелой цепи антитела человека. В соответствии с так называемым методом “подгонки”, последовательность вариабельного домена антитела грызуна скринируют по всей библиотеке известных последовательностей вариабельных доменов антитела человека. Затем идентифицируют последовательность V-домена человека, которая имеет наибольшее сходство с последовательностью грызунов, и присутствующую в ней каркасную область человека (FR) используют для создания гуманизованного антитела (Sims et al., J. Immunol. 151:2296 (1993); Chothia et al., J. Mol. Biol. 196:901 (1987)). В другом методе используют конкретную каркасную область, происходящую от консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Та же самая каркасная область может быть использована для получения нескольких различных гуманизованных антител (Carter et al., Proc. Natl. Acad. Sci., USA, 89:4285 (1992); Presta et al., J. Immunol, 151:2623 (1993)).
Кроме того, важно, чтобы гуманизованные антитела сохраняли высокую аффинность связывания с антигеном и другие благоприятные биологические свойства. Для достижения этой цели, в соответствии с предпочтительным способом, гуманизованные антитела получают путем анализа исходных последовательностей и различных концептуальных гуманизованных продуктов с использованием трехмерных моделей родительских и гуманизованных последовательностей. Трехмерные иммуноглобулиновые модели являются общедоступными и хорошо известны специалистам. Существуют компьютерные программы, которые иллюстрируют и представляют вероятные трехмерные конформационные структуры выбранных последовательностей-кандидатов иммуноглобулинов. Исследование этих представлений позволяет проанализировать вероятную роль данных остатков в функционировании последовательностей-кандидатов иммуноглобулина, то есть остатков, которые влияют на способность иммуноглобулина-кандидата связываться с его антигеном. Таким образом, остатки FR могут быть отобраны из последовательностей реципиента и “импортных” последовательностей и объединены, в результате чего может быть получено желаемое антитело с нужными свойствами, такими как повышенная аффинность по отношению к антигену(ам)-мишени(ям). Вообще говоря, остатки гипервариабельной области непосредственно влияют на связывание с антигеном, и в основном, участвуют в таком связывании.
Гуманизованным антителом может быть фрагмент антитела, такой как Fab, который может быть, но необязательно, конъюгирован с одним или несколькими цитотоксическими средствами с получением иммуноконъюгата. Альтернативно, таким гуманизованным антителом может быть полноразмерное антитело, такое как полноразмерное антитело IgG1.
Антитела человекаи метод фагового представления
В качестве альтернативы гуманизованным антителам могут быть продуцированы антитела человека. Так, например, в настоящее время могут быть получены трансгенные животные (например, мыши), которые, после иммунизации, способны продуцировать полный репертуар антител человека без продуцирования эндогенного иммуноглобулина. Так, например, сообщалось, что гомозиготная делеция гена области стыка в тяжелой цепи (JН) антитела у химерных мышей и мышей, мутантных по зародышевой линии, приводит к полному ингибированию продуцирования эндогенного антитела. Перенос набора генов иммуноглобулина зародышевой линии человека мышам, мутантным по зародышевой линии, может приводить к продуцированию антител человека после стимуляции антигеном. См. например, Jakobovits et al., Proc. Natl. Acad. Sci., USA, 90:2551 (1993); Jakobovits et al., Nature 362:255-258 (1993); Bruggerman et al., Year in Immuno, 7:33 (1993) и патенты США №№ 5545806, 5569825, 5591669 (все от GenPharm), 5545807 и заявку WO 97/17852.
Альтернативно, для продуцирования антител человека и фрагментов антител in vitro из набора генов вариабельного домена (V) иммуноглобулина, происходящего от неиммунизованных доноров, может быть применена технология фагового представления (McCafferty et al. Nature 348:552-553 [1990]). В соответствии с этой технологией, гены домена V антитела клонируют с сохранением рамки считывания в ген главного или минорного белка оболочки нитчатого бактериофага, такого как М13 или fd, и представляют в качестве функциональных фрагментов антитела на поверхности фаговой частицы. Поскольку нитеобразная частица содержит копию одноцепочечной ДНК фагового генома, то отбор на основе функциональных свойств антитела также позволяет проводить отбор гена, кодирующего антитело, обладающее этими свойствами. Таким образом, фаг имитирует некоторые свойства В-клеток. Фаговое представление может быть осуществлено в различных форматах; см., например, обзор в работе Johnson, Kevin S. и Chiswell, David J., Current Opinion in Structural Biology 3:564-571 (1993). Для осуществления фагового представления может быть использовано несколько источников V-генных сегментов. Clackson et al., Nature, 352:624-628 (1991) выделили массив разнообразных антиоксазолоновых антител из небольшой рандомизированной комбинаторной библиотеки генов V, полученных из селезенки иммунизованных мышей. При этом может быть сконструирован набор генов V от неиммунизованных людей-доноров, а затем могут быть выделены антитела против массива различных антигенов (включая аутоантигены), в основном, в соответствии с методами, описанными Marks et al., J. Mol. Biol. 222:581-597 (1991) или Griffith et al., EMBO J. 12:725-734 (1993). См. также патенты США №№ 5565332 и 5573905.
Как обсуждалось выше, антитела человекамогут также продуцироваться in vitro активированными В-клетками (см. патенты США №№ 5567610 и 5229275).
Фрагменты антител
В некоторых случаях, предпочтительнее использовать не целые антитела, а фрагменты антител. Чем меньше размер фрагментов, тем быстрее их клиренс, и тем легче осуществляется их доступ к солидным опухолям.
Для получения фрагментов антител были разработаны различные методы. Традиционно эти фрагменты образуются в результате протеолитического расщепления интактных антител (см., например, Morimoto et al., Journal of Biochemical and Biophysical Methods 24:107-117 (1992) и Brennan et al., Science, 229:81 (1985)). Однако такие фрагменты могут продуцироваться непосредственно рекомбинантными клетками-хозяевами. Fab-, Fv- и scFv-фрагменты антител могут экспрессироваться в E.coli и секретироваться из E.coli, что облегчает продуцирование большого количества этих фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, обсуждаемых выше. Альтернативно, Fab'-SH-фрагменты могут быть непосредственно выделены из E.coli и химически связаны с образованием F(ab')2-фрагментов (Carter et al., Bio/Technology 10:163-167 (1992)). В соответствии с другим подходом F(ab')2-фрагменты могут быть выделены непосредственно из культуры рекомбинантной клетки-хозяина. Fab- и F(ab')2-фрагменты, имеющие более продолжительное время полужизни in vivo и содержащие остатки эпитопа, связывающегося с рецептором “спасения”, описаны в патенте США № 5869046. Специалистам известны и другие методы получения фрагментов антител. В других вариантах изобретения выбранным антителом является одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185, патент США № 5571894 и патент США № 5587458. Fv и sFv представляют собой только молекулы с интактными связывающими сайтами, не содержащими константных областей; а поэтому они могут быть использованы для снижения уровня неспецифического связывания при их применении in vivo. Гибридные scFv-белки могут быть сконструированы с получением гибрида эффекторного белка, содержащего sFv либо у амино-конца, либо у карбокси-конца. См. выше публикацию “Antibody Engineering”, ed. Borrebaeck. Фрагментом антитела может быть также “линейное антитело”, например, антитело, описанное в патенте США № 5641870. Такие фрагменты линейных антител могут быть моноспецифическими или биспецифическими.
Биспецифические антитела
Биспецифическими антителами являются антитела, которые обладают специфичностью связывания по меньшей мере с двумя различными эпитопами. Репрезентативные биспецифические антитела могут связываться с двумя различными эпитопами белка CD20. Другие такие антитела могут включать сайт связывания с CD20 и сайт связывания с другим белком. Альтернативно, ветвь анти-CD20 антитела может быть объединена с ветвью, связывающейся со стимулирующей молекулой, присутствующей на лейкоците, такой как молекула Т-клеточного рецептора (например, CD3), или Fc-рецепторов для IgG (FcγR), таких как FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16), или NKG2D или другого лиганда, активирующего NK-клетки, в результате чего клеточные защитные механизмы будут направлены на CD20-экспрессирующие клетки и позволят определить локализацию этих клеток. Биспецифические антитела могут быть также использованы для определения локализации цитотоксических агентов в клетках, экспрессирующих CD20. Эти антитела имеют ветвь, связывающуюся с CD20, и ветвь, связывающуюся с цитотоксическим агентом (например, с сапорином, антителом против интерферона-α, винкаалкалоидом, цепью рицина А, метотрексатом или гаптеном, меченным радиоактивным изотопом). Биспецифические антитела могут быть продуцированы в виде полноразмерных антител или в виде фрагментов антител (например, F(ab')2-фрагментов биспецифических антител).
В WO96/16673 описано биспецифическое анти-ErbB2/анти-FcγRIII антитело, а в патенте США № 5837234 описано биспецифическое анти-ErbB2/анти-FcγRI антитело. В WO 98/02463 описано биспецифическое анти-ErbB2/Fcα антитело. В патенте США № 5821337 описано биспецифическое анти-ErbB2/анти-CD3 антитело.
Методы продуцирования биспецифических антител известны специалистам. Традиционное продуцирование полноразмерных биспецифических антител основано на коэкспрессии двух пар тяжелой цепи-легкой цепи иммуноглобулина, где указанные две цепи обладают различными специфичностями (Millstein et al., Nature, 305:537-539 (1983)). Из-за рандомизированного набора тяжелой и легкой цепей иммуноглобулина, эти гибридомы (квадромы) продуцируют потенциальную смесь из 10 различных молекул антител, из которых только одна молекула имеет “правильную” биспецифическую структуру. Очистка такой “правильной” молекулы, которую обычно осуществляют путем проведения стадий аффинной хроматографии, представляет значительные трудности и дает низкий выход продукта. Аналогичные процедуры описаны в WO 93/08829 и у Traunecker et al., EMBO J., 10:3655-3659 (1991).
В соответствии с другим подходом вариабельные домены антитела с нужными специфичностями связывания (сайты связывания “антитело-антиген”) присоединяют к последовательностям константного домена иммуноглобулина. Такое слияние, предпочтительно, осуществляют с константным доменом тяжелой цепи иммуноглобулина Ig, содержащим по меньшей мере часть шарнирной области, СН2 и СН3. При этом, предпочтительно, чтобы этот гибрид имел первую константную область тяжелой цепи (СН1), содержащую сайт, необходимый для связывания с легкой цепью, присутствующей по меньшей мере в одном из гибридов. ДНК, кодирующую гибриды тяжелой цепи иммуноглобулина и, если это необходимо, легкой цепи иммуноглобулина, встраивают в отдельные экспрессионные векторы, и ко-трансфецируют в подходящую клетку-хозяина. Это обеспечивает более высокую степень гибкости при коррекции соотношений трех полипептидных фрагментов в тех вариантах изобретения, в которых неравные содержания трех полипептидных цепей, используемых в данной конструкции, дают оптимальные выходы нужного биспецифического антитела. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессионный вектор, если экспрессия по меньшей мере двух полипептидных цепей при равном соотношении дает высокие выходы, или если такие соотношения не оказывают значительного влияния на выход нужной комбинации цепей.
В предпочтительном варианте такого подхода биспецифические антитела состоят из гибридной тяжелой цепи иммуноглобулина, обеспечивающей первую специфичность связывания, в одной ветви, и гибридной пары “тяжелая цепь - легкая цепь” иммуноглобулина (обеспечивающей вторую специфичность связывания), в другой ветви. Было обнаружено, что эта асимметричная структура облегчает отделение нужного биспецифического соединения от нежелательных комбинаций цепей иммуноглобулина, поскольку присутствие легкой цепи иммуноглобулина только в одной половине биспецифической молекулы обеспечивает простой способ его выделения. Этот способ описан в WO 94/04690. Более подробное описание получения биспецифических антител, можно найти, например, в публикации Suresh et al., Methods in Enzymology, 121:210 (1986).
В соответствии с другим подходом, описанным в патенте США № 5731168, может быть сконструирована пограничная область между парой молекул антитела в целях максимизации процента гетеродимеров, выделенных из рекомбинантной клеточной культуры. Такая граница, предпочтительно, содержит по меньшей мере часть домена СН3. В этом методе, небольшие боковые цепи одной или нескольких аминокислот в пограничной области первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозина или триптофана). В пограничной области второй молекулы антитела создают компенсирующие “полости”, имеющие размер, идентичный или аналогичный размеру более крупной(ых) боковой(ых) цепи(ей), путем замены крупных боковых цепей аминокислот более мелкими боковыми цепями (например, аланина или треонина). Это позволяет увеличить выход гетеродимеров по отношению к другим нежелательным конечным продуктам, таким как гомодимеры.
Биспецифические антитела включают перекрестно-связанные антитела или их “гетероконъюгаты”. Так, например, одно из антител в указанном гетероконъюгате может быть связано с авидином, а другое с биотином. Такие антитела были, например, предложены для доставки клеток иммунной системы к нежелательным клеткам (патент США № 4676980) и для лечения ВИЧ-инфекций (WO 91/00360, WO 92/200373 и ЕР 03089). Антитела-гетероконъюгаты могут быть получены любыми стандартными методами перекрестного связывания. Подходящие перекрестно-связывающие агенты хорошо известны специалистам и описаны в патенте США № 4676980 наряду с различными методами перекрестного связывания.
Методы продуцирования биспецифических антител из фрагментов антител также описаны в литературе. Так, например, биспецифические антитела могут быть получены путем химического связывания. В работе Brennan et al., Science, 229:81 (1985) описана процедура, в которой интактные антитела подвергают протеолитическому расщеплению с образованием F(ab')2-фрагментов. Эти фрагменты восстанавливают в присутствии агента, образующего дитиоловый комплекс, такого как арсенит натрия, для стабилизации смежных дитиолов и для предотвращения образования межмолекулярных дисульфидных связей. Затем полученные Fab'-фрагменты превращают в производные тионитробензоата (TNВ). После этого, одно из производных Fab'-TNВ снова превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNВ, в результате чего получают биспецифическое антитело. Продуцированные таким образом биспецифические антитела могут быть использованы в качестве агентов для селективной иммобилизации ферментов.
Наблюдающийся в последнее время прогресс в данной области позволяет осуществлять непосредственное выделение Fab'-SН-фрагментов из E.coli, которые могут быть химически связаны с образованием биспецифических антител. В публикации Shalaby et al., J. Exp. Med., 175:217-225 (1992) описано продуцирование полностью гуманизованной молекулы F(ab')2-фрагмента биспецифического антитела. Каждый Fab'-фрагмент отдельно секретировался из E.coli и был подвергнут прямому химическому связыванию in vitro с образованием биспецифического антитела. Полученное таким образом биспецифическое антитело обладает способностью связываться с клетками, сверхэкспрессирующими рецептор ЕrbB2 и с нормальными Т-клетками человека, а также запускать литическую активность цитотоксических лимфоцитов человека, направленную против клеток-мишеней опухоли молочной железы человека.
Были также описаны другие методы получения и выделения фрагментов биспецифических антител непосредственно из рекомбинантной клеточной культуры. Так, например, биспецифические антитела были продуцированы с использованием “лейциновых молний”. Kostelny et al., J. Immunol., 148(5):1547-1553 (1992). Пептиды лейциновой молнии, происходящие от белков Fos и Jun, были присоединены к Fab'-частям двух других антител путем лигирования генов. Гомодимеры антитела были восстановлены в шарнирной области с образованием мономеров, а затем снова окислены с образованием гетеродимеров данного антитела. Этот метод может быть также использован для продуцирования гомодимеров антитела. Технология “диантител”, описанная Hollinger et al., Proc. Natl. Acad. Sci., USA, 90:6444-6448 (1993), дает альтернативный механизм получения фрагментов биспецифического антитела. Эти фрагменты содержат VН, присоединенный к VL посредством линкера, который является слишком коротким для создания пары между двумя доменами одной и той же цепи. В соответствии с этим, VН- и VL-домены одного фрагмента вынуждены спариваться с комплементарными VL- и VН-доменами другого фрагмента, образуя тем самым два антигенсвязывающих сайта. Также была описана другая стратегия получения фрагментов биспецифических антител с использованием одноцепочечных Fv(sFv)-димеров. См. Gruber et al., J. Immunol., 152:5368 (1994).
Рассматриваются также антитела с более чем двумя валентностями. Так, например, могут быть получены и триспецифические антитела. Tutt et al., J. Immunol. 147:60 (1991).
Поливалентные антитела
Поливалентное антитело может быть интернализовано (и/или катаболизировано) клетками, экспрессирующими антиген, с которым связываются антитела, быстрее, чем двухвалентное антитело. Антитела согласно изобретению могут представлять собой поливалентные антитела (не относящиеся к классу IgМ) с тремя или более антигенсвязывающими сайтами (например, четырехвалентные антитела), которые могут быть легко продуцированы путем рекомбинантной экспрессии нуклеиновой кислоты, кодирующей полипептидные цепи антитела. Такое поливалентное антитело может содержать домен димеризации и три или более антигенсвязывающих сайтов. Предпочтительный домен димеризации содержит (или состоит из) Fc-область(и) или шарнирную(ой) область(и). В этом случае, указанное антитело содержит Fc-область и три или более антигенсвязывающих сайтов, находящихся у амино-конца по отношению к Fc-области. Предпочтительное поливалентное антитело согласно изобретению содержит примерно от трех до восьми, а предпочтительно, четыре антигенсвязывающих сайта (или состоит из них). Указанное поливалентное антитело содержит по меньшей мере одну полипептидную цепь (а предпочтительно, две полипептидных цепи), где указанная(ые) полипептидная(ые) цепь(и) содержит(ат) два или более вариабельных доменов. Так, например, полипептидная(ые) цепь(и) может(ут) содержать VD1-(X1)n-VD2-(X2)n-Fc, где VD1 представляет собой первый вариабельный домен, VD2 представляет собой второй вариабельный домен, Fc представляет собой одну полипептидную цепь Fc-области, Х1 и Х2 представляют собой аминокислоту или полипептид, а n равно 0 или 1. Так, например, указанная(ые) полипептидная(ые) цепь(и) может(гут) содержать цепь: VH-CH1-гибкий линкер-VH-CH1-Fc-область или цепь: VH-CH1-VH-CH1-Fc-область. Используемое здесь поливалентное антитело, кроме того, предпочтительно, содержит по меньшей мере два (а предпочтительно, четыре) полипептида вариабельного домена легкой цепи. Описанное здесь поливалентное антитело может содержать, например, примерно от двух до восьми полипептидов вариабельного домена легкой цепи. Рассматриваемые здесь полипептиды вариабельного домена легкой цепи содержат вариабельный домен легкой цепи, и кроме того, но необязательно, CL-домен.
Векторы, клетки-хозяева и методы рекомбинантных ДНК
Отбор и трансформация клеток-хозяев
Клетками-хозяевами, подходящими для клонирования или экспрессии описанных здесь рекомбинантных mAb, иммуноадгезинов и других полипептидов-антагонистов, являются клетки прокариотов, дрожжей или высших эукариотов. Подходящими прокариотами, используемыми для этих целей, являются эубактерии, такие как грамотрицательные или грамположительные микроорганизмы, например, энтеробактерии, такие как Esсherichia, например, E.coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescаns и Shigella, а также Bacilli, такие как B. subtilis и B.licheniformis (например, B.licheniformis 41Р, описанная в DD266710, опубликованной 12 апреля 1989), Pseudomonas, такие как P.aeruginosa и Streptomyces. Одним из предпочтительных клонирующих хозяев E.coli является штамм E.coli 294 (АТСС 31446), хотя могут быть использованы и другие штаммы, такие как E.coli В, E.coli Х1776 (АТСС 31537) и E.coli W3110 (ATCC 27325). Эти примеры приводятся в иллюстративных целях и не ограничивают объем изобретения.
Полноразмерное антитело, фрагменты антител и гибридные белки антител могут быть продуцированы в бактериях, а особенно, в тех случаях, когда нет необходимости в гликозилировании и в сообщении эффекторной функции Fc, например, когда указанное терапевтическое антитело конъюгировано с цитотоксическим средством (например, токсином), и сам иммуноконъюгат является эффективным в отношении деструкции опухолевых клеток. Полноразмерные антитела имеют продолжительное время полужизни в кровотоке. Продуцирование антител в E.coli является более быстрым и менее дорогостоящим. Описание экспрессии фрагментов антител и полипептидов в бактериях можно найти, например, в патенте США № 5648237 (Carter et al.), в патенте США № 5789199 (Joly et al.) и в патенте США № 5840523 (Simmons et al.), где описаны области инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции, и эти патенты вводятся в настоящее описание посредством ссылки. После экспрессии, указанное антитело выделяют из клеточной массы E.coli в растворимые фракции, а затем оно может быть очищено, например, на колонке с белком А или с G-белком, в зависимости от его изотипа. Конечная очистка может быть осуществлена способом, аналогичным способу очистки антител, экспрессируемых, например, в клетках СНО.
Помимо прокариотов, подходящими клонирующими или экспрессирующими хозяевами для антитело-кодирующих векторов, таких как анти-CD20 антитело-кодирующие векторы, являются эукариотические микробы, такие как нитчатые грибы или дрожжи. Из низших эукариотических микроорганизмов-хозяев, наиболее часто используемыми являются Saccharomyces cerevisiae или обычные пекарские дрожжи. Однако в настоящем изобретении используются общедоступные различные бактерии другого рода и вида и их различные штаммы, такие как Schizosaccharomyces pombe; клетки-хозяева Kluyveromyces, такие как K.lactis, K.fragilis (ATCC 12424), K.bulgaricus (ATCC 16045), K.wickeramii (ATCC 24178), K.waltii (ATCC 56500), K.drosophilarum (ATCC 36906), K. thermotolerans и K.marxianus; yarrowia (EP402226); Pichia pastoris (ЕР183070); Candida; Trichodermareesia (EP244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; нитчатые грибы, такие как, например, Neurospora, Penicillium, Tolypocladium, и клетки-хозяева Aspergillus, такие как A. nidulans и A.niger.
Клетки-хозяева, подходящие для экспрессии, например, гликозилированного CD20-связывающего антитела, происходят от многоклеточных организмов. Примерами клеток беспозвоночных являются клетки растений и насекомых. Были идентифицированы различные бакуловирусные штаммы и варианты, а также соответствующие пермиссивные клетки-хозяева насекомых, таких как Spodoptera frugiperda (гусеница совки), Aedes aegypti (желтолихорадочный комар), Aedes albopictus (белопятнистый комар), Drosophilamelanogaster (плодовая мушка) и Bombyx mori (тутовый шелкопряд). В настоящее время имеется ряд доступных вирусных штаммов, которые могут быть использованы для трансфекции, например, вариант L-1 Autographa californica NPV и штамм Bm-5 Bombyx mori NPV, и такие вирусы могут быть использованы в качестве вируса согласно изобретению, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве клеток-хозяев могут быть также использованы клетки растительных культур хлопчатника, кукурузы, картофеля, сои, петунии, томатов и табака.
Однако самый большой интерес представляют клетки позвоночных, и размножение клеток позвоночных в культуре (тканевой культуре) становится рутинной процедурой. Примерами обычно используемых линий клеток-хозяев млекопитающих являются клеточная линия CV1 почек обезьяны, трансформированная SV40 (COS-7, ATCC CRL 1651); клеточная линия почек эмбриона человека (клетки 293 или клетки 293, субклонированные для роста в суспензионной культуре [Graham et al., J. Gen. Virol. 36:59 (1977)]; клетки почек детеныша хомячка (ВНК, АТСС CCL 10); клетки яичника китайского хомячка/DHFR (CHO, Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); клетки мышиСертоли (ТM4, Mather, Biol. Reprod. 23:243-251 (1980)); клетки почек обезьяны (CV1 ATCC CCL 70); клетки почек африканской зеленой мартышки (VERO-76, ATCC CRL-1587); клетки карциномы шейки матки человека (HELA, ATCC CCL 2); клетки почек собак (MDCK, ATCC CCL 34); клетки печени лабораторной крысы Buffalo (BRL 3A, ATCC CRL 1442); клетки легких человека (W138, ATCC CCL 75); клетки печени человека (HepG2, HB 8065); опухолевые клетки молочной железы мыши (MMT 060562, ATCC CCL51); клетки TRI (Mather et al., Annal N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC5; клетки FS4 и клеточная линия гепатомы человека(HepG2).
Клетки-хозяева трансформируют экспрессионными или клонирующими векторами для продуцирования антител, истощающих В-клетки, таких как CD20-связывающие антитела, или антител-антагонистов интегрина, и культивируют в подходящих питательных средах, модифицированных, если это необходимо, для индуцирования промоторов, отбора трансформантов или амплификации генов, кодирующих нужные последовательности.
Культивирование клеток-хозяев
Клетки-хозяева, используемые для продуцирования антитела согласно изобретению, могут быть культивированы в различных средах. Средами, подходящими для культивирования клеток-хозяев, являются коммерчески доступные среды, такие как среда Хэмса F10 (Sigma), минимальная поддерживающая среда ((МЕМ)(Sigma), RPMI-1640 (Sigma) и модифицированная по способу Дульбекко среда Игла (DMEM), Sigma). Кроме того, в качестве культуральной среды для культивирования клеток-хозяев может быть использована любая среда, описанная в публикации Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980), в патентах США № 4767704, 4657866, 4927762, 4560655 или 5122469; в WO 90103430; в WO 87/00195 или в патенте США Re.№ 30985. В любую из этих сред могут быть добавлены, если это необходимо, гормоны и/или другие факторы роста (такие как инсулин, трансферрин или эпидермальный фактор роста), соли (такие как хлорид натрия и фосфат кальция и магния), буферы (такие как HEPES), нуклеотиды (такие как аденозин и тимидин), антибиотики (такие как лекарственное средство гентамицинТМ), микроэлементы (определенные как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярных дозах), и глюкоза или эквивалентный источник энергии. Могут быть также включены любые другие необходимые добавки в соответствующих концентрациях, известные специалистам в данной области. Условиями культивирования, такими как температура, рН и т.п., являются условия, которые обычно используются для экспрессии выбранных клеток-хозяев и известны среднему специалисту в данной области.
Очистка антитела
C применением техники рекомбинантных ДНК, антитело может быть продуцировано внутри клеток или в периплазматическом пространстве, либо оно может быть непосредственно секретировано в среду. Если в первой стадии антитело продуцируется внутри клеток, то затем клеточный дебрис или клетки-хозяева или их лизированные фрагменты удаляют, например, путем центрифугирования или ультрафильтрации. В публикации Carter et al., Bio/Technology 10:163-167 (1992) описана процедура выделения антител, которые секретируются в периплазматическое пространство E.coli. Вкратце, клеточную массу оттаивают в присутствии ацетата натрия (рН 3,5), EDTA и фенилметилсульфонилфторида (PMSF) в течение примерно 30 минут. Клеточный дебрис может быть удален путем центрифугирования. Если антитело секретируется в среду, то, обычно, сначала концентрируют супернатанты, полученные из таких экспрессионных систем, с использованием коммерчески доступного фильтра для концентрирования белков, например, устройства для ультрафильтрации Amicon или Millipore Pellicon. Для ингибирования протеолиза, в любой из предшествующих стадий может быть использован ингибитор протеазы, такой как PMSF, а для предупреждения размножения случайно вносимых примесных микроорганизмов могут быть использованы антибиотики.
Композиция антитела, полученная из клеток, может быть очищена, например, с помощью хроматографии на гидроксиаппатитах, гель-электрофореза, диализа и аффинной хроматографии, при этом предпочтительным методом очистки является аффинная хроматография. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, присутствующего в данном антителе. Белок А может быть использован для очистки антител, содержащих тяжелые цепи γ1, γ2 или γ4 иммуноглобулина человека (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Для всех изотипов мыши и для цепи γ3 человека рекомендуется использовать G-белок (Guss et al., EMBO J. 5:15671575 (1986)). В качестве матрицы, с которой связывается аффинный лиганд, наиболее часто применяется агароза, но могут быть использованы и другие матрицы. Механически стабильные матрицы, такие как стекло с регулируемым размером пор или поли(стиролдивинил)бензол, позволяют достичь более высокой скорости потока и меньшей продолжительности времени обработки, чем это может быть достигнуто с использованием агарозы. Если антитело содержит домен СН3, то для его очистки может быть использована смола Bakerbond ABXTM (J.T. Baker, Phillipsburg, N.J.). В зависимости от выделяемого антитела могут быть также применены и другие методы очистки белка, такие как фракционирование на ионообменной колонке, преципитация этанолом, обращенно-фазовая ВЭЖХ, хроматография на двуокиси кремния, хроматография на гепарин-сефарозеТМ, хроматография на анионо- или катионообменной смоле (например, на колонке с полиаспарагиновой кислотой), хроматофокусирование, электрофорез в ДСН-ПААГ и преципитация сульфатом аммония.
После проведения любой(ых) предварительной(ых) стадии(й) очистки смесь, содержащая представляющее интерес антитело и примеси, может быть подвергнута гидрофобной хроматографии при низком рН с использованием элюирующего буфера при рН примерно 2,5-4,5, и предпочтительно, при низкой концентрации соли (например, примерно 0-0,25М).
Конъюгаты антител
Антитело может быть конъюгировано с цитотоксическим средством, таким как токсин или радиоактивный изотоп. В некоторых вариантах изобретения, предпочтительным токсином является калихеамицин, майтанзиноид, доластатин, ауристатин Е и их аналоги или производные.
Терапевтическое применение композиций антител
CD20-связывающие антитела согласно изобретению могут быть использованы для лечения различных злокачественных и незлокачественных заболеваний, включая аутоиммунные заболевания и родственные состояния, и В-клеточных опухолей или злокачественных опухолей, характеризующихся экспрессией CD20 В-клетками, включая В-клеточные лимфомы и лейкозы. Стволовые клетки (предшественники В-клеток) костного мозга, в которых отсутствует антиген CD20, способствуют регенерации здоровых В-клеток и возращению их нормального уровня после проведения лечения в течение нескольких месяцев.
Используемый здесь термин “аутоиммунное заболевание” означает заболевание или расстройство, вызываемое реакцией, продуцируемой организмом на свои собственные ткани и направленной против этих тканей, или их ко-сегрегацию или манифестацию или связанное с ними состояние. Примерами аутоиммунных заболеваний или расстройств являются, но не ограничиваются ими, артрит (ревматоидный артрит, юношеский ревматоидный артрит, остеоартрит, псориатический артрит и анкилозирующий спондилит), псориаз, дерматит, включая атопический дерматит; хроническая идиопатическая крапивница, включая хроническую аутоиммунную крапивницу, полимиозит/дерматомиозит, токсический эпидермальный некролиз, системную склеродермию и склероз; реакции, связанные с воспалительным заболеванием кишечника (ВЗК) (болезнь Крона, язвенный колит) и ВЗК с ко-сегрегирующейся с гангренозной пиодермией, нодозной эритемой, первичным склерозирующим холангитом и/или эписклеритом), респираторный дистресс-синдром, включая респираторный дистресс-синдром взрослых (РДСВ); менингит; IgЕ-опосредуемые заболевания, такие как анафилаксический шок и аллергический ринит; энцефалит, такой как энцефалит Расмуссена; увеит; колит, такой как микроскопический колит и коллагенозный колит; гломерулонефрит (ГН), такой как мембранозный ГН, идиопатический мембранозный ГН, мембранозный пролиферативный ГН (МПГН), включая ГН типа I и типа II, и быстро прогрессирующий ГН; аллергические состояния, экзема, астма, состояния, связанные с инфильтрацией Т-клеток, и с хроническими воспалительными ответами; атеросклероз; аутоиммунный миокардит; дефицит адгезии лейкоцитов; системная красная волчанка (СКВ), такая как кожная СКВ; волчанка (включая нефрит, церебрит, детскую волчанку, не-почечную волчанку, дискоидную волчанку, алопецию); юношеский диабет; рассеянный склероз (РС), такой как рассеянный склероз спинного мозга и зрительного нерва; аллергический энцефаломиелит, иммунные ответы, связанные с острой и замедленной гиперчувствительностью, опосредуемой цитокинами и Т-лимфоцитами; туберкулез; саркоидоз; гранулематоз, включая гранулематоз Вегенера, агранулоцитоз; васкулит (включая васкулит крупных кровеносных сосудов (включая ревматическую полимиалгию и гигантоклеточный артериит (Такаясу)), васкулит средних кровеносных сосудов (включая болезнь Кавазаки и узелковый полиартериит), васкулит ЦНС и АNCA-ассоциированный васкулит, такой как васкулит или синдром Черга-Штраусса (СЧШ); апластическая анемия; положительная анемия Кумбса; анемия Даймонда-Блекфана; иммунная гемолитическая анемия; включая аутоиммунную гемолитическую анемию (АИГА); пернициозная анемия; истинная эритроцитарная аплазия (ИЭА); дефицит фактора VIII; гемофилия А; аутоиммунная нейтропения; панцитопения; лейкопения; заболевания, приводящие к диапедезу лейкоцитов; воспалительные расстройства ЦНС; синдром поражения многих органов; тяжелая миастения; заболевания, опосредуемые образованием комплекса “антиген-антитело”; болезнь гломерулярных базальных мембран, катализируемая реакцией антитело-антиген; антифосфолипидный синдром; аллергический нейрит; болезнь Бехчета; синдром Каслмана; синдром Гудпасчера; миастенический синдром Ламберта-Итона; синдром Рейно; синдром Сьегрена; синдром Стивенса-Джонсона; отторжение трансплантата твердого органа (включая предварительную обработку на высокие титры панели реактивных антител; отложение IgА в тканях и отторжение трансплантата почки, печени, тонкой кишки, сердца и т.п.); реакция “трансплантат против хозяина” (GVHD); буллезный пемфигоид; пузырчатка (включая пузырчатку вульгарную, пузырчатку листовидную и пемфигоид слизистых оболочек - мембранозный пемфигоид); аутоиммунная полиэндокринопатия; болезнь Райтера; синдром “негнущегося человека”; нефрит, связанный с иммунным комплексом; IgМ-полиневропатия или IgМ-опосредованная невропатия; идиопатическая тромбоцитопеническая пурпура (ИТП); тромботическая тромбоцитопеническая пурпура (ТТП); тромбоцитопения (например, развивающаяся у пациента с инфарктом миокарда), включая, аутоиммунную тромбоцитопению, аутоиммунное заболевание яичек и яичника, включая аутоиммунный орхит и оофорит, первичный гипотиреоидит, аутоиммунные эндокринные заболевания, включая аутоиммунный тиреодит, хронический тиреоидит (тиреоидит Хашимото), подострый тиреоидит, идиопатический гипотиреоидит; болезнь Адиссона; болезнь Грейвса; аутоиммунные плюригландулярные синдромы (или плюригландулярные эндокринопатические синдромы); диабет типа I, также называемый инсулинзависимым сахарным диабетом (ИЗСД), включая детский ИЗСД и синдром Шихана; аутоиммунный гепатит; лимфоидный интерстициальный пневмонит (ЛИП); облитерирующий бронхиолит (не передающийся, в отличие от NSIP); синдром Гийена-Барре; болезнь Бергера (IgА-нефропатия); первичный билиарный цирроз; кишечная спру (глютеновая энтеропатия), не поддающаяся лечению спру с ко-сегрегированным герпетиформным дерматитом; криоглобулинемия; амилотрофический боковой склероз (АБС; болезнь Луи Герига); ишемическая болезнь сердца; аутоиммунное заболевание внутреннего уха (АЗВУ); аутоиммунная потеря слуха; синдром пляшущих глаз (СПГ); полихондрит, такой как не поддающийся лечению полихондрит; легочный альвеолярный протеиноз; амилоидоз; гигантоклеточный гепатит; склерит; моноклональная гаммопатия неопределенной/неясной этиологии, MGUS); периферическая невропатия; паранеопластический синдром; “каналопатии”, такие как эпилепсия, мигрень, аритмия, мышечные расстройства, глухота, слепота, периодический паралич и “каналопатии” ЦНС; аутизм, воспалительная миопатия и очаговый сегментарный гломерулосклероз (ОСГС).
В-клеточная опухоль или злокачественная опухоль, В-клетки которой экспрессируют CD20, представляет собой опухоль, характеризующуюся аномальной пролиферацией клеток, экспрессирующих CD20 на своей поверхности. В-клеточными опухолями, имеющими CD20+-В-клетки, являются CD20-позитивная болезнь Ходжкина, включая, лимфоцитарную болезнь Ходжкина (ЛБХ); не-ходжкинская лимфома (НХЛ); фолликулярная центроклеточная (ФЦК) лимфома; острый лимфоцитарный лейкоз (ОЛЛ); хронический лимфоцитарный лейкоз (ХЛЛ); ретикулоэндотелиоз. Не-ходжкинскими лимфомами являются низкозлокачественная/фолликулярная не-ходжкинская лимфома (НХЛ); мелкоклеточная лимфоцитарная лимфома (МЛЛ); среднезлокачественная/фолликулярная НХЛ; среднезлокачественная диффузная НХЛ; высокозлокачественная иммунобластная НХЛ; высокозлокачественная лимфобластная НХЛ; высокозлокачественная мелкоклеточная недифференцированная НХЛ; генерализованная НХЛ; плазмацитоидная лимфоцитарная лимфома; лимфома клеток коры головного мозга; лимфома, связанная со СПИД'ом; и макроглобулинемия Вальденстрема. Также рассматривается лечение рецидивов этих раковых заболеваний. ЛБХ представляет собой тип болезни Ходжкина, которая, несмотря на проводимую лучевую терапию или химиотерапию, имеет тенденцию к частым рецидивам и характеризуется присутствием CD20-позитивных злокачественных клеток. ХЛЛ представляет собой один из четырех основных типов лейкоза. Рак зрелых В-клеток, называемых лимфоцитами, а именно, ХЛЛ, характеризуется прогрессирующей аккумуляцией клеток крови, костного мозга и лимфатических тканей. Инертная лимфома представляет собой медленно развивающуюся неоперабельную опухоль, при которой средняя продолжительность жизни пациента, после ряда ремиссий и рецидивов, составляет от 6 до 10 лет.
Используемый здесь термин “не-ходжкинская лимфома” или “НХЛ” означает рак лимфатической системы, за исключением лимфомы Ходжкина. В общих чертах, лимфомы Ходжкина и не-ходжкинские лимфомы могут отличаться тем, что в лимфоме Ходжкина присутствуют клетки Рида-Штернберга, а в не-ходжкинской лимфоме, эти клетки отсутствуют. Примерами не-ходжкинских лимфом, охватываемых используемым здесь термином, являются все лимфомы, которые могут быть идентифицированы специалистом в данной области (например, онкологом или патологом) в соответствии с известными схемами классификации, такими как Пересмотренная Евро-Американская схема классификации лимфом (REAL), описанная в “Цветном атласе клинической гематологии” (3-е издание) (Color Atlas of Clinical Hematology (3rd edition), A. Victor Hoffbrand and John E.Pettit (eds.)(Harcourt Publishers Ltd., 2000). См., в частности, списки, представленные на фиг.11.57, 11.58 и 11.59. Более конкретными примерами таких лимфом являются, но не ограничиваются ими, рецидивирующая или не поддающаяся лечению НХЛ; пограничная низкозлокачественная НХЛ первой линии; НХЛ на стадии III/IV; НХЛ, резистентная к химиотерапии; лимфобластный лейкоз и/или лимфома, содержащая В-клетки-предшественники; мелкоклеточная лимфоцитарная лимфома; В-клеточный хронический лимфоцитарный лейкоз и/или пролимфоцитарный лейкоз и/или мелкоклеточная лимфоцитарная лимфома; В-клеточная пролимфоцитарная лимфома; иммуноцитома и/или лимфоплазматическая лимфома; лимфоплазмацитарная лимфома; В-клеточная лимфома маргинальной зоны; лимфома маргинальной зоны селезенки; лимфома экстранодальной маргинальной зоны - MALT; нодальная лимфома маргинальной зоны; ретикулоэндотелиоз; плазмацетома и/или плазмаклеточная миелома; низкозлокачественная/фолликулярная лимфома; среднезлокачественная/фолликулярная НХЛ; лимфома коры головного мозга; фолликулярно-центроклеточная лимфома (фолликулярная); среднезлокачественная диффузная НХЛ; диффузная крупноклеточная В-клеточная лимфома; агрессивная НХЛ (включая агрессивную пограничную и агрессивную рецидивирующую НХЛ); НХЛ, рецидивирующая после трансплантации аутологичных стволовых клеток или резистентная к такой трансплантации; первичная медиастинальная крупноклеточная В-клеточная лимфома; первичная эффузионная лимфома; высокозлокачественная иммунобластная НХЛ; высокозлокачественная лимфобластная НХЛ; высокозлокачественная мелкоклеточная недифференцированная НХЛ; генерализованная НХЛ; лимфома Беркитта; лимфобластный лейкоз и/или лимфома, содержащая Т-клетки-предшественники (периферические); Т-клеточная лимфома и/или Т-клеточный лейкоз взрослых; Т-клеточный хронический лимфоцитарный лейкоз и/или пролимфоцитарный лейкоз; крупноклеточный гранулярный лимфоцитарный лейкоз; грибовидный микоз и/или синдром Сезари; экстранодальная лимфома, содержащая природные клетки-киллеры/Т-клетки (назального типа); Т-клеточная лимфома энтеропатического типа; печеночно-селезеночная Т-клеточная лимфома; подкожная панникулит-подобная Т-клеточная лимфома; лимфома кожи (кожная лимфома); анапластическая крупноклеточная лимфома; ангиоцентрическая лимфома; Т-клеточная лимфома тонкого кишечника; периферическая Т-клеточная лимфома (если это не определено особо) и ангиоиммунобластная Т-клеточная лимфома.
В конкретных вариантах изобретения способы лечения В-клеточных раковых опухолей, содержащих CD20+-В-клеток согласно изобретению, применяются для лечения не-ходжкинской лимфомы (НХЛ), лимфоцитарной болезни Ходжкина (ЛБХ), мелкоклеточной лимфоцитарной лимфомы (МЛЛ), и хронического лимфоцитарного лейкоза (ХЛЛ).
В конкретных вариантах изобретения, способы лечения аутоиммунного заболевания или заболевания, связанного с истощением В-клеток, применяются для лечения ревматоидного артрита и юношеского ревматоидного артрита, системной красной волчанки (СКВ), включая волчаночный нефрит, болезни Вегенера, воспалительного заболевания кишечника, идиопатической тромбоцитопенической пурпуры (ИТП), тромботической тромбоцитопенической пурпуры (ТТП), аутоиммунной тромбоцитопении, рассеянного склероза, псориаза, IgА-нефропатии, IgМ-полиневропатии, тяжелой миастении, васкулита, сахарного диабета, синдрома Рейно, синдрома Сьегрена и гломерулонефрита.
Желательный уровень истощения В-клеток зависит от конкретного заболевания. Для лечения CD20-позитивного рака может оказаться желательным максимизировать истощение В-клеток, которые являются мишенями для анти-CD20 антител согласно изобретению. Так, например, для лечения CD20-позитивной В-клеточной опухоли может оказаться желательным, чтобы истощение В-клеток было достаточным по меньшей мере для предупреждения прогрессирования указанного заболевания, которое может быть оценено врачом-специалистом в данной области, например, путем мониторинга роста опухоли (размера), пролиферации раковых клеток, развития метастазов и появления других признаков и симптомов конкретного ракового заболевания. Предпочтительно, чтобы такое истощение В-клеток было достаточным для предупреждения прогрессирования заболевания по меньшей мере в течение 2 месяцев, более предпочтительно, в течение 3 месяцев, еще более предпочтительно, в течение 4 месяцев, еще более предпочтительно, в течение 5 месяцев, а наиболее предпочтительно, в течение 6 или более месяцев. В еще более предпочтительных вариантах, истощение В-клеток является достаточным для увеличения времени ремиссии по меньшей мере на 6 месяцев, более предпочтительно, на 9 месяцев, более предпочтительно, на 1 год, еще более предпочтительно, на 2 года, еще более предпочтительно, на 3 года, а наиболее предпочтительно, на 5 лет или более. В наиболее предпочтительном варианте изобретения, истощение В-клеток является достаточным для полного излечения заболевания. В предпочтительных вариантах изобретения, истощение В-клеток у раковых пациентов по меньшей мере примерно на 75%, а более предпочтительно, на 80%, 85%, 90%, 95%, 99% и даже на 100% превышает фоновый уровень до проведения лечения.
Для лечения аутоиммунного заболевания может оказаться желательным модулировать степень истощения В-клеток в зависимости от типа заболевания и/или от тяжести состояния у индивидуума путем коррекции дозы CD20-связывающего антитела. Таким образом, истощение В-клеток может быть, но необязательно, полным. В некоторых случаях, полное истощение В-клеток может оказаться желательным в начале лечения, а на последующих стадиях лечения доза может быть соответствующим образом скорректирована для достижения лишь частичного истощения В-клеток. В одном из вариантов изобретения, истощение CD20-позитивных В-клеток составляет по меньшей мере 20%, т.е., 80% или менее, по сравнению с фоновым уровнем до проведения лечения. В других вариантах изобретения, истощение В-клеток составляет 25%, 30%, 40%, 50%, 60%, 70% или более. Предпочтительно, чтобы истощение В-клеток было достаточным для прекращения прогрессирования указанного заболевания, более предпочтительно, для ослабления признаков и симптомов конкретного заболевания в процессе лечения, а наиболее предпочтительно, для полного излечения заболевания.
Параметры оценки эффективности или успешного лечения опухоли известны врачам-специалистам по данному заболеванию. В общих чертах, врач-специалист в данной области должен следить за ослаблением признаков и симптомов конкретного заболевания. Такими параметрами могут быть: средняя продолжительность периода времени до начала прогрессирования заболевания, время ремиссии и время стабильного состояния.
В нижеследующих работах описаны лимфомы и ХЛЛ, их диагностика, лечение и стандартные медицинские процедуры для определения эффективности лечения. См. Canellos G.P., Lister T.A., Sklar J.L.: The Lymphomas. W.B. Saunders Company, Philadelphia, 1998; van Besien K & Cabanillas, F: Clinical Manifestations, Staging and Treatment of Non-Hodgkin's Lymphoma, Chap. 70 рр. 1293-1338: Hematology, Basic Principles and Practice, 3rd ed. Hoffman et al. (editors). Churchill Livingstone, Philadelphia, 2000 and Rai K. & Patel D: Chronic Lymphocytic Leukemia, Chap. 72, pp.1350-1362: Hematology, Basic Principles and Practice, 3rd ed., Hoffman et al. (editors). Churchill Livingstone, Philadelphia, 2000.
Параметры оценки эффективности или успешного лечения аутоиммунного заболевания или родственного ему заболевания известны врачам-специалистам по данному заболеванию. В общих чертах, врач-специалист в данной области должен следить за ослаблением признаков и симптомов конкретного заболевания. Ниже приводятся соответствующие примеры.
В одном из вариантов изобретения, способы и композиции согласно изобретению могут быть использованы для лечения ревматоидного артрита. РА характеризуется воспалением множества суставов, потерей хряща и эрозией кости, которая приводит к деструкции суставов, и, в конечном счете, к ухудшению функции суставов. Кроме того, поскольку РА является системным заболеванием, то он может оказывать воздействие и на ткани других органов, таких как легкие, глаза и костный мозг.
CD20-связывающие антитела могут быть использованы в качестве терапии первого ряда для пациентов с РА на ранней стадии (то есть, пациентов, которым не вводили метотрексат (МТХ)), или в комбинации, например, с МТХ или циклофосфамидом. Либо, эти антитела могут быть использованы в качестве терапевтических средств второго ряда для лечения пациентов, которые являются невосприимчивыми к DMARD и/или МТХ, в комбинации, например, с МТХ. CD20-связывающие антитела могут быть также введены в комбинации с агентами, мобилизующими В-клетки, такими как антитела против интегрина, которые способствуют миграции В-клеток в кровоток и, тем самым, их более эффективному уничтожению. CD20-связывающие антитела могут быть использованы для предупреждения и предотвращения поражения суставов, замедления структурного повреждения, уменьшения боли, связанной с воспалением при РА, и, в общих чертах, для ослабления признаков и симптомов умеренного или тяжелого РА. Пациент с РА может быть подвергнут лечению анти-CD20 антителом до или после лечения другими лекарственными средствами, обычно используемыми для лечения РА, или одновременно с таким лечением (см. ниже описание комбинированной терапии). В одном из вариантов изобретения, CD20-связывающее антитело вводят пациентам, которые оказались невосприимчивыми к ранее проводимому лечению противоревматическими средствами, влияющими на данное заболевание, и/или у которых наблюдался неадекватный ответ на введение лишь одного метотрексата. В другом варианте изобретения, пациентам вводят гуманизованное CD20-связывающее антитело плюс циклофосфамид, или CD20-связывающее антитело плюс метотрексат.
Один из методов оценки эффективности лечения РА основан на критериях, разработанных Американским колледжем ревматологов (ACR), которые позволяют измерять процент положительной динамики заболевания болезненных и опухших суставов, и т.п. Так, например, пациенту с РА, у которого, по сравнению с пациентом, не проходившим лечение антителом (например, по сравнению с его состоянием до лечения), или принимавшим плацебо, наблюдается 20%-ное улучшение, может быть дана оценка АСR20. Другими способами определения эффективности лечения антителом является рентгенографическое исследование, такое как рентгенографическая оценка по Шарпу, используемая для оценки структурного повреждения, такого как эрозия кости и сужение просвета между суставами. Пациенты могут быть также подвергнуты обследованию с точки зрения профилактики потери трудоспособности или улучшения трудоспособности с получением количественных показателей, определенных по опроснику состояния здоровья [HAQ], а также в результате AIMS-оценки и SF36-оценки, проводимых во время или после лечения. Критерий АСR 20 может означать 20% снижение числа хрупких (болезненных) и опухших суставов плюс 20% улучшение по меньшей мере по 3 из 5 дополнительных признаков:
1. Самооценка пациентом боли по визуальной аналоговой шкале (VAS),
2. Самооценка пациентом общего состояния здоровья (VAS),
3. Оценка лечащим врачом общего состояния здоровья (VAS),
4. Самооценка пациентом потери своей трудоспособности, определенной по опроснику о состоянии здоровья, и
5. Реагенты острой фазы, CRP или ESR.
Аналогичным образом могут быть определены ACR 50 и 70. Пациенту, предпочтительно, вводят CD20-связывающее антитело согласно изобретению в количестве, эффективном для достижения оценки ACR20, предпочтительно по меньшей мере ACR30, более предпочтительно по меньшей мере ACR50, еще более предпочтительно по меньшей мере ACR70, а наиболее предпочтительно по меньшей мере ACR75 и выше.
Псориатический артрит имеет уникальные и различные рентгенографические признаки. При псориатическом артрите, эрозия суставов и сужение просвета между суставами могут быть также оценены по методу Шарпа. Описанные здесь гуманизованное CD20-связывающие антитела могут быть использованы для предупреждения поражения суставов, а также для ослабления патологических признаков и симптомов указанного расстройства.
В еще одном своем аспекте настоящее изобретение относится к способу лечения волчанки или СКВ путем введения пациенту, страдающему СКВ, терапевтически эффективного количества гуманизованного CD20-связывающего антитела согласно изобретению. Оценки SLEDAI позволяют количественно оценивать активность заболевания. SLEDAI представляет собой весовой коэффициент 24 клинических и лабораторных параметров, которые коррелируют с активностью заболевания, при этом, диапазон числовых значений этого коэффициента составляет 0-103. См. Bryan Gescuk & John Davis, “Novel therapeutic agent for systemic lupus erythematosus”, Current Opinion in Rheumatology 2002, 14:515-521. Очевидно, что антитела против двухцепочечной ДНК вызывают воспалительные реакции в почках и другие манифестации волчанки. Пациенты, проходящие лечение антителами, могут наблюдаться в течение периода времени до появления обострения почечного заболевания, которое определяют как значимое воспроизводимое увеличение креатинина в сыворотке, белка в моче или крови в моче. Альтернативно или дополнительно, пациенты могут быть подвергнуты мониторингу на уровни антиядерных антител и антител против двухцепочечной ДНК. Лечение СКВ включает введение высоких доз кортикостероидов и/или циклофосфамида (HDCC).
Спондилоартропатии представляют собой группу заболеваний суставов, включая анкилозирующий спондидит, псориатический артрит и болезнь Крона. Эффективность лечения может быть подтверждена самим пациентом, а также врачом с помощью различных средств, применяемых для оценки общего состояния здоровья пациента.
Для лечения псориаза применяются различные лекарственные средства, и такое лечение непосредственно зависит от тяжести заболевания. Пациентам с более мягкой формой псориаза обычно проводят местное лечение такими средствами, как стероиды для местного применения, антралин, кальципотриен, клобетазол и тазаротен, а для пациентов с умеренной и тяжелой формой псориаза, более подходящим лечением является системная терапия (с использованием метотрексата, ретиноидов, циклоспорина, РUVA и UVВ). Могут быть также использованы дегтярные смолы. Такая терапия связана с проблемами безопасности, с необходимостью проведения длительного курса лечения или процедур, причиняющих неудобство пациенту. Кроме того, некоторые способы лечения требуют применения дорогостоящего оборудования и специального помещения в амбулаторных учреждениях. Лекарственные средства для системного лечения могут давать серьезные побочные эффекты, включая гипертензию, гиперлипидемию, подавление функции костного мозга, заболевание печени, заболевание почек и расстройство желудочно-кишечного тракта. Кроме того, применение фототерапии может приводить к увеличению заболеваемости раком кожи. Помимо неудобства и дискомфорта, связанного с применением местного лечения, фототерапии и системного лечение, пациенту требуется проведение курсов терапии и мониторинга продолжительности облучения, связанного с побочными эффектами.
Эффективность лечения псориаза оценивают путем проведения мониторинга изменения клинических признаков и симптомов заболевания, включая оценку врачом общего состояния здоровья пациента (PGA), оценку площади поражения псориазом и показатель тяжести заболевания (PASI), и оценку симптомов псориаза (PSA), по сравнению с состоянием пациента до лечения. Оценка состояния пациента может быть проведена периодически самим пациентом во время его лечения по визуальной аналоговой шкале, используемой для определения степени зуда, наблюдаемого в конкретные периоды времени.
Анти-HER2 антитела, имеющие Fc-мутации согласно изобретению, могут быть использованы для лечения раковой опухоли, которая экспрессирует или сверхэкспрессирует HER2. “HER2-экспрессирующей раковой опухолью” является опухоль, содержащая клетки, имеющие на своей поверхности белок HER2. Раковой опухолью, которая “сверхэкспрессирует” рецептор HER, является опухоль на клеточной поверхности, в которой наблюдаются значительно более высокие уровни рецептора HER, такого как HER2, по сравнению с не-раковыми клетками тканей того же типа. Такая сверхэкспрессия может возникать вследствие амплификации гена или повышения уровня его транскрипции или трансляции. Сверхэкспрессия рецептора HER может быть определена в диагностическом или прогностическом анализе путем оценки повышения уровней белка HER, присутствующего на поверхности клеток (например, с помощью иммуногистохимического анализа; ИГХ). Альтернативно или дополнительно, могут быть измерены уровни HER-кодирующей нуклеиновой кислоты в клетках, например, посредством флуоресцентной гибридизации in situ (FISH; см. заявку WO 98/45479, опубликованную в октябре 1998), Саузерн-блот-анализа или с помощью полимеразной цепной реакции (ПЦР), такой как количественная ПЦР в реальном времени (РВ-ПЦР). Сверхэкспрессия рецептора HER может быть также исследована путем определения уровня “слущивания” антигена (например, внеклеточного домена HER) в биологической жидкости, такой как сыворотка (см. например, патент США № 4933294, выданный 12 июня 1990; заявку WO91/05264, опубликованную 18 апреля 1991; патент США № 5401638, выданный 28 марта, 1995, и публикацию Sias et al., J. Immunol. Methods 132:73-80 (1990)). Помимо вышеописанных анализов, специалистом в данной области могут быть проведены различные анализы in vivo. Так, например, клетки в организме пациента могут быть обработаны антителом, которое может быть, но необязательно, помечены детектируемой меткой, например, радиоактивным изотопом, а связывание антитела с клетками пациента может быть оценено, например, путем внешнего сканирования на радиоактивность или путем анализа биоптата, взятого у пациента, предварительно обработанного указанным антителом.
Различные раковые заболевания, которые могут быть подвергнуты лечению композициями антител против Her-2, перечислены ниже.
Термины “рак” и “раковый” означают или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нарушением регуляции клеточного роста. Примерами рака являются, но не ограничиваются ими, карцинома, лимфома, бластома (включая медуллобластому и ретинобластому), саркома (включая липосаркому и саркому синовиальных клеток), нейроэндокринные опухоли (включая карциноидные опухоли, гастриному и раковую опухоль клеток панкреатических островков), мезотелиома, шваннома (включая невриному слухового нерва), менингиома, аденокарцинома, меланома и лейкоз или лимфоидные злокачественные опухоли. Более конкретными примерами таких раковых опухолей являются плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, не-мелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких, рак брюшной полости, гепатоцеллюлярный рак, рак кишечника или желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластома, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатома, рак молочной железы, рак толстой кишки, рак прямой кишки, рак ободочной кишки, карцинома эндометрия или матки, карцинома слюнной железы, рак почек, рак предстательной железы, рак вульвы, рак щитовидной железы, гепатокарцинома, карцинома заднего прохода, карцинома пениса, рак яичек, рак пищевода, опухоли желчных путей, а также рак головы и шеи.
Также считается, что анти-HER2 антитело может быть использовано для лечения различных незлокачественных заболеваний или расстройств, таких как аутоиммунное заболевание (например, псориаз); эндометриоз; склеродермия; рестеноз; полипы, такие как полипы толстой кишки, полипы носа или полипы желудочно-кишечного тракта; фиброаденома; респираторное заболевание; холецистит; нейрофиброматоз; поликистоз почек; воспалительные заболевания; кожные болезни, включая псориаз и дерматит; сосудистое заболевание; состояния, характеризующиеся аномальной пролиферацией сосудистых эпителиальных клеток; язвы желудочно-кишечного тракта; болезнь Менетрие; секреторные аденомы или синдром потери белка; почечные расстройства; ангиогенные расстройства; глазные болезни, такие как возрастная дегенерация желтого пятна, синдром потенциального гистоплазмоза глаз, неоваскуляризация сетчатки в результате пролиферативной диабетической ретинопатии, васкуляризация сетчатки, диабетическая ретинопатия, или возрастная дегенерация желтого пятна; патологии костей, такие как остеоартрит, рахит и остеопороз; повреждения после приступа ишемии головного мозга; заболевания, связанные с фиброзом или отеками, такие как цирроз печени, фиброз легких, саркоидоз, тиреоидит, синдром системной повышенной вязкости крови, болезнь Ослера-Вебера-Рандю, хроническое окклюзионное поражение легких, или отеки после ожогов, травм, облучения, инсульта, гипоксии или ишемии; кожные реакции гиперчувствительности; диабетическая ретинопатия и диабетическая нефропатия; синдром Гийена-Барре; реакция “трансплантат против хозяина” или отторжение трансплантата; болезнь Пэджета; воспаление костей или суставов; старение кожи под действием светового излучения (например, вызываемое УФ-облучением кожи человека); доброкачественная гипертрофия предстательной железы; некоторые микробные инфекции, включая микробные патогены, выбранные из аденовирусов, хантавирусов, Borrelia burgdorferi, Yersinia spp. и Bordetella pertussis; тромбоз, вызванный агрегацией тромбоцитов; заболевания репродуктивных органов, такие как эндометриоз, синдром гиперстимуляции яичника, преэклампсия, дисфункциональные маточные кровотечения или менометроррагия; синовит; атерома; острая и хроническая нефропатии (включая пролиферативный гломерулонефрит и индуцированное диабетом почечное заболевание); экзема; образование гипертрофированных рубцов; эндотоксический шок и грибковая инфекция; наследственный аденоматозный полипоз; нейродегенеративные заболевания (например, болезнь Альцгеймера, деменция, связанная со СПИД'ом, болезнь Паркинсона, амиотрофический боковой склероз, пигментоз сетчатки, атрофия мышц позвоночника и дегенерация мозжечка); миелодиспластические синдромы; апластическая анемия; ишемическое поражение; фиброз легких, почек или печени; Т-клеточно-опосредуемая гиперчувствительность; гипертрофическое сужение привратника на ранней стадии; синдром обструкции мочевых путей; псориатический артрит; и тиреоидит Хашимото. Предпочтительными не-злокачественными заболеваниями, имеющими показания к рассматриваемой здесь терапии являются псориаз, эндометриоз, склеродермия, сосудистое заболевание (например, рестеноз, атеросклероз, ишемическая болезнь сердца или гипертензия), полипы толстой кишки, фиброаденома или респираторное заболевание (например, астма, хронический бронхит, бронхоэктаз или кистозный фиброз).
Антиангиогенные антитела и анти-VEGF антитела согласно изобретению могут быть использованы для лечения расстройств, связанных с ангиогенезом, которые включают нижеследующие опухолевые и не-опухолевые заболевания. Опухолевыми заболеваниями являются, но не ограничиваются ими, карцинома, лимфома, бластома, саркома и лейкоз или лимфоидные злокачественные опухоли. Более конкретными примерами таких раковых заболеваний являются рак почек, рак молочной железы, рак толстой кишки, рак прямой кишки, рак ободочной кишки, рак легких, включая мелкоклеточный рак легких, не-мелкоклеточный рак легких, аденокарциному легких и плоскоклеточную карциному легких; плоскоклеточный рак (например, плоскоклеточный эпителиальный рак), рак шейки матки, рак яичника, рак предстательной железы, рак печени, рак мочевого пузыря, рак брюшины, гепатоцеллюлярный рак, рак кишечника или желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, рак головы и шеи, глиобластома, ретинобластома, астроцитома, текомы, арренобластомы, гепатома, злокачественные заболевания кроветворной системы, включая не-ходжкинскую лимфому (НХЛ), множественную миелому и острые злокачественные заболевания кроветворной системы; карцинома эндометрия или матки, эндометриоз, фибросакромы, хориокарцинома, карцинома слюнных желез, рак вульвы, рак щитовидной железы, карциномы пищевода, карцинома печени, карцинома заднего прохода, карцинома пениса, карцинома носоглотки, карцинома горла, саркома Капоши, меланома, саркомы кожи, шваннома, олигодендроглиома, нейробластома, рабдомиосаркома, остеогенная саркома, лейомиосаркома, карцинома мочевых путей, карцинома щитовидной железы, опухоль Вильмса, а также аномальная пролиферация сосудов, связанная с факоматозами, отеки (такие как отеки, связанные с опухолями головного мозга), и синдром Мейжа. Более конкретно, раковыми заболеваниями, поддающимися лечению антагонистами согласно изобретению, являются рак почек, рак молочной железы, рак ободочной кишки, не-мелкоклеточный рак легких, не-ходжкинская лимфома (НХЛ), рак предстательной железы, рак печени, рак головы и шеи, меланома, рак яичника, мезотелиома и множественная миелома.
Не-опухолевыми заболеваниями, поддающимися лечению антиангиогенными антителами, включая анти-VEGF антитела, являются, но не ограничиваются ими, нежелательная или аберрантная гипертрофия, артрит, ревматоидный артрит (РА), псориаз, псориатические бляшки, саркоидоз, атеросклероз, атеросклеротические бляшки, отек в результате инфаркта миокарда, диабетические и другие пролиферативные ретинопатии, включая ретинопатию недоношенных, ретролентальную фиброплазию, неоваскулярную глаукому, возрастную дегенерацию желтого пятна, диабетический отек желтого пятна, неоваскуляризацию роговицы, неоваскуляризацию трансплантата роговицы, отторжение трансплантата роговицы, неоваскуляризацию сетчатки/хороидальной оболочки, неоваскуляризацию угла глазного яблока (покраснение глаза), неоваскулярное заболевание глаз; рестеноз сосудов; артериовенозная мальформация (АВМ); менингиома; гемангиома; ангиофиброма; гиперплазия щитовидной железы (включая болезнь Грейвса); трансплантация роговицы глаза и других тканей; хроническое воспаление; воспаление легких; острое поражение легких/респираторный дистресс-синдром взрослых (РДСВ); сепсис; первичная легочная гипертензия; злокачественные экссудаты в области легких; отек головного мозга (например, связанных с инсультом/закрытым повреждением/травмой головы); синовит; образование паннуса при РА; оссифицирующий миозит; гипертрофия костей; остеоартрит (ОА); не поддающийся лечению асцит; поликистоз яичника; эндометриоз; заболевания, связанные с секвестрацией жидкости в третьем пространстве [в полости полых органов] (панкреатит, туннельный синдром, ожоги, заболевание кишечника); фиброма матки; преждевременные роды; хроническое воспаление, такое как ВЗК (болезнь Крона и язвенный колит); отторжение почечного аллотрансплантата; воспалительное заболевание кишечника; нефротический синдром; нежелательный или аберрантный рост тканевой массы (не-раковых тканей); гемофилическая артропатия; гипертрофированные рубцы; подавление роста волос; синдром Ослера-Вебера; пиогенная гранулема; ретролентальная фиброплазия; склеродермия; трахома, васкулярная адгезия; синовит; дерматит; преэклампсия; асциты; выпоты в область перикарда (например, связанные с перикардитом) и плевральные выпоты.
Анти-CD11а антитела, имеющие аминокислотные модификации в Fc согласно изобретению, могут быть использованы для лечения LFA-1-опосредуемых заболеваний. Термин “LFA-1-опосредуемые заболевания” означает патологические состояния, вызываемые клеточно-адгезивными взаимодействиями с рецептором LFA-1 на лимфоцитах. Примерами таких заболеваний являются Т-клеточные воспалительные ответы, такие как воспалительные заболевания кожи, включая псориаз; ответы, связанные с воспалительным заболеванием кишечника (таким как болезнь Крона и язвенный колит); респираторный дистресс-синдром взрослых; дерматит; менингит; энцефалит; увеит; аллергические состояния, такие как экзема и астма, и другие состояния, связанные с инфильтрацией Т-клеток, и хронические воспалительные ответы; реакции гиперчувствительности кожи (включая контакт с ядовитым плющем и ядовитым дубом); атеросклероз; дефицит адгезии лейкоцитов; аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка (СКВ), сахарный диабет, рассеянный склероз, синдром Рейно, аутоиммунный тиреоидит, экспериментальный аутоиммунный энцефаломиелит, синдром Сьегрена, юношеский диабет и иммунные ответы, связанные с замедленной гиперчувствительностью, опосредуемой цитокинами и Т-лимфоцитами, обычно обнаруживаемыми при туберкулезе, саркоидозе, полимиозите, гранулематозе и васкулитах; пернициозная анемия; заболевания, связанные с диапедезом лейкоцитов; воспалительное заболевание ЦНС; синдром поражения многих органов в результате сепсиса или травмы; аутоиммунная гемолитическая анемия; тяжелая миастения; заболевания, опосредуемые комплексом “антиген-антитело”; отторжение трансплантата всех типов, включая реакцию “трансплантат против хозяина” или “хозяин против трансплантата”.
Анти-IgЕ антитела, имеющие аминокислотные модификации в Fc согласно изобретению, которые приводят к повышению уровня связывания с FcRn и увеличению времени полужизни в сыворотке, могут быть использованы для лечения IgЕ-опосредуемых заболеваний.
IgЕ-опосредуемые заболевания включают атопические заболевания, характеризующиеся врожденной предрасположенностью к иммунному ответу на множество широко распространенных природных вдыхаемых и проглатываемых антигенов и к непрерывному продуцированию антител IgЕ. Конкретными атопическими заболеваниями являются аллергическая астма, аллергический ринит, атопический дерматит и аллергическая гастроэнтеропатия. У пациентов с атопическими заболеваниями часто возникают различные аллергии, а это означает, что у них вырабатываются антитела IgЕ ко многим аллергенам окружающей среды, включая сезонные, постоянные и профессиональные аллергены, и в результате, возникают соответствующие симптомы. Примерами сезонных аллергенов являются пыльца (например, травы, деревьев, ржи, тимофеевки, амброзии), а примерами постоянных аллергенов являются грибки (например, плесень, плесневые споры), перья, продукты жизнедеятельности животных и насекомых (например, клещей домашней пыли). Примерами профессиональных аллергенов являются детергенты, металлы и изоцианаты. Не-антигенными специфическими раздражителями, которые могут вызывать IgЕ-опосредуемую реакцию, являются инфекционные агенты, раздражающие факторы, такие как дымовые газы, газы, образующиеся после сгорания топлива, частицы выхлопных газов дизельного топлива и диоксида серы, физическая нагрузка, холодовые факторы и эмоциональный стресс. Реакции гиперчувствительности могут возникать в результате воздействия пищевых белков, яда, вакцин, гормонов, антисыворотки, ферментов и латекса, а также антибиотиков, мышечных релаксантов, витаминов, цитотоксинов, опиатов и полисахаридов, таких как декстрин, комплекса “железо-декстран” и полигелин.
Однако заболеваниями, связанными с повышенными уровнями IgЕ, являются, но не ограничиваются ими, наследственные (атопические) заболевания. Другими заболеваниями, связанными с повышенными уровнями IgЕ, которые, очевидно, опосредуются IgЕ и поддаются лечению композициями согласно изобретению, являются гиперчувствительность (например, анафилактическая гиперчувствительность), экзема, крапивница, аллергический бронхопульмонарный аспергиллез, паразитарные болезни, синдром сверхэкспрессии IgЕ, атаксия-телангиэктазия, синдром Вискотта-Алдрича, синдром Черга-Штраусса, системный васкулит, алимфоплазия тимуса, IgЕ-экспрессирующая миелома, реакция “трансплантат против хозяина”, воспалительное заболевание кишечника (например, болезнь Крона, язвенный колит, колит неясной этиологии и инфекционный колит), гастроэнтеропатия, энтерит, мукозит (например, мукозит ротовой полости, мукозит желудочно-кишечного тракта, мукозит носа и проктит), некрозирующий энтероколит и эзофагит.
Дозы
В зависимости от заболевания, подвергаемого лечению, и факторов, которые влияют на выбор дозы, и которые должны быть известны врачу-специалисту в данной области, антагонисты и антитела согласно изобретению могут быть введены в дозе, эффективной для лечения такого заболевания и обладающей минимальным токсическим действием и минимальными побочными эффектами. Для лечения CD20-позитивного рака или аутоиммунного заболевания, терапевтически эффективная доза составляет примерно от 250 мг/м2 до 400 мг/м2 или 500 мг/м2, а предпочтительно, примерно 250-375 мг/м2. В одном из вариантов изобретения, указанная доза составляет 275-375 мг/м2. В одном из вариантов лечения CD20-позитивной В-клеточной опухоли, антитело вводят в дозе, составляющей 300-375 мг/м2. В конкретном варианте изобретения, для лечения пациентов, страдающих В-клеточной лимфомой, такой как не-ходжкинская лимфома, анти-CD20 антитела и гуманизованные анти-CD20 антитела согласно изобретению вводят человеку-пациенту в дозе 10 мг/кг или 375 мг/м2. В одном из вариантов изобретения, ритуксимаб может быть введен в дозе 7-15 мг/кг. Для лечения НХЛ, одна из схем введения доз может предусматривать введение одной дозы композиции антител, составляющей 10 мг/кг в первую неделю лечения, а затем после 2-недельного перерыва, введение второй дозы антитела в том же количестве. В общих чертах, пациенты с НХЛ проходят такой курс лечения один раз в год, но при возникновении рецидивов лимфомы, такое лечение может быть проведено повторно. В другой схеме введения доз, пациентам с низкозлокачественной НХЛ в течение четырех недель вводят вариант гуманизованного 2Н7, а предпочтительно, v16 (375 мг/м2, еженедельно), а затем, через 5 недель проводят три дополнительных курса лечения антителом плюс стандартную химиотерапию СНОР (циклофосфамидом, доксорубицином, винкристином и преднизоном) или СVР (циклофосфамидом, винкристином и преднизоном), которую проводят каждые три недели за три цикла.
В одном из вариантов изобретения, для лечения ревматоидного артрита вводят две дозы гуманизованного антитела в количестве от 125 мг/м2 (эквивалентном примерно 200 мг/дозу) до 600 мг/м2, например, первую дозу 200 мг вводят в первый день, а вторую дозу 200 мг вводят на 15-й день. В других вариантах изобретения, указанные дозы составляют 250 мг, 275 мг, 300 мг, 325 мг, 350 мг, 375 мг, 400 мг, 425 мг, 450 мг, 475 мг, 500 мг, 525 мг, 550 мг, 575 мг, 600 мг/дозу.
Для лечения заболевания, антитела против В-клеток-мишеней, такие как CD20-связывающие антитела согласно изобретению, могут быть введены пациенту непрерывно или периодически, как может быть определено лечащим врачом-специалистом.
У пациента, которому лекарственное средство вводят путем внутривенного вливания или подкожно, могут наблюдаться побочные эффекты, такие как повышение температуры, озноб, чувство жжения, астения и головная боль. Для ослабления или минимизации таких побочных эффектов, пациенту может(могут) быть сначала введена(ы) первоначальная(ые) обычная(ые) доза(ы) антитела, а затем терапевтическая доза. Для вырабатывания у пациента толерантности к более высоким дозам, обычная(ые) доза(ы) должна(ы) быть ниже терапевтической дозы.
Способ введения
Антитела, используемые в способах согласно изобретению, вводят человеку методами, известными практическим врачам, такими как внутривенное введение, например, введение ударной дозы или непрерывное вливание в течение определенного периода времени, подкожное, внутримышечное, внутриартериальное, внутрибрюшинное, внутрилегочное, интрацереброспинальное, внутрисуставное, интрасиновиальное и интратекальное введение, а также введение в пораженный участок или ингаляция (например, интраназальная), а в основном, внутривенное или подкожное введение.
В одном из вариантов изобретения, гуманизованное антитело 2Н7 вводят путем внутривенного вливания с 0,9% раствора хлорида натрия в качестве инфузионного носителя.
Комбинированная терапия
Для лечения В-клеточных опухолей, описанных выше, пациенту могут быть введены CD20-связывающие антитела согласно изобретению в комбинации с одним или несколькими терапевтическими средствами, такими как химиотерапевтическое средство, в соответствии со схемой введения множества лекарственных средств. CD20-связывающее антитело может быть введено одновременно, последовательно или поочередно с химиотерапевтическим средством, либо после другой терапии, к которой данный пациент оказался невосприимчивым. Стандартными химиотерапевтическими средствами для лечения лимфомы могут быть циклофосфамид, цитарабин, мелфалан и митоксантрон плюс мелфалан. Одной из наиболее часто применяемых химиотерапевтических схем лечения не-ходжкинской лимфомы является СНОР. Лекарственными средствами, используемыми в схеме СНОР, являются: циклофосфамид (торговый знак “цитоксан”, неозар); адриамицин (доксорубицин/гидроксидоксорубицин); винкристин (онковин); и преднизолон (иногда называемый дельтазоном или оразоном). В конкретных вариантах изобретения, CD20-связывающее антитело вводят пациенту, нуждающемуся в этом, в комбинации с одним или несколькими нижеследующими химиотерапевтическими средствами, такими как доксорубицин, циклофосфамид, винкристин и преднизолон. В конкретном варианте изобретения, пациента, страдающего лимфомой (такой как не-ходжкинская лимфома), подвергают лечению анти-CD20 антителом согласно изобретению в комбинации с терапией СНОР (циклофосфамидом, доксорубицином, винкристином и преднизоном). В другом варианте изобретения, пациент, страдающий раком, может быть подвергнут лечению гуманизованным CD20-связывающим антителом согласно изобретению в комбинации с химиотерапией СVP (циклофосфамидом, винкристином и преднизоном). В конкретном варианте изобретения, пациента, страдающего CD20-позитивной НХЛ, подвергают лечению гуманизованным 2Н7.v16 или его вариантом, описанным выше, в комбинации с СVP. В конкретном варианте лечения ХЛЛ, CD20-связывающее антитело вводят в комбинации с химиотерапией, включающей одно из таких средств, как флударабин и цитоксан, или оба эти средства.
Для лечения аутоиммунных заболеваний или аутоиммунных родственных состояний, описанных выше, пациент может быть подвергнут лечению средством, истощающим В-клетки, таким как CD20-связывающие антитела согласно изобретению в комбинации со вторым терапевтическим средством, таким как иммунодепрессант, в соответствии со схемой введения множества лекарственных средств. Указанное средство, истощающее В-клетки, может быть введено одновременно, последовательно или поочередно с иммунодепрессантом, либо после другой терапии, к которой данный пациент оказался невосприимчивым. Иммунодепрессант может быть введен в обычно используемых дозах или в меньших дозах. Выбор предпочтительного вспомогательного иммунодепрессанта зависит от многих факторов, включая тип заболевания, подвергаемого лечению, а также историю болезни пациента.
Термин “иммунодепрессант”, используемый здесь для проведения вспомогательной терапии, означает средство, которое подавляет или маскирует иммунную систему пациента. Такие средства должны включать вещества, которые подавляют продуцирование цитокинов, ингибируют или подавляют экспрессию аутоантигена, или маскируют антигены МНС. Примерами таких средств являются стероиды, такие как глюкокортикостероиды, например, преднизон, метилпреднизолон и дексаметазон; 2-амино-6-арил-5-замещенные пиримидины (см. патент США № 4665077), азатиоприн (или циклофосфамид, в том случае, если наблюдается побочная реакция на азатиоприн); бромкриптин; глутаральдегид (маскирующий антигены МНС, как описано в патенте США № 4120649); антиидиотипические антитела против антигенов МНС и фрагментов МНС; циклоспорин А; антагонисты цитокина или рецептора цитокина, включая антитела против интерферона-γ, β или α; антитела против фактора некроза опухоли-α; антитела против фактора некроза опухоли-β; антитела против интерлейкина-2 и антитела против рецептора IL-2; антитела против L3T4; гетерологичное антитело против лимфоцитарного глобулина; пан-Т-антитела, а предпочтительно, анти-CD3 или анти-CD4/CD4a антител; растворимый пептид, содержащий LFA-3-связывающий домен (заявка WO 90/08187, опубликованная 7/26/90); стрептокиназа; TGF-β; стрептодорназа; РНК или ДНК хозяина; FK506; RS-61443; дезоксиспергуалин; рапамицин; Т-клеточный рецептор (патент США № 5114721); фрагменты Т-клеточного рецептора (Offner et al., Science 251:430-432 (1991); WO 90/11294 и WO 91/01133) и антитела против Т-клеточного рецептора (ЕР 340109), такие как Т10В9.
Для лечения ревматоидного артрита пациенту может быть введено анти-CD20 антитело согласно изобретению в комбинации с одним или несколькими нижеследующими средствами, такими как: DMARDS (модифицирующие заболевание противоревматические лекарственные средства, например, метотрексат), NSAI или NSAID (нестероидные противовоспалительные лекарственные средства), HUMIRATM (адалимумаб; Abbott Laboratories), ARAVA® (лефлуномид), REMICADE® (инфликсимаб; Centocor Inc., of Malvern, Pa), ENBREL (этанерцепт; Immunex, WA) и ингибиторы СОХ-2. Лекарственными средствами DMARD, обычно используемыми для лечения РА, являются гидроксихлорохин, сульфасалазин, метотрексат, лефлуномид, этанерцепт, инфликсимаб, азатиоприн, D-пеницилламин, золото (для перорального введения), золото (для внутримышечного введения), миноциклин, циклоспорин и иммуноадсорбирующий стафилококковый белок А. Адалимумаб представляет собой моноклональное антитело человека, связывающееся с TNF-α. Инфликсимаб представляет собой химерное моноклональное антитело, связывающееся с TNF-α. Этанерцепт представляет собой гибридный белок “иммуноадгезин”, состоящий из внеклеточной лиганд-связывающей части рецептора человека фактора некроза опухоли размером 75 кД (р75)(TNFR), связанной с Fc-частью IgG1 человека. Описание лечения РА можно найти, например, в руководстве “Guidelines for the management of rheumatoid arthritis” Arthritis & Rheumatism 46(2):328-346 (February, 2002). В конкретном варианте изобретения, пациент, страдающий РА, может быть подвергнут лечению анти-CD20 антителом согласно изобретению в комбинации с метотрексатом (МТХ). Репрезентативная доза МТХ составляет примерно 7,5-25 мг/кг/неделю. МТХ может быть введен перорально и подкожно.
Для лечения анкилозирующего спондилита, псориатического артрита и болезни Крона пациенту может быть введено CD20-связывающее антитело согласно изобретению в комбинации, например, со средством Remicade® (инфликсимабом, поставляемым Centocor Inc., of Malvern, Pa) и ENBREL (этанерцептом; Immunex, WA).
Для лечения СКВ вводят высокие дозы кортикостероидов и/или циклофосфамида (HDCC).
Для лечения псориаза пациенту может быть введено CD20-связывающее антитело в сочетании с местной терапией лекарственными средствами, такими как стероиды для местного применения, антралин, кальципотриен, клобетазол и тазаротен, или в сочетании с терапией метотрексатом, ретиноидами, циклоспорином, РUVA и UVВ. В одном из вариантов изобретения пациент с псориазом может быть подвергнут лечению CD20-связывающим антителом с последовательным или одновременным введением циклоспорина.
Фармацевтические композиции
Терапевтические композиции антител, используемых в соответствии с настоящим изобретением, получают в виде препаратов, удобных для хранения, путем смешивания антитела, имеющего нужную степень чистоты, с необязательными физиологически приемлемыми носителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980)), в форме лиофилизованных композиций или водных растворов. Приемлемые носители, наполнители или стабилизаторы в используемых дозах и концентрациях должны быть нетоксичными для реципиентов, и ими являются буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензэтония; фенолоспирт, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные полипептиды (имеющие примерно менее, чем 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; металлокомплексы (например, комплексы Zn - белок); и/или неионогенные поверхностно-активные вещества, такие как твинТМ, плюроникТМ или полиэтиленгликоль (ПЭГ).
Репрезентативные композиции анти-CD20 антител описаны в заявке WO 98/56418, точное содержание которой вводится в настоящую заявку посредством ссылки. Другой композицией является жидкая мультидозовая композиция, содержащая 40 мг/мл анти-CD20 антитела, 25 мМ ацетата, 150 мМ трегалозы, 0,9% бензилового спирта, 0,02% полисорбата 20 при рН 5,0, и имеющая минимальный срок хранения 2 года при 2-8°С. Другая представляющая интерес композиция анти-CD20 антител содержит 10 мг/мл антитела в 9,0 мг/мл хлорида натрия, 7,35 мг/мл дигидрата цитрата натрия, 0,7 мг/мл полисорбата 80 и стерильную воду для инъекций, рН 6,5. Еще одна водная фармацевтическая композиция содержит 10-30 мМ ацетата натрия, при рН 4,8-5,5, а предпочтительно, при рН 5,5, полисорбат, используемый в качестве поверхностно-активного вещества в количестве примерно 0,01-0,1% об/об, трегалозу в количестве примерно 2-10% масс/об и бензиловый спирт, используемый в качестве консерванта (патент США 6171586). Лиофилизованные композиции, адаптированные для подкожного введения, описаны в WO 97/04801. Такие лиофилизованные композиции могут быть разведены подходящим разбавителем до высокой концентрации белка, и такая разведенная композиция может быть подкожно введена млекопитающему, подвергаемому лечению в соответствии с настоящим изобретением.
Одна из композиций, содержащая гуманизованные варианты 2Н7, включает антитело в концентрации 12-14 мг/мл в 10 мМ гистидина, 6% сахарозы, 0,02% полисорбата 20, рН 5,8. В конкретном варианте изобретения, композиция, содержащая варианты 2Н7, а в частности, 2Н7.v16, включает 20 мг/мл антитела в 10 мМ сульфата гистидина, 60 мг/мл сахарозы, 0,2 мг/мл полисорбата 20 и стерильную воду для инъекций, рН 5,8.
Описанная здесь композиция может также содержать несколько активных соединений, необходимых для конкретного показания, а предпочтительно, имеющих дополнительные активности, не оказывающие негативного влияния друг на друга. Так, например, может оказаться желательным дополнительное введение цитотоксического средства, химиотерапевтического средства, цитокина или иммунодепрессанта (например, средства, которое действует на Т-клетки, такого как циклоспорин, или антитела, которое связывается с Т-клетками, например, антитела, связывающегося с LFA-1). Эффективное количество таких дополнительных средств зависит от количества антитела, присутствующего в данной композиции, от типа заболевания или расстройства, или от способа лечения, а также от других факторов, обсуждаемых выше. Указанные средства обычно вводят в таких же дозах и таким же способом, как описано в настоящей заявке, или в дозе, составляющей примерно от 1 до 99% от вышеописанных применяемых доз.
Активные ингредиенты могут быть также заключены в микрокапсулы, полученные, например, методами коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозную или желатиновую микрокапсулы и в полиметилметакрилатные микрокапсулы, соответственно, в системы для доставки коллоидальных лекарственных средств (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такая методика описана в руководстве Remington's Pharmaceutical Sciences, 16th edition, Osol, A. Ed. (1980).
Могут быть получены препараты пролонгированного высвобождения. Подходящими примерами препаратов пролонгированного высвобождения являются полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих антагонист, где указанные матрицы имеют форму готовых изделий, например, пленок или микрокапсул. Примерами матриц пролонгированного высвобождения являются полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и этил-L-глутамата, неразлагаемый сополимер этилена-винилацетата, разлагаемые сополимеры молочной кислоты - гликолевой кислоты, такие как LUPRON DEPOTТМ (микросферы для инъекций, состоящие из сополимера молочной кислоты - гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляная кислота.
Композиции, используемые для in vivo введения, должны быть стерильными. Это может быть легко осуществлено путем фильтрации через стерильные фильтрующие мембраны.
Промышленные изделия и наборы
В другом своем варианте, настоящее изобретение относится к промышленному изделию, содержащему материалы, используемые для лечения вышеупомянутых заболеваний, например, аутоиммунного заболевания или рака, такого как ХЛЛ. Такое промышленное изделие содержит по меньшей мере один контейнер и этикетку или вкладыш, вложенный в упаковку или наклеенный на контейнер. Подходящими контейнерами являются, например, бутыли, флаконы, шприцы и т.п. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. По меньшей мере один контейнер содержит композицию, которая является эффективной для лечения указанного состояния, и может иметь стерильное входное отверстие (например, таким контейнером может быть пакет для внутривенного введения раствора или сосуд, имеющий пробку, протыкаемую иглой для подкожных инъекций). В таком промышленном изделии могут присутствовать две терапевтические композиции. В первой композиции по меньшей мере одним активным агентом является Fc-вариант антитела согласно изобретению. На этикетке или во вкладыше, вложенном в упаковку, должно быть указано, что такая композиция используется для лечения конкретного состояния. На этикетке или во вкладыше, вложенном в упаковку, могут также содержаться инструкции по введению таких композиций пациенту. На вкладыше, вложенном в упаковку промышленного изделия, содержащего терапевтические средства, имеются инструкции, которые обычно содержат информацию о показаниях, применении, дозах, способе введения, противопоказаниях и/или предупреждении, относящихся к применению таких терапевтических продуктов. Кроме того, указанное промышленное изделие может также включать контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может также включать и другие материалы, необходимые с точки зрения коммерческого производства и потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Экспериментальные примеры
Нижеследующие экспериментальные примеры приводятся лишь в целях иллюстрации, и не должны рассматриваться как ограничение объема изобретения.
Пример 1
Фаговое представление IgG1-Fc человека для отбора моносайтовых мутантов с оптимизированным рН-зависимым связыванием с FcRn человека
Для фагового представления, авторами настоящего изобретения был использован “бесшарнирный” вариант IgG1-Fc человека, в котором дисульфиды шарнирной области были удалены (С226 был делетирован, а С229 заменен остатком Ser), а С-конец был присоединен к С-концевой области белка gIII М13 (g3p) в фагмидной конструкции (рW0437). Последовательность белка (SEQ ID NO:38) представлена на фиг.7. В качестве мишени для фагового отбора, авторы использовали FcRn человека (huFcRn), который был биотинилирован и иммобилизован на покрытых нейтравидином иммунносорбентных планшетах (MaxisorpТМ), в буфере с рН 6,0, и который тщательно промывали буфером, рН 6,0, для удаления низкоаффинных вариантов, а элюированные рН-чувствительные варианты с более высокой аффинностью промывали буфером при рН 7,4. В третьем раунде отбора, доминантным клоном был N434W (этому варианту соответствовали 44 из 48 секвенированных клонов), при этом, также присутствовали клоны N434Y (3/48) и N434F (1/48).
Для минимизации числа мутаций в Fc (а следовательно, минимизации риска иммуногенности терапевтических антител) библиотеки фагового представления содержали только одну аминокислотную замену. Наиболее широко применяемыми методами создания рандомизированных библиотек фрагментов антител для отбора путем фагового представления, является олигонуклеотид-направленный мутагенез, осуществляемый для одновременного введения мутаций в множество остатков, и неспецифический мутагенез, осуществляемый с помощью ПЦР с вероятностью ошибки или аналогичным методом (см. Clackson & Lowman (eds.), Phage Display: A Practical Approach, Oxford University Press (2004)); однако, обычно, эти методы приводят к введению множества мутаций на одну молекулу, которые должны быть затем восстановлены для определения минимального числа мутаций, необходимых для достижения нужных молекулярных свойств. В качестве альтернативы, авторами настоящего изобретения была сконструирована рандомизированная библиотека путем системного введения мутации каждого остатка по отдельности в 10А FcRn (в структуре, в том случае, если FcRn связывается с IgG, гомологичной структуре FcRn крысы (Burnmeister, 1997)) с помощью олигонуклеотид-направленного мутагенеза. Таким образом, 43 “мини-библиотеки”, каждая из которых состоит из 20 вариантов в конкретном аминокислотном положении (таблица 1), составляют полную библиотеку из 8600 вариантов, используемых для отбора моносайтовых Fc-вариантов с повышенным уровнем рН-зависимого связывания с FcRn.
Предыдущие попытки проведения отбора на Fc-варианты, которые связываются с FcRn человека с более высокой аффинностью, оказались безуспешными (Dall'Acqua 2002; US2003/0190311). В этих исследованиях, huFcRn непосредственно наносили на планшет Maxisorp. Авторами настоящего изобретения было обнаружено, что huFcRn является очень чувствительным к условиям нанесения на планшет, и для сохранения его способности связываться с Fc, он должен быть биотинилирован и иммобилизован на покрытых нейтравидином планшетах Maxisorp.
Планшеты Maxisorp покрывали 2 мкг/мл нейтравидина в 50 мМ карбонатного буфера, рН 9,6, в течение ночи при 4єС, а затем блокировали аналитическим разбавителем (PBS + 0,5% ВSA, рН 6,0). 50 мкл huFcRn (~0,2 мг/мл) биотинилировали путем смешивания с 10 мкл свежеприготовленного 10 мМ биотин-LС-NНS (Pierce) при комнатной температуре в течение 30 минут. Непрореагировавший биотин-LС-NНS инактивировали добавлением 10 мкл 1 М триса. huFcRn-биотин очищали от избыточного количества биотин-триса с помощью гель-фильтрации на колонке РD-10, уравновешенной PBS, рН 6,0 (Amersham-Pharmacia). Было собрано 2 мл продукта (huFcRn-биотина, 5 мкг/мл). huFcRn-биотин иммобилизовали в 8 лунках, покрытых нейтравидином, и лунки блокировали в течение 1 часа (110 мкл/лунку). Планшет три раза быстро ополаскивали аналитическим разбавителем, а затем добавляли фаг.
Фаговые частицы, культивированные в течение ночи до конфлюентности, собирали путем преципитации смесью 2,5М NаСl/20% ПЭГ и ресуспендировали в аналитическом разбавителе, обычно в концентрации 1013 фага/мл. Затем фаг разводили 1:10 в аналитическом разбавителе и оставляли для связывания с лунками, покрытыми huFcRn-биотином (или с непокрытыми лунками, используемыми в качестве негативного контроля), примерно на 1 час (100 мкл/лунку). Планшеты промывали PBS + 0,05% твина, рН 6,0. Промывки осуществляли с увеличением жесткости для каждого раунда отбора (первый раунд: 10 быстрых промывок; второй раунд: 20 быстрых промывок; третий раунд: 40 быстрых промывок; четвертый раунд: 16 быстрых промывок и 20 промывок по 15 секунд; пятый раунд: 4 быстрых промывки и одна промывка в течение 3 минут, и эти промывки повторяли 5 раз (всего 20 промывок)). Оставшийся связанный фаг элюировали 110 мкл PBS при рН 7,4 и добавляли к 10 мл культуры E.coli в логарифмической фазе роста (XL1-Blue; Stratagene, Inc.) для размножения.
Пример 2
Характеризация растворимых белков Fc-варианта
Растворимые Fc-варианты, имеющие указанные мутации, экспрессировали, очищали и анализировали в анализе на связывание BIAcore для определения аффинности связывания этих вариантов с FcRn человека и собакоподобных обезьян, а также с FcRn крысы и мыши. Такие Fc-варианты были также проанализированы с помощью эксклюзионной хроматографии для определения их тенденции к агрегации.
Варианты Fc-фрагментов были экспрессированы путем трансформации клеток E.coli 34В8 мутантными фагмидами рW0437, культивирования в течение 24 часов при 30°С в среде, не содержащей фосфата, для индуцирования экспрессии генов Fc и сбора клеток. Клеточную массу замораживали в течение ночи и подвергали лизису путем создания осмотического шока в 10 мМ триса, 1 мМ EDTA. Лизат осветляли путем центрифугирования и наносили на колонку с белком А. Колонку промывали PBS, растворимый Fc элюировали белок А-цитратным элюирующим буфером (0,1М цитрат, рН 3,0) и нейтрализовали трисом при рН 7,5. Растворимый Fc концентрировали на аппарате Amicon Centriprep.
FcRn человека, FcRn собакоподобных обезьян, а также FcRn мыши и крысы иммобилизовали химическим NHS-методом на чипах Biacore CM5 при различных плотностях (100-3000 единиц отклика). Fc-варианты серийно разводили с 10 мкМ до 1 нМ в PBS при рН 6,0, и в течение определенного периода времени проводили мониторинг связывания. Для родительского “бесшарнирного” Fc (т.е., дикого типа), равновесное связывание с huFcRn достиглось почти сразу, что указывало на то, что Fc имеет очень быструю скорость ассоциации и диссоциации, а Kd составляет приблизительно 700 нМ, как было определено с помощью анализа на равновесие (фиг.8). Для N434W-варианта скорость ассоциации была значительно ниже, а скорость диссоциации была крайне низкой. Путем введении мутации N434W при более низкой скорости потока и в течение более длительного периода времени может быть проведен анализ на равновесие, и в этом случае Kd составляет примерно 4 нМ. N434W-, N434F- и N434А-варианты и тройной мутант N434А + Е380А + Т307А, очевидно, обладали более высокой аффинностью, которая, например, в ~170 раз, ~9 раз, ~2,7 раз и в ~14 раз превышала аффинность Fc-области дикого типа, соответственно, при рН 6,0. В отличие от этого, при рН 7,4, аффинность N434-вариантов по отношению к huFcRn была слишком низкой и не могла быть измерена в данном анализе. Увеличение аффинности связывания N434W-варианта по сравнению с аффинностью антитела дикого типа не было достаточным для связывания с FcRn собакоподобных обезьян, что указывало на то, что такая аффинность примерно лишь в 10 раз превышала аффинность связывания с FcRn крысы, а фактически, она была такой же, как и аффинность дикого типа в отношении связывания с FcRn мыши (данные не приводятся). Таким образом, повышение аффинности, достигаемое при введении этой мутации, является специфическим для FcRn человека.
Очевидно, что в результате эффекта валентности, агрегированный Fc может обладать более высокой аффинностью связывания с FcRn. Авторами настоящего изобретения были проанализированы Fc-варианты (дикого типа (WT), N434W, N434Y, N434F, N434А и N434А + Е380А + Т307А) путем проведения количественной эксклюзионной хроматографии. Очевидно, что все варианты были по меньшей мере на 90% мономерными, за исключением N434W, и имели значительное число димерных, тетрамерных и октамерных форм. Мономерный вариант N434W был очищен от олигомерных форм с помощью препаративной эксклюзионной хроматографии на колонке S-200. Очищенный мономерный материал сохранял свою высокую аффинность связывания с huFcRn в анализе на связывание с SРR, что указывает на то, что повышение аффинности, наблюдаемое для N434W, фактически, обусловлено изменениями его природной аффинности связывания с huFcRn, а не артефактом агрегации. Очищенный олигомерный N434W действительно обнаруживал пониженную аффинность связывания с FcRn (фиг.8).
Пример 3
Характеризация гуманизованных вариантов анти-CD20 IgG1,
имеющих мутации в Fc
Мутации, идентифицированные посредством фагового представления Fc человека, были также протестированы на их эффекты по отношению к исходному интактному антителу, 2Н7.v138. Антитело 2Н7.v138 представляет собой гуманизованное анти-CD20 антитело, в котором Fc, в целях повышения ADCC- и CDС-активности, был модифицирован посредством введения следующих мутаций: S298А, К326А, Е333А, К334А. В указанное исходное антитело были введены мутации в положении N434, а IgG (таблица 2) был получен путем кратковременной трансфекции клеток 293, как описано ранее. В каждом случае, было обнаружено, что очищенные варианты IgG имели низкие уровни агрегации белка, как было определено с помощью эксклюзионной хроматографии, описанной выше.
Варианты 2Н7.v138 IgG1 человека анализировали на рН-зависимое связывание с FcRn человека в ELISA с использованием биотинилированного FcRn. 96-луночные микротитрационные планшеты MaxiSorp (Nunc, Roskilde, Denmark) покрывали 2 мкг/мл нейтравидина (Pierce, Rockford, IL) при 100 мкл/лунку в 50 мМ карбонатрого буфера, рН 9,6, при 4°С в течение ночи. Планшеты промывали PBS, содержащим 0,05% полисорбат (промывочным буфером), рН 7,4, и блокировали PBS, содержащим 0,5% ВSA, рН 7,4, при 150 мкл/лунку. После инкубирования в течение одного часа при комнатной температуре, планшеты промывали промывочным буфером, рН 7,4. FcRn человека биотинилировали с использованием биотина-Х-NНS (Research Organics, Cleveland, OH). Биотинилированный FcRn добавляли в планшеты при 2 мкг/мл, 100 мкл/лунку, в PBS, содержащем 0,5% ВSA, 0,05% полисорбата 20 (буфер для образцов), рН 7,4. Планшеты инкубировали в течение одного часа и промывали промывочным буфером, рН 6,0. Затем в планшеты добавляли семь двухкратных серийных разведений антител IgG (3,1-200 нг/мл) в буфере для образца, рН 6,0. После инкубирования в течение двух часов планшеты промывали промывочным буфером, рН 6,0. Связанный IgG детектировали путем добавления меченного пероксидазой козьего F(ab')2-фрагмента против F(ab')2 IgG человека (Jackson ImmunoResearch, West Grove, PA) при 100 мкл/лунку в буфере для образца, рН 6,0. После инкубирования в течение одного часа планшеты промывали промывочным буфером, рН 6,0, и добавляли субстрат 3,3',5,5'-тетраметилбензидин (ТМВ)(Kirkegaard & Perry Laboratories) при 100 мкл/лунку. Реакцию прекращали добавлением 1 М фосфорной кислоты при 100 мкл/лунку. Оптическую плотность считывали при 450 нм на мультисканирующем ридере Ascent (Thermo Labsystems, Helsinki, Finland). Затем вычисляли оптическую плотность в средней точке стандартной кривой (mid-OD). Соответствующие концентрации стандарта и образцов в этой средней точке mid-OD определяли по кривой титрования с использованием программы для построения четырехпараметрической нелинейной регрессионной кривой (KaleidaGraph, Synergy software, Reading, PA). Относительную активность вычисляли путем деления концентрации стандарта в средней точке mid-OD на концентрацию образца.
Для оценки диссоциации связанного IgG от FcRn при рН 6,0 или при рН 7,4, проводили аналогичный анализ, за исключением того, что после стадии инкубирования образца и промывки планшетов добавляли 100 мкл/лунку буфера для образца при рН 6,0 или 7,4. Планшеты инкубировали в течение 45 минут и промывали. Затем проводили анализ как описано выше.
Результаты (фиг.9) показали, что относительные аффинности связывания аналогичны аффинностям, наблюдаемым для Fc-вариантов. При рН 6,0, относительные аффинности связывания составляли v477>v478=v479>v364>v138. При рН 7,4, относительные аффинности связывания были стабильно ниже, чем при рН 6,0, причем, эти относительные аффинности связывания распределялись аналогичным образом: v477>v478=v479>v364>v138.
Указанные Fc-мутации могут широко применяться для антител IgG человека.
Пример 4
In vivo исследования влияния связывания с FcRn на фармакокинетические свойства
Для определения влияния повышенной аффинности связывания с FcRn на фармакокинетику этих Fc-вариантов антител in vivo, собакоподобным обезьянам (Macaca fascicularis) или другим приматам внутривенно инъецировали каждый вариант антитела, и в течение определенного периода времени брали пробы крови для мониторинга клиренса указанного антитела. Нескольким животным инъецировали одну или несколько доз. В одном эксперименте, во время 0 на день 1 вводили одну i.v. дозу 1-20 мг/кг. Перед введением дозы и через 6 ч, 24 ч и 72 ч после введения дозы, у каждого животного брали пробы крови (сыворотки). На 8-ой день, 10-й день, 30-й день и 60-й день брали дополнительные пробы крови. Концентрации антител в пробах сыворотки определяли с помощью ELISA. Зависимое от времени увеличение концентрации антител в сыворотке моделировали стандартными фармакологическими методами (Shargel & Yu, Applied Pharmaceuticals and Pharmacokinetics, Fourth edition, pp.67-98, Appleton & Lange, Stamford, CT (1999)). Для подсчета первоначального распределения антител а тканях (альфа-фаза), а затем распределения в конечной фазе или фазе элиминации (бета-фазе) использовали двух-камерную модель. Вычисленный таким образом полупериод элиминации (t1/2β) позволил выявить эффект повышения аффинности связывания с FcRn, обусловленный сохранением IgG в кровотоке благодаря функции FcRn.
В одном из таких исследований были проведены сравнения фармакокинетики трех гуманизованных моноклональных анти-ВR3 антител (PRO145234, PRO145181 и PRO145182) с различными аффинностями связывания с FcRn собакоподобных обезьян. ВR3 (также известный как BAFF-R) представляет собой трансмембранный белок типа III, состоящий из 184 остатков и экспрессируемый на поверхности В-клеток (Thompson J.S. et al. (2001) Science 293, 2108-2111; Yan M. et al. (2001) Curr. Biol. 11, 1547-1552). PRO145234 представляет собой анти-ВR3 антитело дикого типа, а PRO145181 и PRO145182 представляют собой варианты N434А и N434W, соответственно, которые имеют повышенную аффинность связывания с FcRn человека и собакоподобных обезьян.
Семнадцать самцов и 17 самок собакоподобных обезьян (Macaca fascicularis) получали от фирмы SNBL USA. На время физического обследования в начале исследования (например, в начале акклиматизации), обезьяны имели возраст 45 лет и массу 24 кг. В исследованиях участвовали только здоровые на вид животные и животные, не имеющие явных отклонений. Тридцать животных были произвольно распределены по их массе по трем группам. Животным в группах 1, 2 и 3 вводили одну i.v. дозу 20 мг/кг PRO145234 (дикого типа), PRO145181 (N434А) или PRO145182 (N434W), соответственно. Протокол исследований систематизирован в Таблице 11.
Для проведения фармакокинетического анализа, из периферической вены каждого животного брали приблизительно 1,0 мл крови в следующие моменты времени:
• Перед введением дозы.
• Через 30 минут и через 6 часов после введения дозы на 1-й день исследования.
• В дни исследования 2, 3, 4, 5, 8, 11, 15, 18, 22, 29, 36, 43, 50, 57, 64, 71, 78, 85, 92, 99, 106, 113, 120, 127 и 134.
Для проведения анализа на анти-терапевтическое антитело, из периферической вены каждого животного брали приблизительно 1,0 мл крови в следующие моменты времени:
• Перед введением дозы.
• В дни исследования 15, 29, 43, 57, 71, 85, 99, 113, 127 и 134.
Пробы крови для проведения фармакокинетического анализа (ФК) и анализа на анти-терапевтическое антитело (АТА) собирали в пробирки сепаратора для сбора сыворотки и оставляли для свертывания при комнатной температуре приблизительно на 30-80 минут. Сыворотку (приблизительно 0,5 мл) получали путем центрифугирования (2000×g в течение 15 минут при комнатной температуре). Пробы сыворотки переносили в предварительно помеченные 1,5-миллилитровые пробирки Эппендорфа и хранили в холодильнике при температуре от -60°С до -80°С, после чего их помещали на сухой лед, а затем ночью отправляли в лабораторию Genentech для определения концентраций PRO145234, PRO145181 и PRO145182.
Концентрации PRO145234, PRO145181 и PRO145182 в каждой пробе сыворотки определяли с помощью ELISA-анализа. В этом анализе нижний предел количественной оценки (LLOQ) в сыворотке составляет 0,05 мкг/мл. Величины ниже этого предела регистрировали как пренебрежимо малую величину (LTR). Антитерапевтические антитела в каждом образце определяли с помощью перекрывающегося иммуноферментного анализа факторов свертывания крови (ECLA).
В анализе данных использовали номинальную дозу и время сбора образца с минимальными отклонениями от схемы исследования. Среднее значение и ср.кв.от. для сывороточных концентраций PRO145234, PRO145181 и PRO145182 у самцов и самок собакоподобных обезьян вычисляли с использованием программы Exсel (version 2000, Microsoft Corporation, Redmond, WA) и строили график с помощью программы SigmaPlot (version 9.0; Systat Software, Inc., Point Richmond, CA). Сывороточные концентрации, которые были меньше регистрируемого предела величины, исключали из всех анализов данных. Ср. кв.от. не вычисляли, если n ≤ 2. Результаты представлены величинами до трех значащих цифр.
Фармакокинетические параметры оценивали с использованием двухкамерной модели Гаусса-Ньютона (Levenberg & Hartley) со схемой математического взвешивания 1/ŷ (WinNonlin Version 3.2; Pharsight Corporation; Mountain View, CA). У восьми из десяти собакоподобных обезьян в группе 1 (дикого типа; PRO145234) и у пяти из 10 собакоподобных обезьян в группе 3 (N434W; PRO145182) АТА вырабатывалось на 57-й день. В общих чертах, обнаружение АТА в конкретный период времени коррелировало с резким снижением сывороточных концентраций в течение этого времени или в последующее время, то есть присутствие АТА приводило к сокращению конечного времени полужизни и снижению времени воздействия лекарственного средства. Для оценки степени влияния АТА-ответа на фармакокинетику, средние значения ФК-параметров для каждой группы вычисляли двумя методами. В методе 1, ФК-параметры (среднее значение ± стандартное отклонение) вычисляли с использованием данных, полученных для всех 10 собакоподобных обезьян в каждой группе. В методе 2, ФК-параметры вычисляли с использованием данных, полученных только для собакоподобных обезьян, у которых не вырабатывались анти-терапевтические антитела на день 57 (n = 2 для группы 1, n = 10 для группы 2 и n = 5 для группы 3). Для групп 1 и 3, метод 1 давал более низкие величины конечного времени полужизни (t1/2,β) и времени воздействия лекарственного средства (AUC; мера общего воздействия лекарственного средства) по сравнению с методом 2. Однако, в целом, результаты для двух этих методов были аналогичными. Поэтому, средние величины зарегистрированных ФК-параметров вычисляли методом 1 (например, включая данные для всех собакоподобных обезьян).
Результаты
После одного i.v. введения ударной дозы 20 мг/кг PRO145234 (антитела дикого типа), PRO145181 (вариант N434А) и PRO145182 (вариант N434W), сывороточные концентрации обнаруживали двухфазное распределение, при этом, наблюдалась быстрая начальная фаза распределения с последующей более медленной фазой элиминации (фигура 12). Оцениваемые ФК-параметры для каждой группы представлены в таблице 12 и включают данные для всех десяти собакоподобных обезьян в каждой группе. Конечное время полужизни (среднее ± ср.кв.от.) PRO145234 (антитела дикого типа) составляло 6,15 ± 2,01 дней и варьировалось от 4,24 до 11,0 дней у десяти собакоподобных обезьян. Среднее конечное время полужизни (t1/2,β) PRO145234 у двух собакоподобных обезьян, у которых на 57-й день не вырабатывались ATA, составляло 8,95 дней. Для PRO145181 (вариант N434A), среднее конечное время полужизни составляло 1,41 ± 1,55 дней, и в 1,6-2,3 раза превышало время полужизни PRO145234 (p<0,05). Для PRO145182 (вариант N434W), среднее значение ± ср.кв.от. конечного времени полужизни у десяти собакоподобных обезьян составляло 9,55 ± 2,49 дней. Эта величина значительно превышала общую среднюю величину t1/2,β PRO145234 (антитела дикого типа) у десяти собакоподобных обезьян (р<0,05), но была почти аналогична средней величине t1/2,β PRO145234 у двух собакоподобных обезьян, у которых не вырабатывались детектируемые уровни АТА (8,95 дней). Вероятно, что наблюдаемое различие в величинах t1/2,β для PRO145234 (антитела дикого типа) и для PRO145182 (варианта N434W) не соответствовало истинному из-за АТА-ответа у животных этих двух групп.
Площадь под кривой (AUС) зависимости концентрации от времени, экстраполированной до ∞ (бесконечности) для PRO145234 (антитела дикого типа), составляла 2440 ± 398 день · мкг/мл и варьировалась в пределах от 1740 до 3140 день · мкг/мл для десяти собакоподобных обезьян. Среднее значение AUC для PRO145234 у двух собакоподобных обезьян, у которых на 57-й день не вырабатывалось АТА, составляло 2850 день · мкг/мл. Для PRO145181 (варианта N434А), среднее значение AUC составляло 4450 ± 685 день · мкг/мл и в 1,6-1,8 раз превышало значение для PRO145234 (антитела дикого типа) (р<0,05). Какого-либо различия между AUC для PRO145234 (антитела дикого типа) и для PRO145182 (варианта N434W) не наблюдалось.
В целом, фармакокинетику PRO145234, PRO145181 и PRO145182 оценивали после введения собакоподобным обезьянами одной i.v. дозы 20 мг/кг. У восьми из 10 собакоподобных обезьян, которым вводили PRO145234, вырабатывались анти-терапевтические антитела (АТА) на 56-й день, и у пяти из 10 собакоподобных обезьян, которым вводили PRO145182, также вырабатывались АТА на 56-й день. У собакоподобных обезьян, которым вводили PRO145181, антитела АТА не вырабатывались на 56-й день. PRO145181 (вариант N343А) обнаруживал увеличение конечного времени полужизни и увеличение AUC по сравнению с PRO145234 (антителом дикого типа)(р<0,05). PRO145182 обнаруживал небольшое увеличение конечного времени полужизни по сравнению с PRO145234; однако, вероятно, что такое наблюдаемое различие является ложным результатом, обусловленным вырабатыванием анти-терапевтического антитела в ответ на введение PRO145234 и PRO145182.
Пример 5
Варианты IgG1 человека с повышенной аффинностью связывания с FcγRIII
Для повышения антитело-зависимой клеточно-опосредуемой цитотоксичности (ADCC) посредством повышения аффинности связывания IgG с активирующими Fcγ-рецепторами и снижения аффинности связывания IgG с ингибирующими Fcγ-рецепторами были введены мутации, описанные ранее (Shields et al., J. Biol. Chem. 276:6591-6604 (2001); Presta et al., Biochem. Soc. Trans. 30:487-490 (2002)). Мутации, повышающие ADCC-активность при сохранении или увеличении комплемент-зависимой цитотоксичности (CDC), представляют особый интерес, поскольку оба эти механизма могут играть важную роль в лизисе CD20-позитивных клеток in vivo. В частности, три Ala-мутации, взятые в комбинации, а именно: S298А+Е333А+К334А, были ранее идентифицированы как мутации, повышающие CDС-активность в результате повышения аффинности связывания с С1q (Idusogie et al., J. Immunol. 164:4178-4184 (2000)); Idusogie et al. J. Immunol. 166:2571-2575 (2001)) и повышающие ADCC-активность в результате повышения уровня связывания с FcγRIII и снижения уровня связывания с FcγRII (Shields et al., 2001). Эти мутации, вместе с другой заменой, повышающей ADCC- и CDС-активность, а именно, К326А, были внесены в гуманизованный вариант анти-CD20 антитела, известный как 2Н7.v138 (таблица 3).
В настоящей заявке описаны дополнительные аминокислотные замены в положениях 298, 333 и 334. Каждую замену вводили в исходное 2Н7.v16 и сравнивали с v16 в ELISA-анализе на относительное связывание с высокоаффинным или с низкоаффинным изотипом FcγRIII человека (фиг.11). Эти результаты показали, что несколько замен в этих положениях, таких как S298Т, S298L, Е333L и К334G, были вполне допустимыми и оказывали незначительное влияние на аффинность связывания с FcγRIII (таблица 1). Другие замены, такие как S298G, Е333G и К334R, оказывали негативное влияние на связывание, что было обусловлено либо нежелательными взаимодействиями этих боковых цепей с рецептором, либо дестабилизирующим воздействием на структуру Fc. Одна мутация, К334L, была идентифицирована как мутация, которая приводила к увеличению аффинности связывания с FcγRIII более, чем в 3 раза.
Эти результаты показали, что другие замены, помимо Ala, в выбранных положениях Fc, которые дают эффекты в комбинации с Ala-заменами, могут приводить к повышению уровня связывания с Fcγ-рецепторами. В частности, замена К334L приводит к повышению уровня связывания с FcγRIII и может дополнительно повышать уровня связывания в комбинации с другими Fc-мутациями, такими как мутации в 2Н7.v138. Было высказано предположение, что такие варианты антител обладают повышенной ADCC-активностью и являются более эффективными в отношении истощения клеток-мишеней in vivo.
Пример 6
Гистидиновые мутанты
В данном примере, точковые мутации были проанализированы посредством гистидинового сканирования (His-сканирования) остатков пограничной области между Fc и FcRn, полученной из опубликованной структуры IgG крысыв комплексе с FcRn крысы (Burnmeister, 1997). Авторы настоящего изобретения пришли к заключению, что замены His могут оказаться предпочтительными для рН-зависимого воздействия на связывание IgG с FcRn, поскольку титр боковой цепи His часто определяется при рН 6-7. Замены His в сайте Fc, где для связывания с FcRn предпочтительной является протонированная форма, но не непротонированная форма, должны приводить к получению желательных свойств, обеспечивающих увеличение времени полужизни данной молекулы in vivo.
Авторы настоящего изобретения провели дополнительную характеризацию ранее описанных точковых мутаций, внесенных в полноразмерное антитело (Herceptin®), и исследование свойств нескольких новых вариантов, включая комбинации точковых мутаций.
Конструирование FcRn-вариантов трастумузаба
В предыдущих примерах описаны некоторые мутации в Fc, которые приводят к увеличению аффинности связывания с FcRn, и которые были исследованы в Fc-фрагментах или в остове интактного антитела 2Н7.v138. Для исследования влияния этих мутаций на полноразмерный IgG1 человека, в котором отсутствуют другие Fc-варианты, в остов исходного rhuMab 4D5 (трастузумаба, герцептина®) были введены мутации N434W, N434Y, N434F и N434А c помощью олигонуклеотидного сайт-направленного мутагенеза, описанного ранее. Поскольку три из четырех ароматических аминокислот имели замены в положении N434, введенные с использованием Fc-фаговых библиотек точковых мутаций, авторами был сделан вывод, что, в основном, ароматические замены приводят к повышению аффинности связывания с FcRn (при низком рН, и возможно, при высоком рН). Поэтому была также введена дополнительная мутация N434Н. Эти 5 вариантов герцептина выделяли из крупномасштабных нестационарных клеточных культур СНО путем проведения аффинной хроматографии на белке А и последующей эксклюзионной хроматографии для удаления агрегатов.
Кроме того, в герцептин были введены мутации Е380А, Е380А + Т307А, +/- N434А, и +/- N434Н. Антитела были экспрессированы в клетках 293, очищены с помощью хроматографии на белке А и проанализированы на связывание с FcRn.
Для идентификации дополнительных остатков, играющих важную роль в связывании с FcRn, и мутаций, повышающих аффинность связывания, был применен метод гистидинового сканирования. В этих экспериментах остатки, присутствующие в пограничной области между Fc и FcRn, заменяли гистидиновыми остатками (в соответствии с гомологией структуры FcRn крысы (Burnmeister, 1997)). Антитела с такими мутациями были экспрессированы в клетках 293, очищены и проанализированы на связывание, как описано выше. Мутации, полученные посредством гистидинового сканирования и повышающие аффинность связывания с FcRn, объединяли с мутациями в положении N434, в результате чего получали дополнительную серию вариантов.
ELISA FcRn
Растворимый FcRn получали как было описано ранее (Shields et al., 2001). 96-луночные микротитрационные планшеты MaxiSorp (Nunc, Roskilde, Denmark) покрывали 2 мкг/мл нейтравидина (Pierce, Rockford, IL) при 100 мкл/лунку в 50 мМ карбонатного буфера, рН 9,6, при 4°С в течение ночи. Планшеты промывали PBS, содержащим 0,05% полисорбат (промывочным буфером), рН 7,4, и блокировали PBS, содержащим 0,5% ВSA, рН 7,4, при 150 мкл/лунку. После инкубирования в течение одного часа при комнатной температуре, планшеты промывали промывочным буфером, рН 7,4. FcRn человека биотинилировали с использованием биотина-Х-NНS (Research Organics, Cleveland, OH). Биотинилированный FcRn добавляли в планшеты при 2 мкг/мл, 100 мкл/лунку, в PBS, содержащем 0,5% ВSA, 0,05% полисорбата 20 (аналитический буфер), рН 7,4. Планшеты инкубировали в течение одного часа и промывали промывочным буфером, рН 6,0. Затем в планшеты добавляли семь двухкратных серийных разведений антител IgG (3,1-200 нг/мл) в аналитическом буфере, рН 6,0. В качестве стандарта использовали герцептин. После инкубирования в течение двух часов, планшеты промывали промывочным буфером, рН 6,0. Стадию диссоциации проводили путем добавления аналитического буфера при рН 6,0 или при рН 7,4, 100 мкл/лунку. Планшеты инкубировали в течение 45 минут и промывали промывочным буфером, рН 6,0. Связанный IgG детектировали путем добавления меченного пероксидазой козьего F(ab')2-фрагмента против F(ab')2 IgG человека (Jackson ImmunoResearch, West Grove, PA) при 100 мкл/лунку в аналитическом буфере, рН 6,0. После инкубирования в течение одного часа, планшеты промывали промывочным буфером, рН 6,0, и добавляли субстрат 3,3',5,5'-тетраметилбензидин (ТМВ)(Kirkegaard & Perry Laboratories) при 100 мкл/лунку. Реакцию прекращали добавлением 1 М фосфорной кислоты при 100 мкл/лунку. Оптическую плотность считывали при 450 нм на мультисканирующем ридере Ascent (Thermo Labsystems, Helsinki, Finland). Затем вычисляли оптическую плотность в средней точке кривой для герцептина при рН 6,0 (mid-OD). Соответствующие концентрации герцептина и образцов в этой средней точке mid-OD определяли по кривой титрования с использованием программы для построения четырехпараметрической нелинейной регрессионной кривой (KaleidaGraph, Synergy software, Reading, PA). Относительную активность вычисляли путем деления концентрации стандарта в средней точке mid-OD на концентрацию образца.
Методы BIACORE
Кажущаяся скорость ассоциации (kа), кажущаяся скорость диссоциации (kd) и кажущаяся константа (КD) нескольких вариантов 4D5, связывающихся с FcRn человека и собакоподобных обезьян, измеряли методом поверхностного плазмонного резонанса с использованием системы BIAcore-3000 (6,7). Аффинность связывания каждого антитела с антигеном, определяемая по вышеописанной кажущейся константе равновесной диссоциации, вычисляли (7) по формуле КD=Кd/Ка, а также непосредственно измеряли в экспериментах по равновесному связыванию.
Иммобилизацию FcRn человека и собакоподобных обезьян на биосенсорном чипе с карбоксиметилированным декстраном (саt. # CM5, BIAcore Inc.) осуществляли методом конъюгирования с амином, в основном, в соответствии с инструкциями производителей (6,8). Вкратце, биосенсорный чип активировали с использованием гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) в смеси с N-гидроксисукцинимидом (NHS). Затем FcRn, предварительно уравновешенный в 10 мМ ацетата натрия, рН 4, инъецировали на активированный чип с получением концентраций 700-900 единиц отклика (RU) иммобилизованного FcRn собакоподобных обезьян и приблизительно 2000 RU FcRn человека. Непрореагировавшие сукцинимидные группы блокировали путем введения 1М этаноламина.
Кинетику реакции измеряли следующим образом. 3-кратные серийные разведения (1 мкМ - 0,5 нМ) антитела инъецировали в течение 2 минут в рабочем буфере (в забуференном фосфатом физиологическом растворе, рН 6, содержащем 0,05% твина-20) при 25°С и при скорости потока 0,02 мл/мин. Регенерация была достигнута путем введения 0,01 мл 10 мМ триса, рН 9, 150 мМ NаСl. По этим данным строили кривую простой лангмуровской модели связывания 1:1 для каждого антитела. Константы скорости псевдо-первого порядка (ks) вычисляли для каждой кривой ассоциации и строили график зависимости от концентрации белка с получением ка ± SE (стандартная ошибка при подборе эмпирической кривой). Измерения равновесного связывания проводили при рН 6 и при рН 7,4. 3-кратные серийные разведения (1 мкМ - 0,5 нМ) антитела инъецировали в течение 6 минут в рабочем буфере (в забуференном фосфатом физиологическом растворе, содержащем 0,05% твина-20) при 25°С и при скорости потока 2 мкл/мин. После инъекции скорость потока увеличивали до 0,02 мл/мин. Регенерация была достигнута путем введения 0,01 мл 10 мМ триса, рН 9, 150 мМ NаСl. После этого строили кривую зависимости количества антитела, связанного при равновесии (Req), от концентрации антитела, а затем строили четырехпараметрическую кривую “доза - ответ” для определения КD.
Результаты ELISA
Был определен уровень связывания с FcRn при рН 6,0 и 7,4. Относительные аффинности связывания были вычислены как описано в разделе “Материалы и методы” и представлены в таблице 4. Эти результаты показали, что варианты с мутациями N434A, N434W, N434Y, N434F или N434H давали повышенный уровень связывания при рН 6. Увеличение уровня связывания, по сравнению с герцептином, также наблюдалось для вариантов N434W, N434Y и N434F при рН 7,4.
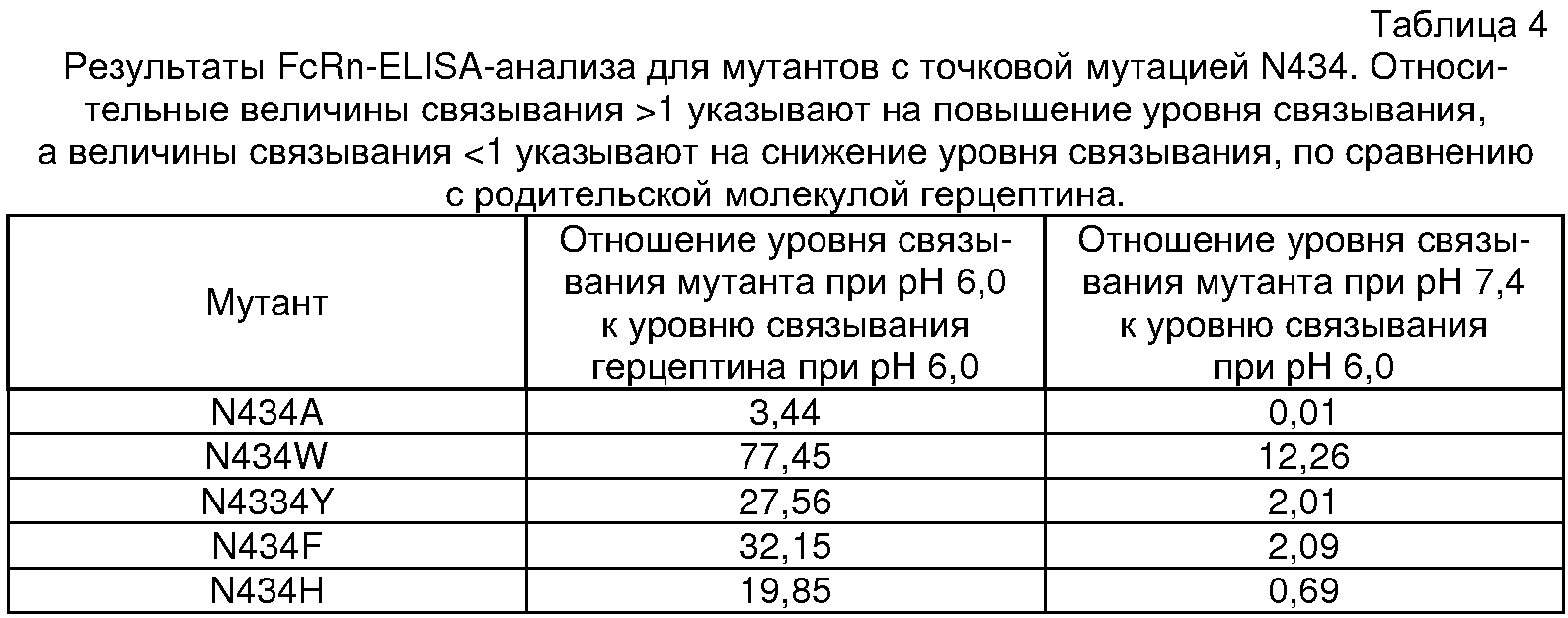
Комбинация вариантов с N434Н или N434А и ранее описанные Ala-замены (Shields et al., 2000) также обнаруживали повышенный уровень связывания при рН 6,0, но, при этом, обнаруживали незначительное повышение уровня связывания, или вообще не обнаруживали повышение уровня связывания при рН 7,4 (таблица 5).

His-сканирование пограничной области Fc позволило идентифицировать несколько замен His, которые повышают или снижают уровень связывания с FcRn (таблица 6). Было обнаружено, что некоторые из этих вариантов обнаруживают рН-зависимое связывание, но, при этом, они обнаруживают незначительное взаимодействие с FcRn при рН 7,4, или вообще не обнаруживают какого-либо детектируемого взаимодействия. Хотя ни одна из этих дополнительных His-мутаций не приводила к большему увеличению уровня связывания при рН 6, чем мутация N434Н, однако, каждая из замен Q311Н, D312Н, N315Н и G385Н приводила к более, чем 4-кратному увеличению уровня связывания при рН 6, но не приводила к значимому увеличению уровня связывания при рН 7,4.

И наконец, несколько точковых мутаций, внесенных посредством His-сканирования, были попарно скомбинированы с мутациями N434А или N434Н. Из этих вариантов, двойные мутанты Т289Н/N434Н и N315Н/N434Н обнаруживали наибольшее увеличение уровня связывания при рН 6, но не обнаруживали явного увеличения связывания при рН 7,4.

Результаты анализа BIAcore
В результате проведения ELISA-анализа на связывание с FcRn было отобрано несколько антител, и эти антитела были подразделены на три группы для проведения анализа BIAcore. Группа 1 состояла, главным образом, из мутантов по положению Asn434, группа 2 состояла из мутантов, полученных путем гистидинового сканирования, а группа 3 состояла из ранее полученных и описанных мутантов (3). Результаты кинетического анализа и анализа на равновесное связывание антител группы 1 при рН 6 (таблица 8) позволяют предположить, что увеличение значения КD является результатом изменения величин ка и/или кd. Кроме того, мутанты, которые обладают повышенной способностью связываться с FcRn человека, очевидно, также обладают повышенной способностью связываться с FcRn собакоподобных обезьян. Мутантами, обладающими наибольшей способностью связываться с FcRn при рН 6, являются мутанты с заменами N434W, N434Y и N434F. Однако, эти мутанты также обнаруживали значимое увеличение уровня связывания при рН 7,4. В противоположность этому, герцептин, N434А, N434Н и Т250Q/M428L обнаруживали незначительный уровень связывания при рН 7,4 или вообще не обнаруживали какого-либо связывания при рН 7,4. Следует отметить, что уровень связывания N434W, N434Y и N434F при рН 7,4 значительно превышал уровень связывания Fc дикого типа, а скорость ассоциации и диссоциации была настолько высокой, что константы равновесной диссоциации не могли быть точно определены. Поэтому, уровень связывания при рН 7,4 был указан в таблице 4 как + или -. В частности, знак - означает уровни связывания, аналогичные уровням связывания с герцептином, знак +/- означает пренебрежимо малый уровень связывания, знак + означает заметное увеличение уровня связывания, а знак ++ означает значимый уровень связывания.
Существуют некоторые различия между КD, определенными в анализе кинетических параметров связывания и в анализе на равновесное связывание. Однако в результате сравнения этих величин был получен коэффициент корреляции, который составлял 0,994 для связывания с FcRn человека, и 0,934 для связывания с FcRn собакоподобных обезьян, что позволяет сделать предположение о наличии системного отклонения.
Анализы антител группы 2 на кинетические параметры связывания и на равновесное связывание (таблица 9) дали результаты, аналогичные результатам для антител группы 1. Мутанты, которые обладали повышенной способностью связывания с FcRn человека, также обладали повышенной способностью связываться с FcRn собакоподобных обезьян. Мутантами, обладающими наибольшей способностью связываться с FcRn при рН 6, являются мутанты с заменами N434Н/Т370А/Е380А, N434Н/Т289Н и N434Н/N315Н. Однако эти мутанты также обнаруживали значимое увеличение уровня связывания при рН 7,4. В противоположность этому, остальные антитела обнаруживали незначительный уровень связывания при рН 7,4 или вообще не обнаруживали какого-либо связывания при рН 7,4.
Оценка коэффициента корреляции между КD, определенными в анализе кинетических параметров связывания и в анализе на равновесное связывание, показала, что коэффициент корреляции для связывания с FcRn человека составлял 0,246, а коэффициент корреляции для связывания с FcRn собакоподобных обезьян составлял 0,966. Причиной низкого коэффициента корреляции для связывания с FcRn человека является мутация G385Н, присутствие которой связано с некоторыми проблемами агрегации в процессе равновесного связывания. После исключения этого частного значения данных получали коэффициент корреляции 0,916.
Анализы кинетических параметров связывания и анализ на равновесное связывание для антител группы 3 (таблица 10) дали результаты, аналогичные результатам для антител группы 1. Мутанты, которые обладали повышенной способностью связывания с FcRn человека, также обладали повышенной способностью связывания с FcRn собакоподобных обезьян. Мутант с комбинированной мутацией Т250Q/M428L обладал наибольшей способностью связывания с FcRn при рН 6. Хотя этот мутант имел несколько повышенный уровень связывания при рН 7,4, однако, этот уровень был низким по сравнению с уровнями для мутантов групп 1 и 2.
Оценка коэффициента корреляции между КD, определенными в анализе кинетических параметров связывания и в анализе на равновесное связывание, показала, что коэффициент корреляции для связывания с FcRn человека составлял 0,966, а коэффициент корреляции для связывания с FcRn собакоподобных обезьян составлял 0,902.
Авторами настоящего изобретения ранее сообщалось, что аффинности связывания “бесшарнирных” Fc, содержащих мутации N434W, N434F и N434А, с FcRn человека в 170; 9; и 2,7 раз превышали аффинности связывания дикого типа при рН 6. В этом примере авторами были проанализированы эти и другие мутации для полноразмерного антитела 4D5. При сравнении результатов, полученных в анализе на равновесное связывание, авторами настоящего изобретения было обнаружено, что мутации N434W, N434F и N434А приводили к 20-, 7- и 2-кратному увеличению аффинности связывания с FcRn человека при рН 6. Аналогичные результаты наблюдались при связывании с FcRn собакоподобных обезьян. Другие варианты, содержащие замены ароматических аминокислот, такие как N434Y и N434Н, обнаруживали 9- и 4-кратное увеличение уровня связывания с FcRn человека при рН 6. Однако все N434W-, N434Y- и N434F-мутанты также обнаруживали повышенный уровень связывания с FcRn человека и собакоподобных обезьян при рН 7,4.
Принимая во внимание многообещающие результаты, полученные для N434Н-мутаций, и важную роль гистидиновых остатков в рН-зависимом взаимодействии Fc-FcRn (9), авторами настоящего изобретения было принято решение провести исследование гистидиновых мутаций в других условиях. Исходя из структуры, определенной для комплекса Fc-FcRn крысы (9,10) и предполагаемой гомологии с белками человека, было проведено гистидиновое сканирование. Кроме того, были проведены исследования мутации N434Н в комбинации с мутациями Т370А и Е380А, идентифицированными Presta и коллегами (4). Вариантами, которые обнаруживали увеличение уровня связывания при рН 6, но не обнаруживали увеличение уровня связывания при рН 7,4, как показал анализ BIAcore, являются варианты G385Н, D312Н, N315Н и N434Н. Ни одна из новых гистидиновых мутаций или гистидиновых комбинированных мутаций не давало такого увеличения уровня связывания с FcRn при рН 6, которое было бы намного выше уровня связывания, сообщаемого лишь одной мутацией N434Н. Однако все комбинированные мутации обнаруживали значимое увеличение уровня связывания с FcRn при рН 7,4. Дополнительные варианты, содержащие комбинации двух или нескольких гистидиновых мутаций, могут обладать повышенной способностью к рН-зависимому связыванию с FcRn. Кроме того, идентификация сайтов, на которые влияют His-мутации, позволяет предположить о наличии новых сайтов для дополнительных аминокислотных замен.
И наконец, авторами настоящего изобретения были также исследованы мутации, описанные Hinton и коллегами (3) для молекулы IgG1. Хотя они сообщали, что мутации Т250Q, М428L и Т250Q/М428L, внесенные в остов молекулы IgG2, приводили к 3-, 7- и 28-кратному увеличению уровня связывания при рН 6, соответственно, однако, в случае молекулы IgG1, авторы настоящего изобретения наблюдали более скромное увеличение уровня связывания, то есть, в 3, 3 и 5 раз, соответственно. Аналогичные результаты наблюдались для связывания с FcRn собакоподобных обезьян. Мутанты с одной заменой не обнаруживали увеличения уровня связывания с FcRn человека или собакоподобных обезьян при рН 7,4, а двойной мутант обнаруживал лишь небольшое увеличение уровня связывания.
В этом исследовании, авторами настоящего изобретения были количественно оценены аффинности связывания нескольких Fc-мутантов с FcRn человека и собакоподобных обезьян при рН 6 и рН 7,4. Авторами настоящего изобретения было установлено, что все аффинности и увеличения аффинностей связывания данной молекулы с FcRn человека и FcRn собакоподобных обезьян были аналогичными. Систематизация вариантов с повышенной аффинностью связывания при рН 6, проводимая на основе анализов ELISA и BIAcore, в основном, совпадала, однако, оценки связывания при рН 7,4 иногда отличались. Такое несоответствие может быть обусловлено различиями в поведении FcRn или IgG в различных применяемых процедурах иммобилизации.
Библиография для примера 6
Ссылки
1. Ghetie, V., and Ward, E. S. (2000) Anna Rev Immunol 18, 739-766
2. Ghetie, V., and Ward, E. S. (1997) Immunol Today 18, 592-598
3. Hinton, P. R., Johlfs, M. G., Xiong, J. M., Hanestad, K., Ong, K. C, Bullock, C, Keller, S., Tang, M. Т., Tso, J. Y., Vasquez, M., and Tsurushita, N. (2004) J Biol Chem 279, 6213-6216
4. Shields, R. L., Namenuk, A. K., Hong, K., Meng, Y. G., Rae, J., Briggs, J., Xie, D., Lai, J., Stadlen, A., Li, В., Fox, J. A., and Presta, L. G. (2001) У Biol Chem 276, 6591-6604
5. Dall'Acqua, W. F., Woods, R. M., Ward, E. S., Palaszynski, S. R., Patel, N. K., Brewah, Y. A., Wu, H., Kiener, P. A., and Langermann, S. (2002) J Immunol 169, 5171-5180
6. Johnsson, В., Lofas, S., and Lindquist, G. (1991) Anal Biochem 198, 268-277
7. Karlsson, R., Michaelsson, A., and Mattsson, L. (1991) JImmunol Methods 145, 229-240
8. IAcore, Inc. (1991) BlAcore Methods Manual, Piscataway, NJ
9. Martin, W. L., West, A. P., Jr., Can, L., and Bjorkman, P. J. (2001) Mol Cell 7, 867-877
10. Burmeister, W. P., Huber, A. H., and Bjorkman, P. J. (1994) Nature 372, 379-383
Ссылки
Работы, цитируемые в настоящей заявке, включая патенты, патентные публикации и другие публикации, вводятся в настоящее описание посредством ссылки.
Настоящее изобретение может быть осуществлено, если это не оговорено особо, с применением стандартных методов молекулярной биологии и т.п., известных специалистам. Такие методы хорошо описаны в литературе. См., например, Molecular Cloning: A Laboratory Manual, (J. Sambrook et ai, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., 1989); Current Protocols in Molecular Biology (F. Ausubel et al., eds., 1987 updated); Essential Molecular Biology (T. Brown ed., IRL Press 1991); Gene Expression Technology (Goeddel ed., Academic Press 1991); Methods for Cloning and Analysis of Eukaryotic Genes (A. Bothwell et al. eds., Bartlett Publ. 1990); Gene Transfer and Expression (M. Kriegler, Stockton Press 1990); Recombinant DNA Methodology II (R. Wu et al. eds., Academic Press 1995); PCR: A Practical Approach (M. McPherson et al., IRL Press at Oxford University Press 1991); Oligonucleotide Synthesis (M. Gait ed., 1984); Cell Culture for Biochemists (R. Adams ed., Elsevier Science Publishers 1990); Gene Transfer Vectors for Mammalian Cells (J. Miller & M. Calos eds., 1987); Mammalian Cell Biotechnology (M. Butler ed., 1991); Animal Cell Culture (J. Pollard et al. eds., Humana Press 1990); Culture of Animal Cells. 2nd Ed. (R. Freshney et al. eds., Alan R. Liss 1987); Flow Cytometry and Sorting (M. Melamed et al. eds., Wiley-Liss 1990); the series Methods in Enzvmology (Academic Press, Inc.);Wirth M. and Hauser H. (1993); Immunochemistrv in Practice. 3rd edition, A. Johnstone & R. Thorpe, Blackwell Science, Cambridge, MA, 1996; Techniques in Immunocvtochemistry. (G. Bullock & P. Petrusz eds., Academic Press 1982, 1983, 1985, 1989); Handbook of Experimental Immunology, (D. Weir & C. Blackwell, eds.); Current Protocols in Immunology (J. Coligan et al. eds. 1991); Immunoassay (E. P. Diamandis & Т.К. Christopoulos, eds., Academic Press, Inc., 1996); Coding (1986) Monoclonal Antibodies: Principles and Practice (2d ed) Academic Press, New York; Ed Harlow and David Lane, Antibodies A laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1988; Antibody Engineering. 2nd edition (C. Borrebaeck, ed., Oxford University Press, 1995); and the series Annual Review of Immunology; the series Advances in Immunology.




























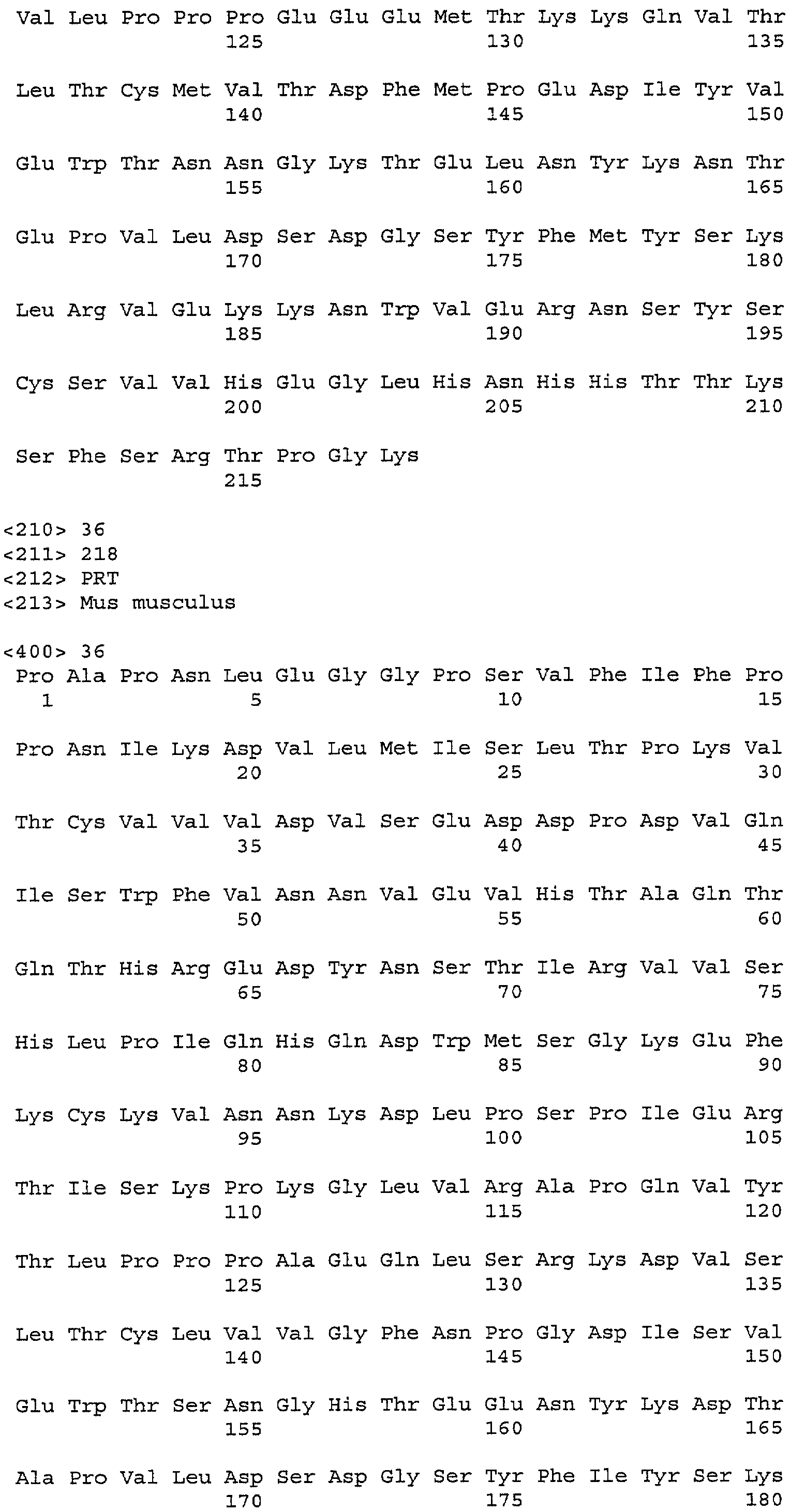






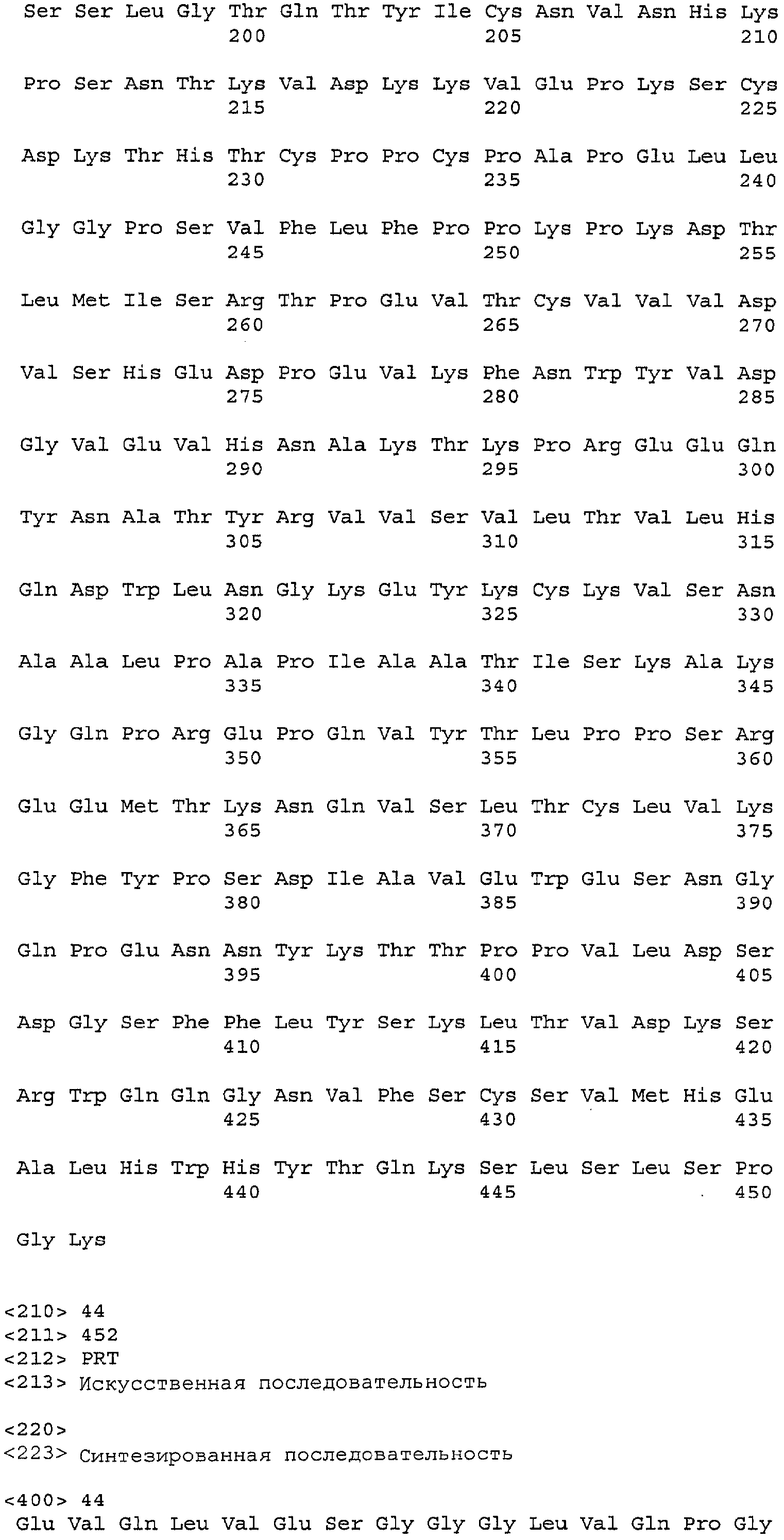
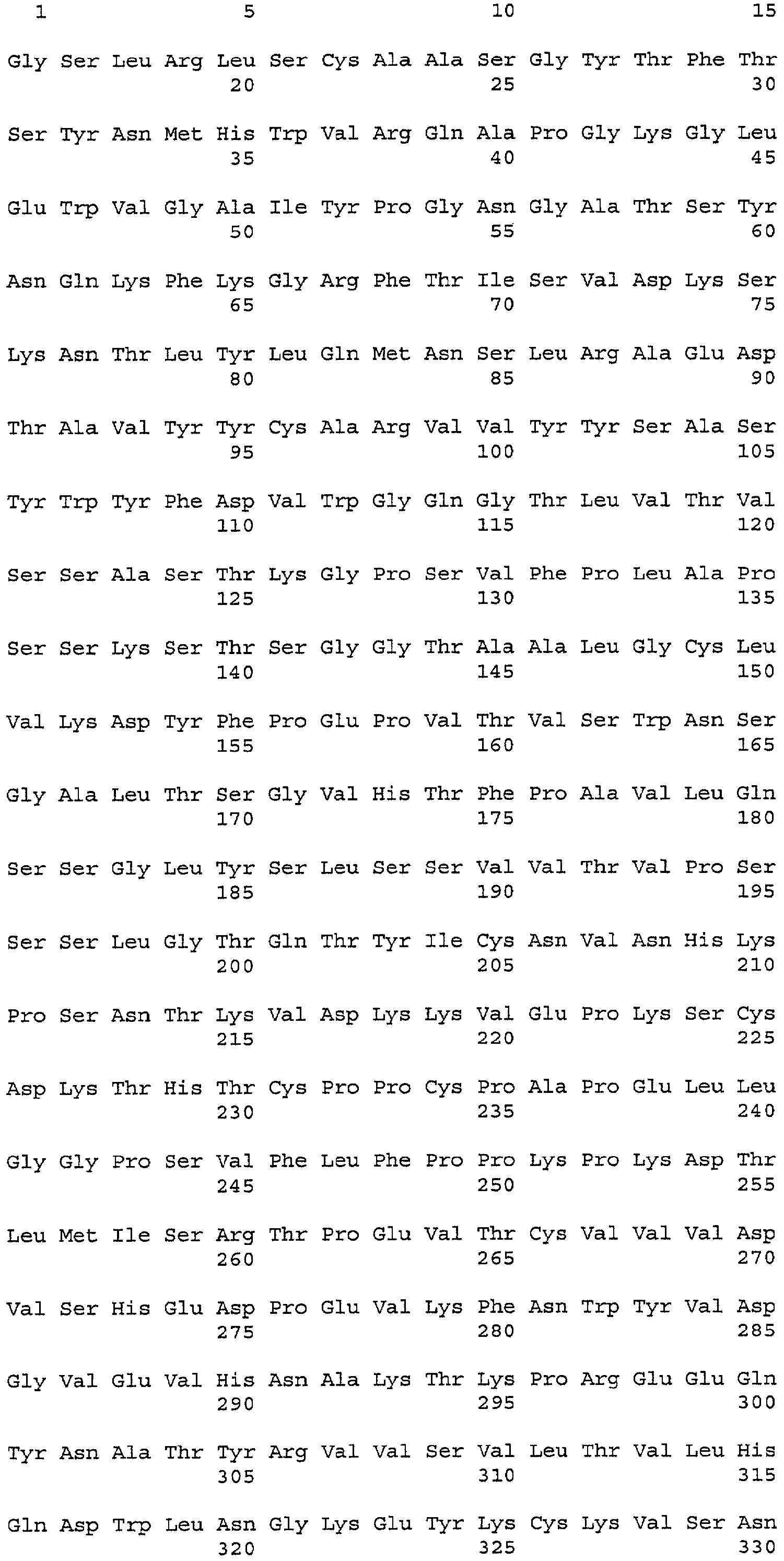







Реферат
Изобретение относится к биотехнологии. Описаны варианты полипептида, содержащие Fc-области IgG, имеющие аминокислотные модификации, придающие указанным полипептидам измененные эффекторные функции Fc. Раскрыта композиция для нацеливания антитела на антиген, содержащая указанный полипептид. Описан способ получения указанного полипептида. Также описаны способы лечения В-клеточной опухоли или злокачественного заболевания, характеризующихся экспрессией CD20 В-клетками, лечения хронического лимфоцитарного лейкоза, ослабления симптомов В-клеточного регулируемого аутоиммунного заболевания, лечения расстройства, связанного с ангиогенезом, лечения НЕR2-экспрессирующей раковой опухоли, лечения LFA-1-опосредуемого расстройства, лечения IgE-опосредуемого расстройства, где указанные способы включают введение пациенту терапевтически эффективного количества указанного полипептида. 36 н. и 27 з.п. ф-лы, 13 ил., 12 табл.
Формула
где указанный полипептид, необязательно, дополнительно содержит одну или несколько аминокислотных замен в Fc-области IgG в положениях остатков, выбранных из группы, состоящей из D265A, S298A/E333A/K334A, K334L, K322А, K326А, K326W, Е380А и Е380А/Т307А, сообщающих указанному полипептиду по меньшей мере одно из нижеследующих свойств, выбранных из таких свойств, как повышенный уровень связывания с FcγR, повышенная антителозависимая клеточная цитотоксичность (ADCC), повышенная комплементзависимая цитотоксичность (CDC), пониженная CDC, повышенная ADCC- и CDC-функции, повышенная ADCC, но при этом пониженная CDC-функция, повышенный уровень связывания с FcRn и более продолжительное время полужизни в сыворотке, по сравнению с полипептидом, имеющим Fc-область с нативной последовательностью,
где указанные остатки пронумерованы в соответствии с Европейской нумерацией по Кэбату и
где полипептид обладает повышенной связывающей аффинностью в отношении FcRn по сравнению с полипептидом, имеющим Fc-область с нативной последовательностью.
где указанное антитело, необязательно, дополнительно содержит одну или несколько аминокислотных замен в Fc-области IgG в положениях остатков, выбранных из группы, состоящей из D265A, S298A/E333A/K334A, K334L, K322А, K326А, K326W, Е380А и Е380А/Т307А, сообщающих указанному антителу по меньшей мере одно из нижеследующих свойств, выбранных из таких свойств, как повышенный уровень связывания с FcγR, повышенная антителозависимая клеточная цитотоксичность (ADCC), повышенная комплементзависимая цитотоксичность (CDC), пониженная CDC, повышенная ADCC- и CDC-функции, повышенная ADCC-, но при этом пониженная CDC-функция, повышенный уровень связывания с FcRn и более продолжительное время полужизни в сыворотке по сравнению с антителом, имеющим Fc-область с нативной последовательностью,
где указанные остатки пронумерованы в соответствии с Европейской нумерацией по Кэбату и
где полипептид обладает повышенной связывающей аффинностью в отношении FcRn по сравнению с полипептидом, имеющим Fc-область с нативной последовательностью.
a. SEQ ID NO:2;
b. SEQ ID NO:42 и
c. SEQ ID NO:45,
и где L-цепь содержит последовательность vL SEQ ID NO:1 или полноразмерную последовательность SEQ ID NO:26.
последовательностей vL SEQ ID NO:9 и vH SEQ ID NO:10; и последовательностей vL SEQ ID NO: 11 и vH SEQ ID NO:12.
последовательностей vL SEQ ID NO:49 и vH SEQ ID NO:50;
последовательностей vL SEQ ID NO:51 и vH SEQ ID NO:52 и последовательностей vL SEQ ID NO:53 и vH SEQ ID NO:54.
где полипептид или антитело, необязательно, дополнительно содержат одну или несколько аминокислотных замен в Fc-области IgG в положениях остатков, выбранных из группы, состоящей из D265A, S298A/E333A/K334A, K334L, K322А, K326А, K326W, Е380А и Е380А/Т307А, сообщающих указанному полипептиду или антителу по меньшей мере одно из нижеследующих свойств, выбранных из таких свойств, как повышенный уровень связывания с FcγR, повышенная ADCC, повышенная CDC, пониженная CDC, повышенная ADCC- и CDC-функции, повышенная ADCC-, но при этом пониженная CDC-функция по сравнению с антителом, имеющим Fc-область с нативной последовательностью,
где указанные остатки пронумерованы в соответствии с Европейской нумерацией по Кэбату и
где полипептид или антитело обладает повышенной связывающей аффинностью в отношении FcRn по сравнению с полипептидом или антителом, имеющими Fc-область с нативной последовательностью.
где полипептид или антитело, необязательно, дополнительно содержит одну или несколько аминокислотных замен в Fc-области IgG в положениях остатков, выбранных из группы, состоящей из D265A, S298A/E333A/K334A, K334L, K322А, K326А, K326W, Е380А и Е380А/Т307А, сообщающих указанному полипептиду по меньшей мере одно из нижеследующих свойств, выбранных из таких свойств, как повышенный уровень связывания с FcγR, повышенная ADCC, повышенная CDC, пониженная CDC, повышенная ADCC- и CDC-функции, повышенная ADCC-, но при этом пониженная CDC-функция по сравнению с антителом, имеющим Fc-область с нативной последовательностью,
где указанные остатки пронумерованы в соответствии с Европейской нумерацией по Кэбату и
где полипептид или антитело обладает повышенной связывающей аффинностью в отношении FcRn по сравнению с полипептидом или антителом, имеющими Fc-область с нативной последовательностью.
1) где полипептид или антитело дополнительно содержит одну или несколько аминокислотных замен в Fc-области IgG в положениях остатков, выбранных из группы, состоящей из D265A, S298A/E333A/K334A, K334L, K322А, K326А, K326W, Е380А и Е380А/Т307А, сообщающих указанному полипептиду по меньшей мере одно из нижеследующих свойств, выбранных из таких свойств, как повышенный уровень связывания с FcγR, повышенная антителозависимая клеточная цитотоксичность (ADCC), повышенная комплементзависимая цитотоксичность (CDC), пониженная CDC, повышенная ADCC- и CDC-функции, повышенная ADCC-, но при этом пониженная CDC-функция, повышенный уровень связывания с FcRn и более продолжительное время полужизни в сыворотке по сравнению с полипептидом или антителом, имеющим Fc-область с нативной последовательностью,
2) где полипептид или антитело дополнительно содержит аминокислотные замены Т307А/Е380А в Fc-области IgG или
3) где полипептид или антитело дополнительно содержит аминокислотные замены Т289Н или N315Н,
где указанные остатки пронумерованы в соответствии с Европейской нумерацией по Кэбату и
где полипептид или антитело обладает повышенной связывающей аффинностью в отношении FcRn по сравнению с полипептидом или антителом, имеющим Fc-область с нативной последовательностью.
vL SEQ ID NO:3, связанной с последовательностью vH SEQ ID NO:4; и последовательности vL SEQ ID NO:5, связанной с последовательностью vH SEQ ID NO:6.
где указанные остатки пронумерованы в соответствии с Европейской нумерацией по Кэбату и
где антитело обладает повышенной связывающей аффинностью в отношении FcRn по сравнению с антителом, имеющим Fc-область с нативной последовательностью.
где указанные остатки пронумерованы в соответствии с Европейской нумерацией по Кэбату и
где антитело обладает повышенной связывающей аффинностью в отношении FcRn по сравнению с антителом, имеющим Fc-область с нативной последовательностью.

Комментарии