Мультиорганный чип с улучшенной долговечностью и гомеостазом - RU2630667C2
Код документа: RU2630667C2
Чертежи








Описание
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Возрастает научный и экономический интерес к миниатюризированным трехмерным (3D) системам культивирования органов или органоидов. Эти 3D системы культивирования предназначены для обеспечения возможности изучения функционирования органов и их реакции на определенные стимулы, а также для тестирования влияния химических соединений или композиций на конкретные органы или их группы и для исследования фармакокинетических свойств таких соединений или композиций. В частности, в отношении тестирования безопасности химических соединений, требуются альтернативные варианты для замены экспериментов на животных и для получения данных, которые можно с большей легкостью использовать для эффективного и надежного прогнозирования безопасности для человека. Качество такой in vitro 3D системы культивирования будет зависеть от ее способности, настолько точно, насколько это возможно, воспроизводить физиологическую функцию и окружение соответствующего органа или органоида. Этой цели можно достичь, только если органы не рассматриваются как отдельные, независимые объекты, а сложность взаимодействия между различными органами в организме имитируется настолько точно, насколько это возможно. Для обеспечения получения значимых данных требуется, чтобы система культивирования оставалась стабильной в течение длительного периода времени. Однако большинство известных 3D систем культивирования, известных на сегодняшний день, воспроизводят только один тип клеток или обеспечивают моделирование только одного типа органа или органоида. Только недавно были описаны 3D системы культивирования, рассчитанные на несколько органов и обеспечивающие динамическое культивирование этих нескольких органов.
В патентном документе WO 2009/146911 А2 было представлено устройство "орган-на-чипе". Это устройство "орган-на-чипе" сконструировано так, что оно является автономным и контролируемым датчиками. Устройство обеспечивает возможность создания или поддержания органов или органоидов, а также ниш стволовых клеток в формате миниатюризированного чипа. Устройство "орган-на-чипе" может содержать множество секций роста органов, содержащих орган или органоид, резервуар для подачи среды и резервуар для сброса среды, функционально соединенные друг с другом таким образом, что к органам или органоидам секции роста органов может подаваться среда из резервуара для подачи среды, а продукты распада и отходы могут удаляться посредством резервуара для сброса среды. Хотя эта модель обеспечивает возможность одновременного культивирования более одного органа на одном чипе, это устройство не обеспечивает возможность взаимодействия и взаимного влияния между различными органами на чипе. Кроме того, это устройство не отражает все функции, необходимые для достижения гомеостаза в системе культивирования в течение длительного периода времени.
В патентном документе WO 2012/016711 А1 представлена 3D модель клеточной культуры, содержащая одну или несколько секций роста органов, автономную систему циркуляции, сконфигурированную для снабжения органов или органоидов, культивируемых в секциях роста органов, питательными веществами, и сборник экстракапиллярной жидкости или отходов для сбора межклеточной жидкости и продуктов распада из секций роста органов. Эта система обеспечивает возможность одновременного культивирования более одного органа и имитирует сосудистую систему, снабжающую и соединяющую различные органы. Таким образом, эта система обеспечивает возможность взаимодействия и взаимного влияния между органами или органоидами в системе. Однако это устройство не воспроизводит все функции, необходимые для достижения гомеостаза в системе культивирования в течение длительного периода времени.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к устройству в виде мультиорганного чипа, которое имитирует основные функции организма, необходимые для гомеостаза органа и/или организма. Устройство в виде мультиорганного чипа по настоящему изобретению сконструировано так, чтобы воспроизводить автономную систему циркуляции, имитирующую кровеносную систему высшего организма, которая снабжает ряд различных эквивалентов органов. Эквиваленты органов выбраны и расположены таким образом, что представлены основные функции снабжения питательными веществами, удаления отходов и снабжения кислородом, и при этом они являются полностью функциональными для поддержания гомеостаза эквивалентов органов в течение длительного периода времени.
Предусматривается устройство в виде мультиорганного чипа, причем устройство содержит
- базовый слой;
- слой органов, расположенный на базовом слое;
- антральный слой, расположенный на слое органов; и слой приводов;
где
- базовый слой сконфигурирован так, чтобы обеспечивать твердую подложку для других слоев;
- слой органов сконфигурирован так, чтобы содержать
множество отдельных эквивалентов органов, причем каждый эквивалент органа содержит одну или несколько секций роста органов, причем каждая из секций роста органов сконфигурирована так, чтобы содержать полость для органоидов для размещения по меньшей мере одного органоида органа и содержать микровход и микровыход для жидкостного соединения полости для органоидов секции роста органов и автономной системы циркуляции, где слой органов содержит по меньшей мере один эквивалент органа, сконфигурированный так, чтобы представлять следующие органы: легкое, тонкий кишечник, селезенку, поджелудочную железу, печень, почку и костный мозг, соответственно, и
автономную систему циркуляции, сконфигурированную так, чтобы она находилась в непосредственном жидкостном соединении с секциями роста органов в слое органов посредством микровходов и выходов секций роста органов;
- антральный слой сконфигурирован так, чтобы содержать множество полостей и трубок, расположенных так, что они находятся в жидкостном соединении с выбранными эквивалентами органов или секциями роста органов для обеспечения возможности обмена жидкостями между полостями и секциями роста органов; и
- слой приводов сконфигурирован так, чтобы содержать множество приводов, расположенных и сконфигурированных для регулировки силы давления, прилагаемой к выбранному эквиваленту органа, автономной системе циркуляции и/или ее части.
Дополнительные подробности и предпочтительные варианты осуществления настоящего изобретения определены в изложенном ниже описании и в формуле изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано более подробно. Если не указано иное, все технические и научные термины, используемые в данном документе, имеют такое же значение, что и в обычном понимании специалиста в соответствующей области техники. Если первый слой или объект указан как расположенный над вторым слоем или объектом, первый слой или объект может располагаться непосредственно над вторым слоем или объектом, или другой слой или объект может присутствовать между первым и вторым слоем или объектом.
Устройство в виде мультиорганного чипа по настоящему изобретению состоит из ряда слоев с различными функциональностями. Мультиорганный чип содержит базовый слой, слой органов, необязательно слой, удерживающий органы, антральный слой и слой приводов.
Базовый слой сконфигурирован так, чтобы обеспечивать твердую подложку для других слоев, так что с устройством в виде мультиорганного чипа можно с легкостью работать и управлять им. Предпочтительно указанный базовый слой изготовлен из прозрачного материала. Преимущество заключается в том, что слой органов является оптически доступным с нижней стороны и, таким образом, обеспечивает возможность наблюдения органоидов в секции роста органов в ходе культивирования посредством микроскопии, например, посредством 2-фотонной микроскопии. Так как базовый слой изготовлен из прозрачного материала, слой органов является доступным с нижней стороны и обеспечивает возможность визуализации, основанной на соотношении интенсивности флуоресценции, для измерения локального внутритканевого значения pH, микроскопии с гашением фосфоресценции для измерения внутритканевого pO>2 и инфракрасной спектроскопии для выявления физиологического стресса.
Предпочтительные материалы для базового слоя включают стекло и оптически прозрачные синтетические полимеры, такие как, например, полистирол (PS), поликарбонат (PC), полисилоксан и/или полидиметилсилоксан (PDMS).
Для отслеживания состояния устройства и для обеспечения возможности контролируемого культивирования органоидов базовый слой может содержать один или несколько датчиков, сконфигурированных и расположенных так, чтобы измерять испускаемые сигналы и/или передавать сигналы к одному или нескольким эквивалентам органов, секциям роста органов и/или из автономной системы циркуляции. Используются датчики, которые характеризуются высокой чувствительностью с обеспечением возможности точного измерения даже при небольших объемах образца. Предпочтительно базовый слой содержит датчики для измерения основных параметров гомеостаза организма человека, например, жизнеспособность органоидов или клеток, температура, pH, жидкостный баланс, давление, объем потока, давление кислорода или потребление кислорода, потребление питательных веществ, адсорбция жидкости, секреция кишечного сока, синтез альбумина, синтез желчи, экскреция мочевины, ионный баланс, осмоляльность и электрическое взаимодействие. Датчики, которые могут применяться, включают без ограничения датчики pH, датчики pO>2, датчики захвата анализируемого вещества, кондуктометрические датчики, датчики плазмонного резонанса, датчики температуры, датчики CO2, датчики NO, датчики хемотаксиса, датчики цитокинов, датчики ионов, датчики давления, потенциометрические датчики, амперометрические датчики, проточные датчики, датчики наполнения, датчики сопротивления, датчики электромагнитного поля, датчики на поверхностных акустических волнах и датчики метаболизма. Предпочтительно базовый слой содержит по меньшей мере следующий набор датчиков:
2 датчика pO2, сконфигурированных и расположенных так, чтобы измерять pO2 в жидкости автономной системы циркуляции слоя органов, предпочтительно один датчик pO2 расположен под артериолярным транспортным каналом поблизости от его начала из эквивалента легкого и один датчик pO2 расположен под венулярным транспортным каналом поблизости от его начала из эквивалента легкого;
4 датчики трансэпителиального/эндотелиального электрического сопротивления (TEER) для идентификации утечки в автономной системе циркуляции (если сопротивление между двумя датчиками TEER равно 0, утечка является вероятной), предпочтительно два датчика TEER расположены в автономной системе циркуляции, например, один датчик TEER расположен поблизости от начала артериолярного транспортного канала из эквивалента легкого и один датчик TEER расположен на конце артериолярного транспортного канала, наиболее удаленном от начала артериолярного транспортного канала из эквивалента легкого, два датчика TEER сконфигурированы и расположены в эквиваленте печени, необязательно могут присутствовать два дополнительных датчика TEER, сконфигурированных и расположенных в эквиваленте кожи или кишечника, причем вместе взятые обеспечивают отслеживание функциональности клеточных барьеров, например, эпителиальных или эндотелиальных барьеров между органами и кровотоком; электрические датчики, которые взаимодействуют с биологическими ганглиями нейронов, сконфигурированные и расположенные так, что они контактируют с ганглиями в эквивалентах органов.
Устройство в виде мультиорганного чипа по настоящему изобретению содержит слой органов, расположенный над базовым слоем. Слой органов сконфигурирован так, чтобы содержать множество отдельных эквивалентов органов, причем каждый эквивалент органа содержит одну или несколько секций роста органов. Каждая из секций роста органов в слое органов сконфигурирована так, чтобы содержать полость для органоидов для размещения одного органоида определенного типа органа. Каждая секция роста органов сконфигурирована так, чтобы содержать микровход и микровыход для жидкостного соединения полости для органоидов секции роста органов и автономной системы циркуляции слоя органов. Слой органов содержит по меньшей мере один эквивалент органа, сконфигурированный так, чтобы представлять следующие органы: легкое, тонкий кишечник, селезенка, поджелудочная железа, печень, почка и костный мозг, соответственно. Слой органов может содержать дополнительные эквиваленты органов, такие как, например, эквиваленты следующих органов: кожи, яичек, головного мозга и/или жировой ткани. Кроме того, слой органов содержит автономную систему циркуляции, сконфигурированную так, чтобы она находилась в непосредственном жидкостном соединении с секциями роста органов в слое органов посредством микровходов и выходов секций роста органов эквивалентов органов.
Используемое в данном документе выражение "эквивалент органа" относится ко всем секциям роста органов, которые содержат органоиды или один конкретный тип органа. Все органы и системы организма, например, организма человека построены из составных, идентичных, функционально самодостаточных структурных элементов, органоидных элементов. Эти органоидные элементы имеют чрезвычайно малые размеры - от нескольких клеточных слоев до нескольких миллиметров. Дольки печени, нефроны почки, дерма и эпидермис кожи, слизистая оболочка кишечника, островки Лангерганса поджелудочной железы, серое и белое вещество коры головного мозга и мозжечка, а также способствующие состоянию покоя ниши стволовых клеток взрослого организма представляют собой лишь небольшую выборку примеров таких органоидных структур человека, причем все они обладают выраженной функциональностью и высокоизменчивой геометрией конгломерата. По причине характерной функциональности, высокого уровня самодостаточности и множественности указанных микроорганоидов в соответствующем органе, модель их способности реагировать на любые химические вещества представляется репрезентативной для всего органа. Для реализации наиболее значительных функций органов и систем природа создала чрезвычайно малые, но сложно устроенные биологические структуры. Размножение этих органоидных структур в любом данном органе является инструментом природы для управления рисками во избежание полной потери функциональности при частичных повреждениях органа. С другой стороны, данная концепция позволила легко приспосабливать размер органа и его форму к нуждам данных видов - например, печень у мышей и человека - по-прежнему, с использованием разработанного генерального плана для построения единичного функционального органоидного элемента. Уникальная и интересная возможность тестирования химических веществ, обеспечивающая возможность прогнозирования воздействия на человека, заключается в создании эквивалентов микроорганоидов человека in vitro. В настоящем изобретении "органоиды" означают искусственные, образуемые de novo, функциональные клеточные агрегаты различных типов клеток in vitro, которые демонстрируют по меньшей мере одну функцию органа или ткани, предпочтительно демонстрируют большинство или практически все функции органа или ткани. Таким образом, в устройстве в виде мультиорганного чипа по настоящему изобретению эквивалент органа представлен одной или несколькими секциями роста органов, причем каждая секция роста органов содержит полость для органоидов для размещения одного органоида соответствующего типа органа. Таким образом, размер эквивалента органа можно легко регулировать посредством выбора соответствующего количества секций роста органов или органоидов соответствующего типа органа.
Специалист в данной области техники хорошо осведомлен о структуре органоида определенного органа и ему известно каким образом получить указанный органоид. Далее приведены некоторые примеры органоидов конкретных органов: органоиды легкого в форме альвеол, органоиды поджелудочной железы в форме островков Лангерганса, органоиды селезенки в форме белой и красной пульпы, органоиды тонкого кишечника в форме ворсинок, органоиды печени в форме долек, органоиды почки в форме нефронов, элементы костного мозга, органоиды костного мозга в форме кости и хряща, элементы кожи в форме придатков, органоиды жировой ткани в форме кластеров, органоиды яичек в форме долек и органоиды головного мозга в форме коры мозжечка.
Органоид печени может представлять собой дольку печени гексагональной формы объемом 1,2-2,2 мм3.
Органоид легкого может представлять собой альвеолу легкого сфероидальной формы, имеющую поверхность 0,15-0,25 мм2.
Органоид поджелудочной железы может представлять собой островок Лангерганса, окруженный экзокринной тканью, причем все они имеют сфероидальную форму и объем 0,2-0,5 мм3.
Органоид селезенки может представлять собой участок ткани белой и красной пульпы сфероидальной формы объемом 0,3-0,6 мм3.
Органоид тонкого кишечника может представлять собой ворсинку столбчатой формы, имеющую поверхность 0,2-0,4 мм2.
Органоид почки может представлять собой нефрон почки со сфероидальной капсулой и цилиндрическим канальцем и поверхностью фильтрации 6-7,5 мм2.
Органоид костного мозга может представлять собой элемент, имеющий форму с крупными порами, образованный из костного мозга, кости и хряща объемом 0,006-0,008 мм3.
Органоид кожи может представлять собой сегмент гексагональной формы, содержащий придатки, имеющий поверхность 1,2-2 мм2.
Органоид жировой ткани может представлять собой кластер жировых клеток сфероидальной формы объемом 0,0004-0,0006 мм3.
Органоид яичек может представлять собой дольку яичка сфероидальной формы объемом 0,006-0,008 мм3. Органоид головного мозга может представлять собой кортикальную колонку цилиндрической формы и иметь поверхность 0,02-0,03 мм2.
Слой органов может быть сконструирован так, что
- секция роста органов для эквивалента печени сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 5-15 органоидов печени, где каждый органоид печени представляет собой дольку печени, предпочтительно полость для органоидов сконфигурирована для размещения 10 органоидов печени;
- секция роста органов для эквивалента легкого сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 2000-4000 органоидов легкого, где каждый органоид легкого представляет собой альвеолу легкого, предпочтительно полость для органоидов сконфигурирована для размещения 3000 органоидов легкого;
- секция роста органов для эквивалента поджелудочной железы сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 5-15 органоидов поджелудочной железы, где каждый органоид поджелудочной железы представляет собой островок Лангерганса, предпочтительно полость для органоидов сконфигурирована для размещения 10 органоидов поджелудочной железы;
- секция роста органов для эквивалента селезенки сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 5-15 органоидов селезенки, где каждый органоид селезенки представляет собой белую и красную пульпу, предпочтительно полость для органоидов сконфигурирована для размещения 10 органоидов селезенки;
- секция роста органов для эквивалента тонкого кишечника сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 40-80 органоидов тонкого кишечника, где каждый органоид тонкого кишечника представляет собой ворсинку, предпочтительно полость для органоидов сконфигурирована для размещения 60 органоидов тонкого кишечника;
- секция роста органов для эквивалента почки сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 10-30 органоидов почки, где каждый органоид почки представляет собой нефрон, предпочтительно полость для органоидов сконфигурирована для размещения 20 органоидов почки; и
- секция роста органов для эквивалента костного мозга сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 1000-2000 органоидов костного мозга, где каждый органоид костного мозга представляет собой элемент, образованный из костного мозга, кости и хряща, предпочтительно полость для органоидов сконфигурирована для размещения 1400 органоидов костного мозга.
Кроме того, слой органов может быть сконструирован так, что
- секция роста органов для эквивалента кожи сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 10-20 органоидов кожи, где каждый органоид кожи представляет собой придаток кожи, предпочтительно полость для органоидов сконфигурирована для размещения 15 органоидов кожи;
- секция роста органов для эквивалента жировой ткани сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 200000-300000 органоидов жировой ткани, где каждый органоид жировой ткани представляет собой кластер жировых клеток, предпочтительно полость для органоидов сконфигурирована для размещения 240000 органоидов жировой ткани;
- секция роста органов для эквивалента яичек сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 10-20 органоидов яичек, где каждый органоид яичек представляет собой дольку яичка, предпочтительно полость для органоидов сконфигурирована для размещения 15 органоидов яичек; и
- секция роста органов для эквивалента головного мозга сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 100-300 органоидов головного мозга, где каждый органоид головного мозга представляет собой кортикальную колонку, предпочтительно полость для органоидов сконфигурирована для размещения 200 органоидов головного мозга.
Каждый из эквивалентов органов может быть сконфигурирован для размещения количества органоидов, которое является пропорциональным по отношению к количеству органоидов, присутствующих, в среднем, в соответствующем органе организма млекопитающего, предпочтительно человека. Для того, чтобы отобразить организм, преимущественным является выбор размера всех эквивалентов органов в устройстве в виде мультиорганного чипа по настоящему изобретению так, чтобы он воспроизводил относительную пропорциональность размеров органов при физиологических условиях в организме. Предпочтительно размер всех эквивалентов органов в устройстве в виде мультиорганного чипа является уменьшенным с использованием одного и того же предварительно определенного коэффициента пропорциональности. Этот коэффициент пропорциональности может варьировать в зависимости от предполагаемого размера устройства в виде мультиорганного чипа, причем предпочтительный коэффициент пропорциональности равен 0,00001 (1/100000). Если необходимо отобразить организм человека, устройство в виде мультиорганного чипа предпочтительно сконфигурировано так, чтобы содержать следующее:
1 органоид печени,
300 органоидов легкого,
1 органоид поджелудочной железы,
1 органоид селезенки,
6 органоидов тонкого кишечника,
2 органоида почки,
140 органоидов костного мозга и необязательно
1 или 2 органоида кожи,
24000 органоидов жировой ткани,
1 или 2 органоида яичек,
20 органоидов головного мозга или их множество.
В конкретном предпочтительном варианте осуществления устройство в виде мультиорганного чипа предпочтительно сконфигурировано так, чтобы содержать следующее:
10 органоидов печени,
3000 органоидов легкого,
10 органоидов поджелудочной железы,
10 органоидов селезенки,
60 органоидов тонкого кишечника,
20 органоидов почки,
1400 органоидов костного мозга и необязательно
15 органоидов кожи,
240000 органоидов жировой ткани,
15 органоидов яичек,
200 органоидов головного мозга
или их множество.
Предпочтительно секция роста органов дополнительно содержит одну или несколько ниш стволовых клеток. Для обеспечения системы, которая может работать в условиях гомеостаза в течение длительного периода времени, преимущественным является обеспечение источника клеток, который может обеспечивать обновление клеточной популяции в органоиде. Каждый орган характеризуется определенным значением времени обновления клеточной популяции, в течение которого клетки органа заменяются новыми клетками. Это обновление клеточной популяции в органе обеспечивает то, что клетки органа являются жизнеспособными и полностью функциональными. Указанное обновление клеточной популяции можно имитировать посредством введения ниши стволовых клеток для одного, некоторых или всех эквивалентов органов в устройстве в виде мультиорганного чипа. Указанные ниши стволовых клеток могут быть частью одной, некоторых или всех секций роста органов для эквивалента органа.
Структура и путь получения таких секций роста органов, в том числе полостей для органов и ниш стволовых клеток, уже описаны в патентных документах WO 2012/016711 А1 и WO 2009/146911 А2, раскрытие которых включено в данный документ посредством ссылки.
Слой органов может быть получен из подходящего материала. Предпочтительные материалы включают SiO2, стекло и синтетические полимеры. Предпочтительные синтетические полимеры включают полистирол (PS), поликарбонат (PC), полиамид (PA), полиимид (PI), полиэфирэфиркетон (PEEK), полифениленсульфид (PPSE), эпоксидную смолу (EP), ненасыщенный сложный полиэфир (UP), фенольную смолу (PF), полисилоксан, например, полидиметилсилоксан (PDMS), меламиновую смолу (MF), сложный эфир циановой кислоты (CA), политетрафторэтилен (PTFE) и их смеси. Особенно предпочтительными являются синтетические полимеры, которые оптически прозрачны и включают, например, полистирол (PS), поликарбонат (PC) и полисилоксан, например, полидиметилсилоксан (PDMS). Особенно предпочтительный материал содержит PDMS.
Слой органов содержит автономную систему циркуляции. Автономная система циркуляции сконструирована так, чтобы имитировать сосудистую систему организма и, таким образом, снабжает все эквиваленты органов в устройстве в виде мультиорганного чипа по настоящему изобретению питательными веществами, O2 и обеспечивает возможность взаимодействия и взаимного - влияния между эквивалентами органов. Присутствие указанной автономной системы циркуляции является жизненно важным для гомеостаза во всем устройстве в виде мультиорганного чипа. Выражение "автономный" относится к тому, что жидкость может циркулировать в системе циркуляции и предпочтительно отсутствует жидкостное соединение для непрерывной подачи жидкости, например, среды, крови или эквивалента крови, из внешнего резервуара в систему циркуляции. В данном контексте, "внешний" означает, что резервуар не является составной частью системы циркуляции или устройства в виде мультиорганного чипа, например, не соединен с системой циркуляции посредством трубок. Если в ходе инкубации потребуется восполнение веществ, например, питательных веществ и/или жидкостей, предпочтительным является, чтобы такие питательные вещества или жидкости подавались прерывисто через отверстие подачи, которое предпочтительно располагается в артериолярном или венулярном транспортном канале системы циркуляции или располагается в антральном слое.
Автономная система циркуляции сконфигурирована так, чтобы она находилась в непосредственном жидкостном соединении с секциями роста органов для эквивалентов органов в слое органов посредством микровходов и выходов указанных секций роста органов. Структура и путь получения такой автономной системы циркуляции уже описаны в патентном документе WO 2012/016711 А1, раскрытие которого включено в данный документ посредством ссылки. Внутренняя поверхность автономной системы циркуляции может быть выстлана эндотелиальными клетками и необязательно клетками гладкой мускулатуры.
Автономная система циркуляции содержит:
артериолярный транспортный канал, который непосредственно соединяет микровыходы секций роста органов для эквивалента легкого с микровходами секций роста органов в слое органов, для обеспечения возможности транспорта жидкости с высоким значением р02 в указанные секции роста органов; и
венулярный транспортный канал, который непосредственно соединяет микровыходы секций роста органов с микровходами секций роста органов для эквивалента легкого, для обеспечения возможности транспорта жидкости с низким значением pO2 из секций роста органов в эквивалент легкого.
Автономная система циркуляции может быть заполнена жидкостью, способной транспортировать питательные вещества и O2 в эквиваленты органов. Предпочтительно указанная жидкость представляет собой кровь или эквивалент крови.
Жидкость в автономной системе циркуляции циркулирует направленно благодаря скоординированной работе приводов в слое приводов устройства в виде мультиорганного чипа. При этом возможно имитировать не только достаточное давление в системе циркуляции, которое соответствует давлению в сосудистой системе организма, но также обеспечивается возможность имитации сокращения сердца. Таким образом, автономная система циркуляции устройства в виде мультиорганного чипа по настоящему изобретению подходит для обеспечения сдвиговых усилий и микроокружения, которое соответствует ситуации, наблюдаемой при физиологических условиях.
Автономная система циркуляции может быть сконфигурирована так, что микровыходы секций роста органов для эквивалентов тонкого кишечника, селезенки и поджелудочной железы соединены так, что они находятся в непосредственном жидкостном соединении друг с другом и с дополнительными микровходами секций роста органов для эквивалента печени с обеспечением возможности жидкостного соединения эквивалента селезенки, поджелудочной железы, тонкого кишечника и печени таким образом, что жидкостное соединение селезенки, поджелудочной железы и тонкого кишечника с венулярным транспортным каналом автономной системы циркуляции может осуществляться только посредством прохождения через эквивалент печени. Это строение обеспечивает возможность имитации основных функций пищеварительной системы высшего организма такого как, например, человек. Преимущество такого строения заключается в том, что в устройстве в виде мультиорганного чипа можно проводить культивирование в течение длительного времени посредством снабжения эквивалента тонкого кишечника питательными веществами из резервуара, расположенного в антральном слое. Эквиваленты органов в устройстве в виде мультиорганного чипа по настоящему изобретению затем будут снабжаться питательными веществами, прошедшими пищеварительную систему. Таким образом, питательные вещества предусматриваются в такой форме и таким образом, что является в большей степени сопоставимым с физиологическими условиями в организме. Больше нет необходимости во внешнем резервуаре для среды, из которого постоянно осуществляется подача в систему циркуляции для снабжения эквивалентов органов.
Автономная система циркуляции и эквиваленты органов предпочтительно сконфигурированы так, что артериолярный транспортный канал, начинающийся из эквивалента легкого, имеет разветвления по направлению потока, в которых ответвляются артериолярные каналы, которые снабжают эквиваленты органов. Жидкость, проходящая через определенный эквивалент органа, направляется по каналу в венулярный транспортный канал через венулярные каналы, ответвляющиеся от венулярного транспортного канала в соответствующих разветвлениях. Предпочтительно автономная система циркуляции и эквиваленты органов сконфигурированы так, что артериолярный транспортный канал, начинающийся из эквивалента легкого, по направлению потока имеет следующее:
- первое разветвление, в котором ответвляется первый артериолярный канал, снабжающий эквивалент тонкого кишечника, селезенки и поджелудочной железы;
- второе разветвление, в котором ответвляется второй артериолярный канал, снабжающий эквивалент печени;
- третье разветвление, в котором ответвляется третий артериолярный канал, снабжающий эквивалент почки;
- четвертое разветвление, в котором ответвляется четвертый артериолярный канал, снабжающий эквивалент почки;
- пятое разветвление, в котором ответвляется пятый артериолярный канал, снабжающий костный мозг;
- необязательное шестое разветвление, в котором ответвляется шестой артериолярный канал, снабжающий эквивалент кожи;
- необязательное седьмое разветвление, в котором ответвляется седьмой артериолярный канал, снабжающий эквивалент жировой ткани;
- необязательное восьмое разветвление, в котором ответвляется восьмой артериолярный канал, снабжающий эквивалент яичек; и
- необязательное девятое разветвление, в котором ответвляется девятый артериолярный канал, снабжающий эквивалент головного мозга.
Автономная система циркуляции сконфигурирована так, что диаметр артериолярного транспортного канала по направлению потока постоянно уменьшается, так что сумма значений площади поперечного сечения всех артериолярных транспортных каналов, в том числе всех разветвлений на определенном расстоянии от эквивалента легкого, остается постоянной, и при этом в венулярном транспортном канале по направлению потока указанное уменьшение диаметра постоянно изменяется в обратном направлении, так что сумма значений площади поперечного сечения всех венулярных транспортных каналов, в том числе всех разветвлений на определенном расстоянии от эквивалента легкого, остается постоянной.
Слой органов может быть сконфигурирован так, что полости для органоидов секций роста органов являются открытыми со стороны, противоположной по отношению к базовому слою. Это обеспечивает возможность внесения органоидов или клеток-предшественников в соответствующие полости для органоидов перед получением полностью собранного устройства в виде мультиорганного чипа. В этом случае устройство в виде мультиорганного чипа дополнительно содержит в иных случаях необязательный слой, удерживающий органы. Слой, удерживающий органы, расположен между слоем органов и антральным слоем. Слой, удерживающий органы, сконфигурирован для изоляции и/или стабилизации слоя органов таким образом, что поддерживается взаимодействие выбранных эквивалентов органов с антральным слоем. Слой, удерживающий органы, может предусматриваться в виде слоя толщиной 50-500 мкм, предпочтительно толщиной 100-300 мкм, более предпочтительно толщиной 200 мкм. Слой, удерживающий органы, можно получить из материала, который содержит синтетический полимер, такой как, например, полистирол (PS), поликарбонат (PC), полисилоксан и/или полидиметилсилоксан (PDMS), или состоит из него. Предпочтительно материал содержит поликарбонат или состоит из него. В особенности в участках, где слой, удерживающий органы, покрывает эквивалент органа, который имеет экскреторную функцию и/или продуцирует значительное количество межклеточной жидкости, например, почка, печень, селезенка и тонкий кишечник, слой, удерживающий органы, сконфигурирован так, чтобы обеспечивать возможность жидкостного соединения слоя органов и антрального слоя. Этого жидкостного соединения можно достичь, например, путем обеспечения пор в слое, удерживающем органы, предпочтительно путем обеспечения пор со средним диаметром 5-7 мкм. В альтернативном случае или дополнительно, толщину слоя, удерживающего органы, в участке, обеспечивающем возможность жидкостного соединения слоя органов и слоя, удерживающего органы, можно уменьшить до средней толщины 5-15 мкм, предпочтительно до 10 мкм.
Устройство в виде мультиорганного чипа по настоящему изобретению содержит антральный слой, расположенный над слоем органов. Антральный слой сконфигурирован так, чтобы содержать множество полостей и трубок расположенных так, что они находятся в жидкостном соединении с выбранными эквивалентами органов или секциями роста органов для обеспечения возможности обмена жидкостями между полостями антрального слоя и секциями роста органов в слое органов. Ряд органов имеют экскреторные функции и/или продуцируют значительные количества межклеточной жидкости, которые должны отводиться, если предполагается культивирование или инкубация в течение длительного периода времени. В особенности, поскольку жидкость автономной системы циркуляции циркулирует постоянно без обмена и замены, отведение продуктов распада из системы является жизненно важным. В частности, мочу, образовавшуюся в эквиваленте почки, и экскременты из эквивалента тонкого кишечника необходимо удалять из системы для обеспечения возможности функционирования устройства в виде мультиорганного чипа в условиях гомеостаза в течение длительного периода времени. Кроме того, поскольку подача среды в систему осуществляется не постоянно, требуется резервуар для снабжения эквивалента тонкого кишечника питательными веществами. Предпочтительно этот резервуар для питательных веществ как таковой располагается не в слое органов, а в антральном слое. Это обеспечивает возможность прерывистого повторного заполнения резервуара для питательных веществ при функционировании устройства в виде мультиорганного чипа без непосредственного взаимодействия со слоем органов.
Антральный слой может быть сконфигурирован так, чтобы содержать
полость, расположенную над эквивалентом тонкого кишечника и находящуюся в жидкостном соединении с эквивалентом тонкого кишечника и резервуаром для питания так, что эквивалент тонкого кишечника может снабжаться питательными веществами из резервуара для питания;
полость, расположенную над тонким кишечником и находящуюся в жидкостном соединении с эквивалентом тонкого кишечника и резервуаром для экскрементов, так, что материал, экскретированный из эквивалента тонкого кишечника, может транспортироваться в резервуар для экскрементов;
полость, расположенную над эквивалентом печени и находящуюся в жидкостном соединении с эквивалентом печени и полостью, расположенной над эквивалентом тонкого кишечника так, что материал, экскретированный из эквивалента печени, может транспортироваться в полость, расположенную над тонким кишечником; и
полость, расположенную над эквивалентом почки и находящуюся в жидкостном соединении с эквивалентом почки и резервуаром для мочи так, что в резервуар для мочи поступает материал, экскретированный из эквивалента почки.
Резервуар для питания, резервуар для экскрементов и резервуар для мочи являются составной частью антрального слоя.
Антральный слой может дополнительно содержать отверстие, которое обеспечивает возможность введения химических соединений, таких как, например, тестовых соединений, в жидкость автономной системы циркуляции и отбора образцов из жидкости автономной системы циркуляции.
Устройство в виде мультиорганного чипа по настоящему изобретению содержит слой приводов. Слой приводов сконфигурирован так, чтобы содержать множество приводов, расположенных и сконфигурированных для регулировки силы давления, прилагаемой к выбранному эквиваленту органа, автономной системе циркуляции и/или ее части. Для функционирования организма в условиях гомеостаза необходимо обеспечить контролируемое движение и приложение силы в системе. Очевидно, кровь в сосудистой системе должна перемещаться для обеспечения надлежащей функции. Однако перистальтическое движение кишечника является необходимым, так же, как и сжатие и расширение легкого для обеспечения потока воздуха. В устройстве в виде мультиорганного чипа по настоящему изобретению указанное движение или приложение силы осуществляется посредством приводов слоя приводов. Конфигурация и расположение приводящих элементов в слое приводов зависит от общего строения устройства в виде мультиорганного чипа, в частности, расположения эквивалентов органов в слое органов. Приводы могут быть выполнены в виде устройств, действие которых основано на давлении воздуха, сконфигурированных для приложения силы давления к эквиваленту органа или автономной системе циркуляции или ее части. Эти приводы могут находиться под контролем внешнего устройства, которое может быть программируемым.
Предпочтительно слой приводов содержит
один или несколько приводов, воздействующих на автономную систему циркуляции, для обеспечения возможности направленного движения жидкости для имитации сокращения сердца;
один или несколько приводов, воздействующих на антральный слой, для обеспечения возможности направленного движения для имитации перистальтического движения кишечника;
один или несколько приводов, воздействующих на эквивалент легкого, для обеспечения потока воздуха для имитации дыхания;
один или несколько приводов, воздействующих на эквивалент костного мозга, для обеспечения возможности регулируемого сжатия для имитации сжатия кости;
один или несколько приводов, воздействующих на артериолярный транспортный канал автономной системы циркуляции, для имитации сужения артериол;
один или несколько приводов, воздействующих на эквивалент печени, для обеспечения возможности направленного движения жидкости для отведения желчи из эквивалента печени и
один или несколько приводов, воздействующих на антральный слой, для обеспечения возможности направленного движения жидкости для отведения мочи из эквивалента почки.
В предпочтительном варианте осуществления устройства в виде мультиорганного чипа по настоящему изобретению слой органов содержит полидиметилсилоксан (PDMS) или состоит из него, причем слой, удерживающий органы, содержит поликарбонат или состоит из него, антральный слой содержит PDMS или состоит из него, и/или слой приводов содержит поликарбонат или состоит из него.
Настоящее изобретение направлено на устройство в виде мультиорганного чипа, определенное выше и в формуле изобретения, без органоидов, клеток и жидкости. Настоящее изобретение также направлено на устройство в виде мультиорганного чипа определенное выше, где устройство в виде мультиорганного чипа содержит соответствующие органоиды, клетки и жидкости.
Мультиорганный чип по настоящему изобретению характеризуется его способностью к длительному функционированию в условиях гомеостаза и сходством с организмом в физиологических условиях. Мультиорганный чип можно применять при различных настройках в зависимости от содержания и строения эквивалентов органов, присутствующих в устройстве. В дополнение к применениям при тестировании системной безопасности, в иммунологических, инфекционных и/или онкологических моделях, представлены следующие предпочтительные области применения устройства в виде мультиорганного чипа по настоящему изобретению.



Далее настоящее изобретение более подробно объяснено при помощи примера.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 показано схематическое представление варианта осуществления устройства в виде мультиорганного чипа по настоящему изобретению со структурой всех его слоев.
На фигуре 2 показан схематический вид сверху слоя приводов из варианта осуществления на фигуре 1.
На фигуре 3 показан схематический вид сверху антрального слоя из варианта осуществления на фигуре 1.
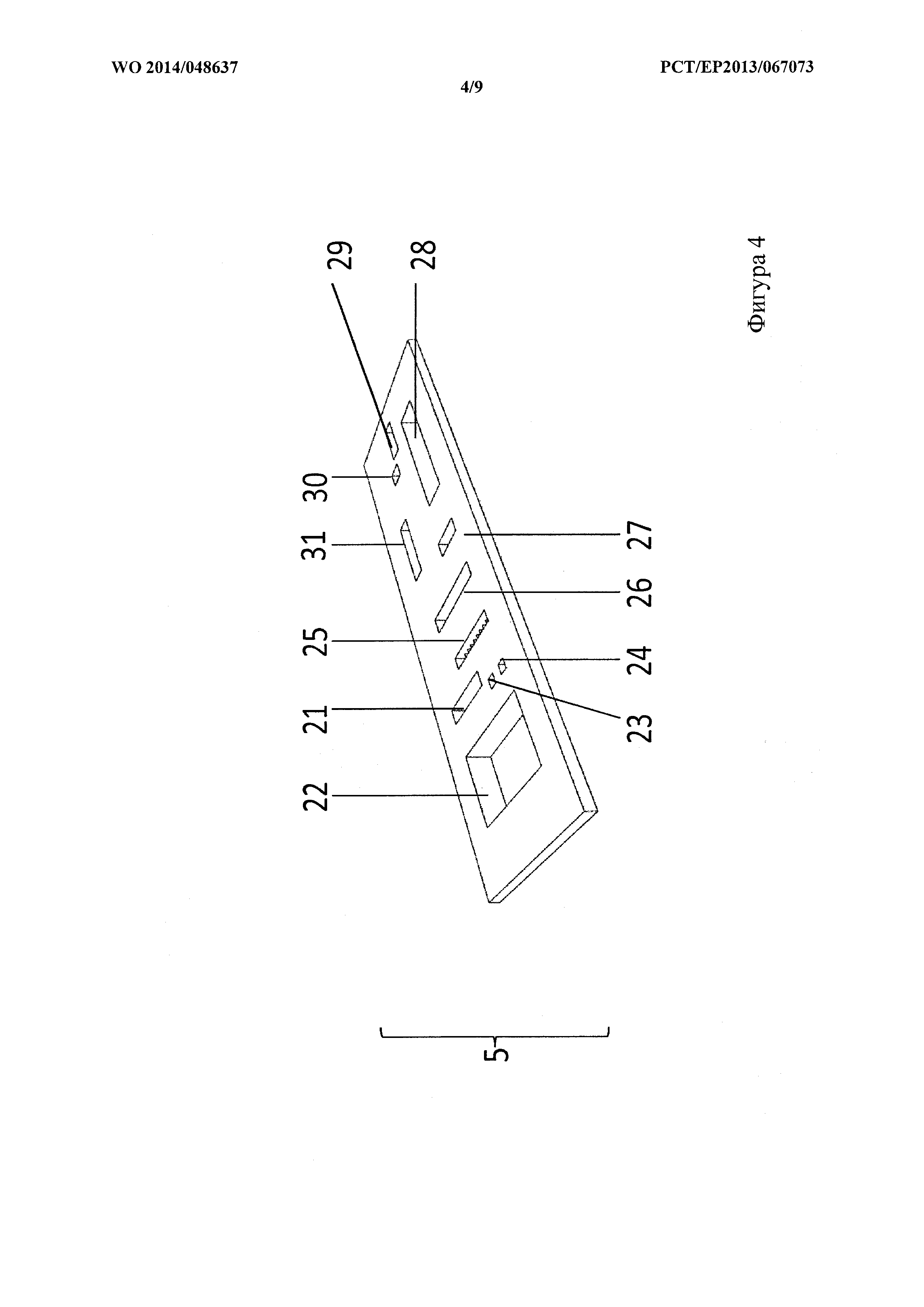
На фигуре 4 показан схематический вид сверху слоя, удерживающего органы, из варианта осуществления на фигуре 1.
На фигуре 5 показан схематический вид сверху слоя органов из варианта осуществления на фигуре 1.
На фигуре 6 показан схематический вид сверху базового слоя из варианта осуществления на фигуре 1.
На фигуре 7 показан общий вид микрожидкостного устройства в виде мультиорганного чипа (МОС), (a) покомпонентное изображение
устройства, содержащего CP из поликарбоната, чип из PDMS и стекла, вмещающий два микрососудистых контура (размер: 76 мм ×25 мм; высота: 3 мм), и нагреваемый МОС-держатель; (b) поперечное сечение перистальтического микронасоса на чипе, работающего с запрограммированным периодическим сжатием и расширением трех последовательно расположенных мембран из PDMS (толщина: 500 мкм); стрелка указывает направление потока, (c) вид сверху схемы МОС, на которой изображены два отдельных микрожидкостных контура (высота канала: 100 мкм; ширина: 500 мкм), причем каждый вмещает два участка вставки (компартменты) (диаметр вставки: 5 мм). Точки A и B в каждом контуре обозначают положение неинвазивного анализа потока жидкости и клеток.
На фигуре 8 показана оценка динамических свойств жидкости в МОС на фиг. 7. (а). Иллюстративные профили скорости на протяжении четырех стадий полного насосного цикла (частота: 0,476 Гц), измеренной в двух дискретных точках анализа потока жидкости для подтверждения пульсирующего характера потока жидкости (черный круг = открытый клапан, белый круг = закрытый клапан), (b) среднее значение скорости (мм/с) и соответствующее значение сдвигового напряжения (дин/см2) в зависимости от значений частоты работы насоса (Гц) в обеих точках.
ПРИМЕРЫ
Пример 1 Устройство в виде мультиорганного чипа по настоящему изобретению
Как изображено на фигуре 1, устройство 1 в виде мультиорганного чипа содержит базовый слой 3, слой 6 органов, слой 5, удерживающий органы, антральный слой 4 и слой 2 приводов.
Как показано на фигуре 6, базовый слой 3 сконфигурирован так, чтобы обеспечивать твердую подложку для других слоев. Базовый слой 3 изготовлен из стекла или прозрачного синтетического полимера, такого как, например, полистирол (PS), поликарбонат (PC), полисилоксан и/или полидиметилсилоксан (PDMS). Базовый слой 3 также содержит определенное количество датчиков 32 и 33, сконструированных и расположенных для наблюдения и контроля работы системы. Некоторые из этих датчиков 32 сконфигурированы для подачи электрических стимулов к эквивалентам органов в слое органов, другие датчики 33 сконфигурированы для измерения параметров системы для обеспечения надлежащей функции. Базовый слой 3 содержит отверстия, посредством которых данные, полученные при помощи датчиков, можно извлечь и использовать для других целей, таких как, например, регуляция системы.
Слой 6 органов показан на фигуре 5. Слой 6 органов расположен над базовым слоем 3, изготовлен из PDMS и сконфигурирован так, чтобы содержать множество отдельных эквивалентов органов, причем каждый эквивалент органа содержит одну или несколько секций роста органов, при этом каждая секция роста органов сконфигурирована так, чтобы содержать полость для органоидов для размещения по меньшей мере одного органоида определенного органа. Слой 6 органов содержит эквивалент 22 легкого, эквивалент 21 тонкого кишечника, эквивалент 23 селезенки, эквивалент 24 поджелудочной железы, эквивалент 25 печени, эквивалент 26 почки, эквивалент 27 костного мозга, эквивалент 28 жировой ткани, эквивалент 29 головного мозга, эквивалент 30 яичек и эквивалент 31 кожи. Каждая секция роста органов содержит микровход и микровыход для жидкостного соединения полости для органоидов секции роста органов и автономной системы 34 циркуляции. Автономная система 34 циркуляции сконфигурирована так, чтобы она находилась в непосредственном жидкостном соединении с секциями роста органов в слое 6 органов посредством микровходов и выходов секций роста органов. Автономная система 34 циркуляции содержит артериолярный транспортный канал, непосредственно соединяющий микровыходы секций роста органов эквивалента 22 легкого с микровходами всех других секций роста органов в слое 6 органов для обеспечения возможности транспорта жидкости с высоким значением pO2 в указанные секции роста органов; и венулярный транспортный канал, непосредственно соединяющий микровыходы секций роста органов с микровходами секций роста органов эквивалента 22 легкого для обеспечения возможности транспорта жидкости с низким значением pO2 из секций роста органов в эквивалент 22 легкого. Автономная система 34 циркуляции сконфигурирована так, что микровыходы секций роста органов для эквивалентов 21, 23, 24 тонкого кишечника, селезенки и поджелудочной железы соединены так, что они находятся в непосредственном жидкостном соединении друг с другом и с дополнительными микровходами секций роста органов для эквивалента 25 печени с обеспечением возможности жидкостного соединения эквивалента 23, 24, 21, 25 селезенки, поджелудочной железы, тонкого кишечника и печени таким образом, что жидкостное соединение эквивалента 23, 24, 21 селезенки, поджелудочной железы и тонкого кишечника с венулярным транспортным каналом автономной системы 34 циркуляции может осуществляться только посредством прохождения через эквивалент 25 печени. Эквиваленты органов и автономная система 34 циркуляции сконфигурированы так, что артериолярный транспортный канал начинающийся из эквивалента 22 легкого, по направлению потока имеет следующее:
- первое разветвление, в котором ответвляется первый артериолярный канал, снабжающий эквивалент 21, 23 и 24 тонкого кишечника, селезенки и поджелудочной железы;
- второе разветвление, в котором ответвляется второй артериолярный канал, снабжающий эквивалент 25 печени;
- третье разветвление, в котором ответвляется третий артериолярный канал, снабжающий эквивалент 26 почки;
- четвертое разветвление, в котором ответвляется четвертый артериолярный канал, снабжающий эквивалент 27 костного мозга;
- необязательное пятое разветвление, в котором ответвляется пятый артериолярный канал, снабжающий эквивалент кожи 31;
- шестое разветвление, в котором ответвляется шестой артериолярный канал, снабжающий эквивалент 28 жировой ткани;
- седьмое разветвление, в котором ответвляется седьмой артериолярный канал, снабжающий эквивалент 30 яичек; и
- восьмое разветвление, в котором ответвляется восьмой артериолярный канал, снабжающий эквивалент 29 головного мозга.
Диаметр артериолярного транспортного канала по направлению потока (из эквивалента 22 легкого в другие эквиваленты органов) постоянно уменьшается, так что сумма значений площади поперечного сечения всех артериолярных транспортных каналов, в том числе всех разветвлений на определенном расстоянии от эквивалента 22 легкого остается постоянной, и при этом в венулярном транспортном канале по направлению потока (из других эквивалентов органов в эквивалент 22 легкого) указанное уменьшение диаметра постоянно изменяется в обратном направлении, так что сумма значений площади поперечного сечения всех венулярных транспортных каналов, в том числе всех разветвлений на определенном расстоянии от эквивалента легкого, остается постоянной.
Каждый из эквивалентов органов сконфигурирован для размещения количества органоидов, которое является пропорциональным по отношению к количеству органоидов, присутствующих, в среднем, в соответствующем органе организма млекопитающего, предпочтительно человека, причем размер всех эквивалентов органов в устройстве в виде мультиорганного чипа является уменьшенным с использованием одного и того же предварительно определенного коэффициента пропорциональности, например, коэффициента 0,00001 (1/100000).
Слой 6 органов сконструирован так, что
- секция роста органов для эквивалента 25 печени сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 5-15 органоидов печени, где каждый органоид печени представляет собой дольку печени, предпочтительно полость для органоидов сконфигурирована для размещения 10 органоидов печени;
- секция роста органов для эквивалента 22 легкого сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 2000-4000 органоидов легкого, где каждый органоид легкого представляет собой альвеолу легкого, предпочтительно полость для органоидов сконфигурирована для размещения 3000 органоидов легкого;
- секция роста органов для эквивалента 24 поджелудочной железы сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 5-15 органоидов поджелудочной железы, где каждый органоид поджелудочной железы представляет собой островок Лангерганса, предпочтительно полость для органоидов сконфигурирована для размещения 10 органоидов поджелудочной железы;
- секция роста органов для эквивалента 23 селезенки сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 5-15 органоидов селезенки, где каждый органоид селезенки представляет собой белую и красную пульпу, предпочтительно полость для органоидов сконфигурирована для размещения 10 органоидов селезенки;
- секция роста органов для эквивалента 21 тонкого кишечника сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 40-80 органоидов тонкого кишечника, где каждый органоид тонкого кишечника представляет собой ворсинку, предпочтительно полость для органоидов сконфигурирована для размещения 60 органоидов тонкого кишечника;
- секция роста органов для эквивалента 26 почки сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 10-30 органоидов почки, где каждый органоид почки представляет собой нефрон, предпочтительно полость для органоидов сконфигурирована для размещения 20 органоидов почки;
- секция роста органов для эквивалента 27 костного мозга сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 1000-2000 органоидов костного мозга, где каждый органоид костного мозга представляет собой элемент, образованный из костного мозга, кости и хряща, предпочтительно полость для органоидов сконфигурирована для размещения 1400 органоидов костного мозга;
- секция роста органов для эквивалента 31 кожи сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 10-15 органоидов кожи, где каждый органоид кожи представляет собой придаток кожи, предпочтительно полость для органоидов сконфигурирована для размещения 15 органоидов кожи;
- секция роста органов для эквивалента 28 жировой ткани сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 200000-300000 органоидов жировой ткани, где каждый органоид жировой ткани представляет собой кластер жировых клеток, предпочтительно полость для органоидов сконфигурирована для размещения 240000 органоидов жировой ткани;
- секция роста органов для эквивалента 30 яичек сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 10-20 органоидов яичек, где каждый органоид яичек представляет собой дольку яичка, предпочтительно полость для органоидов сконфигурирована для размещения 15 органоидов яичек; и
- секция роста органов для эквивалента 29 головного мозга сконфигурирована так, чтобы обеспечивать полость для органоидов для размещения 150-250 органоидов головного мозга, где каждый органоид головного мозга представляет собой кортикальную колонку, предпочтительно полость для органоидов сконфигурирована для размещения 200 органоидов головного мозга.
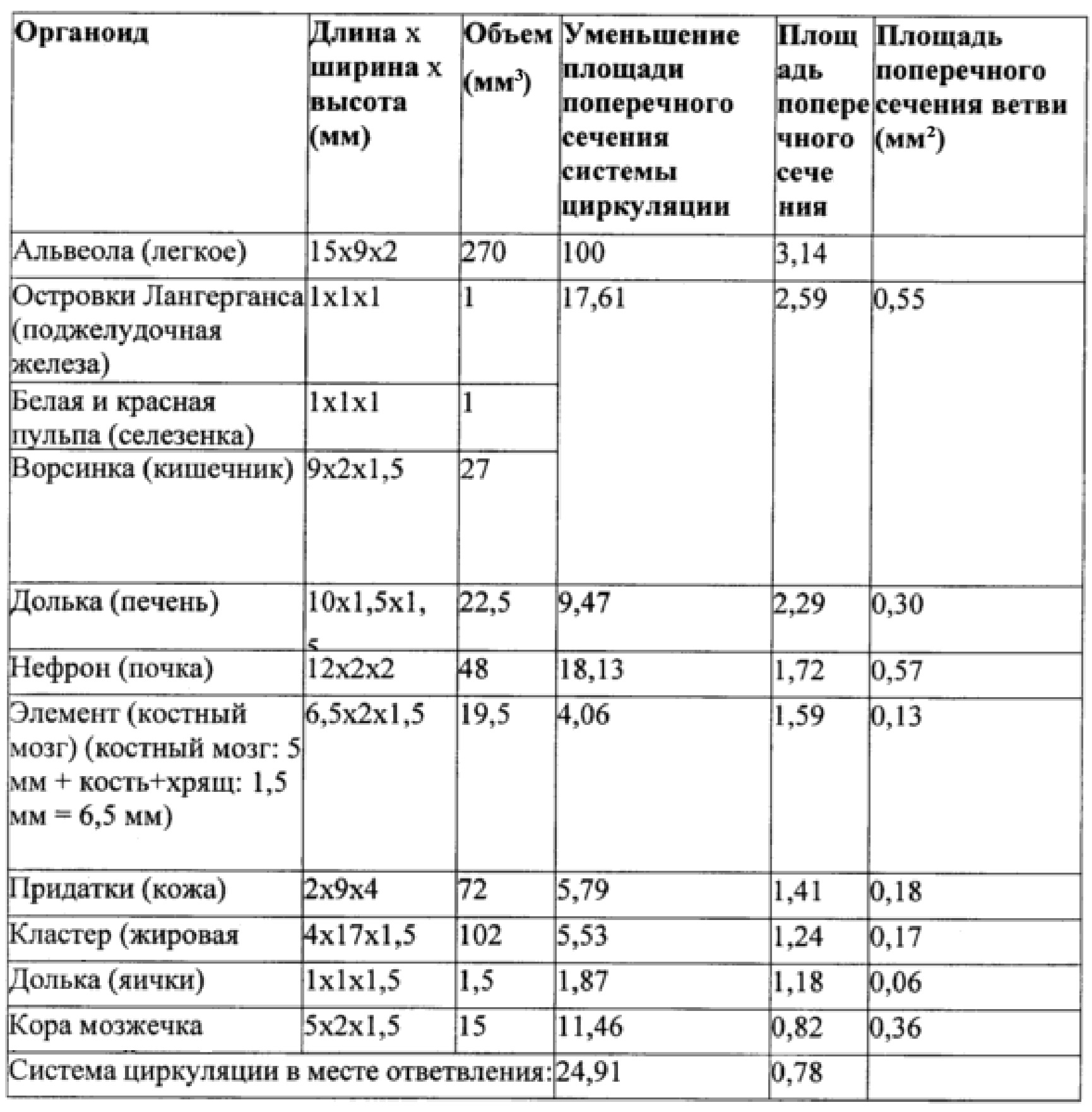
Далее параметры в таблице 2 представлены для слоя 6 органов, изготовленного из слоя PDMS высотой 3 мм.

Слой 5, удерживающий органы, расположен между слоем 6 органов и антральным слоем 4, см. фигуру 4. Слой 5, удерживающий органы, сконфигурирован для изоляции и/или стабилизации слоя 6 органов таким образом, что поддерживается жидкостное соединение выбранных эквивалентов органов с антральным слоем 4. Слой 5, удерживающий органы, предусматривается в виде слоя толщиной 200 мкм. Слой 5, удерживающий органы, изготовлен из материала, который содержит поликарбонат (PC) или состоит из него. В участках, где слой 5, удерживающий органы, покрывает один из эквивалентов 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31 органов, слой 5, удерживающий органы, сконфигурирован так, чтобы обеспечивать возможность жидкостного соединения слоя 6 органов и антрального слоя 4. В частности, в участках, где слой 5, удерживающий органы, покрывает эквивалент органа, который имеет экскреторную функцию и/или продуцирует значительное количество межклеточной жидкости, например, почка 26, печень 25, селезенка 23 и тонкий кишечник 21, этого жидкостного соединения можно достичь, например, путем обеспечения пор в слое 5, удерживающем органы, предпочтительно путем обеспечения пор со средним диаметром 5-7 мкм. В альтернативном случае или дополнительно, в участке, обеспечивающем возможность жидкостного соединения слоя 6 органов и антрального слоя 4, толщину слоя 5, удерживающего органы, можно уменьшить до средней толщины 5-15 мкм, предпочтительно 10 мкм.
Антральный слой 4 изображен на фигуре 3 и сконфигурирован так, чтобы содержать множество полостей и трубок, расположенных так, что они находятся в жидкостном соединении с выбранными эквивалентами органов или секциями роста органов в слое 6 органов для обеспечения возможности обмена жидкостями между полостями и секциями роста органов. Антральный слой 4 содержит PDMS или состоит из него. Антральный слой 4 сконфигурирован так, чтобы содержать
полость, расположенную над эквивалентом 21 тонкого кишечника и находящуюся в жидкостном соединении с эквивалентом 21 тонкого кишечника и резервуаром 18 для питания, так что эквивалент 21 тонкого кишечника может снабжаться питательными веществами из резервуара 18 для питания;
полость, расположенную над эквивалентом 21 тонкого кишечника и находящуюся в жидкостном соединении с эквивалентом 21 тонкого кишечника и резервуаром 19 для экскрементов так, что материал, экскретированный из эквивалента 21 тонкого кишечника, может транспортироваться в резервуар 19 для экскрементов;
полость, расположенную над эквивалентом 25 печени и находящуюся в жидкостном соединении с эквивалентом 25 печени и полостью, расположенной над эквивалентом 21 тонкого кишечника, так что материал экскретированный из эквивалента 25 печени, может транспортироваться в полость, расположенную над эквивалентом тонкого кишечника 21; и
полость, расположенную над эквивалентом 26 почки и находящуюся в жидкостном соединении с эквивалентом 26 почки и резервуаром 20 для мочи, так что в резервуар 20 для мочи поступает материал, экскретированный из эквивалента 26 почки. Резервуар 18 для питания, резервуар 19 для экскрементов и резервуар 20 для мочи являются составными частями антрального слоя 4 и предпочтительно сконфигурированы так, что к ним можно получить доступ извне.
Слой 2 приводов сконфигурирован так, чтобы содержать множество приводов, расположенных и сконфигурированных для регулировки силы давления, прилагаемой к выбранному эквиваленту органов, автономной системе циркуляции и/или ее части, см. фигуру 2. Слой приводов изготовлен из поликарбоната.
Слой приводов 2 содержит
3 привода 10, создающих давление, воздействующих на автономную систему 34 циркуляции, для обеспечения возможности направленного движения жидкости для имитации сокращения сердца;
3 перистальтических привода 11, воздействующих на антральный слой 4 таким образом, что обеспечивается возможность направленного движения для имитации перистальтического движения кишечника;
один привод 12, воздействующий на эквивалент 22 легкого, для обеспечения потока воздуха для имитации легочного дыхания;
один привод 17, воздействующий на эквивалент 27 костного мозга, для обеспечения возможности регулируемого сжатия для имитации сжатия кости;
8 приводов 14, воздействующих на артериолярный транспортный канал автономной системы 34 циркуляции, для имитации сужения артериол;
1 привод 13, воздействующий на эквивалент 25 печени, для обеспечения возможности направленного движения жидкости для отведения желчи из эквивалента 25 печени;
1 привод 13, воздействующий на эквивалент 26 почки, для обеспечения возможности направленного движения жидкости для отведения мочи из эквивалента 26 почки в резервуар 20 почки; и
1 привод 13, воздействующий на эквивалент 23 селезенки.
Кроме того, слой приводов содержит отверстие 16 для осуществления доступа к резервуару 18 для питания, отверстие 16 для осуществления доступа к резервуару для экскрементов, отверстие 16 для осуществления доступа к резервуару для мочи 20 и одно отверстие 16 для осуществления доступа к венулярному транспортному каналу автономной системы 34 циркуляции.
Пример 2 Интеграция биологической сосудистой системы в устройство в виде мультиорганного чипа по настоящему изобретению
Цель заключалась в имитации транспортной части сосудистой системы человека -сердца и сосудов - на чипе для того, чтобы продемонстрировать возможность создания функционального эквивалента сосудистой системы в устройстве в виде мультиорганного чипа или устройстве "человек-на-чипе" по настоящему изобретению. Получали микронасос на чипе для поддержания постоянного длительного потока жидкости через систему микроканалов, полностью покрытую первичными дермальными клетками микрососудистого эндотелия человека (HDMEC). В отличие от большинства существующих микросистем для изучения эффектов сдвигового напряжения на EG с применением постоянного сдвигового напряжения в диапазоне 10-40 дин/см2, цель заключалась в получении осциллирующего сдвигового напряжения с реверсивным характером, которое ранее использовали при различных условиях проведения эксперимента. В микрососудистой транспортной системе, представленной в данном документе, объединены два отдельных компартмента, которые сконструированы для интеграции отдельных эквивалентов органов с объемом биомассы каждого до 100 мг.Изготавливали специальные вставки для обеспечения ветвления сосудов и уменьшения диаметра в участках отдельных компартментов для культивирования органов с обеспечением дальнейшей васкуляризации органа. Быстрое создание прототипа с применением легкой литографии и формование копий из PDMS обеспечивает возможность легкого приспособления конструкции к количеству органов и их специфическому расположению, причем прикрепление осуществляется во всех случаях к одному и тому же стандартному формату основы чипа. Кроме того, были реализованы две важные особенности для преодоления технических ограничений при работе с большинством существующих микрожидкостных систем: i) не зависящее от термостата функционирование микросистемы обеспечивали посредством доведенной до нужного состояния подложки чипа, и ii) обеспечивали доступность для микроскопирования всех без исключения участков каналов контура, что делает возможным видеомикроскопию в реальном времени.
Материалы и способы. Конструирование и изготовление устройства
Сконструировали и изготовили микрожидкостное устройство в виде мультиорганного чипа (МОС), вмещающее два отдельных микрососудистых контура, каждый из которых функционирует с использованием отдельного перистальтического микронасоса на чипе. На фиг.7 проиллюстрирован общий вид системы. Покровная пластина вмещает шесть нагнетательных фитингов и четыре вставки, образующие 300 мкл компартменты, причем каждый из них предназначен для обмена средой и дальнейшей интеграции эквивалентов органов. МОС-держатель обеспечивает контролируемое постоянное поддержание температуры в МОС на уровне 37°C (фиг. 7а). Устанавливали перистальтические микронасосы на чипе (фиг. 7b). Программное обеспечение для управления микронасосами обеспечивает движение потока жидкости как по часовой стрелке, так и против часовой стрелки. Скорость потока (Q) можно изменять посредством регулирования частоты работы насоса. Каждый контур с микроканалами (фиг. 7с) содержит общий объем 10 мкл, тогда как каждый из двух отдельных компартментов, образованных вставкой, для культивирования дополнительных эквивалентов органов имеет вместимость до 300 мкл. Для изготовления МОС применялась стандартная легкая литография и формование копий из PDMS (Sylgard 184, Dow Corning, Мидленд, Мичиган, США). Вкратце, исходную форму изготавливали посредством связывания кремниевой пластины со стеклянной пластиной. На кремниевую пластину наносили фоторезист и формировали рисунок с применением фотошаблона и УФ-излучения. Затем протравливали незащищенные кремниевые участки и снимали фоторезист. Для изготовления микросистемы покровную пластину (CP) обрабатывали добавкой на основе кремнийорганического каучука (WACKER® PRIMER G 790; Wacker Chemie, Мюнхен, Германия) при 80°C в течение 20 мин. Полученной покровной пластиной закрывали исходную форму (высота канала 100 мкм, ширина 500 мкм) и в эту систему для литья вводили PDMS (соотношение PDMS и отверждающего реагента 10:1 объем/объем). Структуру инкубировали при 80°C в течение по меньшей мере 60 мин. Винты с тефлоновым покрытием использовали для получения четырех не содержащих PDMS компартментов для культивирования и шести мембран из PDMS толщиной 500 мкм, входящих в состав двух микронасосов на чипе (три мембраны на микронасос). Отлитый слой PDMS образует непроницаемое для жидкости соединение с СР. Затем осуществляли необратимое связывание слоя PDMS, прикрепленного к CP, при помощи обработки посредством плазменного оксидирования при низком давлении (Femto; Diener, Эбхаузен, Германия), со стеклом для микроскопирования. Стерильную среду вводили непосредственно в два микрососудистых контура для того, чтобы избежать нейтрализации поверхности.
Динамические характеристики жидкости
Неинвазивную методику измерения скорости по изображениям микрочастиц (микроPIV) использовали для характеристики потока жидкости в точке А и В (см. фиг. 7с) микрожидкостного контура. Вкратце, инверсионный микроскоп Zeiss Primovert (Zeiss, Иена, Германия) со стандартной галогенной лампой в качестве источника непрерывного освещения, объединенный с CMOS-камерой (Baumer Optronic НХС40, разрешение: 2048×2048 пикселов, интерфейс: CameraLink; Baumer Optronic, Радеберг, Германия) использовали для отслеживания перемещения 15 мкм полистирольных гранул (4*104 г/мл; Life Technologies, Дармштадт, Германия) при времени экспозиции 4 мкс на одно изображение. Выбирали низкое значение увеличения (4х) для ограничения сдвига между двумя кадрами приблизительно 50 пикселами (1 пиксел = 3,2 мкм). Z-фокус устанавливали на центральную часть жидкостного канала в соответствующей точке (на 50 мкм выше стеклянной пластинки) для определения максимальной скорости. Осуществляли наблюдение посредством проверочного окна в центральной части жидкостного канала (1024 пиксела ×100 пикселов, 3,28 мм ×0,32 мм) с достижением частоты кадров до 3200 кадров в секунду. В конечном итоге, корреляцию определяли при помощи программного обеспечения (Fraunhofer IWS, Дрезден, Германия), которое анализирует стек изображений из 15000 кадров с расчетом максимального значения корреляции для x-компонента смещения в определенном участке. Рассчитанные значения для пяти последовательных кадров усредняли для сведения к минимуму артефактов. Следующую конфигурацию насоса использовали для всех экспериментов: давление - 500 мбар; вакуум - 520 мбар и поток воздуха - 1,5 л/мин при 350 мбар. Временную зависимость измеряли в двух различных местоположениях (А+В) на чипе, как показано на фигуре 7с.
Поскольку ламинарный поток характеризуется максимальным значением скорости (vmax) в центральной части микроканала, среднее значение сдвигового напряжения (x) можно рассчитать при помощи следующего уравнения:
где vmax представляет собой значение усредненной скорости в центральной части канала, p представляет собой динамическую вязкость (рассчитанную как 1 мПа/с) и h представляет собой высоту канала (100 мкм).
Выделение и культивирование клеток
HDMEC выделяли из крайней плоти человека, полученной с информированным согласием и разрешением комитета по вопросам этики из педиатрической хирургической операции после обычной процедуры обрезания от доноров детского возраста. Все образцы кожи, которые использовали для выделения клеток, обрабатывали в течение одного дня после их отбора. Перед выделением образцы крайней плоти очищали в 80% этаноле в течение 30 с и промывали фосфатно-солевым буферным раствором (PBS; РАА, Кельбе, Германия). Кожное кольцо раскрывали и удаляли подкожную ткань. Для отделения тонкого эпидермального слоя от дермы полученный образец крайней плоти инкубировали в 5 мг/мл растворе диспазы II (Sigma-Aldrich, Шнельдорф, Германия) при 4°C в течение 15-18 ч. Дерму разрезали на небольшие кусочки и затем инкубировали с 4 мг/мл раствором коллагеназы NB 4 (Serva, Гейдельберг, Германия) при 37°C в течение 75 мин. Смесь пропускали через 70 мкм нейлоновый фильтр и центрифугировали при 300 g в течение 5 мин. Полученный в результате клеточный осадок ресуспендировали в среде для роста эндотелиальных клеток MV2 (ECGM- MV2; PromoCell, Гейдельберг, Германия), дополненной Supplement-Pack MV2 (PromoCell, Гейдельберг, Германия), 1% P-S и 0,05% фунгизоном. Клетки высевали во флакон Т-75 и выращивали с 5% CO2 при 37°C. Среду заменяли через один день после посева. Через два-пять дней после первичного посева HDMEC очищали посредством магнитной сортировки клеток (MACS). Клетки собирали при помощи 0,05% (0,5 мг/мл) трипсина/EDTA (РАА, Кельбе, Германия) и проводили положительный отбор в отношении ЕС при помощи CD31 MicroBead Kit (Miltenyi Biotec, Бергиш-Гладбах, Германия) в соответствии с инструкциями производителя. ECGM-MV2, дополненную Supplement-Pack MV2, и 1% P-S (полная ECGM-MV2) использовали для извлечения клеток из колонки. Контроль чистоты выделенных клеток осуществляли непосредственно после каждой MACS при помощи FACS-анализов. При необходимости циклы отделения повторяли до получения>90% клеток, положительных по CD31. Очищенные HDMEC либо замораживали для последующего использования, либо использовали непосредственно после размножения. HDMEC размножали во флаконах Т-75 с полной ECGM-MV2 до получения 70-90% конфлюентности при трехдневном режиме питания. Во всех исследованиях использовали клетки между 3-им и 8-ым пассажем для обеспечения сохранения у клеток их первичных эндотелиальных характеристик.
Культивирование HDMEC на различных обработанных поверхностях из PDMS
HDMEC высевали при плотности 104 клеток/см2 на три типа поверхностей из PDMS: необработанную, покрытую 100 мкг/мл фибронектином (Sigma Aldrich, Шнельдорф, Германия) и обработанную воздушной плазмой. Обработку воздушной плазмой осуществляли в системе плазмы низкого давления (50 Вт) при частоте 13,56 МГц в течение 30 с. После 48 ч культивирования сравнивали характер роста и морфологию клеток при помощи световой микроскопии.
Посев ЕС и культивирование в МОС
Перед посевом каждый МОС промывали средой и инкубировали в статических условиях в течение 3 дней с 5% CO2 при 37°C. HDMEC собирали из растущих культур с использованием 0,05% трипсина/EDTA (РАА, Кельбе, Германия). Суспензию клеток концентрировали путем центрифугирования и определение числа клеток осуществляли с применением счетчика клеток с анализатором жизнеспособности ViCell (Beckman Coulter, Фуллертон, Калифорния, США). Жизнеспособность клеток во всех экспериментах составляла >90%. Отцентрифугированные клетки ресуспендировали с использованием полной ECGM-MV2 до конечной концентрации 2×107 клеток/мл. После этого суспензию клеток переносили в 1 мл шприц. Клетки вводили через один из двух компартментов в каждом контуре. Шприц соединяли с адаптером канюля Люэра x1/4-28 конус (IDEX Health & Science, Вертхайм-Мондфельд, Германия). Из этого фитинга вытесняли воздух, затем его привинчивали к специальному резьбовому (МОС) адаптеру (MicCell MOC-I 1/4" - 28 UNF × М10 Fitting (PEEK); Gesim, Дрезден, Германия). Пустой шприц таким же образом соединяли со вторым компартментом. После равномерной инфузии клеток в оба контура устройство инкубировали с 5% CO2 при 37°C в статических условиях в течение 3 ч для обеспечения возможности прикрепления клеток к стенкам канала. В каждый компартмент добавляли свежую среду в количестве 300 мкл и затем промывали каналы из PDMS с использованием микронасоса на чипе в каждом контуре. Частоту 0,476 Гц применяли для непрерывного динамического функционирования каждого микрососудистого контура МОС. Для культивирования в МОС при статических условиях каналы промывали свежей средой в течение 5 мин с использованием разности гидростатического давления на входе и выходе из компартмента.
Количество среды 150 мкл на компартмент заменяли каждые 1-2 дня как в динамических, так и в статических МОС-системах, при этом рост и жизнеспособность клеток отслеживали путем исследования при помощи световой микроскопии в точках А и В каждой системы циркуляции (фиг. 7 с). Кроме того, жизнеспособность клеток определяли при помощи анализа с использованием кальцеина AM. Раствор 5 мкг/мл красно-оранжевого кальцеина AM CellTrace (Life Technologies, Дармштадт, Германия) добавляли в оба компартмента в каждом контуре МОС при объеме 100 мкл. МОС прокачивали насосом в течение 2 мин и затем инкубировали в статических условиях с 5% CO2 при 37°C в течение 30 мин. Затем микроканалы дважды промывали средой посредством замены среды во вставках-компартментах свежей средой. Изображения получали с использованием флуоресцентной микроскопии (BZ9000; Кеуепсе, Ной-Изенбург, Германия). Обычные эксперименты с использованием МОС завершали через 4 дня (10 динамических МОС и 12 статических МОС). Отдельные МОС функционировали в таком же режиме более 7, 14 и 32 дней для получения первых показателей длительного функционирования микрососудистых контуров. Для оценки возможности замены CO2-термостат, необходимого для функционирования МОС, МОС-держателем, показанным на фиг. 7а, 9 экспериментов с использованием МОС (7 динамических МОС и 2 статических МОС) осуществляли с использованием держателя исключительно в течение времени работы до 7 дней.
Характеристика метаболизма ЕС в МОС
Концентрацию глюкозы в среде измеряли в соответствии с инструкциями производителя с использованием методики №1070 Stanbio Glucose LiquiColor® (Oxidase) (Stanbio Laboratory, Боерн, Техас, США). Вкратце, 99 мкл реагента добавляли в 96-луночный микротитровальный планшет (Greiner Bio-One, Фрикенхаузен, Германия), предварительно нагретый до 37°C и добавляли 1 мкл образца среды. Спустя еще 5 мин инкубации при 37°C концентрацию глюкозы количественно определяли при помощи микропланшет-ридера (FLUOstar Omega; BMG Labtech, Ортенберг, Германия) при 500 нм с использованием воды в качестве эталона.
Концентрацию лактата в среде измеряли в соответствии с инструкциями производителя с использованием методики LOD-PAP (Diaglobal, Берлин, Германия). Вкратце, 99 мкл реагента смешивали с 1 мкл образца среды в 96-луночном формате многолуночного планшета и измеряли поглощение при 520 нм с помощью микропланшет-ридера с использованием воды в качестве эталона.
Иммунофлуоресцентное окрашивание ЕС внутри МОС
Спустя 4 дня в культуре ЕС фиксировали внутри микрососудистого контура холодным ацетоном при -20°C в течение 10 мин, дважды промывали PBS в течение 5 мин, инкубировали с 10% сывороткой козы в PBS в течение еще 20 мин, а затем инкубировали с первичным антителом, мышиным антителом к CD31 человека (1:500; 7,1 мг/мл; DRFZ, Берлин, Германия) при комнатной температуре (RT) в течение 2 часов. Затем контуры дважды промывали PBS с последующей инкубацией со вторичным антителом, антителом козы к Ig мыши, конъюгированным с Alexa Fluor 594 (1:200, 2 мг/мл; Life Technologies, Дармштадт, Германия), в темноте при RT в течение 40 мин. После промывки добавляли антитело овцы к vWF человека, конъюгированное с FITC (1:50, 10 мг/мл; Abeam, Кембридж, Великобритания) и инкубировали при RT в течение 2 ч. Ядра подвергали контрастному окрашиванию при помощи Hoechst 33342 (1:1000, 10 мг/мл; Life Technologies, Дармштадт, Германия). Осуществляли другое иммунофлуоресцентное окрашивание при помощи первичного антитела, антитела мыши к VE-кадгерину человека (1:100, 0,2 мг/мл; Santa Cruz Biotechnology, Гейдельберг, Германия). ЕС фиксировали 4% PFA в течение 10 мин, дважды промывали PBS в течение 5 мин и пермеабилизировали при помощи 0,2% Triton Х-100 в течение 5 мин. После двух промывок PBS осуществляли окрашивание для выявления первичных и вторичных антител, как описано выше. Культуры в МОС окрашивали на предмет филаментного актина в сочетании с VE-кадгерином при помощи фаллоидина Oregon Green® 488 (Life Technologies, Дармштадт, Германия) в соответствии с инструкциями производителя.
Каждый растворитель добавляли во вставки-компартменты МОС и перекачивали в течение 1-2 мин для равномерного распределения. Изображения получали либо посредством стандартной флуоресцентной микроскопии, либо двухфотонной микроскопии (TriMScope II; LaVision BioTec, Билефельд, Германия). Все микрососудистые каналы визуализировали через их стенки из стекла для микроскопирования. 3D изображения реконструировали из полученного стека изображений с применением программного обеспечения Imaris (Bitplane, Цюрих, Швейцария).
Характеристика эффектов сдвигового напряжения
Изображения окрашенных посредством иммунофлуоресцентного окрашивания HDMEC получали в точках А и В каждого микрососудистого контура (фиг. 7с) для отслеживания индуцируемых потоком морфологических изменений с использованием стандартного флуоресцентного микроскопа. Мембраны HDMEC на изображениях восстанавливали вручную для автоматического распознавания ЕС. Алгоритм распознавания участков связывания использовали для идентификации ЕС и расчета соответствующего периметра, размера клеток, центра тяжести и ориентации (пространственный невзвешенный момент второго порядка относительно главной оси) каждой ЕС. Параметр, представляющий собой безразмерный коэффициент формы (SI), использовали для количественного определения удлинения клеток, которое определяется следующим образом:
где А представляет собой площадь клетки, а Р представляет собой периметр клетки. Значение SI варьирует 0 до 1, где 0 представляет собой прямую линию и 1 представляет собой идеальную окружность. Дополнительно, угол ориентации измеряли для количественного определения выравнивания HDMEC по направлению потока, где 0° означает, что главная ось клетки является точно выровненной по направлению потока, а 90° означает, что клетка является выровненной перпендикулярно направлению потока. Исходный код был реализован в программе Matlab (MathWorks, Исманинг, Германия). Для анализа использовали значение SI и угол ориентации клетки для по меньшей мере 200 клеток на изображение.
Создание микроканалов, структурированных посредством фемтосекундной лазерной абляции
Управляемый САМ фемтосекундный лазер (TissueSurgeon; Rowiak, Ганновер, Германия) с длиной волны 1030 нм (энергия импульса = 120 нДж), длительностью импульса 400 фс и частотой повторения импульсов 10 МГц использовался Rowiak для создания микроканалов до 40×40 мкм2 в материале PDMS. Конструкцию канала выбирали для получения наименьших достижимых значений диаметра и для обеспечения возможности непрерывного потока среды через каждый из разветвленных каналов. HDMEC высевали в предварительно структурированные микроканалы в форме из PDMS и окрашивали посредством анализа с кальцеином AM (Life Technologies, Дармштадт, Германия) 1 день спустя после начала культивирования. После этого форму из PDMS помещали в компартмент для тканей МОС. Изображения получали посредством стандартной флуоресцентной микроскопии.
Результаты и обсуждение. Оценка динамических свойств жидкости
МикроР1У успешно использовали в иллюстративных целях для характеристики профилей потока жидкости в различных точках контуров МОС (фиг. 8а). Полная доступность для микроскопирования всех без исключения участков МОС обеспечивает углубленные анализы различных других областей МОС и, в перспективе, разные конструкции МОС. Можно продемонстрировать возможность оптимального анализа посредством микроскопии и режим работы мембран перистальтического микронасоса микрожидкостного контура МОС, заполненного эритроцитами человека, при съемке с нижней точки. Надежный перистальтический микронасос на чипе был интегрирован в микрососудистый контур, способный обеспечивать бесперебойную циркуляцию среды в стерильных условиях в течение недель и месяцев при скорости потока в диапазоне от 7 мкл/мин (наиболее низкая частота) до 70 мкл/мин (наиболее высокая частота). Частоту пульсирующей работы можно увеличивать до 2,4 Гц, что соответствует высокой, но все еще наблюдаемой при физиологических условиях у человека активности сердца 144 удара в минуту. При этой частоте сдвиговое напряжение, измеренное в точках А и В микрососудистого контура, достигает приблизительно 25 дин/см (фиг. 8b), что является наблюдаемым при физиологических условиях сдвиговым напряжением, относящимся к наиболее высоким значениям в диапазоне для микрососудистой системы. Среднее значение скорости увеличивалось практически линейно с частотой работы насоса. Частота работы насоса, используемая в данных экспериментах (0,476 Гц), соответствует менее, чем 30 "ударов сердца" в минуту (приблизительно половина физиологического значения для взрослого в покое) для того, чтобы избежать потери ЕС на протяжении ранних фаз покрытия поверхности. Эта фаза, в некоторой степени, имеет сходство с составной частью процесса заживления ран in vivo. Как проиллюстрировано на фиг. 8а, осциллирующее сдвиговое напряжение - еще одна необходимая физиологическая особенность - может быть реализовано при функционировании МОС благодаря конструкции микронасоса. Форма волны такого колебания в определенном местоположении в микрососудистой системе зависит от частоты работы насоса и конкретной конструкции МОС. Определенные формы волны у человека ассоциируются с предрасположенностью к определенным заболеваниям. Предполагается дальнейшая оценка платформы МОС применительно к исследованию таких патологических процессов в сердечно-сосудистой системе человека.
Источник, выделение и культивирование ЕС
На сегодняшний день большинство исследований воздействия сдвигового напряжения на человеческие ЕС человека в микрожидкостных системах осуществляют с использованием эндотелиальных клеток пупочной вены человека (HUVEC) по причине легкого доступа к большим количествам клеток и их высокой фенотипической пластичности. Предположительно, HDMEC характеризуются по меньшей мере такой же пластичностью фенотипа, но с более высоким потенциалом быстрой in vitro адаптации к изменению локального окружения. Kamm и соавторы, например, достигли успеха при культивировании HDMEC в вертикально расположенных микроканалах и наблюдали морфогенез капилляров на коллагеновых гелях в боковом направлении. В отличие от всех других органов организма, кожа у позвоночных должна быстро адаптироваться к изменяющимся значениям внешней температуры посредством немедленного сужения или расширения кровеносных сосудов. Более того, кожа хищных животных является органом с наиболее выраженной подверженностью частым повреждениям по причине их агрессивного образа жизни. Эти два фактора, взятые вместе с продолжительностью жизни человека, могли привести к выбору HDMEC по причине не имеющей аналогов пластичности их фенотипа и уникального потенциала в отношении неоангиогенеза. Оба фактора имеют наибольшую важность для создания функционального in vitro эквивалента сосудистой системы человека. Способность к неоангиогенезу, в частности, является необходимой для создания второй части сосудистой системы человека - капиллярной сети эквивалентов органов - в МОС. Новейшие исследования молекулярных механизмов ангиогенеза подтверждают важную роль локального окружения, в том числе сдвигового напряжения. Были описаны различные методики для выделения человеческих ЕС из различных тканей. Применялось выделение ЕС при помощи магнитных шариков после расщепления ткани, с использованием MicroBeads с CD31 (РЕСАМ-1), поскольку он конститутивно экспрессируется на поверхности фактически всех типов ЕС и не присутствует на клетках какого-либо другого типа, за исключением популяции лейкоцитов. В частности, он не экспрессируется на дермальных фибробластах и клетках гладкой мускулатуры. Анализировали морфологию и наличие ряда маркеров, специфичных для эндотелиальных клеток, для подтверждения эндотелиального происхождения. Выделенные HDMEC характеризовались морфологией типа "булыжной мостовой" при фазово-контрастной микроскопии и были положительными по специфичному для эндотелиальных клеток маркеру CD31, VE-кадгерину и фактору фон Виллебранда (vWF). Окрашивание на предмет 5 В5, маркера, специфичного для фибробластов, и a-актина гладкой мускулатуры, маркера, специфичного для клеток гладкой мускулатуры, продемонстрировало отсутствие роста других типов клеток. Кроме того, HDMEC демонстрировали поглощение ac-LDL, меченного Alexa594, после воздействия в течение 4 ч. Смесь дермальных фибробластов и клеток гладкой мускулатуры служила в качестве контроля для всех окрашиваний (данные не показаны). HDMEC можно культивировать до восьми пассажей без значительных изменений морфологии и экспрессии маркеров. Полученные авторами данные указывают на то, что данный способ является надежным и воспроизводимым путем выделения CD-31 - положительных HDMEC из крайней плоти человека. Было рассчитано, что среднее количество HDMEC, полностью покрывающих два микрососудистых контура МОС находилось в пределах 2*105 клеток. В среднем, 1*107 первичных HDMEC после сортировки можно было получить из одного образца крайней плоти человека. Коэффициент увеличения количества клеток ~3000 сохранялся от исходного посева до 7-8 пассажа культивирования HDMEC, таким образом, обеспечивалась возможность получения 3*1010 клеток из одного образца крайней плоти. Теоретически, это соответствовало МОС с 5000 загруженных клеток (два контура на МОС). Оптимизация получения и размножения может быть предусмотрена для дополнительного улучшения выхода HDMEC.
Создание стабильных микрососудистых контуров в МОС
В пилотном сравнительном исследовании прикрепления ЕС к покрытым фибронектином и обработанным воздушной плазмой поверхностям из PDMS была выявлена по меньшей мере одинаковая адгезия HDMEC к PDMS в статических культурах. Кроме того, обработка плазмой длительное время считалась подходящей методикой для увеличения гидрофильности микроканалов из PDMS. Следовательно, обработку воздушной плазмой, в конечном итоге, выбрали для активации поверхности при изготовлении МОС. Фибронектин широко используется в качестве материала покрытия для прикрепления ЕС и их культивирования в микрожидкостных устройствах на основе PDMS. Несмотря на простоту работы в лабораторном масштабе, далее процедура покрытия фибронектином может приводить к снижению рабочей скорости и стерильности в крупном промышленном масштабе при высокой производительности. Обработка PDMS воздушной плазмой, как предложено авторами, является воспроизводимым, быстрым и масштабируемым способом получения микроустройств на основе PDMS для эффективного прикрепления ЕС.
Затем получали микрососудистый контур, содержащий перистальтический микронасос, два компартмента для дальнейшего культивирования эквивалентов органов и соединяющие микроканалы, полностью покрытый функциональным монослоем HDMEC, с пульсирующим потоком среды в течение 4 дней культивирования. Ранее полное покрытие контура линией человеческих ЕС человека было продемонстрировано в другом месте. В данном документе основное внимание уделяется быстрому созданию такой миниатюризированной сердечно-сосудистой системы человека с использованием первичных HDMEC. Кроме того, осуществляли ежедневное отслеживание метаболической активности ЕС. Повышенную метаболическую активность в течение первых дней после прикрепления и покрытия поверхности можно объяснить повышенной подвижностью и пролиферацией клеток. Процент потерь в системе 50% на ранних стадиях экспериментов, в первую очередь обусловленный загрязнением, в настоящее время был эффективно снижен до приблизительно 20% в ходе обычного использования МОС в лаборатории авторов. Системы общего контроля качества, установленные во всех без исключения промышленных лабораториях для тестирования in vitro, могут полностью устранить этот процент потерь в "исследовательской лаборатории".
Адгезия ЕС к стенкам канала сохранялась и они оставались жизнеспособными, что наблюдали при окрашивании красно-оранжевым кальцеином AM. Кроме того, клетки тестировали в отношении поглощения Alexa594-ac-LDL. Поскольку дальнейшего изменения морфологии эндотелиальных клеток 4 дня спустя от начала культивирования не наблюдали, эксперименты прекращали для проведения анализа. Углубленные анализы с применением иммунофлуоресценции плотного слоя ЕС в день 4 продемонстрировали явно выраженную жизнеспособность и функциональность сосудов. HDMEC, образующие микрососудистый контур, были положительными по CD31, vWF и VE-кадгерину. Кроме того, HDMEC были способны покрыть все стенки каналов с образованием непроницаемого для жидкости слоя. Такие стабильные микрососудистые контуры, с одной стороны, могут выступать в качестве биологических мембран, предотвращающих перенос молекул в окружающий слой PDMS, описанный незадолго до этого. С другой стороны, они могут служить в качестве гемосовместимых сосудистых сетей для циркуляции цельной крови, предотвращая свертывание крови.
Влияние сдвигового напряжения
При воздействии ламинарного сдвигового напряжения ЕС и их микрофиламенты выравниваются по направлению потока. In vivo ЕС в различных местоположениях подвергаются воздействию различных типов потока, например, ламинарного, пульсирующего и турбулентного; причем последний, например, как было описано, приводит к увеличению скорости обновления клеточной популяции. Удлинение, индуцированное наблюдаемым при физиологических условиях сдвиговым напряжением, и выравнивание по направлению потока подтверждалось при культивировании в МОС с построением графика для значений SI и угла ориентации HDMEC в микрососудистых контурах, полученных при пульсирующем потоке (Q=40,56 мкл/мин, r=5,17 дин/см2), по отношению к полученным в условиях статического культивирования. Изменение распределения филаментного актина (F-актина) наблюдали при переходе от статического к динамическому культивированию. ЕС при статических условиях являются полигональными, и F-актин организован в виде плотного диска на периферии клетки; в то же время при сдвиговом напряжении приблизительно 5 дин/см F-актин образует пучки стресс-фибрилл. Значение SI и угол ориентации значительно отличались при статическом и динамическом культивировании ЕС в МОС и находились в диапазоне предыдущих данных для HDMEC в микрожидкостных устройствах.
В конечном итоге, наблюдали в равной степени превосходную жизнеспособность клеток в точках анализа при ограниченном количестве ориентировочных длительных экспериментов с использованием микрососудистых МОС в течение 14 дней (n=4) культивирования и в первом одиночном микрососудистом МОС в течение 32 дней (данные не показаны).
Вывод
Предположительно, циркуляция крови через выстланные ЕС микроконтуры, соединяющие эквиваленты органов друг с другом в физиологическом порядке, является первым и основным необходимым требованием для полной имитации гомеостаза организма человека в микромасштабе. Таким образом, авторы в данном случае успешно применяли методики легкой литографии, формования копий и двухфотонной лазерной абляции для создания не зависящей от термостата микрососудистой системы циркуляции, имитирующей транспортную функцию сердечно-сосудистой системы человека в микромасштабе. В двухслойном чипе из стекла и PDMS размещен участок стандартного стекла для микроскопирования, причем высота канала равна 100 мкм и общая высота равна 3 мм. Две отдельные цилиндрические вставки для культивирования тканей, причем каждая имеет участок со стандартной полостью 96-луночного планшета, расположены в микрососудистом контуре. Была разработана надежная методика с применением осциллирующего сдвигового напряжения в течение 4 дней для покрытия всех поверхностей системы, контактирующих с жидкостью, функциональным плотно сомкнутым слоем HDMEC. В отличие от роста HDMEC в вертикальной плоскости, описанного в литературе, покрытие всей данной микрососудистой системы человеческими ЕС впервые обеспечивает биологическую гемосовместимость такой микрососудистой системы. Схема чипа приводит к уменьшению объема циркулирующей жидкости в микрососудистой транспортной системе вплоть до 10 мкл, что по меньшей мере на два порядка меньше величины циркулирующего объема, применяемого в любых системах, работающих с внешними насосами и резервуарами. Что более важно, вставки для культивирования тканей, причем максимальный объем каждой из них равен 300 мкл, будут обеспечивать возможность точного регулирования физиологических соотношений жидкости и ткани, если отдельные эквиваленты органов получают на следующей стадии развития. Методика изготовления является удобной и универсальной, и при этом изменения конструкции могут быть реализованы при значениях времени цикла разработки от конструирования до устройства всего лишь 2-3 месяца. Выравнивание и удлинение ЕС по направлению потока, всесторонне продемонстрированное in vitro, наблюдали с отличной детализацией посредством цейтраферной видеомикроскопии. Микрожидкостные каналы, имеющие другие конструкции, с одинаковой эффективностью покрывались HDMEC в лабораториях авторов при помощи описанной методики. Были получены первые данные относительно того, что после создания микрососудистой системы циркуляции, она, в конечном итоге, характеризовалась сроком службы по меньшей мере 32 дня.
СПИСОК ССЫЛОЧНЫХ ПОЗИЦИЙ
1 устройство в виде мультиорганного чипа
2 слой приводов
3 базовый слой
4 антральный слой
5 слой, удерживающий органы
6 слой органов
10 привод, создающий давление (сердце)
11 перистальтический привод
12 привод, обеспечивающий поток воздуха
13 приводы
14 привод, обеспечивающий сужение артериол
16 отверстие
17 привод, обеспечивающий сжатие кости
18 резервуар для питания
19 резервуар для экскрементов
20 резервуар для мочи
21 эквивалент тонкого кишечника
22 эквивалент легкого
23 эквивалент селезенки
24 эквивалент поджелудочной
25 эквивалент печени
26 эквивалент почки
27 эквивалент костного мозга
28 эквивалент жировой ткани
29 эквивалент головного мозга
30 эквивалент яичек
31 эквивалент кожи
32 электрический датчик
33 датчик
34 автономная система циркуляции
Реферат
Изобретение относится к области биохимии. Предложен мультиорганный чип для культивирования органов и/или органоидов. Чип содержит последовательно базовый слой, слой органов, слой удерживания органов, антральный слой и слой приводов. Слой органов содержит множество отдельных эквивалентов органов, каждый эквивалент органа содержит одну или несколько секций роста органов, каждая из секций роста содержит полость для размещения органоида органа, микровход и микровыход для жидкостного соединения полости и автономной системы циркуляции. Антральный слой содержит множество полостей и трубок в жидкостном соединении с эквивалентами органов или секциями роста органов. Слой для удерживания органов изолирует и/или стабилизирует слой органов для поддерживания жидкостного соединения эквивалентов органов с антральным слоем. Слой приводов содержит множество приводов для регулировки силы давления, прикладываемой к выбранному эквиваленту органа, автономной системе циркуляции и/или ее части. Изобретение обеспечивает имитацию основных функций организма, необходимых для гомеостаза органа и/или организма. 14 з.п. ф-лы, 9 ил., 2 табл., 2 пр.

Комментарии