Способ получени 4-аминодифениламина - RU2224741C2
Код документа: RU2224741C2
Описание
Область техники
Настоящее изобретение относится к способу получения 4-аминодифениламина (4-АДФА) через получение промежуточного соединения 4-нитродифениламина и/или 4-нитрозодифениламина, и/или их солей, в котором анилин взаимодействует с нитробензолом в жидкой среде, с образованием предшественников 4-АДФА, т.е. 4-нитрозодифениламин (4-NОДФА), 4-нитродифениламин (4-NO2ДФА) и/или их солей, которые после гидрирования дают 4-АДФА.
Предпосылки изобретения
4-Аминодифениламин (4-АДФА) широко применяют в качестве промежуточного продукта при получении алкилированных производных, проявляющих прекрасные свойства при использовании в качестве антиозонантов, антиоксидантов и стабилизаторов.
Известные способы промышленного получения 4-АДФА начинают с гидрирования промежуточных соединений, т.е. 4-NОДФА или 4-NO2ДФА. Однако получение данных промежуточных соединений, включающее несколько технологически сложных стадий, сопровождается получением ряда побочных продуктов, органических и неорганических отходов, подлежащих уничтожению, что является одной из самых серьезных проблем данного способа получения.
Экологически и экономически предпочтительные альтернативные способы получения промежуточных соединений 4-АДФА включают прямое взаимодействие анилина и нитробензола. Такая реакция инициируется основаниями, образующими в результате реакции анион анилида, который впоследствии замещает водород в нитробензоле по механизму реакции нуклеофильного присоединения (A. Wohl et al., Ber. 34, 2442-2450, 1901; и A.Wohl, Ber. 36, 4135-4138, 1903), при этом при использовании в качестве основания твердого гидроксида калия получают главным образом феназин и оксид феназина, при использовании гидроксида натрия получают также 4-NОДФА.
В пятидесятые годы многие ученые исследовали и описали механизм нуклеофильной реакции Wohl-Aue анилина и его производных с ароматическими нитросоединениями под воздействием оснований (NaOH, КОН, даже NaNH2) в среде бензола, толуола и ксилола с получением производных феназина. Кроме них, в это же время были также выделены и описаны другие продукты реакции, такие как 4-нитрозодифениламин, 4-нитрозамещенные дифениламины, азобензолы, азоксибензолы (E.I. Abramova et al., Zhur.Obshcnei Khim. 22, 502-509, 1953; S.B. Serebryanyi, Uspekhi Khimii 24, 313-345, 1955; S.B. Serebryanyi, Ukrain. Khim. Zhur. 21, 350-360, 1955; V.P. Chernetskii et al., Zhur. Obshchei Khim. 25, 2161-2170, 1955) .
Известно (N.R. Ayyangar et al., Tetrahedron Letters 31, 3217-3220, 1990), что 4-NОДФА и 4-NO2ДФА получают в результате реакции нитробензола с ацетанилидом в присутствии диполярного апротонного растворителя, диметилсульфоксида (ДМСО) под действием гидроксида натрия и карбоната калия, а также (A.A. Frimer et al., J.Org.Chem. 48, 1700-1705, 1983), что 4-NO2ДФА получают с выходом до 24% в результате реакции анилина с нитробензолом в присутствии оснований, применяя в данном случае бутилат или перекись калия в среде бензола и в присутствии краун-эфира.
Подобным образом (D.J. Stuehr et al., J.Org.Chem. 50, 694-696, 1985) в результате реакции анилина и N-метиланилина в ДМСО с перекисью калия вместе с 18-краун-6-эфиром, а также третичным бутилатом калия, в качестве реакционного продукта была получена смесь 4-NОДФА, 4-NО2ДФА, 4-АДФА, азобензола, 4-фенилазодифениламина и фенилформамида (выход не указан).
Известно получение 4-АДФА окислением анилина феррицианидом в сильнощелочной среде (патент США 4760186 и патент Великобритании 1440767), в котором осуществляют соединение “голова-хвост” двух анилиновых молекул.
Патент США 5574187 описывает получение 4-АДФА замещением фенилгидроксиламина анилином в присутствии кислотного катализатора. Выход продукта является средним (макс. 51,2%).
Сущность способа, описанного в следующем патенте США 5420354 заключается в реакции нитробензола с анилином в присутствии водорода, катализатора гидрирования, кислотного катализатора и ингибитора гидрирования, непосредственно приводящей к получению 4-АДФА, но со сравнительно низким выходом (макс. 12%) и низкой селективностью реакции подобно другим вышеупомянутым методикам.
В заявке ЕР 566783, на имя AKZO N.V., описан способ получения 4-нитродифениламина реакцией нитробензола с анилином в среде полярного апротонного растворителя, в частности диметилсульфоксида и третичного бутанола, в сильнощелочной реакционной системе, в которой гидроксиды щелочных и щелочно-земельных металлов, алкоксиды, амиды и гидриды щелочных металлов используют в качестве оснований, наконец, в присутствии катализатора фазового переноса, такого как кислый сернокислый тетрабутиламмоний. Был достигнут сравнительно высокий выход, однако селективность реакции недостаточна. Поэтому возникает необходимость отделения продукта (NО2 ДФА) от побочных продуктов кристаллизацией. Более того, в процессе выделения продуктов получают соли, таким образом дополнительно увеличивая стоимость их обработки. Также возникает вопрос о экономичном рециркулировании оснований и смесей растворителя обратно в процесс.
Другой способ получения 4-АДФА, в котором не используют галогены, включает реакцию анилина с 4-фенилазодифениламином в присутствии сильных оснований, таких как третичный бутилат калия с краун-эфирами или с четвертичными гидроксидами аммония (патенты США 5382691, 5633407, 5618979 и 5451702). Последующее превращение 4-FAДФА в 4-АДФА может быть осуществлено либо каталитическим гидрированием в соответствии с патентом США 5451702, либо реакцией нуклеофильного замещения 4-FАДФА амином в присутствии сильных оснований (патенты США 5382691, 5633407 и 5618979). 4-АДФА может быть также получен (см. патенты США 5618979 и 5633407, а также работу М.К. Stern et al., J.Org.Chem. 59, 5627-5632, 1994) в одну стадию непосредственно реакцией азобензола, в частности азоксибензола, с анилином в присутствии сильнощелочных катализаторов. Однако во всех вышеуказанных методиках исходным сырьем является азобензол, который представляет собой менее труднодоступное сырье и должен быть получен заранее. Кроме того, возникает большое количество отходов, которые должны быть обязательно обработаны или уничтожены.
В ряде патентов на имя компании Monsanto (патенты США 5117063, 5453451, 5608111, 5623088) описан способ получения промежуточных продуктов 4-АДТА прямой реакцией анилина с нитробензолом в апротонном растворителе с контролируемым количеством протонного растворителя под воздействием оснований, включающих щелочные гидроксиды, алкоголяты, гидриды и четвертичные гидроксиды аммония с алкил-, арил- и аралкилзаместителями, а также алкилзамещенные гидроксиды диаммония. Тем не менее, высокий выход реакционных продуктов и высокая селективность могут быть достигнуты только при использовании четвертичных гидроксидов аммония. Механизм реакции описан в (м.к. Stern et al., J. Am. Chem. Soc. 114, 9237-9238, 1992 и New J. Chem. 20, 259-268, 1996).
В результате сравнения соответствующих оснований, описанных в вышеупомянутых патентах и работах, применяемых в реакции анилина с нитробензолом, становится понятно, что щелочные гидроксиды обеспечивают низкий выход промежуточных соединений 4-АДФА. Выход существенно увеличивается при использовании щелочных гидроксидов вместе с краун-эфирами. Тем не менее, принимая во внимание их технически сложное получение, их промышленное применение не очень возможно. Реакция в присутствии бутилата калия и ДМСО также дает низкую селективность. В противоположность этому, при использовании в реакции в качестве оснований четвертичных гидроксидов аммония достигаются как высокая селективность, так и высокий выход. Тем не менее, их недостатком является низкая стабильность, они разлагаются в концентрированном виде, поэтому они должны храниться только в разбавленных водных растворах. Другим недостатком является также их низкая термостойкость, они легко разлагаются при высоких температурах (А. Соре et al., Оrg. Reactions, Vol. XI, р. 317, 1960; Hellman H., Angew. Chem. 65, 475-485, 1953; F. Moller, Methoden der Organischen Chemie, Houben-Weyl XI/1, p. 961-967, 262, 1957, and. XI/2, p. 623, 631-640, 1958).
Вследствие действия четвертичных гидроксидов аммония на первичные амины также имеет место их легкое алкилирование. Например, гидроксид тетраметиламмония (ТМАН) взаимодействует с анилином, давая N-метиланилин в количестве, зависящем от условий реакции (патент США 5687691). Полученный N-метиланилин может быть с трудом отделен от анилина, но это должно быть сделано перед рециркулированием анилина обратно в дальнейший реакционный цикл, чтобы избежать образования нежелательных примесей метилированных производных 4-АДФА.
Недостатком четвертичных гидроокисей аммония per se также является высокая стоимость. Поэтому в каждом цикле возникает необходимость выделения и рециркуляции четвертичных аммониевых оснований для следующего производственного цикла, что не может быть сделано без снижения их активности.
Целью настоящего изобретения является разработка способа, использующего преимущества известных способов и устраняющего их недостатки.
Описание изобретения
Целью настоящего изобретения является способ получения 4-аминодифениламина через получение промежуточного соединения 4-нитродифениламина и/или 4-нитрозодифениламина, и/или их солей взаимодействием анилина и нитробензола в жидкой среде при температуре от 50 до 130°С, атмосферном или пониженном давлении, атмосфере инертного газа или в присутствии кислорода воздуха с последующим гидрированием промежуточного соединения 4-нитродифениламина и/или нитрозодифениламина и побочных продуктов, и выделением 4-аминодифениламина и побочных продуктов и рециклом неконвертированного сырья. Сущность данного изобретения заключается в том, что реакцию анилина с нитробензолом осуществляют в реакционной системе, включающей раствор цвиттерионной соли с гидроксидами общей формулы
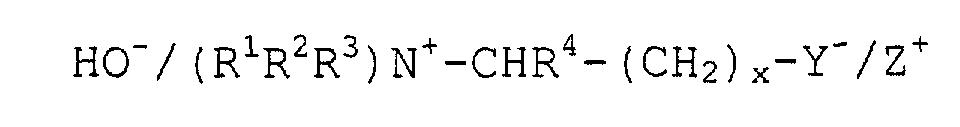
где R1 и R2 обозначают радикал от метила до додецила,
R3 обозначает метил, этил, фенил, бензил,
R4 обозначает водород или метил,
х означает целое число от 0 до 5,
Y- означает CO, SO
Z+ обозначает катион щелочного металла Na, К, Cs или четырехзамещенный катион четвертичного аммония, такого как тетраметиламмоний, либо их взаимные сочетания, в которых количество как соли цвиттериона, так и гидроксида находится, по меньшей мере, в эквимолярном соотношении с количеством нитробензола, прореагировавшего в реакции, с образованием 4-нитрозодифениламина и/или 4-нитродифениламина, которые после гидрирования дают 4-АДФА, и после реакции рециркулируют, по меньшей мере, половину реакционной системы.
Установлено, что предпочтительно проводить
реакцию в присутствии раствора соли цвиттериона с гидроксидами общей формулы, где R1, R2 и R3 представляют метил, R4 представляет водород, х представляет О,
Y- представляет CO
Реакционная среда может быть получена отдельно и/или она может быть получена in situ в реакционной системе из исходного сырья. Жидкую среду для реакции анилина с нитробензолом получают смешиванием с водой и/или, по меньшей мере, одним органическим соединением, таким как анилин, пиридин, толуол, ксилол, циклогексан и алифатические спирты, имеющие в молекуле от 1 до 4 атомов углерода.
Преимущество данного способа, включающего реакцию анилина с нитробензолом, главным образом заключается в использовании реакционной системы в соответствии с настоящим изобретением. Она технически более легкодоступна и более устойчива, чем сами четвертичные гидроксиды аммония и алкилдиаммония, в то время как реакция анилина с нитробензолом является достаточно селективной для получения промежуточных соединений 4-АДФА (с селективностью, составляющей, по меньшей мере, 50% 4-нитродифениламина и нитрозодифениламина), при этом выход получаемого продукта является высоким.
Одним из преимуществ способа в соответствии с настоящим изобретением является также технически доступный широкий диапазон как биполярных, так и многополярных органических соединений, содержащих в молекуле, по меньшей мере, один катион азота, а также их стабильность, не только термальная, но и стабильность при гидрировании, и тот факт, что реакционная система может быть регенерирована.
Из литературы (М. Rabinowitz et al., Angew.Chem. 98, 958-968, 1986) известно, что многие органические реакции, инициируемые гидроксидами, протекают в условиях системы КФП/ОН-, т.е. в присутствии катализаторов фазового переноса (КФП). Обычно применяемые КФП представляют собой четвертичные ионы аммония. Также известно применение цвиттерионных солей в некоторых реакциях в качестве катализаторов фазового переноса, однако в данном случае предполагаемый механизм отличен, поскольку из биполярной внутренней соли цвиттериона и гидроксида образуется бис-ионная пара (Starks, G. et al., Phase Transfer Catalysts Principles and Technique, N.Y. Acad. Press 1978, p. 67, 127, 365; Yu. Sh. Goldberg et al., Dokl. Akad. Nauk SSSR 294, 1387-1391, 1987; Yu. Sh. Goldberg et al., Zhur. Org. Khim., 23, 1561-1563, 1987; Yu.Sh. Goldberg et al., Tetrahedron 46, 1911-1922, 1990).
Под цвиттерионами подразумеваются соединения, содержащие в своих молекулах, помимо карбоксильной группы, пералкилированную аминогруппу, при этом данные группы взаимно образуют внутренние соли. Такие соединения не содержат мигрирующего водорода, а содержат группу четвертичного аммония.
В способах, известных из литературы, цвиттерионные соли применяют в качестве катализаторов фазового переноса в каталитическом количестве, а именно в количестве от 1 до 5 мол.%. В настоящее время установлено, что при использовании способа получения промежуточных соединений 4-АДФА в соответствии с настоящим изобретением может быть достигнута полная конверсия нитробензола с анилином при проведении реакции с, по меньшей мере, эквимолярным количеством цвиттерионной соли и гидроксида относительно количества нитробензола, присутствующего в реакции, что указывает на иной ход реакции.
Цвиттерионные соли, также известные как бетаины или, в частности, сульфобетаины, выпускаются промышленностью в виде внутримолекулярных солей или гидратированных форм, либо могут быть получены в соответствии со способами, известными из литературы (Methoden der Organischen Chemie (Houben-Weyl), XI/2, p. 627-650, 1958; Ullmans Enzyklopadie der Technischen Chemie, Vol. 2, p. 497-498, Verlag Chemie 1982; Goldberg Yu. Sh. et al., Tetrahedron 46, 1911-1922, 1990; Goldberg Yu. Sh. et al., Dokl. Akad. Nauk SSSR 297, 1387-1391, 1987; Willstatter R., Ber., 35, 584-620, 1907, патент США 4672077 и Бельгийский патент 903785).
Реакционная система для конденсации анилина с нитробензолом может быть получена следующим образом: получают раствор гидроксида в протонном растворителе (в воде, метаноле или 2-пропаноле), добавляют к нему кристаллическую цвиттерионную соль, возможно, в виде гидрата, а затем вводят соответствующий растворитель, например анилин. Можно поступать также следующим образом: анилин добавляют к раствору гидроксида в протонном растворителе и к такой смеси добавляют цвиттерионную соль. При получении реакционной системы, состоящей из смеси гидроксидов, можно также поступать следующим образом: к разбавленному водному раствору гидроксида четвертичного аммония добавляют кристаллическую цвиттерионную соль и после ее растворения твердый гидроксид щелочного металла, и наконец добавляют анилин. Также может быть получен раствор метилата растворением щелочного металла, его оксида или гидроксида в метаноле и добавлением раствора цвиттерионной соли в анилине.
Взаимное соотношение реакционных компонентов может изменяться в широком диапазоне таким образом, чтобы лимитирующим компонентом была либо цвиттерионная соль, или нитробензол, или анилин. Их взаимное соотношение может быть выбрано таким образом, чтобы реакция проходила в оптимальных условиях.
Реакция может быть осуществлена в широком диапазоне температур от 50 до 130°С.
Реакция может быть проведена в атмосфере инертного газа или в аэробных условиях, при атмосферном или пониженном давлении, в то время как выход, конверсия и селективность реакции зависят от условий реакции.
В реакции также могут быть использованы вспомогательные протонные и апротонные растворители, такие как третичный бутиловый спирт, ДМСО, диметиловый эфир диэтиленгликоля, монометиловый эфир этиленгликоля, толуол, ксилол, циклогексан и т.д.
Основными продуктами, получаемыми в результате реакции, являются 4-NOДФА и 4-NO2ДФА, присутствующие в реакционной смеси в свободном виде или в виде солей. Реакционная смесь, кроме этих соединений и реакционной воды, может включать такие вещества, как 4-фенилазодифениламин, азобензол, азоксибензол, 2-нитродифениламин, феназин или окись феназина. Это зависит от молярного соотношения реакционных компонентов системы, а также от типа цвиттерионов, их солей, протонного растворителя, возможно, от вспомогательного растворителя и их концентрации в реакционной смеси, температуры, продолжительности реакции и степени конверсии нитробензола. Данные факты хорошо известны специалистам в данной области.
4-АДФА получают из смеси 4-NOДФA, 4-NO2ДФА и 4-фенил-азодифениламина или их солей известными способами каталитического гидрирования после разбавления реакционной смеси растворителем.
Примеры вариантов осуществления изобретения
Следующие примеры иллюстрируют, но никоим образом не ограничивают объем формулы изобретения.
Пример 1
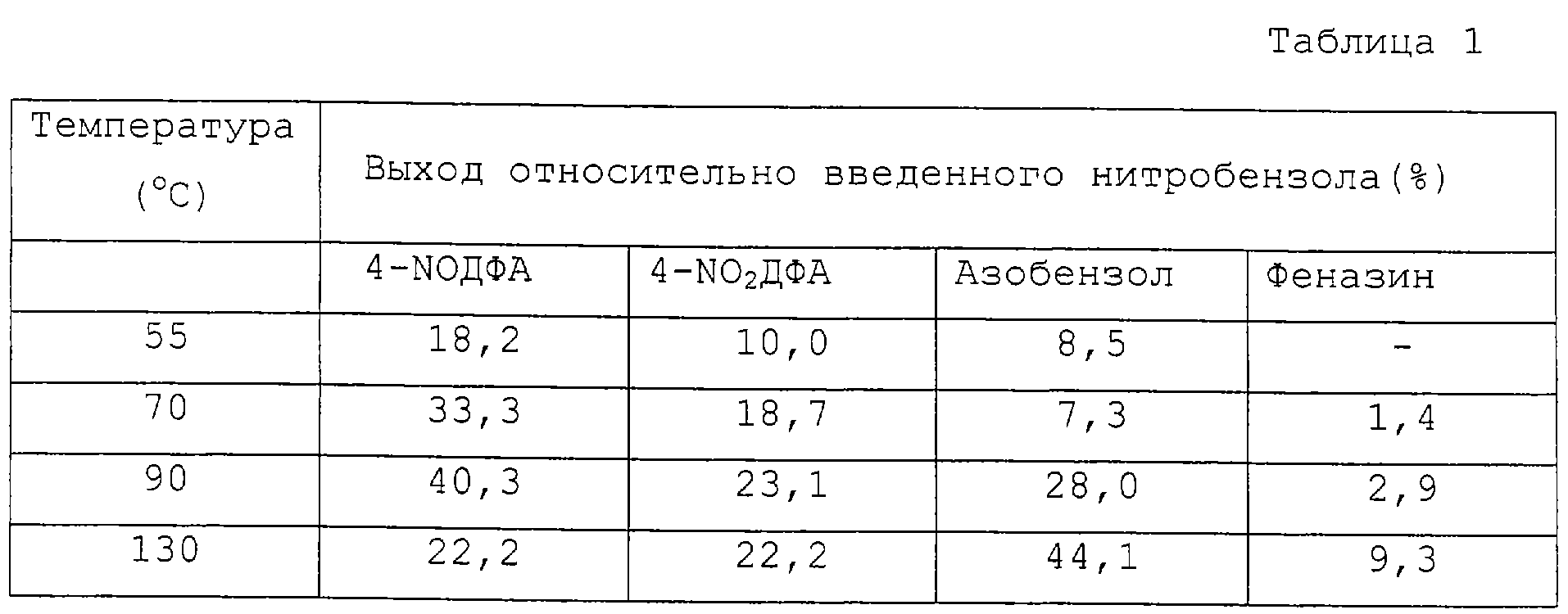
Результаты реакции анилина с нитробензолом в анаэробных условиях, когда реакционная система представляет собой раствор бетаина и гидроксида калия в метаноле при различных температурах в интервале от 55 до 130°С.
Реакцию проводят в аппаратах, состоящих из 100-мл 3-горлой колбы, оборудованной магнитной мешалкой, термометром, капельной воронкой и насадкой для азеотропной перегонки. Аппараты соединены с водоструйным насосом.
3, 5 г (84,02%) гидроксида калия (0,052 моля) растворяют в 6 г метанола. Добавляют 6,1 г бетаина (0,052 моля), и после нагревания до 50°С добавляют 37,0 г анилина (0,49 молей). Воздух в аппарате заменяют азотом и после нагревания до реакционной температуры вначале отгоняют метанол при давлении 5,2 кРа, а затем при интенсивном перемешивании в течение 1,5 часов порциями добавляют нитробензол, в целом 6, 4 г (0, 052 моля). Реакционную смесь оставляют взаимодействовать в течение еще 3 часов, затем ее охлаждают, разбавляют метанолом и анализируют с использованием высокоэффективной жидкостной хроматографии. Выход реакционных компонентов определяют относительно количества нитробензола, вводимого в реакцию. Другие реакционные условия и полученные результаты представлены в таблице 1.
Пример 2
Результаты взаимодействия анилина и нитробензола при использовании гидроксида натрия, калия и цезия в реакционной системе, содержащей гидроксид бетаина.
Реакционные системы получают взаимодействием моногидрата бетаина со щелочными гидроксидами. В соответствии с методикой, описанной в примере 1, проводят 3 идентичные реакции при температуре 70°С с различными катионами щелочных металлов, указанных в таблице 2.

Пример 3
Результаты взаимодействия анилина и нитробензола с реакционной системой бетаингидроксид натрия в метаноле в аэробных условиях.
К раствору катализатора, включающему 0,066 моль бетаина и 0,066 моль гидроксида натрия в 15 г метанола, добавляют 0,4 моля анилина. После нагревания реакционной смеси до 70°С к реакционной смеси порциями добавляют нитробензол (0,052 моль) в течение 1,5 часов. Молярное соотношение анилин/нитробензол составляет 7,69:1. Метанол и реакционную воду постепенно удаляют из реакционной смеси при пониженном давлении. По завершении порционного добавления нитробензола смесь перемешивают в течение еще 3,5 часов. После разбавления метанолом смесь анализируют, определяя выход продуктов реакции, выражаемый в % относительно нитробензола, загруженного в реакционную смесь: 4-NОДФА 26,3%; 4- NO2ДФА 16,8%; 4-FАДФА 5,1%; азобензол 40,8%.
Пример 4
Модифицированная методика, в которой все компоненты реакции вводят в реакцию вначале.
В колбе, в 5,0 мл воды растворяют 2,66 г (83,0%) гидроксида калия и добавляют 5,31 г гидрата бетаина, 24,1 г анилина и 4,83 г нитробензола. Молярное соотношение анилин/нитробензол составляет 6,596:1. Реакционную смесь интенсивно перемешивают при 80°С в атмосфере азота в течение 5 часов. В течение этого периода времени давление в аппарате постепенно понижают с 53 кРа до 2,6 кРа. Наконец реакционную смесь растворяют в метаноле и анализируют с помощью высокоэффективной жидкостной хроматографии. Конверсия нитробензола составляла 75,6%, а выход (в %) индивидуальных продуктов, вычисленный относительно вводимого нитробензола, составляет: 4-NOДФА 35,7; 4-NO2ДФА 17,8%; 4-FАДФА 0,12%; азобензол 10,9%; феназин 1,25%.
Пример 5
Взаимодействие анилина с избытком нитробензола (в качестве растворителя) в присутствии реакционной системы бетаин-гидроксид калия в анаэробных условиях.
К раствору 3,38 г (83%) гидроксида калия в 3,0 мл воды добавляют 6,85 г гидрата бетаина и 26,8 г нитробензола. При температуре 80°С и давлении 20 кРа к реакционной смеси в атмосфере азота порциями добавляют 4,9 г анилина в течение 1,5 часов. По завершении порционного добавления нитробензола реакционную смесь интенсивно перемешивают в течение еще 6 часов. После охлаждения реакционную смесь растворяют в метаноле. Получают следующий выход, вычисленный относительно нитробензола, вводимого в реакцию: 4-NОДФА 1,5%; 4- NO2ДФА 0,2%; азобензол 2,5%.
Пример 6
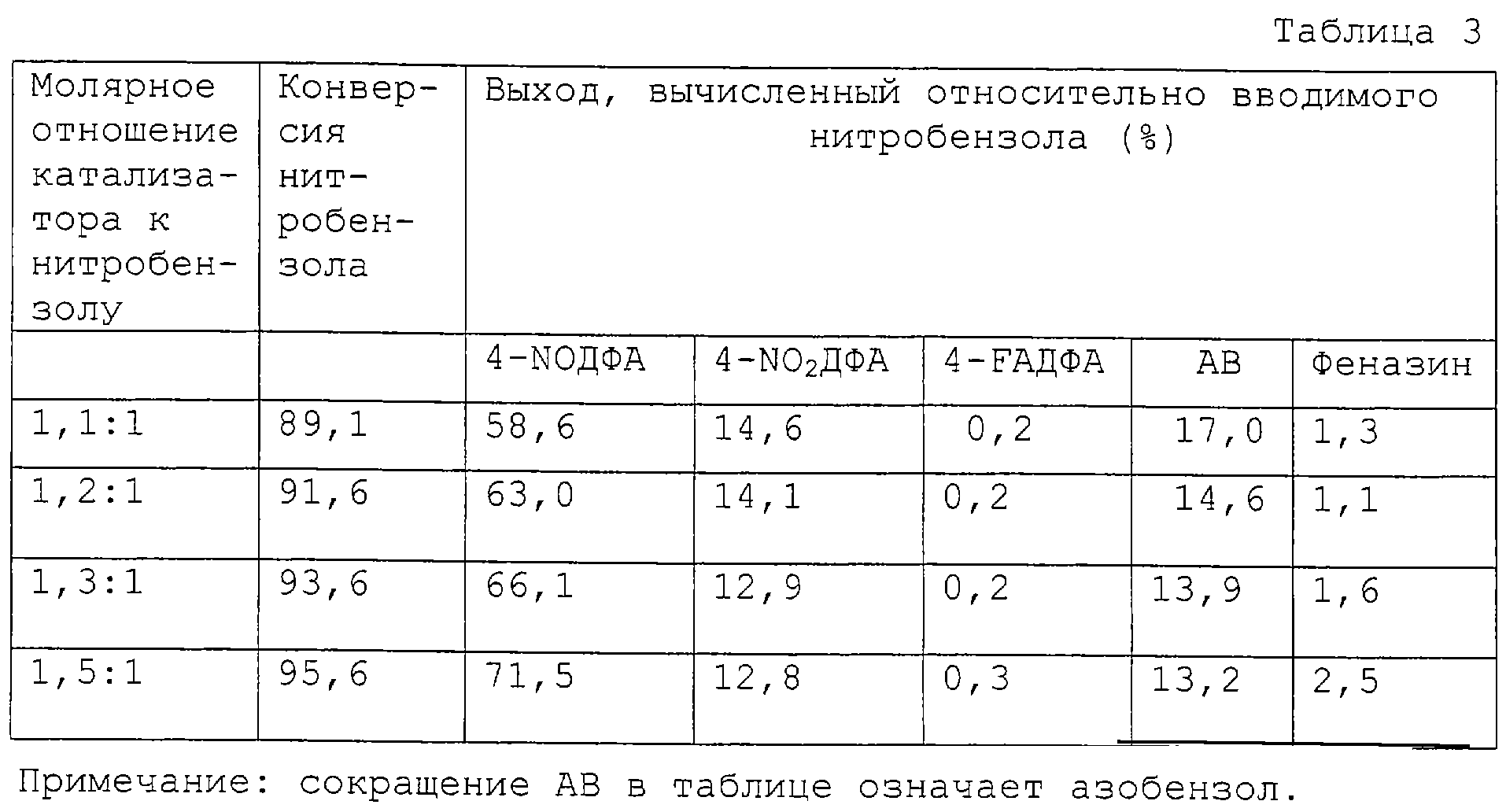
Действие молярного соотношения бетаина-гидроксида калия и нитробензола на ход реакции.
Применяя методику, описанную в примере 1, осуществляют взаимодействие анилина с нитробензолом при молярном соотношении 7:1 с тем отличием, что молярное соотношение реакционной системы к нитробензолу изменяется от 1:1 до 1,5:1. Бетаин гидрат и гидроокись калия образуют реакционную систему с молярным соотношением 1:1 в растворе метанола. Результаты экспериментов, приведенные в таблице 3, показывают действие повышения количества реакционной системы на выход реакции и конверсию нитробензола.
Пример 7
Взаимодействие анилина с нитробензолом в условиях, при которых воду (введенную в качестве растворителя вместе с реакционной водой) непрерывно удаляют из реакционной среды, в частности, дистилляцией в виде азеотропа вода-анилин, постепенно уменьшая вакуум в системе.
114,0 г (0,131 моль) 20% раствора эквимолярного количества бетаина и гидроокиси калия помещают в 500-мл трехгорлую колбу, и после нагревания до 50°С воду отгоняют в вакууме, до тех пор пока в колбе не останется кристаллическая суспензия.
Добавляют 72,3 г анилина (0,776 моль), а затем к реакционной смеси в течение 1,5 часов при 80°С в атмосфере азота при интенсивном перемешивании порциями добавляют 13,5 г (0,1097 моль) нитробензола. В ходе добавления анилина в колбе поддерживают давление 26 кРа, подвергая дистилляции азеотроп вода-анилин. Во время последней стадии реакции, на которой реакционную смесь перемешивают в течение еще 4,5 часов, давление в аппарате постепенно снижают от 26 кРа в начале до 4 кРа в конце реакции. После охлаждения реакционную смесь анализируют. Достигается 100% конверсия нитробензола при следующем выходе (в %) отдельных компонентов реакции (подсчитано относительно введенного нитробензола): 4-NОДФА 82,1%; 4- NO2ДФА 11,7%; азобензол 11,6%; феназин 1,4%.
Пример 8
Взаимодействие анилина с нитробензолом в присутствии реакционной системы, представляющей собой водный раствор карбоксилата N,N,N-тризамещенного аммоний-алкила формулы

(где R1, R2, R3, R4 и х приведены в таблице и Y- представляет CO
0,25 моль анилина добавляют к смеси, приготовленной из 0,04 моля соответствующего замещенного моногидрата бетаина, 0,04 моля гидроксида калия (86,0%) и 5 мл воды. К реакционной смеси в течение 1,5 часов при 80°С и давлении 14 кРа в защитной атмосфере азота порциями добавляют в целом 0,039 моль нитробензола. Реакционную смесь перемешивают в течение еще 4 часов, чтобы закончить реакцию. Определяют конверсию реакции и выход промежуточных соединений 4-АДФА (т.е. 4-NОДФА, 4-NO2ДФА и 4-FАДФА), подсчитываемых относительно прореагировавшего нитробензола (таблица 4).
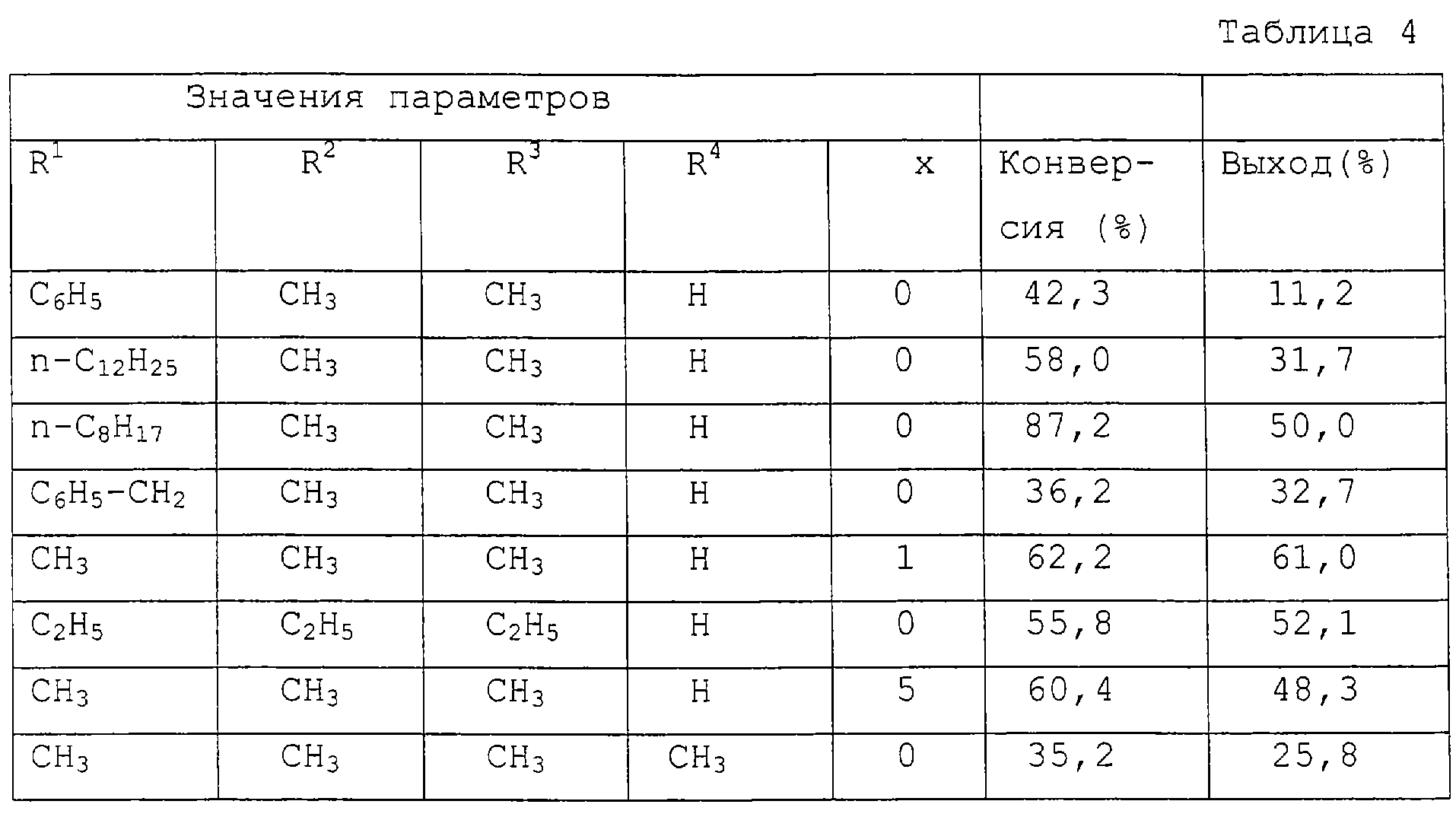
Пример 9
Взаимодействие анилина и нитробензола в присутствии реакционной системы бетаин-гидроксид калия в метаноле в анаэробных условиях.
48,2 г анилина (7-кратный молярный избыток относительно нитробензола) добавляют к раствору 5,8 г (85,0%) гидроксида калия и 11,9 г гидрата бетаина (10% молярный избыток относительно нитробензола 9,8 г) и реакционную смесь нагревают до 75°С, воздух в аппарате заменяют азотом, а нитробензол добавляют порциями при интенсивном перемешивании и начальном давлении 26 кРа в течение 2 часов. Реакцию продолжают в течение еще 3 часов, постепенно снижая давление до 6 кРа. Реакцию прекращают, охлаждая и растворяя реакционную смесь в метаноле. Получают 96,7% конверсию нитробензола и следующий выход (в %) относительно введенного нитробензола: промежуточные соединения 4-АДФА 80,5%; азобензол 11,0%; феназин 4,2%.
Пример 10
Взаимодействие анилина с нитробензолом в присутствии реакционной системы, состоящей из триметиламмоний-пропансульфоната и гидроксида калия в водном растворе.
0, 517 моль анилина добавляют при 80°С к раствору катализатора, состоящему из 0,0858 моль триметиламмоний-пропансульфоната и 0,0858 моль гидроксида калия в 6,6 мл воды. Часть воды отгоняют при пониженном давлении (21 кРа) в виде азеотропа, затем к реакционной смеси при интенсивном перемешивании при 80°С и давлении 26 кРа в течение 1,5 часов добавляют нитробензол 0,078 моль. Образуется вязкая смесь, которую перемешивают еще в течение 3 часов. Затем ее разбавляют метанолом и анализируют. Конверсия нитробензола достигает 71,1%. Выход продуктов реакции относительно введенного в реакцию нитробензола составляет (в %): промежуточные соединения 4-АДФА 28,6%; азобензол 7,2%; феназин 0,5%.
Пример 11
Влияние вспомогательных полярных растворителей на взаимодействие анилина с нитробензолом в присутствии реакционной системы, состоящей из бетаина и гидроксида калия.
К приготовленному водному раствору бетаина (0,0883 моля) и гидроксида калия (0,0883 моля) и 0, 0736 моль нитробензола, добавляют 48,0 г (0,515 моль) анилина, а избыток воды отгоняют при пониженном давлении. Затем добавляют 15 мл вспомогательного растворителя, а нитробензол добавляют при интенсивном перемешивании в атмосфере инертного газа при 70°С и пониженном давлении (7 кРа) в течение 1,5 часов. Еще через два часа реакцию прекращают, при этом общая продолжительность реакции составляет 3,5 часа. Результаты приведены в таблице 5.

Пример 12
Влияние краун-эфира в качестве агента фазового переноса на конверсию и выход реакции.
Экспериментальные условия:
Молярное соотношение анилин:нитробензол:бетаин-КОН:18-дибензокраун-6-эфир=7:1:1,1:0,1; реакцию проводят в атмосфере инертного газа при 80°С и давлении 7,3 кРа, при этом общая продолжительность реакции составляет 6 часов (таблица 6).

Пример 13
Испытание методики, в которой раствор бетаина и гидроксид калия добавляют порциями к реакционной смеси реагентов в аэробных условиях.
Раствор, включающий 6,0 г гидроксида калия (концентрация КОН составляет 84%), 12,1 г бетаина и 10,5 мл воды добавляют порциями к смеси 9,6 г нитробензола и 48,0 г анилина при интенсивном перемешивании, 80°С и давлении 8 кРа в течение 2 часов. Молярное соотношение анилин/нитробензол составляет 6,610:1. Перемешивание продолжают еще в течение 2 часов 45 минут в условиях азеотропной дистилляции. После охлаждения реакционную смесь растворяют в метаноле и анализируют. При 94,7% конверсии нитробензола получают следующий выход (в %) относительно нитробензола, введенного в реакцию: промежуточные соединения 4-АДФА 76,6%; азобензол 16,9%; феназин 1,2%.
Содержание М-метиланилина составляет менее 0,05% (относительно введенного бетаина).
Пример 14
Взаимодействие анилина с нитробензолом в присутствии реакционной системы в соответствии с настоящим изобретением при нормальном давлении без отгонки растворителя из реакционной смеси в анаэробных условиях.
Нитробензол (4,7 г) добавляют порциями к реакционной смеси, включающей 24,0 г анилина, 2,68 г 84% гидроокиси калия, 5,5 г гидрата бетаина и 3 г метанола, при 75°С и нормальном давлении в атмосфере азота в течение 2 часов. Молярное соотношение анилин/нитробензол составляет 6,750:1. Затем реакционную смесь перемешивают еще в течение 2 часов при 80°С при кипячении с обратным холодильником. После охлаждения и разбавления метанолом смесь анализируют. Конверсия нитробензола достигает 75,1%. Выход (в %) относительно введенного нитробензола составляет: промежуточные соединения 4-АДФА 57,0%; азобензол 5,5%; феназин 1,8%.
Пример 15
Влияние полярности вспомогательных растворителей, образующих азеотропные смеси с водой, на ход взаимодействия нитробензола с анилином в анаэробных условиях.
0, 078 моль нитробензола добавляют порциями к реакционной смеси, включающей 0,09 моль КОН (концентрация 84%), 0,09 моль гидрата бетаина, 4 мл воды, 0,51 моль анилина и 15 мл вспомогательного растворителя, при 80°С в течение 1,5 часов. Завершение реакции требует еще 4,5 часов, на протяжении которых воду непрерывно удаляют из реакционной среды в виде азеотропа со вспомогательным растворителем. В эксперименте с 2-пропанолом азеотроп отгоняют через короткую колонну при атмосферном давлении. В эксперименте с пиридином азеотроп отгоняют при пониженном давлении, составляющем от 13,3 до 9,3 кРа. В эксперименте с циклогексаном воду непрерывно удаляют в виде азеотропа при помощи азеотропной насадки. Результаты приведены в таблице 7.

Пример 16
Взаимодействие анилина и нитробензола под действием реакционной системы, состоящей из водного раствора бетаина и гидроксида калия при различных взаимных молярных соотношениях и при различных соотношениях с бензолом.
Методика реакции аналогична методике, описанной в примере 8. Взаимные молярные соотношения бетаина и КОН к 1 молю нитробензола, а также полученные результаты представлены в таблице 8.

Пример 17
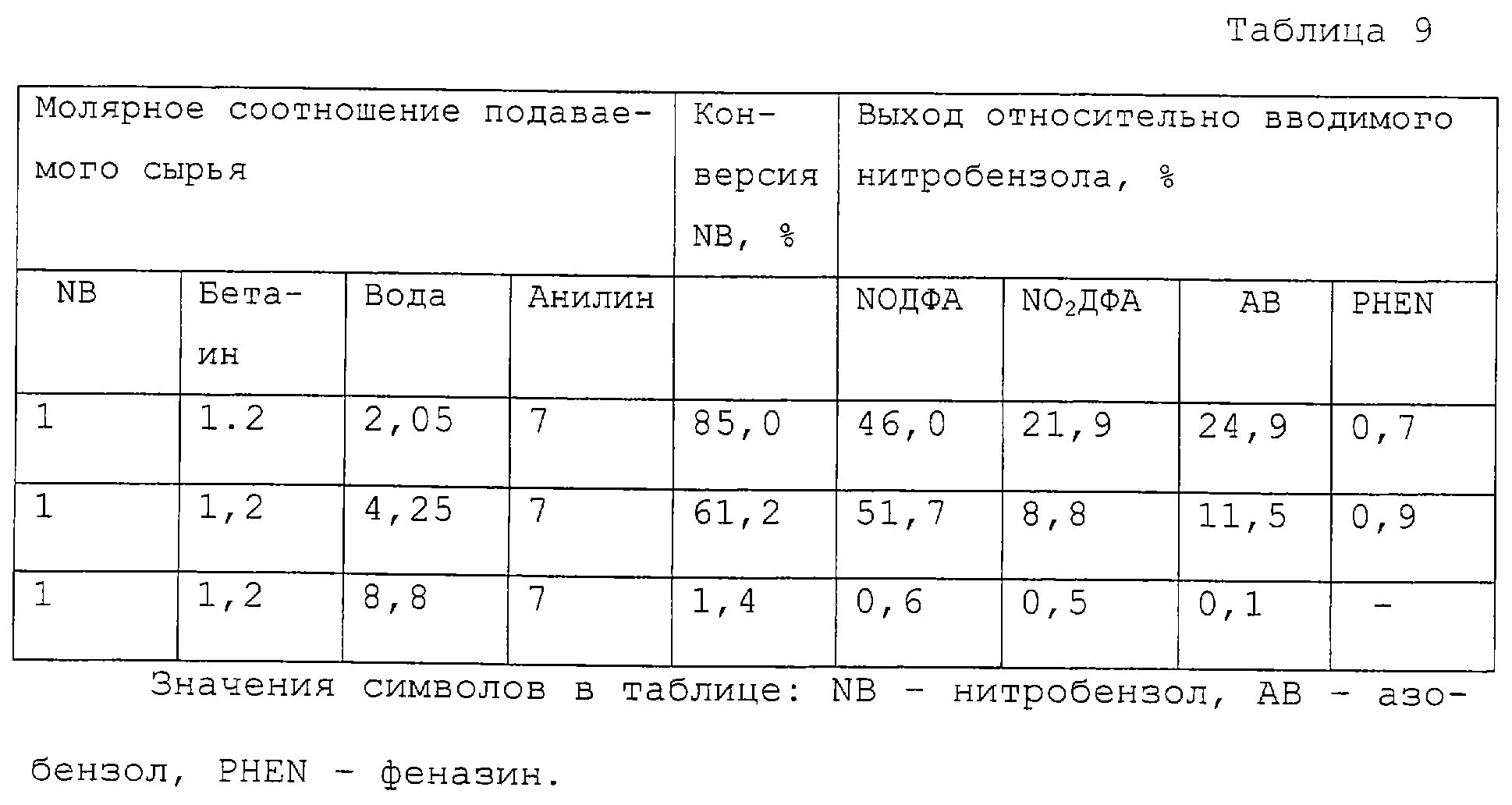
Влияние содержания воды на взаимодействие анилина и нитробензола .
Реакционной смеси, включающей анилин, нитробензол, гидроксид калия, бетаин и воду при взаимных молярных соотношениях, указанных в таблице 9, дают возможность взаимодействовать при интенсивном перемешивании, 80°С, атмосферном давлении, в атмосфере азота в течение 6 часов. После охлаждения и разбавления метанолом полученный раствор анализируют, а результаты выражают в виде конверсии нитробензола и выхода относительно введенного нитробензола. Общее содержание воды в реакционной смеси включает реакционную воду, воду для растворения и воду, содержащуюся в сырье, и выражено в молях на 1 моль нитробензола .
Пример 18
Влияние различных молярных соотношений органических и неорганических гидроксидов к бетаину на конденсацию анилина и нитробензола, а также одновременное влияние бетаина и гидроксида тетраметиламмония (ТМАН) на метилирование анилина в М-метиланилин (N-MAn) очевидно из результатов, представленных в таблице 10.
Семикратный молярный избыток анилина добавляют к приготовленному водному раствору отдельных компонентов в реакционной системе, включающей ТМАН, бетаин и гидроксид калия. После азеотропной отгонки воды к реакционной смеси при 70°С и давлении 7,3 кРа в течение 1,5 часов добавляют 0,95 моль нитробензола. Реакцию завершают еще через 2 часа. Выход (таблица 10) компонентов в реакционном продукте подсчитывают относительно введенного нитробензола. N-метиланилин (N-MAn) выражают в молярных процентах относительно введенного ТМАН.

Предел определяемости для N-МАn в применяемом способе составляет 0,05%.
Пример 19
Реакционную смесь, полученную в соответствии с методикой, описанной в примере 7, разбавляют метанолом с получением раствора с 30% метанолом, а также добавляют влажный катализатор (Ni Ренея) в количестве 30% (относительно веса нитробензола, загруженного в конденсационную смесь). Реакция протекает при 60°С и начальном давлении 5 МРа в течение 7 минут. Отобранный образец реакционной смеси анализируют на содержание 4-АДФА. Выход 4-АДФА относительно прореагировавшего нитробензола составляет 88,5%.
Пример 20
Порция реакционного раствора с последующей обработкой конденсационной смеси и выделение продукта 4-АДФА.
Для реакции анилина с нитробензолом под действием реакционной системы раствора триметиламмонио-ацетата с гидроксидом калия применяют устройство, включающее реактор объемом 250 л, снабженный скоростной мешалкой, смесительной рубашкой, нагреваемой горячей водой для регулирования температуры в реакторе, входом для азота под поверхностью реакционной смеси, конденсатор для конденсации паров из реактора и приемник для сбора конденсата, используемый как фазовый сепаратор, а также снабженный сливом для рециркуляции анилиновой фазы, содержащей нитробензол, обратно в реактор, при этом отделенную водную фазу конденсата постоянно удаляют из фазового сепаратора. Реактор также снабжен термометром и регулятором давления.
19,1 л дистиллированной воды, 12,8 кг твердого КОН, содержащего 86, 5% КОН, помещают во вспомогательную емкость объемом 50 л и после его растворения добавляют 26,6 кг гидрата бетаина. После растворения всех компонентов получают реакционную систему в виде водного раствора, используемую в реакции.
111,8 кг (1,2 кмоль) анилина помещают в реактор и добавляют 58,5 кг вышеуказанного раствора. Реактор закрывают и один раз продувают азотом, при этом перемешивая смесь. Прекратив продувку реактора азотом, в нем устанавливают абсолютное давление 20кРа, и его содержимое постепенно нагревают до температуры 80°С. По достижении указанной температуры в реактор начинают добавлять порциями 21,1 кг нитробензола (0,17 кмоль) с такой скоростью, чтобы весь нитробензол был добавлен в течение 1,5 часов. Азеотроп анилин-вода, отогнанный из реактора, собирают в приемник, где разделяют водную и анилиновую фазы. Анилиновая фаза содержит определенное количество нитробензола, поэтому ее периодически рециркулируют в конденсационный реактор на протяжении всего эксперимента. После добавления всего количества нитробензола давление постепенно снижают до 14 кРа и реакционная смесь взаимодействует при указанном давлении и температуре 80°С в течение 1,5 часов. Затем давление постепенно снижают до 8 кРа, и при таком давлении реакционная смесь взаимодействует в течение 1,5 часов. Наконец, давление в реакторе снижают до 4 кРа и реакция в реакционной смеси завершается в течение 1,5 часов. Наконец ее охлаждают до 40°С, добавляют приблизительно 15% метанола, смесь удаляют из реактора и взвешивают. Анализ реакционной смеси показывает, что происходит 100% конверсия нитробензола при следующем выходе (в %) отдельных компонентов реакции (подсчитанных относительно введенного нитробензола): 4-NОДФА 77,0%; 4-NO2ДФА 14,3%; 4-фенилазодифениламин 0,21%; азобензол 9,6%; феназин 1,3%.
Примечание: содержание N-метиланилина составляет менее 0,05% относительно введенного бетаина.
Реакционную смесь, полученную в результате конденсации, разбавляют метанолом таким образом, чтобы его содержание в разбавленной конденсационной смеси составляло 30 мас.%, и гидрируют ее в условиях, описанных в примере 19. Отобранный образец реакционной смеси анализируют на содержание 4-АДФА. Выход 4-АДФА в продукте гидрирования относительно прореагировавшего нитробензола составляет 89,9%.
По завершении гидрирования катализатор (Ni Ренея) отфильтровывают и промывают метанолом и дистиллированной водой. Промывочные растворы добавляют к продукту гидрирования. Метанол отгоняют от разбавленного продукта гидрирования при абсолютном давлении 35 кРа и температуре от 60 до 70°С. После отгонки метанола продукт гидрирования разделяют на водную и органическую фазы, органическую фазу после разделения вновь экстрагируют дистиллированной водой, а затем фазы разделяют. Чтобы облегчить разделение фаз, к органической фазе добавляют небольшое количество толуола. Остатки органической фазы в водной фазе удаляют экстракцией толуолом, который затем добавляют к органической фазе.
Обработанная таким образом водная фаза представляет собой реакционную систему, используемую в следующем эксперименте (пример 21).
Анилин и небольшую часть головного погона отгоняют от органической фазы продукта гидрирования при давлении от 2 до 3 кРа и температуре от 70 до 180°С. Остаток в кубе представляет собой сырой 4-АДФА с содержанием 1,6 мас.% феназина, который затем подвергают ректификации в эффективной вакуумной колонне. Получают дистиллированный 4-АДФА, содержащий 99,3% активного вещества, в то время как выход дистиллированного 4-АДФА относительно прореагировавшего нитробензола составляет 86,4%.
Часть нитробензола, превратившегося во время конденсации в азобензол, подвергают гидрированию в анилин. Это проявляется в положительном балансе рециркулированного анилина в ходе получения 4-АДФА (конденсация, гидрирование, ректификация 4-АДФА, где регенерируется большее количество анилина, чем количество, соответствующее его потреблению для образования 4-АДФА.
Пример 21
Использование при конденсации рециркулированной реакционной системы.
Применяют такой же способ конденсации анилинина и нитробензола, как и в примере 20, добавляя рециркулированную реакционную систему в реактор к анилину, т.е. соответствующее количество обработанной водной фазы со стадии гидрирования (пример 20), таким образом, что молярное отношение катализатора к нитробензолу составляет 1,15.
По завершении конденсации образец удаляют из конденсационной реакционной смеси. В соответствии с анализом конверсия нитробензола составляет 95,5% со следующим выходом (в %) отдельных компонентов реакции (относительно введенного нитробензола) : 4-NОДФА 73,5%; 4-NO2ДФА 13,5%; 4-фенилазодифениламин 0,17%; азобензол 12, 6%; феназин 1,2%.
Примечание: содержание N-метиланилина составляет менее 0,05% относительно введенного бетаина.
Реферат
Настоящее изобретение относится к способу получения 4-аминодифениламина через получение
промежуточного соединения 4-нитродифениламина и/или
4-нитрозодифениламина, и/или их солей взаимодействием анилина с нитробензолом в жидкой среде при температуре от 50 до 130°С, при атмосферном или
пониженном давлении, в атмосфере инертного газа или в
присутствии кислорода воздуха, с последующим гидрированием промежуточного соединения 4-нитродифениламина и/или 4-нитрозодифениламина и побочных
продуктов в присутствии катализатора, с выделением
4-аминодифениламина и побочных продуктов, и рециклом непревращенных исходных соединений, при этом взаимодействие анилина с нитробензолом осуществляют
в реакционной системе, включающей раствор солей
цвиттерионов с гидроксидами общей формулы НО-/ (R1R2R3)N+-CHR4- (CH2)x-Y-/Z+,
где R1 и R2 представляет радикал от метила до додецила; R3 обозначает метил, этил; R4 обозначает водород или
метил, х обозначает целое число от 0 до 5,
Y- обозначает CO

Комментарии