Усовершенствованный способ синтеза частично n-гидроксиэтилированных третичных 1,6-гександиаминов - RU2739315C2
Код документа: RU2739315C2
Чертежи




Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к синтезу частично N-гидроксиэтилированных третичных 1,6-гександиаминов.
Общий контекст
Частично N-гидроксиэтилированные третичные 1,6-гександиамины могут представлять интерес для различных областей применения.
Частично N-гидроксиэтилированные третичные 1,6-гександиамины можно с успехом применять, например, в отмывке кислых газов, какими являются природный газ или дымовые газы. Под отмывкой кислых газов понимают уменьшение содержания в них кислотных соединений, таких как сероводород (H2S), диоксид углерода (CO2), сернистый карбонил (COS), дисульфид углерода (CS2).
Частично N-гидроксиэтилированные третичные 1,6-гександиамины могут входить в композиции, ведущие к образованию полимеров, в частности, полиуретанов.
Частично N-гидроксиэтилированные третичные 1,6-гександиамины могут использоваться в качестве соединений-предшественников молекул, применяющихся в других областях химии.
Из частично N-гидроксиэтилированных третичных 1,6-гександиаминов известен синтез N,N'-диметил-N,N'-ди(2-гидроксиэтил)-1,6-гександиамина формулы (I2) ниже, в котором используются реакционноспособные галогенированные предшественники.

Документ US 2005/0164903 описывает, например, синтез N,N'-диметил-N,N'-ди(2-гидроксиэтил)-1,6-гександиамина путем реакции конденсации между одним молем 1,6-дихлоргексана и двумя молями 2-(метиламино)этанола. Эта реакция конденсации неизбежно приводит к образованию двух молей соляной кислоты. Очистка амина требует превращения соляной кислоты в соль по реакции с основанием, например, ее превращения в хлорид натрия по реакции с гидроксидом натрия или с карбонатом натрия.
Ishidate и др., 1958 ("Studies on carcinostatic substances. XVIII. Anticancer action of N,N'-бис(2-chloroethyl)-N,N'-dimethylpolymethylenediamines", Chemical & Pharmaceutical Bulletin (1958), vol.6, pp. 164-169) описывают синтез N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамина путем реакции конденсации между одним молем 1,6-дибромгексана и двумя молями 2-(метиламино)этанола. Эта реакция конденсации неизбежно приводит к образованию двух молей бромистоводородной кислоты. В таком случае очистка амина предусматривает превращение бромистоводородной кислоты в соль по реакции с основанием, например, ее превращение в бромид натрия по реакции с гидроксидом натрия или с карбонатом натрия.
В статье Nie и Bowman, 2002 ("Synthesis and photopolymerization of N,N'-dimethyl,-N,N'-di(methacryloxyethyl)-1,6-hexanediamine as a polymerizable amine coinitiator for dental restorations" Biomaterials 23, 2002, pp 1221-1226) описывается синтез N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамина путем реакции конденсации между N,N'-диметил-1,6-гександиамином и 2-бромоэтанолом в присутствии гидроксида натрия. При этом способе синтеза образуется два моля бромида натрия на моль N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамина.
В статье Ishidate и др., 1958 ("Studies on carcinostatic substances. XVIII. Anticancer action of N,N'-бис(2-chloroethyl)-N,N'-dimethylpolymethylenediamines", Chemical & Pharmaceutical Bulletin (1958), vol.6, pp. 164-169) описывается также синтез N,N'-диметил-N,N'-ди(2-гидроксиэтил)-1,6-гександиамина в четыре стадии, исходя из 1,6-гександиамина, причем первой стадией является реакция между одним молем 1,6-гександиамина и двумя молями тозилхлорида, или п-толуолсульфонилхлорида, с получением одного моля N,N'-диметил-N,N'-дитозил-1,6-гександиамина и двух молей соляной кислоты. Очистка продукта реакции предусматривает превращение соляной кислоты в соль по реакции с основанием, например, ее превращение в хлорид натрия по реакции с гидроксидом натрия или с карбонатом натрия.
В статье Ishidate и др., 1958 ("Studies on carcinostatic substances. XVIII. Anticancer action of N,N'-бис(2-chloroethyl)-N,N'-dimethylpolymethylenediamines", Chemical & Pharmaceutical Bulletin (1958), vol.6, pp. 164-169) описывается также синтез N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамина в три стадии, исходя из 1,6-дибромгексана, причем первой стадией является реакция между одним молем 1,6-дибромгексана и двумя молями метиламин тозилата или N-метил-п-толуолсульфамида, приводящая к одному молю N,N'-ди(п-тозил)гександиамина и двум молям бромистоводородной кислоты. Очистка амина предусматривает превращение бромистоводородной кислоты в соль по реакции с основанием, например, ее превращение в бромид натрия по реакции с гидроксидом натрия или с карбонатом натрия.
В указанных способах синтеза предшествующего уровня реакции, параллельно желаемых продуктам, дают соли. Образованные соли необходимо удалить из среды, например, фильтрацией, или центрифугированием, или промывкой. Эти способы синтеза, требующие контроля и удаления значительных количеств солей, не соответствуют условиям, требуемых в настоящее время в целях экологически безопасной и надежной химии. Поэтому распространение этих способов синтеза на промышленный масштаб не желательно.
Цели и сущность изобретения
Авторы изобретения обнаружили, что некоторые частично N-гидроксиэтилированные третичные 1,6-гександиамины, отвечающие общей формуле (I), определенной ниже, можно получить способом, в котором не используются такие галогеновые соединения, как например, 1,6-дихлоргексан, 1,6-бромогексан или другой 1,6-дигалогексан, никакие другие галогеновые соединения, как, например, 2-бромоэтанол или другой 2-галоэтанол, и никакие реагенты, относящиеся к семейству тозилгалогенидов, как, например, тозилхлорид. Авторы изобретения обнаружили, что эти частично N-гидроксиэтилированные третичные 1,6-гександиамины можно получить способом, не образующим соль, что благоприятно для перехода на промышленный масштаб.
В предлагаемом настоящим изобретением способе синтеза всегда в качестве исходных продуктов используются предшественники, не содержащие атомов галогенов, он основан на реакциях, не требующих прибегать к органическим галогенированным реагентам.
В частности, способ синтеза согласно изобретению использует семейство предшественников, не содержащих атома галогена и имеющих углеродный скелет, представляющий собой линейную цепь из 6 атомов углерода, в которой атомы углерода, находящиеся в положении 1 и 6, то есть в положении альфа и омега, не соединены с атом галогена, такого, например, как атом хлора или брома.
Это семейство предшественников имеет линейную цепь из 6 атомов углерода, их которых 4 центральных атома углерода соединены, каждый, с 2 атомами водорода, а 2 атомы углерода, находящиеся в положении 1 и 6, то есть в положении альфа и омега, соединены, каждый, либо:
- простой связью с атомом азота, в этом случае предшественник представляет собой 1,6-гександиамин,
- простой связью с атомом кислорода, в этом случае предшественник представляет собой 1,6-гександиол,
- двойной связью с атомом кислорода, в этом случае предшественник представляет собой адипальдегид,
- двойной связью с атомом кислорода, а также простой связью с атомом кислорода, в этом случае предшественник представляет собой адипиновую кислоту или диэфир адипиновой кислоты.
Наряду с этим семейством предшественников, другие продукты, использующиеся для получения частично N-гидроксиэтилированных третичных 1,6-гександиаминов общей формулы (I), также ни в коем случае не являются органическими галогенированными соединениями.
Соединения общей формулы (I) могут быть получены, исходя из этого семейства предшественников, в зависимости от условий, в 1-3 реакционные стадии, в которых не образуются галоидоводородные кислоты.
В реакциях, протекающих в процессе синтеза, не образуются соли, которые нужно отделять и устранять. Эти реакции образуют в процессе синтеза только такие попутные продукты, как вода и/или легкие спирты.
В этом отношении изобретение выгодно отличается от предшествующего уровня техники.
Итак, настоящее изобретение предлагает способ синтеза по меньшей мере одного азотсодержащего соединения, относящегося к семейству частично N-гидроксиэтилированных третичных 1,6-гександиаминов следующей общей формулы (I):

в которой радикалы R1, R2, R3 независимо выбраны из метильного радикала и гидроксиэтильного радикала, и по меньшей мере один радикал из R1, R2, и R3 является метильным радикалом.
Способ включает n реакционных стадий, где n может составлять от 1 до 3, и ни на одной из реакционных стадий не используется галогенсодержащий реагент.
Способ включает по меньшей мере одну первую реакцию между первым соединением-предшественником, не содержащим атома галогена, и вторым соединением-предшественником, не содержащим атома галогена, причем указанное первое соединение-предшественник имеет углеродный скелет, образованный линейной цепью из 6 атомов углерода, из которых 4 центральных атома углерода соединены, каждый, с 2 атомами водорода, а атомы углерода, находящиеся в положении альфа и омега, не соединены с атомом галогена.
В одном варианте осуществления изобретения образуют по меньшей мере N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамин следующей формулы (I2):

В одном варианте осуществления первое соединение-предшественник является 1,6-гександиамином, а второе соединение-предшественник этиленоксидом. В таком случае способ включает:
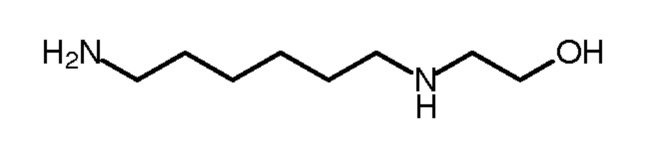
- первую стадию реакции между 1,6-гександиамином и этиленоксидом с образованием по меньшей мере одного промежуточного соединения, выбранного из списка, содержащего N-(2-гидроксиэтил)-1,6-гександиамин, N-N'-ди(гидроксиэтил)-1,6-гександиамин, N,N-ди(гидроксиэтил)-1,6-гександиамин и N-N-N'-три(2-гидроксиэтил)-1,6-гександиамин;
- вторую стадию метилирования первичных или вторичных аминогрупп указанного, по меньшей мере одного, промежуточного соединения с получением по меньшей мере одного соединения общей формулы (I).
Предпочтительно, вторая стадия метилирования проводится путем реакции между указанным промежуточным соединением, формальдегидом и водородом в присутствии катализатора гидрирования, или путем реакции между указанным промежуточным соединением, формальдегидом и муравьиной кислотой по реакции Эшвайлера-Кларка.
Остаточный непрореагировавший 1,6-гександиамин, выходящий с указанной первой стадии реакции, предпочтительно возвращают на первую стадию реакции после отделения путем перегонки указанного 1,6-гександиамина от указанного, по меньшей мере одного, промежуточного соединения.
Предпочтительно, мольное отношение этиленоксида к 1,6-гександиамину меньше или равно 3/1, предпочтительно меньше или равно 2,5/1.
Кроме того, способ может также включать, в конце первой реакционной стадии, по меньшей мере один этап отделения, предпочтительно перегонкой, по меньшей мере одного промежуточного соединения, чтобы получить конкретное соединение общей формулы (I) или комбинацию конкретных соединений, отвечающих общей формуле (I), на выходе второй стадии метилирования.
В одном варианте осуществления первое соединение-предшественник является 1,6-гександиолом, а второе соединение-предшественник является метиламинам. В таком случае способ включает:
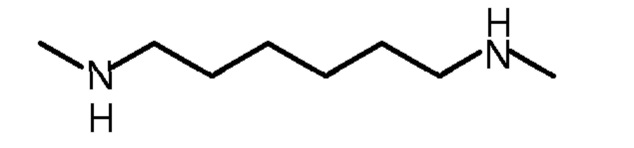
- первую стадию реакции конденсации между 1,6-гександиолом и метиламином, предпочтительно проводимую в присутствии водорода и катализатора гидрирования, с образованием N,N'-диметил-1,6-гександиамина;
- вторую стадию реакции между N,N'-диметил-1,6-гександиамином и этиленоксидом с образованием N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамина.
В одном варианте осуществления первое соединение-предшественник является адипальдегидом, а второе соединение-предшественник является метиламином.
В этом случае способ может включать:
- первую реакционную стадию конденсации между адипальдегидом и метиламином, чтобы получить 1,6-бис(метилимино)-гексан;
- вторую реакционную стадию восстановления 1,6-бис(метилимино)-гексана, чтобы получить N,N'-диметил-1,6-гександиамин;
- третью реакционную стадию этоксилирования N,N'-диметил-1,6-гександиамина этиленоксидом, чтобы получить N,N'-диметил-N-N'-ди(-гидроксиэтил)-1,6-гександиамин.
Альтернативно, способ может включать стадию конденсации адипальдегида N-метил-2-аминоэтанолом в присутствии водорода и катализатора гидрирования с получением N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамина.
В одном варианте осуществления первое соединение-предшественник является адипиновой кислотой или диэфиром адипиновой кислоты.
В этом случае второе соединение-предшественник может представлять собой N-метил-2-аминоэтанол, и способ включает тогда две следующие стадии:
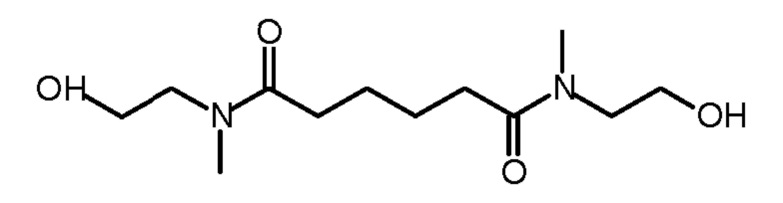
-первая стадия реакции конденсации N-метил-2-аминоэтанола адипиновой кислотой или диэфиром адипиновой кислоты, причем указанный диэфир адипиновой кислоты предпочтительно представляет собой диметиладипат или диэтиладипат, чтобы получить N,N'-диметил-N,N'-ди(гидроксиэтил)-адипамид;
- вторая стадия восстановления амидных групп N,N'-диметил-N,N'-ди(гидроксиэтил)адипамида до третичных аминогрупп, чтобы получить N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамин.
Альтернативно, второе соединение-предшественник может быть метиламином, и способ включает тогда три следующие стадии:
- первая стадия конденсации метиламина адипиновой кислотой или диэфиром адипиновой кислоты, причем указанный диэфир адипиновой кислоты предпочтительно является диметиладипатом или диэтиладипатом, чтобы получить N,N'-диметил-N,N'-адипамид;
- вторая стадия восстановления амидных групп N,N'-диметил-N,N'-адипамида до третичных аминогрупп с получением N,N'-диметил-1,6-гександиамина, предпочтительно путем каталитического гидрирования или под действием гидридов, предпочтительно гидрида лития и алюминия;
- третья стадия этоксилирования вторичных аминогрупп N,N'-диметил-1,6-гександиамина этиленоксидом с получением N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамина.
В другом варианте осуществления первое соединение-предшественник является 1,6-гександиамином, а второе соединение-предшественник является формальдегидом. В таком случае способ включает:
- первую стадию частичного метилирования 1,6-гександиамина путем реакции с формальдегидом и водородом в присутствии катализатора гидрирования, чтобы получить по меньшей мере одно промежуточное соединение, выбранное из списка, включающего N-метил-1,6-гександиамин, N,N-диметил-1,6-гександиамин, N,N'-диметил-1,6-гександиамин и N,N,N'-триметил-1,6-гександиамин;
- вторую стадию реакции между этиленоксидом и по меньшей мере одним промежуточным соединением, чтобы образовать по меньшей мере одно соединение общей формулы (I).
Другие объекты и преимущества изобретения выявятся при рассмотрении следующего описания частных примеров осуществления изобретения, приведенных в качестве неограничивающих примеров, причем описание обращается к прилагаемым фигурам, описанным ниже.
Краткое описание фигур
Фигура 1 показывает способ синтеза соединений общей формулы (I) из 1,6-гександиамина в соответствии с одним вариантом осуществления изобретения.
Фигура 2 показывает синтез N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамина из 1,6-гександиола в соответствии с одним вариантом осуществления изобретения.
Фигура 3 показывает синтез N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамина из адипальдегида в соответствии с одним вариантом осуществления изобретения (3 стадии).
Фигура 4 показывает синтез N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамина из адипальдегид в соответствии с другим вариантом осуществления изобретенияя (одна стадия).
Фигура 5 показывает синтез N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамина из диметиладипата или адипиновой кислоты в соответствии с одним вариантом осуществления изобретения (2 стадии).
Фигура 6 показывает синтез N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамина из диметиладипата или адипиновой кислоты в соответствии с другим вариантом осуществления изобретения (3 стадии).
Фигура 7 показывает способ синтеза соединений общей формулы (I), исходя из 1,6-гександиамина, в соответствии с другим вариантом осуществления изобретения.
На фигурах сокращение "cat" означает катализатор, а стрелки показывают стадии реакции. Таким образом, речь идет о реакционных схемах. Иллюстрации способа синтеза согласно изобретению включают не все компоненты, необходимые для его осуществления. Представлены только элементы, необходимые для понимания изобретения, при этом специалист способен дополнить это представление для осуществления изобретения.
Подробное описание изобретения
Настоящее изобретение относится к синтезу частично N-гидроксиэтилированных третичных 1,6-гександиаминов следующей общей формулы (I):

в которой
радикалы R1, R2, R3 независимо выбраны из метильного радикала и гидроксиэтильного радикала, и
по меньшей мере один радикал R1, R2 и R3 является метильным радикалом.
Предпочтительно, радикалы R1 и R3 являются метильными радикалами, а радикал R2 является гидроксиэтильным радикалом, или радикалы R2 и R3 являются метильными радикалами, а радикал R1 является гидроксиэтильным радикалом.
В соответствии с изобретением моно с успехом синтезировать по меньшей мере один из следующих частично N-гидроксиэтилированных третичных 1,6-гександиаминов:
N,N,N'-триметил-N'-(2-гидроксиэтил)-1,6-гександиамин следующей формулы (I1):

N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамин следующей формулы (I2):

N,N-диметил-N',N'-ди(гидроксиэтил)-1,6-гександиамин следующей формулы (I3):

N-метил-N,N',N'-три(2-гидроксиэтил)-1,6-гександиамин следующей формулы (I4):

Синтез из 1,6-гександиамина
Фигура 1 иллюстрирует синтез по меньшей мере одного соединения общей формулы (I), исходя из 1,6-гександиамина формулы (III).
Синтез состоит из последовательности двух реакционных стадий, исходя из 1,6-гександиамина.
Первая стадия состоит в том, чтобы привести в реакцию 1,6-гександиамин с этиленоксидом (формула (IV)) в количестве и условиях, подходящих, чтобы получить или частично этоксилированный 1,6-гександиамин, такой как N-(2-гидроксиэтил)-1,6-гександиамин (формула II1), или N-N'-ди(гидроксиэтил)-1,6-гександиамин (формула II2), или N,N-ди(гидроксиэтил)-1,6-гександиамин (формула II3), или N-N-N'-три(2-гидроксиэтил)-1,6-гександиамин (формула II4), или смесь этих молекул. Эти частично этоксилированные 1,6-гександиамины формул (II1) - (II4) являются промежуточными продуктами в этом способе синтеза.
Условия реакции адаптированы так, чтобы не образовывался N,N,N',N'-тетра(2-гидроксиэтил)-1,6-гександиамин и чтобы минимизировать количество остаточного 1,6-гександиамина. Для этого выгодно работать при мольном отношении этиленоксида к 1,6-гександиамину, не превышающем 3/1, предпочтительно не превышающем 2,5/1. Выбор мольного соотношения между этиленоксидом и 1,6-гександиамином обуславливает состав полученных продуктов.
Когда присутствует остаточный 1,6-гександиамин, его можно удалить из среды, например, перегонкой, и при необходимости вернуть в цикл.
Когда получают N,N,N',N'-тетра(2-гидрокси)-1,6-гександиамин, его можно удалить из среды, например, перегонкой.
Когда получают смесь промежуточных соединений, ее можно использовать как есть для осуществления второй стадии или же ее можно подвергнуть разделению, например, путем перегонки, чтобы на выходе второй стадии получить одно из соединений общей формулы (I) или комбинацию этих соединений (формулы I1 - I4).
Второе стадия состоит в метилировании первичных или вторичных аминогрупп промежуточных соединений формул II1 - II4, полученных на первой стадии, чтобы получить N,N,N'-триметил-N'-(2-гидроксиэтил)-1,6-гександиамин (формула I1), и/или N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамин (формула I2), и/или N,N-диметил-N'-N'-ди(гидроксиэтил)-1,6-гександиамин (формула I3), и/или N-метил-N-N'-N'-три(2-гидроксиэтил)-1,6-гександиамин (формула I4).
Метилирование аминогрупп можно осуществить любыми способами, известными специалисту, в частности, по реакции формальдегида (HCHO) и водорода (H2) в присутствии подходящего катализатора гидрирования (как показано на фигуре 1) или, например, по реакции между формальдегидом и муравьиной кислотой согласно так называемой реакции Эшвайлера-Кларка.
В соответствии с альтернативным способом синтеза из 1,6-гександиамина, стадии этоксилирования и метилирования можено поменять местами по сравнению со способом, описанным выше и показанным на фигуре 1. В этом случае первая стадия частичного метилирования 1,6-гександиамина путем реакции с формальдегидом и водородом в присутствии катализатора гидрирования ведет к N-метил-1,6-гександиамину (формула (II'4)), и/или N,N-диметил-1,6-гександиамину (формула (II'3)), и/или к N,N'-диметил-1,6-гександиамину (формула (II'2)), и/или к N,N,N'-триметил-1,6-гександиамину (формула (II'1)). Затем на второй стадии первичные и вторичные аминогруппы этоксилируют путем реакции с этиленоксидом (формула (IV)). Этот вариант этого первого способа синтеза показан на фигуре 7.
Синтез из 1,6-гександиола
Соединение общей формулы (I) можно синтезировать, исходя из 1,6-гександиола (формула (V)).
Фигура 2 иллюстрирует синтез одного примера соединения общей формулы (I), а именно N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамина формулы (I2), исходя из 1,6-гександиола формулы (V).
Синтез состоит в последовательности двух реакционных стадий: конденсация 1,6-гександиола метиламином (MeNH2), используемым обычно в избытке, в присутствии водорода и подходящего катализатора, чтобы привести к N,N'-диметил-1,6-гександиамину (формула (VI)), который затем преобразуют в N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамин (формула (I2)) путем реакции этоксилирования этиленоксидом (формула (IV)).
Синтез из адипальдегида
Соединение общей формулы (I) можно синтезировать, исходя из адипальдегида.
Синтез в 3 реакционные стадии
Соединение общей формулы (I) можно синтезировать в три реакционные стадии, исходя из адипальдегида (формула (VII)).
Фигура 3 иллюстрирует синтез одного примера соединения общей формулы (I), а именно N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамина формулы (I2), из адипальдегида формулы (VII), в соответствии со способом синтеза в три реакционные стадии.
Синтез состоит в последовательности трех реакционных стадий.
Первая стадия состоит в реакции конденсации адипальдегида (формула (VII)) метиламином (MeNH2), приводя к 1,6-бис(метилимино)гексану (формула (VIII)).
Вторая реакционная стадия состоит в восстановлении 1,6-бис(метилимино)гексана (формула (VIII)) до N,N'-диметил-1,6-гександиамина (формула (VI)).
Третья реакционная стадия состоит в этоксилировании N,N'-диметил-1,6-гександиамина (формула (VI)) этиленоксидом (формула (IV)), чтобы получить N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамин (формула (I2)).
Синтез в 1 реакционную стадию
Соединение общей формулы (I) можно синтезировать в одну реакционную реакцию, исходя из адипальдегида (формула (VII)).
Фигура 4 иллюстрирует синтез одного примера соединения общей формулы (I), а именно N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамина формулы (I2), исходя из адипальдегида (формула (VII)), в соответствии со способом синтеза в одну реакционную стадию.
Синтез состоит в конденсации адипальдегида (формула (VII)) N-метил-2-аминоэтанолом (формула (IX)) в присутствии водорода и подходящего катализатора гидрирования, чтобы получить N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамин (формула (I2)).
Это превращение, называемое также восстановительным аминированием, является результатом последовательности двух реакций: конденсация вторичного амина альдегидом, приводящая к енамину, а затем гидрирование этого последнего до третичного амина.
Синтез из адипиновой кислоты или диэфира адипиновой кислоты
Соединение общей формулы (I) можно синтезировать, исходя из адипиновой кислоты или диэфира адипиновой кислоты.
Синтез в 2 реакционные стадии
Соединение общей формулы (I) можно синтезировать в две реакционные стадии, исходя из адипиновой кислоты (формула (XI)) или диэфира адипиновой кислоты, такого, как диметиладипат (формула (X)).
Фигура 5 иллюстрирует синтез одного примера соединения общей формулы (I), а именно N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамина формулы (I2), исходя из адипиновой кислоты (формула (XI)) или диэфира адипиновой кислоты, как диметиладипат (формула (X)), способом синтеза в две реакционные стадии.
Первая стадия состоит в реакции конденсации N-метил-2-аминоэтанола (формула (IX)) либо адипиновой кислотой (формула (XI)), либо диэфиром адипиновой кислоты, таким, например, но без ограничений, как диметиладипат (формула (X)) или диэтиладипат. Полученный продукт конденсации представляет собой диамид N,N'-диметил-N,N'-ди(гидроксиэтил)-адипамида (формула (XII)).
Вторая стадия состоит в восстановлении амидных групп N,N'-диметил-N,N'-ди(гидроксиэтил)-адипамида (формула (XII)) до третичных аминогрупп, чтобы получить N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамин (формула (I2)).
Это восстановление можно осуществить любым известным способом, таким как восстановление путем каталитического гидрирования или под действием гидридов, таких как гидрид лития и алюминия.
Синтез в 3 реакционные стадии
Соединение общей формулы (I) можно синтезировать в три реакционные стадии, исходя из адипиновой кислоты (формула (XI)) или диэфира адипиновой кислоты, такого как диметиладипат (формула (X)).
Фигура 6 иллюстрирует синтез одного примера соединения общей формулы (I), а именно N,N'-диметил-N,N'-ди(гидроксиэтил)-1,6-гександиамин формулы (I2), исходя из адипиновой кислоты (формула (XI)) или диэфира адипиновой кислоты, такого как диметиладипат (формула (X)), способом синтеза в три реакционные стадии.
Первая стадия состоит в конденсации метиламина (MeNH2) либо адипиновой кислотой (формула (XI)), либо диэфиром адипиновой кислоты, таким, например, но без ограничений, как диметиладипат (формула (X)) или диэтиладипат. Полученный продукт конденсации является диамидом: N,N'-диметил-N,N'-адипамид формулы (XIII).
Вторая стадия состоит в восстановлении амидных групп N,N'-диметил-N,N'-адипамида формулы (XIII) до третичных аминогрупп, чтобы получить N,N'-диметил-1,6-гександиамин (формула (VI)). Это восстановление можно осуществить любыми известными способами, такими как восстановление путем каталитического гидрирования, или под действием гидридов, таких как гидрид лития и алюминия.
Третья стадия состоит в этоксилировании вторичных аминогрупп N,N'-диметил-1,6-гександиамина (формула (VI)) этиленоксидом (формула (IV)) с получением N,N'-диметил-N-N'-ди(гидроксиэтил)-1,6-гександиамина (формула (I2)).
Приложение: Список названий соединений, представленных на фигурах, и их формулы
Реферат
Изобретение относится к способу синтеза N,N'-диметил-N,N'-ди(2-гидроксиэтил)-1,6-гександиамина формулы (I2). Способ включает две реакционные стадии и по меньшей мере одну первую реакцию между первым соединением-предшественником, не содержащим атома галогена, и вторым соединением-предшественником, не содержащим атома галогена, причем указанное первое соединение-предшественник имеет углеродный скелет, образованный линейной цепью из 6 атомов углерода, из которых 4 центральных атома углерода соединены, каждый, с 2 атомами водорода, а атомы углерода, находящиеся в положении альфа и омега, не соединены с атомом галогена. При этом ни в одной из двух реакционных стадий не участвует органический галогенированный реагент. Первое соединение-предшественник является 1,6-гександиамином, а второе соединение-предшественник является этиленоксидом. Указанный способ включает первую стадию реакции между 1,6-гександиамином и этиленоксидом с образованием по меньшей мере одного промежуточного соединения, выбранного из списка, содержащего N-(2-гидроксиэтил)-1,6-гександиамин, N,N'-ди(2-гидроксиэтил)-1,6-гександиамин, N,N-ди(2-гидроксиэтил)-1,6-гександиамин и N,N,N'-три(2-гидроксиэтил)-1,6-гександиамин. Указанный способ также включает вторую стадию метилирования первичных или вторичных аминогрупп указанного по меньшей мере одного промежуточного соединения с получением N,N'-диметил-N,N'-ди(2-гидроксиэтил)-1,6-гександиамина следующей формулы (I2), причем вторую стадию метилирования проводят путем реакции между указанным промежуточным соединением, формальдегидом и водородом в присутствии катализатора гидрирования или путем реакции между указанным промежуточным соединением, формальдегидом и муравьиной кислотой по реакции Эшвайлера-Кларка. В предлагаемом способе не используются галогенированные реагенты, что позволяет избежать образования солей, которые нужно отделять и устранять. 3 з.п. ф-лы, 7 ил.(I2)
Формула

Документы, цитированные в отчёте о поиске
Способ синтеза высших этаноламинов





















Комментарии