Способ получения замещенных ароматических аминов - RU2155749C2
Код документа: RU2155749C2
Чертежи


Описание
Предпосылки создания изобретения
Данное изобретение относится к способу получения замещенных ароматических аминов. Другим аспектом данного
изобретения является получение 4-аминодифениламина (4-АДФА) или его замещенных производных. Еще одним аспектом данного изобретения является получение из замещенных ароматических аминов, таких как
4-АДФА или его замещенных производных, алкилированных ароматических аминов или их замещенных производных, используемых в качестве антиоксидантов.
Известно получение замещенных ароматических аминов по механизму нуклеофильного ароматического замещения, где аминофункциональный нуклеофил замещает галоген. Например, известно получение 4-АДФА по механизму нуклеофильного ароматического замещения, где анилиновое производное замещает галоген. Этот способ включает получение промежуточного соединения 4-АДФА, а именно 4-нитродифениламина (4-НДФА), с последующим восстановлением нитрорадикала. 4-НДФА получается путем взаимодействия п-хлорнитробензола с анилиновым производным, таким как форманилид или его соль со щелочным металлом, в присутствии акцептора кислоты или нейтрализующего агента, такого как карбонат калия, и, необязательно, с использованием катализатора. См., например, патенты США 4187248; 4683332; 4155936; 4670595; 4122118; 4614817; 4209463; 4196146; 4187249; 4140716. Этот способ неудобен тем, что замещаемый галоген является коррозионноактивным для реакторов и присутствует в отходящих парах, и поэтому они требуют очистки, что приводит к значительным затратам. Кроме того, использование анилинового производного, такого как форманилид, и п-хлорнитробензола требует дополнительного производственного оборудования и необходимости производств таких исходных материалов из анилина и нитробензола, соответственно.
Также известно получение 4-АДФА из анилина путем связывания голова к хвосту. См. , например, патент Великобритании 1440767 и патент США 4760186. Этот способ имеет тот недостаток, что выход 4-АДФА неприемлем для коммерческого производства. Известно также декарбоксилирование уретана с получением 4-НДФА. См., патент США 3847990. Однако такой метод коммерчески нецелесообразен с точки зрения стоимости и выхода.
Известно получение 4-АДФА путем гидрирования п-нитрозодифенилгидроксиамина, который может быть получен каталитической димеризацией нитробензола с использованием в качестве восстанавливающего агента алифатических соединений, бензола, нафталина или этилен-ненасыщенных соединений. См., например, патенты США 4178315 и 4404401. Также известно получение п-нитрозодифениламина из дифениламина и алкилнитрата в присутствии избытка хлористого водорода. См., например, патенты США 4518803 и 4479008.
Ароматические амидные связи образуются в процессе взаимодействия амина с хлорангидридом кислоты. Этот способ образования ароматических амидных связей также имеет тот недостаток, что замещению подвергается хлорангидрид, который коррозионноактивен для реакторов и присутствует в паровых выбросах, из которых его нужно удалять со значительными затратами. Негалогенидный процесс, который приводит к образованию ароматических амидных связей в замещенных ароматических аминах, устранил бы эти проблемы.
Способ по данному изобретению является негалогенидным способом получения замещенных ароматических аминов и поэтому исключает как дорогостоящее удаление галогенидов из паровых выбросов, так и проблемы коррозии, связанные с галогенидами. Кроме того, по способу данного изобретения могут быть получены замещенные ароматические амины, содержащие ароматические амидные связи.
Сущность
изобретения
Объектом изобретения является способ получения замещенных ароматических аминов для использования при получении алкилированных ароматических аминов или их замещенных производных.
Дополнительным объектом изобретения является способ получения 4-АДФА или его замещенных производных для использования при получении алкилированных п-фенилендиаминов или их замещенных производных. Еще
одним объектом изобретения является эффективный и экономичный способ получения 4-АДФА или его замещенных производных и алкилированных п-фенилендиаминов, жизнеспособных с коммерческой точки зрения. И
еще одним объектом изобретения является способ получения алкилированных п-фенилендиаминов или их замещенных производных для использования в качестве антиоксидантов и антиозонантов.
Согласно изобретению предложен способ получения замещенных ароматических аминов, который включает прибавление друг к другу нуклеофильного соединения, выбранного из группы, содержащей анилин, замещенные производные анилина, алифатические амины, замещенные производные алифатических аминов и амидов, и азосодержащего соединения, представленного формулой X-R2-N=N-R2-Y, или его гидразопроизводного, в присутствии подходящей системы растворителей и взаимодействие нуклеофильного соединения и соединения, представленного формулой X-R1-N=N-R2-Y, или его азокси- или гидразопроизводных, в присутствии подходящего основания и регулируемого количества протонного вещества при температуре реакции, равной примерно 10oC-150oC, при ограниченных реакционных параметрах, где молярное отношение протонного вещества к основанию составляет от 0:1 до около 5:1, где R1 является ароматической группой и R2 выбрано из группы, содержащей алифатическую и ароматическую группы, а X и Y независимо выбраны из группы, содержащей водород, галогены, -NO2, -NH2, арильные группы, алкильные группы, алкокси группы, сульфонатные группы, -SO3H, -OH, -COH, -COOH и алкильные, арильные, арилалкильные или алкиларильные группы, содержащие, по крайней мере, одну NH2-группу, и далее восстановление продукта взаимодействия нуклеофильного соединения с азосодержащим соединением в условиях, которые приводят к получению замещенного ароматического амина. Когда R2 является алифатической группой, X находится в мета или орто-положении по отношению к R1. Когда R2 является ароматической группой, по крайней мере, один из X и Y находится в мета или орто-положении по отношению к R1 и R2, соответственно. Галогениды выбраны из группы, содержащей хлорид, бромид и фторид. Сульфонатные группы, которые здесь используются, являются эфирами сульфоновых кислот. Примеры сульфонатов включают, но не ограничиваются ими, алкилсульфонаты, аралкилсульфонаты, арилсульфонаты и тому подобное.
В одном из осуществлений представлен способ получения 4-аминодифениламина или его замещенных производных, который включает прибавление друг к другу анилина или замещенных производных анилина и азобензола или замещенных производных азобензола или его азокси- или гидразопроизводных в присутствии подходящей системы растворителей, и взаимодействие анилина или замещенных производных анилина с азобензолом или замещенными производными азобензола в присутствии подходящего основания и регулируемого количества протонного вещества при подходящей температуре реакции, равной от около 10oC до около 150oC при определенных параметрах реакций, где мольное отношение протонного вещества к основанию составляет от 0:1 до около 5:1, и далее восстановление продукта взаимодействия анилина или его замещенного производного и азобензола или его замещенного производного в условиях, которые приводят к получению 4-аминодифениламина или его замещенного производного. Кроме того, в соответствии с изобретением предложен способ получения алкилированного ароматического амина или его замещенных производных, которых включает восстановительное алкилирование замещенных ароматических аминов, полученных по изобретению.
Подробное описание изобретения
Изобретение относится к способу получения замещенных ароматических аминов, включающему:
(а) прибавление друг к другу
нуклеофильного соединения, выбранного из группы, содержащей анилин, замещенные производные анилина, алифатические амины, замещенные производные алифатических аминов и амиды, и азосодержащего
соединения, представленного формулой X-R1-N= N-R2-Y, или его азокси- или гидразопроизводных, в присутствии подходящей системы растворителей, и
(b) взаимодействие
нуклеофильного соединения, выбранного из группы, содержащей анилин, замещенные производные анилина, алифатические амины, замещенные производные алифатических аминов и амидов, с азосодержащим
соединением, представленным формулой X-R1-N=N-R2-Y или его азокси- или гидразопроизводным, в присутствии подходящего основания и регулируемого количества протонного вещества при
температуре реакции, равной от около 10oC до около 150oC при определенных параметрах реакции, где мольное отношение протонного вещества к основанию составляет от 0:1 до около 5:1,
где R1 является ароматической группой, R2 выбран из группы, содержащей алифатические и ароматические группы, и X и Y независимо выбраны из группы, содержащей водород, галогены,
-NO2, -NH2, арильные группы, алкильные группы, алкоксигруппы, сульфонатные группы, - SO3H, -OH, -COH, -COOH и алкильные, арильные, арилалкильные или алкиларильные
группы, содержащие, по крайней мере, одну -NH2 группу, где, если R2 является алифатическим, X находится в мета или орто-положении по отношению к R1, и, если R2 является ароматическим, по крайней мере, один из X и Y находится в мета или орто-положении по отношению к R1 и R2, соответственно, и где галогены выбраны из группы,
содержащей хлор, бром и фтор, и
(c) восстановление продукта взаимодействия (b) в условиях, которые приводят к получению замещенного ароматического амина.
Для получения
алкилированных ароматических аминов или их замещенных производных способ по изобретению дополнительно включает:
(d) восстановительное алкилирование замещенных ароматических аминов.
Для получения замещенных ароматических аминов, когда нуклеофильное соединение является амидом, способ по изобретению дополнительно включает:
d') взаимодействие замещенного
ароматического амина с аммиаком в условиях, которые приводят к получению соответствующего замещенного ароматического амина или амида.
Альтернативно, для получения замещенных
ароматических аминов, когда нуклеофильное соединение являете амидом, способ по изобретению дополнительно включает:
(d') взаимодействие замещенного ароматического амина с водой в присутствии
подходящего основного или кислотного катализатора в условиях, которые приводят к получению соответствующего замещенного ароматического амина и кислоты или его соли, соответствующих амиду со стадии
(a).
Замещенные ароматические амины, полученные на стадии (d'), могут быть восстановительно алкилированы с получением соответствующих алкилированных ароматических аминов.
При одном из осуществлений изобретение относится к способу получения 4-АДФА или его замещенных производных, включающему:
(а) прибавление друг к другу анилина или замещенных
производных анилина и азобензола или замещенных производных азобензола или его азокси- или гидразопроизводных в присутствии подходящей системы растворителей, и
(b) взаимодействие анилина или
замещенных производных анилина с азобензолом или замещенными производными азобензола или его азокси- или гидразопроизводным в присутствии подходящего основания и регулируемого количества протонного
материала при температуре реакции, равной от около 10oC до около 150oC при определенных параметрах реакции, где мольное отношение протонного материала к основанию составляет от
0:1 до около 5:1, и
(c) восстановление продукта взаимодействия (b) в условиях, которые приводят к получению 4-АДФА или его замещенных производных.
Для получения алкилированных
п-фенилендиаминов или их замещенных производных способ по изобретению дополнительно включает:
(d) восстановительное алкилирование 4-АДФА или его замещенных производных.
Данное
изобретение, кроме того, относится к способу получения алкилированного ароматического амина или его замещенного производного, включающему:
(a) прибавление друг к другу нуклеофильного
соединения, выбранного из группы, содержащей анилин, замещенные производные анилина, алифатические амины, замещенные производные алифатических аминов или амиды, и азосодержащего соединения,
представленного формулой X-R1-N=N-R2-Y, или его азокси- или гидразопроизводных в присутствии подходящей системы растворителей, и
(b) взаимодействия нуклеофильного
соединения с азосодержащим соединением в присутствии подходящего основания и регулируемого количества протонного материала при температуре реакции, равной от около 10oC до около 150oC при определенных параметрах реакции, где мольное отношение протонного материала к основанию составляет от 0:1 до около 5:1, где R1 является ароматической группой, R2
выбрано из группы, содержащей алифатические и ароматические группы, и X и Y независимо выбраны из группы, содержащей водород, галогены, -NO2, -NH2, арильные группы, алкильные
группы, алкоксигруппы, сульфонатные группы, -SO3H, -OH, -COH, -COOH и алкильные, арильные, арилалкильные и алкиларильные группы, содержащие, по крайней мере, одну -NH2-группу,
где, если R2 является алифатическим, X находится в мета или орто-положении по отношению к R1, и, если R2 является ароматическим, по крайней мере, один из X и Y
находится в мета или орто-положении по отношению R1 и R2, соответственно, и где галогены выбраны из группы, содержащей хлор, бром и фтор, с получением замещенных ароматических
азосоединений и
(c) восстановительное алкилирование продукта взаимодействия (b) в условиях, которые приводят к получению алкилированного ароматического амина или его замещенного производного.
Для получения алкилированных ароматических аминов, когда нуклеофильное соединение является амидом, способ по изобретению дополнительно включает:
(d) взаимодействие алкилированного
ароматического амина или его замещенного производного с аммиаком в условиях, которые приводят к получению соответствующего алкилированного ароматического амина или его замещенного производного и
амида.
Для получения алкилированных ароматических аминов, когда нуклеофильное соединение является амидом, способ по изобретению может альтернативно включать взаимодействие замещенного ароматического азосоединения со стадии (b) с аммиаком в условиях, которые приводят к получению соответствующего замещенного ароматического азосоединения и амида перед восстановительным алкилированием на стадии (c).
Альтернативно, для получения алкилированных ароматических аминов, когда нуклеофильное соединение является амидом, способ по изобретению, кроме того, включает:
(d) взаимодействие алкилированного ароматического амина или его замещенного производного с водой в присутствии подходящего основного или кислотного катализатора в условиях, которые приводят к
получению соответствующего алкилированного ароматического амина или его замещенного производного и кислоты или его соли, соответствующей амиду со стадии (a).
Для получения алкилированных ароматических аминов, когда нуклеофильное соединение является амидом, способ по изобретению может альтернативно включать взаимодействие замещенного ароматического азосоединения со стадии (b) с водой в присутствии подходящего основного или кислотного катализатора в условиях, которые приводят к получению соответствующего замещенного ароматического азосоединения и кислоты или ее соли, соответствующей амиду со стадии (a), перед восстановительным алкилированием на стадии (c).
При получении замещенных ароматических азосоединений мольное отношение нуклеофильного соединения, выбранного из группы, содержащей анилин, замещенные производные анилина, алифатические амины, замещенные производные алифатические амины и амиды, к X-R1-N=N-R2-Y или его азокси- или гидразопроизводным может меняться от большого избытка X-R1-N=N-R2-Y или его азокси- или гидразопроизводных до большого избытка нуклеофильного соединения, выбранного из группы, содержащей анилин, замещенные производные анилина, алифатические амины, замещенные производные алифатических аминов и амидов. Предпочтительно, взаимодействие проводится с применением избытка нуклеофильного соединения, выбранного из группы, содержащей анилин, замещенные производные анилина, алифатические амины, замещенные производные алифатических аминов и амидов. Более предпочтительно, мольное отношение нуклеофильного соединения к X-R1-N= N-R2-Y или азокси- или гидразопроизводным составляет, по крайней мере, около 1:1.
Как использовано здесь, термин "замещенные производные анилина" означает анилин, содержащий один или более электрон акцепторных или электронодонорных заместителей в ароматическом кольце. Подходящие заместители включают, но не ограничиваются ими, галогены, -NO2, -NH2, алкильные группы, алкоксигруппы, сульфонатные группы, - SO3H, -OH, -COOH и арильные, арилалкильные или алкиларильные группы, содержащие, по крайней мере, одну -NH2-группу. Галогены выбраны из группы, содержащей хлор, бром или фтор. Предпочтительные алкильные или алкокси-группы содержат от 1 до 6 атомов углерода. Предпочтительные арильные, арилалкильные или алкиларильные группы содержат от около 6 до около 18 атомов углерода. Примеры замещенных анилиновых производных включают, но не ограничиваются ими, 2- метоксианилин, 4-метоксианилин, 4-хлоранилин, п-толуидин, 4- нитроанилин, 3-броманилин, 3-бро-4-аминотолуол, п-аминобензойную кислоту, 2, 4-диаминотолуол, 2,5-дихлоранилин, 1,4-фенилендиамин, 4,4'-метилендианилин, 1,3,5-триаминобензол и их смеси.
Анинил или замещенные производные анилина могут прибавляться непосредственно или могут образовываться in situ путем прибавления соединения, которое будет образовывать анилин или соответствующее производное анилина в условиях, имеющихся в реакционной системе.
Амиды, которые могут использоваться по данному изобретению, включают ароматические амидные производные, замещенные алифатические амидные производные и диамиды, имеющие формулу:

где R4 и R5, независимо, выбраны из группы, содержащей ароматические группы, алифатические группы и прямую связь, и A выбран из группы, содержащей

Алифатические амиды и замещенные производные алифатических амидов, которые могут использоваться по этому изобретению, представляются формулой:

где n является 0 или 1, R3 выбран из группы, содержащей алкильную, арилалкильную, алкенильную, арилалкенильную, циклоалкильную и циклоалкенильную группы, и X выбран из группы, содержащей водород, -NO2, -NH2, арильные группы, алкоксигруппы, сульфонатные группы, -SO3H, -OH, -COH, -COOH и алкильные, арильные, арилалкильные или алкильные группы, содержащие, по крайней мере, одну -NH2-группу. Предпочтительные алкильные и алкоксигруппы содержат от 1 до около 6 атомов углерода. Предпочтительные арильные, арилалкильные и алкиларильные группы содержат от около 6 до около 18 атомов углерода.
Примеры алифатических амидов и замещенных производных алифатических амидов включают, но не ограничиваются ими, изобутирамид, мочевину, ацетамид, пропиламид и их смеси.
Как он использован здесь, термин "замещенные производные ароматических амидов" обозначает ароматические амиды, содержащие один или более электроноакцепторных или электронодонорных заместителей в ароматическом кольце. Подходящие заместители включают, но не ограничиваются ими, галогены, -NO2, -NH2, алкильные группы, алкоксигруппы, сульфонатные группы, -SO3H, -OH, -COH, -COOH, и алкильные, арильные, арилалкильные или алкиларильные группы, содержащие, по крайней мере, одну -NH2-группу. Галогениды выбраны из группы, содержащей хлор, бром, и фтор. Предпочтительные алкильные и алкоксигруппы содержат от 1 до около 6 атомов углерода. Предпочтительные арильные, арилалкильные и алкиларильные группы содержат от около 6 до около 18 атомов углерода.
Примеры ароматических амидов и замещенных производных ароматических амидов, включают, но не ограничиваются ими, бензамид, 4-метилбензамид, 4-метоксибензамид, 4-хлорбензамид, 2-метилбензамид, 4-нитробензамид, 4-аминобензамид и их смеси.
Диамиды, которые могут применяться в соответствии со способом по изобретению, включают, но не ограничиваются ими, амид адипиновой кислоты, амид щавелевой кислоты, диамид терефталевой кислоты, 4, 4'- дифенилдикарбоксамид и их смеси.
Алифатические амины и замещенные алифатические амины, которые могут применяться по данному изобретению - это соединения, выбранные из группы,
содержащей соединения, представленные формулой X'-R6-NH-R7-Y' и соединения, представленные формулой
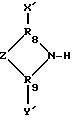
где R6 выбран из группы, содержащей алкильные, алкенильные, циклоалкильные и циклоалкенильные группы, R7 выбран из группы, содержащей прямую связь, алкильные, алкенильные, циклоалкенильные и циклоалкильные группы, R8 и R9 независимо выбраны из группы, содержащей алкильные и алкенильные группы, Z выбран из группы, содержащей прямую связь, -NH-, -N(R10)-, -O- и -S-, где R10 является алкильной группой, и X' и Y' независимо выбраны из группы, содержащей водород, галоген, -NO2, -NH2, арильные группы, алкоксигруппы, сульфонатные группы, - SO2H, -OH, -COH, -COOH, и алкильные, арильные, арилалкильные или алкиларильные группы, содержащие, по крайней мере, одну -NH2-группу. Галогены выбраны из группы, содержащей хлор, бром и фтор. Предпочтительные алифатические группы R6 и R7 содержат от 1 до около 12 атомов углерода. Предпочтительные арильные, арилалкильные и алкиларильные группы содержат от около 6 до около 18 атомов углерода. Предпочтительные алкоксигруппы содержат от 1 до около 6 атомов углерода.
Примеры алифатических аминов и замещенных производных алифатических аминов включают, но не ограничиваются ими, циклогексиламин, 2-бутиламин, изопропиламин, 2-гексиламин, 2- гептиламин, 1,4-диметилпентиламин, 1-метилгептиламин, 1-этил-3-метилпентиламин, 1,3-диметилбутиламин, октиламин, пиперидин, пиперазин, гексаметилендиамин, 2-амино-1-пропанол, 2-амино-1- бутанол, 6-аминогексановую кислоту и их смеси.
Как он использован здесь, термин "азосодержащие соединения" обозначает соединения по изобретению, которые изображены формулой X-R1 -N=N-R2-Y, или их азокси- или гидразопроизводные, где R1 является ароматической группой, R2 выбран из группы, содержащей алифатические и ароматические группы, а X и Y независимо выбраны из группы, содержащей водород, галоген, -NO2, -NH2, арильные группы, алкильные группы, алкоксигруппы, сульфонатные группы, -SO3H, -OH, -COH, - COOH и алкильные, арильные, арилалкильные или алкиларильные группы, содержащие, по крайней мере, одну -NH2-группу. Когда R2 является алифатической группой, X находится в мета или орто-положении по отношению к R1. Когда R2 является ароматическим, по крайней мере, один из X и Y находятся в мета или орто-положении по отношению к R1 и R2, соответственно. Галогены выбраны из группы, содержащей хлор, бром и фтор. Предпочтительные алифатические группы R1 и R2 содержат от 1 до примерно 12 атомов углерода, и предпочтительные ароматические группы R1 и R2 содержат от около 6 до около 18 атомов углерода. Предпочтительные алкильные и алкоксигруппы содержат от 1 до около 6 атомов углерода. Предпочтительные арильные, арилалкильные и алкиларильные группы содержат от около 6 до около 18 атомов углерода. Примеры азосодержащих соединений включают, но не ограничиваются ими, азобензол, замещенные производные азобензола, азоксибензол, 4-(фенилазо) дифениламин, 1,2-дифенилгидразин и их смеси.
Когда азосодержащее соединение является азобензолом, азобензол может быть получен путем окислительного азосочетания анилина в присутствии подходящего основания. Когда нуклеофильным соединением, используемым при взаимодействии с азобензолом, является анилин, и реакция проводится в аэробных условиях, азобензол может быть получен in situ путем окислительного азосочетания анилина в присутствии подходящего основания. Окислительное азосочетание анилина известно в данной области, см. Jeon, S. and Sawyer, D.T.Hidroxid-Induced Synthesis of the Superoxide Ion From Dioxygen and Aniline, Hydroxylamine, or Hudrozine, Inorg. Chem., 1990, Vol. 29, pp. 4612-4615 и условия реакции, указанные здесь для получения замещенных ароматических азосоединений, достаточны для окислительного азосочетания анилина до азобензола.
Как он использован здесь, термин "замещенные производные азобензола" означают азобензол, содержащий один или более электроноакцепторных или электронодонорных заместителей на одном или обоих ароматических кольцах. Подходящие заместители включают, но не ограничиваются ими, галогены, -NO2, -NH2, алкильные группы, алкоксигруппы, сульфонатные группы, - SO3H, -OH, -COOH и арильные, арилалкильные или алкиларильные группы, содержащие, по крайней мере, одну -NH2-группу. Галогены выбраны из группы, содержащей хлор, бром и фтор. Предпочтительные алкильные и алкоксигруппы содержат от 1 до около 6 атомов углерода. Предпочтительные арильные, арилалкильные и алкиларильные группы содержат от около 6 до около 18 атомов углерода. Примеры замещенных производных азобензола включают, но не ограничиваются ими, 3,4'-дихлоразобензол, п-фенилазобензолсульфоновую кислоту, п-(2,4-дигидроксифенилазо)бензолсульфоновую кислоту и их смеси.
Подходящие системы растворителей включают, но не ограничиваются ими, такие растворители, как диметилсульфоксид, нуклеофильные соединения, такие как замещенные производные анилина, анилин и амиды, имеющие температуру плавления ниже температуры реакции, например, расплавленный бензамид, диметилформамид, N-метил-2-пирролидон, пиридин, этиленгликольдиметиловый эфир, амины, такие как диизопропилэтиламин, втор-бутиламин и 2-гептиламин, и тому подобное и их смеси. Как описано более детально ниже, могут использоваться смеси растворителей, в которых объединены один или более подходящие растворители и другой растворитель, такой как регулируемое количество протонного растворителя, например, метанола или воды.
Подходящие основания включают, но не ограничиваются ими, органические и неорганические основания, такие как щелочные металлы, такие как металлический натрий, гидриды щелочных металлов, гидроксиды и алкоксиды, такие как гидрид натрия, гидроксид лития, гидроксид натрия, гидроксид цезия, гидроксид калия, трет-бутоксид калия и тому подобное, включая их смеси. Другие приемлемые основные вещества включают, но не ограничиваются ими, катализаторы межфазного переноса в сочетании с подходящим источником основания, таким как тетразамещенные аммоний-гидроксиды или галогениды, где каждый заместитель независимо выбран из алкильных, арильных или арилалкильных групп, где алкильные, арильные и арилалкильные группы предпочтительно имеют от 1 до около 18 атомов углерода, включая тетраалкиламмоний гидроксиды, например тетраметиламмоний гидроксид, тетраалкиламмоний галогениды, например тетрабутиламмоний хлорид, арилтриалкиламмоний гидроксиды, например фенилтриметиламмоний гидроксид, арилалкилтриалкиламмоний гидроксиды, например бензилтриметиламмоний гидроксид, алкилзамещенные диаммоний гидроксиды, например бис-дибутилэтилгексаметилендиаммоний гидроксид, и другие сочетания катализаторов межфазного переноса и подходящих оснований, такие как соответствующие основания в сочетании с ариламмонийными солями, краун-эфирами и тому подобное, основания аминов, такие как литий, бис(триметилсилил)амид, 2- аминогептан и тому подобное, и алкилмагний-галогениды, включая их смеси. Предпочтительными продуктами для использования в качестве оснований являются гидроксиды щелочных металлов, такие как гидроксид калия, алкоксиды щелочных металлов, такие как трет- бутоксид калия, гидроксиды щелочных металлов или алкоксиды, в сочетании с межфазными катализаторами, такие как гидроксид калия в сочетании с краун-эфирами, и гидроксиды тетраалкиламмония, такие как гидроксид тетраметиламмония или гидроксид тетрабутиламмония.
Предпочтительно, основание прибавляется к нуклеофильному соединению для получения смеси, которая затем объединяется с азосодержащим соединением или замещенным ароматическим азосоединением. Альтернативно, основание может добавляться после того, как нуклеофильное соединение объединено с азосодержащим соединением или замещенным ароматическим азосоединением. Добавление продуктов может проводиться над или под поверхностью смеси.
Для получения замещенных ароматических аминов количество основания, применяемое в соответствии с этим изобретением, может быть удобно выражено в виде мольного отношения подходящего основания к азосодержащему соединению. В широком интервале молярное отношение основания к азосодержащему соединению будет составлять примерно от 1:1 до примерно 10:1, предпочтительно от около 1:1 до около 4:1 и наиболее предпочтительно от около 1:1 до около 2:1.
Реакцию нуклеофильного соединения с азосодержащим соединением проводят при температуре в интервале от около 10oC до около 150oC, как, например, от около 20oC до около 120oC, предпочтительно от около 30oC до около 100oC. Наиболее предпочтительная температура для проведения реакции нуклеофильного соединения с азосодержащим соединением составляет от около 50oC до около 90oC.
Важно регулировать количество протонного материала, присутствующего в реакционной смеси нуклеофильного соединения с азосодержащим соединением. Количество протонного материала, используемого в соответствии с изобретением, может быть удобно выражено в виде мольного отношения по отношению к количеству основания, присутствующего в начале реакции нуклеофильного соединения с азосодержащим соединением. В широком интервале мольное отношение протонного материала к основанию будет составлять от около 0:1 до около 5:1, предпочтительно от 0: 1 до около 3:1 и наиболее предпочтительно от 0:1 до около 1:1. Таким образом, данное взаимодействие можно проводить в безводных условиях. Как он использован здесь в отношении взаимодействия нуклеофильного соединения с азосодержащим соединением, термин "регулируемое количество" протонного материала представляет количество вплоть до такого, которое тормозит реакцию нуклеофильного соединения с азосодержащим соединением. Верхний предел для количества протонного материала, присутствующего в реакции меняется в зависимости от растворителя. Кроме того, количество протонного материала, которое допустимо, будет меняться в зависимости от типа основания, количества основания, катиона основания, используемого в различных системах растворителей. Однако, конкретный верхний предел количества протонного материала для конкретного растворителя, тип и количество основания, катион основания и тому подобное определяются специалистом. Минимальное количество протонного материала, необходимое для поддержания избирательности в отношении желаемых продуктов, будет также зависеть от растворителя, типа и количества основания, катиона основания и тому подобного, используемых и определяемых специалистом.
Так как количество протонного материала, присутствующего в реакции является важным, можно снизить количество протонного вещества настолько, насколько возможно, и потом вновь вернуть в реакционную смесь желаемое количество. Протонные вещества, которые могут быть использованы для добавления в реакционную смесь, известны специалистам и включают, но не ограничиваются ими, воду, метанол, изоамиловый спирт, трет-бутанол и тому подобное, и их смеси. Способы определения количества протонного вещества и способы уменьшения насколько возможно количества протонного материала известны в данной области. Например, количество воды, присутствующее в некоторых реагентах может быть определено путем использования прибора Карла-Фишера, и количество воды может быть снижено отгонкой и/или высушиванием при пониженном давлении, высушиванием в присутствии P2O5 и других агентов, азеотропной отгонкой с использованием, например, ксилола и тому подобное, включая их сочетания.
В одном из осуществлений для регулирования количества протонного материала в процессе взаимодействия нуклеофильного соединения с азосодержащим соединением добавляется осушитель таким образом, чтобы он присутствовал при взаимодействии нуклеофильного соединения с азосодержащим соединением. Например, когда протонный материал является водой, осушитель удаляет воду, присутствующую в процессе взаимодействия нуклеофильного соединения с азосодержащим соединением, что приводит к большей конверсии азосодержащего соединения и дает выход замещенного ароматического азосоединения или замещенного ароматического амина. Как он использован здесь, термин "осушитель" означает вещество, присутствующее в процессе взаимодействия нуклеофильного соединения с азосодержащим соединением дополнительно к используемому подходящему основанию. Примеры подходящих осушителей включают, но не ограничиваются ими, безводный сульфат натрия, молекулярные сита, такие как типа 4A, 5A и 13X, коммерчески доступные от фирмы Union Carbide Corporation, хлорид кальция, дигидрат гидроксида тетраметиламмония, безводные основания, такие как KOH и NaOH, и активированный оксид алюминия.
В другом осуществлении для регулирования количества протонного продукта в процессе взаимодействия нуклеофильного соединения с азосодержащим соединением протонный продукт непрерывно удаляется из реакционной смеси путем отгонки. Если присутствующий протонный продукт образует азеотропную смесь с одним из соединений в реакционной смеси, протонный продукт можно удалять путем непрерывной азеотропной отгонки протонного продукта с использованием азеотропной смеси. Непрерывное удаление протонного продукта дает возможность использования меньших количеств основания при взаимодействии нуклеофильного соединения и азосодержащего соединения, в то же время обеспечивая очень высокую степень превращения азосодержащего соединения и превосходный выход замещенного ароматического азосоединения или замещенного ароматического амина.
Обычно, взаимодействие можно осуществлять в аэробных или анаэробных условиях. Когда нуклеофильное соединение является вторичным алифатическим амином, взаимодействие можно проводить только в аэробных условиях, т.е. в анаэробных условиях применимы только алифатические амины или замещенные производные алифатических аминов, имеющие формулу X'-R6-NH2. В аэробных условиях взаимодействие проводят, по существу, так, как описано выше, в реакционных условиях с доступом кислорода, обычно с доступом воздуха. В анаэробных условиях давление, при котором проводится взаимодействие, может меняться, и оптимальное давление, так же, как и оптимальное сочетание давления и температуры легко определяются специалистом. Например, взаимодействие можно осуществлять при давлении, меняющемся в интервале от около 0 фунт/дюйм2 (0 кг/см2) до около 250 фунт/дюйм2 (17,6 кг/см2), так, например, от около 14 фунт/дюйм2 (1 кг/см2) до около 150 фунт/дюйм2 (10,5 кг/см2). В анаэробных условиях взаимодействие можно осуществлять при атмосферном давлении или пониженном или повышенном давлении в присутствии инертного газа, такого как азот или аргон. Оптимальные условия для конкретного набора параметров реакции, таких как температура, основание, растворитель и тому подобное, легко определяются специалистом в данной области при применении методик данного изобретения.
Восстановление замещенных ароматических азосоединений до замещенных ароматических аминов в соответствии со способом по изобретению можно проводить путем каталитического гидрирования или путем обычных способов восстановления. Примеры общеизвестных способов восстановления включают использование источника гидрида, например, боргидрида натрия, в сочетании с подходящим катализатором, таким как палладий- или платина-на-угле, и использование цинковой пыли в сочетании с уксусной кислотой. Предпочтительно это восстановление проводится путем каталитического восстановления, где гидрирование осуществляют под давлением водорода в присутствии подходящего катализатора гидрирования. Примеры подходящих металлических катализаторов гидрирования включают никель, палладий, платину, родий и тому подобное. Предпочтительные катализаторы гидрирования включают платину-на-угле, палладий-на-угле и никель Ренея. Гидрирование можно проводить в различных растворителях, таких как те растворители, которые используются при взаимодействии нуклеофильного соединения с азотсодержащим соединением. Примеры подходящих растворителей для гидрирования включают, но не ограничиваются ими, толуол, ксилол, анилин; этанол, диметилсульфоксид, воду и их смеси. Предпочтительно гидрирование проводится с использованием катализатора платина-на-угле или палладий-на-угле в подходящем растворителе, таком как, например, либо этанол, анилин или диметилсульфоксид, их смеси, либо смеси, которые включают воду в качестве растворителя. Когда используют каталитическое гидрирование, давление водорода будет от около 30 фунт/дюйм2 (2,1 кг/см2) H2 до около 2500 фунт/дюйм2 (176 кг/см2) H2, предпочтительно от около 50 фунт/дюйм2 (3,5 кг/см2) H2 до около 340 фунт/дюйм2 (23,9 кг/см2) H2. Температура каталитического гидрирования будет от около 50oC до около 150oC, предпочтительно от около 70oC до около 120oC. Время, необходимое для каталитического гидрирования, будет, в основном, колебаться в пределах от около 30 минут до около 24 часов, предпочтительно от около 2 часов до около 12 часов. В случае восстановления с использованием цинковой пыли и уксусной кислоты температуры восстановления может быть такой низкой, как комнатная температура.
Восстановительное алкилирование замещенных ароматических аминов, например 4-АДФА или замещенных ароматических азосоединений для получения алкилированных ароматических аминов или их замещенных производных, применимых в качестве антиоксидантов или антиозонантов, может проводиться любыми из нескольких хорошо известных способов. См. , например, патент США 4900868. Предпочтительно, замещенный ароматический амин или замещенное ароматическое азосоединение и подходящий кетон или альдегид взаимодействуют в присутствии водорода и подходящего катализатора. Подходящие катализаторы включают никелевый, палладиевый, платиновый и родиевый металлические катализаторы. Предпочтительными катализаторами являются платиновый и палладиевый катализаторы, такие как платина-на-угле и палладий-на-угле. Подходящие кетоны включают, но не ограничиваются ими, метилизобутилкетон (МИБК), ацетон, метилизоамилкетон и 2-октанон. Условия реакции для восстановительного алкилирования могут быть теми же самыми, что и условия реакции восстановления, описанные выше. Необходимо отметить, что восстановление замещенных ароматических азосоединений и алкилирование восстановленного материала может проводиться в том же самом реакционном сосуде с использованием кетона в качестве растворителя. См., например, патенты США 3414616, 4463191 и Bannerjee et al., J.Chem. Soc. Chem. Coom. Vol. 18, pp. 1275-1276 (1988).
В осуществлении, когда нуклеофильное соединение является амидом, после восстановительного алкилирования проводят аминолиз или гидролиз, может также проводиться второе восстановительное диалкилирование для получения диалкилированного продукта.
Аминолиз замещенных ароматических аминов или алкилированных замещенных ароматических аминов, содержащих ароматическую амидную связь, которые могут быть получены взаимодействием амида в качестве нуклеофильного соединения с азосодержащим соединением с получением замещенного ароматического азосоединения с последующим восстановлением или восстановительным алкилированием замещенного ароматического азосоединения, может проводиться путем взаимодействия замещенного ароматического амина или алкилированного замещенного ароматического амина с помощью аммиака с получением соответствующего замещенного ароматического амина или алкилированного замещенного ароматического амина и амида, которые могут быть возвращены в процесс. См. например, Jenckes, W. Р. , J Am. Chem. Soc., Vol. 92, pp. 3201-3202 (1970). Аммиак может использоваться в реакции аминолиза как в виде аммиака, так и в виде гидроксида аммония. Если присутствует гидроксид аммония, взаимодействие может привести к получению кислоты, соответствующей исходному амидному продукту, в дополнение к исходному амидному продукту. Предпочтительно, замещенный ароматический амин, содержащий ароматическую амидную связь, подвергают взаимодействию с аммиаком в присутствии растворителя, например метанола. Кроме того, аминолиз замещенных ароматических азосоединений, содержащих ароматическую амидную связь, которые могут быть получены взаимодействием амида в качестве нуклеофильного соединения с азосодержащим соединением, может проводиться путем взаимодействия замещенного ароматического азосоединения с аммиаком для получения соответствующего замещенного ароматического азосоединения и амида перед восстановлением или восстановительным алкилированием замещенного ароматического азосоединения.
Гидролиз замещенных ароматических аминов или алкилированных замещенных ароматических аминов, содержащих ароматическую амидную связь, которые могут быть получены взаимодействием амида в качестве нуклеофильного соединения с азосодержащим соединением с получением замещенного ароматического азосоединения и последующим восстановлением или восстановительным алкилированием замещенного ароматического азосоединения, может проводиться путем взаимодействия замещенного ароматического амина или алкилированного замещенного ароматического амина с водой в присутствии подходящего основного или кислотного катализатора с получением соответствующего замещенного ароматического амина или алкилированного замещенного ароматического амина и кислоты или ее соли, соответствующей исходному амидному продукту. Кроме того, гидролиз замещенных ароматических азосоединений, содержащих ароматическую амидную связь, которые могут быть получены путем реакции амида в качестве нуклеофильного соединения с азосодержащим соединением, может проводиться путем взаимодействия замещенного ароматического азосоединения с водой в присутствии подходящего щелочного или кислотного катализатора с получением соответствующего замещенного ароматического азосоединения и кислоты или ее соли, соответствующей исходному амидному материалу, перед восстановлением или восстановительным алкилированием замещенного ароматического азосоединения. Примеры подходящих основных катализаторов включают, но не ограничиваются ими, гидроксиды щелочных металлов, гидроксиды щелочноземельных металлов, алкоксиды щелочных металлов, гидроксиды тетраалкиламмония, гидроксид аммония и тому подобное и их смеси. В данном случае предпочтительно использовать основной катализатор, так как выбранные подходящие основания, используемые при взаимодействии амида с азосодержащим соединением могут также использоваться в качестве основного катализатора в реакции гидролиза. Температура реакции гидролиза должна обычно находиться в интервале от около 60oC до около 120o C.
При предпочтительном осуществлении изобретения восстановление или восстановительное алкилирование проводится в присутствии воды, например, вода добавляется к реакционной смеси в конце взаимодействия нуклеофильного соединения и азосодержащего соединения. Использование воды в процессе восстановления или восстановительного алкилирования особенно удобно, когда подходящее основание, используемое при реакции нуклеофильного соединения и азосодержащего соединения, является водорастворимым. Когда используемое подходящее основание является водорастворимым, количество добавляемой воды предпочтительно должно равняться, по крайней мере, количеству, необходимому для экстрагирования подходящего основания из органической фазы.
Предусмотренные эквиваленты реагентов и реагирующих веществ, представленные выше, такими являются реагентами и реагирующими веществами или веществами, соответствующими им и имеющими те же основные свойства, где одна или более разных групп, например, -NO2, являются просто вариантами и не являются существенными для данной реакции. Кроме того, когда заместитель указывается как, или может быть, водородом, точная химическая природа заместителя, отличного от водорода, находящемся в этом положении, не является существенной, поскольку он не оказывает отрицательного воздействия на общую активность и/или протекание синтеза.
Химические реакции, описанные выше, в основном, представлены с точки зрения их наиболее широкого применения в соответствии со способом по изобретению. Иногда условия реакции не могут быть воспроизведены таким образом, как конкретно описано для каждого реагирующего вещества и реагента в раскрываемом объеме. Например, некоторые подходящие основания не могут быть так же растворимы в одном растворителе, как в других. Реагирующие вещества и реагенты, для которых это имеет место, могут быть легко определены специалистами в данной области. Во всех таких случаях взаимодействие может быть успешно осуществлено с помощью обычных модификаций, известных специалистам, например путем соответствующей регулировки температуры, давления и тому подобного, путем замены на альтернативные общеизвестные реагенты, такие как другие растворители или другие основания, путем обычной модификации условий реакции и тому подобного, или же для способа по изобретению должны быть применены другие реакции, описанные здесь, или иные общепринятые. Во всех примерах по получению все исходные продукты являются известными или их легко можно получить из известных исходных продуктов.
ПРИМЕРЫ
Продукты и методы: анилин, производные анилина и азобензол от фирмы Aldrich Chemical имели высокую степень чистоты и использовались без дополнительной
очистки.
Растворители от фирмы Aldrich Chemical были марки "безводный". Гидроксид тетраметиламмония представлен в виде пентагидрата.
Исследование ВДЖХ: Для анализа реакционных смесей применяли ВДЖХ с обращенной фазой. Использовали 5 мкм Beckman/Altex Ultrasphere-ODS (4,6 х 150 мм) колонку с бинарной градиентной насосной системой.
Для контроля всех реакций использовали ВДЖХ серии Waters 600 с колонкой Vydas 201HS 54 (4,6 х 250 мм) и определение в УФ области при 254 нм. Во всех случаях использовался стандартный метод наружного анализа. Аутеничные образцы продуктов, которые используются в качестве стандартов, получали известными из литературы методами (см. табл. 1 в конце описания).
ПРИМЕР 1
Этот пример
иллюстрирует действие протонного продукта на получение 4-(фенилазо)дифениламина при взаимодействии анилина с азобензолом в присутствии основания и катализатора межфазного переноса.
Смесь анилина (1,25 г), изобензола (0,45 г), трет-бутоксида калия (0,55 г) и 18-краун-6 (0,65 г) перемешивали в атмосфере азота. К реакционной смеси добавляли различные количества воды, и раствор нагревали до 80oC в течение двух часов, после чего отбирали аликвоту и анилизировали с помощью ВДЖХ (см. табл. 2 в конце описания).
ПРИМЕР 2
Этот пример
иллюстрирует получение 4-(фенилазо)дифениламина и его замещенных производных при взаимодействии анилина или замещенных производных анилина с азобензолом.
(a) 10 ммоль азобензола, 20 ммоль трет-бутоксида калия и 10 ммоль 18-краун-6 перемешивали в 10 г анилина в атмосфере азота при 80oC в течение 30 минут. Взвешенную аликвоту исследовали путем ВДЖХ и было обнаружено, что образец содержит 40% 4-(фенилазо)дифениламина, 50% азобензола и 10% гидразобензола.
(b) 10 ммоль азобензола, 20 ммоль трет-бутоксида калия и 10 ммоль 18-краун-6 перемешивали в 5 г п-анизидина в атмосфере азота при 60oC в течение 12 часов. Для гомогенизации раствора добавляли 10 мл 90% метанола. Взвешенную аликвоту исследовали путем ВДЖХ и было обнаружено, что образец содержит 80% (4-(4-метоксифенилазо) дифениламина и 19% азобензола.
(c) 10 ммоль азобензола, 20 ммоль трет-бутоксида калия и 10 ммоль 18-краун-6 перемешивали в 5 г п-хлоранилина в атмосфере азота при 70oC в течение 12 часов. 10 мл 90% метанола добавляли для гомогенизации раствора. Взвешенную аликвоту исследовали путем ВЭЖХ и было обнаружено, что образец содержит 31% 4-(4- хлорфенилазо) дифениламина, 38% гидразобензола и 30% азобензола.
(d) 10 ммоль азобензола, 20 ммоль трет-бутоксида калия и 10 ммолей 18-краун-6 перемешивали в 5 г п-толуидина в атмосфере азота при 80oC в течение 12 часов. Добавляли 10 мл 90% метанола для гомогенизации раствора. Взвешенную аликвоту исследовали путем ВЭЖХ и было обнаружено, что образец содержит 60% 4- (толуилфенилазо) дифениламина и 40% азобензола.
(e) 10 ммоль азобензола, 5 г п-нитроанилина, 20 ммоль трет-бутоксида калия и 10 ммоль 18-краун-6 перемешивали в 4 мл ДМСО в атмосфере азота при 100oC в течение 72 часов. Для гомогенизации раствора добавляли 10 мл 90% метанола. Взвешенную аликвоту исследовали путем ВЭЖХ и было обнаружено, что образец содержит 23% 4-(нитрофенилазо)дифениламина и 74% азобензола.
(f) 10 ммоль азобензола, 2 г 1,4-фенилендиамина, 20 ммоль трет-бутоксида калия и 10 ммоль 18-краун-6 перемешивали в 4 мл ДМСО в атмосфере азота при 100oC в течение 72 часов. Для гомогенизации раствора добавляли 10 мл 90% метанола. Взвешенную аликвоту исследовали путем ВДЖХ и было обнаружено, что образец содержит 90% 4-(аминофенилазо)-дифениламина.
ПРИМЕР 3
Этот пример иллюстрирует получение 4-(фенилазо)дифениламина при взаимодействии анилина с азобензолом.
75 мл 25% водного раствора тетраметиламмония гидроксида выпаривали досуха при 60oC/20 мм рт.ст. с последующим добавлением 18,5 г азобензола и 75 мл анилина. Раствор перемешивали при 60o C/20 мм рт. ст. в течение 4 часов, отгоняли примерно 30 мл анилина и затем добавляли 50 мл воды. Исследование анилинового раствора показало наличие 99% выхода 4-(фенилазо)дифениламина и 6% п-метиланилина по данным ВДЖХ в расчете на изобензол.
ПРИМЕР 4
Этот пример иллюстрирует получение 4-(фенилазо)дифениламина в аэробных условиях.
Раствор 25% водного гидроксида тетраметиламмония (8 мл) концентрировали в вакууме при 75oC до образования твердого вещества. Добавляли азобензол (1,8 г) и анилин (10 мл) и раствор перемешивали в тех же самых условиях в течение 4 часов и затем в присутствии воздуха в течение 12 часов. Анализ реакционной смеси с помощью ВДЖХ показал 90% выход 4-(фенилазо) дифениламина.
ПРИМЕР 5
Этот пример иллюстрирует каталитическое гидрирование 4-(фенилазо)дифениламина до 4-АДФА.
К раствору 4-(фенилазо)дифениламина/анилина, полученному путем взаимодействия азобензола с анилином в присутствии гидроксида тетраметиламмония, добавляли 5 г 1% платины-на-угле и гидрировали при 2000 фунт/дюйм2 (141 кг/см2) водорода и 120oC в течение 2 часов. Раствору давали охладиться до комнатной температуры и катализатор отфильтровывали и промывали метанолом. Отбирали взвешенную аликвоту, и исследовали с помощью ВДЖХ и было обнаружено, что выход 4-аминодифениламина составляет 83%.
ПРИМЕР 6
Этот пример иллюстрирует получение 4-АДФА при взаимодействии анилина с азобензолом с образованием 4-(фенилазо)дифениламина с
последующим каталитическим гидрированием реакционной смеси.
Раствор 25% водного гидроксида тетраметиламмония (8 мл) концентрировали в вакууме при 75oC до образования твердого вещества. Добавляли азобензол (1,8 г) и анилин (10 мл) и раствор перемешивали в тех же самых условиях в течение 4 часов и затем в присутствии воздуха в течение 12 часов. Анализ реакционной смеси с помощью ВДЖХ показал 90% выход 4-(фенилазо)дифениламина. К реакционной смеси добавляли воду (10 мл) и 1 г 1% катализатора платина-на-угле. Раствор переносили в 300 см3 автоклав из нержавеющей стали и гидрировали при давлении водорода 70 фунт/дюйм2 (4,9 кг/см2) при 70oC в течение 12 часов. Анализ органического слоя реакционной смеси показал 90% выход 4-АДФА в расчете на 4-(фенилазо) дифениламина.
ПРИМЕР 7
Этот пример иллюстрирует восстановление 4-(фенилазо) дифениламина до 4-АДФА и анилина с использованием цинковой
пыли и уксусной кислоты.
4-(Фенилазо)дифениламин (0,3 г) растворяли в 5 мл этанола. К вышеуказанному раствору добавляли 0,07 г цинковой пыли с последующим добавлением 1 мл уксусной кислоты. Раствор перемешивали в атмосфере азота в течение 30 минут при комнатной температуре и затем твердое вещество удаляли путем фильтрации. Отбирали взвешенную аликвоту для анализа путем ВДЖХ и было определено, что выход составляет 100% 4-аминодифениламина и 100% анилина, в расчете на 4-(фенилазо)дифениламина.
Реферат
Описывается способ получения замещенных ароматических аминов, который включает прибавление друг к другу нуклеофильного соединения и азосодержащего соединения в присутствии подходящей системы растворителей, взаимодействия нуклеофильного соединения с азосодержащим соединением в присутствии подходящего основания и регулируемого количества протонного продукта при температуре, равной примерно 10 - 150oС, в ограниченных реакционных параметрах, где мольное отношение протонного продукта к основанию составляет от 0:1 до около 5: 1, и восстановление продукта взаимодействия нуклеофильного соединения и азосодержащего соединения в условиях, которые приводят к получению замещенного ароматического амина. Технический результат - упрощение процесса. 2 с. и 21 з.п.ф-лы, 2 табл.

Комментарии