Устройство и способ выделения твердой фракции из образца текучей среды - RU2480522C2
Код документа: RU2480522C2
Чертежи












Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка подана с испрашиванием приоритета по предварительной заявке UK № 0704180.9, поданной 2 марта 2007, предварительной заявке UK № 0722448.8, поданной 15 ноября 2007, и предварительной заявке UK № 0801901.0, поданной 1 февраля 2008, содержание которых полностью включено в настоящую заявку.
Область техники
Данное изобретение относится к выделению твердой фракции из образца текучей среды. В частности, данное изобретение относится к устройству и способам для выделения лечебной клеточной фракции из биологического образца, например образца костного мозга.
Уровень техники
Клетки-предшественники могут дифференцироваться во многих направлениях и, соответственно, потенциально подходят для различных областей лечебной помощи. Полагают, что обогащенная фракция этих клеток, поставляемая к участку больной или поврежденной ткани, может оказывать максимальный лечебный эффект благодаря ускоренному восстановлению тканей. Обычно клетки-предшественники, содержащиеся в гетерогенной смеси нетерапевтических клеток в некоторых тканях и текучих средах млекопитающих являются чрезвычайно редкой популяцией клеток (Caplan, 2005). Имеются публикации, описывающие различные способы и устройства, обеспечивающие захват клеток, включая седиментацию (Takazawa & Tokashiki, 1989), центрифугирование (Apelman и др., 1992; Jaeger, 1992), фильтрацию с помощью вращающихся фильтров (Himmerlflab и др., 1969), а также микрофильтрацию в поперечном потоке (Maiorella и др., 1991). Однако все они имеют ряд недостатков. При седиментации наблюдается низкая скорость осаждения клеток и замедление процесса сепарации. В основе устройств для центрифугирования лежит принцип создания радиальной силы, обеспечивающей выведение клеток из текучей среды и, несмотря на возможность быстрого получения высокого выхода препарата, использование этих устройств обычно связано с высокими затратами. Кроме того, существует потенциальная опасность повреждения или нежелательного изменения, например клеток-предшественников, из-за высоких тангенциальных напряжений. При фильтрации с помощью вращающихся фильтров и фильтров поперечного потока используются мембраны, обеспечивающие фильтрацию взвеси клеток, при этом такие мембраны восприимчивы к засорению, что влечет за собой потерю эксплуатационных качеств. К другим способам сепарации с использованием подобных фильтров относятся фильтрация с контролем сдвига (Vogel и Kroner, 1999), фильтрация с тангенциальным потоком (Radlett, 1972) и динамическая фильтрация. В этом случае скорость и эффективность сепарации зависит от степени загрязнения. Динамическая фильтрация основана на принципе относительного движения между мембраной и корпусом для создания сдвигового потока независимо от потока, проходящего через фильтр (Castilho & Medrohno, 2002). К наиболее распространенным устройствам динамической фильтрации относятся вихревые фильтры и фильтры с вращающимися дисками (Stromberg и др., 1989). Авторы Karumanchi и др. (2002) опубликовали обзор способов сепарации для клеток и биомакромолекул под действием поля, в которых для достижения желаемой сепарации используют электрические, магнитные и акустические явления. Диэлектрофорез представляет собой боковое движение незаряженных частиц, обусловленное воздействием поляризации, создаваемой неоднородными электрическими полями (Docoslis и др., 1997, 1999). Этот способ может использоваться только для среды с очень низкой электрической проводимостью, в противном случае происходит перегрев текучей среды. Способы магнитной сепарации делятся на два типа. Способы первого типа основаны на том, что клетки подлежащие разделению обладают магнитными свойствами (например, красные кровяные тельца, бактерии обладающие свойствами магнитотаксиса), а в способах второго типа немагнитный компонент требуемой смеси должен быть намагничен посредством чувствительного к магнитному полю объекта. В обоих случаях, для выполнения сепарации, текучую среду необходимо подвергнуть воздействию магнитного поля. Магнитная сепарация широко используется для разделения множества клеток, включая обработку костного мозга для обогащения клетками-предшественниками (Roath и др., 1990). Для разделения микроорганизмов и клеток широко применяются акустические сепараторы, причем почти все они основаны на использовании ультразвуковых волн. Удержание клеток с помощью ультразвука достигается благодаря формированию стоячих волн, при котором ультразвуковая волна отражается в направлении, обратном направлению ее распространения. Клетки оказываются захваченными в узловых плоскостях давления стоячей волны. Авторами Kilburn и др., (1989), и в патентном документе W095/001214 впервые сообщалось о возможности использования этих волн для отделения клеток от взвеси. Позже появилось множество других сообщений об использовании этого способа (Coakley и др., 1994; Dobelhoof-Dier, 1994; Gaida и др. 1996; Gorenfio и др., 2003, 2004). Ультразвуковые сепараторы требуют тщательной настройки и обычно обладают ограниченной пропускной способностью, обусловливающей извлечение небольшого объема клеток. Кроме того, данный способ используется для удаления гомогенной популяции клеток из жидкой фазы и, соответственно, не подходит для захвата клеток определенной популяции из гетерогенной смеси.
Настоящим изобретением предлагается устройство и способы для выделения твердой фракции из образца текучей среды. В частности настоящим изобретением предлагается способ выделения фракции клеток из гетерогенной смеси клеток, содержащейся в образце текучей среды. Процедура выделения клеток является одноэтапной, при этом разделение клеток основано на принципе механической фильтрации образца с использованием только физических средств.
Сущность изобретения
В соответствии с одним аспектом настоящего изобретения предлагается устройство для выделения твердой фракции из образца текучей среды, причем данное устройство сдержит фильтрационный блок, содержащий:
генерирующий акустические волны элемент,
по меньшей мере один фильтр, который делит указанный блок на предфильтрационную камеру для вмещения образца текучей среды, и послефильтрационную камеру для вмещения текучей среды, способной передавать акустические волны,
подложку, выполненную с возможностью соединения с послефильтрационной камерой, причем данная подложка способна резонировать при воздействии на нее акустической волны,
в котором
генерирующий акустические волны элемент выполнен с возможностью соединения с указанной подложкой так, что генерирующий акустические волны элемент вызывает резонирование подложки, которая, в свою очередь, передает акустическую стоячую волну как через текучую среду в послефильтрационной камере, так и через образец текучей среды в предфильтрационной камере.
Передача акустической стоячей волны через текучие среды, находящиеся в фильтрационном блоке приводит к возмущению указанных текучих сред в ходе выделения, либо в непрерывном, либо в импульсном режиме. Благодаря такому возмущению минимизируется возможность загрязнения и засорения фильтра.
В вариантах осуществления настоящего изобретения, в которых данное устройство используется для выделения фракции клеток из образца текучей среды, возмущение текучих сред в данном блоке имеет дополнительное преимущество, которое заключается в сведении к минимуму времени контакта клеток с фильтром, или времени пребывания клеток в предфильтрационной камере. Такое решение является желательным, поскольку если клетки находятся в контакте с поверхностью фильтра или достаточно близко к ней, то они стремятся под действием давления окружающей текучей среды проникнуть через поры фильтра. Подобное проникновение клеток через поры возможно в результате их деформации, однако во время такого проникновения клетки могут подвергаться нежелательным напряжениям, например напряжению сдвига, которые могут иметь вредные последствия для клетки. В частности, было показано, что напряжение сдвига оказывает существенное влияние на функционирование белых кровяных клеток (Carter и др., 2003). Таким образом, желательно предотвратить прохождение через фильтр интересующих клеток. В связи с этим, указанный фильтр выполнен таким образом, что допускает прохождение текучей среды и других клеточных фракций и одновременно удерживает интересующие клетки в предфильтрационной камере.
Генерирующий акустические волны элемент представляет собой устройство, которое может генерировать поле акустических волн в ответ на электрический сигнал. Например, в простом громкоговорителе при создании акустической волны электрический сигнал физически прогибает мембрану при определенной амплитуде и частоте. Другие акустические элементы содержат пьезоэлектрические преобразователи, создающие энергию вибрации в ответ на приложенное переменное напряжение, при этом физическая вибрация передается к текучей среде в виде акустического воздействия. Примерами пьезоэлектрических элементов являются керамические диски с электродами из металлической пленки, расположенными на каждой стороне, причем данные тонкие пьезоэлектрические пленки, как правило, выполнены из окиси цинка.
Использование генерирующего акустические волны элемента, соединенного с подложкой, способной к вхождению в резонанс, имеет ряд преимуществ перед использованием одного акустического элемента. Акустический элемент не входит в непосредственный контакт с текучей средой, поскольку данный элемент выполнен таким образом, что лучший резонанс достигается когда он прикреплен к материалу подложки, имеющему большую площадь, чем диффузор самого элемента. Это означает, что при использовании небольшого акустического элемента к текучей среде может быть передано большее количество энергии. В целом, такое решение значительно улучшает эффективность использования энергии и повышает зону обслуживания данным устройством, что является особенно предпочтительным при обработке больших объемов текучей среды. Подходящий акустический элемент можно приобрести в компании NXT Technology Limited (Гонконг), модель №RM-ETN0033K19C-2K01.
В вариантах осуществления данного изобретения генерирующий акустические волны элемент создает акустическую стоячую волну с частотой в диапазоне около 300-700 Гц. Между объемом текучей среды и требуемой оптимальной частотой существует взаимосвязь. Следовательно, согласно предпочтительному варианту осуществления данного изобретения пользователь может рассчитать частоту акустической стоячей волны в зависимости от объема образца текучей среды. Например, для образца объемом около 5-15 мл оптимальная частота акустической стоячей волны составляет около 300-700 Гц.
В конкретном варианте осуществления данного изобретения генерирующий акустические волны элемент представляет собой громкоговоритель с мощностью 0,4 Вт, сопротивлением 4 Ом, размахом амплитуды около 4,2-7,36 В и частотным диапазоном около 300-700 Гц.
В вариантах осуществления данного изобретения подложка расположена, по существу, параллельно фильтру.
В вариантах осуществления данного изобретения подложка расположена у основания фильтрационного блока.
Подложка может представлять собой элемент громкоговорителя, выполненного в соответствии с технологией DML (Distributed Mode Loudspeaker (громкоговоритель с распределенными модами колебаний)). Такой громкоговоритель содержит тонкую пластину, к которой подсоединен возбудитель (например, электродинамический возбудитель, выполненный в соответствии с технологией NXT). Возбудитель содержит постоянный магнит и звуковую катушку. При подаче на звуковую катушку аудиосигнала она начинает совершать колебательное движение в осевом направлении.
В обычных громкоговорителях перемещение катушки приводит к перемещению диффузора, который действует как поршень, вызывая колебания воздуха, тогда как в основе работы громкоговорителей с распределенными модами колебаний лежит иной принцип, основанный на возбуждении в тонкой пластинке множества изгибных резонансных колебаний. В результате в пластинке получают колебание сложной формы, создающее в свою очередь слышимый звук.
В соответствии с заявленным изобретением для осуществления процесса фильтрации в предложенном устройстве необходимо создать резонанс текучей среды, находящейся над подложкой. При этом в текучей среде, находящейся в постфильтрационной камере возникает стоячая волна.
Путем изменения жесткости, диаметра, толщины, массы или плотности подложки можно регулировать резонансную частоту системы. Так, чем жестче подложка, тем выше резонансная частота и, соответственно, чем гибче подложка, тем ниже резонансная частота.
Подложка, используемая совместно с возбудителями, выполненными по технологии NXT, может, представлять собой составной диск, например диск, содержащий центральный лист из пластика, помещенный между двумя слоями из нержавеющей стали. Путем изменения материала центрального листа и толщины оболочек, можно регулировать жесткость подложки, и, следовательно, резонансную частоту системы.
Данная подложка может быть выполнена из любого подходящего материала, способного входить в резонанс в ответ на воздействие генерирующего акустические волны элемента, например из металла, керамического или полимерного материала. Поскольку данная подложка может входить в контакт с используемой в устройстве текучей средой, предпочтительно, ее выполняют из медицинского материала, что уменьшает опасность любого загрязнения токсичным веществом.
Подложка может быть соединена с послефильтрационной камерой любым подходящим способом, например путем приклеивания, сварки, винтового соединения или прессовой посадки. Конкретный способ соединения подложки с послефильтрационной камерой не влияет на технический результат, обеспечиваемый изобретением.
В вариантах осуществления данного изобретения генерирующий акустические волны элемент соединен с подложкой с возможностью съема. Такое соединение достигается различными средствами, известными специалисту в данной области техники, например посредством клейкого вещества. Такое решение особенно предпочтительно при условии использования одноразового фильтрационного блока, так как акустический элемент может быть отсоединен и использован повторно на других блоках.
Перемещение образца текучей среды через фильтр может представлять собой пассивное перемещение под действием гравитационных сил. Согласно альтернативному варианту осуществления, могут применять активное перемещение образца текучей среды через фильтр под воздействием положительного или отрицательного давления. Расход образца текучей среды через фильтр может быть постоянным или переменным.
В вариантах осуществления данного изобретения текучая среда, которая может передавать акустическую волну и помещенная в послефильтрационную камеру, также действует как промывочная текучая среда. В этом варианте имеется нагнетательный насос, который продвигает промывочную текучую среду из послефильтрационной камеры через фильтр к предфильтрационной камере. Одновременно откачивающий насос вытягивает текучую среду из предфильтрационной камеры к послефильтрационной камере. Таким образом, образец текучей среды и промывочная текучая среда последовательно перемещаются в противоположных направлениях через фильтр так, что в результате образец текучей среды перемещается в послефильтрационную камеру, а отделяемая твердая фракция удерживается в предфильтрационной камере.
Последовательное перемещение образца текучей среды и промывочной текучей среды в противоположных направлениях через фильтр предотвращает загрязнение или засорение фильтра, дополнительно увеличивая эффективность процесса отделения. Указанное последовательное перемещение может быть цикличным, при этом одна фаза цикла представляет собой быструю обратную промывку фильтра с использованием промывочной текучей среды, а вторая фаза цикла - пропускание образца текучей среды вниз через фильтр. Данный циклический процесс продолжают для того, чтобы уменьшить объем образца до достаточной величины и одновременно удержать достаточный объем текучей среды выше фильтра так, чтобы фракция частиц находилась в растворе. Обычно объем образца уменьшают приблизительно в 10 раз.
В других вариантах осуществления данного изобретения во время процесса выделения выполняют встряхивание самого фильтра. Данное встряхивание можно получить, например, посредством соединения фильтра с подвижным держателем. Встряхивание может выполняться в вертикальном или боковом направлении, или с обеспечением сочетания этих направлений. В альтернативных вариантах осуществления данного изобретения фильтр может приводиться во вращение.
Другие средства дополнительного возмущения промывочной текучей среды и/или образца текучей среды включают использование вращающегося элемента (например, крыльчатки или вкладыша в текучей среде), вращения стенок камеры, или вращения стенок камеры, в которой стенки выполнены с дефлекторами, или использование активного чипа.
По термином "образец текучей среды" подразумевают любую текучую среду, из которой необходимо выделить твердые компоненты. Образец может быть получен из любого источника, например организма, группы организмов одного и того же вида, или разных видов, из окружающей среды такой, как тело, или вода, или грунт, или из пищевого источника, или промышленного источника. Образец может представлять собой обработанный или необработанный образец. Образец может быть газом или жидкостью. Образец может быть экстрактом, например жидким экстрактом из образца грунта или пищи.
Данное устройство, в частности, подходит для жидкостей, которые обладают вязкостью и повышенной тенденцией к загрязнению фильтра посредством образования пленки или покрытия на его поверхности. Обратная промывка промывочной текучей средой через фильтр и, опционально, возмущение образца текучей среды и/или фильтра значительно уменьшают загрязнение фильтра, а также поддерживают фракцию находящихся в предфильтрационной подкамере частиц в растворе.
Источником данного образца может служить субъект, который может представлять собой любой организм, например животное или человека. Животное может представлять собой любое дикое или домашнее животное. Домашнее животное может быть, например, комнатным животным, таким как собака или кошка.
Данный образец может быть биологическим образцом, например образцом крови, выпота, мочи, спермы, аспирата костного мозга, спинномозговой жидкости, взвеси клеток из ткани, слизи, мокроты или слюны. Данный биологический образец может быть получен от любого животного, а не только от человека.
Термин "образец крови", используемый в данном документе, относится к обработанному или необработанному образцу крови, включая образцы пуповинной крови, аспираты костного мозга, кровь внутренних органов или периферических органов, а также он может быть любого объема и может быть получен от любого субъекта, такого как животное или человек. Предпочтительным субъектом является человек.
Твердая фракция, подлежащая выделению из образца биологической текучей среды, может содержать по меньшей мере одну клеточную фракцию. Предпочтительно данная клеточная фракция содержит лечебную клетку, которая представляет собой любую клетку, которая может оказывать лечебное или целебное воздействие.
Клеточная фракция может содержать по меньшей мере одно белое кровяное тельце или состоять по меньшей мере из одного белого кровяного тельца. "Белое кровяное тельце" представляет собой лейкоцит или клетку кроветворной линии, которая не является ретикулоцитом или тромбоцитом и которая может быть обнаружена в крови животного или человека. Лейкоцит может содержать естественные клетки-киллеры ("NK-клетки") и лимфоциты, например В-лимфоциты ("В-клетки") или Т-лимфоциты ("Т-клетки"). Лейкоциты также могут содержать клетки фагоцитов, такие как моноциты, макрофаги и гранулоциты, включая базофилы, эозинофилы и нейтрофилы. Лейкоциты могут также содержать мастоциты.
Клеточная фракция может содержать по меньшей мере одно красное кровяное тельце или состоять по меньшей мере из одного красного кровяного тельца. "Красное кровяное тельце" представляет собой эритроцит.
Клеточная фракция может содержать по меньшей мере одну неопластическую клетку или состоять по меньшей мере из одной неопластической клетки. Термин "неопластическая клетка" относится к аномальным клеткам, которые обладают свойством неконтролируемого клеточного разрастания и продолжают расти после прекращения стимулирующих воздействий, которые вызывают новый рост. Неопластические клетки имеют тенденцию к частичному или полному отсутствию структурной организации и функциональной координации с нормальной тканью и могут быть доброкачественными или злокачественными.
Клеточная фракция может содержать по меньшей мере одну злокачественную клетку или состоять по меньшей мере из одной злокачественной клетки. Термин "злокачественная клетка" относится к клетке, обладающей свойством локального инвазивного и деструктивного роста и метастазирования. Примеры злокачественной клетки включают такие клетки, как лейкозные клетки, клетки лимфомы, раковые клетки твердых новообразований, клетки твердых метастатических новообразований (например, раковые клетки молочной железы, раковые клетки простаты, раковые клетки легких, раковые клетки толстой кишки) в различных текучих средах тела, включая кровь, костный мозг, асцитические жидкости, мочу, смывы из бронха, причем примеры указанных клеток не исчерпываются данным перечнем.
Клеточная фракция может содержать по меньшей мере одну раковую клетку или состоять по меньшей мере из одной раковой клетки. Термин "раковая клетка" относится к клетке, которая проявляет нерегулируемый рост и, в большинстве случаев, теряет по меньшей мере одно из своих дифференцирующих свойств, например характерную морфологию, немигрирующее поведение, межклеточное взаимодействие и сигнализирующее поведение клетки, экспрессию протеина и паттерн секреции.
Клеточная фракция может содержать по меньшей мере одну стволовую клетку или состоять по меньшей мере из одной стволовой клетки. "Стволовая клетка" представляет собой недифференцированную клетку, которая может давать начало, посредством одного или более циклов деления клеток, по меньшей мере одному типу дифференцированных клеток.
Клеточная фракция может содержать по меньшей мере одну клетку-предшественника или состоять по меньшей мере из одной клетки-предшественника. "Клетка-предшественник" представляет собой коммитированную, но недифференцированную клетку, которая может давать начало, посредством одного или более циклов деления клеток, по меньшей мере одному типу дифференцированных клеток. Обычно стволовая клетка дает начало клетке-предшественнику посредством одного или более циклов деления клеток в ответ на конкретное стимулирующее воздействие или ряд стимулирующих воздействий, а клетка-предшественник дает начало дифференцированным клеткам одного или более типов в ответ на конкретное стимулирующее воздействие или ряд стимулирующих воздействий.
Костный мозг (или medulla ossea) представляет собой мягкую ткань, находящуюся в полой внутренней части костей. Существует два типа костного мозга - красный костный мозг (известный также как миелоидная ткань) и желтый костный мозг. Красные кровяные тельца, тромбоциты и наибольшая часть белых кровяных телец возникают в красном костном мозге, некоторые клетки белых кровяных телец развиваются в желтом костном мозге.
Костный мозг содержит два типа стволовых клеток - кроветворные стволовые клетки и мезенхимные стволовые клетки. Стволовые клетки являются первичными клетками, общими для всех многоклеточных организмов, которые сохраняют способность к собственному обновлению посредством деления клеток и могут дифференцироваться в широком диапазоне конкретных типов клеток. Кроветворные стволовые клетки дают начало трем классам клеток крови, которые обнаруживаются в системе кровообращения - клеткам белых кровяных телец (лейкоцитам), клеткам красных кровяных телец (эритроцитам) и кровяным пластинкам (тромбоцитам). Мезенхимные стволовые клетки упорядочены вокруг центрального синуса в костном мозге и обладают способностью дифференцироваться в остеобласты, хондроциты, миоциты и многие другие типы клеток.
В то время как стволовые клетки эмбриона являются истинными стволовыми клетками, так как они являются тотипотентными или плюрипотентными и демонстрируют неограниченную способность к самообновлению, зрелые стволовые клетки в костном мозге более уместно определить как клетки-предшественники, которые подобно стволовым клеткам обладают способностью к самообновлению и дифференциации, хотя значительно более ограничены. Клетки-предшественники обычно являются унипотентными или мультипотентными, а не плюрипотентными.
Мезенхимные стволовые клетки, или МСК, в классическом случае получаемые из костного мозга, являются мультипотентными стволовыми клетками, которые могут дифференцироваться в различные типы клеток. Типы клеток, в которые дифференцируются МСК, включают остеобласты, хондроциты, миоциты, адипоциты, и нервные клетки.
Плотность костного мозга может изменяться и изменяется от пациента к пациенту, поэтому вязкость костного мозга не одинакова. Более молодые пациенты часто имеют более плотный и вязкий костный мозг, что обусловлено наличием большей трабекулярной ткани в полости кости. Фильтрация такого вязкого костного мозга обычно вызывает загрязнение фильтров в разделительных устройствах.
В вариантах осуществления данного изобретения образец текучей среды представляет собой аспират костного мозга.
В других вариантах осуществления данного изобретения образец текучей среды представляет собой аспират костного мозга, а твердая фракция является клеткой-предшественником.
Термин "ткань", используемый в данном документе, включает четыре основных типа ткани, присутствующей у всех животных - эпителиальную, соединительную, мышечную и нервную ткань.
Примеры соединительной ткани включают ткань кожи, мышечную, хрящевую, костную ткань, ткань сухожилия, связки, ткань суставной капсулы и жировую ткань.
Термин "жировая ткань", используемый в данном документе, обозначает жировую клетчатку и другие источники микрососудистой ткани в теле. Жировая ткань представляет собой сложную ткань, содержащую множественные типы клеток, включая адипоциты, перициты, фибробласты, макрофаги, стволовые клетки и микрососудистые клетки. По существу, жировая ткань представляет собой один из наиболее подходящих источников клеток-предшественников в теле.
Термин "микрососудистые клетки", используемый в данном документе, относится к клеткам, составляющим структуру микроциркуляционного русла, то есть клеткам эндотелия, гладкомышечным клеткам и перицитам.
Жировая ткань может быть получена из "жирового" депо в теле. Подходящие депо содержатся в эпидидимисе, межлопаточном скоплении жировой ткани или инфрапателлярном скоплении жировой ткани (скоплении жировой ткани при болезни Гоффы). Альтернативно, жировая ткань может быть аспиратом жира, полученным при липосакции, что потенциально является наиболее простым способом получения такой ткани.
Если аспират жира может быть введен непосредственно в предлагаемое устройство, то фрагменты жировой ткани требуют предварительной обработки. Фрагменты жировой ткани измельчают и/или ферментируют для освобождения клеточного компонента данной ткани. Затем данный клеточный компонент могут суспендировать в соответствующем носителе и ввести в предлагаемое устройство.
Предусматривается, что липоаспират и/или взвесь клеток, полученная вышеуказанным способом, может подвергаться дополнительной обработке до введения ее в данное устройство. Например, для выделения больших крупинок жира и адипоцитов из фракции стромальных клеток (содержащей стволовые клетки, эндотелиальные клетки и перициты) может применяться гравитационное осаждение и/или центрифугирование.
В вариантах осуществления данного изобретения, в которых выполняется фильтрация биологического образца, фильтрационный блок может быть присоединен к аспиратору так, что данная текучая среда переносится непосредственно от субъекта в фильтрационный блок. Данный фильтрационный блок может использоваться в стерильных условиях, что снижает опасность загрязнения образца в промежутке между его извлечением из тела пациента и введением в фильтрационный блок.
В альтернативных вариантах осуществления данного изобретения твердая фракция может состоять из этиологического агента, например бактерий, грибка, представителя простейших, вируса, паразитирующего организма или приона, который может инфицировать субъект.
Данный образец может быть взвесью клеток, полученных в искусственных условиях (in vitro).
Фильтр, который также можно рассматривать как пленку, может быть изготовлен из любого материала, пригодного для выделения твердой фракции из образца текучей среды способом, описанным в данном изобретении. Данный фильтр может быть выполнен из естественного или синтетического материала или из комбинации этих материалов. К числу подходящих материалов относятся металлы, сплавы металлов, керамика или полимерные материалы, причем данный перечень материалов не носит ограничительного характера. Примерами таких материалов являются поликарбонат PLC (ПКБ), полиэтилентерефталат PET (ПЭТ), полиидид (ПИ), никель и нержавеющая сталь. Данные материалы предпочтительно являются медицинскими материалами. Подходящие трековые фильтры выпускаются компанией it4ip (Бельгия). Подходящие фильтры из никелевой фольги выпускаются компанией Tecan Limited (Великобритания).
В вариантах осуществления настоящего изобретения данный фильтр выполнен, по существу, плоским. То есть, данный фильтр имеет двухмерный профиль, в котором диаметр фильтра превышает его высоту. Подобный профиль увеличивает площадь потенциальной поверхности, которой фильтр взаимодействует с образцом текучей среды, при этом повышается скорость фильтрации. Данный профиль также сводит к минимуму возможность засорения фильтра каким-либо твердым веществом.
Подходящая толщина фильтра может составлять, например, 11, 23 и 50 мкм. Чем тоньше фильтр, тем выше расход текучей среды через него.
Предусматривается, что данный фильтр может быть выполнен с порами одинакового диаметра или с порами разного диаметра и одинаковой геометрической формы. Альтернативно, фильтр может быть выполнен с порами, имеющими одинаковый диаметр и разную геометрическую форму. Альтернативно, фильтр может быть выполнен с порами разного диаметра и разной геометрической формы.
К подходящим геометрическим формам относятся формы, имеющие круглые, эллипсоидные, квадратные, прямоугольные или треугольные боковые поперечные сечения, причем данный перечень форм не носит ограничительного характера.
Поры могут иметь суженную форму. Сужение пор способствует деформации клеток под действием вакуума. В зависимости от размера поры у каждого суженного конца и его ориентации можно произвести отбор предпочтительных клеток на основе их размера. В предпочтительных вариантах осуществления данного изобретения самый узкий конец суженной поры расположен у верхней поверхности фильтра. Такое расположение допускает прохождение через пору меньших клеток, в то время как более крупные клетки удерживаются над фильтром. С другой стороны, по-видимому, это усложняет возврат клеток в послефильтрационной камере через поры во время поступления промывочной текучей среды вверх через фильтр в ходе обратной промывки. Было установлено, что если самый узкий конец поры расположен у нижней поверхности фильтра, то наблюдается тенденция вхождения клеток в пору, в результате чего они деформируются, для того чтобы пройти через самый узкий конец.
В конкретных вариантах осуществления данного изобретения поры имеют диаметр, находящийся в диапазоне приблизительно 1-12 мкм.
В дополнительных вариантах осуществления данного изобретения поры могут иметь цилиндрическую форму.
В других вариантах осуществления данного изобретения, в которых клетки-предшественники отделяют от аспирата костного мозга, подходящий фильтр выполнен из полиэтилентерефталата (ПЭТ), имеет толщину 23 мкм, диаметр пор 3 мкм и плотность пор 400000 пор/см2. Величина оптимального отрицательного давления, создаваемого вакуумным насосом для эффективного «протягивания» текучей среды через фильтр, находится в диапазоне приблизительно от -0,1 до -0,5 psi (-0,007 - -0,035 кг/см2), в частности от -0,2 до -0,3 psi (-0,014 - -0,021 кг/см2). Альтернативно, для эффективного «проталкивания» текучей среды через фильтр может быть создано положительное давление. Величина оптимального положительного давления, создаваемого подобным насосом, находится в диапазоне приблизительно от 0,1 до 0,5 psi (0,007-0,035 кг/см2), в частности от 0,2 до -0,3 psi (0,014-0,021 кг/см2).
Конструкция фильтрационного блока может быть видоизменена с уменьшением соотношения геометрических размеров предфильтрационной камеры для образца текучей среды. Тем самым обеспечивается большая площадь поверхности при фильтрации на единицу объема. В других вариантах осуществления данного изобретения предфильтрационная камера фильтрационного блока разделена на несколько камер, которые могут быть использованы для вмещения партии образцов текучей среды, представленных в виде луночного планшета.
После фильтрации оставшийся образец текучей среды, который содержит выделенную твердую фракцию (которую также называют очищенной, обогащенной или концентрированной), может быть удален из верхней камеры фильтрационного блока посредством всасывания, например с использованием пипетки, и либо сохранен, либо использован. В других вариантах осуществления данного изобретения, в частности в вариантах, в которых оставшийся образец текучей среды содержит фракцию лечебных клеток, он может быть смешан, например, с гидрогелем или костным цементом. В этих вариантах осуществления гидрогель или костный цемент служат в качестве депо клеток.
В соответствии с одним аспектом данного изобретения предлагается способ выделения твердой фракции из образца текучей среды, причем данный способ включает следующие этапы:
i) введение образца текучей среды в устройство по изобретению,
ii) фильтрация образца текучей среды,
iii) удаление выделенной фракции из предфильтрационной камеры.
В соответствии с другим аспектом данного изобретения предлагается способ изоляции или выделения лечебных клеток из образца текучей среды с использованием предлагаемого устройства.
В вариантах осуществления данного изобретения образец текучей среды может быть биологическим образцом таким, как образец крови, выпота, мочи, спермы, аспирата костного мозга, спинномозговой жидкости, взвеси клеток из ткани, слизи, мокроты или слюны.
В вариантах осуществления данного изобретения лечебная клетка представляет собой клетку-предшественник.
В соответствии с другим аспектом данного изобретения предлагается способ изоляции или выделения лечебных клеток из аспирата костного мозга с использованием предлагаемого устройства.
В вариантах осуществления данного изобретения лечебная клетка представляет собой клетку-предшественник.
Данной системой можно управлять вручную. Однако для повышения общей эффективности и точности процесса выделения, в частности, когда данное устройство используется медицинским персоналом в операционной, предпочтительно его автоматизировать. Для этого можно использовать программируемый логический контроллер PLC (ПЛК), который может быть запрограммирован на переключение вакуумного насоса и насоса для обратной промывки на включение и выключение с циклическим чередованием во временной последовательности. Под действием разряжения, создаваемого вакуумным насосом образец текучей среды втягивается вниз через фильтр, а промывочная текучая среда с помощью насоса для обратной промывки продвигает вверх через фильтр.
Фильтрационная камера и/или фильтр могут быть заменяемыми. Блок управления может быть сменным или специализированным автономным блоком.
Согласно другому аспекту данного изобретения изолированная лечебная клетка (клетки) может быть введена в необходимое место непосредственно в виде взвеси. Согласно альтернативному варианту клетки могут быть соединены или скомбинированы с соответствующим материалом носителя, например с гелем, пастой, цементом, клеем, клеточным каркасом, пленкой, имплантатом или повязкой.
Предусматривается, что изолированные лечебные клетки могут быть использованы в ряде областей медицины для лечения людей и/или животных с целью заживления, регенерации и/или наращивания тканей. К таким областям медицины относятся, например, ортопедия, неврология, сердечно-сосудистая хирургия, дерматология, косметическая хирургия и стоматология.
Предусматривается, что в некоторых вариантах осуществления данного изобретения изолированные лечебные клетки содержат мезенхимные стволовые клетки. Эти клетки способны к дифференциации на остеобласты, хондроциты, миоциты и адипоциты. Лечебная фракция, содержащая мезенхимные стволовые клетки, может быть использована в случае ортопедических показаний, например в результате заболевания или ранения, например в случае восстановление хряща, костей (включая лечение перелома), лечение артродеза позвонков, лечение дегенеративных дисков (включая восстановление кольцевидных структур, наращивание nucleous populous, наращивание дисков).
Функциональные эндотелиальные клетки-предшественники ЕРС (ЭКП) являются основными для образования и развития сосудов, а также развития кровеносных сосудов. Было показано, что ЭКП развиваются из одноядерных клеток костного мозга взрослых животных. Таким образом, предусматривается, что в некоторых вариантах осуществления данного изобретения изолированные лечебные клетки содержат ЭКП и эта лечебная фракция может быть использована по показаниям, по которым повреждение или ткань с ишемией требует заживления, восстановления или развития кровеносных сосудов, например при заболевании периферических сосудов.
Соответственно, предлагаются способы для i) образования новых кровеносных сосудов в ткани субъекта, ii) увеличения кровотока в ткани субъекта, iii) лечения больной ткани субъекта, iv) увеличения развития кровеносных сосудов в больной ткани или v) предотвращения сердечной недостаточности у субъекта, причем все из указанных способов включают этапы:
a) выделения одноядерных клеток костного мозга с использованием устройства в соответствии с данным изобретением,
b) локальную трансплантацию в ткань эффективного объема одноядерных клеток костного мозга с формированием в данной ткани новых кровеносных сосудов.
В вариантах осуществления данного изобретения одноядерные клетки костного мозга являются аутогенными.
Ткань, в которую трансплантируют одноядерные клетки костного мозга, включает нездоровую или поврежденную ткань, а также любую ткань, которая нуждается в заживлении или восстановлении, включая ткань с недостаточным кровоснабжением, например ткань, обнаруживаемую при хронической ишемии, а, также, ткань сердечной мышцы, скелетной мышцы, мозга, например, пораженную при параличе или неправильном артериовенозном развитии, коронарных сосудов, почек, печени, органов желудочно-кишечного тракта, ткань с мышечной атрофией, включая неврологические нарушения на основе мышечной атрофии, причем данный перечень не носит ограничительного характера.
В вариантах осуществления данного изобретения новые кровеносные сосуды являются капиллярами и/или коллатеральными кровеносными сосудами.
Краткое описание чертежей
Далее настоящее изобретение описано со ссылкой на сопроводительные чертежи, на которых:
на фиг.1 схематически показан общий принцип работы предлагаемого устройства;
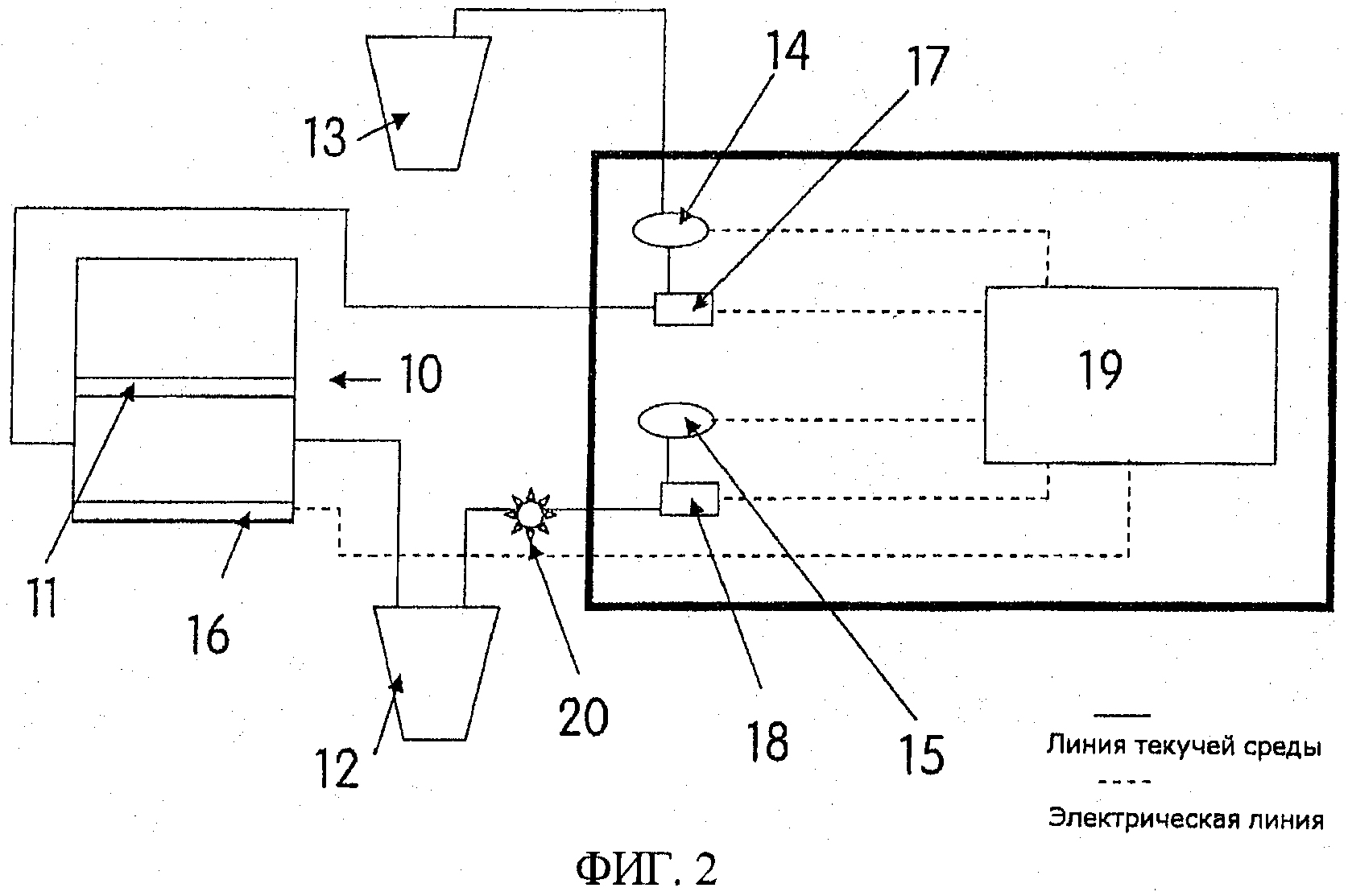
на фиг.2 схематически показан вариант осуществления предлагаемого устройства, в котором текучие среды в пред- и послефильтрационной камерах последовательно перемещаются через фильтр;
на фиг.3 показана фотография блока управления;
на фиг.4 показана фотография фильтрационного блока;
на фиг.5 показана фотография фильтрационного блока, соединенного с блоком управления;
на фиг.6 показана фотография элемента, генерирующего акустическую волну;
на фиг.7 показан держатель вибрационного фильтра, предназначенный для использования в фильтрационном блоке;
на фиг.8 показано среднее значение обогащения одноядерных клеток MNC (ОЯК) из цельной свиной крови с использованием в предлагаемом устройстве фильтров с заданным средним размером пор (n=6);
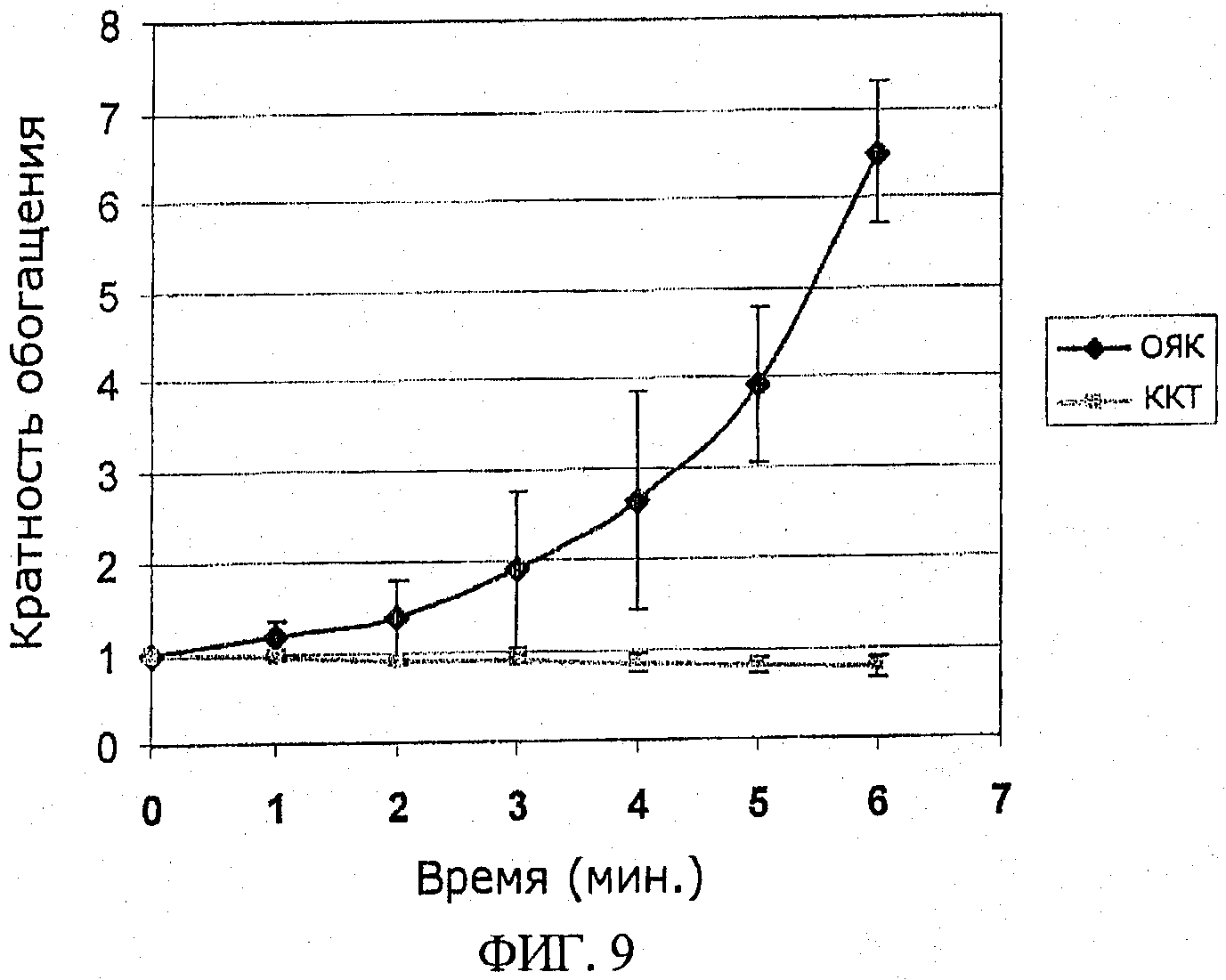
на фиг.9 проиллюстрировано время, затрачиваемое на обработку для обогащения клеток ОЯК из цельной свиной крови с использованием в предлагаемом устройстве фильтров со средним размером пор около 2,9 мкм (n=3);
на фиг.10 проиллюстрировано уменьшение объема ткани свиного костного мозга за период времени более 8 мин при использовании предлагаемого устройства и с соблюдением различных рабочих условий. В устройстве используется фильтр со средним размером пор около 3 мкм при расходе текучей среды 6 капель/мин;
на фиг.11 проиллюстрирован оптимизированный расход текучей среды через фильтр, регулируемый посредством ограничения разрежения встроенным игольчатым клапаном;
на фиг.12 проиллюстрирована кратность обогащения белых кровяных телец и красных кровяных телец при использовании предлагаемого устройства;
на фиг.13 проиллюстрировано отношение белых кровяных телец к красным кровяным тельцам в образце цельной свиной крови до и после фильтрации с использованием предлагаемого устройства;
на фиг.14 представлены данные, полученные при использовании устройства для выделения, иллюстрирующие возможность 10-кратного и более снижения объема при выделении одноядерных клеток >90%. Между снижением объема и концентрацией одноядерных клеток существует линейная зависимость. Стандартное время обработки составляет менее 10 минут;
на фиг.15 показан график распределения размеров пор в ПЭТ фильтре при выделении одноядерных клеток из аспирата свиного костного мозга.
Осуществление изобретения
На фиг.1 схематически показан общий принцип работы предлагаемого устройства, в котором следующие ссылочные позиции обозначают:
1. Фильтрационный блок
2. Пористый фильтр
3. Верхняя (предфильтрационная) камера для вмещения образца текучей среды
4. Образец текучей среды
5. Нижняя (послефильтрационная) камера для вмещения текучей среды для обратной промывки
6. Текучая среда в послефильтрационной камере
7. Резонирующая подложка
8. Генерирующий акустическую волну элемент
9. Вакуумная вытяжка (опционально)
Пористый фильтр 2 разделяет фильтрационный блок 1 на две камеры - верхнюю (предфильтрационную) камеру 3, в которую вводят образец 4 текучей среды, в котором необходимо произвести разделение клеток, и нижнюю (послефильтрационную) камеру 5, в которую вводят текучую среду 6, способную передавать акустическую стоячую волну. Акустический элемент 8 соединен с подложкой 7, которая расположена в днище нижней камеры, резонирует в ответ на воздействие элемента, генерирующего акустическую волну и создает стоячую волну, проходящую через две жидкие фазы и фильтр для возмущения образца. Одновременно циклическая работа вакуумной вытяжки 9 вызывает перемещение образца вниз через фильтр. Управление разрежением, расходом текучей среды и частотой вибрации выполняется дистанционным блоком, включающим соответствующие насосы и клапаны.
Следует отметить, что изобретение описано на примере предпочтительного варианта осуществления, в соответствии с которым предложенное устройство содержит один фильтр, однако в соответствии с другими вариантами осуществления предложенное устройство может содержать два или более фильтров.
На верхней части фильтра остается концентрированная фракция более крупных клеток, в то время как меньшие клетки проходят через фильтр к емкости для отходов (не показана).
В конкретном варианте осуществления данного изобретения акустический элемент является громкоговорителем с мощностью 0,4 Вт, сопротивлением 4 Ом, размахом амплитуды примерно 4,2-7,36 В, и частотным диапазоном примерно 300-700 Гц.
На фиг.2 схематически показан вариант осуществления предлагаемого устройства, в котором текучие среды в пред- и послефильтрационной камерах последовательно перемещаются через фильтр, причем следующими ссылочными позициями обозначены:
10. Фильтрационный блок
11. Пористый фильтр
12. Емкость для текучей среды, удаляемой из фильтрационного блока
13. Емкость для текучей среды для обратной промывки
14. Насос для обратной промывки
15. Вакуумный насос
16. Гененерирующий акустическую волну элемент/резонирующая подложка
17. Электромагнитный клапан (линия обратной промывки)
18. Электромагнитный клапан (вакуумная линия)
19. Цифровой блок управления на основе программируемого логического контроллера PLC (ПЛК) и дисплей
20. Игольчатый клапан
Данный чертеж иллюстрирует устройство, которое содержит фильтрационный блок согласно изобретению (показанный на фиг.1) и блок управления. Контроллер ПЛК (Mitsubuishi AL2-24MR-04) блока управления может быть запрограммирован на включение и выключение вакуумного насоса 15 и насоса 14 для обратной промывки (оба насоса - Koge KPV14A-6А). Он также используется для управления приведением в действие электромагнитных клапанов 17 и 18 (Cole Parmer 98302-02). Программирование может быть выполнено таким образом, что включение клапанов и насосов осуществляется согласно некоторой временной последовательности, или так, что управление насосами происходит вручную. В данный блок управления встроены усилитель и чип генератора сигналов, которые позволяют с помощью контроллера ПЛК задавать частоту и амплитуду акустического элемента 18. Фильтрационный блок и блок управления посредством соответствующих труб соединены с емкостью для сбора текучей среды удаляемой из устройства 12 и емкостью для подачи текучей среды 13 для обратной промывки.
На фиг.3 показана фотография блока управления, на которой следующими ссылочными позициями обозначены:
21. Блок контроллера ПЛК, расположенный в блоке управления
22. Клавиатура управления
23. Элемент включения/выключения устройства
24. Элемент управления электромагнитным клапаном вакуумной линии
25. Элемент включения/выключения акустического элемента
26. Элемент ручной коррекции разрежения
27. Элемент ручной коррекции обратной промывки
28. Элемент управления акустической частотой
29. Элемент управления амплитудой акустического элемента
30. Индикатор частоты акустического элемента
31. Светодиод индикации прокапывания
На фиг.4 показана фотография фильтрационного блока с пространственным разделением элементов, на которой следующими ссылочными позициями обозначены:
32. Верхняя камера
33. Средняя камера
34. Зажимы для крепления верхней камеры и средних камер
35. Мембранный фильтр
36. Кольцевые уплотнения для уплотнения фильтра при соединении верхней и средней камер
37. Верхний резервуар средней камеры для размещения образца ткани
38. Впускное отверстие в резервуар с физиологическим раствором под фильтром
39. Нижняя камера
40. Акустический элемент
41. Кольцевое уплотнение акустического элемента
42. Выход для электрического подключения акустического элемента
На фиг.5 показана фотография фильтрационного блока, соединенного с блоком управления, на которой следующими ссылочными позициями обозначены:
43. Фильтрационный блок
44. Вакуумная линия от фильтрационного блока к вакуумному
насосу
45. Вакуумный насос
46. Электромагнитный клапан управления разряжением
47. Вакуумная линия к камере для отходов
48. Камера для отходов
49. Линия обратной промывки к фильтрационному блоку
50. Насос для обратной промывки
51. Электромагнитный клапан управления обратной промывкой
52. Резервуар с физиологическим раствором для обратной промывки
53. Датчик прокапывания
На фиг.6 показана фотография генерирующего акустические волны элемента. Ссылочной позицией 54 обозначен электродинамический возбудитель по технологии NXT (Next Generation Transducer - Преобразователь следующего поколения).
Ниже описаны варианты осуществления изобретения, согласно которым текучие среды последовательно проходят через фильтр.
В нормальном режиме эксплуатации фильтр свободен от текучей среды. Для подачи текучей среды в нижнюю камеру фильтрационного блока 13 включают насос для обратной промывки до тех пор, пока текучая среда не пройдет через фильтр (12) в верхнюю (предфильтрационную) камеру. Акустический элемент имеет размах амплитуды в диапазоне 4,2-7,36 В и частотный диапазон 300-700 Гц. Данный элемент предназначен для возбуждения в текучей среде стоячей волны при этом соблюдается условие постоянного возмущения текучей среды. Чтобы понизить уровень текучей среды до уровня ее прохождения через фильтр включают вакуумный насос. Расход текучей среды через фильтр регулируется, соответственно, игольчатым клапаном 22. В верхнюю (предфильтрационную) камеру подают образец текучей среды, соблюдая при этом условие его постоянного возмущения. Посредством контроллера ПЛК управляют циклическим процессом быстрой обратной промывки и вакуумной вытяжки таким образом, что объем образца медленно уменьшается. Обычно процесс останавливают с помощью контроллера ПЛК при уменьшении объема образца в 10 раз. Указанный объем образца извлекают из верхней (предфильтрационной) камеры.
На фиг.7 показан держатель фильтра, предназначенный для использования в предложенном устройстве. Конструкция держателя фильтра допускает перемещение фильтра в боковом или вертикальном направлении или и с обеспечением сочетания направлений. Держатель 55 имеет, по существу, круговую форму. Подковообразный или U-образный паз 56 делит данный держатель на два участка, наружный кольцевой участок 57 и центральный круглый изолированный участок 58. Участок 57 соединен с участком 58 перемычками 59а и 59b. Участок 58 содержит множество равномерно распределенных пор. Данные поры имеют, по существу, круглую форму с диаметром около 3 мкм. На наружной поверхности участка 57 на одной линии с перемычкой 59b выполнен стержневой элемент 60, управление которым выполняется механически посредством двигателя и кулачкового упора (не показан), расположенными снаружи данного устройства.
Держатель фильтра и фильтр выполнены в виде единого узла из пластика.
Примеры выделения твердой фракции из образца текучей среды.
1. Образцы аспирата костного мозга человека
Аспират костного мозга был приобретен в компании Cambrex, причем до использования он были пропущен через фильтр с ячейками в 70 мкм для удаления любых адипоцитов и крупных агрегатов клеток. С помощью счетчика Коултера был выполнен подсчет белых кровяных телец WBC (БКТ) и красных кровяных телец RBC (ККТ). 2 мл взвеси клеток было добавлено в предлагаемое устройство, в котором в качестве фильтра была использована сетка с размером пор около 3 мкм. Процесс сепарации запускался посредством блока управления настоящего устройства и поддерживался до тех пор, пока в верхней камере устройства, сверху фильтра не осталась концентрированная фракция текучей среды в объеме приблизительно 200 мкл. По окончании процесса сепарации 100 мкл концентрата были удалены из верхней части фильтра, находящегося в устройстве и затем пропущены через счетчик Коултера, калибровка которого выполнялась ежедневно перед каждым экспериментом в соответствии с установленными стандартами.
2. Образцы аспирата свиного костного мозга
Выделение и увеличение клеточных популяций свиньи
Свежие свиные задние конечности были получены с бойни. Из головки бедра каждой ноги был извлечен трабекулярный костный мозг и собран в сосуды, содержащие физиологический раствор с фосфатным буфером (PBS). Костный мозг был тонко измельчен с помощью ножниц, полученную суспензию подвергли перемешиванию на орбитальном шейкере при 370С/5% CO2. Затем супернатант был пропущен через фильтр с ячейками в 70 мкм и помещен в отдельные пробирки. Далее указанные пробирки приводились во вращение в течение 5 мин при скорости 1500 об/мин, и супернатант сбрасывался, а полученный осадок ресуспендировался в 10 мл среды α-МЕМ (минимальная эссенциальная среда Игла) с добавлением 15% FCS (телячьей сыворотки крови).
Суспензия костного мозга, выделенного и обработанного вышеописанным способом в объеме 100 мл была пропущена через счетчик Коултера, калибровка которого выполнялась ежедневно перед каждым экспериментом в соответствии с установленными стандартами. Используя полученные данные о количестве клеток БКТ и клеток ККТ, концентрацию клеток БКТ экстракта костного мозга доводили до значения 1×107 клеток/мл посредством разведения этого экстракта плазмой крови свиньи. 2 мл такой текучей среды было помещено в устройство для выделения.
Подготовка плазмы крови свиньи
Свежая свиная кровь была собрана на бойне в резервуар для хранения, который содержал 4% трехосновный раствор цитрата натрия (в процентах веса к объему) (Sigma) при соотношении цитрата натрия к крови, равном 1:9. Кровь была помещена в аликвотных количествах в пробирки типа "falcon" объемом 50 мл и подвергнута вращению в течение 30 мин при скорости 2500 об/мин, а супернатант перенесен в другую пробирку типа "falcon". Данный супернатант снова был подвергнут вращению в течение 30 мин при скорости 2500 об/мин, после чего супернатант был перенесен в другую пробирку типа "falcon" объемом 50 мл и сохранен при -20°С до готовности к использованию.
Разделение аспирата свиного костного мозга в Фиколле
Костный мозг был извлечен из свежей свиной головки бедра вышеизложенным способом, а конечный клеточный осадок ресуспендирован в 25 мл среды α-МЕМ с добавлением 15% FCS.
Свежая свиная кровь была разбавлена физиологическим раствором с фосфатным буфером для уменьшения количества клеток ККТ до концентрации, равной приблизительно 3,5×109 клеток/мл. После этого количество клеток БКТ было увеличено до концентрации равной приблизительно до 2,5×107 клеток/мл посредством добавления полученного ранее костного мозга. Затем эта кровь была разведена в соотношении 2:1 (сбалансированный солевой раствор: кровь), после поверх 15 мл фиколла (Ficoll) (фирмы Amersham biosciences) был нанесен слой из 35 мл этой разведенной крови. Затем пробирки подвергли вращению в течение 30 мин при 1800 об/мин с выключенным тормозным механизмом (Megafuge 1.OR SOP/CB/021). После этого слой клеток БКТ был экстрагирован, осажден в пробирках и ресуспендирован в среде DMEM (минимальная эссенциальная среда Игла в модификации Дюльбекко) с низким содержанием глюкозы, при этом подсчеты выполнялись как для продуктов клеток БКТ, так и клеток ККТ.
3. Образцы свиной крови
Свежая свиная кровь была собрана на бойне в резервуар для хранения, который содержал 4% трехосновный раствор цитрата натрия (процентное отношение веса к объему) при соотношении цитрата натрия к крови 1:9. В типичном случае, 20 мл аликвотной пробы свиной крови пропускали через фильтр с ячейками размером 70 мкм и помещали в пробирку для сбора фильтрата. Этот процесс повторялся три раза с использованием при каждом проходе нового фильтра. 2 мл конечного фильтрата образца было помещено в предлагаемое устройство для выделения.
Результаты
На фиг.8 показано, что при получении одноядерных клеток MNC (ОЯК) из цельной свиной крови оптимальным является фильтр с размером пор около 3 мкм (р<0,05). Проведенное статистическое испытание представляло собой односторонний дисперсионный анализ (ANOVA) с последующим анализом по способу Тьюки и доверительным интервалом 95%.
На фиг.9 показано, что при использовании фильтра с размером пор около 3 мкм в течение 6 минут можно получить более чем 6-кратное обогащение клеток ОЯК из цельной свиной крови.
На фиг.10 проиллюстрирована возможность получения почти 10-кратного снижения объема ткани свиного костного мозга при сочетании следующих рабочих условий в устройстве: (i) вакуумная вытяжка образца текучей среды вниз через фильтр, (ii) обратное продвижение промывочной текучей среды вверх через фильтр и (iii) наличие акустического элемента, который генерирует и передает стоячую волну вверх через промывочную текучую среду и образец текучей среды.
На фиг.11 проиллюстрирован оптимальный расход текучей среды через фильтр. Образец текучей среды был получен из свиного костного мозга. Объем образца текучей среды в предфильтрационной камере составлял 2 мл. Объем образца текучей среды после фильтрации составлял 200 мкл. Время, за которое было достигнуто данное уменьшение объема образца текучей среды составляло: 8 мин при расходе 6 капель/мин, 4 мин при расходе 12 капель/мин, и 2 мин - при расходе 25 капель/мин. Во всех случаях использовался сетчатый фильтр с размером пор 3 мкм. Было установлено, что оптимальный расход составляет 6 капель/мин, так как при таком расходе достигается большая концентрация клеток ОЯК в концентрате образца текучей среды по сравнению с расходом в 12 капель/мин или 25 капель/мин.
На фиг.12 проиллюстрировано обогащение клеток БКТ по сравнению с клетками ККТ в образце текучей среды после фильтрации. Цифровые данные диаграммы менее 1 относятся к проходящим через фильтр клеткам ККТ.
На фиг.13 проиллюстрировано отношение ККТ/БКТ в образце цельной свиной крови до и после фильтрации. Перед фильтрацией соотношение ККТ:БКТ составляет около 375:1, после фильтрации соотношение ККТ:БКТ составляет около 50:1.
На фиг.14. проиллюстрирована кратность концентрации ядросодержащих клеток костного мозга и % удержания ядросодержащих клеток костного мозга из костного мозга человека с использованием ПЭТ фильтра с толщиной 23 мкм, плотностью расположения пор 400000 и размером пор 3,5 мкм.
На фиг.15 проиллюстрировано распределение размеров пор на ПЭТ фильтре с плотностью расположения пор 400000. На данном чертеже дополнительно проиллюстрированы характеристики этого фильтра с учетом обработки клеток из аспирата костного мозга.
Список литературы
Caplan Al. Mesenchymal stem cells: Cell Based Reconstructive Therapy in orthopaedics. Tissue Eng. 11 (7/8) 1198-1211 (2005);
Takazawa Y, Tokashiki M. Production of human-mouse chimeric antibody by high cell density perfusion culture. Cytotechnology 2 95-101 (1989);
Apelman S. Separation of animal cells in continuous cell culture systems. In Animal cell technology: basic and applied aspects. Kluwer Academic Publishers 149-54 (1992);
Jaeger V. High density perfusion culture of animal cells using a novel continuous flow centrifuge: In Animal cell technology: basic and applied aspects 209-348 (1992);
Himmerlfarb P, Thayer PS et al. Spin filter culture: the propagation of mammalian cells in suspension. Science 164 555-7 (1969);
Maiorella B, Dorin G et al. Crossflow micro filtration of animal cells. Biotechnol. Bioeng. 37 121-6(1991);
Vogel JH, Kroner KH. Controlled shear filtration: a novel technique for animal cell separation. Biotechnol. Bioeng. 63(6) 663-74 (1999);
Radlett PJ. The concentration of mammalian cells in a tangential flow filtration unit. J Appl. Chem Biotechnol. 22 495 (1972);
Castilho LR, Medronho RA. Cell retention devices for suspended cell-perfusion cultures. Adv. Biochem Eng Biotechnol. 74 129-69 (2002);
Stromberg RR, Friedman LI et al. Membrane technology applied to donor plasmapheresis. J Membrane Sci 44(1) 131-143 (1989);
Karumanchi RSMS et al. Field assisted extraction of cells, particles and macromolecules. Trends Biotechnol. 20 (2) 72-78 (2002);
Docoslis A et al. A novel dielectrophoresis-based device for the selective retention of viable cells in culture media. Biotechnol. Bioeng. 54(3) 239-50 (1997);
Docoslis A et al. Dielectrophoretic forces can be safely used to retain viable cells in perfusion cultures of animal cells. Cytotechnology 30 133-42 (1999);
Roath S, Richards Smith A et al. High gradient magnetic separation in blood and bone marrow processing. J Magnetism and Magnetic Mater. 85 (1-3) 285-90 (1990);
Kilburn DG, Clarke DJ et al. Enhanced sedimentation of mammalian cells following acoustic aggregation. Biotechnol. Bioeng. 34 559-62 (1989);
Coakley WT, Whitworth G et al. Ultrasonic manipulation of particles and cells. Bioseparation. 4 73-83 (1994);
Doblhoff-Dier O, Gaider TH et al. A novel ultrasonic resonance field device for the retention of animal cells. Biotechnol. Prog. 10 428-432 (1994);
Gaida TH et al. Selective retention of viable cells in ultrasonic resonance field devices. Biotechnol. Prog. 12 73-6 (1996);
Gorenflo VM, Smith L et al. Scale-up and optimisation of an acoustic filter for 200 L/day perfusion of CHO cell culture. Biotechnol. Bioeng. 80 (4) 438-44 (2002);
Gorenflo GM, Angepat S et al. Optimization of an acoustic cell filter with a novel air backflush system. Biotechnol. Prog. 19 30-6 (2003).
Реферат
Изобретение относится к области биотехнологии. Предложено устройство для выделения твердой фракции из образца текучей среды. Устройство включает пористый фильтр (2), разделяющий фильтрационный блок (1) на верхнюю предфильтрационную камеру (3), в которую помещают образец текучей среды (4), из которого необходимо выделить клетки, и нижнюю послефильтрационную камеру (5), в которую помещают текучую среду, способную передавать акустическую стоячую волну. Акустический элемент (8) соединен с возможностью съема с подложкой (7), которая расположена внизу нижней камеры (5). Подложка резонирует в ответ на генерирующий акустическую волну элемент (8) и генерирует стоячую волну с частотой в диапазоне 300-700 Гц, проходящую через две жидкие фазы и фильтр для возмущения образца (4). Циклический процесс вакуумной вытяжки (9) вызывает движение образца (4) вниз через фильтр (2). Текучие среды, находящиеся в пред- и послефильтрационной камерах, последовательно перемещаются через фильтр в противоположных направлениях. При этом диаметр пор фильтра равен 2-4 мкм. Фильтр соединен с держателем, выполненным с возможностью вызывать вибрацию фильтра в вертикальном или боковом направлении, или с обеспечением сочетания этих направлений. Также предложен способ выделения твердой фракции из образца текучей среды с применением указанного устройства. Изобретения позволяют минимизировать засорение фильтра и выделять в один этап клетки определенной популяции из гетерогенной смеси клеток. 2 н. и 22 з.п. ф-лы, 1 пр., 15 ил.
Формула
по меньшей мере один фильтр, разделяющий данный блок на предфильтрационную камеру для вмещения образца текучей среды и послефильтрационную камеру для вмещения текучей среды, способной передавать акустические волны,
подложку, выполненную с возможностью соединения с послефильтрационной камерой, причем указанная подложка способна резонировать под воздействием акустической волны,
в котором
указанный генерирующий акустические волны элемент выполнен с возможностью соединения с указанной подложкой так, что генерирующий акустические волны элемент вызывает резонирование подложки, которая, в свою очередь, передает акустическую стоячую волну с частотой в диапазоне около 300-700 Гц как через текучую среду в послефильтрационной камере, так и через образец текучей среды в предфильтрационной камере.
i) введение образца текучей среды в устройство по п.1,
ii) фильтрация образца текучей среды и
iii) удаление выделенной фракции из предфильтрационной камеры.

Комментарии