Системы и способы анализа нуклеиновых кислот и белков посредством мобильного устройства - RU2669867C2
Код документа: RU2669867C2
Чертежи





























Описание
Ссылки на родственные заявки
[0001] Настоящая заявка испрашивает приоритет согласно заявке на предварительный патент США №61/951084 с датой подачи 11 марта 2014 г.; заявке на предварительный патент США №61/875661 с датой подачи 9 сентября 2013 г.; заявке на предварительный патент США 61/790354 с датой подачи 15 марта 2013 г. Все содержание вышеупомянутых заявок включено в настоящую заявку посредством ссылки.
Уровень техники
[0002] Регистрация и анализ генетического материала биологического организма могут быть использованы для идентификации болезнетворных организмов, генотипирования, идентификации биомаркера, персонализованной медицины, персонализированного питания, персонализированного ухода за кожей, персонализированных лечебно-косметических средств, персонализированных нутрицевтиков, сопутствующей диагностики, учета и оценки побочных действий лекарственных средств, фармакогенетики и нутригеномики. Наличие вида в биологической пробе быть подтверждено посредством сравнения нуклеиновой кислоты, присутствующей в образце, с нуклеиновой кислотой в известном эталонном образце. Однако до выполнения этого сравнения нуклеиновые кислоты должны быть экстрагированы из образца, амплифицированы и затем зарегистрированы. Как правило, операции экстракции, амплификации и регистрации проходят в течение часов, дней или недель в лаборатории или госпитале. Например, амплификация обычно включает полимеразную цепную реакцию, описанную в патентах США №4683202 и 4683195. Для амплификации нуклеиновых кислот посредством обычной полимеразной цепной реакции нуклеиновые кислоты должны быть неоднократно нагреты и охлаждены в присутствии ферментов, нуклеотидов, праймеров и буферных растворов.
[0003] Обычные способы и устройства для экстракции, амплификации и регистрации нуклеиновых кислот обычно не подходят в достаточной степени для использования в мобильной или полевой установке вне инфраструктуры специализированной лаборатории. Одна лишь экстракция и амплификация занимают часы, если не дни, в зависимости от типа организма, длины цепи нуклеиновой кислоты и количества циклов. Кроме того, имеющиеся на рынке устройства и способы требуют квалифицированного персонала, наличия проточной воды и электричества. Кроме того, должны быть жестко контролируемы температура, pH фактор и ингредиенты буферных растворов. Загрязнители способны подавлять используемые при репликации ферменты полимеразы нуклеиновой кислоты или мешать им, что уменьшает эффективность и надежность процесса амплификации. Подобные ограничения относятся к обычным методикам экстракции и регистрации нуклеиновых кислот. Следовательно, существует необходимость в автоматизированных, интегральных, компактных, надежных, быстрых, точных и простых в использовании устройстве и способе регистрации, определении количества и идентификации нуклеиновых кислот.
Раскрытие изобретения
[0004] Настоящее изобретение относится к системе и способу для экспресс-анализа, количественного анализа и идентификации нуклеиновых кислот или белков.
[0005] Настоящее изобретение предлагает портативную или мобильную или размещенную по месту лечения систему для экстракции, при необходимости амплификации, и регистрации (и при необходимости количественного определения) нуклеиновых кислот или белков, использующую компактную интегральную микросхему в комбинации с портативной системой или мобильным устройством для анализа зарегистрированных сигналов, проведения сравнения и распространения результатов по беспроводной сети. Сменные модули могут быть использованы для выполнения одной или больше операций из экстракции, амплификации и регистрации.
[0006] Настоящее изобретение обладает многими преимуществами. Настоящее изобретение быстрее, дешевле, обладает большими возможностями развертывания в полевых условиях и более точное по сравнению с обычными способами регистрации и анализа нуклеиновых кислот или, в некоторых вариантах реализации настоящего изобретения, белков. В отличие от известных способов, которые требуют от часов до недель для характеризации или анализа даже больших образцов, настоящее изобретение обычно производит измерения за время меньше часа, или меньше получаса, например, в течение нескольких минут. Настоящее изобретение достаточно чувствительно для регистрации нуклеиновых кислот, экстрагированых из образца, содержащих всего несколько клеток (см. раздел «Пояснение на примерах»). В отличие от обычных диагностических устройств и способов, требующих настольного оборудования в лаборатории или клинике, отлично обученного технического персонала, электричества, воды и, часто, охлаждения образцов и реактивов, настоящее изобретение может быть осуществлено в виде портативного или мобильного устройства, при необходимости использующего компактную интегральную микросхему одноразового использования. Результаты могут быть распространены через одну или более сетей связи, таких как беспроводная сеть и/или Интернет. Система согласно настоящему изобретению не требует квалифицированного персонала или обученных лаборантов и может работать за пределами госпиталя или инфраструктуры централизованной лаборатории. Система согласно настоящему изобретению устойчива к различным экологическим переменным и может работать в широких пределах изменения pH фактора, температуры, традиционной служебной инфраструктуры и, при необходимости, без охлаждения.
[0007] Настоящее изобретение может быть использовано для регистрации и различения молекул нуклеиновой кислоты или белков от единственного биологического организма или другого источника или множества организмов или источников. В дополнение к тому, что настоящее изобретение способно обнаружить и проанализировать неизвестную нуклеиновую кислоту, но методология достаточно чувствительна для различения видов в пределах гена, или выявления точечных мутаций и/или последовательностей биомаркеров и/или аллелей предрасположенности к заболеваниям. В вариантах реализации настоящего изобретения, использующих интегральные микросхемы однократного использования, имеет место также значительный эффект уменьшения стоимости по сравнению со стоимостью обычных диагностических проб.
[0008] Кроме того, в вариантах реализации настоящего изобретения, использующих процессы нетепловой амплификации нуклеиновой кислоты, описанные в патенте США №7494791 (все содержание которого включено в настоящую заявку посредством ссылки), могут быть достигнуты частоты появления ошибок, меньшие чем примерно 1×10-7 ошибок/пара азотистых оснований или лучше (например, меньше, чем 10-10 ошибок/пара азотистых оснований). Даже при наличии «трудных последовательностей» (последовательностей, для которых полимеразный фермент имеет тенденцию скользить, делать ошибки или прекращать работать; примеры трудных последовательностей включают повторяющиеся последовательности, последовательности полиаделиновой кислоты, богатые гуанином-цитозином последовательности, тринуклеотидные повторные последовательности и т.д.) может быть достигнута частота появления ошибок, меньше чем 1×10-3 ошибок/пара азотистых оснований или лучше (например, меньше чем 10-6 ошибок/пара азотистых оснований). Описанные нетепловые способы амплификации нуклеиновой кислоты могут быть использованы для амплификации последовательностей длиной до 20000 пар азотистых оснований при использовании реактивов, способных выдерживать более 100 циклов репликации нуклеиновой кислоты. Могут быть использованы другие изотермические способы амплификации, например, опосредованная петлями изотермическая амплификация (LAMP), например, такая как сформулирована в статье Т. Notomi et al., Nucleic Acids Research, 28, e63 (2000)); определяемая геликазой амплификация (HDA), например, описанная в статье Vincent М., Xu Y., Kong Н. (2004), «Определяемая геликазой изотермическая амплификация ДНК», EMBO Rep. 5 (8): 795-800; амплификация замещением цепей (SDA), например, описанная в статье Walker G.T. et al., Proc. Natl. Acad. Sci. USA, 89, 392-396 (1992); все содержание которых включено в настоящую заявку посредством ссылки. Могут быть использованы мостовая амплификация, амплификация по типу катящегося кольца и любые другие способы амплификации (тепловой или изотермической).
[0009] В одном варианте реализации согласно настоящему изобретению предложена система для экспресс-анализа биологических образцов. Система содержит мобильное устройство, которое получает по меньшей мере одну интегральную микросхему. Мобильное устройство обрабатывает интегральную микросхему для анализа загруженного в нее биологического образца. Мобильное устройство и интегральная микросхема вместе выполнены с возможностью выполнения по меньшей мере одной операции из манипуляции и управления молекулой или системой текучей среды на интегральной микросхеме. Мобильное устройство и интегральная микросхема вместе выполнены с возможностью точного управления по меньшей мере одним параметром, который управляет по меньшей мере одной из множества операций при анализе биологического образца с точностью плюс или минус 10%, плюс или минус 1%, плюс или минус 0,1%, плюс или минус 0,01%, плюс или минус 0,001% или плюс или минус 0,0001%.
[0010] В другом варианте реализации настоящего изобретения предложена система для экспресс-анализа биологических образцов. Система содержит портативный узел управления, получающий по меньшей мере одну компактную интегральную микросхему. Интегральная микросхема содержит модуль экстракции; при необходимости модуль амплификации нуклеиновой кислоты, связанный по текучей среде с модулем экстракции; и модуль регистрации биологического образца, связанный по текучей среде с модулем амплификации нуклеиновой кислоты или модулем экстракции. Портативный узел управления обрабатывает интегральную микросхему для анализа загруженного в него биологического образца, используя: модуль управления экстракцией; модуль управления амплификацией нуклеиновой кислоты, функционально присоединенный к модулю управления экстракцией; и модуль управления регистрацией биологического образца, функционально соединенный с модулем амплификации нуклеиновой кислоты и модулем экстракции.
[0011] В другом варианте реализации настоящего изобретения предложена система для экспресс-анализа биологических образцов. Система содержит портативный узел управления, получающий по меньшей мере одну компактную интегральную микросхему. Интегральная микросхема содержит инжекционное отверстие, предназначенное для загрузки биологического образца и, при необходимости, одного или большего количества реактивов, на интегральную микросхему; модуль экстракции; модуль амплификации нуклеиновой кислоты, связанный по текучей среде с модулем экстракции; и модуль регистрации, связанный по текучей среде с модулем амплификации нуклеиновой кислоты. Портативный узел содержит модуль управления экстракцией, в некоторых вариантах реализации настоящего изобретения содержащий, например, средства захвата магнитных частиц, предназначенные для захвата магнитных частиц, введенные в биологический образец, загруженный на интегральную микросхему; модуль управления амплификацией нуклеиновой кислоты, функционально соединенный с модулем управления экстракцией, причем в некоторых вариантах реализации настоящего изобретения указанные средства амплификации нуклеиновой кислоты содержат, например, основанные на термоэлектрических, тонкопленочных, инфракрасных или оптических эффектах или механические средства нагрева, предназначенные для нагрева/охлаждения модуля амплификации нуклеиновой кислоты интегральной микросхемы; и модуль управления регистрацией, функционально соединенный с модулем амплификации нуклеиновой кислоты и модулем экстракции нуклеиновой кислоты. В некоторых вариантах реализации настоящего изобретения модуль управления регистрацией содержит средства регистрации флуоресценции для регистрации нуклеиновых кислот или белков; и, например, в некоторых вариантах реализации настоящего изобретения средства управления капиллярным электрофорезом, функционально соединенные со средствами регистрации флуоресценции, причем указанные средства управления капиллярным электрофорезом дополнительно содержат блок управления высоким электрическим напряжением для приложения электрического напряжения к модулю регистрации нуклеиновой кислоты интегральной микросхемы, причем указанное электрическое напряжение достаточно для выполнения разделения нуклеиновых кислот или белков; и средства выработки давления текучей среды для перемещения биологического образца и/или нуклеиновых кислот через интегральную микросхему.
[0012] В другом варианте реализации настоящего изобретения предложен способ экспресс-анализа биологических образцов. Способ включает: (1) выполнение по меньшей мере одной интегральной микросхемы, причем указанная интегральная микросхема содержит: модуль экстракции нуклеиновой кислоты; модуль амплификации нуклеиновой кислоты, связанный по текучей среде с модулем экстракции нуклеиновой кислоты; и модуль регистрации нуклеиновой кислоты, связанный по текучей среде с модулем амплификации нуклеиновой кислоты; (2) загрузку по меньшей мере одного биологического образца на по меньшей мере одну интегральную микросхему; (3) функциональное соединение портативного узла управления с по меньшей мере одной интегральной микросхемой, причем указанный портативный узел управления содержит: модуль управления экстракцией нуклеиновой кислоты; модуль управления амплификацией нуклеиновой кислоты, функционально соединенный с модулем управления экстракцией нуклеиновой кислоты; и модуль управления регистрацией нуклеиновой кислоты, функционально соединенный с модулем амплификации нуклеиновой кислоты и модулем экстракции нуклеиновой кислоты; и (4) активизацию портативного узла управления для выполнения экстракции, амплификации и регистрации нуклеиновой кислоты от биологического образца, загруженного в указанную интегральную микросхему.
[0013] В другом варианте реализации настоящего изобретения предложен способ экспресс-анализа биологических образцов. Способ включает: (1) выполнение по меньшей мере одной интегральной микросхемы, причем указанная интегральная микросхема содержит: модуль экстракции белка; и модуль регистрации белка, связанный по текучей среде с модулем экстракции белка; (2) загрузку по меньшей мере одного биологического образца на по меньшей мере одну интегральную микросхему; (3) функциональное соединение портативного узла управления с по меньшей мере одной интегральной микросхемой, причем указанный портативный узел управления содержит модуль управления экстракцией белка; и модуль управления регистрацией белка, функционально соединенный с модулем экстракции белка; и (4) активизация портативного узла управления для выполнения экстракции и регистрации белка в биологическом образце, загруженном в указанную интегральную микросхему.
[0014] В другом варианте реализации настоящего изобретения предложена интегральная микросхема для быстрого последовательного выполнения экстракции, амплификации и разделения нуклеиновой кислоты в биологическом образце. Интегральная микросхема содержит кожух, объединяющий в себе микрожидкостные каналы, последовательно соединенные по текучей среде с модулем экстракции нуклеиновой кислоты, модулем амплификации нуклеиновой кислоты и модулем разделения нуклеиновой кислоты; по меньшей мере одно впускное отверстие для образцов, предназначенное для инжекции биологических образцы и реактивов, связанное по текучей среде с модулем экстракции нуклеиновой кислоты; причем модуль экстракции нуклеиновой кислоты содержит по меньшей мере одну камеру экстракции для экстракции нуклеиновых кислот из биологических образцов и указанная камера экстракции соединена с отверстием для впуска образца посредством по меньшей мере одного канала для перемещения образца; причем модуль амплификации нуклеиновой кислоты содержит по меньшей мере одну камеру амплификации для амплификации нуклеиновых кислот и указанная камера амплификации нуклеиновой кислоты соединена с экстракционной камерой посредством по меньшей мере одного канала для перемещения нуклеиновой кислоты; и причем модуль разделения нуклеиновой кислоты содержит по меньшей мере один канал регистрации для разделения и регистрации нуклеиновых кислот, причем указанный канал регистрации соединен с камерой амплификации нуклеиновой кислоты посредством по меньшей мере одного канала для перемещения продукта амплификации.
[0015] В другом варианте реализации настоящего изобретения предложен способ экспресс-анализа биологических образцов. Способ включает обеспечение по меньшей мере одной интегральной микросхемой, причем указанная интегральная микросхема содержит: модуль экстракции нуклеиновой кислоты; модуль амплификации нуклеиновой кислоты, связанный по текучей среде с модулем экстракции нуклеиновой кислоты; и модуль регистрации нуклеиновой кислоты, связанный по текучей среде с модулем амплификации нуклеиновой кислоты. Способ дополнительно включает загрузку по меньшей мере одного биологического образца на по меньшей мере одну интегральную микросхему; и функциональное соединение портативного узла управления с по меньшей мере одной интегральной микросхемой. Портативный узел управления содержит модуль управления экстракцией нуклеиновой кислоты; модуль управления амплификацией нуклеиновой кислоты, функционально соединенный с модулем управления экстракцией нуклеиновой кислоты; и модуль управления регистрацией нуклеиновой кислоты, функционально соединенный с модулем амплификации нуклеиновой кислоты и модулем экстракции нуклеиновой кислоты. Способ дополнительно включает активизацию портативного узла управления для выполнения экстракции, амплификации и регистрации нуклеиновой кислоты в биологическом образце, загруженном в указанную интегральную микросхему; и на основании регистрации нуклеиновой кислоты от биологического образца, определение по меньшей мере одного биомаркера, связанного с пациентом, представляющим собой источник по меньшей мере одного биологического образца.
[0016] В дополнительных соответствующих вариантах реализации настоящего изобретения способ может включать, на основании по меньшей мере одного биомаркера, определение по меньшей мере одного из следующего: (i) дозировка по меньшей мере одного лекарственного средства для проведения терапевтического лечения заболевания, связанного с по меньшей мере одним биомаркером; (ii) комбинация определенного количества лекарственных средств для проведения терапевтического лечения заболевания, связанного с по меньшей мере одним биомаркером; и (iii) определение того, представляет ли собой пациент, представляющий собой источник по меньшей мере одного биологического образца, респондером относительно медикаментозного лечения заболевания, связанного с по меньшей мере одним биомаркером.
[0017] В других соответствующих вариантах реализации настоящего изобретения способ может включать, на основании регистрации нуклеиновой кислоты от биологического образца, определение количества, по меньшей мере для одного биологического образца, по меньшей мере одного биомаркера, связанного с пациентом, представляющим собой источник по меньшей мере одного биологического образца; и, на основании количества по меньшей мере одного биомаркера в по меньшей мере одном биологическом образце, определение степени прогресса лечения заболевания, связанного с по меньшей мере одним биомаркером в пациенте, представляющим собой источник по меньшей мере одного биологического образца.
[0018] В еще одних соответствующих вариантах реализации настоящего изобретения способ может включать, на основании регистрации нуклеиновой кислоты от биологического образца, определение по меньшей мере одного биомаркера, связанного с пациентом, представляющим собой источник по меньшей мере одного биологического образца; и на основании по меньшей мере одного биомаркера, определение по меньшей мере одного из следующего: (i) выбор изделия для персонального ухода за пациентом, представляющим собой источник по меньшей мере одного биологического образца, (ii) поставленное количество изделия для персонального ухода за пациентом, (iii) например, косметический тип кожи пациента, и (iv) количество по меньшей мере одного косметического биомаркера пациента в по меньшей мере одном биологическом образце.
[0019] В других соответствующих вариантах реализации настоящего изобретения способ может включать, на основании регистрации нуклеиновой кислоты от биологического образца, определение количества, по меньшей мере в одном биологическом образце, по меньшей мере одного косметического биомаркера, связанного с пациентом, представляющим собой источник по меньшей мере одного биологического образца; и, на основании количества по меньшей мере одного биомаркера в по меньшей мере одном биологическом образце, определение уровня прогресса косметического лечения пациента, представляющего собой источник по меньшей мере одного биологического образца.
[0020] В дополнительных соответствующих вариантах реализации настоящего изобретения способ может включать, на основании регистрации нуклеиновой кислоты от биологического образца, определение по меньшей мере одного биомаркера, связанного с пациентом, представляющим собой источник по меньшей мере одного биологического образца; и, на основании по меньшей мере одного биомаркера, определение степени или типа здоровья пациента, представляющего собой источник по меньшей мере одного биологического образца.
[0021] В других соответствующих вариантах реализации настоящего изобретения способ может включать, на основании регистрации нуклеиновой кислоты от биологического образца, определение по меньшей мере одного биомаркера, связанного с пациентом, представляющим собой источник по меньшей мере одного биологического образца; и, на основании по меньшей мере одного биомаркера, определение того, является ли пациент, представляющий собой источник по меньшей мере одного биологического образца, представителем субпопуляции генетической совокупности относительно по меньшей мере одного биомаркера.
[0022] В дополнительных соответствующих вариантах реализации настоящего изобретения способ может включать, на основании регистрации нуклеиновой кислоты от биологического образца, определение по меньшей мере одного биомаркера, связанного с пациентом, представляющим собой источник по меньшей мере одного биологического образца; и, на основании по меньшей мере одного биомаркера, определение по меньшей мере части персонализированного геномного профиля пациента, представляющего собой источник по меньшей мере одного биологического образца.
[0023] В дополнительных соответствующих вариантах реализации настоящего изобретения определение по меньшей мере части персонализированного геномного профиля может включать регистрацию нуклеиновой кислоты, связанной со здоровьем пациента, спортивным питанием пациента, персонализированной диетой пациента и питанием или персонализированным питанием пациента.
[0024] В другом варианте реализации настоящего изобретения предложена система для экспресс-анализа биологических образцов. Система содержит по меньшей мере одну интегральную микросхему, причем указанная интегральная микросхема содержит: модуль экстракции нуклеиновой кислоты; модуль амплификации нуклеиновой кислоты, связанный по текучей среде с модулем экстракции нуклеиновой кислоты; и модуль регистрации нуклеиновой кислоты, связанный по текучей среде с модулем амплификации нуклеиновой кислоты, для по меньшей мере одного биологического образца, загруженного по меньшей мере на одну интегральную микросхему. Система дополнительно содержит портативный узел управления, содержащий: модуль управления экстракцией нуклеиновой кислоты; модуль управления амплификацией нуклеиновой кислоты, функционально соединенный с модулем управления экстракцией нуклеиновой кислоты; и модуль управления регистрацией нуклеиновой кислоты, функционально соединенный с модулем амплификации нуклеиновой кислоты и модулем экстракции нуклеиновой кислоты; причем портативный узел управления выполняет экстракцию, амплификацию и регистрацию нуклеиновой кислоты от биологического образца, загруженного на указанную интегральную микросхему. Система дополнительно содержит блок генетического анализа, выполненный с возможностью определения, на основании регистрации нуклеиновой кислоты от биологического образца, по меньшей мере одного биомаркера, связанного с пациентом, представляющим собой источник по меньшей мере одного биологического образца. Блок генетического анализа выполнен с дополнительной возможностью определения, на основании по меньшей мере одного биомаркера, по меньшей мере части персонализированного геномного профиля пациента, представляющего собой источник по меньшей мере одного биологического образца.
[0025] В другом варианте реализации настоящего изобретения предложена система для экспресс-анализа биологических образцов. Система содержит по меньшей мере одну интегральную микросхему, причем указанная интегральная микросхема содержит: модуль экстракции нуклеиновой кислоты; модуль амплификации нуклеиновой кислоты, связанный по текучей среде с модулем экстракции нуклеиновой кислоты; и модуль регистрации нуклеиновой кислоты, связанный по текучей среде с модулем амплификации нуклеиновой кислоты для по меньшей мере одного биологического образца, загруженного на по меньшей мере одну интегральную микросхему. Система дополнительно содержит портативный узел управления, содержащий: модуль управления экстракцией нуклеиновой кислоты; модуль управления амплификацией нуклеиновой кислоты, функционально соединенный с модулем управления экстракцией нуклеиновой кислоты; и модуль управления регистрацией нуклеиновой кислоты, функционально соединенный с модулем амплификации нуклеиновой кислоты и модулем экстракции нуклеиновой кислоты; причем портативный узел управления выполняет экстракцию, амплификацию и регистрацию нуклеиновой кислоты от биологического образца, загруженного на указанную интегральную микросхему. Система дополнительно содержит блок генетического анализа, выполненный с возможностью определения, на основании регистрации нуклеиновой кислоты от биологического образца, по меньшей мере одного биомаркера, связанного с пациентом, представляющим собой источник по меньшей мере одного биологического образца; и блок контроля за пульсациями сердца, соединенный с блоком генетического анализа и выполненный с возможностью управления блоком усиленной внешней контрпульсации (ЕЕСР) или другим блоком контроля за пульсациями сердца, основанным на по меньшей мере одном биомаркере.
[0026] В вариантах реализации настоящего изобретения может быть выполнено разделение белков, например, посредством электрофореза.
[0027] Предложены дополнительные соответствующие системы и способы.
Краткое описание чертежей
[0028] Предшествующее будет ясно из последующего более конкретного описания взятых в качестве примера вариантов реализации настоящего изобретения, показанных на прилагаемых рисунках, на которых одинаковые позиционные обозначения относятся к одинаковым частям, рассматриваемым в различных видах. Чертежи не обязательно вычерчены в масштабе, а вместо этого акцент сделан на иллюстрацию вариантов реализации настоящего изобретения.
[0029] На фиг. 1 показан один вариант реализации портативной пробы или мобильной системы с компактной интегральной микросхемой для регистрации и анализа нуклеиновых кислот.
[0030] На фиг. 1А показан вариант реализации модульной конструкции портативной системы взятия пробы в связи с геномной базой данных.
[0031] На фиг. 2 показан вариант реализации модульной конструкции системы и устройства согласно настоящему изобретению.
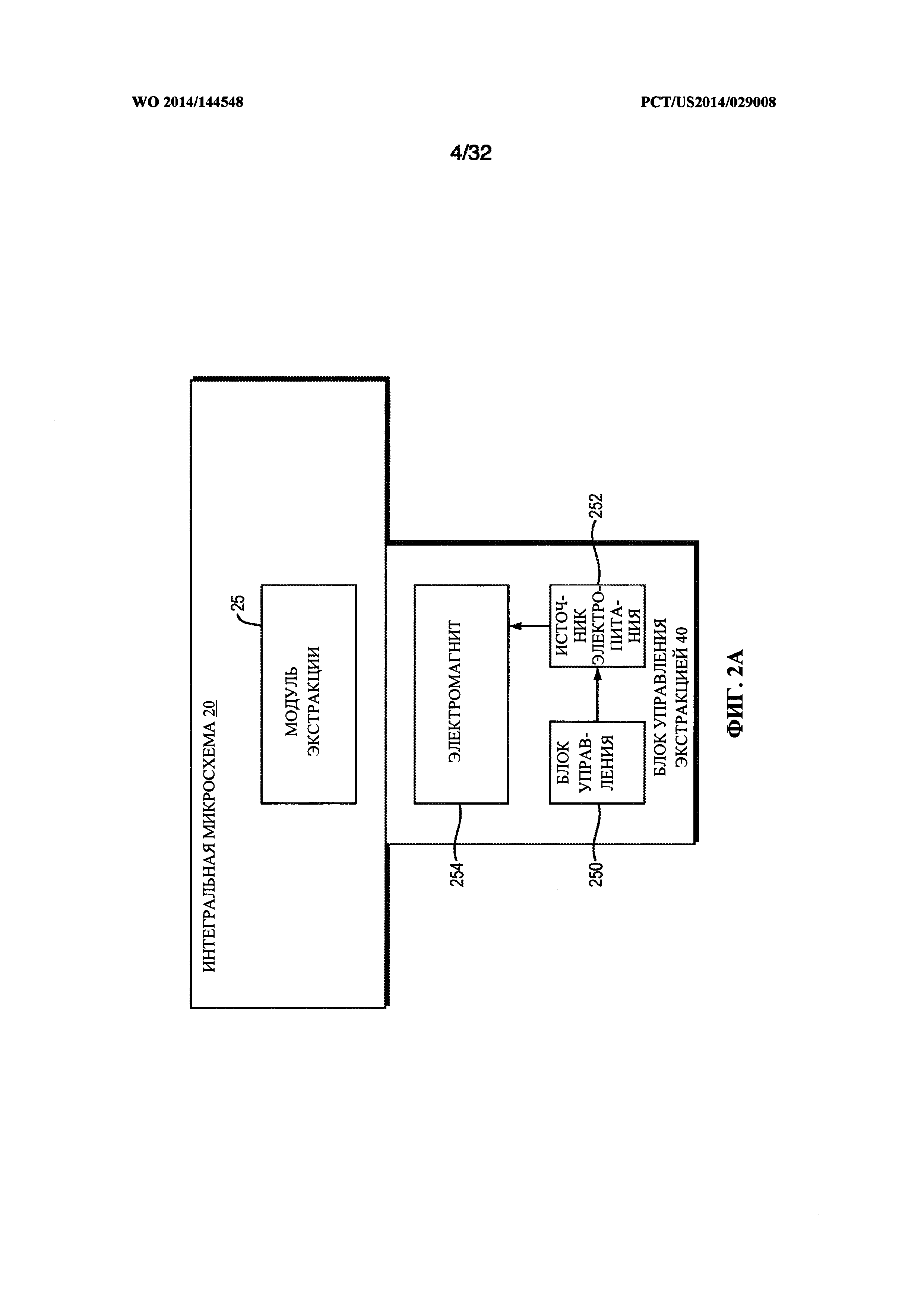
[0032] На фиг. 2А показан вариант реализации модульной конструкции модуля управления экстракцией.
[0033] На фиг. 2B показан вариант реализации модульной конструкции модуля управления амплификацией.
[0034] На фиг. 3 показан иллюстративный пример блок-схемы способа регистрации и анализа нуклеиновых кислот.
[0035] На фиг. 4 показан иллюстративный вариант реализации компактной интегральной микросхемы, которая может быть использована с устройством и способом настоящего изобретения.
[0036] На фиг. 5 показаны взятые в качестве примера пассивные запорные клапаны для управления потоком текучей среды на интегральной микросхеме.
[0037] На фиг. 6А и 6B показан взятый в качестве примера электромагнитно управляемый клапан и способ управления потоком текучей среды через интегральную микросхему, используемую в настоящем изобретении.
[0038] На фиг. 7A и 7B показан взятый в качестве примера способ управления потоком текучей среды к лункам на микросхеме и от них.
[0039] На фиг. 8A-8C показано взятое в качестве примера распределение каналов и способы инжекции образца в каналы, используемые для капиллярного электрофореза, в качестве варианта реализации настоящего изобретения.
[0040] На фиг. 9А показан вариант реализации модульной конструкции модуля управления регистрацией флуоресценции.
[0041] На фиг. 9B показаны взятые в качестве примера система и способ для регистрации сигналов флуоресценции, выработанных в модуле регистрации нуклеиновой кислоты интегральной микросхемы.
[0042] На фиг. 10 показана блок-схема, иллюстрирующая полезность настоящей заявки в различных приложениях.
[0043] На фиг. 11 показан модуль аппаратных средств для использования с компактными интегральными микросхемами в соответствии с вариантами реализации настоящего изобретения.
[0044] На фиг. 12 показано нагревательное устройство на основе эффекта Пельтье для использования с модулем аппаратных средств по фиг. 11.
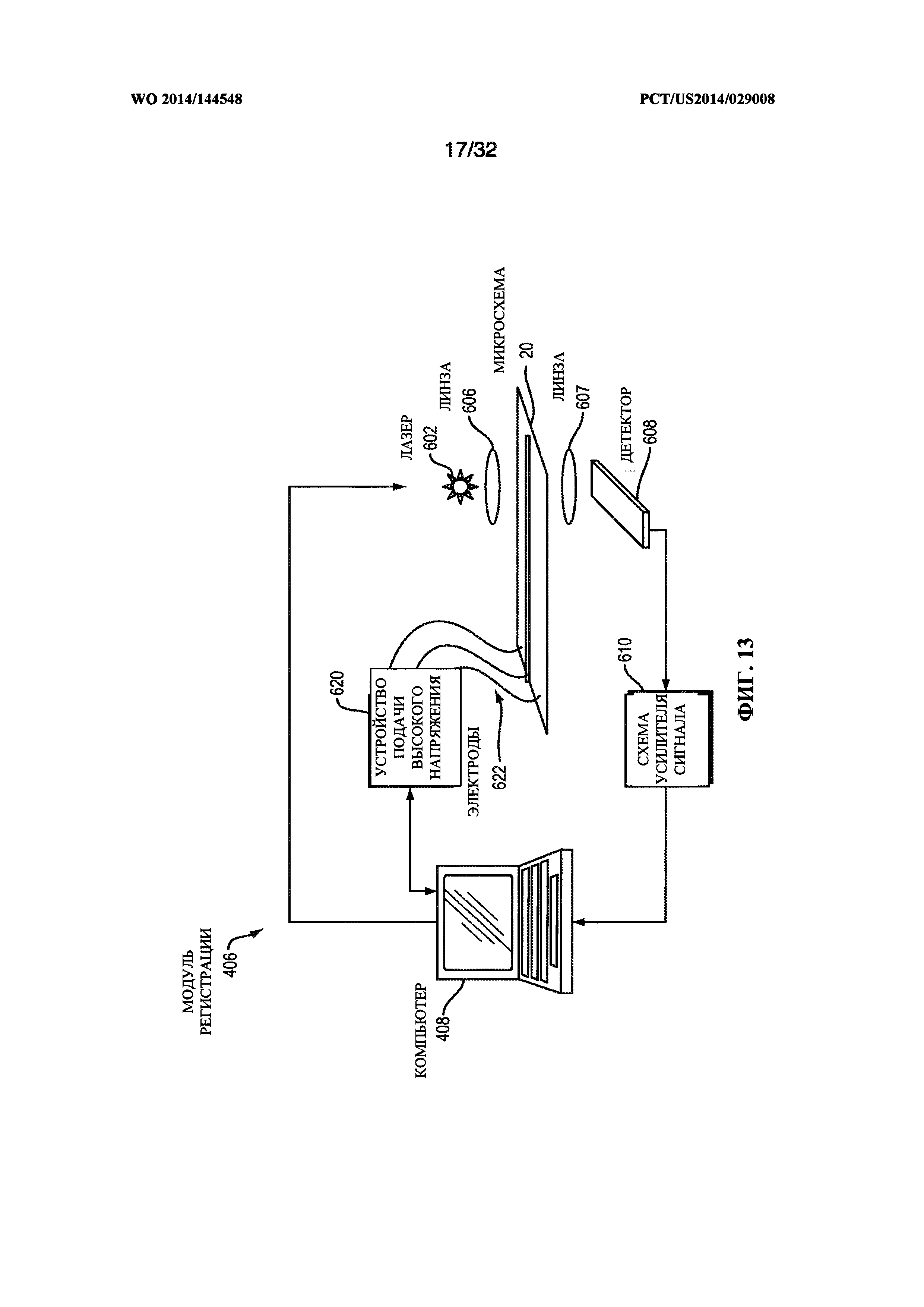
[0045] На фиг. 13 показана система регистрации для использования с компактной интегральной микросхемой.
[0046] На фиг. 14 показана система аппаратных средств для использования с компактными интегральными микросхемами в соответствии с вариантами реализации настоящего изобретения.
[0047] На фиг. 15А и 15B показаны другие виды микрожидкостного клапана компактной интегральной микросхемы, основанного на надувной инкапсулированной эластичной мембране.
[0048] На фиг. 16A-16F показаны другие виды микрожидкостного клапана компактной интегральной микросхемы, основанного на надувной инкапсулированной эластичной мембране.
[0049] На фиг. 17A, 17B, 17C, и 17D показаны результаты очистки и амплификации ДНК на микросхеме.
[0050] На фиг. 18 показано описание основанного на агарозном геле электрофореза, подтверждающего размер полученного в результате амплификации продукта.
[0051] На фиг. 19A, 19B, 19C, и 19D показаны результаты очистки и амплификации ДНК на микросхеме.
[0052] На фиг. 20 показано описание основанного на агарозном геле электрофореза, подтверждающего размер полученного в результате амплификации продукта.
[0053] На фиг. 21 показаны переносные устройства. (A) - трансдермальный пластырь или дермальный пластырь; (B) - браслет, содержащий устройство в соответствии с настоящим изобретением и полоску для удержания устройства на запястье, руке, ноге, пальце; и (C) - пластырь, адгезивно присоединяемый к внешней части тела с одной стороны, и устройство в соответствии с настоящим изобретением на той же самой или противоположной стороне.
[0054] На фиг. 22 показаны устройства, выполненные в качестве имплантируемых устройства, инжектируемых устройств или проглатываемых устройств согласно настоящему изобретению.
[0055] На фиг. 23 показан график целевых калибровочных кривых для ряда разбавления для количественного анализа вируса иммунодефицита человека, в эксперименте в соответствии с вариантом реализации настоящего изобретения.
[0056] На фиг. 24 показан график кривых, показывающих типичный динамический диапазон обычного устройства для полимеразной цепной реакции для амплификации целевого вируса иммунодефицита человека первого типа.
[0057] На фиг. 25А показан график кривых, показывающих тестирование обычного бактериального болезнетворного организма E.Coli в системе в соответствии с вариантом реализации настоящего изобретения.
[0058] На фиг. 25B показана диаграмма линейного приближения между количественными циклами и количеством копий ДНК в эксперименте согласно фиг. 25A.
[0059] На фиг. 26 показана диаграмма устройства в соответствии с вариантом реализации настоящего изобретения.
[0060] На фиг. 27 показана таблица выбранных сердечно-сосудистых воспалительных биомаркеров, которые могут быть определены, измерены и/или отслежены в соответствии с вариантом реализации настоящего изобретения.
[0061] На фиг. 28 показана таблица выбранных диабетных воспалительных биомаркеров, которые могут быть определены, измерены и/или отслежены в соответствии с вариантом реализации настоящего изобретения.
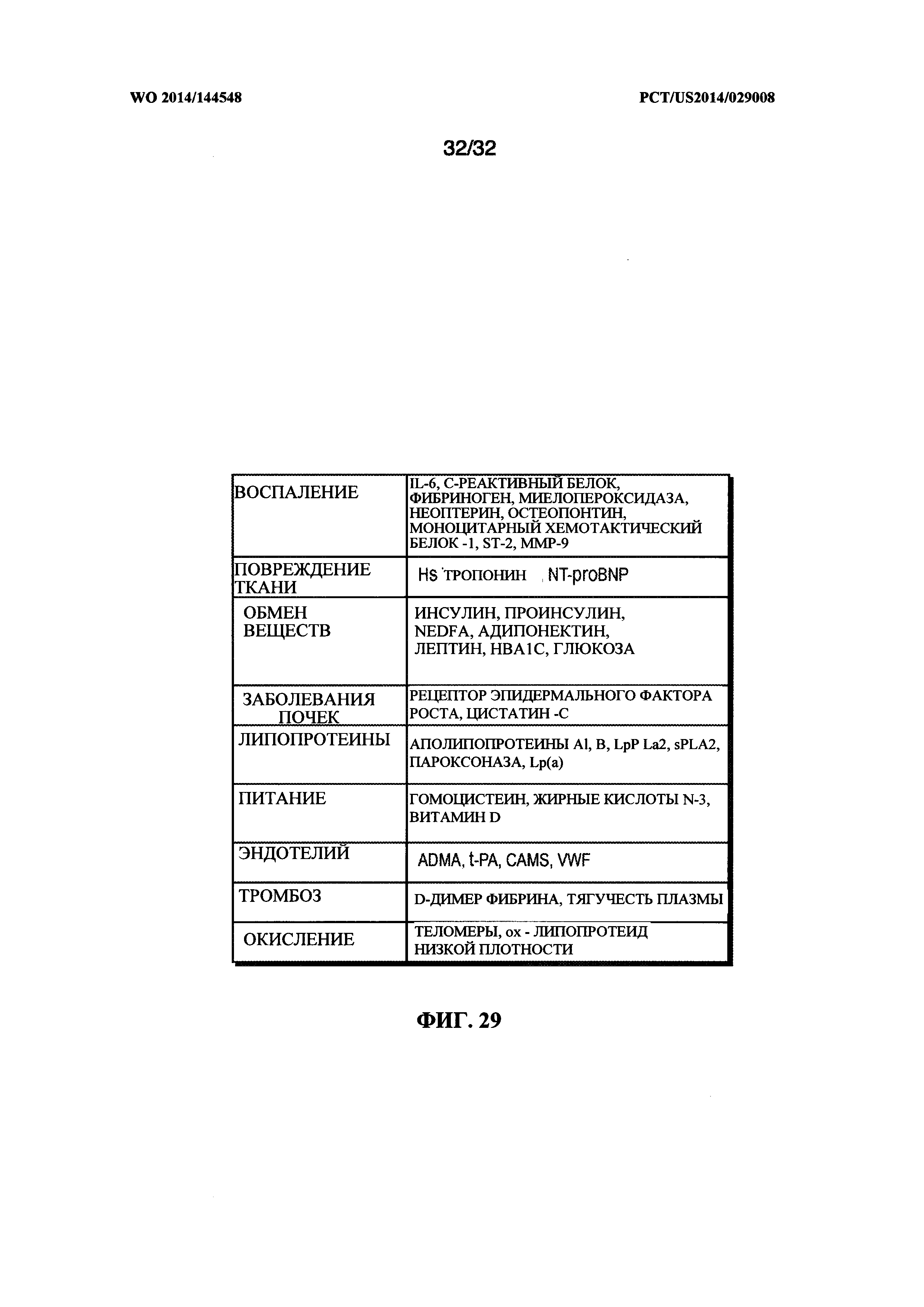
[0062] На фиг. 29 показана таблица выбранных биомаркеров для ожирения, диабета и развития сердечно-сосудистых заболеваний, которые могут быть определены, измерены и/или отслежены в соответствии с вариантом реализации настоящего изобретения.
Подробное описание изобретения
[0063] Ниже приведено описание взятых в качестве примера вариантов реализации настоящего изобретения.
[0064] При использовании в настоящей заявке термин «текучая среда» относится и к газу и к жидкости.
[0065] При использовании в настоящей заявке термин «микрожидкостный» относится к устройству и/или способам, работающим при объемах текучей среды от 0,1 до 100 мкл или имеющим отношение к таким объемам, и предпочтительно между 1 и 10 мкл.
[0066] При использовании в настоящей заявке термин «система текучей среды» означает систему с текучей средой, например, текучей средой в по меньшей мере одном канале, по меньшей мере в одной камере, по меньшей мере в одной лунке и/или по меньшей мере в одном отверстии, каждое из которых может быть микрожидкостным.
[0067] При использовании в настоящей заявке термин «нуклеиновая кислота» относится к макромолекуле, составленной из цепей (полимерных или олигомерных) мономерного нуклеотида. Наиболее распространенные нуклеиновые кислоты представляют собой дезоксирибонуклеиновую кислоту (ДНК) и рибонуклеиновую кислоту (РНК). Дополнительно понятно, что настоящее изобретение может быть использовано для регистрации и идентификации образцов, содержащие искусственные нуклеиновые кислоты, такие как среди других пептид-нуклеиновую кислоту, морфолино, закрытую нуклеиновую кислоту, гликоль-нуклеиновую кислоту и треоза-нуклеиновую кислоту. В различных вариантах реализации настоящего изобретения нуклеиновые кислоты могут быть получены из множества источников, таких как бактерии, вирусы, люди и животные, а также, среди других, от таких источников, как растения и грибы. Источник может быть болезнетворным организмом. В качестве альтернативы источник может быть синтетическим организмом. Нуклеиновые кислоты могут быть геномными, внехромосомными или синтетическими. При использовании термина «ДНК» в настоящей заявке специалист в данной области техники понимает, что описанные в настоящей заявке способы и устройства может быть применены к другим нуклеиновым кислотам, например, к РНК или упомянутым выше кислотам. Кроме того, термины «нуклеиновая кислота», «полинуклеотид» и «олигонуклеотид» использованы в настоящей заявке с включением полимерной формы нуклеотидов любой длины, включая, но не ограничиваясь этим, рибонуклеотиды или дезоксирибонуклеотиды. Нет никакого заранее определенного различия в длине между этими терминами. Необходимо дополнительно отметить, что эти термины относятся только к основной структуре молекулы. Таким образом, в определенных вариантах реализации настоящего изобретения эти термины могут включать тройную, двойную и одноцепочечные ДНК, пептид-нуклеиновую кислоту, а также тройную, двойную и одноцепочечную РНК. Они также включают модификации, например, полученные посредством метилирования и/или кэппированием, и немодифицированные формы полинуклеотида. В частности, термины «нуклеиновая кислота», «полинуклеотид» и «олигонуклеотид» включают полидезоксирибонуклеотиды (содержащие 2-деокси-D-рибозу), полирибонуклеотиды (содержащие D-рибозу), и любой другой тип полинуклеотида, представляющий собой N- или С-гликозид на основании пурина или пиримидина, и другие полимеры, содержащих ненуклеотидные остовы, например, полимеры полиамида (например, пептид-нуклеиновые кислоты) и полиморфолино (выпускаемое компанией «Anti-Virals, Inc.», Корваллис, Орегон, США, под названием Neugene), и другие синтетические полимеры нуклеиновой кислоты с характерной последовательностью, при условии, что эти полимеры содержат нуклеиновые основания в конфигурации, обеспечивающей возможность спаривания оснований и межплоскостное взаимодействие оснований, которые можно найти в ДНК и РНК.
[0068] При использовании в настоящей заявке термин «белок» означает биологическую молекулу, содержащую одну или большее количество цепей аминокислот. Белки отличны друг от друга в основном по их последовательности аминокислот, которую диктует нуклеотидная последовательность кодирующего гена. Пептид представляет собой одну линейную полимерную цепь двух или большего количества аминокислот, соединенных вместе пептидными связями между карбоксильными и аминогруппами соседних аминокислотных остатков; многократные пептиды в цепи могут быть названы полипептидами. Белки могут быть выполнены из одного или большего количества полипептидов. Вскоре после синтеза или даже во время синтеза, остатки в белке часто подвержены химической модификации посредством посттрансляционной модификации, изменяющей физические и химические свойства, фолдинг, стабильность, активность и в конечном счете функции белков. Иногда к белкам прикреплены непептидные группы, которые можно назвать простетическими группами или кофакторами.
[0069] При использовании в настоящей заявке термин «биологический образец» включает образец любого материала, содержащий нуклеиновые кислоты и/или белки, которые могут быть экстрагированы, проанализированы и зарегистрированы. В предпочтительном варианте реализации материал был в жидкой или газообразной форме, или мог быть растворен или суспендирован в текучей среде или газе, или мог быть превращен в жидкость или газ или иначе подготовлен к анализу посредством устройства и способа согласно настоящему изобретению. Твердые образцы типа образцов кала или почвы могли быть, например, помещены в воду и затем загружены на микросхему. Могут быть использованы аэрозольные биологические образцы. «Биологический образец» может быть образцом ткани, образцом биожидкости, экологическим образцом или другим типом образца или его частью. Предпочтительно получение биологического образца из биологической текучей среды, такой как, но не ограничиваясь этим, кровь, слюна, сперма, моча, околоплодные воды, цереброспинальная текучая среда, синовиальная текучая среда, гиалиновая текучая среда, желудочная текучая среда, носоглоточный аспират и/или лимфа. Биологическая проба может также быть материалом или текучей средой, которые загрязнены нуклеиновой кислотой и/или источником белка. Биологическая проба быть образцом ткани, водным образцом, воздушным образцом, образцом пищевого продукта или образцом сельскохозяйственной культуры. При биологическом анализе образца предпочтительна регистрация любого одного или большего количества передаваемых через воду болезнетворных организмов, передаваемых через воздух болезнетворных организмов, передаваемых через пищевой продукт болезнетворных организмов или передаваемых через сельскохозяйственную культуру болезнетворных организмов.
[0070] При использовании в настоящей заявке термин «биологический анализ» относится к выполнению биохимических проб, в которых образцы, например, клетки, нуклеиновые кислоты, белки или другие биологические молекулы использованы в качестве исходного материала для получения информации для целей диагноза, идентификации видов, выделения точковых мутаций и/или аллелей предрасположенности к заболеваниям, качественного анализа, количественного анализа (например, для установления вирусной нагрузки) и для других целей, описанных в настоящей заявке. Пример использования этой технологии состоит в регистрации болезнетворного организма посредством выделения генетической информации из клеток. При использовании в настоящей заявке термин «операция» «биологического анализа» относится к операциям экстракции, при необходимости амплификации, и регистрации.
[0071] При использовании в настоящей заявке термин «биомаркер» относится к измеренной характеристике, которая может быть использована в качестве индикатора некоторого биологического состояния или заболевания. Например, биомаркер может быть измерен и оценен для исследования нормальных биологических процессов, процессов, связанных с болезнетворными организмами, или фармакологических реакций на терапевтическое лечение.
[0072] При использовании в настоящей заявке термин «терапевтическое лечение» относится к предпринятой попытке исправления проблемы со здоровьем.
[0073] При использовании в настоящей заявке термин «блок генетического анализа» относится к процессору, например, к аппаратному компьютерному процессору или другому специализированному процессору для обработки цифровых сигналов, который принимает электронные сигналы, хранит электронные сигналы, подает на выход электронные сигналы и обрабатывает электронные сигналы, например, на основании компьютерной программы, связывающей электронные сигналы с генетическим анализом. Например, блок генетического анализа может быть запрограммирован для определения биомаркеров, основанных на входном сигнале, связанном с зарегистрированными нуклеиновыми кислотами, и для определения и подачи на выход персонифицированного геномного профиля, основанного на биомаркерах.
[0074] При использовании в настоящей заявке термин «блок управления раздачей» относится к процессору, например, к аппаратному компьютерному процессору или другому специализированному процессору для обработки цифровых сигналов, который принимает электронные сигналы, хранит электронные сигналы, подает на выход электронные сигналы и обрабатывает электронные сигналы, например, на основании компьютерной программы, связывающей электронные сигналы с раздачей по меньшей мере части продукта. Например, блок управления раздачей может быть выполнен с возможностью определения по меньшей мере части подлежащего раздаче продукта на основании, по меньшей мере частично, персонифицированного геномного профиля.
[0075] При использовании в настоящей заявке термин «активатор раздачи» относится к устройству или системе, выполненных с возможностью раздачи по меньшей мере части изделия. Например, активатор раздачи может представлять собой по меньшей мере часть одного из следующего: торговый автомат; автоматизированный кассовый аппарат; и терминал самообслуживания; и может содержать трехмерный принтер, выполненный с возможностью печати по меньшей мере части изделия, или раздачи предварительно упакованного изделия.
[0076] Части вариантов реализации настоящего изобретения, например, блок генетического анализа, могут быть выполнены посредством использования одной или большего количества компьютерных систем и могут, например, быть частью программы, работающей на компьютерном процессоре. Например, варианты реализации настоящего изобретения могут быть выполнены посредством использования аппаратных средств, программного обеспечения или их комбинации. При реализации посредством программного обеспечения программный код может быть сохранен в любой форме постоянной среды, доступной для считывания компьютером, и загружен и выполнен на любом подходящем процессоре или совокупности процессоров, размещенных на одном компьютере или распределенных по множеству компьютеров.
Общее описание
[0077] Как понятно специалисту в данной области техники, настоящее изобретение может включать часть аппаратных средств, часть программного обеспечения и/или комбинацию из частей программного и аппаратного обеспечения. В одном варианте реализации настоящее изобретение представляет собой портативные средства обработки, которые соединены посредством интерфейса с компактной интегральной микросхемой для выполнения, в одном варианте реализации настоящего изобретения, экстракции, амплификации и регистрации нуклеиновых кислот в биологическом образце согласно используемым компьютером команд, выполняемых в машиночитаемой среде, или в другом варианте реализации настоящего изобретения, для разделения белков, например, посредством электрофореза. Система может использовать сменные модули, как описано дополнительно ниже согласно фиг. 2.
[0078] При использовании в настоящей заявке термин «компактная» относится к компоновке микрожидкостного устройства, минимизирующей пространство, используемое описанными ниже каналами текучей среды, камерами, лунками и отверстиями, например, достигаемое при компоновке микрожидкостного устройства. В одном варианте реализации настоящего изобретения использование пересекающих друг друга каналов текучей среды и совместно используемых лунок дает пример компактной конструкции. При использовании в настоящей заявке термин «интегральный» относится к компоновке микрожидкостного устройства, в которой используемые для различных целей каналы текучей среды, камеры, лунки и отверстия собраны на/в одном микрожидкостном устройстве. Например, показанный на фиг. 4 вариант реализации микросхемы содержит камеры экстракции нуклеиновой кислоты, используемые для экстракции нуклеиновой кислоты, камеры амплификации нуклеиновой кислоты, используемые для амплификации нуклеиновой кислоты, и каналы регистрации, используемы для разделения и регистрации нуклеиновых кислот. Хотя указанные в предыдущем предложении камеры и каналы описаны во множественном числе, совершенно понятно, что они могли быть «по меньшей мере одной» такой камерой или каналом. Кроме того, совершенно понятно, что при использовании в настоящей заявке один или большее количество «модулей» могут совместно использовать общую камеру, например один или большее количество модулей экстракции, амплификация и регистрации могут совместно использовать одну или большее количество общих камер. При использовании в настоящей заявке термин «портативная» относится к системе или устройству или мобильному устройству, которое можно легко переносить или передавать вручную пациентом. При использовании в настоящей заявке термин «мобильное устройство» относится к небольшому портативному устройству, обычно содержащему экран дисплея с сенсорным входом и/или миниатюрную клавиатуру и весящему меньше примерно 10 кг, включая, например, смартфон, планшет, ноутбук или другое портативное медицинское устройство.
[0079] Система может хранить показания, имеющие отношение к зарегистрированной нуклеиновой кислоте в машиночитаемой среде или облаке, и сравнивать эти показания с записями, хранимыми в геномных или транскриптомных базах данных, которые могут быть сохранены в машиночитаемой среде или в удаленном месте. В альтернативных вариантах изобретения информация, имеющая отношение к исходному эталону, сохранена в машиночитаемой памяти, расположенной в пределах системы. В еще одном варианте реализации настоящего изобретения стандарт нуклеиновой кислоты включен в интегральную микросхему, которая может быть использована с системой согласно настоящему изобретению.
[0080] Средства процессора могут представлять собой, например, миникомпьютер, микрокомпьютер, устройство UNIX, персональный компьютер, например, компьютер с процессором компании «Intel» или аналогичным устройством, микропроцессор или другой подходящий компьютер или даже смартфон. Они также обычно содержат обычные компьютерные компоненты (не показаны), например, материнскую плату, блок центрального процессора, оперативное запоминающее устройство, дисководы и периферийные устройства, такие как клавиатура и дисплей. Оперативное запоминающее устройство хранит операционную систему, например, Windows СЕ, или другую операционную систему и соответствующее программное обеспечение для сигналов обработки, имеющих отношение к зарегистрированным нуклеиновым кислотам или белкам.
[0081] Части описанных в настоящей заявке вариантов реализации настоящего изобретения могут быть выполнены посредством использования одной или большего количества компьютерных систем. Например, варианты реализации настоящего изобретения могут быть выполнены посредством использования аппаратных средств, программного обеспечения или их комбинации. При реализации посредством программного обеспечения программный код может быть сохранен в любой форме постоянной среды, доступной для считывания компьютером, и загружен и выполнен на любом подходящем процессоре или совокупности процессоров, размещенных на одном компьютере или распределенных по множеству компьютеров.
[0082] Кроме того, совершенно понятно, что компьютер может быть выполнен в любой из многих форм, таких как ноутбук, планшетный компьютер или компьютер, внедренный в устройство, обычно не рассматриваемое как компьютер, но с подходящими возможностями обработки, включая «персональный цифровой секретарь», смартфон или любое другое подходящее портативное или мобильное электронное устройство.
[0083] Кроме того, компьютер может содержать одно или большее количество устройств входа и выхода. Эти устройства могут быть использованы, среди прочего, для выполнения пользовательского интерфейса. Примеры устройств выхода, которые могут быть использованы для выполнения пользовательского интерфейса, включают принтеры или экраны дисплея для визуального представления выхода и спикеры или другие генерирующие звук устройства для акустического представления выхода. Примеры устройств входа, которые могут быть использованы для пользовательского интерфейса, включают клавиатуры и указывающие устройства, например, мыши, тачпады и планшетные цифраторы. В качестве другого примера компьютер может получать входную информацию посредством распознавания речи или в другом акустическом формате.
[0084] Такие компьютеры могут быть связаны одной или большим количеством сетей в любой подходящей форме, включая как локальную сеть, так и глобальную сеть, например, сеть предприятия или Интернет. Такие сети могут быть основаны на любой подходящей технологии, могут работать согласно любому подходящему протоколу и могут представлять собой беспроводные сети, проводные сети или волоконно-оптические сети.
[0085] Кроме того, различные описанные в настоящей заявке способы или процессы могут быть закодированы в виде программного обеспечения, выполняемого на одном или большем количестве процессоров, использующих любую из множества операционных систем или платформ. Необходимо дополнительно отметить, что такое программное обеспечение может быть написано на любом из многих подходящих языков программирования и/или написано посредством использования средств программирования или написания сценариев, и также может быть скомпилировано как исполняемый код на машинном языке или промежуточный код, выполняемый в интегрированной системе или на виртуальной машине.
[0086] В этом отношении, по меньшей мере часть изобретения может быть выполнена в виде доступной для считывания компьютером среды (или среды, доступной для считывания множеством компьютеров) (например, в виде машинной памяти, одного или большего количества гибких дисков, компакт-дисков, оптических дисков, магнитных лент, флэш-памяти, конфигурации цепи в матрицах логических элементов с эксплуатационным программированием или других полупроводниковых устройств, или в виде другой практически осуществимой компьютерной среды хранения) с закодированными в ней одной или большим количеством программ, которые при их выполнении на одном или большем количестве компьютеров или других процессоров реализуют способы, выполняющие описанные выше различные варианты реализации настоящего изобретения. Доступная для считывания компьютером среда или среды могут быть выполнены транспортабельными, так что хранимые в них программа или программы могут быть загружены в один или большее количество различных компьютеров или в другие процессоры для реализации различных описанных выше аспектов настоящего изобретения.
[0087] В этом отношении совершенно понятно, что одна реализация вышеописанных вариантов содержит по меньшей мере одну доступную для считывания компьютером среду с размещенной в ней компьютерной программой (например, с определенным количеством команд), которая при ее реализации на процессоре выполняет некоторые или все вышеупомянутые функции этих вариантов реализации изобретения. При использовании в настоящей заявке термин «доступная для считывания компьютером среда» охватывает только постоянную доступную для считывания компьютером среду, которая, как можно полагать, представляет собой устройство или изделие (т.е. изделие промышленного производства). Доступная для считывания компьютером среда может, например, представлять собой материальный носитель, на котором может быть закодирована или сохранена доступная для считывания компьютером информация, среду для хранения, в которой доступная для считывания компьютером информация может быть закодирована или сохранена, и/или постоянную среду, в которой доступная для считывания компьютером информация может быть закодирована или сохранена. Другие неисчерпывающие примеры доступных для считывания компьютером сред включают машинную память (например, постоянное запоминающее устройство, оперативное запоминающее устройство, флэш-память или другой тип машинной памяти), магнитный диск или ленту, оптический диск и/или другие типы доступных для считывания компьютером сред, которые, как можно полагать, представляют собой устройство или изделие.
[0088] Термины «программа» или «программное обеспечение» использованы в настоящей заявке в родовом смысле, обозначая любой тип машинного кода или набор выполнимых компьютером команд, которые могут быть использованы для программирования компьютера или другого процессора для реализации описанных выше различных аспектов настоящего изобретения. Кроме того, совершенно понятно, что согласно одному аспекту этого варианта реализации настоящего изобретения одна или большее количество компьютерных программ, которые при выполнении реализуют способы согласно настоящему изобретению, не обязательно размещены на одном компьютере или процессоре, но могут быть распределены модульным способом среди многих различных компьютеров или процессоров для реализации различных аспектов настоящего изобретения.
[0089] Выполняемые компьютером команды могут быть во многих формах, например, в виде программных модулей, выполняемых одним или большим количеством компьютеров или других устройств. Обычно программные модули содержат стандартные подпрограммы, программы, объекты, компоненты, структуры данных и т.д., которые выполняют конкретные задачи или реализуют определенные абстрактные типы данных. Обычно функциональные возможности программных модулей могут быть скомбинированы или распределены по желанию в различных вариантах реализации настоящего изобретения.
[0090] В одном варианте реализации настоящего изобретения портативная система 10 для взятия пробы представляет собой устройство с размером, примерно соответствующим размерам мобильного беспроводного устройства, как показано на фиг. 1. Пользователь взаимодействует с портативной системой 10 для взятия пробы, используя средства 12 визуализации (например, жидкокристаллический дисплей) и средства 14 ввода (например, клавиатуру). Для использования портативной системы 10 для взятия пробы пользователь помещает образец 22 на интегральную микросхему 20 (описанную более подробно ниже) и затем вставляет интегральную микросхему 20 в щель 16 в самой системе.
[0091] После загрузки пользователем интегральной микросхемы 20 портативная система 10 для взятия пробы экстрагирует, амплифицирует и регистрирует нуклеиновые кислоты в образце 22, используя описанные ниже способы или в зависимости от других используемых модулей, например, электрофореза. Микропроцессор (не показан) обрабатывает зарегистрированный сигнал, который может быть представлен пользователю через средства 12 визуализации и передан другим пользователям посредством средств 18 связи. Средства 18 связи могут быть использованы для передачи и приема модулированных сигналов данных, имеющих отношение к биологическому образцу 22.
[0092] Термин «модулированный сигнал данных» относится к распространяющемуся сигналу, одна или большее количество характеристик которого установлены или изменены для кодирования информации в сигнале. Взятый в качестве примера модулированный сигнал данных включает несущую волну или другой способ для перемещения. Коммуникационные среды включают любые среды передачи информации. В качестве примера, но не ограничения, коммуникационные среды включают: проводные среды, например, проводную сеть или непосредственное проводное соединение и беспроводные коммуникационные среды, например, акустические, инфракрасные, радиоволновые, микроволновые, технологии с распределенным спектром и другие технологии беспроводных сред.
[0093] Настоящее изобретение может содержать геномную или транскриптомическую базу данных для хранения некоторое количество геномных или транскриптомических профилей или целевых последовательностей биомаркера. В одном варианте реализации настоящего изобретения настоящее изобретение может содержать профиль сигнала для одного эталонного образца. Устройство согласно настоящему изобретению может также быть соединено с дистанционно размещенной геномной или транскриптомической базе данных, например, к базам данных, поддерживаемых Национальными Институтами Здоровья, Центром по контролю и профилактике заболеваний и т.д. Такое соединение содействует отслеживанию вспышек заболеваний и координации ответных мер в широко распределенных местах проведения анализа. Примеры мест проведения анализа включают больницы, пограничные переходы, аэропорты, лагеря беженцев, фермы, карантинные зоны, места бедствия, укрытия для бездомных, дома престарелых, мясоперерабатывающие заводы и центры пищевой промышленности. Специалисты в данной области техники способны указать другие места проведения анализа, к которым применимо настоящее изобретение.
[0094] Устройство согласно настоящему изобретению не обязательно должно быть непосредственно соединено с геномными или транскриптомическими базами данных, хотя это может иметь место при необходимости. В других вариантах реализации настоящего изобретения устройство может быть соединено с геномными или транскриптомическими базами данных посредством различных сетей, общественных или частных, например, посредством локальных сетей, глобальных сетей или через Интернет. В одном варианте реализации настоящего изобретения геномные базы данных доступны через общедоступную сеть, например, Интернет. Данные передают в защищенном виде, например, посредством протокола безопасных соединений (SSL) или защищенной копии.
[0095] В варианте реализации настоящего изобретения, показанном на фиг. 1A, портативная система 10 для взятия пробы соединена с геномной базой 5 данных посредством подключения к Интернету 1 и серверу 3. Средства 15 обработки в портативной системе 10 для взятия пробы передают и получают данные, сохраняемые в памяти 17, в геномную базу 5 данных и из нее посредством средств 18 связи, которые могут представлять собой, соединение типа Ethernet или другие подходящие средства связи. Средства 15 обработки управляют накоплением и обработкой данных о ДНК, используя модули 40, 50, 60 экстракции, амплификации и регистрации. Средства 15 обработки хранят собранные данные в памяти 17 и представляют их пользователю через средства 12 визуализации; они получают команды и запросы от пользователя через средства 14 ввода.
[0096] В некоторых вариантах изобретения устройство выполнено мобильным или размещено по месту лечения и при необходимости выполнено карманным.
Модули экстракции, амплификации и регистрации
[0097] Портативная система 10 для взятия пробы (фиг. 1) использует комбинацию модулей для экстракции, амплификации и регистрации нуклеиновых кислот в образце 22 (фиг. 1). Весь процесс, включая любую обработку 70 данных зарегистрированного сигнала, обычно занимает менее 20 минут, как показано на фиг. 3, и может занимать менее 180 минут, менее 120 минут, менее 90 минут, менее 60 минут, менее 30 минут, менее 20 минут, менее 10 минут, менее 5 минут или менее 1 минуты.
[0098] Каждый из модулей может содержать один из различных вариантов реализации и комбинации, показанные на фиг. 2.
[0099] Биологический образец 22 (фиг. 1) загружают на интегральную микросхему 20 (фиг. 1 и фиг. 4). Загрузка биологического образца быть выполнена вручную, через отверстие 100 для впуска образца (фиг. 4) или посредством средств автоматизированной загрузки внутри портативной системы 10. Например, отверстие 100 для впуска может быть загружено вручную или посредством автоматически работающего загрузочного устройства, например, пипетки. В качестве альтернативы, в вариантах реализации настоящего изобретения, предназначенных для полевого использования, отверстие 100 для впуска может быть загружено непосредственно тампоном или уколотым пальцем, посредством нажатия уколотого пальца на отверстие 100 для впуска. Силы капиллярности вынуждают кровь перетекать из укола в отверстие 100 для впуска.
[00100] Нуклеиновые кислоты экстрагируют в модуле 25 экстракции нуклеиновой кислоты из интегральной микросхемы 20 (фиг. 4) под управлением модуля 40 управления экстракции нуклеиновой кислоты (фиг. 2 и 3). Например, и как видно на фиг. 2, модуль 40 управления экстракцией нуклеиновой кислоты может содержать любое из подходящих средств для реализации упомянутых ниже способов или любые другие подходящие средства для экстракции нуклеиновых кислот из биологических образцов: химическая экстракция (заявка WO 2005/05073691), обработка ультразвуком (заявка WO 1999/9933559), механическая фрагментация, использующая изготовленные способами микротехнологии выступы, расположенные на интегральной микросхеме (патент США №5635358 и заявка WO 2006/06029387), тепловые средства разрушения клеточных мембран (см., например, заявку WO 2005/05011967), электрошоковое открытие клеточных пор, включая средства приложения переменного электрического напряжения к биологическому образцу, загруженному на интегральную микросхему, причем указанное электрическое напряжение достаточно для разрыва клеток в биологическом образце (публикация заявки на патент США 2004/6783647), при необходимости содержащие прикрепленный к ним, при необходимости ковалентно, зонд для нуклеиновой кислоты (заявка WO 2005/05073691 и заявка WO 2003/03104774), или магнитные микроносители, при необходимости содержащие прикрепленный к ним, при необходимости ковалентно, зонд для нуклеиновой кислоты (публикация заявки на патент США 2002/6344326). Все упомянутые выше публикации полностью включены в настоящую заявку посредством ссылки. В предпочтительном варианте реализации настоящего изобретения, использующем магнитные микроносители, модуль 40 экстракции нуклеиновой кислоты использует средства захвата магнитных частиц, например, магнит.
[00101] В одном варианте реализации настоящего изобретения магнитные микроносители могут содержать прикрепленный к ним, при необходимости ковалентно, зонд для нуклеиновой кислоты. В этом варианте реализации настоящего изобретения малый электромагнит или постоянный магнит могут быть использованы для управления магнитными микроносителями в модуле экстракции. Магнитные микроносители, которые могут быть использованы, представляют собой любые выпускаемые промышленностью комплекты для очистки нуклеиновой кислоты посредством магнитных микроносителей, поставляемые такими производителями, как компании «Agencourt Bioscience)), «Cosmo Bio Co., Ltd.», «Invitek GmbH», «Polysciences, Inc.», «Roche Applied Science)), «B-Bridge International», «Dynal Biotech», «Novagen» или «Promega». Использование магнитных микроносителей для очистки ДНК или РНК описано, например, в статье Caldarelli-Stefano et al., «Использование магнитных микроносителей для экстракции ДНК ткани и полимеразная цепная реакция для IS6110 Mycobacterium tuberculosis», Mol Pathol. Июнь 1999; 52 (3): 158-160.
[00102] Как показано на фиг. 2А, модуль 40 управления экстракцией может содержать блок 250 управления, источник 252 энергии и электромагнит 254. По команде от модуля 40 управления экстракцией блок 250 управления подает электропитание от источника энергии 252 к электромагниту 254, прилагая магнитное поле (не показано) к модулю 25 экстракции. Это вынуждает магнитные микроносители (не показаны) в модуле 25 собираться вдоль внутренней стенки камеры экстракции (не показана) в модуле 25 экстракции. Блок 250 управления высвобождает магнитные микроносители посредством выключения источника 250 энергии, что вынуждает электромагнит 254 прекратить приложение магнитного поля.
[00103] Экстрагированные нуклеиновые кислоты могут быть амплифицированы внутри модуля 27 амплификации нуклеиновой кислоты из интегральной микросхемы 20 (фиг. 4) под управлением модуля 50 управления амплификацией нуклеиновой кислоты (фиг. 2 и 3). Амплификация может быть выполнена посредством использования любой подходящей методики амплификации, включая обычные методики, основанные на полимеразной цепной реакции, описанные в патентах США №4683202 и №4683195, содержание которых полностью включено в настоящую заявку посредством ссылки. Нуклеиновые кислоты могут также быть амплифицированы посредством использования изотермических способов, например, способом, описанным в патенте США №7494791, содержание которого полностью включено в настоящую заявку посредством ссылки.
[00104] В некоторых вариантах реализации настоящего изобретения амплификация нуклеиновой кислоты включает полимеразную цепную реакцию с обратной транскрипцией.
[00105] Обратившись к фиг. 2, можно видеть, что модуль 50 управления амплификацией нуклеиновой кислоты может содержать любые подходящие средства для выполнения амплификации нуклеиновой кислоты (т.е., увеличения количества копий матрицы нуклеиновой кислоты). Амплификация может быть или линейной или экспоненциальной. В одном варианте реализации настоящего изобретения модуль 50 включает средства для луночной амплификации нуклеиновой кислоты. Как показано на фиг. 2B, такие средства могут включать средства 201 для нагрева/охлаждения модуля 27 амплификации нуклеиновой кислоты в интегральной микросхеме 20. Примеры средств 201 нагрева для нагрева/охлаждения модуля амплификации нуклеиновой кислоты в интегральной микросхеме включают устройства на основе эффекта Пельтье (заявка WO 1998/9850147, содержание которой полностью включено в настоящую заявку посредством ссылки) и основанные на тонких пленках устройства. В других вариантах реализации настоящего изобретения средства для нагрева модуля амплификации нуклеиновой кислоты в интегральной микросхеме (см. фиг. 4, элемент 25) могут представлять собой средства нагрева инфракрасным излучением (заявка WO 1996/9641864, содержание которой полностью включено в настоящую заявку посредством ссылки) или средства нагрева микроволновым излучением.
[00106] Как показано на фиг. 2B, средства 201 нагрева могут содержать элемент 203 нагрева/охлаждения, температурный датчик 205, блок 207 обработки, блок 209 управления электропитанием и источник 211 энергии. По команде от модуля 50 управления амплификацией блок 207 обработки инициирует нагрев/охлаждение посредством указания блоку 209 управления электропитанием подавать электропитание от источника 211 энергии к элементу 203 нагрева/охлаждения. Блок 207 обработки отслеживает температуру элемента 203 нагрева/охлаждения посредством температурного датчика 205 и регулирует его команды к блоку 209 управления электропитанием при необходимости поддержания нужной температуры модуля 27 амплификации.
[00107] В другом варианте реализации настоящего изобретения модуль 50 (см. фиг. 2 и 3) содержит средства для основанной на текучей среде амплификации нуклеиновой кислоты (см., например, патент США 7041481 содержание которого полностью включено в настоящую заявку посредством ссылки). Такие средства могут включать средства выработки потока текучей среды, предназначенного для выработки потока буферных растворов через модуль амплификации нуклеиновой кислоты в интегральной микросхеме, причем указанные средства генерации потока текучей среды функционально связаны со средствами управления температурой для управления температурой модуля амплификации нуклеиновой кислоты в интегральной микросхеме.
[00108] В других вариантах реализации настоящего изобретения модуль 50 (см. фиг. 2 и 3) содержит средства управления полимеразной цепной реакцией в режиме реального времени для амплификации нуклеиновой кислоты (см., например, патент США 7315376, содержание которого полностью включено в настоящую заявку посредством ссылки).
[00109] В других вариантах реализации настоящего изобретения модуль 50 (см. фиг. 2 и 3) содержит средства для приложения контролируемого механического напряжения к цепям нуклеиновой кислоты внутри модуля амплификации нуклеиновой кислоты в интегральной микросхеме (см. фиг. 4, элемент 25). Подробное описание изобретения таких средств приведено в патенте №7494791, содержание которого полностью включено в настоящую заявку посредством ссылки.
[00110] При использовании в настоящей заявке термин «механическое напряжение» при его использовании в контексте амплификации, обработки и/или регистрации нуклеиновой кислоты, относится к альтернативе циклическому температурному воздействию или термическому денатурированию двухспиральной нуклеиновой кислоты или к нетемпературному управляемому процессу амплификации нуклеиновой кислоты или денатурации или отжигу или расширению праймера. Приложение «механического напряжения» к нуклеиновым кислотам представляет собой результат приложения физической силы, отличной от происходящей исключительно от тепловой энергии, к цепи нуклеиновой кислоты. Механическое напряжение может быть «с управляемой точностью» (как определено в другом месте в настоящей заявке) и/или быть управляемым с возможностью регулировки и/или переменным.
[00111] Механическое напряжение с управляемой точностью может представлять собой механическое напряжение, гидродинамическое напряжение, электромагнитное напряжение или их комбинации. Кроме того, в некоторых вариантах реализации настоящего изобретения, средства для приложения управляемого механического напряжения к цепи нуклеиновой кислоты выполнены с возможностью работы изотермическим образом. При использовании в настоящей заявке в контексте амплификации, обработки и регистрации нуклеиновой кислоты, термин «изотермический» относится к способу амплификации нуклеиновой кислоты, при котором нет необходимости в циклическом температурном воздействии и предпочтителен процесс амплификации, все операции которого могут быть выполнены при по существу одинаковой температуре.
[00112] Варианты реализации настоящего изобретения, использующие средства для управляемого механического напряжения, прилагаемого к цепи нуклеиновой кислоты внутри модуля амплификации нуклеиновой кислоты интегральной микросхемы (см. фиг. 4, элемент 25), имеют существенные преимущества по сравнению со средствами для обычной (способы циклического температурного воздействия) амплификации нуклеиновой кислоты. Эти преимущества включают повышенную точность в целом и, в частности, при амплификации «трудных» последовательностей (например, богатых гуанином-цитозином последовательностей), длину амплифицированных последовательностей, выход реакции и скорость реакции (полное время реакции амплификации). Другие важные преимущества включают более высокую эффективность амплификации и способность улучшать точность амплификации, например, посредством коррекции активности экзонуклеазы при использовании механического напряжения (см. патент США №7494791, патент США №8632973 и заявку на патент США №14/106,399, содержание которых полностью включено в настоящую заявку посредством ссылки).
[00113] Варианты реализации настоящего изобретения, использующие средства для приложения управляемого механического напряжения к цепи нуклеиновой кислоты, включают приспособление для приложения переменного и управляемого механического напряжения к молекулам нуклеиновой кислоты, сохраненным внутри модуля амплификации нуклеиновой кислоты интегральной микросхемы (см. фиг. 4, элемент 27). Такое приспособление может содержать первую поверхность и вторую поверхность со средствами для фиксации молекул нуклеиновой кислоты на них, причем указанные первая и вторая поверхности выполнены с возможностью перемещения друг относительно друга. В качестве альтернативы такое приспособление может содержать по меньшей мере одну поверхность со средствами для фиксации молекул нуклеиновой кислоты на ней, причем устройство дополнительно содержит приспособление для раздачи управляемого и переменного потока текучей среды по указанным молекулам нуклеиновой кислоты. В другом варианте реализации настоящего изобретения такое приспособление может содержать по меньшей мере одну поверхность со средствами для фиксации на ней молекул нуклеиновой кислоты, дополнительно содержащую пути для потока текучей среды, распределяемого между средствами для фиксации указанных молекул нуклеиновой кислоты. В других вариантах реализации настоящего изобретения такое приспособление может содержать приспособление для раздачи управляемого и переменного потока текучей среды по указанным молекулам нуклеиновой кислоты, выполненное с возможностью создания градиента скорости в ламинарном потоке текучей среды. В качестве альтернативы такое приспособление может содержать каналы потока текучей среды, выполненные с возможностью получения градиента скорости в ламинарном потоке текучей среды, точки торможения внутри потока текучей среды, потоков текучей среды в противоположном направлении или комбинации их. В других вариантах реализации настоящего изобретения такое приспособление может содержать набор оптических, электрических или магнитных манипуляторов (например, оптических микропинцетов, индивидуально управляемых магнитных микроносителей и т.д.), выполненный с возможностью управления частицами, связанными с молекулами нуклеиновой кислоты. Средства задержания нуклеиновых кислот внутри модуля амплификации нуклеиновой кислоты интегральной микросхемы (см. фиг. 4, элемент 27) могут включать способные к активации праймеры, содержащие группы образования комплексов для иммобилизации одноцепочечных участков липких концов, полученных во время амплификации нуклеиновой кислоты. В качестве альтернативы полимеразы нуклеиновой кислоты могут быть иммобилизированы или иначе сохранены на поверхности интегральной микросхемы 20.
[00114] Регистрация амплифицированных нуклеиновых кислот происходит в модуле 29 регистрации нуклеиновой кислоты в интегральной микросхеме 20 (фиг. 4) под управлением модуля 60 управления регистрацией нуклеиновой кислоты (фиг. 2 и 3).
[00115] В различных вариантах реализации настоящего изобретения модуль 60 может содержать флуоресцентные или электрооптические средства 950 регистрации для регистрации нуклеиновых кислот, как показано на фиг. 9A. Средства 950 регистрации флуоресценции могут содержать излучатель 952, например, светодиод и/или лазерный диод, устройство 954 сбора и накопления данных, например, фотоприемник, фотоэлектронный умножитель или полупроводниковый приемник света, лавинный фотодиод и блок 956 обработки для хранения и обработки собранных данных. В одном варианте реализации настоящего изобретения излучатель 952 возбуждает образец испускаемым излучением 960 с выработкой сигнала 962 флуоресценции, принимаемого устройством 954 сбора данных. В варианте реализации настоящего изобретения, показанном на фиг. 9A, испускаемое излучение 960 облучает модуль 29 регистрации в геометрии пропускания, хотя совершенно понятно, что могут быть также использованы также отражение и другие конфигурации. Устройство 954 сбора и накопления данных преобразует сигнал 962 флуоресценции в модулированный сигнал 958 данных, который регистрирует и записывает блок 956 обработки.
[00116] Амплифицированные нуклеиновые кислоты могут быть разделены и зарегистрированы при использовании капиллярного электрофореза, как описано в патенте США №6261431, содержание которого полностью включено в настоящую заявку посредством ссылки. В некоторых вариантах реализации настоящего изобретения модуль 60 может содержать средства управления капиллярным электрофорезом для выполнения разделения нуклеиновых кислот, причем указанные средства управления капиллярным электрофорезом функционально соединены со средствами регистрации флуоресценции. Средства управления капиллярным электрофорезом могут дополнительно содержать блок управления высоким электрическим напряжением для приложения электрического напряжения к модулю 60 регистрации нуклеиновой кислоты в интегральной микросхеме 20, причем указанное электрическое напряжение достаточно для разделения нуклеиновых кислот.
[00117] Обратившись к фиг. 4, можно видеть, что в одном варианте реализации настоящего изобретения капиллярный электрофорез выполнен в каналах 112 регистрации, которые могут быть заполнены соответствующим буферным раствором и, при необходимости, предварительно заполнены матрицей просеивания, например, среди других, агарозой, гидроксипропил-целлюлозой или полиакриламидом. В определенных вариантах реализации настоящего изобретения конечный пользователь может заполнить каналы регистрации 112 (фиг. 4) матрицей просеивания в месте использования.
[00118] В качестве альтернативы модуль 60 управления регистрацией нуклеиновой кислоты дополнительно содержит микроматрицу гибридизации, например, микроматрицы GeneChip®, производимые компанией «Affimetrix», Санта-Клара, Калифорния.
[00119] В одном варианте реализации настоящего изобретения модуль 60 управления регистрацией нуклеиновой кислоты содержит электрохимические средства для регистрации нуклеиновых кислот. Пример электрохимического средства для регистрации нуклеиновых кислот описан в публикации заявки на патент США 2008/0081329, содержание которой полностью включено в настоящую заявку посредством ссылки. Кратко, такие средства реализуют способ выявления наличия или отсутствия целевого субстрата в образце для испытаний. Эти средства включают электрод с проводящей поверхностью и зонд, прикрепленный к проводящей поверхности и способный быть прикрепленным к целевому субстрату. Связанный с проводящей поверхностью зонд входит в контакт с образцом для испытаний с образованием связанного с поверхностью целевого комплекса. Связанный с поверхностью целевой комплекс дополнительно содержит первый окислительно-восстановительный комплекс. Связанный с поверхностью зонд или связанный с поверхностью целевой комплекс, при его наличии, входят в контакт с текучей средой, содержащей второй окислительно-восстановительный комплекс, причем один комплекс из первого или второго окислительно-восстановительных комплексов представляет собой окислительно-восстановительный комплекс с переходным металлом, способный выполнить реакцию окисления-восстановления, а другой комплекс из первого или второго окислительно-восстановительных комплексов представляет собой окислительно-восстановительный каталитический комплекс, способный к катализации реакции окисления-восстановления окислительно-восстановительного комплекса с переходным металлом. Окислительно-восстановительный комплекс с переходным металлом не обеспечивает существенного объема реакции окисления-восстановления в отсутствие окислительно-восстановительного каталитического комплекса. Обнаружена реакция окисления-восстановления комплекса с переходным металлом, которая катализируется окислительно-восстановительным каталитическим комплексом.
[00120] В другом варианте реализации настоящего изобретения модуль 60 управления регистрацией нуклеиновой кислоты содержит средства измерения импеданса для регистрации нуклеиновых кислот. Пример средств измерения импеданса для регистрации нуклеиновых кислот описан, например, в патенте США 7169556, содержание которого полностью включено в настоящую заявку посредством ссылки. Кратко, способ включает контакт нуклеиновой кислоты, содержащей первую часть и вторую часть, с подложкой с прикрепленной к ней олигонуклеотидами, причем олигонуклеотиды размещены между парой электродов, олигонуклеотиды имеют последовательность, дополнительную к первой части последовательности указанной нуклеиновой кислоты, и контакт происходит при условиях, эффективных для обеспечения возможности гибридизации олигонуклеотидов на подложке со указанной нуклеиновой кислотой. После гибридизация нуклеиновой кислоты и олигонуклеотида нуклеиновая кислота, связанная с подложкой, входит в контакт с первым типом проводящих частиц (например, с металлическими микроносителями), причем проводящие частицы выполнены из материала, способного проводить электричество, проводящие частицы имеют один или большее количество прикрепленных к ним типов олигонуклеотидов, по меньшей мере один из типов олигонуклеотидов имеет последовательность, дополнительную ко второй части последовательности указанной нуклеиновой кислоты, контакт происходит при условиях, эффективных для обеспечения возможности гибридизации олигонуклеотидов на проводящих частицах с нуклеиновой кислотой с образованием испытательной подложки, образующей комплекс с проводящими частицами. После выполнения второй гибридизации испытательная подложка входит в контакт с водным солевым раствором, имеющим концентрацию, в достаточной степени подходящую для дегибридизации и удаления не связанных специфически проводящих частиц. Гибридизация/дегибридизация приводит к заметному изменению значения импеданса между электродами, возникающему вследствие наличия специфически связанных проводящих частиц.
[00121] В соответствии с вариантом реализации настоящего изобретения любая из многих различных возможных методик экстракции, амплификации и регистрации может быть используема в комбинации; или действительно одна или большее количество операций экстракции, амплификации и регистрации могут быть опущены в целом из комбинации экстракции, амплификации и регистрации. Например, в модульной системе согласно фиг. 2, любой из возможных типов модулей, показанных как модуль 40 экстракции, или другой тип экстракционного модуля могут быть использованы для экстракции; и такой модуль(-и) 40 экстракции может быть использован в комбинации с любым из возможных типов модулей, показанных как модуль 50 амплификации, или в комбинации с другим типом модуля амплификации; и кроме того такой модуль(-и) 40 экстракции и модуль(-и) 50 амплификации могут быть использованы в комбинации с любым из возможных типов модулей, показанных как модуль 60 регистрации, или в комбинации с другим типом модуля регистрации. В зависимости от подлежащей регистрации мишени могут быть использованы различные комбинации таких модулей. Во-первых, биологический образец, например, кровь, слюна и т.д., может быть использован в качестве биологического образца, подлежащего анализу; или может быть использован твердый образец (например, проба фекалий) или аэрозольный образец. В модуле 40 экстракции целевую нуклеиновую кислоту или белок отделяют от остальной части биологического образца. Амплификация может затем происходить в модуле 50 амплификации. В другом случае, если цель представляет собой белок, он может быть передан непосредственно в модуль 60 регистрации, например, в модуль капиллярного электрофореза, или в любой из других модулей регистрации, показанных на фиг. 2, или в другой тип модуля регистрации, включающего, например, модуль анализа кривой плавления, модуль хемилюминесценции, модуль квантовой точки, модуль, использующий наночастицы, например, наночастицы золота, или модуль регистрации, основанный на использовании излучения. В другом случае, если подлежащий анализу начальный биологический образец представляет собой нуклеиновую кислоту, то возможно нет необходимости в использовании модуля 40 экстракции и образец может быть непосредственно послан в модуль 60 регистрации. Что касается модуля 50 амплификации, то в дополнение к типам модулей, показанным на фиг. 2, другие подлежащие использованию возможные модули представляют собой модуль опосредованной петлями изотермической амплификации (LAMP), модуль определяемой геликазой амплификации (HDA), модуль амплификации замещением цепей (SDA). Способ опосредованной петлями изотермической амплификации может быть использован так, как описано в статье Т. Notomi et al., Nucleic Acids Research, 28, e63 (2000); способ определяемой геликазой амплификации может быть использован так, как описано в статье Vincent М., Xu Y., Kong Н. (2004), «Определяемая геликазой изотермическая амплификация ДНК», EMBO Rep. 5 (8): 795-800; способ амплификации замещением цепей может быть использован так, как описано в статье Walker G.T. et al., Proc. Natl. Acad. Sci. USA, 89, 392-396 (1992); все содержание которых включено в настоящую заявку посредством ссылки. Модули в системе могут быть выполнены сменными между термическими и изотермическими модулями амплификации; и может быть использован любой описанный в настоящей заявке способ амплификации, например, определяемая геликазой амплификация, амплификация замещением цепей, и любой из способов, описанных в патенте США №7 494 791, патенте США №8632973 и заявке на патент США №14/106 399 (все компании «Nanobiosym, Inc.»), содержание которых полностью включено в настоящую заявку посредством ссылки. В одном конкретном варианте реализации настоящего изобретения портативная система 10 для взятия пробы содержит модуль 40 управления экстракцией, выполненный с возможностью использования магнитных микроносителей для экстракции нуклеиновых кислот, модуль управления 50 амплификацией, использующий способы циклического температурного воздействия с устройством на основе эффекта Пельтье, и модуль 60 управления регистрацией, использующий капиллярный электрофорез и флуоресцентную регистрацию сигнала для разделения и регистрации нуклеиновых кислот.
[00122] В соответствии с вариантом реализации настоящего изобретения, различные интегральные микросхемы способны быть проанализированы одним мобильным устройством, причем каждая из различных возможных интегральных микросхем имеет различные функциональные возможности, признаваемые и выполняемые одним мобильным устройством. Например, одна микросхема может быть использована для анализа нуклеиновых кислот, а другая микросхема может быть использована в том же самом мобильном устройстве для анализа белков.
[00123] Диаграмма типичного потока материала и данных через систему согласно настоящему изобретению, такую как модульная система, показанная на фиг. 2, показана на фиг. 3. Модули 40, 50, 60 экстракции, амплификации и регистрации обычно работают в течение примерно 4 минут каждый, по сравнению с периодами от часов до недель при использовании обычных способов. В вариантах реализации настоящего изобретения регистрация может длиться менее 2 часов, менее 1 часа, менее 30 минут, менее 1 минуты или менее 1 секунды от начала анализа образца. В варианте реализации настоящего изобретения интегральная микросхема 20, содержащая модули 40, 50, 60 экстракции, амплификации и регистрации, обычно весит примерно 35 г, тогда как специализированная интегральная схема, используемая для обработки зарегистрированного сигнала, весит примерно 25 г, что дает полный вес картриджа примерно в 60 г. Модули размещены на интегральной микросхеме и управляемы соответствующими модулями управления (не показаны) в портативной системе 10 для взятия пробы.
[00124] Аналогично, в некоторых вариантах реализации настоящего изобретения устройство на основе эффекта Пельтье или тонкопленочный нагреватель или другие средства регулирования температуры могут быть использованы для нагрева и охлаждения камеры 108 амплификации нуклеиновой кислоты (фиг. 4) при контроле температуры камеры 108 посредством термопары. Процесс капиллярного электрофореза может быть управляем модулем управления регистрацией, который управляет напряженностью и постоянством электрического поля, прилагаемого к каналам, используемым для капиллярного электрофореза.
[00125] В некоторых вариантах реализации настоящего изобретения система 10 (фиг. 1) может содержать средства выработки давления текучей среды для перемещения биологического образца и/или нуклеиновых кислот через интегральную микросхему. Давление текучей среды может быть выработано перистальтическими насосами, поршневыми насосами, пневматическими насосами или любыми другими подходящими средствами. В качестве альтернативы давление может быть приложено к микрожидкостным каналам в микросхеме посредством шприца с ручным приводом, присоединенного к соответствующему впускному отверстию, например, к отверстию 100 для впуска образца, отверстию 108 для добавления реактива, лунке 120 для образца, лунке 116 для буферного раствора или лунке 114 для остатков буферного раствора (фиг. 4).
[00126] Средства управления клапанами (например, клапанами, показанными более подробно на фиг. 7 и 8A и 8B и описанными ниже) могут быть введены в систему 10 (фиг. 1). Клапаны управляют перемещением текучей среды между различными модулями и вдоль различных каналов для перемещения. Может быть использовано любое количество конструкций клапана, включая пассивные запорные клапаны, клапаны с механическим приводом, клапаны с электромагнитным приводом, клапаны с ферромагнитной жидкостью, пневматические клапаны или любые другие подходящие клапаны.
[00127] В некоторых вариантах реализации настоящего изобретения система 10 (фиг. 1) содержит средства обработки данных для хранения, классифицирования, представления в количественной форме и передачи данных, полученных при анализе биологического образца. Средства обработки данных могут включать средства для беспроводной передачи данных.
[00128] В определенных вариантах реализации настоящего изобретения зависимость интенсивности сигнала от времени может быть проанализирована для получения показания относительно типов и количества для разновидностей нуклеиновых кислот, присутствующих в биологическом образце 22 (фиг. 1). Например, построение графика зарегистрированного сигнала вместе с графиком сигнала, вырабатываемого эталонным образцом, обеспечивает пользователю возможность определения, присутствуют ли в анализируемом образце болезнетворные организмы, существующие в эталонном образце, поскольку идентичные болезнетворные организмы дают пики сигнала в один момент времени (при одинаковых условиях проведения анализа). Средства обработки данных дополнительно содержат средства вычисления вирусной нагрузки для вычисления вирусных нагрузок (например, посредством интегрирования площади под кривой, отображающей сигнал флуоресценции в зависимости от времени).
[00129] В других вариантах реализации настоящего изобретения система 10 дополнительно содержит средства показа данных для подачи данных на выход.
[00130] Портативная система 10 для взятия пробы взаимодействует с интегральной микросхемой 20 посредством электрических, тепловых и механических интерфейсов. Зажимы и/или захваты удерживают микросхему на месте с достаточной устойчивостью, гарантирующей, что вибрации не приводят к разориентации электродов, детекторов (например, фотоприемников) или нагревателей. Нагреватель (и при необходимости охлаждающий элемент типа струйного холодильника) (не показан), размещенный под, над или на модуле 40 управления амплификацией нагревает и/или охлаждает определенные секции микросхемы, как описано ниже. Аналогичным образом, электроды, размещенные вблизи модуля 60 управления регистрацией, могут быть использованы для управления разделением и потоком текучей среды через микросхему, как описано ниже. Поскольку микросхема 20 выполнена прозрачной, электромагнитные лучи, такие как инфракрасные или электромагнитные лучи для нагревания, или оптические лучи для опроса флуоресцентных меток могут быть использованы при проведении проб для лунок, камер и каналов в микросхеме 20.
Интегральная микросхема
[00131] Хотя приведенное ниже описание относится к конкретным вариантам реализации интегральной микросхемы 20 (фиг. 1 и фиг. 4), совершенно понятно, что другие структуры микросхемы могут быть использованы с портативной системой 10 (фиг. 1) согласно настоящему изобретению.
[00132] В одном варианте реализации настоящее изобретение представляет собой компактную интегральную микросхему, предназначенную для использования с системой для экспресс-анализа биологических образцов.
[00133] Интегральная микросхема 20 может быть выполнена из стекла, любой пластмассы с хорошими оптическими свойствами, включая, но не ограничиваясь этим, полиэтилен, полипропилен, полиуретанимид, политетрафторэтилен, поликарбонат, циклический сополимер олефина, полиамиды, циклический полимер олефина, полиметилметакрилат, полиакриламид, пенопласт или любой другой подходящий материал или комбинацию материалов.
[00134] Интегральная микросхема содержит по меньшей мере одно отверстие для впуска образца, предназначенное для инжекции биологических образцов и реактивов; модуль экстракции нуклеиновой кислоты, содержащий по меньшей мере одну камеру экстракции для экстракции нуклеиновых кислот из биологических образцов, причем указанная камера экстракции соединена с отверстием для впуска образца по меньшей мере одним каналом для перемещения образца; модуль амплификации нуклеиновой кислоты, содержащий по меньшей мере одну камеру амплификации для амплификации нуклеиновых кислот, причем указанная камера амплификации нуклеиновой кислоты соединена с экстракционной камерой по меньшей мере одним каналом для перемещения нуклеиновой кислоты; и модуль регистрации нуклеиновой кислоты, содержащий по меньшей мере один канал регистрации для разделения и регистрации нуклеиновых кислот, причем указанный канал регистрации соединен с камерой амплификации нуклеиновой кислоты по меньшей мере одним каналом для перемещения продукта амплификации. В предпочтительном варианте реализации по меньшей мере одно отверстие для впуска образца, по меньшей мере одна камера экстракции, по меньшей мере одна камера амплификации и по меньшей мере один канал регистрации были размещены таким образом, который минимизирует использование пространства. Как описано выше в связи с фиг. 2, могут быть использованы сменные модули.
[00135] В предпочтительном варианте реализации модуль амплификации нуклеиновой кислоты дополнительно содержит по меньшей мере одно отверстие для добавления реактива, связанное по текучей среде с по меньшей мере одним каналом для перемещения нуклеиновой кислоты. В определенных вариантах реализации настоящего изобретения модуль регистрации нуклеиновой кислоты дополнительно содержит по меньшей мере одну лунку для образца, связанную по текучей среде с по меньшей мере одним каналом для перемещения продукта амплификации. В некоторых вариантах реализации настоящего изобретения модуль регистрации нуклеиновой кислоты дополнительно содержит по меньшей мере одну лунку для отходов образца, связанную по текучей среде с по меньшей мере одним каналом регистрации; лунку для отходов буферного раствора, связанную по текучей среде с по меньшей мере одним каналом регистрации; и лунку для буферного раствора, связанную по текучей среде с по меньшей мере одним каналом регистрации. В предпочтительном варианте реализации интегральная микросхема согласно настоящему изобретению содержит по меньшей мере два отверстия для впуска образца; по меньшей мере две камеры экстракции нуклеиновой кислоты, причем каждая указанная камера экстракции нуклеиновой кислоты соединена с одним из по меньшей мере двух отверстий для впуска образца посредством соответствующего канала для перемещения образца; по меньшей мере две камеры амплификации нуклеиновой кислоты, причем каждая указанная камера амплификации нуклеиновой кислоты соединена с одной из по меньшей мере двух камер экстракции посредством соответствующего канала для перемещения нуклеиновой кислоты; и по меньшей мере два канала регистрации, причем каждый из указанных каналов регистрации соединен с соответствующей камерой амплификации нуклеиновой кислоты посредством соответствующего канала для перемещения продукта амплификации.
[00136] В вариантах реализации настоящего изобретения происходит пересечение по меньшей мере двух каналов регистрации. В одном варианте реализации настоящего изобретения, показанном на фиг. 4, имеет место пересечение каналов 112 регистрации под прямым углом. Понятно, что в зависимости от общей формы интегральной микросхемы 20, числа каналов регистрации и необходимого расположения интегральной микросхемы может быть выбран любой угол пересечения. Предпочтительно компактное расположение. Обратившись к фиг. 4, можно видеть, что пересечение каналов 112 регистрации дает преимущество компактного дизайна, так что лунки 118 для отходов образца и лунка 116 для буферного раствора могут быть разделены несколькими (или всеми) каналами 112 регистрации. Необходимо дополнительно отметить, что в варианте реализации настоящего изобретения, в котором пользователь загружает каналы 112 регистрации молекулярным ситом, пересечение каналов 112 регистрации в лунке 116 для буферного раствора дает преимущество одновременной загрузки всех каналов регистрации.
[00137] Интегральная микросхема может дополнительно содержать по меньшей мере два отверстия для добавления реактива, причем каждое указанное отверстие для добавления реактива связано по текучей среде с соответствующим каналом для перемещения нуклеиновой кислоты; по меньшей мере две лунки для образца, причем каждая указанная лунка для образца связана по текучей среде с соответствующим каналом для перемещения продукта амплификации. В предпочтительном варианте реализации по меньшей мере две лунки для образца были выполнены с возможностью добавления и/или удаления дополнительных реактивов.
[00138] В определенных вариантах реализации настоящего изобретения интегральная микросхема дополнительно содержит по меньшей мере одну лунку для отходов образца, причем каждая указанная по меньшей мере одна лунка для отходов образца соединена с по меньшей мере двумя каналами регистрации посредством по меньшей мере двух каналов для отходов образца. В предпочтительном варианте реализации по меньшей мере одна лунка для отходов образца была выполнена с возможностью добавления и/или удаления дополнительных реактивов.
[00139] В других вариантах реализации настоящего изобретения интегральная микросхема дополнительно содержит по меньшей мере одну лунку для отходов буферного раствора, причем каждая указанная лунка для отходов буферного раствора связана по текучей среде с по меньшей мере двумя каналами регистрации; и лунку для буферного раствора, связанную по текучей среде с по меньшей мере двумя каналами регистрации. В предпочтительном варианте реализации по меньшей мере одна лунка для отходов буферного раствора и лунка для буферного раствора были выполнены с возможностью добавления и/или удаления дополнительных реактивов.
[00140] В одном варианте реализации настоящего изобретения лунка для буферного раствора размещена в точке пересечения по меньшей мере двух каналов регистрации, причем лунка для буферного раствора связана по текучей среде с указанными пересекающимися каналами регистрации.
[00141] В предпочтительном варианте реализации каждый канал для отходов образца был соединен с каналом регистрации вниз по потоку от по меньшей мере одного канала для перемещения продукта амплификации, эффективно увеличивая тем самым поперечное сечение пересечения по меньшей мере, одного канала для перемещения продукта амплификации и по меньшей мере, одного канала для перемещения продукта амплификации (см. фиг. 8A-8C и описание ниже). При использовании в настоящей заявке термин «вниз по потоку» определен как направление, в котором нуклеиновые кислоты идут через канал регистрации во время разделения.
[00142] В некоторых вариантах реализации настоящего изобретения интегральная микросхема дополнительно содержит выполненные в виде микроэлементов выступы (штырьки), размещенные в по меньшей мере одной камере экстракции нуклеиновой кислоты и/или в по меньшей мере одном канале для перемещения образца. Как описано ранее, выполненные в виде микроэлементов выступы, размещенные на интегральной микросхеме, могут быть использованы для механического сдвига клеток в биологическом образце, как описано, например, в патенте США №5635358 и заявке WO 2006/06029387, содержание которых полностью включено в настоящую заявку посредством ссылки.
[00143] Интегральная микросхема может дополнительно содержать по меньшей мере два электрода для приложения электрического напряжения по меньшей мере к одному каналу регистрации. В других вариантах реализации настоящего изобретения интегральная микросхема может содержать дополнительные электрические контакты для подачи электропитания и/или сигналов управления к приспособлению с электроприводом, которое может быть размещено внутри интегральной микросхемы.
[00144] В соответствии с одним аспектом настоящее изобретение представляет собой новый клапанный узел, как показано на фиг. 5 и фиг. 6A и 6B, и как подробнее описано ниже. Таким образом, в одном варианте реализации настоящее изобретение представляет собой клапанный узел в микрожидкостном устройстве.
[00145] В одном варианте реализации настоящего изобретения клапанный узел содержит микрожидкостный канал для перемещения текучей среды, причем указанный микрожидкостный канал выполнен между верхней поверхностью и нижней поверхностью и имеет продольную ось; клапанное отверстие в верхней поверхности для получения пассивного запорного клапана; и пассивный запорный клапан, выполненный с возможностью введения в клапанное отверстие. В предпочтительном варианте реализации часть нижней поверхности напротив клапанного отверстия имеет однородную глубину вдоль продольной оси. Такая конфигурация упрощает процесс выполнения интегральной микросхемы, устраняя или уменьшая строгие требования к ориентации частей.
[00146] В другом варианте реализации настоящего изобретения клапанный узел содержит канал для перемещения для перемещения текучей среды; феррожидкостный канал, пересекающий указанный канал для перемещения; первый феррожидкостный резервуар и второй феррожидкостный резервуар, причем указанные первый и второй феррожидкостные резервуары соединены феррожидкостным каналом; феррожидкость или в одном или в обоих феррожидкостных резервуарах; и постоянный магнит или электромагнит для заполнения феррожидкостного канала феррожидкостью. Феррожидкости обычно представляют собой коллоидные смеси с магнитными частицами, суспендированными в текучей среде и дополнительно содержащие детергент/поверхностно-активный материал, примешанный к текучей среде для предотвращения слипания частиц. (См. также статью Berger et al. (июль 1999), «Подготовка и свойства водных феррожидкостей». Journal of Chemical Education 76 (7): pp. 943-948), содержание которой полностью включено в настоящую заявку посредством ссылки.) Могут быть использованы любые выпускаемые промышленностью феррожидкости, например, феррожидкость, производимую компанией «Ferrotec Corporation)), Бедфорд, Нью-Хэмпшир.
[00147] В еще одном варианте реализации (при рассмотрении теперь фиг. 7A и 7B) настоящее изобретение представляет собой клапанный узел в микрожидкостном устройстве, содержащий: резервуар; впускные каналы для перемещения текучей среды, имеющие выпускной конец, соединенный с резервуаром; первый и второй выпускные каналы для перемещения текучей среды, каждый из которых имеет впускной конец, соединенный с резервуаром; феррожидкость, размещенную в резервуаре; и магнит для управления положением феррожидкости в резервуаре. Во время работы клапанного узла согласно фиг. 7A и 7B феррожидкость внутри резервуара размещена так, чтобы закрывать или выпускной конец впускного канала; или впускной конец первого выпускного канала, но не впускной конец второго выпускного канала; или впускной конец второго канала, но не впускной конец первого выпускного канала; или ни выпускной конец второго впускного канала, ни впускные концы первого и второго выпускных каналов.
[00148] В варианте реализации настоящего изобретения, показанном на фиг. 4, интегральная микросхема 20 содержит восемь областей 130 для образцов, каждый из которых содержит модуль 25 экстракции нуклеиновой кислоты, модуль 27 амплификации нуклеиновой кислоты и модуль 29 регистрации нуклеиновой кислоты. Микросхема может быть выполнена из стекла, акриловой смолы или любого другого подходящего материала. Как правило, микросхема имеет размер толстой кредитной карты. В одном варианте реализации настоящего изобретения длина микросхемы составляет от 1 до 4 дюймов, ширина от 1 до 4 дюймов; предпочтительные размеры интегральной микросхемы 20 составляют 2 дюйма в ширину на 4 дюйма в длину.
[00149] Каждая область 130 для образцов содержит одно отверстие 100 для впуска образца, одну камеру 104 экстракции, одну камеру 108 амплификации и один канал 112 регистрации. Совершенно понятно, что для каждого биологического образца имеет место отдельный и четко определенный путь от соответствующего отверстия для впуска образца до соответствующей камеры экстракции, затем к соответствующей камере амплификации и затем к соответствующему каналу регистрации. Таким образом избегают перекрестного загрязнения образцов и обеспечивают их целостность. Однако имеют место общие лунки (например, лунки 118 для отходов образца и лунки 112 для буферного раствора), которые совместно использованы несколькими участками для образцов. Такое совместное использование уменьшает пространство, необходимое для размещения интегральной микросхемы, и также уменьшает отходы материала.
[00150] Совершенно понятно, что микросхема может быть выполнена с любым количеством участков для образца (например, 1, 12, 24, 256, 386 или 512) при условии, что размер области 130 для образца достаточен для экстракции, амплификации и регистрации нуклеиновых кислот. Области 130 для образца могут быть использованы для анализа множества различных образцов для одной и той же самой целевой последовательности биомаркера или болезнетворного организма, одного образца для множества различных болезнетворных организмов или биомаркеров, или для любой подходящей пермутации или комбинации образцов и болезнетворных организмов или биомаркеров, при условии наличия подходящих эталонов.
[00151] Биологический образец 22 (см. фиг. 1), реактивы, используемые для экстракции, амплификации и регистрации, выполняют перемещение между различными лунками и реакционными камерами посредством микрожидкостных каналов 102 для перемещения, как показано на фиг. 4. В конкретном варианте реализации настоящего изобретения канал 102 для перемещения обладает поперечным сечением (10-1000) мкм × (10-1000) мкм и предпочтительно 200 мкм × 100 мкм и имеет достаточный размер для размещения потока магнитных микроносителей, используемых в варианте реализации процесса экстракции. В одном варианте реализации настоящего изобретения отверстия и лунки, например, отверстия 100 для впуска образца, отверстия 106 для ввода/вывода реактива, лунки 114 для отходов буферного раствора, лунки 116 для буферного раствора, лунки 118 для отходов образца и лунки 120 для образца имеют диаметр 0,5-10,0 мм, и предпочтительно, диаметр 0,9-5,0 мм с глубинами, определенными толщиной интегральной микросхемы 20. Камеры 108 амплификации нуклеиновой кислоты обычно обладают диаметром 0,1-30,0 мм и, предпочтительно, диаметром 10,0 мм и глубиной от 10 мкм до 19,0 мм и, предпочтительно, глубиной 0,5 мм. Камеры 104 экстракции нуклеиновой кислоты могут быть 1-25 мм в длину и 1-30 мм в ширину, предпочтительнее 15 мм в длину и 10 мм в ширину. Модули 29 регистрации нуклеиновой кислоты в интегральной микросхеме 20, использующие капиллярный электрофорез, обычно имеют каналы 112 регистрации с поперечными сечениями (10-200) мкм × (10-200) мкм, предпочтительнее 50 мкм ×10 мкм.
[00152] Поток текучей среды через каналы, отверстия, лунки и камеры управляем комбинацией клапанов и средств проталкивания, которые могут представлять собой шприц с ручным приводом, соединенный с отверстием 100 для впуска образца. Также могут быть использованы другие средства проталкивания, например, перистальтические насосы или поршневые насосы. Средства проталкивания продвигают текучие среды через каналы и камеру, если только закрытый клапан не блокирует поток текучей среды. Клапаны могут использовать любую из многих технологий, включая такие технологии, как пробки с ручным приводом, клапаны с механическим приводом, клапаны с электромагнитным приводом, клапаны с ферромагнитной жидкостью, пневматические клапаны или любые другие подходящие клапаны.
[00153] Например, на фиг. 5 показан клапанный узел 152, содержащий пассивный запорный клапан 150, отверстие 151 клапана и канал 102 для перемещения, образованный верхней поверхностью 160 и нижней поверхностью 161. Пассивный запорный клапан 150 может быть вставлен в отверстие 151 клапана для управления потоком текучей среды в камеру 108 амплификации нуклеиновой кислоты через канал 102 для перемещения. Клапан 150 может быть вставлен вручную или может быть с механическим приводом. В одном варианте реализации настоящего изобретения впускное отверстие 100 для образца, отверстие 106 для впуска/выпуска реактива, лунка 118 для отходов образца, лунка 120 для образца, лунка 114 для отходов буферного раствора и лунка 116 для буферного раствора могут действовать в качестве отверстия 151 клапана для получения пассивных запорных клапанов 150.
[00154] На фиг. 6A и 6B показан альтернативный метод управления потоком текучей среды посредством использования феррожидкостных клапанов 600. Феррожидкости обычно представляют собой коллоидные смеси с магнитными частицами, суспендированными в текучей среде, и дополнительно содержащие детергент/поверхностно-активный материал, примешанный к текучей среде для предотвращения слипания частиц. (См. также статью Berger et al. (июль 1999), «Подготовка и свойства водных феррожидкостей». Journal of Chemical Education 76 (7): pp. 943-948), содержание которой полностью включено в настоящую заявку посредством ссылки.) Могут быть использованы любые выпускаемые промышленностью феррожидкости, например, феррожидкость, производимую компанией «Ferrotec Corporation)), Бедфорд, Нью-Хэмпшир. Размещенные по одной линии феррожидкостные клапаны 600 содержат канал 601 для перемещения феррожидкости, расположенный поперек канала 102 для перемещения. Один конец канала 601 для перемещения феррожидкости закончен в резервуаре 604 для феррожидкости, заполненным феррожидкостью 602, а другой конец закончен в резервуаре 606 для отходов. В «открытом» состоянии феррожидкость 602 пребывает в резервуаре 604 для феррожидкости, позволяя текучей среде течь по каналу 102 для перемещения в направлении 608 потока текучей среды, как показано на фиг. 6A. Размещение магнита 610 вблизи резервуара 606 для отходов протягивает феррожидкость 602 по каналу 601 для перемещения феррожидкости, блокируя канал 102 для перемещения, как показано на фиг. 6B.
[00155] На фиг. 7A и 7B показано, как феррожидкостные клапаны 600 могут быть использованы для управления потоком текучей среды в содержащие несколько отверстий камеры и лунки и из них. В варианте реализации настоящего изобретения, показанном на фиг. 7А и 7B, текучая среда входит в лунку 702 через впускное отверстие 704. Небольшое количество феррожидкости 602 размещено в лунке 702. В положении, при котором оба выпускных отверстия 706а и 706b открыты, феррожидкость 602 пребывает в устойчивом положении в лунке 702, как показано на фиг. 7A. Лунка 702, показанная на фиг. 7A и 7B, содержит одно впускное отверстие 702 и два выпускных отверстия 706а, 706b; в других вариантах реализации настоящего изобретения лунка 702 может иметь множество впускных и выпускных отверстий 704, 706.
[00156] Текучая среда входит в лунку 702 через впускное отверстие 704. Текучая среда может выходить из лунки 702 или через выпускное отверстие 706a или через выпускное отверстие 706b, в зависимости от положения феррожидкости 602. Как показано на фиг. 7B, феррожидкость 602 может быть размещена с возможностью блокировки выпускного отверстия 706a посредством использования магнита 610, оставляя другое выпускное отверстие 706b открытым для выпуска текучей среды. Точно так же выпускное отверстие 706b может быть заблокировано, а выпускное отверстие 706а открыто. Также понятно, что впускное отверстие 704 может также быть заблокировано. Также понятно, что направление потока текучей среды может быть изменено на обратное. В одном варианте реализации настоящего изобретения различные текучие среды могут входить в лунку 702 через выпускные отверстия 706а и 706b, а впускное отверстие 704 может служить отверстием для выпуска текучей среды.
[00157] Снова обратившись к варианту реализации настоящего изобретения, показанному на фиг. 4, можно видеть, что в одном варианте реализации пользователь загружает магнитные микроносители, покрытые стрептавидином (например, гранулы стрептавидина марки FMAT® компании «Applied Biosystems», размер 6-8 микрон), в область 130 для образца. Магнитные микроносители могут быть перемещены вдоль микрожидкостного канала 102 для перемещения в камеру 104 экстракции нуклеиновой кислоты под давлением от насоса шприца или от любых других подходящих средств выработки давления текучей среды. В качестве альтернативы, магнитные микроносители могут уже быть загружены в камеру 104 экстракции. Затем пользователь загружает биологический образец 22 в область 130 для образца через отверстие 100 для впуска образца. После загрузки биологического образца 22 он проходит через тот же самый канал 102 для перемещения от отверстия 100 для впуска образца к камере 104 экстракции. Магнитные микроносители (не показаны) прикреплены посредством покрытия из стрептавидина к нуклеиновым кислотам в биологическом образце 22. По завершении процесса прикрепления приложение магнитного поля к камере экстракции вынуждает магнитные микроносители (и прикрепленные нуклеиновые кислоты) к перемещению в направлении магнитного поля, что экстрагирует нуклеиновые кислоты из биологического образца 22.
[00158] Пользователь заканчивает процесс экстракции, промывая камеру 104 экстракции раствором для промывания (не показан), инжектированным через отверстие для впуска образца. Раствор для промывания течет через камеру 104 экстракции к отверстию 106 впуска/выпуска реактива 106, от которого пользователь экстрагирует продукты промывания. Пользователь может повторять цикл промывания, пока экстрагированная нуклеиновая кислота не будет в достаточной степени свободной от загрязнений, чтобы быть амплифицированной и зарегистрированной.
[00159] При отсутствии загрязнителей в экстрагированной нуклеиновой кислоте ее вынуждают (например, посредством приложения давления от шприца или насоса) выполнять перемещение вниз по потоку в камеру 108 амплификации нуклеиновой кислоты, которую пользователь затем загружает реактивами через отверстие 106 для впуска/выпуска реактивов. Пользователь затем изолирует камеру амплификации посредством закрытия соответствующих клапанов перед инициированием проведения амплификации обычными способами амплификации. Термоэлектрический нагреватель (не показан) может быть использован для нагрева и охлаждения реактивов в камере 108 амплификации. В одном варианте реализации настоящего изобретения реактивы включают праймеры, полимеразу ДНК (например, полимеразу Taq), деоксинуклеотидные трифосфаты, буферный раствор и двухвалентные катионы.
[00160] После амплификации нуклеиновой кислоты в достаточной степени происходит открытие клапанов, изолирующих камеру 108 амплификации, и смывание амплифицированных нуклеиновых кислот в лунку 120 для образца, которая соединена с каналом 112 регистрации через канал 102 для перемещения, как показано на фиг. 8А.
[00161] В одном варианте реализации настоящего изобретения капиллярный электрофорез использован для регистрации и идентификации нуклеиновых кислот, присутствующих в биологическом образце 22. Капиллярный электрофорез включает прохождение электрического тока через электролит, например, водный буферный раствор, смешанный с анализируемым образцом в коротком (длиной порядка 50 мкм) канале, например, в канале 112. Ток вынуждает образец мигрировать вниз по каналу 112 регистрации; однако, при миграции происходит разделение компонент, поскольку их скорости миграции зависят, среди других переменных, от их молекулярных весов, величины тока и размера канала.
[00162] В одном варианте реализации настоящего изобретения пользователь добавляет раствор электролита и, при необходимости, матрицу просеивания, к каналу 112 регистрации через лунку для буферного раствора 116 (также показанную на фиг. 4). В вариантах реализации настоящего изобретения, в которых лунка 116 для буферного раствора соединена со множеством каналов 116 регистрации, например, как показано на фиг. 4, достигнута одновременная загрузка всех каналов регистрации. После заполнения лунки 116 для буферного раствора электрическое поле 130, приложенное к электродам, расположенным на или вблизи лунки 120 для образца и лунки 118 для отходов образца, вынуждает амплифицированную нуклеиновую кислоту 23 мигрировать из лунки 120 для образца в лунку 118 для отходов образца посредством канала регистрации 112, как показано на фиг. 8B. Обычно напряженность электрического поля 130 составляет примерно 400 В. Накопление экстрагированных нуклеиновых кислот происходит в области накопления 113, размещенной в канале 112 регистрации между точками пересечения каналов 102 для перемещения, которые соединяют лунку 120 для образца и лунку 118 для отходов образца с каналом 112 регистрации. Отход из лунки 120 для образца продвигается к лунке 118 для отходов образца.
[00163] На фиг. 8C показано, как приложение электрического поля 131 к каналу 112 регистрации (от лунки 116 с буферным раствором к лунке 114 с отходом буферного раствора) приводит к разделению образца амплифицированной нуклеиновой кислоты 23 на разновидности 140 согласно молекулярному весу. Обычно напряженность сильного электрического поля 131 составляет примерно 6 кВ. Поскольку ампликоны от различных целевых последовательностей биомаркера или различных болезнетворных организмов имеют различные молекулярные веса, различные биомаркеры или болезнетворные организмы идут вниз по каналу 112 регистрации с различными скоростями. Неизвестная разновидность может быть идентифицирована посредством сравнения ее скорости со скоростью для эталона (не показан) в том же самом канале 112 регистрации или в идентичном канале 112 регистрации при том же самом сильном электрическом поле 131.
[00164] На фиг. 9B показана работа взятого в качестве примера модуля 60 управления регистрацией на основе капиллярного электрофореза. Как описано выше, электрическое поле 131 протягивает разновидности 140 по каналу 112 регистрации к лунке 114 с отходом буферного раствора. При перемещении разновидностей 140 по каналу 112 регистрации они по одной в данный момент времени проходят через область 1005 измерения, где происходит их опрос лучом 1004 лазера или светодиода или другого источника света с выработкой сигнала, который, как можно интерпретировать, дает показание относительно целевой последовательности биомаркера или о типе болезнетворного организма и определяет величину соответствующей нагрузки.
[00165] В варианте реализации настоящего изобретения сигнал 1010 флуоресценции выработан посредством освещения разделенной нагрузки 140 лучом 1004 лазера или светодиода или другого источника света соответствующей частоты. Лазер 1002 вырабатывает луч 1004 лазера, который может быть направлен к участку измерения посредством зеркала 1006. В качестве альтернативы луч 1004 лазера может быть сфокусирован на образец линзой. Луч может также быть выработан светодиодом или другим источником света вместо лазера и он может быть или не может быть подан посредством волоконно-оптического кабеля. Совершенно понятно, что разнообразные оптические конфигурации могут быть использованы для опроса разновидностей 140.
[00166] Луч 1004 лазера возбуждает разделенную нагрузку 140 для выработки флуоресцентного луча 1010, отделенного от луча 1004 лазера дихроичным светоделителем 1007. В варианте реализации настоящего изобретения детектор 1012 вырабатывает фотоэлектронный ток (не показан), реагируя на интенсивность флуоресцентного луча 1010. Фотоэлектронный ток может быть подан на процессор 1014, который может быть использован для анализа зарегистрированного флуоресцентного луча 1010. Например, анализ может представлять собой сравнение зарегистрированного сигнала с кривой 1021 эталонного сигнала от известного эталонного образца на графике выходного сигнала 1020, где соответствующие пики на линиях указывают на наличие идентичных последовательностей биомаркера или болезнетворных организмов. Интегрирование областей под пиками дает показание об относительном количестве биомаркеров или болезнетворных организмов (т.е. о вирусной нагрузке), присутствующих в каждом образце. В вариантах реализации настоящего изобретения программное обеспечение коррелирует график 1020 выходного сигнала с кривой 1021 эталонного сигнала посредством использования стандартных методик корреляции для выработки выходного результата, подходящего для интерпретации пользователем.
(Лаборатория на микросхеме» для регистрации нуклеиновой кислоты или белка
[00167] Варианты реализации настоящего изобретения включают интегральную микросхему, способную выполнить вышеупомянутую биологическую пробу в одном устройстве, также называемым интегральной микрожидкостной микросхемой или «лабораторией на микросхеме». Интегральная микросхема разработана для последовательного выполнения следующих трех процессов: (1) экстракции из биологических клеток; (2) последовательной специфической амплификации нуклеиновой кислоты посредством полимеразной цепной реакции; и (3) разделения по размерам амплифицированной ДНК посредством капиллярного электрофореза в комбинации с регистрацией флуоресценции от выделенной ДНК.
[00168] Очевидно, что интегральная микрожидкостная микросхема или «лаборатория на микросхеме», подобная той, что описана в настоящем разделе, может быть использована для регистрации белка, при соответствующей модификации методик для использования при регистрации белка. Например, при регистрации белка, в одном варианте реализации настоящего изобретения может быть использован только модуль экстракции и модуль регистрации без использования амплификации. Кроме того, в некоторых вариантах реализации настоящего изобретения может быть использован только модуль регистрации. В других вариантах реализации настоящего изобретения могут быть использованы только модуль экстракции и модуль секвенирования и регистрации нуклеиновой кислоты без модуля амплификации. Любой из этих модулей может быть использован сам по себе или в комбинации друг с другом.
[00169] В одном варианте реализации сформулированное в настоящей заявке изобретение представляет собой интегральную микросхему для быстрой экстракции, амплификации и разделения нуклеиновой кислоты в биологическом образце. Изобретение также содержит систему аппаратных средств, получающую по меньшей мере одну интегральную микросхему. Интегральная микросхема представляет собой микрожидкостное устройство, содержащее микрожидкостные каналы, последовательно связанные по текучей среде с функциональными модулями: модулем экстракции нуклеиновой кислоты, модулем амплификации нуклеиновой кислоты и модулем разделения нуклеиновой кислоты.
[00170] В одном варианте реализации настоящего изобретения исследуемый биологический образец загружают на интегральную микросхему и нуклеиновую кислоту экстрагируют из биологического образца внутри модуля экстракции. Например, биологический образец содержит клетки и клеточную ДНК экстрагируют из клеток. Процесс экстракции, предпочтительно, использует осаждение нуклеиновой кислоты посредством магнитных микроносителей. Затем посредством давления текучей среды происходит перемещение экстрагированной нуклеиновой кислоты в модуль амплификации нуклеиновой кислоты, где происходит амплификация нуклеиновой кислоты посредством полимеразной цепной реакции. В некоторых вариантах реализации настоящего изобретения амплификация использует циклическое температурное воздействие. В других вариантах реализации настоящего изобретения амплификация использует изотермические методики амплификации, включая, но не ограничиваясь этим, способы, описанные в патенте США №7494791, патенте США №8632973 и заявке на патент США №14/106399 (все принадлежат компании «Nanobiosym, Inc.»), содержание которых полностью включено в настоящую заявку посредством ссылки. Затем посредством давления текучей среды происходит перемещение продуктов амплификации нуклеиновой кислоты в модуль разделения нуклеиновой кислоты, где происходит разделение и регистрация нуклеиновых кислот посредством капиллярного электрофореза. Предпочтительно использование флуоресцентно меченых праймеров нуклеиновой кислоты и регистрация продуктов нуклеиновой кислоты посредством флуоресцентной регистрации. Три описанных выше последовательных процесса происходят внутри одной интегральной микросхемы.
[00171] Последовательный процесс экстракции, амплификации, разделения/регистрации управляем системой аппаратных средств, содержащей модуль управления экстракцией нуклеиновой кислоты, модуль управления амплификацией нуклеиновой кислоты и модуль управления регистрацией нуклеиновой кислоты. Предпочтительно, чтобы эти модули соответственно контролировали: (1) использование магнита для осаждения нуклеиновых кислот, прикрепленных к магнитным микроносителям, (2) циклическое температурное воздействие во время амплификации экстрагированых нуклеиновых кислот, и (3) регистрацию нуклеиновых кислот при помощи флуоресценции.
[00172] На фиг. 10 можно видеть, что в различных вариантах реализации настоящее изобретение обеспечивает возможность достижения успехов в здравоохранении и в других отраслях промышленности. Детально описанные ниже интегральная микросхема и система аппаратных средств согласно настоящему изобретению могут быть использованы для анализа биологических образцов при биозащите, для испытаний различных условий окружающей среды, для испытаний на наличие в продовольствии болезнетворных организмов, в медицинских услугах, при трансплантации органов, в медико-биологических исследованиях, в промышленных приложениях, в сельском хозяйстве, при криминалистических испытаниях, в ветеринарии и в биомедицинских испытаниях в рамках приложений для здравоохранения, включая чрезвычайные положения в здравоохранении.
Компактная конструкция интегральной микросхемы
[00173] Снова обратившись к фиг. 4, можно видеть, что эта фигура представляет собой иллюстрацию интегральной микрожидкостной микросхемы 20 согласно вариантам реализации настоящего изобретения, содержащей восемь участков 130 для образцов, каждый из которых содержит модуль 25 экстракции, модуль 27 амплификации и модуль 29 регистрации. В интегральной микросхеме 20 вышеупомянутые процессы проведены в замкнутых камерах, открытых лунках и соединительных каналах, комбинация которых представляет собой микрожидкостную микросхему. В этой интегральной микросхеме 20 мультиплексная конструкция, позволяющая проводить анализ множества образцов, достигнута посредством архитектуры, в которой каждый образец обладает независимым путем для текучей среды в отдельном участке 130 для образцов от впуска до окончательной регистрации без какой-либо возможности перекрестного загрязнения. Каждая область 130 для образцов содержит одно отверстие 100 для впуска образца, одну камеру 104 экстракции, одну камеру 108 амплификации и один канал 112 для регистрации. Имеют место общие лунки (например, лунки 118 для отходов образца и лунки 116 для буферного раствора), совместно используемые несколькими областями 130 для образцов. Это совместное использование общих лунок уменьшает объем пространства, необходимого для конструкции интегральной микросхемы, и также уменьшает отходы материалов и реактивов, таких как подвижный буферный раствор для капиллярного электрофореза.
[00174] В конкретном варианте реализации настоящего изобретения, показанном на фиг. 4, четыре лунки 100 для впуска образца (загрузочные отверстия) размещены на каждом краю микросхемы, принимая, таким образом, восемь образцов. Эти лунки 100 затем независимо присоединены посредством каналов 102 к набору замкнутых камер 104 экстракции, предназначенных для экстракции нуклеиновой кислоты. Каждая из этих камер 104 экстракции в свою очередь соединена с другим набором открытых лунок (отверстия 106 для впуска/выпуска реактива), что обеспечивает возможность непрерывного потока текучей среды через камеру 104 экстракции, как это необходимо для выполнения экстракционной пробы. В предпочтительных вариантах реализации настоящего изобретения поток текучей среды через каналы, отверстия, лунки и камеры управляем комбинацией описанных ниже клапанов и средств проталкивания. Подходящие средства проталкивания включают шприцы с ручным приводом, соединенные с лунками 100 для впуска образца, перистальтические насосы или поршневые насосы.
[00175] Отверстия 106 для впуска/выпуска реактива в свою очередь соединены с другим набором замкнутых камер 108 амплификации, предназначенных для амплификации. Камеры 108 амплификации также соединены с лунками 120 для образцов на одной стороне и с отверстиями 106 для впуска/выпуска реактива (совместно используемых соответствующими камерами 104 для экстракции) на другой стороне, что снова обеспечивает возможность непрерывного потока текучей среды через камеры 108 амплификации.
[00176] Наконец, каждый из путей для текучей среды независимо закончен в наборе отдельных каналов 112 разделения/регистрации (каналов для капиллярного электрофореза), в которых разделение посредством электрофореза достигнуто до регистрации флуоресценции по направлению к концу каналов 112 для капиллярного электрофореза. Еще раз отметим, что модуль электрофореза специально разработан для мультиплексной инжекции и разделения всех восьми образцов, которые были ранее подвергнуты процессам экстракции и амплификации на микросхеме.
[00177] Лунки 120 на стороне электрофореза камер 108 амплификации открыты и использованы в качестве лунок 120 образца для капиллярного электрофореза. Таким образом, каждый образец (или продукт амплификации) содержит отдельную лунку 120 образца для капиллярного электрофореза, идущую от соответствующей камеры 108 амплификации. Однако лунка 116 для буферного раствора, необходимая для выполнения пробы способом капиллярного электрофореза, совместно использована образцами (или всеми или между двумя соседними путями для образца), как показано на фиг. 4. Эта мультиплексная конструкция также уменьшает сложность электропроводки высокого напряжения: при наличии общей лунки 116 для буферного раствора меньше электродов необходимо для работы системы, поскольку один электрод может быть совместно использован несколькими каналами. Например, один электрод высокого напряжения (предпочтительно, превышающего 6 кВ) может быть использован для всех восьми образцов, подвергаемых капиллярному электрофорезу. Проводимая микросхемой 20 операция капиллярного электрофореза гарантирует, что совместно используемая лунка 116 для буферного раствора не создает опасности перекрестного загрязнения образцов. Ниже со ссылками на фиг. 4 и 8A-8C более подробно описана операция капиллярного электрофореза, включая загрузку и разгрузку лунок 114, 116, 118, и 120 и приложение электрических полей.
[00178] Как правило, микросхема имеет размер толстой кредитной карты. В одном варианте реализации настоящего изобретения длина микросхемы составляет от 2,5 до 25 см, ширина от 2,5 см до 15 см и толщина от 0,1 мм до 10 мм; предпочтительные размеры интегральной микросхемы 20 составляют 5 см в ширину на 10 см в длину и на 2 мм в толщину. Специалист в данной области техники понимает, что размер и конструкция конкретной микросхемы представляют собой вопрос предпочтений.
[00179] В предпочтительном варианте размеры деталей микросхемы 20 составляют (10-200) мкм на (10-200) мкм (например, 50 мкм на 20 мкм) для каналов 112 регистрации (капиллярный электрофорез) и (10-1000) мкм на (10-1000) мкм (например, 200 мкм на 100 мкм) для всех других каналов. Специалистам в данной области техники очевидно, что для каналов, через которые текут магнитные микроносители, размер канала должен быть выбран так, чтобы гарантировать свободный поток магнитных микроносителей. Каналы 112 регистрации (капиллярный электрофорез) могут быть длиной 10-120 мм (например, длиной 80 мм). Увеличенный размер каналов 112 капиллярного электрофореза требует более высоких значений электрического напряжения для проведения анализа посредством капиллярного электрофореза. Размеры других каналов, например, каналов 102 для перемещения, а также каналов, соединяющих камеры 104 экстракции и отверстия 106 для впуска/выпуска реактива, отверстия 106 для впуска/выпуска реактива и камеры 108 амплификации, камеры 108 амплификации и лунки 120 для образцов, лунки 120 для образцов и каналы 112 регистрации, не критичны.
[00180] В предпочтительных вариантах реализации настоящего изобретения круглые лунки и камеры, например, лунки 116 для буферного раствора, имеют диаметр 5-15 мм (например, 10 мм) и глубину 0,05-1 мм (например, 0,5 мм). Шестиугольные камеры, например, камеры 104 экстракции, могут иметь длину 5-25 мм (например, 15 мм) (с конусными краями) и ширину 5-15 мм (например, 10 мм). Эта разновидность шестиугольной конструкции содействует легкому протеканию потока текучей среды в камерах 104 экстракции, в частности, потому, что процесс включает поток текучей среды большого объема. В других вариантах реализации настоящего изобретения могут быть использованы круглые камеры диаметром 0,1-30 мм и глубиной 0,01-19 мм и шестиугольные камеры длиной 1-25 мм (с конусными краями) и шириной 1-30 мм.
[00181] В предпочтительных вариантах реализации лунки доступа и впускные отверстия, такие как впускные лунки 100, обладают диаметром 0,9-5 мм и глубинами, определяемыми толщиной пластика, использованного при выполнении микросхемы 20. В альтернативных вариантах реализации могут быть использованы лунки доступа с диаметром 0,5-10 мм. И снова глубина лунки определена толщиной использованной пластмассы и обычно составляет 0,5-2 мм.
Выполнение компактных интегральных микросхем
[00182] Варианты реализации микрожидкостных микросхем, изготовленных для реализации описанных в настоящей заявке целей и приложений, выполнены из пластика, полимеров или разлагаемых микроорганизмами полимеров; следовательно, эти микросхемы рентабельны при производстве и могут быть использованы в качестве устройств одноразового использования. Этот аспект одноразового использования, таким образом, гарантирует, что такие проблемы, как загрязнение при переносе, что представляет собой типичную проблему, связанную с повторным использованием инструментов биологической обработки, сведено к минимуму вплоть до устранения. Эти микросхемы могут также быть выполнены из стекла, кремния и из других материалов.
[00183] Процесс изготовления, связанный с выработкой этих микросхем, включает микроизготовление структур в кремнии (Si) или стекле или алюминии (Al) или в другом таком материале для создания шаблона с нужными микрожидкостными структурами. Это создает негативные микрожидкостные структуры на микроизготовленном устройстве из Si/стекла. Этот процесс затем включает изготовление формы на основе резины на этом микроизготовленном устройстве из Si /стекла с образованием позитивной формы. Горячее тиснение резиновой формы на пластиковой пластинке образует микрожидкостную структуру, идентичную начальному микроизготовленному устройству из Si/стекла. В этом процессе пластиковую пластинку нагревают и прижимают к позитивной резиновой форме, вынуждая пластинку стать пластичной. Эта пластичность делает пластик пластинки соответствующим картине на резиновой форме, образую негативную структуру в пластиковой пластинке, идентичную негативной структуре начального микроизготовленного устройства из Si/стекла. Пластиковые пластины, имеющие негативную структуру, выдавленную на них, будут в конечном счете просверлены и прикреплены к другой необработанной пластиковой пластинке с образованием закрытых жидкостных структур.
[00184] Для тиснения и прикрепления могут быть использованы пластиковые материалы, например, полиэтилен, полипропилен, полиуретанимид, политетрафторэтилен, поликарбонат, циклический сополимер олефина и циклический полимер олефина, полиметилметакрилат, полиакриламид, полистирен или любые такие материалы в зависимости от индивидуальных требований конкретного приложения.
[00185] Вышеупомянутый процесс горячего тиснения для производства пластиковых микрожидкостных микросхем дает возможность производства дешевых устройств, подходящих для однократного использования. Кроме того, поскольку пластиковое производство обычно масштабируемо с нелинейным отношением стоимости, также возможно значительное уменьшение стоимости производства посредством серийной обработки этих микрожидкостных устройств. Произведенные пластиковые микрожидкостные микросхемы могут быть использованы для выполнения биологических проб, как описано ниже.
Модульная конструкция
[00186] Обратившись к фиг. 4, можно видеть, что микросхема 20 включает три модуля, а именно, модуль 25 экстракции ДНК, модуль 27 амплификации посредством полимеразной цепной реакции и модуль 29 разделения посредством электрофореза, используемых при биологическом анализе или при диагностической пробе. В целом, весь процесс экстракции, амплификация и разделения происходит внутри одной микросхемы, причем происходит перенос образца потоком текучей среды от одного модуля к следующему модулю.
[00187] Этот интегральный процесс включает лизис клеток, прикрепление магнитных микроносителей к нуклеиновой кислоте, повторное суспендирование /десорбцию микроносителей, прикрепленных к нуклеиновой кислоте, амплификацию экстрагированной нуклеиновой кислоты и регистрацию амплифицированной нуклеиновой кислоты. Во время процесса экстракции образец культивируют и промывают для выработки экстрагированной ДНК в камере 104 экстракции. При амплификации, происходящей в модуле 27 амплификации, экстрагированную ДНК загружают в камеру 108 амплификации вместе с мастер-миксом амплификации. ДНК и мастер-микс амплификации уплотнены в камере 108 амплификации, которую нагревают и охлаждают согласно соответствующему тепловому протоколу. После завершения протокола амплифицированный образец передают в лунку 120 для образцов для последующего разделения и регистрации. Матрица/гель просеивания, буферный раствор и при необходимости стандарты молекулярного веса загружают в соответствующие лунки для капиллярного электрофореза и лунки для буферного раствора (лунки 114, 116, 118 и 120), и прилагают первое электрическое поле, вынуждая образец войти в канал 112 регистрации (капиллярного электрофореза). Приложение второго электрического поля к каналу 112 регистрации вынуждает образец выполнить разделение на разновидности, которые проходят вдоль области регистрации, где флуоресцентные метки, прикрепленные к разновидностям, могут быть стимулированы и зарегистрированы. Экстракция, амплификация и регистрация описаны более подробно ниже.
Модуль экстракции нуклеиновой кислоты или белка
[00188] Очевидно, что модуль экстракции, подобный описанному ниже в настоящем разделе, может быть использован для экстракции белка при соответствующей модификации описанных ниже методик для нуклеиновых кислот с целью использования их для экстракции белка.
[00189] Способ экстракции нуклеиновой кислоты, реализуемый в этой интегральной микросхеме, использует магнитные микроносители, причем нуклеиновая кислота от претерпевших химический лизис клеток захвачена магнитными микроносителями. Магнитные микроносители могут быть покрыты любым подходящим лигандом, который связан с изолированной мишенью. Примеры покрытий включают стрептавидин (для использования с биотинилированными мишенями), антитела против нужной мишени, белок A, белок G, олиго-dT (для использования с информационной РНК).
[00190] Эти микроносители могут быть сохранены в камере для дополнительной последующей амплификации непосредственно от микроносителей с прикрепленной ДНК или посредством извлечения ДНК из микроносителей до амплификации. Для выполнения экстракционной пробы первоначально комбинацию лизисного буферного раствора и покрытых стрептавидином магнитных микроносителей (поставленных, например, компанией «Dynal Direct®», поставленных компанией «Invitrogen» или приготовленных конечным пользователем согласно протоколам, известным в этой области техники), смешивают с образцом клетки и выполняют экстракционный процесс согласно описанному ниже протоколу. Компоненты и характеристики буферных растворов и микроносителей, используемых в экстракционном протоколе, также подробно описаны в последующем протоколе.
[00191] Взятый в качестве примера протокол для экстракционной процедуры, предназначенной для использования с компактными интегральными микросхемами, включая микросхему 20, показанную на фиг. 4, включает: лизис клеток, прикрепление магнитных микроносителей к нуклеиновой кислоте, повторное суспендирование / десорбцию микроносителей, прикрепленных к нуклеиновой кислоте и регистрацию нуклеиновой кислоты. Загрузка размещенных на микросхеме камер экстракции через лунки 100 для впуска образца (см. фиг. 4) образцом клетки объемом примерно 0,01-10 мкл может быть выполнена посредством использования пипетки или шприца.
[00192] Затем через лунки 100 происходит загрузка раствора с магнитными микроносителями / раствора для лизиса в камеру экстракции, содержащую ранее поданный образец клетки. Подача раствора с микроносителями в камеру экстракции приводит к смешиванию клеток с раствором с микроносителями во время прохождения потока.
[00193] При использовании в настоящей заявке термин «буферный раствор для лизиса» относится к любому буферному раствору, используемому для лизиса клеток в экспериментах, анализирующих соединения в клетках. Как правило, буферный раствор для лизиса содержит детергент, приводящий к разрушению клеточной мембраны. Примеры таких детергентов включают TritonX-100, NP40 или Tween-20. Другие компоненты буферного раствора для лизиса могут включать протеазные ингибиторы, ДНК-азы; магниевые соли, лизоцим, дисульфидные восстановители, например, β-меркаптоэтанол, ионные хелатирующие агенты, например, этилендиаминтетрауксусную кислоту, и консервирующие средства, например, азид натрия. Специалистам в данной области техники понятно, что конкретный используемый буферный раствор определен на основании исходного материала и подлежащей анализу мишени.
[00194] После заполнения камер 104 экстракции происходит остановка загрузки магнитных микроносителей. Заполненную камеру экстракции культивируют при комнатной температуре в течение нескольких минут, чтобы позволить связывание мишени, например, ДНК, с лигандами, нанесенными на магнитные микроносители.
[00195] В некоторых вариантах реализации настоящего изобретения после завершения культивации происходит установка магнита (или ввод во взаимодействие при использовании электромагнита) под камерой 104 экстракции из микросхемы 20 (фиг. 4). Магнит вызывает оседание магнитных микроносителей и приводит к задержанию магнитных микроносителей в камере 104 экстракции при вымывании дебриса клеток. Обычно используемый магнит прилагает к камере экстракции поле напряженностью примерно 12000-13000 Гаусс. Очевидно, что напряженность поля магнита зависит от размера микроносителей, размера образцов и других факторов и может быть отрегулирована соответствующим образом.
[00196] В некоторых вариантах реализации настоящего изобретения неочищенный экстракт вымывают из камеры экстракции при еще включенном магните. Промывающий раствор загружают в ту же самую лунку на микросхеме, как и ранее загружаемые компоненты. Примеры промывающего раствора включают буферный раствор Tris / этилендиаминтетрауксусная кислота (ТЕ), фосфорнокислый буферный раствор (NaH2PO4, NaCl, рН 8), или другие стандартные промывающие буферные растворы, известные в этой области техники.
[00197] В некоторых вариантах реализации настоящего изобретения операция промывки может быть повторена определенное количество раз, достаточное, чтобы гарантировать, что очищаемая мишень (например, ДНК) свободна от раствора для лизиса и клеточного дебриса. Специалисты в данной области техники будут в состоянии легко определить количество циклов промывки, необходимое для достижения этого. Уловленные целевые молекулы (например, ДНК) могут теперь быть элюированы в камеру 104 экстракции при использовании обычных буферных растворов для элюции, известных в этой области техники.
[00198] Раствор, протекающий через камеру 104 экстракции, будет удален через отверстие 106 впуска/выпуска реактива 106 на другом конце камеры экстракции пипеткой, шприцем, насосом или любыми другими подходящими средствами. Этот раствор отходов периодически удаляют через отверстие 106 впуска/выпуска реактива.
[00199] Операции амплификации ДНК/РНК могут быть выполнены несколькими различными способами. Один способ включает добавление магнитных микроносителей, не подавляющих амплификацию, причем ДНК/РНК прикреплена к микроносителям, непосредственно к мастер-миксу амплификации. В других вариантах реализации настоящего изобретения регистрация ДНК/РНК может быть выполнена непосредственно без амплификации, например, посредством непосредственного считывания последовательности нуклеиновой кислоты.
[00200] При использовании в настоящей заявке термин «мастер-микс» относится к раствору, содержащему полимеразу (например, полимеразу ДНК Taq, обратную транскриптазу), хлористый магний и соединение дезоксирибонуклеотидов в буферном растворе реакции (например, в водном растворе (NH4)2SO4 TrisHCl, Tween20, pH 8,8). Специалистам в данной области техники понятно, что конкретный мастер-микс выбран на основе амплифицируемой мишени, условий проведения испытаний и предпочтительной полимеразы.
[00201] Второй способ включает элюирование ДНК или РНК от микроносителей с последующим повторным суспендированием ДНК в любом стандартном буферном растворе, известном в данной области техники, который не подавляет амплификацию.
[00202] При непосредственном использовании при амплификации микроносителей с прикрепленными нуклеиновыми кислотами мастер-микс загружают в камеру 108 амплификации. Размещенный ниже камеры экстракции 104 магнит затем выводят из взаимодействия, что обеспечивает возможность свободного всплывания магнитных микроносителей в камере экстракции. Для предотвращения вытекания магнитных микроносителей (и ДНК, прикрепленной к микроносителям) из камеры экстракции 104 отверстия 106 и лунки 120 с обеих сторон камеры 104 экстракции уплотнены. Например, отверстия 106 для впуска/выпуска реактива и лунки 120 могут быть уплотнены запорными кранами или каналы 102, соединяющие впускные/выпускные отверстия 106 и лунки 120 с камерой 104 экстракции, могут быть уплотнены посредством использования эластичных или феррожидкостных клапанов. Таким образом, микроносители могут выполнять свободное перемещение в камере 104 экстракции, но не способны выходить из камеры экстракции 104. После завершения экстракции микросхема готова быть подвергнутой амплификации.
[00203] В противном случае, когда не используют микроносители с прикрепленной ДНК, камеру экстракции промывают буферным раствором с повторной суспензией. Буферный раствор с повторной суспензией загружают в камеру 104 экстракции, пока он снова не заполнит полностью камеру 104 экстракции, вытесняя и разгружая промывающий буферный раствор из камеры 104 экстракции. Затем размещенный ниже камеры экстракции 104 магнит выводят из взаимодействия и лунки 100 и отверстия 106 для впуска/выпуска реактива уплотняют, используя соответствующее размещение клапанов.
[00204] Затем микросхему нагревают до 50-90°C (например, до 70°C) посредством устройства на основе эффекта Пельтье или другого соответствующего источника высокой температуры, обычно используемого в качестве средства управления или регулировки температуры, например, как способ регулирования температуры для амплификации. Это приводит к элюции ДНК от магнитных микроносителей.
[00205] После нагревания клапаны, блокирующие перенос текучей среды от камер 104 экстракции к камерам 108 амплификации через канал 102 для перемещения, открыты. Наконец, происходит смытие экстрагированной ДНК/РНК/белка из камеры 104 экстракции в камеру 108 амплификации.
[00206] Процесс экстракции ДНК/РНК/белка завершен и экстрагированная ДНК, прикреплена ли она к магнитным микроносителям или нет, готова к проведению амплификации на микросхеме, как подробно описано ниже. В зависимости от объема раствора ДНК/РНК, необходимого для амплификации или регистрации (т.е., концентрации ДНК), часть элюируемой ДНК/РНК может быть выгружена из камеры экстракции и добавлен мастер-микс амплификации.
Модуль амплификации
[00207] В соответствии с вариантами реализации настоящего изобретения, как описано в другом месте в настоящей заявке, модуль амплификации может быть изотермическим или может быть тепловым. Аналогично, в соответствии с другими вариантами реализации настоящего изобретения, как описано в другом месте в настоящей заявке, модуль амплификации может быть заменен только одним циклом амплификации или репликации ДНК/РНК или секвенирования ДНК/РНК и этот процесс может быть изотермическим или может быть тепловым. В другом варианте реализации настоящего изобретения не выполняют никакой амплификации.
[00208] В одном варианте реализации настоящего изобретения экстрагированную ДНК/РНК из модуля экстракции и мастер-микс амплификации смешивают в модуле 108 амплификации. Мастер-микс амплификации содержит (кроме других описанных ниже стандартных реактивов) набор характерных для последовательности прямых и обратных праймеров для амплификации представляющей интерес генетической последовательности (обычно уникальной характеристики разновидностей) в экстрагированной ДНК/РНК.
[00209] В некоторых вариантах реализации настоящего изобретения, после загрузки нужного количества мастер-микса амплификации в камеру 108 амплификации, циклическое температурное воздействие выполняют при нужной температуре денатурации ДНК (70-100°C) и температурах отжига праймеров (40-70°C).
[00210] В некоторых вариантах реализации настоящего изобретения амплификация достигнута посредством размещения в интегральной микросхеме средств точного регулирования температуры и, например, запрограммированного протокола цикличного изменения температуры. (См., например, протокол для амплификации (700 пар нуклеотидов) фрагмента ДНК, характерного для клетки Е. coli DH10B, описанный в разделе «Пояснения на примерах».) Специалист может легко установить количество циклов на основании начальной концентрации образца и необходимой концентрации окончательного продукта амплификации.
[00211] В других вариантах реализации настоящего изобретения амплификация достигнута посредством размещения в интегральной микросхеме средств точного управления молекулами ДНК или РНК и, например, запрограммированного протокола циклического изменения механического напряжения.
[00212] В одном варианте реализации настоящего изобретения амплификация выполнена посредством использования модуля аппаратных средств, подробно описанного ниже.
[00213] В определенных вариантах реализации настоящего изобретения специалист в данной области техники добавит 10°C к вышеупомянутым температурам и добавит дополнительную минуту ко времени каждой операции культивации.
[00214] Завершение циклического температурного воздействия или циклического механического напряжения приводит к амплификации последовательности ДНК/РНК как это разработано в праймерах, готовых к анализу при использовании описанного впоследствии способа.
Модуль капиллярного электрофореза
[00215] В определенных вариантах реализации настоящего изобретения после завершения амплификации/репликации определенной последовательности, реплицированные/амплифицированные молекулы ДНК, подвергнуты разделению по размерам и затем флуоресцентной регистрации в модуле 29 разделения из микросхемы 20, показанной на фиг. 4. Основанная на электрофорезе регистрация достигнута следующим образом.
[00216] Обратимся снова к фиг. 4. Каналы 112 регистрации (капиллярного электрофореза) загружены матрицей просеивания (также называемой в настоящей заявке «гелем») из полиакриламида (например, полимера GenceScan, ABI или самодельных растворов полиакриламида, подходящих для использования при капиллярном электрофорезе). Это достигнуто посредством подачи матрицы просеивания во все восемь мультиплексных модулей 29 разделения одновременно из центральной лунки 116 для буферного раствора на интегральной микросхеме 20. Затем буферный раствор для выполнения капиллярного электрофореза (любой стандартный буферный раствор, известный специалистам в данной области техники и подходящий для использования при капиллярном электрофорезе) загружают во все кроме одной из лунок для капиллярного электрофореза (т.е., буферный раствор загружают в лунку 116 для буферного раствора капиллярного электрофореза, лунку 114 для отходов буферного раствора капиллярного электрофореза и в лунки 118 для отходов образца при капиллярном электрофорезе, но не в лунку 120 для образца при капиллярном электрофорезе). Лунку 120 для образца при капиллярном электрофорезе сначала загружают продуктом амплификации посредством давления, перемещающего образец из камеры 108 амплификации в лунку 120 для образца при капиллярном электрофорезе. Затем подвижный буферный раствор добавляют к продукту амплификации в лунку 120 для образца при капиллярном электрофорезе.
[00217] Специалистам в данной области техники также ясно, что различные гелевые среды могут быть использованы для разделения посредством электрофореза. Например, полиакриламид или агарозный гель (например, с разными концентрациями от 0,1% до 20%) могут быть использованы для разделения РНК и ДНК. Додецилсульфатнатриевый полиакриломидный гель или агарозный гель могут быть использованы для разделения белков. При анализе белков низкие концентрации акриламида могут быть использованы для разделения белков с высоким молекулярным весом (например, 5% для 40-200 килодальтон), а высокие концентрации акриламида могут быть использованы для разделения белков с низким молекулярным весом (например, 15% для 10-40 килодальтон). Точно так же низкие концентрации агарозы могут быть использованы для разделения нуклеиновой кислоты с высоким молекулярным весом (например, 0,5% для 1-30 тысяч пар нуклеотидов), а высокие концентрации агарозы могут быть использованы для разделения нуклеиновой кислоты с низким молекулярным весом (например, 1,5% для 0,1-2 тысяч пар нуклеотидов).
[00218] Примеры буферного раствора, подходящего для использования при капиллярном электрофорезе, включают буферный раствор трис/ борат/ этилендиаминтетрауксусная кислота (ТВЕ) (например, для нуклеиновых кислот, отделяемых на матрице агарозы), трис/глицин/додецилсульфат натрия (например, для белков, отделяемых на полиакриломидном геле). Специалистам понятно, что выбор подвижного буферного раствора будет зависеть от анализируемой мишени.
[00219] В качестве альтернативы при необходимости использования стандартов размера для проверки размера продукта амплификации, стандарты размера (например, Gene Scan TAMRA или ABI) могут быть добавлены к продукту амплификации и подвижному буферному раствору, загруженному поверх него. Подвижный буферный раствор и амплифицированная ДНК могут быть смешаны с образованием однородной суспензии внутри лунки 120. В этом случае для обеспечения возможности флуоресцентной регистрация ДНК, праймеры, маркированные флуорофором, аналогичные стандартам размера (например, VIC, ABI), будут приводит к маркировке амплифицированной ДНК, как можно ожидать в результате процесса амплификации.
[00220] Могут быть использованы любые подходящие стандарты молекулярного веса для разделения нуклеиновой кислоты. Примеры включают маркер молекулярного веса GelPilot®, поставляемый компанией «QiaGen», и Molecular Weight Ladder, поставляемый компанией «New England Biolabs».
[00221] Флуоресцентно маркированные праймеры нуклеиновой кислоты присутствуют на рынке (например, поставляемые компанией «Sigma-Aldrich») или могут быть синтезированы специалистами на основании известных протоколов. (См., например, статью Prudnikov et al., Nucleic Acid Res. 1996, 15 ноября; 24 (22): 4535-4542, или протокол, существующий онлайн в URL http://info.med.yale.edu/genetics/ward/tavi/n_label.html. Все содержание этих публикаций полностью включено в настоящую заявку посредством ссылки.) Примеры флуоресцентных ярлыков включают 6-карбоксифлуоресцеин, 5'-тетрахлорофлуоресцеин, Texas Red (хлорангидрид сульфородаминовой 101 кислоты), квантовые точки и флуоресцентно меченые наночастицы.
[00222] На фиг. 8A-8C показан процесс капиллярного электрофореза, выполняемый в каналах 112 регистрации (капиллярного электрофореза). После загрузки реактивов в лунки 114, 116, 118 и 120, сетку платинового электрода (не показана) опускают на микросхему 20 (фиг. 4), погружая конец электрода во все лунки 114, 116, 118 и 120. Как показано на фиг. 8B, электрическое поле 130, например, кратковременное, относительно низкое электрическое напряжение инжекции (например, примерно 400 В), приложено между лункой 120 для образца и лункой 118 для отходов образца. Это приводит к перемещению продукта амплификации (амплифицированной нуклеиновой кислоты 23) вдоль частей канала 102 для перемещения и каналов 112 регистрации (капиллярного электрофореза), которые соединяют лунку 120 для образца и лунку 118 для отходов образца. Затем, как показано на фиг. 8C, сильное электрическое поле 131, например, с высоким напряжением, примерно составляющим 6 кВ, прилагают между лункой 116 для буферного раствора и лункой 114 для отходов буферного раствора. Это приводит к перемещению амплифицированной нуклеиновой кислоты 23, захваченной в каналах 102 для перемещения и в каналах 112 регистрации (капиллярного электрофореза) вдоль пути, соединяющем эти лунки.
[00223] Приложение сильного электрического поля 131 приводит к разделению молекул ДНК на основании размера молекулы. Далее вниз по каналам 112 регистрации от начального позиционирования ДНК в канале 112 (капиллярный электрофорез) (например, в 75 мм от места, где ДНК 23 была захвачена на пути между лункой 116 для буферного раствора и лункой 114 для отходов буферного раствора) флуоресценция может быть стимулирована посредством подходящего освещения разделенных разновидностей 140 лазерным источником или светодиодом или другим источником света с длиной волны, согласной с длиной волны возбуждения флуорофора, прикрепленного к разновидностям 140. Специалист способен легко установить соответствующую длину волны, которая должна быть использована на основании выбранного флуорофора.
[00224] Как описано ниже со ссылками на фиг. 11, модуль 406 управления регистрацией из модуля 400 аппаратных средств воспринимает флуоресценцию возбужденных флуорофоров, прикрепленных в качестве метки к амплифицированной ДНК или к стандартам размера.
[00225] Модуль 29 разделения из микросхемы 20 (фиг. 4) может быть эффективно использован в качестве независимого модуля для ряда других приложений, включая анализ ДНК, РНК и белков. Для настройки микросхемы под конкретное приложение может быть необходимо преобразование параметров потока для достижения нужного уровня аналитических данных (т.е. с высоким разрешением при разделении).
[00226] В любом описанном в настоящей заявке варианте реализации настоящего изобретения длина канала 112 регистрации может составлять от нескольких сантиметров до многих метров, чтобы быть приспособленной к разделению большого количества независимых молекул. Это улучшает возможность разрешения разделенных молекул.
[00227] Аналогичным образом приложенные электрические поля (например, электрическое поле 130 и сильное электрическое поле 131) могут быть изменены от милливольт до многих тысяч вольт для достижения желательного уровня разделения фрагмента (ДНК/РНК/белки). Это также улучшает способность разрешения разделенных молекул. Специалист способен установить напряженность прилагаемого электрического поля на основании длины каналов 112 регистрации (фиг. 4), необходимой разрешающей способности и представляющих интерес молекул.
[00228] Специалистам в данной области техники также ясно, что различные гелевые среды могут быть использованы для разделения посредством электрофореза. Например, полиакриламид или агарозный гель (например, с разными концентрациями от 0,1% до 20%) могут быть использованы для разделения РНК и ДНК. Додецилсульфатнатриевый полиакриломидный гель или агарозный гель могут быть использованы для разделения белков. При анализе белков низкие концентрации акриламида могут быть использованы для разделения белков с высоким молекулярным весом (например, 5% для 40-200 килодальтон), а высокие концентрации акриламида могут быть использованы для разделения белков с низким молекулярным весом (например, 15% для 10-40 килодальтон). Точно так же низкие концентрации агарозы могут быть использованы для разделения нуклеиновой кислоты с высоким молекулярным весом (например, 0,5% для 1-30 тысяч пар нуклеотидов), а высокие концентрации агарозы могут быть использованы для разделения нуклеиновой кислоты с низким молекулярным весом (например, 1,5% для 0,1-2 тысяч пар нуклеотидов).
[00229] Кроме того, могут быть использованы стратегии неоптической регистрации, например, стратегии электрохимической регистрации, что уменьшает необходимость флуоресцентной маркировки молекул, подлежащих регистрации посредством разделения.
Комплекты и предварительно загруженные интегральные микросхемы
[00230] Во взятом в качестве примера варианте реализации настоящего изобретения различные интегральные микросхемы могут быть подготовлены для анализа различных болезнетворных организмов, заболеваний и биологических образцов.
[00231] Конечные пользователи описанной в настоящей заявке интегральной микросхемы могут развернуть микросхему и систему аппаратных средств (описанных ниже) в соответствующих местоположениях для анализа множества биологических образцов, как описано выше со ссылкой на фиг. 10. Для дополнительного обеспечения этой возможности интегральные микросхемы согласно настоящему изобретению могут быть включены в комплект, содержащий дополнительные компоненты, например, реактивы, включая различные описанные выше буферные растворы, молекулярные маркерные гены, стандарты молекулярного веса, магнитные микроносители, олигонуклеотиды, флуоресцентные красители, матрицы просеивания при капиллярном электрофорезе и т.п. В качестве альтернативы многие из этих компонент могут быть предварительно загружены на интегральную микросхему.
[00232] Обратившись к фиг. 4, можно видеть, что интегральная микросхема 20 может быть выполнена с по меньшей мере одной камерой 104 экстракции, содержащей магнитные микроносители, которые могут быть покрыты, например, стрептавидином. В некоторых вариантах реализации настоящего изобретения по меньшей мере одна камера 104 экстракции может содержать реактивы для лизиса клеток и экстракции нуклеиновой кислоты (например, описанный выше буферный раствор для лизиса). В некоторых вариантах реализации настоящего изобретения по меньшей мере одна камера 104 экстракции может содержать микроизготовленные выступы, размещенные в канале 102 для перемещения и/или в по меньшей мере одном таком канале, который может быть предназначен для механического сдвига и лизиса клеток в биологическом образце. По меньшей мере одна камера 108 амплификации может быть предварительно загружена магнитными микроносителями, олигонуклеотидами, при необходимости флуоресцентно маркированными, мастер-миксом амплификации и т.п. По меньшей мере один канал 112 регистрации может быть предварительно загружен матрицей просеивания для капиллярного электрофореза и/или подвижным буферным раствором и/или стандартами молекулярного веса. В другом варианте реализации настоящего изобретения по меньшей мере один канал 112 регистрации содержит микроматрицу гибридизации для идентификации амплифицированных мишеней нуклеиновой кислоты.
[00233] В других вариантах реализации настоящего изобретения интегральная микросхема согласно настоящему изобретению может содержать по меньшей мере два электрода для приложения электрического напряжения к по меньшей мере одному каналу 112 регистрации. В других вариантах реализации настоящего изобретения интегральная микросхема может содержать по меньшей мере один клапан управления потоком для управления потоком текучей среды через по меньшей мере один микрожидкостный канал. Клапаны могут представлять собой пассивные запорные клапаны или могут быть выполнены в виде любой клапанной системы, детально описанной ниже.
Управление точностью
[00234] Вариант реализации настоящего изобретения использует нанооперации и управление точностью молекул в наношкале. Посредством управления точностью молекул или жидкостными системами с чрезвычайно высокой точностью вариант реализации настоящего изобретения может резко улучшить общее качество, получаемое химическими и биохимическими реакциями, проводимыми при управляемых с высокой точностью и настраиваемых условиях на наноинженерных микросхемах или на разработанных с высокой точностью микросхемах. Следовательно, при использовании нанотехнологии вариант реализации настоящего изобретения может внести улучшения не только по меньшей мере в одну операцию интегрального процесса, но способен также резко улучшить полное отношение (сигнал/шум), увеличивая способность регистрации ничтожно малых количеств биологических мишеней, например, патогенных нуклеиновых кислот, последовательностей биомаркера или белков в образце текучей среды. Элементы управления точностью в наноинженерных микросхемах согласно варианту реализации настоящего изобретения, и в устройстве платформы согласно варианту реализации настоящего изобретения, сжимают полный гауссовый разброс в продуктах, произведенных в результате реакций на микросхеме, приводя к улучшению на порядки для некоторых критических характеристик, включая скорость, точность, способность к развертыванию, адаптируемость и надежность.
[00235] Вариант реализации настоящего изобретения обеспечивает проведение точного или наноразмерного управления нуклеиновыми кислотами и белками. Наноразмерный или прецизионный реактор обеспечивает неожиданное улучшение в отношении времени, стоимости, скорости и инфраструктуры, необходимых для выполнения анализа биологических образцов, по сравнению с обычными системами большего размера. Например, механическое напряжение может быть приложено к нуклеиновой кислоте, например, посредством электромагнитного поля, приложенного в реакционной камере, что может вынудить нуклеиновую кислоту, например, молекулу ДНК шириной 2 нм, выполнить растяжение в определенном направлении. Это ускоряет тенденцию выполнения реакции, например, посредством открытия ДНК. Таким образом, реализовано мелкомасштабное управление молекулой. Управление в таком малом масштабе обеспечивает возможность достижения большего отношения (сигнал/шум), улучшенного выхода и уменьшает время установления равновесия в реакционной камере. Различные силы могут быть использованы для управления в наномасштабе, например механические, электромагнитные силы и/или гидродинамические силы и использованы типы механического напряжения, описанные в патенте США №7494791, содержание которого полностью включено в настоящую заявку посредством ссылки.
[00236] При использовании в настоящей заявке термин «управление точностью» параметра относится к способности управления параметром таким образом, что повторные измерения параметра при неизменных условиях показывают одинаковые результаты в пределах определенной степени точности, и кроме того относится к способности регулировки параметра к его новому значению с такой степенью точности. Например, в соответствии с вариантом реализации настоящего изобретения, точность параметра, управляющего по меньшей мере одной операцией реакции, используемой для анализа биологического образца, может быть управляема в пределах плюс или минус 10%, плюс или минус 1%, плюс или минус 0,1%, плюс или минус 0,01%, плюс или минус 0,001%) или плюс или минус 0,0001%, и значение параметра может быть отрегулировано к новому значению параметра с такой же степенью точности. Такое управление точностью может быть выполнено разными способами, включая, например, использование управляемого потока текучей среды или приложение механического напряжения, как для белков, так и для нуклеиновых кислот.
[00237] При использовании в настоящей заявке приложение механического напряжения к нуклеиновой кислоте или белку включает прямое и косвенное приложение силы к нуклеиновой кислоте или белку, которая стремится растягивать или удлинять нуклеиновую кислоту или белок. В качестве примеров, напряжение может быть приложено к нуклеиновой кислоте или белку посредством непосредственного приложения механического напряжения, гидродинамических усилий в потоке текучей среды или электромагнитных полей, или действующих на нуклеиновую кислоту или молекулы белка непосредственно и/или действующих на поверхности, подложки или частицы и т.п., связанные с нуклеиновой кислотой или белком.
[00238] В соответствии с вариантом реализации настоящего изобретения, механическое напряжение, стремящееся растянуть нуклеиновую кислоту, может быть приложено в течение по меньшей мере одного цикла. Необходимо дополнительно отметить, что механическое напряжение, стремящееся растянуть нуклеиновую кислоту, может быть приложено и при необходимости изменено во время каждого цикла из следующих операций (а) - (е) в способе амплификации нуклеиновой кислоты:
(a) контактирование одного или большего количества матричных цепей одноцепочечной нуклеиновой кислоты с одним или большим количеством праймеров олигонуклеотида, дополнительных к части одной или большего количества матричных цепей;
(b) отжиг по меньшей мере одного праймера из одного или большего количества праймеров к части одной или большего количества матричных цепей, к которым праймер дополнителен;
(c) контактирование одной или большего количества матричных цепей с полимеразой нуклеиновой кислоты и по меньшей мере с четырьмя различными трифосфатами нуклеозида;
(d) растяжение по меньшей мере одного отожженного праймера посредством полимеразы нуклеиновой кислоты с образованием, тем самым, одного или большего количества продуктов растяжения, связанных с одной или большим количеством матричных цепей;
(e) отделение одного или большего количества продуктов растяжения от одного или большего количества матричных цепей; и
(f) повторение операций (a), (b), (c), (d) и (e) для амплификации нуклеиновой кислоты,
причем по меньшей мере один из одного или большего количества продуктов растяжения в операции (e) использован в качестве матричных цепей в последующем цикле операций (a)-(e),
причем, для последнего цикла, операция (e) не обязательна.
[00239] Кроме того, по меньшей мере одна операция из операций (b) или (d) включает приложение механического напряжения, стремящегося растянуть нуклеиновую кислоту в одну или большее количество матричных цепей. В некоторых вариантах процесс может быть выполнен изотермическим образом.
[00240] В соответствии с вариантом реализации настоящего изобретения управление точностью может быть достигнуто посредством использования, например, гидродинамического фокусирования, описанного, например, в статье Wong et al., «Деформация молекул ДНК гидродинамическим фокусированием», J. Fluid Mech., 2003, vol. 497, pp. 55-65, издательство Кембриджского университета; и/или посредством использования механической силы, например, посредством использования методик, описанных в статье Liphardt et al., «Обратимое разворачивание одиночных молекул РНК механической силой», Science, 2001, vol. 292, pp. 733-737, Американское Общество содействия науке; содержание которых полностью включено в настоящую заявку посредством ссылки. Могут быть использованы другие методики.
[00241] Уровень управления точностью может быть порядка нанометров, учитывая, что, например, диаметр ДНК составляет 2 нм, а диаметр белка может составлять 10 нм. В соответствии с вариантом реализации настоящего изобретения управление поступательным положением или вращательной ориентацией молекулы может быть достигнуто с точностью выше 100 нм, выше 10 нм или выше 1 нм. Кроме того, сами реакционные камеры могут быть выполнены малыми, например, меньше 10 мм, меньше 1 мм, меньше 100 микрон, меньше 10 микрон, меньше 1 микрона, меньше 100 нм, меньше 10 нм или меньше 1 нм в самом большом своем размере. Необходимо дополнительно отметить, что температура, давление, скорость диффузии, механическое напряжение, химическая концентрация, концентрация солей, концентрация ферментов или другие параметры, регулирующие реакцию или управляющие ею, могут претерпевать изменение в пределах жестко контролируемого диапазона, например, плюс или минус 10%, плюс или минус 1%, плюс или минус 0,1%, плюс или минус 0,01%, плюс или минус 0,001% или плюс или минус 0,0001%.
[00242] При использовании в настоящей заявке, где система выполнена с возможностью контроля точности параметра, такое управление точностью параметров может быть выполнено, например, посредством использования одного или большего количества модулей программного обеспечения или модулей аппаратных средств, реализуемых под управлением компьютерного процессора в мобильном устройстве согласно варианту реализации настоящего изобретения. Компьютерный процессор может содержать один или большее количество модулей управления, принимающих закодированные в цифровой форме сигналы, соответствующие значениям одного или большего количества управляемых параметров, и специально запрограммированных для регулирования с обратной связью этих подлежащих управлению параметров. Например, модуль управления способен получать значение параметра и на основании этого значения параметра способен регулировать одну или большее количество сил или других условий, воздействующих на анализируемую молекулу (например, при приложении механического напряжения). В результате такого регулирования, выполняемого модулем управления, параметр будет затем изменен и, следовательно, может быть образована замкнутая цепь обратной связи, в соответствии с которой модуль управления выполняет управление с обратной связью для одного или большего количества управляемых параметров. В дополнение к приему закодированных в цифровой форме сигналов от одного или большего количества других компьютерных модулей модуль управления может также принимать один или большее количество входных сигналов от одного или большего количества датчиков, которые регистрируют значения управляемых параметров; например датчик температуры или давления могут подавать входные сигналы от датчиков температуры или давления в модуль управления.
Система аппаратных средств
[00243] Как описано выше, компактная интегральная микросхема с биологической пробой предназначена быть однократно используемой. Настоящее изобретение также содержит систему аппаратных средств, содержащую механические, электрические и электронные устройства, а также доступные для считывания компьютером команды управления этими устройствами. Специалисту также понятно, что такая система аппаратных средств может быть выполнена с возможностью размещения различных конструкций микросхем, использующих вышеупомянутые модули биологической обработки (например, экстракции нуклеиновой кислоты, тепловой или изотермической амплификации, основанной на лазере регистрации флуоресценции и разделения посредством капиллярного электрофореза).
[00244] На фиг. 11 показана блок-схема системы 400 аппаратных средств, включенной в настоящее изобретение. Подробности конструкции системы 400 аппаратных средств подробно описаны ниже со ссылками на фиг. 14.
[00245] Обратившись к фиг. 11, можно видеть, что микросхема 20 (которая может быть выполнена однократно используемой) обычно вставлена в модуль 400 аппаратных средств, управляемый интерфейсом 408 микропроцессора/компьютера. Как показано на фиг. 11, модуль 400 аппаратных средств содержит модуль 402 управления экстракцией, модуль 404 управления амплификацией и модуль 406 управления регистрацией. Централизованно управляемый модуль 400 аппаратных средств может работать так, чтобы реализовывать последовательные процессы на микросхеме 20, или модули 402, 404, и 406 могут быть управляемы индивидуально для выполнения операций любого одного модуля или комбинации двух модулей. Индивидуальные характеристики каждого модуля 400 аппаратных средств описаны ниже.
[00246] Средства интерфейса 408 микропроцессора/компьютера могут содержать, например, соответствующий компьютер, например, любой описанный в настоящей заявке, и обычные компьютерные компоненты, например, любые описанные в настоящей заявке; и могут содержать оперативное запоминающее устройство, хранящее операционную систему, например, любую описанную в настоящей заявке, и соответствующее программное обеспечение для обработки сигналов, имеющих отношение к зарегистрированным нуклеиновым кислотам.
Модуль управления экстракцией
[00247] Обратимся снова к фиг. 11. Магнит или электромагнит с напряженностью 12000-13000 Гаусс в модуле 402 экстракции активизирован ниже или выше камеры экстракции (камер 104, показанных на фиг. 4), как требуется. Приложение магнитного поля может быть управляемо в течение от одной секунды до многих десятков минут для обеспечения возможности агрегации и задержания магнитных микроносителей, как это необходимо по протоколу. Как описано в протоколе экстракции, при желании высокая температура может быть использована для извлечения ДНК из микроносителей. Следовательно, в дополнение к приложению магнитного поля, использование высокой температуры примерно в диапазоне 50-90°C во время амплификации в течение любого подходящего отрезка времени может быть достигнуто системой 400 аппаратных средств при использовании того же самого модуля высокой температуры, что использован ниже описанным модулем 704 амплификации.
Модуль управления амплификацией
[00248] На фиг. 11 температура в модуле 404 амплификации претерпевает циклическое изменение примерно в диапазоне 40-95°C для циклического температурного воздействия. Этого достигают используя устройство на основе эффекта Пельтье, или любое другое подходящее устройство нагрева/охлаждения, которое может быть использовано для амплификации. Вплоть до трех температур циклического температурного воздействия в течение нужного временного интервала и повторяемое циклическое изменение дают возможность процесса денатурирования ДНК (70-100°C), отжига праймера (примерно 40-80°C) и температуры растяжения (50-90°C), создавая экспоненциальную амплификацию ДНК. Обозначенная камера амплификации на микросхеме 20 установлена над устройством на основе эффекта Пельтье, способного к цикличному изменению температуры.
[00249] На фиг. 12 показана блок-схема взятого в качестве примера варианта реализации устройства 550 на основе эффекта Пельтье, которое использовано модулем 404 управления амплификации (фиг. 11). Компьютерный интерфейс 408 управляет микропроцессором 556, который осуществляет цифровое пропорциональное/интегральное/дифференциальное управление с обратной связью над блоком 562 циклического температурного воздействия. Цифро-аналоговый преобразователь 558 преобразует цифровое значение, полученное от микропроцессора 556, в аналоговое значение электрического напряжения или тока, прилагаемое к источнику 560 электропитания, который соединен с блоком 562 циклического температурного воздействия. Регулирование аналогового напряжения или тока приводит к изменению выходных значений источника 560 электропитания, что, в свою очередь, приводит к изменению температуры блока 562 циклического температурного воздействия. Поскольку микросхема (не показана) соединена с блоком 562 циклического температурного воздействия, изменения значения температуры блока 562 циклического температурного воздействия соответствующим образом нагревают или охлаждают микросхему. Температурный датчик 554 отслеживает температуру микросхемы и/или блока 562 циклического температурного воздействия и подает параметр аналогового сигнала, например, аналоговое напряжение, к аналого-цифровому преобразователю 552. Аналого-цифровой преобразователь 552 переводит параметр аналогового сигнала в цифровое значение, подходящее для использования микропроцессором 556.
Модуль управления регистрацией
[00250] На фиг. 13 показана блок-схема модуля 406 управления регистрацией согласно вариантам реализации настоящей патентоспособной системы. Для регистрации амплифицированной ДНК, или, в некоторых вариантах реализации настоящего изобретения, разделенных белков, использована индуцированная лазерным излучением флуоресценция, комбинированная с электрофорезом высокого напряжения. Модуль 406 управления регистрацией использует программируемое устройство 620 подачи высокого электрического напряжения для приложения сигналов необходимого электрического напряжения (от 400 В до 10 кВ) через электроды 622 вдоль определенных каналов на микросхеме 20. Использован элемент безопасности для отключения устройства 620 подачи высокого напряжения, если оболочка (не показана), окружающая электронику и микросхему, не закрыта и заземлена.
[00251] Лазерный источник 602 с необходимой длиной волны и подходящей конфигурацией фильтров (не показаны) освещает выбранную часть микросхемы 20 через линзу 606. Освещение возбуждает флуорофоры, прикрепленные к ДНК или белкам, вынуждая флуорофоры испускать излучение (не показано) с длиной волны, отличной от лазерной длины волны. Фильтры задерживают лазерное излучение и пропускают испущенное излучение, собираемое линзой 607. Линза 607 фокусирует отфильтрованное излучение на детектор 608, например, на фотоэлектронный умножитель, лавинный фотодиод, устройство с зарядовой связью или другой подходящий детектор. Детектор испускает сигнал, например, фотоэлектронный ток, который усилен (и при необходимости отфильтрован) схемой 610 усилителя сигнала. Компьютер 408 регистрирует и обрабатывает усиленный сигнал; компьютер 408 может также быть использован для управления устройством 620 подачи высокого напряжения и лазером 602 посредством интерфейса программного обеспечения, как описано ниже. Специалистам в данной области техники понятно, что альтернативные конфигурации оптических компонентов могут быть использованы для опроса флуоресцентных маркеров, прикрепленных к ДНК.
Подробная конструкция системы 400 аппаратных средств
[00252] На фиг. 14 показана блок-схема системы 400 аппаратных средств согласно вариантам реализации настоящего изобретения. В углублении 758 держателя 752 размещена компактная интегральная микросхема (не показана), например, микросхема 20 по фиг. 4. Микросхема может быть закреплена в держателе 752 посредством регулируемых зажимов или любых других подходящих средств удержания. Нагреватель 562 (узел 562 на основе эффекта Пельтье по фиг. 12) и магнит 756 размещены под держателем 752 таким образом, что они размещены рядом с соответствующими частями микросхемы, удерживаемой в держателе 752. В предпочтительных вариантах реализации настоящего изобретения нагреватель 562 и магнит 756 могут быть выполнены перемещаемыми для приспособления к микросхемам различного размера или конфигурации.
[00253] Крышка 754 может быть установлена с шарниром или другим подходящим приспособлением над микросхемой, удерживаемой в углублении 758 держателя 752. Размещение крышки 754 над микросхемой приводит к введению электродов 776 в соответствующие лунки микросхемы (например, лунки 114, 116, 118 и 120 для капиллярного электрофореза из микросхемы 20 согласно фиг. 4). Электроды 776, соединенные с источником 620 высокого электрического напряжения, контролируемым компьютером 408, способны прилагать электрические поля переменной напряженности (например, 400-6000 В) к соответствующим секциям микросхемы, например, к каналам 112 капиллярного электрофореза, показанным на фиг. 4 и 8A-8C.
[00254] Система 400 аппаратных средств также содержит систему регистрации, аналогичную системе, показанной на фиг. 13. Лазер 602 вырабатывает луч 760 лазера (сплошная линия), отражаемый светоделителем 766 и двумя зеркалами 781 и 783 для освещения части микросхемы, содержащей флуоресцентно помеченную нуклеиновую кислоту, например, каналы 112 регистрации, показанные на фиг. 4 и 8A-8C. При освещении лучом 760 лазера, флуоресцентные метки испускают флуоресцентное излучение. Часть этого флуоресцентного излучения образует флуоресцентный луч 762 (пунктир), который проходит вдоль пути луча 760 лазера, но в противоположном направлении. Часть флуоресцентного луча 762 проходит через светоделитель 766 и через фильтр 764, который отфильтровывает свет на длинах волн, отличных от длины волны флуоресценции. Прошедший фильтрацию флуоресцентный луч 762 освещает детектор 608 (например, фотоэлектронный умножитель, лавинный фотодиод, устройство с зарядовой связью, линейную матрицу или другой подходящий детектор), который передает соответствующий сигнал, например, фотоэлектронный ток, к усилителю 778. Усилитель 778 усиливает сигнал от детектора 608 и передает его к компьютеру 408, который может регистрировать, обрабатывать и выводить на дисплей результаты, связанные с измерением флуоресценции.
Интерфейс программного обеспечения
[00255] Некоторые варианты реализации настоящего изобретения содержат программный модуль, выполненный с возможностью управления каждым из трех модулей биологических аппаратных средств (т.е., модулем 402 управления экстракцией, модулем 404 управления амплификацией и модулем 406 управления регистрацией из системы 400 аппаратных средств, показанной на фиг. 11 и описанной выше), независимо используя графический интерфейс пользователя.
[00256] Графический интерфейс пользователя обеспечивает пользователю возможность управления модулем экстракции посредством ввода данных пользователем или заранее запрограммированной инициацией магнитного поля. В определенном варианте реализации настоящего изобретения магнитное поле может быть подано с перерывами в течение определенных интервалов времени, как указано в описанном выше протоколе. Графический интерфейс пользователя также обеспечивает пользователю возможность приложения температуры в течение установленных периодов времени.
[00257] Графический интерфейс пользователя обеспечивает пользователю возможность устанавливать определяемые пользователем температуры (обычно 3 различных значения температуры, как описано ранее) и временные интервалы пребывания при каждой температуре. Пользователь может также описать необходимое количество тепловых циклов, повторяющих вышеупомянутые входные температуры и параметры времени. Графический интерфейс пользователя обеспечивает пользователю возможность установить параметры получения и накопления микропроцессором/компьютером данных о температуре микросхемы/образца от установки аппаратных средств; получаемые в результате данные могут быть показаны в виде графика зависимости температуры от времени в режиме реального времени.
[00258] Кроме того, графический интерфейс пользователя обеспечивает пользователю возможность: (1) выбирать и включать любую пару электродов, выполненных с возможностью приложения сигналов высокого напряжения; (2) последовательно описывать вышеупомянутый выбор для данного временного интервала, как необходимо пользователю; (3) выполнять слежение с обратной связью над электрическим напряжением, приложенным к любой включенной паре электродов и графически представлять эти данные в зависимости от времени; (4) выполнять слежение с обратной связью над величиной тока от любой подключенной пары электродов и графически представлять эти данные как функцию времени; (5) графически представлять полученный сигнал флуоресценции как функцию времени; и (6) идентифицировать/отличать сигнал флуоресценции (пик/интенсивность) от сигналов стандарта размера. Эти функции могут быть использованы для подтверждения амплификации для идентификации наличия (или отсутствия) определенной последовательности в ДНК.
[00259] Система аппаратных средств и доступные для считывания компьютером команды согласно настоящему изобретению могут также облегчать сравнение данных, полученных посредством анализа биологического образца при использовании описанной в настоящей заявке интегральной микросхемы, с геномной базой данных, хранящей множество геномных профилей.
Размещение микрожидкостных клапанов
[00260] Микрожидкостные клапаны и насосы обычно используют в микросхеме, например, микросхеме 20 по фиг. 5 (которой, в одном варианте реализации настоящего изобретения, может быть микросхема 20 по фиг. 4), для достижения управляемого потока и для задержания текучей среды и пара внутри микросхемы.
[00261] Например, и как видно из фиг. 4, резиновые запорные клапаны могут быть использованы в качестве клапанов в некоторых вариантах реализации настоящего изобретения. Такие резиновые запорные клапаны вставляют, например, в лунку 1000 впуска образца и в отверстие 106 впуска/выпуска реактива из микросхемы 20 во время экстракции нуклеиновых кислот, чтобы уплотнить камеру 104 экстракции. Точно так же во время амплификации камера 108 амплификации может быть уплотнена посредством вставления запорных клапанов в отверстие 106 впуска/выпуска реактива и в лунку 120 для образца.
[00262] В других вариантах реализации настоящего изобретения могут быть использованы различные клапанные системы. Такие системы описаны в другом месте настоящей заявки, например со ссылками на фиг. 5, 6A-6B и 7А-7B.
[00263] Другие варианты реализации интегральной микрожидкостной микросхемы включают клапанную технологию, называемую «эластичными клапанами», примеры которой показаны на фиг. 15A и 15B. Как показано на фиг. 15A и 15B, эластичный клапан 1100 использует надувную эластичную инкапсулированную мембрану 1110, подобную катетеру, используемому в медицинской хирургии, для уплотнения путей текучей среды внутри микросхемы. Пути текучей среды включают каналы 1102, образованные между верхней подложкой 1104 микросхемы и нижней подложкой 1106 микросхемы. Наполнение или приведение в действие мембраны 1110 может быть достигнуто посредством впускной воздушной трубы 1112, присоединенной к мембране 1110, как показано на фиг. 15А и 15B (т.е. мембрана 1110 приводится в действие и управляется пневматическим образом). При размещении откачанной мембраны 1110 в открытом отверстии 1108, как показано на фиг. 15А, происходит прохождение потока текучей среды 1114 через канал 1102. Однако при наполнении эластичного клапана воздухом 1116, как показано на фиг. 15B, он растягивается и уплотняет открытое отверстие 1108 и, следовательно, ограничивает прохождение потока текучей среды 1114 через открытое отверстие 1108 в канале 1102. В интегральной микросхеме набор таких клапанов 1100 может быть использован для достижения необходимого регулирования потока.
[00264] В другой конфигурации работы вышеописанные эластичные клапаны могут быть внедрены, а не вставлены, в микросхему или могут работать с внешней границей раздела для достижения более высоких уровней автоматизации. Пример такой конфигурации включает процесс изготовления, в котором эластичные мембраны зажаты между двумя слоями микросхемы вдоль любого канала, требующего регулирования потока. Впускная воздушная труба, используемая для приведения в действие эластичного мембранного клапана, также внедрена в микросхему и перенесена к периферии микросхемы для присоединения внешней линии давления воздуха. И внедренные и внешние клапанные системы и системы накачки могут эффективно быть использованы для подачи через клапан /накачки объемов от нанолитров до многих миллилитров.
[00265] На фиг. 16A-16F показан эластичный клапанный узел 1200, содержащий набор эластичных клапанов, таких как эластичные клапаны 1100, показанные на фиг. 15A и 15B, и выполненный с возможностью обеспечения насосных операций, подобных таковым для паразитного насоса. Клапанный узел 1200 содержит открытую лунку 1202a, загруженную текучей средой и соединенную с замкнутой камерой 1208 через канал 1206a. Замкнутая камера 1208 соединена со второй открытой лункой 1202b через второй канал 1206b. Эластичные мембраны 1204a и 1204b управляют потоком текучей среды в каналах 1206a и 1206b, соответственно, согласно принципам, описанным выше. Третья эластичная мембрана 1204 с, размещенная в замкнутой камере 1208, управляет тем, входит ли текучая среда в замкнутую камеру 1208 или выходит из нее. Пневматические впускные трубы 1212a-1212c, соединенные с эластичными мембранами 1204a-1204c, соответственно, обеспечивают возможность накачки и откачки мембран 1204a-1204c.
[00266] Как показано на фиг. 16A-16F, текучая среда может быть перемещена из открытой лунки 1202a в замкнутую камеру 1208 посредством последовательных операций накачки и откачки трех мембран 1204a-1204c. Сначала текучую среду загружают в открытую лунку 1202a, как показано на фиг. 16А. Эластичные мембраны 1204a-1204c затем накачивают в последовательности, показанной на фиг. 16B-16D. После накачки всех трех мембран 1204a-1204c мембрану 1204а в канале 1206а откачивают, создавая всасывание, перемещающее текучую среду из открытой лунки 1202a в канал 1206a. Откачивание мембраны 1204c в замкнутой камере 1208 создает дополнительное всасывание, перемещающее текучую среду из канала 1206a в замкнутую камеру 1208. Текучая среда может также быть разгружена из замкнутой камеры 1208 в любую из открытых лунок 1202a и 1202b посредством аналогичной последовательности операций для мембран 1204a-c.
Способы, использующие систему и интегральную микросхему
[00267] В варианте реализации настоящего изобретения предложена портативная система для экстракции, при необходимости амплификации, и регистрации нуклеиновых кислот, использующая компактную интегральную микросхему в комбинации с портативной системой для анализа зарегистрированных сигналов, и сравнения и распространения результатов через беспроводную сеть. Портативное, основанное на микросхеме диагностическое устройство может быть использовано для быстрой и точной регистрации характерных признаков ДНК/РНК в биологических образцах. Портативное устройство может быть использовано в качестве платформы для персонализированной и мобильной наномедицины или сопутствующей диагностики и как инструмент для улучшения эффективности, уменьшения токсичности, помощи для ускорения клинических испытаний и одобрения регулирующих органов относительно новых лекарственных средств.
[00268] В одном варианте реализации настоящего изобретения система может быть использована в способе реализации персонифицированной медицины. В широком смысле персонифицированная медицина использует генетику для обеспечения правильного пациента правильным лекарственным средством в правильной дозе для получения правильного результата. В варианте реализации настоящего изобретения портативная система для выполнения пробы использована для экстракции, амплификации и регистрации нуклеиновых кислот в образце, и в частности, регистрации персонифицированных биомаркеров, основанных на нуклеиновых кислотах. Система может затем определить соответствующую дозировку и/или сочетание лекарств для реализации персональной медицины, основанной на зарегистрированных персонифицированных биомаркерах. Могут быть обеспечены целенаправленное лекарственное средство и соответствующая диагностика. Кроме того, система может быть использована для выявления, является ли лицо пациентом, у которого достигнут лечебный эффект в результате медикаментозного лечения. Система может также быть использована для содействия разделению пациентов на группы для усовершенствования безопасности и эффективности лекарственного средства, и может помочь оптимизировать дозировку и терапевтические режимы. Необходимо дополнительно отметить, что система может быть использована для слежения за пациентом, например, посредством слежения за уровнями нуклеиновой кислоты, найденной в биообразцах от пациента, взятых в разное время. Такой контроль может быть использован, например, для отслеживания прогресса лечения пациента, или для контроля протекания заболевания пациента. Например, диабет и другие хронические заболевания могут быть диагностированы, классифицированы или отслежены посредством маркеров ДНК/РНК, например, маркеров воспаления. Например, регистрация персонализированного геномного профиля может включать регистрацию нуклеиновых кислот, показательных для типа или подтипа диабета.
[00269] В другом варианте реализации настоящего изобретения портативная система согласно варианту реализации настоящего изобретения может быть использована для содействия в проведении нормативных клинических испытаний, меньших по объему и более дешевых, посредством обогащения популяций исследования. Индивидуализированные испытания с генетическими субпопуляциями способны резко усилить терапевтический эффект и сократить процесс одобрения. Полученная в результате комбинация лекарственного средства и соответствующей диагностики имеет исключительное значение для целевой генетической популяции.
[00270] В другом варианте реализации настоящего изобретения портативная система в соответствии с изобретением может быть использована для обеспечения персонального ухода, например в областях косметики, косметических лекарственных средств и в приложениях, связанных с уходом за кожей. Например, портативная система для выполнения пробы может быть использована для экстракции, амплификации и регистрации нуклеиновых кислот в образце; и в частности для регистрации персонифицированных биомаркеров, основанных на нуклеиновых кислотах. Система может затем определить тип, количество или комбинацию продуктов персонального ухода, подлежащих выдаче на основании персонифицированных биомаркеров. Например, система может быть использована для выбора и выдачи косметики, основанных на персонифицированных косметических биомаркерах. В одном примере тип кожи определяют на основании персонифицированных биомаркеров, что может затем быть использовано для выявления типа, количества или комбинации косметических продуктов для выдачи пациенту. Мобильное устройство может быть использовано для измерения и выявления количества, в режиме реального времени, присутствующих ключевых биомаркеров (которые, например, могут быть основаны на ДНК или РНК). Биомаркеры последовательности (например, биомаркеры красоты, например, связанный с возрастом локус, определенные гены старения или уровни экспрессии генов, качество кожи) могут быть измерены в связи со средствами для ухода за кожей. Портативная система согласно варианту реализации настоящего изобретения может быть использована для корреляции генотипа пациентов с такими биомаркерами последовательности. Интегральная микросхема может быть приспособлена для согласования с библиотекой целевых генов для биометрии красоты. Биометрия красоты пациента может быть измерена посредством выявления количество биомаркеров красоты пациента в режиме реального времени при использовании портативной системы согласно варианту реализации настоящего изобретения. Затем может быть определено, как эти биомаркеры изменяются со временем при использовании соответствующих косметических продуктов. Варианты реализации настоящего изобретения могут также быть использованы для профилактики, для нутригеномики, и для аюрведической геномики, например, для проведения аюрведического диагноза посредством генов, соответствующих типам телосложения Вата, Каппа и Питта.
[00271] В другом варианте реализации может быть использована портативная система в соответствии с настоящим изобретением, в которой способности регистрации интегральной микросхемы связаны с конкретными, уникально определенными фармацевтическими продуктами. Например, портативная система для выполнения пробы может быть использована для экстракции, амплификации и регистрации нуклеиновых кислот в образце; и, в частности, регистрации персонифицированных биомаркеров, основанных на нуклеиновых кислотах, причем персонифицированные биомаркеры могут указывать на наличие конкретного штамма заболевания или болезнетворного организма. Система способна затем однозначно определить индивидуальную дозировку и/или сочетание лекарств для приема на основании конкретных биомаркеров штамма. В одном примере предназначенные для приема дозировки лекарственных средств и/или их комбинации могут быть определены для конкретных штаммов вируса иммунодефицита человека. Портативная система согласно настоящему изобретению может быть использована для регистрации штаммов вируса иммунодефицита человека по месту лечения, выявления вирусной нагрузки относительно вируса иммунодефицита человека, и генотипирования вируса иммунодефицита человека или в качестве устройств или инструментов учета и оценки побочных действий лекарственных средств для контроля и предотвращения передачи вируса иммунодефицита человека от матери к ребенку.
[00272] В более общем смысле вариант реализации согласно настоящему изобретению может быть использован для генотипирования любого организма, определяя, тем самым, по меньшей мере одно из следующего: предрасположенность к генетическому заболеванию, штамм заболевания и устойчивость болезней к антибиотикам. Например, может быть определен тип вирусного гепатита; или может быть идентифицирован ген рака.
[00273] В различных вариантах реализации настоящего изобретения портативная система согласно настоящему изобретению может быть использована во множестве различных возможных отраслей. Например, портативная система для проведения анализа может быть использована для экстракции, амплификации и регистрации нуклеиновых кислот в образце. Зарегистрированные нуклеиновые кислоты могут затем быть использованы в любой из множества различных возможных отраслей (в дополнение к отраслям, описанным в другом месте настоящей заявки). Например, зарегистрированные нуклеиновые кислоты могут иметь отношение к безопасности пищевых продуктов, заболеваниям сельскохозяйственных культур, ветеринарным приложениям, археологии, судебной экспертизе, питанию, нутрицевтикам, нутригеномикам, к проверке/очистке воды, пищевым продуктам и напиткам, к экологическому контролю, таможне, безопасности, защите, биотопливу, спортивным состязаниям и к поддержанию здоровья; и могут быть использованы для комбинации диагностических испытаний и терапии.
[00274] Система согласно варианту реализации настоящего изобретения может быть использована для выявления персонифицированного геномного профиля пациента, представляющего собой источник биологического образца. Персонифицированный геномный профиль может затем быть использован для персонального выбора нутрицевтика, лечебнокосметического средства, фармацевтического препарата, пищевых продуктов или напитков, или питания для пациента, основанных на персонифицированном геномном профиле. Персонифицированный геномный профиль может, например, быть использован для персонализированной профилактики, персонализированного спортивного питания, персонализированной диеты или персонализированного питания пациента. Например, в области спорта воспалительные маркерные гены могут быть определены для регистрации, измерения и лечения травмы атлета, например, при травматическом повреждении головного мозга атлета в контактных видах спорта. В другом варианте реализации настоящего изобретения маркерные гены могут быть определены для оценки кровяного допинга в спортивных состязаниях. В другом варианте реализации настоящего изобретения маркерные гены РНК могут быть измерены для различных видов фенотипической экспрессии.
[00275] Система согласно варианту реализации настоящего изобретения может быть использована для персонализированного питания, в которой устройство считывания микросхемы (например, модуль управления экстракцией нуклеиновой кислоты, модуль управления амплификацией нуклеиновой кислоты и модуль управления регистрацией нуклеиновой кислоты) и программное обеспечение приспособлены для содействия персональному выбору пищевых продуктов и напитков и питания, основанных на профилях ДНК/РНК пациента. В широком смысле персонифицированное питание включает использование генетики для снабжения правильного потребителя правильным питанием в режиме реального времени для достижения правильного результата. В варианте реализации настоящего изобретения сопровождающие персонифицированные пищевые добавки могут быть предоставлены пациенту на основании его профиля ДНК/РНК. Могут быть обеспечены целенаправленные питание и сопутствующая диагностика и могут быть разработаны сопутствующая диагностика для обеспечения здоровья и биомаркеры хорошего здоровья. Может быть обеспечен целостный и интегральный подход к обеспечению здоровья и профилактике. Потребителям может быть обеспечена обратная связь для измерения их прогресса, не только посредством общепринятых фенотипичных маркеров, но также посредством биомаркеров ДНК/РНК, которые обеспечивают надежные и достоверные измерения прогресса. Посредством выявления генетического профиля пациента, или его предрасположенности, на основании его маркеров ДНК/РНК, может быть персонализирована диета пациента. Персонифицированный геномный профиль может быть использован для выявления пищевой предрасположенности пациента, например, генетической пищевой аллергии, непереносимости или чувствительности, например, чувствительности к клейковине, непереносимости клейковины или непереносимости лактозы, и выработки персональной диеты на основе этого профиля. Воспалительные маркерные гены могут быть измерены как способ контроля, независимо от того, допустима ли определенная диета или нет. Кроме того, недостатки питания могут быть обнаружены, измерены и затем исправлены посредством добавления питательных микродобавок в пищевые продукты или напитки. Например, авитаминозы, дефицит минералов и другие дефициты (например, дефицит витамина B12, дефицит фолата, дефицит железа) могут быть определены на основании биомаркеров, измеренных в соответствии с вариантом реализации настоящего изобретения. Дефицит может затем быть устранен посредством добавления соответствующих добавок в виде питательного микроэлемента к пищевому продукту или напитку. Кроме того, могут быть определены пробиотики или пребиотики, которые дефицитны или видоизменены в микробиоме пациента. Например, биологический образец от слюны, кишечника или мочи пациента может быть получен и проанализирован для выявления того, какие пробиотики или пребиотики в микробиоме пациента дефицитны или видоизменены, например, в ротовой микробиоме пациента или микробиоме кишечника. Дефицитный пробиотик или пребиотик могут затем быть добавлены в пищевые продукты или напитки пациента для содействия восстановлению нормальной микробиомы пациента.
[00276] В варианте реализации настоящего изобретения персонифицированное питание может быть выполнено на основании выявления биомаркеров воспаления. Воспаление имеет место во многих заболеваниях, включая рак, сердечно-сосудистые заболевания, заболевание Альцгеймера, заболевания легких, артрит, аутоиммунные заболевания, неврологические заболевания и диабет. В одном варианте реализации настоящего изобретения диета пациента может быть персонализирована посредством выявления генетического профиля пациента, или его предрасположенности на основании маркеров ДНК/РНК. В качестве примера на фиг. 27 перечислены отобранные сердечнососудистые биомаркеры воспаления, которые могут быть определены, измерены и/или отслежены в соответствии с вариантом реализации настоящего изобретения. На фиг. 28 перечислены выбранные воспалительные биомаркеры для диабета, которые могут быть использованы. В персонализированной медицине, а также при персонализированном питании могут быть использованы биомаркеры, показанные на фиг. 29, например для выявления ожирения, диабета и развития сердечно-сосудистых заболеваний. Специалистам в данной области техники очевидно, что могут быть использованы другие биомаркеры, отличные от указанных на фиг. 27-29, и что такие биомаркеры могут быть использованы для персонализированного питания, персонализированной медицины и других методик, сформулированных в настоящей заявке.
[00277] В другом варианте реализации настоящего изобретения привычки потребителя в отношении пищевых продуктов или напитков могут быть дополнены посредством раздачи пищевых продуктов или напитков на основании нутригеномного профиля пациента. Описанные в настоящей заявке системы могут быть внедрены в конструктивное решение активатора раздачи, такого как по меньшей мере часть торгового автомата, банкомата или терминала самообслуживания, которые могут быть управляемы на основании входных сигналов управления от описанной в настоящей заявке системы. Например, пациент может подать биологический образец в блок генетического анализа, выполненный с возможностью выявления биомаркеров, связанные с пациентом. На основании этих биомаркеров может быть выявлен персонифицированный геномный профиль пациента, представляющего собой источник по меньшей мере одной биологического образца. Блок управления раздачей затем выполнен с возможностью определения продукта, или части продукта, подлежащего раздаче на основании персонифицированного геномного профиля. Активатор раздачи соединен с блоком управления раздачей и выполнен с возможностью раздачи по меньшей мере части продукта под управлением блока управления раздачей. Например, при использовании такой системы потребитель может вставлять биологический образец, например, образец слюны, в торговый автомат, который должен определить, на основании нутригеномного профиля потребителя, какие пищевые продукты или напитки наиболее подходят для этого потребителя. Активатор раздачи может содержать трехмерный принтер, выполненный с возможностью печати по меньшей мере, части продукта, или активатор раздачи может быть выполнен с возможностью раздачи предварительно упакованного продукта. Продукт может быть, например, пищевым продуктом, напитком, продуктом лечебной косметики, нутрицевтиком, фармацевтическим препаратом, препаратом траволечения, препаратом альтернативной медицины и косметическим препаратом. Блок управления раздачей может быть выполнен с возможностью определения продукта, или части продукта, подлежащего раздаче на основании пищевой предрасположенности, пищевой недостаточности, и по меньшей мере одного пробиотика или пребиотика, который дефицитен или изменен в микробиоме, любой из которых может быть определен посредством регистрации нуклеиновых кислот на основании описанных в настоящей заявке вариантов реализации настоящего изобретения. Трехмерный принтер может, например, быть использован для печати пищевого продукта или напитка потребителя в торговом автомате или терминале самообслуживания на основании генетического профиля потребителя. Дополнительная информация может быть введена потребителем, использующим интерфейс пользователя, например, клавиатуру, сенсорную панель, интерфейс распознавания речи, интерфейс с дополненной реальностью или другую разновидность интерфейса пользователя. Потребителю можно, например, предоставлять некоторую информацию относительно альтернативных ингредиентов, которые были бы полезны на основании профиля потребителя, и затем обеспечить возможность выбора одного или большего количества ингредиентов, используя интерфейс пользователя для раздачи по заказу пищевого продукта или напитка. Система, например, торговый автомат, может объединять сопутствующую диагностику по месту использования и производство по месту использования улучшенных питательными компонентами пищевых продуктов или напитков, например посредством использования трехмерной печати пищевых продуктов или напитков. Пищевые продукты, напитки, лечебно-косметические средства, нутрицевтики и косметические препараты могут быть трехмерно напечатаны таким образом. Например, что касается косметики, потребитель в терминале самообслуживания на прилавке магазина косметики может быть обеспечен персональным профилем посредством использования системы, описанной в настоящей заявке, и затем ему может быть предоставлена возможность печати собственных косметических препаратов потребителя, например, раствора для ухода за кожей. Подобные системы могут быть предусмотрены для нутрицевтиков, травяных сборов, препаратов альтернативной медицины, травяных чаев, продуктов питания и напитков. Например, специи или другие ингредиенты, например, куркума, корица, зеленый чай или другие противовоспалительные ингредиенты могут быть выданы в виде соков для уменьшения уровней воспаления потребителя. Дозы для потребителя могут быть обеспечены системой управления, основанной на генетическом профиле потребителя, что описано в предшествующих вариантах реализации настоящего изобретения.
[00278] В другом варианте реализации настоящего изобретения описанные в настоящей заявке системы использованы вместе с терапевтическим устройством на основе усиленной внешней контрпульсации. Уровни сердечных маркеров, маркеров воспаления и других маркеров, связанных с улучшением сердечной функции, отслежены в режиме реального времени описанными в настоящей заявке системами анализа нуклеиновой кислоты и использованы для подачи входных сигналов электронного управления в устройство усиленной внешней контрпульсация, например, для увеличения или уменьшения дозы титруемого раствора или потока крови. Например, факторы воспаления, фактор роста эндотелия сосудов, эндотелиальные факторы автороста, другие наборы экспрессирующихся генов, сердечные маркеры, маркеры ДНК/РНК, которые коррелированны с кардиальным статусом, и так далее, могут быть отслежены описанными в настоящей заявке системами. Посредством объединения описанных в настоящей заявке систем анализа нуклеиновой кислоты с устройством терапии на основе усиленной внешней контрпульсации может быть обеспечен инструмент, помогающий вызывать обратное развитие атеросклероза посредством совместного воздействия, образуемого стимуляцией эндотелиального восстановления посредством потока и при измерении воспалительных факторов. Биомаркеры, вовлеченные в атеросклеротический процесс, могут быть отслежены одновременно на множестве каналов системы анализа нуклеиновой кислоты, и входные сигналы электронного управления могут быть поданы в устройство усиленной внешней контрпульсации на основании уровней биомаркеров.
[00279] В различных вариантах реализации настоящего изобретения результаты, обеспеченные портативной системой в соответствии с настоящим изобретением, могут включать вирусную нагрузку (например, в единицах количества организмов /мл), предсказанное количество клеток в единице объема (например, предсказанное количество клеток CD4 в единицах клетки/мм3), и титрование дозировки лекарственного средства.
[00280] В других вариантах реализации настоящего изобретения портативная система согласно настоящему изобретению может иметь связь с другими системами множеством различных возможных способов. Портативная система способна передавать и принимать модулированные сигналы данных, имеющие отношение к биологическому образцу, и может обеспечивать связь посредством проводной среды (например, проводной сети или непосредственного проводного соединения) или беспроводной среды (например, акустической, инфракрасной, радиоволновой, микроволновой, широкополосной). Портативная система может, например, выполнять связь через глобальную сеть связи и/или мобильную сеть и/или посредством текстового сообщения (например, SMS-сообщения). Портативная система может быть соединена с дистанционной геномной базой данных, хранящей геномные профили. Портативная система может хранить или передавать или принимать профиль сигнала одного эталонного образца.
[00281] В других вариантах реализации настоящего изобретения портативная система или мобильное устройство могут быть выполнены как часть любого устройства (или интерфейс с ним) из множества различных возможных широкодоступных карманных или планшетных устройств, например, смартфона, персонального цифрового секретаря, сотового телефона или другого карманного или планшетного устройства, использующего компактную интегральную микросхему (при необходимости однократного использования). Кроме того, подобные графические интерфейсы пользователя и внешняя конструкция могут быть использованы так, как они использованы на таких широко доступных карманных или планшетных устройствах. В одном примере вариант реализации настоящего изобретения может быть выполнен в графическом интерфейсе пользователя или внешнем интерфейсе (или может взаимодействовать с такими интерфейсами, или использовать их), аналогичных интерфейсам устройств марок iPhone, iPad или iPod, все из которых выпущены компанией «Apple Inc.», Купертино, Калифорния, США, или устройства марки Galaxy, выпускаемой компанией «Samsung Electronics Co. Ltd.», Сувон, Южная Корея.
[00282] В варианте реализации настоящего изобретения портативная система, или множество таких портативных систем, размещенных в разных местах, могут быть использованы для слежения за вспышкой заболевания в разбросанных местах проведения анализа. Портативная система может быть соединена посредством одной или большего количества сетей (например, локальной сети, глобальной сети и/или Интернета); и может участвовать в двухстороннем обмене информацией между центральным центром сбора данных и конечным пользователем системы. Центр сбора данных может предоставлять известную информацию о карте распространения болезнетворного организма/заболевания в систему конечного пользователя/изобретения для биологического анализа образца, и впоследствии система/конечный пользователь изобретения могут передавать результаты проб в центр сбора данных. Центр сбора данных может получать информацию о географическом местоположении и другую информацию об идентификации заболевания от системы конечных пользователей/изобретения. Центр сбора данных может контролировать поступающие результаты проб от множества развернутых блоков/систем изобретения и использовать программы регистрации картины, например, для слежения за вспышкой заболевания. Центр сбора данных способен программными средствами вырабатывать уведомления дистанционным портативным системам в соответствии с изобретением после регистрации пороговых особенностей.
Дальнейшее использование и приложение системы и интегральной микросхемы
[00283] В различных вариантах реализации настоящего изобретения система согласно настоящему изобретению может быть использована для идентификации болезнетворных организмов, диагностики нарушений, имеющих генетический маркер, или выявления генотипа пациента. Способы согласно настоящему изобретению включают: (1) выполнение по меньшей мере одной интегральной микросхемы; (2) загрузку по меньшей мере одного биологического образца на по меньшей мере одну интегральную микросхему; (3) функциональное соединение портативного узла управления с по меньшей мере одной интегральной микросхемой; и (4) активацию портативного узла управления для выполнения экстракции, амплификации и регистрации нуклеиновой кислоты от биологического образца, загруженного на указанную интегральную микросхему.
[00284] Настоящее изобретение может быть использовано для диагностики и регистрации большого разнообразия болезнетворных организмов и нарушений, имеющих генетический материал на основании нуклеиновой кислоты и/или генетические компоненты. В дополнение к регистрации таких заболеваний, как вирус иммунодефицита человека, вирус гепатита B, вирус гепатита C и заболеваний, передаваемых половым путем, система и способ согласно настоящему изобретению могут быть использованы для регистрации и диагностики молекулярных диагностических целей, возникающие в областях онкологии, сердечно-сосудистых заболеваний, при тестировании идентичности и дородовом скрининге.
[00285] Предпочтительно получение биологического образца из биологической текучей среды, например, но не ограничиваясь этим, из крови, слюны, спермы, мочи, амниотической текучей среды, цереброспинальной текучей среды, синовиальной текучей среды, стекловидной текучей среды, желудочной текучей среды, носоглоточного аспирата и/или лимфы.
[00286] Биологический образец может быть образцом ткани, водным образцом, воздушным образцом, образцом пищевого продукта или образцом сельскохозяйственной культуры. Предпочтительно, чтобы регистрация посредством анализа биологического образца обнаруживала любой один или большее количество передаваемых через воду болезнетворных организмов, передаваемых через воздух болезнетворных организмов, передаваемых через пищевой продукт болезнетворных организмов или передаваемых через сельскохозяйственные культуры болезнетворных организмов.
[00287] Болезнетворный организм, регистрируемый системой и способом согласно настоящему изобретению, может происходить от множества хозяев. Хозяин, или биологический или небиологический, должен быть способным поддерживать репликацию возбудителя инфекции, обеспечивая возможность репликации возбудителя инфекции в или на хозяине. Примеры таких хозяев включают жидкие или твердые культурные среды in vitro, клетки или ткани животных, растений или одноклеточных организмов, целые организмы, включая млекопитающих, например, людей.
[00288] Система и способы согласно настоящему изобретению могут быть использованы в одной или в большем количестве следующих областей. В одном варианте реализации настоящего изобретения система и способ согласно настоящему изобретению могут быть использованы для защиты от биологического оружия. Например, настоящее изобретение может быть использовано для регистрации болезнетворных организмов в режиме реального времени и в месте их появления. В другом варианте реализации настоящего изобретения система и способ согласно настоящему изобретению могут быть использованы в области наук о жизни. Например, настоящее изобретение может быть использовано в качестве портативного аналитического инструмента и вместе с ним. В другом варианте реализации настоящего изобретения система и способ согласно настоящему изобретению могут быть использованы в области клинической диагностики. Например, настоящее изобретение может быть использовано для диагностики и/или идентификации болезнетворных организмов врачами, медсестрами или неквалифицированными пользователями в больницах, домах или на природе. Настоящее изобретение может также быть использовано для генотипирования организма, выявляя, тем самым, предрасположенность к генетическим заболеваниям, если таковая вообще имеет место, или устойчивость к антибиотику, если таковая вообще имеет место. Настоящее изобретение может также может быть использовано для определения болезнетворных организмов, присутствующих в пациенте, и профилей чувствительности и устойчивости этих болезнетворных организмов к различным антибиотикам. Настоящее изобретение может также быть использовано в качестве устройства для учета и оценки побочных действий лекарственных средств, прогностического индикатора заболевания и устройства для комбинации диагностических испытаний и терапии. В другом варианте реализации настоящего изобретения система и способ согласно настоящему изобретению могут быть использованы в области промышленного и сельскохозяйственного контроля. Например, настоящее изобретение может быть использовано для контроля и/или регистрации болезнетворных организмов, передаваемых через пищевой продукт, зерновые культуры, домашний скот и т.п. В другом варианте реализации настоящего изобретения система и способ согласно настоящему изобретению могут быть использованы в области судебной экспертизы. Например, настоящее изобретение может быть использовано для генетической идентификации пациента.
[00289] В одном варианте реализации настоящего изобретения генетические отклонения и нарушения, имеющие генетический компонент, могут быть диагностированы посредством использования системы и способа согласно настоящему изобретению. Например, были идентифицированы многочисленные онкогены, включая р53, связанный с развитием рака груди, рака ободочной и прямой кишки и других разновидностей рака; c-erbВ2, связанный с развитием и метастазами рака молочной железы; и BRCA1, имеющий место в 50% от всего наследственного рака молочной железы, и также связанный с увеличенным риском возникновения рака предстательной железы и других разновидностей рака. Скрининг на эти генетические маркеры может быть выполнен при использовании системы и способов, описанных в настоящей заявке.
[00290] Возбудители инфекции, которые могут быть диагностированы посредством использования системы и способа согласно настоящему изобретению, включают, не ограничиваясь этим, бактерии, вирусы, грибы, актиномицеты и паразиты. Примеры включают, не ограничиваясь этим, эшерихию, шигеллу, сальмонеллу, Arizona (подген III сальмонеллы), цитробактер, клебсиеллу, энтерогактер, серратию, протеус, провиденцию, морганеллу; вибрио- и кампилобактер; бруцеллу, например, бруцеллез; иерсинии; пастереллу; франкиселлу; актинобациллез; гемофильную палочку, бордетеллу (например, Burdetella pertussis); псевдомонаду и легионеллу; бактероиды, веретенообразные бактерии, стрептобациллы и калимматобактерии; бациллы (спорогенные аэробные бактерии); клостридии (спорогенные анаэробные бактерии); листерию и эризипелотрикс; коринебактерии; микобактерии; спирохеты; рикеттсии; хламидии; микоплазмы; поксвирусы; вирусы герпеса; паповавирусы; аденовирусы; ортомиксовирусы, парамиксовирусы; вирусы бешенства; вирус цитомегалии; ретровирусы; пикорнавирусы; корнавирусы; ротавирусы; вирусы гепатита (например, вирус гепатита C, вирус гепатита B); тогавирусы; буньявирусы; аренавирусы; криптококки; кандида (например, Candida albicans, Candida glabrata, Candida parapsilosis, Candida tropicalis); споротраксы; илестоплазма; грибки Coccidioides; бластомицеты; аспергиллы; зигомицеты; Dematiaceae; возбудитель фузариоза; простейшие; нематоды; и платигельминты.
[00291] В других вариантах реализации настоящего изобретения, ретровирусы, например, вирус иммунодефицита человека первого типа, вирус иммунодефицита человека второго типа, любая из групп M, N, O или P вируса иммунодефицита человека первого типа, любой подтип A-K группы M вируса иммунодефицита человека первого типа, или любой другой известный тип или подтип вируса иммунодефицита человека, вирус Т-клеточного лейкоза человека первого типа и вирус Т-клеточного лейкоза человека второго типа и вирусы герпеса, такие как вирус простого герпеса первого типа, вирус простого герпеса второго типа, вирус ветряной оспы, вирус Эпштейна-Варра, цитомегаловирус и герпесвирус человека шестого типа могут быть обнаружены посредством использования системы и способов согласно настоящему изобретению.
[00292] В других вариантах реализации настоящего изобретения нарушения и заболевания, подлежащие обнаружению при использовании системы и способов согласно настоящему изобретению, включают: боррелии, человеческий Т-клеточный вирус лимфомы/лейкоза первого типа, человеческий Т-клеточный вирус лимфомы/лейкоза второго типа, вирус иммунодефицита человека, вирус гриппа, вирус парагриппа, аденовирусы, вирус простого герпеса, вирус ветряной оспы, папилломавирус человека (родовой, 6, 11, 16, 18, 31, 33), Moraxella catarrhalis, стрептококковая пневмония, гемофильная инфекция, виды Legionella; человеческий парвовирус В19, стрептококк группы В.
[00293] В других вариантах реализации настоящего изобретения нарушения и заболевания, подлежащие обнаружению при использовании системы и способов согласно настоящему изобретению, включают генетические отклонения и нарушения, для которых есть генетическая предрасположенность. Примеры включает, не ограничиваясь этим, муковисцидоз, болезнь Гоше, дефицит среднецепочечной ацилдегидразы, миотоническую дистрофию, натриевую каналопатию, хлоридную каналопатию, мышечную дистрофию Дюшенна-Беккера.
[00294] В определенных вариантах реализации настоящего изобретения могут быть диагностированы следующие болезнетворные организмы: вирус иммунодефицита человека, бактерия туберкулеза, вирус гепатита С, вирус атипичной пневмонии, хламидия трахоматис, вирус цитомегалии, Gardnerella vaginalis, стрептококк группы A, стрептококк группы В, вирус папилломы человека, Neisseria gonorrhoeae, Trichomonas vaginalis, Bordetella pertussis и E.coli.
[00295] В одном варианте реализации настоящего изобретения подлежащий регистрации возбудитель инфекции представляет собой устойчивый к метицилину золотистый стафилококк. Золотистый стафилококк представляет собой один из самых важных болезнетворных организмов, приводящих к внутрибольничным и бытовым инфекциям. Бета-лактамные антибиотики представляют собой предпочтительные препараты для серьезных инфекций золотистого стафилококка. Начиная с введения метицилина в клиническую практику в 1961 году, постоянно растет появление штаммов устойчивого к метицилину золотистого стафилококка и госпитальные инфекции стали серьезной проблемой по всему миру. Следовательно, регистрация устойчивости к метицилину имеет важные применения для терапии и управления пациентами. В клинической лаборатории золотистый стафилококк идентифицируют по характеристикам роста и посредством последующей регистрации активности каталазы и коагулазы или по определенным поверхностным компонентам. Испытания на дезоксирибонуклеазу и термостойкую эндонуклеазу были использованы в качестве подтверждающих анализов в отношении неокончательных или отрицательных испытаний на коагулазу. Обычные испытания на восприимчивость золотистого стафилококка достоверно обнаруживают устойчивость к метицилину или оксациллину при использовании способов разведения в агаре или скриннинга в агаре согласно стандартам Национального комитета по клиническим лабораторным стандартам. Устойчивость к метицилину связана с выработкой связанного с пенициллином белка, закодированного геном mecA, или, в редких случаях, с гипервыработкой бета-лактамазы.
[00296] В известных способах регистрации устойчивого к метицилину золотистого стафилококка используют основанное на бульоне и на агаре антимикробное испытание на восприимчивость и получают фенотипический профиль отклика данного микроорганизма на набор реактивов. Эти способы медленные и сталкиваются с проблемами, такими как ложные положительные результаты и ложные отрицательные результаты. Эти недостатки возникают вследствие экспрессии генов устойчивости в стафилококке, что может быть выражено весьма неоднородным образом, делая фенотипическое исследование затруднительным. Могут быть использованы молекулярные способы, нацеленные на регистрацию гена устойчивости mec A. Скрининг на мутации в амплифицированном продукте может быть облегчен при помощи наборов зондов высокой плотности, таких как марки Affimetrix® Genechips™, которые могут быть использованы в практике настоящего изобретения.
[00297] Аналогично, выявление устойчивости к лекарственному средству посредством регистрации определенных генов устойчивости к противомикробным препаратам (генотипирование устойчивости) может быть выполнено во многих организмах. Примеры перечислены в следующей Таблице 1:


[00298] В других вариантах реализации настоящего изобретения вирусные и микробные заболевания, которые могут диагностированы посредством использования системы и способа настоящего изобретения, перечислены в Таблице 2:


[00299] В дальнейших вариантах реализации настоящего изобретения инфекционные заболевания, перечисленные в Таблице 3, могут быть проверены посредством использования системы и способа согласно настоящему изобретению.

[00300] При наличии вышеупомянутых особенностей и преимуществ настоящего изобретения обеспечена возможность многих успехов в здравоохранении (и в других отраслях промышленности), особенно в многоцелевых секторах. Такие сектора в медицинской промышленности включают:
[00301] правительственный сектор (например, Центры по контролю и профилактике заболеваний, военные операции, Министерство сельского хозяйства и т.д.),
[00302] коммерческий сектор (например, больницы/медицинские учреждения, аналитические/диагностические лаборатории, фармацевтические предприятия и т.д.), и
[00303] частный сектор (например, врачи, фермеры/владельцы ранчо, отдельные лица).
[00304] Во взятом в качестве примера варианте реализации настоящего изобретения лаборатории или фармацевтические компании служат пунктами распределения разнообразных описанных выше подготовленных интегральных микросхем. Различные микросхемы подготовлены для анализа различных болезнетворных организмов и заболеваний. Конечные пользователи микросхем происходят из различных секторов и развертывают портативную систему для выполнения проб (описанную выше) в соответствующих местоположениях и средах, включающих использование в доме пациента, в поле (например, в точках проверки зерновых культур и в ветеринарных точках проверки), в отдаленных/сельских местах, а также в больницах/медицинских центрах, местах ввоза и т.п. Ввиду автоматической настройки подключаемых устройств (т.е., быстрый цикл работы считывающего устройства, разнообразие проб, выполняемых микросхемами, и одноразовое использование микросхем) между интегральными микросхемами и портативной системой взятия проб согласно настоящему изобретению, данная портативная система/устройство взятия проб согласно настоящему изобретению способны считывать множество различных микросхем (для регистрации различных болезнетворных организмов/заболеваний) на месте или могут быть предназначены для считывания одного типа микросхем (для регистрации определенного болезнетворного организма/заболевания).
[00305] Во время использования портативной системы для взятия проб имеет место двусторонний обмен информацией между центральным центром сбора данных (где рабочие библиотеки данных и данные о биоинформатике постоянно хранятся или поддерживаются) и конечным пользователем системы. Посредством такого двухстороннего обмена центр сбора данных предоставляет известную информацию о географическом распространении болезнетворного организма/заболевания системе конечного пользователя/изобретения для биологического анализа образца, и затем система/конечный пользователь изобретения передает результаты проб в центр сбора данных. В дополнение к результатам проб центр сбора данных может получить информацию о географическом местоположении и другую информацию об идентификации заболевания от конечного пользователя/системы изобретения. Центр сбора данных контролирует поступающие результаты проб от множества развернутых блоков/систем согласно изобретению и использует программы регистрации картины (известные в данной области техники). Например, может быть зарегистрирована картина количества случаев данного заболевания в ограниченном географическом районе, или картина движения (распространения) данного заболевания может быть зарегистрирована на основании данных, полученных от множества конечных пользователей. Предложены другие варианты регистрации и отслеживания для определенных условий или местонахождений болезнетворных организмов/болезней (например, в средствах раздачи воды, продовольственных зерновых культурах, банках крови и плазмы, и т.д.).
[00306] В свою очередь, центр сбора данных может быть выполнен с возможностью программной выработке уведомлений при регистрации пороговых значений. Центр сбора данных может уведомлять медперсонал (машину скорой помощи, отделение неотложной хирургии, врача), воинские части, правительственные агентства и так далее. Такое уведомление может быть выполнено на подписной основе, где принимающие уведомления стороны платят за подписку на принятие тревожных сообщений и уведомлений от центра сбора данных. Могут иметь место различные уровни подписки, где стороны /пользователи платят на одном уровне за право иметь доступ к библиотекам данных и на другом уровне за право иметь доступ к собранным данным с результатами проб. На другом уровне подписки подписчику могут быть предоставлены автоматизированные тревожные сообщения и уведомления, использующие предоставленную подписчиком контактную информацию (где и в какой среде/форме подавать тревожные сообщения).
[00307] При использовании в настоящей заявке уведомления и тревожные сообщения могут быть выполнены в виде электронного письма, телефонного звонка, тревожного сигнала или в виде другой акустической и/или визуальной индикации.
[00308] Кроме того, центр сбора данных может быть выполнен с возможностью дополнительного ответа конечному пользователю после получения и обработки результатов проб, полученных от конечного пользователя. Вместе с заданными результатами проб центр сбора данных выполняет перекрестные ссылки на другую известную соответствующую информацию, например, на генотип, эффективную терапию/лечение и т.д. Центр сбора данных передает эту дополнительную информацию конечному пользователю для использования на месте.
[00309] Аналогичным образом настоящее изобретение обеспечивает усовершенствованные способы медицинского обслуживания и лечения, борьбы с болезнями, биозащиты (частота возникновения заболевания и регистрация болезнетворного организма в режиме реального времени, а также слежение в режиме реального времени за заражением и распространением инфекции), и другое многообразное использование в промышленности.
Взятые в качестве примера конфигурации устройства
[00310] Описанные в настоящей заявке изобретения могут быть сформированы в виде продуктов или устройств (или использованы в них), которые включают, не ограничиваясь этим, карманные устройства, компьютерные планшеты, портативные компьютеры, смартфоны, имплантируемые устройства, проглатываемые устройства, пригодные для ношения на теле устройства и инжекционные устройства.
[00311] «Пригодное для ношения на теле устройство» представляет собой устройство, предназначенное для использования на внешней части тела, например, на руке, ноге, коже, внутри рта, на пояснице. Пригодное для ношения на теле устройство выполнено с возможностью удержания на теле, например, но не ограничиваясь этим, посредством защелок, браслета, липкого пластыря, трансдермальных пластырей, внутриротовых пластырей, стекол, головной повязки, повязки на щиколотке, обувных аксессуаров (в подошве) и т.д. Имплантируемое устройство способно обычным способом выполнять операции описанных в настоящей заявке устройств и при необходимости подавать выходные параметры операций устройства в компьютер, например, посредством беспроводной связи. В соответствии с вариантом реализации настоящего изобретения пригодное для ношения на теле устройство может содержать один или большее количество отдельных компонентов, которые могут или не могут быть прикреплены или механически связаны вместе и/или могут быть размещены на одной или большем количестве различных внешних частей тела, и которые способны выполнять связь друг с другом с помощью беспроводных технологий и/или с использованием проводной связи. В соответствии с вариантом реализации настоящего изобретения пригодное для ношения на теле устройство может также содержать только часть устройств, описанных в настоящей заявке, и может выполнять связь с помощью беспроводных технологий и/или по проводам с другими частями описанного в настоящей заявке устройства, причем такие другие части размещены внутри и/или вне человеческого тела. Взятые в качестве примера пригодные для ношения на теле устройства показаны на фиг. 21 и выполнены как: (A) трансдермальный пластырь или дермальный пластырь; (B) браслет, содержащий устройство согласно настоящему изобретению и полоску для удержания устройства на запястье, руке, ноге, пальце; и (C) пластырь, адгезивно прикрепленный к внешней части тела с одной стороны и к устройству согласно настоящему изобретению с той же самой или с противоположной стороны. В некоторых вариантах реализации настоящего изобретения все компоненты устройства размещены на пригодном для ношения на теле устройстве. В других вариантах реализации настоящего изобретения некоторые из компонентов размещены на пригодном для ношения на теле устройстве и передают сигнал приемнику, размещенному в другом месте. В соответствии с вариантом реализации настоящего изобретения пригодное для ношения на теле устройство может также содержать только часть устройств, описанных в настоящей заявке, и способно выполнять связь с помощью беспроводных технологий и/или по проводам с другими частями описанного в настоящей заявке устройства, причем такие другие части размещены внутри и/или вне человеческого тела.
[00312] «Имплантируемое устройство» представляет собой устройство, размещенное в хирургически или естественно образованной впадине человеческого тела для оставаться там на дни, месяцы или дольше. Имплантируемое устройство может обычно выполнять операции описанных в настоящей заявке устройств и при необходимости подавать выходные параметры операций устройства в компьютер, например, посредством беспроводной связи. В соответствии с вариантом реализации настоящего изобретения имплантируемое устройство может содержать один или большее количество отдельных компонентов, которые могут или не могут быть прикреплены или механически связаны вместе и/или могут быть размещены на одной или большем количестве различных внешних частей тела, и которые способны выполнять связь друг с другом с помощью беспроводных технологий и/или с использованием проводной связи. В соответствии с вариантом реализации настоящего изобретения имплантируемое устройство может также содержать только часть устройств, описанных в настоящей заявке, и способно выполнять связь с помощью беспроводных технологий и/или по проводам с другими частями описанного в настоящей заявке устройства, причем такие другие части размещены внутри и/или вне человеческого тела.
[00313] «Проглатываемое устройство» представляет собой устройство, которое может быть подано пациенту перорально для персонального контроля. Например, устройство может быть проглатываемым отметчиком событий, используемым для регистрации событий с отметкой времени и зарегистрированных пациентом, при использовании описанных в настоящей заявке устройств. Проглатываемый компонент связан с помощью беспроводных технологий с внешним записывающим устройством, которое регистрирует дату и время заглатывания, а также уникальный серийный номер проглатываемого устройства.
[00314] «Инжекционное устройство» представляет собой устройство, которое может быть инжектировано на место внутрь человеческого тела и способно быть сохраненным в намеченном месте внутри тела. Инжекционное устройство способно рутинным образом выполнять операции описанных в настоящей заявке устройств и при необходимости подавать выходные параметры операций устройства в компьютер, например, посредством беспроводной связи.
[00315] Взятые в качестве примера имплантируемое, инжекционное или проглатываемое устройства показаны на фиг. 22. Устройства согласно настоящему изобретению внедрены в подложку носителя.
Пояснение на примерах
[00316] Процедура очистки ДНК
[00317] Следующий пример описан со ссылками на интегральную микросхему, показанную на фиг. 4, и модуль регистрации флуоресценции, показанный на фиг. 9B.
[00318] Пользователь инжектирует биологический образец, магнитные микроносители и буферный раствор для лизиса в камеры 104 экстракции нуклеиновой кислоты через отверстия 100 для впуска образца, затем загружает интегральную микросхему 20 в портативную систему для проведения пробы (10, фиг. 1). Система культивирует биологический образец в течение 7 минут, в течение которых происходит лизис и связывание ДНК в образце с магнитными микроносителями. Система затем входит во взаимодействие с магнитом, вынуждающим магнитные микроносители (и прикрепленную ДНК) образовывать кластеры в области действия поля. Микроносители вымывают в течение двух-трех минут посредством моющего буферного раствора, инжектируемого пользователем в камеры 104 экстракции через отверстия 100 для впуска образца. Магнит выводят из взаимодействия во время промывки. Пользователь повторяет этот цикл один раз перед инжекцией свободной от ДНК/РНК воды через отверстия 100 для впуска образца. Затем пользователь выводит магнит из взаимодействия, нагревает текучую среду в камере экстракции нуклеиновой кислоты при 70°C в течение 8-10 минут, выделяя, таким образом, ДНК. Магнит вводят во взаимодействие для иммобилизации микроносителей, отверстие 106 для добавления реактива уплотняют пассивным запорным клапаном, и используют шприц для введения экстрагированной ДНК в камеры 108 амплификации нуклеиновой кислоты.
[00319] Пользователь уплотняет камеры 108 амплификации, предпочтительно посредством пассивных запорных клапанов, введенных в отверстия 106 для добавления реактива и лунки 120 для образцов. После уплотнения камеры экстрагированную ДНК смешивают с мастер-миксом полимеразной цепной реакции перед тем, как холодильник, работающий на основе эффекта Пельтье, выполняет температурный цикл между 50°C и 97°C до 35 раз для амплификации экстрагированной ДНК. После окончания амплификации пользователь разуплотняет камеру амплификации и затем перемещает амплифицированную нуклеиновую кислоту в модуль регистрации, используя накачиваемый вручную шприц, соединенный с интегральной микросхемой через отверстия 106 для добавления реактива.
[00320] Пользователь загружает полимерный гель/матрицу просеивания и буферный раствор для проведения капиллярного электрофореза в восемь каналов 112 регистрации через лунку 116 для буферного раствора. Затем стандарты молекулярного веса загружают в лунки 120 для образцов. Затем пользователь прилагает напряжение 400 В к электродам, размещенным на лунке 120 для образцов и лунках 118 для отходов образца или около них для втягивания амплифицированной нуклеиновой кислоты в каналы 112 регистрации. После поступления достаточного количества амплифицированной нуклеиновой кислоты в канал регистрации пользователь выключает поле с напряжением 440 В и затем прилагает поле с напряжением 6 кВ между лункой для отходов буферного раствора и лункой для буферного раствора. Это приводит к сепарации стандарта молекулярного веса вдоль каналов 112 регистрации, обеспечивая эталонные значения времени. После дополнительного промывания каналов 112 регистрации пользователь повторяет процесс, используя амплифицированные нуклеиновые кислоты, принудительно загруженные в лунки 120 для образцов под давлением от шприца, приложенного к камерам 108 амплификации нуклеиновой кислоты. Это вынуждает амплифицированные нуклеиновые кислоты выполнить разделение на разновидности и мигрировать по каналам 112 регистрации.
[00321] При миграции стандарты молекулярного веса или амплифицированные разновидности нуклеиновой кислоты проходят через область 1005 измерения, где их опрашивают под управлением модуля 60 управления регистрации, выполненного с возможностью регистрации сигналов флуоресценции, как показано на фиг. 9B. При миграции разновидностей 140 через область 1005 измерения, они освещены лучом 1004 лазера соответствующей длины волны, что вынуждает разновидности 140 испускать флуоресцентный луч 1010 другой длины волны. Флуоресцентный луч 1010 и луч 1004 лазера распространяются из области 1005 измерения 1005 к дихроичному светоделителю 1007, который отражает луч 1004 лазера и пропускает флуоресцентный луч 1010. Устройство 1008 блокирования луча поглощает луч 1004 лазера, а детектор 1012 воспринимает флуоресцентный луч 1010. Детектор 1012 вырабатывает фотоэлектронный ток (не показан), величина которого пропорциональна интенсивности флуоресцентного луча 1010. Процессор 1014 регистрирует, записывает и обрабатывает зарегистрированный фотоэлектронный ток в зависимости от времени.
[00322] Зарегистрированный обработанный сигнал сравнивают с сигналом от известного эталона, проанализированного при идентичных условиях, для идентификации болезнетворных организмов в образце. Система описывает этот процесс идентификации посредством диаграммы 1020 выходного сигнала. Анализ известного эталона выдает кривую 1021 сигнала для эталона с пиками, соответствующими известным болезнетворным организмам в известном количестве. Сравнение временной ординаты пика 1022 сигнала от неизвестного образца с кривой 1021 сигнала для эталона дает пользователю указание на тип болезнетворного организма; система определяет вирусную нагрузку посредством вычисления площади под пиком 1022 сигнала.
[00323] Клеточные культуры
[00324] Для демонстрации характеристик интегральной микросхемы клетки Е. coli были использованы для экспериментального тестирования. Клетки Е. coli (DH-10B, компания «Invitrogen») были подвергнуты культивированию в течение ночи в трубках объемом 5 мл в среде Лурия-Бертани (компания «Invitrogen») примерно при температуре 37°C в аппарате для встряхивания при частоте 200 об/мин. Исходная культура была затем или непосредственно использована для экспериментов или разбавлена (в свободной от рибонуклеазе воде) для получения необходимого клеточного раствора/концентрации клеток. Концентрация культивируемых клеток была получена посредством измерения культуры в спектрофотометре (марки Ultraspec 10, компания «Amersham Biosciences)), Великобритания). Подробное описание типа Е. coli таково: клетки Е. coli DH10B (ElectroMAX™ DH10B™, САТ-проба №12033-015, компания «Invitrogen», США); Генотип: F-mcrA Δ(mrr-hsdRMS-mcrBC) ϕ80lacZ ΔM15 ΔlacX74 recAl endAl araD139 Δ (ara, leu) 7697 galU galK λ - rpsL nupG tonA; приблизительный размер всей геномной ДНК составляет примерно 4,6×106 пар нуклеотидов.
[00325] Эксперименты были выполнены на микросхеме при использовании этих клеток. Две серии экспериментов описаны ниже. В первой серии исходная культура (от 0,2 до 2 мкл) была непосредственно использована для экспериментов с микросхемой. Во второй серии экспериментов 1 мкл исходной культуры был последовательно разбавлен до неограниченного разбавления. В каждом из этих экспериментов измерения были проведены в ходе проведения биологической пробы, и для клеток и для концентрации ДНК, обеспечивая, тем самым, количественные данные для анализа. Концентрация клеток была определена количественно, как описано ранее, а концентрация ДНК была измерена на спектрофотометре марки Nanovue® (компания «GE Health Sciences))). Однако, вследствие наличия пределов чувствительности у обоих используемых спектрофотометров количественный анализ образцов с низкой концентрацией был затруднительным до завершения биологической пробы, включающей амплификацию, что обеспечивало возможность амплификации ДНК, которое было легко измеримым. Нижеуказанные эксперименты были выполнены на интегральной микросхеме при использовании описанных выше протоколов.
[00326] Идентификация болезнетворного организма при использовании исходной клеточной культуры
[00327] На фиг. 17А-17D и фиг. 8 показаны результаты первой серии экспериментов, в которой разные количества исходной культуры вместе с раствором с магнитными микроносителями (т.е., с раствором для лизиса и с суспензией магнитных микроносителей марки Dynal®, покрытых стрептавидином) были загружены в камеру экстракции микросхемы. Количество клеток (колониеобразующих единиц), введенных в микросхему, было получено из значения измеренной концентрации культуры. После лизиса клеток и захвата ДНК микроносителями, как описано в протоколе выше, ДНК было повторно суспендировано в 2 мкл воды (свободной от РНК-азы). Затем была измерена концентрация экстрагированной ДНК и мастер-микс (ранее определенная проба) был затем добавлен.
[00328] Амплификация была затем выполнена в камере амплификации на микросхеме.
[00329] Наконец, после завершения амплификации концентрация ДНК была снова измерена и были получены значения количества молекул и коэффициентов амплификации. На фиг. 17A, 17B, 17C и 17D показаны результаты проведенной на микросхеме очистки и амплификации ДНК. На графиках показаны: фиг. 17А - коэффициент амплификации как функция начального количества ДНК, фиг. 17B - окончательное количество ДНК как функция начального количества ДНК, фиг. 17C - окончательная концентрация ДНК как функция начальной концентрации ДНК, и фиг. 17D - количество экстрагированной ДНК как функция количества клеток на входе.
[00330] Обычный основанный на использовании геля электрофорез давал возможность проверки размера окончательного продукта амплификации, равного примерно 700 пар нуклеотидов, как показано на фиг. 18, что было ожидаемо от конструкции начального праймера. Результаты, показанные на фиг. 18, отражают:
[00331] полоса 2: электрофоретическое расщепление ДНК;
[00332] полоса 4: положительное управление для амплификации клеток DH10B (примерно 700 пар нуклеотидов);
[00333] полоса 5: отрицательное управление для амплификации клеток DH10B;
[00334] полоса 6: электрофоретическое расщепление ДНК;
[00335] полоса 8: положительное управление для амплификации клеток DH10B (примерно 700 пар нуклеотидов);
[00336] полоса 9: отрицательное управление для амплификации клеток DH10B; Полоса 10: электрофоретическое расщепление с 50 парами нуклеотидов.
Идентификация болезнетворного организма при использовании разбавленной клеточной культуры
[00337] На фиг. 19А-19D и фиг. 20 показаны результаты второй серии экспериментов, в которой 1 мкл раствора исходной культуры был последовательно разбавлен посредством 9 мкл воды для достижения производных растворов клеток вплоть до содержания меньше, чем одна клетка. Поскольку основанный на микросхеме подход может работать только с очень малыми объемами (обычно несколько микролитров), разбавленные культуры затем были подвергнуты скручиванию для гарантии использования всех клеток в растворах. Эти капсулы со скрученными клетками были затем добавлены к 10 мкл раствора магнитных микроносителей Dynal®, и процесс экстракции, аналогичный процессу из первой серии экспериментов, был выполнен.
[00338] Как было выполнено ранее, экстрагированная ДНК была повторно суспендирована в 2 мкл воды, что сопровождалось добавлением примерно 8 мкл мастер-микса амплификации. Амплификация была затем выполнена на микросхеме.
[00339] Концентрации ДНК были измерены до и после амплификации. Данные затем были использованы для получения значений концентрации ДНК и коэффициента амплификации для каждого используемого образца с разбавленным раствором культуры. На фиг. 19A, 19B, 19C и 19D показаны результаты очистки и амплификации ДНК на микросхеме. На графиках показаны: фиг. 19A - измеренное количество молекул ДНК как функция количества клеток на входе, фиг. 19B - окончательное количество молекул ДНК после амплификации как функция начального количества молекул ДНК до амплификации, фиг. 19C - коэффициент амплификации как функция измеренного начального количества молекул ДНК, и фиг. 19D - коэффициент амплификации как функция теоретического начального количества молекул ДНК.
[00340] Обычный основанный на использовании геля электрофорез давал возможность проверки размера окончательного продукта амплификации, равного примерно 700 пар нуклеотидов, как показано на фиг. 20. Результаты, показанные на фиг. 20, отражают:
[00341] полоса 1: электрофоретическое расщепление ДНК;
[00342] полоса 3: положительное управление для амплификации клеток DH10B (примерно 700 пар нуклеотидов);
[00343] полоса 5: отрицательное управление для амплификации клеток DH10B;
[00344] полоса 7: электрофоретическое расщепление ДНК;
[00345] полоса 9: положительное управление для амплификации клеток DH10B (примерно 700 пар нуклеотидов).
[00346] Результаты
[00347] Как очевидно из любого из вышеупомянутых экспериментов по амплификации, имеет место уменьшение эффективности (что очевидно из значений коэффициента амплификации) при увеличении концентрации начального образца. В идеальной пробе, где теоретические ограничивающие факторы незначительны, должна быть ожидаема экспоненциальная амплификация. Однако, при учете ограничений, связанных с такими факторами как: (1) потеря эффективности ферментов после циклического температурного воздействия, (2) отсутствие достаточного количества дезоксинуклеозидтрифосфатов и набора праймеров, (3) адсорбционный фактор (неблагоприятно усиленный отношениями поверхности к объему в микросхеме), подавляющий извлечение амплифицированной ДНК или вызывающий ее плохое извлечение, теоретический уровень амплификации может быть затруднительно достигнуть. Однако, как отмечено во второй серии экспериментов, достигнута поддающаяся регистрации амплификация только с примерно двенадцатью стартовыми клетками в незагрязненном входном образце.
[00348] Демонстрация амплификации, количественный анализ вируса иммунодефицита человека первого типа
[00349] В отличие от устройств для выполнения полимеразной цепной реакции, в настоящее время продаваемых для исследования вирусной нагрузки, система согласно варианту реализации настоящего изобретения не требует никакой офлайновой подготовки образца и операции обработки изолированы внутри настроенной наносхемы. Биологические текучие среды подают непосредственно к наносхеме, размещенной внутри устройства.
[00350] Система согласно варианту реализации настоящего изобретения представляет собой количественную систему относительно комплементарной ДНК, ДНК или РНК в очень широком динамическом диапазоне. Например, при проведении пробы комплементарной ДНК инактивированного вируса иммунодефицита человека первого типа, чем выше титр вируса иммунодефицита человека первого типа в образце, тем раньше произойдет повышение сигнала регистрации выше исходного уровня. Чем ниже титр вируса иммунодефицита человека первого типа в образце, тем большее количество циклов амплификации необходимо для выработки поддающегося регистрации количества материала вируса иммунодефицита человека первого типа. О появлении сигнала детектора сообщают как о критическом пороговом значении (Ct). Величина Ct определена как число доли цикла, где сигнал детектора превышает заранее определенный порог и начинает фазу экспоненциального роста. Более высокое значение Ct указывает на пониженный титр начального целевого материала вируса иммунодефицита человека первого типа.
[00351] На фиг. 23 показаны целевые калибровочные кривые для ряда растворов, содержащих от 106 до 102 молекул комплементарной ДНК вируса иммунодефицита человека первого типа, в эксперименте в соответствии с вариантом реализации настоящего изобретения. При увеличении концентрации материала вируса иммунодефицита первого типа калибровочные кривые показывают сдвиг к более ранним циклам. Следовательно, крайняя левая калибровочная кривая соответствует самому высокому уровню титра вируса, а самая правая калибровочная кривая соответствует самому низкому уровню титра вируса (фиг. 23). Горизонтальная синяя линия отражает значение Ct для этой серии экспериментов. Предварительные исследования в соответствии с вариантом реализации настоящего изобретения продемонстрировали динамический диапазон диагностики вируса иммунодефицита человека начиная со значения меньше 50 копий до 2 миллионов копий начального количества молекул комплементарной ДНК или молекул РНК вируса иммунодефицита человека первого типа и доказательство правильности концепции с другими болезнетворными организмами, причем в стадии реализации находятся исследования, нацеленные на репликацию уровня регистрации одной молекулы, что ранее достигнуто с другим болезнетворным организмом (Е. coli). В верхнем левом углу на фиг. 23 показана картина устройства-прототипа в соответствии с вариантом реализации настоящего изобретения, которое меньше обычного ноутбука. Фиг. 26 представляет собой увеличенное изображение устройства, содержащего экран 2601 дисплея и отсек 2602, в который вставлена микросхема, содержащая биологический образец для анализа. Операционная система этого устройства интуитивно понятна пользователю и обладает эффективно интегрированными функциональными особенностями вместе с новаторской интегральной способностью для совместного использования и хранения данных. Менее чем за час были образованы данные фиг. 23.
[00352] Было продемонстрировано, что устройство в соответствии с вариантом реализации настоящего изобретения образует калибровочные кривые для количественной оценки, начинающейся с эталонных образцов вируса иммунодефицита человека первого типа с усиленным РНК, которые содержат точно определенное количество копий нашей целевой последовательности РНК вируса иммунодефицита человека первого типа. Средства управления усиленной РНК стали промышленным стандартом в широком диапазоне диагностических испытаний, включая большинство коммерческих испытаний на вирусную нагрузку с вирусом иммунодефицита человека.
[00353] Прямое сравнительное исследование с одобренным Управлением США по надзору за качеством пищевых продуктов и лекарственных средств устройством типа Stratagem для проведения полимеразной цепной реакции
[00354] Мы дополнительно продемонстрировали данные о технических возможностях системы в соответствии с вариантом реализации настоящего изобретения посредством определения эффективности прототипов по сравнению с «золотым стандартом» - устройством марки Stratagene МХ4000 для количественного проведения полимеразной цепной реакции.
[00355] На фиг. 24 инактивированный вирус иммунодефицита человека первого типа был последовательно разбавлен до начальных величин в диапазоне от 106 до 102 молекул комплементарной ДНК вируса иммунодефицита человека первого типа. Вирусные нагрузки были определены количественно посредством использования порогового цикла (Ct) от обычных кривых амплификации, образованных флуоресценцией красителей SYBR. Эти калибровочные кривые, основанные на известных концентрациях вируса иммунодефицита человека первого типа, были воспроизведены. На фиг. 24 показан динамический диапазон традиционного устройства для проведения полимеразной цепной реакции, предназначенного для амплификации целевого вируса иммунодефицита человека первого типа. Горизонтальная синяя линия показывает значение Ct для этой серии экспериментов. Фиг. 23 (выше) иллюстрирует те же самые образцы с известными концентрациями вируса иммунодефицита человека первого типа в системе согласно варианту реализации настоящего изобретения. Эти данные предоставляют подтверждение концепции изобретения, что количественные данные о вирусной нагрузке в соответствии с вариантом реализации настоящего изобретения в принципе эквивалентны данным системы Stratagene в отношении значения Ct, согласования кривых и динамических диапазонов. Значение вирусной нагрузки, измеренной «золотым стандартом» -одобренным Управлением США по надзору за качеством пищевых продуктов и лекарственных средств устройством Stratagene, примерно в десять раз больше, по сравнению с системой, реализованной в соответствии с настоящим изобретением.
[00356] Регистрация бактериальной нагрузки с количественным анализом точности
[00357] Обычный бактериальный болезнетворный организм E.Coli был испытан в системе в соответствии с вариантом реализации настоящего изобретения, демонстрируя динамический диапазон регистрации от 1000 копий до 10000000 копий E.Coli ДНК/мкл (фиг. 25A, слева). Коэффициент корреляции Пирсона R2=0,9886 указывает на статистически значимое линейное приближение между количеством циклов и количеством копий ДНК, демонстрируя надежность технологии (фиг. 25B, справа).
[00358] Содержание всех процитированных в настоящей заявке патентов, опубликованных заявок и ссылок полностью включено в настоящую заявку посредством ссылки.
[00359] Хотя настоящее изобретение было, в частности, проиллюстрировано и описано со ссылками на взятые в качестве примера его варианты реализации, специалистам в данной области техники совершенно понятно, что здесь могут быть внесены различные изменения в форме и деталях без отклонения от объема изобретения, охваченного прилагаемыми пунктами формулы изобретения.
Реферат
Изобретение относится к системе и способу для экспресс-анализа, количественного анализа и идентификации нуклеиновых кислот или белков. Система для анализа биологических образцов содержит мобильное устройство, по меньшей мере одну интегральную микросхему, совместно сконфигурированные для выполнения, по меньшей мере, одного цикла операций, причем каждый цикл операций включает: экстракцию по меньшей мере одного биологического материала из образца; генерирование одного или нескольких продуктов из по меньшей мере одного биологического материала, и обнаружение по меньшей мере одного биологического материала в образце, в котором наноразмерное управление применяется в течение по меньшей мере одного цикла операций. Изобретение обеспечивает более точную регистрацию и анализ нуклеиновых кислот или белков. 3 н. и 19 з.п. ф-лы, 3 табл., 29 ил.
Формула
Документы, цитированные в отчёте о поиске
Портативный диагностический прибор и способ его применения с электронным устройством и диагностическим картриджем при диагностическом экспресс-исследовании

Комментарии