Оптический индикатор для обнаружения бактериальных патогенов - RU2519339C2
Код документа: RU2519339C2
Чертежи










Описание
Настоящее изобретение касается оптического индикаторного устройства, в котором используется сольватохромный краситель как часть диагностического прибора для установления различия между бактериальными и вирусными патогенами, вызывающими инфекции. В частности, данное изобретение включает химическую реакцию между бактериями и красителем или индикатором на основе красителя.
Часто при первичном обследовании пациента врачам может быть затруднительно отличить бактериальные инфекции, вызванные бактериями, от инфекций, вызванных вирусом. Около 30 миллионов случаев тонзиллофарингита диагностируется каждый год, основной причиной заражения которым являются вирусы. Риновирус, аденовирус, коксаки-вирус, эховирус, коронавирус, а также вирусы Эпштейна-Барра являются наиболее частыми причинами вирусных тонзиллофарингитов. Ошибочный диагноз, однако, часто приводит к назначению избыточного количества антибиотиков, что представляет собой растущую проблему общественного здравоохранения вследствие формирования устойчивых к действию антибиотиков микробов. В действительности, врачи не могут различить вирусные и бактериальные инфекции горла приблизительно в 50% случаев. Из примерно 6,7 миллионов посещений взрослыми пациентами, связанных с заболеваниями горла, к поставщикам первичной медицинской помощи каждый год, антибиотики назначают в 70 - 75% случаев.
Посев из зева на микрофлору остается «золотым стандартом» для диагностики, но результаты могут быть недоступны вплоть до 48 часов. Несмотря на относительную быстроту, использование быстрых скрининг-тестов на стрептококк может быть проблематичным из-за вероятности ошибки от 5 до 40%. Кроме того, доступные экспресс-методы предназначены только для диагностики бета-гемолитических стрептококков группы А, несмотря на то что могут присутствовать и другие бактерии (такие как гонококки Neisseria gonorrhoeae, дифтерийная палочка Corynebacterium diphtheriae, гемофильная палочка Haemophilus influenzae, диплококки Moraxella catarrhalis и стрептококки группы С и группы G). Стрептококки группы С, в частности, могут быть более распространены у студентов высших учебных заведений и молодежи от 18 до 21 года и не определяются с помощью экспресс-тестов на стрептококк. Обычно полученный отрицательный результат теста означает, что инфекция, наиболее вероятно является вирусной, но, тем не менее, полученная культура и данные могут противоречить первоначальному результату экспресс-теста. Пациентам могут быть прописаны антибиотики в качестве меры предосторожности во время ожидания результатов посева, или их могут вызвать через несколько дней, и проинформировать, что им необходимо принимать антибиотики, если результаты посева возвращаются положительными. В течение этого времени они, кроме того, могут также неосознанно заражать инфекцией других людей.
Таким образом, существует необходимость в тесте, который мог бы позволить врачам быстро и безошибочно различать бактериальные и вирусные инфекции горла.
За пределами врачебного кабинета существует еще большая потребность в устройствах, предоставляющих дополнительную информацию потребителю. Неявка на работу по причине болезни продолжает обременять предприятия в финансовом отношении, что составляет в среднем 15% от расходов на зарплату. При заболевании сотрудников их рабочее время тратится не только на отдых и выздоровление, но зачастую на поход к врачу для диагностики и лечения. Кроме того, работникам может понадобиться взять перерыв в их производственном графике, чтобы отвести своих заболевших детей к врачу.
Так как общие вирусные инфекции, которые могут вызывать боль в горле, обычно являются несерьезными или облегчаются антибиотиками, потребители могли бы действовать иначе, если бы они обладали большей информацией о своем заболевании до посещения врача. Заблаговременное понимание того, что их симптомы с большей вероятностью являются вирусными по природе, могло бы позволить потребителю сэкономить деньги и время на посещения врача и должным образом лечиться самим с помощью отдыха, приема жидкости и лекарств, отпускаемых без рецепта. Аналогичным образом, обладание информацией, что инфекция, скорее всего, бактериальная по своей природе, также могло бы руководить поведением потребителя. Люди могли бы быть более информированы о том, когда им необходимо обратиться к врачу, а также могли бы иметь более разумные оценки относительно видов лечения, которые могли бы облегчить их состояние (продаваемые без рецепта лекарства по сравнению с предписанными антибиотиками, например). Таким образом, потребители могли бы извлечь большую пользу из устройств, которые предоставляют дополнительную информацию об их симптомах и вариантах лечения.
Следовательно, существует необходимость в оптическом индикаторе, который может проводить различие между бактериальными и вирусными патогенами. Кроме того, индикаторное устройство, которое можно легко использовать посредством клинических или домашних настроек, может помочь в обеспечении быстрой, точной и согласованной диагностической или детектируемой информацией, как для медицинских работников, так и для обычных потребителей.
Настоящее изобретение касается простого детекторного или индикаторного устройства, которое использует компонент, изменяющий цвет, для сообщения информации пользователю. Устройство содержит визуально или оптически чувствительный краситель. Как правило, устройство включает впитывающую подушечку, краситель или пропитанную красителем мембрану (реакционную панель) и окно для просмотра результатов, расположенные в единичном модуле. Устройство обнаружения может являться быстродействующим клиническим диагностическим вспомогательным средством, которое медицинский работник или потребитель могут использовать посредством взятия пробного мазка у пациента, введения в контакт с впитывающей подушечкой тампона, содержащего образец, закрывания или закрепления (например, складывания и запечатывания) устройства в соответствии с инструкциями таким образом, что происходит контакт между пропитанной красителем мембраной (реакционной панелью) и впитывающей подушечкой. Затем можно перевернуть устройство, чтобы прочитать результат в окне для просмотра результатов образца. Цветной эталон может быть расположен рядом с окном для просмотра результатов образца в качестве сравнения. Руководство по интерпретации полученных результатов также может находиться на обратной стороне исследуемой подложки. Краситель является чувствительным к клеткам бактерий и нечувствительным к вирусам, поэтому диагностическое устройство может различать бактериальные и вирусные патогены.
Настоящее изобретение также относится к способу использования индикаторного устройства для определения бактериальной инфекции. Способ включает предоставление испытательного устройства, такого как описано здесь, нанесение испытательного образца на вышеуказанную зону контакта образца; закрытие вышеуказанного первого листа напротив вышеуказанного второго листа так, что вышеупомянутая впитывающая подушечка контактирует с вышеуказанной реакционной зоной с красителем; а также наблюдение за изменением цвета, которое проявляется в окне для просмотра результатов. Устройство имеет подложку, оснащенную, по меньшей мере, первым и вторым противостоящими листами, при этом первый и второй листы каждый имеют внутреннюю и наружную поверхность, при этом вышеупомянутый первый лист имеет зону контакта образца, оснащенную впитывающей подушечкой, расположенной на вышеуказанной внутренней поверхности первого листа, и вышеупомянутый второй лист имеет реакционную зону с красителем, расположенную на вышеуказанной внутренней поверхности второго листа напротив вышеупомянутой зоны контакта образца, а также окно для результатов на вышеуказанной наружной поверхности второго листа, в котором проявляется визуальная информация. При необходимости врач или потребитель могут отправить или вернуть испытательные устройства поставщику услуг проведения тестов, чтобы получить интерпретацию результатов.
Понятно, что вышеприведенные краткое изложение и последующее подробное описание, а также примеры являются лишь представляющими изобретение и предназначены для общего впечатления с целью понимания изобретения. Дополнительные характеристики и преимущества настоящего диагностического индикаторного устройства, а также связанные с ним промышленные изделия и способы будут раскрыты в последующем подробном описании.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1А и 1В являются иллюстрациями, разложенными на плоскости, варианта исполнения настоящего индикаторного устройства, имеющего первую (100) и вторую панели (200). Фиг.1А показывает вид наружной поверхности панелей (100а, 200а), в то время как Фиг.1В демонстрирует вид внутренней стороны панелей (100b, 200b) с противоположной стороны в виде разложенных на плоскости.
Фиг.1C является трехмерным представлением варианта исполнения, показанного на Фиг.1А и 1В, показывая двухлистовой формат теста, похожий на открытку.
Фиг.2А и 2В являются иллюстрациями, разложенными на плоскости, второго варианта исполнения настоящего изобретения со складной третьей панелью (300), которая расположена между первой и второй панелью во время использования. Фиг.2А является видом снаружи (100а, 200а, 300а), а Фиг.2В является видом с обратной стороны, с внутренней стороны трех панелей (100b, 200b, 300b) при разворачивании на плоскости.
Фиг.2С является трехмерным представлением варианта исполнения, показанного на Фиг.2А и 2В, с тремя панелями или листами.
Фиг.3 представляет собой схематическое изображение нескольких возможных визуальных проявлений, которые дают информацию о том, присутствует ли бактериальный патоген в испытательном образце, после того как образец наносится на зону контакта и вступает в реакцию с оптически активным сольватохромным красителем. На Фиг.3А изображено отсутствие изменения цвета относительно эталонного пятна, следовательно, «отрицательный» результат («Negative»), тогда как на Фиг.3D изображен положительный результат («Positive»). Краситель обесцвечивается в течение периода примерно 5-10 минут, как проиллюстрировано на примере перехода на Фиг.3В и 3С от исходного цвета красителя к бледно-желтому и вплоть до белого цвета. Фиг.3D является "сильным" положительным сигналом, в то время как Фиг.3F и 3Е иллюстрируют примеры различных проявлений "слабых" положительных результатов, которые различаются по частичной или относительной интенсивности обесцвечивания.
Фиг.4 представляет собой калибровочную кривую для золотистого стафилококка S. aureus, для сравнения оптических измерений изменения цвета (значения полного цифрового различия, величины АЕ) в зависимости от присутствующей концентрации колониеобразующих единиц бактерий.
Фиг.5 является кривой титрования бактериальных компонентов клеточной стенки в зависимости от концентрации индикаторного красителя.
Фиг.6 является примером схематической последовательности операций, которая демонстрирует протокол или способ применения этапов цикла настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
- А. -
Раздел I. - Структура устройства
Настоящее изобретение касается клинического устройства обнаружения, которое может обеспечить анализ с быстрым результатом, который достоверно может различать бактериальные и вирусные патогены, способные вызвать различные инфекции полости рта, слухового канала и верхних дыхательных путей. Как правило, это устройство обнаружения имеет впитывающую подушечку для приема испытательного образца, сольватохромную мембрану, содержащую краситель, и область для просмотра результатов. Когда вышеуказанная впитывающая подушечка, содержащая испытательный образец, связанный с ней, соприкасается с сольватохромным красителем, в области для просмотра результатов проявляется визуальный сигнал. Изменение в цвете сольватохромного красителя указывает на наличие бактериального патогена. Лабораторные исследования подтверждают предположение, что изменение цвета является следствием реакции между клеточными остатками бактерий (кислотными остатками бактериальной клеточной поверхности) и сольватохромным красителем. Визуальный сигнал может быть считан и количественно измерен с помощью оптического сканирующего устройства, такого, которое в настоящее время является коммерчески доступным. Кроме того, мы полагаем, что бактериальная клеточная стенка несет основную ответственность за это изменение цвета. Таким образом, настоящее изобретение обеспечивает способ обнаружения целых клеток бактерий или больших фрагментов стенок бактериальных клеток, подвергнутых лизису. Это свойство отличает настоящее изобретение от имеющейся в настоящее время технологии, относящейся к горизонтальному проточному анализу.
Согласно изобретению, диагностическое или тестовое устройство имеет впитывающую подушечку в зоне контакта образца, расположенную напротив зону обнаружения, содержащую сольватохромный краситель, а также окно для визуализации результатов так, что испытательный образец, нанесенный на вышеуказанную впитывающую подушечку, соприкасается с вышеуказанной зоной обнаружения, расположенной напротив, вступает в реакцию с сольватохромным красителем в зоне обнаружения и показывает видимый сигнал посредством окна для визуализации результатов. Диагностическое устройство имеет подложку, которую можно согнуть, чтобы иметь по меньшей мере первую и вторую панели или листы, расположенные напротив друг друга. Первый и второй листы имеют каждый и внутреннюю, и наружную поверхность. Зона контакта образца с впитывающей подушечкой находится на внутренней поверхности первого листа. Зона индикатора с красителем находится на внутренней поверхности второго листа, находящегося напротив зоны контакта образца. Окно для результатов, в котором проявляется визуальная информация, находится на наружной поверхности второго листа. В определенных вариантах исполнения изобретения подложка является полужесткой и сгибаемой. Подложка дополнительно может включать третий лист, который загибается между первым и вторым листами. Третий лист имеет реакционное отверстие, расположенное напротив зоны контакта образца. Когда три листа правильно сложены, впитывающая подушечка в зоне контакта образца, реакционное отверстие, зона индикатора с красителем и окно для просмотра результатов, соответственно, все совмещены друг с другом по оси.
Согласно варианту исполнения изобретения, тестовое индикаторное устройство 10 может иметь сходство со сложенной брошюрой или похожей на открытку подложкой 11, содержащей, по меньшей мере, два листа или страницы, расположенных напротив друг друга. Как изображено на Фиг.1А, 1В и 1C, две панели 100, 200 или листы 12, 14 раскрываются в стороны друг от друга, как сложенная вдвое открытка или книга, согласно одному варианту исполнения. В другом варианте исполнения, как, например, изображено на Фиг.2А, 2В, и 2С, один из двух листов скомпонован так, чтобы иметь третью панель 300, которая сгибается, чтобы создать третий отворот 26 структуры в три сложения. Каждый лист подложки имеет первую, или внутреннюю, поверхность 12а, 14а, и вторую, или наружную, поверхность 12b, 14b, а общая конструкция 10, 11 в закрытом состоянии имеет переднюю и заднюю стороны. Брошюра из двух листов, такая как показано на Фиг.1C, открывается, чтобы показать зону нанесения испытательного образца 18 или окно на внутренней поверхности 12а. Зона нанесения образца имеет впитывающую подушечку для образца 20, с которой приводится в контакт мазок, содержащий образец, для переноса биологического образца. Впитывающая подушечка 20 (например, белого цвета) - на одной стороне, а окрашенная мембрана 19, 22 (например, синего цвета) - на противоположной стороне (на левой и правой сторонах, соответственно, как изображено на Фиг.1В). Контактирование испытательного образца, который содержит положительную концентрацию патогенов, с пропитанной красителем мембраной (то есть, реакционной прокладкой) 22 приведет к изменению цвета (например, от синего к белому или желтовато-белому). На задней панели 13 испытательной подложки или устройства расположено окно для результатов испытаний 24. Рядом с окном для результатов образца 24 может располагаться контрольный индикатор 25, как показано на Фиг.1А, или цветной эталон 15, а также руководство по интерпретации данных 17, чтобы помочь пользователю сравнить цвета при толковании результатов испытания, так как показано на Фиг.2А. В промышленном варианте исполнения целое устройство может поставляться упакованным для поддержания чистых или стерильных условий, в светозащитном чехле, который нужно открыть для извлечения аналитического устройства.
Когда панели правильно сложены, окно для визуализации результатов 24 выровнено вдоль оси визирования с зоной контакта образца 18 и зоной обнаружения 22, которые сообщают пользователю результаты испытания. Впитывающая подушечка 20 и зона контакта образца 18 могут быть расположены на части первой панели или подложки, а сольватохромный краситель 19 и зона обнаружения 22 расположены на части той же подложки, находящейся напротив. По существу, первая и находящаяся напротив подложки могут быть двумя листами 12, 14 или частями одной и той же подложки, сложенными лицом друг к другу. В других вариантах исполнения впитывающая подушечка и индикаторный краситель могут быть размещены на обособленных, отдельных первой и второй подложках. В некоторых конфигурациях, таких как вариант исполнения как на Фиг.2А-С, третий лист или клапан 26 одной и той же подложки (или первой или второй подложек) может быть расположен между зоной контакта образца и зоной обнаружения, когда сложен путем сгибания внутрь. Если присутствует третий лист, то этот третий лист 15 имеет прорезанное реакционное окно 23, которое расположено соосно с зоной контакта образца 18 и зоной обнаружения 22, подогнанное к каждой из областей впитывающей подушечки 20 и индикаторного красителя 19, соответственно, к двум зонам; таким образом, что когда третий лист 26 сгибается поверх реакционной зоны обнаружения 22, то открытое реакционное окно 23 располагается над зоной обнаружения. Сольватохромный краситель, вероятно, реагирует с кислотными остатками из бактериального патогена в испытательном образце, вызывая изменение в цвете сольватохромного красителя. Сольватохромный краситель не реагирует с вирусным патогеном в испытательном образце, что в результате не вызывает изменения в цвете.
Предполагается, что согласно определенным промышленным вариантам исполнения изобретения, диагностическое устройство имеет определенную маркировку и товарные идентификационные знаки с нанесением на лицевой стороне, а также заднюю сторону, где расположено окно для просмотра результатов образца, а также две внутренние панели. Когда диагностическое устройство открыто, аналогично книге, инструкции по использованию анализа и впитывающая подушечка будут на расположенной слева внутренней панели, а пропитанная красителем мембрана (реакционная панель) и отверстие или мембрана (помеченные как "реакционное окно") будут на расположенной справа внутренней панели. Мембрана реакционной панели может быть покрыта защитной пленкой или листом, которые следует удалить перед нанесением образца на впитывающую подушечку. Когда защитное покрытие снимается, после него остается клей, который позволяет устройству быть "закрытым", как книга, и запечатанным. Это заставляет впитывающую подушечку войти в тесный контакт с пропитанной красителем мембраной реакционной панели. После того как краситель вступил в реакцию с испытательным образцом, анализирующее устройство можно перевернуть для наблюдения за результатами образца в смотровом окне.
Цветной эталон дается на задней стороне теста, чтобы помочь в интерпретации данных. Обесцвечивание окраски окна для результатов следует оценивать по тому, насколько близко синий цвет реакционной панели похож на синий цвет цветового эталона. Если оба остаются синими, результаты являются отрицательными. Если синий цвет окна для результатов исчезает или полностью или почти полностью, превращаясь в белый или желтовато-белый, то это следует интерпретировать как положительный результат. Если синий цвет исчезает лишь незначительно (становится бледно-голубым в противоположность белому или желтовато-белому), то это следует интерпретировать как слабый положительный результат (смотрите Фиг.3 для некоторых примеров результатов и их предлагаемой интерпретации).
На подложке имеются слова, числа, схематические рисунки или символы, которые сообщают инструкции пользователю для выполнения последовательности действий для использования устройства обнаружения. Как правило, инструкции по применению могут предусматривать, что пользователь (1) прикладывает образец мазка из горла к впитывающей подушечке, (2) удаляет защитный покрывающий лист с реакционной панели, (3) надавливает на впитывающую подушечку для соприкосновения с реакционной панелью и (4) просматривает результаты через окно. Несколько схем или символов, которые обеспечивают сравнение визуальных проявлений, расположены на наружной поверхности второго листа непосредственно у окна для результатов. Схемы или символы могут показывать соответственные уровни или отрицательного, или положительного (например, слабого или сильного) результатов. В других итерациях схемы или символы могут проявляться как знак "+" или "-", Фиг.1А. Относительное изменение цвета и/или четкость проявления сигнала могут быть использованы для отражения соответствующего уровня концентрации микробов в образце, как, например, изображено на сравнительном участке бактериальной инфекции Фиг.1А (17), 2А (17), и 3Е и F. Контрольный цветной эталон для удобства визуального сравнения может быть расположен около окна для просмотра результатов.
Настоящее устройство может быть изготовлено из различных материалов. Подложки, которые являются носителями зоны контакта с образцом и реакционной зоны, могут быть сделаны из полужестких материалов, например, бумажного или картонного сырья легкого или среднего веса, KIMDURA™ (пластиковой бумаги), пластиковой пленки (например, полиэтилена, полипропилена, нейлона, сложного полиэфира, полибутилена, полилактона или полистирола) или нитрильного или каучукового латекса. Другие материалы могут включать нетканый материал из полипропилена или полиэтилена, например, спанбонд (SB), мельтблаун (MB), спанбонд-мельтблаун-спанбонд (SMS) или ламинированный материал с пленкой из спанбонда (SFL). Органические материалы подложки могут включать хлопковые или шелковые волокна, древесину или нитроцеллюлозу. Неорганические материалы подложки могут включать стекло или керамику и металлическую фольгу или листы. Подложка может частично включать ламинированные материалы или сочетания из двух или более видов материалов, упомянутых выше. Окно для просмотра результатов может быть или открытым, или иметь прозрачную пластиковую пленку.
Впитывающая подушечка 20 может быть выполнена из пористой мембраны 28 из гидрофильного материала. Пористая мембрана, например, может быть образована из материалов синтетического или природного происхождения, таких как полисахариды (например, целлюлозные материалы, такие как бумага и производные целлюлозы, такие как ацетат целлюлозы и нитроцеллюлоза); простой полиэфирсульфон; полиэтилен; нейлон; поливинилиденфторид (ПВДФ); сложный полиэфир; полипропилен; диоксид кремния; неорганические материалы, такие как дезактивированный оксид алюминия, стекло, кизельгур, сульфат магния (MgSO4) или другие неорганические мелкодисперсные материалы, равномерно распределенные в пористой полимерной матрице в сочетании с полимерами, такими как винилхлорид, сополимер винилхлорида и пропилена и сополимер винилхлорида и винилацетата; ткань, как натурального происхождения (например, хлопок), так и синтетическая (например, нейлон или вискоза); пористые гели, такие как силикагель, агароза, декстран и желатин; полимерные пленки, такие как полиакриламид, и так далее. В отдельном варианте исполнения изобретения пористая мембрана изготавливается из нитроцеллюлозы и/или материалов из простого полиэфирсульфона. Следует понимать, что термин "нитроцеллюлоза" относится к сложным азотнокислым эфирам целлюлозы, которые могут представлять собой исключительно нитроцеллюлозу или смешанный сложный эфир азотной кислоты и других кислот, таких как алифатические карбоновые кислоты, содержащие от 1 до 7 атомов углерода.
Поры мембраны могут иметь средний размер от около 1 микрона до около 50 микрон, в некоторых вариантах исполнения от около 5 микрон до около 30 микрон, а в некоторых вариантах исполнения от около 5 микрон до около 15 микрон. Размер и форма пористой мембраны могут также различаться, что полностью признается специалистами. Например, полоса пористой мембраны может иметь длину от около 10 до около 100 миллиметров, в некоторых вариантах исполнения от около 20 до около 80 миллиметров, а в некоторых вариантах исполнения от около 40 до около 60 миллиметров. Ширина мембранной полосы может также изменяться в пределах от около 0,5 до около 20 миллиметров, в некоторых вариантах исполнения от около 1 до около 15 миллиметров, а в некоторых вариантах исполнения от около 2 до около 10 миллиметров. Аналогичным образом, толщина полосы мембраны, как правило, достаточно мала, чтобы сделать возможным обнаружение, основанное на пропускании. Например, полоса мембраны может иметь толщину менее около 500 микрометров, в некоторых вариантах исполнения менее около 250 микрометров, а в некоторых вариантах исполнения менее около 150 микрометров.
Поддерживающая подложка 11 может быть размещена в непосредственном прилегании к пористой мембране, как показано на Фиг.1, или между пористой мембраной 20 и поддерживающей подложкой 11 могут быть расположены один или более промежуточных слоев. При желании подложка 11 может быть изготовлена из пропускающего свет материала, такого как прозрачные или оптически рассеивающие (например, полупрозрачные) материалы. Также, как правило, желательно, чтобы подложка 11 являлась непроницаемой для жидкостей, так чтобы жидкость, протекающая через мембрану, не просачивалась через подложку 11. Примеры подходящих материалов для подложки включают, однако, без ограничения только ими:
стекло; полимерные материалы, такие как полистирол, полипропилен, сложный полиэфир (например, пленка Mylar®), полибутадиен, поливинилхлорид, полиамид, поликарбонат, эпоксиды, метакрилаты и полимеламин; и так далее. Чтобы обеспечить достаточную конструкционную поддержку для пористой мембраны, подложку 11, как правило, выбирают, чтобы иметь определенную минимальную толщину. Точно также, толщина подложки 11, как правило, не настолько велика, чтобы отрицательно влиять на ее оптические свойства. Таким образом, например, подложка 11 может иметь толщину, которая колеблется от приблизительно 100 до приблизительно 5000 микрометров, в некоторых вариантах исполнения от приблизительно 150 до приблизительно 2000 микрометров, а в некоторых вариантах исполнения от приблизительно 250 до приблизительно 1000 микрометров. Например, может быть доступна такая подходящая полоса мембраны, имеющая толщину около 125 микрометров, производства фирмы Millipore Corp., Бедфорд, Массачусетс под наименованием "SHF180UB25".
Как известно из уровня техники, пористая мембрана может быть установлена на подложке 11, где получающийся ламинат можно высечь штампом до желаемого размера и формы. Как вариант, пористая мембрана может быть просто нанесена ламинированием на подложку 11, например, с помощью клея. В некоторых вариантах исполнения нитроцеллюлозная или нейлоновая пористая мембрана приклеивается к пленке Mylar®. Клей, который используется для присоединения пористой мембраны к пленке Mylar®, такой же как клей, затвердевающий под давлением. Ламинатные структуры этого типа, как считается, являются коммерчески доступными от фирмы Millipore Corp., Бедфорд, Массачусетс. Кроме того, другие примеры подходящих структур ламинированных устройств описаны в патенте США US 5,075,077 согласно Durley, III и др., который включен здесь в его полном объеме посредством ссылки на него по всем важным параметрам.
Раздел II. - Краситель
Краситель или индикаторное окрашивающее вещество используется в настоящем устройстве. Краситель или окрашивающее вещество могут обеспечить широкий спектр срабатывания на бактерии или другие микроорганизмы, который отличается от его реакции на вирусы. Считается, что сольватохромный краситель в зоне окрашивающего индикатора является чувствительным к определенным кислотным остаткам на поверхностях бактериальной клетки и изменяет цвет, когда положительный испытательный образец вступает в контакт с сольватохромным красителем. Например, эффективная диагностика на основе сольватохромного красителя может включать краситель Рейхардта для различения бактериальной и вирусной фарингеальных инфекций.
Сольватохромные индикаторы являются особенно эффективными в подверженности явному изменению цвета в присутствии широкого спектра бактерий или других микроорганизмов, однако очень ограниченно, если вообще изменяются, в присутствии вирусов, связанных с заболеваниями верхних дыхательных путей. Примером разновидности сольватохромного индикатора, который может быть использован в настоящем изобретении, являются мероцианиновые индикаторы (например, моно-, ди- и три-мероцианины). Мероцианиновые индикаторы, такие как мероцианин 540, подпадают под классификацию индикаторов донор - простой акцептор по Гриффитсу, как обсуждалось в публикации «Colour and Constitution of Organic Molecules» Academic Press, London (1976). Точнее говоря, мероцианиновые индикаторы имеют основные ядра и кислотные ядра, разделенные посредством цепи сопряжения, обладающей четным числом метиновых атомов углерода. Такие индикаторы содержат карбонильную группу, которая действует в качестве электроноакцепторной составляющей. Акцептор электронов сопряжен с электронодонорной группой, такой как гидроксильная или аминогруппа. Мероцианиновые индикаторы могут быть циклическими или ациклическими (например, винилоговые амиды циклических мероцианиновых индикаторов). Например, циклические мероцианиновые индикаторы обычно имеют следующую структуру:

в которой n является любым целым числом, включая 0. Как показано выше посредством общих структур 1 и 1', мероцианиновые индикаторы, как правило, имеют резонансную форму с разделением заряда (то есть, "цвиттер-ионную"). Цвиттер-ионными индикаторами являются такие, которые содержат оба, как положительный, так и отрицательный заряды, и в сумме являются нейтральными, но высокозарядными. Не намереваясь ограничиваться теорией, полагают, что цвиттер-ионная форма вносит существенный вклад в основное состояние индикатора. Окрашивание, создаваемое такими индикаторами, таким образом, зависит от молекулярной разницы полярности между основным и возбужденным состоянием индикатора. Такой отдельный пример мероцианинового индикатора, который обладает основным состоянием более полярным, чем возбужденное состояние, приводится ниже в качестве структуры 2.

Приведенная слева каноническая форма 2 с разделенным зарядом является главной составляющей основного состояния, тогда как приведенная справа каноническая форма 2' является главной составляющей первого возбужденного состояния. Кроме того, другие примеры подходящих мероцианиновых индикаторов приведены ниже в следующих структурах 3-13.









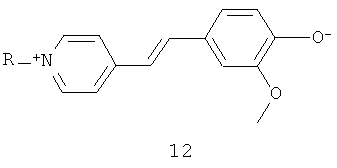
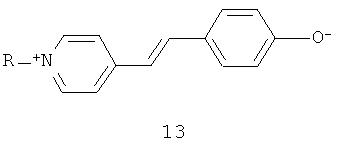
В которых "R" представляет собой группу, такую как метил-, алкил-, арил-, фенил- и т.д.
Индиго является еще одним примером подходящего сольватохромного индикатора для использования в рассматриваемой статье. Индиго имеет основное состояние, которое значительно менее полярно, чем возбужденное состояние. Например, индиго обычно имеет следующую структуру 14:

Находящаяся слева каноническая форма 14 является главной составляющей основного состояния индикатора, тогда как приведенная справа каноническая форма 14' является главной составляющей возбужденного состояния.
Другие подходящие сольватохромные индикаторы, которые могут быть использованы в устройстве обнаружения, включают такие, которые обладают постоянной цвиттер-ионной формой. А именно, эти индикаторы имеют формальный положительный и отрицательный заряды, содержащиеся внутри непрерывной тт-электронной системы. В отличие от мероцианиновых индикаторов, упоминаемых выше, нейтральную резонансную структуру нельзя нарисовать для подобных постоянных цвиттер-ионных индикаторов. Типичные индикаторы этого класса включают N-фенолятные бетаиновые индикаторы, как например, такие, что имеют следующую общую структуру:

в которой R1-R5 независимо друг от друга являются выбранными из группы, состоящей из водорода, нитрогруппы (например, азота), галогена или линейных, разветвленных или циклических групп, содержащих от 1 до 20 атомов углерода (например, алкила, фенила, арила, пиридинила и т.д.), которые могут быть насыщенными или ненасыщенными, а также незамещенными или, при необходимости, у одного и того же или у разных атомов углерода быть замещенными одним, двумя или более галогенами, нитро-, циано-, гидрокси-, алкокси-, амино-, фенил-, арил-, пиридинил- или алкиламиногруппами. Например, N-фенолятным бетаиновым индикатором может являться 4-(2,4,6-трифенилпиридиний-1-ил)-2,6-дифенилфенолят (краситель Рейхардта), имеющий следующую общую структуру 15:
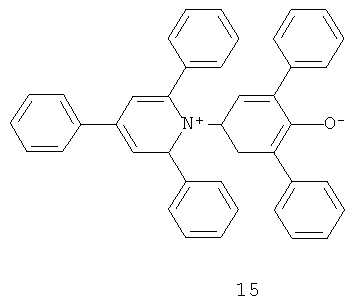
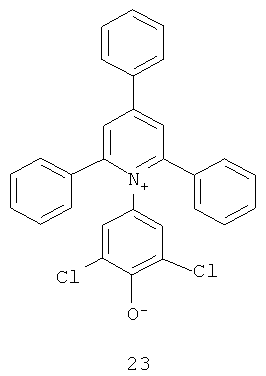
Краситель Рейхардта демонстрирует сильную отрицательную сольватохромию и таким образом может претерпевать значительное изменение цвета от синего до бесцветного в присутствии бактерий. Другими словами, краситель Рейхардта отображает сдвиг в поглощении света в сторону более короткой длины волны и, следовательно, обладает видимым изменением цвета по мере возрастания растворяющей силы элюента (полярности). Другие примеры подходящих отрицательно сольватохромных пиридиниевых N-фенолятных бетаиновых индикаторов приведены ниже в структурах 16-23:

где R представляет собой атом водорода, -С(СН3)3, -СF3 или C6F13



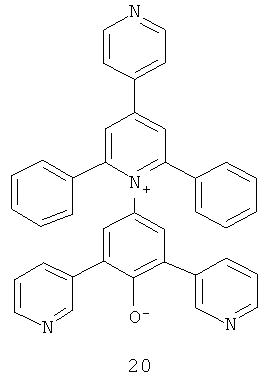


Дополнительные примеры индикаторов, имеющих постоянную цвиттер-ионную форму, включают индикаторы, имеющие следующую общую структуру 24:

где n равно 0 или больше, а Х является кислородом, углеродом, азотом, серой и т.д. Отдельные примеры постоянных цвиттер-ионных индикаторов, показанные в структуре 24, включают следующие структуры 25-33.








Другие подходящие сольватохромные индикаторы могут включать, однако, не ограничиваясь только ими: 4-дицианметилен-2-метил-6-(п-диметиламиностирил)-4Н-пиран (DCM); 6-пропионил-2-(диметиламино)нафталин (PRODAN); 9-(диэтиламино)-5Н-бензо[а]феноксазин-5-он (Нильский красный); 4-(дициановинил)джулолидин (DCVJ); феноловый синий, стибазолиевые индикаторы; кумариновые индикаторы; кетоцианиновые индикаторы, N,N-диметил-4-нитроанилин (NDMNA) и N-метил-2-нитроанилин (NM2NA); Нильский синий; 1-анилинонафталин-3-сульфокислоту (1,8-ANS), a также дапоксилбутилсульфонамид (DBS) и другие аналоги на основе Dapoxyl®. Помимо вышеупомянутых индикаторов, другие подходящие индикаторы, которые могут быть использованы в настоящем изобретении, включают, однако, не ограничиваясь только ими: 4-[2-N-замещенные-1,4-гидропиридин-4-илидин)этилиден]циклогекса-2,5-диен-1-он, красные пиразолоновые индикаторы, азометиновые индикаторы, индоанилиновые индикаторы, а также их смеси.
Основным материалом реакционной панели является мембранный фильтр ANODISC™ (фирмы Whatman® Inc, Флорхэм Парк, Нью-Джерси). Материалом впитывающей подушечки является мембрана Hi-Flow™ Plus HF120, поставляемая фирмой Millipore (Биллерика, Массачусетс). Краситель Рейхардта производится фирмой Tyger Scientific, Inc (Юинг, Нью-Джерси).
В других итерациях настоящего изобретения мы предусматриваем в том числе устройство контроля, такое как жирная или сухая кислота, нанесенная полосами на абсорбирующую мембрану или конкретное устройство бактериального контроля, нанесенное полосами на мембрану перед реакционной зоной. Образец может быть нанесен тампоном в виде полосы, а сопутствующая жидкость может высвободить кислоту или микроб для реакции с сольватохромным красителем (например, красителем Рейхардта).
Преимуществом данного средства диагностики является сравнительно быстрое время реакции и диагностическая четкость сигнала изменения цвета. Изменение цвета обычно происходит в течение приблизительно 30 минут контактирования испытательного образца с сольватохромным красителем в зоне реакции красителя. Как правило, реакция происходит в интервале примерно 20-25 минут, в идеале за промежуток менее чем 10-15 минут, и наиболее желательно в течение промежутка приблизительно 5-10 минут. В некоторых вариантах исполнения изобретения время реакции может быть таким непродолжительным, как 1-3 минуты. Время реакции может быть соотнесено с относительной тяжестью или степенью поражения бактериальной инфекцией. Изменение цвета может варьироваться по времени проявления в зависимости от концентрации бактерий (в КОЕ/мл) в испытательном образце. Если сольватохромный краситель не претерпевает изменения цвета после приблизительно 10 минут прохождения реакции, то это указывает на отсутствие бактериального патогена в испытательном образце.
Определение конечного результата может осуществляться визуально невооруженным глазом или с помощью электронного или цифрового считывающего устройства, сканера, веб-камеры или других оптических систем визуализации, которые доступны в настоящее время. Помимо невооруженного глаза, относительная интенсивность и пределы изменения цвета сольватохромного красителя могут быть лучше или более точно отслежены с использованием оптического считывающего устройства. Кроме того, результаты могут быть интерпретированы или с помощью изменения цвета на мембране, или с помощью вспомогательного индикатора, такого как световой сигнал жидкокристаллического индикатора, который включается из-за изменений в электрохимии красителя, вызванной контактом с микробом. Результаты могут быть интерпретированы с помощью сравнительной разницы в степени изменения при обесцвечивании красителя. Интерпретация результатов также может осуществляться путем присвоения знака "+" положительному тесту по сравнению со знаком "-" в качестве настройки по умолчанию.
-В.-
Раздел III. - Эмпирические примеры
Лабораторное испытание показало, что сольватохромные красители, такие как краситель Рейхардта, являются перспективным средством для обнаружения широкого ряда бактерий, также как и для проведения различия между бактериальными инфекциями и вирусными инфекциями. При использовании красителя Рейхардта в качестве индикаторного красителя он изменяет цвет от однородного темно-бирюзового/синего до бесцветного в присутствии бактерий, но не вирусов (или, что отчетливо заметно, для вирусов в значительно меньшей степени).
Специфическая конструкция данного диагностического устройства не требует, чтобы пациент или врач соприкасались с индикаторным красителем. Скорее, желательно, чтобы испытательный образец наносился или соприкасался с впитывающей подушечкой с помощью изолированного тампона. Например, стерильный тампон можно приложить к глотке пациента и миндалинам (при их наличии), чтобы получить образец таким же образом, как сбор анализов для культуры. Содержащий образец тампон затем соприкасается с зоной испытательного образца, таким образом, избегая любого непосредственного контакта реакционной панели с пациентом или медицинским специалистом.
Как вариант, образец может быть нанесен на устройство с помощью тампона или какого-либо прямого метода отбора проб, таких как слюна, кровь, слезы и т.д. Сам тампон также может быть использован для размещения в устройстве, так, чтобы изменение цвета могло бы происходить на части тампона, когда жидкость просачивается через верхушку. Тампон или устройство отбора проб могут также содержать любое количество известных микрожидкостных компонентов для направления и концентрирования любого образца. Блок растворителя также может быть использован, чтобы добавлять жидкость для целей капиллярного течения.
Следующие примеры иллюстрируют эффективность данного устройства обнаружения для проведения различия между бактериальными и вирусными патогенами.
1. Первоначальное проведение испытаний индикаторного красителя в присутствии S. aureus, P. aeruginosa и Е. соli.
Раствор красителя Рейхардта (0.5 г красителя в 20 г ацетонитрила) был приготовлен и помещен на специальную абсорбирующую подложку и высушен на воздухе. Покрытые красителем Рейхардта пластины исследовали на изменение цвета, видимое глазом, с использованием следующих микроорганизмов, перечисленных в Фармакопее США USP (United States Pharmacopoeia) XXIV в качестве умеренных патогенных микроорганизмов: золотистого стафилококка S. aureus (АТСС #6538), кишечной палочки Е. coli (АТСС #8739) и синегнойной палочки Р. aeruginosa (АТСС #9027). Лиофилизированные культуры вышеперечисленных организмов начали выращивать в 5 мл пробирках стерильного триптиказо-соевого бульона (TSB), являющегося коммерчески доступным производства фирмы Becton Dickinson (BBL) Labs. Для поддержания исходных культур при одной и той же концентрации бактериальных клеток из дня в день одну (1) каплю (приблизительно 0,1 мл) в стерильных условиях переносили из каждой стоковой культуры в пробирку со стерильным бульоном TSB объемом 5 мл с использованием стерильной пипетки для переноса. Прежде чем какая-либо из культур была использована для проведения испытаний на чувствительность, для каждого организма было сделано пять (5) переносов культуры.
Исходя из концентраций исходной культуры от 109 до 108 КОЕ (колониеобразующих единиц)/мл, были проведены последовательные разведения 1:10 с использованием 9 мл объемов стерильной деионизированной воды. В зависимости от желаемой концентрации обычно производились следующие разведения: 107, 106, 105, 104 и 103 КОЕ/мл. Определение количества жизнеспособных бактерий посевом было выполнено на всех исходных культурах перед началом проведения испытаний на чувствительность. Эти подсчеты вместе с произведенными последовательными разбавлениями были использованы для вычисления фактической концентрации бактерий для проводимого испытания.
Специальные абсорбирующие подложки, покрытые красителем Рейхардта, были подвергнуты испытаниям путем поглощения 100 мкл аликвоты жидкости, содержащей наивысшую концентрацию бактерий. В области, смоченной бактериями, краситель стал бесцветным, показывая наличие бактерий. Аналогичное по размеру пятно жидкости среды, которая не содержала бактерий, не изменило цвет. Эксперимент продолжался с менее концентрированными аликвотами бактерий до тех пор, пока пятно не перестало демонстрировать видимого изменения. Оказалось, что нижний предел индикации для грамотрицательных бактерий составляет 1000 КОЕ/мл, а для грамположительных бактерий уже 100 КОЕ/мл.
2. Проведение испытаний в присутствии бактерий Salmonella
Аналогичным образом, покрытые красителем Рейхардта специальные абсорбирующие подложки подвергали испытаниям с жидкостью, содержащей бактерии Salmonella. В условиях, предоставленных фирмой Gibraltar Labs (Фэрфилд, Нью-Джерси), помещали аликвоты растворов объемом 100 мкл на абсорбирующую подложку. Влажные пятна становились белыми, указывая, что Salmonella обесцветила краситель. Следовательно, краситель является чувствительным к Salmonella. Питательная среда в чистом виде или вода также были помещены на салфетку и существенно не обесцветили покрытие.
3. Проведение испытаний в присутствии дополнительных микроорганизмов
Во время процесса испытаний мы обнаружили, что раствор красителя Рейхардта может быть использован для полуколичественной оценки концентрации микробов. Для того чтобы осуществить это, каплю раствора с требуемым микробом можно поместить на специальную абсорбирующую подложку. Затем можно добавлять по каплям раствор красителя Рейхардта к этому пятну до тех пор, пока синий цвет сохраняется, вместо того, чтобы происходило быстрое обесцвечивание. 107 КОЕ/мл S. aureus, С.albicans, гарднереллы G. vaginalis, Е. Соli, Р. aeruginosa и L. acidophilus были нанесены из пипетки на специальную абсорбирующую подложку (100 мкл каждого). Дополнительно 107 КОЕ/мл грибов A. niger также было нанесено из пипетки на абсорбирующую подложку. Затем к каждому пятну был добавлен в 10 мкл аликвотах краситель Рейхардта (160 мг в 10 г ацетонитрила), а количество капель, необходимое для установления постоянного цвета, было подсчитано.
Количество красителя, необходимое для поддержания постоянного пурпурного цвета для каждого организма, приведено в Таблице 1. Самая сильная реакция наблюдалась в случае L. acidophilus, за ним следуют S. aureus, G. vaginalis, E. соli', Р. aeruginosa, С.albicans, и, наконец, A. niger. Результаты предполагали, что организмы различаются по своей способности к обесцвечиванию красителя, причем, некоторые вызывают более быструю/более интенсивную реакцию, чем другие.
Испытание также было проведено со спорами бактерий, таких как Anthracis bacillus. Данные этих испытаний предполагают, что краситель Рейхардта (как было испытано) не был достаточно чувствительным к спорам бактерий. Испытание с помощью вегетативного организма, однако, показало, что обесцвечивание имело место, демонстрируя, что краситель был нечувствителен к оболочке споры, а не к конкретному организму. Таким образом, при попытке обнаружить бактериальные споры, для начала может быть необходимо предварительно обработать образец химически так, чтобы удалить оболочку споры.
4. Быстрый количественный анализ бактерий с помощью обработанной индикатором поверхности
Бумага марки Neenah была покрыта раствором красителя Рейхардта (80 мг/10 г ацетонитрила) и подвешена для просушки. Для построения калибровочной кривой были использованы аликвоты (100 мкл) S. aureus. Для генерации числовой калибровочной кривой путем построения графика зависимости полного цифрового различия дельта Е (рассчитывается с использованием значений L*, А*, и В*, полученных на спектрофотометре с помощью метода CIELAB) от величины логарифма концентраций log КОЕ/мл был использован переносной спектрофотометр.
Оптические измерения (значения дельта Е), сгенерированные из калибровочной кривой, были использованы для создания графика, показанного на Фиг.4. "1" (по оси у) представляет собой "едва заметное" изменение цвета. Результаты подтверждают, что изменения цвета, ранее наблюдаемые визуально, действительно, при использовании спектрофотометра могут быть обнаружены и отличаться друг от друга. Кроме того, результаты показывают, что восприимчивость красителя к бактериям S. aureus зависит от дозы и, похоже, снижается по мере того, как уменьшается концентрация бактерий.
5. Проведение испытаний в присутствии дополнительных растворителей
Реакция обесцвечивания, наблюдаемая с красителем Рейхардта, была тщательно исследована, и было обнаружено, что она происходит в случаях, когда краситель растворен в различных растворителях, таких как изопропанол, ацетонитрил, этанол, диметилформамид, октанол и метанол. Также было обнаружено, что краситель может быть растворен в различных детергентах, таких как Tween®, и по-прежнему сохранять свою реакционную способность, особенно, если к тому же используется несущий растворитель, такой как изопропанол.
6. Проведение испытаний в присутствии компонентов бактериальной клеточной стенки
Понимание того, как работает эта индикаторная технология, было получено с помощью использования молекул, обычно встречающихся в клеточных стенках бактерий. Несмотря на то что существует некоторая общность у соединений, которые содержат поверхности грамположительных и грамотрицательных бактерий, их структура и химический состав отличаются друг от друга. Грамотрицательные бактерии имеют наружную мембрану, покрытую липополисахаридом (ЛПС). ЛПС придает общий отрицательный заряд поверхности грамотрицательных бактерий и способствует их патогенезу. Грамположительные бактерии покрыты толстым пластинчатым слоем пептидогликана, или муреина. Пластины формируются из чередующихся молекул N-ацетилглюкозамина и N-ацетилмурамовой кислоты. Тейхоевые кислоты также находятся в грамположительных бактериях и могут быть связаны с N-ацетилмурамовой кислотой. Несмотря на то что Грамотрицательные бактерии также содержат пептидогликан, слой на грамположительных бактериях значительно толще.
Растворы полученного из Е. соli нейтрализованного липополисахарида (компонент липид А удален), липотейхоевой кислоты, полученной из фекального стрептококка Streptococcus faecalis, полученного из Е. соli липополисахарида и мурамовой кислоты (фирмы Sigma-Aldrich, Сент-Луис, Миссури) были помещены на покрытую красителем специальную абсорбирующую подложку. За исключением чистого ЛПС, все растворы были приготовлены в 5% (масс./масс.), 1% (масс./масс.) и 0,2% (масс./масс.) концентрациях. Чистый ЛПС был приготовлен в концентрациях 0,1% (масс./масс.), 0,02% (масс./масс.), и 0,004% (масс./масс.) по соображениям безопасности.
В качестве дополнительного эксперимента, растворы полученного из Е. соli нейтрализованного липополисахарида (компонент липид А удален), липотейхоевой кислоты, полученной из фекального стрептококка Streptococcus faecalis, полученного из Е. соli липополисахарида и мурамовой кислоты были помещены на специальную абсорбирующую подложку. За исключением чистого ЛПС, все растворы были приготовлены в 5% (масс./масс.), 1% (масс./масс.) и 0,2% (масс./масс.) концентрациях. Чистый ЛПС был приготовлен в концентрациях 0,1% (масс./масс.), 0,02% (масс./масс.), и 0,004% (масс./масс.) по соображениям безопасности. Краситель Рейхардта (160 мг в 10 г ацетонитрила) был добавлен в виде 10 мкл аликвот к каждому пятну, а количество красителя, необходимое для получения постоянного цвета, было зафиксировано.
Мурамовая кислота проявляла самую сильную реакцию, приводящую к почти мгновенному обесцвечиванию красителя в обеих экспериментальных системах. Другие соединения также вызвали окончательное обесцвечивание красителя, но, оказалось, что не реагировали так сильно, как мурамовая кислота. Так как мурамовая кислота содержится в грамположительных бактериях в более значительных концентрациях, то эти результаты демонстрируют потенциал этого красителя к тому, чтобы не только давать данные по КОЕ/мл, но также чтобы проводить различие между грамположительными и грамотрицательными бактериями, основываясь на интенсивности и скорости реакции. Результаты титриметрического эксперимента приведены на Фиг.5.
7. Проведение испытаний в присутствии автоклавированных бактерий
Для того чтобы подтвердить, что бактериальная клеточная стенка играет решающую роль в этой реакции, флакон с S. aureus (106 КОЕ/мл) перед испытанием с индикаторным аэрозолем (160 мг красителя Рейхардта в 10 г изопропанола) обработали в автоклаве. Автоклавирование убивает бактерии, главным образом, путем разрывания клеточной стенки на части. Пар из автоклава проникает в бактерии и разрывает мембрану. Когда раствор обработанного в автоклаве S. aureus был нанесен из пипетки на поверхность и опрыскан индикаторным аэрозолем с красителем Рейхардта (160 мг в 10 г изопропанола), обесцвечивания не наблюдалось. Эти данные предполагают, что для обесцвечивания красителя Рейхардта бактериями может быть необходима неповрежденная клеточная стенка.
8. Проведение испытаний в присутствии протопластов
Дополнительное испытание для проверки реакции с клеточной стенкой было выполнено посредством создания протопластов путем ферментативного расщепления бактериальной клеточной стенки. Схематически, 1 мл S. aureus (108 КОЕ/мл) вводили в реакцию с 9 мл 200 мкг/мл лизоцима яичного белка (фирмы Sigma-Aldrich, Сент-Луис, Миссури), суспендированного в ТМ-буфере (0,05 М Трис-HCI, рН 7,4, 20 мМ MgCl2) с 15% (масс./об.) сахарозы (фирмы Sigma-Aldrich, Сент-Луис, Миссури). Реакцию проводили в течение одного часа при 30°С, после чего раствор центрифугировали при 10000×g и дважды промывали ТМ-буфером, содержащим 13% (масс./об.) сахарозы, согласно методикам, описанным в публикации Taku and Fun (The Journal of Biological Chemistry, 1979).
Раствор, содержащий протопласты, вступал в реакцию (аликвота 100 мкл) на наклейке производства фирмы «Avery», покрытой красителем Рейхардта (80 мг 10 г ацетонитрила). Необработанные бактерии разводили десятикратно в буфере ТМ /13% сахарозы (без лизоцима) и помещали на наклейку в качестве положительного контроля. Примерно через 5 минут бактериальные растворы отсосали с поверхности, обнаружив обесцвечивание на необработанных бактериях для положительного контроля, но минимальное обесцвечивание на растворе, который, как предполагалось, содержит протопласты.
Чтобы подтвердить, что протопласты действительно были созданы, на образце было проведено окрашивание по Граму. Окрашивание по Граму показало абсорбцию красителя кристаллический фиолетовый контрольным образцом S. aureus, в то время как образец, содержащий протопласт, не проявил поглощения красителя. Это означает, что клеточная стенка была эффективно удалена, так как грам положительные организмы, такие как S. aureus, должны обнаруживать окрашивание клеточной стенки в качестве части процедуры окрашивания по Граму.
Чтобы подтвердить, что предполагаемые протопласты были действительно жизнеспособными организмами и не были безвозвратно повреждены во время экспериментального процесса, аликвоты раствора протопластов, а также положительного контроля (в ТМ / 13% сахарозы) были посеяны, и на следующий день было подсчитано количество клеток. Количества для протопласта и контрольных растворов составили 7,9×108 КОЕ/мл и 5,9×108КОЕ/мл соответственно, указывая на то, что протопласты были жизнеспособными, и что количества клеток не снизились во время экспериментальной процедуры.
Таким образом, экспериментальные данные из реакции с протопластами предполагают, что наличие клеточной стенки является критически важным для обесцвечивания красителя Рейхардта под действием бактерий. Поэтому процессы или условия, которые повреждают клеточную стенку, могут уменьшить чувствительность красителя Рейхардта к бактериям.
9. Проведение испытаний в присутствии патогенов, связанных с верхними дыхательными путями
В некоторых примерах использования образцов, обработанных красителем Рейхардта, эти образцы подвергали реакции с 100 микролитрами каждой из следующих бактерий: гемофильной палочки Haemophilus influenzae (ATCC # 49247) (Н. influenzae), палочки Моракса-Аксенфельда Moraxella lacunata (ATCC # 17972) (М. lacunata), стрептококков группы A Streptococcus pyogenes (ATCC # 10782) (S. pyogenes), пневмококков Streptococcus pneumoniae (ATCC # 10015) (S. pneumoniae). Также были испытаны следующие виды вирусов: риновирус типа 42 (получен 5/13/82 от фирмы Hoffman La Roche), вирус гриппа А (ATCC # VR-544), аденовирус типа 2 (ATCC # VR-846), аденовирус типа 5 (ATCC # VR-5).
Исследования показали, что обработанные красителем образцы обесцвечивались этими патогенными организмами, особенно S. pyogenes и S. pneumonia. В предыдущих экспериментах было замечено, что грамположительные бактерии вызывают более сильный обесцвечивающий отклик, чем другие виды микроорганизмов.
Испытание с помощью риновируса, вируса гриппа и аденовируса показало заметно меньшее обесцвечивание красителя, чем то, которое наблюдалось в случае контроля с бактериями Salmonella при аналогичной концентрации. Сравнение с контролем среды также показало, что наблюдаемое обесцвечивание минимально. Аденовирус, в частности, показал почти полное отсутствие способности к обесцвечиванию красителя.
В другом примере некоторые из данных устройств для анализа испытывались с S. pyogenes, S. pneumonia, метициллин-резистентным золотистым стафилококком (MRSA), риновирусом и аденовирусом 2. Все бактерии были приготовлены в триптиказо-соевом бульоне (TSB) до концентрации 107КОЕ/мл, тогда как вирусы были приготовлены в среде Игла в модификации Дульбекко (DMEM) с 5% эмбриональной бычьей сывороткой (FBS) до значения TCID 50 приблизительно 10-6,5. Дополнительные растворы были приготовлены для каждого микроорганизма с 5% муцина (и 5% эмбриональной бычьей сыворотки (FBS) для бактериальных образцов). Тампон обмакивают в каждый из растворов и прикладывают к впитывающей подушечке устройства. Пробу закрывают и герметизируют подходящим клеем. Через 5 минут нами было обнаружено, что бактериальные образцы вызвали обесцвечивание мембраны, которое было легко видно невооруженным глазом, в то время как вирусные образцы его не вызвали.
Настоящее изобретение было описано в общих чертах и подробно пояснено на примерах. Считается, что технология, воплощенная в настоящем индикаторном тестовом устройстве, может предоставить эффективный, рентабельный и быстродействующий диагностический прибор, как в домашних условиях, так и в клинической обстановке, и в то же время представляющий незначительные сложности или опасность для пациента или врача. Специалисты понимают, что изобретение не ограничивается вариантами исполнения, в частности, показанными здесь, а что изменения и вариации могут быть сделаны без отклонения от рамок изобретения, как определено следующими пунктами формулы изобретения или их эквивалентами, включая другие эквивалентные компоненты, известные в настоящее время или разрабатываемые, которые могут быть использованы в рамках настоящего изобретения. Таким образом, в случае если изменения не отклоняются от рамок изобретения каким либо иным способом, то эти изменения должны быть истолкованы как включенные в данный документ.
Реферат
Группа изобретений относится к области медицины и может быть использована для обнаружения бактериальных патогенов в образце. Клиническое индикаторное устройство для обнаружения бактериальных патогенов содержит подложку, которую можно сложить, чтобы получить два находящихся друг напротив друга листа. На внутренней стороне первого листа подложки содержится зона контакта образца со впитывающей подушечкой, а на внутренней стороне второго листа напротив зоны контакта образца содержится индикаторная зона с сольватохромным красителем, изменяющим цвет при наличии бактериального патогена в исследуемом образце. Устройство также содержит окно для результатов на наружной поверхности второго листа, причем впитывающая подушечка соприкасается с реакционной зоной с красителем, когда первый лист складывается со вторым. Группа изобретений относится также к варианту указанного устройства, в котором первая и находящаяся напротив нее вторая подложки являются двумя листами или частями одной и той же первой подложки, согнутыми лицом друг к другу, и к способу использования указанного устройства для анализа бактериальной инфекции. Группа изобретений обеспечивает возможность простого и быстрого обнаружения бактерий в образце, а также позволяет различить бактериальные и вирусные патогены. 3 н. и 13 з.п. ф-лы, 6 ил., 1 табл., 9 пр.
Формула
причем впитывающая подушечка соприкасается с реакционной зоной с красителем, когда первый лист складывается со вторым листом, и
индикаторная зона с красителем содержит сольватохромный краситель, который изменяет цвет, когда положительный испытательный образец вступает в контакт с индикаторной зоной с сольватохромным красителем, причем изменение в цвете сольватохромного красителя означает наличие бактериального патогена.
a) предоставление испытательного устройства, имеющего подложку, включающую, по меньшей мере, первый и второй листы, расположенные друг напротив друга, причем каждый из первого и второго листов имеет внутреннюю и наружную поверхность, при этом первый лист имеет зону контакта образца, оснащенную впитывающей подушечкой, расположенной на внутренней поверхности первого листа, а второй лист имеет зону реакции с красителем, содержащую сольватохромный краситель, который изменяет цвет, когда положительный испытательный образец вступает в контакт с зоной реакции с красителем, которая расположена на внутренней поверхности второго листа напротив зоны контакта образца, причем изменение в цвете сольватохромного красителя означает наличие бактериального патогена, а также окно для результатов на наружной поверхности второго листа, где проявляется визуальная информация;
b) нанесение испытательного образца на зону контакта образца,
c) складывание первого листа со вторым листом таким образом, что впитывающая подушечка соприкасается с зоной реакции красителя; и
d) наблюдение за изменением цвета, проявляющимся в окне для результатов.
причем впитывающая подушечка и зона контакта образца являются частью, по меньшей мере первой подложки, а зона диагностирования и сольватохромный краситель расположены на находящейся напротив подложке, а окно для визуализации результатов выровнено вдоль зрительной оси с зоной контакта образца и зоной диагностирования,
при этом первая и находящаяся напротив нее подложки являются двумя листами или частями одной и той же первой подложки, согнутыми лицом друг к другу.
Документы, цитированные в отчёте о поиске
Устройство для хроматографического анализа для обнаружения и/или определения аналита в образце (варианты)

Комментарии