Гидрофильные полимерные частицы и способы их получения - RU2643034C2
Код документа: RU2643034C2
Чертежи
Описание
Область техники, к которой относится изобретение
Настоящее раскрытие, в целом, относится к гидрофильным полимерным частицам и относится к способам получения и применения таких гидрофильных полимерных частиц.
Уровень техники
Полимерные частицы все больше и больше применяют в качестве компонентов для методик разделения и для облегчения определения анолитов как в химических, так и биологических системах. Например, полимерные частицы применяют в хроматографических методиках для выделения целевых молекул из раствора. Согласно другому примеру, полимерные частицы, имеющие покрытие с магнитными свойствами, используют в методиках разделения в магнитном поле. В последнее время полимерные частицы применяют для повышения качества методик по типу ELISA, и их можно применять для захвата полинуклеотидов.
Тем не менее, такие методики разделения и аналитические методики обладают недостатками вследствие вариации размера частиц. Значительная вариация размера частиц приводит к вариации массы частиц, а также вариации числа реакционных центров, доступных для взаимодействия с целевыми анолитами. Для методик разделения в магнитном поле вариация размера может привести к понижению эффективности разделений. Для хроматографических методик и различных методик захвата полинуклеотидов вариация размера может привести к вариации числа центров, доступных для взаимодействия с полинуклеотидами, что приводит к вариации эффективности захвата или разделения.
В связи с этим, была бы необходима улучшенная полимерная частица и способ получения такой полимерной частицы.
Раскрытие изобретения
Согласно первому аспекту способ получения частицы предусматривает полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и преобразование полимерной частицы в частицу гидрогеля.
Согласно второму аспекту способ получения частицы предусматривает полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой акриламидный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и преобразование полимерной частицы в гидрофильную частицу.
Согласно третьему аспекту способ получения частицы предусматривает полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой способный к радикальной полимеризации мономер, с диакриламидным сшивателем, имеющим гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп. Способ дополнительно предусматривает удаление по меньшей мере части из множества гидрофобных защитных групп.
Согласно четвертому аспекту способ получения частицы предусматривает полимеризацию множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп; удаление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы с получением гидрофильной частицы; и связывание олигонуклеотида с гидрофильной частицей.
Согласно пятому аспекту множество частиц включает по меньшей мере 100000 частиц. По меньшей мере одна частица множества частиц включает гидрогель. Множество частиц имеет средний размер частицы, составляющий не более 100 микрометров, и коэффициент вариации, составляющий не более 5%.
Согласно шестому аспекту система включает матрицу с лунками. По меньшей мере одна лунка у матрицы с лунками функционально связана с ISFET-датчиком. Система дополнительно включает множество частиц гидрогеля, имеющих коэффициент вариации, составляющий не более 5%. По меньшей мере одна частица гидрогеля из множества частиц гидрогеля размещена в лунке матрицы с лунками.
Согласно седьмому аспекту множество частиц получают посредством способа, предусматривающего полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и предусматривающего преобразование полимерной частицы в частицу гидрогеля.
Согласно восьмому аспекту композиция включает водную смесь акриламидного мономера и сшивателя, причем акриламидный мономер включает гидрофобную защитную группу, а мономер и сшиватель включены в массовом соотношении мономер:сшиватель в диапазоне от 15:1 до 1:2.
Согласно девятому аспекту способ секвенирования полинуклеотида предусматривает обеспечение устройства, включающего матрицу с лунками. По меньшей мере одну лунку функционально связывают с ISFET, и она включает частицу, полученную посредством способа в соответствии с описанными выше аспектами. Частица присоединена к полинуклеотиду. Способ дополнительно предусматривает внесение раствора, включающего нуклеотиды предопределенного типа, в устройство и наблюдение за ионной реакцией на внесение раствора.
Согласно десятому аспекту способ нуклеотидного встраивания предусматривает обеспечение частицы, полученной посредством способа в соответствии с описанными выше аспектами. Частица присоединена к дуплексу нуклеиновой кислоты, включающему матричную нуклеиновую кислоту, гибридизированную с праймером. Дуплекс связан с полимеразой. Способ дополнительно предусматривает приведение частицы в контакт с одним или несколькими нуклеотидами и встраивание по меньшей мере одного нуклеотида на конце праймера при помощи полимеразы.
Согласно одиннадцатому аспекту способ получения частицы предусматривает промотирование затравочной частицы с получением дисперсной фазы в водной суспензии, полимеризацию в дисперсной фазе множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и преобразование полимерной частицы в частицу гидрогеля.
Согласно двенадцатому аспекту способ получения частицы предусматривает внесение затравочной частицы в водную суспензию, причем затравочная частица содержит гидрофобный полимер, и предусматривает промотирование затравочной частицы с образованием дисперсной фазы в водной суспензии. Способ дополнительно предусматривает полимеризацию в дисперсной фазе множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей гидрофильный полимер, имеющий множество гидрофобных защитных групп. Полимерная частица включает гидрофобный полимер. Способ также предусматривает отщепление множества гидрофобных защитных групп от гидрофильного полимера и экстракцию гидрофобного полимера из полимерной частицы с получением частицы гидрогеля.
Согласно тринадцатому аспекту частица включает полимер, полученный в результате полимеризации гидроксиалкилакриламида и диакриламида. Диакриламид включает гидроксильную группу. Частица абсорбирует по меньшей мере 300 мас.% воды по массе полимера при воздействии воды.
Краткое описание чертежей
Настоящее раскрытие можно понять лучше, а его многочисленные признаки и преимущества станут наглядными для специалистов в настоящей области техники посредством обращения к прилагаемым чертежам.
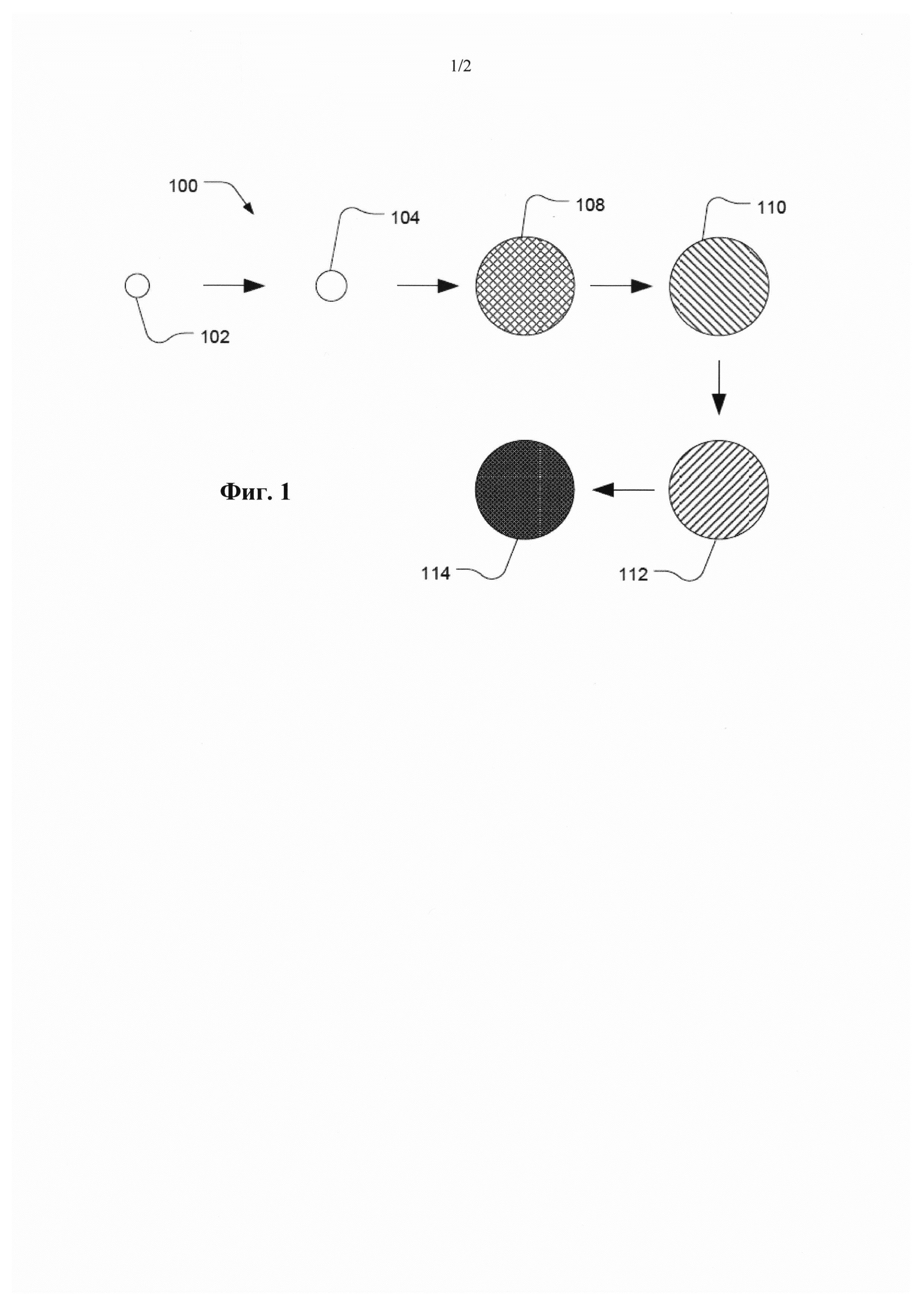
Фиг. 1 представляет собой изображение иллюстративной последовательности процессов для получения иллюстративной полимерной частицы.
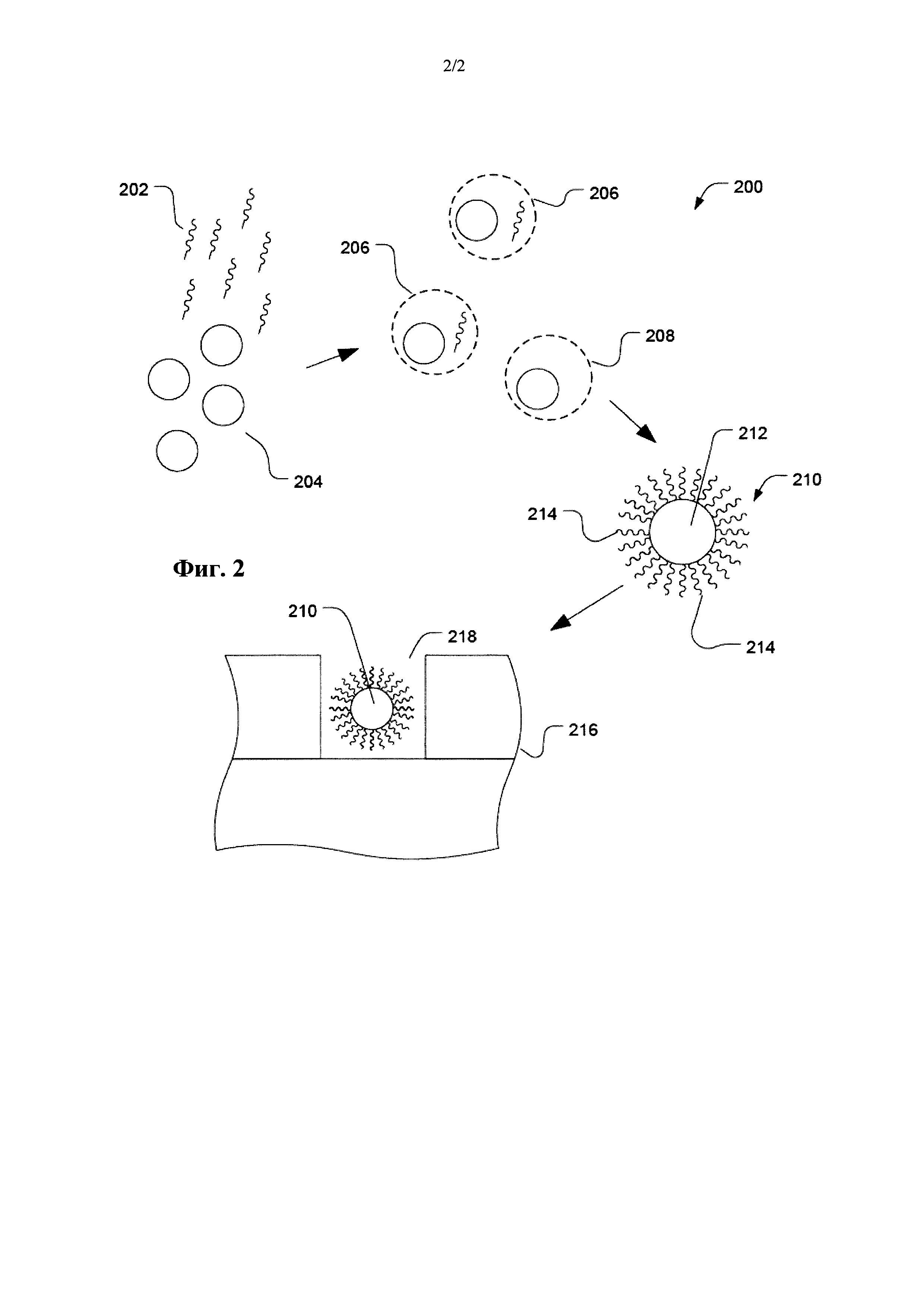
Фиг. 2 представляет собой изображение иллюстративного способа секвенирования с использованием полимерных частиц.
Применение одинаковых условных символов для различных чертежей указывает на одинаковые или идентичные элементы.
Осуществление изобретения
Согласно иллюстративному варианту осуществления способ получения полимерных частиц предусматривает полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой мономер, имеющий гидрофильные функциональные группы, защищенные при помощи гидрофобной защитной группы. В результате полимеризации получают полимерную частицу, включающую множество гидрофобных защитных групп. Способ дополнительно предусматривает преобразование полимерной частицы до гидрофильной частицы, такой как частица гидрогеля. Согласно примеру, мономер включает гидрофильный способный к радикальной полимеризации мономер, такой как гидрофильный виниловый мономер, в частности акриламид. Мономер представляет собой гидрофильный мономер, включающий гидрофильную функциональную группу, защищенную при помощи гидрофобной защитной группы. Например, гидрофобная защитная группа может включать силильную функциональную группу или ее производные. Полимеризация также может включать полимеризацию в присутствии сшивателя, такого как виниловый сшиватель, включая иллюстративные диакриламидные сшиватели. Сшиватели могут быть сшивателями с защитными группами, которые представляют собой гидрофобные защитные группы. Согласно примеру, преобразование полимерной частицы в гидрофильную частицу может включать удаление по меньшей мере части гидрофобных защитных групп у полимерной частицы. В частности, гидрофобная защитная группа может представлять собой отщепляемую кислотой защитную группу, а удаление гидрофобной защитной группы может включать отщепление кислотой гидрофобной защитной группы у полимерной частицы.
Иллюстративные полимерные частицы, получаемые посредством таких способов, могут иметь необходимый размер или коэффициент вариации. В частности, полимерные частицы могут быть гидрофильными. Например, полимерные частицы могут включать частицы гидрогеля. Кроме того, полимерные частицы могут иметь средний размер частицы, составляющий не более 100 мкм, к примеру, не более 30 мкм, не более 3 мкм или не более 2 мкм. Полимерные частицы могут иметь коэффициент вариации не более 15%, к примеру, не более 5%.
В частности, такие частицы могут быть пригодны для захвата целевых анолитов, таких как полинуклеотиды. Согласно примеру, полимерные частицы могут быть пригодны для секвенирования полинуклеотидов при помощи способов секвенирования, которые предусматривают детектирование света, или способов секвенирования, которые предусматривают детектирование ионов.
Согласно конкретному варианту осуществления дисперсную фазу получают в водной суспензии. Дисперсная фаза предпочтительно является гидрофобной. Согласно примеру, дисперсную фазу получают в результате промотирования затравочных частиц, таких как гидрофобные затравочные частицы, с образованием дисперсной фазы. Промотирование способствует абсорбции гидрофобных компонентов в затравочной частице.
Мономеры, имеющие удаляемые гидрофобные защитные группы, предпочтительно находятся в дисперсной фазе. В дисперсной фазе мономеры полимеризируются. Необязательно, в дисперсной фазе с мономерами полимеризируется сшиватель. Согласно примеру, в котором дисперсную фазу получают из затравочной частицы, такой как гидрофобная затравочная частица, ассоциированный с затравочной частицей полимер может быть удален. Например, полимер затравочной частицы можно растворить при помощи растворителей и можно экстрагировать из полимерной частицы.
Гидрофобные защитные группы можно удалить, к примеру, посредством отщепления по меньшей мере части гидрофобных защитных групп у полимерной частицы. В результате получают гидрофильную частицу, такую как частица гидрогеля.
Согласно примеру, полученную в результате гидрофильную частицу можно активировать для облегчения конъюгирования с целевым анолитом, таким как полинуклеотид. Например, в результате отщепления гидрофобных защитных групп на гидрофильной частице может остаться гидрофильная функциональная группа, к примеру, гидроксильные группы, аминогруппы, тиоловые группы или их комбинация. Согласно конкретному примеру, гидроксильные группы можно активировать посредством преобразования гидроксильных групп в сульфоэфирные группы или хлор. Функциональные сульфоэфирные группы или хлор можно заместить или заменить при помощи нуклеофильного замещения. В частности, олигонуклеотиды, имеющие нуклеофильную концевую группу, такую как аминогруппа или тиоловая группа, можно присоединить к гидрофильной частице посредством нуклеофильного замещения сульфонатной группы или хлора. Такие частицы могут быть особенно пригодны для захвата полинуклеотидов для применения в методиках секвенирования.
Согласно другому примеру, сульфированные частицы можно дополнительно подвергнуть реакции с моно- или мультинуклеофильными моно- или мультифункциональными реагентами, которые могут образовывать присоединение к частице, в то же время сохраняя нуклеофильную активность для олигонуклеотидов, содержащих электрофильные группы, такими как малеимид. В дополнение к этому, остаточную нуклеофильную активность можно преобразовать в электрофильную активность посредством присоединения к мультиэлектрофильным реагентам, которые после этого должны будут присоединяться к олигонуклеотидам, содержащим нуклеофильные группы.
Другие методики конъюгирования предусматривают применение мономеров, которые содержат гидрофобные защитные группы на карбоксильных группах, в ходе синтеза частиц. Удаление защитной группы с карбоксильной группы делает доступной карбоксильную группу, которая в дальнейшем может вступать в реакцию с олигонуклеотидами, имеющими нуклеофильную группу, такую как аминогруппу, или обеспечивает присоединение олигонуклеотида.
Другие методики конъюгирования включают применение мономеров, которые содержат гидрофобные защитные группы на аминогруппах, в ходе синтеза частиц. Удаление защитной группы с аминогруппы делает доступной нуклеофильную группу, которую дополнительно можно модифицировать при помощи вступающих в реакцию с аминами бифункциональных биэлектрофильных реагентов, которые образуют монофункциональную электрофильную группу после соединения с полимерной частицей. Такую электрофильную группу можно подвергнуть реакции с олигонуклеотидами, имеющими нуклеофильную группу, такую как аминогруппа или тиоловая группа, что приводит к присоединению олигонуклеотида в результате реакции со свободным электрофилом.
Проиллюстрированный на Фиг. 1 способ 100 предусматривает обеспечение наличия затравочной частицы 102. Мономеры добавляют в суспензию, и предпочтительно они находятся в дисперсной фазе 104, образованной от промотированной затравочной частицы. Мономер и необязательно сшиватель полимеризуют с получением полимерной частицы 108. Полимерную частицу 108 можно отделить от затравочного полимера с получением полимерной частицы 110. Гидрофобные защитные группы на полимерной частице 110 удаляют с получением гидрофильной частицы 112. Гидрофильную частицу 112 можно активировать с получением конъюгированной частицы 114.
Затравочная частица 102 может включать затравочный полимер. Согласно примеру, затравочный полимер является гидрофобным. В частности, затравочный полимер может включать стироловый полимер, акриловый полимер, акриламид, другой гидрофобный виниловый полимер или любую их комбинацию. Согласно примеру, затравочная частица 102 является монодисперсной, например, имеющей коэффициент вариации не более 20%. Коэффициент вариации (CV) определяют как 100 кратное стандартное среднеквадратическое отклонение, деленное на среднее, причем "среднее" представляет собой средний диаметр частицы, а стандартное отклонение представляет собой стандартное отклонение размера частицы. В соответствии с другим вариантом, "среднее" может представлять собой либо z-средний, либо модовый диаметр частицы. В соответствии с обычной практикой CV рассчитывают по основной моде, т.е. основному пику, таким образом исключая неосновные пики, относящиеся к агрегатам. Таким образом, некоторые частицы с более низким или превышающим моду размером можно исключить при расчете, который, например, может быть основан на приблизительно 90% от общего числа детектируемых частиц. Такое определение CV можно осуществить на дисковой центрифуге CPS. В частности, совокупность затравочных частиц 102 может иметь коэффициент вариации не более 10%, к примеру, не более 5,0%, не более 3,5%, не более 3%, не более 2,5%, не более 2% или даже не более 1,0%. Кроме того, затравочная частица 102 может иметь изначальный размер частицы не более 0,6 мкм. Например, изначальный размер частицы может составлять не более 0,45 мкм, к примеру, не более 0,35 мкм или даже не более 0,15 мкм. В соответствии с другим вариантом, для получения более крупных полимерных частиц можно применять более крупные затравочные частицы, имеющие изначальный размер по меньшей мере 3 мкм, к примеру, по меньшей мере 5 мкм, по меньшей мере 10 мкм, по меньшей мере 20 мкм или по меньшей мере 50 мкм. Согласно примеру, изначальный размер частицы может составлять не более 100 мкм.
Затравочную частицу 102 можно промотировать в водной суспензии с получением промотированной дисперсной фазы 104. В частности, промотирование затравочных частиц включает перемешивание растворителя с промотором в водной суспензии с получением дисперсной фазы. Промотированные затравочные частицы легче абсорбируют гидрофобные компоненты. Растворитель может быть смешиваемым с водой. Например, растворитель может включать альдегид или кетон, такой как формальдегид, ацетон, метилэтилкетон, диизопропиловый кетон, диметилформамид или их комбинации; растворитель на основе простого эфира, такой как тетрагидрофуран, простой диметиловый эфир или их комбинации; растворитель на основе сложного эфира; гетероциклический растворитель, такой как пиридин, диоксан, тетрагидрофурфуриловый спирт, N-метил-2-пирролидон или их комбинации; или их комбинации. Согласно примеру, растворитель может включать кетон, такой как ацетон. Согласно другому примеру, растворитель может включать растворитель на основе простого эфира, такой как тетрагидрофуран. Согласно дополнительному примеру, растворитель может включать гетероциклический растворитель, такой как пиридин.
Промотор или промотирующее средство может быть гидрофобным и иметь низкую растворимость в воде, к примеру, растворимость в воде, составляющую не более 0,01 г/л при 25°C. Например, промотор может включать диоктаноилпероксид, диоктиладипат, н-бутилфталат, додеканол, полистирол с молекулярной массой ниже 20 кДа или их комбинацию. Согласно примеру, диоктаноилпероксид может также выполнять роль ингибитора для реакции полимеризации. Промотором также может быть полистирол с низкой молекулярной массой, например, полученный в ходе отдельного этапа полимеризации с помощью низкого соотношения мономер/ингибитор или добавления реагентов передачи цепи в ходе затравочной полимеризации. Промотор обычно эмульгируют в гомогенизаторе под высоким давлением.
Водная суспензия также может включать поверхностно-активное вещество. Поверхностно-активное вещество может представлять собой ионное поверхностно-активное вещество, амфотерное поверхностно-активное вещество или неионное поверхностно-активное вещество. Ионным поверхностно-активным веществом может быть анионное поверхностно-активное вещество. Согласно другому примеру, ионным поверхностно-активным веществом может быть катионное поверхностно-активное вещество. Иллюстративное анионное поверхностно-активное вещество включает сульфатное поверхностно-активное вещество, сульфонатное поверхностно-активное вещество, фосфатное поверхностно-активное вещество, карбоксилатное поверхностно-активное вещество или любую их комбинацию. Иллюстративное сульфатное поверхностно-активное вещество включает алкилсульфаты, такие как лаурилсульфат аммония, лаурилсульфат натрия (додецилсульфат натрия (SDS)) или их комбинацию, алкилэфирсульфат, такой как лауретсульфат натрия, миретсульфат натрия или любая их комбинацию, или любую их комбинацию. Иллюстративное сульфонатное поверхностно-активное вещество включает алкилсульфонат, такой как додецил сульфонат натрия, докузаты, такие как диоктилсульфосукцинат натрия, алкилбензилсульфонат или любую их комбинацию. Иллюстративное фосфатное поверхностно-активное вещество включает алкилариловый простой эфир фосфата, алкиловый простой эфир фосфата или любую их комбинацию. Иллюстративное поверхностно-активное вещество на основе карбоновой кислоты включает алкилкарбоксилаты, такие как соли жирных кислот или стеарат натрия, лауроилсаркозинат натрия, соль желчной кислоты, такую как дезоксихолат натрия, или любую их комбинацию.
Иллюстративное катионное поверхностно-активное вещество включает первичные, вторичные или третичные амины, поверхностно-активные вещества на основе четвертичного аммония или любую их комбинацию. Иллюстративное поверхностно-активное вещество на основе четвертичного аммония включает соли алкилтриметиламмония, такие как бромид цетилтриметиламмония (CTAB) или хлорид цетилтриметиламмония (CTAC), хлорид цетилпиридиния (CPC), полиэтоксилированный талловамин (POEA), бензалкония хлорид (BAC), бензетония хлорид (BZT), 5-бром-5-нитро-1,3-диоксан, диметилдиоктадециламмония хлорид, диоктадецилдиметиламмония бромид (DODAB) или любую их комбинацию.
Иллюстративное амфотерное поверхностно-активное вещество включает первичный, вторичный или третичный амин или катион четвертичного аммония с сульфонатным, карбоксилатном или фосфатным анионом. Иллюстративное сульфонатное амфотерное поверхностно-активное вещество включает (3-[(3-холамидопропил)диметиламмоний]-1-пропансульфонат), султаин, такой как кокамидопропилгидроксисултаин или любую их комбинацию. Иллюстративное амфотерное поверхностно-активное вещество на основе карбоновой кислоты включает аминокислоты, иминокислоты, бетаины, такие как кокамидопропилбетаин, или любую их комбинацию. Иллюстративное фосфатное амфотерное поверхностно-активное вещество включает лецитин. Согласно следующему примеру, поверхностно-активное вещество может представлять собой неионное поверхностно-активное вещество, такое как поверхностно-активное вещество на основе полиетиленгликоля.
Обратимся к Фиг. 1, добавленные в суспензию мономеры предпочтительно обычно находятся в дисперсной фазе 104, образованной от промотированной затравочной частицы. Сшиватель, такой как гидрофобный сшиватель, также можно добавлять к водной суспензии, и он предпочтительно находится в дисперсной фазе. Согласно примеру, сшиватель имеет растворимость в воде, составляющую не более 10 г/л. Кроме того, к водной суспензии можно также добавить пороген, и предпочтительно он может находиться в дисперсной фазе. Согласно следующему примеру, дисперсная фаза может включать акридитные олигонуклеотиды, такие как ионозамещенный акридитный олигонуклеотид. Проиллюстрированный на Фиг. 1 мономер и необязательно сшиватель полимеризуют с получением полимерной частицы 108.
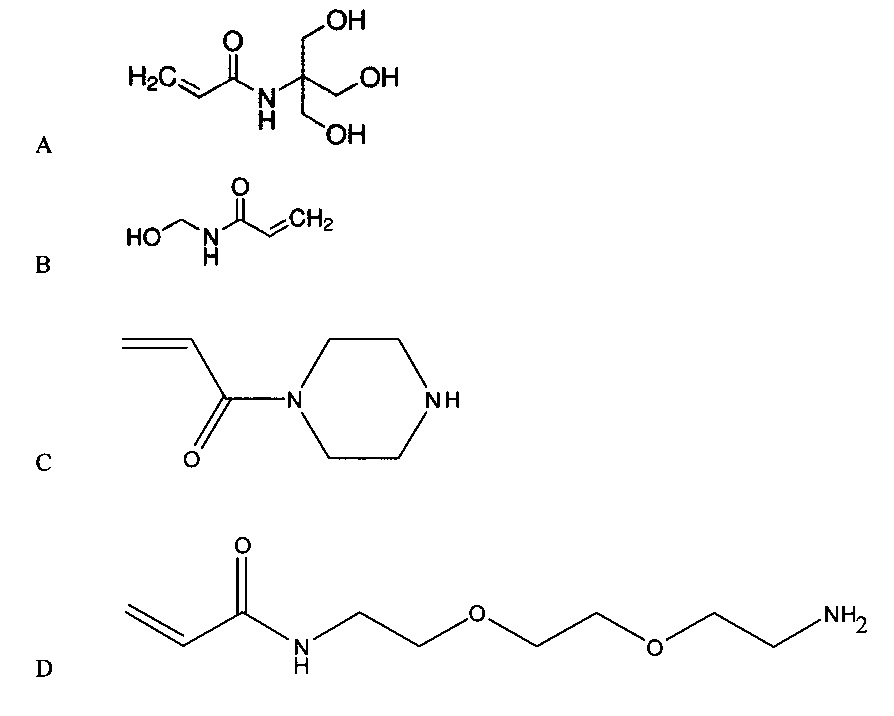
Мономер может представлять собой способный к радикальной полимеризации мономер, такой как виниловый мономер. В частности, мономер может включать гидрофильный мономер, связанный с гидрофобной защитной группой. Согласно примеру, гидрофильный мономер может включать акриламид, винилацетат, гидроксиалкилметакрилат или любую их комбинацию. Согласно конкретному примеру, гидрофильный мономер является акриламидом, таким как акриламид, включающий гидроксильные группы, аминогруппы, карбоксильные группы или их комбинацию. Согласно примеру, гидрофильный мономер представляет собой аминоалкилакриламид, акриламид, функционализированный пропиленгликолем с аминогруппой на конце (C, проиллюстрирован ниже), акрилопиперазин (D, проиллюстрирован ниже) или их комбинацию. Согласно другому примеру, акриламид может представлять собой гидроксиалкилакриламид, такой как гидроксиэтилакриламид. В частности, гидроксиалкилакриламид может включать N-трис(гидроксиметил)метил)акриламид (A, проиллюстрирован ниже), N-(гидроксиметил)акриламид (B, проиллюстрирован ниже) или их комбинацию. Согласно следующему примеру, можно применять смесь мономеров, такую как смесь гидроксиалкиакриламида и функционализированного амином акриламида или смесь акриламида и функционализированного амином акриламида. Согласно примеру, функционализированный амином акриламид можно включить в соотношении гидроксиалкилакриламид:функционализированный амином акриламид или акриламид:функционализированный амином акриламид в диапазоне от 100:1 до 1:1, к примеру, в диапазоне от 100:1 до 2:1, в диапазоне от 50:1 до 3:1, в диапазоне от 50:1 до 5:1 или даже в диапазоне от 50:1 до 10:1.
Согласно конкретному примеру, гидрофильный мономер включает гидроксильные группы или включает амины. Гидрофобная защитная группа защищает гидрофильность мономера, например, посредством связывания с гидроксильной группой или аминогруппой. Такие защитные группы в настоящем документе называют защитные группы для гидроксильных групп или гидроксигрупп при связывании с гидроксильной группой. В частности, гидрофобную защитную группу можно удалить, к примеру, посредством отщепления, например, кислотного отщепления. Можно выбрать гидрофобную группу, отщепляющуюся в кислотных условиях, что не приводит в результате к гидролизу лежащего в основе полимера или его частей. Например, для значений pH ниже 6 при наличии акриламидного полимера гидрофобная защитная группа отщепляется при pH, превышающем pH, при котором гидролизируется амидная часть акриламида. Для значений pH выше 9 гидрофобная защитная группа отщепляется при pH, который ниже pH, при котором гидролизируется амидная часть акриламида.
Иллюстративная гидрофобная защитная группа включает металлорганический фрагмент. Например, металлорганический фрагмент может формировать силилэфирную функциональную группу. Силилэфирная функциональная группа может быть получена от галогенированного силилового соединения, такого как соединение с общим составом R1Si(R2)(R3)(R4), где R1 является галогеном, таким как хлор, а R2, R3 и R4 независимо выбраны из водорода, алкильной группы, такой как метил, этил, пропил, бутил, арильная группа, силильные группы, их эфирных производных или любой их комбинации. Иллюстративная силилэфирная функциональная группа получена от трет-бутилдиметилсилилхлорида, триметилсилилхлорида, триэтилсилилхлорида, трипропилсилилхлорида, трибутилсилилхлорида, дифенилметилсилилхлорида, хлор(диметил)фенилсилана или их комбинации. Согласно конкретному примеру, мономер с защитной группой включает N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид или tBDMS-HEAM, N-(2-((триэтилсилил)окси)этил)акриламид или TES-HEAM или их комбинацию. Согласно другому примеру, гидрофобная защитная группа может включать органический фрагмент. Иллюстративный органический фрагмент может включать фрагмент алкилоксисарбонильной группы, такой как t-бутилоксикарбонил, флуоренилметилоксикарбонил или их комбинация. Согласно примеру, такой органический фрагмент может представлять собой гидрофобную защитную группу, связанную с функциональной аминогруппой, такой как функциональная аминогруппа у функционализированного амином акриламида или его сополимера.
Мономер с защитной группой можно включить в количестве по отношению к исходному затравочному полимеру, выраженному как соотношение масс (мономер с защитной группой:затравочный полимер), в диапазоне от 100:1 до 1:2, к примеру, в диапазоне от 50:1 до 1:1, в диапазоне от 45:1 до 2:1, в диапазоне от 30:1 до 5:1 или даже в диапазоне от 20:1 до 8:1. В соответствии с другим вариантом, мономер можно включать в количестве в диапазоне от 10:1 до 1:2, к примеру, в диапазоне от 5:1 до 1:2 или даже в диапазоне от 2:1 до 1:2.
Дисперсная фаза также может включать сшиватель. Согласно примеру, сшиватель включают в массовом соотношении мономер с защитной группой к сшивателю в диапазоне от 15:1 до 1:2, к примеру, в диапазоне от 10:1 до 1:1, в диапазоне от 6:1 до 1:1 или даже в диапазоне от 4:1 до 1:1. Сшиватель может иметь низкую растворимость в воде (например, менее 10 г/л), в связи с чем предпочтительной является дисперсная фаза. В частности, сшиватель может представлять собой дивиниловый сшиватель. Например, дивиниловый сшиватель может включать диакриламид, такой как Ν,Ν'-(этан-1,2-диил)бис(2-гидроксилэтил)акриламид, Ν,Ν'-(2-гидроксипропан-1,3-диил)диакриламид или их комбинацию. Согласно другому примеру, дивиниловый сшиватель включает этиленгликоль диметакрилат, дивинилбензол, гексаметиленбисакриламид, триметилолпропантриметакрилат, их производное с защитной группой или их комбинацию. Согласно следующему примеру, сшиватель может быть защищен при помощи гидрофобной защитной группы, такой как защитная группа для гидроксильной группы. В частности, гидрофобная защитная группа может представлять собой металлорганический фрагмент. Например, металлорганический фрагмент может образовывать силилэфирную функциональную группу. Иллюстративная силилэфирная функциональная группа может быть получена от трет-бутилдиметилсилилхлорида, триметилсилилхлорида, триэтилсилилхлорида, трипропилсилилхлорида, трибутилсилилхлорида, дифенилметилсилилхлорида, хлор(диметил)фенилсилана или их комбинации. Иллюстративный диакриламидный сшиватель с защитной группой включает Ν,Ν'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, N,N'-(N-(2-((трет-бутилдиметилсилил)окси)пропан-1,3-диил)диакриламид, N,N'-(этан-1,2-диил)бис(N-(2-((триэтилсилил)окси)этил)акриламид, Ν,Ν'-(N-(2-((триэтилсилил)окси)пропан-1,3-диил)диакриламид, N-[2-(акрилоиламино)-1,2-дигидроксиэтил]акриламид с защищенной силильной группой, такой как Ν,Ν'(2,3-бис((триэтилсилил)окси)бутан-1,4-диил)диакриламид, или их комбинацию. Согласно другому примеру, защитная группа может включать фрагмент алкилоксисарбониловой группы, такой как t-бутилоксикарбонил, флуоренилметилоксикарбонил или их комбинация. В частности, сшиватель, включающий гидроксильную группу, может быть защищен защитной группой, такой как описанные выше в отношении мономера с защитной группой.
В дополнение к этому, полимеризация гидрофильного мономера, имеющего гидрофобную защиту, может включать полимеризацию в присутствии порогена. Иллюстративный пороген включает ароматический пороген. Согласно примеру, ароматический пороген включает бензол, толуол, ксилол, мезителен, фенэтилацетат, диэтиладипат, гексилацетат, этилбензоат, фенилацетат, бутилацетат или их комбинацию. Пороген обычно характеризуется параметром растворимости, равным 15-20. Согласно другому примеру, пороген является алканольным порогеном, таким как додеканол. Пороген можно включать в количествах, относительных к органической фазе в реакционноспособной системе, в диапазоне от 1 мас.% до 99 мас.%, к примеру, в диапазоне от 30 мас.% до 90 мас.% или даже в диапазоне от 50 мас.% до 85 мас.%.
Мономер выбирают из группы мономеров, которые образуют гидрогель в своей незащищенной форме, так, чтобы при применении олигонуклеотиды и полимеразы могли достичь своих целей.
Гидрофильные акриламиды и особенно диакриламиды плохо растворяются в растворителе, который не смешивается с водой, и в тоже время растворяет гидрофобный затравочный полимер. Защитную группу как для мономера, так и для сшивателя можно выбрать такую, чтобы растворимость мономеров в гидрофобной фазе была достаточно большой для достижения достаточно большой концентрации для осуществления полимеризации. В то же время защитная группа не может быть настолько большой, чтобы полимеризацию нельзя было осуществить по причине стерического затруднения. Удаление защитной группы можно осуществить в условиях, в которых не будет гидролизироваться полимер.
Необязательно, можно включить инициатор полимеризации. Иллюстративный инициатор полимеризации может инициировать полимеризацию посредством создания свободных радикалов. Иллюстративный инициатор полимеризации включает азоинициатор, такой как маслорастворимые азоинициаторы. Другой инициатор может включать персульфат аммония. Следующий иллюстративный инициатор может включать тетраметилэтилендиамин Согласно примеру, инициатор полимеризации можно включить в количестве от 0,001 мас.% до 3 мас.% по массе дисперсной фазы.
После полимеризации полимерная частица 108 может быть удалена с затравочного полимера с получением полимерной частицы 110, все еще имеющей гидрофобные защитные группы. Например, затравочный полимер можно экстрагировать при помощи растворителя, такого как альдегид или кетон, такой как ацетон, метилэтилкетон, диизопропиловый кетон, бутилацетат, циклогексанон, диметилформамид или их комбинация, фталатный растворитель, такой как н-бутилфталат, растворитель на основе простого эфира, такой как тетрагидрофуран, простой диизопропиловый эфир, простой метилтретбутиловый эфир, простой диметиловый эфир, простой диэтиловый эфир или их комбинация, растворитель на основе сложного эфира, такой как этилацетат, бутилацетат или их комбинация, гетероциклический растворитель, такой как пиридин, диоксан, тетрагидрофурфуриловый спирт или их комбинация, галогенированные растворители, такие как дихлорометан, хлороформ или их комбинация. В соответствии с другим вариантом, затравочный полимер можно экстрагировать после преобразования полимерной частицы в гидрофильную частицу. Например, затравочный полимер можно экстрагировать после удаления защитной группы у полимера частицы, к примеру, удаления силильных групп на полимере, полученном из мономера с защитной группой.
Как проиллюстрировано на Фиг. 1, полимерную частицу 110 после экстракции затравочного полимера можно преобразовать в гидрофильную полимерную частицу посредством удаления по меньшей мере части гидрофобных защитных групп. Например, гидрофобные защитные группы могут быть удалены в результате кислотного отщепления от полимерных частиц. В частности, с помощью такого удаления можно удалить практически все гидрофобные защитные группы у полимерной частицы, к примеру, удаляя по меньшей мере 80% гидрофобных защитных групп или даже по меньшей мере 90% гидрофобных защитных групп.
Согласно примеру, гидрофобные защитные группы подвергают кислотному отщеплению посредством добавления кислоты, такой как органическая кислота. В частности, органическая кислота может иметь pKa в диапазоне от 3,0 до 5,5. Например, органическая кислота может включать уксусную кислоту, молочную кислоту, лимонную кислоту или любую их комбинацию. В соответствии с другим вариантом, можно применять неорганические кислоты.
После удаления по меньшей мере части гидрофобных защитных групп получают гидрофильную частицу 112. Гидрофильная частица 112 может представлять собой частицу гидрогеля. Гидрогель является полимером, который может абсорбировать по меньшей мере 20% от своей массы воды, к примеру, по меньшей мере 45%, по меньшей мере 65%, по меньшей мере 85%, по меньшей мере 100%, по меньшей мере 300%, по меньшей мере 1000%, по меньшей мере 1500% или даже по меньшей мере 2000% от своей массы воды.
Гидрофильный полимер 112 можно активировать для облегчения конъюгации с целевым анолитом, таким как полинуклеотид. Например, функциональные группы на гидрофильной частице 112 можно усилить, чтобы сделать возможным связывание с целевыми анолитами или рецепторами анолитов. Согласно конкретному примеру, функциональные группы гидрофильного полимера можно модифицировать при помощи реагентов, способных преобразовывать функциональные группы гидрофильного полимера в реакционноспособные фрагменты, которые можно подвергнуть нуклеофильному или электрофильному замещению. Например, гидроксильные группы на гидрофильной частице можно активировать посредством замены по меньшей мере части гидроксильных групп на сульфонатную группу или хлор. Иллюстративные сульфонатные группы могут быть получены от тресил-, метилсульфонил-, тосил- или фосилхлорида или любой их комбинации. Сульфонат может содействовать нуклеофилам в замене сульфоната. Сульфонат дополнительно может вступать в реакцию с высвобожденным хлором с образованием хлорсодержащей группы, которую можно применять в процессе конъюгирования частиц. Согласно другому примеру, можно активировать аминогруппы на гидрофильном полимере 112.
Например, целевой анолит или рецепторы анолита могут связываться с гидрофильным полимером посредством нуклеофильного замещения с сульфонатной группой. Согласно конкретному примеру, рецепторы целевого анолита с нуклеофилами на концах, такими как амин или тиол, можно подвергнуть нуклеофильному замещению для замены сульфонатной группы на поверхности гидрофильного полимера 112. В результате активации можно получить конъюгированную частицу 114.
Согласно другому примеру, сульфированные частицы можно дополнительно подвергнуть реакции с моно- или мультинуклеофильными моно- или мультифункциональными реагентами, которые могут образовывать присоединение к частице, в то же время сохраняя нуклеофильную активность для олигонуклеотидов, содержащих электрофильные группы, таких как малеимид. В дополнение к этому, остаточную нуклеофильную активность можно преобразовать в электрофильную активность посредством присоединения к мультиэлектрофильным реагентам, которые после этого должны будут присоединяться к олигонуклеотидам, содержащим нуклеофильные группы.
Согласно другому примеру, содержащий функциональную группу мономер можно добавлять в ходе полимеризации. Мономер может включать, например, акриламид, содержащий реакционноспособную группу карбоновой кислоты, сложного эфира, галоген или другую реакционноспособную аминогруппу. Группу на основе сложного эфира можно гидролизировать до реакции с содержащим аминогруппы олигонуклеотидом.
Другие методики конъюгирования включают применение мономеров, которые содержат гидрофобные защитные группы на аминогруппах, в ходе синтеза частиц. Удаление защитной группы с аминогруппы делает доступной нуклеофильную группу, которую дополнительно можно модифицировать при помощи вступающих в реакцию с аминами бифункциональных биэлектрофильных реагентов, которые образуют монофункциональную электрофильную группу после соединения с полимерной частицей. Такую электрофильную группу можно подвергнуть реакции с олигонуклеотидам и, имеющими нуклеофильную группу, такую как аминогруппа или тиоловая группа, что приводит к присоединению олигонуклеотида в результате реакции со свободным электрофилом.
Если частица 112 получена из комбинации амино- и гидроксилакриламидов, то удаление защитных групп у частицы гидрогеля дает в результате комбинацию нуклеофильных аминогруп и нейтральных гидроксильных групп. Аминогруппы можно модифицировать при помощи бифункциональных биэлектрофильных фрагментов, таких как диизоцианат или сложный бис-NHS эфир, что в результате приводит к образованию гидрофильной частицы, реакционноспособной по отношению к нуклеофилам. Иллюстративный сложный бис-NHS эфир включает сложные бис-сукцинимидил-C2-C12-алкиловые эфиры, такие как бис-сукцинимидилсуберат или бис-сукцинимидилглутарат.
Другие химические способы активации предусматривают включение множества этапов для преобразования определенной функциональной группы с целью образования конкретных необходимых связей. Например, модифицированную сульфонатом гидроксильную группу можно преобразовывать в нуклеофильную группу посредством нескольких способов. Согласно примеру, реакция сульфоната с азидным анионом дает в результате замещенный азидом гидрофильный полимер. Азид можно непосредственно использовать для конъюгации с замещенной ацетиленом биомолекулой посредством "клик-химии", такую реакцию можно осуществить с медным катализом или без него. Необязательно, азид можно преобразовать до амина посредством, например, каталитического восстановления при помощи водорода или восстановления при помощи органического фосфина. Полученный в результате амин можно затем преобразовать в электрофильную группу при помощи различных реагентов, таких как диизоцианаты, сложные бис-NHS-эфиры, хлорангидрид циануровой кислоты или их комбинация. Согласно примеру, применение диизоцианатов приводит к образованию группировки мочевины между полимером и линкером, что приводит в результате к образованию остаточной изоцианатной группы, которая может вступать в реакцию с замещенной амином биомолекулой с образованием группировки мочевины между линкером и биомолекулой. Согласно другому примеру, применение сложных бис-NHS-эфиров приводит к образованию амидной связи между полимером и линкером и остаточной группы сложного NHS-эфира, которая способна вступать в реакцию с замещенной амином биомолекулой с образованием амидной связи между линкером и биомолекулой. Согласно следующему примеру, применение хлорангидрид циануровой кислоты приводит к образованию аминотриазинового мостика между полимером и линкером и двух остаточных хлортриазиновых групп, одна из которых способна вступать в реакцию с замещенной амином биомолекулой с образованием аминотриазинового мостика между линкером и биомолекулой. Другие нуклеофильные группы можно включить в частицу посредством сульфонатной активации. Например, реакцию сульфированных частиц с анионом тиобензойной кислоты и гидролиз последующего тиобензоата включает тиол в частицу, которая может в дальнейшем вступать в реакцию с замещенной малеимидом биомолекулой с образованием тиосукцинимидного мостика с биомолекулой. Тиол также может вступать в реакцию с бромацетильной группой.
Альтернативно, в ходе полимеризации можно применять акридитные олигонуклеотиды для включения олигонуклеотидов. Иллюстративный акридитный олигонуклеотид может включать ионозамещенные олигонуклеотиды.
Ковалентные связи биомолекул на прочных или полимерных подложках можно создать при помощи электрофильных фрагментов на подложке, связанных с нуклеофильными фрагментами на биомолекуле, или нуклеофильных элементов на подложке, связанных с электрофильными элементами на биомолекуле. В связи с гидрофильной природой большинства общеизвестных представляющих интерес биомолекул, предпочтительный растворитель для такого связывания представляет собой воду или воду, содержащую определенный растворимый в воде растворитель для того, чтобы диспергировать биомолекулу по подложке. В частности, полинуклеотиды обычно связываются с подложками в водных системах благодаря их полианионной природе. Поскольку вода конкурирует с нуклеофилом за электрофил путем гидролиза электрофила в инактивированный фрагмент для конъюгации, водные системы обычно дают низкий выход связанного продукта, причем выход основан на электрофильной части пары. При необходимости высоких выходов электрофильной части реакционной пары необходимы высокие концентрации нуклеофила для прохождения реакции и уменьшения гидролиза, что приводит к неэфективному использованию нуклеофила. В случае полинуклеиновых кислот противоион металла у фосфата можно заменить на липофильный противоин для того, чтобы способствовать растворению биомолекулы в полярных, нереакционноспособных, неводных растворителях. Такие растворители могут включать амиды или мочевины, такие как формамид, Ν,Ν-диметилформамид, ацетамид, Ν,Ν-диметилацетамид, гексаметилфосфорамид, пирролидон, N-метилпирролидон, Ν,Ν,Ν',Ν'-тетраметилмочевина, N,N'-диметил-N,N'-триметиленмочевина или их комбинация, карбонаты, такие как диметилкарбонат, пропиленкарбонат или их комбинация, простые эфиры, такие как тетрагидрофуран, сульфоксиды и сульфоны, такие как диметилсульфоксид, диметилсульфон или их комбинация, стерически затрудненные спирты, такие как трет-бутиловый спирт, или их комбинацию. Липофильные катионы могут включать катионы тетраалкиламония или тетраариламония, такие как тетраметиламоний, тетраэтиламоний, тетрапропиламоний, тетрабутиламоний, тетрапентиламоний, тетрагексиламоний, тетрагептиламоний, тетраоктиламоний и смеси их алкилов и арилов, катионы тетраарилфосфония, такие как тетрафенилфосфоний, тетраалкиларсоний или тетраариларсоний, такой как тетрафениларсоний, и катионы триалкилсульфония катионы, такие как триметилсульфоний, или их комбинацию. Преобразование полинуклеиновых кислот в растворимые в органическом растворителе материалы посредством обмена металлических катионов с липофильными катионами можно осуществить при помощи ряда стандартных методик катионного обмена.
Согласно другому примеру, частицы можно получить при помощи методик полимеризации в эмульсии, при которой гидрофобная фаза образует дисперсную фазу в гидрофильной фазе. Описанные выше мономеры, сшиватели и другие средства и соединения, которые способствуют получению гидрофобных фаз, обычно содержаться в гидрофобной фазе, в которой происходит полимеризация.
Поверхностно-активные вещества, такие как описанные выше, можно применять в гидрофильной фазе для поддержания образования эмульсии. При применении затравочной частицы поверхностно-активное вещество можно применять в концентрации, ниже критической концентрации мицеллообразования. В соответствии с другим вариантом, поверхностно-активное вещество можно применять в концентрации, превышающей критическую концентрацию мицеллообразования. Полимеризацию в эмульсии обычно осуществляют при помощи растворимого в воде инициатора по типу персульфата калия или аммония.
В результате добавления инициатора к подогретой эмульсии мономеров начинается зародышеобразование частиц в водной фазе, а полученные частицы стабилизируют с помощью поверхностно-активных веществ. При образовании большинства частиц за короткий период времени можно получить моноразмерные затравочные частицы. Более позднее увеличение размера частицы происходит по причине того, что мономер диффундирует через водную фазу из больших капель мономеров к намного меньшим затравочным частицам.
В частности, с помощью вышеизложенного способа можно получить множество частиц, имеющих необходимый размер частиц и коэффициент вариации. Набор частиц может включать, например, 100000 частиц, к примеру, 500000 частиц, более 1 миллиона частиц, более 10 миллионов частиц или даже по меньшей мере 1×1010. Частицы из множества частиц могут представлять собой гидрофильные полимерные частицы, такие как частицы гидрогеля. Согласно конкретному примеру, частица гидрогеля может представлять собой акриламидную частицу, такую как частица, включающая сшитый гидроксиалкилакриламидный полимер или сшитый сополимер гидроалкилакриламида и функционализированного амином акриламида. Согласно другому примеру, частица может представлять собой сшитый сополимер акриламида и функционализированного амином акриламида.
Множество частиц могут иметь необходимый размер частиц, такой как размер частицы, составляющий не более 100 мкм, не более 30 мкм или не более 3 мкм. Средний размер частиц представляет собой средний диаметр частицы. Например, средний размер частицы может составлять не более 2 мкм, к примеру, не более 1,5 мкм, не более 1,1 мкм, не более 0,8 мкм, не более 0,6 мкм, не более 0,5 мкм или даже не более 0,3 мкм. Согласно конкретному примеру, средний размер частицы может находиться в диапазоне от 0,1 мкм до 100 мкм, к примеру, в диапазоне от 0,1 мкм до 50 мкм или в диапазоне от 0,1 мкм до 1,1 мкм. Согласно некоторым аспектам, описанный выше способ обеспечивает технические преимущества для получения частиц, имеющих размер частицы в диапазоне от 5 мкм до 100 мкм, к примеру, в диапазоне от 20 мкм до 100 мкм или в диапазоне от 30 мкм до 70 мкм. Согласно другим аспектам, описанный выше способ обеспечивает технические преимущества для получения частиц, имеющих размер частицы, составляющий не более 1,1 мкм. Если затравка имеет больший размер, можно получить более крупные частицы. Размер частиц можно корректировать по размеру затравочной частицы. Согласно настоящему способу размер полимерной частицы является менее зависимым от выбора поверхностно-активного вещества и концентрации по сравнению с другими способами.
Кроме того, множество частиц является монодисперсным и может иметь необходимый низкий коэффициент вариации, к примеру, коэффициент вариации, составляющий не более 20%. Как указано выше, коэффициент вариации (CV) определяют как 100 кратное стандартное среднеквадратическое отклонение, деленное на среднее, причем "среднее" представляет собой средний диаметр частицы, а стандартное отклонение представляет собой стандартное отклонение размера частицы. Альтернативно, "среднее" может представлять собой либо z-средний, либо модовый диаметр частицы. В соответствии с обычной практикой CV рассчитывают по основной моде, т.е. основному пику, таким образом исключая неосновные пики, относящиеся к агрегатам. Таким образом, некоторые частицы с более низким или превышающим моду размером можно исключить при расчете, который, например, может быть основан на приблизительно 90% от общего числа детектируемых частиц. Такое определение CV можно осуществить на дисковой центрифуге CPS или счетчике Культера. Например, коэффициент вариации (CV) множества частиц может составлять не более 15%, к примеру, не более 10%, не более 5%, не более 4,5%, не более 4,0%, не более 3,5% или даже не более 3,0%. Такой CV можно достичь без фильтрации или других эксклюзионных методик.
В частности, для поддержания низкой вариации размера гранул необходимо предупреждать слипания капель в ходе полимеризации. Такое предупреждение легче осуществлять в эмульсии по типу масло-в-воде, чем в эмульсии по типу вода-в-масле, поскольку легче стабилизировать систему, в которой вода является диспергирующей фазой. Тем не менее, гидрофильные мономеры предпочтительно не располагаются в масляной фазе.
Согласно следующему примеру, гидрофильная полимерная частица в воде может составлять не более 50 мас.% полимера, к примеру, не более 30 мас.% полимера, не более 20 мас.% полимера, не более 10 мас.% полимера, не более 5 мас.% полимера или даже не более 2 мас.% полимера.
Согласно дополнительному примеру полимерная частица может иметь пористость, позволяющую проникновение белков и ферментов. Согласно примеру, полимерные частицы могут иметь пористость, позволяющую проникновение белков, имеющих размер, составляющий по меньшей мере 50 килодальтон, к примеру, по меньшей мере 100 килодальтон, по меньшей мере 200 килодальтон, по меньшей мере 250 килодальтон или даже по меньшей мере 350 килодальтон.
Согласно другому примеру, при конъюгировании полимерная частица может иметь плотность полинуклеотидов, называемую нуклеотидной плотностью, составляющую по меньшей мере 7×104 на мкм3. Например, нуклеотидная плотность может составлять по меньшей мере 105 на мкм3, к примеру, по меньшей мере 106 на мкм3, по меньшей мере 5×106 на мкм3, по меньшей мере 8×106 на мкм3, по меньшей мере 1×107 на мкм3 или даже по меньшей мере 3×107 на мкм3. Согласно следующему примеру, нуклеотидная плотность может составлять не более 1015 на мкм3.
Такие полимерные частицы можно применять в различных методиках разделения и аналитических методиках. В частности, полимерные частицы могут быть пригодны при связывании полинуклеотидов. Такое связывание полинуклеотидов может быть пригодным для выделения полинуклеотидов из раствора, или его можно использовать в аналитических методиках, таких как секвенирование. Согласно конкретному примеру, проиллюстрированному на Фиг. 2, такие полимерные частицы можно применять в качестве основы для полинуклеотидов в ходе методик секвенирования. Например, такие гидрофильные частицы могут иммобилизировать полинуклеотид для секвенирования при помощи методик флуоресцентного секвенирования. Согласно другому примеру, гидрофильные частицы могут иммобилизировать множество копий полинуклеотида для секвенирования при помощи ионочувствительных методик.
В целом, полимерную частицу можно обрабатывать для включения биомолекулы, включающей нуклеозиды, нуклеотиды, нуклеиновые кислоты (олигонуклеотиды и полинуклеотиды), полипептиды, сахариды, полисахариды, липиды или их производные или аналоги. Например, полимерная частица может связываться с биомолекулой и прикрепляться к ней. С полимерной частицей может связываться, или прикрепляться к ней, терминальный конец или любая внутренняя часть биомолекулы. Полимерная частица может связываться с биомолекулой или прикрепляться к ней при помощи образования химических связей. Образование химической связи включает образование ковалентных или нековалентных связей, включая ионную связь, водородную связь, аффинную связь, диполь-дипольную связь, ван-дер-вальсову связь и гидрофобную связь. Образование химической связи включает аффинность между партнерами связывания, например между авидиновым фрагментом и биотиновым фрагментом, антигенным эпитопом и антителом или его иммунологически реактивным фрагментом, антителом и гептеном, дигоксигеновым фрагментом и антителом к дигоксигену, флюоресцеиновым фрагментом и антителом к флюоресцеину, оператором и репрессором, нуклеазой и нуклеотидом, лектином и полисахаридом, стероидом и связывающим стероид белком, активным соединением и рецептором к активному соединению, гормоном и рецептором гормона, ферментом и субстратом, иммуноглобулином и белком A или олигонуклеотидом или полинуклеотидом и его соответствующей комплементарной цепью.
Согласно примеру, полимерную частицу можно использовать в системе с поверхностью. Система содержит одну или несколько полимерных частиц на поверхности. Поверхность может представлять собой твердую поверхность. Поверхность может включать плоские, вогнутые или выпуклые поверхности или любую их комбинацию. Поверхность может иметь текстуру и особенности, включая следы от протравливания, пустоты или бугорки. У поверхности может отсутствовать какая-либо текстура или особенности. Поверхность может включать внутренние стенки капилляра, канала, борозды, стенки или сосуда. Поверхность может представлять собой ячейку. Поверхность может быть пористой, полупористой или без пор. Поверхность может представлять собой фильтр или гель. Поверхность может включать верхнюю часть иглы (например, массив игл). Поверхность может быть выполнена из материалов, таких как стекло, боросиликатное стекло, силикагель, кварц, плавленный кварц, слюда, полиакриламид, пластиковый полистирол, поликарбонат, полиметакрилат (PMA), полиметилметакрилат (PMMA), полидиметилсилоксан (PDMS), кремний, германий, графит, керамика, кремний, полупроводник, диэлектрик с высоким показателем преломления, кристаллы, гели, полимеры или пленки (например, пленки из золота, серебра, алюминия или алмаза). Поверхность может включать твердую подложку, имеющую металлическую пленку или металлическое покрытие. Поверхность необязательно может быть прозрачный, минимально отражающей, минимально абсорбирующей или характеризоваться низкой флуоресценцией.
Поверхность может иметь размеры, сходные с титрационными микропланшетами, имеющими 96, 384, 1536, 3456 или 9600 лунок. Поверхность может составлять приблизительно 1-20 см в любом линейном размере, приблизительно 1-10 см в любом линейном размере, приблизительно 0,10-1 см в любом линейном размере или приблизительно 0,001 нм - 1 см в любом линейном размере. Поверхность (и любую текстуру или особенности) можно получить посредством методик нанопроизводства.
Множество полимерных частиц можно расположить случайным образом или упорядоченно на поверхности или в комбинации случайного или упорядоченного расположения. Упорядоченные расположения включают прямолинейную и гексагональную схемы. Поверхность может включать множество участков, расположенных случайным образом или упорядоченно или в их комбинации. Одна или несколько полимерных частиц могут быть расположены в одном участке, в нескольких участках или во всех участках. Некоторые участки могут иметь одну полимерную частицу, а другие участки могут иметь множество полимерных частиц. По меньшей мере один участок может не иметь полимерной частицы. Согласно расположению, по меньшей мере две полимерные частицы могут контактировать друг с другом, или контакт между полимерными частицами может отсутствовать.
Как проиллюстрировано на Фиг. 2, множество полимерных частиц 204 может быть расположено в растворе одновременно с множеством полинуклеотидов 202. Множество частиц 204 можно активировать или иным образом подготовить для связывания с полинуклеотидами 202. Например, частицы 204 могут включать олигонуклеотидные комплементарные цепи для части полинуклеотидов из множества полинуклеотидов 202. Согласно другому примеру, полимерные частицы 204 можно модифицировать целевыми полинуклеотидами 204 при помощи таких методик, как биотин-стрептовидиновое связывание.
Согласно конкретному варианту осуществления, гидрофильные частицы и полинуклеотиды подвергают амплификации в ходе полимеразной цепной реакции (PCR). Например, капли 206 или 208 дисперсной фазы получают как часть эмульсии, и они могут включать гидрофильную частицу или полинуклеотид. Согласно примеру, полинуклеотиды 202 и гидрофильные частицы 204 вносят в низкой концентрации и соотношениях относительно друг к другу так, чтобы отдельный полинуклеотид 202 мог располагаться в той же капле дисперсной фазы, что и отдельная гидрофильная частица 204. Другие капли, такие как капля 208, могут включать отдельную гидрофильную частицу и не включать полинуклеотид. Каждая капля 206 или 208 может включать ферменты, нуклеотиды, соли или другие компоненты, достаточные для облегчения дупликации полинуклеотида.
Согласно конкретному варианту осуществления, присутствует такой фермент, как полимераза, связанный с гидрофильной частицей или частицей гидрогеля капли дисперсной фазы или находящийся в непосредственной близости к ним. Согласно примеру, полимераза присутствует в капле дисперсной фазы для облегчения дупликации полинуклеотида. Согласно описанным в настоящем документе способам можно применять различные полимеразы нуклеиновых кислот. Согласно иллюстративному варианту осуществления, полимераза может включать фермент, его фрагмент или субъединицу, которые могут катализировать дупликацию полинуклеотида. Согласно другому варианту осуществления, полимераза может быть встречающейся в природе полимеразой, рекомбинантной полимеразой, мутантной полимеразой, вариантной полимеразой, химерной или иначе сконструированной полимеразой, химически модифицированной полимеразой, синтетическими молекулами или ее аналогом, производным или фрагментом.
Согласно варианту осуществления, полимераза может принадлежать к любой ДНК-полимеразе семейства A (также известного как семейство pol I) или к любой ДНК-полимеразе семейства В. Согласно вариантам осуществления, ДНК-полимераза может представлять собой рекомбинантную форму, которая может дуплицировать полинуклеотиды с высокой точностью и выходом по сравнению с нерекомбинантной ДНК-полимеразой. Например, полимераза может включать полимеразу с высокой точностью воспроизведения или термоустойчивую полимеразу. Согласно вариантам осуществления, условия для дуплицирования полинуклеотидов могут включать условия 'Hot Start', например, полимеразы Hot Start, такие как ДНК-полимераза Amplitaq Gold® (Applied Biosciences) или ДНК-полимераза KOD Hot Start (EMD Biosciences). Обычно, полимераза 'Hot Start' включает термоустойчивую полимеразу и одно или несколько антител, которые ингибируют ДНК-полимеразу и 3'-5' экзонуклеазную активность при комнатной температуре.
Согласно вариантам осуществления, полимераза может представлять собой фермент, такой как Taq полимераза (от Thermus aquaticus), Tfí полимераза (от Thermus filiformis), Bst полимераза (от Bacillus stearothermophilus), Pfu полимераза (от Pyrococcus furiosus), Tth полимераза (от Thermus thermophilus), Pow полимераза (от Pyrococcus woesei), Tli полимераза (от Thermococcus litoralis), Ultima полимераза (от Thermotoga marítima), KOD полимераза (от Thermococcus kodakaraensis), Pol I и II полимеразы (от Pyrococcus abyssi) и Pab (от Pyrococcus abyssi).
Согласно вариантам осуществления, полимераза может быть рекомбинантной формой Thermococcus kodakaraensis. Согласно вариантам осуществления, полимераза может представлять собой KOD или KOD-подобную ДНК-полимеразу, такую как KOD полимераза (EMD Biosciences), KOD "Hot Start" полимераза (EMD Biosciences), KOD Xtreme Hot Start ДНК-полимераза (EMD Biosciences), KOD XL ДНК-полимераза (EMD Biosciences), Taq ДНК-полимераза Platinum® (Invitrogen), Taq ДНК-полимераза Platinum® High Fidelity (Invitrogen), Platinum® Pfx (Invitrogen), Accuprime™ Pfx (Invitrogen), Taq ДНК-полимераза Accuprime™ High Fidelity (Invitrogen) или ДНК-полимераза Amplitaq Gold® (Applied Biosystems). Согласно вариантам осуществления, полимераза может представлять собой ДНК-полимеразу, содержащую мутации, аналогичные обсуждаемым в настоящем документе полимеразам.
Согласно вариантам осуществления, дупликация полинуклеотида может включать модулирование условий дупликации. Модулирование может необязательно включать повышение или понижение концентрации полимеразы, повышение или понижение концентрации нуклеотидов, повышение или понижение концентрации катионов, повышение или понижение температуры, времени или pH реакции или т.п. Модулирование может включать повышение или понижение скорости реакции, повышение или понижение выхода продукта реакции или т.п. Согласно вариантам осуществления, дупликацию можно осуществлять в присутствии соответствующих буферов или нуклеотидов (включая нуклеотидные аналоги или биотинилированные нуклеотиды).
В частности, подлежащий амплификации полинуклеотид можно захватывать полимерной частицей. Иллюстративные способы захвата нуклеиновой кислоты могут включать гибридизацию полинуклеотида с олигонуклеотидом, который присоединен к полимерной частице. Согласно вариантам осуществления, способы захвата нуклеиновых кислот предусматривают: (a) внесение полимерной частицы, прикрепленной к одноцепочечному олигонуклеотиду (например, олигонуклеотиду для захвата), (b) внесение одноцепочечного полинуклеотида и (c) гибридизацию одноцепочечного олигонуклеотида с одноцепочечными полинуклеотидами с захватом, таким образом, одноцепочечного полинуклеотида полимерной частицей. Согласно вариантам осуществления, каждая из полимерных частиц может быть прикреплена ко множеству одноцепочечных олигонуклеотидов (например, олигонуклеотидов для захвата). Согласно вариантам осуществления, этап (c) можно выполнять со множеством одноцепочечных полинуклеотидов. Согласно вариантам осуществления, по меньшей мере часть одноцепочечного олигонуклеотида содержит нуклеотидную последовательность, которая является комплементарной (или частично комплементарной) по меньшей мере части одноцепочечного полинуклеотида.
Согласно примеру, способ дополнительно предусматривает амплификацию полинуклеотида во множество полинуклеотидов и прикрепление по меньшей мере части множества полинуклеотидов к гидрофильной частице с образованием, таким образом, гидрофильной частицы, включающей множество прикрепленных полинуклеотидов. В соответствии с другим вариантом, способ может дополнительно предусматривать амплификацию полинуклеотида во множество комплементарных полинуклеотидов посредством удлинения олигонуклеотида с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов.
Согласно вариантам осуществления, способы нуклеотидного встраивания предусматривают: проведение реакции нуклеотидной полимеризации на полинуклеотиде, который гибридизируется с олигонуклеотидом, который прикреплен к полимерной частице. Согласно вариантам осуществления, способы нуклеотидного встраивания предусматривают: (a) внесение полимерной частицы прикрепленной к одноцепочечному олигонуклеотиду (например, праймерному олигонуклеотиду), (b) внесение одноцепочечного матричного полинуклеотида, (c) гибридизацию одноцепочечного олигонуклеотида с одноцепочечным матричным полинуклеотидом и (d) приведение одноцепочечного матричного полинуклеотида в контакт с полимеразой и по меньшей мере одним нуклеотидом в условиях, подходящих для того, чтобы полимераза катализировала полимеризацию по меньшей мере одного нуклеотида на одноцепочечном олигонуклеотиде, с осуществлением, таким образом, нуклеотидного встраивания. Согласно вариантам осуществления, каждая из полимерных частиц может быть прикреплена ко множеству одноцепочечных олигонуклеотидов (например, олигонуклеотидов для захвата). Согласно вариантам осуществления, этапы (b), (c) или (d) можно выполнять со множеством одноцепочечных полинуклеотидов. Согласно вариантам осуществления, по меньшей мере часть одноцепочечного олигонуклеотида содержит нуклеотидную последовательность, которая является комплементарной (или частично комплементарной) по меньшей мере части одноцепочечного полинуклеотида. Согласно вариантам осуществления, система содержит одноцепочечный полинуклеотид, гибридизированный с одноцепочечным олигонуклеотидом, который прикреплен к полимерной частице, причем по меньшей мере один нуклеотид полимеризируют на конце одноцепочечного олигонуклеотида.
Согласно вариантам осуществления, способы удлинения праймера предусматривают: проведение реакции удлинения праймера на полинуклеотиде, который гибридизирован с олигонуклеотидом, который прикреплен к полимерной частице. Согласно вариантам осуществления, способы удлинения праймера нуклеиновой кислоты предусматривают: (a) внесение полимерной частицы прикрепленной к одноцепочечному олигонуклеотиду (например, праймерному олигонуклеотиду), (b) внесение одноцепочечного матричного полинуклеотида, (c) гибридизацию одноцепочечного олигонуклеотида с одноцепочечным матричным полинуклеотидом и (d) приведение одноцепочечного матричного полинуклеотида в контакт с полимеразой и по меньшей мере одним нуклеотидом в условиях, подходящих для того, чтобы полимераза катализировала полимеризацию по меньшей мере одного нуклеотида на одноцепочечном олигонуклеотиде, с удлинением, таким образом, праймера. Согласно вариантам осуществления, каждая из полимерных частиц может быть прикреплена ко множеству одноцепочечных олигонуклеотидов (например, олигонуклеотидов для захвата). Согласно вариантам осуществления, этап (b), (c) или (d) можно выполнять со множеством одноцепочечных полинуклеотидов. Согласно вариантам осуществления, по меньшей мере часть одноцепочечного олигонуклеотида содержит нуклеотидную последовательность, которая является комплементарной (или частично комплементарной) по меньшей мере части одноцепочечного полинуклеотида. Согласно вариантам осуществления, система содержит одноцепочечный полинуклеотид, гибридизированный с одноцепочечным олигонуклеотидом, который прикреплен к полимерной частице, причем одноцепочечный олигонуклеотид удлиняют на один или несколько нуклеотидов.
Согласно вариантам осуществления, способы амплификации нуклеиновой кислоты предусматривают: проведение реакции удлинения праймера на полинуклеотиде, который гибридизирован с олигонуклеотидом, который прикреплен к полимерной частице. Согласно вариантам осуществления, способы амплификации нуклеиновой кислоты предусматривают: (a) внесение полимерной частицы прикрепленной к одноцепочечному олигонуклеотиду (например, праймерному олигонуклеотиду), (b) внесение одноцепочечного матричного полинуклеотида, (c) гибридизацию одноцепочечного олигонуклеотида с одноцепочечным матричным полинуклеотидом, (d) приведение одноцепочечного матричного полинуклеотида в контакт с полимеразой и по меньшей мере одним нуклеотидом в условиях, подходящих для того, чтобы полимераза катализировала полимеризацию по меньшей мере одного нуклеотида на одноцепочечном олигонуклеотиде, с образованием, таким образом, удлиненного одноцепочечного олигонуклеотида. Согласно вариантам осуществления, способ дополнительно предусматривает: (e) удаление (например, денатурацию) одноцепочечного матричного полинуклеотида из удлиненного одноцепочечного олигонуклеотида так, чтобы одноцепочечный олигонуклеотид оставался прикрепленным к полимерной частице, (f) гибридизацию оставшегося одноцепочечного олигонуклеотида со вторым одноцепочечным матричным полинуклеотидом и (g) приведение второго одноцепочечного матричного полинуклеотида в контакт со второй полимеразой и вторым по меньшей мере одним нуклеотидом в условиях, подходящих для того, чтобы вторая полимераза катализировала полимеризацию второго по меньшей мере одного нуклеотида на одноцепочечном олигонуклеотиде, с образованием, таким образом, очередного удлиненного одноцепочечного олигонуклеотида. Согласно вариантам осуществления, этапы (e), (f) и (g) можно повторить по меньшей мере один раз. Согласно вариантам осуществления, полимераза и вторая полимераза включают термоустойчивую полимеразу. Согласно вариантам осуществления, условия, подходящие для нуклеотидной полимеризации, включают выполнение этапов нуклеотидной полимеризации (например, этапов (d) или (g)) при повышенной температуре. Согласно вариантам осуществления, условия, подходящие для нуклеотидной полимеризации, включают выполнение этапов нуклеотидной полимеризации (например, этапов (d) или (g)) при переменных температурах (например, повышенной температуре и относительно более низкой температуре). Согласно вариантам осуществления, переменная температура варьирует в диапазоне от 60 до 95°C. Согласно вариантам осуществления, температурные циклы могут составлять от приблизительно 10 секунд до приблизительно 5 минут, или приблизительно 10 минут, или приблизительно 15 минут, или дольше. Согласно вариантам осуществления, при помощи способов амплификации нуклеиновых кислот можно получить одну или несколько полимерных частиц, каждая из которых прикреплена ко множеству матричных полинуклеотидов, содержащих последовательности, которые являются комплементарными одноцепочечному матричному полинуклеотиду или второму одноцепочечному матричному полинуклеотиду. Согласно вариантам осуществления, каждая из полимерных частиц может быть прикреплена ко множеству одноцепочечных олигонуклеотидов (например, олигонуклеотидов для захвата). Согласно вариантам осуществления, этап (b), (c), (d), (e), (f) или (g) можно выполнять со множеством одноцепочечных полинуклеотидов. Согласно вариантам осуществления, по меньшей мере часть одноцепочечного олигонуклеотида содержит нуклеотидную последовательность, которая является комплементарной (или частично комплементарной) по меньшей мере части одноцепочечного полинуклеотида. Согласно вариантам осуществления, способы амплификации нуклеиновых кислот (которые описаны выше) можно осуществлять в растворе водной фазы в масляной фазе (например, капле дисперсной фазы).
После PCR получают частицы, такие как частица 210, которые могут включать гидрофильную частицу 212 и множество копий 214 полинуклеотида. Не смотря на то, что полинуклеотиды 214 проиллюстрированы как находящиеся на поверхности частицы 210, полинуклеотиды можно удлинять внутри частицы 210. Частицы гидрогеля и гидрофильные частицы, имеющие низкую концентрацию полимера по отношению к воде, могут включать полинуклеотидные сегменты на внутренней части частицы и по всей частице 210, или полинуклеотиды могут располагаются в порах и других отверстиях. В частности, частица 210 может допускать диффузию ферментов, нуклеотидов, праймеров и продуктов реакции, используемых для наблюдения за реакцией. Высокое число полинуклеотидов на частицу дает более хороший сигнал.
Согласно вариантам осуществления, полимерные частицы, полученные в результате осуществления процедуры деэмульгирования, можно собрать и промыть при подготовке к секвенированию. Сбор можно выполнять посредством приведения биотиновых частиц (например, связанных с амплифицированными полинуклеотидными матрицами, которые прикреплены к полимерным частицам) в контакт с авидиновыми частицами и отделения от полимерных частиц без биотинилированных матриц. Собранные полимерные частицы, которые несут двухцепочечные матричные полинуклеотиды, можно денатурировать с образованием одноцепочечных матричных полинуклеотидов для секвенирования. Этапы денатурации могут включать обработку основанием (например, NaOH), формамидом или пирролидоном.
Согласно иллюстративному варианту осуществления частицу 210 можно использовать в устройстве для секвенирования. Например, устройство 216 для секвенирования может включать матрицу 218 с лунками. Частицу 210 можно поместить в лунку 218.
Согласно примеру, в лунки 218 можно добавить праймер или частицу 210 можно предварительно подвергнуть действию праймера перед размещением в лунке 218. В частности, частица 210 может включать связанный праймер. Праймер и полинуклеотид образуют дуплекс нуклеиновой кислоты, включающий полинуклеотид (например, матричную нуклеиновую кислоту), гибридизированный с праймером. Дуплекс нуклеиновой кислоты по меньшей мере частично является двухцепочечным полинуклеотидом. В лунке 218 могут быть предусмотрены ферменты и нуклеотиды для облегчения прохождения детектируемых реакций, таких как нуклеотидное встраивание.
Секвенирование можно осуществлять посредством детектирования присоединения нуклеотида. Присоединение нуклеотида можно детектировать с применением таких способов, как способы на основе флуоресцентного излучения или способы детектирования ионов. Например, для системы 216 может быть предусмотрен набор нуклеотидов с флуоресцентной меткой, он и может быть перенесен в лунку 218. Лунку 218 также можно подвергнуть действию энергии возбуждения. При захвате нуклеотида полимеразой и присоединении его к концу удлиняющегося праймера метка нуклеотида может флуоресцировать, указывая какой тип нуклеотида присоединен.
Согласно альтернативному примеру, растворы, содержащие один тип нуклеотида, можно подавать последовательно. В ответ на присоединение нуклеотида pH локальной среды лунки 218 может изменяться. Такое изменение pH можно детектировать посредством ионно-чувствительных полевых транзисторов (ISFET). В этой связи, изменение pH можно использовать для создания сигнала, указывающего порядок нуклеотидов, комплементарных полинуклеотиду частицы 210.
В частности, система для секвенирования может включать лунку или множество лунок, расположенные над панелью с ионным датчиком, таким как транзистор на эффекте поля (FET). Согласно вариантам осуществления, система включает одну или несколько полимерных частиц, загруженных в лунку, которая расположена над панелью с ионным датчиком (например, FET), или одну или несколько полимерных частиц, загруженных во множество лунок, которые расположены над панелями с ионными датчиками (например, FET). Согласно вариантам осуществления, FET может представлять собой chemFET или ISFET. "ChemFET" или химический транзистор на эффекте поля включает тип транзистора на эффекте поля, который действует как химический датчик. ChemFET имеет структурный аналог транзистора MOSFET, в котором заряд на электроде затвора подается в результате химического процесса. "ISFET" или ионно-селективный полевой транзистор можно применять для измерения концентраций ионов в растворе, при изменении концентрации ионов (таких как H+) ток через транзистор изменяется соответственно.
Согласно вариантам осуществления, FET может представлять собой матрицу FET. Применяемый в настоящем документе термин "матрица" представляет собой планарное упорядочивание элементов, таких как датчики или лунки. Матрица может быть одномерной или двухмерной. Одномерная матрица может представлять собой матрицу, имеющую одну колонку (или ряд) элементов в первой координате и множество колонок (или рядов) во второй координате. Число колонок (или рядов) в первой или второй координате может быть одинаковым или не быть одинаковым. FET или матрица может включать 102, 103, 104, 105, 106, 107 или более FET.
Согласно вариантам осуществления, под матрицей FET-датчиков могут быть сформированы одна или несколько микропотоковых структур, предназначенные для сдерживания или ограничения биологической или химической реакции. Например, согласно одному осуществлению, микрожидкостная сруктура(структуры) может быть сконфигурирована в виде одной или нескольких лунок (или микролунок, или реакционных камер, или реакционных лунок, названия которых в настоящем документе используют взаимозаменяемо), размещенных под одним или несколькими датчиками матрицы, так, чтобы один или несколько датчиков, над которыми размещена указанная лунка, детектировали и измеряли наличие анолита, уровень или концентрацию в указанной лунке. Согласно вариантам осуществления, соответствие FET-датчиков и реакционных лунок может составлять 1:1.
Обратимся к Фиг. 2, согласно другому примеру, лунку 218 в матрице лунок можно функционально связать с измерительными устройствами. Например, для способов на основе флуоресцентного излучения лунку 218 можно функционально связать с устройством для детектирования света. Что касается ионного детектирования, нижнюю поверхность лунки 218 можно расположить поверх панели с ионным датчиком, таким как транзистор на эффекте поля.
Одна иллюстративная система, включающая секвенирование посредством детектирования ионных побочных продуктов нуклеотидного встраивания, представляет собой секвенсер Ion Torrent PGM™ (Life Technologies), который является системой ионного секвенирования, которая секвенирует матрицы нуклеиновой кислоты посредством детектирование ионов водорода, вырабатываемых как побочный продукт нуклеотидного встраивания. Как правило, ионы водорода выделяются в качестве побочных продуктов нуклеотидных встраиваний, происходящих в ходе матричного синтеза нуклеиновых кислот посредством полимеразы. Секвенсор Ion Torrent PGM™ детектирует нуклеотидные встраивания посредством детекции водородных ионных побочных продуктов нуклеотидных встраиваний. Секвенсер Ion Torrent PGM™ может включать множество подлежащий секвенированию матричных полинуклеотидов, каждый матричный полинуклеотид расположен в соответственной лунке для реакции секвенирования в матрице. Каждая из лунок матрицы может быть связана по меньшей мере с одним ионным датчиком, который может детектировать высвобождение ионов Н+ или изменения pH раствора, производимого в качестве побочного продукта нуклеотидного встраивания. Ионный датчик включает транзистор на эффекте поля (FET), соединенный с ионно-чувствительным слоем для детекции, который может воспринимать наличие ионов Н+ или изменения pH раствора. Ионный датчик может подавать выходные сигналы, указывающие на нуклеотидное встраивание, которые можно представить как скачкообразное изменение напряжения, величина которого коррелирует с концентрацией ионов Н+ в соответственной лунке или реакционной камере. В реакционную камеру можно последовательно подавать потоком различные типы нуклеотидов, а они могут быть встраиваться полимеразой в удлиняющийся праймер (или участок полимеризации) в порядке, определяемом последовательностью матричного полинуклеотида. Каждое нуклеотидное встраивание может сопровождаться высвобождением ионов Н+ в реакционной лунке вместе с сопутствующим изменением локального pH. Высвобождение ионов Н+ можно регистрировать посредством FET датчика, который производит сигналы, указывающие на осуществление нуклеотидного встраивания. Нуклеотиды, которые не встроились в ходе потока конкретного нуклеотида, не могут производить сигналы. Амплитуда сигналов от FET также можно коррелировать с числом нуклеотидов конкретного типа, встраивающихся в удлиняющуюся молекулу нуклеиновой кислоты, что, таким образом, позволяет анализировать гомополимерные участки. Таким образом, отслеживание встраивания по многочисленным лункам или реакционным камерам в ходе цикла множества потоков нуклеотидов секвенсора в реакционную камеру может позволить прибору одновременный анализ последовательности множества полинуклеотидов. Дополнительные детали касательно композиций, схемы и принципа действия секвенсора Ion Torrent PGM™ можно найти, например, в заявке на выдачу патента США №12/002781, в настоящее время опубликованной как патентная публикация США №2009/0026082, и выданном патенте США №8262900, заявке на выдачу патента США №12/474897, в настоящее время опубликованной как патентная публикация США №2010/0137143, и заявке на выдачу патента США №12/492844, в настоящее время опубликованной как патентная публикация США №2010/0282617, все из которых включены с помощью ссылки в настоящий документ в полном их объеме.
Из вариантов осуществления полимерных частиц видны технические преимущества при применении в методиках секвенирования, особенно в методиках ионного секвенирования. В частности, варианты осуществления полимерных частиц не предусматривают использование буфера или повышают длительность или точность считывания.
Согласно дальнейшему примеру, у полимерных частиц можно наблюдать большую однородность и более низкий CV без фильтрации, чем у частиц, полученных согласно другим способам. Например, с помощью приведенных выше способов можно непосредственно получать полимерные частицы без применения какой-либо процедуры отбора, такой как фильтрование или применение центрифуги. В частности, полимеризацию в эмульсии можно применять для получения частиц, подходящих в качестве затравочных частиц. Как правило, затравочные частицы являются несшитыми с тем, чтобы они могли адсорбировать молекулу промотора.
В норме, для получения затравочных частиц с CV, составляющим менее 5%, применяют стирол, а сообщения по другим мономерам являются малочисленными. К удивлению и предпочтительно, tBDMS НЕАМ можно применять для получения зародышей с CV, составляющим 2%, при помощи способа, такого как описанный выше способ полимеризации в эмульсии.
Кроме того, варианты осуществления настоящего способа предусматривают контроль размера, основанный на размере затравочной частицы. Дополнительно, варианты осуществления частиц, получаемых посредством таких способов, обеспечивают повышение конъюгации, к примеру повышение конъюгации на 60-80%, по сравнению с другими способами.
Например, при измерении на Ion Torrent 314 PGM, варианты осуществления конъюгированных полимерных частиц характеризуются средними длинами считывания Q17 по меньшей мере 200 п.о., к примеру, по меньшей мере 250 п.о., по меньшей мере 300 п.о., по меньшей мере 350 п.о. или даже по меньшей мере 400 п.о. В частности, конъюгированные полимерные частицы могут характеризоваться средними длинами считывания Q17 по меньшей мере 500 п.о. Согласно другому примеру, совокупности конъюгированных полимерных частиц характеризуются проходом 200Q17 по меньшей мере 200 тысяч, к примеру, по меньшей мере 300 тысяч, по меньшей мере 350 тысяч или даже по меньшей мере 400 тысяч.
Примеры
Пример 1
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((трет-бутилдиметилсилил)окси)этил)акриламид) получали из гидроксиалкилакриламидного мономера и галогенированной силильной группы.
К раствору гидроксиэтилакриламида (50,01 г, 434 ммоль) и имидазола (73,94 г, 1086 ммоль) в DMF (132 г) добавляли t-бутилдиметилсилила хлорид (66,11 г, 439 ммоль) за три части с 30 минутными интервалами при 0°C в условиях инертной атмосферы (Ar). Через 15 минут после последнего добавления добавляли дополнительный DMF (18,90 г). Реакционной смеси позволяли постепенно достичь комнатной температуры и помешивали в течение примерно 24 часов. Реакционную смесь гасили водой (101 г) и помешивали в течение одного часа. Смесь затем экстрагировали простым диэтиловым эфиром и промывали водой и солевым раствором. Органическую фазу сушили (MgSO4) на протяжении ночи. Выпаривание давало 93,59 г продукта. Для окончания выпаривания добавляли 4-метоксифенол (MEHQ) (9 мг, 100 ppm). Продукт хранили при -20°C.
Пример 2
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((трет-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризировали в дисперсной фазе и удаляли защитную группу с получением частицы гидрогеля.
Эмульсию инициатора получали посредством смешивания 1,14 г додецилсульфата натрия (SDS), 190 г воды, 9,50 г ацетона и 19,0 г диоктаноилпероксида при помощи гомогенизатора ultraturax типа Ystral™ X10/25 ("ultraturax") в течение 2 минут и гомогенизировали при помощи гомогенизатора под давлением в течение 7 минут.
В 0,5 л сосуде 202,42 г дисперсии монодисперсных полистироловых зародышей размером 0,53 микрона с содержанием твердой фазы 7,2 мас.% смешивали с 115,65 г эмульсии инициатора. Смесь помешивали при 26°C в течение 20 часов с получением раствора промотированных зародышей.
Раствор PVP получали из 16,02 г поливинилпирролидона (PVP) К-30. К-30 медленно добавляли к 959 г воды и помешивали в течение 30 минут с последующим добавлением 1,08 г SDS.
Буферный раствор готовили из 47,99 г гидрокарбоната натрия, добавленного к 912 г воды.
Эмульсию мономеров готовили из 19,63 г толуола, 11,49 г tBDMS-HEAM, 0,77 г диметакрилата этиленгликоля (EDMA), 187,42 г воды и 186,4 г раствора ΡVP, перемешанных с помощью ultraturax в течение 2 минут, и дополнительно гомогенизировали в течение 5 минут.
В 0,5 л реактор добавляли 29,45 г промотированных затравочных частиц и 189,93 г эмульсии мономеров с последующим добавлением 26,65 г буфферного раствора. Смесь помешивали в течение 2 часов при 25°C и затем добавляли 53,33 г воды. Смесь нагревали до 60°C. Спустя 1 час при 60°C температуру поднимали до 70°C и сохраняли на уровне 70°C в течение 5 часов.
Реакционную смесь переносили в 1-литровый сосуд для центрифугирования и центрифугировали в центрифуге Sorvall RC3CPlus в течение 60 минут со скоростью 4500 об/мин Кремообразный флотационный продукт переносили в новый 1-литровый сосуд и центрифугировали два раза в тетрагидрофуране (THF).
Разбухший в THF гелевый осадок смешивали с ледяной уксусной кислотой и водой до массового соотношения 1:3:1 и встряхивали при комнатной температуре на протяжении ночи. Гель обрабатывали посредством удаления надосадочной жидкости после центрифугирования и добавления смеси THF и воды в соотношении ТНР:вода 1:1, два раза и один раз воды, с последующим трехкратным диметилформамидом (DMF) и трехкратным сухим DMF.
Пример 3
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением частицы гидрогеля.
Карбонатный буферный раствор готовили из 42,1 г гидрокарбоната натрия, добавленного к 800 г воды с получением 0,5 M буферного раствора. Доводили pH буфера до 10 при помощи 0,5 M гидроксида натрия.
Эмульсию инициатора готовили из 0,96 г SDS, 160 г воды, 8,00 г ацетона и 16,0 г диоктаноилпероксида. Доводили pH до 9 при помощи 0,5 M раствора карбонатного буфера. Смесь гомогенизировали при помощи гомогенизатора ultraturax типа Ystral™ XI0/25 ("ultraturax") в течение 2 минут и гомогенизировали при помощи гомогенизатора под давлением в течение 6 минут.
В 0,5 л сосуде 31,2 г дисперсии монодисперсных полистироловых зародышей размером 0,31 микрона с содержанием твердой фазы 15,91 мас.% смешивали с 103,1 г эмульсии инициатора. Смесь помешивали при 26°C в течение 20 часов с получением дисперсии промотированных зародышей.
Раствор PVA готовили посредством медленного добавления 80 г 87-89% гидролизированного поливинилового спирта (PVA) к 2000 г воды, помешивания и нагревания до 80°C в течение 1 часа и охлаждения. Раствор ΡVA в количестве 91 г смешивали с 867 г воды, 0,74 г SDS и 4,24 г 0,5 M натрий-карбонатного буфера.
Эмульсию мономеров готовили из 29,2 г толуола, 7,71 г tBDMS-HEAM, 0,76 г EDMA и 249 г раствора PVA, перемешанных посредством ultraturax в течение 2 минут, и дополнительно гомогенизировали в течение 5 минут.
В 0,5 л реактор добавляли 13,3 г промотированных затравочных частиц и 287 г эмульсии мономеров. Смесь помешивали в течение 1 часа при 25°C и нагревали до 50°C. Спустя 1 час при 50°C температуру повышали до 70°C. Спустя два часа добавляли 2,8 мл 0,5 M буферного раствора и температуру поддерживали в течение еще одного часа.
Реакционную смесь переносили в 1-литровый сосуд для центрифугирования и центрифугировали в центрифуге Sorvall RC3CPlus в течение 60 минут со скоростью 4500 об/мин Кремообразный флотационный продукт переносили в новый 1-литровый сосуд и центрифугировали два раза в THF.
К 102 г разбухшего в THF гелевого осадка добавляли ледяную уксусную кислоту и воду в массовом соотношении 1:3:1 и дисперсию встряхивали при комнатной температуре на протяжении ночи. Гель обрабатывали посредством удаления надосадочной жидкости после центрифугирования и двухкратного добавления THF и воды в соотношении ТНР:вода 1:1 с последующим трехкратным центрифугированием с DMF и тремя центрифугированиями с сухим DMF.
По результатам определения содержание твердой фазы продукта составляло 0,48 г, а диаметр гранулы в воде по результатам микроскопии составлял 1,6 микрона.
Пример 4
Частицы гидрогеля, полученные согласно примеру 13, активировали с помощью трезилхлорида.
В частности, 26 г дисперсии DMF, содержавшей 3,08% геля с гидроксильными группами из описанного выше примера 3, промывали три раза при помощи 30 мл безводного DMF посредством центрифугирования и удаления надосадочной жидкости. После последнего центрифугирования объем геля в DMF доводили до 26 мл и пробирку быстро продували аргоном. Добавляли безводный пиридин в количестве 0,241 мл с последующим добавлением 0,318 г трезилхлорида. Пробирку встряхивали на протяжении ночи. Дисперсию четыре раза центрифугировали с 30 мл ледяного безводного DMF, удаляя надосадочную жидкость после каждого центрифугирования, и два раза центрифугировали с ледяным безводным N-метил-2-пирролидоном (NMP). Частицы ресуспендировали в 50 мл (2% сухого) безводного NMP.
Пример 5
Частицы гидрогеля, полученные согласно примеру 13, активировали с помощью фозилхлорида.
Дисперсию DMF в количестве 26 г, содержавшую 3,08% геля с гидроксильными группами из примера 3, три раза промывали при помощи 30 мл безводного DMF посредством центрифугирования и удаления надосадочной жидкости. После последнего центрифугирования объем геля в DMF доводили до 26 мл и пробирку быстро продували аргоном. Добавляли безводный пиридин в количестве 0,080 мл с последующим добавлением 0,313 г фозилхлорида. Пробирку встряхивали на протяжении ночи и центрифугировали, удаляя надосадочную жидкость и добавляя 30 мл ледяного безводного DMF четыре раза и ледяного безводного NMP два раза. Частицы ресуспендировали в 50 мл (2% сухого) безводного NMP.
Пример 6
Частицы гидрогеля, полученные согласно примеру 13, активировали с помощью метилсульфонилхлорида.
DMF в количестве 16 г, содержавший 3,08% гелья с гидроксильными группами из примера 3, промывали три раза при помощи 30 мл безводного DMF посредством центрифугирования и удаления надосадочной жидкости. После последнего центрифугирования объем геля в DMF доводили до 16 мл и пробирку быстро продували аргоном. Добавляли безводный пиридин в количестве 0,049 мл с последующим добавлением 0,313 г метилсульфонилхлорида. Пробирку встряхивали на протяжении ночи и центрифугировали, удаляя надосадочную жидкость и добавляя 30 мл ледяного безводного DMF четыре раза и ледяного безводного NMP два раза. Частицы ресуспендировали в 50 мл (2% сухого) безводного NMP.
Пример 7
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали с помощью дивинилбензольного сшивателя в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением частицы гидрогеля.
Эмульсию инициатора готовили из 1,26 г SDS, 210 г воды, 10,5 г ацетона и 21,0 г диоктаноилпероксида, перемешанных при помощи гомогенизатора ultraturax типа Ystral™ Χ10/25 ("ultraturax") в течение 2 минут и гомогенизировали посредством гомогенизатора под давлением в течение 7 минут.
В 0,5 л сосуде 40,7 г дисперсии монодисперсных полистироловых зародышей размером 0,31 микрона с содержанием твердой фазы 15,9 мас.% смешивали с 142,2 г эмульсии инициатора. Смесь помешивали при 26°C в течение 48 часов с получением дисперсии промотированных зародышей.
Раствор PVA получали посредством медленного добавления 80 г 87-89% гидролизированного поливинилового спирта (PVA) к 2000 г воды и помешивания и нагревания до 80°C в течение 1 часа. Затем раствор PVA охлаждали.
К 208 г концентрированного раствора PVA добавляли 1806 г воды, 1,76 г SDS и 7,68 г тетраборнокислого натрия, получая раствор тетраборнокислого натрия и PVA.
Толуол в количестве 31,08 г, 9,79 г tBDMS НЕАМ, 0,37 г 80% дивинилбензола (DVB) (содержавшего 0,296 г DVB и 0,074 г этилвинилбензола), 273,7 г раствора тетраборнокислого натрия и PVA смешивали посредством ultraturax в течение 2 минут и дополнительно гомогенизировали в течение 5 минут с получением эмульсии мономеров.
В 0,5 л реакторе 10,1 г промотированных затравочных частиц смешивали с 289,9 г эмульсии мономеров. Смесь помешивали в течение 1 часа при 30°C, 1 часа при 50°C и 2 часов при 75°C.
Реакционную смесь переносили в 1-литровый сосуд для центрифугирования и центрифугировали в центрифуге Sorvall RC3CPlus в течение 80 минут со скоростью 4500 об/мин Кремообразный флотационный продукт собирали и центрифугировали шесть раз в THF.
К 160 г разбухшего в THF гелевого осадка добавляли ледяную уксусную кислоту и воду в массовом соотношении 1:3:1. Дисперсию встряхивали при комнатной температуре на протяжении ночи. Гель обрабатывали посредством удаления надосадочной жидкости после центрифугирования и добавления THF и воды в соотношении ТНР:вода 1:1 два раза и один раз воды с последующим трехкратным DMF. Затем определяли, что содержание твердой фазы DMF составляло 1,01 г. Дисперсию гранул переносили в воду и проверяли посредством микроскопии. Гранулы были моноразмерными, а диаметр гранулы составлял 1,9 микрона.
Пример 8
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали с помощью сшивателя с защитной группой в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением частицы гидрогеля.
Концентрированный раствор PVA готовили из 80 г поливинилового спирта (PVA), медленно добавляемого к 2000 г воды. Раствор помешивали и нагревали до 80°C в течение 1 часа и охлаждали.
К 160,5 г концентрированного раствора PVA добавляли 1425 г воды, 1,56 г SDS и 6,06 г тетраборнокислого натрия. Доводили pH раствора до 8,2 при помощи 2 M HCl.
Толуол в количестве 11,8 г, 11,80 г 3-фенилпропанола, 0,15 г 2,2'-азобис-(2-метилбутиронитрила) (AMBN), 7,78 г tBDMS НЕАМ, 1,44 г N,N'-(N-(2-((триэтилсилил)окси)пропан-1,3-диил)диакриламида (TES-PBAM) (82% чистоты) и 291,6 г раствора тетраборнокислого натрия и PVA смешивали посредством ultraturax в течение 2 минут, и дополнительно гомогенизировали в течение 5 минут с получением эмульсии мономеров.
В 0,5 л реакторе 5,96 г водной дисперсии полистироловых затравочных частиц (диаметр зародыша 0,385 мкм, 8,08 мас.% твердых веществ) смешивали с 294,5 г эмульсии мономеров. Газообразным аргоном (10-20 мл/мин) барботировали смесь, одновременно помешивая и нагревая 1 час при 30°C и 1 час при 50°C. Поток аргона останавливали, а нагрев и помешивание продолжали в течение 3 часов при 80°C.
Реакционную смесь переносили в 1-литровый сосуд для центрифугирования и центрифугировали в центрифуге Sorvall RC3CPlus в течение 50 минут со скоростью 4500 об/мин Кремообразный флотационный продукт собирали и центрифугировали четыре раза в THF.
К 209 г разбухшего в THF гелевого осадка добавляли 209 г ледяной уксусной кислоты и 105 г воды. Смесь встряхивали при комнатной температуре на протяжении ночи. Гель обрабатывали посредством удаления надосадочной жидкости после центрифугирования и добавления THF и воды в соотношении THF:вода 1:1 два раза и один раз воды с последующим трехкратным DMF.
По результатам определения содержание твердой фазы составляло 1,97 г. Под микроскопом с фазоконтрастным оборудованием можно было измерить, что диаметр разбухшего в воде геля составлял 1,9 мкм. CV составлял не более 5,0%.
Пример 9
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали с помощью сшивателя N,N'-(этан-1,2-диил)бис(N-((терт-бутилдиметилсилил)окси)этил)акриламида (tBDMS ЕВНЕАМ) в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением частицы гидрогеля.
Концентрированный раствор PVA получали из 80 г поливинилового спирта (PVA), медленно добавляемого к 2000 г воды, с последующим помешиванием и нагреванием до 80°C в течение 1 часа и охлаждением.
К 88 г концентрированного раствора PVA добавляли 785 г воды, 0,88 г SDS и 3,33 г тетраборнокислого натрия с получением раствора тетраборнокислого натрия и PVA.
Эмульсию мономеров получали из 7,82 г толуола, 0,040 г 2,2'-азобис-(2-метилбутиронитрила) (AMBN), 2,06 г tBDMS НЕАМ, 0,51 г tBDMS-EBHEAM (95% чистоты) и 92,9 г раствора тетраборнокислого натрия PVA, смешанных посредством ultraturax в течение 2 минут, и дополнительно гомогенизировали в течение 5 минут.
В 0,5 л реакторе 5,96 г водной дисперсии затравочных частиц (диаметр зародыша 0,319 мкм, 8,07 мас.% твердых веществ) смешивали с 88,34 г эмульсии мономеров. Газообразным аргоном (10-20 мл/мин) барботировали смесь, одновременно помешивая и нагревая 1 час при 30°C и 2 часа при 40°C. Поток аргона останавливали, а нагрев и помешивание продолжали в течение 3 часов при 80°C.
Реакционную смесь переносили в 1-литровый сосуд для центрифугирования и центрифугировали в центрифуге Sorvall RC3CPlus в течение 50 минут со скоростью 4500 об/мин Кремообразный флотационный продукт собирали и центрифугировали два раза в THF.
К 83,9 г разбухшего в THF гелевого осадка добавляли такую же массу ледяной уксусной кислоты и половину массы воды. Смесь встряхивали при комнатной температуре на протяжении ночи. Гель обрабатывали посредством удаления надосадочной жидкости после центрифугирования и добавления THF и воды в соотношении THF:вода 1:1 два раза и один раз воды с последующим трехкратным DMF.
По результатам определения содержание твердой фазы составляло 1,63 г. Диаметр разбухшего в воде геля измеряли под микроскопом с фазоконтрастным оборудованием, и в среднем он составлял 1,6 мкм. CV составлял не более 5,0%.
Пример 10
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали с помощью дивинибензольного сшивателя (DVB) в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением частицы гидрогеля.
Эмульсию инициатора готовили из 1,2 г SDS, 200 г воды, 10 г ацетона и 20,0 г диоктаноилпероксида, смешанных при помощи гомогенизатора ultraturax типа Ystral™ Х10/25 ("ultraturax") в течение 2 минут, и гомогенизировали посредством гомогенизатора под давлением в течение 7 минут.
В 0,5 л сосуде 31,64 г дисперсии моно дисперсных полистироловых зародышей размером 0,13 микрон с содержанием твердой фазы 4,55 мас.% смешивали с 15,84 г эмульсии инициатора. Смесь помешивали при 26°C в течение 6 дней с получением дисперсии промотированных зародышей.
Готовили раствор тетраборнокислого натрия с помощью 1922 г воды, смешанных с 5,92 г SDS и 7,33 г тетраборнокислого натрия.
Эмульсию мономеров готовили из 172,4 г толуола, 54,76 г tBDMS НЕАМ, 2,75 г 80% дивинилбензола (DVB) (содержавшего 2,2 г DVB и 0,55 г этилвинилбензола) и 1468 г раствора тетраборнокислого натрия, смешанных посредством ultraturax, и дополнительно гомогенизировали в течение 17 минут.
В 0,5 л реакторе 22,6 г промотированных затравочных частиц смешивали с 277,6 г эмульсии мономеров. Смесь помешивали в течение 1 часа при 30°C, 1 часа при 40°C и 2 часов при 75°C.
Реакционную смесь переносили в 1-литровый сосуд для центрифугирования и центрифугировали в центрифуге Sorvall RC3CPlus в течение 90 минут со скоростью 4500 об./мин Кремообразный флотационный продукт собирали и центрифугировали четыре раза в THF.
К 73,3 г разбухшего в THF гелевого осадка добавляли равную массу ледяной уксусной кислоты и 36,7 г воды, а дисперсию встряхивали при комнатной температуре на протяжении ночи. Гель обрабатывали посредством удаления надосадочной жидкости после центрифугирования и добавления THF и воды в соотношениях THF:вода 7:3 и ТНР:вода 6:4, с последующим трехкратным центрифугированием с DMF.
По результатам определения содержание твердой фазы составляло 1,50 г.
Пример 11
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали с помощью DVB-сшивателя в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением гидрофильной частицы.
Концентрированный раствор PVA готовили из 80 г поливинилового спирта (PVA), медленно добавляемого к 2000 г воды. Дисперсию помешивали и нагревали до 80°C в течение 1 часа и охлаждали.
К 208 г концентрированного раствора PVA добавляли 1814 г воды, 2,08 г SDS и 7,71 г тетраборнокислого натрия с получением раствора тетраборнокислого натрия и PVA.
Эмульсию мономеров готовили из 22,34 г толуола, 0,164 г 2,2'-азобис-(2-метилбутиронитрила) (AMBN), 16,58 г tBDMS НЕАМ, 3,46 г 80% дивинилбензола (содержавшего 2,77 г DVB и 0,69 г этилвинилбензола) и 275 г раствора тетраборнокислого натрия и PVA, смешанных посредством ultraturax в течение 2 минут, и дополнительно гомогенизировали в течение 5 минут.
В 0,5 л реакторе 8,46 г водной дисперсии затравочных частиц (диаметр зародыша 0,550 мкм, 7,20 мас.% твердых веществ) смешивали с 292,15 г эмульсии мономеров. Смесь помешивали и нагревали в течение 1 часа при 30°C, 1 часа при 50°C и 2 часов при 75°C.
Реакционную смесь переносили в 1-литровый сосуд для центрифугирования и центрифугировали в центрифуге Sorvall RC3CPlus в течение 50 минут со скоростью 4500 об./мин Кремообразный флотационный продукт собирали и центрифугировали два раза в THF.
К 83,9 г разбухшего в THF гелевого осадка добавляли такую же массу ледяной уксусной кислоты и половину массы воды. Смесь встряхивали при комнатной температуре на протяжении ночи. Гель обрабатывали посредством удаления надосадочной жидкости после центрифугирования и добавления THF и воды в соотношении THF:вода 1:1 два раза и один раз воды с последующим трехкратным DMF.
По результатам определения содержание твердой фазы составляло 7,5 г. Диаметр разбухшего в воде геля можно было измерить под микроскопом с фазоконтрастным оборудованием, и определяли, что в среднем он составлял 1,8 мкм. CV составлял не более 5,0%.
Пример 12
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали с помощью сшивателя tBDMS-EBHEAM в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением частицы гидрогеля.
Концентрированный раствор PVA получали из 80 г поливинилового спирта (PVA), медленно добавляемого к 2000 г воды, с последующим помешиванием и нагреванием до 80°C в течение 1 часа и охлаждением.
К 88 г концентрированного раствора PVA добавляли 785 г воды, 0,88 г SDS и 3,33 г тетраборнокислого натрия с получением раствора тетраборнокислого натрия и ΡVA.
Эмульсию мономеров получали из 7,82 г толуола, 0,040 г 2,2'-азобис-(2-метилбутиронитрила) (AMBN), 2,06 г tBDMS НЕАМ, 0,96 г tBDMS-EBHEAM (95% чистоты) и 92,9 г раствора тетраборнокислого натрия и PVA, смешанных посредством ultraturax в течение 2 минут, и дополнительно гомогенизировали в течение 5 минут.
В 0,5 л реакторе 5,96 г водной дисперсии затравочных частиц (диаметр зародыша 0,319 мкм, 8,07 мас.% твердых веществ) смешивали с 88,34 г эмульсии мономеров. Газообразным аргоном (10-20 мл/мин) барботировали смесь, одновременно помешивая и нагревая 1 час при 30°C и 2 часа при 40°C. Поток аргона останавливали, а нагрев и помешивание продолжали в течение 3 часов при 80°C.
Реакционную смесь переносили в 1-литровый сосуд для центрифугирования и центрифугировали в центрифуге Sorvall RC3CPlus в течение 50 минут со скоростью 4500 об/мин Кремообразный флотационный продукт собирали и центрифугировали два раза в THF.
К 83,9 г разбухшего в THF гелевого осадка добавляли такую же массу ледяной уксусной кислоты и половину массы воды. Смесь встряхивали при комнатной температуре на протяжении ночи. Гель обрабатывали посредством удаления надосадочной жидкости после центрифугирования и добавления THF и воды в соотношении THF:вода 1:1 два раза и один раз воды с последующим трехкратным DMF.
По результатам определения содержание твердой фазы составляло 1,63 г. Диаметр разбухшего в воде геля измеряли под микроскопом с фазоконтрастным оборудованием, и в среднем он составлял 1,6 мкм. CV составлял не более 5,0%.
Пример 13
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали с помощью сшивателя N,N'-(этан-1,2-диил)бис(N-((трет-бутилдиметилсилил)окси)этил)акриламид (TBDMS ЕВНЕАМ) в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением гидрофильной частицы.
Концентрированный раствор PVA готовили посредством медленного добавления 80 г поливинилового спирта (PVA) к 2000 г воды при помешивании. Смесь помешивали и нагревали до 80°C в течение 1 часа и охлаждали.
К 241,8 г концентрированного раствора PVA добавляли 2128,6 г воды, 2,32 г SDS и 9,97 г тетраборнокислого натрия с получением раствора тетраборнокислого натрия и PVA.
Эмульсию мономеров готовили посредством смешивания 72,68 г толуола, 0,29 г 2,2'-азобис-(2-метилбутиронитрила) (AMBN), 14,59 г tBDMS НЕАМ, 4,46 г TBDMS ЕВНЕАМ и 835,8 г раствора тетраборнокислого натрия и PVA, смешанных посредством ultraturax в течении 2 минут, и дополнительно гомогенизировали в течение 9 минут в гомогенизаторе Gauline APV-100 под высоким давлением при 400 барах.
В 1 л реакторе 16,86 г водной дисперсии затравочных частиц (диаметр зародыша 0,319 мкм, 8,07 мас.% твердых веществ) смешивали с 897 г эмульсии мономеров. Смесь помешивали и нагревали в течение 3 часов при 40°C при одновременном барботировании смеси аргоном со скоростью 0,05 л/мин в течение первых 2 часов и со скоростью 0,15 л/ мин в течение 1 часа. Поток аргона затем останавливали и эмульсию нагревали в течение 3 часов при 80°C.
Реакционную смесь переносили в 1-литровый сосуд для центрифугирования и центрифугировали в центрифуге Sorvall RC3CPlus в течение 60 минут со скоростью 4700 об/мин Кремообразный флотационный продукт переносили в новый 500 мл стеклянный сосуд и ресуспендировали до 370,74 г водой, доводили pH до 3,86 при помощи 21,09 г 0,5 M уксусной кислоты. Смесь помешивали при 60°C в течение 2 часов.
Гель обрабатывали посредством добавления 9 объемов THF для удаления у геля защитных групп и центрифугировали в центрифуге Sorvall RC3CPlus в течение 10 минут со скоростью 3500 об/мин с последующими двумя центрифугированиями с DMF и двумя центрифугированиями с сухим DMF, все с добавлением 7,5% THF перед центрифугированием. Определяли, что содержание твердой фазы геля в DMF составляло 6,37 г. Дисперсию гранул переносили в воду и проверяли посредством микроскопии, и диаметр гранулы составлял 1,7 микрона в воде.
Пример 14
Частицы гидрогеля, полученные согласно примеру 13, активировали с помощью метансульфонилхлорида.
1,51 г геля с гидроксильными группами из примера 13, диспергированного в DMF, разделяли на две колбы для центрифугирования и три раза промывали путем центрифугирования и удаления надосадочной жидкости с применением смеси растворителей, представлявшей собой 200 мл безводного DMF и 15 г безводного THF. После последнего центрифугирования содержимое двух колб объединяли друг с другом и еще один раз промывали безводным DMF. По результатам определения сухое содержимое составляло 2,32 мас.%.
54,74 г дисперсии DMF, содержавшей 2,32 мас.% описанного выше геля с гидроксильными группами, переносили в три круглодонных, имеющих горлышко сосуда для кипячения с механическим помешиванием перед добавлением 8,76 г DMF для доведения сухого содержимого до 2,00%. Круглодонный сосуд для кипячения непрерывно продували аргоном. Добавляли безводный пиридин в количестве 0,2077 г с последующим добавлением 0,1692 г метансульфонилхлорида. Содержимое сосуда помешивали при комнатной температуре на протяжении ночи.
Дисперсию три раза центрифугировали с 200 мл безводного DMF, удаляя надосадочную жидкость после каждого центрифугирования и ресуспендировали в безводном N-метил-2-пирролидоне (NMP) с получением 122,81 г суспензии. По результатам определения сухое содержимое составляло 0,91%, что давало 1,12 г частиц активированного геля.
Пример 15
Получали примерно 280 миллион частиц гидрогеля как раскрыто в примере 11 и подвергали воздействию условий для облегчения дупликации полинуклеотидов, присутствующих в каплях дисперсной фазы.
Частицы гидрогеля инкубировали в присутствии библиотеки ДНК (L499, примерно 70 миллионов молекул) и ДНК-полимеразы Amplitaq Gold® (Applied Biosystems) или ДНК-полимеразы KOD Hot Start (EMD Biosciences). Образец вносили в систему Ion OneTouch™ (Life Technologies), собирали на подложке и обогащали в основном согласно инструкциям производителя. Процент выделения частиц гидрогеля перед обогащением определяли с помощью системы Guava SYBR Gold Stain. Обогащение частиц гидрогеля осуществляли с помощью системы Ion OneTouch ES™ (Life Technologies) в основном согласно инструкциям производителя (Life Technologies). Было обнаружено, что процент частиц гидрогеля после выделения (таблица 1) был ниже при применении KOD полимеразы, тем не менее, общие проценты выделения после обогащения были больше при применении KOD полимеразы (27,4%) по сравнению с 9,5% и 18,2%, соответственно, для ДНК-полимеразы Amplitaq Gold®.


Пример 14
Полимерные частицы получали в соответствии с примером 9, производили сульфонирование для обеспечения 15% мезилирования и обрабатывали ацетатом и концентрированным аммонием. После конъюгации и ПЦР полимерные частицы использовали в тесте по секвенированию с применением чипа Ion Torrent 316.
Полимерные частицы характеризовались значением 200q17, составлявшим 1,2 миллиона, к примеру, по меньшей мере 1,4 миллиона. Кроме того, полимерные частицы характеризовались значением aq17 при базовом тестировании, составлявшим по меньшей мере 350 миллиона, к примеру, по меньшей мере 400 миллиона. В дополнение к этому, частицы характеризовались средним значением q17, составлявшим по меньшей мере 175, к примеру, по меньшей мере 180.
Пример 15
Акриламидный мономер с защищенной силильной группой, (N-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали с помощью сшивателя tBDMS-EBHEAM в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением частицы гидрогеля.
Получали эмульсию путем сначала растворения 1,74 г SDS в 290,00 г воды, а затем добавления 14,50 г ацетона и 29,00 г бис(2-этилгексил)адипата (DOA). Эмульсию перемешивали с помощью ultraturax в течение 2 минут и дополнительно гомогенизировали в течение 5,6 минут в гомогенизаторе высокого давления Gauline APV-100 при давлении 400 бар.
К 43,89 г затравочных частиц (диаметр затравочных частиц 0,140 мкм, 4,85 мас.% твердых веществ) в сосуде добавляли 31,14 г такой эмульсии. Для активации смесь встряхивали при 40°C в течение 40 часов в качалке с водяным термостатом.
Готовили раствор SDS и тетраборнокислого натрия путем растворения 4,54 г SDS и 9,69 г тетраборнокислого натрия в 2369,8 г воды.
Получали эмульсию мономеров из 125,29 г 2-фенэтилацетата, 0,468 г 2,2'-азобис-(2-метилбутиронитрила) (AMBN), 19,51 г tBDMS НЕАМ, 5,99 г tBDMS-EBHEAM и 816,75 г раствор тетраборнокислого натрия и SDS, перемешивали с помощью ultraturax в течение 5 минут и дополнительно гомогенизировали в течение 9,68 минуты.
В 1 л реакторе 62,53 г водной дисперсии активированных затравочных частиц смешивали с 938,1 г эмульсии мономеров. Смесь помешивали и нагревали при температуре 40°C в течение 2 часов. Смесь дополнительно помешивали и нагревали при 40°C в течение еще одного часа при барботировании смеси газообразным аргоном (150-200 мл/мин). Количество O2 в эмульсии в этот момент времени представляло собой показатель, равный 0 ppb. Поток аргона останавливали и продолжали нагревание и помешивание в течение 10 часов при температуре 70°C.
Реакционную смесь переносили в четыре 250 мл сосуда для центрифугирования и центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 60 минут со скоростью 13000 об/мин Надосадочные жидкости отбрасывали, а осадки собирали и переносили в стеклянный сосуд путем добавления воды.
pH водной дисперсии гелей доводили до 3,8 путем добавления 0,5 M раствора уксусной кислоты. Подкисленную дисперсию геля встряхивали при 60°C в качалке с водяным термостатом в течение 2 часов и охлаждали.
Дисперсию геля переносили в три 1 л сосуда, в каждый добавляли 300 г THF, сосуды встряхивали при комнатной температуре в течение 30 минут на вибрационном столе и центрифугировали в центрифуге Sorvall RC3CPlus от Thermo Scientific в течение 25 минут на скорости 4500 об/мин Верхние фазы полученных двухфазных смесей отбрасывали, в каждый сосуд добавляли 50 г THF, сосуды встряхивали при комнатной температуре в течение 30 минут на вибрационном столе и центрифугировали в центрифуге в течение 25 минут на скорости 4500 об/мин Надосадочные жидкости отбрасывали.
Содержимое каждого сосуда разделяли на два 250 мл сосуда для центрифугирования. Добавляли примерно 100 г DMF на каждый сосуд и сосуды встряхивали на протяжении ночи при комнатной температуре на вибрационном столе. Содержимое каждого сосуда доводили до 200 г путем добавления 20 г THF и некоторого количества DMF. Сосуды центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 70 минут со скоростью 13000 об/мин Надосадочные жидкости отбрасывали.
Добавляли примерно 100 г DMF на каждый сосуд и сосуды встряхивали в течение 40 минут при комнатной температуре на вибрационном столе. Содержимое каждого сосуда доводили до 200 г путем добавления 20 г THF и некоторого количества DMF. Сосуды центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 70 минут со скоростью 13000 об/мин Надосадочные жидкости отбрасывали и все осадки объединяли в новом сосуде с использованием минимальных количеств DMF.
По результатам определения содержание твердой фазы составляло 2,34 г. Диаметр разбухшего в воде геля измеряли под микроскопом с фазоконтрастным оборудованием, и в среднем он составлял 0,80 мкм.
Разбухший в воде гель дополнительно анализировали в дисковой центрифуге (CPS Instruments, Inc, модель DC20000) с использованием градиента 3 и 7 мас.% растворов сахарозы и скоростью вращения 15000 об/мин Согласно результатам измерений диаметр составлял 0,4995 мкм при плотности частиц 1,032 г/мл. Согласно результатам измерений CV (числовой) составлял 3,6%.
Пример 16
Акриламидный мономер с защищенной силильной группой, (Ν-(2-((терт-бутилдиметилсилил)окси)этил)акриламид) (tBDMS-HEAM), полимеризовали с помощью сшивателя tBDMS-EBHEAM в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением частицы гидрогеля.
Получали эмульсию путем сначала растворения 1,98 г SDS в 330,05 г воды, а затем добавления 16,51 г ацетона и 33,00 г DOA. Эмульсию перемешивали с помощью ultraturax в течение 2 минут и дополнительно гомогенизировали в течение 6,4 минут в гомогенизаторе высокого давления Gauline APV-100 при давлении 400 бар.
К 68,57 г затравочных частиц (диаметр затравочных частиц 0,081 мкм, 4,91 мас.% твердых веществ) в сосуде добавляли 37,71 г такой эмульсии. Для активации смесь встряхивали при 40°C в течение 20 часов в качалке с водяным термостатом.
Готовили раствор SDS и тетраборнокислого натрия путем растворения 3,77 г SDS и 7,59 г тетраборнокислого натрия в 1975,6 г воды.
Получали эмульсию мономеров из 33,89 г 2-фенэтилацетата, 0,126 г 2,2'-азобис-(2-метилбутиронитрила) (AMBN), 5,26 г tBDMS НЕАМ, 1,61 г tBDMS-EBHEAM и 223,32 г раствора тетраборнокислого натрия и SDS, перемешивали с помощью ultraturax в течение 5 минут и дополнительно гомогенизировали в течение 2,6 минуты.
В 250 мл реакторе 20,31 г водной дисперсии активированных затравочных частиц смешивали с 228,23 г эмульсии мономеров. Смесь помешивали и нагревали при температуре 40°C в течение 2 часов. Смесь дополнительно помешивали и нагревали при 40°C в течение еще одного часа при барботировании смеси газообразным аргоном (150-200 мл/мин). Количество O2 в эмульсии в этот момент времени представляло собой показатель, равный 230 ppb. Поток аргона останавливали и продолжали нагревание и помешивание в течение 10 часов при температуре 70°C.
Реакционную смесь переносили в 250 мл сосуд для центрифугирования и центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 90 минут со скоростью 12500 об/мин Надосадочную жидкость отбрасывали, а осадок собирали и переносили в стеклянный сосуд путем добавления воды.
pH водной дисперсии гелей доводили до 3,85 путем добавления 0,5 M раствора уксусной кислоты. Подкисленную дисперсию геля встряхивали при 60°C в качалке с водяным термостатом в течение 2,5 часов и охлаждали.
Дисперсию геля переносили в 1 л сосуд, добавляли 170,6 г THF, сосуд встряхивали при комнатной температуре в течение 10 минут на вибрационном столе и центрифугировали в центрифуге Thermo Scientific Sorvall RC3CPlus от Thermo Scientific в течение 30 минут на скорости 4500 об/мин Верхнюю фазу полученной двухфазной смеси отбрасывали. Добавляли 86,81 г THF, сосуд встряхивали при комнатной температуре в течение 15 минут на вибрационном столе и центрифугировали в течение 30 минут на 4500 об/мин Надосадочную жидкость отбрасывали.
200 г DMF добавляли на гелевый осадок в 1 л сосуде и такую суспензию разделяли на два 250 мл сосуда для центрифугирования. Сосуды встряхивали при комнатной температуре в течение 153 минут на вибрационном столе и содержимое каждого сосуда доводили до 200 г путем добавления 30 г THF и некоторого количества DMF. Сосуды центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 90 минут со скоростью 14000 об/мин Надосадочные жидкости отбрасывали.
В каждый сосуд добавляли 100 г DMF и суспензии встряхивали при комнатной температуре в течение 20 минут на вибрационном столе. Содержимое каждого сосуда доводили до 200 г путем добавления 30 г THF и некоторого количества DMF и сосуды центрифугировали в центрифуге Avanti J-20 XP от Beckman Coulter в течение 90 минут при 14000 об/мин Надосадочные жидкости отбрасывали и все осадки объединяли в новом сосуде с использованием минимальных количеств DMF. По результатам определения содержание твердой фазы составляло 2,03 г.
Разбухший в воде гель дополнительно анализировали в дисковой центрифуге (CPS Instruments, Inc, модель DC20000) с использованием градиента 3 и 7 мас.% растворов сахарозы и скоростью вращения 20000 об/мин Согласно результатам измерений диаметр составлял 0,2885 мкм при плотности частиц 1,032 г/мл. Согласно результатам измерений CV (числовой) составлял 5,56%.
Пример 17
Аминоакриламидный мономер с защитной группой (N-трет-бутоксикарбонил-N'-акрилоил-пиперазин) полимеризовали с мономером tBDMS-HEAM и сшивателем tBDMS-ЕВНЕАМ в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением аминочастицы гидрогеля.
Получали эмульсию путем сначала растворения 1,74 г SDS в 290,00 г воды, а затем добавления 14,50 г ацетона и 29,00 г DOA. Эмульсию перемешивали с помощью ultraturax в течение 2 минут и дополнительно гомогенизировали в течение 5,6 минут в гомогенизаторе высокого давления Gauline APV-100 при давлении 400 бар.
К 62,93 г затравочных частиц (диаметр затравочных частиц 0,126 мкм, 4,59 мас.% твердых веществ) в сосуде добавляли 41,33 г такой эмульсии. Для активации смесь встряхивали при 40°C в течение 40 часов в качалке с водяным термостатом.
Готовили раствор SDS и тетраборнокислого натрия путем растворения 4,54 г SDS и 9,69 г тетраборнокислого натрия в 2369,8 г воды.
Получали эмульсию мономеров из 34,22 г 2-фенэтилацетата, 0,13 г AMBN, 4,98 г tBDMS HEAM, 1,61 г tBDMS-EBHEAM, 0,37 г N-трет-бутоксикарбонил-N'-акрилоил-пиперазина и 221,73 г раствора тетраборнокислого натрия и SDS, смешанных с помощью ultraturax в течение 5 минут и дополнительно гомогенизировали в течение 4 минут.
В 250 мл реакторе 17,09 г водной дисперсии активированных затравочных частиц смешивали с 223,1 г эмульсии мономеров. Смесь помешивали и нагревали при температуре 40°C в течение 2 часов. Смесь дополнительно помешивали и нагревали при 40°C в течение еще одного часа при барботировании смеси газообразным аргоном (150-200 мл/мин). Количество O2 в эмульсии в этот момент времени представляло собой показатель, равный 500 ppb. Поток аргона останавливали и продолжали нагревание и помешивание в течение 10 часов при температуре 70°C.
Реакционную смесь переносили в 250 мл сосуд для центрифугирования и центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 60 минут со скоростью 12000 об/мин Надосадочную жидкость отбрасывали, а осадок собирали и переносили в стеклянный сосуд путем добавления воды.
pH водной дисперсии гелей доводили до 3,8 путем добавления 0,5 M раствора уксусной кислоты. Подкисленную дисперсию геля встряхивали при 60°C в качалке с водяным термостатом в течение 2,5 часов и охлаждали.
Дисперсию геля переносили в 1 л сосуд, добавляли 317,24 г THF, сосуд встряхивали при комнатной температуре в течение 30 минут на вибрационном столе и центрифугировали в центрифуге Thermo Scientific Sorvall RC3CPlus от Thermo Scientific в течение 30 минут на скорости 4500 об/мин Верхнюю фазу полученной двухфазной смеси отбрасывали. Добавляли 169,63 г THF, сосуд встряхивали при комнатной температуре в течение 23 минут на вибрационном столе и сосуд центрифугировали в течение 30 минут на 4500 об/мин Надосадочную жидкость отбрасывали.
Добавляли примерно 170 г воды на гелевый осадок и сосуд встряхивали при комнатной температуре на протяжении ночи на вибрационном столе. Сосуд центрифугировали в течение 30 минут на 4500 об/мин Надосадочную жидкость отбрасывали.
На гелевый осадок добавляли примерно 170 г воды.
32,2 г суспензии гидрогеля (1,55 мас.% твердых веществ) разбавляли 33 г воды. Доводили pH до pH 1,0 посредством 3,2 мл 2 M HCl. Суспензию переносили в 250 мл реактор вместе с 54 г воды. Суспензию нагревали при 60°C в течение 18 часов. Реакционную смесь затем переносили в 250 мл сосуд для центрифугирования в Avanti J-20 XP от Beckman Coulter.
Гель обрабатывали путем центрифугирования после первоначального разбавления водой и титрования суспензии до примерно pH 10 с помощью 10 мас.% NaOH с получением общей массы 175 г. После повторения этой процедуры гель дополнительно три раза обрабатывали водой. В ходе этого процесса скорость центрифугирования постепенно уменьшали от 14500 об/мин до 6000 об/мин в течение 5 минут. После того, как отбросили надосадочную жидкость, гель затем разбавляли посредством DMF до 175 г и полученную суспензию встряхивали на протяжении ночи. После центрифугирования на 6500 об/мин в течение 5 минут и отбрасывания надосадочной жидкости обработку продолжали тремя дополнительными соответствующими промываниями посредством DMF.
Гель разбавляли в NMP до 175 г и центрифугировали на 7000 об/мин в течение 5 минут. Сухое вещество затем доводили до 0,29 мас.% твердых веществ с получением 71 г суспензии.
Пример 18
Аминоакриламидный мономер с защитной группой (N-флуоренилметилоксикарбонил-N1-акрилоил-пиперазин) полимеризовали с мономером tBDMS-HEAM и сшивателем tBDMS-EBHEAM в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением аминочастицы гидрогеля.
Получали эмульсию путем сначала растворения 1,74 г SDS в 290,00 г воды, а затем добавления 14,50 г ацетона и 29,00 г DOA. Эмульсию перемешивали с помощью ultraturax в течение 2 минут и дополнительно гомогенизировали в течение 5,6 минут в гомогенизаторе высокого давления Gauline APV-100 при давлении 400 бар.
К 62,93 г затравочных частиц (диаметр затравочных частиц 0,126 мкм, 4,59 мас.% твердых веществ) в сосуде добавляли 41,33 г такой эмульсии. Для активации смесь встряхивали при 40°C в течение 40 часов в качалке с водяным термостатом.
Готовили раствор SDS и тетраборнокислого натрия путем растворения 4,54 г SDS и 9,69 г тетраборнокислого натрия в 2369,8 г воды.
Получали эмульсию мономеров из 34,22 г 2-фенэтилацетата, 0,13 г AMBN, 4,98 г tBDMS НЕАМ, 1,61 г tBDMS-EBHEAM, 0,59 г N-флуоренилметилоксикарбонил-N'-акрилоил-пиперазина и 221,71 г раствора тетраборнокислого натрия и SDS, смешанных с помощью ultraturax в течение 5 минут и дополнительно гомогенизировали в течение 4 минут.
В 250 мл реакторе 17,09 г водной дисперсии активированных затравочных частиц смешивали с 223,23 г эмульсии мономеров. Смесь помешивали и нагревали при температуре 40°C в течение 2 часов. Смесь дополнительно помешивали и нагревали при 40°C в течение еще одного часа при барботировании смеси газообразным аргоном (150-200 мл/мин). Количество O2 в эмульсии в этот момент времени представляло собой показатель, равный 62 ppb. Поток аргона останавливали и продолжали нагревание и помешивание в течение 10 часов при температуре 70°C.
Реакционную смесь переносили в 250 мл сосуд для центрифугирования и центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 60 минут со скоростью 12000 об/мин Надосадочную жидкость отбрасывали, а осадок собирали и переносили в стеклянный сосуд путем добавления воды.
pH водной дисперсии гелей доводили до 3,8 путем добавления 0,5 M раствора уксусной кислоты. Подкисленную дисперсию геля встряхивали при 60°C в качалке с водяным термостатом в течение 2,5 часов и охлаждали.
Дисперсию геля переносили в 1 л сосуд, добавляли 287,06 г THF, сосуд встряхивали при комнатной температуре в течение 30 минут на вибрационном столе и центрифугировали в центрифуге Thermo Scientific Sorvall RC3CPlus от Thermo Scientific в течение 30 минут на скорости 4500 об/мин Верхнюю фазу полученной двухфазной смеси отбрасывали. Добавляли 111,41 г THF, сосуд встряхивали при комнатной температуре в течение 23 минут на вибрационном столе и сосуд центрифугировали в течение 30 минут на 4500 об/мин Надосадочную жидкость отбрасывали. Добавляли DMF на гель и сосуд встряхивали на протяжении ночи при комнатной температуре на вибрационном столе.
К суспензии гранул в DMF с массой 120 г добавляли 10 мл пиперидина и встряхивали при комнатной температуре на вибрационном столе в течение 60 минут. Добавляли 45 г THF и сосуд центрифугировали в центрифуге Avanti J-20 XP от Beckman Coulter в течение 90 минут при 14000 об/мин Надосадочную жидкость отбрасывали.
Добавляли DMF до достижения массы суспензии 112 г и встряхивали гель на вибрационном столе в течение 4 часов. Добавляли 37 г THF и сосуд центрифугировали в центрифуге Avanti J-20 XP от Beckman Coulter в течение 60 минут на 14000 об/мин Надосадочную жидкость отбрасывали.
Добавляли DMF до достижения массы суспензии 130 г и гель встряхивали на вибрационном столе в течение 90 минут. Добавляли 40 г THF и сосуд центрифугировали в центрифуге Avanti J-20 XP от Beckman Coulter в течение 90 минут при 14000 об/мин Надосадочную жидкость отбрасывали.
Добавляли 105 г сухого 1-метил-2-пирролидинона (NMP) на бане и встряхивали в течение 3 дней. Разбухший в воде гель анализировали в дисковой центрифуге (CPS Instruments, Inc, модель DC20000) с использованием градиента 3 и 7 мас.% растворов сахарозы и скоростью вращения 15000 об/мин По результатам измерения диаметр составлял 0,3694 мкм, а CV (числовой) 4,8%.
Пример 19
Аминоакриламидный мономер с защитной группой ((9Н-флюорен-9-ил)метил(2-(2-(2-акриламидоэтокси)этокси)этил)карбамат) полимеризовали с мономером tBDMS-HEAM и сшивателем tBDMS-EBHEAM в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением аминочастицы гидрогеля.
Получали эмульсию путем сначала растворения 1,68 г SDS в 280,00 г воды, а затем добавления 14,00 г ацетона и 28,00 г DOA. Эмульсию перемешивали с помощью ultraturax в течение 2 минут и дополнительно гомогенизировали в течение 5,4 минут в гомогенизаторе высокого давления Gauline APV-100 при давлении 400 бар.
К 52,61 г затравочных частиц (диаметр затравочных частиц 0,126 мкм, 4,59 мас.% твердых веществ) в сосуде добавляли 26,58 г такой эмульсии. Для активации смесь встряхивали при 40°C в течение 16 часов в качалке с водяным термостатом.
Готовили раствор SDS и тетраборнокислого натрия путем растворения 3,21 г SDS и 8,07 г тетраборнокислого натрия в 1823,6 г воды.
Получали эмульсию мономеров из 33,68 г 2-фенэтилацетата, 0,13 г AMBN, 4,89 г tBDMS НЕАМ, 1,61 г tBDMS-EBHEAM, 0,64 г (9Н-флуорен-9-ил)метил (2-(2-(2-акриламидоэтокси)этокси)этил)карбамата и 218,95 г раствора тетраборнокислого натрия и SDS, смешанных с помощью ultraturax в течение 5 минут и дополнительно гомогенизировали в течение 2,6 минуты.
В 250 мл реакторе 15,53 г водной дисперсии активированных затравочных частиц смешивали с 234,9 г эмульсии мономеров. Смесь помешивали и нагревали при температуре 40°C в течение 2 часов. Смесь дополнительно помешивали и нагревали при 40°C в течение еще одного часа при барботировании смеси газообразным аргоном (150-200 мл/мин). Количество O2 в эмульсии в этот момент времени представляло собой показатель, равный 75 ppb. Поток аргона останавливали и продолжали нагревание и помешивание в течение 10 часов при температуре 70°C.
Реакционную смесь переносили в 250 мл сосуд для центрифугирования и центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 60 минут со скоростью 13000 об/мин Надосадочную жидкость отбрасывали, а осадок собирали и переносили в стеклянный сосуд путем добавления воды.
pH водной дисперсии гелей доводили до 3,7 путем добавления 0,5 M раствора уксусной кислоты. Подкисленную дисперсию геля встряхивали при 60°C в качалке с водяным термостатом в течение 2,5 часов и охлаждали.
Дисперсию геля переносили в 1 л сосуд, добавляли 180 г THF и центрифугировали в центрифуге Thermo Scientific Sorvall RC3CPlus от Thermo Scientific в течение 30 минут на скорости 4500 об/мин Верхнюю фазу полученной двухфазной смеси отбрасывали и смесь встряхивали при комнатной температуре в течение 15 минут на вибрационном столе. Добавляли 160 г THF и сосуд центрифугировали в течение 30 минут на 4500 об/мин Надосадочную жидкость отбрасывали.
Гель переносили в стеклянный сосуд с DMF. На 50 г такой суспензии гранул в DMF добавляли 5 мл пиперидина и смесь встряхивали при комнатной температуре на вибрационном столе в течение 60 минут.
50 г такой суспензии переносили в 250 мл сосуд для центрифугирования и добавляли 23 г THF. Сосуд центрифугировали в центрифуге Avanti J-20 XP от Beckman Coulter в течение 10 минут на 10000 об/мин Надосадочную жидкость отбрасывали, добавляли DMF и смесь встряхивали на вибрационном столе в течение 16 часов при комнатной температуре.
Разбухший в воде гель анализировали в дисковой центрифуге (CPS Instruments, Inc, модель DC20000) с использованием градиента 3 и 7 мас.% растворов сахарозы и скоростью вращения 15000 об/мин Согласно результатам измерений диаметр составлял 0,4517 мкм при плотности частиц 1,032 г/мл. Согласно результатам измерений CV (числовой) составлял 3,7%.
Пример 20
Аминоакриламидный мономер с защитной группой N-Вос-N-акрилоил-4,7,10-триоксатридекан-1,13-диамин полимеризовали с мономером tBDMS-HEAM и сшивателем tBDMS-EBHEAM в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением аминочастицы гидрогеля.
Раствор PVA готовили посредством медленного добавления 80 г 87-89% гидролизированного поливинилового спирта (PVA) к 2000 г воды, помешивания и нагревания до 80°C в течение 1 часа и охлаждения. Раствор PVA в количестве 67,66 г смешивали с 582,70 г воды, 0,62 г SDS и 2,74 г тетраборнокислого натрия.
Получали эмульсию мономеров из 26,39 г 2-фенэтилацетата, 0,098 г AMBN, 3,97 г tBDMS НЕАМ, 1,26 г tBDMS-EBHEAM, 0,21 г N-Вос-N-акрилоил-4,7,10-триоксатридекан-1,13-диамина и 176,12 г раствора PVA и тетраборнокислого натрия, смешанных с помощью ultraturax в течение нескольких минут, и дополнительно гомогенизировали в течение 2 минут.
В 250 мл реакторе 7,15 г водной дисперсии затравочных частиц (диаметр частиц 0,319 мкм, 8,07 мас.% твердых веществ) смешивали с 193,02 г эмульсии мономеров. Смесь помешивали и нагревали при температуре 40°C в течение 2 часов. Смесь дополнительно помешивали и нагревали при 40°C в течение еще одного часа при барботировании смеси газообразным аргоном (150-200 мл/мин). Количество O2 в эмульсии в этот момент времени представляло собой показатель, равный 40 ppb. Поток аргона останавливали и продолжали нагревание и помешивание в течение 10 часов при температуре 70°C.
Реакционную смесь переносили в 250 мл сосуд для центрифугирования и центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 40 минут со скоростью 12500 об/мин Надосадочную жидкость отбрасывали, а осадок собирали и переносили в стеклянный сосуд путем добавления воды.
Добавляли 1 M раствор H2SO4 на гелевую суспензию в объемном соотношении 9:1 до достижения 0,1 M концентрации H2SO4. Суспензию встряхивали при 60°C в течение 3 часов и охлаждали до комнатной температуры.
Концентрированный раствор NaOH добавляли по каплям до достижения pH 12. К суспензии добавляли 500 г THF, разделяли на две 250 мл колби и смеси встряхивали при комнатной температуре в течение 60 минут на вибрационном столе. Сосуды центрифугировали в центрифуге Sorvall RC3CPlus от Thermo Scientific в течение 30 минут на 4500 об/мин Верхние фазы полученных двухфазных смесей отбрасывали, в каждый сосуд добавляли воду и сосуды встряхивали при комнатной температуре на протяжении ночи на вибрационном столе. pH смесей доводили до 12,3 путем добавления концентрированного раствора NaOH, сосуды встряхивали при комнатной температуре в течение 25 минут на вибрационном столе и сосуды центрифугировали в течение 30 минут на 4500 об/мин в центрифуге Avanti J-20 XP от Beckman Coulter. Надосадочные жидкости отбрасывали.
В каждый сосуд добавляли воду и доводили pH смесей до 12,2 путем добавления концентрированного раствора NaOH. Сосуды встряхивали при комнатной температуре на протяжении ночи на вибрационном столе и сосуды центрифугировали в течение 30 минут на 4000 об/мин в центрифуге Sorvall RC3CPlus от Thermo Scientific. Надосадочные жидкости отбрасывали.
В каждый сосуд добавляли воду, сосуды встряхивали при комнатной температуре в течение 4 часов на вибрационном столе и сосуды центрифугировали в течение 30 минут на 6500 об/мин в центрифуге Avanti J-20 XP от Beckman Coulter. Надосадочные жидкости отбрасывали.
В каждый сосуд добавляли NMP, сосуды встряхивали при комнатной температуре на протяжении ночи на вибрационном столе и сосуды центрифугировали в течение 30 минут на 4500 об/мин в центрифуге Sorvall RC3CPlus от Thermo Scientific. Примерно половину надосадочных жидкостей отбрасывали.
Гелевые осадки объединяли в одной колбе, добавляли NMP и сосуды центрифугировали в течение 60 минут на 4500 об/мин в центрифуге Sorvall RC3CPlus от Thermo Scientific. Надосадочные жидкости отбрасывали.
В сосуд добавляли NMP, сосуд встряхивали при комнатной температуре в течение 3 часов на вибрационном столе и сосуд центрифугировали в течение 50 минут на 6500 об/мин в центрифуге Avanti J-20 XP от Beckman Coulter. Надосадочные жидкости отбрасывали.
Добавляли еще немного NMP, и по результатам определения содержание твердой фазы дисперсии составляло 0,108%. Диаметр разбухшего в воде геля измеряли под микроскопом с фазоконтрастным оборудованием, и в среднем он составлял 1,79 мкм.
Разбухший в воде гель дополнительно анализировали в дисковой центрифуге (CPS Instruments, Inc, модель DC20000) с использованием градиента 3 и 7 мас.% растворов сахарозы и скоростью вращения 10050 об/мин Согласно результатам измерений диаметр составлял 0,934 мкм при плотности частиц 1,032 г/мл.
Пример 21
Аминоакриламидный мономер с защитной группой N-Вос-N-акрилоил-4,7,10-триоксатридекан-1,13-диамин полимеризовали с мономером tBDMS-HEAM и сшивателем tBDMS-EBHEAM в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением аминочастицы гидрогеля.
Получали эмульсию путем сначала растворения 1,74 г SDS в 290,00 г воды, а затем добавления 14,50 г ацетона и 29,00 г бис(2-этилгексил)адипата (DOA). Эмульсию перемешивали с помощью ultraturax в течение 2 минут и дополнительно гомогенизировали в течение 5,6 минут в гомогенизаторе высокого давления Gauline APV-100 при давлении 400 бар.
К 52,27 г затравочных частиц (диаметр затравочных частиц 0,126 мкм, 4,59 мас.% твердых веществ) в сосуде добавляли 26,58 г такой эмульсии. Для активации смесь встряхивали при 40°C в течение 40 часов в качалке с водяным термостатом.
Готовили раствор SDS и тетраборнокислого натрия путем растворения 1,87 г SDS и 4,04 г тетраборнокислого натрия в 987,5 г воды.
Получали эмульсию мономеров из 62,81 г 2-фензтилацетата, 0,238 г AMBN, 9,13 г tBDMS НЕАМ, 3,00 г tBDMS-EBHEAM, 1,05 г N-Вос-N-акрилоил-4,7,10-триоксатридекан-1,13-диамина и 408,39 г раствора SDS и тетраборнокислого натрия, смешанных с помощью ultraturax в течение нескольких минут, и дополнительно гомогенизировали в течение 4,8 минут.
В 500 мл реакторе 31,06 г водной дисперсии активированных затравочных частиц смешивали с 469,6 г эмульсии мономеров. Смесь помешивали и нагревали при температуре 40°C в течение 2 часов. Смесь дополнительно помешивали и нагревали при 40°C в течение еще одного часа при барботировании смеси газообразным аргоном (200 мл/мин). Поток аргона останавливали и продолжали нагревание и помешивание в течение 10 часов при температуре 70°C.
Реакционную смесь переносили в четыре 250 мл сосуда для центрифугирования и центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 60 минут со скоростью 13000 об/мин Надосадочные жидкости отбрасывали, а осадки собирали и переносили в стеклянный сосуд путем добавления воды.
pH водной дисперсии гелей доводили до 3,8 путем добавления 0,5 M раствора уксусной кислоты. Подкисленную дисперсию геля встряхивали при 60°C в качалке с водяным термостатом в течение 2 часов и охлаждали.
Добавляли 1 M раствор H2SO4 на гелевую суспензию в объемном соотношении 9:1 до достижения 0,1 M концентрации H2SO4. Суспензию встряхивали при 60°C в течение 3 часов и охлаждали до комнатной температуры.
Концентрированный раствор NaOH добавляли по каплям до достижения pH 12. Суспензию разделяли на два 1 л сосуда для центрифугирования. В каждый сосуд добавляли 380 г THF и смеси встряхивали при комнатной температуре в течение 145 минут на вибрационном столе. Сосуды центрифугировали в центрифуге Sorvall RC3CPlus от Thermo Scientific в течение 30 минут на 4500 об/мин Надосадочные жидкости отбрасывали, в каждый сосуд добавляли воду и сосуды встряхивали при комнатной температуре в течение 2 часов на вибрационном столе. Добавляли еще воду и сосуды центрифугировали в центрифуге Sorvall RC3CPlus от Thermo Scientific в течение 60 минут со скоростью 4500 об/мин Надосадочные жидкости отбрасывали.
Гель переносили в четыре 250 мл сосуда для центрифугирования и сосуды центрифугировали в течение 45 минут на 14500 об/мин в центрифуге Avanti J-20 XP от Beckman Coulter. Надосадочные жидкости отбрасывали.
В каждый сосуд добавляли воду, сосуды встряхивали при комнатной температуре в течение 60 минут на вибрационном столе и сосуды центрифугировали в течение 45 минут на 14500 об/мин в центрифуге Avanti J-20 XP от Beckman Coulter. Надосадочные жидкости отбрасывали.
В каждый сосуд добавляли воду и доводили pH смесей до 12 путем добавления концентрированного раствора NaOH. Сосуды встряхивали при комнатной температуре в течение 25 минут на вибрационном столе и сосуды центрифугировали в течение 30 минут на 6500 об/мин в центрифуге Avanti J-20 XP от Beckman Coulter. Надосадочные жидкости отбрасывали.
В каждый сосуд добавляли воду и доводили pH смесей до 12,3 путем добавления концентрированного раствора NaOH. Сосуды встряхивали при комнатной температуре на протяжении ночи на вибрационном столе и сосуды центрифугировали в течение 30 минут на 4000 об/мин в центрифуге Sorvall RC3CPlus от Thermo Scientific. Надосадочные жидкости отбрасывали.
В каждый сосуд добавляли воду, сосуды встряхивали при комнатной температуре в течение 4 часов на вибрационном столе и сосуды центрифугировали в течение 30 минут на 6500 об/мин в центрифуге Avanti J-20 XP от Beckman Coulter. Надосадочные жидкости отбрасывали.
В каждый сосуд добавляли NMP, сосуды встряхивали при комнатной температуре на протяжении ночи на вибрационном столе и сосуды центрифугировали в течение 30 минут на 4500 об/мин в центрифуге Sorvall RC3CPlus от Thermo Scientific. Надосадочные жидкости отбрасывали.
В сосуды добавляли NMP, сосуды встряхивали при комнатной температуре в течение 5 часов на вибрационном столе и сосуды центрифугировали в течение 50 минут на 6500 об/мин в центрифуге Avanti J-20 XP от Beckman Coulter. Надосадочные жидкости отбрасывали.
Добавляли еще немного NMP и определяли, что твердое содержимое дисперсии составляло 0 408%. Диаметр разбухшего в воде геля измеряли под микроскопом с фазоконтрастным оборудованием, и в среднем он составлял 0,86 мкм. Диаметр разбухшего в воде геля также измеряли в дисковой центрифуге (CPS Instruments, Inc, модель DC20000) с использованием градиента 3 и 7 мас.% растворов сахарозы и скоростью вращения 15000 об./мин Согласно результатам измерений диаметр составлял 0,511 мкм при плотности частиц 1,032 г/мл. Согласно результатам измерений CV (числовой) составлял 4,82%.
Пример 22
tBDMS-HEAM полимеризовали с помощью сшивателя tBDMS-EBHEAM в дисперсной фазе, образованной из полистироловых частиц, и удаляли защитную группу с получением частицы гидрогеля.
Получали эмульсию путем сначала растворения 1,14 г SDS в 280,00 г воды, а затем добавления 28,50 г ацетона и 19,00 г DOA. Эмульсию перемешивали с помощью ultraturax в течение 5 минут и дополнительно гомогенизировали в течение 4 минут в гомогенизаторе высокого давления Gauline APV-100 при давлении 400 бар.
К 7,39 г затравочных частиц (диаметр затравочных частиц 4,96 мкм, 9,54 мас.% твердых веществ) в сосуде добавляли 30,55 г такой эмульсии. Для активации смесь встряхивали при 40°C в течение 22 часов в качалке с водяным термостатом.
Нагревали 300 г H2O до 80°C и растворяли в ней 4,2 г Methocel N-100. Добавляли 332 г H2O с получением раствора Methocel K-100.
Добавляли 2,41 г тетраборнокислого натрия на 94,8 г раствора Methocel. Массу этого раствора доводили до 420,2 г путем добавления воды с получением раствора тетраборнокислого натрия, который готовили путем перемешивания.
Эмульсию мономеров формировали из раствора 35,72 г 2-фенэтилацетата, 0,138 г AMBN, 5,56 г tBDMS НЕАМ, 1,71 г tBDMS-EBHEAM и 165,89 г тетраборнокислого натрия, перемешанных с помощью ultraturax в течение нескольких минут, и дополнительно гомогенизировали в течение 2,1 минуты.
В 250 мл реакторе 9,25 г водной дисперсии активированных затравочных частиц смешивали с 177,0 г эмульсии мономеров и 63,26 г раствора Methocel K-100. Смесь помешивали и нагревали при 40°C в течение 2,5 часов. Смесь дополнительно помешивали и нагревали при 40°C в течение еще 30 минут при барботировании смеси газообразным аргоном (200 мл/мин). Поток аргона останавливали и продолжали нагревание и помешивание в течение 10 часов при температуре 70°C.
Часть реакционной смеси переносили в 250 мл сосуд для центрифугирования и центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 60 минут со скоростью 13000 об/мин Надосадочную жидкость отбрасывали, а осадок собирали и переносили в стеклянный сосуд путем добавления воды.
pH водной дисперсии гелей доводили до 3,8 путем добавления 0,5 M раствора уксусной кислоты. Подкисленную дисперсию геля встряхивали при 60°C в качалке с водяным термостатом в течение 150 минут и охлаждали.
Дисперсию геля переносили в 1 л сосуд, добавляли 300,00 г THF и сосуд встряхивали при комнатной температуре в течение 25 минут на вибрационном столе и центрифугировали в центрифуге Sorvall RC3CPlus от Thermo Scientific в течение 30 минут на скорости 4500 об/мин Верхнюю фазу полученной двухфазной смеси отбрасывали, в сосуд добавляли 50 г THF. Сосуд встряхивали при комнатной температуре в течение 30 минут на вибрационном столе и центрифугировали в течение 25 минут на скорости 4500 об/мин Надосадочную жидкость отбрасывали.
Содержимое сосуда разделяли на два 250 мл сосуда для центрифугирования. Добавляли примерно 100 г DMF на каждый сосуд и сосуды встряхивали на протяжении ночи при комнатной температуре на вибрационном столе. Содержимое каждого сосуда доводили до 200 г путем добавления 20 г THF и некоторого количества DMF. Сосуды центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 70 минут со скоростью 13000 об/мин Надосадочные жидкости отбрасывали.
Добавляли примерно 100 г DMF на каждый сосуд и сосуды встряхивали в течение 40 минут при комнатной температуре на вибрационном столе. Содержимое каждого сосуда доводили до 200 г путем добавления 20 г THF и некоторого количества DMF. Сосуды центрифугировали в центрифуге Avanti J-20 XP Beckman Coulter в течение 70 минут со скоростью 13000 об/мин Надосадочные жидкости отбрасывали и все осадки объединяли в новом сосуде с использованием минимальных количеств DMF.
По результатам определения содержание твердой фазы составляло 2,34 г. Диаметр разбухших в воде гелей измеряли под микроскопом с фазоконтрастным оборудованием, и в среднем он составлял 47,5 мкм.
Пример 23
Мономер tBDMS-HEAM полимеризовали в водной эмульсии с получением моноразмерных затравочных частиц.
250 мл воды кипятили в 250 мл конической колбе в течение 10 минут и охлаждали с помощью ванны с ледяной водой с продуванием в ней газообразным Ar.
В 50 мл конической колбе растворяли 0,04 г SDS в 10,1 г такой кипяченой воды с помощью магнитной мешалки.
В другой 50 мл конической колбе растворяли 0,059 г персульфата калия в 10 г кипяченой воды с помощью магнитной мешалки.
В 100 мл заключенный в кожух двухсекционный реактор, оснащенный механической мешалкой, температурным зондом, водяным охладителем и источником Ar, добавляли 0,20 г тетраборнокислого натрия и 80 г кипящей воды, предварительно кипяченой в течение по меньшей мере 30 минут, и реактор нагревали до 80°C с помощью нагревательной бани, в то же время верхнеприводную мешалку, оснащенную поли(тетрафторэтиленовой) лопастью, выставляли на помешивание со скоростью 150±5 об/мин Раствор продували посредством Ar в течение 20 минут.
При достижении температуры раствора 80°C трубку для подачи Ar извлекали из раствора, сохраняя давление Ar, и в реактор добавляли раствор SDS, непосредственно перед этим обработанный ультразвуком в течение 5 минут.
Спустя 8 минут после добавления раствора SDS устанавливали механическую мешалку на помешивание со скоростью 250±5 об/мин
В течение 5 минут 9,22 г tBDMS-HEAM продували Ar, а затем добавляли в реактор. Спустя 1 минуту после добавления tBDMS-HEAM устанавливали механическую мешалку на помешивание со скоростью 350±5 об/мин
Спустя 5 минут после добавления tBDMS-HEAM в реактор быстро добавляли раствор персульфата калия, непосредственно перед этим продутый Ar в течение 5 минут, и реактор герметизировали, при этом над эмульсией продолжали пропускать поток Ar.
Спустя 270 минут после добавления персульфата калия устанавливали механическую мешалку на помешивание со скоростью 250±5 об/мин и останавливали поток Ar. Эмульсию дополнительно полимеризовали в течение 18 часов.
Охлаждали партию до комнатной температуры и всю партию переносили в пластиковую колбу. С помощью динамического рассеяния света (Malvern, Nano ZS) измеряли диаметр, и было обнаружено, что он составлял 0,398 мкм. Согласно результатам измерения PDI составлял 0,015. Согласно результатам измерений с применением устройства для эксклюзионной хроматографии (Waters 717plus, оснащенное рефрактометрическим детектором Waters 2414 и колонками Polymer Laboratories с 5 мкм Mixed-C и размером 300 мм × 7,5 мм) среднемассовая молекулярная масса и показатели среднечисловой молекулярной массы составляли 707 кДа и 102 кДа, соответственно.
CV частицы измеряли в дисковой центрифуге (CPS Instruments, Inc, модель DC20000) с использованием градиента 3 и 7 мас.% растворов сахарозы и скоростью вращения 20000 об/мин, и было обнаружено, что он составлял 2,0%.
Пример 24
Активация аминогидрогеля и конъюгация гидрогеля с ДНК-зондом с концевой аминогруппой.
К раствору 100 миллиардов частиц аминогидрогеля (диаметр = 0,55 микрона, 23 миллиона аминогрупп/микрон3) в безводном, не содержащем аминогруппы N-метилпирролидоне (NMP) (600 мкл), добавляли твердый бис-сукцинимидилсуберат (22, 1 мг, 60 мкмоль) с последующим добавлением трибутиламина (14 мкл, 60 мкмоль). После помешивания при 60°C в течение 1 часа гидрогели выделяли с помощью центрифугирования (30 мин с 21300 rcf). Осадок гидрогеля разбавляли не содержащим аминогруппы безводным NMP (1 мл) и выделяли с помощью центрифугирования; такой процесс промывания повторяли 2 раза и конечный осадок ресуспендировали в NMP (600 мкл). Такую суспензию гидрогеля обрабатывали ангидридом уксусной кислоты (30 мкл, 317 мкмоль) и трибутиламином (30 мкл, 126 мкмоль) и помешивали при комнатной температуре в течение 2 часов. Полученный гидрогель выделяли путем центрифугирования (30 мин с 21300 rcf), а осадок разбавляли не содержащим аминогруппы безводным NMP (1 мл) и выделяли с помощью центрифугирования; такой процесс промывания повторяли 2 раза, и конечный активированный, блокированный осадок разбавляли 1 мкмолем 3 мкмолярного раствора в NMP тетрабутиламмоний-5'-амино-олигонуклеотида, трибутиламина (1 мкмоль) и не содержащим аминогруппы NMP до конечного объема, составлявшего 600 мкл. После помешивания при 70°C в течение 16 часов конъюгированный с ДНК гидрогель выделяли с помощью центрифугирования (30 мин с 21300 rcf). Осадок промывали посредством NMP (1 мл) с последующим промыванием деионизированной водой (1 мл) с применением центрифугирования для выделения осадков. Конечный осадок гидрогеля разбавляли посредством IX ТЕ-буфера (1,6 мл) и помешивали при 80°C в течение 1 часа. Гидрогели выделяли с помощью центрифугирования (30 мин с 21300 rcf) и дважды промывали посредством DI воды (1 мл) (с помощью центрифугирования для выделения осадка). К конечному осадку добавляли 30% водный аммоний, спустя 15 минут при комнатной температуре, выделяли гидрогель с помощью центрифугирования (20 мин с 21300 rcf) и 3X промывали посредством DI воды (1 мл) с помощью центрифугирования для выделения. Конечный осадок повторно диспергировали в буфере для проведения необходимой амплификации.
Пример 25
Олигонуклеотид непосредственно конъюгировали с активированной метилсульфонилом частицей. Активированные метилсульфонилхлоридом микрогели получали с помощью посевной эмульсионной полимеризации. Полученные таким образом частицы промывали в N-метил-2-пирролидоне (NMP) в препарате для конъюгации с подвергающейся ионообмену одноцепочечной ДНК.
Натриевую соль 5'-NH2-С6-30-мерного олигонуклеотида растворяли в 0,1 M тетрабутиламмония ацетате и вводили на колонку для обращенно-фазовой HPLC. Элюирование осуществляли с помощью подвижной фазы, представлявшей собой 0,1 M тетрабутиламмония ацетат. Содержавшую нуклеиновые кислоты фракцию собирали, лиофилизировали до сухого порошка и ресуспендировали в сухом N-метил-2-пирролидоне (NMP).
Пять миллионов частиц (5,0×109) диспергировали в 350 мкл безводного NMP и для диспергирования встряхивали на вортексе. К смеси частиц непосредственно добавляли 124 мкл Bu4NAc-ДНК (5'-NH2-C6-30-мерного олигонуклеотида) в NMP (4,10 мМ). Затем к реакционной смеси добавляли 19,5 мкл тетраэтиламмония бората (26,14 мМ) до конечного объема, составлявшего ~500 мкл.
Реакционную смесь быстро перемешивали на вортексе и аккуратно перемешивали при 70°C в течение 16 часов. Смесь центрифугировали, надосадочную жидкость декантировали, а частицы ресуспендировали в 1 мл NMP. После перемешивания на вортексе ресуспендированные частицы микрогеля осаждали за два цикла осаждения/диспергирования в NMP. После второго промывания NMP осадки вносили в 1 мл 2xSSPE/0,1% додецилсульфата натрия (SDS), перемешивали и центрифугировали с получением осадков. Наконец, частицы вносили в 1 мл 1x PBS/0,1% Triton Х-100, перемешивали и центрифугировали с получением осадка, повторяя этот процесс три раза. После конечного цикла конъюгированные микрогели ресуспендировали в 500 мкл 1xPBS/0,1% Triton X-100.
Согласно первому аспекту, способ получения частицы предусматривает полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой гидрофильний мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и преобразование полимерной частицы в частицу гидрогеля.
Согласно примеру по первому аспекту, преобразование полимерной частицы включает удаление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы. Например, удаление по меньшей мере части из множества гидрофобных защитных групп включает кислотное отщепление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы.
Согласно другому примеру по первому аспекту и приведенным выше примерам, преобразование полимерной частицы включает удаление практически всех из множества гидрофобных защитных групп у полимерной частицы.
Согласно следующему примеру по первому аспекту и приведенным выше примерам, способ дополнительно предусматривает промотирование затравочной частицы в водной суспензии с получением дисперсной фазы. Согласно примеру, массовое соотношение мономер с защитной группой:затравочные частицы находится в диапазоне от 150:1 до 1:1, таком как диапазон от 50:1 до 1:1. Согласно другому примеру, затравочная частица включает затравочный полимер. Способ может дополнительно предусматривать экстракцию затравочного полимера после преобразования полимерной частицы. Согласно примеру, затравочный полимер может быть гидрофобным. Согласно другому примеру, затравочный полимер включает стироловый полимер, акриловый полимер, другой виниловый полимер или их комбинацию. Согласно конкретному примеру из приведенных выше примеров, затравочная частица имеет изначальный размер частицы, составляющий не более 0,6 микрометра, такой как не более 0,45 микрометра, не более 0,35 микрометра или не более 0,15 микрометра. Согласно другому примеру из приведенных выше примеров, промотирование затравочной частицы включает смешивание растворителя и промотирующего средства с затравочной частицей. Например, промотирующее средство является гидрофобным. Согласно другому примеру, промотирующее средство включает диоктаноилпероксид.
Согласно дополнительному примеру по первому аспекту и приведенным выше примерам, гидрофильный мономер включает акриламид.
Согласно другому примеру по первому аспекту и приведенным выше примерам, гидрофобная защитная группа включает защитную группу для гидроксильной группы.
Согласно следующему примеру по первому аспекту или приведенным выше примерам, гидрофобная защитная группа включает металлорганический фрагмент. Например, металлорганический фрагмент образует силилэфирную функциональную группу. Согласно примеру, силилэфирная функциональная группа получена от трет-бутилдиметилсиланового простого эфира, триметилсилилового простого эфира, триэтилсилилового простого эфира, дифенилметилсилилового простого эфира или их комбинации.
Согласно примеру, по первому аспекту и приведенным выше примерам полимеризация множества мономерных звеньев дополнительно включает смешивание сшивателя с гидрофильным мономером, имеющим гидрофобную защитную группу. Например, смешивание сшивателя может включать смешивание сшивателя в массовом соотношении гидрофильный мономер:сшиватель в диапазоне от 15:1 до 1:2. Диапазон может представлять собой от 10:1 до 1:1. Согласно другому примеру, сшивателем является сшиватель с низкой растворимостью в воде. Согласно примеру, из приведенных выше примеров сшивателем является дивиниловый сшиватель. Например, дивиниловый сшиватель включает диакриламид. Согласно конкретному примеру из приведенных выше примеров диакриламид, включает N,N'-(этан-1,2-диил)бис(N-(2-((терт-бутилдиметилсилил)окси)этил)акриламид, N,N'-(2-гидроксипропан-1,3-диил)диакриламид, его производное с защитной группой или их комбинацию. Диакриламид может, например, включать N,N'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, Ν,Ν'-(Ν-(2-((трет-бутилдиметилсилил)окси)пропан-1,3-диил) диакриламид, Ν,Ν'-(этан-1,2-диил)бис(N-(2-((триэтилсилил)окси)этил)акриламид, Ν,Ν'-(N-(2-((триэтилсилил)окси)пропан-1,3-диил)диакриламид, N-[2-(акрилоиламино)-1,2-дигидроксиэтил]акриламид с защищенной силильной группой, такой как Ν,Ν'(2,3-бис((триэтилсилил)окси)бутан-1,4-диил)диакриламид, или их комбинацию. Согласно другому примеру из приведенных выше примеров, дивиниловый сшиватель включает этиленгликольдиметакрилат, дивинилбензол, гексаметиленбисакриламид, триметилолпропантриметакрилат или их комбинацию.
Согласно другому примеру по первому аспекту и приведенным выше примерам, полимеризация множества мономерных звеньев предусматривает смешивание порогена с гидрофильным мономером, имеющим гидрофобную защитную группу. Например, пороген может представлять собой ароматический пороген. Согласно примеру, ароматический пороген включает толуол.
Согласно дополнительному примеру по первому аспекту и приведенным выше примерам способ дополнительно предусматривает активацию частицы гидрогеля. Согласно примеру, преобразование включает обеспечение одной или нескольких гидроксильных групп на частице гидрогеля, и причем активация включает преобразование по меньшей мере одной из одной или нескольких гидроксильных групп в сульфоэфирную группу. Например, преобразование может включать обеспечение одной или нескольких гидроксильных групп на частице гидрогеля, и причем активация включает замену по меньшей мере одной из одной или нескольких гидроксильных групп азидным функциональным фрагментом. Согласно другому примеру, способ дополнительно предусматривает связывание олигонуклеотида с активированным полимером гидрогеля. Например, связывание включает нуклеофильное замещение, а олигонуклеотид представляет собой олигонуклеотид с нуклеофильной группой на конце. Нуклеофильной группой у олигонуклеотида с нуклеофильной группой на конце может быть аминогруппа. Нуклеофильной группой у олигонуклеотида с нуклеофильной группой на конце может быть тиоловая группа. Согласно примеру из приведенного выше примера, способ дополнительно предусматривает гибридизацию полинуклеотида с олигонуклеотидом. Например, способ может дополнительно предусматривать амплификацию полинуклеотида во множество полинуклеотидов и прикрепление по меньшей мере части множества полинуклеотидов к частице гидрогеля с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов. В соответствии с другим вариантом, способ может дополнительно предусматривать амплификацию полинуклеотида во множество комплементарных полинуклеотидов посредством удлинения олигонуклеотида с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов.
Согласно другому примеру по первому аспекту и приведенным выше примерам, частица гидрогеля представляет собой частицу из множества аналогично полученных частиц гидрогеля, имеющих средний размер частицы, составляющий не более 2 микрометров. Например, средний размер частицы может составлять не более 1 микрометра, такой как не более 0,8 микрометра или не более 0,5 микрометра.
Согласно следующему примеру по первому аспекту и приведенным выше примерам, частица гидрогеля представляет собой частицу из множества аналогично полученных частиц гидрогеля, которые практически однородны по размеру.
Согласно дополнительному примеру по первому аспекту или приведенным выше примерам, частица гидрогеля представляет собой частицу из множества аналогично полученных частиц гидрогеля, характеризующихся коэффициентом вариации не более 5,0%. Например, коэффициент вариации составляет не более 3,5%.
Согласно второму аспекту, способ получения частицы предусматривает полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой акриламидный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и преобразование полимерной частицы в гидрофильную частицу.
Согласно примеру по второму аспекту, преобразование полимерной частицы включает удаление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы. Например, удаление по меньшей мере части из множества гидрофобных защитных групп включает кислотное отщепление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы.
Согласно другому примеру по второму аспекту или приведенным выше примерам, преобразование полимерной частицы включает удаление практически всех из множества гидрофобных защитных групп у полимерной частицы.
Согласно дополнительному примеру по второму аспекту или приведенным выше примерам, способ дополнительно предусматривает промотирование затравочной частицы в водной суспензии с получением дисперсной фазы. Например, массовое соотношение мономер с защитной группой:затравочные частицы находится в диапазоне от 50:1 до 1:1. Согласно другому примеру, затравочная частица включает затравочный полимер. Согласно примеру из приведенных выше примеров, способ дополнительно предусматривает экстракцию затравочного полимера после преобразования полимерной частицы. Затравочный полимер может быть гидрофобным. Согласно другому примеру, затравочный полимер включает стироловый полимер, акриловый полимер, другой виниловый полимер или их комбинацию. Согласно примеру из приведенных выше примеров затравочная частица имеет изначальный размер частицы, составляющий не более 0,6 микрометра. Согласно дополнительному примеру из приведенных выше примеров, промотирование затравочной частицы включает смешивание растворителя и промотирующего средства с затравочной частицей. Например, промотирующее средство может быть гидрофобным.
Согласно другому примеру по второму аспекту или приведенным выше примерам, гидрофобная защитная группа включает защитную группу для гидроксильной группы. Согласно дополнительному примеру по второму аспекту и приведенным выше примерам, гидрофобная защитная группа включает металлорганический фрагмент. Например, металлорганический фрагмент может образовывать силилэфирную функциональную группу. Согласно примеру, силилэфирная функциональная группа может быть получена от трет-бутилдиметилсиланового простого эфира, триметилсилилового простого эфира, триэтилсилилового простого эфира, дифенилметилсилилового простого эфира или их комбинации.
Согласно следующему примеру по второму аспекту и приведенным выше примерам, полимеризация множества мономерных звеньев дополнительно включает смешивание сшивателя с акриламидным мономером, имеющим гидрофобную защитную группу. Смешивание сшивателя может включать смешивание сшивателя в массовом соотношении гидрофильный мономер:сшиватель в диапазоне от 15:1 до 1:2. Согласно примеру, сшивателем является сшиватель с низкой растворимостью в воде. Согласно другому примеру, сшивателем является дивиниловый сшиватель.
Согласно дополнительному примеру по второму аспекту и приведенным выше примерам, полимеризация множества мономерных звеньев предусматривает смешивание порогена с акриламидным мономером, имеющим гидрофобную защитную группу. Например, пороген может включать ароматический пороген.
Согласно другому примеру по второму аспекту и приведенным выше примерам, способ дополнительно предусматривает активацию гидрофильной частицы. Согласно примеру, преобразование включает обеспечение одной или нескольких гидроксильных групп на частице гидрогеля, и причем активация включает преобразование по меньшей мере одной из одной или нескольких гидроксильных групп в сульфоэфирную группу. Согласно другому примеру, преобразование включает обеспечение одной или нескольких гидроксильных групп на частице гидрогеля, и причем активация включает замену по меньшей мере одной из одной или нескольких гидроксильных групп азидным функциональным фрагментом. Согласно дополнительному примеру, способ дополнительно предусматривает связывание олигонуклеотида с активированным полимером гидрогеля. Связывание может включать нуклеофильное замещение, а олигонуклеотид представляет собой олигонуклеотид с нуклеофильной группой на конце. Нуклеофильной группой у олигонуклеотида с нуклеофильной группой на конце может быть аминогруппа. Согласно другому примеру, нуклеофильная группа у олигонуклеотида с нуклеофильной группой на конце может включать тиоловую группу. Согласно дополнительному примеру, способ дополнительно предусматривает гибридизацию полинуклеотида с олигонуклеотидом. Согласно другому примеру, способ дополнительно предусматривает амплификацию полинуклеотида во множество полинуклеотидов и прикрепление по меньшей мере части множества полинуклеотидов к гидрофильной частице с образованием, таким образом, гидрофильной частицы, включающей множество прикрепленных полинуклеотидов. В соответствии с другим вариантом, способ может дополнительно предусматривать амплификацию полинуклеотида во множество комплементарных полинуклеотидов посредством удлинения олигонуклеотида с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов.
Согласно следующему примеру по второму аспекту и приведенным выше примерам, гидрофильная частица представляет собой частицу из множества аналогично полученных гидрофильных частиц, имеющих средний размер частицы, составляющий не более 2 микрометров.
Согласно дополнительному примеру по второму аспекту и приведенным выше примерам, гидрофильная частица представляет собой частицу из множества аналогично полученных гидрофильных частиц, которые практически однородны по размеру.
Согласно следующему примеру по второму аспекту и приведенным выше примерам, гидрофильная частица представляет собой частицу из множества аналогично полученных гидрофильных частиц, характеризующихся коэффициентом вариации не более 5,0%.
Согласно третьему аспекту, способ получения частицы предусматривает полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой способный к радикальной полимеризации мономер, с диакриламидным сшивателем, имеющим гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп. Способ дополнительно предусматривает удаление по меньшей мере части из множества гидрофобных защитных групп.
Согласно примеру по третьему аспекту, диакриламид включает Ν,Ν'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, N,N'-(2-гидроксипропан-1,3-диил)диакриламид, его производное с защитной группой или их комбинацию. Диакриламид может, например, включать N,N'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, Ν,Ν'-(Ν-(2-((трет-бутилдиметилсилил)окси)пропан-1,3-диил)диакриламид, Ν,Ν'-(этан-1,2-диил)бис(N-(2-((триэтилсилил)окси)этил)акриламид, Ν,Ν'-(N-(2-((триэтилсилил)окси)пропан-1,3-диил)диакриламид, N-[2-(акрилоиламино)-1,2-дигидроксиэтил]акриламид с защищенной силильной группой, такой как Ν,Ν'(2,3-бис((триэтилсилил)окси)бутан-1,4-диил)диакриламид, или их комбинацию.
Согласно другому примеру по третьему аспекту или приведенным выше примерам, полимеризация предусматривает смешивание диакриламидного сшивателя в массовом соотношении способный к радикальной полимеризации мономер:сшиватель в диапазоне от 15:1 до 1:2.
Согласно дополнительному примеру по третьему аспекту или приведенным выше примерам, удаление по меньшей мере части из множества гидрофобных защитных групп включает кислотное отщепление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы.
Согласно следующему примеру по третьему аспекту или приведенным выше примерам, способный к радикальной полимеризации мономер представляет собой виниловый мономер. Согласно примеру, виниловый мономер включает акрилат, акриламид, виниловый спирт, винилацетат, акриламидометилпропансульфоновую кислоту или их комбинацию. Например, виниловый мономер представляет собой акриламид.
Согласно другому примеру по третьему аспекту или приведенным выше примерам, способ дополнительно предусматривает промотирование затравочной частицы в водной суспензии с получением дисперсной фазы. Например, массовое соотношение мономер с защитной группой:затравочные частицы находится в диапазоне от 50:1 до 1:1. Согласно другому примеру, затравочная частица включает затравочный полимер. Согласно следующему примеру, способ дополнительно предусматривает экстракцию затравочного полимера после преобразования полимерной частицы. Согласно примеру, затравочный полимер является гидрофобным. Согласно другому примеру, затравочный полимер включает стироловый полимер, акриловый полимер, другой виниловый полимер или их комбинацию. Согласно дополнительному примеру, затравочная частица имеет изначальный размер частицы, составляющий не более 0,6 микрометра. Согласно другому примеру, промотирование затравочной частицы включает смешивание растворителя и промотирующего средства с затравочной частицей.
Согласно следующему примеру по третьему аспекту или приведенным выше примерам, гидрофобная защитная группа включает защитную группу для гидроксильной группы.
Согласно дополнительному примеру по третьему аспекту или приведенным выше примерам, гидрофобная защитная группа включает металлорганический фрагмент. Согласно примеру, металлорганический фрагмент образует силилэфирную функциональную группу. Согласно другому примеру, силилэфирная функциональная группа получена от трет-бутилдиметилсиланового простого эфира, триметилсилилового простого эфира, триэтилсилилового простого эфира, дифенилметилсилилового простого эфира или их комбинации.
Согласно другому примеру по третьему аспекту или приведенным выше примерам, полимеризация множества мономерных звеньев предусматривает смешивание порогена со способным к радикальной полимеризации мономером и диакриламидным сшивателем. Например, пороген может представлять собой ароматический пороген.
Согласно следующему примеру по третьему аспекту или приведенным выше примерам, способ дополнительно предусматривает активацию гидрофильной частицы. Например, способ дополнительно предусматривает связывание олигонуклеотида с активированным полимером гидрогеля. Согласно другому примеру, связывание включает нуклеофильное замещение, а олигонуклеотид представляет собой олигонуклеотид с нуклеофильной группой на конце. Например, нуклеофильная группа у олигонуклеотида с нуклеофильной группой на конце представляет собой аминогруппу. Согласно следующему примеру, нуклеофильная группа у олигонуклеотида с нуклеофильной группой на конце представляет собой тиоловую группу. Согласно другому примеру, способ дополнительно предусматривает гибридизацию полинуклеотида с олигонуклеотидом. Согласно дополнительному примеру, способ дополнительно предусматривает амплификацию полинуклеотида во множество полинуклеотидов и прикрепление по меньшей мере части множества полинуклеотидов к гидрофильной частице с образованием, таким образом, гидрофильной частицы, включающей множество прикрепленных полинуклеотидов. В соответствии с другим вариантом, способ может дополнительно предусматривать амплификацию полинуклеотида во множество комплементарных полинуклеотидов посредством удлинения олигонуклеотида с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов.
Согласно дополнительному примеру по третьему аспекту или приведенным выше примерам, гидрофильная частица представляет собой частицу из множества аналогично полученных гидрофильных частиц, имеющих средний размер частицы, составляющий не более 2 микрометров.
Согласно следующему примеру по третьему аспекту или приведенным выше примерам, гидрофильная частица представляет собой частицу из множества аналогично полученных гидрофильных частиц, характеризующихся коэффициентом вариации не более 5,0%.
Согласно четвертому аспекту, способ получения частицы предусматривает полимеризацию множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, удаление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы с получением гидрофильной частицы, и связывание олигонуклеотида с гидрофильной частицей.
Согласно примеру по четвертому аспекту или приведенным выше примерам, удаление по меньшей мере части из множества гидрофобных защитных групп включает кислотное отщепление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы.
Согласно другому примеру по четвертому аспекту или приведенным выше примерам, гидрофильный мономер включает акриламид.
Согласно дополнительному примеру по четвертому аспекту или приведенным выше примерам, гидрофобная защитная группа включает защитную группу для гидроксильной группы.
Согласно следующему примеру по четвертому аспекту или приведенным выше примерам, гидрофобная защитная группа включает металлорганический фрагмент. Например, металлорганический фрагмент может образовывать силилэфирную функциональную группу.
Согласно примеру по четвертому аспекту или приведенным выше примерам, полимеризация множества мономерных звеньев дополнительно включает смешивание сшивателя с гидрофильным мономером, имеющим гидрофобную защитную группу. Например, сшиватель может представлять собой дивиниловый сшиватель. Согласно другому примеру, дивиниловый сшиватель включает диакриламид.
Согласно другому примеру по четвертому аспекту или приведенным выше примерам, способ дополнительно предусматривает активацию частицы гидрогеля перед связыванием с олигонуклеотидом. Например, удаление может включать обеспечение одной или нескольких гидроксильных групп на гидрофильной частице, и причем активация включает преобразование по меньшей мере одной из одной или нескольких гидроксильных групп в сульфоэфирную группу. Согласно другому примеру, удаление включает обеспечение одной или нескольких гидроксильных групп на гидрофильной частице, и причем активация включает замену по меньшей мере одной из одной или нескольких гидроксильных групп азидным функциональным фрагментом. Согласно дополнительному примеру, связывание включает связывание олигонуклеотида с активированным полимером гидрогеля. Согласно дополнительному примеру, связывание включает нуклеофильное замещение, а олигонуклеотид представляет собой олигонуклеотид с нуклеофильной группой на конце. Например, нуклеофильная группа у олигонуклеотида с нуклеофильной группой на конце может быть аминогруппой. Согласно другому примеру, нуклеофильная группа у олигонуклеотида с нуклеофильной группой на конце может включать тиоловую группу.
Согласно следующему примеру по четвертому аспекту или приведенным выше примерам, способ дополнительно предусматривает гибридизацию полинуклеотида с олигонуклеотидом. Например, способ дополнительно предусматривает амплификацию полинуклеотида во множество полинуклеотидов и прикрепление по меньшей мере части множества полинуклеотидов к частице гидрогеля с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов. В соответствии с другим вариантом, способ может дополнительно предусматривать амплификацию полинуклеотида во множество комплементарных полинуклеотидов посредством удлинения олигонуклеотида с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов.
Согласно пятому аспекту, множество частиц включает по меньшей мере 100000 частиц. По меньшей мере одна частица множества частиц включает гидрогель. Множество частиц имеет средний размер частицы, составляющий не более 100 микрометров, и коэффициент вариации, составляющий не более 5%. Например, коэффициент вариации составляет не более 4,5%, к примеру, не более 4,0%, не более 3,5% или не более 3,0%.
Согласно примеру по пятому аспекту или приведенным выше примерам, средний размер составляет не более 30 микрометров, к примеру, не более 1,5 микрометра, не более 1,1 микрометра, не более 0,6 микрометра или не более 0,5 микрометра.
Согласно другому примеру по пятому аспекту или приведенным выше примерам, гидрогель включает акриламидный полимер.
Согласно следующему примеру по пятому аспекту или приведенным выше примерам, частицы из множества частиц имеют среднюю пористость, составляющую по меньшей мере 60%.
Согласно шестому аспекту, система включает матрицу с лунками. По меньшей мере одна лунка у матрицы с лунками функционально связана с ISFET-датчиком. Система дополнительно включает множество частиц гидрогеля, имеющих коэффициент вариации, составляющий не более 5%. По меньшей мере одна частица гидрогеля из множества частиц гидрогеля размещена в лунке матрицы с лунками.
Согласно седьмому аспекту, множество частиц получают посредством способа, предусматривающего полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и предусматривающего преобразование полимерной частицы в частицу гидрогеля.
Согласно примеру по седьмому аспекту множество частиц, характеризуется коэффициентом вариации, составляющим не более 5,0%, к примеру, не более 4,0%, не более 3,5% или не более 3,0%.
Согласно другому примеру по седьмому аспекту или приведенным выше примерам, множество частиц характеризуется средним размером, составляющим не более 100 микрометров. Например, средний размер может составлять не более 30 микрометров, к примеру, не более 1,5 микрометра или не более 0,8 микрометра.
Согласно дополнительному примеру по седьмому аспекту или приведенным выше примерам, гидрофильный мономер включает акриламидный мономер.
Согласно следующему примеру по седьмому аспекту или приведенным выше примерам, частицы из множества частиц имеют среднюю пористость, составляющую по меньшей мере 60%.
Согласно восьмому аспекту, композиция включает водную смесь акриламидного мономера и сшивателя, причем акриламидный мономер включает гидрофобную защитную группу, а мономер и сшиватель включены в массовом соотношении мономер:сшиватель в диапазоне от 15:1 до 1:2.
Согласно примеру по восьмому аспекту, сшивателем является дивиниловый сшиватель. Например, дивиниловый сшиватель может включать диакриламид. Согласно другому примеру, диакриламид включает N,N'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, N,N'-(2-гидроксипропан-1,3-диил)диакриламид, его производное с защитной группой или их комбинацию. Диакриламид может, например, включать N,N'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, Ν,Ν'-(Ν-(2-((трет-бутилдиметилсилил)окси)пропан-1,3-диил)диакриламид, N,N'-(этан-1,2-диил)бис(N-(2-((триэтилсилил)окси)этил)акриламид, Ν,Ν'-(N-(2-((триэтилсилил)окси)пропан-1,3-диил)диакриламид, N-[2-(акрилоиламино)-l,2-дигидроксиэтил]акриламид с защищенной силильной группой, такой как Ν,Ν'(2,3-бис((триэтилсилил)окси)бутан-1,4-диил)диакриламид, или их комбинацию. Согласно дополнительному примеру, дивиниловый сшиватель включает этиленгликольдиметакрилат, дивинилбензол, гексаметиленбисакриламид, триметилолпропантриметакрилат или их комбинацию.
Согласно другому примеру по восьмому аспекту или приведенным выше примерам, соотношение находится в диапазоне от 10:1 до 1:1.
Согласно девятому аспекту, способ секвенирования полинуклеотида предусматривает обеспечение устройства, включающего матрицу с лунками. По меньшей мере одну лунку функционально связывают с ISFET, и она включает частицу, полученную посредством способа в соответствии с описанными выше аспектами. Частица присоединена к полинуклеотиду. Способ дополнительно предусматривает внесение раствора, включающего нуклеотиды предопределенного типа, в устройство и наблюдение за ионной реакцией на внесение раствора.
Согласно десятому аспекту, способ нуклеотидного встраивания предусматривает обеспечение частицы, полученной посредством способа в соответствии с описанными выше аспектами. Частица присоединена к дуплексу нуклеиновой кислоты, включающему матричную нуклеиновую кислоту, гибридизированную с праймером. Дуплекс связан с полимеразой. Способ дополнительно предусматривает приведение частицы в контакт с одним или несколькими нуклеотидами и встраивание по меньшей мере одного нуклеотида на конце праймера при помощи полимеразы.
Согласно примеру по десятому аспекту, встраивание дополнительно включает образование побочного продукта нуклеотидного встраивания.
Согласно другому примеру по десятому аспекту и приведенным выше примерам, способ дополнительно предусматривает детектирование встраивания путем детектирования побочного продукта с помощью транзистора на эффекте поля (FET).
Согласно одиннадцатому аспекту, способ получения частицы предусматривает промотирование затравочной частицы с получением дисперсной фазы в водной суспензии, полимеризацию в дисперсной фазе множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и преобразование полимерной частицы в частицу гидрогеля.
Согласно двенадцатому аспекту, способ получения частицы предусматривает внесение затравочной частицы в водную суспензию, причем затравочная частица содержит гидрофобный полимер, и предусматривает промотирование затравочной частицы с образование дисперсной фазы в водной суспензии. Способ дополнительно предусматривает полимеризацию в дисперсной фазе множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей гидрофильный полимер, имеющий множество гидрофобных защитных групп. Полимерная частица включает гидрофобный полимер. Способ также предусматривает отщепление множества гидрофобных защитных групп от гидрофильного полимера и экстракцию гидрофобного полимера из полимерной частицы с получением частицы гидрогеля.
Согласно тринадцатому аспекту, частица включает полимер, полученный в результате полимеризации гидроксиалкилакриламида и диакриламида. Диакриламид включает гидроксильную группу. Частица абсорбирует по меньшей мере 300 мас.% воды по массе полимера при воздействии воды.
Согласно примеру по тринадцатому аспекту, частица абсорбирует по меньшей мере 1000 мас.% воды по массе полимера при воздействии воды.
Согласно другому примеру по тринадцатому аспекту и приведенным выше примерам, частица характеризуется размером частицы, который составляет не более 100 микрометров. Например, размер частицы может составлять не более 30 микрометров, к примеру, не более 1,5 микрометра.
Согласно следующему примеру по тринадцатому аспекту и приведенным выше примерам, гидроксиалкилакриламид включает гидроксиэтилакриламид.
Согласно дополнительному примеру по тринадцатому аспекту и приведенным выше примерам, гидроксиалкилакриламид включает N-[трис(гидроксиметил)метил)акриламид (A, проиллюстрирован ниже), N-(гидроксиметил)акриламид (B, проиллюстрирован ниже) или их комбинацию.
Согласно другому примеру по тринадцатому аспекту и приведенным выше примерам, диакриламид включает Ν,Ν'-(этан-1,2-диил)бис(2-гидроксилэтил)акриламид, N,N'-(2-гидроксипропан-1,3-диил)диакриламид, их производное с защитной группой или их комбинацию. Диакриламид может, например, включать Ν,Ν'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, Ν,Ν'-(Ν-(2-((трет-бутилдиметилсилил)окси)пропан-1,3-диил)диакриламид, N,N'-(этан-1,2-диил)бис(N-(2-((триэтилсилил)окси)этил)акриламид, Ν,Ν'-(N-(2-((триэтилсилил)окси)пропан-1,3-диил)диакриламид, N-[2-(акрилоиламино)-1,2-дигидроксиэтил]акриламид с защищенной силильной группой, такой как Ν,Ν'(2,3-бис((триэтилсилил)окси)бутан-1,4-диил)диакриламид, или их комбинацию.
Варианты осуществления могут соответствовать любому из приведенных далее пронумерованных пунктов.
1. Способ получения частицы, причем способ предусматривает полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой гидрофильний мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и преобразование полимерной частицы в гидрофильную частицу.
2. Способ по пункту 1, предусматривающий, что гидрофильная частица представляет собой частицу гидрогеля.
3. Способ по пункту 1 или пункту 2, предусматривающий, что гидрофильный мономер включает акриламидный мономер.
4. Способ по пункту 1 или пункту 2, предусматривающий, что гидрофильный мономер представляет собой способный к радикальной полимеризации мономер, а дисперсная фаза дополнительно включает диакриламидный сшиватель, имеющий гидрофобную защитную группу.
5. Способ по любому из пунктов 1-4, предусматривающий, что преобразование полимерной частицы включает удаление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы.
6. Способ по пункту 5, предусматривающий, что удаление по меньшей мере части из множества гидрофобных защитных групп включает кислотное отщепление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы.
7. Способ по любому из пунктов 1-6, предусматривающий, что преобразование полимерной частицы включает удаление практически всего множества гидрофобных защитных групп у полимерной частицы.
8. Способ по любому из пунктов 1-7, дополнительно предусматривающий промотирование затравочной частицы в водной суспензии с получением дисперсной фазы.
9. Способ по пункту 8, предусматривающий, что массовое соотношение мономер с защитной группой затравочные частицы находится в диапазоне от 150:1 до 1:1.
10. Способ по пункту 8, предусматривающий, что затравочная частица включает затравочный полимер.
11. Способ по пункту 10, дополнительно предусматривающий экстракцию затравочного полимера после преобразования полимерной частицы.
12. Способ по пункту 10, предусматривающий, что затравочный полимер является гидрофобным.
13. Способ по пункту 10, предусматривающий, что затравочный полимер включает стироловый полимер, акриловый полимер, акриламид, другой виниловый полимер или их комбинацию.
14. Способ по пункту 8, предусматривающий, что затравочная частица имеет изначальный размер частицы, составляющий не более 0,6 микрометра.
15. Способ по пункту 14, предусматривающий, что изначальный размер частицы составляет не более 0,45 микрометра.
16. Способ по пункту 15, предусматривающий, что изначальный размер частицы составляет не более 0,35 микрометра.
17. Способ по пункту 16, предусматривающий, что изначальный размер частицы составляет не более 0,15 микрометра.
18. Способ по пункту 8, предусматривающий, что затравочная частица имеет изначальный размер частицы в диапазоне от 1 микрометра до 7 микрометров.
19. Способ по пункту 8, предусматривающий, что промотирование затравочной частицы включает смешивание растворителя и промотирующего средства с затравочной частицей.
20. Способ по пункту 19, предусматривающий, что промотирующее средство является гидрофобным и имеет растворимость в воде, составляющую менее 0,01 г/л при 25°C.
21. Способ по пункту 19, предусматривающий, что промотирующее средство включает диоктаноилпероксид, или диоктиладипат, или полистирол с молекулярной массой ниже 20 кДа.
22. Способ по любому из пунктов 1-21, предусматривающий, что гидрофильный мономер включает акриламид.
23. Способ по любому из пунктов 4-22, предусматривающий, что способный к радикальной полимеризации мономер представляет собой виниловый мономер.
24. Способ по пункту 23, предусматривающий, что виниловый мономер включает акрилат, акриламид, виниловый спирт, винилацетат, акриламидо-метил-пропансульфоновую кислоту или их комбинацию.
25. Способ по пункту 24, предусматривающий, что виниловый мономер представляет собой акриламид.
26. Способ по любому из пунктов 1-25, предусматривающий, что гидрофобная защитная группа включает защитную группу для гидроксильной группы.
27. Способ по любому из пунктов 1-25, предусматривающий, что гидрофобная защитная группа включает защитную группу для аминогруппы.
28. Способ по любому из пунктов 1-27, предусматривающий, что гидрофобная защитная группа включает металлорганический фрагмент.
29. Способ по пункту 28, предусматривающий, что металлорганический фрагмент образует силилэфирную функциональную группу.
30. Способ по пункту 29, предусматривающий, что силилэфирная функциональная группа получена от трет-бутилдиметилсиланового простого эфира, триметилсилилового простого эфира, триэтилсилилового простого эфира, дифенилметилсилилового простого эфира или их комбинации.
31. Способ по любому из пунктов 1-30, предусматривающий, что полимеризация множества мономерных звеньев дополнительно включает смешивание сшивателя с гидрофильным мономером, имеющим гидрофобную защитную группу.
32. Способ по пункту 31, предусматривающий, что смешивание сшивателя включает смешивание сшивателя в массовом соотношении гидрофильный мономер:сшиватель в диапазоне от 15:1 до 1:2.
33. Способ по пункту 32, предусматривающий, что диапазон представляет собой от 10:1 до 1:1.
34. Способ по пункту 31, предусматривающий, что сшиватель является сшивателем с низкой растворимостью в воде и имеет растворимость в воде, составляющую менее 10 г/л при 25°C.
35. Способ по пункту 31, предусматривающий, что сшиватель представляет собой дивиниловый сшиватель.
36. Способ по пункту 35, предусматривающий, что дивиниловый сшиватель включает диакриламид.
37. Способ по пункту 4 или пункту 36, предусматривающий, что диакриламид включает N,N'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, N,N'-(2-гидроксипропан-1,3-диил)диакриламид, их производное с защитной группой или их комбинацию.
38. Способ по пункту 4 или пункту 37, предусматривающий, что диакриламид включает N,N'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, Ν,Ν'-(N-(2-((трет-бутилдиметилсилил)окси)пропан-1,3-диил)диакриламид, N,N'-(этан-1,2-диил)бис(N-(2-((триэтилсилил)окси)этил)акриламид, Ν,Ν'-(N-(2-((триэтилсилил)окси)пропан-1,3-диил)диакриламид, N-[2-(акрилоиламино)-1,2-дигидроксиэтил]акриламид с защищенной силильной группой, такой как Ν,Ν'(2,3-бис((триэтилсилил)окси)бутан-1,4-диил)диакриламид, или их комбинацию.
39. Способ по пункту 35, предусматривающий, что дивиниловый сшиватель включает этиленгликольдиметакрилат, дивинилбензол, гексаметиленбисакриламид, триметилолпропантриметакрилат или их комбинацию.
40. Способ по любому из пунктов 1-39, предусматривающий, что полимеризация множества мономерных звеньев включает смешивание порогена с гидрофильным мономером, имеющим гидрофобную защитную группу.
41. Способ по пункту 40, предусматривающий, что пороген представляет собой ароматический пороген.
42. Способ по пункту 41, предусматривающий, что ароматический пороген включает толуол, ксилол, мезителен, фениленэтилацетат или этилбензоат.
43. Способ по любому из пунктов 1-42, дополнительно предусматривающий активацию гидрофильной частицы или частицы гидрогеля.
44. Способ по пункту 43, предусматривающий, что преобразование включает обеспечение одной или нескольких гидроксильных групп на частице гидрогеля, и причем активация включает преобразование по меньшей мере одной из одной или нескольких гидроксильных групп до эфиров алкилсульфоновых или арилсульфоновых кислот.
45. Способ по пункту 43, предусматривающий, что преобразование включает обеспечение одной или нескольких гидроксильных групп на частице гидрогеля, и причем активация включает замену по меньшей мере одной из одной или нескольких гидроксильных групп азидным функциональным фрагментом.
46. Способ по пункту 43, предусматривающий, что преобразование включает обеспечение одной или нескольких аминогрупп на частице гидрогеля, и причем активация включает осуществление реакции по меньшей мере одной из одной или нескольких аминогрупп с бис-сукцинимидил-С2-С12-алкилэфиром.
47. Способ по пункту 43, дополнительно предусматривающий связывание олигонуклеотида с активированным полимером гидрогеля.
48. Способ по пункту 47, предусматривающий, что связывание включает нуклеофильное замещение, а олигонуклеотид представляет собой олигонулеотид с нуклеофильной группой на конце.
49. Способ по пункту 48, предусматривающий, что нуклеофильная группа у олигонуклеотида с нуклеофильной группой на конце представляет собой аминогруппу.
50. Способ по пункту 48, предусматривающий, что нуклеофильная группа у олигонуклеотида с нуклеофильной группой на конце представляет собой тиоловую группу.
51. Способ по пункту 47, дополнительно предусматривающий гибридизацию полинуклеотида с олигонуклеотидом.
52. Способ по пункту 51, дополнительно предусматривающий амплификацию полинуклеотида во множество полинуклеотидов и прикрепление по меньшей мере части множества полинуклеотидов к частице гидрогеля с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов.
53. Способ по пункту 51, дополнительно предусматривающий амплификацию полинуклеотида во множество комплементарных полинуклеотидов посредством удлинения олигонуклеотида с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов.
54. Способ по любому из пунктов 1-53, предусматривающий, что частица гидрогеля представляет собой частицу из множества аналогично полученных частиц гидрогеля, имеющих средний размер частицы, составляющий не более 2 микрометров в воде.
55. Способ по пункту 54, предусматривающий, что средний размер частицы составляет не более 1 микрометра.
56. Способ по пункту 55, предусматривающий, что средний размер частицы составляет не более 0,8 микрометра.
57. Способ по пункту 56, предусматривающий, что средний размер частицы составляет не более 0,5 микрометра.
58. Способ по любому из пунктов 1-44, предусматривающий, что частица гидрогеля представляет собой частицу из множества аналогично полученных частиц гидрогеля, имеющих средний размер частицы в диапазоне от 5 микрометров до 100 микрометров в воде.
59. Способ по любому из пунктов 1-58, предусматривающий, что частица гидрогеля представляет собой частицу из множества аналогично полученных частиц гидрогеля, которые являются практически однородными по размеру.
60. Способ по любому из пунктов 1-59, предусматривающий, что частица гидрогеля представляет собой частицу из множества аналогично полученных частиц гидрогеля, имеющих коэффициент вариации, составляющий не более 5,0%.
61. Способ по пункту 60, предусматривающий, что коэффициент вариации составляет не более 3,5%.
62. Способ получения частицы, причем способ предусматривает полимеризацию множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп; удаление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы с получением гидрофильной частицы; и связывание олигонуклеотида с гидрофильной частицей.
63. Способ по пункту 62, предусматривающий, что удаление по меньшей мере части из множества гидрофобных защитных групп включает кислотное отщепление по меньшей мере части из множества гидрофобных защитных групп у полимерной частицы.
64. Способ по пункту 62 или 63, предусматривающий, что гидрофильный мономер включает акриламид.
65. Способ по любому из пунктов 62-64, предусматривающий, что гидрофобная защитная группа включает защитную группу для гидроксильной группы.
66. Способ по любому из пунктов 62-65, предусматривающий, что гидрофобная защитная группа включает металлорганический фрагмент.
67. Способ по пункту 66, предусматривающий, что металлорганический фрагмент образует силилэфирную функциональную группу.
68. Способ по любому из пунктов 62-67, предусматривающий, что полимеризация множества мономерных звеньев дополнительно включает смешивание сшивателя с гидрофильным мономером, имеющим гидрофобную защитную группу.
69. Способ по пункту 68, предусматривающий, что сшиватель представляет собой дивиниловый сшиватель.
70. Способ по пункту 69, предусматривающий, что дивиниловый сшиватель включает диакриламид.
71. Способ по любому из пунктов 62-70, дополнительно предусматривающий активацию частицы гидрогеля перед связыванием олигонуклеотида.
72. Способ по пункту 71, предусматривающий, что удаление включает обеспечение одной или нескольких гидроксильных групп на гидрофильной частице, и причем активация включает преобразование по меньшей мере одной из одной или нескольких гидроксильных групп в сульфоэфирную группу.
73. Способ по пункту 71, предусматривающий, что удаление включает обеспечение одной или нескольких гидроксильных групп на гидрофильной частице, и причем активация включает замену по меньшей мере одной из одной или нескольких гидроксильных групп азидным функциональным фрагментом.
74. Способ по пункту 71, предусматривающий, что связывание включает связывание олигонуклеотида с активированным полимером гидрогеля.
75. Способ по пункту 74, предусматривающий, что связывание включает нуклеофильное замещение, а олигонуклеотид представляет собой олигонулеотид с нуклеофильной группой на конце.
76. Способ по пункту 75, предусматривающий, что нуклеофильная группа у олигонуклеотида с нуклеофильной группой на конце представляет собой аминогруппу.
77. Способ по пункту 75, предусматривающий, что нуклеофильная группа у олигонуклеотида с нуклеофильной группой на конце представляет собой тиоловую группу.
78. Способ по любому из пунктов 62-77, дополнительно предусматривающий гибридизацию полинуклеотида с олигонуклеотидом.
79. Способ по пункту 78, дополнительно предусматривающий амплификацию полинуклеотида во множество полинуклеотидов и прикрепление по меньшей мере части множества полинуклеотидов к частице гидрогеля с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов.
80. Способ по пункту 78, дополнительно предусматривающий амплификацию полинуклеотида во множество комплементарных полинуклеотидов посредством удлинения олигонуклеотида с образованием, таким образом, частицы гидрогеля, включающей множество прикрепленных полинуклеотидов.
81. Множество частиц, включающее по меньшей мере 100000 частиц, причем по меньшей мере одна частица множества частиц включает гидрогель, множество частиц имеет средний размер частицы не более 100 микрометров, а коэффициент вариации составляет не более 5%.
82. Множество частиц по пункту 81, причем каждая из по меньшей мере 100000 частиц включает гидрогель.
83. Множество частиц по пункту 81 или 82, причем коэффициент вариации составляет не более 4,5%.
84. Множество частиц по пункту 83, причем коэффициент вариации составляет не более 4,0%.
85. Множество частиц по пункту 84, причем коэффициент вариации составляет не более 3,5%.
86. Множество частиц по пункту 85, причем коэффициент вариации составляет не более 3,0%.
87. Множество частиц по любому из пунктов 81-86, причем средний размер составляет не более 30 микрометров.
88. Множество частиц по пункту 87, причем средний размер составляет не более 1,5 микрометра.
89. Множество частиц по пункту 88, причем средний размер составляет не более 1,1 микрометра.
90. Множество частиц по пункту 89, причем средний размер составляет не более 0,6 микрометра.
91. Множество частиц по пункту 90, причем средний размер составляет не более 0,5 микрометра.
92. Множество частиц по любому из пунктов 81-91, причем гидрогель включает акриламидный полимер.
93. Множество частиц по любому из пунктов 81-92, причем частицы множества частиц имеют среднюю пористость, составляющую по меньшей мере 60%.
94. Система, включающая матрицу с лунками, причем по меньшей мере одна лунка у матрицы с лунками функционально связана с ISFET-датчиком, и множество частиц гидрогеля, имеющих коэффициент вариации, не превышающий 5%, причем по меньшей мере одна частица гидрогеля из множества частиц гидрогеля расположена в лунке матрицы с лунками.
95. Множество частиц, полученных посредством способа, предусматривающего полимеризацию в дисперсной фазе водной суспензии множества мономерных звеньев, представляющих собой гидрофильний мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп, и преобразование полимерной частицы в частицу гидрогеля.
96. Множество частиц по пункту 95, причем множество частиц имеет коэффициент вариации, составляющий не более 5,0%.
97. Множество частиц по пункту 96, причем коэффициент вариации составляет не более 4,0%.
98. Множество частиц по пункту 97, причем коэффициент вариации составляет не более 3,5%.
99. Множество частиц по пункту 98, причем коэффициент вариации составляет не более 3,0%.
100. Множество частиц по любому из пунктов 95-99, причем множество частиц имеет средний размер, составляющий не более 100 микрометров.
101. Множество частиц по пункту 100, причем средний размер составляет не более 30 микрометра.
102. Множество частиц по пункту 101, причем средний размер составляет не более 5 микрометра.
103. Множество частиц по пункту 102, причем средний размер составляет не более 1,5 микрометра.
104. Множество частиц по пункту 103, причем средний размер составляет не более 0,8 микрометра.
105. Множество частиц по любому из пунктов 95-104, причем гидрофильный мономер включает акриламидный мономер.
106. Множество частиц по любому из пунктов 95-105, причем частицы множества частиц имеют среднюю пористость, составляющую по меньшей мере 60%.
107. Композиция, содержащая водную смесь акриламидного мономера и сшиватель, причем акриламидный мономер включает гидрофобную защитную группу, а мономер и сшиватель включены в массовом соотношении мономер:сшиватель в диапазоне от 15:1 до 1:2.
108. Композиция по пункту 107, причем сшиватель представляет собой дивиниловый сшиватель.
109. Композиция по пункту 108, причем дивиниловый сшиватель включает диакриламид.
110. Композиция по пункту 109, причем диакриламид включает Ν,Ν'-(этан-1,2-диил)бис(N-(2-((терт-бутилдиметилсилил)окси)этил)акриламид, N,N'-(2-гидроксипропан-1,3-диил)диакриламид, их производное с защитной группой или их комбинацию.
111. Композиция по пункту 110, причем диакриламид включает Ν,Ν'-(этан-1,2-диил)бис(N-(2-((трет-бутилдиметилсилил)окси)этил)акриламид, Ν,Ν'-(Ν-(2-((трет-бутилдиметилсилил)окси)пропан-1,3-диил)диакриламид, N,N'-(этан-1,2-диил)бис(N-(2-((триэтилсилил)окси)этил)акриламид, N,N'-(N-(2-((триэтилсилил)окси)пропан-1,3-диил)диакриламид, N-[2-(акрилоиламино)-1,2-дигидроксиэтил]акриламид с защищенной силильной группой, такой как Ν,Ν'(2,3-бис((триэтилсилил)окси)бутан-1,4-диил)диакриламид, или их комбинацию.
112. Композиция по пункту 108, причем дивиниловый сшиватель включает этиленгликольдиметакрилат, дивинилбензол, гексаметиленбисакриламид, триметилолпропантриметакрилат или их комбинацию.
113. Композиция по любому из пунктов 107-112, причем соотношение находится в диапазоне от 10:1 до 1:1.
114. Способ секвенирования полинуклеотида, причем способ предусматривает обеспечение устройства, включающего матрицу с лунками, причем по меньшей мере одна лунка функционально связана с ISFET и включает частицу, полученную посредством способа по любому из пунктов 1-80, причем частица прикреплена к полинуклеотиду, внесение раствора, включающего нуклеотиды предопределенного типа, в устройство и наблюдение за ионной реакцией на внесение раствора.
115. Способ нуклеотидного встраивания, предусматривающий обеспечение частицы, полученной посредством способа по любому из пунктов 1-80, причем частица прикреплена к дуплексу нуклеиновой кислоты, включающему матричную нуклеиновую кислоту, гибридизированную с праймером, а дуплекс связан с полимеразой; приведение частицы в контакт с одним или несколькими нуклеотидами и встраивание по меньшей мере одного нуклеотида на конце праймера при помощи полимеразы.
116. Способ по пункту 115, причем встраивание дополнительно включает образование побочного продукта нуклеотидного встраивания.
117. Способ по пункту 115 или 116, дополнительно предусматривающий детектирование встраивания путем детектирования побочного продукта с помощью транзистора на эффекте поля (FET).
118. Способ получения частицы, причем способ предусматривает промотирование затравочной частицы с получением дисперсной фазы в водной суспензии, полимеризацию в дисперсной фазе множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей множество гидрофобных защитных групп; и преобразование полимерной частицы в частицу гидрогеля.
119. Способ получения частицы, причем способ предусматривает внесение затравочной частицы в водную суспензию, причем затравочная частица содержит гидрофобный полимер, промотирование затравочной частицы в водной суспензии с получением дисперсной фазы, полимеризацию в дисперсной фазе множества мономерных звеньев, представляющих собой гидрофильный мономер, имеющий гидрофобную защитную группу, с получением, таким образом, полимерной частицы, включающей гидрофильный полимер, имеющий множество гидрофобных защитных групп, причем полимерная частица включает гидрофобный полимер, отщепление множества гидрофобных защитных групп от гидрофильного полимера и экстракцию гидрофобного полимера из полимерной частицы с получением частицы гидрогеля.
120. Совокупность частиц, имеющих коэффициент вариации, составляющий не более 5%, и включающих полимер, полученный в результате полимеризации гидроксиалкилакриламида и диакриламида, при этом диакриламид включает гидроксильную группу, причем частица абсорбирует по меньшей мере 300 мас.% воды по массе полимера при воздействии воды.
121. Частица по пункту 120, причем частица абсорбирует по меньшей мере 300 мас.% воды по массе полимера при воздействии воды.
122. Частица по пункту 120 или 121, причем частица имеет размер частицы, составляющий не более 100 микрометров.
123. Частица по пункту 122, причем размер частицы составляет не более 30 микрометров.
124. Частица по пункту 123, причем размер частицы составляет не более 1,5 микрометра.
125. Частица по любому из пунктов 120-124, причем гидроксиалкилакриламид включает гидроксиэтилакриламид.
126. Частица по любому из пунктов 120-125, причем гидроксиалкилакриламид включает N-[трис(гидроксиметил)метил)акриламид, N-(гидроксиметил)акриламид или их комбинацию.
127. Частица по любому из пунктов 120-126, причем диакриламид включает Ν,Ν'-(этан-1,2-диил)бис(2-гидроксилэтил)акриламид, N,N'-(2-гидроксипропан-1,3-диил)диакриламид, их производное с защитной группой или их комбинацию.
Следует отметить, что не все описанные выше в общем описании или примерах действия являются необходимыми, что часть действий может не быть необходимой, и что помимо описанных можно осуществлять одно или несколько дополнительных действий. Кроме того, порядок, в котором перечислены действия, не является обязательным порядком, в котором их осуществляют.
В приведенном выше описании идеи были описаны на основании конкретных вариантов осуществления. Тем не менее, специалист в настоящей области технике поймет, что различные модификации и изменения можно осуществить без отклонения от объема настоящего изобретения, который изложен в приведенной ниже формуле изобретения. Соответственно, описание и фигуры необходимо рассматривать в иллюстративном, а не в ограничивающем смысле, и все такие модификации подразумевают включенными в объем настоящего изобретения.
Применяемые в настоящем документе термины "содержит", "содержащий", "включает", "включающий", "имеет", "имеющий" или любые их варианты подразумевают как охватывающие неисключающее включение. Например, процесс, способ, изделие или устройство, которые включают перечень признаков, не обязательно ограничены только такими признаками, но могут включать другие признаки, которые в прямой форме не перечислены или присущи такому процессу, способу, изделию или устройству. Кроме того, если в прямой форме не указано иное, "или" относится к включительному "или", а не исключительному "или". Например, условие A или B удовлетворяют по любому из следующих: А является истинным (или присутствует), а B является ложным (или отсутствует), А является ложным (или отсутствуют), а B является истинным (или присутствует), и A и B являются истинными (или присутствуют).
Также для описания описанных в настоящем описании элементов и компонентов используют формы единственного числа. Это делают только для удобства и для передачи общего смысла объема настоящего изобретения. Это описание необходимо понимать как включающее одно или по меньшей мере одно, а форма единственного числа также включает форму множественного числа, если не очевидно, что это не означает иное.
Выше были описаны преимущества, другие положительные качества и решения задач с привязкой к конкретным вариантам осуществления. Тем не менее, преимущества, положительные качестве, решения задач и любой признак(и), который может привести к появлению или большему проявлению любого преимущества, положительного качестве или решения, не следует понимать в качестве критического, необходимого или обязательного признака любого или всех пунктов формулы изобретения.
После прочтения описания специалисты в настоящей области техники поймут, что определенные признаки для наглядности описаны в настоящем документе в контексте отдельных вариантов осуществления, и их также можно объединить в одном варианте осуществления. С другой стороны, различные признаки, которые для краткости описаны в контексте одного варианта осуществления, можно также реализовать отдельно или в любой подкомбинации. Кроме того, отсылки к указанным в диапазонах значениям включают абсолютно все значения в пределах такого диапазона.
Реферат
Изобретение относится к вариантам способа получения частиц, которые можно применять в различных методиках разделения и аналитических методах для захвата полинуклеотидов. Способ заключается в том, что вначале в водную суспензию вносят затравочные частицы, включающие гидрофобный полимер. Затем проводят промотирование затравочных частиц в водной суспензии с образованием дисперсной фазы. После этого осуществляют полимеризацию гидрофильного мономера, включающего акриламидный мономер, имеющий гидрофобную защитную группу, в дисперсной фазе, с диакриламидным сшивателем, имеющим гидрофобную защитную группу. Получают полимерную частицу, которая представляет собой частицу гидрогеля, включающую множество гидрофобных защитных групп. Из полимерной частицы удаляют по меньшей мере часть гидрофобных защитных групп и получают гидрофильную частицу. Затем проводят связывание олигонуклеотида с гидрофильной частицей. В одном из вариантов способа проводят отщепление множества гидрофобных защитных групп от гидрофильного полимера, полученного на стадии полимеризации, и экстракцию гидрофобного полимера из полимерной частицы с получением частицы гидрогеля. Изобретение позволяет получить частицы, которые могут эффективно связываться с полинуклеотидами. 4 н. и 69 з.п. ф-лы, 2 ил., 1 табл., 25 пр.

Комментарии