Производные феноксиуксусной кислоты - RU2360901C2
Код документа: RU2360901C2
Описание
Настоящее изобретение относится к замещенным феноксиуксусным кислотам, полезным в качестве фармацевтических соединений для лечения респираторных расстройств, фармацевтическим композициям, содержащим их, и способам их получения.
В ЕРА 1170594 раскрыты способы идентификации соединений, полезных для лечения болезненных состояний, опосредованных простагландином D2, лигандом для орфанового рецептора CRTh2. В GB 1356834 раскрыт ряд соединений, для которых указано, что они обладают противовоспалительной, аналгетической и жаропонижающей активностью. Обнаружено, что некоторые феноксиуксусные кислоты активны в отношении рецептора CRTh2, и, следовательно, ожидается, что они будут потенциально полезными для лечения различных респираторных заболеваний, включая астму и хроническую обструктивную болезнь легких (ХОБЛ).
Следовательно, в первом аспекте согласно изобретению предложен способ лечения заболеваний или состояний человека, при которых полезно модулирование CRTh2-рецепторной активности, включающий введение пациенту соединения формулы (I) или его фармацевтически приемлемых соли или сольвата:

где W представляет собой О, S(O)n (где n равен 0, 1 или 2), NR15, CR1OR2 или CR1R2;
X представляет собой водород, галоген, циано, нитро, S(O)nR6, OR12 или С1-6алкил, который может быть замещен одним или более чем одним атомом галогена;
Y выбран из водорода, галогена, CN, нитро, SO2R3, OR4, SR4, SOR3, SO2NR4R5, CONR4R5, NR4R5, NR6SO2R3, NR6CO2R6, NR6COR3, С2-С6алкенила, С2-С6алкинила, С3-С7циклоалкила или C1-6алкила, причем последние четыре группы возможно замещены одним или более чем одним заместителем, независимо выбранным из галогена, OR6 и NR6R7, S(O)nR6, где n равен 0, 1 или 2;
Z представляет собой арил или гетероарил, возможно замещенный одним или более чем одним заместителем, независимо выбранным из водорода, галогена, CN, ОН, SH, нитро, CO2R6, SO2R9, OR9, SR9, SOR9, SO2NR10R11, CONR10R11, NR10R11, NHSO2R9, NR9SO2R9, NR6CO2R6, NHCOR9, NR9COR9, арила, гетероарила, С2-С6алкенила, С2-С6алкинила, С3-С7циклоалкила или C1-6алкила, причем последние четыре группы возможно замещены одним или более чем одним заместителем, независимо выбранным из галогена, С3-С7циклоалкила, OR6, NR6R7, S(O)nR6 (где n равен 0, 1 или 2), CONR6R7, NR6COR7, SO2NR6R7 и NR6SO2R7;
R1 и R2 независимо представляют собой атом водорода, галоген, С2-С6алкенильную, С2-С6алкинильную, С3-С7циклоалкильную или C1-6алкильную группу, причем последние четыре группы возможно замещены одним или более чем одним заместителем, независимо выбранным из галогена, С3-С7циклоалкила, NR6R7, OR6, S(O)nR6 (где n равен 0, 1 или 2);
или
R1 и R2 вместе могут образовывать 3-8-членное кольцо, возможно содержащее один или более чем один атом, выбранный из О, S, NR6, и само возможно замещенное одним или более чем одним C1-С3алкилом или галогеном;
R3 представляет собой С3-С7циклоалкил или C1-6алкил, любой из которых возможно может быть замещен одним или более чем одним заместителем, независимо выбранным из галогена, С3-С7циклоалкила, OR6 и NR6R7, S(O)nR6(где n равен 0, 1 или 2), CONR6R7, NR6COR7, SO2NR6R7 и NR6SO2R7;
R4 и R5 независимо представляют собой водород, С3-С7циклоалкил или C1-6алкил, причем последние две группы возможно замещены одним или более чем одним заместителем, независимо выбранным из галогена, С3-С7циклоалкила, OR6 и NR6R7, S(O)nR6 (где n равен 0, 1 или 2), CONR6R7, NR6COR7, SO2NR6R7 и NR6SO2R7;
или
R4 и R5 вместе с атомом азота, к которому они присоединены, могут образовывать 3-8-членное насыщенное гетероциклическое кольцо, возможно содержащее один или более чем один атом, выбранный из О, S(O)n (где n равен 0, 1 или 2), NR8, и само возможно замещенное галогеном или C1-3алкилом;
R6 и R7 независимо представляют собой атом водорода или С1-С6алкил;
R8 представляет собой водород, С1-4алкил, -СОС1-С4алкил, CO2С1-С4алкил, SO2R6 или CONR6C1-C4алкил;
R9 представляет собой арил, гетероарил, С3-С7циклоалкил или С1-6алкил, причем две последние группы возможно могут быть замещены одним или более чем одним заместителем, независимо выбранным из галогена, С3-С7циклоалкила, арила, гетероарила, OR6 и NR6R7, S(O)nR6 (где n равен 0, 1 или 2), CONR6R7, NR6COR7, SO2NR6R7 и NR6SO2R7;
R10 и R11 независимо представляют собой арил или гетероарил, водород, С3-С7циклоалкил или C1-6алкил, причем последние две группы возможно замещены одним или более чем одним заместителем, независимо выбранным из галогена, С3-С7циклоалкила, арила, гетероарила, OR6 и NR6R7, S(O)nR6 (где n равен 0, 1 или 2), CONR6R7, NR6COR7,
SO2NR6R7 и NR6SO2R7;
или
R10 и R11 вместе с атомом азота, к которому они присоединены, могут образовывать 3-8-членное насыщенное гетероциклическое кольцо, возможно содержащее один или более чем один атом, выбранный из О, S(O)n (где n равен 0, 1 или 2), NR8, и само возможно замещенное галогеном или С1-С3алкилом;
R12 представляет собой атом водорода или С1-6алкил, который может быть замещен одним или более чем одним атомом галогена, и
R15 представляет собой атом водорода, C1-С6алкил, SO2R6 или COR6.
Примеры арила включают фенил и нафтил.
Гетероарил определен как 5-7-членное ароматическое кольцо или может быть 6,6- или 6,5-конденсированным бициклическим кольцом, причем все они возможно содержат один или более чем один гетероатом, выбранный из N, S и О. Примеры включают пиридин, пиримидин, тиазол, оксазол, пиразол, имидазол, фуран, изоксазол, пиррол, изотиазол и азулен, нафтил, инден, хинолин, изохинолин, индол, индолизин, бензо[b]фуран, бензо[b]тиофен, 1Н-индазол, бензимидазол, бензотиазол, бензоксазол, пурин, 4Н-хинолизин, циннолин, фталазин, хиназолин, хиноксалин, 1,8-нафтиридин, птеридин и хинолон.
Арильные или гетероарильные группы возможно могут быть замещены одним или более чем одним заместителем, независимо выбранным из водорода, галогена, CN, ОН, SH, нитро, CO2R6, SO2R9, OR9, SR9, SOR9, SO2NR10R11, CONR10R11, NR10R11,
NHSO2R9, NR9SO2R9, NR6CO2R6, NHCOR9, NR9COR9, арила, гетероарила, С2-С6алкенила, С2-С6алкинила, С3-С7циклоалкила или С1-6алкила, причем последние четыре группы возможно замещены одним или более чем одним заместителем, независимо выбранным из галогена, С3-С7циклоалкила, OR6, NR6R7, S(O)nR6 (где n равен 0, 1 или 2), CONR6R7, NR6COR7, SO2NR6R7 и NR6SO2R7. Заместители могут находиться в любом подходящем положении арильных и гетероарильных колец, включая атомы азота, если это подходит.
В контексте настоящего описания, если не оговорено особо, алкильная или алкенильная группа либо алкильная или алкенильная группировка в группе заместителе может быть линейной или разветвленной.
Гетероциклические кольца, такие как определены для R4, R5 и R10 и R11, означают насыщенные гетероциклы; примеры включают морфолин, азетидин, пирролидин, пиперидин и пиперазин.
Некоторые соединения формулы (I) способны к существованию в стереоизомерных формах. Следует понимать, что изобретение охватывает все геометрические и оптические изомеры соединений формулы (I) и их смеси, включая рацематы. Таутомеры и их смеси также составляют аспект настоящего изобретения.
Предпочтительно W представляет собой О, S(O)n (где n равен 0, 1 или 2), CR1R2 или NR15, где R15 является водородом или метилом.
Более предпочтительно W представляет собой О, СН2 или NR15, где R15является водородом или метилом.
Еще более предпочтительно W представляет собой О, CH2 или NH.
Наиболее предпочтительно W представляет собой О.
Предпочтительно Х представляет собой галоген, в частности фторо и хлоро, или
C1-2алкил, возможно замещенный одним или более чем одним атомом галогена, такой как CF3.
Более предпочтительно Х представляет собой фторо, хлоро или трифторметил.
Еще более предпочтительно Х представляет собой фторо или хлоро.
Предпочтительно Y представляет собой водород, галоген, в частности фторо и хлоро, или C1-6алкил, такой как метил.
Более предпочтительно Y представляет собой водород или галоген, в частности фторо и хлоро.
Еще более предпочтительно Y представляет собой водород.
Предпочтительно Z представляет собой фенил, пиридил или пиримидил, возможно замещенные, как определено выше, более предпочтительно Z представляет собой фенил, возможно замещенный, как определено выше.
Предпочтительные заместители для всех групп Z включают такие заместители, которые приведены здесь в качестве примера, в частности галоген, CN, C1-3алкил, возможно замещенный одним или более чем одним атомом галогена, SO2R9, OR9, SR9, SOR9, SO2NR10R11, CONR10R11, NHSO2R9, NR9SO2R9, NHCOR9 или NR9COR9. Предпочтительно R9 представляет собой метил или этил.
Более предпочтительные заместители для всех групп Z включают галоген, в частности фторо и хлоро, С1-3алкил, возможно замещенный одним или более чем одним атомом галогена, SO2R9, SO2NR10R11, NHSO2R9 или NR9SO2R9.
Предпочтительно Z представляет собой фенил, замещенный одним или двумя заместителями; предпочтительно заместитель, расположенный в положении 4, выбран из SO2R9, SO2NR10R11, NHSO2R9 или NR9SO2R9. Предпочтительно R9 является метилом или этилом. Предпочтительно R10 и R11оба представляют собой метил.
Предпочтительно Z представляет собой фенил, замещенный двумя заместителями; предпочтительно заместитель, расположенный в положении 4, выбран из SO2R9, SO2NMe2, NHSO2R9 или NR9SO2R9, где R9 является метилом или этилом, и заместитель в положении 2 или 3 выбран из фторо, хлоро или C1-3алкила, возможно замещенного одним или более чем одним атомом галогена.
Предпочтительно R1 и R2 независимо представляют собой водород или C1-3алкил.
Более предпочтительно R1 и R2 независимо представляют собой водород или метил.
Предпочтительно, если R1 представляет собой алкил, и R2 представляет собой водород в цепи кислоты, то S-изомер является предпочтительным.
Предпочтительные соединения формулы (I) включают такие соединения, которые приведены здесь в качестве примера, как в форме свободного основания, так и в виде их фармацевтически приемлемых солей и сольватов.
В следующем аспекте согласно изобретению предложена подгруппа соединений формулы (I), то есть соединения формулы (IA) или их фармацевтически приемлемые соли или сольваты:
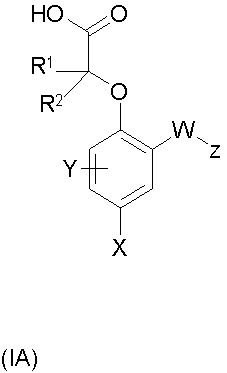
где W представляет собой О, СН2, S(O)n (где n равен 0, 1 или 2) или NR15, где R15 является водородом или метилом;
Х представляет собой галоген или C1-6алкил, который может быть замещен одним или более чем одним атомом галогена;
Y представляет собой водород, галоген или C1-6алкил;
Z представляет собой фенил, пиридил или пиримидил, каждый из которых возможно замещен одним или более чем одним заместителем, независимо выбранным из галогена, CN, С1-3алкила, возможно замещенного одним или более чем одним атомом галогена, SO2R9, OR9, SR9, SOR9, SO2NR10R11, CONR10R11, NHSo2R9, NR9SO2R9, NHCOR9, NR9COR9;
R1 и R2 независимо представляют собой водород или C1-6алкил;
R6 и R7 независимо представляют собой атом водорода или C1-6алкил;
R8 представляет собой водород, С1-4алкил, -СОС1-4алкил, CO2С1-С4алкил, SO2R6 или CONR6C1-С4алкил;
R9 представляет собой C1-6алкил, возможно замещенный галогеном; и
R10 и R11 независимо представляют собой водород или С1-6алкил при условии, что
- соединения 2-[4-метил-2-(бензил)фенокси]уксусная кислота, 2-[4-хлор-2-(бензил)фенокси]пропионовая кислота, 2-[4-бром-2-(4-хлорфенокси)фенокси]пропионовая кислота и 2-[4-хлор-2-(4-хлорфенокси)фенокси]пропионовая кислота исключены;
- если Х представляет собой фторо и W представляет собой S, то Z не является 5-фтор-2-гидроксифенилом;
- если Х представляет собой хлоро, Y представляет собой 3-метил, R1 и R2 оба представляют собой водород и W представляет собой СН2, то Z не является фенилом.
Приемлемо, когда W представляет собой О, СН2, S(O)n (где n равен 0, 1 или 2) или NR15, где R15 является водородом или метилом. Предпочтительно W представляет собой О, S, СН2, NH или NMe, более предпочтительно W представляет собой О, СН2 или NH, еще более предпочтительно W представляет собой О или NH, наиболее предпочтительно W представляет собой О.
Предпочтительно R1 и R2 независимо представляют собой водород или метил. Более предпочтительно R1 и R2 оба представляют собой водород, или один представляет собой водород, а другой представляет собой метил.
Предпочтительно X представляет собой галоген, в частности фторо и хлоро, или
С1-2алкил, возможно замещенный одним или более чем одним атомом галогена, такой как CF3.
Более предпочтительно Х представляет собой фторо, хлоро или трифторметил.
Еще более предпочтительно Х представляет собой фторо или хлоро.
Предпочтительно Y представляет собой водород, галоген, в частности фторо и хлоро, или C1-6алкил, такой как метил.
Более предпочтительно Y представляет собой водород или галоген, в частности фторо и хлоро.
Еще более предпочтительно Y представляет собой водород.
Предпочтительно Z представляет собой фенил, замещенный двумя заместителями; предпочтительно заместитель, расположенный в положении 4, выбран из SO2R9, SO2NR10R11, NHSO2R9 или NR9SO2R9, и заместитель в положении 2 или 3 выбран из фторо, хлоро или C1-3алкила, возможно замещенного одним или более чем одним атомом галогена. Предпочтительно R9 является метилом или этилом. Предпочтительно R10 и R11 оба представляют собой метил.
Предпочтительные соединения формулы (IA) включают:
[4-хлор-2-[[4-(этилсульфонил)фенил]тио]фенокси]-уксусную кислоту,
[4-хлор-2-[[4-(этилсульфонил)-2-метилфенил]тио]фенокси]-уксусную кислоту,
[4-хлор-2-[4-(этилсульфонил)фенокси]фенокси]-уксусную кислоту,
[4-хлор-2-[[4-(метилсульфонил)фенил]амино]фенокси]-уксусную кислоту,
(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)уксусную кислоту,
(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенокси)уксусную кислоту,
(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)уксусную кислоту,
{4-хлор-2-[(5-хлорпиридин-2-ил)тио]фенокси}уксусную кислоту,
{4-хлор-2-[(2-хлор-4-цианофенил)тио]фенокси}уксусную кислоту,
(4-хлор-2-{[2-(метилсульфонил)фенил]тио}фенокси)уксусную кислоту,
(4-хлор-2-{[4-(метилсульфонил)фенил]сульфинил}фенокси)уксусную кислоту,
(4-хлор-2-{[4-(метилсульфонил)фенил]сульфонил}фенокси)уксусную кислоту,
[4-хлор-2-({4-[(метиламино)карбонил]фенил}тио)фенокси]уксусную кислоту,
(2S)-2-(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовую кислоту,
(2R)-2-(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовую кислоту,
(2S)-2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)пропионовую кислоту,
(2S)-2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенокси)пропионовую кислоту,
2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)-2-метилпропионовую кислоту,
{4-хлор-2-[4-(метилсульфонил)фенокси]фенокси}уксусную кислоту,
{4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусную кислоту,
{4-хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}уксусную кислоту,
(2S)-2-{4-хлор-2-[4-(метилсульфонил)фенокси]фенокси}пропионовую кислоту,
(2S)-2-{4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}пропионовую кислоту,
(2S)-2-{4-хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}пропионовую кислоту,
{4,5-дихлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусную кислоту,
{2-[2-хлор-4-(метилсульфонил)фенокси]-4,5-дифторфенокси}уксусную кислоту,
2-{4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}-2-метилпропионовую кислоту,
(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)уксусную кислоту,
(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)уксусную кислоту,
[2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенокси]уксусную кислоту,
(2S)-2-[2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенокси]пропионовую кислоту,
[2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-(трифторметил)фенокси]уксусную кислоту,
(2S)-2-[2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-(трифторметил)фенокси]пропионовую кислоту,
[2-({4-[(диметиламино)сульфонил]фенил}тио)-4-(трифторметил)фенокси]уксусную кислоту,
[2-[2-хлор-4-(метилсульфонил)фенокси]-4-(трифторметил)фенокси]уксусную кислоту,
[2-[2-хлор-4-(этилсульфонил)фенокси]-4-(трифторметил)фенокси]уксусную кислоту,
2-[2-[2-хлор-4-(метилсульфонил)фенокси]-4-(трифторметил)фенокси]масляную кислоту,
[2-{4-[(диметиламино)сульфонил]фенокси}-4-(трифторметил)фенокси]уксусную кислоту,
(2S)-2-[2-{4-[(диметиламино)сульфонил]фенокси}-4-(трифторметил)фенокси]пропионовую кислоту,
{2-[2-хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}уксусную кислоту,
{2-[2-хлор-4-(этилсульфонил)фенокси]-4-фторфенокси}уксусную кислоту,
2-{2-[2-хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}-2-метилпропионовую кислоту,
(2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-фторфенокси)уксусную кислоту,
(2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-фторфенокси)уксусную кислоту,
2-(2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-фторфенокси)-2-метилпропионовую кислоту,
(2-{2-хлор-4-[(этилсульфонил)амино]фенокси}-4-фторфенокси)уксусную кислоту,
(2S)-2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)пропионовую кислоту,
2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)-2-метилпропионовую кислоту,
(2S)-2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)пропионовую кислоту,
2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)-2-метилпропионовую кислоту,
[4-хлор-2-(пиримидин-5-илокси)фенокси]уксусную кислоту,
[4-хлор-2-(хинолин-3-илокси)фенокси]уксусную кислоту,
(2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-фторфенокси)уксусную кислоту,
(2S)-2-(2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-фторфенокси)пропионовую кислоту,
{4-хлор-2-[[2-хлор-4-(метилсульфонил)фенил](метил)амино]фенокси}уксусную кислоту,
{4-хлор-2-[[2-хлор-4-(метилсульфонил)фенил](этил)амино]фенокси}уксусную кислоту,
(2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)уксусную кислоту,
{2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусную кислоту,
{4-хлор-2-[4-(метилсульфонил)-3-(трифторметил)фенокси]фенокси}уксусную кислоту,
[4-хлор-2-(хинолин-8-илтио)фенокси]уксусную кислоту,
(2S)-2-[4-хлор-2-(4-нитрофенокси)фенокси]-пропионовую кислоту,
(2S)-2-(2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)пропионовую кислоту,
2-(2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)-2-метилпропионовую кислоту,
[2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусную кислоту,
[2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусную кислоту,
[2-[4-(этилсульфонил)бензил]-4-(трифторметил)фенокси]уксусную кислоту,
[4-хлор-2-(3-цианобензил)фенокси]уксусную кислоту,
и их фармацевтически приемлемые соли и сольваты.
Упомянутое выше соединение формулы (I) может быть превращено в свои фармацевтически приемлемые соль или сольват, предпочтительно в соль присоединения основания, такую как соль натрия, калия, кальция, алюминия, лития, магния, цинка, бензатина, хлорпрокаина, холина, трет-бутиламина, диэтаноламина, этаноламина, этилдиамина, меглумина, трометамина или прокаина, либо в соль присоединения кислоты, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат или п-толуолсульфонат.
Специалистам в данной области будет понятно, что в способах по настоящему изобретению некоторые функциональные группы в исходных реагентах или промежуточном соединении могут нуждаться в защите при помощи защитных групп. Таким образом, получение соединения формулы (I) может включать на соответствующей стадии удаление одной или более чем одной защитной группы. Защита функциональных групп и снятие защиты с функциональных групп полностью описаны в "Protective Groups in Organic Chemistry", edited by J.W.F.McOmie, Plenum Press (1973), и "Protective Groups in Organic Synthesis", 3rd edition, T.W.Greene & P.G.M.Wuts, Wiley-lnterscience (1999).
Соединения формулы (I) могут быть получены путем взаимодействия соединения формулы (II):

где W, X, Y и Z являются такими, как определено в формуле (I), или представляют собой их защищенные производные, с соединением формулы (III);

где R1 и R2 являются такими, как определено в формуле (I), или представляют собой их защищенные производные, R13 представляет собой Н или C1-С10алкильную группу, и L является уходящей группой, и, возможно, после этого в любом порядке:
- удаления любой защитной группы,
- гидролиза сложноэфирной группы R13 до соответствующей кислоты,
- окисления сульфидов до сульфоксидов или сульфонов,
- образования фармацевтически приемлемой соли.
Реакцию можно проводить в подходящем растворителе, таком как диметилформамид (ДМФА), с использованием основания, такого как карбонат калия или тому подобного. Подходящие группы R13 включают С1-6алкильные группы, такие как метил, этил или трет-бутил. Подходящая L представляет собой уходящую группу, такую как галогено, в частности хлор или бром. Также, для того, чтобы можно было осуществить реакцию Мицунобу с соединением (II), используя, например, трифенилфосфин и диэтилазодикарбоксилат, L может представлять собой гидрокси.
Гидролиз сложноэфирной группы R13 можно проводить с использованием общепринятых методик, например обработкой сложных метиловых и этиловых эфиров водным гидроксидом натрия и обработкой сложных трет-бутиловых эфиров кислотами, такими как трифторуксусная кислота.
Предпочтительные промежуточные соединения формулы (II) включают:
4-хлор-2-[[4-(этилсульфонил)-2-метилфенил]тио]-фенол,
4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенол,
4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенол,
4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенол,
4-хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенол,
2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенол,
2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-фторфенол,
4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенол,
2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-фторфенол,
2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенол,
2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-(трифторметил)фенол,
2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-(трифторметил)фенол.
Соединения формулы (II) могут быть получены путем взаимодействия соединения формулы (IV) с соединением формулы (V) с последующим удалением защитной группы R14, если R14 не представляет собой Н:

где X, Y и Z являются такими, как определено в формуле (I), или представляют собой их защищенные производные, V представляет собой S, NR6 или О, R14 представляет собой Н или подходящую защитную группу, например бензил, L1 представляет собой йодид, бромид, хлорид, фторид или активированный спирт, такой как трифлат.
Реакцию можно проводить в подходящем растворителе, таком как 1-метил-2-пирролидинон, с использованием основания, такого как карбонат калия, предпочтительно при повышенных температурах. Также реакцию можно проводить с палладиевым или медным катализаторами.
Предпочтительные промежуточные соединения формулы (V) включают:
3-хлор-4-фторфенилметилсульфон,
3-хлор-4-фторфенилэтилсульфон.
Последовательность упомянутых выше стадий может быть изменена, например соединение формулы (VI) может быть образовано путем взаимодействия соединения формулы (VII) с соединением формулы (V).


Предпочтительные промежуточные соединения формулы (VII) включают:
2-(4-хлор-2-гидроксифенокси)-2-метилпропионовую кислоту,
(4-фтор-2-гидроксифенокси)уксусную кислоту,
2-(4-фтор-2-гидроксифенокси)-2-метилпропионовую кислоту,
(2S)-2-(4-хлор-2-гидроксифенокси)пропионовую кислоту.
Соединения формулы (I) могут быть получены из соединения формулы (VIII) путем образования металлорганического соединения (IX) с последующим взаимодействием с электрофилом, таким как (X) или (XI), и затем удалением защитной группы R14, как изображено на Схеме 1:
Схема 1

где X, Y являются такими, как определено в формуле (I), или представляют собой их защищенные производные, W определен как CF1OR2или CR1R2, R13 является таким, как определено в формуле (IV), Е представляет собой водород или галоген, и М представляет собой металл, такой как Na или Li. Например, если R14 представляет собой бензил, и Е представляет собой бром, то для образования промежуточного соединения (IX), где М представляет собой Li, можно использовать бутиллитий. Реакцию проводят при -78°С в тетрагидрофуране (ТГФ), затем гасят электрофилом, таким как (X) или (XI). Если R2 представляет собой ОН, то его удаление может быть осуществлено путем восстановления, например гидрирования с использованием Pd/C. Затем можно удалить защитную группу R14.
Соединения формулы (IV), где V представляет собой S, могут быть получены путем взаимодействия соединения формулы (IX) с элементарной серой.
Соединения формулы (I), где W представляет собой N, могут быть получены путем взаимодействия соединения формулы (XII) с соединением формулы (V),

где X, Y, R1 и R2 являются такими, как определено в формуле (I), или представляют собой их защищенные производные. Реакцию можно проводить в подходящем растворителе, таком как 1-метил-2-пирролидинон, с использованием основания, такого как карбонат калия, предпочтительно при повышенных температурах.
Соединения формулы (II), где W представляет собой N, могут быть получены путем взаимодействия соединения формулы (XIII) с соединением формулы (V).

Реакцию можно проводить в подходящем растворителе, таком как 1-метил-2-пирролидинон, с использованием основания, такого как карбонат калия, предпочтительно при повышенных температурах.
Соединения формулы (II), где W представляет собой С, могут быть получены путем взаимодействия соединения формулы (XIV) с соединением формулы (XV),

где X, Y, R1, R2, R14, Z и L являются такими, как определено выше, или представляют собой их защищенные производные.
Реакцию можно проводить в подходящем растворителе, таком как диметиловый эфир этиленгликоля, с использованием основания, такого как карбонат калия, и палладиевого катализатора, предпочтительно при повышенных температурах.
Соединения формулы (I) и соединение формулы (II) могут быть получены путем взаимодействия соединения формулы (XVI) или соединения формулы (XVII) с соединением формулы (XVIII),

где X, Y, R1, R2, R13, R14, Z и W являются такими, как определено выше, или представляют собой их защищенные производные, G является галогеном, трифлатом или бороновой кислотой. Реакцию можно проводить в подходящем растворителе, таком как изопропиловый спирт, с использованием основания, такого как карбонат калия, и металлического катализатора, такого как медь, предпочтительно при повышенных температурах.
В следующем аспекте согласно настоящему изобретению предложено применение нового соединения формулы (I)/(IA) и его фармацевтически приемлемых соли или сольвата в терапии.
Соединения формулы (I) обладают активностью как фармацевтические средства, в частности как модуляторы CRTh2-рецепторной активности, и могут быть использованы в лечении (терапевтическом или профилактическом) состояний/заболеваний у человека и отличных от человека животных, которые обостряются или вызываются повышенным или нерегулируемым продуцированием PGD2 и его метаболитов. Примеры таких состояний/заболеваний включают:
(1) (дыхательные пути) - обструктивные заболевания дыхательных путей, включая: астму, в том числе бронхиальную, аллергическую, наследственную бронхиальную, приобретенную бронхиальную, вызванную физической нагрузкой, индуцированную приемом лекарств (включая индуцированную приемом аспирина и NSAID) и индуцированную пылью астму, как интермиттирующую, так и персистирующую, и всех степеней тяжести, и другие случаи гиперчувствительности дыхательных путей; хроническую обструктивную болезнь легких (ХОБЛ); бронхит, в том числе инфекционный и эозинофильный бронхит; эмфизему; бронхоэктаз; муковисцидоз; саркоидоз; легкое "фермера" и родственные заболевания; гиперчувствительный пневмонит; фиброз легкого, в том числе криптогенный фиброзирующий альвеолит, идиопатическую интерстициальную пневмонию, фиброз, являющийся осложнением противоопухолевой терапии и хронической инфекции, включая туберкулез и аспергиллез и другие грибковые инфекции; осложнения легочной трансплантации; васкулитоподобные и тромботические расстройства легочной сосудистой сети и легочную гипертензию; противокашлевую активность, в том числе лечение хронического кашля, ассоциированного с воспалительными и секреторными состояниями дыхательных путей, и ятрогенного кашля; острый и хронический ринит, в том числе медикаментозный ринит и вазомоторный ринит; круглогодичный и сезонный аллергический ринит, в том числе нервный ринит (сенная лихорадка); назальный полипоз; острую вирусную инфекцию, в том числе простуду, и инфекцию, вызванную респираторно-синцитиальным вирусом, вирусом гриппа, коронавирусом (включая SARS) и аденовирусом;
(2) (кости и суставы) артритиды, ассоциированные с остеоартритом/остеоартрозом или включающие остеоартрит/остеоартроз, как первичный, так и вторичный по отношению, например, к врожденной дисплазии тазобедренного сустава; шейный и поясничный спондилит и поясничную и шейную боль; ревматоидный артрит и болезнь Стилла; серонегативные спондилоартропатии, в том числе анкилозирующий спондилит, псориатический артрит, реактивный артрит и недифференцируемую спондилоартропатию; септический артрит и другие ассоциированные с инфекцией артропатии и заболевания кости, такие как туберкулез, в том числе болезнь Потта и синдром Понсе; острый и хронический индуцируемый отложением кристаллов синовит, в том числе уратную подагру, заболевание вследствие отложения пирофосфата кальция и воспаление сухожилий, сумки и синовиальное воспаление, ассоциированные с апатитом кальция; болезнь Бехчета; первичный и вторичный синдром Шегрена; системный склероз и ограниченную склеродермию; системную красную волчанку, смешанное заболевание соединительной ткани и недифференцированное заболевание соединительной ткани; воспалительные миопатии, в том числе дерматомиозит и полимиозит; ревматическую полимиалгию; юношеский артрит, в том числе идиопатические воспалительные артритиды суставов любой локализации и ассоциированные синдромы, и ревматизм и его системные осложнения; васкулитиды, в том числе гигантоклеточный артериит, синдром Такаясу, синдром Черга-Штраусса (Churg-Strauss), нодозный полиартериит, микроскопический полиартериит и васкулитиды, ассоциированные с вирусной инфекцией, гиперчувствительными реакциями, криоглобулинами и парапротеинами; поясничную боль; семейную средиземноморскую лихорадку, синдром Макла-Уэллса (Muckle-Wells), семейную ирландскую лихорадку, болезнь Кикучи (Kikuchi); индуцированные приемом лекарств артралгии, поражения кожи при тендините и миопатии;
(3) (кожа) псориаз, атопический дерматит, контактный дерматит или другие экзематозные дерматозы и гиперчувствительные реакции замедленного типа; фито- и фотодерматит; себоррейный дерматит, герпетиформный дерматит, плоский лишай, склеротический атрофический лишай, гангренозную пиодермию, кожный саркоид, дискоидную красную волчанку, пузырчатку, пемфигоид, врожденный буллезный эпидермолиз, крапивницу, ангионевротический отек, васкулитиды, токсические эритемы, кожные эозинофилии, гнездную алопецию, мужское облысение, синдром Свита (Sweet), болезнь Вебера-Крисчена, многоформную эритему; целлюлит, как инфекционный, так и неинфекционный; панникулит; кожные лимфомы, немеланомный рак кожи и другие диспластические поражения; расстройства, индуцированные приемом лекарств, включая стойкие лекарственные сыпи;
(4) (глаза) блефарит; конъюнктивит, в том числе круглогодичный и весенний аллергический конъюнктивит; ирит; передний и задний увеит; хориоидит; аутоиммунную реакцию; дегенеративные или воспалительные расстройства, влияющие на сетчатку; офтальмит, включая симпатический офтальмит; саркоидоз; инфекции, в том числе вирусные, грибковые и бактериальные;
(5) (желудочно-кишечный тракт) глоссит, гингивит, периодонтит; эзофагит, включая рефлюкс-эзофагит; эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, колит, включая неспецифический язвенный колит, проктит, зуд заднего прохода; заболевание брюшной полости, синдром раздраженной кишки и пищевые аллергии, которые могут проявиться вдали от кишечника (например, мигрень, ринит или экзема);
(6) (абдоминальная область) гепатит, в том числе аутоиммунный, алкогольный и вирусный; фиброз и цирроз печени; холецистит; панкреатит, как острый, так и хронический;
(7) (мочеполовая система) нефрит, включая интерстициальный и гломерулонефрит; нефротический синдром; цистит, включая острый и хронический (интерстициальный) цистит и язву Ханнера; острый и хронический уретрит, простатит, эпидидимит, оофорит и сальпингит; вульвовагинит; болезнь Пейрони; эректильную дисфункцию (как мужскую, так и женскую);
(8) (отторжение аллотрансплантата) острое и хроническое после, например, трансплантации почки, сердца, печени, легкого, костного мозга, кожи или роговицы или после переливания крови; или хроническую болезнь "трансплантат против хозяина";
(9) (ЦНС) болезнь Альцгеймера и другие приводящие к слабоумию расстройства, включая CJD (Creutzfeldt-Jacob disease; болезнь Крейтцфельдта-Якоба) и nvCJD; амилоидоз; рассеянный склероз и другие демиелинизирующие синдромы; церебральный атеросклероз и васкулит; височный артериит; тяжелую миастению; острую и хроническую боль (острую, интермиттирующую или персистирующую, или центрального, или периферического происхождения), включая висцеральную боль, головную боль, мигрень, тригеминальную невралгию, атипичную лицевую боль, суставную и костную боль, боль, являющуюся результатом рака и опухолевой инвазии, невропатические болевые синдромы, в том числе диабетические, постгерпетические и ВИЧ-ассоциированные невропатии; нейросаркоидоз; осложнения в центральной и периферической нервной системах вследствие злокачественных, инфекционных или аутоиммунных процессов;
(10) другие аутоиммунные и аллергические расстройства, включая тиреоидит Хашимото, болезнь Грейвса, болезнь Аддисона, сахарный диабет, идиопатическую тромбоцитопеническую пурпуру, эозинофильный фасцит, гипер-lgE синдром, антифосфолипидный синдром;
(11) другие расстройства с воспалительным или иммунологическим компонентом, включая синдром приобретенного иммунодефицита (СПИД), лепру, синдром Сезари и паранеопластические синдромы;
(12) (сердечно-сосудистая система) атеросклероз, влияющий на коронарное и периферическое кровообращение; перикардит; миокардит, воспалительные и аутоиммунные кардиомиопатии, включая миокардиальный саркоид; ишемические реперфузионные поражения; эндокардит, вальвулит и аортит, включая инфекционный (например, сифилитический); васкулитиды; заболевания проксимальных и периферических вен, включая флебит и тромбоз, включая тромбоз глубоких вен и осложнения варикозных вен;
(13) (онкология) лечение обычных видов рака, включая опухоли предстательной железы, молочной железы, легкого, яичников, поджелудочной железы, кишечника и толстой кишки, желудка, кожи и головного мозга, и злокачественные новообразования, влияющие на костный мозг (включая лейкозы) и лимфопролиферативные системы, такие как лимфома Ходжкина или неходжкинская лимфома; включая предупреждение и лечение метастатического заболевания и опухолевых рецидивов и паранеопластических синдромов;
(14) заболевания, ассоциированные с повышенными уровнями PGD2 или его метаболитов.
Таким образом, согласно настоящему изобретению предложено соединение формулы (IA) или его фармацевтически приемлемые соль или сольват, такие как определено выше, для применения в терапии.
Предпочтительно, соединения (I)/(IA) по изобретению используют для лечения заболеваний, при которых хемокиновый рецептор принадлежит подсемейству CRTh2-рецепторов.
Особыми состояниями, которые могут быть подвергнуты лечению соединениями по изобретению, являются астма, ринит и другие заболевания, при которых уровни PGD2 или его метаболитов повышены. Предпочтительно, чтобы соединения по изобретению использовали для лечения астмы или ринита.
В следующем аспекте согласно настоящему изобретению предложено применение соединения формулы (I)/(IA) или его фармацевтически приемлемых соли или сольвата, таких как определено выше, в изготовлении лекарства для применения в терапии.
Кроме того, изобретение относится к комбинированным терапиям, где соединение формулы (I)/(IA) или его фармацевтически приемлемые соль, сольват или гидролизуемый in vivo сложный эфир, или фармацевтическую композицию, или препарат, содержащие соединение формулы (I)/(IA), вводят одновременно или последовательно или в виде комбинированного препарата с другим терапевтическим агентом или агентами для лечения одного или более чем одного из перечисленных состояний.
В частности, для лечения воспалительных заболеваний, ревматоидного артрита, псориаза, воспалительного заболевания кишечника, ХОБЛ, астмы и аллергического ринита соединения по изобретению можно объединять с такими агентами, как ингибиторы фактора некроза опухоли альфа (TNF-α), такими как анти-TNF-моноклональные антитела (например, ремикад, CDP-870 и адалимумаб) и TNF-рецепторные иммуноглобулиновые молекулы (такие как энбрел); неселективные ингибиторы циклооксигеназ (СОХ)-1/СОХ-2, применяемые местно или системно (такие как пироксикам, диклофенак, пропионовые кислоты, такие как напроксен, флубипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, такие как мефенамовая кислота, индометацин, сулиндак, азапропазон, пиразолоны, такие как фенилбутазон, салицилаты, такие как аспирин), ингибиторы СОХ-2 (такие как мелоксикам, целекоксиб, рофекоксиб, валдекоксиб, люмарококсиб (lumarocoxib), парекоксиб и эторикоксиб); глюкокортикостероиды (вводимые местными, пероральными, внутримышечными, внутривенными или внутрисуставными способами); метотрексат, лефуномид; гидроксихлорохин, d-пеницилламин, ауранофин или другие парентеральные или пероральные препараты золота.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с ингибитором биосинтеза лейкотриенов, ингибитором 5-липоксигеназы (5-LO) или антагонистом белка, активирующего 5-липоксигеназу (FLAP), такими как зилейтон; АВТ-761; фенлейтон; тепоксалин; Abbott-79175; Abbott-85761; N-(5-замещенные)-тиофен-2-алкилсульфонамиды; 2,6-ди-трет-бутилфенолгидразоны; метокситетрагидропираны, такие как Zeneca ZD-2138; соединение SB-210661; пиридинил-замещенные 2-цианонафталиновые соединения, такие как L-739,010; 2-цианохинолиновые соединения, такие как L-746,530; индольные и хинолиновые соединения, такие как МК-591, МК-886 и BAY x 1005.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с антагонистом рецепторов лейкотриенов (LT)B4, LTC4, LTD4 и LTE4, выбранным из группы, состоящей из фенотиазин-3-онов, таких как L-651,392; амидиновых соединений, таких как CGS-25019c; бензоксаламинов, таких как онтазоласт; бензолкарбоксимидамидов, таких как BIIL 284/260; и таких соединений, как зафирлукаст, аблукаст, монтелукаст, пранлукаст, верлукаст (МК-679), RG-12525, Ro-245913, иралукаст (CGP 45715А) и BAY x 7195.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с ингибитором фосфодиэстеразы (PDE), таким как метилксантанины, включая теофиллин и аминофиллин; и селективными ингибиторами изофермента PDE, включая ингибиторы PDE4 и ингибиторы изоформы PDE4D и ингибиторы PDE5.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с антагонистами гистаминовых рецепторов типа 1, такими как цетиризин, лоратадин, дезлоратадин, фексофенадин, акривастин, терфенадин, астемизол, азеластин, левокабастин, хлорфенирамин, прометазин, циклизин и миколастин, применяемые перорально, местно или парентерально.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с гастропротекторным антагонистом гистаминового рецептора типа 2.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с антагонистами гистаминового рецептора типа 4.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с сосудосуживающим симпатомиметическим агентом, являющимся агонистом альфа-1/альфа-2 адренергических рецепторов, таким как пропилгекседрин, фенилэфрин, фенилпропаноламин, эфедрин, псевдоэфедрин, нафазолина гидрохлорид, оксиметазолина гидрохлорид, тетрагидрозолина гидрохлорид, ксилометазолина гидрохлорид, трамазолина гидрохлорид и этилнорэпинефрина гидрохлорид.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с антихолинергическими агентами, включая антагонисты мускариновых рецепторов (М1, М2 и М3), такие как атропин, гиосцин, гликопирролат, ипратропия бромид; тиотропия бромид; окситропия бромид;пирензепин; и телензепин.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с агонистом бета-адренергических рецепторов (включая бета-рецепторные подтипы 1-4), таким как изопреналин, салбутамол, формотерол, салметерол, тербуталин, орципреналин, битолтерола мезилат и пирбутерол.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с хромоном, включая хромогликат натрия и натрия недокромил.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с миметиком инсулиноподобного фактора роста I типа (IGF-1).
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с глюкокортикоидом, вводимым ингаляцией, таким как флунизолид, триамцинолона ацетонид, беклометазона дипропионат, будесонид, флутиказона пропионат, циклезонид и мометазона фуроат.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с ингибитором матриксных металлопротеаз (ММР), то есть стромелизинов, коллагеназ и желатиназ, а также аггреканазы; в частности коллагеназы-1 (ММР-1), коллагеназы-2 (ММР-8), коллагеназы-3 (ММР-13), стромелизина-1 (ММР-3), стромелизина-2 (ММР-10) и стромелизина-3 (ММР-11) и ММР-9 и ММР-12.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с модуляторами функции хемокиновых рецепторов, такими как антагонисты CCR1, CCR2, CCR2A, CCR2B, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 и CCR11 (для семейства С-С); CXCR1, CXCR2, CXCR3, CXCR4 и CXCR5 (для семейства С-Х-С) и СХ3CR1 для семейства С-Х3-С.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с цитокином или модулятором функции цитокинов, включая альфа-, бета- и гамма-интерферон; интерлейкинами (IL), включая IL от 1 до 15, и антагонистами или ингибиторами интерлейкинов, включая агенты, которые действуют на цитокиновые пути передачи сигнала.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с иммуноглобулином (Ig) или Ig-препаратом, или антагонистом, или антителом, модулирующим Ig-функционирование, таким как анти-IgE (омализумаб).
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с другими системными или местно применяемыми противовоспалительными агентами, включая талидомид и производные, ретиноиды, дитранол и кальципотриол.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с антибактериальным агентом, включая производные пенициллина, тетрациклины, макролиды, бета-лактамы, фторхинолоны и ингалируемые аминогликозиды; и противовирусными агентами, включая ацикловир, фамцикловир, валацикловир, ганцикловир, цидофовир; амантадин, римантадин; рибавирин; занамавир и оселтамавир; ингибиторами протеаз, такими как индинавир, нелфинавир, ритонавир и саквинавир; нуклеозидными ингибиторами обратной транскриптазы, такими как диданозин, ламивудин, ставудин, залцитабин, зидовудин; ненуклеозидными ингибиторами обратной транскриптазы, такими как невирапин, эфавиренц.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с сердечно-сосудистыми агентами, такими как блокаторы кальциевых каналов, блокаторы бета-адренергических рецепторов, ингибиторы ангиотензин-превращающего фермента (АСЕ), антагонисты рецепторов ангиотензина-2; агенты, снижающие уровень липидов, такие как статины и фибраты; модуляторы морфологии клеток крови, такие как пентоксифиллин; тромболитики и антикоагулянты, включая ингибиторы агрегации тромбоцитов.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с агентами для центральной нервной системы (ЦНС), такими как антидепрессанты (такие как сертралин), антипаркинсонические лекарственные средства (такие как депренил, L-допа, реквип, мирапекс, ингибиторы МАОВ (моноаминоксидазы В), такие как селегин и расагилин, ингибиторы comP (катехол-о-метилтрансферазы), такие как Тасмар, А-2 ингибиторы, ингибиторы обратного захвата допамина, антагонисты NMDA (N-метил-D-аспартата), агонисты никотина, агонисты допамина и ингибиторы нейрональной синтазы оксида азота) и лекарственные средства для лечения болезни Альцгеймера, такие как донепезил, такрин, ингибиторы СОХ-2, пропентофиллин или метрифонат.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с агентами для лечения острой и хронической боли, включая анальгетики центрального и периферического действия, такие как опиоидные аналоги и производные, карбамазепин, фенитоин, валпроат натрия, амитриптилин и другие антидепрессанты, и нестероидные противовоспалительные агенты.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с анестезирующими агентами местного действия, применяемыми парентерально или местно, такими каклигнокаин.
Кроме того, настоящее изобретение еще относится к комбинации соединения по изобретению вместе с (1) ингибиторами триптазы; (2) антагонистами фактора активации тромбоцитов (PAF); (3) ингибиторами интерлейкин-превращающего фермента (ICE); (4) ингибиторами инозинмонофосфата дегидрогеназы (IMPDH); (5) ингибиторами молекул адгезии, включая антагонисты VLA-4; (6) катепсинами; (7) ингибиторами МАР-киназы; (8) ингибиторами глюкозо-6-фосфат-дегидрогеназы; (9) антагонистами кининовых рецепторов B1 и B2; (10) средствами против подагры, например колхицином; (11) ингибиторами ксантиноксидазы, например аллопуринолом; (12) средствами, способствующими выведению мочевой кислоты, например пробенецидом, сульфинпиразоном и бензбромароном; (13) средствами, усиливающими секрецию гормона роста; (14) трансформирующим фактором роста (TGFβ); (15) тромбоцитарным фактором роста (PDGF); (16) фактором роста фибробластов, например основным фактором роста фибробластов (bFGF); (17) гранулоцитарно-макрофагальным колониестимулирующим фактором (GM-CSF); (18) капсаициновым кремом; (19) антагонистами рецепторов тахикинина NK1 и NK3, выбранными из группы, состоящей из NKP-608С; SB-233412 (талнетант); и D-4418; (20) ингибиторами эластазы, выбранными из группы, состоящей из UT-77 и ZD-0892; (21) ингибиторами TNF-превращающего фермента (ТАСЕ); (22) ингибиторами индуцируемой синтазы оксида азота (iNOS) или (23) молекулой, гомологичной рецепторам хемоаттрактантов, экспрессируемой на Th2-клетках (СРТН2-антагонисты); (24) ингибиторами Р38.
Соединения по настоящему изобретению также можно применять в комбинации с противоостеопорозными агентами, включая гормональные агенты, такие как ралоксифен, и бифосфонаты, такие как алендронат.
Соединения по изобретению также можно применять в комбинации с существующими терапевтическими агентами для лечения остеоартрита. Подходящие агенты для использования в комбинации включают обычные нестероидные противовоспалительные агенты (далее NSAID), такие как пироксикам, диклофенак, пропионовые кислоты, такие как напроксен, флубипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, такие как мефенамовая кислота, индометацин, сулиндак, апазон, пиразолоны, такие как фенилбутазон, салицилаты, такие как аспирин, ингибиторы СОХ-2, такие как целекоксиб, валдекоксиб, рофекоксиб и эторикоксиб, анальгетики и внутрисуставные терапевтические средства, такие как кортикостероиды и производные гиалуроновых кислот, и пищевые добавки, такие как глюкозамин.
Соединения по изобретению также можно применять в комбинации с существующими терапевтическими агентами для лечения рака. Подходящие агенты для использования в комбинации включают:
(1) антипролиферативные/антинеопластические лекарственные средства и их комбинации, применяемые в медицинской онкологии, такие как алкилирующие агенты (например, цис-платина, карбоплатин, циклофосфамид, азотная горчица (nitrogen mustard), мелфалан, хлорамбуцил, бусульфан и нитрозомочевины); антиметаболиты (например, антифолаты, такие как фторпиримидины, подобные 5-фторурацилу и тегафуру, ралтитрексед, метотрексат, цитозинарабинозид, гидроксимочевина, гемцитабин и паклитаксел); противоопухолевые антибиотики (например, антрациклины, подобные адриамицину, блеомицину, доксорубицину, дауномицину, эпирубицину, идарубицину, митомицину-С, дактиномицину и митрамицину); антимитотические агенты (например, винкаалкалоиды, подобные винкристину, винбластину, виндезину и винорелбину, и таксоиды, подобные таксолу и таксотеру); и ингибиторы топоизомеразы (например, эпиподофиллотоксины, подобные этопозиду и тенипозиду, амсакрин, топотекан и камптотецины);
(2) цитостатические агенты, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и йодоксифен), негативные регуляторы эстрогеновых рецепторов (например, фулвестрант), антиандрогены (например, бикалутамид, флутамид, нилутамид и ацетат ципротерона), антагонисты LHRH (рилизинг-фактора лютеинизирующего гормона) или агонисты LHRH (например, гозерелин, лейпрорелин и бусерелин), прогестогены (например, ацетат мегестрола), ингибиторы ароматазы (например, как анастрозол, летрозол, воразол (vorazole) и эксеместан) и ингибиторы 5α-редуктазы, такие как финастерид;
(3) агенты, которые ингибируют инвазию раковых клеток (например, ингибиторы металлопротеиназы, подобные маримастату, и ингибиторы функционирования рецепторов урокиназного активатора плазминогена);
(4) ингибиторы функции фактора роста, например, включают антитела к факторам роста, антитела к рецепторам факторов роста (например, анти-erbb2-антитело трастузумаб и анти-erbb1-антитело цетуксимаб [С225]), ингибиторы фарнезилтрансферазы, ингибиторы тирозинкиназы и ингибиторы серин/треонинкиназы, например ингибиторы семейства эпидермальных факторов роста (EGFR) (например, ингибиторы тирозинкиназы EGFR-семейства, такие как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (гефитиниб, AZD1839), N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4-амин (CI 1033)), например ингибиторы семейства тромбоцитарных факторов роста, и, например, ингибиторы семейства факторов роста гепатоцитов;
(5) антиангиогенные агенты, такие как агенты, которые ингибируют эффекты фактора роста эндотелия сосудов (например, антитело против фактора роста эндотелиальных клеток сосудов бевацизумаб, соединения, такие как раскрытые в международных заявках на патент WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354), и соединения с другими механизмами действия (например, линомид, ингибиторы функции интегрина αvβ3 и ангиостатин);
(6) агенты, вызывающие повреждение сосудов, такие как комбретастатин А4 и соединения, раскрытые в международных заявках на патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213;
(7) антисмысловые терапии, например такие, которые направлены на мишени, перечисленные выше, такие как ISIS 2503, анти-ras антисмысловая терапия;
(8) генотерапевтические подходы, включая, например, подходы по замене аберрантных генов, таких как аберрантный р53 или аберрантный BRCA1, или BRCA2, подходы GDEPT (ген-направленный фермент пролекарственной терапии), такие как использующие цитозиндеаминазу, тимидинкиназу или бактериальный фермент нитроредуктазу, и подходы по повышению переносимости пациентами химиотерапии или лучевой терапии, как например, генная терапия множественной лекарственной устойчивости;
и
(9) иммунотерапевтические подходы, включая, например, ex-vivo и in-vivo подходы по повышению иммуногенности опухолевых клеток пациента, такие как трансфекция цитокинами, например интерлейкином-2, интерлейкином-4 или гранулоцитарно-макрофагальным колониестимулирующим фактором, подходы по снижению Т-клеточной анергии, подходы с использованием трансфецированных иммунных клеток, например трансфецированных цитокинами дендритных клеток, подходы с использованием трансфецированных цитокинами опухолевых клеточных линий и подходы с использованием антиидиотипических антител.
В еще одном дополнительном аспекте согласно настоящему изобретению предложено применение соединения формулы (I) или его фармацевтически приемлемых соли или сольвата, таких как определено выше, в изготовлении лекарства для лечения заболеваний или состояний у человека, при которых полезно модулирование CRTh2-рецепторной активности.
В контексте настоящего описания термин "терапия" также включает "профилактику", если нет каких-либо особых противоположных указаний. Термины "терапевтический" и "терапевтически" следует истолковывать соответственно.
Кроме того, согласно изобретению еще предложен способ лечения заболеваний, опосредованных PGD2 или его метаболитами, где простаноид связывается со своим рецептором (в особенности CRTh2-рецептором), который включает введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или пролекарства, таких как определено выше.
Также в изобретении предложен способ лечения воспалительного заболевания, особенно псориаза, у пациента, страдающего от указанного заболевания или рискующего заболеть им, который включает введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемых соли или сольвата, таких как определено выше.
Для вышеупомянутых терапевтических применений вводимая дозировка будет несомненно изменяться в зависимости от применяемого соединения, способа введения, желаемого лечения и указанного расстройства.
Соединение формулы (I), его пролекарства и фармацевтически приемлемые соли и сольваты могут быть использованы как таковые, но обычно их будут вводить в форме фармацевтической композиции, в которой соединение формулы (I)/соль/сольват (активный ингредиент) находится в ассоциации с фармацевтически приемлемым адъювантом, разбавителем или носителем. В зависимости от способа введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.% (массовый процент), более предпочтительно от 0,05 до 80 мас.%, еще более предпочтительно от 0,10 до 70 мас.% и еще более предпочтительно от 0,10 до 50 мас.% активного ингредиента, при этом все массовые проценты даны в расчете на общую массу композиции.
В настоящем изобретении также предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемые соль или сольват, такие как определено выше, в ассоциации с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Фармацевтические композиции можно вводить местно (например, в легкое и/или дыхательные пути или на кожу) в форме растворов, суспензий, гептафторалкановых аэрозолей и сухих порошковых препаратов; или системно, например посредством перорального введения в форме таблеток, капсул, сиропов, порошков или гранул, или парентерального введения в форме растворов или суспензий, или подкожного введения, или ректального введения в форме суппозиториев, или трансдермально. Предпочтительно соединение по изобретению вводят перорально.
Далее изобретение будет проиллюстрировано следующими неограничивающими примерами, в которых, если не оговорено особо:
(1) данные1H ЯМР, когда они предоставлены, приведены в виде значений дельта для основных диагностических протонов в миллионных долях (млн-1) относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта;
(2) масс-спектры (МС): обычно сообщаются только те ионы, которые указывают исходную массу, и, если не оговорено особо, приведенная масса иона представляет собой массу положительно заряженного иона (М+Н)+;
(3) соединения, указанные в заголовках примеров и способов, названы с использованием программы ACD/name (версия 6.0) от Advanced Chemical Development Inc, Canada;
(4) если не оговорено особо, обращенно-фазовую ВЭЖХ (ОФ-ВЭЖХ) проводили, используя Symmetry, NovaPak или Ex-Terra обращенно-фазовую колонку с диоксидом кремния;
(5) растворители сушили с использованием MgSO4 или Na2SO4;
(6) конечные соединения получали в виде свободной кислоты или подходящей соли, такой как натриевая;
(7) использовали следующие сокращения:
Пример 1
Натриевая соль [4-хлор-2-[[4-(этилсульфонил)фенил]тио]фенокси]-уксусной кислоты

(1) 6-Хлор-2-метокси-бензолтиол
Трифенилфосфин (11,4 г) порциями добавляли к перемешиваемому раствору 5-хлор-2-метоксибензолсульфонилхлорида (3,0 г) в ТГФ (30 мл). Добавляли воду (4 мл) и смесь перемешивали при КТ в течение 2 ч, после чего реакционную смесь разбавляли водой (25 мл), затем 2М раствором гидроксида натрия и промывали эфиром. Водный слой подкисляли 2М соляной кислотой и экстрагировали этилацетатом. Органический слой сушили и упаривали при пониженном давлении; выход 3,1 г.
МС: электрораспылительная ионизация (ЭРИ) (-ve) 173 (М-1).
(2) 4-Хлор-2-[[4-(этилсульфонил)фенил]тио]-1-метокси-бензол
Карбонат калия (0,315 г) добавляли к перемешиваемому раствору продукта со стадии (1) (0,4 г) и этил-(4-бром-фенил)-сульфона (0,285 г) в NMP (10 мл) и смесь нагревали при 90°С в течение 1 ч. Смесь распределяли между водой и этилацетатом, органическую фазу отделяли, сушили и упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 25% этилацетат/изогексан. Выход 0,4 г.
1H ЯМР CDCl3: δ 7.76-6.91 (7Н, m), 3.81 (3Н, s), 3.13-3.06 (2H, q), 1.30-1.22 (3H, t).
(3) 4-Хлор-2-[[4-(этилсульфонил)фенил]тио]-фенол
Раствор трибромида бора (1М в ДХМ; 2,3 мл) медленно добавляли к перемешиваемому раствору продукта со стадии (2) (0,4 г) в ДХМ (20 мл) при 0°С. Через 0,5 ч добавляли еще 4 мл раствора трибромида бора и смесь перемешивали в течение 1 ч. Реакцию гасили измельченным льдом и реакционную смесь распределяли между водой и ДХМ. Органическую фазу отделяли, сушили и упаривали при пониженном давлении; выход 0,3 г.
MC: ЭРИ (-ve) 327 (M-1).
(4) 1,1РДиметилэтиловый эфир [4-хлор-2-[[4-(этилсульфонил)фенил]тио]фенокси]-уксусной кислоты
Смесь продукта со стадии (3) (0,3 г), трет-бутилбромацетата (0,15 мл) и карбоната калия (0,13 г) в ДМФА (20 мл) перемешивали при КТ в течение ночи. Смесь распределяли между водой и этилацетатом, органическую фазу отделяли, сушили и упаривали при пониженном давлении. Выход 0,55 г.
МС: ЭРИ (+ve) 460 (M+NH4).
(5) Натриевая соль [4-хлор-2-[[4-(этилсульфонил)фенил]тио]фенокси]-уксусной кислоты
Трифторуксусную кислоту (10 мл) добавляли к раствору продукта со стадии (4) (0,55 г) в ДХМ (10 мл) и смесь перемешивали при КТ в течение 1 ч. Смесь упаривали при пониженном давлении и остаток очищали обращенно-фазовой ВЭЖХ. Натриевую соль получали с использованием гидроксида натрия; выход 0,21 г.
1H ЯМР диметилсульфоксид-d6 (ДМСО-d6): δ 7.74-7.71 (2Н, m), 7.49-6.90 (4Н, m), 6.90-6.88 (1Н, d), 4.16 (2Н, s), 3.26-3.22 (2Н, q), 1.11-1.06 (3H, t).
МС: ЭРИ (-ve) 385 (М-1).
Пример 2
Натриевая соль [4-хлор-2-[[4-(этилсульфонил)-2-метилфенил]тио]фенокси]-уксусной кислоты

(1) 1-Бром-4-(этилтио)-2-метил-бензол
Бром (2,2 мл) добавляли к раствору 1-(этилтио)-3-метилбензола (6,6 г) в уксусной кислоте (20 мл) при 0°С. Смесь перемешивали при КТ в течение 2 ч, затем при пониженном давлении удаляли растворитель. Остаток очищали хроматографией на диоксиде кремния, элюируя ДХМ. Выход 6,6 г.
МС: химическая ионизация при атмосферном давлении (ХИАД) (+ve) 247/9 (М+1).
(2) 1-Бром-4-(этилсульфонил)-2-метил-бензол
3-Хлорпероксибензойную кислоту (70%-ной чистоты; 11,8 г) добавляли к раствору продукта со стадии (1) (5 г) в ДХМ (60 мл) и перемешивали при КТ в течение 4 ч. Смесь распределяли между ДХМ и водным раствором метабисульфита натрия, органическую фазу промывали водным раствором гидрокарбоната натрия, водой, сушили и упаривали при пониженном давлении. Выход 5,73 г.
1H ЯМР CDCl3: δ 7.76-7.73 (2Н, m), 7.58-7.56 (1Н, m), 3.10 (2Н, q), 2.49 (3H,s),1.28(3H, t).
(3) 4-Хлор-2-[[4-(этилсульфонил)-2-метилфенил]тио]-1-метокси-бензол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (2), используя продукт со стадии (2). Выход 0,25 г.
1H ЯМР CDCl3: δ 7.70-6.91 (6Н, m), 3.82 (3H, s), 3.13-3.06 (2H, q), 2.48 (3H, s), 1.30-1.22 (3H, t).
(4) 4-Хлор-2-[[4-(этилсульфонил)-2-метилфенил]тио]-фенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (3), используя продукт со стадии (3). Выход 0,3 г.
МС: ЭРИ (-ve) 341 (М-1).
(5) 1,1-Диметилэтиловый эфир [4-хлор-2-[[4-(этилсульфонил)-2-метилфенил]тио]фенокси]-уксусной кислоты
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (4), используя продукт со стадии (4). Выход 0,5 г.
МС: ЭРИ (+ve) 474 (M+NH4).
(6) Натриевая соль [4-хлор-2-[[4-(этилсульфонил)-2-метилфенил]тио]фенокси]-уксусной кислоты
Указанное в заголовке соединение получали способом из Примера 1, стадия (5), используя продукт со стадии (5). Выход 0,225 г.
1H ЯМР ДМСО-d6: δ 7.73-7.72 (1Н, d), 7.55-7.52 (1Н, dd), 7.41-7.38 (1Н, dd), 7.27-7.21 (2H, m), 6.89-6.87 (1Н, d), 4.14 (2H, s), 3.27-3.22 (2H, q), 2.42 (3H, s), 1.10-1.07(3H, t).
МС: ЭРИ(-ve) 399 (М-1).
Пример 3
[2-[e4-(Этилсульфонил)фенил](гидрокси)метил]-4-(трифторметил)фенокси]уксусная кислота

(1) Бензил-2-бром-4-(трифторметил)фениловый эфир
Бензилбромид (21,4 мл) добавляли к перемешиваемой смеси 2-бром-4-трифторметилфенола (46,4 г) и карбоната калия (39 г) в ДМФА (200 мл). Через 18 ч смесь распределяли между диэтиловым эфиром и водой, органический слой промывали водой, 2М раствором гидроксида натрия, водой, сушили и при пониженном давлении выпаривали растворитель. Выход 58,7 г.
1H ЯМР CDCl3: δ 7.83 (1Н, s), 7.51-7.32 (6H, m), 6.98 (1H, d), 5.21 (2H, s).
(2) [2-(Бензилокси)-5-(трифторметил)фенил][4-(этилтио)фенил]метанол
Раствор бутиллития (1,6 М в гексане; 1,03 мл) добавляли к перемешиваемому раствору продукта со стадии (1) (0,5 г) в диэтиловом эфире (20 мл) при -78°С. Через 1 ч добавляли 4-этилсульфанил-бензальдегид (0,25 г) и перемешивали в течение следующего 1 ч. Реакцию гасили водой, экстрагировали диэтиловым эфиром и органический слой сушили, затем упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 50% диэтиловый эфир/изогексан. Выход 0,7 г.
1H ЯМР CDCl3: δ 7.36-7.13 (12Н, m), 6.04-6.03 (1H, d), 5.05 (2H, s), 2.96-2.89 (2H, q), 2.64-2.62 (1 H, d), 1.33-1.28 (3H, t).
МС: ЭРИ (+ve) 401 (M-OH).
(3) [2-(Бензилокси)-5-(трифторметил)фенил][4-(этилсульфонил)фенил]метанол
Указанное в подзаголовке соединение получали способом из Примера 2, стадия (2), используя продукт со стадии (2). Выход 0,45 г.
МС: ЭРИ (+ve) 468 (M+NH4).
(4) 2-[[4-(Этилсульфонил)фенил](гидрокси)метил]-4-(трифторметил)фенол
Смесь продукта со стадии (3) (0,225 г), палладия (10%) на угле (0,05 г) в этаноле (20 мл) гидрировали при давлении 1 бар (100 кПа) в течение 45 мин. После фильтрования растворитель выпаривали при пониженном давлении. Выход 0,22 г.
МС: ЭРИ (-ve) 359 (М-Н).
(5) [2-[[4-(Этилсульфонил)фенил](гидрокси)метил]-4-(трифторметил)фенокси]уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадии (4) и (5), используя продукт со стадии (4). Выход 0,045 г.
1H ЯМР ДМСО-d6: δ 7.80-7.52 (6Н, m), 7.07-7.04 (1Н, d), 6.12 (1H, s), 4.46 (2H, s), 3.41 (1H, bm), 3.27-3.20 (2H, q), 1.09-1.04 (3H, t).
МС: ЭРИ (+ve) 436 (M+NH4).
Пример 4
[2-[4-(Этилсульфонил)бензил]-4-(трифторметил)фенокси]уксусная кислота

(1) 2-[4-(Этилсульфонил)бензил]-4-(трифторметил)фенол
Смесь продукта со стадии (3) Примера 3 (0,225 г), палладия (10%) на угле (0,05 г) и уксусной кислоты (2 капли) в этаноле гидрировали при давлении 3 бар (300 кПа) в течение 2 ч, затем при давлении 5 бар (500 кПа) в течение 5 ч. После фильтрования растворитель выпаривали при пониженном давлении. Выход 0,16 г.
МС: ЭРИ (-ve) 343 (М-Н).
(2) 2-[4-(Этилсульфонил)бензил]-4-(трифторметил)фенокси]уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадии (4) и (5), используя продукт со стадии (1). Выход 0,11 г.
1H ЯМР ДМСО-d6: δ 7.75-7.46 (6Н, m), 6.92-6.89 (1H, d), 4.21 (2H, s), 4.10 (2H, s), 3.31-3.19 (2H, q), 1.09-1.04 (3H, t).
МС: ЭРИ (-ve) 401 (М-Н).
Пример 5
Натриевая соль [4-хлор-2-[4-(этилсульфонил)фенокси]фенокси]-уксусной кислоты

(1) Этиловый эфир (4-хлор-2-метоксифенокси)-уксусной кислоты
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (4), используя этилбромацетат и 4-хлор-2-метоксифенол. Выход 2,7 г.
1H ЯМР CDCl3: δ 6.88-6.74 (3H, m), 4.64 (2Н, s), 4.29-4.21 (2Н, q), 3.88-3.87 (3H, s), 1.30-1.20 (3H, t).
(2) (4-Хлор-2-гидроксифенокси)-уксусная кислота
Смесь продукта со стадии (1) (2,7 г) в 48%-ном водном бромистом водороде (30 мл) нагревали при температуре дефлегмации в течение 2 ч. Растворитель выпаривали, остаток промывали водой и сушили; выход 1,7 г.
1H ЯМР ДМСО-d6: δ 6.89-6.72 (3H, m), 4.66 (2Н, m), 3.79 (1H, s).
(3) Натриевая соль [4-хлор-2-[4-(этилсульфонил)фенокси]фенокси]-уксусной кислоты
Карбонат цезия (0,2 г) добавляли к перемешиваемой смеси продукта со стадии (2) (0,3 г), этил-(4-бром-фенил)-сульфона (0,37 г) и йодида меди (5% (мольн.)) в NMP (20 мл) и смесь нагревали при 170°С (температура масляной бани) в течение 10 ч. Смесь гасили 1М раствором гидроксида натрия и экстрагировали этилацетатом. Водный слой подкисляли соляной кислотой и экстрагировали этилацетатом. Органический экстракт сушили и упаривали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ, натриевую соль получали с использованием гидроксида натрия. Выход 0,068 г.
1H ЯМР ДМСО-d6: δ 7.81-6.91 (7Н, m), 4.06 (2Н, s), 3.26-3.21 (2Н, q), 1.11-1.08(3H, t).
МС: ЭРИ (-ve) 369 (М-Н).
Пример 6
[4-Хлор-2-[[4-(метилсульфонил)фенил]амино]фенокси]-уксусная кислота

(1) Этиловый эфир (4-хлор-2-нитрофенокси)-уксусной кислоты
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (4), используя этилбромацетат и 4-хлор-2-нитрофенол. Выход 1,4 г.
(2) 6-Хлор-2Н-1,4-бензоксазин-3(4Н)-он
Порошок железа (1,4 г) добавляли к раствору продукта со стадии (1) (1,4 г) в уксусной кислоте (30 мл) и смесь перемешивали при КТ в течение 1 ч. Смесь фильтровали и при пониженном давлении упаривали фильтрат. Выход 0,44 г.
1H ЯМР ДМСО-d6: δ 8.43 (1Н, m), 6.92-6.81 (3H, m), 4.61 (2H, s).
(3) [4-Хлор-2-[[4-(метилсульфонил)фенил]амино]фенокси]-уксусная кислота
Карбонат калия (0,265 г) добавляли к раствору продукта со стадии (2) (0,44 г) и 4-фторфенилметилсульфона (0,331 г) в NMP (20 мл) и смесь нагревали при 120°С в течение 16 ч. Реакционную смесь разбавляли водой и экстрагировали этилацетатом, органическую фазу сушили и упаривали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ; выход 0,096 г.
1H ЯМР ДМСО-d6: δ 11.33 (1Н, s), 7.72-7.69 (2H, d), 7.31-7.30 (1Н, m), 7.20-7.00 (3H, m), 6.92-6.89 (1Н, d), 4.14 (2H, s), 3.11 (3H, s).
МС: APCI (+ve) 356 (M+H).
Пример 7
(4-Хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)уксусная кислота

(1) 3-Хлор-4-фторфенилметилсульфид
Йодметан (1,15 мл) добавляли к перемешиваемой смеси 3-хлор-4-фтор-бензолтиола (3,0 г), карбоната калия (2,48 г) в ДМФА (20 мл) и оставляли на ночь. Реакционную смесь разбавляли водой и экстрагировали диэтиловым эфиром, органическую фазу сушили и упаривали при пониженном давлении; выход 4,3 г.
1H ЯМР CDCl3: δ 7.31-7.14 (2Н, m), 7.13-7.03 (1Н, m), 3.23-3.21 (3H, s).
(2) 3-Хлор-4-фторфенилметилсульфон
Указанное в подзаголовке соединение получали способом из Примера 2, стадия (2), используя продукт со стадии (1). Выход 3,8 г.
1H ЯМР CDCl3: δ 8.06-8.03 (1Н, m), 7.89-7.84 (1Н, m), 7.38-7.32 (1Н, m), 3.08 (3H, s).
(3) 4-Хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадии (1)-(3), используя продукт со стадии (2).
МС: ЭРИ(-ve) 347 (М-1).
(4) (4-Хлор-2e{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадии (4) и (5), используя продукт со стадии (3). Выход 0,158 г.
1H ЯМР ДМСО-d6: δ 13.12 (1Н, bs), 7.997-7.99 (1Н, m), 7.69-7.58 (3H, m), 7.18-6.97 (2Н, d), 4.80 (2Н, s), 3.24 (3H, s).
МС: ЭРИ (-ve) 406 (M-1).
Пример 8
Натриевая соль (4-хлор-2-{[2-хлор-4-(этилсульсронил)фенил]тио}фенокси)уксусной кислоты

(1) 3-Хлор-4-фторфенилэтилсульфон
Указанное в подзаголовке соединение получали способом из Примера 7, стадии (1) и (2), используя йодэтан.
1H ЯМР CDCl3: δ 8.01-7.98 (1Н, d), 7.84-7.79 (1H, m), 7.37-7.31 (1H, m), 3.17-3.09 (2H, q), 1.33-1.26 (3H, t).
(2)4-Хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадии (1)-(3), используя продукт со стадии (1).
МС: ЭРИ (-ve) 362 (М-1).
(3) Натриевая соль (4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенокси)уксусной кислоты
Указанное в заголовке соединение получали способом из Примера 1, стадии (4) и (5), используя продукт со стадии (2); выход 0,19 г.
1H ЯМР ДМСО-d6: δ 7.90-7.89 (1H, d), 7.61-7.58 (1H, d), 7.53-7.49 (2H, m), 7.29-7.27 (1H, d), 6.95-6.92 (1H, d), 4.17 (2H, s), 3.34-3.30 (2H, m), 1.14-1.08 (3H, m).
МС: ЭРИ (-ve) 420 (М-1).
Пример 9
(4-Хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)уксусная кислота

(1) 4-Хлор-2-{[4-(метилсульфонил)фенил]тио}фенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадии (1)-(3), используя метил-(4-бром-фенил)сульфон; выход 0,98 г.
МС: ЭРИ (-ve) 313 (М-1).
(2) трет-Бутиловый эфир (4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)уксусной кислоты
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (4), используя продукт со стадии (1); выход 0,95 г.
МС: ЭРИ (+ve) 443 (M+NH4).
(3) (4-Хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадия (5), используя продукт со стадии (2); выход 0,165 г.
1H ЯМР ДМСО-d6: δ 7.80-7.77 (2Н, m), 7.47-7.41 (3H, m), 7.38-7.37 (1H, d), 6.93-6.91 (1H, d), 4.27 (2Н, s), 3.19 (3H, s).
МС: ЭРИ (-ve) 371 (М-1).
Пример 10
{4-Хлор-2-[(5-хлорпиридин-2-ил)тио]фенокси}уксусная кислота

Указанное в заголовке соединение получали общим способом Примера 1.
1H ЯМР ДМСО-d6: δ 8.46-8.45 (1H, m), 7.76-7.73 (1H, d), 7.59-7.58 (1H, d), 7.52-7.50 (1H, d), 7.10-7.04 (2Н, m), 4.74 (2Н, s).
МС: ЭРИ (-ve) 329 (М-1).
Пример 11
{4-хлор-2-[(2-хлор-4-цианофенил)тио]фенокси}уксусная кислота

Указанное в заголовке соединение получали общим способом Примера 1.
1H ЯМР ДМСО-d6: δ 8.07 (1Н, d), 7.62-7.57 (3H, m), 7.16-7.12 (1Н, m), 6.90-6.87 (1H, d), 4.75 (2H, s).
МС: ЭРИ(-ve) 353 (М-1).
Пример 12
(4-хлор-2-{[2-(метилсульфонил)фенил]тио}фенокси)уксусная кислота

Указанное в заголовке соединение получали общим способом Примера 1.
1H ЯМР ДМСО-d6: δ 13.05 (1Н, bs), 7.94-7.92 (1Н, d), 7.60-7.42 (4H, m), 7.42-7.08 (2H, m), 4.67 (2H, s), 3.44 (3H, s).
МС: ЭРИ (-ve) 371 (М-1).
Пример 13
Натриевая соль (4-хлор-2-{[4-(метилсульфонил)фенил]сульфинил}фенокси)уксусной кислоты

(1) трет-Бутиловый эфир (4-хлор-2-{[4-(метилсульфонил)фенил]сульфинил}фенокси)уксусной кислоты
3-Хлорпероксибензойную кислоту (70%-ной чистоты; 0,2 г) добавляли к раствору продукта со стадии (2) Примера 9 (0,35 г) в ДХМ (10 мл) и перемешивали при 0°С в течение 1 ч. Смесь распределяли между ДХМ и водным раствором метабисульфита натрия, органическую фазу промывали водным раствором гидрокарбоната натрия, водой, сушили и упаривали при пониженном давлении. Выход 0,34 г.
МС: ХИАД (-ve) 388 (M-трет-бутил).
(2) Натриевая соль (4-хлор-2-{[4-(метилсульфонил)фенил]сульфинил}фенокси)уксусной кислоты
Указанное в заголовке соединение получали способом из Примера 1, стадия (5), используя продукт со стадии (1); выход 0,071 г.
1H ЯМР ДМСО-d6: δ 8.33-8.31 (2Н, d), 8.01-7.99 (2Н, d), 7.56-7.55 (1Н, d), 7.45-7.42 (1Н, d), 6.95-6.93 (1Н, d), 4.30-4.22 (2Н, q), 3.24 (3H, s).
МС: ХИАД (+ve) 389 (M+1).
Пример 14
(4-Хлор-2-{[4-(метилсульфонил)фенил]сульфонил}фенокси)уксусная кислота
(1) трет-Бутиловый эфир (4-хлор-2-{[4-(метилсульфонил)фенил]сульфонил}фенокси)уксусной кислоты
3-Хлорпероксибензойную кислоту (70%-ной чистоты; 0,4 г) добавляли к раствору продукта со стадии (2) Примера 9 (0,35 г) в ДХМ (10 мл) и перемешивали при 0°С в течение 1 ч. Смесь распределяли между ДХМ и водным раствором метабисульфита натрия, органическую фазу промывали водным раствором гидрокарбоната натрия, водой, сушили и упаривали при пониженном давлении. Выход 0,36 г.
(2) (4-Хлор-2-{[4-(метилсульфонил)фенил]сульфонил}фенокси)уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадия (5), используя продукт со стадии (1); выход 0,108 г.
1H ЯМР ДМСО-d6: δ 8.35-8.32 (2Н, d), 8.10-8.06 (2Н, d), 7.96-7.95 (1H, d), 7.71-7.68 (1H, d), 7.08-7.06 (1H, d), 4.46 (2Н, s), 3.27 (3H, s).
MC: ЭРИ (-ve) 403 (M-1).
Пример Р5
[4-Хлор-2-({4-[(метиламино)карбонил]фенил}тио)фенокси]уксусная кислота

(1) Этиловый эфир 4-[(5-хлор-2-метоксифенил)тио]бензойной кислоты
Смесь продукта со стадии (1) Примера 1 (0,5 г), этил-4-фтор-бензоата (0,32 мл), 25%-ного (мас.) фторида калия на оксиде алюминия (1,25 г) и 18-краун-6 (8 мг) в ДМСО (20 мл) нагревали при 140°С в течение 4 ч. Смесь охлаждали, разбавляли этилацетатом (100 мл), фильтровали и фильтрат промывали водой, соляным раствором, сушили и упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью ДХМ/изогексан (2:1); выход 0,24 г.
MC: ЭРИ (+ve) 323 (M+1).
(2) 4-[Р5-Хлор-2-метоксифенил)тио]бензойная кислота
Смесь продукта со стадии (1) (0,24 г), гидроксида лития (0,036 г) в метаноле (30 мл) и воде (5 мл) перемешивали при КТ в течение ночи, затем подкисляли 2М соляной кислотой. Смесь экстрагировали этилацетатом, органическую фазу сушили и упаривали при пониженном давлении; выход 0,23 г.
МС: ЭРИ (-ve) 293 (М-1).
(3) 4-[(5-Хлор-2-метоксифенил)тио]-N-метилбензамид
Смесь продукта со стадии (2) (0,23 г), гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (0,22 г), 1-гидроксибензотриазола (0,15 г), N,N-диизопропилэтиламина (0,3 г) и метиламина (2М в ТГФ; 0,78 мл) в ДМФА (10 мл) перемешивали при КТ в течение ночи. Добавляли воду и смесь экстрагировали этилацетатом, органическую фазу сушили и упаривали при пониженном давлении; выход 0,24 г.
МС: ЭРИ (+ve) 308 (М+1).
(4) [4-Хлор-2e({4-[(метиламино)карбонил]фенил}тио)фенокси]уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадии (3)-(5), используя продукт со стадии (3); выход 0,119 г.
1H ЯМР ДМСО-d6: δ 13.12 (1Н, bs), 8.47-8.46 (1Н, m), 7.82-7.80 (2Н, m), 7.40-7.34 (3H, m), 7.04-7.01 (2Н, m), 4.78 (2Н, s), 2.66 (3H, s).
MC: ЭРИ (-ve) 350 (M-1).
Пример 16
(2S)-2-(4-Хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовая кислота

(1) трет-Бутиловый эфир (2S)-2-(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовой кислоты
Диизопропилазодикарбоксилат (0,19 мл) добавляли к перемешиваемому раствору продукта со стадии (1) Примера 9 (0,3 г), трифенилфосфина (0,25 г), R-трет-бутиллактата (0,14 г) в ТГФ (10 мл). Через 2 ч растворитель выпаривали при пониженном давлении и остаток очищали хроматографией на диоксиде кремния, элюируя смесью диэтиловый эфир/изогексан (2:1); выход 0,6 г.
МС: ЭРИ (+ve) 460 (M+NH4).
(2) (2S)-2-(4-Хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовая кислота
Указанное в заголовке соединение получали способом из Примера 1, стадия (5), используя продукт со стадии (1); выход 0,15 г.
1H ЯМР ДМСО-d6: δ 7.82-7.80 (2Н, m), 7.46-7.39 (4Н, m), 6.95-6.93 (1H, d), 4.66-4.64 (1H, m), 3.18 (3H, s), 1.25-1.23 (3H, d).
МС: ЭРИ (-ve) 385 (М-1).
Пример 17
(2Re-2-(4-Хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовая кислота
(1) Метиловый эфир (2R)-2-(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовой кислоты
Указанное в подзаголовке соединение получали способом из Примера 16, стадия (1), используя S-метиллактат; выход 0,35 г.
МС: ЭРИ (+ve) 418 (М+NH4).
(2) (2R)-2-(4-Хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовая кислота
Указанное в заголовке соединение получали способом из Примера 15, стадия (2), используя продукт со стадии (1); выход 0,13 г.
1H ЯМР ДМСО-d6: δ 7.82-7.79 (2Н, m), 7.47-7.40 (4Н, m), 6.96-6.94 (1H, d), 4.70-4.67 (1H, q), 3.18 (3H, s), 1.26-1.12 (3H, d).
МС: ЭРИ (-ve) 385 (М-1).
Пример 18
Натриевая соль (2S)-2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)пропионовой кислоты

Указанное в заголовке соединение получали способом из Примера 16, используя продукт Примера 7, стадия (3); выход 0,2 г.
1H ЯМР ДМСО-d6: δ 7.96-7.95 (1H, m), 7.67-7.63 (1H, m), 7.49-7.45 (2Н, m), 7.35-7.32 (1H, m), 6.93-6.90 (1H, d), 4.27-4.20 (1H, q), 3.23 (3H, s), 1.17-1.06 (3H, d).
МС: ЭРИ (-ve) 419/421 (M-1).
Пример 19
Натриевая соль (2S)-2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенокси)пропионовой кислоты

Указанное в заголовке соединение получали способом из Примера 16, используя продукт Примера 8, стадия (2); выход 0,54 г.
1H ЯМР ДМСО-d6: δ 7.90-7.89 (1Н, m), 7.62-7.47 (3H, m), 7.30-7.28 (1H, d), 6.95-6.92 (1H, d), 4.35-4.32 (1H, q), 3.39-3.29 (2H, q),1.13-1,05 (6H, d+t).
MC: ЭРИ (-ve) 433 (M-1).
Пример 20
2-(4-Хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)-2-метилпропионовая кислота

Указанное в заголовке соединение получали способом из Примера 1, стадия (4), используя продукт Примера 7, стадия (3), и трет-бутил-2-бромизобутират; выход 0,028 г.
1H ЯМР ДМСО-d6: δ 8.02-8.01 (1H, m), 7.73-7.69 (1H, m), 7.56-7.50 (2H, m), 7.12-6.95 (2H, d), 3.25 (3H, s), 1.33 (6H, s).
MC: ЭРИ (-ve) 433/435 (M-1).
Пример 21
Натриевая соль {4-хлор-2-[4-(метилсульфонил)фенокси]фенокси}уксусной кислоты

Смесь продукта со стадии (2) Примера 5 (0,3 г), метил-(4-фтор-фенил)сульфона (0,226 г) и карбоната калия (0,18 г) в NMP (20 мл) нагревали при 160°С в течение 2 ч. Смесь распределяли между этилацетатом и 2М соляной кислотой, органическую фазу отделяли, сушили и упаривали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ, натриевую соль получали с использованием гидроксида натрия. Выход 0,103 г.
1H ЯМР ДМСО-d6: δ 7.85-7.80 (1Н, d), 7.25-7.14 (5Н, d), 6.95-6.91 (1H, d), 4.10 (2H, s), 3.17 (3H, s).
МС: ЭРИ (-ve) 355(М-1).
Пример 22
Натриевая соль {4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусной кислоты

Указанное в заголовке соединение получали способом из Примера 21, используя продукты Примера 5, стадия (2), и Примера 7, стадия (2); выход 0,132 г.
1H ЯМР ДМСО-d6: δ 8.05-8.04 (1H, m), 7.73-7.71 (1H, m), 7.28-7.25 (2H, m), 7.18-7.16 (1H, m), 6.96-6.94 (1H, m), 4.11 (2H, s), 3.24 (3H, s).
МС: ЭРИ (-ve) 389(М-1).
Пример 23
{4-Хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}уксусная кислота

Указанное в заголовке соединение получали способом из Примера 21, используя продукты Примера 5, стадия (2), и Примера 8, стадия (1); выход 0,296 г.
1H ЯМР ДМСО-d6: δ 8.00-7.99 (1Н, d), 7.72-7.68 (1Н, m), 7.34-7.32 (2H, m), 7.07-7.04 (2H, d), 4.41 (2H, s), 3.39-3.29 (2H, q), 1.15-1.07 (3H, t).
МС: ЭРИ (-ve) 403/405 (М-1).
Пример 24
Натриевая соль (2S)-2-{4-хлор-2-[4-(метилсульфонил)фенокси]фенокси}пропионовой кислоты

(1) 4-Хлор-1-метокси-2-[4-(метилсульфонил)фенокси]бензол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (2), используя 5-хлор-2-метокси-фенол; выход 0,35 г.
1H ЯМР CDCl3: δ 7.88-7.85 (2H, d), 7.27-6.95 (5Н, m), 3.78 (3H, s), 3.06-3.05 (3H, s).
(2) 4-Хлор-2-[4-(метилсульфонил)фенокси]фенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (3), используя продукт со стадии (1); выход 0,17 г.
МС: ХИАД (-ve) 297(М-1).
(3) Натриевая соль (2S)-2-{4-хлор-2-[4-(метилсульфонил)фенокси]фенокси}пропионовой кислоты
Указанное в заголовке соединение получали способом из Примера 16, используя продукт со стадии (2); выход 0,063 г.
1H ЯМР ДМСО-d6: δ 7.85-7.80 (2H, m), 7.22-7.16 (4H, m), 6.93-6.90 (1Н, d), 4.19-4.12 (1H, q), 3.14 (3H, s), 1.11-1.06 (3H, d).
МС: ЭРИ (-ve) 369(М-1).
Пример 25
(2S)-2-{4-Хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}пропионовая кислота

(1) 3-Хлор-4-(5-хлор-2-метоксифенокси)фенилметилсульфон
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (2), используя продукт Примера 7, стадия (2), и 6-хлор-2-метоксифенол.
Выход 4,0 г.
МС: ЭРИ (+ve) 363 (M+NN4).
(2) 4-Хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (3), используя продукт со стадии (1). Выход 3,0 г.
МС: ЭРИ (-ve) 331 (М-1).
(3) (2S)-2-{4-Хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}пропионовая кислота
Указанное в заголовке соединение получали способом из Примера 16, используя продукт со стадии (2). Выход 0,206 г.
1H ЯМР ДМСО-d6: δ 8.09-8.08 (1Н, m), 7.78-7.75 (1Н, m), 7.39-7.32 (2H, m), 7.09-7.07 (1Н, d), 7.00-6.98 (1Н, d), 4.87-4.80 (1Н, q), 3.24 (3H, s), 1.25-1.15 (3H, d).
МС: ЭРИ (-ve) 403/405 (М-1).
Пример 26
(2S)-2-{4-Хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}пропионовая кислота

(1) 4-Хлор-2-[2-хлор-4-(этилсульфонил)фенокси]-1-метоксибензол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (2), используя продукт Примера 8, стадия (1), и 5-хлор-2-метоксифенол.
Выход 3,30 г.
МС: ЭРИ (+ve) 378 (M+NH4).
(2) 4-Хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (3), используя продукт со стадии (1). Выход 3,10 г.
МС: ЭРИ (-ve) 345(М-1).
(3) Метиловый эфир (2S)-2-{4-хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}пропионовой кислоты
Указанное в подзаголовке соединение получали способом из Примера 16, стадия (1), используя продукт состади и (2) и R-метиллактат. Выход 2,30 г.
МС: ЭРИ (+ve) 435 (M+NH4).
(4) (2S)-2-{4-Хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}пропионовая кислота
Смесь продукта со стадии (3) (2,3 г) и гидроксида лития (0,303 г) в воде (10 мл) и ТГФ (10 мл) перемешивали при КТ в течение 1 ч. Смесь разбавляли водой, экстрагировали диэтиловым эфиром, затем водный слой подкисляли 2М соляной кислотой и экстрагировали этилацетатом. Этилацетатный слой сушили, упаривали при пониженном давлении и остаток очищали ОФ-ВЭЖХ.
1H ЯМР ДМСО-d6: δ 7.99-7.67 (2Н, m), 7.33-6.95 (4Н, m), 4.36-4.34 (1H, q), 3.35-3.29 (2Н, q), 1.25-1.15 (6H, m).
МС: ЭРИ (-ve) 417/419 (М-1).
Пример 27
{4,5-Дихлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусная кислота

Смесь гидрида натрия (60%-ная (мас.) дисперсия в масле; 0,223 г) и 4,5-дихлорпирокатехина (1 г) в ДМФА (10 мл) перемешивали при КТ в течение 15 мин. Добавляли трет-бутил-бромацетат (0,9 мл), перемешивали при КТ в течение 2 ч, затем добавляли карбонат калия (0,77 г) и продукт со стадии (2) Примера 7 (0,7 г) и смесь нагревали при 90°С в течение 14 ч. Смесь распределяли между 2М раствором гидроксида натрия и диэтиловым эфиром, водный слой подкисляли 2М соляной кислотой и экстрагировали этилацетатом. Этилацетатный слой сушили, упаривали при пониженном давлении и остаток очищали ОФ-ВЭЖХ. Выход 0,349 г.
1H ЯМР ДМСО-d6: δ 8.06-7.71 (2Н, m), 7.54 (1Н, s), 7.27-7.13 (2H, m), 4.32 (2H, s), 3.24 (3H, s).
МС: ЭРИ (-ve) 423/425 (M-1).
Пример 28
{2-[2-Хлор-4-(метилсульфонил)фенокси]-4,5-дифторфенокси}уксусная кислота

(1) 4,5-Дифтор-2-метоксифенол
Тиометилат натрия (0,4 г) добавляли к раствору 1,2-дифтор-4,5-диметоксибензола (1,0 г) в ДМФА (10 мл) при КТ, затем нагревали при 100°С в течение 4 ч. Добавляли следующие 0,8 г тиометилата натрия, смесь нагревали в течение следующих 2 ч. Смесь охлаждали, распределяли между этилацетатом и 2М соляной кислотой и органическую фазу сушили и упаривали при пониженном давлении; выход 1,05 г.
(2) трет-Бутиловый эфир (4,5-дифтор-2-метоксифенокси)уксусной кислоты
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (4), используя продукт со стадии (1); выход 0,75 г.
1H ЯМР CDCl3: δ 6.76-6.70 (2Н, m), 4.51 (2Н, s), 3.84 (3H, s), 1.48 (9H, s).
(3) (4,5-Дифтор-2-гидроксифенокси)уксусная кислота
Смесь продукта со стадии (2) (0,75 г) и хлорида лития (0,345 г) в ДМФА (20 мл) нагревали при 150°С в течение 6 ч, охлаждали и распределяли между этилацетатом и 2М соляной кислотой. Органическую фазу сушили и упаривали при пониженном давлении; выход 0,7 г.
(4) {2-[2-Хлор-4-(метилсульфонил)фенокси]-4,5-дифторфенокси}уксусная кислота
Смесь гидрида натрия (60%-ная (мас.) дисперсия в масле; 0,275 г) и продукта со стадии (3) (0,7 г) в ДМФА (10 мл) перемешивали при КТ в течение 15 мин. Добавляли продукт со стадии (2) Примера 7 (0,715 г) и смесь нагревали при 85°С в течение 15 ч. Смесь распределяли между 2М раствором гидроксида натрия и диэтиловым эфиром, водный слой подкисляли 2М соляной кислотой и экстрагировали этилацетатом. Этилацетатный слой сушили, упаривали при пониженном давлении, и остаток очищали ОФ-ВЭЖХ. Выход 0,076 г.
1H ЯМР ДМСО-d6: δ 8.07 (1Н, s), 7.76-7.73 (1Н, m), 7.59-7.54 (1Н, m), 7.43-7.38 (1Н, m), 6.98-6.96 (1Н, m), 4.69 (2Н, s), 3.24 (3H, s).
MC: ЭРИ (-ve) 391 (M-1).
Пример 29
2-{4-Хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}-2-метилпропионовая кислота

(1) 2-(Бензилокси)-4-хлорфенол
Сульфурилхлорид (0,965 мл) добавляли к перемешиваемому раствору 2-(бензилокси)фенола (2,0 г) в безводном толуоле (20 мл) при 0°С. Смесь нагревали до КТ и перемешивали в течение ночи, затем охлаждали до 0°С и перед экстрагированием этилацетатом гасили смесью лед-вода. Органическую фазу сушили, упаривали при пониженном давлении и остаток очищали хроматографией на диоксиде кремния, элюируя смесью ДХМ/изогексан (1:1). Выход 1,5 г.
МС:ЭРИ (-ve) 233 (М-1).
(2) 2-[2-(Бензилокси)-4-хлорфенокси]-2-метилпропионовая кислота
Порошкообразный гидроксид натрия (0,253 г) добавляли к перемешиваемой смеси продукта со стадии (1) (1,5 г) и 1,1,1-трихлор-2-метилпропанола (3,0 г) в ацетоне (40 мл) при 0°С. После перемешивания при КТ в течение 1 ч смесь охлаждали до 0°С и добавляли следующую порцию гидроксида натрия (0,253 г). После трехкратного повторения смесь перемешивали при КТ в течение ночи, затем гасили 2М соляной кислотой и экстрагировали этилацетатом. Органическую фазу сушили, упаривали при пониженном давлении и остаток очищали хроматографией на диоксиде кремния, элюируя смесью диэтиловый эфир/изогексан (1:1). Выход 1,4 г.
(3) 2-(4-Хлор-2-гидроксифенокси)-2-метилпропионовая кислота
Смесь продукта со стадии (2) (1,4 г) и 10%-ного Pd/C (0,14 г) в этилацетате (30 мл) гидрировали при 2 бар (200 кПа) в течение 3 ч, затем фильтровали через целит. Фильтрат упаривали при пониженном давлении; выход 0,6 г.
МС: ЭРИ (-ve) 229(М-1).
(4) 2-{4-Хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}-2-метилпропионовая кислота
Указанное в заголовке соединение получали способом из Примера 28, стадия (4), используя продукт со стадии (3). Выход 0,039 г.
1H ЯМР ДМСО-d6: δ 8.08-8.07 (1Н, s), 7.78-7.75 (1Н, m), 7.39-7.39 (1H, m), 7.28-7.25 (1Н, m), 7.06-6.98 (2H, m), 3.24 (3H, s), 1.22 (6H, s).
МС: ЭРИ (-ve) 417(М-1).
Пример 30
(4-Хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)уксусная кислота

Смесь продукта со стадии (1) Примера 8 (0,21 г), 6-хлор-2Н-1,4-бензоксазин-3(4Н)-она (0,15 г) и карбоната калия (0,23 г) в ДМФА нагревали в микроволновой печи (СЕМ, 50 Вт) при 120°С в течение 5 мин. Смесь нагревали при 140°С в течение следующих 5 мин, охлаждали и распределяли между этилацетатом и 2М соляной кислотой. Органическую фазу отделяли, промывали соляным раствором, сушили и упаривали при пониженном давлении. Остаток очищали ОФ-ВЭЖХ; выход 0,08 г.
1H ЯМР ДМСО-d6: δ 8.82 (1Н, s), 7.78 (1Н, s), 7.57 (1Н, d), 7.33 (1Н, s), 7.17 (1Н, d), 7.10 (1Н, d), 7.07 (1Н, d), 4.51 (2H, s), 3.24 (2H, q), 1.10 (3H, t).
МС: ХИАД (-ve) 402 (М-1).
Пример 31
(4-Хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)уксусная кислота

Указанное в заголовке соединение получали способом из Примера 30, используя продукт Примера 7, стадия (2). Выход 1,54 г.
1H ЯМР ДМСО-d6: δ 13.14 (1Н, s), 7.94 (1Н, s), 7.87 (1H, s), 7.61 (1H, d), 7.35 (1H, s), 7.22 (1H, d), 7.09 (1H, d), 6.99 (1H, d), 4.77 (2H, s), 3.18 (3H, s).
МС: ХИАД (+ve) 391 (М+1).
Пример 32
[2-{[2-Хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенокси]уксусная кислота

(1) 2-(Бензилокси)-5-(трифторметил)бензолтиол
Раствор бутиллития (1,6 М в гексанах; 18,5 мл) по каплям добавляли к перемешиваемому раствору 2-(бензилокси)-5-трифторметилтиофенола (7,0 г) в безводном диэтиловом эфире (40 мл) при -78°С. Через 40 мин добавляли элементарную серу (0,68 г), смесь перемешивали при -78°С в течение 1 ч, гасили 2 М раствором NaOH и экстрагировали диэтиловым эфиром. Водный слой подкисляли, экстрагировали этилацетатом, этилацетатный слой сушили и упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью диэтиловый эфир/изогексан (1:6); выход 4,40 г.
МС: ЭРИ (-ve) 283 (М-1).
(2) 4-{[2-(Бензилокси)-5-(трифторметил)фенил]тио}-3-хлорфенилметилсульфон
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (2), используя продукт со стадии (1) и продукт Примера 7, стадия (2); выход 0,43 г.
1H ЯМР CDCl3: δ 7.89-6.81 (11 H, m), 5.13 (2H, s), 3.00 (3H, s).
(3) 2-{[2-Хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (3), используя продукт со стадии (2); выход 0,22 г.
МС: ЭРИ (-ve) 381/383 (М-1).
(4) [2-{[2-Хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенокси]уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадии (4) и (5), используя продукт со стадии (3); выход 0,054 г.
1H ЯМР ДМСО-d6: δ 7.998-7.99 (1Н, s), 7.90-7.88 (2H, m), 7.67-7.65 (1H, d), 7.28-7.26 (1H, d), 7.03-7.01 (1H, d), 4.77 (2H, s), 3.23 (3H, s).
MC: ЭРИ (-ve) 438 (M-1).
Пример 33
Натриевая соль (2S)-2-[2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенокси]пропионовой кислоты

Указанное в заголовке соединение получали способом из Примера 16, используя продукт Примера 32, стадия (3).
1H ЯМР ДМСО-d6: δ 7.97 (1H, s), 7.82-7.80 (2H, m), 7.66-7.65 (1H, m), 7.31-7.28 (1H, d), 7.10-7.07 (1H, d), 4.54-4.49 (1H, q), 2.99 (3H, s), 1.20-1.18 (3H, d).
MC: ЭРИ (-ve) 453 (M-1).
Пример 34
Натриевая соль [2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-(трифторметил)фенокси]уксусной кислоты

Указанное в заголовке соединение получали способом из Примера 32, используя продукт Примера 8, стадия (1).
1H ЯМР ДМСО-d6: δ 7.90-7.81 (3H, m), 7.59-7.56 (1Н, d), 7.30-7.27 (1Н, d), 7.10-7.08 (1Н, d), 4.27 (2H, s), 3.39-3.29 (2H, q), 1.10-1.07 (3H, t).
МС: ЭРИ (-ve) 453(М-1).
Пример 35
Натриевая соль (2S)-2-[2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-(трифторметил)фенокси]пропионовой кислоты

Указанное в заголовке соединение получали способом из Примера 16 и Примера 32.
1H ЯМР ДМСО-d6: δ 7.90-7.78 (3H, m), 7.60-7.57 (1Н, m), 7.37-7.35 (1Н, d), 7.06-7.04 (1Н, d), 4.37-4.35 (1Н, q), 3.34-3.29 (2H, q), 1.14-1.05 (6H, d+t).
МС: ЭРИ (-ve) 467(М-1).
Пример 36
Натриевая соль [2-({4-[(диметиламино)сульфонил]фенил}тио)-4-(трифторметил)фенокси]уксусной кислоты

(1) 4-Фтор-N,N-диметилбензолсульфонамид
Гидрохлорид диметиламина (1,27 г) добавляли к раствору 4-фтор-бензолсульфонилхлорида (3,0 г) и N,N-диизопропилэтиламина (5,37 мл) в дихлорметане (30 мл), смесь перемешивали при КТ в течение 1 ч, разбавляли водой, экстрагировали дихлорметаном, сушили и упаривали при пониженном давлении; выход 3,0 г.
(2) Натриевая соль [2-({4-[(диметиламино)сульфонил]фенил}тио)-4-(трифторметил)фенокси]уксусной кислоты
Указанное в заголовке соединение получали способом из Примера 32, используя продукт со стадии (1).
1H ЯМР ДМСО-d6: δ 7.73-7.71 (1Н, m), 7.62-7.60 (3H, m), 7.51-7.49 (2H, d), 7.04-7.02 (1Н, d), 4.25 (2H, s), 2.58 (6H, s).
MC: ЭРИ (-ve) 434 (M-1).
Пример 37
[2-[2-Хлор-4-(метилсульфонил)фенокси]-4-(трифторметил)фенокси]уксусная кислота

(1) Бензил-2-фтор-5-(трифторметил)фениловый эфир
Смесь 5-(трифторметил)-2-фторфенола (2,0 г), бензилбромида (1,45 мл) и карбоната калия (1,65 г) в безводном ДМФА (20 мл) перемешивали при КТ в течение ночи. Смесь гасили водой, и твердое вещество отфильтровывали и сушили; выход 2,20 г.
1H ЯМР CDCl3: δ 7.47-7.14 (8Н, m), 5.16 (2H, s).
(2) 2-(Бензилокси)-1-метокси-4-(трифторметил)бензол
Раствор метилата натрия в метаноле (25%-ный (мас.), 20 мл) и продукта со стадии (1) (1,20 г) нагревали при 100°С в течение 3 ч. Смесь гасили водой (100 мл) и твердое вещество отфильтровывали и сушили; выход 1,28 г.
1H ЯМР CDCl3: δ 7.46-6.91 (8Н, m), 5.15 (2H, s), 3.19 (3H, s).
(3) 2-Метокси-5-(трифторметил)фенол
Указанное в подзаголовке соединение получали способом из Примера 29, стадия (3), используя продукт со стадии (2); выход 0,70 г.
МС: ЭРИ (-ve) 191 (М-1).
(4) [2-[2-Хлор-4-(метилсульфонил)фенокси]-4-(трифторметил)фенокси]уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадии (2)-(5), используя продукт со стадии (3).
1H ЯМР ДМСО-d6: δ 8.08 (1Н, m), 7.77-7.65 (3H, m), 7.33-7.30 (1Н, d), 6.95-6.92 (1Н, d), 4.79 (2H, s), 3.25 (3H, s).
MC: ЭРИ (-ve) 423 (М-1).
Пример 38
[2-[2-Хлор-4-(этилсульфонил)фенокси]-4-(трифторметил)фенокси]уксусная кислота

Указанное в заголовке соединение получали способом из Примера 37, используя продукт Примера 8, стадия (1).
1H ЯМР ДМСО-d6: δ 7.99 (1Н, s), 7.68-7.54 (3H, m), 7.20-7.18 (1H, d), 7.11-7.09 (1H, d), 4.20 (2H, s), 3.35-3.30 (2H, q), 1.12-1.08 (3H, t).
МС: ЭРИ (-ve) 437(М-1).
Пример 39
Натриевая соль 2-[2-[2-хлор-4-(метилсульфонил)фенокси]-4-(трифторметил)фенокси]масляной кислоты

Указанное в заголовке соединение получали способом из Примера 37, используя этил-2-бутират.
1H ЯМР ДМСО-d6: δ 8.05-8.04 (1H, s), 7.71-7.68 (1H, m), 7.57-7.56 (2H, m), 7.17-7.15 (1H, d), 7.05-7.03 (1H, d), 4.14-4.11 (1H, t), 3.20 (3H, s), 1.59-1.52 (2H, m), 0.52-0.49 (3H, t).
МС: ЭРИ (-ve) 451 (М-1).
Пример 40
Натриевая соль [2-{4-[(диметиламино)сульфонил]фенокси}-4-(трифторметил)фенокси]уксусной кислоты

(1) 4-[2-Гидрокси-5-(трифторметил)фенокси]-N,N-диметилбензолсульфонамид
Указанное в подзаголовке соединение получали способом из Примера 1, стадии (2) и (3), используя продукты Примера 37, стадия (3), и Примера 36, стадия (1); выход 0,95 г.
МС: ЭРИ (-ve) 360(М-1).
(2) Натриевая соль [2-{4-[(диметиламино)сульфонил]фенокси}-4-(трифторметил)фенокси]уксусной кислоты
Указанное в заголовке соединение получали способом из Примера 1, стадии (4) и (5), используя продукт со стадии (1).
1H ЯМР ДМСО-d6: δ 7.68-7.66 (2Н, m), 7.56-7.54 (1Н, d), 7.50-7.49 (1H, m), 7.20-7.07 (3H, m), 4.21 (2Н, s), 2.58 (6H, s).
МС: ЭРИ (-ve) 418(М-1).
Пример 41
Натриевая соль (2S)-2-[2-{4-[(диметиламино)сульфонил]фенокси}-4-(трифторметил)фенокси]пропионовой кислоты

Указанное в заголовке соединение получали способом из Примера 16, используя продукт Примера 40, стадия (1).
1H ЯМР ДМСО-d6: δ 7.68-7.64 (2Н, m), 7.55-7.51 (2Н, m), 7.22-7.20 (2H, m), 7.07-7.05 (1H, d), 4.35-4.30 (1H, m), 2.57 (6H, s), 1.12-1.09 (3H, d).
MC: ЭРИ (-ve) 432 (M-1).
Пример 42
{2-[2-Хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}уксусная кислота

(1) трет-Бутиловый эфир (4-фтор-2-метоксифенокси)уксусной кислоты
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (4), используя 4-фтор-2-метоксифенол; выход 1,0 г.
МС: ЭРИ (-ve) 201 (M-трет-бутил).
(2) (4-Фтор-2-гидроксифенокси)уксусная кислота
Указанное в подзаголовке соединение получали способом из Примера 28, стадия (3), используя продукт со стадии (1); выход 0,72 г.
MC: ЭРИ (-ve) 185 (M-1).
(3) {2-[2-Хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадия (2), используя продукт со стадии (2) и продукт Примера 7, стадия (2).
1H ЯМР ДМСО-d6: δ 8.08 (1H, s), 7.78-7.75 (1H, d), 7.25-7.22 (1H, m), 7.16-7.15 (2Н, m), 6.96-6.93 (1H, d), 4.69 (2Н, s), 3.24 (3H, s).
МС: ЭРИ (-ve) 373(М-1).
Пример 43
{2-[2-Хлор-4-(этилсульфонил)фенокси]-4-фторфенокси}уксусная кислота

Указанное в заголовке соединение получали способом из Примера 42, используя продукт Примера 8, стадия (1).
1H ЯМР ДМСО-d6: δ 8.00-7.99 (1Н, m), 7.72-7.69 (1Н, d), 7.21-7.02 (4H, m), 4.43 (2H, s), 3.40-3.30 (2H, q), 1.12-1.07 (3H, t).
МС: ЭРИ (-ve) 387 (М-1).
Пример 44
2-{2-[2-Хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}-2-метилпропионовая кислота

(1) трет-Бутиловый эфир 2-(4-фтор-2-метоксифенокси)-2-метилпропионовой кислоты
Карбонат калия (0,97 г) добавляли к раствору 2-метокси-4-фторфенола (1,0 г) и трет-бутил-2-бромизобутирата (1,31 мл) в ацетонитриле (20 мл) и нагревали при температуре дефлегмации в течение 26 ч. Смесь разбавляли водой и экстрагировали этилацетатом, органическую фазу сушили и упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью изогексан/диэтиловый эфир (3:1); выход 0,83 г.
1H ЯМР CDCl3: δ 6.94-6.89 (1Н, m), 6.64-6.59 (1Н, m), 6.55-6.49 (1Н, m), 3.79 (3H, s), 1.52-1.41 (15H, 2×s).
(2) 2-(4-Фтор-2-гидроксифенокси)-2-метилпрогтионовая кислота
Указанное в подзаголовке соединение получали способом из Примера 28, стадия (3), используя продукт со стадии (1); выход 0,7 г.
МС: ЭРИ (-ve) 213 (М-1).
(3) 2-{2-[2-Хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}-2-метилпропионовая кислота
Указанное в заголовке соединение получали способом из Примера 1, стадия (2), используя продукт со стадии (2); выход 0,065 г.
1H ЯМР ДМСО-d6: δ 8.08-8.07 (1Н, s), 7.79-7.75 (1Н, d), 7.27-7.23 (1H, m), 7.12-7.09 (2H, m), 6.97-6.95 (1Н, d), 3.24 (3H, s), 1.23 (6H, s).
МС: ЭРИ (-ve) 401 (М-1).
Пример 45
(2-{[2-Хлор-4-(метилсульфонил)фенил]тио}-4-фторфенокси)уксусная кислота

(1) 5-Фтор-2-метоксибензолсульфонилхлорид
4-Фторанизол (10,0 г) осторожно добавляли к хлорсульфоновой кислоте (45,81 г) при 0°С. Смесь перемешивали при КТ в течение 2 ч, затем гасили смесью лед-вода (500 мл) и твердое вещество отфильтровывали и сушили; выход 16,50 г.
1H ЯМР CDCl3: δ 7.72-7.68 (1Н, m), 7.44-7.38 (1Н, m), 7.12-7.08 (1Н, m), 4.05(3H, s).
(2) 5-Фтор-2-метоксибензолтиол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (1), используя продукт со стадии (1); выход 1,7 г.
MC: ЭРИ (-ve) 157 (М-1).
(3) 3-Хлор-4-[(5-фтор-2-метоксифенил)тио]фенилметилсульфон
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (2), используя продукт со стадии (2) и продукт Примера 7, стадия (2); выход 0,8 г.
1H ЯМР CDCl3: δ 7.91-7.90 (1Н, s), 7.59-7.56 (1Н, d), 7.26-7.17 (2H, m), 7.00-6.96 (1Н, m), 6.82-6.79 (1Н, d), 3.80 (3H, s), 3.03 (3H, s).
(4) 2-{[2-Хлор-4-(метилсульфонил)фенил]тио}-4-фторфенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (3), используя продукт со стадии (3); выход 0,6 г.
МС: ЭРИ (-ve) 331 (М-1).
(5) (2-{[2-Хлор-4-(метилсульфонил)фенил]тио}-4-фторфенокси)уксусная кислота
Гидрид натрия (60%-ная дисперсия в масле; 0,024 г) добавляли к продукту со стадии (4) (0,20 г) в безводном ДМФА (10 мл) и перед добавлением метил-бромацетата (0,060 мл) перемешивали при КТ в течение 30 мин. Раствор перемешивали при КТ в течение 2 ч, разбавляли водой и экстрагировали диэтиловым эфиром. Органическую фазу сушили и упаривали при пониженном давлении, получая масло. Масло растворяли в ТГФ (20 мл) и воде (10 мл), затем добавляли гидроксид натрия (0,037 г) и перемешивали при КТ в течение ночи. Смесь подкисляли 2М HCl, экстрагировали этилацетатом, органическую фазу сушили и упаривали при пониженном давлении. Остаток очищали обращенно-фазовой ВЭЖХ. Выход 0,045 г.
1H ЯМР ДМСО-d6: δ 8.00-7.99 (1Н, s), 7.70-7.66 (1Н, d), 7.45-7.37 (2H, m), 7.18-7.14 (1Н, m), 7.02-6.99 (1Н, m), 4.77 (2H, s), 3.24 (3H, s).
МС: ЭРИ (-ve) 389 (М-1).
Пример 46
(2-{[2-Хлор-4-(этилсульфонил)фенил]тио}-4-фторфенокси)уксусная кислота
Указанное в заголовке соединение получали способом из Примера 45, используя продукт Примера 8, стадия (1); выход 0,029 г.
1H ЯМР ДМСО-d6: δ 7.92 (1Н, s), 7.64-7.61 (1Н, d), 7.44-7.34 (2H, m), 7.10-7.06 (2H, m), 4.55 (2H, s), 3.41-3.28 (2H, q), 1.11-1.06 (3H, t).
MC: ЭРИ (-ve) 403 (M-1).
Пример 47
2-(2-{[2-Хлор-4-(метилсульфонил)фенил]тио}-4-фторфенокси)-2-метилпропионовая кислота

Указанное в заголовке соединение получали способом из Примера 29, стадия (2), используя продукт Примера 45, стадия (4); выход 0,05 г.
1H ЯМР ДМСО-d6: δ 7.98-7.97 (1Н, s), 7.70-7.67 (1Н, d), 7.32-7.20 (2H, m), 7.07-7.02 (2H, m), 3.24 (3H, s), 1,21 (6H, s).
MC: ЭРИ (-ve) 417 (M-1).
Пример 48
[4-Хлор-2-(3-цианобензил)фенокси]уксусная кислота

(1) 3-[2-(Бензилокси)-5-хлорбензил]бензонитрил
Смесь 2-бензилокси-5-хлорфенилбороновой кислоты (2,1 г), 3-цианобензилбромида (1,57 г), карбоната натрия (1,7 г) и тетракис(трифенилфосфин)палладия (0) (0,46 г) в диметиловом эфире этиленгликоля (30 мл) нагревали при 80°С в течение 5 ч. Смесь охлаждали, распределяли между водой и диэтиловым эфиром, органическую фазу отделяли, сушили и упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 5% этилацетат/изогексан; выход 0,53 г.
1H ЯМР ДМСО-d6: δ 7.68-7.24 (11Н, m), 7.08 (1H, а), 5.10 (2Н, s), 3.97 (2H, s).
(2) [4-Хлор-2-(3-цианобензил)фенокси]уксусная кислота
Указанное в заголовке соединение получали способом из Примера 1, стадии (3)-(5), используя продукт со стадии (1); выход 0,175 г.
1H ЯМР ДМСО-d6: δ 7.81 (1H, s), 7,68-7.63 (2H, m), 7.47 (1H, t), 7.34 (1H, d), 7.24 (1H, dd), 6.93 (1H, d), 4.74 (2H, s), 3.99 (2H, s).
МС: ХИАД (-ve) 300/302 (М-1).
Пример 49
(2-{2-Хлор-4-[(этилсульфонил)амино]фенокси}-4-фторфенокси)уксусная кислота

(1) 2-Хлор-1-(5-фтор-2-метоксифенокси)-4-нитробензол
Гидрид натрия (60%-ная дисперсия в масле; 0,281 г) добавляли к раствору 5-фтор-2-метоксифенола (1,0 г) в ДМФА (20 мл) и перемешивали при КТ в течение 30 мин. Добавляли 2-Хлор-1-фтор-4-нитробензол (1,23 г) и смесь перемешивали при КТ в течение 16 ч, затем разбавляли водой и экстрагировали диэтиловым эфиром. Органическую фазу сушили и упаривали при пониженном давлении; выход 1,95 г.
МС: ЭРИ (-ve) 296 (М-1).
(2) 3-Хлор-4-(5-фтор-2-метоксифенокси)анилин
Порошок железа (2,0 г) добавляли к раствору продукта со стадии (1) (1,95 г) в уксусной кислоте (40 мл) и смесь перемешивали при КТ в течение ночи. Смесь фильтровали и фильтрат упаривали при пониженном давлении. Остаток распределяли между водным раствором гидрокарбоната натрия и этилацетатом, органическую фазу сушили и упаривали при пониженном давлении.
МС: ЭРИ (+ve) 268 (М+1).
(3) 2-(4-Амино-2-хлорфенокси)-4-фторфенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (3), используя продукт со стадии (2); выход 0,75 г.
МС: ЭРИ (-ve) 252(М-1).
(4) трет-Бутиловый эфир [2-(4-амино-2-хлорфенокси)-4-фторфенокси]уксусной кислоты
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (4), используя продукт со стадии (3); выход 0,38 г.
1H ЯМР CDCl3: δ 6.96-6.33 (6Н, m), 4.62 (2Н, s), 3.68 (2H, s), 1.47 (9H, s).
(5) (2-{2-Хлор-4-[(этилсульфонил)амино]фенокси}-4-фторфенокси)уксусная кислота
Этансульфонилхлорид (0,05 мл) добавляли к раствору продукта со стадии (4) (0,19 г) в пиридине (10 мл) и перемешивали при КТ в течение 2 ч. Растворитель выпаривали при пониженном давлении и остаток растворяли в ДХМ (10 мл) и трифторуксусной кислоте (10 мл). После перемешивания при КТ в течение 2 ч растворитель удаляли и остаток очищали ОФ-ВЭЖХ; выход 0,062 г.
1H ЯМР ДМСО-d6: δ 7.36-6.74 (6Н, m), 4.59 (2Н, s), 3.16-3.08 (2H, q), 1.22-1.18(3H, t).
MC: ЭРИ (-ve) 402 (M-1).
Пример 50
(2S)-2-(4-Хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)пропионовая кислота

(1) 4-Хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (2), используя продукт со стадии (1) Примера 8 (1,0 г) и 5-хлор-2-бензоксазолон (0,85 г); выход 0,55 г.
МС: ЭРИ (-ve) 345(М-1).
(2) (2S)-2-(4-Хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)пропионовая кислота
Указанное в заголовке соединение получали способом из Примера 16, используя продукт со стадии (1) (0,24 г); выход 0,04 г.
1H ЯМР ДМСО-d6: δ 8.84 (1Н, bs), 7.80 (1H, s), 7.58 (1H, s), 7.34 (1H, s), 7.17-7.06 (3H, m), 4.60 (1H, q), 3.24 (2H, q), 1.36 (3H, d), 1.09 (3H, t).
MC: ЭРИ (-ve) 416 (M-1).
Пример 51
2-(4-Хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)-2-метилпропионовая кислота

Указанное в заголовке соединение получали способом из Примера 29, стадия (2), используя продукт Примера 50, стадия (1); выход 0,16 г.
1H ЯМР ДМСО-d6: δ 8.15 (1Н, bs), 7.83 (1Н, s), 7.60 (1H, а), 7.36 (1Н, s), 7.13 (1Н, а), 7.01-6.94 (2Н, m), 3.27 (2H, q), 1.38 (6H, s), 1.08 (3H, t).
МС: ЭРИ (-ve) 430 (М-1).
Пример 52
(2S)-2-(4-Хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)пропионовая кислота

Указанное в заголовке соединение получали способом из Примера 50, используя продукт Примера 7, стадия (2); выход 0,075 г.
1H ЯМР ДМСО-d6: δ 7.94 (1Н, s), 7.88 (1Н, s), 7.64 (1Н, d), 7.37-7.32 (1Н, m), 7.20-7.06 (3H, m), 4.89 (1Н, q), 3.18 (3H, s), 1.38 (3H, d).
МС: ЭРИ (-ve) 402 (М-1).
Пример 53
2-(4-Хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)-2-метилпропионовая кислота

Указанное в заголовке соединение получали способом из Примера 50, стадия (1), и Примера 29, стадия (2); выход 0,05 г.
1H ЯМР ДМСО-d6: δ 7.86 (1Н, s), 7.64 (1Н, d), 7.28-7.22 (1H, m), 7.10-7.06 (2H, m), 7.02 (1Н, d), 3.17 (3H, s), 1.39 (6H, s).
МС: ЭРИ (-ve) 416 (М-1).
Пример 54
[4-Хлор-2-(пиримидин-5-илокси)фенокси]уксусная кислота

Смесь продукта со стадии (2) Примера 5 (0,2 г), 5-бромпиримидина (0,308 г), тетраметилгептан-3,5-диона (0,046 г), карбоната цезия (0,65 г) и хлорида меди (0,045 г) в NMP (2 мл) нагревали при 130°С в течение ночи, затем при 150°С. Смесь фильтровали, фильтрат промывали диэтиловым эфиром, подкисляли до рН 4 2М соляной кислотой и экстрагировали этилацетатом. Этилацетатный слой промывали водой, сушили и упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью этилацетат/уксусная кислота. Выход 0,007 г.
1H ЯМР ДМСО-d6: δ 8.92 (1Н, s), 8.52 (2H, s), 7.42 (1Н, s), 7.33 (1Н, dd), 7.13 (1H, d), 4.74 (2H, s).
MC: ЭРИ (-ve) 279 (M-1).
Пример 55
[4-Хлор-2-(хинолин-3-илокси)фенокси]уксусная кислота

Указанное в заголовке соединение получали способом из Примера 54; выход 0,035 г.
1H ЯМР ДМСО-d6: δ 8.00 (1Н, d), 7.84 (1Н, d), 7.67-7.63 (2H, m), 7.54 (1H, t), 7.38 (1Н, d), 7.32 (1Н, dd), 7.17 (1Н, d), 4.74 (2H, s).
МС:ЭРИ (-ve) 328 (М-1).
Пример 56
(2-{[2-Хлор-4-(метилсульфонил)фенил]амино}-4-фторфенокси)уксусная кислота

(1) 2-Хлор-N-(5-фтор-2-метоксифенил)-4-(метилсульфонил)анилин
Смесь 2-бром-4-фторанизола (6,0 г), 2-хлор-4-метилсульфониланилина (9,0 г), карбоната цезия (14,7 г), ацетата палладия (0,33 г) и 2-(дициклогексилфосфино)-2',4',6'-три-изопропил-1,1'-бифенила (0,54 г) в диоксане (60 мл) нагревали при 100°С в течение 20 ч. Смесь охлаждали и распределяли между этилацетатом и водой. Органическую фазу отделяли, промывали соляным раствором, сушили и упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 25% этилацетат/изогексан. Выход 3,2 г.
МС: ЭРИ(+ve) 330 (М+1).
(2) 2-{[2-Хлор-4-(метилсульфонил)фенил]амино}-4-фторфенол
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (3), используя продукт со стадии (1); выход 2,2 г.
МС: ЭРИ (+ve) 316 (М+1).
(3) (2-{[2-Хлор-4-(метилсульфонил)фенил]амино}-4-фторфенокси)уксусная кислота
трет-Бутилат натрия (0,073 г) добавляли к раствору продукта со стадии (2) (0,2 г) в ТГФ (10 мл) и перемешивали при КТ в течение 5 мин. Добавляли этилбромацетат (0,078 мл), смесь перемешивали в течение 1 ч, после чего добавляли 2М раствор гидроксида натрия (2 мл). Через 3 ч добавляли 2М соляную кислоту и смесь экстрагировали этилацетатом. Органическую фазу промывали соляным раствором, сушили и упаривали при пониженном давлении. Остаток очищали ОФ-ВЭЖХ; выход 0,11 г.
1H ЯМР ДМСО-d6: δ 13.14 (s, 1Н), 7.97 (s, 1H), 7.89 (s, 1H), 7.64 (d, 1H), 7.20 (d, 1H), 7.12 (m, 2H), 6.98 (m, 1H), 4.75 (s, 2H), 3.18 (s, 3H).
МС:ЭРИ (-ve) 372 (М-1).
Пример 57
(2S)-2-(2-{[2-Хлор-4-(метилсульфонил)фенил]амино}-4-фторфенокси)пропионовая кислота

Диизопропилазодикарбоксилат (0,14 мл) добавляли к перемешиваемому раствору продукта со стадии (2) Примера 56 (0,2 г), трифенилфосфина (0,18 г), R-метиллактата (0,1 г) в ТГФ (10 мл). Через 20 ч добавляли водный 1М раствор гидроксида натрия (2 мл) и перемешивали в течение 4 ч. Смесь разбавляли водой (30 мл), затем распределяли между этилацетатом и 2М соляной кислотой. Органическую фазу отделяли, промывали соляным раствором, сушили и упаривали при пониженном давлении. Остаток очищали ОФ-ВЭЖХ; выход 0,094 г.
1H ЯМР ДМСО-d6: δ 13.23 (s, 1Н), 7.99 (s, 1Н), 7.90 (s, 1Н), 7.66 (d, 1H), 7.22 (m, 2H), 7.12 (m, 1Н), 6.96 (m, 1Н), 4.86 (q, 1Н), 3.18 (s, 3H), 1.43 (d, 3H).
МС: ЭРИ (-ve) 386 (М-1).
Пример 58
{4-Хлор-2-[[2-хлор-4-(метилсульфонил)фенил](метил)амино]фенокси}уксусная кислота

Гидрид натрия (60%-ная дисперсия в масле; 0,11 г) добавляли к раствору продукта Примера 31 (0,5 г) в ДМФА (5 мл) и перемешивали при КТ в течение 10 мин. Добавляли метилйодид (1 мл), перемешивали в течение 5 ч, затем добавляли метанол (1 мл) с последующим добавлением 1М раствора гидроксида натрия (3 мл). После перемешивания в течение следующих 20 ч, смесь подкисляли 2М соляной кислотой и экстрагировали этилацетатом. Органическую фазу промывали соляным раствором, сушили и упаривали при пониженном давлении. Остаток очищали ОФ-ВЭЖХ; выход 0,21 г.
1H ЯМР ДМСО-d6: δ 13.01 (s, 1Н), 7.82 (d, 1Н), 7.81 (s, 1Н), 7.43 (d, 1Н), 7.15 (d, 1Н), 7.00 (d, 1Н), 6.84 (s, 1Н), 4.69 (s, 2H), 3.27 (s, 3H), 3.23 (s, 3H).
МС: ЭРИ (-ve) 402(М-1).
Пример 59
{4-Хлор-2-[[2-хлор-4-(метилсульфонил)фенил](этил)амино]фенокси}уксусная кислота

Указанное в заголовке соединение получали способом из Примера 58, используя йодэтан; выход 0,017 г.
1H ЯМР ДМСО-d6: δ 7.79 (s, 1Н), 7.78 (d, 1H), 7.44 (d, 1H), 7.13 (d, 1H), 6.99 (d, 1H), 6.82 (s, 1H), 4.63 (s, 2H), 3.80 (q, 2H), 3.23 (s, 3H), 1.13 (t, 3H).
МС: ЭРИ (-ve) 416 (М-1).
Пример 60
(2-{[2-Хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)уксусная кислота

(1) 5-Фтор-1,3-бензоксазол-2(3H)-он
Раствор 2-амино-4-фторфенола (4,0 г), карбонилдиимидазола (1,7 г) в ДХМ (100 мл) и ацетонитриле (30 мл) перемешивали при КТ в течение 5 ч. Растворитель удаляли при пониженном давлении и остаток очищали хроматографией на диоксиде кремния, элюируя смесью 30% этилацетат/изогексан; выход 4,0 г.
MC: ЭРИ (+ve) 154 (M+1).
(2) 2-{[2-Хлор-4-(этилсульфонил)фенил]амино}-4-фторфенол
Смесь продукта со стадии (1) (1,38 г), продукта со стадии (1) Примера 8 (2,0 г) и карбоната калия (3,7 г) в NMP (20 мл) нагревали в микроволновой печи СЕМ (100°С/50 ватт) в течение 15 мин. Добавляли метанол (30 мл) с последующим добавлением 1М раствора гидроксида натрия и реакционную смесь перемешивали при КТ в течение 3 ч. Смесь подкисляли 2М соляной кислотой, экстрагировали этилацетатом, органическую фазу промывали водой, соляным раствором, сушили и упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 25% этилацетат/изогексан; выход 2,0 г.
МС: ЭРИ (+ve) 330 (М+1).
(3) (2-{[2-Хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)уксусная кислота
Указанное в заголовке соединение получали способом из Примера 56, стадия (3), используя продукт со стадии (2); выход 0,35 г.
1H ЯМР ДМСО-d6: δ 13.14 (s, 1Н), 7.99 (s, 1H), 7.82 (s, 1H), 7.59 (d, 1H), 7.22 (d, 1H), 7.12 (s, 1H), 7.11 (d, 1H), 6.99 (m, 1H), 4.74 (s, 2H), 3.25 (q, 2H), 1.10 (t, 3H).
МС: ЭРИ (-ve) 386 (М-1).
Пример 61
{2-[2-Хлор-4-(метилсульфонил)фенокси]фенокси}уксусная кислота

Гидрид натрия (60%-ная дисперсия в масле; 0,24 г) добавляли к раствору (2-гидроксифенокси)уксусной кислоты (0,5 г) в ДМФА (20 мл) и перемешивали при 40°С в течение 30 мин. Добавляли продукт со стадии (2) Примера 7 (0,62 г), затем смесь нагревали при 75°С в течение 30 ч. Добавляли 2М раствор гидроксида натрия и экстрагировали этилацетатом. Водный слой подкисляли 2М соляной кислотой и экстрагировали этилацетатом. Органическую фазу сушили, упаривали при пониженном давлении и остаток очищали ОФ-ВЭЖХ; выход 0,21 г.
1H ЯМР ДМСО-d6: δ 8.05-6.93 (7Н, m), 4.47 (2H, s), 3.23 (3H, s).
МС: ХИАД (-ve) 355(М-1).
Пример 62
{4-Хлор-2-[4-(метилсульфонил)-3-(трифторметил)фенокси]фенокси}уксусная кислота

(1) 4-Бром-2-(трифторметил)фенилметилсульфид
Смесь тиометилата натрия (0,317 г) и 5-бром-2-фторбензотрифторида (1,0 г) в ДМФА (4 мл) нагревали при 50°С в течение 1 ч, затем выливали в воду и экстрагировали изогексаном. Органическую фазу промывали соляным раствором, сушили и упаривали при пониженном давлении. Выход 0,762 г.
1H ЯМР ДМСО-d6: δ 7.74 (1Н, d), 7.59 (1Н, dd), 7.22 (1Н, d), 2.51 (3H, s).
(2) 4-Бром-2-(трифторметил)фенилметилсульфон
Указанное в подзаголовке соединение получали способом из Примера 2, стадия (2), используя продукт со стадии (1); выход 0,8 г.
(3) Метиловый эфир {4-хлор-2-[4-(метилсульфонил)-3-(трифторметил)фенокси]фенокси}уксусной кислоты
Смесь трет-бутилата натрия (0,96 г), продукта со стадии (2) Примера 5 (0,4 г) в ДМСО (10 мл) перемешивали при КТ в течение 1 ч, затем добавляли продукт со стадии (2) (0,66 г). Смесь нагревали при 120°С в течение 6 ч, охлаждали и распределяли между этилацетатом и 2М соляной кислотой. Органическую фазу отделяли, промывали водой, сушили и упаривали при пониженном давлении. Остаток подвергали этерификации, используя триметилдиазометан в смеси ДХМ/метанол; выход 0,205 г.
1H ЯМР CDCl3: δ 8.22 (1Н, d), 7.47 (1Н, d), 7.27-7.13 (3H, m), 6.86 (1Н, d), 4.61 (2H, s), 3.74 (3H, s), 3.17 (3H, s).
(4) {4-Хлор-2-[4-(метилсульфонил)-3-(трифторметил)фенокси]фенокси}уксусная кислота
1М раствор гидроксида натрия (0,5 мл) добавляли к раствору продукта со стадии (3) (0,197 г) в метаноле (1 мл) и тетрагидрофуране (3 мл) и перемешивали при КТ в течение 16 ч. Растворитель выпаривали при пониженном давлении и остаток распределяли между ДХМ и 2М соляной кислотой. Органическую фазу сушили, упаривали при пониженном давлении и остаток перекристаллизовывали из смеси ДХМ/изогексан; выход 0,108 г.
1H ЯМР ДМСО-d6: δ 13.10 (1Н, s), 8.16 (1Н, d), 7.51 (1H, d), 7.46 (1H, d), 7.38 (1H, dd), 7.33 (1H, dd), 7.18 (1H, d), 4.75 (2H, s), 3.24 (3H, s).
МС: ХИАД (-ve) 423 (М-1).
Пример 63
[4-Хлор-2-(хинолин-8-илтио)фенокси]уксусная кислота
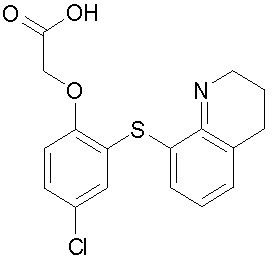
(1) трет-Бутиловый эфир (4-хлор-2-йодфенокси)уксусной кислоты
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (4), используя 4-хлор-2-йод-фенол (4,75 г); выход 6,88 г.
1H ЯМР CDCl3: δ 7.77 (1H, d), 7.24 (1H, dd), 6.61 (1H, d), 4.55 (2H, s), 1.48 (9H, s).
(2) [4-Хлор-2-(хинолин-8-илтио)фенокси]уксусная кислота
Смесь продукта со стадии (1) (0,262 г), гидрохлорида 8-хинолинтиола (0,141 г), йодида меди (I) (7 мг), карбоната калия (0,295 г) и этиленгликоля (0,08 мл) в изопропиловом спирте (3 мл) нагревали при 80°С в течение 48 ч. Смесь распределяли между ДХМ и 2М соляной кислотой, органическую фазу сушили, упаривали при пониженном давлении и остаток очищали хроматографией на диоксиде кремния, элюируя смесью ДХМ:метанол:уксусная кислота (90:9:1). Остаток растирали со смесью диэтиловый эфир/метанол, фильтровали и сушили; выход 0,101 г.
1H ЯМР ДМСО-d6: δ 13.00 (1Н, bs), 8.95 (1Н, d), 8.42 (1H, d), 7.81 (1H, d), 7.63 (1H, dd), 7.57-7.37 (3H, m), 7.08 (2H, d), 4.79 (2H, s).
МС: ХИАД (-ve) 344/6 (M-1).
Пример 64
(2S)-2-[4-Хлор-2-(4-нитрофенокси)фенокси]-пропионовая кислота

(1) Метиловый эфир (2S)-2-(4-хлор-2-формилфенокси)пропионовой кислоты
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (2), используя 5-хлор-2-гидроксибензальдегид и метил-(2R)-2-(4-толуолсульфонил)лактат.
1H ЯМР CDCl3: δ 10.50 (1H, s), 7.81 (1H, d), 7.44 (1H, dd), 6.79 (1H, d), 4.87 (1H, q), 3.77 (3H, s), 1.70 (3H, d).
(2) (2S)-2-(4-Хлор-2-гидроксифенокси)пропионовая кислота
Указанное в подзаголовке соединение получали способом из Примера 1, стадия (2), и Примера 26, стадия (4), используя продукт со стадии (1).
МС: ХИАД (-ve) 215/7 (М-1).
(3) (2S)-2-[4-Хлор-2-(4-нитрофенокси)фенокси]-пропионовая кислота
К раствору (2S)-2-(4-хлор-2-гидроксифенокси)-пропионовой кислоты (0,216 г) и 1-фтор-4-нитро-бензола (0,127 г) в NMP (3 мл) добавляли карбонат калия (0,276 г) и реакционную смесь нагревали при 90°С в течение 2 ч. После охлаждения до КТ добавляли воду и диэтиловый эфир. Водный слой отделяли и еще раз экстрагировали диэтиловым эфиром. Водный слой отделяли, подкисляли до рН 2 и экстрагировали диэтиловым эфиром. Этот последний экстракт сушили и упаривали при пониженном давлении. Остаток очищали хроматографией на диоксиде кремния, элюируя смесью 30-50% этилацетат/изогексан+1% АсОН; выход 0,2 г.
1H ЯМР ДМСО-d6: δ 8.22 (2Н, d), 7.40 (1H, d), 7.34 (1H, dd), 7.09 (3H, m), 4.85 (1H, q), 1.26(3H, d).
MC: ХИАД (-ve) 336.
Пример 65
(2S)-2-(2-{[2-Хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)пропионовая кислота

Указанное в заголовке соединение получали способом из Примера 57, используя продукт Примера 60, стадия (2).
1H ЯМР ДМСО-d6: δ 13.22 (s, 1H), 8.04 (s, 1H), 7.83 (s, 1H), 7.61 (d, 1H), 7.24 (d, 1H), 7.18 (d, 1H), 7.12 (m, 1H), 6.97 (m, 1H), 4.85 (q, 1H), 3.26 (q, 2Н), 1.42 (d, 3H), 1.10(t, 3H).
MC: ХИАД (-ve) 400.
Пример 66
Натриевая соль 2-(2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)-2-метилпропионовой кислоты

Указанное в заголовке соединение получали способом из Примера 29, стадия (2), используя продукт Примера 60, стадия (2).
1H ЯМР ДМСО-d6: δ 10.67 (s, 1H), 7.77 (s, 1H), 7.56 (d, 1H), 7.22 (d, 1H), 7.04 (m, 2Н), 6.75 (m, 1H), 3.24 (q, 2H), 1.38 (s, 6H), 1.10 (t, 3H).
МС: ХИАД (ve) 414.
Пример 67
[2-{[2-Хлор-4-(метилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусная кислота

(1) 2-{[2-Хлор-4-(метилсульфонил)фенил]амино}-4-(трифторметил)фенол
Указанное в подзаголовке соединение получали способом из Примера 60, стадия (2), используя 5-(трифторметил)-1,3-бензоксазол-2(3H)-он и продукт Примера 7, стадия (2).
МС: ЭРИ (+ve) 366 (М+1).
(2) [2-{[2-Хлор-4-(метилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусная кислота
Указанное в заголовке соединение получали способом из Примера 56, стадия (3), используя продукт со стадии (1).
1H ЯМР ДМСО-d6: δ 8.50 (s, 1Н), 7.86 (s, 1H), 7.59 (m, 2H), 7.49 (d, 1H), 7.19 (d, 1H), 7.02 (d, 1H), 4.60 (s, 2H), 3.17 (s, 3H).
МС: ХИАД (-ve) 422 (М-1).
Пример 68
[2-{[2-Хлор-4-(этилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусная кислота

(1) 2-{[2-Хлор-4-(этилсульфонил)фенил]амино}-4-(трифторметил)фенол
Указанное в подзаголовке соединение получали способом из Примера 60, стадия (2), используя 5-(трифторметил)-1,3-бензоксазол-2(3H)-он и продукт Примера 8, стадия (1).
МС: ЭРИ (+ve) 380 (М+1).
(2) [2-{[2-Хлор-4-(этилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусная кислота
Указанное в заголовке соединение получали способом из Примера 56, стадия (3), используя продукт со стадии (1).
1H ЯМР ДМСО-d6: δ 13.18 (s, 1Н), 8.09 (s, 1H), 7.81 (s, 1H), 7.63 (s, 1H), 7.55 (m, 2H), 7.23 (d, 1H), 6.87 (d, 1H), 4.85 (s, 2H), 3.24 (q, 2H), 1.10 (t, 3H).
МС: ХИАД (-ve) 436 (М-1).
Фармакологические данные
Анализ связывания лиганда
[3H]PGD2 с удельной активностью 100-210 Ки/ммоль закупали у Perkin Elmer Life Sciences. Все другие химические реактивы были химически чистыми,
НЕК-клетки, экспрессирующие rhCRTh2/Ga16, обычным образом поддерживали в DMEM, содержащей 10% фетальной сыворотки теленка (HyClone), 1 мг/мл генетицина, 2 мМ L-глутамина и 1% заменимых аминокислот. Для получения мембран адгерентные трансфецированные НЕК-клетки выращивали до конфлюэнтности в фабриках для двухслойных культур тканей (Fisher, номер по каталогу ТКТ-170-070Е). Максимальные уровни рецепторной экспрессии индуцировали добавлением 500 мМ бутирата натрия в течение последних 18 часов культивирования. Адгерентные клетки промывали один раз физиологическим раствором, забуференным фосфатом (PBS, по 50 мл на клеточную фабрику), и отделяли путем добавления по 50 мл охлажденного во льду буфера гомогенизации мембран [20 мМ HEPES (рН 7,4), 0,1 мМ дитиотреитол, 1 мМ EDTA, 0,1 мМ фенилметилсульфонилфторид и 100 мкг/мл бацитрацина] на клеточную фабрику. Клетки осаждали центрифугированием при 220×g в течение 10 минут при 4°С, ресуспендировали в половине первоначального объема свежего буфера гомогенизации мембран и разрушали, используя гомогенизатор Polytron, в течение 2-х 20 секундных "взрывов", выдерживая пробирки во льду в течение всего времени. Неразрушенные клетки удаляли центрифугированием при 220×g в течение 10 минут при 4°С, и мембранную фракцию осаждали центрифугированием при 90000×g в течение 30 минут при 4°С. Конечный осадок ресуспендировали в 4 мл буфера гомогенизации мембран на клеточную фабрику и определяли содержание белка. Мембраны хранили при -80°С в подходящих аликвотах.
Все анализы проводили в белых 96-луночных NBS планшетах Corning с прозрачным дном (Fisher). Перед анализом мембраны НЕК-клеток, содержащие CRTh2, наносили на SPA PVT WGA гранулы (Amersham). Для нанесения покрытия мембраны инкубировали с гранулами в типичном случае в количестве 25 мкг мембранного белка на мг гранул при 4°С и постоянном встряхивании в течение ночи. (Концентрации для оптимального нанесения покрытия определяли для каждой партии мембран). Гранулы осаждали центрифугированием (800хд в течение 7 минут при 4°С), промывали один раз буфером для анализа (50 мМ HEPES рН 7,4, содержащий 5 мМ хлорида магния) и окончательно ресуспендировали в буфере для анализа при концентрации гранул 10 мг/мл.
Каждый анализ содержал 20 мкл 6,25 нМ [3H]PGD2, 20 мкл насыщенных мембранами SPA-гранул, все в буфере для анализа, и 10 мкл раствора соединения или 13,14-дигидро-15-кето-простагландина D2 (DK-PGD2, для определения неспецифического связывания, химическая компания Cayman). Соединения и DK-PGD2 растворяли в ДМСО и разбавляли в том же растворителе до 100-кратно увеличенной требуемой конечной концентрации. Добавляли буфер для анализа для достижения конечной концентрации ДМСО, равной 10% (теперь соединения находились в 10-кратно увеличенной требуемой конечной концентрации), и этот раствор добавляли в планшет для анализа. Планшет для анализа инкубировали при комнатной температуре в течение 2 часов и считывали на жидкостном сцинтилляционном счетчике Wallac Microbeta (1 минута на лунку).
Соединения формулы (I) имеют значения IC50 менее (<) 10 мкМ.
Конкретно, пример 4 имеет pIC50=8,0, пример 5 имеет pIC50=8,0 и пример 43 имеет pIC50=9,0.
Реферат
Изобретение относится к способу модулирования CRTh2-рецепторной активности с использованием соединений формулы (I) или их фармацевтически приемлемых солей, где W представляет собой О, S(O)n (где n равен 0, 1 или 2), NR15, CR1OR2 или CR1R2; X представляет собой водород, галоген или C1-6алкил, который может быть замещен одним или более чем одним атомом галогена; Y представляет собой водород, галоген; Z представляет собой фенил, пиридил, пиримидил или хинолил, возможно замещенный одним или более чем одним заместителем, независимо выбранным из галогена, CN, нитро, SO2R9, SO2NR10R11, CONR10R11, NHSO2R или C1-3алкила, замещенного одним или более чем одним атомом галогена; R1 и R2 независимо представляют собой атом водород или C1-6алкильную группу; R9 представляет собой ! C1-6алкил; R10 и R11 независимо представляют собой водород или C1-6алкил, R15 представляет собой атом водорода или C1-С6-алкил. 6 н. и 13 з.п. ф-лы.
Формула

где W представляет собой О, S(O)n (где n равен 0, 1 или 2), NR15, CR1OR2 или CR1R2;
X представляет собой водород, галоген или C1-6алкил, который может быть замещен одним или более чем одним атомом галогена;
Y представляет собой водород, галоген;
Z представляет собой фенил, пиридил, пиримидил или хинолил, возможно замещенный одним или более чем одним заместителем, независимо выбранным из галогена, CN, нитро, SO2R9, SO2NR10R11, CONR10R11, NHSO2R9 или C1-3алкила, замещенного одним или более чем одним атомом галогена;
R1 и R2 независимо представляют собой атом водорода или C1-6алкильную группу;
R9 представляет собой C1-6алкил;
R10 и R11 независимо представляют собой водород или C1-6алкил, R15 представляет собой атом водорода или C1-С6-алкил.
[4-хлор-2-[[4-(этилсульфонил)фенил]тио]фенокси]-уксусной кислоты,
[4-хлор-2-[[4-(этилсульфонил)-2-метилфенил]тио]фенокси]-уксусной кислоты,
[2-[[4-(этилсульфонил)фенил](гидрокси)метил]-4-(трифторметил)фенокси]уксусной кислоты,
[2-[4-(этилсульфонил)бензил]-4-(трифторметил)фенокси]уксусной кислоты,
[4-хлор-2-[4-(этилсульфонил)фенокси]фенокси]-уксусной кислоты,
[4-хлор-2-[[4-(метилсульфонил)фенил]амино]фенокси]-уксусной кислоты,
(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)уксусной кислоты,
(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенокси)уксусной кислоты,
(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)уксусной кислоты,
{4-хлор-2-[(5-хлорпиридин-2-ил)тио]фенокси}уксусной кислоты,
{4-хлор-2-[(2-хлор-4-цианофенил)тио]фенокси}уксусной кислоты,
(4-хлор-2-{[2-(метилсульфонил)фенил]тио}фенокси)уксусной кислоты,
(4-хлор-2-{[4-(метилсульфонил)фенил]сульфинил}фенокси)уксусной кислоты,
(4-хлор-2-{[4-(метилсульфонил)фенил]сульфонил}фенокси)уксусной кислоты,
[4-хлор-2-({4-[(метиламино)карбонил]фенил}тио)фенокси]уксусной кислоты,
(2S)-2-(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовой кислоты,
(2R)-2-(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовой кислоты,
(2S)-2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)пропионовой кислоты,
(2S)-2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенокси)пропионовой кислоты,
2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)-2-метилпропионовой кислоты,
{4-хлор-2-[4-(метилсульфонил)фенокси]фенокси}уксусной кислоты,
{4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусной кислоты,
{4-хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}уксусной кислоты,
(2S)-2-{4-хлор-2-[4-(метилсульфонил)фенокси]фенокси}пропионовой кислоты,
(2S)-2-{4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}пропионовой кислоты,
(2S)-2-{4-хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}пропионовой кислоты,
{4,5-дихлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусной кислоты,
{2-[2-хлор-4-(метилсульфонил)фенокси]-4,5-дифторфенокси}уксусной кислоты,
2-{4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}-2-метилпропионовой кислоты,
(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)уксусной кислоты,
(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)уксусной кислоты,
[2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенокси]уксусной кислоты,
(2S)-2-[2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенокси]пропионовой кислоты,
[2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-(трифторметил)фенокси]уксусной кислоты,
(2S)-2-[2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-(трифторметил)фенокси]пропионовой кислоты,
[2-({4-[(диметиламино)сульфонил]фенил}тио)-4-(трифторметил)фенокси]уксусной кислоты,
[2-[2-хлор-4-(метилсульфонил)фенокси]-4-(трифторметил)фенокси]уксусной кислоты,
[2-[2-хлор-4-(этилсульфонил)фенокси]-4-(трифторметил)фенокси]уксусной кислоты,
2-[2-[2-хлор-4-(метилсульфонил)фенокси]-4-(трифторметил)фенокси]масляной кислоты,
[2-{4-[(диметиламино)сульфонил]фенокси}-4-(трифторметил)фенокси]уксусной кислоты,
(2S)-2-[2-{4-[(диметиламино)сульфонил]фенокси}-4-(трифторметил)фенокси]пропионовой кислоты,
{2-[2-хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}уксусной кислоты,
{2-[2-хлор-4-(этилсульфонил)фенокси]-4-фторфенокси}уксусной кислоты,
2-{2-[2-хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}-2-метилпропионовой кислоты,
(2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-фторфенокси)уксусной кислоты,
(2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-фторфенокси)уксусной кислоты,
2-(2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-фторфенокси)-2-метилпропионовой кислоты,
[4-хлор-2-(3-цианобензил)фенокси]уксусной кислоты,
(2-{2-хлор-4-[(этилсульфонил)амино]фенокси}-4-фторфенокси)уксусной кислоты,
(2S)-2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)пропионовой кислоты,
2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)-2-метилпропионовой кислоты,
(2S)-2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)пропионовой кислоты,
2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)-2-метилпропионовой кислоты,
[4-хлор-2-(пиримидин-5-илокси)фенокси]уксусной кислоты,
[4-хлор-2-(хинолин-3-илокси)фенокси]уксусной кислоты,
(2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-фторфенокси)уксусной кислоты,
(2S)-2-(2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-фторфенокси)пропионовой кислоты,
{4-хлор-2-[[2-хлор-4-(метилсульфонил)фенил](метил)амино]фенокси}уксусной кислоты,
{4-хлор-2-[[2-хлор-4-(метилсульфонил)фенил](этил)амино]фенокси}уксусной кислоты,
(2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)уксусной кислоты,
{2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусной кислоты,
{4-хлор-2-[4-(метилсульфонил)-3-(трифторметил)фенокси]фенокси}уксусной кислоты,
[4-хлор-2-(хинолин-8-илтио)фенокси]уксусной кислоты,
(2S)-2-[4-хлор-2-(4-нитрофенокси)фенокси]-пропионовой кислоты,
(2S)-2-(2-{12-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)пропионовой кислоты,
2-(2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)-2-метилпропионовой кислоты,
[2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусной кислоты,
[2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусной кислоты
и их фармацевтически приемлемых солей.

где W представляет собой О, CH2, S(O)n, где n равен 0, 1 или 2, или NR15, где R15 является водородом или метилом;
Х представляет собой галоген или C1-6алкил, который может быть замещен одним или более чем одним атомом галогена;
Y представляет собой водород или галоген;
Z представляет собой фенил, пиридил или пиримидил, каждый из которых возможно замещен одним или более чем одним заместителем, независимо выбранным из галогена, CN, C1-3алкила, возможно замещенного одним или более чем одним атомом галогена, SO2R9, SO2NR10R11, CONR10R11, NHSO2R9;
R1 и R2 независимо представляют собой водород или C1-6алкил;
R9 представляет собой С1-6алкил, возможно замещенный галогеном; и R10 и R11 независимо представляют собой водород или С1-6алкил, при условии, что
соединения 2-[4-метил-2-(бензил)фенокси]уксусная кислота, 2-[4-хлор-2-(бензил)фенокси]пропионовая кислота, 2-[4-бром-2-(4-хлорфенокси)фенокси]пропионовая кислота, 2-[4-хлор-2-(4-хлорфенокси)фенокси]пропионовая кислота, 4-метил-2-(пара-толуолсульфонил)фенилуксусная кислота исключены;
если Х представляет собой фторо, и W представляет собой S, то Z не является 5-фтор-2-гидроксифенилом;
если Х представляет собой хлоро, Y представляет собой 3-метил, R1 и R2 оба представляют собой водород, и W представляет собой СН2, то Z не является фенилом.
[4-хлор-2-[[4-(этилсульфонил)фенил]тио]фенокси]-уксусной кислоты,
[4-хлор-2-[[4-(этилсульфонил)-2-метилфенил]тио]фенокси]-уксусной кислоты,
[4-хлор-2-[4-(этилсульфонил)фенокси]фенокси]-уксусной кислоты,
[4-хлор-2-[[4-(метилсульфонил)фенил]амино]фенокси]-уксусной кислоты,
(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)уксусной кислоты,
(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенокси)уксусной кислоты,
(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)уксусной кислоты,
{4-хлор-2-[(5-хлорпиридин-2-ил)тио]фенокси}уксусной кислоты,
{4-хлор-2-[(2-хлор-4-цианофенил)тио]фенокси}уксусной кислоты,
(4-хлор-2-{[2-(метилсульфонил)фенил]тио}фенокси)уксусной кислоты,
(4-хлор-2-{[4-(метилсульфонил)фенил]сульфинил}фенокси)уксусной кислоты,
(4-хлор-2-{[4-(метилсульфонил)фенил]сульфонил}фенокси)уксусной кислоты,
[4-хлор-2-({4-[(метиламино)карбонил]фенил}тио)фенокси]уксусной кислоты,
(2S)-2-(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовой кислоты,
(2R)-2-(4-хлор-2-{[4-(метилсульфонил)фенил]тио}фенокси)пропионовой кислоты,
(2S)-2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)пропионовой кислоты,
(2S)-2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]тио}фенокси)пропионовой кислоты,
2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]тио}фенокси)-2-метилпропионовой кислоты,
{4-хлор-2-[4-(метилсульфонил)фенокси]фенокси}уксусной кислоты,
{4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусной кислоты,
{4-хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}уксусной кислоты,
(2S)-2-{4-хлор-2-[4-(метилсульфонил)фенокси]фенокси}пропионовой кислоты,
(2S)-2-{4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}пропионовой кислоты,
(2S)-2-{4-хлор-2-[2-хлор-4-(этилсульфонил)фенокси]фенокси}пропионовой кислоты,
{4,5-дихлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}уксусной кислоты,
{2-[2-хлор-4-(метилсульфонил)фенокси]-4,5-дифторфенокси}уксусной кислоты,
2-{4-хлор-2-[2-хлор-4-(метилсульфонил)фенокси]фенокси}-2-метилпропионовой кислоты,
(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)уксусной кислоты,
(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)уксусной кислоты,
[2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенокси]уксусной кислоты,
(2S)-2-[2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-(трифторметил)фенокси]пропионовой кислоты,
[2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-(трифторметил)фенокси]уксусной кислоты,
(2S)-2-[2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-(трифторметил)фенокси]пропионовой кислоты,
[2-({4-[(диметиламино)сульфонил]фенил}тио)-4-(трифторметил)фенокси]уксусной кислоты,
[2-[2-хлор-4-(метилсульфонил)фенокси]-4-(трифторметил)фенокси]уксусной кислоты,
[2-[2-хлор-4-(этилсульфонил)фенокси]-4-(трифторметил)фенокси]уксусной кислоты,
2-[2-[2-хлор-4-(метилсульфонил)фенокси]-4-(трифторметил)фенокси]масляной кислоты,
[2-{4-[(диметиламино)сульфонил]фенокси}-4-(трифторметил)фенокси]уксусной кислоты,
(2S)-2-[2-{4-[(диметиламино)сульфонил]фенокси}-4-(трифторметил)фенокси]пропионовой кислоты,
{2-[2-хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}уксусной кислоты,
{2-[2-хлор-4-(этилсульфонил)фенокси]-4-фторфенокси}уксусной кислоты,
2-{2-[2-хлор-4-(метилсульфонил)фенокси]-4-фторфенокси}-2-метилпропионовой кислоты,
(2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-фторфенокси)уксусной кислоты,
(2-{[2-хлор-4-(этилсульфонил)фенил]тио}-4-фторфенокси)уксусной кислоты,
2-(2-{[2-хлор-4-(метилсульфонил)фенил]тио}-4-фторфенокси)-2-метилпропионовой кислоты,
(2-{2-хлор-4-[(этилсульфонил)амино]фенокси}-4-фторфенокси)уксусной кислоты,
(2S)-2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)пропионовой кислоты,
2-(4-хлор-2-{[2-хлор-4-(этилсульфонил)фенил]амино}фенокси)-2-метилпропионовой кислоты,
(2S)-2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)пропионовой кислоты,
2-(4-хлор-2-{[2-хлор-4-(метилсульфонил)фенил]амино}фенокси)-2-метилпропионовой кислоты,
[4-хлор-2-(пиримидин-5-илокси)фенокси]уксусной кислоты,
(2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-фторфенокси)уксусной кислоты,
(2S)-2-(2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-фторфенокси)пропионовой кислоты,
{4-хлор-2-[[2-хлор-4-(метилсульфонил)фенил](метил)амино]фенокси}уксусной кислоты,
{4-хлор-2-[[2-хлор-4-(метилсульфонил)фенил](этил)амино]фенокси}уксусной кислоты,
(2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)уксусной кислоты,
{4-хлор-2-[4-(метилсульфонил)-3-(трифторметил)фенокси]фенокси}уксусной кислоты,
(2S)-2-(2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)пропионовой кислоты,
2-(2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-фторфенокси)-2-метилпропионовой кислоты,
[2-{[2-хлор-4-(метилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусной кислоты,
[2-{[2-хлор-4-(этилсульфонил)фенил]амино}-4-(трифторметил)фенокси]уксусной кислоты,
[2-[4-(этилсульфонил)бензил]-4-(трифторметил)фенокси]уксусной кислоты,
[4-хлор-2-(3-цианобензил)фенокси]уксусной кислоты и их фармацевтически приемлемых солей.
2-(4-хлор-2-гидроксифенокси)-2-метилпропионовой кислоты,
(4-фтор-2-гидроксифенокси)уксусной кислоты,
2-(4-фтор-2-гидроксифенокси)-2-метилпропионовой кислоты,
(2S)-2-(4-хлор-2-гидроксифенокси)пропионовой кислоты.

Комментарии