Слитый белок дефектная хлорамфеникол ацетилтрансфераза (сат)-соматостатин и его применения - RU2501565C2
Код документа: RU2501565C2
Чертежи












Описание
Область техники
Настоящее изобретение относится к химерным полипептидам на основе соматостатина, полинуклеотидам, которые используются для кодирования этих полипептидов, средствам для изоляции и получения таких полипептидов и к их применению. Настоящее изобретение также относится к новым адъювантам и композициям для иммунизации, предназначенным для повышения иммуногенности, например, к химерным полипептидам на основе соматостатина в соответствии с изобретением, а также к другим подобным антигенам.
Предпосылки создания изобретения
Соматостатин (также известный как фактор, тормозящий выделение гормона роста или GHIH) представляет собой пептидный гормон, который вырабатывается в гипоталамусе, а также и в некоторых органах пищеварительной системы. Соматостатин в общем случае является вовлеченным в регуляцию эндокринной системы путем взаимодействия со слитыми с G-белком рецепторами соматостатина. Этот сигнальный каскад на основе соматостатина приводит к возникновению ряда воздействий, которые распространяются в организме.
В соответствии с аспектами настоящего изобретения соматостатин является известным как такой, который ингибирует высвобождение гормона роста и тиреотропного гормона из передней доли гипофиза. (Patel YC и Srikant CB, Somatostatin and its receptors Adv Mol Cell Endocrinol, 1999. 3 43-73). Другие гормоны, которые ингибируются с помощью соматостатина, включают инсулин, глюкагон, секретин, гастрин, пепсин, малетин и тому подобные. (Patel YC и Srikant CB Somatostatin and its receptors Adv Mol Cell Endocrinol, 1999. 3 43-73). Способность соматостатина регулировать достаточно большое количество факторов/гормонов, необходимых для роста и усвоения пищи, сделало соматостатин центральной мишенью для контроля роста животных в области животноводства, то есть, ингибирование соматостатина приводит к получению повышенных уровней гормона роста, который присутствует у животного, представляющего интерес, и, таким образом, приводит к получению животных с повышенной способностью к выработке молока, для обеспечения больших количеств мяса и т.п.
В частности, иммунизация животных соматостатином была признанной в качестве средства для нейтрализации соматостатина у животного, представляющего интерес, и удаляет, таким образом, нормальное ингибиторное влияние соматостатина на различные аспекты продуктивности животных, например, выработку молока у коров молочных пород. Reichlin S., ред., 1987, Somatostatin, Basic and Clinical Status, Plenum Press, New York (стр.3-50, 121-136, 146-156, 169-182, 221-228, 267-274) Spencer G.S., 1985, Hormonal systems regulating growth, review, Livestock Production Science, 12, 31-46. Является важным, что такие процедуры иммунизации на основе соматостатина позволяют избежать непосредственного воздействия анаболических гормонов, например, гормона роста и подобных ему у животного и дают возможность осуществлять незначительные изменения концентрации эндогенных анаболических факторов и, таким образом, обеспечивают получение экологически чистых продуктов.
Соматостатин является известным как такой, который обладает коротким периодом полураспада в крови. Для того чтобы повысить иммунологические эффекты соматостатина, были усовершенствованы прописи для иммунизации с целью увеличения периода полураспада белков путем конъюгации соматостатина с целевыми белками носителями. Такие конъюгированные белки соматостатина были сконструированы для того, чтобы обеспечить более высокие значения периода полураспада и повышенную антигенность в крови, и таким образом, имеют повышенную выгоду (в частности, в отношении затрат на получение соматостатина). Например, химерные белки соматостатина раскрываются в патенте США №6,316,004 (и соответствующем европейском патенте ЕР 0645454), где различные конъюгированные белки, содержащие соматостатин, были продемонстрированы как такие, которые обладают повышенной иммуногенностью и функцией в отношении продуктивности сельскохозяйственных животных по сравнению с другими традиционными процедурами иммунизации или процедурами, которые основываются на введении анаболического гормона.
Однако для улучшения общей продуктивности и временного охвата в области животноводства являются необходимыми композиции с более низкой дозой, а также процедуры для иммунизации, обеспечивающие более высокую антигенность. Настоящее изобретение является направленным на обеспечение таких более антигенных и функционально активных соединений, композиций и процедур для иммунизации на основе соматостатина.
С этой целью и обеспечивается настоящее раскрытие.
Краткое изложение сущности изобретения
Настоящее изобретение обеспечивает новые полипептиды и полинуклеотиды, которые их кодируют, обладающие улучшенной иммуногенностью соматостатина. Полипептиды в соответствии с изобретением включают соматостатин-14, слитый с существенно инактивированным белком хлорамфеникол ацетилтрансферазы посредством функционально оптимизированного линкера. Химерные полипептиды в соответствии с изобретением обеспечивают высокоэффективные и недорогие материалы для применения в области животноводства, как описывается более подробно ниже. Воплощения в соответствии с изобретением включают последовательности аминокислот и последовательности нуклеиновой кислоты, как определено в SEQ ID NO: 1-14.
Настоящее изобретение также обеспечивает процедуры получения и очистки для создания химерных полипептидов в соответствии с изобретением в свободном от эндотоксина и высокофункциональном состоянии. Свободные от эндотоксина полипептиды обеспечивают существенное и неожиданное преимущество для применения у некоторых животных, представляющих интерес, где незначительные количества эндотоксина, которые типично предполагаются как благоприятные для стимуляции иммунного ответа, фактически приводят к значительному функциональному недостатку. Это, в частности, касается случая, когда полипептиды в соответствии с изобретением используются для иммунизации при выведении и выращивании коров молочных пород в США. Кроме того, поскольку химерныеполипептиды в соответствии с изобретением демонстрируют улучшенную функцию по сравнению с традиционными материалами, более низкие дозы и меньшее их количество используются для иммуниации животных, которые представляют интерес. Такое снижение требуемых количеств также обеспечивает получаемое в результате снижение уровня эндотоксина в вакцинах в соответствии с изобретением. Комбинация изоляции в свободном от эндотоксина состоянии и используемых меньших количеств химерных полипептидов в соответствии с изобретением позволяет использовать в данной заявке существенно свободные от эндотоксина вакцины.
Изобретение также обеспечивает адъювантные композиции, обладющие улучшенной функцией и безопасностью по сравнению с традиционными адъювантными материалами. Адъюванты, описанные в данной заявке, не содержат материалов, имеющих происхождение от животных, и являются свободными от большинства известных химических канцерогенов, например, бензола и других подобных материалов. Адъювантные композиции, описанные в данной заявке, подтвердили свою пригодность как неожиданно эффективные при стимуляции иммунного ответа, когда являются соединенными с целевыми антигенами.
Изобретение также обеспечивает вакцины, содержащие химерные полипептиды в соответствии с изобретением в сочетании с адъювантными композициями в соответствии с изобретением. Вакцины, описанные в данной заявке, используются для индукции иммунного ответа у вакцинированных млекопитающих и птиц, например, у сельскохозяйственных животных, которые представляют интерес. Типичные сельскохозяйственные животные для применения в данной заявке включают: коров молочных пород, свиней, овец, коз, индюков, кролей и телят. В некоторых аспектах полипептиды в соответствии с изобретением получают и очищают с низким содержанием или при отсутствии ассоциированного эндотоксина. Эти вакцины были оптимизированными для того, чтобы стимулировать безопасные и улучшенные иммуногенные реакции у животного, представляющего интерес.
Изобретение также включает способы вакцинации животных, которые представляют интерес, а также птиц, при использовании вакцин в соответствии с изобретением. Типичные способы обеспечиваются для вакцинации коров молочных пород для повышения продукции молока безопасным (как для животного, так и для конечного пользователя), эффективным с точки зрения материальных затрат и пригодным способом. Другие типичные способы включают вакцинацию поросят, овец, индюков, коз, кролей или телят для повышения продукции мяса (и, в частности, нежирного мяса) у животного, представляющего интерес, безопасным и эффективным с точки зрения материальных затрат способом.
Эти и различные другие характеристики и преимущества в соответствии с изобретением будет понятными из приведенного ниже подробного описания и обзора приложенных пунктов формулы
Краткое описание фигур
Фигура 1 представляет собой схематическую иллюстрацию pET30b CatSom плазмиды в соответствии с воплощением настоящего изобретения. Плазмида включает маркер устойчивости к канамицину, Lac оператор, Т7 промотор, кодирующую последовательность CAT, все в соответствии с воплощениями изобретения, также являются включенными линкерный участок в соответствии с изобретение и кодирующий участок соматостатина в соответствии с изобретение.
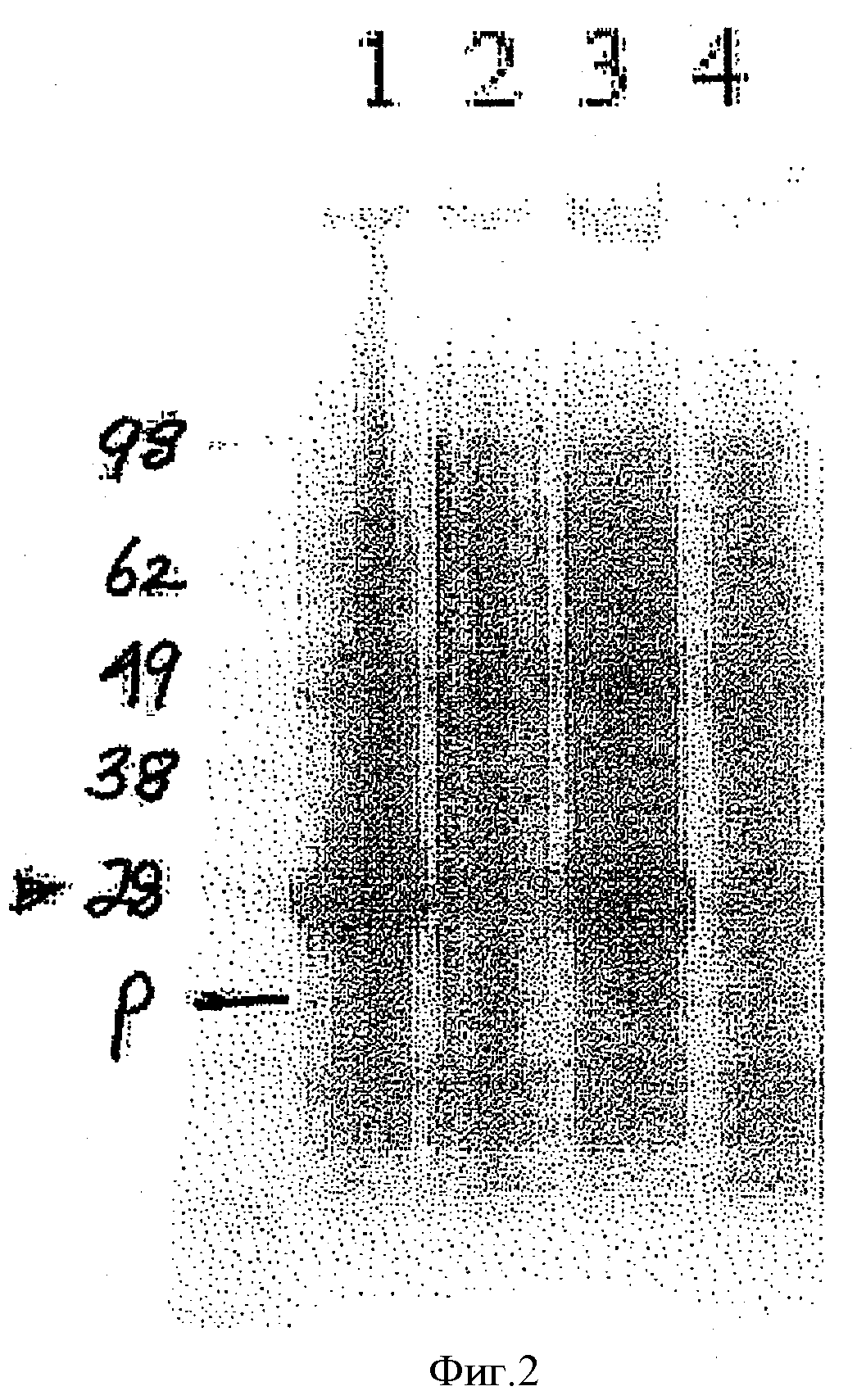
Фигура 2 представляет собой иллюстрацию окрашенного SDS-ПАГЭ, демонстрирующего полоску 28 кДа, соответствующую спрогнозированному размеру оптимизированного по кодонам, полипептида на основе дефектной CAT и соматостатина в соответствии с изобретением. Дорожка 1 представляет собой LB + IPTG, восстанавливающмй. Дорожка 2 представляет собой LB, восстанавливающий, Дорожка 3 представляет собой LB + IPTG и Дорожка 4 представляет собой LB.
Фигуры 3А и 3В представляют собой таблицы, демонстрирующие продукцию молока в литрах в сутки у вакцинированного (при использовании вакцины, как описано в Примерах) и у контрольного молочного скота (BSY). Каждая корова имеет специфический идентификационный номер, как представлено в каждой таблице.
Идентификация последовательностей и идентификаторы последовательностей
SEQ ID NO: 1 AGCKNFFWKTFTSC
SEQ ID NO 1a GCTGGCTGCAAGAATTTCTTCTGGAAGACTTTCACA TCCTGT
SEQ ID NO: 2 (Hisl92 → Gly, His 193 → Gly):



Подробное описание изобретения
Воплощения в соответствии с настоящим изобретением обеспечивают химерные полипептиды и конструкции нуклеиновых кислот, которые их кодируют, обладающие улучшенной иммуногенностью соматостатина. Воплощения данной заявки включают способы для получения химерного белка, а также способы применения химерного белка для повышения определенной продуктивности сельскохозяйственных животных, представляющих интерес, и, в частности, для повышения продукции молока у коров молочных пород и продукции мяса у крупного рогатого скота, свиней, овец, кролей, коз, телят и т.д.
Воплощения в соответствии с настоящим изобретением также включают новые адъюванты для применения с химерными белками в соответствии с изобретением для повышенной иммуногенности у животных, которые представляют интерес, повышенной безопасности для вакцинированных животных, которые представляют интерес, и улучшенной безопасности для потребителей животных, которые представляют интерес, то есть, потребителей вакцинированного животного или потребителей продукта, полученного от вакцинированного животного.
В одном аспекте изобретение обеспечивает химерный белок соматостатина, сконструированный для повышенной иммуногенности соматостатина. Химерный белок соматостатина воплощения включает аминокислотную последовательность соматостатина-14, связанную с помощью линкерной последовательности с существенно инактивированным укороченным белком хлорамфеникол ацетилтрансферазы (CAT). В некоторых случаях линкер (также в данной заявке упоминается как спейсер) является оптимизированным для улучшения продукции химерного полипептида в целевых хозяйских клетках. В других случая также обеспечиваются способы получения и изоляции таких повышенных количеств химерного белка в существенно свободном от эндотоксина состоянии.
В другом аспекте изобретение обеспечивает новые адъювантные композиции (которые не содержат каких-либо белков животного происхождения или химических агентов, подобных бензолу) и вакцины, которые содержат химерные белки соматостатина в соответствии с изобретением. Воплощения включают непредвиденно эффективные композиции адъювант/химерный белок соматостатина (типично существенно свободный от эндотоксина), то есть, новые вакцины, композиции для индукции антигенности у вакцинированных сельскохозяйственных животных, которые представляют интерес. В некоторых воплощениях представляющие интерес сельскохозяйственные животные представляют собой коров молочных пород, телят, свиней, коз и т.д. Следует отметить, что поскольку адъюванты в соответствии с настоящим изобретением являются описанными в комбинации с химерными белками соматостатина в соответствии с настоящей заявкой, предусматривается, что адъюванты в соответствии с настоящим изобретением могут использоваться с другими вакцинами у различных животных, которые представляют интерес, например, у людей, свиней, собак, котов и т.д.
В других аспектах обеспечиваются способы для вакцинации животных, которые представляют интерес, при использовании в виде нескольких или одной дозы новой вакцины для получения повышенной продуктивности и, в частности, повышенной продукции молока у коров молочных пород и других подобных сельскохозяйственных животных. Эти улучшенные процедуры дозирования (меньшее количество вакцинаций и более низкая концентрация химерного соматостатина) обеспечивают длительную эффективность и снижение затрат, которые при использовании в молочной промышленности представляют значительный прогресс в достижении производительности сельскохозяйственных животных. Кроме того, способы, описанные в данной заявке, позволяют избежать применения терапии на основе рекомбинантного гормона роста, что представляет собой задачу охрану здоровья, то есть, как по отношению к представляющим интерес сельскохозяйственным животным, так и к конечному потребителю и окружающей среды, где выделение рекомбинантного гормона роста осуществляется в грунтовые воды.
Определения
Следующие определения обеспечиваются для того, чтобы способствовать пониманию некоторых терминов, которые часто встречаются в данной заявке и не подразумеваются для ограничения объема настоящего раскрытия.
Термин "аминокислота" относится к любой из двадцати существующих в природе аминокислот, а также к любой модифицированной аминокислотной последовательности. Модификации включать природные процессы, такие, как посттрансляционный процессинг, или могут включать химические модификации, которые являются известными в области техники. Модификации включают, но без ограничения: фосфорилирование, убиквитинизацию, ацетилирование, амидирование, гликозилирование, ковалентное присоединение флавина, АДФ-рибозилирование, перекрестное связывание, иодирование, метилирование и тому подобное.
Термины "химерный полипептид" или "слитый белок" относятся к первому полипептиду, содержащему присоединенный второй, гетерологичный полипептид, так, что первый и второй полипептиды экспрессируются в рамке. Часто два полипептида могут быть соединенными с помощью линкерного или спейсерного сегмента для оптимизиции экспрессии и функции химерного(ых) полипептида(ов) в соответствии с изобретением.
Термин "эндотоксин" относится к токсинам, ассоциированным с клеточными стенками грамнегативных бактерий. В некоторых случаях токсины представляют собой липополисахаридные компоненты бактериальных мембран, компоненты внешней мембраны клеточной стенки грамнегативных бактерий.
Термин "хозяйская клетка" или "хозяйские клетки" относятся к клеткам, адаптированным к культуре ex vivo. Является характерным, что хозяйские клетки, которые обсуждаются в данной заявке, являются способными к экспрессии химерных белков в соответствии с изобретением. Примеры приемлемых хозяйских клеток, полезных в аспектах в соответствии с изобретением, включают, но без ограничения, клетки бактерий, дрожжей, насекомых и млекопитающих. Специфические примеры таких клеток включают SF9 клетки насекомых (Summers и Smith, 1987, Texas Agriculture Experiment Station Bulletin, стр.1555), клетки E.coli (BL21 (DE3), Novagen), дрожжи (Pichia pastoris, Invitrogen) и клетки печени человека (Нер G2 (АТСС НВ8065).
Термин "последовательность нуклеиновой кислоты" относится к порядку последовательности дезоксирибонуклеотидов в цепочке дезоксирибонуклеиновой кислоты. Порядок этих дезоксирибонуклеотидов определяет порядок аминокислот в полипептидной цепи. Последовательность дезоксирибонуклеотидов кодирует аминокислотную последовательность.
Термины "белок", пептид" и "полипептид" используются попеременно для обозначения аминокислотного полимера или набора двух или более взаимодействующих или связанных аминокислотных полимеров.
Термин "существенно" относится к "большой степени," например, существенно удаленный означает, что по крайней мере, 75%, более типично, по крайней мере, 80%, 85%, 90%, 95% и наиболее типично, 96%, 97%, 98%, 99% целевого материала является удаленным; существенно неактивный означает, что, по крайней мере, 75%, более типично, 80%, 85%, 90%, 95% и наиболее типично, 96% 97%, 98%, 99% фермента является инактивированным. Как таковой термин существенно неактивный CAT фермент представляет собой такой, который обладает 75%, 80%, 85%, 90%, 95% 96%, 97%, 98%, 99% или 100% удаленной активности. (CAT активность может быть определена при использовании известных функциональных анализов, например, связывания н-бутирил кофермента А с радиоактивно меченным хлорамфениколом и последующее измерение с помощью жидкостно-сцинтилляционного измерения активности (LCS); путем определения количества радиоактивной метки, перенесенной с14Сацетил СоА на хлорамфеникол с помощью тонкослойной хроматографии (смотри Molecular Cloning: A Laboratory Model, третье изд., J Sambrook и DW Russell, 2001. Cold Spring Harbor Press) или с помощью других известных или подобных им анализов).
Термин "вектор" используется в отношении молекул нуклеиновой кислоты, которые переносят сегмент(ы) ДНК с одной клетки на другую клетку. Термин "переносчик" иногда используется попеременно с термином "вектор". Два обычных вида векторов представляют собой плазмиды и вирусные векторы.
Соматостатин
Рядом исследований было показано, что животные, иммунизированные с помощью соматостатина, имеют среднее суточное увеличение массы, которое составляет 10-20%, снижение потребности организма в пище 9% и 11% увеличение эффективности усвоения пищи. Животные, иммунизированные с помощью соматостатина, и также их приплод, имеют правильные пропорции, а распределение веса животных между мышцами, костями и жиром является таким же, что и у контрольных животных (смотри Reichlin, 1987). Таким образом, иммунизация с помощью соматостатина обеспечивает полезный и безопасный путь повышения продуктивности животных. Это является особенно важным при сравнение с применением рекомбинантного гормона роста, использование которого поднимает проблему повышенного содержания гормона в молоке или мясе, полученном от обработанных животных, или безопасности для самих животных, или накопления гормона в экосистеме, в частности, водоснабжения с использованием грунтовых вод.
Соматостатин-14 представляет собой биологически активный тетрадекапептид, который вырабатывается гипоталамусом и желудочно-кишечным трактом. Аминокислотная последовательность тетрадекапептида является следующей:
AGCKNFFWKTFTSC (SEQ ID NO: 1). Последовательность соматостатина-14 является высококонсервативной среди млекопитающих (Lin XW и др. Evolution of neuroendocrine peptide systems: gonadotropin-releasing hormon and somatostatin. Comp Biochem Physiol С Pharmacol Toxicol Endocrinol. 1998 119(3): 375-88.) Тетрадекапептид кодируется последовательностью нуклеиновой кислоты GCTGGCTGCAAGAATTTCTTCTGGAAGACTTTCACATCCTGT (SEQ ID NO: 1a) (следует отметить, что могут использоваться другие последовательности нуклеиновой кислоты для кодирования SEQ ID NO: 1, однако, SEQ ID NO: 1a обеспечивается с целью иллюстрации).
Соматостатин-14 является известным как такой, который обладает сильным ингибиторным эффектом на большое количество гормонов, вовлеченных в рост и усвоение пищи у животных. Как было описано ранее в патенте США №6,316,004 (введен в данную заявку в качестве ссылки для всех целей), соматостатин-14 и химерные варианты соматостатина могут использоваться в иммунизации животных для повышения суточной прибавки веса, а там, где это является применимым, продукции молока. Такие процедуры иммунизации осуществляют с традиционными адъювантами и не применяют материалы на основе соматостатина в соответствии с изобретением. Следует отметить, что обработка животных, которые представляют интерес, с помощью антител к соматостатину зарекомендовала себя как излишне дорогая и функционально не эффективная, что, таким образом, исключило непосредственную обработку с помощью антител как непрактичную. Muromtsev G.S., и др., 1990, Basics of agricultural biotechnology, Agropromizdat, Moscow, стр.102-106. Один аспект в соответствии с настоящим изобретением основывается на идее, что антитела к соматостатину, сформированные при использовании композиции и способов, описанных в данной заявке, аттенуируют, но полностью не устраняют в основном ингибирующее действие соматостатина у животных, представляющих интерес. Этот процесс обеспечивает естественное и пропорциональное увеличение роста и продуктивности у иммунизированных животных, которые представляют интерес.
Как таковые аспекты в соответствии с настоящим изобретением способствуют иммунизации на основе соматостатина путем обеспечение высокоиммуногенных материалов для применения при иммунизации животных, которые представляют интерес. Такие соединения для иммунизации на основе соматостатина были оптимизированы для экспрессии и антигенности. В некоторых воплощениях соматостатин-14 экспрессируется в виде оптимизированного по кодонам химерного полипептида дефектная CAT - соматостатин. Эти материалы обеспечивают неожиданное улучшение по сравнению с другими вакцинами для иммунизации.
Новые оптимизированные по кодонам конструкции дефектная CAT - соматостатин
Один аспект в соответствии с изобретением обеспечивает изолированные молекулы нуклеиновой кислоты, которые кодируют химерные белки, обладающие оптимизированной иммуногенной активностью соматостатина. В частности, воплощения в соответствии с изобретением включают новые конструкции нуклеиновых кислот, которые кодируют CAT слитые белки, обладающие иммуногенной активностью по отношению к соматостатину. Такие полипептиды были идентифицированы для оптимальной функциональной активности в процедурах иммунизации.
В одном воплощении конструкция, которая схематически представлена на Фигуре 1, обеспечивается для кодирования химерных полипептидов в соответствии с изобретением. Конструкции нуклеиновых кислот в соответствии с изобретением в общем случае кодируют неактивный CAT фермент без 10 С-терминальных аминокислот и включают одну или две аминокислоты, заменяющие гистидин. Существенная инактивация CAT дает возможность устранить вредные реакции на CAT у инъецируемого животного, представляющего интерес (и, таким образом, устранить резистентность к CAT). Следует отметить, что хлорамфеникол представляет собой традиционно используемый антибиотик в животноводстве, и устойчивость к хлорамфениколу у крупного рогато скота будет вредной для безопасности вакцинированных животных при использовании материалов в соответствии с изобретением. Как таковые конструкции, содержащие инактивированную CAT, обладают иммуногенностью CAT при отсутствии вредных побочных эффектов развития устойчивости у вакцинированных животных (проблематичный вопрос безопасности для животных).
Фермент CAT подвергают инактивации путем удаления группы имидазола His193 (His195 в каноническом CATIII варианте, смотри Lewendon и др., ниже). В другом воплощении фермент CAT инактивируют путем удаления групп имидазола как His193, так и соседнего His192 (соответственно, His195 и His194 для CATIII). Удаление существенной для His193 (His195 в CATIII) группы имидазола из активного сайта CAT и замена его аланином, глицином или другими подобными аминокислотами приводит к существенной инактивации CAT фермента (Lewendon А и др. (1994). Replacement of catalytic histidine-195 of chloramphenocol acetyl transferase: evidence for a general base role for glutamate. Biochemistry. 33(7): 1944-50.). В заключение, воплощения данной заявки могут также включать инактивацию CAT фермента путем удаления только группы имидазола His192 (His 194 для САТ111). Что касается His193, то замена может осуществляться с помощью аланина, глицина и других подобных аминокислот. В некоторых аспектах одна или более замененных аминокислот гистидна кодируются нуклеиновыми кислотами, которые размещаются в положениях 574-576 и 577-579 последовательности SEQ ID NO: 2 (соответствует номерам аминокислот 192 и 193 в последовательности SEQ ID NO: 3). В некоторых воплощениях последовательности нуклеиновой кислоты в соответствии с изобретением включают SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 6. Химерные белки в соответствии с изобретением, которые включают конструкции с замещенным гистидином, описанные в данной заявке, обеспечивают высокоиммуногенные белки с небольшой или с отсутствующей CAT активностью, значительное усовершенствование по сравнению с существующим уровнем техники. Существенно инактивированный CAT фермент воплощения присоединяют к полипептиду соматостатина в соответствии с изобретением. Такое присоединение может осуществляться непосредственно или с помощью линкера (как более полно описано ниже).
Инактивация целевых сайтов (His192 и/или His193) может быть выполнена при использовании любого количества известных квалифицированному специалисту в данной области техники процедур, включая сайт-направленный мутагенез и соединение синтетических генов. В одном воплощении последовательность нуклеиновой кислоты, которая кодирует гистидин в положении 193, модифицируют для кодирования аланина, глицина или других подобных аминокислот. В другом воплощении последовательности нуклеиновой кислоты, которая кодирует гистидин в положении 192, модифицируют для кодирования аланина, глицина или других подобных аминокислот. Типичная комбинация замен для положений 192 и 193 химерного полипептидна включает: аланин, аланин; аланин, глицин; глицин, аланин; и глицин, глицин.
Воплощения в соответствии с настоящим изобретением также включают аминокислотные последовательности для дефектных по CAT полипептидов в соответствии с изобретением, включая аминокислотную последовательность, содержащую SEQ ID NO: 7, 8 и 3 (соответствует his → gly в положении 193, his → ala в положении 193, и his → gly в положениях 192 и 193).
Как показано на Фигуре 1, существенно неактивный фермент CAT может связываться с соматостатином-14 с помощью спейсера различной длины. Спейсер является необходимым для обеспечения презентации кодированного соматостатина на общей поверхности. Воплощения спейсера данной заявки обеспечивают для оптимальной резистентности к протеазам и для оптимальной демонстрации эпитопов, их включения в химерные полипептиды в соответствии с изобретением продемонстрировали неожиданное улучшение по сравнению с конструкциями, содержащими линкерную(ые) последовательность(и) настоящего изобретения.
Воплощения спейсера, таким образом, были оптимизированы по длине и составу для обеспечения экспрессии дефектной CAT - соматостатина в различных микроорганизмах, и, в частности, в Е.coli. Оригинальные конструкции, как описывается в патенте США №6,316,004, включают спейсер, содержащий редкие кодоны Е.coli, и требуют для коэкспрессии редких тРНК из второй или хелперной плазмиды. Воплощения спейсера, описанные в данной заявке, удаляют эти редкие кодоны Е.coli и, таким образом, удаляют необходимость во второй хелперной плазмиде, что представляет собой усовершенствование по сравнению с предыдущей технологией.
В типичном воплощении спейсер имеет последовательность нуклеиновой кислоты tgggaactgcaccgttctggtccacgcccgcgccctcgcccacgtccggaattcatg (SEQ ID NO: 9). Один пример спейсера в соответствии с изобретением имеет аминокислотную последовательность welhrsgprprprprpefm (SEQ ID NO: 10). Типичная аминокислотая последовательность для спейсера в соответствии с изобретением представляет собой welhrsgp(rp)nefm, где n>1 (SEQ ID NO: 11). Как отмечалось выше, такие новые спейсерные последовательности обеспечивают улучшенную резистентность к протеазам (тем самым позволяя повысить продукцию по сравнению с конструкциями, раскрытыми в патенте США №6,316,004), и обеспечивают оптимальное воздейстие соматостатина-14. Комбинация соматостатина-14, присоединенного к существенно инактивированному ферменту CAT (конструкции, замещенные гистидином) с помощью линкеров с оптимальной конфигурацией, которые демонстрируют неожиданное и удивительное усовершенствование по сравнению с другими традиционными материалами, при использовании для иммунизации животных, которые представляют интерес, с целью достижения улучшенной продуктивности.
Хотя и не такие, которые являются оптимальными по своей функции, но другие линкерные последовательности вариабельной длины могут использоваться для соединения соматостатина-14 с существенно инактивированным ферментом CAT. Кроме того, является очевидным, что непосредственное слияние соматостатина-14 с существенно инактивированным ферментом CAT может также использоваться в данной заявке и рассматривается как такое, которое входит в объем настоящего изобретения.
Векторы и хозяйские клетки
Настоящее изобретение также относится к векторам, включающим полинуклеотидные молекулы в соответствии с изобретением, а также к хозяйским клеткам, трансформированным с помощью таких векторов. Любая из полинуклеотидных молекул в соответствии с изобретением может присоединяться к вектору, который обычно включает селективный маркер и источник репликации, для размножения хозяина, который представляет интерес. Хозяйские клетки являются генетически сконструированными для включения этих векторов и, таким образом, экспрессируют полипептиды в соответствии с изобретением. В общем случае, векторы, описанные в данной заявке, включают полинуклеотидные молекулы в соответствии с изобретением, оперативно связанные с приемлемыми последовательностями для регуляции транскрипции или трансляции, такими, как те, что используются в микробных хозяйских клетках или вирусах. Примеры регуляторных последовательностей включают транскрипционные промоторы, операторы, или энхансеры, рибосомальные сайты связывания мРНК и приемлемые последовательности, которые контролируют транскрипцию и трансляцию. Нуклеотидные последовательности являются оперативно связанными, когда регуляторные последовательности, описанные в данной заявке, являются функционально связанными с полинуклеотидами, кодирующими химерные полипептиды в соответствии с изобретением.
Типичные векторы включают плазмиды, дрожжевые челночные векторы, бакуловирус, инактивированный аденовирус и подобные им. В одном воплощении вектор представляет собой модифицированную pET30b CatSom плазмиду (смотри Фигуру 1). Целевые хозяйские клетки для применения в данной заявке включают бактериального хозяина, например, Е.coli, дрожжи, SF-9 клетки насекомых, клетки млекопитающих, клетки растений и тому подобное.
В одном воплощении регуляторные последовательности включают Т71ас, CAT, Trp или Т5 промотор для экспрессии химерных полипептидов в соответствии с изобретением в Е.coli или других подобных бактериях. Такие регуляторные последовательности являются известными в области техники и используются при приемлемых и известных условиях.
В том случае, когда для экспрессии используются генерически модифицированные клетки зеленых растений, могут использоваться системы подобные тем, что разработаны Planet Biotechnology и другие.
Были сконструированы различные плазмиды в соответствии с изобретением для экспрессии химерных полипептидов в соответствии с изобретением при использовании целевых регуляторных последовательностей. Иллюстративные плазмиды могут включать Т71ас промотор (смотри Фигуру 1).
Хозяйские клетки для экспрессии целевых химерных полипептидов включают прокариот, дрожжи и клетки высших эукариотических организмов. Иллюстративные прокариотические хозяева включают бактерии родов Escherichia, Bacillus и Salmonella, а также родов Pseudomonas и Streptomyces. В типичном воплощении хозяйская клетка является таковой рода Escherichia и может представлять собой Escherichia coli (Е.coli). Как показано в примерах, приведенных ниже, конструкции в соответствии с изобретением обеспечивают оптимальную экспрессию соматостатина - дефектной CAT при различных условиях. Такие конструкции являются особенно эффективными для экспрессии в прокариотических хозяевах и, в частности, в бактериях рода Escherichia. Следует также отметить, что могут использоваться разнообразные растительные системы экспрессии в контексте настоящего изобретения, типично при использовании Agrobacterium tumefaciens.
Очистка свободных от эндотоксина слитых белков
Аспекты в соответствии с настоящим изобретением включают применение свободного от эндотоксина, оптимизированного по кодонам соматостатина, слитого с дефектной CAT для использования при вакцинации животных и, в частности, для вакцинации сельскохозяйственных животных, которых разводят в Соединенных Штатах. Свободные от эндотоксина материалы являются особенно важными для разведения и выращивания крупного рогатого скота и в Соединенных Штатах (смотри, например, Drackley, JK 2004. Physiological adaptations in transition dairy cows. стр.74-87 in Proc. Minnesota Dairy Herd Health Conf., St Paul, MN. University of Minnesota, St. Paul).
В одном воплощении химерные иммуногенные белки, включающие соматостатин, в соответствии с изобретением получают путем трансформации целевых клеток с помощью приемлемых содержащих соматостатин векторов. Как отмечалось выше, векторы для применения в данной заявке включают известные плазмидные и векторные системы, приемлемые для экспрессии в выбранных хозяйских клетках.
В одном аспекте в соответствии с изобретением химерные иммуногенные, содержащие соматостатин белки экспрессируются в целевых хозяйских клетках. Экспрессию химерного белка осуществляют при использовании целевой регуляторной последовательности. В некоторых аспектах химерные полипептиды были оптимизированы (в частности, в отношении спейсерной последовательности, раскрытой в данной заявке) для экспрессии в Е.coli.
Химерный белок может подвергаться очистке в соответствии с известными технологиями очистки белка, включая, например, лизис при использовании лизоцима, дифференциальное центрифугирование телец включения, хроматографии на молекулярных ситах и подобных им. Процедуры рефолдинга могут осуществляться в хлориде гуанидина и мочевине при щелочном значении рН, после чего осуществляют диализ и лиофилизацию.
В одном воплощении клетки Е.coli подвергают трансформации при использовании плазмиды, содержащей оптимизированный по кодонам CAT-дефектный соматостатин - pET30b CatSom; при этом pET30b CatSom содержит приемлемые для Е.coli основные регуляторные последовательности для экспрессии. В некоторых случаях осуществление ферментации этих клеток в объеме приблизительно 10 литров обеспечивает получение, по крайней мере, 500 грамм и в некоторых случаях 600 грамм общей биомассы, что дает выход, составляющий 4-6 грамм общего белка. С помощью окрашивания серебром и Кумасси голубым было показано, что вплоть до половины белка может представлять собой химерныйбелок (смотри Пример 2 и Фигуру 2).
В некоторых воплощениях, описанных в данной заявке, химерный белок в соответствии с изобретением очищают из трансформированных хозяйских клеток в существенно свободном от эндотоксина состоянии. Выявление того факта, что эндотоксин и, в частности, многократное воздействие эндотоксина, у некоторых животных и, в частности, у коров молочных пород, приводит к получению животных с существенной патологией (мастит и эндотоксиновый шок у выведенных и выращиваемых в Соединенных Штатах коров молочныхпород), представляло собой неожиданный и удивительный результат, полученный изобретателями в соответствии с настоящей заявкой.. Выявление этого факта привело к попытке удалить или снизить количество дозы эндотоксин или количество вакцинаций у коров молочных пород. Следует отметить, что этот основанный на эндотоксине эффект значительно меньше реализуется при разведении и выращивание молочных коров в России и других странах, поскольку молочный крупный рогатый скот имеет происхождение от различных пород коров. Holstein Association, 1 Holstein Place, Brattleboro, Vermont 05302-0808. Выявление этого у молочных коров в Соединенных Штатах является в общем случае противоположным ожиданию того, что если вакцина будет включать некоторое низкое количество эндотоксина, то это поможет максимально повысить иммунный ответ у животных, как это происходит в случает коров молочных пород при вакцинации соматостатином на рынках некоторых других европейских стран (смотри патент США №6,316,004).
Как таковые некоторые воплощения, описанные в данной заявке, являются направленными на получение существенно свободных от эндотоксина химерных белков для применения в вакцина, и, в частности, для применения в вакцинах, используемых в животноводстве и используемых в животноводстве в Соединенных Штатах. В некоторых воплощениях уровни эндотоксина находятся на уровне 1 ед. эндотоксина/мл или ниже, а в других воплощениях уровни эндотоксина являются существенно устраненными, то есть, химерные полипептиды в соответствии с изобретением являются существенно свободными от эндотоксина.
В одном воплощении извлеченный из лизированных хозяйских клеток IB многократно промывают при использовании промывочного раствора, свободного от эндотоксина, то есть, свободной от эндотоксина воды или раствора. Восстановленный IP осадок может подвергаться необязательному промыванию до тех пор, пока уровни эндотоксина не станут ниже значения приблизительно 1 ед. эндотоксина/мл (анализы эндотоксина можно осуществлять при использовании одного или более известных анализов, включая коммерчески доступные аналитические наборы от МР Biochemicals, Charles River, и т.п.). В некоторых воплощениях промывочный раствор является свободным от эндотоксина и включает один или более ингибитор(ов) протеолиза белка например, фенилметансульфонилфторид (PMSF), 4-(2-аминоэтил)-бензолсульфонилфторид (AEBSF), и т.п.В некоторых воплощениях промывочный раствор представляет собой забуференный фосфатом физиологический раствор (PBS), содержащий ингибиторно эффективные количества PMSF, AEBSF или комбинации PMSF и AEBSF.
В некоторых аспектах существенно свободные от эндотоксина образцы могут подвергаться обработке с помощью раствора для разворачивания белка со значением рН 12,5, который содержит мочевину, и подвергаться повторной сборке в растворе для сборки белка, имеющем сниженную молярность мочевины, с аргинином, глицерином и/или сахарозой. Концентрацию очищенного химерного белка подвергают модификации в интервале от 1 до 3 мг/мл и типично приблизительно от 1,4 до 1,8 мг/мл. В некоторых случаях существенно свободный от эндотоксина химерный белок обеспечивают для вакцинных композиций при концентрации приблизительно от 1,5 до 5 мг/2 мл дозы и более типично, от 2,0 до 3,5 мг/2 мл дозы.
Другие процедуры по удалению эндотоксина предполагаются как такие, которые входят в объем настоящего изобретения и могут включать, например, коммерчески доступные ионообменные колонки для удаления эндотоксина, гидрофобные колонки и т.п. (смотри, например, Mustang Е или G колонки (Millipore)).
Усиливающий иммунный ответ адъювант
Воплощения в соответствии с изобретением обеспечивают новые адъюванты для улучшенной индукции гуморального иммунитета. Эти адъюванты обеспечивают значительное повышение по сравнению с традиционными материалами для индукции гуморального иммунитета. Адъюванты, описанные в данной заявке, могут использоваться во многих вакцинах, но представлены в примерах в применении с полипептидами в соответствии с изобретением для вакцинации коров молочных пород, свиней или телят.
Является важным, что компоненты адъювантов, описанных в данной заявке, имеют не животное происхождение, устраняя, таким образом, потенциальную перекрестную контаминацию вакцинированных животных с потенциально загрязненными компонентами адъюванта. Например, воплощения, описанные в данной заявке, могут использовать Твин 80, не содержащий веществ животного происхождения. Это является особенно важным тогда, когда животное, представляющее интерес, представляет собой молочную корову, по причине беспокойства по поводу губкообразной энцефалопатии крупного рогатого скота (BSE) или других подобных заболеваний крупного рогатого скота. Следует отметить, что эти беспокойства являются в равной степени применимыми для лечения человека, где адъювант, имеющий не животное происхождение, обеспечивает значительное преимущество безопасности. Кроме того, воплощения адъюванта, описанные в данной заявке, являются свободными от бензола и других подобных канцерогенных соединений. Эти воплощения обеспечивают преимущество безопасности, которое является недоступным для большинства традиционных адъювантных соединений. Например, воплощения, описанные в данной заявке, могут использовать Carbopol® 974P или полициклическую кислоту, свободную от бензола.
В одном воплощении иммунологический адъювант включает эмульсию масло-вводе в комбинации с выбранными антигенами, смешанными в эмульсионном премиксе. Иллюстративные эмульсии масло-в-воде для применения в данной заявке включают комбинации минерального масла, Твин 80, Span 85 и целевые полимеры (свободная от бензола полиакриловая кислота). В некоторых случаях целевой полимер является выбранным из группы, состоящей из гомополимера Карбомера типа В. Типичные эмульсии масло-вода включают от приблизительно 8-10% минерального масла (об./об.), от 0,003 до 0,004% Твина 80 (об./об.), от 0,007 до 0,008 Span 85 (об./об.) и от 0,04 до 0,06% полимера (вес./об.).
Иллюстративные эмульсионные премиксы в соответствии с изобретением состоят из полимера с высоким молекулярным весом, поверхностно-активного агента и эмульгатора в приблизительно 50% масляно-водной основе. Полимеры с высоким молекулярным весом для применения в данной заявке включают акриловые кислоты, перекрестно связанные с аллиловыми этерами пентаэритритола. В некоторых случаях полимеры с высоким молекулярным весом имеют RVT вязкость Брукфильда от приблизительно 29000 до 40000, например, Карбопол® 974P (Noveon, Inc).
Способ получения оптимизированного иммунного ответа у коров молочных пород или других сельскохозяйственных животных, представляющих интерес
В соответствии с композициями и способами настоящего изобретения иммуногенные композиции, описанные в данной заявке (свободные от эндотоксина, оптимизированные по кодонам, САТ-дефектные конструкции соматостатина) объединяют с новыми адъювантами, как описано выше, для обеспечения вакцин в соответствии с изобретением. В одном воплощении свободные от эндотоксина, оптимизированные по кодонам, CAT дефектные конструкции соматостатина вводятся при общей дозе 2,98 мг/2 мл (где от 5% до 25% составляет адъювант (об./об.), более типично от 10% до 20% составляет адъювант и, наиболее типично, приблизительно 20% составляет адъювант). Следует отметить, что другие традиционные адъюванты также предполагаются в рамках настоящего изобретения и могут использоваться с оптимизированными по кодонам, САТ-дефектными конструкциями соматостатина в соответствии с изобретением, однако оптимальные результаты были показаны тогда, когда новые адъюванты, описанные в данной заявке, используются в таком диапазоне.
Задача новых конструкций соматостатина и адъюванта заключается в повышении продуктивности животных, представляющих интерес, типично, сельскохозяйственных животных и, более типично, коров молочных пород, телят, овец, свиней или коз.
Препарат вводится внутримышечно или подкожно, предпочтительно менее 12 раз, более предпочтительно менее 6 раз, и в некоторых случаях только один раз. Тогда, когда требуется более одной инъекции у животных, которые представляют интерес, интервал, составляющий от 14 до 28 дней перед следующей инъекцией является типичным. Как отмечалось выше, воплощения, описанные в данной заявке, дают возможность избежать применения обработки с помощью рекомбинантного гормона у животных, которые представляют интерес, основное преимущество в области животноводства (рекомбинантный гормон роста был ассоциирован с ранним наступлением половой зрелости у девочек и различными проблемами окружающей среды, связанные с тем, что органические удобрения от обработанного крупного рогатого скота могут неблагоприятным образом влиять как на поверхностную окружающую среду, так и на грунтовые воды).
Стерильные композиции в соответствии с изобретением могут вводиться с помощью подкожной или внутримышечной инъекции. Типичные сайты введения представляют собой шею или хвост животного, представляющего интерес, хотя могут использоваться и другие сайты. Следует отметить, что сайт должен использоваться так, чтобы побочные реакции не препятствовали способности животного двигаться, есть, пить и т.п.
Как отмечалось выше, вакцины, описанные в данной заявке, типично в свободном от эндотоксина состоянии, при использовании новых адъювантов, описанных в данной заявке, обеспечивают значительное повышение продукции мяса и молока у коров молочных пород, крупного рогатого скота, свиней и т.п. Однако такие обработки не сопровождаются повышением потребления корма.
ПРИМЕРЫ
Приведенные ниже примеры обеспечиваются только для иллюстративных целей и не предназначены для ограничения объема в соответствии с изобретением.
Пример 1: Конструирование слитого белка дефектный CAT - соматостатин
Данный пример иллюстрирует продукцию слитого белка CAT-дефектного соматостатина в соответствии с воплощениями настоящего изобретения. Осуществляли сайт-направленный мутагенез на плазмиде pET30b-Cat-Som для замены His192 и His193 остатками глицина (после модификации: Gly192 и Gly193). Инактивация His193 (и His192) остатков устраняла способность фермента CAT принимать протоны, обеспечивая, таким образом, полную инактивацию CAT.
Спейсер в той же плазмиде pET30b-Cat-Som (имеющей замену(ы) His) был оптимизирован по кодонам для экспрессии с помощью Е.coli при отсутствии совместно экспрессируемых молекул тРНК.
Модифицированная конструкция нуклеиновой кислоты CAT-дефектного соматостатиа является представленной как SEQ ID NO: 12. Последовательность слитого белка САТ-дефектного соматостатин является раскрытой как SEQ ID NO: 13, по сравнению с немодифицированным слитым белком САТ-соматостатин (SEQ ID NO: 14).
Пример 2: Слитый белок САТ-дефектного соматостатина может экспрессироваться на высоком уровне
Оптимизированную по кодонам конструкцию САТ-дефектного соматостатина, как описано в Примере 1, использовали для экспрессии слитого белка в клетках BL21(DE3). Трансформированные клетки выращивали в среде LB и индуцировали с помощью 0,4 мМ IPTG в течение приблизительно трех часов. Один миллилитр клеток из культуры с оптической плотностью OD 0,7 осаждали и нагревали при 70°С в течение 10 минут в 100 мкл SDS буфера для образцов. Образец объемом 40 мкл клеточного экстракта загружали на каждую дорожку SDS ПАГЭ.
Как показано на Фигуре 2, полоса 28 кДа, соответствующая предсказанному размеру оптимизированного по кодонам слитого белка САТ-дефектного соматостатина, была видимой в дорожках 1 (LB + IPTG, восстанавливающий) и 3 (LB + IPTG) после индукции с помощью IPTG. Никакой экспрессии не наблюдали в дорожках 2 (LB, восстанавливающий) и 4 (LB). Как и ожидалось, не было различия в размерах белка при осуществлении разгонки при стандартных условиях и восстанавливающих условиях.
Пример 3: Вакцина, содержащая свободный от эндотоксина, оптимизированный по кодонам САТ-дефектный оматостатин
Иллюстративная вакцина в соответствии с настоящим изобретением:
Пример 4: Свободные от эндотоксина химерные пептиды/адъюванты обеспечивают повышенную продукцию молока
Идентифицировали случайный пул коров молочных пород (Holstein Crosses - выведенные и выращенные в США), каждый из них состоял из коров через 31-65 дней после отела (третья - пятая лактация). Каждую корову подвергали анализу и определяли как такую, которая имеет оптимальное состояние здоровья, с помощью ветеринара.
Средний вес коров в исследовании составлял приблизительно от 1000 до 1200 фунтов. Шесть коров в периоде лактации обрабатывали 1,96 мг химерного белка/2 мл дозы в JH14. Альтернативно, 9 коров в периоде лактации обеспечивали при использовании традиционной обработки с помощью pBST. Изучение обработок и молочной продуктивности при исследовании молочной продуктивности осуществляли
в большом масштабе на молочном заводе.
Вакцинации проводили в день 0. Анти-SST сывороточные антитела и сывороточные уровни IGF-1 подвергали анализу в течение 4 недель. Молочную продуктивность и общее состояние здоровья животных определяли в соответствии с регулярным расписанием.
Шесть коров, которые были вакцинированы при использовании композиции в соответствии с изобретением, описанным в данной заявке, имели нормальный внешний вид, при отсутствии реакции на эндотоксин и отказа от приема корма. Все шесть коров имели позитивный серологический ответ на SST со средним значением титра 1:14. Молочная продуктивность шести коров, полученная при использовании только одной вакцинации (смотри Фиг.3А), продемонстрировала среднее значение выхода молока 23,7%.
Девять коров, обработанных при использовании традиционных инъекций pBST, в дни 0 и 14 продемонстрировали среднее значение молочной продуктивности 2% (смотри Фиг.3 В).
Данные этого примера показывают значительное повышение эффективности при использовании свободных от эндотоксина конструкций в комбинации с адъювантами в соответствии с изобретением у коров молочных пород. Эти результаты являются значительно улучшенными в отношении состояния здоровья и продуктивности животных по сравнению с коровами, которым дважды вводили pBST.
Пример 5: Свободные от эндотоксина химерные пептиды/адъюванты обеспечивают повышение мясной продуктивности у поросят подвергнутых обработке свиноматок
Идентифицировали случайный пул свиноматок приблизительно, по крайней мере, за 35-36 дней до опороса. Каждую свиноматку подвергали исследованию и определяли оптимальное состояние здоровья с помощью ветеринара. Беременных свиноматок подвергали иммунизации дважды при использовании вакцины в соответствии с изобретением (смотри Пример 3), один раз за 35-36 дней до родов и один раз за 8 дней до родов. Контрольную группу беременных свиноматок поддерживали с целью сравнения (при отсутствии вакцинации и при использовании вакцинации с помощью стерильного физиологического раствора).
Родившиеся поросята из вакцинированной группы будут иметь более высокую выживаемость и будут обладать большим средним размером. Повышение среднего размера поросят повышает процент выживаемости, поскольку большие поросята с меньшей вероятностью будут отталкиваться от молочной железы свиноматки. Подвергнутые обработке и контрольные поросята подвергались взвешиванию в день 21, день 30 и день 75. Вакцинации в соответствии с настоящим изобретением будут повышать дневную прибавку веса в среднем на 35% в течение периода времени 75 дней.
Важно отметить, что выживаемость поросят и вес увеличиваются при использовании вакцины в соответствии с настоящим изобретением при отсутствии рекомбинантного гормона роста. Это представляет собой значительное усовершенствование по сравнению с гормональной терапией.
Пример 6: Свободные от эндотоксина химерные пептиды/адъюванты обеспечивают повышенную продукцию мяса у подвергнутых обработке телят
Случайный пул телят в возрасте от одного до трех месяцев идентифицировали и подвергали обработке с помощью композиции в соответствии с изобретением. Повышение веса в течение периода времени примерно 10 месяцев подвергали мониторингу и сравнивали с контрольной группой, которую обрабатывали таким же образом, что и инъекционную группу, за исключением того, что в первом случае использовали инъекции в соответствии с изобретением. Каждого теленка подвергали исследованию и определяли на оптимальное состояние здоровья с помощью ветеринара в течение всего периода обработки.
Инъекции для группы вакцинации осуществляли в неделю 0, через 4 и 8 недель (три общие вакцинации). Вакцинации будут обеспечиваться подкожно или внутримышечно в область шеи при использовании 18-21 размера сс иголки. Также обеспечивали бустер-инъекции (4 бустер-инъекции, 3 бустер-инъекции или без бустер-инъекций). Вакцинные инъекции включали 2 мг/2 мл химерного полипептида. Химерный полипептид получали так, как описано в данной заявке, заменяя оба остатка гистидина в CAT аминокислотами глицина в соответствии с изобретением и при оптимизации линкера так, как описывается в SEQ ID NO: 3.
Каждого из вакцинированных и контрольных телят взвешивали, принимая во внимание исходный вес. Ожидается, что вакцинированные в соответствии с изобретением животные будут демонстрировать прибавку веса по сравнению с контрольными животными, которая составляет от 15 до 40%. Такое повышение среднего веса для подвергнутых обработке телят демонстрирует значительное преимущество по сравнению с отсутствием обработки.
Является важным отметить, что полученное от обработанных телят мясо не содержит рекомбинантного гормона роста.
Несмотря на то, что изобретение было специфически продемонстрировано и описано со ссылкой на ряд воплощений, специалисту в данной области техники будет понятным, что могут быть внесены изменения в форму и детали различных воплощений, раскрытых в данной заявке, при отсутствии отступления от духа и объема настоящего изобретения, и различные воплощения, раскрытые в данной заявке, не предназначены для того, чтобы служить ограничением пунктов формулы изобретения.
Реферат
Группа изобретений раскрывает химерные полипептиды, иммуногенные композиции на их основе, а также способы повышения продукции молока и постного мяса, включающие вакцинацию указанными пептидами. Химерные полипептиды обладают иммуногенностью соматостатина и включают аминокислотную последовательность соматостатина-14, связанную с существенно неактивным и укороченным полипептидом хлорамфеникол ацетилтрансферазы, где соматостатин-14 является связанным с неактивной хлорамфеникол ацетилтрансферазой с помощью спейсера. Данные пептиды обладают улучшенной иммуногенностью, что позволяет применять их в меньших дозах при лечении коров и сельскохозяйственных животных. 8 н. и 3 з.п. ф-лы, 4 ил., 6 пр.
Формула
вакцинацию коров молочных пород с помощью одной или более доз иммуногенной композиции, содержащей химерный полипептид по п.1;
и фармацевтически приемлемый адъювант в количестве, эффективном для
того, чтобы вызвать иммуногенный ответ, и
предоставление периода времени, по крайней мере, десять дней, в течение которых продукция молока коровами молочных пород будет повышаться по сравнению с продукцией молока теми же коровами при отсутствии вакцинации.
предоставление периода времени, по крайней мере, десять дней, в течение которых продукция молока коровами молочных пород будет повышаться по сравнению с продукцией молока теми же коровами при отсутствии вакцинации.
предоставление периода времени, по крайней мере, десять дней, в течение которых продукция постного мяса животным будет повышаться по сравнению с продукцией постного мяса теми же животными при отсутствии вакцинации.
предоставление периода времени, по крайней мере, десять дней, в течение которых продукция молока коровами молочных пород будет повышаться по сравнению с продукцией молока теми же коровами при отсутствии вакцинации.

Комментарии