Способ получения производных ароматических аминоспиртов или их фармакологически приемлемых солей - SU1535377A3
Код документа: SU1535377A3
Описание
Изобретение относится к способу получения новых произподных ароматических аминоспиртов общей формулы
Ч
АгСН2Ш-С-Яг 1 -С-Н3 ОН
где Аг выбран из группы, содержащей группу формул
которые могут быть замещены одним или двумя заместителями, содержащими вместе не более четырех атомов углерода и которые выбраны из группы, содержащей галоид, цианогруппу, С1-С3 апкил или С,-С3-алкоксил, каждый из которых может быть замещен гидрокси- или С,-С,-алкоксигруппой, галоидзамещенный С.,-Сг алкил или алкоксил, группу , где п - целое число О, 1 или 2, a Rj С С -алкил, который может быть замещен гидроксилом или С -Сг-алкоксигруппой, Аг может быть также замещен имидазолильной или морФолиногруппой;
R, - С,-С3-апкил замещенный окси- группой, или ее моноэтиловый или монометиловый эфир;
R7- С П-С .g-алкил, водород, оксиме тил, моноэтиловый или монометиловый эфир;
R3 - водород или метил;
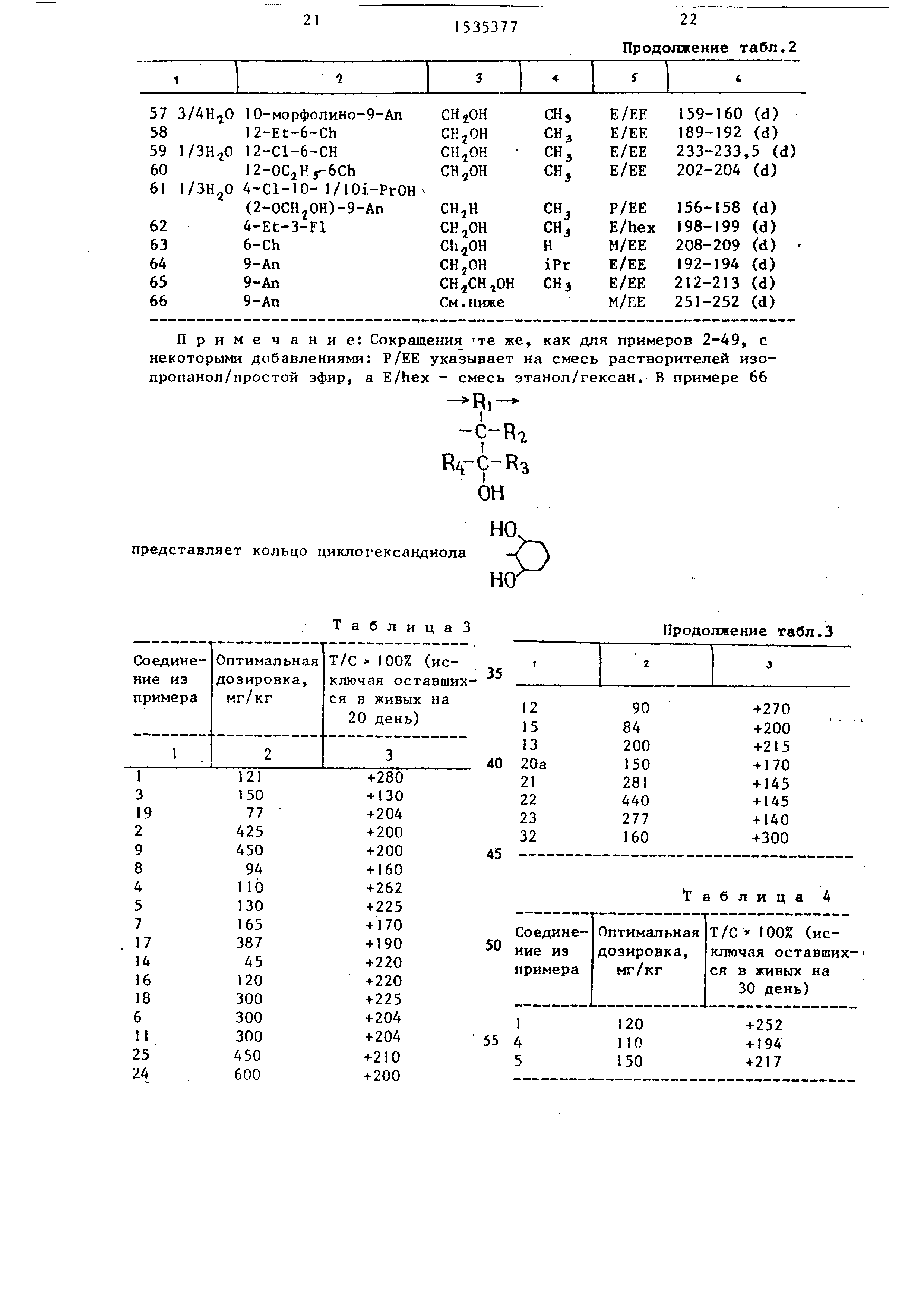
R ,, Р7, Р Зи R4, взятые вместе, содержат не более 5 атомов углерода, или группа
-C-R7
R rC-R3 он
может образовывать кольцо циклогексан- диола
0
5
или их фармакологически приемлемых солей.
Соединения формулы (Т) обладают биоцидной активностью по отношению к патогенным и опухолевым клеткам.
Целью изобретения является разработка способа получения новых производных ароматических аминоспиртов, обладающих противоопухолевой активностью - новый вид активности в этом ряду.
Пример 1 . 2- (6-Хризенилме- тил)амино -2-метил-1,3-пропандиол- хлоргидрат.
В колбу Эрленмейера емкостью 2 л добавляют 6-хризенкарбальдегид (21,2 г, 82,7 ммоль), 2-метил-2-ами- но-1,3-пропандиол, (9,13 г, 86,8 ммоль), пара-толуол(моно)суль- фокислоту, H-jO (0,5 г, 2,5 ммоль) и 500 мл толуола. Смесь нагревают до температуры кипения и поддерживают при этой температуре в течение нескольких минут, вода при этом испаряется (2-3 мл). Полученный в результате раствор золотистого цвета охлаждают до комнатной температуры, .разбавляют при помощи 500 мл абсолютного EtOH и перемешивают в течение ночи. В реакцию добавляют NaBH3CN (95%, 2,51 г, 42 ммоль). После его растворения добавляют индикатор (бромкрезольнуго зелень, 5 мг). В полученный в результате голубой раствор добавляют 5 капель 1 М раствора НС1 в абсолютном EtOH каждые 15 мин. Через три дня индикатор становится зеленым, потом желтым и в колбе появляется обильный белый осадок. Затем в колбу добавляют 10 мл 1 М раствора НС1 в абсолютном EtOH. Реакцию разбавляют в четыре раза абсолютным простым эфиром и перемешивают в течение 1 ч. Осадок за- 0 тем отделяют фильтрацией через воронку с пористой стеклянной пластинкой и отжимают до сухого состояния. Фильтровальную лепешку тщательно промывают мл 20Ј-ного раствора соля- 5 ноЛ кислоты, прессуют с целью сушки, а затем промывают 4 раза порциями по 500 мл СНгС1а, снова прессуют и сушат отсасыванием жидкости. Твердое веше5
ство растворяют в 1400 мл абсолютного EtOH. В смесь добавляют I мл 1 М раствора НС1 в абсолютном EtOH и 5 г Калгона (торговая марка), активированного древесного угля, смесь подвергают кипячению и фильтруют через подушку из Целита (торговая марка). Прозрачный желтый раствор концентрируют до объема 500 мл и разбавляют в 2 раза при помощи абсолютного
В результате последующей кристаллизации (2х) из смесей CH3OH EtlO (1)ЗП получают 18,07 г (57,2%) с температурой точки плавления 241-243°С (разложение) 2- (6-хризенилметип)амино J-2-метил- 1,3-пропандиолхлоргидра- та.
Примеры 2-49. Используя методы , аналогичные описанным в примере I, и используя соответствующий альдегид и аминоалканол в качестве исходных продуктов получают следующие соединения формулы (I) в форме их хлоргидратов (табл. 1).
П р и м е р 50. А. 2- (6-Хризенил- метил)амино -2-метил-1,3-пропандиол- метансульфонат.
В колбу емкостью 12 л с круглым дном, снабженную мешалкой, расположенную сверху, холодильником, термометром и ловушкой Дина-Старка добавляют хризен-6-карбальдегид (260 г, 1,01 моль), 2-апмно-2-метил-1,3- пропандиол (213 г, 2,03 моль), моногидрат пара-толуол(моно)сульфокисло- ты (20,8 г, 0,104 моль) и 3,8 л толуола . Смесь кипятят при перемешивании с удалением воды в течение 2 ч (или до тех пор, пока вода уже не будет собираться в ловушке). Затем смесь охлаждают до комнатной температуры и разбавляют при помощи 3,8 л абсолютного EtOH. Порциями в перемешиваемую смесь добавляют твердый бо- рогидрид натрия (46 г, 1,22 моль), при этом с использованием внешнего охлаждения температуру поддерживают на уровне 25-30°С. После того, как процедура добавления завершена, реакционную смесь перемешивают еще в течение 3 ч при комнатной температуре . Затем реакционную смесь концентрируют под вакуумом до объема 800 мл, поддерживая температуру колбы 40°С или ниже. Шлам разбавляют водой (6л) и охлаждают до 5°С.
Твердое вещество удаляют фильтрацией и промывают водой (2 1,5 л).
0
0
5
0
5
0
5
5
0
Затем твердое вещество суспендируют в смесь абсолютного этилового спирта или метилового спирта (2,5 л) н метан(моно)сульфокислоты (107,2 г, 1,12 моль). Полученный в результате раствор фильтруют и разбавляют при помощи 5 л толуола. После кристаллизации в течение ночи при комнатной температуре смесь охлаждают до температуры 5°С, которую поддерживают в течение I ч, а затем фильтруют. Твердое вещество промывают при помощи толуола (100 мл) и сушат, в результате чего получают 417 г (98%) 2-(6- хризенилметил)амино -2-метил-1,3-про- пандиолметансульфоната, температура плавления 239-240°С (разложение).
B.2- (6-Хризенилметил)амино -2- метил-1,3-пропандиол.
В энергично перемешиваемый раствор хлоргидрата 2- (6-хризенилметил) амино J-2-метил-1, 3- пропандиола из примера 1 (20 г, 52,36 ммоль)в смеси 5 СНЭОН (200 мл) и воды (800 мл) по каплям в течение 10 мин добавляют 1 М раствор NaOH (55 мл). Полученный в результате осадок выделяют фильтрацией и промывают теплой водой (4
500 мл), а затем (1 л), сушат отсасыванием и помещают в вакуумную печь, в которой его выдерживают в течение ночи. Было получено всего 17,43 г (96,4%) 2- (6-хризенилметил) амино -2-метил-1,3-пропандиола с температурой плавления 200-202 С.
C.2- (6-хризенилметил)аминоJ-2- метил-1,3-пропандиоллактат.
Смесь свободного основания 2- (6- хризенилметил)амино -2-метил-1,3-пропандиола (3,45 г, 10 ммоль) и молочной кислоты (1,04 г, 10 ммоль) в СН3ОН (500 мл) доводят до кипения и фильтруют через воронку с пористой стеклянной пластинкой. Растворитель удаляют с использованием роторного испарителя, в результате чего получают белое твердое вещество. Оно кристаллизуется (смесь CHjOH/Et O) 3 раза, в результате чего получают 1,84 г (42,2%) лактата 2- С(6-хризе- нилметил)амино -2-метил-1,3-пропандиола , температура плавления 163- 164°С.
D.2- (6-Хризенилметил)аминоJ-2- метил-1,3-пропандиолцитрат.
Смесь свободного основания 2- (6- хризенилметил)амино -2-метил-1,3-пропандиола (3,45 г, 10 ммоль) и лимон7153
ной кислоты (1,92 г, 100 ммоль), в (500 мл) нагревают до тех пор, пока она не растворится, затем смесь фильтруют через воронку с пористой стеклянной пластинкой. Далее растворитель удаляют, в результате чего получают неочищенный продукт - белое твердое вещество. Его доводят до кипения в абсолютном EtOH ( мл) и фильтруют, в результате чего получают белое твердое вещество. Затем его подвергают рекристаллизации 2 « «(смесь CHjOH/FtjO), Фильтруют и сушат в течение ночи в вакуумной печи, в результате чего получают 1,24 г цитрата 2- (6-хризенилметил)амино - 2-метил-1,3-пропандиола, температура плавления 146-151°С.
Е. Оксиэтансульфонат 2-(6-хризе- нилметил)амино -2-метил-1, 3-пропандиола .
Метансульфонат 2- (6-хризенилме- тил)амино -2-метил-1,3-пропандиола (10,0 г, 26,63 ммоль) нейтрализуют при помощи 1 н. раствора NaOH (30 мл) в смеси СН3ОН /вода 200/800 мл. Образующееся белое твердое вещество отделяют фильтрацией, промывают последовательно теплой водой ( мл), СН3ОН (200 мл) и Et70 ( мл), жидкость частично удаляют отсасыванием , а затем снова суспендируют в СН3ОН (500 мл). В суспензию добавляют 0,43 мл водного раствора 2-окси- этан(моно)сульфокислоты (30 мл).
При слабом нагревании получают раствор , который затем фильтруют, растворитель удаляют на роторном испарителе , в результате чего получают влаж ное белое твердое вещество. Его растирают с сухим , в результате чего получают 2-оксиэтансульфонат-2- Х6-хризенилметил) амино - 2-метил-1, 3- пропандиола.
Примеры 51-66. Используя методы, аналогичные описанным, получают следующие соединения формулы (I) в форме их солей метансульфоната (табл. 2).
П р и м е р 67. 2- (6-Хризенилме- тил)амино }-2-метил-1,3-пропандиол- диацетат.
Смесь хлоргидрата 2- (6-хризенил- метил) амино -2-метил-1,3-пропандиола (5,0 г, 13,1 ммоль) и ацётилхло- рида (5,0 мл, 70,3 ммоль) кипятят в сухом ТГФ (200 мл) в атмосфере азота
в течение 12 ч. Реакционную смесь сливают в насыщенный раствор NaHC03 (500 мл) и экстрагируют при помощи Et OAc ( мл). Слои Et OAc соединяют , сушат (КгС03) и фильтруют, в результате чего получают слегка желтую прозрачную жидкость. После выпаривания растворителя получают не совсем белое твердое вещество. Его ре- кристаллизутот из смеси толуол/гексан 1:1. После фильтрации и сушки получают 3,67 г (65,2%) 2-(6-хриэенилме- тил)амино -2-метил-1,3-пропандилди- ацетата, температура плавления 136- 137,5°С.
П р и м е р 68. Метансульфонат мезо-3-(6-хризенилметил)амино -2,4- пентандиола.
В колбу с круглым дном добавляют ацетат меэо-3-амино-3-метил-2,4-пен тадиола и равномолярное количество метилата натрия и СК3ОН (100 мл).После нагревания с тем, чтобы обеспечить растворение, растворитель удаляют на роторном испарителе, а после добавления хризен-6-карбальдегида реакция протекает в соответствии с процедурой восстановительного амини- рования, описанной в примере 50, в результате чего получают метансульфо- нат мезо-3- (6-хризенилметил)аминоJ- 2,4-пентандиола с температурой плавления 221-223°С (CF3OH/Et,0).
П р и м е р ы 69 и 70. t(3- Фторантенилметил) амино- 1-е/, 3-в(-цик- логександиолметансульфонат и 2-р- ((- хризонилметил)амино J-1 -с/, 3-о(-цикло- гександиолметансульфонат.
Используя процедуру из примера 50, соединение 42 превращают в его свободное основание. В результате добавления эквивалента метан(моно) сульфокислоты (99,5%) и последующей кристаллизации (смесь EtOH/Et70) получают 2-ft- (3-фторантенилметил)амино -1-ot , 3-о(-циклогександиол метан- сульфонат, температура плавления 214- 216°С (разложение), 2-р- (6-хризенил- метил) амино -1-«, 3-о(-циклогександи- олметансульфонат, температура плавления 280-281°С (разложение), получают из соответствующего хлоргидрата при помощи аналогичной процедуры.
П р и м е р 71. Метансульфонат (+2)-(2Rx, 3RS, 4RX)3-К6-хризенил- метил)амино -3-метил-2,5-пентандиола.
В колбу с круглым дном добавляют (l-)-(2Rx, 3RS, 4RX) З-амино-3-метил2 ,4-пентандиолацетат и равномолярное количество метилата натрия и СН3ОН (100 мл). Растворитель затем выпаривают на роторном испарителе, а после добавления хризен-6-карбальдегида продолжается реакция восстановительного аминирования, описанная в примере 1 , в результате чего получают
гида и (+-)(2R,,3R „)-2-амнно-2-метил- 1,3-бутандиолацетата получают () (2Rx,2Sy)-2- (3- фторантенилметнл- аминоJ-2-метил-1,3-бутандиолхлор- гидрат с температурой плавления 242- 243°С (разложение) (EtOH/EtjO).
П р и м е р 76. ()(2Rx,3Sx)-2- (6-хризенилметил)амино -2-метил-1,3










Реферат
Изобретение касается производных ароматических аминоспиртов, в частности получения соединений общей ф-лы AR-CH-NH-CR1R2-CR3R4-OH, где AR - а) @ , б) @ , в) @ , г) @ , д) @ , е) @ , которые могут быть моно- или дизамещены, содержать не более четырех атомов углерода и выбраны из группы, включающей галоид, CN, C1-C3-алкил, C1-C3-алкоксил (каждый из которых может быть замещен OH или C1-C2-алкоксигруппой), галоид-C1-C2-алкил (или алкоксил), S(O)NR5при N= 0-2 и R5-C1-C2-алкил, который может быть замещен OH или C1-C2-алкоксигруппой, AR может быть замещен имидазолильной или морфолиновой группой
R1-C1-C3-алкил, замещенный оксигруппой, или ее моноэтиловый или монометиловый эфир
R2-H, C1-C3-алкил, оксиметил, моноэтиловый или монометиловый эфир
R2-H, CH3
R4-H
R1-R4вместе содержат не более пяти атомов углерода или группа -CR1R2-CR3-OH R1-R4может представлять собой кольцо циклогександиола -CH-CH(OH)-(CH2)3-CH-OH, или их фармакологически приемлемых солей, обладающих биоцидной активностью к патогенным и опухолевым клеткам, что может быть использовано в медицине. Цель - создание новых веществ с активностью, не характерной для данного класса. Синтез ведут восстановлением
никола монджелли
фабио аниматиметноD oF pRoDUcING нYDRоснLоRIDеS oF DеRIVатIVеS oF DISтамINе аIт - италияIт - италия
Iт - италия
Iт - италияИзобре

Формула


Комментарии