Синтетический пептид hiv (варианты), иммуногенная композиция для индукции иммунного ответа против пептидов hiv, диагностический набор для определения hiv-специфичных антител - RU2201421C2
Код документа: RU2201421C2
Чертежи





















Описание
Рассматриваемая заявка является частичным продолжением патентной заявки США 08/073378, поданной 9 июня 1993 г.
Настоящее изобретение относится к области иммунологии и, в частности, относится к синтетическим пептидам, содержащим Т- и В-клеточные эпитопы протеинов вируса иммунодефицита человека.
AIDS является заболеванием, которое является конечным результатом инфицирования вирусом иммунодефицита человека (НIV).
В настоящее время не существует эффективной вакцины, которая могла бы защитить человечество от HIV инфекции, так что разработка эффективной HIV-вакцины совершенно необходима. Ранее, HIV-l частицы, полностью инактивированные за счет химической обработки, вакцинный вектор, кодирующий полный протеин оболочки (gр160) HIV-1, и очищенный рекомбинантный gр120 рассматривались как возможные HIV вакцины. Хотя инактивированные HIV-1 вирусные препараты и вызывают осуществляемую за счет Т-клеток замедленного типа реакцию гиперчувствительности (DTH) у человека, вакцина gр160 и gр120 (варианты рекомбинантных вакцин) индуцируют нейтрализующие вирус антитела, ни один из этих иммуногенов, как было показано, не представляет собой эффективной вакцины против HIV человека (ссылка 1 - см. литературные ссылки, перечисленные в конце описания).
Авторский интерес в HIV вакцинологии состоит в разработке синтетических HIV-1 пептидов для введения в вакцины и предполагает, что вакцинная HIV-1-рекомбинантная субъединица, используемая вместе с этими HIV-1 пептидными вакцинами, может привести к выработке более эффективных иммунных реакций против HIV-1. Для создания синтетических возможных HIV вакцин, иммуногенные вирусные В-клеточные нейтрализующие эпитопы (BE), содержащие высшей степени консервативную последовательность между вирусными изолятами, связывают с функциональной Т-хелперной клеточной детерминантой (детерминантами) (ТAD) для выработки сильной и длительной перекрестно-защитной реакции антител. Кроме того, HIV-специфические Т-лимфоцитные (СТL) эпитопы могут быть включены в синтетические конструкции для создания осуществляемого за счет клеток иммунитета к HIV инфекции.
Специфическая и преимущественная пространственная связь между некоторыми Т- и В-клеточными эпитопами может оказаться необходимой для тандемных эпитопов, для их эффективного процессинга и за счет этого придания им иммуногенности. Таким образом, важно идентифицировать соответствующие Т- и В-клеточные эпитопные последовательности HIV-1 протеинов и объединить их в оптимальной конфигурации, с тем, чтобы как Т-, так и В-клеточная память могла бы эффективно вызывать продуцирование антител нужной специфичности. Как было обнаружено, THD не универсальны и функционируют иммунологически только, если представлены в ассоциации с соответствующими основного комплекса гистосовместимости (МНС) класса 11 антигенами. Существует характеристическая иерархия Т-клеточного эпитопного доминирования. Поэтому для создания эффективной синтетической AIDS вакцины важно использовать наиболее эффективную ТНD различных HIV-1 gр160, gаg, pol и других генных продуктов. Последние исследования показали, что gаg генные продукты могут играть решающую роль в выработке иммунных реакций против HIV инфекции. Таким образом, клиническое развитие AIDS связано с уменьшением циркулирующих антител до gаg р24 протеина, и антитела, вырабатываемые против иммунодоминантного gаg р17 пептида, способны ингибировать HIV-1 инфекцию ин витро (ссылки 2, 3).
В нашей опубликованной международной патентной заявке WО 90/13564 описаны идентификация и характеризация Т-клеточного эпитопа ядерного протеина, р24Е HIV-1, и конструирование синтетических химерических пептидов, содержащих аминокислотную последовательность Т-клеточного эпитопа, связанную с аминокислотной последовательностью В-клеточного эпитопа оболочкового или ядерного протеина HIV-1. За счет связывания В-клеточных эпитопов с Т-клеточными эпитопами вызывается иммунная реакция на В-клеточные эпитопы, тогда как никакой реакции не наблюдается, если В-клеточный эпитоп не связан таким образом. Приведены данные в этой опубликованной заявке в отношении р24 Т-клеточного эпитопа, BE3 эпитопа, ENV эпитопа и V3A эпитопа, все они были получены из HIV-1/LAV изолята, с линкерной последовательностью между этими эпитопами или без нее.
Конкретные конструкции, которые тестированы в опубликованной WO заявке, являются ВЕ3 связанными с С-терминальным концом р24Е за счет прямого связывания, либо с N-терминальным концом р24Е, либо двумя пролиновыми остатками, либо за счет прямого связывания, ENV связанными с N-терминальным концом и связанными с С-терминальным концом р24Е в обоих случаях двумя пролиновыми остатками, и V3А связанными с N-терминальным концом р24 двумя пролиновыми остатками.
V3А последовательность, тестированную в публикации (остатки 308-327) вариабельной петли HIV-1 gр120 из HIV-1/А изолята, делают иммуногенной за счет связывания молекулы с N-концом р24Е без пролинового линкера.
Из патента США 4925784 (Crowl) известно получение за счет рекомбинации протеина слияния, содержащего аминокислоты 15-512 из gаg протеина и 44-140 из env протеина LAV изолята HIV-l /НTLV - 111/, то есть, полипептида или протеина, содержащего 1093 аминокислоты, значительно более длинного, нежели любой синтетический пептид, который не превышает 150 аминокислот в длину, а обычно бывает не более 50 аминокислот в длину. Такие крупные молекулы протеинов слияния описаны как пригодные для диагностических целей и материалов для вакцин.
Оболочковый гликопротеин (env) вируса иммунодефицита человека (HIV) сильно изменчив в независимых изолятах, а также в последовательных изолятах отдельного инфицированного индивидуума. Аминокислотная вариабельность в env сосредоточена в специфических вариабельных участках (в большинстве случаев в поверхностной части gр120, образующейся при протеолитическом вызревании исходного gp160 генного продукта), причем остальные участки менее вариабельны. Однако большинство вариабельных участков часто содержит нейтрализующие эпитопы, так что вирус частично ускользает от иммунной реакции хозяина и устанавливает стойкую инфекцию. Эта вариабельность составляет проблемы для диагностических методик, основанных на специфических взаимодействиях, в которых используют отдельные или смешанные реагенты, обычно используемые для тестирования образцов на наличие HIV-1. Такая вариабельность представляет также проблемы для любой возможной вакцины или иммунотерапии, так как любой подходящий агент должен вызывать реакцию на много штаммов HIV-1.
Таким образом, в выработке иммунной реакции хозяина на множество иммунологически различающихся HIV изолятов существуют две проблемы. Во-первых, любой конкретный хозяин в аутбридинговой популяции будет иметь конкретный HLA гаплотип и, таким образом, по-разному реагирует на конкретный Т-клеточный эпитоп. Во-вторых, антитела могут не распознавать или не нейтрализовать множество иммуногенически различных HIV изолятов и, в частности, тех HIV изолятов, которые были свежесобраны у пациентов как первичные полевые изоляты.
Было бы выгодным обеспечить для диагностических целей для выработки иммунологических реагентов, лечения и вакцинации против HIV, синтетические пептиды, содержащие Т-клеточные эпитопы, на которые большинство хозяев будет реагировать, и В-клеточные эпитопы протеина различных HIV изолятов, включая первичные полевые изоляты.
Настоящее изобретение относится к созданию синтетических пептидов, конкретно, синтетических HIV-1 пептидов, пригодных для создания иммунной реакции против инфицирования HIV или для определения HIV инфекции, где синтетические HIV-1 пептиды содержат Т-хелперную детерминанту (Т-клеточный эпитоп) HIV-1 ядерного протеина, в частности, р24Е аминокислотной последовательности GPKEPFRDYVDRFYK (последовательность ID 2), и аминокислотные последовательности, соответствующие В-клеточным эпитопам HIV-1 протеинов, а именно gр160, gаg и роl протеинов, вакцин против AIDS, содержащих, по крайней мере, один из таких синтетических HIV-1 пептидов, и композиций, процедур и диагностических наборов для детектирования HIV антигенов с использованием таких синтетических HIV-1 пептидов.
Под термином "синтетический пептид" в том смысле, как здесь использован, подразумевают соединение Т-клеточный эпитоп содержащей аминокислотной последовательности с В-клеточный эпитоп содержащей аминокислотной последовательностью для создания синтетической Т-В или В-Т конструкции, используя, например, процесс пептидного синтеза, такой, как описан в примере 1 далее.
Преимущественный HIV-1 штамм, обнаруженный в AIDS популяции Северной Америки и Западной Европы, принадлежит к HIV-1 (MN) изоляту. Поэтому, синтетическая HIV вакцина, способная обеспечить защиту против этого серотипа, может содержать р24Е и THD и нейтрализующие эпитопы HIV-1 (MN) протеинов в качестве В-клеточных эпитопов. Как было показано, два участка или эпитопных кластера во внеклеточной компоненте HIV-1 (МN) оболочкового протеина, gр120, вызывают нейтрализующие антитела против вируса. Один из этих участков является третьей гипервариабельной (V3) петлей, которая охватывает аминокислотные остатки 301-335 gp120 (МN) (ссылка 4). Штаммо- и группо-специфические моноклональные антитела, выделенные у индивидуумов, инфицированных МN изолятом, как было показано, распознают различные ядерные аминокислотные последовательности в "корончатом" участке V3 петли (ссылка 5).
Другой эпитопный кластер gpl20, который вызывает образование нейтрализующих антител, является СD4 связывающим сайтом. Исследования с моноклональными антителами, выделенными из HIV-1 инфицированных индивидуумов и шимпанзе, показали, что нейтрализующие эпитопы в CD4 связывающем сайте образованы несоприкасающимися аминокислотными остатками из множественных сайтов gр120.
Более того, результаты, полученные на этих двух типах нейтрализующих антител, показали, что ин витро нейтрализации данной дозы HIV-1 вируса можно достичь с гораздо более низкими концентрациями V3-специфических нейтрализующих моноклональных антител, нежели для реакции против СD4 связывающего сайта.
При конструировании синтетических пептидов настоящего изобретения, авторы химически синтезировали набор линейных синтетических HIV-1 (МN) пептидов (показано в таблице 1 далее - см. таблицы в конце описательного текста), содержащих различные фланкирующие последовательности, соседние с высоко консервативной последовательностью (GPGR - послед. ID 1) в "корончатом" участке V3 (MN) петли, связанные либо с амино (N-), либо с карбокси (С-) концами ТHD, р24Е (GРКЕРFRDYVDRFYK - послед. ID 2). Кроме того, авторы синтеризовали дополнительные наборы линейных синтетических пептидов (как показано в таблицах VI, VII, IX, Х и XI далее).
Кроме того, были синтезированы и исследованы пять тетрамерных пептидов, как представлено на фиг.1, в которых В-клеточный эпитоп содержащая последовательность была связана с С-концом р24Е, а именно, p24E-V3MN (MAP), содержащая линейную р24Е-V3MN последовательность; СLТВ-34 (MAP), содержащая линейную СLТВ-34 последовательность; CLТВ-36 (MAP), содержащая линейную CLTB-36 последовательность; CLTB-91 (MAP), содержащая линейную СLТВ-91 последовательность; и VP-T-B (MAP), содержащая линейную VP последовательность (см. фиг. 1), каждая VP последовательность, содержащая гибридную V3 последовательность остатков 307-316 и 315-325 HIV-1 (MN) и HIV-1 (BRU) изолятов, соответственно, связана с С-концом р24Е.
В соответствии с одним из аспектов настоящего изобретения предложен синтетический пептид, который содержит, по крайней мере, одну аминокислотную последовательность, содержащую Т-клеточный эпитоп gаg протеина изолята вируса иммунодефицита человека (HIV), связанная по ее N-концу или С-концу, с, по крайней мере, одной аминокислотной последовательностью, содержащей В-клеточный эпитоп V3 петли оболочкового протеина Н изолята, где, если расположены у указанного N-терминального конца, В-клеточный эпитоп содержащая последовательность и Т-клеточный эпитоп содержащая последовательность, связаны непосредственно. Такие синтетические пептиды являются новыми и не были раскрыты в вышеуказанной WO 90/13564.
В соответствии с другим аспектом настоящего изобретения предложен синтетический пептид, который содержит, по крайней мере, одну аминокислотную последовательность, содержащую Т-клеточный эпитоп gаg протеина изолята вируса иммунодефицита человека (HIV), связанную по ее N-концу или С-концу, с, по крайней мере, одной аминокислотной последовательностью, содержащей В-клеточиый эпитоп gр41 протеина HIV изолята, содержащего последовательность X1LKDWX2, где Х1 - Е, А, G или Q, а X2 - А или Т, в частности, ELKDWA (см. ссылку 10), или последовательность, которая способна вызывать образование HIV-специфической антисыворотки и распознавать последовательность X1LKDWX2. Такие синтетические пептиды являются новыми и не раскрыты в вышеуказанной WO 90/13564.
Следующий аспект изобретения предлагает синтетическую пептидную молекулу, содержащую множество индивидуальных химерических синтетических пептидов, связанных с образованием мультимерной молекулы, причем каждый из указанных индивидуальных синтетических пептидов содержит аминокислоту, содержащую Т-клеточный эпитоп gаg или оболочкового протеина изолята вируса иммунодефицита человека (HIV), связанную с аминокислотной последовательностью, содержащей В-клеточный эпитоп gаg или оболочкового протеина HIV изолята. Такие мультимерные молекулы являются новыми и не раскрыты в вышеуказанной WO 90/13564.
Далее настоящее изобретение включает антитела, специфические к любому из синтетических пептидов, предложенных здесь, и последовательности нуклеиновых кислот, кодирующие синтетический пептид, как он здесь предложен, причем последовательности нуклеиновых кислот могут быть включены в вектор экспрессии.
HIV изолят, к которому относится настоящее изобретение, обычно является HIV-1 изолятом. Аминокислотные последовательности синтетических пептидов, содержащих последовательности Т-клеточные к В-клеточные эпитопы содержащих последовательностей могут быть различными HIV-1 изолятами, включая LAV, BRU, МN, SF2, RF, PR1, 1714, 2054, НХВ2, Z6, ВХ08, 111В и SС. Можно также использовать консенсусные последовательности различных изолятов.
В том варианте изобретения, где аминокислотная последовательность, содержащая В-клеточный эпитоп, получена из V3 петли протеина, эта аминокислотная последовательность, предпочтительно, содержит последовательность GX1 GX2, где Х1 - Р или Z, а Х2 - R, К или Q, или последовательность, которая способна вызвать выработку HIV-специфической антисыворотки и распознавать последовательность GX1GX2, в частности, последовательность GPGR. Последовательность, содержащая В-клеточный эпитоп, может содержать содержащие В-клеточный эпитоп последовательности V3 петли из, по крайней мере, двух различных HIV-1 изолятов и может содержать консенсусные последовательности V3 петли из, по крайней мере, двух HIV-1 первичных изолятов.
В различных вариантах изобретения Т-клеточный эпитоп содержащая аминокислотная последовательность, предпочтительно, содержит последовательность р24 протеина, например, р24Е, P24N, Р24Z, Р24М и Р24Н, особенно Р24Е. Далее в таблицах I и IX приведены последовательности тех пептидов, которые высоко консервативны среди HIV-1 изолятов. Такие последовательности включают также часть, вариант или мутант любой из выбранных последовательностей, которая сохраняет Т-клеточные свойства выбранной последовательности.
Аминокислотная последовательность, содержащая В-клеточный эпитоп, может быть непосредственно соединена с С-терминальной аминокислотой аминокислотной последовательности, содержащей Т-клеточный эпитоп.
Последовательность, содержащую В-клеточный эпитоп, можно дополнительно связать с другой аминокислотной последовательностью, содержащей HIV Т-клеточный эпитоп, которая может быть последовательностью gаg или оболочкового протеина HIV. Последовательность, содержащую В-клеточный эпитоп, можно также связать с другой аминокислотной последовательностью, содержащей В-клеточный эпитоп HIV. В-клеточные эпитопы gp41 протеина и содержащую X1LKDWX2 последовательность можно соединить друг с другом или с аминокислотной последовательностью, содержащей В-клеточный эпитоп V3 петли.
Предложенные здесь миультимерные молекулы могут содержать множество идентичных индивидуальных химерических синтетических пептидов и, предпочтительно, содержат определенные ранее синтетические пептиды.
Далее в настоящем изобретении предложена иммуногенная композиция, содержащая иммуно-эффективное количество, по крайней мере, одного синтетического пептида, предложенного в соответствии с изобретением, или, по крайней мере, одну молекулу нуклеиновой кислоты, кодирующую любой из синтетических пептидов, и его фармацевтически приемлемый носитель. Кроме того, в настоящем изобретении предложен способ иммунизации хозяина, предпочтительно, человека, который включает введение пациенту иммуногенной композиции, как указано здесь.
Иммуногенная композиция может содержать большинство из синтетических пептидов, выбранных так, чтобы обеспечить иммунную реакцию на множество иммунологически-различных HIV-1 изолятов, и, предпочтительно, выбранных далее так, чтобы обеспечить иммунную реакцию у множества хозяев, по-разному реагирующих на любой конкретный Т-клеточиый эпитоп.
Наиболее подходящий "коктейль" из пептидов, пригодный для получения иммуногенной композиции, включает пептиды, идентифицированные как CTLB-36, CTLB-91 и ВХ08 в приводимых далее таблицах. Эта композиция может далее содержать пептид, идентифицированный как MPK-2, в таблице XI далее.
Иммуногенную композицию можно приготовить в виде, пригодном как для введения через слизистую, так и парэнтерального введения. Иммуногенная композиция может содержать далее, по крайней мере, один другой иммуногенный или иммуностимулирующий материал, в частности, адъювант, такой, как фосфат алюминия или гидроксид алюминия.
Настоящее изобретение распространяется также на диагностические
наборы, пригодные для детектирования HIV специфических антител в тестовом образце, причем набор содержит:
(а) поверхность,
(b) по крайней мере, один пептид, содержащий аминокислотную
последовательность, эпитопно специфическую для HIV-специфических антител, иммобилизованную на поверхности, которая предоставлена,
(с) средства для осуществления контакта антител и, по крайней
мере, одного иммобилизованного пептида с образованием комплекса, и
(d) средства для детектирования комплекса.
В другом аспекте изобретения предложен диагностический набор для
определения HIV антигена в тестовом образце, причем набор содержит:
(а) поверхность,
(b) антитело, эпитопно специфическое и перекрестно не реактивное для определенных эпитопов HIV
антигена, иммобилизованного на поверхности и выработанного против используемых пептидов,
(c) средства для осуществления контакта антител и HIV антигена с образованием комплекса, и
(d) средства для детектирования комплекса.
Фиг. 1 представляет структуру тетрамерных пептидов, которые способны вызвать реакции поликлональных антител у мышей и/или морских свинок против HIV-1.
На фиг.2 графически представлены реакции антител у морских свинок, иммунизованных неинфекционнными, нереплицируемыми HIV-1 (111В)-подобными частицами с последующим бустингом НIV-1 пептидным коктейлем, по способу изобретения.
Фиг. 3 представляет графически реакционную способность антисыворотки морских свинок, выработанной после примирования неинфекционными не-реплицируемыми HIV-1 (111B)-подобными частицами и повторной иммунизацией HIV-1 пептидным коктейлем, как представлено в одном варианте изобретения.
В одном из вариантов, настоящее изобретение включает пептиды, содержащие аминокислотную последовательность, соответствующую антигенным детерминантам V3 петли, связанную с N- или С-концами высоко консервативных Т-клеточных эпитопов, р24Е, HIV-1 ядерного протеина, Р24 (как представлено в таблице I). Эти пептиды могут содержать, например, последовательность


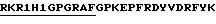



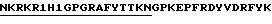

Эти пептиды способны вызывать реакции поликлональных HIV-специфических антител у мышей, морских свинок и обезьян (таблицы III и IV).
В другом варианте настоящее изобретение включает мультимерные молекулы, такие, как тетрамерные пептиды (как представлено на фиг. 1), способные вызывать реакции поликлональных антител против HIV-1 у мышей или морских свинок (таблица XIII). Эти мультмерные молекулы могут содержать, например, четыре линейные р24Е- V3MN последовательности (последовательность ID 9), тетрамеризованные с использованием технологии синтеза пептидов за счет лизинового разветвления, обозначенные р24Е-V3МN (МAР-мульти-антигенный пептид). Такие обработки могут также включать, например, четыре лизин-разветвленные СLТВ-34 последовательности (последовательность ID 6), обозначенные СLТВ-34 (MAP). Эти тетрамеры могут также содержать, например, четыре лизин-разветвленные СLТВ-36 последовательности (последовательность ID 3), обозначенные СLТВ-36 (MAP). Эти тетрамеры могут содержать также, например, четыре лизин-разветвленные СLТВ-91 последовательности (последовательность ID 20) и обозначен CLТВ-91 (MAP). Эти тетрамеры могут содержать также, например, четыре лизин-разветвленные VP-T-B линейные последовательности




Новые иммуногенные композиции настоящего изобретения содержат пептиды, содержащие иммуногенные Т- и В-клеточные эпитопы HIV, полученные как пептиды, которые связывают специфические антигенные детерминанты из их внеклеточного оболочкового домена, gр120, gр41 и ядерного протеина р24 HIV-1. Эти композиции пригодны для иммунизации для выработки HIV-специфических гуморальных иммунных реакций при введении млекопитающим, что продемонстрировано на мышах, морских свинках и обезьянах, как видно из данных, представленных далее в примерах.
Синтез пептидов
Для конструирования HIV иммуногена на основе синтетического пептида, синтезируют химически линейные
пептиды, содержащие последовательности из V3 петли и gр41, связанные либо с N-, либо с С-концами пептидов, содержащих Т-клеточные эпитопы, используя автоматизированный AB1 430A твердофазный пептидный
синтезатор, как описано в примере 1. Различные комбинации создают в адъюванте Фреунда (FA) или алюминийфосфате (alum) для сравнения их способности индуцировать HIV-специфические иммунные реакции у
млекопитающих.
Получают также пять мультимерных молекул, обозначенных p24EV3MN (MAP), CLTB-34-(MAP), СLТВ-36 (MAP), CLTB-91 (MAP) и Т-B-VР (MAP), образованных за счет тетрамеризации с использованием технологии пептидного синтеза с лизин-разветвлением соответствующих линейных тандемных эпитопов, т.е. p24E-V3MN, CLTB-34, CLTB-36, СLТВ-91 и VР-Т-В. Исследуют их способность вызывать HIV-специфические иммунные реакции у млекопитающих при введении в alum или FA.
Иммуногенность линейных HIV пептидов у млекопитающих
Способность линейных HIV пептидов вызывать
реакции антител у млекопитающих исследуют, иммунизуя мышей, морских свинок или обезьян индивидуальными пептидами, эмульгированными в FA или адсорбированными на alum. После четырех инъекций по 10 мкг
каждая (подкожные инъекции) реакции IgG антител определяют с помощью пептидоспецифического ЕIА и ин витро синцитин-блокирующего анализа (таблицы II, III, IV, V, XII).
Четыре различных V3 (МN) пептида, а именно, V3MN, СLТВ-29, СLТВ-55 и СLTВ-56, содержащие различные последовательности, фланкирующие "коронную" часть (GPGR) V3 (МN) петли, но не содержащие р24Е последовательности, оказываются либо вовсе неиммуногенными, либо слабо иммуногенными независимо от того, инъектируют их в FА или на алюминийфосфате (alum) (см. далее таблицу III). Функции носителя р24Е для повышения иммуногенности этих пептидов были показаны в исследованиях, проведенных с соответствующими синтетическими HIV-1 пептидами, содержащими Т-клеточный эпитоп и В-клеточный эпитоп. Так, синтетические HIV-1 пептиды в Т-В ориентации вызывают гораздо более сильные V3 (MN)-специфические реакции антител нежели соответствующие свободные V3 (МN) пептиды или В-Т двойники (см. таблицу III). Поэтому результаты этих исследований показывают, что ориентация V3 (МN) пептида по отношению к Р24Е влияет на иммуногенность синтетических HIV-1 пептидов настоящего изобретения. Сравнение соответствующих титров анти-V3 пептидных антител, определенных в мышиной и морских свинок антисыворотке, выработанной против индивидуальных синтетических HIV-1 пептидов, введенных либо в FА, либо на алюминийфосфате (alum), показывает, что CLTB-36 является наиболее иммуногенным пептидом как для мышей, так и для морских свинок (таблица III).
Иммуногенность СLТВ-36 была продемонстрирована далее по способности этого пептида (приготовленного в адъюванте ISA 51) вызывать сильную реакцию пептидо-специфических антител у приматов (таблица IV), причем эти антитела, как оказалось, нейтрализуют вирус. Замечательно, что как мышиная, так и морских свинок антисыворотка, выработанная против СLТВ-34 и СLТВ-36, оказались способны к перекрестной реакции против V3 пептидов различных HIV-1 серотипов (таблица V далее).
Новое применение р24Е и V3 последовательности для конструирования иммуногенных Т-В пептидов проиллюстрирована далее в исследованиях, проведенных с тремя другими химерическими пептидами, обозначенными р24Е-SР10(А), СLТВ-91, СLТВ-84 и TI-SР10(А)-МN (см. таблицу I). Результаты таблицы III далее показывают, что будучи введенными либо в FА, либо на alum, р24Е-SР10(А) последовательность которого


Пять других наборов HIV-1 синтетических пептидов были получены. В первом наборе пептидов, представленном в таблице IV (последовательность 1D 38-47), V3 последовательности двух различных США клинических HIV изолятов, 1714 (NTRKR1HMGPGRAFYATGD11G-последовательность ID 48), и 2054 (NTRKG1H1GPGRAFYTGE1VGD1RQ-последовательность ID 49), были связаны с С-концами р24Е и Т1 из р24Е-1714 и Т1-2054, соответственно. Кроме того, V3 консенсусная последовательность, PR1 (NTRKS1P1GPGRAFYTTG-последовательность ID 50) консенсусных изолятов из Нью-Йорка и Амстердама, была связана либо с р24Е, Т1 либо с Р24М с образованием, соответствующих Т-В пептидов CLTB-PR1, Т1-PR1 и p24M-PRl. Кроме того, три других Т-В пептида были сконструированы за счет связывания р24Е с V3 последовательностями LA1 (NTRKS1R1QRGPGRAFYTIG-последовательность ID 51), RF (NTRKS1TKGPGRV1YATGQ11G-последовательность ID 52) и гибридной V3 последовательностью МN и RF (NKRKR1H1GPGRV1YATGQ11G-последовательность ID 53) с образованием, соответственно, СLТВ-V3В, CLTB-V3RF и CLTB-HB конструкций.
Второй набор конструкций представлен в таблице VII (последовательности ID 54-68). Конкретные gр41 последовательности, использованные для их конструирования, содержат нейтрализующий эпитоп ELDKWA (последовательность ID 69), описанный в ссылке 6. Результаты, представленные в таблице VIII, показывают, что каждый из этих пептидов распознается нейтрализующим моноклональным антителом человека, 2F5 (ссылка 6).
В таблице IX представлен третий набор пептидов, который был сконструирован (последовательности ID 70-84). Эти конструкции включают использование СLТВ-56 последовательности для связывания либо N-, либо С-конца трех различных Т-клеточных эпитопов из gag, а именно Р24N (QMREPRGSD1AGTTSTL-последовательность ID 70), P24L (EEMMTACQGV GGPGHK-последовательность ID 73) и р24М (GHKARVLAEAMSQVТ-последовательность ID 30, 76) для образования В-Т или Т-В синтетических пептидов, соответственно. Кроме того, консенсусная последовательность, PRl (NTRKS1PlGPGRAFYTTG-последовательность ID 50, 80) изолятов из Нью-Йорка и Амстердама были также связаны либо с N-, либо с С-концом Т-клеточного эпитопа Р24Н (P1VQN1QGQMVHQA1- последовательность ID 79) или Т5 (VKYKVVK1EPLGVAP- последовательность ID 82) с образованием соответствующих В-Т или Т-В пептидов.
Четвертый набор пептидов представлен в таблице Х (последовательности ID 85-92). Были сконструированы пептиды СLТВ-102 и СLТВ-105, которые содержат гибридную последовательность gр41 (ELLELDKWASLWNWF-последовательность ID 93) и СLТВ-56, связанные с С- и N-концом Т-хелперного эпитопа, р24Е, соответственно. CLTB-103 и СLТВ-107 являются пептидами, содержащими СLТВ-56, и ту же gp41 последовательность, связанную с С- и N-концом Р24Е, соответственно. Для конструирования СLТВ-160 и СLТВ-161 были использованы V3 последовательности из консенсуса (LIP) изолятов Лондона, Индии и Парижа, V3 последовательность (THAI) Таиланда. Вирус HIV-1 и консенсус первичных изолятов, обнаруженных в Нью-Йорке и Амстердаме, были использованы для связывания с С-концом Т-клеточного эпитопа, Р24Е и Т1, соответственно.
Пятый набор сконструированных пептидов представлен в таблице XI (последовательности 94-97). Пептид МРК-1 содержит копию gр41 нейтрализующего эпитопа (ЕLDKWA-последовательность ID 98), связанную GPG-линкерной последовательностью по ее N- и С-концам с Т1 и р24Е Т-клеточными эпитопами, соответственно. Конструкция пептида, МРК-2, была такой же, как и у МРК-1, за исключением того, что ориентации Т1 и Р24Е были обратными. Конструкции МРК-3 и MРК-4 включают использование двух копий gр41 последовательности ЕLDКWAS для того, чтобы связать МРК-1 зa счет его N- или С-конца либо с Т-1 и р24Е, либо р24Е и Т1, соответственно.
Иммуногенность HIV-1 пептидного коктейля
Иммуногенность коктейля, содержащего пять пептидов настоящего
изобретения, оценивают на морских свинках (таблица II). Эти тандемные пептиды состоят из: CLTB-70, содержащего V3 последовательность HIV-1 (SF2) изолята, связанную с С-концом р24Е, CLTB-72,
содержащего 3 последовательность HIV-1 (111В), связанный с С-концом р24Е, СLТВ-74, содержащего V3 последовательность HIV-1 (RF), связанный с С-концом р24Е; CLТВ-76, содержащего V3 последовательность
HIV-1 (6), связанную с С-концом р24 и р24Е-GP41C, содержащим gр41 последовательность HIV-1 (BRU), связанную с С-концом р24Е. Результаты, представленные в таблице II, показывают, что животные,
иммунизованные коктейлем, приготовленным в FA или alum, демонстрируют сильные реакции антител против каждого из пяти тандемных пептидов.
Поэтому вышеуказанные результаты демонстрируют способность пептидного коктейля (если он адсорбирован на alum) вызывать сильные реакции антител против V3 петель четырех различных HIV-1 изолятов (SF2, 111В, RF и Z6) и gр41 последовательности HIV-1 (BRU).
Исследовали также схему иммунизации с использованием другого коктейля HIV-1 пептидов, состоящего из СLТВ-36, СLТВ-91, СLТВ-84 (представлены в таблице I) и СLТВ-70 (представлен в таблице II) и HIV-1 само-собранной, не реплицируемой, не инфекционной HIV-1 подобной частицы (как указано в WO 91/058564, опубликованной 2 мая 1991). Результаты, представленные на фиг.2, показывают, что морские свинки, предварительно иммунизованные HIV-подобными частицами, эмульгированными в неполном адъюванте Фреунда, и бустер-иммунизованные коктейлем, адсорбированным на alum, вызывают сильные реакции антител против СLТB-56 пептидов. Титр нейтрализующей вирус антисыворотки против МN изолята с последующей второй бустерной инъекцией коклейлем составляет 1,091. Весьма значительно, что результаты, представленные на фиг.3, демонстрируют далее, что антисыворотка, собранная у животных после второй бустерной инъекции пептидным коктейлем, демонстрирует сильную перекрестную реактивность против пептидов, содержащих V3 последовательности нескольких выращенных в лаборатории вирусов и первичных клинических изолятов.
Другие пептидные коктейли могут содержать иммуноэффективное количество любого из раскрытых пептидов, включая синтетический пептид, который содержит, по крайней мере, одну аминокислотную последовательность, содержащую Т-клеточный эпитоп gаg протеина изолята вируса иммунодефицита (HIV) человека, связанный по своему N-концу или С-концу с, по крайней мере, одной аминокислотной последовательностью, содержащей В-клеточный эпитоп gр41 протеина HIV изолята, содержащего последовательность X1LKDWX2, где Х1 представляет Е, А, G или Q, а Х2 представляет А или Т или последовательность, способную вызвать выработку HIV-специфической антисыворотки и распознать последовательность Х1LKDWX2 и, в частности, пептид МРК-2 (последовательность ID 95, таблица XI).
Функциональную активность антисыворотки, выработанной против синтетических HIV-1 пептидов, исследуют, тестируют их способность ингибировать образование синцитий, индуцируемую гомологичным HIV-1 (МN) изолятом. Мышиная антисыворотка после иммунизации четырьмя V3 (MN) пептидами, содержащими только В-клеточный эпитоп содержащие последовательности, а именно V3MN, СLTВ-29, СLТВ-55 и СLТВ-56, введенные либо в FA, либо в алюминийфосфате (alum), лишена синцитий-блокирующей активности (см. таблицу XII далее). Антисыворотка морских свинок, выработанная против СLТВ-56, приготовленном в FA, но не в алюминийфосфате (alum), как было обнаружено, ингибирует более 90% синцитий ингибиторной активности при разбавлении 1 в 10. Мышиная и морских свинок антисыворотка, выработанная против В-Т тандемных синтетических пептидов, а именно, V3М-р24Е, CLTB-32 и СLТВ-35, либо в FA, либо в alum, которая демонстрирует низкие титры антител, реактивных против соответствующих В-клеточные эпитопы содержащих пептидов, а именно, V3МN, СLТВ-29 и СLТВ-55, как было обнаружено, не обладает синцитий-блокирующей активностью. Однако антисыворотка морских свинок, выработанная против СLТВ-37, введенных в FА или алюминийфосфате (alum), которая демонстрирует титр СLTВ-56-специфических антител 1 в 1250 и 1 в 450, соответственно, причем в общих случаях как было обнаружено, имеет синцитий-ингибирующие титры 1 в 10. Результаты функциональных исследований, проведенные с антисывороткой, выработанной против иммуногенных Т-В синтетических пептидов, выявили, что как мышиная, так и морских свинок антисыворотка, выработанная против Т-В синтетического пептида, СLТВ-36, как в FA, так и в алюминийфосфате (alum), сильно ингибирует образование синцитий, индуцируемое гомологичным (МN) вирусом. Кроме того, антисыворотка, выработанная против СLТВ-36, подготовленного в ISА 51, в cynomolgus обезьянах, так же, как было обнаружено, дает хорошие нейтрализующие титры (278 и 430 у двух животных) против MN изолята (см. таблицу IV). Антисыворотка мышей и морских свинок, выработанная против р24Е и СLТВ-34 в FА, содержащая более высокие титры V3MN- и СLТВ-55-специфических антител, нежели соответствующая антисыворотка, выработанная против пептида в alum, так же, как было обнаружено, обладает хорошей синцитий-блокирующей активностью. Оказалось также, что виды животных, использованные для иммунизации, влияют на продуцирование V3-(MN)-специфических функциональных антител. Этот эффект иллюстрируется, например, тем фактом, что хотя Т-В тандемный синтетический пептид СLТВ-28 в FA индуцирует тот же титр анти-СLТВ-29 антител у мышей и морских свинок, только лишь антисыворотка, выработанная у последних, имеет высокий титр синцитий-ингибирующей активности.
Иммуногенность мультимерных
молекул у млекопитающих
Способность мультимерных молекул СLТВ-36 (MAP), CLTB-91 (MAP), СLTВ-34 (MAP), p24E-V3MN (MAP) и VР-ТВ (МАР) (в их соответствующих конфигурациях, представленных на
фиг.1) вызывать реакции антител у млекопитающих исследуют, иммунизуя мышей и морских свинок молекулами, эмульгированными в FA или alum. После четырех доз (каждая по 100 мкг) реакции IgG-антител
определяют с помощью пептидо-специфического EL1SA и с помощью ин витро анализа блокирования синтиций.
Результаты исследований иммуногенности, осуществленные с мультимерными молекулами на мышах и морских свинках, приведены в таблице ХIII далее. Высокие титры CLТВ-56-специфических пептидных антител были выработаны как у мышей, так и у морских свинок, иммунизованных тетрамером СLTВ-36 (MAP) как в FА, так и в alum. СLТВ-91 (MAP), приготовленный либо в FA, либо в alum, аналогичным образом индуцирует высокие титры СLТВ-56-специфических антител у этих животных. Тетрамерный Т-В тандемный синтетический пептид СLТВ-34 (MAP), Р24Е-V3MN (MAP) или VPТВ (MAP), введенные в FA, также способны вызывать выработку высоких титров соответствующих СLТВ-55, V3МN и VР-специфических антител у морских свинок. Антисыворотки мышей и морских свинок, выработанные против СLТВ-36 (MAP), как в FА, так и в alum, сильно ингибируют образование синцитий, индуцированное HIV-1 (МN) вирусом (таблица ХIV далее). Антисыворотка морских свинок, выработанная против разветвленных пептидов СLTВ-34 (MAP) и VР-Т-В (MAP) в FA, аналогичным образом проявляет эффективную активность по блокированию синцитий.
Специалистам совершенно очевидно, что различные варианты настоящего изобретения имеют множество применений в областях вакцинации, диагностики, лечения HIV инфекций и в создании иммунологических реагентов. Далее представлены нелимитирующие обсуждения таких применений.
Получение и использование вакцин
Было показано, что пептиды настоящего
изобретения могут вызывать иммунные реакции. Одно из возможных применений таких молекул стоит поэтому в основе потенциальных вакцин против AIDS и состояний, связанных с AIDS. В другом аспекте в
настоящем изобретении предложена вакцина против AIDS и состояний, связанных с AIDS, содержащая молекулы в соответствии с настоящим изобретением.
Иммуногенные композиции, которые можно использовать в качестве вакцин, можно получить из иммуногенных пептидов, как здесь обсуждается. Иммуногенная композиция вызывает иммунную реакцию, которая приводит к образованию антител, которые являются опсонизирующими или антивирусными. Если вакцинированный субъект заражается HIV, антитела связывают вирус и, тем самым, его инактивируют.
Вакцины, содержащие пептиды, обычно хорошо известны специалистам, что раскрыто в патентах США 4601903, 4599231, 4599230 и 4596792. Вакцины могут быть приготовлены в виде жидких растворов или эмульсий для инъекций. Пептиды могут быть смешаны с фармацевтически приемлемыми эксципиентами, которые совместимы с пептидами. Эксципиенты могут включать воду, физиологический раствор, декстрозу, глицерин, этанол и их сочетания. Вакцины могут содержать далее такие вспомогательные вещества, как смачивающие или эмульгирующие агенты, или адъюванты для повышения эффективности вакцин. Способы достижения адъювантного эффекта для вакцин включают использование таких агентов, как гидроксид или фосфат алюминия (alum), обычно используемые как 0,05-0,1% раствор в буферированном фосфатом физиологическом растворе. Растворы можно вводить парэнтерально, за счет подкожных или внутримышечных инъекций. В другом варианте другие способы введения включают суппозитории и оральные формы, в зависимости от необходимости. Для суппозиториев связующие и носители могут включать, например, полиалкиленгликоли или триглицериды. Композиции для орального введения могут включать обычно используемые эксципиенты, такие, как, например, сахарин, целлюлоза и карбонат магния фармацевтической степени чистоты. Эти композиции имеют форму растворов, суспензий, таблеток, пилюль, капсул, композиций с замедленным выделением, или порошков, и содержат от 10 до 95% пептидов.
Вакцины вводят способом, который согласуется с дозированной формой, и в таком количестве, которое является терапевтически эффективным, защитным и иммуногенным.
Необходимое для введения количество зависит от конкретного субъекта и включает, например, способность иммунной системы индивидуума синтезировать антитела и осуществлять клеточную иммунную реакцию. Точное количество активного ингредиента, необходимое для введения, зависит от суждений практикующего врача. Однако подходящие интервалы доз легко может определить специалист, и они могут быть порядка микрограммов пептида. Подходящие схемы для первоначального введения и бустерных доз также могут меняться, но могут включать первоначальное введение с последующими введениями, например, по крайней мере, одну пре-пептидную иммунизацию само-собранными неинфекционными, нереплицирующимися HIV-подобными частицами, такими, как описаны в WO 91/058564, с последующей, по крайней мере, одной вторичной иммунизацией предложенными здесь пептидами.
Дозы вакцин могут также зависеть от способа введения, а также могут меняться в зависимости от веса хозяина.
Молекулы нуклеиновой кислоты, кодирующие пептиды настоящего изобретения, также могут быть использованы непосредственно для иммунизации за счет введения непосредственно молекул нуклеиновой кислоты, например, с помощью инъекций, или за счет конструирования вначале живого вектора, такого, как Salmonella, BCG, аденовирус, поксвирус, вакцина или полиовирус, и введения вектора. Обсуждение некоторых живых векторов, которые были использованы для введения с ними гетерологичных антигенов, в иммунную систему, обсуждаются, например, с О'Наgаn 1992 (ссылка 10). Способы непосредственных инъекций ДНК в тестовые субъекты для генетической иммунизации описаны, например, Ulmer 1993 (ссылка 11).
Использование пептидов, предложенных здесь, ин виво может потребовать их модификации, так как сами пептиды могут обладать недостаточным сроком полу-распада в сыворотке и/или тканях. Для этой цели молекулу настоящего изобретения можно необязательно связать с молекулой носителя, возможно за счет химических групп аминокислот консервативной последовательности или за счет дополнительных аминокислот, добавляемых к N- или С-концам. Известны множество подходящих, связей, например, использование боковых цепей Туг остатков. Подходящие носители включают, например, гемоцианин лимфы улитки (КZН), сывороточный альбумин, очищенные производные протеина или туберкулин (РРД), яичный альбумин, непротеиновые носители и многие другие.
В дополнение, может оказаться выгодным модифицировать пептиды для того, чтобы придать им конформационные ограничения. Это может оказаться полезным, например, для имитации встречающихся в природе конформаций пептида в контексте нативного протеина для оптимизации эффекторных иммунных реакций, которые вызываются. Модифицированные пептиды здесь называют "аналоговыми" пептидами. Термин "аналог" распространяется на любые функциональные и/или структурные эквиваленты пептида, характеризуемые повышенной стабильностью и/или эффективностью ин виво или ин витро по отношению к практике настоящего изобретения. Термин "аналог" используют здесь также для распространения на любое аминокислотное производное пептидов, как здесь указано.
Аналоги пептидов, о которых здесь идет речь, включают (но не ограничиваются ими) модификации по боковым цепям, и включения неприродных аминокислот и/или их производных, не аминокислотных мономеров и сшивающих линкеров. Возможны также и другие способы, введения конформационных ограничений для пептидов или их аналогов.
Следует учитывать, что пептиды
настоящего изобретения можно модифицировать множеством различных способов, без заметного изменения их функционально важного иммуногенного поведения. Возможные модификации пептидных последовательностей
могут включать следующие:
Одну или более из индивидуальных аминокислот можно заменить на аминокислоты, которые обладают сравнимыми или аналогичными свойствами, например:
V можно
заменить на I,
Т можно заменить на S,
К можно заменить на R и
L можно заменить на I, V или М.
Одну или более из аминокислот пептидов изобретения можно заменить на "ретро-инверсо" аминокислоту, то есть, бифункциональный амин с функциональной группой, соответствующей аминокислоте, как раскрыто в WO 91/13909.
Одну или более из аминокислот можно удалить.
Вместо самих пептидов можно использовать структурные аналоги, имитирующие трехмерную структуру пептида.
Примеры модификации боковых цепей, охватываемые настоящим изобретением, включают модификации аминогрупп, например, за счет восстановительного алкилирования в результате взаимодействия с альдегидом с последующим восстановлением NaBH4, амидирование за счет метилацетимидата, ацилирование уксусным ангидридом, карбамоилирование аминогрупп цианатом, три-нитробензилирование аминогрупп 2,4,6-тринитробензолсульфоновой кислотой (TNB), ацилирование аминогрупп янтарным ангидридом и тетрагидрофталевым ангидридом и пиридоксилирование лизина пиридоксал-5'-фосфатом с последующим восстановлением NaBH4.
Гуанидино группы остатков аргинина можно модифицировать за счет образования продуктов гетероциклической конденсации с такими реагентами, как 2,3-бутандион, фенилглиоксаль и глиоксаль.
Карбоксигруппу можно модифицировать карбодиимидной активацией за счет образования О-ацилизомочевины с последующим получением производного, например, соответствующего амида.
Сульфогидрильные группы можно модифицировать такими способами, как карбоксиметилирование иодоуксусной кислотой или иодоацетамидом, окисление пермуравьиной кислотой до цистеиновой кислоты, образование смешанных дисульфидов с другими тиольными соединениями, реакции с малеимидом, малеиновым ангидридом или другими замещенными малеимидами, образование производных ртути за счет использования хлормеркурбензоата, 4-хлормеркурфенилсульфоновой кислоты, фенилмиркурий хлорида, 2-хлор-меркурис-4-нитрофенола и других соединений ртути, и карбамоилирование цианатом при щелочных значениях рН.
Триптофановые остатки можно модифицировать, например, окислением N-бромсукцинимидом или за счет алкилирования индольного кольца 2-гидрокси-5-нитробензилбромидом или сульфонилгалидами.
С другой стороны, тирозиновые остатки можно изменить за счет нитрирования тетранитрометаном до получения 3-нитротирозинового производного. Модификацию имидазольного кольца гистидинового остатка можно осуществить за счет алкилирования производными иодоуксусной кислоты или N-карбэтоксилирования за счет диэтилпирокарбоната.
Примеры включения неприродных аминокислот и производных в процессе синтеза пептидов включают (но не ограничиваются) использование норлейцина, 4-аминомасляной кислоты, 4-амино-3-гидрокси-5-фенилпентановой кислоты, 6-аминогексановой кислоты, трет.-бутилглицина, норвалина, фенилглицина, орнитина, саркозина, 4-амино-3-гидрокси-6-метилгептановой кислоты, 2-тиенилаланина и/или Д-изомеров аминокислот.
Можно использовать перекрестные линкеры, например, для стабилизации трехмерных конформаций, используя гомо-бифункциональные перекрестные линкеры, такие, как бифункциональные сложные имидоэфиры, содержащие (СН2 )n пространственные группы с n=1-6, глутаральдегид, сложные эфиры N-гидроксисукцинимида и гетеро-бифункциональные реагенты, которые обычно содержат амино-реактивный фрагмент, такой, как N-гидроксисукцинимид, и другие группы специфически-реактивных фрагментов, такие как малеимидо или дитио (для Н) или карбодиимид (для СООН). Кроме того, пептиды могут быть пространственно ограничены, например, за счет включения α-метиламинокислот, введения двойных связей между соседними С атомами аминокислот и образования циклических пептидов или аналогов за счет введения таких ковалентных связей, как образующие амидную связь между N- и С-концами, между двумя боковыми цепями или между боковой цепью и N- или С-концом.
Пептиды настоящего изобретения или их аналоги могут существовать в виде единой длины, или в виде множественного тандема, или в виде нетандемных повторов. Отдельный тип пептида или аналога может образовывать повторы, или повторы могут состоять из различных молекул, включая подходящие молекулы носителя.
Иммуногенность пептидов настоящего изобретения можно также изменять за счет соединения с фрагментами жирных кислот для получения пептидов, содержащих липиды. Обычные фрагменты жирных кислот включают гликолипидные аналоги, N-пальмитил-S-(2RS)-2,3-бис-(пальмитоилокси)пропил-цистеинил-серин (РАМ3CyS-Ser), N-пальмитил-S- (2,3-бис-)пальмитоилокси)-(2RS)-пропил-(R)-цистеин (ТРС) или дипальмитиллизиновый фрагмент.
Пептиды могут быть также конъюгированы с аминокислотами, содержащими липиды, такими, как октадециловый сложный эфир ароматической кислоты, такой как тирозин, включая октадецилтирозин (ОТН).
Молекулы в соответствии с настоящим изобретением могут далее найти применение при лечении (активном или при профилактике) АIDS и родственных состояний, причем это осуществляется либо за счет нарушения связывания НIV вируса с клетками человека или животного либо за счет нарушения трехмерной организации вируса.
Дальнейший аспект изобретения предлагает способ профилактики или лечения AIDS или родственных состояний, включающий введение эффективного количества пептида по способу настоящего изобретения.
Иммуноанализ
Пептиды настоящего изобретения можно использовать в качестве иммуногенов, как антигенов в иммуноанализах,
включая иммуносорбентные анализы со связанными энзимами (EL1SA), R1A и другие неэнзимные анализы по связыванию антител, или процедуры, известные специалистам для определения анти-HIV антител. В EL1SA
анализах пептиды иммобилизуют на выбранной поверхности, например, поверхности, способной связывать пептиды, такой, как ячейки полистирольных микротитровальных пластин. После промывки для удаления
неполностью адсорбированных пептидов, неспецифический протеин, такой, как раствор альбумина бычьей сыворотки (ВSА) или казеина, которые, как известно, антигенно нейтральны по отношению к тестируемому
образцу, может быть связан с выбранной поверхностью. Это обеспечивает блокирование сайтов неспецифической адсорбции на иммобилизующей поверхности и за счет этого снижает фон, связанный с
неспецифическим связыванием антисыворотки на поверхности.
В одном из диагностических вариантов, когда желательно идентифицировать антитела, которые распознают множество HIV изолятов, множество пептидов настоящего изобретения иммобилизуют на выбранной поверхности. В другом варианте, если В-клеточный эпитоп пептида настоящего изобретения высоко консервативен среди различных HIV изолятов (например, В-клеточный эпитоп из gаg или gр41), отдельный пептид или ограниченное количество пептидов может быть иммобилизовано. В другом диагностическом варианте, когда желательно специфически идентифицировать антитела, которые распознают отдельный HIV изолят (например, BRU, МN или SF2), может быть иммобилизован один пептид настоящего изобретения. Этот диагностический вариант имеет особое применение в области медицины, клинических испытаниях, криминалистике и судебной медицине, когда определение конкретного HIV изолята, отвечающего на выработку антител, может оказаться решающим.
Обычно пептиды имеют около 12 остатков и вплоть до от около 14 до около 40 остатков. Следует учитывать, что смесь пептидов можно использовать либо в качестве иммуногена, например, в вакцинах, или в качестве диагностического агента. Могут возникнуть обстоятельства, в которых смесь пептидов из консервативных участков и/или из неконсервативных участков используют для обеспечения перекрестной защиты изолятов и/или диагностики. В таких случаях смесь пептидных иммуногенов обычно называют "коктейлем" для использования в качестве иммуногенной композиции или диагностического реагента.
Затем иммобилизующую поверхность контактируют с образцом, таким как клинический или биологический материал, подлежащий тестированию, таким образом, чтобы обеспечить образование иммунного комплекса (антиген/антитело). Это можно осуществить, разбавляя образец такими разбавителями как раствор ВSA, бычий гаммаглобулин (BGG) и/или буферированный фосфатом физиологический раствор (РВ) Твин. Затем образец инкубируют примерно 2-4 ч при температуре порядка 25-37oС. После инкубирования поверхность, с которой контактировал образец, промывают для удаления неиммунозакомплексованного материала. Процедура промывки может включать промывку таким раствором, как РВS/Твин, или боратный буфер.
После образования специфических иммунокомплексов между тестируемым образцом и связанным пептидом и последующих промывок наличие и даже количество образовавшегося иммунокомплекса можно определить, подвергая иммунокомплекс обработке вторым антителом, обладающим специфичностью для первого антитела. Если тестируемый образец взят у человека, вторым антителом является антитело, обладающее специфичностью к иммуноглобулинам человека и вообще, IgG. Для обеспечения средств детектирования второе антитело может обладать ассоциированной активностью, как например, энзиматической активностью, которая обеспечит, например, цветовое проявление после инкубирования с соответствующим хромогенным субстратом. Количественного определения можно достичь, измеряя степень проявляющейся окраски, используя, например, спектрофотометр с приемником в видимой области спектра.
Другие применения
Молекулы, которые связываются с консервативной последовательностью, на которой основано настоящее изобретение, в
частности, антитела, родственные антителам молекулы, и их структурные аналоги можно также использовать как агенты при лечении и для диагностики AIDS и родственных заболеваний.
Варианты антител (включая сайт связывания антигена), такие, как химерические антитела, гуманизованные антитела, veneеred антитела и сконструированные антитела, которые связываются с пептидами настоящего изобретения, включены в объем настоящего изобретения.
Антитела и другие молекулы, которые связываются с пептидами настоящего изобретения, можно использовать для терапевтических
(активных и профилактических) целей и диагностических целей рядом различных способов, включая следующие:
Для пассивной иммунизации за счет введения подходящих антител, возможно
гуманизированных антител, HIV пациентам.
Для активации, дополнения или осуществления зависимой от антител клеточной цитотоксичности (АДСС) за счет использования антител подходящего субкласса или изотипа (возможно полученного при конструировании соответствующего антитела), способного осуществлять нужные функции.
Для целенаправленной доставки токсинов или других агентов, например, за счет использования иммунотоксинов, содержащих конъюгаты антитела и цитотоксического фрагмента, для прямого или косвенного связывания с мишеневой консервативной последовательностью, например, из gр120 или gр41.
Для целенаправленной доставки высоко иммуногенных материалов на поверхность HIV-инфицированных клеток, что приводит к возможной аблации таких клеток либо за счет гуморальной, либо иммунной клеточных систем хозяина.
Для детектирования НIV, например, с использованием различных способов иммуноанализа.
В еще одном диагностическом варианте пептид настоящего изобретения (индивидуально или в виде смесей, включая коктейли) пригоден для выработки HIV-антиген специфических антител (включая моноклональные антитела), которые можно использовать для детектирования НIV или антигенов, или для неитрализовании HIV в образцах, включая биологические образцы.
В альтернативном диагностическом варианте пептиды настоящего изобретения кожно использовать для того, чтобы специфически стимулировать HIV-специфические Т-клетки в биологических образцах, например, HIV-инфицированных индивидуумов.
Вышеуказанное раскрытие изобретения в общих чертах описывает изобретение. Более полно его можно понять, обращаясь к нижеследующим конкретным примерам. Эти примеры представлены только с целью иллюстрации и никоим образом не ограничивают объем изобретения. Хотя здесь были использованы специфические термины, они использованы в описательном смысле, но не с целью ограничений.
Примеры
Способы синтеза пептидов, иммуноанализа энзимов (Е1А) и ин витро синцитий-блокирующего анализа (ссылка 7), используемые Dr. Thomas Matthews группой в
Duke University (NC, USA), которые не полно описаны в настоящем описании, полно раскрыты в научной литературе и хорошо известны специалистам.
Пример I
Этот пример
иллюстрирует синтез линейных пептидов
Пептиды, представленные в таблицах I, II, VI, VII, IX, Х и XI далее, были синтезированы в соответствии с аминокислотными последовательностями,
которые
сообщались для различных HIV-1 изолятов, идентифицированных здесь, с использованием ABI (Applied Biosystems Inc.) 430А пептидного синтезатора и оптимизированной t-Вос химии в соответствии с
указаниями изготовителей. Неочищенные пептиды удаляют из смолы за счет обработки фтористоводородной кислотой (HF) и очищают с помощью высокоэффективной жидкостной хроматографии с обращенной фазой
(RP-HPLС), используя Vydac C4 полупрепаративную колонку (1•30 см), используя 15-55% градиент ацетонитрила в 0,1% (объем/объем) трифторуксусной кислоте (TFA), проявляют 40 минут при скорости
потока 2 мл/мин. Все синтетические пептиды (таблица I далее), использованные в иммунологическом тестировании и в исследованиях иммунизации, были более 95% степени чистоты по данным аналитической ВЭЖХ.
Анализ композиции аминокислот осуществлялся на Waters Pico-Fag системе, и результаты анализа находились в хорошем соответствии с теоретическими композициями.
Пример II
Этот
пример иллюстрирует синтез разветвленных пептидов
Синтетические разветвленные HIV-1 пептиды (MAP), представленные на фиг. 1, были получены с использованием АВI 430А пептидного синтезатора и
были синтезированы в соответствии со способом, описанным ранее Таm (ссылка 8). MAP пептиды очищают с помощью RP-HPLC, как указано в примере 1 для линейных пептидов.
Пример III
Этот пример описывает схему, используемую для тестирования иммуногенности HIV-l химерических пептидов.
Пять 6-12-недельных мышей Bа1b/с (Н-2d) или три 6-8-недельные самки морских свинок Duncan Hartley, полученные от Charles River фермы животных, Montreal. Canada и Hazleton фермы, Denver, Co., USA, соответственно, по отдельности иммунизуют 100 мкг данного свободного пептида следующим образом. Животным подкожно вводят данную дозу пептида, эмульгированную в полном адъюванте Фреунда (СFА) или адсорбированную на 3 мг алюминийфосфата (alum), после этого следуют бустерные дозы в том же количестве того же самого пептида, эмульгированного в неполном адъюванте Фреунда (IFА) или адсорбированного на 3 мг алюминийфосфата (alum) спустя три недели.
Мышам вводят бустерные инъекции дважды тем же количеством того же пептида, приготовленного в соответствующих адъювантах с трехнедельными интервалами. Сыворотку экспериментальных мышей и морских свинок собирают на 9 и 14 день после бустерной инъекции, соответственно, и анализируют на пептидо-специфические IgG антитела, используя стандартный иммуносорбентный анализ со связанным энзимом (ЕIА) и оценивая синцитий-блокирующую активность.
Пример IV
Этот пример иллюстрирует тестирование анти-пептидных антител с использованием энзимного иммуноанализа (EIA).
ЕIА для детектирования антител, реактивных с V3 пептидом различных конструкций, осуществляют, покрывая EIA пластины (Covalink, Nunc, Denmark) соответствующими ВЕ-содержащими V3 пептидами (как показано в таблице I далее и на фиг. 1), в количестве 1 мкг на ячейку в соответствии с процедурой, раскрытой в ссылке 9. После 30 минут инкубирования при 4oС несвязанные пептиды удаляют, промывают пластины трижды промывочным буфером (буферированный фосфатом физиологический раствор) (РВS) рН 7,0, содержащим 0,025% Твин 20 (Вio-Rad Laboratories, Richmond, CA). Проводят трехкратное разбавление каждого из экспериментальных образцов сыворотки, начиная при 1 в 50, в РВS, содержащем 0,05% обезжиренного молока, и 100 мкл разбавленной сыворотки добавляют затем в каждую из покрытых пептидом ячеек. Каждое разбавление образцов сыворотки анализируют в дубликате. Связывание V3 пептидо-специфических антител с иммобилизованным пептидом обеспечивается за счет инкубирования пластин в течение 1 часа при комнатной температуре. Несвязанные антитела удаляют, промывая пластины трижды промывочным буфером. 0,01 мкл конъюгата козьего анти-мышиного IqG антитела-пероксидазы хрена (Jackson Lab. ), разбавленного 1 в 5000 в промывочном буфере в соответствии с рекомендациями изготовителя, затем добавляют к каждой тестируемой ячейке для детектирования специфического связывания анти-V3 пептидного антитела с мишеневым пептидом. После одного часа инкубирования при комнатной температуре, несвязанный антитело-конъюгат удаляют, промывая пластины четыре раза промывочным буфером. Количество связанного конъюгата оценивают, добавляя 100 мкл смеси тетраметилбензидина (ТМВ) и перекиси водорода (1 часть ТМВ на 9 частей перекиси водорода, в соответствии с указаниями изготовителей, АDI Diagnostic Inc., Willowdale, Canada). Окраске дают проявиться при комнатной температуре в темноте в течение 10-15 мин и фиксируют, добавляя 100 мкл 1 н. серной кислоты. Оптические плотности энзимных реакций записывают на Titertek Multi Scan спектрофотометре (МСС/340 модель) на 450 нм. Полученные результаты приведены в таблице III и выражены как средние обратные величины реактивных титров. Обратные величины титров для сыворотки нормальных мышей, независимо от гаплотипов, всегда были менее 50.
Заключение
В заключение следует сказать, что настоящее
изобретение обеспечивает получение некоторых синтетических пептидов, содержащих аминокислотные последовательности, содержащие Т-клеточные эпитопы HIV gаg протеина и аминокислотные последовательности,
соответствующие V3 петле оболочкового протеина, включающего GPGR последовательность и/или gp41 протеин, содержащий ELKDWA последовательность, тетрамерные формы таких пептидов, способные вызвать
иммунную реакцию на HIV-1 инфекцию, и композиции вакцин, содержащие такие тандемные синтетические пептиды. В объеме настоящего изобретения возможны модификации.
Реферат
Изобретение относится к биотехнологии и иммунологии и может быть использовано для получения вакцины против HIV инфекции. Синтетический пептид HIV содержит аминокислотную последовательность Т-клеточного эпитопа gag протеина вируса иммунодефицита, выбранного из P24N, P24L, P24M, P24H и P24E, связанную с аминокислотной последовательностью В-клеточного эпитопа петли V3 белка оболочки изолята HIV, содержащую последовательность GPGR, или содержащую гибридную последовательность петли V3 из двух различных изолятов HIV-1, или содержащую консенсусную последовательность петли V3 разных изолятов, или связанную с аминокислотной последовательностью В-клеточного эпитопа белка gp41 изолята HIV, содержащего, в частности ELKDWA. Тетромерная форма синтетического пептида HIV содержит индивидуальные синтетические пептиды с аминокислотной последовательностью Т-клеточного эпитопа белка gag изолята HIV, связанной с последовательностью В-клеточного эпитопа. Иммуногенная композиция, содержащая синтетический пептид, индуцирует иммунный ответ против пептидов HIV. Диагностический набор для определения HIV-специфических антител включает синтетический пептид. Изобретение позволяет разрабатывать синтетические вакцины против HIV. 8 с. и 26 з.п. ф-лы, 3 ил., 14 табл.
Формула
(GPKEPFRDYVDRFYKNKRKRIHIGPGRAFYTTKN)4,
(GPKEPFRDYVDRFYKRKRIHIGPGRAFYTTKN)4,
(GPKEPFRDYVDRFYKNTRKSIRIQRGPGRAFYTTKN)4,
(KQIINWQEVEKAMYANKRKRIHIGPGRAFYTTKN)4 и
(GPKEPFRDYVDRFYKRIHIGPGRAFYTTKN)4.

Комментарии