Способ одновременного обнаружения антигенов и антител против инфекционного микроорганизма - RU2300769C2
Код документа: RU2300769C2
Чертежи

Описание
Изобретение относится к обнаружению in vitro инфекции, вызванной инфекционным микроорганизмом, в частности вирусным, и касается, в частности, обнаружения in vitro инфекции, вызванной вирусом гепатита С. Точнее изобретение относится к способу одновременного обнаружения антигена инфекционного микроорганизма, в частности вирусного, и антител против этого инфекционного микроорганизма, а также к реактивам и наборам для осуществления способа. В частности, изобретение относится к способу одновременного обнаружения антигена вируса гепатита С и антител против вируса гепатита С, а также к реактивам и наборам для его осуществления.
Инфекция, вызываемая вирусом гепатита С, называемого ранее гепатитом неА, неВ, представляет собой проблему в здравоохранении, в частности, в области переливания крови, которая была признана и вызывала озабоченность на протяжении длительного времени.
В заявке на патент ЕР 318216, опубликованной 31 мая 1989 г., описано клонирование фрагментов кДНК вируса, вызывающего гепатит С у человека, названного HCV (по-английски) или VHC (по-французски). В ней описаны также последовательность пяти генов, кодирующих неструктурные белки (NS1-NS5) вируса (около 78% от общего генома вируса гепатита С), антиген С 100-3 (содержащий 363 аминокислоты, (область NS3-NS4) слитый с супероксиддисмутазой), а также способ обнаружения антител против вируса гепатита C с помощью антигена С 100-3. Данный способ обнаружения антител против вируса гепатита С так называемого первого поколения позволил, в числе прочего, установить, что вирус гепатита С является главной причиной заболевания гепатитом неА, неВ, называемым теперь гепатитом С. Однако данный способ не позволяет обнаруживать более 70-80% сывороток, инфицированных данным вирусом. Такая недостаточная чувствительность не обеспечивает также раннего выявления инфекции.
Okamoto и др. (1990а), а также заявка на патент ЕР 388232, опубликованная 19 сентября 1990 г., описывают 5'-концевую последовательность генома вируса гепатита С, т.е. последовательность генов, кодирующих структурные белки (капсидные, кор, оболочечные) вируса, вызывающего гепатит С.
Okamoto и др. (1990b) опубликовали сведения о применении последовательности аминокислот 39-74 капсида вируса гепатита С в качестве мишени для обнаружения антител против вируса гепатита С твердофазным иммуноферментным анализом.
В статье Hosein и др. (1991 г.) описан иммунологический анализ по обнаружению антител против вируса гепатита С, основанный на использовании структурных (капсид, область АА 1-120) и неструктурных (NS3-NS4, область АА 1200-1800) синтетических пептидных антигенов. Он доказывает эффективность синтетических пептидов при обнаружении антител против вируса гепатита С и комбинации из структурных и неструктурных антигенов, повышающей чувствительность и, следовательно, обеспечивающей более ранний характер обнаружения. Описанный здесь анализ гарантирует более раннее обнаружение антител: за 4-10 недель. Из статьи также следует, что не имеется основного иммунодоминантного эпитопа, такого, как известный, например, для вирусов СПИДа.
Nasoff и др. (1991 г.) установили, что большая часть доминатных иммунореактивных эпитопов капсида локализована в N-концевой области (АА 1-40) и что антитела против этих эпитопов появляются вскоре после инфицирования.
Тесты по обнаружению антител против вируса гепатита С так называемого второго поколения (т.е. тесты, основанные на одновременном использовании иммобилизованных неструктурных и структурных антигенов) означают существенное продвижение вперед по сравнению с тестами первого поколения. Однако их чувствительность все еще недостаточна: в действительности они позволяют обнаружить не более 95-98% сывороток, зараженных вирусом гепатита С. Следовательно, такое обнаружение является недостаточно ранним и позволяет пропустить незамеченной инфицированную донорскую кровь при ее переливании. Действительно, для снижения риска в период после переливания крови необходимо выявлять присутствие самого вируса до появления антител и как можно раньше после заражения. Период между заражением и сероконверсией (т.е. появлением антител) называется "серологическим окном" («антительным окном»).
Разные коллективы авторов (Garson и др., 1990 г.; Shieh и др., 1991 г.) предлагали обнаруживать вирусную рибонуклеиновую кислоту с помощью полимеразной цепной реакции (PCR) в целях решения проблемы чувствительности и упомянутого выше требования раннего характера обнаружения. Действительно, данный способ обеспечивает чрезвычайно чувствительное и раннее обнаружение инфекции, вызванной вирусом гепатита С, а именно уже через несколько суток после инфицирования вирусом, т.е. за 4-8 недель до увеличения количества циркулирующих противовирусных антител. В настоящее время он является эталонным способом обнаружения вируса в биологических жидкостях.
Однако способ PCR для вируса гепатита С наталкивается на разные трудности. С одной стороны, он предусматривает проведение предварительных стадий извлечения и очистки РНК и затем ее обратную транскрипцию в кДНК, причем на этих предварительных стадиях часть вирусного материала теряется. С другой стороны, он требует применения специального дорогостоящего оборудования. Кроме того, он не позволяет одновременно обрабатывать большое количество проб, что часто является причиной заражения.
Другим подходом для раннего обнаружения инфекции, вызванной вирусом гепатита С, является обнаружение циркулирующего вирусного (капсидного) антигена. Этот антиген также появляется за несколько недель до образования сывороточных антител против вируса гепатита С. Takahashi и др., 1992 г., описали способ твердофазного иммуноферментного анализа (ELISA) для обнаружения капсидного антигена с помощью пары антител.
Однако обнаружение такого антигена весьма затруднительно, большей частью, вследствие малой доли выявляемых в крови антигенов и из-за качества имеющихся иммунологических реактивов.
Hajime Tokita и др., 2000 г., описали сэндвич-иммуноанализ с использованием пары моноклональных антител (5F11 и 5Е3), известный на рынке под названием "Immucheck F HCV Ag Core Kokusai" и являющийся весьма чувствительным. Авторы данной статьи подчеркивают, что мутация Thr49Pro в капсидном белке снижает чувствительность анализа. Пытаясь обнаружить капсидный антиген на ранней стадии, Peterson и др., 2000 г., описали способ обнаружения с помощью ELISA для капсидного антигена вируса гепатита C с использованием моноклональных антител против капсида без предварительной обработки пробы. В статье показано, что с помощью трех независимых методов анализа (обнаружение РНК вируса гепатита С посредством PCR, антител против вируса гепатита С и капсидного антигена с помощью ELISA) может быть эффективно обнаружен циркулирующий капсидный антиген вируса гепатита С в образцах крови, взятой на ранней серологически отрицательной стадии инфекции (т.е. через 1 сутки после обнаружения РНК).
Раннее обнаружение инфекции, вызванной вирусом гепатита С, в сочетании с возможностью выявления ответных реакций антител, следующих за серологической конверсией на протяжении всей инфекции, остается актуальной задачей, в первую очередь, в области переливания крови.
Совершенно необходимо располагать способом, являющимся простым, чувствительным, специфическим, воспроизводимым, дешевым, легко осуществимым и поддающимся автоматизации при массовом обнаружении для обнаружения, в первую очередь, антигена вируса гепатита С в период серологического окна для последующего слежения за серологической реакцией пациента после серологической конверсии и для одновременного обнаружения антител против вирусов гепатита С и антигена вируса гепатита С.
Однако при этом возникает главная проблема, касающаяся количества антигена вируса гепатита С и интерференции между антителами против вируса гепатита С в сыворотке и мечеными антителами против вируса гепатита С. Следовательно, введение антигена-мишени в твердую фазу с целью обнаружения заданного антитела, которая имела бы те же эпитопы, что и эпитопы, узнанные меченым(и) антителом (антителами), применяемым(и) с целью одновременного обнаружения антигена способом сэндвич, необратимо привело бы к связыванию меченого (меченых) антитела (антител) с твердой фазой и, следовательно, к ложноположительному результату.
Это особенно справедливо для системы одновременного обнаружения на одной и той же твердой фазе антител против капсида вируса гепатита С и капсидного антигена вируса гепатита С. Следовательно, иммобилизация капсидного антигена на ту же твердую фазу с целью обнаружения антител против капсида вируса гепатита С, имеющего те же эпитопы, что и эпитопы, узнанные посредством меченого (меченых) антитела (антител) против капсида вируса гепатита С, используемого (используемых) для обнаружения капсидного антигена, приводит к связыванию меченого (меченых) антитела (антител) с твердой фазой, что приводит к ложноположительному результату.
Для предупреждения риска интерференции Chiron Corp. провела тесты по обнаружению капсидного антигена и только антител против NS3/NS4 у пациентов. Для этого Chiron применила, с одной стороны, антиген NS3/4a, иммобилизованный на твердой фазе, для связывания антител против вируса гепатита С в тестируемой пробе и, с другой стороны, также иммобилизованные моноклональные антитела (с11-3 и с11-7) против капсида вируса гепатита С. Связанные антитела обнаруживали с помощью антигена, слитого с супероксиддисмутазой, в присутствии моноклонального антитела, меченного пероксидазой, в то время как связанный антиген обнаруживали с помощью другого моноклонального антитела, также меченного пероксидазой (VII European Congress of the International Society of Blood Transfusion (VII Европейский конгресс Международного общества по переливанию крови), г. Париж, 15-18 июля 2001 г.).
В связи с проблемой интерференции в заявке на патент ЕР 1020727 (заявитель "Advanced Life Science Institute") предложен способ одновременного обнаружения капсидного антигена вируса гепатита С и антител против капсида вируса гепатита С (тест типа "Combo"), согласно которому антиген связывается и метится антителами против разных капсидных эпитопов, служащих одновременно для связывания и выявления или обнаружения антител против капсида. Приведен представительный пример, в котором для одновременного теста по обнаружению антигена способом сэндвич и антител непрямым тестом используют для обнаружения антигена первое (иммобилизованое) антитело против эпитопов последовательности аминокислот от (АА) 100 до 130 капсида вируса гепатита С и второе (детектирующее) антитело против эпитопов последовательности АА40-50, а для обнаружения антител используемый иммобилизованный антиген содержит, в свою очередь, последовательности АА1-42 и АА66-80.
Однако этот способ не свободен от недостатков, в частности, по той причине, что для него требуется применение антител против эпитопов, относительно удаленных один от другого и являющихся в действительности менее значительными и мало иммуногенными. Кроме того, ему присущ недостаток, заключающийся в том, что из-за отсутствия последовательности АА43-65 не могут обнаруживаться антитела против указанной последовательности, и, следовательно, снижается чувствительность. Кроме того, при этом способе связывание капсидного антигена и антител против капсида происходит с помощью двух белковых капсидных зон, четко различающихся между собой, т.е. не наложенных одна на другую (АА 1-42 и АА 66-80 для обнаружения антител и АА 100-130 для обнаружения антигена), в отличие от настоящего изобретения.
В заявке на изобретение WO 01/96875 А2 (заявитель "CHIRON") описан в числе прочего тест по одновременному обнаружению капсида и антител против NS3 и NS4 (неполный тест "Combo", фиг.2), при котором в качестве детергента применяется N-лаурилсаркозин. Однако в ней очень кратко излагается полный тест "Combo", стр.33, фиг.8, т.е. тест по одновременному обнаружению капсидного антигена (способом сэндвич) и антител против капсида и неструктурных антибелков вируса гепатита С (сандвич двойного антигена). Для связывания антигена применяются два иммобилизованных антитела с11-3 и с11-7, способных узнавать обширный N-концевой участок (АА 10-53) капсида вируса гепатита С, а для обнаружения применяется третье антитело с 11-14, способное узнать С-концевой участок (АА 120-130) капсида вируса гепатита С. Для обнаружения антител используется иммобилизованный антиген, слитый с множественными эпитопами ("МЕРА 12", см. табл.2 в заявке WO 01/96875) и содержащий после слияния с фрагментом супероксиддисмутазы антигены NS3, NS4, NS5 и серии последовательностей капсида нескольких штаммов вируса гепатита С: АА 9-53, носителей мутации R47L, АА 64-88 и АА 67-84. Последовательности АА 54-63 и АА 54-66 в этих обеих сериях последовательности отсутствуют.
Однако реальное проведение полного теста "Combo " в заявке на патент WO 01/97875 А2 не описано. Следовательно, для среднего специалиста не представляется возможным определить четко и однозначно, является ли тест Combo согласно фиг.8 работоспособным, и еще в меньшей степени, может ли он решить стоящую проблему, т.е. по возможности рано обнаружить инфекцию, вызванную вирусом гепатита С. Как бы то ни было, остается очевидным, что в лучшем случае тест "Combo" согласно заявке WO 01/96875 А2 безусловно не обнаружит все антитела против недостающих последовательностей АА 54-63 и АА 54-66. Отсюда следует риск потери чувствительности.
В заявке на патент ЕР 1251353 А2 (заявитель "Ortho-Clinical Diagnostics") описан полный тест "Combo", при котором применяются те же антитела для обнаружения капсида, однако без уточнения их происхождения и специфичности эпитопов. Кроме того, в ней уточняется, что используемым детергентом является детергент типа BRIJ или MYRJ, который очевидно предпочтителен вместо N-лаурилсаркозина в наборе для обнаружения капсидного антигена, предлагаемом на рынке "Ortho Clinical Diagnostics" (см. пример 3 [0012]). Обнаружение антител против капсида проводится с помощью модифицированного капсидного антигена (мутагенезом): C22KSN▽47,48 (белок, слитый с супероксиддисмутазой и содержащий последовательность АА 10-99 капсида с делецией аминокислот 47 и 48) или C22KSR47L (белок, слитый с супероксиддисмутазой и содержащий последовательность АА 10-99 капсида, с лейцином, замещающим аргинин в позиции 47).
В заявке на патент WO 03/002749 А2 (заявитель "Abbott") описаны многочисленные антигены и тесты по обнаружению капсидного антигена вируса гепатита С. Только в полном тесте "Combo", который описывается в ней под названием "Real Combo" (фиг.1, стр.59), для обнаружения антител против капсида используется биотинилированный пептид, соответствующий аминокислотам 11-28 капсида и иммобилизованный на твердой фазе. Для обнаружения капсида заявкой предусматривается применение комбинация антител С11-14 (Advanced Life Science Institute) (узнающих последовательность капсида АА45-50) иммобилизованных на твердой фазе и СП-10 (узнающего последовательность АА 32-36 капсида), меченного акридином. Согласно заявке WO 03/002749А2 связывание капсидного антигена и антител против капсида происходит посредством двух отчетливо различающихся между собой капсидных сайтов, т.е. не наложенных друг на друга (АА 11-28 для обнаружения антител и АА 45-50 для обнаружения антигена) в отличие от настоящего изобретения.
Поэтому для решения стоящей проблемы авторы данного изобретения поставили своей целью создание альтернативного способа.
В настоящее время разработан способ одновременного обнаружения антигена вируса гепатита С и антител пациента против этого антигена, которым решается проблема интерференции и достигается уровень чувствительности и раннее обнаружение, приближающееся к уровню чувствительности при PCR, что позволяет полностью отслеживать серологическую реакцию пациента после серологической конверсии.
Авторы изобретения решили данную проблему, создав искусственно, путем изменения структуры, различающиеся эпитопы антигенов-мишеней для связывания антител. Модифицированные таким образом эпитопы оказались инактивированными. Одновременно антитела, предназначенные для связывания и/или обнаружения антигенов выбираются, в свою очередь, таким образом, чтобы они точно узнавали немодифицированные эпитопы, присутствующие на антигенах пациента, и не могли связываться с модифицированными антигенами, не содержащими более эти эпитопы. Ввиду того что эпитопы более не идентичны, то отсутствует конкуренция между антителами, используемыми для связывания и/или обнаружения антигена вируса гепатита С, и антителами пациента. В противоположность некоторым известным из уровня техники способам связывание капсидного антигена и связывание антител против капсида могут происходить в одной и той же белковой зоне капсида с исключением потери определенного количества антител против капсида при обнаружении, как это будет показано ниже.
Поскольку на N-концевом участке капсида идентифицируется множество эпитопов, то эта белковая зона оказывается наиболее пригодной для одновременного очень чувствительного обнаружения капсидного антигена и антител против капсида.
Благодаря данному изобретению становится возможным одновременно применять при обнаружении антител и антигенов наиболее иммуннореактивные последовательности и таким образом улучшить чувствительность обнаружения.
Само собой разумеется, что изобретение не ограничивается обнаружением только инфекции, вызванной вирусом гепатита С. Оно распространяется также на спосо6, реактивы и наборы, описываемые ниже и предназначенные для обнаружения и/или слежения за инфекцией, вызванной инфекционными микроорганизмами любого вида (например, вирусами, такими как вирусы, вызывающие разные виды гепатита А, В, С, D или Е, ретровирусы, в частности, вирусы СПИДа человека (ВИЧ-1, ВИЧ-1 группы 0, ВИЧ-2) или обезьяны, цитомегаловирус, флавивирусы, в их числе вирусы лихорадки денге, а также бактерии, микробные паразиты и пр.), для которых требуется одновременное обнаружение антигенов и антител. Изобретение, описанное в основном применительно к вирусу гепатита С, имеет более широкое значение и может быть легко понято специалистом.
Определение понятий
Термин "вирус гепатита С" применяется в данном случае для всех штаммов, всех типов, подтипов и генотипов вируса, вызывающего гепатит С. Способ согласно изобретению имеет своей целью обнаружение любой инфекции, вызванной вирусом гепатита С, какими бы ни были его происхождение и генотип. Это предполагает, в частности, хорошо известные типы и подтипы вируса, распространенные в Европе, США, Японии и т.д. (т.е. 6 основных генотипов: 1, 2, 3, 4, 5, 6 и их подтипов 1a, 1b, 3а, ...). См. Stuyver et al., 1994 г.; Bukh, 1995 г.
Под "вирусом иммунодефицита человека", или ВИЧ, понимаются любые штаммы, типы, подтипы, группы и генотипы ретровируса, вызывающего СПИД человека. Термином "ВИЧ" объеденены между собой, в частности, ВИЧ-1 (ВИЧ-1 группы М, ВИЧ-1 группы 0) и ВИЧ-2, а также их варианты.
В контексте изобретения "биологическая проба" представлена преимущественно биологической жидкостью, такой как кровь, плазма, сыворотка, моча, спинно-мозговая жидкость, слюна и пр.
Термин "антитело" относится к любому целому антителу или его функциональному фрагменту, содержащему или состоящему, по меньшей мере, из одного антиген-связывающего сайта, позволяющего этому антителу связываться, по меньшей мере, с одной антигенной детерминантой антигена. В качестве примера фрагментов антител можно указать на фрагменты Fab, Fab', F(ab')2, а также на цепочки scFv (single chain variable fragment), dsFv (double-stranded variable fragment) и пр. Такие функциональные фрагменты могут быть получены, в частности, генной инженерией.
Продуцирование моноклональных антител или моноспецифических поликлональных сывороток, применяемых в рамках настоящего изобретения, зависит от традиционных приемов, описываемых ниже более подробно.
Под "связывающим (иммобилизованным) антителом" понимается антитело или часть его, предпочтительно иммобилизованая на твердой фазе, способная связывать антиген микроорганизма, например, вируса гепатита С или ВИЧ в биологической пробе путем специфического узнавания (связывания).
Присутствие антител и антигенов в биологической пробе определяется "детектирующими средствами". Поскольку речь идет об обнаружении антигена, то изобретением предусматривается, в частности, обнаружение с помощью, по меньшей мере, одного "детектирующего антитела". Такое меченое детектирующее антитело способно связываться со связанным антигеном благодаря специфическому узнаванию, узнавая эпитоп, отличающийся от эпитопа, узнанного иммобилизованным антителом, или идентичный вследствие присутствия содержащего повторы фрагмента капсида. Если речь идет об обнаружении антител, то можно использовать, в частности, антитела против иммуноглобулина или против изотипа, например, мечеными антителами против иммуноглобулинов G.
Термин "меченый" означает как прямое мечение (посредством ферментов, радиоизотопов, флюорохромов, люминесцирующих соединений и пр.), так и непрямое мечение (например, посредством антител, которые, в свою очередь, были подвернуты прямому мечению, или посредством реактивов, представляющих собой меченую "стереоспецифическую пару", такую как - но не исключительно - пара "меченый авидин-биотин" и пр.).
Под "фрагментом антигена" подразумевается полный или часть природного или рекомбинированного белка инфекционного микроорганизма, такого как вирус гепатита С или ВИЧ, способный индуцировать образование антител в организме инфицированного пациента или иммунизированного животного. Речь может идти о полном или о части капсидного белка или о неструктурных белках вируса гепатита С, в частности NS3 и NS4, полученных или не полученных генной инженерией. Также может идти речь о полном или части белка, кодированном геном gag ВИЧ, в частности Р25 (ВИЧ-1) или Р26 (ВИЧ-2), или о белке, кодированном геном оболочки, в частности, gp41 (ВИЧ-1) или gp36 (ВИЧ-2).
Под "связывающим антигеном" понимается выделенный фрагмент антигена, предпочтительно иммобилизованный на твердой фазе, способный быть узнанным антителами против микроорганизма, такими, как антитела против вируса гепатита С или против вируса иммунодефицита человека, и способный обеспечивать специфическое связывание с последними.
Под "детектирующим антигеном" понимается меченый и измененный антиген в качестве связывающего антигена (т.е. содержащего, по меньшей мере, один эпитоп или инактивированный эпитоп). Он позволяет обнаружить вследствие конкуренции либо связанный антиген, либо антитела классическим способом сэндвич "антиген-антитело-антиген", называемым также способом "сэндвич двойного антигена" (Maiolini и др., 1978 г.).
Согласно изобретению связывающий антиген и/или, при необходимости, детектирующий антиген, используемый, в частности, при обнаружении антител способом сэндвич "антиген-антитело-антиген", содержит, по меньшей мере, один эпитоп или инактивированный эпитоп."Эпитоп" представляет собой последовательность аминокислот, которая узнается антителом и которая обеспечивает специфическое связывание с последним.
Что касается белков вируса гепатита С, то идентифицировано несколько эпитопов капсидного белка. Известны, в частности, эпитопы, локализованные между аминокислотой 16 и аминокислотой 40, а также между аминокислотой 44 и аминокислотой 47. Можно также сослаться, например, на статьи или публикации авторов Okamoto и др., 1990 г.; Nasoff и др., 1991 г.; Leahny и др., 1991 г.; Takahishi и др., 1992 г.; Sällberg и др., 1993 г.; Ishida, 1993 г.
Многочисленные эпитопы неструктурных белков вируса гепатита С также известны специалисту. Для белка NS3 известны эпитопы, локализованные между аминокислотой 1188 и аминокислотой 1493 (Yang и др., 1995 г.), между аминокислотой 1175 и аминокислотой 1334 (Yang и др., 1999 г.), а также эпитоп, расположенный между аминокислотой 1460 и аминокислотой 1532 (Clayes и др., 1995 г.).
Один из наиболее известных эпитопов NS4, а именно эпитоп 5-1-1 (АА 1689-1706), упомянут у Cerino и др., 1991 г.
Для ВИЧ в уровне техники также описано несколько эпитопов. В частности, речь идет об эпитопах белка Р25 ВИЧ-1 (группа М), локализованных между аминокислотами 293-350, а также об иммунодоминантном эпитопе белка gp41, описанного Gnann и др., 1987 г., или о варианте этой последовательности; также речь идет, например, об эпитопе белка Р26, в частности, об эпитопе последовательности, гомологичной последовательности эпитопа белка Р25 ВИЧ-1, описанного выше, или об эпитопе белка gp36 ВИЧ-2, в частности, об иммунодоминантном эпитопе белка gp36, описанного Gnann и др., 1987 г., или о варианте этой последовательности.
"Эпитоп" или "инактивированный эпитоп" означает, что структура (первичная, вторичная, третичная и/или четвертичная) эпитопа изменена таким образом, чтобы связывающий или детектирующий антиген, содержащий такой инактивированный эпитоп, не мог связываться со связывающим и/или детектирующим антителом против одновременно обнаруживаемого антигена при полном сохранении способности связывать антитела против микроорганизма, такие как антитела против вируса гепатита С или вируса иммунодефицита человека, возможно, присутствующие в биологической пробе, посредством узнавания других, не являющихся инактиврованными эпитопов. Следовательно, связывающие и/или детектирующие антитела выбираются таким образом, чтобы специфически узнавался соответствующий эпитоп в "интактном" виде, т.е. в "активном" или "нативном" виде на антигене, присутствующем в биологической пробе. В рамках настоящего изобретения этот эпитоп в нативном виде называется также "гомологичным" эпитопом инактивированного эпитопа.
Термин "специфично" в том случае, когда он относится к узнаванию или к специфическому связыванию антитела с антигеном, означает, что антитело взаимодействует с антигеном без существенного взаимодействия с другими антигенами, или применяется в том случае, когда речь идет о "специфическом" узнавании с помощью эпитопа, в частности, посредством квази-исключительного узнавания этого эпитопа. Предпочтительными являются константы ассоциации, превышающие 108 L.mol-1.
Связывающие и детектирующие антитела
Антитела, используемые в данном изобретении, являются специфическими антителами по отношению к антигену и вследствие этого представляют собой моноклональные или поликлональные моноспецифические антитела, т.е. они специфически узнают только один эпитоп.
Моноклональные антитела могут быть получены классическим способом лимфоцитарного слияния и выращивания гибридом, описанным Kohler и Milstein, 1975 г. Также известны и другие способы получения моноклональных антител (Harlow и др., 1988 г.). Моноклональные антитела могут быть получены иммунизацией млекопитающего животного (например, мыши, крысы, кролика, даже человека и пр.) с применением способа лимфоцитарного слияния, приводящего к образованию гибридом (Kohler и Milstein, 1975 г.).
Существуют также способы, альтернативные по отношению к этому распространенному способу. Например, можно продуцировать моноклональные антитела способом экспрессии нуклеиновой кислоты, клонированной на основе гибридомы. Также можно продуцировать антитела посредством экспрессии в фаге ("phage display") путем введения кДНК антител в векторы, являющиеся типичными нитчатыми фагами (например, fUSE5 для Е. coli., Scott и др., 1990 г.). Последние образуют банки и содержат на своей поверхности фрагменты scFv. Протоколы строения таких банков антител описаны у Marks и др., 1991 г.
Поликлональные антитела могут быть получены из сыворотки животного, иммунизированного от антигена пептидного происхождения обычными способами.
Как правило, можно применять, например, в качестве иммуногена, полипептид, в частности рекомбинированный, или олигопептид. В соответствии с классическим способом кроликов иммунизируют пептидным иммуногеном в эквивалентном количестве 1 мг согласно методике, описанной Benoit и et al., 1982 г. С интервалом в четыре недели животным вводили по 200 мкг антигена и через 10-14 суток их забивали. После третьего введения оценивали способность антисыворотки связываться с пептидным антигеном, меченным радиоактивным иодом с помощью хлорамина-Т. После этого проводили очистку с помощью ионообменной хроматографии на колонке с карбоксиметилцеллюлозой. Антитела элюировали и выделяли фракцию IgG с помощью методов, которые хорошо известны специалисту, например, на диэтиламиноэтил-Sephadex.
Для повышения специфичности поликлональной сыворотки антитела можно очищать с помощью иммуноаффинной хроматографии с использованием пептидов (таких как пептиды капсида АА 16-44 и АА 39-74 вируса гепатита С - в качестве неограничивающего примера), которые применялись для иммунизации и были иммобилизованы на твердой фазе. Антисыворотку приводят в контакт с таким иммобилизованным на твердой фазе пептидом в течение времени, достаточного для протекания иммунной реакции между пептидом и молекулой антитела, необходимой для образования иммунологического твердофазного комплекса.
В частности, заявители использовали специфические антитела против вируса гепатита С, которые приведены в нижеследующей таблице 1.
Что касается теста "Combo" для обнаружения ВИЧ, то применяемое антитело представляет собой преимущественно моноклональное антитело, узнающее одну из следущих полипептидных последовательностей или соответствующую последовательность измененного штамма ВИЧ:
- эпитоп белка Р25 ВИЧ-1 группы М последовательности308QASQEVKNWMTETLL322 (SEQ. ID №24);
- эпитоп белка Р26, в частности, эпитоп последовательности, гомологической по отношению к эпитопу белка Р25 ВИЧ-1 (последовательность SEQ ID №24), как, например, эпитоп, содержащий последовательность QTDPAVKNWMTQTLL SEQ ID №25) (изолят ВИЧ: ROD).
Само собой разумеется, что специалист в состоянии приготовить или приобрести моноклональные антитела, специфичность эпитопа которых будет сходна или идентична специфичности, описанной для указанных выше антител, и которые будут пригодны для осуществления настоящего изобретения.
Связывающие и/или детектирующие антигены
Связывающий и/или детектирующий антиген, используемый в изобретении, содержит, по меньшей мере, один инактивированный эпитоп. Инактивирование, по меньшей мере, двух эпитопов в антигене может оказаться необходимым в том случае, когда применяются два разных антитела, для которых присутствует риск взаимодействия со связывающим и/или детектирующим антигеном. Это имеет место, например, при иммуноанализах способом сэндвич, при которых применяются связывающее антитело, иммобилизованное на той же поверхности, что и связывающий антиген, и детектирующее антитело. Следовательно, связывающее антитело выбирается таким образом, чтобы оно специфически узнавало эпитоп на нативном антигене пациента, гомологичном одному из двух инактивированных эпитопов на связывающем антигене, в то время как детектирующее антитело выбирается так, чтобы оно специфично узнавало эпитоп на нативном антигене пациента, гомологичном другому из обоих инактивированных эпитопов на связывающем антигене.
Связывающий и/или детектирующий антиген может содержать или состоять из одного пептида, имитирующего полностью или частично эпитоп белкового антигена микроорганизма, в частности, вируса гепатита С или ВИЧ.
Предпочтительно речь идет о пептиде капсидного белка, причем обнаружение антител против капсидов происходит особенно эффективно, в частности, в случае хронических гепатитов, когда наблюдается очень мало антигенов и больше циркулирующих антител против капсидов. Речь может идти также о пептиде (пептидах) неструктурного белка, такого как NS3 и/или NS4. Также возможны комбинации из различных связывающих или детектирующих антигенов. Такой вариант осуществления, при котором применяются несколько разных связывающих и/или детектирующих антигенов, позволяет, например, одновременно обнаружить антитела против капсида и антитела против неструктурных белков NS3 и/или NS4 вируса гепатита С. Особо предпочтительно одновременное обнаружение антител против капсида и антител против NS3. Изобретение касается также одновременного обнаружения капсидного антигена, антитела против капсида, антитела против структурных капсульных белков Е1 и/или Е2, капсульного антигена Е1 и/или Е2 и/или антител против неструктурных белков NS3 и/или NS4 вируса гепатита С. Другие возможные комбинации также входят в объем настоящего изобретения.
Аналогично в объем изобретения входит одновременное обнаружение антигена gag, антитела против gag и/или антитела против капсулы вируса СПИДа (ВИЧ-1, ВИЧ-2 и пр.), последовательности которых опубликованы в статьях Wain-Hobson и др., 1985 г.; Ratner и др., 1985 г.; Sanchez-Pescador и др., 1985 г.; Guyader и др., 1987 г. Предпочтительно, чтобы обнаруживаемый антиген gag представлял собой белок Р25 ВИЧ-1 или Р26 ВИЧ-2, а искомые антитела против gag действовали против этих белков. Всегда предпочтительно, чтобы капсульные антигены, предназначенные для обнаружения антител против капсулы ВИЧ-1 и ВИЧ-2, представляли собой gp41 ВИЧ-1 и gp36 ВИЧ-2.
Аналогично обнаружение антигена NS1, описанное у Alcon и др., 2002 г., проводимое одновременно с обнаружением антител против NS1 и даже антител против NS2, NS3 и/или S4 вирусов лихорадки денге, входит в объем изобретения.
Способы применения специалисту хорошо известны.
Предпочтительно, поскольку это более практично, чтобы связывающие и/или детектирующие антигены представляли собой синтетические пептиды, полученные стандартными способами, хорошо известными среднему специалисту. В качестве примера можно упомянуть синтез по Меррифильду (Merrifield), являющийся эффективным с точки зрения чистоты, антигенной специфичности, отсутствия нежелательных вторичных продуктов, а также простоты применения (Marrifield, 1963 г.; R.C. Sheppard, 1971 г.; Atherton и др., 1989 г.). В качестве автоматического синтезатора пригоден синтезатор "9050 Plus Pep Synthesizer" ф. Millipore, синтезатор "Pioneer" ф. Perseptive, синтезатор "433A" ф. ABI (Applied Biosystems Inc.) или синтезатор "Symphony" ф. Rainin. Пептиды могут быть также получены путем синтеза в гомогенной фазе.
Инактивация эпитопов на связывающих и/или детектирующих антигенах может производиться разными способами. Единственное условие, необходимое для данной модификации эпитопов, состоит в том, чтобы связывающий и/или детектирующий антиген не мог связываться со связывающим и/или детектирующим антителом при сохранении в значительной степени способности связывать антитела против микроорганизма, в частности, антитела против вируса гепатита С или антивируса иммунодефицита человека, вероятно, присутствующих в биологической пробе.
Модификация, по меньшей мере, одной аминокислоты, предпочтительно двух аминокислот, в каждом целевом эпитопе может оказаться достаточной для инактивации эпитопа без дестабилизации остальных немодифицированных эпитопов. Такая модификация может быть достигнута, в частности, замещением аминокислоты, например, замещением остатка неглицина остатком глицина или аланина или замещением аминокислоты одного класса аминокислотой другого класса. Можно, например, заместить аминокислоту с полярной боковой цепью (такую, как аспарагин, глутамин, серин, треонин и тирозин) аминокислотой с неполярной боковой цепью (такой, как глицин, аланин, валин, лейцин, изолейцин, фенилаланин, метионин, триптофан и цистеин) и наоборот. Также можно заместить аминокислоту с щелочной боковой цепью (такую, как лизин, аргинин и гистидин) аминокислотой с кислой боковой цепью (такой, как аспарагиновая и глутаминовая кислоты), и наоборот, или же заместить аминокислоту, боковая цепь которой содержит кольцо (например, тирозин, фенилаланин), аминокислотой с линейной боковой цепью, и наоборот. Делеция одной или нескольких аминокислот или введение одной или нескольких аминокислот, в частности, неприродных аминокислот, в эпитоп также позволяет инактивировать этот эпитоп. Также возможны изменения функциональных групп аминокислот, а именно, групп ОН, NH2 или SH.
Из эффективных пептидов согласно настоящему изобретению можно указать на пептиды, производные от любого вида инфекционных микроорганизмов (таких, как вирусы, например, вирусы, вызывающие разные виды гепатита, ретровирусы, в частности, вызывающие СПИД (ВИЧ-1, ВИЧ-2, ...), цитомегаловирус, вирусы лихорадки денге, а также бактерии, микробные паразиты и пр.), для которых желательно проводить одновременное обнаружение антигенов и антител.
В частности, в порядке иллюстрации, но без ограничения, можно указать на пептиды капсида вируса гепатита С, а именно на пептиды аминокислот 1-75, 6-68 и 1-53. Эти последовательности, соответствующие последовательностям, согласующимся с генотипом 1 (подтипы 1а, 1b, 1с), приводятся ниже и обозначены соответственно SEQ ID №1, №2 и №3:
SEQ ID №1:
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31GGV34YL36LPRRGPRL44
GVR47 ATRKTSERSQPRGRRQPIPKARRPEGRS75
SEQ ID №2:
6KPQRKTKRNTNRRPQDVKFPGGGQIV31GGV34YL36LPRRGPRL44GVR47ATRKTS
ERSQPRGRRQPIPKA68
SEQ ID №3:
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31GGV34YL36LPRRGPRL44
GVR47ATRKTS53.
Таким же образом, пептид или полипептид, эффективный в рамках настоящего изобретения, может представлять собой полипептид gag или капсульный полипептид ВИЧ.
В частности, речь идет о пептиде, соответствующем последовательности, согласующейся с белком Р25 ВИЧ-1, последовательность которого обозначена идентификатором последовательности SEQ ID №23 в приводимом перечне последовательностей.
SEQ ID №23:
293FRDYVDRFYKTLRAEQASQEVKNWMTETLLVQNANPDCKTILKALGPAATLE
ЕММТАС350.
Также речь может идти о пептиде, содержащем эпитоп gp41 ВИЧ-1, в частности, пептид последовательностей SEQ ID №№26-31:
SEQ ID №26: LGLWGCSGKLIC,
SEQ ID №27: LGIWGCSGKLIC,
SEQ ID №28: LGLWGCSGKHIC,
SEQ ID №29: LGMWGCSGKHIC,
SEQ ID №30: RILAVERYLKDQQLLGIWGCSGKLIC,
SEQ ID №31: RILAVERYLKDQQLLGIWGSGKLICTTAVPWNAS.
Применение полипептида gag или капсульного полипептида ВИЧ-2 в качестве связывающего и/или детектирующего антигена также входит в объем настоящего изобретения. В частности, речь идет о полипептиде gp36 последовательности SEQ ID №32 или SEQ ID №33, а именно:
SEQ ID №32: LNSWGCAFRQVC,
SEQ ID №33: RVTAIEKYLQDQARLNSWGCAFRQVCHTTV
PWVNDS.
Также речь может идти о полипептиде белка Р26 ВИЧ-2, например, о пептиде с последовательностью, гомологической относительно последовательности полипептида белка Р25, описанного идентификатором последовательности SEQ ID №23.
В объем изобретения входят также модифицированные пептиды или полипептиды, пригодные в качестве связывающих и/или детектирующих антигенов. В частности, имеются в виду фрагменты пептида капсида, содержащие, по меньшей мере, один модифицированный эпитоп. Таким образом, предметом изобретения является пептид или полипептид капсидного белка вируса гепатита С, содержащий, по меньшей мере, один нативный эпитоп и, по меньшей мере, один инактивированный эпитоп, причем этот инактивированный эпитоп не способен быть узнанным антителом против капсида. Предпочтительные пептиды характеризуются замещением двух, трех или четырех аминокислот, в частности, на участке, образованном аминокислотами 20-40, и на участке, образованном аминокислотами 44-47. Следующие мутации представляют особый интерес и являются предпочтительными:
- замещение аминокислот 34, 44 и 47 остатками глицина (последовательность SEQ ID №4, пептид обозначен как "Cap 1-75 (G34-G44-G47)"):
SEQ ID1 4: Cap 1-75 (G34-G44-G47)
1 MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31GGG34YL36LPRRGPRG
44GVG47ATRKTSERSQPRGRRQPIPKARRPEGRS75
- замещение аминокислот 31, 44 и 47 остатками глицина (последовательность SEQ ID1 5, пептид обозначен как "Cap 1-75 (G31-G44-G47));
SEQ ID1 5: Cap 1-75 (G31-G44-G47)
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIG31GGV34YL36LPRRGPRG44GVG47A
TRKTSERSQPRGRRQPIPKARRPEGRS75
- замещение аминокислот 36, 44 и 47 остатками глицина (последовательность SEQ ID1 6, пептид обозначен как "Cap 1-75 (G36-G44-G47));
SEQ ID1 6: Cap 1-75 (G36-G44-G47)
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31GGV34YG36LPRRGPRG44GVG47A
TRKTSERSQPRGRRQPIPKARRPEGRS75
- замещение аминокислот 34, 44 и 47 остатками глицина (последовательность SEQ ID17, пептид обозначен, как "Cap 6-68 (G34-G44-G47));
SEQ ID1 7: Cap 6-68 (G34-G44-G47)
6KPQRKTKRNTNRRPQDVKFPGGGQIV31GGG34YL36LPRRGPRG44GVG47 ATRKTS
ERSQPRGRRQPIPKA68
- замещение аминокислот 31, 44 и 47 остатками глицина (последовательность SEQ ID1 8, пептид обозначен как "Cap 6-68 (G31-G44-G47));
SEQ ID1 8: Cap 6-68 (G31-G44-G47)
6KPQRKTKRNTNRRPQDVKFPGGGQIG31GGV34YL36LPRRGPRG44 GVG47ATRKTS
ERSQPRGRRQPIPKA68
- замещение аминокислот 36, 44 и 47 остатками глицина (последовательность SEQ ID1 9, пептид обозначен как "Cap 6-68 (G36-G44-G47));
SEQ ID1 9: Cap 6-68 (G36-G44-G47)
6KPQRKTKRNTNRRPQDVKFPGGGQIV31GGV34YG36 LPRRGPRG44GVG47ATRKTS
ERSQPRGRRQPIPKARRPEGRS75
- замещение аминокислот 34, 44 и 47 остатками глицина (последовательность SEQ ID1 10, пептид обозначен как "Cap 1-53 (G34-G44-G47));
SEQ ID1 10: Cap 1-53 (G34-G44-G47)
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31 GGG34YL36LPRRGPRG44GVG47A
TRKTS53
- замещение аминокислот 31, 44 и 47 остатками глицина (последовательность SEQ ID1 11, пептид обозначен как "Cap 1-53 (G31-G44-G47));
SEQ ID1 11: Cap 1-53 (G31-G44-G47)
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIG31GGV34YL36LPRRGPRG44GVG47A
TRKTS53
- замещение аминокислот 36, 44 и 47 остатками глицина (последовательность SEQ ID1 12, пептид обозначен как "Cap 1-53 (G36-G44-G47));
SEQ ID1 12: Cap 1-53 (G36-G44-G47)
1 MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31GGV34YG36LPRRGPRG44GVG47A
TRKTS53
- делеция аминокислот 45 и 46:
SEQ ID113: Cap 1-75 (G34-del(45-46))
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31GGG34YL36LPRRGPRL44R47 ATR
KTSERSQPRGRRQPIPKARRPEGRS75
- изменение длины скелета:
SEQ ID1 14: Cap 1-75 (G34-BA45)
1 MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31GGG34YL36LPRRGPRL44βA45VR4
7ATRKTSERSQPRGRRQPIPKARRPEGRS75,
где βА означает β-аланин.
- изменение длины скелета в результате введения аминокислоты и мутаций:
SEQ ID115: Cap 1-75 (G34-G46-G46')
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIN31GGG34YL36LPRRGPRL44G45G46G4
6'R47ATRKTSERSQPRGRRQPIPKARRPEGRS75
- перемена полярности:
SEQ ID1 16: Cap 1-75 (nL29.-G30-G44.G47)
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGnL29G30V31GGV34YL36LPRRGPRG44GV
G47 ATRKTSERSQPRGRRQPIPKARRPEGRS75,
где nL означает nor-лейцин
- замещение аминокислот
SEQ ID1 17: Cap 1-75 (G34-F35-G44-G47)
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31GGG34F35L36LPRRGPRG44GVG47
ATRKTSERSQPRGRRQPIPKARRPEGRS75
- замещение аминокислот
SEQ ID1 18: Cap 1-75 (G34-hS35-G44-G47)
1MSTNPKPQRKTKRNTNRRPQDVKFPGGGQIV31GGG34hS35L36LPRRGPRG44GVG4
7ATRKTSERSQPRGRRQPIPKARRPEGRS75,
где hS означает гомосерин.
Также изобретение касается пептида или полипептида белка gag ВИЧ, содержащего, по меньшей мере, один нативный эпитоп и, по меньшей мере, один инактивированный эпитоп, при этом инактивированный эпитоп не способен быть узнанным антителом против того же белка gag. В частности, упомянутый полипептид содержит последовательность, согласующуюся с белком Р25 ВИЧ-1, и может замещаться одним, двумя, тремя, четырьмя и пятью аминокислотами, в частности, на участке, образованном аминокислотами 293-322. Предпочтительно, чтобы упомянутый видоизмененный полипептид содержал последовательность, согласующуюся с белком Р25 ВИЧ-1 (М), при котором аминокислоты 295, 298, 310 и 312 замещены остатком глицина, а аминокислота 316 - остатком фенилаланина:
293FRGYVGRFYKTLRAEQAGQGVKNFMTETLLVQNANPDCLTILKALGRAATLE
ЕММТАС350 (SEQ ID №22).
Во время применения этих пептидных последовательностей может оказаться целесообразным добавление аминокислот C-G-G- (т.е. Cys-Gly-Gly) в N-концевой позиции для упрощения их связывания с носителем или любой интересующей молекулой. Особо эффективным в этом отношении является пептид C-G-G-CAP 1-75 (G34-G44-G47).
Способы обнаружения
Изобретение предлагает в общем виде способ обнаружения in vitro инфекции, вызванной микроорганизмом, в биологической пробе, обеспечивающий одновременное обнаружение антигена упомянутого микроорганизма и антитела против него, присутствующих в биологической пробе, при этом способ включает в себя:
а) приготовление биологической пробы, содержащей связывающее антитело против микроорганизма и связывающий антиген, производный от этого микроорганизма;
б) инкубацию смеси в условиях, обеспечивающих образование комплексов "антигены-антитела";
в) выявление образовавшихся комплексов "антигены-антитела", при котором при необходимости применяется, по меньшей мере, одно меченое детектирующее антитело, способное связываться с антигеном упомянутого связанного микроорганизма, и/или, при необходимости, также меченый детектирующий антиген, способный связываться с антителом против связанного микроорганизма,
причем в данном способе связывающий (иммобилизованный) антиген упомянутого микроорганизма содержит или является фрагментом антигена этого микроорганизма, по меньшей мере, один эпитоп которого инактивирован, а
связывающее и/или детектирующее антитело узнает нативный эпитоп связанного антигена.
Само собой разумеется, что способ согласно изобретению не ограничивается применением одной только пары "антитело/антиген". Он может быть осуществлен путем применения нескольких разных связывающих антител и нескольких разных связывающих антигенов.
В частности, изобретением предлагается способ обнаружения in vitro инфекции, вызванной вирусом гепатита С, в биологической пробе, обеспечивающий одновременное обнаружение антигена вируса гепатита С и антитела против вируса гепатита С против упомянутого антигена вируса гепатита С, присутствующих в биологической пробе, при этом способ включает в себя:
а) приготовление биологической пробы, содержащей связывающее антитело против вируса гепатита С и связывающий антиген вируса гепатита С;
б) инкубацию смеси в условиях, обеспечивающих образование комплексов "антигены-антитела";
в) выявление образовавшихся комплексов "антигены-антитела", при котором при необходимости применяется, по меньшей мере, одно меченое детектирующее антитело, способное связываться с антигеном связанного вируса гепатита С, и/или, при необходимости, также меченый детектирующий антиген, способный связываться со связанным антителом против вируса гепатита С,
причем в данном способе связывающий антиген вируса гепатита С содержит или является фрагментом антигена вируса гепатита С, по меньшей мере, один эпитоп которого инактивирован,а
связывающее и/или детектирующее антитело узнает указанный нативный эпитоп связанного антигена.
Кроме того, изобретением предлагается способ обнаружения in vitro инфекции, вызванной вирусом иммунодефицита человека (ВИЧ), в биологической пробе, обеспечивающий одновременное обнаружение антигена ВИЧ и антитела ВИЧ против этого антигена ВИЧ, содержащихся в биологической пробе, при этом способ включает в себя:
а) приготовление биологической пробы, содержащей связывающее антитело против ВИЧ и связывающий антиген ВИЧ;
б) инкубацию смеси в условиях, обеспечивающих образование комплексов "антигены-антитела";
в) выявление образовавшихся комплексов "антигены-антитела", при котором при необходимости применяется, по меньшей мере, одно меченое детектирующее антитело, способное связываться с антигеном связанного ВИЧ, и/или, при необходимости, меченый детектирующий антиген, способный связываться со связанным антителом против ВИЧ,
причем в данном способе связывающий антиген ВИЧ содержит или является фрагментом антигена ВИЧ, по меньшей мере, один эпитоп которого инактивирован, а
связывающее и/или детектирующее антитело узнает указанный нативный эпитоп связанного антигена.
Данный способ позволяет обнаруживать преимущественно ВИЧ-1, ВИЧ-2 или одновременно ВИЧ-1 и ВИЧ-2. Следовательно, согласно рассмотренной альтернативе используемый связывающий антиген ВИЧ может содержать или являться связывающим антигеном ВИЧ-1, связывающим антигеном ВИЧ-2, связывающим антигеном ВИЧ-1 и ВИЧ-2 или комбинацией соответственно из связывающего антигена ВИЧ-1 и связывающего антигена ВИЧ-2.
Биологическая проба может быть, при необходимости, обработана на предварительной стадии или в нее могут быть введены связывающие антиген и антитело в условиях, способствующих экспозиции подлежащих обнаружению антигенов. Предпочтительно, чтобы проба обрабатывалась денатурирующим средством перед проведением обнаружения и премущественно до приведения в контакт с применяемыми антителами. В случае обнаружения капсида вируса гепатита С или белка gag ВИЧ таким денатурирующим средством может служить, в частности, один или несколько детергентов неионного типа, такие как, например, Nonidet P-40 (NP40) (трет-октилфенокси-поли(оксиэтилен)этанол, обозначаемый также как IGEPAL CA630), или же кислый раствор.
Такой комбинированный иммунологический анализ может проводиться в разных форматах, хорошо известных среднему специалисту: в виде твердой фазы или однородной фазы; в одну или две стадии; способом двойного сэндвича (сэндвич для двойного обнаружении антигенов и антител); или непрямым способом (для обнаружении антигена), в качестве неограничивающих примеров.
Согласно предпочтительному варианту выполнения связывающее антитело и связывающий антиген иммобилизованы на твердой фазе. Можно применять в качестве неограничивающих примеров твердой фазы микропланшеты, в частности, микропланшеты из полистирола, такие как предлагаемые на рынке "Nunc", Дания. Также можно применять твердые частицы или шарики, парамагнитные шарики, такие, как поставляемые "Dynal" или "Merck-Eurolab" (Франция) (под маркой Estapor®), а также пробирки из полистирола или полипропилена и т.д.
Особо предпочтителен формат иммуноанализа типа сэндвич с расположением между двумя антителами (связывающим и детектирующим) для обнаружении антигенов в биологической пробе, в то время как антитела могут быть выявлены применением связывающего антигена и меченого конъюгата, который закрепляется на антителе (согласно формату, обозначаемому обычно "непрямым форматом"), например, меченом белке А или меченом антителе против иммуноглобулина или против изотипа. Также можно эффективно выявлять антитела с использованием связывающего антигена и меченого антигена, которые закрепляются на антителе (согласно формату, обозначаемому как "сэндвич антиген-антитело-антиген" или "сэндвич из двойного антигена").
Возможен также конкурентный формат иммунологического анализа по обнаружению антигенов. Также возможны и другие виды иммунологического анализа, которые хорошо известны специалисту.
В целом согласно изобретению связывающее антитело и детектирующее антитело (в частности, используемое в способе сэндвич) выбираются таким образом, чтобы они узнавали выявляемый нативный антиген-мишень, присутствующий в биологической пробе, в виде нативного эпитопа, гомологичного инактивированному эпитопу на связывающем антигене, и чтобы они не узнавали инактивированный эпитоп на связывающем антигене.
Одновременное обнаружение антигена микроорганизма и антитела против него, в частности одновременное обнаружение антигена вируса гепатита С и антител против вируса гепатита С или же антигена ВИЧ и антител против ВИЧ, согласно изобретению может проводиться в одну стадию, а именно при одновременном приготовлении биологической пробы, детектирующих средств, таких как, в частности, детектирующее антитело (детектирующие антитела) одновременно со связывающим антителом (связывающими антителами) и связывающим антигеном (связывающими антигенами). В этом случае иммуноанализ по обнаружению антигена и иммуноанализ по обнаружению антител проводятся оба предпочтительно способом сэндвич. В качестве альтернативы детекторные средства, такие как, в частности, детектирующее антитело или детектирующие антитела, могут быть введены в смесь на второй стадии, т.е. после образования первых комплексов "антигены-антитела". В этом случае случае речь идет уже об анализе в две стадии.
Как уже указывалось выше, связывающий антиген может представлять собой, в частности, фрагмент антигена капсидного белка вируса гепатита С, при котором, по меньшей мере, один эпитоп инактивирован. Связывающий антиген может быть также образован фрагментом антигена неструктурного белка вируса гепатита С, в частности, но не исключительно, белка NS3 или NS4, при котором, по меньшей мере, один эпитоп также инактивирован. Наконец, связывающий антиген может быть образован комбинацией из фрагмента антигена капсидного белка, в котором, по меньшей мере, один эпитоп инактивирован, и фрагмента антигена неструктурного белка вируса гепатита С, т.е. NS3 или NS4, при котором, по меньшей мере, один эпитоп также инактивирован. Любой вариант, рассматриваемый специалистом, входит в состав изобретения.
Согласно предпочтительному варианту выполнения изобретения способ обнаружения инфекции, вызванной вирусом гепатита С, в биологической пробе включает в себя:
а) приготовление пробы, содержащей связывающие антитела против вируса гепатита С и связывающий антиген вируса гепатита С, иммобилизованных на твердой фазе;
б) инкубацию смеси в условиях, обеспечивающих образование комплексов "антигены-антитела";
в) разделение твердой и жидкой фаз;
г) приведение в контакт твердой фазы с меченым детектирующим антителом, способным связывать связанный антиген вируса гепатита С, и с меченым антителом или антителами против иммуноглобулина или против изотипа, способным связывать связанное антитело против вируса гепатита С,
причем антиген, связывающий антитело против вируса гепатита С, содержит или является фрагментом антигена капсидного белка вируса гепатита С, оба эпитопа которого инактивированы, а
связывающие и детектирующие антитела узнают каждый один из нативных эпитопов связанного капсидного антигена.
Согласно другому предпочтительному варианту выполнения способ согласно изобретению позволяет обнаружить инфекцию, вызванную вирусом иммунодефицита человека, таким как ВИЧ-1 или ВИЧ-2. Предпочтительно, чтобы при этом способе использовались одновременно связывающий антиген, производный от ВИЧ-1, и связывающий антиген, производный от ВИЧ-2, таким образом, чтобы можно было одновременно обнаружить антитела против ВИЧ-1 и против ВИЧ-2. В соответствии с этим предпочтительным вариантом способ согласно изобретению может применяться в одинаковой мере для выявления инфекции, вызванной ВИЧ-1 и/или ВИЧ-2.
Связывающий антиген содержит, по меньшей мере, один фрагмент антигена белка gag ВИЧ, например, белка Р25 ВИЧ-1 или Р26 ВИЧ-2, при котором, по меньшей мере, один эпитоп инактивирован. Связывающий антиген может также содержать фрагмент антигена капсульного белка ВИЧ, в частности, но не исключительно, белка gp41 ВИЧ-1 или белка gp36 ВИЧ-2. Наконец, связывающий антиген может состоять из комбинации фрагментов антигенов белка gag ВИЧ-1 или ВИЧ-2, дополняемой при необходимости фрагментами антигенов белка капсулы ВИЧ-1 и ВИЧ-2. Любой вариант, рассматриваемый специалистом, входит в объем изобретения.
Согласно предпочтительному варианту выполнения изобретения способ обнаружения инфекции, вызванной вирусом иммунодефицита человека (ВИЧ), в биологической пробе включает в себя:
а) приготовление пробы, содержащей связывающие антитела против ВИЧ и связывающий антиген ВИЧ, иммобилизованных на твердой фазе;
б) инкубацию смеси в условиях, обеспечивающих образование комплексов "антигены-антитела";
в) разделение твердой и жидкой фаз;
г) приведение в контакт твердой фазы с меченым детектирующим антителом, способным связывать связанный антиген ВИЧ, и с меченым антителом или антителами против иммуноглобулина или против изотипа, способным связывать связанное антитело против ВИЧ,
причем антиген для связывания антитела против ВИЧ содержит или является фрагментом антигена белка gag ВИЧ, по меньше мере, один эпитоп которого инактивирован, а
связывающие и детектирующие антитела узнают каждый один из нативных эпитопов связанного антигена gag.
Предпочтительно, чтобы способ согласно изобретению имел своей целью обнаружение инфекции, вызванной ВИЧ-1 или ВИЧ-2 или ВИЧ-1 и ВИЧ-2. Согласно последней альтернативе антиген, связывающий антитело против ВИЧ, представляет собой комбинацию из фрагмента белка gag ВИЧ-1 и фрагмента белка gag ВИЧ-2.
Для обнаружения присутствия образовавшихся комплексов "антигены-антитела" могут применяться количественные определения иммуноферментного твердофазного анализа, радиоиммунологических анализов и любого другого способа обнаружения. Один и тот же тип или несколько типов маркеров могут применяться для обнаружения, с одной стороны, антигена инфекционного микроорганизма, в частности, антигена вируса гепатита С или вируса иммунодефицита человека и, с другой стороны, антитела против инфекционного микроорганизма, в частности, антитела против вируса гепатита С или против ВИЧ.
Обнаружение присутствия антигенов или антител в биологической пробе может дополняться количественной оценкой, например измерением сигналов маркеров (цвет, люминесценция, радиоактивность, ...) с помощью стандартных способов, хорошо известных специалисту.
Наборы
Наборы и реактивы для обнаружения инфекции, вызванной микроорганизмом, таким как вирус гепатита С или вирус иммунодефицита человека, в биологической пробе согласно изобретению могут быть приготовлены для осуществления изобретения, являющегося простым и применимым для многочисленных биологических проб.
Следовательно, предметом изобретения является набор для обнаружения инфекции, вызванной микроорганизмом, в биологической пробе, содержащий:
- связывающий или детектирующий антиген, содержащий или являющийся фрагментом антигена белка микроорганизма, причем этот фрагмент содержит, по меньшей, мере один инактивированный эпитоп и полностью сохраняет способность связывать антитела против микроорганизма, вероятно, присутствующие в биологической пробе;
- антитело против нативного эпитопа белка микроорганизма.
Другим, отдельным предметом изобретения является набор для обнаружения инфекции, вызванной вирусом гепатита С, в биологической пробе, содержащий:
- связывающий или детектирующий антиген, содержащий или являющийся фрагментом антигена белка вируса гепатита С, причем этот фрагмент содержит, по меньшей мере, один инактивированный эпитоп и полностью сохраняет способность связывать антитела против вируса гепатита С, вероятно, присутствующие в биологической пробе;
- антитело против нативного эпитопа белка вируса гепатита С, являющееся преимущественно антителом для связывания указанного антигена вируса гепатита С, присутствующего в биологической пробе.
Еще одним предметом изобретения является набор для обнаружения инфекции, вызванной вирусом иммунодефицита человека (ВИЧ), в биологической пробе, содержащий:
- связывающий или детектирующий антиген, содержащий или являющийся фрагментом антигена белка ВИЧ, причем этот фрагмент содержит, по меньшей мере, один инактивированный эпитоп и полностью сохраняет способность связывать антитела против ВИЧ, вероятно, присутствующие в биологической пробе;
- антитело против нативного эпитопа белка ВИЧ, являющееся преимущественно антителом для связывания указанного антигена ВИЧ, присутствующего в биологической пробе.
Предпочтительно, чтобы такой набор содержал несколько антигенов и несколько связывающих антител.
Как уже указывалось выше, предпочтительно, чтобы связывающие антитело и антиген были иммобилизованы на твердой фазе, такой как микропланшета.
Предпочтительный набор включает в себя:
а) связывающий антиген, содержащий или являющийся фрагментом антигена белка вируса гепатита С, причем этот фрагмент содержит, по меньшей мере, два инактивированных эпитопа и полностью сохраняет способность связывать антитела против вируса гепатита С, вероятно, присутствующие в биологической пробе;
б) связывающее антитело против одного из нативных эпитопов белка вируса гепатита С;
причем связывающие антиген и антитело иммобилизованы на твердой фазе;
в1) меченое детектирующее антитело против другого из нативных эпитопов белка вируса гепатита С;
в2) и/или при необходимости меченый детектирующий антиген, содержащий или являющийся фрагментом антигена белка вируса гепатита С, причем этот фрагмент содержит, по меньшей мере, два инактивированных эпитопа и полностью сохраняет способность связывать антитела против вируса гепатита С, вероятно, присутствующие в биологической пробе.
Предпочтительно также, чтобы набор согласно изобретению содержал:
а) связывающий антиген, содержащий или являющийся фрагментом антигена белка ВИЧ, причем этот фрагмент содержит, по меньшей мере, один инактивированный эпитоп и полностью сохраняет способность связывать антитела против ВИЧ, вероятно, присутствующие в биологической пробе;
б) связывающее антитело против одного из нативных эпитопов белка ВИЧ, причем связывающие антиген и антитело иммобилизованы на твердой фазе;
в1) меченое детектирующее антитело против другого из нативных эпитопов белка ВИЧ;
в2) при необходимости меченый детектирующий антиген, содержащий или являющийся фрагментом антигена белка ВИЧ, причем этот фрагмент содержит, по меньшей мере, один инактивированный эпитоп и полностью сохраняет способность связывать антитела против ВИЧ, вероятно, присутствующие в биологической пробе.
Набор может дополнительно содержать средство для обнаружения указанных антител, присутствующих в биологической пробе и образующих комплекс со связывающим антигеном, например, меченое антитело против иммуноглобулина или против изотипа или же детектирующий антиген. Предпочтительно, чтобы детектирующий антиген являлся фрагментом антигена, например белка вируса гепатита С или ВИЧ, содержащим, по меньшей мере, один инактивированный эпитоп и полностью сохраняющим способность к связыванию антител (против вируса гепатита С или против ВИЧ), вероятно, присутствующих в пробе.
Также набор может включать в себя детергент, в частности, неионный, такой как NP40 (Sigma) или любой неионный эквивалентный детергент, известный специалисту.
Как уже описано выше, связывающий антиген в качестве детектирующего антигена может представлять собой, в частности, фрагмент капсидного белка вируса гепатита С, фрагмент, по меньшей мере, один эпитоп которого инактивирован, а связывающее и/или детектирующее антитело выбирается таким, чтобы можно было узнать нативный эпитоп капсидного белка.
В частности, предметом изобретения является набор реактивов, содержащий капсидный пептид вируса гепатита С с мутированными, по меньшей мере, двумя разными эпитопами, такой, как пептид 1-75 (G34-G44-G47), и пару антител, не способных узнать пептид 1-75 (G34-G44-G47), но узнающие соответствующую нативную последовательность вируса гепатита С.
В том случае когда обнаруженным микроорганизмом является ВИЧ, связывающий антиген в качестве детектирующего антигена, может быть, в частности, фрагментом белка gag ВИЧ, по меньшей мере, один эпитоп которого инактивирован, а связывающее и/или детектирующее антитело выбирается таким образом, чтобы можно было узнать нативный эпитоп белка gag.
В частности, предметом изобретения является набор реактивов, содержащий пептид белка Р25, мутированный, по меньшей мере, в одном отдельном эпитопе, такой как пептид с последовательностью SEQ ID №22, а также пару антител, не способных узнать пептид последовательности SEQ ID №22, но узнающих нативную последовательность белка Р25 ВИЧ-1.
Приводимые ниже фигуры и примеры поясняют изобретение без ограничения его объема.
Описание фигур
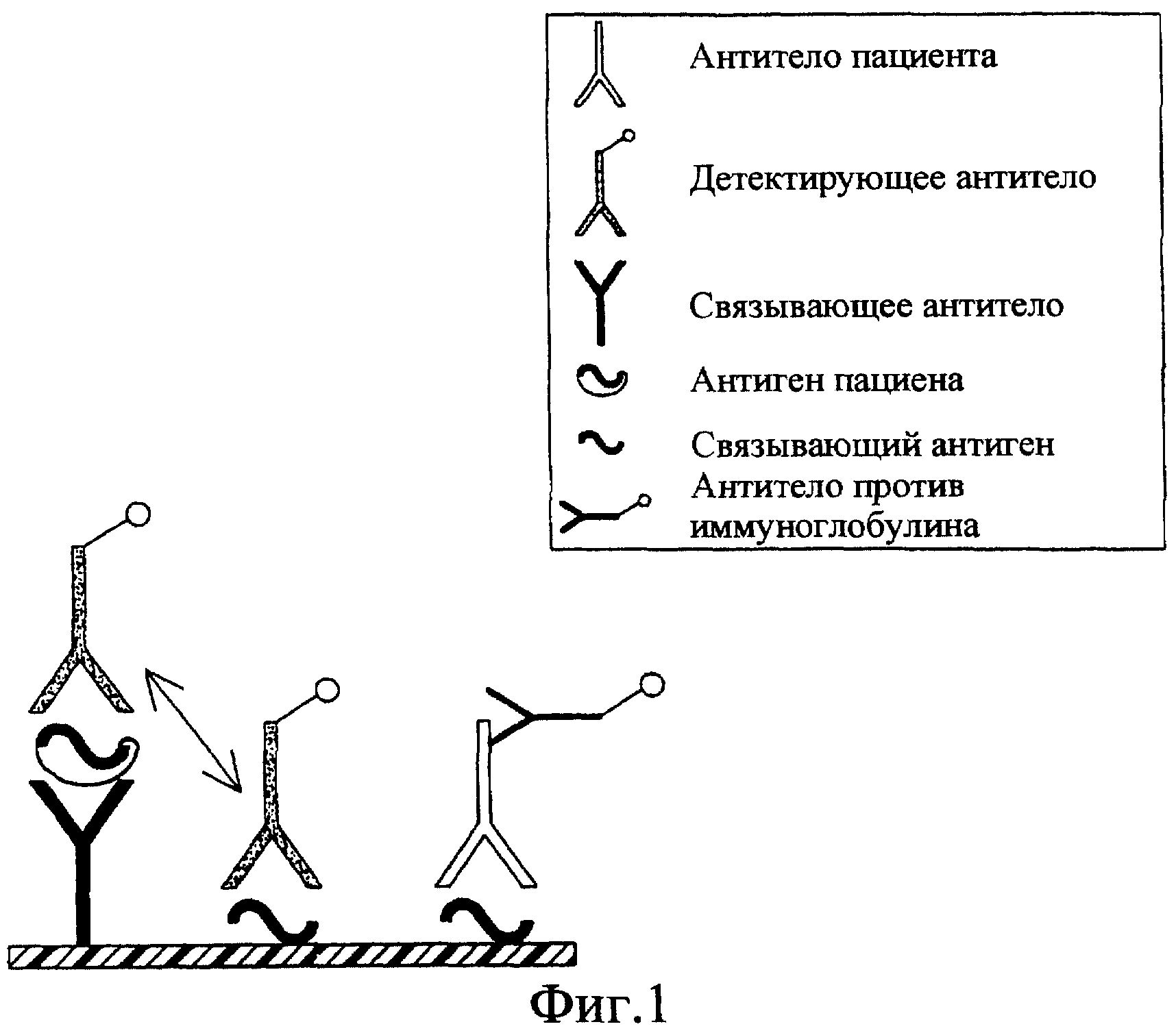
Фиг.1 - схема, иллюстрирующая один из способов обнаружения, применявшихся до изобретения с использованием иммобилизованных на твердой фазе связывающего антитела и немодифицированного связывающего антигена. Схема поясняет конкуренцию между антителом пациента и детектирующим антителом в отношении связи со связывающим антигеном.
Фиг.2 - схема, сравнивающая вариант выполнения настоящего изобретения. Поскольку связывающий антиген является мутированным, то он не может быть более узнан детектирующим антителом. Следовательно, будет отсутствовать интерференция между обнаружением антитела и обнаружением антигена.
ПРИМЕРЫ. Обнаружение инфекции, вызванной вирусом гепатита С
Материалы для протоколов 1a и 1b
Конъюгат моноклонального антитела против капсида-пероксидазы ("acm-POD"): конъюгат моноклонального антитела против капсида, Acm 2 (см. табл.1), меченного пероксидазой, получают в соответствии с протоколом, описанным в заявке на патент ЕР 0752102. Конъюгат меченного пероксидазой антитела Acm2 разбавляют раствором для первой стадии (описано ниже) таким образом, чтобы можно было получить в случае положительной пробы повышенную оптическую плотность (например, более 1,5 единицы) в условиях, которые хорошо известны специалисту.
Также применяется и другое моноклональное антитело против капсида Acm 1 (см. табл.1) для иммобилизации на твердой фазе (см. ниже).
Материалы для протокола 1с
Конъюгат моноклонального антитела против капсида-пероксидаза ("acm-POD"):
конъюгат моноклонального антитела против капсида, Acm (см. табл.1), меченного пероксидазой, получают в соответствии с протоколом, описанным в заявке на патент ЕР 0752102. Конъюгат меченного пероксидазой антитела Acm2 разбавляют раствором для первой стадии (описано ниже) таким образом, чтобы можно было получить в случае положительной пробы повышенную оптическую плотность (например, более 1,5 единицы) в условиях, которые хорошо известны специалисту.
Для иммобилизации на твердой фазе применяется другое моноклональное антитело против капсида, Acm 3 (см. табл.1) (см. ниже).
Материалы для протокола 1d
1) Конъюгат биотинилированного моноклонального антитела против капсида: конъюгат моноклонального антитела против капсида, Acm 5 (см. табл.1), меченного биотином, получают в соответствии с протоколом, описанным у Greg Т. Hermanson в 1996 г. Биотинилированное антитело Acm 5 разбавляют раствором для первой стадии (описано ниже) таким образом, чтобы можно было получить в случае положительной пробы повышенную оптическую плотность (например, более 1,5 единицы) в условиях, хорошо известных специалисту.
Для иммобилизации на твердой фазе применяется другое моноклональное антитело против капсида, Acm 1 (см. табл.1) (см. ниже).
2) Конъюгат стрептавидина, меченный пероксидазой: конъюгат стрептавидина, меченный пероксидазой, получают в соответствии с протоколом, описанным у Greg Т. Hermanson в 1996 г. Конъюгат стрептавидина, меченный пероксидазой, разбавляют раствором для второй стадии (описано ниже) таким образом, чтобы можно было получить в случае положительной пробы повышенную оптическую плотность (например, более 1,5 единицы) в условиях, хорошо известных специалисту.
Общие материалы для протоколов 1a, 1b, 1с и 1d
1) Твердая фаза: микропланшета Maxisorp, "Nunc" (Дания).
2) Растворы I и II протоколов согласно изобретению:
Раствор I: буферный раствор Tris, NaCl 0,05 М, рН 6,7, содержащий NP40 (трет. октилфенокси-поли(оксиэтилен)этанол - IGEPAL СА 630, Sigma) в количестве 0,25%.
Раствор II: буферный раствор цитрата (50 мМ), рН 6,7, и 20% глицерата, содержащий конъюгат поликлонального антитела мыши против IgG (Fc) человека, меченный пероксидазой (Jackson Immunoreseach Laboratories, США), в разведении, позволяющем в случае положительной пробы получить повышенную оптическую плотность (например, более 1,5 единиц) в условиях, хорошо известных специалисту.
3) Проявляющий раствор: проявляющий раствор был приготовлен из:
3а) субстратного буфера: раствор лимоной кислоты (0,075 М) и ацетата натрия (0,1 М), рН 4,0, содержащий Н2О2 в количестве 0,015% и диметилсульфоксид (PROLABO) в количестве 4% и
3б) хромогенного субстрата: тетраметилбензидин (Sigma) в конечной концентрации 0,7 мМ в субстратном буфере;
4) останавливающий раствор: 1 N H2SO4.
Способы
Протокол 1а: способ одновременного обнаружения капсидного антигена и антител (против капсида и против NS3, NS4) вируса гепатита С в пробе (сыворотка или плазма)
Способ основан на иммуноферментном анализе типа сэндвич для обнаружения антигена и непрямого иммуноферментного анализа для типа обнаружения антител.
Способ включает следующие стадии:
Готовят сенсибилизирующий раствор из:
- смеси антигенов вируса гепатита С: мутированный пептид C-G-G-Cap 1-75 (G34-G44-G47) (капсид), содержащий последовательность SEQ ID №4 и два рекомбинированных белка, полученных из клонов Escherichia coli, отобранных по неструктурным областям NS3 (клон NS3.1: АА 1192-1492) и NS4 (клон 5-1-1: АА 1694-1735) и
- моноклонального антитела против капсида (Acm 1) в буфере Tris 0,5 М, рН 7,4.
Лунки микропланшеты (Nunc, Maxisorp) сенсибилизировали указанным выше раствором из расчета 110 мкл на лунку.
Микропланшеты инкубировали в течение ночи при температуре окружающей среды (18-24°С).
После удаления сенсибилизирующего раствора планшеты промывали фосфатным буфером (0,01 М, рН 7,4), содержащим 0,1% Tween 20, затем блокировали фосфатным буфером (0,01М, рН 7), содержащим 5% сахарозы, 25% обезжиренного сухого молока (CandiaTM, Франция, или любое другое обезжиренное сухое молоко, аналогичное имеющемуся в продаже) и 10 мМ этилендиаминтетрауксусной кислоты (ЭДТА).
В каждую лунку последовательно добавляли 100 мкл раствора для первой стадии, содержащей моноклональные антитела против капсида Acm 2, меченные пероксидазой, и затем 50 мкл пробы (сыворотки или плазмы).
Планшеты инкубировали при 37° С в течение 1,5 ч. Присутствовавшие капсидные антигены вируса гепатита С связывались с моноклональными антителами, иммобилизованными Acm 1 на твердой фазе, и с моноклональными антителами против капсида Acm 2, меченными пероксидазой, образуя сэндвич-комплексы из этих двух антител. Если присутствовали антитела против вируса гепатита С, то таким же образом они связывались с антигенами, иммобилизованными на твердой фазе.
После этого планшеты промывали (трижды) промывочным раствором (буфер NaCl 0,01М, рН 7,4, содержащий Tween 20 в количестве 0,1%).
В каждую лунку добавляли 100 мкл раствора II, содержащего антитела против IgG человека, меченные пероксидазой. Планшеты инкубировали при температуре окружащей среды (18-24°С) в течение 30 минут. Меченые антитела против IgG человека связывались со специфическими антителами, связавшимися с твердой фазой.
Затем планшеты промывали (пятикратно) промывочным раствором (буфер Tris NaCl 0,01 М, рН 7,4, содержащий Tween 20 в количестве 0,1%). Таким образом, удаляли не связанный конъюгат против IgG человека.
В каждую лунку добавляли 100 мкл проявляющего раствора. Реакцию проводили в темноте в течение 30 минут при температуре окружающей среды (18-24°С).
Затем в каждую лунку добавляли 100 мкл останавливающего раствора.
После остановки реакции с помощью спектрофотометра определяли оптическую плотность при 450/620 нм.
Определение пороговой величины
Пороговую величину определяли после статистического анализа данных о специфичности и чувствительности посредством кривой ROC (Receiver Operating Characteristic) (Berck и Schultz, 1986 г.).
Исследование специфичности проводили на 1000 пробах, отобранных от здоровых лиц, а исследование чувствительности - на 200 положительных пробах, содержащих вирус гепатита С (в частности, в начале сероконверсии) на коммерческих панелях: BBI (Boston Biomedica Company, США), Impath (США), Serologicals (США), Nabi (США), ProMedDx (США).
Пороговая величина рассчитывалась по каждой планшете на основании сигнала положительной контрольной пробы, деленного на постоянный коэффициент X, специфический для теста. В приведенных примерах она составила около 0,280 единицы оптической плотности.
Как можно видеть из протокола, в противоположность некоторым известным из уровня техники способам связывание капсидного антигена и связывание антител против капсида происходили согласно настоящему изобретению в одной и той же белковой области капсида: область антигена, с которой связываются антитела против капсида (АА 1-75), включает специфическую область антигена (АА 44-47), через которую иммобилизованые антитела против капсида (amc 1) связывают капсидный антиген. Таким образом, согласно изобретению потеря некоторого количества антител против капсида при обнаружении сведена к минимуму, а чувствительность в результате этого возросла.
Протокол 1b: способ одновременного обнаружения капсидного антигена и антител (против NS3 и NS4) вируса гепатита С в пробе (сыворотка или плазма)
Способ основан на иммуноферментном анализе типа сэндвич для обнаружения антигена и непрямого иммуноферментного анализа для обнаружения антител.
Способ включает следующие стадии:
Готовят сенсибилизирующий раствор из:
- смеси антигенов вируса гепатита С: двух рекомбинированных белков, полученных из клонов Escherichia coli, отобранных по неструктурным областям NS3 (клон NS3.1: АА 1192-1492) и NS4 (клон 5-1-1: АА 1694-1735) и
- моноклональных антител против капсида (Acm 1) в буфере Tris 0,5 М, рН 7,4.
Лунки микропланшеты (Nunc, Maxisorp) сенсибилизировали указанным выше раствором из расчета 110 мкл на лунку.
Последующие стадии аналогичны стадиям протокола 1а.
Протокол 1с: способ одновременного обнаружения капсидного антигена и антител (против капсида и против NS3, NS4) вируса гепатита С в пробе (сыворотка или плазма)
Способ основан на иммуноферментном анализе типа сэндвич для обнаружения антигена и непрямого иммуноферментного анализа для обнаружения антител.
Способ включает следующие стадии:
Готовят сенсибилизирующий раствор из:
- смеси антигенов вируса гепатита С: мутированного пептида C-G-G-Cap 1-75 (G31-G44-G47) (капсид), содержащего последовательность SEQ ID №5, или мутированного пептида C-G-G-Cap 1-53 (G31-G44-G47), содержащего последовательность SEQ ID №11, или мутированного пептида C-G-G-Cap (G31-G44-G47), содержащего последовательность SEQ ID №8, и двух рекомбинированных белков, полученных из клонов Escherichia coli, отобранных по неструктурным областям NS3 (клон NS3.1: АА 1192-1492) и NS4 (клон 5-1-1: АА 1694-1735) и
- моноклональных антител против капсида (Acm 3) в буфере Tris 0,5 М, рН 7,4.
Лунки микропланшеты (Nunc, Maxisorp) сенсибилизировали указанным выше раствором из расчета 110 мкл на лунку.
Микропланшеты инкубировали в течение ночи при температуре окружающей среды (18-24°С).
После удаления сенсибилизирующего раствора планшеты промыли фосфатным буфером (0,01 М, рН 7,4), содержащим 0,1% Tween 20, затем блокировали фосфатным буфером (0,01 М, рН 7), содержащим 5% сахарозы, 25% обезжиренного сухого молока (CandiaTM, Франция, или любое другое обезжиренное сухое молоко, аналогичное имеющемуся в продаже) и 10 мМ этилендиаминтетрауксусной кислоты (ЭДТА).
В каждую лунку последовательно добавляли 100 мкл раствора для первой стадии, содержащего моноклональные антитела против капсида Acm 2, меченные пероксидазой, а затем 50 мкл пробы (сыворотки или плазмы).
Планшеты инкубировали при 37°С в течение 1,5 ч. Присутствовавшие капсидные антигены вируса гепатита С связывались с моноклональными антителами Acm 3, иммобилизованными на твердой фазе, и с моноклональными антителами против капсида Acm 1, меченными пероксидазой, образуя с этими двумя антителами сэндвич-комплексы. Если присутствовали антитела против вируса гепатита С, то таким же образом они связывались с антигенами, иммобилизованными на твердой фазе.
Последующие стадии были идентичны стадиям протокола 1а.
Как можно заключить в данном случае, связывание капсидного антигена и связывание антитела против капсида происходили согласно настоящему изобретению также в одной и той же белковой области капсида: область антигена, в которой связываются антитела против капсида (АА 1-75), включает специфическую область антигена (АА 29-34), посредством которой иммобилизованные антитела против капсида (acm 3) связывает капсидный антиген. Таким образом, согласно изобретению потеря некоторого количества антител против капсида при обнаружении сведена к минимуму, а чувствительность в результате этого возросла.
Протокол 1d: способ одновременного обнаружения капсидного антигена и антител (против капсида и против NS3, NS4) вируса гепатита С в пробе (сыворотка или плазма)
Способ основан на иммуноферментном анализе типа сэндвич для обнаружения антигена и непрямого иммуноферментного анализа для обнаружения антител.
Способ включает следующие стадии:
Готовят сенсибилизирующий раствор из:
- смеси антигенов вируса гепатита С: мутированного пептида C-G-G-Cap 1-75 (G34-G44-G47) (капсид), содержащего последовательность SEQ ID №4, или мутированного пептида C-G-G-Cap 1-75 (G34-G46-G46'), содержащего последовательность SEQ ID №15, или мутированного пептида C-G-G-Cap 1-75 (G34-ВА45), содержащего последовательность SEQ ID №14, и двух рекомбинированных белков, полученных из клонов Escherichia coli, отобранных по неструктурным областям NS3 (клон NS3.1: АА 1192-1492) и NS4 (клон 5-1-1: АА 1694-1735) и
- моноклональных антител против капсида (Acm 1) в буфере Tris 0,5 М, рН 7,4.
Лунки микропланшеты (Nunc, Maxisorp) сенсибилизировали указанным выше раствором из расчета 110 мкл на лунку.
Микропланшеты инкубировали в течение ночи при температуре окружающей среды (18-24°С).
После удаления сенсибилизирующего раствора планшеты промыли фосфатным буфером (0,01 М, рН 7,4) с содержанием 0,1% Tween 20, затем блокировали фосфатным буфером (0,01 М, рН 7), содержащим 5% сахарозы, 25% обезжиренного сухого молока (CandiaTM, Франция, или любое другое обезжиренное сухое молоко, аналолгичное имеющемуся в продаже) и 10 мМ этилендиаминтетрауксусной кислоты.
В каждую лунку последовательно добавляли 100 мкл раствора I, содержащего биотинилированные моноклональные антитела против капсида Acm 5, затем 50 мкл пробы (сыворотки или плазмы).
Планшеты инкубировали при 37°С в течение 1,5 ч.
Присутствовавшие капсидные антигены вируса гепатита С связывались с моноклональными антителами Acm 1, иммобилизованными на твердой фазе, и с биотинилированными моноклональными антителами против капсида Acm 5, образуя с этими двумя антителами сэндвич-комплексы.
Если присутствовали антитела против вируса гепатита С, то таким же образом они связывались с антигенами, иммобилизованными на твердой фазе.
После этого планшеты промывали (трижды) промывочным раствором (буфер NaCl 0,01 М, рН 7, 4, содержащий Tween 20 в количестве 0,1%).
В каждую лунку добавляли 100 мкл раствора II, содержащего антитела против IgG человека, меченные пероксидазой, и стрептавидин, меченный пероксидазой. Планшеты инкубировали при температуре окружающей среды (18-24°С) в течение 30 минут. Меченые антитела против IgG человека связывались со специфическими антителами, связавшимися с твердой фазой, а меченный пероксидазой стрептавидин связывался с биотинилированными антителами Acm 5, связавшимися с той же твердой фазой.
Последующие стадии были идентичны стадиям протокола 1а.
Как можно видеть и в данном случае, связывание капсидного антигена и связывание антител против капсида происходили согласно настоящему изобретению также в одной и той же белковой области капсида: область антигена, с которой связываются антитела против капсида (АА 1-75), включает специфическую область антигена (АА 44-47), посредством которой иммобилизованные антитела против капсида (Acm 1) связывает капсидный антиген. Таким образом, согласно изобретению потеря некоторого количества антител против капсида при обнаружении сведена к минимуму, а чувствительность в результате этого возросла.
Пример 1: обнаружение капсидного антигена вируса гепатита С в пробе (сыворотка или плазма) во время серологического окна
Пробы сыворотки или плазмы, отобранные от зараженных вирусом гепатита С пациентов, перенесенные на коммерческие панели (Impath, США) и оказавшиеся отрицательными в отношении антител и положительными в отношении нуклеиновой кислоты (PCR), тестировали способом, описанным в Протоколе 1а.
Результаты, приведенные в таблице 2, сопоставляли с результатами, полученными при PCR (полимеразной цепной реакции).
Таким образом, результаты, полученные способом согласно изобретению, коррелируют с результатами PCR. Следовательно, описанное изобретение позволяет достоверно обнаруживать капсидные антигены при еще отсутствующих антителах, т.е. в пробах, отобранных в период серологического окна.
Пример 2: обнаружение антител против капсида в пробах (сыворотка или плазма), отрицательных по антигену вируса гепатита С
Пробы сыворотоки или плазмы, отобранные от зараженных вирусом гепатита С пациентов, перенесенные на собственные и коммерческие панели и оказавшиеся положительными в отношении антител (капсида) и отрицательными в отношении антигена (капсида), тестировали способами, описанными в Протоколах 1а и 1b.
При отсутствии пептида 1-75 (G34-G44-G47) (содержащего последовательность SEQ ID №4) на твердой фазе (Протокол 1b) тестированные пробы (специфические по отношению к капсиду) не дали результатов, в то время как они оказались положительными в соответствии с Протоколом 1 и при проведении традиционного теста на антитела (см. табл.3).
Следовательно, изобретение позволяет обнаружить у лиц, зараженных вирусом гепатита С, положительные пробы по антителам против капсида и отрицательные по антигену капсида.
Пример 3: одновременное обнаружение капсидного антигена и антител против вируса гепатита С в пробе (сыворотка или плазма)
В соответствии с Протоколом 1а (см. таблицы 4, 5) тестировали две панели проб на сероконверсию PHV 907 и PHV 917 (т.е. две серии сывороток или плазм, полученных от двух пациентов, зараженных вирусом гепатита С или во время сероконверсии), предлагаемые на рынке BBI (Boston Biomedica Company, США).
Как следует из табл.4 и 5, присутствие вирусной РНК (тест PRC) коррелирует с положительным сигналом на антиген, полученном согласно Протоколу 1а согласно изобретению; таким же образом положительный ответ может быть получен на пробы на сероконверсию, являющиеся положительными в отношении антител и/или антигена. Это четко показывает, что двойное обнаружение (антигена капсида и антитела против капсида) может применяться одновременно при одном и том же анализе без интерференции.
Кроме того, описанное изобретение представляет совершенно особый интерес с точки зрения диагностики с помощью PCR, так как оно позволяет обнаруживать отрицательные пробы по PCR и положительные по антителам.
Пример 4: сравнение свойств различных мутированных пептидов для обнаружения антител против капсида
Пробы сыворотки или плазмы, отобранные от зараженных вирусом гепатита С пациентов, перенесенные на собственные и коммерческие панели и оказавшиеся положительными в отношении антител (капсида) и отрицательными в отношении антигена (капсида), тестировали способами, описанными в Протоколах 1с и 1d (см. таблицы 6 и 7).
В тестированных пробах мутированные пептиды, приведенные в таблице 6 для сравнения, обладают довольно схожими характеристиками.
Напротив, наиболее выраженные расхождения между пептидами в отношении ответной реакции показаны в таблице 7. Пептиды последовательностей SEQ ID №15 и SEQ ID №14 не позволяют детектировать некоторые разбавленные пробы с содержанием антикапсида, причем те же пробы узнаются при тестировании в чистом виде.
Пример 5: влияние одновременного обнаружения капсидного антигена и антитела против вируса гепатита С на диагностику и уменьшение серологического окна
Восемь стандартных панелей сероконверсии (BBI, США), (Impath, США) тестировали способом согласно изобретению (обозначенному как тест "Combo") при соблюдении протоколов 1а (с применением пептида C-G-G-Cap 1-75 (G34-G44-G47 с последовательностью SEQ ID №4), 1с (с применением пептида C-G-G-Cap 1-75 (G31-G44-G47) с последовательностью SEQ ID №5) и 1d (с применением пептида C-G-G-Cap 1-75 (G34-G44-G47) с последовательностью SEQ ID №4).
В таблице 8 приведены результаты, полученные при обнаружении антигена (тест "Иммуноферментный твердофазный анализ") или рибонуклеиновой кислоты (тест PCR), а также при обнаружении антител и при проведении теста "Combo" (форматы 1a, 1c, 1d), и касающиеся разных сероконверсии. Для 4 сероконверсии из 8 протоколы 1а, 1c и 1d позволяют обнаружить первую положительную пробу, совпадающую с появлением вирусной РНК, обнаруженной тестом PCR. Среднее количество суток, прошедших от обнаружения антигена до обнаружения антител, соответствующих уменьшению серологического окна, составляет 33 для двух протоколов 1а, 1c и 1d.
Пример 6: Сравнение свойств и классификация разных способов тестирования сывороток во время сероконверсии
21 стандартную панель (BBI, США; Impath, США) с разной специфичностью тестировали с помощью способа согласно изобретению согласно протоколам 1а, 1c и с помощью серии наиболее эффективных стандартных тестов согласно классификации MDA (Medical Devices Agency), выполненной в США в феврале 2002 г. При этом сравнении учитывалось количество суток запаздывания по отношению к обнаружению РНК (тестом PCR). Таким образом, набор, являющийся в целом минимальным, оказался наиболее эффективным для раннего обнаружения (таблица 9).
Последнюю пробу не детектировали: +3 суток добавлены произвольно.
Результаты, полученные согласно протоколам 1а, 1с и 1d согласно изобретению, позволяют в более ранний срок обнаружить инфекцию, вызванную вирусом гепатита С (опоздание составляет в среднем только 8 суток по сравнению PCR с протоколом 1а, 7,7 суток с протоколом 1с и 7,4 суток с протоколом 1d), т.е. до появления антител.
Таким образом, способ согласно изобретению занимает первое место в классификации благодаря трем протоколам (1a, 1c, 1d), предусматривающим применение пар антител и разных мутированных пептидов.
В заключение следует отметить, что результаты, полученные с помощью протоколов 1а, 1c и 1d согласно изобретению, свидетельствуют о том, что изобретение позволяет эффективно и очень рано обнаружить инфекцию, вызываемую вирусом гепатита С, при чувствительности, близкой к чувствительности PCR, полностью обеспечивая возможность прослеживания хода серологического развития заболевания пациента после сероконверсии.
Пример 7: исследование специфичности на основе трех протоколов "Combo" 1a, 1c, 1d
Исследование специфичности проводилось на основе проб сыворотки доноров крови (получены от "Etablissement Fransais du Sang" (Французское учреждение крови), (Рюнжи, Франция). Результаты, полученные согласно протоколам 1a, 1c, 1d, представлены соответственно в таблицах 10, 11, 12.
Независимо от применяемого протокола (1a, 1c, 1d) отмечаются хорошие показатели по специфичности.
Как следует из описания, благодаря связыванию капсидного антигена и антител против капсида в одной и той же белковой области капсида тест "Combo" для обнаружения вируса гепатита С неожиданно характеризуется чувствительностью, близкой к чувствительности PCR, и более высокой, чем чувствительность некоторых известных из уровня техники способов.
Этот результат оказался неожиданным, поскольку, изменяя пептиды-мишени капсида, существовала вероятность не обнаружить значительное количество антител.
Пример 8: обнаружение инфекции, вызванной вирусом иммунодефицита человека (ВИЧ-1)
Описанный в данном изобретении способ применим также для обнаружения инфекции, вызываемой любым видом инфекционных микроорганизмов (таких, как вирусы, например, вирусы, вызывающие различные гепатиты, ретровирусы, в частности, ретровирусы, вызывающие СПИД у человека (ВИЧ-1, ВИЧ-1 группы О, ВИЧ-2) или обезьяны, цитомегаловирус, флавивирусы, в их числе вирусы лихорадки денге, а также бактерии, микробные паразиты и пр.), для которых требуется одновременное обнаружение антигенов и антител.
В примере 8 показано применение данного изобретения для одновременного обнаружения антигена Р25 (gag) вируса иммунодифицита человека (ВИЧ-1) и антител против Р25.
Общие материалы для протоколов а, b, с
1) Выбранная твердая фаза: микропланшета Maxisorp, "Nunc", Дания.
2) Раствор I: буфер Tris, NaCl 0,05 M, рН 6,7, содержащий NP40 (IGEPAL СА 630, Sigma) в количестве 0,25%.
3) Раствор II: буфер Tris NaCl 0,01 М, рН 7,4, содержащий Tween 20 в количестве 0,1%.
4) Проявляющий раствор, содержащий:
4а) субстратный буферный раствор: раствор лимонной кислоты (0,075 М) и ацетата натрия (0,1 М) рН 4,0, содержащий H2O2 в количестве 0,015%, и диметилсульфоксида (PROLABO) в количестве 4% и
4б) хромогенный субстрат: тетраметилбензидин (Sigma) с конечной концентрацией 0,7 мМ в субстратном буферном растворе.
5) Останавливающий раствор: IN H2SO4.
Материалы для протокола а: обнаружение антител Р25 ВИЧ-1
Мутированный синтетический пептид соответствует последовательности SEQ ID №22:
293FRGYVGRFYKTLRAEQAGQGVKNFMTETLLVQNANPDCKTILKALGPAATLE
ЕММТАС350
и содержит мутации (G295-G298-G310-G312-F316) по отношению к последовательности, согласующейся с белком Р25 ВИЧ-1, т.е. SEQ ID №23:
293 FRDYVDRFYKTLRAEQASQEVKNWMTETLLVQNANPDCKTILKALGPAATLE
EMMNAC350
Конъюгат поликлональных антител барана против IgG (H+L) человека, меченный пероксидазой (Bio-Rad). Перед применением конъюгат разводили раствором II (описан выше) таким образом, чтобы для положительной пробы можно было получить повышенную оптическую плотность в условиях, хорошо известных среднему специалисту.
Материалы для протокола b: обнаружение антигена Р25 ВИЧ-1
Моноклональные антитела против Р25 Рm25, узнающие последовательность белка Р25 ВИЧ-1 М:
30QASQEVKNWMTETLL322 (SEQ ID №24).
Конъюгат моноклональных антител Pm25, описанный выше, меченный пероксидазой. Перед применением конъюгат разводили раствором II (описан выше) таким образом, чтобы для положительной пробы можно было получить повышенную оптическую плотность в условиях, хорошо известных среднему специалисту.
Материалы для протокола с: одновременное обнаружение ("Combo") антител против Р25 и антигена Р25 ВИЧ-1
Мутированный синтетический пептид соответствовал последовательности SEQ ID №22:
293FRGYVGRFYKTLRAEQAGQGVKNFMTETLLVQNANPDCKTILKALGPAATLE
ЕММТАС350.
Моноклинальное антитело Рm25, узнающее последовательность белка Р25 ВИЧ-1 М:
308QASQEVKNWMTETLL322 (SEQ ID №24).
Конъюгат поликлональных антител барана против IgG (H+L) человека, меченный пероксидазой (Bio-Rad).
Конъюгат моноклональных антител Рm25 описан выше и мечен пероксидазой.
Оба приведенных выше конъюгата иммунопероксидазы разводили совместно перед применением раствором для второй стадии (описан выше) таким образом, чтобы можно было получить в случае положительной пробы повышенную оптическую плотность в условиях, хорошо известных специалисту.
Способы
Протокол а: обнаружение антител против Р25 ВИЧ-1
Способ основан на непрямом иммуноферментном анализе для обнаружения антител против Р25 ВИЧ-1.
Способ включает следующие стадии:
Готовили сенсибилизирующий раствор, содержащий мутированный пептид SEQ ID №22 (G295-G298-G310-G312-F316), содержащий последовательность SEQ ID №22, в карбонатном буфере с рН 9,6.
Лунки микропланшеты (Nunc, Maxisorp) сенсибилизировали указанным выше раствором из расчета 110 мкл на лунку.
Микропланшеты инкубировали в течение ночи при температуре окружающей среды(18-24°С).
После удаления сенсибилизирующего раствора планшеты промыли фосфатным буфером (0,01М, рН 7,4), содержащим 0,1% Tween 20, затем блокировали фосфатным буфером (0,01 М, рН 7), содержащим 5% сахарозы, 25% обезжиренного сухого молока (CandiaTM, Франция, или любое другое обезжиренное сухое молоко, аналогичное имеющемуся в продаже).
В каждую лунку последовательно добавляли по 80 мкл раствора I и затем 20 мкл пробы (сыворотки или плазмы).
Планшеты инкубировали при 37°С в течение 1 ч. Если антитела против Р25 ВИЧ-1 присутствуют, то они связываются с пептидом, иммобилизованным на твердой фазе.
После этого планшеты промывали (трижды) промывочным раствором (буфер Tris NaCl 0,01 М, pH 7,4, содержащий Tween 20 в количестве 0,1%).
В каждую лунку помещали по 100 мкл раствора II, содержащего антитела против IgG человека, меченные пероксидазой. Планшеты инкубировали при температуре окружащей среды (18-24°С) в течение 30 минут. Меченые антитела против IgG человека связывались со специфическими антителами, связавшимися с твердой фазой.
После этого лунки промывали (пятикратно) промывочным раствором (буфер Tris NaCl 0,01 М, pH 7,4, содержащий Tween 20 в количестве 0,1%). Таким образом, удалялся несвязанный конъюгат против IgG человека.
В каждую лунку добавляли по 100 мкл проявляющего раствора. Планшеты инкубировали в темноте 30 минут при температуре окружающей среды (18-24°С).
После этого в каждую лунку добавляли по 100 мкл останавливающего раствора.
После остановки реакции с помощью спектрофотометра определяли оптическую плотность при 450/620 нм.
Протокол b: обнаружение антигена Р25 ВИЧ-1
Способ основан на иммуноферментном анализе типа сэндвич для обнаружения антител Р25 ВИЧ-1.
Способ включает следующие стадии:
Готовили сенсибилизирующий раствор, содержащий моноклональные антитела против Р25 ВИЧ-1 (Рm25) в карбонатном буфере с pH 9,6.
Лунки микропланшеты (Nunc, Maxisorp) сенсибилизировали указанным выше раствором из расчета 110 мкл на лунку.
Последующие стадии аналогичны стадиям протокола "а" до второй стадии.
На второй стадии в лунки добавляли 100 мкл раствора II, содержавшего моноклональные антитела Pm25, меченные пероксидазой. Планшеты инкубировали при температуре окружающей среды (18-24°С) в течение 30 минут. Меченые моноклональные антитела Pm25 связывались с антигеном Р25, иммобилизованном на твердой фазе, в случае его присутствия.
Конечные стадии аналогичны стадиям протокола "а".
Протокол с: одновременное обнаружение (Combo) антигена Р25 ВИЧ-1 и антител против Р25 ВИЧ-1 в пробе (сыворотка или плазма)
Способ на иммуноферментном анализе типа сэндвич для обнаружения антигена и непрямого иммуноферментного анализа стадии для обнаружения антител.
Способ включает следующие стадии:
Готовят сенсибилизирующий раствор, содержащий:
- мутированный пептид SEQ ID №22 (G295-G298-G310-G312-F316) и
- моноклональные антитела против Р25 (Pm25) в карбонатном буфере с рН 9,6.
Лунки микропланшеты (Nunc, Maxisorp) сенсибилизировали указанным выше раствором из расчета 110 мкл на лунку.
Микропланшеты инкубировали в течение ночи при температуре окружающей среды (18-24°С).
После удаления сенсибилизирующего раствора планшеты промыли фосфатным буфером (0,01 М, рН 7,4), содержщим 0,1% Tween 20, и блокировали фосфатным буфером (0,01 М, рН 7), содержщим 5% сахарозы, 25% обезжиренного сухого молока (CandiaTM, Франция, или любое другое обезжиренное сухое молоко, аналогичное имеющемуся в продаже).
В каждую лунку последовательно добавляли по 80 мкл раствора I и затем 20 мкл пробы (сыворотки или плазмы).
Планшеты инкубировали при 37°С в течение 1 ч. Присутствующий антиген Р25 связывается с моноклональными антителами, иммобилизованными на твердой фазе. Антитела против Р25 связываются с пептидным антигеном, иммобилизованным на твердой фазе.
Последующие стадии аналогичны стадиям протокола 1а до второй стадии.
На второй стадии добавляли 100 мкл раствора II, содержавшего моноклональные антитела Pm25, меченные пероксидазой, и антитела против IgG (H+L) человека, меченные пероксидазой. Планшеты инкубировали при температуре окружающей среды (18-24°С) в течение 30 минут. Меченые моноклональные антитела Pm25 связывались с антигеном Р25, иммобилизованным на твердой фазе. Меченые антитела против IgG (H+L) человека связывались, в свою очередь, со специфическими антителами, связавшимися с твердой фазой.
Конечные стадии аналогичны стадиям протокола "а".
Как следует из приведеных результатов, связывание антигена Р25 ВИЧ-1 и связывание антител против Р25 ВИЧ-1 происходят согласно изобретению в одной и той же белковой области капсида: область антигена, с которой связываются антитела против Р25 (АА293-350), включает и специфическую область антигена (АА308-322), с которой иммобилизованные антитела против Р25 (Pm25) связывают антиген Р25.
Само собой разумеется, что специалист, руководствующийся приведенным примером 8, например, мог бы легко осуществить иммуноанализ по одновременному обнаружению антигена Р25 (gag) ВИЧ-1, антител против Р25 ВИЧ-1 и антитела против гликопротеина gp41 (капсулы) ВИЧ-1. Для обнаружения антител против gp41 ВИЧ-1 достаточно использовать - в качестве неограничивающего примера - либо полный природный или рекомбинантный гликопротеин gp4, известный из уровня техники, либо пептид, содержащий иммунодоминантный эпитоп гликопротеина gp41, такой как описанный в публикации Gnann, JW., и др., 1987 г.
В объем изобретения входят также иммуноанализы по одновременному обнаружению антигена Р26 (gag) ВИЧ-2, антител против Р26 ВИЧ-2 и антител против гликопротеина gp36 (капсулы) ВИЧ-2. Для обнаружения антигена Р26 специалист может использовать антитела против Р26, известные из уровня техники, а для обнаружения антител против Р26 - пептидные антигены Р26, например, производные от последовательности ВИЧ-2, опубликованной Guyader и др., 1987 г. Для обнаружения антител против gp36 специалист может использовать - в качестве неограничивающего примера - либо полный природный или рекомбинантный гликопротеин gp36, известный из уровня техники, либо пептид, содержащий иммунодоминантный эпитоп гликопротеина gp36, такой как описанный в публикации Gnann, JW., и др., 1987 г.
Он также может легко осуществить иммуноанализ "Combo ВИЧ-1+ВИЧ-2", сочетая обнаружение одновременно антигена Р25 ВИЧ-1, антигена Р26 ВИЧ-2, антител против Р25 ВИЧ-1, антител против Р26 ВИЧ-2, антител против gp41 ВИЧ-1 и антител против gp36 ВИЧ-2, который также входит в объем настоящего изобретения.
Источники информации
Alcon et al., J. of Clin. Microbiol., 2002, vol. 40(2), pp.376-381.
Atherton et al. (1989) "solid phase peptide synthesis, a practical approach", IRL Press, Oxford University Press, pp.25-34.
Benoit et al, (1982) PNAS USA, 79, pp.917-921.
Berck et Schultz, (1986), Arch. Pathol. Lab. Med., 10, pp.13-20.
Bukh, Semin. Liver Dis. (1995) 15: 41-63;
Cerino et al., (1991), J. Immunology, Vol.147(8), pp.2692-2696.
Clayes et al. (1995), J of Medical Virology, 45, pp.273-281.
Garson et al., (1990) Lancet, 336, pp.878-879.
Gnann, JW, et al. (1987) Science, 237: pp.1346-1349.
Guyader et al. (1987) Nature 326, pp.662-669.
Hajime Tokita et al. (2000) J. Clin. Microbiol, Vol.38, pp.3450-3452.
Harlow et al. (1988) ed., "Antibodies: a laboratory manual".
Hermanson Greg Т., (1996) Bioconjugate techniques, Academic Press, New York, pp.373-380 et pp.580-583.
Hosein et al. (1991) PNAS Vol.88, May, pp.3647-3651.
Icardi et al. (2001) J. Clin. Microbiol., 39, pp.3110-3114.
Ishida, (1993), J. Clin. Microbiol., Vol.31, No.4,, pp.936-940.
Kohler et Milstein, (1975) Nature, 256, pp.495-497.
Leahy et al. (1991) Third International Symposium on HCV, Strasbourg, poster B35.
Maiolini et al., (1978) Journal of lmmunological Methods, 20, pp.25-34.
Marks et al. (1991) J. Mol. Biol, 222, pp.581-597.
Merrifield (1963) J. Amer. Chem. Soc" 85, pp.2149-2154.
Nasoffet al. (1991) PNAS Vol.88, No.12, pp.5462-5466.
Okamoto et al. (1990a) Japan J. Exp.Med., vol.60(3), pp.167-177.
Okamoto et al. (1990b) Japan J. Exp.Med., vol. 60(4), pp.223-233.
Peterson et al. (2000) Vox sanguinis, Vol.78, pp.80-85.
Ratner et al. (1985) Nature, 313, pp.277-284.
Sallberg et al. (1992) J. Clin. Microbiology, Vol.30(8), pp.1989-1994.
Sanchez-Pescador et al. (1985) Science, 227, pp.484-492.
Scott et al. (1990), Science, 249, pp.386-390.
Sheppard, dans «Peptides 1971», Nesvadba H (ed.) North Holland, Amsterdam, p.111.
Shieh et al. (1991) Laboratory Investigation Vol.65, No.4, pp.408-411.
Simmonds, (1995), Hepatology,, 21, pp.570-583.
Stuyveretal. (1994), P.N.A.S. USA, 91, pp.10134-10138.
Takahashi et al. (1992) J. Gen. ViroL, Vol.73(3)" London, pp.667-672.
Wain-Hobson et al. (1985) Cell, 40, pp.9-17.
Yang et al. (1995) Clin. Exp Immunol, 101, pp.272-277.
Yang et al. (1999), J of Medical Virology, 57, pp.345-350.
Реферат
Изобретение относится к области медицины, а именно к диагностике in vitro инфекции, вызванной микроорганизмом, а также касается применения реактивов и наборов для обнаружения антигенов и антител против инфекционного микроорганизма. Проводится одновременное обнаружение антигена микроорганизма и антител против данного антигена. Для обнаружения инфекции осуществляют контактирование биологической пробы со связывающим антителом против микроорганизма и связывающим антигеном из данного микроорганизма. Смесь инкубируют и выявляют образовавшиеся комплексы «антиген-антитело», с использованием меченых в случае необходимости детектирующего антитела и/или детектирующего антигена, при этом связывающий и/или меченый детектирующий антиген содержит фрагмент антигена микроорганизма, по меньшей мере, один эпитоп которого инактивирован, а связывающее и/или детектирующее антитело узнает нативный эпитоп связавшегося антигена. Предложены также набор и для обнаружения инфекции и пептиды или полипептиды белков вируса гепатита С и ВИЧ, с помощью которых возможно осуществление способа диагностики данных заболеваний. Использование способа позволяет повысить точность диагностики инфекции, вызванной микроорганизмом. 4 н. и 38 з.п. ф-лы, 13 табл., 2 ил.

Комментарии