Композиции и способы селективной деградации белка - RU2020115889A
Код документа: RU2020115889A
Формула
1. Слитый полипептид, содержащий полипептид, связывающий соединение формулы (I) (COF1)/CRBN (цереблон), и гетерологичный полипептид, например, гетерологичный полипептид млекопитающего, бактериальный или вирусный полипептид, где соединение формулы (I) представляет собой:
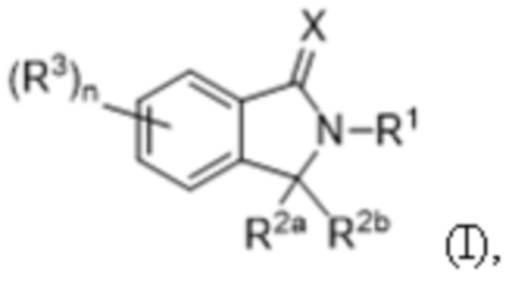
или его фармацевтически приемлемую соль, сложный эфир, гидрат, сольват или таутомер, где:
X представляет собой O или S;
R1 представляет собой C1-С6алкил, C2-С6алкенил, C2-С6алкинил, C1-С6гетероалкил, карбоциклил, гетероциклил, арил или гетероарил, каждый из которых независимо и необязательно замещен одним или несколькими R4;
каждый из R2aи R2b независимо представляет собой водород или C1-С6алкил; или R2aи R2b вместе с атомом углерода, к которому они присоединены, образуют карбонильную группу или тиокарбонильную группу;
каждый из R3 независимо представляет собой C1-С6алкил, C2-С6алкенил, C2-С6алкинил, C1-С6гетероалкил, галоген, циано, -C(O)RA, -C(O)ORB, -ORB, -N(RC)(RD), -C(O)N(RC)(RD), -N(RC)C(O)RA, -S(O)xRE, -S(O)xN(RC)(RD) или -N(RC)S(O)xRE, где каждый алкил, алкенил, алкинил и гетероалкил независимо и необязательно замещен одним или несколькими R6;
каждый R4 независимо представляет собой C1-С6алкил, C2-С6алкенил, C2-С6алкинил, C1-С6гетероалкил, галоген, циано, оксо, -C(O)RA, -C(O)ORB, -ORB, -N(RC)(RD), -C(O)N(RC)(RD), -N(RC)C(O)RA, -S(O)xRE, -S(O)xN(RC)(RD), -N (RC)S(O)xRE, карбоциклил, гетероциклил, арил или гетероарил, где каждый алкил, алкенил, алкинил, гетероалкил, карбоциклил, гетероциклил, арил и гетероарил независимо и необязательно замещен одним или несколькими R7;
каждый из RA, RB, RC, RD и RE независимо представляет собой водород или C1-С6алкил;
каждый R6 независимо представляет собой C1-С6алкил, оксо, циано, -ORB, -N(RC)(RD), -C(O)N(RC)(RD), -N(RC)C(O)RA, арил или гетероарил, где каждый арил и гетероарил независимо и необязательно замещен одним или несколькими R8;
каждый R7 независимо представляет собой галоген, оксо, циано, -ORB, -N(RC)(RD), -C(O)N(RC)(RD) или -N(RC)C(O)RA;
каждый R8 независимо представляет собой C1-С6алкил, циано, -ORB, -N(RC)(RD), -C(O)N(RC)(RD) или -N(RC)C(O)RA;
n составляет 0, 1, 2, 3 или 4; и
x составляет 0, 1 или 2.
2. Слитый полипептид по п. 1, где:
(i) ассоциация слитого полипептида с CRBN в отсутствие COF1 составляет, например, не более 0,01%, 0,1%, 1%, 5%, 10%, 15% или 20% от ассоциации слитого полипептида с CRBN в присутствии COF1, например, избытка COF1, например, как измерено с помощью анализа, описанного в данном документе, например, иммунопреципитации;
(ii) слитый полипептид не связывается с CRBN в отсутствие COF1;
(iii) убиквитинирование слитого полипептида в отсутствие COF1 составляет, например, не более 0,01%, 0,1%, 1%, 10%, 20%, 30%, 40%, 50%, 60% или 70% от убиквитинирования слитого полипептида в присутствии COF1, например, избытка COF1, например, как измерено с помощью анализа, описанного в данном документе; или
(iv) деградация слитого полипептида в отсутствие COF1 составляет, например, не более 0,01%, 0,1%, 1%, 10%, 20%, 30%, 40%, 50%, 60% или 70% от деградации слитого полипептида в присутствии COF1, например, избытка COF1, например, как измерено с помощью анализа, описанного в данном документе, например, вестерн-блоттинг-анализа или анализа посредством проточной цитометрии.
3. Слитый полипептид по п. 1 или 2, где:
(i) COF1/CRBN-связывающий полипептид составляет от 10 до 95 аминокислотных остатков в длину, от 15 до 90 аминокислотных остатков в длину, от 20 до 85 аминокислотных остатков в длину, от 25 до 80 аминокислотных остатков в длину, от 30 до 75 аминокислотных остатков в длину, от 35 до 70 аминокислотных остатков в длину, от 40 до 65 аминокислотных остатков в длину, от 45 до 65 аминокислотных остатков в длину, от 50 до 65 аминокислотных остатков в длину или от 55 до 65 аминокислотных остатков в длину;
(ii) COF1/CRBN-связывающий полипептид содержит в направлении от N-конца к C-концу: первую бета-нить, бета-шпильку, вторую бета-нить, первую альфа-спираль и вторую альфа спираль, необязательно, где бета-шпилька и вторая альфа-спираль разделены не более чем 60, 50, 40 или 30 аминокислотными остатками;
(iii) COF1/CRBN-связывающий полипептид содержит COF1/CRBN-связывающую последовательность из встречающегося в природе полипептида или его COF1/CRBN-связывающего варианта, например, встречающегося в природе полипептида IKZF или его COF1/CRBN-связывающего варианта, например, встречающегося в природе IKZF1, IKZF2, IKZF3, IKZF4, IKZF5 или их COF1/CRBN-связывающего варианта;
(iv) COF1/CRBN-связывающий полипептид содержит полипептид IKZF или его структурный мотив, необязательно, где полипептид IKZF представляет собой полипептид IKZF1, полипептид IKZF3, полипептид IKZF2 с заменой H141Q (пронумерованной в соответствии с SEQ ID NO: 21) или полипептид IKZF4 с заменой H188Q (пронумерованной в соответствии с SEQ ID NO: 22);
(v) COF1/CRBN-связывающий полипептид содержит от приблизительно 10 до приблизительно 95 аминокислотных остатков, от приблизительно 15 до приблизительно 90 аминокислотных остатков, от приблизительно 20 до приблизительно 85 аминокислотных остатков, от приблизительно 25 до приблизительно 80 аминокислотных остатков, от приблизительно 30 до приблизительно 75 аминокислотных остатков, от приблизительно 35 до приблизительно 70 аминокислотных остатков, от приблизительно 40 до приблизительно 65 аминокислотных остатков, от приблизительно 45 до приблизительно 65 аминокислотных остатков, от приблизительно 50 до приблизительно 65 аминокислотных остатков или от приблизительно 55 до приблизительно 65 аминокислотных остатков из IKZF1 или IKZF3;
(vi) COF1/CRBN-связывающий полипептид содержит аминокислотные остатки 136-180 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19) (например, COF1/CRBN-связывающий полипептид содержит аминокислотную последовательность под SEQ ID NO: 5) или последовательность, которая отличается от аминокислотных остатков 136-180 из IKZF3 (пронумерованных в соответствии с SEQ ID NO: 19) не более чем 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотными остатками (например, последовательность, которая отличается от аминокислотных остатков 136-180 из SEQ ID NO: 19 не более чем 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотными остатками) (например, последовательность, имеющую не более 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотных замен по сравнению с аминокислотными остатками 136-180 из SEQ ID NO: 19);
(vii) COF1/CRBN-связывающий полипептид содержит аминокислотные остатки 136-170 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19) (например, COF1/CRBN-связывающий полипептид содержит аминокислотную последовательность под SEQ ID NO: 6) или последовательность, которая отличается от аминокислотных остатков 136-170 из IKZF3 (пронумерованных в соответствии с SEQ ID NO: 19) не более чем 1, 2, 3, 4, 5, 10, 15, 20, 25 или 30 аминокислотными остатками (например, последовательность, которая отличается от аминокислотных остатков 136-170 из SEQ ID NO: 19 не более чем 1, 2, 3, 4, 5, 10, 15, 20, 25 или 30 аминокислотными остатками) (например, последовательность, имеющую не более 1, 2, 3, 4, 5, 10, 15, 20, 25 или 30 аминокислотных замен по сравнению с аминокислотными остатками 136-170 из SEQ ID NO: 19);
(viii) COF1/CRBN-связывающий полипептид содержит аминокислотную последовательность, характеризующуюся по меньшей мере 85% идентичностью с SEQ ID NO: 3, где один, два, три или все из следующих аминокислотных остатков COF1/CRBN-связывающего полипептида остаются неизмененными относительно соответствующих остатков в SEQ ID NO: 3: глутамин в положении 147, цистеин в положении 148, глутамин в положении 150, глицин в положении 152, лейцин в положении 161 или лейцин в положении 162, пронумерованные в соответствии с SEQ ID NO: 19;
(ix) COF1/CRBN-связывающий полипептид содержит аминокислотные остатки 136-139 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19), например, COF1/CRBN-связывающий полипептид содержит аминокислотную последовательность под SEQ ID NO: 40;
(x) COF1/CRBN-связывающий полипептид содержит аминокислотные остатки 136-180 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19), например, COF1/CRBN-связывающий полипептид содержит или состоит из аминокислотной последовательности под SEQ ID NO: 5 или 77;
(xi) COF1/CRBN-связывающий полипептид содержит аминокислотные остатки 136-170 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19), например, COF1/CRBN-связывающий полипептид содержит или состоит из аминокислотной последовательности под SEQ ID NO: 6 или 78;
(xii) COF1/CRBN-связывающий полипептид содержит аминокислотные остатки 236-249 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19) (например, COF1/CRBN-связывающий полипептид содержит аминокислотную последовательность под SEQ ID NO: 11) или последовательность, которая отличается от аминокислотных остатков 236-249 из IKZF3 (пронумерованных в соответствии с SEQ ID NO: 19) не более чем 1, 2, 3, 4, 5, 6 или 7 аминокислотными остатками (например, последовательность, которая отличается от аминокислотных остатков 236-249 из SEQ ID NO: 19 не более чем 1, 2, 3, 4, 5, 6 или 7 аминокислотными остатками) (например, последовательность, имеющую не более 1, 2, 3, 4, 5, 6 или 7 аминокислотных замен по сравнению с аминокислотными остатками 236-249 из SEQ ID NO: 19);
(xiii) COF1/CRBN-связывающий полипептид содержит аминокислотные остатки 236-249 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19), например, COF1/CRBN-связывающий полипептид содержит аминокислотную последовательность под SEQ ID NO: 11;
(xiv) COF1/CRBN-связывающий полипептид содержит аминокислотную последовательность MALEKMALEKMALE (SEQ ID NO: 91);
(xv) COF1/CRBN-связывающий полипептид содержит первую последовательность, содержащую аминокислотные остатки 136-180 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19) (например, первую последовательность, содержащую аминокислотную последовательность под SEQ ID NO: 5), или первую последовательность, которая отличается от аминокислотных остатков 136-180 из IKZF3 (пронумерованных в соответствии с SEQ ID NO: 19) не более чем 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотными остатками (например, первую последовательность, которая отличается от аминокислотных остатков 136-180 из SEQ ID NO: 19 не более чем 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотными остатками); и вторую последовательность, содержащую аминокислотные остатки 236-249 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19) (например, вторую последовательность, содержащую аминокислотную последовательность под SEQ ID NO: 11), или вторую последовательность, которая отличается от аминокислотных остатков 236-249 из IKZF3 (пронумерованных в соответствии с SEQ ID NO: 19) не более чем 1, 2, 3, 4, 5, 6 или 7 аминокислотными остатками (например, вторую последовательность, которая отличается от аминокислотных остатков 236-249 из SEQ ID NO: 19 не более чем 1, 2, 3, 4, 5, 6 или 7 аминокислотными остатками);
(xvi) COF1/CRBN-связывающий полипептид содержит аминокислотные остатки 136-180 и 236-249 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19), например, COF1/CRBN-связывающий полипептид содержит или состоит из аминокислотной последовательности под SEQ ID NO: 1 или 3;
(xvii) COF1/CRBN-связывающий полипептид содержит или состоит из аминокислотной последовательности под SEQ ID NO: 1 или 3;
(xviii) COF1/CRBN-связывающий полипептид содержит первую последовательность, содержащую аминокислотные остатки 136-180 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19), и вторую последовательность, содержащую аминокислотную последовательность MALEKMALEKMALE (SEQ ID NO: 91), например, COF1/CRBN-связывающий полипептид содержит или состоит из аминокислотной последовательности под SEQ ID NO: 14 или 85;
(xix) COF1/CRBN-связывающий полипептид содержит первую последовательность, содержащую аминокислотные остатки 136-170 из IKZF3 (пронумерованные в соответствии с SEQ ID NO: 19), и вторую последовательность, содержащую аминокислотную последовательность MALEKMALEKMALE (SEQ ID NO: 91), например, COF1/CRBN-связывающий полипептид содержит или состоит из аминокислотной последовательности под SEQ ID NO: 15 или 86; или
(xx) COF1/CRBN-связывающий полипептид содержит на по меньшей мере один лизин меньше, чем соответствующая нативная последовательность.
4. Слитый полипептид по любому из пп. 1-3, где:
(i) COF1 представляет собой иммуномодулирующее лекарственное средство на основе имида (IMiD) или его фармацевтически приемлемую соль;
(ii) COF1 представляет собой талидомид или его аналог или фармацевтически приемлемую соль;
(iii) COF1 выбрано из группы, состоящей из леналидомида, помалидомида, талидомида и 2-(4-(трет-бутил)фенил)-N-((2-(2,6-диоксопиперидин-3-ил)-1-оксоизоиндолин-5-ил)метил)ацетамида или их фармацевтически приемлемой соли;
(iv) COF1 выбрано из группы, состоящей из:
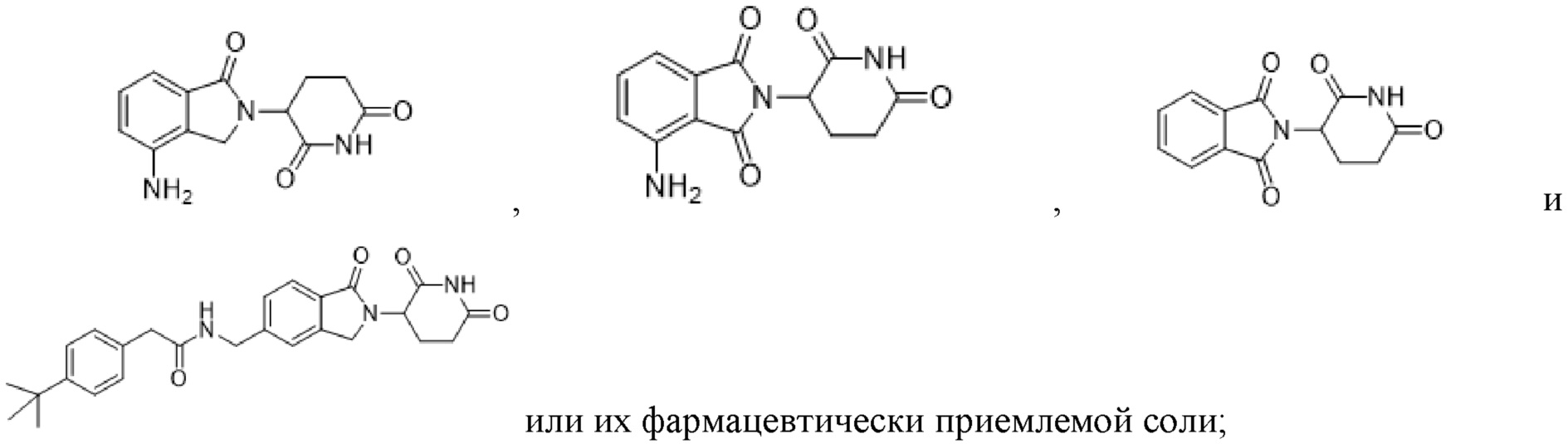
(vi) COF1 представляет собой леналидомид или его аналог или фармацевтически приемлемую соль.
5. Слитый полипептид по любому из пп. 1-4, где слитый полипептид дополнительно содержит домен деградации, где домен деградации отделен от COF1/CRBN-связывающего полипептида и гетерологичного полипептида с помощью гетерологичного сайта расщепления протеазами, необязательно, где:
(i) слитый полипептид содержит в направлении от N-конца к C-концу:
(a) домен деградации, гетерологичный сайт расщепления протеазами, гетерологичный полипептид и COF1/CRBN-связывающий полипептид;
(b) домен деградации, гетерологичный сайт расщепления протеазами, COF1/CRBN-связывающий полипептид и гетерологичный полипептид;
(c) COF1/CRBN-связывающий полипептид, гетерологичный полипептид, гетерологичный сайт расщепления протеазами и домен деградации; или
(d) гетерологичный полипептид и COF1/CRBN-связывающий полипептид, гетерологичный сайт расщепления протеазами и домен деградации;
(ii) домен деградации имеет первое состояние, ассоциированное с первым уровнем экспрессии слитого полипептида, и второе состояние, ассоциированное со вторым уровнем экспрессии слитого полипептида, где второй уровень увеличивается, например, в по меньшей мере 2, 3, 4, 5, 10, 20 или 30 раз, по сравнению с первым уровнем в присутствии стабилизирующего соединения;
(iii) домен деградации выбран из домена эстрогенового рецептора (ER), домена белка FKB (FKBP) или домена дигидрофолатредуктазы (DHFR);
(iv) домен деградации содержит аминокислотную последовательность, которая на по меньшей мере 90, 95, 97, 98, 99 или 100% идентична SEQ ID NO: 46 или 48;
(v) домен деградации содержит аминокислотную последовательность, которая на по меньшей мере 90, 95, 97, 98, 99 или 100% идентична SEQ ID NO: 50;
(vi) домен деградации содержит аминокислотную последовательность, которая на по меньшей мере 90, 95, 97, 98, 99 или 100% идентична SEQ ID NO: 51;
(vii) гетерологичный сайт расщепления протеазами расщепляется под действием внутриклеточной протеазы млекопитающего;
(viii) гетерологичный сайт расщепления протеазами расщепляется под действием протеазы, выбранной из группы, состоящей из фурина, PCSK1, PCSK5, PCSK6, PCSK7, катепсина B, гранзима B, фактора XA, энтерокиназы, гененазы, сортазы, протеазы precission, тромбина, протеазы TEV и эластазы-1;
(ix) гетерологичный сайт расщепления протеазами содержит последовательность, имеющую мотив расщепления, выбранный из группы, состоящей из консенсусного мотива RX(K/R)R (X может быть любой аминокислотой; SEQ ID NO: 52), консенсусного мотива RXXX[KR]R (X может быть любой аминокислотой; SEQ ID NO: 53), консенсусного мотива RRX (SEQ ID NO: 54), консенсусного мотива I-E-P-D-X (SEQ ID NO: 55), Ile-Glu/Asp-Gly-Arg (SEQ ID NO: 56), Asp-Asp-Asp-Asp-Lys (SEQ ID NO: 57), Pro-Gly-Ala-Ala-His-Tyr (SEQ ID NO: 58), консенсусного мотива LPXTG/A (SEQ ID NO: 59), Leu-Glu-Val-Phe-Gln-Gly-Pro (SEQ ID NO: 60), Leu-Val-Pro-Arg-Gly-Ser (SEQ ID NO: 61), E-N-L-Y-F-Q-G (SEQ ID NO: 62) и [AGSV]-X (X может быть любой аминокислотой; SEQ ID NO: 63);
(x) гетерологичный сайт расщепления протеазами содержит сайт расщепления фурином, выбранный из группы, состоящей из RTKR (SEQ ID NO: 123); GTGAEDPRPSRKRRSLGDVG (SEQ ID NO: 125); GTGAEDPRPSRKRR (SEQ ID NO: 127); LQWLEQQVAKRRTKR (SEQ ID NO: 129); GTGAEDPRPSRKRRSLGG (SEQ ID NO: 131); GTGAEDPRPSRKRRSLG (SEQ ID NO: 133); SLNLTESHNSRKKR (SEQ ID NO: 135); CKINGYPKRGRKRR (SEQ ID NO: 137) и SARNRQKR (SEQ ID NO: 34);
(xi) гетерологичный сайт расщепления протеазами расщепляется под действием внеклеточной протеазы млекопитающего;
(xii) внеклеточная протеаза млекопитающего выбрана из группы, состоящей из фактора XA, энтерокиназы, гененазы, сортазы, протеазы precission, тромбина, протеазы TEV и эластазы-1; или
(xiii) гетерологичный сайт расщепления протеазами содержит аминокислотную последовательность, выбранную из группы, состоящей из Ile-Glu/Asp-Gly-Arg (SEQ ID NO: 56), Asp-Asp-Asp-Asp-Lys (SEQ ID NO: 57), Pro-Gly-Ala-Ala-His-Tyr (SEQ ID NO: 58), консенсусного мотива LPXTG/A (SEQ ID NO: 59), Leu-Glu-Val-Phe-Gln-Gly-Pro (SEQ ID NO: 60), Leu-Val-Pro-Arg-Gly-Ser (SEQ ID NO: 61), E-N-L-Y-F-Q-G (SEQ ID NO: 62) и [AGSV]-X (X может быть любой аминокислотой; SEQ ID NO: 63).
6. Слитый полипептид, содержащий полипептид, связывающий соединение формулы (III) (COF3)/CRBN (цереблон), и гетерологичный полипептид, например, гетерологичный полипептид млекопитающего, бактериальный или вирусный полипептид, где соединение формулы (III) представляет собой:

или его фармацевтически приемлемую соль, сложный эфир, гидрат, сольват или таутомер, где:
X1 представляет собой CR3;

каждый R1 независимо представляет собой C1-С6алкил, C1-С6галогеналкил, C1-С6гидроксиалкил или галоген, или
два R1 вместе с атомами углерода, к которым они присоединены, образуют 5- или 6-членное гетероциклильное кольцо, или
два R1, когда они находятся при смежных атомах, вместе с атомами, к которым они присоединены, образуют C6-С10арил или 5- или 6-членное гетероарильное кольцо, содержащее 1-3 гетероатома, выбранные из O, N и S;
R2 представляет собой водород, C1-С6алкил, -C(O)C1-С6алкил, -C(O)(CH2)0-3-C6-С10арил, -C(O)O(CH2)0-3-C6-С10арил, C6-С10арил или 5- или 6-членный гетероарил, содержащий 1-3 гетероатома, выбранные из O, N и S, C3-С8карбоциклил или 5-7-гетероциклил, содержащий 1-3 гетероатома, выбранные из O, N и S, где алкил необязательно замещен одним или несколькими R4; и арил, гетероарил, карбоциклил и гетероциклил необязательно замещены одним или несколькими R5, или
R1 и R2, когда они находятся при смежных атомах, вместе с атомами, к которым они присоединены, образуют 5- или 6-членное гетероциклильное кольцо;
R3 представляет собой водород, или R3 отсутствует, если
 представляет собой двойную связь;
представляет собой двойную связь;

каждый R4 независимо выбран из -C(O)OR6, -C(O)NR6R6', -NR6C(O)R6', галогена, -OH, -NH2, циано, C6-С10арила, 5- или 6-членного гетероарила, содержащего 1-4 гетероатома, выбранные из O, N и S, C3-С8карбоциклила и 5-7-членного гетероциклильного кольца, содержащего 1-3 гетероатома, выбранные из O, N и S, где арил, гетероарил, карбоциклил и гетероциклил необязательно замещены одним или несколькими R7;
каждый R5 независимо выбран из C1-С6алкила, C2-С6алкенила, C2-С6алкинила, C1-С6алкокси, C1-С6галогеналкила, C1-С6галогеналкокси, C1-С6гидроксиалкила, галогена, -OH, -NH2, циано, C3-С7карбоциклила, 5-7-членного гетероциклила, содержащего 1-3 гетероатома, выбранные из O, N и S, C6-С10арила и 5- или 6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из O, N и S, или
два R5, когда они находятся при смежных атомах, вместе с атомами, к которым они присоединены, образуют C6-С10арил или 5- или 6-членный гетероарил, содержащий 1-3 гетероатома, выбранные из O, N и S, необязательно замещенные одним или несколькими R10, или
два R5, когда они находятся при смежных атомах, вместе с атомами, к которым они присоединены, образуют C5-С7карбоциклил или 5-7-членный гетероциклил, содержащий 1-3 гетероатома, выбранные из O, N и S, необязательно замещенные одним или несколькими R10;
каждый R6 и R6' независимо представляет собой водород, C1-С6алкил или C6-С10арил;
каждый R7 независимо выбран из C1-С6алкила, C2-С6алкенила, C2-С6алкинила, C1-С6алкокси, C1-С6галогеналкила, C1-С6галогеналкокси, -C(O)R8, -(CH2)0-3C(O)OR8, -C(O)NR8R9, -NR8C(O)R9, -NR8C(O)OR9, -S(O)pNR8R9, -S(O)pR12, (C1-C6)гидроксиалкила, галогена, -OH, -O(CH2)1-3CN, -NH2, циано, -O(CH2)0-3-C6-С10арила, адамантила, -O(CH2)0-3-5- или 6-членного гетероарила, содержащего 1-3 гетероатома, выбранные из O, N и S, C6-С10арила, моноциклического или бициклического 5-10-членного гетероарила, содержащего 1-3 гетероатома, выбранные из O, N и S, C3-С7карбоциклила и 5-7-членного гетероциклила, содержащего 1-3 гетероатома, выбранные из O, N и S, где алкил необязательно замещен одним или несколькими R11, и арил, гетероарил и гетероциклил необязательно замещены одним или несколькими заместителями, каждый из которых независимо выбран из галогена, C1-С6алкила, C1-С6галогеналкила и C1-С6алкокси, или
два R7 вместе с атомом углерода, к которому они присоединены, образуют =(O), или
два R7, когда они находятся при смежных атомах, вместе с атомами, к которым они присоединены, образуют C6-С10арил или 5- или 6-членный гетероарил, содержащий 1-3 гетероатома, выбранные из O, N и S, необязательно замещенные одним или несколькими R10, или
два R7 вместе с атомами, к которым они присоединены, образуют C5-С7карбоциклил или 5-7-членный гетероциклил, содержащий 1-3 гетероатома, выбранные из O, N и S, необязательно замещенные одним или несколькими R10;
каждый R8 и R9 независимо представляет собой водород или C1-С6алкил;
каждый R10 независимо выбран из C1-С6алкила, C1-С6алкокси, C1-С6галогеналкила, C1-С6галогеналкокси, C1-С6гидроксиалкила, галогена, -OH, -NH2 и циано, или
два R10 вместе с атомом углерода, к которому они присоединены, образуют =(O);
каждый R11 независимо выбран из циано, C1-С6алкокси, C6-С10арила и 5-7-членного гетероциклила, содержащего 1-3 гетероатома, выбранные из O, N и S, где каждый арил и гетероциклил необязательно замещен одним или несколькими заместителями, каждый из которых независимо выбран из C1-С6алкила, C1-С6алкокси, C1-С6галогеналкила, C1-С6галогеналкокси, C1-С6гидроксиалкила, галогена, -OH, -NH2 и циано;
R12 представляет собой C1-С6алкил, C1-С6галогеналкил, C6-С10арил или 5-7-членный гетероциклил, содержащий 1-3 гетероатома, выбранные из O, N и S;
Rx представляет собой водород или дейтерий;
p составляет 0, 1 или 2;
n составляет 0, 1 или 2;
y составляет 1 или 2, где n+y≤3; и
q составляет 0, 1, 2, 3 или 4.
7. Слитый полипептид по п. 6, где:
(i) соединение формулы (III) представляет собой соединение формулы (III-b):

или его фармацевтически приемлемую соль, гидрат, сольват, пролекарство, стереоизомер и таутомер, где X1, R1, R2, n, q и их подпеременные определены, как описано для формулы (III) в п. 6;
(ii) соединение формулы (III) представляет собой соединение формулы (III-d):
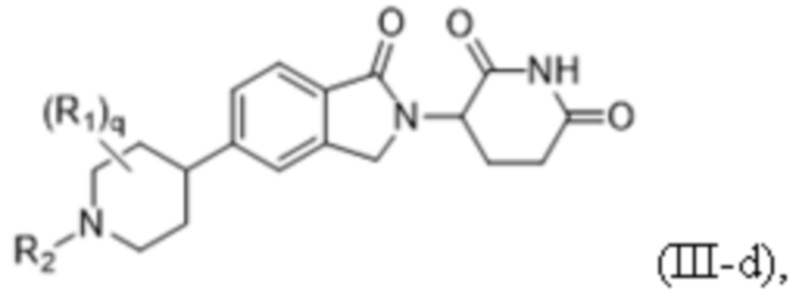
или его фармацевтически приемлемую соль, гидрат, сольват, пролекарство, стереоизомер и таутомер, где R1, R2, q и их подпеременные определены, как описано для формулы (III) в п. 6.
8. Слитый полипептид по п. 6 или 7, где:
(i) ассоциация слитого полипептида с CRBN в отсутствие COF3 составляет, например, не более 0,01%, 0,1%, 1%, 5%, 10%, 15% или 20% от ассоциации слитого полипептида с CRBN в присутствии COF3, например, избытка COF3, например, как измерено с помощью анализа, описанного в данном документе, например, иммунопреципитации, необязательно, где слитый полипептид не связывается с CRBN в отсутствие COF3;
(ii) убиквитинирование слитого полипептида в отсутствие COF3 составляет, например, не более 0,01%, 0,1%, 1%, 10%, 20%, 30%, 40%, 50%, 60% или 70% от убиквитинирования слитого полипептида в присутствии COF3, например, избытка COF3, например, как измерено с помощью анализа, описанного в данном документе, необязательно, где слитый полипептид подвергается убиквитинированию по одному или нескольким остаткам лизина или метионина в присутствии COF3; или
(iii) деградация слитого полипептида в отсутствие COF3 составляет, например, не более 0,01%, 0,1%, 1%, 10%, 20%, 30%, 40%, 50%, 60% или 70% от деградации слитого полипептида в присутствии COF3, например, избытка COF3, например, как измерено с помощью анализа, описанного в данном документе, например, вестерн-блоттинг-анализа или анализа посредством проточной цитометрии, необязательно, где деградация слитого полипептида опосредована убиквитинированием в присутствии COF3;
необязательно, где ассоциация, убиквитинирование и/или деградация измеряются в клетке млекопитающего, например, клетке человека.
9. Слитый полипептид по любому из пп. 1-8, где:
(i) COF3/CRBN-связывающий полипептид составляет от 10 до 95 аминокислотных остатков в длину, от 15 до 90 аминокислотных остатков в длину, от 20 до 85 аминокислотных остатков в длину, от 25 до 80 аминокислотных остатков в длину, от 30 до 75 аминокислотных остатков в длину, от 35 до 70 аминокислотных остатков в длину, от 40 до 65 аминокислотных остатков в длину, от 45 до 65 аминокислотных остатков в длину, от 50 до 65 аминокислотных остатков в длину или от 55 до 65 аминокислотных остатков в длину;
(ii) COF3/CRBN-связывающий полипептид содержит бета-изгиб, бета-шпильку, бета-нить или альфа-спираль, необязательно, где COF3/CRBN-связывающий полипептид содержит в направлении от N-конца к C-концу: первую бета-нить, бета-шпильку, вторую бета-нить и первую альфа-спираль, необязательно, где COF3/CRBN-связывающий полипептид содержит в направлении от N-конца к C-концу: первую бета-нить, бета-шпильку, вторую бета-нить, первую альфа-спираль и вторую альфа-спираль, необязательно, где бета-шпилька и вторая альфа-спираль разделены не более чем 60, 50, 40 или 30 аминокислотными остатками;
(iii) COF3/CRBN-связывающий полипептид содержит COF3/CRBN-связывающую последовательность из встречающегося в природе полипептида или его COF3/CRBN-связывающего варианта, например, встречающегося в природе полипептида IKZF или его COF3/CRBN-связывающего варианта, например, встречающегося в природе IKZF2 или его COF3/CRBN-связывающего варианта, необязательно, где COF3/CRBN-связывающий полипептид содержит две или более прерывистые последовательности из встречающегося в природе полипептида IKZF, например, встречающегося в природе IKZF2;
(iv) COF3/CRBN-связывающий полипептид содержит аминокислотные остатки 130-174 из IKZF2 (пронумерованные в соответствии с SEQ ID NO: 21) (например, COF3/CRBN-связывающий полипептид содержит аминокислотную последовательность под SEQ ID NO: 113) или последовательность, которая отличается от аминокислотных остатков 130-174 из IKZF2 (пронумерованных в соответствии с SEQ ID NO: 21) не более чем 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотными остатками (например, последовательность, которая отличается от аминокислотных остатков 130-174 из SEQ ID NO: 21 не более чем 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотными остатками) (например, последовательность, имеющую не более 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35 или 40 аминокислотных замен по сравнению с аминокислотными остатками 130-174 из SEQ ID NO: 21);
(v) COF3/CRBN-связывающий полипептид содержит аминокислотные остатки 230-243 из IKZF2 (пронумерованные в соответствии с SEQ ID NO: 21) (например, COF3/CRBN-связывающий полипептид содержит аминокислотную последовательность под SEQ ID NO: 114) или последовательность, которая отличается от аминокислотных остатков 230-243 из IKZF2 (пронумерованных в соответствии с SEQ ID NO: 21) не более чем 1, 2, 3, 4, 5 или 10 аминокислотными остатками (например, последовательность, которая отличается от аминокислотных остатков 230-243 из SEQ ID NO: 21 не более чем 1, 2, 3, 4, 5 или 10 аминокислотными остатками) (например, последовательность, имеющую не более 1, 2, 3, 4, 5 или 10 аминокислотных замен по сравнению с аминокислотными остатками 230-243 из SEQ ID NO: 21);
(vi) COF3/CRBN-связывающий полипептид содержит аминокислотные остатки 130-174 из IKZF2 (пронумерованные в соответствии с SEQ ID NO: 21), например, COF3/CRBN-связывающий полипептид содержит аминокислотную последовательность под SEQ ID NO: 113;
(vii) COF3/CRBN-связывающий полипептид содержит аминокислотные остатки 230-243 из IKZF2 (пронумерованные в соответствии с SEQ ID NO: 21), например, COF3/CRBN-связывающий полипептид содержит аминокислотную последовательность под SEQ ID NO: 114; или
(viii) COF3/CRBN-связывающий полипептид содержит или состоит из аминокислотной последовательности под SEQ ID NO: 109.
10. Слитый полипептид по любому из пп. 1-9, где гетерологичный полипептид выбран из цитоплазматического и/или ядерного полипептида или трансмембранного полипептида, например, гетерологичного полипептида из таблицы 2, необязательно, где:
(i) цитоплазматический и/или ядерный полипептид выбран из группы, состоящей из компонента пути апоптоза (например, каспазы 9), компонента системы CRISPR/Cas (например, Cas9), транскрипционного фактора (например, MITF, c-Myc, STAT3, STAT5, NF-каппа-B, бета-катенина, Notch, GLI или c-JUN), Tet-метилцитозиндиоксигеназы-2 (TET2), FKBP и тау-белка; или
(ii) трансмембранный полипептид выбран из группы, состоящей из CD62L, CCR1, CCR2, CCR5, CCR7, CCR10, CXCR2, CXCR3, CXCR4, CXCR6, CTLA4, PD1, BTLA, VISTA, CD137L, CD80, CD86, TIGIT, CD3, CD8, CD19, CD22, CD20, BCMA и химерного антигенного рецептора (CAR).
11. Слитый полипептид по любому из пп. 1-10, где гетерологичный полипептид представляет собой химерный антигенный рецептор (CAR), содержащий антигенсвязывающий домен, трансмембранный домен и один или несколько внутриклеточных сигнальных доменов, необязательно, где указанный внутриклеточный сигнальный домен содержит один или несколько первичных сигнальных доменов или один или несколько костимулирующих сигнальных доменов, необязательно, где:
(i) один из указанных одного или нескольких первичных сигнальных доменов содержит стимулирующий домен CD3-дзета;
(ii) один или несколько из указанных костимулирующих сигнальных доменов представляют собой внутриклеточный домен из костимулирующего белка, выбранного из группы, состоящей из CD27, CD28, 4-1BB (CD137), OX40, GITR, CD30, CD40, ICOS, BAFFR, HVEM, ICAM-1, лимфоцитарного функционально-ассоциированного антигена-1 (LFA-1), CD2, CDS, CD7, CD287, LIGHT, NKG2C, NKG2D, SLAMF7, NKp80, NKp30, NKp44, NKp46, CD160, B7-H3 и лиганда, который специфически связывается с CD83;
(iii) указанные один или несколько из указанных костимулирующих сигнальных доменов содержат костимулирующий домен 4-1BB;
(iv) указанные один или несколько из указанных костимулирующих сигнальных доменов содержат костимулирующий домен CD28;
(v) указанный антигенсвязывающий домен представляет собой scFv;
(vi) указанный антигенсвязывающий домен связывает антиген, выбранный из группы, состоящей из CD19; CD123; CD22; CD30; CD171; CS-1; лектиноподобной молекулы-1 C-типа, CD33; варианта III рецептора эпидермального фактора роста (EGFRvIII); ганглиозида G2 (GD2); ганглиозида GD3; представителя семейства рецепторов TNF; антигена созревания B-клеток; Tn-антигена ((Tn Ag) или (GalNAcα-Ser/Thr)); простатического специфического мембранного антигена (PSMA); орфанного рецептора-1, подобного рецепторной тирозинкиназе (ROR1); Fms-подобной тирозинкиназы 3 (FLT3); опухолеассоциированного гликопротеина-72 (TAG72); CD38; CD44v6; раково-эмбрионального антигена (CEA); молекулы адгезии эпителиальных клеток (EPCAM); B7H3 (CD276); KIT (CD117); субъединицы альфа-2 рецептора интерлейкина-13; мезотелина; альфа-субъединицы рецептора интерлейкина-11 (IL-11Ra); антигена стволовых клеток предстательной железы (PSCA); сериновой протеазы-21; рецептора-2 фактора роста эндотелия сосудов (VEGFR2); антигена системы Льюис (Y); CD24; рецептора фактора роста тромбоцитов бета-типа (PDGFR-бета); стадиеспецифического эмбрионального антигена-4 (SSEA-4); CD20; рецептора фолиевой кислоты альфа-типа; рецепторной тирозинпротеинкиназы ERBB2 (Her2/neu); муцина-1, ассоциированного с клеточной поверхностью (MUC1); рецептора эпидермального фактора роста (EGFR); молекулы адгезии нейронов (NCAM); простазы; простатической кислой фосфатазы (PAP); мутантного фактора элонгации 2 (ELF2M); эфрина B2; белка активации фибробластов альфа (FAP); рецептора инсулиноподобного фактора роста-1 (рецептора IGF-I), карбоангидразы IX (CAIX); субъединицы-9 протеасомы (просомы, мультикаталитической протеазы) бета-типа (LMP2); гликопротеина 100 (gp100); онкогенного полипептида, состоящего из кластерного региона точечных разрывов (BCR) и гомолога-1 вирусного онкогена лейкоза мышей Абельсона (Abl) (bcr-abl); тирозиназы; эфринового рецептора-2 A-типа (EphA2); фукозил-GM1; молекулы адгезии, представляющей собой сиалилированный антиген системы Льюис (sLe); ганглиозида GM3; трансглютаминазы-5 (TGS5); высокомолекулярного меланома-ассоциированного антигена (HMWMAA); ганглиозида o-ацетил-GD2 (OAcGD2); рецептора фолиевой кислоты бета-типа; маркера-1 эндотелия опухоли (TEM1/CD248); белка, родственного маркеру-7 эндотелия опухоли (TEM7R); клаудина-6 (CLDN6); рецептора тиреотропного гормона (TSHR); представителя D группы 5 класса С рецепторов, сопряженных с G-белком (GPRC5D); белка, кодируемого открытой рамкой считывания 61 X-хромосомы (CXORF61); CD97; CD179a; киназы анапластической лимфомы (ALK); полисиаловой кислоты; плацентоспецифического белка-1 (PLAC1); гексасахаридной части гликоцерамида globoH (GloboH); дифференцировочного антигена молочной железы (NY-BR-1); уроплакина-2 (UPK2); клеточного рецептора-1 вируса гепатита A (HAVCR1); бета-3 адренорецептора (ADRB3); паннексина-3 (PANX3); рецептора-20, сопряженного с G-белком (GPR20); антигена локуса K9 комплекса лимфоцитарных антигенов 6 (LY6K); обонятельного рецептора 51E2 (OR51E2); белка, кодируемого альтернативной рамкой считывания гена TCR-гамма (TARP); белка опухоли Вильмса (WT1); раково-тестикулярного антигена-1 (NY-ESO-1); раково-тестикулярного антигена-2 (LAGE-1a); меланома-ассоциированного антигена-1 (MAGE-A1); белка, кодируемого транслокационным вариантом-6 гена ETS, локализованным в р-плече 12 хромосомы (ETV6-AML); белка-17 сперматозоидов (SPA17); представителя 1А семейства X-антигенов (XAGE1); ангиопоэтин-связывающего рецептора-2 клеточной поверхности 2 (Tie 2); раково-тестикулярного антигена-1 из клеток меланомы (MAD-CT-1); раково-тестикулярного антигена-2 из клеток меланомы (MAD-CT-2); Fos-родственного антигена-1; опухолевого белка p53 (p53); мутанта p53; простеина; сурвивина; теломеразы; опухолевого антигена-1 карциномы предстательной железы, антигена-1 меланомы, распознаваемого T-клетками; мутантного белка саркомы крыс (Ras); обратной транскриптазы теломеразы человека (hTERT); антигенов саркомы с точечными разрывами при транслокации; меланомного ингибитора апоптоза (ML-IAP); ERG (продукта слитого гена трансмембранной сериновой протеазы-2 (TMPRSS2) и ETS); N-ацетилглюкозаминилтрансферазы V (NA17); белка с парным box-доменом Рах-3 (PAX3); андрогенового рецептора; циклина-B1; нейробластомного гомолога вирусного онкогена миелоцитоматоза птиц v-myc (MYCN); представителя С семейства гомологов Ras (RhoC); белка-2, родственного тирозиназе (TRP-2); цитохрома P450 1B1 (CYP1B1); белка, подобного CCCTC-связывающему фактору (белку с "цинковыми пальцами"), антигена плоскоклеточной карциномы 3, распознаваемого Т-клетками (SART3); белка с парным box-доменом Рах-5 (PAX5); проакрозин-связывающего белка sp32 (OY-TES1); лимфоцит-специфической протеинтирозинкиназы (LCK); якорного белка-4 киназы A (AKAP-4); антигена 2 синовиальной саркомы с точечным разрывом в X-хромосоме (SSX2); рецептора конечных продуктов неферментативного гликозилирования (RAGE-1); почечного убиквитарного белка-1 (RU1); почечного убиквитарного белка-2 (RU2); легумаина; Е6 вируса папилломы человека (HPV E6); Е7 вируса папилломы человека (HPV E7); кишечной карбоксилэстеразы; мутантного белка теплового шока 70-2 (mut hsp70-2); CD79a; CD79b; CD72; иммуноглобулиноподобного рецептора-1, ассоциированного с лейкоцитами (LAIR1); рецептора Fc-фрагмента IgA (FCAR или CD89); представителя 2 подсемейства А иммуноглобулиноподобных рецепторов лейкоцитов (LILRA2); представителя f семейства белков, подобных молекулам CD300 (CD300LF); представителя А семейства 12 лектиновых доменов С-типа (CLEC12A); антигена-2 клеток стромы костного мозга (BST2); белка-2, подобного муциноподобному рецептору гормонов, содержащему EGF-подобный модуль (EMR2); лимфоцитарного антигена-75 (LY75); глипикана-3 (GPC3); белка-5, подобного Fc-рецептору (FCRL5); и полипептида-1, подобного лямбда-цепи иммуноглобулина (IGLL1); или
(vii) указанный антиген выбран из CD19, CD22, BCMA, CD20, CD123, EGFRvIII или мезотелина.
12. Молекула нуклеиновой кислоты, кодирующая слитый полипептид по любому из пп. 1-11.
13. Вектор, содержащий молекулу нуклеиновой кислоты по п. 12.
14. Клетка, например, клетка-хозяин, содержащая слитый полипептид по любому из пп. 1-11, молекулу нуклеиновой кислоты по п. 12 или вектор по п. 13, необязательно, где клетка представляет собой T-клетку или NK-клетку.
15. Фармацевтическая композиция, содержащая слитый полипептид по любому из пп. 1-11 или клетку по п. 14 и фармацевтически приемлемый носитель, вспомогательное вещество или стабилизатор.
16. Способ получения клетки по п. 14, причем указанный способ предусматривает обеспечение клетки, например, иммунной эффекторной клетки, с молекулой нуклеиновой кислоты по п. 12 или вектором по п. 13.
17. Способ деградации слитого полипептида, предусматривающий приведение слитого полипептида по любому из пп. 1-11 или клетки, содержащей указанный слитый полипептид, в контакт с COF1 или COF3, необязательно, где в присутствии COF1 или COF3 уровень экспрессии указанного слитого полипептида значительно уменьшается, например, на по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 процентов, относительно уровня экспрессии указанного слитого полипептида в отсутствие COF1 или COF3, например, как измерено с помощью анализа, описанного в данном документе, например, вестерн-блоттинг-анализа или анализа посредством проточной цитометрии.
18. Способ лечения субъекта, у которого имеется рак, предусматривающий введение субъекту эффективного количества слитого полипептида по любому из пп. 1-11, молекулы нуклеиновой кислоты по п. 12, вектора по п. 13, клетки по п. 14 или фармацевтической композиции по п. 15.
19. Способ лечения субъекта, у которого имеется рак, предусматривающий:
(i) введение эффективного количества COF1 или COF3 субъекту, где субъекту вводили слитый полипептид по любому из пп. 1-11, молекулу нуклеиновой кислоты по п. 12, вектор по п. 13, клетку по п. 14 или фармацевтическую композицию по п. 15, где:
(a) у субъекта развилась нежелательная реакция, она развивается или ожидается ее развитие,
(b) введение COF1 или COF3 осуществляют в ответ на возникновение нежелательной реакции у субъекта или в ответ на ожидание возникновения нежелательной реакции у субъекта, и/или
(c) введение COF1 или COF3 снижает или предупреждает нежелательный эффект.
20. Способ по п. 19, дополнительно предусматривающий после стадии (i):
(ii) прекращение введения COF1 или COF3, где:
(a) у субъекта произошел рецидив, происходит рецидив или ожидается рецидив,
(b) прекращение введения COF1 или COF3 осуществляют в ответ на рецидив опухоли у субъекта или в ответ на ожидание рецидива у субъекта, и/или
(c) прекращение введения COF1 или COF3 приводит к лечению или предупреждению рецидива опухоли.

Комментарии