Биологически доступная для перорального применения кофейная кислота, относящаяся к противоопухолевым лекарственным средствам - RU2456265C2
Код документа: RU2456265C2
Чертежи































Описание
В данной заявке испрашивается приоритет согласно предварительной заявке США № 60/744105, поданной 31 марта 2006, содержание которой включено в данное описание посредством ссылки.
Правительство США обладает правом на настоящее изобретение в силу финансирования Национальным институтом здравоохранения, грант под номером СА 101936.
В целом настоящее изобретение относится к лечению связанных с пролиферацией клеток заболеваний, таких как злокачественное новообразование. Более конкретно, изобретение относится к кофейной кислоте и ее аналогам, полезным для лечения связанных с пролиферацией клеток заболеваний, таких как злокачественное новообразование, способам синтеза данных соединений и способам лечения, использующих данные соединения.
Соединение AG490 является ингибитором киназы, который ингибирует янус-киназу 2/переносчик сигнала и активатор транскрипции-3 (Jak2/STAT3) сигнального пути. AG490 принадлежит к группе соединений, определяемой родоначальным природным продуктом - кофейной кислотой и ее природными производными, подобным бензиловому эфиру кофейной кислоты.

Направленное ингибирование Jak2/STAT3-пути с помощью аналогов кофейной кислоты, таких как AG490, ингибирует рост опухолевых клеток и повышает восприимчивость к апоптическому стимулу, таким образом, ингибиторы данного пути, вероятно, представляют собой потенциальные лекарственные средства для лечения злокачественного новообразования (Catlett-Falcone et al, 1999; Alas and Bonavida, 2003; Burdelya et al, 2002). AG490 не может рассматриваться как лекарственная молекула из-за ее нестабильности в биологических матрицах (кровь, ткани и т.д.) и недостатка активности (Kondo et al, 2007; Burdelya et al, 2002; Meydan et al, 1996; Constantin et al, 1998). Опосредованная или непосредственная рецептором активация Jak2/STAT3-пути с помощью таких стимуляторов, как EGF, scr и IL-6 (многочисленных интерлейкинов и цитокинов), промотируя сохранение пролиферации и ангиогенеза опухолей человека (Bharti et al, Verma et al, Kerr et al), требует более активных и более стабильных ингибиторов, чем AG490, чтобы иметь потенциал в качестве противоопухолевых лекарственных средств.
Сигнальный путь Jak2/STAT3 участвует в развитии различных злокачественных новообразований. STAT3 конститутивно активируется в карциноме поджелудочной железы, мультиформной глиобластоме и плоскоклеточной карциноме головы и шеи, в числе прочих, и было показано, что его активация действует на экспрессию VEGF (фактор роста эндотелия сосудов), ангиогенез, рост опухоли и метастаз in vivo. По этой причине STAT3 может быть превосходной мишенью для разработки лекарственного средства (Yu and Jove, 2004). В настоящее время не существует эффективных ингибиторов.
AG490, аналог кофейной кислоты, иногда называют тирфостином. В патенте США № 6426366 и публикации заявки на патент США 2003/0013748 описаны соединения, которые имеют структурную аналогию с AG490.
AG490, однако, обладает ограниченной активностью при исследовании на животных и должен применяться в высоких концентрациях (~50-100 мкМ) для достижения ингибирования Jak2/STAT3 передачи сигнала и противоопухолевых эффектов. Такая низкая активность AG490 является неудовлетворительной, чтобы служить основанием для клинического исследования данного соединения при лечении злокачественного новообразования (Burdelya et al, 2002; Meydan et al, 1996; Constantin et al, 1998). Таким образом, существует потребность в лекарственных средствах, которые проявляют сильное антипролиферативное действие посредством подобного механизма при низких терапевтических концентрациях.
В настоящем изобретении преодолеваются недостатки известного уровня техники путем обеспечения соединений, которые проявляют улучшенные фармакологические профили (например, биостабильность, биодоступность, повышенное проникновение в ткани, улучшенные фармакокинетики, увеличенную активность), если сравнивать с AG490 и другими соединениями, которые структурно родственны кофейной кислоте; данные соединения блокируют опосредованную IL-6 активацию Jak2/STAT3 при низких микромолярных концентрациях и тормозят связанную с ним последующую антиапоптотическую, ангиогенную и способствующую пролиферации передачу сигнала. Настоящее изобретение включает соединения, которые имеют применение в качестве противоопухолевых и/или химиотерапевтических лекарственных средств, способы синтеза данных соединений и способы применения данных соединений для лечения пациентов со злокачественным новообразованием.
В данном изобретении раскрыты соединения нового класса, которые ингибируют фосфорилирование Jak2 и STAT3 и многие связанные с ними последующие мишени. Они также эффективно ингибируют рост опухоли in vitro и in vivo. В отличие от AG490, соединения настоящего изобретения, например аналоги кофейной кислоты с циклоалкильными заместителями (см. ниже), проявляют высокую активность против различных видов злокачественного новообразования, включая опухоли поджелудочной железы, такие как Colo357-FG, опухоли мозга, такие как U87-MG, D54, U251, и линии стволовых опухолевых клеток мультиформной глиобластомы и опухолей головы и шеи, включая линии опухолевых клеток плоскоклеточной карциномы. Данные соединения ингибируют как IL-6, EGF стимулированную, так и конститутивную STAT3 активацию, подавляя экспрессию Bcl-2, Bcl-XL, сурвивина и Mcl-I и индуцируя апоптоз, все при низких микромолярных концентрациях.
В одном аспекте настоящее изобретение относится к соединениям со структурной формулой, представленной в таблице 1.
Таблица 1
Примеры различных типов аналогов кофейной кислоты.


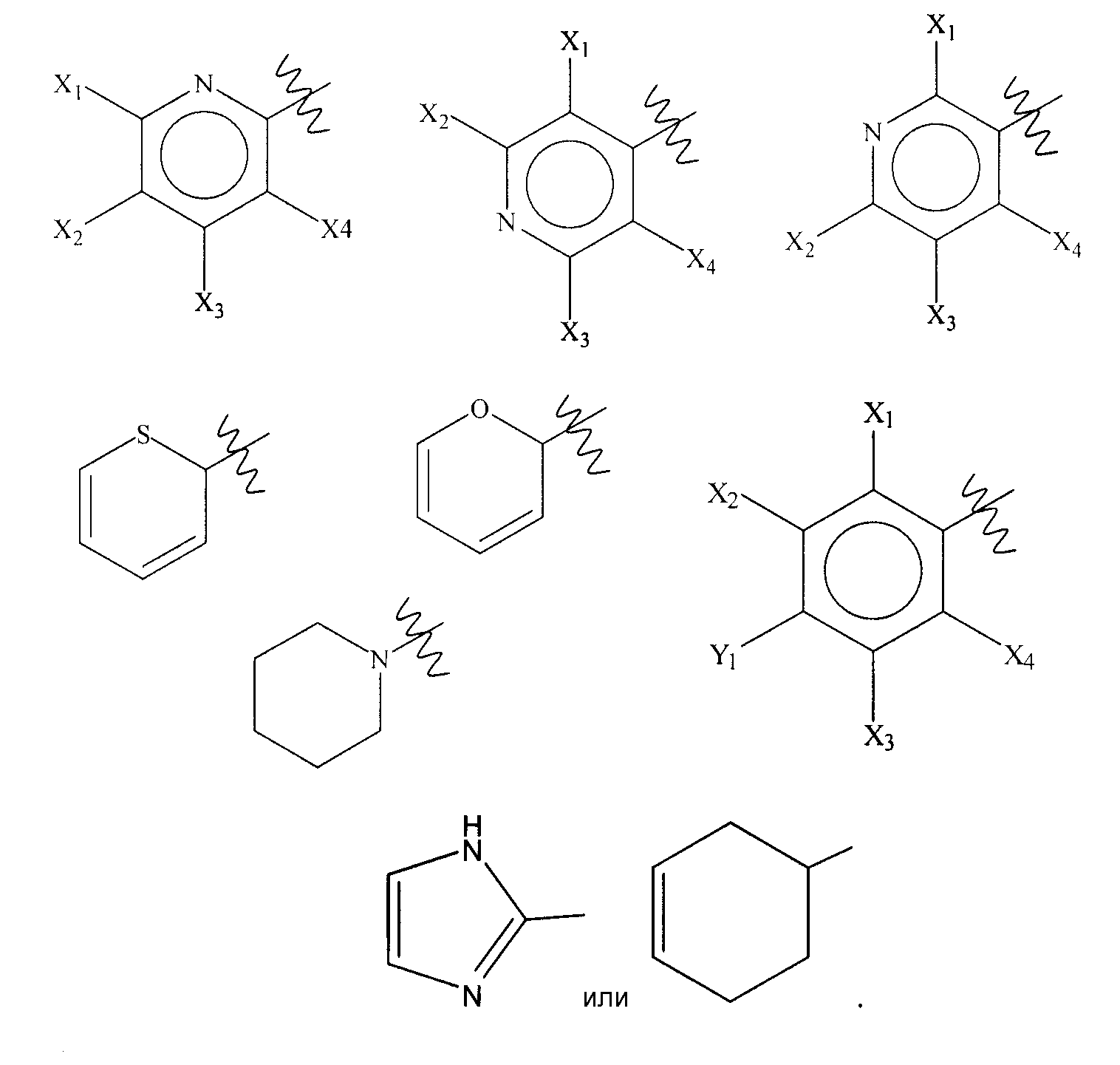
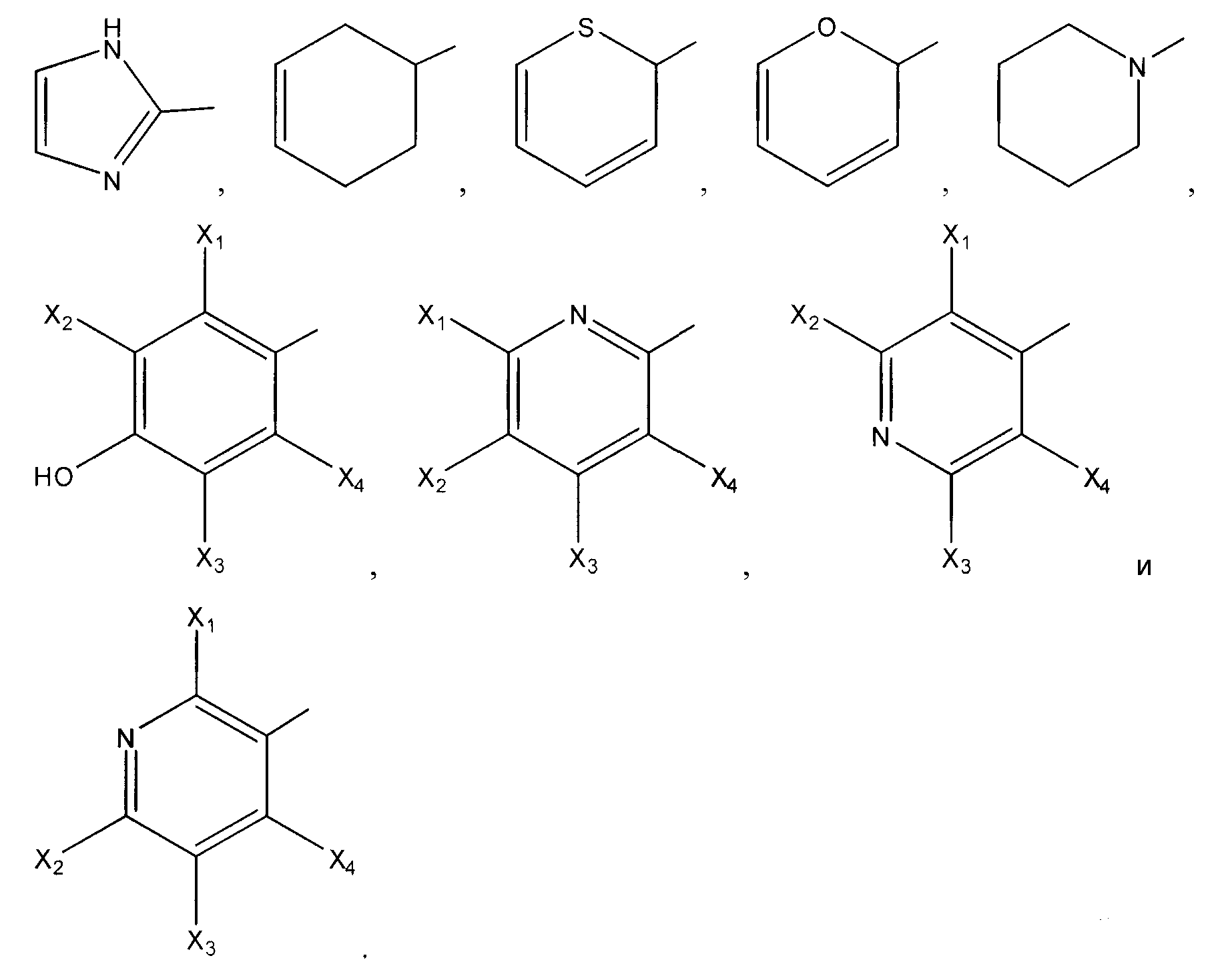
В некоторых аспектах изобретения химические структуры, представленные в таблице 1, можно охарактеризовать следующим образом: R1 представляет собой -H или цианогруппу, и R2 представляет собой гетероатом-замещенный или гетероатом-незамещенный C3-C7циклоалкил; X1 представляет собой галоген, и R3 представляет собой гетероатом-замещенный или гетероатом-незамещенный C3-C7циклоалкил, C6-C10арил или C7-C10аралкил; X2 представляет собой галоген, и R4 представляет собой гидрокси или гетероатом-замещенный или гетероатом-незамещенный C1-С10ацилокси; X3 представляет собой галоген или гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил или C1-С10алкокси; R5 представляет собой -H или цианогруппу, и R6 представляет собой гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил, C3-C7циклоалкил, C1-С10ацилокси, C6-С10арил или C7-С10аралкил; X4 представляет собой галоген или гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил или C1-С10алкокси; R7 представляет собой -H или цианогруппу; R8 представляет собой гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил, C3-С7циклоалкил, C1-С10ацилокси, C6-С10арил или C7-С10аралкил; X5 представляет собой гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил или C1-С10алкокси; R9 представляет собой -H или цианогруппу; R10 представляет собой гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил, C3-С7циклоалкил, C1-С10ацилокси, C6-С10арил или C7-С10аралкил; A представляет собой -C(O)- или -S(O2)-; X6 представляет собой галоген или гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил или C1-С10алкокси; R11 представляет собой гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил, C3-С7циклоалкил, C1-С10ацилокси, C6-С10арил или C7-С10аралкил; R12 представляет собой циклододецил, имидазоил или циклогексенил; R13 представляет собой -H или гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил, C3-С7циклоалкил, C1-С10ацилокси, C6-С10арил или C7-С10аралкил; X7 представляет собой галоген или гетероатом-замещенный или гетероатом-незамещенный C1-С10алкил или C1-С10алкокси; R14 представляет собой

Другие аспекты настоящего изобретения включают фармацевтически приемлемые соли, гидраты, амин-N-оксиды, имин-N-оксиды, таутомеры и оптические изомеры соединений, описанных выше и на всем протяжении данного описания.
В определенных вариантах осуществления R2 может представлять собой циклопропил, циклобутил, циклопентил или циклогексил. В дополнительных вариантах осуществления R3 может представлять собой фенил, бензил, циклопропил, циклобутил, циклопентил или циклогексил. В еще дополнительных вариантах осуществления X1 или X2 может представлять собой -F, -Cl, -Br или -I. Кроме того, в дополнительных вариантах осуществления R4 может представлять собой гидрокси, ацетокси или 2,2-диметилпропионилокси. Кроме того, в еще дополнительных вариантах осуществления X3 или X4 может представлять собой метокси, -F, -Cl, -Br или -I. В нескольких вариантах осуществления R6 или R8 может представлять собой метил или циклопропил. В определенных аспектах X5 может представлять собой метил или ацетоксиметил.
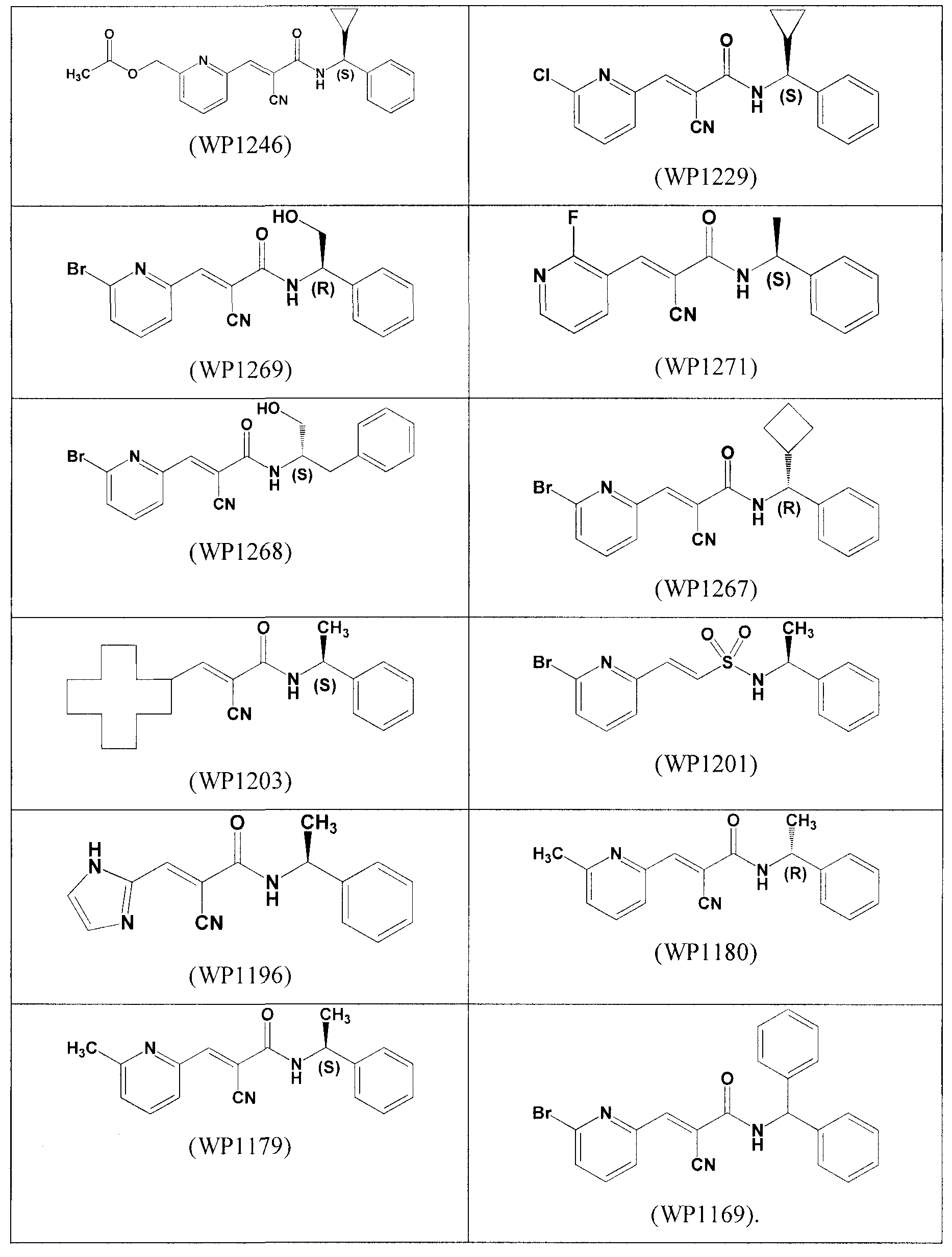
Соединения, представленные в таблице 2, представляют собой конкретные примеры соединений, обеспечиваемых данным изобретением.
Таблица 2
Дополнительные примеры аналогов кофейной кислоты



Несколько соединений в таблице 2 представлены в виде отдельных энантиомеров или диастереомеров. Изобретение обеспечивает все возможные стереоизомеры любого из соединений, представленных в таблице 2 выше, а также всех описанных в данном описании. В нескольких вариантах осуществления предоставленное соединение будет представлять собой один энантиомер, по существу свободный от других стереоизомеров. В других вариантах осуществления соединение будет представлять собой смесь различных стереоизомеров, где каждый стереоизомер имеет аналогичную молекулярную формулу. В определенных данных вариантах осуществления изобретение обеспечивает рацемическую смесь с данной молекулярной формулой.
В другом аспекте настоящее изобретение включает соединение формулы:

где A представляет собой -C(O)- или -SO2-. В определенных вариантах осуществления R1 представляет собой циклододецил,
В нескольких из таких вариантов осуществления X1, X2, X3 и X4, каждый независимо, представляет собой водород, галоген, алкил, алкоксил, ацетоксил, алкилацетоксил, -OH, тригалогенметил или -NO2; Y1 представляет собой галоген, -OH или -NO2; и R2 выбирают из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкиларила, галогена, водорода, -OH, -NO2, простого тиоэфира, амино, -SH, или -NH2; R3 представляет собой

где Z3 может представлять собой двухвалентный алкил; и где m1 равен 1, 2, 3 или 4; и R4 может представлять собой водород, -CN, замещенный амин, -CH2S-алкил, алкил или -CH2N3. В нескольких из данных вариантов осуществления R5 и R6, каждый независимо, представляет собой
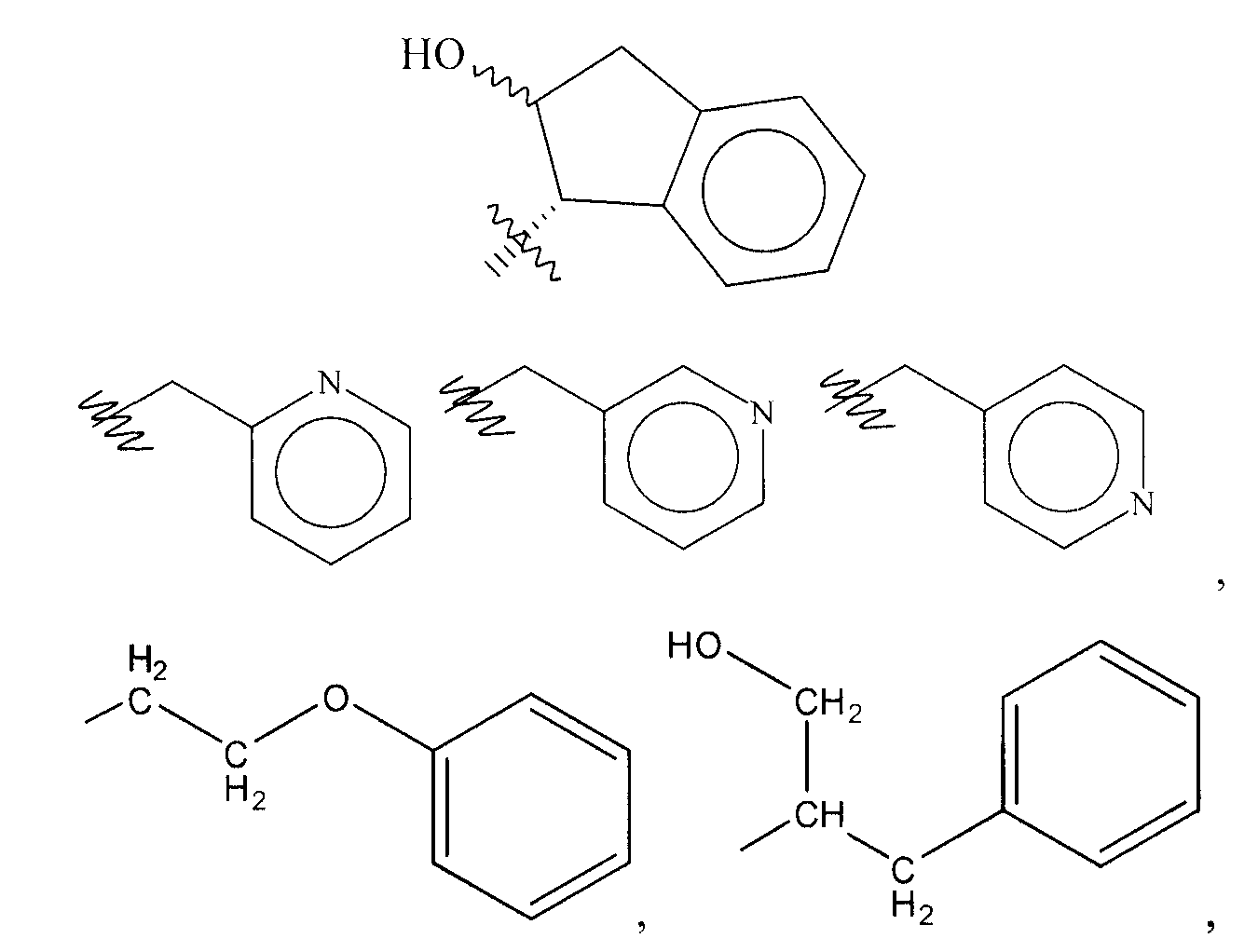
моносахарид, производное моносахарида, полисахарид, производное полисахарида, арил или аралкил; Z выбирают из группы, состоящей из -NH, -S- и -О-, и X5 и X6, каждый независимо, выбирают из группы, состоящей из водорода, высшего алкила, низшего алкила, циклоалкила, циклоарилалкила, аралкила, арила, алкоксила, гидроксила, гидроксилалкила, сложного алкилового эфира, сложный алкиловый эфир-алкила, алкилацетоксила или арилоксила; при условии, что если R4 представляет собой -CN, замещенный амин, -CH2S-алкил, алкил или -CH2N3, то R1 выбирают из группы, состоящей из циклододецила,
В дополнительных вариантах осуществления R3 представляет собой

где X5 или X6 представляет собой высший алкил, гидроксил, арил, алкоксил, арилоксил, циклоалкил, циклоарилалкил, аралкил, сложный алкиловый эфир, сложный алкиловый эфир-алкил, алкилацетокси или арилоксил.
В конкретных вариантах осуществления Z3 может представлять собой -C2H4-. В нескольких примерах X1, X2, X3 и X4, каждый независимо, представляет собой -F, -Cl, -Br, -CH3, метокси или алкилацетоксил. В дополнительных вариантах осуществления X5 или X6 независимо представляет собой водород, циклопропил, циклобутил, -CH3, -CH2OH, циклопентил, -CH2OAc, -CH2OC(O)C(CH3)3, -CH2C6H5, циклогексил или арил.
В других вариантах осуществления R5 представляет собой аралкил, имеющий структуру:

и
арил, имеющий структуру:

где m равен 0, 1, 2, 3, 4, 5, 6 или 7, и где X5 и X6, каждый независимо, выбирают из группы, состоящей из водорода и алкила, и где R7, R8, R9, R10 и R11, каждый независимо, выбирают из группы, состоящей из водорода, галогена, алкила, алкокси, -OH, тригалогенметила и -NO2.
Способ лечения связанного с пролиферацией клеток заболевания, включающий введение субъекту количества первого соединения, эффективного для лечения связанного с пролиферацией клеток заболевания, где первое соединение представляет собой кофейную кислоту, бензиловый эфир кофейной кислоты или одно из соединений по настоящему изобретению, такое как соединение согласно таблице 1 или соединение, представленное в таблице 2.
В другом аспекте настоящее изобретение касается способа лечения связанного с пролиферацией клеток заболевания, включающего введение терапевтически значимого количества первого соединения по настоящему изобретению субъекту. Субъектом может быть млекопитающее, и млекопитающим может быть человек. Первое соединение может содержать фармацевтически приемлемый эксципиент, разбавитель или наполнитель. Связанное с пролиферацией клеток заболевание может представлять собой злокачественное новообразование. Злокачественное новообразование может представлять собой меланому, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак легкого, гепатокарциному, ретинобластому, астроцитому, глиобластому, лейкоз, рак крови, мозга, кожи, глаза, языка, десны, нейробластому, рак головы, шеи, молочной железы, поджелудочной железы, почки, кости, тестикулярный рак, рак яичника, мезотелиому, рак шейки матки, желудочно-кишечного тракта, лимфому, рак толстой кишки или мочевого пузыря.
Связанное с пролиферацией клеток заболевание может представлять собой ревматоидный артрит, воспалительные заболевания кишечника, остеоартрит, лейомиому, аденомы, липомы, гемангиомы, фибромы, окклюзию сосуда, рестеноз, атеросклероз, пренеопластическое поражение, карциному in situ, внутриротовую волосистую лейкоплакию или псориаз и различные формы псориаза, включая псориатический артрит, другие воспалительные состояния кожи, такие как крапивница, экзема, атопический дерматит, анулярная гранулема, ангиома, базально-клеточная карцинома, плоскоклеточная карцинома, злокачественная меланома, себорейный дерматит, розовые угри, другие сверхактивные аутоиммунные расстройства, такие как ревматоидный артрит, хронический активный гепатит, тиреоидит Хашимото, волчанка, заболевания соединительной ткани, смешанные заболевания соединительной ткани и воспалительные заболевания нервной системы, такие как воспалительный лейкоэнцефалит.
В определенных вариантах осуществления активация STAT3 уменьшается в клетках субъекта. В клетках субъекта может снижаться экспрессия c-myc. Первое соединение может вводиться в комбинации с терапевтически значимым количеством второго соединения. Второе соединение может представлять собой соединение против злокачественного новообразования. Первое соединение может вводиться в комбинации с хирургической операцией, лучевой терапией или генной терапией.
Любой вариант осуществления, обсуждаемый в данном описании в отношении одного аспекта изобретения, равным образом применяется к другим аспектам изобретения, если не указано конкретно.
Используемый в данном описании термин «приблизительно» указывает, что величина включает стандартное отклонение ошибки для прибора или способа, используемого для определения величины. При использовании термина «или» в формуле изобретения подразумевается «и/или», если только прямо не указано, что относится к только одному варианту или варианты являются взаимоисключающими, хотя раскрытие говорит в пользу того, что определение относится только к одному варианту и к «и/или». Используемое сочетание со словом «содержащий» или другими словоформами в формуле изобретения, подразумевается «один или более», если не указано конкретно. Термины «содержать», «иметь» и включать» являются допускающими изменения глаголами-связками. Любые формы и время одного или нескольких из данных глаголов, такие как «содержит», «содержащий», «имеет», «имеющий», «включать» и «включающий» также являются допускающими изменения. Например, любой способ, который «содержит», «имеет» или «включает» одну или несколько стадий, не ограничивается тем, что имеет только одну или несколько таких стадий, а также охватывает другие не указанные стадии. Аналогично, любое средство, которое «содержит», «имеет» или «включает» одну или несколько характерных черт, не ограничивается тем, что имеет только одну или несколько таких характерных черт, а также охватывает другие не указанные характерные черты.
Термины «ингибирующий», «уменьшающий» или «предотвращающий» или любые варианты данных терминов, когда используются в формуле изобретения и/или описании, включают любое измеримое снижение или полное ингибирование для достижения желаемого результата.
Термин «эффективный», как термин, используемый в описании и/или формуле изобретения, подразумевает достаточный для достижения желаемого, ожидаемого или предполагаемого результата.
Как используется в данном описании, «преимущественно один энантиомер или по существу свободный от других оптических изомеров» подразумевает, что соединение содержит по меньшей мере 95% одного энантиомера или, более предпочтительно, по меньшей мере 98% одного энантиомера или, наиболее предпочтительно, по меньшей мере 99% одного энантиомера.
Другие объекты, признаки и преимущества настоящего изобретения станут очевидными из последующего подробного описания. Следует понимать, однако, что подробное описание и любые конкретные представленные примеры, хотя и показывающие конкретные варианты осуществления изобретения, даны только в качестве иллюстрации, так как различные изменения и модификации, не отходя от сущности и объема изобретения, станут очевидными специалисту в данной области из данного детального описания.
Следующие чертежи составляют часть настоящего описания и включены для дополнительной демонстрации некоторых аспектов настоящего изобретения. Изобретение может быть более понято по соотнесению с одним или несколькими из данных чертежей в сочетании с подробным описанием конкретных вариантов осуществления, представленных в данном описании.
Фиг.1: Ингибирование конститутивно активируемого STAT3 в клетках Colo357-FG с помощью WP1066 и WP1193. Вестерн-блоттинги фосфорилированного STAT3 по Tyr705 и общего STAT3.
Фиг.2: Кривая доза-эффект для WP1193 в присутствии различных линий клеток. Величины представляют собой среднее±стандартное отклонение трех экспериментов.
Фиг.3: Кривая доза-эффект для WP1145 в присутствии различных линий клеток.
Фиг.4: Кривая доза-эффект для WP1163 в присутствии линии клеток U87.
Фиг.5: Кривая доза-эффект для WP1164 в присутствии линии клеток U87.
Фиг.6: Кривая доза-эффект для WP1164 в присутствии линии клеток Colo357-FG.
Фиг.7: Кривая доза-эффект для WP1166 в присутствии линии клеток U87.
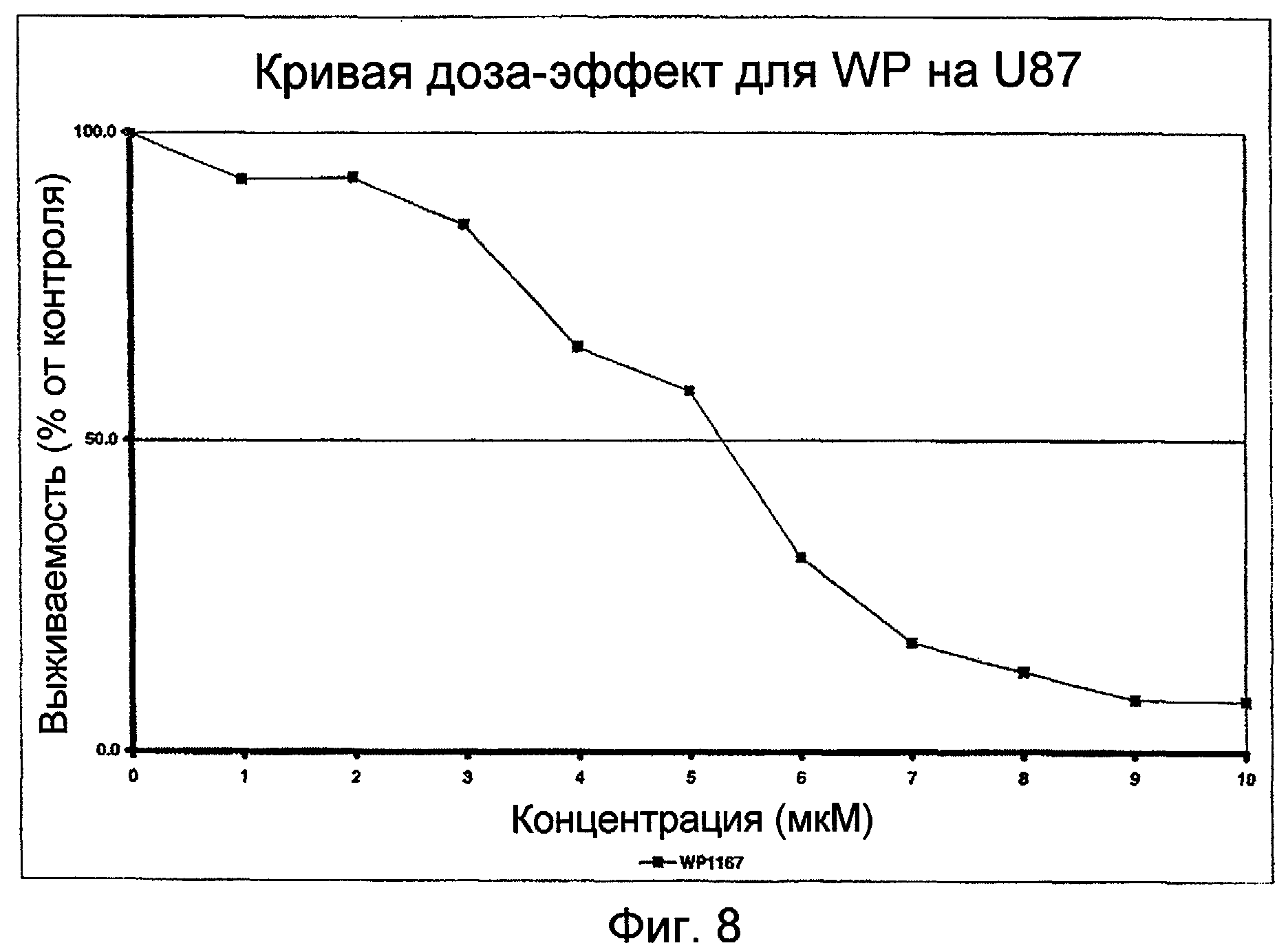
Фиг.8: Кривая доза-эффект для WP1167 в присутствии линии клеток U87.
Фиг.9: Кривая доза-эффект для WP1168 в присутствии линии клеток U87.
Фиг.10: Кривая доза-эффект для WP1169 в присутствии линии клеток U87.
Фиг.11: Кривая доза-эффект для WP1229 в присутствии линий клеток U87 и FG.
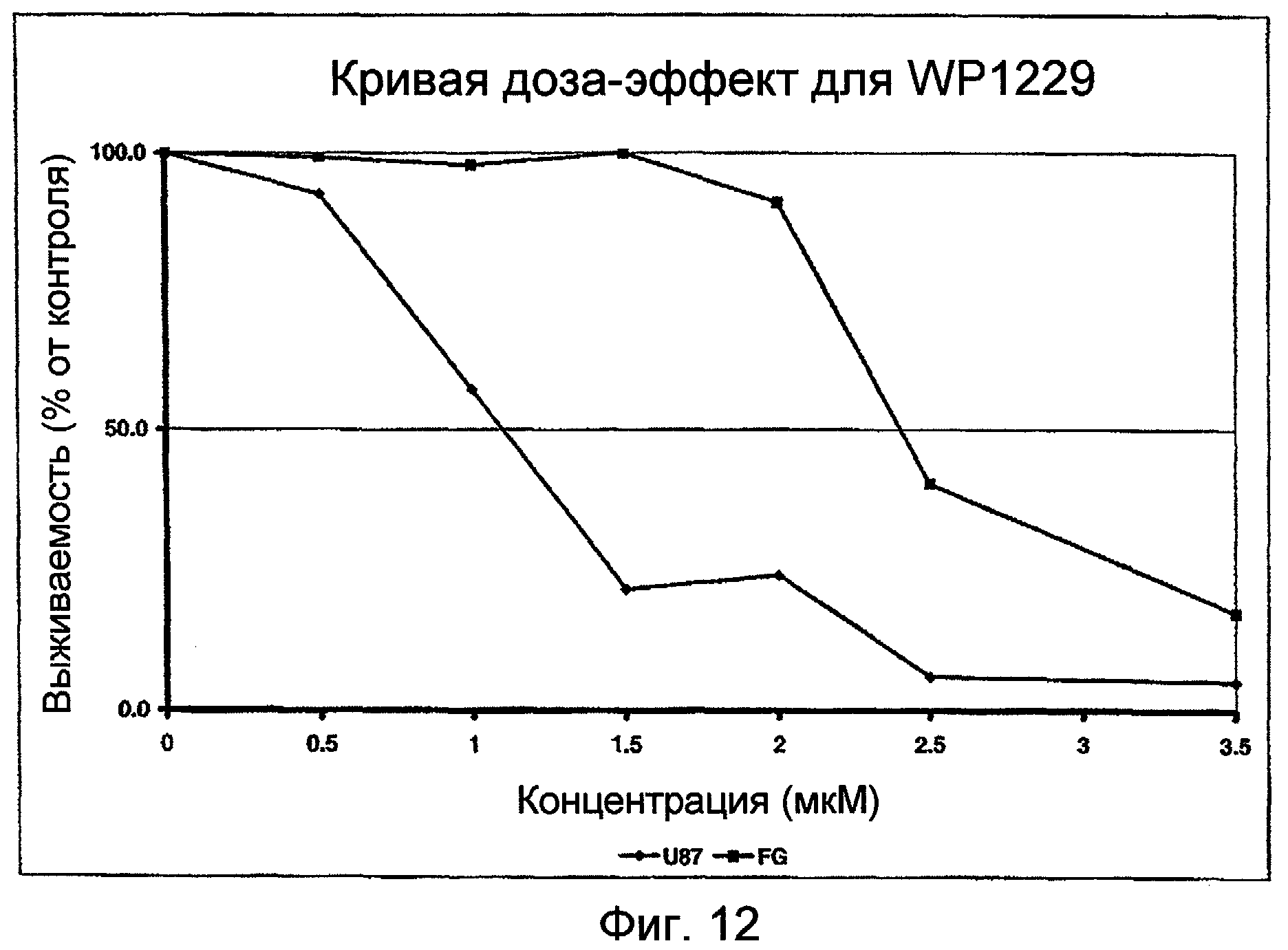
Фиг.12: Кривая доза-эффект для WP1229 в присутствии линии клеток U87.
Фиг.13: Кривая доза-эффект для WP1146 в присутствии линии клеток U87. Величины представляют собой среднее±стандартное отклонение трех экспериментов.
Фиг.14: Кривая доза-эффект для WP1267 в присутствии линии клеток Colo357-FG. Величины представляют собой среднее±ст.откл. (планки погрешностей) трех экспериментов.
Фиг.15: Кривая доза-эффект для WP1267 в присутствии линии клеток U87. Величины представляют собой среднее±ст.откл. (планки погрешностей) трех экспериментов.
Фиг.16: Кривая доза-эффект для WP1268 в присутствии линии клеток Colo357-FG. Величины представляют собой среднее±ст.откл. (планки погрешностей) трех экспериментов.
Фиг.17: Кривая доза-эффект для WP 1268 в присутствии линии клеток U87. Величины представляют собой среднее±ст.откл. (планки погрешностей) трех экспериментов.
Фиг.18: Кривая доза-эффект для WP1269 в присутствии линии клеток U87. Величины представляют собой среднее±ст.откл. (планки погрешностей) трех экспериментов.
Фиг.19: Кривая доза-эффект для WP1269 в присутствии линии клеток Colo357-FG. Величины представляют собой среднее±ст.откл. (планки погрешностей) трех экспериментов.
Фиг.20: Кривая доза-эффект для WP1282 в присутствии линии клеток Colo357-FG.
Фиг.21: Кривая доза-эффект для WP 1282 в присутствии линии клеток U87.
Фиг.22: Кривая доза-эффект для WP1283 в присутствии линии клеток Colo357-FG.
Фиг.23: Кривая доза-эффект для WP1283 в присутствии линии клеток U87.
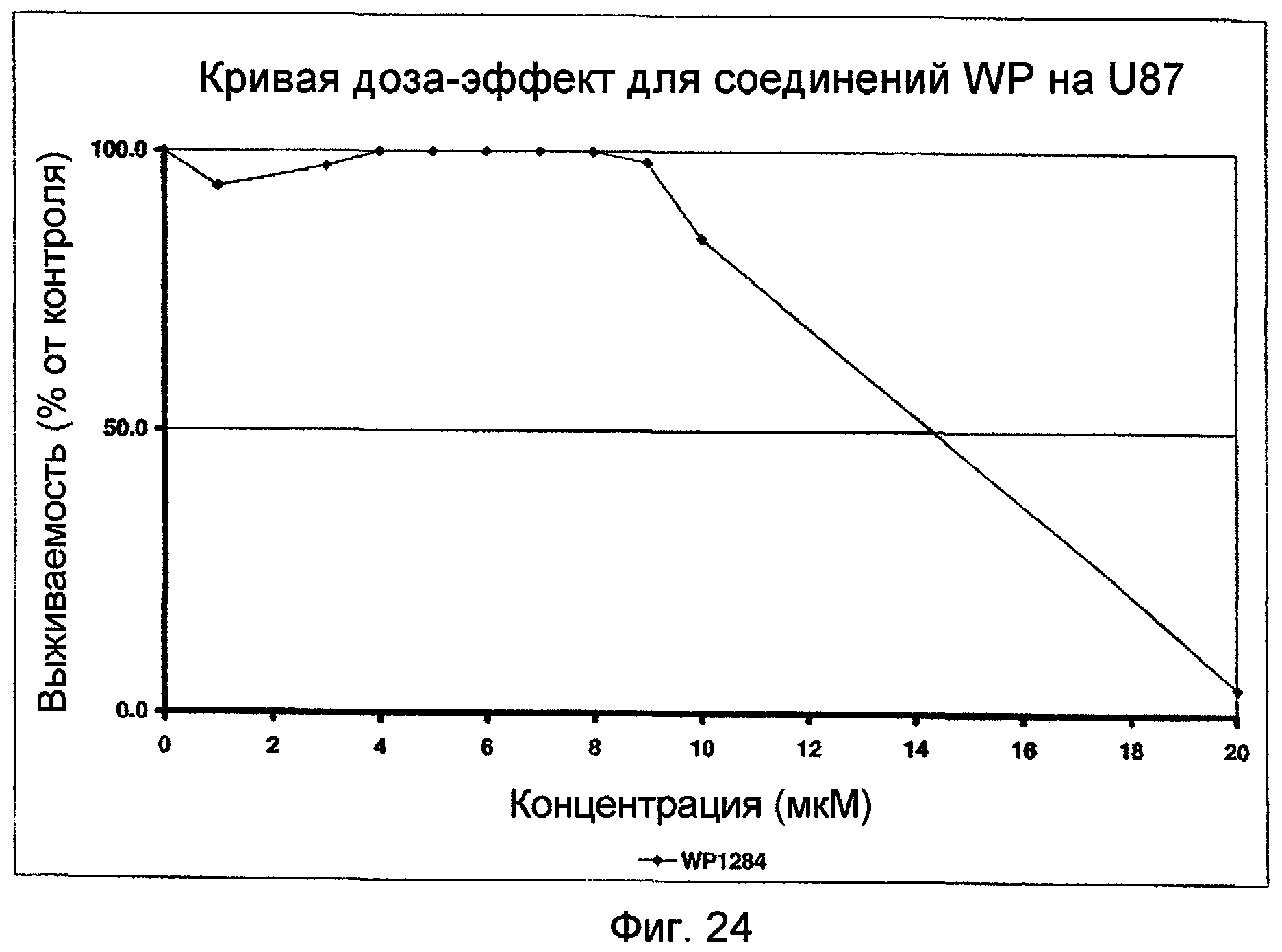
Фиг.24: Кривая доза-эффект для WP1284 в присутствии линии клеток U87.
Фиг.25: Кривая доза-эффект для WP1284 в присутствии линии клеток Colo357-FG.
Фиг.26: Кривая доза-эффект для WP1285 в присутствии линии клеток U87.
Фиг.27: Кривая доза-эффект для WP1285 в присутствии линии клеток Colo357-FG.
Фиг.28: Кривая доза-эффект для WP1286 в присутствии линии клеток U87.
Фиг.29: Кривая доза-эффект для WP1286 в присутствии линии клеток Colo357-FG.
Фиг.30: Кривая доза-эффект для WP1293 в присутствии линии клеток Colo357-FG.
Фиг.31: Кривая доза-эффект для WP1293 в присутствии линии клеток U87.
Фиг.32: Кривая доза-эффект для WP 1302 в присутствии линии клеток U87.
Фиг.33: Кривая доза-эффект для WP1302 в присутствии линии клеток Colo357-FG.
Фиг.34: Соединение WP1193 более активно, чем WP 1066, ингибирует фосфорилирование STAT3. График демонстрирует зависимость выживаемости (% от контроля) от концентрации в микромолярных единицах.
I. Настоящее изобретение
Предшествующие исследования продемонстрировали, что цитокиновые пути, которые активируют факторы транскрипции (например, NF-kB, STAT3), не регулируются или активируются посредством генетических повреждений или аутокринных/паракринных механизмов в разнообразных типах опухолей (Hallek et al., 1998; Hideshima et al., 2002). Данные пути вносят вклад в онкогенность и развитие злокачественного новообразования. В настоящем изобретении были синтезированы новые соединения, и с помощью in vitro-скрининга было обнаружено, что данные соединения могут блокировать опосредованную IL-6 активацию STAT3 при низких концентрациях (~1 мкM). По сравнению с AG490 данные соединения являются значительно более активными (в 20-50 раз) в клетках опухоли в отношении ингибирования Jak2/STAT3-сигнального пути в обработанных IL-6 клетках. Данные соединения также индуцируют апоптоз в большом диапазоне солидных и гематологических опухолевых клеток при концентрациях, которые соответствуют их ингибирующей активности Jak2/STAT3-пути. В настоящем изобретении раскрываются соединения, которые инактивируют гены и сигнальные пути, важные для выживаемости и развития опухолевой клетки, и данные соединения могут использоваться одни или в комбинации с другими агентами для лечения злокачественного новообразования.
II. Химические определения
Используемый в данном описании термин «амино» означает -NH2; термин «нитро» означает -NO2; термин «галоген» обозначает -F, -Cl, -Br или -I; термин «меркапто» означает -SH; термин «циано» означает -CN; термин «силил» означает -SiH3, и термин «гидрокси» означает -OH.
«Алкан» относится к ациклическому разветвленному или неразветвленному углеводороду, в большинстве случаев имеющему общую формулу CnH2n+2. «Алкил» относится к одновалентной группе, полученной из алкана при отщеплении атома водорода от любого атома, соответственно имеющей формулу -CnH2n+1 в большинстве случаев. Алкильные группы либо с неразветвленной (нормальной), либо с разветвленной цепью могут быть замещены дополнительной ациклической алкильной, циклоалкильной или циклической алкильной группами. Алкильная группа может быть гетероатом-замещенной или гетероатом-незамещенной, см. ниже. Предпочтительно, алкильная группа имеет 1-12 атомов углерода. Более предпочтительно, она представляет собой низший алкил, имеющий 1-7 атомов углерода, более предпочтительно 1-4 атомов углерода. Высший алкил имеет 8 или более атомов углерода. «Двухвалентный алкил» относится к двухвалентной группе, полученной из алкана при отщеплении двух атомов водорода либо от одного и того же атома углерода (например, метилeн, этилиден, пропилиден), либо от различных атомов углерода (например -C2H4-).
«Циклоалкан» относится к насыщенным моноциклическим углеводородам с боковыми цепями или без них.
«Циклоалкил» относится к одновалентной группе, полученной из циклоалкана при отщеплении атома водорода от кольцевого атома углерода.
Термин «гетероатом-замещенный», когда используется для изменения класса органических радикалов (например, алкил, арил, ацил и т.д.), означает, что один или более одного атома водорода данного радикала заменено гетероатомом или содержащей гетероатом группой. Примеры гетероатомов и содержащих гетероатом групп включают гидрокси, циано, алкокси, =О, =S, -NO2, -N(CH3)2, амино или -SH. Конкретные замещенные гетероатомом органические радикалы определены более подробно ниже.
Термин «гетероатом-незамещенный», когда используется для изменения класса органических радикалов (например, алкил, арил, ацил и т.д.), означает, что ни один из атомов водорода данного радикала не является замененным гетероатомом или содержащей гетероатом группой. Замещение атома водорода атомом углерода или содержащей только атомы углерода и водорода группой не является достаточным для получения гетероатом-замещенной группы. Например, группа -C6H4C≡CH является примером незамещенной гетероатомом арильной группы, в то время как -C6H4F является примером гетероатом-замещенной арильной группы. Конкретные гетероатом-замещенные органические радикалы определены более подробно ниже.
Термин «гетероатом-незамещенный Cnалкил» относится к алкилу, в дополнение, имеющему в сумме n атомов углерода, все из которых являются неароматическими, 3 или более атомов водорода и ни одного гетероатома. Например, гетероатом-незамещенный C1-C10алкил имеет 1-10 атомов углерода. Группы -CH3, циклопропилметил, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, -CH2CH2CH2CH3, -CH(CH3)CH2CH3, -CH2CH(CH3)2, -C(CH3)3 и -CH2C(CH3)3, все являются примерами гетероатом-незамещенных алкильных групп.
Термин «гетероатом-замещенный Cnалкил» относится к алкилу, в дополнение, имеющему в сумме n атомов углерода, все из которых являются неароматическими, 0, 1 или более одного атома водорода и по меньшей мере один гетероатом, где каждый гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C1-C10алкил имеет 1-10 атомов углерода. Следующие группы являются примерами гетероатом-замещенных алкильных групп: трифторметил, -CH2F, -CH2Cl, -CH2Br, -CH2OH, -CH2OCH3, -CH2OCH2CH3, -CH2OCH2CH2CH3, -CH2OCH(CH3)2, -CH2OCH2CF3, -CH2OCOCH3, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CH2NHCH2CH3, -CH2N(CH3)CH2CH3, -CH2NHCH2CH2CH3, -CH2NHCH(CH3)2, -CH2OCH(CH2)2, -CH2NHCH(CH2)2, -CH2CH2NHCH(CH2)2, -CH2N(CH2CH3)2, -CH2CH2F, -CH2CH2Cl, -CH2CH2Br, -CH2CH2I, -CH2CH2OH, CH2CH2OCOCH3, -CH2CH2NH2, -CH2CH2N(CH3)2, -CH2CH2NHCH2CH3, -CH2CH2N(CH3)CH2CH3, -CH2CH2NHCH2CH2CH3, -CH2CH2NHCH(CH3)2, -CH2CH2N(CH2CH3)2, -CH2CH2NHCO2C(CH3)3 и -CH2Si(CH3)3.
Термин «гетероатом-незамещенный Cnциклоалкил» относится к циклоалкилу, в дополнение, имеющему в сумме n атомов углерода, все из которых являются неароматическими, 3 или более атомов водорода и ни одного гетероатома. Например, гетероатом-незамещенный C3-C10циклоалкил имеет 3-10 атомов углерода. Группы -CH(CH2)2(циклопропил), циклобутил, циклопентил и циклогексил, все являются примерами гетероатом-незамещенных циклоалкильных групп.
Термин «гетероатом-замещенный Cnциклоалкил» относится к циклоалкилу, в дополнение, имеющему в сумме n атомов углерода, все из которых являются неароматическими, 0, 1 или более одного атома водорода и по меньшей мере один гетероатом, где каждый гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C3-C10циклоалкил имеет 3-10 атомов углерода.
Термин «гетероатом-незамещенный Cnалкенил» относится к радикалу, имеющему линейную или разветвленную, циклическую или ациклическую структуру, в дополнение, имеющему по меньшей мере одну неароматическую углерод-углеродную двойную связь, но ни одной углерод-углеродной тройной связи, в сумме n атомов углерода, три или более атома водорода и ни одного гетероатома. Например, гетероатом-незамещенный C2-C10алкенил имеет 2-10 атомов углерода. Гетероатом-незамещенные алкенильные группы включают -CH=CH2, -CH=CHCH3, -CH=CHCH2CH3, -CH=CHCH2CH2CH3, -CH=CHCH(CH3)2, -CH=CHCH(CH2)2, -CH2CH=CH2, -CH2CH=CHCH3, -CH2CH=CHCH2CH3, -CH2CH=CHCH2CH2CH3, -CH2CH=CHCH(CH3)2, -CH2CH=CHCH(CH2)2 и -CH=CH-C6H5.
Термин «гетероатом-замещенный Cnалкенил» относится к радикалу, имеющему один неароматический атом углерода как место присоединения по меньшей мере одной неароматической углерод-углеродной двойной связи, но ни одной углерод-углеродной тройной связи, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему в сумме n атомов углерода, 0, 1 или более одного атома водорода и по меньшей мере один гетероатом, где каждый гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C2-C10алкенил имеет 2-10 атомов углерода. Группы -CH=CHF, -CH=CHCl и -CH=CHBr, все являются примерами гетероатом-замещенных алкенильных групп.
Термин «гетероатом-незамещенный Cnалкинил» относится к радикалу, имеющему линейную или разветвленную, циклическую или ациклическую структуру, в дополнение, имеющему по меньшей мере одну углерод-углеродную тройную связь, в сумме n атомов углерода, по меньшей мере один атом водорода и ни одного гетероатома. Например, гетероатом-незамещенный C2-C10алкинил имеет 2-10 атомов углерода. Группы -C≡CH, -C=CCH3 и -C≡CC6H5 являются примерами гетероатом-незамещенных алкинильных групп.
Термин «гетероатом-замещенный Cnалкинил» относится к радикалу, имеющему один неароматический атом углерода как место присоединения по меньшей мере одной неароматической углерод-углеродной тройной связи, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру и имеющему в сумме n атомов углерода, 0, 1 или более одного атома водорода и по меньшей мере один гетероатом, где каждый гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C2-C10алкинил имеет 2-10 атомов углерода. Группа -C≡CSi(CH3)3является примером гетероатом-замещенной алкинильной группы.
Термин «гетероатом-незамещенный Cnарил» относится к радикалу, имеющему один атом углерода как место присоединения, где атом углерода является частью структуры ароматического кольца, содержащего только атомы углерода, в дополнение, имеющему в сумме n атомов углерода, 5 или более атомов водорода и ни одного гетероатома. Например, гетероатом-незамещенный C6-C10арил имеет 6-10 атомов углерода. Примеры гетероатом-незамещенных арильных групп включают фенил, метилфенил, (диметил)фенил, -C6H4CH2CH3, -C6H4CH2CH2CH3, -C6H4CH(CH3)2, -C6H4CH(CH2)2, -C6H3(CH3)CH2CH3, -C6H4CH=CH2, -C6H4CH=CHCH3, -C6H4C=CH, -C6H4C=CCH3, нафтил, хинолил, индолил и радикал, полученный из бифенила. Термин «гетероатом-незамещенный арил» включает карбоциклические арильные группы, биарильные группы и радикалы, полученные из полициклических конденсированных углеводородов (PAH).
Термин «гетероатом-замещенный Cnарил» относится к радикалу, имеющему либо один ароматический атом углерода, либо один ароматический гетероатом как место присоединения, в дополнение, имеющему в сумме n атомов углерода, по меньшей мере один атом водорода и по меньшей мере один гетероатом, кроме того, где каждый гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-незамещенный C6-C10гетероарил имеет 6-10 атомов углерода. Термин «гетероатом-замещенный арил» включает гетероарильные и гетероциклические арильные группы. Он также включает все группы, полученные из следующих соединений, включающих: пиррол, фуран, тиофен, имидазол, оксазол, изоксазол, тиазол, изотиазол, триазол, пиразол, пиридин, пиразин, пиридазин, пиримид и подобные. Дополнительные примеры гетероатом-замещенных арильных групп включают группы: -C6H4F, -C6H4Cl, -C6H4Br, -C6H4I, -C6H4OH, -C6H4OCH3, -C6H4OCH2CH3, -C6H4OCOCH3, -C6H4OC6H5, -C6H4NH2, -C6H4NHCH3, -C6H4NHCH2CH3, -C6H4CH2Cl, -C6H4CH2Br, -C6H4CH2OH, -C6H4CH2OCOCH3, -C6H4CH2NH2, -C6H4N(CH3)2, -C6H4CH2CH2Cl, -C6H4CH2CH2OH, -C6H4CH2CH2OCOCH3, -C6H4CH2CH2NH2, -C6H4CH2CH=CH2, -C6H4CF3, -C6H4CN, -C6H4C=CSi(CH3)3, -C6H4COH, -C6H4COCH3, -C6H4COCH2CH3, -C6H4COCH2CF3, -C6H4COC6H5, -C6H4CO2H, -C6H4CO2CH3, -C6H4CONH2, -C6H4CONHCH3, -C6H4CON(CH3)2, фуранил, тиенил, пиридил, пирролил, пиримидил, пиразинил и имидазоил.
Термин «гетероатом-незамещенный Cnаралкил» относится к радикалу, имеющему один насыщенный атом углерода как место присоединения, в дополнение, имеющий в сумме n атомов углерода, где по меньшей мере 6 атомов углерода образуют структуру ароматического кольца, содержащую только атомы углерода, 7 или более атомов водорода и ни одного гетероатома. Например, гетероатом-незамещенный C7-C10аралкил имеет 7-10 атомов углерода. «Аралкил» включает гетероатом-замещенный алкил с арильной группой. Примеры гетероатом-незамещенных аралкилов включают фенилметил (бензил) и фенилэтил.
Термин «гетероатом-замещенный Cnаралкил» относится к радикалу, имеющему один насыщенный атом углерода как место присоединения, в дополнение, имеющий в сумме n атомов углерода, 0, 1 или более одного атома водорода и по меньшей мере один гетероатом, где по меньшей мере один из гетероатомов включен в структуру ароматического кольца, кроме того, где каждый гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C7-C10гетероаралкил имеет 7-10 атомов углерода.
Термин «гетероатом-незамещенный Cnацил» относится к радикалу, имеющему один атом углерода карбонильной группы как место присоединения, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того имеющему в сумме n атомов углерода, 1 или более атомов водорода, всего один атом кислорода и ни одного дополнительного гетероатома. Например, гетероатом-незамещенный C1-C10ацил имеет 1-10 атомов углерода. Группы -COH, -COCH3, -COCH2CH3, -COCH2CH2CH3, -COCH(CH3)2, -COCH(CH2)2, -COC6H5, -COC6H4CH3, -COC6H4CH2CH3, -COC6H4CH2CH2CH3, -COC6H4CH(CH3)2, -COC6H4CH(CH2)2 и -COC6H3(CH3)2 являются примерами гетероатом-незамещенных ацильных групп.
Термин «гетероатом-замещенный Cnацил» относится к радикалу, имеющему один атом углерода как место присоединения, причем атом углерода является частью карбонильной группы, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, в дополнение, имеющему в сумме n атомов углерода, 0, 1 или более одного атома водорода, по меньшей мере один дополнительный гетероатом в дополнение к кислороду карбонильной группы, где каждый дополнительный гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C1-С10ацил имеет 1-10 атомов углерода. Термин гетероатом-замещенный ацил включает карбамоильную, тиокарбоксилатную группу и группу тиокарбоновой кислоты. Группы -COCH2CF3, -CO2H, -CO2CH3, -CO2CH2CH3, -CO2CH2CH2CH3, -CO2CH(CH3)2, -CO2CH(CH2)2, -CONH2, -CONHCH3, -CONHCH2CH3, -CONHCH2CH2CH3, -CONHCH(CH3)2, -CONHCH(CH2)2, -CON(CH3)2, -CON(CH2CH3)CH3, -CON(CH2CH3)2 и -CONHCH2CF3 являются примерами гетероатом-замещенных ацильных групп.
Термин «гетероатом-незамещенный Cnалкокси» относится к группе, имеющей структуру -OR, где R представляет собой гетероатом-незамещенный Cnалкил, как определено выше. Гетероатом-незамещенные алкоксигруппы включают -OCH3, -OCH2CH3, -OCH2CH2CH3, -OCH(CH3)2 и -OCH(CH2)2.
Термин «гетероатом-замещенный Cnалкокси» относится к группе, имеющей структуру -OR, где R представляет собой гетероатом-замещенный Cnалкил, как определено выше. Например, -OCH2CF3 представляет собой гетероатом-замещенную алкоксигруппу.
Термин «гетероатом-незамещенный Cnалкенилокси» относится к группе, имеющей структуру -OR, где R представляет собой гетероатом-незамещенный Cnалкенил, как определено выше.
Термин «гетероатом-замещенный Cnалкенилокси» относится к группе, имеющей структуру -OR, где R представляет собой гетероатом-замещенный Cnалкенил, как определено выше.
Термин «гетероатом-незамещенный Cnалкинилокси» относится к группе, имеющей структуру -OR, где R представляет собой гетероатом-незамещенный Cnалкинил, как определено выше.
Термин «гетероатом-замещенный Cnалкинилокси» относится к группе, имеющей структуру -OR, где R представляет собой гетероатом-замещенный Cnалкинил, как определено выше.
Термин «гетероатом-незамещенный Cnарилокси» относится к группе, имеющей структуру -OAr, где Ar представляет собой гетероатом-незамещенный Cnарил, как определено выше. Примером гетероатом-незамещенной арилоксигруппы является -OC6H5.
Термин «гетероатом-замещенный Cnарилокси» относится к группе, имеющей структуру -OAr, где Ar представляет собой гетероатом-замещенный Cnарил, как определено выше.
Термин «гетероатом-незамещенный Cnаралкилокси» относится к группе, имеющей структуру -OAr, где Ar представляет собой гетероатом-незамещенный Cnаралкил, как определено выше.
Термин «гетероатом-замещенный Cnаралкилокси» относится к группе, имеющей структуру -OAr, где Ar представляет собой гетероатом-замещенный Cnаралкил, как определено выше.
Термин «гетероатом-незамещенный Cnацилокси» относится к группе, имеющей структуру -OAc, где Ac представляет собой гетероатом-незамещенный Cnацил, как определено выше. Гетероатом-незамещенная ацилоксигруппа включает алкилкарбонилокси и арилкарбонилоксигруппы. Например, -OCOCH3 является примером гетероатом-незамещенной ацилоксигруппы.
Термин «гетероатом-замещенный Cnацилокси» относится к группе, имеющей структуру -OAc, где Ac представляет собой гетероатом-замещенный Cnацил, как определено выше. Гетероатом-замещенная ацилоксигруппа включает алкоксикарбонилокси, арилоксикарбонилокси, карбоксилатную, алкилкарбонильную, алкоксикарбонильную, аминокарбонильную и алкилтиокарбонильную группы.
Термин «гетероатом-незамещенный Cnалкиламино» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему один или два насыщенных атома углерода, присоединенных к атому азота, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, содержащую в сумме n атомов углерода, все из которых являются неароматическими, 4 или более атомов водорода, всего 1 атом азота и ни одного дополнительного гетероатома. Например, гетероатом-незамещенный C1-С10алкиламино имеет 1-10 атомов углерода. Термин «гетероатом-незамещенный Cnалкиламино» включает группы со структурой -NHR, где R представляет собой гетероатом-незамещенный Cnалкил, как определено выше. Гетероатом-незамещенная алкиламиногруппа может включать -NHCH3, -NHCH2CH3, -NHCH2CH2CH3, -NHCH(CH3)2, -NHCH(CH2)2, -NHCH2CH2CH2CH3, -NHCH(CH3)CH2CH3, -NHCH2CH(CH3)2, -NHC(CH3)3, -N(CH3)2, -N(CH3)CH2CH3, -N(CH2CH3)2, N-пирролидинил и N-пиперидинил.
Термин «гетероатом-замещенный Cnалкиламино» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему один или два насыщенных атома углерода, присоединенных к атому азота, ни одной углерод-углеродной двойной или тройной связи, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему в сумме n атомов углерода, все из которых являются неароматическими, 0, 1 или более одного атома водорода и по меньшей мере один дополнительный гетероатом, то есть в дополнение к атому азота в месте присоединения, где каждый дополнительный гетероатом независимо выбирают из группы, состоящей из Ν, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C1-C10алкиламино имеет 1-10 атомов углерода. Термин «гетероатом-замещенный Cnалкиламино» включает группы со структурой -ΝHR, где R представляет собой гетероатом-замещенный Cnалкил, как определено выше.
Термин «гетероатом-незамещенный Cnалкениламино» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему один или два атома углерода, присоединенных к атому азота, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, содержащую по меньшей мере одну неароматическую углерод-углеродную двойную связь, в сумме n атомов углерода, 4 или более атомов водорода, всего один атом азота и ни одного дополнительного гетероатома. Например, гетероатом-незамещенный C2-C10алкениламино имеет 2-10 атомов углерода. Термин «гетероатом-незамещенный Cnалкениламино» включает группы со структурой -ΝHR, где R представляет собой гетероатом-незамещенный Cnалкенил, как определено выше. Примеры гетероатом-незамещенных Cnалкениламиногрупп также включают диалкениламино и алкил(алкенил)аминогруппы.
Термин «гетероатом-замещенный Cnалкениламино» относится к радикалу, имеющему один атом азота как место присоединения и по меньшей мере одну дополнительную углерод-углеродную неароматическую двойную связь, но ни одной углерод-углеродной тройной связи, кроме того, имеющему один или два атома углерода, присоединенных к атому азота, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему в сумме n атомов углерода, 0, 1 или более одного атома водорода и по меньшей мере один дополнительный гетероатом, то есть в дополнение к атому азота в месте присоединения, где каждый дополнительный гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C2-C10алкениламино имеет 2-10 атомов углерода. Термин «гетероатом-замещенный Cnалкениламино» включает группы со структурой -NHR, где R представляет собой гетероатом-замещенный Cnалкенил, как определено выше.
Термин «гетероатом-незамещенный Cnалкиниламино» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему один или два атома углерода, присоединенных к атому азота, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, содержащую по меньшей мере одну углерод-углеродную тройную связь, в сумме n атомов углерода, по меньшей мере один атом водорода, всего один атом азота и ни одного дополнительного гетероатома. Например, гетероатом-незамещенный C2-C10алкиниламино имеет 2-10 атомов углерода. Термин «гетероатом-незамещенный Cnалкиниламино» включает группы со структурой -NHR, где R представляет собой гетероатом-незамещенный Cnалкинил, как определено выше. Aлкиниламиногруппа включает диалкиниламино и алкил(алкинил)аминогруппы.
Термин «гетероатом-замещенный Cnалкиниламино» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему один или два атома углерода, присоединенных к атому азота, кроме того, имеющему по меньшей мере одну неароматическую углерод-углеродную тройную связь, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, и кроме того, имеющему в сумме n атомов углерода, 0, 1 или более одного атома водорода и по меньшей мере один дополнительный гетероатом, то есть в дополнение к атому азота в месте присоединения, где каждый дополнительный гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C2-С10алкиниламино имеет 2-10 атомов углерода. Термин «гетероатом-замещенный Cnалкиниламино» включает группы со структурой -NHR, где R представляет собой гетероатом-замещенный Cnалкинил, как определено выше.
Термин «гетероатом-незамещенный Cnариламино» относится к радикалу, имеющему один атом азота как место присоединения, в дополнение, имеющему по меньшей мере одну структуру ароматического кольца, присоединенную к атому азота, где структура ароматического кольца содержит только атомы углерода, кроме того, имеющему в сумме n атомов углерода, 6 или более атомов водорода, всего один атом азота и ни одного дополнительного гетероатома. Например, гетероатом-незамещенный C6-C10ариламино имеет 6-10 атомов углерода. Термин «гетероатом-незамещенный Cnариламино» включает группы со структурой -NHR, где R представляет собой гетероатом-незамещенный Cnарил, как определено выше. Гетероатом-незамещенная ариламиногруппа включает диариламино и алкил(арил)аминогруппы.
Термин «гетероатом-замещенный Cnариламино» относится к радикалу, имеющему один атом азота как место присоединения, в дополнение, имеющему в сумме n атомов углерода, по меньшей мере один атом водорода, по меньшей мере один дополнительный гетероатом, то есть в дополнение к атому азота в месте присоединения, где по меньшей мере один атом углерода включен в структуру ароматического кольца, кроме того, где каждый дополнительный гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C6-C10ариламино имеет 6-10 атомов углерода. Термин «гетероатом-замещенный Cnариламино» включает группы со структурой -NHR, где R представляет собой гетероатом-замещенный Cnарил, как определено выше. Гетероатом-замещенная ариламиногруппа включает гетероариламиногруппы.
Термин «гетероатом-незамещенный Cnаралкиламино» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему один или два насыщенных атома углерода, присоединенных к атому азота, в дополнение, имеющему в сумме n атомов углерода, где по меньшей мере 6 атомов углерода образуют структуру ароматического кольца, содержащую только атомы углерода, 8 или более атомов водорода, всего один атом азота и ни одного дополнительного гетероатома. Например, гетероатом-незамещенный C7-C10аралкиламино имеет 7-10 атомов углерода. Термин «гетероатом-незамещенный Cnаралкиламино» включает группы со структурой -NHR, где R представляет собой гетероатом-незамещенный Cnаралкил, как определено выше. Aралкиламиногруппа включает диаралкиламиногруппы.
Термин «гетероатом-замещенный Cnаралкиламино» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему по меньшей мере один или два насыщенных атома углерода, присоединенных к атому азота, в дополнение, имеющему в сумме n атомов углерода, 0, 1 или более одного атома водорода, по меньшей мере один дополнительный гетероатом, то есть в дополнение к атому азота в месте присоединения, где по меньшей мере один атом углерода включен в ароматическое кольцо, кроме того, где каждый гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C7-C10аралкиламино имеет 7-10 атомов углерода. Термин «гетероатом-замещенный Cnаралкиламино» включает группы со структурой -NHR, где R представляет собой гетероатом-замещенный Cnаралкил, как определено выше. Термин «гетероатом-замещенный аралкиламино» включает термин «гетероаралкиламино».
Термин «гетероатом-незамещенный Cnамидо» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему карбонильную группу, присоединенную через ее атом углерода к атому азота, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему в сумме n атомов углерода, 1 или более атомов водорода, всего один атом кислорода, всего один атом азота и ни одного дополнительного гетероатома. Например, гетероатом-незамещенный C1-C10амидо имеет 1-10 атомов углерода. Термин «гетероатом-незамещенный Cnамидо» включает группы со структурой -NHR, где R представляет собой гетероатом-незамещенный Cnацил, как определено выше. Термин амидо включает N-алкиламидо, N-ариламидо, N-аралкиламидо, ациламино, алкилкарбониламино, арилкарбониламино и уреидогруппы. Группа -ΝHCOCH3 является примером гетероатом-незамещенной амидогруппы.
Термин «гетероатом-замещенный Cnамидо» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему карбонильную группу, присоединенную через ее атом углерода к атому азота, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему в сумме n ароматических или неароматических атомов углерода, 0, 1 или более одного атома водорода, по меньшей мере один дополнительный гетероатом дополнительно к кислороду карбонильной группы, где каждый дополнительный гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C1-C10амидо имеет 1-10 атомов углерода. Термин «гетероатом-замещенный Cn-амидо» включает группы со структурой -NHR, где R представляет собой гетероатом-незамещенный Cnацил, как определено выше. Группа -NHCO2CH3 является примером гетероатом-замещенной амидогруппы.
Термин «гетероатом-незамещенный Cnсульфонамидо» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему сульфонильную группу, присоединенную через ее атом серы к атому азота, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему в сумме n атомов углерода, 1 или более атомов водорода, всего один атом кислорода, всего один атом азота и ни одного дополнительного гетероатома. Например, гетероатом-незамещенный C1-C10сульфонамидо имеет 1-10 атомов углерода. Термин амидо включает N-алкилсульфонамидо, N-арилсульфонамидо, N-аралкилсульфонамидо, сульфониламино, алкилсульфонамино и арилсульфонаминогруппы. Группа -NHS(O)2CH3 является примером гетероатом-незамещенной сульфонамидогруппы.
Термин «гетероатом-замещенный Cnсульфонамидо» относится к радикалу, имеющему один атом азота как место присоединения, кроме того, имеющему сульфонильную группу, присоединенную через ее атом серы к атому азота, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему в сумме n ароматических или неароматических атомов углерода, 0, 1 или более одного атома водорода, по меньшей мере один дополнительный гетероатом в дополнение к атомам серы и кислорода сульфонильной группы, где каждый дополнительный гетероатом независимо выбирают из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C1-C10сульфонамидо имеет 1-10 атомов углерода. Группа -NHS(O)2OCH3 является примером гетероатом-замещенной сульфонамидогруппы.
Термин «гетероатом-незамещенный Cnалкилтио» относится к группе, имеющей структуру -SR, где R представляет собой гетероатом-незамещенный Cnалкил, как определено выше. Группа -SCH3 является примером гетероатом-незамещенной алкилтиогруппы.
Термин «гетероатом-замещенный Cnалкилтио» относится к группе, имеющей структуру -SR, где R представляет собой гетероатом-замещенный Cnалкил, как определено выше.
Термин «гетероатом-незамещенный Cnалкенилтио» относится к группе, имеющей структуру -SR, где R представляет собой гетероатом-незамещенный Cnалкенил, как определено выше.
Термин «гетероатом-замещенный Cnалкенилтио» относится к группе, имеющей структуру -SR, где R представляет собой гетероатом-замещенный Cnалкенил, как определено выше.
Термин «гетероатом-незамещенный Cnалкинилтио» относится к группе, имеющей структуру -SR, где R представляет собой гетероатом-незамещенный Cnалкинил, как определено выше.
Термин «гетероатом-замещенный Cnалкинилтио» относится к группе, имеющей структуру -SR, где R представляет собой гетероатом-замещенный Cnалкинил, как определено выше.
Термин «гетероатом-незамещенный Cnарилтио» относится к группе, имеющей структуру -SAr, где Ar представляет собой гетероатом-незамещенный Cnарил, как определено выше. Группа -SC6H5 является примером гетероатом-незамещенной арилтиогруппы.
Термин «гетероатом-замещенный Cnарилтио» относится к группе, имеющей структуру -SAr, где Ar представляет собой гетероатом-замещенный Cnарил, как определено выше.
Термин «гетероатом-незамещенный Cnаралкилтио» относится к группе, имеющей структуру -SAr, где Ar представляет собой гетероатом-незамещенный Cnаралкил, как определено выше. Группа -SCH2C6H5 является примером гетероатом-незамещенной аралкильной группы.
Термин «гетероатом-замещенный Cnаралкилтио» относится к группе, имеющей структуру -SAr, где Ar представляет собой гетероатом-замещенный Cnаралкил, как определено выше.
Термин «гетероатом-незамещенный Cnацилтио» относится к группе, имеющей структуру -SAc, где Ac представляет собой гетероатом-незамещенный Cnацил, как определено выше. Группа -SCOCH3 является примером гетероатом-незамещенной ацилтиогруппы.
Термин «гетероатом-замещенный Cnацилтио» относится к группе, имеющей структуру -SAc, где Ac представляет собой гетероатом-замещенный Cnацил, как определено выше.
Термин «гетероатом-незамещенный Cnалкилсилил» относится к радикалу, имеющему один атом кремния как место присоединения, кроме того, имеющему один, два или три насыщенных атома углерода, присоединенных к атому кремния, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, содержащую в сумме n атомов углерода, все из которых являются неароматическими, 5 или более атомов водорода, всего 1 атом кремния и ни одного дополнительного гетероатома. Например, гетероатом-незамещенный C1-C10алкилсилил имеет 1-10 атомов углерода. Aлкилсилильная группа включает диалкиламиногруппы. Группы -Si(CH3)3 и -Si(CH3)2C(CH3)3 являются примерами гетероатом-незамещенных алкилсилильных групп.
Термин «гетероатом-замещенный Cnалкилсилил» относится к радикалу, имеющему один атом кремния как место присоединения, кроме того, имеющему один, два или три насыщенных атома углерода, присоединенных к атому кремния, ни одной углерод-углеродной двойной или тройной связи, в дополнение, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему в сумме n атомов углерода, все из которых являются неароматическими, 0, 1 или более одного атома водорода, и по меньшей мере один дополнительный гетероатом, то есть в дополнение к атому кремния в месте присоединения, где каждый дополнительный гетероатом независимо выбирают группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, гетероатом-замещенный C1-C10алкилсилил имеет 1-10 атомов углерода.
Используемый в данном описании термин «фармацевтически приемлемые соли» относится к солям соединений настоящего изобретения, которые являются по существу нетоксичными для живых организмов. Типичные фармацевтически приемлемые соли включают соли, полученные при взаимодействии соединения настоящего изобретения с неорганической или органической кислотой или органическим основанием, в зависимости от заместителей, присутствующих в соединении по изобретению.
Примеры неорганических кислот, которые могут быть использованы для получения фармацевтически приемлемых солей, включают хлористоводородную кислоту, фосфорную кислоту, серную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, фосфористую кислоту и тому подобное. Примеры органических кислот, которые могут использоваться для получения фармацевтически приемлемых солей, включают алифатические моно- и дикарбоновые кислоты, такие как щавелевая кислота, угольная кислота, лимонная кислота, янтарная кислота, фенил-гетероатом-замещенные карбоновые кислоты, алифатические и ароматические серные кислоты и тому подобное. Фармацевтически приемлемые соли, полученные из неорганических или органических кислот, таким образом, включают гидрохлорид, гидробромид, нитрат, сульфат, пиросульфат, бисульфат, сульфит, бисульфат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, гидройодид, гидрофторид, ацетат, пропионат, формиат, оксалат, цитрат, лактат, п-толуолсульфонат, метансульфонат, малеат и тому подобное. Другие подходящие соли известны специалисту в данной области.
Подходящие фармацевтически приемлемые соли могут также образовываться при взаимодействии соединений по изобретению с органическим основанием, таким как метиламин, этиламин, этаноламин, лизин, орнитин и тому подобное. Другие подходящие соли известны специалисту в данной области.
Фармацевтически приемлемые соли включают соли, которые образуются между карбоксилатной или сульфонатной группами, находящимися в некоторых соединениях настоящего изобретения, и неорганическими катионами, такими как натрий, калий, аммоний или кальций, или такими органическими катионами, как изопропиламмоний, триметиламмоний, тетраметиламмоний и имидазолий.
Следует понимать, что конкретный анион или катион, образующий часть любой соли настоящего изобретения, не является критическим, при условии, что соль, в целом, является фармацевтически приемлемой, и при условии, что анион или катион не приводит к нежелательным качествам или эффектам. Кроме того, дополнительные фармацевтически приемлемые соли известны специалистам в данной области и могут использоваться в объеме изобретения. Дополнительные примеры фармацевтически приемлемых солей и способы их получения и применения представлены в «Pharmaceutical Salts: Properties, Selection и Use - A Handbook» (2002), которая включена в данное описание посредством ссылки.
Используемый в данном описании термин «пациент» предназначен для включения живых организмов, у которых наблюдаются определенные состояния, описанные выше. Примеры включают людей, обезьян, коров, овец, коз, собак, кошек, мышей, крыс и их трансгенный вид. В предпочтительном варианте осуществления пациентом является примат. В еще более предпочтительном варианте осуществления приматом является человек. В других примерах субъекты включают экспериментальных животных, таких как мыши, крысы, собаки, кошки, козы, овцы, свиньи и коровы. Экспериментальное животное может быть животной моделью данного заболевания, например, трансгенная мышь с невропатологией типа Альцгеймера. Пациентом может быть человек, страдающий от нейродегенеративного заболевания, такого как болезнь Альцгеймера или болезнь Паркинсона.
Используемый в данном описании термин «IC50» относится к ингибирующей дозе, которая представляет 50% от полученного максимального ответа.
Используемый в данном описании термин «водорастворимый» означает, что соединение растворяется в воде по меньшей мере вплоть до 0,010 моль/литр или классифицируется как растворимое в соответствии с предшествующей литературой.
Используемый в данном описании «преимущественно один энантиомер» означает, что соединение содержит по меньшей мере 85% одного энантиомера или, более предпочтительно, по меньшей мере 90% одного энантиомера или, даже более предпочтительно, по меньшей мере 95% одного энантиомера или, наиболее предпочтительно, по меньшей мере 99% одного энантиомера. Аналогично, фраза «по существу свободный от других оптических изомеров» означает, что композиция содержит самое большее 5% другого энантиомера или диастереомера, более предпочтительно, 2% другого энантиомера или диастереомера и, наиболее предпочтительно, 1% другого энантиомера или диастереомера.
Используемое в данном описании определение в единственном числе может означать один или более. Используемые в данном описании определения в сочетании со словами «включающий» или «имеющий» могут означать один или более одного. Используемый в данном описании «другой» может означать по меньшей мере второй или более.
Другие используемые аббревиатуры являются следующими: ДМСО, диметилсульфоксид; iNOS, индуцируемая NO-синтаза; COX-2, циклооксигеназа-2; NGF, фактор роста нервов; IBMX, изобутилметилксантин; FBS, фетальная бычья сыворотка; GPDH, глицерин-3-фосфатдегидрогеназа; RXR, рецептор ретиноида Х; TGF-β, трансформирующий фактор роста-β; IFN-γ, интерферон-γ; LPS, бактериальный эндотоксичный липополисахарид; TNF-α, фактор некроза опухоли-α; IL-1β, интерлейкин-1β; GAPDH, глицеральдегид-3-фосфатдегидрогеназа; MTT, 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолийбромид; TCA, трихлоруксусная кислота; HO-1, индуцируемая гем-оксигеназа.
III. Кофейная кислота, ее производные и их аналоги
Настоящее изобретение относится к подобным кофейной кислоте соединениям для лечения связанных с пролиферацией клеток заболеваний, таких как злокачественное новообразование. Соединения по настоящему изобретению представлены выше, в описании сущности изобретения, формуле изобретения, а также в примерах ниже.
IV. Связанные с пролиферацией клеток заболевания
Термин «связанные с пролиферацией клеток заболевания» относится к расстройствам, являющимся следствием чрезмерно повышенного и/или неконтролируемого роста клетки(ок) в многоклеточном организме, которое приводит к нанесению вреда (например, дискомфорт или снижению продолжительности жизни) многоклеточному организму. Связанные с пролиферацией клеток заболевания могут возникать у животных или людей. Злокачественное новообразование является примером заболевания, связанного с клеточной пролиферацией, и определенные варианты осуществления настоящего изобретения непосредственно связаны с лечением злокачественного новообразования.
В определенных вариантах осуществления соединения и способы по настоящему изобретению могут применяться для лечения широкого ряда злокачественных состояний, включая, например, меланому, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак легкого, гепатокарциному, ретинобластому, астроцитому, глиобластому, лейкоз, рак крови, мозга, кожи, глаза, языка, десны, нейробластому, рак головы, шеи, молочной железы, поджелудочной железы, почки, кости, тестикулярный рак, рак яичника, мезотелиому, рак шейки матки, желудочно-кишечного тракта, лимфому, рак толстой кишки и/или мочевого пузыря. Злокачественное новообразование может охватывать опухоль, образованную злокачественными клетками. Такие злокачественные состояния могут включать клетки, которые являются злокачественными, предзлокачественными и/или малигнантными (озлокачествленными).
Также ожидается, что соединения настоящего изобретения могут также применяться для лечения связанных с пролиферацией клеток заболеваний, других, чем злокачественное новообразование. Другие связанные с пролиферацией клеток заболевания, которые могут подвергаться лечению в определенных вариантах осуществления настоящего изобретения, включают, например, ревматоидный артрит, воспалительные заболевания кишечника, остеоартрит, лейомиому, аденомы, липомы, гемангиомы, фибромы, окклюзию сосуда, рестеноз, атеросклероз, пренеопластические поражения (например, аденоматозная гиперплазия, внутриэпителиальная неоплазия предстательной железы), карциному in situ, внутриротовую волосистую лейкоплакию и/или псориаз и различные формы псориаза, включая псориатический артрит, другие воспалительные состояния кожи, такие как крапивница, экзема, атопический дерматит, анулярная гранулема, ангиома, базально-клеточная карцинома, плоскоклеточная карцинома, злокачественная меланома, себорейный дерматит, розовые угри, другие сверхактивные аутоиммунные расстройства, такие как ревматоидный артрит, хронический активный гепатит, тиреоидит Хашимото, волчанка, заболевания соединительной ткани, смешанные заболевания соединительной ткани и воспалительные заболевания нервной системы, такие как рассеянный склероз, воспалительный лейкоэнцефалит.
Соединения по настоящему изобретению могут действовать путем селективного ингибирования фосфорилирования STAT3, как описано у Iwamaru et al (2006), что включено в данное описание посредством ссылки. В указанных исследованиях WP1066, ингибитор, родственный по структуре AG490, но значительно более активный и эффективный против клеток злокачественной глиомы U87-MG и U373-MG in vitro и in vivo. Было показано, что значения IC50 для WP1066 раны 5,6 мкM в случае клеток U87-MG и 3,7 мкM в случае клеток U373-MG, которые представляют 18-кратное и восьмикратное увеличение в активности, соответственно, в отношении AG490. WP1066, активируя Bax, подавляют экспрессию c-myc, Bcl-XL и Mcl-1 и индуцируют апоптоз. Системное интраперитонеальное введение WP1066 мыши значительно (P<0,001) ингибирует рост подкожных ксенотрансплантатов злокачественных глиом в течение 30-ти дневного последующего периода. Иммуногистохимический анализ удаленных оперативно опухолей обнаружил, что уровни фосфорилирования STAT3 в группе, подвергавшейся лечению WP 1066, остаются ингибированными в течение 3 недель после конечной инъекции WP 1066, в то время как опухоли контрольной группы экспрессировали высокие уровни фософрилированных STAT3. Соединения по настоящему изобретению могут даже быть более активными, чем WP1066. Например, как показано на фиг.34, соединение WP1193, как было показано, ингибирует фосфорилирование STAT3 более эффективно, чем WP1066. Принимая во внимание структурную аналогию между соединениями по настоящему изобретению и соединениями, тестируемыми у Iwamaru et al., 2006, в данном изобретении предполагается, что соединения настоящего изобретения будут более эффективными для лечения различных типов злокачественных новообразований, включая злокачественные глиомы человека, которые являются наиболее общими злокачественными опухолями мозга, и астроцитарные опухоли стадий II-IV (2002) по Всемирной организации здравоохранения. В изобретении дополнительно предполагается, что соединения настоящего изобретения будут полезны для лечения таких опухолей, у которых STAT3 конститутивно активируется, такие как злокачественные новообразования, описанные у Yu and Jove (2004), которое включено в данное описание посредством ссылки. Такие опухоли включают солидные опухоли, такие как рак молочной железы, рак головы и шеи, меланома, рак яичников, рак легкого, рак поджелудочной железы и рак предстательной железы, и опухоли крови, такие как множественная миелома, лейкозы (например, HTLV-I-зависимый, острый миелобластный лейкоз, лейкоз из больших гранулярных лимфоцитов), и лимфомы (например, связанные с вирусом Эпштейн-Барра (EBV)/Беркитта, грибовидный микоз, кожная Т-клеточная лимфома, не-ходжкинская лимфома и анапластическая крупноклеточная лимфома). Также ожидается, что соединения по настоящему изобретению способны проникать через гематоэнцефалический барьер исходя из их структурного сходства с WP1066.
Кроме того, соединения по настоящему изобретению могут применяться для лечения заболеваний, помимо заболеваний, связанных с гиперпролиферацией. Например, определенные соединения WP могут быть полезны для лечения гипертрофии и ишемии (патент США 6433018), а также инфекции гепатита B (патент США 6420338). Таким образом, соединения по настоящему изобретению могут также быть полезны для лечения других заболеваний, включая гипертрофию, ишемию и вирусную инфекцию (например, инфекция гепатита B), псориаз и различные формы псориаза, включая псориатический артрит, другие воспалительные состояния кожи, такие как крапивница, экзема, атопический дерматит, анулярная гранулема, ангиома, базально-клеточная карцинома, плоскоклеточная карцинома, злокачественная меланома, себорейный дерматит, розовые угри, другие сверхактивные аутоиммунные расстройства, такие как ревматоидный артрит, хронический активный гепатит, тиреоидит Хашимото, волчанка, заболевания соединительной ткани, смешанные заболевания соединительной ткани и воспалительные заболевания нервной системы, такие как воспалительный лейкоэнцефалит.
V. Фармацевтические композиции
Противоопухолевые соединения настоящего изобретения могут вводиться для уничтожения определенных клеток, вовлеченных в связанную с пролиферацией клеток заболевание, таких как опухолевые клетки, любым способом, который дает возможность контактировать активному компоненту с местом действия агента в опухоли. Они могут вводиться любыми традиционными способами, доступными для применения совместно с лекарственными препаратами, либо как отдельные терапевтически активные компоненты, либо в виде комбинации терапевтически активных компонентов. Они могут вводиться сами по себе, но обычно вводятся с фармацевтически приемлемым носителем, выбранным в зависимости от способа введения и стандартной фармацевтической практики.
Водные композиции по настоящему изобретению будут содержать эффективное количество соединений для уничтожения или замедления роста злокачественных клеток. Такие композиции в основном будут растворяться или диспергироваться в фармацевтически приемлемом носителе или водной среде.
Термины «соединения AG» и «соединения WP» относятся к конкретным примерам настоящего изобретения.
Фразы «фармацевтически или фармакологически приемлемый» относятся к молекулярным субстанциям и композициям, которые не продуцируют неблагоприятную, аллергическую или другую нежелательную реакцию, когда их вводят животному или человеку при необходимости. Используемый в данном описании «фармацевтически приемлемый носитель» включает какой-либо и все растворители, диспергирующую среду, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и тому подобное. Использование таких сред и агентов для фармацевтически активных субстанций хорошо известно в данной области. За исключением, когда какая-либо традиционная среда или агент является несовместимым с активными компонентами, предполагается их использование в терапевтических композициях. Дополнительные активные компоненты, такие как другие агенты против злокачественных заболеваний, также могут быть введены в композиции.
В дополнение к соединениям, составленным в композиции для парентерального введения, такого как внутривенная или внутримышечная инъекция, другие фармацевтически приемлемые формы включают, например, таблетки или другие твердые формы для перорального введения; капсулы с замедленным высвобождением; и любые другие формы, используемые в настоящее время, включая кремы, лосьоны, полоскания для рта, ингаляторы, липидные носители, липосомы и тому подобное.
A. Парентеральное введение
Активные соединения в большинстве случаев должны быть составлены для парентерального введения, например, составлены для инъекции посредством внутривенного, внутримышечного, подкожного или даже интраперитонеального метода. Получение водной композиции, которая содержит антрациклин по настоящему изобретению в качестве активного компонента, хорошо известно специалистам в данной области в свете настоящего описания. Обычно такие композиции могут быть получены как инъецируемые, либо как жидкие растворы, либо суспензии; также могут быть получены твердые формы, подходящие для применения при получении растворов или суспензий при добавлении жидкости перед инъекцией; и препараты также могут быть получены в виде эмульсии.
Растворы активных соединений в виде свободного основания или фармакологически приемлемых солей могут быть получены в воде, подходящим образом смешивая с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии могут быть также получены в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. В случае обычных условий хранения и применения, данные препараты содержат консерванты для предотвращения роста микроорганизмов.
В некоторых формах желательным будет составить в композицию соединения в форме соли, обычно для улучшения растворимости и биодоступности и для обеспечения более легкого усвоения активной лекарственной формы. Используемый в данном описании термин «фармацевтически приемлемая соль» относится к соединениям, которые образуются из подкисленного раствора замещенного антрациклина подходящими физиологически переносимыми кислотами. Подходящие физиологически переносимые кислоты представляют собой органические или неорганические кислоты, такие как хлористоводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, лимонная кислота, щавелевая кислота, малоновая кислота, салициловая кислота, малеиновая кислота, метансульфоновая кислота, изотионовая кислота, молочная кислота, глюконовая кислота, глюкуроновая кислота, сульфаминовая кислота, бензойная кислота, винная кислота и памовая кислота. Обычно такие солевые формы активного соединения будут обеспечиваться или смешиваться перед применением.
Фармацевтические формы, подходящие для применения для инъецирования, включают стерильные водные растворы и дисперсии; композиции, включающие кунжутное масло, арахисовое масло или водный пропилeнгликоль; и стерильные порошки для непосредственного получения стерильных инъецируемых растворов и дисперсий. Во всех случаях форма должна быть стерильной и должна быть текучей в такой степени, чтобы иметь легкое введение с помощью шприца. Она должна быть стабильна в условиях производства и хранения и должна быть предохранена от инфицирующего действия микроорганизмов, таких как бактерии и грибы.
Активные соединения могут быть составлены в композиции в нейтральной и солевой форме. Фармацевтически приемлемые соли включают аддитивные соли кислот, которые образуются с неорганическими кислотами, такими как, например, хлористоводородная и фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, винная, миндальная и тому подобное.
Соединения по настоящему изобретению также могут быть составлены в композиции, содержащие липосомы или любой другой липидный носитель. Липосомы включают мультивезикулярные липосомы, многослойные липосомы и однослойные липосомы.
Носитель может быть также растворителем или диспергирующей средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и тому подобное), их подходящие смеси и растительные масла. Соответствующая текучесть может поддерживаться, например, путем использования покрытия, такого как лецитин, при поддерживании требуемого размера частиц в случае дисперсии и при использовании поверхностно-активных веществ. Предупреждение действия микроорганизмов может быть осуществлено с помощью различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и тому подобное. В большинстве случаев, будет предпочтительно включать изотонические агенты, например, сахара или хлорид натрия. Пролонгированная абсорбция инъецируемых композиций может осуществляться с помощью использования в композиции агентов, замедляющих абсорбцию, например, моностеарата алюминия и желатина.
Стерильные инъецируемые растворы получают при включении активных соединений в требуемом количестве в подходящие растворители с различными другими перечисленными выше компонентами, при необходимости, с последующей стерилизацией фильтрованием. Обычно дисперсии получают включением различных стерилизованных активных компонентов в стерильный наполнитель, который содержит основную диспергирующую среду и другие требуемые ингредиенты, из перечисленных выше. В случае стерильных порошков для получения стерильных инъецируемых растворов, предпочтительными способами получения являются методы сушки в вакууме и лиофильной сушки, которые дают порошок активного компонента плюс какой-либо дополнительный желаемый ингредиент из их предварительно стерилизованного фильтрованием раствора.
В определенных случаях терапевтические композиции по изобретению могут также быть получены в формах, подходящих для местного применения, таких как кремы и лосьоны. Данные формы могут применяться для лечения кожных заболеваний, таких как различные саркомы.
После получения лекарственной формы растворы будут вводиться способом, совместимым с лекарственной формой, и в таком количестве, которое является терапевтически эффективным. Препараты легко вводятся в различных лекарственных формах, таких как типы инъецируемых растворов, описанных выше, причем применимыми являются даже высвобождаемые лекарственные средства в капсулах и тому подобное.
Для парентерального введения в водном растворе, например, раствор должен быть соответствующим образом забуферен, если необходимо, и жидкий разбавитель сначала приводят в изотоническое состояние с помощью достаточного количества солевого раствора или глюкозы. Данные конкретные водные растворы являются особенно подходящими для внутривенного, внутримышечного, подкожного и интраперитонеального введения. В этой связи, стерильная водная среда, которая может быть использована, хорошо известна специалисту в данной области в свете настоящего описания. Например, одна доза может быть растворена в 1 мл изотонического раствора NaCl и либо добавлена к 1000 мл раствора для подкожного вливания, либо инъецирована в предполагаемое место инфузии (см., например, «Remington's Pharmaceutical Sciences» 15th Edition, pages 1035-1038 and 1570-1580). Некоторое варьирование в дозировании будет необходимо осуществлять в зависимости от состояния субъекта, подвергаемого лечению. Ответственный за введение специалист будет, в любом случае, определять соответствующую дозу для конкретного субъекта.
B. Пероральное введение
В некоторых вариантах осуществления активные соединения могут вводиться перорально. Это предполагается для агентов, которые в целом резистентны или приведены в состояние резистентности к протеолизу пищеварительными ферментами. Полагают, что такие соединения включают все такие соединения или лекарственные средства, которые доступны в таблетированной форме от производителя, и их производные и аналоги.
При пероральном введении активные соединения могут вводиться, например, с инертным разбавителем или с усвояемым пищевым носителем, или они могут быть заключены в твердые или мягкие пустотелые желатиновые капсулы, или спрессованы в таблетки, или введены непосредственно с продуктами питания. При пероральном терапевтическом введении активные соединения могут быть введены с эксципиентами и применяться в виде проглатываемых таблеток, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и тому подобное. Такие композиции и препараты должны содержать по меньшей мере 0,1% активного соединения. Процентное содержание композиций и препаратов может, конечно, варьироваться и обычно может составлять приблизительно от 2 до приблизительно 60% от массы единицы. Количество активных соединений в таких терапевтически полезных композициях является таким, чтобы была получена подходящая доза.
Таблетки, пастилки, пилюли, капсулы и тому подобное также могут содержать следующее: связующее, как например, трагакант, камедь, кукурузный крахмал или желатин; эксципиенты, такие как дикальцийфосфат; дезинтегрирующий агент, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота и тому подобное; лубрикант, такой как стеарат магния; и подслащивающий агент, такой как сахароза, лактоза или сахарин, или может быть добавлен ароматизатор, такой как мята, масло гаультерии или ароматизатор вишни. Когда единичная дозированная форма представляет собой капсулу, она может содержать, в дополнение к типам веществ, перечисленных выше, жидкий носитель. Различные другие вещества могут присутствовать в качестве покрытий или для изменения иным образом внешнего вида дозированной единицы. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или ими обоими. Сироп или эликсир могут содержать активные соединения, сахарозу в качестве подслащивающего агента, метил- и пропилпарабены в качестве консервантов, краситель и ароматизатор, такой как ароматизатор вишни или апельсина. Конечно, любое вещество, используемое при получении любой единичной дозированной формы, должно быть фармацевтически чистым и по существу нетоксичным в применяемых количествах. Кроме того, активные соединения могут быть включены в композиции и препараты с замедленным высвобождением.
После получения лекарственного препарата соединения будут вводиться способом, совместимым с дозированной формой, и в таком количестве, которое является терапевтически эффективным. Композиции легко вводятся в различных дозированных формах, как описано ниже в конкретных примерах.
VI. Способы лечения
Одной из основных задач в онкологии в настоящее время является эффективное лечение данной опухоли. Опухоли часто являются резистентными к традиционным методам лечения. Таким образом, большие усилия направлены на обнаружение эффективного способа лечения злокачественного новообразования. Одним из путей достижения этого является комбинация новых лекарственных средств с традиционными методами лечения. В рамках настоящего изобретения предполагается, что способы лечения с применением соединений могут комбинироваться с хирургической операцией, химиотерапией, лучевой терапией и/или генной терапией.
«Эффективные количества» или «терапевтически значимое количество» представляют собой такие количества соединений, которые будут достаточными для получения терапевтического эффекта (например, эффективное, чтобы воспроизводимо угнетать, ослаблять, уменьшать, ингибировать или иным способом отменять рост злокачественной клетки). Эффективное количество, применительно к лечению субъекта, представляет собой достаточное для получения терапевтического эффекта количество. Используемый в данном описании термин «терапевтический эффект» относится к тому, что вызывает и усиливает хорошее самочувствие субъекта в отношении медицинского лечения заболевания у субъекта, связанного с пролиферацией клеток. Неполный перечень примеров этого включает продление жизни пациентов на какой-либо период времени; ослабление или задержка в опухолевом развитии заболевания; ослабление гиперпролиферации; уменьшение роста опухоли; отсрочка метастазирования; уменьшение скорости пролиферации злокачественной клетки, опухолевой клетки или любой другой гиперпролиферирующей клетки; индукция апоптоза в любой обработанной клетке или любой клетке, подвергающейся воздействию обработанной клетки; и/или ослабление боли у субъекта, что может быть связано с состоянием пациента.
Следующие примеры включены для демонстрации предпочтительных вариантов осуществления изобретения. Специалистам в данной области будет очевидно, что раскрытые в примерах способы, которые следуют представленным раскрываемым способам, хорошо функционируют в практике изобретения и, таким образом, могут рассматриваться, как представляющие предпочтительные методы для его осуществления на практике. Однако специалистам в данной области, в свете настоящего описания, будет понятно, что могут быть произведены различные изменения в конкретных вариантах осуществления, которые раскрыты, и все еще получены подобные или аналогичные результаты без отклонения от сущности и объема изобретения.
ПРИМЕР 1
Общий способ синтеза соединений
На следующей схеме показан способ получения конкретного аналога кофейной кислоты. Используя аналоги указанных исходных веществ, специалист в данной области может легко применить данный способ для получения других аналогов кофейной кислоты.

Получение 2-метил-1-оксидо-6-замещенных пиридинов
Пероксид водорода (1 мл 35%, масс./об., 10 ммоль) добавляли к раствору пиридинового соединения (10 ммоль) в ледяной уксусной кислоте (6 мл) и смесь нагревали при 70-80°C при перемешивании в течение 3 ч. Добавляли дополнительную аликвоту 35% (масс./об.) H2O2 и оставляли реакцию протекать в течение 9 ч при 70-80°C. Уменьшали объем реакционной смеси в вакууме, добавляли воду (2 мл), смесь концентрировали в вакууме и остаток подщелачивали, используя сухой Na2CО3. Добавляли хлороформ (5 мл), данную смесь оставляли стоять при 25°C в течение 5 мин и удаляли фильтрованием нерастворимые Na2CO3 и NaOAc. Фильтрат сушили (натрия сульфат) и удаляли растворитель в вакууме, с получением целевого продукта. Выход зависит от заместителя в положении 2, 55%-85%. Продукты без дополнительной очистки использовали на следующей стадии.
Общий способ получения 2-(ацетоксиметил)-6-замещенных пиридинов
Раствор 2-метил-1-оксидо-3-замещенного пиридина (6 ммоль) в уксусном ангидриде (4,32г, 42 ммоль, 4 мл) кипятили с обратным холодильником в течение 1 ч. Добавляли этанол (3 мл) к реакционной смеси и оставляли реакцию протекать при кипении с обратным холодильником в течение 10 мин. Реакционную смесь охлаждали на водяной бане со льдом, выливая в воду (10 мл), и нейтрализовали 10% водным NaHCО3. Экстракция простым эфиром (2×25 мл), промывание экстракта насыщенным раствором соли (10 мл), сушка органической фракции (натрия сульфат) и удаление растворителя в вакууме давали остаток. Очистка остатка колоночной хроматографией на силикагеле с использованием смеси гексаны/этилацетат (70/30, об./об.) в качестве элюента давала соответствующий продукт в виде масла, который затем использовали для получения 2-гидроксиметил-6-замещенных пиридинов.
Общий способ получения 2-гидроксиметил-6-замещенных пиридинов
Смесь 2-(ацетоксиметил)-6-замещенного пиридина (5 ммоль), 1н. NaOH (6 мл) и MeOH (12 мл) перемешивали при 25°C в течение 1,5 ч. Реакционную смесь выливали в воду (30 мл), экстрагировали этилацетатом (2×50 мл), промывали EtOAc-экстракт насыщенным раствором соли (10 мл), сушили этилацетатную фракцию (Na2SO4) и удаляли растворитель в вакууме, с получением остатка. Очистка остатка колоночной хроматографией на силикагеле с использованием смеси гексаны/этилацетат (60/40, об./об.) в качестве элюента давала соответствующий продукт в виде масла, который затем использовали для получения 6-замещенных-2-пиридинкарбоксиальдегидов.
Общий способ получения 6-замещенных-2-пиридинкарбоксиальдегидов
Раствор безводной H3PO4 в ДМСО (1,5 мл, 1,0M) добавляли к раствору 6-замещенного-2-(гидроксиметил)пиридина (3 ммоль) и N,N-дициклогексилкарбодиимида (1,86 г, 9 ммоль) в ДМСО (7 мл) и оставляли реакцию протекать при 25°C в течение 1,5 ч. Выпавшую в осадок дициклогексилмочевину отфильтровывали, отфильтрованный осадок промывали простым эфиром (15 мл) и промывные воды экстрагировали простым эфиром (2×30 мл). Объединенные органические растворы промывали насыщенным раствором соли (10 мл), органическую фракцию сушили (натрия сульфат) и растворитель удаляли в вакууме. Полученный остаток очищали колоночной хроматографией на силикагеле, используя смесь простой эфир/гексаны (40/60, об./об.) в качестве элюента, с получением соответствующего продукта.
Получение лиганда: (S)-2-амино-3-метил-1,1-дифенилбутан-1-ол
Раствор фенилмагнийбромида (3,0 M, 600 мл, 1,7 моль) в диэтиловом эфире перемешивали при 0°C и разбавляли ТГФ (300 мл), с последующим добавлением порциями гидрохлорида метилового эфира L-валина (50 г, 0,298 моль) при одновременном поддерживании температуры ниже 10°C. После перемешивания в течение 3 часов при Ткомн реакционную смесь медленно выливали в охлажденный льдом раствор аммонийхлорида. К смеси добавляли диэтиловый эфир (500 мл) и этилацетат (500 мл). После разделения двух фаз водную фазу повторно экстрагировали трет-бутилметиловым эфиром (1 л). Объединенные органические фазы перемешивали при 0°C и медленно подкисляли 35% хлористоводородной кислотой (приблизительно 40 мл) и водой. Полученный, таким образом, осадок гидрохлорида отфильтровывали и промывали трет-бутилметиловым эфиром. Затем смесь переносили в дихлорметан (1 л) и воду (1 л) и подщелачивали при 0°C 35% гидроксидом натрия (приблизительно 50 мл). После разделения фаз водную фазу повторно экстрагировали дихлорметаном (1 л). Объединенные органические фазы промывали водой и затем насыщенным раствором соли, сушили над сульфатом натрия и концентрировали. После кристаллизации из изопропилового эфира получали (S)-2-амино-3-метил-1,1-дифенилбутан-1-ол (61 г, 87%).
Синтез энантиомерных аминов
Раствор (S)-2-амино-3-метил-1,1-дифенилбутан-1-ола (47 ммоль, 12г) в ТГФ (80 мл) перемешивали при температуре ниже 30°C с последующим медленным добавлением раствора боран-тетрагидрофуран (1 M, 95 мл). Давали возможность температуре повыситься до комнатной температуры в течение 2 ч. Затем реакционную смесь перемешивали при 0°C и добавляли раствор чистого анти-циклопропил(фенил)метаминбензилоксима (19 ммоль, 5г) в ТГФ (10 мл). После перемешивания смеси в течение 20 ч при комнатной температуре реакционную смесь охлаждали до 0°C и обрабатывали хлористоводородной кислотой (2 н., 100 мл). Смесь перемешивали в течение 16 ч, затем подщелачивали при 0°C добавлением 35% гидроксида натрия (100 мл), с последующей экстракцией этилацетатом. Экстракт промывали водой и насыщенным раствором соли, сушили над сульфатом натрия и упаривали досуха. Амин очищали ЖХ (система очистки BIOTAGE SP1), используя смесь хлороформ:метанол (в градиенте до 25% метанола), с получением 2,1 г (S)-циклопропил(фенил)метамина, выход 72%.
Получение этилцианоацетата
Смесь цианоуксусной кислоты (1 ммоль), этилового спирта (1 мл) и п-толуолсульфокислоты (0,1 ммоль) кипятили с обратным холодильником в толуоле (20 мл) в течение 12 ч. Реакционную смесь промывали насыщенным раствором бикарбоната натрия, затем водой до нейтрального рН. Органический раствор сушили над сульфатом натрия. Осушающий агент и растворители удаляли и неочищенный сложный эфир перегоняли при пониженном давлении 97-98°C/21,3 гПА (16 мм рт.ст.). Выход 72%.
Получение N-(фенилалкил)циннамидов (общая методика)
Готовили смесь (S)-циклопропил(фенил)метанамина (4,12 г, 28 ммоль) и этилцианоацетата (9,4 г, 84 ммоль) в толуоле (10 мл) и перемешивали при кипении с обратным холодильником в течение 4 часов. Ход реакции контролировали ТСХ. После завершения реакции растворитель выпаривали досуха. Продукт очищали ЖХ (система очистки Biotage SP1), с получением 4,08 г (68%) N-((5)-циклопропил(фенил)метил)-2-изоцианоацетамида в качестве промежуточного продукта.
Готовили смесь N-((5)-циклопропил(фенил)метил)-2-изоцианоацетамида (1 ммоль), 6-замещенного-2-пиридинкарбоксиальдегида (1 ммоль) и пиперидина (каталитическое, 1 капля) в ацетонитриле (50 мл) и нагревали до кипения с обратным холодильником в течение 24 ч. Растворитель выпаривали досуха и продукт очищали ЖХ (система очистки Biotage SP1), с получением WP1140 (WP1193) в виде белого порошка (50%).
Синтез WP1204
Синтез N-((S)-1-фенилэтил)акриламида
S-(α)-Метилбензиламин (6 мл) растворяли в сухом дихлорметане (10 мл), охлаждали до 0°C и затем по каплям добавляли акроилхлорид (4 мл). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин, затем растворитель выпаривали досуха. Неочищенный продукт очищали колоночной хроматографией, используя гексаны, смесь гексаны:этилацетат 9:1, с получением чистого N-((S)-1-фенилэтил)акриламида с хорошим выходом.
Синтез (Е)-3-(6-бромпиридин-2-ил)-N-((S)-1-фенилэтил)акриламида
К раствору трифенилфосфина (0,496 ммоль) в ДМФА (DMF) (10 мл) добавляли ацетат палладия (0,245 ммоль) при комнатной температуре в атмосфере аргона. Смесь перемешивали в течение 5 мин, затем добавляли 2,6-дибромпиридин (12,7 ммоль), с последующим добавлением N-((S)-1-фенилэтил)акриламида (14,0 ммоль) и триэтиламина (35,9 ммоль) и реакционную смесь перемешивали при 140°C в течение 7 ч. Большую часть растворителя удаляли при пониженном давлении. Добавляли разбавленную HCl и продукт экстрагировали этилацетатом. Органические слои объединяли, промывали насыщенным раствором соли, сушили над сульфатом натрия. Осушающий агент и растворитель удаляли и продукт очищали колоночной хроматографией, используя гексаны и смесь гексаны:этилацетат 2:1 в качестве элюентов, с получением чистого продукта с хорошим выходом.
ПРИМЕР 2
Химические сдвиги ЯМР некоторых соединений
Следующие соединения получали в соответствии с методикой, указанной выше.
WP1082
(2E)-N-бензил-2-циано-3-(циклогекс-3-енил)акриламид
1H-ЯМР (CDCl3, δ) м.д. 7,78 (д, 1H, J=10,5 Гц, H-3), 7,40-7,32 (м, 5H, Н аромат. бензила), 6,54 (ушир.с, 1H, NH), 5,79 (м, 1H, H-3'), 5,71 (дддд, 1H, J=11,8 Гц, J=6,4 Гц, J=4,3 Гц, J=2,0 Гц, H-4'), 3,01-2,93 (м, 1H, H-1'), 4,57 (д, 2H, J=5,7 Гц, CH2 бензила), 2,23-2,14 (м, 3H, 2', 2', 6'), 2,05-2,00 (м, 1H, 6'), 1,86-1,83 (м, 1H, 6'), 1,66-1,60 (м, 2H, 5', 5').
WP1193
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((S)-циклопропил(фенил)метил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,22 (с, 1H, H-3), 7,68 (дд, 1H, J=8,9 Гц, J=6,3 Гц, H-4'), 7,60 (д, 1H, J=6,3 Гц, H-5'), 7,59 (д, 1H, J=8,5 Гц, H-3'), 7,43-7,28 (м, 5H, фенил), 7,02 (д, 1H, J=7,5 Гц, NH), 4,53 (дд, 1H, J=8,5 Гц, H-1”), 1,37-1,23 (м, 1H, H-2”), 0,74-0,64 (м, 2H, CH2-циклопропил), 0,55-0,42 (м, 2H, CH2-циклопропил).
WP1145
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((S)-1,2-дифенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,13 (с, 1H, H-3), 7,66 (дд, 1H, J=7,9 Гц, J=7,3 Гц, H-4'), 7,58 (дд, 1H, J=7,9 Гц, J=1,1 Гц, H-5'), 7,56 (дд, 1H, J=7,3 Гц, J=1 Гц, H-3'), 7,39-7,11 (м, 10H, фенил), 6,93 (д, 1H, J=7,3 Гц, NH), 5,38 (ддд, 1H, J=7,7 Гц, J=14,4 Гц, H-1”), 3,25 (дд, H, J=14,3 Гц, J=6,4 Гц, H-2”), 3,17 (дд, H, J=14,3 Гц, J=6,4 Гц, H-2”).
WP1159
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-(2-феноксиэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,22 (с, 1H, H-3), 7,67 (дд, 1H, J=7,5 Гц, H-4'), 7,61 (дд, 1H, J=7,5 Гц, J=1,5 Гц, H-5'), 7,58 (дд, 1H, J=7,5 Гц, J=1,5 Гц, H-3'), 7,32-7,27 (м, 3H, фенил), 7,04 (ушир.с, 1H, NH), 7,00-6,91 (м, 2H, фенил), 4,14 (т, 2H, J=5,1 Гц, H-2”), 3,85 (дд, 2H, J=10,7 Гц, J=5,1 Гц, H-1”).
WP1163
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((R)-циклопропил(фенил)метил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,19 (с, 1H, H-3), 7,66 (дд, 1H, J=9,0 Гц, J=6,4 Гц, H-4'), 7,575 (д, 1H, J=6,4 Гц, H-5'), 7,57 (д, 1H, J=9,0 Гц, H-3'), 7,41-7,26 (м, 5H, фенил), 7,01 (д, 1H, J=7,5 Гц, NH), 4,50 (дд, 1H, J=8,3 Гц, H-1”), 1,35-1,23 (м, 1H, H-2”), 0,72-0,62 (м, 2H, CH2-циклопропил), 0,54-0,40 (м, 2H, CH2-циклопропил).
WP1164
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((S)-циклобутил(фенил)метил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,18 (с, 1H, H-3), 7,65 (дд, 1H, J=7,5 Гц, H-4'), 7,57 (д, 1H, J=7,5 Гц, H-5'), 7,56 (д, 1H, J=7,5 Гц, H-3'), 7,36-7,24 (м, 5H, фенил), 6,74 (д, 1H, J=8,0 Гц, NH), 5,05 (дд, 1H, J=9,0 Гц, H-1”), 2,78 (дд, 1H, J=9,0 Гц, H-2”), 2,16-1,75 (м, 6H, CH2 циклобутила).
WP1166
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((S)-циклогексил(фенил)метил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,19 (с, 1H, H-3), 7,68 (дд, 1H, J=8,0 Гц, J=7,3 Гц, H-4'), 7,59 (дд, 1H, J=8,0 Гц, J=1,1 Гц, H-5'), 7,58 (дд, 1H, J=7,3 Гц, J=1,1 Гц, H-3'), 7,40-7,29 (м, 5H, фенил), 6,90 (д, 1H, J=9,2 Гц, NH), 4,87 (дд, 1H, J=8,5 Гц, H-1”), 1,93-0,9 (м, 10 H, H-циклогексил).
WP1167
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((1S,2R)-2,3-дигидро-2-гидрокси-1Н-инден-1-ил)акриламид
1H-ЯМР (ДМСО-d6, δ) м.д.: 8,25 (с, 1H, H-3), 8,24 (д, 1H, J=8,2 Гц, NH), 7,96 (дд, 1H, J=7,6 Гц, Гц, H-4'), 7,89 (дд, 1H, J=7,6 Гц, J=1,0 Гц, H-5'), 7,82 (дд, 1H, J=7,6 Гц, J=1,1 Гц, H-3'), 7,27-7,21 (м, 4H, H аромат. индена), 5,38 (д, 1H, J=4,5 Гц, OH), 5,34 (дд, 1H, J=8,5 Гц, J=5,2 Гц, H-1”), 4,53 (ддд, 1H, J=8,2 Гц, J=4,7 Гц, J=1,3 Гц, H-2”), 3,13 (дд, 1H, J=16,4 Гц, J=5,3 Гц, H-3”), 2,87 (д, 1H, J=16,4 Гц, H-3”).
WP1168
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((1R,2S)-2,3-дигидро-2-гидрокси-1Н-инден-1-ил)акриламид
1H-ЯМР (ДМСО-d6, δ) м.д.: 8,25 (с, 1H, H-3), 8,24 (д, 1H, J=8,2 Гц, NH), 7,96 (дд, 1H, J=7,6 Гц, Гц, H-4'), 7,90 (дд, 1H, J=7,6 Гц, J=1,0 Гц, H-5'), 7,82 (дд, 1H, J=7,6 Гц, J=1,0 Гц, H-3'), 7,29-7,21 (м, 4H, Н аромат индена), 5,38 (д, 1H, J=4,5 Гц, OH), 5,33 (дд, 1H, J=8,4 Гц, J=5,2 Гц, H-1”), 4,54 (дд, 1H, J=4,7 Гц, J=1,8 Гц, H-2”), 3,13 (дд, 1H, J=16,4 Гц, J=5,2 Гц, H-3”), 2,87 (дд, 1H, J=16,4 Гц, J=1,3 Гц, H-3”).
WP1169
(E)-N-бензгидрил-3-(6-бромпиридин-2-ил)-2-цианоакриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,24 (с, 1H, H-3), 7,67 (дд, 1H, J=7,6 Гц, H-4'), 7,60 (д, 1H, J=7,6 Гц, H-5'), 7,59 (д, 1H, J=7,6 Гц, H-3'), 7,40-7,27 (м, 10H, фенил), 7,16 (д, 1H, J=7,5 Гц, NH), 6,37 (д, 1H, J=8,0 Гц, H-1”).
WP1179
(E)-2-циано-3-(6-метилпиридин-2-ил)-N-((S)-1-фенилэтил)акриламид)
1H-ЯМР (CDCl3, δ) м.д.: 8,29 (с, 1H, H-3), 7,70 (дд, 1H, J=7,7 Гц, H-4'), 7,44-7,26 (м, 7H, H-3', H-5' и фенил), 6,81 (д, 1H, J=7,2 Гц, NH), 5,28 (дт, 1H, J=14,4 Гц, J=6,9 Гц, H-1”), 2,66 (с, 3H, Me метилпиридина), 1,63 (д, 3H, J=6,9 Гц, Me).
WP1180
(E)-2-циано-3-(6-метилпиридин-2-ил)-N-((R)-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,29 (с, 1H, H-3), 7,70 (дд, 1H, J=7,8 Гц, H-4'), 7,44-7,26 (м, 7H, H-3', H-5' и фенил), 6,81 (д, 1H, J=7,2 Гц, NH), 5,16 (дт, 1H, J=14,2 Гц, J=7,1 Гц, H-1”), 2,66 (с, 3H, Me метилпиридина), 1,63 (д, 3H, J=7,1 Гц, Me).
WP1196
(E)-2-циано-3-(1Н-имидазол-2-ил)-N-((S)-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 11,25 (ушир.с, 1H, NH), 8,39 (с, 1H, H-3), 7,44-7,26 (м, 7H, H-2', H-3' и фенил), 7,00 (ушир.с, 1H, NH), 6,76 (д, 1H, J=6,6 Гц, NHCO), 5,20 (дт, 1H, J=14,0 Гц, J=7,1 Гц, H-1”), 1,63 (д, 3H, J=7,1 Гц, Me).
WP1203
(E)-2-циано-3-циклододецил-N-((S)-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 7,33-7,20 (м, 6H, H-3 и фенил), 6,33 (д, 1H, J=7,0 Гц, NH), 5,16 (дт, 1H, J=14,4 Гц, J=7,0 Гц, H-1”), 2,76 (ддд, 2H, J=7,0 Гц, J=3,5 Гц, H-2' или H-12'), 2,54 (дд, 2H, J=7,6 Гц, H-2' или H-12'), 1,69-1,37 (м, 22H, H-1', Me и циклододецил).
WP1225
(E)-3-(6-хлорпиридин-2-ил)-2-циано-N-((R)-циклопропил(фенил)метил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,25 (с, 1H, H-3), 7,79 (дд, 1H, J=7,9 Гц, H-4'), 7,57 (д, 1H, J=7,9 Гц, H-5'), 7,45 (д, 1H, J=7,9 Гц, H-3'), 7,43-7,31 (м, 5H, фенил), 7,0 (д, 1H, J=7,5 Гц, NH), 4,54 (дд, 1H, J=8,5 Гц, H-1”), 1,37-1,26 (м, 1H, H-2”), 0,75-0,65 (м, 2H, CH2-циклопропил), 0,58-0,44 (м, 2H, CH2-циклопропил).
WP1246
(6-((E)-2-((S)-циклопропил(фенил)метилкарбамоил)-2-циановинил)пиридин-2-ил)метилацетат
1H-ЯМР (CDCl3, δ) м.д.: 8,28 (с, 1H, H-3), 7,83 (дд, 1H, J=7,8 Гц, H-4'), 7,52 (д, 1H, J=7,8 Гц, H-5'), 7,45 (д, 1H, J=7,8 Гц, H-3'), 7,43-7,29 (м, 5H, фенил), 7,02 (д, 1H, J=7,7 Гц, NH), 5,34 (с, 2H, CH2Ac), 4,53 (дд, 1H, J=8,4 Гц, H-1”), 2,22 (с, 3H, Ac), 1,37-1,26 (м, 1H, H-2”), 0,71-0,67 (м, 2H, CH2-циклопропил), 0,53-0,45 (м, 2H, CH2-циклопропил).
WP1267
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((R)-циклобутил(фенил)метил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,20 (с, 1H, H-3), 7,68 (дд, 1H, J=8,0 Гц, J=7,1 Гц, H-4'), 7,59 (дд, 1H, J=8,0 Гц, J=1,0 Гц, H-5'), 7,58 (д, 1H, J=7,5 Гц, J=1,0 Гц, H-3'), 7,38-7,26 (м, 5H, фенил), 6,75 (д, 1H, J=8,5 Гц, NH), 5,08 (дд, 1H, J=9,8 Гц, H-1”), 2,85-2,76 (м, 1H, H-2”), 2,16-1,78 (м, 6H, CH2 циклобутила).
WP1268
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((S)-1-гидрокси-3-фенилпропан-2-ил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,22 (с, 1H, H-3), 7,71 (дд, 1H, J=7,65 Гц, H-4'), 7,66 (д, 1H, J=7,65 Гц, H-5'), 7,63 (д, 1H, J=7,65 Гц, H-3'), 7,40-7,28 (м, 5H, фенил), 6,85 (д, 1H, J=7,1 Гц, NH), 4,4-4,37 (м, 1H, H-1”), 3,83 (дд, 1H, J=11 Гц, J=3,6 Гц, CH2Ph), 3,75 (дд, 1H, J=11 Гц, J=4,9 Гц, CH2Ph), 3,08 (дд, 1H, J=13,75 Гц, J=7,15 Гц, CH2OH), 3,01 (дд, 1H, J=13,75 Гц, J=7,15 Гц, CH2OH), 2,22 (ушир.с, 1H, OH).
WP1269
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((R)-2-гидрокси-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,26 (с, 1H, H-3), 7,71 (дд, 1H, J=7,65 Гц, H-4'), 7,66 (д, 1H, J=7,65 Гц, H-5'), 7,64 (д, 1H, J=7,65 Гц, H-3'), 7,45-7,38 (м, 5H, фенил), 7,27 (ушир.с, 1H, NH), 5,29-5,26 (м, 1H, H-1”), 4,05-4,04 (м, 2H, CH2OH), 2,06 (ушир.с, 1H, OH).
WP1271
(E)-2-циано-3-(2-фторпиридин-3-ил)-N-((S)-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,61 (ддд, 1H, J=9,4 Гц, J=7,8 Гц, J=1,5 Гц, H-6'), 8,51 (с, 1H, H-3), 8,31 (м, 1H, H-4'), 7,42-7,26 (м, 6H, H-5' и фенил), 6,54 (д, 1H, J=7,2 Гц, NH), 5,25 (дт, 1H, J=14,1 Гц, J=6,8 Гц, H-1”), 1,62 (д, 3H, J=6,9 Гц, Me).
WP1272
(E)-2-циано-N-((S)-циклопропил(фенил)метил)-3-(2-фторпиридин-3-ил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,63 (ддд, 1H, J=9,4 Гц, J=7,9 Гц, J=1,5 Гц, H-6'), 8,51 (с, 1H, H-3), 8,37 (м, 1H, H-4'), 7,41-7,27 (м, 6H, H-5' и фенил), 6,77 (д, 1H, J=7,1 Гц, NH), 4,51 (дд, 1H, J=8,3 Гц, H-1”), 1,35-1,23 (м, 1H, H-2”), 0,73-0,41 (м, 4H, CH2 циклопропила).
WP1280
(E)-2-циано-3-(3-фторпиридин-4-ил)-N-((S)-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,65 (д, 1H, J=1,5 Гц, H-2'), 8,59 (д, 1H, J=5,1 Гц, H-6'), 8,52 (д, 1H, J=0,6 Гц, H-3), 7,95 (дд, 1H, J=5,4 Гц, H-5'), 7,42-7,29 (м, 5H, фенил), 6,59 (д, 1H, J=6,6 Гц, NH), 5,25 (дд, 1H, J=7,2 Гц, H-1”), 1,62 (д, 3H, J=6,9 Гц, Me).
WP1282
(E)-3-(6-бромпиридин-2-ил)-2-циано-N-((R)-циклопентил(фенил)метил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,16 (с, 1H, H-3), 7,65 (дд, 1H, J=8,0 Гц, H-4'), 7,58 (д, 1H, J=8,0 Гц, H-5'), 7,55 (д, 1H, J=8,00 Гц, H-3'), 7,36-7,28 (м, 5H, фенил), 6,09 (д, 1H, J=8,0 Гц, NH), 4,86 (дт, 1H, J=9,5 Гц, H-1”), 2,37 (ддд, 1H, J=10,2 Гц, J=5,1 Гц, H-2”), 1,92-1,18 (м, 8H, CH2 циклопентила).
WP1283
(E)-3-(3-бромпиридин-4-ил)-2-циано-N-((S)-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,87 (с, 1H, H-2'), 8,67 (д, 1H, J=5,1 Гц, H-6'), 8,53 (с, 1H, H-3), 7,79 (дд, 1H, J=5,1 Гц, H-5'), 7,41-7,29 (м, 5H, фенил), 6,61 (д, 1H, J=7,2 Гц, NH), 5,25 (дт, 1H, J=14,2 Гц, J=7,2 Гц, H-1”), 1,62 (д, 3H, J=6,9 Гц, Me).
WP1284
(E)-3-(5-бромпиридин-3-ил)-2-циано-N-((S)-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,86 (д, 1H, J=2,1 Гц, H-6'), 8,79 (д, 1H, J=2,1 Гц, H-2'), 8,46 (дд, 1H, J=2,1 Гц, H-4'), 8,26 (с, 1H, H-3), 7,42-7,29 (м, 5H, фенил), 6,55 (д, 1H, J=8,1 Гц, NH), 5,25 (дт, 1H, J=14,1 Гц, J=6,9 Гц, H-1”), 1,62 (д, 3H, J=6,9 Гц, Me).
WP1285
(E)-3-(2-бромпиридин-3-ил)-2-циано-N-((S)-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,59 (д, 1H, J=3,0 Гц, H-3), 8,47 (дд, 1H, J=4,8 Гц, J=1,8 Гц, H-6'), 8,28 (ддд, 1H, J=7,5 Гц, J=1,8 Гц, J=0,6 Гц, H-4'), 7,41 (ддд, 1H, J=8,1 Гц, J=4,8 Гц, J=0,6 Гц, H-5'), 7,39-7,29 (м, 5H, фенил), 6,55 (д, 1H, J=7,5 Гц, NH), 5,25 (дт, 1H, J=14,1 Гц, J=7,2 Гц, H-1”), 1,62 (д, 3H, J=7,2 Гц, Me).
WP1286
(E)-3-(6-бромпиридин-3-ил)-2-циано-N-((S)-1-фенилэтил)акриламид
1H-ЯМР (CDCl3, δ) м.д.: 8,66 (д, 1H, J=2,1 Гц, H-2'), 8,27 (с, 1H, H-3), 8,23 (дд, 1H, J=8,4 Гц, J=2,4 Гц, H-4'), 7,63 (д, 1H, J=7,8 Гц, H-5'), 7,35-7,26 (м, 5H, фенил), 6,56 (д, 1H, J=6,9 Гц, NH), 5,24 (дт, 1H, J=14,1 Гц, J=7,2 Гц, H-1”), 1,61 (д, 3H, J=7,2 Гц, Me).
WP1293
(R)-2-((E)-3-(6-бромпиридин-2-ил)-2-цианоакриламидо)-2-фенилэтилацетат
1H-ЯМР (CDCl3, δ) м.д.: 8,19 (с, 1H, H-3), 7,67 (дд, 1H, J=7,5 Гц, H-4'), 7,59 (дд, 1H, J=7,5 Гц, J=1,2 Гц, H-5'), 7,58 (дд, 1H, J=7,5 Гц, J=1,2 Гц, H-3'), 7,41-7,21 (м, 5H, фенил), 7,22 (д, 1H, J=7,8 Гц, NH), 5,40 (дт, 1H, J=11,4 Гц, J=6,0 Гц, H-1”), 4,43 (д, 2H, J=6,3 Гц, CH2OAc), 2,08 (с, 3H, OAc).
WP1302
(R)-2-((E)-3-(6-бромпиридин-2-ил)-2-цианоакриламидо)-2-фенилэтилпивалат
1H-ЯМР (CDCl3, δ) м.д.: 8,19 (с, 1H, H-3), 7,67 (дд, 1H, J=8,7 Гц, J=6,3 Гц, H-4'), 7,59 (д, 1H, J=6,3 Гц, H-5'), 7,58 (д, 1H, J=8,7 Гц, H-3'), 7,38-7,30 (м, 5H, фенил), 7,26 (д, 1H, J=6,5 Гц, NH), 5,43 (дт, 1H, J=11,4 Гц, J=5,4 Гц, H-1”), 4,43 (д, 2H, J=5,4 Гц, CH2O), 2,08 (с, 9H, CH3).
Синтез WP1201 ((S)-N-((E)-2-(6-бромпиридин-2-ил)винилсульфонил)-1-фенилэтанамин)

2-Хлорэтансульфонилхлорид (5,7 ммоль, 930 мг) растворяли в дихлорметане (10 мл). Полученный раствор охлаждали до -78°C. Добавляли триэтиламин (TEA) (5,7 ммоль, 0,8 мл) и реакционную смесь перемешивали при -78°C в течение 30 мин, затем в течение 45 мин при 0°C. Реакционную смесь охлаждали до -78°C и добавляли смесь (S)-метилбензиламина (5,7 ммоль, 690 мг) и TEA (5,7 ммоль, 0,8 мл) в дихлорметане (10 мл), перемешивание при -78°C продолжали в течение дополнительных 20 мин, затем охлаждающую баню убирали и реакционную смесь перемешивали в течение 20 мин при Ткомн. Растворители выпаривали досуха и неочищенный продукт очищали ЖХ хроматографией (система очистки ISCO LC), используя смесь гексаны:этилацетат с градиентом вплоть до 50% этилацетата в качестве элюента, с получением 0,78 г сульфонамида (A) (выход 65%).
Растворяли трифенилфосфин (1,1 ммоль, 28 мг) в ДМФА (DMF) (3 мл). Добавляли ацетат палладия (II) (0,53 ммоль, 113,5 мг) и смесь перемешивали в атмосфере Ar в течение 5 мин. Добавляли сульфонамид (A) (2,8 ммоль, 600 мг), 2,6-дибромпиридин (2,8 ммоль, 640 мг), TEA (1 мл) и DMF (3 мл) и смесь нагревали при кипячении с обратным холодильником в течение 2,5 ч. Реакционную смесь охлаждали, затем разбавляли водой (50 мл). Полученную смесь экстрагировали этилацетатом (3×50 мл). Объединенные экстракты сушили над сульфатом натрия. Продукт очищали ЖХ (система очистки BIOTAGE LC), используя смесь гексаны:этилацетат с градиентом вплоть до 50% этилацетата в качестве элюента, с получением 460 мг WP1201 (выход 45%).
1H-ЯМР (CDCl3, δ) м.д.: 7,55 (дд, 1H, J=8,0 Гц, J=7,4 Гц, H-4'), 7,46 (дд, 1H, J=8,0 Гц, J=0,9 Гц, H-5') 7,33-7,20 (м, 5H, фенил), 7,17 (дд, 1H, J=7,4 Гц, J=0,9 Гц, H-3'), 7,17 (д, 1H, J=14,9 Гц, H-3), 7,09 (д, 1H, J=14,9 Гц, H-2), 4,80 (д, 1H, J=7,1 Гц, NH), 4,62 (дт, 1H, J=13,8 Гц, J=6,9 Гц, H-1”), 1,59 (д, 3H, J=6,9 Гц, Me).
ПРИМЕР 3
Общие методы исследования
Культуры клеток
Линии клеток глиобластомы U87 и опухоли поджелудочной железы, AsPc-1, Panc-1, Colo357-FG и Colo357-L3.6 выдерживали в DMEM с 10% фетальной бычьей сыворотки (FBS), 100 мг/мл стрептомицина и 100 Ед/мл пенициллина в 5% CO2 при 37°C.
Линии опухолевых клеток выдерживали в DMEM с 10% фетальной бычьей сыворотки (FBS), 100 мкг/мл стрептомицина и 100 Ед/мл пенициллина в 5% CO2 при 37°C.
AsPc-1: Линия клеток опухоли поджелудочной железы человека, образованная из асцитов пациента с гистологически подтвержденной аденокарциномой головки поджелудочной железы. См. Chen et al. (1982).
Panc-1: Линия эпителиоидных клеток, берущая начало из карциномы поджелудочной железы человека, происходящей из клеток эпителия протоков. См. Lieber et al. (1975).
Colo357 получена из метастаза аденокарциномы поджелудочной железы. См. Morgan et al. (1980).
Colo357-FG и Colo357-L3: Colo357-FG, быстрорастущий вариант, продуцирующий метастаз регионального лимфатического узла у 58% бестимусных мышей после подкожной имплантации и роста. Он также продуцирует печеночный метастаз у 64% и легочный метастаз у 43% бестимусных мышей после внутриселезеночной имплантации опухолевых клеток. См. Vezeridis et al. (1990).
Colo357-L3.5, образованный последовательными пассажами клеток опухоли поджелудочной железы человека из печени бестимусной мыши. См. Vezeridis et al. (1992).
WM793 линии опухолевых клеток меланомы человека использовали с разных стадий развития и их биологические и молекулярные исследования. См. Satyamoorthy et al. (1997).
Исследование на цитотоксичность
Для исследования на цитотоксичность 1500 опухолевых клеток высевали в 96-луночные с плоским дном культуральные планшеты в полной среде. Через 20 часов добавляли свежую среду, содержащую различные концентрации WP1066. Число клеток подсчитывали через 72 часа с применением MTS-анализа (набор реактивов для нерадиоактивного анализа клеточной пролиферации Promega CellTiter AQ, Madison, WI, USA) путем измерения поглощения при 490 нм с помощью 96-луночного планшет-ридера. Данные представлены как относительное ингибирование пролиферации плюс стандартное отклонение (SD) из восьми измерений. Число клеток в присутствии ДМСО принимали за 100%.
Исследование апоптоза
6×105 культивированных клеток рака поджелудочной железы высевали в 100-мм чашку за 24 ч до обработки. После обработки с различными временными точками и концентрациями WP1066 или ДМСО (растворитель) клетки прокрашивали с помощью аннексина V-FITC. Флуоресценцию измеряли на Becton Dickinson (San Jose, CA) FACS-экспериментом (сортировка клеток методом возбужденной флуоресценции) для по меньшей мере 10000 событий.
Исследование вестерн-блоттинг
Культивированные клетки рака поджелудочной железы, обработанные в различные временные точки и различными концентрациями WP-соединений или ДМСО (растворитель), лизировали в лизирующем буфере, и равные количества белковых экстрактов разделяли электрофорезом в полиакриламидном геле с натрийдодецилсульфатом и переносили на мембраны Hybond-P. Мембраны подвергали иммуно-блоттингу с применением фосфоспецифических STAT3, общего STAT3, Bcl-xL, сурвивина, PARP, каспазы-8 и GADPH антител. Первичные антитела визуализировали пероксидаза-конъюгированными антителами козла против кролика или против мыши, используя систему усиления хемилюминесценции (ECF) и Molecular Dynamics Storm Phosphorlmager.
Все композиции, раскрытые и заявленные в данном описании, могут быть получены и произведены без лишнего экспериментирования в свете настоящего описания. Хотя композиции и способы данного изобретения описаны на примерах предпочтительных вариантов осуществления, специалисту в данной области будет очевидно, что могут иметь место изменения в композициях и в стадиях или последовательности стадий описываемого способа без отклонения от концепции, существа и объема изобретения. Более конкретно, будет очевидно, что некоторые агенты, которые как химически, так и физиологически родственны, могут быть использованы вместо описанных в данном описании агентов, когда могут достигаться такие же или аналогичные результаты. Полагают, что все подобные замены и модификации, очевидные специалисту в данной области, охватываются целью, сущностью и объемом изобретения, как определено прилагаемой формулой изобретения.
Ссылки
Следующие ссылки, при условии, что они представляют иллюстративные методические или другие детали, дополнительно к изложенному выше, непосредственно включены в данное описание посредством ссылки.
U.S. Patent 6433018.
U.S. Patent 6420338.
U.S. Patent 6426366.
Arbel et al., Am. J. Obstet. Gynecol., 188(5):1283-90, 2003.
Bharti et al., J. Immunol., 171(7):3863-3871, 2003.
Burdelya et al., Mol. Cancer Ther., 1(11):893-9, 2002.
Catlett-Falcone et al., Immunity, 10(1):105-15, 1999.
Chen et al., In Vitro, 18(1):24-34, 1982.
Constantin et al., Eur. J. Immunol., 28(11):3523-9, 1998.
Hallek et al., Blood, 91(1):3-21, 1998.
Hideshima et al., J. Biol. Chem., 277(19):16639-47, 2002.
Iwamaru1 et al., Oncogene, 1-10, 2006.
Jernberg-Wiklund et al., Int. J. Cancer, 51(1):116-23, 1992.
Kerr et al., FEBS Lett., 546(1):1-5, 2003.
Kuehl et al., Curr. Top Microbiol. Immunol., 224:277-82, 1997.
Lieber et al., Int. J. Cancer, 15(5):741-747, 1975.
Meydan et al., Nature, 379(6566):645-8, 1996.
Morgan et al., Int. J. Cancer, 25(5):591-598, 1980.
"Remington's Pharmaceutical Sciences" 15th Edition, pages 1035-1038 and 1570-1580.
Satyamoorthy et al., Melanoma Res., 7(Suppl.2):S35-S42, 1997.
Alas and Bonavida, Clin. Cancer Res., 9(1):316-26, 2003.
Selvanayagam et al., Blood, 71(1):30-5, 1988.
Verma et al., Cancer Metastasis Rev., 22(4):423-34, 2003.
Vezeridis et al., Cancer, 69(8):2060-2063, 1992.
Vezeridis et al., J. Surg. Res., 48(1):51-55, 1990.
Wermuth and Stahl, In: Pharmaceutical Salts: Properties, Selection and Use-A Handbook, Verlag Helvetica Chimica Acta, 2002.
World Health Organization grades II-IV, Kleihues et al. (Eds.), 2002.
Yu and Jove, Nature Rev. Cancer, 4(2):97-105, 2004.
Реферат
Настоящее изобретение относится к соединениям, выбранным из группы, структурные формулы и значения радикалов которых такие, как представлено в п.1 и в п.9 формулы изобретения, а также к способу лечения, связанного с пролиферацией клеток заболевания, включающему введение субъекту данных соединений. Технический результат: получены и описаны новые соединения, которые показывают значительную активность в качестве ингибиторов путей Jak2/STAT3 и последующих мишеней и ингибируют рост и выживаемость линий опухолевых клеток. 3 н. и 49 з.п. ф-лы, 3 прим., 2 табл., 34 ил.
Формула

где R1 представляет собой -Н или цианогруппу, и R2 представляет собой гетероатомзамещенный или гетероатомнезамещенный C3-C7циклоалкил;

где X1 представляет собой галоген, и R3 представляет собой гетероатомзамещенный или гетероатомнезамещенный C3-C7циклоалкил, C6-C10арил или C7-C10аралкил;

где Х2 представляет собой галоген, и R4 представляет собой гидрокси или гетероатомзамещенный или гетероатомнезамещенный C1-C10ацилокси;

где X3 представляет собой галоген или гетероатомзамещенный или гетероатомнезамещенный C1-C10алкил или C1-C10алкокси,
R5 представляет собой -Н или цианогруппу, и
R6 представляет собой гетероатомзамещенный или гетероатомнезамещенный C3-C7циклоалкил, C6-C10арил или C7-C10аралкил;

где X4 представляет собой галоген или гетероатомзамещенный или гетероатомнезамещенный C1-C10алкил или C1-C10алкокси,
R7 представляет собой -H или цианогруппу, и
R8 представляет собой гетероатомзамещенный или гетероатомнезамещенный C3-C7циклоалкил, C6-C10арил или C7-C10аралкил;
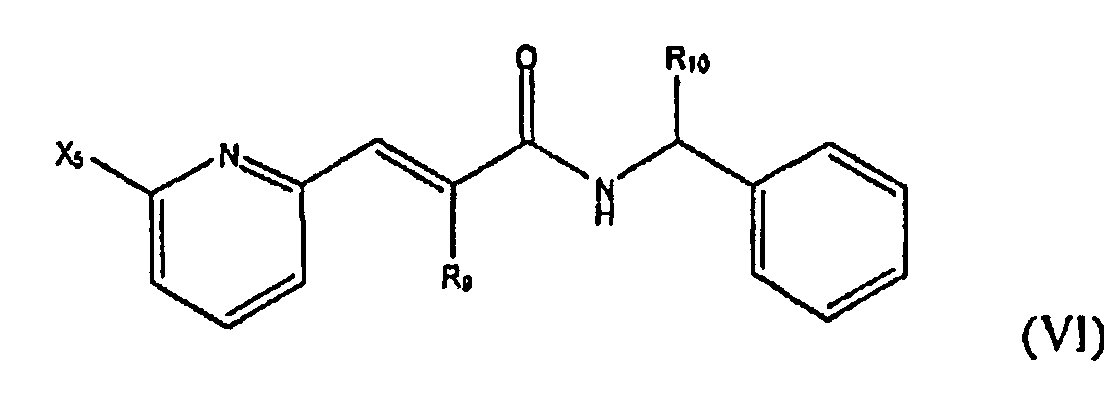
где Х5 представляет собой гетероатомзамещенный или гетероатомнезамещенный C1-C10алкил,
R9 представляет собой -Н или цианогруппу, и
R10 представляет собой гетероатомзамещенный или гетероатомнезамещенный C1-C10алкил, C3-C7циклоалкил, С1-С10ацилокси, С6-С10арил или С7-С10аралкил;

где А представляет собой -S(O2)-, и
X6 представляет собой галоген или гетероатомзамещенный или гетероатомнезамещенный C1-C10алкил или C1-С10алкокси,
R11 представляет собой гетероатомзамещенный или гетероатомнезамещенный C1-С10алкил, С3-С7циклоалкил, C1-С10ацилокси, С6-С10арил или С7-С10аралкил;

где R12 представляет собой циклододецил, имидазоил или циклогексенил,
R13 представляет собой -Н или гетероатомзамещенный или гетероатомнезамещенный С1-С10алкил, С3-С7циклоалкил, С1-С10ацилокси, С6-С10арил или С7-С10аралкил; и

где Х7 представляет собой галоген или гетероатомзамещенный или гетероатомнезамещенный C1-С10алкил или C1-С10алкокси,
R14 представляет собой

и его фармацевтически приемлемые соли, таутомеры и оптические изомеры.






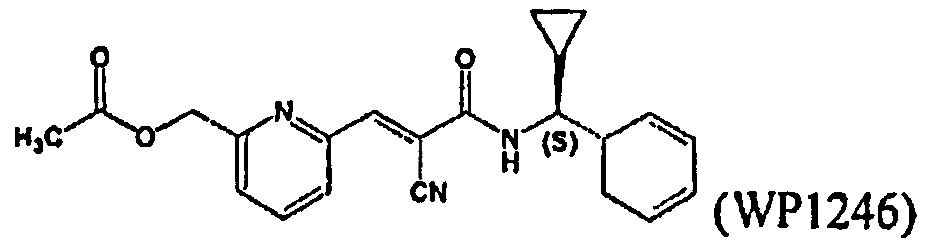
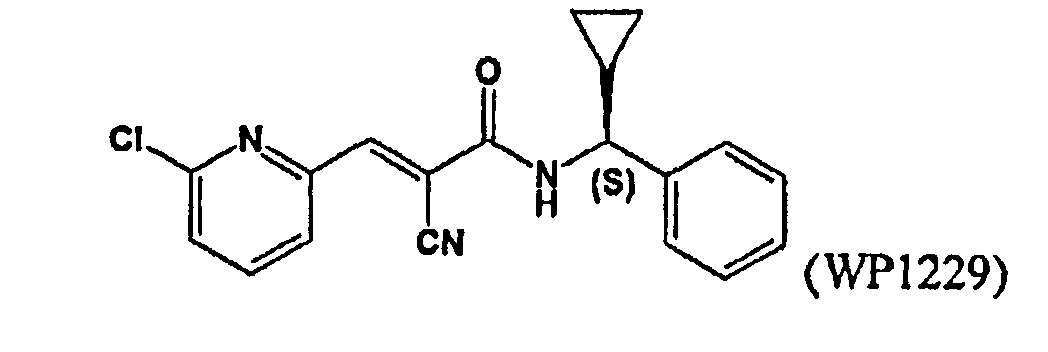













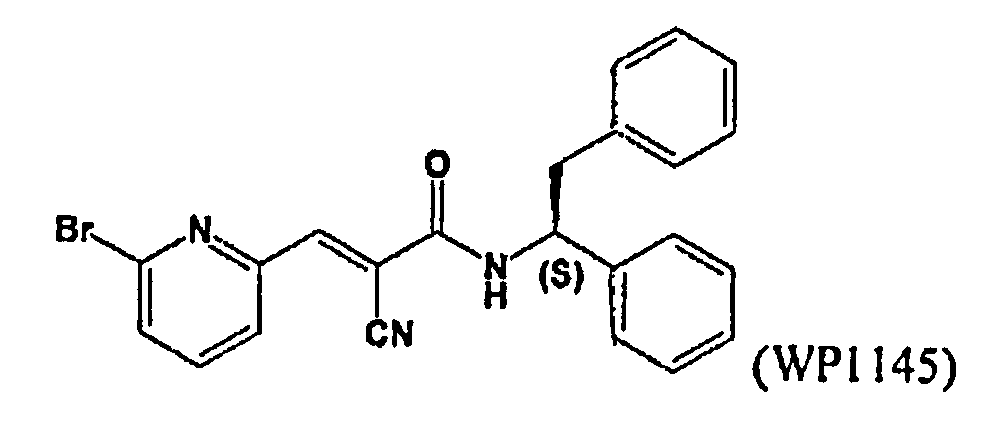



где А выбирают из группы, состоящей из -C(O)- и -SO2-;
R1 выбирают из группы, состоящей из циклододецила









где X1, X2, Х3 и X4 каждый независимо выбирают из группы, состоящей из водорода, галогена, алкила, алкоксила, ацетоксила, алкилацетоксила, -OH, тригалогенметила и -NO2;
Y1 выбирают из группы, состоящей из галогена, -ОН и -NO2; и
R2 выбирают из группы, состоящей из алкила, алкенила, алкинила, алкокси, алкиларила, галогена, водорода, -OH, -NO2, тиоэфира, амино, -SH и -NH2;
R3 выбирают из группы, состоящей из





где Z3 представляет собой двухвалентный алкил; и
где m1 равен 1, 2, 3 или 4; и
R4 выбирают из группы, состоящей из водорода, -CN, замещенного амина, -CH2S-алкила, алкила и -CH2N3;
где R5 и R6 каждый независимо выбирают из группы, состоящей из





моносахарида, производного моносахарида, полисахарида, производного полисахарида, арила и алкиларила;
Z выбирают из группы, состоящей из -NH, -S- и -O-, и
Х5 и Х6 каждый независимо выбирают из группы, состоящей из водорода, C≥8алкила, C1-7алкила, циклоалкила, циклоарилалкила, алкиларила, арила, алкоксила, гидроксила, гидроксилалкила, сложного алкилового эфира, сложный алкиловый эфир-алкила, алкилацетоксила или арилоксила;
при условии, что, если R4 представляет собой -CN, замещенный амин, -CH2S-алкил, алкил или -CH2N3, то R1 выбирают из группы, состоящей из циклододецила,







и R3 представляет собой

где X5 или Х6 представляет собой арил, алкоксил, арилоксил, циклоалкил, циклоарилалкил, алкиларил, сложный алкиловый эфир, сложный алкиловый эфир-алкил, алкилацетокси или арилоксил.

















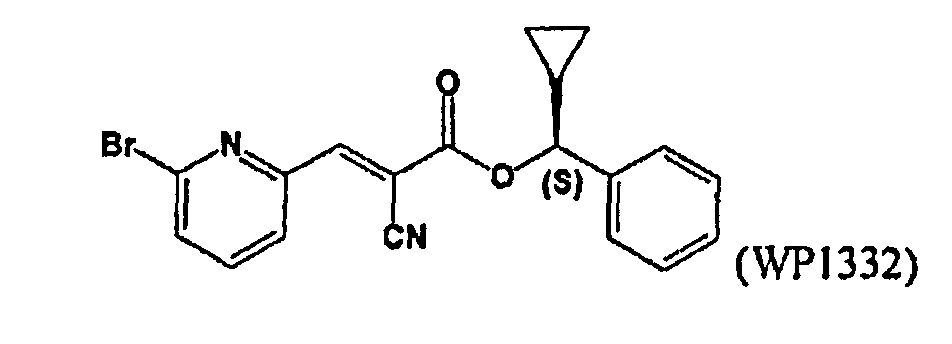

Комментарии