Способ идентификации веществ, потенциальных для лечения аутоиммунных заболеваний (варианты), высокоочищенная днк (варианты) и высокоочищенный полипептид (варианты) - RU2160447C2
Код документа: RU2160447C2
Чертежи








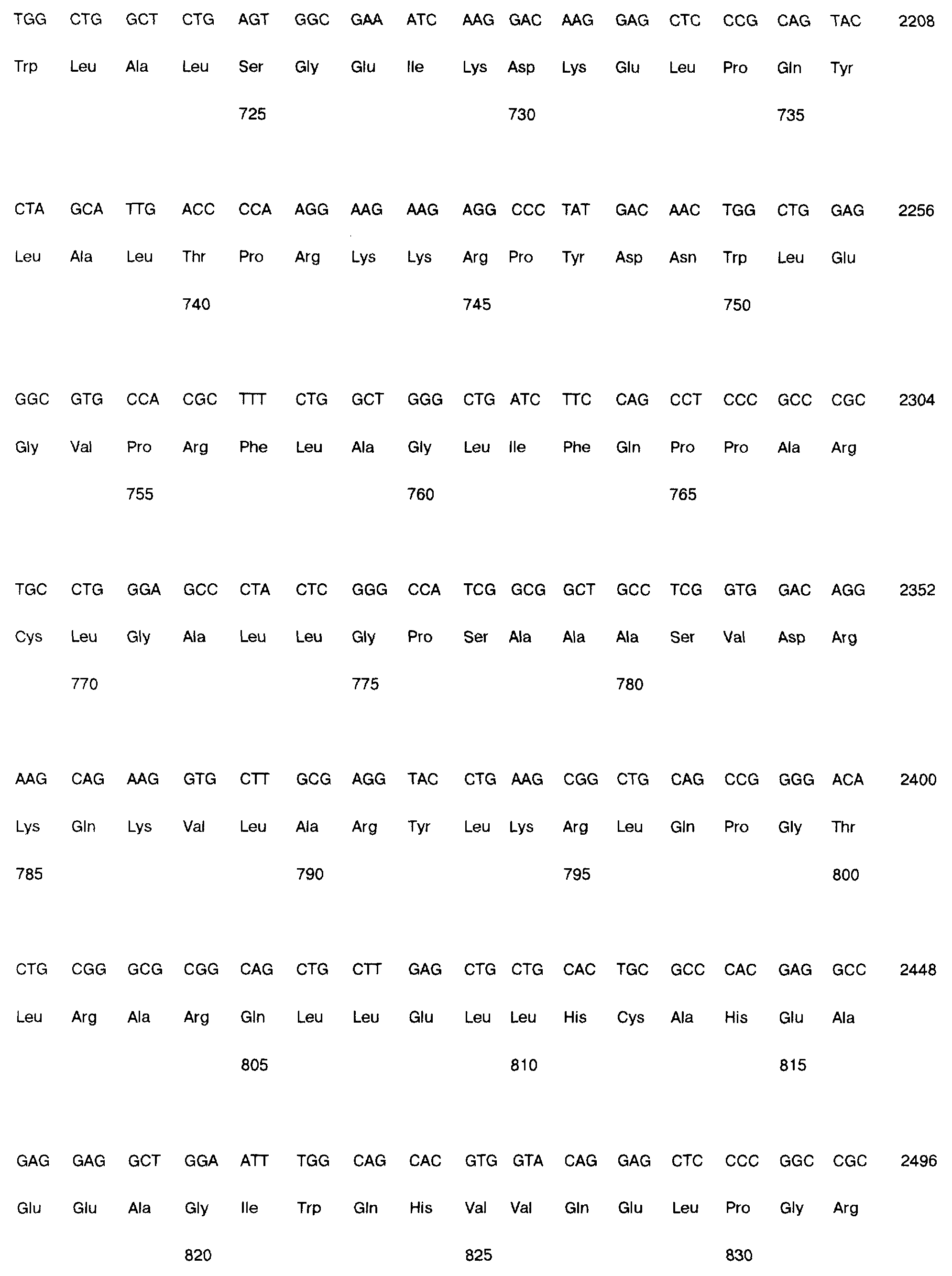


















Описание
Изобретение связано с аутоиммунными заболеваниями.
Молекулы класса II, отвечающие за основную тканевую совместимость (ОТС), действуют на поверхности иммуноцитов и B-лимфоцитов. Молекулы ОТС класса II участвуют в формировании иммунного ответа за счет связывания антигенов и их передачи на T-лимфоциты. Таким образом, уровень экспрессии молекул ОТС класса II влияет на индукцию иммунного ответа.
Гены, кодирующие α- и β- полипептиды антигенов ОТС класса II, локализованы в области хромосомы HLA-D (histocompatability leukocyte antigen-D - лейкоцитарный антиген D, отвечающий за тканевую совместимость). Изотипы генов класса II обозначаются как HLA-DR, HLA-DQ, HLA-DP. Среди этих генов наблюдается существенный аллельный полиморфизм; например, к HLA-DR аллелям относятся аллели DR1, DR2, DR3 и DR4. Кроме того, существуют подтипы данных аллелей; например, к подтипам DR4 относятся Dw4, Dw10, Dw13, Dw14 и Dw15.
Различные аутоиммунные заболевания связаны с экспрессией конкретных аллелей генов ОТС класса II. Примерно у 93% больных ревматоидным артритом экспрессируются HLA-DR1, HLA-DR4 или оба эти гена (McDermott et al., Bulletin on the Rheumatic Diseases, 38: 1-10; см. табл. 1).
Другие аутоиммунные заболевания также связаны с экспрессией конкретных аллелей. Например, с различными HLA-DR аллелями ассоциированы синдром Фелти, ксеродерматоз, системная красная волчанка, а также развитие токсичности от воздействия золота и пеницилламина (McDermott et al., Bulletin on the Rheumatic Diseases, 38: 1-10; см. табл. 2).
Другим примером является болезнь Стилла-Шоффара с нарушением артикуляции, которая ассоциирована с HLA-DPB2.1 (Begovich et al., 1989, PNAS 86: 9489-9493). Примерно у 70% пациентов с инсулинзависимым сахарным диабетом экспрессируются гены HLA-DQ3.2B, DQA1 или DQB1, а чувствительность к аутоиммунному кожному заболеванию - обыкновенной пузырчатке - связана с экспрессией HLA-DQB1.3 (Scharf et al., 1989, PNAS 86: 6215-6219).
Активация транскрипции генов ОТС класса II зависит от активатора транскрипции CIITA (Steimle et al., 1993, Cell 75: 135-146).
Мы обнаружили, что для активации транскрипции достаточно части CIITA при условии, что нет остаточного количества белка и, с другой стороны, полностью имеется система транскрипции. Мы рассматриваем этот домен как CIITA-домен активации транскрипции, и нами было установлено, что он позволяет получать полезную информацию для идентификации веществ, ингибирующих CIITA-зависимую транскрипцию. Такие вещества являются потенциальными терапевтическими средствами для лечения аутоиммунных заболеваний за счет присущей им способности ингибировать транскрипцию генов ОТС класса II. Мы также открыли, что вторая часть CIITA является достаточной при условии, что нет остаточного количества белка и, с другой стороны, полностью имеется система транскрипции, чтобы осуществить посредничество между CIITA и его белком-мишенью в клеточной системе транскрипции и активировать все промоторы ОТС класса II. Мы рассматриваем этот домен как CIITA-домен взаимодействия, а вещества, ингибирующие связывание этого домена с его белком-мишенью, - как способные ингибировать CIITA-зависимую транскрипцию и, таким образом, являющиеся потенциальными лекарственными средствами для терапии аутоиммунных заболеваний. Также мы обнаружили, что мутант CIITA (упомянутый в данной работе как клон 13 CIITA) активирует транскрипцию подгруппы генов ОТС класса II. Мы обозначаем данные мутанты как специфичные по изотипу; домены активации транскрипции и взаимодействия CIITA белков, специфичных по изотипу, пригодны для идентификации веществ, являющихся специфичными по изотипу ингибиторами транскрипции.
Таким образом, в предлагаемых в данном изобретении методах используются CIITA-домены активации и взаимодействия для того, чтобы определить, может ли вещество потенциально рассматриваться как терапевтическое средство для лечения аутоиммунных заболеваний. Наличие или отсутствие функционирующего CIITA-домена активации или функционирующего CIITA-домена взаимодействия может быть установлено при использовании методик определения транскрипции, которые изложены далее. В одном из методов способность вещества ингибировать транскрипцию репортерного гена оценивается по ингибированию транскрипции, показывающей, что вещество, возможно, является терапевтическим средством для лечения аутоиммунных заболеваний. В другом методе оценивается способность вещества ингибировать связывание CIITA-домена взаимодействия со своим рецепторным белком, и ингибирование связи показывает, что вещество, возможно, является терапевтическим средством для лечения аутоиммунных заболеваний. Еще в одном из методов определяется способность CIITA-взаимодействующего домена принимать участие в осуществлении транскрипции в отсутствии CIITA-домена активации транскрипции и в присутствии домена активации транскрипции другого белка. Вещества, ингибирующие функцию домена взаимодействия, возможно, являются терапевтическими средствами для лечения аутоиммунных заболеваний. Данный метод позволяет идентифицировать вещества, являющиеся специфичными по изотипу ингибиторами транскрипции, путем оценивания способности CIITA-домена взаимодействия дикого типа принимать участие в транскрипции в присутствии исследуемых веществ и путем мониторинга экспрессии каждого изотипа в присутствии ингибитора специфического изотипа. CIITA-домен взаимодействия дикого типа принимает участие в транскрипции только подгруппы ОТС генов класса II.
Для идентификации веществ, которые являются специфичными по изотипу ингибиторами транскрипции, данное изобретение далее представляет методы, в которых используются специфичные по изотипу CIITA-домены взаимодействия и активации транскрипции. В этих методах определяется способность испытываемых веществ по-разному воздействовать на транскрипцию, осуществляемую CIITA-доменами взаимодействия и активации транскрипции дикого типа и специфичными по изотипу. Такие специфичные по изотипу ингибиторы пригодны для селективного воздействия на иммунную систему.
Ингибирование транскрипции может быть определено in vivo, in vitro или в исследованиях с использованием клеток. Известно большое количество разнообразных методик оценки активности домена активации транскрипции (см., например, Keegan et al., 1986, Science 23: 699; Ma et al., 1987, Cell 48: 847; Lin et al., 1988, Cell 54: 659; Sadowski et al., 1988, Nature 335: 563; Roberts et al. , 1993, Nature 363: 741; Ma et al., 1988, Cell 55: 443). Эти и другие исследования транскрипции могут быть модифицированы для идентифицирования веществ, ингибирующих CIITA активацию транскрипции. Эта цель может быть достигнута путем замещения домена активации, использовавшегося в ранее описанном исследовании, на вновь идентифицированный CIITA-домен активации транскрипции. Вещества, ингибирующие CIITA-активацию транскрипции, могут быть идентифицированы просто внесением этих веществ в реакцию при проведении транскрипции и определением, являются ли они ингибиторами транскрипции. Возможно, что такие вещества могут оказаться лекарственными средствами в терапии аутоиммунных заболеваний.
В предпочтительных воплощениях изобретения выявление веществ, которые могут оказаться лекарственными
средствами для лечения аутоиммунных заболеваний, осуществляется следующим образом:
а) используется составной белок, который включает домен CIITA-активации транскрипции (без действующего
CIITA-домена взаимодействия), объединенный с ДНК-связывающим белком (например, ДНК-связывающий/димеризующий домен LexA или ДНК-связывающий домен GAL4);
б) составной белок вводится в систему
транскрипции (например, in vitro или в прокариотические или эукариотические клетки, такие как бактериальные, дрожжевые, а также клетки растений или млекопитающих) с системой транскрипции, имеющей ДНК
с регуляторной последовательностью (например, на плазмиде или на хромосоме), с которой связывается составной белок, и регуляторной последовательностью, функционально связанной с репортерным геном
(например, геном, кодирующим β- галактозидазу, CAT, GUS, люциферазу, гормон роста человека или щелочную фосфатазу);
в) измеряется уровень транскрипции репортерного гена (например, с
помощью стандартных приемов определения уровня активности образовавшейся РНК или белка репортерного гена. Например, транскрипция гена lacZ может быть измерена при выращивании клеток в глубинной или
поверхностной культуре на средах, содержащих X-gal, путем измерения количества синтезированного синего хромофора): и
г) выполняются указанные выше стадии а-в в присутствии тестируемого
вещества, уменьшение уровня транскрипции (относительно уровней, наблюдаемых в отсутствии этого вещества) свидетельствует о том, что это вещество ингибирует CIITA-активацию транскрипции и, таким
образом, может оказаться лекарственным средством в терапии аутоиммунных заболеваний.
В других предпочитаемых воплощениях изобретения используется CIITA-домен взаимодействия для
идентификации возможных лекарственных средств для терапии аутоиммунных заболеваний. Эти способы включают в себя:
а) использование составного белка, который включает CIITA-домен взаимодействия,
объединенный с доменом активации транскрипции, отличным от CIITA (например, домен активации транскрипции фактора α-трансдукции (α-TDF) вируса простого герпеса):
б)
использование CIITA-взаимодействующего белка-мишени (например, CIITA-взаимодействующий белок-мишень В-клеток человека);
в) введение составного белка и белка-мишени в систему транскрипции
(например, in vitro или в прокариотические или эукариотические клетки, такие как бактериальные, дрожжевые, а также клетки растений или млекопитающих, такие как B-клетки человека (например, клон 13,
Raji или RM3 клетки)) с системой транскрипции, имеющей ДНК, которая имеет регуляторную последовательность, включающую последовательность промотора ОТС класса II (например, на плазмиде или хромосоме) и
регуляторную последовательность, функционально связанную с репортерным геном (например, геном ОТС класса II, геном, кодирующим β- галактозидазу, CAT, GUS, люциферазу, гормон роста человека или
щелочную фосфатазу); и
г) измерение уровня транскрипции репортерного гена (например, с использованием стандартных методик для определения уровня активности РНК или белка - продуктов
репортерного гена. Например, транскрипция генов ОТС класса II может быть измерена в линии B-клеток человека с использованием FACS для определения увеличения экспрессии молекул ОТС класса II на
поверхности клеток); и
д) при выполнении указанных выше стадий а-г в присутствии тестируемого вещества уменьшение уровня транскрипции (относительно уровней, наблюдаемых в отсутствии этого
вещества) свидетельствует о том, что это вещество ингибирует способность CIITA-домена взаимодействия принимать участие в транскрипции и, таким образом, является потенциальным лекарственным средством в
терапии аутоиммунных заболеваний. Вещества, являющиеся изоспецифичными по типу ингибиторами транскрипции, могут быть идентифицированы благодаря их качеству по-разному ингибировать экспрессию генов ОТС
класса II. Например, экспрессия CIITA-домена взаимодействия дикого типа в клетках клона 13 восстанавливает транскрипцию изотипов HLA-DR, -DQ и -DR. Вещество, которое ингибирует транскрипцию, но не с
помощью специфичности изотипа, воспрепятствует восстановлению экспрессии всех трех генов. Напротив, специфичный по изотипу ингибитор транскрипции будет препятствовать восстановлению экспрессии только
подгруппы генов.
В других предпочтительных воплощениях изобретения определение веществ, которые могут быть лекарственными средствами для лечения аутоиммунных заболеваний, включает в
себя:
а) использование первого составного белка, который включает CIITA-домен взаимодействия (без функционирующего CIITA-домена активации), объединенный с ДНК-связывающим белком (например,
ДНК- связывающий/димеризующий домен LexA или ДНК-связывающий домен GAL4);
б) введение составного белка в систему транскрипции (например, in vitro или в прокариотические или эукариотические
клетки, например бактериальные, дрожжевые клетки растений или млекопитающих) с системой транскрипции, имеющей ДНК, которая содержит регуляторную последовательность (например, на плазмиде или
хромосоме), с которой связывается первый составной белок, и регуляторную последовательность, функционально связанную с репортерным геном (например, геном, кодирующим β- галактозидазу, CAT, GUS,
люциферазу, гормон роста человека или щелочную фосфатазу);
в) использование второго составного белка, для которого характерно включение домена активации транскрипции (например, В42 домен
активации транскрипции), объединенного с CIITA-взаимодействующим белком-мишенью, как описано в данной работе;
г) измерение уровня транскрипции репортерного гена (например, с применением
стандартных методик по измерению уровня активности РНК или белка этого репортерного гена. Например, транскрипция lacZ гена может быть измерена путем выращивания клеток в глубинной или поверхностной
культуре на средах, содержащих X-gal, и измерения количества синтезированного синего хромофора); и
д) при выполнении указанных выше стадий а-г в присутствии тестируемого вещества уменьшение
уровня транскрипции (относительно уровней, наблюдаемых в отсутствии этого вещества) свидетельствует о том, что это вещество ингибирует способность CIITA-домена взаимодействия связываться со своим
белком-мишенью и, таким образом, оно является потенциальным лекарственным средством в терапии аутоиммунных заболеваний. Вещество, которое ингибирует связывание, может действовать различными способами,
включая пространственное вмешательство в связывание или изменение структуры CIITA или его белка-мишени. Хотя существующий механизм, с помощью которого вещество препятствует транскрипции, может быть не
известен, вещество, тем не менее, оценивается как терапевтическое средство. Другие способы оценки взаимодействия белков друг с другом также могут быть использованы для определения веществ,
ингибирующих связывание CIITA-домена взаимодействия с его белком-мишенью. Специалист с помощью стандартных приемов молекулярной биологии может использовать ELISAs, блоттинг по Саузерну, фильтр- и
мембранно-связывающие белки или иммобилизованные белки для идентификации веществ, ингибирующих связывание CIITA-домена взаимодействия с соответствующим белком-мишенью.
Данное изобретение также дает характеристику высокоочищенному полипептиду, который включает CIITA-домен активации транскрипции без действующего CIITA-домена взаимодействия. Предпочтительно, чтобы полипептид включал последовательность более чем 50 аминокислот, в высокой степени идентичную последовательности более чем 50 аминокислот в положении 26-352, которая показана на фиг. 1.
Аналогичным образом в данном изобретении дается характеристика высокоочищенной ДНК (например, геномной ДНК, кДНК или искусственно синтезированной ДНК), кодирующей CIITA-домен активации транскрипции без кодирования функционирующего CIITA-домена взаимодействия.
Далее в изобретении описывается высокоочищенный полипептид, который включает CIITA-домен взаимодействия, но без функционирующего CIITA-домена активации транскрипции. Предпочтительно в полипептид включена последовательность из более чем 50 аминокислот, в высокой степени идентичная последовательности из более чем 50 аминокислот в положении 301-1130 последовательности, показанной на фиг. 1.
Аналогичным образом в данном изобретении дается характеристика высокоочищенной ДНК (например, геномной ДНК, кДНК или искусственно синтезированной ДНК), кодирующей CIITA-домен взаимодействия без кодирования функционирующего CIITA-домена активации транскрипции.
Кроме того, в данном изобретении дается характеристика высокоочищенного полипептида, который включает домен взаимодействия полипептида CIITA линии клеток клона 13 (для описания линии клеток см. Ono et al., 1991, J. Exp. Med. 173: 629-637). CIITA клона 13 активирует транскрипцию ОТС гена DQ класса II, но не активирует транскрипцию ОТС генов DR и DP класса II. Предпочтительно, чтобы полипептид включал последовательность более чем 50 аминокислот, в высокой степени идентичную последовательности более чем 50 аминокислот в положении 301-1177, как показано на фиг. 1, несмотря на утрату аминокислот 1-300 и 1078-1 130 последовательности, показанной на фиг. 1. Аналогичным образом в изобретении дается высокоочищенная ДНК (например, геномная ДНК, кДНК или искусственно синтезированная ДНК), кодирующая CIITA клона 13.
Другие специфичные по изотипу мутанты CIITA также включены в данное изобретение, и далее в изобретении излагаются методы, которые используют домены активации и взаимодействия специфичных по изотипу мутантов CIITA для того, чтобы определить, является ли вещество специфичным по изотипу ингибитором транскрипции. Вещество, которое относится к специфичным по изотипу ингибиторам, также является потенциальным средством для лечения аутоиммунных заболеваний. Так, вещество, в частности, представляет интерес, если оно может ингибировать транскрипцию конкретных генов, о которых известно, что они участвуют в проявлении аутоиммунного заболевания, хотя не препятствуют экспрессии других ОТС генов класса II. Так, специфичное по изотипу вещество, когда применяется в качестве средства для терапии аутоиммунного заболевания, может позволить избежать ответного общего подавления иммунитета.
Специфичное по изотипу вещество может быть идентифицировано с применением специфичного по изотипу CIITA в одном из описанных в данном изобретении исследований по ингибированию при сравнении результатов, полученных при применении CIITA дикого типа или мутантного с отличной специфичностью по изотипу. Например, вещество, ингибирующее транскрипцию, которая зависит от CIITA дикого типа, но не CIITA клона 13, пригоднo для ингибирования транскрипции ОТС генов DR и DP класса II. Поскольку в 93% случаев заболевания ревматоидным артритом наблюдается экспрессия DR1 и/или DR4, вещество, специфически ингибирующее транскрипцию генов DR является очевидным кандидатом для того, чтобы оказаться лекарственным средством в терапии ревматоидного артрита. Сходным образом два специфичных по изотипу мутанта CIITA могут быть использованы для определения того, является ли вещество специфичным по изотипу ингибитором транскрипции. Например, сравнительный метод может включать первый CIITA-мутант, который активирует транскрипцию DR и DP, и второй мутант CIITA, который активирует только транскрипцию DP. Вещество, ингибирующее способность первого мутанта, но не второго, пригодно для селективного ингибирования экспрессии DR.
Под "геном-активатором транскрипции класса II (class II transactivator gene)" (CIITA-ген) подразумевается ген, кодирующий активатор транскрипции совместно с геном, который примерно на 80% или более имеет последовательность, идентичную последовательности CIITA, представленной на фиг. 1 (SEQ ID NO: 1).
Под "CIITA-доменом, активирующим транскрипцию", подразумевается полипептид, чья последовательность примерно на 80% или более идентична аминокислотной последовательности полипептида CIITA в положении 26-352, показанного на фиг. 1, но без функционирующего CIITA-домена взаимодействия.
Под "CIITA-доменом взаимодействия" подразумевается полипептид, у которого примерно на 80% или более аминокислотная последовательность в положении 301-1130 совпадает с последовательностью CIITA-полипептида, показанного на фиг. 1, но без функционирующего CIITA-домена активации транскрипции. Примером мутантного CIITA-домена взаимодействия является домен взаимодействия клона 13 CIITA, у которого последовательность ДНК характеризуется, по меньшей мере частично, делецией нуклеотидов в положении 3211-3214 последовательности ДНК CIITA дикого типа, показанной на фиг. 1 (что соответствует нуклеотидной последовательности ранее описанной кДНК в положении 3326-3329 (Steimle et al., infra)), в результате чего по сравнению с диким типом белок укорачивается на 53 аминокислоты.
Следует иметь в виду, что CIITA-домены активации транскрипции и взаимодействия, показанные в этой работе, перекрываются примерно на 51 аминокислоту. Однако перекрывающаяся область недостаточна для того, чтобы обеспечить функционирование домена активации транскрипции или домена взаимодействия. Таким образом, полипептид, имеющий аминокислоты в положении 26-352 и утративший их в положении 353-1130 в последовательности, показанной на фиг. 1, имеет действующий домен активации транскрипции, но утратил действующий домен, обеспечивающий взаимодействие. Сходным образом полипептид, обладающий аминокислотной последовательностью в положении 301-1130 и утративший ее в положении 1-300 в последовательности, показанной на фиг. 1, имеет действующий домен взаимодействия, но утратил действующий домен активации транскрипции.
Под "полипептидом" подразумевается любая цепь аминокислот независимо от ее длины или посттрансляционной модификации (например, по типу гликозилирования или фосфорилирования).
Под "функционально связанным" подразумевается, что ген и регуляторная последовательность (последовательности) соединены таким образом, что происходит экспрессия генов, при которой соответствующие молекулы (например, белки активации транскрипции) связаны с регуляторной последовательностью (последовательностями).
Под "репортерным геном" имеется в виду ген, чья экспрессия может быть исследована; к таким генам относятся гены lacZ, хлорамфениколацетилтрансферазы (CAT), β- глюкуронидазы (GUS) и люциферазы.
Под "высокоидентичными" имеются в виду полипептиды или нуклеиновые кислоты, которые имеют по меньшей мере 50%, предпочтительнее - 85%, еще более предпочтительно - 90% и наиболее предпочтительно - 95% гомологии по отношению к соответствующей аминокислотной или нуклеотидной последовательности. В случае полипептидов длина сравниваемых последовательностей в целом должна состоять по меньшей мере из 16 аминокислот, предпочтительнее - по меньшей мере из 20 аминокислот, еще более предпочтительно - по меньшей мере из 25 аминокислот и наиболее предпочтительно - по меньшей мере из 35 аминокислот. Для нуклеиновых кислот длина сопоставляемых последовательностей должна в целом состоять по меньшей мере из 50 нуклеотидов, предпочтительнее - по меньшей мере из 60 нуклеотидов, еще более предпочтительно - по меньшей мере из 75 нуклеотидов и наиболее предпочтительно - из 110 нуклеотидов.
Идентичность последовательностей обычно определяется с использованием автоматизированного анализатора последовательностей (сиквинатора) (например, Sequence Analysis Software Package of the Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, Wl). Такие анализаторы подбирают схожие последовательности путем установления степеней гомологии для различных замещений, делеций и других модификаций. Консервативные замещения обычно включают замещения в составе следующих групп: глицин, аланин; валин, изолейцин, лейцин; аспарагиновая кислота, глютаминовая кислота, аспарагин, глютамин; серин, треонин; лизин, аргинин; а также фенилаланин, тирозин.
Под "высокоочищенным полипептидом" подразумевается полипептид, прошедший очистку от обычно присутствующих естественных примесей. Обычно полипептид считается высокоочищенным, когда он по меньшей мере на 60% (по весу) освобожден от белков и естественным образом присутствующих органических молекул. Желательно, чтобы препарат по меньшей мере на 75%, более предпочтительно - по меньшей мере на 90% и наиболее предпочтительно - по меньшей мере на 99% (по весу) состоял из желаемого белка. Высокоочищенный CIITA-домен активации транскрипции или CIITA-домен взаимодействия могут быть получены, например, путем экстракции из природного источника (например, клеток человека); путем экспрессии рекомбинантной нуклеиновой кислоты, кодирующей CIITA-домен активации транскрипции или CIITA-домен взаимодействия; или путем химического синтеза полипептида. Степень очистки препарата может быть определена любым приемлемым методом (например, хроматографией на колонке, электрофорезом в полиакриламидном геле или с помощью ВЭЖХ).
Белок является высокоочищенным от природных примесей, когда он отделяется от этих примесей, сопровождающих белок в естественных условиях. Таким образом, химически синтезированный белок, синтезированный in vitro или произведенный в клеточной системе, но не в той, в которой этот белок присутствует в естественных природных условиях, будет в высокой степени свободен от природно-ассоциированных с ним компонентов. Соответственно к высокоочищенным полипептидам относятся полипептиды эукариотов, но синтезированные в Е. coli или в других прокариотах.
Под "высокоочищенной ДНК" подразумевается ДНК, свободная от генов, которые в природном геноме организма, от которого происходит использовавшаяся в данном изобретении ДНК, примыкают к гену. Следовательно, под данное определение подпадает, например, рекомбинантная ДНК, включенная в вектор; в состав автономно реплицирующейся плазмиды или вируса; или в геном прокариота или эукариота (например, дрожжевой клетки); или существующая в качестве отдельной молекулы (например, кДНК или геномная, или фрагмент кДНК, полученный с помощью ПЦР или в результате обработки эндонуклеазами рестрикции) независимо от других последовательностей. К такой ДНК также относится рекомбинантная ДНК, которая является частью гибридного гена, кодирующего дополнительную полипептидную последовательность.
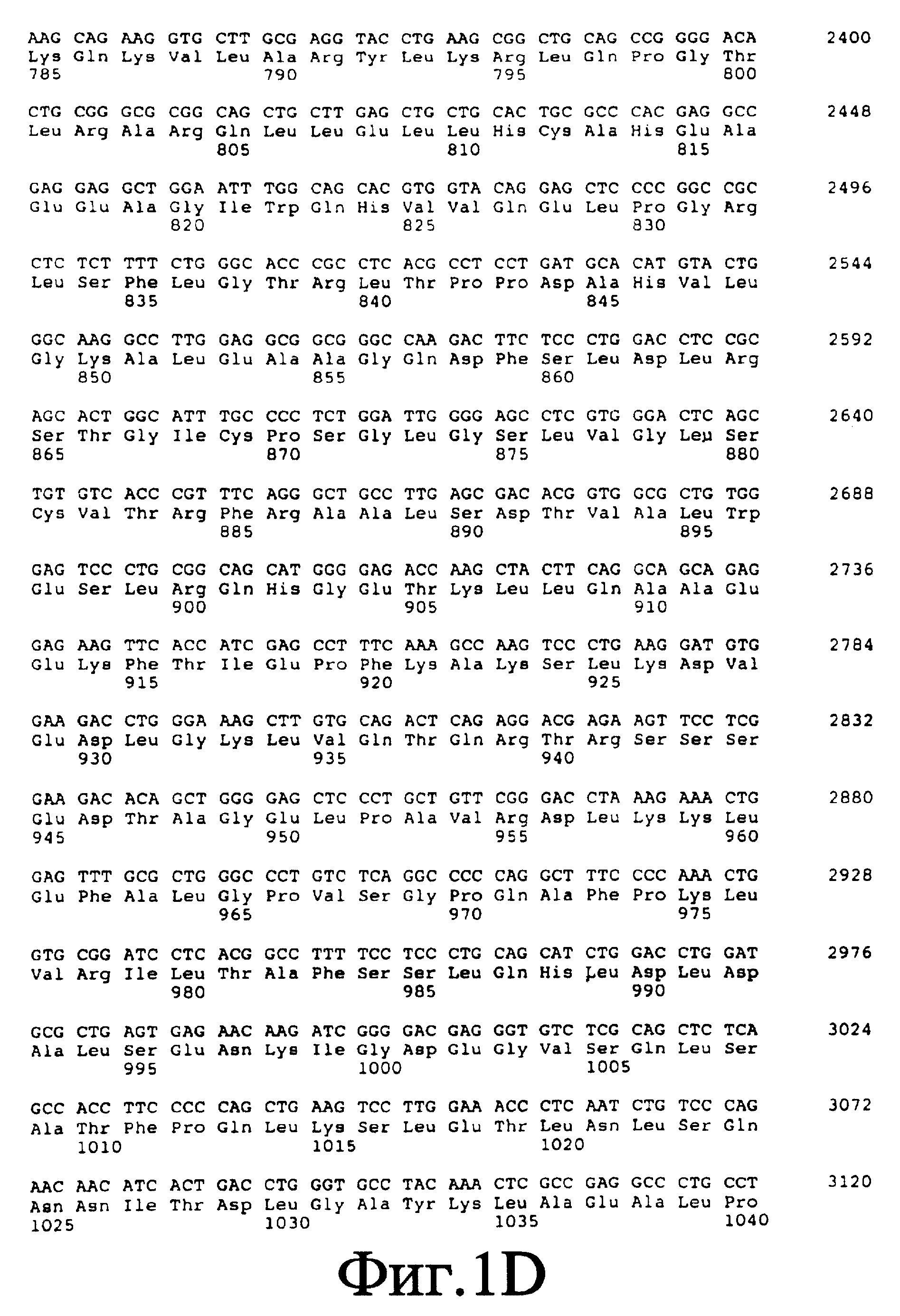
На фиг. 1 приведена нуклеотидная и соответствующая ей аминокислотная последовательности CIITA полностью по всей длине (SEQ ID NO: 1).
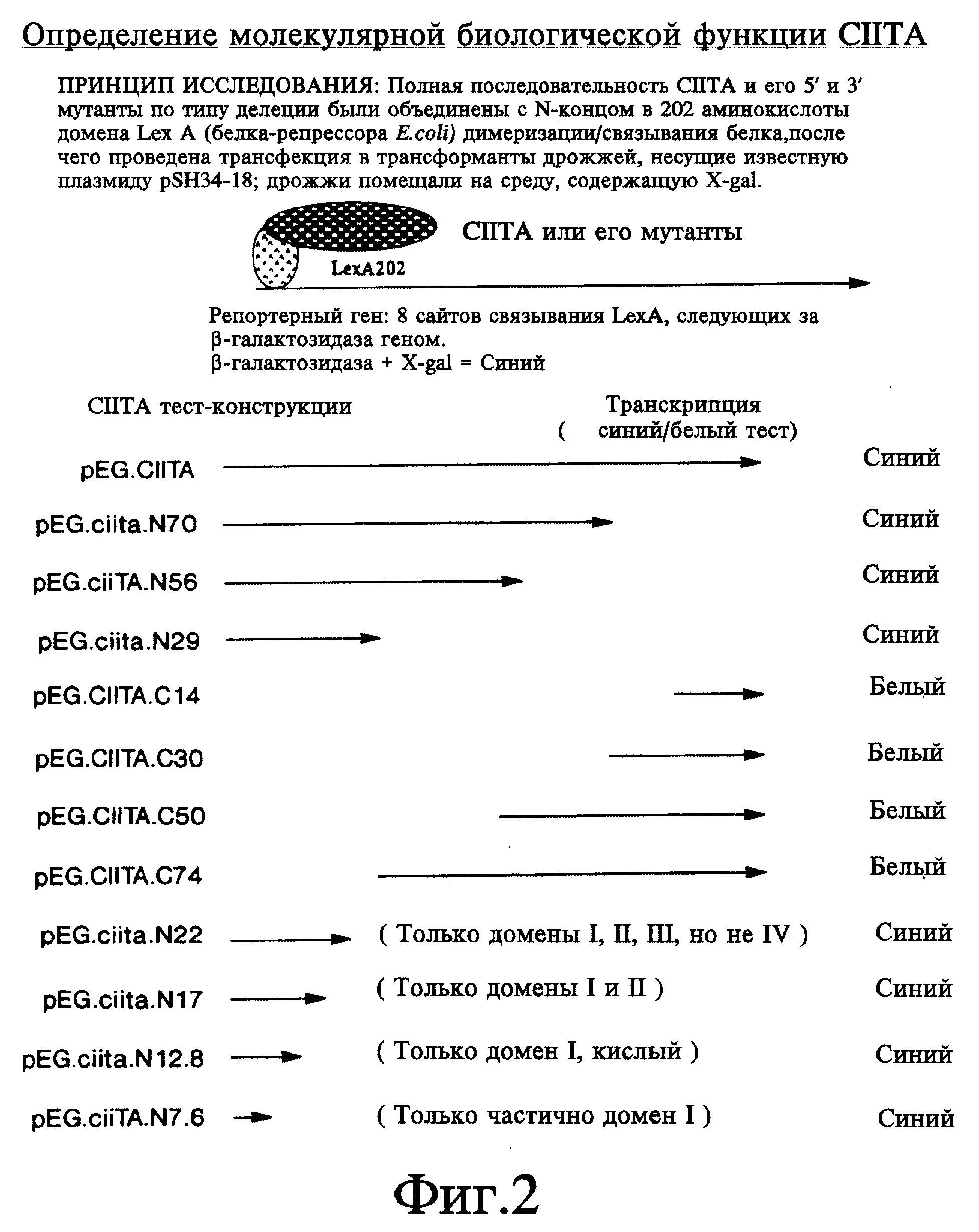
На фиг. 2 схематично представлены мутанты CIITA по типу делеции и метод in vivo, который применяется для идентификации доменов CIITA по активации транскрипции и взаимодействию. Результаты исследования транскрипции также суммированы здесь.
На фиг. 3 показана фотография клеток дрожжей, применявшихся для исследований транскрипции с целью идентификации доменов CIITA по активации транскрипции и взаимодействию.
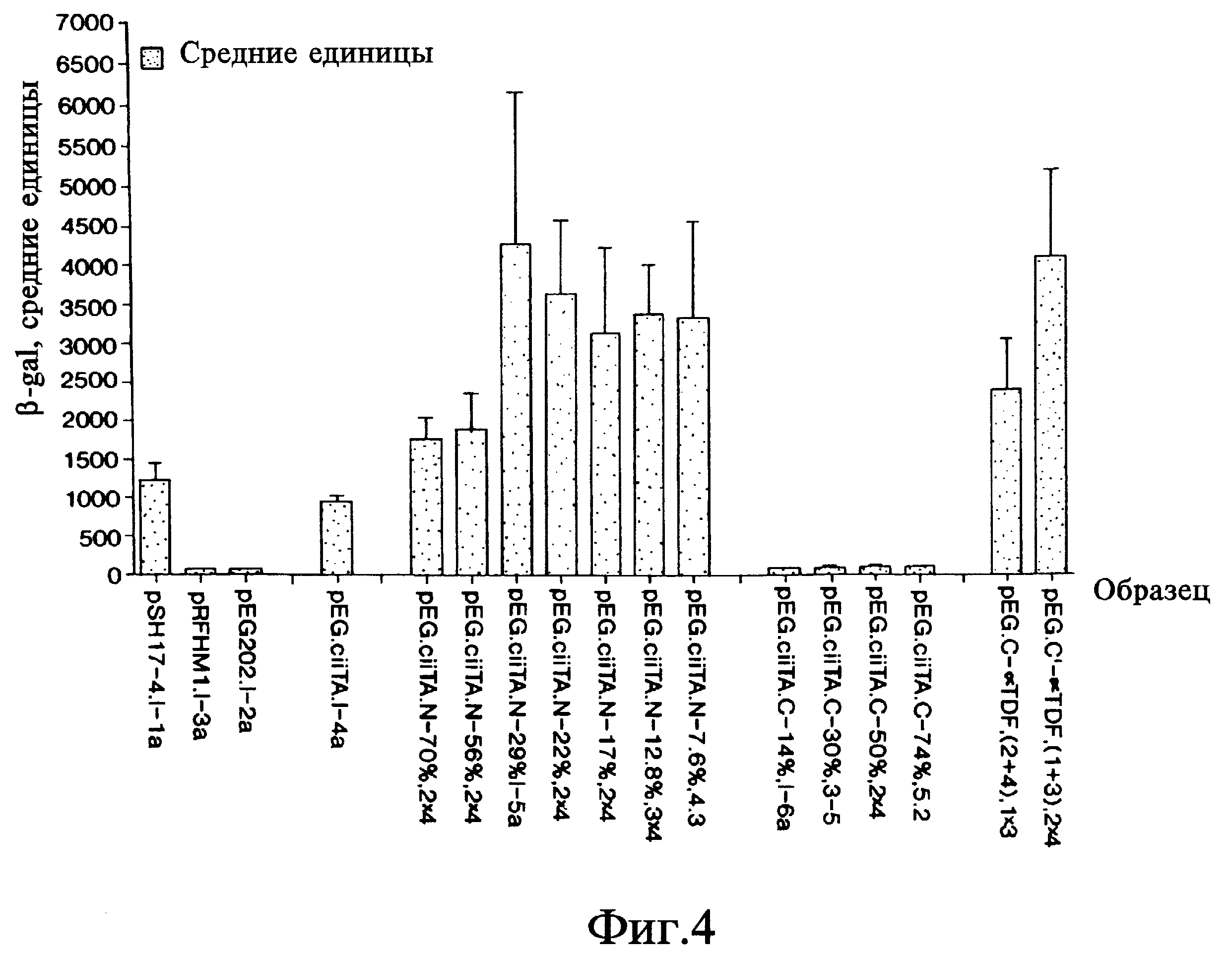
На фиг. 4 дана гистограмма, на которой показаны результаты, полученные при использовании колориметрического метода, применявшегося для измерения транскрипции гена lacZ для идентификации доменов CIITA активации транскрипции и взаимодействия.
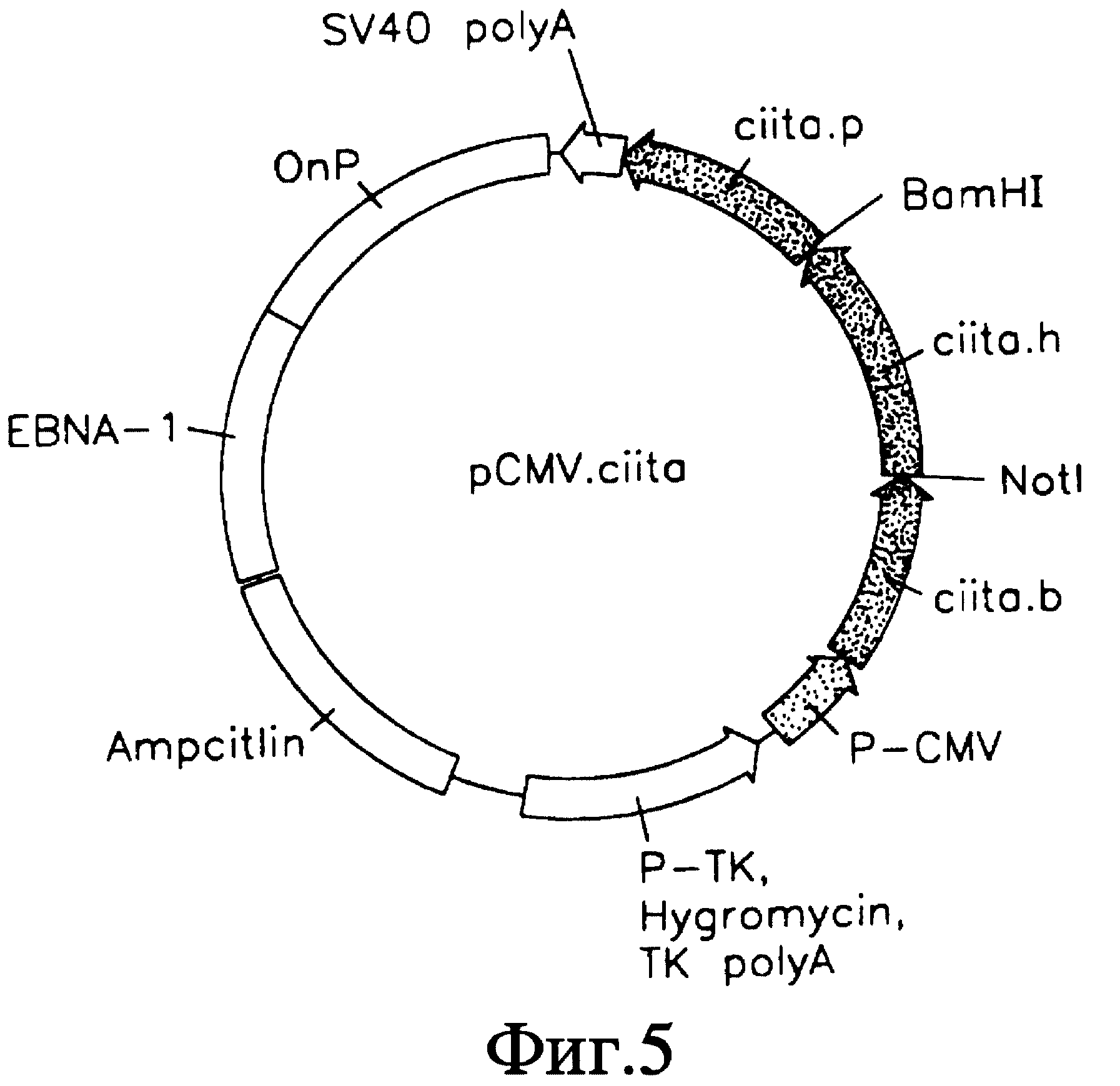
На фиг. 5 схематично представлена плазмида pCMV.ciita.
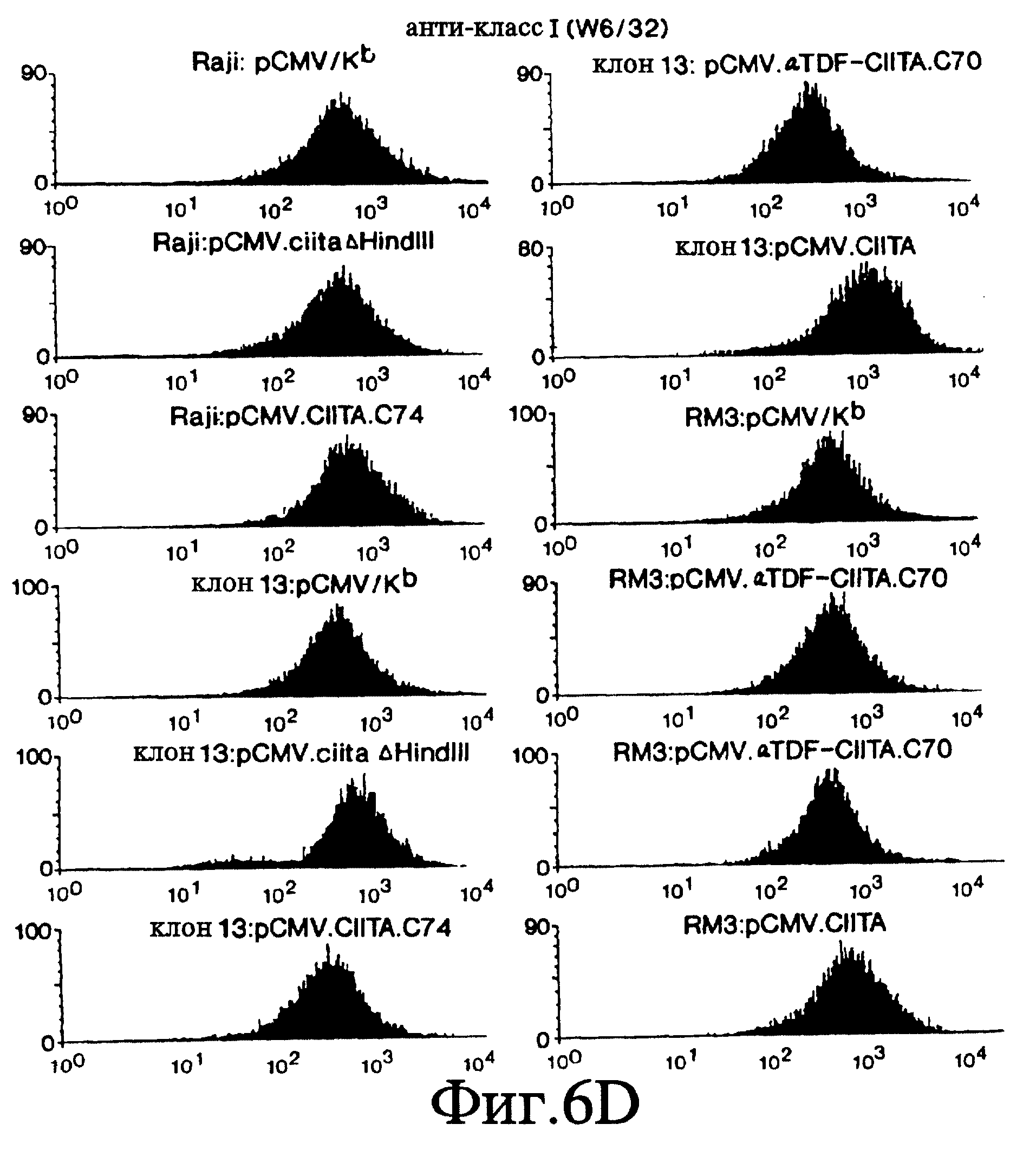
Фиг. 6 А-Е представляет серию FACS профилей, которые показывают, что экспрессия составного белка α- TDF/CIITA в клетках клона 13 и RM3 восстанавливает экспрессию ОТС генов класса II.
Фиг. 7 представляет серию FACS профилей, которые показывают, что экспрессия CIITA дикого типа в клетках клона 13 корректирует недостаточность в экспрессии изотипов DR и DP и увеличивает экспрессию DQ.
Фиг. 8 А-F схематично представляет плазмиды, описанные в данной работе.
Домен CIITA активации
транскрипции
В первую очередь мы обнаружили, что для активации транскрипции достаточно присутствия фрагмента CIITA без остаточных количеств белка CIITA и, с другой стороны, наличия полной
системы транскрипции. Мы полагаем, что данный сегмент является доменом CIITA по активации транскрипции. Для идентификации этого домена CIITA был сконструирован ряд плазмид (на базе вектора pEG202) с
целью получения составных белков, содержащих порции CIITA, соединенных с N-концевыми 202 аминокислотами ДНК-связывающего/димеризующего домена LexA - белка-репрессора E. coli. Способы конструирования
данных плазмид и других плазмид, описанных в данной работе, изложены далее под заглавием "Конструирование плазмид".
Клетки дрожжевого штамма EGY48 (his3- и ura3-) были затем поочередно трансформированы каждой из сконструированных плазмид LexA-CIITA и одновременно известной плазмидой (pSH 18-34), несущей lacZ. Экспрессия данных плазмид в дрожжах поддерживалась за счет экспрессии HIS3 гена, локализованного на плазмиде LexA-CIITA, и экспрессии гена URA3, локализованного на плазмиде pSH 18-34. Регуляторные последовательности плазмиды, несущей lacZ, включали 8 LexA сайтов связывания на участке GAL1, расположенных выше активирующих последовательностей (фиг. 2). В данном исследовании выполняющие роль ДНК-связывающих белков LexA полипептиды поставляют CIITA-полипептиды непосредственно к сайту транскрипции.
В отсутствии LexA составного белка клетки дрожжей, несущие плазмиду pSH18-34 репортерного гена, не образовывали фиксируемых количеств β- галактозидазы гена lacZ и оставались белыми на средах, содержащих X-gal (фиг. 3; pHRFM1, контроль отрицательный). Кроме того, дрожжи, несущие плазмиду, которая экспрессирует только LexA N-концевые 202 аминокислоты или составной белок, которые, как известно, не обладают способностью к транскрипции (pSH17-4), не могут вырабатывать фиксируемые количества β- галактозидазы. Напротив, штаммы дрожжей, обладающие LexA-полипептидом, слитым с CIITA-доменом активации транскрипции (примерно 29% N-конца), индуцировали синтез достаточно больших количеств β- галактозидазы по сравнению с исходными клетками дрожжей, и на средах, содержащих X-gal, появлялся синий пигмент (фиг. 3; pSH17-4, контроль положительный). Кроме того, количественные колориметрические исследования были выполнены путем измерения оптической плотности сред, содержащих составные белки и о-нитрофенил -β- галактозид (o-nitrophenyl -β-galactoside (ONPG); см. фиг. 4) (Ausubel et al., In: Current Protocols in Molecular Biology, J. Wiley & Sons, 1994). Наши данные также показали, что полипептид, в состав которого входит примерно 8% N-концевой области CIITA, способен активировать транскрипцию. В этой части CIITA содержится кислая часть домена активации транскрипции; при желании можно сравнить эксперименты, проведенные с использованием 29% и 8% N-конца. Полипептид, содержащий примерно 29% N-концевой области CIITA, активирует транскрипцию по меньшей мере также эффективно, как целый белок CIITA. Таким образом, аминокислоты с 26 по 352 и нуклеотиды в положении с 78 по 1056 от полной длины CIITA (см. фиг. 1) представляют домен активации транскрипции (эти номера соотносятся с CIITA-кодирующей последовательностью, начало которой отсчитывается от 116 нуклеотида CIITA кДНК последовательности (Steimle et al., infra)).
Применение домена CIITA активации транскрипции для идентификации лекарственных средств для лечения аутоиммунных заболеваний
CIITA-домен активации может применяться в способе определения веществ, ингибирующих CIITA-зависимую транскрипцию. Поскольку CIITA требуется для активации ОТС генов класса II, вещества, специфически
ингибирующие CIITA-зависимую транскрипцию, являются явными кандидатами для лечения аутоиммунных заболеваний. Наше открытие того факта, что фрагмент CIITA (обозначаемый как CIITA-домен активации
транскрипции) способен активировать транскрипцию в отсутствии остаточного CIITA-белка и в присутствии полной системы транскрипции, способствует идентификации веществ, которые ингибируют активацию
транскрипции, осуществляемую CIITA.
Полезные вещества определяются по их способности ингибировать CIITA-зависимую транскрипцию. С этой позиции можно тестировать вещество по ингибированию транскрипции в любой системе исследования транскрипции, в которой применяется CIITA-активирующий домен. Далее приводится пример анализа, который может быть применен для выявления веществ, ингибирущих CIITA-зависимую транскрипцию; вещества, идентифицированные таким способом, являются перспективными для лечения аутоиммунных заболеваний. Другие способы исследования (например, описанные Keegan et al., 1986, Science 23: 699; Ma et al., 1987, Cell 48: 847; Lin et al., 1988, Cell 54: 659; Sadowski et al., 1988, Nature 335: 563; Roberts et al., 1993, Nature 363: 741; и Ma et al., 1988, Cell 55: 443) могут быть модифицированы для того, чтобы применить домен CIITA активации транскрипции, который мы обнаружили. Домен CIITA активации транскрипции может быть клонирован обычным образом на подходящем векторе, и, таким образом, другие исследования транскрипции не исключаются из данного изобретения, границы которого очерчены далее в пунктах.
Пример 1. Определение веществ, способных ингибировать домен CIITA активации транскрипции.
Для определения полезных веществ в клетки дрожжей штамма-хозяина EGY48 (his3-, ura3- и leu-) были трансформированы две плазмиды. Первая плазмида, pSH 18-34, несет сайт начала транскрипции GAL1 ТАТА и сегмент GAL1, кодирующий последовательность, оперативно связанную с геном lacZ (Zervos et al., 1993, Cell 72: 223-232 и Gyuris et al., 1993, Cell 75: 791-803). Эта плазмида также несет 8 сайтов связывания для LexA на участке GAL1 впереди расположенных активирующих последовательностей, а также селективный маркер URA3.
Вторая плазмида, pEG.ciita. N 29, получена из исходной плазмиды pEG202 и несет последовательности, которые кодируют домен CIITA активации транскрипции. Эта плазмида также несет ген селективного маркера (HIS3) и ДНК-связывающий и димеризующий домены LexA (аминокислоты 1-202). В контрольных штаммах дрожжей второй плазмидой может быть плазмида pSH17-4 (Gyuris et al., 1993, Cell 75: 791-803), которая кодирует LexA, слитый с доменом активации транскрипции, например таким, как домен pHRFM1 или CDK2 (Zervos et al., 1993, Cell 72: 223-232 и Gyuris et al., 1993, Cell 75: 791-803).
Небольшое количество клеток штаммов дрожжей, подвергшихся двойной трансформации, смешивается с веществами, предназначенными для скрининга, и выращивается на подходящей среде (например, SGR, -his, -ura, + X-gal (80 мг/л)) в подходящих условиях (например, при 30oC в условиях встряхивания на протяжении ночи). Затем определяется количество синтезированного синего хромофора (например, путем измерения оптической плотности или путем оценки культур вручную). Вещества, ингибирующие активацию транскрипции тест-плазмидой (pEG. ciita.N29), но не контрольной плазмидой (pSH17-4), могут ингибировать экспрессию ОТС молекул класса II, и, следовательно, очевидно являются перспективными для терапии аутоиммунных заболеваний.
Домен
CIITA-взаимодействия
Описанный выше делеционный анализ также показал, что полипептид, имеющий в составе аминокислоты 1-26 и 301-1130 (нуклеотиды 1-78 и 903-3390) от полной последовательности
CIITA, один не активирует транскрипцию (фиг. 1-3). Поскольку этот домен не способен к активации транскрипции без домена активации транскрипции (производного от CIITA или иного активатора транскрипции),
мы пришли к выводу, что этот домен принимает участие в транскрипции за счет связывания с другим компонентом клеточного механизма транскрипции (например, полимеразой или ДНК-связывающим белком).
Соответственно аминокислоты 301-1130 (74% с C-конца) CIITA были названы CIITA-доменом взаимодействия. Хотя CIITA-домен взаимодействия не может один активировать транскрипцию, вещества, ингибирующие
связывание домена взаимодействия с его нормальным клеточным белком-мишенью, пригодны для ингибирования транскрипции CIITA и, следовательно, могут оказаться пригодными для лечения аутоиммунных
заболеваний.
Применение домена CIITA-взаимодействия для восстановления экспрессии генов ОТС класса II.
Чтобы доказать, что последовательность аминокислот 301-1130 заключает в себе домен CIITA-взаимодействия, мы исследовали способность этого фрагмента CIITA восстанавливать экспрессию генов ОТС класса II в линиях мутантных клеток, утративших способность экспрессировать эти гены. В этих исследованиях мы использовали плазмиду pCMV.ciita (фиг. 5) для того, чтобы сконструировать плазмиду pCMV.αTDF-CIITA.C70, которая создает составной белок домена взаимодействия CIITA и домена активации транскрипции фактора α- трансдукции вируса простого герпеса (Herpes Simplex Virus - HSV) штамма F. В качестве отрицательного контроля была создана плазмида pCMV.CIITA.C74, в которой был подвергнут делеции CIITA-домен активации транскрипции. В качестве второго отрицательного контроля использовалась плазмида pCMV.ciitaΔHindIII, которая кодирует CIITA-домен активации транскрипции при отсутствии домена взаимодействия. В качестве контроля эффективности трансфекции клетки были подвергнуты трансфекции pCMV/Kb. В качестве положительного контроля клетки были подвергнуты трансфекции pCMV.ciita, полностью кодирующей CIITA. Эти плазмиды были независимо друг от друга введены в В-клетки человекa. Одна из линий В-клеток, RM3, недостаточна по экспрессии изотипов DR, DP и DQ. Вторая линия В-клеток, клон 13, недостаточна по экспрессии DR и DP, но не DQ. Третья линия клеток, Raji, экспрессирует три гена ОТС класса II на уровне экспрессии дикого типа. Клетки каждой линии окрашивались с помощью стандартных методов антителами к DR (LB3.1), DQ (SPV.L3, которые эквивалентны Genox.53), DP (B7/21), молекул класса I (W6/32) или Кb (Y-3) и затем исследовались путем сортировки флуоресцентно-активированных клеток (fluorescence activated cell sorting - FACS; фиг. 6). Эти данные показывают, что экспрессия α - TDF/CIITA-домена взаимодействия составного белка в В-клетках млекопитающих восстанавливает экспрессию ОТС генов класса II на поверхности клеток мутантных линий. Таким образом, аминокислоты в положении 301-1130 CIITA могут действовать как домен взаимодействия.
Пример 2. Исследование с помощью клеток веществ, являющихся ингибиторами домена взаимодействия.
Охарактеризованный выше способ может быть модифицирован с целью создать метод определения, является ли данное вещество ингибитором CIITA-зависимой транскрипции. Согласно этому способу тестируемое вещество просто добавляется к культуре клеток, подвергшихся трансфекции. Вещество, ингибирующее способность составного белка α-TDF/CIITA восстанавливать экспрессию ОТС молекул класса II на поверхности клеток, возможно, является терапевтическим средством для лечения аутоиммунных заболеваний. Такой метод также позволяет идентифицировать вещества, которые являются ингибиторами транскрипции, специфическими по изотипу. Например, вещество, которое вызывает с помощью составного белка α-TDFFF/CIITA восстановление экспрессии только у подгруппы генов ОТС класса II, является специфичным по изотипу ингибитором. Такое вещество обоснованно можно pаcсматривать как потенциальное средство, излечивающее аутоиммунное заболевание, поскольку оно обеспечивает селективное ингибирование транскрипции ОТС генов класса II. Изложенный выше метод, базирующийся на использовании клеток, может применяться один или в сочетании со способом, описанным далее, в котором задействовано два составных белка.
CIITA-взаимодействующий белок-мишень
В других исследованиях вещество, ингибирующее CIITA-зависимую транскрипцию, также может быть идентифицировано посредством
его способности ингибировать связывание CIITA-домена взаимодействия с его белком-мишенью в клеточном механизме транскрипции. Теперь мы обнаружили, что функцией аминокислот в положении 301-1130 CIITA
является посредничество в транскрипции за счет связывания с другим белком (белками) (называемым в данной работе белком-мишенью (или белками-мишенями)) в клетке, CIITA белок-мишень может быть быстро и
удобно клонирован путем использования широко распространенной техники клонирования, известной как ловушка взаимодействия. Как показано далее, модификация ловушки взаимодействия может применяться для
идентификации веществ, ингибирующих связывание CIITA-взаимодействующего домена с его белком-мишенью; такие вещества могут быть лекарственными препаратами в терапии аутоиммунных заболеваний. Вкратце
ловушка взаимодействия обеспечивает домен взаимодействия белка и активирующий домен второго белка для быстрого и легкого определения белка-мишени, с которым ассоциируется домен взаимодействия.
Белок-мишень препятствует домену взаимодействия принимать участие в транскрипции репортерного гена; транскрипция может исследоваться, как описано в infra. Применяя данную систему и CIITA-домен
взаимодействия, который мы открыли, белок-мишень CIITA-домена взаимодействия может быть клонирован легко и быстро. Здесь изложено описание клонирования белка-мишени CIITA и использование CIITA-домена
взаимодействия для идентификации потенциальных лекарственных средств для терапии аутоиммунных заболеваний.
Пример 3. Kлонирование CIITA-взаимодействующего белка-мишени.
Для того чтобы клонировать белок-мишень CIITA-домена взаимодействия, в клетки хозяина (например, клетки дрожжей штамма EGY48) трансформировали первую плазмиду, которая кодирует первый составной белок. Первый сборный белок включает в себя ДНК-связывающий белок (например, 202 аминокислоты LexA с N-конца), соединенный с CIITA-доменом взаимодействия без CIITA-домена активации. Дрожжевые клетки также несут репортерный ген (например, lacZ, CAT, GUS, гормона роста человека, щелочной фосфотазы или люцеферазы), который оперативно связан с регуляторной последовательностью, с которой связан первый составной белок. Репортерный ген может быть локализован на плазмиде или на хромосоме. Кроме того, дрожжевая клетка трансформируется плазмидой, которая кодирует второй составной белок. Второй составной белок включает домен активации транскрипции белка (например, B42 кислый домен активации (Ma et al. , 1988, Cell 55: 443-446)), объединенный с тестируемым полипептидом, который исследуется на способность участвовать в транскрипции репортерного гена, как описано в infra. Полипептид, препятствующий транскрипции репортерного гена, является белком-мишенью CIITA-домена взаимодействия. Молекулы ДНК, кодирующие потенциальный белок-мишень, получены из библиотеки (библиотека кДНК, приготовленная из poly(А) РНК, полученной из В-клеток лимфосаркомы Беркитта, Raji). В контрольных исследованиях CIITA-домен взаимодействия замещен доменом взаимодействия другого белка (например, pHRFM1 или CDK2 (Zervos and Gyuris, infra)).
Пример 4. Использование CIITA-домена взаимодействия для идентификации лекарственных средств для лечения аутоиммунных заболеваний.
Вещества, ингибирующие транскрипцию путем вмешательства в CIITA-домен взаимодействия, могут быть идентифицированы путем изучения их способности ингибировать связывание CIITA-домена взаимодействия с белком-мишенью. Может быть использован любой метод, определяющий взаимодействия по типу белок-белок, для идентификации веществ, которые при добавлении в ходе анализа ингибируют межбелковое взаимодействие. Например, исследования, базирующиеся на ELISAs, блоттинге по Саузерну, фильтр- и мембранно-связывающих белках и иммобилизованных белках, относятся к тем способам, которые могут быть применены для определения ингибирования связывания CIITA-взаимодействующего домена с его белком-мишенью. В дальнейшем приводится подробное описание примера идентификации веществ, ингибирующих действие CIITA-домена взаимодействия, и, следовательно, являющихся потенциальными лекарственными средствами для терапии аутоиммунных заболеваний.
В одном предпочитаемом способе клетки хозяина (например, дрожжевые клетки штамма EGY48) трансформируются первой плазмидой, которая кодирует первый составной белок. В состав первого составного белка входит ДНК-связывающий белок (например, N-конец LexA из 202 аминокислот), объединенный с CIITA-доменом взаимодействия без CIITA-домена активации. Клетки дрожжей также несут известный ген (например, lacZ, CAT, GUS, гормона роста человека, щелочной фосфотазы или люциферазы), оперативно связанный с регуляторной последовательностью, к которой присоединяется составной белок. Репортерный ген может быть расположен на плазмиде или хромосоме. Кроме того, в дрожжевые клетки трансформируется плазмида, несущая второй составной белок. Второй составной белок включает в себя домен активации транскрипции белка (например, B42), объединенный с белком-мишенью CIITA-домена взаимодействия.
Полезные вещества выявляются по их способности ингибировать транскрипцию репортерного гена в данном исследовании. Небольшие количества трансформированных клеток смешивали с тестируемыми веществами и выращивали на среде, пригодной для осуществления экспрессии плазмид, и в благоприятных условиях (например, при 30oC в условиях встряхивания в течение ночи). Уровень экспрессии гена измеряли. Например, если в качестве репортерного гена был выбран lacZ ген, может быть измерено количество синего хромофорного пигмента, образовавшегося в присутствии X-gal (например, путем измерения оптической плотности или оценкой интенсивности окраски клеточной культуры без использования инструментов). Вещества, ингибирующие активацию транскрипции в исследованиях, где используется CIITA-домен взаимодействия, но не контролирующие домен взаимодействия, могут ингибировать экспрессию молекул ОТС класса II, и, таким образом очевидно, что эти вещества могут быть лекарственными средствами для терапии аутоиммунных заболеваний. Такой анализ может проводиться без дополнительных исследований или быть скомбинированным с исследованиями на основе клеток, описанных в примере 2.
Идентификация мутанта
CIITA клона 13
Мы идентифицировали мутацию CIITA, которая изменяет способность белка активировать транскрипцию некоторых изотипов ОТС класса II. Этот мутант CIITA, названный клон 13 CIITA,
присутствует в клетках линии клона 13, которая является производной от В-клеток лимфомы человека, Jijoye (получен от L.Glimcher, Harvard University, МА). CIITA клона 13 дефектен в транскрипции
изотипов DR и DP, но не DQ ОТС генов класса II. Мы обнаружили, что экспрессия CIITA гена дикого типа в клетках клона 13 препятствует транскрибированию в клетках изотипов DR и DP. В этих исследованиях
ген CIITA был клонирован в составе вектора pCMV, и получившийся вектор pCMV.ciita (фиг. 5) затем был трансфецирован с помощью электропорации в клетки клона 13.
Трансфецированные клетки анализировались FACS для определения экспрессии DR и DP изотипов (фиг. 7). В качестве контроля аналогичным образом были исследованы клетки Raji (которые экспрессируют DR, DP и DQ изотипы), а также нетрансформированные клетки клона 13. Использовались стандартные способы окрашивания клеток с применением антител. Помимо обработки клеток анти-DR (LB3.1; L243 антитела от Becton-Dickinson также могут использоваться), анти-DQ (Genox.53; АТСС #НВ103) или анти-DP (В7/21; Becton-Dickinson) антителами, клетки окрашивались также с использованием антител антиклассa I (W6/32: положительный контроль, АТСС #НВ95) и анти-Kb антитела (Y-3: отрицательный контроль, АТСС #НВ176). Согласно фиг. 7 экспрессия CIITA в клетках клона 13 увеличивает соответствующую флюоресценцию этих клеток после окрашивания анти-DP, анти-DR или анти-DQ антителами. Таким образом, экспрессия CIITA дикого типа в клетках клона 13 корректирует недостаточность мутанта CIITA клона 13.
Пример 5. Идентификация веществ, специфичных по изотипу.
Домен взаимодействия мутанта CIITA клона 13 может быть использован
в исследованиях, описанных в примере 4 для идентификации веществ,
являющихся специфичными по изотипу ингибиторами CIITA-зависимой транскрипции. При желании домен активации транскрипции CIITA клона 13 или полипептид целиком могут быть использованы в других
исследованиях для определения полезных веществ. Вещества, ингибирующие CIITA-зависимую транскрипцию, включая CIITA дикого типа, но не мутант CIITA клона 13, пригодны для ингибирования экспрессии DR и
DP ОТС изотипы класса II без ингибирования экспрессии изотипа DQ. Такие вещества специфичны по изотипу и могут быть использованы для ингибирования экспрессии отдельных генов, участвующих в выработке
иммунного ответа, без возникновения общей иммуносупрессии. Поскольку многие аутоиммунные заболевания, такие как ревматоидный артрит (см. табл. 1 и 2), ассоциированы с отдельными изотипами, вещества,
способные ингибировать экспрессию подгруппы генов ОТС класса II, являются весьма ценными для избирательного воздействия на иммунную систему.
Другие воплощения находятся в рамках изложенных далее пунктов, например домены активации и взаимодействия мутантов CIITA, специфичных по изотипу, помимо клона 13 CIITA в данном изобретении. Мутанты CIITA, специфичные по изотипу, могут быть идентифицированы, как описано выше для клона 13 CIITA. Линии клеток, дефектные в экспрессии подгруппы генов ОТС класса II, являются перспективными источниками специфичных по изотипу белков CIITA. Линия клеток, содержащая специфичный по изотипу CIITA, может быть определена путем экспрессии CIITA дикого типа в исследуемой линии клеток и определения, является ли экспрессия CIITA корректирующим обстоятельством для недостаточности экспрессии ОТС гена (генов) класса II. Мутантный ген CIITA может быть клонирован с использованием методик, описанных для клона 13 CIITA. Так, методы, представленные в примере 5, могут быть использованы для выделения других CIITA мутантов, специфичных по изотипу, которые могут быть использованы для определения, является ли вещество специфичным по изотипу ингибитором транскрипции.
Также в изобретении присутствуют дополнительные методы исследования CIITA-зависимой транскрипции. Например, ранее описанные методы анализа транскрипции (см., например, Keegan et al., 1986, Science 23: 699; Ma et al. , 1987, Cell 48: 847; Lin et al., 1988, Cell 54: 659; Sadowski et al., 1988, Nature 335: 563; Roberts et al., 1993, Nature 363: 741; Ma et al., 1988, Cell 55: 443) могут при соответствующей замене CIITA-домена активации транскрипции использоваться для идентификации полезных веществ путем простого добавления веществ в реакцию. Кроме того, модификации вышеописанного исследования могут быть использованы в данном изобретении. Например, другие ДНК-связывающие белки, такие как GAL4, могут использоваться вместо LexA. Репортерные гены, такие как ген хлорамфениколацетилтрансферазы (CAT), люциферазы, β- глюкуронидазы (GUS), гормона роста человека, щелочной фосфотазы или любые другие гены, чья экспрессия может быть исследована, могут заменить lacZ ген. Помимо дрожжей также могут использоваться другие клетки, например, клетки прокариотов или других эукариотов (например, бактериальные, клетки млекопитающих или растений). Способы определения межбелковых взаимодействий, такие, как исследования, базирующиеся на ELISAs, блоттинге по Саузерну, фильтр- и мембранно-связанных белках также могут быть использованы для идентификации веществ, которые ингибируют связывание CIITA-домена взаимодействия с его белком-мишенью. Очевидно, что стандартные методы молекулярной биологии позволят использовать CIITA-домен взаимодействия в других исследованиях межбелковых взаимодействий.
Конструирование плазмид
Исходные матрицы CIITA были получены с помощью полимеразной цепной реакции с обратной транскрипцией
(reverse transcription-polymerase chain reaction - RT-PCR (ОТ-ПЦР)) с poly(A) РНК, выделенной из HLA класса II положительных лимфоидных В-клеток линии Raji. Продукты полимеразной цепной реакции были
затем непосредственно клонированы в pCRII (Invitrogen). Среди полученных клонов три (pCRII.ciita.b, pCRII.ciita.h и pCRII.ciita.p) были использованы для создания полной конструкции эукариотической
экспрессированной кДНК (см. фиг. 5 и 8).
pCRII. ciita.b: CIITA-специфичные праймеры ПЦР, использовавшиеся для создания этой плазмиды, были для 5' конца 5'-GGAAGCTGAGGGCACGAGGAG-3' и для 3' конца - 3'-САGААGАGАСАGGGGАСGGТААС-5'.
pCRII. ciita.h: CIITA-специфичные праймеры ПЦР, использовавшиеся для создания этой плазмиды, были для 5' конца 5'-CTCCAACAAGCTTCCAAAATG-3' и для 3' конца - 3'- GTACAAGAGACTCCTGTGATTG-5'.
pCRII. ciita.p: CIITA-специфичные праймеры ПЦР, использовавшиеся для создания этой плазмиды, были для 5' конца 5'-GTCCCTGAAGGATGTGGAAGAC- 3' и для 3' конца - 3'-GTCTGACCTTCGTGTCGAAG-5'.
pCMV. ciita: данная плазмида была создана путем многоступенчатого субклонирования с использованием в качестве вектора pLB-1 и в качестве вставок pCRII. ciita. b, pCRII. ciita.h и pCRII.ciita.p. Первоначально для создания вектора ДНК pLB-1 разрезалась рестриктазой HindIII, обрабатывалась полимеразой T4 с последующим расщеплением, вызванным Notl: вставка ДНК CIITA с 5' конца была сделана с помощью обработки pCRII.ciita.b рестриктазой EcoRI по сайтам, прилегающим к вставке, полученной с помощью ПЦР, в pCRII конструкциях, очистки в геле более мелкого фрагмента, обработки полимеразой T4 с последующим расщеплением, вызванным с помощью Notl (Notl при нуклеотиде 1340 в последовательности CIITA). Эти два фрагмента лигировались лигазой T4, а полученная в результате дочерняя по отношению к pCMV.ciita плазмида была названа pCMV.ciita.b.
pCMV.ciita.b в дальнейшем была подвергнута обработке рестриктазой BamHI, и меньший по размеру фрагмент очищен в геле, однонитевые концы застроены T4 полимеразой с последующим расщеплением, вызванным Notl. pCRII.ciita.p была разрезана аналогичным образом рестриктазой EcoRI, однонитевые концы застроены T4 полимеразой с последующим расщеплением, вызванным Notl. Меньший по размеру фрагмент был очищен в геле и использовался. Вектор и встраиваемые фрагменты были лигированы лигазой T4, и полученная в результате вторая дочерняя по отношению к pCMV.ciita плазмида была названа pCMV.ciita.bp.
pCMV. ciita. bp в дальнейшем обрабатывалась BamHI и Notl; pCRII.ciita.h также разрезалась BamHI и Notl, и меньший фрагмент прошел гель-очистку. Эти два фрагмента сшивались лигазой T4, и полученная в результате плазмида, содержащая CIITA кДНК последовательности (нуклеотиды 48-4471), названа pCMV. ciita.bp.
pCMV. CIITA: эта плазмида была создана после того, как уже была сделана плазмида pCMV.ciita и получено подтверждение ее биологической функции в восстановлении общей экспрессии HLA классa II (путем трансфекции отрицательных по HLA классу II клеток, относящихся к линиям RM3 и клону 13, и анализa FACS). Сконструированная CIITA кДНК, называемая pKS/CIITA (+) (полученная от доктора В. Mach, University of Geneva: Geneva, Switzerland), также использовалась в этой работе. В этой плазмиде был вектор pBluescript KS (+) (Stratagene), и кДНК была вставлена в Sall сайт многократно клонируемого сайта. Для того чтобы создать плазмиду pCMV.CIITA, плазмида pCMV была расщеплена с помощью Xhol и Nhel, и фрагмент CIITA кДНК был получен путем разрезания pKS/CIITA рестриктазами Xhol и Spel, которые имеют сайты распознавания, примыкающие к концам вставки кДНК. Два фрагмента были лигированы лигазой T4, и полученная плазмида была названа pCMV.CIITA (заглавные буквы показывают, что источником ДНК послужила исходная библиотека кДНК).
pEG. CIITA: эта плазмида была создана с использованием pEG.CIITA.Sall и pTrc. CIITA. pEG. CIITA. Sall обрабатывалась рестриктазой BamHI, и наиболее крупный фрагмент прошел гель-очистку; последовательность CIITA была получена при обработке pTrc.ciita рестриктазой BamHI, после чего вектор и вставка были сшиты лигазой T4.
pEG. CIITA. Sall pEG202 была первоначально переведена в линейную форму с помощью рестриктазы Sall и дефосфорилирована CIP; CIITA кДНК была получена из pCMV. CIITA после обработки рестриктазой Sall; затем вектор и фрагмент-вставка были лигированы, и сконструированная pEG плазмида со вставкой CIITA кДНК была названа pEG.CIITA.Sall.
pTrc. ciita: первоначально данная плазмида была получена от сверхэкспрессии рекомбинантного белка CIITA. В первую очередь была клонирована 5'-последовательность CIITA (с использованием ПЦР тем же способом, что и описанное далее конструирование pEG. ciita.N 29) по сайту BamHI и сайту Xhol pTrcHisC (Invitrogen). Получившаяся плазмида, названная pTrc5 или pTrc/ciita5, была переведена в линейную форму с помощью Xhol, однонитевые концы застроены полимеразой T4 и активирована DraIII; нижерасположенные 3790 пар оснований CIITA были получены при обработке pCMV.ciita рестриктазами Scal и DraIII, и два фрагмента были лигированы.
pEG. ciita.N29: пара праймеров ПЦР была созданa с целью слить N-концевой фрагмент CIITA, содержащий 29% N-конца in frame, с pEG202 после 202-го кодона - N-терминатора транскрипции LexA. Последовательность удаленного, 5', праймера: AATGGATCcgttgcctggctcca (заглавные буквы означают ДНК-маркирующую последовательность, которая включает сайт BamHI для клонирования in frame): последовательность ближнего, 3', праймера: CCGCTCGAGcggcaccatacgtgt (ДНК-маркирующая последовательность включает сайт Xhol). Эти праймеры были использованы вместе с полной по длине матрицей CIITA кДНК в полимеразной цепной реакции (ПЦР) для получения фрагмента в 1060 пар оснований. Профили ПЦР снимались трижды при 95oC 5 мин, при 55oC 5 мин и при 72oC в течение 3 мин; последующие 30 циклов по 1 мин при 95oC, 60oC в течение 2 мин и при 72oC в течение 1 мин. Получившийся фрагмент ДНК расщеплялся BamHI и Xhol и клонировался по соответствующим BamHI и Xhol сайтам в векторе pEG202. Терминальный кодон для этого составного белка представлен векторной последовательностью, следующей за сайтом Xhol в плазмиде pEG202.
pCMV и pLB-1: плазмида pCMV является EBV сверхэкспрессирующим вектором, полученным за счет частичного гидролиза pREP7 (Invitrogen) рестриктазой Sall; вставка BgIII линкера по второму сайту Sall (nt.1091) после его однонитевого застраивания с использованием фрагмента Кленова; двойной гидролиз HindIII и BgIII; и в заключениe лигирование с CMV фрагментом промотора, принадлежащего pCDM8 (Invitrogen), который был приготовлен путем расщепления pCDM8 рестриктазой Spel; заполнение с использованием фрагмента Кленова: вставка линкера BgIII; расщепление HindIII и BgIII и гель-очистка. Вектором, использовавшимся для создания первой субконструкции ciita (прописные буквы указывают на то, что конструкция была получена с помощью ПЦР), была плазмида pLB-1, полученная из pCMV за счет вставки "лишнего" фрагмента ДНК между сайтами HindIII и Notl для того, чтобы облегчить HindIII/Notl двойное расщепление.
pEG. CIITA.C74: плазмида pEG202 была переведена в линейную форму рестриктазой BamHI, однонитевые концы застроены полимеразой T4, и плазмида активирована Sall; вставка была сделана при обработке pCMV.CIITA рестриктазой Sphl, однонитевые концы застроены полимеразой T4, и вставка активирована Sall; затем два фрагмента были лигированы.
pEG. CIITA.CSO: плазмида pEG202 была переведена в линейную форму рестриктазой EcoRI, однонитевые концы застроены полимеразой T4, и плазмида активирована Sall; вставка была приготовлена при обработке pCMV.CIITA Ncol, однонитевые концы застроены полимеразой T4, и вставка активирована Sall; затем оба фрагмента лигировались.
pEG. CIITA.C30: плазмида pEG202 была переведена в линейную форму рестриктазой BamHI, однонитевые концы застроены полимеразой T4, и плазмида активирована Sall: вставка была приготовлена путем обработки pCMV.CIITA рестриктазой Kpnl, однонитевые концы застроены полимеразой T4, и вставка активирована с помощью Sall: затем оба фрагмента были лигированы.
pEG. CIITA.C14: плазмида pEG.CIITA была полностью разрезана рестриктазой BamHI, разбавлена и лигирована. Применяя стандартные методы, была выделена повторно закольцованная структура, которая содержит CIITA ORF N-14%.
pEG. ciita.N70: плазмида pEG202 была переведена в линейную форму рестриктазой Xhol, однонитевые концы застроены полимеразой T4, и плазмида активирована BamHI. Вставка была приготовлена путем обработки pEG.ciiTA рестриктазой Kpnl, однонитевые концы застроены полимеразой T4, и вставка активирована BamHI: затем два фрагмента были лигированы. pEG.ciiTA, конструкция для сверхэкспрессии CIITA, была создана клонированием CIITA открытой рамкой считывания, как при конструировании pEG.ciiTA (см. выше), в составе рЕТ28с (Novagen).
pEG. ciita.N56: плазмида pEG202 была переведена в линейную форму рестриктазой Xhol, однонитевые концы застроены полимеразой T4, и плазмида активирована BamHI. Вставка была приготовлена путем обработки pEG.ciiTA рестриктазой Sfil, однонитевые концы застроены полимеразой T4, и вставка активирована BamHI; затем два фрагмента были лигированы.
pEG. ciita. N22: вставка была получена путем обработки рестриктазой BanI ciita-содержащего Nhel/Xhol фрагмента pTrc5, однонитевые концы застроены полимеразой T4, и вставка разрезана BamHI. Вектор был приготовлен переводом в линейную форму pEG202 рестриктазой Xhol, однонитевые концы застроены полимеразой T4, и в итоге вектор был разрезан рестриктазой BamHI. Приготовленные вставка и вектор затем были лигированы.
pEG. ciita. N17: вставка была получена путем обработки рестриктазой Eael Nhel/Xhol фрагмента pTrc5 маленького размера, однонитевые концы застроены полимеразой T4, и в итоге вставка разрезана BamHI. Вектор был приготовлен переводом в линейную форму pEG202 рестриктазой Xhol, однонитевые концы застроены полимеразой T4, и в итоге разрезан рестриктазой BamHI. Приготовленные вставка и вектор затем были лигированы.
pEG. ciita. N12: вставка была получена путем обработки рестриктазой Mspl маленького фрагмента Nhel/Xhol плазмиды pTrc5, однонитевые концы застроены полимеразой T4, и в итоге вставка была разрезанa BamHI. Вектор был приготовлен переводом в линейную форму pEG202 рестриктазой Sall, однонитевые концы застроены полимеразой T4, и в итоге вектор был разрезан рестриктазой BamHI. Приготовленные вставка и вектор затем были лигированы в рамке.
pEG.ciita.N7.6: вставка была получена путем обработки рестриктазой EcoNI маленького фрагмента Nhel/Xhol плазмиды pTrc5, однонитевые концы застроены полимеразой T4, и в итоге вставка разрезана BamHI. Вектор был приготовлен переводом в линейную форму pEG202 рестриктазой Xhol, однонитевые концы застроены полимеразой T4, и в итоге вектор разрезан рестриктазой BamHI. Приготовленные вставка и вектор затем были лигированы.
pEG. C-αTDF: данная плазмида была сконструирована путем включения в состав плазмиды pEG202 16% С-конца HSV1 (штамм F) α-трансдуцирующий фактор (Pellet et al., 1985, PNAS 82: 5870-5874; номер по каталогу K03350).
pEG. C'-αTDF: данная плазмида была сконструирована путем включения 16% с С-конца (за исключением трех самых концевых кодонов) HSV1 (штамм F) α-трансдуцирующий фактор. Вставка в данной плазмиде позднее была использована при конструировании плазмиды pCMV.αTDF-CIITA.C70.
pCMV. ciitaΔHindIII: данная плазмида содержит 29% CIITA с N-конца ORF и создавалась обработкой pCMV.clita рестриктазой HindIII и очисткой основной полосы с последующей рециклизацией.
pCMV. CIITA. C74: в этой плазмиде содержится 25 кодонов от N-конца и примерно 74% от С-конца ORF CIITA. Это было достигнуто многоступенчатым субклонированием. Первоначально pKS/CIITA(+) была обработана рестриктазой Ncol, однонитевые концы застроены полимеразой T4, и затем как вектор разрезана Xhol. Параллельно проводилась обработка рестриктазой SphI, однонитевые концы застроены полимеразой T4 и затем как вставка разрезана Xhol. Два фрагмента были лигированы полимеразой T4, и получившаяся плазмида была названа pKS.CIITAΔN/S. Для создания плазмиды pCMV.CIITA.C74 с помощью рестриктаз Spel и Xhol была разрезана pKS.CIITAΔN/S, и фрагмент, содержащий CIITA, затем был вставлен в вектор pCMV, разрезанный Nhel/Xhol.
pCMV. αTDF-CIITA. C70: плазмида сконструирована многоступенчатым субклонированием. Первоначально pKS/CIITA(+) расщеплялась Tth111I, однонитевые концы застраивались полимеразой T4 и затем сшивались лигазой T4. Эта промежуточная конструкция, которая была названа pKS/CIITAΔTth, в дальнейшем расщеплялась рестриктазами Ncol и Aatll, однонитевые концы застраивались полимеразой T4, и лигирована in frame с фрагментом, который кодирует 16% С-конца (за исключением трех крайних кодонов на С-конце) HSV1 (штамм F) α-трансдуцирующий фактор. Вторая промежуточная конструкция была названа pKST/α TDF-CIITA.ΔTth. Notl фрагмент, содержащий 5' αTDF-CIITA, затем был использован для перемещения соответствующего 5'Notl фрагмента плазмиды pKS/CIITA(+). Эта третья промежуточная конструкция была названа pKS/αTDF-CIITA.C70. Для создания pCMV.αTDF- CIITA.C70 расщеплялась pKS/αTDF-CIITA.C70 рестриктазами Spel и Xhol. Фрагмент, содержащий αTDF-CIITA, затем был вставлен по месту расщепления Nhel/Xhol вектора pCMV.
Список последовательностей приведен в конце описания.
Реферат
Описаны способы идентификации веществ, которые ингибируют активацию транскрипции СIIТА и, таким образом, ингибируют экспрессию генов ОТС класса II. Такие вещества могут воздействовать на индукцию иммунного ответа. В способах применяются домены активации и взаимодействия специфичных по изотипу белков СIIТА, что позволяет идентифицировать вещества, являющиеся специфичными по изотипу ингибиторами транскрипции, которые можно использовать для селективного воздействия на иммунную систему. Кроме того, описаны высокоочищенные полипептиды, а также высокоочищенные ДНК, кодирующие эти полипептиды. Изобретение обеспечивает возможность идентифицировать вещества, потенциальные для лечения аутоиммунных заболеваний. 7 с. и 16 з.п. ф-лы, 2 табл. , 8 ил.

Комментарии