Варианты сериновой протеазы с множественными мутациями - RU2558261C2
Код документа: RU2558261C2
Чертежи







Описание
Настоящая заявка представляет собой подачу международной заявки с USSN 11/809104, зарегистрированной 31 мая 2007 года, которая представляет собой продолжение рассматриваемой патентной заявки США с серийным номером 11/583334, зарегистрированной 19 октября 2006 года, которая представляет собой частичное продолжение рассматриваемой патентной заявки США с серийным номером 10/576331, по которой испрашивается приоритет по PCT/US2004/039066, зарегистрированной 19 ноября 2004 года, по которой испрашивается приоритет по предварительной патентной заявке США с серийным номером 60/523609, зарегистрированной 19 ноября 2003 года, рассмотрение которой в настоящее время прекращено.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым сериновым протеазам видов Micrococcineae с множественными заменами. В частности, настоящее изобретение относится к сериновым протеазам с множественными заменами, к ДНК, кодирующим эти протеазы, к векторам, содержащим ДНК, кодирующие протеазы, клеткам-хозяевам, трансформированным ДНК-содержащим вектором, и продуцируемым клетками-хозяевами ферментам. Настоящее изобретение также относится к чистящим композициям (например, детергентным композициям), композициям животных кормов и композициям для обработки тканей и кожи, содержащим эти варианты сериновых протеаз. В особенно предпочтительных вариантах осуществления настоящее изобретение относится к мутантным протеазам (т.е. вариантам протеаз), полученным из протеаз дикого типа, описываемых в настоящем документе. Эти варианты протеаз также находят применение в многочисленных приложениях.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Сериновые протеазы представляют собой подгруппу ферментов различных классов с широким диапазоном специфичности и биологических функций (см., например Stroud, Sci. Amer., 131:74-88 [1974]). Несмотря на их функциональное разнообразие, каталитический аппарат сериновых протеаз представлен по меньшей мере двумя генетически различными семействами ферментов: 1) субтилизины; и 2) родственные химотрипсину сериновые протеазы млекопитающих и гомологичные бактериальные сериновые протеазы (например, трипсины). Эти два семейства сериновых протеаз демонстрируют необычно сходные механизмы катализа (см., например Kraut, Ann. Rev. Biochem., 46:331-358 [1977]). Кроме того, хотя первичная структура является непохожей, третичная структура этих двух семейств ферментов совместно дает консервативную каталитическую триаду аминокислот, состоящую из серина, гистидина и аспарагиновой кислоты.
В отличие от этого, субтилизины и родственные химотрипсину сериновые протеазы содержат каталитическую триаду, состоящую из аспарагиновой кислоты, гистидина и серина. У родственных субтилизину протеаз порядок расположения этих аминокислот при чтении от N- к С-концу составляет аспарагиновую кислоту-гистидин-серин. Однако у родственных химотрипсину протеаз порядок расположения составляет гистидин-аспарагиновую кислоту-серин. С субтилизинами проведено большое количество исследований, в основном вследствие их применимости в очистных и кормовых составах. Дополнительные исследования были сфокусированы на вредных условиях окружающей среды (например, воздействие окислителей, хелатирующих средств, экстремальных температур и/или pH), которые могут вредно влиять на функциональность этих ферментов при различных применениях. Тем не менее, в данной области остается необходимость в ферментных системах, которые способны противостоять этим вредным условиям и сохранять активность или обладать улучшенной активностью по сравнению с известными в данной области в настоящее время ферментными системами.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым сериновым протеазам видов Micrococcineae с множественными заменами. В частности, настоящее изобретение относится к сериновым протеазам с множественными заменами, ДНК, кодирующим эти протеазы, векторам, содержащим ДНК, кодирующие протеазы, клеткам-хозяевам, трансформированным ДНК-содержащим вектором, и продуцируемым клетками-хозяевами ферментам. Настоящее изобретение также относится к чистящим композициям (например, детергентным композициям), композициям животных кормов и композициям для обработки тканей и кожи, содержащим эти варианты сериновых протеаз. В особенно предпочтительных вариантах осуществления настоящее изобретение относится к мутантным протеазам (т.е. вариантам протеаз), полученным из протеаз дикого типа, описываемых в настоящем документе. Эти варианты протеаз также находят применение в многочисленных приложениях.
Настоящее изобретение относится к выделенным вариантам сериновых протеаз с аминокислотной последовательностью, содержащей по меньшей мере две аминокислотные замены, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. Настоящее изобретение дополнительно относится к композициям, содержащим вариант(ы) выделенной сериновой протеазы по меньшей мере с двумя аминокислотными заменами, где замены произведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления композиции содержат по меньшей мере один вариант сериновой протеазы, где вариант сериновой протеазы обладает иммунологической перекрестной реактивностью с сериновой протеазой, приведенной в SEQ ID NO:8. В некоторых дополнительных предпочтительных вариантах осуществления последовательность варианта сериновой протеазы содержит замены по меньшей мере в двух положениях аминокислот, выбранных из положений 1, 2, 3, 4, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 19, 22, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 51, 52, 54, 55, 56, 57, 59, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 96, 99, 100, 101, 103, 104, 105, 107, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 121, 123, 124, 125, 126, 127, 128, 129, 130, 132, 133, 134, 135, 136, 137, 140, 141, 142, 143, 144, 145, 146, 147, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 170, 171, 172, 175, 176, 177, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188 и 189, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
В некоторых предпочтительных вариантах осуществления вариант сериновой протеазы содержит по меньшей мере две замены, выбранные из G12D, R14I, R14L, R14M, R14S, R16I, R16L, R16Q, N24E, N24H, N24M, N24T, N24W, R35E, R35F, R35H, T36S, G49A, G54D, G54L, R61V, A64K, G65Q, Q71F, Y75G, S76A, S76L, S76N, S76T, S76V, R79K, R79T, Q81K, Q81P, T86K, A93G, A93H, A93S, S99A, T109M, N112E, T116E, R123F, R123L, R123Q, R123S, R127A, R127K, R127Q, R159E, R159F, R159G, R159K, R159L, R159Q, R179N, R179Q, I181K, I181Q, I181T, D184N, D184T и S187Q, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых дополнительных предпочтительных вариантах осуществления вариант сериновой протеазы содержит несколько замен, выбранных из R16Q/R35F/R159Q, R16Q/R123L, R14L/R127Q/R159Q, R14L/R179Q, R123L/R127Q/R179Q, R16Q/R79T/R127Q, R16Q/R79T, R35E/R123L/R127Q/R179Q и G12D/R35E/G63R/R79K/T109M, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления вариант сериновой протеазы содержит следующие замены R123L, R127Q и R179Q, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
В некоторых дополнительных предпочтительных вариантах осуществления вариант сериновой протеазы содержит по меньшей мере две замены, выбранные из D2G, D2Q, V3I, V3L, N7A, N7L, N7S, I11A, I11Q, R14E, N24A, N24E, N24H, N24L, N24M, N24Q, N24T, N24V, T36D, T36F, T36G, T36H, T36I, T36L, T36N, T36P,

T183I, G186E, G186I, G186V, S187P, S187T и S188M, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
В некоторых дополнительных вариантах осуществления вариант сериновой протеазы содержит по меньшей мере две замены, выбранные из F1A, F1T, D2A, D2H, D2N, V3T, N7H, N7I, A8G, A8K, T10G, T10K,


T183K, T183M, D184F, D184H, D184Q, D184R, S185I, S185V, S187E и S187L, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
В дополнительных вариантах осуществления, вариант сериновой протеазы содержит по меньшей мере две замены, выбранные из

где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В дополнительных вариантах осуществления вариант сериновой протеазы содержит по меньшей мере две замены, выбранные из F1N, F1P,


R179N, R179S, R179T, R179V, R179W, R179Y, S187E, и S188E, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
В некоторых дополнительных вариантах осуществления настоящее изобретение относится к варианту сериновой протеазы, где аминокислотная последовательность протеазы содержит по меньшей мере две замены, выбранные из

Y176P, G186S и S188A, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых вариантах осуществления аминокислотная последовательность варианта сериновой протеазы содержит по меньшей мере две замены, выбранные из

S188V и P189S, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
Настоящее изобретение дополнительно относится к варианту сериновой протеазы, где аминокислотная последовательность протеазы содержит по меньшей мере две замены, выбранные из F1T, T10N, R14D, R14G,

R123F, R123H, R123I, R123L, R123N, R123Q, R127A, R127Q, T129S, L142V, N145E, R159D, R159E, R159F, R159N, R159Q, N170D, N170Y, I172T, R179A, R179D, R179E, R179I, R179K, R179M, R179N, R179T, R179V, R179Y, I181L и G186N, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых альтернативных вариантах осуществления аминокислотная последовательность протеазы содержит по меньшей мере две замены, выбранные из F1D, V3L, N7L, A8E, A8G, T10D,

T182V, T183E, T183I и S185N, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO: 8. В некоторых дополнительных вариантах осуществления вариант сериновой протеазы содержит по меньшей мере две замены, выбранные из

и S187P, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
В некоторых дополнительных вариантах осуществления аминокислотная последовательность варианта сериновой протеазы содержит по меньшей мере две замены, выбранные из F1T, A8D, A8G, T10E, T10L, T10Q, I11L, I11S, I11T, G12D, G12Y, R14E, R14L, R14N, R14P, S15E, R16A, R16G, R16I, R16N, N24L, N24S, V31F, R35A, A38D, A38F, A38N, A38V, A38Y, T40V, A41N, N42H, G49F, G49H, G49S, S51Q, S51T, G54A, G54L, G54M, N55F, R61H, R61K, R61M, R61S, R61T, A64N, A64S, A64T, A64V, A64W, G65R, G65V, V66D, N67F, N67K, N67M, N67Q, N67T, L69W, A70G, A70P, Q71D,

S185I, G186L, S187E, S187Q и S188Q, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления аминокислотная последовательность варианта сериновой протеазы содержит по меньшей мере две замены, выбранные из A8R, A8S, A8T, A8V, R14E, R14L, R14M,

R179T, R179V, R179Y, M180D, T182V, T183I, G186E, G186V и S187P, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO: 8. В некоторых дополнительных вариантах осуществления аминокислотная последовательность варианта сериновой протеазы содержит по меньшей мере две замены, выбранные из

G186T, S187E, S187T и S188E, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых дополнительных вариантах осуществления аминокислотная последовательность варианта сериновой протеазы содержит по меньшей мере две замены, выбранные из:
T10A, T10G, T10L, I11A, I11S, I11T, G12I,

G186V, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
Настоящее изобретение также относится к вариантам сериновых протеаз с улучшенной стабильностью по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых вариантах осуществления варианты обладают улучшенной термостабильностью по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых особенно предпочтительных вариантах осуществления варианты содержат несколько замен, выбранных из

где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых альтернативных вариантах осуществления варианты обладают улучшенной стабильностью в LAS по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых особенно предпочтительных вариантах осуществления варианты содержат несколько замен, выбранных из T121E/R123F/R159E,







R14M/S76N/A93G/R127Q/R159K/I181K, R14M/S76N/A93G/R127Y/R159K/I181K и R14M/S76N/G78D/A93G/R127K/R159K/I181K, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
Настоящее изобретение также относится к вариантам сериновых протеаз с улучшенной активностью по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления варианты обладают улучшенной казеинолитической активностью по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых особенно предпочтительных вариантах осуществления варианты содержат несколько замен, выбранных из R14L/R79T, G12D/R35H/R159E, G12D/R35H/R123Q, G12D/R35H/R123F/R159E, G12D/R35H, G12D/R35E/R159E, G12D/R35E/R123Q/R159E, G12D/R35E/R123Q, G12D/R35E, G12D/R35D/R159E, G12D/R35D/R123Q/R159E, G12D/R35D, G12D/R159E, G12D/R14Q/R35H, G12D/R14I/R35H, 024E/G049A/A093H/R127K/A143N/R159K/I181Q, N24M/S76V/A93H/R127K/R159K, R14I/N24E/R35D/A64K/N67A/G78D/R123F/R159K/D184T R127A/R159K, R14I/G65Q и R14I/G65Q/R159K R14I/S76V, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых альтернативных вариантах осуществления варианты обладают улучшенной кератинолитической активностью по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых особенно предпочтительных вариантах осуществления варианты содержат несколько замен, выбранных из




R14I/T36S/G65Q/R127A/R159K и R35F/R127A/R159K, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
Настоящее изобретение также относится к вариантам сериновых протеаз с улучшенной активностью в отношении эффективности стирки по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления варианты содержат несколько замен, выбранных из




и R14M/S76N/G78D/A93G/R127K/R159K/I181K, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых вариантах осуществления варианты обладают улучшенной активностью в отношении эффективности мытья посуды по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления варианты содержат несколько замен, выбранных из R14N/R127K/R159L, R14I/A64K/T86K/N112E/R123F/D184T, G12D/R35E/G63R/R79K/T109M, R14L, G12D/R35E и R14M/S76D/A93H/R127K/R159K/I181K, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO: 8. В некоторых предпочтительных вариантах осуществления варианты обладают улучшенной активностью в отношении удаления загрязнений по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления варианты содержат несколько замен, выбранных из:


и R35F/R127A/R159K, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
Настоящее изобретение также относится к вариантам сериновых протеаз по меньшей мере с одним измененным свойством поверхности по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления варианты содержат по меньшей мере две замены в участках выбранных из группы, состоящей из 1, 2, 4, 7, 8, 10, 11, 12, 13, 14, 15, 16, 22, 24, 25, 32, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 57, 59, 61, 62, 63, 64, 65, 66, 67, 68, 69, 71, 73, 74, 75, 76, 77, 78, 79, 80, 81, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 95, 99, 100, 101, 102, 103, 104, 105, 106, 107, 108, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 121, 123, 124, 126, 127, 128, 130, 131, 132, 133, 134, 135, 137, 143, 144, 145, 146, 147, 148, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 170, 171, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183 и 184, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
В некоторых особенно предпочтительных вариантах осуществления варианты протеаз обладают по меньшей мере одним улучшенным свойством по сравнению с протеазой Cellulomonas 69B4 дикого типа, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых особенно предпочтительных вариантах осуществления по меньшей мере одно улучшенное свойство выбрано из группы, состоящей из кислотостойкости, термостабильности, гидролиза казеина, гидролиза кератина, эффективности очистки и стабильности в LAS.
Настоящее изобретение также относится к экспрессирующим векторам, содержащим полинуклеотидную последовательность, кодирующую варианты сериновых протеаз с аминокислотной последовательностью, содержащей по меньшей мере две аминокислотные замены, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. Настоящее изобретение также относится к клеткам-хозяевам, содержащим по меньшей мере один экспрессирующий вектор. В некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой вид Bacillus, тогда как в некоторых других вариантах осуществления клетка-хозяин представляет собой вид Streptomyces, в некоторых других вариантах осуществления клетка-хозяин представляет собой вид Aspergillus, а в некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой вид Trichoderma. Настоящее изобретение также относится к вариантам сериновых протеаз, продуцируемых клетками-хозяевами.
Настоящее изобретение также относится к композициям, содержащим по меньшей мере часть вариантов сериновых протеаз с аминокислотной последовательностью, содержащей по меньшей мере две аминокислотные замены, где замены произведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8, представленную в настоящем документе.
Настоящее изобретение также дополнительно относится к полинуклеотидным последовательностям, кодирующим варианты сериновых протеаз с аминокислотными последовательностями, содержащими по меньшей мере две аминокислотные замены, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. Настоящее изобретение дополнительно относится к экспрессирующим векторам, содержащим полинуклеотидную последовательность, кодирующую варианты сериновых протеаз с аминокислотной последовательностью, содержащей по меньшей мере две аминокислотные замены, где замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. Настоящее изобретение также относится к клеткам-хозяевам, содержащим по меньшей мере один экспрессирующий вектор. В некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой вид Bacillus, тогда как в некоторых других вариантах осуществления клетка-хозяин представляет собой вид Streptomyces, в некоторых других вариантах осуществления клетка-хозяин представляет собой вид Aspergillus, а в некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой вид Trichoderma. Настоящее изобретение также относится к вариантам сериновых протеаз, продуцируемых клетками-хозяевами.
Настоящее изобретение дополнительно относится к чистящим композициям, содержащим варианты сериновых протеаз с аминокислотными последовательностями, содержащими по меньшей мере две аминокислотные замены, где замены произведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления чистящие композиции содержат по меньшей мере один вариант сериновой протеазы, где сериновая протеаза обладает иммунологической перекрестной реактивностью с сериновой протеазой, приведенной в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления замены произведены в положениях, эквивалентных положениям 1, 2, 3, 4, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 19, 22, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 51, 52, 54, 55, 56, 57, 59, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 96, 99, 100, 101, 103, 104, 105, 107, 109, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 121, 123, 124, 125, 126, 127, 128, 129, 130, 132, 133, 134, 135, 136, 137, 140, 141, 142, 143, 144, 145, 146, 147, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 170, 171, 172, 175, 176, 177, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188 и 189, в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8. В некоторых предпочтительных вариантах осуществления чистящие композиции дополнительно содержат один или несколько дополнительных ферментов или производных ферментов, выбранных из группы, состоящей из протеаз, амилаз, липаз, маннаназ, пектиназ, кутиназ, оксидоредуктаз, гемицеллюлаз и целлюлаз.
Настоящее изобретение также относится к композициям, содержащим варианты сериновых протеаз с аминокислотными последовательностями, содержащими по меньшей мере две аминокислотные замены, где замены прозведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8, и по меньшей мере один стабилизатор. В некоторых предпочтительных вариантах осуществления композиции представляют собой чистящие композиции. В некоторых особенно предпочтительных вариантах осуществления стабилизатор выбран из буры, глицерина и конкурентных ингибиторов. В некоторых дополнительных особенно предпочтительных вариантах осуществления конкурентные ингибиторы стабилизируют варианты сериновых протеаз относительно анионных поверхностно-активных веществ. В некоторых предпочтительных вариантах осуществления вариант сериновой протеазы представляет собой стабильный к автолизу вариант.
Настоящее изобретение также относится к чистящим композициям, содержащим по меньшей мере 0,0001 массового процента вариантов сериновых протеаз с аминокислотными последовательностями, содержащими по меньшей мере две аминокислотные замены, где замены произведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8, и, необязательно, вспомогательный ингредиент. В некоторых предпочтительных вариантах осуществления композиции содержат приблизительно от 0,001 до приблизительно 0,5 массового процента по меньшей мере одного варианта сериновой протеазы. В некоторых предпочтительных вариантах осуществления композиции содержат приблизительно от 0,01 до приблизительно 0,1 массового процента сериновой протеазы. В некоторых дополнительных предпочтительных вариантах осуществления чистящие композиции содержат вспомогательный ингредиент. В некоторых дополнительных предпочтительных вариантах осуществления чистящие композиции содержат достаточное количество модификатора pH с получением композиции с точным значением pH приблизительно от 3 до приблизительно 5, где композиции по существу не содержат веществ, которые гидролизуют при pH приблизительно от 3 до приблизительно 5. В некоторых альтернативных предпочтительных вариантах осуществления чистящие композиции содержат вещества, содержащие поверхностно-активное вещество. В некоторых особенно предпочтительных вариантах осуществления поверхностно-активное вещество содержит поверхностно-активное вещество алкилсульфат натрия, которое содержит этиленоксидную группу.
Настоящее изобретение дополнительно относится к чистящим композициям, содержащим варианты сериновых протеаз с аминокислотными последовательностями, содержащими по меньшей мере две аминокислотные замены, где замены произведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8, где чистящая композиция представляет собой жидкость. В некоторых альтернативных вариантах осуществления чистящая композиция представляет собой порошок, гранулированную или таблетированную композицию.
Настоящее изобретение дополнительно относится к чистящим композициям, содержащим варианты сериновых протеаз с аминокислотными последовательностями, содержащими по меньшей мере две аминокислотные замены, где замены произведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8, где чистящие композиции дополнительно содержат источник пероксида водорода. В некоторых предпочтительных вариантах осуществления источник пероксида водорода содержит по меньшей мере одну персоль, где персоль представляет собой перборат щелочного металла, перкарбонат щелочного металла, перфосфат щелочного металла, персульфат щелочного металла или их смесь. В некоторых особенно предпочтительных вариантах осуществления чистящие композиции дополнительно содержат катализатор отбеливания, активатор отбеливания и/или их смеси.
Настоящее изобретение также относится к способам очистки, включающим в себя этапы: a) приведения поверхности и/или изделия, содержащего ткань, в контакт по меньшей мере с одной чистящей композицией по настоящему изобретению; и b) необязательно промывки и/или ополаскивания поверхности или вещества.
Настоящее изобретение также относится к кормам для животных, содержащим варианты сериновых протеаз с аминокислотными последовательностями, содержащими по меньшей мере две аминокислотные замены, где замены произведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
Настоящее изобретение также относится к композициям для обработки тканей и кожи, содержащим варианты сериновых протеаз с аминокислотными последовательностями, содержащими по меньшей мере две аминокислотные замены, где замены произведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
Настоящее изобретение также относится к средствам личной гигиены, содержащим варианты сериновых протеаз с аминокислотными последовательностями, содержащими по меньшей мере две аминокислотные замены, где замены произведены в положениях, эквивалентных положениям в протеазе Cellulomonas 69B4, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:8.
ОПИСАНИЕ РИСУНКОВ
На фигуре 1 представлена карта плазмиды pHPLT-ASP-C1-2.
На фигуре 2 представлена карта плазмиды pXX-KpnI.
На фигуре 3 представлена карта плазмиды pHPLT.
На фигуре 4 представлена карта плазмиды pUC18.
На фигуре 5 представлена карта плазмиды pUC18-ASP
На фигуре 6 представлена таблица, демонстрирующая результаты тестов на терготометре, проводимых в отсутствие буфера HEPES (дозировка фермента составляла 0,55 м.д.).
На фигуре 7 представлена таблица, демонстрирующая результаты тестов на терготометре, проводимых в присутствии буфера HEPES (дозировка фермента составляла 0,55 м.д.).
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым сериновым протеазам видов Micrococcineae с множественными заменами. В частности, настоящее изобретение относится к сериновым протеазам с множественными заменами, ДНК, кодирующим эти протеазы, векторам, содержащим ДНК, кодирующие протеазы, клеткам-хозяевам, трансформированным ДНК-содержащим вектором и продуцируемым клетками-хозяевами ферментам. Настоящее изобретение также относится к чистящим композициям (например, детергентным композициям), композициям кормов для животных и композициям для обработки тканей и кожи, содержащим эти варианты сериновых протеаз. В особенно предпочтительных вариантах осуществления настоящее изобретение относится к мутантным протеазам (т.е. вариантам протеаз), полученным из протеаз дикого типа, описываемых в настоящем документе. Эти варианты протеаз также находят применение в многочисленных приложениях.
Настоящее изобретение относится к вариантам протеазных ферментов с множественными заменами. Важно, что эти варианты ферментов обладают хорошей стабильностью и протеолитической активностью. Эти варианты ферментов находят применение в различных приложениях, включая в качестве неограничивающих примеров, чистящие композиции, корм для животных, обработку тканей и т.д. Настоящее изобретение также относится к способам получения этих ферментов. В некоторых предпочтительных вариантах осуществления варианты протеаз по настоящему изобретению находятся в чистой или относительно чистой форме.
Настоящее изобретение также относится к нуклеотидным последовательностям, подходящим для получения вариантов протеаз по настоящему изобретению в рекомбинантных организмах. В некоторых вариантах осуществления рекомбинантная продукция предоставляет способы получения вариантов протеаз в рентабельных количествах.
Если не указано иначе, практическое осуществление настоящего изобретения включает общепринятые способы, общеупотребительные в молекулярной биологии, микробиологии и рекомбинантной ДНК, которые известны специалистам в данной области. Такие способы известны специалистам в данной области и описаны в многочисленных руководствах и справочниках (см., например, Sambrook et al., "Molecular Cloning: A Laboratory Manual", Second Edition (Cold Spring Harbor), [1989]); и Ausubel et al., Current Protocols in Molecular Biology" [1987]). Все указанные в настоящем документе патенты, патентные заявки, статьи и публикации, выше и ниже, таким образом, явно включены в настоящий документ в качестве ссылки.
Если в настоящем документе не определено иначе, все технические и научные термины, используемые в настоящем документе, имеют то же значение, как обычно понимает специалист в области, к которой принадлежит настоящее изобретение. Например, в Singleton and Sainsbury, Dictionary of Microbiology and Molecular Biology, 2d Ed., John Wiley and Sons, NY (1994); и Hale and Marham, The Harper Collins Dictionary of Biology, Harper Perennial, NY (1991) специалистам в данной области представлены общие словари многих терминов, используемых в данном изобретении. Хотя в практическом осуществлении настоящего изобретения находят применение любые способы и материалы, подобные или эквивалентные способам и материалам, описываемым в настоящем документе, предпочтительные способы и материалы описаны в настоящем документе. Таким образом, определенные непосредственно ниже термины более полно описаны по отношению к спецификации в целом. Также, как применяют в настоящем документе, если в контексте явно не указано иначе, форма единственного числа включает указание на множественное число. Числовые диапазоны являются включающими в себя числа, определяющие диапазон. Если не указано иначе, нуклеиновые кислоты записывают слева направо в направлении от 5' к 3'; аминокислотные последовательности записывают слева направо в направлении от N-конца к С-концу, соответственно. Следует понимать, что данное изобретение не ограничено конкретными описанными способами, протоколами и реагентами, так как они в зависимости от ситуации, в которой их используют специалисты в данной области, могут варьировать.
Если не указано иначе, в практическом осуществлении настоящего изобретения, применяют общепринятые способы очистки белков, молекулярной биологии, микробиологии, способы рекомбинантной ДНК и секвенирования белков, которые все известны специалистам в данной области.
Кроме того, представленные в настоящем документе заголовки не являются ограничением различных аспектов или вариантов осуществления изобретения, которые могут иметь отношение к спецификации в целом. Таким образом, определенные непосредственно ниже термины более полно определены по отношению к спецификации в целом. Тем не менее, для облегчения понимания изобретения, ниже определен ряд терминов. Дополнительные определения представлены в патентной заявке США с серийным № 10/576331, которая в полном объеме включена в качестве ссылки.
I. Определения
Как применяют в настоящем документе, термины "протеазная" и "протеолитическая активность" относятся к белку или пептиду, демонстрирующему способность гидролизовать пептиды или субстраты с пептидными связями. Существует множество хорошо известных способов измерения протеолитической активности (Kalisz, "Microbial Proteinases", In: Fiechter (ed.), Advances in Biochemical Engineering/Biotechnology. [1988]). Например, протеолитическую активность можно определять посредством сравнительных анализов, в которых анализируют способность соответствующих протеаз гидролизовать коммерческий субстрат. Иллюстративные субстраты, пригодные для анализа протеазной или протеолитической активности, включают в качестве неограничивающих примеров диметилказеин (Sigma C-9801), бычий коллаген (Sigma C-9879), бычий эластин (Sigma E-1625) и бычий кератин (ICN Biomedical 902111). Колориметрические анализы с применением этих субстратов хорошо известны в данной области (см., например, WO 99/34011 и патент США № 6376450, которые оба включены в настоящий документ в качестве ссылки). В определении концентрации активного фермента для фракций, собранных при градиентном элюировании, также находит применение анализ pNA (см., например, Del Mar et al., Anal. Biochem., 99:316-320 [1979]). В этом анализе измеряют скорость, c которой высвобождается п-нитроанилин по мере того, как фермент гидролизует растворимый синтетический субстрат, сукцинилаланин-аланин-пролин-фенилаланин-п-нитроанилид (sAAPF-pNA). Скорость образования желтой окраски вследствие реакции гидролиза измеряют при 410 нм на спектрофотометре и она пропорционально концентрации активного фермента. Кроме того, можно использовать измерение поглощения при 280 нм для определения общей концентрации белка. Отношение активный фермент/общий белок позволяет определять чистоту фермента.
Как применяют в настоящем документе, термины "протеаза ASP", "протеаза Asp" и "Asp" относятся к сериновым протеазам, описываемым в настоящем документе. В некоторых предпочтительных вариантах осуществления протеаза Asp представляет собой протеазу, обозначаемую в настоящем документе как протеаза 69B4, полученная из штамма Cellulomonas 69B4. Таким образом, в предпочтительных вариантах осуществления термин "протеаза 69B4" относится к встречающийся в природе зрелой протеазе, полученной из штамма Cellulomonas 69B4 (DSM 16035) с аминокислотными последовательностями, по существу идентичными с аминокислотными последовательностями, представленными в SEQ ID NO:8. В альтернативных вариантах осуществления настоящее изобретение относится к частям протеазы ASP.
Термин "гомологи протеазы Cellulomonas" относится к встречающимся в природе протеазам с аминокислотными последовательностями, по существу идентичными со зрелой протеазой, полученной из штамма Cellulomonas 69B4, или к полинуклеотидным последовательностям, кодирующим такие встречающиеся в природе протеазы, где эти протеазы сохраняют функциональные характеристики сериновой протеазы, кодируемой такими нуклеиновыми кислотами. В некоторых вариантах осуществления эти гомологи протеазы обозначают как "cellulomonadin".
Как применяют в настоящем документе, термины "вариант протеазы", "вариант ASP", "вариант протеазы ASP" и "вариант протеазы 69B" используют в отношении протеазы, которая сходна с ASP дикого типа, в частности по своей функции, но содержащей в своей аминокислотной последовательности мутации (например, замены), которые делают ее отличной по последовательности от протеазы дикого типа. Некоторые из аминокислотных остатков идентифицированных как замещенные являются консервативными остатками, тогда как другие - нет. В некоторых вариантах осуществления варианты протеазы по настоящему изобретению включают зрелые формы вариантов протеазы, тогда как в других вариантах осуществления настоящее изобретение относится к про- и препро-формам таких вариантов протеаз.
Как применяют в настоящем документе, "виды Cellulomonas" относится ко всем видам в роде "Cellulomonas", который представляет собой грамположительные бактерии, классифицированные как представители семейства Cellulomonadaceae, подпорядка Micrococcineae, порядка Actinomycetales, класса Actinobacteria. Общепризнанно, что род Cellulomonas продолжает претерпевать таксономическую реорганизацию. Таким образом, следует иметь в виду, что род включает виды, которые были переклассифицированы.
Как применяют в настоящем документе, "виды Streptomyces" относятся ко всем видам в роде "Streptomyces", которые представляют собой грамположительные бактерии, классифицированные как представители семейства Streptomycetaceae, подпорядка Streptomycineae, порядка Actinomycetales, класса Actinobacteria. Общепризнанно, что род Streptomyces продолжает претерпевать таксономическую реорганизацию. Таким образом, следует иметь в виду, что род включает виды, которые были переклассифицированы.
Как применяют в настоящем документе, "род Bacillus" включает все виды рода "Bacillus", которые известны специалистам в данной области, включая в качестве неограничивающих примеров B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus и B. thuringiensis. Общепризнанно, что род Bacillus продолжает претерпевать таксономическую реорганизацию. Таким образом, следует иметь в виду, что род включает виды, которые были переклассифицированы, включая в качестве неограничивающих примеров, такие организмы, как B. stearothermophilus, которые в настоящее время называют "Geobacillus stearothermophilus". Образование стабильных эндоспор в присутствии кислорода рассматривают как определяющую характеристику рода Bacillus, хотя эта характеристика также свойственна недавно названным Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus и Virgibacillus.
Термины "полинуклеотид" и "нуклеиновая кислота", используемые в настоящем документе взаимозаменяемо, относятся к полимерной форме нуклеотидов, рибонуклеотидов или дезоксирибонуклеотидов, любой длины. Эти термины включают в качестве неограничивающих примеров, одно-, двух- или трехцепочечные ДНК, геномную ДНК, кДНК, РНК, гибрид ДНК-РНК или полимер, содержащий пуриновые и пиримидиновые основания, или другие природные, химически, биохимически модифицированные, неприродные или дериватизированные нуклеиновые основания. Следующее представляет собой неограничивающие примеры полинуклеотидов: гены, генные фрагменты, хромосомные фрагменты, EST, экзоны, интроны, мРНК, тРНК, рРНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, вектора, выделенные ДНК любой последовательности, выделенные РНК любой последовательности, зонды нуклеиновых кислот и праймеры. В некоторых вариантах осуществления полинуклеотиды содержат модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов, урацил, другие сахара и связывающие группы, такие как фторрибоза и тиоат, и разветвления нуклеотидов. В альтернативных вариантах осуществления последовательность нуклеотидов прерывается ненуклеотидными компонентами.
Как применяют в настоящем документе термин "ген" относится к полинуклеотиду (например, участку ДНК), который кодирует полипептид и включает области, предшествующие кодирующим областям и следующие за ними, а также промежуточные последовательности (интроны) между отдельными кодирующими сегментами (экзонами).
Как применяют в настоящем документе, "гомологичные гены" относятся к паре генов из различных, но, как правило, родственных видов, которые соответствуют друг другу и которые идентичны или очень сходны друг с другом. Термин включает гены, которые разошлись вследствие видообразования (т.е. развития новых видов) (например, ортологичные гены), а также гены, которые разделились вследствие генетической дупликации (например, паралогичные гены).
Как применяют в настоящем документе, "гомология" относится к сходству или идентичности последовательностей, где идентичность является более предпочтительной. Данную гомологию определяют с использованием стандартных способов, известных в данной области (см., например, Smith and Waterman, Adv. Appl. Math., 2:482 [1981]; Needleman and Wunsch, J. Mol. Biol., 48:443 [1970]; Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85:2444 [1988]; такие программы, как GAP, BESTFIT, FASTA и TFASTA в пакете Wisconsin Genetics Software Package (Genetics Computer Group, Madison, WI); и Devereux et al., Nucl. Acid Res., 12:387-395 [1984]).
Как применяют в настоящем документе, "аналогичная последовательность" представляет собой последовательность, где функция гена по существу является такой же, как у гена протеазы штамма Cellulomonas 69B4. Дополнительно, у аналогичных генов последовательность по меньшей мере на 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98%, 99% или 100% идентична с последовательностью протеаза штамма Cellulomonas 69B4. Альтернативно, аналогичные последовательности имеют выравнивание генов, находящихся в области протеазы штамма Cellulomonas 69B4, от 70 до 100% и/или имеют по меньшей мере от 5 до 10 генов, находящихся в области, выровненной с генами в хромосоме штамма Cellulomonas 69B4. В дополнительных вариантах осуществления у последовательностей имеется более одного из указанных выше свойств. Аналогичные последовательности определяют известными способами выравнивания последовательностей. Общеупотребительный способ выравнивания представляет собой BLAST, хотя, как указано выше и ниже, существуют другие способы, которые также находят применение в выравнивании последовательностей.
Как применяют в настоящем документе, "рекомбинант" включает указание на клетку или вектор, которые модифицированы посредством введения гетерологичной последовательности нуклеиновой кислоты или на клетку, которая получена из модифицированной таким образом клетки. Таким образом, например, рекомбинантные клетки экспрессируют гены, которые не находятся в идентичных формах в природной форме (не рекомбинанты) клетки, или экспрессируют природные гены, которые в ином случае экспрессированы аномально, полностью под контролем экспрессии или отсутствия экспрессии как результат преднамеренного вмешательства человека. "Рекомбинация", "рекомбинирующий" и получение "рекомбинированной" нуклеиновой кислоты, как правило, представляет собой сборку фрагментов двух или более фрагментов нуклеиновых кислот, где сборка приводит к получению химерного гена.
В предпочтительном варианте осуществления мутантные последовательности ДНК получают сайт-насыщающим мутагенезом по меньшей мере в одном кодоне. В другом предпочтительном варианте осуществления сайт-насыщающий мутагенез проводят для двух или более кодонов. В дополнительном варианте осуществления мутантные последовательности ДНК обладают более 50%, более 55%, более 60%, более 65%, более 70%, более 75%, более 80%, более 85%, более 90%, более 95% или более 98% гомологии с последовательностью дикого типа. В альтернативных вариантах осуществления мутантную ДНК получают in vivo с использованием любого известного способа мутагенеза, например, такого как радиация, нитрозогуанидин и т.п. Затем желаемую последовательность ДНК выделяют и используют в способах, представленных в настоящем документе.
Как применяют в настоящем документе "аминокислота" относится к пептидной или белковой последовательности или ее частям.
Как применяют в настоящем документе, "представляющий интерес белок" и "представляющий интерес полипептид" относится к белку/полипептиду, который является желаемым и/или оцениваемым. В некоторых вариантах осуществления представляющий интерес белок экспрессирован внутриклеточно, тогда как в других вариантах осуществления он представляет собой секретируемый полипептид. В особенно предпочтительных вариантах осуществления этот фермент включает сериновые протеазы по настоящему изобретению. В некоторых вариантах осуществления представляющий интерес белок является секретируемым полипептидом, который слит с сигнальным пептидом (т.е. аминоконцевое удлинение секретируемого белка). Почти у всех секретируемых белков используется аминоконцевое удлинение белка, которое играет ключевую роль в направлении и транслокации белков-предшественников через мембрану. Это удлинение протеолитически удаляется сигнальной пептидазой при переносе через мембрану или непосредственно после него.
Как применяют в настоящем документе, термин "гетерологичный белок" относится к белку или полипептиду, который в клетке-хозяине в природе не встречается. Примеры гетерологичных белков включают ферменты, такие как гидролазы, включая протеазы. В некоторых вариантах осуществления гены, кодирующие белки, представляют собой встречающиеся в природе гены, тогда как в других вариантах осуществления применяют мутантные и/или синтетические гены.
Как применяют в настоящем документе, "гомологичный белок" относится к белку или полипептиду, встречающемуся в клетке в природе. В предпочтительных вариантах осуществления клетка представляет собой грамположительную клетку, тогда как в особенно предпочтительных вариантах осуществления клетка представляет собой клетку-хозяина Bacillus. В альтернативных вариантах осуществления гомологичный белок представляет собой природный белок, продуцируемый другими организмами, включая в качестве неограничивающих примеров E. coli, Streptomyces, Trichoderma и Aspergillus. Данное изобретение относится к клеткам-хозяевам, продуцирующим гомологичный белок посредством технологии рекомбинантных ДНК.
Термины "белок" и "полипептид" используют в настоящем документе взаимозаменяемо. На всем протяжении данного описания для аминокислот используют 3-х буквенный код, определенный в соответствии с IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN). Также следует понимать, что вследствие вырожденности генетического кода полипептид может кодировать более одной нуклеотидной последовательности.
"Встречающийся в природе фермент" относится к ферменту с немодифицированной аминокислотной последовательностью, идентичной аминокислотной последовательности, обнаруживаемой в природе. Встречающиеся в природе ферменты включают природные ферменты, ферменты, которые экспрессируются или находятся в конкретном микроорганизме в природе.
Термины "происходящий из" и "полученный из" относятся не только к протеазе, получаемой из штамма рассматриваемого организма или продуцируемой им, но также к протеазе, кодируемой последовательностью ДНК, выделенной из такого штамма и продуцируемой в организме-хозяине, содержащем такую последовательность ДНК. Дополнительно термин относится к протеазе, которую кодирует последовательность ДНК синтетического происхождения и/или кДНК и которая обладает идентифицирующими характеристиками рассматриваемой протеазы. В качестве примера, "протеазы, происходящие из Cellulomonas" относятся к ферментам с протеолитической активностью, которые продуцируют Cellulomonas в природе, а также к сериновым протеазам, подобным сериновым протеазам, продуцируемым источниками Cellulomonas, но которые способами генетической инженерии продуцируют не являющиеся Cellulomonas организмы, трансформированные нуклеиновой кислотой, кодирующей сериновые протеазы.
"Производное" в объеме данного определения, как правило, сохраняет характеристическую протеолитическую активность, наблюдаемую у формы дикого типа, природной или исходной формы при условии, что производное пригодно для сходных целей, что и форма дикого типа, природная или исходная форма. Функциональные производные сериновой протеазы включают встречающиеся в природе, синтетически или рекомбинантно полученные пептиды или пептидные фрагменты, обладающие общими характеристиками сериновой протеазы по настоящему изобретению.
Термин "функциональное производное" относится к производному нуклеиновой кислоты с функциональными характеристиками нуклеиновой кислоты, кодирующей сериновую протеазу. Функциональные производные нуклеиновой кислоты, кодирующие сериновую протеазу по настоящему изобретению, включают встречающиеся в природе, синтетически или рекомбинантно полученные нуклеиновые кислоты или их фрагменты и кодируют сериновую протеазу, характеристическую для настоящего изобретения. Нуклеиновая кислота дикого типа, кодирующая сериновые протеазы по изобретению, включает встречающиеся в природе аллели и гомологи на основе вырожденности генетического кода, известной в данной области.
Термин "идентичные" в отношении двух нуклеиновых кислот или полипептидных последовательностей относится к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании при максимальном соответствии, как измеряют с применением одного из указанных ниже алгоритмов анализа или сравнения последовательностей.
Термин "оптимальное выравнивание" относится к выравниванию, дающему наибольшее значение процента идентичности.
"Процент идентичности последовательностей", "процент идентичности аминокислотных последовательностей", "процент идентичности генных последовательностей" и/или "процент идентичности последовательностей нуклеиновых кислот/полинуклеотидных последовательностей", в отношении двух аминокислотных, полинуклеотидных и/или генных последовательностей (соответственно), относится к проценту остатков, которые идентичны в двух последовательностях при оптимальном выравнивании последовательностей. Таким образом, 80% идентичность аминокислотных последовательностей означает, что 80% аминокислот в двух оптимально выровненных полипептидных последовательностях являются идентичными.
Таким образом, фраза "по существу идентичный" в отношении двух нуклеиновых кислот или полипептидов относится к полинуклеотиду или полипептиду, последовательность которого по меньшей мере на 70% идентична, предпочтительно, по меньшей мере на 75%, предпочтительно, по меньшей мере на 80%, предпочтительно, по меньшей мере на 85%, предпочтительно, по меньшей мере на 90%, предпочтительно, по меньшей мере на 95%, предпочтительно, по меньшей мере на 97%, предпочтительно, по меньшей мере на 98% и предпочтительно, по меньшей мере на 99% идентична с эталонной последовательностью при применении программ или алгоритмов (например, BLAST, ALIGN, CLUSTAL) с применением стандартных параметров. Одним из указаний на то, что два полипептида являются по существу идентичными, является то, что первый полипептид является иммунологически перекрестно-реактивным со вторым полипептидом. Как правило, иммунологически перекрестно-реактивными являются полипептиды, которые отличаются консервативными аминокислотными заменами. Таким образом, полипептид по существу идентичен со вторым полипептидом, например, тогда, когда два пептида отличаются только консервативной заменой. Другим указанием на то, что две последовательности нуклеиновой кислоты являются по существу идентичными, является то, что две молекулы гибридизуются друг с другом в строгих условиях (например, в диапазоне от средней до высокой жесткости).
В данном контексте фраза "эквивалент" относится к ферментам сериновым протеазам, которые кодируются полинуклеотидом, способных к гибридизации с полинуклеотидом с последовательностью, представленной в SEQ ID NO:1, в условиях от средней до максимальной жесткости. Например, являться эквивалентным означает, что эквивалентная зрелая сериновая протеаза содержит по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% и/или по меньшей мере 99% последовательностей, идентичных со зрелой сериновой протеазой Cellulomonas с аминокислотной последовательностью SEQ ID NO:8.
Термин "выделенный" или "очищенный" относится к веществу, которое удалено их своего исходного окружения (например, природная среда, если оно встречается в природе). Например, говорят, что вещество "очищено", когда оно присутствует в конкретной композиции в более высокой концентрации, чем существует во встречающемся в природе организме или организме дикого типа или в сочетании с компонентами обычно не присутствующими при экспрессии во встречающемся в природе организме или организме дикого типа. Например, встречающийся в природе полинуклеотид или полипептид, находящийся у живущего животного, не является выделенным, но тот же полинуклеотид или полипептид, отделенный от некоторых или всех одновременно присутствующих в живой системе веществ, является выделенным. Такие полинуклеотиды могут являться частью вектора и/или такие полинуклеотиды или полипептиды могут являться частью композиции и все еще являться выделенными, поскольку такой вектор или композиция не являются частью их природного окружения. В предпочтительных вариантах осуществления говорят, что нуклеиновая кислота или белок являются очищенными, например, если это приводит по существу к одной полосе на электрофоретическом геле или блоте.
Термин "выделенный", когда его применяют по отношению к последовательности ДНК, относится к последовательности ДНК, которая выделена из его природного генетического окружения и, таким образом не содержит посторонних или нежелательных кодирующих последовательностей, и находится в форме, пригодной для использования в генетически конструируемых системах продукции белка. Такие выделенные молекулы представляют собой молекулы, которые выделяют из их природного окружения и они включают кДНК и геномные клоны. Выделенные молекулы ДНК по настоящему изобретению не содержат других генов, с которыми они, как правило, ассоциированы, но могут включать встречающиеся в природе 5'- и 3'-нетранслируемые области, такие как промоторы и терминаторы. Идентификация ассоциированных областей специалисту в данной области очевидна (см., например, Dynan and Tijan, Nature 316:774-78 [1985]). Термин "выделенная последовательность ДНК" альтернативно обозначают как "клонированная последовательность ДНК".
При использовании в отношении белка термин "выделенный" относится к белку, который находится в условиях, отличных от его природного окружения. В предпочтительной форме выделенный белок по существу не содержит других белков, в частности других гомологичных белков. Выделенный белок является более чем на 10% чистым, предпочтительно - более чем на 20% чистым, и даже более предпочтительно - более чем на 30% чистым, как определяют посредством SDS-PAGE. Дополнительные аспекты изобретения включают белок в более очищенной форме (т.е. более чем на 40% чистый, более чем на 60% чистый, более чем на 80% чистый, более чем на 90% чистый, более чем на 95% чистый, более чем на 97% чистый, и даже более чем на 99% чистый), как определяют посредством SDS-PAGE.
Как применяют в настоящем документе, термин "комбинаторный мутагенез" относится к способам, в которых получают библиотеки вариантов исходной последовательности. В этих библиотеках, варианты содержат одну или несколько мутаций (например, замен), выбранных из предопределенного набора мутаций. Кроме того, способы представляют средства внесения случайных мутаций, которые не являются представителями предопределенного набора мутаций (например, замен). В некоторых вариантах осуществления способы включают способы, указанные в патентной заявке США с серийным № 09/699250, зарегистрированной 26 октября 2000 года, таким образом, включенной в качестве ссылки. В альтернативных вариантах осуществления способы комбинаторного мутагенеза включают коммерчески доступные наборы (например, QuikChange® Multisite, Stratagene, San Diego, CA).
Как применяют в настоящем документе, термин "библиотека мутантов" относится к популяции клеток, которые идентичны в большинстве их генома, но включают различные гомологи одного или нескольких генов. Такие библиотеки можно использовать, например, для идентификации генов или оперонов с улучшенными характеристиками.
Как применяют в настоящем документе, термин "исходный ген" относится к представляющему интерес гену, который кодирует представляющий интерес белок, который необходимо улучшить и/или изменить с применением настоящего изобретения.
Как применяют в настоящем документе, термин "множественное выравнивание последовательностей" ("MSA") относится к последовательностям нескольких гомологов исходного гена, которые выравнивают с применением алгоритма (например, Clustal W).
Как применяют в настоящем документе, термины "консенсусная последовательность" и "каноническая последовательность" относятся к архетипической аминокислотной последовательности, по отношению к которой сравнивают все варианты представляющих интерес конкретного белка или последовательности. Термины также относятся к последовательности, в которой указаны нуклеотиды, которые наиболее часто присутствуют в представляющей интерес последовательности ДНК. Для каждого положения в гене консенсусная последовательность дает аминокислоту, которая наиболее часто встречается в этом положении в MSA.
Как применяют в настоящем документе, термин "консенсусная мутация" относится к отличию последовательности исходного гена и консенсусной последовательности. Консенсусные мутации идентифицируют, сравнивая последовательности исходного гена и консенсусную последовательность, полученную на основе MSA. В некоторых вариантах осуществления в исходный ген вносят консенсусные мутации так, что он становится более сходным с консенсусной последовательностью. Консенсусные мутации также включают изменения аминокислот, которые изменяют аминокислоту в исходном гене на аминокислоту, которая более часто встречается в MSA на этой позиции относительно частоты этой аминокислоты в исходном гене. Таким образом, термин консенсусная мутация включает все одноаминокислотные замены, которые заменяют аминокислоту в исходном гене на аминокислоту, которая более часто встречается, чем аминокислота в MSA.
Как применяют в настоящем документе, термин "исходный удачный вариант" относится к варианту, который идентифицирован посредством скрининга библиотеки комбинаторного мутагенеза консенсусной последовательности. В предпочтительных вариантах осуществления исходные удачные варианты обладают улучшенными рабочими характеристиками, по сравнению с исходным геном.
Как применяют в настоящем документе, термин "улучшенный удачный вариант" относится к варианту, который идентифицирован посредством скрининга улучшенной библиотеки комбинаторного мутагенеза консенсусной последовательности.
Как применяют в настоящем документе, термины "улучшающая мутация" и "улучшающая рабочие характеристики мутация" ("улучшающая замена" и "улучшающая рабочие характеристики замена") относятся к мутации (например, замене), которая приводит к улучшенным параметрам при ее введении в исходный ген. В некоторых предпочтительных вариантах осуществления эти мутации (например, замены) идентифицируют посредством секвенирования удачных вариантов, которые были идентифицированы на этапе скринирования способа. В большинстве вариантов осуществления мутации (например, замены), которые наиболее часто встречаются в удачных вариантах, вероятно, являются улучшающими мутациями (например, заменами) по сравнению с не подвергнутой скринингу библиотекой комбинаторного мутагенеза консенсусной последовательности.
Как применяют в настоящем документе, термин "улучшенная библиотека комбинаторного мутагенеза консенсусной последовательности" относится к библиотеке CCM, которая спроектирована и сконструирована на основе результатов скрининга и/или секвенирования более раннего раунда мутагенеза CCM и скрининга. В некоторых вариантах осуществления улучшенная библиотека CCM основывается на последовательности исходного удачного варианта, являющегося результатом более раннего раунда CCM. В дополнительных вариантах осуществления улучшенный CCM разрабатывают так, чтобы преимущество имели мутации, которые многократно встречались в исходных удачных вариантах на ранних раундах мутагенеза и скрининга. В некоторых предпочтительных вариантах осуществления это осуществляют, исключая праймеры, кодирующие ухудшающие характеристики мутации, или увеличивая концентрацию праймеров, кодирующих улучшающие рабочие характеристики мутации по отношению к другим праймерам, которые используют в ранних библиотеках CCM.
Как применяют в настоящем документе, термин "ухудшающие характеристики мутации" относится к мутациям в библиотеке комбинаторного мутагенеза консенсусной последовательности, которые менее часто встречаются в удачных вариантах, являющихся результатами скрининга, по сравнению с не подвергаемой скринингу библиотеки комбинаторного мутагенеза консенсусной последовательности. В предпочтительных вариантах осуществления способ скрининга устраняет варианты и/или уменьшает частоту вариантов, которые содержат "ухудшающие характеристики мутации".
Как применяют в настоящем документе, термин "функциональный анализ" относится к анализу, который позволяет получать данные об активности белков. В особенно предпочтительных вариантах осуществления термин относится к системам анализа, в которых белок анализируют на его способность действовать с его обычной эффективностью. Например, в случае ферментов функциональный анализ включает определение эффективности фермента в катализе реакции.
Как применяют в настоящем документе, термин "свойство-мишень" относится к свойству исходного гена, которое необходимо изменять. Не следует понимать, что настоящее изобретение ограничено каким-либо конкретным свойством-мишенью. Однако в некоторых предпочтительных вариантах осуществления свойство-мишень представляет собой стабильность продукта гена (например, устойчивость к денатурации, протеолизу или другим разрушающим факторам), тогда как в других вариантах осуществления изменяют уровень продукции у продуцирующего хозяина. Фактически полагают, что в настоящем изобретении найдет применение любое свойство исходного гена.
Как применяют в настоящем документе, термин "свойство" или его грамматические эквиваленты в отношении нуклеиновой кислоты относятся к любой характеристике или атрибуту нуклеиновой кислоты, которые можно выбирать или детектировать. Эти свойства включают в качестве неограничивающих примеров, свойство воздействовать на связывание с полипептидом, свойство, присущее клетке, содержащей конкретную нуклеиновую кислоту, свойство воздействовать на транскрипцию генов (например, сила промотора, распознавание промотора, регуляция промотора, энхансерная функция), свойство воздействовать на процессинг РНК (например, сплайсинг РНК, стабильность РНК, конформацию РНК и посттранскрипционную модификацию), свойство воздействовать на трансляцию (например, уровень, регуляцию, связывание мРНК с рибосомальными белками, посттрансляционную модификацию). Например, можно изменять участок связывания нуклеиновой кислоты для фактора транскрипции, полимеразы, регулирующего фактора и т.д. с получением желаемых характеристик или для идентификации нежелательных характеристик.
Как применяют в настоящем документе, термин "свойство" или его грамматические эквиваленты в отношении полипептида относится к любой характеристике или атрибуту полипептида, которые можно выбирать или детектировать. Эти свойства включают в качестве неограничивающих примеров стабильность к окислению, субстратную специфичность, каталитическую активность, термостабильность, устойчивость к щелочам, профиль активности pH, устойчивость к протеолитическому разрушению, KM, kkaт, отношение kkaт/KM, укладку белка, индукцию иммунного ответа, способность связывать лиганд, способность связываться с рецептором, способность быть секретируемым, способность экспонироваться на поверхности клетки, способность к олигомеризации, способность к передаче сигнала, способность стимулировать клеточную пролиферацию, способность ингибировать клеточную пролиферацию, способность индуцировать апоптоз, способность быть модифицируемым посредством фосфорилирования или гликозилирования, способность лечить заболевание.
Как применяют в настоящем документе, термин "скрининг" имеет свое обычное в данной области значение и, в основном, является многоэтапным процессом. На первом этапе получают мутантную нуклеиновую кислоту или вариант полипептида на ее основе. На втором этапе определяют свойство мутантной нуклеиновой кислоты или варианта полипептида. На третьем этапе определенное свойство сравнивают со свойством соответствующей нуклеиновой кислоты-предшественника, со свойством соответствующего встречающегося в природе полипептида или со свойством исходного материала (например, исходная последовательность) с получением мутантной нуклеиновой кислоты.
Специалистам в данной области очевидно, что способ скрининга для получения нуклеиновой кислоты или белка с измененным свойством зависит от свойства исходного материала, модификация которого предназначена облегчить получение мутантной нуклеиновой кислоты. Таким образом, специалисты в данной области поймут, что изобретение не ограничено никаким конкретным свойством, которое необходимо подвергать скринингу, и что в следующем далее описании свойств перечислены только иллюстративные примеры. Способы скрининга любого конкретного свойства, как правило, описаны в данной области. Например, можно измерять связывание, pH, специфичность и т.д., перед мутацией и после нее, где замена означает изменение. Предпочтительно, скрининг проводят высокопроизводительным способом, включая одновременный скрининг нескольких образцов, включая в качестве неограничивающих примеров анализы с использованием чипов, фагового дисплея и нескольких субстратов и/или индикаторов.
Как применяют в настоящем документе, в некоторых вариантах осуществления скрининг включает этапы отбора, в которых популяцию вариантов обогащают представляющими интерес вариантами. Примеры этих вариантов осуществления включают отбор вариантов, которые придают организму-хозяину преимущества в росте, а также фаговый дисплей или другой способ дисплея, где варианты можно отбирать из популяции вариантов на основе их связывания или каталитических свойств. В предпочтительном варианте осуществления библиотеку вариантов подвергают стрессу (например, температура, протеаза, денатурация и т.д.), а затем варианты, которые все еще являются интактными, идентифицируют в скрининге или обогащают ими популяцию посредством отбора. Следует понимать, что термин включает любые подходящие способы отбора. Фактически не следует понимать, что настоящее изобретение ограничено каким-либо конкретным способом скрининга.
Как применяют в настоящем документе, термин "направленная рандомизация" относится к способу, который позволяет получить множество последовательностей, где рандомизированы одно или несколько положений. В некоторых вариантах осуществления рандомизация является полной (т.е. в рандомизируемом положении могут встречаться все четыре нуклеотида, A, T, G и C). В альтернативных вариантах осуществления рандомизация нуклеотида ограничена поднабором четырех нуклеотидов. Направленную рандомизацию можно применять к одному или нескольким кодонам последовательности, кодирующей один или несколько представляющих интерес белков. Полученные в результате библиотеки при экспрессии позволяют получать множества белков, в которых одно или несколько аминокислотных положений может содержать совокупность всех 20 аминокислот или подмножество аминокислот, определенное схемой рандомизации рандомизируемого кодона. В некоторых вариантах осуществления отдельные представители множества, являющиеся результатом направленной рандомизации отличаются количеством аминокислот, вследствие направленной или случайной вставки или делеции кодонов. В дополнительных вариантах осуществления в получаемые множества белков включают синтетические аминокислоты. В некоторых предпочтительных вариантах осуществления большинство представителей множества, являющегося результатом направленной рандомизации, демонстрируют большую гомологию последовательности с консенсусной последовательностью, чем исходный ген. В некоторых вариантах осуществления последовательность кодирует один или несколько представляющих интерес белков. В альтернативных вариантах осуществления белки обладают отличающимися биологическими функциями. В некоторых предпочтительных вариантах осуществления поступающая последовательность содержит по меньшей мере один селективный маркер.
Термины "модифицированная последовательность" и "модифицированные гены" используют в настоящем документе взаимозаменяемо для обозначения последовательности, которая содержит делецию, вставку или прерывание встречающейся в природе последовательности нуклеиновой кислоты. В некоторых предпочтительных вариантах осуществления продукт экспрессии модифицированной последовательности представляет собой укороченный белок (например, если модификация представляет собой делецию или прерывание последовательности). В некоторых особенно предпочтительных вариантах осуществления укороченный белок сохраняет биологическую активность. В альтернативных вариантах осуществления продукт экспрессии модифицированной последовательности представляет собой удлиненный белок (например, модификации, включающие вставку в последовательность нуклеиновой кислоты). В некоторых вариантах осуществления вставка приводит к укороченному белку (например, когда вставка приводит к формированию стоп-кодона). Таким образом, вставка в качестве продукта экспрессии может приводить или к укороченному белку, или к удлиненному белку.
Как применяют в настоящем документе, термин "замена" включает замену одной аминокислоты в аминокислотной последовательности другой аминокислотой в данном положении аминокислотной последовательности. Таким образом, термин включает ситуации, в которых вставка и/или делеция одной аминокислоты в аминокислотной последовательности изменяет относительные положения аминокислот в последовательности. Таким образом, хотя аминокислота может не являться конкретной мишенью для замены (например, способами, описываемыми в настоящем документе), данную кислоту можно "заместить" другой аминокислотой в последовательности вследствие изменения ее относительного положения в последовательности. Например, посредством вставки аминокислоты между аминокислотами в положениях 1 и 2 SEQ ID NO:8, получаемая в результате последовательность сдвигается на одну аминокислоту (т.е. аминокислота, исходно находящаяся в положении 2, теперь находится в положении 3 и т.д.). Следует понимать, что термин включает множественные, а также единичные замены в аминокислотной последовательности (т.е. единичные или множественные замены). Также следует отметить, что, как применяют в настоящем документе, замены аминокислот указывают в виде встречающейся в природе аминокислоте, за которой следует замещаемая аминокислота. Таким образом, N024E (также указываемая, как N24E) означает, что аспарагин в положении 24 SEQ ID NO:8 замещен глутаминовой кислотой. Как указано в настоящем документе, множественные замены обозначают посредством или "/", или "-". Таким образом, "R127A-G65Q" и "R127A/G65Q" означают, что аминокислоты в положениях 127 и 65 замещены (т.е. аргинин в положении 127 замещен аланином, а глицин в положении 65 замещен глутамином).
Как применяют в настоящем документе, термины "мутантная последовательность" и "мутантный ген" используют взаимозаменяемо и они относятся к последовательности, которая содержит изменение по меньшей мере в одном кодоне, произошедшее в последовательности дикого типа клетки-хозяина. Продукт экспрессии мутантной последовательности представляет собой белок с измененной относительно дикого типа аминокислотной последовательностью. Продукт экспрессии может обладать измененными функциональными свойствами (например, улучшенной ферментативной активностью).
Как применяют в настоящем документе, термин "улучшающая мутация" относится к мутации, для которой значения ΔΔ G для свойства являются лучшими, чем для исходного белка (значения ΔΔ G, <0).
Как применяют в настоящем документе, термин "ухудшающая мутация" относится к мутации, для которой значения ΔΔ G для свойства являются худшими, чем для исходного белка (значения ΔΔ G, >0).
Как применяют в настоящем документе, термин "продуктивный участок" относится к положениям, которые содержат по меньшей мере одну улучшающую мутацию для данного свойства.
Как применяют в настоящем документе, термин "непродуктивный участок" относится к положениям, которые не содержат улучшающих мутаций для данного свойства.
Термины "мутагенный праймер" или "мутагенный олигонуклеотид" (используемые в настоящем документе взаимозаменяемо) служат для обозначения олигонуклеотидных конструкций, которые соответствуют части матричной последовательности и которые способны гибридизоваться с ней. Что касается мутагенных праймеров, праймер не точно соответствует матричной нуклеиновой кислоте, где несоответствие или несоответствия в праймере используют для внесения желаемой мутации в библиотеку нуклеиновых кислот. Как применяют в настоящем документе, "немутагенный праймер" или "немутагенный олигонуклеотид" относится к олигонуклеотидным композициям, которые точно соответствуют матричной нуклеиновой кислоте. В одном из вариантов осуществления изобретения используют только мутагенные праймеры. В другом предпочтительном варианте осуществления изобретения праймеры сконструированы так, чтобы по меньшей мере для одной области для которой включен мутагенный праймер, в олигонуклеотидную смесь также был включен немутагенный праймер. Добавляя смесь мутагенных праймеров и немутагенных праймеров, соответствующих по меньшей мере одному из мутагенных праймеров, возможно получать итоговую библиотеку нуклеиновых кислот, в которой представлено множество различных комбинаторных мутационных вариантов. Например, если желательно, чтобы некоторые из представителей библиотеки мутантных нуклеиновых кислот сохраняли их последовательности-предшественники в определенных положения, тогда как другие представители являются мутантными по таким участкам, немутагенные праймеры предоставляют возможность получать в библиотеке нуклеиновых кислот конкретный уровень немутантных представителей для данного остатка. В способах по изобретению применяют мутагенные и немутагенные олигонуклеотиды, длина которых, как правило, составляет от 10 до 50 оснований, более предпочтительно - приблизительно от 15 до 45 оснований. Однако для получения желаемых результатов мутагенеза необходимым может являться использование праймеров, которые или короче 10 оснований, или длиннее 50 оснований. В отношении соответствующих мутагенных и немутагенных праймеров не обязательно, чтобы соответствующие олигонуклеотиды были одинаковой длины, но только, чтобы существовало перекрытие в области, соответствующей мутации, которую необходимо внести.
Праймеры по настоящему изобретению можно добавлять в предопределенном отношении. Например, если желательно, чтобы полученная в результате библиотека содержала значительный уровень определенной конкретной мутации и меньшее количество другой мутации в том же или другом участки, посредством регуляции количества добавляемого праймера возможно получать желательную библиотеку со смещением. Альтернативно, добавляя меньшие или большие количества немутагенных праймеров, возможно регулировать частоту, с которой в мутантной библиотеке нуклеиновых кислот образуется соответствующая мутация(и).
Как применяют в настоящем документе, фраза "смежные мутации" относится к мутациям, которые представлены в одном и том же олигонуклеотидном праймере. Например, смежные мутации могут являться соседними или близко расположенными друг к другу, однако их может вносить в образующиеся в результате мутантные матричные нуклеиновые кислоты один и тот же праймер.
Как применяют в настоящем документе, фраза "несмежные мутации" относится к мутациям, которые представлены в отдельных олигонуклеотидных праймерах. Например, несмежные мутации вносят в образующиеся в результате мутантные матричные нуклеиновые кислоты отдельно полученные олигонуклеотидные праймеры.
Термины "последовательность дикого типа" или "ген дикого типа" используют в настоящем документе взаимозаменяемо для обозначения последовательности, которая является природной или встречается в природе в клетке-хозяине. В некоторых вариантах осуществления последовательность дикого типа относится к представляющей интерес последовательности, которая является отправной точкой программы белковой инженерии. Последовательность дикого типа может кодировать гомологичный, или гетерологичный белок. Гомологичный белок представляет собой белок, который клетка-хозяин может продуцировать без вмешательства. Гетерологичный белок представляет собой белок, который клетка без вмешательства продуцировать не может.
Как применяют в настоящем документе, термин "антитела" относится к иммуноглобулинам. Антитела включают в качестве неограничивающих примеров иммуноглобулины, полученные непосредственно у любых видов, у которых желательно получать антитела. Кроме того, настоящее изобретение относится к модифицированным антителам. Термин также относится к фрагментам антител, которые сохраняют способность связываться с эпитопом, с которым связывается интактное антитело, и включает поликлональные антитела, моноклональные антитела, химерные антитела, антиидиотипические (анти-ID) антитела. Фрагменты антител включают в качестве неограничивающих примеров, определяющие комплементарность области (CDR), одноцепочечные фрагменты вариабельных областей (scFv), вариабельную область тяжелой цепи (VH), вариабельную область легкой цепи (VL). В настоящее изобретение также включены поликлональные и моноклональные антитела. Предпочтительно антитела представляют собой моноклональные антитела.
Термин "стабильный к окислению" относится к протеазам по настоящему изобретению, которые сохраняют определенную степень ферментативной активности в течение данного периода времени в условиях, преобладающих в течение процесса протеолиза, гидролиза, очистки или другого процесса по изобретению, например, при воздействии отбеливателей или окислителей или в контакте с ними. В некоторых вариантах осуществления протеазы после контакта с отбеливателем или окислителем в течение данного периода времени, например по меньшей мере 1 минуты, 3 минут, 5 минут, 8 минут, 12 минут, 16 минут, 20 минут и т.д. сохраняют по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98% или 99% протеолитической активности. В некоторых вариантах осуществления стабильность измеряют, как описано в примерах.
Термин "стабильный к хелаторам" относится к протеазам по настоящему изобретению, которые сохраняют определенную степень ферментативной активности в течение данного периода времени в условиях, преобладающих в течение процесса протеолиза, гидролиза, очистки или другого процесса по изобретению, например, при воздействии хелаторов или контакте с ними. В некоторых вариантах осуществления протеазы после контакта с хелатором в течение данного периода времени, например по меньшей мере 10 минут, 20 минут, 40 минут, 60 минут, 100 минут и т.д. сохраняют по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98% или 99% протеолитической активности. В некоторых вариантах осуществления стабильность к хелаторам измеряют, как описано в примерах.
Термины "термически стабильный" и "термостабильный" относятся к протеазам по настоящему изобретению, которые сохраняют определенную степень ферментативной активности после воздействия в течение данного периода времени указанных температур в условиях, преобладающих в течение процесса протеолиза, гидролиза, очистки или другого процесса по изобретению, например, при воздействии измененных температур. Измененные температуры включают увеличенные или сниженные температуры. В некоторых вариантах осуществления протеазы после воздействия измененных температур в течение данного периода времени, например по меньшей мере 60 минут, 120 минут, 180 минут, 240 минут, 300 минут и т.д. сохраняют по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98% или 99% протеолитической активности. В некоторых вариантах осуществления термостабильность определяют, как описано в примерах.
Термин "увеличенная стабильность" по отношению к протеазе, стабильной к окислению, хелатору, температуре и/или pH, относится к более высокой сохраняющейся протеолитической активности в течение промежутка времени по сравнению с другими сериновыми протеазами (например, субтилизиновыми протеазами) и/или ферментами дикого типа.
Термин "сниженная стабильность" по отношению к протеазе, стабильной к окислению, хелатору, температуре и/или pH, относится к меньшей сохраняющейся протеолитической активности в течение промежутка времени по сравнению с другими сериновыми протеазами (например, субтилизиновыми протеазами) и/или ферментами дикого типа.
Термин "очищающая активность" относится к эффективности очистки, достигаемой с протеазой в условиях, преобладающих в течение процесса протеолиза, гидролиза, очистки или другого процесса по изобретению. В некоторых вариантах осуществления эффективность очистки определяют, применяя различные анализы очистки, относящиеся к чувствительным к ферментам загрязнителям, например, траве, крови, молоку или яичному белку, как определяют различными способами хроматографии, спектрофотометрии или другими количественными способами, после применения к загрязнителям стандартных условий стирки. Иллюстративные анализы в качестве неограничивающих примеров включают анализы, описанные в WO 99/34011 и патенте США 6605458 (которые оба включены в настоящий документ в качестве ссылки), а также способы, включенные в примеры.
Термин "эффективное очищающее количество" протеазы относится к количеству протеазы, описываемой выше в настоящем документе, которое достигает желаемого уровня ферментативной активности в конкретной чистящей композиции. Специалист в данной области легко определит такие эффективные количества, и они основаны на многих факторах, таких как конкретная используемая протеаза, применение очистки, конкретная композиция чистящей композиции и требуется ли жидкая или сухая (например, гранулированная, кусковая) композиция и т.д.
Как применяют в настоящем документе, термин "дополнительные чистящие вещества" означает любое жидкое, твердое или газообразное вещество, выбранное для конкретного желаемого типа чистящей композиции и формы продукта (например, жидкость, гранулированная композиция, порошок, кусковая форма, паста, аэрозоль, таблетка, гель или пенная композиция), где вещества также предпочтительно совместимы с протеазным ферментом, используемым в композиции. В некоторых вариантах осуществления гранулярные композиции находятся в "спрессованной" форме, тогда как в других вариантах осуществления жидкие композиции находятся в "концентрированной" форме.
Термин "улучшенная эффективность" по отношению к очищающей активности относится к увеличенной или большей очищающей активности в отношении определенных чувствительных к ферментам загрязнителей, таких как яйца, молоко, трава или кровь, как определяют посредством обычной оценки после стандартного цикла стирки и/или нескольких циклов стирки.
Термин "сниженная эффективность" по отношению к очищающей активности относится к уменьшенной или меньшей очищающей активности в отношении определенных чувствительных к ферментам загрязнителей, таких как яйца, молоко, трава или кровь, как определяют посредством обычной оценки после стандартного цикла стирки.
Термин "сравнительная эффективность" по отношению к очищающей активности относится по меньшей мере к 60%, по меньшей мере к 70%, по меньшей мере к 80%, по меньшей мере к 90%, по меньшей мере к 95% очищающей активности сравнительной субтилизиновой протеазе (например, коммерчески доступной протеазы), включая в качестве неограничивающих примеров протеазу OPTIMASE™ (Genencor), протеазные продукты PURAFECT™ (Genencor), протеазу SAVINASE™ (Novozymes), варианты BPN' (см., например, патент США № Re 34606), протеазы RELASE™, DURAZYME™, EVERLASE™, KANNASE™ (Novozymes), протеазы MAXACAL™, MAXAPEM™, PROPERASE™ (Genencor; также см., патент США № Re 34606, и патенты США №№ 5700676; 5955340; 6312936 и 6482628), и продукты вариантов протеаз B. lentus (например, продукты, описанные в WO 92/21760, WO 95/23221 и/или WO 97/07770). Иллюстративные субтилизиновые варианты протеаз включают в качестве неограничивающих примеров варианты с заменами или делециями по положениям остатков, эквивалентным положениям 76, 101, 103, 104, 120, 159, 167, 170, 194, 195, 217, 232, 235, 236, 245, 248 и/или 252 BPN'. Эффективность очистки можно определять, сравнивая протеазы по настоящему изобретению с субтилизиновыми протеазами в различных анализах очистки, относящихся к чувствительным к ферментам загрязнителям, таким как трава, кровь или молоко, как определяют обычными спектрофотометрическими или аналитическими способами после стандартных условий циклов стирки.
Как применяют в настоящем документе, система с "низкой концентрацией детергента" включает детергенты, где в воде для стирки присутствует менее чем приблизительно 800 м.д. детергентных компонентов. Как правило, в качестве систем с низкой концентрацией детергента, рассматривают японские детергенты, так как они в воде для стирки, как правило, содержат приблизительно 667 м.д. детергентных компонентов.
Как применяют в настоящем документе, системы со "средней концентрацией детергента" включают детергенты, где в воде для стирки присутствует приблизительно от 800 м.д. до приблизительно 2000 м.д. детергентных компонентов. Как правило, в качестве систем со средней концентрацией детергента, рассматривают североамериканские детергенты, так как они в воде для стирки, как правило, содержат приблизительно 975 м.д. детергентных компонентов. Бразильские детергенты, как правило, содержат в воде для стирки приблизительно 1500 м.д. детергентных компонентов.
Как применяют в настоящем документе, системы с "высокой концентрацией детергента" включает детергенты, где в воде для стирки присутствует более чем приблизительно 2000 м.д. детергентных компонентов. Как правило, в качестве систем с высокой концентрацией детергента рассматривают европейские детергенты, так как они в воде для стирки содержат приблизительно 3000-8000 м.д. детергентных компонентов.
Как применяют в настоящем документе, "композиции для очистки тканей" включают детергенты для ручной стирки и машинной стирки, включая аддитивные композиции для стирки и композиции, пригодные для использования для выдерживания и/или предварительной очистки загрязненных тканей (например, одежды, полотен и других текстильных материалов).
Как применяют в настоящем документе, "композиции для очистки отличных от тканей материалов" включают чистящие композиции для нетекстильных (т.е. тканевых) поверхностей, включая в качестве неограничивающих примеров детергенты для мытья посуды, композиции для чистки ротовой полости, композиции для чистки зубов и композиции для личной гигиены.
"Спрессованную" форму чистящих композиций по настоящему документу лучше всего отражать посредством плотности и, в зависимости от композиции, посредством количества неорганической наполнительной соли. Неорганические наполнительные соли представляют собой традиционные ингредиенты детергентных композиций в порошковой форме. В традиционных детергентных композициях наполнительные соли присутствуют в существенных количествах, как правило, 17-35% по массе от общей композиции. В отличие от этого, в спрессованных композициях, наполнительная соль присутствует в количествах, не превосходящих 15% от общей композиции. В некоторых вариантах осуществления наполнительная соль присутствует в количествах, не превосходящих 10% или, более предпочтительно, 5% по массе композиции. В некоторых вариантах осуществления неорганические наполнительные соли выбраны из сульфатов и хлоридов щелочных или щелочноземельных металлов. Предпочтительной наполнительной солью является сульфат натрия.
II. Ферменты сериновых протеаз по настоящему изобретению и их последовательности
Настоящее изобретение относится к выделенным полинуклеотидам, кодирующим аминокислотные последовательности, кодирующие варианты протеаз. В патентной заявке США с серийным № 10/576331, в полном объеме включенной в качестве ссылки, предоставлены различные протеазы, включая сериновую протеазу Cellulomonas дикого типа, а также многочисленные варианты протеаз, кодирующих сигнальный пептид последовательностей и аминокислотных последовательностей. В некоторых предпочтительных вариантах осуществления настоящего изобретения, вид Cellulomonas представляет собой штамм Cellulomonas 69B4 (DSM16035), как описано в патентной заявке США с серийным № 10/576331.
A. Сериновые протеазы
Хотя в данном виде организмов могут существовать вариации последовательности встречающегося в природе фермента, ферменты конкретного типа, продуцируемые организмами одного вида, как правило, являются по существу идентичными в отношении субстратной специфичности и/или уровней протеолитической активности в данных условиях (например, температуре, pH, твердости воды, окислительных условиях, условиях комплексообразования и концентрации) и т.д. Таким образом, для целей настоящего изобретения полагают, что другие штаммы и виды Cellulomonas также продуцируют протеазу Cellulomonas по настоящему изобретению и, таким образом, представляют собой пригодные источники протеазы по настоящему изобретению. Фактически, как представлено в настоящем документе, полагают, что по настоящему изобретению найдут применение другие представители Micrococcineae.
В некоторых вариантах осуществления протеолитические полипептиды по данному изобретению характеризуют физико-химически, тогда как в других вариантах осуществления их характеризуют на основе их функциональности, а в дополнительных вариантах осуществления их характеризуют с использованием обоих наборов этих свойств. При физико-химической характеристики пользуются преимуществом хорошо известных способов, таких как SDS-электрофорез, гель-фильтрация, аминокислотная композиция, масс-спектрометрия (например, MALDI-TOF-MS, LC-ES-MS/MS и т.д.) и седиментация для определения молекулярной массы белков, изоэлектрофокусирования для определения pI белков, секвенирования аминокислот для определения аминокислотных последовательностей белка, кристаллографических исследований для определения третичных структур белков и связывание антител для определения антигенных эпитопов, присутствующих в белках.
В некоторых вариантах осуществления функциональные характеристики определяют хорошо известными специалистам в области протеаз способами, и они включают в качестве неограничивающих примеров гидролиз различных коммерческих субстратов, таких как диметилказеин ("DMC") и/или AAPF-pNA. Этот предпочтительный способ функциональной характеристики более подробно описан в представленных примерах.
Зрелая протеаза также демонстрирует протеолитическую активность (например, гидролитическая активность в отношении субстрата с пептидными связями), такого как DMC. В дополнительных вариантах осуществления протеазы по настоящему изобретению обеспечивают улучшенную эффективность стирки в указанных условиях. Хотя, как описано в настоящем документе, настоящее изобретение относится к протеазе 69B, в некоторых вариантах осуществления протеазы по настоящему изобретению по сравнению с протеолитической активностью 69B4 демонстрируют, по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98% или 99% протеолитическую активность. В некоторых вариантах осуществления протеазы демонстрируют по меньшей мере 50%, 60%, 70%, 75%, 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98% или 99% протеолитическую активность по сравнению с протеолитической активностью протеаз, продаваемых под торговыми марками SAVINASE® (Novzymes) или PURAFECT® (Genencor) в тех же условиях. В некоторых вариантах осуществления протеазы по настоящему изобретению демонстрируют сравнительную или улучшенную эффективность стирки в указанных условиях по сравнению с 69B4 в тех же условиях. В некоторых предпочтительных вариантах осуществления протеазы по настоящему изобретению демонстрируют сравнительную или улучшенную эффективность стирки в указанных условиях по сравнению с протеазами, продаваемыми под торговыми марками SAVINASE® (Novozymes) или PURAFECT® (Genencor) в тех же условиях.
В дополнительных вариантах осуществления протеазы и/или полинуклеотиды, кодирующие протеазы по настоящему изобретению, предоставлены в очищенной форме (т.е. присутствуют в конкретной композиции в большей или меньшей концентрации, чем существует во встречающемся в природе организме или организме дикого типа) или в сочетании с компонентам обычно не присутствующими при экспрессии во встречающемся в природе организме или организме дикого типа. Однако не следует понимать, что настоящее изобретение ограничено протеазами какого-либо конкретного уровня очистки, так как в различных применениях, в которых подходят протеазы по настоящему изобретению, находят применение различные диапазоны очистки протеаз.
B. Нуклеиновые и аминокислотные последовательности сериновых протеаз
Ниже представлена последовательность ДНК гена asp (SEQ ID NO:1), полученная из штамма Cellulomonas 69B4 (DSM 16035). Инициирующий полинуклеотид, кодирующий сигнальный пептид протеазы штамма Cellulomonas 69B4 обозначен жирным шрифтом (ATG). Эта последовательность также включает сигнальный пептид и сериновую протеазу-предшественник.
Следующая последовательность ДНК (SEQ ID NO:2) кодирует сигнальный пептид (SEQ ID NO:9), который функционально связан протеазой-предшественником (SEQ ID NO:7), получаемой из штамма Cellulomonas 69B4 (DSM 16035). Инициирующий полинуклеотид, кодирующий сигнальный пептид протеазы штамма Cellulomonas 69B4 представлен жирным шрифтом (ATG). Терминирующий кодон (TGA) начинается с остатка 1486. Остатки 85, 595 и 1162, относящиеся к инициирующим остаткам N-концевой пропоследовательности, зрелой последовательности и карбоксиконцевой пропоследовательности, соответственно, обозначены жирным шрифтом и подчеркнуты.
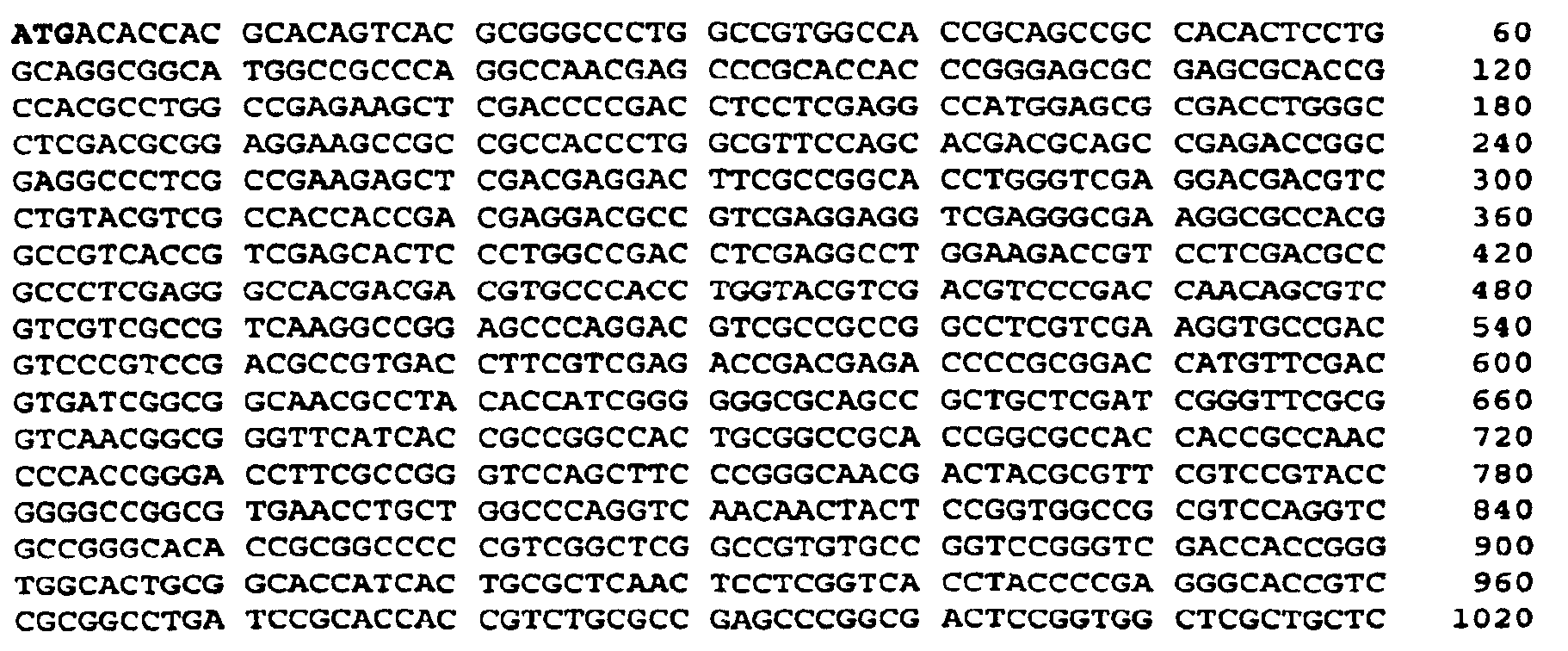

Представленная ниже последовательность ДНК (SEQ ID NO:3) кодирует протеазу-предшественник, получаемую из штамма Cellulomonas 69B4 (DSM 16035).


Представленная ниже последовательность ДНК (SEQ ID NO:4) кодирует зрелую протеазу, получаемую из штамма Cellulomonas 69B4 (DSM 16035).

Представленная ниже последовательность ДНК (SEQ ID NO:5) кодирует сигнальный пептид, получаемый из штамма Cellulomonas 69B4 (DSM 16035)

Представленная ниже последовательность представляет собой аминокислотную последовательность (SEQ ID NO:6) сигнальной последовательности и протеазы-предшественника, получаемых из штамма Cellulomonas 69B4 (DSM 16035), включая сигнальную последовательность [участки 1a-c] (остатки 1-28 [от -198 до -171]), N-концевую пропоследовательность [участки 2a-r] (остатки 29-198 [от -170 до -1]), зрелую протеазу [участки 3a-t] (остатки 199-387 [1-189]) и C-концевую пропоследовательность [участки 4a-l] (остатки 388-495 [190-398]), кодируемые последовательностями ДНК, указанными в SEQ ID NO: 1, 2, 3 и 4. N-концевая последовательность аминокислотной последовательности зрелой протеазы приведена жирным шрифтом.


Представленная ниже последовательность (SEQ ID NO:7) представляет собой аминокислотную последовательность протеазы-предшественника, получаемой из штамма Cellulomonas 69B4 (DSM 16035) (SEQ ID NO:7).

Представленная ниже последовательность (SEQ ID NO:8) представляет собой аминокислотную последовательность зрелой протеазы, получаемой из штамма Cellulomonas 69B4 (DSM 16035). Остатки H32, D56 и S132 каталитической триады приведены жирным шрифтом и подчеркнуты.

Представленная ниже последовательность (SEQ ID NO:9) представляет собой аминокислотную последовательность сигнального пептида протеазы, получаемой из штамма Cellulomonas 69B4 (DSM 16035).
1 MTPRTVTRAL AVATAAATLL AGGMAAQA (SEQ ID NO:9)
В некоторых вариантах осуществления настоящее изобретение относится к вариантам, которые содержат по меньшей мере часть приведенного в SEQ. ID NO:1 полинуклеотида длиной приблизительно 1621 пар оснований. В некоторых особенно предпочтительных вариантах осуществления настоящее изобретение относится к вариантам, содержащим по сравнению с сериновой протеазой дикого типа (например, "исходной") несколько мутаций. В некоторых из этих особенно предпочтительных вариантах осуществления эти варианты с несколькими мутациями демонстрируют по сравнению с сериновой протеазой дикого типа (например, "исходной") улучшенную эффективность.
Как понятно специалистам в данной области, сигнальный пептид, протеазу-предшественника и/или зрелую протеазу, предоставленные по настоящему документу и/или из патентной заявки США с серийным № 10/576331, в полном объеме включенной в качестве ссылки (например, SEQ ID NO: 6, 7 и/или 8 из патентной заявки США с серийным № 10/576331), или протеазу с % идентичности последовательности, описанную выше, вследствие вырожденности генетического кода могут кодировать несколько полинуклеотидов. Другой вариант осуществления настоящего изобретения относится к полинуклеотиду, содержащему нуклеотидную последовательность по меньшей мере с 70% идентичностью последовательности, по меньшей мере с 75% идентичностью последовательности, по меньшей мере с 80% идентичностью последовательности, по меньшей мере с 85% идентичностью последовательности, по меньшей мере с 90% идентичностью последовательности, по меньшей мере с 92% идентичностью последовательности, по меньшей мере с 95% идентичностью последовательности, по меньшей мере с 97% идентичностью последовательности, по меньшей мере с 98% идентичностью последовательности и, по меньшей мере с 99% идентичностью последовательности с полинуклеотидными последовательностями SEQ ID NO: 2, 3 и/или 4, соответственно, кодирующими сигнальный пептид и протеазу-предшественника, протеазу-предшественника и/или зрелую протеазу, соответственно.
В дополнительных вариантах осуществления настоящее изобретение относится к фрагментам или участкам ДНК, которая кодирует протеазы, при условии, что кодируемый фрагмент сохраняет протеолитическую активность. Другой вариант осуществления настоящего изобретения относится к полинуклеотидам по меньшей мере с 20% длиной последовательности, по меньшей мере с 30% длиной последовательности, по меньшей мере с 40% длиной последовательности, по меньшей мере с 50% длиной последовательности, по меньшей мере с 60% длиной последовательности, 70% длиной последовательности, по меньшей мере с 75% длиной последовательности, по меньшей мере с 80% длиной последовательности, по меньшей мере с 85% длиной последовательности, по меньшей мере с 90% длиной последовательности, по меньшей мере с 92% длиной последовательности, по меньшей мере с 95% длиной последовательности, по меньшей мере с 97% длиной последовательности, по меньшей мере с 98% длиной последовательности и, по меньшей мере с 99% последовательностью от полинуклеотидной последовательности SEQ ID NO:1, кодирующей протеазу-предшественника. В альтернативных вариантах осуществления эти фрагменты или участки последовательности представляют собой смежные участки последовательности, пригодные для перестановки последовательности ДНК в рекомбинантных последовательностях ДНК (см. например, патент США № 6132970).
Другой вариант осуществления изобретения включает фрагменты ДНК, описываемые в настоящем документе, которые находят применение в соответствии с известными в данной области способами получения фрагментов ДНК частичной длины, допускающие использование для выделения или идентификации полинуклеотидов, кодирующих описываемый в настоящем документе фермент зрелой протеазы из Cellulomonas 69B4 или ее фрагмент с протеолитической активностью. Кроме того, представленная в SEQ ID NO:1 ДНК находит применение для идентификации гомологичных фрагментов ДНК из других видов, а особенно из видов Cellulomonas, кодирующих протеазу или ее часть с протеолитической активностью.
Кроме того, настоящее изобретение относится к использованию последовательностей праймеров или зондов, сконструированных на основе SEQ ID NO:1 или ее подходящего участка или фрагмента (например, по меньшей мере приблизительно 5-20 или 10-15 смежных нуклеотидов), в качестве зондов или праймеров для скрининга нуклеиновой кислоты геномного происхождения или происходящей из кДНК. В некоторых вариантах осуществления настоящее изобретение относится к ДНК-зондам желаемой длины (т.е. как правило, длиной от 100 до 1000 оснований) на основе последовательностей из SEQ ID NO:1.
В некоторых вариантах осуществления фрагменты ДНК отделяют электрофоретически, вырезают из геля и выделяют из агарового матрикса геля. В предпочтительных вариантах осуществления этот очищенный фрагмент ДНК затем метят (с использованием, например, системы мечения Megaprime по инструкциям производителя) c включением в ДНК P32. Меченый зонд денатурируют нагреванием до 95°C в течение данного периода времени (например, 5 минут) и сразу же добавляют к мембране и раствору для предгибридизации. Реакцию гибридизации проводят в течение соответствующего периода времени и в соответствующих условиях (например, 18 часов при 37°C) при слабом перемешивании или вращении. Мембрану промывают (например, дважды в SSC/0,3% SDS), а затем отмывают в соответствующем отмывочном растворе при слабом перемешивании. Желаемая жесткость представляет собой отражение условий, в которых отмывают мембрану (фильтр). В некоторых вариантах осуществления по настоящему документу, условия с "низкой жесткостью" включают отмывку раствором 0,2× SSC/0,1% SDS при 20°C в течение 15 минут, тогда как в других вариантах осуществления условия со "средней жесткостью", включают дополнительный этап отмывки, включающий отмывку раствором 0,2× SSC/0,1% SDS при 37°C в течение 30 минут, тогда как в других вариантах осуществления условия с "высокой жесткостью" включают дополнительный этап отмывки, включающий отмывку раствором 0,2× SSC/0,1% SDS при 37°C в течение 45 минут, а в дополнительных вариантах осуществления условия с "максимальной жесткостью" включают дополнительный этап отмывки, включающий отмывку раствором 0,2× SSC/0,1% SDS при 37°C в течение 60 минут. Таким образом, в различных вариантах осуществления настоящего изобретения предоставлены полинуклеотиды, способные гибридизоваться с зондом, получаемым из нуклеотидной последовательности, приведенной в SEQ ID NO: 1 или 2, в условиях со средней, высокой и/или максимальной жесткостью.
После отмывки мембрану сушат и детектируют связавшийся зонд. Если в качестве метящего средства используют P32 или другой радиоактивный изотоп, связавшийся зонд детектируют посредством авторадиографии. Специалистам в данной области хорошо известны другие способы для визуализации других зондов. Обнаружение связавшегося зонда означает, что последовательность нуклеиновой кислоты обладает желаемой гомологией и, таким образом, идентичностью с любой представляющей интерес последовательностью, предоставленной в настоящем документе, и находится в объеме данного изобретения. Таким образом, настоящее изобретение относится к способам детекции нуклеиновой кислоты, кодирующей протеазу по настоящему изобретению, которые включают гибридизацию части или всей последовательности нуклеиновой кислоты SEQ ID NO:1 с другой нуклеиновой кислотой геномного происхождения или происходящей из кДНК.
Как указано выше, для придания определенной " жесткости", как определено ниже, в других вариантах осуществления условия гибридизации основываются на температуре плавления (Tm) связывающегося комплекса нуклеиновых кислот. "Максимальная жесткость", как правило, соответствует приблизительно Tm-5°C (5°C ниже Tm зонда); "высокая жесткость" - приблизительно от 5°C до 10°C ниже Tm; "промежуточная жесткость" - приблизительно от 10°C до 20°C ниже Tm; и "низкая жесткость" - приблизительно от 20°C до 25°C ниже Tm. Как известно специалистам в данной области, среднюю, высокую и/или максимальную жесткость гибридизация выбирают так, чтобы условия были оптимизированы для идентификации или детекции гомологичных полинуклеотидных последовательностей или эквивалентных полинуклеотидных последовательностей.
В дополнительных вариантах осуществления настоящее изобретение относится к конструкциям нуклеиновой кислоты (т.е. экспрессирующим векторам), содержащим полинуклеотиды, кодирующие протеазы по настоящему изобретению. В дополнительных вариантах осуществления настоящее изобретение относится к клеткам-хозяевам, трансформированным по меньшей мере одним из этих векторов.
В дополнительных вариантах осуществления настоящее изобретение относится к полинуклеотидным последовательностям, дополнительно кодирующим сигнальную последовательность, как описано в патентной заявке США с серийным № 10/576331, в полном объеме включенной в качестве ссылки. В некоторых из этих вариантов осуществления настоящее изобретение относится к последовательности с предполагаемой сигнальной последовательностью и к полинуклеотидам способным к гибридизации с зондом, получаемым из нуклеотидной последовательности, приведенной SEQ ID NO:1 в условиях со средней, высокой и/или максимальной жесткостью, где сигнальные последовательности обладают по существу такой же сигнальной активностью, как сигнальная последовательность, кодируемая полинуклеотидом по настоящему изобретению.
В некоторых вариантах осуществления о сигнальной активности свидетельствует по существу такой же уровень секреции протеазы в ферментационную среду, как и у исходного вещества, как описано в патентной заявке США с серийным № 10/576331. Дополнительные средства определения уровней секреции гетерологичного или гомологичного белка в грамположительной клетке-хозяине и детекции секретируемых белков включают использование поликлональных или моноклональных антител, специфичных для данного белка. Как хорошо известно в данной области, примеры включают твердофазный иммуноферментный анализ (ELISA), радиоиммунологический анализ (RIA) и активируемую флуоресценцией сортировку клеток (FACS).
Дополнительные аспекты настоящего изобретения включают полипептиды, с протеолитической активностью, с 65% идентичностью аминокислотной последовательности, по меньшей мере, с 70% идентичностью последовательности, по меньшей мере, с 75% идентичностью аминокислотной последовательности, по меньшей мере, с 80% идентичностью аминокислотной последовательности, по меньшей мере, с 85% идентичностью аминокислотной последовательности, по меньшей мере, с 90% идентичностью аминокислотной последовательности, по меньшей мере, с 92% идентичностью аминокислотной последовательности, по меньшей мере, с 95% идентичностью аминокислотной последовательности, по меньшей мере, с 97% идентичностью аминокислотной последовательности, по меньшей мере, с 98% идентичностью аминокислотной последовательности и, по меньшей мере, с 99% идентичностью аминокислотной последовательности с аминокислотной последовательностью SEQ ID NO: 7 или 8, и как описано в настоящем документе и в патентной заявке США с серийным № 10/576331. Протеолитическую активность этих полипептидов определяют известными в данной области способами, и они включают такие способы, как способы, используемые для оценки действия детергента. В дополнительных вариантах осуществления полипептиды являются выделенными.
III. Получение полинуклеотидов, кодирующих протеазы Micrococcineae (например, Cellulomonas) по настоящему изобретению
В некоторых вариантах осуществления нуклеиновую кислоту, кодирующую протеазу по настоящему изобретению получают стандартными способами, известными в данной области, например, из клонированной ДНК (например, "библиотеки" ДНК), химическим синтезом, клонированием кДНК, ПЦР, клонированием геномной ДНК или ее фрагментов или очищают из желаемой клетки, такой как клетка видов бактерий или грибов (см., например, Sambrook et al., выше [1989]; и Glover and Hames (eds.), DNA Cloning: A Practical Approach. Vols. 1 and 2, Second Edition). Синтез полинуклеотидных последовательностей хорошо известен в данной области (см., например, Beaucage and Caruthers, Tetrahedron Lett., 22:1859-1862 [1981]), включая использование автоматизированных синтезаторов (см., например, Needham-VanDevanter et al., Nucl. Acids Res., 12:6159-6168 [1984]). Последовательности ДНК также можно делать по заказу и получать из множества коммерческих источников. Как более подробно описано в настоящем документе, в некоторых вариантах осуществления последовательности нуклеиновой кислоты, полученные из геномной ДНК, в дополнение к кодирующим областям содержат регуляторные области.
В некоторых вариантах осуществления, включающих молекулярное клонирование гена из геномной ДНК, получают фрагменты ДНК, некоторые из которых содержат по меньшей мере часть желаемого гена. В некоторых вариантах осуществления ДНК расщепляют по специфическим участкам с использованием различных рестрикционных ферментов. В некоторых альтернативных вариантах осуществления для фрагментации ДНК используют ДНКазу в присутствии марганца, или ДНК физически разбивают (например, ультразвуком). Затем полученные линейные фрагменты ДНК разделяют по размеру и амплифицируют стандартными способами, включая в качестве неограничивающих примеров агарозу и электрофорез в полиакриламидном геле, ПЦР и колоночную хроматографию.
После получения фрагментов нуклеиновой кислоты рядом способов можно проводить идентификацию специфического фрагмента ДНК, кодирующего протеазу. Например, для детекции полученного гена в некоторых вариантах осуществления выделяют кодирующий протеолитический гидролизующий фермент ген asp или его специфическую РНК, или его фрагмент, такой как зонд или праймер, метят, а затем используют в гибридизационных анализах, хорошо известных специалистам в данной области (см., например, Benton and Davis, Science 196:180 [1977]; и Grunstein and Hogness, Proc. Natl. Acad. Sci. USA 72:3961 [1975]). В предпочтительных вариантах осуществления фрагменты ДНК, обладающие значительным сходством последовательностей с зондом, гибридизуют в условиях от средней до высокой жесткости.
В некоторых предпочтительных вариантах осуществления амплификацию проводят с применением ПЦР, как известно в данной области. В некоторых предпочтительных вариантах осуществления в качестве праймера для ПЦР используют последовательность нуклеиновой кислоты, по меньшей мере, приблизительно из 4 нуклеотидов и приблизительно до 60 нуклеотидов из SEQ ID NO:1-5, (т.е. фрагменты), предпочтительно, приблизительно от 12 до 30 нуклеотидов, а более предпочтительно - приблизительно 25 нуклеотидов в любом подходящем сочетании. Эти же фрагменты также находят применение в качестве зондов для способов гибридизации и детекции продукта.
В некоторых вариантах осуществления для выделения конструкций нуклеиновой кислоты по изобретению из библиотеки кДНК или геномной библиотеки применяют ПЦР с использованием вырожденных олигонуклеотидных праймеров, полученных на основе аминокислотной последовательности белка. Праймеры могут представлять собой участок любой длины, например по меньшей мере 4, по меньшей мере 5, по меньшей мере 8, по меньшей мере 15, по меньшей мере 20, нуклеотидов.
Ввиду указанного выше следует понимать, что полинуклеотидные последовательности, предоставленные по настоящему документу и основанные на полинуклеотидных последовательностях, приведенных в SEQ ID NO:1-5, пригодны для получения идентичных или гомологичных фрагментов полинуклеотидов из других видов, а особенно из бактерий, которые кодируют ферменты с активностью сериновых протеаз, демонстрируемой протеазой 69B4. Дополнительные последовательности предоставлены в патентной заявке США с серийным № 10/576331.
IV. Варианты сериновых протеаз по настоящему изобретению с несколькими мутациями
Как указано в настоящем документе, в особенно предпочтительных вариантах осуществления настоящее изобретение относится к вариантам сериновой протеазы с множественными мутациями. В некоторых наиболее предпочтительных вариантах осуществления эти варианты демонстрируют улучшенную эффективность по сравнению с исходной (например, дикого типа) протеазой. В некоторых из этих наиболее предпочтительных вариантах осуществления варианты обладают улучшенной эффективностью стирки, стабильностью в LAS и/или протеолитической активностью. Таким образом, эти варианты находят применение в многочисленных приложениях, включая в качестве неограничивающих примеров детергенты для мытья посуды, детергенты для стирки и детергенты для очищения поверхностей.
V. Экспрессия и выделение сериновых протеаз по настоящему изобретению
По настоящему документу находят применение любые подходящие средства для экспрессии и выделения сериновых протеаз по настоящему изобретению. Фактически, специалистам в данной области известно множество способов, подходящих для клонирования полученного из Cellulomonas полипептида с протеолитической активностью, а также дополнительного фермента (например, второй пептид с протеолитической активностью, такой как протеаза, целлюлаза, маннаназа или амилаза и т.д.). Также в данной области известно множество способов для введения в гены или геномы клеток-хозяев по меньшей мере одной (например, нескольких) копии полинуклеотида(ов), кодирующего фермент(ы) по настоящему изобретению в сочетании с любыми желаемыми дополнительными последовательностями.
В основном, при получении производного протеаза Cellulomonas 69B4 или его гомолога находят применение стандартные способы клонирования генов и введения экзогенных кодирующих протеазы областей (включая множественные копии экзогенных кодирующих областей) в указанные гены. Фактически, в настоящей спецификации, включая примеры, предоставлены такие указания. Однако также пригодны дополнительные известные в данной области способы (см., например, Sambrook et al. выше (1989); Ausubel et al., выше [1995]; и Harwood and Cutting, (eds.) "Molecular Biological Methods for Bacillus" John Wiley and Sons, [1990]; и WO 96/34946).
В некоторых предпочтительных вариантах осуществления полинуклеотидные последовательности по настоящему изобретению экспрессируют посредством их функционального связывания с контролирующими экспрессию последовательностями в подходящем экспрессирующем векторе и применяют посредством этого экспрессирующего вектора для трансформации подходящего хозяина общепринятыми в данной области способами. В некоторых вариантах осуществления полипептиды, полученные при экспрессии последовательностей ДНК по данному изобретению, выделяют из ферментационной среды клеточных культур и очищают множеством общепринятых в данной области способов. Специалисты в данной области могут выбрать наиболее подходящие способы выделения и очистки.
Более конкретно, настоящее изобретение относится к конструкциям, векторам, содержащим полинуклеотиды, описываемые в настоящем документе, клеткам-хозяевам, трансформированным такими векторами, протеазам, экспрессируемым такими клетками-хозяевами, способам и системам экспрессии для получения ферментов сериновых протеаз, получаемых из микроорганизмов, в частности, представителей Micrococcineae, включая в качестве неограничивающих примеров виды Cellulomonas. В некоторых вариантах осуществления полинуклеотид(ы), кодирующие сериновую протеазу(ы), используют для получения рекомбинантных клеток-хозяев, пригодных для экспрессии сериновых(ой) протеаз(ы). В некоторых предпочтительных вариантах осуществления экспрессирующие хозяева способны к продукции протеаз(ы) в коммерчески рентабельных количествах. Дополнительные подробности представлены в патентной заявке США с серийным № 10/576331.
VI. Рекомбинантные векторы и клетки-хозяева
Как указано выше, в некоторых вариантах осуществления настоящее изобретение относится к векторам, содержащим указанные выше полинуклеотиды. В некоторых вариантах осуществления вектора (т.е. конструкции) по изобретению, кодирующие протеазу, являются геномного происхождения (например, полученные с использованием геномной библиотеки и скрининга на последовательности ДНК, кодирующие всю протеазу или ее часть, посредством гибридизации с использованием синтетических олигонуклеотидных зондов в соответствии со стандартными способами). Эти вектора более подробно описаны в патентной заявке США с серийным № 10/576331.
Как указано выше, в некоторых вариантах осуществления настоящее изобретение также относится к клеткам-хозяевам, трансформированным описанными выше векторами. Дополнительные клетки-хозяева более подробно описаны в патентной заявке США с серийным № 10/576331.
VII. Применения для ферментов сериновых протеаз
Как более подробно описано в настоящем документе, протеазы по настоящему изобретению обладают важными характеристиками, которые делают их очень подходящими для определенных применений. Например, протеазы по настоящему изобретению обладают повышенной термостабильностью. В некоторых вариантах осуществления ферменты по сравнению с некоторыми известными в настоящее время протеазами также проявляют повышенную стабильность к окислению и повышенную стабильность к хелаторам. Таким образом, эти протеазы находят применение в чистящих композициях. Фактически, в определенных условиях стирки, протеазы по настоящему изобретению демонстрируют сравнительную или улучшенную эффективность стирки по сравнению с используемыми в настоящее время субтилизиновыми протеазы. Таким образом, полагают, что чистящие и/или ферментные композиции по настоящему изобретению можно предоставлять во множество чистящих композиций. В некоторых вариантах осуществления протеазы по настоящему изобретению используют таким же способом, как и субтилизиновые протеазы (т.е. используемые в настоящее время протеазы). Таким образом, протеазы по настоящему изобретению находят применение в различных чистящих композициях, а также в приложениях для кормов для животных, обработки кожи (например, мягчения), гидролиза белка и в использовании для текстильного производства. Идентифицированные протеазы также находят применение в приложениях для личной гигиены.
Таким образом, протеазы по настоящему изобретению находят применение в ряде промышленных приложений, в частности в очищающей, дезинфекционной областях индустрии, индустрии кормов для животных и текстильной/кожевенной индустрии. В некоторых вариантах осуществления протеаза(ы) по настоящему изобретению комбинируют с детергентами, добавками для повышения моющего действия, отбеливающими средствами и другими традиционными ингредиентами с получением множества новых чистящих композиций, пригодных для стирки и других областях очистки, например, таких как детергенты для стирки (порошковые и жидкие), средства для замачивания перед стиркой, все тканевые отбеливатели, детергенты для автоматического мытья посуды (жидкие и порошковые), бытовые чистящие средства, особенно применения для кускового и жидкого мыла, и очистители сливных отверстий. Кроме того, протеазы находят применение в очистке контактных линз, а также других элементов, посредством контакта таких материалов с водным раствором чистящей композиции. Кроме того эти встречающиеся в природе протеазы можно использовать, например для гидролиза пептидов, переработки отходов, текстильных приложений, очистки медицинского оборудования, удаления биопленки и в качестве разрезающих слитные белки ферментов при получении белка и т.д. Композиции этих продуктов не важны для настоящего изобретения, поскольку протеаза(ы) сохраняют свое действие в используемых условиях. В некоторых вариантах осуществления композиции легко получать, комбинируя эффективное очищающее количество протеазы или ферментной композиции, содержащей композицию протеазного фермента, с традиционными компонентами таких композиций в их известных в данной области количествах.
Протеазы по настоящему изобретению находят конкретное применение в очищающей индустрии, включая в качестве неограничивающих примеров детергенты для стирки и мытья посуды. В этих приложениях ферменты помещают в различные стрессовые факторы окружающей среды. Протеазы по настоящему изобретению дают преимущества относительно многих используемых в настоящее время ферментов, вследствие их стабильности в различных условиях.
Фактически, существует множество условий стирки, включая различные детергентные композиции, объемы воды для стирки, температуры воды для стирки и продолжительность мытья, которые воздействуют на протеазы, участвующие в стирке. Кроме того, детергентные композиции, используемые в различных географических регионах, содержат различные концентрации их соответствующих компонентов, присутствующих в воде для стирки. Например, европейский детергент, как правило, содержит в воде для стирки приблизительно 4500-5000 м.д. детергентных компонентов, тогда как японский детергент, как правило, содержит в воде для стирки приблизительно 667 м.д. детергентных компонентов. В Северной Америке, в частности в Соединенных Штатах, детергенты, как правило, содержат в воде для стирки приблизительно 975 м.д. детергентных компонентов.
Система с низкой концентрацией детергента содержит детергенты, где в воде для стирки присутствует менее чем приблизительно 800 м.д. детергентных компонентов. Как правило, в качестве системы с низкой концентрацией детергента, рассматривают японские детергенты, так как они в воде для стирки содержат приблизительно 667 м.д. детергентных компонентов.
Детергент со средней концентрацией включает детергенты, где в воде для стирки присутствует приблизительно от 800 м.д. до приблизительно 2000 м.д. детергентных компонентов. Как правило, в качестве систем со средней концентрацией детергента, рассматривают североамериканские детергенты, так как они в воде для стирки содержат приблизительно 975 м.д. детергентных компонентов. Бразильские детергенты, как правило, содержат в воде для стирки приблизительно 1500 м.д. детергентных компонентов.
Система с высокой концентрацией детергента включает детергенты, где в воде для стирки присутствует более чем приблизительно 2000 м.д. детергентных компонентов. Как правило, в качестве систем с высокой концентрацией детергента рассматривают европейские детергенты, так как они в воде для стирки содержат приблизительно 4500-5000 м.д. детергентных компонентов.
Латиноамериканские детергенты, как правило, являются высокопенными детергентами с фосфатной добавкой для повышения моющего действия, а диапазон детергентов, используемый в Латинской Америке, может попадать в средние и высокие концентрации детергентов, так как он находятся в диапазоне от 1500 м.д. до 6000 м.д. детергентных компонентов в воде для стирки. Как указано выше, в Бразилии в воде для стирки, как правило, содержится приблизительно 1500 м.д. детергентных компонентов. Однако системы с высокой концентрацией детергента в воде для стирки приблизительно до 6000 м.д. детергентных компонентов могут использовать в других географических регионах, где применяют высокопенный детергент с фосфатной добавкой для повышения моющего действия, не ограничиваясь другими странами Латинской Америки.
В свете указанного выше очевидно, что концентрации детергентных композиций в типичных моющих растворах во всем мире варьируют от менее чем приблизительно 800 м.д. детергентной композиции ("географические регионы с низкой концентрацией детергента"), например приблизительно 667 м.д. в Японии, до приблизительно от 800 м.д. до приблизительно 2000 м.д. ("географические регионы со средней концентрацией детергента"), например, приблизительно 975 м.д. в США и приблизительно 1500 м.д. в Бразилии, до более чем приблизительно 2000 м.д. ("географические регионы с высокой концентрацией детергента"), например, приблизительно от 4500 м.д. до приблизительно 5000 м.д. в Европе и приблизительно 6000 м.д. в географических регионах с высокопенным фосфатным средством с фосфатной добавкой для повышения моющего действия.
Концентрации типичных моющих растворов определяют эмпирически. Например, в США типичная стиральная машина вмещает объем моющего раствора приблизительно 64,4 л. Таким образом, для получения концентрации детергента в моющем растворе приблизительно 975 м.д., в 64,4 л моющего раствора необходимо добавить приблизительно 62,79 г детергентной композиции. Данное количество представляет собой обычное количество, отмеряемое в воду для стирки потребителем с использованием мерной чашки, предоставляемой с детергентом.
В качестве дополнительного примера в различных географических областях используют различные температуры стирки. Температура воды для стирки в Японии, как правило, меньше, чем температура воды для стирки, используемая в Европе. Например, температура воды для стирки в Северной Америке и Японии может составлять от 10 до 30°C (например, приблизительно 20°C), тогда как температура воды для стирки в Европе, как правило, составляет от 30 до 60°C (например, приблизительно 40°C).
В качестве дополнительного примера в различных географических областях, как правило, различается жесткость воды. Жесткость воды, как правило, описывают в зависимости от гран на галлон совокупных Ca2+/Mg2+. Жесткость представляет собой меру количества кальция (Ca2+) и магния (Mg2+) в воде. Большинство воды в Соединенных Штатах является жесткой, но степень жесткости варьирует. Вода от умеренно жесткой (60-120 м.д.) до жесткой (121-181 м.д.) содержит от 60 до 181 миллионных долей (преобразование миллионных долей в граны на галлон США представляет собой кол-во м.д. деленное на 17,1 равное гранам на галлон) твердых минералов (см. таблицу 13-1).
Жесткость воды в Европе, как правило, является большей, чем 10,5 (например, 10,5-20,0) гран на галлон совокупных Ca2+/Mg2+ (например, приблизительно 15 гран на галлон совокупных Ca2+/Mg2+). Жесткость воды в Северной Америке обычно выше, чем жесткость воды в Японии, но меньше чем жесткость воды в Европе. Жесткость воды в Северной Америке может составлять от 3 до 10 гран, 3-8 гран или приблизительно 6 гран. Жесткость воды в Японии, как правило, меньше, чем жесткость воды в Северной Америке, как правило, менее чем 4, например, 3 грана на галлон совокупных Ca2+/Mg2+.
Таким образом, в некоторых вариантах осуществления настоящее изобретение относится к протеазам, которые демонстрируют неожиданную эффективность стирки, по меньшей мере, в одном наборе условий стирки (например, температура воды, жесткость воды и/или концентрация детергента). В некоторых вариантах осуществления протеазы по настоящему изобретению по эффективность стирки сравнимы с субтилизиновыми протеазами. В некоторых вариантах осуществления протеазы по настоящему изобретению демонстрируют увеличенную эффективность стирки по сравнению с субтилизиновыми протеазами. Таким образом, в некоторых предпочтительных вариантах осуществления настоящего изобретения, предоставленные по настоящему документу протеазы демонстрируют увеличенную стабильность к окислению, увеличенную термостабильность и/или увеличенную стабильность к хелаторам.
В некоторых предпочтительных вариантах осуществления настоящее изобретение относится к протеазе ASP, а также к гомологам и вариантам данной протеазы. В особенно предпочтительных вариантах осуществления варианты ASP содержат в последовательности протеазы ASP дикого типа множественные замены. Эти протеазы находят применение в любых приложениях, в которых желательно очищать основанные на белках загрязнители с текстильных изделий или тканей.
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению составляют в виде детергентных композиций для ручной или машинной стирки, включая аддитивные композиции для стирки и композиции, пригодные для использования в предварительной очистке загрязненных тканей, добавляемые к ополаскивателю композиции для смягчения тканей, и композиции для применения в обычной бытовой деятельности для очистки твердых поверхностей, а также при мытье посуды. Специалистам в данной области хорошо известны различные препараты, которые можно использовать в качестве чистящих композиций. В предпочтительных вариантах осуществления протеазы по настоящему изобретению обладают сравнительной или улучшенной эффективностью в детергентных композициях (т.е. по сравнению с другими протеазами). В некоторых вариантах осуществления эффективность очистки оценивают, стандартными способами сравнивая протеазы по настоящему изобретению с субтилизиновыми протеазами в различных анализах очистки, где используют чувствительные к ферментам загрязнители, такие как яйца, траву, кровь, молоко и т.д. Фактически, специалистам в данной области хорошо известны спектрофотометрические и другие аналитические способы, используемые для оценки эффективности детергента в условиях стандартного цикла стирки.
Анализы, которые находят применение по настоящему изобретению, включают в качестве неограничивающих примеров анализы, описанные в WO 99/34011 и в патенте США № 6605458 (см., например, пример 3). В патенте США № 6605458 в примере 3 используют дозу детергента 3,0 г/л при pH 10,5, время стирки 15 минут, при 15°C, жесткость воды 6°dH, концентрация фермента 10 нМ в 150 мл аналитическом стакане со стеклянной палочкой для перемешивания, 5 кусков ткани (phi 2,5 см) в 50 мл, тестовый материал EMPA 117 из Center for Test Materials Holland. Измерение коэффициента отражения "R" на тестовом материале проводили при 460 нм с использованием фотометра Macbeth ColorEye 7000. Дополнительные способы предоставлены в примерах в настоящем документе. Таким образом, эти способы также находят применение в настоящем изобретении.
Добавление протеаз по изобретению к традиционным чистящим композициям не создает никаких конкретных ограничений для применения. Другими словами любые температура и pH, подходящие для детергента также подходят для композиций по настоящему изобретению, при условии, что значение pH находится в диапазоне, указанном в настоящем документе, а температура находится ниже описанной температуры денатурации протеаз. Кроме того, протеазы по настоящему изобретению находят применение в чистящих композициях, которые не включают детергенты, снова отдельно или в сочетании с добавками для повышения моющего действия и стабилизаторами.
При использовании в чистящих композициях или детергентах дополнительно рассматривают стабильность к окислению. Таким образом, в некоторых приложениях, эта стабильность увеличена, уменьшена или сравнима с субтилизиновыми протеазами, как желательно для различных применений. В некоторых предпочтительных вариантах осуществления желательна увеличенная стабильность к окислению. Некоторые из протеаз по настоящему изобретению находят конкретное применение в таких приложениях.
При использовании в чистящих композициях или детергентах дополнительно рассматривают термостабильность. Таким образом, в некоторых приложениях, эта стабильность увеличена, уменьшена или сравнима с субтилизиновыми протеазами, как желательно для различных применений. В некоторых предпочтительных вариантах осуществления желательна увеличенная термостабильность. Некоторые из протеаз по настоящему изобретению находят конкретное применение в таких приложениях.
При использовании в чистящих композициях или детергентах дополнительно рассматривают стабильность к хелаторам. Таким образом, в некоторых приложениях, эта стабильность увеличена, уменьшена или сравнима с субтилизиновыми протеазами, как желательно для различных применений. В некоторых предпочтительных вариантах осуществления желательна увеличенная стабильность к хелаторам. Некоторые из протеаз по настоящему изобретению находят конкретное применение в таких приложениях.
В некоторых вариантах осуществления настоящего изобретения предоставлены встречающиеся в природе протеазы, демонстрирующие модифицированную ферментативную активность при различных pH при сравнении с субтилизиновыми протеазами. Профиль активности pH представляет собой график зависимости pH от активности фермента и его можно построить, как описано в примерах и/или известными в данной области способами. В некоторых вариантах осуществления желательно получать встречающиеся в природе протеазы с более широкими профилями (т.е. протеазы с большей активностью в диапазоне pH, чем сравнимая субтилизиновая протеаза). В других вариантах осуществления ферменты не обладают значимо большей активностью при любом pH или имеют встречающиеся в природе гомологи с более узкими профилями (т.е. ферменты с увеличенной активностью при сравнении с субтилизиновыми протеазами при данном pH, и меньшей активностью в других случаях). Таким образом, в различных вариантах осуществления протеазы по настоящему изобретению имеют различающиеся оптимумы и/или диапазоны pH. Не следует понимать, что настоящее изобретение ограничено каким-либо конкретным pH или диапазоном pH.
В некоторых вариантах осуществления настоящего изобретения чистящие композиции содержат протеазы по настоящему изобретению на уровне от 0,00001% до 10% 69B4 и/или других протеаз по настоящему изобретению по массе композиции и остаток (например, от 99,999% до 90,0%), содержащий дополнительные чистящие вещества по массе композиции. В других аспектах по настоящему изобретению, чистящие композиции по настоящему изобретению содержат 69B4 и/или другие протеазы на уровне от 0,0001% до 10%, от 0,001% до 5%, от 0,001% до 2%, от 0,005% до 0,5% 69B4 или другой протеазы по настоящему изобретению по массе композиции и остаток чистящей композиции (например, от 99,9999% до 90,0%, от 99,999% до 98%, от 99,995% до 99,5% по массе), содержащей дополнительные чистящие вещества.
В некоторых вариантах осуществления предпочтительные чистящие композиции в дополнение к препарату протеазы по изобретению содержат один или несколько дополнительных ферментов или производных ферментов, которые обеспечивают эффективность очистки и/или преимущества по уходу за тканью. Такие ферменты включают в качестве неограничивающих примеров другие протеазы, липазы, кутиназы, амилазы, целлюлазы, пероксидазы, оксидазы (например, лакказа) и/или маннаназы.
В композициях по настоящему изобретению находит применение любая другая протеаза, пригодная для использования в щелочных растворах. Подходящие протеазы включают протеазы животного, растительного или микробного происхождения. В особенно предпочтительных вариантах осуществления используют микробные протеазы. В некоторых вариантах осуществления включены химически или генетически модифицированные мутанты. В некоторых вариантах осуществления протеаза представляет собой сериновую протеазу, предпочтительно щелочную микробную протеазу или трипсиноподобную протеазу. Примеры щелочных протеаз включают субтилизины, особенно субтилизины, происходящие из Bacillus (например, субтилизин, фермент B. lentus, фермент B. amyloliquefaciens, субтилизин Carlsberg, субтилизин 309, субтилизин 147 и субтилизин 168). Дополнительные примеры включают мутантные протеазы, описанные в патентах США. №№ RE 34606, 5955340, 5700676, 6312936 и 6482628, которые все включены в настоящий документ в качестве ссылки. Дополнительные примеры протеаз включают в качестве неограничивающих примеров трипсин (например, свиного или бычьего происхождения) и протеазу, описанную в WO 89/06270. Предпочтительные коммерчески доступные протеазные ферменты включают ферменты, продаваемые под торговыми марками MAXATASE®, MAXACAL™, MAXAPEM™, OPTICLEAN®, OPTIMASE®, PROPERASE®, PURAFECT® и PURAFECT® OXP (Genencor), ферменты, продаваемые под торговыми марками ALCALASE®, SAVINASE®, PRIMASE®, DURAZYM™, RELASE® и ESPERASE® (Novozymes); и фермент, продаваемый под торговой маркой BLAP™ (Henkel Kommanditgesellschaft auf Aktien, Duesseldorf, Germany). Различные протеазы описаны в W095/23221, WO 92/21760 и в патентах США №№ 5801039, 5340735, 5500364, 5855625. В US RE 34606 описан дополнительный вариант BPN ("вар. BPN' 1" и "вариант BPN 1"; как обозначено в настоящем документе). В US 5955340 и 5700676 описан дополнительный вариант GG36 ("вар. GG36 1" и "вариант GG36 1"; как обозначено в настоящем документе). В патентах США 6312936 и 6482628 описан дополнительный вариант GG36. В одном из аспектов настоящего изобретения чистящие композиции по настоящему изобретению содержат дополнительные протеазные ферменты на уровне от 0,00001% до 10% дополнительной протеазы по массе композиции и от 99,999% до 90,0% по массе композиции вспомогательных чистящих веществ. В других вариантах осуществления настоящего изобретения, чистящие композиции по настоящему изобретению также содержат, протеазы на уровне от 0,0001% до 10%, от 0,001% до 5%, от 0,001% до 2%, от 0,005% до 0,5% протеазы 69B4 (или ее гомологи или варианты) по массе композиции и остаток чистящей композиции (например, от 99,9999% до 90,0%, от 99,999% до 98%, от 99,995% до 99,5% по массе), содержащей дополнительные чистящие вещества.
Кроме того, по настоящему изобретению находит применение любая липаза, пригодная для использования в щелочных растворах. Подходящие липазы включают в качестве неограничивающих примеров липазы бактериального или грибкового происхождения. В данное изобретение включены химические или генетически модифицированные мутанты. Примеры пригодных липаз включают липазу Humicola lanuginosa (см., например, EP 258068 и EP 305216), липазу Rhizomucor miehei (см., например, EP 238023), липазу Candida, такую как липазу C. antarctica (например, липаза C. antarctica A или B; см., например, EP 214761), липазу Pseudomonas, такую как липаза P. alcaligenes и P. pseudoalcaligenes (см., например, EP 218272), липазу P. cepacia (см., например, EP 331376), липазу P. stutzeri (см., например, GB 1372034), липазу P. fluorescens, липазу Bacillus (например, липазу B. subtilis [Dartois et al., Biochem. Biophys. Acta 1131:253-260 [1993]); липазу B. stearothermophilus [см., например, JP 64/744992] и липазу B. pumilus [см., например, WO 91/16422]).
Кроме того, в некоторых вариантах осуществления настоящего изобретения находит применение ряд клонированных липаз, включая в качестве неограничивающих примеров, липазу Penicillium camembertii (см., Yamaguchi et al., Gene 103:61-67 [1991]), липазу Geotricum candidum (см., Schimada et al., J. Biochem., 106:383-388 [1989]) и различные липазы Rhizopus, такие как липаза R. delemar (см. Hass et al., Gene 109:117-113 [1991]), липаза R. niveus (Kugimiya et al., Biosci. Biotech. Biochem. 56:716-719 [1992]) и липаза R. oryzae.
В некоторых вариантах осуществления настоящего изобретения находят применение другие типы липолитических ферментов, такие как кутиназы, также включая в качестве неограничивающих примеров кутиназу, происходящую из Pseudomonas mendocina (см. WO 88/09367), или кутиназу, происходящую из Fusarium solani pisi (см. WO 90/09446).
Дополнительные подходящие липазы включают коммерчески доступные липазы, такие как M1 LIPASE™, LUMA FAST™ и LIPOMAX™ (Genencor); LIPOLASE® и LIPOLASE® ULTRA (Novozymes) и LIPASE P™ "Amano" (Amano Pharmaceutical Co. Ltd., Japan).
В некоторых вариантах осуществления настоящего изобретения чистящие композиции по настоящему изобретению дополнительно содержат липазы на уровне от 0,00001% до 10%, дополнительной липазы по массе композиции и остаток вспомогательных чистящих веществ по массе композиции. В других аспектах по настоящему изобретению, чистящие композиции по настоящему изобретению также содержат липазы на уровне от 0,0001% до 10%, от 0,001% до 5%, от 0,001% до 2%, от 0,005% до 0,5% липазы по массе композиции.
В некоторых вариантах осуществления настоящего изобретения также находит применение любая амилаза (альфа и/или бета), пригодная для использования в щелочных растворах. Подходящие амилазы включают в качестве неограничивающих примеров амилазы бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. Амилазы, которые находят применение по настоящему изобретению, включают в качестве неограничивающих примеров α-амилазы, получаемые из B. licheniformis (например, см. GB 1296839). Коммерчески доступные амилазы, которые находят применение по настоящему изобретению, включают в качестве неограничивающих примеров DURAMYL®, TERMAMYL®, FUNGAMYL®, STAINZYME® и BAN™ (Novozymes) и RAPIDASE® и MAXAMYL® P (Genencor International). В некоторых вариантах осуществления настоящего изобретения чистящие композиции по настоящему изобретению дополнительно содержат амилазы на уровне от 0,00001% до 10% дополнительной амилазы по массе композиции и остаток вспомогательных чистящих веществ по массе композиции. В других аспектах по настоящему изобретению чистящие композиции по настоящему изобретению также содержат амилазы на уровне от 0,0001% до 10%, от 0,001% до 5%, от 0,001% до 2%, от 0,005% до 0,5% амилазы по массе композиции.
В вариантах осуществления настоящего изобретения находят применение любые целлюлазы, пригодные для использования в щелочных растворах. Подходящие целлюлазы включают в качестве неограничивающих примеров целлюлазы бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. Подходящие целлюлазы включают в качестве неограничивающих примеров целлюлазы Humicola insolens (см., например, патент США № 4435307). Особенно подходящие целлюлазы представляют собой целлюлазы с преимуществами в отношении сохранения цвета (см., например, EP 0495257).
Коммерчески доступные целлюлазы, которые находят применение по настоящему изобретению включают в качестве неограничивающих примеров CELLUZYME® (Novozymes) и KAC-500(B)™ (Kao Corporation). В некоторых вариантах осуществления целлюлазы включены в качестве частей или фрагментов зрелых целлюлаз дикого типа или их вариантов, где часть на N-конце удалена (см., например, патент США № 5874276).
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению могут дополнительно содержать целлюлазы на уровне от 0,00001% до 10% дополнительной целлюлазы по массе композиции и остаток вспомогательных чистящих веществ по массе композиции. В других аспектах по настоящему изобретению чистящие композиции по настоящему изобретению также содержат целлюлазы на уровне от 0,0001% до 10%, от 0,001% до 5%, от 0,001% до 2%, от 0,005% до 0,5% целлюлазы по массе композиции.
По настоящему изобретению находят применение любые маннаназы, пригодные для использования в детергентных композициях и или щелочных растворах. Подходящие маннаназы включают в качестве неограничивающих примеров маннаназы бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. Известны различные маннаназы, которые находят применение по настоящему изобретению (см., например, патент США № 6566114, патент США № 6602842 и патент США № 6440991, которые все включены в настоящий документ в качестве ссылки).
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению могут дополнительно содержать маннаназы на уровне от 0,00001% до 10% дополнительной маннаназы по массе композиции и остаток вспомогательных чистящих веществ по массе композиции. В других аспектах по настоящему изобретению, чистящие композиции по настоящему изобретению также содержат, маннаназы на уровне от 0,0001% до 10%, от 0,001% до 5%, от 0,001% до 2%, от 0,005% до 0,5% маннаназы по массе композиции.
В некоторых вариантах осуществления используют пероксидазы в сочетании с пероксидом водорода или его источником (например, перкарбонатом, перборатом или персульфатом). В альтернативных вариантах осуществления используют оксидазы в сочетании с кислородом. Оба типа ферментов используют для "отбеливающего раствора" (т.е. для предотвращения переноса текстильного красителя с окрашенной ткани на другую ткань, когда ткани в моющей жидкости стирают вместе), предпочтительно совместно с усилителем (см., например, WO 94/12621 и WO 95/01426). Подходящие пероксидазы/оксидазы включают в качестве неограничивающих примеров пероксидазы/оксидазы растительного, бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты.
В некоторых вариантах осуществления чистящие композиции по настоящему изобретению могут дополнительно содержать пероксидазные и/или оксидазные ферменты на уровне от 0,00001% до 10% дополнительной пероксидазы и/или оксидазы по массе композиции и остаток вспомогательных чистящих веществ по массе композиции. В других аспектах по настоящему изобретению, чистящие композиции по настоящему изобретению также содержат пероксидазные и/или оксидазные ферменты на уровне от 0,0001% до 10%, от 0,001% до 5%, от 0,001% до 2%, от 0,005% до 0,5% пероксидазных и/или оксидазных ферментов по массе композиции.
В настоящее изобретение включены смеси указанных выше ферментов, в частности смесь фермента 69B4, одной или нескольких дополнительных протеаз, по меньшей мере, одной амилазы, по меньшей мере, одной липазы, по меньшей мере, одной маннаназы и/или, по меньшей мере, одной целлюлазы. Фактически, полагают, в настоящем изобретении находят применение различные смеси этих ферментов.
Полагают, что варьирующие уровни протеазы и одного или нескольких дополнительных ферментов могут независимо достигать 10%, а остаток чистящей композиции составляют дополнительные чистящие вещества. Конкретный выбор вспомогательных чистящих веществ легко сделать, принимая в расчет поверхность, предмет или ткань для очистки и желаемую форму композиции для условий очистки при использовании (например, используя детергент для стирки).
Примеры подходящих дополнительных чистящих веществ включают в качестве неограничивающих примеров, поверхностно-активные вещества, добавки для повышения моющего действия, отбеливатели, активаторы отбеливания, катализаторы отбеливания, другие ферменты, системы стабилизации фермента, хелаторы, оптические отбеливатели, грязеудаляющие полимеры, средства переноса красителя, дисперсанты, пеногасители, красители, ароматизаторы, красители, наполнительные соли, гидротропные вещества, фотоактиваторы, флуоресцирующие вещества, кондиционеры тканей, гидролизуемые поверхностно-активные вещества, консерванты, антиоксиданты, противоусадочные средства, средства против образования складок, гермициды, фунгициды, цветные гранулы, silvercare, препятствующие осмолению средства и/или противокоррозионные средства, источники щелочной среды, растворители, носители, технологические добавки, пигменты и контролирующие pH средства (см., например, патенты США №№ 6610642, 6605458, 5705464, 5710115, 5698504, 5695679, 5686014 и 5646101, которые все включены в настоящий документ в качестве ссылки). Варианты осуществления конкретных материалов чистящих композиций подробно проиллюстрированы ниже.
Если дополнительные чистящие вещества в чистящих композициях не совместимы с протеазами по настоящему изобретению, то используют подходящие способы содержания дополнительных чистящих веществ и протеаз(ы) в раздельном виде (т.е. вне контакта друг с другом) пока комбинация двух компонентов не станет подходящей. Такие способы разделения включают любой подходящий известный в данной области способ (например, желатиновые капсулы, инкапсуляцию, таблетки, физическое разделение и т.д.).
Предпочтительно эффективное количество одной или нескольких протеаз, предоставляемых по настоящему документу, включено в композиции, пригодные для очистки множества поверхностей, нуждающихся в удалении белковых загрязнений. Такие чистящие композиции включают чистящие композиции для таких приложений, как очистка твердых поверхностей, тканей и посуды. Фактически, в некоторых вариантах осуществления настоящее изобретение относится к композициям для очистки тканей, хотя в других вариантах осуществления настоящее изобретение относится к композициям для очистки отличных от тканей материалов. В частности настоящее изобретение также относится к чистящим композициям, подходящим для личной гигиены, включая композиции для ухода за полостью рта (включая зубные порошки, зубные пасты, жидкости для полоскания ротовой полости и т.д., а также композиции для очистки зубов), кожей и композиции для очищения волос. Следует понимать, что настоящее изобретение относится к детергентным композициям в любой форме (т.е. жидкость, гранулы, кусковая форма, полутвердая форма, гель, эмульсия, таблетки, капсулы и т.д.).
В качестве примера, ниже более подробно описаны некоторые чистящие композиции, где находит применение протеаза по настоящему изобретению. В вариантах осуществления, в которых чистящие композиции по настоящему изобретению составлены в качестве композиций, пригодных для использования в способе(ах) машинной стирки, композиции по настоящему изобретению предпочтительно содержат, по меньшей мере, одно поверхностно-активное вещество и, по меньшей мере, одно добавочное соединение для повышения моющего действия, а также одно или несколько дополнительных чистящих веществ, предпочтительно выбранных из органических полимерных соединений, отбеливающих средств, дополнительных ферментов, пеногасителей, дисперсантов, дисперсантов известковых мыл, почвенной суспензии и средств против отложений и ингибиторов коррозии. В некоторых вариантах осуществления композиции для стирки также содержат смягчающие средства (т.е. в виде добавочных дополнительных чистящих веществ).
Композиции по настоящему изобретению также находят применение в качестве детергентных добавок в твердой или жидкой форме. Такие добавки предназначены для дополнения и/или увеличения эффективности традиционных детергентных композиций и их можно добавлять на любом этапе процесса очистки.
В вариантах осуществления, составленных в виде композиций для применения в способах ручной мойки посуды, композиции по изобретению предпочтительно содержат по меньшей мере одно поверхностно-активное вещество, а предпочтительно - по меньшей мере, одно добавочное дополнительное чистящее вещество, выбранное из органических полимерных соединений, усиливающих пенообразование средств, ионов металлов группы II, растворителей, гидротропных веществ и дополнительных ферментов.
В некоторых вариантах осуществления плотность детергентных композиций для стирки по настоящему документу находится в диапазоне от 400 до 1200 г/литр, тогда как в других вариантах осуществления она находится в диапазоне от 500 до 950 г/литр композиции, когда ее измеряют при 20°C.
В некоторых вариантах осуществления совместно с протеазами по настоящему изобретению находят применение различные чистящие композиции, такие как чистящие композиции, представленные в патенте США № 6605458. Таким образом, в некоторых вариантах осуществления композиции, содержащие, по меньшей мере, одну протеазу по настоящему изобретению, представляют собой спрессованные гранулярные композиции для очистки тканей, тогда как в других вариантах осуществления композиция представляет собой гранулярную композицию для очистки тканей, пригодную для стирки окрашенных тканей, в дополнительных вариантах осуществления композиция представляет собой гранулярную композицию для очистки тканей, которая обеспечивает смягчение по всему рабочему объему стирки, в дополнительных вариантах осуществления композиция представляет собой высокопроизводительную жидкую композицию для очистки тканей.
В некоторых вариантах осуществления композиции, содержащие по меньшей мере одну протеазу по настоящему изобретению, представляют собой композиции для очистки тканей, такие как композиции, описанные в патенте США № 6610642 и патенте США № 6376450. Кроме того, протеазы по настоящему изобретению находят применение в гранулярных детергентных композициях для стирки для конкретного применения в условиях стирки для Европы или Японии (см., например, патент США 6610642).
В альтернативных вариантах осуществления настоящее изобретение относится к композициям для чистки твердых поверхностей, содержащим, по меньшей мере, одну протеазу по настоящему документу. Таким образом, в некоторых вариантах осуществления композиции, содержащие по меньшей мере одну протеазу по настоящему изобретению, представляют собой композиции для чистки твердых поверхностей, такие как композиции для чистки твердых поверхностей, описанные в патентах США №№ 6610642, патенте США № 6376450 и патенте США № 6376450.
В дополнительных вариантах осуществления настоящее изобретение относится к композициям для мытья посуды, содержащим по меньшей мере одну протеазу, предоставленную по настоящему документу. Таким образом, в некоторых вариантах осуществления композиции, содержащие по меньшей мере одну протеазу по настоящему изобретению, представляют собой композиции для чистки твердых поверхностей, такие как композиции для чистки твердых поверхностей, описанные в патенте США № 6610642 и патенте США № 6376450.
В дополнительных вариантах осуществления настоящее изобретение относится к композициям для мытья посуды, содержащим по меньшей мере одну протеазу, предоставленную по настоящему документу. Таким образом, в некоторых вариантах осуществления композиции, содержащие по меньшей мере одну протеазу по настоящему изобретению, содержат композиции для ухода за полостью рта, такие как композиции для ухода за полостью рта в патенте США № 6376450 и патенте США № 6376450.
Композиции и описания соединений и дополнительные чистящие вещества, содержащиеся в указанных выше патентах США №№ 6376450; 6605458; 6605458 и 6610642, явно включены в настоящий документ в качестве ссылки. Дополнительные примеры приведены ниже в примерах.
Дополнительно настоящее изобретение относится к композициям и способам для получения пищи или корма для животных, характеризующихся тем, что с пищей или кормом для животных смешана протеаза по изобретению. В некоторых вариантах осуществления протеазу добавляют в виде сухого продукта до обработки, тогда как в других вариантах осуществления ее добавляют в виде жидкости до или после обработки. В некоторых вариантах осуществления, в которых используют сухой порошок, фермент разводят в качестве жидкости на твердом носителе, таком как размолотое зерно. Протеазы по настоящему изобретению находят применение в качестве компонентов кормов и/или добавок для животных, таких как компоненты кормов и/или добавок для животных, описанные в патенте США № 5612055, патенте США № 5314692 и патент США № 5147642, которые, таким образом, все включены в данное описание в качестве ссылки.
Ферментная кормовая добавка по настоящему изобретению пригодна для получения рядом способов. Например, в некоторых вариантах осуществления ее получают, просто смешивая различные ферменты с подходящей активностью с получением ферментной смеси. В некоторых вариантах осуществления эту ферментную смесь непосредственно смешивают с кормом, тогда как в других вариантах осуществления ею обогащают вещество основанного на злаке носителя, такого как молотые пшеница, кукуруза или соевая мука. Настоящее изобретение также относится к этим обогащенным носителям, так как они находят применение в качестве ферментных кормовых добавок.
В некоторых альтернативных вариантах осуществления основанный на злаке носитель (например, молотая пшеница или кукуруза) обогащают одновременно или последовательно ферментами с соответствующей активностью. Например, в некоторых вариантах осуществления на носитель из молотой пшеницы вначале распыляют ксиланазу, потом протеазу и, необязательно, β-глюканазу. Настоящее изобретение также относится к этим обогащенным носителям, так как они находят применение в качестве ферментных кормовых добавок. В предпочтительных вариантах осуществления эти обогащенные носители содержат, по меньшей мере, одну протеазу по настоящему изобретению.
В некоторых вариантах осуществления кормовую добавку по настоящему изобретению непосредственно смешивают с кормом для животных, тогда как в альтернативных вариантах осуществления ее смешивают с одной или несколькими другими кормовыми добавками, такими как витаминная кормовая добавка, минеральная кормовая добавка и/или аминокислотная кормовая добавка. Затем полученную кормовую добавку, содержащую несколько различных типов компонентов в соответствующем количестве, смешивают с кормом.
В некоторых предпочтительных вариантах осуществления кормовую добавку по настоящему изобретению, включающую основанные на злаках носители, как правило, смешивают в количествах 0,01-50 г на килограмм корма, более предпочтительно - 0,1-10 г/килограмм, а наиболее предпочтительно - приблизительно 1 г/килограмм.
В альтернативных вариантах осуществления ферментная кормовая добавка по настоящему изобретению предусматривает конструирование рекомбинантных микроорганизмов, которые продуцируют желаемый фермент(ы) в желаемом относительном количестве. В некоторых вариантах осуществления это осуществляют, увеличивая число копий гена, кодирующего, по меньшей мере, одну протеазу по настоящему изобретению, и/или используя подходящий сильный промотор, функционально связанный с полинуклеотидом, кодирующим протеазу(ы). В дополнительных вариантах осуществления у штамма рекомбинантного микроорганизма определенные виды ферментативной активности по желанию устранены (например, целлюлазная, эндоглюканазная и т.д.).
В дополнительных вариантах осуществления ферментные кормовые добавки, предоставляемые по настоящему изобретению также содержат другие ферменты, включая в качестве неограничивающих примеров, по меньшей мере, одну из ксиланазы, α-амилазы, глюкоамилазы, пектиназы, маннаназы, α-галактозидазы, фитазы и/или липазы. В некоторых вариантах осуществления ферменты с желаемой активностью смешивают с ксиланазой и протеазой до обогащения ими основанного на злаке носителя, или, альтернативно, такой основанный на злаке носитель обогащают такими ферментами одновременно или последовательно. Затем носитель в свою очередь смешивают с основанным на злаках кормом с получением конечного корма. В альтернативных вариантах осуществления ферментную кормовую добавку составляют в виде раствора с отдельными видами ферментативной активностью, а затем смешивают с кормовым материалом, предварительно сформированным в виде гранул или в виде кормовой смеси.
В дополнительных вариантах осуществления ферментную кормовую добавку включают в рацион животных, добавляя ее во второй (т.е. другой) корм или питьевую воду для животных. Таким образом, то, чтобы ферментная смесь, предоставляемая по настоящему изобретению, сама была добавлена в основанный на злаках корм, не является необходимостью, хотя такое обогащение представляет собой особенно предпочтительный вариант осуществления настоящего изобретения. Отношение единиц ксиланазной активности на грамм кормовой добавки к единицам протеазной активности на грамм кормовой добавки предпочтительно составляет 1:0,001-1,000, более предпочтительно - 1:0,01-100, а наиболее предпочтительно - 1:0,1-10. Как указано выше, ферментная смесь, предоставляемая по настоящему изобретению, предпочтительно находит применение в качестве кормовой добавки для получения основанного на злаках корма.
В некоторых вариантах осуществления основанный на злаках корм содержит, по меньшей мере, 25% по массе, или более предпочтительно - по меньшей мере, 35% по массе, пшеницы или кукурузы или сочетание обоих этих злаков. Корм дополнительно содержит протеазу (т.е. по меньшей мере одну протеазу по настоящему изобретению) в таком количестве, чтобы корм содержал протеазу в таком количестве, чтобы корм включал 100-100000 единиц протеазной активности на кг.
Основанные на злаках корма, предоставленные по настоящему изобретению, находят применение в качестве кормов для множества не являющихся человеком животных, включая домашнюю птицу (например, индейка, гусь, утка, курица и т.д.), домашний скот (например, свинью, овцу, крупный рогатый скот, козу и т.д.) и домашних животных (например, лошадь, собака, кошка, кролик, мышь и т.д.). Корма особенно подходят для домашней птицы и свиней, и в частности для бройлерных цыплят.
Настоящее изобретение также относится к композициям для обработки тканей, которые содержат по меньшей мере одну из протеаз по настоящему изобретению. В некоторых вариантах осуществления по меньшей мере одна протеаза по настоящему изобретению является компонентом композиций, подходящих для обработки шелка или шерсти (см., например, U.S. RE Pat. No. 216034, EP 134267, патент США № 4533359 и EP 344259).
Кроме того, протеазы по настоящему изобретению находят применение в ряде приложений, где желательно разделять фосфор от фитата. Таким образом, настоящее изобретение также относится к способам получения шерсти или материала животного волоса с улучшенными свойствами. В некоторых предпочтительных вариантах осуществления эти способы включают этапы предварительной обработки шерсти, шерстяных волокон или материала животного волоса способом, выбранным из группы, состоящей из способов плазменной обработки и способа Delhey; и обработки предварительно обработанной шерсти или материала животного волоса протеолитическим ферментом (например, по меньшей мере, одной протеазой по настоящему изобретению) в количестве, эффективном для улучшения свойств. В некоторых вариантах осуществления обработка протеолитическим ферментом происходит до плазменной обработки, тогда как в других вариантах осуществления она происходит после плазменной обработки. В некоторых дополнительных вариантах осуществления ее проводят в виде отдельного этапа, тогда как в других вариантах осуществления ее проводят в сочетании с мездрением или окраской шерсти или материала животного волоса. В дополнительных вариантах осуществления на этапе обработки ферментом присутствует, по меньшей мере, одно поверхностно-активное вещество и/или, по меньшей мере, один смягчитель, тогда как в других вариантах осуществления поверхностно-активное вещество(а) и/или смягчитель(и) включают в отдельный этап, где шерсть или материал животного волоса подвергают обработке смягчителем.
В некоторых вариантах осуществления композиции по настоящему изобретению находят применение в способах для предупреждения усадки шерстяных волокон (см., например, JP 4-327274). В некоторых вариантах осуществления композиции используют в способах предупреждающей усадку обработки шерстяных волокон, подвергая волокна обработке низкотемпературной плазмой с последующей обработкой предупреждающей усадку смолой, такой как блок-уретановая смола, полиамидэпохлоргидриновой смолой, глиоксалевой смолой, этилмочевиноформальдегидной смолой или акрилатной смолой, а затем обрабатывая уменьшающим массу протеолитическим ферментом для получения эффекта смягчения). В некоторых вариантах осуществления этап обработки плазмой представляет собой низкотемпературную обработку, предпочтительно обработку коронным разрядом или обработку светящимся разрядом.
В некоторых вариантах осуществления обработку низкотемпературной плазмой проводят с использованием газа, предпочтительно - газа, выбранного из группы, состоящей из воздуха, кислорода, азота, аммиака, гелия или аргона. Как правило, используют воздух, но предпочтительным может являться использование любого другого из указанных газов.
Обработку низкотемпературной плазмой предпочтительно проводят при давлении приблизительно от 0,1 мм рт.ст. до 5 мм рт.ст. в течение приблизительно от 2 секунд до приблизительно 300 секунд, предпочтительно - в течение приблизительно от 5 секунд до приблизительно 100 секунд, более предпочтительно - приблизительно от 5 секунд до приблизительно 30 секунд.
Как указано выше, настоящее изобретение находит применение в отношении таких способов, как способ Delhey (см., например, DE-A-4332692). В данном способе шерсть обрабатывают в водном растворе пероксида водорода в присутствии растворимого вольфрамата, необязательно с последующей обработкой в растворе или дисперсии синтетических полимеров для улучшения свойств противосвойлачиваемости шерсти. В данном способе, шерсть обрабатывают в водном растворе пероксида водорода (0,1-35% (масс./масс.), предпочтительно 2-10% (масс./масс.)), в присутствии 2-60% (масс./масс.), предпочтительно 8-20% (масс./масс.) катализатора (предпочтительно Na2WO4) и в присутствии неионного увлажнителя. Предпочтительно обработку проводят при pH 8-11 и комнатной температуре. Время обработки зависит от концентрации пероксида водорода и катализатора, но предпочтительно составляет 2 минуты или менее. После окислительной обработки шерсть прополаскивают водой. Для удаления остаточного пероксида водорода и необязательно для дополнительного отбеливания шерсть дополнительно обрабатывают кислотными растворами восстановителей (например, сульфитами, фосфитами и т.д.).
В некоторых вариантах осуществления этап обработки ферментами проводят в течение приблизительно от 1 минуты до приблизительно 120 минут. Этот этап предпочтительно проводят при температуре приблизительно от 20°C до приблизительно 60°C, более предпочтительно - приблизительно от 30°C до приблизительно 50°C. Альтернативно, шерсть выдерживают в водном ферментном растворе или в нее его добавляют, а затем ее подвергают обработке паром при обычных температуре и давлении, как правило, в течение приблизительно от 30 секунд до приблизительно 3 минут. В некоторых предпочтительных вариантах осуществления обработку протеолитическим ферментом проводят в кислотной, или нейтральной, или щелочной среде, которая может включать буфер.
В альтернативных вариантах осуществления этап обработки ферментами проводят в присутствии одного или нескольких традиционных анионных, неионных (например, добанол; Henkel AG) или катионных поверхностно-активных веществ. Пример пригодного неионного поверхностно-активного вещества представляет собой добанол (из Henkel AG). В дополнительных вариантах осуществления шерсть или материал животного волоса до или одновременно с обработкой протеолитическим ферментом подвергают ультразвуковой обработке. В некоторых предпочтительных вариантах осуществления ультразвуковую обработку проводят при температуре приблизительно 50°C в течение приблизительно 5 минут. В некоторых предпочтительных вариантах осуществления количество протеолитического фермента, используемого на этапе обработки ферментами составляет приблизительно от 0,2% масс./масс. до приблизительно 10% масс./масс., на основе массы шерсти или материала животного волоса. В некоторых вариантах осуществления для ряда этапов обработки обработку ферментами проводят при окрашивании и/или мездрении шерсти или материала животного волоса, просто посредством добавления протеазы в емкость для окраски, ополаскивания и/или мездрения. В некоторых вариантах осуществления обработку ферментами проводят после плазменной обработки, но в других вариантах осуществления два этапа обработки проводят в обратном порядке.
Смягчители, традиционно используемые для шерсти, как правило, представляют собой катионные смягчители, органические катионные смягчители или продукты на основе силикона, но также пригодны анионные или неионные смягчители. Примеры пригодных смягчителей включают, в качестве неограничивающих примеров, полиэтиленовые смягчители и силиконовые смягчители (т.е. диметилполисилоксаны (силиконовые масла)), H-полисилоксаны, силиконовые эластомеры, аминофункциональные диметилполисилоксаны, аминофункциональные силиконовые эластомеры и эпоксифункциональные диметилполисилоксаны и органические катионные смягчители (например, алкилпроизводные четвертичного аммония).
В дополнительных вариантах осуществления настоящее изобретение относится к композициям для обработки шкур животных, которые содержат, по меньшей мере, одну протеазу по настоящему изобретению. В некоторых вариантах осуществления протеазы по настоящему изобретению находят применение в композициях для обработки шкур животных, таких как композиции, описанные в WO 03/00865 (Insect Biotech Co., Taejeon-Si, Korea). В дополнительных вариантах осуществления настоящее изобретение относится к способам для переработки шкур и/или кож в кожу, включающим ферментативную обработку шкуры или кож протеазой по настоящему изобретению (см., например, WO 96/11285). В дополнительных вариантах осуществления настоящее изобретение относится к композициям для преработки кож или шкур животных в кожу, которые содержат по меньшей мере одну протеазу по настоящему изобретению.
Шкуры и кожи, как правило, поставляют в кожевенные фабрики в форме просоленных или высушенных сырых шкур или кож. Переработка шкур или кож в кожу включает несколько различных этапов процесса, включающих этапы выдерживания, удаления меха и мягчения. Эти этапы составляют влажную обработку и их проводят в дубильне. Ферментативная обработка с применением протеаз по настоящему изобретению при процессе обработки кожи применима в любое время процесса обработки. Однако, как правило, протеазы применяют при влажной обработке (т.е. при выдержке, удаление волоса и/или мягчении). Таким образом, в некоторых предпочтительных вариантах осуществления ферментативная обработка по меньшей мере одной протеазой по настоящему изобретению происходит на этапе влажной обработки.
В некоторых вариантах осуществления способы выдержки по настоящему изобретению проводят в стандартных условиях выдержки (например, при pH в диапазоне pH 6,0-11). В некоторых предпочтительных вариантах осуществления диапазон представляет собой pH 7,0-10,0. В альтернативных вариантах осуществления температура находится в диапазоне 20-30°C, тогда как в других вариантах осуществления она предпочтительно находится в диапазоне 24-28°C. В дополнительных вариантах осуществления время реакции находится в диапазоне 2-24 часа, хотя предпочтительный диапазон составляет 4-16 часов. В дополнительных вариантах осуществления по желанию добавляют поверхностно-активные вещества и/или консерванты.
Вторая фаза этапа мягчения, как правило, начинается с добавления самого мягчителя. В некоторых вариантах осуществления ферментативную обработку проводят при мягчении. В некоторых предпочтительных вариантах осуществления ферментативную обработку проводят при мягчении после фазы обеззоливания. В некоторых вариантах осуществления процесс мягчения по настоящему изобретению проводят в стандартных условиях (например, при pH в диапазоне pH 6,0-9,0). В некоторых предпочтительных вариантах осуществления диапазон pH составляет от 6,0 до 8,5. В дополнительных вариантах осуществления температура находится в диапазоне 20-30°C, хотя в предпочтительных вариантах осуществления температура находится в диапазоне 25-28°C. В некоторых вариантах осуществления время реакции находится в диапазоне 20-90 минут, тогда как в других вариантах осуществления она находится в диапазоне 40-80 минут. Способы для получения кожи хорошо известны специалистам в данной области (см., например, WO 94/069429 WO 90/1121189, патент США № 3840433, EP 505920, GB 2233665 и патент США № 3986926, которые все включены в настоящий документ в качестве ссылки).
В дополнительных вариантах осуществления настоящее изобретение относится к мягчителям, содержащим по меньшей мере одну протеазу по настоящему изобретению. Мягчитель представляет собой средство или содержащий фермент препарат, содержащий химически активные ингредиенты для применения в процессах дубления, в частности на этапе мягчения процесса производства кожи. В некоторых вариантах осуществления настоящее изобретение относится к мягчителям, содержащим протеазу и подходящие вспомогательные вещества. В некоторых вариантах осуществления эти средства включают в качестве неограничивающих примеров химические вещества, известные и используемые в данной области, например разбавители, эмульгаторы, обеззоливатели и носители. В некоторых вариантах осуществления мягчитель, содержащий, по меньшей мере, одну протеазу по настоящему изобретению составляют так, как известно в данной области (см., например, GB-A2250289, WO 96/11285 и EP 0784703).
В некоторых вариантах осуществления мягчитель по настоящему изобретению содержит от 0,00005 до 0,01 грамм активной протеазы на грамм мягчителя, тогда как в других вариантах осуществления мягчитель содержит от 0,0002 до 0,004 грамм активной протеазы на грамм мягчителя.
Таким образом, протеазы по настоящему изобретению находят применение в многочисленных приложениях и условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Настоящее изобретение более подробно описано в следующих ниже примерах, которые никаким образом не предназначены для ограничения объема изобретения, приведенного в формуле изобретения. Приложенные фигуры следует рассматривать как составные части спецификации и описания изобретения. Все цитируемые в настоящем документе ссылки конкретно включены в качестве ссылки для всего, что в них описано. Следующие ниже примеры предоставлены для иллюстрации, а не для ограничения описываемого в заявке изобретения.
В экспериментальном описании, которое приведено ниже, применяются следующие сокращения: PI (ингибитор протеиназ), м.д. (миллионная доля); М (молярный); мМ (миллимолярный); мкМ (микромолярный); нМ (наномолярный); моль (моль); ммоль (миллимоль); мкмоль (микромоль); нмоль (наномоль); г (грамм); мг (миллиграмм); мкг (микрограмм); пг (пикограмм); л (литров); мл (миллилитры); мкл (микролитры); см (сантиметры); мм (миллиметры); мкм (микрометры); нм (нанометры); Ед (единицы); В (вольты); MW (молекулярная масса); сек (секунды); мин (минута/минуты); час (час/часы); °C (градусы Цельсия); QS (в достаточном количестве); н.д. (не делалось); н.п. (не применимо); об/мин (оборотов в минуту); H2O (вода); dH2O (деионизированная вода); (HCl (соляная кислота); а.к. (аминокислота); п.н. (пары нуклеотидов); т.п.н. (тысячи пар нуклеотидов); кДа (килодальтон); кДНК (копия или комплементарная ДНК); ДНК (дезоксирибонуклеиновая кислота); оцДНК (одноцепочечная ДНК); дцДНК (двухцепочечная ДНК); dNTP (дезоксирибонуклеотидтрифосфат); РНК (рибонуклеиновая кислота); MgCl2 (хлорид магния); NaCl (хлорид натрия); масс./об. (масса к объему); об./об. (объем к объему); g (ускорение силы тяжести); OD (оптическая плотность); фосфатно-солевой буфер Дульбекко (DPBS); SOC (2% бактотриптон, 0,5% бактодрожжевой экстракт, 10 мМ NaCl, 2,5 мМ KCl); среда Terrific Broth (TB; 12 г/л бактотриптона, 24 г/л глицерина, 2,31 г/л KH2PO4 и 12,54 г/л K2HPO4); OD280 (оптическая плотность при 280 нм); OD600 (оптическая плотность при 600 нм); A405 (поглощение при 405 нм); Vмакс (максимальная начальная скорость катализируемой ферментом реакции); PAGE (электрофорез в полиакриламидном геле); PBS (фосфатно-солевой буфер [150 мМ NaCl, 10 мМ натрий-фосфатный буфер, pH 7,2]); PBST (PBS + 0,25% TWEEN® 20); PEG (полиэтиленгликоль); ПЦР (полимеразная цепная реакция); ОТ-ПЦР (ПЦР с обратной транскрипцией); SDS (додецилсульфат натрия); Tris (трис(гидроксиметил)аминометан); HEPES (N-[2-гидроксиэтил]пиперазин-N-[2-этансульфоновая кислота]); HBS (забуференный HEPES физиологический раствор); Tris-HCl (трис[гидроксиметил]аминометангидрохлорид); трицин (N-[трис(гидроксиметил)метил]глицин); CHES (2-(N-циклогексиламино)этансульфоновая кислота); TAPS (3-{[трис(гидроксиметил)метил]амино}пропансульфоновая кислота); CAPS (3-(циклогексиламино)пропансульфоновая кислота; DMSO (диметилсульфоксид); DTT (1,4-дитио-DL-треитол); SA (синапиновая кислота (s,5-диметокси-4-гидроксифенилакриловая кислота); ТФУ (трихлоруксусная кислота); Glut и GSH (восстановленный глутатион); GSSG (окисленный глутатион); TCEP (трис[2-карбоксиэтил]фосфин); Ки (Кюри); мКи (миллиКюри); мкКи (микроКюри); ВЭЖХ (высокоэффективная жидкостная хроматография); ОФ-ВЭЖХ (обратнофазовая высокоэффективная жидкостная хроматография); TLC (тонкослойная хроматография); MALDI-TOF (времяпролетная масс-спектрометрия с лазерной десорбцией-ионизацией посредством матрицы); Ts (тозил); Bn (бензил); Ph (фенил); Ms (мезил); Et (этил), Me (метил); Taq (ДНК-полимераза Thermus aquaticus); фрагмент Кленова (большой фрагмент (Кленова) ДНК полимеразы I); EGTA (этиленгликоль-бис(β-аминоэтиловый эфир) N,N,N',N'-тетрауксусная кислота); ЭДТА (этилендиаминтетрауксусная кислота); bla (β-лактамаза или ген устойчивости к ампициллину); HDL (жидкость высокой плотности);



Сериновая протеаза дикого типа, используемая в следующих примерах, подробно описана в US04/39006 и US04/39066, которые оба включены в настоящий документ в качестве ссылки в полном объеме. Кроме того, в примере 2 патентной заявки США с серийным № 10/576331 предоставлены подробности для получения протеазы 69B4 из грамположительной алкалофильной бактерии 69B4. Как указано на всем протяжении настоящей заявки, данная приоритетная заявка в полном объеме включена в настоящий документ в качестве ссылки.
ПРИМЕР 1
Анализы
В следующих ниже примерах, использовали различные анализы, такие как определение белков, основанные на применении тесты и основанные на стабильности тесты. Для простоты чтения следующие анализы приведены ниже и на них ссылаются в соответствующих примерах. Любые отклонения от протоколов, предоставленных ниже, в любых экспериментах, проводимых при получении по настоящему изобретению, указаны в примерах.
Некоторые из детергентов, используемые в следующих примерах, имеют приведенные ниже композиции. В композициях I и II, остаток (до 100%) представляет собой ароматизатор/краситель и/или воду. pH данных композиций приблизительно составляет от 5 до приблизительно 7 для композиции I, и приблизительно от 7,5 до приблизительно 8,5 для композиции II. В композиции III, остаток (до 100%) состоит из воды и/или малых количеств ароматизатора, красителя, осветлителя/SRPI/карбоксиметилцеллюлозы натрия/фотоотбеливателя/MgSO4/PVPV1/пеногасителя/
высокомолекулярного PEG/глины.
A. Анализ с ТФУ для определения содержания белка в 96-луночных планшетах для микротитрования
Данный анализ начинали с использованием фильтрованного супернатанта культуры из планшетов для микротитрования, выращиваемых 4 суток при 33°C с перемешиванием при 230 об/мин и увлажненной аэрации. Для анализа использовали свежий 96-луночный плоскодонный планшет. Сначала в лунки помещали 100 мкл/лунку 0,25 н. HCl. Затем в лунки добавляли 50 мкл фильтрованного культурального бульона. Затем определяли светорассеяние/поглощение при 405 нм (с использованием 5 секундного смешанного режима на планшетном сканере), для получения "фонового" считывания.
Для теста, в планшеты помещали 100 мкл/лунку 15% (масс./об.) ТФУ и инкубировали от 5 до 30 мин при комнатной температуре. Затем определяли светорассеяние/поглощение при 405 нм (с использованием 5 секундного смешанного режима на планшетном сканере).
Расчеты проводили, вычитая фон (т.е. отсутствие ТФУ) из тестового считывания с ТФУ. При желании, можно получить стандартную кривую, калибруя считывания с ТФУ с анализами клонов с AAPF с известными коэффициентами пересчета. Однако результаты для ТФУ являются линейными в отношении концентрации белка от 50 до 500 м.д. и таким образом их можно прямо наносить на график зависимости эффективности фермента с целью выбора наиболее эффективных вариантов.
B. Анализ протеазы с suc-AAPF-pNA в 96-луночных планшетах для микротитрования
В данной системе анализа, используемые растворы реагентов представляли собой:
1. 100 мМ Tris/HCl, pH 8,6, содержащий 0,005% TWEEN®-80 (буфер Tris)
2. 100 мМ буфер Tris, pH 8,6, содержащий 10 мМ CaCl2 и 0,005% TWEEN®-80 (буфер Tris)
3. 160 мМ suc-AAPF-pNA в DMSO (основной раствор suc-AAPF-pNA) (Sigma: S-7388)
Для получения рабочего раствора suc-AAPF-pNA, 1 мл основного раствора AAPF добавляли к 100 мл буфера Tris и хорошо перемешивали, по меньшей мере, в течение 10 секунд.
Анализ проводили, к каждой лунке добавляя 10 мкл разбавленного раствора протеазы, с последующим добавлением (быстрым) 190 мкл 1 мг/мл рабочего раствора AAPF. Растворы перемешивали в течение 5 сек и считывали изменение поглощения при 410 нм в устройстве для считывания MTP, при 25°C. Протеазную активность выражали в виде ЕА (активность = ΔOD мин-1·мл-1).
C. Анализ гидролиза кератина
В данной системе анализа, используемые химические соединения и растворы реагентов представляли собой:
Способ:
Перед инкубацией кератин просеивали на 100 мкм фильтре небольшими порциями за один раз. Затем 10 г < 100 мкм кератина перемешивали в растворе детергента, по меньшей мере, в течение 20 минут при комнатной температуре с регулярным доведением pH до 8,2. Наконец суспензию центрифугировали в течение 20 минут при комнатной температуре (Sorvall, ротор GSA, 13000 об/мин). Затем эту процедуру повторяли. Наконец влажный осадок суспендировали в детергенте до общего объема 200 мл и суспензию при пипетировании оставляли перемешиваться. Перед инкубацией планшеты для микротитрования (MTP) заполняли 200 мкл субстрата на лунку многоканальной пипеткой Biohit и наконечниками 1200 мкл (6 доз по 200 мкл и дозируемых так быстро, как только возможно во избежание осаждения кератина в наконечниках). Затем к содержащим субстрат MTP добавляли 10 мкл фильтрованной культуры. Планшеты закрывали липкой лентой, помещали в инкубатор и инкубировали при 20°C в течение 3 часов при 350 об/мин (Innova 4330 [New Brunswick]). После инкубации планшеты центрифугировали в течение 3 минут при 3000 об/мин (центрифуга iSigma 6K 15). Приблизительно за 15 минут до удаления из инкубатора 1-го планшета, готовили реагент TNBS, смешивая 1 мл раствора TNBS с 50 мл реагента A.
В MTP добавляли 60 мкл TNBS с реагентом A на лунку. Из инкубированных планшетов 10 мкл переносили в MTP с TNBS с реагентом A. Планшеты закрывали липкой лентой и перемешивали в течение 20 минут на настольном шейкере (BMG Thermostar) при комнатной температуре и 500 об/мин. Наконец, в лунки добавляли 200 мкл реагента B, перемешивали 1 минуту на шейкере и измеряли поглощение при 405 нм на устройстве для считывания MTP.
Расчет активности гидролиза кератина:
Полученные значения поглощения корректировали на значение фона (субстрат без фермента). Полученное поглощение является мерой гидролитической активности. Для каждого образца (варианта) рассчитывали показатель эффективности. Показатель эффективности сравнивает эффективность варианта (фактическое значение) и стандартного фермента (теоретическое значение) при той же концентрации белка. Кроме того, теоретические значения можно рассчитывать с использованием параметров уравнения Ленгмюра стандартного фермента. Показатель эффективности (PI), больший 1 (PI > 1) идентифицирует лучший вариант (по сравнению со стандартным [например, дикий тип]), тогда как PI 1 (PI = 1) идентифицирует вариант, эффективность которого сравнима со стандартом, а PI, меньший 1 (PI<1) идентифицирует вариант, эффективность которого хуже, чем у стандарта.
Таким образом, PI идентифицирует победителей, а также варианты, которые менее желательны для использования в определенных обстоятельствах.
D. Анализ микрообразцов для тестирования эффективности протеазы
Все детергенты, используемые в этих анализах, не содержали ферментов.
Детергентные препараты:
1. Жидкий детергент для холодной воды (условия США):
Воду Milli-Q доводили до жесткости воды 6 гран на галлон (Ca/Mg = 3/1), добавляли 1,60 г/л детергента и раствор детергента интенсивно перемешивали, по меньшей мере, в течение 15 минут.
Затем добавляли 5 мМ буфера Hepes и pH доводили до 8,2. Детергент перед использованием в анализе фильтровали через 0,22 мкм фильтр (например, фильтр наверху колбы Nalgene).
2. Жидкий детергент для низкого pH (условия США):
Воду Milli-Q доводили до жесткости воды 6 гран на галлон (Ca/Mg = 3/1), добавляли 1,60 г/л детергента TIDE®-LVJ-1 или TIDE® 2005) или 1,50 г/л детергента (TIDE®-SNOW) и раствор детергента интенсивно перемешивали, по меньшей мере, в течение 15 минут. pH доводили до 6,0, используя раствор 1 н. NaOH. Детергент перед использованием в анализе фильтровали через 0,22 мкм фильтр (например, фильтр наверху колбы Nalgene).
Микрообразцы ткани
Микрообразцы ткани с диаметром окружности 1/4" заказывали в CFT Vlaardingen и она их доставляла. Микрообразцы ткани предварительно обрабатывали с использованием способа фиксации, описанного ниже. Отдельные микрообразцы ткани вертикально помещали в каждую лунку 96-луночного планшета для микротитрования для воздействия на всю площадь поверхности (т.е. не плоско на дно лунки).
Фиксация образцов ткани "3K":
Данную конкретную фиксацию образцов ткани проводили при комнатной температуре. Однако количество добавляемого 30% H2O2, составляет в 10 раз больше, чем в способе фиксации образца ткани с суперфиксацией, т.е. проводимом при 60°C, с использованием европейских условий). Наблюдалось образование пузырей (вспенивание) и, таким образом, чтобы это учесть, необходимо использовать больший резервуар. Сначала, в 10 л резервуар помещали 8 литров дистиллированной воды и добавляли 80 мл 30% пероксида водорода. Воду и пероксид хорошо перемешивали ковшом. Затем, 40 частей образцов ткани EMPA 116 перед добавлением в раствор распределяли во вращающем устройстве для обеспечения однородной фиксации. Образцы ткани вращали в растворе (с использованием ковша) в течение 30 минут, непрерывно в течение первых пяти минут и периодически в течение оставшихся 25 минут. Раствор удаляли, и образцы ткани 6 раз прополаскивали приблизительно 6 литрами дистиллированный воды каждый раз. Образцы ткани помещали сверху бумажной салфетки для просушки. Высохшие на воздухе образцы ткани штамповали с использованием 1/4" кольцевого штампа на выдавливающем прессе. Отдельный микрообразец ткани помещали вертикально в каждую лунку 96-луночного планшета для микротитрования для воздействия на всю площадь поверхности (т.е. не плоско на дно лунки).
Образцы ферментов:
Образцы ферментов тестировали в соответствующих концентрациях для соответствующей географической области и разбавляли в 10 мМ NaCl, 0,005% TWEEN®-80 растворе.
Способ тестирования:
Инкубатор устанавливали на желаемую температуру: 20°C для условий холодной водной жидкости или 30°C для условий жидкости с низким pH. Предварительно обработанные и раскроенные образцы тканей помещали в лунки 96-луночного MTP, как описано выше. Образцы ферментов при необходимости разбавляли в 10 мМ NaCl, 0,005% TWEEN®-80 до 20× желаемой концентрации. Желаемые растворы детергентов получали, как описано выше. Затем в каждую лунку MTP добавляли 190 мкл раствора детергента. К этой смеси в каждую лунку добавляли 10 мкл раствора фермента (для обеспечения общего объема 200 мкл/лунку). MTP герметически закрывали на устройстве для герметического закрывания планшетов и помещали в инкубатор на 60 минут, с перемешиванием при 350 об/мин. После инкубации в соответствующих условиях из каждой лунки удаляли 100 мкл раствора и помещали в свежий MTP. Свежий MTP, содержащий 100 мкл раствора/лунку, считывали при 405 нм в устройстве для считывания MTP. Также были включены отрицательные контроли, а также контроли, содержащие микрообразец ткани и детергент, но не содержащие фермента. Исходный раствор использовали при концентрации 15000 гран на галлон (Ca/Mg 3:1 (1,92 M Ca2+ = 282,3 г/л CaCl2•2H2O; 0,64 M Mg2+ = 30,1 г/л MgCl2•6H2O).
Расчет эффективности BMI:
Полученные значения поглощения корректировали на значения отрицательного контроля (полученные после инкубации микрообразцов ткани в отсутствие фермента). Полученное в результате поглощение являлось мерой гидролитической активности. Для каждого образца (варианта) рассчитывали показатель эффективности. Показатель эффективности сравнивает эффективность варианта (фактическое значение) и стандартного фермента (теоретическое значение) при той же концентрации белка. Кроме того, теоретические значения можно рассчитывать с использованием параметров уравнения Ленгмюра стандартного фермента. Показатель эффективности (PI), больший 1 (PI > 1) идентифицирует лучший вариант (по сравнению со стандартном [например, дикий тип]), тогда как PI 1 (PI = 1) идентифицирует вариант, эффективность которого сравнима со стандартом, а PI, меньший 1 (PI<1) идентифицирует вариант, эффективность которого хуже, чем у стандарта.
Таким образом, PI идентифицирует победителей, а также варианты, которые менее желательны для использования в определенных обстоятельствах.
D. Анализ гидролиза диметилказеина (96 луночный)
Используемые в данной системе анализа химические соединения и растворы реагентов представляли собой:
Способ:
Для получения субстрата, 4 г DMC растворяли 400 мл буфера PIPES. Профильтрованные супернатанты культур разбавляли буфером PIPES; конечная концентрация контролей в планшете для роста составляла 20 м.д. Затем 10 мкл каждого разведенного супернатанта добавляли к 200 мкл субстрата в лунках MTP. Планшет MTP закрывали липкой лентой, перемешивали в течение нескольких секунд и помещали в термостат при 37°C в течение 2 часов без перемешивания.
Приблизительно за 15 минут до удаления из термостата 1-го планшета, готовили реагент TNBS, смешивая 1 мл раствора TNBS с 50 мл реагента A. В MTP добавляли 60 мкл TNBS с реагентом A на лунку. Инкубированные планшеты перемешивали в течение нескольких секунды, после чего переносили 10 мкл в MTP с TNBS с реагентом A. Планшеты закрывали липкой лентой и перемешивали в течение 20 минут на настольном шейкере (BMG Thermostar) при комнатной температуре и 500 об/мин. Наконец, в лунки добавляли 200 мкл реагента B, перемешивали 1 минуту на шейкере и измеряли поглощение при 405 нм на устройстве для считывания MTP.
Расчет активности гидролиза диметилказеина:
Полученные значения поглощения корректировали на значения отрицательного контроля (субстрат без фермента). Полученное в результате поглощение являлось мерой гидролитической активности. (Относительную) специфическую активность образца рассчитывали посредством деления поглощения на определенную концентрацию белка.
E. Анализ термостабильности
Данный анализ основан на гидролизе диметилказеина, перед нагреванием и после нагревания забуференного супернатанта культур. Использовали те же химические вещества и растворы реагентов, как описано для анализа гидролиза диметилказеина.
Способ:
Профильтрованные супернатанты культур разбавляли до 20 м.д. в буфере PIPES (на основе концентрации контролей в планшетах для роста). Сначала, брали 10 мкл образца каждого разбавленного фермента для определения исходной активности в анализе диметилказеина и обрабатывали, как описано ниже. Затем 50 мкл каждого разбавленного супернатанта помещали в пустые лунки MTP. Планшет MTP инкубировали в инкубаторе iEMS с шейкером HT (Thermo Labsystems) в течение 90 минут при 60°C и 400 об/мин. Планшеты охлаждали на льду в течение 5 минут. Затем, 10 мкл раствора добавляли в свежий MTP, содержащий 200 мкл субстрата диметилказеина/лунку для определения после инкубации конечной активности. Данный MTP закрывали липкой лентой, перемешивали в течение нескольких секунд и помещали в термостат при 37°C в течение 2 часов без перемешивания. Использовали тот же способ детекции, который использовали для анализа гидролиза DMC.
Расчет термостабильности:
Остаточную активность образца выражали в виде отношения конечного поглощения и начального поглощения, скорректированных на значения отрицательных контролей.
F. Анализ стабильности в LAS
Стабильность в LAS измеряли после инкубации тестируемой протеазы в присутствии 0,06% LAS (додецилбензолсульфонат натрия), а остаточную активность определяли с использованием анализа с AAPF.
Реагенты:
Додецилбензолсульфонат, натриевая соль (=LAS): Sigma D-2525
TWEEN®-80: Sigma P-8074
Буфер TRIS (без кислоты): Sigma T-1378); 6,35 г растворяют приблизительно в 960 мл воды; pH доводят до 8,2 4 н. HCl. Конечная концентрация TRIS составляет 52,5 мМ.
Исходный раствор LAS: Получают 10,5% раствор LAS в воде MQ (=10,5 г на 100 мл MQ)
Буфер TRIS - 100 мМ/pH 8,6 (100 мМ Tris/0,005% Tween80)
Буфер TRIS-Ca, pH 8,6 (100 мМ Tris/10 мМ CaCl2/0,005% Tween80)
Оборудование:
Плоскодонные MTP: Costar (№9017)
Biomek FX
Устройство для многоканального пипетирования ASYS
Устройство для считывания MTP Spectramax
инкубатор/шейкер iEMS
Инкубатор/шейкер Innova 4330
Многоканальная пипетка Biohit
Шейкер BMG Thermostar
Способ:
0,063% раствор LAS получали в 52,5 мМ буфере Tris pH 8,2. Рабочий раствор AAPF получали, добавляя 1 мл 100 мг/мл исходного раствора AAPF (в DMSO) в 100 мл (100 мМ) буфера TRIS, pH 8,6. Для разбавления супернатантов, плоскодонные планшеты заполняли буфером для разбавления и добавляли аликвоту супернатанта и хорошо перемешивали. Степень разбавления зависела от концентрации контролей ASP в планшетах для роста (активности AAPF). Желаемая концентрация белка составляла 80 м.д.
Десять мкл разбавленного супернатанта добавляли к 190 мкл 0,063% буфера LAS/лунку. MTP закрывали липкой лентой, перемешивали в течение нескольких секунд и помещали в инкубатор (Innova 4230) при 25°C или 35°C в течение 60 минут при перемешивании при 200 об/мин. Исходную активность (t = 10 минут) определяли после 10 минут инкубации, перенося 10 мкл смеси из каждой лунки в свежий MTP, содержащий 190 мкл рабочего раствора AAPF. Эти растворы хорошо перемешивали и измеряли активность AAPF с использованием устройства для считывания MTP (20 считываний за 5 минут и при 25°C).
Конечную активность (t = 60 минут) определяли, отбирая следующие 10 мкл раствора из инкубируемого планшета после 60 минут инкубации. Затем определяли активность AAPF, как описано выше. Расчеты проводили следующим образом: % остаточной активности составлял [значение t-60] × 100 / [значение t-10].
ПРИМЕР 2
Получение протеазы ASP в B. subtilis
В данном примере описаны эксперименты, проводимые для получения протеазы 69B4 (также обозначаемой в настоящем документе как "ASP", "Asp" и "протеаза ASP" и "протеаза Asp") в B. subtilis. В данном примере описана трансформация плазмиды pHPLT-ASP-C1-2 (см. фиг.1) в B. subtilis. Трансформацию проводили как известно в данной области (см., например, WO 02/14490, включенную в настоящий документ в качестве ссылки). Для оптимизации экспрессии ASP в B. subtilis, посредством DNA2,0 получали синтетическую последовательность ДНК и использовали в этих экспериментах по экспрессии. Последовательность ДНК (синтетическая последовательность ДНК ASP) предоставлена ниже, с использованием кодонов, адаптированных для видов Bacillus, кодирует белок-предшественник ASP дикого типа:


В приведенной выше последовательности, жирный шрифт означает ДНК, кодирующую зрелую протеазу, обычный шрифт означает лидерную последовательность, а подчеркнутый шрифт означает N-концевую и C-концевую пропоследовательности.
Экспрессия синтетического гена ASP
Для экспрессии ASP в B. subtilis экспрессирующие Asp кассеты встраивали в вектор pXX-KpnI (см. фиг. 2) и затем клонировали в вектор pHPLT (см. фиг. 3). pXX-KpnI представляет собой основанный на pUC вектор с экспрессией под контролем промотора aprE (B. subtilis), геном cat, и дупликацией промотора aprE для увеличения числа копий в B. subtilis. Селективный рост в E. coli обеспечивает ген bla. Участок KpnI, введенный в участок связывания рибосомы, ниже области промотора aprE вместе с участком HindIII, позволяет клонировать экспрессирующие Asp кассеты в pXX-KpnI.pHPLT-EBS2c2, производное pHPLT (Solingen et al., Extremophiles 5:333-341 [2001]), содержащую промотор термостабильной амилазы LAT (PLAT) Bacillus licheniformis, с последующими участками рестрикции XbaI и HpaI для клонирования экспрессирующих ASP конструкций.
Экспрессирующую Asp кассету клонировали в вектор pXX-KpnI, содержащий ДНК, кодирующую гибридный сигнальный пептид, составленный из 5 N-концевых аминокислот сигнального пептида AprE субтилизина, слитых с 25 C-концевыми аминокислотами сигнального пептида Asp (MRSKKRTVTRALAVATAAATLLAGGMAAQA; SEQ ID NO:11). Экспрессирующую Asp кассету, клонированную в вектор pXX-KpnI, трансформировали в E. coli (Electromax DH10B, Invitrogen, каталожный № 12033-015). Используемые праймеры и стратегия клонирования приведены в таблице 2-1. Затем экспрессирующие кассеты клонировали из этих векторов и вводили в экспрессирующий вектор pHPLT для трансформации в штамм B. subtilis (ΔaprE, ΔnprE, oppA, ΔspollE, degUHy32, ΔamyE::(xylR,pxylA-comK)). Используемые праймеры и стратегия клонирования для клонирования экспрессирующих ASP кассет в pHPLT приведены в таблице 2-2. Трансформацию в B. subtilis проводили, как описано в WO 02/14490, включенную в настоящий документ в качестве ссылки.
Праймеры получали в MWG и Invitrogen. Для амплификации ПЦР (0,2 мкМ праймеров, от 25 до 30 циклов) по протоколу Invitrogen использовали ДНК-полимеразу Invitrogen Platinum Taq High Fidelity (каталожный № 11304-029). Реакции лигирования экспрессирующих ASP кассет и векторов-хозяев проводили с использованием T4 ДНК-лигазы Invitrogen (каталожный № 15224-025), по протоколу Invitrogen как рекомендовано для обычного клонирования липких концов).
Экспрессию гена asp исследовали в штамме B. subtilis (ΔaprE, ΔnprE, oppA, ΔspollE, degUHy32, ΔamyE::(xylR,pxylA-comK)). Плазмиду pHPLT-ASP-C1-2 (см. таблицу 2-2 и фиг.1), трансформировали в B. subtilis (ΔaprE, ΔnprE, oppA, ΔspollE, degUHy32, ΔamyE::(xylR,pxylA-comK)). Трансформацию проводили как известно в данной области (см., например, WO 02/14490, включенную в настоящий документ в качестве ссылки).
Селективный рост трансформантов B. subtilis (ΔaprE, ΔnprE, oppA, ΔspollE, degUHy32, ΔamyE::(xylR,pxylA-comK)), несущих вектор pHPLT-ASP-C1-2 осуществляли во встряхиваемых колбах, содержащих 25 мл синтетической среды Maxatase (SMM), с 0,97 г/л CaCl2•6H2O вместо 0,5 г/л CaCl2 (см. патент США № 5324653, включенный в настоящий документ в качестве ссылки) с 20 мг/л неомицина. Данное выращивание приводило к продукции секретируемой протеазы ASP с протеолитической активностью. Анализ на геле проводили с использованием гелей NuPage Novex 10% Bis-Tris (Invitrogen, каталожный № NP0301BOX). Для получения образцов для анализа 2 объема супернатанта смешивали с 1 объемом 1M HCl, 1 объемом 4× буфера для образцов LDS (Invitrogen, каталожный № NP0007) и 1% PMSF (20 мг/мл), а затем нагревали в течение 10 минут при 70°C. Затем 25 мкл каждого образца наносили на гель совместно с 10 мкл SeeBlue и 2 предварительно окрашенными белковыми стандартами (Invitrogen, каталожный № LC5925). Результаты отчетливо демонстрировали, что стратегия клонирования asp, описанная в данном примере, приводила к получению активной Asp, продуцируемой в B. subtilis.
Кроме того, образцы тех же ферментационных бульонов оценивали следующим образом: отбирали 10 мкл разбавленного супернатанта и добавляли к 190 мкл раствора субстрата AAPF (конц. 1 мг/мл, в 0,1 M Tris/0,005% TWEEN®, pH 8,6). Наблюдали скорость увеличения поглощения при 410 нм вследствие высвобождения п-нитроанилина (25°C), так как это предоставляет меру продуцируемой концентрации ASP. Данные результаты показали, что трансформация B. subtilis pHPLT-ASP-C1-2 приводила к продукции измеряемых уровней протеазы ASP.
ПРИМЕР 3
Конструирование комбинаторных мутантов
В данном примере описано конструирование библиотеки с множественными мутациями варианта ASP. Вариант ASP, который служит в качестве основы для библиотеки с множественными мутациями содержит замены R014I-A064K-T086K-T116E-R123F. Этот вариант клонировали в вектор pHPLT. Для конструирования библиотеки использовали набор QuikChange® для множественного сайт-специфического мутагенеза (QCMS) (Stratagene). Фосфорилированные на 5'-конце праймеры, используемые для получения библиотеки, приведены в таблице 3-1. Следует отметить, что очищенные ВЭЖХ, PAGE или другим способом праймеры дают намного лучшие результаты в отношении встраивания полноразмерных праймеров, а также значительное снижение содержащихся в праймерах ошибок. В этих экспериментах очищенные праймеры не использовали.

Получение pUC18-ASP
Вариант ASP, содержащий замены R014I-A064K-T086K-T116E-R123F клонировали из вектора pHPLT в вектор pUC18 (Invitrogen, каталожный номер 15363013; см. фиг.1), с использованием участков рестрикции PstI и HindIII. Затем плазмиду pUC18-ASP (см. фиг.2) электропорировали в электрокомпетентные клетки E. coli (Invitrogen, каталожный № C4040-52, One Shot® TOP10 Electrocomp™ E. coli, dam+) и селективно выращивали на планшетах с агаром, содержащих 100 мг/л ампициллина, что в результате приводило к несущим плазмиду pUC18-ASP клеткам E. coli. Этот способ использовали для получения метилированной по участкам GATC ДНК ASP, необходимой для выполнения протокола QCMS, так как плазмида pHPLT-ASP-C1-2 не реплицируется в E. coli.
Из клеток E. coli, несущих плазмиду pUC18-ASP, посредством набора минипреп получали ДНК. Конкретно, штамм растили в течение ночи в 10 мл 2× среды TY со 100 м.д. ампициллина, после чего клетки откручивали. Для получения плазмидной ДНК использовали набор Qiagen spin miniprep DNA (каталожный № 27106) посредством этапов, определенных в руководстве к набору Qiagen miniprep. Выделенную посредством набора минипреп ДНК элюировали 50 мкл буфера Qiagen EB, поставляемого в наборе.
Конструирование библиотеки с множественными мутациями
Участки для использования в конструировании библиотеки с множественными мутациями выбирали так, как указано ниже. Для каждого свойства, необходимого в конечной молекуле, мутации оценивали как "улучшающие" или "ухудшающие", с участками, определенными как благоприятные. Как минимум, участки для комбинации должны быть продуктивными для каждого желаемого свойства и как минимум для большинства важных свойств. Для гарантии того, что библиотека имеет наивысшую вероятность для улучшения или поддержания всех важных свойств, использовали указанные ниже критерии.
Для каждого свойства, устанавливали значение отсечения для ΔΔ G. Например, для процесса, проходящего при 25°C, значения ΔΔ G < 0,06 Ккал представляют мутации, которые не хуже, чем 90% активность исходных белков, тогда как значения ΔΔ G > 1,13 Ккал представляют мутации, которые составляют 125% от активности исходных белков.
Библиотеку с множественными мутациями конструировали, как указано в наборе Stratagene QCMS, за исключением используемой в реакциях концентрации праймеров. Конкретно, 1 мкл метилированной, очищенной плазмиды pUC18-ASP (приблизительно 70 нг) смешивали с 15 мкл стерильной дистиллированной воды, 1,5 мкл dNTP, 2,5 мкл 10× буфера, 1 мкл смеси ферментов и 1,0 мкл смеси мутантных праймеров (всего 100 пмоль праймеров). Смесь праймеров получали с использованием 10 мкл каждого из восемнадцати мутантных праймеров (100 пмоль/л); добавляя 50 нг каждого праймера для библиотеки по рекомендациям Stratagene, что имело результатом меньше мутаций в предшествующем раунде мутагенеза. Таким образом, протокол в текущем раунде мутагенеза модифицировали с включением 100 пмоль праймеров в каждую реакцию. Условия циклов представляли собой 95°C в течение 1 мин, с последующими 30 циклами, состоящими из 95°C в течение 1 мин, 55°C в течение 1 мин и 65°C в течение 12 мин, в термоциклере MJ Research PTC-200 с использованием тонкостенных 0,2 мл пробирок для ПЦР. Продукт реакции расщепляли с использованием 1 мкл DpnI из набора QCMS посредством инкубации при 37°C в течение ночи. Добавляли дополнительные 0,5 мкл DpnI и реакционную смесь инкубировали в течение 1 часа.
Затем, библиотеку ДНК (мутированный одноцепочечный продукт pUC18-ASP) электропорировали в электрокомпетентные клетки E. coli (Invitrogen, каталожный № C4040-52, One Shot® TOP10 Electrocomp™ E. coli, dam+) и селективно выращивали на планшетах с агаром, содержащих 100 мг/л ампициллина, что в результате приводило к библиотеке ASP с множественными мутациями в клетках E. coli. Колонии (десятки тысяч) собирали и использовали набор Qiagen spin miniprep DNA (каталожный № 27106) для получения плазмидной ДНК по этапам, указанным в руководстве набора Qiagen miniprep. Полученную посредством набора минипреп ДНК элюировали 50 мкл буфера Qiagen EB, поставляемого в наборе.
Полученную посредством набора минипреп ДНК расщепляли с использованием ферментов рестрикции ДНК PstI и HindIII. Смесь фрагментов библиотеки ASP (PstI × HindIII) очищали на геле и клонировали в расщепленный HindIII x PstI фрагмент вектора pHPLT из 4154 пар нуклеотидов посредством лигазной реакции с использованием ДНК-лигазы T4 Invitrogen (каталожный № 15224-025), по протоколу Invitrogen, как рекомендовано для стандартного клонирования липких концов. В другом подходе синтетические фрагменты библиотеки ASP получали посредством GeneArt. Эти фрагменты библиотеки ASP также расщепляли PstI и HindIII, очищали и клонировали в расщепленный HindIII x PstI фрагмент вектора pHPLT из 4154 пар нуклеотидов посредством лигазной реакции.
Для трансформации смеси лигазной реакции непосредственно в клетки Bacillus библиотечную ДНК (смесь фрагментов библиотеки ASP, клонированных pHPLT) амплифицировали с применением набора TempliPhi (Amersham каталожный № 25-6400). С этой целью 1 мкл смеси лигазной реакции смешивали с 5 мкл буфера для образцов из набора TempliPhi и нагревали в течение 3 минут при 95°C для денатурации ДНК. Реакционную смесь помещали на лед для охлаждения в течение 2 минут, а затем недолго откручивали. Затем добавляли 5 мкл реакционного буфера и 0,2 мкл, полимеразы phi29 из набора TempliPhi, и реакционные смеси инкубировали при 30°C в устройстве для ПЦР MJ Research в течение 4 часов. Фермент phi29 инактивировали нагреванием в реакционных смесях посредством инкубации при 65°C в течение 10 мин в устройстве для ПЦР.
Для трансформации библиотеки в Bacillus 0,1 мкл продукта реакции амплификации с TempliPhi смешивали с 500 мкл компетентных клеток B. subtilis (ΔaprE, ΔnprE, oppA, ΔspollE, degUHy32, ΔamyE::(xylR,pxylA-comK)) с последующим интенсивным встряхиванием при 37°C в течение 1 часа и 100 и 500 мкл наносили на планшеты с HI-agar, содержащие 20 м.д. неомицинсульфата (Sigma, каталожный № N-1876; содержит 732 мкг неомицина на мг) и 0,5% обезжиренное молоко. Для секвенирования отобрали девяносто пять клонов из библиотеки.
Мутагенез работал хорошо в том смысле, что только 14% клонов были такими же как и исходная последовательность (ASP с R014I-A064K-T086K-T116E-R123F), приблизительно 3% содержали дополнительные мутации. Все оставшиеся секвенированные клоны (72%) были мутантными и из них приблизительно 94% являлись уникальными мутантами. Результаты секвенирования библиотеки предоставлены ниже в таблице 3-3.


ПРИМЕР 4
Получение неочищенных образцов ферментов вариантов ASP
Варианты белков Asp получали, выращивая трансформанты B. subtilis (описанных выше и в патентной заявке США с серийным № 10/576331) в 96-луночном MTP при 37°C в течение 68 часов в среде MBD (среда определенной композиции на основе MOPS). Среду MBD по существу получали так, как известно в данной области (см. Neidhardt et al., J. Bacteriol., 119:736-747 [1974]), за исключением того, что NH4Cl2, FeSO4, и CaCl2 в основную среду не добавляли, использовали 3 мМ K2HPO4, и основную среду дополняли 60 мМ мочевиной, 75 г/л глюкозой и 1% soytone. Также, добавляли питательные микроэлементы в виде 100× исходного раствора, содержащего в одном литре 400 мг FeSO4•7H2O, 100 мг MnSO4•H2O, 100 мг ZnSO4•7H2O, 50 мг CuCl2•2H2O, 100 мг CoCl2•6H2O, 100 мг NaMoO4•2H2O, 100 мг Na2B4O7•10H2O, 10 мл 1M CaCl2 и 10 мл 0,5 M цитрата натрия.
В следующих примерах описаны тесты, проводимые на различных мутантах ASP. Использовали способы, описанные выше в примере 1. В следующих таблицах, в "коде вариантов" представлена аминокислота дикого типа, положение в аминокислотной последовательности, и замещающая аминокислота (т.е. "F001A" означает, что в данном конкретном варианте фенилаланин в положении 1 в аминокислотной последовательности замещен на аланин).
ПРИМЕР 5
Активность гидролиза казеина вариантов с множественным замещением
В данном примере описаны эксперименты, проводимые для определения казеинолитической активности различных вариантов ASP с множественным замещением. Используемый в этих экспериментах протокол описан в примере 1 выше. В следующей таблице представлены варианты, содержащие мутации в каждом варианте, а также активность казеина для тех из них, у которых активность превышала активность ASP дикого типа плюс 1 стандартное отклонение (≥ 1,13 единиц активности).
В следующей таблице представлены варианты, содержащие мутации в каждом варианте, а также активность казеина для тех из них, у которых активность превышала активность ASP дикого типа плюс 1 стандартное отклонение (> 0,85 единиц активности).
Как показывают эти результаты, в данной системе анализа лучшей эффективностью, чем ASP дикого типа, обладают множество вариантов с множественным замещением.
ПРИМЕР 6
Активность гидролиза кератина вариантов с множественным замещением
В данном примере описаны эксперименты, проводимые для определения кератинолитической активности различных вариантов ASP с множественным замещением. Используемый в этих экспериментах протокол описан в примере 1 выше. В следующей таблице представлены варианты, содержащие мутации в каждом варианте, а также активность гидролиза кератина для тех из них, у которых активность превышала активность ASP дикого типа плюс 1 стандартное отклонение (показатель эффективности ≥ 1,1).
В следующей таблице представлены варианты, содержащие мутации в каждом варианте, а также кератинолитическая активность для тех из них, у которых активность превышала активность ASP дикого типа плюс 1 стандартное отклонение (показатель эффективности > 1,2).
Как показывают эти результаты, в данной системе анализа лучшей эффективностью, чем ASP дикого типа, обладают множество вариантов с множественным замещением.
ПРИМЕР 7
Термостабильность вариантов с множественным замещением
В данном примере описаны эксперименты, проводимые для определения термостабильности различных вариантов ASP с множественным замещением. Используемый в этих экспериментах протокол описан в примере 1 выше. В следующей таблице представлены варианты, содержащие мутации в каждом варианте, а также остаточная активность казеина для тех из них, у которых активность превышала активность ASP дикого типа плюс 1 стандартное отклонение (≥ 48% остаточной активности).
Как показывают эти результаты, в данной системе анализа лучшей эффективностью, чем ASP дикого типа, обладают множество вариантов с множественным замещением.
ПРИМЕР 8
Стабильность вариантов с множественным замещением в LAS
В данном примере описаны эксперименты, проводимые для определения стабильности различных вариантов ASP с множественным замещением в LAS. Используемый в этих экспериментах протокол описан в примере 1 выше, с используемой температурой 25°C. В следующей таблице представлены варианты, содержащие мутации в каждом варианте, а также остаточная активность AAPF для тех из них, у которых активность превышала активность ASP дикого типа плюс 1 стандартное отклонение (≥ 10% остаточной активности).



Стабильность вариантов с множественными заменами в LAS тестировали в дополнительных экспериментах. В первом наборе экспериментов использовали тестовые условия, описанные в примере 1 при температуре 25°C. В следующей таблице, представлены варианты, активность которых превышала активность дикого типа плюс 1 стандартное отклонение (> 20% остаточной активности).



В дополнительных экспериментах использовали другие условия тестирования. В одном наборе условий тестировали стабильность в LAS при повышенной температуре (35°C), с использованием протокола, описанного в примере 1. В следующей таблице приведен процент остаточной активности для вариантов, демонстрирующих активность большую, чем у дикого типа плюс одно стандартное отклонение (> 5% остаточной активности).


В дополнительных экспериментах варианты тестировали при 35°C с использованием протокола, описанного в примере 1. В следующей таблице представлены результаты для вариантов с G12D и R35E, и > 70% остаточной активности.
В дополнительных экспериментах тестировали другие условия. В еще одной серии экспериментов определяли индексы эффективности для множества вариантов с множественными заменами с использованием протокола из примера 1 и тестировали при 25°C. В следующей таблице, представлены результаты определения показателя эффективности (PI) для вариантов с остаточной активностью большей, чем у дикого типа плюс 1 стандартное отклонение (показатель эффективности > 1,1).


В дополнительных экспериментах тестировали стабильность множества вариантов в LAS при 25°C с использованием протокола, приведенного в примере 1. Как указано выше, критерием отбора была остаточная активность, большая чем у WT + 1 стандартное отклонение (показатель (индекс) эффективности > 1,1).



Как показывают эти результаты, в данной системе анализа лучшей эффективностью, чем ASP дикого типа, обладают множество вариантов с множественным замещением.
ПРИМЕР 9
Эффективность удаления загрязнений мутантов с множественным замещением
Используемый в этих экспериментах протокол описан в примере 1 выше. В следующей таблице представлены варианты, содержащие мутации в каждом варианте, для вариантов с активностью большей, чем у дикого типа плюс одно стандартное отклонение (показатель эффективности [PI] > 1,1 ). Как показывают эти результаты в данной системе анализа лучшей эффективностью, чем ASP дикого типа, обладают множество вариантов с множественным замещением.
В дополнительных экспериментах с использованием жидкого детергента получены приведенные ниже результаты. Варианты, приведенные в следующей таблице, демонстрировали активность, большую чем у дикого типа плюс одно стандартное отклонение (показатель эффективности > 1,1), как представлено в следующих ниже таблицах.


В дополнительных экспериментах получены приведенные ниже результаты. В этих экспериментах, варианты сравнивали с 0,5 м.д. ASP дикого типа в качестве эталона. Результаты в следующей таблице представлены для вариантов с активностью, большей, чем у дикого типа плюс одно стандартное отклонение (показатель эффективности >1,1).

В дополнительных экспериментах получены приведенные ниже результаты. Варианты, приведенные в следующей таблице демонстрировали активность, большую, чем у дикого типа плюс одно стандартное отклонение (показатель эффективности >1,1).

ПРИМЕР 10
Эффективность удаления загрязнений мутантов с множественным замещением
В данном примере описаны эксперименты, проводимые для определения возможности удаление загрязнений различными вариантами ASP с множественным замещением. В этих экспериментах использовали приведенные ниже протоколы и материалы.
Вначале получали воду со 105 м.д. (≈ 6 гран на галлон) посредством начального получения исходного раствора со 10000 м.д. (3/1 Ca+2/Mg+2), растворяя 11,020 г/л хлорид кальция дигидрат (CaCl2•2H2O) MW 147,01 г/моль и 5,08 г/л хлорид магния гексагидрат (MgCl2•6H2O) MW 203,3 г/моль в 1000 мл деионизированой воды. Раствор со 105 м.д. получали, разбавляя 10,50 мл исходного раствора с 10000 м.д. с 989,50 мл деионизированой воды.
Раствор детергента TIDE® 2005 (1,6 г/л) получали в воде со 105 м.д., растворяя 11,2 г TIDE®-2005 в 7 литрах вода с 105 м.д.
Загрязненные кровью-молоком-чернилами (BMI) образцы ткани EMPA 116 (11 × 8 см), EMPA 117 (11 × 8 см) из EMPA Testmaterialien AG и загрязненные травой образцы ткани EMPA 164 (10 × 7,5 см) из EMPA Testmaterialien AG и загрязненные средой Equest grass medium (10 × 7,5 см) из Warwick Equest Limited использованные в этих экспериментах, нумеровали с использованием водостойкого карандаша (на загрязненных сторонах). Загрязненные стороны образцов тканей измеряли с использованием Tristimulus Minolta Meter CR-300 (Minolta) и анализировали с использованием уравнения L (L*a*b), D65 Std. Illuminate, на белой основе. Считывания проводил для каждого образца ткани. Так как травяные загрязнители очень чувствительны к свету, загрязненные травой образцы тканей до их использования закрывали и хранили в темноте. Каждый тест эффективности стирки проводили два раза.
В течение теста, использовали внешний балласт (большее механическое действие). Этот балласт, содержащий 2 куска по 10 × 10 см EMPA 221 (незагрязненный хлопок, EMPA Testmaterialien AG, помещенные в один стакан. Эти образцы тканей EMPA 221 не были пронумерованы и измерены.
Тест эффективности стирки проводили с использованием 6 контейнерного, стендового терготометра (TOM) модели 7243S (United States Testing). Температуру доводили до 15°C или 60°F. Половину объема TOM заполняли льдом. Время стирки устанавливали на 12 минут. Тестовые стаканы заполняли 1 литром раствора детергента (полученного в воде со 105 м.д., как описано выше). После достижения растворами 15°C или 60°F, производили старт TOM с перемешиванием 100 об/мин. Затем к смеси добавляли образцы вариантов, как указано ниже. В качестве контроля использовали раствор детергента TIDE® 2005 (Procter & Gamble) без добавления какого-либо образца фермента. Варианты тестировали в двух различных концентрациях (т.е. при 0,55 м.д. и при 2,75 м.д.).
В каждый стакан одновременно поместили шесть образцов тканей (с одними и теми же загрязнителями). Кроме того, добавили 2 образца ткани EMPA 221. Например: для загрязненных BMI образцов тканей - 3 EMPA 116 и 3 EMPA 117 + 2 EMPA 221 (общая масса приблизительно составляет 13,25 грамм), или для загрязненных травой образцов тканей 3 EMPA 164 и 3 загрязненных средой Equest grass medium + 2 EMPA 221 (общая масса приблизительно составляет 13,22 грамм). Затем время стирки снова устанавливали на 12 минут. Через 12 минут стирки все образцы тканей EMPA 116 и EMPA 117 ополаскивали в стакане, а все загрязненные травой образцы тканей ополаскивали в отдельном стакане в течение 3 минут в холодной проточной воде. Затем образцы ткани EMPA 221 убирали. Образцы тканей помещали в центробежную сушку на 2 минуты (образцы тканей EMPA 116 и EMPA 117 сушили отдельно от загрязненных травой образцов тканей). Затем, загрязненные травой образцы тканей сушили на воздухе без света или глажения, тогда как образцы тканей EMPA 116 и EMPA 117 сушили посредством глажения.
После сушки загрязненные стороны образцов тканей оценивали с использованием Tristimulus Minolta Meter CR-300 посредством уравнения L (L*a*b), D65 Std. Illuminate, на белой подложке, при 3 считываниях на образец ткани. Процент удаления загрязнений рассчитывали с использованием уравнения:
% удаления загрязнений = (значение L после стирки - значение L до стирки)/(L0 белый хлопок- значение L до стирки) × 100%
Для получения меры для удаления загрязнений каждого отдельного варианта затем рассчитывали изменение процента удаления загрязнений, вычитая процент удаления загрязнений, полученный с раствором детергента TIDE® 2005 без какого-либо варианта из процента удаления загрязнений в присутствии каждого варианта (дельта % SR). Результаты приведены в таблице 10-1.
Возможности удаления загрязнений для различных вариантов ASP с множественным замещением тестировали в дополнительных экспериментах. Использовали условия тестирования, как описано выше, с указанными ниже модификациями. В этих тестах получали раствор детергента TIDE®2005 SNOW (1,5 г/л) в воде со 105 м.д. растворяя 37,5 г TIDE®2005 SNOW в 25 литрах воды со 105 м.д. Кроме того, загрязненные BMI образцы ткани EMPA 116 разрезали на куски 10 × 7,5 см. Образцы ткани EMPA 117 заменяли на фиксированные образцы ткани EMPA 116 (CFT) и также разрезали на куски 10 × 7,5 см. В этих экспериментах образцы ткани EMPA 164 не использовали. Варианты тестировали при одной концентрации 0,55 м.д. Одновременно в стакан помещали шесть образцов тканей (т.е. 6 EMPA 116 или 6 фиксированных EMPA 116 или 6 Equest). Кроме того, добавляли 2 образца ткани EMPA 221. В качестве контроля использовали раствор детергента TIDE® 2005 SNOW (Procter & Gamble) без добавления какого-либо образца фермента. Каждый тест эффективности стирки проводили четыре раза. Результаты (средняя дельта % SR, стандартное отклонение (STD) и количество повторений (n)) представлены на фигуре 6.
Возможности удаления загрязнений для различных вариантов ASP с множественным замещением тестировали в другом наборе экспериментов. Использовали условия тестирования, как описано выше, с указанными ниже модификациями. В этих тестах, раствор детергента TIDE®2005 SNOW (1,5 г/л), содержащий буфер HEPES, получали в воде со 105 м.д., растворяя 37,5 г TIDE® 2005 SNOW в 25 литрах воды со 105 м.д. Затем добавляли 30 г HEPES (=5 мМ; C8H18N2O4S), раствор перемешивали, и pH доводили до 7,8 ± 19 мл 4 н. NaOH. Следует отметить, что этот раствор можно хранить в течение 36 часов при комнатной температуре. В этих тестах использовали только загрязненные BMI образцы ткани EMPA 116 размером 10 × 7,5 см и образцы тканей, загрязненные средой Equest grass medium размером 10 × 7,5 см. Варианты тестировали при одной концентрации 0,55 м.д. Одновременно в стакан помещали шесть образцов тканей (6 EMPA 116 или 6 загрязненных средой Equest grass medium). Кроме того, добавляли 2 образца ткани EMPA 221. В качестве контроля использовали раствор детергента TIDE® 2005 SNOW (Procter & Gamble) с буфером HEPES без добавления какого-либо образца фермента. Каждый тест эффективности стирки проводили четыре раза. Результаты (средняя Δ % SR, стандартное отклонение (STD) и количество повторов (n)) представлены на фигуре 7.
Как показывают эти результаты, в данной системе анализа лучшей эффективностью, чем ASP дикого типа, обладают множество вариантов с множественным замещением.
ПРИМЕР 11
Эффективность удаления загрязнений в случае мутантов с множественным замещением, тестируемая при низком pH
В данном примере описаны эксперименты, проводимые для определения эффективности удаления загрязнений у различных вариантов ASP с множественным замещением. Используемый в этих экспериментах протокол описан в примере 1 выше. В следующей таблице представлены варианты, содержащие мутации в каждом варианте для тех из них, у которых активность превышала активность ASP дикого типа плюс 1 стандартное отклонение (показатель эффективности 1,1).



В дополнительных экспериментах с использованием жидкого детергента получены приведенные ниже результаты. Варианты, представлены в следующей таблице демонстрировали активность, большую, чем у дикого типа плюс одно стандартное отклонение (> 1,1 показатель эффективности).

Как показывают эти результаты, в данной системе анализа лучшей эффективностью, чем ASP дикого типа, обладают множество вариантов с множественным замещением.
ПРИМЕР 12
Эффективность очистки вариантов ASP при автоматической мойке посуды
В данном примере описаны эксперименты, проводимые для определения эффективности очистки вариантов ASP при автоматической мойке посуды (ADW) детергентом TABLET ACTION PACK® в сравнении с эталонной сериновой протеазой ("Протеаза B") на чувствительных к протеазам загрязнителях. Как показано в таблице ниже, варианты ASP удаляют загрязнители намного лучше, чем протеаза B.
Проводили тест по микромойке с использованием 24-луночных планшетов. Штамповали Диски из нержавеющей стали с использованием молота и штамповального пресса. Диски очищали и взвешивали для получения исходных масс. Как описано ниже получали яичные загрязнители ("Получение взболтанных яиц" и "Получение яичного желтка"). Затем 50 мкл полученных яиц наносили на каждый диск. Препаратам позволяли высыхать при комнатной температуре в течение 30 минут, затем их пекли в печи при 80°C в течение 2 часов. Диски охлаждали до комнатной температуры. После загрязнения диски взвешивали для получения массы загрязнений на дисках. Загрязненные диски вставляли в 24-луночный полистирольный планшет NUNCLON®. Получали рабочий раствор для автоматической мойки посуды посредством тщательного смешивания соответствующего количества ADW без фермента (например, Powder 4500 м.д.) в 1 л воды с 11 гран на галлон при 40°C. Жесткость раствора получали, смешивая 188,57 г CaCl2•2H2O и 86,92 г MgCl2•6H2O в 1 л деионизированной воды. В тесте в каждую лунку при 55°C добавляли 2 мл предварительно нагретого раствора ADW. Затем в каждую лунку помещали соответствующее количество фермента. В некоторых вариантах осуществления тесты проводили с использование шести параллелей, с четырьмя повторами, тогда как в других вариантах осуществления тест проводили в четырех параллелях с шестью повторами. Затем планшеты герметически закрывали пленкой. Планшеты помещали в предварительно нагретый инкубатор/шейкер и закрепляли кюветодержателями. Планшеты мыли в течение 30 минут при соответствующей температуре (например, 55°C для европейских условий мойки) при 180 об/мин. После мойки планшеты осторожно ополаскивали, три раза опуская их в теплую водную баню. Диски вынимали из планшетов и сушили в термостате в течение 1 часа при 80°C. После сушки диски взвешивали для получения массы вымытых дисков. Гравиметрическую оценку, дающую приблизительный процент удаления, рассчитывали, следующим образом:
% удаления = (масса с загрязнением - масса после мойки)/(масса с загрязнением - масса в чистом состоянии) × 100
Индекс удаления = % удаления / % удаления эталонной протеазой (протеазой B)
Получение взболтанных яиц
Яйца для применения в тестировании протеазы и/или детергентных композиций, содержащих тестируемый фермент(ы) подготавливали следующим образом. Сначала 100 мл молока 10% жирности смешивали с 3 целыми яйцами. Смесь жарили с продолжением перемешивания до тех пор, пока смесь не становилась почти не текучей. Затем добавляли дополнительные 40 мл молока и смесь перемешивали с помощью ручного перемешивания или блендера до высокооднородного состоянии без признаков комков. Перед загрязнением яичной смеси позволяли остывать до комнатной температуры.
Получение яичного желтка
Водяную баню нагревали, устанавливая температурный датчик на плиту при 60°C. Над стаканом помещали процеживатель мякоти. Для получения яичных желтков разбивали 6-9 яиц и желтки отделяли от белков. Желточные мешки не разрушали, хотя любой остаток, находящийся на желтках удаляли. Желтки осторожно прополаскивали в холодной воде. Желтки осторожно разрушали над сортировщиком или стаканом. После процеживания желтков стакан, содержащий процеженные желтки, помещали в водную баню. Желтки перемешивали в течение 30 минут при 60°C. Желтки убирали из водяной бани и помещали в холодную водную баню на 30 минут. Любую пленку, образующуюся на поверхности, осторожно удаляли.
Получение яичных загрязнителей с использованием пластин из нержавеющей стали(1 × 3 дюйма)
Каждую металлическую пластину погружали в препарат взболтанных яиц или яичного желтка (полученных как описано выше) и однократно обстукивали, убеждаясь, что на каждом диске присутствовало приблизительно одинаковое количество. Обратные стороны пластин вытирали тканью для их очистки. Затем пластины помещали на две полки термостата в порядке номеров. Пластины оставляли сушиться в течение 30 минут при комнатной температуре. Пластины прожаривали в течение 2 часов при 80°C (+/-1°C), с обменом верхней и нижней полок и поворачивали на 180° (+/-1°C) через 1 час. Охлажденные загрязненные пластины взвешивали в порядке 1-96.
Для мойки восемь загрязненных пластин помещали на верхнюю и нижнюю решетку моющей машины. Предварительная мойка и основная мойка с учетом возможностей стаканов Whirlpool 840 составляли 40 мл для предварительной мойки и 60 мл для основной мойки. Как правило, в одном тесте запускали четыре средства с использованием четырех машин GE 500. Для тестового цикла загрязненные пластины помещали в машины, и тестируемое средство помещали в стаканы для предварительной мойки и основной мойки. Температуру воды устанавливали на 120°F и машины запускали на нормальном цикле мойки. В конце последнего цикла ополаскивания пластины вынимали из машин для взвешивания. Пластины не проходили цикл сушки. В конце четвертого повторения каждое средство однократно запускали в каждой машине. Все четыре повторения проводили в одни сутки. На следующие сутки повторяли те же процедуры с использованием новых загрязненных субстратов с получением всего 8 повторений на средство, которые затем усредняли с получением конечных результатов. Гравиметрическую оценку, дающую приблизительный процент удаления, рассчитывали, следующим образом:
% удаления = (масса с загрязнением - масса после мойки)/(масса с загрязнением - масса в чистом состоянии) × 100
Индекс удаления = % удаления / % удаления эталонной протеазой (протеазой B)
Результаты этих тестов эффективности представлены ниже в таблице 12-1:
ПРИМЕР 13
Эффективность очистки вариантов ASP в порошковых детергентах для стирки
В данном примере описаны эксперименты, проводимые для определения эффективности очистки вариантов ASP при стирке порошковым детергентом ARIEL®. В этих экспериментах, эффективность вариантов сравнивали с эталонной сериновой протеазой (например, "протеаза C") при очистке реальных элементов (RIC).
Тесты проводили с использованием стиральных машин Meile с использованием следующих условий: температура - 40°C, жесткость - 21 гран на галлон, детергент - 7300 м.д., протеаза - 0,88 м.д., RI - 0,75 кг, общий балласт и RI - 2,5 кг, вода - 13 л, время стирки - 20 минут, время полоскания - 3 × 5 минут.
В этих экспериментах для чистого балласта использовали двуспальные и полутороспальные простыни и чистые носки (J&R Coordinating Service). Кроме того, тестировали реальные потребительских объектов (RI), включая носки, футболки, наволочки, полотенца и чайные полотенца. В этих экспериментах использовали загрязнения, содержащие дрожжи и AS1 (искусственный загрязнитель 1; Equest). Композиция AS1 представлена ниже в таблице 13-1.
Предметы одежды разрезали пополам так, чтобы обеспечить одинаковый размер предмета одежды для тестирования, где предметы одежды выбрали для однородного уровня загрязнения. Две половины кодируют в приведенном на схеме порядке пар (например, левая сторона/правая сторона предмета одежды).
Предметы одежды, помеченный "A", стирали с вариантом ASP, тогда как предметы, одежды помеченные "B", стирали с протеазой C. Тесты проводили по схеме 4×4×2 (каждую обработку повторяли в четырех машинах с двумя внутренними повторами с RI).
Процедура тестирования
Объединяли балласт из свернутых постельных простыней и RI с получением общей массы загрузки 2,5 кг и подготавливали для загрузки в машину для ручной стирки Meile, с открытой на передней панели патрубком "21 гран на галлон". Затем стиральную машину включали. Температуру устанавливали на 40°C и на четыре цикла стирки. Затем в стиральную машину помещали балласт и RI. Кроме того к каждому повтор добавляли 20 г AS1 и чистые носки, загрязненные 17 г пекарских дрожжей. Затем в лоток для детергента в машине добавляли детергент (95 г) и запускали цикл. После того, как детергент вымоется из лотка, добавляли любые жидкости, которые нужно было добавить. Затем машина отрабатывала все ее циклы. После завершения цикла стирки содержимое переносили в сушку и сушили в течение 30 минут. Затем визуально оценивали объекты с получением результатов PSU и предпочтительных номеров в программе LSG.
Оценка тестов
Всю совокупность тестов оценивали один раз в пределах 72 часов стирки и сушки тестируемых объектов. Разделенный элемент предмета одежды размещали в экспертной комнате и оценивали, по меньшей мере, 3 эксперта с использованием шкалы Scheffe. Дополнительно, по меньшей мере, 2 эксперта, оценивали загрязнитель A по отношению к загрязнителю B.
Обработка результатов
Оценки вводили в ручной Psion с установленным программным обеспечением для тестирования стирки. Когда завершали работу со всеми разделенными элементами, данные переносили в персональный компьютер, где рассчитывали степень PSU, % преимущества между обработками A и B и LSD для каждого предмета одежды. Значимые различия между средствами рассчитывали с доверительным интервалом 90%.
Для сравнения двух средств (формул) используют системы степеней градации PSU. Две формулы тестируют на эффективность (например, остаточные загрязнения после стирки). В этих экспериментах сравнивают несколько тканей, выстиранных обоими средствами (например, средство A и средство B). Два или более экспертов осуществляют оценку, при которой используют следующую шкалу Schelle:
0: Нет предпочтений
1: Я думаю, что это средство немного лучше (не уверен)
2: Я знаю, что это средство немного лучше
3: Это средство лучше
4: Это средство намного лучше
ПРИМЕР 14
Стабильность вариантов ASP при хранении
В данном примере описаны эксперименты, проводимые для определения стабильности различных вариантов ASP, тестируемых в жидком детергенте TIDE® в сравнении с ASP дикого типа, при хранении. Протеазную активность вариантов ASP и ASP дикого типа тестировали с использованием автоматического анализатора Hitachi 911. В этих тестах для оценки протеазной активности в качестве субстрата использовали сукцинил-L-Ala-L-Pro-L-Phe-п-нитроанилид (pNA). В данном тесте активная протеаза расщепляет концевую карбоксиамидную связь с выходом п-нитроанилина. Интенсивность полученной желтой окраски, считанная при 415 нм/450 нм, пропорциональна активности протеазы в образце, который калибровали по протеазному стандарту SAVINASE®.
Как указано в следующей таблице, по сравнению ASP дикого типа существовали значительные улучшения стабильности при хранении сконструированных вариантов. В данной таблице "% остаточной активности" определяли с использованием следующей формулы: % остаточной активности = Активность/Исходная активность × 100%
ПРИМЕР 15
Определение очищающей активности ASP
В данном примере описаны эксперименты, проводимые для определения очищающей активности ASP в различных условиях, а также описаны свойства различных условий стирки.
Существует широкое разнообразие условий стирки, включая различные детергентные препараты, объем воды для стирки, температура воды для стирки и время стирки. Таким образом, компоненты детергента, такие как протеазы должны быть способны переносить вредные условия окружающей среды и функционировать в них. Например, детергентные препараты, используемые в различных регионах, содержат различные концентрации их соответствующих компонентов, присутствующих в воде для стирки. Например, европейский детергент, как правило, содержит в воде для стирки приблизительно 3000-8000 м.д. детергентных компонентов, тогда как японский детергент, как правило, содержит в воде для стирки менее 800 (например, 667 м.д.) детергентных компонентов. В Северной Америке, в частности в Соединенных Штатах, детергенты, как правило, содержат в воде для стирки приблизительно от 800 до 2000 (например, 975 м.д.) детергентных компонентов.
Латиноамериканские детергенты, как правило, являются высокопенными детергентами с фосфатной добавкой для повышения моющего действия, а диапазон детергентов, используемый в Латинской Америке, может попадать в средние и высокие концентрации детергентов, так как он находятся в диапазоне от 1500 м.д. до 6000 м.д. детергентных компонентов в воде для стирки. В бразильских детергентах в воде для стирки, как правило, содержится приблизительно 1500 м.д. детергентных компонентов. Однако системы с высокой концентрацией детергента в воде для стирки приблизительно до 6000 м.д. детергентных компонентов могут использовать в других географических регионах, где применяют высокопенный детергент с фосфатной добавкой для повышения моющего действия, не ограничиваясь другими странами Латинской Америки.
В свете указанного выше очевидно, что концентрации детергентных композиций в типичных моющих растворах во всем мире варьируют от менее чем приблизительно 800 м.д. детергентной композиции ("географические регионы с низкой концентрацией детергента"), например приблизительно 667 м.д. в Японии, до приблизительно от 800 м.д. до приблизительно 2000 м.д. ("географические регионы со средней концентрацией детергента"), например, приблизительно 975 м.д. в США и приблизительно 1500 м.д. в Бразилии, до более чем приблизительно 2000 м.д. ("географические регионы с высокой концентрацией детергента"), например, приблизительно от 3500 м.д. до приблизительно 8000 м.д. в Европе и приблизительно 6000 м.д. в географических регионах с высокопенным фосфатным средством с фосфатной добавкой для повышения моющего действия.
Концентрации типичных моющих растворов определяют эмпирически. Например, в США типичная стиральная машина вмещает объем моющего раствора приблизительно 64,4 л. Таким образом, для получения концентрации детергента в моющем растворе приблизительно 975 м.д., в 64,4 л моющего раствора необходимо добавить приблизительно 62,79 г детергентной композиции. Данное количество представляет собой обычное количество, отмеряемое в воду для стирки потребителем с использованием мерной чашки, предоставляемой с детергентом.
В качестве дополнительного примера в различных географических областях используют различные температуры стирки. Температура воды для стирки в Японии, как правило, меньше, чем температура воды для стирки, используемая в Европе. Например, температура воды для стирки в Северной Америке и Японии может составлять от 10 до 30°C (например, приблизительно 20°C), тогда как температура воды для стирки в Европе, как правило, составляет от 30 до 50°C (например, приблизительно 40°C).
В качестве дополнительного примера, в разных географических зонах вода может иметь разную жесткость. Жесткость воды обычно измеряют в гранах на галлон смеси ионов Ca2+/Mg2+. Жесткость является мерой количества кальция (Ca2+) и магния (Mg2+) в воде. В Соединенных Штатах вода в основном жесткая, но степень ее жесткости варьирует от места к месту. От умеренно жесткой (60-120 ч./млн.) до жесткой (121-181 ч./млн.), вода содержит от 60 до 181 частей на миллион (части на миллион, в переводе на граны на галлон США, составляют количество ч./млн., деленное на 17,1, что и равно гранам на галлон) минералов жесткости. В таблице 15-1 указаны интервалы жесткости воды.
Жесткость воды в Европе, как правило, является большей, чем 10,5 (например, 10,5-20,0) гран на галлон совокупных Ca2+/Mg2+ (например, приблизительно 15 гран на галлон совокупных Ca2+/Mg2+). Жесткость воды в Северной Америке, как правило, больше, чем жесткость воды в Японии, но меньше чем жесткость воды в Европе. Например, жесткость воды в Северной Америке может составлять от 3 до 10 гран, 3-8 гран или приблизительно 6 гран. Жесткость воды в Японии, как правило, меньше, чем жесткость воды в Северной Америке, как правило, менее чем 4, например, 3 грана на галлон совокупных Ca2+/Mg2+.
Настоящее изобретение относится к вариантам протеазы, обеспечивающим улучшенную эффективность стирки, по меньшей мере, в одном наборе условий стирки, а, как правило, в нескольких условиях стирки.
Как описано в настоящем документе, варианты протеазы тестируют на эффективность при различных типах детергента и условиях стирки с использованием анализа микрообразцов ткани (см. выше, и патентную заявку США с серийным № 09/554992; и WO 99/34011, которые включены в настоящий документ в качестве ссылки). Также варианты протеазы сходным образом тестируют на других загрязняющих субстратах.
ПРИМЕР 16
Жидкие композиции для очистки тканей
В данном примере представлены жидкие композиции для очистки тканей, которые находят применение по настоящему изобретению. Полагают, что эти композиции найдут конкретное применение в условиях машинной стирки в Японии, а также для приложений, включающих очистку тонких и/или нежных тканей. В таблице 13-1 представлена подходящая композиция. Однако не следует понимать, что настоящее изобретение ограничено данным конкретным средством, так как по настоящему изобретению находят применение множество других средств.
pH в композициях примера 16-4 (I)-(II) приблизительно составляет от 5 до приблизительно 7, а (III)-(V) - приблизительно от 7,5 до приблизительно 8,5. #1: добавить 1 н. водный раствор HCl для установки чистого pH формулы в диапазоне приблизительно от 3 до приблизительно 5.
ПРИМЕР 17
Жидкие композиции для мытья посуды
В данном примере представлены жидкие композиции для мытья посуды, которые находят применение по настоящему изобретению. Полагают, что эти композиции найдут конкретное применение в условиях мытья посуды в Японии. Однако не следует понимать, что настоящее изобретение ограничено данным конкретным средством, так как по настоящему изобретению находят применение множество других средств.
По настоящему изобретению представлены следующие прессованные композиции высокой плотности для мытья посуды.
По настоящему изобретению представлены следующие жидкие детергентные композиции для ручной мойки посуды.
pH в композициях примера 17-1 от (I) до (VI) приблизительно составляет от 9,6 до приблизительно 11,3.
По настоящему изобретению представлены следующие композиции жидких детергентов для автоматического мытья посуды.
По настоящему изобретению представлены следующие таблетированные детергентные композиции. Эти композиции получают прессованием гранулярных детергентных композиций для мытья посуды при давлении 13 кН/см2 с использованием стандартного 12 головочного ротационного пресса.
pH в примерах от 17-4 (I) до (VIII) составляет приблизительно от 10 до приблизительно 11,5.
Масса таблетки в примерах от 17-4 (I) до 7 (VIII) составляет приблизительно от 20 грамм до приблизительно 30 грамм.
Следующая композиция для мытья посуды найдет особенное применение в условиях мытья в Японии.
ПРИМЕР 18
Жидкие композиции для очистки тканей
Протеазы по настоящему изобретению находят конкретное применение в чистящих композициях. Например, полагают, что по изобретению можно получать жидкую композицию для очистки тканей с конкретным применением в условиях машинной стирки в Японии. В некоторых предпочтительных вариантах осуществления эти композиции содержат следующие компоненты, представленные в таблице 18-1.
ПРИМЕР 19
Гранулярные композиции для очистки тканей
В данном примере представлены гранулярные композиции для очистки тканей, которые находят применение по настоящему изобретению. В следующих таблицах представлены подходящие композиции. Однако не следует понимать, что настоящее изобретение ограничено данными конкретными средствами, так как по настоящему изобретению находят применение множество других препаратов.
По настоящему изобретению представлены следующие композиции для стирки. Эти композиции пригодны для использования в виде гранул или таблеток.
Полагают, что следующие детергентные композиции для стирки найдут особое применение в условиях машинной стирки в Европе.
ПРИМЕР 20
Детергентные композиции для чистки твердых поверхностей
Настоящее изобретение также относится к композициям, подходящим для чистки твердых поверхностей.
pH этих композиций составляет приблизительно от 7,4 до приблизительно 9,5.
ПРИМЕР 21
Корм для животных, содержащий ASP
Настоящее изобретение также относится к композициям животных кормов, содержащих варианты ASP. В данном примере представлен один такой корм, подходящий для домашней птицы. Однако не следует понимать, что настоящее изобретение ограничено данной конкретной композиции, так как протеазы по настоящему изобретению находят применение во многих других кормовых композициях. Далее полагают, что корма по настоящему изобретению подходят для кормления любого животного, включая в качестве неограничивающих примеров домашний скот (например, крупный рогатый скот, свиней, овец и т.д.), а также домашних животных (например, собаки, кошки, лошади, грызуны и т.д.). В следующей таблице представлена композиция для комбикорма, а именно основанный на кукурузе начальный корм, подходящий для кормления индюшат в возрасте от 3 недель.
В некоторых вариантах осуществления данную кормовую композицию дополняют различными концентрациями протеаз(ы) по настоящему изобретению (например, 2000 единиц/кг, 4000 единиц/кг и 6000 единиц/кг).
Все патенты и публикации, указанные в описании, приведены для специалистов в области, к которой относится данное изобретении. Все патенты и публикации включены в настоящий документ в качестве ссылки в той же степени, как если бы каждая конкретная публикация была конкретно и отдельно указана для включения в качестве ссылки.
Имея описание предпочтительных вариантов осуществления настоящего изобретения, специалистам в данной области ясно, что можно получать различные модификации описанных вариантов осуществления и что такие модификации следует включать в объем настоящего изобретения.
Специалисты в данной области легко поймут, что настоящее изобретение хорошо адаптировано для осуществления целей и получения указанных следствий и преимуществ, а также как присущие им. Композиции и способы, описываемые в настоящем документе, представляющие предпочтительные варианты осуществления являются иллюстративными, и не предназначены для ограничения объема изобретения. Специалист в данной области легко поймет, что с описанным в настоящем документе изобретением можно производить различные изменения и модификации без отклонения от объема и сущности изобретения.
Изобретение, иллюстративно описываемое в настоящем документе, надлежащим образом можно осуществлять на практике в отсутствие любых компонента или компонентов, ограничения или ограничений, которые конкретно не описаны в настоящем документе. Термины и выражения, которые применяют, используются в качестве описательных терминов, а не ограничения, и что не было намерения в использовании таких терминов и выражений исключать любые эквиваленты представленных и описанных возможностей или их частей, но следует понимать, что в заявленном объеме изобретения возможны различные модификации. Таким образом, следует понимать, что хотя настоящее изобретение конкретно описано посредством предпочтительных вариантов осуществления и необязательных возможностей, специалист в данной области может проводить модификацию и вариацию основных описанных понятий по настоящему изобретению и что такие модификации и вариации предусмотрены в объеме данного изобретения, как определено в приложенной формуле изобретения.
Изобретение описано в настоящем изобретении в широком смысле и обобщительно. Каждая более узкая и менее общая группировка, попадающая в общее описание, также составляет часть изобретения. Это включает общее описание изобретению с условием или отрицательным ограничением, удаляющим любой объект из рода, вне зависимости процитирован ли конкретно или нет удаляемый материал.
Реферат
Изобретение относится к области биохимии, в частности к выделенному варианту сериновой протеазы, содержащему, по меньшей мере, от пяти до восьми аминокислотных замен в положениях, выбранных из группы, состоящей из положений 12, 14, 15, 16, 24, 35, 36, 39, 49, 54, 61, 63, 64, 65, 67, 69, 75, 76, 78, 79, 81, 86, 92, 93, 99, 109, 112, 121, 123, 125, 127, 143, 159, 179, 181, 184, 189, где заменяющая аминокислота в указанном положении выбрана из группы, состоящей из F, G, L, V, I, S, A, Y, K, W, M, P, N, Q, T, E, H, R, C, N и D, где указанные замены сделаны в положениях, эквивалентных положениям в протеазе Cellulomonas 69 В4, а также к молекуле нуклеиновой кислоты, ее кодирующей. Раскрыты экспрессионный вектор, содержащий вышеуказанную молекулу нуклеиновой кислоты, а также клетка-хозяин, его содержащая. Также раскрыты чистящая композиция, корм для животных, композиция для обработки ткани или кожи, содержащие вышеуказанный вариант сериновой протеазы, а также способ очистки с использованием вышеуказанной чистящей композиции. Заявленное изобретение имеет улучшенную казеинолитическую активность и/или термостабильность, и/или стабильность в LAS, и/или улучшенный гидролиз казеина по сравнению с протеазой, не имеющей указанное число замен. 14 н. и 49 з.п. ф-лы, 7 ил., 21 табл., 21 пр.
Формула
R16Q/R79T/R123L/R159Q/R179Q, G12D/S15E/R35D/R123F/R159E.
R16Q/R79T/R123L/R159Q/R179Q,
R14L/R35F/R79T/R123L/R159Q,
G12D/S15E/R35H/R123F/R127Q/R159E,
G12D/S15E/R35D/R123F/R159E,
G12D/R14Q/R35E/R127Q/R159E,
G12D/R14D/R35H/R123D/R127Q,
R14I/G65Q/N67L/Y75G/R127A/R159K,
R14I/G65Q/S76V/R127A/R159K,
R14I/R35F/G65Q/R127A/R159K,
R14I/R35F/N67L/R127A/R159K,
R14I/T36S/G65Q/R127A/R159K,
N024A/G049A/A093H/S099N/R127K/A143N/R159K/I181Q,
N024A/S076A/A093H/S099G/R127K/R159K,
N024A/S076T/A093S/S099G/R127K/R159K,
N024E/G049A/A093G/S099G/R127K/A143N/R159K/I181T,
N024E/G049A/A093H//R127K/A143N/R159K/I181Q,
N024E/G049A/A093S/S099D/R127K/A143N/R159K/I181Q,
N024H/G049A/A093T/S099A/R127K/A143N/R159K/I181Q,
N024H/S076A/A093G/S099G/R127K/R159K,
N024H/S076A/A093H/S099G/R127K/R159K,
N024H/S076A/A093S/S099A/R127K/R159K/G054H/L069H,
N024H/S076A/A093T/S099G/R127K/R159K,
N024H/S076N/A093Q/S099W/R127K/R159K,
N024H/S076V/A093Q/S099G/R127K/R159K,
N024L/G049A/A093H/S099A/R127K/A143N/R159K/I181Q,
N024L/G049A/A093S/S099A/R127K/A143N/R159K/I181Q,
N024L/S076V/A093H/S099G/R127K,
N024L/S076V/A093S/S099A/R127K/R159K,
N024M/G049A/A093G/S099A/R127K/A143N/R159K/I181Q,
N024M/G049A/A093H/S099D/R127K/A143N/R159K/I18IQ,
N024M/G049A/A093S/S099A/R127K/A143N/R159K/1181Q,
N024M/G049A/A093S/S099W/R127K/A143N/R159K/I181Q,
N024Q/G049A/A093H/S099A/R127K/A143N/R159K/I181T,
N024Q/G049A/A093S/S099A/R127K/A143N/R159K/I181Q,
N024Q/G049A/A093S/S099A/R127K/A143N/R159K/I181T,
N024Q/S076A/A093H/S099A/R127K/R159K/T03 9N,
N024Q/S076A/A093H/S099W/R127K/R159K,
N024Q/S076I/A093T/S099G/R159K,
N024Q/S076T/A093S/R127K/R159K,
N024S/S076A/A093G/S099G/R127K/R159K/G054A,
N024S/S076A/A093H/S099T/R127K/R159K,
N024S/S076A/A093S/S099W/R127K/R159K,
N024S/S076A/A093T/S099W/R127K,
N024S/S076T/A093Q/S099W/R127K/R159K,
N024S/S076Y/A093T/S099A/R127K/R159K,
N024T/G049A/A093G/S099A/R127K/A143N/R159K/I181Q,
N024T/G049A/A093H/S099A/R127K/A143N/R159K/I181Q,
N024T/G049A/A093H/S099A/R127K/A143N/R159K/I181T,
N024T/G049A/A093H/S099D/R127K/A143N/R159K/I181Q,
N024T/G049A/A093S/S099A/R127K/A143N/R159K/I181T,
N024T/G049A/A093T/S099A/R127K/A143N/R159K/I181T,
N024T/S076N/A093Q/S099T/R127K/R159K,
N024T/S076T/A093T/S099N/R127K/R159K,
N024V/S076V/A093Q/S099G/R127K/R159K,
N024W/A093G/S099W/R127K/R159K,
N024W/G049A/A093H/S099A/R127K/A143N/R159K/I181Q,
N024W/G049A/A093S/S099A/R127K/A143N/R159K/I181K,
N024W/G049A/A093S/S099A/R127K/A143N/R159K/I181Q,
N024W/S076A/A093T/S099A/R127K/R159K,
N024W/S076I/A093Q/S099G/R127K/R159K,
N024W/S076N/A093T/S099G/R159K,
N024W/S076T/A093H/S099A/R127K/R159K,
N024W/S076T/A093H/S099W/R127K/R159K,
N024W/S076V/A093H/S099A/R127K/R159K,
N24A/G54E/S76D/A93G/R127K/R159K,
N24E/G54L/S76E/A93G/R127K/R159K,
N24E/G54Q/A93S/R127K/R159K,
N24E/S76D/A93T/R127K/R159K,
N24H/G54E/A93G/R127K/R159K,
N24H/S76D/A93H/R127K/R159K,
N24L/G54E/A93G/R127K/R159K,
N24L/G54L/A93G/R127K/R159K,
N24L/G54Q/S76A/A93H/R127K/R159K,
N24L/S76T/A93G/R127K/R159K,
N24L/S76T/A93H/R127K/R159K,
N24M/G54E/A93H/R127K/R159K,
N24M/G54E/S76N/A93S/R127K/R159K,
N24M/G54I/A93H/R127K/R159K/S187I,
N24Q/G54D/A93H/R127K/R159K,
N24Q/G54I/A93G/R127K/R159K,
N24Q/G54I/S76E/A93H/R127K/R159K,
N24Q/G54Q/A93G/R127K/R159K,
N24Q/G54Q/S76T/A93H/R127K/R159K,
N24Q/S76A/A93G/R127K/R159K,
N24T/G54D/S76V/A93G/R127K/R159K,
N24T/G54E/S76V/A93H/R127K/R159K,
N24T/G54I/A93G/R127K/R159K,
N24T/G54N/A93H/R127K/R159K,
N24T/G54Q/S76N/A93G/R127K/R159K,
N24T/G54Q/S76V/R127K/R159K,
N24T/S76L/A93G/R127K/R159K,
N24W/G54D/A93H/R127K/R159K,
N24W/G54I/S76A/A93H/R127K/R159K,
N24W/S76A/A93H/R127K/R159K,
N24W/S76E/A93G/R127K/R159K,
R014I/S076A/A093G/R127K/R159K/I181T,
R014I/S076A/A093H/R127K/R159K/I181K,
R014I/S076A/A093H/R127K/R159K/I181Q,
R014I/S076A/A093H/R127K/R159K/I181T,
R014I/S076D/A093H/R127K/R159K/I181Q,
R014I/S076D/A093S/R127K/R159K/I181T,
R014I/S076E/A093S/R127K/R159K/I181Q,
R014I/S076E/A093T/R127K/R159K/I181K,
R014I/S076I/A093S/R127K/R159K/I181Q,
R014I/S076N/A093H/R127K/R159K/I181Q,
R014I/S076T/A093G/R127K/R159K/I181Q,
R014K/S076A/A093G/R127K/R159K/I181K,
R014K/S076E/A093H/R127K/R159K/I181K,
R014K/S076T/A093H/R127K/R159K/I181Q,
R014L/S076A/A093H/R127K/R159K,
R014L/S076A/A093H/R127K/R159K/I181Q,
R014L/S076D/A093H/R127K/R159K/I181T,
R014L/S076E/A093H/R127K/R159K/I181K,
R014M/S076A/A093G/R127K/R159K/I181K,
R014M/S076A/A093G/R127K/R159K/I181T,
R014M/S076A/A093H/R127K/R159K/I181T,
R014M/S076A/A093S/R127K/R159K/I181K,
R014M/S076A/A093S/R127K/R159K/I181T,
R014M/S076A/A093T/R127K/R159K/I181Q,
R014M/S076D/A093S/R127K/R159K/I181T,
R014M/S076E/A093G/R127K/R159K/I181T,
R014M/S076E/A093H/R127K/R159K/I181T,
R014M/S076E/A093S/R127K/R159K/I181T,
R014M/S076N/A093G/R127K/R159K/I181K,
R014M/S076N/A093G/R127K/R159K/I181T,
R014M/S076N/A093H/R127K/R159K/I181Q,
R014M/S076N/A093H/R127K/R159K/I181T,
R014M/S076N/A093S/R127K/R159K/I181T,
R014M/S076N/A093T/R127K/R159K/I181T,
R014M/S076T/A093H/R127K/R159K/I181K,
R014M/S076V/A093G/R127K/R159K/I181Q,
R014M/S076V/A093H/R127K/R159K/I181Q,
R14I/N24A/A64K/R123F/R159E/D184T,
R14I/A64K/R123F/R159F/D184T,
R14I/A64K/R123F/R159E/D184T,
R14I/N24Q/R35E/A64K/R123F/D184T,
R14I/N24Q/A64K/N67S/R123F/R159F/D184T,
R14I/N24A/R35E/A64K/N67S/R123F/R159E/D184T,
R14I/N24A/R35E/A64K/N67S/G78D/R123F/D184T,
R14I/N24A/R35D/A64K/R123F/R127K/R159F/D184T,
R14I/N24A/A64K/R123F/R159N/D184T,
R14I/N24Q/R35D/A64K/N67S/R123F/R159K/D184T,
R14I/N24E/A64K/R123F/R127K/R159K/D184T,
R14I/N24A/A64K/R123F/D184T,
R14I/A64K/R123F/R127K/R159F/D184T,
R14I/A64K/R123F/R159E/D184T,
R14I/A64K/R123F/R159N/D184T,
R14I/A64K/R123F/R159K/D184T,
R14I/A64K/R123F/R127Y/R159E/D184T,
R14I/A64K/R123F/R127Y/R159K/D184T,
R14I/N24Q/A64K/R123F/R127Q/R159K/D184T,
R14I/A64K/R123F/R159K/D184T,
R14I/N24Q/R35D/A64K/N67S/R123F/R159K/D184T,
R14I/N24A/R35D/A64K/N67A/R123F/R159F/D184T,
R14I/A64K/R123F/R127K/R159E/D184T,
N24E/R35E/G54D/N67S/R127K/R159N,
N24Q/R35D/N67S/R127K/R159E,
R14I/A63K/R123F/R159E/D184T,
R14I/A63K/R123F/R159F/D184T,
R14I/A63K/R123F/R159K/D184T,
R14I/A63K/R123F/R159N/D184T,
R14I/G54D/A63K/R123F/D184T,
R14I/G54D/S76N/A93H/R127K/R159K/I181Q,
R14I/G54D/S76V/A93S/R127K/R159K/I181K,
R14I/N24A/A63K/R123F/D184T,
R14I/N24E/A63K/R123F/D184T,
R14I/N24Q/A63K/R123F/D184T,
R14I/N24T/A63K/R123F/D184T,
R14I/N24T/S76N/A93H/R127K/R159K/I181Q,
R14I/N24T/S76V/A93S/R127K/R159K/I181K,
R14I/N67A/S76N/A93H/R127K/R159K/I181Q,
R14I/N67L/S76N/A93H/R127K/R159K/I181Q,
R14I/N67S/S76N/A93H/R127K/R159K/I181Q,
R14I/R35D/S76N/A93H/R127K/R159K/I181Q,
R14I/R35E/A63K/R123F/D184T,
R14I/R35E/S76N/A93H/R127K/R159K/I181Q,
R14I/R35E/S76V/A93S/R127K/R159K/I181K,
R14I/R35K/A63K/R123F/D184T,
R14I/S76N/A93H/R127K/R159E/I181Q,
R14I/S76N/A93H/R127K/R159F/I181Q,
R14I/S76N/A93H/R127K/R159N/I181Q,
R14I/S76N/A93H/R127Q/R159K/I181Q,
R14I/S76N/A93H/R127Y/R159K/I181Q,
R14I/S76V/A93S/R127K/R159F/I181K,
R14I/S76V/A93S/R127K/R159N/I181K,
R14I/S76V/A93S/R127Q/R159K/I181K,
R14I/S76V/A93S/R127Y/R159K/I181K,
R14M/G54D/S76N/A93G/R127K/R159K/I181K,
R14M/N24A/S76N/A93G/R127K/R159K/I181K,
R14M/N24E/S76N/A93G/R127K/R159K/I181K,
R14M/N24Q/S76N/A93G/R127K/R159K/I181K,
R14M/N24T/S76N/A93G/R127K/R159K/I181K,
R14M/N67S/S76N/A93G/R127K/R159K/I181K,
R14M/R35D/S76N/A93G/R127K/R159K/I181K,
R14M/R35E/S76N/A93G/R127K/R159K/I181K,
R14M/S76N/A93G/R127K/R159E/I181K,
R14M/S76N/A93G/R127K/R159F/I181K,
R14M/S76N/A93G/R127K/R159N/I181K,
R14M/S76N/A93G/R127Q/R159K/I181K и
R14M/S76N/A93G/R127Y/R159K/I181K.
N024E/G049A/A093H/R127K/A143N/R159K/I181Q,
N024E/G049A/A093S/S099D/R127K/A143N/R159K/I181Q,
N024Q/G049A/A093S/S099A/R127K/A143N/R159K/I181Q,
N024Q/G049A/A093S/S099A/R127K/A143N/R159K/I181T,
N024Q/G049A/A093S/S099N/R127K/A143N/R159K/I181Q,
N024T/G049A/A093S/S099A/R127K/A143N/R159K/I181T,
N024W/G049A/A093S/S099A/R127K/A143N/R159K/I181Q,
N24A/G54E/S76D/A93G/R127K/R159K,
N24E/G54L/S76E/A93G/R127K/R159K,
N24E/G54Q/A93S/R127K/R159K,
N24E/S76D/A93T/R127K/R159K,
N24M/G54E/A93H/R127K/R159K,
N24M/G54E/S76N/A93S/R127K/R159K,
N24Q/G54D/S76L/A93G/R127K/R159K,
N24Q/G54I/S76E/A93H/R127K/R159K,
N24T/G54D/S76V/A93G/R127K/R159K,
N24T/G54E/S76V/A93H/R127K/R159K,
N24W/G54D/A93H/R127K/R159K,
N24W/S76E/A93G/R127K/R159K,
R014I/S076A/A093G/R127K/R159K/I181T,
R014I/S076A/A093H/R127K/R159K/I181Q,
R014I/S076D/A093H/R127K/R159K/I181Q,
R014I/S076D/A093H/R127K/R159K/I181T,
R014I/S076D/A093S/R127K/R159K/I181T,
R014I/S076E/A093S/R127K/R159K/I181Q,
R014I/S076E/A093T/R127K/R159K/I181K,
R014I/S076I/A093S/R127K/R159K/I181Q,
R014I/S076N/A093H/R127K/R159K/I181Q,
R014I/S076T/A093G/R127K/R159K/I181Q,
R014I/S076V/A093H/R127K/R159K/I181Q,
R014K/S076A/A093S/R127K/R159K/I181T,
R014K/S076E/A093H/R127K/R159K/I181T,
R014K/S076E/A093S/R127K/R159K/I181T,
R014K/S076T/A093H/R127K/R159K/I181Q,
R014L/S076A/A093H/R127K/R159K,
R014L/S076A/A093H/R127K/R159K/I181Q,
R014L/S076D/A093H/R127K/R159K/I181T,
R014L/S076E/A093H/R127K/R159K/I181K,
R014M/S076A/A093G/R127K/R159K/I181T,
R014M/S076A/A093H/R127K/R159K/I181T,
R014M/S076A/A093S/R127K/R159K/I181K,
R014M/S076A/A093S/R127K/R159K/I181T,
R014M/S076A/A093T/R127K/R159K/I181Q,
R014M/S076D/A093S/R127K/R159K/I181T,
R014M/S076E/A093G/R127K/R159K/I181T,
R014M/S076E/A093H/R127K/R159K/I181T,
R014M/S076E/A093S/R127K/R159K/I181T,
R014M/S076N/A093G/R127K/R159K/I181K,
R014M/S076N/A093G/R127K/R159K/I181T,
R014M/S076N/A093H/R127K/R159K/I181T,
R014M/S076N/A093S/R127K/R159K/I181T,
R014M/S076V/A093G/R127K/R159K/I181Q,
R14I/N24Q/R35D/A64K/N67S/R123F/R159K/D184T,
R14I/N24E/A64K/R123F/R127K/R159K/D184T,
R14I/N24Q/A64K/R123F/R127Q/R159K/D184T,
R14I/N24Q/R35D/A64K/N67S/R123F/R159K/D184T,
R14I/R35F/G65Q/R127A/R159K,
R14I/T36S/G65Q/R127A/R159K.
N024E/G049A/A093H//R127K/A143N/R159K/I181Q,
N024H/S076A/A093S/S099A/R127K/R159K/G054H/L069H,
N024H/S076A/A093T/S099G/R127K/R159K,
N024L/S076V/A093S/S099A/R127K/R159K,
N024Q/G049A/A093S/S099A/R121K/A143N/R159K/I181T,
N024T/G049A/A093S/S099A/R127K/A143N/R159K/I181T,
N24E/G54Q/A93S/R127K/R159K,
N24H/G54L/S76V/A93H/R127K/R159K,
N24L/G54Q/S76A/A93H/R127K/R159K,
N24M/G54E/A93H/R127K/R159K,
N24M/S76V/A93H/R127K/R159K,
N24Q/G54Q/S76T/A93H/R127K/R159K,
N24Q/S76A/A93G/R127K/R159K,
N24T/G54Q/S76N/A93G/R127K/R159K,
N24W/G54D/A93H/R127K/R159K,
N24W/S76A/A93H/R127K/R159K,
N24W/S76T/A93G/R127K/R159K,
N24W/S76V/A93G/R127K/R159K,
N24W/S76Y/A93G/R127K/R159K,
R014I/S076A/A093G/R127K/R159K/I181T,
R0141/S076A/A093H/R127K/R159K/I181K,
R014I/S076A/A093H/R127K/R159K/I181Q,
R014I/S076A/A093H/R127K/R159K/I181T,
R014I/S076D/A093S/R127K/R159K/I181T,
R014I/S076E/A093T/R127K/R159K/I181K,
R014I/S076N/A093H/R127K/R159K/I181Q,
R014I/S076V/A093H/R127K/R159K/I181Q,
R014I/S076V/A093S/R127K/R159K/I181K,
R014K/S076A/A093S/R127K/R159K/I181T,
R014K/S076E/A093H/R127K/R159K/I181K,
R014K/S076I/A093S/R127K/R159K/I181T,
R014K/S076T/A093H/R127K/R159K/I181K,
R014K/S076T/A093H/R127K/R159K/I181T,
R014K/S076V/A093H/R127K/R159K/I181K,
R014L/S076A/A093H/R127K/R159K,
R014L/S076A/A093H/R127K/R159K/I181Q,
R014L/S076D/A093H/R127K/R159K/I181T,
R014L/S076E/A093H/R127K/R159K/I181K,
R014M/S076A/A093G/R127K/R159K/I181K,
R014M/S076A/A093G/R127K/R159K/I181T,
R014M/S076A/A093H/R127K/R159K/I181T,
R014M/S076A/A093S/R127K/R159K/I181K,
R014M/S076A/A093S/R127K/R159K/I181T,
R014M/S076A/A093T/R127K/R159K/I181Q,
R014M/S076I/A093H/R127K/R159K/I181T,
R014M/S076I/A093S/R127K/R159K/I181T,
R014M/S076N/A093G/R127K/R159K/I181K,
R014M/S076N/A093G/R127K/R159K/I181T,
R014M/S076N/A093H/R127K/R159K/I181T,
R014M/S076N/A093S/R127K/R159K/I181T,
R014M/S076T/A093H/R127K/R159K/I181K,
R014M/S076V/A093G/R127K/R159K/I181Q,
R014M/S076W/A093H/R127K/R159K/I181K,
R014M/S076Y/A093H/R127K/R159K/I181K,
R014M/S076Y/A093H/R127K/R159K/I181T,
R14I/A64K/R123F/R159F/D184T,
R14I/N24Q/A64K/N67S/R123F/R159F/D184T,
R14I/N24Q/A64K/N67A/R123F/R159K/D184T,
R14I/N24A/A64K/R123F/R159N/D184T,
R14I/N24Q/R35D/A64K/N67S/R123F/R159K/D184T,
R14I/N24Q/A64K/N67A/R123F/R159K/D184T,
R14I/N24E/A64K/R123F/R127K/R159K/D184T,
R14I/N24A/A64K/R123F/D184T,
R14I/A64K/R123F/R127K/R159F/D184T,
R14I/A64K/R123F/R159N/D184T,
R14I/A64K/R123F/R159K/D184T,
R14I/A64K/R123F/R127Y/R159K/D184T,
R14I/N24Q/A64K/R123F/R127Q/R159K/D184T,
R14I/A64K/R123F/R159K/D184T,
R14I/N24Q/R35D/A64K/N67S/R123F/R159K/D184T,
R14I/N24Q/A64K/N67A/R123F/R127K/R159K/D184T,
R14I/A63K/N67A/R123F/D184T,
R14I/A63K/N67L/R123F/D184T,
R14I/A63K/N67S/R123F/D184T,
R14I/A63K/R123F/R159F/D184T,
R14I/A63K/R123F/R159K/D184T,
R14I/A63K/R123F/R159N/D184T,
R14I/G54D/A63K/R123F/D184T,
R14I/N24A/A63K/R123F/D184T,
R14I/N24A/S76V/A93S/R127K/R159K/I181K,
R14I/N24E/A63K/R123F/D184T,
R14I/N24Q/A63K/R123F/D184T,
R14I/N24Q/S76V/A93S/R127K/R159K/I181K,
R14I/N24T/A63K/R123F/D184T,
R14I/N24T/S76V/A93S/R127K/R159K/I181K,
R14I/N67S/S76N/A93H/R127K/R159K/I181Q,
R14I/R35E/A63K/R123F/D184T,
R14I/R35K/A63K/R123F/D184T,
R14I/S76V/A93S/R127K/R159F/I181K,
R14I/S76V/A93S/R127K/R159N/I181K,
R14I/S76V/A93S/R127Y/R159K/I181K,
R14M/N24T/S76N/A93G/R127K/R159K/I181K,
R14M/N67S/S76N/A93G/R127K/R159K/I181K и
R14M/S76N/A93G/R127K/R159F/I181K.
R14I/A64K/T86K/N112E/R123F/D184T,
G12D/R35E/G63R/R79K/T109M, и
R14M/S76D/A93H/R127K/R159K/I181K.
N024E/G049A/A093H/R127K/A143N/R159K/I181Q,
N024E/G049A/A093S/S099D/R127K/A143N/R159K/I181Q,
N024Q/G049A/A093S/S099A/R127K/A143N/R159K/I181T,
N24A/G54E/S76D/A93G/R127K/R159K,
N24E/G54L/S76E/A93G/R127K/R159K,
N24E/G54Q/A93S/R127K/R159K,
N24E/S76D/A93T/R127K/R159K,
N24H/G54E/A93G/R127K/R159K,
N24L/S76T/A93G/R127K/R159K,
N24M/G54E/A93H/R127K/R159K,
N24M/G54E/S76N/A93S/R127K/R159K,
N24M/S76V/A93H/R127K/R159K,
N24Q/G54D/S76L/A93G/R127K/R159K,
N24Q/G54I/S76T/A93G/R127K/R159K,
N24Q/G54Q/A93G/R127K/R159K,
N24Q/S76A/A93G/R127K/R159K,
N24T/G54Q/S76N/A93G/R127K/R159K,
N24T/G54Q/S76V/R127K/R159K,
N24W/G54D/A93H/R127K/R159K,
R014I/S076A/A093G/R127K/R159K/I181T,
R014I/S076A/A093H/R127K/R159K/I181Q,
R014I/S076D/A093H/R127K/R159K/I181Q,
R014I/S076D/A093H/R127K/R159K/I181T,
R014I/S076D/A093S/R127K/R159K/I181T,
R014I/S076E/A093S/R127K/R159K/I181Q,
R014I/S076E/A093T/R127K/R159K/I181K,
R014I/S076N/A093H/R127K/R159K/I181Q,
R014L/S076A/A093H/R127K/R159K,
R014L/S076A/A093H/R127K/R159K/I181Q,
R014L/S076D/A093H/R127K/R159K/I181T,
R014M/S076A/A093G/R127K/R159K/I181T,
R014M/S076A/A093S/R127K/R159K/I181K,
R014M/S076A/A093S/R127K/R159K/I181T,
R014M/S076A/A093T/R127K/R159K/I181Q,
R014M/S076D/A093S/R127K/R159K/I181T,
R014M/S076E/A093H/R127K/R159K/I181T,
R014M/S076E/A093S/R127K/R159K/I181T,
R014M/S076N/A093G/R127K/R159K/I181K,
R014M/S076N/A093G/R127K/R159K/I181T,
R014M/S076N/A093H/R127K/R159K/I181T,
R014M/S076N/A093S/R127K/R159K/I181T.
a) приведения поверхности и/или изделия, содержащего ткань, в контакт с чистящей композицией по п. 39 и
b) необязательной промывки и/или ополаскивания указанной поверхности или вещества.
a) приведения поверхности и/или изделия, содержащего ткань, в контакт с чистящей композицией по п. 46 и
b) необязательной промывки и/или ополаскивания указанной поверхности или вещества.
a) приведения поверхности и/или изделия, содержащего ткань, в контакт с чистящей композицией по п. 50 и
b) необязательной промывки и/или ополаскивания указанной поверхности или вещества.
a) приведения поверхности и/или изделия, содержащего ткань, в контакт с чистящей композицией по п. 51 и
b) необязательной промывки и/или ополаскивания указанной поверхности или вещества.
a) приведения поверхности и/или изделия, содержащего ткань, в контакт с чистящей композицией по п. 54; и
b) необязательной промывки и/или ополаскивания указанных поверхности или вещества.

Комментарии