Новое сложноэфирное соединение алициклической дикарбоновой кислоты и способ его изготовления - RU2642069C2
Код документа: RU2642069C2
Чертежи



Описание
Область техники, к которой относится изобретение
[0001] Настоящее изобретение относится к новому сложноэфирному соединению алициклической дикарбоновой кислоты, содержащему циклогексановый цикл, и способу его изготовления.
Уровень техники
[0002] Сложная полиэфирная смола, синтезированная из алициклической дикарбоновой кислоты и алициклического диола, может использоваться для применения в качестве оптических материалов, электронных информационных материалов и материалов медицинского назначения благодаря превосходной прозрачности, теплостойкости, стойкости к атмосферным воздействиям, газонепроницаемости и оптическим свойствам.
[0003] Например, используя 1,4-циклогександикарбоновую кислоту (1,4-ЦГДК) в качестве алициклической дикарбоновой кислоты и 1,4-циклогександиметанол (1,4-ЦГДМ) в качестве алициклического диола, синтезируют сложную полиэфирную смолу, превосходную по биоразлагаемости (согласно, например, патентному документу 1), проводящий сложный полиэфир, выделяющий малое количество газа (согласно, например, патентному документу 2), и сложный полиэфир с коротким временем исчезновения пены, пригодный для применения в области медицины (согласно, например, патентному документу 3). Кроме того, используя трицикло[3.3.1.13,7]декандикарбоновую кислоту в качестве алициклической дикарбоновой кислоты и трицикло[3.3.1.13,7]декандекандиол в качестве алициклического диола, синтезируют сложную полиэфирную смолу со слабой оптической анизотропией, превосходной пластичности (согласно, например, патентному документу 4).
Список документов, относящихся к предшествующему уровню техники
Патентный документ
[0004] Патентный документ 1
Опубликованный патент Японии №2000-290356
Патентный документ 2
Опубликованный патент Японии №2004-124022
Патентный документ 3
Опубликованный патент Японии №2005-298555
Патентный документ 4
патент Японии №3862538
Краткое описание изобретения
Проблемы, решаемые изобретением
[0005] Цель настоящего изобретения состоит в предоставлении нового сложноэфирного соединения алициклической дикарбоновой кислоты, содержащего циклогексановый цикл, и способа его промышленного изготовления.
Способы решения проблем
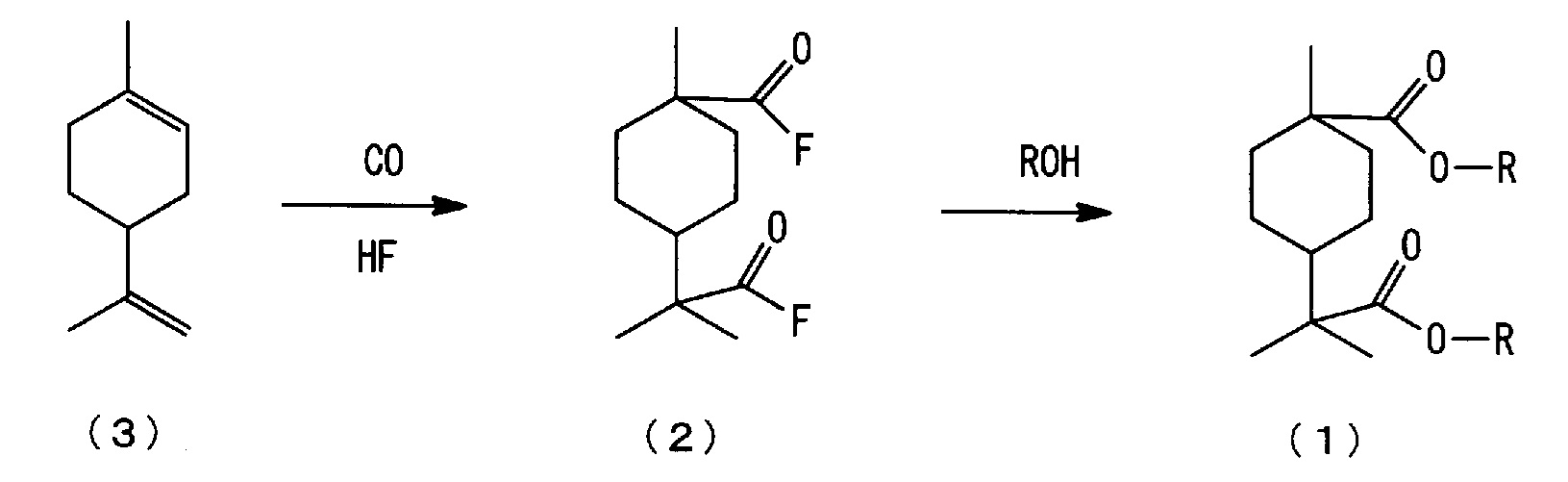
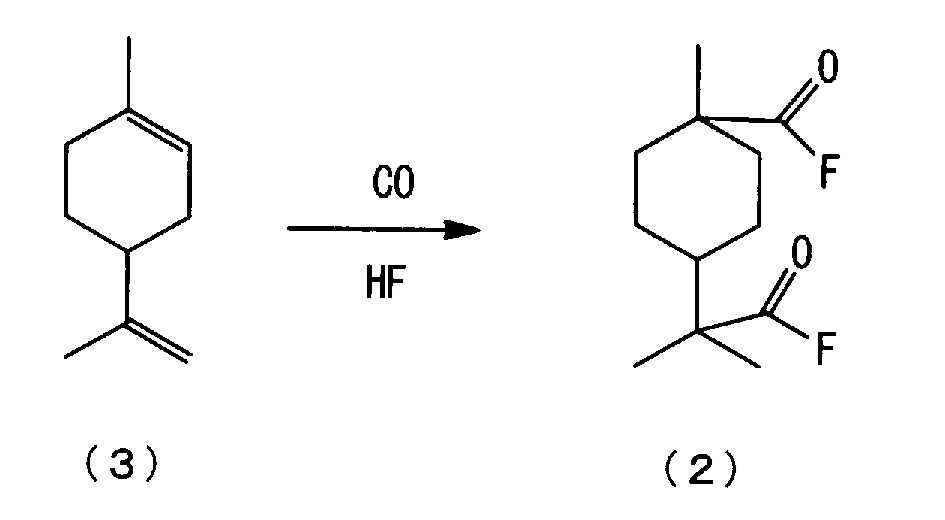
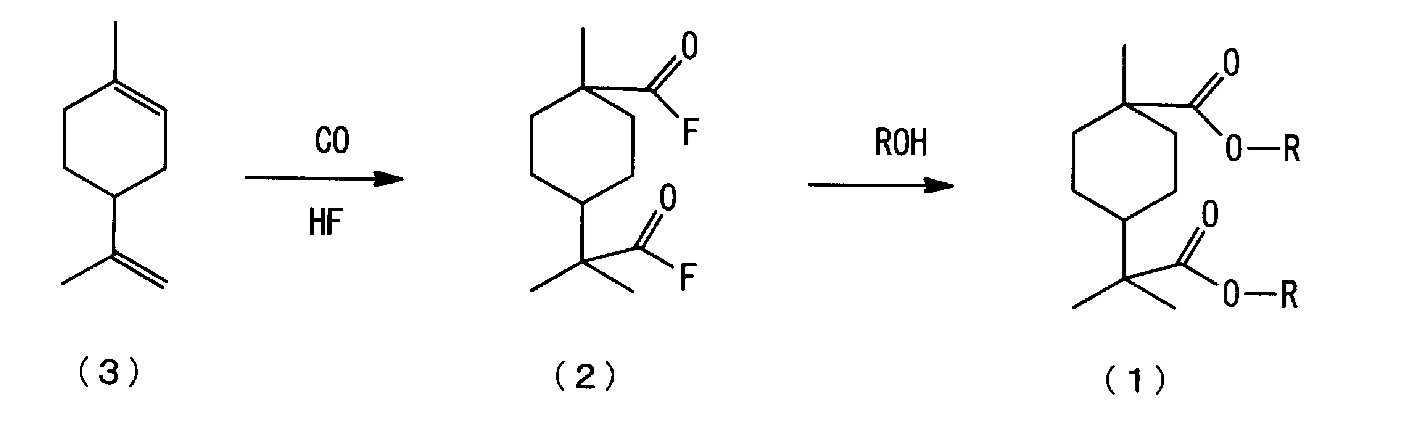
[0006] Настоящим изобретением рассмотрен способ изготовления нового сложноэфирного соединения алициклической дикарбоновой кислоты, представленного нижеследующей формулой (1), из 4-изопропенил-1-метил-1-циклогексена, представленного нижеследующей формулой (3), и установлено, что новое сложноэфирное соединение алициклической дикарбоновой кислоты, представленное нижеследующей формулой (1), может быть изготовлено, например, взаимодействием 4-изопропенил-1-метил-1-циклогексена, представленного нижеследующей формулой (3), с монооксидом углерода в присутствии фторида водорода (здесь далее именуемого также "HF"), с последующим взаимодействием полученного алициклического фторида дикарбоновой кислоты, представленного нижеследующей формулой (2), со спиртом.
[0007]
Таким образом, настоящее изобретение выполнено на базе открытия.
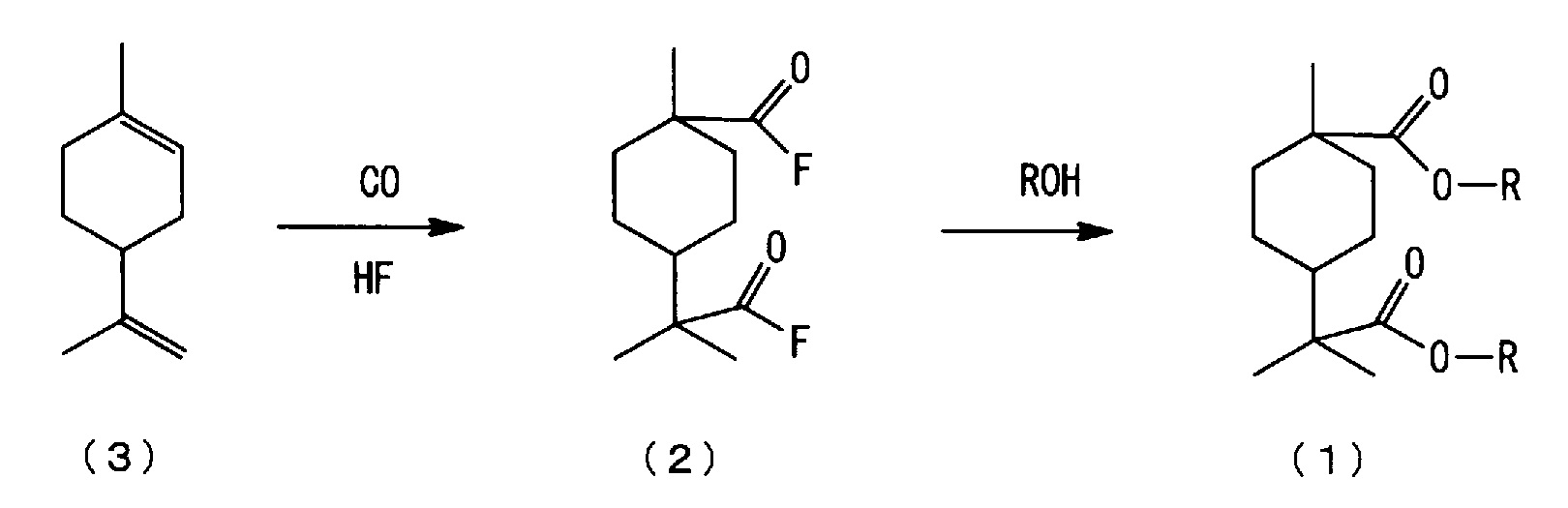
где каждый R независимо означает алкильную группу с 1-4 атомами углерода.
[0008]
При этом настоящее изобретение описывается следующим образом.
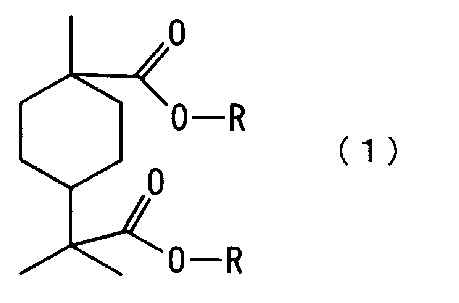
[1] Сложноэфирное соединение алициклической дикарбоновой кислоты, представленное следующей формулой (1):

где каждый R независимо означает алкильную группу с 1-4 атомами углерода.
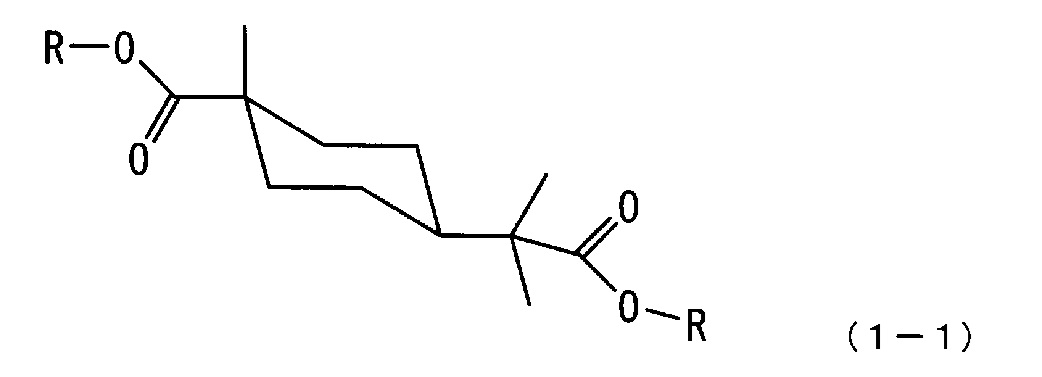
[2] Сложноэфирное соединение алициклической дикарбоновой кислоты по п.[1], где соединение имеет стерическую структуру, представленную следующей формулой (1-1):

где каждый R независимо означает алкильную группу с 1-4 атомами углерода.
[3] Способ изготовления сложноэфирного соединения алициклической дикарбоновой кислоты, включающий стадии:
взаимодействия 4-изопропенил-1-метил-1-циклогексена, представленного нижеследующей формулой (3), с монооксидом углерода в присутствии фторида водорода с образованием фторида алициклической дикарбоновой кислоты, представленного нижеследующей формулой (2); и
взаимодействия полученного фторида алициклической дикарбоновой кислоты, представленного нижеследующей формулой (2), со спиртом с образованием сложноэфирного соединения алициклической дикарбоновой кислоты, представленного нижеследующей формулой (1):
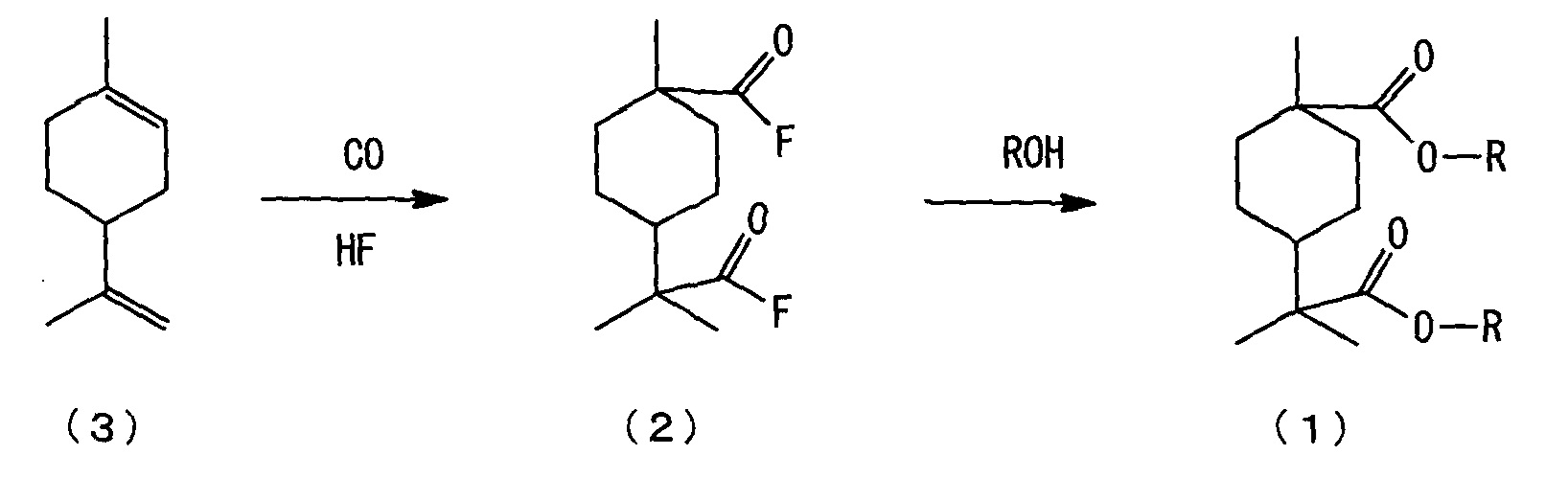
где каждый R независимо означает алкильную группу с 1-4 атомами углерода.
Преимущества изобретения
[0009] Новое сложноэфирное соединение алициклической дикарбоновой кислоты, представленное формулой (1) по настоящему изобретению может быть использовано, например, в качестве исходного вещества для сложных полиэфирных смол. Поскольку в способе изготовления по настоящему изобретению используется соединение, представленное формулой (3), полученное из биомассы в качестве сырья, можно утверждать, что способ изготовления экологически благоприятен с точки зрения углеродной нейтральности.
Краткое описание чертежей
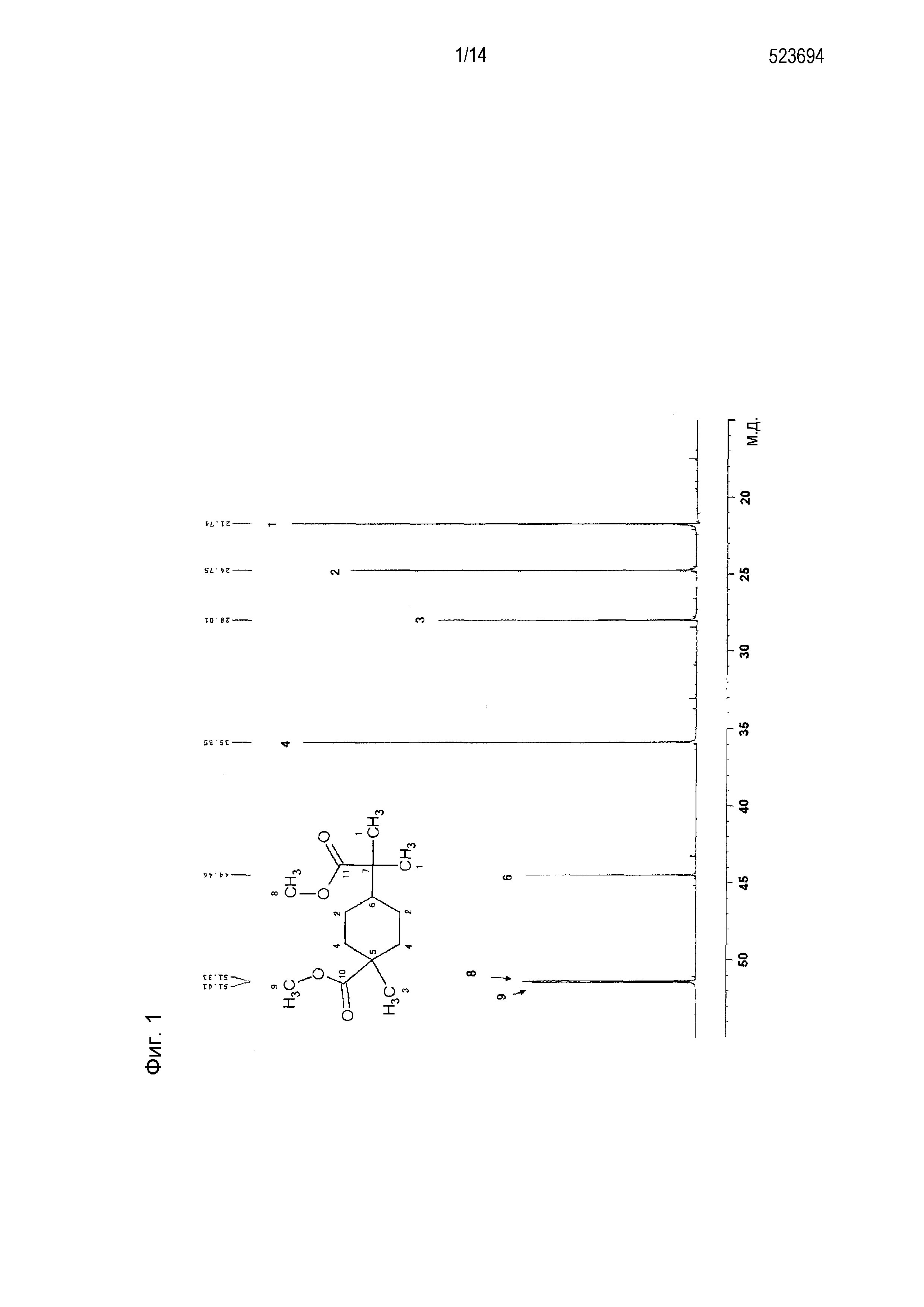
[0010] Фигура 1 представляет схематическое изображение результатов измерений ЯМР DEPT 45° продукта, полученного по примеру 1
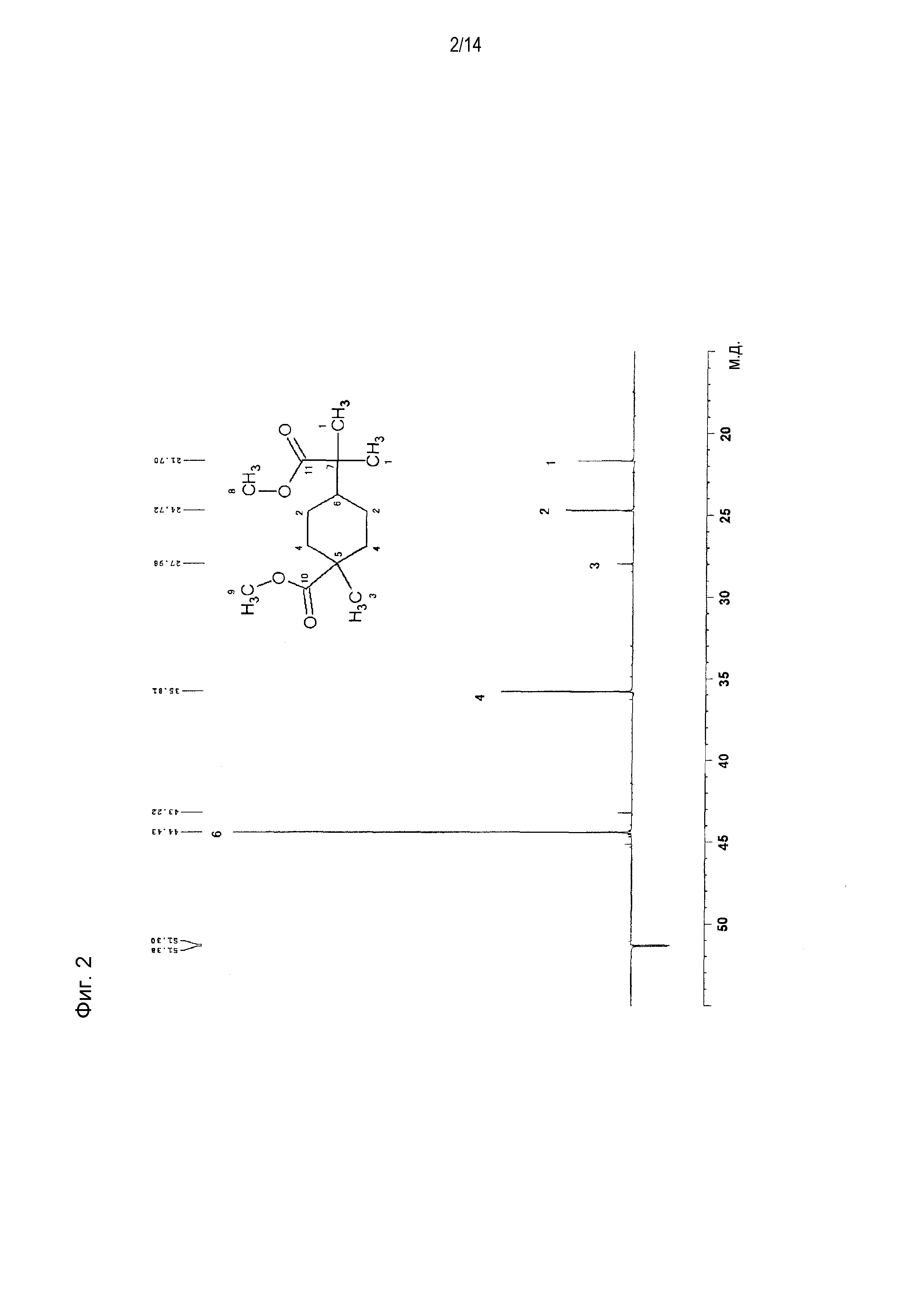
Фигура 2 представляет схематическое изображение результатов измерений ЯМР DEPT 90° продукта, полученного по примеру 1.
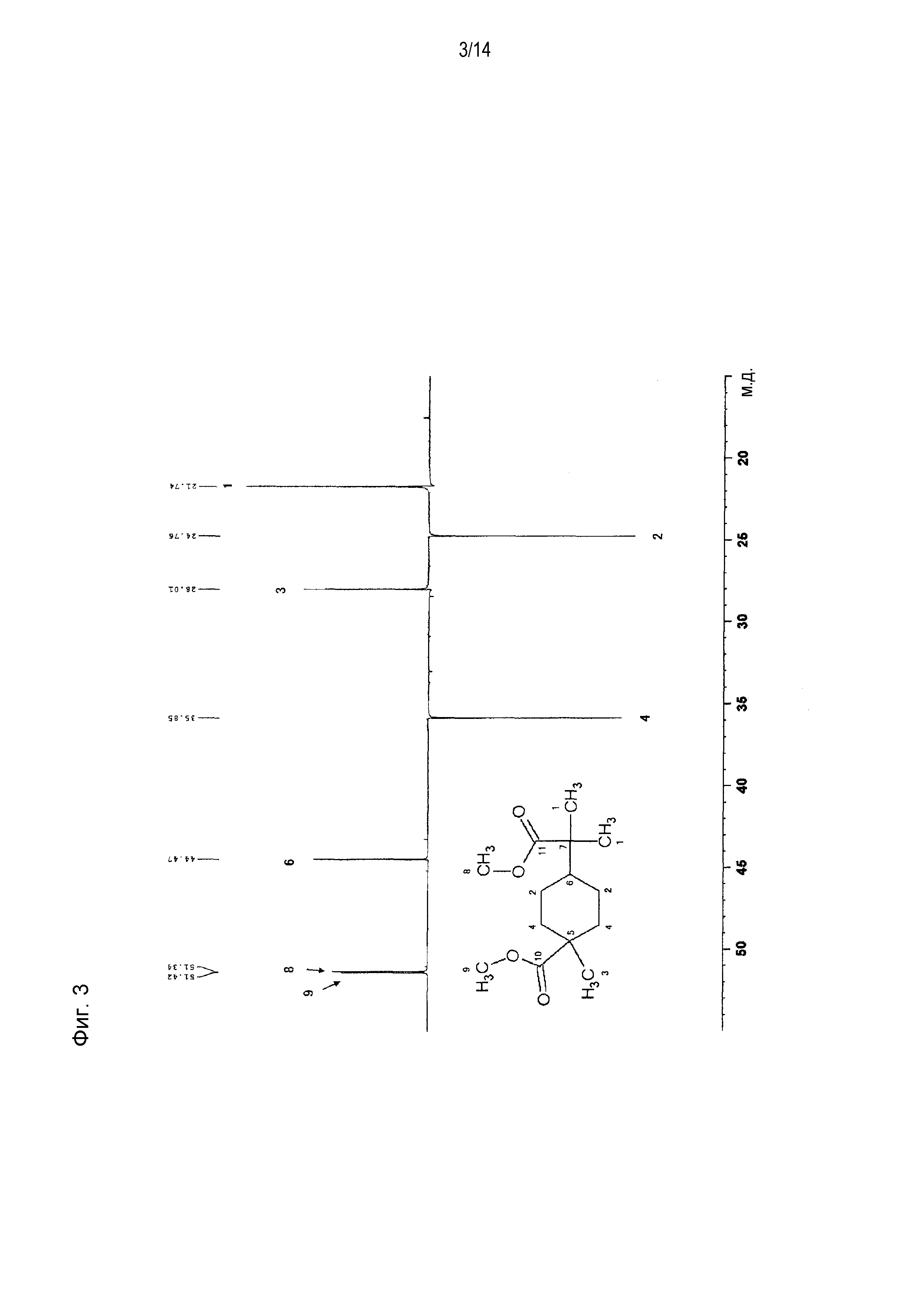
Фигура 3 представляет схематическое изображение результатов измерений ЯМР DEPT 135° продукта, полученного по примеру 1.
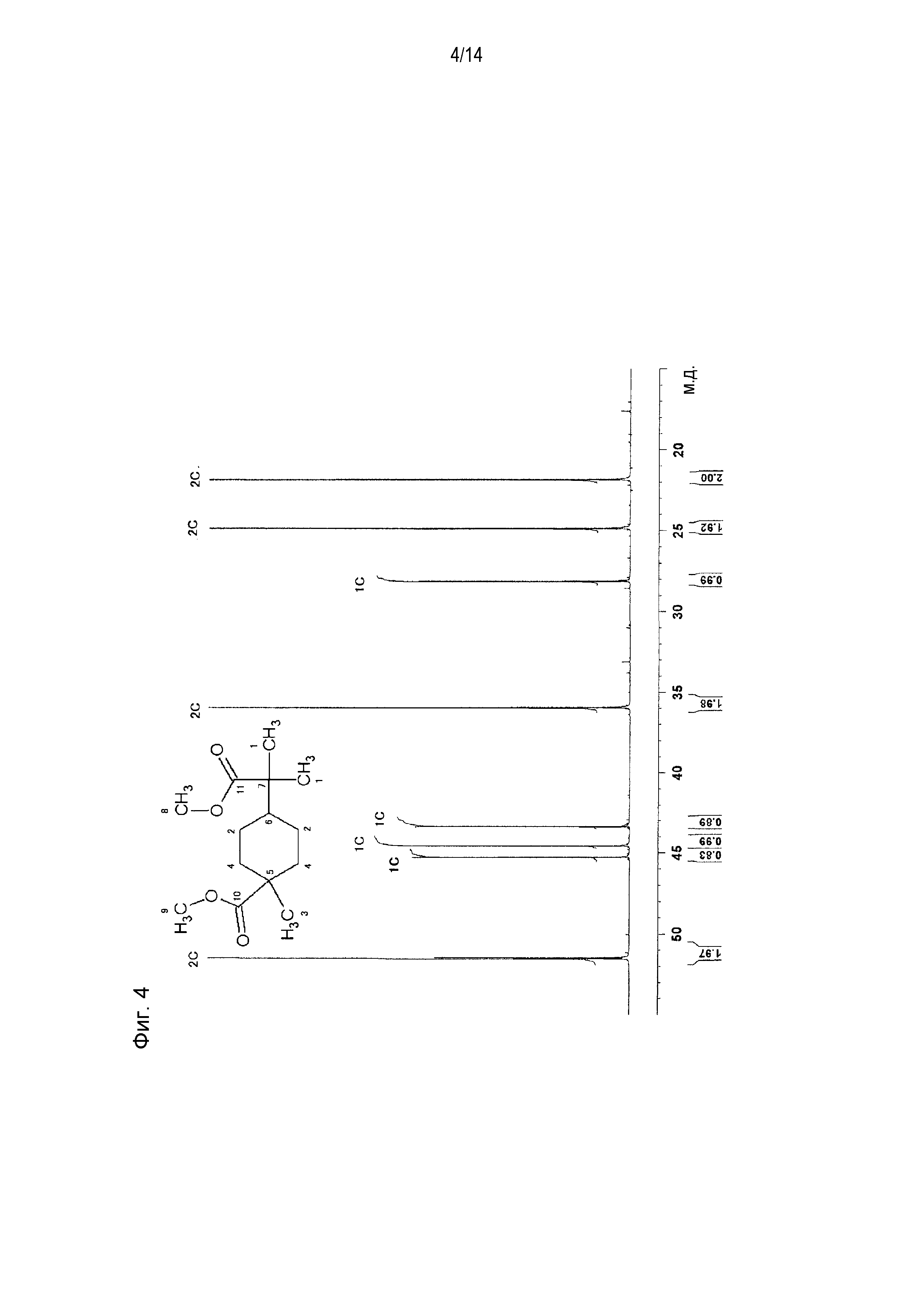
Фигура 4 представляет схематическое изображение результатов измерений ЯМР Carbon i.g. продукта, полученного по примеру 1.
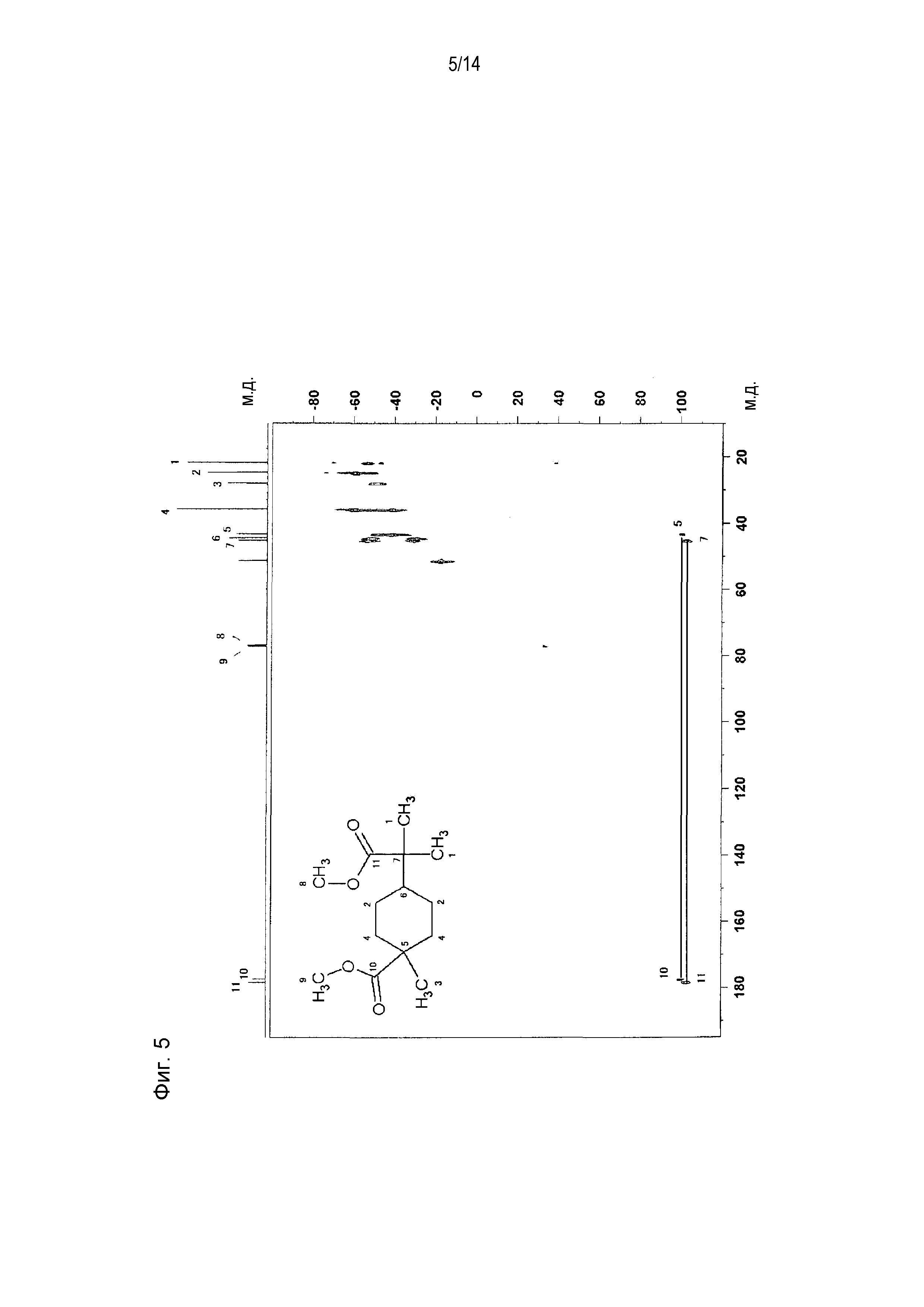
Фигура 5 представляет схематическое изображение результатов измерений ЯМР INADEQUATE продукта, полученного по примеру 1.
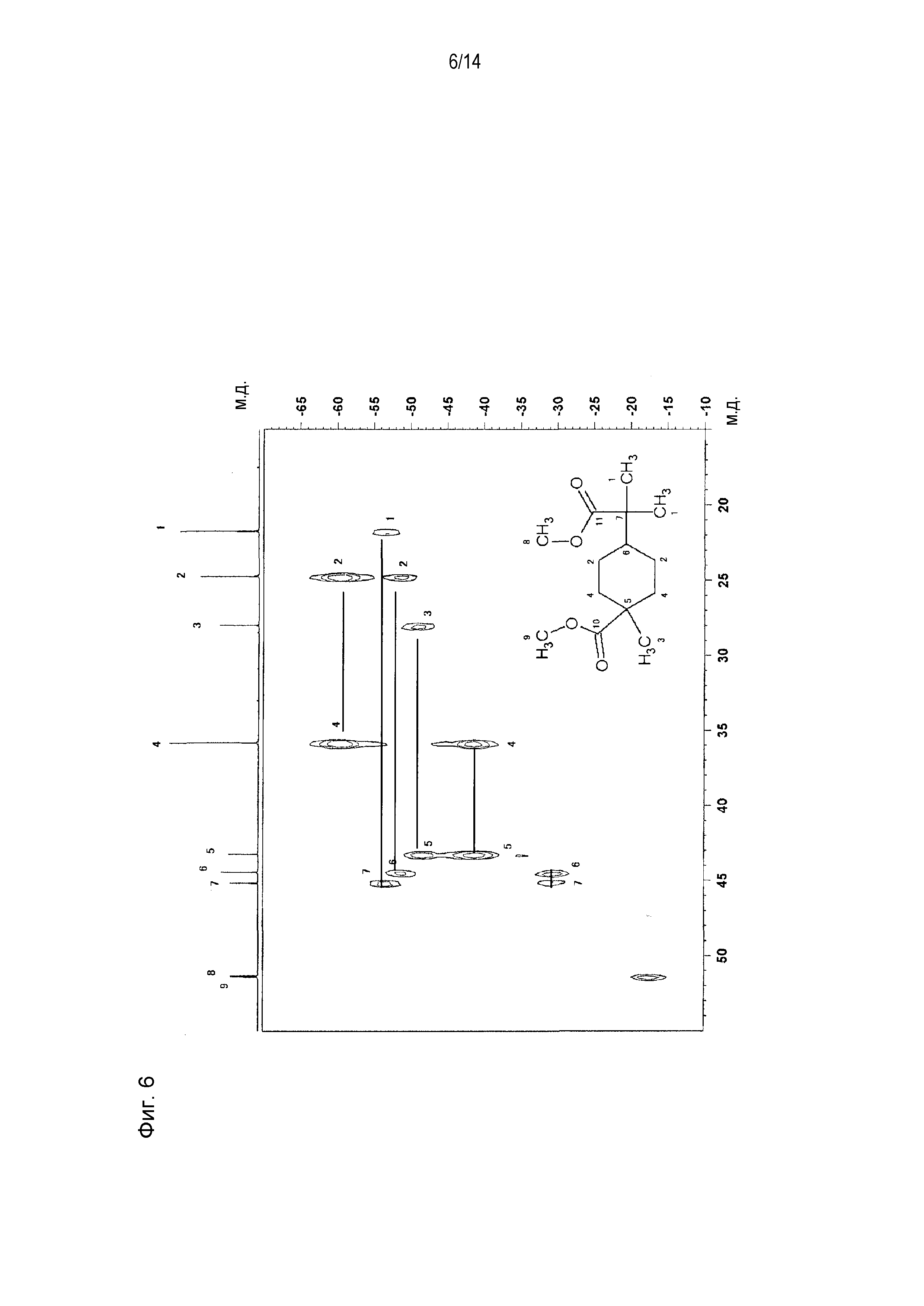
Фигура 6 представляет увеличенное схематическое изображение результатов измерений на участке 15-55 м.д. фигуры 5.
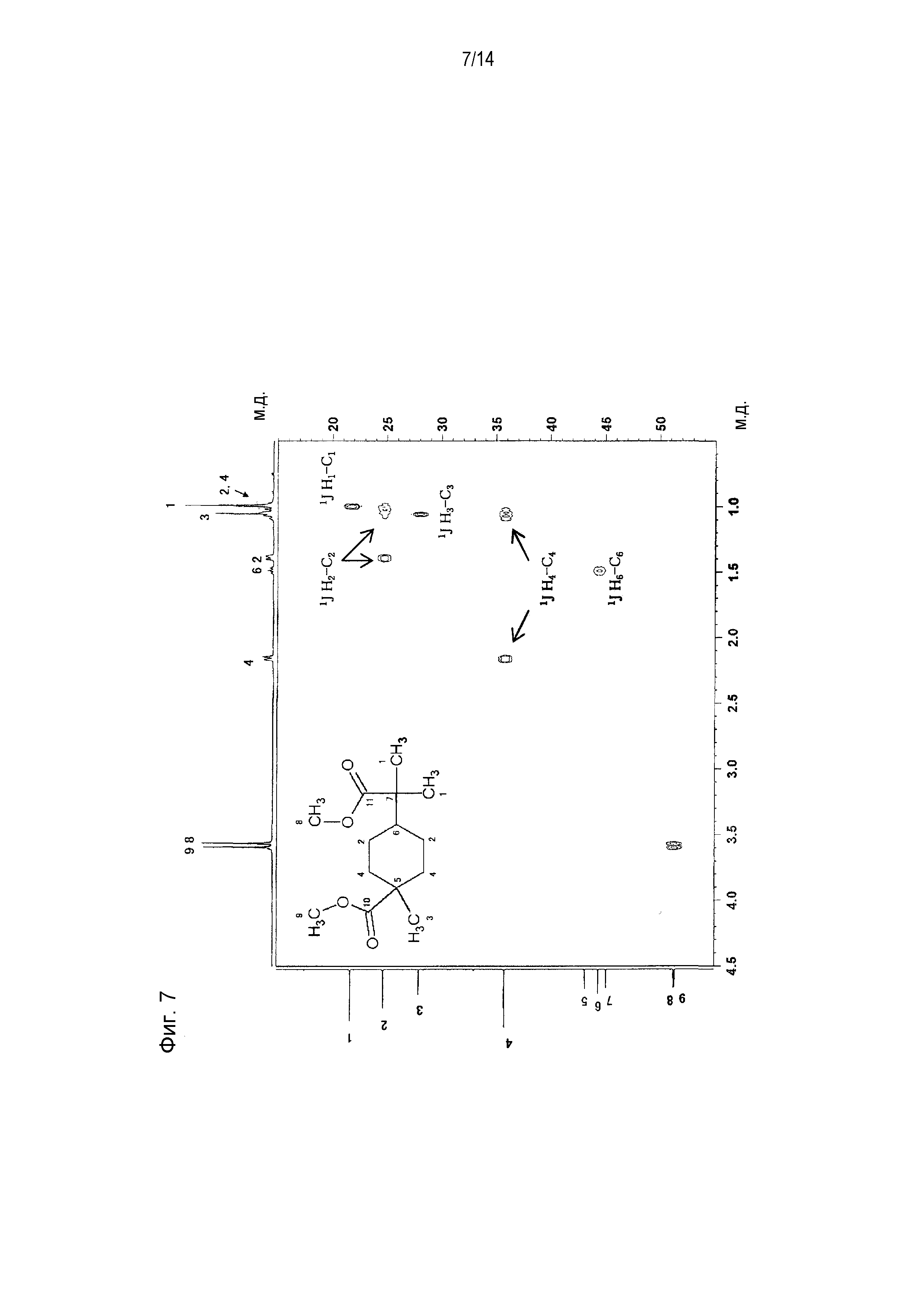
Фигура 7 представляет схематическое изображение результатов измерений ЯМР HSQC продукта, полученного по примеру 1.
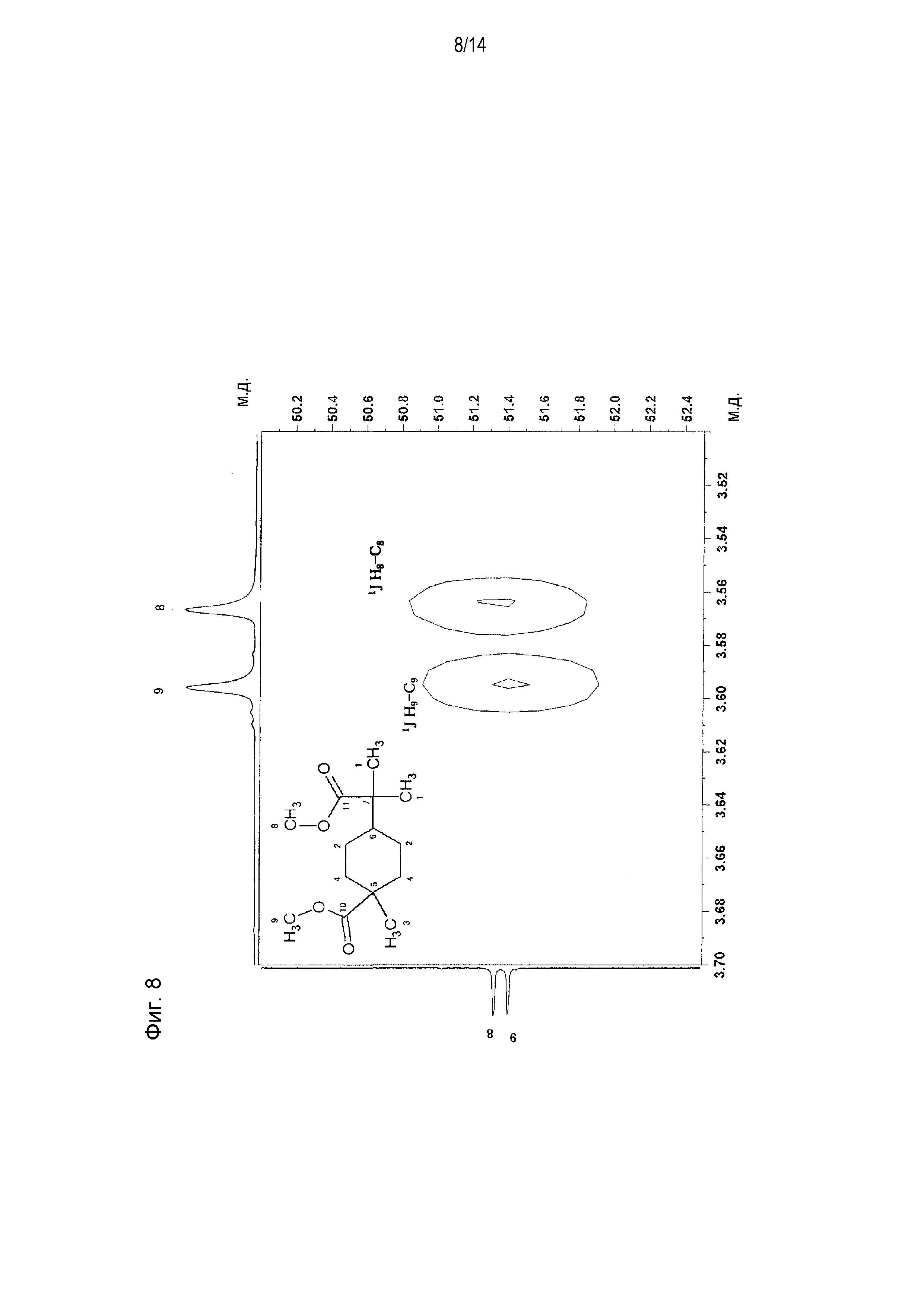
Фигура 8 представляет увеличенное схематическое изображение результатов измерений на участке 3,50-3,70 м.д. фигуры 7.
Фигура 9 представляет схематическое изображение результатов измерений ЯМР HMBC продукта, полученного по примеру 1.
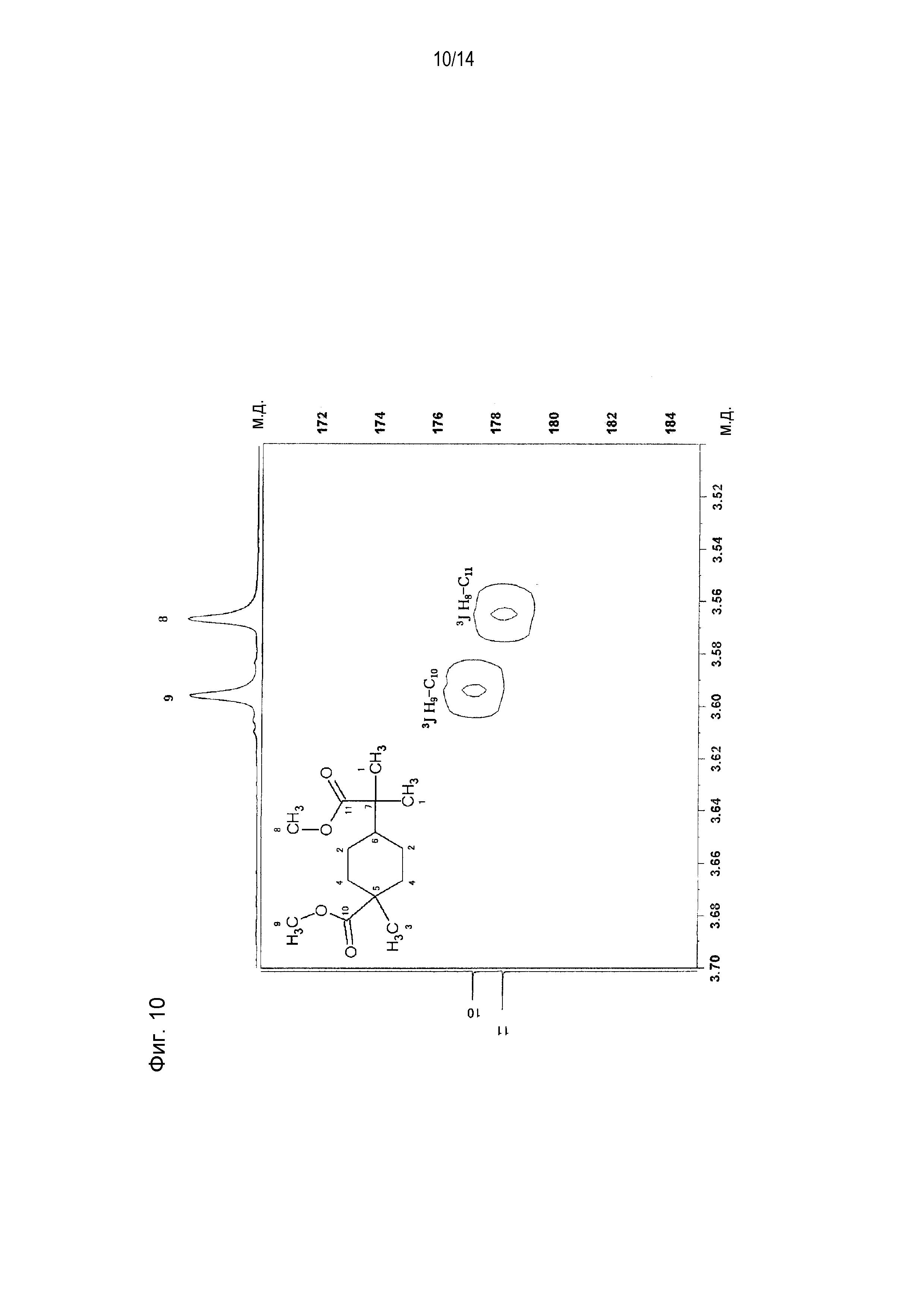
Фигура 10 представляет увеличенное схематическое изображение результатов измерений на участке 3,50-3,70 м.д. фигуры 9.
Фигура 11 представляет схематическое изображение результатов измерений ЯМР1H продукта, полученного по примеру 1.
Фигура 12 представляет увеличенное схематическое изображение, отображающее горизонтальную ось пика 6 фигуры 1 в Гц.
Фигура 13 представляет схематическое изображение результатов измерений ЯМР COZY продукта, полученного по примеру 1.
Фигура 14 представляет схематическое изображение результатов измерений ЯМР NOEZY продукта, полученного по примеру 1.
Способ осуществления изобретения
[0011] Варианты осуществления настоящего изобретения (здесь далее также именуемые "настоящий вариант осуществления") описаны далее более подробно.
Однако нижеследующие варианты осуществления предложены с целью иллюстрации настоящего изобретения, и настоящее изобретение не ограничивается только ими.
[0012] Новое сложноэфирное соединение алициклической дикарбоновой кислоты по настоящему варианту осуществления представлено следующей формулой (1)
[0013]
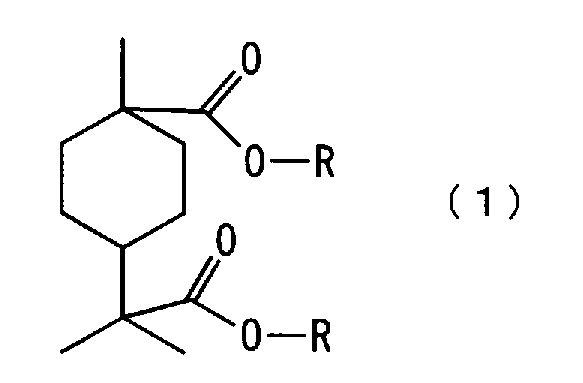
где каждый R независимо означает алкильную группу с 1-4 атомами углерода.
[0014] Примеры алкильной группы, обозначенной R, с 1-4 атомами углерода в формуле (1) включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу и трет-бутильную группу, хотя конкретно не ограничены. Среди них предпочтительны метильная группа, этильная группа и н-пропильная группа, более предпочтительны метильная группа и этильная группа, и еще более предпочтительна метильная группа.
[0015] Сложноэфирное соединение алициклической дикарбоновой кислоты, представленное формулой (1), может быть использовано, например, в качестве, исходного вещества для сложных полиэфирных смол, и превосходный по оптическим свойствам и теплостойкости материал может быть изготовлен с использованием сложноэфирного соединения алициклической дикарбоновой кислоты. Примеры применения материала с такими свойствами включают, однако строго этим не ограничиваясь, оптические материалы, такие как линзы.
[0016] Благодаря наличию циклогексанового цикла соединение по настоящему варианту осуществления может иметь ряд стерических структур. Стерическая структура соединения по настоящему варианту осуществления различается, например, в зависимости от того, находится ли функциональная группа или атом водорода, связанные с углеродом в циклогексановом цикле, в аксиальном или экваториальном положении, и стерическая структура соответствует транс- или цис-конфигурации в зависимости от различия в положении двух функциональных групп, связанных с углеродом в циклогексановом цикле.
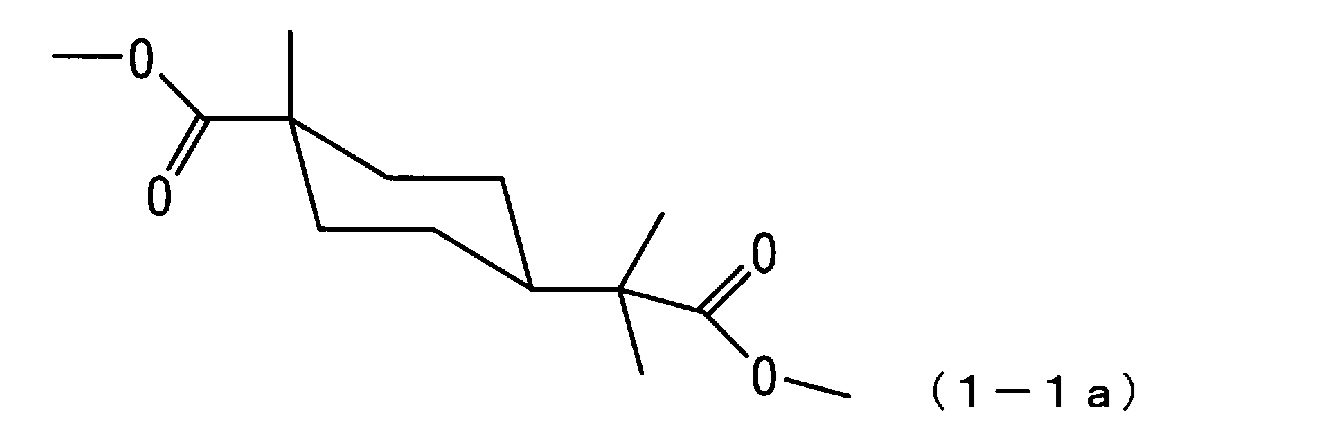
[0017] Соединение по настоящему варианту осуществления проявляет тенденцию к стабилизации в случае наличия стерической структуры циклогексанового цикла, содержащего функциональную группу с большим стерическим затруднением, такую как 1-метокси-2-метил-1-оксопропан-2-ильную группу, в экваториальном положении и атом водорода или тому подобное с малым стерическим затруднением в аксиальном положении. Также соединение по настоящему варианту осуществления с транс-конфигурацией проявляет тенденцию к большей реакционной способности реакционноспособного заместителя, такого как карбоксилатная группа. Сложноэфирное соединение алициклической дикарбоновой кислоты, обладающее такими свойствами, полезно в качестве исходного вещества для сложной полиэфирной смолы, превосходной по оптической анизотропии.
[0018] В соответствии с вышесказанным соединение по настоящему варианту осуществления предпочтительно является сложноэфирным соединением алициклической дикарбоновой кислоты со стерической структурой, представленной следующей формулой (1-1).
[0019]
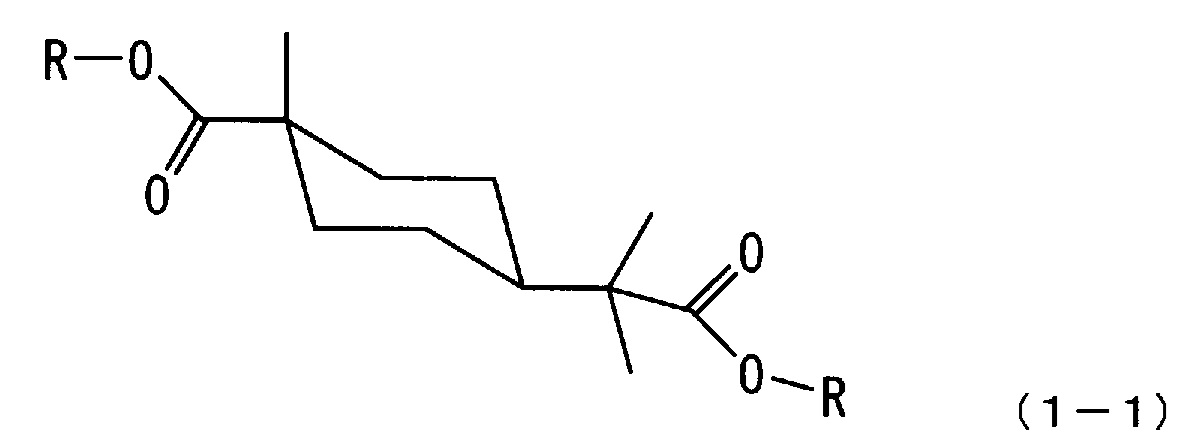
где каждый R независимо означает алкильную группу с 1-4 атомами углерода.
[0020] Способ изготовления нового сложноэфирного соединения алициклической дикарбоновой кислоты по настоящему варианту осуществления включает следующие стадии (a) и (b):
(a) стадию взаимодействия 4-изопропенил-1-метил-1-циклогексена, представленного нижеследующей формулой (3), с монооксидом углерода в присутствии фторида водорода (здесь далее именуемого также "HF") с получением фторида алициклической дикарбоновой кислоты, представленного нижеследующей формулой (2), (здесь далее в ряде случаев сокращенно называемую "стадией карбонилирования); и
(b) стадию взаимодействия полученного фторида алициклической дикарбоновой кислоты, представленного нижеследующей формулой (2), со спиртом с получением сложноэфирного соединения алициклической дикарбоновой кислоты, представленного нижеследующей формулой (1), (здесь далее в ряде случаев сокращенно называемую "стадией этерификации").
[0021]
где каждый R независимо означает алкильную группу с 1-4 атомами углерода.
[0022] <(a) Стадия карбонилирования>
На стадии (a) реакцию карбонилирования 4-изопропенил-1-метил-1-циклогексена, представленного нижеследующей формулой (3), предпочтительно осуществляют в присутствии HF под давлением монооксида углерода. На стадии (a) получают алициклическое карбонильное соединение, представленное нижеследующей формулой (2) (здесь далее также называемое "фторидом алициклической дикарбоновой кислоты"). Продукт реакции карбонилирования на стадии (a) может содержать различные побочные продукты (включающие другие изомеры).
[0023]
[0024] [Монооксид углерода]
Монооксид углерода для применения на стадии карбонилирования может содержать инертный газ, такой как азот и метан. Стадию карбонилирования осуществляют при парциальном давлении монооксида углерода предпочтительно в диапазоне от 0,5 до 5 МПа, более предпочтительно от 1 до 4 МПа, еще предпочтительней от 1,5 до 3 МПа. При парциальном давлении монооксида углерода свыше 0,5 МПа реакция карбонилирования протекает в достаточной степени без конкуренции с побочными реакциями, такими как реакции диспропорционирования и полимеризации, так что целевое вещество, т.е. фторид алициклической дикарбоновой кислоты, может быть получено с высоким выходом. С учетом нагрузки на оборудование предпочтительно парциальное давление монооксида углерода в 5 МПа или ниже.
[0025] [Фторид водорода]
Поскольку HF для применения на стадии карбонилирования выполняет функцию растворителя, катализатора и второго исходного вещества для взаимодействия, предпочтительно использовать практически безводный HF. В настоящем варианте осуществления практически безводный HF означает HF с концентрацией воды 200 ч/млн или меньше. На стадии карбонилирования количество HF предпочтительно в 4-30 раз больше, в молях, более предпочтительно в 7-20 раз больше, в молях, еще предпочтительней 10-15 раз больше, в молях, количества исходного вещества - 4-изопропенил-1-метил-1-циклогексена. При количестве используемого HF в 4 раза больше, в молях, или выше реакция карбонилирования протекает эффективно, с подавляемой конкуренцией побочных реакций, таких как диспропорционирование и полимеризация, так что целевое вещество, т.е. фторид алициклической дикарбоновой кислоты, может быть получено с высоким выходом. Предпочтительное используемое количество HF, в молях, в 30 раз или менее больше, желательней в 15 раз или менее больше, учитывая стоимость исходных веществ и производительность.
[0026] [Условия взаимодействия]
Тип реакции карбонилирования на стадии (a) конкретно не ограничен. Возможно использование любого типа: периодического типа, полунепрерывного типа, непрерывного типа и тому подобного.
[0027] Реакционная температура реакции карбонилирования на стадии (a) предпочтительно составляет в диапазоне от -50°C до 30°C, более предпочтительно от -40°C до 0°C, еще предпочтительней от -30 до -10°C. При реакционной температуре реакции карбонилирования в 30°C или ниже, в особенности -10°C или ниже, обычно достигается улучшенная селективность. Реакцию карбонилирования на стадии (a) предпочтительно осуществлять при -50°C или выше, с учетом скорости реакции.
[0028] Реакционное давление реакции карбонилирования на стадии (a) предпочтительно составляет в диапазоне от 0,6 до 5,0 МПа, более предпочтительно от 1,1 до 4,0 МПа, еще предпочтительней от 1,6 до 3,0 МПа.
[0029] <(b) Стадия этерификации>
Стадия этерификации является стадией взаимодействия фторида алициклической дикарбоновой кислоты, полученного на стадии карбонилирования, со спиртом, содержащим 1-4 атома углерода, с получением сложноэфирного соединения алициклической дикарбоновой кислоты. На стадии этерификации может непосредственно использоваться реакционная жидкость, полученная на стадии карбонилирования. С учетом коррозионности реакционной установки, на стадии этерификации предпочтителен способ, по которому заданное количество спирта добавляют к реакционной жидкости, полученной на стадии карбонилирования. Альтернативно, избыточное количество HF может быть отогнано из реакционной жидкости, полученной на стадии карбонилирования, и затем к реакционной жидкости может быть добавлен спирт для этерификации.
[0030]
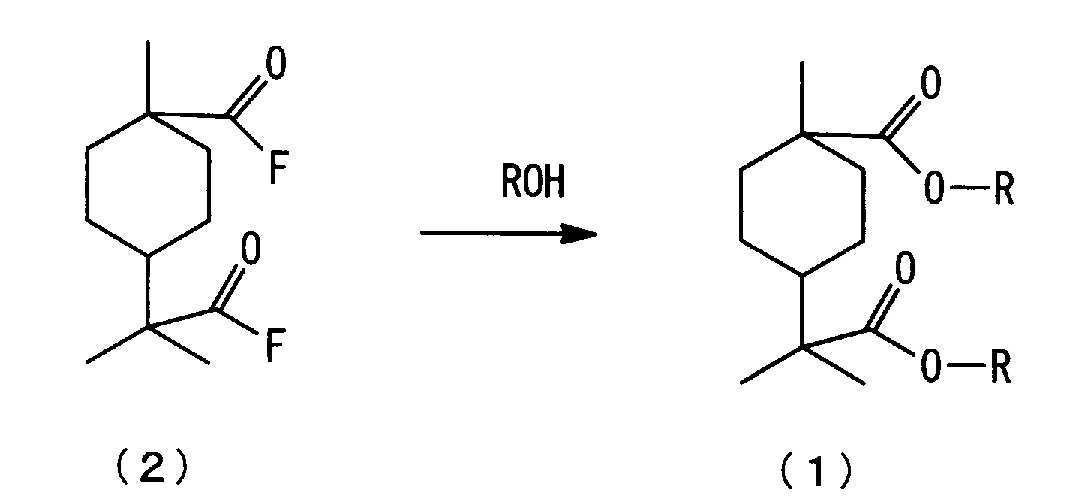
где каждый R независимо означает алкильную группу с 1-4 атомами углерода.
[0031] Конкретные примеры спирта для применения на стадии этерификации включают метанол, этанол, н-пропанол, изопропанол, н-бутиловый спирт, изобутиловый спирт и трет-бутиловый спирт, хотя конкретно не ограничены.
Среди них, с учетом их реакционноспособности, предпочтителен метанол или этанол. На стадии этерификации может быть использован только один тип спирта, либо два или более типов могут использоваться в комбинации.
[0032] Количество спирта, используемое на стадии этерификации, предпочтительно в 1,0-2,5 раза больше, в молях, более предпочтительно в 1,2-2,3 раза больше, в молях, еще предпочтительней в 1,5-2,0 раза больше, в молях, количества исходного вещества - 4-изопропенил-1-метил-1-циклогексена - на стадии карбонилирования. При количестве используемого спирта в 1,0 раз больше, в молях, или выше оставшееся количество непрореагировавшего фторида алициклической дикарбоновой кислоты невелико и приводит к несущественной коррозии установки на последующей стадии, что предпочтительно. Предпочтительно количество используемого спирт в 2,5 раза больше, в молях, или ниже, с точки зрения подавления коррозии установки под действием воды, полученной при реакции межмолекулярной дегидратации спирта.
[0033] Реакционная температура на стадии этерификации предпочтительно составляет от -40°C или выше и до 20°C или ниже, более предпочтительно от -35 до 10°C, еще предпочтительней от -30 до 0°C, с точки зрения подавления разложения сложноэфирного соединения алициклической дикарбоновой кислоты, представленного приведенной выше формулой (1). При реакционной температуре -40°C или выше скорость этерификации может быть увеличена для улучшения выхода. При реакционной температуре 20°C или ниже может подавляться разложение сложного эфира и может подавляться образование воды в качестве побочного продукта реакции дегидратации спирта.
[0034] Стадию этерификации предпочтительно осуществляют при нормальном давлении.
[0035] <Другие стадии>
Способ изготовления по настоящему варианту осуществления может включать другие стадии, иные, чем вышеописанные стадии (a) и (b). Примеры другой стадии включают стадию экстракции жидкость-жидкость, стадию регенерации катализатора, стадию нейтрализации и промывки, стадию регенерации вспомогательного агента и стадию очистки, хотя конкретно не ограничены.
[0036] Примеры стадии очистки включают, после отгонки HF из реакционной жидкости, содержащей сложноэфирное соединение алициклической дикарбоновой кислоты, представленное формулой (1), полученное на стадии этерификации, стадию очистки реакционной жидкости общепринятым способом, таким как перегонка, хотя конкретно не ограничены.
Примеры
[0037] В дальнейшем настоящее изобретение конкретно описано сопровождающими примерами, но данное изобретение не рассматривается как ограничиваемое этими примерами. Если не указано иное, "%" впоследствии означает масс. %.
[0038] <Аналитический метод и условия>
[Газовая хроматография]
В газовой хроматографии используют измерительный прибор GC-17A, производства SHIMADZU CORPORATION, и капиллярную колонку HR-1, производства ULBON (0,32 мм φ ×25 м ×0,50 мкм. Условия повышения температуры устанавливают такие, что температура поднимается от 100°C до 300°C со скоростью 5°C/мин.
[0039] [Выход и изомерное соотношение сложноэфирного соединения дикарбоновой кислоты]
Методом анализа газовой хроматографией получают соотношение площадей (ГХ%) нескольких типов изомерных сложноэфирных соединений дикарбоновой кислоты, в качестве продуктов, и выход и изомерное соотношение сложноэфирных соединений дикарбоновой кислоты рассчитывают по методу внутреннего стандарта, используя следующее уравнение.
[0040] {Выход сложноэфирного соединения дикарбоновой кислоты (мольн.%)}={Общий прирост массы сложноэфирного соединения дикарбоновой кислоты/256,3}/{Загрузочная масса сырья/136,2}×100
[0041] {Изомерное соотношение (%)}={Метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилат (ГХ%)}/{Общее содержание сложноэфирных соединений дикарбоновой кислоты (GC%)}×100
[0042] Изомер в описании означает структурный изомер, имеющий карбонильную группу в различном инверсионном положении.
[0043] [ГХ-МС]
В качестве измерительного прибора ГХ-МС используют ГХ-МС-спектрометр POLARIS Q производства Thermo ELECTRON Corporation.
[0044] [ЯМР]
ЯМР измеряют в следующих условиях.
[0045] Прибор: Bruker Avance 600II (600 МГц-ЯМР)
Режим: Proton, Carbon, DEPT 45°, 90° и 135°, Carbon i.g. и INADEQUATE, HSQC, H2BC, HMBC
Растворитель: CDCl3 (дейтерированный хлороформ)
Вещество для внутреннего стандарта: тетраметилсилан
[0046] <Пример 1>
Получение метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата
[0047]

[0048] [Стадия карбонилирования]
Используя автоклав из нержавеющей стали с внутренним объемом 500 мл, включающий мешалку с типом привода Nack, три входных отверстия в верхней части и одно экстракционное отверстие на дне, с рубашкой для регулирования внутренней температуры, стадию карбонилирования осуществляют следующим образом.
[0049] Сначала атмосферную среду в автоклаве заменяют монооксидом углерода. После чего в автоклав вводят 230 г (11,5 моль) безводного фторида водорода и температуру жидкости в автоклаве устанавливают на -27°C. Затем внутри автоклава повышают давление до 2 МПа с помощью монооксида углерода.
[0050] В автоклав с реакционной температурой, поддерживаемой при -27°C, и реакционным давлением, поддерживаемым при 2 МПа, подают через верхнюю часть автоклава 104,4 г (0,77 моль) 4-изопропенил-1-метил-1-циклогексена для осуществления реакции карбонилирования. После завершения подачи, перемешиванием реакционной жидкости, продолжаемым около 10 минут, до тех пор, пока не перестанет наблюдаться абсорбция монооксида углерода, получают фторид алициклической дикарбоновой кислоты.
[0051] [Стадия этерификации]
После чего в автоклав с реакционной температурой, поддерживаемой при -27°C, подают через верхнюю часть автоклава 49,1 г (1,53 моль) метанола, осуществляя таким образом этерификацию фторида алициклической дикарбоновой кислоты при перемешивании реакционной жидкости в течение 1 часа.
[0052] Реакционную жидкость извлекают через нижнюю часть автоклава в ледяную воду, для того, чтобы разделить масляную фазу и водную фазу. После чего масляную фазу дважды промывают 100 мл 2% водного раствора каустической соды и дважды 100 мл дистиллированной воды, и затем дегидратируют 10 г безводного сульфата натрия. После дегидратации полученную жидкость анализируют газовой хроматографией. В результате, выход сложноэфирного соединения дикарбоновой кислоты составляет 26,6 мольн. % (из расчета на 4-изопропенил-1-метил-1-циклогексен) и выход метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата составляет 21,1 мольн. % (из расчета на 4-изопропенил-1-метил-1-циклогексен, изомерное соотношение: 79,2%).
[0053] [Выделение и очистка продукта]
Перегонкой при пониженном давлении жидкости, полученной на стадии этерификации, с помощью испарителя, удаляют из жидкости низкокипящие вещества. Затем жидкость, из которой были удалены низкокипящие вещества, очищают, используя ректификационную колонну с числом теоретических тарелок 20 (температура перегонки: 177°C, величина вакуума: 20 торр). Очисткой получают 42,0 г продукта в виде основной фракции с изомерным соотношением 92,0% согласно анализу газовой хроматографией (выход при перегонке: 93,2 мольн. % из расчета на метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилат).
[0054] <Идентификация продукта>
По результату анализа ГХ-МС полученный выделением и очисткой продукт по примеру 1 имеет молекулярную массу 256.
[0055] Используя прибор для ЯМР, выполняют измерениеЯМР1H -, измерение ЯМР13C, измерение ЯМРDEPT 45°, 90° и 135°, измерение ЯМРCarbon i.g., измерение ЯМРINADEQUATE, измерение ЯМРHSQC, измерение ЯМРH2BC и измерение ЯМРHMBC. Результаты измерения ЯМР1H и измерения ЯМР13C приведены ниже, и результаты измерения ЯМРDEPT 45°, 90° и 135°, измерения ЯМРCarbon i.g., измерения ЯМРINADEQUATE, измерения ЯМРHSQC-, измерения ЯМРH2BC и измерения ЯМРHMBC представлены на фигурах 1-10.
[0056] [Результаты измерения ЯМР продукта, полученного по примеру 1]
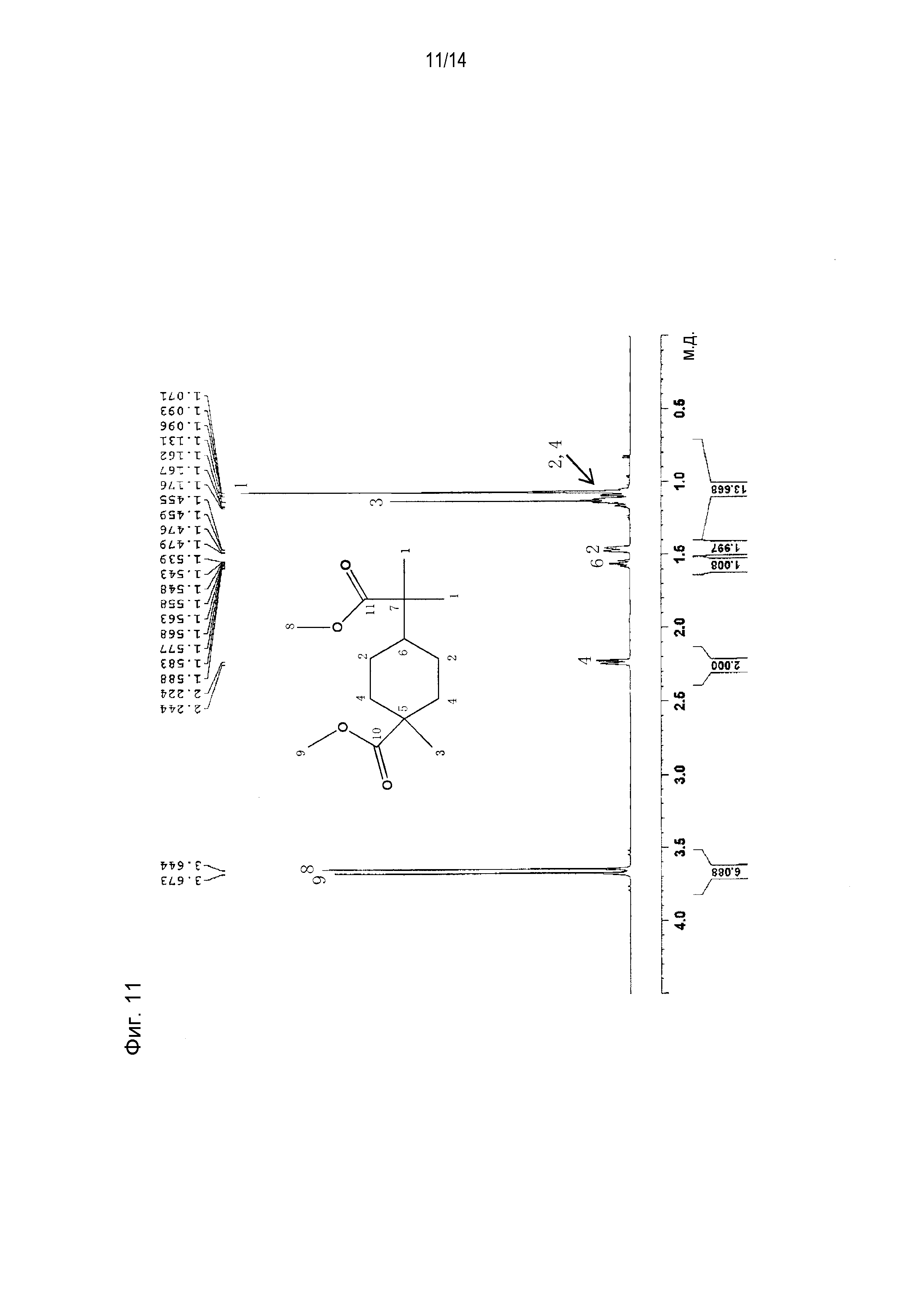
1H-ЯМР (600 МГц, CDCl3, TMS, м.д.) δ: 0,994-1,055 (м, 14H), 1,380-1,401 (м, 2H), 1,488 (м, 1H), 2,147-2,168 (м, 2H), 3,567 (с, 3H), 3,596 (с, 3H)
[0057]13C-ЯМР (600 МГц, CDCl3, TMS, м.д.) δ: 21,74, 24,75, 28,01, 35,85, 43,25, 44,46, 45,17, 51,33, 51,41, 177,31, 178,34.
[0058] Фигура 1 представляет схематическое изображение результатов измерений ЯМР DEPT 45°. Из фигуры 1 установлено, что пятый и седьмой пики четвертичных атомов углерода отсутствуют. Фигура 2 представляет схематическое изображение результатов измерений DEPT ЯМР 90°. Из фигуры 2 установлено, что шестой пик третичного атома углерода интенсивно проявляется. Фигура 3 представляет схематическое изображение результатов измерений DEPT ЯМР 135°. Из фигуры 3 установлено, что второй и четвертый пики вторичных атомов углерода обнаружены в направлении вниз. Фигура 4 представляет схематическое изображение результатов измерений ЯМР Carbon i.g. Фигурой 4 подтверждено число углерода. Фигура 5 и фигура 6 представляют схематическое изображение результатов измерений ЯМР INADEQUATE (фигура 6 представляет увеличенное схематическое изображение результатов измерений на участке 15-55 м.д. фигуры 5). Из фигуры 5 и фигуры 6 установлена корреляция прямого связывания между углеродами. Фигура 7 и фигура 8 представляют схематическое изображение результатов измерений ЯМР HSQC (фигура 8 представляет увеличенное схематическое изображение результатов измерений на участке 3,50-3,70 м.д. фигуры 7). Из фигуры 7 и фигуры 8 идентифицирован атом водорода, связанный с каждым атомом углерода. Фигура 9 и фигура 10 представляют схематическое изображение результатов измерений ЯМР HMBC (фигура 10 представляет увеличенное схематическое изображение результатов измерений на участке 3,50-3,70 м.д. фигуры 9). Из фигуры 9 и фигуры 10 определен атом водорода, который расположен через 2 связи от каждого атома углерода.
[0059] На основании всестороннего анализа результатов измерений основной компонент продукта, полученного по примеру 1, идентифицирован как метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилат.
[0060] <Идентификация стерической структуры>
Стерическая структура метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата, полученного по примеру 1, идентифицирована измерением ЯМР, как указано ниже.
[0061] Фигура 11 представляет схематическое изображение результатов измерений ЯМР1H. Фигура 12 представляет увеличенное схематическое изображение пика 6 (пика атома водорода, связанного с углеродом, к которому присоединена 1-метокси-2-метил-1-оксопропан-2-ильная группа) фигуры 11. Из фигуры 12 видно, что пик расщепляется на 9 и константа связывания для каждого пика равна 12 Гц или 3 Гц. Из этого следует, что атом водорода в положении 6 (атом водорода, связанный с углеродом, к которому присоединена 1-метокси-2-метил-1-оксопропан-2-ильная группа) соединения, приведенного на фигуре 11 (метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата) находится в аксиальном положении циклогексанового цикла.
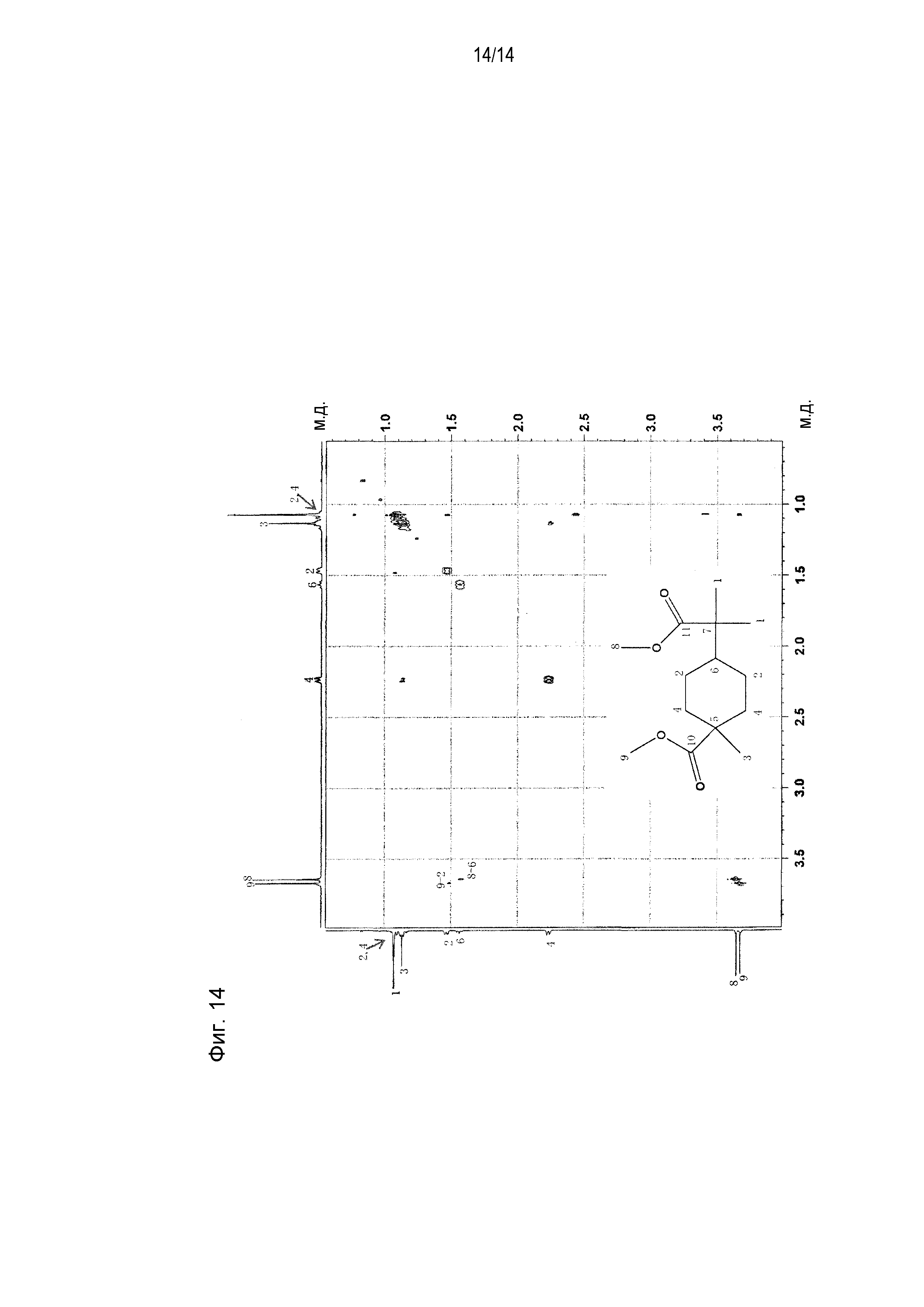
[0062] Фигура 13 представляет схематическое изображение результатов измерений ЯМР COZY. Фигура 14 представляет схематическое изображение результатов измерений ЯМР NOEZY. Из сопоставления результатов измерений на фигуре 13 и фигуре 14 видно, что существуют характерные для измерения ЯМР NOEZY корреляции между атомами водорода в положении 2 и положении 9 и между атомами водорода в положении 6 и положении 8 соединения, представленного на фигурах 13 и 14 (метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата). Другими словами, показано, что атомы водорода в положении 2 и положении 9 пространственно расположены на близком расстоянии и атомы водорода в положении 6 и положении 8 пространственно расположены на близком расстоянии. Это указывает на то, что соединение, представленное на фигурах 13 и 14 (метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилат) содержит карбоксилатную группу в экваториальном положении циклогексанового цикла.
[0063] Из приведенных выше результатов измерений стерическая структура метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата, полученного по примеру 1, идентифицирована как транс-конфигурация, представленная следующей формулой (1-1a)
[0064]
[0065] <Пример 2>
За исключением того, что реакционную температуру на стадии карбонилирования устанавливают на -15°C, стадию карбонилирования, стадию этерификации и выделение и очистку продукта выполняют так же, как в примере 1. После выделения и очистки полученную жидкость анализируют газовой хроматографией. В результате выход сложноэфирного соединения дикарбоновой кислоты равен 25,6 мольн. % (из расчета на 4-изопропенил-1-метил-1-циклогексен) и выход метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата равен 18,7 мольн. % (из расчета на 4-изопропенил-1-метил-1-циклогексен, изомерное соотношение: 73,0%).
[0066] <Пример 3>
За исключением того, что давление монооксида углерода в автоклаве устанавливают на 3 МПа, стадию карбонилирования, стадию этерификации и выделение и очистку продукта выполняют так же, как в примере 2. После выделения и очистки полученную жидкость анализируют газовой хроматографией. В результате выход сложноэфирного соединения дикарбоновой кислоты равен 27,5 мольн. % (из расчета на 4-изопропенил-1-метил-1-циклогексен) и выход метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата равен 20,1 мольн. % (из расчета на 4-изопропенил-1-метил-1-циклогексен, изомерное соотношение: 73,1%).
Промышленная применимость
[0067] Новое сложноэфирное соединение алициклической дикарбоновой кислоты, полученное по настоящему изобретению, применимо в качестве различных промышленных химических сырьевых материалов и сырья для изготовления функциональных оптических материалов и функциональных электронных материалов.
Реферат
Изобретение относится к новому сложноэфирному соединению алициклической дикарбоновой кислоты, представленному формулой (1), где каждый R независимо означает алкильную группу с 1-4 атомами углерода. Изобретение также относится к способу изготовления сложноэфирного соединения алициклической дикарбоновой кислоты, включающему стадии взаимодействия 4-изопропенил-1-метил-1-циклогексена, представленного нижеследующей формулой (3), с монооксидом углерода в присутствии фторида водорода с образованием фторида алициклической дикарбоновой кислоты, представленного нижеследующей формулой (2); и взаимодействия полученного фторида алициклической дикарбоновой кислоты, представленного нижеследующей формулой (2), со спиртом с образованием сложноэфирного соединения алициклической дикарбоновой кислоты, представленного формулой (1). Полученное новое сложноэфирное соединение может быть использовано, например, в качестве исходного вещества для сложных полиэфирных смол. 2 н. и 1 з.п. ф-лы, 14 ил., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Композиция сложного ароматического полиэфира для изготовления контейнеров, формованных вытяжкой с раздувом

Комментарии