Композиции и способы, включающие варианты микробных протеаз - RU2541786C2
Код документа: RU2541786C2
Чертежи

Описание
Область техники, к которой относится изобретение
Настоящее изобретение предоставляет варианты субтилизинов и композиции, включающие, по меньшей мере, один вариант субтилизина, представленный в настоящей заявке, а также способы применения указанных вариантов и композиций.
Уровень техники
Сериновые протеазы представляют собой подгруппу карбонилгидролаз, включающих обширный класс ферментов, обладающих широкой специфичностью и целым спектром биологических функций. В отношении субтилизинов проводили много исследований, что в значительной степени обусловлено их ценностью в производстве моющих средств и продуктов питания. Дополнительная работа была сосредоточена на неблагоприятных экологических условиях (например, на воздействии окислительных агентов, хелатирующих агентов, экстремальных температуры и/или уровней pH), которые могут неблагоприятно воздействовать на функциональные возможности данных ферментов в различных областях применения. Тем не менее, в уровне техники сохраняется потребность в ферментных системах, которые обладают устойчивостью к указанным неблагоприятным условиям и сохраняют исходную или имеют повышенную активность по сравнению с ферментными системами, известными в уровне техники на настоящий момент.
Сущность изобретения
Настоящее изобретение обеспечивает варианты субтилизинов и композиции, включающие, по меньшей мере, один вариант субтилизина, представленный в настоящей заявке, а также способы применения указанных вариантов и композиций. В частности, настоящее изобретение обеспечивает различные протеазы, подходящие для производства стирально-моющих средств.
Настоящее изобретение обеспечивает варианты субтилизина, включающие, по меньшей мере, одну модификацию, где, по меньшей мере, одна модификация выбрана из G100C, S101D, S101H, Q103D, M124G, L126G, S132H, S161N, Q275Z и/или, по меньшей мере, из одного набора модификаций, выбранного из
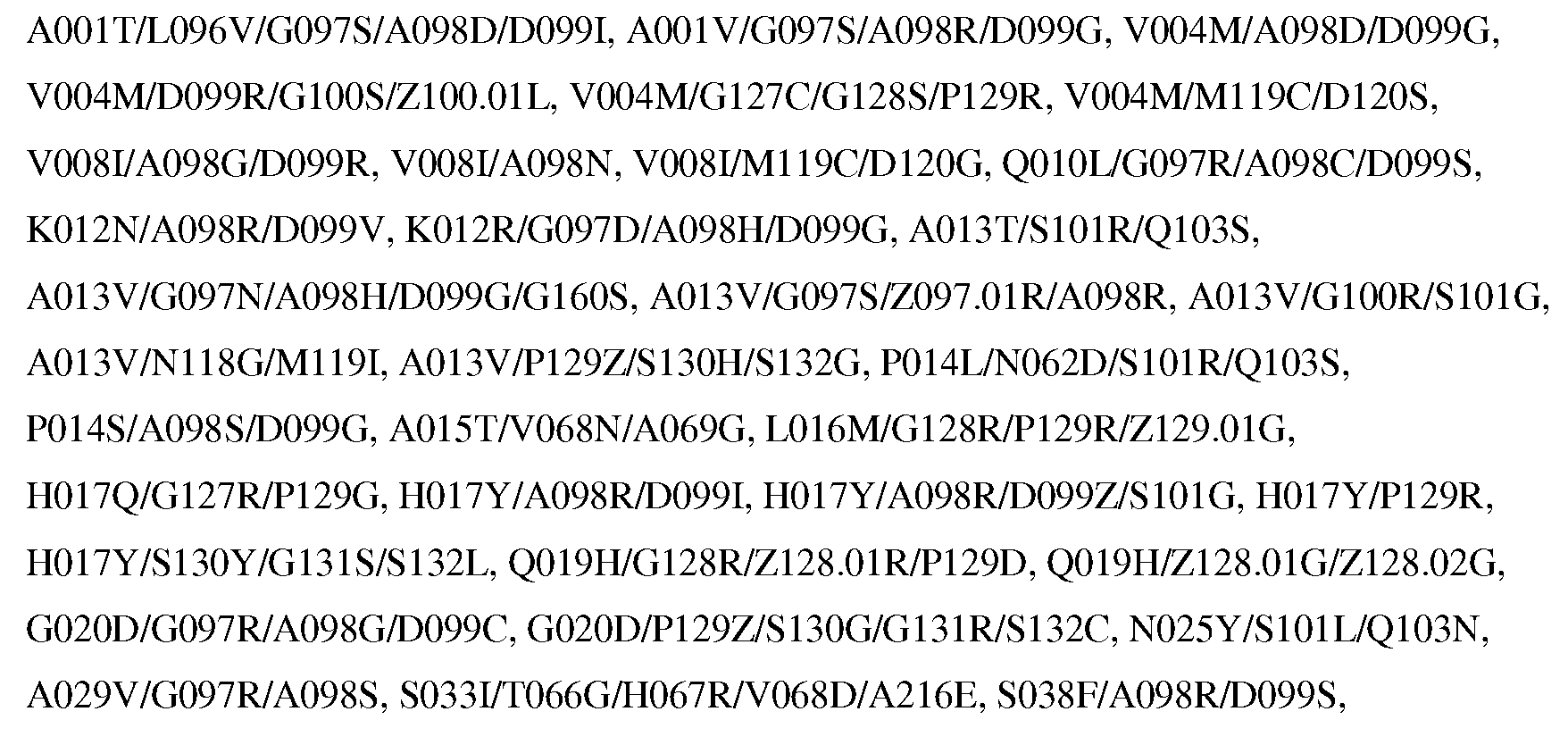






где положения соответствуют положениям субтилизина BPN' SEQ ID NO:2.
Настоящее изобретение также обеспечивает варианты субтилизина, включающие, по меньшей мере, один набор модификаций, где указанный набор модификаций выбран из:

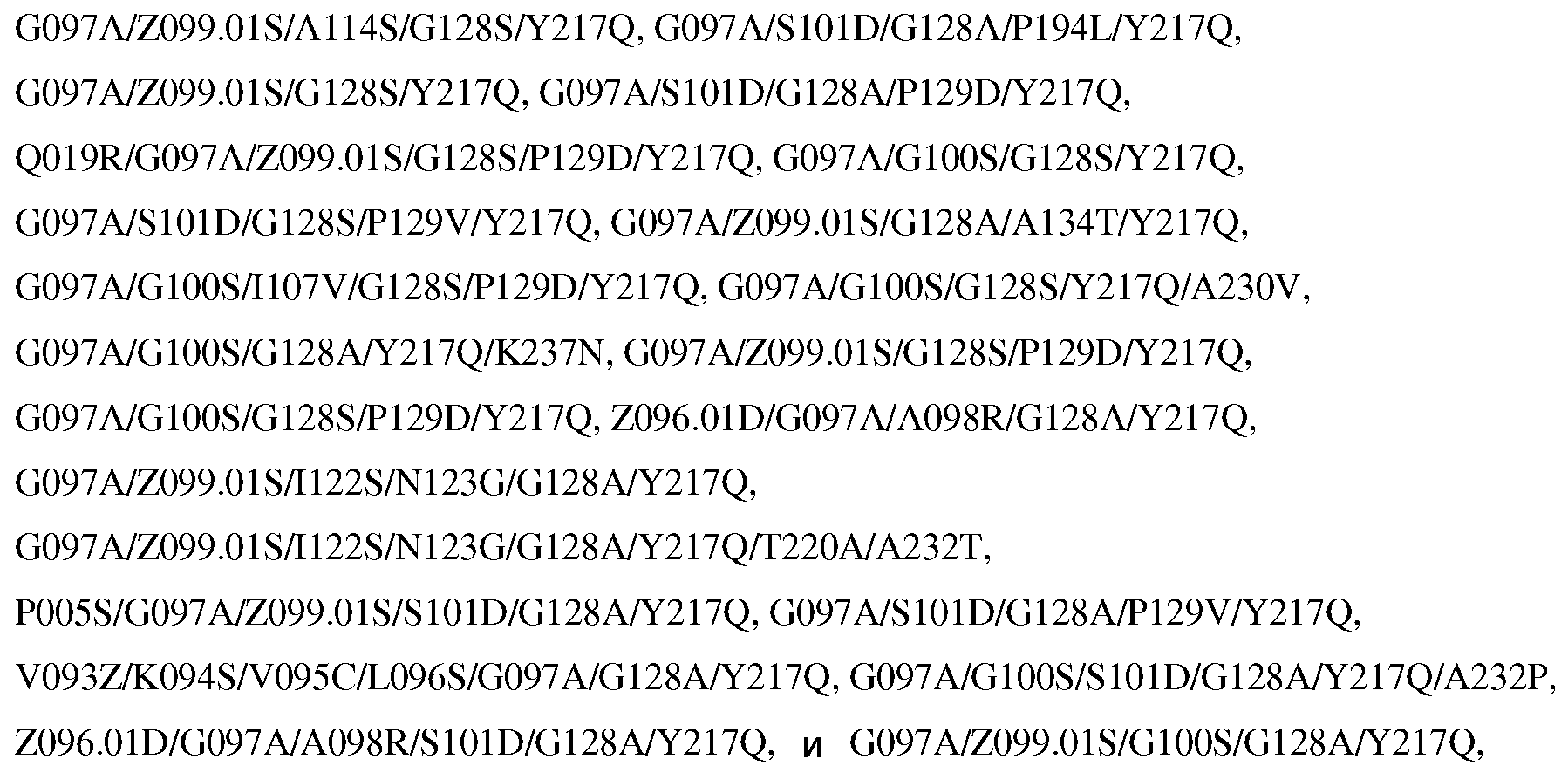
где положения соответствуют положениям субтилизина BPN' SEQ ID NO:2.
Настоящее изобретение также обеспечивает варианты субтилизина, включающие, по меньшей мере, один набор модификаций, где указанный набор модификаций выбран из:


где положения соответствуют положениям субтилизина BPN' SEQ ID NO:2.
Настоящее изобретение также обеспечивает варианты субтилизина, включающие, по меньшей мере, один набор модификаций, где указанный набор модификаций выбран из:

где положения соответствуют положениям субтилизина BPN' SEQ ID NO:2.
Настоящее изобретение также обеспечивает варианты субтилизина, включающие замену Y217L и дополнительно, по меньшей мере, любой один набор из наборов модификаций, представленных выше, где положения соответствуют положениям субтилизина BPN' SEQ ID NO:2. Настоящее изобретение дополнительно обеспечивает варианты субтилизина, включающие замены G97A/G128A/Y217Q, а также включающие, по меньшей мере, любую одну модификацию из наборов модификаций, представленных в настоящей заявке, где положения соответствуют положениям субтилизина BPN' SEQ ID NO:2.
Настоящее изобретение также обеспечивает чистящие композиции, включающие, по меньшей мере, один вариант субтилизина, представленный в настоящей заявке. В некоторых предпочтительных вариантах осуществления чистящая композиция является стиральным моющим средством. В некоторых особо предпочтительных вариантах осуществления стиральное моющее средство является мощным жидким стиральным моющим средством. В некоторых альтернативных вариантах осуществления чистящая композиция является средством для мытья посуды. В некоторых других вариантах осуществления чистящие композиции дополнительно включают один или несколько дополнительных ферментов или производных фермента, выбранных из группы, состоящей из гемицеллюлаз, пероксидаз, протеаз, целлюлаз, ксиланаз, липаз, фосфолипаз, эстераз, кутиназ, пектиназ, кератиназ, редуктаз, оксидаз, фенолоксидаз, липоксигеназ, лигниназ, пуллуланаз, танназ, пентозаназ, маланаз, β-глюканаз, арабинозидаз, гиалуронидазы, хондроитиназы, лакказы и амилаз или их смесей. В некоторых других вариантах осуществления чистящие композиции дополнительно включают, по меньшей мере, один стабилизатор. В некоторых дополнительных вариантах осуществления чистящие композиции включают, по меньшей мере, 0,0001 вес.%, по меньшей мере, любого одного из вариантов субтилизина, представленных в настоящей заявке, и необязательно, по меньшей мере, один подходящий дополнительный компонент.
В некоторых вариантах осуществления настоящего изобретения предложены способы очистки, где способ включает этапы: контакта поверхности и/или изделия, включающего ткань, по меньшей мере, с одной из чистящих композиций, представленных в настоящей заявке, и необязательно мытья и/или промывания поверхности или изделия.
Настоящее изобретение также обеспечивает корма для животных, включающие, по меньшей мере, один вариант субтилизина, представленный в настоящей заявке, а также композиции для обработки продукта питания, включающие, по меньшей мере, один вариант субтилизина, представленный в настоящей заявке.
Краткое описание фигур
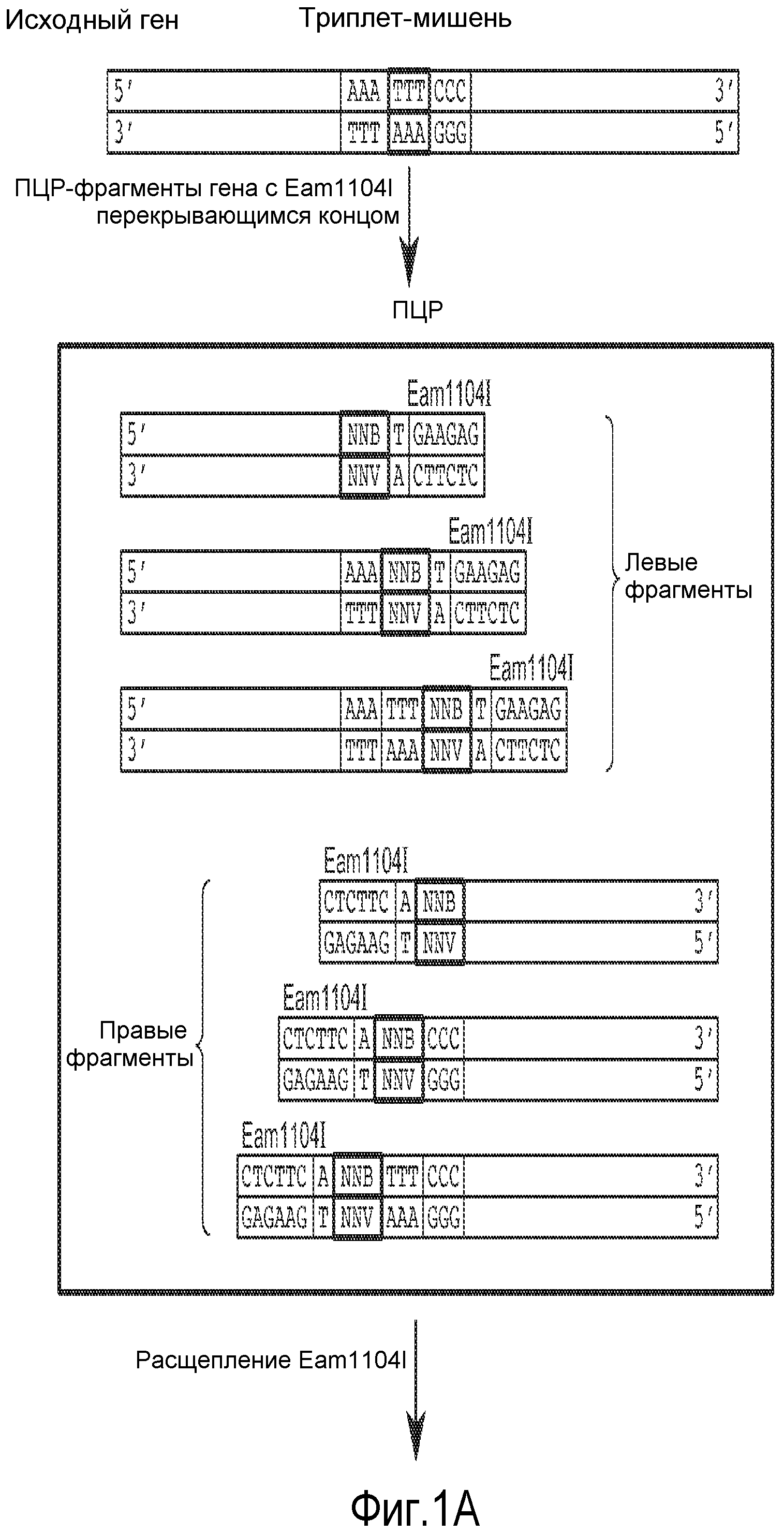
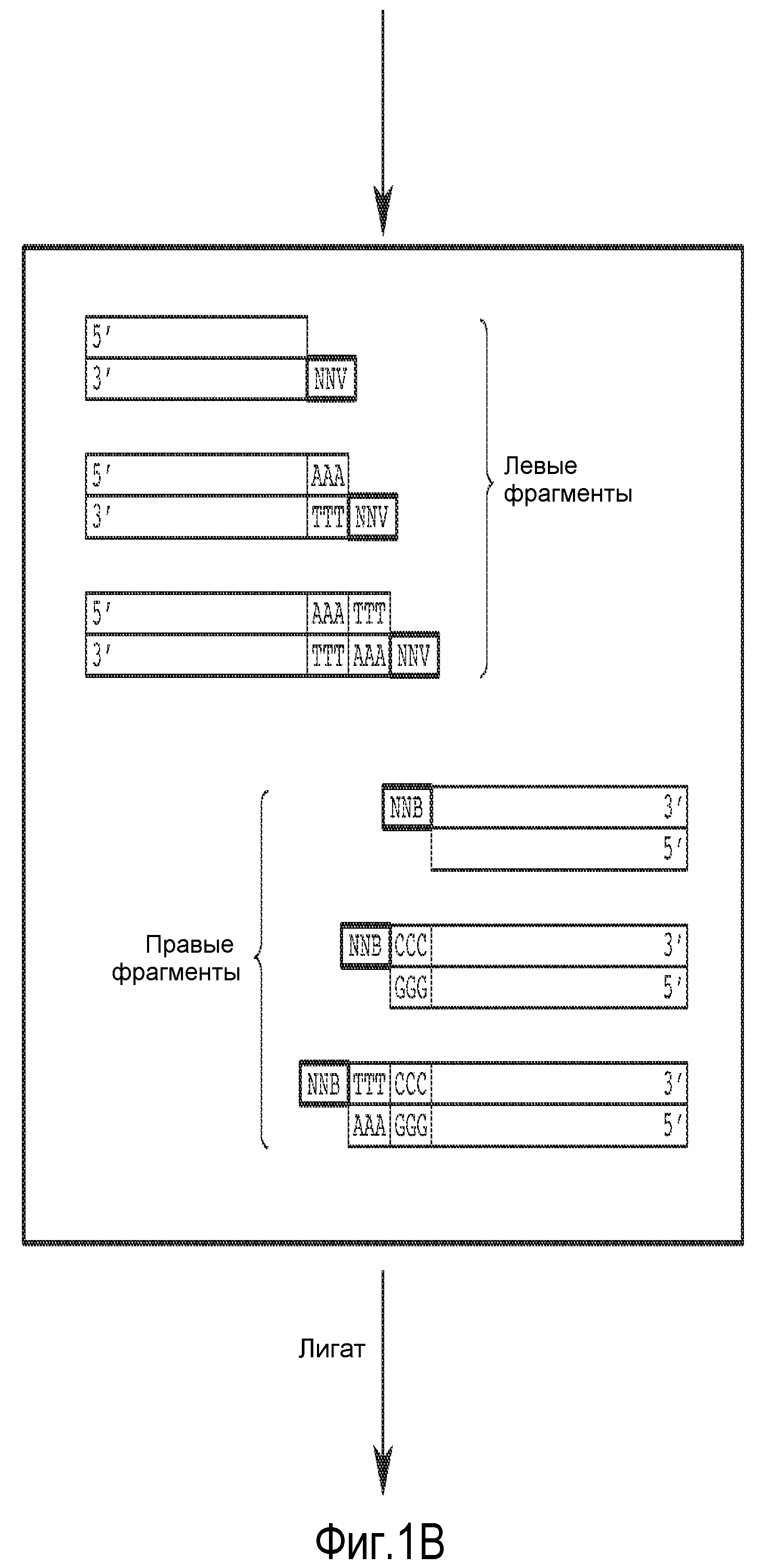
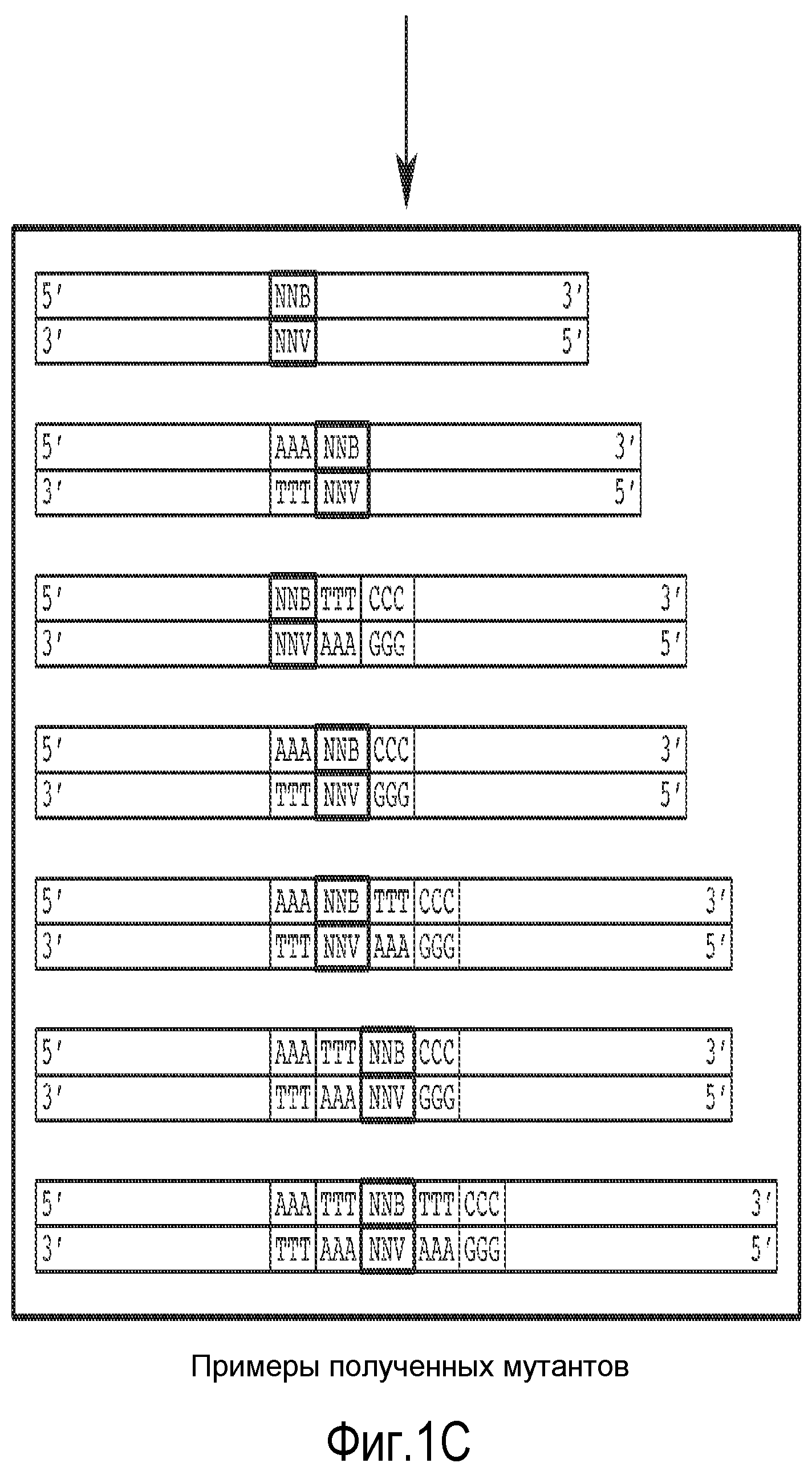
На фиг. 1 показана диаграмма, иллюстрирующая способ, применяемый для получения делеций и вставок внутри рамки считывания. Была создана библиотека, в которой 33% клонов имело замены; 33% клонов имело вставки и 33% клонов имело делеции.
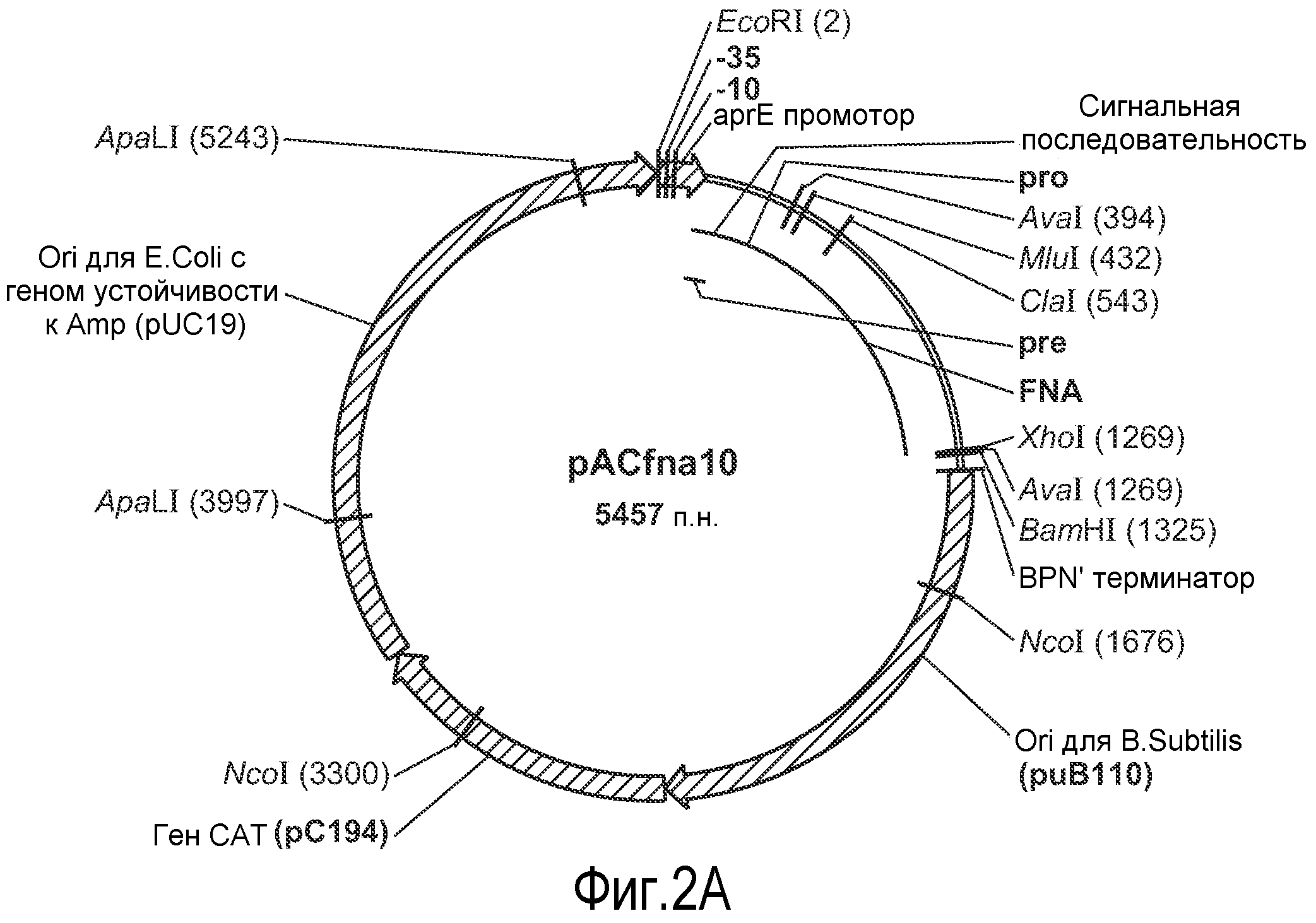
Фиг. 2A представляет схему плазмиды pAC-FNA10. Элементы плазмиды являются следующими: pUB110=фрагмент ДНК из плазмиды pUB110 (McKenzie et al., Plasmid 15:93-103 [1986]), pBR322=фрагмент ДНК из плазмиды pBR322 (Bolivar et al., Gene 2:95-113 [1977]), pC194=фрагмент ДНК из плазмиды pC194 (Horinouchi and Weisblum, J. Bacteriol 150:815-825 [1982]).
На фиг. 2B приведена схема pHPLT-FNA.
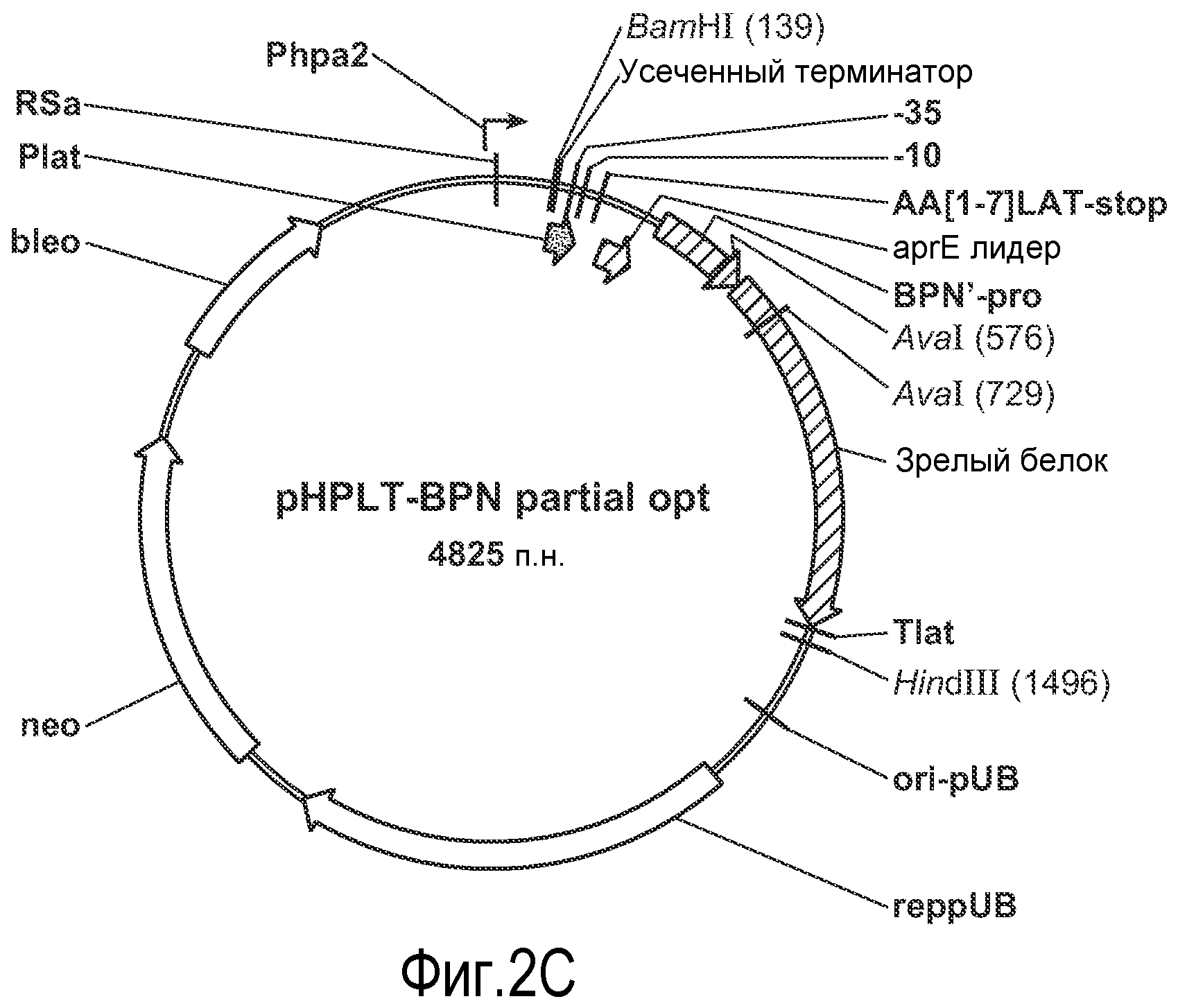
На фиг. 2C приведена схема pHPLT-BPN. Вектор pHPLT содержит LAT-промотор (PLAT), последовательность, кодирующую сигнальный пептид LAT (preLAT). Сайт начала репликации и neoR получены из плазмиды pUB110.
Описание изобретения
Настоящее изобретение обеспечивает варианты субтилизинов и композиции, включающие, по меньшей мере, один вариант субтилизина, представленный в настоящей заявке, а также способы применения указанных вариантов и композиций. Модификация протеаз-предшественников согласно изобретению в целях получения соответствующих вариантов субтилизинов включает, по меньшей мере, одну замену, по меньшей мере, одну делецию или, по меньшей мере, одну вставку. В некоторых вариантах осуществления модификация включает комбинацию мутаций. Например, в некоторых вариантах осуществления модификация включает комбинацию, по меньшей мере, одной замены и, по меньшей мере, одной делеции. В некоторых других вариантах осуществления модификация включает комбинацию, по меньшей мере, одной замены и, по меньшей мере, одной вставки. В некоторых дальнейших вариантах осуществления модификация включает комбинацию, по меньшей мере, одной делеции и, по меньшей мере, одной вставки. В других вариантах осуществления модификация включает комбинацию, по меньшей мере, одной замены, по меньшей мере, одной делеции и, по меньшей мере, одной вставки.
В уровне техники известно несколько подходящих способов получения модифицированных полинуклеотидных последовательностей по настоящему изобретению, включающих, помимо прочего, сайт-насыщающий мутагенез, сканирующий мутагенез, инсерционный мутагенез, делеционный мутагенез, случайный мутагенез, сайт-направленный мутагенез и направленную эволюцию, а также различные другие рекомбинационные методы. Обычно применяемые способы включают ДНК-перетасовку (см. Stemmer, Proc Natl Acad Sci USA 25:10747-51 [1994]), способы, основанные на негомологичной рекомбинации генов (например, ITCHY) (Ostermeier et al., Bioorg Med Chem. 7:2139-44 [1999]), SCRACHY (Lutz et al. Proc Natl Acad Sci USA 98:11248-53 [2001]), SHIPREC (Sieber et al., Nat Biotechnol., 19:456-60 [2001]) и NRR (Bittker et al., Nat Biotechnol., 20:1024-9 [2001]; Bittker et al., Proc Natl Acad Sci. USA 101:7011-6 [2004]), а также способы, основанные на использовании олигонуклеотидов для вставки случайных и специфических мутаций, делеций и/или вставок (Ness et al., Nat Biotechnol. 20:1251-5 [2002]; Coco et al., Nat Biotechnol., 20:1246-50 [2002]; Zha et al., Chembiochem. 3:34-9 [2003], Glaser et al., J Immunol., 149:3903-13 [1992], Sondek and Shortle, Proc Natl Acad Sci USA 89:3581-5 [1992], Yanez et al., Nucleic Acids Res., 32:el58 [2004], Osuna et al., Nucleic Acids Res., 32:el36 [2004], Gaytan et al., Nucleic Acids Res., 29:E9 [2001] и Gaytan et al., Nucleic Acids Res., 30:e84 [2002]).
В некоторых вариантах осуществления родительский полноразмерный полинуклеотид лигирован в соответствующую экспрессионную плазмиду, а затем способ мутагенеза применяется для упрощения конструирования модифицированной протеазы по настоящему изобретению, хотя могут применяться другие способы. Способ основан на методе, описанном Pisarchik et al. (Pisarchik et al., Prot. Eng. Des. Select, 20:257-265 [2007]). В некоторых вариантах осуществления обеспечивается дополнительное преимущество, состоящее в том, что рестриктаза, которая применяется в настоящей заявке, производит расщепление вне своей последовательности узнавания, что позволяет провести рестрикцию фактически любой нуклеотидной последовательности и избежать образования разреза в сайте рестрикции. Сначала, как описано в настоящей заявке, получают и секвенируют природный ген, кодирующий полноразмерную протеазу, который затем сканируют с поиском одной или более точек, в которых требуется сделать мутацию (делецию, вставку, замену или их комбинацию) одной или более аминокислот. Мутацию гена с целью такого изменения его последовательности, чтобы она соответствовала требуемой последовательности, выполняют с помощью удлинения праймера в соответствии с общеизвестными методами. Фрагменты слева и справа от целевой точки (точек) мутации амплифицируются с помощью ПЦР и включают сайт рестрикции Eam1104I. Левый и правый фрагменты расщепляют с использованием Eam1104I, получая некоторое количество фрагментов, имеющих комплементарные липкие концы длиной три нуклеотида, которые затем объединяют и лигируют с получением библиотеки модифицированных последовательностей, содержащих одну или более мутаций. Данный способ позволяет избежать возникновения мутаций со сдвигом рамки считывания. Кроме того, данный способ упрощает процесс мутагенеза, поскольку все синтетические олигонуклеотиды могут иметь один и тот же сайт рестрикции, и поэтому для создания сайтов рестрикции не потребуются синтетические линкеры, как это необходимо в некоторых других способах.
Композиции
Настоящее изобретение обеспечивает варианты протеаз и композиции, включающие, по меньшей мере, один из вариантов субтилизинов, представленных в настоящей заявке. В некоторых вариантах осуществления настоящее изобретение обеспечивает способы получения протеазы с различными коммерческими назначениями, в которых требуется расщепление или синтез полипептидов, включая чистящие композиции, а также пищевые компоненты, обработку ткани, отделку кожи, переработку зерна, переработку мяса, переработку продуктов питания, получение белковых гидролизатов, средств, способствующих пищеварению, бактерицидных композиций, бактериостатических композиций, фунгистатических композиций и средств для личной гигиены (например, для ухода за полостью рта, для ухода за волосами и/или для ухода за кожей).
Настоящее изобретение дополнительно обеспечивает ферментные композиции, обладающие сопоставимой или улучшенной моющей эффективностью, по сравнению с применяемыми на настоящий момент субтилизиновыми протеазами.
Чистящие композиции
Чистящая композиция по настоящему изобретению предпочтительно применяется, например, в области стирки. Фактически, благодаря уникальным преимуществам, связанным с повышенной эффективностью в растворах с более низкой температурой, ферменты по настоящему изобретению идеально подходят для применения в стирке. Кроме того, ферменты по настоящему изобретению могут применяться как в гранулированных, так и в жидких композициях.
Варианты протеаз по настоящему изобретению также находят применение в стирально-моющих добавках. В некоторых вариантах осуществления применяется низкотемпературный чистящий раствор. Добавка, в наиболее простой форме, может являться одной или несколькими протеазами. В некоторых вариантах осуществления добавка упакована в дозированной форме для добавления в процессе чистки. Любая подходящая разовая дозированная форма также может применяться согласно настоящему изобретению, включая, помимо прочего, гранулы, таблетки, желатиновые капсулы или другие разовые дозированные формы, такие как дозированные порошки или жидкости. В некоторых вариантах осуществления включен наполнитель(и) или носитель(и), увеличивающие объем такой композиции. Подходящий наполнитель или носитель включают, помимо прочего, различные соли, например, сульфат, карбонат и силикат, а также тальк, глину и т.п. Подходящий наполнитель или носитель в случае жидких композиций включает, помимо прочего, воду или низкомолекулярные первичные и вторичные спирты, включая полиолы и диолы. Примеры таких спиртов включают, помимо прочих, метанол, этанол, пропанол и изопропанол. В некоторых вариантах осуществления композиции содержат приблизительно от 5% до приблизительно 90% подобных материалов. Кислотные наполнители могут применяться для снижения pH. В альтернативе чистящая добавка включает дополнительные компоненты, как более подробно описано ниже.
Настоящие чистящие композиции и чистящие добавки требуют эффективного количества, по меньшей мере, одного из вариантов протеаз, представленных в настоящей заявке, отдельно или в комбинации с другими протеазами и/или дополнительными ферментами. Необходимый уровень фермента достигают путем добавления одного или нескольких вариантов протеаз по настоящему изобретению. Обычно настоящие чистящие композиции включают, по меньшей мере, приблизительно 0,0001 вес.%, от приблизительно 0,0001 до приблизительно 1, от приблизительно 0,001 до приблизительно 0,5 или даже от приблизительно 0,01 до приблизительно 0,1 вес.%, по меньшей мере, одного из вариантов протеаз по настоящему изобретению.
Чистящие композиции, описанные в настоящей заявке, обычно составлены так, что в процессе применения в операциях по очистке в воде моечная вода имеет pH от приблизительно 5,0 до приблизительно 11,5 или даже от приблизительно 7,5 до приблизительно 10,5. Состав жидких средств обычно подобран так, что они в чистом виде имеют pH от приблизительно 3,0 до приблизительно 9,0 или даже от приблизительно 3 до приблизительно 5. Гранулированные средства для стирки обычно имеют такой состав, что их pH составляет от приблизительно 9 до приблизительно 11. Способы регулирования pH на рекомендованных практических уровнях включают применение буферов, щелочей, кислот и т.д. и известны специалистам, квалифицированным в данной области.
Подходящие чистящие композиции с низким pH в чистом виде обычно имеют pH от приблизительно 3 до приблизительно 5, и обычно не содержат поверхностно-активных веществ, которые подвергаются гидролизу в среде с таким pH. Подобные поверхностно-активные вещества включают поверхностно-активные вещества из группы алкилсульфатов натрия, которые включают, по меньшей мере, одну этиленоксидную группу или даже от приблизительно от 1 до приблизительно 16 молей этилоксида. Такие чистящие композиции обычно включают достаточное количество модификатора pH, такого как гидроксид натрия, моноэтаноламин или хлороводородная кислота, с получением такой чистящей композиции, которая в чистом виде имеет pH от приблизительно 3 до приблизительно 5. Такие композиции обычно включают, по меньшей мере, один кислотоустойчивый фермент. В некоторых вариантах осуществления композиции представляют собой жидкости, тогда как в других вариантах осуществления они представляют собой твердые вещества. Уровень pH таких жидких композиций обычно измеряется как pH в чистом виде. Уровень pH таких твердых композиций измеряется как pH 10%-го раствора твердых веществ указанной композиции, где растворителем является дистиллированная вода. В данных вариантах осуществления все измерения pH проводят при 20°C.
В некоторых вариантах осуществления, когда вариант протеазы (протеаз) применяется в гранулированной композиции или жидкости, предпочтительно, чтобы вариант протеазы находился в форме инкапсулированной частицы, чтобы защитить вариант протеазы от других компонентов гранулированной композиции при хранении. Кроме того, инкапсулирование также является способом регулирования доступности варианта протеазы в процессе чистки. В некоторых вариантах осуществления инкапсулирование увеличивает эффективность варианта протеазы (протеаз) и/или дополнительных ферментов. В этой связи варианты протеаз по настоящему изобретению инкапсулированы с использованием любого подходящего инкапсулирующего материала, известного в уровне техники. В некоторых вариантах осуществления инкапсулирующий материал обычно инкапсулирует, по меньшей мере, часть катализатора для варианта протеазы (протеаз) по настоящему изобретению. Как правило, инкапсулирующий материал растворим в воде и/или является диспергируемым в воде. В некоторых вариантах осуществления инкапсулирующий материал имеет температуру стеклования (Тс) 0°C или выше. Температура стеклования более подробно описана в WO 97/11151. Инкапсулирующий материал выбран из группы, состоящей из углеводов, природных или синтетических смол, хитина, хитозана, целлюлозы и производных целлюлозы, силикатов, фосфатов, боратов, поливинилового спирта, полиэтиленгликоля, твердых парафинов и их комбинаций. В случае, когда инкапсулирующим материалом является углевод, он обычно выбран из моносахаридов, олигосахаридов, полисахаридов и их комбинаций. Как правило, инкапсулирующим материалом является крахмал. Подходящие крахмалы описаны в EP 0922499; US 4977252; US 5354559 и US 5935826. В некоторых вариантах осуществления инкапсулирующим материалом является микросфера, изготовленная из пластмассы, такой как термопласты, акрилонитрил, метакрилонитрил, полиакрилонитрил, полиметакрилонитрил и их смеси; коммерчески доступные микросферы, которые могут применяться, включают микросферы EXPANCEL® (Stockviksverken, Sweden) и PM 6545, PM 6550, PM 7220, PM 7228, EXTENDOSPHERES®, LUXSIL®, Q-CEL®, а также SPHERICEL® (PQ Corp., Valley Forge, PA).
Как описано в настоящей заявке, варианты протеаз по настоящему изобретению находят конкретное применение в стирально-моющих средствах. В данных областях применения ферменты находятся в условиях воздействий различных внешних факторов. Варианты протеаз по настоящему изобретению предоставляют преимущества по сравнению со многими ферментами, используемыми в настоящее время, благодаря своей стабильности в различных условиях.
Фактически существуют различные условия стирки или мойки, включающие различные составы моющих средств, объемы моечной воды, температуры моечной воды и продолжительность стирки или мойки, воздействию которых подвергаются протеазы, применяемые в стирке или мойке. Кроме того, моющие составы, используемые в различных географических районах, имеют различные концентрации соответствующих компонентов, которые присутствуют в моечной воде. Например, европейское моющее средство обычно содержит приблизительно 4500-5000 м.д. моющих компонентов в моечной воде, в то время как японское моющее средство обычно содержит приблизительно 667 м.д. моющих компонентов в моечной воде. В Северной Америке, в особенности в Соединенных Штатах, моющие средства обычно содержат приблизительно 975 м.д. компонентов моющих средств в моечной воде.
Система с низкой концентрацией моющего средства включает моющие средства, где менее чем приблизительно 800 м.д. моющих компонентов присутствуют в моечной воде. Японские моющие средства обычно считаются системой с низкой концентрацией моющего средства, поскольку они содержат в моечной воде приблизительно 667 м.д. компонентов моющих средств.
Моющие средства средней концентрации включают моющие средства, где в моечной воде присутствует от приблизительно 800 м.д. до приблизительно 2000 м.д. компонентов моющих средств. Североамериканские моющие средства обычно считаются системами со средней концентрацией моющих средств, поскольку они содержат приблизительно 975 м.д. компонентов моющих средств в моечной воде. В Бразилии в моечной воде обычно содержится приблизительно 1500 м.д. компонентов моющих средств.
Система с высокой концентрацией моющих средств включает моющие средства, где в моечной воде присутствует более чем приблизительно 2000 м.д. компонентов моющих средств. Европейские моющие средства обычно считаются системами с высокой концентрацией моющих средств, поскольку в моечной воде они содержат приблизительно 4500-5000 м.д. компонентов моющих средств.
Латиноамериканские моющие средства обычно являются сильнопенящимися моющими средствами на фосфатной основе, при этом ассортимент моющих средств, используемых в Латинской Америке, может включать моющие средства средних и высоких концентраций, поскольку они различаются по содержанию компонентов моющих средств в моечной воде от 1500 м.д. до 6000 м.д. Как указано выше, в Бразилии моечная вода обычно содержит приблизительно 1500 м.д. компонентов моющих средств. Впрочем, в других географических районах, не ограниченных другими латиноамериканскими странами, сильнопенящееся моющее средство на фосфатной основе может включать системы с высокой концентрацией моющих средств, составляющей до приблизительно 6000 м.д. компонентов моющего средства, присутствующих в моечной воде.
С учетом вышеизложенного очевидно, что концентрации моющих композиций в обычных моечных растворах во всем мире варьируют от менее чем приблизительно 800 м.д. моющей композиции ("географические районы с низкой концентрацией моющих средств"), например, приблизительно 667 м.д. в Японии, до приблизительно 800-2000 м.д. ("географические районы со средней концентрацией моющих средств"), например, приблизительно 975 м.д. в США и приблизительно 1500 м.д. в Бразилии и более чем приблизительно до 2000 м.д. ("географические районы с высокой концентрацией моющих средств"), например, приблизительно от 4500 м.д. до приблизительно 5000 м.д. в Европе и приблизительно 6000 м.д. в географических районах, где используются сильнопенящиеся моющие средства на фосфатной основе.
Концентрации обычного моечного раствора определяют эмпирически. Например, в США обычная стиральная машина вмещает объем приблизительно 64,4 л моечного раствора. Соответственно, чтобы в моечном растворе получить концентрацию приблизительно 975 м.д. моющего средства, в 64,4 л моечного раствора требуется добавить приблизительно 62,79 г моющей композиции. Указанное количество является стандартным количеством, дозируемым в моечную воду потребителем с помощью мерного стаканчика, поставляемого с моющим средством.
В качестве следующего примера, в различных географических районах используют различные моечные температуры. Температура моечной воды в Японии обычно ниже используемой в Европе. Например, температура моечной воды в Северной Америке и Японии обычно составляет 10-30°C (например, приблизительно 20°C), тогда как температура моечной воды в Европе обычно составляет 30-60°C (например, приблизительно 40°C).
В качестве другого примера, в различных географических районах вода обычно имеет разную жесткость. Жесткость воды обычно описывается в гранах на галлон смеси Ca2+/Mg2+. Жесткость является мерой количества кальция (Ca2+) и магния (Mg2+) в воде. Большая часть воды в Соединенных Штатах является жесткой, но степень жесткости изменяется. Вода от умеренно жесткой (60-120 м.д.) до жесткой (121-181 м.д.) содержит 60-181 миллионных долей (миллионные доли преобразуются в граны на американский галлон - число м.д., деленное на 17,1, равно гранам на галлон) минеральных солей жесткости.
Жесткость европейской воды обычно превышает 10,5 (например, 10,5-20,0) гранов на галлон смеси Ca2+/Mg2+ (например, приблизительно 15 гранов на галлон смеси Ca2+/Mg2+). Жесткость североамериканской воды обычно выше, чем жесткость японской воды, но меньше, чем жесткость европейской воды. Например, жесткость североамериканской воды может составлять 3-10 гранов, 3-8 гранов или приблизительно 6 гранов. Жесткость японской воды обычно ниже, чем жесткость североамериканской воды, и обычно меньше 4 и равна, например, 3 гранам на галлон смеси Ca2+/Mg2+.
Таким образом, в некоторых вариантах осуществления настоящее изобретение обеспечивает различные протеазы, которые демонстрируют неожиданно эффективное моющее действие, по меньшей мере, в одном наборе условий (например, температура воды, жесткость воды и/или концентрация моющего средства). В некоторых вариантах осуществления варианты протеаз по настоящему изобретению сопоставимы по эффективности моющего действия с другими субтилизиновыми протеазами. В некоторых вариантах осуществления варианты протеаз по настоящему изобретению демонстрируют повышенную эффективность моющего действия по сравнению с субтилизиновыми протеазами, коммерчески доступными в настоящее время. Таким образом, в некоторых предпочтительных вариантах осуществления настоящего изобретения варианты протеаз, представленные в настоящей заявке, демонстрируют повышенную устойчивость к окислению, повышенную термическую устойчивость и/или повышенную устойчивость к комплексонам. Кроме того, варианты протеаз по настоящему изобретению находят применение в чистящих композициях, которые не включают моющих средств, либо отдельно, либо в комбинации с основными компонентами и стабилизаторами.
В некоторых вариантах осуществления настоящего изобретения чистящие композиции включают, по меньшей мере, один вариант протеазы по настоящему изобретению на уровне от приблизительно 0,00001% до приблизительно 10% по весу композиции и прочие компоненты (например, составляющие от приблизительно 99,999% до приблизительно 90,0% по весу композиции), включающие вспомогательные чистящие материалы. В других аспектах настоящего изобретения чистящие композиции по настоящему изобретению включают, по меньшей мере, один вариант протеазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% по весу композиции, а также прочие компоненты чистящей композиции (например, составляющие от приблизительно 99,9999% до приблизительно 90,0%, от приблизительно 99,999% до приблизительно 98%, от приблизительно 99,995% до приблизительно 99,5% по весу), включающие вспомогательные чистящие материалы.
В некоторых вариантах осуществления предпочтительные чистящие композиции включают один или более дополнительных ферментов или производных фермента, которые обеспечивают эффективность чистки и/или эффекты ухода за тканью, в дополнение к одному или нескольким вариантам протеаз, представленным в настоящей заявке. Такие ферменты включают, помимо прочих, другие протеазы, липазы, кутиназы, амилазы, целлюлазы, пероксидазы, оксидазы (например, лакказы) и/или маннаназы.
В композициях по настоящему изобретению может применяться любая другая подходящая протеаза. Подходящие протеазы включают протеазы животного, растительного или микробного происхождения. В некоторых особенно предпочтительных вариантах осуществления применяются микробные протеазы. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. В некоторых вариантах осуществления протеаза является сериновой протеазой, предпочтительно микробной щелочной протеазой или трипсиноподобной протеазой. Примеры щелочных протеаз включают субтилизины, в особенности субтилизины, полученные из Bacillus (например, субтилизин, lentus, amyloliquefaciens, субтилизин Carlsberg, субтилизин 309, субтилизин 147 и субтилизин 168). Дополнительные примеры включают мутантные протеазы, описанные в патентах США RE 34606, 5955340, 5700676, 6312936 и 6482628, которые включены в настоящую заявку путем отсылки. Дополнительные примеры протеаз включают, помимо прочего, трипсин (например, свиной или бычий) и протеазу Fusarium, описанную в WO 89/06270. Предпочтительные коммерчески доступные ферменты протеазы включают MAXATASE®, MAXACAL™, MAXAPEM™, OPTICLEAN®, OPTIMASE®, PROPERASE®, PURAFECT® и PURAFECT® OXP (Genencor); ALCALASE®, SAVINASE®, PRIMASE®, DURAZYM™, RELASE® и ESPERASE® (Novozymes) и BLAP™ (Henkel Kommanditgesellschaft auf Aktien, Duesseldorf, Germany). Варианты протеаз описаны в WO 95/23221, WO 92/21760 и патентах США 5801039, 5340735, 5500364, 5855625, US RE 34606, 5955340, 5700676, 6312936 и 6482628, а также в других патентах.
Кроме того, в настоящем изобретении находит применение любая подходящая липаза. Подходящие липазы включают, помимо прочих, липазы бактериального или грибкового происхождения. В настоящее изобретение включены химически или генетически модифицированные мутанты. Примеры полезных липаз включают липазу Humicola lanuginosa (см., например, EP 258068 и EP 305216), липазу Rhizomucor miehei (см., например, EP 238023), липазу Candida, такую как липаза C. antarctica (например, липаза C. antarctica A или B; см., например, EP 214761), липазу Pseudomonas, такую как липаза P. alcaligenes и P. pseudoalcaligenes (см., например, EP 218272), липазу P. cepacia (см., например, EP 331376), липазу P. stutzeri (см., например, GB 1372034), липазу P. fluorescens, липазу Bacillus (например, липазу B. subtilis [Dartois et al., Biochem. Biophys. Acta 1131:253-260 [1993]); липазу B. stearothermophilus [см. например, JP 64/744992] и липазу B. pumilus [см. например, WO 91/16422]).
Кроме того, ряд клонированных липаз находит применение в некоторых вариантах осуществления настоящего изобретения, включая, помимо прочих, липазу Penicillium camembertii (см., Yamaguchi et al., Gene 103:61-67 [1991]), липазу Geotricum candidum (см., Schimada et al., J. Biochem., 106:383-388 [1989]), а также различные липазы Rhizopus, например, липаза R. delemar (см., Hass et al., Gene 109:117-113 [1991]), липаза R. niveus (Kugimiya et al., Biosci. Biotech. Biochem. 56:716-719 [1992]) и липаза R. oryzae.
Другие типы липолитических ферментов, таких как кутиназы, также находят применение в некоторых вариантах осуществления настоящего изобретения, включая, помимо прочего, кутиназу, полученную из Pseudomonas mendocina (см. WO 88/09367), и кутиназу, полученную из Fusarium solani pisi (см. WO 90/09446).
Дополнительные подходящие липазы включают коммерчески доступные липазы, такие как M1 LIPASE™, LUMA FAST™ и LIPOMAX™ (Genencor); LIPOLASE® и LIPOLASE® ULTRA (Novozymes); а также LIPASE P™ "Amano" (Amano Pharmaceutical Co. Ltd., Japan).
В некоторых вариантах осуществления настоящего изобретения чистящие композиции по настоящему изобретению дополнительно включают липазы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной липазы по весу композиции, а также прочие компоненты, включающие вспомогательные чистящие материалы, от веса композиции. В других аспектах настоящего изобретения чистящие композиции по настоящему изобретению также включают липазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% липазы от веса композиции.
Любая амилаза (альфа и/или бета), подходящая для применения в щелочных растворах, также находит применение в некоторых вариантах осуществления настоящего изобретения. Подходящие амилазы включают, помимо прочего, амилазы бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. Амилазы, которые находят применение в настоящем изобретении, включают, помимо прочих, α-амилазы, полученные из B. licheniformis (см., например, GB 1296839). Коммерчески доступные амилазы, которые находят применение в настоящем изобретении, включают, помимо прочих, DURAMYL®, TERMAMYL®, FUNGAMYL® и BAN™ (Novozymes), а также RAPIDASE® и MAXAMYL® P (Genencor).
В некоторых вариантах осуществления настоящего изобретения чистящие композиции по настоящему изобретению дополнительно включают амилазы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной амилазы по весу композиции, а также прочие компоненты, включающие вспомогательные чистящие материалы, по весу композиции. В других аспектах настоящего изобретения чистящие композиции по настоящему изобретению также включают амилазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% амилазы по весу композиции.
В некоторых других вариантах осуществления в чистящих композициях по настоящему изобретению находит применение любая подходящая целлюлаза. Подходящие целлюлазы включают, помимо прочего, целлюлазы бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. Подходящие целлюлазы включают, помимо прочего, целлюлазы Humicola insolens (см., например, патент США 4435307). Наиболее подходящими целлюлазами являются целлюлазы, которые обеспечивают эффект сохранения цвета (см., например, EP 0495257). Коммерчески доступные целлюлазы, которые находят применение в настоящем изобретении, включают, помимо прочих, CELLUZYME® (Novozymes) и KAC-500(B)™ (Kao Corporation). В некоторых вариантах осуществления целлюлазы включены как части или фрагменты зрелого белка дикого типа или варианта целлюлаз, в которых удалена N-концевая часть (см., например, патент США 5874276). В некоторых вариантах осуществления чистящие композиции по настоящему изобретению дополнительно включают целлюлазы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной целлюлазы по весу композиции, а также прочие компоненты, включающие вспомогательные чистящие материалы, по весу композиции. В других аспектах настоящего изобретения чистящие композиции по настоящему изобретению также включают целлюлазы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% целлюлазы по весу композиции.
Любая маннаназа, подходящая для применения в моющих композициях, также находит применение в настоящем изобретении. Подходящие маннаназы включают, помимо прочих, маннаназы бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. Известны различные маннаназы, которые находят применение в настоящем изобретении (см., например, патент США 6566114, патент США 6602842 и патент США 6440991, которые включены в настоящую заявку путем отсылки). В некоторых вариантах осуществления чистящие композиции по настоящему изобретению дополнительно включают маннаназы на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной маннаназы по весу композиции, а также прочие компоненты, включающие вспомогательные чистящие материалы, по весу композиции. В других аспектах настоящего изобретения чистящие композиции по настоящему изобретению также включают маннаназы на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% маннаназы по весу композиции.
В некоторых вариантах осуществления в композициях по настоящему изобретению пероксидазы применяются в комбинации с перекисью водорода или ее источником (например, перкарбонатом, перборатом или персульфатом). В некоторых альтернативных вариантах осуществления оксидазы применяются в комбинации с кислородом. Оба типа ферментов применяются для "обесцвечивания раствора" (то есть для предотвращения переноса красителя для ткани с окрашенной ткани на другую ткань при совместной стирке тканей в моечной жидкости), предпочтительно вместе с усиливающим агентом (см., например, WO 94/12621 и WO 95/01426). Подходящие пероксидазы/оксидазы включают, помимо прочих, пероксидазы/оксидазы растительного, бактериального или грибкового происхождения. В некоторые варианты осуществления включены химически или генетически модифицированные мутанты. В некоторых вариантах осуществления чистящие композиции по настоящему изобретению дополнительно включают ферменты пероксидазу и/или оксидазу на уровне от приблизительно 0,00001% до приблизительно 10% дополнительной пероксидазы и/или оксидазы по весу композиции, а также прочие компоненты, включающие вспомогательные чистящие материалы, по весу композиции. В других аспектах настоящего изобретения чистящие композиции по настоящему изобретению также включают ферменты пероксидазу и/или оксидазу на уровне от приблизительно 0,0001% до приблизительно 10%, от приблизительно 0,001% до приблизительно 5%, от приблизительно 0,001% до приблизительно 2%, от приблизительно 0,005% до приблизительно 0,5% ферментов пероксидазы и/или оксидазы по весу композиции.
В некоторых вариантах осуществления применение находят дополнительные ферменты, включая, помимо прочих, пергидролазы (см., например, WO 05/056782). Кроме того, в некоторых наиболее предпочтительных вариантах осуществления включены смеси вышеуказанных ферментов, в частности, одна или более дополнительных протеаз, амилаз, липаз, маннаназ и/или, по меньшей мере, одна целлюлаза. Фактически, предполагается, что различные смеси указанных ферментов найдут применение в настоящем изобретении. Также предполагается, что переменные уровни варианта протеазы (протеаз) и один или более дополнительных ферментов вместе могут независимо варьировать в пределах до приблизительно 10%, при этом остальные компоненты чистящей композиции являются вспомогательными чистящими материалами. Определенный выбор вспомогательных чистящих материалов может быть легко сделан с учетом очищаемой поверхности, изделия или ткани, а также требуемой формы композиции для условий очистки в процессе применения (например, при использовании моющего средства).
Примеры подходящих вспомогательных чистящих материалов включают, помимо прочего, поверхностно-активные вещества, моющие компоненты, отбеливатели, активаторы отбеливания, катализаторы отбеливания, другие ферменты, фермент-стабилизирующие системы, хелатирующие агенты, оптические отбеливатели, грязеудаляющие полимеры, агенты переноса красителей, диспергирующие агенты, пеногасители, красители, отдушки, красящие вещества, соли-наполнители, гидротропы, фотоактиваторы, флуорофоры, кондиционеры для тканей, гидролизуемые поверхностно-активные вещества, консерванты, антиоксиданты, противоусадочные добавки, противоскладочные добавки, гермициды, фунгициды, цветные гранулы, соединения серебра, добавки против потускнения и/или антикоррозионные добавки, источники щелочной среды, солюбилизирующие агенты, носители, технологические добавки, пигменты и регуляторы pH (см., например, патенты США 6610642, 6605458, 5705464, 5710115, 5698504, 5695679, 5686014 и 5646101, включенные в настоящую заявку путем отсылки). Варианты осуществления материалов конкретных чистящих композиций подробно проиллюстрированы ниже. В тех вариантах осуществления, в которых вспомогательные чистящие материалы не совместимы с вариантами протеаз по настоящему изобретению в чистящих композициях, используются подходящие способы раздельного хранения вспомогательных чистящих материалов и варианта протеазы (протеаз) (то есть без контакта друг с другом), пока не потребуется комбинация двух указанных компонентов. Такие способы разделения включают любой подходящий способ, известный в уровне техники (например, желатиновые капсулы, инкапсулирование, таблетки, физическое разделение и т.д.).
В качестве примера, несколько чистящих композиций, в которых находят применение варианты протеаз по настоящему изобретению, более подробно описаны ниже. В вариантах осуществления, в которых чистящие композиции по настоящему изобретению составлены в виде композиций, подходящих для применения в способе (способах) машинной стирки, композиции по настоящему изобретению предпочтительно содержат, по меньшей мере, одно поверхностно-активное вещество и, по меньшей мере, один основной компонент, а также один или более вспомогательных чистящих материалов, предпочтительно выбранных из органических полимерных соединений, отбеливающих агентов, дополнительных ферментов, пеногасителей, диспергирующих агентов, кальциевых диспергирующих агентов, грязесуспендирующих агентов и ингибиторов повторного оседания грязи, а также ингибиторов коррозии. В некоторых вариантах осуществления композиции для стирки также содержат смягчители (то есть в качестве дополнительных вспомогательных чистящих материалов). Композиции по настоящему изобретению также находят применение в качестве вспомогательных моющих средств в твердой или жидкой форме. Подобные вспомогательные средства предназначены для дополнения и/или усиления эффективности стандартных моющих композиций и могут быть добавлены на любой стадии процесса чистки. В некоторых вариантах осуществления плотность моющих композиций для стирки в настоящей заявке варьирует в пределах от приблизительно 400 до приблизительно 1200 г/литр, тогда как в других вариантах осуществления их плотность варьирует в пределах от приблизительно 500 до приблизительно 950 г/литр композиции, согласно измерению при 20°C.
В некоторых вариантах осуществления различные чистящие композиции, такие как представленные в патенте США 6605458, находят применение с вариантами протеаз по настоящему изобретению. Таким образом, в некоторых вариантах осуществления композиции, включающие, по меньшей мере, один вариант протеазы по настоящему изобретению, представляют собой компактную гранулированную чистящую композицию для тканей, тогда как в других вариантах осуществления композиция является гранулированной чистящей композицией для тканей, которая применяется при стирке цветных тканей, в других вариантах осуществления композиция является гранулированной чистящей композицией для тканей, которая обеспечивает умягчение в моечном объеме, в дополнительных вариантах осуществления композиция является высокоэффективной жидкой чистящей композицией для тканей. В некоторых вариантах осуществления композиции, включающие, по меньшей мере, один вариант протеазы по настоящему изобретению, являются чистящими композициями для тканей, такими как описанные в патентах США 6610642 и 6376450. Кроме того, варианты протеаз по настоящему изобретению находят применение в гранулированных моющих композициях для стирки, предназначенных для специализированного применения в условиях стирки в Европе или Японии (см., например, патент США 6610642).
Чистящие композиции по настоящему изобретению составлены в любой подходящей форме и приготовлены любым способом, выбранным разработчиком рецептуры, неограничивающие примеры которых описаны в патентах США 5879584, 5691297, 5574005, 5569645, 5565422, 5516448, 5489392 и 5486303, которые включены в настоящую заявку путем отсылки. В случае если требуется чистящая композиция с низким pH, то pH такой композиции регулируют путем добавления такого материала, как моноэтаноламин, или кислотного материала, например HCl.
Хотя неограничивающий список добавок, приведенный ниже, не является существенным в рамках настоящего изобретения, он подходит для применения в настоящих чистящих композициях. В некоторые варианты осуществления указанные добавки включены, например, с целью содействия или усиления эффективности чистки, для обработки очищаемого субстрата или изменения эстетических свойств чистящей композиции, как, например, в некотором случае отдушками, красящими веществами, красителями и т.п. Следует понимать, что такие добавки предназначены для добавления к вариантам протеаз по настоящему изобретению. Определенные свойства данных дополнительных компонентов, а также уровни их включения зависят от физической формы композиции и характера чистящей операции, в которой их предполагается использовать. Подходящие дополнительные материалы включают, помимо прочего, поверхностно-активные вещества, основные компоненты, хелатирующие агенты, ингибиторы переноса красителя, способствующие нанесению добавки, диспергирующие агенты, дополнительные ферменты и стабилизаторы ферментов, каталитические материалы, активаторы отбеливания, усилители отбеливания, пероксид водорода, источники пероксида водорода, предварительно полученные надкислоты, полимерные диспергирующие агенты, грязеудаляющие агенты/ингибиторы повторного оседания грязи, оптические отбеливатели, пеногасители, красители, отдушки, эластификаторы структуры, мягчители тканей, носители, гидротропы, технологические добавки и/или пигменты. В дополнение к описанию, приведенному ниже, подходящие примеры подобных других добавок и уровни их использования описаны в патентах США 5576282, 6306812 и 6326348, которые включены путем отсылки. Вышеуказанные вспомогательные компоненты могут составлять остальную часть чистящих композиций по настоящему изобретению.
В некоторых вариантах осуществления чистящие композиции согласно настоящему изобретению включают поверхностно-активное вещество или систему поверхностно-активных веществ, где поверхностно-активное вещество выбрано из неионных поверхностно-активных веществ, анионных поверхностно-активных веществ, катионных поверхностно-активных веществ, амфолитных поверхностно-активных веществ, цвиттерионных поверхностно-активных веществ, полуполярных неионных поверхностно-активных веществ и их смесей.
В некоторых дополнительных вариантах осуществления чистящие композиции по настоящему изобретению включают один или более основных компонентов моющего средства или системы основных компонентов. Основные компоненты включают, помимо прочего, щелочной металл, аммоний и алканоламмонийные соли полифосфатов, силикаты щелочных металлов, карбонаты щелочноземельных и щелочных металлов, алюмосиликатные поликарбоксилатные соединения, эфир гидроксиполикарбоксилаты, сополимеры малеинового ангидрида с этиленом или винилметиловым эфиром, 1,3,5-тригидроксибензол-2,4,6-трисульфоновую кислоту и карбоксиметилоксиянтарную кислоту, различные соли щелочных металлов, аммония и замещенного аммония, полиуксусные кислоты, такие как этилендиаминтетрауксусная кислота и нитрилотриуксусная кислота, а также поликарбоксилаты, такие как меллитовая кислота, янтарная кислота, лимонная кислота, оксидиянтарная кислота, полималеиновая кислота, бензол-1,3,5-трикарбоновая кислота, карбоксиметилоксиянтарная кислота и их растворимые соли.
В некоторых других вариантах осуществления настоящие чистящие композиции содержат хелатирующий агент. Подходящие хелатирующие агенты включают медь-, железо- и/или марганец-связывающие агенты и их смеси.
В некоторых других вариантах осуществления чистящие композиции, представленные в настоящей заявке, содержат добавки, способствующие нанесению. Подходящие добавки, способствующие нанесению, включают полиэтиленгликоль, полипропиленгликоль, поликарбоксилат, грязеудаляющие полимеры, такие как политерефталевая кислота, глины, такие как каолинит, монтмориллонит, аттапульгит, иллит, бентонит, галлуазит и их смеси.
В некоторых дополнительных вариантах осуществления чистящие композиции по настоящему изобретению также включают один или более ингибиторов переноса красителей. Подходящие полимерные ингибиторы переноса красителей включают, помимо прочего, поливинилпирролидоновые полимеры, полиамин-N-оксидные полимеры, сополимеры N-винилпирролидона и N-винилимидазола, поливинилоксазолидоны и поливинилимидазолы или их смеси.
В некоторых дополнительных вариантах осуществления чистящие композиции по настоящему изобретению также содержат диспергирующие агенты. Подходящие водорастворимые органические материалы включают гомо- или сополимерные кислоты или их соли, в которых поликарбоновая кислота включает, по меньшей мере, два карбоксильных радикала, отделенных друг от друга не более чем двумя атомами углерода.
В некоторых наиболее предпочтительных вариантах осуществления чистящие композиции включают один или более моющих ферментов, которые обеспечивают эффективность очистки и/или ухода за тканью. Примеры подходящих ферментов включают, помимо прочих, гемицеллюлазы, пероксидазы, протеазы, целлюлазы, ксиланазы, липазы, фосфолипазы, эстеразы, кутиназы, пектиназы, кератиназы, редуктазы, оксидазы, фенолоксидазы, липоксигеназы, лигниназы, пуллуланазы, танназы, пентозаназы, маланазы, β-глюканазы, арабинозидазы, гиалуронидазу, хондроитиназу, лакказу и амилазы или их смеси. Типичная комбинация представляет собой коктейль из стандартно используемых ферментов, включающий, по меньшей мере, одну протеазу, по меньшей мере, одну липазу, по меньшей мере, одну кутиназу и/или, по меньшей мере, одну целлюлазу вместе с, по меньшей мере, одной амилазой.
В некоторых других вариантах осуществления ферменты, применяемые в чистящих композициях, стабилизированы любым подходящим методом. В некоторых вариантах осуществления ферменты, применяемые в настоящей заявке, стабилизированы присутствием в готовых композициях водорастворимых источников ионов кальция и/или магния, которые обеспечивают доступность таких ионов ферментам.
В некоторых других вариантах осуществления чистящие композиции по настоящему изобретению включают каталитические комплексы металлов. Одним из типов металлосодержащего катализатора отбеливания является система катализаторов, включающая катион переходного металла с определенной каталитической активностью отбеливания, такой как катионы меди, железа, титана, рутения, вольфрама, молибдена или марганца, вспомогательный катион металла, обладающий небольшой или не обладающий каталитической активностью отбеливания, такой как катионы цинка или алюминия, и секвестрант, обладающий определенными константами устойчивости с каталитическими и вспомогательными катионами металлов, в частности, этилендиаминтетрауксусную кислоту, этилендиаминтетра(метиленфосфоновую кислоту) и их водорастворимые соли. Такие катализаторы раскрыты в патенте США 4430243.
В некоторых вариантах осуществления настоящие композиции могут быть катализированы с помощью соединения марганца. Такие соединения и уровни их использования хорошо известны в уровне техники и включают, например, катализаторы на основе марганца, раскрытые в патенте США 5576282. Кроме того, кобальтовые катализаторы отбеливания, которые могут применяться в настоящем изобретении, известны и описаны, например, в патентах США 5597936 и 5595967. Такие кобальтовые катализаторы можно легко получить известными методами, например, как описано в патентах США 5597936 и 5595967. В некоторых вариантах осуществления композиции, представленные в настоящей заявке, также предпочтительно могут включать комплекс переходного металла с жестким макрополициклическим лигандом (то есть "MRL"). На практике, и не в качестве ограничения, настоящие композиции и способы чистки могут регулироваться с целью обеспечения порядка, по меньшей мере, одной части на сто миллионов активных частиц MRL в водной моющей среде, и предпочтительно содержат от приблизительно 0,005 м.д. до приблизительно 25 м.д., более предпочтительно от приблизительно 0,05 м.д. до приблизительно 10 м.д. и наиболее предпочтительно от приблизительно 0,1 м.д. до приблизительно 5 м.д. MRL в моечном растворе. Предпочтительные переходные металлы в настоящем катализаторе отбеливания на основе переходного металла включают марганец, железо и хром. Предпочтительные MRL в настоящей заявке представляют собой специальный тип ультражесткого лиганда с поперечными мостиками, такого как 5,12-диэтил-1,5,8,12-тетраазабицикло[6.6.2]гексадекан. Подходящие MRL на основе переходных металлов можно легко получить с помощью известных методов, таких как описанные, например, в WO 00/32601 и US 6225464.
Как указано выше, чистящие композиции по настоящему изобретению составлены в любой подходящей форме и приготовлены любым способом, выбранным разработчиком рецептуры, неограничивающие примеры которых описаны в патентах США 5879584, 5691297, 5574005, 5569645, 5516448, 5489392 и 5486303, которые включены в настоящую заявку путем отсылки.
Чистящие композиции, раскрытые в настоящей заявке, находят применение в чистке некоторого участка (например, поверхности, посуды или ткани). Как правило, по меньшей мере, часть участка подвергают контакту с вариантом осуществления настоящей чистящей композиции в чистом виде или разведенной в моечном растворе, а затем участок необязательно промывают и/или ополаскивают. В рамках настоящего изобретения "стирка" включает, помимо прочего, чистку и механическое перемешивание. В некоторых вариантах осуществления чистящие композиции обычно применяются в концентрациях приблизительно от 500 м.д. до приблизительно 15000 м.д. в растворе. В случае, когда моечным растворителем является вода, температура воды обычно составляет от приблизительно 5°C до приблизительно 90°C, а когда участок включает ткань, массовое соотношение воды к ткани обычно составляет от приблизительно 1:1 до приблизительно 30:1.
Определения
Если не указано иное, практическое осуществление настоящего изобретения включает стандартные способы, обычно применяемые в молекулярной биологии, инженерии белка, микробиологии и генной инженерии, которые известны из уровня техники. Такие способы известны специалистам в данной области и описаны в многочисленных текстах и справочниках (см., например, Sambrook et al., "Molecular Cloning: A Laboratory Manual", Second Edition (Cold Spring Harbor), [1989]), а также Ausubel et al., "Current Protocols in Molecular Biology" [1987]). Все патенты, заявки на патенты, статьи и публикации, упомянутые в настоящей заявке, как выше, так и ниже, настоящим прямо включены путем отсылки.
Если не указано иное, все технические и научные термины, используемые в настоящей заявке, имеют стандартное значение, в каком они обычно понимаются средним специалистом в данной области техники, к которой относится настоящее изобретение. Существуют различные словари, доступные и известные специалистам в данной области, в которых приведены определения данных терминов. Хотя любые способы и материалы, подобные или эквивалентные описанным в настоящей заявке, находят применение в практическом осуществлении настоящего изобретения, в настоящей заявке описаны предпочтительные способы и материалы. Таким образом, термины, непосредственно определенные ниже, более полно описаны в отношении всего описания в целом. Кроме того, используемые в оригинальном тексте настоящей заявки термины в форме единственного числа включают также ссылку на множественное число, если из контекста явно не следует иное. Числовые диапазоны включают в себя числа, определяющие диапазон. Если не указано иное, нуклеиновые кислоты представлены слева направо, в ориентации от 5' к 3'; аминокислотные последовательности представлены слева направо, в ориентации от N- к C-концу соответственно. Следует понимать, что настоящее изобретение не ограничивается конкретными описанными принципами, методиками и реактивами, поскольку они могут изменяться в зависимости от ситуации, к которой они применяются специалистами в данной области техники.
В практическом осуществлении настоящего изобретения применяются, если не указано иное, стандартные методы очистки белков, молекулярной биологии, микробиологии, генной инженерии и секвенирования белка, которые находятся в рамках компетенции специалистов в данной области.
Кроме того, заголовки, приведенные в настоящей заявке, не являются ограничением различных аспектов или вариантов осуществления изобретения, которые могут относиться к описанию в целом. Таким образом, термины, непосредственно определенные ниже, более полно определяются в отношении описания в целом. Тем не менее, для облегчения понимания изобретения некоторые термины определены ниже.
Используемые в настоящем описании термины "протеаза" и "протеолитическая активность" относятся к белку или пептиду, проявляющим способность гидролизировать пептиды или субстраты, содержащие пептидные связи. Существует много общеизвестных методик измерения протеолитической активности (Kalisz, "Microbial Proteinases", In: Fiechter (ed.), Advances in Biochemical Engineering/Biotechnology. [1988]). Например, протеолитическая активность может быть выявлена с помощью сравнительного теста, в котором анализируют соответствующую способность протеазы гидролизировать коммерческий субстрат. Примеры субстратов, применяемых в анализе протеаз или протеолитической активности, включают, помимо прочих, диметилказеин (Sigma C-9801), бычий коллаген (Sigma C-9879), бычий эластин (Sigma E-1625) и бычий кератин (ICN Biomedical 902111). Колориметрический анализ, в котором используются указанные субстраты, известен в уровне техники (см., например, WO 99/34011 и патент США 6376450, включенные в настоящую заявку путем отсылки). Тест pNA (см., например, Del Mar et al., Anal. Biochem., 99:316-320 [1979]) также находит применение при определении концентрации активного фермента во фракциях, собранных в процессе градиентного элюирования. Данный тест позволяет измерить скорость образования п-нитроанилина при гидролизе под действием фермента растворимого синтетического субстрата, сукцинил-аланин-аланин-пролин-фенилаланин-п-нитроанилида (sAAPF-pNA). Скорость развития желтого цвета в реакции гидролиза измеряется при 410 нм на спектрофотометре и пропорциональна концентрации активного фермента. Кроме того, измерения поглощения при 280 нм могут использоваться для определения концентрации суммарного белка. Соотношение активного фермента/суммарного белка дает чистоту фермента.
Используемый в настоящем описании "род Bacillus" включает все виды в пределах рода "Bacillus", известные специлистам в данной области, включая, помимо прочих, B. subtilis, B. licheniformis, B. lentus, B. brevis, B. stearothermophilus, B. alkalophilus, B. amyloliquefaciens, B. clausii, B. halodurans, B. megaterium, B. coagulans, B. circulans, B. lautus и B. thuringiensis. Известно, что род Bacillus продолжает подвергаться таксономической перестройке. Таким образом, предполагается, что род включает виды, которые были переклассифицированы, включая, помимо прочих, такие организмы, как B. stearothermophilus, который теперь называют "Geobacillus stearothermophilus". Продукция устойчивых эндоспор в присутствии кислорода считается определяющим признаком рода Bacillus, хотя указанный признак также относится к недавно названным Alicyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thermobacillus, Ureibacillus и Virgibacillus.
Термины "полинуклеотид" и "нуклеиновая кислота", попеременно используемые в настоящей заявке, относятся к полимерной форме нуклеотидов любой длины, либо рибонуклеотидов, либо дезоксирибонуклеотидов. Данные термины включают, помимо прочего, одно-, дву- или тринитевую ДНК, геномную ДНК, кДНК, РНК, ДНК-РНК гибрид или полимер, включающий пуриновые и пиримидиновые основания, или другие природные, химически, биохимически модифицированные, неприродные или дериватизированные нуклеотидные основания. Неограничивающие примеры полинуклеотидов включают: гены, фрагменты генов, фрагменты хромосом, EST, экзоны, интроны, мРНК, тРНК, рРНК, рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенная ДНК любой последовательности, выделенная РНК любой последовательности, нуклеиновые зонды и праймеры. В некоторых вариантах осуществления полинуклеотиды включают модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов, урацил, другие сахара и связывающие группы, такие как фторрибоза и тиоат, а также нуклеотидные боковые цепи. В альтернативных вариантах осуществления нуклеотидная последовательность прервана ненуклеотидными компонентами.
Используемые в настоящем описании термины "ДНК конструкция" и "трансформирующая ДНК" используются попеременно и относятся к ДНК, используемой для введения последовательности в реципиентную клетку или организм. ДНК может быть получена in vitro с помощью ПЦР или любого другого подходящего метода(ов), известного специалистам в данной области. В наиболее предпочтительных вариантах осуществления ДНК конструкция включает целевую последовательность (например, в качестве экзогенной последовательности). В некоторых вариантах осуществления последовательность функционально связана с дополнительными элементами, такими как регуляторные элементы (например, промоторы и т.д.). ДНК конструкция может дополнительно включать селективный маркер. Она также может включать экзогенную последовательность, которая фланкирована гомологичными фрагментами. В другом варианте осуществления трансформирующая ДНК включает другие негомологичные последовательности, добавленные на концы (например, штатные или фланкирующие последовательности). В некоторых вариантах осуществления концы экзогенной последовательности соединены так, что трансформирующая ДНК формирует замкнутый круг. Трансформирующие последовательности могут быть последовательностями дикого типа, мутантными или модифицированными последовательностями. В некоторых вариантах осуществления ДНК конструкция включает последовательности, гомологичные хромосоме клетки-хозяина. В других вариантах осуществления ДНК конструкция включает негомологичные последовательности. После тогокак ДНК конструкция собрана in vitro, она может использоваться для: 1) вставки гетерологичных последовательностей в требуемую целевую последовательность клетки-хозяина и/или 2) мутирования области хромосомы клетки-хозяина (т.е. замены эндогенной последовательности гетерологичной последовательностью), 3) удаления целевых генов и/или 4) введения реплицирующейся плазмиды в хозяйскую клетку.
Используемые в настоящем описании термины "кассета экспрессии" и "вектор экспрессии" относятся к конструкциям нуклеиновой кислоты, полученным рекомбинантно или синтетически, с набором определенных элементов нуклеиновой кислоты, которые обеспечивают транскрипцию специфической нуклеиновой кислоты в целевой клетке. Рекомбинантная кассета экспрессии может быть включена в плазмиду, хромосому, митохондриальную ДНК, пластидную ДНК, вирус или фрагмент нуклеиновой кислоты. Как правило, рекомбинантная часть кассеты экспрессии вектора экспрессии включает, среди прочих последовательностей, транскрибируемую последовательность нуклеиновой кислоты и промотор. В предпочтительных вариантах осуществления векторы экспрессии обладают способностью включить и экспрессировать гетерологичные фрагменты ДНК в клетке-хозяине. Многие прокариотические и эукариотические векторы экспрессии коммерчески доступны. Выбор подходящих векторов экспрессии находится в рамках знаний специалистов в данной области. Термин "кассета экспрессии" в настоящей заявке используется попеременно с " ДНК конструкцией", а также их грамматическими эквивалентами. Выбор подходящих векторов экспрессии находится в рамках знаний специалистов в данной области.
Используемый в настоящем описании термин "вектор" относится к полинуклеотидной конструкции, созданной для введения нуклеиновых кислот в клетку одного или нескольких типов. Векторы включают клонирующие векторы, векторы экспрессии, бинарные векторы, плазмиды, кассеты и т.п. В некоторых вариантах осуществления полинуклеотидная конструкция включает последовательность ДНК, кодирующую протеазу (например, предшественник или зрелую протеазу), которая функционально связана с подходящей пропоследовательностью (например, секреторной и т.д.), способной к осуществлению экспрессии ДНК в подходящей хозяйской клетке.
Используемый в настоящем описании термин "плазмида" относится к кольцевой, двунитевой (ds) ДНК конструкции, используемой в качестве клонирующего вектора, которая формирует внехромосомный самореплицирующийся генетический элемент в некоторых эукариотах или прокариотах или интегрируется в хозяйскую хромосому.
Используемый в настоящем описании, в контексте введения последовательности нуклеиновой кислоты в клетку, термин "введенный" относится к любому способу, подходящему для переноса последовательности нуклеиновой кислоты в клетку. Подобные способы введения включают, помимо прочих, слияние протопластов, трансфекцию, трансформацию, конъюгирование и трансдукцию (см., например, Ferrari et al., "Genetics", в Hardwood et al., (eds.), Bacillus. Plenum Publishing Corp., стр. 57-72, [1989]).
Используемые в настоящем описании термины "трансформированный" и "стабильно трансформированный" относятся к клетке, в которую введена чужеродная (гетерологичная) полинуклеотидная последовательность, интегрированная в ее геном или являющаяся эписомной плазмидой, которая сохраняется, по меньшей мере, у двух поколений.
Нуклеиновая кислота "функционально связана", когда она находится в функциональной связи с другой последовательностью нуклеиновой кислоты. Например, ДНК, кодирующая секреторную лидерную последовательность (то есть сигнальный пептид), является функционально связанной с ДНК полипептида, если она экспрессируется в виде белка-предшественника, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или сайт связывания рибосомы функционально связан с кодирующей последовательностью, если он расположен так, что способствует трансляции. В большинстве случаев "функционально связанный" означает, что связываемые последовательности ДНК являются смежными и, в случае секреторной лидерной последовательности, являются смежными и находятся в одной рамке считывания. Впрочем, энхансеры не обязательно должны быть смежными. Соединение выполняют с помощью лигирования в подходящих сайтах рестрикции. Если такие сайты не присутствуют, в соответствии с общепринятой практикой используются синтетические олигонуклеотидные адаптеры или линкеры.
Используемый в настоящей заявке термин "ген" относится к полинуклеотиду (например, сегменту ДНК), который кодирует полипептид и включает области, расположенные до и после кодирующих областей, а также промежуточные последовательности (интроны) между отдельными кодирующими сегментами (экзоны).
Используемые в настоящей заявке "гомологичные гены" относятся к паре генов из различных, но обычно родственных видов, которые соответствуют друг другу и которые являются идентичными или очень схожи друг с другом. Термин охватывает гены, которые выделены в результате видообразования (то есть развития новых видов) (например, ортологичные гены), а также гены, которые были выделены при дупликации гена (например, паралогичные гены).
Используемые в настоящей заявке "ортолог" и "ортологичные гены" относятся к генам в различных видах, которые произошли от общего анцестрального гена (то есть гомологичного гена) в результате видообразования. Как правило, ортологи сохраняют ту же функцию в процессе развития. Идентификация ортологов находит применение в надежном предсказании функции гена в недавно секвенированных геномах.
Используемые в настоящей заявке "паралог" и "паралогичные гены" относятся к генам, которые связаны дупликацией в пределах генома. Хотя ортологи сохраняют ту же функцию в цикле развития, паралоги приобретают новые функции, даже при том, что некоторые функции часто схожи с исходными. Примеры паралогичных генов включают, помимо прочих, гены, кодирующие трипсин, химотрипсин, эластазу и тромбин, которые являются сериновыми протеиназами и встречаются вместе в пределах одних и тех же видов.
Используемые в настоящей заявке белки определяются как имеющие обычную "укладку", если они имеют такие же основные вторичные структуры, в той же конфигурации и с теми же топологическими связями. Различные белки с одинаковой укладкой часто содержат периферические элементы вторичной структуры и скрученные области, которые отличаются по размеру и конформации. В некоторых случаях указанные отличающиеся периферические области могут составлять половину структуры. Белки, помещенные вместе в ту же категорию укладки, не обязательно имеют общее эволюционное происхождение (например, структурные подобия, являющиеся результатом физических и химических свойств белков, способствующие определенным конфигурациям укладки и топологиям цепи).
Используемая в настоящей заявке "гомология" относится к подобию или идентичности последовательности, при этом предпочтительной является идентичность. Указанную гомологию определяют, используя стандартные методы, известные из уровня техники (см., например, Smith and Waterman, Adv. Appl. Math., 2:482 [1981]; Needleman and Wunsch, J. Mol. Biol., 48:443 [1970]; Pearson and Lipman, Proc. Natl. Acad. Sci. USA 85:2444 [1988]; программы, такие как GAP, BESTFIT, FASTA и TFASTA в пакете Wisconsin Genetics Software Package (Genetics Computer Group, Madison, WI); и Devereux et al., Nucl. Acid Res., 12:387-395 [1984]).
Используемая в настоящей заявке "аналогичная последовательность" является последовательностью, у которой функция гена по существу такая же, как и у гена, основанного на субтилизиновой протеазе дикого типа. Дополнительно аналогичные гены включают, по меньшей мере, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95%, приблизительно 97%, приблизительно 98%, приблизительно 99% или приблизительно 100% идентичность последовательности с последовательностью дикого типа субтилизиновой протеазы. С другой стороны, аналогичные последовательности имеют выравнивание от приблизительно 70 до приблизительно 100% генов, присутствующих в области субтилизиновой протеазы B. amyloliquefaciens. В дополнительных вариантах осуществления более чем одно из вышеуказанных свойств относится к последовательности. Аналогичные последовательности определяются с помощью известных способов выравнивания последовательности. Обычно используемым способом выравнивания является BLAST, хотя, как указано выше и ниже, существуют другие методы, которые также находят применение в выравнивании последовательностей.
Одним из примеров применяемого алгоритма является PILEUP. PILEUP создает множественное выравнивание последовательностей из группы родственных последовательностей, используя прогрессивные, попарные выравнивания. Он также может составить схему, отображающую кластерные отношения, используемые для создания выравнивания. PILEUP использует упрощение метода прогрессивного выравнивания Фенга и Дулитла (Feng and Doolittle, J. Mol. Evol., 35:351-360 [1987]). Способ подобен описанному Хиггинсом и Шарпом (Higgins and Sharp, CABIOS 5:151-153 [1989]). Применяемые параметры PILEUP включают штраф за делецию по умолчанию 3,00, штраф за продолжение делеции по умолчанию 0,10, а также взвешенные концевые делеции.
Другим примером применимого алгоритма является алгоритм BLAST, описанный Альтшуль и сотр., (Altschul et al., J. Mol. Biol., 215:403-410, [1990]; и Karlin et al., Proc. Natl. Acad. Sci. USA 90:5873-5787 [1993]). Наиболее применимой программой BLAST является программа WU-BLAST-2 (см., Altschul et al., Meth. Enzymol., 266:460-480 [1996]). WU-BLAST-2 использует несколько параметров поиска, большинство из которых устанавливаются значениями по умолчанию. Регулируемые параметры устанавливаются со следующими значениями: overlap span=1, overlap fraction=0,125, word threshold (T)=11. Параметры HSP S и HSP S2 являются динамическими значениями и устанавливаются самой программой в зависимости от состава конкретной последовательности и состава специфической базы данных, по которой производится поиск целевой последовательности. Впрочем, значения могут быть установлены так, чтобы увеличить чувствительность. Значение % идентичности аминокислотной последовательности определяется числом совпадений идентичных остатков, деленным на общее количество остатков "более длинной" последовательности в выровненной области. "Более длинной" последовательностью является последовательность, имеющая наиболее достоверные остатки в выровненной области (делеции, введенные WU-BLAST-2, чтобы максимизировать оценку выравнивания, игнорируются).
Таким образом, "процент (%) идентичности последовательности нуклеиновой кислоты" определяется как процент нуклеотидных остатков в кандидатной последовательности, которые идентичны нуклеотидным остаткам исходной последовательности (то есть целевой последовательности). В предпочтительном способе используется модуль BLASTN алгоритма WU-BLASTA-2, с установленными параметрами по умолчанию, с установленными значениями промежутка перекрывания и доли перекрывания - 1 и 0,125, соответственно.
Используемый в настоящей заявке "рекомбинантный" включает ссылку на клетку или вектор, который был модифицирован введением гетерологичной последовательности нуклеиновой кислоты, или на то, что клетка получена из клетки, модифицированной таким способом. Таким образом, например, рекомбинантные клетки экспрессируют гены, которые не присутствуют в идентичной форме в нативной (нерекомбинантной) форме клетки, или экспрессируют нативные гены, которые иным образом нетипично экспрессируются, экспрессируются недостаточно или не экспрессируются вообще, в результате преднамеренного вмешательства человека. "Рекомбинация", "рекомбинирующий" и образование "рекомбинированной" нуклеиновой кислоты в большинстве случаев является сборкой двух или более фрагментов нуклеиновой кислоты, которая приводит к образованию химерного гена.
В некоторых предпочтительных вариантах осуществления мутантные последовательности ДНК получают с помощью сайт-насыщающего мутагенеза, по меньшей мере, по одному кодону. В другом предпочтительном варианте осуществления сайт-насыщающий мутагенез выполняют для двух или более кодонов. В другом варианте осуществления мутантные последовательности ДНК обладают более чем приблизительно 50%, более чем приблизительно 55%, более чем приблизительно 60%, более чем приблизительно 65%, более чем приблизительно 70%, более чем приблизительно 75%, более чем приблизительно 80%, более чем приблизительно 85%, более чем приблизительно 90%, более чем приблизительно 95% или более чем приблизительно 98% гомологии с последовательностью дикого типа. В альтернативных вариантах осуществления мутантная ДНК образуется in vivo в результате любого известного мутагенного процесса, например, при воздействии радиации, нитрозогуанидина и т.п. Затем нужную последовательность ДНК выделяют и используют в способах, представленных в настоящей заявке.
Используемые в настоящем описании термины "амплификация" и "амплификация гена" относятся к процессу, при котором специфические последовательности ДНК непропорционально реплицируются, в результате чего амплифицированный ген присутствует в более высоком количестве копий, чем первоначально присутствовало в геноме. В некоторых вариантах осуществления отбор клеток по росту в присутствии лекарственного средства (например, ингибитора ингибируемого фермента) приводит к амплификации либо эндогенного гена, кодирующего продукт гена, требуемый для роста в присутствии лекарственного средства, либо к амплификации экзогенных (то есть введенных) последовательностей, кодирующих продукт данного гена, или обоих.
"Амплификация" является специальным случаем репликации нуклеиновой кислоты, включающей специфичность к матрице. Ее следует отличать от неспецифичной репликации матрицы (то есть репликации, которая зависит от матрицы, но не зависит от специфичной матрицы). Специфичность к матрице в данном случае отличается от точности репликации (то есть точного синтеза надлежащей полинуклеотидной последовательности) и нуклеотидной (рибо- или дезоксирибо-) специфичности. Специфичность к матрице часто описывается через специфичность к "мишени". Целевые последовательности являются "мишенями" в том смысле, что они подвергаются сортировке из других нуклеиновых кислот. Способы амплификации были разработаны, прежде всего, в целях указанного сортинга.
Используемый в настоящем описании термин "праймер" относится к олигонуклеотиду, существующему в природе в очищенной смеси рестриктов, либо полученному искусственно, который способен функционировать в качестве точки инициации синтеза, когда он находится в условиях, в которых индуцируется синтез продукта элонгации праймера, который комплементарен цепи нуклеиновой кислоты (то есть в присутствии нуклеотидов и индуцирующего агента, такого как ДНК-полимераза, и при подходящих температуре и pH). Праймер предпочтительно является однонитевым для максимальной эффективности амплификации, однако в альтернативе он может быть двунитевым. В том случае, если праймер является двунитевым, его сначала обрабатывают, чтобы разделить его цепи перед применением в получении продуктов элонгации. Предпочтительно праймер является олигодезоксирибонуклеотидом. Праймер должен иметь достаточную длину, чтобы обеспечивать синтез продуктов элогации в присутствии индуцирующего агента. Точная длина праймеров обычно зависит от многих факторов, включая температуру, источник праймера, а также используемый метод.
Используемый в настоящем описании термин "зонд" относится к олигонуклеотиду (то есть последовательности нуклеотидов), либо существующему в природе в очищенной смеси рестриктов, либо полученному искусственно, рекомбинантно или с помощью ПЦР-амплификации, который способен к гибридизации с другим целевым олигонуклеотидом. Зонд может быть однонитевым или двунитевым. Зонды могут применяться при детектировании, идентификации и выделении последовательностей конкретных генов. Предполагается, что любой зонд, используемый в настоящем изобретении, помечен любой "репортерной молекулой", чтобы его можно было обнаружить в любой системе детектирования, включающей, помимо прочего, ферментную (например, ELISA, а также гистохимические тесты на основе ферментов), флуоресцентную, радиоактивную и люминесцентную системы. Предполагается, что настоящее изобретение не ограничивается какой-либо конкретной системой детектирования или меткой.
Используемый в настоящем описании термин "мишень", при использовании в отношении полимеразной цепной реакции, относится к области нуклеиновой кислоты, ограниченной праймерами, используемыми в полимеразной цепной реакции. Таким образом, "мишень" подвергается сортировке из других последовательностей нуклеиновых кислот. "Сегмент" определяется как область нуклеиновой кислоты в пределах целевой последовательности.
Используемый в настоящем описании термин "полимеразная цепная реакция" ("ПЦР") относится к способам патентов США 4683202, 4683195 и 4965188, включенных путем отсылки, которые включают способы увеличения концентрации сегмента целевой последовательности в смеси геномной ДНК, без клонирования или очистки. Данный процесс амплификации целевой последовательности состоит из введения большого избытка двух олигонуклеотидных праймеров в смесь ДНК, содержащую требуемую целевую последовательность с последующим точным проведением термического цикла в присутствии ДНК-полимеразы. Указанные два праймера комплементарны своим соответствующим цепям двунитевой целевой последовательности. Для проведения амплификации смесь подвергают денатурации, после чего праймеры отжигаются со своими комплементарными последовательностями в целевой молекуле. После отжига праймеры достраиваются полимеразой с образованием новой пары комплементарных цепей. Стадии денатурации, отжига праймеров и элонгации полимеразой могут быть повторены много раз (то есть денатурация, отжиг и элонгация составляют один "цикл", при этом может быть много "циклов"), с получением высокой концентрации амплифицированного сегмента нужной целевой последовательности. Длина амплифицированного сегмента нужной целевой последовательности определяется относительными положениями праймеров друг относительно друга, и поэтому указанная длина является регулируемым параметром. Вследствие цикличности процесса способ упоминается как "полимеразная цепная реакция" (в дальнейшем "ПЦР"). Поскольку требуемые амплифицируемые сегменты целевой последовательности становятся преобладающими (в значении концентрации) последовательностями в смеси, они являются так называемыми "ПЦР амплифицированными".
Используемый в настоящем описании термин "реактивы для амплификации" относится к таким реактивам (дезоксирибонуклеотидтрифосфаты, буфер и т.д.), которые необходимы для амплификации, за исключением праймеров, матрицы нуклеиновой кислоты и амплифицирующего фермента. Как правило, реактивы для амплификации, вместе с другими компонентами реакции, вносятся и содержатся в реакционной емкости (пробирка, микролунка и т.д.).
Используемый в настоящем описании термин "ПЦР-ОТ" относится к репликации и амплификации последовательностей РНК. В данном методе с ПЦР объединена обратная транскрипция, при этом чаще всего используется одноферментная методика, в которой применяется термостабильная полимераза, как описано в патенте США 5322770, который включен в настоящую заявку путем отсылки. В ПЦР-ОТ РНК-матрица превращается в кДНК благодаря обратной транскриптазной активности полимеразы, а затем амплифицируется с использованием полимеразной активности полимеразы (то есть, как в других методах ПЦР).
Используемые в настоящем описании термины "эндонуклеазы рестрикции" и "ферменты рестрикции" относятся к бактериальным ферментам, каждый из которых расщепляет двунитевую ДНК в специфической нуклеотидной последовательности или вблизи нее.
"Сайт рестрикции" относится к нуклеотидной последовательности, узнаваемой и расщепляемой данной эндонуклеазой рестрикции, и обычно представляет собой место для вставки ДНК фрагментов. В некоторых вариантах осуществления изобретения сайты рестрикции встроены в селективный маркер и в 5'- и 3'-концы ДНК конструкции.
"Гомологичная рекомбинация" означает обмен ДНК фрагментами между двумя молекулами ДНК или парными хромосомами на участке идентичных или практически идентичных нуклеотидных последовательностей. В предпочтительном варианте осуществления хромосомная интеграция является гомологичной рекомбинацией.
Используемая в настоящей заявке "аминокислота" относится к последовательностям пептида или белка или их частям. Термины "белок", "пептид" и "полипептид" используются попеременно.
Используемый в настоящей заявке "целевой белок" и "целевой полипептид" относятся к белку/полипептиду, который является требуемым и/или должен быть оценен. В некоторых вариантах осуществления целевой белок экспрессируется внутриклеточно, тогда как в других вариантах осуществления он является секретируемым полипептидом. В наиболее предпочтительных вариантах осуществления указанные ферменты включают сериновые протеазы по настоящему изобретению. В некоторых вариантах осуществления целевой белок представляет собой секретируемый полипептид, который слит с сигнальным пептидом (то есть с N-концевым удлиняющим фрагментом на секретируемом белке). Практически во всех секретируемых белках используется N-концевой удлиняющий фрагмент, который играет важную роль в направлении и перемещении белков-предшественников через мембрану. Указанный удлиняющий фрагмент протеолитически отщепляется сигнальной пептидазой в процессе или сразу после пересечения мембраны.
Полинуклеотид, как говорят, "кодирует" РНК или полипептид, если, в его нативном состоянии или при введении методами, известными специалистам в данной области, он может быть транскрибироваться и/или транслироваться с получением РНК, полипептида или их фрагментов. Антисмысловая цепь такой нуклеиновой кислоты, как также говорят, кодирует последовательности. Как известно из уровня техники, ДНК может транскрибироваться РНК-полимеразой с получением РНК, а РНК может подвергаться обратной транскрипции обратной транскриптазой с получением ДНК. Таким образом, ДНК может кодировать РНК, и наоборот.
"Штамм-хозяин" или "клетка-хозяин" относятся к подходящему реципиенту для вектора экспрессии, включающего ДНК согласно настоящему изобретению.
Фермент "сверхэкспрессируется" в клетке-хозяине, если фермент экспрессируется в клетке с более высоким уровнем, чем уровень, с которым он экспрессируется в соответствующей клетке дикого типа.
Термины "белок" и "полипептид" в настоящем описании используются попеременно. 3-буквенный код для аминокислот, определенный в соответствии с объединенной комиссией IUPAC-IUB по биохимической номенклатуре (JCBN), используется в настоящем описании. Также следует понимать, что полипептид может кодироваться более чем одной нуклеотидной последовательностью из-за вырожденности генетического кода.
"Пропоследовательность" представляет собой аминокислотную последовательность между сигнальной последовательностью и зрелой протеазой, которая необходима для секретирования протеазы. Расщепление пропоследовательности приводит к образованию зрелой активной протеазы.
Термин "сигнальная последовательность" или "сигнальный пептид" относится к любой последовательности нуклеотидов и/или аминокислот, которые могут участвовать в секретировании зрелых форм белка или белков предшественников. Данное определение сигнальной последовательности является функциональным, при этом оно включает все те аминокислотные последовательности, которые кодируются N-концевым фрагментом гена белка, который участвует в процессе секреции белка. Обычно, но не всегда, они связаны с N-концевой областью белка или N-концевой областью белка-предшественника. Сигнальная последовательность может быть эндогенной или экзогенной. Сигнальная последовательность может происходить из последовательности, которая обычно связана с белком (например, протеазой), или может происходить из гена, кодирующего другой секретируемый белок. Один из примеров экзогенной сигнальной последовательности включает первые семь аминокислотных остатков сигнальной последовательности из субтилизина Bacillus subtilis, слитых с остальной частью из сигнальной последовательности субтилизина Bacillus lentus (ATCC 21536).
Термин "гибридная сигнальная последовательность" относится к сигнальным последовательностям, в которых часть последовательности получена из экспрессирующего организма-хозяина и слита с сигнальной последовательностью экспрессируемого гена. В некоторых вариантах осуществления используются синтетические последовательности.
Термин "зрелая" форма белка или пептида относится к конечной функциональной форме белка или пептида. Например, зрелая форма BPN' субтилизиновой протеазы по настоящему изобретению включает, по меньшей мере, аминокислотную последовательность, идентичную по положениям 1-275 SEQ ID NO:2, приведенной ниже:
AQSVPYGVSQIKAPALHSQGYTGSNVKVAVIDSGIDSSHPDLKVAGGASMVPSETNPFQDNNSHGTHVAGTVAALNNSIGVLGVAPSASLYAVKVLGADGSGQYSWIINGIEWAIANNMDVINMSLGGPSGSAALKAAVDKAVASGVVVVAAAGNEGTSGSSSTVGYPGKYPSVIAVGAVDSSNQRASFSSVGPELDVMAPGVSIQSTLPGNKYGAYNGTSMASPHVAGAAALILSKHPNWTNTQVRSSLENTTTKLGDSFYYGKGLINVQAAAQ (SEQ ID NO:2).
Термин "предшественник" белка или пептида относится к зрелой форме белка, содержащей пропоследовательность, которая функционально связана с N- или C-концом белка. Предшественник также может содержать "сигнальную" последовательность, которая функционально связана N-концом пропоследовательности. Предшественник также может включать дополнительные полинуклеотиды, которые задействованы в посттрансляционной активности (например, полинуклеотиды, которые образуются при его расщеплении с образованием зрелой формы белка или пептида).
"Природный фермент" относится к ферменту, имеющему немодифицированную аминокислотную последовательность, которая идентична последовательности, существующей в природе. Природные ферменты включают нативные ферменты, то есть такие ферменты, которые обычно экспрессируются или присутствуют в конкретном микроорганизме.
Термины "происходящий из" и "полученный из" относятся не только к протеазе, которую продуцирует или может продуцировать штамм соответствующего организма, но также и к протеазе, кодируемой последовательностью ДНК, выделенной из такого штамма, и продуцируемой в организме-хозяине, содержащем такую последовательность ДНК. Дополнительно термин относится к протеазе, которая кодируется синтетической и/или полученной из кДНК последовательностью ДНК и которая обладает отличительными признаками соответствующей протеазы.
"Производная" в рамках данного определения обычно сохраняет характерную протеолитическую активность, наблюдаемую в диком типе, нативной или родительской форме, в такой степени, что производная может применяться в аналогичных целях, как и дикий тип, нативная или родительская форма. Функциональные производные сериновой протеазы охватывают природные, искусственно или рекомбинантно полученные пептиды или фрагменты пептида, которые имеют общие признаки сериновой протеазы согласно настоящему изобретению.
Термин "функциональная производная" относится к производной нуклеиновой кислоты, которая имеет функциональные признаки нуклеиновой кислоты, которая кодирует сериновую протеазу. Функциональные производные нуклеиновой кислоты, которые кодируют сериновую протеазу по настоящему изобретению, охватывают природные, искусственно или рекомбинантно полученные нуклеиновые кислоты или фрагменты и обладают признаками сериновой протеазы согласно настоящему изобретению. Нуклеиновая кислота дикого типа, кодирующая сериновые протеазы согласно изобретению, включает природные аллели и гомологи, основанные на вырожденности генетического кода, известной из уровня техники.
Термин "идентичный" в отношении двух нуклеиновых кислот или полипептидных последовательностей относится к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании с максимальным соответствием, согласно измерению с использованием одного из следующих алгоритмов сравнения или анализа последовательности.
Термин "оптимальное выравнивание" относится к выравниванию, дающему наиболее высокую оценку процентной идентичности.
"Процентная идентичность последовательности", "процентная идентичность аминокислотной последовательности", "процентная идентичность последовательности гена" и/или "процентная идентичность полинуклеотидной последовательности", в отношении двух аминокислотных, полинуклеотидных и/или генных последовательностей (в зависимости от ситуации), относятся к процентному отношению остатков, которые являются идентичными в двух последовательностях, когда последовательности оптимально выровнены. Таким образом, 80%-ная идентичность аминокислотной последовательности означает, что 80% аминокислот в двух оптимально выровненных полипептидных последовательностях являются идентичными.
Фраза "практически идентичный" в отношении двух нуклеиновых кислот или полипептидов, таким образом, относится к полинуклеотиду или полипептиду, который включает, по меньшей мере, приблизительно 70%-ную идентичность последовательности, предпочтительно, по меньшей мере, приблизительно 75%, предпочтительно, по меньшей мере, приблизительно 80%, предпочтительно, по меньшей мере, приблизительно 85%, предпочтительно, по меньшей мере, приблизительно 90%, предпочтительно, по меньшей мере, приблизительно 95%, предпочтительно, по меньшей мере, приблизительно 97%, предпочтительно, по меньшей мере, приблизительно 98% и предпочтительно, по меньшей мере, приблизительно 99%-ную идентичность последовательности, по сравнению с референсной последовательностью, при использовании программ или алгоритмов (например, BLAST, ALIGN, CLUSTAL) с применением стандартных параметров. Одним из признаков того, что два полипептида являются практически идентичными, является то, что первый полипептид иммунологически перекрестно реактивен в отношении второго полипептида. Как правило, полипептиды, которые отличаются тем, что содержат консервативные аминокислотные замены, являются иммунологически перекрестно реактивными. Таким образом, полипептид практически идентичен второму полипептиду, например, когда два указанных пептида отличаются только консервативной заменой. Другой признак того, что две последовательности нуклеиновых кислот являются практически идентичными, состоит в том, что две указанных молекулы гибридизуются друг с другом в жестких условиях (например, в диапазоне от средней до высокой жесткости).
Фраза "эквивалентный" в данном контексте относится к ферментам сериновым протеазам, которые кодируются полинуклеотидом, способным гибридизоваться с полинуклеотидом, имеющим последовательность, приведенную в SEQ ID NO:1, в условиях от средней до максимальной жесткости. Например, является эквивалентным означает, что эквивалентная зрелая сериновая протеаза включает, по меньшей мере, приблизительно 70%, по меньшей мере, приблизительно 75%, по меньшей мере, приблизительно 80%, по меньшей мере, приблизительно 85%, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 91%, по меньшей мере, приблизительно 92%, по меньшей мере, приблизительно 93%, по меньшей мере, приблизительно 94%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 96%, по меньшей мере, приблизительно 97%, по меньшей мере, приблизительно 98% и/или, по меньшей мере, приблизительно 99%-ную идентичность последовательности со зрелой субтилизиновой протеазой, имеющей аминокислотную последовательность SEQ ID NO:2.
Термин "выделенный" или "очищенный" относится к материалу, который удален из его исходного окружения (например, природного окружения, если он является природным). Например, материал называется "очищенным", когда он присутствует в конкретной композиции в более высокой или более низкой концентрации, по сравнению с той концентрацией, в которой он существует в природном или немодифицированном организме, или в комбинации с компонентами, которые не присутствуют обычно при экспрессии в природном или немодифицированном организме. Например, природный полинуклеотид или полипептид, присутствующие в живом животном, не является выделенным, но когда тот же полинуклеотид или полипептид частично или полностью отделен от материалов, существующих вместе с ним в природной системе, он является выделенным. В некоторых вариантах осуществления такие полинуклеотиды являются частью вектора, и/или такие полинуклеотиды или полипептиды являются частью композиции, при этом они по-прежнему являются выделенными, поскольку такой вектор или композиция не являются частью их природного окружения. В предпочтительных вариантах осуществления нуклеиновая кислота или белок считаются очищенными, например, если они приводят к появлению по существу одной полосы на электрофорезном геле или блоте.
Термин "выделенный", при использовании в отношении последовательности ДНК, относится к последовательности ДНК, которая была удалена из ее природной генетической среды и, таким образом, не содержит других посторонних или нежелательных кодирующих последовательностей и находится в форме, подходящей для применения в генноинженерных системах получения белка. Такие выделенные молекулы представляют собой молекулы, которые отделены от их природного окружения и включают в себя кДНК и геномные клоны. Выделенные молекулы ДНК по настоящему изобретению не содержат других генов, с которыми они обычно ассоциированы, но могут включать природные 5'- и 3'-нетранслируемые области, например, промоторы и терминаторы. Идентификация ассоциированных областей очевидна среднему специалисту в данной области (см., например, Dynan and Tijan, Nature 316:774-78 [1985]). Термин "выделенная последовательность ДНК" альтернативно именуется как "клонированная последовательность ДНК".
Термин "выделенный", при использовании в отношении белка, относится к белку, который присутствует в условиях, отличающихся от его нативного окружения. В предпочтительной форме выделенный белок практически не содержит других белков, в особенности других гомологичных белков. Выделенный белок является чистым более чем на приблизительно 10%, предпочтительно чистым более чем на приблизительно 20%, а более предпочтительно чистым более чем на приблизительно 30% согласно определению с помощью электрофореза в ДСН-ПААГ. Другие аспекты изобретения охватывают белок в высокоочищенной форме (то есть чистый более чем на приблизительно 40%, чистый более чем на приблизительно 60%, чистый более чем на приблизительно 80%, чистый более чем на приблизительно 90%, чистый более чем на приблизительно 95%, чистый более чем на приблизительно 97% и даже чистый более чем на приблизительно 99%) согласно определению с помощью электрофореза в ДСН-ПААГ.
Используемый в настоящем описании термин "комбинаторный мутагенез" относится к способам, в которых получают библиотеки вариантов исходной последовательности. В данных библиотеках варианты содержат одну или несколько мутаций, выбранных из заданного набора мутаций. Кроме того, указанные способы обеспечивают возможность введения случайных мутаций, которые не были включены в заданный набор мутаций. В некоторых вариантах осуществления способы включают способы, описанные в заявке на патент США 09/699250, поданной 26 октября 2000 года, которая настоящим включена путем отсылки. В альтернативных вариантах осуществления способы комбинаторного мутагенеза охватывают коммерчески доступные наборы (например, QuikChange® Multisite, Stratagene, San Diego, CA).
Используемый в настоящем описании термин "библиотека мутантов" относится к популяции клеток, которые являются идентичными по большей части своего генома, но включают различные гомологи одного или нескольких генов. Подобные библиотеки могут использоваться, например, для идентификации генов или оперонов с улучшенными признаками.
Используемый в настоящем описании термин "исходный ген" относится к целевому гену, кодирующему целевой белок, который необходимо улучшить и/или изменить с помощью настоящего изобретения.
Используемый в настоящем описании термин "множественное выравнивание последовательностей" ("MSA") относится к последовательностям множества гомологов исходного гена, которые выравнивают, используя алгоритм (например, Clustal W).
Используемый в настоящем описании термин "консенсусная последовательность" и "каноническая последовательность" относятся к архитипической аминокислотной последовательности, с которой сравниваются все варианты конкретного целевого белка или последовательности. Указанные термины также относятся к последовательности, которая содержит нуклеотиды, которые наиболее часто присутствуют в целевой последовательности ДНК. Для каждого положения в гене консенсусная последовательность дает аминокислоту, которая наиболее часто встречается в данном положении в MSA.
Используемый в настоящем описании термин "консенсусная мутация" относится к различию в последовательности исходного гена и консенсусной последовательности. Консенсусные мутации идентифицируют путем сравнения последовательности исходного гена и консенсусной последовательности, получаемой в результате MSA. В некоторых вариантах осуществления консенсусные мутации вводят в исходный ген, который приобретает большее подобие с консенсусной последовательностью. Консенсусные мутации также включают аминокислотные замены, при которых аминокислота в исходном гене заменяется аминокислотой, которая более часто присутствует в MSA в данном положении по сравнению с частотой встречаемости данной аминокислоты в исходном гене. Таким образом, термин консенсусная мутация включает все одиночные аминокислотные замены, при которых аминокислота в исходном гене заменяется более распространенной аминокислотой в MSA.
Используемый в настоящем описании термин "усовершенствованная комбинаторная библиотека консенсусного мутагенеза" относится к библиотеке CCM, которая разработана и создана на основе результатов скрининга и/или секвенирования на раннем этапе CCM мутагенеза и скрининга. В некоторых вариантах осуществления усовершенствованная библиотека CCM основана на последовательности первоначального попадания, полученной на раннем этапе CCM. В дополнительных вариантах осуществления усовершенствованный CCM разработан так, что мутации, часто наблюдаемые в первоначальных попаданиях на ранних этапах мутагенеза и скрининга, одобряются. В некоторых предпочтительных вариантах осуществления это достигается путем исключения праймеров, которые кодируют мутации, снижающие эффективность, или путем увеличения концентрации праймеров, которые кодируют мутации, повышающие эффективность, относительно других праймеров, которые ранее использовались в библиотеках CCM.
Используемый в настоящем описании термин "снижающие эффективность мутации" относится к мутациям в комбинаторной библиотеке консенсусного мутагенеза, которые менее часто находятся в попаданиях, полученных в результате скрининга, по сравнению с комбинаторными библиотеками консенсусного мутагенеза, которые не подвергались скринингу. В предпочтительных вариантах осуществления процесс скрининга приводит к удалению и/или уменьшению частоты вариантов, которые содержат "мутации, снижающие эффективность".
Используемый в настоящем описании термин "функциональный тест" относится к анализу, который обеспечивает оценку активности белка. В наиболее предпочтительных вариантах осуществления данный термин относится к системам анализа, в которых белок анализируют на предмет его способности функционировать с его обычной возможностью. Например, в случае ферментов функциональный тест включает определение эффективности фермента при катализировании реакции.
Используемый в настоящем описании термин "целевой параметр" относится к параметру исходного гена, который требуется изменить. Предполагается, что настоящее изобретение не ограничивается каким-либо конкретным целевым параметром. Впрочем, в некоторых предпочтительных вариантах осуществления целевым параметром является стабильность продукта гена (например, устойчивость к денатурации, протеолизу или другим деструктивным факторам), тогда как в других вариантах осуществления изменению подвергают уровень продукции в организме-продуценте. Фактически, предполагается, что любой параметр исходного гена находит применение в настоящем изобретении.
Термин "параметр" или его грамматические эквиваленты в отношении нуклеиновой кислоты, используемой в настоящей заявке, относится к любому свойству или признаку нуклеиновой кислоты, который может быть отобран или обнаружен. Указанные параметры включают, помимо прочих, параметр, влияющий на связывание с полипептидом, параметр, придаваемый клетке, включающей конкретную нуклеиновую кислоту, параметр, затрагивающий транскрипцию гена (например, силу промотора, узнавание промотора, регуляцию промотора, функцию энхансера), параметр, влияющий на процессинг РНК (например, РНК-сплайсинг, стабильность РНК, конформацию РНК и посттранскрипционную модификацию), параметр, влияющий на трансляцию (например, уровень, регуляцию, связывание мРНК с рибосомными белками, посттрансляционную модификацию). Например, сайт связывания фактора транскрипции, полимеразы, фактора регуляции и т.д., содержащийся в нуклеиновой кислоте, может быть изменен с целью получения требуемых свойств или для идентификации нежелательных свойств.
Термин "параметр" или его грамматические эквиваленты, в отношении к полипептиду (включая белки), используемый в настоящей заявке, относится к любому свойству или признаку полипептида, который может быть отобран или обнаружен. Указанные параметры включают, помимо прочих, устойчивость к окислению, субстратную специфичность, каталитическую активность, термостабильность, устойчивость в щелочной среде, профиль активности в зависимости от pH, устойчивость к протеолитическому расщеплению, KM, kcat, отношение kcat/kM, фолдинг белка, индукцию иммунного ответа, способность связываться с лигандом, способность связываться с рецептором, способность к секреции, способность презентирования на поверхности клетки, способность к олигомеризации, способность к сигнализации, способность стимулировать пролиферацию клеток, способность ингибировать пролиферацию клеток, способность индуцировать апоптоз, способность к модификации посредством фосфорилирования или гликозилирования и/или способность к лечению заболевания и т.д.
Термины "модифицированная последовательность" и "модифицированные гены" в настоящем описании используются попеременно и относятся к последовательности, которая включает делецию, вставку или прерывание последовательности природной нуклеиновой кислоты. В некоторых предпочтительных вариантах осуществления продукт экспрессии модифицированной последовательности представляет собой усеченный белок (например, если модификация является делецией или прерыванием последовательности). В некоторых наиболее предпочтительных вариантах осуществления усеченный белок сохраняет биологическую активность. В альтернативных вариантах осуществления продукт экспрессии модифицированной последовательности представляет собой удлиненный белок (например, в случае модификаций, включающих вставку в последовательность нуклеиновой кислоты). В некоторых вариантах осуществления вставка приводит к образованию усеченного белка (например, когда вставка приводит к формированию стоп-кодона). Таким образом, вставка может привести к образованию в качестве продукта экспрессии либо усеченного белка, либо удлиненного белка.
Используемые в настоящем описании термины "мутантная последовательность" и "мутантный ген" используются попеременно и относятся к последовательности, в которой изменен, по меньшей мере, один кодон, присутствующий в последовательности дикого типа клетки-хозяина. Продуктом экспрессии мутантной последовательности является белок с измененной аминокислотной последовательностью по сравнению с последовательностью дикого типа. Продукт экспрессии может обладать измененными функциональными свойствами (например, увеличенной ферментативной активностью).
Термины "мутагенный праймер" или "мутагенный олигонуклеотид" (попеременно используемые в настоящем описании) относятся к олигонуклеотидным композициям, которые соответствуют части последовательности матрицы и способны гибридизоваться с ней. Что касается мутагенных праймеров, такой праймер не соответствует матричной нуклеиновой кислоте точно, при этом ошибка или ошибки спаривания в праймере используются для введения необходимой мутации в библиотеку нуклеиновых кислот. Используемые в настоящем описании "немутагенный праймер" или "немутагенный олигонуклеотид" относятся к олигонуклеотидным композициям, которые точно соответствуют матричной нуклеиновой кислоте. В одном варианте осуществления изобретения используются только мутагенные праймеры. В другом предпочтительном варианте осуществления изобретения праймеры создаются таким образом, чтобы, по меньшей мере, для одной области, в которую был включен мутагенный праймер, существовал также немутагенный праймер, включенный в смесь олигонуклеотидов. При добавлении смеси мутагенных праймеров и немутагенных праймеров, которые соответствуют, по меньшей мере, одному из мутагенных праймеров, можно в результате получить библиотеку нуклеиновых кислот, в которой представлены различные комбинаторные мутационные профили. Например, если требуется, чтобы некоторые из членов библиотеки мутантных нуклеиновых кислот сохранили последовательность своих предшественников в определенных положениях, тогда как другие члены содержали мутации в таких участках, немутагенные праймеры обеспечивают возможность получения определенного уровня немутантных членов по данному остатку в библиотеке нуклеиновых кислот. В способах изобретения применяются мутагенные и немутагенные олигонуклеотиды, которые обычно имеют длину 10-50 оснований, более предпочтительно приблизительно 15-45 оснований. Впрочем, может потребоваться использовать праймеры, которые короче 10 оснований или длиннее 50 оснований, чтобы получить требуемый результат мутагенеза. В отношении соответствующих мутагенных и немутагенных праймеров вовсе не обязательно, чтобы олигонуклеотиды имели идентичную длину, а нужно только, чтобы обеспечивалось перекрывание с областью, которая соответствует вводимой мутации. Праймеры могут быть добавлены в заданном соотношении согласно настоящему изобретению. Например, если требуется, чтобы получаемая библиотека имела существенный уровень некоторой конкретной мутации и меньшую величину другой мутации в том же или в другом участке, путем регулирования количества добавляемого праймера можно получить требуемую несимметричную библиотеку. В альтернативе, посредством добавления меньшего или большего количества немутагенных праймеров можно регулировать частоту, с которой соответствующая мутация(и) производится в библиотеке мутантных нуклеиновых кислот.
Используемая в настоящем описании фраза "сопряженные мутации" относится к мутациям, которые присутсвуют в пределах одного и того же олигонуклеотидного праймера. Например, сопряженные мутации могут быть смежными или располагаться вблизи друг друга, при этом они будут введены в получаемые мутантные матричные нуклеиновые кислоты с помощью одного и того же праймера.
Термины "последовательность дикого типа" или "ген дикого типа" в настоящем описании используются попеременно и относятся к последовательности, которая является нативной или естественно присутствует в клетке-хозяине. В некоторых вариантах осуществления последовательность дикого типа относится к целевой последовательности, которая является исходной точкой в проекте инженерии белка (то есть "родительской" последовательности). Последовательность дикого типа может кодировать гомологичный или гетерологичный белок. Гомологичный белок является белком, который клетка-хозяин продуцирует без вмешательства. Гетерологичный белок является белком, который клетка-хозяин не будет продуцировать без вмешательства.
Используемые в настоящем описании термины "вариант протеазы", "вариант субтилизина", "вариант субтилизиновой протеазы" используются применительно к протеазам, аналогичным субтилизину дикого типа или родительской протеазе (например, субтилизину), которые используются в качестве исходной точки в белковой инженерии. Указанные варианты аналогичны по своим функциям дикому типу или другому родителю, но содержат в своей аминокислотной последовательности мутации, которые отличают их по последовательности от дикого типа или родительской протеазы (например, субтилизина).
Если не указано иное, числа номера положений аминокислот соответствуют положениям в последовательности зрелого субтилизина Bacillus amyloliquefaciens SEQ ID NO:2. Впрочем, изобретение не ограничивается мутацией указанного конкретного субтилизина и распространяется на протеазы-предшественники, содержащие аминокислотные остатки в положениях, которые являются "эквивалентными" определенным идентифицированным остаткам в субтилизине Bacillus amyloliquefaciens.
Используемые в настоящем описании термины "модификация" и "мутация" относятся к любому изменению аминокислотной последовательности. Предполагается, что данный термин охватывает замены, делеции, вставки и/или замещение боковых цепей аминокислот в целевой аминокислотной последовательности (например, последовательности субтилизина). Также предполагается, что термин охватывает химическую модификацию целевой аминокислотной последовательности (например, последовательности субтилизина).
Термин "устойчивый к окислению" относится к протеазам настоящего изобретения, которые сохраняют указанную величину ферментативной активности в течение заданного промежутка времени при условиях, преобладающих в течение процесса протеолиза, гидролиза, чистки или другого процесса согласно изобретению, например, при воздействии или контакте с отбеливающими агентами или окислителями. В некоторых вариантах осуществления протеазы сохраняют, по меньшей мере, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеолитической активности после контакта с отбеливающим или окисляющим агентом в течение заданного периода времени, составляющего, например, по меньшей мере, приблизительно 1 минуту, приблизительно 3 минуты, приблизительно 5 минут, приблизительно 8 минут, приблизительно 12 минут, приблизительно 16 минут, приблизительно 20 минут и т.д. В некоторых вариантах осуществления устойчивость измеряют, как описано в примерах.
Термин "устойчивый к комплексонам" относится к протеазам настоящего изобретения, которые сохраняют указанное количество ферментативной активности в течение заданного промежутка времени при условиях, преобладающих в течение процесса протеолиза, гидролиза, чистки или другого процесса изобретения, например, при воздействии или контакте с хелатирующими агентами. В некоторых вариантах осуществления протеазы сохраняют, по меньшей мере, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеолитической активности после контакта с хелатирующим агентом в течение заданного периода времени, составляющего, например, по меньшей мере, приблизительно 10 минут, приблизительно 20 минут, приблизительно 40 минут, приблизительно 60 минут, приблизительно 100 минут и т.д. В некоторых вариантах осуществления устойчивость к комплексонам измеряется, как описано в примерах.
Термины "термически стабильный" и "термостабильный" относятся к протеазам по настоящему изобретению, которые сохраняют указанное количество ферментативной активности после воздействия установленных температур в течение заданного промежутка времени при условиях, преобладающих в течение процесса протеолиза, гидролиза, чистки или другого процесса изобретения, например, при воздействии измененной температуры. Измененные температуры включают повышенные или пониженные температуры. В некоторых вариантах осуществления протеазы сохраняют, по меньшей мере, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 92%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98% или приблизительно 99% протеолитической активности после воздействия измененных температур в течение заданного периода времени, составляющего, например, по меньшей мере, приблизительно 60 минут, приблизительно 120 минут, приблизительно 180 минут, приблизительно 240 минут, приблизительно 300 минут и т.д. В некоторых вариантах осуществления термостабильность определяют, как описано в примерах.
Термин "повышенная стабильность", в отношении устойчивой к окислению, воздействию комплексонов, термически и/или pH-стабильной протеазы, относится к более высокой сохраняемой в течение времени протеолитической активности по сравнению с другими сериновыми протеазами (например, субтилизиновыми протеазами) и/или ферментами дикого типа.
Термин "сниженная стабильность", в отношении устойчивой к окислению, воздействию комплексонов, термически и/или pH-стабильной протеазы, относится к более низкой сохраняемой в течение времени протеолитической активности по сравнению с другими сериновыми протеазами (например, субтилизиновыми протеазами) и/или ферментами дикого типа.
Термин "чистящая активность" относится к эффективности чистки, достигаемой протеазой при условиях, преобладающих в течение процесса протеолиза, гидролиза, чистки или другого процесса изобретения. В некоторых вариантах осуществления эффективность чистки определяют с помощью различных тестов по очистке с использованием различных ферменточувствительных красящих материалов, например, травы, крови, молока или яичного белка, с последующим применением различных хроматографических, спектрофотометрических или других количественных методов обработки красящих материалов в стандартных моечных условиях. Примеры тестов включают, помимо прочего, тесты, описанные в WO 99/34011 и патенте США 6605458 (которые включены в настоящую заявку путем отсылки), а также способы, включенные в примеры.
Термин "чистящее эффективное количество" протеазы относится к количеству протеазы, описанной выше, которое обеспечивает требуемый уровень ферментативной активности в определенной чистящей композиции. Такие эффективные количества с легкостью могут быть определены средним специалистом в данной области техники и зависят от многих факторов, таких как конкретная применяемая протеаза, область применения чистки, определенный состав чистящей композиции, а также от того, какая композиция требуется, жидкая или сухая (например, гранулированная, в виде карандаша) и т.д.
Термин "дополнительные чистящие материалы", используемый в настоящей заявке, означает любой жидкий, твердый или газообразный материал, выбранный для конкретного типа требуемой чистящей композиции и формы продукта (например, композиции в форме жидкости, гранулы, порошка, карандаша, пасты, спрея, таблетки, геля или пены), где указанные материалы также предпочтительно совместимы с ферментом протеазой, применяемым в композиции. В некоторых вариантах осуществления гранулированные композиции находятся в "компактной" форме, тогда как в других вариантах осуществления жидкие композиции находятся в "концентрированной" форме.
Термин "повышенная эффективность", применительно к чистящей активности, относится к увеличенной или более высокой чистящей активности определенного фермента в отношении чувствительных красящих материалов, таких как яйцо, молоко, трава или кровь, согласно определению с помощью обычной оценки после проведения стандартного моечного цикла и/или нескольких моечных циклов.
Термин "пониженная эффективность", применительно к чистящей активности, относится к уменьшенной или сниженной чистящей активности определенного фермента в отношении чувствительных красящих материалов, таких как яйцо, молоко, трава или кровь, согласно определению с помощью обычной оценки после проведения стандартного моечного цикла.
Термин "сравнительная эффективность", применительно к чистящей активности, относится, по меньшей мере, к приблизительно 60%, по меньшей мере, приблизительно 70%, по меньшей мере, приблизительно 80%, по меньшей мере, приблизительно 90% или, по меньшей мере, приблизительно 95% чистящей активности в сравнении с субтилизиновой протеазой (например, коммерчески доступными протеазами), включая, помимо прочего, протеазу OPTIMASE™ (Genencor), протеазосодержащие продукты PURAFECT™ (Genencor), протеазу SAVINASE™ (Novozymes), BPN'-варианты (см. например, патент США Re 34606), протеазы RELASE™, DURAZYME™, EVERLASE™, KANNASE™ (Novozymes), протеазы MAXACAL™, MAXAPEM™, PROPERASE™ (Genencor; см. также патент США Re 34606 и патенты США 5700676, 5955340, 6312936 и 6482628), а также продукты, содержащие вариант протеазы B. lentus (например, описанные в WO 92/21760, WO 95/23221 и/или WO 97/07770).
Эффективность чистки может быть определена путем сравнения протеазы по настоящему изобретению с субтилизиновыми протеазами в различных тестах по очистке с использованием чувствительных к ферментам красящих материалов, таких как трава, кровь или молоко, согласно определению с помощью стандартных спектрофотометрических или аналитических методов после проведения моечного цикла со стандартными условиями.
Используемые в настоящей заявке "чистящие композиции" и "чистящие составы" относятся к композициям, которые находят применение при удалении нежелательных соединений с очищаемых изделий, таких как ткань, посуда, контактные линзы, других твердых субстратов, волос (шампуни), кожи (мыла и кремы), зубов (жидкости для полоскания рта, зубные пасты) и т.д. Термин охватывает любые материалы/соединения, выбранные для конкретного типа требуемой чистящей композиции и формы продукта (например, композиции в форме жидкости, геля, гранулы или спрея), при условии, что композиция совместима с пергидролазой и другим ферментом(ами), применяемым в композиции. Определенный выбор материалов чистящей композиции с легкостью может быть сделан с учетом поверхности, изделия или ткани, подвергаемых очистке, а также на основе требуемой формы композиции и условий чистки в процессе применения.
Термины, приведенные ниже, относятся к любой композиции, которая подходит для очистки, отбеливания, дезинфекции и/или стерилизации любого объекта и/или поверхности. Предполагается, что данные термины включают, помимо прочего, моющие композиции (например, жидкие и/или твердые стирально-моющие средства и моющие средства для тонких тканей; чистящие составы для твердых поверхностей, таких как стекло, дерево, керамика и металлические столы, а также окна; средства для чистки ковров; средства для чистки духовых шкафов; кондиционеры тканей; смягчители тканей и средства для предварительного замачивания, а также средства для мытья посуды).
Фактически термин "чистящая композиция", используемый в настоящей заявке, включает, если не указано иное, универсальные или высокоэффективные моющие средства в гранулированной или порошковой форме, в особенности чистящие моющие средства; универсальные моющие средства в форме жидкости, геля или пасты, в особенности так называемые высокоэффективные тяжелые жидкости (HDL); жидкие моющие средства для тонких тканей; средства для ручного мытья посуды или легкие средства для мытья посуды, в особенности сильнопенящиеся; средства для машинного мытья посуды, включающие различные таблетированные, гранулированные, жидкие средства и вспомогательные ополаскиватели для применения в домашнем хозяйстве и на предприятиях; жидкие чистящие и дезинфицирующие средства, включающие антибактериальные средства для мытья рук, чистящие карандаши, жидкости для полоскания рта, средства для чистки зубных протезов, средства для чистки автомобилей или ковров, средства для чистки сантехники; шампуни и ополаскиватели для волос; гели для душа и пены для ванны и средства для чистки металлических поверхностей, а также вспомогательные чистящие средства, например, отбеливающие добавки и пятновыводители-карандаши или средства для предварительной обработки.
Используемые в настоящем описании термины "моющая композиция" и "моющий состав" используются применительно к смесям, которые предназначены для применения в моечной среде для очистки загрязненных объектов. В некоторых предпочтительных вариантах осуществления данный термин используется применительно к стирке тканей и/или одежды (например, "стирально-моющие средства"). В альтернативных вариантах осуществления термин относится к другим моющим средствам, используемым, например, для мытья посуды, столовых приборов и т.д. (например, "средства для мытья посуды"). Предполагается, что настоящее изобретение не ограничивается каким-либо конкретным моющим составом или композицией. Фактически, предполагается, что в дополнение к пергидролазе термин охватывает моющие средства, которые содержат поверхностно-активные вещества, трансферазу(ы), гидролитические ферменты, оксидоредуктазы, наполнители, отбеливающие агенты, активаторы отбеливания, синьку и флуоресцентные красители, ингибиторы слеживания, дезодорирующие агенты, активаторы ферментов, антиоксиданты и солюбилизаторы.
Используемые в настоящей заявке "композиции для чистки тканей" включают стирально-моющие композиции для ручной и машинной стирки, включая вспомогательные стиральные композиции и композиции, подходящие для применения в пропитывании и/или предварительной обработке загрязненных тканей (например, одежды, белья и других текстильных материалов).
Используемые в настоящей заявке "композиции для чистки материалов, не относящихся к тканям" включают композиции для чистки поверхностей нетекстильных материалов (то есть не являющихся тканями), включающие, помимо прочего, композиции для мытья посуды, композиции для чистки полости рта, композиции для чистки зубных протезов, а также композиции для личной гигиены.
"Компактная" форма чистящих композиций в настоящей заявке наилучшим образом отражается плотностью и, применительно к композиции, количеством неорганической соли-наполнителя. Неорганические соли-наполнители являются обычными компонентами моющих композиций в порошковой форме. В обычных моющих композициях соли-наполнители присутствуют в существенных количествах, которые обычно составляют от приблизительно 17 до приблизительно 35% от полного веса композиции. С другой стороны, в компактных композициях соль-наполнитель присутствует в количествах, не превышающих приблизительно 15% от полного веса композиции. В некоторых вариантах осуществления соль-наполнитель присутствует в количествах, которые не превышают приблизительно 10% или более предпочтительно приблизительно 5% по весу композиции. В некоторых вариантах осуществления неорганические соли-наполнители выбраны из сульфатов и хлоридов щелочных и щелочноземельных металлов. Предпочтительной солью-наполнителем является сульфат натрия.
Используемый в настоящем описании термин "поверхностно-активное вещество" относится к любому соединению, которое обладает общепризнанными в уровне техники поверхностно-активными качествами. Поверхностно-активные вещества обычно включают анионные, катионные, неионные и цвиттерионные соединения, которые описаны ниже.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Далее настоящее изобретение описано более подробно в следующих примерах, которые никоим образом не должны ограничивать объем заявленного изобретения. Прилагаемые фигуры следует рассматривать как неотъемлемые части описания изобретения. Следующие примеры предложены в целях неограничивающего иллюстрирования заявленного изобретения.
В следующем описании экспериментов применяются следующие сокращения: PI или Pi (коэффициент эффективности), м.д. (миллионные доли); М (молярный); мМ (миллимолярный); мкМ (микромолярный); нМ (наномолярный); моль (моли); ммоль (миллимоли); мкмоль (микромоли); нмоль (наномоли); г (граммы); мг (миллиграммы); мкг (микрограммы); пг (пикограммы); л (литры); мл (миллилитры); мкл (микролитры); см (сантиметры); мм (миллиметры); мкл (микрометры); нм (нанометры); Е (единицы); V (вольты); MW (молекулярная масса); с (секунды); мин (минуты); ч (часы); °C (градусы Цельсия); QS (достаточное количество); ND (не выполняли); NA (не применимо); об/мин (оборотов в минуту); H2O (вода); dH2O (деионизированная вода); HCl (хлороводородная кислота); aa (аминокислота); п.н. (пары нуклеотидов); т.п.н. (тысячи пар нуклеотидов); кДа (килодальтоны); кДНК (комплементарная ДНК); ДНК (дезоксирибонуклеиновая кислота); онДНК (однонитевая ДНК); днДНК (двунитевая ДНК); dNTP (дезоксирибонуклеотидтрифосфат); РНК (рибонуклеиновая кислота); MgCl2 (хлорид магния); NaCl (хлорид натрия); в/об (вес/объем); об/об (объем к объему); g (сила тяжести); OD (оптическая плотность); фосфатный буферный раствор Дульбекко (DPBS); SOC (2% бакто-триптон, 0,5% бакто-дрожжевой экстракт, 10 мМ NaCl, 2,5 мМ KCl); Terrific Broth (TB; 12 г/л бакто-триптона, 24 г/л глицерина, 2,31 г/л KH2PO4 и 12,54 г/л K2HPO4); OD280 (оптическая плотность при 280 нм); OD600 (оптическая плотность при 600 нм); A405 (поглощение при 405 нм); Vmax (максимальная начальная скорость катализируемой ферментом реакции); ПААГЭ (электрофорез в полиакриламидном геле); PBS (фосфатно-соляной буфер [150 мМ NaCl, 10 мМ натрийфосфатный буфер, pH 7,2]); PBST (PBS+0,25% TWEEN®-20); PEG (полиэтиленгликоль); ПЦР (полимеразная цепная реакция); ПЦР-ОТ (ПЦР с обратной транскрипцией); ДСН (додецилсульфат натрия); Трис (Трис(гидроксиметил)аминометан); HEPES (N-[2-гидроксиэтил]пиперазин-N-[2-этансульфоновая кислота]); HBS (HEPES-соляной буфер); Трис-HCl (Трис[гидроксиметил]аминометан-гидрохлорид); Трицин (N-[Трис-(гидроксиметил)метил]глицин); CHES (2-(N-циклогексиламино)этансульфоновая кислота); TAPS (3-{[Трис-(гидроксиметил)метил]амино}пропансульфоновая кислота); CAPS (3-(трициклогексиламино)пропансульфоновая кислота; ДМСО (диметилсульфоксид); DTT (1,4-дитио-DL-треитол); SA (синапиновая кислота (3,5-диметокси-4-гидроксикоричная кислота); ТХУ (трихлоруксусная кислота); Glut и GSH (восстановленный глутатинон); GSSG (окисленный глутатинон); TCEP (Трис[2-карбоксиэтил]фосфин); Ки (Кюри); мКи (милликюри); мкКи (микрокюри); ВЭЖХ (высокоэффективная жидкостная хроматография); ОФ-ВЭЖХ (обращеннофазовая высокоэффективная жидкостная хроматография); ТСХ (тонкослойная хроматография); МАЛДИ-ВП (матрично-активированная лазерная десорбция/ионизация с времяпролетной масс-спектрометрией); Ts (тозил); Bn (бензил); Ph (фенил); Ms (мезил); Et (этил), Me (метил); Taq (ДНК-полимераза Thermus aquaticus); Klenow (большой фрагмент ДНК-полимеразы I (фрагмент Кленова)); ЭГТА (этиленгликоль-бис(β-аминоэтилэфир)-N,N,N',N'-тетрауксусная кислота); ЭДТА (этилендиаминтетрауксусная кислота); bla (β-лактамаза или ген устойчивости к ампициллину); HDL (жидкость высокой плотности); MJ Research (MJ Research, Reno, NV); Baseclear (Baseclear BV, Inc., Leiden, the Netherlands); PerSeptive (PerSeptive Biosystems, Framingham, MA); Thermo Finnigan (ThermoFinnigan, San Jose, CA); Argo (Argo BioAnalytica, Morris Plains, NJ); Seitz EKS (SeitzSchenk Filtersystems GmbH, Bad Kreuznach, Germany); Pall (Pall Corp., East Hills, NY); Spectrum (Spectrum Laboratories, Dominguez Rancho, CA); Molecular Structure (Molecular Structure Corp., Woodlands, TX); Accelrys (Accelrys, Inc., San Diego, CA); Chemical Computing (Chemical Computing Corp., Montreal, Canada); New Brunswick (New Brunswick Scientific, Co., Edison, NJ); CFT (Center for Test Materials, Vlaardingen, the Netherlands); Test Fabrics (Test Fabrics, Inc., West Pittiston, PA), Procter&Gamble (Procter&Gamble, Inc., Cincinnati, OH); Epicentre (Epicentre Biotechnologies, Madison, WI); GE Healthcare (GE Healthcare, Chalfont St. Giles, United Kingdom); OXOID (Oxoid, Basingstoke, Hampshire, UK); Megazyme (Megazyme International Ireland Ltd., Bray Business Park, Bray, Co., Wicklow, Ireland); Finnzymes (Finnzymes Oy, Espoo, Finland); Kelco (CP Kelco, Wilmington, DE); Corning (Corning Life Sciences, Corning, NY); NEN (NEN Life Science Products, Boston, MA); Pharma AS (Pharma AS, Oslo, Norway); Dynal (Dynal, Oslo, Norway); Bio-Synthesis (Bio-Synthesis, Lewisville, TX); ATCC (American Type Culture Collection, Rockville, MD); Gibco/BRL (Gibco/BRL, Grand Island, NY); Sigma (Sigma Chemical Co., St. Louis, MO); Pharmacia (Pharmacia Biotech, Piscataway, NJ); NCBI (National Center for Biotechnology Information); Applied Biosystems (Applied Biosystems, Foster City, CA); BD Biosciences и/или Clontech (BD Biosciences CLONTECH Laboratories, Palo Alto, CA); Operon Technologies (Operon Technologies, Inc., Alameda, CA); MWG Biotech (MWG Biotech, High Point, NC); Oligos Etc (Oligos Etc. Inc, Wilsonville, OR); Bachem (Bachem Bioscience, Inc., King of Prussia, PA); Difco (Difco Laboratories, Detroit, MI); Mediatech (Mediatech, Herndon, VA; Santa Cruz (Santa Cruz Biotechnology, Inc., Santa Cruz, CA); Oxoid (Oxoid Inc., Ogdensburg, NY); Worthington (Worthington Biochemical Corp., Freehold, NJ); GIBCO BRL или Gibco BRL (Life Technologies, Inc., Gaithersburg, MD); Millipore (Millipore, Billerica, MA); Bio-Rad (Bio-Rad, Hercules, CA); Invitrogen (Invitrogen Corp., San Diego, CA); New England Biolabs и NEB (New England Biolabs, Ipswich, MA); Sigma (Sigma Chemical Co., St. Louis, MO); Pierce (Pierce Biotechnology, Rockford, IL); Takara (Takara Bio Inc. Otsu, Japan); Roche (Hoffmann-La Roche, Basel, Switzerland); EM Science (EM Science, Gibbstown, NJ); Qiagen (Qiagen, Inc., Valencia, CA); Biodesign (Biodesign Intl., Saco, Maine); Aptagen (Aptagen, Inc., Herndon, VA); Sorvall (Sorvall, Kendro Laboratory Products, Asheville, NC); United States Testing (United States Testing Co., Hoboken, NJ); Molecular Devices (Molecular Devices, Corp., Sunnyvale, CA); R&D Systems (R&D Systems, Minneapolis, MN); Stratagene (Stratagene Cloning Systems, La Jolla, CA); Marsh (Marsh Biosciences, Rochester, NY); Geneart (Geneart GmbH, Regensburg, Germany); DNA2.0 (DNA2.0, Menlo Park, CA); Gene Oracle (Gene Oracle, Mountain View, CA); Zymo Research (Zymo Research, Orange, CA); Bio-Tek (Bio-Tek Instruments, Winooski, VT); Biacore (Biacore, Inc., Piscataway, NJ); PeproTech (PeproTech, Rocky Hill, NJ); SynPep (SynPep, Dublin, CA); New Objective (New Objective brand; Scientific Instrument Services, Inc., Ringoes, NJ); Waters (Waters, Inc., Milford, MA); Matrix Science (Matrix Science, Boston, MA); Dionex (Dionex, Corp., Sunnyvale, CA); Monsanto (Monsanto Co., St. Louis, MO); Wintershall (Wintershall AG, Kassel, Germany); BASF (BASF Co., Florham Park, NJ); Huntsman (Huntsman Petrochemical Corp., Salt Lake City, UT); Enichem (Enichem Iberica, Barcelona, Spain); Fluka Chemie AG (Fluka Chemie AG, Buchs, Switzerland); Gist-Brocades (Gist-Brocades, NV, Delft, Netherlands); Dow Corning (Dow Corning Corp., Midland, MI); а также Microsoft (Microsoft, Inc., Redmond, WA).
ПРИМЕР 1
Анализы
В следующих примерах использовали различные анализы, описанные ниже для удобства в прочтении. Любые отступления от методик, приведенных ниже, указаны в примерах. В настоящем изобретении нумерация субтилизина соответствует нумерации последовательности зрелой BPN', представленной ниже:
AQSVPYGVSQIKAPALHSQGYTGSNVKVAVIDSGIDSSHPDLKVAGGASMVPSETNPFQDNNSHGTHVAGTVAALNNSIGVLGVAPSASLYAVKVLGADGSGQYSWIINGIEWAIANNMDVINMSLGGPSGSAALKAAVDKAVASGVVVVAAAGNEGTSGSSSTVGYPGKYPSVIAVGAVDSSNQRASFSSVGPELDVMAPGVSIQSTLPGNKYGAYNGTSMASPHVAGAAALILSKHPNWTNTQVRSSLENTTTKLGDSFYYGKGLINVQAAAQ (SEQ ID NO:1)
A. Анализ ТХУ с целью определения содержания белка в 96-луночных микропланшетах
Для BPN' (например, референсной протеазы) и вариантов BPN' данный анализ начинали, используя супернатант отфильтрованной культуры из микропланшетов, выращенной в течение 3-4 дней при 33°C с перемешиванием при 230 об/мин и аэрацией увлажненным воздухом. Для анализа использовали новые 96-луночные плоскодонные микропланшеты (MTP). Сначала в каждую лунку вносили 100 мкл/лунка 0,25 Н HCl. Затем добавляли 50 мкл отфильтрованной культуры. После этого определяли рассеивание/поглощение при 405 нм (используя режим перемешивания в планшет-ридере, в течение 5 сек) для получения "пустого" значения. Для теста 100 мкл/лунка 15% (в/об) трихлоруксусной кислоты (ТХУ) добавляли в планшеты и инкубировали 5-30 мин при комнатной температуре. Затем определяли рассеивание/поглощение при 405 нм (используя режим перемешивания в планшет-ридере, в течение 5 сек).
Использовали следующее оборудование: Biomek FX Robot (Beckman Coulter) и MTP-ридер SpectraMAX (тип 340; Molecular Devices); MTP тип 9017 (Costar).
Вычисления выполняли, вычитая пустое значение (без ТХУ) из тестовых значений с ТХУ, получив относительные значения содержания белка в пробах. При необходимости можно создать стандартную кривую, калибруя значения ТХУ с AAPF анализами клонов с известными коэффициентами пересчета. Впрочем, результаты ТХУ линейны относительно концентрации белка от 50 до 500 мг белка на мл (м.д.) и могут, таким образом, быть отложены на графике непосредственно в зависимости от активности фермента для выбора наиболее эффективных вариантов. Мутность/оптическое рассеяние увеличиваются прямо пропорционально общему количеству осаждаемого белка в культуральном супернатанте.
B. AAPF анализ протеазы в 96-луночных микропланшетах
Для определения протеазной активности протеаз и их вариантов согласно настоящему изобретению измеряли гидролиз N-сукцинил-L-аланил-L-аланил-L-пролил-L-фенил-п-нитроанилида (suc-AAPF-pNA). Использовали следующие растворы реактивов: 100 мМ Трис/HCl, pH 8,6, содержащий 0,005% TWEEN®-80 (Трис-буфер для разведения); 100 мМ Трис-буфер, pH 8,6, содержащий 10 мМ CaCl2 и 0,005% TWEEN®-80 (Трис/Ca-буфер) и 160 мМ suc-AAPF-pNA в ДМСО (стоковый раствор suc-AAPF-pNA) (Sigma: S-7388). Для получения рабочего раствора suc-AAPF-pNA 1 мл стокового раствора suc-AAPF-pNA добавляли к 100 мл Трис/Ca-буфера и тщательно перемешивали в течение, по меньшей мере, 10 секунд. Анализ проводили, добавляя 10 мкл разведенного раствора протеазы в каждую лунку, после чего сразу же добавляли 190 мкл 1 мг/мл рабочего раствора suc-AAPF-pNA. Растворы перемешивали в течение 5 секунд и изменение оптического поглощения в кинетическом режиме (20 измерений за 5 минут) измеряли при 410 нм в MTP-ридере при 25°C. Активность протеаз выражали в единицах AU (активность=ΔOD·мин-1мл-1).
C. Анализы на устойчивость к поверхностно-активному веществу и хелатирующему агенту
Устойчивость к воздействию ЛАС и ЛАС/ЭДТА измеряли после инкубирования тестируемой протеазы в присутствии ЛАС и ЛАС/ЭДТА соответственно в зависимости от остаточной активности, определяемой с использованием AAPF анализа.
Метод определения устойчивости к ЛАС
Реактивы:
Линейный додецилбензолсульфонат (ЛАС) в виде натриевой соли: Sigma D-2525
TWEEN®-80: Sigma P-8074
Трис-буфер (в виде основания): Sigma T-1378; 6,35 г растворяли в приблизительно 960 мл воды; pH доводили до 8,2 4Н HCl. Конечная концентрация Трис - 52,5 мМ.
Стоковый раствор ЛАС: готовили 10,5% раствор ЛАС в воде MQ (10,5 г в 100 мл MQ)
Трис-буфер - 100 мМ/pH 8,6 (100 мМ Трис/0,005% Tween®-80)
Трис-Ca буфер, pH 8,6 (100 мМ Трис/10 мМ CaCl2/0,005% Tween®-80)
Оборудование:
Плоскодонные MTP (Costar No. 9017)
Biomek FX
Мультисэмплер ASYS
Spectramax MTP-ридер
Инкубатор/шейкер iEMS
Инкубатор/шейкер Innova 4330
Многоканальная пипетка Biohit
Шейкер BMG Thermostar
Готовили 0,063% раствор ЛАС в 52,5 мМ Трис-буфере, pH 8,2. Рабочий раствор suc-AAPF-pNA получали путем добавления 1 мл 100 мг/мл стокового раствора suc-AAPF-pNA (в ДМСО) к 100 мл Трис-буфера (100 мМ), pH 8,6. С целью разведения супернатантов плоскодонные планшеты заполняли буфером для разведения, добавляли аликвоту супернатанта и тщательно перемешивали. Степень разведения зависела от концентрации контрольных проб протеазы в планшетах для культивирования (активность AAPF). Требуемая концентрация белка составляла 80 м.д.
Десять мкл разведенного супернатанта добавляли к 190 мкл 0,063% ЛАС буфера/лунку. MTP закрывали лентой, встряхивали в течение нескольких секунд и помещали в инкубатор (Innova 4230) при 45°C на 60 минут с перемешиванием при 200 об/мин. Начальную активность (t=10 минут) определяли через 10 минут инкубирования, внося 10 мкл смеси в каждую лунку нового MTP, содержащую 190 мкл рабочего раствора suc-AAPF-pNA. Данные растворы тщательно перемешивали и измеряли активность AAPF, используя MTP-ридер (20 измерений за 5 минут при 25°C).
Конечную активность (t=60 минут) определяли, отбирая еще 10 мкл раствора из планшета для инкубирования через 60 минут инкубирования. Затем определяли активность AAPF, как описано выше. Устойчивость образцов определяли путем вычисления отношения остаточной и начальной активности AAPF следующим образом:
Остаточная активность (%)=[значение t-60]*100/[значение t-10].
Методопределения устойчивости к ЛАС/ЭДТА
Устойчивость вариантов протеазы в присутствии репрезентативного анионного поверхностно-активного вещества (ЛАС - линейного алкилбензолсульфоната, додецилбензолсульфоната натрия - DOBS) и ЭДТА (динатриевой соли) измеряли после инкубирования при определенных условиях, а остаточную активность определяли, используя AAPF анализ. Использовали следующие реактивы: додецилбензолсульфонат натрия (DOBS, Sigma D-2525), TWEEN®-80 (Sigma P-8074), динатриевую соль ЭДТА (Siegfried Handel 164599-02), HEPES (Sigma H-7523); разгрузочный буфер: 50 мМ HEPES (11,9 г/л)+0,005% TWEEN®-80, pH 8,0; нагрузочный буфер: 50 мМ HEPES (11,9 г/л), 0,1% (в/об) DOBS (1 г/л), 10 мМ ЭДТА (3,36 г/л), pH 8,0, супернатанты культур референсной протеазы и варианта протеазы, содержащие 200-400 мкг/мл белков. Использовали следующее оборудование: MTP с V- или U-образным дном в качестве планшетов для разведения (Greiner 651101 и 650161 соответственно), плоскодонные MTP планшеты (Corning 9017) для разгрузочного и ЛАС/ЭДТА буфера, а также suc-AAPF-pNA, Biomek FX (Beckman Coulter), Spectramax Plus 384 MTP Reader (Molecular Devices), инкубатор/шейкер iEMS (амплитуда - 1 мм, Thermo Electron Corporation), герметизирующая лента: Nunc (236366).
Инкубатор/шейкер iEMS (Thermo/Labsystems) устанавливали на 29°C. Супернатанты культур разводили в планшетах, содержащих разгрузочный буфер до концентрации ~25 м.д. (планшет с эталонным разведением). 20 мкл пробы из планшета с эталонным разведением добавляли в планшеты, содержащие 180 мкл разгрузочного буфера, с получением конечной инкубационной концентрации 2,5 м.д. Содержимое перемешивали и выдерживали при комнатной температуре и выполняли AAPF анализ в этом же планшете. 20 мкл пробы из планшета с эталонным разведением также добавляли в планшеты, содержащие 180 мкл нагрузочного буфера (50 мМ HEPES (11,9 г/л), 0,1% (в/об), DOBS (1 г/л), 10 мМ ЭДТА (3,36 г/л), pH 8,0). Растворы перемешивали и сразу же помещали в шейкер iEMS при 29°C на 30 минут при 400 об/мин. Через 30 минут инкубирования проводили AAPF анализ в нагрузочном планшете. Устойчивость образцов определяли путем вычисления отношения остаточной и начальной активности AAPF следующим образом: Остаточная активность (%)=[mOD.мин-1, с нагрузкой]*100/[mOD.мин-1 без нагрузки].
D. Анализы эффективности чистки
Эффективность удаления красящего материала вариантов протеазы определяли в коммерчески доступных моющих средствах. Термическую инактивацию коммерческих моющих составов использовали для разрушения ферментативной активности любых белковых компонентов с сохранением свойств неферментативных компонентов. Таким образом, данный метод подходил для подготовки коммерческих моющих средств к применению в анализе вариантов ферментов по настоящему изобретению.
Микрообразцы ткани
Микрообразцы ткани диаметром ¼" (6,4 мм) были получены от CFT. Один или два микрообразца помещали вертикально в каждую лунку 96-луночного MTP, чтобы вся поверхность образца была полностью доступна для обработки (то есть не укладывали на дно лунки).
Анализ с BMI микрообразцами
Микрообразцы ткани, содержащие молоко, кровь и чернила (BMI), диаметром 0,25 дюйма (6,4 мм) были получены от CFT. Перед разрезанием образцов ткань (EMPA 116) промывали водой. Один микрообразец помещали вертикально в каждую лунку 96-луночного микропланшета, чтобы вся поверхность образца была доступна для обработки (то есть не укладывали на дно лунки). Требуемый раствор моющего средства подготавливали, как описано в настоящей заявке. После уравновешивания Thermomixer при 25°C 190 мкл раствора моющего средства добавляли в каждую лунку MTP, содержащую микрообразцы. К данной смеси добавляли 10 мкл разведенного раствора фермента, чтобы конечная концентрация фермента составила 1 мкг/мл (согласно BCA анализу). MTP закрывали лентой и помещали в инкубатор на 30 минут с перемешиванием при 1400 об/мин. После инкубирования в подходящих условиях 100 мкл раствора из каждой лунки переносили в новый MTP. Новый MTP, содержащий 100 мкл раствора в лунке, считывали при 405 нм, используя MTP-ридер SpectraMax. Также в анализ включали холостые контроли, как и контроль, содержащий два микрообразца, моющее средство, но без фермента.
Предварительно промытый образец ткани
Данный тип микрообразца предварительно промывали в деионизированной воде в течение 20 минут при температуре окружающей среды. После стадии предварительной промывки образцы помещали на бумажные полотенца для просушки. Затем высушенные на воздухе образцы выбивали кольцевым пробойником диаметром ¼" (6,4 мм) на ударном прессе. Наконец, два микрообразца вертикально помещали в каждую лунку 96-луночного MTP, чтобы вся поверхность образца была доступна для обработки (то есть образцы не укладывали на дно лунки).
Моющие средства
Для североамериканских (NA) и западноевропейских (WE) высокоэффективных стиральных (HDL) моющих средств термоинактивацию проводили путем выдерживания предварительно взвешенного жидкого моющего средства (в стеклянной колбе) в водяной бане при 95°C в течение 2 часов. Моющие средства были куплены в местных супермаркетах. И непрогретые, и прогретые моющие средства оценивали в течение 5 минут после растворения моющего средства, чтобы точно определить процент дезактивированного фермента. Активность фермента анализировали с помощью AAPF анализа.
Для анализа активности фермента в термоинактивированных моющих средствах рабочие растворы моющих средств приготавливали из термоинактивированных стоков. Требуемые количества солей жесткости (6 или 12 gpg (гранов на галлон)) и буфер добавляли к моющим растворам для создания необходимых условий. Растворы перемешивали на вортексе или путем переворачивания колб.
Ферменты и оборудование
Образцы референсных сериновых протеаз и их вариантов получали из профильтрованной культуральной среды культур, выращенных в MTP планшетах. Использовали следующее оборудование: Biomek FX Robot (Beckman Coulter), MTP-ридер SpectraMAX (тип 340; Molecular Devices), инкубатор/шейкер iEMS (Thermo/Labsystems); плоскодонные MTP (Costar, тип 9017, используемые для считывания реакционных планшетов после инкубирования); а также MTP планшеты с V-образным дном (Greiner 651101, используемые для предварительного разведения супернатанта). В данном анализе протеазы гидролизируют субстрат и высвобождают пигмент и нерастворимые частицы из субстрата. Таким образом, степень мутности является показателем активности фермента.
Эффективность удаления красящих материалов референсных сериновых протеаз и полученных на их основе вариантов определяли на микрообразцах ткани в микромасштабе на MTP, в коммерчески доступном термоинактивированном моющем средстве. Использовали следующие реактивы: 5 мМ HEPES, pH 8,0, или 5 мМ MOPS, pH 7 буферы, с соотношением Ca:Mg 3:1 для средней жесткости воды. (CaCl2:MgCl2·6H2O); стоковый раствор 15000 гранов на галлон (gpg) (256,5 г/л) разбавлли до 6 gpg, 2 BMI-образца (кровь/молоко/чернила) на планшет: хлопчатобумажные образцы EMPA-116 BMI, изготовленные фирмой CFT: предварительно промытые и выбитые 2 образца на лунку, а также термоинактивированное моющее средство TIDE®2X Cold, доступное в продаже, в котором было подтверждено отсутствие протеазной активности.

В инкубаторе устанавливали требуемую температуру (16°C или 32°C). Пробы по 10 мкл из планшета с эталонным разведением с ~10 м.д. фермента добавляли в планшеты с 2 образцами BMI, содержащие 190 мкл рабочих растворов моющего средства, приведенных выше. Объем доводили так, чтобы получить конечную концентрацию 0,5 м.д. для вариантов в аналитических планшетах. Планшеты сразу же переносили в инкубатор iEMS и инкубировали в течение 30 минут с перемешиванием 1400 об/мин при данной температуре. После инкубирования 100 мкл супернатанта переносили в новые 96-луночные планшеты и измеряли оптическое поглощение в MTP-ридере при 405 нм и/или 600 нм. Контрольные лунки, содержащие 1 или 2 микрообразца ткани и моющее средство без добавления образцов протеазы, также были включены в тест. Измерение при 405 нм обеспечивает более высокое значение и позволяет отследить удаление пигмента, тогда как измерение при 600 нм позволяет отследить мутность и очистку.
Вычисление активности при удалении красящего материала для всех методов анализа с использованием микрообразцов ткани
Полученное значение оптического поглощения корректировали с учетом холостого значения (субстрат без фермента), получая уровень гидролитической активности. Для каждого образца (варианта) вычисляли коэффициент эффективности. Коэффициент эффективности сравнивает эффективность варианта (фактическое значение) и стандартного фермента (теоретическое значение) при одинаковой концентрации белка. Кроме того, теоретические значения могут быть вычислены с использованием параметров уравнения Ленгмюра стандартного фермента.
E. Сравнительная удельная активность протеаз и их вариантов
Чтобы провести различие между вариантами протеаз, вычисляли сравнительную удельную активность, используя в качестве субстрата suc-AAPF-pNA, что позволяло выполнить сравнение и ранжирование вариантов по отношению к дикому типу или стандартной протеазе. Удельную активность в отношении субстрата suc-AAPF-pNA определяли путем деления протеолитической активности на измеренные значения ТХУ каждого образца, используя анализы, описанные выше. Используя данные значения, вычисляли сравнительную удельную активность (удельная активность варианта/удельная активность референсной протеазы).
F. Коэффициент эффективности
Коэффициент эффективности сравнивает эффективность варианта (фактическое значение) и стандартной или референсной протеазы (теоретическое значение) при одинаковой концентрации белка. Кроме того, теоретические значения могут быть вычислены с использованием параметров уравнения Ленгмюра стандартной протеазы. Коэффициент эффективности (PI), который выше 1 (PI>1), идентифицирует лучший вариант по сравнению со стандартом (например, диким типом), тогда как PI, равный 1 (PI=1), идентифицирует вариант, который функционирует так же, как и стандарт, а PI, который ниже 1 (PI<1), идентифицирует вариант, который функционирует хуже, чем стандарт. Таким образом, PI позволяет идентифицировать не только более эффективные варианты, но и те варианты, которые менее пригодны к применению при некоторых обстоятельствах.
ПРИМЕР 2
Создание библиотеки с направленными ISD (вставками, заменами, делециями)
Метод на основе ПЦР использовали для создания библиотеки модифицированных полинуклеотидных последовательностей субтилизина B. amyloliquefaciens BPN'-Y217L (коммерчески доступного как субтилизин PURAFECT® PRIME), содержащих вставки, делеции и/или замены в рамке считывания в двух областях BPN'-Y217L (положения 63-77 и 92-132 зрелой области), как показано на фиг. 1 (см. Pisarchik et al., Prot. Eng. Des. Select., 20:257-265 [2007]). Два набора олигонуклеотидов, которые равномерно покрывали целевые области гена BPN'-Y217L полноразмерного белка длиной 392 аминокислот, в прямом и обратном направлении, использовали для амплификации 5'- и 3'-сегментов части гена BPN'-Y217L. Кодирующая область зрелой протеазы BPN'-Y217L содержит сайты рестрикции KpnI и XhoI для целей клонирования:

Аминокислотная последовательность белка-предшественника BPN'-Y217L приведена ниже. В данной последовательности жирным шрифтом показана зрелая протеаза BPN'-Y217L:
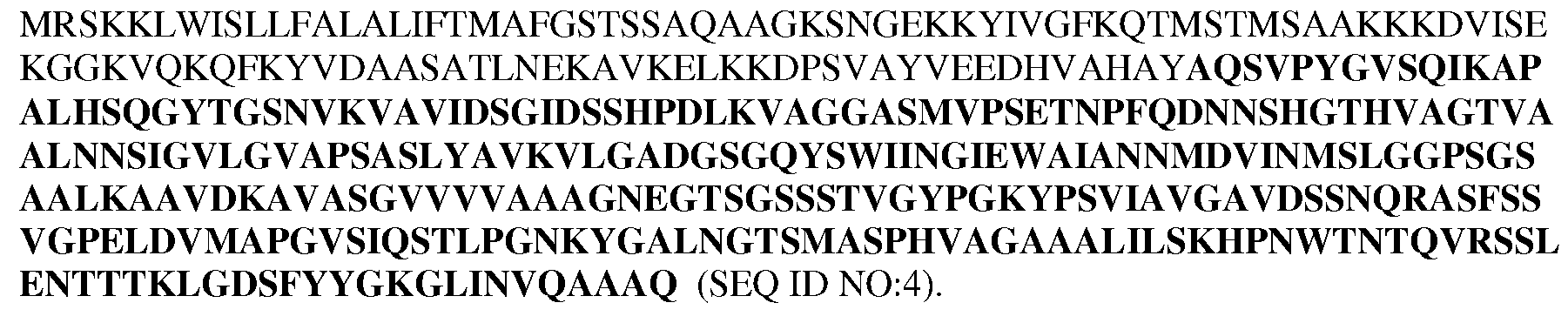
Аминокислотную последовательность зрелой протеазы BPN'-Y217L использовали в качестве основы для создания различных библиотек, описанных в настоящей заявке:

Каждый олигонуклеотид содержал приблизительно 20-24 нуклеотида, необходимых для отжига с матрицей, целевые кодоны (с вырождением или без) и сайт узнавания Eam1104I. Каждый последующий праймер сдвигали на 3 п.н. вправо по ходу последовательности, до конца целевой области. Две реакции ПЦР (5'- и 3'-сегменты) содержали 5'-прямые или 3'-обратные олигонуклеотиды, фланкирующие последовательность гена, в комбинации с соответствующими противоположно направленными олигонуклеотидами. 5'-Фрагменты амплифицировали с плазмиды pAC-FNA10 (см. фиг. 2A) с использованием одного прямого праймера (P3203, TGGATCAGTTTGCTGTTTGCT; SEQ ID NO:6) и обратных праймеров P4385-P4441 (см. таблицу 2-1), каждый из которых содержал сайт рестрикции Eam1104I. 3'-Фрагменты амплифицировали с использованием одного обратного праймера (P3435, ATGTATCAAGATAAGAAAGAACAAG; SEQ ID NO:7) и прямых праймеров P4328-P4384 (см. таблицу 2-1), каждый из которых содержал сайт рестрикции Eam1104I.
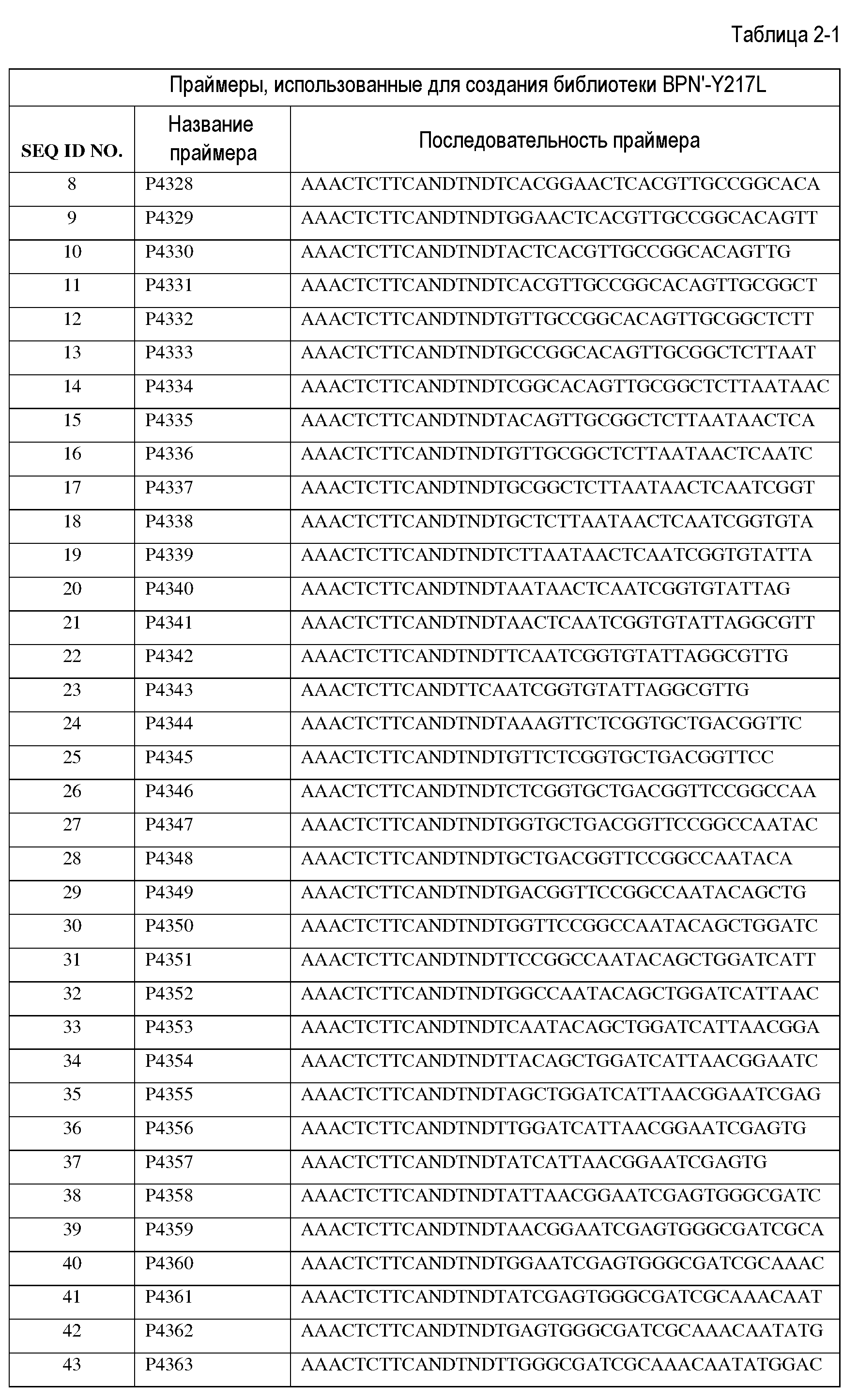
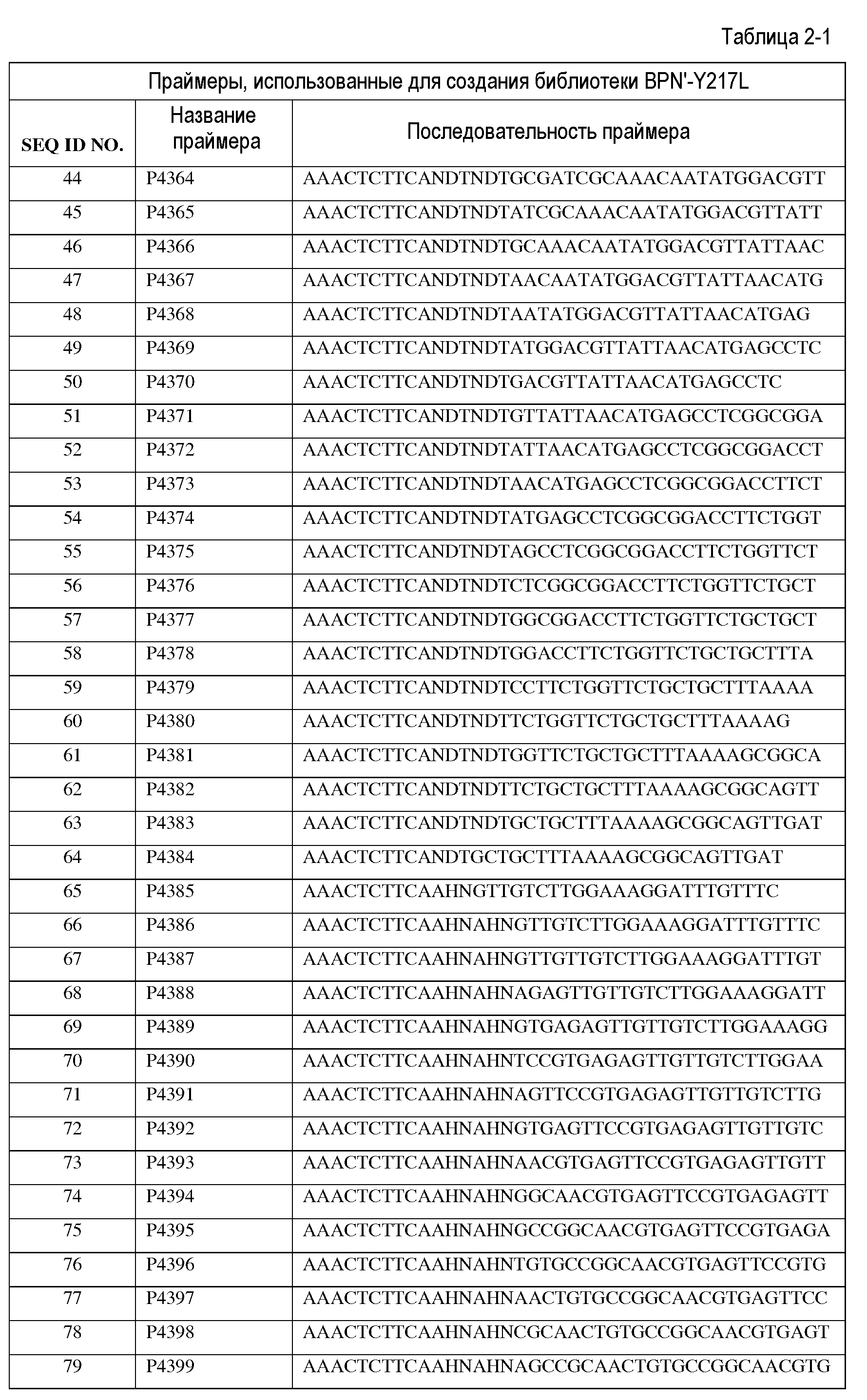

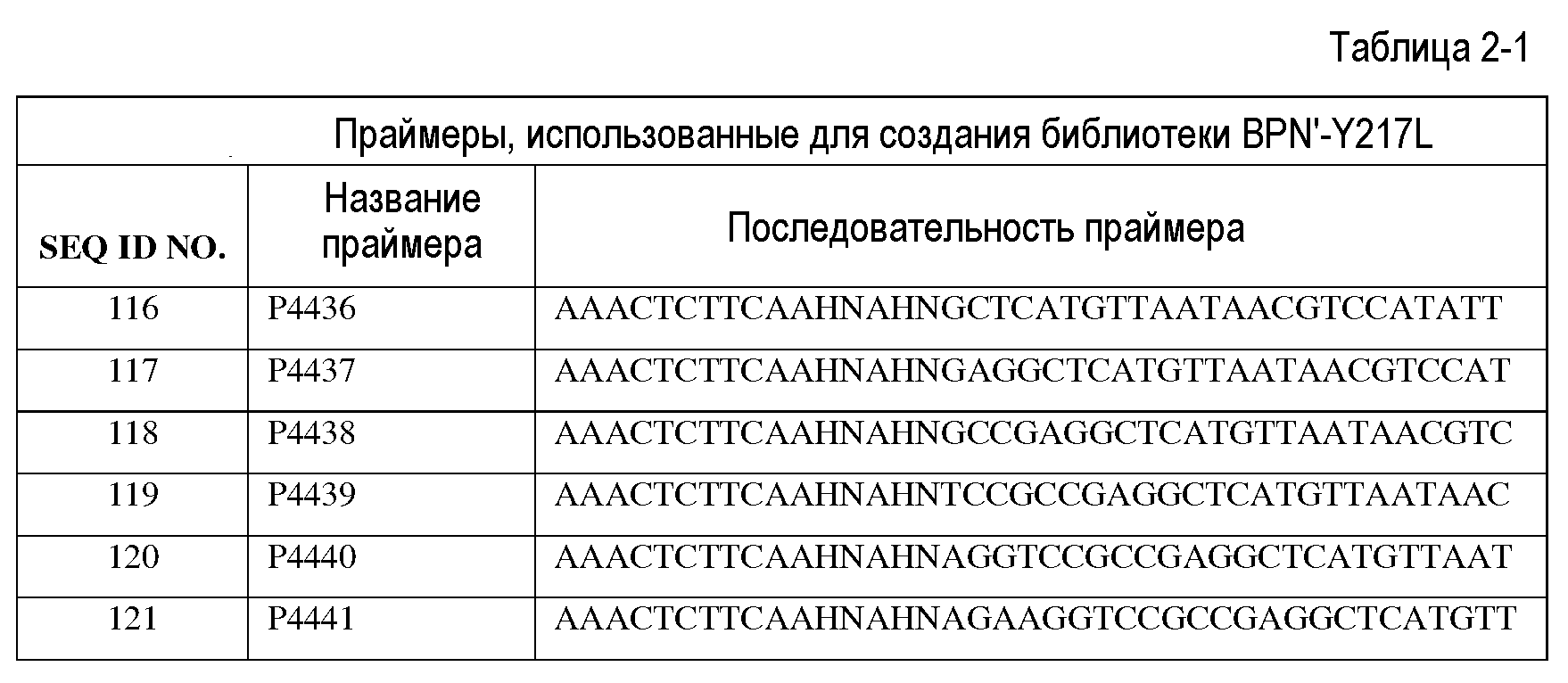
Каждая реакция амплификации содержала 30 пмоль каждого олигонуклеотида и 100 нг ДНК матрицы pAC-FNA10. Реакции амплификации проводили с использованием ДНК-полимеразы Vent (New England Biolabs). ПЦР-смесь (20 мкл) подвергали первоначальному нагреву до 95°C в течение 2,5 мин, затем 30 циклам денатурации при 94°C в течение 15 с, отжигу при 55°C в течение 15 с и элонгации при 72°C в течение 40 с. После амплификации левый и правый фрагменты, полученные с помощью реакций ПЦР, выделяли из геля и смешивали (приблизительно по 200 нг каждого фрагмента). Каждая смесь содержала три левых фрагмента, направленных на три смежных кодона, и три правых фрагмента, направленных на те же кодоны. Указанные смеси расщепляли Eam1104I, лигировали ДНК-лигазой T4 и амплифицировали с использованием фланкирующих праймеров (P4299 CGTTGAAGAAGATCACGTAGCA, SEQ ID NO:122; и P3246 TTTATTTTATAAACTCATTCCCTGAT, SEQ ID NO:123). Полученные фрагменты расщепляли с использованием MluI и XhoI и клонировали по сайтам MluI/XhoI в экспрессионную плазмиду Bacillus subtilis pHPLT-FNA (фиг. 2B). Полинуклеотидная последовательность кассеты экспрессии BPN'-Y217L из используемого вектора pHPLT показана ниже.
Полинуклеотидная последовательность кассеты экспрессии из вектора pHPLT (Plat промотор - pre-pro-BPN'-Y217L - терминатор) (SEQ ID NO:124) приведена ниже:

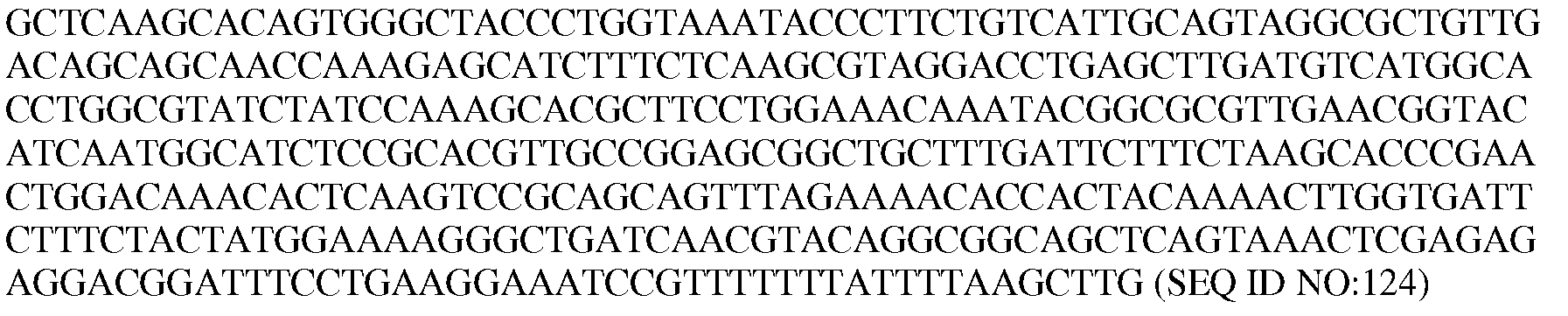
Лигазные смеси амплифицировали, используя амплификацию по типу катящегося кольца согласно рекомендациям производителя (Epicentre). Один мкл лигазной смеси смешивали с 5 мкл буфера для образца, нагревали до 95°C в течение 3 минут и охлаждали на льду. Затем в каждую пробирку добавляли 5 мкл реакционного буфера и 0,2 мкл фермента, после чего проводили инкубирование при 30°C в течение 10 часов. Продукты амплификации по типу катящегося кольца разводили в 100 раз и использовали для трансформации Bacillus subtilis. Клетки Bacillus subtilis (генотип: ΔaprE, ΔnprE, ΔspoIIE, amyE::xylRPxylAcomK-phleo), сделанные компетентными с помощью индукции гена comK под контролем индуцируемого ксилозой промотора (см., например, Hahn et al., Mol Microbiol, 21:763-775 [1996]), трансформировали 45 библиотеками, содержащими последовательности ДНК, кодирующие протеазу BPN'-Y217L с мутированными областями. Клетки выращивали в 1 мл среды Лурия-Бертрани (LB) при 37°C в течение 1 часа, а затем высевали на чашки LB, содержащие 1,6% обезжиренного молока и 10 мг/л неомицина, и оставляли на ночь при 37°C. По меньшей мере, 2000 клонов из каждой из 45 библиотек скринировали на предмет образования зон обесцвечивания. При посеве на чашки с обезжиренным молоком 0,05-20% клонов производили зоны обесцвечивания. Ограниченное число клонов, производящих зоны обесцвечивания, секвенировали. Указанные клоны отличались по соотношению вставок и делеций, но при этом ни один из них не имел мутаций, приводивших к сдвигу рамки считывания. Клоны, производящие зоны обесцвечивания, дополнительно скринировали на активность AAPF, используя анализ в 96-луночных планшетах, описанный в примере 1. Варианты белка BPN'-Y217L получали путем культивирования трансформантов B. subtilis в 96-луночных микропланшетах, как описано ранее. Концентрацию белка в супернатантах культур определяли с помощью осаждения ТХУ, как описано в примере 1.
ПРИМЕР 3
Эффективность удаления красящего материала вариантов BPN'-Y217L, полученных посредством направленных ISD
Результаты экспериментов, проведенных с целью определения активности при удалении красящих материалов (анализ на микрообразцах ткани для определения эффективности удаления красящих материалов при стирке с использованием образцов ткани EMPA 116 (красящие материалы BMI, CFT) при pH 8/16°C) и определения концентрации белка с помощью осаждения ТХУ (тесты целевых параметров) для вариантов BPN'-Y217L, полученных, как описано выше, представлены в таблице 3-1. Результаты были получены с использованием методов, описанных в примере 1, со следующими модификациями для анализа эффективности удаления красящих материалов. В тестах использовали термоинактивированное моющее средство Tide 2X (Procter&Gamble).
Термоинактивация коммерческих моющих составов служила для разрушения эндогенной ферментативной активности любых белковых компонентов с сохранением свойств неферментативных компонентов. Термоинактивацию моющих средств выполняли путем выдерживания предварительно взвешенных количеств жидкого моющего средства (в стеклянной колбе) в водяной бане при 95°C в течение 2 часов. Моющее средство было закуплено в местных супермаркетах. Непрогретые и прогретые моющие средства оценивали в течение 5 минут после растворения моющего средства, чтобы точно определить процент дезактивированного фермента. Активность фермента определяли с помощью AAPF анализа. Как описано в настоящей заявке, функциональные характеристики вариантов BPN'-Y217L определяли количественно как коэффициент эффективности ("Pi" или "PI"), который является отношением эффективности варианта к эффективности исходного белка BPN'-Y217L. Варианты BPN'-Y217L, демонстрирующие значение PI, большее или равное 0,5, при удалении красящего материала BMI и/или осаждении ТХУ показывали улучшенные эффекты при очистке и/или экспрессии.
Мутации обозначены однобуквенным кодом, который соответствует исходной аминокислоте, затем следует трехзначный номер положения, а затем однобуквенный код мутантной аминокислоты, присутствующей в варианте. Например, мутация с заменой глицина (G) в положении 87 серином (S) обозначена как "G087S". Множественные мутации обозначены путем вставки знака "/" между мутациями. Мутации в положениях 87 и 90 обозначены как "G087S/A090Y". В случае делеций используется однобуквенный код "Z". В случае вставки относительно родительской последовательности однобуквенный код "Z" находится слева от номера положения. В случае делеции однобуквенный код "Z" находится справа от номера положения. В случае вставок номер положения представляет собой номер положения перед аминокислотной вставкой (вставками) плюс 0,01 для каждой аминокислоты. Например, вставка трех аминокислотных остатков аланина (A), серина (S) и тирозина (Y) между положениями 87 и 88 обозначена как "Z087.01A/Z087.02S/Z087.03Y." Таким образом, в случае сочетания всех мутаций, указанных выше, и делеции в положении 100 обозначение является следующим: "G087S/Z087.01A/Z087.02S/Z087.03Y/A090Y/A100Z."
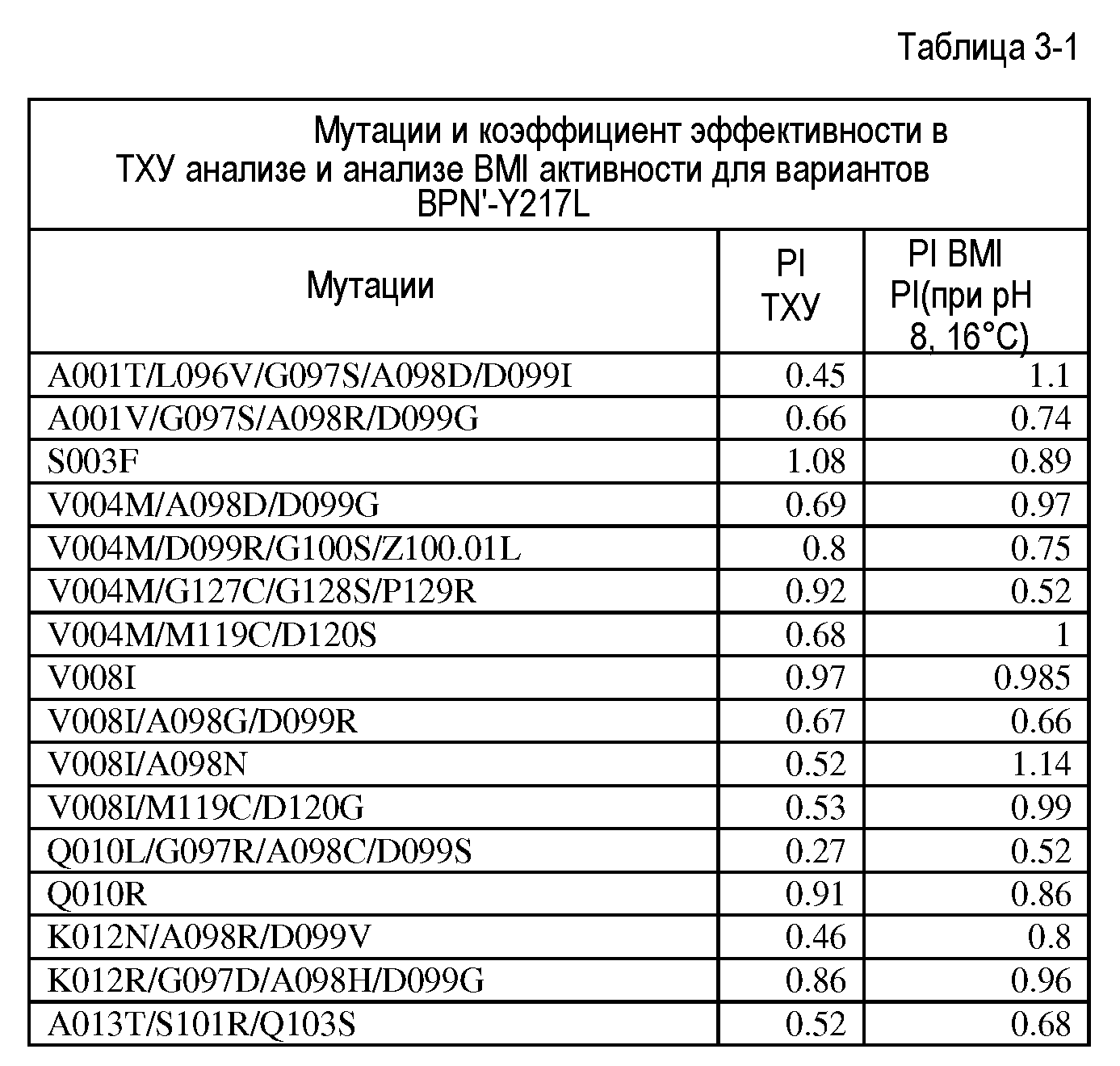
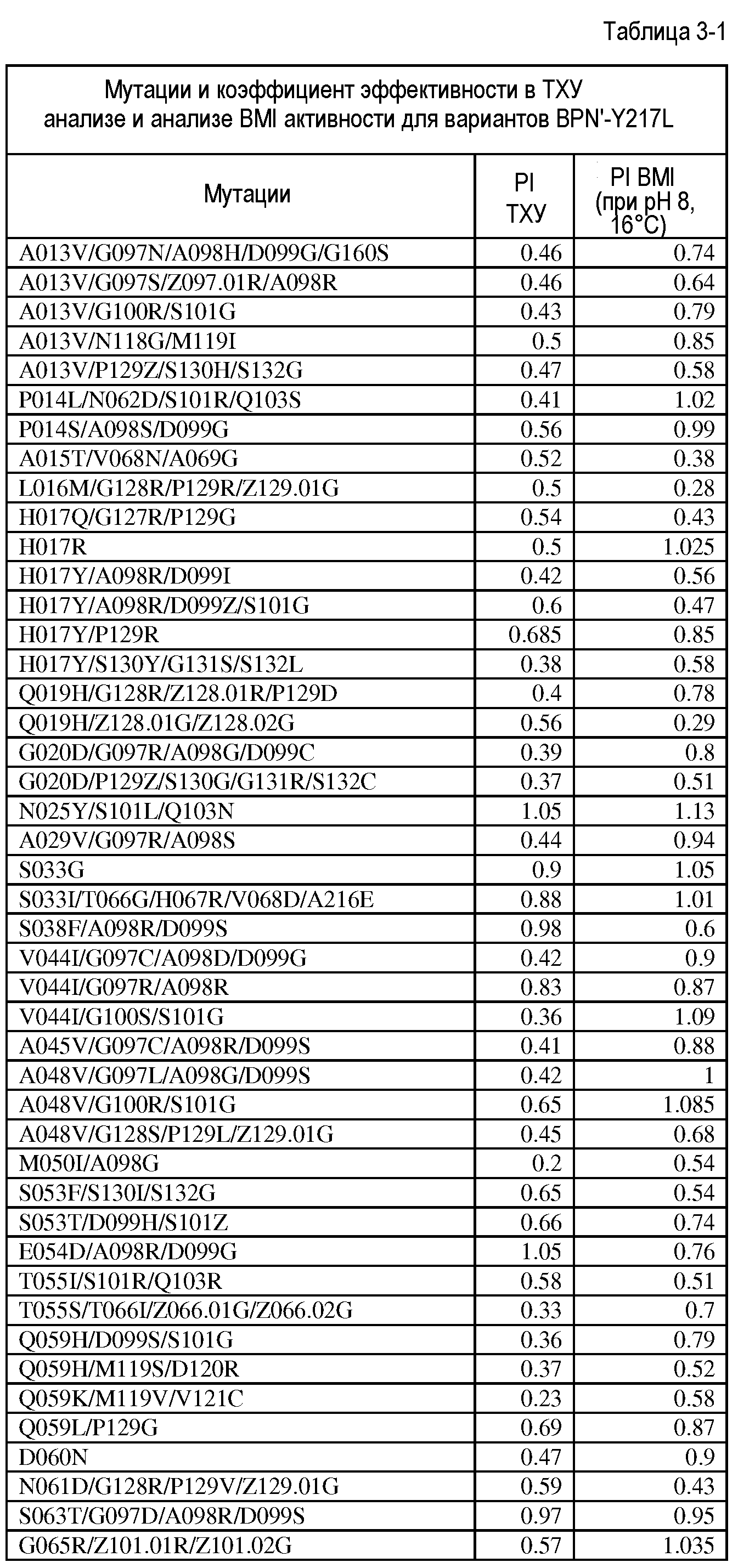

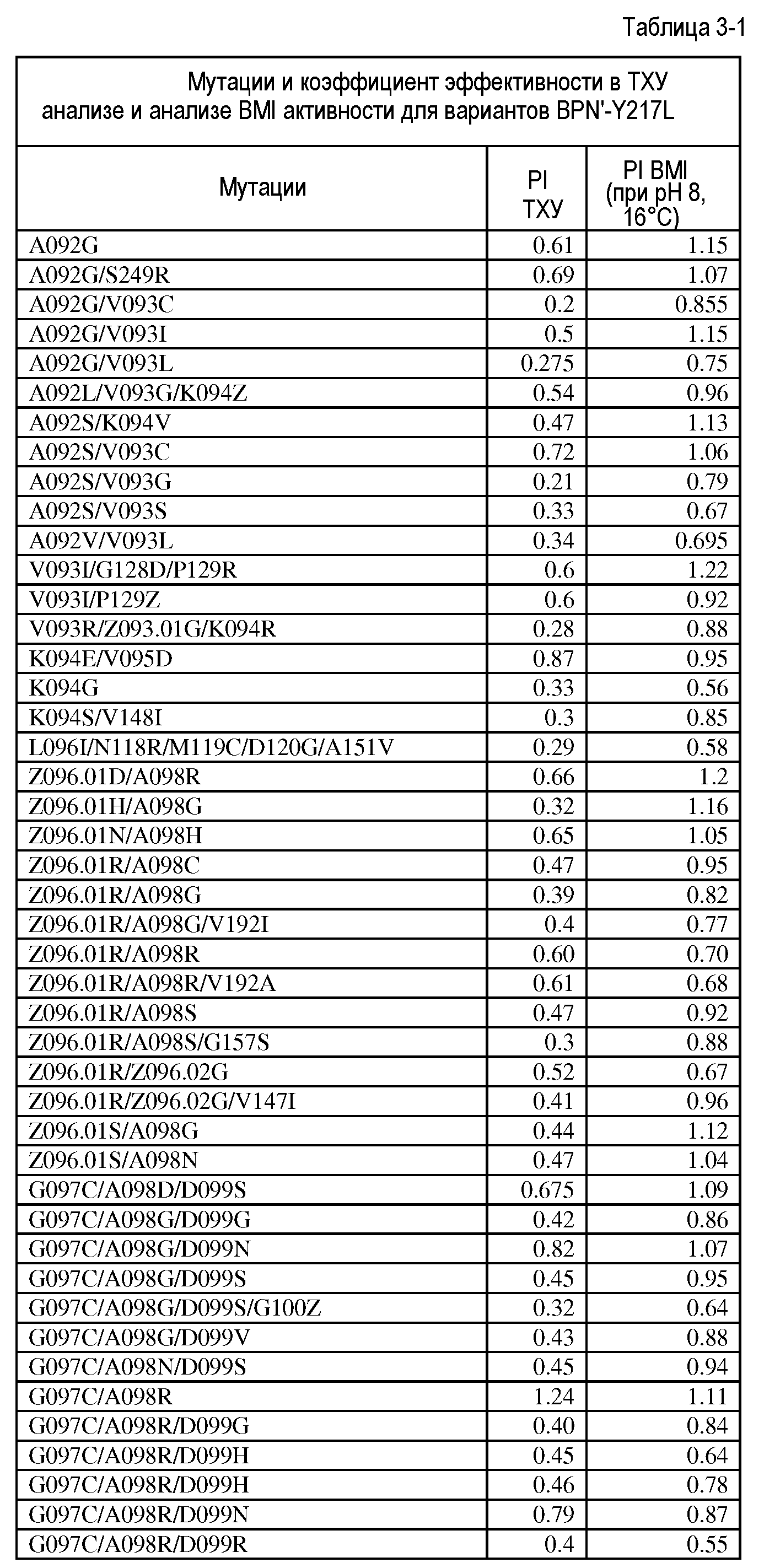

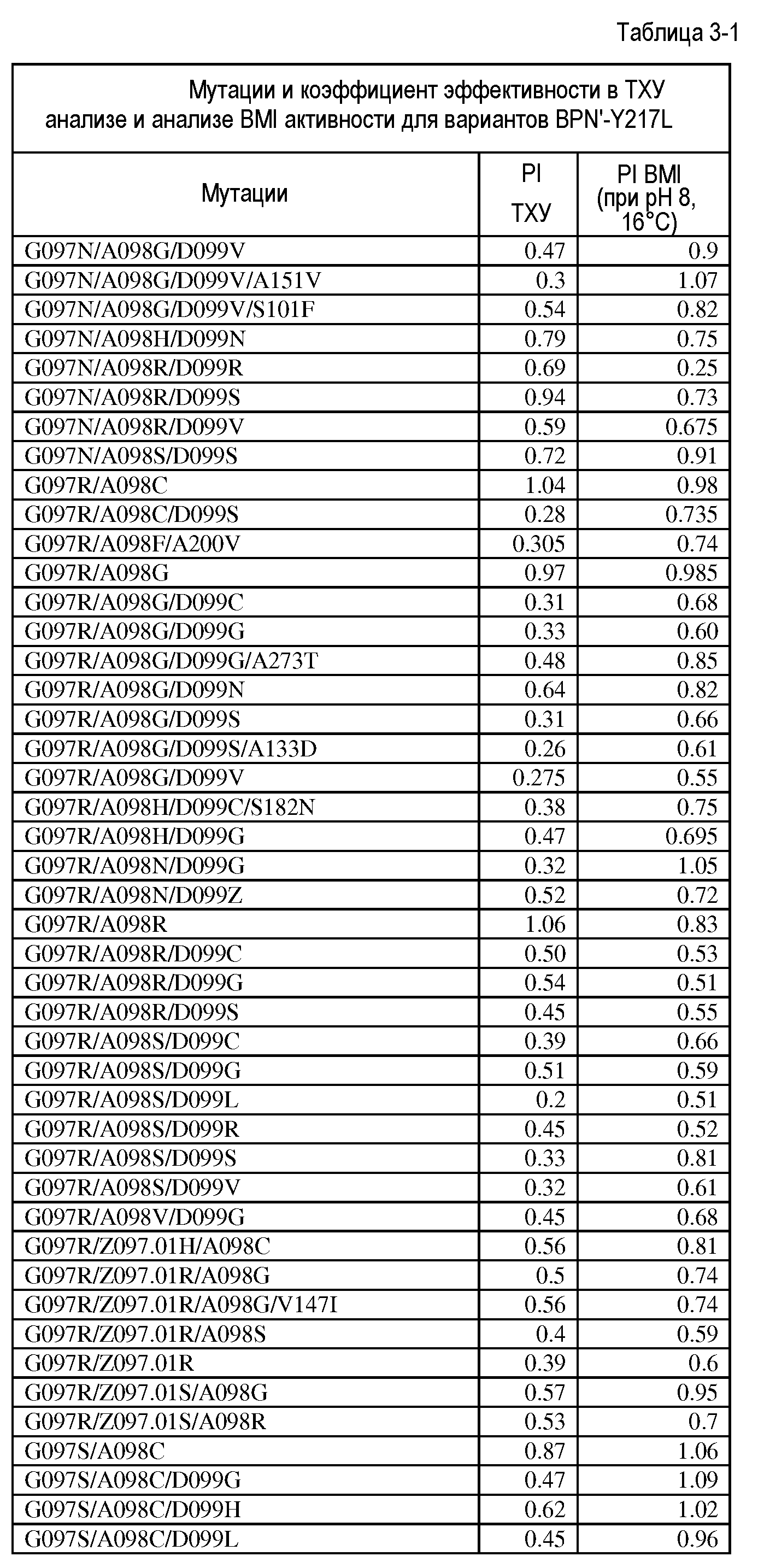
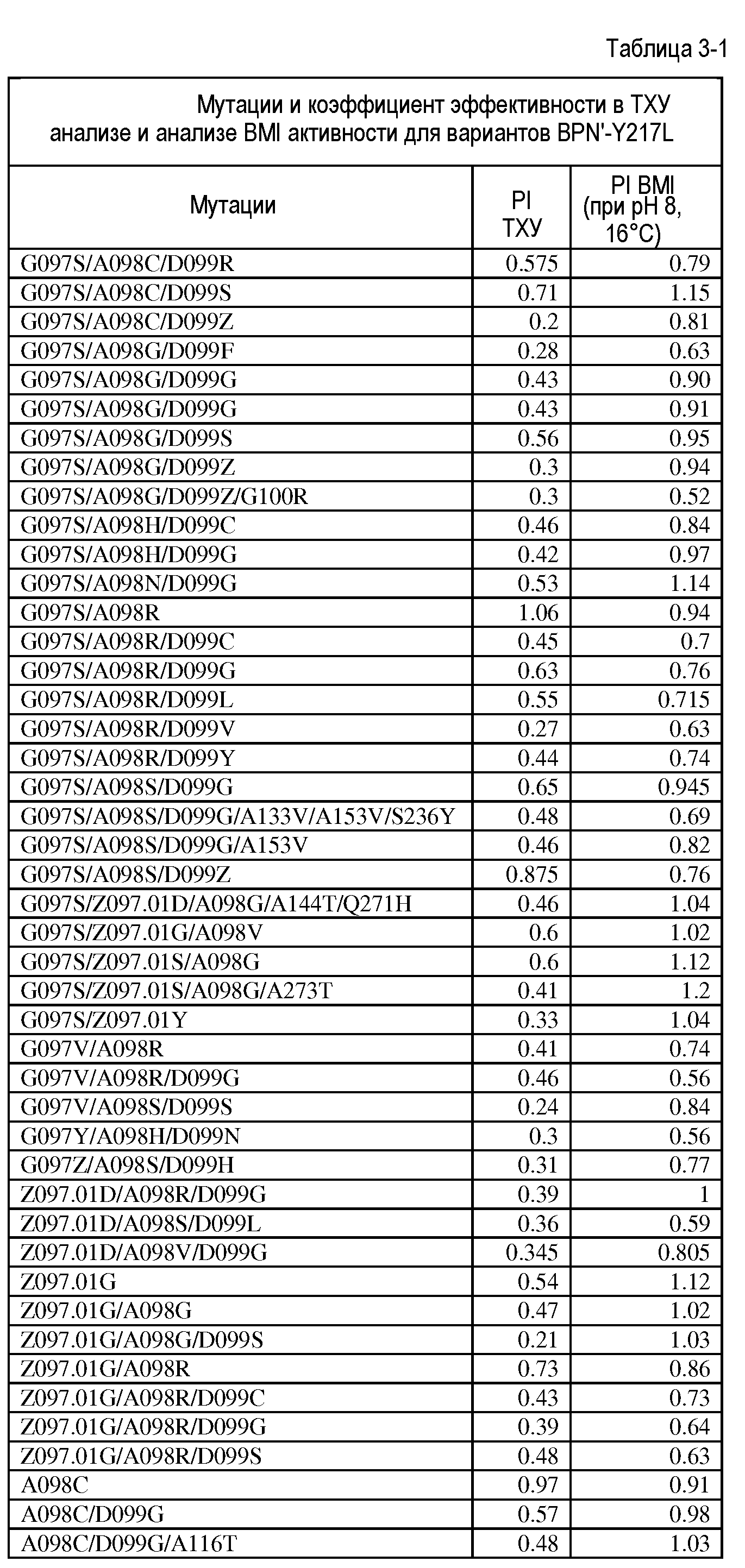
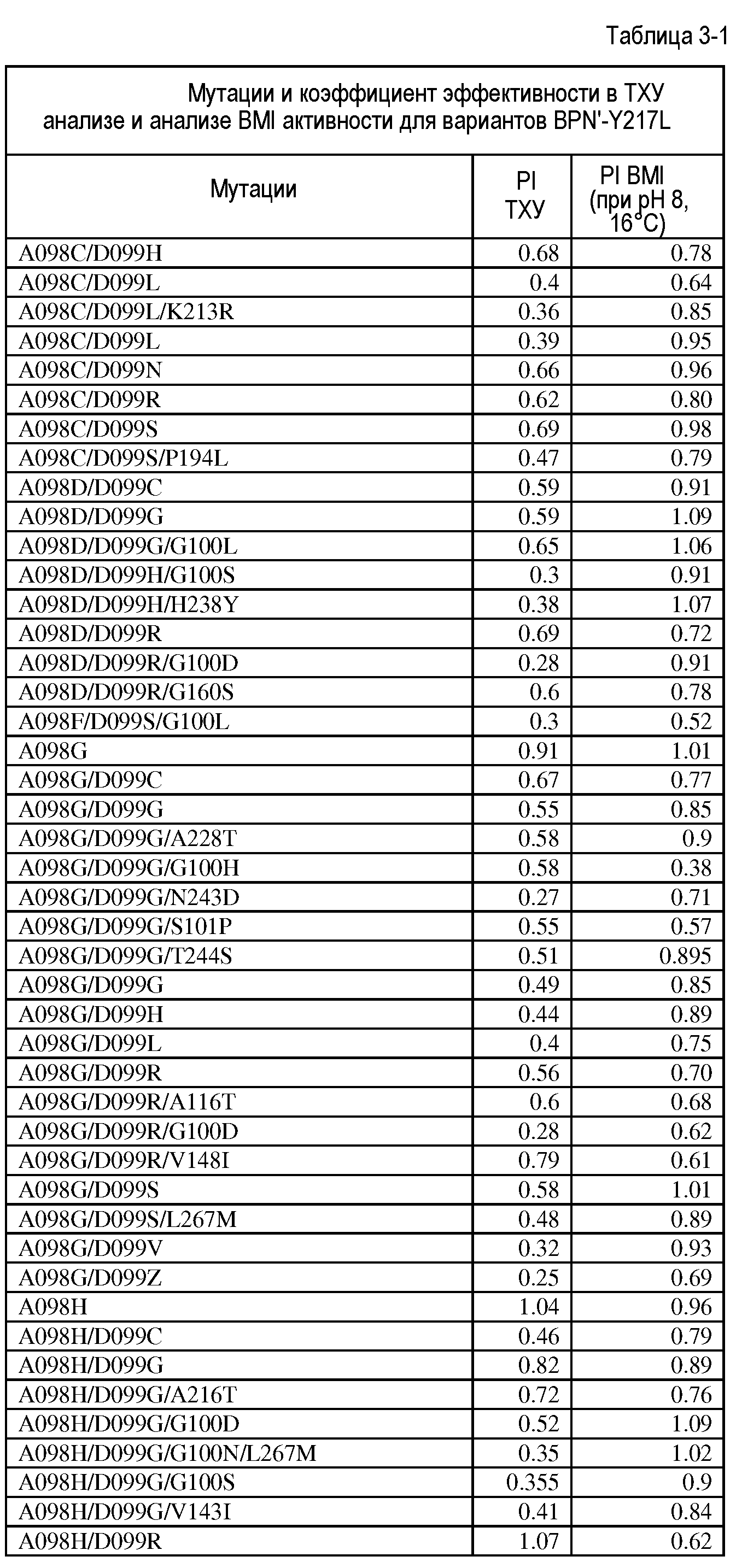
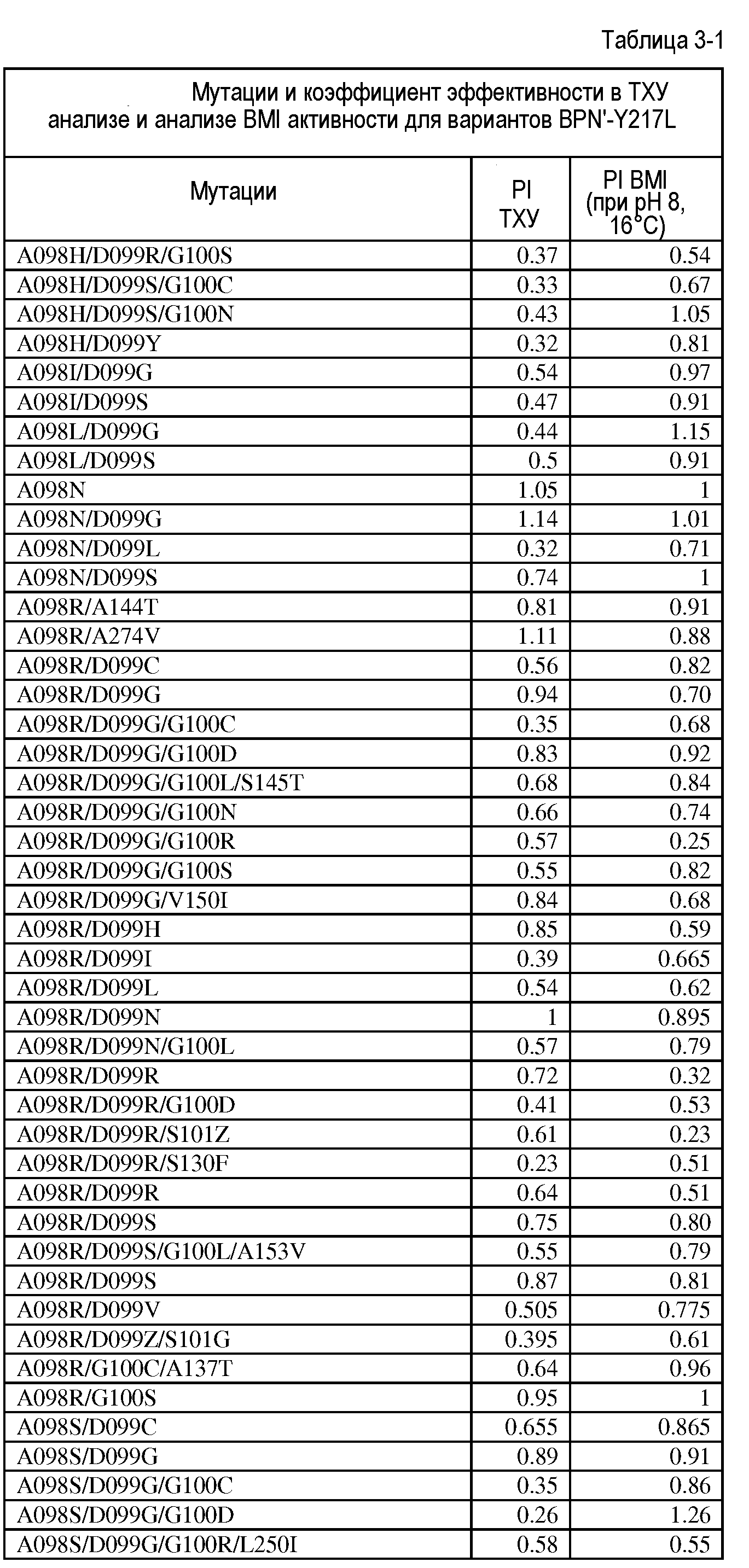
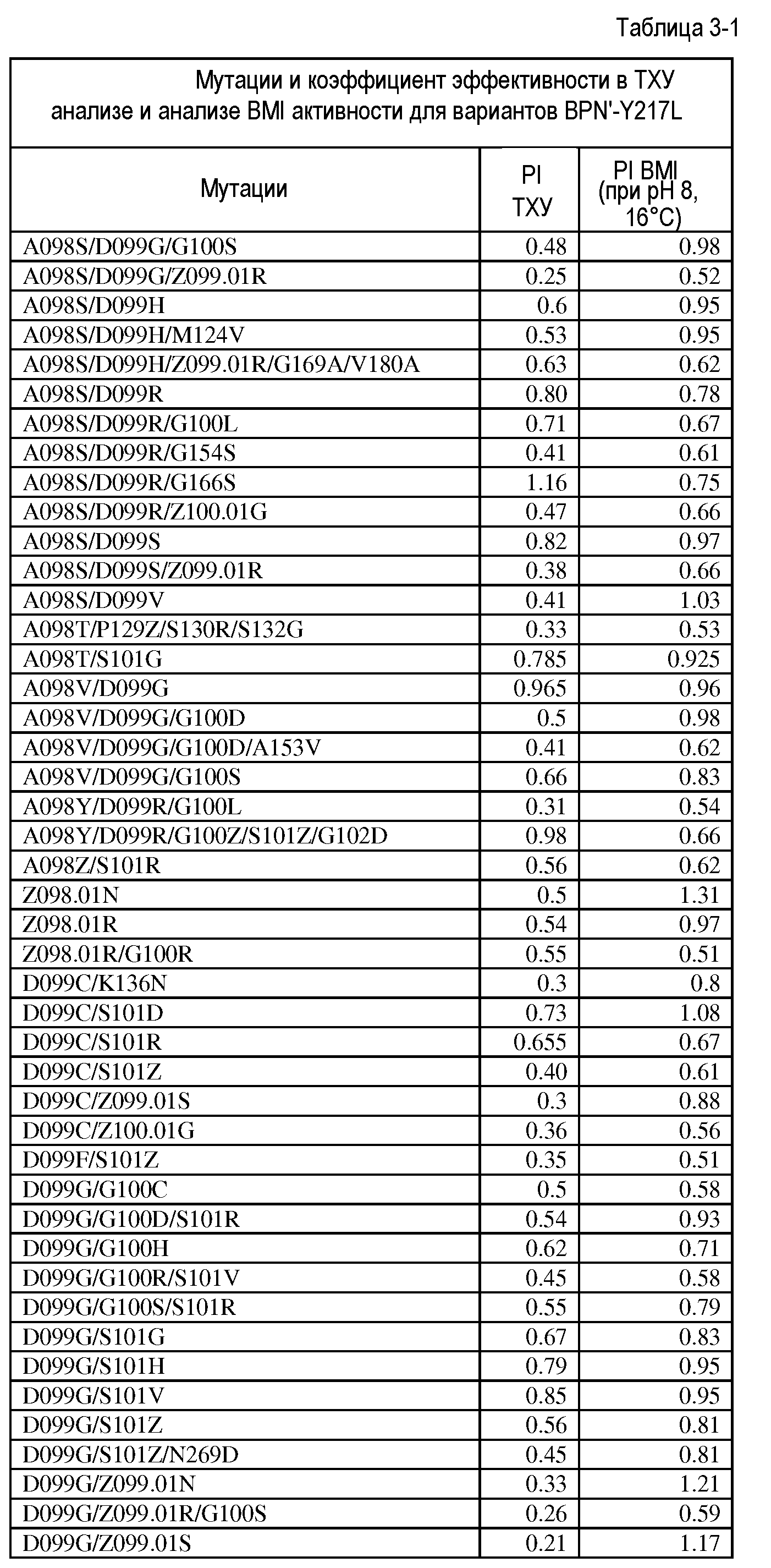
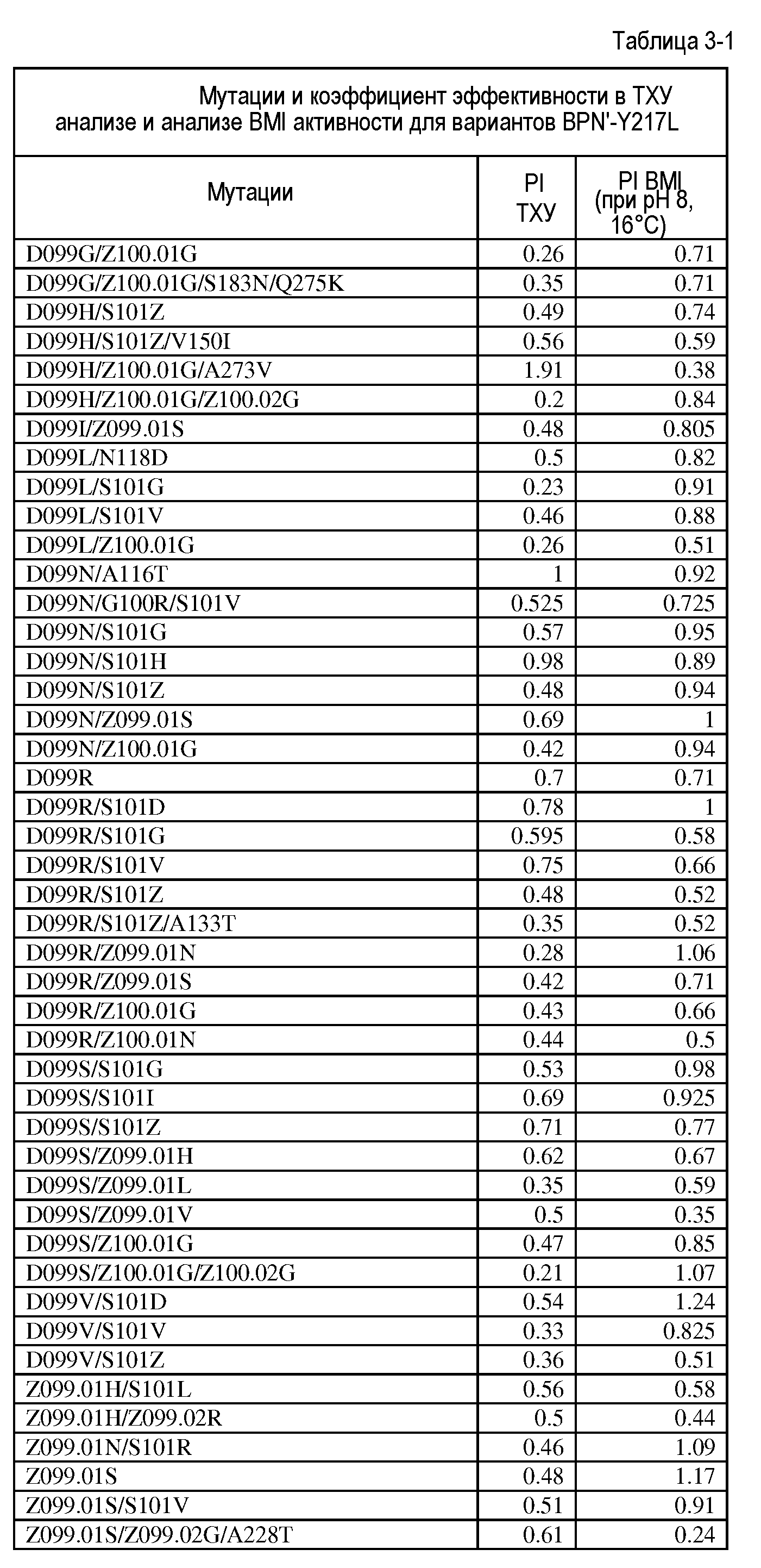

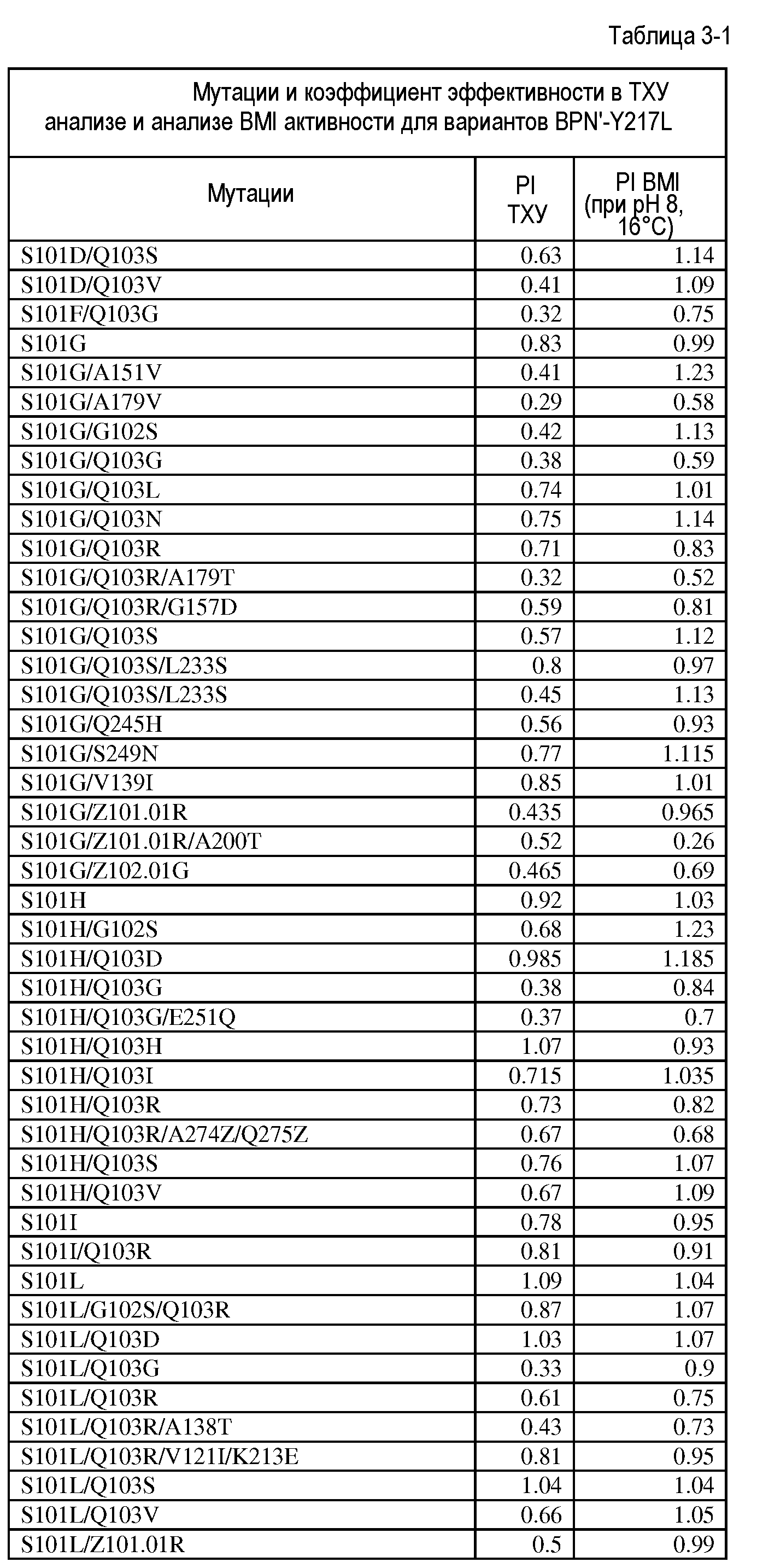
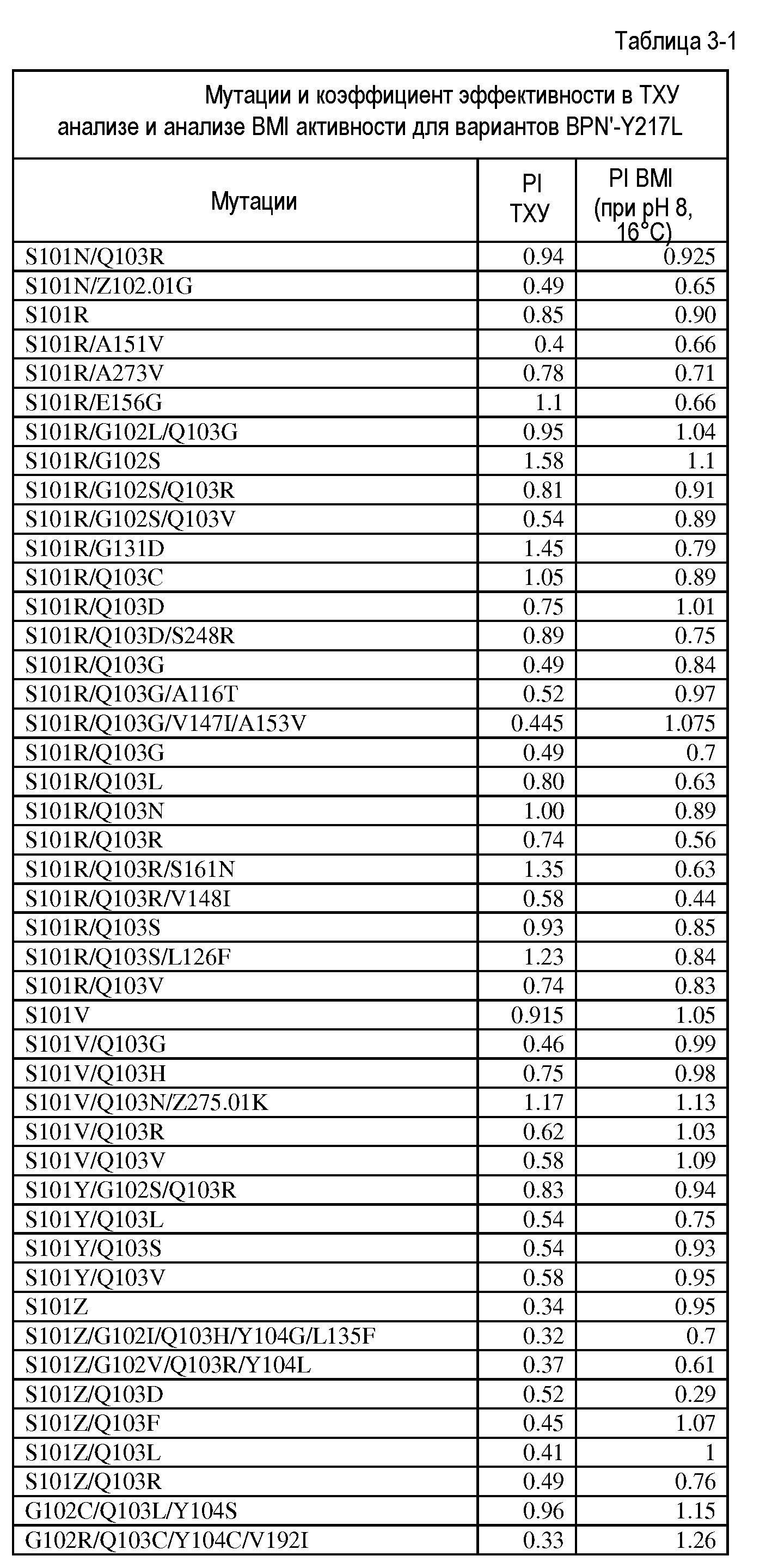



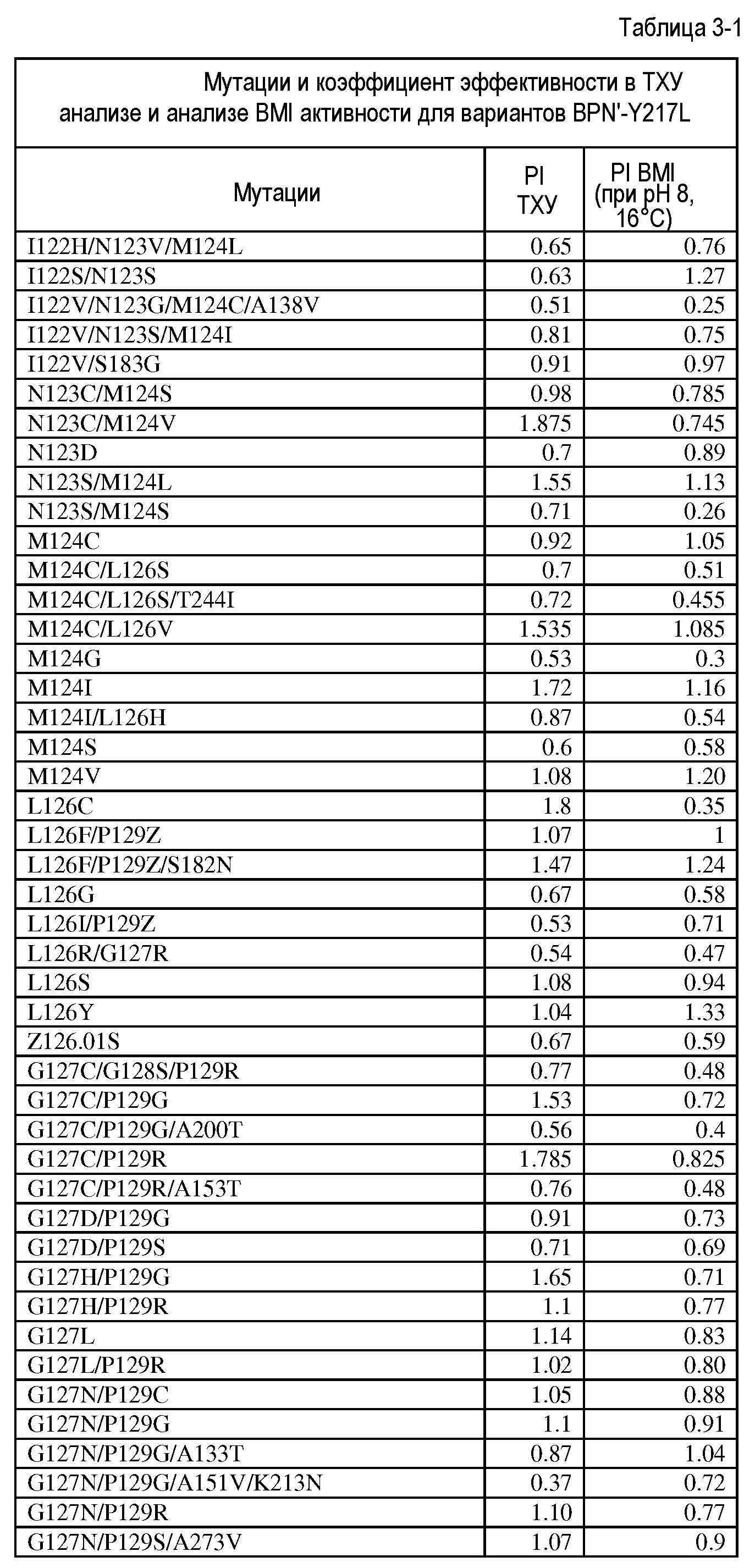
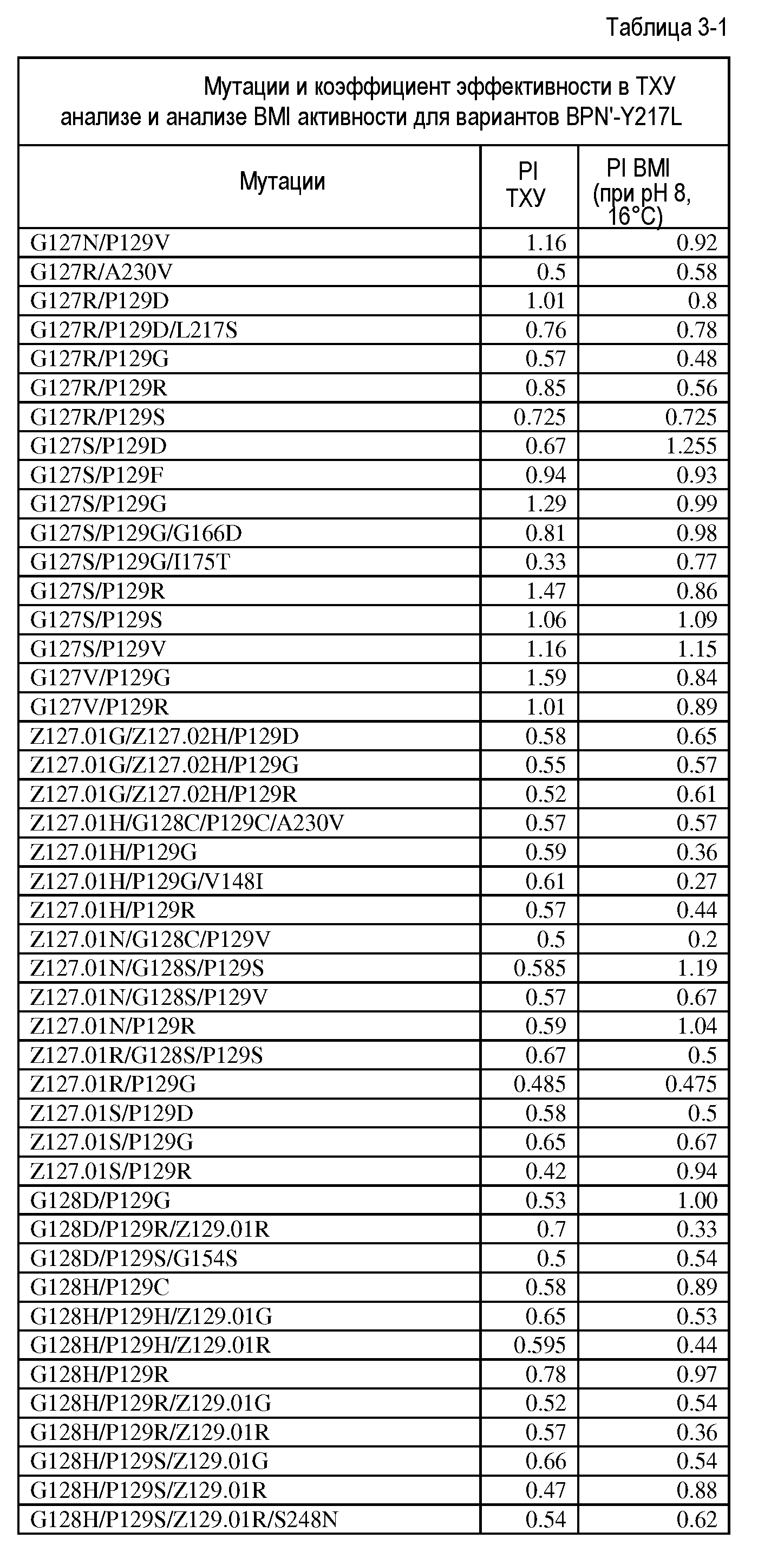
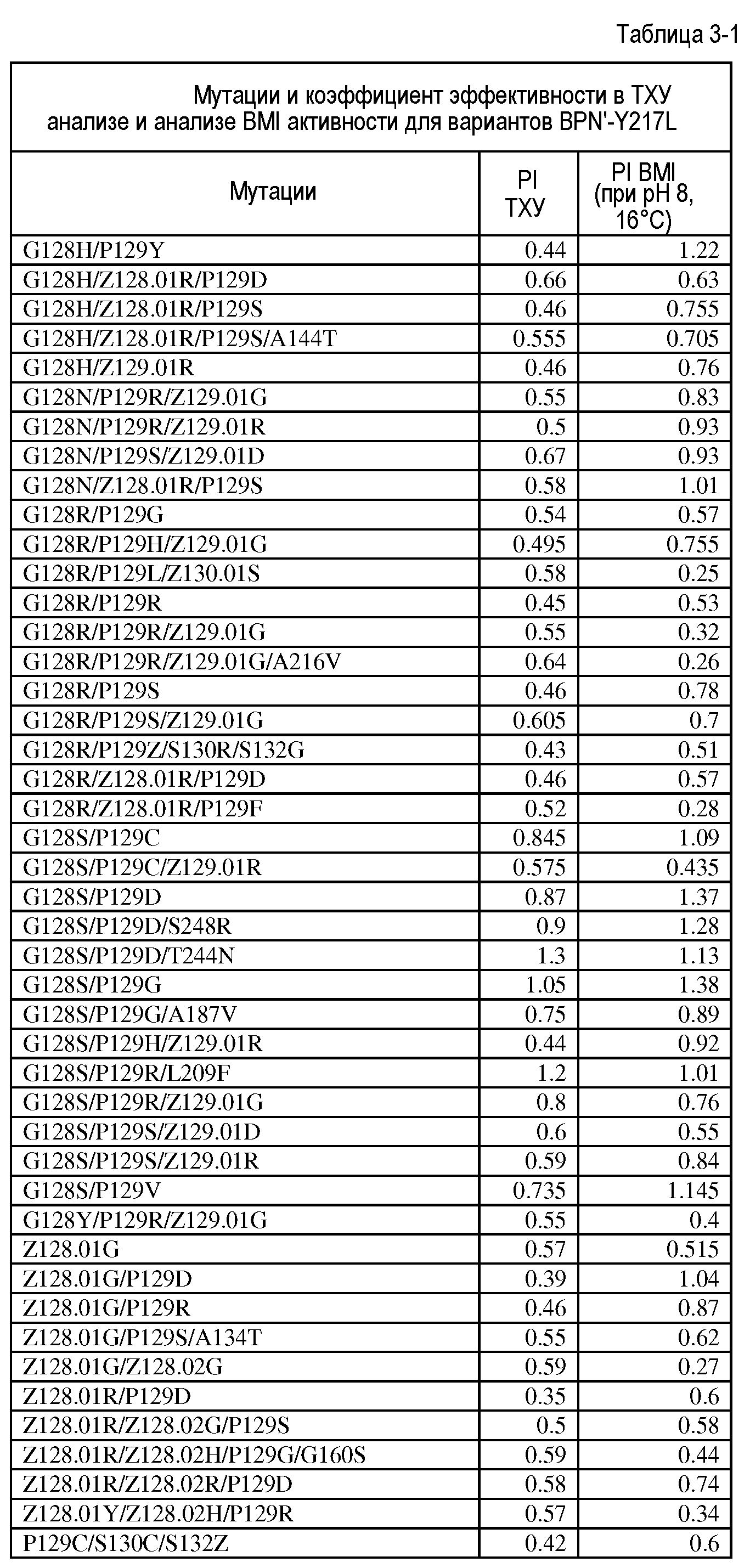



В таблице 3-2 приведен перечень вставок, которые составляют комбинации.

ПРИМЕР 4
Создание комбинаторных вариантов BPN'3
Комбинаторные варианты создавали при использовании BPN'G97A-G128A-Y217Q ("BPN'3") в качестве исходного, в соответствии со стратегией, которая включала ПЦР с удлинением перекрывающихся фрагментов (фьюжн-ПЦР) с использованием четырех фрагментов гена. Фрагмент 1 амплифицировали с использованием праймеров P4974 и P4977 (см. таблицу 4-1). Фрагмент 4 амплифицировали с использованием праймеров 4978 и P4976 (таблица 4-1). Фрагменты 1 и 4 не содержали мутаций. Фрагменты 2 и 3 получали в виде набора из 12 и 16 последовательностей соответственно, которые содержали требуемые мутации, с использованием либо BPN'3 в качестве матрицы, либо в отсутствие матрицы, с использованием частично перекрывающихся прямых и обратных праймеров.
Набор последовательностей фрагмента 2 амплифицировали с использованием следующих праймеров:
01: P4979 и P4980 (BPN'3 в качестве матрицы)
02: P4981 и P4982 (без матрицы)
03: P4983 и P4984 (без матрицы)
04: P4985 и P4986 (без матрицы)
05: P4987 и P4988 (без матрицы)
06: P4989 и P4990 (без матрицы)
07: P4991 и P4992 (без матрицы)
08: P4993 и P4994 (без матрицы)
09: P4995 и P4996 (без матрицы)
10: P4997 и P4998 (без матрицы)
11: P4999 и P5000 (без матрицы)
12: P5001 и P5002 (без матрицы)
Набор последовательностей фрагмента 3 амплифицировали с использованием следующих праймеров:
01: P5003 и P5004 (BPN'3 в качестве матрицы)
02: P5005 и P5006 (без матрицы)
03: P5007 и P5008 (без матрицы)
04: P5009 и P5010 (без матрицы)
05: P5011 и P5012 (без матрицы)
06: P5013 и P5014 (без матрицы)
07: P5015 и P5016 (без матрицы)
08: P5017 и P5018 (без матрицы)
09: P5019 и P5020 (без матрицы)
10: P5021 и P5022 (без матрицы)
11: P5023 и P5024 (без матрицы)
12: P5025 и P5026 (без матрицы)
13: P5027 и P5028 (без матрицы)
14: P5029 и P5030 (без матрицы)
15: P5031 и P5032 (без матрицы)
16: P5033 и P5034 (без матрицы)
Последовательности праймеров, использованные при создании комбинаторных вариантов, приведены в таблице 4-1.
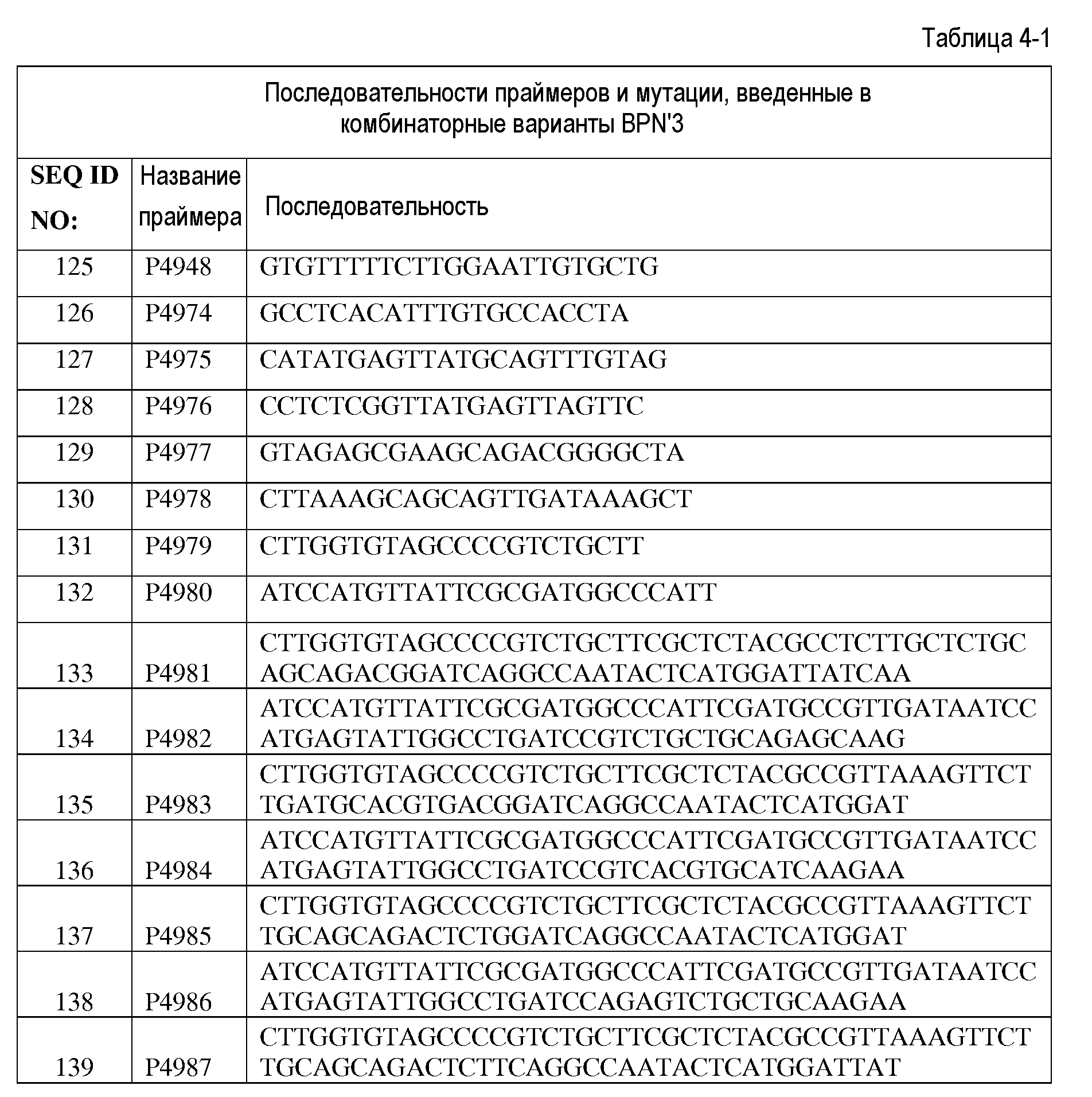
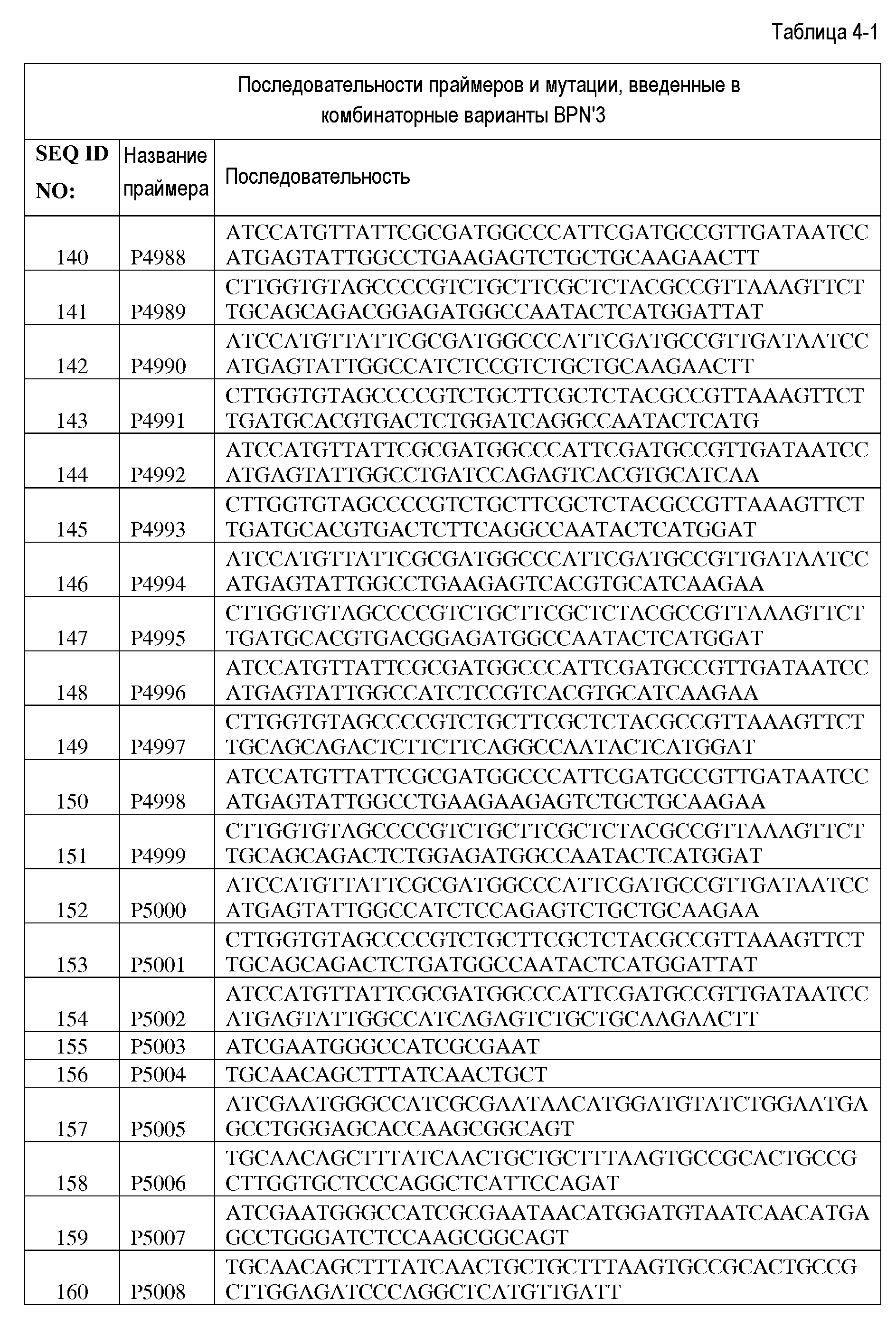
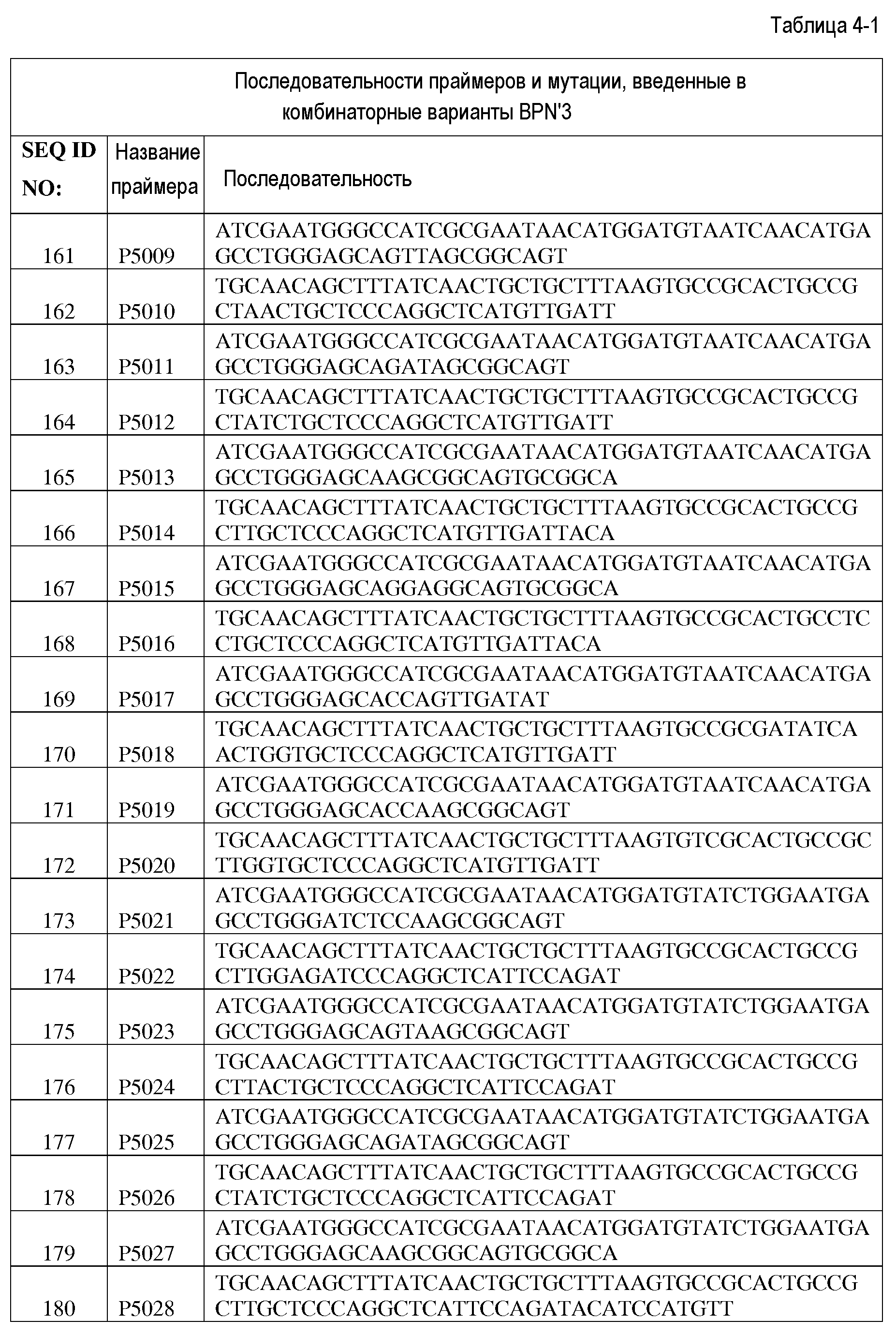

Каждая реакция амплификации содержала 30 пмоль каждого олигонуклеотида и 100 нг ДНК-матрицы. Реакции амплификации проводили с использованием ДНК-полимеразы Vent (New England Biolabs). ПЦР-смесь (20 мкл) подвергали первоначальному нагреву при 95°C в течение 2,5 минут, с последующими 30 циклами денатурации при 94°C в течение 15 с, отжигом при 55°C в течение 15 с и элонгации при 72°C в течение 40 с. После амплификации все фрагменты очищали с помощью набора Gel Band Purification kit (Qiagen) и смешивали для применения в качестве матриц для фьюжн-ПЦР с использованием праймеров P4975 и P4948. Полноразмерный фрагмент ДНК из реакции фьюжн-ПЦР очищали с помощью набора Gel Band Purification kit (QIAGEN), расщепляли рестриктазами BamHI и HindIII и встраивали в экспрессионную плазмиду Bacillus pHPLT-BPN partial opt (фиг. 2C), расщепленную теми же рестриктазами.
Лигазные смеси амплифицировали с использованием амплификации по типу катящегося кольца согласно рекомендациям производителя (Epicentre). Один мкл лигазной смеси смешивали с 5 мкл буфера для образца, нагревали до 95°C в течение 3 минут и охлаждали на льду. Затем в каждую пробирку добавляли 5 мкл реакционного буфера и 0,2 мкл фермента, после чего проводили инкубирование при 30°C в течение 10 часов. Продукты амплификации по типу катящегося кольца разводили в 100 раз и использовали 1 мкл полученной разведенной смеси для трансформации клеток Bacillus subtilis (генотип: ΔaprE, ΔnprE, ΔspoIIE, amyE::xylRPxylAcomK-phleo), как описано в Примере 2. Трансформированные клетки высевали на чашки LB, содержащие 1,6% обезжиренного молока и 10 м.д. неомицина, и оставляли на ночь при 37°C. Отбирали только колонии с зоной обесцвечивания вокруг, которые выращивали в микропланшетах с целью последующего анализа, как описано в примере 2. Концентрацию белка в супернатантах культур определяли с помощью осаждения ТХУ, как описано в примере 1.





ПРИМЕР 5
Эффективность удаления красящих материалов комбинаторных вариантов BPN'3
Активность удаления красящих материаловкомбинаторных вариантов BPN'3, полученных, как описано в примере 4, анализировали, как описано в примере 3. Как описано в настоящей заявке, функциональные характеристики вариантов BPN' определяли количественно как коэффициент эффективности (Pi), который представляет собой отношение эффективностиварианта в сравнении с исходным белком BPN'3. Варианты BPN'3, демонстрирующие значение Pi, большее или равное 0,5, при удалении красящего материала BMI и/или осаждении ТХУ показывали улучшенные эффекты при очистке и/или экспрессии. Коэффициенты эффективности, меньшие или равные 0,05, округляли до 0,05 и выделяли жирным шрифтом в таблице. Результаты приведены в таблице 5-1.
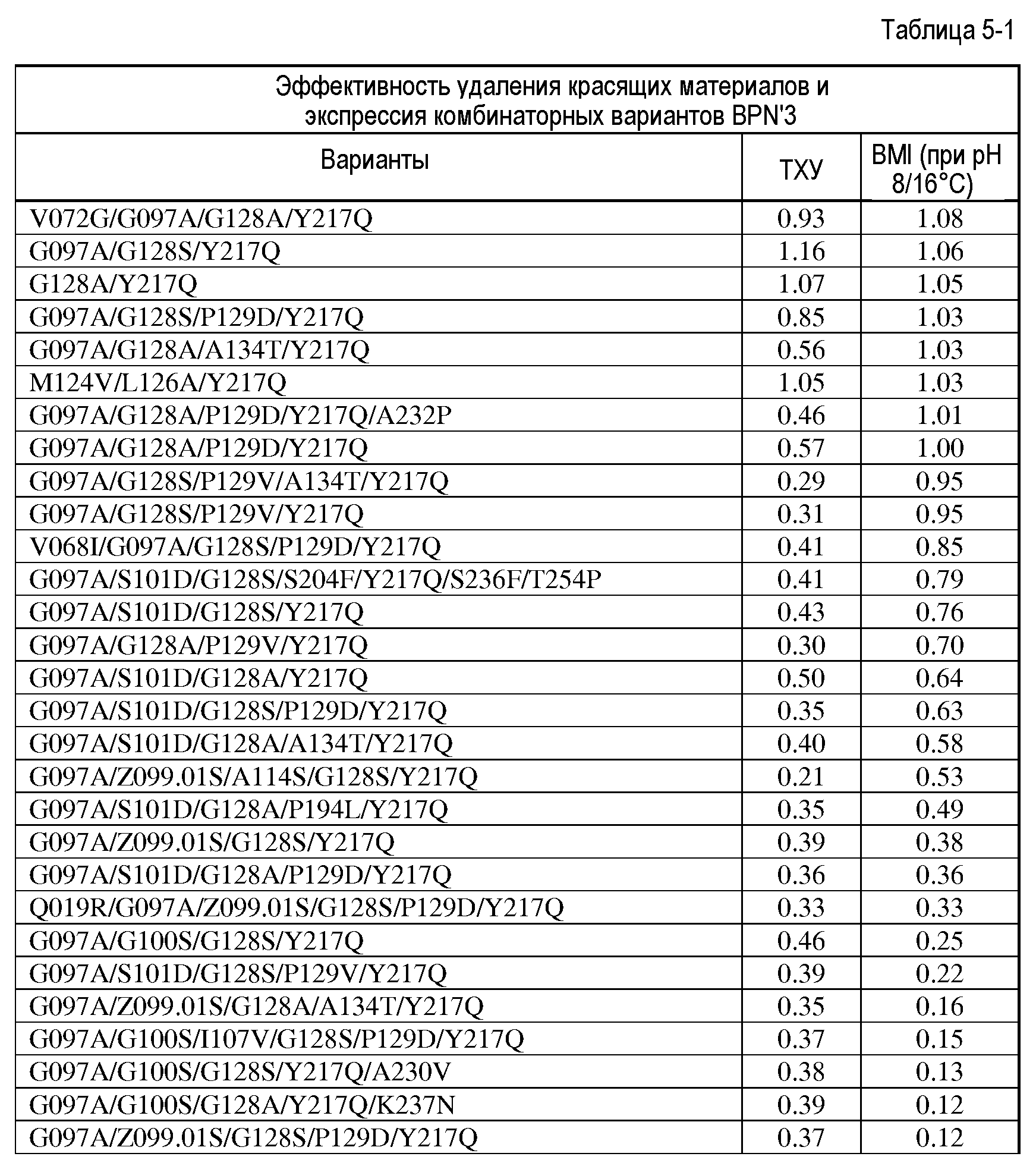

ПРИМЕР 6
Создание комбинаторных вариантов BPN'3 по положениям 128, 129 и 130
Комбинаторные библиотеки, сфокусированные на положениях 128/129/130 в BPN'G97A-G128A-Y217Q (BPN'3), получали с использованием сайт-направленного насыщающего мутагенеза и/или сайт-направленной вставки и/или делеции. Полученные варианты содержали мутации, включающие замены, вставки и делеции. Библиотеки L1, L2 и L3 основаны на положении дикого типа S130S, а L4 основана на S130A. Четыре библиотеки насыщения, сфокусированные на положениях 128/129 и 130, были сконструированы, как показано в таблице 6-1.

Перед созданием библиотеки, в положения 128 и 129 последовательности BPN3' вводили два стоп-кодона, чтобы инактивировать протеазу. Это сделали, чтобы обеспечить низкий фон исходной плазмиды в библиотеках. Исходную плазмиду (pHPLT-BPN'3) метилировали с использованием двух микрограммов плазмидной ДНК и метилазы (New England Biolabs) согласно методике NEB. Затем метилированную ДНК выделяли с использованием набора DNA Clean and Concentrator kit (Zymo Research). Мутагенез проводили с использованием методов, известных в уровне техники (см. Amin et al., Biotechniques 35:1134-1140, [2003]), используя модифицированную версию набора для множественного сайт-направленного мутагенеза QuikChange multi site-directed mutagenesis kit (QCMS) (Stratagene).
Реакция мутагенеза содержала 60 нг плазмиды-матрицы, 0,5 мкл прямого праймера 128/129 Stop F (25 мкМ), 0,5 мкл обратного праймера 128/129 Stop R (25 мкМ), 1 мкл dNTP's (из набора QCMS), 2,5 мкл 10x реакционного буфера QCMS, 18,5 мкл деионизированной воды и 1 мкл смеси ферментов (из набора QCMS), с общим объемом 25 мкл. В реакции мутагенеза использовали следующую программу амплификатора: 1 цикл при 95°С в течение 1 мин, затем 25 циклов при 95°C в течение 1 мин, 55°C в течение 1 мин и 68°C в течение 11 минут (амплификатор MJ Research). ДНК матрицу расщепляли DpnI (набор QCMS, Qiagen) и 1,5 мкл реакции амплифицировали с помощью амплификации по типу катящегося кольца (RCA) с использованием набора Templiphi (Amersham) согласно методике производителя.
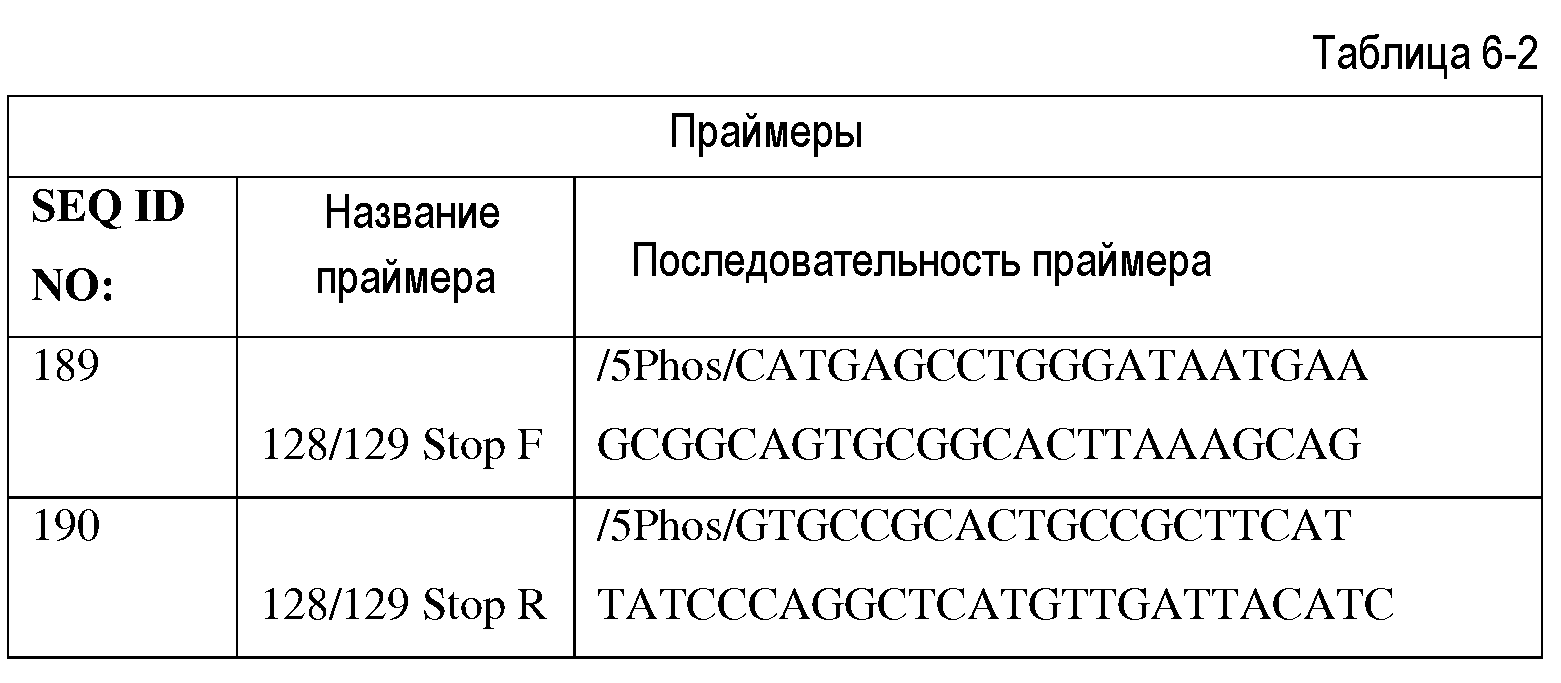
Один микролитр амплифицированной ДНК использовали для трансформации 100 мкл компетентных клеток Bacillus subtilis (генотип: ΔaprE, ΔnprE, ΔspoIIE, amyE::xylRPxylAcomK-phleo). Аликвоты трансформационной смеси объемами 20 мкл или 80 мкл высевали на чашки с LB агаром, содержащим с 10 мкг/мл неомицина + 1,6% обезжиренного молока (Teknova). После роста отбирали 4 колонии, не формирующие зоны обесцвечивания на чашках с обезжиренным молоком, чтобы идентифицировать плазмиду с правильной последовательностью. Правильный вариант с двумя стоп-кодонами в положениях 128/129, названный "pHPLT-BPN' 128/129 Stop" выбирали в качестве исходной плазмиды для создания комбинаторных библиотек, описанных в таблице 6-1.
Плазмиду pHPLT-BPN' 128/129 Stop метилировали и использовали в качестве матрицы с вырожденными праймерами, показанными в Таблице 6-3.

Перекрывающиеся прямые и обратные праймеры (очищенные с помощью ПАГЭ) с NNS кодоном(ами) в середине и 17-20 фланкирующими основаниями создавали для каждой выбранной библиотеки, соответствующие последовательности каждого прямого (F) и обратного (R) праймеров приведены в таблице 6-3. Мутагенез Quick-change® и амплификацию по типу катящегося кольца для указанных 4-х реакций выполняли, как описано выше. Трансформанты высевали на чашки с LB агаром, содержащие 10 мкг/мл неомицина + 1,6% обезжиренного молока. Все колонии, формирующие зоны обесцвечивания, отбирали в два микропланшета, содержащих 125 мкл среды LB с 10 мкг/мл неомицина. Клоны секвенировали в Quintara Biosciences. С целью экспрессии белка культуры выращивали в течение ночи в микрофильтрационных планшетах (0,22 мкм, Millipore), содержащих 180 мкл обогащенной полуопределенной среды на основе MOPS буфера, с мочевиной в качестве основного источника азота, глюкозой в качестве основного источника углерода, 1% soytone для стабильного роста клеток и с 2,5 мкг/мл неомицина. Культуры выращивали в течение 64 часов при 37°C, 250 об/мин и 70%-ной влажности. Концентрацию белка в супернатантах культур определяли с помощью осаждения ТХУ, как описано в примере 1.
ПРИМЕР 7
Эффективность удаления красящих материалов комбинаторных вариантов BPN'3 по положениям 128, 129 и 130
Активность удаления красящих материалов комбинаторных вариантов BPN'3 по положениям 128, 129 и 130, созданных, как описано в примере 6, анализировали, как описано в примере 3. Как описано в настоящей заявке, функциональные характеристики вариантов BPN' определяли количественно как коэффициент эффективности (Pi), который представляет собой отношение эффективностиварианта и исходного белка BPN'3. Варианты BPN'3, демонстрирующие значение Pi, большее или равное 0,5, для эффективности удаления красящего материала BMI и/или при осаждении ТХУ, показывали улучшенные эффекты очистки и/или экспрессии. Результаты представлены в таблице 7-1.



ПРИМЕР 8
Конструирование комбинаторных вариантов BPN'
Комбинаторные варианты BPN' получали с помощью ПЦР с удлинением перекрывающихся фрагментов (фьюжн-ПЦР) с использованием следующих мутантов BPN' в качестве исходных молекул: BPN' G97A/G128A/Y217Q, BPN' M124V/L126A/Y217Q, BPN' G128A/Y217Q и BPN' N123G/Y217Q, с целью введения вставок или замен в положения 96, 98, 129 и/или 222. Для каждого полученного комбинаторного мутанта исходная молекула ДНК, введенные мутации и используемые ПЦР-праймеры приведены в таблице 8-1. Для создания каждого мутанта два фрагмента 1 и 2 получали с использованием ПЦР-праймеров (таблица 8-2) в 5'- и 3'-областях гена, используя соответствующую исходную молекулу, представленную в таблице 8-1. Указанные фрагменты смешивали и амплифицировали с использованием фланкирующих праймеров P4973 и P4950 (таблица 8-2), получив полноразмерный ген.
Каждая реакция амплификации содержала 30 пмоль каждого ПЦР-праймера и 100 нг ДНК-матрицы. Реакции амплификации проводили с использованием ДНК-полимеразы Vent (New England Biolabs). ПЦР-смесь (20 мкл) подвергали первоначальному нагреву при 95°C в течение 2,5 минут, затем 30 циклам денатурации при 94°C в течение 15 с, отжигу при 55°C в течение 15 с и элонгации при 72°C в течение 40 с. После амплификации 5'- и 3'-фрагменты выделяли из геля с помощью набора для выделения из геля QIAGEN, смешивали и амплифицировали с использованием фланкирующих праймеров P4973 и P4950. Полученный полноразмерный фрагмент ДНК выделяли из геля с помощью набора для выделения из геля QIAGEN, расщепляли рестриктазами BamHI и HindIII и встраивали в вектор pHPLT-BPN', содержащий соответствующие исходные молекулы, который был также расщеплен теми же рестриктазами. Лигазные смеси амплифицировали с использованием амплификации по типу катящегося кольца согласно рекомендации производителя (Epicentre). Один микролитр лигазной смеси смешивали с 5 мкл буфера для образца, нагревали при 95°C в течение 3 минут и охлаждали на льду. Затем 5 мкл реакционного буфера и 0,2 мкл фермента добавляли в каждую пробирку с последующим проведением инкубирования при 30°C в течение 10 часов. Продукты амплификации по типу катящегося кольца разводили в 100 раз и использовали для трансформации клеток Bacillus subtilis (генотип: ΔaprE, ΔnprE, ΔspoIIE, amyE::xylRPxylAcomK-phleo), как описано в примере 2. Трансформанты высевали на чашки с LB-агаром, содержащие 1,6% обезжиренного молока и 10 м.д. неомицина, и оставляли на ночь при 37°C. Отбирали только колонии с зонами обесцвечивания, которые выращивали в микропланшетах с целью последующего анализа, как описано в примере 2. Концентрацию белка в супернатантах культур определяли с помощью осаждения ТХУ, как описано в примере 1.
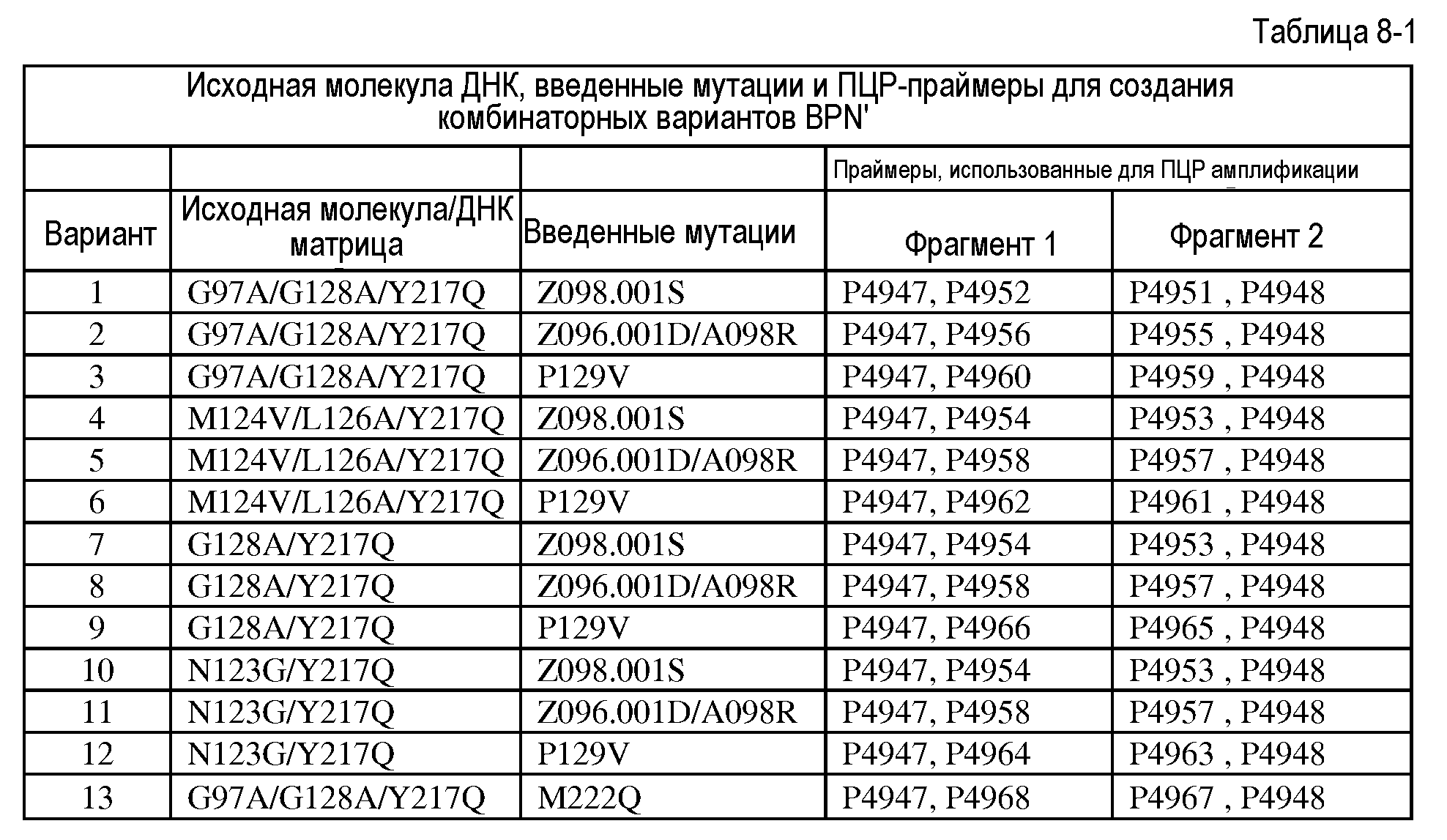


ПРИМЕР 9
Эффективность удаления красящих материалов комбинаторных вариантов BPN'
Активность удаления красящих материаловкомбинаторных вариантов BPN', полученных, как описано в примере 8, анализировали, как описано в примере 3. Как описано в настоящей заявке, функциональные характеристики вариантов BPN' определяли количественно как коэффициент эффективности (Pi), который представляет собой отношение эффективности варианта и BPN'3 (BPN' G97A-G128A-Y217Q). Варианты, демонстрирующие значение Pi, большее или равное 0,5, для эффективности удаления красящих материаловBMI и/или при осаждении ТХУ, показывали улучшенные эффекты очистки и/или экспрессии. Коэффициенты эффективности, меньшие или равные 0,05, округляли до 0,05 и выделяли полужирным курсивом в таблице. Результаты приведены в таблице 9-1.
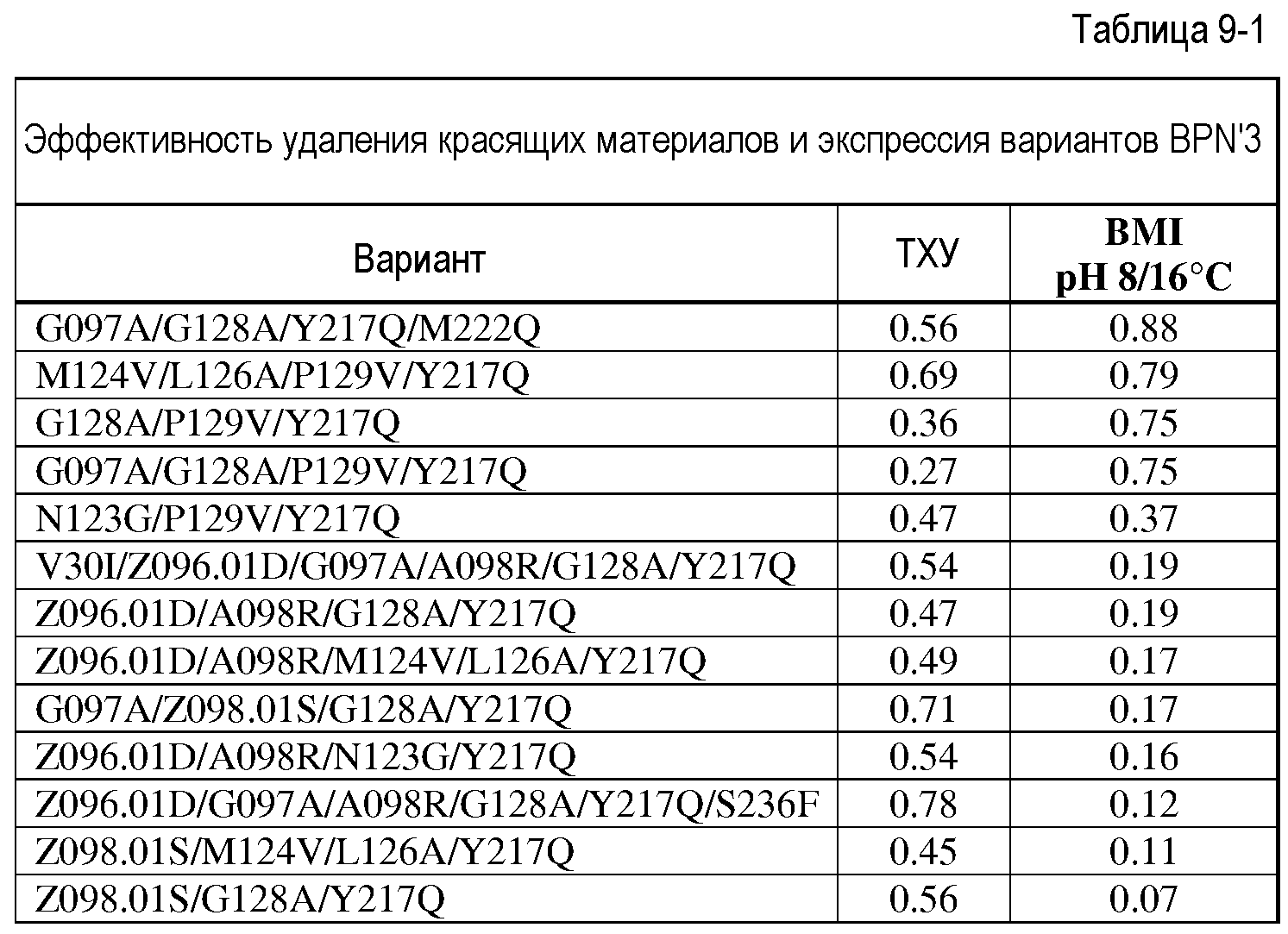

Все патенты и публикации, упомянутые в настоящем описании, являются показателем уровня специалистов в данной области техники, к которой относится изобретение. Указанные специалисты в данной области техники с легкостью понимают, что настоящее изобретение хорошо приспособлено для осуществления объектов и получения конечных результатов и преимуществ, не только упомянутых, но и присущих им. Композиции и способы, описанные в настоящей заявке, являются репрезентативными в отношении предпочтительных вариантов осуществления, примерными, и не должны ограничивать объем изобретения. Специалисту, квалифицированному в данной области техники, очевидно, что различные замены и модификации могут быть внесены в изобретение, раскрытое в настоящей заявке, без отступления от объема и сущности изобретения.
Изобретение, иллюстративно описанное в настоящей заявке, надлежащим образом может быть осуществлено в отсутствие какого-либо элемента или элементов, ограничения или ограничений, которые прямо не указаны в настоящей заявке. Термины и выражения, которые были применены, используются в качестве терминов описания, но не ограничения, при этом нет никакого намерения, что при использовании подобных терминов и выражений исключаются какие-либо эквиваленты показанных и описанных признаков или их частей, однако очевидно, что различные модификации допускаются в рамках заявленного изобретения. Таким образом, следует понимать, что хотя настоящее изобретение было прямо раскрыто посредством предпочтительных вариантов осуществления и необязательных признаков, модификации и вариации принципов, раскрытых в настоящей заявке, могут быть обращены к специалистам в данной области, при этом подобные модификации и вариации, как предполагают, включены в объем настоящего изобретения, как определено в настоящей заявке.
Изобретение было описано широко и в общих чертах в настоящей заявке. Каждая из более узких категорий и подвидовых групп, подпадающих под общее описание, также составляют часть изобретения. Это включает общее описание изобретения с условием или отрицательным ограничением, исключающим какой-либо объект из класса, вне зависимости от того, был ли исключенный материал прямо указан в настоящей заявке.
Реферат
Изобретение относится к биотехнологии и представляет собой варианты субтилизина, сохраняющие его активность. Изобретение относится также к чистящей композиции, содержащей вариант субтилизина, и к способу очистки поверхности и/или изделия, включающего ткань, с помощью указанной композиции. Изобретение позволяет получить эффективные в очистке варианты субтилизина. 3 н. и 6 з.п. ф-лы, 6 ил., 13 табл., 8 пр.
Формула
a) контакта поверхности и/или изделия, включающего ткань, с чистящей композицией по любому из пп. 2-8 и
b) необязательно, промывку и/или ополаскивание указанной поверхности или изделия.

Комментарии