Снижающая иммунный стресс композиция (варианты), способ улучшения показателей роста и способ снижения иммунного стресса с ее помощью - RU2465005C2
Код документа: RU2465005C2
Чертежи




Описание
Область техники, к которой относится изобретение
Настоящее изобретение предоставляет композиции и способы снижения иммунологического стресса и улучшения характеристик роста животного. В частности, изобретение предоставляет композиции, содержащие ферменты, которые эффективны для снижения иммунологического стресса, или те, которые эффективны для лечения или предупреждения инфекции, либо те, которые эффективны для целей улучшения показателей роста животного. Изобретение также предоставляет способы применения композиций.
Уровень техники
Животное может испытывать иммунологический стресс по ряду причин, включая воздействие антигена, который распознается иммунной системой животного. Антиген может инициировать иммунный ответ, который представляет собой адаптивный иммунный ответ или который представляет собой врожденный иммунный ответ. Когда иммунный ответ является инициированным, животное испытывает иммунологический стресс, поскольку его иммунная система отвечает на воспринимаемую опасность. Часто иммунологический стресс ухудшает показатели роста животного.
Белки острой фазы (АРР - от англ. acute phase proteins) представляют собой белки крови, концентрация которых в крови изменяется, когда животное испытывает стресс, такой как инфекция, воспаление, хирургическая травма или другие внутренние или внешние стимулы. См., например, статью Murata et al., Vet. J. 168:28 (2004). APP, как считают, играет роль во врожденном иммунном ответе животного. Например, APP могут участвовать в восстановлении гомеостаза и ограничении роста микробов вплоть до развития приобретенного иммунитета.
APP включают "отрицательные" белки, концентрация которых снижается при стрессе, и "положительные" белки, концентрация которых возрастает при стрессе. См., например, статью Murata et al., выше. Отрицательные APP включают альбумин и трансферрин. Положительные APP включает белки, синтезирующиеся гепатоцитами при стимуляции провоспалительными цитокинами и высвобождающиеся в кровоток, например, гаптоглобин, С-реактивный белок, сывороточный амилоид А, церулоплазмин, фибриноген и α-1-кислый гликопротеин (AGP). Внепеченочная продукция APP описана также для большинства видов млекопитающих. См. там же. Считают, что провоспалительные цитокины, такие как интерлейкин-6 (ИЛ-6) и фактор некроза опухоли α (ФНО-α), являются основными посредниками синтеза APP в печени. Воспаление, инфекция или повреждение ткани инициирует высвобождение цитокинов клетками, ориентированными на защиту, вызывая тем самым синтез APP. Индукция положительных APP ассоциирована также со снижением уровня синтеза отрицательных APP. См. там же.
Разработаны способы количественной оценки APP, и концентрация циркулирующих в кровотоке APP (например, сывороточные уровни APP) коррелирует с тяжестью состояния животного. См. там же. Так, концентрацию APP можно использовать в качестве индикатора уровня иммунного стресса животного.
Иммунная система животных может распознать антигены, которые не являются реальной угрозой для здоровья животного, такие как ингредиенты растительной и животной природы, в композициях корма для животных. Данные антигены могут инициировать иммунный ответ, такой как врожденный иммунный ответ, приводя тем самым к тому, что животное испытывает иммунологический стресс. Данный ответ на стресс можно выявить и мониторировать по сывороточной концентрации АРР.
Даже когда инициирующий иммунитет антиген не представляет реальной угрозы для здоровья животного, ответ на стресс может иметь неблагоприятный эффект. Это можно наблюдать, например, как снижение эффективности корма, уменьшение скорости набора массы тела, повышение чувствительности к инфекции или повышение температуры тела.
Описано применение антител, таких как антитела к фосфолипазе А2, для уменьшения желудочно-кишечного воспаления у животных. См., например, патент США №6383485. Описаны композиции кормов, которые содержат гемицеллюлазу, способную к разложению β-маннан-содержащей гемицеллюлозы (например, гемицеллюлазу типа β-маннаназы), такую как эндо-1,4-β-маннаназа, или фосфолипазу, такую как фосфолипаза А2, для повышения эффективности кормов. См., например, международную публикацию WO 97/41739, патент США №6162473 и патент США №6183739.
Аналогичным образом описаны композиции, включающие фермент, такой как PI-PLC, который расщепляет связь, воздействуя таким образом на высвобождение белка или углевода клеточной поверхности, предназначенные для лечения или предупреждения инфекции пищеварительного тракта. См., например, международную публикацию WO 01/41785. В статье Walsh et al., J.Anim. Sci. 73: 1074 (1995) обсуждают композиции кормов, включающие ферменты глюканазы, которые расщепляют смешанный глюкановый субстрат, такие как 1,4-β-глюканаза, которая расщепляет смешанные β-1,3-, β,4-субстраты. Однако в проведенных авторами тестах ни PI-PLC, ни 1,4-β-глюканаза не проявляют активности снижения иммунного стресса.
Ранее отсутствовало описание композиции корма, включающей фермент, который отличен от гемицеллюлазы типа β-маннаназы или фосфолипазы, и который присутствует в количестве, эффективном для снижения иммунологического стресса.
Соответственно имеется потребность в композиции и способе снижения иммунологического стресса у животных.
Раскрытие изобретения
Один вариант осуществления предоставляет композицию, подходящую для перорального введения животному, включающую фермент, снижающий иммунный стресс, в перорально приемлемом носителе. Композиция выбрана из группы, состоящей из: (i) корма для животных, содержащего количество фермента, эффективного для снижения уровня положительного белка острой фазы у животного, повышения уровня отрицательного белка острой фазы у животного и/или улучшения показателей роста животного, (ii) жидкой композиции, отличной от корма для животных, включающей по меньшей мере 40000 ME (международных единиц) фермента/л, и (iii) твердой композиции, отличной от корма для животных, включающей по меньшей мере 40000 ME (международных единиц) фермента/кг. Фермент отличен от гемицеллюлазы типа β-маннаназы или фосфолипазы, и, если фермент содержит 1,3-β-глюканазу, композиция выбрана из группы, состоящей из (i) корма для животных, включающего по меньшей мере 20 ME 1,3-β-глюканазы/кг корма;
(ii) жидкой композиции, отличной от корма для животных, включающей по меньшей мере 155000 ME 1,3-β-глюканазы/л, и (iii) твердой композиции, отличной от корма для животных, включающий по меньшей мере 300000 ME 1,3-β-глюканазы/кг.
В одном варианте осуществления композиция представляет собой корм для животных, включающий по меньшей мере 20 ME фермента/кг корма. В другом варианте осуществления композиция представляет собой твердую композицию, отличную от корма для животных, включающую по меньшей мере 80000 ME фермента/кг или по меньшей мере 160000 ME фермента/кг.
В одном варианте осуществления композиция представляет собой корм для животных, который включает ингредиент, который вызывает иммунный ответ у животного, и фермент содержит фермент, который разлагает данный ингредиент. В одном варианте осуществления ингредиент представляет собой антиген, представляемый патогенным микроорганизмом.
В одном варианте осуществления фермент содержит 1,3-β-глюканазу. В одном варианте осуществления фермент содержит 1,3-β-глюканазу, и композиция выбрана из группы, состоящей из (i) корма для животных, включающего по меньшей мере 30 ME 1,3-β-глюканазы/кг корма; (ii) жидкой композиции, отличной от корма для животных, включающей по меньшей мере 230000 ME 1,3-β-глюканазы/л, и (iii) твердой композиции, отличной от корма для животных, включающей по меньшей мере 450000 ME 1,3-β-глюканазы/кг.
Другой вариант осуществления представляет композицию, подходящую для перорального введения животному, содержащую два или более ферментов, снижающих иммунный стресс, причем композиция включает по меньшей мере один фермент, снижающий иммунный стресс, отличный от 1,4-β-маннаназы и 1,3-β-глюканазы. Композиция выбрана из группы, состоящей из: (i) корма для животных, включающего количество указанных ферментов, снижающих иммунный стресс, эффективное для снижения уровня положительного белка острой фазы у указанного животного, повышения уровня отрицательного белка острой фазы у указанного животного и/или улучшения показателей роста животного; (ii) жидкой композиции, отличной от корма для животных, включающей по меньшей мере один фермент, снижающий иммунный стресс, в количестве по меньшей мере 40000 ME фермента/л, и (iii) твердой композиции, отличной от корма для животных, включающей по меньшей мере один фермент, снижающий иммунный стресс, в количестве по меньшей мере 40000 ME фермента/кг.
В одном варианте осуществления композиция представляет собой корм для животных, содержащий по меньшей мере один фермент, снижающий иммунный стресс, в количестве по меньшей мере 20 ME фермента/кг корма.
В другом варианте осуществления композиция представляет собой твердую композицию, отличную от корма для животных, включающую по меньшей мере один фермент, снижающий иммунный стресс, в количестве по меньшей мере 80000 ME фермента/кг или по меньшей мере 160000 ME фермента/кг.
В специальных вариантах осуществления композиция выбрана из группы, состоящей из (i) композиции, содержащей 1,4-β-маннаназу и хитиназу; (ii) композиции, содержащей 1,4-β-маннаназу и ксилоглюканазу, (iii) композиции, содержащей 1,4-β-маннаназу и арабинаназу, (iv) композиции, содержащей 1,3-β-глюканазу и хитиназу, (v) композиции, содержащей 1,3-β-глюканазу и ксилоглюканазу, (vi) композиции, содержащей 1,3-β-глюканазу и арабинаназу, и (vii) композиции, содержащей 1,4-β-маннаназу, 1,3-β-глюканазу и арабинаназу.
Другой вариант осуществления представляет композицию, подходящую для перорального введения животному, содержащую 1,4-β-маннаназу и 1,3-β-глюканазу. Композиция выбрана из группы, состоящей из (i) корма для животных, включающего 1,4-β-маннаназу и по меньшей мере 20 ME 1,3-β-глюканазы/кг корма, (ii) жидкую композицию, отличную от корма для животных, включающую 1,4-β-маннаназу и по меньшей мере 155000 ME 1,3-β-глюканазы/л и (iii) твердую композицию, отличную от корма для животных, включающую 1,4-β-маннаназу и по меньшей мере 300000 ME 1,3-β-глюканазы/кг. В одном варианте осуществления композиция выбрана из группы, состоящей из (i) корма для животных, включающего 1,4-β-маннаназу и по меньшей мере 30 ME 1,3-β-глюканазы/кг корма; (ii) жидкую композицию, отличную от корма для животных, включающую 1,4-β-маннаназу и по меньшей мере 230000 ME 1,3-β-глюканазы/л, и (iii) твердую композицию, отличную от корма для животных, включающую
1,4-β-маннаназу и по меньшей мере 450000 ME 1,3-β-глюканазы/кг. В одном варианте осуществления композиция, кроме того, включает один или более дополнительных ферментов, снижающих иммунный стресс.
Другой вариант осуществления предусматривает способ улучшения показателей роста животного и/или снижения иммунного стресса у животного, заключающийся во введении животному любой из вышеописанных композиций.
В одном варианте осуществления животному вводят ингредиент, который вызывает иммунный ответ у животного, и композиция содержит по меньшей мере один фермент, снижающий иммунный стресс, который разрушает ингредиент. В одном варианте осуществления ингредиент и фермент вводят в одну и ту же композицию. В одном варианте осуществления композиция представляет собой корм для животных. В одном варианте осуществления ингредиент представляет собой антиген, представляемый патогенным микроорганизмом.
Другой вариант осуществления представляет способ предупреждения или лечения инфекции, связанной в патогенным микроорганизмом, который представляет антиген, заключающийся в пероральном введении нуждающемуся в этом животному любой из вышеописанных композиций, причем композиция включает по меньшей мере один фермент, снижающий иммунный стресс, который разлагает антиген.
Краткое описание чертежей
На фигуре 1 представлена построенная по точкам оптимальная кривая (и лежащее в основе полиномиальное уравнение) для расчета концентрации куриного α-1-кислотного гликопротеина (AGP) в образцах плазмы тестируемых кур с использованием данных, полученных в примере 1.
На фигуре 2 представлен график Бокса (Box) и Уискера (Wisker), графически показывающий уровни AGP в куриной сыворотке, полученной от тестируемых кур, как описано в примере 2. Интервал данных представлен вертикальными линиями. Прямоугольник представляет интервал, в котором лежат данные, с одним стандартным отклонением от среднего. Горизонтальная линия показывает среднее данное.
На фигуре 3 показаны уровни AGP сыворотки, полученной от кур, получающих один из нескольких различных кормов, включая корма, соответствующие изобретению, и корма, соответствующие предшествующему уровню техники, как описано в примере 3.
На фигуре 4 представлена оптимальная построенная по точкам кривая (и лежащее в основе полиномиальное уравнение) для расчета концентрации AGP в образцах плазмы тестируемых индеек с использованием данных, полученных в примере 8.
Осуществление изобретения
Как используют в последующем описании, следует иметь в виду, что термин "какой-либо" охватывает один или более, пока не определяют иначе.
Как используют в данном контексте, термин "животное" относится к любому животному, включая человека и других животных, таких как животные, отличные от человека, в том числе животные-компаньоны, такие как собаки и кошки, скот, например коровы и другие жвачные животные, буйвол, лошади, свиньи, овцы, домашняя птица (например, куры, утки, индейки и гуси) и животные, выращиваемые в аквакультуре (например, рыба, креветки и угри).
В настоящем описании выражения "фермент, который разлагает антиген" и "фермент, который разлагает ингредиент" означают, что фермент превращает антиген или ингредиент в форму, которая не распознается иммунной системой животного. Способность фермента разлагать антиген или ингредиент можно определить измерением концентрации сывороточного АРР животного, причем снижение сывороточной концентрации положительного АРР или снижение сывороточной концентрации отрицательного АРР показывает, что фермент разложил антиген или ингредиент.
Как отмечено выше, термин "АРР" включает "отрицательные" белки, концентрация которых снижается при стрессе, и "положительные" белки, концентрация которых повышается при стрессе. Изобретение включает композиции и способы, которые повышают концентрацию отрицательных белков острой фазы, концентрация которых, как правило, снижается при стрессе, а также композиции и способы, которые снижают концентрацию положительных белков острой фазы, концентрации которых, как правило, повышается при стрессе. Для удобства в последующем обсуждении изобретение иллюстрируют со ссылкой на эффект композиций и способов на положительные белки острой фазы. Таким образом, термин "АРР" в последующем обсуждении, как правило, относится к любому одному или более положительному белку острой фазы, ассоциированному с ответом животного на стресс. Следует иметь в виду, что композиции и способы, описанные в данном контексте, как снижающие концентрацию "АРР" (касательно положительных белков острой фазы), используют также для повышения концентрации отрицательных белков острой фазы.
Один аспект изобретения относится к композиции, содержащей фермент, который эффективен в плане снижения иммунологического стресса, испытываемого животным. Для удобства данные ферменты обозначают в данном контексте как ферменты, "снижающие иммунный стресс". Как используют в данном контексте, термин "фермент, снижающий иммунный стресс", означает любой фермент, который разлагает антиген или молекулярную структуру, которая распознается иммунной системой человека, например антиген или молекулярную структуру, которая инициирует иммунный ответ, приводя тем самым к тому, что животное испытывает иммунологический стресс. Термин "молекулярная структура", как используют в данном контексте, включает общие молекулярные структуры, которые связываются рецепторами в контексте врожденной иммунной системы, такие как молекулярные структуры, которые обычно ассоциированы с патогенами.
Согласно одному варианту осуществления фермент, снижающий иммунный стресс, не является гемицеллюлазой типа β-маннаназы. Согласно одному аспекту данного варианта осуществления фермент, снижающий иммунный стресс, не является эндо-1,4-β-D-маннаназой. В соответствии с другим вариантом осуществления фермент не является фосфолипазой. В соответствии с другим вариантом осуществления фермент, снижающий иммунный стресс, не является 1,4-β-D-глюканазой. В соответствии с другим вариантом осуществления фермент, снижающий иммунный стресс, не является PI-PLC. В соответствии с другим вариантом осуществления фермент, снижающий иммунный стресс, не является гемицеллюлазой типа β-маннаназы или фосфолипазой. В соответствии с еще одним вариантом осуществления фермент, снижающий иммунный стресс, не является гемицеллюлазой типа β-маннаназы, не является 1,4-β-глюканазой и не является фосфолипазой. В соответствии со следующим вариантом осуществления фермент, снижающий иммунный стресс, не является гемицеллюлазой типа β-маннаназы, не является 1,4-β-глюканазой, не является фосфолипазой и не является PI-PLC. В соответствии с одним аспектом любого из вышеописанных вариантов осуществления фермент не является 1,3-β-глюканазой.
Не желая быть связанными какой-либо теорией, авторы настоящего изобретения считают, что разложение антигена или молекулярной структуры ферментом, снижающим иммунный стресс, ингибирует или снижает уровень иммунного ответа, инициируемого антигеном или молекулярной структурой, снижая таким образом иммунологический стресс у животного. Снижение уровня иммунологического стресса можно идентифицировать и мониторировать измерением сывороточной концентрации АРР у животного, используя известные в области техники методы количественного определения АРР. Примеры данных способов упоминаются в статье Murata, et al., см. выше, и описаны и упоминаются в статьях Hulten et al., Vet. Microbiol. 95: 75 (2003) и Holt et al., см. выше, а также в примере 1, см. ниже.
В родственном варианте осуществления изобретение представляет способы снижения иммунологического стресса у животного, которые заключаются во введении животному композиции, содержащей количество фермента, снижающего иммунный стресс, эффективное в плане снижения уровня АРР у животного.
Идентифицирован ряд различных положительных белков острой фазы, включая α-1-кислый гликопротеин (AGP), церулоплазмин (Ср), белки семейства коллектина (например, легочные поверхностно-активные белки, конглютинин и маннан-связывающий лектин), фибриноген (Fb), С-реактивный белок (CRP), гаптоглобин (Нр), ингибиторы протеазы (например, α-1-антитрипсин, α-1-антихимотрипсин и α-2-макроглобулин) и сывороточный амилоид-А (SAA). Другие потенциальные АРР включают липополисахарид-связывающий белок (LPB), фосфолипид-связывающие белки, такие как аннексины, и главный белок острой фазы (MAP). См. статью Murata, et al., выше. Сывороточные концентрации любого из данных или других АРР могут быть использованы для идентификации, оценки и мониторирования активности ферментов в соответствии с изобретением.
Различные АРР могут играть более существенные роли в ответах на стресс различных животных. Например, AGP, как известно, клинически важен у крупного рогатого скота и ассоциирован с инфекцией у свиней, собак, кошек и кур (включая несушек). Церулоплазмин (Ср), как показано, является показателем инфекции у крупного рогатого скота, лошадей и кур. С-реактивный белок (CRP) выявлен у жвачных животных, лошадей, свиней, собак и кошек, хотя не было продемонстрировано, что CRP является АРР у крупного рогатого скота. Показано, что CRP ассоциирован с инфекцией у лошадей и свиней. Фибриноген (Fb) представляет собой надежный показатель воспаления, бактериальной инфекции или хирургической травмы у крупного рогатого скота и овец и ассоциирован с инфекцией у лошадей. Гаптоглобин (Нр) является АРР у ряда продуктивных животных и животных-компаньонов, включая жвачных животных, например крупный рогатый скот, овец, свиней, лошадей и собак. Сывороточный амилоид А (SAA) ассоциирован с воспалением и инфекцией у крупного рогатого скота и с инфекцией у лошадей, свиней, животных-компаньонов, таких как собаки, и кур. Повышение уровней SAA в молоке обнаружено у коров и овец с маститом. Сывороточный липополисахарид-связывающий белок (LBP) ассоциирован с инфекцией у крупного рогатого скота, равно как местные уровни аннексинов (на поверхностях секреторного эпителия в легких зараженного крупного рогатого скота). Показано, что главный белок острой фазы (MAP) является показателем инфекции у свиней. Кроме того, хотя трансферрин обычно считают отрицательным белком острой фазы, он, по-видимому, играет роль положительного белка острой фазы у кур. См. статьи Murata, et al., выше; Holt et al., Poultry Sci. 81: 1295-1300 (2002). Другие авторы также показали, что SAA и Нр, а также CRP и MAP, ассоциированы с инфекцией у свиней. См. статью Hulten et al., выше.
В некоторых вариантах осуществления композиции, соответствующие изобретению, включают количество фермента, снижающего иммунный стресс, которое эффективно в плане снижения сывороточной концентрации АРР у животного. Количество может варьировать в зависимости от животного и фермента, снижающего иммунный стресс, и легко может быть определено компетентным специалистом в области техники при использовании методов, известных в области техники. Например, уровни сывороточного АРР животного можно измерить до и после введения фермента или можно сравнить уровни сывороточного АРР эквивалентных леченых и контрольных животных (В этом плане может быть полезным сравнить леченых и контрольных животных одного возраста, поскольку уровни АРР могут изменяться с возрастом. Например, авторы обнаружили, что уровни сывороточного AGP повышаются с возрастом кур). Снижение концентрации сывороточного АРР, ассоциированное с введением фермента, показывает, что введено эффективное количество фермента.
В других вариантах осуществления, в композиции, соответствующие изобретению, включают количество фермента, снижающего иммунный стресс, которое эффективно для улучшения показателей роста животного (называемых также "продуктивность по живому весу", в частности, в области птицеводства). Как используют в данном контексте, выражение "показатели роста животного" включает любой параметр, который отражает рост животного, включая превращение кормов, всасывание воды, содержание воды в фекалиях, однородность массы тела в стае или в группе животных, жизнеспособность и смертность. Не желая связывать себя какой-либо теорией, считают, что в некоторых условиях эффект фермента, снижающего иммунный стресс, на концентрацию АРР маскируется такими факторами, как факторы, вызывающие иммунный стресс, например, присутствие инфекции на низком уровне в группе животных или стрессовые условия жизни. В данных условиях фермент, снижающий иммунный стресс, тем не менее может быть эффективным в плане улучшения показателей роста животного. Таким образом показатели роста животного представляют собой альтернативную меру эффективности композиций и способов, соответствующих настоящему изобретению.
Композиция может представлять собой любую композицию, подходящую для введения животному. В одном варианте осуществления композиция подходит для перорального введения. В одном специальном варианте осуществления композицию, которая подходит для перорального введения, как правило, признают безопасной для перорального введения животному. В другом специальном варианте осуществления композиция, которая подходит для перорального введения, содержит только ингредиенты и количества указанных ингредиентов, которые, как правило, признают безопасными для перорального введения животному. В другом специальном варианте осуществления композиция, которая подходит для перорального введения, не содержит никаких ингредиентов или количеств указанных ингредиентов, которые, как правило, не распознаются, как безопасные для перорального введения животному. В другом специальном варианте осуществления композиция, которая подходит для перорального введения, содержит только ингредиенты и количества указанных ингредиентов, которые разрешены или которые не запрещены для перорального введения животному. В другом специальном варианте осуществления композиция, которая подходит для перорального введения, не содержит никаких ингредиентов или количеств указанных ингредиентов, которые разрешены или которые не запрещены для перорального введения животному.
В некоторых вариантах осуществления композиция включает перорально приемлемый носитель для фермента. Как используют в данном контексте, выражение "перорально приемлемый носитель" включает любой физиологически приемлемый носитель, подходящий для перорального введения. Перорально приемлемые носители включают без ограничения перечисленным композиции кормов для животных, водные композиции, и жидкие и твердые композиции, подходящие для применения в кормовых продуктах для животных и/или для перорального введения животному. Подходящие носители известны в области техники и включают описанные в патенте США №6780628.
В ряде вариантов осуществления композиция представляет собой корм для животных. Как используют в данном контексте, термин "корм для животных" имеет значение, принятое в области животноводства. Например, корм для животных включает съедобные материалы, которые потребляются домашним скотом вследствие их питательной ценности. Корм для животных включает пищевые рационы, например композиции, которые соответствуют пищевым потребностям животного, и, кроме того, включает композиции, которые не соответствуют пищевым требованиям животных.
В специальных примерах данного варианта осуществления количество фермента составляет, по меньшей мере, приблизительно 50000 международных единиц (МЕ)/тонну США (907,3 кг) корма (то есть 45,365 МЕ/кг), по меньшей мере, приблизительно 60000 МЕ/тонну корма (то есть 54,438 МЕ/кг), по меньшей мере, приблизительно 70000 МЕ/тонну корма (то есть 63,511 МЕ/кг), по меньшей мере, приблизительно 80000 МЕ/тонну корма (то есть 72,584 МЕ/кг), по меньшей мере, приблизительно 90000 МЕ/тонну корма (то есть 81,657 МЕ/кг), по меньшей мере, приблизительно 100000 МЕ/тонну корма (то есть 90,730 МЕ/кг), по меньшей мере, приблизительно 200000 МЕ/тонну корма (то есть 181,460 МЕ/кг) или, по меньшей мере, приблизительно 500000 МЕ/тонну корма (то есть 453,650 МЕ/кг) или более.
В других специальных примерах изобретение представляет корм для животных, включающий фермент, снижающий иммунный стресс, в количестве, по меньшей мере приблизительно 20 МЕ/кг корма, например, по меньшей мере, 20 МЕ/кг корма, по меньшей мере, 25 МЕ/кг корма, по меньшей мере, 30 МЕ/кг корма, по меньшей мере, 35 МЕ/кг корма, по меньшей мере, 40 МЕ/кг корма, по меньшей мере, 45 МЕ/кг корма, по меньшей мере, 50 МЕ/кг корма или более. Не желая связывать себя какой-либо теорией, считают, что корм для животных, включающий количество фермента, снижающего иммунный стресс, по меньшей мере, приблизительно 20 МЕ/кг корма, будет эффективным для снижения уровня положительного белка острой фазы у указанного животного, повышения уровня отрицательного белка острой фазы у указанного животного и/или для улучшения показателей роста животного.
Таким образом, в некоторых вариантах осуществления изобретение предоставляет корм для животных, содержащий фермент, снижающий иммунный стресс, в количестве, эффективном для снижения уровня положительного белка острой фазы у животного, для повышения уровня отрицательного белка острой фазы у животного и/или для улучшения показателей роста животного.
Композицию корма можно получить методами, известными в уровне техники. Например, фермент, снижающий иммунный стресс, можно добавить к другим ингредиентам корма на любой стадии в процессе производства, как считают подходящим компетентные специалисты в области техники. В одном варианте осуществления фермент представлен в виде раствора, такого как жидкий концентрат фермента, который добавляют к другим ингредиентам корма в процессе производства. Альтернативно фермент-содержащий раствор распыляют на практически конечную форму корма для животных. В другом варианте осуществления фермент представлен в виде твердой композиции (такой как порошок), например твердая композиция, которую добавляют к другим ингредиентам корма в процессе производства. Примеры способов изготовления фермент-содержащего корма описаны в международной публикации WO 97/41739.
В ряде вариантов осуществления композиция отлична от корма для животных. Например, композиция может представлять собой жидкую композицию, отличную от корма для животных, или твердую композицию, отличную от корма для животных. Данные композиции могут подходить для непосредственного введения животному или могут быть использованы в виде добавок в корм (например, вводимые в корм перед кормлением) или кормовых добавок (включая добавки, которые разводят другими компонентами корма перед кормлением, и добавки, которые предлагают животному в виде свободного выбора на раздельной основе). Примеры жидкой композиции, отличной от корма для животных, включают жидкие концентраты ферментов, в том числе жидкие концентраты ферментов, которые, как правило, разводят или смешивают с другими ингредиентами перед пероральным введением животному.
В вариантах осуществления, где композиция представляет собой жидкую композицию, отличную от корма для животных, такую как раствор фермента, жидкая композиция или раствор может содержать по меньшей мере приблизительно 40000 международных единиц (МЕ)/л раствора, например, по меньшей мере 40000 МЕ/л, по меньшей мере 50000 МЕ/л, по меньшей мере 60000 МЕ/л, по меньшей мере 70000 МЕ/л, по меньшей мере 80000 МЕ/л, по меньшей мере 90000 МЕ/л, по меньшей мере 100000 МЕ/л, по меньшей мере приблизительно 500000 МЕ/л, по меньшей мере приблизительно 600000 МЕ/л, по меньшей мере приблизительно 700000 МЕ/л, по меньшей мере приблизительно 800000 МЕ/л, по меньшей мере приблизительно 900000 МЕ/л, по меньшей мере приблизительно 1000000 МЕ/л, по меньшей мере приблизительно 2000000 МЕ/л, или по меньшей мере приблизительно 5000000 МЕ/л.
В некоторых вариантах осуществления количество жидкой композиции, отличной от корма для животных, например, приблизительно 500 мл раствора наносят или перемешивают с количеством корма, таким как тонна корма, чтобы получить составы кормов с вышеописанными уровнями ферментов. В других вариантах осуществления количество жидкой композиции отличной от корма для животных, наносят или смешивают с количеством корма для приготовления корма для животных с количеством фермента, эффективным в плане снижения уровня положительного белка острой фазы у животного, повышения уровня отрицательного белка острой фазы у животного и/или улучшения показателей роста животного.
Считают, что имеющиеся в настоящее время композиции жидких концентратов ферментов (отличных от обсуждаемых ниже композиций 1,3-β-глюканазы), которые подходят для перорального введения, содержат значительно меньше, чем, по меньшей мере, приблизительно 40000 МЕ/л фермента, снижающего иммунный стресс, если вообще его содержат, и не являются эффективными в плане снижения уровня положительного белка острой фазы, повышения уровня отрицательного белка острой фазы и/или улучшения показателей роста животного при использовании в соответствии со своими инструкциями.
В вариантах осуществления, где композиция представляет собой твердую композицию, отличную от корма для животных, композиция может включать по меньшей мере приблизительно 40000 МЕ/кг, например, по меньшей мере 40000 МЕ/кг, по меньшей мере 50000 МЕ/кг, по меньшей мере 60000 МЕ/кг, по меньшей мере 70000 МЕ/кг, по меньшей мере 80000 МЕ/кг, по меньшей мере 90000 МЕ/кг, по меньшей мере 100000 МЕ/кг, по меньшей мере 120000 МЕ/кг, по меньшей мере 140000 МЕ/кг, по меньшей мере 160000 МЕ/кг, по меньшей мере 180000 МЕ/кг, по меньшей мере 200000 МЕ/кг или более.
В ряде вариантов осуществления количество твердой композиции, отличной от корма для животных, наносят или смешивают с количеством корма, чтобы получить составы кормов с вышеописанными уровнями ферментов. В других вариантах осуществления количество твердой композиции, отличной от корма для животных, смешивают с количеством корма для получения корма для животных с количеством фермента, эффективным в плане снижения уровня положительного белка острой фазы у животного, повышения уровня отрицательного белка острой фазы у животного и/или улучшения показателей роста животного.
Считают, что имеющиеся в настоящее время композиции твердых порошковых композиций ферментов, которые подходят для перорального введения, содержат значительно меньше, чем по меньшей мере приблизительно 40000 МЕ/л фермента, снижающего иммунный стресс, если вообще его содержат, и не являются эффективными в плане снижения уровня положительного белка острой фазы, повышения уровня отрицательного белка острой фазы и/или улучшения показателей роста животного при использовании в соответствии со своими инструкциями.
Как принято в области техники, термин "ME" или "международная единица" относится к количеству фермента, которое будет катализировать превращение микромоля субстрата в минуту в условиях, которые являются оптимальными для фермента. Эквиваленты масс относительно международных единиц ферментов, снижающих иммунный стресс, известны в области техники и могут быть определены при использовании стандартных анализов. Примеры стандартных анализов для репрезентативных ферментов, снижающих иммунный стресс, приведены ниже.
В одном варианте осуществления фермент экспрессируется растением, которое используют в корме для животных. Например, кукуруза может быть подвергнута генной инженерии, чтобы получить экспрессию фермента, снижающего иммунный стресс, и полученный в результате продукт генетически модифицированной кукурузы может быть использован в корме. На продукцию можно также воздействовать другими генетически модифицированными или классическим образом модифицированными системами, таким как бактерии, например, Е.coli, Bacillus sp., Lactobacillus; дрожжи, например Pichia, Yarrowia, Saccharomyces, Schizosaccharomyces (например, Schizosaccharomyces pombe, Hansenula, Kluyveromyces, Candida) и другие грибы, такие как Aspergillus, Rhizopus, Tricoderma, Penicillium и Humicola.
В соответствии с другим вариантом осуществления фермент, снижающий иммунный стресс, представляет собой капсулу или таблетку для перорального приема. Изобретение также охватывает варианты осуществления, в которых фермент вводят другими путями, например внутривенно, внутрибрюшинно или подкожно в виде компонента композиции, приготовленной для данного применения в соответствии с известной фармакологической практикой.
Иммунная система животного может распознавать как антиген или молекулярную структуру некоторые ингредиенты композиции корма, которые не представляют реальной угрозы для здоровья животного. Тем не менее, ингредиент инициирует иммунный ответ, который приводит к тому, что животное испытывает иммунологический стресс, и который можно выявить и мониторировать по повышению сывороточной концентрации одного или более АРР. Не желая быть связанными какой-либо теорией, авторы настоящего изобретения считают, что данный "ненужный и дающий обратный результат" иммунный ответ может включать рецепторы распознавания типа (PRR), такие как участвующие во врожденной иммунной системе.
Врожденная иммунная система дает иммунный ответ, который не зависит от распознавания специфического антигена. См., например, статью Tosi, J. Allergy Clin. Immunol. 116:241 (2005). Один аспект врожденной иммунной системы включает PRR, которые распознают и связывают ассоциированные с патогеном молекулярные структуры, трансдуцируя сигналы иммунного ответа. См., например, Fabrick et al., J. Biol. Chem. 279:26605 (2004). Примеры PRR включают Toll-подобные рецепторы (TLR), которые распознают ряд молекулярных структур и генерируют внутриклеточные сигналы для активации ряда ответов хозяина. См., например, статьи Tosi, supra; Blach-Olszewska, Arch. Immunol. Ther. Exp. 53:245 (2005). Идентифицированы PRR/TLR, которые распознают маннозу (см., например, статью Blach-Olszewska, выше), 1,3-β-глюкан (см., например, статью Rice et al., J. Leukoc. Biol. 72:140 (2002)), липополисахарид и фосфорилхолин (см., например, статью Baumgarth et al., Semin. Immunopathol. 26: 347 (2005)), липотейхоевую кислоту, растворимый в феноле модулин, мурамилдипептид и пептидогликан (см., например, статью Fournier et al., Clin. Microbiol. Rev. 18: 521 (2005). Описаны иммуномодулирующие рецепторы для маннана (см., например, статью Klabunde et al., Parasitol. Res. 88: 113 (2002) (маннан-связывающий лектин)) и N-ацетил-D-глюкозамина и N-ацетил-D-маннозамина (см., например, статью Hansen et al., J. Immunol. 169: 5726 (2002)). Идентифицированы также TLR для двухцепочечной РНК (см., например, статью Bell et al., Proc. Nat'l. Acad. Sci. USA 102: 10976 (2005)) и ДНК с типами метилирования, которые отличаются от эндогенной ДНК (см., например, статьи Huang at al., J. Immunol 175: 3964 (2005); Nonnemacher et al, Infect, Immun. 71: 850 (2003)).
Хотя данные молекулярные структуры ассоциированы с патогенными микроорганизмами (например, бактериями, вирусами, грибами и простейшими), они также презентируются некоторыми непатогенными молекулами, такими как ингредиенты корма для животных. Врожденный иммунный ответ на непатогенные молекулы, презентируемые данными молекулярными структурами, излишне подвергает животное иммунологическому стрессу и может оказывать вредное воздействие на эффективность корма для животного, замедлять скорость набора массы тела животного или приводить к потере массы тела, делать животное более чувствительным к инфекции, повышать температуру тела животного или иным образом оказывать отрицательное воздействие на здоровье животного или эффективность использования энергии пищи (калорий). Врожденный иммунный ответ, обусловленный функцией MBL (манноза-связывающего лектина), например, индуцирует сильные ответы. Показано, что мутация одного из генов белка, связывающего маннозу, у мышей парадоксальным образом обеспечивает выживание после обычно летального искусственно вызванного острого септического перитонита (см. статью Takahashi К. et al., Microbes Infect. 4(8): 773-784, 2002). В данном случае иммунный стресс вследствие агрессивного врожденного иммунного ответа является более летальным, чем инфекция.
β-Маннан представляет собой компонент соевых продуктов и кормов для животных на соевой основе. Высокомолекулярные формы β-маннана, присутствующие в корме для животного, могут инициировать "ненужный и дающий обратный результат" иммунный ответ, тем самым подвергая животное иммунологическому стрессу. Авторы настоящего изобретения обнаружили, что данный иммунологический стресс можно уменьшить или предотвратить, используя гемицеллюлазу типа β-маннаназы, эндо-1,4-β-D-маннаназу, фермент, который разрушает β-маннаны (например β-галактоманнан, β-глюкоманнан), тем самым уменьшая или предотвращая иммунный ответ на β-маннан. Как показано в примерах ниже, снижение уровня иммунологического стресса отражается в снижении сывороточной концентрации АРР.
α-Маннаназу, которая разлагает α-маннан, используют как фермент, уменьшающий иммунный стресс, в соответствии с изобретением α-маннан не считают гемицеллюлозой, поскольку он не имеет общих характерных свойств гемицеллюлоз.
В области промышленных ферментов термин "гемицеллюлаза" используют как торговое название β-маннаназы. Аналогичным образом в патентах и публикациях, соавторами которых являются авторы данной заявки, термин "гемицеллюлаза" используют для обозначения β-маннаназы, в том числе эндо-1,4-β-D-маннаназы. См., например, патент США №6162473. В других контекстах термин "гемицеллюлаза" может быть шире, охватывая глюканазы и ксиланазы в дополнение к маннаназе, как объясняют ниже.
Термин "гемицелюлоза" создан для описания углеводного растительного материала, полученного экстракцией разбавленным щелочным раствором, который гидролизуется легче, чем целлюлоза. См., например, статьи Schuize, Е., Berichte der Deutschen Botanischen Gesellschaft, 24: 2277(1891); Schuize, E., Z. Physiol. Chem. 16: 387(1892). С того времени термин "гемицеллюлоза" стал определять нерастворимые в воде растительные полисахариды, ассоциированные с целлюлозой, отличные от пектина и крахмалов и полисахариды в соке растений, которые растворимы в разбавленных щелочных растворах. См., например, раздел, написанный Whisler et al., "Hemicelluloses" (Гемицеллюлозы) в монографии IV POLYSACCHARIDE CHEMISTRY (Химия полисахаридов) 112 (Academic Press, 1953). Как правило, считают, что ксилан, β-маннаны и галактаны - представляют собой гемицеллюлозы, хотя некоторые β-маннаны, такие как галактоманнаны камеди плодов рожкового дерева и гуаровой камеди хорошо растворимы. Хвойные деревья содержат много β-маннанов, ассоциированных с целлюлозой, а лиственные деревья содержат много ксиланов.
В противоположность гемицеллюлозам α-маннан, ассоциированный с клеточными стенками грибов, таких как Saccharomyces, - не является структурным компонентом древесины и постоянно обнаруживается в эукариотических гликопротеинах, которые, как правило, растворимы в воде. Таким образом не считают, что α-маннан представляет собой гемицеллюлозу, и α-маннаназа не является гемицеллюлазой. α-Маннаназу используют как фермент, снижающий иммунный стресс, в соответствии с настоящим изобретением, поскольку она разлагает α-маннаны, которые распознаются иммунной системой животного, но не ассоциированы с патогеном. Врожденная иммунная система чувствительна к маннану, поскольку полимеры, содержащие маннозу, присутствуют на поверхности многих патогенов.
Другие ингредиенты корма, которые может распознавать иммунная система животного, включают β-1,3-глюкан (обычный структурный компонент растительных материалов), N-связанные гликопротеиновые комплексы (обнаружены, например, в соевых продуктах), двухцепочечные РНК, выделенные из растений, животных или микробов, растения или животные с чужеродным (неэндогенным) типом миелирования. Так, в соответствии с одним вариантом осуществления изобретение представляет композиции, содержащие один или более ферментов, снижающих иммунные стрессы, которые разлагают один или более данных или других ингредиентов корма.
В родственном варианте осуществления изобретение представляет способы уменьшения иммунологического стресса у животного, которые заключаются во введении животному композиции, содержащей эффективное количество данного фермента или ферментов. Специфические примеры ферментов, снижающих иммунный стресс и антигенов, которые они разлагают, приведены в следующей таблице. Изобретение охватывает композиции, которые включают другие ферменты, снижающие иммунный стресс, которые разлагают те же самые или другие антигены, а также применение данных других ферментов для снижения иммунологического стресса.
В соответствии с некоторыми вариантами осуществления изобретение представляет композицию, содержащую два или более ферментов, снижающих иммунный стресс. В одном варианте осуществления, по меньшей мере, один из двух или более ферментов не является 1,4-β-маннаназой или 1,3-β-глюканазой. В другом варианте осуществления композиция включает 1,4-β-маннаназу и 1,3-β-глюканазу.
В одном специальном варианте осуществления композиция представляет собой корм для животных, содержащий 1,4-β-маннаназу и, по меньшей мере, приблизительно 20 ME 1,3-β-глюканазы/кг корма, например, по меньшей мере, 20 МЕ/кг корма, по меньшей мере, 25 МЕ/кг корма, по меньшей мере, 30 МЕ/кг корма, по меньшей мере, 35 МЕ/кг корма, по меньшей мере, 40 МЕ/кг корма, по меньшей мере, 45 МЕ/кг корма, по меньшей мере, 50 МЕ/кг корма или более 1,3-β-глюканазы.
В другом специальном варианте осуществления, композиция представляет собой жидкую композицию, отличную от корма для животных, включающую 1,4-β-маннаназу и по меньшей мере приблизительно 155000 ME 1,3-β-глюканазы/л, например, по меньшей мере 155000 МЕ/л, по меньшей мере 230000 МЕ/л, по меньшей мере 300000 МЕ/л, по меньшей мере 380000 МЕ/л или более 1,3-β-глюканазы.
В другом специальном варианте осуществления композиция представляет собой твердую композицию, отличную от корма для животных, включающую 1,4-β-маннаназу и по меньшей мере приблизительно 300000 ME 1,3-β-глюканазы/кг, например, по меньшей мере 300000 МЕ/кг, по меньшей мере 450000 МЕ/кг, по меньшей мере 600000 МЕ/кг, по меньшей мере 750000 МЕ/кг, по меньшей мере 900000 МЕ/кг или больше 1,3-β-глюканазы.
В другом варианте осуществления композиция включает 1,4-β-маннаназу и ксилоглюканазу. В другом варианте осуществления композиция включает 1,3-β-глюканазу и ксилоглюканазу. В другом варианте осуществления композиция включает 1,4-β-маннаназу и хитиназу. В другом варианте осуществления композиция включает 1,3-β-глюканазу и хитиназу.
В другом варианте осуществления композиция включает 1,4-β-маннаназу и арабинаназу. В другом варианте осуществления композиция включает 1,3-β-глюканазу и арабинаназу. В другом варианте осуществления композиция включает 1,4-β-маннаназу, 1,3-β-глюканазу и арабинаназу.
Следует иметь в виду, что данные комбинации являются только иллюстративными, и изобретение включает композиции, содержащие другие комбинации ферментов, уменьшающих иммунный стресс. Например, изобретение включает композиции, содержащие один или более ферментов, снижающих иммунный стресс, перечисленных выше и/или обсуждаемых ниже и 1,4-β-маннаназу.
Иммунный стресс, вызываемый ингредиентом корма может не всегда представлять собой ответ врожденной иммунной системы. Хорошо известно, что у некоторого небольшого процента детей, которых кормят заменителем женского молока на основе соевого белка, развивается сильная неблагоприятная кишечная реакция на иммунологической базе (см. отчет Комитета по питанию Американской академии педиатрии, Pediatrics 101(1): стр.148, (1998)). N-Связанные гликопротеины сои, например β-конглицинин, иногда называемый 7S глобулином (см. статьи Ogawa Т., et al., Biosci. Biotechnol. Biochem. 59(5): 831-833, 1995; Burks AW, et al., J. Pediatr. Gastroenterol. Nutr. 8(2): 195-203, 1989), могут представлять собой сильные антигены, и признают, что они обладают антипитательными свойствами, β-конглицинин намеренно удаляют из препаратов изолятов соевого белка, используемых для пищевых добавок, несмотря на его вклад в общий белок. Гидролиз разрушает антигенность. Кроме того, авторы обнаружили, что обогащенная 7S фракция соевого гликопротеина при использовании для кормления самцов птиц, переваривалась хуже, чем другая менее гликозилированная фракция соевого белка.
Примеры подходящих ферментов для разложения углеводов в N-связанных гликопротеинах включают α-фукозидазы, такие как α-1,2-фукозидаза и α-1,3-1,4-фукозидаза, α-маннозидазы, такие как α-1,6-маннозидаза, α-1,2-маннозидаза и α-1,3-маннозидаза, β-1,4-галактозидаза, эндо-β-N-ацетилглюкозаминидаза F (эндо F), пептид-N-(N-ацетил-β-глюкозаминил)аспарагинамидаза F (РNGаза F), РNGаза А, эндо-β-N-ацетилглюкозаминидаза Н (эндо Н), эндо D, эндо С, α-N-ацетилгалактозамидаза, β-1,3-галактозидаза, эндо-N-ацил-нейраминидаза (эндо N), α-2,3-нейраминидаза, α-2,6-нейраминидаза, α-2,8-нейраминидаза, α-N-ацетилгексозаминидаза, эндо-β-N-галактозидаза, эндо-β-N-ацетилгалатозаминидаза, эндо-α-1,6-D-маннаназа, арабиногалактаназа, α-галактозидаза, β-галактозидаза.
Данные ферменты известны в уровне техники и некоторые доступны из коммерческих источников. Альтернативно ферменты, снижающие иммунный стресс, можно получить из микроорганизмов, которые продуцируют ферменты, таких как бактерии, грибы и дрожжи. Кроме того, ферменты можно получить при использовании методов рекомбинантной технологии, известных в области техники, путем, например, генетической инженерии клетки-хозяина с целью получения продукции фермента, например, вызывая транскрипцию и трансляции гена, кодирующего фермент. Последовательности аминокислот ряда приведенных выше ферментов известны в области техники. Используя данные последовательности или известные нуклеотидные последовательности, кодирующие данные последовательности, компетентные специалисты в области техники могут сконструировать подходящие гены для рекомбинантной экспрессии ферментов. Кроме того или альтернативно, нуклеотидную последовательность, кодирующую известный фермент, снижающий иммунный стресс, можно использовать для зондирования библиотеки ДНК (дезоксирибонуклеиновых кислот) с целью идентификации других нуклеотидных последовательностей, кодирующих ферменты, снижающие иммунный стресс. Как известно в области техники, данную библиотеку ДНК можно выделить из определенного организма или популяции организмов или можно получить из естественных источников и, таким образом, представить ДНК из микроорганизмов, которые трудно культивировать.
В вариантах осуществления, где композиция включает комбинацию ферментов, фермент можно получить в индивидуальной форме путем разделения организмов, или два или более ферментов могут продуцироваться одним организмом. Например, один организм можно сконструировать рекомбинантно с целью получения двух или более ферментов методами, известными в области техники.
Как обсуждается выше, иммунная система животного распознает ряд молекулярных структур, представляемых патогенными микроорганизмами, включая липополисахарид (например, ассоциированный с грамотрицательными бактериями), бактериальные жгутики, содержащие консервативный белок флагеллин, пептидогликан (например, ассоциированный с грамположительными бактериями), липотейхоевую кислоту (например, ассоциированный с грамположительными бактериями), связанную лектином L-фиколином С-типа (см. статью Lynch N. J., et al., J. Immunology 172: 1198-1202, 2004), фосфорилхолин (например, ассоциированный с грамположительными и грамотрицательными бактериями), ДНК (такую как бактериальная ДНК с неметилированными мотивами CpG, см. статью Van Uden и Raz, J. Allergy Clin Immunol. 104(5): 902-10, 1999.) и двухцепочечную РНК и 3рРНК (см. статью Hornung, et. al., Science 314: 994-997, 2006). Иммунный ответ на данные молекулы включает повышение уровня сывороточного АРР.
Другие патогенные молекулярные структуры включают молекулы, содержащие N-ацетилглюкозамин и молекулы, содержащие N-ацетилманнозамин. Точная специфичность связывания всех коллектинов может быть неизвестной (манноза-связывающий лектин представляет собой коллектин или лектин С-типа), но связывание с рядом различных бактериальных патогенов наблюдают, например, у Н-фиколина, связанного с поверхностно-активным веществом белка A (SP-A) и конглютинина. Соединения, подобные N-ацетилглюкозамину и N-ацетилманнозамину, могут ингибировать связывание и, таким образом, как предполагают, являются частью специфичности связывания распознаваемой структуры (см. статью Haurum J.S., et al., Biochemical J. 293 (3): 873-878, 1993).
Примеры других антигенов и молекулярных структур, которые могут представлять собой мишень для разложения ферментом в соответствии с изобретением, включают бактериальные липопротеины (см. статью Hacker Н. et al., J. Exper. Med. 192 (4): 595-600, 2000); β-1,3-глюкан, связываемый коллектином дектином-1 (Adachi Y., et al., Infection и Immunity 72 (7): 4159-4171, 2004); флагеллин (который связывает TLF5) (см. статью Honko A.N., и Mizel S.B., Immunol. Res. 33 (1): 83-101, 2005); гликоконъюгаты фукозила, α-Gal-церамид, фибриноген, гепаринсульфат, сульфатированный gal-сахарид, хитозан N- ацетилглюкозамин; асиалоликопротеин и β-галактозиды.
Класс рецепторов, называемых фагоцитарными рецепторами (SR), структурно близок ряду рецепторов врожденного иммунного ответа и может привести к иммунному стрессу. Считают, что SR включены в повторный цикл и очистку в апоптозных или в иным образом поврежденных клетках. Фагоцитарные рецепторы (SR), экспрессируемые макрофагами и дендритными клетками, также представляют собой рецепторы для врожденной иммунной системы. Более того, некоторые SR распознают патогены, и показано, что ряд врожденных иммунных рецепторов важны при апоптозе. Так, в соответствии с одним вариантом осуществления изобретения молекулярные структуры, являющиеся мишенями связывания SR, направлены на разложение ферментом.
Одна из данных мишеней связывания молекулярных структур представляет собой окисленный липопротеин низкой плотности (ЛНП). Рецепторы, называемые LOX-I (см. статью Peiser L, et al., Current Opinion in Immunology 14: 123-128, 2002) SR-PS OX/CXCL-16 (см. статью Fukumoto N., et al., J. Immunol. 173(3): 1620-1627, 2004) и CD36 (см. статью Bruni F., et al., Clin. Appl. Thromb. Hemost. 119(4): 417-28, 2005) связывают окисленный ЛНП, который может присутствовать в ряде кормов, в частности кормов, содержащих муку из субпродуктов животных, такую как кровяная мука. Другая молекулярная структура, являющаяся мишенью связывания SR, представляет собой фосфатидилсерин (PS) и лизофосфатидилсерин (лизо PS). SR для PS включает SR-PSOX/CXCL-16 и другие рецепторы PS (см. статью Schlegel R.A., Williamson P., Cell Death Differ. 8(6): 545-548, 2001).
Воздействие фосфатидилсериновых фосфолипидов может привести к воспалительным реакциям, и считают, что фосфатидилсериновые фосфолипиды присутствуют на некотором уровне в большинстве кормов.
Гиалуронан преобладает во внеклеточных жидкостях животных, но также распознается механизмами врожденной иммунной/фагоцитарной системы, например, при заживлении ран. См., например, статью Jameson, et al., J. Expt. Medicine 210 (8): 1269-1279, 2005. Куриные гребешки являются коммерческим источником гиалуронана, обычно используемого в форме очищенной гиалуроновой кислоты. Так, корм для птицы, сделанный из субпродуктов обработки мяса, может содержать гиалуронан, часто в больших количествах. Гиалуронидазу (ЕС 3.2.1.35), которая разлагает гиалуронан и гиалуроновую кислоту, используют как фермент, снижающий иммунный стресс, в соответствии с изобретением, особенно для животных, которые получают корм из птицы. Например, гиалуронидазу используют для снижения иммунного стресса, ассоциированного с кормлением пищей из птицы.
Ферменты, которые разлагают любую из данных молекулярных структур, тем самым ингибируют или снижают уровень иммунного ответа, таким образом снижая иммунологический стресс у животного. Например, известны ДНКазы и неспецифические нуклеазы, которые разрушают двухцепочечную РНК и бактериальную ДНК. Известны ферменты - рестрикционные эндонуклеазы, специфические в отношении метилированных мотивов цитозин-гуанин в ДНК немлекопитающих. Ферменты, которые разлагают фосфорилхолин, включают фосфорилхолингидролазу, щелочную фосфатазу, кислую фосфатазу, фосфорилхолинэстеразу и фосфорилхолинфосфатазу.
Данное снижение стресса можно выявить и мониторировать измерением уровня сывороточного АРР, как описано выше, причем пониженные концентрации сывороточного АРР отражают пониженный иммунологический стресс.
Как отмечено выше, композиция включает количество фермента, снижающего иммунный стресс, которое эффективно в плане снижения уровня белка острой фазы у животного. Данное количество может варьировать от животного к животному и от фермента к ферменту, но может быть легко установлено компетентными специалистами в области техники, например измерением уровней АРР, как описано выше. Например, уровни сывороточного АРР животного можно измерить до и после введения фермента или можно сравнить уровни сывороточного АРР леченых и контрольных животных. В вариантах осуществления, где эффективное количество оценивают измерением уровней сывороточного АРР до и после введения фермента, последующее измерение можно сделать через по меньшей мере приблизительно один день до по меньшей мере приблизительно нескольких дней или более после исходного введения фермента. Снижение концентрации сывороточного АРР, ассоциированное с введением фермента, показывает, что вводят эффективное количество фермента. Однако следует иметь в виду, что уровни АРР, как правило, снижаются по мере того, как адаптивный иммунный ответ животного дает эффект.
В соответствии с некоторыми вариантами осуществления настоящее изобретение предоставляет композицию, включающую 1,3-β-глюканазу в количестве, эффективном для эффективного снижения уровня положительного белка острой фазы у указанного животного, для повышения уровня отрицательного белка острой фазы у указанного животного и/или для улучшения показателей роста животного. В одном специфическом варианте осуществления композиция представляет собой корм для животных, включающий по меньшей мере приблизительно 20 ME 1,3-β-глюканазы/кг корма, например, по меньшей мере 20 МЕ/кг корма, по меньшей мере 25 МЕ/кг корма, по меньшей мере 30 МЕ/кг корма, по меньшей мере 35 МЕ/кг корма, по меньшей мере 40 МЕ/кг корма, по меньшей мере 45 МЕ/кг корма, по меньшей мере 50 МЕ/кг корма, или более 1,3-β-глюканазы. В другом специальном варианте осуществления композиция представляет собой жидкую композицию, отличную от корма для животных, включающую по меньшей мере приблизительно 155000 ME 1,3-β-глюканазы/л, например, по меньшей мере 155000 МЕ/л, по меньшей мере 230000 МЕ/л, по меньшей мере 300000 МЕ/л, по меньшей мере 380000 МЕ/л, или больше 1,3-β-глюканазы. В другом специальном варианте осуществления композиция представляет собой твердую композицию, отличную от корма для животных, включающую по меньшей мере приблизительно 300000 ME 1,3-β-глюканазы/кг, например, по меньшей мере 300000 МЕ/кг, по меньшей мере 450000 МЕ/кг, по меньшей мере 600000 МЕ/кг, по меньшей мере 750000 МЕ/кг, по меньшей мере 900000 МЕ/кг или больше 1,3-β-глюканазы.
В некоторых вариантах осуществления корма для животных, где фермент содержит 1,3-β-глюканазу, фермент может присутствовать в количестве, которое составляет по меньшей мере приблизительно 100000 ME на тонну корма (то есть 90,73 МЕ/кг).
Данные количества значительно выше, чем содержание 1,3-β-глюканазы в коммерческих ферментных добавках для кормов и коммерчески доступных кормах, которые были проанализированы авторами настоящего изобретения, и было показано, что они содержат максимум от приблизительно 10000 МЕ/тонну корма (то есть 9,73 МЕ/кг), приблизительно 72500 МЕ/л некормовой жидкой композиции или приблизительно 150000 МЕ/кг некормовой твердой композиции. Авторы настоящего изобретения считают, что количество 10000 МЕ/тонну (то есть 9,73 МЕ/кг) корма 1,3-β-глюканазы не было бы эффективным для снижения уровня АРР, и экспериментально подтверждают данное мнение. Кроме того, авторы настоящего изобретения экспериментально установили, что коммерческие продукты, такие как Avizyme (Danisco A/S, Langebrogade 1, Dk-1001, Copenhagen, Denmark) и Rovobio (Adisseo France SAS, 42, Avenue Aristide Briand, BPIOO, 92164 Antony Cedex) и коммерческие корма, содержащие стандартные количества β-1,3-1,4-глюканазы (Brewzyme BG plus, Dyadic International, 140 Intracoastal Pointe Drive, Suite 404, Jupiter, Florida 33477-5094), ксиланазы (Multifect XL, Genencor International, Inc., 925 Page Mill Road, Palo Alto, CA), PI-PLC (ChemGen Corp., 211 Perry Parkway, Gaithersburg, MD) и амилазы (Амилаза FRED, Genencor International, Inc., 925 Page Mill Road, Palo Alto, CA) не снижают уровень АРР. См. пример 3 ниже и фигуру 3. В случаях, когда имеется активность 1,3-β-глюканазы, она находится в вышеуказанных низких пределах и неэффективна в плане снижения уровня AGP.
В другом варианте осуществления фермент, снижающий иммунный стресс, представлен как компонент композиции, которая включает также соединения, содержащие антиген или молекулярную структуру, которые разлагаются ферментом. Например, изобретение включает корм для животных, содержащий β-1,3-глюкан и 1,3-β-глюканазу, корм для животных, содержащий ДНК или двухцепочечную РНК и ДНКазу и/или неспецифические нуклеазы, корм для животных, содержащий N-связанный гликопротеин, и эндо- или экзо-карбогидразу, N-гликаназу или РNGазу или любой из других вышеприведенных ферментов. Другие подходящие комбинации антигенов и ферментов, снижающих иммунный стресс, будут очевидны для компетентных специалистов в области техники и охватываются изобретением.
В данном варианте осуществления ожидают, что уровни сывороточного АРР будут оставаться повышенными до тех пор, пока будут вводить композицию. Таким образом, если эффективное количество фермента, снижающего иммунный стресс, оценивают измерением уровней сывороточного АРР до и после введения фермента, то последующее измерение можно делать через несколько дней или недель после исходного введения фермента.
Как отмечено выше, изобретение включает способы снижения иммунного стресса у животного, включающие введение животному композиции, содержащей фермент, снижающий иммунный стресс, в количестве, эффективном для снижения уровня белка острой фазы у животного. Композиция может представлять собой любую из вышеописанных композиций, включая пероральную композицию, такую как корм для животных, жидкая композиция, отличная от корма для животных, или твердая композиция, отличная от корма для животных. Животное может представлять собой любое животное, включая человека, и может быть здоровым животным или животным, страдающим от инфекции или другого заболевания либо состояния.
Изобретение включает также способы улучшения показателей роста животного, заключающиеся во введении животному композиции, содержащей фермент, снижающий иммунный стресс. В ряде вариантов осуществления композиция включает количество фермента, снижающего иммунный стресс, эффективное для улучшения показателей роста животного. Композиция может представлять собой любую из вышеописанных композиций, включая пероральную композицию, корм для животных, жидкую композицию, отличную от корма для животных, или твердую композицию, отличную от корма для животных. Животное может представлять собой любое животное, включая человека, и может быть здоровым животным или животным, страдающим от инфекции или другого заболевания либо состояния.
В одном варианте осуществления фермент экспрессируется растением, которое используют в корме для животного. Например, кукурузу можно подвергнуть генетической инженерии, чтобы она экспрессировала фермент, снижающий иммунный стресс, и полученный в результате продукт генетически модифицированной кукурузы можно использовать в корме.
В одном варианте осуществления животному вводят фермент, снижающий иммунный стресс, и, кроме того, вводят антиген (например, молекулу, содержащую структуру, разлагаемую ферментом). Фермент и антиген можно вводить раздельно или одновременно в виде части одной и той же или разных композиций. В одном варианте осуществления животному вводят корм, содержащий антиген или содержащую структуру молекулу, и отдельно вводят композицию, содержащую фермент, снижающий иммунный стресс. В другом варианте осуществления животному вводят корм, содержащий антиген или содержащую структуру молекулу и кормовую добавку, содержащую фермент. В другом варианте осуществления животному вводят корм, содержащий как антиген, так и фермент.
Другой аспект изобретения представляет композиции и способы снижения иммунологического стресса путем предупреждения и лечения инфекции, вызываемой патогенными микроорганизмами. Иногда животные потребляют композиции, такие как вода или корм для животных, которые содержат патогенные микроорганизмы (например, бактерии, вирусы, грибы и простейшие), или иным образом подвергаются воздействию данных патогенов. Настоящее изобретение предоставляет композиции, содержащие фермент, который разлагает ключевые компоненты патогенных микроорганизмов (т.е. "патогенный компонент"), в количестве, эффективном для снижения уровня инфекции, и, вследствие этого, уровня АРР, экспрессируемого животным, отвечающим на инфекцию. Композицию используют для снижения иммунологического стресса путем предупреждения или сведения к минимуму инфекции, тем самым снижая иммунологический стресс, вызываемый непосредственно патогеном. В одном конкретном аспекте данного варианта осуществления изобретение представляет способ предупреждения и лечения инфекции пищеварительного тракта.
Ферменты могут также лечить или предупреждать инфекцию посредством разложения компонентов патогена. Это обусловлено тем, что при разложении патогенного компонента патоген может утрачивать свою способность инфицировать хозяина. Данное снижение действительной инфекции привело бы в результате к пониженному иммунному стрессу и снижению уровня сывороточного АРР посредством другого механизма, чем описан выше, но практически неотличимого в плане наблюдаемого снижения уровня АРР. Имеется по меньшей мере три варианта, при которых лечения ферментами могло бы привести к положительному результату. Если молекулярная структура патогена, разлагаемая ферментом, участвует в связывании патогена с клетками-хозяевами, первой стадии, требующейся для инфекции, или в любой другой стадии, необходимой для успешной инфекции, то лечение ферментами могло бы помочь. Альтернативно можно модифицировать связывающую структуру на клетке-хозяине. Например, показано, что ряд бактериальных и протозойных патогенов взаимодействует с протеогликанами на поверхности эукариотической клетки-хозяина, особенно с сульфатированными протеогликанами (см. статью Flekenstein J.M. et al., Infection и Immunity 70 (3): 1530-1537, 2002). Применение ферментов, таких как гепариназа и N-ацетилглюкозамин-4-сульфатаза или арилсульфатазы, могло бы снизить уровень взаимодействия и инфекции.
Во втором варианте разлагаемая молекулярная структура патогена могла бы представлять собой токсин, который нарушает метаболические функции клетки-мишени. В третьем варианте патогенный компонент, разлагаемый ферментом, мог бы участвовать в механизме патогена, направленном на избежание иммунного ответа хозяина. У патогенов обнаружены многочисленные механизмы избежания иммунного ответа, начиная от имитации наружной поверхности клеток-хозяев для ингибирования иммунного ответа, например реакций комплемента и апоптоза. Снижение или предупреждение инфекции можно также оценить измерением сывороточного АРР, причем более высокие уровни АРР ассоциируются с инфекцией.
Ферменты, которые разлагают патогенные компоненты, такие как описаны выше, известны в области техники. Например, показано, что эндосиалидаза, выделенная из бактериофага, предупреждает летальность при системной инфекции Е.coli K1 у крыс путем разложения капсулы PSA (полисиаловой кислоты) на поверхности бактерий. Хотя разложение капсульного углевода не оказывает воздействия на жизнеспособность Е.coli in vitro, утрата капсулы in vivo позволяет иммунной системе хозяина распознавать и бороться с инфекцией, исключая летальный исход (см. статью Mushtaq N., et al. Antimicrobial Agents and ChemoTherapy 48(5): 1503-1508, 2004). Капсула PSA дает возможность поверхности Е.coli выглядеть подобно клетке-хозяину, таким образом избегая врожденных иммунных ответов хозяина. Другим известным ферментом, используемым в настоящем изобретении, является гепариназа I (Нейтралаза, Ibex Technologies, Canada). Многие ферменты имеются в коммерческих источниках или могут быть получены из микроорганизмов, которые продуцируют ферменты, таких как бактерии и грибы, в том числе дрожжи, или могут быть получены рекомбинантным путем, как обсуждается выше.
Требуемые ферменты можно получить технологиями рекомбинантной ДНК, когда известен ген, кодирующий фермент. Развитие методов быстрого секвенирования ДНК привело в результате к созданию больших общедоступных баз данных последовательностей белков и кодирующих их генов, таких как NCBI Genbank. Используя метод быстрого секвенирования, например, из 454 Life Sciences (454 Life Sciences, 20 Commercial Street, Branford, CT 06405), можно секвенировать типичный бактериальный геном в течение четырех часов. Ранее неизвестный ген нового требуемого фермента из генома можно получить зондированием генома с использованием, например, ранее идентифицированных кодирующих последовательностей ферментов того же самого типа или подобных типов, описанных с коммерческих или общедоступных базах данных, используя легкодоступные компьютерные программы, такие как Blast. Компетентные специалисты в области техники могут идентифицировать в геноме ДНК, которая имеет пороговый уровень гомологии с известной последовательностью и другие свойства участка, кодирующего ген, и затем выделить и амплифицировать ген, используя, например, метод полимеразной цепной реакции (ПЦР). Затем ген можно экспрессировать в хозяине, и можно подтвердить его ферментные свойства требуемого белка.
Если требуемая активность фермента заранее неизвестна, ее можно определить, используя стандартные микробиологические методы обогащения, основанные на отборе по росту на субстрате. Микробы, использующие субстрат в качестве единственного источника углерода или азота, должны экспрессировать ферменты, способные разлагать соединение-мишень. Для разработки экономичного получения существует возможность выбора повышения продукции данного фермента с использованием классических мутационных/селекционных методов и методов обогащения применительно к микроорганизму-продуценту или посредством методов экспрессии рекомбинантной ДНК, хорошо известных в области техники.
Композиция, включающая фермент, снижающий иммунный стресс, который разлагает патогенный микроорганизм, может представлять собой любую композицию, подходящую для введения животному, включая композиции, подходящие для перорального введения животному, как описано выше. Как отмечено выше, композиция может включать количество фермента, которое эффективно в плане снижения уровня положительного белка острой фазы (или повышения уровня отрицательного белка острой фазы) у животного и/или улучшения показателей роста животного. Данное количество может варьировать от животного к животному и от фермента к ферменту, но может быть легко установлено компетентными специалистами в области техники, например, измерением уровней АРР и/или мониторированием показателей роста животного, как описано выше и как известно в области техники.
В одном варианте осуществления фермент, снижающий иммунный стресс, который направлен на патогенный антиген, представлен как компонент корма для животных. В одном примере данного варианта осуществления количество фермент составляет по меньшей мере приблизительно 100000 МЕ/тонну корма (то есть 90,730 МЕ/кг).
В другом варианте осуществления фермент, снижающий иммунный стресс, который направлен на патогенный антиген, представлен как компонент композиции, которая также включает патогенный антиген.
Например, изобретение включает корм для животных, содержащий (а) патогенный микроорганизм, представляющий антиген, такой как липополисахарид, пептидогликан, липотейхоевая кислота, фосфорилхолин, двухцепочечная РНК и ДНК и (б) фермент, который разлагает антиген.
Патогенные организмы могут проникнуть в корм вследствие, по-существу, антисанитарных условий, обусловленных высокой плотностью выращивания животных в условиях их производства.
Как отмечено выше, изобретение включает способы снижения иммунного стресса у животного и/или улучшения показателей роста животного, заключающиеся во введении животному композиции, содержащей фермент, снижающий иммунный стресс. В одном варианте осуществления животному вводят фермент, снижающий иммунный стресс, который разлагает патогенный антиген, и, кроме того, вводят патогенный антиген. Фермент и антиген можно вводить раздельно или одновременно в виде части одной и той же или разных композиций. В одном варианте осуществления животному вводят корм, содержащий антиген, и отдельно вводят композицию, содержащую фермент. В другом варианте осуществления животному вводят корм, содержащий антиген и кормовую добавку, содержащую фермент. В другом варианте осуществления животному вводят корм, содержащий как антиген, так и фермент.
Следующие примеры далее иллюстрируют изобретение, но изобретение не ограничено специальными примерами вариантов осуществления.
Иллюстративные примеры, подтверждающие возможность осуществления и реализацию назначения изобретением
Пример 1
Корм для животных, содержащий гемицеллюлазу (эндо-1,4-β-маннаназу) получают и вводят курам и измеряют уровни AGP, как более детально описано ниже.
В целом 4000 односуточных цыплят Cobb X Cobb мужского пола распределяют случайным образом по восьми экспериментальным группам лечения, и каждый вариант лечения осуществляют с 10 повторами:
Две из восьми групп лечения включают снижающие стресс ферменты в соответствии с изобретением: группа лечения 3 (маннаназа в форме упаренного бульона из цельных клеток, полученного при ферментации В.lentus, внесенного в концентрации приблизительно 100 MU/тонну (то есть 362,920 МЕ/кг) в основные диеты) и группа лечения 6 (маннаназа в форме бесклеточного центрифугированного супернатанта бульона, полученного при ферментации В.lentus, внесенного в концентрации приблизительно 30 MU/тонну (то есть 108,876 МЕ/кг) в основные варианты питания). Группа лечения 8 является контрольной без добавленного фермента. (1 MU = 4000 ME).
Партии основного корма в виде муки делят поровну на восемь частей и на каждую разбрызгивают соответствующее количество испытуемых материалов. Корма для начальной стадии выращивания и стадии роста птицы содержат 90 г/т (то есть 81,66 мг/кг) Cobon (антикокцидиальный лекарственный препарат ионофорного типа) и 50 г/т (то есть 45,37 мг/кг) BMD (антибиотик). Корма для завершающей стадии выращивания не содержат лекарственных препаратов.
Питание для начальной стадии дают всем птицам в возрасте от одного до 21 дня, питание для роста от 22 до 35 дней и питание для завершающей стадии от 36 до 42 дней. Питание и воду дают без ограничения. Питание предлагают птице в виде крошек или гранул в течение всех периодов кормления. Водопроводную воду используют как питьевую и подают через внутреннюю водопроводную систему.
Состав и анализы базового экспериментального питания
По две птицы из каждого из десяти загонов в группах лечения 3, 6 и 8 случайным образом выбирают после взвешивания для анализа крови через 42 дня, в целом 20 птиц из 500 на группу лечения. Образцы собирают на льду в пробирки для сбора крови, содержащие противосвертывающий агент гепарин, и получают плазму центрифугированием.
Образцы плазмы крови анализируют на куриный α-1-кислый гликопротеин с использованием набора для анализа на основе имунодиффузии фирмы Cardiotech Services, Inc. (Louisville, KY). Образцы сыворотки, взятые у двух птиц на загон, добавляют в тест-планшеты (5 мкл/лунку) и в некоторые лунки добавляют стандартный чистый AGP в концентрации, доходящей до мкг/мл. Кольца преципитата измеряют, используя шкалу для измерения преципитатных колец для самого близкого диаметра 0,1 мм.
Для построения оптимальной кривой, соответствующей данным, и получения возможности быстрого расчета концентрации AGP в образцах плазмы используют полиномиальное уравнение, как показано на фигуре 1. Измерения диаметров преципитиновых колец для всех выделенных образцов куриной сыворотки и рассчитанная концентрация AGP для каждой птицы показаны в таблице ниже. Птицы, которые получают маннаназу, в среднем имеют очень статистически достоверное снижение средней концентрации AGP по сравнению с контрольными птицами.
День 42. Образцы крови (у - AGP мкг/мл, х - результат измерения кольца в мм)
Пример 2
Проводят другой эксперимент с использованием гемицеллюлазы (эндо-1,4-β-маннаназы). В данном эксперименте группы кур (10 загонов каждая, по 50 птиц на загон) кормят одним из следующих четырех вариантов питания.
Группа лечения 1 (контроль): корм, содержащий антибиотик BMD, обрызганный после гранулирования контрольным составом, и 35% сорбитом с коричневым пищевым красителем, внесенным в количестве 100 мл/тонну (то есть 90,73 мкл/кг) корма.
Группа лечения 2 (контроль): корм без BMD, обрызганный после гранулирования контрольным составом, и 35% сорбитом с коричневым пищевым красителем, внесенным в количестве 100 мл/тонну (то есть 90,73 мкл/кг) корма.
Группа лечения 3: корм, обрызганный после гранулирования составом, содержащим гемицеллюлазу (эндо-1,4-β-маннаназу), выделенную из В.lentus, внесенную в количестве 100 мл/тонну (то есть 90,73 мкл/кг) корма.
Группа лечения 4: корм, приготовленный с порошковой композицией (добавленной в смеситель перед гранулированием), содержащей гемицеллюлазу (эндо-1,4-β-маннаназу), выделенную из В.lentus, причем 454 г композиции добавляют/тонну корма, чтобы получить 100 MU/т корма (то есть 362,920 МЕ/кг). (1 MU = 4000 ME).
В начале эксперимента используют цыплят в возрасте 1 день. Питание дают без ограничений. Корма для начальной стадии (дни 0-21), стадии роста (дни 21-35) и завершающей стадии (дни 35-42) со следующими составами используют как базовые корма.
Ожидаемые количества
В день 21 приблизительно 3 мл крови собирают у 3 птиц на загон (30 на группу). Кровь помещают в гепаринизированную пробирку и слегка перемешивают. Пробирки медленно центрифугируют и затем удаляют сыворотку. Образцы сыворотки помещают в пробирки и помечают номерами загонов. Сыворотку замораживают для последующего анализа AGP, как описано выше в примере 1. Кольца иммунодиффузии, используемые для количественной оценки куриного α1 кислого гликопротеина, просто измеряются, имеют высокую воспроизводимость и показывают коэффициент вариации 4% или меньше.
Средние результаты для дня 21 по 30 птицам/вариант лечения показаны в таблице ниже и графически на фигуре 2. Можно видеть, что удаление антибиотика (BMD) из питания приводит к сильному и существенному повышению уровня AGP в плазме (ср. группу лечения 1 и группу лечения 2). Добавление любого препарата гемицеллюлазы (эндо-1,4-β-маннаназы) в питание без BMD (группы лечения 3 и 4) восстанавливают AGP до уровня, наблюдаемого при использовании антибиотика, указывая на существенное снижение иммунологического стресса.
Проводят также оценку показателей роста кур, результаты которой суммируют в таблице ниже.
Показатели роста
Таким образом, как превращение корма, так и превращение корма с поправкой на массу тела, - улучшаются к дню 21 со статистической значимостью у кур, получающих β-маннаназу. Это показывает, что снижение уровня сывороточного AGP может иметь реальную значимость в отношении показателей животного.
Пример 3
Способность других ферментов, обычно используемых в корме для животных, оценивают в плане положительного действия на AGP. Рационы для кур начальной стадии выращивания коммерческого типа (с низкой энергией метаболизма) составляют с кормовыми продуктами, обычно используемыми в США. Данные рационы (в форме мягкой массы или крошки) дают без ограничения со времени прибытия цыпленка до дня 21 исследования. Экспериментальные лечебные корма получают из данного базового корма для начальной стадии выращивания. Лечебные корма смешивают, чтобы обеспечить равномерное распределение соответственного тест-продукта.
Состав и анализы базового экспериментального питания
BMD 50 г/т (то есть 45,365 мг/кг) и салиномицин 60 г/т (то есть 54,438 мг/кг) добавляют во все корма.
Ферментные препараты
Ферментные препараты. Дополнительная информация
Корм и вода доступны без ограничения на протяжении испытания. В день 15 птиц из групп лечения 17, 18, 19, 20 и 21 перорально инокулируют смешанным инокулюмом, содержащим приблизительно 30000 ооцист Е.Acervulina/птицу, 2500 ооцист Е. Maxima/птицу и 25000 ооцист Е.Tenella/птицу. Способы инокуляции ооцистами кокцидий описаны в SPR SOP: IN1.002.
Определяют средние значения набора массы тела при клеточном содержании, потребления корма и превращения корма. Результаты приводят ниже. Инфицируют только животных, получающих образец 17.
Обнаружено, что коммерческие корма, содержащие стандартные количества амилазы, 1,3-глюканазы, 1,4-глюканазы, ксиланазы и PI-PLC, - не снижают уровни АGР. В действительности, только гемицеллюлаза (эндо-1,4-β-маннаназа) показывает существенный эффект на уровни AGP. Кроме того, сравнение групп лечения 1 и 17 ясно показывает, что AGP является высокочувствительным к АРР у кур, поскольку инфекция повышает уровень AGP до 82 мкг/мл. См. также фигуру 3.
Пример 4
Тестируемый корм для животных, содержащий 1,3-β-глюкан, составляют так, чтобы он включал 1,3-β-глюканазу в концентрации 400000 ME (100 ChemGen Mu)/t (то есть 362,920 МЕ/кг) корма. Тестируемый корм для животных вводят подопытным курам, тогда как контрольные куры получают тот же корм для животных (содержащий 1,3-β-глюкан) без 1,3-β-глюканазы. Через 21 и 42 дня ведения данной схемы оценивают уровни сывороточного AGP в крови, как описано выше. Куры, получающие корм для животных, в состав которого входит фермент, имеют существенно более низкие уровни AGP, чем контрольные животные. Кроме того, подопытные куры демонстрируют более высокую эффективность корма и повышенный набор массы по сравнению с контрольными курами.
Пример 5
Тестируемый корм для животных, содержащий источник бактериальной ДНК (например Biolys ® Lysine или другой продукт ферментации, содержащий клеточные продукты), составляют так, чтобы он включал неспецифическую нуклеазу, выделенную из Cyanobacterium Anabaena sp.7120 (NucA), одну из наиболее активных известных неспецифических нуклеаз (см. статью Meiss G. et al., Eur. J. Biochem. 251(3): 924-934, 1998). Фермент добавляют в концентрации 1 Х 107 единиц Кунитца фермента/кг корма или приблизительно 1 мг (на основе чистого фермента) на кг корма. Тестируемый корм для животных вводят подопытным курам, тогда как контрольные куры получают тот же корм для животных (содержащий бактериальную ДНК) без неспецифической нуклеазы. Через 21 день или 42 дня ведения данной схемы оценивают уровни сывороточного AGP в крови, как описано выше. Куры, получающие корм для животных, в состав которого входит фермент, имеют существенно более низкие уровни AGP, чем контрольные животные.
Пример 6
Тестируемый корм для животных, содержащий мясо-костную муку, кровяную муку или другой субпродукт животного происхождения, составляют так, чтобы он включал фосфатидилсериндекарбоксилазу в концентрации 400000 МЕ/т (то есть 362,920 МЕ/кг) корма. Тестируемый корм для животных вводят тест-курам, тогда как контрольные куры получают тот же корм для животных без фосфатидилсериндекарбоксилазы. Через 21 день или 42 дня ведения данной схемы оценивают уровни сывороточного AGP в крови, как описано выше. Куры, получающие корм для животных, в состав которого входит фермент, имеют существенно более низкие уровни AGP, чем контрольные животные.
Пример 7
Тестируемый корм для животных, содержащий соевую муку или муку, полученную из другого растения, составляют так, чтобы он включал ферменты β-маннаназу и/или 1,3-β-глюканазу, выделенные из В.lentus, каждый в концентрации 400000 МЕ/т (то есть 362,920 МЕ/кг) корма. Тестируемый корм для животных вводят подопытным курам, тогда как контрольные куры получают тот же корм для животных без β-маннаназы или 1,3-β-глюканазы. Через 21 день или 42 дня ведения данной схемы оценивают уровни сывороточного AGP в крови, как описано выше. Куры, получающие корм для животных, в состав которого входит фермент, имеют существенно более низкие уровни AGP, чем контрольные животные.
Пример 8
В данном примере показано, что маннаназа Hemicell®, добавленная в корм (традиционное кукурузно-соевое питание), снижает уровень α1 кислого гликопротеина (AGP) в сыворотке индеек, при этом улучшая также показатели роста. Эксперимент состоит из 48 загонов по 11 индюшат (исходное размещение). Шесть групп лечения повторяют в 8 блоках, рандомизированных в блоках из шести загонов каждый.
Одну группу лечения, которая включает снижающие стресс ферменты в соответствии с изобретением, Группу лечения 1 (коммерческий Hemicell® в концентрации 100 MU/т (то есть 362,920 МЕ/кг) корма), анализируют на AGP (1 MU = 4000 ME). Группа лечения 2 получает контрольный корм без добавленного фермента.
Корм перемешивают, чтобы обеспечить равномерное распределение базовых кормов среди групп лечения. Все ферменты перемешивают (разбрызивают), чтобы обеспечить равномерное распределение тест-ферментов и обеспечить близкие условия питания в группах лечения. Каждый раз, когда готовят лечебный корм, образец из верхней части, середины и нижней части каждой партии лечебного корма смешивают для получения смешанного образца. Один образец берут из каждого смешанного образца для каждого варианта лечения и для проверки уровня фермента.
Питание для индеек, которым кормят в данном исследовании группы лечения 1 и 2, детально описано ниже в следующих таблицах. В таблицах показаны составы компонентов, рассчитанные уровни питательных веществ и, наконец, некоторые измеренные значения питательных веществ с учетом возврата кормов. Питание является репрезентативным в том плане, что его можно было бы использовать при коммерческом выращивании индеек и, вследствие этого, питание несколько раз подбирают на протяжении 20-недельного периода. Композиции питания изменяют на неделе 6, 9, 12, 15 и 18.
Композиции питания для каждого периода немного различаются для групп лечения 1 и 2. Хорошо известно, что маннаназа Hemicell® обладает эффектом повышать эффективное энергетическое содержание кормов (см. патент США №6162473). По этой причине питание группы лечения 1 составлено с меньшим содержанием калорий, чем питание для группы лечения 2, чтобы свести к минимуму разницу в росте между группами лечении 1 и 2 в целях настоящего изобретения.
Композиция ингредиентов и рассчитанные уровни питательных веществ, 0-9 недель
Композиция ингредиентов и рассчитанные уровни питательных веществ, 9-15 недель
Композиция ингредиентов и рассчитанные уровни питательных веществ, 15-20 недель
Анализ питания с возвратом кормов, 0-12 недель
Анализ питания с возвратом кормов, 12-80 недель
Измерение гликопротеина
Кровь получают в конце испытания от четырех птиц на загон, выбранных случайным образом из групп лечения 1, 2 и 5. Кровь собирают в пробирки, содержащие противосвертывающий агент ЭДТА(этилендиаминтетрауксусную кислоту), смешивают, затем центрифугируют для осаждения целых клеток. Планшеты для тестирования AGP индеек получают в Cardiotech Services (Louisville, KY). Тест на AGP представляет собой тест на основе имунодиффузии. Равные объемы тест-образцов или образцов сыворотки добавляют в лунки планшета для иммунодиффузии, как рекомендует изготовитель, затем через два дня инкубирования при комнатной температуре измеряют диаметр полученных в результате колец иммунопреципитации. Образец стандарта очищенного AGP индейки, представляемый в наборе, тестируют в различных концентрациях, чтобы начертить стандартную кривую, как показано на фигуре 4. Полиномиальное уравнение подбора кривой, полученное со стандартом, используют для расчета уровня AGP в плазме индеек в тест-образцах.
Расчет уровней AGP и статистический анализ с использованием t-критерия Стьюдента приведены ниже.
Выбросы > 2 ст. отклонений от среднего отбрасывают.
Среднее AGP плазмы для группы, леченной ферментом, существенно меньше, чем для нелеченой контрольной группы. Для данного анализа один выброс удаляют из анализа из каждой группы. Можно обнаружить птиц, которые испытывают необычное количество стресса вследствие повреждения или инфекции. Пониженный уровень AGP, вызываемый кормлением ферментом, коррелирует со статистически значимыми улучшенными жизненными показателями птиц, как показано ниже в группе лечения 1 (маннаназа) относительно группы лечения 2.
Показатели роста, день 140
Птицы, получающие корм с маннаназой, имеют больший средний набор массы на 3,7%, пониженный уровень превращения корма на 2,3% и уменьшение CV (коэффициента вариации = отклонение по Стьюденту/среднее значение) одинаковости массы тела. Снижение иммунного стресса, как показано посредством пониженных сывороточных уровней AGP, коррелирует с некоторыми измерениями улучшения роста.
Пример 9
В данном примере 1,4-β-маннаназу из В.lentus, 1,3-β-глюканазу из В.lentus и комбинацию данных двух ферментова добавляют в корм (общепринятое кукурузно-соевое питание). Каждый вариант лечения ферментом улучшает показатели роста живой птицы у 700 6-недельных самок индейки породы Nicholas, причем результаты, достигнутые с помощью комбинации, неожиданно превышают результаты, достигнутые при лечении только одним из ферментов.
В эксперименте используют 80 загонов по 40 самок индейки. Лечение повторяют в десяти (10) блоках с использованием восьми вариантов лечения (семь вариантов лечения ферментами и один отрицательный контроль), рандомизированных в каждом блоке.
В группе лечения 3 используют композицию, содержащую фермент, снижающий иммунный стресс, в соответствии с изобретением, 1,4-β-маннаназу в концентрации 100 MU/т (то есть 362,920 МЕ/кг) корма. В группе лечения 6 также используют композицию, содержащую фермент, снижающий иммунный стресс, в соответствии с изобретением, 1,3-β-глюканазу в концентрации 60 MU/т (то есть 217,752 МЕ/кг) корма. В группе лечения 8 используют комбинированную композицию, соответствующую изобретению, включающую 1,4-β-маннаназу в концентрации 100 MU/т (то есть 362,920 МЕ/кг) корма и 1,3-β-глюканазу в концентрации 60 MU/т корма (то есть 217,752 МЕ/кг). Группа лечения 1 получает контрольное питание без добавленного фермента (1 MU = 4000 ME).
Корм перемешивают, чтобы обеспечить равномерное распределение базовых кормов среди групп лечения. Все ферменты перемешивают (разбрызгивают), чтобы обеспечить равномерное распределение тест-ферментов и обеспечить близкие условия питания в группах лечения. Каждый раз, когда готовят лечебный корм, образец из верхней части, середины и нижней части каждой партии лечебного корма смешивают для получения смешанного образца. Один образец берут из каждого смешанного образца для каждого варианта лечения и для проверки уровня фермента.
Питание для индеек, которым кормят в данном исследовании, представляет собой типичные коммерческие корма для индеек. Питание является репрезентативным в том плане, что его можно было бы использовать при коммерческом выращивании индеек и, вследствие этого, питание корректируют через 3 недели. Результаты роста для групп лечения 1, 3, 6 и 8 показаны в таблице ниже.
По сравнению с группой лечения 1 (контроль) самки индейки, получающие лечение группы 3 (корм с 1,4-β-маннаназой), имеют в количественном отношении повышенную среднюю живую массу и в количественном отношении улучшенное (пониженное) превращение корма. Аналогично самки индейки, получающие лечение группы 6 (корм с 1,3-β-глюканазой) имеют статистически достоверную повышенную среднюю живую массу и статистически достоверное улучшенное (пониженное) превращение корма.
Неожиданно, что самки индейки, получающие лечение группы 8 (корм с комбинацией 1,4-β-маннаназы и 1,3-β-глюканазы) имеют необычно большую статистически достоверную повышенную среднюю живую массу и необычно большое статистически достоверное улучшенное (пониженное) превращение корма. Результаты, наблюдаемые в группе лечения 8, превышают результаты, которые можно было бы объяснить аддитивным эффектом двух ферментов, введенных отдельно. Таким образом, комбинированное лечение, включающее 1,4-β-маннаназу и 1,3-β-глюканазу, дает неожиданно большое улучшение показателей роста.
Пример 10
В данном примере 1,3-β-глюканазу из В.lentus, ксилоглюканазу из В.lentus и комбинацию данных двух ферментов добавляют в корм (принятую кукурузно-соевую пищу). Лечение каждым из ферментов улучшает показатели роста живой птицы у самцов бройлерных кур в возрасте 35 дней, причем результаты, достигнутые при использовании комбинации выше, чем результаты, достигнутые при вариантах лечения с использованием только одного из ферментов.
В эксперименте используют 49 загонов по 44 самца кур Cobb x Cobb. Варианты лечения повторяют в семи блоках при семи вариантах лечения (шесть вариантов лечения ферментами и один отрицательный контроль), рандомизированных в каждом блоке.
В группе лечения 4 используют композицию, содержащую фермент, снижающий иммунный стресс, соответствующий изобретению, 1,3-β-глюканазу, в концентрации 70 MU/т (то есть 254,044 МЕ/кг) корма. В группе лечения 5 также используют композицию, содержащую фермент, снижающий иммунный стресс, соответствующий изобретению, ксилоглюканазу, в концентрации 100 MU/т (то есть 362,920 МЕ/кг) корма. В группе лечения 6 используют комбинированную композицию, соответствующую изобретению, содержащую ксилоглюканазу в концентрации 100 MU/т (то есть 362,920 МЕ/кг) корма и 1,3-β-глюканазу в концентрации 60 MU/т (то есть 217,754 МЕ/кг) корма. Группа лечения 1 является контрольной с кормом без добавленного фермента (1 MU = 4000 ME).
Корм перемешивают, чтобы обеспечить равномерное распределение базовых кормов среди групп лечения. Все ферменты перемешивают (разбрызивают), чтобы обеспечить равномерное распределение тест-ферментов и обеспечить близкие условия питания в группах лечения. Каждый раз, когда готовят лечебный корм, образец из верхней части, середины и нижней части каждой партии лечебного корма смешивают для получения смешанного образца. Один образец берут из каждого смешанного образца для каждого варианта лечения и для проверки уровня фермента. Питание, которым кормят в данном исследовании, представляет собой типичные корма для бройлерных кур. Питание является репрезентативным в том плане, что его можно было бы использовать при коммерческом выращивании бройлеров и, вследствие этого, питание корректируют через 3 недели. Результаты роста для групп лечения 1, 4, 5 и 6 через 35 дней выращивания показаны в таблице ниже.
По сравнению с группой лечения 1 (контроль) цыплята, получающие лечение группы 4 (1,3-β-глюканаза), имеют в количественном отношении повышенную среднюю живую массу и в количественном отношении улучшенное (пониженное) превращение корма. Аналогично цыплята, получающие лечение группы 5 (корм с ксилоглюканазой), имеют в количественном отношении повышенную среднюю живую массу и в количественном отношении улучшенное (пониженное) превращение корма. Цыплята, получающие лечение группы 6 (комбинацию 1,3-β-глюканазы и ксилоглюканазы), достигают улучшений в средней живой массе и превращениях корма, превышающих эффект, наблюдаемый, когда ферменты вводят отдельно. Таким образом, комбинированное лечение, включающее 1,3-β-глюканазу и ксилоглюканазу, достигает существенного улучшения в показателях роста.
Пример 11
Снижение уровня сывороточного АРР у кур при введении в корм
ферментов Бройлерных кур выращивают в течение 1-14 дней и кормят типичным кукурузно-соевым питанием для начальной стадии роста (как показано ниже в таблице "Состав питания") с различными добавленными ферментами (как суммировано ниже в таблице Ферменты). Размеры образца для каждого фермента, включают три клетки с восемью птицами/клетку.
Ферменты
"Эстераза" в Группе лечения J представляет собой неохарактеризованный фермент - продукт гена В.lentus, находящегося в одном и том же опероне с ксиланазой. Субстрат для данного фермента не идентифицирован. Его определение как "эстеразы" основано на близости последовательности ДНК данного гена к другим известным генам эстеразы. Активность эстеразы не определена, но была бы близка уровню ксиланазы, если бы два белка имели близкие специфические активности.
1,4-β-галактаназу и 1,3-галактаназу измеряют, используя анализ редуцирующих сахаров с пектиновым субстратом.
На день 14 у всех птиц собирают сыворотку крови и анализируют образцы на содержание α1-кислого гликопротеина (AGP), как описано выше. Средний уровень α1-кислого гликопротеина из каждой группы лечения показан в таблице выше.
Как отражено в таблице, относительно группы лечения А (без фермента) группы лечения Н, I и J дают в результате снижение уровня сывороточного AGP.
Группа лечения Н (хитиназа и 1,4-β-маннаназа) дает существенные результаты только через две недели роста. Хотя количества ферментов находятся на уровнях, которые не дают ответ в других группах лечения (ср. с группой лечения G со сравнимым количеством хитиназы и группами лечения Е и F со сравнимыми количествами 1,4-β-маннаназы), комбинация хитиназы и 1,4-β-маннаназы дает в результате существенное снижение уровня AGP, которое нельзя было бы предсказать по результатам, полученным при использовании только одного фермента.
Группа лечения I (1,3-β-глюканаза и 1,4-β-маннаназа) дает заметные результаты, хотя не явно статистически значимые в данном эксперименте (значение Р=0,125). В других тестах большей продолжительности лечение 1,3-β-глюканазой и 1,4-β-маннаназой все-таки обладает существенным действием на уровень AGP.
Сравнение группы лечения J (ксиланаза, 1,4-β-маннаназа, эстраза; Р=0,083 относительно контрольной группы лечения А) с группой лечения F (ксиланаза + 1,4-β-маннаназа без "эстеразы") показывает, что группа лечения J дает заметный эффект, причем группа лечения F не показывает снижения уровня AGP.
Пример 12
В данном примере анализируют предположение о том, что изменение состава корма путем включения ингредиентов, которые стимулируют врожденную иммунную систему, будет повышать уровни сывороточного АРР. Тест с бройлерными курами в возрасте 21 дня проводят, используя базовое кукурузно-соевое питание с высокоэнергетическим питанием с соевым маслом в качестве контроля. Для получения тест-питания контрольное питание модифицируют так, чтобы оно содержало используемые на практике материалы, предположительно включающие иммуностимулирующие компоненты, при поддержании такой же приблизительно эквивалентной питательной ценности. Тест-питание включает следующие варианты:
кукуруза/соя/соевое масло контроль;
включение смеси масел AV (смесь животных и растительных масел);
включение соевого лецитина;
включение муки из птицы;
включение DDGS (гранулы барды и растворимые побочные продукты, получаемые при производстве этанола) в концентрации 5% с соевой шелухой;
включение DDGS в концентрации 15% масс. без соевой шелухи.
Питание описано более детально в нижеприведенных таблицах.
Смесь AV и соевый лецитин, как ожидают, содержат фосфолипиды, включающие стимулятор врожденной иммунной системы фосфатидилсерин. Мука из птицы может содержать фосфатидилсерин, гиалуронан и различные микробные стимуляторы, выделенные из побочных продуктов производства или вторичного микробного роста, который может иметь место перед обработкой. Ожидают, что DDGS содержит в большом количестве остатки дрожжей, включая клеточные стенки, содержащие α-маннан, 1,3-β-глюкан и хитин, а также потенциально стимулирующие неферментируемые углеводные полимеры из исходного субстрата ферментации.
Составы питания
Для каждого варианта питания бройлерных кур (Cobb x Cobb) выращивают в трех батареях клеток Петерсима с восемью птицами/клетку (0,631 кв. фут/птицу (то есть 590 см2/птицу)). Через 21 день анализируют сывороточные уровни AGP каждой птицы, как описано в предшествующих примерах.
Модифицированные варианты питания дают ясное доказательство того, что врожденная иммунная система основана на существенном повышении уровней сывороточного AGP на 21 день, как показано в следующей таблице. Данные также акцентируют внимание на возможностях снизить иммунный стресс, вызываемый компонентами питания, соответствующими изобретению, например, путем использования композиций, включающих ферменты, которые разлагают ингредиенты, вызывающие иммунный стресс.
Пример 13
Данный пример демонстрирует эффективность композиций, включающих 1,3-β-глюканазу, в снижении иммунного стресса, ассоциированного с 1,3-β-глюканом, который присутствует в кормах, и, посредством его связи с клеточными стенками грибов, представляет собой молекулярную структуру, предположительно универсально распознаваемую врожденной иммунной системой животных. Результаты показывают, что, подобно 1,4-β-маннаназе, 1,3-β-глюканаза снижает сывороточные уровни АРР и улучшает показатели роста животного.
Бройлерных кур (Cobb x Cobb) выращивают со дня 1 до дня 21 на типичном питании из кукурузно-соевой муки с низким содержанием жира, приведенным в таблице ниже. В двух случаях в питание вводят добавки путем однородного разбрызгивания растворов жидких концентратов ферментов, полученных из ферментации В.lentus, чтобы внести либо 400000 МЕ/т (то есть 362,920 МЕ/кг) 1,4-β-маннаназы или 264000 МЕ/т (то есть 239,527 МЕ/кг) 1,3-β-глюканазы (В данном случае тонна представляет собой 2000 фунтов или 907,4 кг).
Состав питания
Для каждого типа питания птиц выращивают в трех батареях клеток Петерсима с восемью птицами/клетку (0,631 кв. фут/птицу (590 см2/птицу)). Через 21 день анализируют сывороточные уровни AGP каждой птицы, как описано в предшествующих примерах. Массы тела птиц и потребленного корма определяют, используя стандартные способы и рассчитывают превращение корма. Результаты показывают в следующей таблице.
WAFC (превращение корма с поправкой на массу) рассчитывают следующим образом:
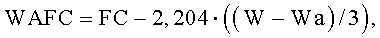
где
FC - масса потребленного корма/набранную массу;
Wa - средняя масса всех птиц в испытании;
W - средний набор живой массы/клетку.
Как 1,4-β-маннаназа, так и 1,3-β-глюканаза снижают сывороточные уровни α1-кислого гликопротеина (AGP). Лечение обоими фермента снижает уровень превращения корма с поправкой на массу и снижение в группе, которую кормят 1,3-β-глюканазой, статистически достоверно.
Пример 14
Испытание с бройлерными курами проводят в батарее клеток Петересима с использованием корма и способов, описанных выше в примере 13 за исключением лечения другими ферментами, как суммируют в таблице ниже.
Литиказу, неочищенный продукт 1,3-β-глюканазы, получаемый при ферментации Arthrobacter luteus, получают в фирме Sigma Chemical Company, St.Louis Mo. Активность литиказы определяют нижеописанным методом редуцирующих сахаров и используют в концентрации 60 MU/т (то есть 217,752 МЕ/кг). Согласно данным изготовителя, данный продукт содержит также другие активности, включая активность хитиназы, которую не измеряют.
Повышенные уровни 1,3-β-глюканазы приводят в результате к повышенному эффекту на уровень AGP (например, доза-ответ) до приблизительно 30 MU/т (108,876 МЕ/кг). Представляя данный тип корма для животных с приблизительно 30 MU/т (108,876 МЕ/кг) 1,3-β-глюканазы, ожидают, что он снизит иммунный стресс, что отражается в пониженном уровне сывороточного AGP и/или улучшенных показателях роста животного.
Результаты также показывают, что ксилоглюканаза эффективна в плане снижения уровней сывороточного AGP. Ксилоглюканаза (ЕС 3.2.1.151) представляет собой 1,4-β-глюканазу со специфичностью в отношении ксилоглюкана, структурного полимера растений.
За исключением литиказы все из ферментов, используемых в данном примере, продуцируются В.lentus. Литиказу продуцирует A.luteus, который переклассифифирован в Cellulosimicrobium cellulans. Показано, что при ферментации A.luteus образуется множество форм 1,3-β-глюканазы. См., например, статью Ferrer P., Microb Cell Factories 5:10, 2006, опубликованную в режиме прямого доступа 17 марта 2006. doi: 10.1186/1475-2859-5-10.
Вышеприведенные результаты показывают, что литиказа снижает уровень куриного сывороточного AGP по меньшей мере также, как препарат 1,3-β-глюканазы В.lentus, показывая, что источник фермента не является важным. Это значит, что можно использовать ферменты из любого источника в соответствии с изобретением. Кроме того, возможно, что хитиназа (как показано Sigma, присутствующая в литиказе) может улучшать эффективность лечения литиказой.
Пример 15
Для оценки активности ферментов можно использовать следующие анализы.
(I) Ксилоглюканаза
Активность ксилоглюканазы можно оценить, используя следующий протокол.
Реагент DNS: 10 г/л NaOH, 2 г/л фенола, 10 г/л динитросалициловой кислоты, 1200 г/л тартрата калия натрия тетрагидрата, готовят каждый день. Непосредственно перед использованием добавляют 0,5 г/л безводного сульфита натрия.
Стандартные растворы и стандартная кривая: готовят серию стандартных растворов D-(+)-маннозы путем растворения в воде в интервале концентраций 0,1-0,5 г/л. 0,6 мл каждого стандарта маннозы (в двух или трех повторностях) добавляют к 1,5 мл рабочего раствора DNS в стеклянных пробирках 13×100 мм. Образец с аликвотой воды 0,6 мл можно использовать как контрольный реагент для нулевого значения на спектрофотометре. Растворы нагревают в кипящей воде в течение 5 минут, охлаждают до температуры окружающей среды и читают поглощение при длине волны 550 нм. Ожидаемый результат представляет собой линейную зависимость доза-ответ в интервале между 0,20 и 1,2 единиц O.D. (оптической плотности). Наклон стандартной кривой (O.D. 550/г/л маннозы) рассчитывают только по линейной части кривой. При данном наклоне величину восстанавливающего сахара в г/л определяют в реакциях фермента.
Ксилоглюкановый субстрат: ксилоглюкан (тамаринд) получают от фирмы Megazyme International Ireland Ltd., Bray, Co., Ireland, растворяют в концентрации 5 г/л в 50 мМ Трис-буфере, рН 7,5 с 0,05% глюкозы.
Условия реакции: 0,25 мл ксилоглюканового субстрата в концентрации 5 г/л используют с 0,05 мл разведения фермента в 50 мМ Трис-буфере, и инкубируют реакционную смесь при 40°С. Для остановки реакции добавляют 0,75 мл реагента DNS и остановленную реакционную смесь нагревают в кипящей водяной бане в течение пяти минут и затем охлаждают перед считыванием поглощения при длине волны 550 нм. Нулевую точку времени с раствором фермента используют для определения фонового уровня.
Расчет: MU ксилоглюканазы ChemGen определяют как способность к образованию 0,72 г восстанавливающего сахара/мин (при использовании маннозы, редуцирующего сахара, в качестве стандарта). Одна MU ChemGen эквивалентна 4000 ME. Другими словами, одна единица ChemGen эквивалентна 250 ME (ME = 1,0 мкмоль/мин).
(II) β-1,3-Глюканаза
Активность β-1,3-глюканазы можно оценить при использовании следующего протокола.
В данном анализе используют тот же реагент DNS, стандартные растворы, стандартную кривую и расчет единиц фермента, и количество разведений, как описано выше для анализа ксилоглюканазы. Используемый буфер представляет собой 50 мМ буфер MOPS (4-морфолинпропансульфоновую кислоту, молекулярная масса = 209,26) с рН 6,5.
Субстрат СМ Pachyman. Карбоксиметил Pachyman (CM Pachyman, CMP) получают в Megazyme International Ireland Ltd., Bray, Co., Ireland. Субстрат СМР готовят в концентрации 5 г/л путем медленного добавления CMP в быстроперемешиваемый 50 мМ раствор буфера MOPS (рН 6,5) при приблизительно 90°С. Порошок фермента хорошо диспергируют и емкость плотно закрывают или запечатывают, при этом суспензию медленно нагревают до кипения и кипятят при медленном нагревании на подогреваемой плите с перемешиванием, чтобы получить вполне гидратированный гель, не содержащий маленьких комочков негидратированного геля, видимых в растворе. Раствор охлаждают до комнатной температуры, хранят при 4°С, когда не используют, и перемешивают перед использованием после хранения.
Условия реакции: 0,25 мл субстрата CM Pachyman в концентрации 5 г/л используют с 0,05 мл раствора фермента в буфере MOPS и реакционную смесь инкубируют при 40°С в течение различных периодов времени до 45 минут. Для остановки реакции добавляют 0,75 мл реагента DNS. Остановленную реакционную смесь нагревают на кипящей водяной бане в течение пяти минут и затем охлаждают перед считыванием поглощения при длине волны 550 нм. Нулевую точку времени с раствором фермента используют для определения фонового уровня.
(III) Хитиназа
Активность хитиназы можно определить, используя флуорогенный хитиновый субстрат, описанный в статье Thompson et al., Appl. Environ. Microbiol. 67: 4001-008 (2001), 4-метилумбеллиферил-β-D-N,N',N'',N'''-тетраацетилхитоттразид. Субстрат растворяют в ДМСО (диметилсульфоксиде) в концентрации 2,5 мМ.
В иллюстративном анализе используют 20 мкл хитинового субстрата (2,5 мМ) со 150 мкл Трис (20,0 мМ, рН 7,5). Субстратную смесь помещают в черный 98-луночный планшет для микротитрования и предварительно нагревают до 37°С в течение 10 минут. Множество повторов реакций начинают с добавления 30 мкл разбавленного фермента и продолжают инкубирование при 37°С. Отдельные реакции останавливают на 2, 4, 6, 8 и 10 минутах с помощью 50 мкл 3М Na2CO3. Флуоресценцию читают в ридере для планшетов для микротитрования (Fluoroscan II), используя длины волн возбуждающей полосы пропускания фильтра волны 355 нм и эмиссионной полосы пропускания фильтра волны 460 нм. Фермент разводят так, что 4-метилумбеллиферон образовывался с линейной скоростью в условиях реакции и в интервале стандартной кривой, полученной в условиях, идентичных условиям анализа фермент, но в отсутствие фермента и субстрата. Высвобождение одного микромоля 4-метилумбеллиферона в минуту определяют как одну ME. Стандартную кривую получают с несколькими концентрациями от нуля до 1·10-4 микромоля 4-метилумбеллиферона в 200 мкл реакционного буферного раствора с последующим добавлением 50 мкл 3М Na2CO3.
Хотя изобретение описано и проиллюстрировано достаточно подробно, для компетентных специалистов в области его осуществления и применения должны быть очевидны различные альтернативные варианты, модификации и усовершенствования, не выходящие за пределы сущности и объема изобретения. Примеры, приведенные в данном тексте, представляют собой предпочтительные варианты, являются иллюстративными и не предназначены для ограничения объема изобретения. Для компетентных специалистов в области техники будут известны модификации в них и другие варианты применения. Данные модификации охватываются сущностью изобретения и определены объемом формулы изобретения.
Компетентному специалисту в области техники будет очевидно, что в изобретении, описанном в данном тексте, можно сделать различные замены и модификации, не выходя из объема и сущности изобретения. Все патенты и публикации, упомянутые в описании, показывают уровни обычных специалистов в области техники, к которой принадлежит изобретение. Все патенты и публикации в данном контексте включены в виде ссылки в той же мере, как если бы для каждой отдельной публикации были специально и отдельно указано, что она включена посредством ссылки.
Реферат
Группа изобретений относится к ветеринарии, выращиванию и кормлению животных. Снижающая иммунный стресс композиция, с возможностью перорального введения животному в виде корма, включает в себя по меньшей мере один снижающий иммунный стресс фермент, который уменьшает уровень положительного белка острой фазы у указанного животного, повышает уровень отрицательного белка острой фазы у указанного животного и/или улучшает показатели роста указанного животного, не являющийся фосфолипазой или гемицеллюлазой, такой как β-маннаназа, в приемлемом для перорального применения носителе при содержании, по меньшей мере, 20 международных единиц/килограмм композиции, композиции в жидкой и твердой форме, а также способ улучшения показателей роста животного и способ снижения иммунного стресса. Группа изобретений обеспечивает повышение эффективности выращивания животных. 5 н.и 38 з.п. ф-лы, 15 пр., 4 ил., 28 табл.

Комментарии