Новые термостабильные фитазы с высокой каталитической эффективностью - RU2758271C2
Код документа: RU2758271C2
Чертежи








Описание
В настоящем изобретении предложены ферменты фитазы, которые проявляют неожиданно высокую термостабильность по сравнению с коммерчески доступными фитазами. Также раскрыты варианты с улучшенной каталитической активностью.
Область техники
Фитазы являются ферментами, высвобождающими неорганический фосфат из фитата. Фитазы применяют в качестве кормовых добавок для увеличения высвобождения неорганического фосфора из фитата в корме. Коммерческие фитазы, которые применяют в настоящее время в промышленности, должны обладать высокой каталитической эффективностью, стабильностью в желудке моногастричных животных и высокой термостабильностью, чтобы сохранить большую часть своей активности после термической обработки при гранулировании кормов.
Минералы являются важнейшими элементами для роста всех организмов. Для животноводства моногастричных животных (например, свиней, птицы) и рыбы корма обычно дополняются минеральными веществами. Семена растений являются богатым источником минералов, так как они содержат ионы, которые комплексуются с фосфатными группами фитиновой кислоты. Жвачные животные не нуждаются в неорганическом фосфате и минералах, поскольку микроорганизмы в рубце вырабатывают ферменты, катализирующие превращение фитата (мио-инозитол-гексафосфата) в инозитол и неорганический фосфат. В ходе данного процесса высвобождаются минералы, которые комплексовались с фитатом.
Фитат встречается в качестве источника запасенного фосфора практически во всех растительных кормах (hytic Acid, Chemistry and Applications, E. Graf (Ed.), Pilatus Press: Minneapolis, MN, U.S.A., 1986). Фитиновая кислота образует нормальную часть семян зерновых и бобовых культур. Ее действие заключается в связывании пищевых минералов, которые необходимы для нового растения, когда оно прорастает из семени. Когда фосфатные группы фитиновой кислоты удаляются семенным ферментом фитазой, способность связывать ионы металлов теряется, и минералы становятся доступными растению. В кормовых зернах для скота микроэлементы, связанные фитиновой кислотой, лишь частично доступны для поглощения моногастричными животными, которым не хватает активности фитазы. Хотя некоторый гидролиз фитата происходит в толстой кишке, большая часть фитата проходит через желудочно-кишечный тракт моногастричных животных и выводится с навозом, способствуя фекальному загрязнению фосфатами в районах интенсивного животноводства. Неорганический фосфор, выделяющийся в толстой кишке, не имеет никакой питательной ценности для скота, поскольку неорганический фосфор всасывается только в тонком кишечнике. Таким образом, значительное количество питательно важных пищевых минералов потенциально недоступно моногастричным животным.
Превращение фитата в инозитол и неорганический фосфор может быть катализировано микробными ферментами, широко известными как фитазы. Фитазы способны катализировать гидролиз гексафосфата мио-инозитола до пентафосфата D-мио-инозитола и ортофосфата. В основе каталитического способа действия лежат два типа фитаз, а именно: 3-фитаза (EC.3.1.3.8) удаляет фосфатные группы в 1 и 3 положениях мио-инозитольного кольца, а также 6-фитаза (EC.3.1.3.6), которая сначала высвобождает фосфат в положении 6 кольца. Сообщается, что некоторые грибковые фитазы гидролизуют пентафосфат инозитола до тетра-, три- и низших фосфатов; например, сообщается, что фитазы A. ficuum производят смеси ди- и моно-фосфатов миоинозитола (Ulah, 1988). Микроорганизмы, продуцирующие фитазу, включают бактерии, такие как Bacillus subtilis (V. K. Powar и V. J. Jagannathan, J. Bacteriol. 151: 1102-1108, 1982) и Pseudomonas (D. J. Cosgrove, Austral. J. Biol. Sci. 2:1207-1220, 1970); дрожжи, такие как Sacchoromyces cerevisiae (N.R. Nayini and P. Markakis, Lebensmittel Wissenschaft und Technologie 17:24-26, 1984); и грибки, такие как Aspergillus terreus (K. Yamada, et al., Agric. Biol Chem. 32:1275-1282, 1968). Ранее сообщалось о возможном использовании микробов, способных продуцировать фитазу, в качестве кормовой добавки для моногастричных животных (Shieh and Ware, патент США №3,297,548; Nelson, T. S. et al., J. Nutrition 101:1289-1294, 1971).
Сообщается также, что микробные фитазы могут быть полезны для производства кормов для животных при определенных промышленных процессах, например, из отходов пшеницы и кукурузы. В процессе мокрого измельчения кукурузы образуется клейковина, продаваемая в качестве корма для животных. Добавление фитазы, как сообщается, может улучшить питательную ценность кормового продукта.
Особый класс 6-фитаз кодируется генами appA E. coli. Первый клонированный и секвенированный ген appA (Gene bank: AAA72086.1), был изначально распознан как кислотная фосфатаза pH 2.5 (Dassa et al., 1990). При клонировании второго гена appA2 (Gene bank: AAR87658.1) и его перепроизводстве в дрожжах Родригес и его коллеги (Rodriguez et al., 1999) предоставили прямые доказательства того, что ферменты appA являются скорее фитазами, чем кислотными фосфатазами. AppA и appA2 содержат шесть аминокислотных различий, а именно S102P, P195S, S197L, K202N, K298M и T299A в области, кодирующей их зрелый белок (Rodriguez et al., 1999). Однако и appA, и appA2 кодируют активные 6-фитазы (WO 2003037102A3 и WO 1999067398A3), и поэтому белки appA и appA2 являются естественными вариантами 6-фитазы E. coli. В настоящее время количество кодируемых вариантов гена appA, депонированных в базе данных, составляет около 450. Многие из депонированных белков appA содержат в кодирующей их области варианты комбинаций шести аминокислот, которые различаются между appA и appA2.
Другие варианты фермента appA были получены в лаборатории с целью получения улучшенных свойств фермента, таких как собственная термостабильность, ферментативная кинетика или повышенная продуктивность appA 6-фитаз в их организмах-источниках (Rodriguez et al 2000; WO 2001036607A1; WO 2006042719 A3; WO 2003037102 A2; WO 2006042719 A3; WO 2003057247 A1).
Варианты фитазы AppA были получены в дрожжевых системах, таких как Pichia pastoris (a.k.a. Komagataella phaffii) (Lee 2005; WO 1999067398 A9) и Trichoderma reesei (WO 1994003612 A1).
AppA2C идентичен appA2 (AAR87658.1) за исключением аминокислот 195P, 197S. Последние две идентичны appA (AAA72086.1). Последовательность appA2C обозначена здесь как SEQ ID NO: 1. Таким образом, Appa2C является гибридом appA и appA2 с естественно присутствующими аминокислотными вариациями.
Основная цель, лежащая в основе настоящего изобретения, заключается в предложении вариантов appA2C, которые демонстрируют улучшенную термостабильность по сравнению с appA2C. Предпочтительно, чтобы эти варианты сохраняли одинаковые характеристики фермента, такие как широкий оптимум рН и быстрая ферментативная кинетика. Кроме того, цель, лежащая в основе настоящего изобретения, заключается в предложении вариантов appA2C, обладающих термостабильностью, сопоставимой или более высокой, чем у фитаз, раскрытых в WO 2003057247 A1 и US 2015132383A1. Таким образом, новые термостабильные варианты appA2C сравниваются с двумя коммерчески доступными фитазами, т.е. OptiPhos и Quantum Blue 5G, обе из которых основаны на вариантах гена appA E. coli. Новые термостабильные варианты appA2C предпочтительно должны иметь более высокую или, по меньшей мере, сопоставимую термостабильность, чем данные фитазы.
Краткое описание изобретения
Авторы данного изобретения с удивлением обнаружили, что конкретные варианты appA2C демонстрируют значительно улучшенную термостабильность по сравнению с OptiPhos. Эти варианты проявляют особые мутации, а именно, по меньшей мере, в положении 26, 84, 159, 181, 207, 233, 277 и 349 последовательности SEQ ID NO: 1 (appA2C).
Первым субвариантом с неожиданно улучшенной термостабильностью является вариант, обозначенный PhOP-0093 (SEQ ID NO: 2). Было показано, что данный вариант демонстрируют улучшенную термостабильность по сравнению с appA2C в том, что он сохраняет 50% термостабильность при температуре, которая на 13,5°С выше, чем для appA2C (50% термостабильность при 79,5°С против 66°С) при экспрессии в E. coli; и которая на 20°С выше, чем для appA2C (50% термостабильность при температуре 86°С против 66°С) при экспрессии в дрожжах Pichia pastoris.
Термостабильность PhOP-0093 (т.е. фитазы, имеющей аминокислотную последовательность SEQ ID NO: 2) сравнима с термостабильностью Quantum Blue 5G (50% термостойкость при 89°C).
Кроме того, авторы настоящего изобретения с удивлением обнаружили, что некоторые дальнейшие мутации в SEQ ID NO: 2 ответственны за еще более высокую термостойкость. Варианты, проявляющие мутации в положениях 26, 84, 159, 181, 207, 233, 277 и 349 последовательности SEQ ID NO: 1 (appA2C), предпочтительно сохраняя аминокислоты E26, W84, V159, Y181, N207, W233, D277 и Y349 последовательности SEQ ID NO: 2, проявляют термостабильность, даже если дальнейшие изменения в SEQ ID NO: 2 производятся для создания вариантов SEQ ID NO: 2. Соответственно, в настоящем изобретении предложено:
1. Фитаза, выбранная из
a) полипептида, содержащего аминокислотную последовательность SEQ ID NO: 2 [Последовательность PhOP-0093],
b) варианта полипептида, содержащего аминокислотную последовательность SEQ ID NO: 2, который
(i) сохраняет следующие аминокислотные положения E26, W84, V159, Y181, N207, W233, D277 и Y349 последовательности SEQ ID NO: 2 и предпочтительно содержит одну или более дополнительных мутаций в положениях 57, 95, 129, 161, 179, 198, 201, 249, 275, 309.
(ii) содержит одну или более замен в положениях, отличных от E26, W84, V159, Y181, N207, W233, D277 и Y349 последовательности SEQ ID NO: 2,
c) варианта полипептида, содержащего аминокислотную последовательность SEQ ID NO: 2, который
(i) сохраняет следующие аминокислотные положения E26, W84, V159, Y181, N207, W233, D277 и Y349 последовательности SEQ ID NO:2, а также
(ii) демонстрирует идентичность последовательности по меньшей мере 90% с SEQ ID NO: 2, предпочтительно 95%, более предпочтительно 98%, наиболее предпочтительно 99%;
d) варианта белка, содержащего аминокислотную последовательность SEQ ID NO: 2, который
(i) сохраняет следующие аминокислотные положения E26, W84, V159, Y181, N207, W233, D277 и Y349 последовательности SEQ ID NO:2, а также
(ii) содержит одну или более замен, добавлений или делеций аминокислот по сравнению с SEQ ID NO: 2.
Предпочтительно, в настоящем изобретении предложена фитаза, выбранная из
d') варианта белка, содержащего аминокислотную последовательность SEQ ID NO: 2, который
(i) сохраняет следующие аминокислотные положения E26, W84, V159, Y181, N207, W233, D277 и Y349 последовательности SEQ ID NO: 2, а также
(ii) содержит одну или более замен, добавлений или делеций аминокислот по сравнению с SEQ ID NO: 2,
при этом вариант содержит от одной до десяти, от одной до пяти, предпочтительно от одной до трех замен аминокислот, и/или от одного до десяти, от одного до пяти, предпочтительно от одного до трех добавлений аминокислот, и/или от одной до десяти, от одной до пяти, предпочтительно от одной до трех делеций аминокислот по сравнению с SEQ ID NO: 2.
в наиболее предпочтительном варианте осуществления этот вариант содержит от одной до трех замен аминокислот и/или от одной до трех замен аминокислот и/или от одной до трех делеций аминокислот по сравнению с SEQ ID NO: 2.
e) белок, демонстрирующий одну или более замен, добавлений или делеций по сравнению с SEQ ID NO: 2.
Предпочтительно, в настоящем изобретении предложена фитаза, выбранная из
e') белок, демонстрирующий одну или более замен, добавлений и/или делеций по сравнению с SEQ ID NO: 2.
при этом белок содержит от одной до десяти, от одной до пяти, предпочтительно от одной до трех замен аминокислот, и/или от одного до десяти, от одного до пяти, предпочтительно от одного до трех добавлений аминокислот, или от одной до десяти, от одной до пяти, предпочтительно от одной до трех делеций аминокислот по сравнению с SEQ ID NO: 2.
в наиболее предпочтительном варианте осуществления этот вариант содержит от одной до трех замен аминокислот и/или от одной до трех замен аминокислот и/или от одной до трех делеций аминокислот по сравнению с SEQ ID NO: 2.
2. Фитаза согласно варианту осуществления 1, которая проявляет термостабильность 50% при 75°C, 80°C, 85°C, 90°C, 95°C или 100°C.
3. Фитаза согласно варианту осуществления 1 или 2, которая проявляет термостабильность 70% при 75°C, 80% при 75°C, 85% при 75°C, 90% при 75°C или 95% при 75°C.
4. Фитаза согласно любому из вариантов осуществления 1-3, которая проявляет термостабильность 50% при 95°C, 55% при 95°C, 60% при 95°C, 65% при 95°C, 80% при 80°C, 80% при 85% или 80% при 90°C.
5. Фитаза согласно любому из вариантов осуществления 1-4, выбранная из полипептидов, содержащих аминокислотную последовательность SEQ ID NO:3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, или SEQ ID NO:11
6. Фитаза согласно варианту осуществления 1b), при этом одна или более дополнительных мутаций выбраны из 57Y, 95P, 129G, 161R, 179R/S/N, 198P, 201K, 249E, 275Y и 309S в SEQ ID NO: 2.
7. Фитаза согласно варианту осуществления 6, при этом одна или более дополнительных мутаций находятся в положениях 47, 65 и/или 247, предпочтительно 47F, 65P и/или 247Y.
8. Фитаза согласно любому из вариантов осуществления 1-7, которая экспрессируется в грибковой клетке-хозяине, предпочтительно в дрожжевой клетке-хозяине.
9. Фитаза согласно любому из вариантов осуществления 1-7, которая экспрессируется в бактериальной клетке-хозяине, предпочтительно E. coli.
10. Последовательность нуклеиновых кислот, кодирующая любую из фитаз согласно любому из вариантов осуществления 1-7.
11. Вектор, содержащий нуклеиновую кислоту согласно варианту осуществления 10.
12. Клетка-хозяин, содержащая нуклеиновую кислоту согласно варианту осуществления 10 или вектор согласно варианту осуществления 11.
13. Клетка-хозяин согласно варианту осуществления 12, которая является грибковой клеткой-хозяином, предпочтительно дрожжевой клеткой-хозяином или бактериальной клеткой-хозяином, предпочтительно E. coli.
14. Применение фитазы согласно любому из вариантов осуществления 1-7 для высвобождения фосфата из фитата.
15. Применение фитазы согласно любому из вариантов осуществления 1-7 в качестве кормового ингредиента.
16. Способ получения фитазы согласно любому из вариантов осуществления 1-7 путем рекомбинантной экспрессии фермента в клетке-хозяине согласно варианту осуществления 12 или 13.
17. Применение фитазы согласно любому из вариантов осуществления 1-7 для увеличения или улучшения коэффициента конверсии корма.
Коэффициент конверсии корма (FCR) - это отношение ввода корма (в кг) к увеличению массы тела, полученному после кормления (в кг).
Предпочтительно, фитаза согласно варианту осуществления 17 содержит одну из аминокислотных последовательностей SEQ ID NOs: 3 или 6. Более предпочтительно, фитазой является PhOP-0136 или PhOP-0161.
18. Применение фитазы согласно любому из вариантов осуществления 1-7 для повышения содержания доступного фосфата в кормах для животных.
Процентное содержание золы (главным образом золы, содержащей кальций и фосфат) в костях, таких как большеберцовая кость, является мерой наличия пищевого фосфора в кормовых продуктах.
Предпочтительно, фитаза согласно варианту осуществления 17 содержит одну из аминокислотных последовательностей SEQ ID NOs: 3 или 6. Более предпочтительно, фитазой является PhOP-0161 или PhOP-0136.
19. Применение фитазы согласно любому из вариантов осуществления 1-7 для улучшения среднесуточного прироста массы тела.
Среднесуточный прирост массы тела (ADG) - это средний прирост массы тела в сутки у животных. Предпочтительно, фитаза согласно варианту осуществления 19 содержит аминокислотную последовательность SEQ ID NO:6. Более предпочтительно, фитазой является PhOP-0161.
Описание Чертежей
На Фигуре 1 показаны профили термостабильности девяти вариантов осуществления настоящего изобретения, экспрессированных в Pichia по сравнению с PhOP-wt (appA2C) и коммерчески доступной фитазой Quantum Blue 5G.
На Фигуре 2 показаны профили термостабильности одиннадцати вариантов осуществления настоящего изобретения, экспрессированных в E. coli по сравнению с PhOP-0093 и PhOP-0122.
На Фигуре 3 показан ДНС-ПААГ анализ супернатантов из Pichia pastoris, продуцирующих appA2C, PhOP-0136, PhOP-0142, PhOP-0161, PhOP-0175 и Quantum Blue 5G.
На Фигуре 4 показан ДНС-ПААГ анализ очищенных фитаз: appA2C, PhOP-0136, PhOP-0142, PhOP-0161, PhOP-0175 и Quantum Blue 5G.
На Фигуре 5 показана калибровочная кривая корреляции концентрации неорганического фосфата Pi и поглощения при 820 нм, А820. Данные четырех различных микротитрационных аналитических планшетов (“Fag 1-12-1”, “Fag 1-12-2”, “Fag 1-17-1”, “Fag 1-17-2”) включены.
На Фигуре 6 показан процент восстановления активного фермента в единицах активности фитазы после гранулирования по сравнению с мешанкой, т.е. до гранулирования. Более высокие количества PhOP-0136, PhOP-0142, PhOP-0161 и PhOP-0175 были получены как при 80°C, так и при 90°C по сравнению с OptiPhos и при 90°C по сравнению с Quantum blue
На Фигуре 7 показано влияние различных фитаз на ростовые показатели бройлеров. Итоговая масса тела и FCR на 35-й день. PhOP-136 и PhOP-161 продемонстрировали отличные показатели, отчасти лучшие, чем OptiPhos.
На Фигуре 8 показано влияние различных фитаз на минерализацию костной ткани цыплят-бройлеров. Данные по золе большеберцовой кости на 21 день. PhOP-161 продемонстрировал отличные показатели, лучшие, чем OptiPhos.
Подробное описание изобретения
В настоящем изобретении предложены варианты фитазы с повышенной термостабильностью по сравнению с appA2C или аналогично по сравнению с OptiPhos. Эти варианты называются PhOP-вариантами (варианты ”фитазы Escherichia coli"). Некоторые явные варианты показаны в SEQ ID NOs. 2-11. Нумерация аминокислот в этих вариантах соответствует нумерации SEQ ID NO: 1 (appA2C), которая соответствует нумерации фитазы дикого типа appA2 (AAR87658.1), в соответствии с публикацией Rodriguez et al., 1999. AppA2 и appA2C содержат в себе 432 аминокислоты, содержащие нативную сигнальную последовательность (22 аминокислоты), за которой следует последовательность зрелой фитазы (410 аминокислот). Нативная сигнальная последовательность показана в SEQ ID NO: 12.
Варианты фитазы согласно настоящему изобретению проявляют превосходную термостабильность. “Термостабильность" определяется путем измерения остаточной ферментативной активности фитазы при температуре 37°C (температура тела) после нагревания фермента фитазы в течение 15 минут до определенной температуры с последующим охлаждением до 37°C. Референсную ферментативную активность определяют после воздействия на фермент температуры 25°C в течение 15 минут и последующего измерения ферментативной активности при 37°C. Относительную активность вычисляют путем сравнения с этой более поздней ферментативной активностью.
Термостабильность 50% (”значение TM50") - это температура, при которой фермент сохраняет 50% своей активности после термической обработки. Значения TM50 являются показательными для оценки и сравнения термостабильности ферментов.
Варианты гена AppA могут быть экспрессированы в любой эукариотической или прокариотической экспрессионной системе. Предпочтительно, варианты фитазы appA получают в E. coli и Pichia pastoris после оптимизации частоты использования кодона. Предпочтительно синтетические варианты генов, кодирующие варианты PhOP фитазы, клонируются в плазмиды для экспрессии в E. coli с использованием сильного промотора, такого как промотор T7, или в P. pastoris с использованием сильного промотора, такого как AOX. Для достижения секреции в периплазму (E. coli) или среду (Pichia) нативная сигнальная последовательность (E. coli, длиной 22 аминокислоты) или альфа-фактор спаривания (Pichia, длиной 89 аминокислот) применялись в качестве N-концевой сигнальной последовательности и слиты со зрелым белком appA2C.
Предпочтительно варианты PhOP-фитазы экспрессируются в E. coli во встряхиваемых колбах или в 96-луночных планшетах. Предпочтительным промотором является сильный промотор T7. Предпочтительно прекультуры, содержащие по одному клону на лунку, инкубируют в течение ночи. После сбора клетки лизируют, подвергая клеточную суспензию трем циклам замораживания-оттаивания в лизисном буфере (100 мМ натрий-цитратного буфера (рН 5,5), 2 мМ MgCl2, 0,5 мг/мл лизоцима, 20 Ед/мл NuCLEANase). Суммарные клеточные экстракты получают после центрифугирования и сбора супернатантов при отделении от клеточного дебриса.
Предпочтительно ферментативная активность фитаз определяется в скрининговых исследованиях следующим образом: фитазы экспрессируются в клетках-хозяевах, предпочтительно в клетках-хозяевах E. coli или Pichia pastoris. Экстракты фермента из E. coli или Pichia pastoris инкубируют в течение 15 минут при температуре, выбранной для тепловой стадии, а также при комнатной температуре (референсной) после инкубации на льду и центрифугирования. Затем активность фитазы определяют при температуре 37°С (температура тела). Ферментативная активность фитазы в 96-луночных планшетах осуществляется по адаптированному методу Кима и Лея (Kim and Lei), J. Anim. Sci. 2005. 83:1062-1067.
Фосфат, высвобождаемый из фитата в ходе 2-ступенчатой процедуры, определяется фотометрически:

Схема 1: схема реакции определения активности фитазы
В таблице 1 представлены 9 явных вариантов (SEQ ID NOs. 3-11) вместе с SEQ ID NO: 2 (PhOP-0093). Эти варианты проявляют выдающуюся термостойкость.

Таблица 1: девять явных вариантов appa2C (SEQ ID NOs. 3-11) в сравнении с appA2C. Эти варианты проявляют исключительную термостабильность.
SEQ ID NO:2 является последовательностью PhOP-0093, SEQ ID NO:3 является последовательностью PhOP-0136, SEQ ID NO:4 является последовательностью PhOP-0138, SEQ ID NO:5 является последовательностью PhOP-0142, SEQ ID NO:6 является последовательностью PhOP-0161, SEQ ID NO:7 является последовательностью PhOP-0169, SEQ ID NO:8 является последовательностью PhOP-0175, SEQ ID NO:9 является последовательностью PhOP-0176, SEQ ID NO:10 является последовательностью PhOP-0179, SEQ ID NO:11 является последовательностью PhOP-0180.
Неожиданно было обнаружено, что мутации в положении 26, 84, 159, 181, 207, 233, 277 и 349 appA2C (SEQ ID NO: 1) необходимы для повышения термостабильности. В то время как другие мутации или изменения в аминокислотной последовательности возможны, или даже полезны, эти 8 мутаций последовательности appA2C, дающих PhOP-0093 (с мутациями 26E, 84W, 159V, 181Y, 207N, 233W, 277D и 349Y относительно SEQ ID NO:1) имеют ключевое значение для повышения термостабиности. Термостабильность повышается, если фитазы экспрессируются в бактериальных клетках, предпочтительно E. coli (см. Таблицу 2).

Таблица 2: термостабильность (значения TM50) фитаз, экспрессируемых в E. coli. Профили термостабильности определяли после нагревания в течение 15 мин до соответствующих температур; относительную активность определяли по сравнению с “нагреванием” в течение 15 мин до 25°С.
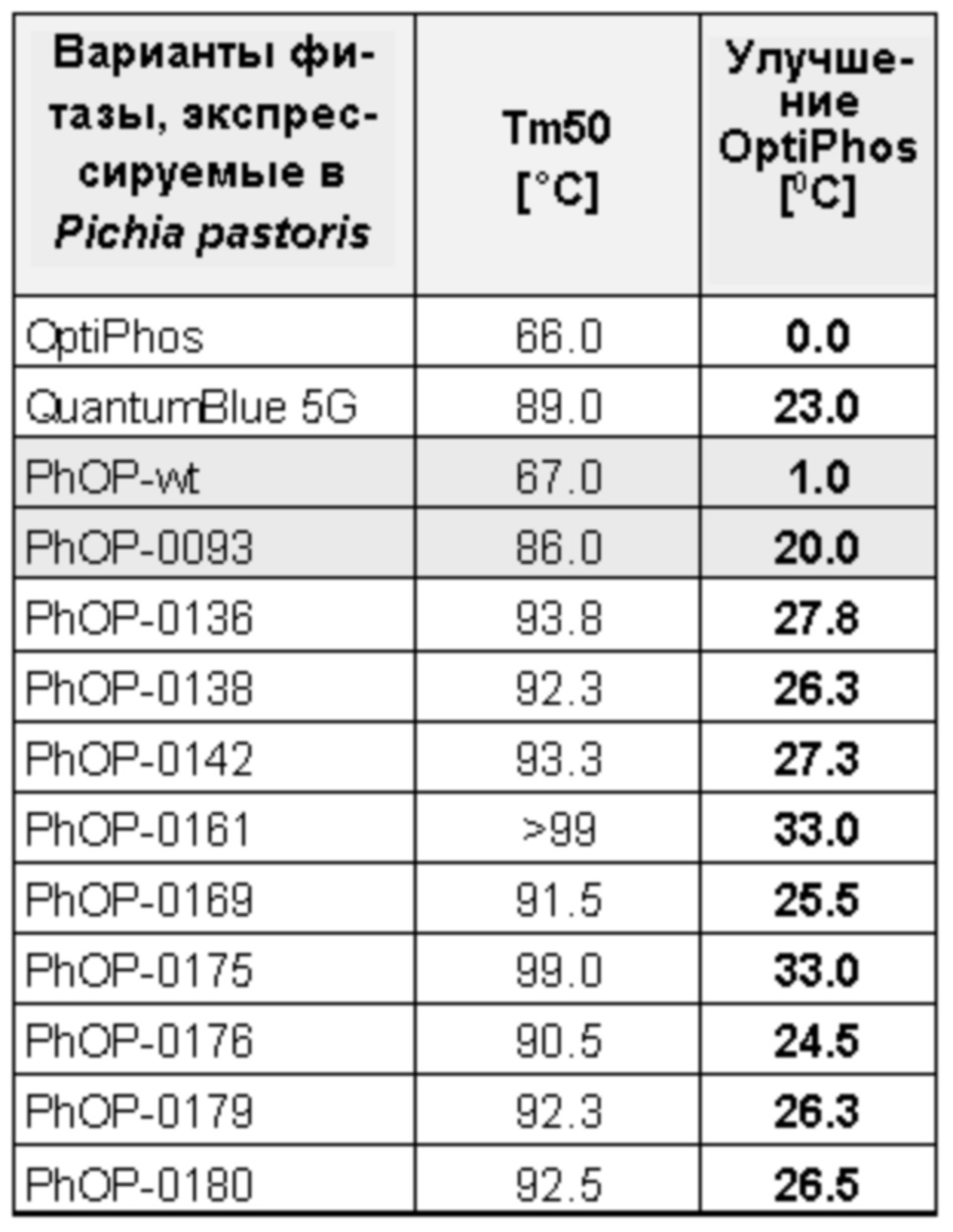
Таблица 3: термостабильность фитаз в Pichia pastoris (значения TM50). Профили термостабильности определяли после нагревания в течение 15 минут до соответствующих температур; относительную активность определяли применительно к “нагреванию” в течение 15 минут до 25°С.
Фитазы, экспрессируемые в дрожжевых клетках-хозяевах вместо бактериальных клеток-хозяев, проявляют еще более высокую термостойкость. Это показано в Таблице 3. Все варианты демонстрируют термостабильность, сопоставимую или более высокую, чем Quantum Blue 5G. Исходные данные приведены на Фигуре 1.
Ниже приведены дальнейшие варианты PhOP-0093, демонстрирующие неожиданно высокую термостабильность.
Некоторые из вариантов фитазы согласно изобретению имеют аминокислотные последовательности вариантов фитазы SEQ ID NOs: 2-11. Все варианты фитазы согласно изобретению характеризуются катализом гидролиза фитата до инозитола и свободного фосфата с выделением минералов из комплекса фитиновой кислоты и обладают улучшенной термостабильностью.
Также в изобретение включены полипептиды, имеющие последовательности, которые "по существу идентичны" последовательности полипептида фитазы. "По существу идентичная" аминокислотная последовательность - это последовательность, которая отличается от референсной последовательности только консервативными аминокислотными заменами, например заменами одной аминокислоты на другую того же класса (например, заменой одной гидрофобной аминокислоты, такой как изолейцин, валин, лейцин или метионин, на другую, или заменой одной полярной аминокислоты на другую, такой как замена аргинина на лизин, глутаминовой кислоты на аспарагиновую кислоту или глутамина на аспарагин).
Фрагменты вариантов фитазы согласно настоящему изобретению сохраняют по меньшей мере одну фитазоспецифическую активность или эпитоп.Активность фитазы можно определить, изучив превращение фитата в инозитол и свободный фосфат.
Например, фрагмент, содержащий, напр., не менее 8-10 аминокислот, может быть использован в качестве иммуногена при производстве фитазоспецифических антител. В дополнение к их применению в качестве пептидов с иммуногенными свойствами, вышеописанные фрагменты фитазы могут применяться в иммунологических анализах, таких как ИФА (ELISAs), для обнаружения присутствия фитазоспецифических антител в образцах.
Другие варианты фитазы, включенные в изобретение, являются вариантами, имеющими аминокислотные последовательности, которые демонстрируют идентичность последовательности по меньшей мере 90% с SEQ ID №2, предпочтительно 95%, более предпочтительно 98%, наиболее предпочтительно 99%.
Длина аминокислотной последовательности для определения идентичности аминокислотных последовательностей может составлять, например, не менее 20 аминокислот, например, не менее 25 или 35 аминокислот.Предпочтительно длина аминокислотной последовательности для определения идентичности аминокислотных последовательностей составляет 400 аминокислот, более предпочтительно 410 аминокислот, наиболее предпочтительно 432 аминокислоты. Идентичность может быть измерена с помощью стандартного программного обеспечения для анализа последовательностей (например, программный пакет анализа последовательностей (Sequence Analysis Software Package) группы Genetics Computer Group, University of Wisconsin Biotechnology Center, 1710 University Avenue, Madison, WI 53705; Также см. Ausubel, et al., supra). Такие процедуры и алгоритмы включают в себя, например, программы BLAST (Basic Local Alignment Search Tool at the National Center for Biological Information), ALIGN, AMAS (Analysis of Multiply Aligned Sequences), AMPS (Protein Multiple Sequence Alignment), ASSET (Aligned Segment Statistical Evaluation Tool), BANDS, BESTSCOR, BIOSCAN (Biological Sequence Comparative Analysis Node), BLIMPS (BLocks IMProved Searcher), FASTA, Intervals & Points, BMB, CLUSTAL V, CLUSTAL W, CONSENSUS, LCONSENSUS, WCONSENSUS, Smith-Waterman algorithm, DARWIN, Las Vegas algorithm, FNAT (Forced Nucleotide Alignment Tool), Framealign, Framesearch, DYNAMIC, FILTER, FSAP (Fristensky Sequence Analysis Package), GAP (Global Alignment Program), GENAL, GIBBS, GenQuest, ISSC (Sensitive Sequence Comparison), LALIGN (Local Sequence Alignment), LCP (Local Content Program), MACAW (Multiple Alignment Construction & Analysis Workbench), MAP (Multiple Alignment Program), MBLKP, MBLKN, PIMA (Pattern-Induced Multi-sequence Alignment), SAGA (Sequence Alignmnet by Genetic ALgorithm) и WHAT-IF.
Полипептиды фитазы согласно изобретению могут быть получены с использованием рекомбинантной экспрессионной системы (см. ниже), химически синтезированы (этот подход может быть более подходящим для небольших фрагментов пептида фитазы) или очищены из организмов, в которых они естественным образом экспрессируются.
В изобретении также предложено выделение молекул нуклеиновых кислот, кодирующих описанные выше полипептиды фитазы. Например, в изобретение включены нуклеиновые кислоты, кодирующие любую из SEQ ID NOs:2-11. Эти нуклеиновые кислоты могут содержать естественно встречающиеся нуклеотидные последовательности или вырожденные последовательности, все еще кодирующие одну и ту же аминокислотную последовательность. Последовательности нуклеиновых кислот согласно изобретению могут содержать нуклеотиды ДНК или РНК, а также их комбинации или модификации.
Настоящее изобретение также относится к векторам, содержащим последовательности нуклеиновых кислот согласно настоящему изобретению, клеткам-хозяевам, которые генетически модифицированы для содержания векторов согласно изобретению, и производству ферментов согласно изобретению рекомбинантными методами.
Клетки-хозяева генетически модифицируются (трансдуцируются, трансформируются или трансфицируются) векторами, содержащими последовательности нуклеиновых кислот согласно настоящему изобретению. Такими векторами могут быть, например, вектор клонирования или вектор экспрессии. Вектор может быть, например, в виде плазмиды, вирусной частицы, фага и т.д. Модифицированные клетки-хозяева можно культивировать в обычных питательных средах, модифицированных соответствующим образом для активации промоторов, отбора трансформантов или амплификации генов согласно настоящему изобретению. Условия культивирования, такие как температура, рН и тому подобное, являются подходящими для клетки-хозяина, выбранной для экспрессии, и будут очевидны для специалиста в данной области техники.
Последовательности нуклеиновых кислот согласно настоящему изобретению могут быть задействованы для получения ферментов рекомбинантными методами. Так, например, последовательность нуклеиновых кислот может содержаться в любом из множества векторов экспрессии для экспрессии фермента. Такие векторы содержат хромосомные, нехромосомные и синтетические последовательности ДНК, например, производные SV40; бактериальные плазмиды; ДНК фага; бакуловирус; дрожжевую плазмиду; векторы, полученные из комбинаций плазмид и ДНК фага, вирусную ДНК, такую как осповакцина, аденовирус, вирус оспы птиц и вирус бульбарного паралича. Однако любой другой вектор может применяться до тех пор, пока он воспроизводим и жизнеспособен в хозяине.
Соответствующая последовательность нуклеиновых кислот может быть введена в вектор с помощью различных процедур. В общем случае последовательность ДНК вводится в соответствующий сайт(ы) эндонуклеазы рестрикции с помощью процедур, известных в данной области техники. Считается, что эти и другие процедуры находятся в пределах компетенции специалистов в данной области техники.
Последовательность нуклеиновых кислот в векторе экспрессии оперативно связана с соответствующей последовательностью(ями) управления экспрессией (промотором) для прямого синтеза мРНК. В качестве репрезентативных примеров таких промоторов можно упомянуть: промотор LTR или SV40, lac или trp E. coli, промотор PL фага лямбда и другие промоторы, которые контролируют экспрессию генов в прокариотических или эукариотических клетках или их вирусах. Вектор экспрессии может также содержать сайт связывания рибосомы для инициации трансляции и терминатор транскрипции. Вектор может также содержать соответствующие последовательности для усиления экспрессии.
Кроме того, вектор экспрессии предпочтительно содержит один или более селективных маркерных генов для обеспечения фенотипического признака для отбора трансформированных клеток-хозяев, таких как дигидрофолат-редуктаза, устойчивость к зеоцину или неомицину для культуры эукариотических клеток, или таких как устойчивость к тетрациклину или ампициллину в E. coli.
Вектор, содержащий соответствующую последовательность ДНК, согласно настоящему изобретению, раскрытому в настоящей заявке, а также соответствующий промотор или контрольную последовательность, может быть задействован для трансформации соответствующего хозяина, что позволяет хозяину экспрессировать полипептид.
В качестве репрезентативных примеров соответствующих хозяев могут быть упомянуты бактериальные клетки, такие как E. coli, Streptomyces, Bacillus subtilis; грибковые клетки, такие как дрожжи; клетки насекомых, такие как Drosophila S2 и Spodoptera Sf9; аденовирусы клеток животных; клетки растений и т.д. Предполагается, что выбор подходящего хозяина известен специалистам в данной области техники на основе приведенных здесь идей. Предпочтительными клетками-хозяевами являются бактериальные и грибковые клетки-хозяева. Более предпочтительными являются дрожжи, в том числе, например, виды Saccharomyces, Kluyveromyces, Torulaspora, Schizosaccharomyces, Pichia, Hansenula, Torulopsis, Candida и Karwinskia. Дрожжи могут быть метилотрофными штаммами, например, штаммы дрожжей Pichia, Hansenula, Torulopsis, Candida, и Karwinskia. Как отмечалось выше, клетка-хозяин может быть не дрожжевой клеткой. К не дрожжевым клеткам, представляющим особый интерес, относятся, например, виды Aspergillus, виды Trichoderma, виды Neurospora, виды Myceliopthora, виды Penicillium, виды Bacillus и виды Lactococcus.
Рекомбинантные фитазы могут быть получены при помощи внутриклеточной экспрессии или внеклеточной секреции в клеточные культуральные среды.
Клетки-хозяева обычно собирают центрифугированием, разрушают физическими или химическими средствами, а полученный суммарный экстракт сохраняют для дальнейшей очистки.
Клетки-хозяева, задействованные в экспрессии ферментов, могут быть разрушены любым удобным методом, включая циклирование замораживания-оттаивания, разрушение ультразвуком, механическое разрушение или использование лизирующих клетки агентов, такие методы хорошо известны специалистам в данной области техники.
Фермент может быть извлечен и очищен из рекомбинантных клеточных культур методами, включающими осаждение сульфатом аммония или этанолом, кислотную экстракцию, анионную или катионообменную хроматографию, фосфоцеллюлозную хроматографию, хроматографию гидрофобного взаимодействия, аффинную хроматографию, гидроксилапатитовую хроматографию и лектиновую хроматографию. Этапы рефолдинга белка могут при необходимости применяться при завершении конфигурации зрелого белка. Наконец, высокоэффективная жидкостная хроматография (ВЭЖХ) может применяться для конечных стадий очистки.
Ферменты согласно настоящему изобретению могут быть очищенным продуктом природного происхождения, или продуктом химических синтетических процедур, или получены рекомбинантными методами из прокариотического или эукариотического хозяина (например, бактерий, дрожжей, высших растений, насекомых или клеток млекопитающих в культуре). В зависимости от хозяина, задействованного в процедуре рекомбинантного производства, ферменты согласно настоящему изобретению могут быть гликозилированы или могут быть негликозилированы. Ферменты согласно изобретению могут также содержать или не содержать исходный остаток аминокислоты метионина.
Фермент согласно настоящему изобретению может быть задействован для любой цели, для достижения которой такая активность фермента необходима или желательна. В предпочтительном варианте осуществления фермент задействуется для катализа гидролиза фитата. Разложение фитата может быть полезно в кормах для животных.
Примеры
1 Общие методы и аналитические методы
1.1 Экспрессия в E. coli и подготовка PhOP - дикого типа и вариантов в процедуре скрининга (формат планшетов для микротитрации (MTP)
Экспрессия PhOP - в E. coli: клетки E. coli BL21(DE3), трансформированные плазмидой pLE1A17 (производное pRSF-1b, Novagen), несущей ген PhOP с его нативной N - концевой сигнальной последовательностью, культивировали в среде ZYM5052 (F. William Studier, Protein Expression and Purification 41 (2005) 207-234), дополненной канамицином (50 мг/л) и выращивали в течение ночи при 30°C. Клетки собирали и лизировали тремя циклами замораживания-оттаивания в лизисном буфере (100 мМ натрий-цитратного буфера, рН 5,5, 2 мМ MgCl2, 0,5 мг/мл лизоцима, 20 Ед/мл NuCLEANase (c-LECTA GmbH)). Суммарные клеточные экстракты получали после центрифугирования и сбора супернатантов из клеточного дебриса.
1.2 Определение объемной активности фитазы
Общий принцип заключается в фотометрическом определении Pi, выделяющегося из фитата в результате двухступенчатой реакции, как показано на Схеме 1.

Схема 1: схема реакции определения активности фитазы.
Неорганический фосфат (Pi) высвобождался из фитата под действием фитазы в буфере, состоящем из 1% (м./об.) фитата, 0,2 М цитрата натрия, рН 5,5.. После инкубации при 37°С в течение 30 мин реакции фитазы останавливали добавлением 1 объема 15% - ной трихлоруксусной кислоты (ТХУ). Слепые контрольные пробы для определения потенциального фосфатного загрязнения образцов фитазы отбирали путем смешивания образцов фитазы с 15% - ной ТХУ, а затем с субстратным буфером. На втором этапе Pi, выделившийся в ходе реакции фитазы, определяли при помощи образования комплексов с молибдатом аммония. После остановки реакции образцы разбавляли в 10 раз Н2О и 75 мкл разбавленных образцов смешивали с 75 мкл комплексообразующего реагента (0,5% молибдата аммония, 0,6 М серной кислоты, 2% аскорбиновой кислоты). После инкубации в течение 60 минут при 37°С измеряли поглощение на длине волны 820 нм. Количественное определение проводили путем сравнения с калибровочной кривой фосфата.
С помощью этого метода концентрацию Pi можно определить очень точно в широком диапазоне. В предпочтительном варианте осуществления активность фитазы определяется для фитазы, экспрессируемой в E. coli и в Pichia pastoris.
1.3 Определение значений Tm50 (термостабильность)
Значение Tm50 было определено как температура, при которой фермент сохраняет 50% своей активности после термической обработки, и поэтому является показательным для оценки и релевантным для сравнения термостабильности фермента. Образцы, содержащие фитазу, подвергали термической обработке при температурах 58-99°С в течение 15 мин и сравнивали с образцом, инкубированным при 25°С для нормализации остаточной активности. После стадии регенерации в течение 30 минут на льду и центрифугирования для удаления осажденного белка объемную активность в образцах определяли с помощью скринингового исследования, описанного в разделе 1.2. Посредством построения графика зависимости остаточной активности от температуры инкубации значения Tm50 получали из этих графиков.
1.4 Субклонирование и экспрессия PhOP-вариантов в Pichia
Гены вариантов, отобранных методом скрининга в системе E. coli, были субклонированы в экспрессионную плазмиду Pichia pLE3B06 под контролем AOX-промотора. Для достижения секреции в среду нативную N-концевую сигнальную последовательность, применяемую в системе E. coli, заменяли сигнальной последовательностью Альфа-фактора спаривания. Трансформацию штамма P. pastoris LE3A100 проводили с помощью линеаризованной pLE3B06-PhOP-конструкции. Положительно трансформированные клоны отбирали путем дополнения стандартной среды Pichia YPD 100 мкг/мл зеоцина. PhOP-клоны предварительно культивировали во встряхиваемых колбах в среде BMGY в течение ночи при 30°C. Экспрессию проводили в стандартной среде Pichia BMMY после индукции промотора AOX метанолом. Среды BMGY и BMMY описаны в руководстве Pichia expression kit K1710-01 компании ThermoFisher Scientific. В культуры BMMY вносили 1/30 объема прекультур BMGY. Каждые 24 часа экспрессии культуру снабжали добавлением 0,5% (об./об.) индуктора-метанола. Экспрессию проводили в течение 72 ч с последующим центрифугированием и восстановлением супернатантов культуры. Для удаления фосфата, присутствующего в стандартной среде BMMY, супернатанты перед определением активности ребуферировали в 0,2 М натрий-цитратном буфере (рН 5,5). Ребуферизацию проводили с применением колонок PD-10 от GE Healthcare в соответствии с протоколом производителя.
2. Инженерия PhOP
Одним из подходов к повышению производительности ферментов и их пригодности для применения в промышленных процессах является ферментная инженерия. Этот метод включает разработку вариантов исходного фермента с улучшенными свойствами (обзор см., например, S. Lutz, U. T. Bornscheuer, Protein Engineering Handbook, Wiley VCH, Weinheim, 2009). Библиотеки вариантов PhOP создали и скринировали в E. coli методами, описанными в 1.1 и 1.2. Шаблонным ферментом для энзимной инженерии являлся PhOP-0093 (SEQ ID NO: 2)
В общей стратегии ферментной инженерии проводили скрининг вариантов фитазы с индивидуальными аминокислотными мутациями, и полезные мутации впоследствии рекомбинировали вместе для получения новых библиотек.
Во-первых, при скрининге библиотеки вариантов PhOP-0093 выявили ряд вариантов фермента с улучшенной термостабильностью (Таблица 4).

Таблица 4: Данные об активности испытанных вариантов
Дальнейшая рекомбинация индивидуальных мутаций и скрининг библиотеки позволили получить ряд вариантов со значительно улучшенной термостабильностью и содержащих различные комбинации замен аминокислот в положениях 57, 95, 129, 161, 179, 198, 201, 249, 275, и 309 (Таблица 5).

Таблица 5: Очень перспективные варианты: 20 наиболее стабильных вариантов среди испытанных
Для группы из одиннадцати вариантов (отмеченных в правой колонке Таблицы 5) сформировали профили термостабильности для определения значений Tm50 в сравнении с PhOP-0093 и PhOP-0122 (Фигура 2). Профили термостабильности выявили улучшение значений Tm50 за счет рекомбинации полезных мутаций в диапазоне ~6-8°C по сравнению с наиболее стабильным вариантом PhOP-0122 из библиотек мутантов или ~8-10°C по сравнению с PhOP-0093. Принимая во внимание улучшение стабильности PhOP-0093 (из E. coli) по сравнению с референсным OptiPhos на 13,5°C, варианты рекомбинации из E. coli являются на 21,5-23,5°C более стабильными, чем референсный OptiPhos. Данные приведены в Таблице 6.
Предполагалось, что варианты, полученные из Pichia, будут еще более стабильными, чем варианты, экспрессируемые в E. coli. Соответственно, для последующего субклонирования и экспрессии в Pichia в соответствии с разделом 1.4 выбрали восемь вариантов, испытанных в E. coli, и дополнительно девятый вариант (PhOP-0180), несущий полезные мутации во всех 10 положениях. Термостабильность этих вариантов показана в Таблице 7 и на Фигуре 1.

Таблица 6: Предпочтительные варианты осуществления изобретения, экспрессированные в E. coli

Таблица 7: Предпочтительные варианты осуществления изобретения, экспрессированные в P. pastoris
Сравнение профилей термостабильности (Фигура 1) выявило значительно улучшенную стабильность по сравнению с референсным OptiPhos для всех полученных итоговых вариантов PhOP. Повышенные значения Tm50 показывают увеличение термостабильности с 24,5 до>33°C. По сравнению с шаблонным вариантом PhOP-0093 термостабильность была дополнительно улучшена на 4,5-13°C. Следовательно, все итоговые варианты демонстрируют более высокую термостабильность, чем коммерчески доступная фитаза Quantum Blue 5G. Наиболее стабильные варианты PhOP-0161 и PhOP-0175 по меньшей мере на ~10°C более стабильны, чем Quantum Blue 5G. Варианты, экспрессируемые и гликозилированные в Pichia, более стабильны, чем ферменты из E. coli, и они не полностью инактивируются при высоких температурах, но сохраняют довольно высокую остаточную активность 30% и выше (например, PhOP-0161 с ~ 60% остаточной активностью после инкубации при 99°C).
3. Новые термостабильные варианты с повышенной скоростью катализа дифосфорилирования фитата
Четыре новых высокотермостабильных варианта фитазы экспрессировали в Pichia pastoris и очищали до однородности. Их кинетику Михаэлиса-Ментена очень подробно изучали в условиях, сходных с условиями пищеварительного тракта моногастричного животного: т.е. при рН 2-4 и температуре 39°С.
На Фигуре 3 показан ДНС-ПААГ анализ супернатантов Pichia pastoris, продуцирующих appA2C, PhOP-0136, PhOP-0142, PhOP-0161, PhOP-0175 и коммерческий продукт Quantum Blue 5G.
Рекомбинантные белки очищали с помощью комбинации обычной хроматографии и ультрафильтрации, а их ферментативные свойства анализировали в кинетических исследованиях in vitro с фитатом в качестве субстрата.
На Фигуре 4 показан ДНС-ПААГ анализ очищенных фитаз: appA2C, PhOP-0136, PhOP-0142, PhOP-0161, PhOP-0175 и Quantum Blue 5G.
4. Определение кинетических параметров
Различные кинетические параметры гидролиза фитатов определяли в реакционном буфере Глицин-HCl при рН 2,0-4,0 и температуре 39°С, оба параметра релевантны для пищеварительного тракта животных (птицы и свиней). Значения Km и Vmax для различных препаратов фитазы были рассчитаны на графике Лайнуивера-Берка при помощи концентраций субстрата в диапазоне от 0,02 до 0,17 мМ.
Вариант PhOP-0136 определили как особенно интересный, поскольку в дополнение к своей высокой термостабильности он показал высокую эффективность каталитической реакции Kcat против фитата. Вариант PhOP-0161 также был интересен, поскольку он имеет более высокий показатель соотношения Kcat/Km, демонстрирующий сочетание высокой специфичности субстрата и эффективности каталитической реакции, также известной как каталитическое совершенство (Berg, J. M., Tymoczko, J. L., Stryer, L., Berg, J. M., Tymoczko, J. L., & Stryer, L. (2002). Biochemistry (5th ed.). W H Freeman. Section 8.4 The Michaelis-Menten Model Accounts for the Kinetic Properties of Many Enzymes.), чем OptiPhos и Quantum Blue 5G в диапазоне рН 2-4.

В Таблице 8 приведены все кинетические параметры (Vmax, Km, Kcat и Kcat/Km), определенные для очищенных фитаз при различных значениях рН:
5. Тест Гранулирования
Термическую стабильность OptiPhos, Quantum Blue и четырех ферментов согласно настоящему изобретению проверяли в эксперименте по гранулированию. Этот тест показывает практическую значимость улучшенной термостабильности ферментов согласно настоящему изобретению в отличие от OptiPhos и Quantum blue. При гранулировании корма при высоких температурах 80 и 90°С в течение примерно 1 мин ферменты согласно настоящему изобретению были более стабильны, чем OptiPhos и Quantum blue. Данные этого эксперимента показаны на Фигуре 6.
Партии кормов для бройлеров гранулировали при помощи кондиционирования паром при 80 и 90°C. Корм для бройлеров поставляла компания Cibus NV. 200,00 г фермента смешивали с 200 кг корма для бройлеров в вертикальном шнековом смесителе. После 15-минутного перемешивания корм гранулировали на грануляторе Labor Monoroll Pellet с прессом 4 х 50 мм при кондиционировании паром при различных температурах.
Гранулы охлаждали сразу после гранулирования с помощью принудительного воздушного охладителя при температуре окружающего воздуха.
На Фигуре 6 показан процент восстановления активного фермента (определяемого при помощи анализа активности ISO30024:2009) после гранулирования по сравнению с мешанкой, т.е. до гранулирования. Более высокие количества PhOP-0136, PhOP-0142, PhOP-0161 и PhOP-0175 получали как при 80°C, так и при 90°C по сравнению с OptiPhos и при 90°C по сравнению с Quantum blue.
6. Тесты Эффективности Кормов
В ходе исследования, проведенного в Университете Вармии и Масзуры (University of Warmia and Maszury), Польша, эффективность новых фитаз PhOP-0136 и PhOP-0161 тестировали и сравнивали с OptiPhos на петушках ROSS 308.
Цель исследования заключалась в оценке влияние различных фитаз на такие показатели, как прибавка массы тела и минерализация костной ткани, как показатель включения фосфатов. В общей сложности 1056 здоровых суточных самцов бройлеров Ross 308 (Gallus gallus) разделили на восемь экспериментальных групп (T1-8):
Т1 - Положительный контроль (достаточный уровень P)
Т2 - Отрицательный контроль (нехватка P)
Т3 - Отрицательный контроль+PhOP-0136 - 250 FTU/кг
Т4 - Отрицательный контроль+PhOP-0136 - 500 FTU/кг
Т5 - Отрицательный контроль+PhOP-0161 - 250 FTU/кг
Т6 - Отрицательный контроль+PhOP-0161 - 500 FTU/кг
Т7 - Отрицательный контроль+PhOP-0175 - 250 FTU/кг
Т8 - Отрицательный контроль+TSP 175 - 500 FTU/кг
Птиц содержали в напольных загонах для содержания цыплят - всего 96 загонов по 0,7 м2 каждый. В каждой экспериментальной группе было по 12 загонов (повторностей), в каждом загоне по 11 птиц - по 132 птицы в каждой экспериментальной группе. Продолжительность периода выращивания составляла 35 дней. Птиц разделяли по половому признаку в инкубатории, чтобы гарантировать, что отобрали только самцов, и после транспортировки на ферму случайным образом распределяли по отдельным обработкам и повторностям. Испытание проходило в обычном птичнике с программой искусственного освещения, автоматизированным газовым отоплением и принудительной вентиляцией. Программа отопления проводилась в соответствии с рекомендациями Ross (Ross Manual (2014): www.aviagen.com). С 1-го по 3-й день температура составляла около 29-30°С, затем ее медленно снижали до 21°С на 21-й день и эту температуру сохраняли на уровне 21°С до конца исследования. Влажность воздуха была в пределах 65-70% до 9-го дня, а затем в пределах 60-70% до конца эксперимента. Корм и вода подавались ad libitum.
Испытуемыми материалами являлись препараты 6-фитаз производства Huvepharma: PhOP-0136, PhOP-0161 и OptiPhos. Для всех трех фитаз каждый раз предоставляли два премикса, предварительно разбавленных носителем (пшеничной мукой) для достижения концентрации в корме соответственно 250 FTU/кг и 500 FTU/кг при добавлении в корм по 500 г/тонна. Уровни добавленной фитазы в корме подтверждали в соответствии с методикой ISO30024:2009.
Ниже показана фитазная активность фитаз, предварительно разбавленных носителем (пшеничной мукой) при различных обработках, и номер партии соответствующего продукта фитазы:
Основные кормовые смеси подготавливали на дробилке кормов Research Diet Services, Нидерланды. Смеси гранулировали при температуре 70°С. Состав и питательная ценность основных кормовых смесей приведены в таблицах 9 и 10. Чтобы избежать проблем со здоровьем в группе отрицательного контроля (Т2) из-за недостаточного содержания фосфора в рационе, птицы всех групп лечения получали одинаковый стартерный корм до 5-го дня, который соответствовал пищевым требованиям цыплят-бройлеров. (Таблица 9). В качестве кормовой смеси положительного контроля выступал экспериментальный корм группы Т1, а в качестве кормовой смеси отрицательного контроля - для групп Т2 и Т8. Корма составляли таким образом, чтобы получить разницу в доступном фосфоре между кормами отрицательного и положительного контролей примерно в 1,5 г/кг. Экспериментальные корма для Т3-Т8 готовили с применением кормовой смеси отрицательного контроля и добавлением соответствующих препаратов фитазы.
В период выращивания использовали кормовые фазы в гранулированном виде:
• 1-5 дней - стартерный корм (одинаковый для всех экспериментальных групп)
• 6-21 день - гроверный корм
• 22-35 дней - финишерный корм
Состав кормов приведен в таблицах 9 и 10
Таблица 9. Состав кормов положительного контроля, %
Таблица 10. Состав кормов отрицательного контроля, %
Измерения
Ниже будут использоваться следующие сокращения
Масса тела (МТ) бройлеров (в расчете на загон) измерялась на 1-е, 5-е, 21-е и 35-е сутки. Расход корма (потребление корма, FI) измеряли в течение опытных периодов: 1-5, 6-21, 22-35 и 1-35 дней. Для анализа костной золы брали по 2 птицы из каждого загона со средним весом в возрасте 21 дня, затем удаляли правые большеберцовые кости и оба образца объединяли. Процентное содержание золы в образцах анализировали, а остатки золы хранили по отдельности для проведения дальнейшего анализа в случае необходимости.
График исследования был следующим:
6.1 Показатели роста в стартерный период (1-5 дней)
В начале эксперимента средняя масса тела суточных цыплят составляла 38,9 г.В стартерный период (1-5 дней) птицы потребляли в среднем 121,0 г корма на одну птицу, а средний коэффициент конверсии корма составлял 1,100 кг/кг. В этот период все экспериментальные группы получали одинаковый стартерный корм.
6.2 Масса тела (МТ) и среднесуточный прирост (ADG)
После взвешивания на 5 день при необходимости проводили обмены повторностей между обработками для достижения одинаковой средней массы тела во всех экспериментальных группах перед началом основного эксперимента. В конце гроверного периода (21-й день) между обработками наблюдались значительные различия в массе тела (МТ). Птицы из группы ПК (Т1) были значительно тяжелее птиц из группы ОК (Т2) и всех групп, дополненных фитазой, за исключением птиц из группы Т6 (PhOP -161 при 500 FTU/кг корма), весивших столько же, сколько и ПК. Также добавление препаратов фитазы в обработку Т3-Т8 значительно улучшило массу тела и среднесуточный прирост (ADG) по сравнению с группой ОК (Т2) к концу гроверного периода. В финишерный период (22-35 дней) ADG птиц ПК и тех, кто получал все виды обработок фитазой (кроме Т3 - только около значимого тренда, Р=0,074), был достоверно выше, чем при обработке ОК (Т2). Масса тела в конце эксперимента (35-е сутки) и ADG на протяжении всего эксперимента (6-35 сутки) были достоверно выше у ПК (Т1, 10,80%) и всех обработок фитазой (от 7,70 в Т7 до 12,44% в Т6), чем у птиц из группы ОК (Т2). Птицы из всех групп обработок фитазой показали одинаковую итоговую МТ и ADG в течение испытательного периода, как друг у друга, так и у ПК. Итоговая масса тела во всех группах обработки (кроме ОК - T2) была выше стандартов Ross 308 (2,283 кг).
6.3 Среднесуточное потребление корма (ADFI)
В целом, наблюдались довольно значительные различия в среднесуточном потреблении корма между обработками в гроверный период (6-21 день; Р=0,055) и в течение всего экспериментального периода (6-35 дней; Р=0,070), птицы из Т5 (PhOP- 161- 250 FTU/кг) и Т6 (PhOP- 161 - 500 FTU/кг), как правило, потребляли больше корма (0,05<Р<0,10), чем птицы из ОК (Т2) в гроверный период. В течение всего эксперимента птицы Т6, как правило, потребляли больше корма, чем птицы ОК (T2). В финишерный период (22-35 дней) наблюдалось значительное влияние обработки на среднесуточное потребление корма. Птицы из T5 (PhOP - 161 - 250 FTU/кг) и T6 (PhOP - 161 - 500 FTU/кг) потребляли значительно больше корма, чем птицы ОК (T2), и также птицы T6 потребляли значительно больше, чем птицы T3 (PhOP - 136 - 250 FTU/кг).
6.4 Коэффициент конверсии корма (FCR)
В течение гроверного периода (6-21 день) между обработками наблюдались значительные различия в FCR. Птицы Т2 (ОК) показали худший в цифровом выражении FCR, а птицы ПК (T1) и птицы Т6 (PhOP - 161 при 500 FTU/кг) значительно лучше конвертировали корм, чем те, кто был в группе ОК (T2). T5 (PhOP - 161 - 250 FTU/кг) и T7 (OptiPhos - 250 FTU/кг) были единственными обработками фитазы, которые имели FCR, который был значительно хуже, чем у ПК (T1). В финишерный период (22-35 дней) значения FCR у птиц ПК и птиц из всех обработок фитазой (кроме Т6 - только около значимой тенденции, Р=0,051) были достоверно ниже, чем при обработке ОК (Т2).
В течение всего эксперимента (6-35 дней) FCR птиц ПК (Т1) был достоверно лучше, чем у птиц из группы ОК (Т2) и Т7 (OptiPhos - 250 FTU/кг) (-6,49% и -2,86% соответственно). Птицы из всех обработок с добавлением фитазы (Т3-Т8) значительно улучшили FCR (с -3,73% до -6,13% в Т7 и Т8 соответственно) по сравнению с группой ОК (Т2). Птицы из T3-T6 и T8 показали такой же FCR, как и птицы из T1 (ПК).
6.5 Зола большеберцовой кости
Снижение уровней доступного Ca и P в рационах птиц из группы отрицательного контроля (T2) привело к значительному снижению зольности большеберцовой кости по сравнению с птицами из группы положительного контроля (T1). Птицы из всех обработок фитазой (Т3-Т8) характеризовались значительно более высоким содержанием золы в большеберцовой кости по сравнению с птицами из группы отрицательного контроля (Т2). Содержание золы в большеберцовой кости птиц из Т6 (PhOP- 161 - 500 FTU/кг) и Т8 (OptiPhos - 500 FTU/кг) было таким же, как и у птиц из Т1 (ПК).
6.6 Выводы
Добавление различных препаратов фитазы в количестве 250 и 500 FTU/кг к корму ОК оказало значительное положительное влияние на:
1) МТ и ADWG птиц из всех групп с добавлением фитазы (T3-T8) в течение экспериментального периода,
2) FCR птиц из всех групп с добавлением фитазы,
3) зола большеберцовой кости из всех групп с добавлением фитазы,
Данные приведены ниже в таблицах 11-13 и на фигурах 7 и 8. В целом, PhOP-161 оказался наиболее перспективным во всех экспериментах (МТ, ADG, FCR и зола большеберцовой кости). Кроме того, PhOP-136 продемонстрировал отличные показатели во всех экспериментах, сходные с данными коммерческого OptiPhos.
Данные показывают, что новые варианты фитазы, предложенные в настоящем изобретении, высвобождают доступный фосфор из кормовых продуктов и обеспечивают отличные показатели роста бройлеров, такие как минерализация костной ткани, МТ, ADG и FCR.

В Таблице 11 приведены значения среднесуточного приросты массы тела (ADG, в г) цыплят, определенные для очищенных фитаз между 5-м и 21-м днями, 21-м и 35-м днями и на 35-й день. Значения внутри столбца с разными надстрочными знаками существенно различаются при р<0,05:

В Таблице 12 приведены значения коэффициента конверсии корма (FCR, в кг/кг) цыплят, определенные для очищенных фитаз на 5-й день, между 21-м и 35-м днями и между 5-м и 35-м днями. Значения внутри столбца с разными надстрочными знаками существенно различаются при р<0,05.
Данные Таблицы 12 также показаны на Фигуре 7.

В Таблице 13 приведен процент содержания золы в большеберцовой кости при различных обработках на 35-й день. Значения внутри столбца с разными надстрочными знаками существенно различаются при р<0,05:
Данные таблицы 13 также показаны на Фигуре 8.
7. Краткое описание
Отправной точкой разработки фитазы согласно изобретению являлся вариант фитазы PhOP-0093, термостабильность которого уже была улучшена на 20°С по сравнению с фитазой OptiPhos. Дальнейшее улучшение термостабильности удалось довольно успешно. Мутагенез и скрининг E. coli привели к повышению температуры до 3°C до уровня PhOP-0093. Рекомбинация полезных мутаций приводит к дальнейшей, отчетливо усиленной стабильности при 8 -10°C по сравнению с PhOP-0093. Перенос этих улучшений стабильности от скрининга хозяина E. coli к конечному продуцирующему хозяину Pichia pastoris успешно осуществили благодаря эффектам гликозилирования.
Достигнутые общие улучшения термостабильности PhOP-вариантов по сравнению с коммерческими фитазами находятся в диапазоне от 24,5 до 33°C (OptiPhos) и от 1,5 до 10°C (Quantum Blue 5G).
Итоговые варианты несут 16-18 мутаций по сравнению с последовательностью appA2C (PhOP-wt):

Таблица 14: Обзор мутаций предпочтительных мутантов
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> HUVEPHARMA EOOD
<120> Новые Термостабильные Фитазы
<130> A29685HVGS
<160> 12
<170> PatentIn version 3.5
<210> 1
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-wt (AppA2c)
<400> 1
Gln Ser Glu Pro Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Asp Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Gln Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Ala Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Asp Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Asn Ala Asn Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Gly His Arg Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Asn
165 170 175
Leu Cys Leu Asn Arg Glu Lys Gln Asp Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Val Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Gln Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Gln Phe Tyr Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Gln Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Thr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 2
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0093
<400> 2
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Asp Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Ala Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Asp Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Asn Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Gly His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Asn
165 170 175
Leu Cys Leu Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Gln Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Gln Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Gln Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 3
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0136
<400> 3
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Tyr Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Pro Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Gly Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Arg Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Gly His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Pro
165 170 175
Leu Cys Lys Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Glu Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Tyr Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Ser Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 4
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0138
<400> 4
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Tyr Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Pro Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Gly Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Arg Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Asn His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Pro
165 170 175
Leu Cys Lys Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Gln Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Tyr Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Ser Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 5
<211> 410
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0142
<400> 5
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Tyr Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Pro Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Asp Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Arg Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Asn His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Pro
165 170 175
Leu Cys Lys Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Glu Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Tyr Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Gln Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 6
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0161
<400> 6
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Tyr Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Pro Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Asp Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Asn Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Ser His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Pro
165 170 175
Leu Cys Lys Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Glu Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Tyr Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Ser Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 7
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0169
<400> 7
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Tyr Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Ala Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Gly Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Arg Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Ser His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Pro
165 170 175
Leu Cys Lys Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Glu Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Tyr Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Ser Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 8
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0175
<400> 8
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Tyr Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Pro Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Asp Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Arg Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Asn His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Asn
165 170 175
Leu Cys Lys Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Glu Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Tyr Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Ser Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 9
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0176
<400> 9
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Asp Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Pro Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Gly Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Arg Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Asn His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Pro
165 170 175
Leu Cys Lys Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Gln Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Tyr Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Ser Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 10
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0179
<400> 10
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Tyr Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Pro Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Gly Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Arg Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Asn His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Pro
165 170 175
Leu Cys Leu Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Glu Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Tyr Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Ser Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 11
<211> 410
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Зрелый Вариант Фитазы, начиная с Q23; PhOP-0180
<400> 11
Gln Ser Glu Glu Glu Leu Lys Leu Glu Ser Val Val Ile Val Ser Arg
1 5 10 15
His Gly Val Arg Ala Pro Thr Lys Ala Thr Gln Leu Met Gln Asp Val
20 25 30
Thr Pro Tyr Ala Trp Pro Thr Trp Pro Val Lys Leu Gly Trp Leu Thr
35 40 45
Pro Arg Gly Gly Glu Leu Ile Ala Tyr Leu Gly His Tyr Trp Arg Gln
50 55 60
Arg Leu Val Ala Asp Gly Leu Leu Pro Lys Lys Gly Cys Pro Gln Pro
65 70 75 80
Gly Gln Val Ala Ile Ile Ala Asp Val Asp Glu Arg Thr Arg Lys Thr
85 90 95
Gly Glu Ala Phe Ala Ala Gly Leu Ala Pro Gly Cys Ala Ile Thr Val
100 105 110
His Thr Gln Ala Asp Thr Ser Ser Pro Asp Pro Leu Phe Asn Pro Leu
115 120 125
Lys Thr Gly Val Cys Gln Leu Asp Val Ala Arg Val Thr Asp Ala Ile
130 135 140
Leu Ser Arg Ala Gly Gly Ser Ile Ala Asp Phe Thr Asn His Tyr Gln
145 150 155 160
Thr Ala Phe Arg Glu Leu Glu Arg Val Leu Asn Phe Pro Gln Ser Pro
165 170 175
Leu Cys Lys Asn Arg Glu Lys Gln Asn Glu Ser Cys Ser Leu Thr Gln
180 185 190
Ala Leu Pro Ser Glu Leu Lys Val Ser Ala Asp Asn Val Ser Leu Thr
195 200 205
Gly Ala Trp Ser Leu Ala Ser Met Leu Thr Glu Ile Phe Leu Leu Gln
210 215 220
Gln Ala Glu Gly Met Pro Glu Pro Gly Trp Gly Arg Ile Thr Asp Ser
225 230 235 240
His Gln Trp Asn Thr Leu Leu Ser Leu His Asn Ala Tyr Phe Asp Leu
245 250 255
Leu Gln Arg Thr Pro Glu Val Ala Arg Ser Arg Ala Thr Pro Leu Leu
260 265 270
Asp Leu Ile Met Ala Ala Leu Thr Pro His Pro Pro Gln Lys Ser Ala
275 280 285
Tyr Gly Val Thr Leu Pro Thr Ser Val Leu Phe Ile Ala Gly His Asp
290 295 300
Thr Asn Leu Ala Asn Leu Gly Gly Ala Leu Glu Leu Asn Trp Thr Leu
305 310 315 320
Pro Gly Gln Pro Asp Asn Tyr Pro Pro Gly Gly Glu Leu Val Phe Glu
325 330 335
Arg Trp Arg Arg Leu Ser Asp Asn Ser Gln Trp Ile Gln Val Ser Leu
340 345 350
Val Phe Gln Thr Leu Gln Gln Met Arg Asp Lys Thr Pro Leu Ser Leu
355 360 365
Asn Thr Pro Pro Gly Glu Val Lys Leu Thr Leu Ala Gly Cys Glu Glu
370 375 380
Arg Asn Ala Gln Gly Met Cys Ser Leu Ala Gly Phe Thr Gln Ile Val
385 390 395 400
Asn Glu Ala Arg Ile Pro Ala Cys Ser Leu
405 410
<210> 12
<211> 22
<212> БЕЛОК
<213> Искусственная Последовательность
<220>
<223> Нативный сигнальный пептид периплазмы с AppA2c (E. coli)
<400> 12
Met Lys Ala Ile Leu Ile Pro Phe Leu Ser Leu Leu Ile Pro Leu Thr
1 5 10 15
Pro Gln Ser Ala Phe Ala
20
<---
Реферат
Изобретение относится к биотехнологии и представляет собой новый фермент фитазу, проявляющую неожиданно высокую термостабильность по сравнению с доступными фитазами. Кроме того, некоторые из новых вариантов фитазы демонстрируют увеличение скорости катализа до четырех раз, что значительно увеличивает скорость дефосфорилирования фитата. 7 н. и 9 з.п. ф-лы, 8 ил., 14 табл., 7 пр.
Формула
Документы, цитированные в отчёте о поиске
Фитаза из bacillus subtilis, ген, кодирующий эту фитазу, способ ее получения и применение
Фитаза, ее применение, корм и кормовая добавка для животных, содержащие ее

Комментарии