Способ получения диэфиров 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты - RU2605936C1
Код документа: RU2605936C1
Описание
Изобретение относится к способу получения диэфиров 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты. Указанные диэфиры могут служить компонентами базовых основ синтетических индустриальных масел.
Данным изобретением решена задача получения диэфиров 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты с длиной спиртового остатка С4-С6.
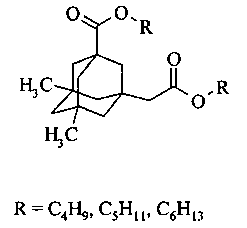
В патентных источниках имеются немногочисленные сведения о способах получения диэфиров на основе замещенных 1,3-адамантандикарбоновых кислот. В патентах US 20120122923 и US 20040242923 описан способ получения сложных эфиров методом прямой этерификации в присутствии серной кислоты или п-толуолсульфокислоты. Продукты образуются с достаточно высокими выходами. К недостаткам способа можно отнести проведение реакции этерификации в избытке соответствующего спирта, поскольку в таком случае процесс может сопровождаться образованием побочных продуктов: алкенов при дегидратации спирта, простых эфиров.
Одностадийный способ получения диэфиров замещенных 1,3-адамантандикарбоновых кислот представлен в патенте РФ 2458911. Способ заключается в пропускании монооксида углерода в раствор 1-бромадамантана в безводном бромистом метилене в присутствии электрофильного катализатора с последующим взаимодействием с внешними нуклеофилами, в качестве которых выступают соответствующие спирты. К недостаткам способа относятся невозможность хранения катализа (готовится непосредственно в реакционном сосуде), использование токсичного и дорогостоящего бромистого метилена, необходимость абсолютирования бромистого метилена.
Похожий способ получения диэфиров 1,3-адамантандикарбоновой и 5,7-диметил-1,3-адамантандикарбоновой кислоты представлен в патенте РФ 2476421. Данный способ отличается от предыдущего тем, что в качестве исходных соединений используют адамантан или 1,3-диметиладамантан. Реакцию также проводят в среде безводного бромистого метилена в присутствии суперэлектрофильного комплекса CBr4·2AlBr3.
В патенте WO 2007094746 представлен способ получения диэфиров 5,7-диметил-1,3-адамантандикарбоновой кислоты, заключающийся во взаимодействии дихлорангидрида 5,7-диметил-1,3-адамантандикарбоновой кислоты с соответствующим спиртом линейного или разветвленного строения в присутствии триэтиламина. Реакции алкоголиза проводят в среде кипящего бензола или толуола. Диэфиры образуются с достаточно высокими выходами (90-98%). Метод достаточно привлекателен с точки зрения внедрения в технологический процесс, однако включает дополнительную стадию получения дихлорангидрида 5,7-диметил-1,3-адамантандикарбоновой кислоты и использование агрессивного, токсичного и дорогостоящего хлористого тионила, а также применение абсолютных растворителей при синтезе диэфиров. Похожий способ синтеза представлен в патенте ЕР 81901541; он обладает вышеперечисленными недостатками.
Наиболее близким по технической сущности к заявляемому способу методом является метод синтеза диэфиров 1,3-замещенных дикарбоновых кислот адамантанового ряда, представленный в статье [Багрий Е.И., Маравин Г.В. Нефтехимия, 2013. В. 53, №6. С. 467-472]. Способ заключается в проведении реакции этерификации между исходной кислотой адамантанового ряда и соответствующим спиртом в присутствии п-толуолсульфокислоты в среде бензола. Для отделения выделяющейся в ходе реакции воды используют насадку Дина-Старка. Процесс ведут в течение 6 ч, выделение продукта осуществляют путем промывания реакционной смеси раствором гидроксида натрия, последующим пропусканием через слой оксида алюминия и очисткой продуктов вакуумной перегонкой. К недостаткам данного способа можно отнести необходимость использования оксида алюминия при выделении продуктов из реакционных смесей и сложность аппаратурно-технологической схемы при промышленном производстве.
Технический результат изобретения является более простым в техническом отношении, экономически эффективным и безопасным методом получения диэфиров 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты.
Технический результат достигается тем, что синтез диэфиров 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты проводили взаимодействием 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты с алифатическими спиртами состава С4-С6 с использованием гетерогенного катализатора - силикагеля, импрегнированного серной кислотой (H2SO4-SiO2), в массовом соотношении 1:0,005-0,01 в отсутствие растворителя при температуре 100-130°С.
Преимуществами предлагаемого способа являются: высокие выходы продуктов в расчете на исходную кислоту, отказ от использования растворителя, возможность повторного использования гетерогенного катализатора.
Техническим результатом изобретения является экономически более эффективный и экологически более безопасный способ получения диэфиров 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты.
Основные отличительные признаки предлагаемого способа можно сформулировать следующим образом.
1. Использование импрегнированного серной кислотой силикагеля, что позволяет повторно использовать его в дальнейших синтезах диэфиров.
2. Проведение реакции в отсутствие растворителя, что существенно упрощает аппаратурно-технологическую схему процесса, так как не требуется регенерация растворителя, и не противоречит принципам «зеленой» химии.
Выполнение способа
Строение синтезированных соединений подтверждено данными ИК- и ЯМР-спектроскопии. ИК-спектр записан на спектрометре Shimadzu IR Affinity в таблетках бромида калия. Спектры ЯМР1Н записаны на приборе Jeol JNM ЕСХ 400 (400 МГц), в ЯМСО-d6. Элементный анализ выполнен на автоматическом CHNS-анализаторе "EuroVectorEA-3000". Для приготовления катализатора использовали силикагель марки Kieselgel с размером пор 230-400 мм.
Изобретение иллюстрируется приведенными ниже примерами. В примерах описано получение заявляемым способом диэфиров 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты.
Приготовление H2SO4-SiO2
К суспензии 29.5 г силикагеля в 60 мл этилацетата добавляют 1.6 мл 98%-ной серной кислоты (2.9 г, 29.5 ммоль). Смесь перемешивают при комнатной температуре в течение 30 минут. Этилацетат упаривают в вакууме роторного испарителя. Остаток нагревают при 100°С в течение 72 ч под вакуумом. Получают силикагель, импрегнированный серной кислотой, в виде сыпучего порошка.
Пример 1. Получение ди-н-бутилового эфира 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты
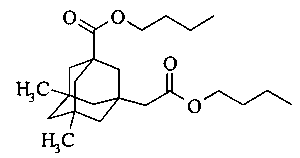
К смеси 20 г (0,075 моль) 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты и 17 мл (13.9 г, 0.19 моль) добавляют 0.14 г H2SO4-SiO2. Реакционную смесь интенсивно перемешивают при температуре 100°С с насадкой Дина-Старка до окончания отделения воды. После окончания реакции смесь охлаждают до комнатной температуры, разбавляют 70 мл толуола. Катализатор отделяют путем фильтрования, промывают небольшим количеством толуола и воды и сушат, а затем прокаливают при 150°С. Органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме водоструйного насоса. Продукт очищают вакуумной перегонкой. Выход 82%. Т. кип. 160-162°С (0.21 торр). ИК-спектр, v, см-1: 1730 см (С=O). Спектр ЯМР1Н, δ, м.д.: 0.85 с (6Н, СН3), 0.89-0.93 т J=7.32 Гц (6Н, СН3), 1.08-1.10 м (2Н, CH2Ad), 1.22-1.24 м (4Н, CH2Ad), 1.32-1.40 м (4Н, CH2Ad, СН2), 1.45-1.47 с (4Н, СН2), 1.57-1.60 м (6Н, CH2Ad, СН2), 2.13 с (2Н, СН2), 4.01-4.04 м (4Н, СН2). Спектр ЯМР13С, δ, м.д.: 13.76 (СН3), 13.84 (СН3), 19.28 (СН2), 30.08 (СН3), 30.75 (СН2), 31.67 (С), 34.62 (С), 42.38 (СН2), 43.32 (С), 44.38 (СН2), 47.70 (СН2), 47.85 (СН2), 49.98 (СН2), 64.04 (СН2), 64.22 (СН2), 171.70 (С), 177.19 (С). Масс-спектр, m/z (Iотн., %): 378 (<1) [М]+, 323 (38), 277 (48), 267 (47), 221 (26), 161 (71), 119 (100), 105 (32), 91 (29), 57 (42). Найдено, %: С 73.03; Н 10.15. С23Н38О4. Вычислено, %: С 72.98; Н 10.12. М 378.54.
Пример 2. К смеси 20 г (0,075 моль) 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты и 17 мл (13.9 г, 0.19 моль) добавляют 0.2 г H2SO4-SiO2. Реакционную смесь интенсивно перемешивают при температуре 100°С с насадкой Дина-Старка до окончания отделения воды. После окончания реакции смесь охлаждают до комнатной температуры, разбавляют 70 мл толуола. Катализатор отделяют путем фильтрования, промывают небольшим количеством толуола и воды и сушат, а затем прокаливают при 150°С. Органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме водоструйного насоса. Продукт очищают вакуумной перегонкой. Выход 87%. Т. кип. 159-161°С (0.21 торр).
Пример 3. К смеси 20 г (0,075 моль) 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты и 17 мл (13.9 г, 0.19 моль) добавляют 0.1 г H2SO4-SiO2. Реакционную смесь интенсивно перемешивают при температуре 100°С с насадкой Дина-Старка до окончания отделения воды. После окончания реакции смесь охлаждают до комнатной температуры, разбавляют 70 мл толуола. Катализатор отделяют путем фильтрования, промывают небольшим количеством толуола и воды и сушат, а затем прокаливают при 150°С. Органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме водоструйного насоса. Продукт очищают вакуумной перегонкой. Выход 76%. Т. кип. 159-162°С (0.21 торр).
Пример 4. Получение ди-н-пентилового эфира 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты
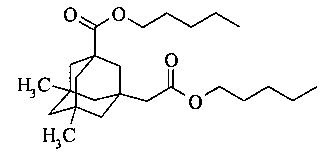
К смеси 20 г (0,075 моль) 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты и 20 мл (16.5 г, 0.19 моль) добавляют 0.14 г H2SO4-SiO2. Реакционную смесь интенсивно перемешивают при температуре 110°С с насадкой Дина-Старка до окончания отделения воды. После окончания реакции смесь охлаждают до комнатной температуры, разбавляют 70 мл толуола. Катализатор отделяют путем фильтрования, промывают небольшим количеством толуола и воды и сушат, а затем прокаливают при 150°С. Органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме водоструйного насоса. Продукт очищают вакуумной перегонкой. Выход 80%. Т. кип. 170-173°С (0.03 торр). ИК-спектр, v, см-1: 1730 см (С=O). Спектр ЯМР1Н, δ, м.д.: 0.84 с (6Н, СН3), 0.86-0.89 т J=7.08 Гц (6Н, СН3), 1.04-1.35 м (14Н, CH2Ad, СН2), 1.43-1.45 м (4Н, СН2), 1.57-1.64 м (6Н, СН2, CH2Ad), 2.12 с (2Н, СН2), 3.98-4.04 м (4Н, СН2). Спектр ЯМР13С, δ, м.д.: 14.05 (СН3), 22.36 (СН3), 28.10 (СН2), 28.26 (СН2), 28.37 (СН2), 28.43 (СН2), 30.07 (СН2), 31.66 (С), 34.62 (С), 42.40 (СН2), 43.31 (С), 44.39 (СН2), 47.70 (СН2), 47.85 (СН2), 49.99 (СН2), 64.30 (СН2), 64.45 (СН2), 171.65 (С), 177.14 (С). Масс-спектр, m/z (Iотн., %): 406 (<1) [М]+, 338 (74), 291 (60), 267 (100), 221 (20), 203 (26), 161 (34), 119 (8), 43 (14).
Пример 5. К смеси 20 г (0,075 моль) 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты и 20 мл (16.5 г, 0.19 моль) добавляют 0.2 г H2SO4-SiO2. Реакционную смесь интенсивно перемешивают при температуре 110°С с насадкой Дина-Старка до окончания отделения воды. После окончания реакции смесь охлаждают до комнатной температуры, разбавляют 70 мл толуола. Катализатор отделяют путем фильтрования, промывают небольшим количеством толуола и воды и сушат, а затем прокаливают при 150°С. Органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме водоструйного насоса. Продукт очищают вакуумной перегонкой. Выход 86%. Т. кип. 171-172°С (0.03 торр).
Пример 6. К смеси 20 г (0,075 моль) 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты и 20 мл (16.5 г, 0.19 моль) добавляют 0.1 г H2SO4-SiO2. Реакционную смесь интенсивно перемешивают при температуре 110°С с насадкой Дина-Старка до окончания отделения воды. После окончания реакции смесь охлаждают до комнатной температуры, разбавляют 70 мл толуола. Катализатор отделяют путем фильтрования, промывают небольшим количеством толуола и воды и сушат, а затем прокаливают при 150°С. Органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме водоструйного насоса. Продукт очищают вакуумной перегонкой. Выход 74%. Т. кип. 170-173°С (0.03 торр).
Пример 7. Получение ди-н-гексилового эфира 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты.
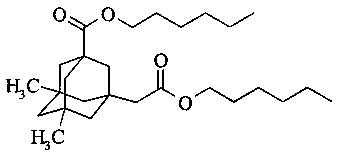
К смеси 20 г (0,075 моль) 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты и 24 мл (19.2 г, 0.19 моль) добавляют 0.14 г H2SO4-SiO2. Реакционную смесь интенсивно перемешивают при температуре 120°С с насадкой Дина-Старка до окончания отделения воды. После окончания реакции смесь охлаждают до комнатной температуры, разбавляют 70 мл толуола. Катализатор отделяют путем фильтрования, промывают небольшим количеством толуола и воды и сушат, а затем прокаливают при 150°С. Органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме водоструйного насоса. Продукт очищают вакуумной перегонкой. Выход 80%. Т. кип. 205-208°С (0.046 торр). ИК-спектр, v, см-1: 1728 см (С=O). Спектр ЯМР1Н, δ, м.д.: 0.84 с (6Н, СН3), 0.86-0.89 т J=6.88 Гц (6Н, СН3), 1.05-1.36 м (18Н, CH2Ad, СН2), 1.43-1.45 м (4Н, СН2), 1.54-1.62 м (6Н, СН2, CH2Ad), 2.12 с (2Н, СН2), 3.98-4.03 м (4Н, СН2). Спектр ЯМР13С, δ, м.д.: 14.08 (СН3), 22.57 (СН2), 22.63 (СН2), 25.60 (СН2), 25.78 (СН2), 28.62 (СН2), 28.70 (СН2), 30.07 (СН3), 31.48 (СН2), 31.65 (С), 34.60 (С), 42.42 (СН2), 43.31 (С), 44.40 (СН2), 47.69 (СН2), 47.85 (СН2), 49.98 (СН2), 64.31 (СН2), 64.49 (СН2), 171.63 (С), 177.12 (С). Масс-спектр, m/z (Iотн., %): 434 (<1) [М]+, 352 (73), 306 (61), 267 (100), 221 (24), 207 (28), 203 (22), 161 (30), 119 (8), 43 (24).
Пример 8. К смеси 20 г (0,075 моль) 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты и 24 мл (19.2 г, 0.19 моль) добавляют 0.2 г H2SO4-SiO2. Реакционную смесь интенсивно перемешивают при температуре 120°С с насадкой Дина-Старка до окончания отделения воды. После окончания реакции смесь охлаждают до комнатной температуры, разбавляют 70 мл толуола. Катализатор отделяют путем фильтрования, промывают небольшим количеством толуола и воды и сушат, а затем прокаливают при 150°С. Органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме водоструйного насоса. Продукт очищают вакуумной перегонкой. Выход 84%. Т. кип. 205-208°С (0.046 торр).
Пример 9. К смеси 20 г (0,075 моль) 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты и 24 мл (19.2 г, 0.19 моль) добавляют 0.1 г H2SO4-SiO2. Реакционную смесь интенсивно перемешивают при температуре 120°С с насадкой Дина-Старка до окончания отделения воды. После окончания реакции смесь охлаждают до комнатной температуры, разбавляют 70 мл толуола. Катализатор отделяют путем фильтрования, промывают небольшим количеством толуола и воды и сушат, а затем прокаливают при 150°С. Органический слой промывают водой, сушат над сульфатом натрия и упаривают в вакууме водоструйного насоса. Продукт очищают вакуумной перегонкой. Выход 72%. Т. кип. 205-208°С (0.046 торр).
Реферат
Изобретение относится к способу получения диэфиров 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты, которые могут быть использованы в качестве ключевых компонентов базовых основ синтетических индустриальных масел. Способ получения диэфиров заключается во взаимодействии 5,7-диметил-3-карбокси-1-адамантилуксусной кислоты с алифатическими спиртами состава С-Сс использованием гетерогенного катализатора - силикагеля, импрегнированного серной кислотой (HSO-SiO), в массовом соотношении 1:0,005-0,01 в отсутствие растворителя при температуре 100-130°С. Уменьшение стоимости производства достигается за счет высоких выходов целевых продуктов, отказа от использования растворителя при проведении реакции, а также использования гетерогенного катализатора - импрегнированного серной кислотой силикагеля. 9 пр.

Комментарии