Применение антиоксидантов для модуляции генов - RU2433819C2
Код документа: RU2433819C2
Чертежи

Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки США серийный № 60/626162, поданной 9 ноября 2004 г., описание которой приведено в настоящем описании в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в целом относится к способам модуляции экспрессии гена у стареющих млекопитающих, в частности к способам модуляции экспрессии гена у стареющих млекопитающих путем введения композиций, содержащих антиоксидант. Настоящее изобретение в целом относится также к композициям, содержащим антиоксидант, которые модулируют экспрессию гена у стареющих млекопитающих и/или снижают окислительный стресс у таких млекопитающих.
УРОВЕНЬ ТЕХНИКИ
Живые клетки непрерывно продуцируют свободные радикалы в процессе нормального функционирования. Свободные радикалы являются высокоактивными веществами, способными необратимо реагировать с множеством биологических молекул, таким образом вызывая прогрессирующее повреждение биологической системы. Свободные радикалы в норме нейтрализуются посредством продукции в организме антиоксидантных ферментов и антиоксидантов из пищевых продуктов. Окислительный стресс, индуцированный свободными радикалами, является важным фактором длительной дегенерации ткани, связанной со старением.
Хотя об антиоксидантах и об их функции у млекопитающих известно много, сохраняется необходимость в альтернативных композициях, содержащих антиоксиданты, и выявлении эффекта таких композиций у млекопитающих и, особенно, у стареющих млекопитающих.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам модуляции экспрессии генов у стареющих млекопитающих. Способы включают введение млекопитающему композиции, содержащей антиоксидант (т.е. композиции, содержащей один или более антиоксидантов и, необязательно, дополнительные ингредиенты). Общее количество одного или нескольких антиоксидантов в композиции достаточно для модуляции экспрессии одного или нескольких генов в одной или более тканях стареющего млекопитающего.
В различных вариантах осуществления изобретения стареющим млекопитающим является млекопитающее, исключая человека, животное-компаньон, собака или кошка.
В некоторых вариантах осуществления изобретения каждый из одного или нескольких генов, чья экспрессия модулируется, независимо представляет собой ген семейства цитохрома Р450, ген семейства аполипотротеина, ген, кодирующий один или более продуктов, которые регулируют гемодинамические характеристики, ген семейства белков теплового шока, ген, кодирующий один или более продуктов, показательных в отношении повреждения ДНК, ген, кодирующий один или более продуктов, которые регулируют клеточный цикл, провоспалительный ген, ген, кодирующий один или более белков, ассоциированных с секреторным путем хромаффина, ген, кодирующий один или более продуктов, которые регулируют транскрипцию гена, ген пути NF-KB, ген, кодирующий один или более продуктов, связанных с иммунными функциями, ген, кодирующий один или более ферментов гликолиза, ген, кодирующий один или более белков окислительного пути митохондрий, или ген, кодирующий один или более рибосомных белков.
В различных вариантах осуществления изобретения один или более генов, чью экспрессию модулируют, включает ген семейства цитохрома Р450; ген семейства аполипотротеина; ген, кодирующий один или более продуктов, которые регулируют гемодинамические характеристики; ген семейства белков теплового шока; ген, кодирующий один или более продуктов, показательных в отношении повреждения ДНК; ген, кодирующий один или более продуктов, которые регулируют клеточный цикл; провоспалительный ген; ген, кодирующий один или более белков, ассоциированных с секреторным путем хромаффина; ген, кодирующий один или более продуктов, которые регулируют транскрипцию гена; ген пути NF-KB; ген, кодирующий один или более продуктов, связанных с иммунными функциями; ген, кодирующий один или более гликолитических ферментов; ген, кодирующий один или более белков окислительного пути митохондрий; или ген, кодирующий один или более рибосомных белков.
В некоторых вариантах осуществления изобретения на модуляцию экспрессии одного или более генов воздействуют в одном или более из надпочечников, печени или коры головного мозга.
В некоторых вариантах осуществления изобретения композицией, содержащей антиоксидант, кормят стареющее млекопитающее.
В некоторых вариантах осуществления изобретения композиция включает витамин Е, витамин С или оба.
В некоторых вариантах осуществления изобретения композиция включает один или более антиоксидантов, выбираемых из витамина Е, витамина С, липоевой кислоты, астаксантина, бета-каротина, L-карнитина, коэнзима Q10, глютатиона, лютеина, ликопена, селена, N-ацетилцистеина, изофлавона(ов) сои, S-аденозилметионина, таурина, токотриенола(ов) и их смесей.
В некоторых вариантах осуществления изобретения композиция включает один или более антиоксидантов, выбираемых из выжимки шпината, выжимки помидор, мякоти цитрусовых, выжимки грейпфрута, гранул моркови, брокколи, зеленого чая, кукурузной глютеновой муки, рисовых отрубей, водорослей, куркумина, селена и их смесей.
В некоторых вариантах осуществления изобретения композиции содержат один или более антиоксидантов, выбираемых из гранул моркови, брокколи, зеленого чая, глютеновой кукурузной муки, рисовых отрубей, водорослей, куркумина, селена и их смесей.
В некоторых вариантах осуществления изобретения композиция содержит один или несколько антиоксидантов, выбираемых из витамина Е, витамина С, фрукта(ов), овоща(ей), каротиноида(ов), флавоноида(ов), полифенола(ов) и их смесей.
Настоящее изобретение также относится, в частности, к композициям, содержащим антиоксиданты, которые модулируют экспрессию генов у стареющих млекопитающих, и к композициям, которые уменьшают окислительный стресс у стареющих млекопитающих.
Другие и дополнительные задачи, характеристики и преимущества настоящего изобретения будут очевидны специалистам в области техники.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
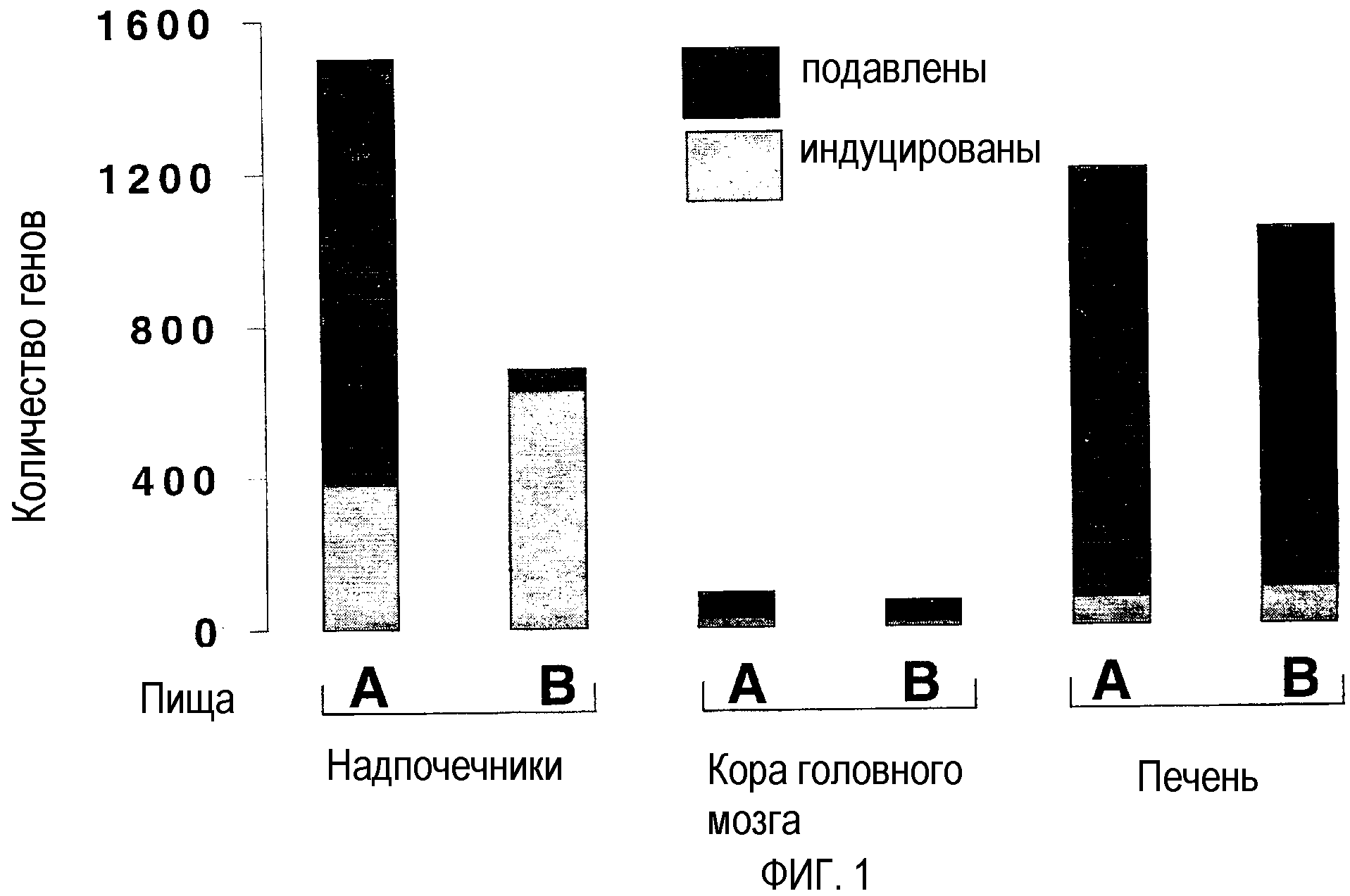
На фиг.1 показана тканеспецифическая модуляция экспрессии гена у мышей, получавших пищу А и В.
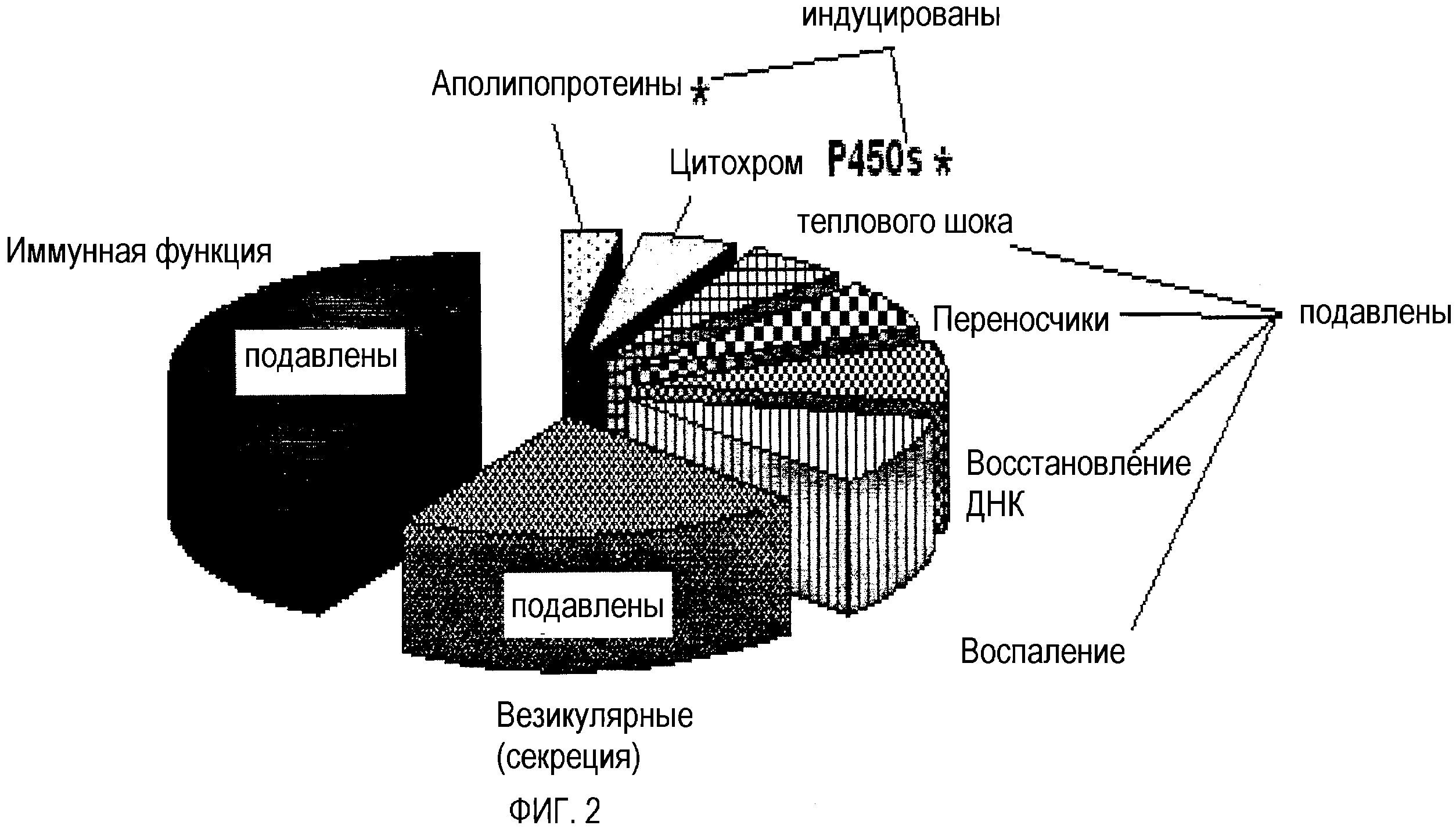
На фиг.2 показаны функциональные классы генов надпочечников, чья экспрессия модулируется у мышей, получавших пищу А и В, и относительное распределение таких генов.
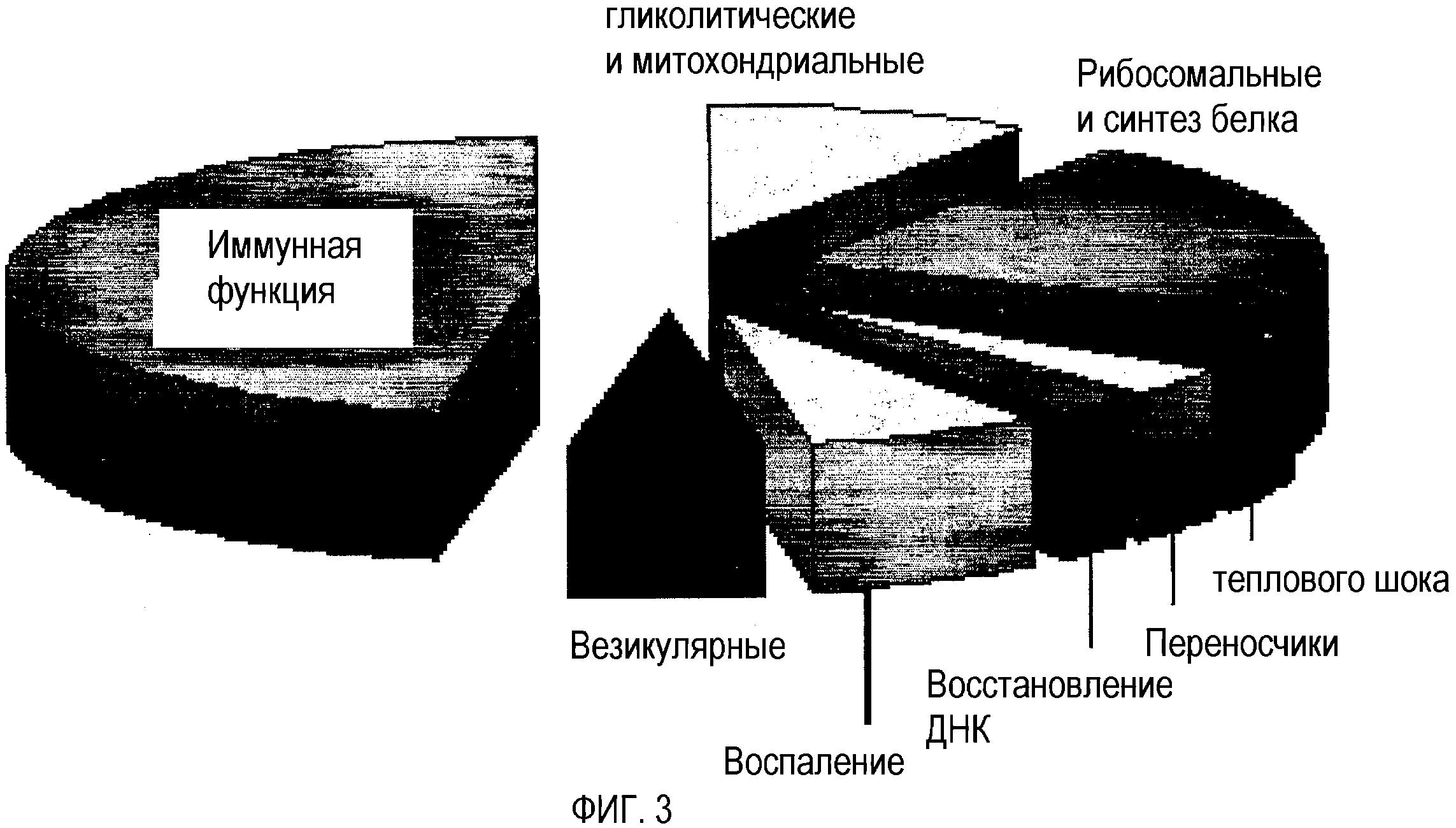
На фиг.3 показаны функциональные классы печеночных генов, чья экспрессия модулируется у мышей, получавших пищу А и В, и относительное распределение таких генов.
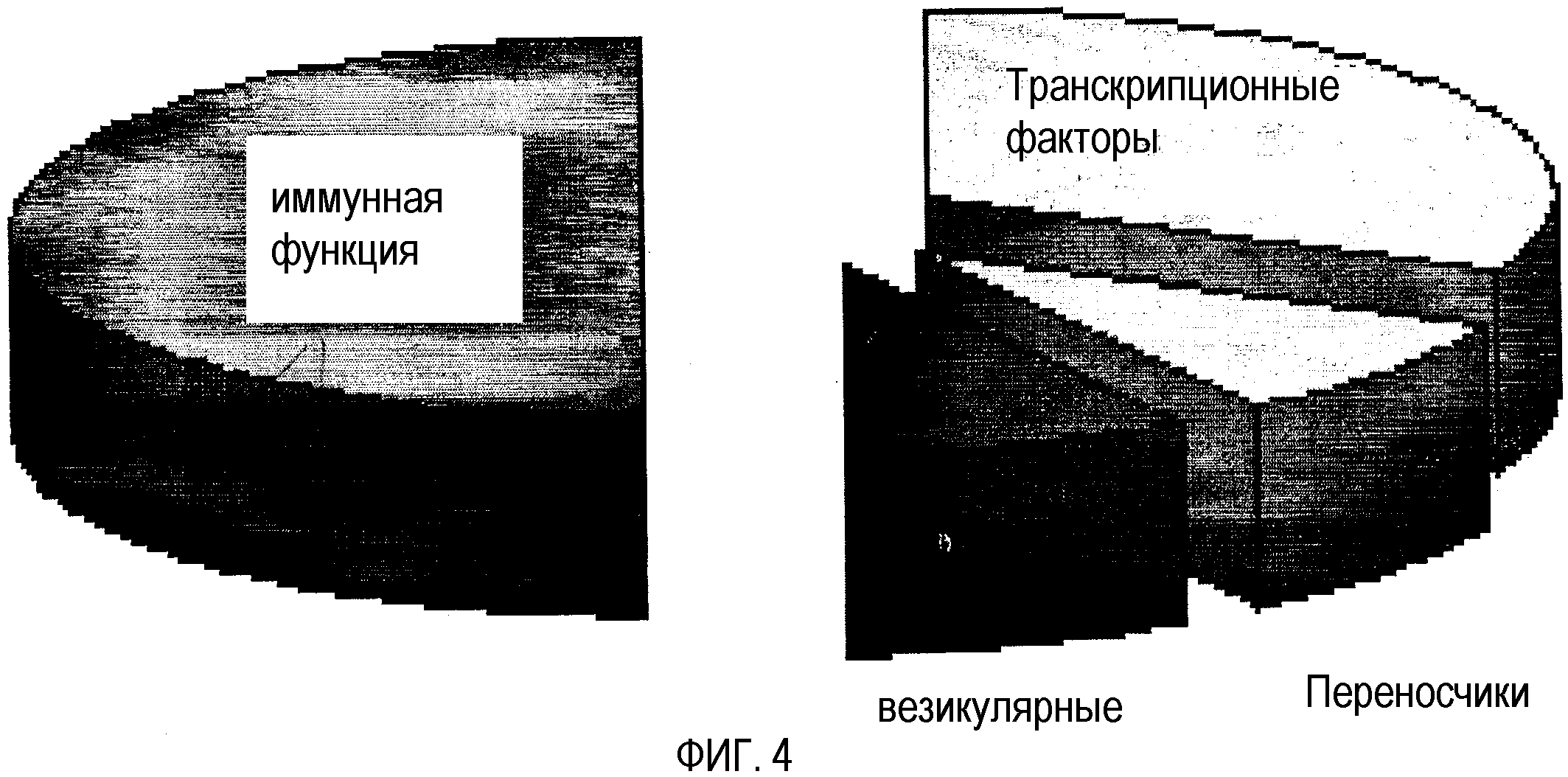
На фиг.4 показана функциональная классификация генов коры головного мозга, чья экспрессия модулируется у мышей, получавших пищу А, и относительное распределение таких генов.
На фиг.5 показаны различные эффекты контрольной пищи и пищи А и В на экспрессию генов «иерархическим кластерным анализом» профилей экспрессии мРНК.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее подробное описание предназначено только для ознакомления специалиста в области техники с изобретением заявителя, его принципами и практическим применением, так чтобы специалисты в области техники могли адаптировать и применить изобретение во множестве его форм, так как они могут быть лучше приспособлены к требованиям определенного применения. Настоящее подробное описание и его конкретные примеры предназначены только для целей иллюстрации. Настоящее изобретение, следовательно, не ограничено вариантами осуществления, раскрытыми в настоящем описании, и может быть различным образом модифицировано.
В различных вариантах осуществления настоящее изобретение относится к способам модуляции экспрессии генов у стареющих млекопитающих. Способы включают введение стареющему млекопитающему композиции, содержащей антиоксидант (т.е. композиции, содержащей один или более антиоксидантов и, необязательно, дополнительные ингредиенты). Общее количество одного или нескольких антиоксидантов в композиции достаточно, чтобы вызвать модуляцию экспрессии одного или более генов у стареющего млекопитающего.
Предусматривается, что способы и композиции по настоящему изобретению могут быть применимы для множества стареющих млекопитающих.
В различных вариантах осуществления настоящего изобретения млекопитающим является млекопитающее, исключая человека. Например, млекопитающее может быть животным-компаньоном (например, собакой, кошкой), приматом (например, мартышкой, павианом), жвачным животным (например, коровой, овцой, козой, лошадью) или грызуном (например, мышью, крысой, морской свинкой).
В различных вариантах осуществления изобретения млекопитающим, исключая человека, является животное-компаньон, собака или кошка.
Как используется в настоящем описании, «стареющее» млекопитающее относится к млекопитающему, которое является взрослым. Например, стареющей собакой является собака, которой по меньшей мере семь лет; стареющей кошкой является кошка, которой по меньшей мере семь лет.
Способы по настоящему изобретению предусматривают введение млекопитающим различных композиций, содержащих антиоксиданты. Предусматриваемые композиции включают, например, продукты питания, добавки, угощения и [съедобные] игрушки (обычно жевательные и потребляемые игрушки). Композицию, содержащую антиоксидант, можно скормить млекопитающему в качестве компонента приема пищи. Прием пищи млекопитающего может соответствовать его обычным питательным потребностям, которые специалист в области техники может определить на основании вида млекопитающего, его возраста, пола, веса и других факторов. Например, типичный прием пищи для собаки в возрасте 1-6 лет содержит около 23% белка (% сухого вещества), около 15% жира (% сухого вещества), около 0,6% фосфора (% сухого вещества) и около 0,3% натрия (% сухого вещества); и типичный прием пищи для старших собак и кошек (% сухого вещества) представлен в таблице 1.
В различных вариантах осуществления изобретения способы модуляции экспрессии одного или более генов включают введение млекопитающему одного или более антиоксидантов, включая комбинацию или смесь антиоксидантов. Антиоксидантом является любое вещество, которое или непосредственно гасит свободные радикалы, или непрямо вызывает гашение свободных радикалов. Специалист в области техники знает, что множество веществ имеют способность гашения или поглощения свободных радикалов. Например, далее указаны необработанные ингредиенты, которые обладают высокой способностью поглощения свободных радикалов (“ORAC”): выжимки шпината, выжимки помидор, мякоть цитрусовых, выжимки грейпфрута, гранулы моркови, брокколи, зеленого чая, гинкго билоба, кукурузная глютеновая мука, водоросли, куркумин, астаксантин, бета-каротин, морковь, глютатион, зеленый чай, лютеин, ликопен, N-ацетилцистеин, полифенолы, изофлавоны сои, шпинат, S-аденозилметионин, серосодержащие аминокислоты, таурин, токотриенолы, витамин С и витамин Е. Например, когда выжимки шпината, выжимки помидор, мякоть цитрусовых, выжимки грейпфрута и гранулы моркови добавляли к композиции в виде 1% включений (всего 5% замещения для продукта с низким содержанием ORAC, такого как кукуруза), они увеличивали содержание ORAC всей композиции и содержание ORAC плазмы животных, которые ели такую композицию.
Во множестве вариантов осуществления изобретения антиоксидантом может быть, например, астаксантин (3,3'-дигидрокси-4,4'-дикето-бета-каротин), бета-каротин, коэнзим Q10 (убихинон), глютатион, L-карнитин, липоевая кислота, лютеин, ликопен, N-ацетилцистеин, полифенол, такой как флавоноид, S-аденозилметионин, селен, изофлавон сои, таурин, токотриенол, витамин С или витамин Е.
В других вариантах осуществления изобретения антиоксидантом может быть пища или пищевой продукт, например шпинат (например, выжимки шпината), помидоры (например, выжимки помидор), цитрусовые (например, мякоть цитрусовых), грейпфрут (например, выжимки грейпфрута), морковь (например, гранулы моркови), брокколи, зеленый чай, гинкго билоба, глютеновая кукурузная мука, рисовые отруби, водоросли, куркумин, масла из морепродуктов или дрожжи (например, селеновые дрожжи) или их смеси.
В других вариантах осуществления изобретения антиоксидантом может быть сырое вещество, например выжимки сырого шпината, выжимки сырых помидор, сырая мякоть цитрусовых, витамины сырых грейпфрутов, сырые гранулы моркови, сырая брокколи, сырой зеленый чай, сырой гинкго билоба, сырая глютеновая кукурузная мука, сырые рисовые отруби или их смеси.
В некоторых вариантах осуществления изобретения композиция, содержащая антиоксидант, может включать витамин Е, витамин С или и витамин Е, и витамин С.
В других вариантах осуществления изобретения композиция, содержащая антиоксидант, может включать один или более антиоксидантов, выбираемых из витамина Е, витамина С, L-карнитина и липоевой кислоты.
В некоторых вариантах осуществления изобретения витамин Е можно вводить в виде токоферола, смеси токоферолов, и/или их различных производных, таких как сложноэфирные производные, например ацетатный, сукцинатный или пальмитатный эфир витамина Е. Витамин Е, как используется в настоящем описании, включает формы и производные, которые обеспечивают активность, подобную витамину Е, после потребления млекопитающим. Витамин Е может быть в альфа-, бета-, гамма- или дельта-конфигурации. Более того, витамин Е может быть также в конфигурации d-стереоизомера или в виде рацемической смеси.
Витамин С может быть введен млекопитающему в виде аскорбиновой кислоты или ее различных производных, например соли фосфата кальция аскорбиновой кислоты, холестериновой соли аскорбиновой кислоты, или аскорбата-2-монофосфата. Витамин С или его производное может быть в любой физической форме, например жидкой, полутвердой, твердой или теплостабильной форме.
Липоевая кислота может быть альфа-липоевой кислотой или липоатной солью или сложным эфиром, например, изомером липоевой кислоты, описанным в патенте США № 5621117. Как используется в настоящем описании, «альфа-липоевая кислота» является синонимом «липоевой кислоты». Липоевую кислоту можно вводить в различных формах, например, рацемической смеси, соли(ей), сложного эфира(ов) и/или амида(ов).
L-карнитин может быть в форме производного, например, соли (например, гидрохлорида), сложного эфира (например, фумаратного эфира или сукцинатного эфира) или в виде ацетилированного L-карнитина.
В некоторых вариантах осуществления изобретения антиоксидант или смесь антиоксидантов могут быть даны млекопитающему в качестве компонента его питания или в виде пищевой добавки. Количества, вводимые в пищу, все в виде мас.% (на основании сухого вещества) пищи, рассчитываются как активное вещество, как таковое, которое измеряется как свободное вещество. Максимальное количество антиоксиданта не должно вызывать токсичности. Предпочтительно, антиоксидант или смесь антиоксидантов дают млекопитающему в количествах, которые эффективны для модуляции одного или более генов у млекопитающего, который их получает. Количества будут варьироваться в зависимости от вида млекопитающего и типа антиоксиданта(ов).
В некоторых вариантах осуществления изобретения содержание витамина Е в композиции составляет от по меньшей мере около 250 част./млн, по меньшей мере около 500 част./млн, или по меньшей мере около 1000 част./млн, и, если нет необходимости, максимально обычно не превосходит около 2000 част./млн или около 1500 част./млн.
В некоторых вариантах осуществления изобретения содержание витамина С в композиции составляет от по меньшей мере около 50 част./млн, по меньшей мере около 75 част./млн или по меньшей мере около 100 част./млн до около 1000 част./млн, до около 5000 част./млн или до около 10000 част./млн.
В некоторых вариантах осуществления настоящего изобретения содержание липоевой кислоты в композиции составляет от по меньшей мере около 25 част./млн, по меньшей мере около 50 част./млн или по меньшей мере около 100 част./млн до около 100 част./млн или до около 600 част./млн, или до количества, которое не токсично для млекопитающего.
В других вариантах осуществления настоящего изобретения диапазон содержания липоевой кислоты может быть от около 100 част./млн до около 200 част./млн.
В некоторых вариантах осуществления изобретения содержание L-карнитина для собак может быть минимально около 50 част./млн, около 200 част./млн или около 300 част./млн. Для кошек могут быть использованы немного большие минимальные количества L-карнитина, например, около 100 част./млн, около 200 част./млн или около 500 част./млн. Например, максимальное нетоксичное количество, которое может быть использовано, составляет менее чем около 5000 част./млн. Для собак могут быть использованы меньшие количества, например, менее чем около 5000 част./млн. Для собак диапазон может быть от около 200 част./млн до около 400 част./млн. Для кошек диапазон может быть от около 400 част./млн до около 600 част./млн.
В различных вариантах осуществления изобретения от около 1 част./млн до около 15 част./млн бета-каротина, от около 0,1 до около 5 част./млн селена, по меньшей мере около 5 част./млн лютеина, по меньшей мере около 25 част./млн токотриенола(ов), по меньшей мере около 25 част./млн коэнзима Q10, по меньшей мере около 50 част./млн S-аденозилметионина, по меньшей мере около 500 част./млн таурина, по меньшей мере около 25 част./млн изофлавона(ов) сои, по меньшей мере около 50 част./млн N-ацетилцистеина, по меньшей мере около 50 част./млн глютатиона, по меньшей мере 50 част./млн экстракта гинкго билоба могут быть использованы независимо или в различных комбинациях.
Общее количество одного или более антиоксидантов в композиции достаточно, чтобы вызвать модуляцию экспрессии одного или более генов или продуктов генов у млекопитающего. Как используется в настоящем описании, «модуляция» экспрессии относится к изменению уровня экспрессии одного или более генов или продуктов генов. Изменение экспрессии гена или продукта генов включает стимуляцию (или индукцию), так что ген или продукт гена экспрессируется в более высоких уровнях, чем обычно обнаруживается у млекопитающих, или обнаруживается в отсутствие добавления антиоксиданта(ов) к пище млекопитающего. Альтернативно, изменением экспрессии может быть ингибирование (или подавление) гена или продукта гена, так что ген или продукт гена экспрессируется в меньшей степени, чем обнаруживается в норме у млекопитающего, или обнаруживается в отсутствие добавления антиоксиданта(ов) к пище млекопитающего.
В некоторых вариантах осуществления изобретения геном, который может модулироваться, может быть ген семейства цитохрома Р450, ген семейства аполипопротеина, ген, кодирующий один или более продуктов, которые регулируют гемодинамические характеристики; ген семейства белков теплового шока; ген, кодирующий один или более продуктов, показательных в отношении повреждения ДНК; ген, кодирующий один или более продуктов, которые регулируют клеточный цикл; провоспалительный ген; ген, кодирующий один или более белков, ассоциированных с секреторным путем хромаффина; ген, кодирующий один или более продуктов, которые регулируют транскрипцию гена; ген пути NF-KB; ген, кодирующий один или более продуктов, связанных с иммунными функциями; ген, кодирующий один или более ферментов гликолиза; ген, кодирующий один или более белков окислительного пути митохондрий; или ген, кодирующий один или более рибосомных белков.
В некоторых вариантах осуществления изобретения может модулироваться комбинация вышеуказанных генов.
В некоторых вариантах осуществления изобретения геном семейства цитохрома Р450 может быть, например, Р450, семейство 2, подсемейство b, полипептид 10 (Cyp2b10), Р450, семейство 2, подсемейство с, полипептид 70 (Cyp2с70), Р450, семейство 2, подсемейство с, полипептид 37 (Cyp2с37), Р450, семейство 2, подсемейство а, полипептид 12 (Cyp2а12), Р450, семейство 2, подсемейство с, полипептид 40 (Cyp2с40), Р450, семейство 3, подсемейство а, полипептид 11 (Cyp3а11), Р450, семейство 3, подсемейство а, полипептид 13 (Cyp3а13), Р450, семейство 3, подсемейство а, полипептид 16 (Cyp3а16), Р450, семейство 3, подсемейство а, полипептид 25 (Cyp3а25), Р450, семейство 2, подсемейство а, полипептид 4 (Cyp2а4) или Р450, семейство 4, подсемейство а, полипептид 10 (Cyp4а10).
В некоторых вариантах осуществления изобретения геном семейства аполипопротеина может быть, например, аполипопротеин С-II (Apoc2), аполипопротеин А-I (Apoа1), аполипопротеин А-II (Apoа2), аполипопротеин А-V (Apoа5) или аполипопротеин Н (Apoh).
В некоторых вариантах осуществления изобретения геном, кодирующим один или более продуктов, которые регулируют гемодинамические свойства, могут быть, например, ген, кодирующий фибриноген, альфа-полипептид (Fga), фактор коагуляции Х (F10), ангиогенин (Ang), параоксоназу 1 (Pon1), кининоген (Kng), фактор коагуляции XII, бета-субъединицу (F13b), белок, связанный с рецептором липопротеинов низкой плотности 2 (Lrp2), фактор коагуляции V (F5), плазминоген (Plg), фактор коагуляции II (F2), ангиотензиноген (Agt) или фибриноген, В бета-полипептид (Fgb).
В некоторых вариантах осуществления изобретения геном белка теплового шока может быть, например, ген, кодирующий белок теплового шока (Hsp105), субъединица шаперона 5 (эпсилон) (Cct5), субъединица шаперона 8 (тета) (Cct8), DnaJ гомолог (Hsp40), подсемейство А, член 1 (Dnaja1), DnaJ гомолог (Hsp40), подсемейство С, член 2 (Dnajс2), DnaJ гомолог (Hsp40), подсемейство С, член 7 (Dnajс7), белок теплового шока 70 кДа 5 (белок, регулируемый глюкозой) (Hspa5), белок теплового шока (Hsp105), белок теплового шока 1, альфа (Hspca), белок теплового шока 1, бета (Hspcb), белок теплового шока 1А (Hspa1a), белок теплового шока 1В (Hspa1b), белок теплового шока 4 (Hspa4), белок теплового шока 8 (Hspa8), белок осмотического стресса (Osp94), белок, связанный с белковой дисульфидной изомеразой (Р5-зависящий) или стресс-индуцированный фосфопротеин 1 (Stip1).
В некоторых вариантах осуществления изобретения геном, кодирующим один или более продуктов, указывающих на повреждение ДНК, может быть, например, ген, кодирующий мутированный гомолог атаксии-телеангиоэктазии (человеческий) (Atm), белок, связывающий ДНК, специфичный к повреждению 1 (Ddb1), дефицит восстановления у грызунов перекрестного восстановления иссечением, комплементарная группа 3 (Ercc3), гентингтон-ассоциированный белок 1 (Hap1), гомолог mutS 2 (E.coli) (Msh2), миелоидный ген, связанный с экотропной интеграцией вируса 1 (Mrg1), онкоген нейробластомы ras (Nras), гомолог RAD21 (S.pombe) (Rad21), ретинобластома 1 (Rb1), белок, связывающий ретинобластому 4 (Rbbp4), белок, связывающий ретинобластому 7 (Rbbp7), белок, связывающий ретинобластому 9 (Rbbp9), гомолог атаксии спинного мозга и мозжечка 2 (человеческий) (Sca2), сшитый ген миотубулярной миопатии 1 (Mtm1), или комплементарное рентгеновское восстановление повреждения в клетках Китайского хомяка 5 (Xrcc5).
В некоторых вариантах осуществления изобретения геном, кодирующим один или более продуктов, которые регулируют клеточный цикл, может быть, например, циклин G1 (Ccng1), циклин D2 (Сcnd2), CDC23 (цикл деления клеток 23, дрожжи, гомолог) (Cdc23), циклин D3 (Ccnd3), циклинзависимая киназа 5 (Cdk5), р21 (CDKN1A)-активированная киназа 2 (Pak2), RAS p21 белок активатор 1 (Rasa1), циклинзависимая киназа 8 (Cdk8), CDC42 эффекторный белок (связывание Rho ГТФазы) 4 (Cdc42ep4), каспаза 8 (Casp8), каспаза 4, цистеинпротеаза, связанная с апоптозом (Casp4), каспаза 12 (Casp12), промотор смерти, ассоциированный с Bcl (Bad), Bcl2-подобный 2 (Bcl212), взаимодействующий белок программируемой клеточной смерти 6 (Pdcd6ip), программируемая смерть клетки 8 (Pdcd8), программируемая смерть клетки 2 (Pdcd2), аннексин А1 (Anxa1), аннексин А2 (Anxa2) или ген, ассоциированный с сигналиндуцированной пролиферацией 1 (Sipa1).
В некоторых вариантах осуществления изобретения провоспалительным геном может быть, например, ген, кодирующий гистидиндекарбоксилазу (Hdc), активированная молекула клеточной адгезии лейкоцитов (Alcam), протокадгерин альфа 4 (Pcdha4), цитозольный фактор нейтрофилов 4 (Ncf4), протеаза тучных клеток 5 (Mcpt5), катепсин S (Ctss), кадгерин 2 (Cdh2), соединительная молекула адгезии клеток 3 (Jcam3), ген, экспрессируемый макрофагами 1 (Mpeg1), катепсин В (Ctsb), белок, связывающий кальциклин (Cacybp), параоксоназа 2 (Pon2), структурный Р лизозим (Lpz-s), Лейкотриен В4 12-гидроксидегидрогеназа (Ltb4dh), лизосомальная кислая липаза 1 (Lipl), лизозим (Lyzs) или аммоний-лиаза гистидина (Hal).
В некоторых вариантах осуществления изобретения геном, кодирующим один или более белков, ассоциированных с секреторным путем хромаффина, может быть, например, белок везикулярной мембраны р24 (Vmp), Са2+-зависимый активаторный белок для секреции (Cadps), секретогранин III (Scg3), синаптотагмин 4 (Syt4), экспортин 1, гомолог CRM1 (дрожжи) (Xpo1), синаптотагминоподобный 4 (Sytl4), рецептор глютамата, ионотропный, AMPA (альфа 2) (Gria2), белок, ассоциированный с синаптосомами 25 (Snap25), нейропилин (Nrp), белок, связывающий белок, ассоциированный с синаптосомами 25 (Snap25bp), белок, ассоциированный с синаптосомами 91 (Snap91), синаптотагмин 1 (Syt1), синаптофизин (Syp), динамин-1-подобный (Dnm1l), РНК-связывающий белок, ассоциированный с цитотоксическими гранулами 1 (Tia1), рабаптин 5 (Rab5ep-связанный), динамин (Dnm), белок тау, ассоциированный с микротрубочками (Mapt), синтаксин 4А (плацентарный) (Stx4a) нейроэндокринный белок 1 секреторных гранул, белок 7В2 (Sgne1), белок везикулярной мембраны р24 (Vmp), коронин, белок, связывающий актин 1А (Corolа), хромогранин А (Chga), синаптотагмин-подобный 4 (Sytl4), субъединица альфа коатомерного белкового комплекса (Copa), динеин, цитоплазменный, легкая цепь 2А (Dncl2a), коатомерный белковый комплекс, субъединица гамма 1 (Copg1), мембранный белок, ассоциированный с пузырьками 4 (Vamp4), sec13-подобный белок (Sec131-связанный), кальнексин (Canx), белок, связывающий синтаксин 3 (Stxbp3), вакуолярный сортирующий белок 16 (дрожжи) (Vps16), SEC22 пузырьковый двигательный протеноподобный 1 (S.cerevisiae) (Sec2211), коатомерный белковый комплекс, субъединица бета 2 (бета прим) (Copb2), протеогликан, секреторные гранулы (Prg), синтаксин 6 (Stx6), тубулин, альфа 3 (Tuba 3), кэппирующий белок альфа 1 (Cappa1) или секреторный носитель мембранный белок 1 (Scamp1).
В некоторых вариантах осуществления изобретения геном, кодирующим один или более продуктов, которые регулируют транскрипцию генов, может быть, например, ген, кодирующий сплайсинговый фактор 3b, субъединица 1 (Sf3b1), Trf (фактор, связанный с TATA-связывающим белком) - проксимальный р (Trfp), РНК-связывающий компонент белка 10 (Rmb10), транскрипционный фактор 4 (Tcf4), транскрипционный фактор 12 (Tcf12), полимераза (ДНК-направленная), бета (Polb), транскрипционный комплекс CCR4-NOT, субъединица 2 (Cnot2), фактор стимуляции отщепления, 3'пре-РНК, субъединица 2, 64 кДа, вариант тау (вариант Cstf2tau), сплайсинговый фактор, богатый по аргинину/серину 1 (ASF/SF2) (Sfrs1), общий транскрипционный фактор II I (Gtf2i), транскрипционный фактор Yy1 (Yy1), белок альфа, связывающий ССААТ/энхансер (C/EBP), связанная последовательность 1 (Cebpa-rs1), PRP4 гомолог пре-мРНК процессингового фактора 4 В (дрожжи) (Prpf4b), сплайсинговый фактор 3а, субъединица 3, 60 кДа (Sf3a3) или полимеразный (РНК) II (ДНК направленный) полипептид Н (Polr2h).
В некоторых вариантах осуществления изобретения геном пути NF-KB может быть амилоид сыворотки А3 (Saa3), лимфотоксин В (Ltb), ядерный фактор усилителя гена каппа легкого полипептида в В-клетках 2, р49/р100 (Nfkb2), ингибитор ядерного фактора усилителя гена каппа легких цепей в В-клетках, альфа (Nfkbia), белок альфа, связывающий ССРАТ/энхансер (C/EBP), связанная последовательность 1 (Cebpa-rs1), суперсемейство рецептора фактора некроза опухолей, член 1а (Tnfrsf 1a) или энхансер ядерного фактора усилителя гена каппа легких цепей в В-клетках, 1, р105 (Nfkbl).
В некоторых вариантах осуществления изобретения геном, кодирующим один или более продуктов, связанных с иммунной функцией, может быть ген, кодирующий ламбда цепь иммуноглобулина, вариант 1 (Igl-V1), гистосовместимость 2, класс II, локус Mb1 (H2-DMb1), лимфотоксин В (Ltb), хемокин (компонент С-С) лиганд 5 (Ссl5), тяжелую цепь иммуноглобулина 4 (igGl сыворотки) (lgh-4), белок с тетратрикопептидом, индуцированный интерфероном (lfit2), гистосовместимость 2, класс II, локус Mb2 (H2-DMb2), орозомукоид 2(Orm2), тяжелую цепь иммуноглобулина 6 (тяжелую цепь Igl) (Igh-6), антиген Cd52 (Cd52), каппа цепь иммуноглобулина вариант 8 (V8) (Igk-V8), антиген CD24a (Cd24a), хемокин (С-Х-С-мотив) рецептор 4 (Cxcr4), фактор 4, регулирующий интерферон (Irf4), цитозольный фактор нейтрофилов 1 (Ncf1), лимфобластомный лейкоз (Lyl1), лимфоцит-специфический 1 (Lsp1), хемокин (С-Х-С компонент) лиганд 13 (Cxc113), амилоид сыворотки А2 (Saa2) или антиген CD79B (Cd79b).
В некоторых вариантах осуществления изобретения геном, кодирующим один или более гликолитических или митохондриальных окислительных ферментов, может быть, например, ген, кодирующий, пируватдегидрогеназу киназу, изофермент 3 (Pdk3), пируваткиназу, мышечную (Pkm2), фосфофруктокиназу тромбоцитов (Pfkp), аденозилсукцинатлиазу (Adsl), альдолазу 1, А изоформу (Aldo1), гексокиназу 1 (Hk1), глицеральдегид-3-фосфат дегидрогеназу (Gapd), фосфофруктокиназу, печень, В-тип (Pfkl), глюкофосфатизомеразу 1 (Gpil), 6-фосфоглюконолактоназу (Pgls), трансальдолазу 1 (Taldo1), транскетолазу (Tkt), 2,3-бисфосфоглицератмутазу (Bpgm), АТФ цитратлиазу (Acly), АТФ-азу, Н+ переносящую, V0 субъединицу В (Atp6v0b), АТФ-азу, Н+ переносящую, V0 субъединицу D изоформу (Atp6v0d1), оксидазную субъединицу цитохрома с, подобную VIIe полипептиду 2 (Cox7a21), АТФ-азу, Н-переносящую, V1 субъединицу А, изоформу 1 (Atp6v1a1), NADH дегидрогеназу (убихинон) 1 альфа субкомплекс, 3 (Ndufa3), или енолазу 1, альфа не-нейронная (Eno1).
В некоторых вариантах осуществления изобретения геном, кодирующим один или более рибосомальных белков, может быть, например, ген, кодирующий митохондриальный рибосомальный белок L54 (Mrpl54), рибосомальный белок S11 (Rps11), рибосомальный белок S19 (Rps19), митохондриальный рибосомальный белок L44 (Mrpl44), рибосомальный белок L13a (Rpl13a), рибосомальный белок S8 (Rps8), рибосомальный белок S12 (Rps12), рибосомальный белок S26 (Rps26), рибосомальный белок L27a (Rpl27a), рибосомальный белок L8 (Rpl8), рибосомальный белок S23 (Rps23), рибосомальный белок L37 (Rp37), рибосомальный белок L13 (Rpl13), рибосомальный белок S3 (Rps3), рибосомальный белок L3 (Rpl3), рибосомальный белок L18 (Rpl18), митохондриальный рибосомальный белок S15 (Mrps15), эукариотический фактор инициации трансляции 3, субъединица 7 (зета) (Eif3s7), рибосомальный белок S5 (Rps5), рибосомальный белок L36 (Rpl36), рибосомальный белок S4, сшитый (Rps4х) или рибосомальный белок L19 (Rpl19).
В различных вариантах осуществления настоящее изобретение предусматривает увеличение экспрессии гена семейства цитохрома Р450, увеличение экспрессии гена семейства аполипопротеина, увеличение экспрессии гена, кодирующего продукт(ы), которые регулируют гемодинамические свойства, снижение экспрессии генов семейства белков теплового шока, снижение экспрессии продуктов гена, которые являются показателями повреждения ДНК, снижение экспрессии гена, чьи продукт(ы) регулируют клеточный цикл, снижение экспрессии провоспалительных генов, снижение экспрессии гена, кодирующего белок, ассоциированный с секреторным путем хромаффина, снижение экспрессии гена, чьи продукт(ы) экспрессии регулируют транскрипцию гена, снижение экспрессии гена пути NF-KB, снижение экспрессии гена, кодирующего продукт(ы), связанные с иммунной функцией, снижение экспрессии гена, кодирующего гликолитический фермент(ы), снижение экспрессии гена, кодирующего белки окислительного пути митохондрий или снижение экспрессии гена, кодирующего рибосомальные белки.
В различных вариантах осуществления изобретения экспрессия гена (или продукта гена) может модулироваться в любом количестве различных тканей и органов, например надпочечниках, печени или коре головного мозга. В других вариантах осуществления изобретения экспрессия гена (или продукта гена) модулируется в надпочечниках, в печени или в коре головного мозга. В дальнейших вариантах осуществления изобретения настоящее изобретение относится к способам изменения поведения у стареющих млекопитающих, включающие введение стареющему млекопитающему композиции, включающей один или более антиоксидантов.
В некоторых вариантах осуществления изобретение относится к способам лечения, профилактики, ингибирования или обращения ухудшения когнитивной и/или физической функции у млекопитающего, ассоциированного со старением, включающим введение млекопитающему одного или более антиоксидантов, чье общее количество является эффективным для модуляции экспрессии одного или более генов. В некоторых вариантах осуществления изобретения такие способы улучшают окислительный статус млекопитающего.
Когнитивная функция, ассоциированная со старением, может относиться к симптомам психического распада, например, потере или нарушению памяти, нарушениям обучаемости, дезориентации и снижению умственной живости.
Физическая функция, ассоциированная со старением, может включать симптомы, например, ухудшения или нарушения функций мышц, ухудшения или нарушений сосудистой функции, ухудшения или нарушений зрения, ухудшения или нарушений слуха, ухудшения или нарушений обоняния, ухудшения или нарушений качества кожи или покровов, ухудшение состояния костей и суставов, ухудшения функции почек, ухудшения или нарушений пищеварительных функций, ухудшения или нарушений иммунной функции, ухудшения или нарушений чувствительности к инсулину и/или ухудшения или нарушений воспалительных ответов.
В некоторых вариантах осуществления настоящее изобретение относится к способам оценки окислительного статуса млекопитающего. Такие способы могут включать определение уровня экспрессии одного или более генов, например генов, описанных в настоящем описании. В различных вариантах осуществления изобретения такие способы могут, кроме того, включать определение уровня экспрессии по меньшей мере одного из таких генов в одной или более тканях, например, надпочечниках, печени или коре головного мозга.
В некоторых вариантах осуществления изобретения настоящее изобретение относится к способам имитации эффектов ограничения калорий на экспрессию генов у млекопитающего. В некоторых аспектах ограничение калорий снижает повреждение от химических метаболических процессов, особенно окислительного повреждения. В других аспектах ограничение калорий является применимым в контроле веса. Такие способы могут включать введение млекопитающему одного или более антиоксидантов в количестве, эффективном для модуляции одного или более генов, кодирующих гликолитический фермент(ы) или белки, ассоциированные с окислительными путями митохондрий. Следовательно, способы по настоящему изобретению также являются применимыми в регуляции массы тела у млекопитающих. Как используется в настоящем описании, «регуляция» массы тела может включать снижение веса, набор веса или поддержание существующего веса.
В некоторых вариантах осуществления настоящее изобретение относится к способам подавления генов, связанных с иммунной функцией, и может быть использовано для лечения, профилактики или ингибирования воспаления и способам снижения повреждения ДНК, о чем свидетельствует уменьшение индуцированных механизмов восстановления ДНК.
В некоторых вариантах осуществления изобретения введение композиций по настоящему изобретению может снижать смерть клеток, о чем свидетельствует сниженный уровень экспрессии мРНК белков теплового шока и обмена мРНК в клеточном цикле.
В некоторых вариантах осуществления изобретения введение композиций по настоящему изобретению приводит к активации генов, таких как члены семейства цитохрома р450, в надпочечниках, таким образом увеличивая метаболизм цитохрома Р450 в надпочечниках. Повышенный метаболизм цитохрома Р450 в надпочечниках может модулировать стероидогенную активность нейроэндокринной/надпочечниковой системы для уменьшения стресса и тревоги у млекопитающих.
В некоторых вариантах осуществления изобретение относится к способам снижения воспалительного ответа подавлением воспалительных/связанных с иммунитетом генов. Введение одного или более антиоксидантов по настоящему изобретению может изменить гемодинамические свойства индукцией (стимуляцией) специфических мРНК. В других вариантах осуществления изобретение относится к способам лечения, профилактики или ингибирования атерогенеза.
В различных вариантах осуществления настоящее изобретение относится к способам оценки эффективности режима для млекопитающих. Млекопитающим может быть любое млекопитающее, к которому применяется режим или которое рассматривается в связи с режимом. Режим может быть, например, для улучшения или предотвращения ухудшения окислительного статуса; имитации эффектов ограничений калорий; регуляции массы тела; лечения, профилактики или ингибирования атерогенеза; лечения, профилактики или ингибирования стресса или тревоги; лечения, профилактики или ингибирования воспаления; или изменения поведения, например улучшения или предотвращения ухудшения когнитивной и/или физической функции.
В некоторых вариантах осуществления изобретения способы оценки эффективности режима включают определение уровня экспрессии одного или более генов, независимо выбираемых из генов семейства цитохрома Р450, генов семейства аполипопротеинов, гена, кодирующего продукт(ы), который регулирует гемодинамические свойства, генов семейства белков теплового шока, генов, кодирующих продукты, показательные в отношении повреждения ДНК, генов, кодирующих продукт(ы), который регулирует клеточный цикл, провоспалительных генов, генов, кодирующих белок(ки), ассоциированных с секреторным путем хромаффина, генов, кодирующих продукт(ы), который регулирует транскрипцию генов, генов пути NF-KB, генов, кодирующих продукт(ы), связанный с иммунной функцией, генов, кодирующих гликолитические фермент(ы), генов, кодирующих белки окислительного пути митохондрий, и генов, кодирующих рибосомальные белки(ок); и сравнение уровня экспрессии с эталонным уровнем экспрессии, так что уровень экспрессии относительно эталонного уровня экспрессии является показателем эффективности лечения.
В различных вариантах осуществления настоящее изобретение описывает микросхему генов или протеомный фильтр. Как используется в настоящем описании, термин «микросхема» включает все устройства, называемые так в Schena (ed.), DNA Microarrays: A Practical Approach (Practical Approach Series), Oxford University Press (1999) (ISBN: 0199637768); Nature Genet 21(1) (suppl): 1-60 (1999); и Schena (ed.), Microarray Biochip: Tools and Technology, Eaton Publishing Company/BioTechniques Books Division (2000) (ISBN: 1881299376), которые включены в настоящее описание полностью в виде ссылки. Микросхемы по настоящему изобретению могут быть микросхемами, полученными для измерения экспрессии по меньшей мере одного гена, показывающего окислительный статус млекопитающего. В некоторых вариантах осуществления изобретения микросхема может быть создана для измерения экспрессии комбинации генов, показательных в отношении окислительного статуса. Геном по настоящим вариантам осуществления может быть, например, ген, описанный выше. В некоторых вариантах осуществления изобретения микросхема может быть использована для измерения экспрессии любого из таких генов или комбинации таких генов.
Как используется в настоящем описании, термин «протеомный» фильтр относится к исследованиям белкового анализа или фильтрам связывания белков, включая исследования или фильтры, которые включают множество белков параллельно. Протеомные подходы к анализу белков описаны, например, в BioTechniques 33: 1308-1316 (2002), описание которого включено здесь полностью в виде ссылки.
Настоящее изобретение не ограничено определенной методологией, протоколами и реагентами, описанными здесь, так как они могут варьироваться. Более того, терминология, используемая в настоящем описании, предназначена только для целей описания определенных вариантов осуществления и не предназначена для ограничения рамок настоящего изобретения. Как используется в настоящем описании и в приложенной формуле изобретения, формы единственного числа включают ссылки на множественное число, если в контексте четко не указано другое, например, ссылка на «млекопитающее» включает множество таких млекопитающих. Термины «включает», «включают», «включающий» должны интерпретироваться скорее включительно, чем исключительно.
Если не определено иначе, все технические и научные термины и любые сокращения, используемые в настоящем описании, имеют такие же значения, как обычно понимаемые средним специалистом в области техники настоящего изобретения. Хотя любые способы и материалы, подобные или эквивалентные приведенным в настоящем описании, могут быть использованы в осуществлении настоящего изобретения, предпочтительные способы, устройства и материалы раскрыты в настоящем описании.
Все патенты, патентные заявки и публикации, упомянутые в настоящем описании, включены здесь в виде ссылки в степени, допущенной законом для целей описания и раскрытия композиций, соединений, способов и другой информации, указанной в настоящем описании, которая может быть использована с настоящим изобретением. Однако ничто в настоящем описании не может расцениваться как допущение, что изобретение не дает право предвосхищать такое описание посредством предшествующего изобретения.
ПРИМЕРЫ
Изобретение далее будет проиллюстрировано следующими примерами его предпочтительных вариантов осуществления, хотя понятно, что такие примеры включены только для целей иллюстрации и не предназначены для ограничения рамок изобретения, если особым образом не указано иначе.
Пример 1
Настоящий пример иллюстрирует подавление окислительного стресса, возникающего у стареющих мышей, получавших различные антиоксиданты, что определяли с использованием биохимических показателей соотношения глютатиона, восстановленного к окисленному (GSH:GSSG) в качестве индикатора окислительного стресса.
Соотношения GSH:GSSG измеряли способом, описанным в Jones, D.P., Redox Potential of GSH/GSSG Couple: Assay and Biological Significance, Methods Enzymol., 348:93-112 (2002).
Вид мышей с ускоренным старением (SAM), который обеспечивает систему модели старения, получали от д-ра Takeda and the counsil on SAM research, University of Tokyo, Tokyo, Japan (Takeda T., et al., Senescence-accelerated mouse (SAM): A novel murine model of senescence, Exp. Gerontol, 32: 105-109 (1997); Takeda T., et al., Pathobiology of the senescence-accelerated mouse (SAM), Exp. Gerontol, 32: 117-127 (1997); Takeda T., et al., Senescence-accelerated mouse (SAM): A biogerontological resource in aging research, Neurobiol Aging, 20: 105-110 (1999)).
Мыши C57BL6 были видом лабораторных долгоживущих мышей.
Если не указано иначе, все мыши с ускоренным старением и C57BL6 получали контрольную пищу, пока их не переводили на пищу А или пищу В. Тех мышей, которых переводили на пищу А или пищу В, кормили соответствующей пищей в течение по меньшей мере 6 месяцев (контрольные мыши получали только контрольную пищу). Если не указано иначе, пищу А получали мыши в возрасте с 5 до 13 месяцев, и пищу В - с 7 до 17 месяцев. Если не указано иначе, композиции используемых пищевых продуктов были, как указано в таблице 2. Количества в таблице 2 представляют собой количества исходных веществ, добавленных к композиции, выраженные в проценте от общей массы.
Состав пищевой основы А: кукуруза, птичья мука, рис, выжимки соевых бобов, глютеновая кукурузная мука, соевое масло, жир, различные ингредиенты (т.е. витамины, минералы и др.).
Состав пищевой основы В: кукуруза, выжимки соевых бобов, соевая мука, глютеновая кукурузная мука, жир, различные ингредиенты (т.е. витамины, минералы и др.).
Основные различия по компонентам между контрольной пищей, пищей А и пищей В представлены в таблице 3.
Количества в таблице 3 представляют собой количества, добавляемые к композиции, выраженные в процентах от общей массы.
Аналитический анализ показал, что контрольная пища содержала 17% белка, 10% жира, приблизительно 200 част./млн витамина Е и <32 част./млн витамина С. Аналитический анализ показал, что пища А содержала 17% белка, 10% жира, приблизительно 500 част./млн витамина Е, приблизительно 80 част./млн витамина С, приблизительно 300 част./млн L-карнитина и приблизительно 125 част./млн липоевой кислоты. Аналитический анализ показал, что пища В содержала 19% белка, 10% жира, приблизительно 500 част./млн витамина Е и приблизительно 80 част./млн витамина С.
Определяли эффекты обогащенной антиоксидантами пищи А и В на окислительный стресс. В одном эксперименте концентрацию восстановленного глютатиона (GSH) и окисленного глютатиона (GSSG), характеристику окислительного баланса, измеряли в плазме мышей с ускоренным старением на контрольной пище или пище А и в группе нормальных мышей (C57BL/6) на контрольной пище. Соотношение GSH:GSSG для мышей с ускоренным старением, получавших контрольную пищу, было меньше, чем соотношение GSH:GSSG для мышей C57BL/6, получавших контрольную пищу, или мышей с ускоренным старением, получавших пищу А. Такие результаты показывают, что мыши с ускоренным старением, получавшие контрольную пищу, находились в состоянии большего окислительного стресса, чем обычные мыши. Результаты также показывают, что пища А (т.е. пища, дополненная витамином Е, витамином С, липоевой кислотой и L-карнитином) уменьшала такой окислительный стресс, как показано улучшением соотношений GSH:GSSG.
В другом эксперименте определяли эффекты пищи В (т.е. комплекса пищи, усиленной антиоксидантами) на соотношения GSH:GSSG в плазме мышей с ускоренным старением в возрасте 17 месяцев. У мышей с ускоренным старением, получавших пищу В, соотношения GSH:GSSG были выше, чем у мышей с ускоренным старением, получавших контрольную пищу. Такие результаты показывают, что пища В уменьшает окислительный стресс, испытываемый мышами с ускоренным старением.
В другом эксперименте соотношения восстановленного к окисленному глютатиону определяли в тканях мышей с ускоренным старением, получавших контрольную пищу или пищу А. По сравнению с мышами с ускоренным старением, получавшими контрольную пищу, у мышей с ускоренным старением, получавших пищу А, было улучшенное соотношение GSH:GSSG в скелетных мышцах (см. таблицу 4). Такие результаты также показывают, что в добавление к улучшению маркеров окислительного стресса в плазме дополненная пища А также улучшала такие же показатели в по меньшей мере одной ткани, скелетной мышце, и является эффективной при внутриклеточной буферизации окислительного стресса.
В другом эксперименте определяли соотношение восстановленного к окисленному глютатиону в тканях мышей с ускоренным старением, получавших или контрольную пищу, или пищу В. Пища В улучшала соотношение GSH:GSSG во всех тканях (печень, почки, сердце, кора головного мозга и скелетные мышцы) по сравнению с контролем, подобранным по полу и возрасту (см. таблицу 5). Такие результаты показывают, что в добавление к улучшенному соотношению GSH:GSSG в плазме пища В также улучшает внутриклеточные соотношения GSH:GSSG. Такие результаты также показывают, что пища В является эффективной в уменьшении избыточной продукции свободных радикалов у мышей с ускоренным старением, возможно приводя к улучшению состояния здоровья с возрастом.
Пример 2
Геномный ответ на антиоксидант(ы) у мышей с ускоренным старением, получавших пищу, содержащую различные антиоксиданты, определяли анализом экспрессии мРНК.
Три группы из 5-6 мышей с ускоренным старением кормили контрольной пищей, пищей А или пищей В, как объяснялось в примере 1 выше. Композиции пищи были такие же, как в примере 1 выше.
Методики молекулярной биологии следуют стандартным протоколам, хорошо известным специалистам в области техники, таким как указанные в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY (1989). Ткани получали от мышей, и РНК экстрагировали из такой ткани. Экстрагированную РНК объединяли по ткани (печень, надпочечники и кора головного мозга) и пищи (контроль, А или В), приводя всего к девяти объединенным образцам РНК. Объединенные образцы общей РНК далее обрабатывали для получения экспрессии генов (мРНК) с использованием олигонуклеотидных векторов высокой плотности Mu74Av2 (Mu74Av2 GeneChip, Affymetrix, Santa Clara, CA) в соответствии с инструкциями производителя. Набор микровекторнного анализа (MAS) 5.0 (Affimetrix) использовали для расчета интенсивности флуоресценции гибридизованных, биотинилированных фрагментов РНК. Весь статистический анализ проводили с помощью MAS 5.0. Каждую мРНК анализировали с 32 различными зондами: 16 зондов для специфического связывания и 16 - для неспецифического связывания. Все сигналы с р<0,05 расценивали статистически значимыми и использовали для анализа биологических эффектов. Определяли приблизительно 4000-8000 генов. Значение определения варьировалось от 10 до 6000. Диапазон значений р был 0,0001-0,05. Статистически значимые различия определяли сравнением интенсивности всех 32 зондов для генов в одной группе с таковыми в другой группе. Значения р<0,05 расценивали статистически значимыми.
Определяли эффект пищи А и В на общую экспрессию генов в различных тканях. Таблица 6 показывает общее количество генов, определяемое анализом GeneChip.
Эффекты пищи А и В сравнивали с профилем экспрессии генов трех тканей, полученных от мышей, получавших контрольную пищу. Различия в определении общего количества генов в тканях трех групп питания могут быть частично объяснены конечным подавлением генов в обрабатываемой ткани.
Подобные количества генов определяли в трех тканях от мышей, получавших контрольную пищу. В печени и надпочечниках определяли меньше генов (28% и 6% соответственно) у мышей, получавших пищу А, предполагая конечное подавление экспрессии генов. Пища В оказывала подобный эффект на активность генома печени. В отношении генома надпочечников пища В показала конечную индукцию активности генома. На активность генома печени подобным образом влияли пища А и В. Кора головного мозга от трех групп кормления мышей меньше отвечала на пищу А и В, что предполагает большую стабильность церебрального генома в отношении диетических составляющих двух видов пищи. Это может быть обусловлено барьером проницаемости, представленным «гематоэнцефалическим барьером» к пищевым антиоксидантам и их предполагаемым продуктам метаболизма.
В заключение, вышеуказанные исследования показали различные эффекты пищи А и В на активность генома надпочечников и сходные эффекты пищи А и В на активность генома печени и коры головного мозга. См. в общем фиг.1.
Пример 3
Эффекты пищи А и В на экспрессию различных классов генов в различных тканях мышей с ускоренным старением определяли с использованием анализа GeneChip, описанного выше.
Фиг.2, 3 и 4 суммируют функциональные классы генов, чья экспрессия модулируется у мышей, получавших пищу А и В, и относительный вклад таких генов в изменения генетических профилей.
Фиг.2 и 3 показывают обзор функциональных классов генов надпочечников и печени соответственно, на которые влияет пища А и В и их относительные распределения. Пища А и В оказывала характерные эффекты на функциональные группы генов, проиллюстрированные на фиг.2 и 3. Наибольшее количество затронутых генов регулирует иммунные функции. Подобным образом, гены, которые регулируют воспаление, секрецию, ответ на повреждение ДНК и тепловой шок, также подавлялись пищей А и В в печени и надпочечниках. Гены, которые кодируют ферменты гликолиза, митохондриального окисления и синтеза белка, были подавлены в печени пищей А и В.
Пища А и В влияла на секреторные пути. Так как печень и надпочечники являются секреторными органами, результаты предполагают, что такая пища может регулировать состав крови и лимфы и функции других органов.
На фиг.4 показана функциональная классификация и относительное распределение дифференциально экспрессируемых генов в коре головного мозга мышей, получавших пищу А. Подобное распределение дифференциально экспрессируемых генов определяли в коре головного мозга мышей, получавших пищу В. Семейства генов восстановления ДНК и белков теплового шока не подавлялись в коре головного мозга мышей, получавших пищу А и В (хотя такие гены подавлялись в печени и надпочечниках мышей, получавших пищу А и В).
Пример 4
Эффекты пищи А и В на экспрессию различных классов генов в надпочечниках мышей с ускоренным старением определяли анализом GeneChip, описанным выше.
Сравнительный анализ профилей экспрессии генов предполагает, что надпочечники являются важным «сенсором» состояния микроэлементов. Так как железа является интегральным компонентом гипоталамо-гипофизарно-надпочечниковой оси, также она может быть важным исполнительным элементом антиоксидантных микроэлементов.
Семейство цитохрома Р450: функциональный генетический анализ показал, что члены семейства цитохрома Р450 индуцировались пищей А и В. Список затронутых членов этого семейства приведен в таблице 7.
Результаты показывают, что пища А и В индуцировала семейство генов цитохрома Р450. Продукты семейства генов цитохрома Р450 играют важную роль в метаболизме ксенобиотиков, арахидоновой кислоты и стероидов. Это предполагает, что пища А и В может модулировать стероидогенную активность такого жизненно важного нейроэндокринного органа.
Семейство аполипопротеинов: функциональный генетический анализ показал, что члены семейства аполипопротеина индуцировались пищей А и В. Список затронутых членов этого семейства приведен в таблице 8.
Такие результаты показывают, что пища А и В индуцирует семейство генов аполипопротеинов. Аполипопротеины играют координационно важную роль в метаболизме стероидов. Это предполагает, что пища А и В может модулировать стероидогенные свойства.
Гены, кодирующие продукты, которые регулируют гемодинамические свойства: функциональный генетический анализ показал, что гены, которые регулируют гемодинамические свойства крови, индуцировались пищей А и В. Список затронутых членов этого семейства приведен в таблице 9.
Такие результаты показывают, что пища А и В индуцирует гены, которые кодируют продукты, которые регулируют гемодинамические свойства. Более того, антиатерогенные эффекты пищи А и В предполагаются индукцией мРНК параоксоназы 1. Высокий уровень параоксоназы 1 ассоциирован с низкой частотой атерогенеза.
Гены, кодирующие белки теплового шока: функциональный генетический анализ показал снижение уровня экспрессии семейства генов, кодирующих белки теплового шока. Список затронутых членов этого семейства приведен в таблице 10.
Такие результаты показывают, что пища А подавляла гены белков теплового шока. Индукция белков теплового шока ассоциирована с увеличенным физиологическим стрессом. Антиоксидантный эффект пищи А предполагали по снижению активности генов, кодирующих белки теплового шока, шапероны и белковые дисульфидизомеразы в надпочечниках и печени (см. также таблицу 19). Результаты значительны в отсутствие эффекта на экспрессию классических антиоксидантных генов, таких как гены для SOD и каталаз. Результаты также предполагают, что пища А обеспечивает защитный эффект в отношении физиологического стресса.
Гены, кодирующие продукты, показательные в отношении повреждения ДНК: функциональный генетический анализ показал снижение уровня экспрессии семейства генов, кодирующих продукты, показательные в отношении повреждения ДНК. Список затронутых членов этого семейства приведен в таблице 11.
Такие результаты показывают, что пища А подавляет гены, кодирующие продукты, показывающие повреждение ДНК. Такие результаты также предполагают, что пища А снижает повреждение ДНК в ткани надпочечников.
Гены клеточного цикла: функциональный генетический анализ показал снижение уровня экспрессии генов, кодирующих продукты, которые регулируют клеточный цикл. Список затронутых членов этого семейства приведен в таблице 12.
Такие результаты показывают, что пища А подавляла гены, кодирующие продукты, которые регулируют клеточный цикл.
Провоспалительные гены: функциональный генетический анализ показал снижение уровня экспрессии провоспалительных генов. Список затронутых членов этого семейства приведен в таблице 13.
Такие результаты показывают, что гены, связанные с воспалением, подавлялись пищей А. Некоторые из таких эффектов могут быть обусловлены снижением специфических популяций клеток, таких как тучные клетки и внедряющиеся макрофаги. Подавление таких генов может быть частично обусловлено подавлением генов, которые кодируют субъединицы провоспалительных факторов транскрипции, ядерный фактор каппа В (NF-kB), митоген-активированный протеин (МAP) киназ и стимулятор и активатор транскрипции (STAT).
Гены, кодирующие белки, ассоциированные с секреторными путями хромаффина: функциональный генетический анализ показал снижение уровня экспрессии генов, которые модулируют секреторные пути. Список затронутых членов этого семейства приведен в таблице 14.
Такие результаты показывают, что пища А подавляла гены, кодирующие белки, ассоциированные с секреторным путем хромаффина.
Гены, кодирующие продукты, которые регулируют транскрипцию генов: функциональный генетический анализ показал снижение уровня экспрессии генов, которые регулируют транскрипцию. Список затронутых членов этого семейства приведен в таблице 15.
Такие результаты показывают, что пища А подавляла гены, которые кодируют ключевые ферменты транскрипционного механизма. Это может обуславливать общее снижение экспрессии генов в надпочечниках.
Гены пути NF-kB: функциональный генетический анализ показал снижение уровня экспрессии генов, кодирующих продукты, которые являются индикаторами активного пути NF-kВ или ключевыми модуляторами его активности. Список затронутых членов этого семейства приведен в таблице 16.
Такие результаты показывают, что пища А подавляла экспрессию генов, которые кодируют продукты, которые являются или индикаторами активного пути NF-kB, или являются ключевыми модуляторами его активности. Более того, пища В подавляла ген сывороточного амилоида А3. Координированное подавление генов, которые кодируют субъединицы транскрипционного фактора NF-kB, может обуславливать подавление генов, которые вызывают воспаление и модулируют иммунные ответы (см. также фиг.2).
Пример 5
Эффекты пищи А и В на экспрессию различных классов генов в печени мышей с ускоренным старением определяли с использованием анализа GeneChip, описанного выше.
Гены, связанные с иммунной функцией: функциональный генетический анализ показал, что гены, связанные с иммунным ответом, подавлялись пищей А и В. Список затронутых членов этого семейства приведен в таблице 17.
Такие результаты показывают, что пища А и В подавляла гены, связанные с иммунной функцией. Координированное подавление генов, которые кодируют тяжелые и легкие (вариабельные, антигенсвязывающие) пептидные цепи иммуноглобулинов, предполагает, что пища А и В может модулировать гуморальную «ветвь» иммунной системы и предполагает важность каждого в регуляции функции лимфоцитов. Так как такие транскрипты в норме ассоциированы с лимфоцитами и транскрипты определяли в печени, данные предполагают, что пища А и В может иметь целью лимфатическую систему, по меньшей мере, таковую печени. Подавляющие эффекты пищи А и В на функцию лимфоцитов дополнительно поддерживаются подавлением мРНК для CD79, CD52 и CD24. Как показано в таблице 17, пища В, видимо, более сильно подавляет активность лимфоцитов.
Пища А и В обладает противовоспалительными профилями в надпочечниках и печени. Подавление таких генов может быть частично обусловлено подавлением генов, которые кодируют субъединицы провоспалительных факторов транскрипции, ядерный фактор каппа-В (NF-kB), митоген-активированные протеин (МАР) киназы и стимулятор и активатор транскрипции (STAT).
Гены, кодирующие гликолитические ферменты и белки окислительного пути митохондрий: функциональный генетический анализ показал, что гены, кодирующие гликолитические ферменты и белки окислительного пути митохондрий, подавлялись пищей А и В. Список затронутых членов этого семейства приведен в таблице 18.
Такие результаты показывают, что пища А и В подавляет экспрессию генов, которые кодируют ферменты, регулирующие скорость метаболизма глюкозы и пирувата. Эффекты пищи А и В на гены, которые кодируют ферменты метаболизма промежуточных продуктов, показывают их отдельные и тканеспецифические эффекты. Такие действия имитируют ограничения калорий.
Гены, кодирующие рибосомальные белки: функциональный генетический анализ показал, что гены, кодирующие рибосомальные белки, подавлялись пищей А и В. Список затронутых членов этого семейства приведен в таблице 19.
Такие результаты показывают, что пища А и В подавляла активность генов, которые кодируют рибосомальные белки. Возможными последствиями таких эффектов двух видов пищи будет ингибирование синтеза белка, и оно может быть связано с ингибированием метаболизма глюкозы и пирувата, как предполагается в таблице 17.
Гены, кодирующие белки теплового шока: функциональный генетический анализ показал подавление генов, кодирующих белки теплового шока. Список затронутых членов этого семейства приведен в таблице 20.
Такие результаты показывают, что в печени пища А и В подавляла гены, которые кодируют белки теплового шока. Такие гены транскрипционно регулируются и индуцируются в ответ на клеточный стресс, такой как окислительный стресс. Как обсуждалось ранее, антиоксидантные эффекты пищи А и В предполагаются снижением активности генов, кодирующих белки теплового шока, шапероны и протеиндисульфидные изомеразы и в печени, и в надпочечниках (см. также таблицу 9). Результаты замечательны в отсутствие эффектов на экспрессию классических генов антиоксидантов, таких как SOD и каталазы.
Гены, кодирующие ферменты, восстанавливающие ДНК: функциональный генетический анализ показал подавление генов, кодирующих ферменты, восстанавливающие ДНК. Список затронутых членов этого семейства приведен в таблице 21.
Такие результаты показывают, что в печени пища А и В подавляет гены, которые кодируют ферменты, восстанавливающие ДНК. Такие гены транскрипционно регулируются и индуцируются в ответ на клеточный стресс, такой как окислительный стресс или повреждение ДНК.
Пример 6
Эффекты пищи А и В на экспрессию различных классов генов в коре головного мозга SAM определяли с использованием анализа GeneChip, описанного выше. Результаты таких анализов приведены в таблицах 22 (пища А) и 23 (пища В).
Как обсуждалось выше, фиг.4 показывает функциональную классификацию и относительное распределение дифференциально экспрессируемых генов в коре головного мозга мышей, получавших пищу А. Подобное распределение дифференциально экспрессируемых генов определяли в коре головного мозга мышей, получавших пищу В.
Фиг.5 иллюстрирует дифференциальные эффекты контрольной пищи, пищи А и пищи В «иерархическим кластерным анализом» профилей экспрессии мРНК, полученных анализом GeneChip, описанным выше. На фиг.5 гены, которые проявляли низкую относительную экспрессию, имеют «светлый» или «мягкий» цвет и те, которые проявляют высокую относительную экспрессию, имеют яркий цвет. Диапазон изменений составляет 2 единицы стандартного отклонения.
Общее количество генов коры головного мозга, затронутых пищей А и В, было существенно ниже, чем определяемое в печени и надпочечниках, и можно предполагать большую «защиту» этого органа непосредственными эффектами диетических компонентов. В добавление к меньшему количеству затронутых генов, диапазон действий на экспрессию генов головного мозга также узкий. Например, в печени эффекты на экспрессию генов варьируются от -130 раз до +3 раз и в надпочечниках от -10 раз до +45 раз, тогда как в коре головного мозга диапазон изменений уровня экспрессии варьируется от -3 раз до +7 раз.
Как показано на фиг.4, гены, связанные с иммунной функцией, и транскрипционные факторы образуют наибольшие кластеры затронутых генов. Данные являются особенно значимыми в отношении отсутствия эффектов на гены, которые кодируют белки теплового шока и клеточного цикла. Однако ряд генов, которые регулируют синаптическую функцию, такие как «Homer 1», представлены пищей А и В в одинаковой степени. Homer 1 регулирует нацеливание специфических субъединиц глютаматных рецепторов на синаптическую мембрану и регулирует действие ионов кальция. Подобным образом, обе пищи А и В также подавляют экспрессию гена для кальций/кальмодулинзависимой протеинкиназы, дополнительно поддерживая предположение, что пища А и В модулирует кальцийзависимые пути передачи сигнала. Также мРНК для фосфатазы двойной специфичности, фермента, важного для регуляции путей передачи сигнала протеинкиназами, индуцировалась в ~20 раз пищей В.
В описании раскрыты типичные предпочтительные варианты осуществления изобретения и, хотя используются специфические термины, они используются только в исходном и описательном смысле и не для целей ограничения; рамки изобретения установлены следующей формулой изобретения. Очевидно, возможно множество модификаций и вариантов настоящего изобретения в свете вышеуказанного описания. Следовательно, необходимо понимать, что в рамках приложенной формулы изобретения изобретение может быть применено иначе, чем конкретно описано.
Реферат
Изобретение относится к области ветеринарии. Способ включает стадию введения пищевой композиции, которая содержит один или несколько антиоксидантов, выбранных из группы: витамин Е, витамин С, липоевая кислота, L-карнитин, бета-каротин, селен, лютеин, токотриенол(ы), коэнзим Q10, S-аденозилметионин, таурин, изофлавон(ы) сои, N-ацетилцистеин, глютатион, которые вводят в определенных количествах. Изобретение обеспечивает уменьшение и снижение оксидативного стресса у стареющего животного-компаньона, уменьшение одного или нескольких симптомов старения. 5 н. и 5 з.п. ф-лы, 23 табл., 5 ил.
Формула
стадию введения пищевой композиции, предназначенной для животного, указанному животному, где указанная композиция содержит один или несколько антиоксидантов, выбранных из группы, состоящей из: витамина Е, витамина С, L-карнитина и липоевой кислоты, астаксантина, бета-каротина, L-карнитина, коэнзима Q10, глютатиона, лютеина, ликопена, селена, N-ацетилцистеина, изофлавона(ов) сои, S-аденозилметионина, таурина, токотриенола(ов), выжимки шпината, выжимки помидор, мякоти цитрусовых, выжимки грейпфрута, гранул моркови, брокколи, зеленого чая, кукурузной, глютеновой муки, рисовых отрубей, водорослей, куркумина, селена и их смесей, и где один или несколько антиоксидантов присутствуют в указанной пищевой композиции, предназначенной для животного, в количестве, эффективном для лечения или профилактики ухудшения когнитивной или физической активности у указанного животного-компаньона.
введения пищевой композиции, предназначенной для животного, указанному животному, где указанная композиция содержит один или несколько антиоксидантов, выбранных из группы, состоящей из: витамина Е, витамина С, L-карнитина и липоевой кислоты, астаксантина, бета-каротина, L-карнитина, коэнзима Q10, глютатиона, лютеина, ликопена, селена, N-ацетилцистеина, изофлавона(ов) сои, S-аденозилметионина, таурина, токотриенола(ов), выжимки шпината, выжимки помидор, мякоти цитрусовых, выжимки грейпфрута, гранул моркови, брокколи, зеленого чая, кукурузной, глютеновой муки, рисовых отрубей, водорослей, куркумина, селена и их смесей, и где указанную композиция вводят указанному животному в количестве, подходящем для лечения или профилактики ухудшения когнитивной или физической активности.

Комментарии