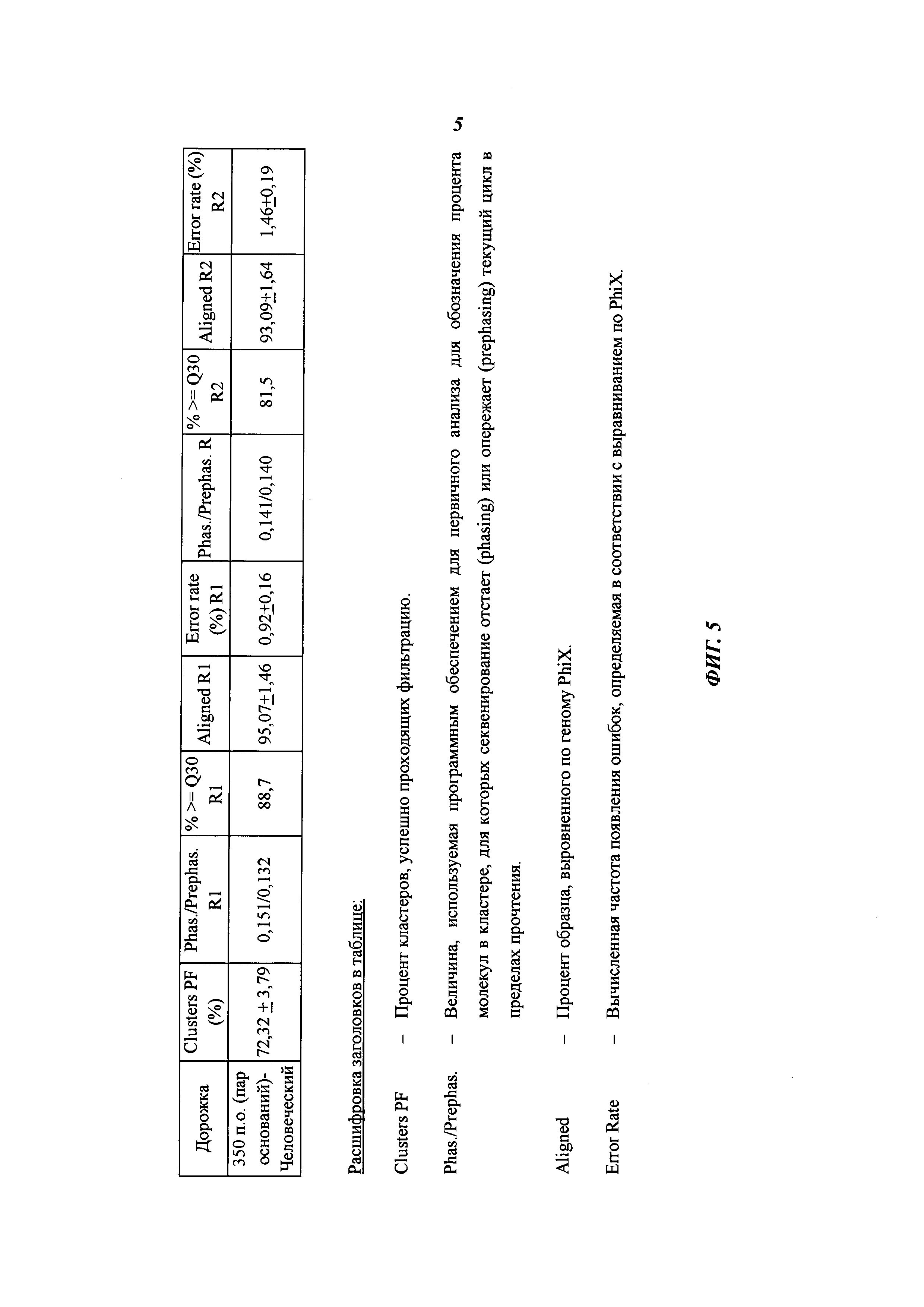
Полиметиновые соединения и их применение в качестве флуоресцентных меток - RU2696562C1
Код документа: RU2696562C1
Чертежи


Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым полиметиновым соединениям и их применению в качестве флуоресцентных маркеров. В частности, такие соединения могут быть применены в качестве флуоресцентных меток для нуклеотидов, применяемых при секвенировании нуклеиновых кислот.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Для более полного описания уровня той области техники, к которой относится настоящее изобретение, в настоящей работе упомянуты некоторые публикации и патентные документы. Содержание каждой из этих публикаций и каждого из документов включено в настоящую работу посредством ссылки.
Обнаружение нуклеиновых кислот не с помощью радиоактивных средств, а с применением флуоресцентных меток, является важной методикой, применяемой в молекулярной биологии. Многие из процедур, применяемых ранее при исследованиях рекомбинантных ДНК, основывались, главным образом, на применении нуклеотидов или полинуклеотидов, меченных радиоактивными метками, например,32Р. Радиоактивные соединения позволяют проводить высокочувствительное обнаружение нуклеиновых кислот и других молекул, представляющих интерес. Однако применение радиоактивных изотопов имеет серьезные недостатки, включающие их высокую стоимость, ограниченный срок годности и, что более важно, их небезопасность. Устранение необходимости применения радиоактивных меток повышает безопасность, одновременно уменьшая степень воздействия на окружающую среду и связанные с этим воздействием затраты, например, необходимые для утилизации реагентов. Неограничивающие примеры способов, подходящих для нерадиоактивного флуоресцентного обнаружения, включают автоматизированное секвенирование ДНК, способы гибридизации, обнаружение продуктов полимеразной цепной реакции в режиме реального времени и иммунологический анализ.
Во многих областях для независимого обнаружения совокупности пространственно перекрывающихся анализируемых веществ (аналитов) желательно применение множества спектрально различаемых флуоресцентных меток. В таких мультиплексных способах может быть уменьшено количество реакционных емкостей, упрощены протоколы экспериментов и упрощено изготовление наборов реагентов, подходящих для конкретного применения. Например, при многоцветном автоматизированном секвенировании ДНК мультиплексное флуоресцентное обнаружение позволяет проводить анализ множества нуклеотидных оснований на одной дорожке для электрофореза, позволяя достичь большей производительности, чем в способах с использованием единственного цвета, и уменьшить неточности, связанные с вариациями электрофоретической подвижности между дорожками.
Однако при мультиплексном флуоресцентном обнаружении могут возникнуть затруднения, поскольку существует ряд важных факторов, которые ограничивают выбор флуоресцентных меток. Во-первых, могут возникнуть проблемы при подборе красителя, эмиссионные спектры которого подходили бы для спектрального разрешения в заданной области применения. Кроме того, при одновременном применении нескольких флуоресцентных красителей генерация сигналов флуоресценции в распознаваемых спектральных областях способом одновременного возбуждения может быть проблематичной, поскольку полосы поглощения красителей, которые могут быть использованы для этой цели, обычно сильно разнесены, и, таким образом, даже для двух красителей достижение более или менее одинаковой эффективности возбуждения флуоресценции проблематично. При выполнении многих способов для возбуждения применяют высокомощные источники света, такие как лазеры, и, таким образом, краситель должен иметь достаточную фотостабильность (светоустойчивость), чтобы выдерживать такое возбуждение. Наконец, особенно важной для осуществления способов молекулярной биологии является степень совместимости с применяемыми реагентами, которую должны иметь флуоресцентные красители, например, совместимости с растворителями и реагентами, буферами, ферментами полимеразой и лигазой, применяемыми в синтезе ДНК.
По мере развития методик секвенирования возникает необходимость создания новых флуоресцентных красителей, их конъюгатов с нуклеиновыми кислотами, а также наборов красителей, которые позволяют устранить все перечисленные выше недостатки и которые, в частности, подходят для высокопроизводительных молекулярных способов, таких как твердофазное секвенирование и подобные способы.
Применение молекул флуоресцентных красителей, имеющих улучшенные флуоресцентные свойства, такие как интенсивность флуоресценции, форма и длина волны максимума полосы флуоресценции, может повысить скорость и точность секвенирования нуклеиновых кислот. Высокая величина сигнала флуоресценции особенно важна при проведении измерений в водных биологических буферных растворах и при повышенных температурах, поскольку интенсивность флуоресценции большинства красителей в таких условиях существенно понижается. Кроме того, на максимум флуоресценции, интенсивность флуоресценции и другие спектральные свойства красителя также влияет природа основания, к которому присоединен краситель. Последовательность-специфичные взаимодействия между нуклеотидными основаниями и флуоресцентными красителями могут быть запрограммированы путем целенаправленного конструирования флуоресцентных красителей. Оптимизация структуры флуоресцентных красителей может повысить эффективность встраивания нуклеотида, понизить частоту ошибок секвенирования и снизить расход реагентов и, таким образом, стоимость секвенирования нуклеиновых кислот.
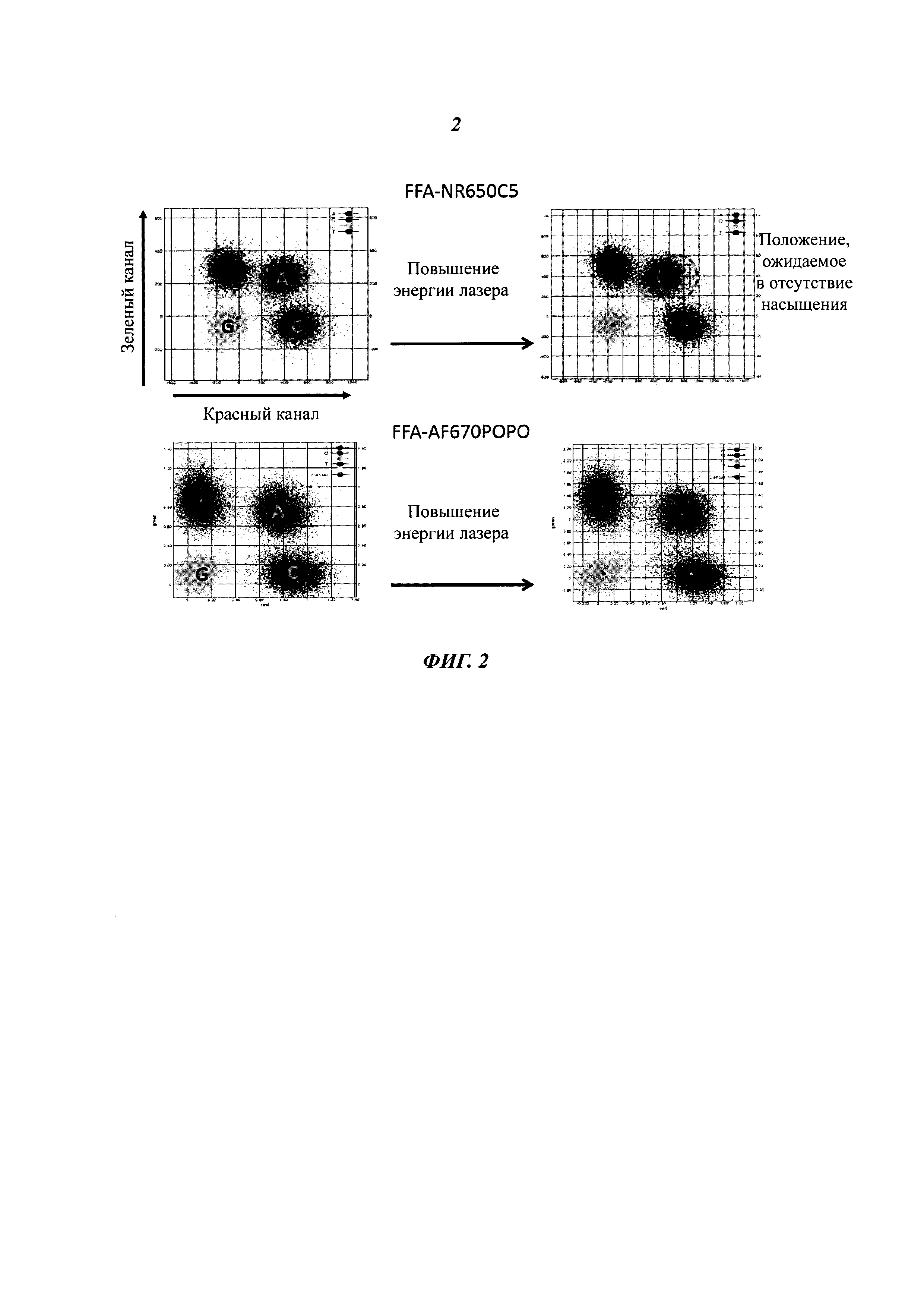
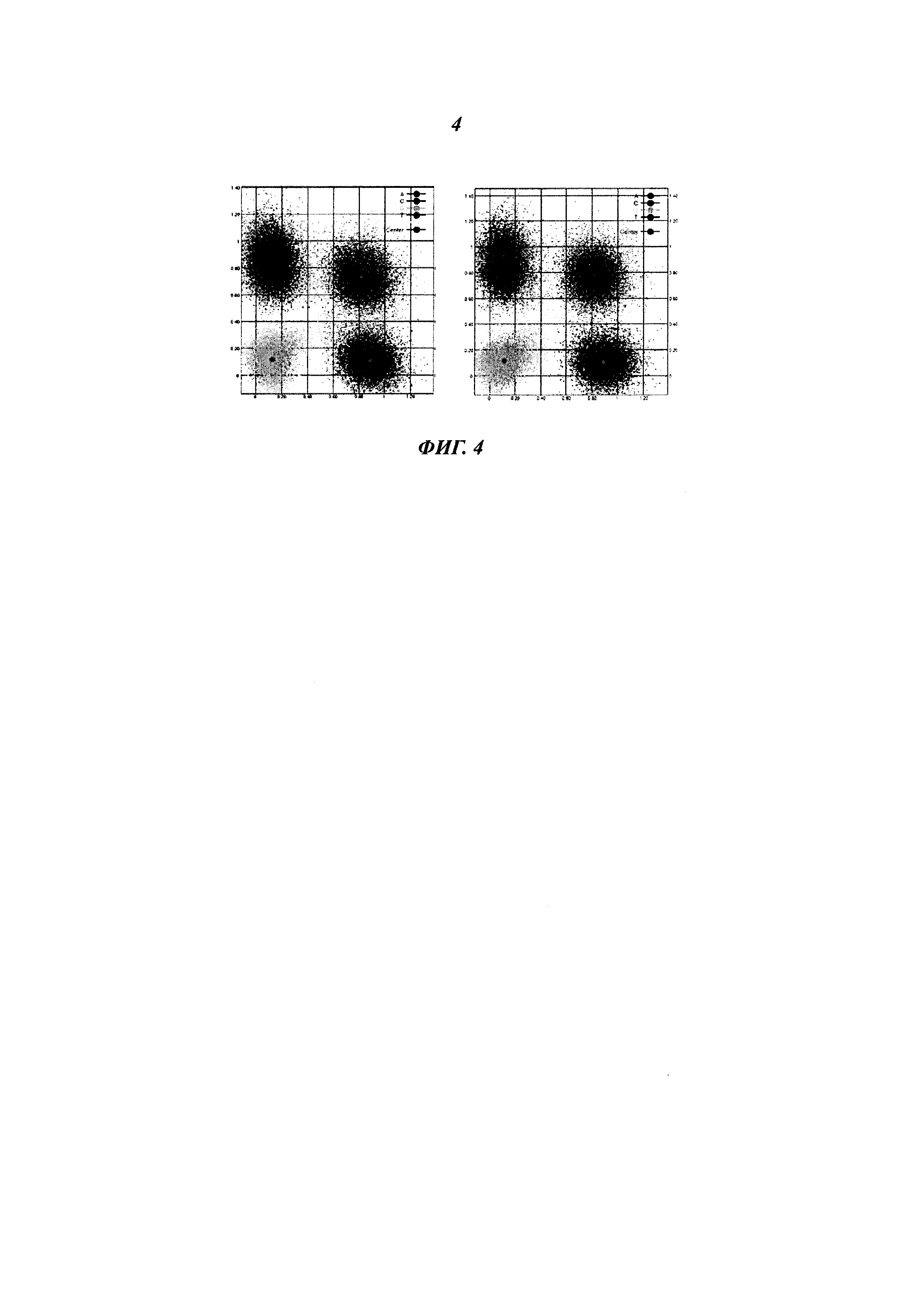
В настоящей работе рассмотрены улучшенные полиметиновые конструкции и их применение в качестве меток биологических молекул, в частности, в качестве меток нуклеотидов, используемых в секвенировании нуклеиновых кислот. Особенно можно отметить улучшения эффективности встраивания меченых нуклеотидов, а также увеличение длины и точности прочтений секвенирования, получаемых с помощью новых флуоресцентных конструкций. Использование молекул, рассмотренных ниже, особенно полезно в тех случаях, когда применяют источники возбуждения с высокой энергией. Возбуждение с высокой энергией может приводить к такой величине насыщения энергией, при которой увеличение количества фотонов, испускаемых метками, при увеличении энергии возбуждения перестает быть линейным. Насыщение энергией может быть вызвано эффектами молекулярного гашения, обусловленными структурой меток, или может быть вызвано метками, продолжительность флуоресценции которых превышает требуемое значение, то есть метки пребывают в возбужденном состоянии больше времени, чем требуется, и лишь затем испускают фотон. Если параллельно применяют множество различных меток, то наличие одной метки, которая достигает насыщения энергией, в то время как яркость других меток продолжает увеличиваться, затрудняет дифференциацию меток. Особенным преимуществом меток, рассмотренных в настоящей работе, является достижение насыщения энергией при более высоком уровне, чем у соответствующих применяемых для мечения соединений предшествующего уровня техники.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Первый аспект настоящего изобретения относится к соединениям, имеющим формулу (I) или ее мезомерную форму:
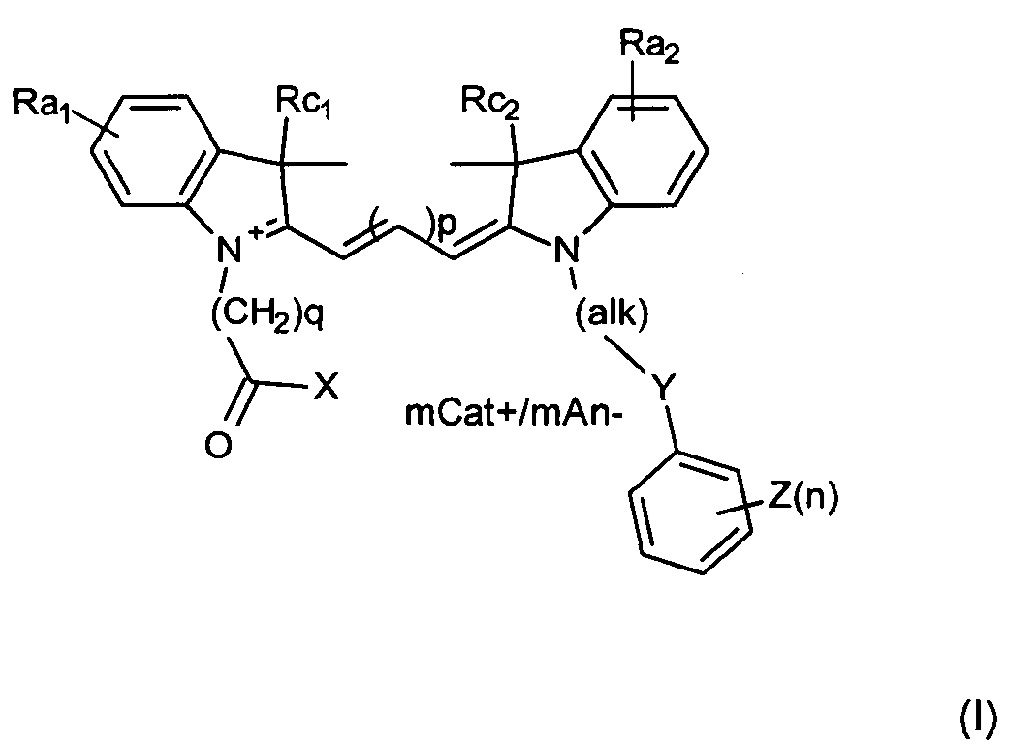
где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода;
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил.
р может быть равен единице; в этом случае соединения имеют формулу (Ia) или ее мезомерные формы:

где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода;
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил.
р может быть равен двум; в этом случае соединения имеют формулу (Ib) или ее мезомерные формы:

где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода;
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил.
В некоторых примерах, в которых Ra1 или Ra2 представляет собой Н, либо Rc1, либо Rc2 может представлять собой группу алкилсульфоновой кислоты. Соединения должны содержать один или более заместителей, содержащих группу сульфоновой кислоты, так что по меньшей мере один из Ra1 или Ra2 представляет собой SO3-, или Ra1 или Ra2 представляет собой дополнительный цикл, сконденсированный с соседним атомом углерода, где дополнительный цикл содержит SO3-, или Rc1 или Rc2 представляет собой группу алкилсульфоновой кислоты.
В некоторых примерах, в которых р равен 2, Rc1 или Rc2 представляет собой группу алкилсульфоновой кислоты.
В некоторых примерах r равен 3.
В некоторых примерах n составляет 1. ОН-группа может находиться в положении 4 цикла. В некоторых примерах n составляет 0, и фенильный цикл не имеет заместителей. В некоторых примерах, в которых n составляет 0, Y представляет собой S или О (но не СН2).
В другом примере осуществления соединения согласно настоящему изобретению могут быть конъюгированы с различными элементами подложки, такими как, например, нуклеозиды, нуклеотиды, полинуклеотиды, полипептиды, углеводы, лиганды, частицы, клетки, полутвердые поверхности (например, гели) и твердые поверхности. Конъюгирование (соединение) может осуществляться через карбоксильную группу С(=O)-Х, которая может быть превращена в амид или сложный эфир.
Таким образом, другой аспект изобретения относится к соединениям, представляющим собой красители, которые включают линкерные группы, позволяющие, например, образовывать ковалентное соединение с такими элементами подложки.
Другой аспект изобретения относится к нуклеозидному или нуклеотидному соединению, определяемому формулой: N-L-Краситель, где N представляет собой нуклеотид, L представляет собой необязательный линкерный фрагмент, и Краситель представляет собой флуоресцентное соединение согласно настоящему изобретению.
Другой аспект изобретения относится к способам секвенирования с применением красителей согласно настоящему изобретению.
Другой аспект изобретения также относится к наборам, включающим красители (в свободной форме или в виде конъюгата), которые могут быть применены в различных иммунологических исследованиях, для мечения олигонуклеотидов и нуклеиновых кислот и для секвенирования ДНК синтезом. Еще один аспект изобретения относится к наборам, включающим "комплекты" красителей, особенно подходящих для проведения циклов секвенирования синтезом на автоматизированной аппаратной платформе.
Дополнительный аспект изобретения относится к химическому синтезу соединений согласно изобретению.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям, особенно подходящим для применения в способах флуоресцентного обнаружения и секвенирования синтезом. Соединения, включающие фрагмент индол-N-фенил, имеют улучшенную интенсивность флуоресценции и фотостабильность по сравнению с N-алкильными аналогами, и, таким образом, их применение позволяет усовершенствовать некоторые варианты применения секвенирования нуклеиновых кислот.
Первый аспект изобретения относится к соединениям, имеющим формулу (I) или ее мезомерные формы:

где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода;
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил.
Изобретение относится к соединению, имеющему формулу (I) или ее мезомерные формы:
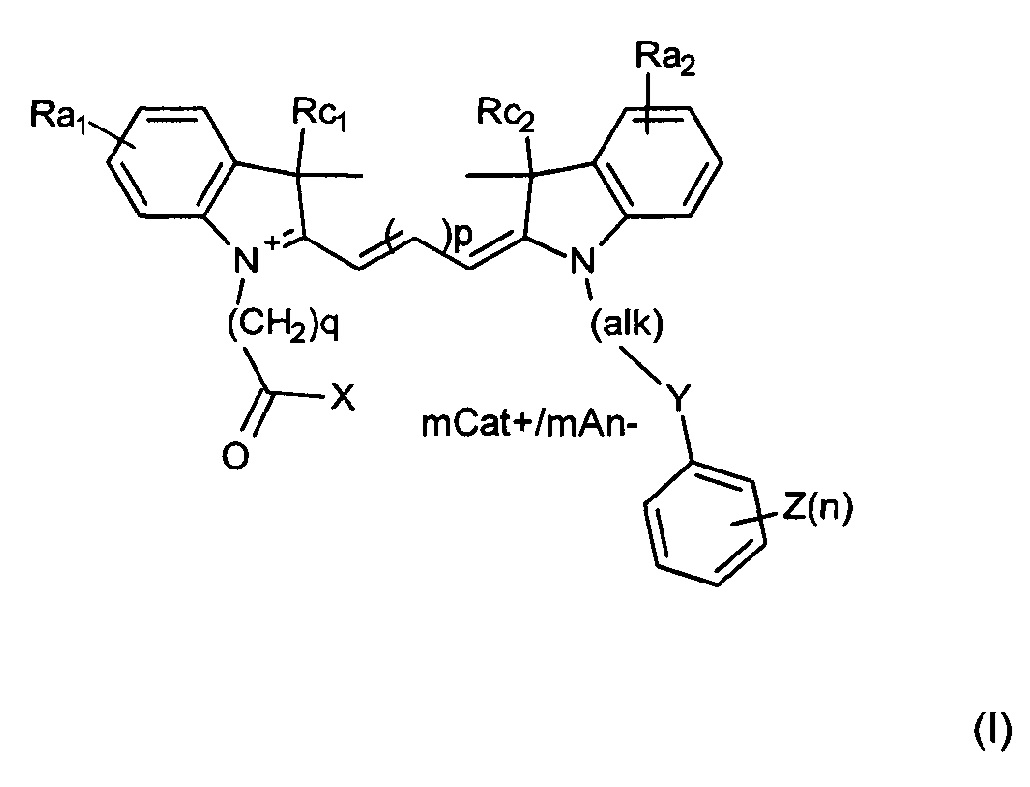
где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода; и
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил, причем по меньшей мере один из Ra1 или Ra2 представляет собой SO3-, или Ra1 или Ra2 представляет собой дополнительный цикл, сконденсированный с соседним атомом углерода, где дополнительный цикл содержит SO3-, или Rc1 или Rc2 представляет собой группу алкилсульфоновой кислоты.
Изобретение относится к соединению, имеющему формулу (I) или ее мезомерные формы:

где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода; и
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил, причем если n составляет 0, то Y представляет собой S или О.
Изобретение относится к соединению, имеющему формулу (I) или ее мезомерные формы:
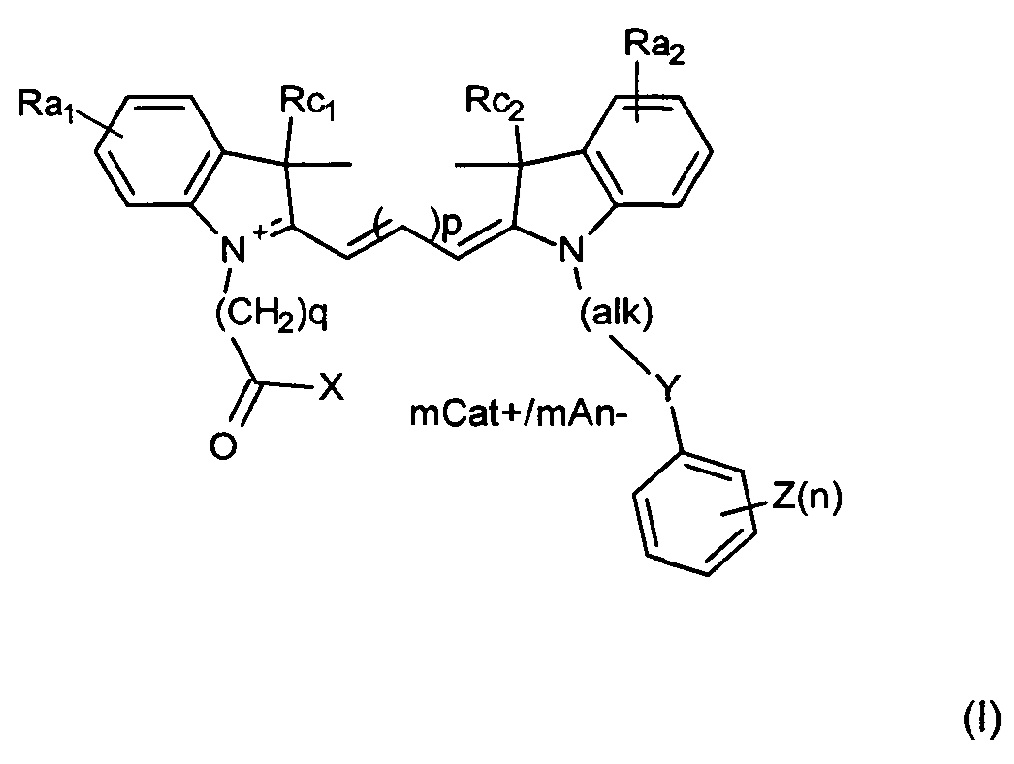
где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода; и
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил, причем по меньшей мере один из Ra1 или Ra2 представляет собой SO3-, или Ra1 или Ra2 представляет собой дополнительный цикл, сконденсированный с соседним атомом углерода, где дополнительный цикл содержит SO3-, или Rc1 или Rc2 представляет собой группу алкилсульфоновой кислоты, и причем если n составляет 0, то Y представляет собой S или О.
Молекулы могут содержать один или более сульфонамидных или SO3- фрагментов в положении Ra. Ra1 и/или Ra2 может представлять собой SO3- или сульфонамид. Другой Ra (Ra1 или Ra2) независимо может представлять собой Н, SO3-, сульфонамид, галоген или дополнительный цикл, сконденсированный с соседним атомом углерода. Ra1 или Ra2 может представлять собой Н. Ra1 или Ra2 может представлять собой SO3-. Ra1 может отличаться от Ra2, например, структура может содержать одну сульфонамидную группу у Ra1, и Н в качестве Ra2. Как Ra1, так и Ra2 могут представлять собой сульфонамидные группы. Сульфонамидная группа может представлять собой SO2NH2 или SO2NHR, где R представляет собой алкильную, замещенную алкильную, арильную или замещенную арильную группу. Если ни Ra1, ни Ra2 не представляют собой SO3- или дополнительный цикл, сконденсированный с соседним атомом углерода, то Rc1 или Rc2 должен представлять собой группу алкилсульфоновой кислоты.
Ra1 или Ra2 могут представлять собой дополнительный алифатический, ароматический или гетероциклический цикл, сконденсированный с соседними атомами углерода индольного цикла. Например, в тех случаях, в которых ароматический цикл представляет собой сконденсированный цикл, концевая группа красителя может быть представлена структурой следующего типа:

где Rd может представлять собой Н, алкил, замещенный алкил, арил, замещенный арил, галоген, карбоксигруппу, сульфонамидную группу или группу сульфоновой кислоты.
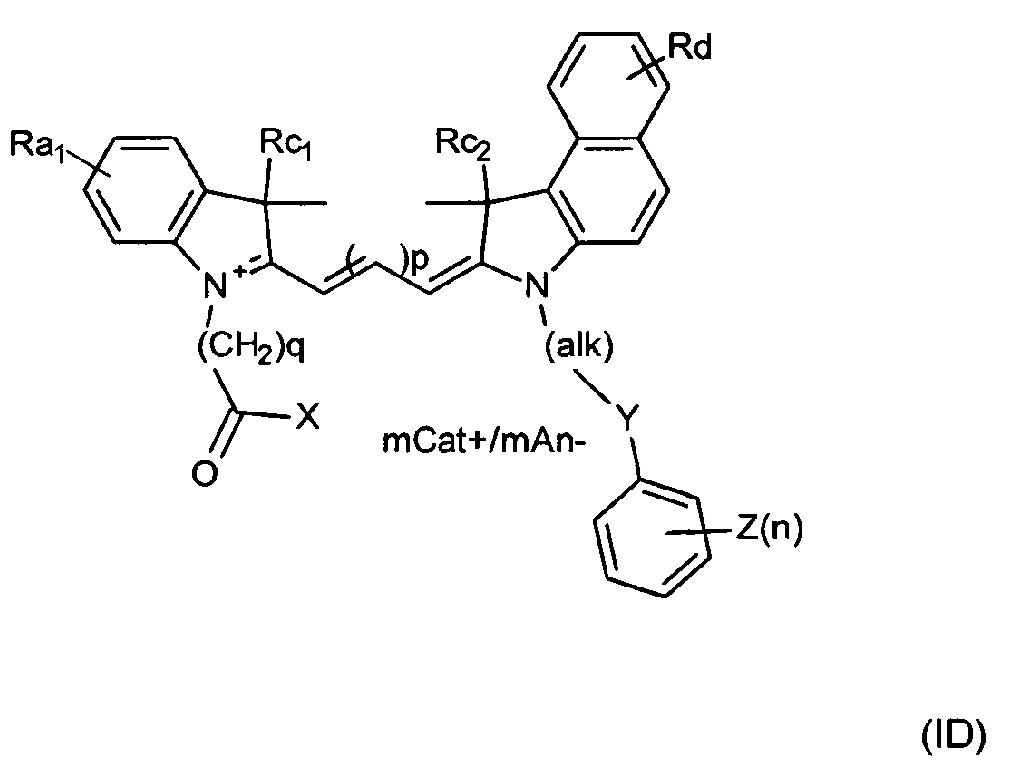
Таким образом, красители согласно изобретению могут быть описаны Формулой (IC) или (ID) или ее мезомерными формами:
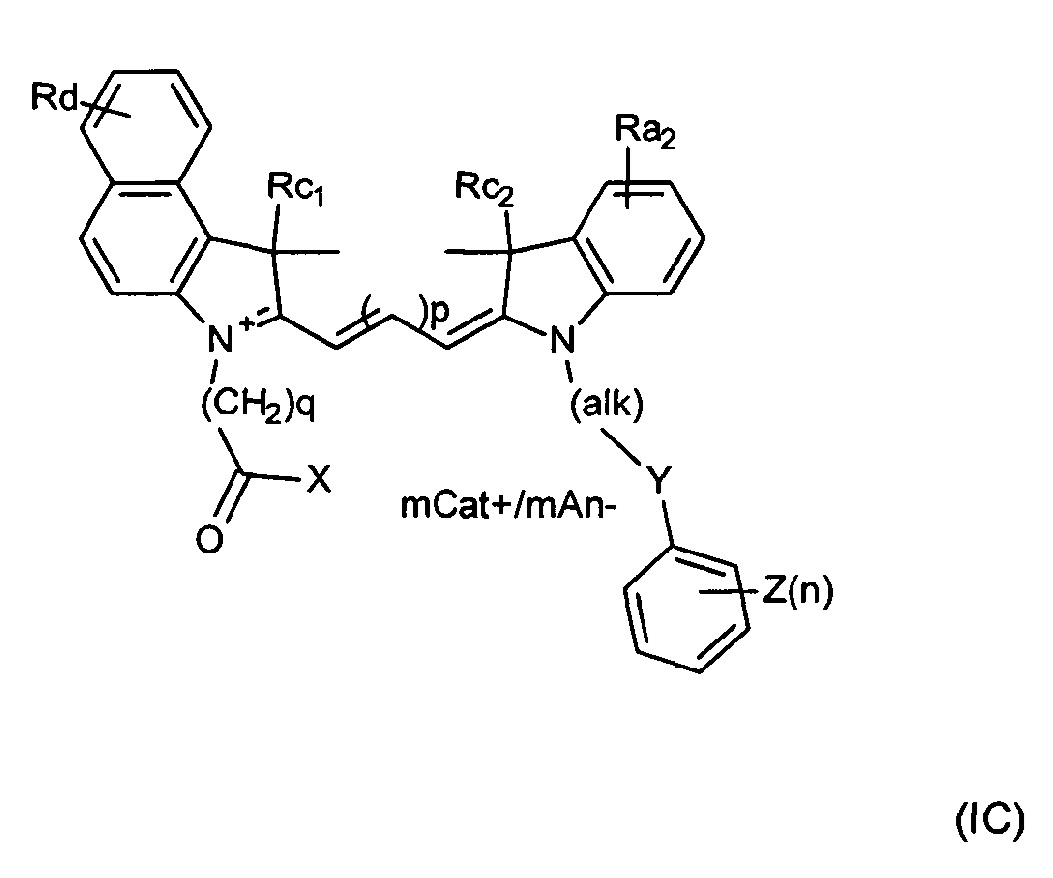

где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода;
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил; и
Rd представляет собой Н, алкил, замещенный алкил, арил, замещенный арил, галоген, карбоксигруппу, сульфонамидную группу или группу сульфоновой кислоты.
Таким образом, красители согласно изобретению могут быть описаны Формулой (IC) или (ID) или ее мезомерными формами:

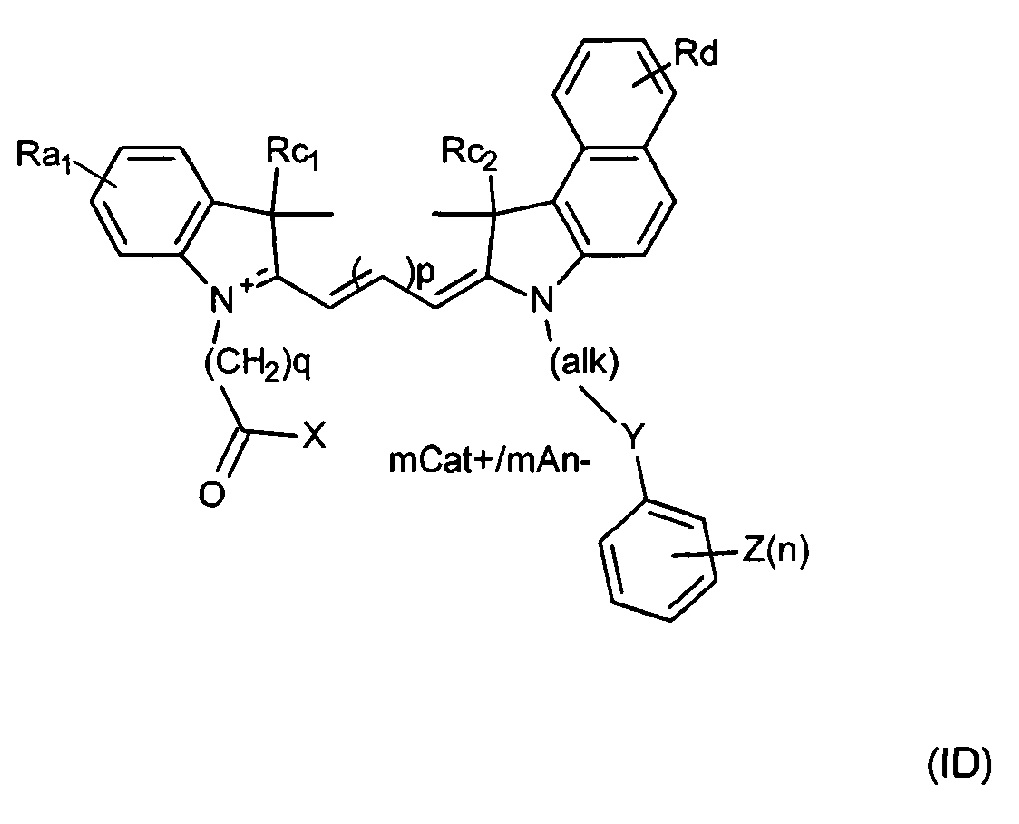
где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода;
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил; и
Rd представляет собой Н, алкил, замещенный алкил, арил, замещенный арил, галоген, карбоксигруппу, сульфонамидную группу или группу сульфоновой кислоты, причем по меньшей мере один из Ra1 или Ra2 представляет собой SO3-, или Rd представляет собой SO3-, или Rc1 или Rc2 представляет собой группу алкилсульфоновой кислоты.
Таким образом, красители согласно изобретению могут быть описаны Формулой (IC) или (ID) или ее мезомерными формами:


где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода;
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил; и
Rd представляет собой Н, алкил, замещенный алкил, арил, замещенный арил, галоген, карбоксигруппу, сульфонамидную группу или группу сульфоновой кислоты, причем если n составляет 0, то Y представляет собой S или О.
Таким образом, красители согласно изобретению могут быть описаны Формулой (IC) или (ID) или ее мезомерными формами:

где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода;
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил; и
Rd представляет собой Н, алкил, замещенный алкил, арил, замещенный арил, галоген, карбоксигруппу, сульфонамидную группу или группу сульфоновой кислоты, причем по меньшей мере один из Ra1 или Ra2 представляет собой SO3-, или Rd представляет собой SO3-, или Rc1 или Rc2 представляет собой группу алкилсульфоновой кислоты, причем если n составляет 0, то Y представляет собой S или О.
В формуле (IC) или (ID) дополнительные циклы, сконденсированные с соседними атомами углерода индольного цикла, могут быть необязательно замещены, например, сульфоновой кислотой или сульфонамидом.
Карбоксигруппа С(=O)-Х или ее производные присоединена к атому азота индола через алкильную цепочку, длина которой составляет q, где q составляет от 1 до 5 атомов углерода или гетероатомов. Цепочка может представлять собой (CH2)q, где q составляет от 1 до 5. Группа может представлять собой (СН2)5СООН.
Молекулы могут содержать один или более алкилсульфонатных фрагметов в положении Rc. Либо Rc1 и/или Rc2 может представлять собой алкил-SO3-. Другой Rc (Rc1 или Rc2) независимо может представлять собой алкил или замещенный алкил. Rc1 и Rc2 независимо могут представлять собой метил, этил, пропил, бутил, пентил, гексил или (CH2)tSO3H, где t составляет от 1 до 6. t может составлять от 1 до 4. t может составлять 4. Rc1 и Rc2 могут представлять собой замещенную алкильную группу. Rc1 и Rc2 могут содержать фрагмент СООН или фрагмент -SO3H или их сложноэфирные или амидные производные.
В некоторых примерах осуществления, если один из Ra1 или Ra2 представляет собой SO3-, и оставшийся Ra1 или Ra2 представляет собой Н или SO3-, либо Rc1, либо Rc2 также может представлять собой группу алкилсульфоновой кислоты.
Группа СООН, представленная как С(=O)-Х, может служить линкерным фрагментом для дополнительного присоединения, или она присоединена к другой молекуле. После проведения конъюгирования группу СООН или СОО- превращают в амид или сложный эфир.
Примеры соединений включают структуры, соответствующие формуле (II) или (IIa) или ее мезомерным формам:

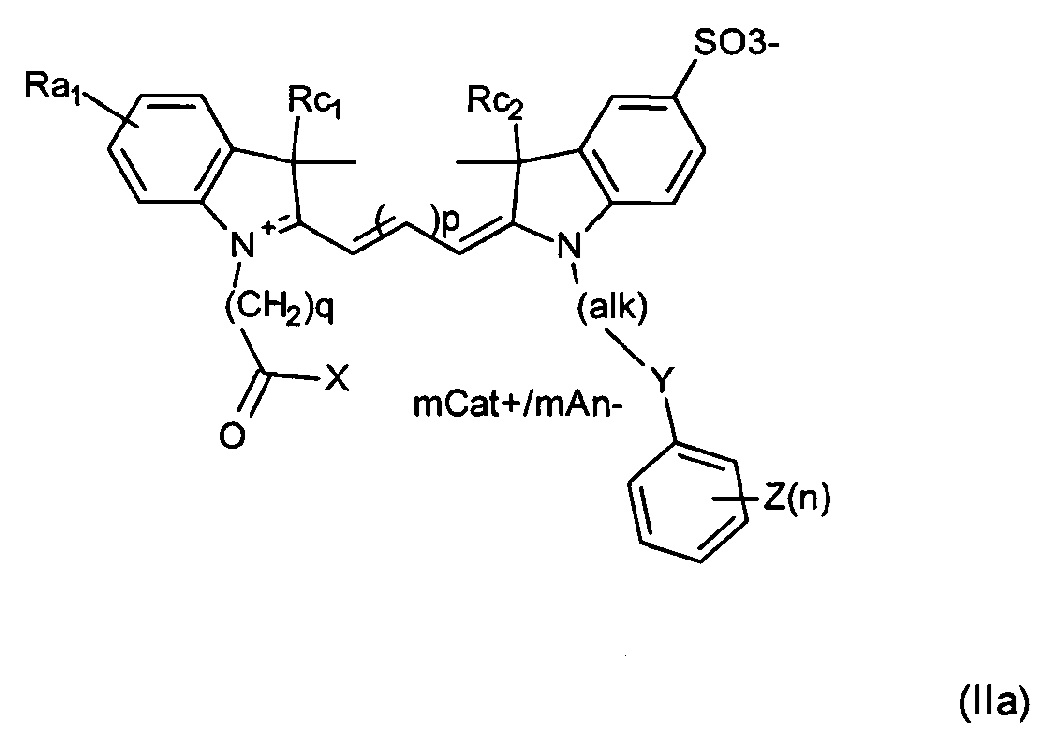
где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода; и
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил.
Примеры соединений включают структуры, соответствующие формуле (II) или (IIa) или ее мезомерным формам:
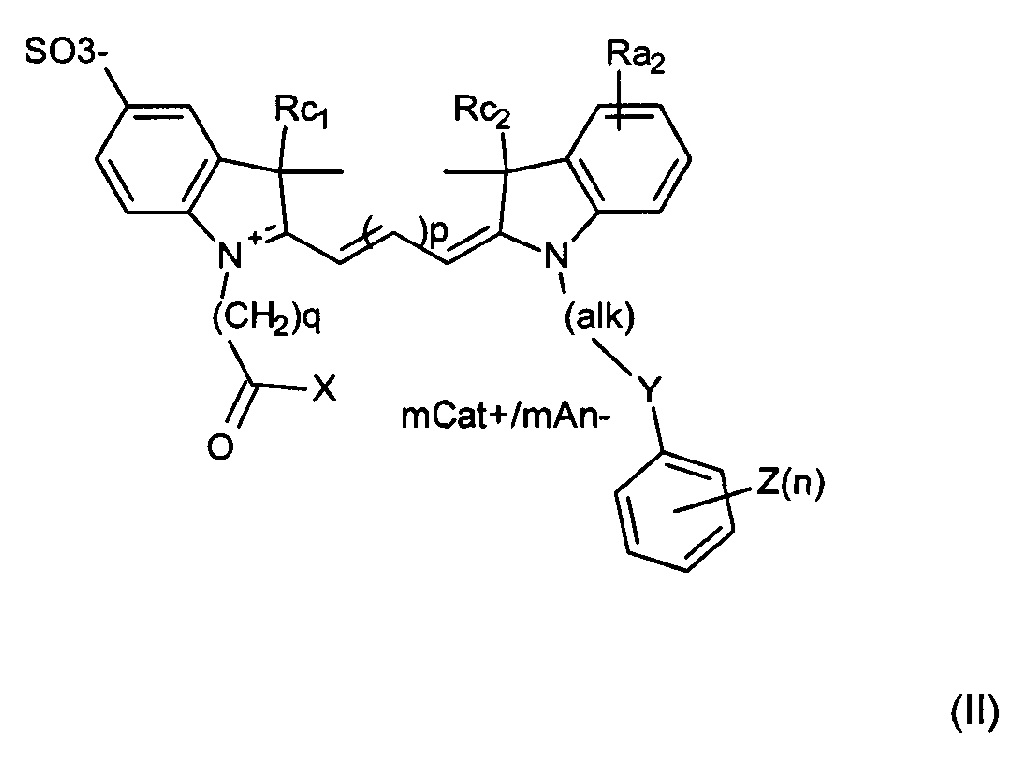
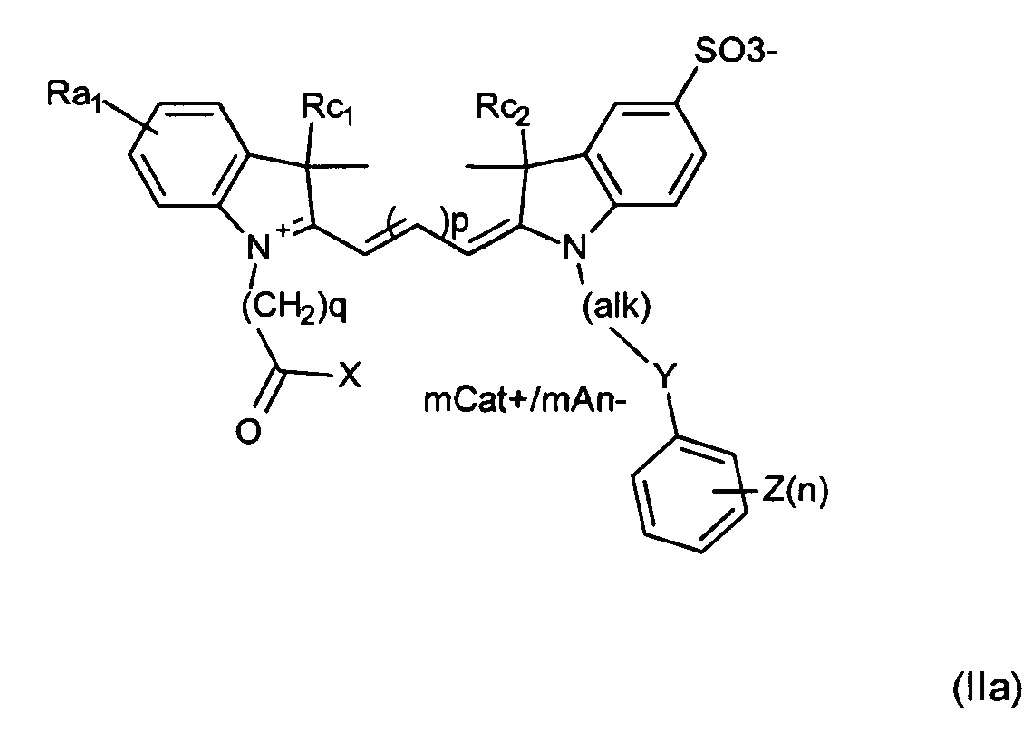
где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода; и
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил, причем если n составляет 0, то Y представляет собой S или О.
Другие примеры соединений включают структуры, соответствующие формуле (IIIa) или (IIIb):

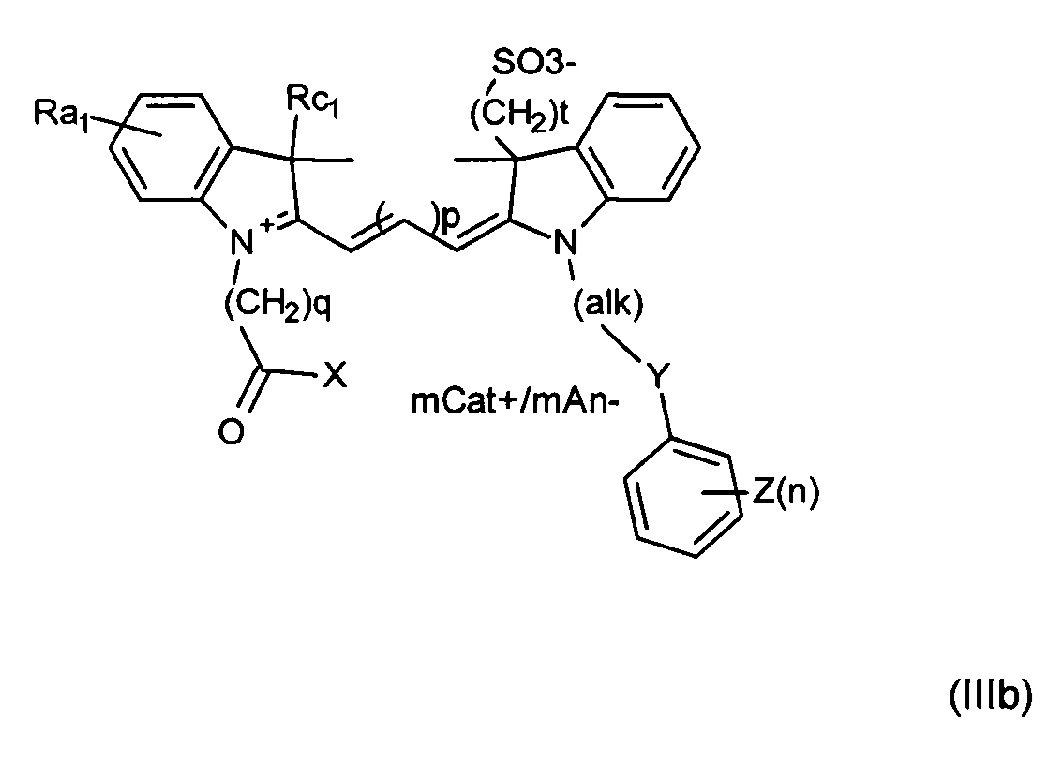
где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
t представляет собой целое число, составляющее от 1 до 6;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода; и
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил.
Другие примеры соединений включают структуры, соответствующие формуле (IIIa) или (IIIb):


где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
р представляет собой целое число, составляющее от 1 до 2;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
t представляет собой целое число, составляющее от 1 до 6;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода; и
каждый из Rc1 и Rc2 независимо представляет собой алкил или замещенный алкил, причем если n составляет 0, то Y представляет собой S или О.
Другие примеры соединений включают структуры, соответствующие формулам (IVa)-(IVd):
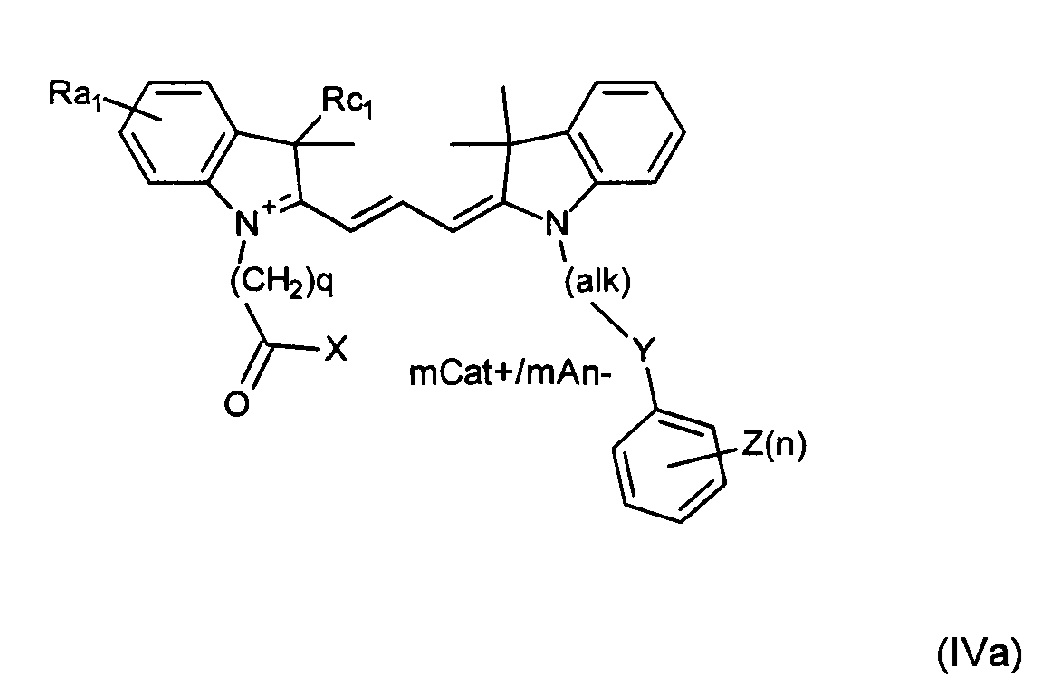
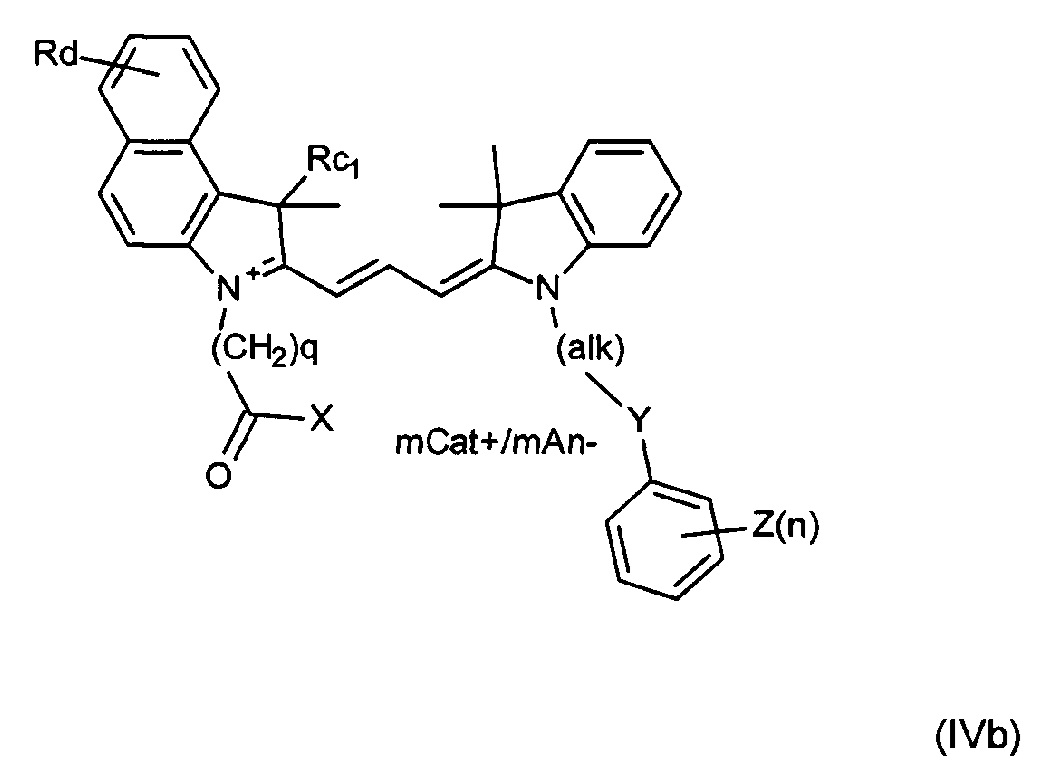


где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3;
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром;
Ra1 представляет собой Н, SO3-, сульфонамид, галоген, или дополнительный цикл, сконденсированный с соседним атомом углерода;
Rc1 представляет собой алкил или замещенный алкил; и
Rd представляет собой Н, алкил, замещенный алкил, арил, замещенный арил, галоген, карбоксигруппу, сульфонамидную группу или группу сульфоновой кислоты.
Другие примеры соединений включают структуры, соответствующие формулам (Va)-(Vd):
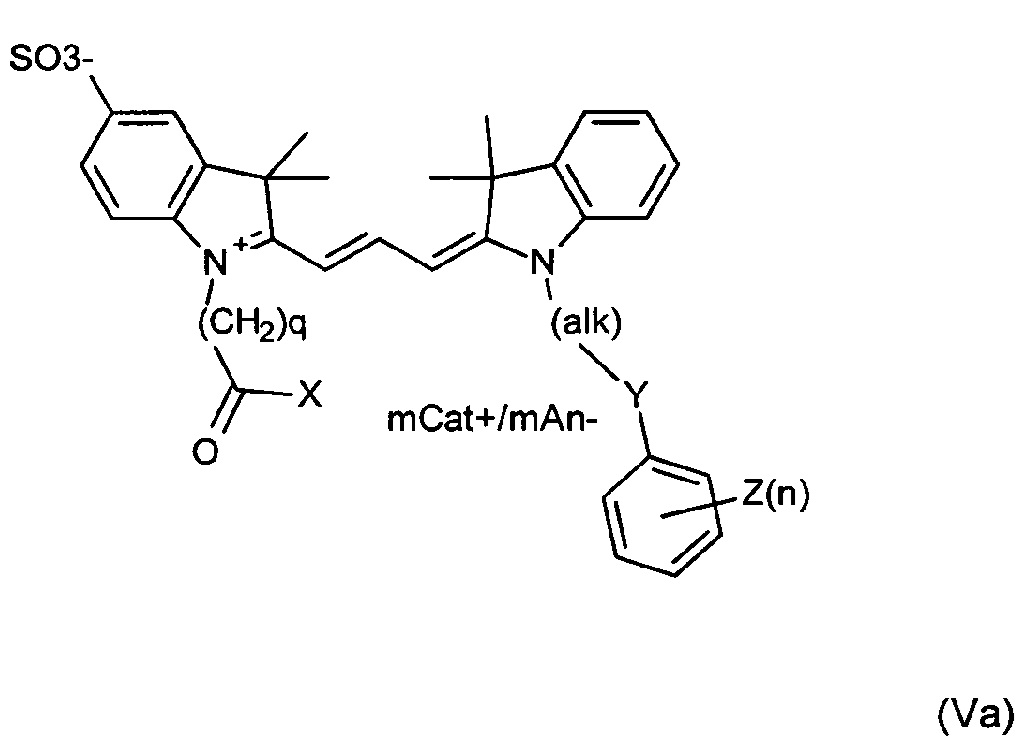



где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3; и
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром.
Другие примеры соединений включают структуры, соответствующие формулам (VIa)-(VId):




где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
q представляет собой целое число, составляющее от 1 до 5;
alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей;
t представляет собой целое число, составляющее от 1 до 6;
Y представляет собой S, О или СН2;
Z представляет собой ОН;
n представляет собой целое число, составляющее от 0 до 3; и
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром.
alk представляет собой алкильную, алкенильную или алкинильную цепочку, содержащую от 1 до 5 атомов углерода, необязательно содержащую одну или более двойных или тройных связей. Alk может представлять собой группу (СН2)r, где r составляет от 1 до 5. Alk может представлять собой (СН2)3. В альтернативном варианте углеродная цепочка может содержать одну или более двойных связей или тройных связей. Цепочка может содержать связующую структуру -СН2-СН=СН-СН2-, необязательно с дополнительными СН2 группами. Цепочка может содержать связующую структуру -СН2-С≡С-СН2-, необязательно с дополнительными СН2 группами.
В любом из примеров, описываемых формулами VII-VIII, r может быть равен 3.
В любом из примеров, описываемых формулами I-VIII, q может быть равен 5.
В любом из примеров, описываемых формулой III, формулой VI или формулой VII, t может быть равен 4.
В любом из примеров, описываемых формулами I-VI, n может быть равен числу, составляющему от 1 до 3. В любом из примеров, описываемых формулами I-VI, n может быть равен 1. В любом из примеров, описываемых формулами I-VI, n может быть равен целому числу, составляющему от 0 до 1. Если n составляет 1, то ОН-группа может находиться в цикле в любом положении. ОН-группа может находиться в положении 4. Если n составляет 2 или 3, то ОН группы могут находиться в фенильном цикле в любых положениях.
В любом из примеров, описываемых формулами I-VI, если n равен нулю, то Y может представлять собой О или S, но не СН2.
В любом из примеров, описываемых формулами I-VI, Y может представлять собой О.
В любом из примеров, описываемых формулами I-VI, Y может представлять собой О. Если Y представляет собой О, то n может составлять от 0 до 3. Если Y представляет собой СН2, то n может составлять от 1 до 3.
Другие примеры соединений включают структуры, соответствующие формулам (VIIa)-(VIId):




где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
q представляет собой целое число, составляющее от 1 до 5;
r представляет собой целое число, составляющее от 1 до 5;
t представляет собой целое число, составляющее от 1 до 6; и
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром.
Другие примеры соединений включают структуры, соответствующие формулам (VIIIa)-(VIIId):
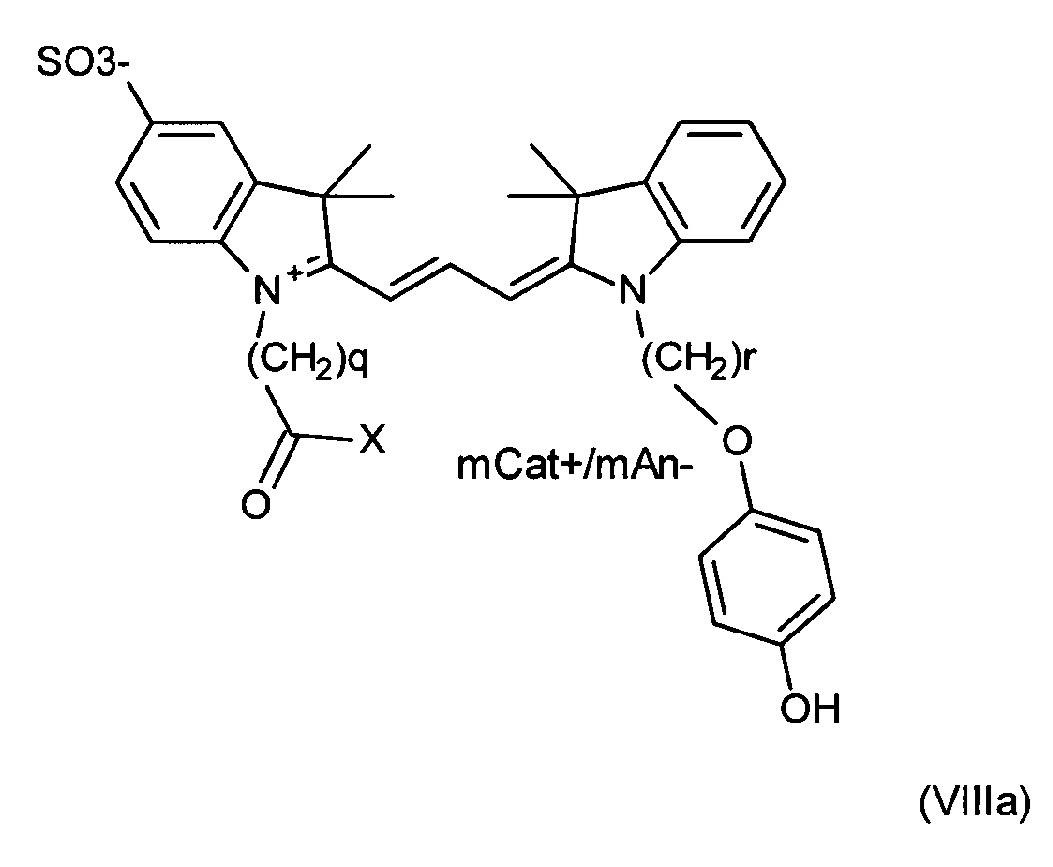


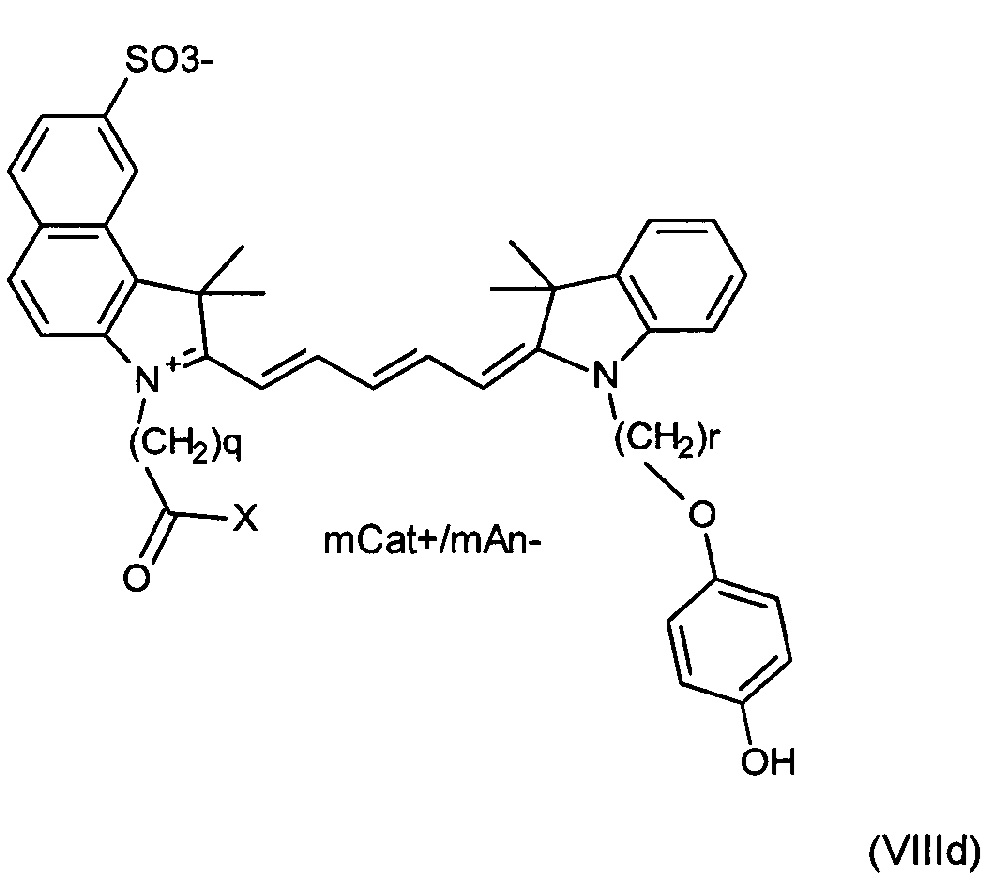
где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и
m представляет собой целое число, составляющее от 0 до 3;
q представляет собой целое число, составляющее от 1 до 5;
r представляет собой целое число, составляющее от 1 до 5; и
X представляет собой ОН или О- или его конъюгат с амидом или сложным эфиром.
Особенно подходящим соединением является нуклеотид или олигонуклеотид, меченный красителем, рассмотренным в настоящей работе.
Меченый нуклеотид или олигонуклеотид может иметь метку, присоединенную к атому азота индола через алкилкарбоксильную группу с образованием амида. Меченый нуклеотид или олигонуклеотид может иметь метку, присоединенную к С5-положению пиримидинового основания, или к С7-положению 7-деаза-пуринового основания через линкерный фрагмент.
Меченый нуклеотид или олигонуклеотид также может содержать блокирующую группу, ковалентно присоединенную к рибозному или дезоксирибозному сахару нуклеотида. Блокирующая группа может быть присоединена к любому положению рибозного или дезоксирибозного сахара. В конкретных примерах осуществления блокирующая группа находится в 3'-ОН положении рибозного или дезоксирибозного сахара нуклеотида.
Изобретение относится к наборам, включающим два или более нуклеотида, где по меньшей мере один нуклеотид представляет собой нуклеотид, меченный соединением согласно настоящему изобретению. Набор может включать два или более меченых нуклеотида. В нуклеотиды могут быть введены две или более флуоресцентные метки. Две или более метки могут быть возбуждены действием одного источника возбуждения, которым может быть лазер. Например, полосы возбуждения двух или более меток могут по меньшей мере частично перекрываться; в этом случае возбуждение в области спектра, соответствующей перекрыванию, приводит к испусканию флуоресцентного излучения обеими метками. В конкретных примерах осуществления испускание излучения двумя или более метками происходит в разных областях спектра таким образом, что присутствие по меньшей мере одной из меток может быть определено в соответствии с эмиссией, распознаваемой оптическими методиками.
Набор может содержать четыре меченых нуклеотида, где первый из четырех нуклеотидов имеет метку из соединения, рассмотренного в настоящей работе. В таком наборе каждый из вторых, третьих и четвертых нуклеотидов может иметь метку из названного соединения, которая необязательно отличается от метки, находящейся на первом нуклеотиде, и необязательно отличается от меток, находящихся на любом другом нуклеотиде. Таким образом, одно или более соединений могут иметь отчетливый максимум поглощения и/или максимум эмиссии, который позволяет отличать это соединение (соединения) от других соединений. Например, каждое соединение может иметь отчетливый максимум поглощения и/или максимум эмиссии, который позволяет отличать каждое из соединений от других трех соединений. Следует понимать, что другие области спектра поглощения и/или эмиссионного спектра, отличающиеся от областей, содержащих максимумы, могут различаться, и эти различия могут быть использованы для того, чтобы различать соединения. В наборе может быть два или более соединений, которые имеют отчетливый максимум поглощения при длине волны более 600 нм. Соединения согласно изобретению обычно поглощают свет в области с длиной волны более 640 нм.
Соединения, нуклеотиды или наборы согласно изобретению могут быть применены для обнаружения, измерения параметров или идентификации биологической системы (включая, например, протекающие в ней процессы или составляющие ее компоненты). Примеры методик, в которых могут быть применены соединения, нуклеотиды или наборы, включают секвенирование, анализ экспрессии, гибридизационный анализ, генетический анализ, анализ РНК, клеточный анализ (например, анализ клеточного связывания или клеточных функций) или анализ белка (например, анализ связывания белка или анализ активности белка). Применение может включать использование автоматического устройства для осуществления определенной методики, такого как устройство автоматического секвенирования. Устройство секвенирования может содержать два лазера, работающих на разных длинах волн.
В настоящей работе рассмотрен способ синтеза соединений согласно изобретению. Соединение, имеющее формулу (X) и/или (Х1), (Х2) (Х3) или (Х4), или его соль может быть применено в качестве исходного материала для синтеза симметричных или несимметричных полиметиновых красителей:
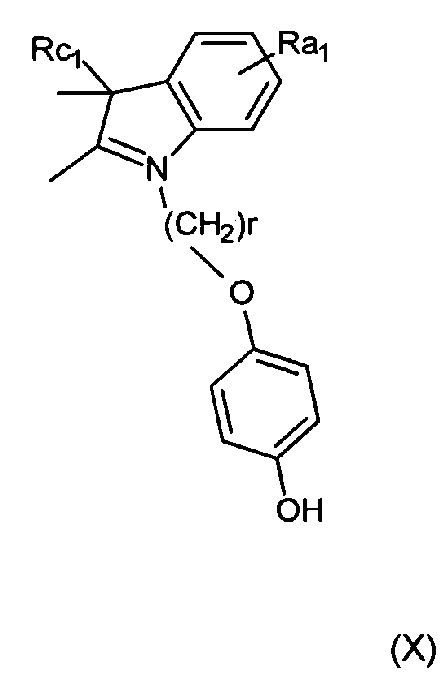


или соль такого соединения, где Ra1 представляет собой Н, SO3-, сульфонамид, галоген или дополнительный цикл, сконденсированный с соседним атомом углерода; Rc1 представляет собой алкил или замещенный алкил; Ar представляет собой ароматическую группу, и R представляет собой алкильную группу. В тех случаях, в которых показаны конкретные примеры с 4-гидроксифенилом, цикл также может быть замещен дополнительными гидроксильными группами, если n составляет более единицы, r может быть равен 3.
В настоящей работе рассмотрен способ синтеза соединений согласно изобретению. Соединение, имеющее формулу (Х5), или его соль может быть применено в качестве исходного материала для синтеза симметричных или несимметричных полиметиновых красителей:
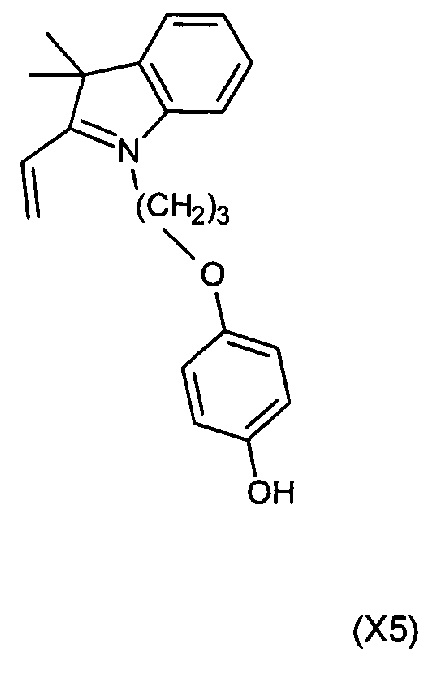
Употребляемый в настоящем описании термин "алкил" означает C1-C20-углеводород и может включать С3-С10 неароматические карбоциклические циклы. В конкретных примерах осуществления алкильные группы представляют собой C1-C6-алкилы, которые представляют собой насыщенные разветвленные или неразветвленные углеводородные радикалы, содержащие от одного до шести атомов углерода, соответственно. В определенных случаях алкильные группы могут включать одну или более ненасыщенных групп и, таким образом, включают алкенил и алкинил.
Употребляемый в настоящем описании термин "галоген" означает фтор (далее обозначаемый F), хлор (далее обозначаемый Cl), бром (далее обозначаемый Br) или йод (далее обозначаемый I) и обычно относится к замещению атома водорода в органическом соединении; это замещение необязательно представляет собой полное замещение водорода.
Термин "замещенный алкил" означает алкильную, алкенильную или алкинильную группы, определение которых приведено выше, которые необязательно могут быть дополнительно замещены заместителями, неограничивающие примеры которых включают галоген, цианогруппу, SO3-, SRa, ORa, NRbRc, оксо-группу, CONRbRc, СООН и COORb. Каждый из Ra, Rb и Rc может быть независимо выбран из Н, алкила, замещенного алкил, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила и замещенного арила. Дополнительно, такой замещенный алкил, замещенный алкенил и замещенный алкинил необязательно может содержать в своем составе по меньшей мере один гетероатом или гетерогруппу, выбранную из О, NRb, S(O)t, где t составляет от 0 до 2, и подобные группы. Замещенный алкил также включает такие группы, как бензил, в которых алкильные группы включают дополнительный арил или замещенный арильный фрагмент.
Красители согласно настоящему изобретению могут быть синтезированы из многих различных исходных материалов, включающих индолы, замещенные простым N-пропил-4-гидроксифениловым эфиром. Красители могут быть синтезированы симметричными, так чтобы на обоих концах полиметиновой цепочки располагались одинаковые индольные фрагменты, или несимметричными, так чтобы на каждом конце хромофора располагались различающиеся индольные фрагменты. Способы получения полиметиновых красителей хорошо известны в данной области техники.
Один из аспектов изобретения относится к окрашивающим соединениям, подходящим для присоединения к элементам подложки, в частности, включающим линкерные группы, которые позволяют присоединять их к элементам подложки. Элементы подложки могут буквально представлять собой любую молекулу или вещество, с которым могут быть конъюгированы красители согласно изобретению, и их неограничивающие примеры могут включать нуклеозиды, нуклеотиды, полинуклеотиды, углеводы, лиганды, частицы, твердые поверхности, органические и неорганические полимеры, хромосомы, ядра, живые клетки и комбинации или сообщества перечисленных элементов. Красители могут быть присоединены через необязательный линкер с помощью разнообразных средств, которые включают гидрофобное притяжение, ионное притяжение и ковалентное соединение. В частности, красители конъюгированы с подложкой посредством ковалентного соединения. В частности, ковалентное соединение создается с помощью линкерной группы.
Конъюгирование (присоединение) соединения, являющегося красителем, с подложкой может быть осуществлено через карбоксильную группу СОХ, которая может быть превращена в амид или сложный эфир.
Красители согласно настоящему изобретению могут включать реакционноспособную линкерную группу в одном из положений заместителя, подходящую для ковалентного присоединения красителя к другой молекуле. Реакционноспособные линкерные группы представляют собой фрагменты, способные образовывать связь (например, ковалентную или нековалентную связь). В одном из конкретных примеров осуществления линкер может представлять собой отщепляемый линкер. Применение термина "отщепляемый линкер" не предполагает того, что весь линкер должен быть удален. Сайт отщепления может быть расположен на таком участке линкера, что после отщепления часть линкера остается присоединенной к красителю и/или элементу подложки. Неограничивающие примеры отщепляемых линкеров могут включать линкеры, отщепляемые при электрофильном воздействии, линкеры, отщепляемые под действием ферментов, линкеры, отщепляемые при нуклеофильном воздействии, фотоотщепляемые линкеры, линкеры, отщепляемые в восстановительной среде (например, линкеры, содержащие дисульфид или азид), линкеры, отщепляемые в окислительной среде, линкеры, отщепляемые посредством применения надежно связанного линкера, и линкеры, отщепляемые в соответствии с механизмом элиминирования. Применение отщепляемого линкера для прикрепления соединения, являющегося красителем, к элементу подложки дает возможность удалять метку, например, после обнаружения, что позволяет устранять мешающий сигнал при дальнейших операциях.
Подходящие линкерные группы могут быть найдены в опубликованной заявке РСТ WO 2004/018493 (которая включена в настоящее описание посредством ссылки), и их примеры включают линкеры, которые могут быть отщеплены под действием водорастворимых фосфинов или водорастворимых катализаторов на основе переходных металлов, полученных из переходного металла и по меньшей мере частично водорастворимых лигандов. В водном растворе последние образуют по меньшей мере частично водорастворимые комплексы переходных металлов. Такие отщепляемые линкеры могут быть применены для присоединения оснований нуклеотидов к меткам, таким как красители согласно изобретению.
Конкретные линкеры могут быть найдены в опубликованной заявке РСТ WO 2004/018493 (которая включена в настоящее описание посредством ссылки), например, такие как линкеры, которые включают фрагменты, имеющие следующие формулы:



(где X выбран из группы, включающей О, S, NH и NQ, где Q представляет собой замещенную или незамещенную C1-10-алкильную группу, Y выбран из группы, включающей О, S, NH и N(аллил), Т представляет собой водород или замещенную или незамещенную C1-10-алкильную группу, и * указывает точку, в которой фрагмент присоединен к оставшейся части нуклеотида или нуклеозида).
В конкретных примерах осуществления длина линкера между флуоресцентным красителем (флуорофором) и гуаниновым основанием может быть изменена, например, введением спейсерной полиэтиленгликолевой группы, что позволяет повысить интенсивность флуоресценции по сравнению с тем же флуорофором, присоединенным к гуаниновому основанию через другие связующие структуры, известные в данной области техники. Примеры линкеров и их свойств приведены в патентной заявке GB 0517097.2, опубликованной как WO 07/020457 (которая включена в настоящее описание посредством ссылки). Конструкция линкеров и, в частности, их увеличенная длина, может повысить яркость флуорофоров, присоединенных к гуаниновым основаниям гуанозиновых нуклеотидов, при введении последних в полинуклеотиды, такие как ДНК. Таким образом, если краситель предназначен для применения в любом из способов анализа, в котором применяют обнаружение метки из флуоресцентного красителя, присоединенной к гуанинсодержащему нуклеотиду, может быть полезно использовать линкер, имеющий спейсерную группу, описываемую формулой -((CH2)2О)n-, где n представляет собой целое число, составляющее от 2 до 50, например, рассмотренный в патентном документе WO 07/020457.
Настоящее изобретение дополнительно относится к конъюгатам нуклеозидов и нуклеотидов, меченных одним или более красителями согласно изобретению (модифицированных нуклеотидов). Меченые нуклеозиды и нуклеотиды подходят для мечения полинуклеотидов, образующихся при ферментативном синтезе, неограничивающие примеры которого включают ПЦР амплификацию, изотермическую амплификацию, твердофазную амплификацию, секвенирование полинуклеотидов (например, твердофазное секвенирование), реакции ник-трансляции и подобные методики.
Метки могут быть введены в нуклеозиды и нуклеотиды на сайты (участки) сахара или нуклеотидного основания. Как известно в данной области техники, "нуклеотид" состоит из азотистого основания, сахара и одной или более фосфатных групп. В РНК сахар представляет собой рибозу, а в ДНК - дезоксирибозу, т.е. сахар, не имеющий гидроксильной группы, которая имеется в рибозе. Азотистое основание представляет собой производное пурина или пиримидина. Пурины могут представлять собой аденин (А) или гуанин (G), и пиримидины могут представлять собой цитозин (С), тимин (Т) или в случае РНК урацил (U). Атом С-1 дезоксирибозы связан с N-1 пиримидина или N-9 пурина. Нуклеотид также является сложным фосфатным эфиром нуклеозида, в котором этерифицирована гидроксильная группа, присоединенная к С-3 или С-5 сахара. Нуклеотиды обычно представляют собой моно-, ди- или трифосфаты.
"Нуклеозид" структурно аналогичен нуклеотиду, но не имеет фосфатных фрагментов. Примером аналога нуклеозида является молекула, в которой метка связана с основанием и которая не имеет фосфатной группы, присоединенной к молекуле сахара.
Несмотря на то, что под основанием обычно понимают пурин или пиримидин, специалист в данной области техники должен понимать, что доступны производные и аналоги, в которых не изменена способность нуклеотида или нуклеозида подвергаться уотсон-криковскому (Watson-Crick) спариванию оснований. "Производное" или "аналог" означает соединение или молекулу, основа структуры которой идентична или близка основе структуры материнского соединения, но которая включает химическую или физическую модификацию, такую как, например, отличающаяся или дополнительная боковая группа, которая позволяет связывать производное нуклеотида или нуклеозида с другой молекулой. Например, основание может представлять собой деазапурин. В конкретных примерах осуществления производные могут подвергаться уотсон-криковскому спариванию. "Производное" и "аналог" также включают, например, синтетические производные нуклеотидов или нуклеозидов, имеющие модифицированные фрагменты основания и/или модифицированные фрагменты сахара. Такие производные и аналоги рассмотрены, например, в публикации Scheit, Nucleotide analogs (John Wiley & Son, 1980) и Uhlman et al., Chemical Reviews 90:543-584, 1990. Аналоги нуклеотидов также могут содержать модифицированные фосфодиэфирные связующие структуры, включающие связующие структуры на основе фосфоротиоата, фосфородитиоата, алкилфосфоната, фосфоранилидата, фосфорамидата и подобных структур.
Краситель может быть присоединен к любому положению в нуклеотидном основании, например, через линкер. В конкретных примерах осуществления полученный аналог может быть способен вступать в уотсон-криковское спаривание оснований. Конкретные сайты мечения нуклеотидных оснований включают положение С5 пиримидинового основания или положение С7 7-деазапуринового основания. Как указано выше, для ковалентного присоединения красителя к нуклеозиду или нуклеотиду может быть применена линкерная группа.
В конкретных примерах осуществления меченый нуклеозид или нуклеотид может быть подходящим для ферментативного встраивания и ферментативной достройки. Соответственно, линкерный фрагмент может иметь длину, достаточную для присоединения нуклеотида к соединению таким образом, чтобы соединение не препятствовало в значительной степени общему связыванию и распознаванию нуклеотида ферментом, осуществляющим репликацию нуклеиновой кислоты. Таким образом, линкер также может включать спейсер. Спейсер отделяет, например, нуклеотидное основание от сайта отщепления или метки.
Нуклеозиды или нуклеотиды, меченные красителями согласно изобретению, могут иметь следующую формулу:

где краситель представляет собой краситель согласно настоящему изобретению, В представляет собой нуклеотидное основание, такое как, например, урацил, тимин, цитозин, аденин, гуанин и подобные основания, и L представляет собой необязательную линкерную группу, которая может присутствовать или отсутствовать. R' может представлять собой Н, монофосфат, дифосфат, трифосфат, тиофосфат, аналог сложного фосфатного эфира, -О- присоединен к реакционноспособной фосфорсодержащей группе, или -О- защищен блокирующей группой. R'' может представлять собой Н, ОН, фосфорамидит или группу, блокирующую 3'-ОН, и R''' представляет собой Н или ОН.
Если R'' представляет собой фосфорамидит, то R' представляет собой отщепляемую кислотой защитную группу гидроксила, которая позволяет проводить последующее взаимодействие с мономером в условиях автоматизированного синтеза.
В одном из конкретных примеров осуществления блокирующая группа отделена и не зависит от красителя, т.е. не присоединена к нему непосредственно. В альтернативном примере осуществления краситель может включать всю или часть группы, блокирующей 3'ОН. Таким образом, R'' может представлять собой группу, блокирующую 3'ОН, которая может включать окрашивающее соединение, рассмотренное в настоящей работе, или не включать его.
В другом альтернативном примере осуществления на 3' атоме углерода пентозного сахара нет блокирующей группы, и краситель (или краситель и линкерная конструкция), присоединенный к основанию, например, может иметь размер или структуру, достаточную для препятствования встраиванию следующего нуклеотида. Таким образом, блокировка может быть обусловлена стерическими затруднениями или может быть обусловлена комбинацией размера, заряда и структуры, независимо от того, присоединен или нет краситель к положению 3' сахара.
В другом альтернативном примере осуществления блокирующая группа находится на 2' или 4' атоме углерода пентозного сахара, и ее размер или структура может быть достаточной для препятствования встраиванию следующего нуклеотида.
Применение блокирующей группы позволяет регулировать полимеризацию, например, посредством остановки достройки (удлинения) при введении модифицированного нуклеотида. Если эффект блокировки обратим, например, без ограничений, посредством изменения химических условия или удаления химического блока, то достройка может быть остановлена в определенный момент, а затем она может быть продолжена.
В другом конкретном примере осуществления группа, блокирующая 3'ОН, включает фрагменты, рассмотренные в документе WO 2004/018497 (который включен в настоящее описание посредством ссылки). Например, блокирующая группа может представлять собой азидометил (CH2N3) или аллил.
В одном из конкретных примеров осуществления присутствует как линкер (между красителем и нуклеотидом), так и блокирующая группа, и они представляют собой отдельные фрагменты. В конкретных примерах осуществления как линкер, так и блокирующая группа могут быть отщеплены в по существу одинаковых условиях. В результате снятие защиты и снятие блокировки могут быть более эффективными, поскольку для удаления и окрашивающего соединения, и блока требуется проведения только одной обработки. Однако в некоторых примерах осуществления линкер и блокирующая группа необязательно должны отщепляться в сходных условиях и, напротив, отщепляются по отдельности в различных условиях.
Настоящее изобретение также относится к полинуклеотидам, включающим окрашивающие соединения (красители). Такие полинуклеотиды могут представлять собой ДНК или РНК, состоящие, соответственно, из дезоксирибонуклеотидов или рибонуклеотидов, соединенных через связующую фосфодиэфирную структуру. Полинуклеотиды согласно изобретению могут включать встречающиеся в природе нуклеотиды, не встречающиеся в природе (или модифицированные) нуклеотиды, отличающиеся от модифицированных нуклеотидов согласно изобретению или любой их комбинации, в комбинации с по меньшей мере одним модифицированным нуклеотидом (например, меченным окрашивающим соединением) согласно изобретению. Полинуклеотиды согласно изобретению также могут включать не встречающиеся в природе связи в основной цепи и/или ненуклеотидные химические модификации. Изобретение также включает применение химерных структур, состоящих из смесей рибонуклеотидов и дезоксирибонуклеотидов, включающих по меньшей мере один модифицированный нуклеотид согласно изобретению.
Модифицированные нуклеотиды (или нуклеозиды), включающие окрашивающее соединение согласно настоящему изобретению, могут быть применены в любом способе анализа, таком как способы, которые включают обнаружение флуоресцентной метки, присоединенной к нуклеотиду или нуклеозиду как таковому или встроенному в или связанному с более крупной молекулярной структурой или конъюгатом. В настоящем контексте термин "встроен (введен) в пол и нуклеотид" может означать, что 5'-фосфат соединен посредством фосфодиэфирной связующей структуры с 3'-гидроксильной группой второго (модифицированного или немодифицированного) нуклеотида, который сам может образовывать часть более длинной полинуклеотидной цепочки. 3'-Конец модифицированного нуклеотида согласно изобретению может быть соединен или не соединен посредством фосфодиэфирной связующей структуры с 5'-фосфатом следующего (модифицированного или немодифицированного) нуклеотида. Таким образом, один из неограничивающих примеров осуществления изобретения относится к способу обнаружения модифицированного нуклеотида, встроенного в полинуклеотид, который включает: (а) встраивание по меньшей мере одного модифицированного нуклеотида согласно изобретению в полинуклеотид и (b) обнаружение модифицированного нуклеотида (нуклеотидов), встроенных в полинуклеотид, посредством обнаружения флуоресцентного сигнала, создаваемого окрашивающим соединением, присоединенным к модифицированному нуклеотиду (нуклеотидам).
Этот способ может включать: этап (а) синтеза, в котором происходит встраивание одного или более модифицированных нуклеотидов согласно изобретению в полинуклеотид, и этап (b) обнаружения, в котором обнаруживают один или более модифицированный нуклеотид (нуклеотиды), встроенный в полинуклеотид, посредством определения или количественного измерения его флуоресценции.
В одном из примеров осуществления настоящего изобретения по меньшей мере один модифицированный нуклеотид встраивается в полинуклеотид при проведении этапа синтеза под действием фермента полимеразы. Тем не менее, могут быть применены другие способы присоединения модифицированных нуклеотидов к полинуклеотидам, такие как, например, химический олигонуклеотидный синтез или присоединение (лигирование) меченых олигонуклеотидов к немеченым олигонуклеотидам. Таким образом, термин "встраивание", применяемый при рассмотрении нуклеотида и полинуклеотида, может включать синтез полинуклеотидов как химическими способами, так и ферментативными способами.
В одном из конкретных примеров осуществления проводят этап синтеза, который необязательно может включать инкубацию матричной полинуклеотидной цепочки в реакционной смеси, включающей флуоресцентно меченые модифицированные нуклеотиды согласно изобретению. Полимераза также может быть введена в условиях, допускающих образование фосфодиэфирной связующей структуры между свободной 3'-гидроксильной группой полинуклеотидной цепочки, ренатурированной с матричной полинуклеотидной цепочкой, и 5'-фосфатной группой модифицированного нуклеотида. Таким образом, этап синтеза может включать образование полинуклеотидной цепочки в соответствии с комплементарным спариванием оснований нуклеотидов с матричной цепочкой.
Во всех примерах осуществления способа этап обнаружения может быть выполнен во время ренатурации (соединения комплементарных нитей) полинуклеотидной цепочки, в которую встраиваются модифицированные нуклеотиды, с матричной цепочкой или после проведения этапа денатурации, в котором обе цепочки разделяют. Между этапом синтеза и этапом обнаружения могут быть включены дополнительные этапы, например, этапы проведения химических или ферментативных реакций или этапы очистки. В частности, целевая цепочка, включающая модифицированный нуклеотид (нуклеотиды), может быть выделена или очищена и затем обработана дополнительно или подвергнута последующему анализу. Например, целевые полинуклеотиды, меченные модифицированным нуклеотидом (нуклеотидами) при проведении этапа синтеза, затем могут быть применены в качестве меченых зондов или праймеров. В других примерах осуществления продукт этапа синтеза согласно изобретению может быть введен в последующие реакционные этапы и, при необходимости, продукт этих последующих этапов может быть очищен или выделен.
Условия, подходящие для проведения этапа синтеза, хорошо известны специалистам, знакомым со стандартными методиками молекулярной биологии. В одном из примеров осуществления этап синтеза может быть аналогичен стандартной реакции достройки праймера с использованием нуклеотидных предшественников, включающих модифицированные нуклеотиды согласно изобретению, в результате чего в присутствии подходящего фермента полимеразы образуется достроенная (удлиненная) целевая цепочка, комплементарная матричной цепочке. В других примерах осуществления сам этап синтеза может составлять часть реакции амплификации, в которой образуется меченый двухцепочечный продукт амплификации, состоящий из ренатурированных комплементарных цепочек, полученных при копировании целевой и матричной полинуклеотидных цепочек. Другие примеры этапов синтеза включают ник-трансляцию, цепь-заместительную полимеризацию, мечение ДНК со случайными праймерами и т.д. Особенно подходящим ферментом полимеразой для этапа синтеза является полимераза, которая может катализировать встраивание одного или более модифицированных нуклеотидов согласно изобретению. Для этой цели могут быть применены разнообразные встречающиеся в природе или модифицированные полимеразы. Например, для реакции синтеза, проводимой в термоциклических условиях, может быть применена термостабильная (термостойкая) полимераза, в то время как применение термостабильной полимеразы может быть нежелательным в изотермических реакциях достройки праймер. Подходящие термостабильные полимеразы, способные катализировать встраивание модифицированных нуклеотидов согласно изобретению, включают полимеразы, рассмотренные в документах WO 2005/024010 или WO 06/120433, каждый из которых включен в настоящее описание посредством ссылки. В реакциях синтеза, которые проводят при более низких температурах, таких как 37°C, ферменты полимеразы не обязательно должны представлять собой термостабильные полимеразы, и, таким образом, выбор полимеразы зависит от ряда факторов, таких как реакционная температура, рН, активность вытеснения цепи и подобных факторов.
Конкретные неограничивающие примеры осуществления изобретения относятся к способам секвенирования нуклеиновых кислот, ресеквенирования нуклеиновых кислот, полногеномного секвенирования, выявления однонуклеотидного (точечного нуклеотидного) полиморфизма или к любому другому применению, включающему обнаружение модифицированного нуклеотида или нуклеозида, меченного красителями согласно изобретению, при его встраивании в полинуклеотид. Модифицированные нуклеотиды или нуклеозиды, меченные красителями согласно изобретению, могут быть применены любом из разнообразных способов, которые могут быть усовершенствованы за счет применения полинуклеотидов, меченных модифицированными нуклеотидами, включающими флуоресцентные красители.
В одном из конкретных примеров осуществления изобретение относится к применению модифицированных нуклеотидов, включающих окрашивающие соединения согласно изобретению, в реакции секвенирования полинуклеотидов синтезом. Секвенирование синтезом обычно включает последовательное добавление одного или более нуклеотидов или олигонуклеотидов к растущей полинуклеотидной цепи в направлении 5' → 3' под действием полимеразы или лигазы с целью образования достроенной (удлиненной) полинуклеотидной цепочки, которая комплементарна матричной нуклеиновой кислоте, которую подвергают секвенированию. Природа (наименование) основания, находящегося в одном или более из добавляемых нуклеотидов, может быть определена при проведении этапа обнаружения или "визуализации". Наименование добавляемого основания может быть определено после каждого этапа встраивания нуклеотида. Затем последовательность матрицы может быть выведена в соответствии с традиционными правилами уотсон-криковского спаривания оснований. Применение модифицированных нуклеотидов, меченных красителями согласно изобретению, для определения природы единичного основания может быть полезно, например, при выявлении однонуклеотидных полиморфизмов, и такие реакции достройки единичного основания включены в объем настоящего изобретения.
В одном из примеров осуществления настоящего изобретения последовательность матричного полинуклеотида определяют посредством обнаружения встраивания одного или более нуклеотидов в растущую цепочку, комплементарную матричному полинуклеотиду, подвергаемому секвенированию, посредством обнаружения флуоресцентной метки (меток), присоединенной к встраиваемому нуклеотиду (нуклеотидам). Секвенирование матричного полинуклеотида может быть инициировано с помощью подходящего праймера (или синтезированного в виде шпилечной конструкции, которая содержит праймер в виде части шпильки), и растущая цепочка поэтапно достроена добавлением нуклеотидов к 3'-концу праймера в реакции, катализируемой полимеразой.
В конкретных примерах осуществления каждый из различных нуклеотидтрифосфатов (А, Т, G и С) может иметь метку из уникального флуорофора и также включать блокирующую группу в положении 3' для предотвращения неконтролируемой полимеризации. В альтернативном варианте один из четырех нуклеотидов может быть немеченым (темным). Фермент полимераза встраивает нуклеотид в растущую цепочку, комплементарную матричному полинуклеотиду, и блокирующая группа предотвращает последующее встраивание нуклеотидов. Не включенные в цепочку нуклеотиды могут быть удалены промывкой, после чего флуоресцентный сигнал, генерируемый каждым из встроенных нуклеотидов, может быть "считан" оптически подходящими средствами, такими, как устройство с зарядовой связью, в котором применяют возбуждение лазером и подходящие эмиссионные фильтры. Затем 3'-блокирующая группа и флуоресцентные окрашивающие соединения могут быть удалены (снятие защиты), (одновременно или последовательно), после чего в растущую цепочку может встраиваться следующий нуклеотид. Обычно природу встроенного нуклеотида определяют после проведения каждого этапа встраивания, но это не строго обязательно. Соответственно, в патенте US 5302509 (который включен в настоящее описание посредством ссылки) рассмотрен способ секвенирования полинуклеотидов, иммобилизованных на твердой подложке.
В способе, примеры которого приведены выше, применяют встраивание флуоресцентно меченых 3'-блокированных нуклеотидов A, G, С и Т в растущую цепочку, комплементарную иммобилизованному полинуклеотиду, в присутствии ДНК полимеразы. Полимераза встраивает основание, комплементарное целевому полинуклеотиду, но последующее достраивание предотвращается наличием 3'-блокирующей группы. Затем может быть считана метка встроенного нуклеотида, и блокирующая группа удалена химическим отщеплением, что позволяет протекать дальнейшей полимеризации. Матричная нуклеиновая кислота, подвергаемая секвенированию в реакции секвенирования синтезом, может представлять собой любой полинуклеотид, который нужно секвенировать. Матричная нуклеиновая кислота, вводимая в реакцию секвенирования, обычно включает двухцепочечную область, содержащую свободную 3'-гидроксильную группу, которая служит праймером или точкой инициирования для добавления следующих нуклеотидов в реакции секвенирования. Область матрицы, подвергаемая секвенированию, выступает за пределы этой свободной 3'-гидроксильной группы, находящейся на комплементарной цепочке. Выступающая область матрицы, подвергаемой секвенированию, может быть одноцепочечной, но может быть и двухцепочечной, при условии, что на цепочке, комплементарной матричной цепочке, подвергаемой секвенированию, "присутствует ник", который обеспечивает наличие свободной 3'-ОН группы для инициирования реакции секвенирования. В таких примерах осуществления секвенирование может протекать в соответствии с механизмом вытеснения цепи. В некоторых примерах осуществления праймер, несущий свободную 3'-гидроксильную группу, может быть добавлен в виде отдельного компонента (например, короткого олигонуклеотида), который гибридизуется с одноцепочечной областью матрицы, подвергаемой секвенированию. В альтернативном варианте как праймер, так и матричная цепочка, подвергаемая секвенированию, могут образовывать часть частично самокомплементарной цепочки нуклеиновой кислоты, которая может образовывать внутримолекулярный дуплекс, такой как, например, шпилечная петлеобразная структура. Шпилечные полинуклеотиды и способы, с помощью которых они могут быть присоединены к твердым подложкам, рассмотрены в международных патентных заявках WO 01/57248 и WO 2005/047301, каждая из которых включена в настоящее описание посредством ссылки. Нуклеотиды могут быть добавлены к растущему праймеру последовательно, что приводит к синтезу полинуклеотидной цепочки в направлении 5' → 3'. Природа добавленного основания может быть определена, в частности, но не обязательно, после каждого добавления нуклеотида, в результате чего получают информацию о последовательности матричной нуклеиновой кислоты. Таким образом, нуклеотид встраивается в цепочку нуклеиновой кислоты (или полинуклеотида) присоединением нуклеотида к свободной 3'-гидроксильной группе цепочки нуклеиновой кислоты через образование фосфодиэфирной связующей структуры с 5'-фосфатной группой нуклеотида.
Подвергаемая секвенированию матричная нуклеиновая кислота может представлять собой ДНК или РНК или даже гибридную молекулу, состоящую из дезоксинуклеотидов и рибонуклеотидов. Матричная нуклеиновая кислота может включать встречающиеся в природе и/или не встречающиеся в природе нуклеотиды и встречающиеся в природе или не встречающиеся в природе связи основной цепи, при условии, что такие структуры не препятствуют копированию матрицы в реакции секвенирования.
В некоторых примерах осуществления подвергаемая секвенированию матричная нуклеиновая кислота может быть присоединена к твердой подложке любым подходящим способом присоединения, известным в данной области техники, например, посредством ковалентного соединения. В некоторых примерах осуществления матричные полинуклеотиды могут быть присоединены непосредственно к твердой подложке (например, к подложке на основе оксида кремния). Однако, в других примерах осуществления изобретения поверхность твердой подложки может быть каким-либо образом модифицирована либо для непосредственного ковалентного присоединения матричных полинуклеотидов, либо для иммобилизации матричных полинуклеотидов с помощью гидрогеля или многослойного полиэлектролита, который сам может быть нековалентно присоединен к твердой подложке.
Массивы (группы), в которых полинуклеотиды непосредственно присоединены к подложкам на основе оксида кремния, представляют собой массивы, например, рассмотренные в документе WO 00/006770 (включен в настоящее описание посредством ссылки), в которых полинуклеотиды иммобилизованы на стеклянной подложке посредством реакции между боковой ("висячей") эпоксидной группой стекла и внутренней аминогруппой полинуклеотида. Кроме того, полинуклеотиды могут быть присоединены к твердой подложке посредством реакции нуклеофила на основе серы с твердой подложкой, например, рассмотренной в документе WO 2005/047301 (который включен в настоящее описание посредством ссылки). Дополнительным примером фиксированных на твердой подложке матричных полинуклеотидов является случай, в котором матричные полинуклеотиды присоединены к гидрогелю, нанесенному на подложку на основе оксида кремния или другие твердые подложки, например, рассмотренные в документах WO 00/31148, WO 01/01143, WO 02/12566, WO 03/014392, патенте US 6465178 и WO 00/53812, каждый из которых включен в настоящее описание посредством ссылки.
Конкретным примером поверхности, на которой могут быть иммобилизованы матричные полинуклеотиды, является полиакриламидный гидрогель. Полиакриламидные гидрогели рассмотрены в цитируемых выше документах и в документе WO 2005/065814, который включен в настоящее описание посредством ссылки.
Молекулы матричной ДНК могут быть присоединены к гранулам или микрочастицам, например, как рассмотрено в патенте US 6172218 (который включен в настоящее описание посредством ссылки). Присоединение к гранулам или микрочастицам может быть полезным при проведении способов, включающих секвенирование. Могут быть подготовлены библиотеки гранул, в которых каждая гранула содержит различные последовательности ДНК. Примеры библиотек и способов их создания рассмотрены в публикациях Nature. 437, 376-380 (2005); Science. 309, 5741, 1728-1732 (2005), каждая из которых включена в настоящее описание посредством ссылки. Секвенирование массивов таких гранул с применением нуклеотидов согласно изобретению включено в объем настоящего изобретения.
Матрица (матрицы), подвергаемая секвенированию, может быть частью "массива", находящегося на твердой подложке, и в этом случае массив может принимать любую подходящую форму. Таким образом, способ согласно изобретению применим ко всем типам массивов с высокой плотностью, включающих массивы единичных молекул, массивы кластеров и массивы гранул. Модифицированные нуклеотиды, меченные красителями согласно настоящему изобретению, могут быть применены для секвенирования матриц в массиве по существу любого типа, неограничивающие примеры которого включают массивы, полученные при иммобилизации молекул нуклеиновых кислот на твердой подложке.
Однако модифицированные нуклеотиды, меченные окрашивающими соединениями согласно изобретению, особенно подходят для секвенирования кластерных массивов. В кластерных массивах отдельные области массива (часто называемые сайтами или элементами) включают множество молекул матричных полинуклеотидов. Обычно множество молекул полинуклеотидов невозможно по отдельности различить оптическими средствами, и поэтому их обнаруживают как ансамбль. В зависимости от того, каким образом сформирован массив, каждый сайт массива может включать множество копий одной индивидуальной молекулы полинуклеотида (например, сайт однороден по отношению к конкретному виду одно- или двухцепочечной нуклеиновой кислоты) или множество копий небольшого количества различных полинуклеотидных молекул (например, множество копий двух различных видов нуклеиновых кислот). Массивы, включающие кластеры молекул нуклеиновых кислот, могут быть получены с помощью обычных методик, известных в данной области техники. Например, в документах WO 98/44151 и WO 00/18957, содержание каждого из которых включено в настоящую работу, рассмотрены способы амплификации нуклеиновых кислот, в которых как матрица, так и продукты амплификации остаются иммобилизованными на твердой подложке с целью образования массива, состоящего из кластеров или "колоний" иммобилизованных молекул нуклеиновых кислот. Молекулы нуклеиновых кислот, находящихся в кластерных массивах, полученных такими способами, являются подходящими матрицами для секвенирования с применением модифицированных нуклеотидов, меченных окрашивающими соединениями согласно изобретению.
Модифицированные нуклеотиды, меченные окрашивающими соединениями согласно настоящему изобретению, также подходят для секвенирования матриц в массивах единичных молекул. Согласно изобретению, употребляемый термин "массив единичных молекул" или "SMA (сокращенно от англ. single molecule array)" означает популяцию молекул полинуклеотидов, распределенных (или расположенных в виде массива) по твердой подложке таким образом, чтобы расстояние между любым индивидуальным полинуклеотидом и всеми другими полинуклеотидами в популяции позволяло индивидуально различать отдельные молекулы полинуклеотидов. Таким образом, в некоторых примерах осуществления целевые молекулы нуклеиновых кислот, иммобилизованные на поверхности твердой подложки, могут быть различены оптическими средствами. Это означает, что в разрешающей области конкретного применяемого визуализирующего устройства появляется один или более различимых сигналов, каждый из которых соответствует одному полинуклеотиду.
Обнаружение единичных молекул может быть доступным, если расстояние между соседними полинуклеотидными молекулами в массиве составляет по меньшей мере 100 нм, предпочтительно, по меньшей мере 250 нм, предпочтительнее, по меньшей мере 300 нм, более предпочтительно, по меньшей мере 350 нм. Таким образом, каждая молекула индивидуально различима и может быть определена в виде единственной молекулярной флуоресцентной точки, и флуоресценция от такой единственной молекулярной флуоресцентной точки также отличается одноступенчатым фотообесцвечиванием.
Употребляемые в настоящей работе термины "индивидуально различимый" и "индивидуальное разрешение" означают, что при визуализации можно отличить одну молекулу массива от соседних молекул. Разделение между индивидуальными молекулами в массиве частично определяется конкретной методикой, применяемой для различения индивидуальных молекул. Общие свойства массивов единичных молекул изложены в патентных заявках WO 00/06770 и WO 01/57248, каждая из которых включена в настоящее описание посредством ссылки. Несмотря на то, что один из вариантов применения модифицированных нуклеотидов согласно изобретению состоит в проведении реакций секвенирования синтезом, применимость модифицированных нуклеотидов не ограничена такими способами. В самом деле, нуклеотиды могут быть с успехом применены в любой методике секвенирования, в которой требуется обнаружение флуоресцентных меток, присоединенных к нуклеотидам, встроенным в полинуклеотид.
В частности, модифицированные нуклеотиды, меченные окрашивающими соединениями согласно изобретению, могут быть применены в автоматизированных протоколах флуоресцентного секвенирования, в частности, циклического секвенирования с применением флуоресцентного красителя-терминатора, созданных на основе способов секвенирования с терминацией цепи, разработанных Сэнгером (Sanger) с сотрудниками. В таких способах в реакции секвенирования с достройкой праймера обычно применяют ферменты и циклическое секвенирование со встраиванием флуоресцентно меченых дидезоксинуклеотидов. Так называемые способы секвенирования по Сэнгеру и схожие протоколы (Сэнгеровского типа) включают рандомизированную терминацию цепи при встраивании меченых дидезоксинуклеотидов.
Таким образом, настоящее изобретение также относится к модифицированным нуклеотидам, меченным окрашивающими соединениями, которые представляют собой дидезоксинуклеотиды, не имеющие гидроксильных групп как в положении 3', так и в положении 2'; такие модифицированные дидезоксинуклеотиды подходят для применения в способах секвенирования по Сэнгеру и подобных способах.
Должно быть понятно, что модифицированные нуклеотиды, меченные окрашивающими соединениями согласно настоящему изобретению и включающие 3'-блокирующие группы, также могут быть применены в способах Сэнгера и подобных им протоколах, поскольку эффект, достигаемый при использовании модифицированных дидезоксинуклеотидов, может быть достигнут при использовании модифицированных нуклеотидов, имеющих 3'-ОН блокирующие группы: и те, и другие предотвращают встраивание последующий нуклеотидов. Если нуклеотиды согласно настоящему изобретению, имеющие 3'-блокирующую группу, применяют в способах секвенирования по Сэнгеру, то следует понимать, что окрашивающие соединения или подходящие для обнаружения метки, присоединенные к нуклеотидам, не обязательно должны быть присоединены через отщепляемые линкеры, поскольку после каждого события встраивания меченого нуклеотида согласно изобретению не происходит дальнейшей инкорпорации других нуклеотидов, и, таким образом, метку не нужно удалять из нуклеотида.
Настоящее изобретение также относится к наборам, включающим модифицированные нуклеозиды и/или нуклеотиды, меченные красителями. Такие наборы обычно включают по меньшей мере один модифицированный нуклеотид или нуклеозид, меченный красителем согласно изобретению, а также по меньшей мере один дополнительный компонент. Дополнительный компонент (компоненты) может представлять собой один или более компонентов, указанных при описании способа, раскрытого выше, или в примерах, представленных ниже. Некоторые неограничивающие примеры компонентов, которые могут быть скомбинированы в виде набора согласно настоящему изобретению, представлены ниже.
В одном из конкретных примеров осуществления набор может включать по меньшей мере один модифицированный нуклеотид или нуклеозид, меченный красителем согласно изобретению, а также модифицированные или немодифицированные нуклеотиды или нуклеозиды. Например, модифицированные нуклеотиды, меченные красителями согласно изобретению, могут быть предоставлены в комбинации с немечеными или нативными (природными) нуклеотидами и/или с флуоресцентно мечеными нуклеотидами или любой их комбинацией. Соответственно, наборы могут включать модифицированные нуклеотиды, меченные красителями согласно изобретению, и модифицированные нуклеотиды, меченные другими соединениями, например, окрашивающими соединениями согласно предшествующему уровню техники. Комбинации нуклеотидов могут быть предоставлены в виде отдельных индивидуальных компонентов (например, один тип нуклеотида в одной емкости или пробирке) или в виде смесей нуклеотидов (например, два или более нуклеотида, смешанных в одной емкости или пробирке).
Если наборы включают совокупность, в частности, два, в особенности, четыре модифицированных нуклеотида, меченных окрашивающим соединением, то различные нуклеотиды могут быть помечены различными окрашивающими соединениями, или один из них может быть темным, не содержащим окрашивающих соединений. Если различные нуклеотиды помечены различными окрашивающими соединениями, то отличительным признаком наборов является то, что содержащиеся в них окрашивающие соединения представляют собой спектрально различимые флуоресцентные красители. Употребляемый в настоящем описании термин "спектрально различимые флуоресцентные красители" означает флуоресцентные красители, которые испускают энергию флуоресценции при длинах волн, которые могут быть распознаны оборудованием для флуоресцентного обнаружения (например, коммерчески доступной платформой капиллярного секвенирования ДНК), если в одном образце находятся два или более таких красителя. Если два модифицированных нуклеотида, меченных флуоресцентными окрашивающими соединениями, поставляют в виде набора, то отличительным признаком некоторых примеров осуществления является то, что возбуждение спектрально различимых флуоресцентных красителей может происходить при одной и той же длине волны, например, одним и тем же лазером. Если четыре модифицированных нуклеотида, меченных флуоресцентными окрашивающими соединениями, поставляют в виде набора, то отличительным признаком некоторых примеров осуществления является то, что возбуждение двух спектрально различимых флуоресцентных красителей может происходить при одной и той же длине волны, и возбуждение двух других спектрально различимых флуоресцентных красителей может происходить при другой длине волны. Конкретные длины волн возбуждения составляют 532 нм, от 630 нм до 700 нм, в частности, 660 нм.
В одном из примеров осуществления набор включает модифицированный нуклеотид, имеющий метку из соединения согласно настоящему изобретению, и второй модифицированный нуклеотид, меченный вторым красителем, причем разность между максимумами поглощения красителей составляет по меньшей мере 10 нм, в частности, от 20 нм до 50 нм. В частности, стоксовы сдвиги двух окрашивающих соединений составляют от 15 до 40 нм, где "стоксов сдвиг" представляет собой расстояние между длиной волны пика поглощения и длиной волны пика эмиссии.
В другом примере осуществления набор может дополнительно включать два других модифицированных нуклеотида, меченных флуоресцентными красителями, причем возбуждение красителей производят одним и тем же лазером при длине волны от 488 нм до 550 нм, в частности, при 532 нм. Разность между максимумами поглощения красителей может составлять по меньшей мере 10 нм, в частности, от 20 нм до 50 нм. В частности, два окрашивающих соединения могут иметь стоксовы сдвиги, составляющие от 20 до 40 нм. В частности, два окрашивающих соединения могут иметь различные максимумы поглощения при длине волны менее 640 нм, в частности, менее 600 нм. Конкретные красители, которые спектрально отличимы от полиметиновых красителей согласно настоящему изобретению и которые отвечают приведенным выше критериям, представляют собой полиметиновые аналоги, рассмотренные в патенте US 5268486 (например, Су3) или в патентной заявке WO 0226891 (Alexa 532; Molecular Probes А20106), или несимметричные полиметины, рассмотренные в патенте US 6924372, где содержание каждого из документов включено в настоящее описание посредством ссылки. Альтернативные красители включают аналоги родамина, например, тетраметилродамин и его аналоги.
В альтернативном примере осуществления наборы согласно изобретению могут содержать нуклеотиды, в которых одинаковые основания помечены двумя различными соединениями. Первый нуклеотид может иметь метку из соединения согласно изобретению. Второй нуклеотид может иметь метку из спектрально отличающегося соединения, например, из "зеленого" красителя, поглощающего излучение при менее 600 нм. Третий нуклеотид может иметь метку из смеси соединения согласно изобретению и спектрально отличающегося соединения, и четвертый нуклеотид может быть "темным" и не содержать метки. Таким образом, нуклеотиды 1-4 могут быть помечены следующим образом: "зеленый", "красный", "красный/зеленый" и темный. Для дополнительного упрощения методики, четыре нуклеотида могут быть помечены двумя красителями, возбуждение которых осуществляют с помощью одного лазера, и, таким образом, метки нуклеотидов 1-4 могут быть следующими: "красный 1", "красный 2", "красный 1/красный 2" и темный или "зеленый 1", "зеленый 2", "зеленый 1/зеленый 2" и темный.
Нуклеотиды могут содержать два красителя согласно настоящему изобретению. Красители, в которых Ra1 или Ra2 представляет собой дополнительный ароматический цикл, сконденсированный с соседними атомами углерода индольного цикла, поглощают излучение большей длины волны по сравнению с красителями, которые не содержат дополнительного ароматического сопряжения (конъюгирования). Набор может содержать два или более нуклеотида, меченных красителями согласно изобретению. Набор может содержать нуклеотид, меченый соединением согласно изобретению, в котором каждый из Ra1 и Ra2 независимо представляет собой Н, SO3-, сульфонамид или галоген, и один нуклеотид, меченый соединением согласно изобретению, в котором один или оба Ra1 и Ra2 представляют собой дополнительный цикл, сконденсированный с соседним атомом углерода. Наборы могут содержать дополнительный нуклеотид, помеченный красителем, поглощение которого лежит в области от 520 нм до 560 нм. Наборы могут дополнительно содержать немеченый нуклеотид.
Нуклеотиды могут содержать два красителя согласно настоящему изобретению. Красители, в которых р составляет единицу, поглощают излучение более коротких длин волн по сравнению с красителями, в которых р составляет два. Набор может содержать два или более нуклеотида, меченных красителями согласно изобретению. Набор может содержать нуклеотид, имеющий метку из соединения согласно изобретению, в которых р составляет единицу, и один нуклеотид имеет метку из соединения согласно изобретению, в котором р составляет два. Наборы могут содержать дополнительный нуклеотид, помеченный третьей меткой. Наборы могут дополнительно содержать немеченый нуклеотид или нуклеотид, меченный четвертой меткой.
Несмотря на то, что выше наборы рассмотрены на примерах конфигураций, включающих различные нуклеотиды, меченные различными окрашивающими соединениями, следует понимать, что наборы могут включать 2, 3, 4 или более различных нуклеотидов, меченных одним и тем же окрашивающим соединением.
В конкретных примерах осуществления набор может включать фермент полимеразу, которая способна катализировать встраивание модифицированных нуклеотидов в полинуклеотид. Другие компоненты, включаемые в такие наборы, могут включать буферы и подобные вещества. Модифицированные нуклеотиды, меченные красителями согласно изобретению, и любые другие нуклеотидные компоненты, включающие смеси различных нуклеотидов, могут быть включены в набор в концентрированной форме, которую следует разбавлять перед использованием. В такие примеры осуществления также может быть включен подходящий буфер разбавления. Кроме того, в набор согласно настоящему изобретению может быть включен один или более компонентов, указанных при рассмотрении способа согласно изобретению.
Следует отметить, что употребление в настоящем описании и прилагаемой формуле изобретения единственного числа включает множественное число, если не имеется ясного и недвусмысленного ограничения одним компонентом. Специалистам в данной области техники должно быть понятно, что в различные примеры осуществления, рассмотренные в настоящей работе, могут быть внесены различные изменения и модификации, не противоречащие объему или характеру изобретения. Таким образом, следует учитывать, что различные примеры осуществления, рассмотренные в настоящей работе, включают другие модификации и варианты, соответствующие объему прилагаемых пунктов формулы изобретения и их эквивалентов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез 4-(3-бромпропокси)фенола

Гидроксид калия (2 г, 35,4 ммоль) и 1,3-дибромпропан (8,3 мл, 81,7 ммоль) добавляли в атмосфере N2 к раствору гидрохинона (3 г, 27,2 ммоль) в метаноле (30 мл). Реакционную смесь перемешивали при 65°C в течение ночи. Затем летучие вещества удаляли в вакууме и добавляли простой диэтиловый эфир (30 мл). Органический слой промывали насыщенным водным раствором хлорида аммония и водой (по 30 мл каждого). Органический слой сушили сульфатом магния, фильтровали, и удаляли в вакууме летучие вещества. Полученную бежевую суспензию очищали флэш-хроматографией на силикагеле (элюент: петролейный эфир/этилацетат 70/30), получая 2,6 г белой суспензии. Выход: 41%.1Н ЯМР (CDCl3): 6,87-6,73 (4Н, мультиплет, Н-Ar); 5,36 (1Н, синглет, ОН); 4,04 (2Н, триплет, J=6,2 Гц); 3,60 (2Н, J=6,2 Гц); 2,28 (2Н, квартет, J=6,2 Гц, Н-2).13С ЯМР (CDCl3): 152,8, 149,6, 116,1; 116,0; 66,7; 34,4; 30,2.
Синтез 4-(2,3-диметил-3H-индол-3-ил)бутан-1-сульфоновой кислоты
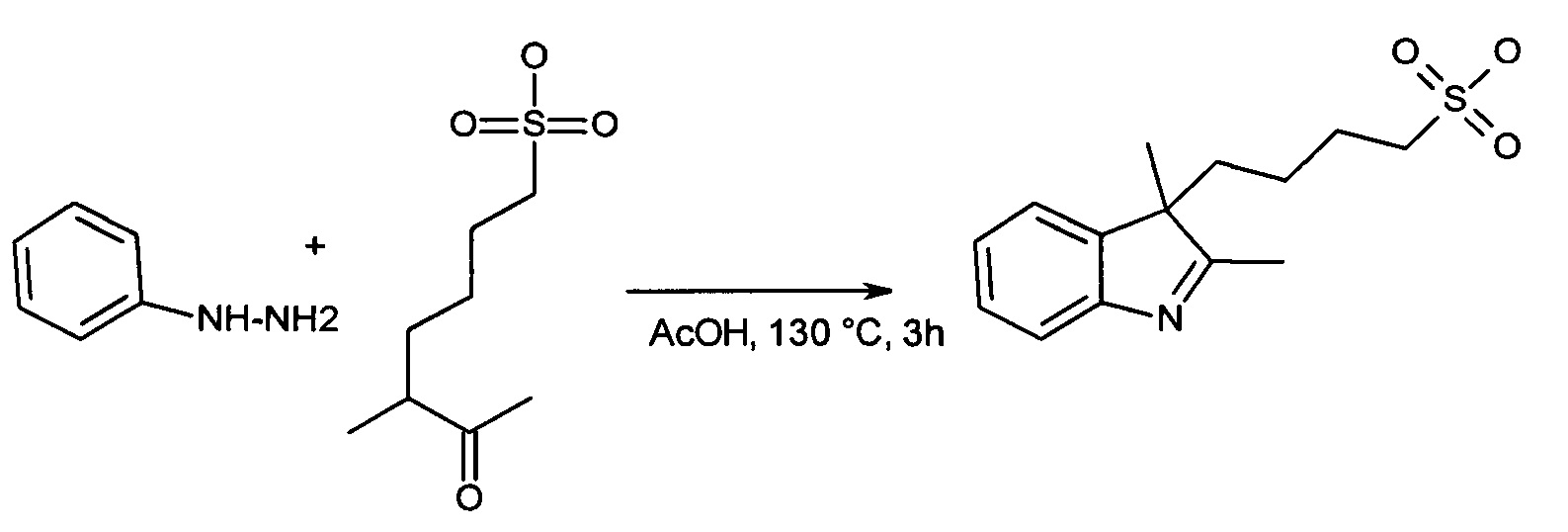
Фенилгидразин (8,6 ммоль, 850 мкл) и 5-метил-6-оксогептансульфоновую кислоту (7,2 ммоль, 1,5 г) перемешивали при 130°C в течение 3 часов в ледяной уксусной кислоте (19 мл). Реакционную смесь охлаждали до комнатной температуры, и растворитель удаляли в вакууме. Остаток очищали флэш-хроматографией на силикагеле (элюент: дихлорметан/метанол 80/20), получая 1,23 г бледно-желтой пены. Выход: 61%. Масс-спектрометрия (DUIS): Е-: 280 (М-1);1Н ЯМР (D2O): 7,42 (1Н, дублет, J=7,8 Гц, Н-4); 7,27 (1Н, триплет, J=7,8 Гц, Н-5); 7,24 (1Н, дублет, J=7,8 Гц, Н-7); 7,17 (1Н, триплет, J=7,8 Гц, Н-6); 2,59 (2Н, дублет дублетов, J=7,6, 8,9 Гц, Н-11); 2,21-2,13 (1Н, мультиплет); 1,88-1,73 (2Н, мультиплет, Н-8); 1,52-1,43 (2Н, мультиплет, Н-10); 1,13 (3Н, синглет, СН3 на С-3); 0,70-0,63 (1Н, мультиплет, Н-9а); 0,51-0,44 (1Н, мультиплет, Н-9b).13С ЯМР (D2O): 190,8; 152,3; 143,7; 127,8; 125,7; 122,2; 118,6; 57,9; 50,5; 48,9; 35,6; 24,0; 22,5; 21,8; 14,8.
Синтез 1-(3-(4-гидроксиФенокси)пропил)-2,3-диметил-3-(4-сульФобутил)-3H-индол-1-ия

Sulfolane = сульфолан
4-(3-Бромпропокси)фенол (1,90 ммоль, 438 мг) и 4-(2,3-диметил-3H-индол-3-ил)бутан-1-сульфоновую кислоту (1,58 ммоль, 504 мг) в сульфолане (2 мл) перемешивали при 120°C в течение 4,5 часа. Реакционную смесь охлаждали до комнатной температуры и непосредственно очищали флэш-хроматографией на силикагеле (элюент: дихлорметан/метанол 65/35), получая 329 мг светло-серого масла. Выход: 40%. Масс-спектрометрия (DUIS): Е-: 430 (М-1), Е+: 432 (М+1);1Н ЯМР (трифторуксусная кислота): 7,75-7,65 (4Н, мультиплет, Н-4/5/6/7); 6,98 (2Н, дублет, J=8,9 Гц, Наг на фениле); 6,85 (2Н, дублет, J=8,9 Гц, Наг на фениле); 4,82 (2Н, двойной триплет, J=6,6 Гц, Н-12); 4,24-4,13 (2Н, мультиплет, Н-14); 3,69 (1Н, s); 3,20-3,06 (2Н, мультиплет, Н-11); 2,91 (3Н, синглет, СН3 на С-2); 2,63-2,52 (2Н, мультиплет, Н-13); 2,41-2,75 (2Н, мультиплет, Н-8); 1,90-1,83 (2Н, мультиплет, Н-10); 1,66 (3Н, синглет, CH3 на С-3); 1,13-0,93 (2Н, мультиплет, Н-9).
Синтез 1-(3-(4-гидроксифенокси)пропил)-2,3,3-триметил-3H-индол-1-ия
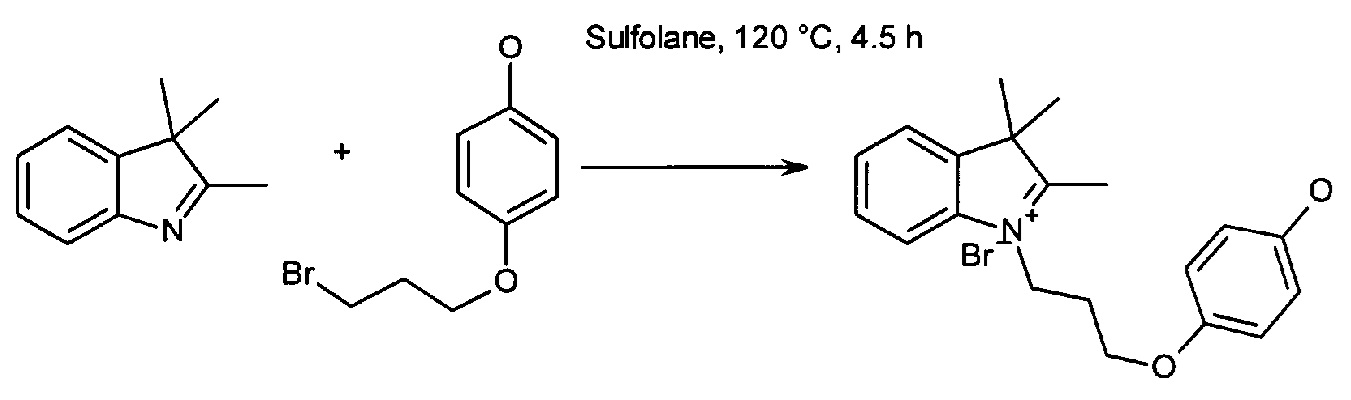
4-(3-Бромпропокси)фенол (1,40 ммоль, 324 мг) и триметилиндоленин (0,80 ммоль, 129 мкл) в сульфолане (1 мл) перемешивали при 120°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры и непосредственно очищали флэш-хроматографией на силикагеле (элюент: дихлорметан/метанол 90/10), получая 260 мг светло-серого масла. Выход: 84%.1Н ЯМР (MeOD): 7,06 (1Н, дублет, J=7,2 Гц, Н-4); 7,00 (1Н, двойной триплет, J=7,8 Гц, Н-5); 6,77-6,64 (5 Н, мультиплет, Н-6 и Н- на фениле орто- и мета-); 6,58 (1Н, дублет, J=7,8 Гц, Н-7); 3,90 (2Н, триплет, J=5,8 Гц, Н-8), 3,71 (2Н, J=6,5 Гц, Н-10); 2,04 (2Н, двойной квартет, J=6,1 Гц, Н-9); 1,30 (6Н, синглет, 2xCH3 на С-3).13С ЯМР (MeOD): 162,7; 153,6; 152,3; 147,2; 138,6; 128,6; 122,7; 119,5; 116,8; 116,6; 116,5; 103,3; 66,8; 45,1; 39,7; 30,6; 27,5.
Синтез AF670POPO
Схема синтеза продукта
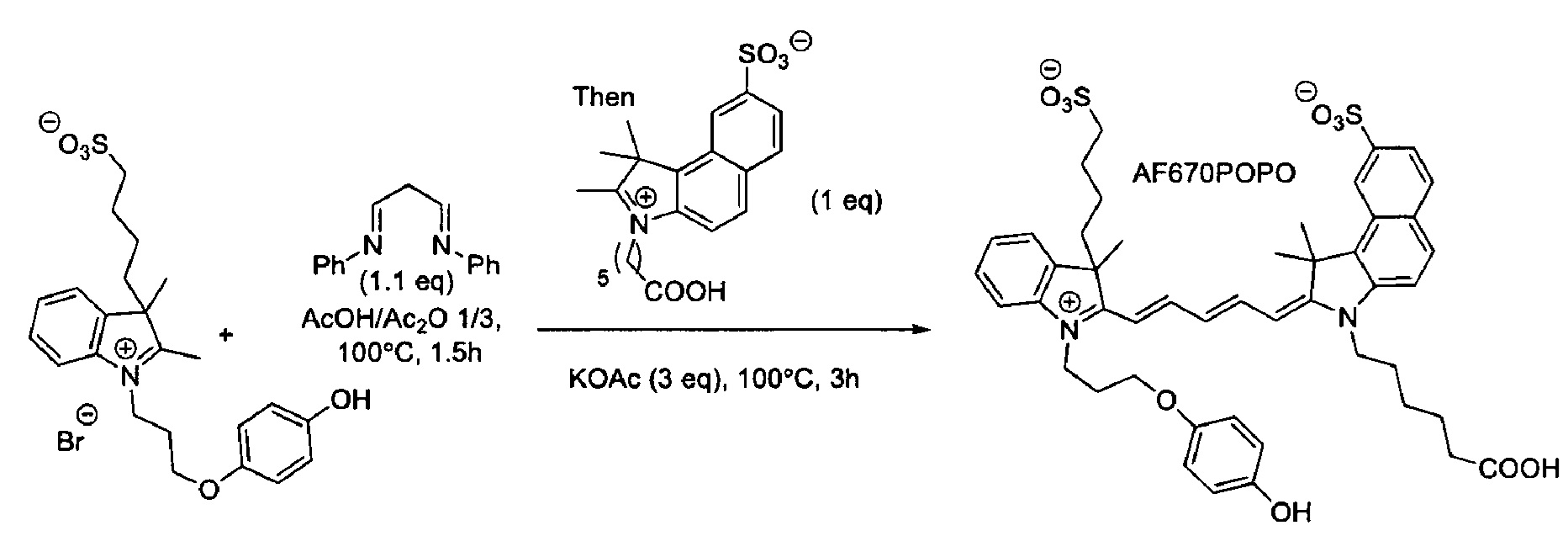
Процедура синтеза красителя:
4-(2,3-диметил-3H-индол-3-ил)бутан-1-сульфоновую кислоту (204 мг, 400 мкмоль) и моногидрохлорид бис(фенилимина) малонового альдегида (114 мг, 440 мкмоль) перемешивали в смеси уксусного ангидрида/уксусной кислоты (2/0,6 мл) при 100°C в течение 1,5 часов. Добавляли ацетат калия (118 мг, 1,20 ммоль) и сульфонированную соль X бензиндолия (193 мг, 400 мкмоль). Реакционную смесь перемешивали при 100°C в течение 3 часов. Затем ее охлаждали до комнатной температуры и добавляли простой диэтиловый эфир (40 мл). Выпадало темно-синее твердое вещество. Его отфильтровывали, промывали дополнительным количеством простого диэтилового эфира (40 мл) и растворяли в воде (25 мл), содержащей ~30% ацетонитрила. Полученный темно-синий раствор фильтровали и очищали препаративной ВЭЖХ. Основные окрашенные в синий цвет (максимум поглощения ~665 нм) фракции собирали, и растворители удаляли в вакууме. Масс-спектрометрия (DUIS): Е-: 869 (М-1), 434,1 (М-2/2).
Красители DX-DX были получены аналогично из соответствующих исходных материалов.
В Таблице 1 представлены спектральные свойства некоторых красителей, полученных рассмотренным образом (растворы в воде, OD ~ 0,2), в сравнении с аналогичными параметрами известного структурного аналога, красителя Std (Патент: P6240WO)


Синтез AF550POPOS0
Схема синтеза продукта
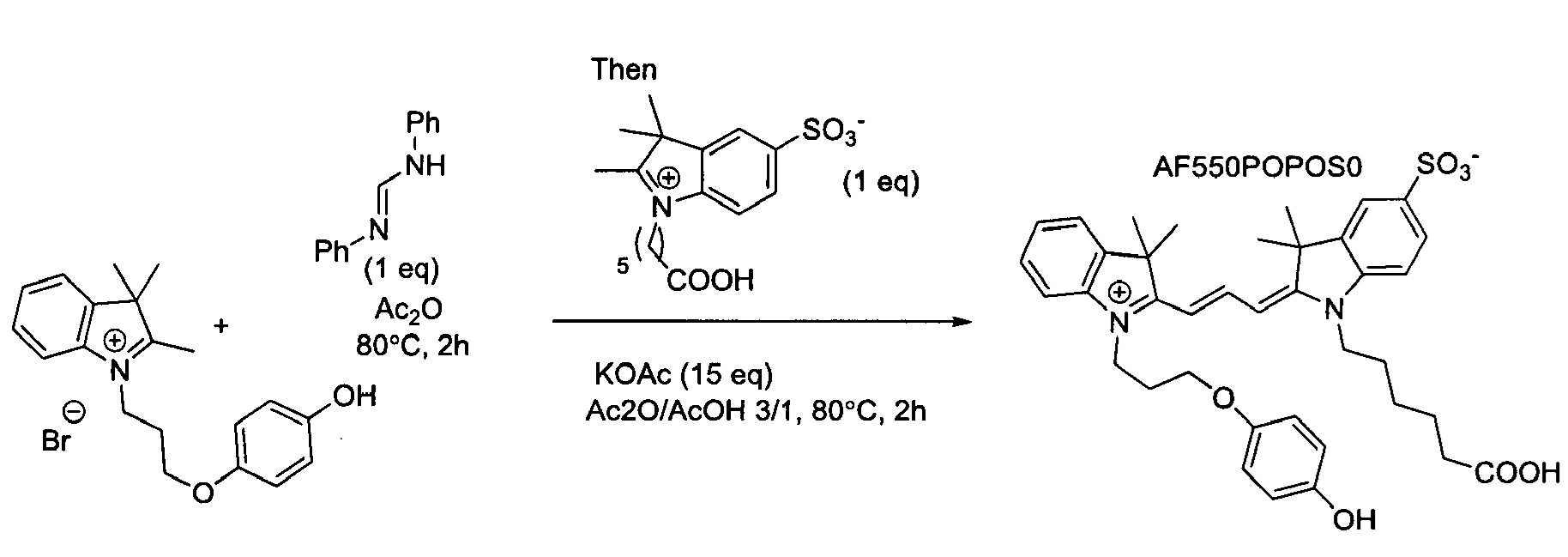
Процедура синтеза красителя:
1-(3-(4-Гидроксифенокси)пропил)-2,3,3-триметил-3H-индол-1-ий (150 мг, 385 мкмоль) и N,N'-дифенилформамидин (74 мг, 385 мкмоль) перемешивали в уксусном ангидриде (2 мл) при 80°C в течение 2 часов. Добавляли уксусную кислоту (0,5 мл), ацетат калия (567 мг, 5,78 ммоль) и сульфонированную соль X индолия (166 мг, 385 мкмоль). Реакционную смесь перемешивали при 80°C в течение 2,5 часов. Затем летучие вещества удаляли под уменьшенным давлением и добавляли простой диэтиловый эфир (20 мл). Выпадало темно-красное твердое вещество. Его отфильтровывали, промывали дополнительным количеством простого диэтилового эфира (20 мл) и растворяли в воде (15 мл), содержащей ~5% ацетонитрила. Полученный темно-красный раствор фильтровали и очищали препаративной ВЭЖХ. Основные окрашенные в красный цвет (максимум поглощения ~550 нм) фракции собирали, и растворители удаляли в вакууме. Масс-спектрометрия (DUIS): Неацетилированный Е-: 671,0 (М-1); Е+: 673,3 (М+1), 774,4 (Et3N+ соль).
В Таблице 2 представлены спектральные свойства некоторых красителей, полученных рассмотренным образом (растворы в воде, OD ~ 0,2), в сравнении с аналогичными параметрами известного структурного аналога, красителя (Патент: P6240WO).
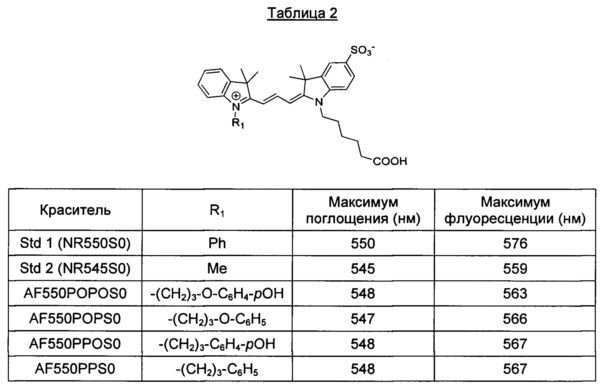
Конъюгат красителя AF670POPO с нуклеотидом (FFA-AF670POPO)

Безводный N,N-диметилацетамид (ДМА, англ. N,N-Dimethylacetamide, сокращенно DMA) (3 мл), TSTU (сокращенние от англ. O-(N-succinimidyl)-1,1,3,3-tetramethyluronium tetrafluoroborate, рус. O-(N-сукцинимидил)-1,1,3,3-тетраметилурония тетрафтороборат) (18 мг, 58,8 мкмоль) и основание Хунига (0,05 мл) добавляли к высушенному образцу красителя AF670POPO (60 мг, 53,5 мкмоль). Проявлялся синий цвет активированного сложного эфира. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Согласно данным ТСХ (20% H2O в CH3CN), активация была завершена. После завершения активации к реакционной смеси добавляли раствор 5 pppA-LN3 в виде соли триэтиламмония (53 мг, 56,1 мкмоль) в смеси ДМА/вода (0,5/0,3 мл). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 18 часов. Протекание реакции сочетания контролировали с помощью ТСХ (20% H2O в ацетонитриле). Реакционную смесь охлаждали до ~4°C с помощью ледяной бани, затем добавляли 10 раствор 0,1 М ТЕАВ (сокращение от англ. tetraethylammonium bromide, рус. бромид тетраэтиламмония) (5 мл) в воде, и смесь перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь помещали на колонку, содержащую ~25 г суспензии полимера DEAE Sephadex (англ. Diethylaminoethyl Sephadex®, т.е. диэтиламиноэтил Sephadex®) в 0,05 М растворе ТЕАВ в воде и промывали ТЕАВ (градиент концентрации от 0,1 М до 1 М). Окрашенные фракции собирали и испаряли, затем вновь совместно испаряли с водой для удаления большего количества ТЕАВ и сушили в вакууме досуха. Остаток затем повторно растворяли в 0,1 М ТЕАВ. Этот раствор фильтровали через шприцевой фильтр с размером пор 0,2 нм в колбу Corning 20. Продукт очищали посредством ВЭЖХ с помощью колонки С18 с обращенной фазой при использовании смеси ацетонитрил - 0,1 М ТЕАВ. Выход 74% (на основании оптической плотности раствора при вычисленном коэффициенте экстинкции).
Конъюгат красителя AF550POPOSO с нуклеотидом (FFT-AF550POPOSO
Безводный ДМА (3 мл), TSTU (19 мг, 63,5 мкмоль) и основание Хунига (0,05 мл) добавляли к высушенному образцу красителя AF550POPOS0 (39 мг, 57,7 мкмоль). Проявлялся красный цвет активированного сложного эфира. Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. В реакционную смесь добавляли раствор pppT-LN3 в виде соли триэтиламмония (59 мг, 63,5 мкмоль) в смеси ДМА/вода (0,5/0,3 мл). Реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 18 часов. Протекание реакции сочетания контролировали с помощью ТСХ (20% H2O в ацетонитриле). Реакционную смесь охлаждали до ~4°C с помощью ледяной бани, затем добавляли 10 раствор 0,1 М ТЕАВ (5 мл) в воде, и смесь перемешивали при комнатной температуре в течение 10 минут. Реакционную смесь помещали на колонку, содержащую -25 г суспензии полимера Sephadex DEAE в 0,05 М растворе ТЕАВ в воде и промывали ТЕАВ (градиент концентрации от 0,1 М до 1 М). Окрашенные фракции собирали и испаряли, затем вновь совместно испаряли с водой для удаления большего количества ТЕАВ и сушили в вакууме досуха. Остаток затем повторно растворяли в 0,1 М ТЕАВ. Этот раствор фильтровали через шприцевой фильтр с размером пор 0,2 нм в колбу Corning 20. Продукт очищали посредством ВЭЖХ с помощью колонки С18 с обращенной фазой при использовании смеси ацетонитрил - 0,1 М ТЕАВ. Выход 48% (на основании оптической плотности раствора при вычисленном коэффициенте экстинкции).
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1: Нуклеотиды FFA, меченные AF670POPO и его аналогами, а также ffA-NR650C5, подвергали испытаниям с помощью модифицированных систем секвенирования Illumina HiseqX, в которых применяли увеличивающуюся приблизительно на 33% энергию возбуждения обоих лазеров (красного и зеленого) в цикле 101 и 251 для прочтений 1 и 2, соответственно (см. сигналы на Фиг. 1).
Фиг. 2: В случае ffA-NR650C5 (Фиг. 2) неожиданно было обнаружено, что изменение красных сигналов не пропорционально изменению мощности красного лазера. Вследствие этого изменялась форма диаграмм разброса разделения оснований в цикле 101. Верхняя правая окружность приближалась к верхней левой окружности, что указывает на то, что соответствующие метки сложнее различить. Наблюдаемое явление указывает на то, что NR650C5, вероятно, достигает фотонасыщения или близок к фотонасыщению при максимальной плотности энергии, применяемой в HiSeqX. Такое изменение диаграммы разброса отрицательно влияет на качество секвенирования. Интересно отметить, что при использовании AF670POPO и его аналогов наблюдалось заметное улучшение. Их сигналы увеличивались пропорционально изменению плотности энергии лазера. Диаграммы разброса сохраняли границы раздела и форму от цикла 100 до цикла 101, когда достигался максимум мощности (Фиг. 2). Верхняя правая окружность на Фиг. 2 находится дальше от верхней левой окружности, чем верхняя правая окружность на Фиг. 1. Таким образом, метки лучше разделены на Фиг. 2.
Фиг. 3: На примере аналогов, имеющих полосу поглощения при 550 нм, интересно отметить, что присутствие гидроксила в фенильном цикле негативно влияло на интенсивность флуоресценции (Фиг. 3). Флуоресценция AF550POPS0 в отсутствие фенольного ОН была в 3 раза выше, чем у AF550POPOS0, имеющего группу ОН.
Фиг. 4: Эти новые аналоги позволяют моделировать и оптимизировать распределение на диаграмме разброса, применяемой в секвенировании. Например, если Т помечен AF550POPOS0, и А помечен смесью AF670POPO и NR550S0, то получают хорошую квадратную диаграмму разброса (Фиг. 4а). Дополнительная замена NR550S0 на AF550POPS0 для зеленого А привела к получению практически квадратной диаграммы разброса (Фиг. 4b).
Фиг. 5: На основании полученных новых свойств ffT-LN3-AF550POPOS0 и ffA-LN3-AF670POPO применяли для секвенирования человеческой матрицы с помощью модифицированного устройства HiSeqX. Было произведено высококачественное секвенирование 2×150 bp (сокращение от англ. base pair, что означает "пара оснований") с частотой появления ошибок <1% для прочтения 1 и с частотой появления ошибок <1,5% для прочтения 2 (основные параметры секвенирования показаны на Фиг. 5). Диаграммы разброса, полученные с помощью меток согласно предшествующему уровню техники, показывают, что прочтение при 2×150 bp не может быть завершено.
Реферат
Настоящее изобретение относится соединению формулы (I) или его мезомерным формам:где mCat+ или mAn- представляет собой органический или неорганический положительно/отрицательно заряженный противоион, и m представляет собой целое число, составляющее от 0 до 2; р представляет собой целое число, составляющее от 1 до 2; q представляет собой целое число, составляющее от 1 до 5; alk представляет собой углеродную цепочку, содержащую от 1 до 5 атомов углерода; Y представляет собой О или СН; Z представляет собой ОН; n представляет собой 0 или 1; X представляет собой ОН или О; Raпредставляет собой SOили дополнительный С-цикл, сконденсированный с соседним атомом углерода, где дополнительный цикл содержит SO; Raпредставляет собой Н; Rcпредставляет собой С-Салкил; Rcпредставляет собой С-Салкил или группу С-Салкилсульфоновой кислоты. Также предложены применение соединения формулы (I) для мечения нуклеотида или олигонуклеотида и применение нуклеотида. Предложенные соединения могут быть применены в качестве флуоресцентных меток для нуклеотидов, применяемых при секвенировании нуклеиновых кислот. 3 н. и 18 з.п. ф-лы, 5 ил., 2 табл.
Формула
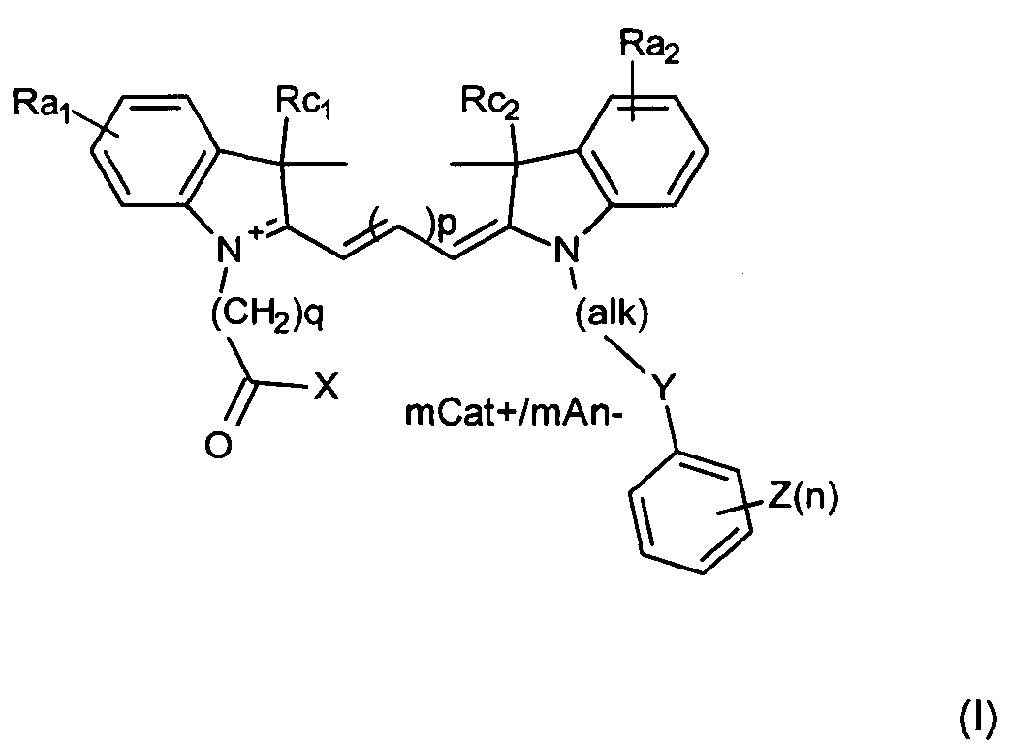


Комментарии