Производные циклопентан- или циклопентен -β- аминокислот и их соли, композиция, активная в отношении штаммов s.aureus candida и trichophyton - RU2126379C1
Код документа: RU2126379C1
Чертежи



Описание
Изобретение относится к новым
химическим соединениям с ценными свойствами, в частности к производным циклопентан- или циклопентен-β-аминокислот общей формулы (I)

где A, B, D, E, G, L, M и T одинаковые или различные и означают водород, галоген, гидроксил, линейный или разветвленный алкил с 1 - 8 атомами углерода, который может быть замещен галогеном, гидроксилом, фенилом, бензилокси- или карбоксигруппой или группой формулы -NR4R5, где R4 и R5 одинаковые или различные и означают водород, фенил или линейный или разветвленный алкил с 1 - 6 атомами углерода,
причем по меньшей мере один из заместителей A, B, D, E, L, M и T не означает водород,
или B и D, E и G или L и M соответственно вместе означают остаток формулы

где R6 и R7 одинаковые или различные и означают водород, галоген, линейный или разветвленный алкил с 1 - 8 атомами углерода, бензил или фенил, или E и G или B и D вместе означают остаток =0,
R1 означает водород или линейный или разветвленный алкил с 1 - 8 атомами углерода,
R2 означает водород, аминозащитную группу, линейный или разветвленный алкил с 1 - 8 атомами углерода, который может быть замещен формилом или линейным или разветвленным ацилом с 1 - 6 атомами углерода, или фенилом или бензоилом, линейный или разветвленный ацил с 1 - 8 атомами углерода, бензоил или остаток аминокислоты формулы

где R9 означает водород или циклоалкил с 3 - 8 атомами углерода, линейный или разветвленный алкил с 1 - 8 атомами углерода, который может быть замещен группой формулы -NR11R12 или R13-OC-, где R11 и R12 независимо друг от друга означают водород, линейный или разветвленный алкил с 1 - 8 атомами углерода или фенил, R13 означает гидросил, бензиокси, алкокси с 1 - 6 атомами углерода, R10 означает водород или аминозамещенную группу,
R3 - означает водород, линейный или разветвленный алкил с 1 - 8 атомами углерода, возможно замещенный фенилом,
и их соли.
Под солями понимают, в частности, кислотно-аддитивные соли. Предпочтительными являются физиологически переносимые соли.
К кислотам, образующим соли, относятся предпочтительно галоидводородные кислоты, как, например, хлористоводородная кислота и бромистоводородная кислота, в частности хлористоводородная кислота, далее фосфорная кислота, азотная кислота, серная кислота, моно- и бифункциональные карбоновые кислоты и гидроксикарбоновые кислоты, как, например, уксусная кислота, малеиновая кислота, малоновая кислота, щавелевая кислота, глюконовая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, салициловая кислота, сорбиновая и молочная кислоты, а также сульфокислоты, как, например, п-толуолсульфокислота, 1,5-нафталиндисульфокислота или камфарсульфокислота.
Защитными группами в рамках настоящего изобретения являются обычно используемые в пептидной химии остатки.
К ним относятся бензилоксикарбонил, 3,4-диметоксибензилкарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 4-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, аллилоксикарбонил, винилоксикарбонил, 2-нитробензилоксикарбонил, 3,4, 5-триметоксибензилоксикарбонил, фталоил, 2,2,2-трихлорэтоксикарбонил, 2,2,2-трихлор-трет. бутоксикарбонил, ментилоксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, формил, ацетил, пропионил, пивалоил, 2-хлорацетил, 2-бромацетил, 2,2,2-трифторацетил, 2,2,2-трихлорацетил, бензоил, бензил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил, фталимидогруппу, изовалероил или бензилоксиметилен, 4-нитробензил, 2,4-динитробензил, 4-нитрофенил или 2-нитрофенилсульфенил.
Предлагаемые соединения могут существовать в стереоизомерных формах, которые имеются в виде изображения и зеркального изображения (энантиомеры) или не имеются в виде изображения и зеркального изображения (диастереомеры), предпочтительно в виде смеси диастереомеров или в виде чистых цис- или транс-изомеров. Изобретение относится также к антиподам, рацематам, смесям диастереомеров, а также чистым изомерам. Рацематные формы, также как и диастереомеры, можно разделять известным способом на чистые стереоизомерные компоненты. Разделение на чистые стереоизомеры проводят, например, путем хроматографического расщепления рацематов диастереомерных эфиров и амидов на оптически активных фазах. Кроме того, возможна кристаллизация диастереомерных солей.
Предпочтительными являются соединения общей формулы (I),
где A, B, D, E, G, L, M и T одинаковые или различные и
означают водород, галоген, гидроксил или линейный или разветвленный алкил с 1 - 6 атомами углерода, который может быть замещен галогеном, гидроксилом, бензилоксигруппой или группой формулы -NR4R5, где R4 и R5 одинаковые или различные и означают водород или линейный или разветвленный алкил с 1 - 4 атомами углерода, причем по меньшей мере один из
вышеуказанных заместителей A, B, D, E, G, L, M и T не означает водород,
или B и D, E и G или L и M соответственно вместе означают остаток формулы
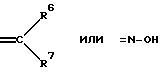
где R6 и R7 одинаковые или различные и означают водород, фтор, хлор, бром, линейный или разветвленный алкил с 1 - 6 атомами углерода, бензил или фенил, или E и G или B и D вместе означают остаток =0,
R1 означает водород или линейный или разветвленный алкил с 1 - 6 атомами углерода,
R2 означает водород, трет.бутоксикарбонил, бензил, 9-флуоренилметилоксикарбонил, линейный или разветвленный алкил с 1 - 6 атомами углерода, который может быть замещен формилом, линейным или разветвленным ацилом с 1 - 4 атомами углерода, фенилом или бензилом, линейный или разветвленный ацил с 1 - 6 атомами углерода, бензоил или остаток аминокислоты формулы
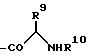
где R9 означает водород, линейный или разветвленный алкил с 1 - 6 атомами углерода, R10 означает водород, трет.бутоксикарбонил, флуоренил-9-метоксикарбонил,
R3 означает водород, линейный или разветвленный алкил с 1 - 6 атомами углерода или бензил,
и их соли.
Особенно предпочтительными являются соединения формулы (I),
где A, B, D, E, G, L, M и T одинаковые или различные и означают водород, фтор, хлор, бром, гидроксил или линейный или разветвленный
алкил с 1 - 4 атомами углерода, который может быть замещен гидроксилом или бензилоксилом,
причем по меньшей мере один из вышеуказанных заместителей не означает водород,
или B и D, Е
и G или L и M соответственно вместе означают остаток формулы

где R6 и R7 одинаковые или различные и означают водород, фтор, хлор, бром, линейный или разветвленный алкил с 1 - 4 атомами углерода, или фенил, или E и G, или B и D соответственно вместе означают остаток =0,
R1 означает водород или линейный или разветвленный алкил с 1 - 4 атомами углерода,
R2 означает водород, бензил, трет.бутоксикарбонил, 9-флуоренилметоксикарбонил, линейный или разветвленный алкил с 1 - 4 атомами углерода, линейный или разветвленный ацил с 1 - 4 атомами углерода или остаток аминокислоты формулы
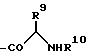
где R9 означает водород, линейный или разветвленный алкил с 1 - 4 атомами углерода, R10 означает водород, трет.бутоксикарбонил или 9-флуоренилметоксикарбонил,
R3 означает водород или линейный или разветвленный алкил с 1 - 4 атомами углерода,
и их соли.
Новые соединения общей формулы (I) можно получать способами-аналогами, например следующими способами.
а) Соединения общей формулы (II)

где A, B, D, L, M и T имеют указанное выше значение, переводят в органическом растворителе, предпочтительно диоксане, сначала с (С1 -С3)-триалкилсилилазидами, затем с эфирами, в присутствии воды в соединения общей формулы (III)

где A, B, D, L, M и T имеют указанное выше значение, и в следующей стадии при помощи кислот, предпочтительно соляной кислоты, переводят с раскрыванием кольца в соединения общей формулы (Ia)

где A, B, D, L, M и T имеют вышеуказанное значение,
с последующим выделением, при необходимости, кислотами, предпочтительно соляной кислотой, или
б) соединения общей формулы (IV)
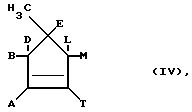
где A, B, D, E, L, M и T имеют указанное выше значение, взаимодействием с хлорсульфонилизоцианатом переводят сначала в соединения общей формулы (V)

где A, B, D, E, L, M и T имеют указанное выше значение,
и затем при помощи кислот, предпочтительно соляной кислоты, с ракрыванием кольца освобождают аминовую и карбоксильную функцию, или
в) соединения общей формулы (VI)

где B, D, E, G, L, M и T имеют указанное выше значение и R15 означает С1-С4-алкил,
взаимодействием с аминами общей формулы (VII)
H2N-R16 (VII),
где R16 означает бензил, который может быть замещен галогеном, нитрогруппой, цианогруппой или алкилом, содержащим до 4 атомов углерода, или остаток формулы -CH(C6H4-nOCH3)2, переводят в органическом растворителе, при необходимости, в присутствии основания в соединения общей формулы (VIII)

где B, D, E, G, L, M, R15 и R16 имеют указанное выше значение,
и затем двукратным гидрированием сначала восстанавливают двойную связь, затем освобождают аминофункцию и в последней операции омыляют кислотой эфир карбоновой кислоты, и получают производные заместителей А - Т, при необходимости с предварительным блокированием аминофункции обработкой защитных групп обычными методами, например окислением, восстановлением или алкилированием, и в случае кислоты омыляют сложный эфир обычными способами, а в случае чистых энантиомеров проводят расщепление рацематов.
Способы могут быть пояснены следующими
схемами:
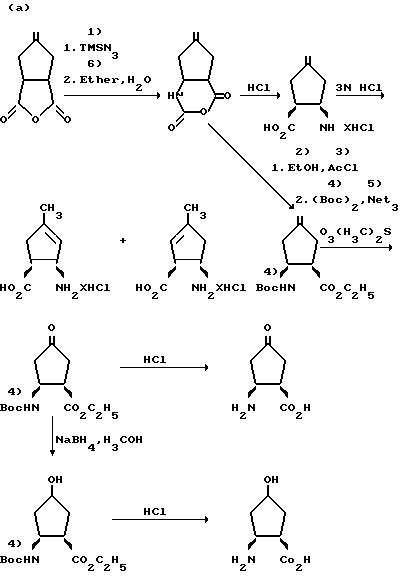

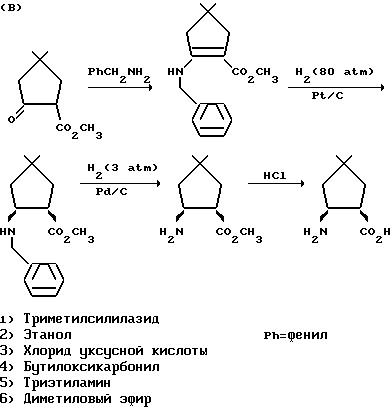
В качестве растворителя для отдельных путей синтеза а), б), в) можно использовать воду и все инертные органические растворители, не изменяющиеся в условиях реакции. К ним относятся спирты, например метанол, этанол, пропанол, изопропанол, простые эфиры, как, например, простой диэтиловый эфир, диоксан, диизопропиловый эфир, тетрагидрофуран, монометиловый и диметиловый эфиры гликоля, галогенированные углеводороды, как хлороформ или метиленхлорид, или амиды, как, например, диметилформамид, диметилацетамид или триамид гексаметилфосфорной кислоты, или ледяную уксусную кислоту, диметилсульфоксид, ацетонитрил или пиридин. Предпочтительными являются диизопропиловый эфир, диэтиловый эфир, диоксан, метанол, этанол и дихлорметан.
Температура реакции варьируется в широком интервале. В основном работают при температуре от -78oС до +150o С, предпочтительно от -10oС до +100oС.
Взаимодействие проводят при нормальном давлении, а также при повышенном или пониженном давлении (например 0,5 - 80 бар). В основном работают при нормальном давлении или при повышенном давлении от 3 до 80 бар.
При осуществлении вариантов способа а), б) и в) соотношение участвующих в реакции веществ может быть любым. В основном работают, однако, с молярными соотношениями реагентов. Выделение и очистку соединений согласно изобретению проводят предпочтительно таким образом, что отгоняют в вакууме растворитель и полученный, при необходимости, после охлаждения льдом кристаллический остаток перекристаллизовывают из подходящего растворителя. В некоторых случаях может быть необходимым полученные соединения очищать хроматографией.
В качестве окислителя пригодны, например, перекись водорода, периодат натрия, надкислоты, как м-хлорпербензойная кислота, или перманганат калия. Предпочтительным является перекись водорода, м-хлорпербензойная кислота и периодат натрия.
В качестве оснований годятся органические амины (триалкил(С1-С6)амины), например триэтиламин, или гетероциклы, как пиридин, метилпиперидин, пиперидин или морфолин. Предпочтительным является триэтиламин.
В качестве кислот для раскрытия кольца (V) пригодны в основном минеральные кислоты. Предпочтительными являются хлористоводородная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота или смеси названных кислот. Предпочтительной является хлористоводородная кислота.
В качестве кислот для деблокирования (III) пригодны С1-С6-карбоновые кислоты, например уксусная или пропионовая. Предпочтительной является уксусная кислота.
Кислоты применяются в основном в количестве 2 - 30 моль, предпочтительно 5 - 15 моль, в расчете на 1 моль соединения формулы (III) или (V).
Омыление сложного эфира карбоновой кислоты проводят обычными способами, обрабатывая эфир в инертном органическом растворителе обычными основаниями, причем образовавшиеся сначала соли могут быть переведены обработкой кислотой в свободные карбоновые кислоты.
Омыление эфира карбоновой кислоты может быть проведено с одной из вышеназванных кислот.
В качестве основания можно использовать обычно используемые для омыления неорганические основания. Предпочтительно используют гидроокиси щелочных или щелочно-земельных металлов, как, например, гидроокись натрия, калия или бария, или карбонаты щелочных металлов, как, например, карбонат натрия или калия, или бикарбонат натрия, или алкоголяты, например метилат или этилат натрия, метилат или этилат калия или трет.бутилат калия. Особенно предпочтительно используют гидроокись натрия или калия.
В качестве растворителя при омылении можно использовать воду или органические растворители, обычно используемые для омыления. Предпочтительно используют спирты, как, например, метанол, этанол, пропанол, изопропанол или бутанол, простые эфиры, как, например, тетрагидрофуран или диоксан, диметилформамид или диметилсульфоксид. Особенно предпочтительно используют спирты как, например, метанол, этанол, пропанол или изопропанол. Также возможно использовать смеси указанных растворителей.
Обычно омыление осуществляют при температуре от 0oС до +100oС, предпочтительно от +20oС до +80oС.
Обычно омыление осуществляют под атмосферным давлением. Однако также возможно осуществлять его под повышенным или пониженным давлением, например под давлением от 0,5 до 5 бар.
При осуществлении омыления основание или кислоту обычно используют в количестве от 1 до 3 моль, предпочтительно от 1 до 1,5 моль, в пересчете на 1 моль сложного эфира. Особенно предпочтительно используют молярное количество реагентов.
При проведении реакции сначала получают соли предлагаемых соединений в качестве промежуточных продуктов, которые можно выделять. Предлагаемые кислоты получают путем обработки карбоксилатов обычными неорганическими кислотами. К ним предпочтительно принадлежат минеральные кислоты, как, например, хлористоводородная кислота, бромистоводородная кислота, серная кислота или фосфорная кислота. При этом при получении карбоновых кислот целесообразным оказалось подкисление основной реакционной смеси омыления на второй стадии без выделения карбоксилатов. Затем кислоты можно выделять известными приемами.
Кислотно-аддитивные соли соединений формулы (I) могут быть просто получены обычными способами, например растворением соединения формулы (I) в подходящем растворителе и добавлением кислоты, например хлористоводородной, выделены известным способом, например фильтрацией, и при необходимости очищены промывкой инертным органическим растворителем.
Отщепление аминозащитных групп происходит известным способом.
Перевод двойных связей в карбонильные функции происходит озонолизом и восстановлением озонида восстановительным агентом, например диметилсульфоксидом, цинком или (С1-С3)-триалкилфосфином.
Восстановление алкоксикарбонильных соединений или альдегидов до соответствующих спиртов обычно проводят гидридами, как, например, боргидридом натрия или калия, предпочтительно боргидридом натрия, в среде инертных растворителей, как, например, простых эфиров, углеводородов или спиртов или в среде их смесей, предпочтительно в среде простых эфиров, как, например, простого диэтилового эфира, тетрагидрофурана или диоксана, или спиртов, как, например, этанола, в случае альдегидов предпочтительно боргидридом натрия в этаноле, при температуре 0oС - 150oС, предпочтительно 20 - 100oС, при атмосферном давлении.
Введение двойных связей происходит в основном переводом спиртов в соответствующие мезилаты, тозилаты, бромиды, иодиды или арилселенильные соединения предпочтительно с 2-нитрофенилселеноцианатом и три-н-бутилфосфином и последующим отщеплением отходящих групп основаниями, предпочтительно одним из вышеприведенных органических атомов, или отщеплением селенильных групп окислением предпочтительно перекисью водорода в смеси воды и тетрагидрофурана.
В качестве растворителей для алкилирования пригодны все обычные органические растворители, не меняющиеся в условиях реакции. К ним предпочтительно принадлежат простые эфиры, как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир, или углеводороды, такие, как, например, бензол, толуол, ксилол, гексан, циклогексан, или нефтяные фракции, или галогенированные углеводороды, такие, как, например, дихлорметан, трихлорметан, тетрахлорметан, дихлорэтилен, трихлорэтилен или хлорбензол, или сложный этиловый эфир уксусной кислоты, триэтиламин, пиридин, диметилсульфоксид, диметилформамид, амид гексаметилфосфорной кислоты, ацетонитрил, ацетон или нитрометан. Кроме того, можно также использовать смеси упомянутых растворителей. Предпочтительно используют дихлорметан.
Алкилирование проводят в указанных выше растворителях при температуре от 0oС до +150oС, предпочтительно при комнатной температуре и до +100oС, при нормальном давлении.
Гидрирование (восстановление, отщепление защитных групп) проходит в основном в одном из вышеприведенных растворителей, таких как спирты, например метанол, этанол или пропанол, в присутствии в качестве катализатора редкого металла, такого как платина, платина на угле, палладий, палладий на животном угле или никель Ренея, в случае двойной связи соединения общей формулы (VIII) предпочтительным является гидрирование водородом с платиной или палладием.
В качестве катализатора применяются в основном кислоты. К ним относятся предпочтительно неорганические кислоты, например соляная или серная кислота, или органические сульфо- или карбоновые кислоты, например метансульфокислота, этансульфокислота, бензолсульфокислота, толуолсульфокислота, уксусная или пропионовая кислота.
Гидрирование проводят при нормальном, повышенном или пониженном давлении (например 0,5 - 5 бар).
Катализаторы и основания применяют в основном в количестве 0 - 10 моль, предпочтительно 1,5 - 3,5 моль, в пересчете на 1 моль соединений общих формул (IV), (V), (VI) или (VIII).
Кислоты применяют в основном в количестве 2 - 30 моль, предпочтительно 5 - 15 моль, в пересчете на 1 моль соединений общих формул (IV), (V), (VI) или (VIII).
Соединения общих формул (II) большей частью являются новыми и могут быть получены, например, тем, что соединения общей формулы (IX)

где A, B, D, L, M и T имеют указанное выше значение,
переводят в соответствующие дикарбоновые кислоты сначала щелочным омылением, предпочтительно гидроокисью лития в воде в одном из вышеприведенных растворителей, предпочтительно тетрагидрофуране, с последующей обработкой ангидридом пропионовой кислоты.
Соединения общей формулы (IX) являются известными или могут быть получены известными способами (см. H.J. Gais, J. Org. Chem. 1989, 54, 5115).
Соединения общих формул (V) и (VIII) являются новыми и могут быть получены одним из вышеприведенных способов.
Соединения общей формулы (IV) сами по себе известны или могут быть получены известными способами.
Соединения общей формулы (VI) большей частью известны или могут быть получены описанным в литературе способом (см. Joc. 1983, 48, 5364; JACS, 1951, 73, 4286; JACS, 1978, 100, 6728).
Амины общей формулы (VII) являются известными и могут быть получены известными способами или имеются в продаже.
Соединения общей формулы (Ia) являются новыми и могут быть получены одним из приведенных выше способов.
Чистые энантиомеры могут быть получены из рацемата тем, что сначала блокируют аминофункцию защитной группой, предпочтительно флуоренил-9-метоксикарбонилом, затем после взаимодействия с хиральными аминами, например фенэтиламином или (-)-хинином, предпочтительно с фенэтиламином, кристаллизуют соответствующие диастереомерные соли и затем отщепляют защитную группу, например, с жидким аммиаком.
Данный способ может быть пояснен следующей схемой:

Дальнейшим объектом изобретения является активная в отношении штаммов S. аureus, Candida и Trichophyton композиция, содержащая соединение вышеприведенной общей формулы (I) или его соль в эффективном количестве и фармацевтически приемлемый носитель.
Активность предлагаемой композиции подтверждается следующими опытами.
Опыт А
Логарифметически
размножающуюся культуру S. аureus 133 разбавляют физиологическим раствором поваренной соли, так чтобы можно было ввести мышам путем инъекции в 0,25 мл 1 • 108 бактерий. Лечение
инфицированных животных происходит спустя 0,5 и 3 часа после заражения. Выживание мышей регистрировали вплоть до 6-го дня после инфицирования. Результаты опыта представлены в таблицах 1 и 2.
Соединение по примеру 32 проявляет по сравнению с необработанным контролем зависящую от дозы терапевтическую активность.
Аналогичным образом были получены приведенные в таблице 3 результаты испытаний. При этом исследуемые соединения давались либо подкожно (далее ПК), либо орально (далее о).
Опыт Б
Путем опыта с градиентом разбавления на
агаровых пластинках с использованием набора Iso-Sensitest фирмы Oxoid определяют минимальную концентрацию торможения (МКТ), достигаемую соединением примера N 32. При этом подготовляют ряд агаровых
пластинок, содержащих активное вещество в снижающихся по двойному разбавлению концентрациях. На агаровые пластинки с помощью прибора Multipoint (фирмы Denley) подают указанные в таблице 4 штаммы,
которые предварительно разбавляют с обспечением содержания по 104 образующих колоний частиц в каждом пятне. Подготовленные таким образом агаровые плитки инкубируют при температуре 37oС, и рост штаммов определяют по истечении примерно 20 часов. Значение МКТ (кг/мл) стоит за минимальную концентрацию активного вещества, при которой невооруженным глазом не наблюдалось роста.
Результаты опыта сведены в таблице 4.
Таблица 4
Значения минимальных концентраций торможения (мкг/мл):
Штамм - МКТ соединения примера N 32 в мкг/мл
S. aureus
133 - 2
S. aureus 48N - <0,25
S. aureus 25085 - 0,5
S. aureus 25701 - 0,5
Опыт В
Аналогично опыту Б определяют МКТ соединения примера N 32 в мг/л в
отношении штаммов, указанных в таблице 5.
Таблица 5
Штамм - МКТ соединения примера N 32 в мг/л
Candida albicans - 0,25
Candida krusei - 1,0
Candida
tropicalis - 4,0
Candida glabrata - 0,4
Trichophyton mentagrophytes - <1
Новое активное вещество может быть известным способом переведено в обычные препаративные
формы, например таблетки, драже, капсулы, пилюли, гранулы, свечи, аэрозоли, сиропы, эмульсии, суспензии и растворы, пасты, мази, гели, кремы, лосьоны, пудру или спрей, с применением инертных,
нетоксичных, фармацевтически пригодных носителей или растворителей. При этом активное вещество должно содержаться в терапевтически активном количестве. Обычно концентрация активного вещества
составляет от 0,1 до 99,9 вес.%, предпочтительно 0,5 - 95 вес. % от общей смеси, т.е. активное вещество содержится в количествах, необходимых для достижения указанного диапазона дозировок.
Активное вещество может быть на одном или нескольких носителях или находиться в микрокапсулированном виде.
Вышеперечисленные фармацевтические композиции могут содержать кроме соединений согласно изобретению также другие фармацевтические соединения.
Препаративные формы могут быть получены путем добавления к активному веществу растворителей и/или носителей, при необходимости, с применением эмульгаторов и/или диспергаторов, причем при использовании воды в качестве разбавителя могут быть использованы органические растворители в качестве вспомогательного растворителя.
Введение препарата происходит обычным способом, предпочтительно орально или парентально, в частности чрезязычно или внутривенно.
В случае парентального введения могут использоваться растворы активного вещества с применением подходящего жидкого носителя.
В основном, для достижения желаемого результата предпочтительным является введение активного вещества в количестве 0,5 - 500, предпочтительно 5 - 100 мг/кг от веса тела каждые 24 часа, при желании в виде многократных доз. Одноразовая доза содержит активное вещество в количестве 1 - 80, в частности 3 - 30 мг/кг веса тела.
Обычно является предпочтительной для достижения эффективного результата при внутривенном введении дозировка 0,001 - 10 мг/кг, предпочтительно 0,01 - 5 мг/кг, а при оральном введении дозировка 0,01 - 25 мг/кг, предпочтительно 0,1 - 10 мг/кг от веса тела.
Также возможны отклонения от указанных количеств в зависимости от веса тела или пути введения, от индивидуального отношения к медикаменту, вида дозировки, времени и интервала введения препарата. Так, в некоторых случаях являются достаточными количества меньше минимальных, а в других случаях - больше максимальных количеств. В случае введения больших количеств является целесообразной многоразовая дозировка в течение дня.
Нижеследующие примеры поясняют получение исходных и промежуточных соединений для получения конечных продуктов формулы (I).
Пример I
1,2-цис-4-метилен-циклопентан-1,2-дикарбоновая кислота

К раствору диэтилового эфира 1,2-цис-4-метилен-циклопентан-1,2-дикарбоновой кислоты (19,0 г; 84 ммоль) в 100 мл тетрагидрофурана прикапывают при 0oС раствор гидрата гидроокиси лития (7,8 г; 185 ммоль) в 150 мл воды. Полученный раствор перемешивают 20 часов при комнатной температуре, удаляют в вакууме тетрагидрофуран и остаток экстрагируют 40 мл этилового эфира. Доводят с помощью 10%-ной соляной кислоты водную фазу до pH 2 и трижды экстрагируют по 200 мл эфиром уксусной кислоты. Объединенные эфирные фазы сушат над сульфатом натрия и растворитель удаляют в вакууме.
Выход: 13,4 г (93% от теории)
Т.пл.: 116 - 120oС
C8H10O4 (М.в. 170,2)
Пример II
Ангидрид 1,2-цис-4-метилен-циклопентан-1,2-дикарбоновой кислоты

Раствор соединения по примеру I (13,0 г; 76,5 ммоль) в 65 мл ангидрида пропионовой кислоты кипятят 3 часа с обратным холодильником. Растворитель удаляют при 60oС/0,5 торр и остаток перегоняют.
Выход: 10,0 г (86% от теории)
Т.кип.: 130 - 140oС/0,1 торр
Т.пл.: 47 - 49oС
C8
H8O3 (М.в. 152,1)
Пример III
6-метилен-циклопентано[3,4-d]оксазин-2,4-(1Н)-дион

Раствор соединения по примеру II (8,8 г, 58 ммоль) и триметилсилилазида (7,9 г, 69 ммоль) в 60 мл нагревают 2 часа при 80oС. Растворитель удаляют в вакууме, остаток вносят в 80 мл эфира и смешивают с водой (0,52 г, 29 ммоль). Смесь интенсивно перемешивают 5 минут и выдерживают 2 дня при 6oС. Выпавший продукт отфильтровывают и промывают диэтиловым эфиром.
Выход: 4,2 г (43% от теории)
Т.пл.: 145oС (разл.)
C8H9NO3 (М.в. 167,2)
Пример IV
Метиловый эфир 1,2-цис-2-N-(трет. бутилоксикарбонил)-амино-4-(2-нитрофенил)-селенил-циклопентан-карбоновой кислоты
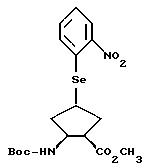
Раствор соединения по примеру 63 (3,30 г; 12,7 ммоль) в 50 мл тетрагидрофурана смешивают в среде аргона с 2-нитрофенилселеноцианатом (3,46 г; 15,2 ммоль) и затем с три-н-бутилфосфином (3,08 г; 15,2 ммоль). Смесь перемешивают 1 час при комнатной температуре, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле (элюент смесь эфира с петролейным эфиром 2 : 1).
Выход: 4,45 г (79% от теории)
Соотношение диастереомеров D1 : D2 = 3 : 1
Rf = 0,28 и 0,39
(эфир/петролейный эфир 2 : 1)
C18H24N2O6Se (М.в. 443,4)
Общее описание получения метиловых эфиров 2-бензиламино-циклопент-1-ен-карбоновой
кислоты

Раствор замещенного метилового эфира 2-гидрокси-циклопентан-карбоновой кислоты (160 ммоль) и бензиламина (34,2 г; 320 ммоль) в 540 мл дихлорметана смешивают с n-толуолсульфокислотой и 108 г молекулярного сита (4А) и нагревают 24 часа до кипени с обратным холодильником с водоотделителем. Смесь фильтруют и фильтрат сгущают в вакууме. Остаток хроматографируют на силикагеле.
Пример V
Метиловый эфир 2-бензиламино-4,
4-диметил-циклопент-1-ен-карбоновой кислоты

Аналогично вышеприведенной прописи получают целевое соединение.
Выход: 30,0 г (72% от теории)
Rf = 0,49 (петролейный эфир/эфир уксусной кислоты 3 : 1)
C16H21NO3 (М.в.
259,3)
Пример VI
Метиловый эфир 2-бензиламино-5-метил-циклопент-1-ен-карбоновой кислоты
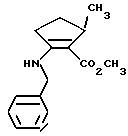
Аналогично вышеприведенной прописи получают целевое соединение.
Выход: 27,9 г (71% от теории)
Rf = 0,42 (эфир/петролейный эфир 5 : 1)
C15H19NO2 (М.в. 245,3)
Пример VII
Метиловый эфир 2-бензиламино-3-метил-циклопент-1-ен-карбоновой кислоты

Аналогично вышеприведенной прописки получают целевое соединение.
Выход: 20,0 г (51% от теории)
Rf = 0,45
(эфир/петролейный эфир 5 : 1)
C15H19NO2 (М.в. 245,3)
Пример VIII
Диэтиловый эфир 4-этилиден-циклопентан-1,2-дикарбоновой кислоты

К раствору трет.бутанолята калия (24,8; 220 ммоль) в 1000 мл диэтилового эфира прибавляют при комнатной температуре в среде аргона этил-трифенилфосфонийбромид (100 г; 270 ммоль) и перемешивают 20 часов при комнатной температуре. При 0oС прикапывают раствор диэтилового эфира 4-циклопентанон-1,2-дикарбоновой кислоты (15,8; 69 ммоль) в 120 мл диэтилового эфира и перемешивают 1 час при 0oС. Смешивают с 300 мл воды, промывают органическую фазу насыщенным раствором поваренной соли, сушат над сульфатом натрия, фильтруют и удаляют в вакууме растворитель. Остаток хроматографируют на силикагеле (петролейный эфир/эфир 2 : 1).
Выход: 13,1 г (79% от теории) смеси цис/транс-диастереомеров.
1Н-ЯМР (дейт. хлороформ): б = 1,23 (т, 6Н), 1,58 (м, 3Н), 2,3 - 2,6 (м, 4Н), 3,0 - 3,22 (м, 2Н), 4,17 (кв, 4Н), 5,35 (см, 1Н)
С13H20O4
Пример IX
4-этилиден-циклопентан-1,2-дикарбоновая кислота

К раствору соединения по примеру VIII (13,1 г; 54,5 ммоль) в 70 мл тетрагидрофурана прикапывают при 0oС раствор гидрата гидроокиси лития (51,1 г; 120 ммоль) в 130 мл воды. Раствор перемешивают 20 часов при комнатной температуре, удаляют в вакууме тетрагидрофуран и остаток экстрагируют один раз с 40 мл эфира. Водную фазу доводят 10%-ной соляной кислотой до значения pH 2 и трижды экстрагируют по 200 мл эфира уксусной кислоты. Объединенные уксусно-эфирные фазы сушат над сульфатом натрия и растворитель удаляют в вакууме.
Выход:
9,0г (90% от теории) смеси диастереомеров
Т.пл.: 170oС
С9H12O4 (М.в. 184,2)
Пример X
Ангидрид 1,
2-цис-4-этилиден-циклопентан-1,2-дикарбоновой кислоты

Раствор соединения по примеру IX (8,25 г; 44,7 ммоль) в 37 мл ангидрида пропионовой кислоты кипятят 3 часа с обратным холодильником. Растворитель удаляют при 60oС/0,5 торр и остаток перегоняют.
Выход: 2,0 г (27%
от теории)
Т.пл.: 150oС/0,1 торр (перегоняют в шариковой трубке)
С9H18O2 (М.в. 166,2)
Пример XI
6-этилиден-циклопентан[3,
4-d]оксазин-2,4-(1Н)-дион

Раствор соединения по примеру X (2,0 г; 12,0 ммоль) и триметилсилилазида (1,66 г; 14,4 ммоль) в 12 мл диоксана нагревают 2 часа при 80oС. Растворитель удаляют в вакууме, остаток вносят в 13 мл эфира и смешивают с водой (0,22 г; 12 ммоль). Смесь интенсивно перемешивают 5 минут и выдерживают 3 часа при 6oС. Выпавший продукт отфильтровывают и промывают эфиром.
Выход: 0,48г (22% от теории) диастереозомерной
смеси
Т.пл.: > 250oС (разл.)
С9H11NO3 (М.в. 181,2)
Пример XII
Диэтиловый эфир 4-бензилиден-циклопентан-1,
2-дикарбоновой кислоты

К раствору трет. бутанолята калия (22,0 г; 196 ммоль) в 1200 мл диэтилового эфира прибавляют при комнатной температуре в среде аргона хлорид бензил-трифенилфосфония (95,4 г; 245 ммоль) и перемешивают 4 часа при комнатной температуре. В заключение прикапывают раствор диэтилового эфира 4-циклопентанон-1,2-дикарбоновой кислоты (14,0 г; 61,3 ммоль) при 0oС и кипятят с обратным холодильником 8 дней. Дальнейшая обработка происходит аналогично примеру VIII.
Выход: 15,9 г (86% от теории) цис/транс-изомеры
Rf = 0,37; 0,43 (петролейный эфир/эфир 5 : 1)
1Н-ЯМР (дейт. хлороформ) : δ = 1,25
(2m, 6H), 2,70 - 3,35 (м, 6Н), 4,17 (кв., 4Н), 6,38 (см, 1Н), 7,12 - 7,40 (м, 5Н)
С18H22O4 (М.в. 302,37)
Пример XIII
4-бензилиден-циклопента-1,2-дикарбоновая кислота

Целевое соединение получают аналогично примеру IX.
Выход: 12,8 г (100%)
Т.пл.: 172oС
С14H14O4 (М.в. 246,26)
Пример XIV
Диэтиловый эфир 1,
2-цис-4-дифторметилен-циклопентан-1,2-дикарбоновой кислоты

К раствору диэтилового эфира 1, 2-цис-4-циклопентанон-1,2-дикарбоновой кислоты (20,0 г; 87,6 ммоль) и дибромдифторметана (36,8 г; 175 ммоль) в тетрагидрофуране (400 мл) прикапывают при 0oС в среде аргона в течение 30 мин трис-(диметиламино)-фосфин (57,1 г; 350 ммоль). Медленно нагревают до комнатной температуры и еще час перемешивают при этой температуре. Смешивают с триэтиламином (17,6 г; 175 ммоль) и перемешивают 15 часов при комнатной температуре. После добавления 500 мл воды реакционную смесь экстрагируют диэтиловым эфиром (3 x 500 мл) и объединенные органические фазы промывают насыщенным раствором поваренной соли (2 х 300 мл), сушат над сульфатом натрия и сгущают в вакууме. Остаток хроматографируют на силикагеле (петролейный эфир/диэтиловый эфир 1 : 1).
Выход: 5,93 г (27% от теории)
1Н-ЯМР (дейт. хлороформ) : δ = 1,28 (т, 6H), 2,55 - 2,90 (4Н), 3,17 (дт. , 2Н), 4,17 (кв., 4Н)
С12H16F2O4 (М.в. 262,4)
Пример XV
1,2-цис-4-дифторметилен-циклопентан-1,2-дикарбоновая кислота

Целевое соединение получают аналогично примеру IX.
Выход: 3,86 г (85% от теории)
Т.пл.: 147 - 149oС
С8H8F2O4 (М.в. 206,
1)
Пример XVI
Ангидрид 4-дифторметилен-циклопентан-1,2-дикарбоновой кислоты

Целевое соединение получают аналогично примеру X.
Выход: 2,25 г (65% от теории)
Т.пл.: 140 - 145oС/0,05 мбар (отгонка с шариковой трубкой)
С8
H6F2O3 (М.в. 188,1)
Пример XVII
6-дифторметилен-циклопентано[3,4-d]оксазин-2,4-(1Н)-дион

Целевое соединение получают аналогично примеру XI.
Выход: 1,40 г (59% от теории)
Т.пл.: 130oС (разл.)
С8H7F2NO3 (М.в. 203,1)
Пример XVIII
Диэтиловый эфир 4,4-дифтор-циклопентан-1,2-дикарбоновой кислоты
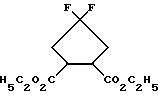
К раствору диэтилового эфира 4-циклопентанон-1,2-дикарбоновой кислоты (6,43 г; 28,2 ммоль) в 100 мл толуола прикапывают при 0oС диэтиламинотрифторид серы (11,28 г; 70 ммоль) и перемешивают 5 дней при комнатной температуре. Раствор выливают в ледяную воду, экстрагируют уксусным эфиром (2 х 200 мл), сушат органическую фазу над сульфатом натрия и удаляют растворитель в вакууме. Остаток хроматографируют на силикагеле (петролейный эфир/диэтиловый эфир 1: 1).
Выход: 3,79 г (56% от теории) диастереомерной смеси.
Rf = 0,65 (петролейный эфир/диэтиловый эфир 1 : 1)
1Н-ЯМР (дейтер. хлороформ) : δ = 1,28 (т, 6Н), 2,52 (см, 4Н), 3,29 (см,
2Н), 4,18 (кв, 4Н)
С11H16O4F2 (М.в. 250,2)
Пример XIX
4,4-дифтор-циклопентан-1,2-дикарбоновая кислота
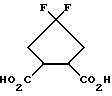
Целевое соединение получают аналогично примеру XI.
Выход: 4,40 г (77% от теории)
Т.пл.: 128oС
С7H8O4F2 (М.в. 194,1)
Пример XX
Ангидрид 4,4-дифтор-циклопентан-1,2-дикарбоновой кислоты

Целевое соединение получают аналогично примеру X.
Выход: 2,90 г (75% от теории)
Т. кип.: 150oC/0,15 мбар (перегонка в шариковой трубке)
С7H6F2O3 (М. в. 176,12)
Пример XXI
6,6-дифтор-циклопентано[3,
4-d]оксазин-2,4-(1Н)-дион

Целевое соединение получают аналогично примеру XI.
Выход: 2,33 г (74% от теории)
Т. пл.: 116oC (разл.)
С7H7F2NO3 (М. в. 191,1)
Пример XXII
Этиловый
эфир-3-бензилоксиметил-циклопентан-2-он-1-карбоновой кислоты

К раствору диизопропиламина лития (138 ммоль) в 300 мл тетрагидрофурана прикапывают при -78oC в среде аргона раствор 2-бензилоксиметил-циклопентан-2-она (23,5 г; 115 ммоль) в 100 мл тетрагидрофурана и перемешивают 30 мин при -78oC и 10 мин при -40oC. При -78oC прикапывают 1,3-диметилтетрагидро-2-(1Н)-пиримидон (14,7 г; 115 ммоль) и прикапывают затем полученный раствор при -78oC к раствору этилового эфира цианмуравьиной кислоты (22,8 г; 230 ммоль). Через 10 мин выливают реакционную смесь в 200 мл воды, удаляют в вакууме тетрагидрофуран и вносят остаток в 1100 мл диэтилового эфира. Органическую фазу промывают водой (3 х 10 мл), сушат над сульфатом натрия и сгущают в вакууме. Остаток хроматографируют на силикагеле (петролейный эфир/диэтиловый эфир 2 : 1).
Выход: 19,3 г (61% от теории)
Rf=0,34 (петролейный эфир/диэтиловый эфир 2 : 1)
С16H20O4 (М. в. 276,3)
Пример XXIII
Этиловый эфир-2-бензиламино-3-бензилоксиметил-циклопент-1-ен-1-карбоновой кислоты

Ph =фенил
Целевое соединение получают аналогично примеру V исходя из соединения по примеру XXII.
Выход: 14,2 г (54% от теории)
Rf=0,62 (петролейный
эфир/диэтиловый эфир 2 : 1)
С24H27NO3 (М. в. 377,48)
Нижеследующие примеры поясняют получение конечных продуктов формулы (I).
Пример
1
Гидрохлорид этилового эфира 1,2-цис-2-амино-4-метилен-циклопентан-1-карбоновой кислоты

К раствору соединения по примеру III (3,90 г; 23,3 ммоль) в 48 мл этилового спирта прикапывают ацетилхлорид (3,01 г; 38,4 ммоль). Раствор перемешивают 20 часов при комнатной температуре
Выход: 4,79 г (100%)
Rf=0,48 (эфир: ацетонитрил: конц. аммиак 10 : 1: 0,1)
С9H15NO2 x HCI (М. в. 169,2 x 36,5)
Пример 2
Гидрохлорид 1,2-цис-2-амино-4-метилен-циклопентан-1-карбоновой кислоты

Раствор соединения по примеру III (0,500 г; 3,00 ммоль) в 30 мл 0,1 н. моляной кислоты перемешивают 4 часа при комнатной температуре. Растворитель удаляют в вакууме при 30oC и остаток сушат 12 часов при 30oC/0,1 торр.
Выход: 0,513 г (96% от теории)
Т. пл.: 190oC
С7H11NO3 x HCI (М. в. 141,2 х 36,5)
Пример 3
Этиловый эфир 1,2-цис-2-N-(трет. бутилоксикарбонил)-амино-4-метилен-циклопентан-1-карбоновой кислоты

Раствор соединения по примеру 1 (15,4 г; 75,0 ммоль) и триэтиламина (22,8 г; 225 ммоль) в 225 мл дихлорметана смешивают при 0oC с ди-трет.бутилкарбонатом (24,8 г; 112 ммоль) и перемешивают 4 часа при комнатной температуре. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле (эфир/петролейный эфир 1 : 3).
Выход: 18,0 г (91% от теории)
Rf=0,29 (эфир/петролейный эфир 1 : 3)
С14H23NO4 (М. в. 269,3)
Пример 4
Этиловый эфир 1,2-цис-2-N-(трет.
бутилоксикарбонил)амино-4-оксоциклопентан-1-карбоновой кислоты
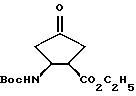
ВОС=бутилоксикарбонил
Через раствор соединения по примеру 3 (18,0 г; 67,0 ммоль) пропускают при -70oC озон до синего окрашивания и в заключение кислород до обесцвечивания. Смешивают с диметилсульфидом (24,8 г; 0, 40 ммоль), нагревают до комнатной температуры и перемешивают при этой температуре еще 2 часа. Растворитель удаляют в вакууме, остаток перемешивают с диизопропиловым эфиром, фильтрируют и промывают диэтиловым эфиром.
Выход: 15,1 г (83% от теории)
Т. пл.: 132oC
С13H21NO5 (М. в. 271,3)
Пример 5
Гидрохлорид этилового эфира 1,2-цис-2-амино-4-оксо-циклопентан-1-карбоновой кислоты
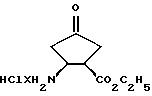
Раствор соединения по примеру 4 (0,980 г; 3,60 ммоль) в 5 мл 4 н. соляной кислоты в растворе диоксана перемешивают 3 часа при комнатной температуре. Растворитель удаляют в вакууме и остаток сушат 20 часов при 50oC/0,1 торр.
Выход: 0,734 г (98% от теории)
1Н-ЯМР (дейтер. диметилсульфоксид): δ/ =1,24 (т, J=7 Гц, 3Н); 2,14-2,80 (м,4Н); 3,49-3,62 (м,1Н); 4,
02-4,28 (м,3Н); 8,53 (с,ш, 3Н)
С8Н13NO3 х HCI ( М. в. 171,2 х 36,5)
Пример 6
Гидрохлорид 1,2-цис-2-амино-4-оксо-циклопентан-1-карбоновой
кислоты

Раствор соединения по примеру 5 (0,500 г; 2,41 ммоль) в 40 мл 3 н. соляной кислоты нагревают 2 часа при 80oC. Растворитель удаляют в вакууме и остаток сушат 20 часов при 50oC/0,1 торр.
Выход: 0,432 г (100%)
1Н-ЯМР (дейтер.
диметилсульфоксид): δ =2,42-2,76 (м,4Н); 3,42-3,56 (м, 1Н); 4,08 (с,ш, 1Н); 8,45 (с,ш, 3Н)
С6H9NO3 x HCI (М. в. 141,3 x 36,5)
Пример 7
Этиловый эфир 1,2-цис-2-N-(трет. бутилоксикарбонил)амино-4-гидрокси-циклопентан-1-карбоновой кислоты

Вос=бутилоксикарбонил
Раствор соединения по примеру 6 (5,00 г; 18,5 ммоль) в 150 мл метанола смешивают при 5oC с боргидридом натрия (0,345 г; 9,0 ммоль) и 1 час перемешивают при комнатной температуре. Растворитель удаляют в вакууме, остаток поглощают водой и экстрагируют метиленхлоридом. Органическую фазу сушат над сульфатом натрия и удаляют в вакууме растворитель.
Выход: 4,9 г (97% от теории)
Соотношение диастереомеров D1 : D2 = 3 : 1
Rf=0,42 и 0,48 (эфир)
С13
H23NO5 (М. в. 273,3)
Пример 8
Гидрохлорид этилового эфира 1,2-цис-2-амино-4-гидрокси-циклопентан-1-карбоновой кислоты

Раствор соединения по примеру 7 (1,10 г; 4,0 ммоль) в 6 мл 4 н. соляной кислоты в диоксане перемешивают 1 час при комнатной температуре. Растворитель удаляют в вакууме и остаток сушат 20 часов при 50oC/0,1 торр.
Выход: 0,82 г (97% от теории)
Соотношение диастереомеров D1 :
D2 = 3 : 1
Масс-спектр (отд.из.): m/z =174 (M+H)
С18H15NO3 x HCI (М. в. 173,2 x 36,5)
Пример 9
Гидрохлорид 1,
2-цис-2-амино-4-гидрокси-циклопентан-1-карбоновой кислоты
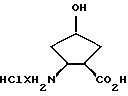
Раствор соединения по примеру 8 (210 мг; 1,0 ммоль) в 13 мл 3 н. соляной кислоты перемешивают 2 часа при 80oC. Растворитель удаляют в вакууме и остаток сушат 20 часов при 50oC/0,1 торр.
Выход:
151 мг (83% от теории)
Соотношение диастереомеров D1 : D2 = 3 : 1
Масс-спектр (отд.из.): m/z =146 (M+H)
С16H11NO3 x
HCI (М. в. 145,2 x 36,5)
Пример 10
Метиловый эфир 1,2-цис-2-бензиламино-4,4-диметилциклопентан-1-карбоновой кислоты

Раствор соединения по примеру VI (8,15 ммоль) в 70 мл этанола смешивают с 1 г платины (5% на активированном угле ) и гидрируют водородом 20 часов при 35oC и давлении 80 бар. Катализатор отфильтровывают, остаток хроматографируют, фильтрат сгущают в вакууме и остаток хроматографируют на силикагеле.
Выход: 2,13 г (51% от
теории)
Rf=0,49 (уксусный эфир/петролейный эфир 1 : 2)
С16H23NO2 (М. в. 261,3)
Пример 11
Метиловый эфир 1,
2-цис-2-бензиламино-5-метил-циклопентан-1-карбоновой кислоты

Аналогично примеру 10 получают целевое соединение.
Выход диастереомера D1 : 0,67 г (33%)
Rf=0,49 (уксусный эфир/петролейный эфир 1 : 2)
Диастереомер D2 =0,59 г
(29%)
Rf=0,34 (уксусный эфир/петролейный эфир 1 : 2)
С15H21NO2 (М. в. 247,34)
Пример 12
Метиловый эфир 1,
2-цис-2-бензиламино-3-метил-циклопентан-1-карбоновой кислоты

Аналогично примеру 10 получают целевое соединение.
Выход: 1,41 г (71% от теории)
Диастереомеры D1 : D2 = 4 : 1
Rf=0,49 и 0,31 (уксусный эфир/петролейный эфир 1 : 4
)
С15H21NO2 (М. в. 247,34)
Пример 13
Гидрохлорид метилового эфира 1,2-цис-2-амино-4,4-диметил-циклопентан-1-карбоновой кислоты

Раствор соединения по примеру 10 (7,70 ммоль) в 77 мл 0,1 н. соляной кислоты (7,70 ммоль), 80 мл воды и 110 мл этанола смешивают с 710 мг палладия (10% на активированном угле) и гидрируют водородом 20 часов при комнатной температуре и 3 бар. Катализатор отфильтровывают, фильтрат сгущают в вакууме и остаток сушат 12 часов при 50oC/0,1 торр.
Выход: 1,52 г (95% от теории)
Т. пл.: 148oC
С9H17NO2 х HCI ( М. в.
171,2 х 36,5)
Пример 14
Гидрохлорид метилового эфира 1,2-цис-2-амино-5-метил-циклопентан-1-карбоновой кислоты

Аналогично примеру 10 получают целевое соединение.
Выход: диастереомер А: 1,43 г (96%), т. пл.: 169oC
диастереомер В: 1,46
г (98%) т. пл.: 64oC .
С8H15NO2 х HCI ( М. в. 157,2 х 36,5)
Пример 15
Гидрохлорид метилового эфира 1,
2-цис-2-амино-3-метил-циклопентан-1-карбоновой кислоты

Аналогично примеру 10 получают целевое соединение.
Выход: 1,50 г (100%)
2 диастереомера D1 : D2 = 4 : 1 .
Rf=0,45 (эфир/ацетонитрил/конц. аммиак 10 : 1 : 0,1)
С8H15NO2 х HCI (М. в. 157,2 х 36,5)
Пример 16
Гидрохлорид 1,2-цис-2-амино-4,4-диметил-циклопентан-1-карбоновой кислоты

Раствор соединения по примеру 13 (4,20 ммоль) в 70 мл 3 н. соляной кислоты кипятят с обратным холодильником 2 часа. Растворитель удаляют в вакууме, остаток промывают тетрагидрофураном и сушат 20 часов при 50oC/0,1 торр.
Выход: 0,81 г (100%)
Т. пл.: 190oC (разл.)
С8H15NO2 х HCI (М. в. 157,2 х 36,5)
Пример 17а и 17б
Гидрохлорид 1,2-цис-2-амино-5-метил-циклопентан-1-карбоновой
кислоты

Аналогично примеру 16 получают целевое соединение.
Выход:
диастереомер А: 0,61 г (81% от теории) (пример 17а)
Т. пл.: 134oC
диастереомер В: 0,73 г (97% от теории) (пример 17б)
Т. пл.: 200oC (разл.)
С7H13NO2 х HCI (М. в. 143,2 х 36,5)
Пример 18
Гидрохлорид 1,2-цис-2-амино-3-метил-циклопентан-1-карбоновой кислоты

Аналогично примеру 16 получают целевое соединение.
Выход: 0,68 г (90%)
Соотношение диастереомеров
D1 : D2 = 4 : 1
Т. пл.: 206oC .
С7H13NO2 х HCI (М. в. 143,2 х 36,5)
Пример 19
Гидрохлорид
1,2-цис-2-амино-2-метил-циклопентан-1-карбоновой кислоты

15 г (0,12 моль) 2-метил-6-азабицикло[3,2,0]гептан-7-она порциями суспендируют в 100 мл концентрированной соляной кислоты и перемешивают суспензию до просветления при 40oC. Раствор экстрагируют диэтиловым эфиром и сгущают водную фазу досуха. После сушки в глубоком вакууме получают 20,7 г (96%) белого твердого вещества.
Т. пл.: 194oC
С7H13NO2 х HCI (М. в. 143 х 36,5)
Пример 20
1,2-цис-2-амино-4-метил-циклопентан-1-карбоновая кислота

3 г (0,024 моль) 4-метил-6-азабицикло[3,2,0] гептан-7-она перемещают вместе с 15 мл конц. солярной кислоты 2 часа при комнатной температуре. После удаления эфира сгущают досуха. Остаток сушат при 40oC в глубоком вакууме.
Выход: 2,9 г (67% от теории)
Т. пл.: 188,5oC
С7H13NO2 х HCI (М. в. 143 х 36,5)
Пример 21
1,2-цис-2-N-(9-флуоренилметилоксикарбонил)амино-4-метилен-циклопентан-1-карбоновая кислота

К раствору соединения по примеру 2 (0,500 г; 2,81 ммоль) в 20 мл 10%-ного водного раствора карбоната натрия прикапывают при 0oC раствор N-(9-флуоренил-метилоксикарбонилокси)-сукцинимида (0,995 г; 2,95 ммоль) в 10 мл диоксана. Смесь перемешивают 12 часов при комнатной температуре и трижды экстрагируют эфиром по 10 мл. Водную фазу при 0oC доводят конц. соляной кислотой до рН 2 и дважды экстрагируют эфиром до 40 мл. Эфирные фазы сушат над сульфатом натрия и удаляют в вакууме растворитель.
Выход:
0,940 г (92% от теории)
Т. пл.: 137oC
С22H21NO4 х HCI (М. в. 363,4)
Пример 22 и Пример 23
1,
2-цис-2-N-(9-флуоренилметилоксикарбонил)амино-4-метил-циклопент-3-ен-1-карбоновая кислота (пример 22)
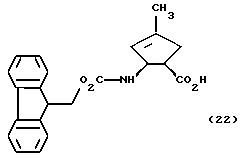
1,2-цис-2-N-(9-флуоренилметилоксикарбонил)амино-4-метил-циклопент-4-ен-1-карбоновая кислота (пример 23)

Раствор соединения по примеру 2 (0,870 г; 4,90 ммоль) в 20 мл 10%-ной соляной кислоты перемешивают 20 часов при комнатной температуре и затем упаривают в вакууме. Остаток растворяют в 25 мл 10%-ного раствора карбоната натрия и смешивают при 0oC с раствором N-(9-флуоренилметилоксикарбонилокси)-сукцинимида (1,65г; 4,30 ммоль) в 15 мл диоксана. Перемешивают 48 часов при комнатной температуре, прибавляют 50 мл воды и дважды экстрагируют эфиром по 20 мл. При 0oC устанавливают рН водной фазы, равное 2, и дважды экстрагируют эфиром по 50 мл. Эфирные фазы сушат над сульфатом натрия, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле (метиленхлорид/метанол 20 : 1).
Выход: 0,211 г (12%) (пример
22)
Rf =0,31 (метиленхлорид/метанол 20 : 1) (пример 22)
Выход: 0,187 г (11%) (пример 23)
Rf =0,28 (метиленхлорид/метанол 20 : 1) (пример 23)
С22H21NO4 х HCI (М. в. 363,4)
Пример 24
1,2-цис-2-амино-4-метил-циклопент-4-ен-1-карбоновая кислота
Раствор соединения по примеру 2 (0,870 г; 4,90 ммоль) в 20 мл 10%-ной соляной кислоты перемешивают 20 часов при комнатной температуре и затем упаривают в вакууме. Остаток растворяют в 8 мл этанола, смешивают с 15 мл эфира и выдерживают 5 дней при 0oC. Выпавший продукт отфильтровывают и промывают эфиром.
Выход: 0,
246 г (28% от теории)
Т. пл.: 196oC
С7H11NO2 х HCI (М. в. 141,2 х 36,5)
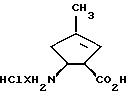
Пример 25
1,
2-цис-2-амино-4-метил-циклопент-4-ен-1-карбоновая кислота

Раствор соединения по примеру 23 (0, 380 г; 1,05 ммоль) в 30 мл жидкого аммиака перемешивают 10 часов. Аммиак отгоняют, смешивают с 50 мл эфира, перемешивают 1 час при комнатной температуре, фильтруют и промывают остаток 20 мл эфира. Остаток вносят в 5 мл воды и 10 мин перемешивают. Фильтруют, промывают 3 мл воды и фильтрат сгущают в вакууме. Остаток перекристаллизовывают из 80%-ного водного этанола.
Выход: 0,082
г (55% от теории)
Т. пл.: 190oC
С7H11NO2 х HCI (М. в. 141,2)
Пример 26
1,
2-цис-2-амино-4-метил-циклопент-3-ен-1-карбоновая
кислота
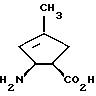
Раствор соединения по примеру 22 (0,410 г; 1,13 ммоль) в 30 мл жидкого аммиака перемешивают 10 часов. Аммиак отгоняют, смешивают с 50 мл эфира, перемешивают 1 час при комнатной температуре, фильтруют и промывают остаток 20 мл эфира. Остаток вносят в 5 мл воды и перемешивают 10 минут. Фильтруют, промывают 3 мл воды и фильтрат сгущают в вакууме. Остаток перекристаллизовывают из 80%-ного водного этанола.
Выход: 0,
112 г (70% от теории)
Т. пл.: 221oC
С7H11NO2 (М. в. 141,2)
Пример 27
Гидрохлорид 1,
2-цис-2-амино-4-метил-циклопент-3-ен-1-карбоновой кислоты

Соединение по примеру 2 (0,110 г; 0, 78 ммоль) растворяют в 7,80 мл (0,78 ммоль) 0,1 н. соляной кислоты. Затем раствор упаривают в вакууме.
Выход: 0,138 г (100% от теории)
Т. пл.: 188oC (разл.)
С7H11NO2 х HCI (М. в. 141,2 х 36,5)
Пример 28
(R)-фенэтиламмониевая соль (+)-1,
2-цис-2-(9-флуоренилметилоксикарбонил)-амино-4-метилен-циклопентан-1-карбоновой кислоты

Раствор соединения по примеру 21 (10,0 г; 27,5 ммоль) в 4,5 мл трет. бутилметилового эфира и 15 мл этанола смешивают с (R )-(+)-фенэтиламином (3,33 г; 27,5 ммоль). Смесь кипятят с обратным холодильником и прикапывают к ней около 80 мл этанола до образования прозрачного раствора. В течение ночи медленно охлаждают до комнатной температуры, отфильтровывают сырой продукт и промывают 20 мл смеси трет.бутилметилового эфира с этанолом 3 : 1. Сырой продукт затем еще раз перекристаллизовывают из 30 мл трет.бутилметилового эфира и 70 мл этанола.
Выход: 3,49 г (26% от
теории)
Т. пл.: 163oC (разл.)
[α] =+17,1 (с=1, метанол)
С20H21NO4 х С8H11N (М. в. 363,4 х 121,2)
Пример 29
(S)-фенэтиламмониевая соль (-)-1,
2-цис-2-(9-флуоренилметилоксикарбонил)-амино-4-метилен-циклопентан-1-карбоновой кислоты

Получение происходит аналогично тому, как описано в примере 28 с использованием (S)-фенэтиламина вместо (R )-фенэтиламина.
Выход: 3,48 г (26% от теории)
Т. пл.: 165oC
[α]
С20H21NO4 х С8H11N (М. в. 363,4 х 121,2)
Пример 30
(-)-1,2-цис-2-(9-флуоренилметилоксикарбонил)амино-4-метилен-циклопентан-1-карбоновая кислота

Соединение по примеру 29 (3,49 г; 7,20 ммоль) суспендируют в 40 мл воды и 40 мл уксусного эфира. Смешивают с 1 н. соляной кислотой до установления рН 2, разделяют фазы и экстрагируют водную фазу 2 раза по 40 мл уксусного эфира. Объединенные эфирные фазы сушат над сульфатом натрия и растворитель удаляют в вакууме.
Выход: 2,46 г (94% от теории)
[α]
Т. пл.: 137oC
Чистота энантиомера = 99,5% (жидкостная хроматография под давлением, Хиральпак АС)
С22H21NO4 (М. в. 363,
4)
Пример 31
(+)-1,2-цис-2-(9-флуоренилметилоксикарбонил)амино-4-метилен-циклопентан-1-карбоновая кислота
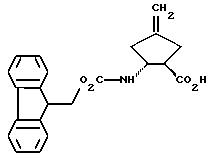
Получение происходит как описано в примере 30.
Выход: 2,46 г (94% от теории)
[α]
Т. пл.: 137oC
Чистота энантиомера = 99,5% (жидкостная хроматография под давлением,
Хиральпак АС)
С22H21NO4 (М. в. 363,4)
Пример 32
Гидрохлорид (-)-1,2-цис-2-амино-4-метилен-циклопентан-1-карбоновой кислоты

Соединение по примеру 31 (1,35 г; 3,71 ммоль) смешивают с 100 мл жидкого аммиака, перемешивают около 10 часов и затем отгоняют аммиак. Остаток смешивают с 120 мл эфира и перемешивают 1 час при комнатной температуре, фильтруют и остаток вносят в 5 мл воды, снова фильтруют, промывают остаток 3 мл воды и фильтрат сгущают в вакууме. Остаток перекристаллизовывают из 80% водного этанола. Полученную свободную аминокислоту (0,451 г; 3,19 ммоль) смешивают с 1 н. соляной кислотой (31,9 мл; 3,19 ммоль) и полученный раствор сгущают в вакууме и остаток сушат в вакууме при 50oC/0,1 торр.
Выход: 0,567 г (86% от теории)
Т. пл.: 184oC
[α]
С7H11NO2 х HCI (М. в. 141,2 х 36,5)
Пример 33
Гидрохлорид (+)-1,2-цис-2-амино-4-метилен-циклопентан-1-карбоновой кислоты

Получение происходит аналогично примеру 32.
Выход: 0,566 г (86% от теории)
Т. пл.: 186oC
[α]
С7H11NO2 х HCI (М. в. 141,2 х 36,5)
Пример 34
Гидрохлорид 1,
2-цис-2-амино-4-этилиден-циклопентан-1-карбоновой кислоты

Соединение по примеру XI (0,30 г; 1, 66 ммоль) смешивают с 0,1 н. соляной кислотой (16,6 мл; 1,66 ммоль). Смесь перемешивают 5 часов до образования прозрачного раствора. Растворитель удаляют в вакууме и остаток сушат 12 часов при 30oC/0,1 торр.
Выход: 0,32 г (100%) смеси диастереомеров
Т. пл.: 188oC
С8H13NO2 х HCI (М. в. 155,2 х 36,5)
Пример 35
(-)-1,2-цис-2-(трет. бутилоксикарбонил)амино-4-метилен-1-карбоновая кислота
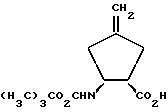
Раствор соединения по примеру 32 (2,0 г; 11,3 ммоль) в 20 мл диоксана смешивают с 16,8 мл 1 М раствора карбоната калия и при 0oC с ди-трет.-бутилкарбонатом (2,68 г; 12,3 ммоль). Перемешивают 20 часов при комнатной температуре, добавляют 30 мл уксусного эфира и доводят 10%-ной соляной кислотой рН раствора до 2. Водную фазу дважды экстрагируют 30 мл уксусного эфира, объединенные органические фазы промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия и сгущают в вакууме.
Выход: 2,73 г (100%)
[α]
С12H19NO4 (М. в. 241,3)
Пример
36
Этиловый эфир (-)-1,2-цис-2-(трет. бутилоксикарбонил)амино-4-метилен-циклопентан-1-карбоновой кислоты

К раствору соединения по примеру 35 (2,73 г; 11,3 ммоль) 4-диметиламинопиридина (0,14 г; 1,1 ммоль) и метанола (1,09 г; 34 ммоль) в 30 мл дихлорметана прикапывают при 0oC раствор дициклогексилкарбодиимида (2,57 г; 12,5 ммоль) в 10 мл дихлорметана. Перемешивают 2 часа при комнатной температуре, отфильтровывают выпавшую дициклогексилмочевину и промывают 50 мл дихлорметана. Осадок промывают 30 мл 0,1 н. соляной кислоты и 30 мл насыщенного раствора бикарбоната натрия, сушат над сульфатом и сгущают в вакууме. Остаток хроматографируют на силикагеле (петролейный эфир/уксусный эфир 3 : 1).
Выход: 2,36 г (82% от теории)
Т пл.: 64oC
[α]
С13H21NO4
Пример 37
Гидрохлорид
метилового эфира (-)-1,2-цис-2-амино-4-метилен-циклопентан-1-карбоновой кислоты
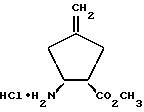
К раствору соединения по примеру 36 (2,10 г; 8,20 ммоль) и 2,6-лугидина (1,76 г; 16,5 ммоль) в 50 мл дихлорметана прикапывают при комнатной температуре в среде аргона (трет.бутилдиметил)силиловый эфир трифторметансульфокислоты (3,27 г; 12,3 ммоль). Перемешивают 15 минут, смешивают с 100 мл насыщенного раствора хлористого аммония и дважды экстрагируют 100 мл эфира. Органические фазы промывают насыщенным раствором поваренной соли, сушат над сульфатом магния и сгущают в вакууме. Остаток растворяют в 50 мл тетрагидрофурана и смешивают с водой (0,30 г; 16,5 ммоль) и фторидом тетрабутиламмония (1,1 М раствор в тетрагидрофуране, 7,5 мл; 8,2 ммоль) при 0oC. Перемешивают 1 час при 0oC, прибавляют 100 мл воды, доводят рН раствора до 9 концентрированным аммиаком, прибавляют 15 г поваренной соли и экстрагируют трижды по 80 мл уксусной кислоты. Органические фазы сушат над сульфатом магния и сгущают в вакууме. Остаток хроматографируют на силикагеле (эфир/ацетонитрил/конц. аммиак 10 : 1 : 0,1).
Выход: 1,15 г (73%)
Т. пл.: 146oC
[α]
С8H13NO2 х HCI (М. в. 155,2 х 36,5)
Пример 38
Метиловый эфир (-)-1,2-цис-2-(N-(трет.
бутилоксикарбонил)-глицинил)-амино-4-метилен-циклопентан-1-карбоновой кислоты

К раствору соединения по примеру 36 (0,40 г; 2,09 ммоль) гидрата 1-гидрокси-1Н-бензотриазола (0,282 г; 2,09 ммоль), N-этилморфолина (0,261 г; 2,09 ммоль) и N-(трет.бутилоксикарбонил)глицина (0,366 г; 2,09 ммоль) в 18 мл тетрагидрофурана прикапывают в среде аргона при 0oC раствор дициклогексилкарбодиимида (0,430 г; 2,09 ммоль) в 2 мл тетрагидрофурана. Перемешивают 1 час при 0oC и 20 часов при комнатной температуре, фильтруют, промывают 10 мл тетрагидрофурана и сгущают в вакууме. Остаток растворяют в 40 мл уксусного эфира, промывают 20 мл насыщенного раствора бикарбоната натрия и 20 мл насыщенного раствора поваренной соли, сушат над сульфатом натрия и сгущают в вакууме.
Выход: 0,585 г (100%)
1Н-ЯМР (дейтр. диметилсульфоксид):
α/ =
1,38 (с,5Н); 2,18-2,73 (м,4Н); 3,08 (дт, 1Н); 3,18 и 3,46 (АВ из АВХ, 2Н); 3,57 (с, 3Н); 4,40 (ддт, 1Н); 4,90 (м, 2Н); 6,88 (Х из АВХ, 1Н); 7,71 (д, 1Н)
С15H24N2О5 (М. в. 312,4)
Пример 39
Метиловый эфир (-)-1,2-цис-2-(N-(трет. бутилоксикарбонил(S)-аланил)амино-4-метилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 38.
Выход: 0,630 г (86% от теории)
1Н-ЯМР (дейтр. диметилсульфоксид):
α = 1,09 (д, 3Н); 1,36 (с, 9Н); 2,22-2,72 (м, 4Н); 3,10 (дт, 1Н); 3,52 (с, 3Н); 3,95 (дкв, 1Н); 4,40 (ддт, 1Н); 4,90 (см, 2Н); 6,78 (д,
1Н); 7,83 (д, 1Н)
С16H26N2О5 (М. в. 326,4)
Пример 40
Гидрохлорид метилового эфира (-)-1,
2-цис-2-(N-глицинил)амино-4-метилен-циклопентан-1-карбоновой кислоты

К раствору соединения по примеру 38 (0,52 г; 1,66 ммоль) и 2,6-лутидина (0,59 г; 5,50 ммоль) в 10 мл дихлорметана прикапывают при 0oC в среде аргона (трет. бутилдиметил) силиловый эфир трифторметансульфокислоты (1, 10 г; 4,15 ммоль) и перемешивают 20 часов при комнатной температуре. Смешивают с 20 мл насыщенного раствора хлористого аммония, дважды экстрагируют по 50 мл эфира, промывают органическую фазу насыщенным раствором поваренной соли, сушат над сульфатом магния и удаляют в вакууме растворитель. Остаток вносят в 10 мл тетрагидрофурана, смешивают с водой (0,06 г; 3,3 ммоль) и прикапывают при 0oC 1,1 М раствор фторида тетрабутиламмония в тетрагидрофуране (3,0 мл; 3,3 ммоль). Перемешивают 1 час при 0oC, смешивают с 20 мл воды и доводят рН раствора концентрированным аммиаком до 9. Прибавляют 4 г поваренной соли, трижды экстрагируют по 20 мл уксусного эфира, органические фазы промывают насыщенным раствором поваренной соли, сушат над сульфатом магния и сгущают в вакууме. Остаток хроматографируют на силикагеле (уксусный эфир/метанол/конц. аммиак 10: 1: 0). Полученное свободное основание вносят в 10 мл, 0,1 н. соляной кислоты и растворитель удаляют в вакууме. Остаток сушат 12 часов при 30oC/0,1 торр.
Выход: 0,202 г (49% от теории)
1Н-ЯМР (дейтр. диметилсульфоксид):
α = 2,25 - 2,72 (м, 4Н); 3,12
(дт, 1Н); 3,40 - 3,62 (м, 2Н); 3,59 (с, 3Н); 4,49 (ддт, 1Н); 4,92 (см, 2Н); 8,05 (с,ш, 3Н); 8,42 (д,1Н),
С10H16N2О3 (М. в. 212,2 х 36,5)
Пример 41
Гидрохлорид метилового эфира (-)-1,2-цис-2-(N-(S)-аланил)амино-4-метилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 40.
Выход: 0,249 г (57% от теории)
[α]
С11H18N2O3 х HCI
Пример 42
(-)-1,2-цис-2-[N-(9-флуоренилметилоксикарбонил)-(S)-норвалинил] амино-4-метилен-циклопентан-1-карбоновая кислота

FMOC =9-флуоренилметилоксикарбонил.
К раствору соединения по примеру 32 (3,00 г; 16,9 ммоль) и бикарбоната натрия (2,84 г; 33,8 ммоль) в 60 мл воды прикапывают раствор 9-флуоренилметилоксикарбонил-норвалин-0-сукцинимида (7,38 г; 16,9 ммоль) в диметоксиэтане (72 мл) и перемешивают в течение ночи при комнатной температуре. Смешивают с тетрагидрофураном (180 мл) и доводят рН раствора 10%-ной соляной кислотой до 2. Экстрагируют эфиром (3 х 300 мл), промывают объединенные эфирные фазы водой (100 мл) и насыщенным раствором поваренной соли (100 мл), сушат над сульфатом натрия. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле (дихлорметан/метанол 10:1).
Выход: 4,58 г (59% от теории)
Т. пл.: 124oC
Rf =0,43 (дихлорметан/метанол 10:1)
С27H30N2O5 (М. в. 462,54)
Пример 43
(-)-1,
2-цис-2-[N-(9-флуоренилметилоксикарбонил)-(S)-норлейцил] амино-4-метилен-циклопентан-1-карбоновая кислота

FMOC =9-флуоренилметилоксикарбонил
Целевое соединение получают аналогично примеру 42.
Выход 4,97 г (74% от теории)
Т. пл.: 151oC
Rf =0,45 (дихлорметан/метанол 10:1)
С28H32N2O5 (М. в. 476,57)
Пример 44
(-)-1,
2-цис-2-[N-(9-флуоренилметилоксикарбонил)-(S)-лейцил] амино-4-метилен-циклопентан-1-карбоновая кислота
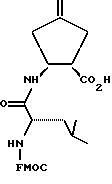
FMOC =9-флуоренилметоксикарбонил
Целевое соединение получают аналогично примеру 42.
Выход: 3,17 г (47% от теории)
[α]
Rf =0,21 (дихлорметан/метанол 20:1)
С28H32N2O5 (М. в. 476,57)
Пример 45
Гидрохлорид (-)-1,2-цис-2-(N-(S)-норвалинил)амино-4-метилен-циклопентан-1-карбноовой кислоты

Соединение по примеру 42 (4,53 г; 9,80 ммоль) смешивают с 150 мл жидкого аммиака, перемешивают 10 часов и затем отгоняют аммиак. Остаток смешивают с 200 мл эфира и перемешивают 1 час при комнатной температуре. Фильтруют и вносят остаток в 60 мл воды, снова фильтруют, промывают остаток 20 мл воды и фильтрат сгущают в вакууме. Остаток растворяют в 89 мл 0,1 н. соляной кислоты, растворитель удаляют в вакууме и остаток сушат в вакууме над пятиокисью фосфора.
Выход: 2,50 г (92%)
Т пл.: 130-135oC
[α]
С12H20N2O3 х HCI (М. в. 240,3 х 36,5)
Пример 46
Гидрохлорид (-)-1,2-цис-2-(N-(S)-норлейцил)амино-4-метилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 45.
Выход: 1,63 г (54% от теории)
Т. пл.: 108oC
[α]
С13H22
N2O3 х HCI (М. в. 254,3 х 36,5)
Пример 47
Гидрохлорид (-)-1,2-цис-2-(N-(S)-лейцил)-амино-4-метилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 45.
Выход: 1,82 г (96% от теории)
Т. пл.: 70-80oC
[α]
С13
H22N2 O3 х HCI (М. в. 254,3 х 36,5)
Пример 48
Метиловый эфир (-)-1,2-цис-2-(N-(трет.
бутилоксикарбонил)-(S)-лейцил)амино-4-метилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 38.
Выход: 0,584 г (56%)
Т. пл.: 124oC
С18H30N2O5 (М. в. 354,5)
Пример 49
Гидрохлорид метилового эфира (-)-1,2-цис-2-(N)-(S)-лейцил)амино-4-метилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 40.
Выход: 0,259 г (65%)
Т пл.: 70oC
[α]
С14H24N2 O3 х HCI (М. в. 268,4 х 36,
5)
Пример 50
Гидрохлорид 1,2-цис-2-амино-4-бензилиден-циклопентан-1-карбоновой кислоты

Раствор соединения по примеру XIII (12,53 г; 50,9 ммоль) в 43 мл ангидрида пропионовой кислоты кипятят 3 часа с обратным холодильником. Растворитель удаляют при 60oC/0,5 торр, остаток сушат 30 мин при 100oC/0,1 торр и растворяют в 60 мл диоксана. После добавления триметилсилилазида (6,84 г; 59,4 ммоль) реакционную смесь нагревают 2 час при 80oC. Растворитель удаляют в вакууме, остаток вносят в 200 мл эфира и смешивают с 0,78 г (43,4 ммоль) воды. Интенсивно перемешивают 30 мин и выдерживают смесь 2 дня при 5oC. Осадок отфильтровывают и удаляют. (Осадок в основном состоит из соединения по примеру XIII). Фильтрат сгущают до объема приблизительно 50 мл и охлаждают 12 часов до 0oC, при этом выкристаллизовывается 6-бензилиден-циклопентан-[3,4] оксазин-2,4-(1Н)-дион (2,52 г), отфильтровывают кристаллы, промывают небольшим количеством эфира и смешивают твердое вещество с 103 мл 0,1 н. соляной кислоты. Перемешивают 1 час при комнатной температуре, фильтруют и фильтрат сгущают в вакууме. Остаток сушат в вакууме над фосфорном ангидридом.
Выход: 0,95 г (7%) смеси
изомеров E/Z =5:1
Т. пл.: 234oC
1Н-ЯМР (дейтер. диметилсульфоксид): δ/ =2,70 - 3,55 (м,5Н), 3,70 (см, 1Н), 6,48 (с, 1Н), 7,12 - 7,42 (м,5Н)
С13H15NO2 х HCI (М. в. 217,3 х 36,5)
Пример 51
Гидрохлорид 1,2-цис-2-амино-4-дифторметилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 2.
Выход: 1,26 г (96%)
Т. пл.:
215oC (разл.)
С7H9F2NO2 х HCI (М. в. 177,2 х 36,5)
Пример 52
Гидрохлорид 1,2-цис-2-амино-4,
4-дифтор-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 2.
Выход: 1,85 г (83%)
Т. пл.: 222oC (разл.)
С6H9F2NO2 х HCI (М. в. 165,1 х 36,5)
Пример 53
Гидрохлорид (-)-1,2-цис-2-амино-4-метил-циклопентан-1-карбоновой кислоты

Раствор соединения по примеру 23 (400 мг; 2,25 ммоль) в 30 мл этанола и 5 мл воды гидрируют в присутствии 50 мг палладия на активированном угле (10%) при 3 бар и комнатной температуре 3 часа. Фильтруют через силикагель и фильтрат сгущают в вакууме. Остаток сушат 12 часов при 25oC/0,1 мбар.
Выход: 396 мг (98%) смеси диастереомеров у С-4 =5:1
Т. пл.: 156oC
С7H13NO2 х HCI (М. в. 143,2 х 36,5)
Пример 54
Гидрохлорид (-)-1,2-цис-2-амино-4-этил-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 53 из соединения, полученного по примеру 34.
Выход: 140 мг
(93%) смеси диастереомеров 16:1
Т. пл.: 205oC (разл.)
С8H15NO2 х HCI (М. в. 157,2 х 36,5)
Пример 55
Гидрохорид 1,
2-цис-2-амино-4-бензил-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 53 из соединения по примеру 50.
Выход: 198 мг (90%) смеси диастереомеров у С-4 =3:1
Т. пл.: 104oC (разл.)
С13H17
NO2 х HCI (М. в. 219,3 х 36,5)
Пример 56
1,2-цис-2-N-(трет. бутилоксикарбонил)амино-4-метилен-циклопентан-1-карбоновая кислота

Раствор соединения по примеру 2 (30,0 г; 170 ммоль) в 350 мл диоксана и 252 мл 1 н. раствора карбоната натрия смешивают при 0oC с ди-трет.бутилдикарбонатом (40,5 г; 185 ммоль) и перемешивают 16 часов при комнатной температуре. Диоксан удаляют в вакууме и водный остаток смешивают с 200 мл уксусного эфира. Добавкой 1 н. водного раствора бисульфата калия устанавливают значение рН водной фазы, равное 2 - 3. Отделяют органическую фазу и водную фазу экстрагируют уксусным эфиром (2 х 200 мл). Объединенные органические фазы промывают водой (2 х 100 мл), сушат над сульфатом натрия и сгущают в вакууме.
Выход: 38,3 г (93%)
1Н-ЯМР (дейтер. диметилсульфоксид): δ =1,39 (с,9Н), 2,
30 - 2,72 (м,4Н), 3,00 (дт, 1Н), 4,12 (дт, 1Н), 4,85 (с, 2Н), 6,78 (д, 1Н), 12,08 (с,1Н)
С12H19NO2 х HCI (М. в. 214,3)
Пример 57
Метиловый
эфир 1,2-цис-2-N-(трет. бутилоксикарбонил)амино-4-метилен-циклопентан-1-карбоновой кислоты

ВОС = бутилоксикарбонил
Раствор соединения по примеру 56 (54,5 г; 226 ммоль) метанола (21,8 г; 680 ммоль) и 4-(N, N-диметиламино)пиридина (2,76 г; 22,6 ммоль) в 600 мл дихлорметана медленно смешивают при 0oC с раствором дициклогексилкарбодиимида (51,4 г; 250 ммоль) в 200 мл дихлорметана. После перемешивания в течение 2 часов при комнатной температуре фильтруют, фильтрат промывают 0,1 н. соляной кислотой (300 мл), насыщенным раствором бикарбоната натрия и водой (300 мл), сушат над сульфатом натрия и сгущают в вакууме. Остаток хроматографируют на силикагеле (петролейный эфир/уксусный эфир 3:1).
Выход: 42,0 г (73%)
Т. пл.: 55oC
Rf = 0,30 (петролейный эфир/уксусный эфир 3:1)
С13
H21NO4 (М. в. 255,3 )
Пример 58
Метиловый эфир 1,2-цис-2-N-(трет.бутилоксикарбонил)амино-4-оксо-циклопентан-1-карбоновой кислоты

ВОС = бутилоксикарбонил
Целевое соединение получают аналогично примеру 4 из соединения по примеру 57.
Выход: 34,4 г (92%)
Т. пл.: 135oC
С12H19NO5 (М. в. 257,3)
Пример 59
Этиловый эфир 1,
2-цис-2-N-(трет. бутилоксикарбонил)амино-4-оксимино-циклопентан-1-карбоновой кислоты

ВОС = бутилоксикарбонил
Раствор соединения по примеру 58 (500 мг; 1,94 ммоль), пиридина (0,80 мл; 9,80 ммоль) и гидрохлорида гидроксиламина (148 мг; 2,25 ммоль) кипятят с обратным холодильником в 10 мл этанола в течение 20 часов. Растворитель удаляют в вакууме, остаток вносят в воду (20 мл) и экстрагируют эфиром (3 х 20 мл). Объединенные эфирные фазы промывают водой (1х 10 мл), сушат над сульфатом натрия и сгущают в вакууме. Остаток хроматографируют на силикагеле (диэтиловый эфир).
Выход: 269 мг (51%)
Rf = 0,67/0,71 (диэтиловый эфир)
С12H20N2O5 (М. в. 272,3)
Пример 60
Гидрохлорид метилового эфира 1,2-цис-2-амино-4-оксимино-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 5 из соединения по примеру 59.
Выход: 103
мг (54%)
Т. пл.: 90 - 95oC (разл.)
С7H12N2O3 х HCI (М. в. 223,1 х 36,5)
Пример 61
Метиловый эфир 1,
2-транс-2-N-(трет.бутилоксикарбонил)-амино-4-метилен-циклопентан-1-карбоновой кислоты

ВОС = бутилоксикарбонил
Раствор соединения по примеру 57 (1,00 г; 3,9 ммоль) и 1,8-диазабицикло[5.4.0] -ундек-7-ена (0,90 г; 5,9 ммоль) в 20 мл метанола кипятят с обратным холодильником 12 часов. Растворитель удаляют в вакууме, остаток вносят в уксусный эфир (30 мл), промывают 1 н. соляной кислотой (10 мл) и водой (10 мл), сушат над сульфатом натрия и сгущают в вакууме. Остаток хроматографируют на силикагеле (петролейный эфир/уксусный эфир 3:1).
Выход: 520 мг (52%)
Т. пл.: 140oC
Rf = 0,26 (петролейный эфир/уксусный
эфир 3:1)
С13H21NO4 (М. в. 255, 3)
Пример 62
Метиловый эфир 1,2-транс-2-амино-4-метилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 37 из соединения по примеру 61.
Выход: 141
мг (30%)
1Н-ЯМР (диметилсульфоксид): δ =2,30 - 2,50, 2,67 - 2,90 (2м,4Н), 3,08 (дт,1Н), 3,68 (с, 3Н), 3,72 (дт,1Н), 4,95 (с, 2Н), 8,40 (с, 3Н)
С8H13NO2 х HCI (М. в. 155,2 х 36,5)
Пример 63
Метиловый эфир 1,2-цис-2-N-(трет. бутилоксикарбонил)амино-4-гидрокси-циклопентан-1-карбоновой кислоты
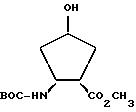
ВОС = бутилоксикарбонил
Целевое соединение получают аналогично примеру 7 из соединения примера 58.
Выход: 3,30 г (97%) смеси диастереомеров = 3:1
1Н-ЯМР (дейтер. хлороформ): δ =1,45 (с,9Н), 3,14 и 3,32 (2дт,1Н), 3,68 и 3,70 (2с, 3Н), 4,40 и 4,46 (2дт,
1Н), 5,40 (д, 1Н)
С12H21NO5 (259,3)
Пример 64
Метиловый эфир 1,2-цис-2-N-(трет. бутилоксикарбонил)амино-4-циклопентен-1-карбоновой
кислоты

ВОС = бутилоксикарбонил
Раствор соединения по примеру IV (3,90 г; 8,80 ммоль) в 87 мл тетрагидрофурана медленно смешивают при 0oC с 30%-ной перекисью водорода (5,23 г; 46,3 ммоль) и еще 3 часа перемешивают при комнатной температуре. После добавления 100 мл ледяной воды экстрагируют дихлорметаном (3 х 100 мл), объединенные органические фазы промывают насыщенным раствором поваренной соли (100 мл), сушат над сульфатом натрия и сгущают в вакууме. Остаток хроматографируют на силикагеле (петролейный эфир/диэтиловый эфир 2:1, Rf = 0,33). Получают 1,32 г (62%) смеси (35:65) целевого соединения и соответствующего 3-циклопентенового изомера. После фракционной кристаллизации из н-гексана (целевое соединение находится в маточнике) получают целевое соединение.
Выход: 142 мг (7%)
1Н-ЯМР (дейтер. хлороформ):
δ/ = 1,48 (с,9Н), 2,37, 2,70 (АВ часть системы АВХ, 2Н), 3,70 (с,3Н), 3,71 (м, 1Н), 4,62 (дт, 1Н), 5,20 (д, 1Н), 5,71 (м, 1Н), 5,96 (м,1Н)
С12H19NO4
(М. в. 241,3)
Пример 65
Гидрохлорид метилового эфира 1,2-цис-2-амино-4-циклопентен-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 5 из соединения по примеру 64.
Выход: 93 мг (89%)
1Н-ЯМР (дейтер.
диметилсульфоксид): δ =2,40 - 2,85 (м,2Н), 3,86 (м,1Н), 4,01 (дт, 1Н), 5,76 (м, 1Н), 5,97 (м, 1Н), 8,10 (с, 3Н)
С7H11NO2 х HCI (М. в. 141,2 х 36,5)
Пример 66
Этиловый эфир 1,2-цис-2-бензиламино-3-бензилоксиметил-циклопентан-1-карбоновой кислоты
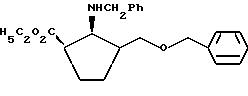
Рh = фенил
Целевое соединение получают аналогично примеру 10 из соединения примера XXIII.
Выход: 8,38 г (76%)
Т. пл.: 215oC (разл.)
Соотношение диастереомеров D1 : D2 = 6:1
Rf = 0,43 (D1), 0,34 (D2) (петролейный эфир/диэтиловый эфир 1:1)
С24H29NO3 (М. в.379,50)
Пример 67
Гидрохлорид этилового эфира 1,2-цис-2-амино-3-гидроксиметил-циклопентан-1-карбоновой кислоты
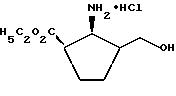
Целевое соединение получают аналогично примеру 13 из соединения примера 66.
Выход: 3,14 г
(97%)
Соотношение изомеров D1 : D2 = 6:1
1Н-ЯМР (дейтер. хлороформ): δ =1,28, 1,29 (2т,3Н), 1,72 - 2,30 (м,4Н), 2,71 (D2) и 2,88
(D1) (2т, 1Н), 3,06 (D2) и 3,27 (D1) (2м, 1Н), 3,50 - 3,90 (м, 3Н), 4,10 - 4,32 (м,3Н), 8,40 (с,3Н)
С9H17NO3 х HCI (М. в.
187,2 х 36,5)
Пример 68
Этиловый эфир 1,2-цис-2-N-(трет. бутилоксикарбонил)амино-3-гидроксиметил-циклопентан-1-карбоновой кислоты

ВОС = бутилоксикарбонил
Целевое соединение получают аналогично примеру 3 из соединения по примеру 67.
Выход: 2,98 г
(98%)
Соотношение диастереомеров D1 : D2 = 5 : 1
1H-ЯРМ (дейтер. хлороформ): δ = 1,28 (2т, 3Н), 1,45 (2с, 9Н), 1,65-2,38 (м, 5Н), 3,02 (D2), 3,06 (D1) (2дт, 1Н), 3,22-3,60 (м, 2Н), 3,95-4,40 (м, 4Н), 4,95 (D1), 5,61 (D2) (2д, 1Н)
C14H25NO5 (М. в. 287,4)
Пример 69
Этиловый эфир 1,2-цис-2-N-(трет.бутилоксикарбонил)амино-3-метилен-циклопентан-1-карбоновая кислота

ВОС = бутилоксикарбонил
К раствору соединения по примеру 68 (2,25 г; 7,83 ммоль) в 210 мл тетрагидрофурана прикапывают в среде аргона при комнатной температуре 2-нитрофенилселеноцианат (3,56 г; 15,7 ммоль) и раствор три-н-бутилфосфина (3,17 г; 15,7 ммоль) в 20 мл тетрагидрофурана. После перемешивания в течение 30 мин прикапывают 30%-ную перекись водорода (1,33 г; 39,2 ммоль) и перемешивают в течение ночи при комнатной температуре. После добавления воды (500 мл) экстрагируют уксусным эфиром (3 х 250 мл), объединенные органические фазы промывают насыщенным раствором бикарбоната натрия (200 мл), сушат над сульфатом магния и растворитель удаляют в вакууме. Остаток хроматографируют на силикагеле (петролейный эфир/диэтиловый эфир 2:1)
Выход: 1,67 г (79%)
Т. пл.,: 64oC
С14H23NO4 (М. в. 269,3)
Пример 70
1,2-цис-2-N-(трет. бутилоксикарбонил)амино-3-метилен-циклопентан-1-карбоновая кислота

ВОС = бутилоксикарбонил
Целевое соединение получают аналогично примеру IX из соединения по примеру 69.
Выход: 1,71 г (97%)
Т. пл.,: 135oC
С12H19NO4 (М. в. 241,3)
Пример 71
Метиловый эфир 1,2-цис-2-N-(трет. бутилоксикарбонил)амино-3-метилен-циклопентан-1-карбоновой кислоты

ВОС = бутилоксикарбонил
Целевое соединение получают аналогично примеру 57 из соединения по примеру 70.
Выход: 1,59 г
(91%)
Т. пл.: 44oC
С13H21NO4 (М. в. 255,3)
Пример 72
Гидрохлорид 1,2-цис-2-амино-3-метилен-циклопентан-1-карбоновой
кислоты

К раствору соединения по примеру 70 (500 мг; 2,07 ммоль) и 2,6-лутидина (890 мг; 8,30 ммоль) в 5 мл дихлорметана прикапывают (трет.бутилдиметил)силиловый эфир трифторметансульфокислоты (1,64 г; 6,21 ммоль) при комнатной температуре в среде аргона. Перемешивают 3 часа, прибавляют 10 мл насыщенного раствора хлористого аммония, экстрагируют эфиром (2 х 20 мл), промывают объединенные органические фазы насыщенным раствором поваренной соли (10 мл), сушат над сульфатом натрия и удаляют в вакууме растворитель. Остаток вносят в 20,7 мл 0,1 н. соляной кислоты и 20 мл тетрагидрофурана, перемешивают 20 часов, удаляют в вакууме тетрагидрофуран, промывают остаток эфиром (10 мл) и сгущают в вакууме водную фазу. Остаток растворяют в 7 мл пропеноксида и 30 мин кипятят с обратным холодильником. Отфильтровывают выпавшее твердое вещество, промывают эфиром и вносят остаток (136 мг) в 9,6 мл 0, 1 н. соляной кислоты. Растворитель удаляют в вакууме и остаток сушат в вакууме над фосфорным ангидридом.
Выход: 190 мг (52%)
Т. пл.,: 208oC (разл.)
С7H11NO2 х HCI (М. в. 141,2 х 36,5)
Пример 73
Гидрохлорид метилового эфира 1,2-цис-2-амино-3-метилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 37 из соединения по примеру 71.
Выход: 145
мг (39%)
Т. пл.: 143oC
С8H13NO2 (М. в. 155,2 х 36,5)
Пример 74
Метиловый эфир 1,
2-транс-2-N-(трет.бутилоксикарбонил)амино-3-метилен-циклопентан-1-карбоновой кислоты

ВОС = бутилоксикарбонил
Целевое соединение получают аналогично примеру 61 из соединения по примеру 71.
Выход: 410 мг (82%)
Т. пл.: 74oC
Rf
=0,43 (петролейный эфир/уксусный эфир 3:1)
С13H21NO4 (М. в. 255,3)
Пример 75
Гидрохлорид метилового эфира 1,
2-транс-2-амино-3-метилен-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 37 из соединения по примеру 74.
Выход: 228 мг (82%)
Т. пл.: 166oC
С8H13NO2 х HCI (М. в. 155,2 х 36,
5)
Пример 76
Метиловый эфир 2-N-(трет.бутилоксикарбонил)амино-циклопентан-3-он-карбоновой кислоты

ВОС = бутилоксикарбонил
Целевое соединение получают аналогично примеру 4 из соединения по примеру 71.
Выход: 898 мг (89%)
2
диастереомера цис :транс = 2:1
Т. пл.: 98oC
С12H19NO5 (М. в. 257,3)
Пример 77
Метиловый эфир
2-амино-циклопентан-3-он-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 5 из соединения по примеру 76.
Выход: 139 мг (92%)
2 диастереомера цис: транс = 2:1
Т. пл.: 250oC
С7H11NO3 х HCI
(М. в. 157,2 х 36,5)
Пример 78
Метиловый эфир 2-N-(трет. бутилоксикарбонил)амино-3,3-дифтор-циклопентан-1-карбоновой кислоты
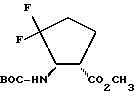
ВОС = бутилоксикарбонил
Целевое соединение получают аналогично примеру XVIII из соединения по примеру 76.
Выход: 176
мг (32%) цис : транс = 2:1
1Н-ЯМР (дейтер. хлороформ): δ =1,46 (с,9Н), 2,10 - 2,42 (м,2Н), 2,49 - 2,70 (м, 2Н), 2,72 (дт, 2Н), 3,72 (с, 3Н), 4,30 - 4,52 (м, 1Н), 4,85 (цис,с,
1Н), 5,20 (транс,с,1Н)
С12H19FO4 (М. в. 279,3)
Пример 79
Метиловый эфир 2-амино-3,3-дифтор-циклопентан-1-карбоновой кислоты

Целевое соединение получают аналогично примеру 5 из соединения по примеру 78.
Выход: 61
мг (48%), цис/транс = 2:1
Т. пл.: 118oC
С7H11F2NO2 х HCI (М. в. 176,2 х 36,5)а
Реферат
Предложены циклопентан- или циклопентен-β-аминокислот формулы I, где A, B, D, E, G, L, M и T означают H, галоген, OH, возможно замещенный C1-C8-алкил или B и D, E и G или L и M означают остаток формулы =CR6R7 или = N-OH, или E и G или B и D вместе означают =0, R1 - H, C1-C8-алкил; R2 - H, аминозащитная группа, C1-C8-алкил, C1-C8-ацил, бензоил или остаток аминоксилоты -CO-CHR9 -NHR10; R3 - H, возможно замещенный C1-C8-алкил и их соли. Соединения формулы I являются биологически активными соединениями и могут использоваться в композиции, активной в отношении штаммов S.aureus, Candida и Trichophyton. 2 с. и 3 з.п.ф-лы, 5 табл.

Формула

в которой A, B, D, E, G, L, M и T одинаковые или различные и означают водород, галоген, гидроксил, линейный или разветвленный алкил с 1 - 8 атомами углерода, который может быть замещен галогеном, гидроксилом, фенилом, бензилокси- или карбоксигруппой или группой формулы - NR4R5, где R4 и R5 одинаковые или различные и означают водород, фенил или линейный или разветвленный алкил с 1 - 6 атомами углерода, причем по меньшей мере один из заместителей A, B, D, E, G, L, M и T не означает водород или B и D, E и G или L и M соответственно вместе означают остаток формулы

или = N-OH,
где R6 и R7 одинаковые или различные и означают водород, галоген, линейный или разветвленный алкил с 1 - 8 атомами углерода, бензил или фенил, или E и G или B и D вместе означают остаток = 0;
R1 означает водород или линейный или развемвленный алкил с 1 - 8 атомами углерода;
R2 означает водород, аминозащитную группу, линейный или разветвленный алкил с 1 - 8 атомами углерода; который может быть замещен формилом или линейным или разветвленным ацилом с 1 - 6 атомами углерода, или фенилом или бензоилом, линейный или разветвленный ацил с 1 - 8 атомами углерода, бензоил,
или остаток аминокислоты формулы

где R9 означает водород, циклоалкил с 3 - 8 атомами углерода, линейный или разветвленный алкил с 1 - 8 атомами углерода, который может быть замещен группой формулы -NR11R12 или R13-OC-, где R11 и R12 независимо друг от друга означают водород, линейный или разветвленный алкил с 1 - 8 атомами углерода, или фенил;
R13 означает гидросил, бензилокси, алкокси с 1 - 6 атомами углерода, R10 означает водород или аминозащитную группу;
R3 означает водород, линейный или разветвленный алкил с 1 - 8 атомами углерода, возможно замещенный фенилом,
и их соли.

или = N-OH,
где R6 и R7 одинаковые или различные и означают водород, фтор, хлор, бром, линейный или разветвленный алкил с 1 - 6 атомами углерода, бензил или фенил,
E и G или B и D вместе означают остаток = 0,
R1 означает водород или линейный или разветвленный алкил с 1 - 6 атомами углерода;
R2 означает водород, трет.бутоксикарбонил, бензил, 9-флуоренилметоксикарбонил, линейный или разветвленный алкил с 1 - 6 атомами углерода, который может быть замещен формилом, линейным или разветвленным ацилом с 1 - 4 атомами углерода, фенилом или бензоилом, линейный или разветвленный ацил с 1 - 6 атомами углерода, бензоил,
или остаток аминокислоты формулы

где R9 означает водород, линейный или разветвленный алкил с 1 - 6 атомами углерода;
R10 означает водород, трет.бутоксикарбонил, 9-флуоренилметоксикарбонил;
R3 означает водород, линейный или разветвленный алкил с 1 - 6 атомами углерода или бензил,
и их соли.

или = N-OH,
где R6 и R7 одинаковые или различные и означают водород, фтор, хлор, бром, линейный или разветвленный алкил с 1 - 4 атомами углерода, или фенил,
или E и G или B и D соответственно вместе означают остаток = 0,
R1 означает водород или линейный или разветвленный алкил с 1 - 4 атомами углерода;
R1 означает водород, бензил, трет.бутоксикарбонил, 9-флуоренилметоксикарбонил, линейный или разветвленный алкил с 1 - 4 атомами углерода, линейный или разветвленный ацил с 1 - 4 атомами углерода,
или остаток аминокислоты формулы

где R9 означает водород, линейный или разветвленный алкил с 1 - 4 атомами углерода;
R10 означает водород, трет.бутоксикарбонил или 9-флуоренилметоксикарбонил;
R3 означает водород линейный или разветвленный алкил с 1 - 4 атомами углерода, и их соли.
29.05.92. - по п. 1, в котором A, B, D, E, G, L, M и T одинаковые или различные и означают водород, гидроксил, линейный или разветвленный алкил с 1 - 8 атомами углерода, который может быть замещен галогеном, гидроксилом, фенилом, или карбоксигруппой или группой формулы -NR4R5, где R4 и R5 одинаковые или различные и означают водород, фенил или линейный или разветвленный алкил с 1 - 6 атомами углерода, или B и D, E и G или L и M, соответственно вместе означают остаток формулы

где R6 и R7 одинаковые или различные и означают водород, линейный или разветвленный алкил с 1 - 8 атомами углерода, бензил или фенил, или E и G или B и D вместе означают остаток = 0;
R1 означает водород или линейный или разветвленный алкил с 1 - 8 атомами углерода;
R2 означает водород, аминозащитную группу, линейный или разветвленный алкил с 1 - 8 атомами углерода, который может быть замещен формилом или линейным или разветвленным ацилом с 1 - 6 атомами углерода, или фенилом или бензоилом, линейным или разветвленный ацил с 1 - 8 атомами углерода, бензоил,
или остаток аминокислоты формулы

R9 означает водород, циклоалкил с 3 - 8 атомами углерода, линейный или разветвленный алкил с 1 - 8 атомами углерода, который может быть замещен группой формулы -NR11R12 или R13-OC-, где R11 и R12 независимо друг от друга означают водород, линейный или разветвленный алкил с 1 - 8 атомами углерода, или фенил;
R13 означает гидроксил, бензилокси, алкокси с 1 - 6 атомами углерода;
R10 означает водород или аминозамещенную группу;
R3 означает водород, линейный или разветвленный алкил с 1 - 8 атомами углерода, возможно замещенный фенилом.

Комментарии