Способ затирания - RU2376347C2
Код документа: RU2376347C2
Чертежи


























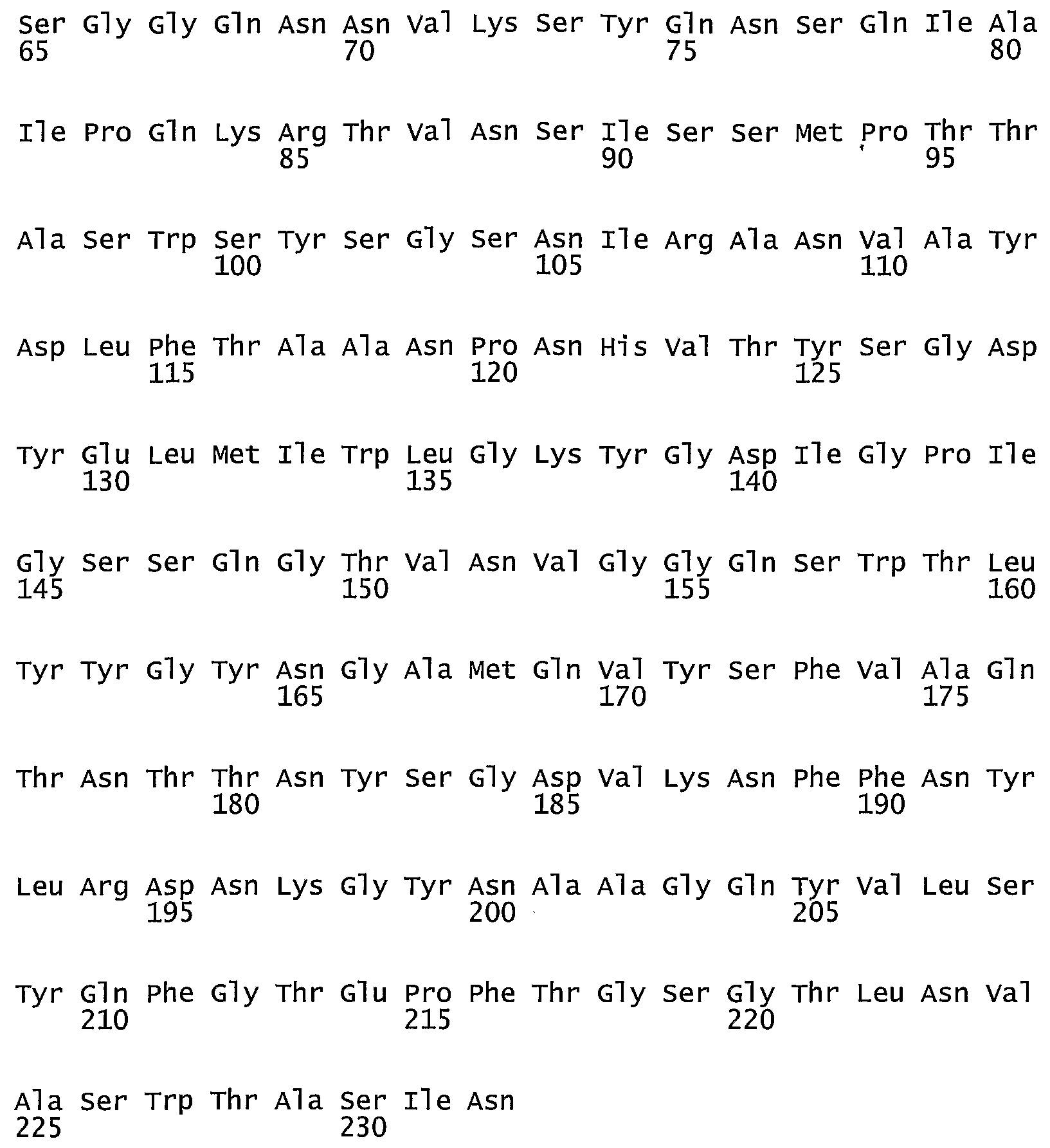
Описание
Настоящее изобретение относится, кроме прочего, к стадии затирания и фильтрации в процессе получения алкогольного напитка, такого как пиво или виски, и к композиции, используемой на стадии затирания и фильтрации такого процесса.
Использование ферментов при пивоварении является общепринятым. Применение ферментов на стадии затирания и фильтрации для того, чтобы улучшить фильтруемость затора и увеличить выход экстракта, описан в WO 97/42302. Однако имеется необходимость в улучшении стадии затирки и фильтрации и в улучшенных ферментных композициях для использования на стадии затирания и фильтрации.
Изобретение предлагает способ получения затора, имеющего улучшенную фильтруемость и/или улучшенный выход экстракта после фильтрации, который включает приготовление затора в присутствии ферментной активности и фильтрацию затора для получения сусла и в котором ферментная активность включает ксиланазу семейства 10 глюкозидгидролазы, присутствующую в количестве по меньшей мере 15 вес.% от общего веса ксиланазного и эндоглюканазного ферментного белка.
Следующий объект изобретения предлагает способ снижения вязкости водного раствора, включающего гидролизат крахмала, предусматривающий испытание по меньшей мере одного ксиланолитического фермента на его гидролитическую активность по отношению к нерастворимому арабиноксилану пшеницы, выбор ксиланолитического фермента, который расщепляет возле разветвленных остатков, оставляя в результате конечно-замещенные олигосахариды ксилозы, и добавление выбранного ксиланолитического фермента к водному раствору, включающему гидролизат крахмала.
В еще одном своем объекте изобретение предлагает способ снижения вязкости водного раствора, включающего гидролизат крахмала, где указанный способ включает испытание по меньшей мере одного эндоглюканолитического фермента на его гидролитическую активность по отношению к бета-глюкану ячменя, выбор эндоглюканолитического фермента, который в условиях: 10 мкг/мл очищенного фермента и 5 мг/мл бета-глюкана ячменя в 50 мМ ацетате натрия, 0,01% Triton X-100 при рН 5,5 и 50°С в течение 1 часа разлагает более чем 70% бета-глюкана ячменя до DP 6 или DP<6, и добавление выбранного эндоглюканолитического фермента к водному раствору, включающему гидролизат крахмала.
В еще одном объекте изобретение предлагает композицию, включающую ксиланазу GH10, присутствующую в количестве по меньшей мере 15 вес.% от общего протеина ферментов, и/или эндоглюканазу GH12, GH7 и/или GH5, присутствующую в количестве по меньшей мере 40 вес.% от общего протеина ферментов.
Другие объекты касаются применений упомянутой композиции в процессе, включающем снижение вязкости водного раствора, содержащего гидролизат крахмала, включая такие процессы, в которых водный раствор, содержащий гидролизат крахмала, предназначен для использования в пищевых композициях.
Определения
В настоящем описании использованы разнообразные термины, которые, как правило, понятны специалистам. Однако некоторые термины использованы в специфическом значении и означают следующее.
Термин "солодовая крупка", как он использован здесь, понимается как крахмал или сахар, содержащий материал, который является основой для приготовления пива, например ячменный солод и добавку.
Термин "солод" понимается как любое осоложенное злаковое зерно, в особенности, ячмень.
Термин "добавка" понимается как часть солодовой крупки, которая не является ячменным солодом. Добавкой может быть любой богатый углеводами материал.
Термин "затор" понимается как водная суспензия крахмала, включающая, например, размолотый ячменный солод, и/или другую добавку, или их комбинацию, замоченные в воде для приготовления сусла.
Термин "сусло" понимается как неферментированный сиропный оттек после экстрагирования солодовой крупки во время затирания.
Термин "барда" понимается как дренированные твердые вещества, остающиеся поле того, как солодовая крупка была экстрагирована и сусло отделено от затора.
Термин "пиво" понимается здесь как ферментированное сусло, например как алкогольный напиток, сваренный из ячменного солода, необязательно, добавки и шишек хмеля.
Термин "извлечение экстракта" в сусле определяется как сумма растворимых веществ, экстрагированных из солодовой крупки (солод и добавки), выраженная в процентах на сухое вещество.
Термин "термостабильный фермент" понимается как фермент, который при температурном режиме и периоде термостатирования, применяемых в способах по настоящему изобретению, в добавленных количествах способен к достаточному разложению рассматриваемого субстрата.
Термин "ксиланаза типа А" понимается как ксиланаза, которая расщепляет арабиноксилановые полимеры, близкие к разветвленным остаткам, оставляя конечно-замещенные олигосахариды ксилозы. Ксиланазы типа А могут быть идентифицированы, используя метод, описанный в разделе "Методы" настоящего описания.
Термин "гомология", когда он использован относительно последовательностей полипептидов или ДНК, указанных в настоящем описании, понимается как степень гомологии между двумя последовательностями, указывающая отклонение первой последовательности от второй. Гомология может быть удобно определена посредством компьютерной программы, известной в данной области, такой как GAP, имеющейся в программном пакете GCG (Program Manual for the Wisconsin Package, Version 8, August 1994, Genetics Computer Group, 575 Science Drive, Madison, Wisconsin, USA 53711) (Needleman, S.B. and Wunsch, C.D., (1970), Journal of Molecular Biology, 48, 443-453). Для сравнения полипептидных последовательностей использованы следующие установки: GAP creation penalty в 3,0 и GAP extension penalty в 0,1.
Термин "DP" представляет степень полимеризации, использованную здесь как среднее число глюкозных блоков в полимерах в гидролизате полисахаридов.
Нумерация семейств гликозидгидролазы (GH) и модулей связывания углеводов (СВМ), примененная в данном описании, следует концепции Coutinho, P.M. and Henrissat, B. (1999), CAZy -Carbohydrate-Active Enzymes server at URL: http://afmb.cnrs-mrs.fr/~cazy/CAZY/index.html или, альтернативно, Coutinho, P.M. and Henrissat, B., 1999: The modular structure of cellulases and other carbohydrate-active enzymes: an integrated database approach, in "Genetics, Biochemistry and Ecology of Cellulose Degradation", K. Ohmmiya, K. Hayashi, K. Sakka, Y. Kobayashi S., Karita and T. Kimura eds., Uni Publishers Co., Tokyo, p. 15-23 и в Bourne, Y. and Henrissat, B. 2001: Glycoside hydrolases and glycosyltransferases: families and functional modules, Current Opinion in Structure Biology 11: 593-600. Эта система классификации групп гликозидгидролаз основывается на подобиях в первичной структуре. Кроме того, члены семейства показывают один и тот же каталитический механизм и имеют подобия в общей трехмерной структуре, хотя семейство может содержать члены с существенными вариациями в специфичности субстрата.
Наименования эндоглюканаз Humicola insolens следует системе Karlsson, J. 2000, Fungi Cellulases, Study of hydrolytic properties of endoglucanases from Trichoderma reesei and Humicola insolens, Lundt University.
Процессы пивоварения хорошо известны в практике и, как правило, включают стадии солодоращения, затирания и ферментации. В традиционных процессах пивоварения солодоращение служит целям превращения нерастворимого крахмала в растворимый крахмал, уменьшения комплексных протеинов, образования цвето- и вкусообразующих соединений, образования питательных веществ для роста дрожжей и развития ферментов. Тремя главными стадиями процесса солодоращения являются замачивание, проращивание и отсушивание.
Замачивание включает смешение зерен ячменя с водой для повышения уровня влаги и активизации метаболических процессов в непроросшем ячмене. На следующей стадии влажный ячмень проращивают выдерживанием его при подходящей температуре и уровне влажности до тех пор, пока не будет достигнуто требуемое изменение, т.е. такое как разложение крахмала и активация ферментов. Конечной стадией является сушка сырого солода в сушилке. Температурный режим в сушилке определяет цвет ячменного солода и количество ферментов, которые выживают для использования в процессе затирания. Низкая температура сушки более подходит для солодов, когда она важна для сохранения ферментной активности. Солоды, высушенные при высоких температурах, очень богаты окрашивателями, такими как карамелизированные сахара, а также придающими вкус соединениями.
Затирание представляет собой процесс превращения крахмала из размолотого ячменного солода и твердых добавок в ферментируемые и неферментируемые сахара для получения сусла желаемого состава. Традиционное затирание включает смешение размолотого ячменного солода и добавок с водой при заданных температуре и объеме для продолжения биохимических изменений, начатых во время процесса солодоращения. Процесс затирания ведут в течение периода времени при различных температурах для того, чтобы активизировать эндогенные ферменты солода, ответственные за разложение протеинов и углеводов. Несомненно, наиболее важным изменением, осуществляемым при затирании, является превращение молекул крахмала в ферментируемые сахара. Главными ферментами, ответственными за превращение крахмала, в традиционном процессе затирания являются альфа- и бета-амилазы. Альфа-амилаза очень быстро уменьшает нерастворимый и растворимый крахмал путем расщепления молекул крахмала намного более коротких цепочек, которые могут быть атакованы бета-амилазой. Получаемым дисахаридом является мальтоза.
После затирания необходимо отделить жидкий экстракт (сусло) от твердых (барда, т.е. нерастворимое зерно и материал лузги, образующие часть солодовой крупки). Отделение сусла является важным, поскольку твердые содержат большие количества некрахмальных полисахаридов, протеина, слабомодифицированного крахмала, жировых веществ, силикатов и полифенолов (таннинов). Важными некрахмальными полисахаридами, присутствующими в злаковых зернах, являются бета-глюкан и арабиноксилан. Эндосперма клеточных стенок ячменя включает 75% бета-глюкана, 20% арабиноксилана и 5% остаточного протеина с малым количеством целлюлозы, глюкоманнана и фенольных кислот. Длинные цепи арабиноксиланов ячменя и, в меньшей степени, бета-глюкана, которые не были модифицированы в результате ферментативного гидролиза, могут вызвать образование гелей при солюбилизации в воде, и эти гели будут сильно повышать вязкость сусла и понижать фильтруемость. Подобным образом для качества сусла очень важно, чтобы бета-глюкан был уменьшен до более мелких олигомеров, поскольку немодифицированные бета-глюканы позднее будут вызывать проблемы со стойкостью к помутнению готового пива. Поэтому ферментные композиции, включающие эндоглюканазы и ксиланазы, такие как Ultraflo® или Viscozyme®, часто используют на стадии растирания для улучшения разделения сусла. Целями разделения сусла, среди прочего, являются:
- получение хорошего извлечения экстракта,
- получение хорошей фильтруемости,
- обеспечение прозрачного сусла.
Извлечение экстракта и фильтруемость являются важными для экономики процесса пивоварения, в то время как прозрачность является необходимостью для получения пива, в котором не образуется муть. Извлечение экстракта, фильтруемость и прозрачность сусла в значительной мере определяются стандартами солодовой крупки, например ячменного солода и типов добавки, а также примененной технологией затирания.
После отделения сусла от барды сусло может быть ферментировано пивными дрожжами для получения пива.
Дополнительную информацию об обычных способах пивоварения можно найти в "Technology Brewing and Malting" by Wolfgang Kunze of Research and Teaching Institute of Brewing, Berlin (VLB), 2nd revised Edition 1999, ISBN 3-921690-39-0.
Изобретение предлагает способ приготовления затора, имеющего улучшенную фильтруемость и/или улучшенный выход экстракта после фильтрации, который включает приготовление затора в присутствии ферментных активностей и фильтрацию затора для получения сусла, в котором ферментные активности включают ксиланазу семейства GH10 в количестве по меньшей мере 15%, 20%, предпочтительно 25%, таком как по меньшей мере 30%, или по меньшей мере 40%, или по меньшей мере 50%, или по меньшей мере 60%, или по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90% или даже 100 вес.% от общего веса ксиланазного и эндоглюканазного ферментного белка.
В предпочтительном осуществлении ксиланаза является ксиланазой типа А, и в особо предпочтительном осуществлении ксиланаза является ксиланазой типа А, имеющей отношение I1,3-концевое/I1,3-внутреннее по меньшей мере 0,25, такое как по меньшей мере 0,30, по меньшей мере 0,40, по меньшей мере 0,50 или даже по меньшей мере 0,60.
В другом предпочтительном осуществлении ксиланаза является ксиланазой, которая при описанном здесь анализе связывания имеет отношение связывания растворимого/нерастворимого волокна ячменя по меньшей мере 0,50, предпочтительно, по меньшей мере 0,60, более предпочтительно, по меньшей мере 0,70, такое как 0,80, 0,90, 1,00, 1,10 или даже по меньшей мере 1,20.
В другом предпочтительном осуществлении ксиланаза происходит из мицелиальных грибов, таких как из штамма Aspergillus sp., предпочтительно из Aspergillus aculeatus (SEQ ID NO:8 или SEQ ID NO:9), из штамма Myceliophotora sp., предпочтительно из Myceliophotora thermophillia (SEQ ID NO:13), из штамма Humicola sp., предпочтительно, из Humicola insolens (SEQ ID NO:12). В еще одном предпочтительном осуществлении ксиланаза происходит из штамма Trichoderma sp., предпочтительно из T. reesei, такой как ксиланаза, показанная в SEQ ID NO: 17. В более предпочтительном варианте выполнения ксиланаза имеет по меньшей мере 50%, такую как по меньшей мере 60%, 70%, 80% или даже 90% гомологию с любой из последовательностей.
В другом предпочтительном осуществлении ксиланаза происходит из бактерий, таких как из штамма Bacillus, предпочтительно из Bacillus halodurans.
В другом предпочтительном осуществлении эндоглюканазой является эндоглюканаза, происходящая из Humicola sp., такая как эндоглюканаза из Humicola insolens (SEQ ID NO:3), или эндоглюканаза из H. insolens (SEQ ID NO:4), из Thermoascus sp., такая как эндоглюканаза, происходящая из Thermoascus aurantiacus (SEQ ID NO:6), или из Aspergillus sp., такая как эндоглюканаза, происходящая из Aspergillus aculeatus (SEQ ID NO:16).
В предпочтительном осуществлении ксиланаза имеет по меньшей мере 50%, такую как по меньшей мере 60%, 70%, 80% или даже 90% гомологию с любой из вышеупомянутых последовательностей.
В другом предпочтительном осуществлении присутствует по меньшей мере один дополнительный фермент, каковым ферментом является арабинофуранозидаза.
Изобретение также предлагает способ уменьшения вязкости водного раствора, включающего гидролизат крахмала, где указанный способ включает испытание по меньшей мере одного ксиланолитического фермента на его гидролитическую активность по отношению к нерастворимому арабиноксилану пшеницы; выбор ксиланолитического фермента, который расщепляет близкие к разветвленным остатки, оставляя в результате конечно-замещенные олигосахариды ксилозы; и добавление выбранного ксиланолитического фермента к водному раствору, включающему гидролизат крахмала.
Изобретение далее предлагает способ уменьшения вязкости водного раствора, включающего гидролизат крахмала, где указанный способ включает испытание по меньшей мере одного эндоглюканолитического фермента на его гидролитическую активность по отношению к бета-глюкану ячменя; выбор эндоглюканолитического фермента, который в условиях: 10 мкг/мл очищенного фермента и 5 мг/мл бета-глюкана ячменя в 50 мМ ацетате натрия, 0,01% Triton X-100 при рН 5,5 и 50°С в течение 1 часа разлагает более чем 70% бета-глюкана ячменя до DP 6 или DP<6; и добавление выбранного эндоглюканолитического фермента к водному раствору, включающему гидролизат крахмала.
В предпочтительном осуществлении двух процессов водный раствор, включающий гидролизат крахмала, представляет собой затор для приготовления пива.
Изобретение предлагает также композицию, включающую ксиланазу семейства GH10, присутствующую в количестве по меньшей мере 15 вес.% от общего веса ферментного белка, и/или эндоглюканазу GH12, GH7 и/или GH5, присутствующую в количестве по меньшей мере 40 вес.% от общего веса ферментного белка.
В предпочтительном осуществлении ксиланаза композиции является ксиланазой типа А и, предпочтительно, ксиланазой типа А, имеющей отношение I1,3-концевое/I1,3-внутреннее по меньшей мере 0,25, такое как по меньшей мере 0,30, по меньшей мере 0,40, по меньшей мере 0,50 или даже по меньшей мере 0,60.
В предпочтительном осуществлении ксиланаза композиции происходит из мицелиальных грибов, таких как из штамма Aspergillus sp., предпочтительно из Aspergillus aculeatus (SEQ ID NO:8 или SEQ ID NO:9), из штамма Myceliophotora sp., предпочтительно из Myceliophotora thermophillia (SEQ ID NO: 13), из штамма Humicola sp., предпочтительно, из Humicola insolens (SEQ ID NO: 12). В предпочтительном осуществлении ксиланаза композиции имеет по меньшей мере 50%, такую как по меньшей мере 60%, 70%, 80% или даже 90% гомологию с любой из вышеупомянутых последовательностей.
В предпочтительном осуществлении ксиланаза композиции происходит из бактерий, таких как из штамма Bacillus, предпочтительно из Bacillus halodurans.
В предпочтительном осуществлении эндоглюканазой композиции является эндоглюканаза, происходящая из Humicola sp., такая как эндоглюканаза из Humicola insolens (SEQ ID NO:3), эндоглюканаза из H. insolens (SEQ ID NO:4), или из Thermoascus sp., такая как эндоглюканаза, происходящая из Thermoascus aurantiacus (SEQ ID NO:6), или из Aspergillus sp., такая как эндоглюканаза, происходящая из Aspergillus aculeatus (SEQ ID NO:16), или из Trichoderma sp., предпочтительно из T. reesei, и/или T. viride, такая как эндоглюканаза семейства 5, показанная в SEQ ID NO:18, бета-глюканаза семейства 7, показанная в SEQ ID NO:19, или бета-глюканаза семейства 12, показанная в SEQ ID NO:20.
В предпочтительном осуществлении эндоглюканаза композиции имеет по меньшей мере 50%, такую как по меньшей мере 60%, 70%, 80% или даже 90% гомологию с любой из вышеупомянутых последовательностей.
В предпочтительном осуществлении ксиланаза семейства GH10 композиции присутствует в количестве по меньшей мере 20%, предпочтительно 25%, таком как по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45% или даже по меньшей мере 50 вес.% от общего веса ксиланазного и эндоглюканазного ферментного белка.
В предпочтительном осуществлении эндоглюканаза GH семейства 12, 7 и/или 5 композиции присутствует в количестве по меньшей мере 25%, предпочтительно 30%, таком как по меньшей мере 35%, по меньшей мере 40%, по меньшей мере 45% или даже по меньшей мере 50%, таком как по меньшей мере 55% или даже по меньшей мере 60 вес.% от общего веса ксиланазного и эндоглюканазного ферментного белка.
Композиция согласно предшествующему аспекту может быть использована в процессе, включающем уменьшение вязкости водного раствора, включающего гидролизат крахмала.
Композиция может быть еще использована в процессе, включающем фильтрацию водного раствора, включающего гидролизат крахмала. В предпочтительном осуществлении водный раствор, включающий гидролизат крахмала, представляет собой затор для приготовления пива, и в другом предпочтительном осуществлении водный раствор, включающий гидролизат крахмала, представляет собой пищевую композицию.
Способ по изобретению может быть применен при затирании любой солодовой крупки. Согласно изобретению солодовая крупка может включать любой содержащий крахмал и/или сахар растительный материал, полученный из любого растения и любой части растения, включая клубни, корни, стебли, листья и семена. Предпочтительно солодовая крупка включает зерно, такое как зерно ячменя, пшеницы, ржи, овса, кома, риса, мило, проса и сорго, и, более предпочтительно, по меньшей мере 10% или, более предпочтительно, по меньшей мере 15%, еще более предпочтительно по меньшей мере 25% или, наиболее предпочтительно, по меньшей мере 35%, так что по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% или даже по меньшей мере 100 вес.% солодовой крупки сусла получают из зерна.
Наиболее предпочтительно солодовая крупка включает осоложенное зерно, такое как ячменный солод. Предпочтительно по меньшей мере 10% или, более предпочтительно, по меньшей мере 15%, еще более предпочтительно по меньшей мере 25% или, наиболее предпочтительно, по меньшей мере 35%, так что по меньшей мере 50%, по меньшей мере 75%, по меньшей мере 90% или даже по меньшей мере 100 вес.% солодовой крупки сусла получают из осоложенного зерна.
Для затирания солодовых крупок с низким содержанием солода ферменты затирания могут быть поданными экзогенно. Ферменты, использованные главным образом как ферменты разложения крахмала, включают пуллуланазы, альфа-амилазы и амилоглюкозидазы. Использование разлагающих крахмал ферментов при затирании хорошо известно специалистам.
Добавка, включающая легкоферментируемые углеводы, такие как сахара или сиропы, может быть добавлена к солодовому затору до, во время или после процесса затирания по изобретению, но предпочтительно добавляется после процесса затирания. Часть добавки может быть обработана протеазой и/или эндоглюканазой и/или подвергнута тепловой обработке перед добавлением к затору по изобретению.
Во время процесса затирания крахмал, экстрагированный из солодовой крупки, постепенно гидролизуется до ферментированных сахаров и более мелких декстринов. Предпочтительно затор является крахмалом, негативным к иодной пробе перед отделением сусла.
Применение соответствующих ксиланазной и эндоглюканазной активностей в способе по настоящему изобретению приводит к эффективному снижению концентрации бета-глюкана и арабиноксилана, облегчающему разделение сусла, обеспечивая таким образом уменьшенное время цикла, высокое извлечение экстракта и прозрачное сусло.
Сусло, изготовленное способом по первому аспекту изобретения, может быть ферментировано для приготовления пива. Ферментация сусла может включать засевание сусла суспензией, содержащей свежие дрожжи, т.е. дрожжи, не использовавшиеся ранее для изобретения, или дрожжи могут быть рецикловыми дрожжами. Применяемые дрожжи могут быть любыми дрожжами, пригодными для пивоварения, в особенности дрожжами, выбранными из Saccharomyces spp., таких как S. cerevisiae и S. uvarum, включая природные или искусственно полученные варианты этих организмов. Способы ферментации сусла для приготовления пива хорошо известны специалистам.
Способ по изобретению может включать добавление гидрогеля диоксида кремния к ферментированному суслу для повышения коллоидной стабильности пива. Способы могут дополнительно включать добавление кизельгура к ферментированному суслу и фильтрацию для того, чтобы сделать пиво светлым. Пивом, изготовленным ферментацией сусла по изобретению, может быть любой тип пива, например эль, крепкий эль, стаут, портер, лагер, пильзнер, горькое, экспортное пиво, солодовый напиток, хаппушу, ламбик, ячменное вино, высокоалкогольное пиво, низкоалкогольное пиво, низкокалорийное пиво или легкое пиво.
Пиво, изготовленное способом по изобретению, может быть дистиллировано для извлечения этанола, например, для получения виски. Предполагается любой сорт виски, включая бурбон, канадское виски, ирландское виски, ржаное виски и шотландское виски.
Ксиланаза
Для данных целей ксиланаза является ферментом, классифицируемым как ЕС 3.2.1.8. Официальным названием является эндо-1,4-бета-ксиланаза. Системным названием является 1,4-бета-D-ксиланксиланогидролаза. Могут быть использованы другие названия, такие как эндо-(1,4)-бета-ксиланаза, (1-4)-бета-ксилан-4-ксиланогидролаза, эндо-1,4-ксиланаза, ксиланаза, бета-1,4-ксиланаза, эндо-1,4-ксиланаза, эндо-бета-1,4-ксиланаза, эндо-1,4-бета-D-ксиланаза, 1,4-бета-ксиланксиланогидролаза, бета-ксиланаза, бета-1,4-ксиланксиланогидролаза, эндо-1,4-бета-ксиланаза, бета-D-ксиланаза. Катализируемой реакцией является эндогидролиз 1,4-бета-D-ксилозидиновых связей в ксиланах.
Хотя ксиланаза, которая должна использоваться в настоящем изобретении, может быть любого происхождения, включая происхождение от млекопитающих, растительное или животное происхождение, в настоящее время предпочтительно, чтобы ксиланаза была микробиального происхождения. В частности, ксиланаза может быть ксиланазой, полученной из мицелиальных грибов или дрожжей.
Ксиланазы были обнаружены в ряде видов грибов, в частности видов Aspergillus, таких как A. niger, A. awamori, A. aculeatus и A. oryzae, Trichoderma, таких как T. reesei или T. harzianum, Penicillum, таких как P. camenbertii, Fusarium, таких как F. oxysporum, Humicola, таких как H. insolens, и Thermomyces lanuginosa, таких как T. lanuginosa. Ксиланазы были также обнаружены в видах бактерий, например в роде Bacillus, таких как B. pumilus.
Предпочтительно согласно способу по изобретению ксиланаза происходит от мицелиального гриба, такого как Aspergillus sp., Bacillos sp., Humicola sp., Mycellophotora sp., Poitrasia sp., Rhyzomucor sp. или Trichoderma.
Было показано, что специфичность субстрата является ключевым параметром для показателей работы ксиланаз в способе по изобретению. Представляется, что ксиланаза с оптимальным показателем работы в способе по изобретению должна быть ферментом, который присоединяется довольно прочно к растворимому арабиноксилану и довольно слабо - к нерастворимому арабиноксилану. Предпочтительно ксиланаза для использования в настоящем изобретении является ксиланазой, которая в анализе на связывание в методиках, описанных в этой заявке, имеет отношение связывания растворимое/нерастворимое волокно ячменя по меньшей мере 0,50, предпочтительно по меньшей мере 0,60, более предпочтительно по меньшей мере 0,70, такое как 0,80, 0,90, 1,00, 1,10 и даже по меньшей мере 1,20.
Ряд идентифицированных ксиланаз, имеющих эти характеристики, является членами семейства 10 глюкозидгидролаз. Предпочтительно ксиланаза для использования в настоящем изобретении является ксиланазой семейства 10 глюкозидгидролаз (GH10), и наиболее предпочтительно ксиланаза является ксиланазой GH10, которая является также ксиланазой типа А, т.е. ксиланазой, которая расщепляет нерастворимые полимеры арабиноксилана пшеницы близко к разветвленным остаткам, оставляя конечно-замещенные олигосахариды ксилозы (см. примеры для определения типов А и В). Поскольку ферменты GH10 способны подойти ближе к разветвленным ксилозным блокам, они образуют более мелкие олигосахариды, чем ксиланазы GH11.
Предпочтительно ксиланаза для использования в данном изобретении имеет функциональный СВМ, такой как СВМ семейства 1.
Предпочтительно согласно способу по изобретению ксиланазу выбирают из списка, состоящего из ксиланазы, показанной как ксиланаза из Aspergillus aculeatus, показанная как SEQ ID NO: 8 (AA XYL I), ксиланаза из Aspergillus aculeatus, показанная как SEQ ID NO: 9 (AA XYL II), ксиланаза из Bacillus halodurans, показанная как SWISS PROT P07528 (BH XYL A), ксиланаза из Humicola insolens, показанная как SEQ ID NO: 12 (HI XYL III), ксиланаза из Myceliophotora thermophila, показанная как SEQ ID NO: 13 (MT XYL I) и ксиланаза из Trichoderma reesei, такая как ксиланаза, показанная как SEQ ID NO: 17. Предпочтительной также является любая последовательность, имеющая по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или даже по меньшей мере 90% гомологии с любой из вышеупомянутых последовательностей ксиланаз.
Эндоглюканаза
Для данных целей эндоглюканаза является ферментом, классифицируемым как ЕС 3.2.1.4. Хотя эндоглюканаза, которая должна использоваться в настоящем изобретении, может быть любого происхождения, включая происхождение от млекопитающих, растительное или животное происхождение, в настоящее время предпочтительно, чтобы эндоглюканаза была микробиального происхождения. В частности, эндоглюканаза может быть эндоглюканазой, полученной из мицелиальных грибов или дрожжей.
Предпочтительно эндоглюканаза является глюканазой семейства 12 гликозидгидролаз (GH12), семейства 7 гликозидгидролаз (GH7), или семейства 5 гликозидгидролаз (GH5). Более предпочтительно эндоглюканаза является полипептидом, имеющим в суперструктуре бета-"рулет с джемом" или b8/a8-полость.
Хотя эндоглюканаза, которая должна использоваться в настоящем изобретении, может быть любого происхождения, включая происхождение от млекопитающих, растительное или животное происхождение, в настоящее время предпочтительно, чтобы эндоглюканаза была микробиального происхождения. В частности, эндоглюканаза может быть эндоглюканазой, полученной из мицелиальных грибов или дрожжей.
Более предпочтительно согласно способу по изобретению эндоглюканаза происходит от мицелиального гриба, такого как Aspergillus sp. или Humicola sp.
Предпочтительно, согласно способу по изобретению эндоглюканазу выбирают из списка, состоящего из эндоглюканазы из Aspergillus aculeatus, показанной в SEQ ID NO: 1 (AA EG I), эндоглюканазы из Aspergillus aculeatus, показанной в SEQ ID NO: 2 (AA EG II), эндоглюканазы из Aspergillus aculeatus, показанной в SEQ ID NO: 16 (AA EG III), эндоглюканазы из Humicola insolens, показанной в SEQ ID NO: 3 (HI EG I), эндоглюканазы из Humicola insolens, показанной в SEQ ID NO: 4 (HI EG III), эндоглюканазы из Humicola insolens, показанной в SEQ ID NO: 5 (HI EG IV), эндоглюканазы из Trichoderma sp., показанной в SEQ ID NO:19, или эндоглюканазы из Trichoderma sp., показанной в SEQ ID NO: 20. Предпочтительной также является любая последовательность, имеющая по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или даже по меньшей мере 90% гомологии с любой из вышеупомянутых последовательностей.
Другие глюканазы GH12 включают эндоглюканазы из Aspergillus sp., такие как из Aspergillus kawachi (SWISSPROT Q12679) или Aspergillus niger (SWISSPROT O74705), Aspergillus oryzae (SWISSPROT O13454), из Erwinia sp., таких как из Erwinia carotonova (SWISSPROT P16630), и из Thermotoga sp., таких как Thermotoga maritima (SWISSPROT Q60032 или Q9S5XB). Предпочтительной также является любая последовательность, имеющая по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или даже по меньшей мере 90% гомологии с любой из вышеупомянутых последовательностей глюканаз GH12.
Другие глюканазы GH7 включают эндоглюканазы, полученные из Agaricus sp., такие как из Agaricus bisporus (SWISSPROT Q92400), из Aspergillus sp., такие как из Aspergillus niger (SWISSPROT Q9UVS8), из Fusarium sp., такие как из Fusarium oxysporum (SWISSPROT P 46238), из Neuspora sp., такие как из Neuspora crassa (SWISSPROT P38676), или из Trichoderma sp., такие как из Trichoderma longibratchiatum (SWISSPROT Q12714). Предпочтительной также является любая последовательность, имеющая по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или даже по меньшей мере 90% гомологии с любой из вышеупомянутых последовательностей глюканаз GH7.
Другие глюканазы GH5 включают эндоглюканазы, полученные из Acidothermus sp., такие как из Acidothermus celluloliticus (SWISSPROT P554583), из Aspergillus sp., такие как из Aspergillus niger (SWISSPROT O74706), или из Bacillus sp., такие как из Bacillus polymixa (SWISSPROT P23548). Предпочтительной также является любая последовательность, имеющая по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или даже по меньшей мере 90% гомологии с любой из вышеупомянутых последовательностей глюканаз GH5.
Арабинофуранозидаза
Арабинофуранозидаза ЕС 3.2.1.55, общее наименование альфа-N-арабинофуранозидаза, гидролизует концевые невосстановленные остатки альфа-L-арабинофуранизида в альфа-L-арабинозидах. Фермент действует на альфа-L-арабинофуранизиды, альфа-L-арабинаны, содержащие (1,3)- и/или (1,5)-связи арабиноксиланы и арабиногалактаны.
МАТЕРИАЛЫ И МЕТОДИКИ
Ксиланазная активность
Ксиланолитическая активность может быть выражена в единицах FXU, определенных при рН 6,0 с ремазол-ксиланом (4-О-метил-D-глюкуроно-D-ксилан, окрашенный Remazol Brilliant Blue R, Fluka) в качестве субстрата.
Образец ксиланазы инкубируют с ремазол-ксилановым субстратом. Фон неразложенного окрашенного субстрата осаждают этанолом. Оставшаяся голубая окраска супернатанта (что определено спектрофотометрически на 585 нм) пропорциональна ксиланазной активности, и ксиланазные единицы затем определяют относительно ферментного стандарта при стандартных условиях реакции: т.е. при 50,0°С, рН 6,0 и времени реакции 30 мин.
Папка AF 293.6/1, описывающая этот аналитический метод более подробно, доступна по запросу в Novozymes A/S, Denmark, каковая папка настоящим включена ссылкой.
Глюканазная активность
Целлюлитическая активность может быть измерена в единицах грибной эндоглюканазы (FBG), определенных на 0,5% бета-глюкановом субстрате при 30°С, рН 5,0 и времени реакции 30 мин. Грибная эндоглюканаза реагирует с высвобождаемой бета-глюканом глюкозой или восстанавливаемым углеводом, который определяется как восстановленный сахар согласно методу Somogyl-Nelson.
Единица активности грибной эндоглюканазы (FBG) является количеством фермента, которое соответственно указанным выше стандартным условиям высвобождает глюкозу или восстанавливаемый углевод с восстановительной способностью, эквивалентной 1 ммоль глюкозы в минуту.
Ферменты
Ultraflo® L., многокомпонентная ферментная композиция, полученная из Humicola insolens, включающая смесь эндоглюканаз, ксиланаз, пентозаназ и арабаназ. Ultraflo® L. стандартизован до 45 FBG/г и имеет плотность приблизительно 1,2 г/мл. Ultraflo® L может быть получен от Novozymes A/S.
Viscozyme® L., многокомпонентная ферментная композиция, полученная из Aspergillus aculeatus, включающая смесь эндоглюканаз, арабаназ и ксиланаз. Viscozyme® L. стандартизован до 100 FBG/г и имеет плотность приблизительно 1,2 г/мл. Viscozyme может быть получен от Novozymes A/S.
Alcase®, Subtilisin, протеазная композиция, полученная из Bacillus licheniformis. Alcase® может быть получен от Novozymes A/S.
Termamyl SC®, Bacillus альфа-амилаза может быть получена от Novozymes A/S.
Были применены следующие однокомпонентные эндоглюканазы и ксиланазы.
МЕТОДЫ
Приготовление затора
Если не указано иное, затирание проводили следующим образом. Исключая отмеченное (например, в отношении дозировки фермента), затор готовили согласно ЕВС: 4.5.1, используя солод, размолотый согласно ЕВС: 1.1. Опыты по затиранию проводили в 500 мл закрываемых крышками сосудах, выдерживаемых в водяной бане с перемешиванием, и каждый содержал затор с 50 г солодовой крупки, дополненный до общего веса в 300±0,2 г водой, предварительно нагретой до начальной температуры инкубации +1°С. Полученное сусло имело приблизительно 12% Плато.
Температурный профиль затирания
Если не указано иное, затирание проводили, используя температуру начальной инкубации 52°С в течение 30 мин, за чем следовал шаг повышения температуры до 63°С с оставлением этой температуры на 20 мин. Профиль продолжали с шагом повышения до 72°С на 30 мин и затирание завершали при 78°С в течение 5 мин. Все поэтапные температурные градиенты осуществляли повышением на 1°С/мин. Затор охлаждали до 20°С в течение 15 мин, что давало в результате суммарный период инкубации 2 ч 11 мин.
Дополнительные методики
Методики анализа сырья, продуктов, сусла, пива и т.д. можно найти в Analytica-EBC, Analysis Committee of EBC, the European Brewing Convention (1998), Verlag Hans Carl Geranke-Fachverlag. Для настоящего изобретения методами, применяемыми для определения следующих параметров, были методы, указанные ниже.
Плато: рефрактометр.
Бета-глюкан: ЕВС: 8.13.2 (High molecular weight beta-glucan content of wort fluorimetric method).
Мутность: ЕВС: 4.7.1.
Фильтруемость: определение объема (мл) фильтрата: согласно ЕВС: 4.5.1 (Extract of Malt: Congress Mash) subsection 8.2. Filterability: объем фильтрата замеряли после 1 ч фильтрации через гофрированную фильтровальную бумагу диаметром 320 мм, Schleicher and Schüll, No 597 1/2, Machery, Nagel and Co в воронки диаметром 200 мм, присоединенные к 500 мл колбам.
Извлечение экстракта: ЕВС: 4.5.1 (Extract of Malt: Congress Mash. Extract in dry). Термин "извлечение экстракта в сусло" определен как сумма растворимых веществ (глюкоза, сахароза, мальтоза, мальтотриоза, декстрин, протеин, смолы, неорганические вещества, другие вещества), экстрагированных из солодовой крупки (солода и добавок), выраженная в процентах в расчете на сухое вещество. Остающаяся нерастворимая часть определяется как барда.


где:
Е1 - содержание экстракта в образце, в % (вес.),
Е2- содержание экстракта в сухой солодовой крупке, в % (вес.),
Р - содержание экстракта в сусле, в % Плато,
М - содержание влаги в солодовой крупке, в % (вес.),
800 - количество дистиллированной воды, добавленной в затор на 100 г солодовой крупки.
Вязкость: автоматический вискозиметр, основанный на принципе катящегося шарика. Измеряемую пробу вводят в стеклянный капилляр, в котором катится стальной шарик. Вязкостные свойства испытуемой жидкости могут быть определены путем измерения времени качения стального шарика. Измеряют время качения to шарика через определенное измеряемое расстояние в капилляре. Динамическую вязкость пробы η рассчитывают из калибровочной константы измерительной системы К1(α), времени качения to и разности плотности Δр между шариком и пробой. Используют следующее уравнение:

где:
η - динамическая вязкость пробы (мПа·с),
К(α) - калибровочная константа для измерительной системы (мПа·с·см3/г),
to - время качения для 100 мм (с),
ρк - плотность шарика (7,85 г/см3),
ρs - измеренная плотность пробы (г/см3).
Вязкость представлена в расчете на экстракт (°Плато) как есть или переведена на 8,6°Плато, основываясь на методике Congress mashing.
Пример 1
Характеристика ксиланаз с использованием анализа связывания
Приготовление фракций волокна
Фракцию растворимого волокна готовили следующим образом:
1. 50 кг ячменя размалывали и суспендировали в 450 кг воды при 50°С при перемешивании.
2. Экстракцию проводили в течение 30 минут при перемешивании.
3. Используя предварительно нагретую отстойную центрифугу и центрифугу отбрасывания твердых частиц, готовили не содержащую частиц и осветленную фракцию.
4. Осветленную фракцию подвергали ультрафильтрации при 50оС на трубчатой мембране с величиной отсечения 20000 дальтон. Процесс ультрафильтрации продолжали до тех пор, пока не возрастет вязкость и не уменьшится значительно поток в систему.
5. Концентрированную фракцию отбирали и лиофилизировали.
Фракцию нерастворимого волокна готовили следующим образом:
1. 50 кг ячменя размалывали и суспендировали в 450 кг воды при 50°С при перемешивании. Добавляли 0,25 кг Termamyl SC и раствор нагревали до 85°С при перемешивании. Реакцию проводили в течение 30 мин. Отбирали образец для анализа крахмала иодной пробой.
2. Образец центрифугировали в течение 5 мин при 3000g (в 10 мл центрифужном стакане). Определяли °Плато, используя рефрактометр на супернатанте. За этим следовало определение конверсии крахмала цветной реакцией с иодом: если цвет синий, значит остается крахмал.
3. Реакцию продолжали до тех пор, пока °Плато не стабилизировались. Продукт реакции был готов для центрифугирования.
4. Центрифугирование проводили, используя отстойную центрифугу. Сепарацию проводили при 75°С и получали прозрачный и не содержащий частиц супернатант. Эту фракцию выгружали. Только твердую фракцию использовали в последующем процессе.
5. Отобранную твердую фракцию суспендировали в 500 кг горячей воды. Температуру взвеси доводили до 50°С.
6. Величину рН доводили до 7,5, используя NaOH. Реакцию гидролиза проводили, используя 125 г Alcalase 2.4 L. Во время гидролиза поддерживали рН 7,5 (рН-стат), и время реакции составляло 120 мин. После этого реакционную смесь оставляли перемешиваться без рН-стата при Т=50°С в течение ночи.
7. Затем рН доводили до 6,5, используя HCl.
8. Реакционную смесь центрифугировали, используя отстойную центрифугу.
9. Твердую фракцию собирали и промывали 500 л воды при 50°С в течение 30 мин. Стадии центрифугирования и промывки повторяли.
10. Эту промытую твердую фракцию лиофилизировали.
Анализ фракции волокон
Состав сахаров во фракциях волокон анализировали следующим образом: к 1 г волокна добавляли 50 мл 1М HCl и выдерживали при 100°С в течение 2 час при встряхивании. После этой обработки реакционную смесь немедленно охлаждали на льду и добавляли 11 мл 4М NaOH, чтобы нейтрализовать смесь. Содержание арабинозы, галактозы, глюкозы и ксилозы определяли количественно, используя систему Dionex BioLC, оборудованную колонкой CarBoPac PA-1, как описано у Sørensen et al. (2003) Biotech. Bioeng. vol. 81, No 6, p. 726-731. Результаты показаны в таблице 1.
Анализ связывания ксиланаз
Анализ связывания ксиланаз проводили следующим образом. Волокно (10 мг) промывали в пробирке Эппендорфа вихревым смешением с 500 мкл ацетатного буфера (50мМ, рН 5,5, 0,1% Triton X-100) перед центрифугированием в течение 2 мин при 13000 g. Промывку и центрифугирование проводили дважды. Затем раствор, содержащий фермент* (500 мкл в ацетатном буфере с рН 5,5), добавляли к субстрату и смесь тщательно перемешивали завихрением и выдерживали в ледяной бане в течение 10 мин. Затем пробирку Эппендорфа, содержащую реакционную смесь, центрифугировали при 14000 g в течение 3 мин, где после этого определяли начальную и остаточную активность, используя в качестве субстрата 0,2% AZCL-арабиноксилан из пшеницы (Megazyme) в 0,2М Na-фосфатном буфере (рН 6,0) + 0,01% Triton-X-100. Колбочку с 900 мкл субстрата предварительно нагревали до 37°С в термомиксере, добавляли 100 мкл пробу фермента, после чего выдерживали в течение 15 мин при 37°С и максимальном встряхивании. Колбочку помещали на лед на 2 мин, перед тем как центрифугировать ее в течение 1 мин при 20000 g. Из супернатанта 2×200 мкл переносили на титрационный микропланшет, измеряли конечный OD 590 нм и сравнивали по отношению с контролем. Контролем был 100 мкл образец фермента, инкубированый с 900 мкл 0,2М Na-фосфатного буфера (рН 6,0) + 0,01% Triton-X-100 вместо субстрата, после чего вся активность была извлечена в супернатант, и эта величина была принята за 1. Результаты показаны в таблице 2.
Две ксиланазы, имеющие самое высокое отношение связывания растворимых/нерастворимых волокон ячменя, ксиланаза II и ксиланаза I из A. aculeatus, были также двумя ксиланазами, имевшими наилучшие показатели в опытах по затиранию.
Пример 2
Определение характеристик специфичности ксиланаз
Ядерно-магнитный резонанс сильного поля (1Н ЯМР) был применен для идентификации различий в специфичности ксиланаз по отношению к нерастворимому арабиноксилану (АХ) пшеницы (нерастворимый Megazyme).
При1Н ЯМР арабиноксилан или его олигосахарид (АХО) показывает сигналы (химические сдвиги) около 5,0-5,5 ч/млн, возрастающие от аномерных протонов Н-1 от α-L-арабинофуранозидных блоков. Индивидуальные различия между ними, зависящие от их локального окружения, могут быть использованы для оценки специфичности ксиланаз по отношению к этому сильно разветвленному полимеру.
Стандартными условиями являлись: 10 мг/мл АХ в 50 мМ ацетатном буфере, рН 5,5 выдерживали с 0,1 XU/мл в течение 120 мин при 30°С. Затем ксиланазу инактивировали (95°С, 20 мин) и раствор концентрировали на роторном испарителе. Затем пробу дважды упаривали от D2O (1 мл) и, наконец, повторно суспендировали в
D2O (~0,8 мл) перед тем, как ее анализировать. Спектр1Н ЯМР регистрировали на Varian Mercury 400 мГц при 30°С. Данные собирали за 100 сканирований и сигнал HDO использовали в качестве опорного сигнала (4,67 ч/млн).
Разложение АХ ксиланазой меняет спектр1Н ЯМР в соответствии со специфичностью фермента. Так, химический сдвиг арабинофуранозида Н-1 изменяется, если арабиноза в получаемом в результате олигосахариде расположена на концевой ксилозе по сравнению с "внутренней" ксилозой. Это может быть результатом того, что ксиланаза способна поместить замещенный ксилозный блок в его +1 субсайт. При использовании приложенных условий было найдено, что все испытанные ксиланазы GH10 были способны делать это, тогда как не было найдено ни одной ксиланазы GH11, имеющей такую характеристику. Тип А относится к ксиланазе, которая расщепляет близкие к разветвленным остатки (замещенные на концах олигосахариды ксилозы), тогда как тип В относится к ксиланазе, которая ведет расщепление между незамещенными ксилозными блоками, давая только внутренне замещенные блоки. Ксиланазы типа А способны также вести расщепление между незамещенными ксилозными блоками. Примеры ксиланаз типа А и типа В, выявленные авторами изобретения, показаны в таблице 3. Для изобретения предпочтительны ксиланазы типа А.
Даже среди ксиланаз типа А предпочтение к расщеплению возле разветвленных остатков или между незамещенными ксилозами варьируется, как показано в таблице 4, где отношение I1,3-концевое/I1,3-внутреннее относится к отношению между соответствующими интегралами двух типов протонов. Так, для типа А расщепление приводит в результате к увеличению I1,3-концевое, тогда как для типа В это не происходит. Химическими сдвигами для двух типов протонов являются: для 1,3-прикрепленного арабинофуранозида Н-1 на концевой ксилозе - 5,26 ч/млн и для 1,3-прикрепленного арабинофуранозида Н-1 на внутренней ксилозе - 5,32 ч/млн. Для изобретения предпочтительной является ксиланаза типа А, имеющая отношение I1,3-концевое/I1,3-внутреннее по меньшей мере 0,25, такое как по меньшей мере 0,30, по меньшей мере 0,40, по меньшей мере 0,50 или даже по меньшей мере 0,60.
Пример 3
Определение характеристик специфичности эндоглюканаз
Специфичность эндоглюканаз изучали путем анализа продуктов разложения после инкубации с бета-глюканом ячменя. Пробирки Эппендорфа с 0,1 и 10 мкг/мл очищенного фермента и 5 мг/мл бета-глюкана ячменя (Megazyme, низкой вязкости) в 50 мМ ацетата натрия, 0,01% Triton X-100 при рН 5,5 выдерживали в термомиксере Эппендорфа при 50°С с перемешиванием.
Испытуемыми ферментами являлись эндоглюканаза EG I из Humicola insolens, эндоглюканаза EG III из Humicola insolens, эндоглюканаза EG IV из Humicola insolens, Aspergillus aculeatus EG II (XG5, Cel12В) и Aspergillus aculeatus EG III (XG53, Cel12A).
Пробы отбирали между 1 и 21,5 ч и инактивировали нагреванием в течение 30 мин при 95°С. Половину каждой пробы разлагали лихеназой (0,085 мкг/мл, Megazyme, из Bacillus subtillis) в 50 мМ MES, 1 мМ CaCl2, pH 6,5 в течение 2 ч при 50°С, после чего лихеназу инактивировали нагреванием до 95°С в течение 30 мин. Обработанные и необработанные лихеназой пробы надлежащим образом разбавляли водой Mill Q и анализировали на системе Dionex DX-500 HPAEC-PAD (колонка CarboPac PA-100; буфер А: 150 мМ NaOH; буфер В: 150 мМ NaOH + 0,6 М ацетата натрия: расход 1 мл/мин. Условия элюирования: 0-3 мин: 95% А + 5% В; 3-19 мин: линейный градиент от 95% А + 5% В до 50% А и 50% В; 19-21 мин: линейный градиент от 50% А + 50% В до 100% В; 21-23 мин: 100% В). В качестве эталона для системы Dionex использовали смесь целлоолигосахаридов (от DP1 до DP6, 100 мМ каждого). Пики на хроматограммах идентифицировали, используя целлоолиго эталоны и известный состав бета-глюкана ячменя после обработки лихеназой (например, Izydorczyk, M.S., Macri, L.J., & MacGregor, A.W., 1997, Carbohydrate Polymers, 35, 249-258). Количественный обсчет пиков на хроматограммах делали, используя факторы отклика, полученные для целлоолиго эталонов, и допуская, что фактор отклика идентичен для олигосахаридов одного и того же DP с бета-1,3 связями. Для олигомеров, более крупных, чем DP6, использовали фактор отклика для DP6.
При анализе продуктов разложения с EG I из Humicola insolens (таблицы 5 и 6) было найдено, что фермент способен разлагать и бета-1,3-, и бета-1,4-связи. Первоначально главными продуктами, возрастающими после обработки лихеназой, являются целлобиоза, целлотриоза и до некоторой степени ламинарибиоза. Это показывает, что связи бета-1,3 между глюкозными блоками в субсайтах -4/-3, -5/-4 и +1/+2 являются допустимыми. Было найдено, что основными продуктами при более высокой дозе фермента (10 мкг/мл) и более длительном времени инкубации (21,5 ч) являются глюкоза и целлобиоза.
С EG III из Humicola insolens (таблицы 7 и 8) основными продуктами после 21,5 ч и при 10 мкг/мл фермента были тетраозы (главным образом, Glu(бета-1,4)Glu(бета-1,3)Glu(бета-1,4)Glu и Glu(бета-1,4)Glu(бета-1,4)Glu(бета-1,3)Glu, но не Glu(бета-1,3)Glu(бета-1,4)Glu(бета-1,4)Glu), пентаозы (возможно, главным образом, Glu(бета-1,3)Glu(бета-1,4)Glu(бета-1,4)Glu(бета-1,3)Glu и Glu(бета-1,4)Glu(бета-1,4)Glu(бета-1,3)Glu(бета-1,4)Glu) и более крупные олигомеры. Состав продуктов разложения после обработки лихеназой показывает, что фермент эксклюзивно разлагает связи бета-1,4 в бета-глюкане. Более того, бета-1,4 связями, которые гидролизуются, являются, преимущественно, те, которые не гидролизуются лихеназами (без смежной бета-1,3-связи к невосстанавливаемому концу). То, что количество Glu(бета-1,4)Glu(бета-1,3)Glu ("Lic3") не понижается значительно после обработки лихеназой даже после 21,5 ч при 10 мкг/мл, показывает, что фермент обладает лишь ограниченной активностью на участках с только двумя бета-1,4-связями между бета-1,3-связями. Появление значительных количеств глюкозы и ламинарибиозы, но не целлобиозы, после обработки лихеназой показывает, что связи бета-1,3 являются допустимыми между блоками глюкозы в субсайтах -3/-2 и +1/+2, но не между -4/-3 или -5/-4.
Фермент EG IV из Humicola insolens главным образом разлагает бета-глюкан до более крупных олигомеров (таблицы 9 и 10), но после 21,5 ч с 10 мкг/мл фермента образуются значительные количества целлобиозы и олигомеров DP4 (вероятно, преимущественно Glu(бета-1,4)Glu(бета-1,3)Glu(бета-1,4)Glu и Glu(бета-1,3)Glu(бета-1,4)Glu(бета-1,4)Glu). Фермент разлагает примерно одинаковые количества связей бета-1,4 и бета-1,3 в бета-глюкане, и, как представляется, расщепляемые связи бета-1,4 бета-глюкана являются теми, которые не имеют смежных бета-1,3-связей по направлению к невосстанавливаемым концам (в отличие от лихеназ). Обработка лихеназой дает повышенное количество целлобиозы сразу после ограниченного гидролиза EG IV, тогда как целлобиоза и глюкоза появляются только после более далеко идущего гидролиза с EG IV. Это показывает, что связи бета-1,3 между глюкозой в субсайтах -5/-4 более приемлемы, чем между -4/-3 и, в особенности, между -3/-2. Появление ламинарибиозы после обработки лихеназой показывает, что приемлемы также связи бета-1,3 между глюкозой в субсайте +1/+2.
Видно, что с Aspergillus aculeatus EG II (XG5, Cel12B) глюкоза является главным низкомолекулярным продуктом (таблицы 11 и 12). Обработка проб лихеназой при малом разложении бета-глюкана EG II дает увеличение целлобиозы, целлотриозы и ламинарибиозы, но не глюкозы. Это показывает, что связи бета-1,3 являются приемлемыми между глюкозными блоками в субсайтах -5/-4, -4/-3 и +1/+2, но, вероятно, не в -3/-2. Таким образом, глюкоза, высвобожденная EG II, возможно высвобождается экзовоздействием на продукты разложения. Фермент способен гидролизовать связи и бета-1,4, и бета-1,3, хотя связи бета-1,4 кажутся предпочтительными. После 20 часов с наиболее высокой концентрацией фермента наблюдается почти полное разложение бета-глюкана до глюкозы.
Aspergillus aculeatus EG III (XG53, Cel12A) быстро разрушает бета-глюкан, давая олигомеры DP4 (главным образом, Glu(бета-1,3)Glu(бета-1,4)Glu(бета-1,4)Glu и Glu(бета-1,3)Glu(бета-1,4)Glu(бета-1,4)Glu) и DP5 (главным образом, Glu(бета-1,4)Glu(бета-1,4)Glu(бета-1,3)Glu(бета-1,4)Glu, но также и некоторое количество Glu(бета-1,4)Glu(бета-1,3)Glu(бета-1,4)Glu(бета-1,4)Glu и Glu(бета-1,4)Glu(бета-1,4)Glu(бета-1,4)Glu(бета-1,3)Glu (таблицы 13 и 14)). После 20 часов с наиболее высокой концентрацией фермента образуются также значительные количества целлобиозы, глюкозы и целлотриозы. Обработка проб лихеназой дает увеличение глюкозы, целлотриозы и ламинарибиозы и, особенно, целлобиозы. Это показывает, что связи бета-1,3 могут быть предпочтительны между глюкозными блоками в субсайтах -4/-3, но приемлемы также между -5/-4, -3/-2 и +1/+2. Фермент способен разрушать и связи бета-1,4, и связи бета-1,3.
Пример 4
Характеристики затирания и фильтрации
Обычную стандартную обработку Ultraflo® 2,7 мг ЕР/кг сухого вещества (СВ) солодовой крупки (индекс 1.000) сравнивали с экспериментальной обработкой Ultraflo® 1,4 мг ЕР/кг СВ солодовой крупки, дополненной различными эндоглюканазами. Доза 0,2 г Ultraflo® /кг СВ солодовой крупки эквивалентна 2,7 мг протеина фермента/кг СВ солодовой крупки.
Ultraflo® 1,4 мг ЕР/кг СВ, дополненный H. insolens EG I, Cel 7b (GH 7) 8 мг ЕР/кг СВ, снижала содержание бета-глюкана по сравнению со стандартной обработкой (индекс 1.000).
Эндоглюканаза III H. insolens (Cel 12a, GH12) и Ultraflo® 1,4 мг ЕР/кг СВ снижала содержание бета-глюкана, O.D. и вязкость, в то же время улучшая также фильтруемость по сравнению со стандартной обработкой.
Ultraflo® 1,4 мг ЕР/кг СВ, дополненная эндоглюканазой T. aurantiacus BG025 (GH 5), значительно снижала содержание бета-глюкана по сравнению со стандартной обработкой.
Обычную стандартную обработку Ultraflo® 0,2 г/кг СВ солодовой крупки (индекс 1.000) сравнивали с экспериментальной обработкой Ultraflo® 0,1 г/кг СВ солодовой крупки, дополненной различными ксиланазами.
Ни одна из двух ксиланаз GH11, тип В из грибов Bh и Cc, не имела положительного влияния на бета-глюкан, OD, извлечение экстракта, вязкость или фильтруемость.
Ксиланаза I Aspergilus aculeatus и ксиланаза II Aspergilus aculeatus снижали вязкость, а также улучшали фильтруемость по сравнению со стандартной обработкой.
Обычную стандартную обработку с Ultraflo® 0,2 г/кг СВ солодовой крупки (индекс 1.000) сравнивали с экспериментальной обработкой с Viscozyme 0,1 или 0 г/кг СВ солодовой крупки, дополненной ксиланазой II Aspergilus aculeatus и различными эндоглюканазами.
Сочетание ксиланазы II Aspergilus aculeatus и эндоглюканазы EG III Aspergilus aculeatus дало значительный эффект на бета-глюкан, вязкость и фильтруемость.
Композиция, включающая Viscozyme® 3,6 мг ЕР/кг СВ, Aspergillus aculeatus EG III 2 мг ЕР/кг СВ и ксиланазу II Aspergillus aculeatus 4 мг ЕР/кг СВ, имела значительно более положительное влияние на бета-глюкан, OD, извлечение экстракта и вязкость, чем имела доза в 7,5 раз больше обычной стандартной дозы Viscozyme® (стандартная доза=3,6 мг ЕР/кг СВ) (таблица 22).
Пример 5
Количественное определение протеиновых связок в гелях SDS-PAGE
Ферментную композицию разбавляли в 250 раз деионизированной водой и выгружали на гель SDS-PAGE с 4-20% Трис-глицина (Nu Page, Invitrogen) и проводили электрофорез, как описано производителем.
После электрофореза гель покрывали пятнами GelCode Blue (Pierce) o/n, после чего обесцвечивали в воде, чтобы фон стал светлым.
Затем полученный гель сканировали, используя денситометр, и анализировали с помощью программы ImageMaster™ v. 1.0 от Amersham Bioscience, следуя методике производителя. Результаты выражены как % плотности связок от общей плотности на данной полосе.
Суммарное количество протеина в образцах фермента измеряли, применяя набор Micro BCA от Pierce, используя методику, прилагаемую к набору.
Реферат
Изобретение относится к пищевой промышленности и биотехнологии и представляет собой ферментную композицию, содержащую ксиланазу семейства GH10, присутствующую в количестве по меньшей мере 33 вес.% от общего веса ферментного белка, и эндоглюканазу GH12, присутствующую в количестве по меньшей мере 14 вес.% от общего веса ферментного белка. Данная композиция используется для получения затора. Изобретение позволяет получать затор с улучшенной фильтруемостью. 2 н. и 18 з.п. ф-лы, 23 табл.
Формула
эндоглюканазу GH12, присутствующую в количестве по меньшей мере 14 вес.% от общего веса ферментного белка.
a) ксиланаза, происходящая из мицелиальных грибов, таких как штамм Aspergillus sp., предпочтительно из Aspergillus aculeatus (SEQ ID NO: 8 или SEQ ID NO: 9), из штамма Myceliophotora sp., предпочтительно из Myceliophotora thermophillia (SEQ ID NO: 13), из штамма Humicola sp., предпочтительно, из Humicola insolens (SEQ ID NO: 12), или из штамма Trichoderma sp., предпочтительно из Т. reesei (SEQ ID NO: 17);
b) ксиланаза, имеющая по меньшей мере 50%, так как по меньшей мере 60%, 70%, 80% или даже 90% гомологию с любой из последовательностей, указанных в а).
a) эндоглюканаза, происходящая из Humicola sp., такая как эндоглюканаза из Humicola insolens (SEQ ID NO: 3), или эндоглюканаза из Н. insolens (SEQ ID NO: 4), из Thermoascus sp., такая как эндоглюканаза, происходящая из Thermoascus aurantiacus (SEQ ID NO: 6), или из Aspergillus sp., такая как эндоглюканаза, происходящая из Aspergillus aculeatus (SEQ ID NO: 16), или из Trichoderma sp., такая как эндоглюканаза из Т. reesei, показанная в SEQ ID NO: 18, эндоглюканаза из Т. viride sp., показанная в SEQ ID NO: 19, или эндоглюканаза из Т. reese, показанная в SEQ ID NO:20;
b) эндоглюканаза, имеющая по меньшей мере 50%, так как по меньшей мере 60%, 70%, 80% или даже 90% гомологию с любой из последовательностей, указанных в а).

Комментарии