Способ получения сложных эфиров 2,2-диметил 3-[(z)способ получения сложных эфиров 2,2-диметил 3-[(z)-1-пропенил]циклопропанкарбоновой кислоты и промеж-1-пропенил]циклопропанкарбоновой кислоты и промежуточные соединения уточные соединения - RU2128161C1
Код документа: RU2128161C1
Описание
Настоящее изобретение относится к способу получения сложных эфиров 2,2-диметил 3-[(Z)1-пропенил] циклопропан-карбоновой кислоты и к промежуточным соединениям.
Таким образом, объектом изобретения является способ получения соединений
формулы (I):

в которой R представляет собой либо расщепляемый сложноэфирный остаток, либо сложноэфирный остаток, известный в химии пиретриноидов, а именно:
а) либо бензильный радикал с возможностью замещения на уровне ароматических вершин одним или несколькими радикалами, выбранными в группе, состоящей из алкильных радикалов, включающих от 1 до 4 атомов углерода, алкиленных радикалов, включающий от 2 до 6 атомов углерода, алкиленоксильных радикалов, включающих от 2 до 6 атомов углерода, алкадиенильных радикалов, включающих от 4 до 8 атомов углерода, метилендиоксильного радикала и галогенных атомов,
б) либо группу

в которой заменитель R1 представляет собой атом водорода или метильный радикал, а заменитель R2 является моноциклическим арилом или группой

в) либо группу

в которой заменитель а представляет собой атом водорода или метильный радикал, а R3 является органическим алифатическим радикалом, включающим от 2 до 6 атомов углерода и одно или несколько ненасыщенных соединений углерод-углерод,
г) либо группу

в которой В представляет собой атом кислорода или серы или группу



д) либо группу

в которой заменители R6, R7, R8 и R9 являются атомом водорода, атомом хлора или метильным радикалом и в которой S/1 символизирует ароматический цикл или аналогичный цикл дигидро, тетрагидро или гексагидро,
е) либо (сукцимидо или малеимидо) метиленную группу,
ж) либо группу

з) либо группу

в которой R10 представляет собой атом водорода или радикал CN, R12 является радикалом -CH2- или атомом кислорода, R11 является тиазолильным или тиадиазолильным радикалом, связь которого с

и) либо группу

в которой R13 представляет собой атом водорода или радикал -CN или

к) либо группу

в которой R13 определен, как указано выше,
л) либо группу

в которой
R4 определен, как указано выше, R15 представляет собой атом фтора, хлора или брома, a R16 является атомом водорода, фтора, хлора или брома,
м) либо группу

в которой R4 определен, как указано выше, а каждый из R17 представляет собой произвольно алкильную группу, включающую от 1 до 4 атомов углерода, алкоксильную группу, включающую от 1 до 4 атомов углерода, алкилтионильную группу, включающую от 1 до 4 атомов углерода, алкилсульфонильную группу, включающую от 1 до 4 атомов углерода, трифторметильную, 3, 4-метилен-диоксильную, хлорную, фторную или бромную, p представляет собой число, равное 0, 1, или 2, а В' является атомом кислорода или атомом серы,
н) либо группу

в которой R18 представляет собой атом фтора или метильный радикал, a R'18 является метильным, этильным или пропаргильным радикалом,
о) либо группу

в которой R21 представляет собой атом водорода, группу



в котором n равен 0, 1 или 2, а радикалы R24, R25 и К26 являются алкильным радикалом, включающим от 1 до 8 атомов углерода, причем радикалы R22 и R23 могут образовывать насыщенный или ненасыщенный углеродный гомоцикл, включающий до 8 атомов углерода, a R19 представляет собой:
либо радикал

в котором R27 и R28, одинаковые или различные, представляют собой атом водорода, галогенный атом, алкильный радикал, включающий от 1 до 8 атомов углерода, или арильный радикал, включающий до 14 атомов углерода,
либо радикал
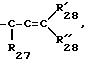
в котором R'27, R'28 и R''28, одинаковые или различные, представляют собой одно из значений, указанных выше для R27 и R28, а пунктирные линии представляют возможную вторую связь,
либо радикал

в котором R29 может иметь значения, указанные выше для R22 и R23 за исключением галогена, циано, NO2,

где n равен 1 или 2 и

либо радикал

в котором R30 и R31, одинаковые или различные, представляют собой атом водорода, алкильный радикал, включающий от 1 до 18 атомов углерода, арильный радикал, включающий до 14 атомов углерода, аралкильный радикал, включающий до 18 атомов углерода, радикал CF3, СО2-алкильный радикал, включающий до 8 атомов углерода, или алкоксильный радикал, включающий до 8 атомов углерода,
n) либо группу

в которой X представляет собой атом серы или кислорода, Y представляет собой группу >С= 0, >C= S или > CH2, R32 представляет собой атом водорода, алкильный радикал, линейный, разветвленный или циклический, насыщенный или ненасыщенный, включающий до 8 атомов углерода, с возможностью замещения одним или несколькими галогенными атомами, или арильный радикал, включающий до 14 атомов углерода, R33 представляет собой атом водорода, алкильный радикал, линейный, разветвленный или циклический, насыщенный или ненасыщенный, включающий до 8 атомов углерода, с возможностью замещения одним или несколькими галогенными атомами, или R33 представляет собой арильный радикал, включающий до 14 атомов углерода, радикал -CF3, -NO2,


р) либо группу

в которой R35 представляет собой атом водорода, алкильный радикал, включающий от 1 до 3 атомов углерода, радикал -C≡N, -C≡CH или CF3, R36 и R38, одинаковые или различные, представляет собой атом водорода, алкильный радикал, включающий от 1 до 3 атомов углерода, с возможностью замещения одним или несколькими галогенными атомами, алкиленный радикал, включающий от 2 до 4 атомов углерода или галогенный атом, а R37 представляет собой фенильный радикал с возможностью замещения одним или несколькими алкильными радикалами, включающими от 1 до 3 атомов углерода, или одним или несколькими галогенными атомами, R' представляет собой атом водорода, алкильный радикал, включающий от 1 до 18 атомов углерода, линейный или разветвленный, насыщенный или ненасыщенный, с возможностью замещения одной или несколькими одинаковыми или различными функциональными группами, или R' представляет собой циклоалифатический радикал, включающий от 3 до 7 атомов углерода, с возможностью замещения одной или несколькими одинаковыми или различными функциональными группами, или R' представляет собой арильную группу, включающую от 6 до 14 атомов углерода, с возможностью замещения одной или несколькими одинаковыми или различными функциональными группами, или R' представляет собой гетероциклический радикал с возможностью замещения одной или несколькими одинаковыми или различными функциональными группами в виде смеси изомеров или изомеров, разделенных на уровне циклопропанового цикла, с той особенностью, что сложный эфир формулы (II):

в которой R определен, как указано выше, подвергается обработке галогенирующим средством для получения соединения формулы (III):
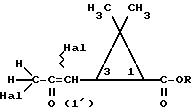
в которой R определен, как указано выше, a Hal представляет собой галогенный атом, имеющий форму смеси изомеров на уровне атома углерода в положении 1', который подвергают обработке основным средством в присутствии соединения формулы R'-ОН, в которой R' определен, как указано выше, для получения искомого соединения формулы (I).
Когда R представляет собой расщепляемый сложноэфирный остаток, речь может идти о любом известном специалистам остатке, в частности об алкильном радикале, включающем от 1 до 18 атомов углерода, таком как метильный, этильный, n-пропильный, изопропильный, n-бутильный, изобутильный или, в первую очередь, трет-бутильный, или об алкильном радикале, как определено выше, замещенном одним или несколькими галогенными атомами, в первую очередь хлором или бромом, таким как бром или хлорметил, моно-, ди- или три- бромэтил или хлорэтил; речь может также идти об алкилсилильном радикале, в котором алкил включает от 1 до 4 атомов углерода, таком как триалкилсилилметил, например трет-бутилдиметилсилил-метил, или арилалкилсилилметил, такой как дифенил-трет-бутил-силилметил; речь может также идти об алкильном радикале, замещенном такими группами как О-алкильная, О-арильная или О-аралкильная, алкильная, включающая предпочтительно от 1 до 4 атомов углерода, арильная, включающая от 6 до 14 атомов углерода и представляющая собой, в первую очередь, фенильный или толильный радикал, и аралкильная, представляющая собой, в первую очередь, бензильный или фенетильный радикал.
Следует только отметить, что вышеуказанный сложноэфирный остаток должен быть расщепляем в нейтральной или кислой среде.
Когда R представляет собой бензильный радикал, замещенный одним или несколькими алкильными радикалами, речь в первую очередь идет о метильном, этильном, пропильном или изопропильном радикалах.
Когда R представляет собой бензильный радикал, замещенный одним или несколькими алкиленными радикалами, речь в первую очередь идет о винильном, аллильном, 2-метилаллильном или изобутенильном радикалах.
Когда R представляет собой бензильный радикал, замещенный одним или несколькими алкиленоксильными радикалами, речь в первую очередь идет о винилоксильном, аллилоксильном, 2-метилаллилоксильном или изобутенилоксильном радикалах.
Когда R представляет собой бензильный радикал, замещенный одним или несколькими алкадиенильными радикалами, речь в первую очередь идет о бутандиенильном или пентадиенильном радикале.
Когда R представляет собой бензильный радикал, замещенный одним или несколькими галогенными атомами, речь в первую очередь идет об атоме хлора, брома или фтора.
Когда R2 представляет собой арильный радикал, речь в первую очередь идет о фенильном радикале, а группа R в этом случае является, в первую очередь, 5-бензил-3-фурилметильной группой.
R3 может представлять собой, в частности, радикал -CH2
-CH=CH2, -CH2
-CH= CH-CH3,
-CH2-CH=CH-CH-CH2, -CH2-CH=CH-CH2 -CH2-C≡CH.
В представляет собой, в
частности, атом кислорода, а
соответствующей группой в этом
случае
является, в первую очередь, такая группа, как 3-феноксибензильная, α -циано-3-феноксибензильная, α
-этинил- 3-феноксибензильная,
1-(3-феноксифенил)-этильная или α
-тиоамидо-3-феноксибензильная. В представляет собой также группу -CO-, а соответствующей группой в этом случае является, в первую
очередь,
3- бензоилбензильная группа.
Когда R14 представляет собой алкильный радикал, речь в первую очередь идет о таком радикале, как метильный, этильный, пропильный, линейный или разветвленный, или бутильный, линейный или разветвленный.
Когда R14 представляет собой алкиленный радикал, речь идет о таком радикале, как винильный, аллильный, бутенильный, пентенильный или гексаенильный.
Когда R14 представляет собой алкинильный радикал, речь в первую очередь идет о таком радикале, как этинильный, пропаргильный или бутинильный.
Когда R14 представляет собой алкильный радикал, речь идет о таком радикале, как метильный, этильный, пропильный, линейный или разветвленный, или бутильный, линейный или разветвленный.
Когда R17, представляет собой алкоксильный радикал, речь идет о таком радикале, как метоксильный, этоксильный, пропоксильный, линейный или разветвленный, или бутоксильный, линейный или разветвленный.
Когда R17 представляет собой алкилтионильный радикал, речь идет о таком радикале, как метилтионильный, этилтионильный, пропилтионильный, линейный или разветвленный, или бутилтионильный, линейный или разветвленный.
Когда R17, представляет собой алкилсульфонильный радикал, речь идет о радикале, соответствующем любому из вышеуказанных алкилтионильных радикалов.
Когда R21 представляет собой алкильный радикал, речь идет о таком радикале, как метильный, этильный, пропильный или изопропильный, и, в первую очередь, о метильном радикале.
Когда один или несколько радикалов R20, R22 и R23 или радикалов, содержащихся в определении R19, R20, R22 и R23, представляют собой галогенный атом, речь идет, в первую очередь, об атоме фтора, хлора или брома.
Когда один или несколько радикалов R20, R22 и R23, или радикалов, содержащихся в определении R19, R20, R22 и R23, представляют собой алкильный радикал, речь идет, в первую очередь, о таком радикале, как метильный, этильный, пропильный, изопропильный, бутильный, изобутильный или n-пентильный.
Когда один или несколько радикалов R20 , R22 и R23 или радикалов, содержащихся в определении R19, R20, R22 и R23, представляют собой арильный радикал, речь идет, в первую очередь, о фенильном радикале, с возможностью его замещения, в частности, алкильным или алкоксильным радикалом, включающим от 1 до 8 атомов углерода, или таким радикалом, как нитро, трифторметильный, гидроксильный, галогенный или аминный.
Когда один или несколько радикалов R20, R22 и R23 или радикалов, содержащихся в определении R19, R20, R22 и R23 представляют собой аралкильный радикал, речь идет, в первую очередь, о бензильном радикале.
Когда один или несколько радикалов R20, R22 и R23 или радикалов, содержащихся в определении R19, R20, R22 и R23, представляют собой -CO2 -алкильный или алкоксильный радикал, под алкильным понимают, в первую очередь, метильный, этильный, пропильный или изопропильный радикал, а под алкоксильным - метоксильный, этоксильный, пропоксильный или изопропоксильный радикал.
Когда R32 или R33 представляет собой алкильный радикал, линейный, разветвленный или циклический, насыщенный или ненасыщенный, речь идет, в первую очередь, о радикале, таком как метильный, этильный, n-пропильный, изопропильный, циклопропильный, циклопропилметильный, бутильный, изобутильный, трет-бутильный, циклобутильный, n-пентильный, циклопентильный, n-гексильный или циклогексильный, или об аллильном, пропаргильном или бутинильном радикале.
Когда указанные радикалы замещены одним или несколькими галогенными атомами, под галогеном понимают фтор, хлор, бром или иод.
Когда R32 или R33 представляет собой арильный радикал, речь идет, в первую очередь, о фенильном радикале.
Когда R33 представляет собой галогенный атом, речь идет, в первую очередь, об атоме фтора, хлора или брома.
Когда R33 представляет собой алкоксильный радикал, речь идет, в первую очередь, о метоксильном, этоксильном, пропоксильном или изопропоксильном радикале.
Когда R33 представляет собой -CO2-алкильный радикал, под алкильным понимают, в первую очередь, такой радикал, как метильный, этильный, пропильный, линейный или разветвленный, или бутильный, линейный или разветвленный.
Когда R34 представляет собой алкильный радикал, речь идет, в первую очередь, о метильном радикале.
Когда R33 представляет собой алкильный радикал, речь идет, в первую очередь, о метильном радикале.
Когда R36 и/или R38 представляет собой алкильный радикал, речь идет, в первую очередь, о метильном или этильном радикале.
Когда алкильный радикал замещен одним или несколькими галогенными атомами, под галогеном понимают, в первую очередь, фтор, хлор или бром.
Когда R36 и/или R38 представляет собой алкиленный радикал, речь идет, в первую очередь, о винильном или аллильном радикале.
Когда R36 и/или R38 представляет собой галогенный атом, речь идет, в первую очередь, об атоме фтора, хлора или брома.
Когда R37 представляет собой фенильный радикал, замещенный алкильным радикалом или галогенным атомом, под алкилом и галогеном понимают, в первую очередь, соответствующие радикалы, указанные выше для R36 и R38.
Когда R' представляет собой линейный или разветвленный алкильный радикал, под алкильным понимают, например, такие радикалы как метильный, этильный, пропильный, линейный или разветвленный, бутильный, линейный или разветвленный, гексильный, линейный или разветвленный, децильный, линейный или разветвленный, тетрадецильный, линейный или разветвленный, октадецильный, линейный или разветвленный.
Когда R' представляет собой линейный или разветвленный алкильный радикал, под ненасыщенным алкильным понимают, например, такие радикалы как этенильный, пропенильный, бутенильный, линейный или разветвленный, гексенильный, линейный или разветвленный, деценильный, линейный или разветвленный, тетрадеценильный, линейный или разветвленный, октадеценильный, линейный или разветвленный, или же ненасыщенные алифатические радикалы, включающие две или несколько двойных связей.
Когда R' представляет собой алкильный радикал, замещенный одной
или
несколькими функциональными группами, под функциональной группой
понимают, в первую
очередь, галогенный атом, группу ОН или SH, группу ORa или SRa, в которых Ra
является алкильным радикалом, включающим от 1 до 8 атомов углерода,
группу NO2 или

в которой Rb и Rc, одинаковые или различные, представляют собой атом водорода, или алкильный радикал, включающий от 1 до 8 атомов углерода, группу C≡N, SO3H или PO4H2 или группу COalc1, SO2 alc2, SO3alc3, в которых alc1, alc2 или alc3 представляют собой алкильный радикал, включающий от 1 до 18 атомов углерода.
R' может также представлять собой алкильный радикал, замещенный арильным радикалом, например бензильным
или фенетильным,
который, в свою очередь, может быть замещен одной или несколькими
группами OH, Oalc или alc, включающими от 1 до 8 атомов углерода, одной или несколькими группами CF3,
OCF3,
SCF3 или группой (G):

R' может также представлять собой алкильный радикал, замещенный на уровне двух соседних атомов углерода группой (G1 ):

или замещенный группой
Когда R' представляет собой алкильный радикал, замещенный одной или несколькими функциональными группами, в качестве предпочтительных значений R' можно назвать радикалы:
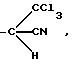
-(CH2)n-CHal3, в котором n принимает целочисленное значение от 1 до 8, a Hal является галогенным атомом, например, радикал -CH2 -CCl3, -CH2-CF3, -CH2-CH2-CCl3 или -CH2-CH2-CF3,
-(CH2)n1-CHHal2, в котором Hal определен, как указано выше, а n1 принимает значение от 0 до 8, например, радикал -CH2-CHCl2, -CH2-CHF2 или -CHF2,
-(CH2)n-CH2Hal, в котором n и Hal определены, как указано выше, например, радикал -CH2-CH2CI или -CH2-CH2F,
-C(CHal3)3 в котором Hal определен, как указано выше, например, радикал -C(CF3 )3 или




или -(CH2)n- CN, в котором n определен, как указано выше,

в котором Hal определен, как указано выше, например, радикал:
-(CH2)n-ORd, в котором n определен, как указано выше, а Rd представляет собой атом водорода или линейный или разветвленный алкильный радикал, включающий от 1 до 8 атомов углерода, например радикал -CH2-OCH3, -CH2-CH2 -O-CH3, -CH2-CH2- O-CH2-CH3 или -CH2-CH2-OH,

в котором n и Rd определены, как указано выше, а два радикала Rd могут быть различными, например, радикал


в котором n определен, как выше, например, радикал
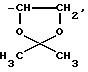

в котором n определен, как выше, например,

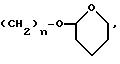
в котором n определен, как выше, например, радикал


в котором n определен, как выше, например, бензильный или фенетильный радикал,

в котором n определен, как выше, например, радикал

Когда R' представляет собой циклоалифатический радикал, включающий от 3 до 7 атомов углерода, речь идет о таком радикале, как циклопропильный, циклобутильный, циклопентильный, циклогексильный или циклогептильный, который может быть связан с атомом кислорода с помощью алкильного радикала, включающего от 1 до 3 атомов углерода, в частности, с помощью метильного радикала.
Когда R' представляет собой циклоалифатический радикал, включающий от 3 до 7 атомов углерода, замещенный одной или несколькими функциональными группами, под функциональной группой понимают, в первую очередь, галогенный атом, алкильный радикал, включающий от 1 до 6 атомов углерода, алкоксильный радикал, включающий от 1 до 6 атомов углерода, группу NO2.
Когда R' представляет собой арильный радикал, с возможностью замещения, речь идет, в первую очередь, о фенильном радикале или о фенильном радикале, замещенном одной или несколькими группами ОН, Oalc или alc, причем alc представляет собой алкильный радикал, включающий от 1 до 8 атомов углерода, или группой CF3, OCF3 или SCF3, или одним или несколькими галогенными атомами.
Когда R' представляет собой гетероциклический радикал, с возможностью замещения, речь идет, в первую очередь, о таком радикале, как пиридильный, фурильный, тиофенильный, оксазолильный или тиазолильный, с возможностью замещения одной или несколькими из вышеперечисленных групп.
Способ, являющийся предметом настоящего изобретения, отличается исключительной стандартностью. Он позволяет получить как расщепляемые сложные эфиры, то есть промежуточные сложные эфиры, превращаемые в биологически активные сложные эфиры обычными методами переэтерификации или гидролиза с последующей этерификацией, так и непосредственно биологически активные сложные эфиры.
Кроме того, настоящий способ отличается исключительной избирательностью, поскольку он приводит к получению соединений формулы (I) с конфигурацией (Z), то есть к биологически активной форме этих соединений.
Предметом настоящего изобретения является, в частности, вышеописанный способ, отличающийся тем, что галогенирующим средством является хлорирующая или бромирующая добавка, причем предпочтение отдается второй добавке.
Среди галогенирующих средств, используемых в настоящем изобретении, можно назвать бром, используемый самостоятельно или на полимерной основе, хлор, N-бромсукцинимиды и N-хлорсукцинимиды, N-бромацетамиды и N-хлорацетамиды, пербромид пиридиния, пербромид гидробромида пиридиния, перхлорат гидрохлорида пиридиния, пербромид фенилтриметиламмония, пербромид 2-карбоксиэтилтри-фенилфосфония, трибромид 2-гидропирролидона, дибромид и дихлорид меди, 5,5-дибром-2,2-диметил-4, 6-диоксо-1,3-диоксан, три- и пентабромид и хлорид фосфора, смеси третичного триметилбром- и триметилхлорсилан-ДМСО-амина, трихлорид железа. Среди них можно назвать, в первую очередь, бром, хлор, N-бромсукцинимиды и N-хлорсукцинимиды и ацетамиды, пербромид и перхлорид пиридиния, пербромид и перхлорид гидробромида и гидрохлорида пиридиния.
Реакция галогенирования проводится в среде растворителя, которым может быть галогенсодержащий растворитель, в частности метиленхлорид, хлороформ, тетрахлорметан, дихлорэтан или смесь этих растворителей, эфир, такой как тетрагидрофуран, диметоксиэтан, метил-трет-бутилэфир или диоксан, ароматический растворитель, такой как бензол, толуол, ксилол или соответствующий насыщенный растворитель, в частности циклогексан, спирт, такой как метанол или этанол, этилацетат или же диметилформамид или диметилсульфоксид.
Выгодно максимальное ограничение образования моно- и тригалогенсодержащих производных рядом с целевыми производными (III), поэтому предметом настоящего изобретения является, в частности, метод, отличающийся тем, что используются примерно 2 эквивалента галогенирующего средства.
В предпочтительных условиях внедрения изобретения используемое основное вещество выбирают из группы, состоящей из гидридов, алкоголятов, амидидов, щелочных и щелочноземельных карбонатов, в частности натрия или калия, третичных аминов, в частности триэтиламина, пиридина или диметиламинопиридина.
Операция выполняется в среде растворителя, которым является либо соединение формулы R'-ОН, либо смесь этого соединения с соответствующим сорастворителем. Этим сорастворителем может быть, в частности, галогенсодержащий растворитель, эфир, ароматический растворитель или соответствующий насыщенный растворитель из числа вышеперечисленных или же диметилформамид или диметилсульфоксид.
Операция выполняется при температуре, пригодной для используемого растворителя, причем эта температура может составлять, в зависимости от случая, примерно от -78oC до +40oC.
Предметом настоящего изобретения, в частности, является вышеописанный способ, отличающийся тем, что R представляет собой сложноэфирный остаток, расщепляемый в нейтральной или кислой среде, выбранный из группы, состоящей из линейных или разветвленных алкильных радикалов, включающих от 1 до 18 атомов углерода, линейных или разветвленных алкильных радикалов, включающих от 1 до 18 атомов углерода, замещенных одним или несколькими галогенными атомами, алкильных радикалов, включающих от 1 до 4 атомов углерода, замещенных силильной группой, и алкильных радикалов, включающих от 1 до 4 атомов углерода, замещенных такими группами, как O-алкильная, O-арильная или O-аралкильная, алкильная, включающая от 1 до 4 атомов углерода, и арильная, включающая от 6 до 14 атомов углерода.
Предметом настоящего изобретения, в частности, является вышеописанный способ, отличающийся тем, что R представляет собой сложноэфирный остаток, расщепляемый в нейтральной или кислой среде, выбранный из группы, состоящей из алкильных радикалов, включающих от 1 до 4 атомов углерода, алкильных радикалов, включающих от 1 до 4 атомов углерода, замещенных одним или несколькими атомами хлора или брома, алкильных радикалов, включающих от 1 до 4 атомов углерода, замещенных алкилсилильной группой, и алкильных радикалов, включающих от 1 до 4 атомов углерода, замещенных такими группами, как O-алкильная, O-арильная или O-аралкильная, как определено выше.
Предметом настоящего изобретения является, в первую очередь, вышеописанный способ, отличающийся тем, что R представляет собой алкильный радикал, включающий от 1 до 4 атомов углерода, в первую очередь трет-бутильный, или метильный или этильный радикал, замещенный одним или несколькими атомами хлора или брома, в первую очередь бром- или хлорметильный радикал или моно-, ди- или трибром- или хлорэтильный радикал.
Предметом
настоящего изобретения также
является вышеописанный способ, отличающийся тем, что R
представляет собой сложноэфирный остаток, выбранный из группы, состоящей из:
бензилового
радикала,
замещенного одним или несколькими
галогенными атомами,
радикалов формулы:

в которой R1 и R2 определены, как указано выше,
радикалов формулы:

в которой а и R3 определены, как указано выше,
радикалов формулы:

в которой R4, R5 и n определены, как указано выше,
радикалов формулы:

в которой R6 , R7, R8, R9 и S/1 определены, как указано выше,
радикалов формулы:

в которой R13, R14 и m определены, как указано выше,
радикалов формулы:

в которой R4 , R15 и R16 определены, как указано выше,
радикалов формулы:

в которой R18 и R'18 определены, как указано выше,
радикалов формулы:

в которой R35, R36, R37 и R38 определены, как указано выше.
Предметом настоящего изобретения является, в первую очередь,
вышеописанный способ, отличающийся тем, что R представляет собой сложноэфирный остаток, выбранный из
группы,
состоящей из:
бензилового радикала, замещенного от 1 до 5 атомами фтора,
радикалов формулы:

в которой R3 представляет собой радикал -CH2 -CH--CH2 или -CH2=C≡CH,
радикалов формулы:

в которой R4 определен, как указано выше,
радикалов формулы:

радикалов формулы:

в которой R14 и m определены, как указано выше,
радикалов формулы:

в которой R4 определен, как указано выше,
радикалов формулы:

в которой R18 и R'18 определены, как указано выше,
радикалов формулы:

в которой R36 представляет собой атом водорода, атом фтора или хрома, R37 является фенильным или 3-фторфенильным радикалом, а R38 - атом водорода, атом фтора или хлора или метильный радикал.
Предметом настоящего изобретения также, в частности, является вышеописанный способ, отличающийся тем, что на начальном этапе используется соединение формулы R'-ОН, в которой R' представляет собой атом водорода, линейный, разветвленный или циклический алкильный радикал, включающий от 1 до 8 атомов углерода, и, в частности, этильный радикал, трет-бутильный радикал или же циклопропильный или циклопропилметильный радикал, линейный или разветвленный алкильный радикал, включающий от 1 до 8 атомов углерода, замещенных одним или несколькими галогенными атомами, и, в частности, одним или несколькими атомами фтора, радикал (CH2)m-O-(CH2)n-CH3, в котором m имеет целочисленное значение от 1 до 8, а n имеет целочисленное значение от О до 8, и, в частности, радикал -CH2 -O-CH3.
Предметом настоящего изобретения является, в первую очередь, вышеописанный способ, отличающийся тем, что на начальном этапе используется соединение формулы (II) со структурой (1R, цис), в которой R представляет собой остаток (R, S) или (S) α -циано -феноксибензилового спирта или остаток (R, S) или (S) α -циано 4-фтор 3-феноксибензилового спирта и соединение формулы R'-ОН, в которой R' представляет собой метильный, этильный, трет-бутильный или 1,1,1,3,3, 3-гексафторпропильный радикал.
Промежуточные соединения формулы (III) являются новыми соединениями, так что предметом настоящего изобретения также являются указанные соединения формулы (III) в виде смесей изомеров или отдельных изомеров на уровне циклопропанового цикла.
Большая часть соединений формулы (I) известны и описаны в патентах или патентных заявках ЕЭС N 38271, 41021, 48186, 110769, 114012, 215701, 357742, 300898, 176387, 261035, 381563 или во французском патенте 2 612 184. Речь идет о биологически активных соединениях, обладающих, как правило, пестицидными свойствами, в частности в отношении насекомых и клещей, или же о промежуточных соединениях в синтезе активных соединений.
Соединениями формулы (I), в которой R представляет собой метильный радикал, замещенный атомом брома или хлора, или этильный радикал, замещенный 1, 2 или 3 атомами брома или хлора, являются расщепляемые сложные эфиры, то есть промежуточные вещества в синтезе биологически активных сложных эфиров. Они до настоящего времени не были описаны и также являются предметом настоящего изобретения.
Расщепление сложных эфиров формулы (I), являющихся промежуточными веществами в синтезе биологически активных сложных эфиров, может производиться обычными методами, известными специалистам. Соответствующие примеры приводятся в патенте ЕЭС 48186, о котором уже шла речь выше, и, в более общих чертах, в статье Т. У. Грина "Защитные группы в органическом синтезе".
Соединения формулы (II), используемые на начальном этапе метода, являющегося предметом настоящего изобретения, могут быть получены по одному из методов, описанных ниже, в экспериментальной части, то есть путем этерификации соответствующей кислоты подходящим спиртом. Соединения формулы (II), за исключением тех из них, в которых R представляет собой метильный, этильный, 3-феноксибензильный или α -циано 3-феноксибензильный радикал, являются новыми соединениями и в качестве таковых - одним из предметов настоящего изобретения.
Вышеуказанная кислота в любой из своих конфигураций хорошо известна и может быть получена одним из методов, известных специалистам. Кислота (IR, цис) описана в журнале Agr. Biol. Chem., том 29, N 8, стр. 784 (1965); кислота (IS, цис) может быть получена по методу, описанному в патенте США 4 296 038; кислота (IR, транс) может быть получена по методу, описанному в журнале Synth. Comm. (1984) 14, стр. 1239-46, а кислота (IS, транс) - тем же методом, беря за основу (-) 3-карен; кислота (IR,S цис) может быть получена с использованием методов, описанных в вышеуказанном журнале Agr. Biol. Chem. или в патенте США 4 296 038, беря за основу рацемический 3-карен, который может быть получен, как описано в журнале J. Org. Chem. (1987), том 52, стр. 1493 или в Tet. Letters (1984), стр. 5255; кислота (IR,S транс), а также кислота (IR,S цис) могут быть получены с использованием методов, описанных в Japan Kokai J 81 079644.
Соединения формулы (II), в которой R представляет собой метильный, 3-феноксибензильный или α -циано 3-феноксибензильный радикал, описаны, например, в журнале Synth. Comm. (1988) 18, стр. 1139-49 и Tetrahedron (1986), 42, стр. 5717-28.
Приводимые далее примеры иллюстрируют настоящее изобретение, вместе с тем не ограничивая его.
ПРИМЕР 1 : (IR, цис) 2,2-диметил
3-[(Z) 2-метоксикарбонил) этенил] циклопропан 1-метилкарбоксилат
ЭТАП А : (1R, цис) 2,2-диметил
3-(1,3-дибром 2-оксопропил) циклопропан
1-метилкарбоксилат
В среде инертного газа
смешивают 2,4 г (1R, цис) 2,2-диметил 3-(2-оксопропил) циклопропан 1-метилкарбоксилата и 30 см3
метиленхлорида, затем охлаждают до
+10oC и добавляют 1,3 см3 брома.
После этого взбалтывают в течение 2 ч при комнатной температуре и вливают в смесь воды и льда. Затем
экстрагируют с помощью метиленхлорида,
высушивают
органическую фазу и выпаривают досуха. Остаток
подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид - гексан (7 : 3), в результате
чего получают 3,2 г искомого
продукта.
Химический состав C10H14Br2О3 = 342,04
% расчетный: C 35,11; H 4,12; Br 46,72;
%
полученный: C 35,0; H 4,2;
Br 46,5.
Инфракрасный спектр: (CHCl3
)
Поглощение:
C=O - 1736, 1719 см-1
COOCH3 - 1438 см-1
Спектр
ЯРМ: CDCl3; 250 МГц
млн-1;
1,22(s),
1,27(s), 1,34 (s): CH3 спарен.; 1,84(d) и 1,98(m): H1 и H3 цис; 3,63 (s),
3,73 (s): CO2
CH3; 5,50 (d, J=11), 5,
67 ((d, J=11): Hal-CH-CH.
ЭТАП Б : (1R, цис) 2,2-диметил 3-[(Z) 2-метоксикарбонил) этенил] циклопропан 1-метилкарбоксилсит
В среде инертного
газа смешивают 0,16 г метилата
натрия и 1,6 см3
метанола. Затем охлаждают примерно до 0oC и медленно добавляют 0,5 г (1R, цис) 2,2-диметил 3-(1,3-дибром
2-оксопропил)
циклопропан 1-метилкарбоксилата,
растворенного в 2,5 см3
метанола. После этого взбалтывают в течение 1 ч 30 мин при температуре примерно -50oC, выпаривают
растворитель при
пониженном давлении при температуре
около +30oC и добавляют
10 см3 метиленхлорида. Затем раствор промывают водой, высушивают и концентрируют досуха. Таким
образом получают 0,
324 г сырого продукта, который
подвергают хроматографии на двуокиси
кремния (элюант: циклогексан - этилацетат (6:4), в результате чего получают 0,262 г целевого продукта.
Инфракрасный спектр; (CHCl3)
Поглощение:
C=O - 1720
см-1
C=C - 1634 см-1
Совместимость с изомером Z
Спектр ЯРМ:
CDCl3; 250 МГц млн-1
1,
28 (s), 1,31 (s): CH3
спарен.; 1,96 (d, J=3,5), 3,25 (dd): H1/H3 цис; 3,46 (s), 3,72 (s): CH3 сложн.
эфир в
п. 3; 5,90 (dd), 6,65 (dd): H в п. 1'- Изомер
Z.
ПРИМЕР 2 : (1R,
цис) 2,2-диметил 3-[(Z) 2-трет-бутоксикарбонил) этенил] циклопропан 1-метилкарбоксилат (Продукт А) и (1R, цис)
2,
2-диметил 3-[(Z) 2-карбоксиэтенил) циклопропан
1-метилкарбоксилат (Продукт Б)
В среде инертного газа смешивают 12 см3 диметоксиэтана и 0,684 г трет-бутилата калия. Затем
медленно
добавляют раствор 0,684 г (1R, цис) 2,2-диметил
3-(1,3-дибром 2-оксопропил)
циклопропан 1-метилкарбоксилата, полученного на Этапе А Примера 1, в 10 см3 диметоксиэтана и
взбалтывают в
течение 40 мин при температуре около -60oC.
После этого добавляют 3
см3 диметоксиэтана и 2 см3 трет-бутанола и взбалтывают в течение 15 мин при
температуре около
-60oC. Затем добавляют воду и метиленхлорид,
отстаивают, экстрагируют
водную фазу с помощью метиленхлорида, промывают водой объединенные органические фазы, высушивают и
концентрируют
досуха при температуре около +30oC. Таким образом
получают 0,219 г
целевого продукта А.
Затем подкисляют объединенные водные фазы 2 н. хлористоводородной кислотой и экстрагируют с помощью метиленхлорида. После этого концентрируют досуха органическую фазу и получают 0,211 г продукта Б, соответствующего сырому (1R, цис) 2,2-диметил 3-[(Z) 2-карбоксиэтенил) циклопропан метилкарбоксилату. Затем продукты А и Б подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид - гексан (8 : 2), а затем циклогексан - этилацетат (6 : 4).
Химический состав продукта А
Инфракрасный спектр:
(CHCl3)
Поглощение
C=O - 1721 см-1 (площадка 1705 см-1)
C=C
- 1631 см-1
O-CH3 - 1439 см-1
O-tBu - 1368 см-1
Спектр ЯРМ: CDCl3; 250 МГц млн-1;
1,27 (s) и 1,31
(s): CH3 спарен.; 1,49: -CO2Bu; 1,92 (d, J=8,5) и 3,26 (m):
H1 и
H3 цис; 3,65: O-CH3; 5,80 (d, J=11,5): CH = αCO; 6,51 (dd, J= 10,5-11,
5): CH =
βCO. дельта Z.
Химический состав продукта Б
Инфракрасный
спектр: (CHCl3)
Поглощение
OH кисл. - 3518 см-1
C=O
- 1723,
1693 см-1
C=C - 1628 см-1
COOMe - 1440
см-1
Спектр ЯРМ: CDCl3; 250 МГц млн-1;
1,28 (s) и 1,32 (s):
CH3 спарен.; 1,99 (d) и 3,21 (m): H1 и H3 цис; 3,67 (s):
CO2CH3; 5,92 (d, J=11) и 6,77 (dd): CO-CH=CH-CH; 11,6 (m): 1H мобильн.
ПРИМЕР 3 : (1R, цис) 2,2-диметил 3-[(Z) 2-[(1,1,1,3,3,3-гексафтор) пропоксикарбонил]
этенил] циклопропан 1-метилкарбоксилат
В среде инертного газа промывают циклогексаном 0,057 г гидрида
натрия в виде 50-процентной взвеси в масле, а затем добавляют 1 см3
диметоксиэтана. После этого в полученную таким образом взвесь добавляют 0,33 г гексафторизопропанола в 1 см3
диметоксиэтана и взбалтывают в течение 30 мин. Раствор охлаждают до +5oC и медленно добавляют раствор 0,173 г (1R, цис) 2,2-диметил 3-(1,3-дибром 2-оксопропил) циклопропан
1-метилкарбоксилата в 1 см3 диметоксиэтана. Затем взбалтывают в течение 1 ч при
температуре +3/+5oC, вливают реакционную смесь в водный раствор 1 н. хлористоводородной кислоты,
экстрагируют с помощью метиленхлорида, высушивают органическую фазу и концентрируют
досуха.
Остаток подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид - гексан (7 : 3), в
результате
чего получают 0,16г искомого продукта.
Спектр ЯРМ: CDCl3
); 250
МГц;
1,30 (s), 1,34 (s): CH3 спарен.; 3,68 (s): CH3 сложн. эфир;
2,06 (d, J= 8,
5): H1; 3,12 (dd): H3; 6,99 (dd): H'1; 6,00 (d,
J=11,5):
H'2; 5,81: > CH-.
ПРИМЕР 4 : (1R, цис) 2,2-диметил 3-[(Z)
2-(1,1,1,3,3,
3-гексафтор) пропоксикарбонил] этенил] циклопропан 1-метилкарбоксилат
В
среде
инертного газа смешивают 1,5 см3 диметоксиэтана, 0,056 г трет-бутилата калия и 0,2 г
гексафторизопропанола, а затем добавляют при температуре +5oC раствор 0,170 г (1R,
цис) 2,
2-диметил 3-(1,3-дибром 2-оксопропил) циклопропан 1-метилкарбоксилата в 0,5 см3
диметоксиэтана. После этого смесь взбалтывают в течение 18 ч при комнатной температуре, добавляют 1
н.
хлористоводородную кислоту, экстрагируют с помощью метиленхлорида, высушивают и концентрируют
досуха. Остаток подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид - гексан (7 : 3),
в
результате чего получают 0,066 г искомого продукта.
Инфракрасный спектр:
(CHCl3)
Поглощение
>C=O - 1758, 1740 и 1718 см-1
C=C
- 1624 см-1
ПРИМЕР 5: (1R, цис) 2,2-диметил 3-[(Z) 2-(1,1,1,3,3,
3-гексафтор) пропоксикарбонил] этенил] циклопропан 1-метилкарбоксилат
Операции выполняются, как
указано в
Примере 4, с использованием вместо трет-бутилата калия 0,027 г метилата натрия. В
результате получают целевой продукт, идентичный продукту, полученному в Примере 4.
ПРИМЕР
6: (1R, цис)
2,2-диметил 3-[(Z) 2-карбоксиэтенил] циклопропан 1-метилкарбоксилат
В
среду инертного газа помещают 1 см3 1 н. раствора карбоната калия, после чего добавляют при
температуре около
+5oC раствор 0,342 г (1R, цис) 2,2-диметил 3-(1,3-дибром
2-оксопропил) циклопропан 1-метилкарбоксилата в 1,5 см3 тетрагидрофурана. Затем взбалтывают в течение
1 ч 30 мин, дают
температуре подняться до 20oC и взбалтывают в течение 4
ч.
Затем добавляют воду, экстрагируют с помощью метиленхлорида, высушивают органическую фазу и выпаривают
растворитель. Остаток
подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид
- этанол (97 : 3), в результате чего получают 0,046 г целевого продукта.
Спектр ЯРМ:
CDCl3; 250 МГц
1,28 (s), 1,32 (s): CH3 спарен.; 1,98 (d, J=8,5), 3,
20 (m): H1/H3 цис; 3,67 (s): CH3 сложн. эфир; 5,91 (d, J=11,5), 6,77
(dd, J=11,5): H (C=C).
ПРИМЕР 7: (1R, цис) 2,2-диметил 3-[(Z)
2-(метоксикарбонил)
этенил] циклопропан 1-карбоксилат (S) α -циано 3-феноксибензила
ЭТАП А: (1R, цис) 2,
2-диметил 3-(1,3-дибром
2-оксопропил) циклопропан 1 -карбоксилат(S)α
- циано
3-феноксибензила
В среде инертного газа смешивают 1,75 г 2,2-диметил 3-(2-оксопропил) циклопропан
1-карбоксилата (S) α
- циано-3-феноксибензила и 17,5 см3
тетрагидрофурана.
Затем при температуре 0/+5oC медленно добавляют 3,29 г пербромида гидробромида пиридиния и
взбалтывают в течение 6 ч при
температуре +5oC. Затем смесь
выдерживают в течение ночи
в леднике, фильтруют и концентрируют фильтрат досуха при пониженном давлении при температуре +25oC. После этого продукт
очищают хроматографией на двуокиси
кремния (элюант : метиленхлорид
- гексан (7 : 3). В результате получают 0,8 г искомого продукта.
Химический состав
C23H20NO4Br2 = 535,
2
% расчетный: C 51,6; H 3,8;
Br 29,9; N 2,6;
% полученный: C 51,4; H 4,0; Br 29,4; N 2,5.
Спектр
ЯРМ: CDCl3; 250 МГц млн-1;
Смесь
изомеров на уровне брома в п. 1'.
1,16 - 1,23 - 1,25 - 1,27: diMe спарен.; 1,88 : H1; 2,07: H3 циклопропила; 6,25 и 6,38:

Исходный сложный эфир получают следующим образом.
В среде инертного газа смешивают 15 см3 метиленхлорида, 2 г 2,2-диметил 3-(2-оксопропил) циклопропан 1-карбоновой кислоты, 2,59 г дициклогексилкарбодиимида и 2,8 см3 пиридина, после чего добавляют за 20 мин при температуре +10oC смесь 2,74 г (S) α -циано 3-феноксибензилового спирта, 20см3 метиленхлорида и 0,02 г диметиламинопиридина. Затем взбалтывают в течение 20 ч при температуре +20oC, фильтруют концентрируют фильтрат досуха при пониженном давлении при температуре +30oC. Остаток подвергают хроматографии на двуокиси кремния (элюант : цикло-гексан-этилацетат (8 : 2), в результате чего получают 3, 71 г искомого продукта.
Инфракрасный спектр (CHCl3)
Поглощение
Карбонил - 1736 см-1
Фенокси - 1588, 1498 см-1
Кислота и OH - Отсутствуют
Спектр
ЯРМ: (CDCl3) 250 МГц
1,
11 (s) и 1,21 (s): diMe спарен.; 1,63 (m): H1 и H3 цис; 2,16 (s): CH3 в п.
α карбонила; 2,87 (m): CH3 в
п.


Круговой дихроизм (диоксан)
Макс. 225 нм Δε = +1; 281
нм Δε = +0,3; 288 нм Δε
= +0,3; 300 нм Δe = +0,07.
ЭТАП Б : (1R, цис) 2,2-диметил 3-[(Z)2-метоксикарбонил) этенил] циклопропан 1 -карбоксилат(S)α
- циано 3-феноксибензила
В среде инертного
газа
смешивают 0,165 г метилата натрия и 3
см3 метанола, после чего добавляют при температуре +5oC 0,770 г продукта,
полученного, как описано в Этапе А, и 6 см3
метанола.
Затем взбалтывают в течение 1 ч при
температуре 0oC, а затем в течение 2430 мин при комнатной температуре и вливают в 25
см3 2 н. хлористоводородной кислоты при
температуре около
+5oC. После этого
экстрагируют с помощью метиленхлорида, промывают водой и высушивают. После выпаривания растворителя
получают 0,6 г сырого продукта, который очищают
хроматографией на
двуокиси кремния (элюант :
метиленхлорид - гексан (8 : 2), а затем (7 : 3). В результате получают 0,267 г смеси, содержащей целевой
продукт.
ПРИМЕР 8: (1R, цис) 2,
2-диметил 3-[(Z)
2-(метоксикарбонил) этенил]
циклопропан 1 -карбоксилат(R,S)α- циано 3-феноксибензила
ЭТАП А: (1R, цис ) 2,2-диметил
3-(1,3-дибром 2-оксопропил) циклопропан 1
-карбоксилат(R,S)α
- циано 3-феноксибензила
В среде инертного газа смешивают 0,380 г (1R, цис) 2,2-диметил 3-(2-оксопропил) циклопропан
1-карбоксилата (R, S) α -циано
3-феноксибензила и 4 см3
тетрахлорметана, после чего
при температуре около +15oC медленно добавляют 102 мкл брома в 1 см3
тетрахлорметана и взбалтывают в течение 4
ч. Затем концентрируют досуха при
температуре около +30o
C и получают 0,530 г искомого сырого продукта, используемого на следующем этапе без
дополнительной обработки. Продукт может быть
очищен путем хроматографии на двуокиси
кремния (элюант : метиленхлорид
- гексан (8:2).
Спектр ЯРМ: CDCl3 250 МГц млн-1;
1,16-1,23-1,25-1,27: CH3 спарен. ; 1,88-2,07: H1 и
H3 цис; 4,06 (d) и
4,39 (d), 4,22: -CO-CH2Br; 5,20 (d) и 5,36 (d): -CO-CH-Br; 6,25 и
6,38: CO2-CH-CN; от 6,95 до 7,45:
ароматические соединения.
Исходный сложный эфир получают следующим образом.
В среде инертного газа смешивают 0,344 г 2, 2-диметил 3-(2-оксопропил) циклопропан 1-карбоновой кислоты, 3 см3 метиленхлорида, 0,48 см3 пиридина и 0,445 г дициклогексилкарбодиимида, а затем добавляют раствор 0,471 г (R, S)α- циано 3-феноксибензилового спирта в 2 см3 метиленхлорида и несколько миллиграммов диметиламинопиридина. Затем взбалтывают при комнатной температуре в течение 18 ч, фильтруют и концентрируют досуха при температуре +30oC. Остаток подвергают хроматографии на двуокиси кремния (элюант : циклогексан - этилацетат (75 : 25), в результате чего получают 0,594 г целевого продукта.
Спектр
ЯРМ: CDCl3; 250 МГц;
От
1,11 до 1,28: CH3 спарен.; от 1,50 до 1,68: H циклопропил; 2,10 (s), 2,16 (s) (3H): -COCH3; 2,85
(m): =C-CH2-CH; 6,27
(s): -CO2-CH-; от 7,03 до 7,45:
ароматические
соединения.
Инфракрасный спектр: (CHCl3)
Поглощение
>C=0
- 1735, 1712 см-1
-⌀-O-⌀ - 1588, 1498
см-1
ЭТАП Б: (1R, цис) 2,2-диметил -3-[(Z) 2- метоксикарбонил) этенил] циклопропан 1 -карбоксилат(R,
S)α- циано 3-феноксибензила
Операции выполняются так же, как на
вышеописанном
Этапе Б Примера 7, используя в качестве исходного продукта дибромистый продукт, полученный на
вышеописанном Этапе А. После очистки, как
описано на вышеописанном Этапе Б Примера 7,
получают целевой
продукт.
ПРИМЕР 9: (1R, цис) 2,2-диметил 3-[(Z) 2-[(1,1,1,3,3,3-гексафтор)
пропоксикарбонил] этенил] циклопропан
1-карбоксилат (R,S) α -циано
3- феноксибензила
В среде
инертного газа промывают циклогексаном 0,030 г гидрида натрия в виде 50-процентной взвеси
в масле, а затем добавляют 1 см3 диметоксиэтана. После этого при
температуре около 0oC
медленно добавляют раствор 0,130 г гексафторизопропанола в 1 см3
диметоксиэтана и взбалтывают в течение 30 мин
при температуре 0/+5oC. Раствор
охлаждают до -5oC и
добавляют раствор 0,163 г (1R, цис) 2,2-диметил 3-(1,3-дибром 2-оксопропил)
циклопропан 1 -карбоксилата(R,S)α- циано
3-феноксибензила, полученного, как описано на
Этапе А Примера 8, в 1 см3 диметоксиэтана и взбалтывают в течение 1 ч 30 мин. Затем вливают в
водный раствор 1 н. хлористоводородной кислоты,
экстрагируют с помощью метиленхлорида,
высушивают органическую фазу и
выпаривают досуха. Остаток подвергают хроматографии на двуокиси кремния (элюант
: метиленхлорид - гексан (8 : 2), в результате
чего получают 0,056 г целевого
продукта.
Спектр ЯРМ:
CDCl3 250 МГц
1,26 (s), 1,30 (s), 1,35 (s), 1,36 (s): CH3 спарен.; 2,10 (d), 3,21 (m): H1/H3 цис; 5,8 (септ):
H CO2-CH(F3
)2; 6,02 (dm), 6,08 (dm): H в п.
2'; 6,32 (s), 6,34 (s): H в п. α
; от 6,81 до 7,5 (m): H ароматич. и H в
п. 1'.
ПРИМЕР 10: (1R,
цис) 2,2-диметил 3-[(Z) 2-[(1,1,1,3,
3,3-гексафторпропокси) карбонил] этенил] циклопропан 1-карбоксилат (R,S) α
-циано 3-феноксибензила
ЭТАП
А: (1R, цис) 2,2-диметил 3-(1,3-дихлор
2-оксопропил) циклопропан 1
-карбоксилат(R,S)α- циано 3-феноксибензила
В среде инертного газа смешивают 0,
300 г (1R, цис) 2,2-диметил
3-(оксопропил) циклопропан 1-карбоксилата (R, S)
α -циано
3-феноксибензила, полученного, как указано в Примере 8, 6 см3 хлороформа и 160 мкл хлористого
сульфурила. Затем смесь
взбалтывают при комнатной температуре в течение 1 ч и
концентрируют
досуха. Таким образом получают 0,546 г сырого искомого сырого продукта, используемого без дополнительной
обработки на следующем
этапе.
ЭТАП Б: (1R, цис) 2,2-диметил
3-[(Z) 2-[(1,1,1,
3,3,3-гексафтор) пропоксикарбонил) этенил] циклопропан 1 -карбоксилат(R,S)α- циано
3-феноксибензила
В среде
инертного газа при температуре около -10oC
смешивают 1 см3 толуола и 0,02 г гидрида натрия, растворенного на 50% в масле, а затем медленно
добавляют 200 мкл
гексафторизопропанола и 1 см3 толуола. Смесь взбалтывают при
температуре -10oC в течение 35 мин и добавляют 0,1 г сырого продукта, полученного на Этапе А,
растворенного в 0,5
см3 толуола. Затем температуре смеси дают подняться до комнатной
и взбалтывают в
течение 2 ч. Растворитель выпаривают и остаток подвергают хроматографии на двуокиси
кремния (элюант :
циклогексан - этилацетат (85 : 15), в результате чего получают целевой продукт,
идентичный
продукту, полученному в Примере 9.
ПРИМЕР 11: (1R, цис) 2,2-диметил
3-[(Z) 2-[(1,1,1,3,3,
3-гексафтор пропокси) карбонил] этенил] циклопропан 1-карбоксилат трет-бутила
ЭТАП А:
(1R, цис) 2,2-диметил 3-(1,3-дибром 2-оксопропил) циклопропан 1-карбоксилат
трет-бутила
В
среде инертного газа смешивают 0,113 г (1R, цис) 2,2-диметил 3-(2-оксопропил)
циклопропан
1-карбоксилата трет-бутила, 3 см3 тетрагидрофурана, а затем добавляют при
температуре +5oC 0,34 г пербромида гидробромида пиридиния. После этого смесь взбалтывают при
комнатной
температуре в течение 1 ч, центрифугируют и концентрируют досуха. Остаток подвергают
хроматографии на
двуокиси кремния (элюант : циклогексан - этилацетат (7 : 3), в результате чего получают
0,165г
искомого продукта.
Спектр ЯРМ: CDCl3; 250 МГц;
От
1,16 до 1,28 :
CH3 спарен.; 1,43 и 1,40: H tBu; от 1,7 до 1,9: H1 и H3; 4,
08
(d), 4,36 (d) и 4,29: -CO-CH2-Br; 5,24 (d) и 5,50 (d): CO-CHBr-.
(1R, цис) 2,2-диметил 3-(2-оксопропил) циклопропан 1-карбоксилата трет-бутила, может быть получен нижеследующим способом.
В среде инертного газа смешивают 0,17 г (1R, цис) 2,2-диметил 3-(1-оксопропил) циклопропан 1-карбоновой кислоты и 1,7 см3 этилацетата, после чего медленно добавляют раствор 0,36 г трет-бутилокси N,N'-диизопропилкарбодиимида в 1 см3 этилацетата. После 6-часового взбалтывания при комнатной температуре добавляют еще 0,15 г трет-бутилокси N,N'-диизопропилкарбодиимида и продолжают взбалтывание еще в течение 16 ч. Затем центрифугируют и выпаривают растворитель. Остаток подвергают хроматографии на двуокиси кремния (элюант : циклогексан - этилацетат (7 : 3), в результате чего получают 0,153 г искомого продукта.
Инфракрасный спектр: (CHCl3)
Поглощение
>C=0 - 1712,
1368
см-1 (CH3 tBu)
Кислота - Отсутствует
Спектр ЯРМ:
CDCl3; 250 МГц,;
1,18 (s) и 1,20 (s): CH3 спарен.; 1,35 (m), 1,50 (d, J=8,
5):
H3 и H1 1,45 (s): H tBu; 2,15 (s): H CH3 в
п. 3'; 2,79
(dd) и 2,93 (dd): H CH2 в п. 1'.
Трет-бутилокси N,N'-диизопропилкарбодиимид может быть получен нижеследующим способом.
В среде инертного газа смешивают 20 г трет-бутанола и 1,73 г монохлорида меди, после чего при температуре +30oC/+35oC добавляют 34 г N,N'-диизопропилкарбодиимида и взбалтывают, давая температуре дойти до уровня комнатной. Затем смесь центрифугируют, прополаскивают фильтр простым изопропиловым эфиром, выпаривают растворитель и перегоняют остаток при давлении 4-5 мм рт. ст. (t кип. 47-48o C). В результате получают 41,08 г искомого продукта.
Спектр ЯРМ: CDCl3; 250 МГц;
1,05 (d), 1,09 (d): CH3; 3,14 (m), 3,68 (m): -CH<; 3,24
(d): NH;
1,47 (s): tBu.
Инфракрасный спектр: (CHCl3)
Поглощение
NH - 3436
см-1
C=N - 1656 см-1
ЭТАП Б: (1R, цис)
2,
2-диметил 3-[(Z) 2-[(1,1,1,3,3,3-гексафторпропокси) карбонил] этенил] циклопропан 1-карбоксилат трет-бутила
В
среде инертного газа смешивают 0,055 г гидрида натрия (в виде 50-процентной
взвеси в масле) и 1 см3 толуола, после чего при температуре +5/+10oC добавляют раствор 0,162 г
гексафторизопропанола в 2 см3 толуола и взбалтывают в течение 30 мин
при температуре +10oC. Затем добавляют раствор 0,184 г (1R, цис) 2,2-диметил 3-(1,3-дибром 2-оксопропил)
циклопропан 1-карбоксилата трет-бутила в 1,5 см3 толуола и взбалтывают
в течение 2 ч при комнатной температуре. После этого смесь вливают в 2 н. хлористоводородную кислоту при +10oC, экстрагируют с помощью этилацетата, промывают органическую фазу водой,
высушивают ее и выпаривают досуха. Остаток подвергают хроматографии на двуокиси кремния (элюант : циклогексан
- этилацетат (95 : 5), в результате чего получают 0,135 г целевого продукта (t пл.
95oC).
Инфракрасный спектр: (CHCl3)
Поглощение
C=О - 1742,
1710 см-1
C=C - 1622 см-1
Спектр ЯРМ:
CDCl3; 250 МГц;
1,28 (s), 1,32 (s): CH3 спарен.; 1,45 (s): H tBu; 1,97 - 3,03 : H1/H3 цис; 5,81 (септ): H -CH(CF3)2; 5,99
(dd, J=11): H в п. 2'; 7,00 (dd, J=11 и 10,5): H в п. 1', изомер Z.
ПРИМЕР 12: (1R, цис) 2,2-диметил
3-[(Z) 2-[(1,1,1,3,3,3-гексафторпропокси) карбонил] этенил] циклопропан
1-карбоксилат 2,2,2-трихлорэтила
ЭТАП А: (1R, цис) 2,2-диметил 3-(1,3-дибром 2-оксопропил) циклопропан 1-карбоксилат 2,
2,2-трихлорэтила
В среде инертного газа смешивают 0,2 г (1R,
цис) 2,2-диметил 3-(2-оксопропил) циклопропан 1-карбоксилата 2,2,2-трихлорэтила, 3 см3 метиленхлорида и 1 см3
хлороформа, после чего добавляют при температуре около +5oC 70 мкл брома и взбалтывают при комнатной температуре в течение 3 ч. Затем добавляют смесь воды и льда, отстаивают и
экстрагируют
с помощью метиленхлорида. Органическую фазу высушивают, а
растворитель выпаривают. Остаток подвергают хроматографии на двуокиси кремния (элюант : метиленхлорид - циклогексан (7 : 3), в
результате чего
получают 0,23 г искомого продукта.
Спектр ЯРМ: CDCl3; 250 МГц млн.-1;
1,22 (s), 1,31 (s) и 1,33 (s): CH3 спарен.; от 1,94 до
2,10 (m): H1 и H3; 4,06 (d), 4,39 (d), 4,74
(d), 4,87 (d), 4,26 (s), 4,70 (s): 2 CH2-X; 5,24 (d) и 5,47 (d):

Исходный сложный эфир получают следующим образом.
В среде инертного газа смешивают 0,2 г (1R, цис) 2,2-диметил 3-(2-оксопропил) циклопропан 1-карбоновой кислоты, 4 см3 метиленхлорида, 280 мкл пиридина и 0,267 г дициклогексилкарбодиимида. По истечении 5 мин добавляют 135 мкл трихлорэтанола и несколько кристаллов диметиламинопиридина. Затем смесь взбалтывают в течение 20 ч при комнатной температуре, центрифугируют и выпаривают досуха. Остаток подвергают хроматографии на двуокиси кремния (элюант : циклогексан - этилацетат (8 : 2), в результате чего получают 0,316 г искомого продукта.
Инфракрасный спектр: (CHCl3)
Поглощение
Кислота и ОН
- Отсутствуют
С=0 - 1732, 1719 см-1
Спектр ЯРМ: CDCl3; 250 МГц млн.-1;
1,18 (s), 1,26 (s): CH3 спарен.; 1,58 (m), 1,75 (d):
H3 и H1
цис; 2,15 (s):CH3-C=O; 2,89 (m): =C-CH2
-C; 4,70 (s): -CO2-CH2-.
ЭТАП Б: (1R, цис) 2,2-диметил 3-[(Z) 2-[(1,1,
1,3,3,3-гексафторпропокси)
карбонил] этенил] циклопропан 1-карбоксилат 2,2,
2-трихлорэтила
В среде инертного газа смешивают 0,036 г гидрида натрия в виде 50-процентной взвеси в масле и 1
см3 толуола, после
чего добавляют при температуре около +10oC раствор 0,135 г гексафторизопропанола в 0,5 см3 толуола и взбалтывают в течение 30 мин при той же
температуре. Затем добавляют раствор
0,170 г продукта, полученного на Этапе А,
в
1 см3 толуола, взбалтывают в течение 1 ч, выдерживают при комнатной температуре и вновь взбалтывают в
течение 1 ч. После этого при температуре
+10oC добавляют 0,1 н.
хлористоводородную кислоту до получения рН 1 и взбалтывают в течение 15 мин. Затем экстрагируют с помощью этилацетата,
высушивают органическую фазу и концентрируют
досуха. Остаток подвергают
хроматографии на двуокиси кремния (элюант : метиленхлорид - циклогексан (7 : 3), в результате чего получают 0,1 г целевого
продукта.
Инфракрасный спектр:
(CHCl3)
Поглощение
C=0 - 1746 см-1
C=C - 1627 см-1
Спектр ЯРМ: CDCl3;
250 МГц млн.-1;
1,35(8):
CH3 спарен. ; 2,19
(d) и H 3,23 (m): H3 и H1 цис; 4,74 (A-B): -CO2-CH2=C; 5,8 (септ.): F3
C-CH-CF3; 6,04 (d, J=11,5): H в п.
2'; 6,93 (dd): H в п.
1'.
ПРИМЕР 13: (1R, цис) 2,2-диметил 3-[(Z) 2-(метоксикарбонил) этенил] циклопропан 1-карбоксилат 2,2,
2- трихлорэтила
В среде инертного газа смешивают
10 см3
метанола и 0,724 г метилата натрия. Затем при температуре 0/+5oC медленно добавляют 4 г продукта, полученного,
как описано на Этапе А Примера 12, в 30 см3
метанола и
взбалтывают в течение 16 ч при температуре примерно +5oC. Затем вливают в смесь воды и льда с добавлением 15 см3
2н. хлористоводородной кислоты. После этого
взбалтывают в
течение 15 мин и экстрагируют с помощью метиленхлорида, промывают органическую фазу водой, высушивают и доводят до сухого состояния. Остаток
подвергают хроматографии на двуокиси кремния
(элюант :
метиленхлорид - циклогексан (1 : 1), в результате чего получают 0,879 г целевого продукта.
Спектр ЯРМ: CDCl3; 250
МГц млн.-1;
1,33 (s): CH3
спарен. ; 2,10 (d): H1; 3,36 (m): H3; 3,73 (s): CH3-О-; 4,73(A-B): -CO2= CH2-C; 5,93(d,
J=11,5): H в п. 2'; 6,59 (dd): H в п. 1'.
Структура
цис,
дельта Z.
ПРИМЕР 14: (1R, цис) 2,2-диметил 3-[(Z) 2-[(1,1,1,3,3,3-гексафторпропокси) карбонил] этенил] циклопропан
1-карбоксилат 2-хлорэтила
ЭТАП А: (1R, цис)
2,
2-диметил
3-(1,3-дибром 2-оксопропил) циклопропан 1-карбоксилат 2-хлорэтила
В среде инертного газа смешивают 0,235 г (1R, цис) 2,
2-диметил 3-(2-оксопропил) циклопропан 1-карбоксилата
2-хлорэтила и 5
см3 хлороформа, после чего медленно добавляют 100 мкл брома. Затем взбалтывают при комнатной температуре в течение 2 ч
и добавляют смесь воды и льда, взбалтывают в
течение
15 мин,
отстаивают и экстрагируют с помощью метиленхлорида. После этого органическую фазу высушивают и выпаривают растворитель. Остаток подвергают
хроматографии на двуокиси кремния (элюант
:
метиленхлорид
- гексан (7 : 3), в результате чего получают 0,067 г искомого продукта.
Спектр ЯРМ: CDCl3; 250 МГц млн.-1
1,20 (s), 1,26 (s), 1,29
(s), 1,
30 (s):
CH3 спарен.; от 1,84 до 2,00 (m): H1 и H3; 3,64 (t), 3,72 (t): -CH2Cl; 4,28 (t), 4,40 (m):
-CO2-CH2-; 4,07 (d), от 4,
20 до 4,
45 (m),
4,28 (m): C-CH2-X; 5,23 (d) и 5,47 (d): =C-CHX-.
Исходный сложный эфир получают следующим образом.
В среде инертного газа смешивают 0,171 г (1R, цис) 2, 2-диметил 3-(2-оксопропил) циклопропан 1-карбоновой кислоты и 0,7 см3 1-бром 2-хлорэтана, после чего при температуре 0/+5oC медленно добавляют 145 мкл триэтиламина и взбалтывают при комнатной температуре. По истечении нескольких часов добавляют еще 20 мкл триэтиламина и 0,2 см3 бромхлорэтана. Смесь взбалтывают всего в течение 20 ч при комнатной температуре, после чего добавляют воду, отстаивают и экстрагируют с помощью метиленхлорида. Органическую фазу высушивают и выпаривают досуха. Остаток подвергают хроматографии на двуокиси кремния (элюант : циклогексан - этилацетат (75 : 25), в результате чего получают 0,172 г искомого продукта.
Спектр ЯРМ: CDCl3;
250 МГц млн.-1;
1,16
(s), 1,23
(s): CH3 спарен.; 1,63 (d, J=8,5), 1,48 (m): H1 и H3 цис; 2,15 (s): -CH3-CO-; 2,88 (m): -CH2
-CO-; 3,66 (t): CH2-Cl; 4,28
(m):
-CO2-CH2-.
Инфракрасный спектр: (CHCl3)
Поглощение
C=O - 1720 см-1
Кислота - Отсутствует
ЭТАП
Б: (1R,
цис) 2,
2-диметил 3-[(Z) 2-[(1,1,1,3,3,3-гексафторпропокси) карбонил] этенил] циклопропан 1-карбоксилат 2-хлорэтила
В среде инертного газа
смешивают 3 см3 толуола и 0,11
г гидрида
натрия в
виде 50-процентной взвеси в масле, после чего при температуре +5/+7oC медленно добавляют раствор 0,5 г 1,1,1,3,3,
3-гексафторизопропанола в 1 см3 толуола.
Затем при той
же
температуре взбалтывают в течение 45 мин и добавляют медленно раствор 0,341 г продукта, полученного, как описано на Этапе А, в 2
см3 толуола и взбалтывают в течение 2 ч
при температуре
+5/+7oC и в течение 1 ч при комнатной температуре. Затем охлаждают до +10oC, добавляют немного уксусной
кислоты, разбавленной наполовину, отстаивают и
экстрагируют с помощью
этилацетата. Органическую фазу высушивают и концентрируют досуха. Остаток подвергают хроматографии на двуокиси кремния (элюант :
метиленхлорид - циклогексан (1 : 1), в
результате чего получают 0,11
г
целевого продукта.
Спектр ЯРМ: CDCl3; 250 МГц млн.-1;
1,32(s), 1,34(s): CH3 спарен. ; 2,10 (d), 3,15 (m):
H1 и H3
цис;
3,69 (t): -CH2-Cl; 4,33 (t): CO2-CH2-; 5,81 (m): CO2-CH<; 6,01 (d, J=11): H
в п. 2'; 6,95 (dd): H в п. 1'.
Инфракрасный
спектр:
(CHCl3)
Поглощение
C=O комплексн. 1760, 1744 и 1726 см-1
C=C 1625 см-1
ПРИМЕР 15: (1R, цис) 2,
2-диметил 3-[(Z) 2-[(1,1,1,3,
3,
3-гексафторпропокси) карбонил] этенил] циклопропан 1-карбоксилат (S) α -циано 3-феноксибензил
Операции выполняются, как
указано в Примере 9, с
использованием на начальном этапе
сложного эфира, полученного на Этапе А Примера 7. После очистки в тех же условиях, что и описанные в Примере 9, получают целевой продукт.
ПРИМЕР
16: (1R, цис) 2,2-диметил 3-[(Z)
2-[(1,
1,1,3,3,3-гексафтор-пропокси) карбонил] этенил] циклопропан карбоксилат 3,4,5,6-тетра-гидрофталимидометила
ЭТАП А : (1R, цис) 2,
2- диметил 3-(1,
3-дибром 2-оксопропил) циклопропан
1-карбоксилат 3,4,5,6- тетрагидрофталимидометила
В среде инертного газа смешивают 0,8 г (1R, цис) 2,2-диметил 3-(2-оксопропил) циклопропан
1-карбоксилата
3,4,5,6-тетрагидрофталимидометила и
8
см3 тетрагидрофурана, после чего медленно добавляют 1,72 г пербромида пиридиния в виде гидробромида. После 6-часового взбалтывания при
температуре
+5oC остаток центрифугируют
и
промывают тетрагидрофураном, после чего концентрируют фильтрат досуха при температуре +25oC при пониженном давлении. Остаток подвергают
хроматографии на двуокиси кремния (элюант :
метиленхлорид), в результате чего получают 0,31 г искомого продукта.
Спектр ЯРМ: CDCl3; 250 МГц млн.-1;
1,
22 (s), 1,19 (s), 1,25 (s) и 1,30 (s):
CH3 спарен.; 1,76 (d) и 1,34 (m): H1 и H3; 1,78 (m): CH2 в п. β и 2,38 (m) CH2 в п. α в
тетрагидрофталимидном цикле; 4,07 (d), 4,
36 (d) и
4,28 (система АВ): -CO2-CH2Br; 5,22 (d), 5,55 (d) и 5,57 (система АВ): -CO2-CH2-; 5,40 (d) и 5,42 (d):
-COCHBr-.
Исходный сложный эфир получают следующим образом.
В среде инертного газа смешивают 1 г 2,2-диметил 3-(2-оксопропил) циклопропан 1-карбоновой кислоты, 8 см3 метиленхлорида, 1,395 см3 пиридина и 1,29 г дициклогексилкарбодиимида, после чего при температуре +5oC вводят раствор 1,1 г 3,4,5, 6-тетрагидрофталимидометилового спирта в 5 см3 метиленхлорида. Затем добавляют несколько миллиграммов диметиламинопиридина и взбалтывают в течение 18 ч, давая температуре подняться. После этого фильтруют и концентрируют фильтрат досуха при пониженном давлении при температуре +30oC. Остаток подвергают хроматографии на двуокиси кремния (элюант : циклогексан - этилацетат (7 : 3), в результате чего получают 0, 336 г искомого продукта.
Спектр ЯРМ: CDCl3; 250 МГц млн.-1
1,22 (s), 1,19 (s), 1,25 (s) и 1,30
(s): CH3 спарен.; 1,76 (d) и 1,34 (m): H1 и
H3; 1,78 (m) и 2,38
(m): CH2 в п. β и CH2 в п.α в тетрагидрофталимидном цикле; 4,07
(d), 4,36 (d) и 4,28 (система АВ): -COCH2Br; 5,
22 (d), 5,
55 (d) и 5,57 (система АВ):
-CO2-CH2-; 5,40 (d) и 5,42 (d): -COCHBr-.
ЭТАП Б : (1R, цис) 2,
2-диметил 3-[(Z) 2-[(1,1,1,3,3,3-гексафторпропокси)
карбонил]
этенил] циклопропан карбоксилат 3,4,
5,6-тетрагидрофталимидометила
В среде инертного газа смешивают 1 см3 толуола и
20 мг гидрида натрия в виде 50-процентной взвеси в
масле. После
этого смесь охлаждают до +5/+10oC и медленно добавляют раствор 67 мг гексафторизопропанола в 0,5 см3 толуола.
Затем взбалтывают в течение 30 мин при температуре
10oC
и добавляют раствор 0,1 г продукта,
полученного на Этапе А, в 1 см3 толуола. После этого смесь взбалтывают, давая
температуре подняться. По истечении 2 ч вливают в смесь 2
н.
хлористоводородной кислоты и льда, взбалтывают в
течение 5 мин и экстрагируют с помощью этилацетата. Органическую фазу промывают водой,
высушивают и концентрируют досуха при температуре +30oC при пониженном давлении. Остаток подвергают
хроматографии на двуокиси кремния (элюант : метиленхлорид), в результате чего получают
0,04 г целевого продукта.
Спектр ЯРМ:
CDCl3; 250 МГц млн.-1;
1,28
(s) и 1,32 (s): CH3 спарен.; 1,98 (d, J=8,5) и 3,13 (m): H1 и
H3 (цис); 1,78 (m) и 2,38 (m): CH2
в п. β и CH2 в п.α в
тетрагидрофталимидном цикле; 5,52 (система АВ): -CO2-CH2N; 6,01 (d, J=11,
5): H в п. 1'; 6,94 (dd, J=10,5 и 11,5): H в п. 2'; 5,80
(m): -CO2-CH-(CF3)2.
ПРИМЕР 17 : (1R, цис) 2,2-диметил 3-[(Z) 2-(метоксикарбонил) этенил]
циклопропан 1-карбоксилат пентафторбензила
ЭТАП А
: (1R, цис) 2,2-диметил 3-(1,3- дибром
2-оксопропил) циклопропан 1-карбоксилат пентафторбензила
В среде инертного газа смешивают
1,2 г (1R, цис) 2,2-диметил 3-(2-оксопропил) циклопропан
1-карбоксилата пентафторбензила и 12 см3 тетрагидрофурана. Затем при температуре +5oC медленно добавляют 2,45 г
пербромида гидробромида пиридиния и взбалтывают в течение 7 ч
при
температуре +5oC. Затем смесь
фильтруют и концентрируют фильтрат досуха при пониженном давлении при температуре +25oC. Остаток подвергают хроматографии на двуокиси кремния
(элюант : метиленхлорид - гексан (7 : 3), в
результате чего получают 1,08 г искомого продукта.
Спектр ЯРМ: CDCl3 250 МГц млн.-1
1,20 (s), 1,24 (s), 1,
26 (s) и 1,30 (s): CH3 спарен.; 1,
73 (d) и 1,96 (m): H1 и H3; 4,07 (d), 4,37 (d) и 4,26 (s): CO2-CH2 5,15 и 5,22: -COCH2Br-; 5,20
(d)
и 5,41 (d): -COCHBr-.
Исходный сложный эфир получают следующим образом.
В среде инертного газа при температуре 0/+5oC смешивают 0,165 г (1R, цис) 2, 2-диметил 3-(2-оксопропил) циклопропан 1-карбоновой кислоты, 2 см3 метиленхлорида, 230 мкл пиридина и 0,213 г дициклогексилкарбодиимида, после чего добавляют смесь, включающую 0,2 г пентафторбензилового спирта, 1 см3 метиленхлорида и несколько миллиграммов диметиламинопиридина. Затем температуре дают подняться и взбалтывают в течение 12 ч. После этого фильтруют, прополаскивают фильтр метиленхлоридом и концентрируют фильтрат досуха. Остаток очищают хроматографией на двуокиси кремния (элюант : циклогексан - этилацетат (80 : 20). В результате получают 0,25 г искомого продукта.
Спектр
ЯРМ: CDCl3; 250 МГц млн.-1
1,16 (s) и 1,20 (s): CH3 спарен.; 1,48 (m) и 1,68 (d):H циклопропила (цис); 2,14 (s):
-CO-CH3; 2,88 (m): -COCH2-; 5,15 (система АВ): -CO2CH2-.
ЭТАП Б :
(1R, цис) 2,2-диметил 3-[(Z) 2-(метоксикарбонил) этенил] циклопропан
1-карбоксилат пентафторбензила
В
среде инертного газа смешивают 0,022 г метилата натрия и 0,3 см3 метанола,
после чего при температуре 0/+5oC медленно добавляют
раствор
0,1 г продукта, полученного на Этапе А, в
1 см3 метанола. Затем взбалтывают в течение 2 ч и вливают в смесь воды,
льда и 0,75 см3 2 н. хлористоводородной кислоты. После
этого
смесь взбалтывают в течение 15 мин и
экстрагируют с помощью метиленхлорида. Органическую фазу промывают водой и высушивают, а
затем концентрируют досуха при температуре +30oC при
пониженном давлении. Остаток подвергают
хроматографии на двуокиси кремния (элюант : метиленхлорид - гексан (7 : 3), в результате чего
получают 0,031 г целевого продукта.
Спектр ЯРМ:
CDCl3; 250 МГц млн.-1
1,28 (s) и 1,31 (s): CH3 спарен.; 1,93 (d, J=8,5) и 3,28 (m): H1 и H3 цис; 3,72 (s): -COOCH3; 5,18
(s): -CO2-CH2-; 5,
91 (d, J=12): H в п. 1; 6,60 (dd, J=12 и 10): H в п. 2'.
ПРИМЕР 18 : (1R,
цис) 2,2-диметил 3-[(Z) 2-[1,1,1,3,3,3-гексафтор) пропоксикарбонил)
этенил] циклопропан 1-карбоксилат
пентафторбензила
В среде инертного газа смешивают 0,03 г гидрида натрия в виде
50-процентной взвеси в масле и 1 см3 толуола. После этого при
температуре +5/+10oC
медленно добавляют раствор 0,099 г гексафторизопропанола в 1 см3 толуола,
взбалтывают в течение 30 мин и добавляют раствор 0,15 г продукта, полученного на
Этапе А Примера 17, в 1 см3 толуола. Затем взбалтывают в течение 2 ч, давая температуре подняться, после
чего вливают в смесь 2 н. хлористоводородной кислоты и льда. Затем экстрагируют с
помощью этилацетата, промывают
органическую фазу водой, высушивают ее и концентрируют досуха при пониженном
давлении. Остаток подвергают хроматографии на двуокиси кремния, в результате чего получают
0,102 г целевого продукта.
Спектр ЯРМ: CDCl3; 250 МГц млн.-1
1,30 (s) и 1,33 (s): CH3 спарен.; 2,03 (d, J=8,5) и 3,15 (m): H1 и
H3 цис; 5,20 (система
АВ): -CO2-CH2-; 5,80: -CO2-CH; 6,03 (d,
J=11,5): H в п. 1'; 6,03 (m): H в п. 2' дельта Z.
ПРИМЕР 19 : (1R, цис) 2,
2-диметил 3-[(Z) 2-(метоксикарбонил)
этенил] циклопропан 1-карбоксилат трет-бутила
В среде
инертного газа смешивают 0,02 г натрия и 0,5 см3 толуола, после чего при температуре
примерно +5oC медленно
добавляют 0,2 см3 метанола. Затем смесь взбалтывают при
комнатной температуре в течение 30 мин, после чего охлаждают до +5oC и добавляют
раствор 0,0768 продукта, полученного на
Этапе А Примера II, в 1 см3 толуола. После этого
взбалтывают в течение 3 ч, давая температуре подняться, а затем подкисляют 2 н. хлористоводородной
кислотой до pH 3-4. После этого добавляют
5 см3 толуола, отстаивают, промывают
органическую фазу водой, высушивают и выпаривают растворитель. Остаток подвергают хроматографии на двуокиси
кремния (элюант : циклогексан - простой
изопропиловый эфир (8 : 2), в результате чего
получают 0,03 г целевого продукта.
Спектр ЯРМ: CDCl3 250 МГц млн.-1;
1.26(s), 1,29 (s): CH3
спарен.; 1,80(d, J=8,5), 3,14 (dd): H1
и H3 цис; 1,44(s): CO2tBu; 3,71 (s); CO2CH3; 5,89(d, J=11,5), 6,
65 (dd, J=11.5 и 10,5): H в п. α и
β CO2CH3,
структура Δ Z.
Пример 20
(1R, цис) 2,2-диметил-3-[(Z)
2-(метоксикарбонил)этенил- циклопропан-1-карбоксилат
2-фтор-6-трифторметилбензила.
Стадия A: (1R, цис) 2,2-диметил-3-(1,3-дибром-оксопропил) циклопропан-1-карбоксилат 2-фторметилбензила.
Смешивают в атмосфере инертного газа 1,185 г (1R, цис) 2, 2-диметил-3-(2-оксопропил) циклопропан-1-карбоксилат 2- фтор-6-трифторметилбензила и 20 см3 тетрагидрофурана. Добавляют медленно при +5oC 2,5 г пербромидпиридиния, затем в течение 3 ч поддерживают при перемешивании при +5oC. Фильтруют и концентрируют фильтрат до сухого состояния при уменьшенном давлении при 25oC. Хроматографируют остаток на двуокиси кремния, элюируя смесью циклогексан - этилацетат (75-25), и получают 1,1 г целевого продукта.
Спектр ЯРМ: (CDCl3 250 МГц ч/млн.) :
1.20 - 1.30: Me (спар); 1.78-2.00-: H1 и
H3; 4,08(d) и 4.38 (d): Bz-CH2-C; 5,20 - 5,65:

Исходный эфир получают следующим образом: смешивают в атмосфере инертного газа при 0, +5oC 3,4 г (1R, цис) 2, 2-диметил-3- (2-оксопропил) циклопропан-1-карбоновой кислоты, 30 см3 метиленхлорида, 4,8 мл пиридина и 4,5 г дициклогексилкарбодиимида, затем добавляют смесь, состоящую из 4,07 г 2-фтор-6-трифторметилбензилового спирта, 20 см3 метиленхлорида и несколько миллиграммов диметиламинопиридина. Повышают температуру и перемешивают в течение 12 ч. Фильтруют, промывают фильтр метилен-хлоридом и концентрируют досуха фильтрат. Очищают остаток хроматографией на двуокиси кремния, элюируя смесью метиленхлорид-изопропиловый эфир (95-5), и получают 4,39 г целевого продукта.
Спектр
ЯРМ: (CDCl3 250 МГц ч/млн) :
1.16 (s) и 1,19
(s) : Me (спар); 1,44 (m): H3; 1,58 (d) H1; 2,15
(s):


Стадия В: (1R, цис) 2,2-диметил-3-[(Z) 2-(метоксикарбонил) этинил]-циклопропан-1-карбоксилат 2-фтор-6-трифторметилбензила. Смешивают в атмосфере инертного газа 0,083 г метилата натрия и 1, 12 см3 метанола, затем медленно добавляют при 0, +5oC раствор из 0,388: г продукта, полученного на стадии А в 3 см3 метанола. Перемешивают в течение 15 мин и экстрагируют метиленхлоридом. Промывают органическую фазу в воде и высушивают ее, затем концентрируют до сухого состояния при 30oC под уменьшенным давлением.
Хроматографируют остаток на двуокиси кремния, элюируя смесью циклогексан-этилацетат (90-10), и получают 9,182 г целевого продукта.
Спектр ЯРМ: (CDCl3; 250 МГц
ч/млн)
1.26 и 1,31: Me
(спар); 1,94 (d): H1; 3,26 (d,
d: H3; 5,28 :


Пример 21
(IR, цис)
2.2-диметил-3-[(Z)
2-(метоксикарбонил)этенил]циклопропан-1-карбоксилат
альфа-циано-4-фтор-3-феноксибензила.
Стадия А (1R, цис) 2,2-диметил(1,3-дибром-2-оксопропил) циклопропан-1-карбоксилат альфа-циано-4-фтор-3-феноксибензила. Смешивают в атмосфере инертного газа 0,17 г (1R, цис) 2,2 -диметил-3-(2-оксопропил) циклопропан-1- карбоксилат альфа-циано-4-фтор-3-феноксибензила и 2 см3 тетрагидрофурана. Медленно добавляют при +5oC 0,38 г пербромида пиридиния, затем выдерживают при перемешивании при +5oC в течение 7 ч. Фильтруют и концентрируют фильтрат досуха при уменьшенном давлении при 25oC. Хроматографируют остаток на двуокиси кремния, элюируя смесью циклогексан-этилацетат (85-15), и получают 0,07 г целевого продукта (Смесь 4 диастереоизомеров).
Спектр ЯРМ: (CDCl3; 250 МГц ч/млн)
1.14 - 1,48 : CH3
(спар); 1,88: H1; 2,06:
H3; 6.18-6.54:


Исходный эфир получают следующим образом.
Смешивают в атмосфере инертного газа при О, +5oC 3, 4 г (1R, цис) 2,2-диметил-3-(2-оксопропил) циклопропан-1-карбоновой кислоты, 30 см3 метиленхлорида, 4,8 мл пиридина и 4,5 г дициклогексилкарбодиимида, затем добавляют смесь, состоящую из 4, 15 г альфа-циано-4-фтор-3-феноксибензилового спирта, 20 см3 метиленхлорида и несколько миллиграммов диметиламинопиридина, поднимают температуру и перемешивают в течение 12 ч. Фильтруют, промывают фильтр метиленхлоридом и концентрируют досуха фильтрат. Очищают остаток хроматографией на двуокиси кремния, элюируя смесью метиленхлорид-изопропиловый эфир (95-5), и получают 2,45 г целевого продукта (смесь 2 диастереоизомеров).
Спектр ЯМР: (CDCl3; 250 МГц ч/млн):
изомер A:
1,19 и 1,24: Me (спар); 1,50 и 1,6 (d): H3 и
H1
2,08:


изомер В:
1,09 и 1,20:Me (спар); 1,62
H1 и
H3; 2,15;



Стадия В (1R, цис) 2, 2-диметил-3-[(Z) 2-(метоксикарбонил) этенил]циклопропан-1-карбоксилат альфа-циано-4-фтор-3-феноксибензила.
Работают в условиях, идентичных условиям, описанным на стадии В предшествующего примера, но исходят из 0,07 г продукта, полученного на стадии А. Получают целевой продукт, идентифицируемый с помощью ЯМР-спектра.
Пример 22.
(1R, цис) 2,2-диметил-3-[(Z) 2-(метоксикарбонил)этинил]циклопропан-1-карбоксилат 5-бензил-3-фурилметила.
Стадия А: (1R, цис) 2,2-диметил-3- (1, 3-дибром-2-оксопропил)циклопропан-1-карбоксилат 5-бензил-3-фурилметила.
Смешивают в атмосфере инертного газа 0,34 г (1R, цис) 2, 2- диметил-3- (2-оксопропил)циклопропан-1-карбоксилат 5-бензил- 3-фурилметила и 4 см3 тетрагидрофурана. Добавляют медленно при +5oC 0,716 г пербромидпиридиния, затем поддерживают при перемешивании при +5oC в течение 6 ч. Фильтруют и концентрируют фильтрат досуха под уменьшенным давлением при 25oC. Хроматографируют остаток на двуокиси кремния, элюируя метиленхлоридом, и получают 0,21 г целевого продукта.
Спектр ЯМР: (CDCl3
; 250 МГц ч/млн) :
1,14-1,26: CH3 (спар); 1,60-1,95: H1 и H3; 3,02 и 3,93: CH2Ф; 4,04-4,
25:


Исходный эфир получают следующим образом.
Смешивают в атмосфере инертного газа при О, +5oC 1, 02 г (1R, цис) 2, 2-диметил-3-(2-оксопропил)циклопропан-1- карбоновой кислоты, 10 см3 метиленхлорида, 1,34 мл пиридина и 1, 334 г дициклогексилкарбодиимида, затем добавляют смесь, состоящую из 1,247 г 5 бензил-3-фурилметанола, 8 см3 метиленхлорида и несколько миллиграмм диметиламинопиридина. Повышают температуру и перемешивают в течение 12 ч. Фильтруют, промывают фильтр метиленхлоридом и концентрируют досуха фильтрат. Очищают остаток хроматографией на двуокиси кремния, элюируя смесью метиленхлорида, и получают 1,4 г целевого продукта.
Спектр ЯМР: (CDCl3, 250 МГц ч/млн): 1,14 и 1,19: CH3 (спар); 1,44: H3; 1,57: H1; 2, 12
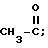

Стадия В; (1R, цис) 2, 2-диметил-3-[(Z) 2-(метоксикарбонил) этенил]циклопропан-1-карбоксилат 5-бенэил-3-фурилметила. Работают в условиях, идентичных условиям, описанным на стадии В примера 1, но исходят из 1,4 г продукта, полученного на стадии А. Получают целевой продукт, идентифицируемый с помощью ЯМР-спектра.
Реферат
Изобретение
относится
к новому способу получения сложных эфиров циклопропанкарбоновой кислоты формулы I

где R - сложноэфирный остаток, расщепляемый в нейтральной или кислой среде и являющийся С1-18алкилом, возможно замещенным галогеном или бензильным радикалом, возможно замещенным по вершинам ароматического кольца одним или несколькими атомами галогена, либо радикал формул (а) -(г),

где R2 - Н или метил;
R3 - арил;
R4 - CN, Н;
R5 - фтор, хлор, бром или водород;
R6, R7, R8, R9 - водород или метил;
S/1 символизирует тетрагидроцикл.
Способ заключается в обработке сложного
эфира формулы
II

примерно 2 эквивалентами галогенирующего средства с последующей обработкой полученного в виде смеси изомеров соединения III

основным средством в присутствии соединения R1OH в среде соответствующего сорастворителя. Способ отличается исключительной избирательностью, поскольку он приводит к получению соединений формулы 1 с конфигурацией ( Z ), то есть к биологически активной форме этих соединений. 4 с. и 8 з.п. ф-лы.
Формула
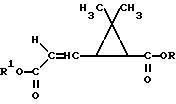
R - представляет собой сложноэфирный остаток, расщепляемый в нейтральной или кислой среде и являющийся линейным или разветвленным алкильным радикалом, включающим от 1 до 18 атомов углерода, возможно замещенным одним или несколькими атомами галогена, либо бензильным радикалом, возможно замещенным по вершинам ароматического кольца одним или несколькими атомами галогена, либо радикалом формулы

где R2 - водород или метил;
R3 - арил;
либо радикалом формулы

где R4 - CN; водород;
либо радикалом формулы

где R4 - указаны выше;
R5 - фтор или хлор, или бром, или водород;
либо радикалом формулы

где R6, R7, R8, R9 - водород или метил;
S/1 символизирует тетрагидроцикл;
при этом R1 является водородом или алкильным радикалом, являющимся насыщенным линейным или разветвленным и включающим от 1 до 18 атомов углерода, возможно замещенным одним или несколькими атомами галогена, в виде смеси изомеров или изомеров, разделенных на уровне циклопропанового кольца, отличающийся тем, что сложный эфир формулы II

где R определен выше,
подвергают обработке примерно двумя эквивалентами галогенирующего средства с получением соединения формулы III

где R определен выше;
Hal является атомом галогена,
в виде смеси изомеров в положении (1') атома углерода, после чего полученное соединение подвергают обработке основным средством в присутствии соединения формулы R1OH, для которого R1 определено выше, в случае необходимости в среде соответствующего сорастворителя.

где R4 и R5 указаны в п.1,
или радикала формулы

где R4 указан в п.1,
или радикала формулы
где R2 и R3 указаны в п.1,
или радикала формулы

где R6 - R9 указаны в п.1;
символ S/1 означает тетрагидроцикл.

где R - метил, замещенный хлором или бромом, или этил, замещенный 1, или 2, или 3 атомами хлора или брома,
R1 - водород, либо алкильный радикал, являющийся насыщенным линейным или разветвленным радикалом и включающим от 1 до 18 атомов углерода, возможно замещенным одним или несколькими атомами галогена,
в качестве промежуточного соединения.

где R представляет собой сложноэфирный остаток, расщепляемый в кислой или нейтральной среде и являющийся линейным или разветвленным алкильным радикалом, включающим от 1 до 18 атомов углерода, возможно замещенным одним или несколькими атомами галогена, либо бензильным радикалом, возможно замещенным по вершинам ароматического кольца одним или несколькими атомами галогена, либо радикалом формулы



в которых значения R2 - R9 указаны в п.1;
символ S/1 означает тетрагидроцикл,
в виде смеси изомеров или отдельных изомеров относительно асимметричного атома углерода, связанного с циклопропановым кольцом,
в качестве промежуточного соединения.

где R - сложноэфирный остаток, расщепляемый в нейтральной или кислой среде и являющийся линейным или разветвленным радикалом, включающим от 3 до 18 атомов углерода или включающим от 1 до 18 атомов углерода, и замещенным одним или несколькими атомами галогена, либо радикалом формулы

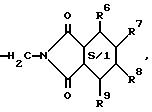
значения R2 - R9 указаны выше;
символ S/1 означает тетрагидроцикл,
в качестве промежуточного соединения.

Комментарии