Способ получения 7β-замещенных 4-азаαандростан-3-онов и способ получения замещенных 7β-алкил-андрост-5-ен-3-онов - RU2114117C1
Код документа: RU2114117C1
Чертежи





Описание
Изобретение относится к новому способу получения 7β-замещенных 4-аза-5α-андростан-3-онов и родственных соединений и к применению таких соединений в качестве ингибиторов-5α-редуктазы.
Известно, что некоторые нежелательные физиологические проявления, такие как обыкновенные угри, гирсутизм, характерное облысение у мужчин и доброкачественная гипертрофия простаты, являются результатом гиперандрогенной стимуляции, вызванной избыточной аккумуляцией тестостерона или подобных андрогенных гормонов в метаболической системе. Прежние попытки предложить химиотерапевтические средства, чтобы противостоять нежелательным последствиям гиперандрогенности, привели в результате к открытию некоторых стероидных антиандрогенов, имеющих свою собственную нежелательную гормональную активность. Эстрогены, например, не только противодействуют влиянию андрогенов, но имеют вдобавок феминизирующее действие. Разработаны также нестероидные антиандрогены, например, 4'-нитро-3'-трифторметилизобутиранилид (Neri, et al., Endo., v. 91, N 2, 1972). Однако эти продукты, хотя освобождают от гормональных эффектов, являются периферически активными, соревнуясь с естественными андрогенами за рецепторные места, и, следовательно, имеют тенденцию феминизировать хозяина мужского рода или плод мужского рода у хозяина женского рода.
Известно, что основным переносчиком андрогенной активности в некоторых органах-мишенях является 5α-дигидротестостерон и что он образуется локально в органе-мишени при действии тестостерон- -5α-редуктазы. Также известно, что ингибиторы тестостерон- -5α-редуктазы будет служить для предупреждения или уменьшения симптомов гиперандрогенной стимуляции.
Ряд 4-аза-стероидных соединений известны в данной области как ингибиторы 5α-редуктазы. Например, в патентах США 4377584, 4220775, 4859681, 4760071 и статьях в J. Med. Chem. 27, p. 1690-1701 (1984) и в J. Med. Chem. 29, 2998-2315 (1986) Rasmusson, et al., патенте США 4845104, Carlin, et al. и патенте США 4732897, Cainelli, et al. описываются 4-аза- -17β-замещенные 5α-андростен-3-оны и упоминается, что они пригодны для лечения связанных с DHT гиперандрогенных состояний.
Однако, несмотря на предположение в прототипах, что гиперандрогенные заболевания являются результатом единственной 5α-редуктазы, имеются сообщения, рассматривающие присутствие других изомеров 5α-редуктазы как у крыс, так и у людей. Например, Bruchovsky, et al., (J. Clin. Endocrinol, Metab., 67 806-816, 1988) и Hudson (J. Steroid Biochem., 26, p. 349-353, 1937) обнаружили активность различных 5α-редуктаз в стромальной и эпителиальной фракциях в простате человека. Кроме того, Moore и Wilson описали две различные редуктазы человека с пиками активности либо при pH 5,5, либо при pH 7-9 (J. Biol., Chem. 251, 19, p. 5895-5900, 1976).
Недавно Andеrsson и Russel выделили ДНК, которая кодирует 5α-редуктазу печени крысы (J. Biol. Chem. 264, p. 16249-16255, 1989). Они обнаружили одну мРНК, которая кодирует редуктазы как печени, так и простаты крысы. Последовательность этого крысиного гена позже была использована для выделения кДНК простаты человека, кодирующей 5α-редуктазу, обозначенную ″5α-редуктаза 1" (Proc. Nat' 1. Acad. Sci., 87, p. 3640-3644, 1990).
Позднее другая, более богатая редуктаза ( 5α-редуктаза 2) была клонирована из простаты человека, и ее свойства идентифицированы с формой, найденной в сырых экстрактах простаты человека (Nature, 354, p. 159-161, 1991).
Далее в "Syndromes of Androgen Resistanсe" - The Biology of Reproduction, v. 46, p. 168-173, (1992), Jean O. Wilson указывается, что фермент 5α-редуктаза 1 может быть ассоциирован с волосяными фолликулами.
Таким образом, подтверждается существование по крайней мере двух генов для 5α-редуктазы и двух различных изомеров 5α-редуктазы у людей. Обе формы присутствуют в ткани простаты, в которой больше 5α-редуктазы 2, а другого изомера - 5α-редуктазы 1, - как полагают, больше в ткани волосистой части головы.
При лечении гиперандрогенных болезненных состояний, например доброкачественной гиперплазии простаты (ВРН), было бы желательно иметь один реальный лекарственный препарат, который является активным против обоих ферментов - 1 и 2 - в простате, чтобы в значительной степени ингибировать образование дигидротестерона (DHT). С другой стороны, было бы желательно иметь реальный лекарственный препарат, который является высокоселективным для ингибирования связанного с волосистой часть головы фермента 5α-редуктазы 1, для применения при лечении заболеваний кожи и волосистой части головы, например угрей и алопеции. Такой лекарственный препарат также можно использовать в сочетании с PROSCAR® (финастерил), который является высокоселективным для фермента простаты 5α- -редуктазы 2 для комбинированной терапии при лечении ВРН.
Непрерывно ведется поиск новых, более эффективных и приемлемых для окружающей среды способов получения 7β- замещенных андростан-3-онов, которые являются эффективными против обоих ферментов α- -редуктазы 1 и 2.
Изобретение раскрывает новый способ получения соединений 7β- -замещенного 4-аза- -5α- -андростан-3-она, которые пригодны для ингибирования изомеров 1 и 2 5α- -редуктазы, и, в частности, эффективны при селективном ингибировании 5α- -редуктазы-1, ассоциированной в волосистой части головы, и ингибирующие изомеры 1 и 2 при оральном парентеральном или местном лечении доброкачественной гиперплазии простаты, угрей, гирсутизма, характерного облысения у мужчин, андрогенной алопеции, простаты, и для предупреждения и лечения рака предстательной железы.
В соответствии с изобретением предлагается способ, включающий стадии:
а) приведение в контакт соединения IV
где
Alk представляет собой (C1-C4)-алкил, аллил и (C3-C6)-циклоалкил, и A представляет собой заместитель, инертный при условии реакции, с восстанавливающей системой, содержащей металлический литий и жидкий аммиак, в инертном органическом растворителе при температуре в интервале от -45 до -78oC в течение времени, достаточного для стереоселективного получения 7β- - соединения V
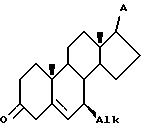
b) приведение в контакт соединения V с агентом изомеризации двойной связи в инертном органическом растворителе при температуре от 40 до 65oC при условиях, в которых радикал A является инертным, в течение времени, достаточного для образования изомеризованного соединения VI

c) приведение в контакт соединения VI с окислителем в инертном растворителе при температуре в интервале от 23oC до 80o C при условиях, в которых радикал A является инертным в течение времени, достаточного для образования секокислоты VII
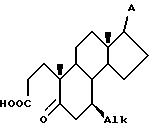
d) контактирование секокислоты VII с амином формулы R-NH2, в которой R представляет собой H, (C1-C4)-алкил, бензил или аллил, при температуре от 100 до 200oC в инертном растворителе, при условиях, при которых A является инертным, с образованием 4-аза-стероида VIII
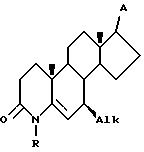
e) контактирование соединения VIII с платиновым катализатором в инертном органическом растворителе при комнатной температуре в течение времени, достаточного для образования 7- Alk -4-аза-стероида VII
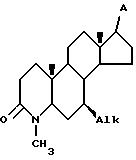
Таким образом, предлагается способ, включающий стадии а) приведение в контакт соединения IV
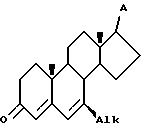
где Alk представляет собой (C1-C4)-алкил, алкил и (C3-C6) - циклоалкил, и A представляет собой заместитель, инертный в условиях реакции, с восстанавливающей системой, содержащей металлический литий и жидкий аммиак, в инертном органическом растворителе при температуре в интервале от -45 до -78oC в течение времени, достаточного для стереоселективного получения 7β- соединения V
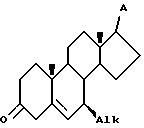
b) приведение в контакт соединения V с агентом изомеризации двойной связи в инертном органическом растворителе при температуре от 40 до 65oC при условиях, при которых радикал A является инертным, в течение времени, достаточного для образования изомеризованного соединения VI
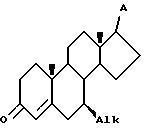
c) приведение в контакт соединения VI с окислителем в инертном растворителе при температуре в интервале от 23 до 80oC в условиях, при которых радикал A является инертным, в течение времени, достаточного для образования секокислоты VII
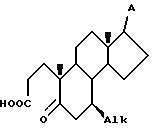
d) приведение в контакт секокислоты VII с амином формулы R-NH2, где R представляет собой H, (C1C4)-алкил, бензил или аллил, при температуре от 100 до 200oC в инертном растворителе при условиях, при которых A является инертным с образованием 4-аза-стероида VIII

e) приведение в контакт соединения VIII с платиновым катализатором в инертном органическом растворителе при комнатной температуре при условиях, при которых A является инертным, в течение времени, достаточного для образования 7- Alk-4-аза-стероида VII
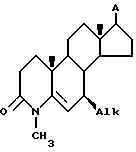
Подробное описание изобретения и предпочтительных вариантов его осуществления.
Используемым здесь термином "(C1-C4)"-алкил обозначаются, например, метил, этил, пропил, изопропил, н-бутил, втор-бутил, изобутил и трет-бутил.
Используемым здесь термином "(C3-C6-циклоалкил" обозначаются циклопропил, циклобутил, циклопентил, циклогексил.
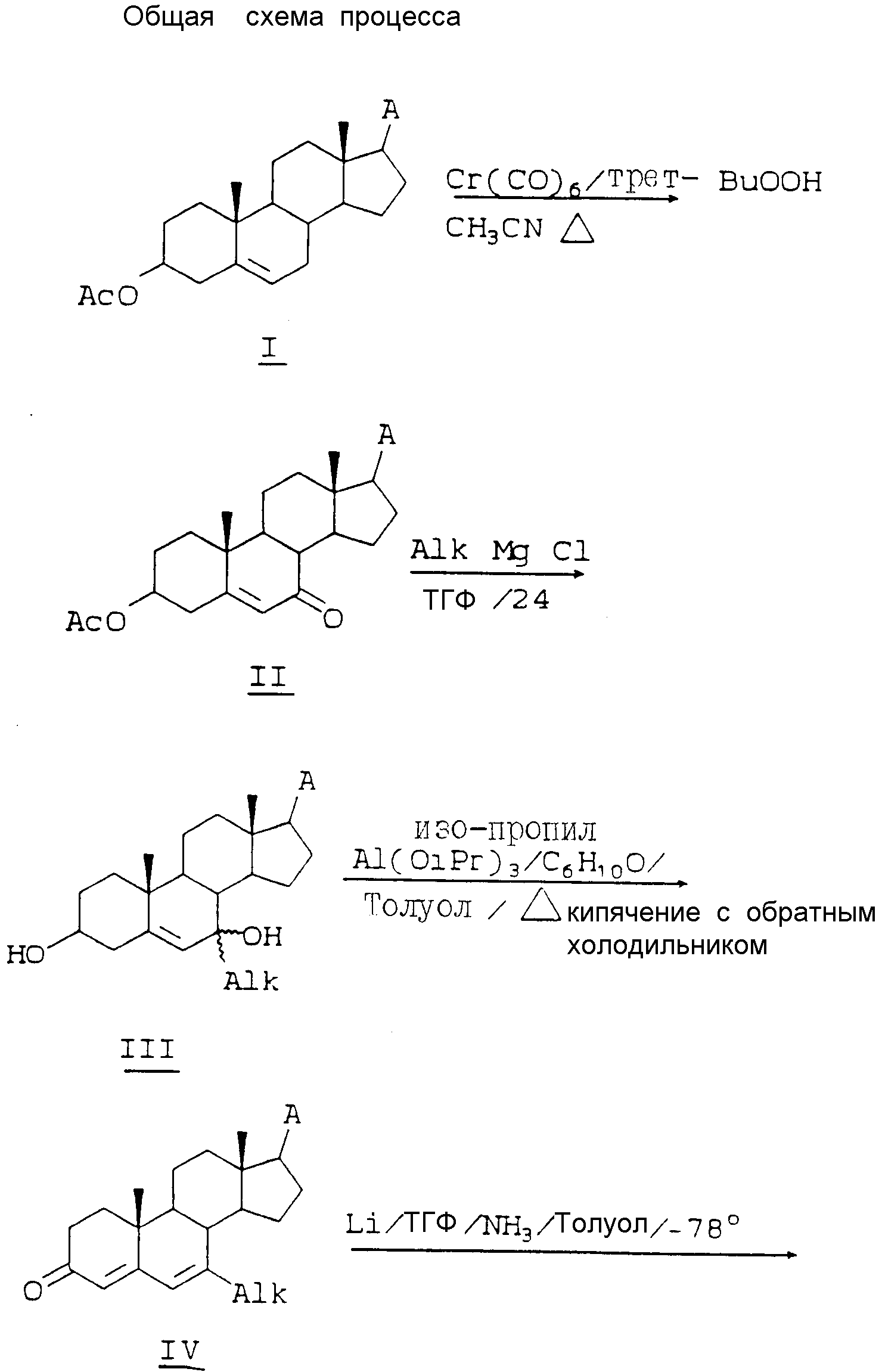
Способ изобретения иллюстрируется общей схемой процесса, приведенной в конце описания.
Ряд 7β-алкил-17-A
Соединения, получаемые по изобретению, которые также включают 7β-алкильную группу,
например, метил,
этил, изопропил, трет-бутил, аллил, и в которых A имеет значения, устанавливаемые ниже, могут быть получены по схеме, представленной в общих чертежах на общей схеме технологического
процесса.
Используемое здесь обозначение Alk 7β-заместителя в формуле означает (C1-C4)-алкил, линейный или разветвленный, например, метил, этил, пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, и циклоалкил.
Заместитель Alk может быть введен в кольцо B 4-аза-стероида в общем случае путем реакции присоединения металлоорганического соединения к карбонильной группе, например, с помощью реакции Гриньяна, при которой 7-карбонильная группа может вступать во взаимодействие с реактивом Гриньяра, содержащем Alk в качестве R-радикала и RMgX. Для способа приемлемыми являются также реакции присоединения по карбонильной группе, использующие металлорганические соединения лития и цинка, которые известны в технике.
Термином "A" обозначается 17-заместитель, который может представлять собой любой заместитель, предпочтительно инертный и не вмешивающийся в ход реакции при конкретных условиях реакции на каждой стадии, представленной в общей схеме технологического процесса.
Группа A может также представлять собой защищенную гидроксильную или защищенную аминогруппу, которая проходит указанную последовательность реакций, и впоследствии защитная группа удаляется, или она может быть также удалена в ходе определенной стадии при условии, что не повлияет на указанную реакцию. Например, когда A представляет собой 17-0-TBDMS, т.е. трет-бутилдиметилсилилоксигруппу, защитная силильная группа может быть удалена, например, в ходе стадии замыкания кольца секокислоты VII до 4-азастероида VIII, так что последующие стадии осуществляют с 17-OH-соединением. Также исходная группа A может быть предшественником нужной A-группы и превращаться в нее попутно на одной из стадии процесса. Например, когда A содержит двойную связь, например, в аналоге стигмастерина, двойная связь в боковой цепи в положении 17 может быть также окислена в ходе образования секокислоты при переходе формы VI в VII.
Примеры группы 17-A включают H, защищенную гидроксильную группу, например, диметил-трет-бутилоилилоксигруппу, гидроксильную группу, защищенную аминогруппу, например, ацетиламиногруппу, аминогруппу, (C1-C10)-алкил, например, метил, этил, 6-метил-гепт-2-ил (боковая цепь в положении 17 в холестаниле), боковую цепь стигмастерина, арил-замещенный (C1 -C10)- алкил, например, омега-фенилпропил, гетероарил-замещенный (C1-C10)-алкил, например, омега-(4-пиридил)-бутил, группу эфира карбоновой кислоты, например, карбометоксигруппу, карбоксамидную группу, например, N-N-диизопропилкарбоксиамидную группу, карбокислотные группы, карбаматные группы, например, группы трет-бутилкарбониламиномочевин, например, н-трет-бутилкарбониламиногруппу, группы простых эфиров, например, н-бутилоксигруппу и т.п.
Исходными веществами для способа являются обычно 3-ацетокси-андрост-5-ены, которые известны и доступны.
Как видно из общей схемы технологического процесса, использующей общие формулы, в которых A имеет упомянутые выше значения, исходной 3-ацетокси-андрост-5-ен-17-A I окисляют до соответствующего 5-ен-7-она II путем обработки, например, трет-бутилпероксидом водорода и гексакарбонилом хрома, например, в ацетонитриле при кипячении с обратным холодильником. В другие растворители, которые могут быть использованы, включены пропионитрил, бутиронитрил. Температура реакции, как правило, составляет от 40 до 85oC, и реакцию осуществляют в сухих условиях, и для ее завершения, как правило, требуется около 24 ч.
В эту топку может быть введена Alk-группа, например, метил, этил, аллил, фенил, путем реакции присоединения металлоорганического соединения к карбонильной группе, например, с помощью реакции Гриньяра, с использованием, например, метил-, аллил- или циклоалкилмагнийхлорида, например, в безводном ТГФ при 0-23oC, с образованием 7-Alk-7-гидроксиаддукта III. Условия реакции Гриньяра являются обычными и включают применение метилмагнийхлорида, этилмагнийбромида, аллилмагнийхлорида, циклопропилмагнийбромида и т.п. Другие подходящие сухие растворители включают диэтиловый эфир, диметоксиэтан, ди-н-бутиловый эфир. Реакцию проводят без доступа влаги, как правило, при температуре в интервале от 0 до 40oC. Обычно для завершения реакции требуется от 6 до 24 ч. Могут быть использованы реакции присоединения других металлоорганических соединений по карбонильной группе.
Аддукт III затем окисляют, например, изопропоксилом алюминия и циклогексаноном (условия окисления по Оппенауэру), например, в кипящем толуоле, с образованием 7-алкил-4,6-диен-3-она IV. Другие реагенты, которые могут быть использованы, представляют собой этоксид алюминия или трет-бутоксид алюминия. Другими растворителями, которые могут быть использованы, являются метилэтилкетон и ксилол. Температурный интервал, как правило, составляет интервал от 60 до 120oC, реакцию осуществляют в условиях отсутствия влаги и, как правило, требуется от 2 до 24 ч для завершения реакции.
Следующая стадия является ключевой, при которой аддукт Гриньяра IV восстанавливают металлическим литием, жидким аммиаком, ТГФ и толуолом при -78oC до стереоселективного выхода 7β - алкил-5-ен-3-она V. Другие металлы, которые могут быть использованы при таком восстановлении, представляют собой натрий, калий и кальций. Другими аминами, которые могут быть использованы, являются метиламин и этиламин. Другими растворителями, которые могут быть использованы, являются н-бутиловый эфир и диметоксиэтан. Реакцию обычно осуществляют в безводных условиях в температурном интервале от 23 до 78oC и для завершения реакции требуется 2-10 ч.
На следующей стадии дельта-5 двойную связь изомеризуют до 4-ена VI, используя ДБУ (1,8-диазабицикло [5.4.0] ундек-7-ен), например, в кипящем тетрагидрофуране (ТГФ), и получают 7-алкил-4-ен-3-он. К другим реагентам изомеризации, которые могут быть использованы, относятся диизопропилэтиламин и ДБН (Aldrich), представляющий собой 1,5-диазабицикло [4.3.0]нон-5-ен. Другими растворителями, которые могут быть использованы, являются толуол и диметиловый эфир. Реакцию обычно осуществляют в сухих условиях при температуре в интервале от 40 до 60oC и, как правило, требуется 1-2 ч для завершения реакции.
Затем расщепляют кольцо A путем обработки, например, перманганатом калия, периодатом натрия, например, в третбутиловом спирте, при 80oC с образованием соответствующей секокислоты VII. Другие окислительные реагенты, которые могут быть использованы, включают тетраоксид рутения и озон. Другими растворителями, которые могут быть использованы, являются CH3CN, CCl4, MeOH и CH2Cl2. Реакции обычно требуется от 2 до 4 ч, чтобы пройти полностью.
Обработка секокислоты соответствующим амином, например, гидроксихлоридом метиламина, и ацетатом натрия в этиленгликоле при 180oC дает в результате, например, 4-метил-4-аза-андрост-5-ен-3-он VIII. Другие амины, которые могут быть использованы, представляют собой этиламин, ацетат аммония, замещенные бензиламины, например, 4-метоксибензиламин, и т.п. Другие приемлемые для реакции растворители включают уксусную кислоту и ксилол. Реакцию обычно осуществляют при температуре в интервале от 100 до 200oC и требуется, как правило, от 2 до 8 ч для ее завершения.
Структуру VIII в свою очередь каталитически гидрируют, например, с Pt, чтобы восстановить 5-дельта двойную связь с образованием 5α- гидрированного соединения IX. Растворитель для реакции восстановления представляет собой обычно уксусную кислоту, но также пригоден EtOH. Катализаторы для такого гидрирования также включают Pd/C и благородные металлы, например, никель. Гидрирование обычно осуществляют в гидрогенизаторе с вибрацией (Shaker hydrogenation apparatus) при комнатной температуре и при давлении H2 от 40 до 2000 ф/дюйм2 (от 0,28 до 14,1 кПа), и, как правило, требуется 1 - 24 ч для ее завершения.
Подобным образом секокислота VII может быть обработана аммиаком, генерированным из ацетата аммония, с образованием соответствующего N-H-соединения X, которое затем может быть обработано аналогично описанному выше каталитической платиной в атмосфере водорода с образованием соответствующего 5α-4N-H-соединения XI.
Во всем этом ряду реакций группа 17-A должна быть инертной или не влияющей на условия отдельной реакции при введении заместителя в положение 7 стероидного кольца B. Общая схема процессов A и B приведена в конце описания.
7β -алкил-17-окси-андростаны.
Способ изобретения является также применимым например, когда 17-A представляет собой гидроксигруппу или защищенную гидроксильную группу. Соответствующая 7β-алкильная группа, например, метил, этил, изопропил, может быть введена по схеме, представленной на общих схемах A и B.
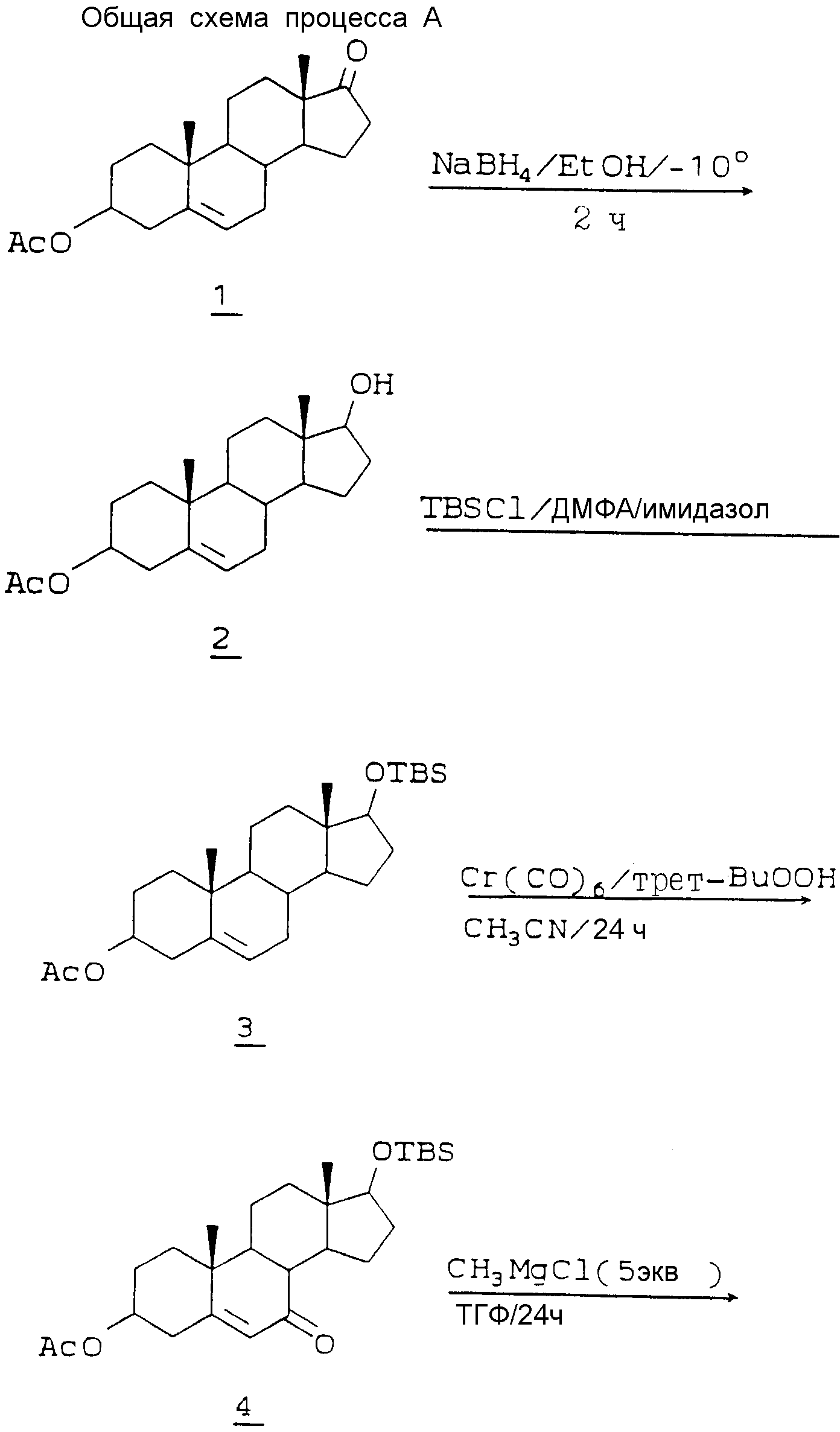
Как видно на схеме процесса A, 3-ацетокси-андрост-5-ен-17-он 1 вступает во взаимодействие с борогидридом натрия в подходящем растворителе, например в этаноле, при -10oC, со стереоспецифическим восстановлением 17-кетона до 17β-ола 2. Гидроксильную группу в положении 17 защищают TBS - группой (трет-бутилдиметилсилилом) взаимодействием TBS - хлорида с 2 в подходящем растворителе, например в ДМФА, в присутствии акцептора протонов, например имидазола, при комнатной температуре с образованием 3.
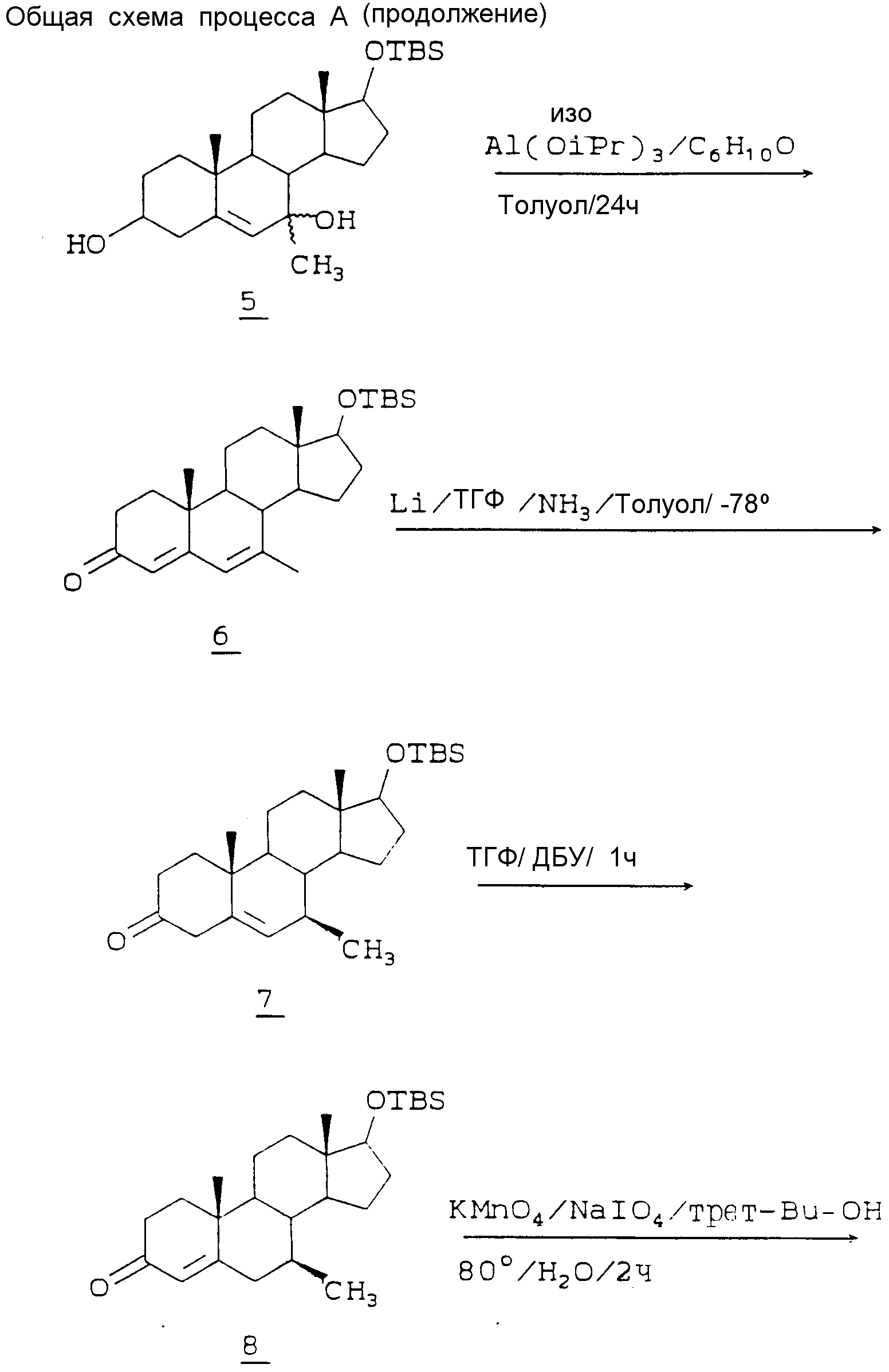
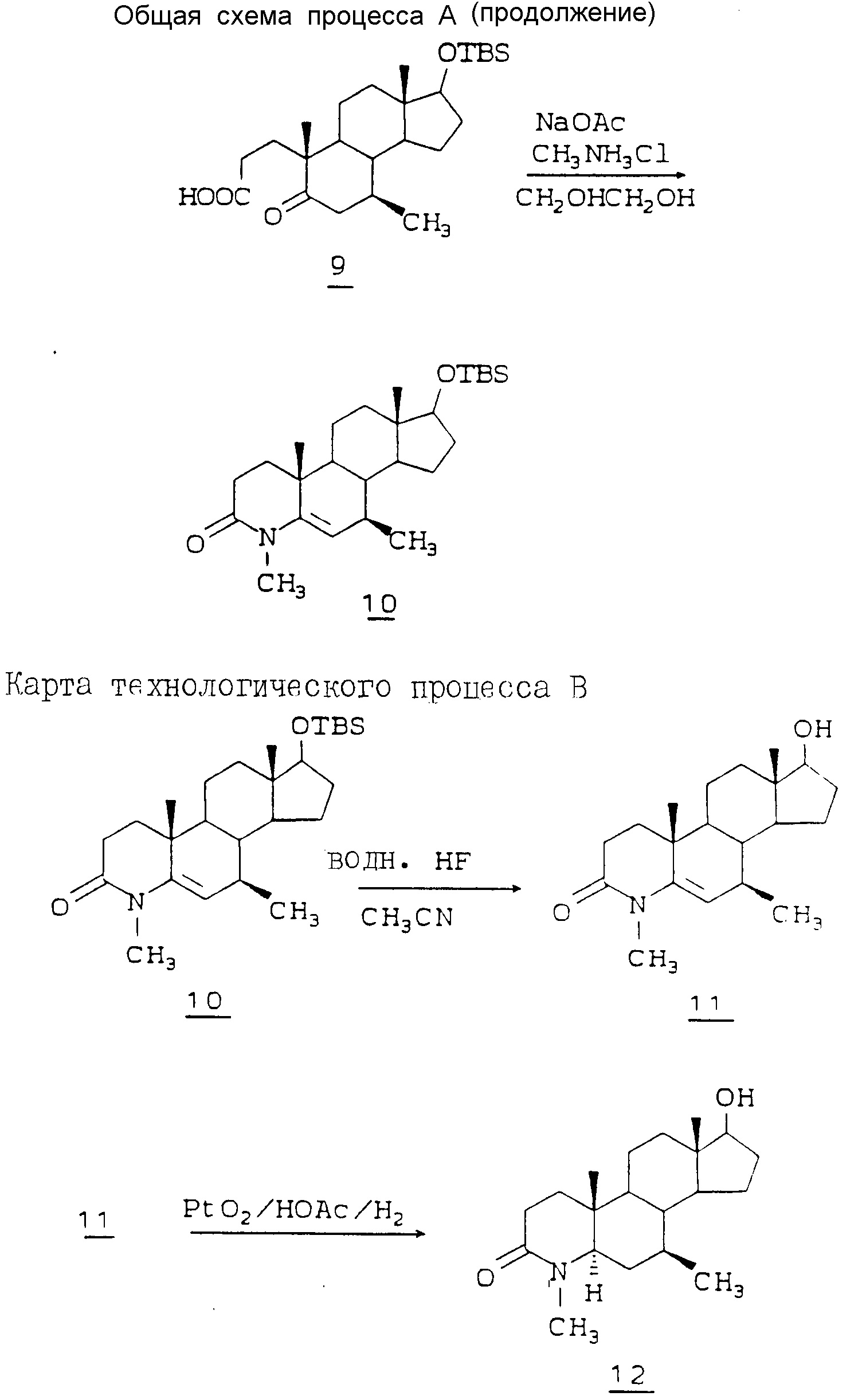
После защиты гидроксильной группы это соединение окисляют в положении 7 до соответствующего 5-ен-7-она 4 обработкой 3 трет-бутилпероксидом водорода и гексакарбонилом хрома, например в ацетонитриле, при кипячении с обратным холодильником. Алкильная группа, например метил, может быть введена в эту точку посредством реакции Гриньяра при использовании, например, метилмагнийхлорида, в безводном ТГФ при 0 - 1oC с образованием 7-метил-7-гидрокси-аддукта 5. Этот продукт реакции Гриньяра затем окисляют изопропоксилом алюминия и циклогексаноном (условия окисления по Оппенауэру) в кипящем толуоле с образованием 7-метил-4,6-диен-3-она 6. Его в свою очередь восстанавливают, используя металлический литий, в жидком аммиаке, ТГФ и толуоле при -78oC, до селективного выхода 7β-метил-5-ен-3-она 7. На следующей стадии дельта-5 двойную связь изомеризуют до 4-ена при использовании ДБУ (1,8-диазабицикло[5,4,0] ундек-7-ен) в кипящем тетрагидрофуране (ТГФ) с образованием 4-ен-3-она 8. Затем расщепляют кольцо A путем обработки перманганатом калия, периодатом натрия в трет-бутиловом спирте при 80oC и получают соответствующую секокислоту 9. Обработка секокислоты 9 соответствующим амином, например, гидрохлоридом метиламина, и ацетатом натрия в этиленгликоле при 180oC дает в результате 4-аза-андрост-5-ен-3-он 10. Затем удаляют защитную TBS - группу, например, водной HF в ацетонитриле при 0oC, и получают спирт 17-B 11. Этот спирт в свою очередь селективно восстанавливают, чтобы удалить 5-дельта-двойную связь, и получают 5α-водородное соединение 12.
Аналоги 7β -этил-холестана.
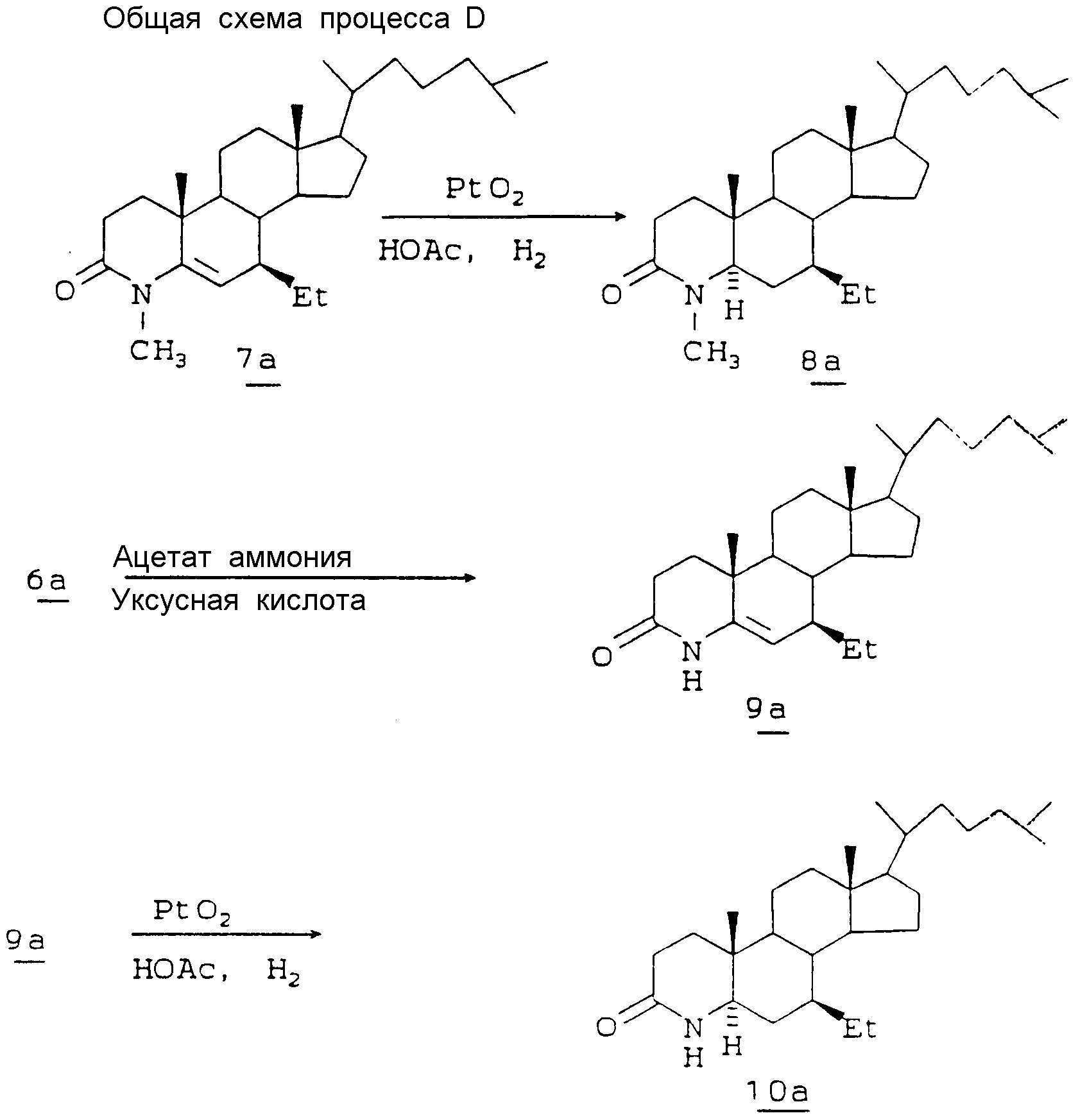
Заместитель 7-этил вводят в ряд холестана так, как показано на общей схеме процессов C и D, приведенной в конце описания, с помощью методик, аналогичных описанным в общей схеме процесса и в схемах A и B.
Исходный холестерилацетат CA доступен коммерчески (Aldrich). Это соединение обрабатывают с применением метода окисления с гексакарбонилом хрома, третбутилпероксидом водорода и ацетонитрилом (описан в ICS Perkin Trans 1985, р. 267, A. J. Pearson) и получают 3-ацетокси-холест-5-ен-7-он 1a. Это соединение может вступать во взаимодействие с алкилсодержащим реактивом Гриньяра, например с этилмагнийхлоридом, с образованием аддукта 2a. Этот аддукт окисляют в условиях реакции по Оппенауэру с образованием диенона 3a, который затем может быть подвергнут восстановлению металлом и аммиаком с образованием 7β-этил-5-ен-3-она 4a. Соединение 4a изомеризуют с применением ДБУ до 4-ен-3-она 5a, который окисляют, чтобы раскрыть кольцо A и получить секокислоту 6a. Эта секокислота может быть обработана аминами, например метиламином, с образованием 4-метил-4-аза-соединения 7a с закрытым A-кольцом. Это соединение в свою очередь может быть каталитически гидрировано с образованием 7-этил-5-альфа-4-метил-4-аза-холестан-3-она 8a.
Подобным образом при обработке секокислоты 6a ацетатом аммония и уксусной кислотой получают соответствующий 4-NH-аналог-соединение 9a, которое может быть каталитически гидрировано с образованием 7β-этил-5α-4-аза-холестан-3-она 10a.
Вышеупомянутые 7-заместители могут быть введены во все соединения, для которых здесь установлено значение группы 17-А, с помощью соответствующих аналогичных методик.
Следующие далее примеры иллюстрируют варианты осуществления изобретения и не должны истолковываться как ограничение объема и сущности изобретения.
Приводимые значения Rf получают стандартной тонкослойной хроматографией на силикагелиевых пластинах. Используемая для элюирования система растворителей дается в круглых скобах после величины Rf.
Масс-спектральные величины даются в виде обоих FAB, т.е. полученные при бомбардировке ускоренными атомами, и приводятся в виде пиков молекулярных ионов (М+1), что является молекулярной массой плюс одна атомная единица массы. Значения масс-спектров при электронных соударениях (E1) приводятся как пики молекулярных ионов и указываются в круглых скобах либо в виде (М), либо (М+2), т. е. молекулярная масса MW, или MW плюс две атомные единицы массы.
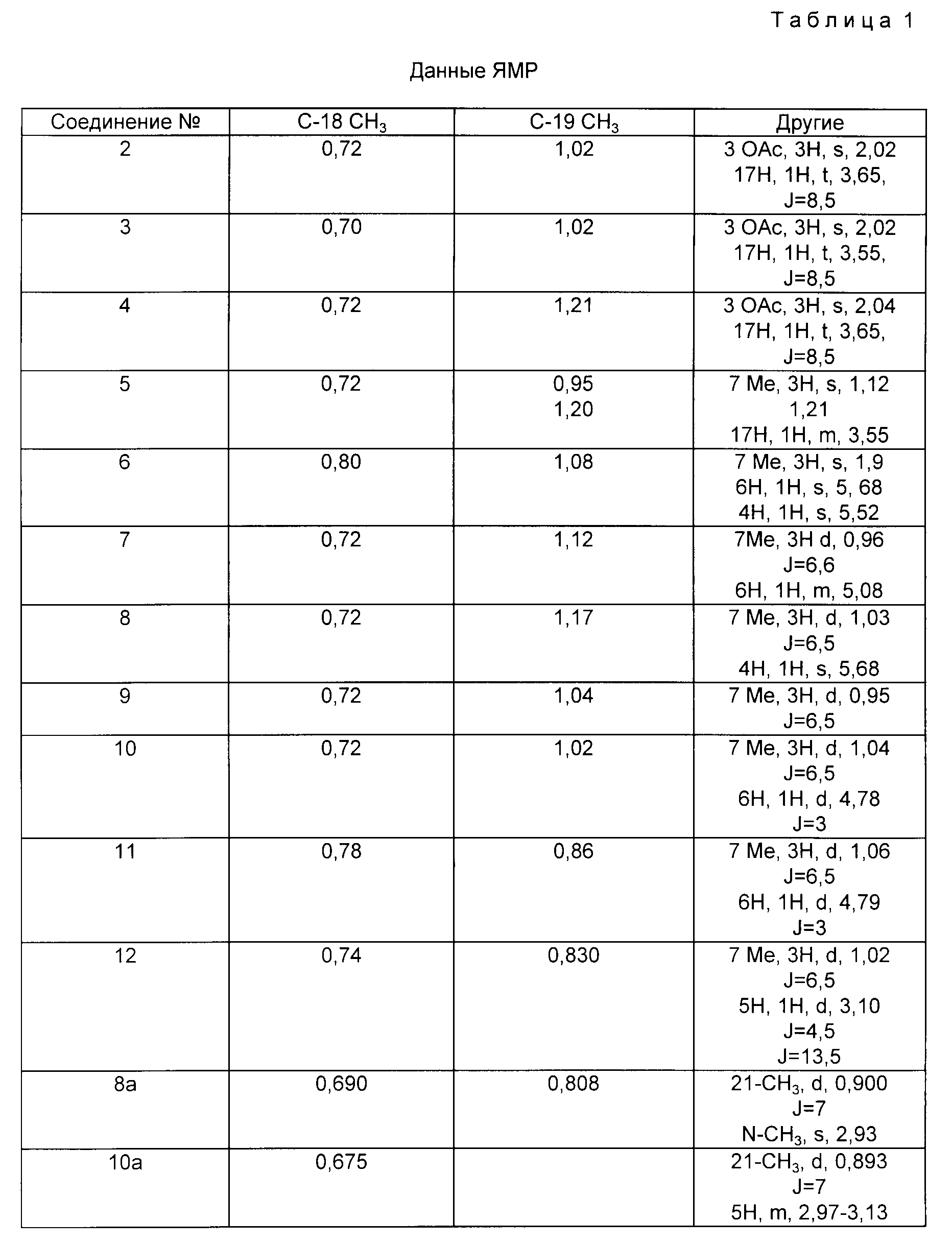
Данные ядерного магнитного резонанса получены при 400 МГц в CDCl3 и сведены в табл.1 как данные ЯМР для каждого соединения в конце примеров. Константа взаимодействия J дается в герцах.
Пример 1. Синтез-3-ацетокси-андрост-5-ен-17-ола (2).
К раствору 100 мг (0,303 ммоль) 3-ацетокси-андрост-5-ен-17-она 1 в 3 мл E OH при -10oC добавляют при перемешивании 22,9 мг (0,606 ммоль) борогидрида натрия. После перемешивания реакционной смеси в течение получаса смесь разбавляют 10 мл воды, растворитель этанол удаляют под вакуумом и остаток экстрагируют этилацетатом. Органический слой промывают водным Na2CO3, соляным раствором, сушат над сульфатом натрия, концентрируют, получают в остатке сырое названное в заголовке соединение 2. Структура соединения подтверждена протонным ЯМР спектром.
Пример 2. Синтез 17-трет-бутилдиметилсилилового эфира 3-ацетоксиандрост-5-ен-17-ола (3).
К раствору андростан-17-ола 2, полученного в примере 1, 4,5 г (13,55 ммоль) растворено в 50 мл диметилформамида, при 23oC добавляют 2,76 г (40,65 ммоль) имидазола и затем 3,063 г (20,32 ммоль) трет-бутилдиметилсилилхлорида. Реакционную смесь перемешивают, и начинает выпадать твердое вещество. Добавляют дополнительно 20 мл ДМФА, и смесь перемешивают еще в течение ночи. Смесь выливают в 1 л воды, твердое вещество отфильтровывают и промывают водой. Твердое вещество растворяют в этилацетате, органический слой промывают соляным раствором и сушат над сульфатом натрия, концентрируют и получают защищенный силильной группой 7-ол-соединение 3, названное в заголовке. Протонный ЯМР подтверждает упомянутую структуру.
Пример 3. Синтез-17-трет-бутилдиметилсилилового эфира 3-ацетокси-андрост-5-ен-7-он-17β-ола (4).
К раствору защищенного TBMS - группой 17-ола 3 из примера 2, содержащего 5,6 г (12,55 ммоль) в 100 мл ацетонитрила, при 23oC добавляют 90% трет-бутилпероксид водорода 3,958 г (43,92 моль) и 138 мг гексакарбонила хрома. После кипячения смеси с обратным холодильником в атмосфере азота в течение 24 ч реакционную смесь выливают в 1 л воды, твердое вещество отфильтровывают, остаток промывают 500 мл воды, и остаток растворяют в 350 мл метиленхлорида. Органический слой промывают соляным раствором, сушат над сульфатом натрия и концентрируют, получают сырое вещество. Тонкослойная хроматография (гексан: этилацетат, 3: 1, на силикагеле) показывает присутствие исходного вещества. Твердое вещество очищают колоночной хроматографией на силикагеле при элюировании 7% этилацетата в гексане и получают названное в заголовке соединение 4. Протонный ЯМР подтверждает предлагаемое строение.
Пример 4. Синтез 17-TBMS эфира 3,7-дигидрокси-7-метил-андрост-5-ен-17β -ола (5).
К раствору продукта 4 из примера 3, содержащего 440 мг (0, 956 ммоль) вещества в сухом тетрагидрофуране, при 0oC добавляют по каплям в течение 5-10 мин метилмагнийхлорид. Реакционную смесь затем продолжают перемешивать при комнатной температуре в течение 24 ч и затем выливают в насыщенный водный раствор хлорида аммония. Растворитель ТГФ удаляют под вакуумом, и водную фазу экстрагируют этилацетатом. Органический слой промывают соляным раствором, сушат, концентрируют и получают сырой продукт. Протонный ЯМР подтверждает структуру названного в заголовке соединения 5, которое используют на следующей стадии без дополнительной очистки.
Пример 5. Синтез 17-трет-бутилдиметилсилилового эфира 7-метил-андрост-4,6-диен-3-он-17-ола (6).
Упомянутый выше продукт реакции Гриньяра 5 (3,5 г, 7,142 ммоль) растворяют в 50 мл толуола и 50 мл толуола и 50 мл циклогексанона, и 20 мл растворителя отгоняют под вакуумом. К остатку добавляют 4,54 г изопропоксида алюминия, и реакционную смесь кипятят в течение ночи - в течение 15 ч. Смесь охлаждают, разбавляют этилацетатом, промывают натрийкалийтартратом, соляным раствором, и органический слой концентрируют под вакуумом, а остаток перегоняют с паром. Остаток экстрагируют этилацетатом, промывают соляным раствором, сушат, и очищают колоночной хроматографией на силикагеле, элюируя 5% EtOAc в гексане, и получают названное в заголовке соединение 6.
Пример 6. Синтез трет-бутилдиметилсилилового эфира 7β-метил-андрост-5-ен-3-он-17-ола (7).
К раствору 370 мг соединения 6 из примера 5 в 5,5 мл аммиака, 1 мл толуола, 1 мл ТГФ добавляют небольшими кусочками 50 мл металлического лития. После перемешивания голубого раствора в течение 2 ч добавляют раствор 1,2-дибромметана в 2 мл ТГФ. После перемешивания раствора при -78oC в течение 10 мин добавляют 250 мг хлорида аммония и смесь перемешивают в течение 10 мин. Избыток аммиака удаляют испарением в парах азота. Реакционную смесь разбавляют соляным раствором, экстрагируют этилацетатом. Органический слой промывают соляным раствором, сушат и концентрируют, получают сырое вещество 7.
Пример 7. Синтез трет-бутилдиметилсилилового эфира 7β-метил-андрост-4-ен-3-он-17-ола (8).
К раствору соединения 7 из примера 6, содержащему 432 мг соединения в 4 мл ТГФ, в атмосфере азота при перемешивании добавляют 150 мкл ДБУ (1,8-диазабицикло[5.4.0] -ундек-7-ена). Смесь кипятят с обратным холодильником в течение 1,5 ч, затем охлаждают и разбавляют раствором NH4Cl. Растворитель ТГФ удаляют под вакуумом, и остаток экстрагируют этилацетатом. Органический слой промывают соляным раствором, сушат и концентрируют при пониженном давлении, получают сырое вещество. Названный в заголовке продукт 8 очищают хроматографией на силикагеле, используя в качестве элюента 10% EtOAc в гексане.
Пример 8. Синтез 17β-(трет-бутилдиметилсилилокси) -7β-метил-5-оксо-А-нор-3,5-секоандростан-3-овой кислоты (9).
К раствору 884 мг соединения 8 в 15 мл трет-бутилового спирта при 80oC добавляют 248 мг карбоната натрия в 1,5 мл воды, после чего добавляют по каплям в течение 15-20 мин смесь 2,273 г периодата натрия и 16,8 мг перманганата калия в 8 мл воды. Реакционную смесь нагревают при 80oC в течение 2 ч, охлаждают, фильтруют, остаток промывают водой, и затем экстракт концентрируют под вакуумом. Экстракт подкисляют водной HCl, экстрагируют этилацетатом, и органический слой промывают водным NaHSO3, соляным раствором, сушат и концентрируют, получают сырое соединение 9. Протонный ЯМР подтверждает предполагаемое строение.
Пример 9. Синтез трет-бутилдиметилсилилового эфира 4,7-диметил-4-аза-андрост-5-ен-3-он-17-ола (10).
К раствору соединения 9, 840 мг, в 5 мл этиленгликоля добавляют 1,5 г ацетата натрия и 737 мг гидрохлорида метиламина. После перемешивания реакционной смеси в течение 4 ч при 180oC смесь охлаждают, разбавляют водой, экстрагируют этилацетатом, сушат и концентрируют, и получают сырое названное в заголовке соединение 10. Протонный ЯМР подтверждает приписываемую ему структуру.
Пример 10. Синтез 4, 7-диметил-4-аза-андрост-5-ен-3-он-17-ола (11).
К раствору 700 мг соединения 10 из примера 9 в 20 мл ацетонитрила при 0oC добавляют 500 мкл водной HF. После перемешивания реакционной смеси в течение 1 ч HF нейтрализуют водным раствором карбоната натрия, разбавляют водой, ацетонитрил удаляют под вакуумом, и остаток экстрагируют этилацетатом. Органический слой сушат, концентрируют, и получают сырое названное в заголовке соединение 11, которое затем очищают препаративной хроматографией на силикагеле при использовании смеси хлороформа с ацетоном в соотношении 3:1.
Пример 11. Синтез 4, 7-диметил-4-аза-андростан-3-он-17-ола (12).
К раствору соединения 11 из примера 10, содержащему 350 мг соединения в 10 мл уксусной кислоты, добавляют 100 мг каталитического диоксида платины, и полученную в результате смесь откачивают и пропускают с водородом. Реакционную смесь встряхивают в течение ночи при комнатной температуре при давлении водорода 40 фунт/дюйм2 (0, 28 кПа). Раствор фильтруют и концентрируют до остатка. Остаток обрабатывают этилацетатом, органический слой затем концентрируют под вакуумом, разбавляют этилацетатом, промывают водным раствором NaHCO3, рассолом, сушат, концентрируют и получают названное в заголовке соединение 12. Масс-спектр: 320, (М+1).
В табл. 1 приведены данные протонного ЯМР (400 МГц в CDCl3) для каждого соединения. В приведенных данных s - синглет, d - дублет, m - мультиплет, J - константа взаимодействия. Значения абсорбции даются в дельта-единицах (δ) и иллюстрируются для метильных протонов углов кольца C-18, C-19 и C-21, и протонов, ассоциированных только с этими частями молекулы.
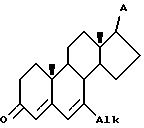
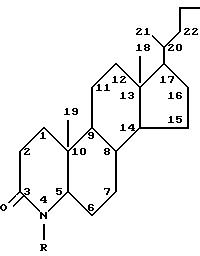
Нумерация атомов в стероиде дается в соответствии с приведенной далее структурной формулой.

Дополнительные экспериментальные данные.
Пример 12.

1,083 мл жидкого NH3 помещают в 5-л 3-горлую круглодонную колбу, снабженную обратным холодильником с сухим льдом и механической мешалкой и перемешивают на бане при -78oC. Добавляют 69,2 г соединения I в 181 мл толуола и 181 мл ТГФ (оба раствора предварительно продувают N2). Добавляют 12,38 г литиевой проволоки (2,74 м, 11,5 экв.), удаляют баню и кипятят голубой раствор с обратным холодильником в течение 3 ч. Затем реакционную массу перемешивают на бане сухой лед/ацетон и гасят медленным добавлением 74,3 мл дибромэтаном в 309 мл дегазированного ТГФ, перемешивают 10 мин и обрабатывают 46 г твердого NH4 Cl, перемешивают 10 мин и выливают смесь в 10,8 л дегазированной H2O (пропускают N2 через H2O в реакторе в течение 20 мин). Разбавляют 3 л EtOAc, отделяют верхний слой, экстрагируют повторно 3 л EtOAc, собирают органические вытяжки, сушат над MgSO4, фильтруют через Na2SO4 и выпаривают, сушат в вакууме и используют полученное соединение непосредственно на следующей стадии синтеза в виде темной оранжевой пены.
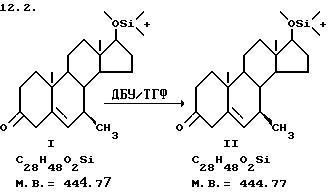
70,9 г соединения II ( Δ5,6 стероида) растворяют в 619 мл дегазированного ТГФ, добавляют 29 мл ДБУ и кипятят с обратным холодильником в течение 4 ч. Затем смесь перемешивают при комнатной температуре в течение ночи. Добавляют 325 мл насыщенного водного раствора NH4Cl, разбавляют EtOAc, разделяют слои, далее повторно экстрагируют водным раствором, объединяют органические слои, промывают насыщенным рассолом, сушат над MgSO4. Смесь фильтруют и выпаривают, сушат в вакууме и выделяют с помощью ТСХ на силикагеле, элюируя 10% EtOAc/гексаном, получают 67,2 г масла темно-оранжевого цвета.
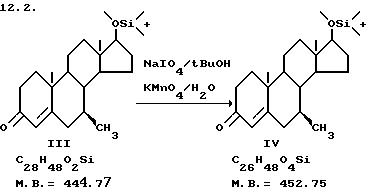
73,57 г (0,165 моль) соединения III (3-он стероид) растворяют в 95,6 м т-BuOH в 3-л 3-горлой колбе. Добавляют 25,8 г Na2CO3 в 120 мл H2O и нагревают до 80oC при перемешивании. К реакционной смеси медленно добавляют горячий раствор 244 г Na2IO4 (предварительно нагретый на паровой бане до достижения жидкого состояния) и 1,91 г KMnO4 в 956 мл H2 O. После завершения добавления кипятят реакционную массу с обратным холодильником в течение 1-2 ч и затем реакционную массу охлаждают и фильтруют через ячеистый фильтр для удаления т-BuOH, экстрагируют CH2Cl2 и доводят pH до 3 с помощью 2,0 NHCl. Трижды экстрагируют CH2Cl2, промывают 5% NaHSO3, насыщенным рассолом, сушат и выпаривают с получением 62,3 г белой пены. Выход 83,4%.
Элементный анализ для C26H48O4Si:
Вычислено,%: C 69,78; H 10,41.
Найдено,%: C 67,04; H 10,26.
Пример 13. Синтез 7-оксохолестерол-3-ацетата (1).
Холестерилацетат (ХА) является соединением, известным в этой области химии, и он может быть окислен до известного 7-оксопроизводного 1 по способу, аналогичному описанному выше (статья Пирсона в журнале JCS Parkins).
Пример 14. Синтез 7-этил-7-гидроксихолестерола (2).
К раствору соединения 1 из примера 1 в количестве 5,0 г (11,32 ммоль) в сухом тетрагидрофуране при 0oC по каплям добавляют 56,6 мл бромистого этилмагния (1 М) в течение 5-10 мин. Реакционную смесь затем перемешивают при комнатной температуре в течение 24 ч, затем выливают в насыщенный водный раствор хлорида аммония. Удаляют ТГФ в вакууме и экстрагируют водную фазу этилацетатом. Органический слой промывают рассолом, сушат и концентрируют с получением светло-желтой пены. R1 = 0,2 (30% EtOAc/гексан). Спектр ПМР подтвердил структуру указанного в заголовке соединения 2, которое используют на следующей стадии без очистки.
Пример 15. Синтез 7-этил-холест-4, -диен-3-он-(3).
Продукт Гриньяра 2, 5,13 г (11,9 моль) растворяют в 50 мл толуола и циклогексанона и около 40 мл растворителя выпаривают в вакууме. К реакционной массе добавляют 7,2 г изопропоксида алюминия и кипятят ее с обратным холодильником в течение 15 ч. Смесь охлаждают, разбавляют этилацетатом, промывают тартратом калия (натрия), рассолом, органический слой концентрируют в вакууме и остаток перегоняют. Остаток экстрагируют этилацетатом. Этилацетатный слой промывают рассолом, сушат и очищают колоночной хроматографией на силикагеле, элюируют 5% EtAOc/гексаном с получением указанного в заглавии соединения 3. Rf = 0,58 (20% EtOAc/гексан). Масс-спектр: 412 (М = 1) FAB, вычислено 411,9.
Пример 16. Синтез 7β-этилхоласт-5-ан-3-она (4).
К раствору, состоящему из 3,1 г соединения 3 из примера 3 в 46 мл аммиака, 10 мл тетрагидрофурана и 10 мл толуола, добавляют 449 г металлического лития в виде маленьких кусочков. После перемешивания голубого раствора в течение 2 ч при -78oC добавляют раствор 1,2-дибромметана в 2 мл тетрагидрофурана. После перемешивания раствора при -78oC в течение 10 мин добавляют 2,1 г хлористого аммония, и смесь перемешивают в течение 10 мин. Избыточный аммиак удаляют упариванием с продувкой азотом. Реакционную смесь разбавляют солевым раствором, экстрагируют этилацетатом. Органический слой промывают солевым раствором, сушат и концентрируют, в результате чего получают соединение 4 в виде сырой коричневой вязкой жидкости, которую используют как таковую в примере 5. Величина Rf составляет 0,70 (20%-ный раствор этилацетата в гексане). Получают следующий масс-спектр: 412 (ионизация электронным ударом); рассчитанный молекулярный вес MW составлял 412,70.
Пример 17. Синтез 7β -этилхолест-4-ен-3-она (5).
К раствору соединения 4, взятого из примера 4, в виде 3,1 г в 30 мл тетрагидрофурана добавляют 1,1 мл 1,8-диазабицикло[5.4.0]ундек-7-ена, в среде азота при перемешивании. Смесь нагревают в сосуде с обратным холодильником в течение 1,5 ч, затем охлаждают и разбавляют раствором хлористого аммония. Затем тетрагидрофурановый растворитель удаляют под вакуумом, и остаток экстрагируют этилацетатом. Органический слой затем промывают водой, солевым раствором, сушат и концентрируют при пониженном давлении, в результате чего получают сырое вязкое маслянистое вещество. Названный продукт 5 очищают хроматографией на силикагеле при использовании в качестве элюента 10%-ного раствора этилацетата в гексане. Получают массовую спектральную линию 412 (ионизация электронным ударом); рассчитанный молекулярный вес MW составляет 412,70. Величина Rf составляет 0,6 (20%-ный раствор этилацетата в гексане).
Пример 18. Синтез 7-этил- 17β-(6-метил-2-гептил)-5-оксо-A-нор-3,5-секоандростан-3-овой кислоты (6).
К раствору, состоящему из 1,0 г соединения 5 в 18 мл трет-бутилового спирта, при 80o C добавляют 300 мг карбоната натрия в 1,8 мл воды, после чего по каплям добавляют на протяжении 15-20 мин смесь, состоящую из 2,74 г периодата натрия с 20,3 мг перманганата калия в 15 мл воды. Реакционную смесь нагревают при 80oC в течение 2 ч, охлаждают, фильтруют, остаток промывают водой, и затем фильтрат концентрируют под вакуумом, подкисляют водным раствором HCl, экстрагируют этилацетатом, и органический слой промывают водным раствором NaHSO3, солевым раствором, сушат и концентрируют, получая сырое соединение 6. Протонный ядерный магнитный резонанс подтверждает наличие предполагаемой структуры. В условиях ионизации с бомбардировкой быстрыми атомами величину отношения массы к заряду m/z у молекулярного иона находят равной 434 (М+2); расчетом получают 432, 69.
Пример 19. Синтез 7-этил-4-метил-4-азахолест-5-ен-3-она (7).
К раствору соединения 6, взятого в количестве 500 мг и находящегося в 10 мл этиленгликоля, добавляют 1, 3 г ацетата натрия и 1,0 г гидрохлорида метиламина. После перемешивания реакционной смеси в течение 4 ч при 180oC смесь охлаждают, разбавляют водой, экстрагируют этилацетатом, сушат и концентрируют, в результате чего получают сырое названное соединение 7. Протонный ядерный магнитный резонанс подтверждает наличие предполагаемой структуры. Величина Rf составляет 0, 70 (20%-ный раствор этилацетата в гексане). Масс-спектральная величина отношения массы к заряду m/z у иона (бомбардировка быстрыми атомами) составляет 429 (М+2); расчетом получают 427,72.
Расчет для C29H49NO:
Вычислено,%: C 81,44; H 11,55; N - 3,27.
Найдено,%: C 82,19; H 10,92; N - 3,11.
Пример 20. Синтез
7-этил-4-метил-4-азахолестан-3-она (8)
К раствору соединения 7 из примера 7, приготовленного из 180 мг в 5 мл уксусной кислоты, добавляют 54 мг диоксида платины, и полученную смесь
откачивают
и продувают водородом. Реакционную смесь встряхивают на протяжении ночи при комнатной температуре в среде водорода. Фильтруют, промывают твердое вещество этилацетатом; объединенные
этилацетатные слои
промывают водным раствором NAHCO3, солевым раствором, сушат, концентрируют до получения названного соединения 8. Масс-спектральным анализом с ионизацией быстрыми атомами
величина отношения
массы к заряду иона m/z найдена равной 431 (M+2); расчетом получают 429,74.
Результаты анализа для C29H51NO:
Вычислено, %: C 81,06; H
11,96; N 3,26.
Найдено: C 81,42; H 12,24; N 3,16.
Пример 21. Синтез 7-этил-4-азахолест-5-ен-3-она (9).
Секокислоту 6 в количестве 0,5 г и ацетат аммония в количестве 0,5 г в 3,5 мл уксусной кислоты нагревают в сосуде с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают, добавляют воду и затем экстрагируют этилацетатом. Органический слой сушат над сульфатом натрия и концентрируют до получения остатка, который элюируют в колонке с силикагелем 10%-ным раствором этилацетата в гексане, в результате чего получают чистое названное соединение 9, температура плавления составляет 147 - 149oC. Масс-спектральным анализом получают 414 (М+1); расчетом находят 413,69. Величина Rf составляет 0,45 (30%-ный раствор этилацетата в гексане).
Результаты анализа для C28H49NO с молекулярным весом 413,69:
Вычислено, %: C 81,30; H 11,45; N 3,39.
Найдено, %: C 81,30; H 11,87; N 3,45.
Пример 22. Синтез 7β-этил-4-аза-5α-холестан-3-она (10).
Следуя общей методике, описанной в примере 8, соединение 9 каталитически гидрируют с получением названного соединения 10. Хроматографией на силикагеле с элюированием 50%-ным раствором этилацетата в гексане получают чистый продукт; температура плавления составляет 169 - 170oC.
Результаты анализа для C28H49NO с молекулярным весом 415,17:
Вычислено, %: C 80,90; H 11,88; N 3,37.
Найдено, %: C 81,02; H 12,57; N 3,47.
Масс-спектральным анализом величину отношения массы к заряду находят равной 416 (M+1).
Величина Rf составляет 0,30 (30%-ный раствор этилацетата в гексане).
Пример 23. Синтез 7-аллил-3,7-дигидроксихолест-5-ена (11).
Следуя аналогичной общей методике проведения реакции Гриньяра, изложенной в примере 2, бромистый аллилмагний взаимодействует с соединением 1 в сухом тетрагидрофуране, в результате чего получают названный продукт 11. Протонный ядерный магнитный резонанс подтверждает предполагаемую структуру.
Масс-спектральным анализом величину отношения массы к заряду находят равной 441 (М+1); расчетом получают 440,71. Величина Rf составляет 0,25 (30%-ный раствор этилацетата в гексане).
Пример 24. Синтез 7-аллилхолест-4,6-диен-3-она (12).
Следуя аналогичной общей методике проведения реакции окисления Оппенауэра, изложенной в примере 3, соединение 11 окисляли, в результате чего получают названное соединение 12. Протонный ядерный магнитный резонанс подтверждает наличие предполагаемой структуры, а также масс-спектральным анализом установлено (с бомбардировкой быстрыми атомами), что величина отношения массы к заряду составляет 423 (М+1); расчетом получали 422,35. Величина Rf составляет 0,78 (30%-ный раствор этилацетата в гексане).
Пример 25. Синтез 7-аллилхолест-5-ен-3-она (13).
Соединение 12 подвергают аналогичному восстановлению с воздействием металла и аммиака в условиях примера 4, в результате чего получают названное соединение 13. Величина Rf составляет 0,5 (5%-ный раствор этилацетата в гексане).
Пример 26. Синтез-7-аллилхолест-4-ен-3-она (14).
Следуя общей методике изомеризации, катализируемой 1,8-диазабицикло[5.4.0]ундек-7-еном, в условиях примера 5 аналогичным образом обрабатывают соединение 13, в результате чего получают названное соединение 14. Масс-спектральным анализом с бомбардировкой быстрыми атомами величину отношения массы к заряду находят равной 425 (М+1); расчетом получают 424,37. Величина Rf составляет 0,45 (5%-ный раствор этилацетата в гексане).
Пример 27. Синтез 7-пропилхолест-4-ен-3-она (18).
7-Аллил-енон (соединение 14) в количестве 1,0 г, 5 мл этилацетата и 50 мг хлористого трифенилфосфинродия (катализатор Уилкинсона) перемешивают в течение 2 ч (в среде H2). Продукты реакции фильтруют через силикагель объемом 25 мл и упаривают досуха, в результате чего получают довольно чистый названный продукт 18, что подтверждено проведением протонного ядерного магнитного резонанса. Масс-спектральным анализом величину отношения массы к заряду находят равной 427 (М+1); расчетом получают 426,39. Величина Rf составляет 0,15 (5%-ный раствор этилацетата в гексане).
Пример 28. Синтез 7-пропил-5-оксо-А-нор-3,5-секохолестановой кислоты (19).
Следуя общей методике примера 6, где описано проведение окислительного разрыва кольца А, соединение 18 (7-пропильный аналог) обрабатывают аналогичным образом, в результате чего получают названную выше секокислоту 19. Предполагаемую структуру подтверждают протонным ядерным магнитным резонансом. Масс-спектральным анализом величину отношения массы к заряду находят равной 447 (М+1) (бомбардировка быстрыми атомами); расчетом получают 446,38. Величина Rf составляет 0,1 (20%-ный раствор этилацетата в гексане).
Пример 29. Синтез 7-пропил-4-метил-4-азахолест-5-ен-3-она (20).
Следуя общей методике примера 7,
соединение 19 обрабатывают
аналогичным образом гидрохлоридом метиламина и ацетатом натрия в этиленгликоле, в результате чего получают названный выше жидкий продукт 20. Предполагаемую структуру
подтверждают протонным ядерным
магнитным резонансом. Масс-спектральным анализом величину отношения массы к заряду находят равной 442 (M+1) (бомбардировка быстрыми атомами); расчетом получают 441,74.
Проводят анализ на углерод,
водород и азот для названного соединения, считая его содержащим 0,2 части H2O; величину молекулярного веса находят равной 441,74:
Вычислено,%: C 80,91;
H 11,63; N 3,15.
Найдено,%: C 81,00; H 12,06; N 2,93.
Величина Rf составляет 0,3 (20%-ный раствор этилацетата в гексане).
Пример 30. Синтез 7-пропил-4-метил-4-аза-5-холестан-3-она (21).
Следуя аналогичной общей методике примера 8, соединение 20 каталитически гидрируют в уксусной кислоте, в результате чего получают
названное жидкое соединение 21. Протонным ядерным магнитным резонансом подтверждают предполагаемую структуру. Масс-спектральным анализом величину отношения массы к заряду находят равной 444 (M+1)
(бомбардировка быстрыми атомами). Для названного соединения проводят анализ на углерод, водород и азот; молекулярный вес составлял 443,41:
Вычислено, %: C 81,19; H 12,05; N 3,16.
Найдено,%: C 80,78; H 12,06; N 3,22.
Величина Rf составляет 0,17 (20%-ный раствор этилацетата в гексане).
Пример 31. Синтез 7-пропил-4-азахолест-5-ен-3-она (22).
Следуя аналогичной методике примера 9, соединение 19 обрабатывают ацетатом аммония в уксусной кислоте, в результате чего получают названное
соединение 22. Перекристаллизацией из смеси этилацетата с диэтиловым эфиром получают белое кристаллическое твердое вещество с температурой плавления 91-94oC. Анализ на содержание углерода,
водорода и азота проводят, считая названное вещество гидратом, содержащим 0,25 H2O; рассчитанный молекулярный вес составлял 427,39:
Вычислено,%: C 80,59, H 11,54, N 3,24;
Найдено,%: C 80,59, H 11,69; N 3,36.
Масс-спектральным анализом величину отношения массы к заряду находят равной 428 (M+1).
Пример 32. Синтез 7-пропил-4-аза-5α -холестан-3-она (23).
Следуя аналогичной методике, описанной в примере 8, соединение 22 каталитически гидрируют, в результате чего получают названное соединение 23; температура
плавления составляет 65-68oC. Анализ на углерод, водород и азот проводят, считая названное соединение гидратом, содержащим 0,25 H2O:
Вычислено,%: C 80,21; H 11,95; N 3,
23.
Найдено,%: C 80,20; H 12,14; N 3,07.
Проводят протонный ядерный магнитный резонанс. Масс-спектральным анализом величину отношения массы к заряду находят равной 430 (M+1); рассчитанный молекулярный вес составляет 429,40. Величина Rf составляет 0,12 (20%-ный раствор этилацетата в гексане).
Пример 33. Синтез 7-метил-7-гидроксихолестерола (24).
Следуя аналогичной методике проведения реакции Гриньяра, описанной в примере 1, холестерилацетат-7-он I подвергают взаимодействию с бромистым метилмагнием, делая это в стандартных условиях проведения реакции Гриньяра, в результате чего получают названное соединение 24 в виде твердого вещества. Ядерный магнитный резонанс подтверждает предполагаемую структуру, и масс-спектральный анализ подтверждает молекулярный вес.
Пример 34. Синтез 7-метилхолест-4,6-диен-3-она (25).
Следуя аналогичной методике примера 2, полученный выше продукт проведения реакции Гриньяра 24 подвергают окислению по Оппенауэру, в результате чего получают названное соединение 7β-метилхолест-4,6-диен-3-он 25.
Пример 35. Синтез 7β-метилхолест-5-ен-3-она (26).
Следуя аналогичной методике примера 4 по восстановлению с использованием металла и аммиака, соединение 25 обрабатывают подобным образом литием в аммиаке, тетрагидрофуране и толуоле, в результате чего получают названное соединение 26.
Пример 36. Синтез 7β-метилхолест-4-ен-3-она (27).
Следуя общей методике изомеризации примера 5 при использовании 1,8-диазабицикло[5.4.0] ундек-7-ена в тетрагидрофуране, соединение 26 обрабатывают аналогичным образом, в результате чего получают названное соединение 27.
Пример 37. Синтез 7-метил- 7β-(2,6-диметилгексил)-5-оксо-A-нор-3,5-секоандростан-3-овой кислоты (28).
Следуя общей методике примера 6 по окислительному разрушению кольца A, соединение 27 аналогичным образом обрабатывают, в результате чего получают названную выше секокислоту 28. Протонный ядерный магнитный резонанс подтверждает предполагаемую структуру.
Пример 38. Синтез 7-метил-4-азахолест-5-ен-3-она (29).
Следуя общей методике примера 9, соединение 28 аналогичным образом обрабатывают хлористым аммонием в уксусной кислоте, в результате чего получают названный выше продукт 29. Масс-спектральным анализом величина отношения массы к заряду иона m/z (бомбардировка быстрыми атомами) найдена равной 400,2 (М+1), (М+2); расчетом получают 399.
Пример 39. Синтез 7-метил-4-азахолестан-3-она (30).
Следуя аналогичной общей методике примера 8, соединение 29 каталитически гидрируют в уксусной кислоте, в результате чего получают названное соединение 30. Масс-спектральным анализом с ионизацией электронным ударом величину отношения массы к заряду иона находят равной 401, расчетом получают 401.
Пример 40. Синтез 7-метил-4-метил-4-азахолест-5-ен-3-она (31).
Секокислоту 28 обрабатывают аналогичным образом, как и в случае примера 7, в результате чего получают чистое названное соединение 31. Масс-спектральным анализом величину отношения массы к заряду иона с бомбардировкой быстрыми атомами находят равной 414 (М+1); расчетом получают 413.
Пример 41. Синтез 7β-метил-4-метил-4-аза- -5α-холестан-3-она (32).
Следуя аналогичной общей методике, описанной в примере 8, соединение 31 каталитически гидрируют, в результате чего получают название соединение 32. Хроматографией на силикагеле с элюированием 30%-ным раствором этилацетата в гексане получают чистый продукт. Масс-спектральным анализом (ионизация электронным ударом) величину отношения массы к заряду находят равной 415; расчетом получают 415.
Пример 42. Синтез 4-метил-4-азахолест-5-ен-3,7-диона (34).
Проводят окисление 4-метил-4-азахолест-5-ен-3-она 33, в результате чего получают названное соединение 34 (патент США N 3264301, выданный Дуренбусу (Doorenboos) и статью в журнале J. Org. Chem. 1961, v. 26, p. 4548). Соединение 33 нагревают при 70oC со смесью, состоящей из пиридиниевого бихромата и трет-бутилгидропероксида в бензоле на протяжении 3-4 ч, в результате чего получают соединение 34.
Пример 43. Синтез 7β-ацетокси-4-метил-4-аза -5α-холестан-3-она (37).
Соединение 34 гидрируют по аналогичной методике примера 8, в результате чего получают 7-H-аналог 35 и 7β-оловое соединение 36. Ацилированием соединения 36 с уксусным ангидридом в присутствии пиридина, 4-диметиламинопиридина в хлористом метилене при 23oC в течение 24 ч получают названное соединение 37.
Пример 44. Синтез 7β-метил-4-аза-5α-холест-1-ен-3-она (49).
К раствору, состоящему из 280 мг (0,698 ммоль) соединения 30, находящегося в 4 мл толуола, добавляют 178,8 мг 2,3-дихлор-5,6-дициан-n-бензохинона, 0,7186 мг бис-триметилсилилтрифторацетамида и 8,163 мг трифторуксусной кислоты, и реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Добавляют 8,1 мг метилацетоацетата, и реакционную смесь нагревают в сосуде с обратным холодильником в течение 24 ч. Содержимое охлаждают, разбавляют этилацетатом, промывают водным раствором карбоната натрия, раствором бисульфита натрия, солевым раствором, сушат над сульфатом магния и концентрируют до получения маслянистого вещества. Сырое соединение очищают препаративной тонкослойной хроматографией на силикагеле, элюируют смесью CHCl3 с ацетоном, взятыми в соотношении 3:1, в результате чего получают чистое соединение 49, в случае которого данные протонного магнитного резонанса подтверждают правильность предполагаемой структуры.
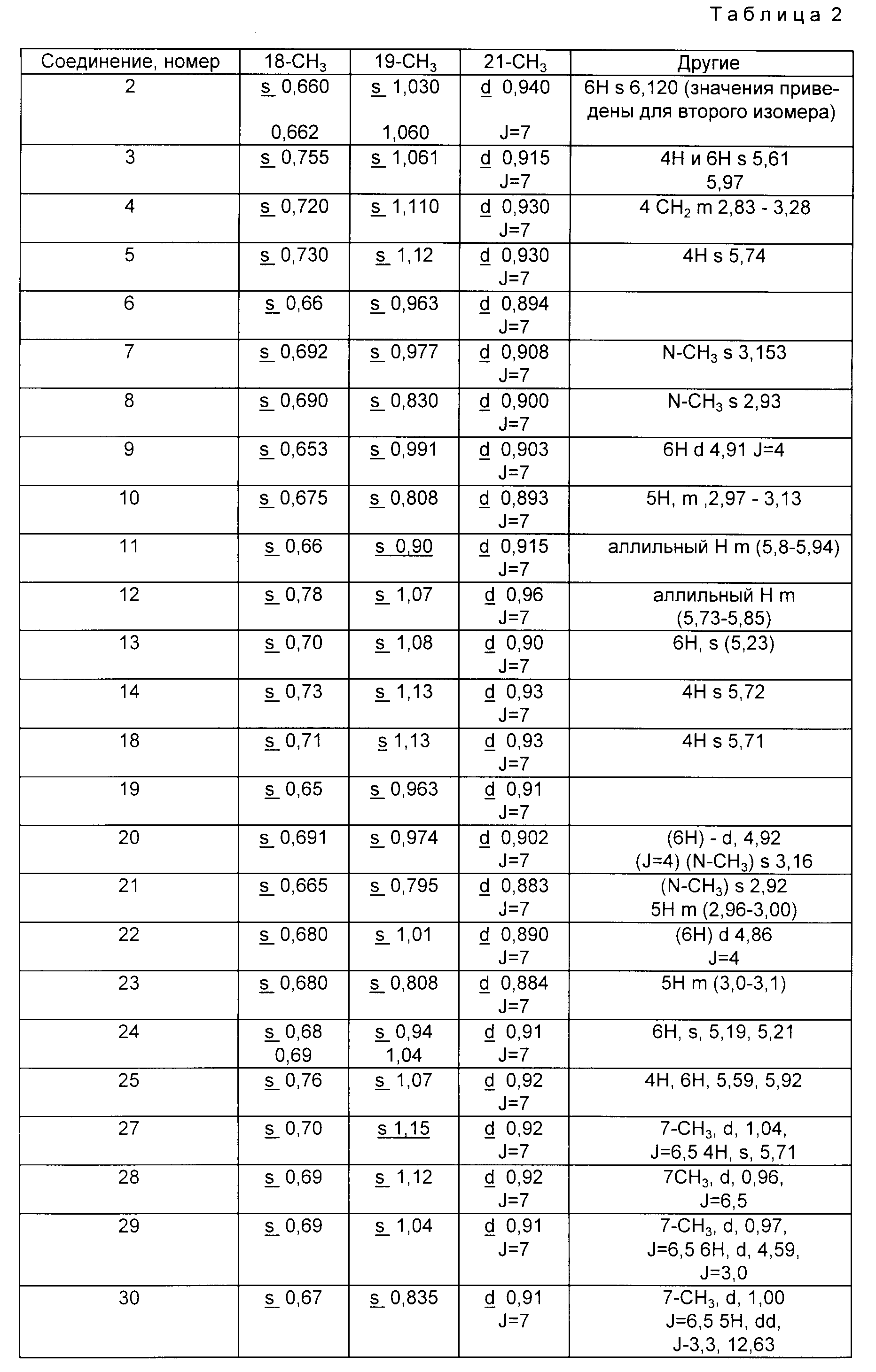
В табл. 2 приведены специфические значения протонного ядерного магнитного резонанса (400 МГц, в CDCl3), отвечающие каждому соединению. Данные приводятся со следующими сокращениями: s - синглет, d - дублет, m - мультиплет, J - постоянная связи. Абсорбционные величины приводят в единицах дельта (Δ) и иллюстрируются для C-18, C-19 и C-21 угловыми кольцевыми метильными протонами и протонами, связанными со специфическими протонами молекулы.
Нумерация, принятая для 4-аза-стероида, приведена на следующей схеме:
Реферат
Описывается новый способ получения 7β-замещенных 4-аза-5α-андростан-3-онов и родственных соединений, которые являются ингибиторами 5α-редуктазы, состоящий в восстановлении соответствующего андростенона литием и жидким аммиаком, контактировании продукта с изомеризующим агентом, окислении продукта до секокислоты и взаимодействии этой секокислоты с амином с циклизацией и образованием 5-аза-5α-андростан-3-онов. 2 с. и 3 з.п.ф-лы, 2 табл.
Формула

где Alk - C1-C2 -алкил;
A - гидрокси-, защищенная гидроксигруппа, C1 - C10-алкил, необязательно замещенный защищенной гидроксигруппой,
отличающийся тем, что проводят стадии
а) контактирования соединения общей формулы IV

где Alk и A имеют указанные значения,
с восстановительной системой, включающей металлический литий и жидкий аммиак, в инертном органическом растворителе при температуре в интервале (-45) - (-78)oC в течение времени, достаточного для стереоселективного получения 7β -соединения общей формулы V

где Alk и A имеют указанные значения,
б) контактирования полученного соединения Y с агентом изомеризации двойной связи в инертном органическом растворителе при температуре (40 - 65)oC, при этом радикал A имеет защищенные гидроксигруппы, в течение времени, достаточного для образования изомеризованного соединения общей формулы VI
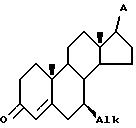
где Alk и A имеют указанные значения
с) контактирования соединения VI с окислителем в инертном органическом растворителе при температуре (23 - 80)oC в течение времени, достаточного для образования секокислоты общей формулы VII
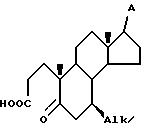
где Alk и A имеют указанные значения,
d) контактирования полученной секокислоты VII с амином формулы R - NH2, где R представляет собой H, C1 - C4-алкил, бензил или аллил, при температуре (100 - 200)oC в инертном растворителе, при этом радикал A имеет защищенные гидроксигруппы, с образованием 4-аза-стероида общей формулы VIII
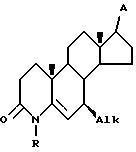
где Alk, A и R имеют указанные значения,
e) контактирования соединения VIII с платиновым катализатором в инертном органическом растворителе при комнатной температуре, при этом радикал A имеет защищенные гидроксигруппы, в течение времени, достаточного для образования целевого соединения IX.
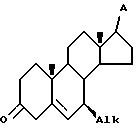
где Alk - C1-C2-алкил;
A - гидрокси-, защищенная гидроксигруппа, C1 - C10 -алкил, необязательно замещенный защищенной гидроксигруппой,
отличающийся тем, что проводят контактирование соединения общей формулы IV
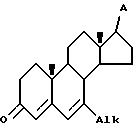
где Alk и A имеют указанные значения,
с восстановительной системой, включающей металлический литий и жидкий аммиак, в инертном органическом растворителе при температуре (-45) - (-78)oC в течение времени, достаточного для стереоселективного образования целевого продукта V.

Комментарии