Замещенные феноксиуксусные кислоты, обладающие модулирующей активностью в отношении рецепторов crth2 - RU2372330C2
Код документа: RU2372330C2
Описание
Настоящее изобретение относится к замещенным феноксиуксусным кислотам как полезным фармацевтическим соединениям для лечения респираторных расстройств, фармацевтическим композициям, содержащим их, и способам их получения.
В ЕРА 1170594 раскрыты способы идентификации соединений, полезных для лечения болезненных состояний, опосредованных простагландином D2, лигандом одиночного (orphan) рецептора CRTH2. В GB 1356834 раскрыт ряд соединений, которые обладают противовоспалительной, аналгезирующей и жаропонижающей активностью. Было обнаружено, что некоторые феноксиуксусные кислоты активны в отношении рецептора CRTH2, и, как следствие, ожидается, что они будут потенциально полезны для лечения различных респираторных заболеваний, включая астму и ХОЗЛ (хроническое обструктивное заболевание легких).
Поэтому в первом аспекте согласно изобретению предложено соединение формулы (I) или его фармацевтически приемлемая соль:
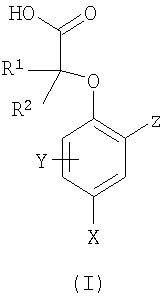
в котором:
Х представляет собой галоген, циано, нитро или С1-4алкил, который замещен одним или более чем одним атомом галогена;
Y выбран из водорода, галогена или C1-С6алкила;
Z представляет собой фенил, нафтил или кольцо А, где А представляет собой шестичленное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, или может представлять собой 6,6- или 6,5-конденсированный бицикл, содержащий один атом О, N или S, или может представлять собой 6,5-конденсированный бицикл, содержащий два атома О, причем фенил, нафтил или кольца А все, возможно, замещены одним или более чем одним заместителем, независимо выбранным из галогена, CN, ОН, нитро, COR9, CO2R6, SO2R9, OR9, SR9,
SO2NR10R11, CONR10R11, NR10R11, NHSO2R9, NR9SO2R9, NR6CO2R6, NR9COR9, NR6CONR4R5, NR6SO2NR4R5, фенила или C1-6алкила, причем последняя группа, возможно, замещена одним или более чем одним заместителем, независимо выбранным из галогена;
R1 и R2 независимо представляют собой атом водорода или C1-6алкильную группу;
R4 и R5 независимо представляют собой водород, С3-С7циклоалкил или С1-6алкил;
R6 представляет собой атом водорода или C1-С6алкил;
R8 представляет собой С1-4алкил;
R9 представляет собой С1-6алкил, возможно, замещенный одним или более чем одним заместителем, независимо выбранным из галогена или фенила;
R10 и R11 независимо представляют собой фенил, 5-членное ароматическое кольцо, содержащее два гетероатома, выбранных из N или S, водород, С3-С7циклоалкил или C1-6алкил, причем последние две группы, возможно, замещены одним или более чем одним заместителем, независимо выбранным из галогена или фенила;
или
R10 и R11 вместе с атомом азота, к которому они присоединены, могут образовывать 3-8-членное насыщенное гетероциклическое кольцо, возможно, содержащее один или более чем один атом, выбранный из О, S(O)n (где n=0, 1 или 2), NR8,
при условии что соединение не представляет собой следующие соединения:






Предпочтительно в соединении формулы (I) X представляет собой трифторметил, нитро, циано или галоген.
Y в соединении формулы (I) может представлять собой водород, галоген или С1-3алкил.
В соединении формулы (I) Z может представлять собой фенил, пиридинил, пиримидил, нафтил, хинолил, бензо[b]тиенил или бензофуранил, каждый, возможно замещенный заместителями, как определено выше.
Предпочтительно Z представляет собой фенил, возможно, замещенный заместителями, как определено выше.
В соединении формулы (I) и R1, и R2 могут представлять собой водород, или один может представлять собой водород, а другой может представлять собой метил или этил, или оба могут представлять собой метил.
Предпочтительно соединение формулы (I) выбрано из:
{[5-хлор-4'-(этилтио)бифенил-2-ил]окси}уксусной кислоты,
{[5-хлор-4'-(этилсульфонил)бифенил-2-ил]окси}уксусной кислоты,
[(4',5-дихлорбифенил-2-ил)окси]уксусной кислоты,
[(5-хлор-4'-цианобифенил-2-ил)окси]уксусной кислоты,
[(5-хлор-4'-метоксибифенил-2-ил)окси]уксусной кислоты,
(4-хлор-2-хинолин-8-илфенокси)уксусной кислоты,
[(5-хлор-3',4'-диметоксибифенил-2-ил)окси]уксусной кислоты,
2'-(карбоксиметокси)-5'-хлорбифенил-4-карбоновой кислоты,
{[5-хлор-4'-(метилсульфонил)бифенил-2-ил]окси}уксусной кислоты,
{[5-хлор-4'-(этилсульфонил)-2'-метилбифенил-2-ил]окси}уксусной кислоты,
{[4'-(метилтио)-5-(трифторметил)бифенил-2-ил]окси}уксусной кислоты,
{[4'-(метилсульфонил)-5-(трифторметил)бифенил-2-ил]окси}уксусной кислоты,
{[4'-(этилсульфонил)-2'-метил-5-(трифторметил)бифенил-2-ил]окси}уксусной кислоты,
(4-хлор-2-пиримидин-5-илфенокси)уксусной кислоты,
{2-[5-(аминосульфонил)пиридин-2-ил]-4-хлорфенокси}уксусной кислоты,
трифторацетата [2-(2-аминопиримидин-5-ил)-4-хлорфенокси]уксусной кислоты,
[4-хлор-2-(4-метил-2-морфолин-4-илпиримидин-5-ил)фенокси]уксусной кислоты,
{4-хлор-2-[2-(диметиламино)пиримидин-5-ил]фенокси}уксусной кислоты,
[4-хлор-2-(2-морфолин-4-илпиримидин-5-ил)фенокси]уксусной кислоты,
{4-хлор-2-[2-(метиламино)пиримидин-5-ил]фенокси}уксусной кислоты,
{2-[2-(бензиламино)пиримидин-5-ил]-4-хлорфенокси}уксусной кислоты,
[4-хлор-2-(2-пиперидин-1-илпиримидин-5-ил)фенокси]уксусной кислоты,
(4-хлор-2-{2-[метил(метилсульфонил)амино]пиримидин-5-ил}фенокси)уксусной кислоты,
[[2',5-дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-хлор-4'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-хлор-4'-(этилсульфонил)-2'-фтор[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(этилсульфонил)-2'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-хлор-4'-(этилсульфонил)-2'-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
2-[[5-хлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]-пропановой кислоты,
2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2R)-пропановой кислоты,
2-[[2',5-дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-хлор-4'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-2-метил-пропановой кислоты,
2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-бутановой кислоты,
[4-хлор-2-[2-[(метилсульфонил)(фенилметил)амино]-5-пиримидинил]фенокси]-уксусной кислоты,
[4-хлор-2-[2-[(этилсульфонил)(фенилметил)амино]-5-пиримидинил]фенокси]-уксусной кислоты,
[2-[2-[ацетил(фенилметил)амино]-5-пиримидинил]-4-хлорфенокси]-уксусной кислоты,
[[4'-(этилсульфонил)-5-фтор-2'-метил[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(этилсульфонил)-4,5-дифтор-2'-метил[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(этилсульфонил)-3,5-дифтор-2'-метил[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(2-амино-5-метил-3-пиридинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-амино-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-амино-2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-хлор-4'-гидрокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(2,4-диметокси-5-пиримидинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',5-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-фтор-2'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-циано-2'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-хлор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',5'-диметил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-хлор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-фтор-6'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-фтор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(этиламино)карбонил]амино]-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-метил-4'-[[(метиламино)карбонил]амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(циклопропиламино)карбонил]амино]-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-метил-4'-[[(гиропиламино)карбонил]амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',4'-диметил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-фтор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(аминокарбонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-фтор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',5'-дифтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-(аминосульфонил)-2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-циано-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-хлор-2'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',5'-дифтор-4'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-фтор-5'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-фтор-4'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-метокси-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(аминосульфонил)-2',5'-дифтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-бензо[b]тиен-3-ил-4-(трифторметил)фенокси]-уксусной кислоты,
[2-(2-бензофуранил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-(1-метилэтил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3',4'-дифтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(1,3-бензодиоксол-5-ил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-этил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-фтор-5-(трифторметил)[1,1':4',1''-терфенил]-2-ил]окси]-уксусной кислоты,
[[4'-(трифторметокси)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',3'-дихлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(1,1-диметилэтил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(6-метокси-2-нафталинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-(этилтио)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-ацетил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(2-хлор-5-метил-4-пиридинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[5'-(аминосульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(8-хинолинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[3'-циано-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-[4-метил-6-[метил(метилсульфонил)амино]-3-пиридинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[[2'-метил-5'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
3-метилового эфира 2'-(карбоксиметокси)-5'-(трифторметил)-[1,1'-бифенил]-3-карбоновой кислоты,
2-метилового эфира 2'-(карбоксиметокси)-5'-(трифторметил)-[1,1'-бифенил]-2-карбоновой кислоты,
[[5-(трифторметил)[1,1':4',1''-терфенил]-2-ил]окси]-уксусной кислоты,
[[3'-фтор-2',4'-диметил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-нитро-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-хлор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-(трифторметил)[1,1':3',1''-терфенил]-2-ил]окси]-уксусной кислоты,
4-метилового эфира 2'-(карбоксиметокси)-5'-(трифторметил)-[1,1'-бифенил]-4-карбоновой кислоты,
[[4'-нитро-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-(трифторметил)-3'-[(трифторметил)тио][1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-(трифторметил)-4'-[(трифторметил)тио][1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(3-пиридинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[2'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-пропокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-пропокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
(2-(2-амино-4-метил-5-пиримидинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-циано-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4',5-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(2-нафталинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-(1-пирролидинилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(диметиламино)сульфонил]-5-(трифторметил)(1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(фенилметил)амино]сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(2,2,2-трифторэтил)амино]сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(5-метил-2-тиазолил)амино]сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(фениламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(диэтиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(циклопропиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(аминосульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(метиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(4-метил-1-пиперазинил)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-[4-метил-2-(5-метил-1,1-диоксидо-1,2,5-тиадиазолидин-2-ил)-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[4-метил-2-[метил(метилсульфонил)амино]-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
аммониевой соли [2-[2-(1,1-диоксидо-2-изотиазолидинил)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[2-(3-гидрокси-1-азетидинил)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[4-метил-2-(4-метил-1-пиперазинил)-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[4-метил-2-(1-пирролидинил)-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[2-(диметиламино)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[5-метил-2-[метил(метилсульфонил)амино]-4-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[2-[[(диметиламино)сульфонил]амино]-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[[2'-хлор-4'-[(метоксикарбонил)амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
2-[[2'-хлор-4'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[3'-циано-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[4'-[(диметиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-хлор-4'-[(диметиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-фтор-4'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[2',5-дихлор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[5-хлор-4'-[(диметиламино)сульфонил][1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[2',5-дихлор-4'-[(диметиламино)сульфонил][1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[(5-хлор-3'-циано[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[5-хлор-4'-[(диметиламино)сульфонил]-2'-фтор[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[5-хлор-4'-(4-морфолинилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[5-хлор-2'-фтор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[4'-(1-азетидинилсульфонил)-5-хлор[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[5-хлор-2'-метил-4'-(1-пирролидинилкарбонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[(2',4'-дихлор-5-циано[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[5-циано-2'-фтор-4'-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
натриевой соли 2-[(3'-циано-5-фтор[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
натриевой соли 2-[(2',4'-дихлор-5-фтор[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-хлор-5-фтор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-хлор-5-фтор-5'-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[4'-(этилсульфонил)-6-метил-5-нитро[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-хлор-4'-(этилсульфонил)-6-метил[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(метилсульфонил)-2',5-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
2-[4-хлор-2-[4-метил-6-[метил(метилсульфонил)амино]-3-пиридинил]фенокси]-(2S)-пропановой кислоты,
2-[2-[4-метил-2-[(метилсульфонил)амино]-5-пиримидинил]-4-(трифторметил)фенокси]-(2S)-пропановой кислоты,
[(5-хлор-3'-циано[1,1'-бифенил]-2-ил)окси]-уксусной кислоты
и их фармацевтически приемлемых солей.
Соединение формулы (I) можно использовать при производстве лекарства, обладающего модулирующей активностью в отношении рецепторов CRTh2.
Согласно настоящему изобретению также предложен способ модулирования активности рецепторов CRTh2, включающий введение пациенту терапевтически эффективного количества соединения формулы (I) или фармацевтически приемлемой соли.
Бициклическое кольцо может быть связано посредством атома углерода или азота и может быть присоединено посредством 5- или 6-членного кольца и может быть полностью или частично насыщенным.
Примеры включают пиридин, пиримидин, тиазол, пиразол, имидазол, изотиазол, нафтил, хинолин, изохинолин, индол, индолизин, бензо[b]фуран, бензо[b]тиофен, 4Н-хинолизин.
В контексте настоящего описания, если не оговорено особо, алкильная или алкенильная группа или алкильная или алкенильная группировка в замещающей группе может быть прямой или разветвленной.
Предпочтительные соединения по изобретению включают соединения, приводимые здесь в качестве примеров, и в форме свободных оснований, а также их фармацевтически приемлемых солей.
Некоторые соединения формулы (I) способны существовать в стереоизомерных формах. Следует понимать, что изобретение включает все геометрические и оптические изомеры соединений формулы (I) и их смеси, включая рацематы. Таутомеры и их смеси также составляют аспект настоящего изобретения.
Соединение формулы (I), упомянутое выше, может быть превращено в его фармацевтически приемлемую соль, предпочтительно соль присоединения оснований, такую как натриевая, калиевая, кальциевая, алюминиевая, литиевая, магниевая, цинковая, с бензатином, хлорпрокаином, холином, диэтаноламином, этаноламином, этилдиамином, меглумином, трометамином или прокаином, или соль присоединения кислот, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат или пара-толуолсульфонат.
Специалистам в данной области техники будет понятно, что в способах по настоящему изобретению некоторым функциональным группам в исходных реагентах и промежуточном соединении может быть необходима защита при помощи защитных групп. Таким образом, получение соединения формулы (I) может включать на соответствующей стадии удаление одной или более чем одной защитной группы. Защита и удаление защиты с функциональных групп полностью описаны в "Protective Groups in Organic Chemistry", под редакцией J. W. F. McOmie, Plenum Press (1973) и "Protective Groups in Organic Synthesis", 3rdedition, T.W. Greene & P.G.M. Wuts, Wiley-lnterscience (1999).
Соединения формулы (I) могут быть получены путем взаимодействия соединения формулы (II):

в котором X, Y и Z являются такими, как определено в формуле (I), или являются их защищенными производными, с соединением формулы (III):

где R1 и R2 являются такими, как определено в формуле (I), или являются их защищенными производными, R12 представляет собой Н или С1-С10алкильную группу, и L представляет собой уходящую группу, и, возможно, после этого в любом порядке:
- удаления любой защитной группы,
- гидролиза эфирной группы R12 до соответствующей кислоты,
- окисления сульфидов до сульфоксидов или сульфонов,
- образования фармацевтически приемлемой соли.
Эта реакция может быть проведена в подходящем растворителе, таком как DMF, при использовании основания, такого как карбонат калия или тому подобное. Подходящие группы R12 включают С1-6алкильные группы, такие как метил, этил или mpem-бутил. Подходящая L представляет собой уходящую группу, такую как галогено, в частности хлор или бром. L может также представлять собой гидрокси, так что реакция Мицунобу может быть проведена с соединением (II) при использовании, например, трифенилфосфина и диэтилазодикарбоксилата.
Гидролиз эфирной группы R12 может быть проведен при использовании стандартных методик, например обработки метиловых и этиловых эфиров водным гидроксидом натрия и обработки трет-бутиловых эфиров кислотами, такими как трифторуксусная кислота.
Соединения формулы (II) могут быть получены путем взаимодействия соединения формулы (IV) с соединением формулы (V) посредством реакции сочетания Сузуки с последующим удалением защиты с группы R13, когда R13 не является Н:


в котором X, Y и Z являются такими, как определено в формуле (I), или являются их защищенными производными, R13 представляет собой Н или подходящую защитную группу, например бензил, L1 представляет собой иодид, бромид, хлорид или трифлат, а R14 и R15 представляют собой Н или C1-С6алкильные группы или R14 и R15 вместе могут образовывать 5- или 6-членное кольцо, возможно, замещенное одним или более чем одним C1-С3алкилом.
Эта реакция может быть проведена в подходящем растворителе, таком как диоксан, при использовании палладиевого катализатора, такого как [1,1-бис(дифенилфосфино)ферроцен]дихлорпалладий, и основания, такого как фторид цезия, предпочтительно при повышенных температурах.
Соединения формулы (IV) могут быть получены из соединения формулы (VI) посредством образования металлоорганического соединения (VII) с последующим взаимодействием с боратным эфиром, как изображено в схеме 1:

в которой X, Y являются такими, как определено в формуле (I), или являются их защищенными производными, R13 является таким, как определено в формуле (IV), Е представляет собой водород или галоген, а М представляет собой металл, такой как Na или Li. Например, когда R13 представляет собой бензил, а Е представляет собой бром, бутиллитий может быть использован для образования промежуточного соединения (VII), где М=Li. Реакцию проводят при -78°С в диэтиловом эфире, затем гасят боратным эфиром, таким как триметилборат.
Соединения формулы (IV) также могут быть получены посредством катализируемого палладием сочетания соединений формулы (VIII),

в которой X, Y и R13 являются такими, как определено выше, a G представляет собой галоген или трифлат, с подходящим эфиром бороновой кислоты, например (IX) или (X).
Соединения формулы (II) также могут быть получены посредством взаимодействия соединения формулы (XI) с соединением формулы (XII) при использовании методики сочетания Сузуки:

в которой X, Y, Z, R13, L1, R14 и R15 являются такими, как определено выше, а соединения формулы (XI) и (XII) могут быть получены при использовании той же методики, которая упомянута выше.
Соединения формулы (II), где Z = гетероарил, также могут быть получены посредством синтеза кольца, например соединение формулы (XIII) может быть образовано посредством взаимодействия соединения формулы (XIV) с соединением формулы (XV).
X, Y и R13 являются такими, как определено выше, а R16 является таким, как определено для заместителя по Z, который определен в формуле (I), или являются их защищенными производными. Реакция может быть проведена в растворителе, таком как этанол, с обратным холодильником и может быть использовано основание, такое как этоксид натрия, если соединение формулы (XV) является солью.

Когда R16 представляет собой S-алкильную группу, может быть проведено дальнейшее превращение посредством окисления до сульфоксида или сульфона при использовании окислителя, такого как mcpba в DCM, при комнатной температуре. Затем можно провести замещение при помощи соответствующего нуклеофила, как определено для Z в формуле (I).
Схема 2:

Последовательность вышеупомянутых стадий может быть изменена, например соединение формулы (XVI) может быть образовано посредством взаимодействия соединения формулы (XVII) с соединением формулы (XII) при использовании сочетания Сузуки.

Соединения формулы (I) могут также быть получены посредством взаимодействия соединения формулы (XVIII), в которой X, Y, R1, R2, R12, R14 и R15 являются такими, как определено выше, с соединением формулы (V) при использовании метода сочетания Сузуки, как определено выше.
Соединение формулы (XVIII) может быть получено способом А или Б.

Кислоту сначала превращали в хлорангидрид кислоты при использовании, например, оксалилхлорида в DCM при комнатной температуре, затем подвергали взаимодействию с 3-метил-3-оксетанметанолом в присутствии основания, такого как триэтиламин, получая эфир. Оксетановый эфир преобразовывали в ОВО эфир при использовании диэтилэфирата трифторида бора в DCM при температуре от -78°С до комнатной температуры. Депротонирование при помощи основания, такого как втор-бутиллитий, при низкой температуре с последующим гашением реакции триметилборатом давало защищенную дикислоту, с которой затем удаляли защиту при использовании HCl, затем гидроксида натрия.

Соединение формулы (IV), где R13=Bn (бензил), a R14 и R15=Н, и пинакон можно перемешивать при комнатной температуре в подходящем растворителе, таком как диэтиловый эфир, получая боронатный эфир. Бензильную группу можно удалить посредством гидрирования при комнатной температуре при использовании палладия на углероде в качестве катализатора, затем алкилировать соединением формулы (III) при использовании основания или в условиях реакции Мицунобу. Обработка кислотой, такой как HCl или трифторуксусная кислота, удаляет затем защитные группы.
Соединения формулы (I) обладают активностью как фармацевтические препараты, в частности как модуляторы активности рецепторов CRTh2, и их можно применять в лечении (терапевтическом или профилактическом) состояний/заболеваний у человека и животных, не являющихся человеком, которые обостряются избыточной или неконтролируемой выработкой PGD2 (простагландина D2) и его метаболитов или вызваны ею. Примеры таких состояний/заболеваний включают:
1) (дыхательные пути) обструктивные заболевания дыхательных путей, включая: астму (такую как бронхиальная, аллергическая, эндогенная, экзогенная или пылевая астма, в частности хроническая или застарелая астма (например, поздняя астма или гиперчувствительность дыхательных путей)); хроническое обструктивное заболевание легких (ХОЗЛ) (такое как необратимое ХОЗЛ); бронхит (включая эозинофильный бронхит); острый, аллергический, атрофический ринит или хронический ринит (такой как хронический ринит с образованием казеозных масс, гипертрофический ринит, гнойный ринит, сухой ринит), медикаментозный ринит; пленчатый ринит (включая крупозный, фибринозный и псевдомембранный ринит), скрофулезный ринит, круглогодичный аллергический ринит, сезонный ринит (включая нервный ринит (сенную лихорадку) и вазомоторный ринит); назальный полипоз; саркоидоз; "легкие фермера" и родственные заболевания; пневмофиброз; идиопатическую интерстициальную пневмонию; муковисцидоз; противокашлевую активность; лечение хронического кашля, ассоциированного с воспалением или ятрогенно вызванного;
2) (кости и суставы) артриты, включая ревматические, инфекционные, аутоиммунные, серонегативные, спондилоартропатии (такие как анкилозирующий спондилоартрит, псориатический артрит или болезнь Рейтера), болезнь Бехчета, синдром Шегрена или системный склероз;
3) (кожа и глаза) псориаз, атопический дерматит, контактный дерматит, другие экзематозные дерматиты, себорейный дерматит, красный плоский лишай, пузырчатка, буллезная пузырчатка, врожденный буллезный эпидермолиз, крапивница, ангиодермит, васкулиты, эритемы, кожные эозинофилии, хронические язвы кожи, увеит, гнездная алопеция, язва роговицы и весенний конъюнктивит;
4) (желудочно-кишечный тракт) заболевание брюшной полости, проктит, эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, неспецифический язвенный колит, синдром повышенной раздражимости кишечника; пищевые аллергии, которые оказывают действие, не относящееся к кишечнику (такие как мигрень, ринит и экзема);
5) (центральная и периферическая нервная система) нейродегенеративные заболевания и деменционные расстройства (такие как болезнь Альцгеймера, боковой амиотрофический склероз и другие заболевания двигательных нейронов, болезнь Крейтцфельда-Якоба и другие прионные заболевания, ВИЧ-энцефалопатия (комплекс СПИД-деменция), болезнь Хантингтона, лобно-височная деменция, деменция, ассоциированная с тельцами Леви, и мультиинфарктная деменция), полиневропатии (такие как синдром Гийена-Барре, хроническая воспалительная демиелинизирующая полирадикулоневропатия, мультифокальная моторная невропатия), плексопатии, демиелинизация ЦНС (такая как рассеянный склероз, острый рассеянный/геморрагический энцефаломиелит и подострый склерозирующий лейкоэнцефалит), нервно-мышечные расстройства (такие как злокачественная миастения и синдром Ламберта-Итона), спинальные расстройства (такие как тропический спастический парапарез и синдром тугоподвижного человека), паранеопластические синдромы (такие как мозжечковая дегенерация и энцефаломиелит), травма ЦНС, мигрень и удар.
6) (другие ткани и системные заболевания) атеросклероз, синдром приобретенного иммунодефицита (СПИД), красная волчанка; системная красная волчанка; тиреоидит Хашимото, диабет I типа, нефротический синдром, эозинофильный фасцит, синдром гипериммуноглобулина Е [IgE], лепроматозная лепра, идиопатическая тромбоцитопеническая пурпура; послеоперационные спайки, сепсис и ишемическое/реперфузионное повреждение в сердце, головном мозге, периферических сосудах конечностей, гепатит (алкогольный, стеатогепатит и хронический вирусный), гломерулонефрит, почечная недостаточность, хроническая почечная недостаточность и других органов;
7) (отторжение аллотрансплантата) острые или хронические последствия, например трансплантации почки, сердца, печени, легкого, костного мозга, кожи и роговицы; и хроническая реакция "трансплантат против хозяина";
8) заболевания, ассоциированные с повышенными уровнями PGD2 или его метаболитов.
1) (дыхательные пути) обструктивные заболевания дыхательных путей, включая: астму, включая бронхиальную, аллергическую, эндогенную, экзогенную, вызванную нагрузкой, лекарственную (включая аспириновую и вызванную НПВС (нестероидными противовоспалительными средствами)) и пылевую астму, как интермиттирующую, так и стойкую, и всех степеней тяжести, и другие причины гиперчувствительности дыхательных путей; хроническое обструктивное заболевание легких (ХОЗЛ); бронхит, включая инфекционный и эозинофильный бронхит; эмфизему; бронхоэктаз; муковисцидоз; саркоидоз; "легкие фермера" и родственные заболевания; гиперчувствительный пневмонит; фиброз легких, включая криптогенный фиброзирующий альвеолит, идиопатическую интерстициальную пневмонию, противоопухолевую терапию, осложненную фиброзом, и хроническую инфекцию, включая туберкулез и аспергиллез и другие грибковые инфекции; осложнения трансплантации легкого; сосудистые и тромботические расстройства сосудов легких и легочную гипертензию; противокашлевую активность, включая лечение хронического кашля, ассоциированного с воспалительными и секреторными состояниями дыхательных путей, и ятрогенный кашель; острый и хронический ринит, включая медикаментозный ринит и вазомоторный ринит; круглогодичный и сезонный аллергический ринит, включая нервный ринит (сенную лихорадку); назальный полипоз; острую вирусную инфекцию, включая насморк и инфекцию, вызванную респираторно-синцитиальным вирусом, грипп, коронавирус (включая SARS (тяжелый острый респираторный синдром)) и аденовирус;
2) (кости и суставы) поражения кожи ревматического или подагрического происхождения, ассоциированные или включающие остеоартрит/остеоартроз, как первичный, так и вторичный, вследствие, например, врожденной дисплазии бедра; шейный и поясничный спондилит и поясничная и шейная боль; ревматоидный артрит и болезнь Стилла; серонегативные спондилоартропатии, включая анкилозирующий спондилоартрит, псориатический артрит, реактивный артрит и недифференцируемая спондилоартропатия; септический артрит и другие инфекционные артропатии и костные расстройства, такие как туберкулез, включая болезнь Потта и полиартрит Понсе; острый и хронический синовит, вызванный отложением кристаллов, включая уратную подагру, заболевание, вызванное отложением пирофосфата кальция, и тендинит, бурсит и синовит, связанные с апатитом кальция; болезнь Бехчета; первичный и вторичный синдром Шегрена; системный склероз и ограниченная склеродермия; системная красная волчанка, смешанные заболевания соединительных тканей и недифференцируемое заболевание соединительных тканей; воспалительные миопатии, включая дерматомиозит и полимиозит; ревматическая полимиалгия; юношеский артрит, включая идиопатические воспалительные поражения кожи ревматического или подагрического происхождения любой суставной локализации и связанные синдромы, и ревматическая атака и ее системные осложнения; васкулиты, включая гигантоклеточный артериит, синдром Такаясу, синдром Чарга-Стросса, нодозный полиартериит, микроскопический полиартериит, и васкулиты, ассоциированные с вирусной инфекцией, реакциями гиперчувствительности, криоглобулинами и парапротеинами; поясничная боль; семейная средиземноморская лихорадка, синдром Макла-Велса и семейная ирландская лихорадка, болезнь Кикучи; лекарственные артралгии, тендиниты и миопатии;
3) (кожа) псориаз, атопический дерматит, контактный дерматит или другие экзематозные дерматиты и аллергические реакции замедленного типа; фито- и фотодерматиты; себорейный дерматит, герпетиформный дерматит, красный плоский лишай, склеротический атрофический лишай, гангренозная пиодермия, кожный саркоид, дискоидная красная волчанка, пузырчатка, пемфигоид, врожденный буллезный эпидермолиз, крапивница, ангионевротический отек, васкулиты, токсические эритемы, кожные эозинофилии, гнездная алопеция, мужское облысение, синдром Свита, болезнь Вебера-Крисчена, многоформная эритема; целлюлит, как инфекционный, так и неинфекционный; панникулит; кожные лимфомы, немеланомный рак кожи и другие диспластические поражения; расстройства, вызванные лекарствами, включая стойкую лекарственную сыпь.
4) (глаза) блефарит; конъюнктивит, включая круглогодичный и весенний аллергический конъюнктивит; ирит; передний и задний увеит; хориоидит; аутоиммунные, дегенеративные или воспалительные расстройства, воздействующие на сетчатку; офтальмию, включая симпатическую офтальмию; саркоидоз; инфекции, включая вирусные, грибковые и бактериальные;
5) (желудочно-кишечный тракт) глоссит, гингивит, периодонтит, эзофагит, включая рефлюкс; эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, колит, включая неспецифический язвенный колит, проктит, анальный зуд; заболевание брюшной полости, синдром повышенной раздражимости кишечника и пищевые аллергии, которые могут оказывать действие, не относящееся к кишечнику (например, мигрень, ринит и экзема);
6) (абдоминальные) гепатит, включая аутоиммунный, алкогольный и вирусный; фиброз и цирроз печени; холецистит; панкреатит, как острый, так и хронический;
7) (мочеполовые) нефрит, включая интерстициальный и гломерулонефрит; нефротический синдром; цистит, включая острый и хронический (интерстициальный) цистит и хроническую язву мочевого пузыря; острый и хронический уретрит, простатит, эпидидимит, оофорит и сальпингит; вульвовагинит; болезнь Пейрони; эректильная дисфункция (как мужская, так и женская);
8) (отторжение аллотрансплантата) острые и хронические последствия, например, трансплантации почки, сердца, печени, легкого, костного мозга, кожи или роговицы или последствия переливания крови; или хроническая реакция "трансплантат против хозяина".
9) (ЦНС) болезнь Альцгеймера и другие деменционные расстройства, включая CJD (болезнь Крейцфельда-Якоба) и ее новый вариант nvCJD; амилоидоз; рассеянный склероз и другие демиелинизирующие синдромы; церебральный атеросклероз и васкулит; височный артериит; злокачественная миастения; острая и хроническая боль (острая, интермиттирующая или стойкая либо центрального, либо периферического происхождения), включая висцеральную боль, головную боль, мигрень, тригеминальную невралгию, атипичную лицевую боль, боль в суставах и костях, боль, возникающая в результате рака и инвазии опухоли, невропатические болевые синдромы, включая диабетическую, постгерпетическую и связанную с ВИЧ невропатию; нейросаркоидоз; осложнения злокачественных, инфекционных или аутоиммунных процессов для центральной и периферической нервной системы;
10) другие аутоиммунные и аллергические расстройства, включая тиреоидит Хашимото, болезнь Грейвса, болезнь Аддисона, сахарный диабет, идиопатическая тромбоцитопеническая пурпура, эозинофильный фасцит, синдром гипериммуноглобулина Е [IgE], антифосфолипидный синдром.
11) другие расстройства с воспалительным или иммунологическим компонентом; включая синдром приобретенного иммунодефицита (СПИД), лепру, синдром Сезари и паранеопластические синдромы;
12) (сердечно-сосудистые) атеросклероз, воздействующий на венечное и периферическое кровообращение; перикардит; миокардит, воспалительные и аутоиммунные кардиомиопатии, включая миокардиальный саркоид; ишемические реперфузионные повреждения; эндокардит, вальвулит и аортит, включая инфекционный (например, сифилитический); васкулиты; поражения проксимальных и периферических вен, включая флебит и тромбоз, включая тромбоз глубоких вен и осложнения варикозного расширения вен;
13) (онкология) лечение распространенных раковых опухолей, включая опухоли простаты, молочной железы, легких, яичников, поджелудочной железы, кишечника и ободочной кишки, желудка, кожи и головного мозга и злокачественные образования, воздействующие на костный мозг (включая лейкозы) и лимфопролиферативные системы, такие как лимфома Ходжкина и не-Ходжкина; включая предупреждение и лечение метастазирующей опухоли и рецидивы опухолей, паранеопластические синдромы;
14) заболевания, ассоциированные с повышенными уровнями PGD2 или его метаболитов.
Для вышеупомянутых терапевтических применений вводимая доза, конечно, будет варьироваться в зависимости от используемого соединения, способа введения, требуемого лечения и указанного расстройства.
Соединение формулы (I) и фармацевтически приемлемые соли могут быть использованы отдельно, но обычно будут вводиться в форме фармацевтической композиции, в которой соединение формулы (I)/соль (активный ингредиент) находится совместно с фармацевтически приемлемым адъювантом, разбавителем или носителем. В зависимости от способа введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.% (массовых процента), более предпочтительно от 0,05 до 80 мас.%, еще более предпочтительно от 0,10 до 70 мас.% и еще более предпочтительно от 0,10 до 50 мас.% активного ингредиента, причем все массовые процентные концентрации рассчитаны исходя из общей массы композиции.
Фармацевтические композиции можно вводить местно (например, в легкое и/или дыхательные пути или на кожу) в форме растворов, суспензий, гептафторалкановых аэрозолей и сухих порошковых препаратов, или системно, например посредством перорального введения в форме таблеток, капсул, сиропов, порошков или гранул, или посредством парентерального введения в форме растворов или суспензий, или посредством подкожного введения, или посредством ректального введения в форме суппозиториев, или трансдермально. Предпочтительно соединение по изобретению вводят перорально.
Изобретение будет теперь проиллюстрировано при помощи следующих неограничивающих его примеров, в которых, если не оговорено особо:
I) когда даны, приводятся данные1Н ЯМР в виде значений дельта для главных определяющих протонов, выраженных в миллионных долях (млн-1) относительно тетраметилсилана (TMS), использованного в качестве внутреннего стандарта;
II) определение масс-спектров (MS): обычно указаны только ионы, которые показывают исходные массы, и если не оговорено особо, приведенные массы ионов являются массами положительных ионов - (М+Н)+;
III) соединения по примерам и способам, указанные в заголовках и подзаголовках, называли, используя программу ACD/name и ACD/name batch (версия 6.00) от Advanced Chemistry Development Inc, Канада;
IV) если не оговорено особо, ВЭЖХ с обращенной фазой проводили, используя колонку с диоксидом кремния с обращенной фазой "Symmetry", "NovaPak" или "Ex-Terra";
V) растворители сушили при помощи MgSO4 или Na2SO4;
VI) использованы следующие аббревиатуры:
Пример 1
{[5-Хлор-4'-(этилтио)бифенил-2-ил]окси}уксусная кислота

1) трет-Бутил-(2-бром-4-хлорфенокси)ацетат
трет-Бутил-бромацетат (2,6 мл) добавляли к перемешиваемой смеси 4-бром-2-хлорфенола (3 г) и карбоната калия (6,2 г) в DMF (40 мл) при комнатной температуре. Через 16 часов реакционную смесь распределяли между диэтиловым эфиром и водой, органический слой отделяли, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 4% EtOAc/изогексан. Выход 4,05 г.
1H ЯМР CDCl3: δ 7.55 (1Н, d); 7.21 (1Н, dd); 6.72 (1H, d); 4.57 (2H, s); 1.48 (9H, s).
2) трет-Бутил-{[5-хлор-4'-(этилтио)бифенил-2-ил]окси}ацетат
Смесь продукта со стадии (1) (2 г), 4-(этилтио)фенилбороновой кислоты (1,5 г), фторида цезия (2 г) и Pd(dppf)Cl2 (0,2 г) в диоксане (40 мл) нагревали с обратным холодильником в течение 3 часов. После охлаждения смесь распределяли между диэтиловым эфиром и водой. Органический слой отделяли, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 5% EtOAc/изогексан. Выход 0,92 г.
MS: APCI (химическая ионизация при атмосферном давлении) (положительный): 379/381 (М+1).
3) {[5-Хлор-4'-(этилтио)бифенил-2-ил]окси}уксусная кислота
Соединение, указанное в заголовке, получали посредством перемешивания смеси продукта со стадии (2) (0,3 г) и трифторуксусной кислоты (4 мл) в DCM (10 мл) при комнатной температуре в течение 5 часов. Растворитель выпаривали при пониженном давлении, остаток растирали с диэтиловым эфиром, затем очищали посредством ВЭЖХ с обращенной фазой. Выход 0,106 г.
1H ЯМР DMSO-d6 (DMSO - диметилсульфоксид): δ 13.07 (1Н, s); 7.54 (2H, d); 7.35-7.33 (4H, m); 7.02 (1Н, d); 4.74 (2H, s); 3.02 (2H, q); 1.27 (3H, t). MS: APCI (отрицательный): 321/3 (M-1).
Пример 2
{[5-Хлор-4'-(этилсульфонил)бифенил-2-ил]окси}уксусная кислота

1) трет-Бутил-{[5-хлор-4'-(этилсульфонил)бифенил-2-ил]окси}ацетат
Мсрbа (1,2 г) добавляли к перемешиваемому раствору продукта со стадии (2) примера 1 (0,6 г) в DCM (10 мл) при комнатной температуре. Через 4 часа смесь распределяли между DCM и водным раствором метабисульфита натрия, органический слой отделяли, промывали водным раствором гидрокарбоната натрия, водой, сушили и упаривали при пониженном давлении. Выход 0,65 г.
2) {[5-Хлор-4'-(этилсульфонил)бифенил-2-ил]окси}уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (1). Выход 0,226 г.
1H ЯМР DMSO-d6: δ 13.14 (1Н, s); 7.92 (2H, d); 7.87 (2H, d); 7.45-7.42 (2H, m); 7.10 (1Н, d); 4.79 (2H, s); 3.35 (2H, q); 1.15 (3H, t). MS: APCI (отрицательный): 353/5 (M-1).
Пример 3
[(4',5-Дихлорбифенил-2-ил)окси]уксусная кислота

1) трет-Бутил-[(4',5-дихлорбифенил-2-ил)окси]ацетат
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) примера 1 и 4-хлорфенилбороновой кислоты. Выход 0,63 г.
1H ЯМР CDCl3: δ 7.54-7.22 (6Н, m); 6.76 (1Н, dd); 4.48 (2H, s); 1.47 (9H, s).
2) [(4',5-Дихлорбифенил-2-ил)окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (1). Выход 0,224 г.
1H ЯМР DMSO-d6: δ 13.00 (1Н, s); 7.61 (2H, d); 7.48 (2H, d); 7.41-7.36 (2H, m); 7.05 (1H, d); 4.75 (2H, s).
MS: APCI (отрицательный): 295/7 (M-1).
Пример 4
[(5-Хлор-4'-цианобифенил-2-ил)окси]уксусная кислота

1) трет-Бутил-[(5-хлор-4'-цианобифенил-2-ил)окси]ацетат
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) примера 1 и 4-цианофенилбороновой кислоты. Выход 0,524 г.
1H ЯМР CDCl3: δ 7.70 (4Н, s); 7.32-7.26 (2H, m); 6.79 (1Н, d); 4.51 (2H, s); 1.48(9H, s).
2) [(5-Хлор-4'-цианобифенил-2-ил)окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (1). Выход 0,109 г.
1H ЯМР DMSO-d6: δ 13.14 (1Н, s); 7.90 (2H, d); 7.80 (2H, d); 7.45-7.41 (2H, m); 7.10 (1H, d); 4.78 (2H, s).
MS: APCI (отрицательный): 286/8 (M-1).
Пример 5
[(5-Хлор-4'-метоксибифенил-2-ил)окси]уксусная кислота

1) трет-Бутил-[(5-хлор-4'-метоксибифенил-2-ил)окси]ацетат
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) примера 1 и 4-метоксифенилбороновой кислоты. Выход 0,610 г.
1H ЯМР CDCl3: δ 7.54 (2Н, d); 7.31-7.18 (2Н, m); 6.96 (2H, d); 6.76 (1H, d); 4.46 (2Н, s); 3.84 (3H, s); 1.46 (9H, s).
2) [(5-Хлор-4'-метоксибифенил-2-ил)окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (1). Выход 0,119 г.
1H ЯМР DMSO-d6: δ 13.08 (1H, s); 7.53 (2Н, d); 7.32-7.29 (2Н, m); 7.01-6.96 (3H, m); 4.72 (2Н, s); 3.79 (3H, s).
MS: APCI (отрицательный): 291/3 (M-1).
Пример 6
(4-Хлор-2-хинолин-8-илфенокси)уксусная кислота, соль с трифторуксусной кислотой

1) трет-Бутил-(4-хлор-2-хинолин-8-илфенокси)ацетат
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) примера 1 и 8-хинолинбороновой кислоты. Выход 0,356 г.
1H ЯМР CDCl3: δ 8.90-8.88 (1H, m); 8.18 (1H, d); 7.85 (1H, d); 7.76 (1H, d); 7.60 (1H, t); 7.40-7.30 (3H, m); 6.87 (1H, d); 4.37 (2Н, s); 1.37 (9H, s).
2) (4-Хлор-2-хинолин-8-илфенокси)уксусная кислота, соль с трифторуксусной кислотой
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (1). Выход 0,25 г.
1H ЯМР DMSO-d6: δ 8.91-8.89 (1Н, m); 8.62 (1H, d); 8.12 (1H, d); 7.85-7.67 (3H, m); 7.46 (1H, dd); 7.38 (1H, d); 7.09 (1H, d); 4.61 (2H, s).
MS: APCI (отрицательный): 312/4 (M-1).
Пример 7
[(5-Хлор-3',4'-диметоксибифенил-2-ил)окси]уксусная кислота

1) трет-Бутил-[(5-хлор-3',4'-диметоксибифенил-2-ил)окси]ацетат
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) примера 1 и 3,4-диметоксифенилбороновой кислоты. Выход 0,86 г.
1H ЯМР CDCl3: δ 7.33-7.12 (4Н, m); 6.93 (1H, d); 6.79 (1H, d); 4.46 (2H, s); 3.93 (3H, s); 3.92 (3H, s); 1.46 (9H, s).
2) [(5-Хлор-3',4'-диметоксибифенил-2-ил)окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (1). Выход 0,32 г.
1H ЯМР DMSO-d6: δ 13.08 (1H, s); 7.36-7.27 (3H, m); 7.12-6.98 (3H, m); 4.74 (2H, s); 3.78 (6H, 2xs).
MS: APCI (отрицательный): 321/3 (M-1).
Пример 8
2'-(Карбоксиметокси)-5'-хлорбифенил-4-карбоновая кислота

Соединение, указанное в заголовке, получали способом стадии (2) и стадии (3) примера 1 при использовании продукта со стадии (1) примера 1 и 4-карбоксифенилбороновой кислоты. Выход 0,035 г.
1H ЯМР DMSO-d6: δ 7.98-7.38 (6H, m); 7.08-7.05 (1H, m); 4.75 (2H, s).
MS: APCI (отрицательный): 305 (M-1).
Пример 9
{[5-Хлор-4'-(метилсульфонил)бифенил-2-ил]окси}уксусная кислота

Соединение, указанное в заголовке, получали способом стадии (2) примера 1 и примера 2 при использовании продукта со стадии (1) примера 1 и 4-(метилтио)бензолбороновой кислоты. Выход 0,1 г.
1H ЯМР DMSO-d6: δ 7.97-7.08 (7Н, m); 4.78 (2H, s); 3.31 (3H, bs).
MS: APCI (отрицательный): 339 (M-1).
Пример 10
{[5-Хлор-4'-(этилсульфонил)-2'-метилбифенил-2-ил]окси}уксусная кислота

1)4-Бром-3-метилфенилэтилсульфид
Бром (2,2 мл) добавляли к раствору 1-(этилтио)-3-метилбензола (6,6 г) в уксусной кислоте (20 мл) при 0°С, смесь перемешивали при комнатной температуре в течение 2 часов, затем растворитель удаляли при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя DCM. Выход 6,6 г,
MS: APCI (положительный): 247/9 (М+1).
2) 2-[4-(Этилтио)-2-метилфенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолан
Смесь продукта со стадии (1) (6,6 г), 4,4,5,5-тетраметил-[1,3,2]-диоксаборолана (1,94 мл), триэтиламина (2,4 мл), ацетата палладия (0,06 г) и 2-(дициклогексилфосфино)бифенила (0,3 г) в диоксане (20 мл) нагревали при 85°С в течение 2 часов. Смесь гасили водным раствором хлорида аммония, экстрагировали диэтиловым эфиром, органический слой сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 50% изогексан/DCM. Выход 0,7 г.
1H ЯМР CDCl3: δ 7.66 (1Н, d); 7.08-7.05 (2Н, m); 2.94-2.92 (2Н, q); 2.5 (3Н, s); 1.43-1.27 (15H, m).
3) {[5-Хлор-4'-(этилсульфонил)-2'-метилбифенил-2-ил]окси}уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (2) примера 1 и примера 2 при использовании продукта со стадии (2) и продукта со стадии (1) примера 1. Выход 0,035 г.
1H ЯМР DMSO-d6: δ 7.79-6.99 (6Н, m); 4.67 (2Н, s); 3.35 (2Н, q); 2.23 (3Н, s); 1.15 (3H, t).
MS: APCl (отрицательный): 367 (M-1).
Пример 11 (Пример сравнения)
[(5-Цианобифенил-2-ил)окси]уксусная кислота
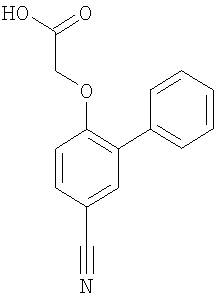
Соединение, указанное в заголовке, получали способом примера 1 при использовании 3-бром-4-гидроксибензонитрила и фенилбороновой кислоты. Выход 0,175 г.
1H ЯМР DMSO-d6: δ 13.18 (1Н, s); 7.81-7.17 (8H, m); 4.87 (2Н, s).
MS: APCl (отрицательный): 252 (M-1).
Пример 12 (Пример сравнения)
[(5-Нитробифенил-2-ил)окси]уксусная кислота

Соединение, указанное в заголовке, получали способом примера 1 при использовании 2-бром-4-нитрофенола и фенилбороновой кислоты. Выход 0,065 г.
1H ЯМР DMSO-d6: δ 13.26 (1Н, s); 8.23 (1Н, dd); 8.12 (1Н, d); 7.63 (2Н, d); 7.50-7.38 (3H, m); 7.25 (1Н, d); 4.94 (2Н, s).
MS: APCl (отрицательный): 272 (M-1).
Пример 13
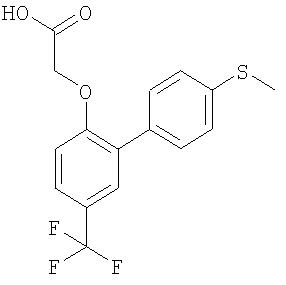
{[4'-(Метилтио)-5-(трифторметил)бифенил-2-ил]окси}уксусная кислота
1) 2-Иод-4-(трифторметил)фенол
Иодид натрия (3,32 мл), затем хлорамин Т (5,91 г) добавляли к перемешиваемому раствору 4-трифторметилфенола (3,0 г) в DMF (30 мл) при 0°С. Смесь нагревали до комнатной температуры, перемешивали в течение 1 часа, разбавляли разбавленной соляной кислотой, затем экстрагировали диэтиловым эфиром. Органический слой промывали водным раствором тиосульфата натрия, сушили и растворитель удаляли при пониженном давлении. Выход 5,25 г.
MS; APCl (отрицательный): 287 (M-1).
2) {[4'-(Метилтио)-5-(трифторметил)бифенил-2-ил]окси}уксусная кислота
Соединение, указанное в заголовке, получали способом примера 1 при использовании продукта со стадии (1) и 4-(метилтио)бензолбороновой кислоты. Выход 0,13 г.
1H ЯМР DMSO-d6: δ 13.16 (1Н, s); 7.68-7.18 (7H, m); 4.85 (2Н, s); 2.51 (3H, s).
MS: APCI (отрицательный): 341 (M-1).
Пример 14
Аммониевая соль {[4'-(метилсульфонил)-5-(трифторметил)бифенил-2-ил]окси}уксусной кислоты

Соединение, указанное в заголовке, получали способами примера 1 и 2 при использовании продукта со стадии (1) примера 13 и 4-(метилтио)бензолбороновой кислоты. Выход 0,14 г.
1H ЯМР DMSO-d6: δ 13.21 (1Н, s); 8.00-7.69 (6H, m); 7.27 (1H, d); 4.89 (2H, s); 3.27 (3Н, s).
MS: APCI (отрицательный): 373 (M-1).
Пример 15
{[4'-(Этилсульфонил)-2'-метил-5-(трифторметил)бифенил-2-ил]окси}уксусная кислота

Соединение, указанное в заголовке, получали способами примера 1 и 2 при использовании продукта со стадии (1) примера 13 и продукта со стадии (2) примера 10. Выход 0,055 г.
1H ЯМР DMSO-d6: δ 7.80-7.12 (6H, m); 4.63 (2H, s); 3.39-3.29 (2H, q); 2.23 (3H, s); 1.18-1.11 (3H,t).
MS: APCI (отрицательный): 401 (M-1).
Пример 16
Аммониевая соль (4-хлор-2-пиримидин-5-илфенокси)уксусной кислоты

1) Бензил-2-бром-4-хлорфениловый эфир
Бензилбромид (13,1 мл) добавляли к перемешиваемой смеси 2-бром-4-хлорфенола (20,7 г) и карбоната калия (27,6 г) в DMF (200 мл). Через 72 часа смесь распределяли между диэтиловым эфиром и водой, органический слой промывали водой, сушили и растворитель выпаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 2% EtOAc/изогексан. Выход 18,1 г.
1H ЯМР CDCl3: δ 7.55 (1Н, s); 7.46-7.18 (6Н, m); 6.84 (1Н, d); 5.14 (2H, s).
2) [2-(Бензилокси)-5-хлорфенил]бороновая кислота
Раствор бутиллития (1,6 М в гексане) (50 мл) по каплям добавляли к перемешиваемому раствору продукта со стадии (1) (23 г) в диэтиловом эфире (300 мл) при -70°С. Через 1 час дополнительно добавляли 18 мл бутиллития, оставляли на 0,75 часа, затем добавляли триметилборат (10 мл) и смесь нагревали до комнатной температуры и оставляли на 16 часов. Добавляли 2 М соляную кислоту (100 мл), перемешивали в течение 1 часа, затем органический слой отделяли и экстрагировали водным раствором гидроксида натрия. Основный слой подкисляли 2 М раствором соляной кислоты, экстрагировали диэтиловым эфиром, который сушили и выпаривали при пониженном давлении. Остаток растирали с изогексаном и фильтровали. Выход 10,8 г.
1H ЯМР CDCl3: δ 7.82 (1Н, d); 7.44-7.34 (6Н, m); 6.90 (1Н, d); 5.99 (2H, s); 5.12 (2H, s).
3) 5-[2-(Бензилокси)-5-хлорфенил]пиримидин
Смесь продукта со стадии (2) (0,2 г), 5-бромпиримидина (0,16 г), карбоната натрия (0,21 г) и тетракистрифенилфосфинпалладия (0) (0,05 г) в диоксане (6 мл) нагревали с обратным холодильником в течение 48 часов. Смесь распределяли между EtOAc и водой, органический слой отделяли, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 20% EtOAc/изогексан. Выход 0,283 г.
MS: APCI (положительный): 297/9 (M+1).
4) 4-Хлор-2-пиримидин-5-илфенол
Смесь продукта со стадии (3) (0,28 г), 10% палладия на углероде (0,04 г) в этаноле (20 мл) гидрировали при давлении 2 бар (0,2 МПа) в течение 24 часов. После фильтрации растворитель выпаривали пои пониженном давлении. Выход 0,19 г.
MS: APCI (положительный): 207/9 (M+1).
5) трет-Бутил-(4-хлор-2-пиримидин-5-илфенокси)ацетат
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 1. Выход 0,216 г.
MS: APCI (положительный): 321/3 (M+1).
6) Аммониевая соль (4-хлор-2-пиримидин-5-илфенокси)уксусной кислоты
Соединение, указанное в заголовке, получали способом стадии (3) примера 1. Выход 0,033 г.
1H ЯМР DMSO-d6: δ 9.15 (1Н, s); 9.08 (2Н, s); 7.57 (1Н, d); 7.44 (1H, dd); 7.10 (1H, d); 4.67 (2H, s).
MS: APCI (положительный): 265/7 (M+1).
Пример 17
{2-[5-(Аминосульфонил)пиридин-2-ил]-4-хлорфенокси}уксусная кислота

Соединение, указанное в заголовке, получали способом примера 16. Выход 0,022 г.
1H ЯМР DMSO-d6: δ 13.19 (1Н, s); 9.05 (1Н, s); 8.29 (1Н, d); 8.21 (1Н, d); 7.84 (1Н, d); 7.65 (2Н, s); 7.49 (1Н, dd); 7.16 (1Н, d); 4.86 (2Н, s).
MS: APCI (положительный): 343/5 (M+1).
Пример 18
[2-(2-Аминопиримидин-5-ил)-4-хлорфенокси]уксусная кислота, соль с трифторуксусной кислотой

Соединение, указанное в заголовке, получали способом примера 16. Выход 0,036 г.
1H ЯМР DMSO-d6: δ 8.56 (2Н, s); 7.45 (1H, d); 7.33 (1H, dd); 7.05 (1H, d); 4.76 (2Н, s).
MS: APCI (положительный): 280/2 (M+1).
Пример 19
[4-Хлор-2-(4-метил-2-морфолин-4-илпиримидин-5-ил)фенокси]уксусная кислота

1) 2-[2-(Бензилокси)-5-хлорфенил]-N-метокси-N-метилацетамид
Гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (8,6 г) добавляли к раствору (2-бензилокси-5-хлорфенил)уксусной кислоты (10,6 г), гидрохлорида N,О-диметилгидроксиламина (4,4 г), 1-гидроксибензотриазола (6,9 г) и N,N-диизопропилэтиламина (20 мл) в DMF (150 мл) и смесь перемешивали при комнатной температуре в течение 16 часов, затем распределяли между этилацетатом и водой. Органический слой промывали 2 М соляной кислотой, водой, сушили и упаривали при пониженном давлении. Выход 12,2 г.
MS: APCI (положительный): 320/2 (M+1).
2) 1-[2-(Бензилокси)-5-хлорфенил]ацетон
Раствор метилмагнийхлорида (3 М в THF) (6 мл) по каплям добавляли к перемешиваемому раствору продукта со стадии (1) (5,2 г) в THF (150 мл) при -70°С. Через 1 час смесь нагревали до комнатной температуры, перемешивали в течение 1 часа, затем гасили водным раствором хлорида аммония. Смесь распределяли между диэтиловым эфиром и водой, органический слой отделяли, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 10% EtOAc/изогексан. Выход 2,22 г.
1H ЯМР CDCl3: δ 7.40-7.30 (5Н, m); 7.26-7 12 (2H, m); 6.85 (1H, d); 5.03 (2H, s); 3.67 (2H, s); 2.12 (3H, s).
3) (3Z)-3-[2-(Бензилокси)-5-хлорфенил]-4-(диметиламино)бут-3-ен-2-он
Смесь продукта со стадии (2) (5,72 г) и диметилацеталя диметилформамида (3,5 мл) в толуоле (50 мл) нагревали при 100°С в течение 12 часов. Растворитель выпаривали при пониженном давлении, получая масло, 6,37 г.
MS: APCI (положительный): 330/2 (М+1).
4) 5-[2-(Бензилокси)-5-хлорфенил]-4-метил-2-(метилтио)пиримидин
Раствор продукта со стадии (3) (4,3 г) в этаноле (20 мл) добавляли к перемешиваемой смеси этоксида натрия (0,98 г) и сульфата S-метилизотиоурония (2 г) в этаноле (30 мл) и смесь нагревали с обратным холодильником в течение 8 часов. Дополнительно добавляли 2 г сульфата S-метилизотиоурония и 1,18 г этоксида натрия и нагревание продолжали в течение 16 часов. Смесь охлаждали, распределяли между диэтиловым эфиром и водой, органический слой промывали водой, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 3-5% EtOAc/изогексан. Выход 1,84 г.
MS: APCI (положительный): 357/9 (М+1).
5) 5-[2-(Бензилокси)-5-хлорфенил]-4-метил-2-(метилсульфонил)пиримидин
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 2. Выход 0,85 г.
MS: APCI (положительный): 389/91 (М+1).
6) 4-Хлор-2-[4-метил-2-(метилсульфонил)пиримидин-5-ил]фенол
Соединение, указанное в подзаголовке, получали способом стадии (4) примера 16. Выход 0,5 г.
MS: APCI (положительный): 299/301 (М+1).
7) трет-Бутил-{4-хлор-2-[4-метил-2-(метилсульфонил)пиримидин-5-ил]фенокси}ацетат
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 1. Выход 0,65 г.
MS: APCI (положительный): 413 (М+1).
8) трет-Бутил-[4-хлор-2-(4-метил-2-морфолин-4-илпиримидин-5-ил)фенокси]ацетат
Раствор продукта со стадии (7) (0,15 г) и морфолина (0,15 мл) в диоксане (3 мл) нагревали при 90°С в течение 24 часов, охлаждали и растворитель выпаривали при пониженном давлении. Продукт использовали неочищенным.
MS: APCI (положительный): 420/422 (М+1).
9) [4-Хлор-2-(4-метил-2-морфолин-4-илпиримидин-5-ил)фенокси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1. Выход 0,046 г.
1H ЯМР DMSO-d6: δ 8.12 (1Н, s); 7.39 (1H, dd); 7.25 (1H, d); 7.00 (1H, d); 4.71 (2H, s); 3.73-3.67 (8H, m); 2.18 (3Н, s).
MS: APCI (положительный): 364/6 (М+1).
Пример 20
{4-Хлор-2-[2-(диметиламино)пиримидин-5-ил]фенокси}уксусная кислота

1) 5-[2-(Бензилокси)-5-хлорфенил]-2-хлорпиримидин
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (2) примера 16 (3,2 г) и 2-хлор-5-бромпиримидина (2,59 г). Выход 2,43 г.
MS: APCI (положительный): 331/3 (М+1).
2) 5-[2-(Бензилокси)-5-хлорфенил]-2-(пропилтио)пиримидин
Пропантиол (3,1 мл) добавляли к перемешиваемой суспензии гидрида натрия (1,4 г; 60% в масле) в DMF (30 мл). Через 1 час добавляли раствор продукта со стадии (1) (2,4 г) в DMF (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, затем распределяли между EtOAc и водой. Органический слой промывали водой, рассолом, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 5% EtOAc/изогексан. Выход 1,87 г.
MS: APCI (положительный) 371 (М+1).
3) 5-[2-(Бензилокси)-5-хлорфенил]-2-(пропилсульфонил)пиримидин
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 2 при использовании продукта со стадии (2).
MS: APCI (положительный) 403 (М+1).
4) трет-Бутил-{4-хлор-2-[2-(пропилсульфонил)пиримидин-5-ил]фенокси}ацетат
Соединение, указанное в подзаголовке, получали способом стадии (4) примера 16 и стадии (1) примера 1 при использовании продукта со стадии (3). Выход 1,04 г.
MS: APCI (положительный) 427 (М+1).
5) {4-Хлор-2-[2-(диметиламино)пиримидин-5-ил]фенокси}уксусная кислота
Гидрохлорид диметиламина (0,82 г) добавляли к перемешиваемому раствору продукта со стадии (4) (0,2 г) и N,N-диизопропилэтиламина (0,9 мл) в NMP (5 мл). Реакционную смесь нагревали при 90°С в течение 6 часов, затем разбавляли EtOAc, промывали водой, рассолом, сушили и упаривали при пониженном давлении. Остаток растворяли в DCM (10 мл), затем добавляли трифторуксусную кислоту (10 мл) и перемешивали в течение 18 часов при комнатной температуре. Реакционную смесь упаривали досуха и остаток очищали посредством ВЭЖХ с обращенной фазой с последующим растиранием с метанолом, получая белое твердое вещество. Выход 0,035 г.
1H ЯМР DMSO-d6: δ 8.60 (2Н, s); 7.42 (1Н, d); 7.32 (1Н, dd); 7.05 (1H, d); 4.77 (2H, s); 3.16 (6H, s).
MS: APCI (отрицательный) 306 (M-1).
Пример 21
[4-Хлор-2-(2-морфолин-4-илпиримидин-5-ил)фенокси]уксусная кислота

Соединение, указанное в заголовке, получали из продукта со стадии (4) примера 20 и морфолина способом стадии (5) примера 20.
1H ЯМР DMSO-d6: δ 13.10 (1Н, уширенный s); 8.65 (2Н, s); 7.45 (1Н, d); 7.34 (1Н, dd); 7.06 (1Н, d); 4.77 (2Н, s); 3.75 (4H, m); 3.67 (4H, m). MS: APCI (отрицательный) 348 (M-1).
Пример 22
{4-Хлор-2-[2-(метиламино)пиримидин-5-ил]фенокси}уксусная кислота

Соединение, указанное в заголовке, получали из продукта со стадии (4) примера 20 и гидрохлорида метиламина способом стадии (5) примера 20.
1H ЯМР DMSO-d6: δ 8.54 (2Н, s); 7.42 (1Н, d); 7.32 (1Н, dd); 7.25 (1Н, уширенный s); 7.04 (1Н, d); 4.76 (2Н, s); 2.84 (3H, s). MS: APCI (отрицательный) 292 (M-1).
Пример 23
{2-[2-(Бензиламино)пиримидин-5-ил]-4-хлорфенокси}уксусная кислота

Соединение, указанное в заголовке, получали из продукта со стадии (4) примера 20 и бензиламина способом стадии (5) примера 20.
1H ЯМР DMSO-d6: δ 13.09 (1Н, уширенный s); 8.54 (2Н, s); 7.90 (1Н, t); 7.42 (1Н, d); 7.35-7.29 (5H, m); 7.22 (1Н, m); 7.03 (1Н, d); 4.76 (2Н, s); 4.55 (2Н, d).
MS: APCI (отрицательный) 368 (M-1).
Пример 24
[4-Хлор-2-(2-пиперидин-1-илпиримидин-5-ил)фенокси]уксусная кислота

Соединение, указанное в заголовке, получали из продукта со стадии (4) примера 20 и пиперидина способом стадии (5) примера 20.
1H ЯМР DMSO-d6: δ 13.10 (1Н, уширенный s); 8.59 (1Н, d); 7.32 (1Н, dd); 7.04 (1Н, d); 4.77 (2H, s); 3.79 (4H, t); 1.65 (2H, m); 1.53 (4H, m). MS: APCI (отрицательный) 346 (M-1).
Пример 25
(4-Хлор-2-{2-[метил(метилсульфонил)амино]пиримидин-5-ил}фенокси)уксусная кислота

1) N-(5-Бромпиримидин-2-ил)-N-метилметансульфонамид
Гидрид натрия (0,22 г; 60% в масле) добавляли к раствору (5-бромпиримидин-2-ил)метиламина (0,85 г) в DMF (10 мл) при 0°С и перемешивали в течение 30 минут. По каплям добавляли метансульфонилхлорид (0,62 г), смесь нагревали до комнатной температуры и дополнительно перемешивали в течение 2 часов. Реакционную смесь гасили водой и затем экстрагировали EtOAc. Органический слой промывали водой, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 1% метанол/DCM. Выход 0,42 г.
MS: APCI (положительный): 266 (М+1).
2) N-[5-(5-Хлор-2-гидроксифенил)пиримидин-2-ил]-N-метилметансульфонамид
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) и 2-гидрокси-6-хлорбороновой кислоты (0,27 г). Выход 0,2 г.
MS: APCI (положительный): 314 (М+1).
3) (4-Хлор-2-{2-[метил(метилсульфонил)амино]пиримидин-5-ил}фенокси)уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (1) и (3) примера 1 при использовании продукта со стадии (2). Выход 0,017 г.
1H ЯМР DMSO-d6: δ 13.16 (1Н, s); 8.94 (2H, s); 7.57 (1H, d); 7.45-7.42 (1H, m); 7.14 (1H, d); 4.82 (2H, s); 3.55 (3H, s); 3.47 (3H, s).
MS: APCI (отрицательный): 370 (M-1).
Пример 26
[[2',5-Дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1) 2-Хлор-4-(этилтио)-1-иодбензол
Раствор 3-хлор-4-иоданилина (5,6 г), изоамилнитрита (8,8 мл) и этилдисульфида (13,4 мл) в ацетонитриле (100 мл) нагревали при 60°С в течение 24 часов. Растворитель удаляли при пониженном давлении и остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 1% этилацетат/изогексан. Выход 4,02 г.
1H ЯМР CDCl3: δ 7.70 (1H, d); 7.36 (1H, d); 6.87 (1H, dd); 2.94 (2H, q); 1.32 (3H, t).
2) [[[2',5-Дихлор-4'-(этилтио)[1,1'-бифенил]-2-ил]окси]метил]бензол
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) и продукта со стадии (2) примера 16. Выход 3,64 г.
1H ЯМР CDCl3: δ 7.4 (1H, s); 7,32-7.18 (9Н, m); 6.92 (1H, d); 5.03 (2H, s); 2.99 (2H,q); 1.36 (3H, t).
3) [[[2',5-Дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]метил]бензол
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 2 при использовании продукта со стадии (2). Выход 3,8 г.
1H ЯМР CDCl3: δ 8.00 (1Н, s); 7.81 (1Н, d); 7.48 (1Н, d); 7.36-7.20 (7Н, m); 6.95 (1Н, d); 5.04 (2Н, s); 3.16 (2Н, q); 1.32 (3Н, t).
4) 2',5-Дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ол
Соединение, указанное в подзаголовке, получали способом стадии (4) примера 16 при использовании продукта со стадии (3). Выход 2,44 г.
1H ЯМР CDCl3: δ 8.03 (1Н, s); 7.85 (1Н, d); 7.55 (1Н, d); 7.30 (1Н, d); 7.16 (1Н, s); 6.92 (1Н, d); 5.20 (2Н, s); 3.17 (2Н, q); 1.36 (3Н, t).
5) Этиловый эфир [[2',5-Дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 1 при использовании продукта со стадии (4) и этилбромацетата. Выход 2,23 г.
6) [[2',5-Дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
Смесь продукта со стадии (5) (2,23 г), 1 М водного гидроксида натрия (10 мл) и THF (20 мл) перемешивали при комнатной температуре в течение 3 часов. Смесь подкисляли 2 М соляной кислотой, экстрагировали диэтиловым эфиром и органический слой промывали водой, сушили и упаривали при пониженном давлении. Остаток перекристаллизовывали из смеси этилацетат/изогексан, выход 0,45 г.
1H ЯМР CDCl3: δ 13.02 (1Н, s); 8.02 (1Н, s); 7.89 (1Н, d); 7.69 (1Н, d); 7.48 (1Н, dd); 7.34 (1Н, d); 7.08 (1Н, d); 4.70 (2Н, s); 3.44 (2Н, q); 1.16 (3Н, t).
MS: APCI (отрицательный): 387/9 (M-1).
Точка плавления: 163-4°С.
Пример 27
[[2'-Хлор-4'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
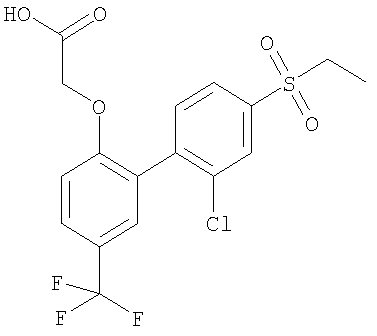
1) 2-Бром-1-(фенилметокси)-4-(трифторметил)бензол
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 16 при использовании 2-бром-4-трифторметилфенола. Выход 58,7 г.
1H ЯМР CDCl3: δ 7.83 (1Н, s); 7.51-7.32 (6Н, m); 6.98 (1Н, d); 5.21 (2Н, s).
2) [2-(Фенилметокси)-5-(трифторметил)фенил]бороновая кислота
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 16 при использовании продукта со стадии (1). Выход 30,7 г.
1H ЯМР CDCl3: δ 8.14 (1Н, d); 7.68 (1Н, dd); 7.44-7.39 (5H, m); 7.05 (1Н, d); 5.79 (2Н, s); 5.20 (2Н, s).
3) [2-Гидрокси-5-(трифторметил)фенил]бороновая кислота
Соединение, указанное в подзаголовке, получали способом стадии (4) примера 16 при использовании продукта со стадии (2). Выход 3,54 г.
4) 2'-Хлор-4'-(этилтио)-5-(трифторметил)[1,1'-бифенил]-2-ол
Смесь ацетата палладия (0,045 г) и три-пара-толилфосфина (0,213 г) в метаноле (10 мл) перемешивали при комнатной температуре в течение 30 минут. Добавляли продукт со стадии (3) (1 г), карбонат натрия (1,27 г), продукт со стадии (1) примера 26 (1,19 г) и метанол (20 мл) и смесь нагревали с обратным холодильником в течение 6 часов. Растворитель удаляли при пониженном давлении и остаток распределяли между диэтиловым эфиром и 2 М соляной кислотой. Органический слой отделяли, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 10% этилацетат/изогексан. Выход 0,503 г.
MS: ионизация электроразбрызгиванием (ESI) (отрицательный): 331/3 (М-1).
5) 2'-Хлор-4'-(этилсульфонил)-5-(трифторметил)(1,1'-бифенил]-2-ол
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 2 при использовании продукта со стадии (4). Выход 0,277 г.
MS: ESI (отрицательный): 363/5 (М-1).
6) 1,1-Диметилэтиловый эфир [[2'-хлор-4'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 1 при использовании продукта со стадии (5). Выход 0,253 г.
7) [[2'-Хлор-4'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (6). Выход 0,154 г.
1H ЯМР CDCl3: δ 13.12 (1Н, s); 8.04 (1Н, s); 7.91 (1Н, d); 7.81 (1Н, d); 7.72 (1H, d); 7.63 (1Н, s); 7.25 (1Н, d); 4.82 (2H, s); 3.45 (2H, q); 1.17 (3H, t).
MS: APCI (отрицательный): 421/3 (М-1).
Точка плавления: 167°С.
Пример 28
[[5-Хлор-4'-(этилсульфонил)-2'-фтор[1,1'-бифенил]-2-ил]окси]уксусная кислота
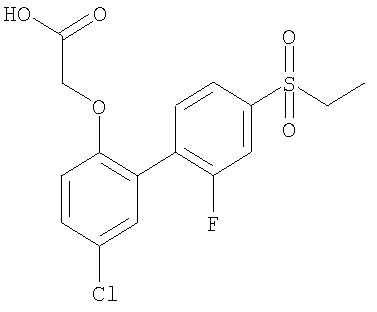
1) 1-Бром-4-(этилтио)-2-фторбензол
Бром (0,3 мл) добавляли к раствору 1-этилсульфанил-3-фторбензола (1 г) в хлороформе (20 мл) при 0°С, затем нагревали до комнатной температуры. Через 2 часа смесь разбавляли DCM, промывали водным раствором тиосульфата натрия, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 10% диэтиловый эфир/изогексан. Выход 1,2 г.
1H ЯМР CDCl3: δ 7.44-6.93 (3H, m); 2.99-2.90 (2H, q); 1.42-1.30 (3H, t).
2) 1-Бром-4-(этилсульфонил)-2-фторбензол
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 2 при использовании продукта со стадии (1). Выход 0,94 г.
1H ЯМР CDCl3: δ 7.81-7.07 (3Н, m); 3.17-3.10 (2H, q); 1.32-1.19 (3H, t).
3) [[[5-Хлор-4'-(этилсульфонил)-фтор[1,1'-бифенил]-ил]окси]метил]бензол
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (2) и продукта со стадии (2) примера 16. Выход 0,55 г.
1H ЯМР CDCl3: δ 7.73-6.96 (11Н, m); 5.09 (2H, s); 3.19-3.13 (2H, q); 1.33-1.27(3H,t).
4) 5-Хлор-4'-(этилсульфонил)-2'-фтор[1,1'-бифенил]-2-ол
Соединение, указанное в подзаголовке, получали способом стадии (4) примера 16 при использовании продукта со стадии (2), выход 0,35 г. MS: ESI (отрицательный) 313 (М-1).
5) [[5-Хлор-4'-(этилсульфонил)-2'-фтор[1,1'-бифенил]-2-ил]окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (1) и стадии (3) примера 1 при использовании продукта со стадии (4), выход 0,205 г.
1H ЯМР DMSO-d6: δ 7.81-7.08 (6Н, m); 4.73 (2H, s); 3.44-3.39 (2H, q); 1.17-1.14(3H,t).
MS: ESI (отрицательный) 371 (М-1).
Пример 29
Натриевая соль [[4'-(этилсульфонил)-2'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты

Соединение, указанное в заголовке, получали способом примера 28, выход 0,26 г.
1H ЯМР DMSO-d6: δ 7.96-7.57 (5Н, m); 7.09-7.07 (1Н, d); 4.31 (2H, s); 3.44-3.35 (2H,q); 1.18-1.14 (3H,t).
MS: ESI (отрицательный) 405 (М-1).
Пример 30
[[5-Хлор-4'-(этилсульфонил)-2'-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1) 1-Бром-4-(этилтио)-2-(трифторметил)бензол
Иодэтан (0,84 мл) добавляли к перемешиваемому раствору 3-трифторметилтиофенола (2 г) и карбоната калия (1,42 г) в DMF (20 мл). Через 72 часа смесь распределяли между диэтиловым эфиром и водой, органический слой отделяли, сушили и упаривали при пониженном давлении. Остаток растворяли в уксусной кислоте (20 мл), охлаждали до 0°С, затем добавляли бром (0,51 мл). Смесь перемешивали при комнатной температуре в течение 16 часов, растворитель удаляли при пониженном давлении и остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 25% DCM/изогексан. Выход 2,05 г.
2) 5-Хлор-4'-(этилтио)-2'-(трифторметил)(1,1'-бифенил]-2-ол
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) и 5-хлор-2-гидроксифенилбороновой кислоты, выход 0,26 г.
MS: ESI (отрицательный) 347 (М-1),
3) 1,1-Диметилэтиловый эфир [[5-хлор-4'-(этилтио)-2'-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 1 при использовании продукта со стадии (2), выход 0,26 г.
MS: APCI (отрицательный) 389/391 (М-1) - трет-бутил.
4) [[5-Хлор-4'-(этилсульфонил)-2'-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (1) примера 2 и стадии (3) примера 1 при использовании продукта со стадии (3), выход 0,045 г.
1H ЯМР DMSO-d6: δ 7.62-7.01 (6Н, m); 4.69-4.66 (2Н, s); 4.20-4.10 (2Н, q); 1.40-1.35 (3H, t).
MS: ESI (отрицательный) 421 (M-1).
Пример 31
2-[[5-Хлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]пропановая кислота

1) 1,1-Диметилэтиловый эфир 2-(2-бром-4-хлорфенокси)пропановой кислоты
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 1 при использовании 2-бром-4-хлорфенола и трет-бутилового эфира 2-бромпропановой кислоты, выход 1,1г.
1H ЯМР DMSO-d6: δ 7.54-7.16 (2Н, m); 6.74-6.71 (1H, d); 3.70 (3Н, s); 1.78-1.76(1H, d); 1.48(9H, s).
2) 1,1-Диметилэтиловый эфир 2-[[5-хлор-4'-(этилтио)[1,1'-бифенил]-2-ил]окси]пропановой кислоты
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) и 4-(этилтио)бензолбороновой кислоты, выход 1,2 г.
MS: APCI (отрицательный) 336 (M-1) - трет-бутил.
3) 2-[[5-Хлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (1) примера 2 и стадии (3) примера 1 при использовании продукта со стадии (2), выход 0,08 г.
1H ЯМР DMSO-d6: δ 7.97-6.96 (7H, m); 4.79-4.76 (1H, m); 3.39-3.31 (2H, t); 1.39-1.37 (3H, d); 1.16-1.07 (3H, t).
MS: ESI (отрицательный) 367 (М-1).
Пример 32
2-[[4'-(Этилсульфонил)-2'-метил-5-(трифторметил)(1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

1) 1-Бром-4-(этилсульфонил)-2-метилбензол
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 2 при использовании продукта со стадии (1) примера 10, выход 4,3 г.
MS: ESI (положительный) 264 (М+1).
2) [2-(Фенилметокси)-5-(трифторметил)фенил]бороновая кислота
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 16 при использовании продукта со стадии (1) примера 27, выход 5,5 г.
1H ЯМР CDCl3: δ 8.14-7.62 (2H, m); 7.43-7.38 (5H, m); 7.01 (1H, m); 5.67 (2H, s); 5.19-5.16 (2H, s).
3) [[[4'-(Этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]метил]бензол
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) и (2), выход 2,72 г.
MS:ESI (положительный) 452 (М+1+NH3).
4) 4'-(Этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ол
Соединение, указанное в подзаголовке, получали способом стадии (4) примера 16 при использовании продукта со стадии (3), выход 2,1 г.
MS: ESI (положительный) 362 (М+1+NH3).
5) Метиловый эфир 2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты
Диэтилазодикарбоксилат (0,14 мл) добавляли к перемешиваемому раствору продукта со стадии (4) (0,3 г), метил-R-лактата (0,083 мл) и трифенилфосфина (0,228 г) в THF (10 мл) при 0°С. Через 4 часа смесь разбавляли водой и экстрагировали этилацетатом, органический слой отделяли, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 50% диэтиловый эфир/изогексан. Выход 0,4 г.
MS: ESI (положительный) 448 (М+1+NH3).
6) 2-[[4'-(Этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
Смесь продукта со стадии (5) (0,4 г) и гидроксида лития (2 эквивалента) в THF (10 мл) и воде (10 мл) перемешивали при комнатной температуре в течение ночи. Смесь распределяли между этилацетатом и водой, водный слой подкисляли 2 М соляной кислотой и экстрагировали этилацетатом. Органический слой сушили, упаривали при пониженном давлении и остаток очищали посредством ВЭЖХ с обращенной фазой. Выход 0,035 г.
1H ЯМР DMSO-d6: δ 7.78-7.44 (5Н, m); 7.16-7.14 (1Н, d); 4.91-4.86 (1H, q); 3.30-3.25 (2H, q); 2.22 (3H, s); 1.33-1.24 (3Н, d); 1.10-1.07 (3H, t).
MS: ESI (положительный) 434 (М+1+NH3).
Пример 33
Натриевая соль 2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2R)-пропановой кислоты

Соединение, указанное в заголовке, получали способом примера 32 при использовании метил-S-лактата, выход 0,2 г.
1H ЯМР DMSO-d6: δ 7.77-7.38 (5Н, m); 7.02-7.00 (1H, d); 4.32 (1H, m); 3.39-3.25 (2H, q); 2.32 (3H, s); 1.21-1.07 (6H, d+t).
MS: ESI (положительный) 434 (М+1+NH3).
Пример 34
Натриевая соль 2-[[2',5-дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты
Соединение, указанное в заголовке, получали способом стадии (5) и (6) примера 32 при использовании продукта со стадии (4) примера 26, выход 0,18 г.
1H ЯМР DMSO-d6: δ 7.99-7,23 (5Н, m); 6.93-6.91 (1Н, d); 4.26-4.24 (1Н, q); 3.46-3.37 (2Н, q); 1.20-1.06 (6H, d+t).
MS: ESI (отрицательный) 402/403 (M-1).
Пример 35
2-[[2'-Хлор-4'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

Соединение, указанное в заголовке, получали способом стадии (5) и (6) примера 32 при использовании продукта со стадии (5) примера 2, выход 0,05 г.
1H ЯМР DMSO-d6: δ 7.98-7.23 (5Н, m); 6.93-6.91 (1Н, d); 4.68 (1Н, m); 3.20-3.15 (2Н, q); 1.48-1.39 (3H, m); 1.34-1.30 (3H, t). MS: ESI (отрицательный) 436 (M-1).
Пример 36
Натриевая соль 2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-2-метилпропановой кислоты

Соединение, указанное в заголовке, получали способом стадии (1) примера 1 и стадии (6) примера 26 при использовании продукта со стадии (4) примера 34, выход 0,18 г.
1H ЯМР DMSO-d6: δ 7.72 (1H, s); 7.71 (1H, d); 7.56 (1H, d); 7.44 (1H, d); 7.35 (1H, s): 7.10 (1H, d); 2.29 (3H, s); 1.38 (6H, s); 1.13 (3H, t). MS: ESI (отрицательный) 429 (M-1).
Пример 37
Натриевая соль 2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]бутановой кислоты

Соединение, указанное в заголовке, получали способом стадии (1) примера 1 и стадии (6) примера 26 при использовании продукта со стадии (4) примера 34, выход 0,29 г.
1H ЯМР DMSO-d6: δ 7.78 (1H, s); 7.71 (1H, d); 7.64 (1H, d); 7.41 (1H, s); 7.01 (1H, d); 4.27 (1H, уширенный s); 3.36 (2H, q); 2.33 (3H, уширенный s); 1.64-1.55 (2H, m); 1.11 (3H, t); 0.66 (3H, уширенный s).
MS: ESI (отрицательный) 429 (M-1).
Пример 38
[4-Хлор-2-[2-[(метилсульфонил)(фенилметил)амино]-5-пиримидинил]фенокси]уксусная кислота

1) N-(5-Бром-2-пиримидинил)-N-(фенилметил)метансульфонамид
Гидрид натрия (0,1 г; 60% дисперсия в масле) добавляли к перемешиваемому раствору бензил-(5-бромпиримидин-2-ил)амина (0,55 г) в DMF (8 мл) при 0°С. Через 30 минут добавляли метансульфонилхлорид (0,286 г) и смесь перемешивали при комнатной температуре в течение 2 часов, затем распределяли между этилацетатом и водой. Органический слой отделяли, промывали водой, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя дихлорметаном. Выход 0,41 г.
MS: APCI (положительный) 344 (М+1).
2) N-[5-(5-Хлор-2-гидроксифенил)-2-пиримидинил]-N-(фенилметил)-метансульфонамид
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) и 5-хлор-2-гидроксифенилбороновой кислоты, выход 0,25 г.
MS: APCI (положительный) 390 (М+1).
3) [4-Хлор-2-[2-[(метилсульфонил)(фенилметил)амино]-5-пиримидинил]фенокси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (1) и стадии (3) примера 1 при использовании продукта со стадии (2), выход 0,07 г.
1H ЯМР DMSO-d6: δ 13.16 (1Н, s); 8.93 (2Н, s); 7.56 (1Н, d); 7.44-7.41 (1Н, m); 7.37-7.31 (4Н, m); 7.27-7.23 (1Н, m); 7.12 (1Н, d); 5.28 (2Н, s); 4.81 (2Н, s); 3.59 (3H, s).
MS: APCI (отрицательный): 446 (M-1).
Пример 39
[4-Хлор-2-[2-[(этилсульфонил)(фенилметил)амино]-5-пиримидинил]фенокси]уксусная кислота

1) N-(5-Бром-2-пиримидинил)-N-(фенилметил)этансульфонамид
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 38 при использовании бензил-(5-бромпиримидин-2-ил)амина и этансульфонилхлорида, выход 0,31 г.
MS: APCI (положительный) 358 (М+1).
2) N-[5-(5-Хлор-2-гидроксифенил)-2-пиримидинил]-N-(фенилметил)-этансульфонамид
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) и 5-хлор-2-гидроксифенилбороновой кислоты, выход 0,25 г.
MS: APCI (положительный) 404 (М+1).
3) [4-Хлор-2-[2-[(этилсульфонил)(фенилметил)амино]-5-пиримидинил]фенокси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (1) и стадии (3) примера 1 при использовании продукта со стадии (2), выход 0,13 г.
1H ЯМР DMSO-d6: δ 13.14 (1Н, s); 8.92 (2H, s); 7.56 (1H, d); 7.44-7.31 (5H, m); 7.27-7.23 (1H, m); 7.12 (1H, d); 5.27 (2H, s); 4.81 (2H, s); 3.87 (2H, q); 1.25 (3Н, t).
MS: APCI (отрицательный): 460 (M-1).
Пример 40
[2-[2-[Ацетил(фенилметил)амино]-5-пиримидинил]-4-хлорфенокси]уксусная кислота

1) N-(5-Бром-2-пиримидинил)-N-(фенилметил)ацетамид
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 38 при использовании бензил-(5-бромпиримидин-2-ил)амина и ацетилхлорида, выход 0,21 г.
MS: APCI (положительный) 306 (М+1).
2) N-[5-(5-Хлор-2-гидроксифенил)-2-пиримидинил]-N-(фенилметил)-ацетамид
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) и 5-хлор-2-гидроксифенилбороновой кислоты, выход 0,16 г.
MS: APCI (положительный) 354 (М+1).
3) [2-[2-[Ацетил(фенилметил)амино]-5-пиримидинил]-4-хлорфенокси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (1) и стадии (3) примера 1 при использовании продукта со стадии (2), выход 0,08 г.
1H ЯМР DMSO-d6: δ 9.01 (2Н, s); 7.59 (1H, d); 7.44 (1H, q); 7.30-7.18 (5H, m); 7.13 (1H, d); 5.26 (2Н, s); 4.81 (2Н, s); 2.45 (3Н, s). MS: APCI (положительный): 412 (M+1).
Пример 41
[[4'-(Этилсульфонил)-5-фтор-2'-метил[1,1'-бифенил]-2-ил]окси]уксусная кислота

1) [4-(Этилтио)-2-метилфенил]бороновая кислота
Порцию в 100 мл раствора продукта со стадии (1) примера 10 (120,7 г) в THF (500 мл) добавляли к перемешиваемой смеси магниевой стружки (13,4 г) в THF (100 мл). Добавляли дибромэтан (0,2 мл) и смесь осторожно нагревали с обратным холодильником при перемешивании. Оставшийся раствор бромида добавляли по каплям, поддерживая реакционную смесь при температуре дефлегмации. После добавления смеси давали охладиться до комнатной температуры, затем переносили с помощью канюли в перемешиваемый раствор триметилбората (112 мл) в THF (200 мл) при 0°С. Смесь нагревали до комнатной температуры, перемешивали в течение 2 часов, затем гасили 2 М соляной кислотой (300 мл). После перемешивания при комнатной температуре в течение 18 часов THF удаляли при пониженном давлении и смесь экстрагировали диэтиловым эфиром. Органический слой отделяли, промывали водой, сушили и упаривали при пониженном давлении. Остаток растирали со смесью диэтиловый эфир/изогексан и фильтровали. Выход 53,02 г.
1H ЯМР CDCl3: δ 8.08 (1H, d); 7.18 (1H, d); 7.15 (1H, s); 3.04 (2Н, q); 2.76 (3H, s); 1.38(3H, t).
2) 1,1-Диметилэтиловый эфир (2-бром-4-фторфенокси)уксусной кислоты
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 1.
3) [[4'-{Этилсульфонил)-5-фтор-2'-метил[1,1'-бифенил]-2-ил]окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (4) примера 27, стадии (1) примера 2 и стадии (3) примера 1 при использовании продукта со стадии (1) и (2), выход 0,045 г.
1H ЯМР DMSO-d6: δ 7.8-7.64 (2Н, m); 7.42 (2Н, d); 7.8-6.0 (3H, m); 4.10 (2H, s); 3.20 (2Н, q); 1.18(3H, t).
MS: APCI (отрицательный): 351 (M-1).
Пример 42
[[4'-(Этилсульфонил)-4,5-дифтор-2'-метил[1,1'-бифенил]-2-ил]окси]уксусная кислота

Соединение, указанное в заголовке, получали способом примера 41, выход 0,081 г.
1H ЯМР DMSO-d6: δ 7.76 (1Н, s); 7.71 (1Н, dd); 7.44 (1Н, d); 7.23 (1Н, t); 7.01-6.94 (1Н, m); 4.32 (2Н, s); 3.39 (2Н, m); 2.25 (3H, s); 1.18 (3H, t).
MS: APCI (отрицательный): 369 (M-1).
Пример 43
[[4'-(Этилсульфонил)-3,5-дифтор-2'-метил[1,1'-бифенил]-2-ил]окси]уксусная кислота

Соединение, указанное в заголовке, получали способом примера 41, выход 0,15 г.
1H ЯМР DMSO-d6: δ 7.82-7.70 (2Н, m); 7.49-7.38 (2Н, m); 7.02-6.90 (1H, m); 4.40 (2Н, d); 3.34 (2Н, q); 1.11 (3H, t).
Пример 44
[2-(2-Амино-5-метил-3-пиридинил)-4-(трифторметил)фенокси]уксусная кислота

1) [4-(Трифторметил)фенокси]уксусная кислота
Гидрид натрия (2,96 г; 60% дисперсия в масле) добавляли к перемешиваемому раствору 4-гидроксибензотрифторида (10 г) в тетрагидрофуране (150 мл) при -78°С. Охлаждающую баню удаляли, смесь перемешивали в течение 1 часа, затем добавляли метилбромацетат (7 мл). Через 1 час добавляли воду, выпаривали тетрагидрофуран при пониженном давлении и остаток распределяли между этилацетатом и 2 М соляной кислотой. Органический слой упаривали при пониженном давлении и остаток растворяли в тетрагидрофуране (120 мл). Добавляли метанол (30 мл), воду (30 мл) и концентрированный раствор гидроксида натрия (6 мл) и смесь перемешивали при комнатной температуре в течение ночи. Органические слои удаляли при пониженном давлении и остаток распределяли между этилацетатом и 2 М соляной кислотой. Органические слои отделяли, сушили и упаривали при пониженном давлении, выход 12,42 г.
1H ЯМР DMSO-d6: δ 13.13 (1H, s); 7.65 (2Н, d); 7.10 (2Н, d); 4.80 (2Н, s).
MS: APCI (отрицательный) 219 (M-1).
2) (3-Метил-3-оксетанил)метиловый эфир [4-(трифторметил)фенокси]уксусной кислоты
Оксалилхлорид (14 мл) добавляли к раствору продукта со стадии (1) (12,42 г) и N,N-диметилформамида (2 капли) в дихлорметане (100 мл) и перемешивали при комнатной температуре в течение 72 часов. Смесь упаривали при пониженном давлении, остаток растворяли в дихлорметане (100 мл), затем добавляли триэтиламин (20 мл) и 3-метил-3-оксетанметанол (17 мл).
Через 2 часа смесь промывали водой, упаривали при пониженном давлении и остаток очищали посредством хроматографии на диоксиде кремния, элюируя дихлорметаном, выход 14,2 г,
1H ЯМР DMSO-d6: δ 7.66 (2Н, d); 7.14 (2H, d); 4.98 (2H, s), 4.34 (2H, d); 4.24 (2H, s); 4.19 (2H, d); 1.21 (3Н, s).
3) 4-Метил-1-[[4-(трифторметил)фенокси]метил]-2,6,7-триоксабицикло[2.2.2]октан
Диэтилэфират трифторида бора (1,48 мл) добавляли к раствору продукта со стадии (2) (14,2 г) в дихлорметане при -78°С. Охлаждающую баню удаляли, смесь перемешивали в течение 3 часов, затем добавляли триэтиламин (6,2 мл). Объем смеси уменьшали в два раза при пониженном давлении, затем фильтровали. Фильтрат упаривали при пониженном давлении, затем остаток очищали посредством хроматографии на диоксиде кремния (предварительно элюированном чистым триэтиламином в количестве, соответствующем одному объему колонки), элюируя дихлорметаном, выход 11,1 г.
1H ЯМР DMSO-d6: δ 7.62 (2H, d); 7.14 (2H, d); 4.04 (2H, s); 3.91 (6H, s); 0.77(3H, s).
MS: APCI (положительный) 305 (M+1).
4) [2-Бороно-4-(трифторметил)фенокси]уксусная кислота
Раствор втор-бутиллития (66 мл; 1,4 М в циклогексане) добавляли по каплям в течение 10 минут к перемешиваемому раствору продукта со стадии (3) (9,44 г) в THF (100 мл) при -78°С. Через 3 часа смесь нагревали до -40°С в течение 5 минут, затем охлаждали до -78°С. Добавляли триметилборат (14,1 мл), затем через 10 минут реакционную смесь гасили 2 М соляной кислотой. Смесь нагревали до комнатной температуры и органическую фазу отделяли. Водный слой экстрагировали этилацетатом, органические слои объединяли и упаривали при пониженном давлении. Остаток растворяли в метаноле (500 мл), затем добавляли смолу BondElut-NH2 (180 г) и смесь интенсивно перемешивали в течение 0,5 часа, затем фильтровали. Смолу промывали смесью 10% уксусная кислота/метанол, затем промывки упаривали при пониженном давлении и сушили под глубоким вакуумом. Остаток растворяли в метаноле (50 мл), тетрагидрофуране (50 мл) и насыщенном водном растворе гидроксида натрия (2 мл), оставляли на 30 минут, затем добавляли 2 М соляную кислоту (50 мл) и органический слой упаривали при пониженном давлении. Оставшийся водный слой экстрагировали этилацетатом, органический слой отделяли, сушили и упаривали при пониженном давлении, выход 5,05 г.
1H ЯМР DMSO-d6: δ 8.07 (1Н. s); 7.89 (1H, d); 7.75 (1H, dd); 7.14 (1H, d); 4.85 (2H, s).
MS: APCI (отрицательный) 263 (M-1).
5) [2-(2-Амино-5-метил-3-пиридинил)-4-(трифторметил)фенокси]уксусная кислота
Смесь продукта со стадии (4) (0,1 г), 2-амино-3-бром-5-метилпиридина (0,071 г), тетракис(трифенилфосфин)палладия (0) (0,046 г), карбоната натрия (0,12 г) в метаноле (2 мл) нагревали в микроволновой печи СЕМ (регулируемая мощность до 150 Вт) при 100°С в течение 10 минут. Смесь вводили в SCX смолу (сульфокатионит), промывали метанолом, затем продукт элюировали смесью метанол/аммиак. Метанол/аммиачный фильтрат упаривали при пониженном давлении, затем вводили в смолу BondElut-NH2. Смолу промывали метанолом, затем продукт элюировали смесью метанол/уксусная кислота. Метанол/уксуснокислый фильтрат упаривали и остаток очищали посредством ВЭЖХ с обращенной фазой. Выход 0,089 г.
1H ЯМР DMSO-d6: δ 7.87 (1H, s); 7.79 (1H, d); 7.69 (1H, s); 7.63 (1H, s); 7.26 (1H, d); 4.9 (2H, s); 2.2(3H, s).
MS: APCI (отрицательный) 325 (M-1).
Примеры 45-123
Следующие соединения синтезировали способом, аналогичным способу примера 44.
Пример 45
[[4'-Амино-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.62 (1H, d); 7.32 (1H, s); 7.05 (1H, d); 6.81 (1H, d); 6.47 (1H, s); 6.44 (1H, d); 4.74 (2H, s); 1.98 (3Н, s).
MS: APCI (отрицательный) 324 (M-1).
Пример 46
[[4'-Амино-2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.65 (1H, d); 7.4 (1H, s), 7.15 (1H, d); 7.04 (1H, d); 6.7 (1H, s); 6.56 (1H, d); 4.76 (2H, s).
MS: APCI (отрицательный) 344/6 (M-1).
Пример 47
[[2'-Хлор-4'-гидрокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 9.98 (1H, s); 7.69 (1H, d); 7.44 (1H, s); 7.21 (1H, d); 7.14 (1H, d); 6.91 (1H, s); 6.80 (1H, d); 4.76 (2H, s).
MS: APCI (отрицательный) 345/7 (M-1).
Пример 48
[2-(2,4-Диметокси-5-пиримидинил)-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.32 (1H, s); 7.71 (1H, d); 7.63 (1H, s); 7.20 (1H, d); 4.8 (2H, s); 3.95 (3H, s); 3.87 (3H, s).
MS: APCI (отрицательный) 357 (M-1).
Пример 49
[[2'-Хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.75 (1H, d); 7.55 (1H, m), 7.50 (1H, s); 7.42 (1H, m); 7.41 (1H, d); 7.40 (1H, d); 7.19 (1H, d); 4.78 (2H, s).
MS: APCI (отрицательный) 329/31 (M-1).
Пример 50
[[2',5-Бис(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.83 (1H, d); 7.75 (1H, d); 7.71 (1H, d); 7.63 (1H, t); 7.44 (1H, s); 7.43 (1H, d); 4.74 (2H, m).
MS: APCI (отрицательный) 363 (M-1).
Пример 51
[[5'-Фтор-2'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.68 (1H, d); 7.51 (1H, s); 7.20 (1H, d); 7.17 (1H, m); 7.15 (1H, m); 7.10 (1H, d); 4.78 (2H, s); 3.7 (3H, s).
MS: APCI (отрицательный) 343 (M-1).
Пример 52
[[5'-Циано-2'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная

1H ЯМР DMSO-d6: δ 7.87 (1Н, d); 7.74 (1H, s); 7.71 (1H, d); 7.56 (1H, s); 7.29 (1H, d); 7.19 (1H, d); 4.77 (2H, s); 3.81 (3H, s).
MS: APCI (отрицательный) 350 (M-1).
Пример 53
[[4'-Хлор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил1окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.71 (1H, d), 7.47 (1H, s), 7.34 (1H, d), 7.30 (1H, d), 7.24 (1H, s), 7.13 (1H, d), 4.73 (2H, s), 2.11 (3H, s).
MS: APCI (отрицательный) 343/345 (M-1).
Пример 54
[[2',5'-Диметил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.64 (1H, d), 7.35 (1H, s), 7.13 (1H, d), 7.07 (1H, d), 7.02 (1H, d), 6.94 (1H, s), 4.50 (2H, s), 2.30 (3H, s), 2.08 (3H, s).
MS: APCI (отрицательный) 323 (M-1).
Пример 55
[[5'-Хлор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.70 (1Н, d), 7.43 (1Н, s), 7.38 (1Н, s), 7.29 (1H, d), 7,19 (1Н, d), 7.14 (1Н, s), 4.70 (2H, s), 2.14 (3H, s).
MS: APCI (отрицательный) 343/345 (M-1).
Пример 56
[[2'-Фтор-6'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.71 (1Н, d), 7.44 (1Н, s), 7.27 (1Н, q), 7.18 (1Н, t), 7.11 (1Н, d), 7.04 (1Н, d), 4.67 (2H, s), 2.06 (3H, s).
MS: APCI (отрицательный) 327 (M-1).
Пример 57
[[4'-Фтор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7,70 (1Н, d), 7.42 (1Н, s), 7.30 (1Н, t), 7.12 (1Н d), 7.10 (1Н, d), 7.04 (1Н, d), 4.69 (2H, s), 2.11 (3H, s).
MS: APCI (отрицательный) 327 (M-1).
Пример 58
[[4'-[[(Этиламино)карбонил]амино]-2'-метил-5-(трифторметил)[1,Г-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6; δ 8.49 (1Н, s), 7.62 (1H, d), 7,31 (1H, s), 7.29 (1H, s), 7.24 (1H, d), 7.04 (1H, d), 7.00 (1H, d), 6.25 (1H, t), 4.60 (2H, s), 3.10 (2H, m), 1.06 (3Н, t).
MS: APCI (отрицательный) 395 (M-1).
Пример 59
[[2'-Метил-4'-[[(метиламино)карбонил]амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.52 (1H, s), 7.65 (1H, d), 7.39 (1H, s), 7.26 (1H, s), 7.26 (1H, d), 7.07 (1H, d), 7.00 (1H, d), 6.05 (1H, d), 4.72 (2H, s), 2.09 (3Н, s).
MS: APCI (положительный) 383 (M+1).
Пример 60
[[4'-[[(Циклопропиламино)карбонил]амино]-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.33 (1H, s), 7.66 (1H, d), 7.37 (1H, s), 7.31 (1H, s), 7.26 (1H, d), 7.08 (1H, d), 7.00 (1H, d), 6.46 (1H, s), 4.75 (2H, s), 2.54 (1H, m), 0.63 (2H, m), 0.42 (2H, m).
MS: APCI (положительный) 409 (M+1).
Пример 61
[[2'-Метил-4[[(пропиламино)карбонил]амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусная кислота

1H ЯМР DMSO-d6: δ 8.48 (1Н, s), 7.64 (1H, d), 7.36 (1H, s), 7.30 (1H, s), 7.24 (1H, d), 7.07 (1H, d), 7.00 (1H, d), 6.23 (1H, t), 4.68 (2H, s), 3.05 (2H, q), 2.10 (3Н, s), 1.44(2H, m),0.88(3H, d).
MS: APCI (положительный) 411 (M+1).
Пример 62
[[2',4'-Диметил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.63 (1H, d), 7.34 (1H, s), 7.03 (4H, m), 4.50 (2H, s), 2.32 (3H, s), 2.11 (3H, s).
MS: APCI (отрицательный) 323 (M-1).
Пример 63
[[5'-Фтор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.65 (1H, d), 7.38 (1H, s), 7.29 (1H, d), 7.27 (1H, d), 7.11 (1H, d), 7.06 (1H, m), 4.40 (2H, s), 2.13 (3Н, s).
MS: APCI (отрицательный) 327 (M-1).
Пример 64
[[4'-(Аминокарбонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
1H ЯМР DMSO-d6; δ (1Н, s), 7.77 (1Н, s), 7.70 (1Н, d), 7.63 (1H, d), 7.34 (1H, s), 7.30 (1H, s), 7.25 (1H, d), 6.98 (1H, d), 4.22 (2H, s), 2.21 (3H, s).
MS: APCI (положительный) 354 (M+1).
Пример 65
[[3'-Фтор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.66 (1H, d), 7.40 (1H, s), 7.27 (1H, d), 7.24 (1H, d), 7.16 (1H, t), 7.05 (1H, d), 4.45 (2H, s), 2.07 (3H, s).
MS: APCI (1ve) 327 (M-1).
Пример 66
[[2',5'-Дифтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.68 (1H, d), 7.58 (1H, s), 7.53 (1H, m), 7.30 (1H, m), 7.28 (1H, m), 7.09 (1H, d), 4.44 (2H, s).
Пример 67
[[5'-(Аминосульфонил)-2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.93 (1Н, d), 7.82 (1H, d), 7.76 (1H, s), 7.73 (1H, d), 7.53 (1H, s), 7.10 (1H, d), 4.38 (2H, s).
MS: APCI (положительный) 408/410 (M+1).
Пример 68
[[4'-Циано-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.78 (1H, s), 7.71 (1H, t), 7.71 (1H, m), 7.46 (1H, s), 7.40 (1H, d), 7.11 (1H, d), 4.61 (2H, s), 2.18 (3H, s).
MS: APCI (отрицательный) 334 (M-1).
Пример 69
[[4'-Хлор-2'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.73 (1H, d), 7.60 (1H, s), 7.56 (1H, s), 7.52 (1H, d), 7.36 (1H, d), 7.17 (1H, d), 4.70 (2H, s).
Пример 70
[[2',5'-Дифтор-4'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.63 (1Н, d), 7.60 (1H, m), 7.52 (1H, s), 7.19 (1H, m), 7.06 (1H, d), 4.39 (2H, s), 3.91 (3Н, s).
Пример 71
[[2'-Фтop-5'-мeтил-5-(тpифтopмeтил)[1,1'-бифeнил]-2-ил]oкcи]yкcуcнaя кислота
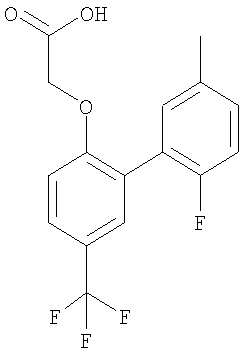
1H ЯМР DMSO-d6: δ 7.74 (1H, d), 7.57 (1H, s), 7.25 (1H, d), 7.26 (1H, s), 7.19 (1H, d), 7.14 (1H, d), 4.85 (2H, s), 2.35 (3Н, s).
Пример 72
[[2'-Фтор-4'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.67 (1H, d), 7.46 (1H, s), 7.40 (1H, t), 7.10 (1H, d), 7.07 (1H, d), 7.07 (1H, s), 4.49 (2H, s), 2.34 (3Н, s).
Пример 73
[[4'-Метокси-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.62 (1Н, d), 7.33 (1H, s), 7.08 (1H, d), 7.00 (1H, d), 6.82 (1H, s), 6.78 (1H, d), 4.45 (2H, s), 3.80 (3Н, s), 2.13 (3Н, s).
Пример 74
[[4'-(Аминосульфонил)-2',5'-дифтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.83 (1H, m), 7.75 (1H, d), 7.69 (1H, s), 7.63 (1H, m), 7.18(1H, d),4.53(2H, s).
MS: APCI (отрицательный) 410 (M-1).
Пример 75
[2-Бензо[b]тиен-3-ил-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.04 (1H, d), 7.87 (1H, s), 7.78 (1H, d), 7,69 (1H, d), 7.67 (1H, s), 7.38 (2H, m), 7.24 (1H, d), 4.81 (2H, s).
MS: APCI (отрицательный) 351 (M-1).
Пример 76
[[5-(Трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
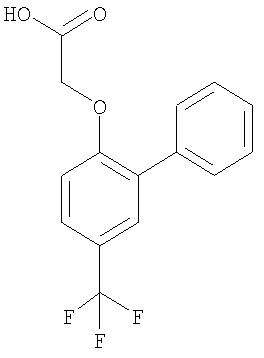
1H ЯМР DMSO-d6: δ 7.69 (1Н, d), 7.60 (3H, m), 7,41 (3H, m), 7.20 (1H, d), 4.88 (2H, s).
MS: APCI (отрицательный) 295 (M-1).
Пример 77
[2-(2-Бензофуранил)-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.24 (1H, s), 7.85 (1H, s), 7.75 (1H, d), 7.70 (2H, d), 7.33 (3H, m), 5.07 (2H, s).
MS: APCI (отрицательный) 335 (M-1).
Пример 78
[[4'-Хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.70 (1H, d), 7.64 (1H, d), 7.62 (1H, s), 7.62 (1H, d), 7.50 (1H, d), 7.50 (1H, d), 7.21 (1H, d), 4.81 (2H, s).
MS: APCI (отрицательный) 329/331 (M-1).
Пример 79
([3'-{1-Метилэтил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.67 (1Н, d), 7.57 (1H, s), 7.48 (1H, s), 7.38 (1H, t), 7.36 (1H, d), 7.25 (1H, d), 7.20 (1H, d), 4.85 (2H, s).
MS: APCI (отрицательный) 337 (M-1).
Пример 80
[[3',4'-Дифтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.76 (1H, d), 7.71 (1H, d), 7.65 (1H, s), 7.51 (1H, d), 7.48 (1H, s), 7.25 (1H, d), 4.89 (2H, s).
MS: APCI (отрицательный) 331 (M-1).
Пример 81
[2-(1,3-Бензодиоксол-5-ил)-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.63 (1H, d), 7.57 (1H, s), 7.22 (1H, s), 7.16 (1H, d), 7.05 (1H, d), 6.98 (1H, d), 6.04 (2H, s), 4.83 (2H, s), MS: APCI (отрицательный) 339 (M-1).
Пример 82
[[4'-Этил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.66 (1Н, d), 7.58 (1Н, s), 7.51 (2H, d), 7.27 (2H, d), 7.18 (1Н, d), 4.86 (2H, s), 2.65 (2H, q), 1.22 (3H, t).
MS: APCI (отрицательный) 323 (M-1).
Пример 83
[[3'-Фтор-5-(трифторметил)[1,1':4',1"-терфенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.74 (1Н, d), 7.65 (2H, m), 7.60 (1Н, m), 7.59 (2H, m), 7.58 (1Н, m), 7.52 (2H, m), 7.43 (1Н, m), 7.12 (1Н, m), 4.51 (2H, s).
MS: APCI (отрицательный) 389 (M-1).
Пример 84
[[4'-(Трифторметокси)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.82 (2H, d), 7.62 (1Н, d), 7.58 (1Н, s), 7.41 (2H, d), 7.05 (1H, d), 4.39 (2H, s).
MS: APCI (отрицательный) 379 (M-1).
Пример 85
[[2',3'-Дихлор-5-(трифторметил)(1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.68 (1Н, d), 7.66 (1H, d), 7.47 (1H, d), 7.48 (1H, s), 7.41 (1H, t), 7.05 (1H, d), 4.26 (2H, d).
MS: APCI (отрицательный) 363 (M-1).
Пример 86
[[4'-(1,1-Диметилэтил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.59 (1H, d), 7.57 (2H, d), 7.51 (1H, s), 7.44 (2H, d), 7.04 (1H, d), 4.47 (2H, s).
MS: APCI (отрицательный) 351 (M-1).
Пример 87
[2-(6-Метокси-2-нафталинил)-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.07 (1H, s), 7.87 (1H, d), 7.85 (2H, s), 7,62 (2H, d), 7.34 (1H, s), 7.17 (1H, d), 7.08 (1H, d), 4.41 (2H, s). MS: APCI (отрицательный) 375 (M-1).
Пример 88
[[4'-(Этилтио)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.61 (2Н, d), 7.59 (1Н, d), 7.52 (1Н, s), 7.35 (2H, d), 7.07 (1Н, d), 4.50 (2H, s), 3.02 (2H, q), 1.27 (3H, t).
MS: APCI (отрицательный) 355 (M-1).
Пример 89
[[4'-Ацетил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.02 (2H, d), 7.77 (2H, d), 7.64 (1Н, s), 7.72 (1Н, d), 7.23 (1Н, d), 4.83 (2H, s), 2.63 (3H, s).
MS: APCI (отрицательный) 337 (M-1).
Пример 90
Аммониевая соль [2-(2-хлор-5-метил-4-пиридинил)-4-(трифторметил)фенокси]уксусной кислоты

1H ЯМР DMSO-d6: δ 8.30 (1Н, d), 7.75-7.66 (1Н, m), 7.49 (1Н, d), 7.04 (2H, d),4.28(2H, s),2.15(3H, s).
MS: APCI (отрицательный) 449 (M-1).
Пример 91
Аммониевая соль [[5'-(аминосульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты

1H ЯМР DMSO-d6: δ 7.73-7.65 (3Н, m), 7.63 (1Н, d), 7.44 (1H, d), 7.37 (1H, d), 7.01 (1H, d), 4.23 (2H, s), 2.24 (3Н, s).
MS: APCI (отрицательный) 388 (M-1).
Пример 92
Аммониевая соль [2-(8-хинолинил)-4-(трифторметил)фенокси]уксусной кислоты

1H ЯМР CDCl3: δ 8.85-8.82 (1H, m), 8.33-8.29 (1H, m), 7.95-7.91 (1H, m), 7.82-7.78 (1H, m), 7.68-7.58 (3Н, m), 7.50-7.46 (1H, m), 7.14-7.10 (1H, m), 4.54 (2H, s).
MS: APCI (отрицательный) 346 (M-1),
Пример 93
Аммониевая соль [[3'-циано-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты

1H ЯМР CDCl3: δ 8.00 (1H, d), 7.87-7.83 (1H, m), 7.66-7.52 (4H, m), 6.99 (1H, d), 4.68 (2H, s).
MS: APCI (отрицательный) 320 (M-1).
Пример 94
Аммониевая соль [2-[4-метил-6-[метил(метилсульфонил)амино]-3-пиридинил]-4-(трифторметил)фенокси]уксусной кислоты

1H ЯМР DMSO-d6: δ 8.20 (1Н, s), 7.71 (1H, m), 7.51-7.47 (1H, m), 7.33 (1H, s), 7.09 (1H, d), 4.52 (2H, s), 3.32 (3Н, s), 3.18 (3H, d), 2.21 (3Н, s).
MS: APCI (отрицательный) 419 (M-1).
Пример 95
Аммониевая соль [[2'-метил-5'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты

1H ЯМР DMSO-d6: δ 7.83-7.80 (1H, m), 7.74-7.69 (2H, m), 7.55 (1H, d), 7.49 (1H, d), 7.09 (1H, d), 4.46 (2H, s), 3.23 (3Н, s), 2.26 (3Н, s).
MS: APCI (положительный) 406 (M+1).
Пример 96
3-Метиловый эфир 2'-(карбоксиметокси)-5'-(трифторметил)-[1,1'-бифенил]-3-карбоновой кислоты

1H ЯМР DMSO-d6: δ 8.15-8.13 (1H, m), 7.99-7.93 (2H, m), 7.68-7.55 (3Н, m), 7.10 (1H, d), 4.46 (2H, s), 3.87 (3Н, s).
MS: APCI (отрицательный) 353 (M-1).
Пример 97
2-Метиловый эфир 2'-(карбоксиметокси)-5'-(трифторметил)-[1,1'-бифенил]-2-карбоновой кислоты

1H ЯМР DMSO-d6; δ 7.77 (1Н, m), 7.66-7.59 (2H, m), 7.51-7.42 (3H, m), 4.23 (2H, s), 3.59 (4H, s).
MS: APCI (отрицательный) 353 (М-1).
Пример 98
[[5-(Трифторметил)[1,1':4',1"-терфенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.75-7.62 (7Н, m), 7.53-7.46 (3H, m), 7.42-7.35 (1Н, m), 7.21-7.15 (1H, m), 4.76 (2H, s).
MS: APCI (отрицательный) 371 (М-1).
Пример 99
[[3'-Фтор-2',4'-диметил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.66-7.62 (1Н, m), 7.55 (1Н, d), 7.34 (2H, d), 7.16 (1Н, d), 4.78 (2H, s), 2.25 (6H, d).
MS: APCI (отрицательный) 341 (М-1).
Пример 100
Аммониевая соль [(2'-нитро-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты

1H ЯМР DMSO-d6: δ 8.00 (1Н, m), 7.83-7.76 (1H, m), 7.70-7.55 (4H, m), 6.94 (1H, d), 4.08 (2H, s).
MS: APCI (отрицательный) 340 (М-1).
Пример 101
[[2'-Метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.65-7.61 (1H, m), 7.34-7.32 (1H, m), 7.28-7.14 (4H, m), 7.02-6.98 (1H, m), 4.36 (2H, s), 2.13 (3H, s).
MS: APCI (отрицательный) 340 (М-1).
Пример 102
[[3'-Хлор-2'-метил-5-(трифторметил)(1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.72-7.66 (1H, m), 7,47-7.40 (2H, m), 7.30-7.22 (1H, m), 7.18-7.14 (1H, m), 7.10-7.06 (1H, m), 4.56 (2H, s), 2.14 (3H, s).
MS: APCI (отрицательный) 343 (М-1).
Пример 103
[[5-(Трифторметил)[1,1':3',1"-терфенил]-2-ил]окси]уксусная кислота
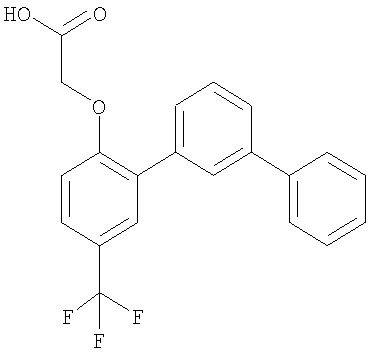
1H ЯМР DMSO-d6: δ 7.92 (1Н, t), 7.76-7.72 (2H, m), 7.68-7.59 (4H, m), 7.56-7.34 (4H, m), 7.19-7.15 (1Н, m), 4.69 (2H, s).
MS: APCI (отрицательный) 371 (М-1).
Пример 104
4-Метиловый эфир 2'-(карбоксиметокси)-5'-(трифторметил)-[1,1'-бифенил]-4-карбоновой кислоты

1H ЯМР DMSO-d6: δ 8.03-7.99 (2H, m), 7.82-7.79 (2H, m), 7.70-7.66 (1Н, m), 7.63-7.61 (1Н, m), 7.17-7.14 (1Н, m), 4.62 (2H, s), 3.88 (3H, s).
MS: APCI (отрицательный) 353 (М-1).
Пример 105
[[4'-Нитро-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.30-8.26 (2H, m), 7.99-7.94 (2H, m), 7.75-7.67 (2H, m), 7.20 (1H, d), 4.65 (2H, s).
MS: APCI (отрицательный) 340 (М-1).
Пример 106
[[5-(Трифторметил)-3'-((трифторметил)тио][1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.05 (1Н, s), 7.91-7.87 (1H, m), 7.74-7.58 (4H, m), 7.17 (1H, d), 4.64 (2H, s).
MS: APCI (отрицательный) 395 (М-1).
Пример 107
[[5-(Трифторметил)-4'-[(трифторметил)тио][1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.79 (4H, s), 7.76-7.72 (1H, m), 7.69-7.67 (1H, m), 7.25 (1H, d), 4.89 (2H, s).
MS: APCI (отрицательный) 395 (М-1).
Пример 108
[[4'-Метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.67-7.63 (1H, m), 7.57-7.54 (1H, m), 7.51-7.47 (2H, m), 7.25 (2H, d), 7.17 (1H, d), 4.82 (2H, s), 2.35 (3H, s).
MS: APCI (отрицательный) 309 (М-1).
Пример 109
[[4'-Фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.71-7.58 (4H, m), 7.31-7.18 (3H, m), 4.86 (2H, s).
MS: APCI (отрицательный) 314 (M-1).
Пример 110
[[3'-Фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.74-7.69 (1Н, m), 7.66-7.64 (1H, m), 7.53-7.42 (3H, m), 7.26-7.18 (2H, m), 4.88 (2H, s).
MS: APCI (отрицательный) 314 (M-1).
Пример 111
[[3'-Метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.70-7.63 (1H, m), 7.56 (1H, d), 7.42-7.28 (3H, m), 7.21-7.15 (2H, m), 4.82 (2H, s), 2.34 (3H, s).
MS: APCI (отрицательный) 309 (M-1).
Пример 112
[2-(3-Пиридинил)-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.88 (1Н, s), 8.56-8.53 (1Н, m), 8.15-8.09 (1H, m), 7.68-7.60 (2H, m), 7.48-7.42 (1Н, m), 7.10 (1Н, d), 4.43 (2H, s).
MS: APCI (положительный) 298 (М+1).
Пример 113
[[2'-Фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.02 (1Н, d), 7.92-7.90 (1Н, m), 7.79-7.54 (4H, m), 7.28 (1H, d), 4.90 (2H, s).
MS: APCI (отрицательный) 313 (М-1).
Пример 114
[[2'-Метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.59 (1Н, d), 7.42 (1Н, s), 7.37-7.30 (2H, m), 7.11-6.95 (3H, m), 4.42 (2H, s), 3.72 (3H, s).
MS: APCI (отрицательный) 325 (М-1).
Пример 115
[[3'-Метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.62 (1Н, d), 7.56-7.54 (1H, m), 7.34 (1H, t), 7.27-7.25 (1H, m), 7.16 (1H, d), 7.11 (1H, d), 6.95-6.90 (1H, m), 4.56 (2H, s), 3.79 (3H, s).
MS: APCI (отрицательный) 325 (М-1).
Пример 116
[[4'-Метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.62-7.54 (4Н, m), 7.04 (1H, d), 6.98 (2H, d), 4.45 (2H, s), 3.79 (3H, s).
MS: APCI (отрицательный) 325 (М-1).
Пример 117
[[3'-(Этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.19-8.17 (1H, m), 8.11-8.07 (1H, m), 7.87-7.83 (1H, m), 7.73-7.64 (3H, m), 7.11 (1H, d), 4.39 (2H, s), 3.38 (2H, q), 1.14 (3H, t).
MS: APCI (отрицательный) 387 (М-1).
Пример 118
[[3'-Пропокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.70-7.65 (1H, m), 7.59 (1H, d), 7.33 (1H, t), 7.22-7.10 (3H, m), 6.95-6.91 (1H, m), 4.86 (2H, s), 3.97 (2H, t), 1.79-1.68 (2H, m), 0.98 (3H, t).
MS: APCI (отрицательный) 353 (М-1).
Пример 119
[[4'-Пропокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7,65-7.61 (1H, m), 7.56-7.50 (3H, m), 7.16 (1H, d), 7.01-6.96 (2H, m), 4.85 (2H, s), 3.97 (2H, t), 1.80-1.70 (2H, m), 0.99 (3H, t).
MS: APCI (отрицательный) 353 (М-1).
Пример 120
[2-(2-Амино-4-метил-5-пиримидинил)-4-(трифторметил)фенокси]уксусная кислота
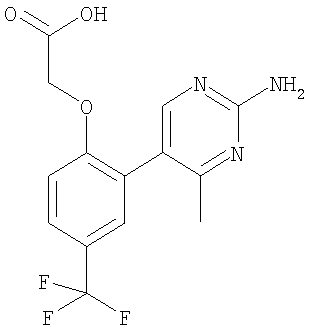
1H ЯМР DMSO-d6: δ 7.99 (s, 1H), 7.62 (dd, 1H), 7.43 (d, 1H), 7.01 (d, 1H), 6.56 (s, 2H), 4.41 (s, 2H), 2.15 (s, 3H).
MS: APCI (положительный) 328.
Пример 121
[[4'-Циано-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР CD3OD: δ 7.86-7.73 (m, 4H), 7.65 (dd, 1H), 7.60 (d, 1H), 7.14 (d, 1H), 4.66(s, 2H).
MS: APCI (положительный) 320.
Пример 122 [[4',5-Бис(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР DMSO-d6: δ 7.90 (2Н, d), 7.78 (2H, d), 7.67 (1H, d), 7.62 (1H, s), 7.10 (1H, d), 4.47 (2H, s).
MS: APCI (отрицательный) 363 (M-1).
Пример 123
[2-(2-Нафталинил)-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР DMSO-d6: δ 8.15 (1H, s), 7.93 (4H, m), 7.67 (1H, s), 7.64 (1H, d), 7.53 (2H, m), 7.09 (1H, d), 4.44 (2H, s).
MS: APCI (отрицательный) 345 (M-1).
Пример 124
[[4'-(1-Пирролидинилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1) 1-[(4-Бромфенил)сульфонил]пирролидин
Раствор 4-бромбензолсульфонилхлорида (0,5 г) и пирролидина (0,284 г) в ацетонитриле (5 мл) перемешивали при комнатной температуре в течение 48 часов, затем распределяли между этилацетатом и водой. Органический слой отделяли, промывали водой, сушили и упаривали при пониженном давлении. Остаток растирали с изогексаном и фильтровали, выход 0,5 г.
1H ЯМР CDCl3: δ 7.72-7.65 (4Н, m); 3.28-3,21 (4H, m); 1.84-1.76 (4H, m).
2) ([4'-(1-Пирролидинилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
Соединение, указанное в заголовке, получали способом примера 44, выход 0,13 г.
1H ЯМР СD3OD: δ 7.83-7.75 (m, 4H), 7.56-7.52 (m, 1H), 7.50 (d, 1H), 7.01 (d, 1H), 4.46 (s, 2H), 3.20-3.14 (m, 4H), 1.72-1.65 (m, 4H).
MS: APCI (отрицательный) 428.
Примеры 125-134
Следующие соединения синтезировали способом, аналогичным способу примера 124.
Пример 125
[[4'-[(Диметиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР CD3OD: δ 7.92-7.81 (m, 4H), 7.67-7.61 (m, 2H), 7.14 (d, 1H), 4.64 (s, 2H), 2.73 (s, 6H).
MS: APCI (положительный) 402.
Пример 126
[[4'-[[(Фенилметил)амино]сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР CD3OD: δ 7.92-7.77 (m, 4H), 7.68 (d, 1H), 7.62 (s, 1H), 7.29-7.14 (m, 6H), 4.73 (s, 2H), 4.13 (s, 2H).
MS: APCI (отрицательный) 464.
Пример 127
[[4'-[[(2,2,2-Трифторэтил)амино]сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
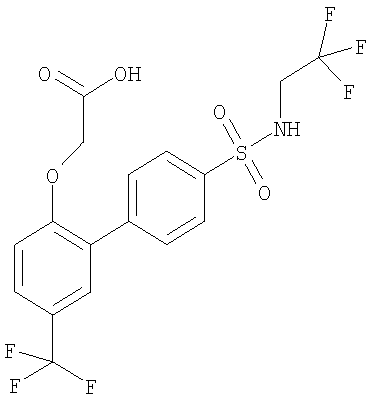
1H ЯМР CD3OD: δ 7.93-7.79 (m, 4H), 7.64 (d, 1H), 7.59 (d, 1H), 7.12 (d, 1H), 4.64 (s, 2H), 3.63 (t, 2H).
MS: APCI (отрицательный) 456.
Пример 128
[[4'-[[(5-Метил-2-тиазолил)амино]сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР СD3OD: δ 7.97-7.92 (m, 2H), 7.82-7.78 (m, 2H), 7.67-7.61 (m, 1H), 7.61-7.58 (m, 1H), 7.12 (d, 2H), 6.82 (d, 1H), 4.61 (s, 2H), 2.27 (d, 3H).
MS: APCI (отрицательный) 471.
Пример 129
[[4'-[(Фениламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР CD3OD: δ 7.81-7.73 (m, 4H), 7.60 (dd, 1 H), 7.54 (d, 1 H), 7.25-7.02 (m, 6H), 4.55 (s, 2H).
MS: APCI (отрицательный) 450.
Пример 130
[[4'-[(Диэтиламино)сульфонил]-5-(трифторметил)(1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР СD3OD: δ 7.85 (s, 4H), 7.63 (dd, 1Н), 7.59 (d, 1H), 7.11 (d, 1H), 4.58 (s, 2H), 3.27(q, 4H), 1.16(t, 6H).
MS: APCI (отрицательный) 450.
Пример 131
[[4'-[(Циклопропиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР CD3OD: δ 7.95-7.84 (m, 4H), 7.64 (dd, 1H), 7.61 (d, 1H), 7.12 (d, 1H),4.61 (s, 2H), 2.23-2.16 (m, 1H), 0.58-0.53 (m, 4H).
MS: APCI (отрицательный) 414.
Пример 132
[[4'-(Аминосульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная

1H ЯМР CD3OD: δ 7.94 (d, 2Н), 7.81 (d, 2H), 7.63 (dd, 1H), 7.58 (d, 1H), 7.12 (d,1H),4.60(s,2H).
MS: APCI (отрицательный) 374.
Пример 133
[[4'-[(Метиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР CD3OD: δ 7.80-7.74 (m, 4H), 7.53 (dd, 1H), 7.50 (d, 1H), 4.48 (s, 2H), 2.47 (s, 3Н).
MS: APCI (отрицательный) 388.
Пример 134
[[4'-[(4-Метил-1-пиперазинил)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1H ЯМР CD3OD: δ 7.85-7.70 (m, 4H), 7.55-7.51 (m, 1H), 7.49 (d, 1H), 7.00 (d, 1H), 4.41 (s, 2H), 3.03-2.95 (m, 4H), 2.48 (t, 4H), 2.21 (s, 3H).
MS: APCI (отрицательный) 457.
Пример 135
[2-[4-Метил-2-(5-метил-1,1-диоксидо-1,2,5-тиадиазолидин-2-ил)-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота
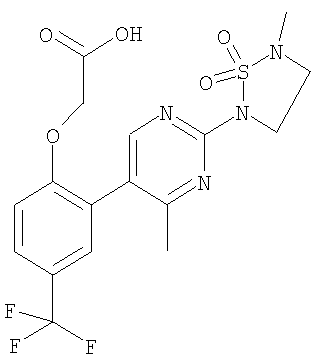
1) 2,5-Дибром-4-метилпиримидин
Изоамилнитрит (21 мл) добавляли к перемешиваемой суспензии 5-бром-4-метил-2-пиримидинамина (1,75 г) в бромоформе (30 мл) и смесь нагревали при 85°С в течение 4 часов. После охлаждения добавляли изогексан (300 мл) и раствор пропускали через слой силикагеля. Силикагель промывали бензином (1000 мл), дихлорметаном (200 мл), затем продукт элюировали этилацетатом. Этилацетатный слой упаривали при пониженном давлении и остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 5% диэтиловый эфир/изогексан, выход 0,9 г.
1H ЯМР CDCl3: δ 8.52 (s, 1H), 2.64 (s, 3H).
MS: APCI (отрицательный) 249/51/53.
2) 5-Бром-4-метил-2-(5-метил-1,1-диоксидо-1,2,5-тиадиазолидин-2-ил)пиримидин
Гидрид натрия (0,128 г; 60% дисперсия в масле) добавляли к перемешиваемому раствору 1,1-диоксида 2-метил-1,2,5-тиадиазолидина (0,433 г) в THF (10 мл). Добавляли DMF (10 мл) и смесь нагревали при 80°С в течение 5 минут, затем добавляли раствор продукта со стадии (1) (0,8 г) в DMF (5 мл). Смесь нагревали при 60°С в течение 10 минут, выливали в воду (100 мл), подкисляли лимонной кислотой и экстрагировали этилацетатом. Органический слой упаривали при пониженном давлении и остаток очищали посредством хроматографии на диоксиде кремния, элюируя диэтиловым эфиром, выход 0,58 г.
1H ЯМР CDCl3: δ 8.50 (s, 1H), 4.05 (t, 2H), 3.45 (t, 2H), 2.87 (s, 3H), 2.58 (s, 3H).
MS: APCI (положительный) 307/9.
3) [2-[4-Метил-2-(5-метил-1,1-диоксидо-1,2,5-тиадиазолидин-2-ил)-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота
Соединение, указанное в заголовке, получали способом примера 44, выход 0,05 г.
1H ЯМР CDCl3: δ 8.34 (s, 1Н), 7.47 (dd, 1H), 7.32 (d, 1H), 6.90 (d, 1H), 4.36 (s, 2H), 4.05 (t, 2H), 3.40 (t, 4H), 2.77 (s, 3Н), 2.27 (s, 3Н).
MS: APCI (положительный) 447.
Примеры 136-137
Следующие соединения синтезировали способом, аналогичным способу примера 135.
Пример 136
[2-[4-Метил-2-[метил(метилсульфонил)амино]-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР CDCl3: δ 8.37 (s, 1H), 7.63 (dd, 1H), 7.40 (d, 1H), 6.96 (d, 1H), 4.60 (s, 2H), 3.57 (s, 3Н), 3.53 (s, 3Н), 2.40 (s, 3Н).
MS: APCI (отрицательный) 418.
Пример 137
Аммониевая соль [2-[2-(1,1-диоксидо-2-изотиазолидинил)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]уксусной кислоты

1H ЯМР CDCl3: δ 8.37 (s, 1H), 7.60 (dd, 1H), 7.36 (d, 1H), 7.02 (d, 1H), 4.53 (s, 2H), 4.09 (t, 2H), 3.49 (t, 2H), 2, 51 (квинтет, 2H), 2.39 (s, 3H). MS: APCI (положительный) 432.
Пример 138
[2-[2-(3-Гидрокси-1-азетидинил)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота

1) 1-(5-Бром-4-метил-2-пиримидинил)-3-азетидинол
Смесь продукта со стадии (1) примера 135 (0,75 г), гидрохлорида азетидин-3-ола (0,66 г) и триэтиламина (0,9 мл) в этаноле (10 мл) перемешивали при комнатной температуре в течение 2 часов. Растворитель удаляли при пониженном давлении и остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 60% диэтиловый эфир/изогексан в качестве элюента, выход 0,7 г.
1H ЯМР CDCl3: δ 8.22 (s, 1Н), 4.78-4.72 (m, 1H), 4.40-4.33 (m, 2H), 3.99-3.93 (m, 2H), 2.45 (s, 3H).
2) [2-[2-(3-Гидрокси-1-азетидинил)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота
Соединение, указанное в заголовке, получали способом, аналогичным способу примера 44, выход 0,04 г.
1H ЯМР CD3OD: δ 8.09 (s, 1H), 7.64 (m, 1H), 7.43 (d, 1H), 7.08 (d, 1H), 4.71 -4.64 (m, 1H), 4.61 (s, 2H), 4.41-4.34 (m, 2H), 3.96-3.91 (m, 2H), 2.25 (s, 3H).
MS: APCI (положительный) 384.
Примеры 139-141
Следующие соединения синтезировали способом, аналогичным способу примера 138.
Пример 139
[2-[4-Метил-2-(4-метил-1-пиперазинил)-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР CDCl3: δ 8.19 (s, 1H), 7.57 (d, 1H), 7.38 (d, 1H), 6.99 (d, 1H), 4.51 (s, 2H), 4.3-3.8 (уширенный s, 4Н), 3-2.8 (уширенный s, 4Н), 2.63 (s, 3H), 2.29 (s, 3Н).
MS: APCI (положительный) 411.
Пример 140
[2-[4-Метил-2-(1-пирролидинил)-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР CD3OD: δ 7.95 (s, 1H), 7.36 (d, 1H), 7.59-7.54 (m, 1H), 7.01 (d, 1H), 4.65 (s, 2H), 3.50 (t, 4Н), 2.15 (s, 3H), 1.96 -1.91 (m, 4Н).
MS: APCI (положительный) 382.
Пример 141
[2-[2-(Диметиламино)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота

1H ЯМР CD3OD: δ 8.05(s, 1H), 7.67-7.63 (m, 1H), 7.44(d, 1H), 7.10(d, 1H), 4.75 (s,2H), 3.20 (s, 6H).
MS: APCI (положительный) 356.
Пример 142
[2-[5-Метил-2-[метил(метилсульфонил)амино]-4-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота

1) N-(4-Хлор-5-метил-2-пиримидинил)-N-метилметансульфонамид
Смесь N-метилсульфонамида (3,35 г), 2,4-дихлор-5-метилпиримидина (5 г) и карбоната калия (4,3 г) в DMF (50 мл) нагревали при 80°С в течение 4 часов. Реакционную смесь гасили водой (200 мл) и экстрагировали этилацетатом. Органический слой сушили, упаривали при пониженном давлении и остаток растирали с диэтиловым эфиром. Твердое вещество отфильтровывали (4-изомер) и фильтрат упаривали при пониженном давлении и подвергали ВЭЖХ с обращенной фазой, получая 2-изомер, выход 0,37 г.
1H ЯМР CDCl3: δ 8.35 (s, 1H), 3.51 (s, 3H), 3.48 (s, 3H), 2.29 (d, 3H).
2) [2-[5-Метил-2-[метил(метилсульфонил)амино]-4-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота
Соединение, указанное в заголовке, получали способом, аналогичным способу примера 44, выход 0,04 г.
1H ЯМР CD3OD: δ 8.50 (s, 1H), 7.16 (d, 1H), 7.74 (dd, 1H), 7.62 (d, 1H), 4.68 (s, 2H), 3.50 (s, 3H), 3.45 (s, 3H), 2.19 (s, 3H).
MS: APCI (положительный) 420.
Пример 143
[2-[2-[[(Диметиламино)сульфонил]амино]-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота

1) N'-(5-Бром-4-метил-2-пиримидинил)-N,N-диметилсульфамид
Смесь 5-бром-4-метил-2-пиримидинамина (0,75 г) и диметилсульфонилхлорида (0,43 мл) в пиридине (20 мл) нагревали при 80°С в течение 17 часов. Растворитель удаляли при пониженном давлении и остаток очищали посредством хроматографии на диоксиде кремния, элюируя диэтиловым эфиром, затем этилацетатом. Остаток затем очищали посредством ВЭЖХ с обращенной фазой, выход 0,12 г.
MS: APCI (отрицательный) 295/6.
2) [2-[2-[[(Диметиламино)сульфонил]амино]-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]уксусная кислота
Соединение, указанное в заголовке, получали способом, аналогичным способу примера 44, выход 0,01 г.
1H ЯМР CD3OD: δ 8.27 (s, 1Н), 7.68 (d, 1Н), 7.49 (s, 1H), 7.11 (d, 1H), 4.70 (s, 2H), 2.98 (s, 6H), 2.32 (s, 3H).
MS: APCI (положительный) 435.
Пример 144
[[2'-Хлор-4'-[(метоксикарбонил)амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1) 2-Хлор-2'-(фенилметокси)-5'-(трифторметил)[1,1'-бифенил]-4-амин
Продукт стадии (2) примера 32 (0,5 г) и 4-бром-3-хлоранилин (0,38 г) растворяли в толуоле (4 мл). Последовательно добавляли этанол (1 мл), 2 М водный карбонат натрия (1 мл) и Pd(PPh3)4 (0,115 г) и смесь нагревали с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали, упаривали, растворяли в EtOAc, промывали водой и рассолом, сушили (MgSO4) и упаривали. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 10% EtOAc/изогексан. Выход 0,23 г.
1H ЯМР DMSO-d6: δ 7.67 (ddd, 1H), 7.4 (d, 1H), 7.27-7.34 (m, 6H), 7.01 (d, 1H), 6.7 (d, 1H), 6.55 (dd, 1H), 5.47 (s, 2H), 5.18 (s, 2H).
2) 4'-Амино-2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ол
5% Pt/C (0,088 г) добавляли к раствору продукта со стадии (1) в этаноле (20 мл) и гидрировали при комнатной температуре и давлении 1 бар (0,1 МПа) в течение 18 часов. Дополнительно добавляли Pt/C (0,1 г) и гидрировали в течение еще 3 часов при 2 бар (0,2 МПа). Катализатор удаляли посредством фильтрации и фильтрат упаривали до получения твердого остатка. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 50% EtOAc/изогексан. Выход 0,083 г.
1H ЯМР DMSO-d6: δ 10.2 (s, 1H), 7.49 (d, 1H), 7.3 (d, 1H), 7.03 (d, 1H), 6.96 (d, 1H), 6.68 (d, 1H), 6.54 (dd, 1H), 5.44 (s, 2H).
3) 1,1-Диметилэтиловый эфир [[4'-амино-2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 1 при использовании продукта со стадии (2). Выход 0,07 г. Использовали на стадии (4) без идентификации.
4) 1,1-Диметилэтиловый эфир [[2'-хлор-4'-[(метоксикарбонил)амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты
Продукт со стадии (3) (0,07 г) растворяли в DCM (5 мл), добавляли триэтиламин (0,024 мл) с последующим добавлением метилхлорформиата (0,013 мл) и перемешивали в течение 20 часов. Дополнительно трижды добавляли триэтиламин (0,024 мл) и метилхлорформиат (0,013 мл) до завершения реакции. Растворитель удаляли посредством выпаривания, получая неочищенный продукт, который передавали на стадию (5) без идентификации.
5) [[2'-Хлор-4'-[(метоксикарбонил)амино]-5"(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (4).
1H ЯМР DMSO-d6: δ 9.94 (s, 1H), 7.69 (dd, 2H), 7.41-7.47 (m, 2H), 7.35 (d, 1H), 7.13 (d, 1H), 4.65(s, 2H), 3.7(s, 3H).
MS: APCI (отрицательный) 402.
Пример 145
2-[[2'-Хлор-4'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

1) 2-Хлор-1 -иод-4-(метилтио)бензол
Метантиолат натрия (5 г) добавляли к раствору 4-фтор-2-хлориодбензола (18,3 г) и перемешивали в течение 20 часов. Смесь выливали в воду, экстрагировали диэтиловым эфиром, промывали рассолом, сушили (MgSO4) и упаривали. Выход 18,5 г.
1H ЯМР DMSO-d6: δ 7.81 (d, 1Н), 7.43 (dd, 1H), 6.98 (dd, 1H), 3.32 (s, 3H).
2) 2-Хлор-1-иод-4-(метилсульфонил)бензол
Mcpba (8,6 г) порциями добавляли к перемешиваемому раствору продукта со стадии (1) (5 г) в DCM (100 мл). Через 1 час реакционную смесь разбавляли DCM (200 мл), промывали насыщенным водным бикарбонатом натрия, сушили (MgSO4) и упаривали при пониженном давлении. Выход 3,2 г.
1H ЯМР DMSO-d6: δ 8.26 (d, 1H), 8.06 (d, 1H), 7.59 (dd, 1H), 3.32 (s, 3H).
3) 2'-Хлор-4'-(метилсульфонил)-5-(трифторметил)-[1,1'-бифенил]-2-ил]окси]метил]бензол
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (2) и продукта со стадии (2) примера 32. Выход 2,2 г.
1H ЯМР DMSO-d6: δ 8.11 (s, 1H), 7.95 (dd, 1H), 7.82 (d, 1H), 7.72 (d, 1H), 7.61 (d, 1H), 7.41 (d, 1H), 7.27-7.36 (m, 5H), 5.25 (s, 2H), 3.35 (s, 3H),
4) 2'-Хлор-4'-(метилсульфонил)-5-(трифторметил)-[1,1'-бифенил]-2-ол
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 144 при использовании продукта со стадии (3). Выход 0,95 г.
1H ЯМР DMSO-d6: δ 10.72 (s, 1H), 8.08 (d, 1H), 7.93 (dd, 1H), 7.63-7.68 (m, 2H), 7.49 (d, 1H), 7.14 (d, 1H), 3.35 (s, 3H).
MS: APCI (отрицательный) 349.
5) 1,1-Диметилэтиловый эфир 2-[[2'-хлор-4'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты
Соединение, указанное в подзаголовке, получали способом стадии (5) примера 32 при использовании продукта со стадии (4) и трет-бутил-R-лактата. Выход 0,25 г.
1H ЯМР DMSO-d6: δ 8.11 (d, 1H), 7.97 (d, 1H), 7.82 (dd, 1H), 7.73 (d, 1H), 7.62 (d, 1H), 7.15 (d, 1H), 5.0 (уширенный s, 1H), 3.36 (s, 3H), 1.36-1.39 (m, 12H).
6) 2-[[2'-Хлор-4'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (5). Выход 0,12 г.
1H ЯМР DMSO-d6: δ 8.09 (d, 1H), 7.95 (dd, 1H), 7.82 (s, 1H), 7.76 (dd, 1H), 7.58 (d, 1H), 7.14 (d, 1H), 4.87 (q, 1H), 3.36 (s, 3Н), 1.35 (d, 3Н).
MS: APCI (отрицательный) 421.
Пример 146
2-[[3'-Циaнo-5-(тpифтopмeтил)[1,1'-бифeнил-2-ил]oкcи]-(2S)-пpoпaновaя кислота

1) 4,4,5,5-Тетраметил-2-[2-(фенилметокси)-5-(трифторметил)фенил]-1,3,2-диоксаборолан
Пинакон (1,82 г) добавляли к раствору продукта со стадии (2) примера 32 (4,54 г) в диэтиловом эфире (40 мл) и перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь разбавляли диэтиловым эфиром (100 мл), промывали рассолом, сушили (MgSO4) и упаривали. Выход 5,7 г.
1H ЯМР DMSO-d6: δ 7.82 (d, 1H), 7.79 (d, 1H), 7.6 (d, 2H), 7.4 (t, 2H), 7.32 (d, 1H), 7.27 (d, 1H), 5.24 (s, 2H), 1.32 (s, 12H).
2) 2-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифторметил)фенол
10% Pd/C (0,5 г) добавляли к раствору продукта со стадии (1) в EtOAc (80 мл) и гидрировали при комнатной температуре и давлении 1 бар (0,1 МПа) в течение 1 часа, и еще в течение 3 часов при 3 бар (0,3 МПа). Катализатор удаляли посредством фильтрации и фильтрат упаривали, получая твердый продукт. Выход 4,2 г.
1H ЯМР DMSO-d6: δ 9.99 (d, 1H), 7.72 (s, 1H), 7.63 (d, 1H), 6.99 (d, 1H), 1.3 (d, 12H).
3) 1,1-Диметилэтиловый эфир 2-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-4-(трифторметил)фенокси]-(2S)-пропановой кислоты
Соединение, указанное в подзаголовке, получали способом стадии (5) примера 32 при использовании продукта со стадии (2) и трет-бутил-R-лактата. Выход 4,0 г. Неочищенное вещество передавали на стадию (4).
4) 2-[2-Бор-4-(трифторметил)фенокси]-(2S)-пропановая кислота
TFA (трифторуксусную кислоту) (10 мл) добавляли к раствору продукта со стадии (3) (4,0 г) в DCM (100 мл) и перемешивали в течение 30 минут. TFA выпаривали и остаток растворяли в смеси 1 М соляной кислоты (30 мл) и ацетонитрила (30 мл). Через 1 час смесь упаривали досуха, растворяли в 1 М гидроксиде натрия, промывали диэтиловым эфиром и доводили до рН 2 концентрированной соляной кислотой. Водный слой затем экстрагировали диэтиловым эфиром, промывали рассолом, сушили (MgSO4) и упаривали. Выход 2,0 г. Неочищенное вещество передавали на стадию (5).
5) 2-[[3'-Циано-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (4) и 3-бромбензонитрила.
1H ЯМР DMSO-d6: δ 8.13 (t, 1H), 8.01 (tdt, 1H), 7.85 (dt, 1H), 7.71-7.76 (m, 2H), 7.65 (dt, 1H), 7.17-7.2 (m, 1H), 5.11 (q, 1H), 1.47 (d, 3Н).
MS: APCI (отрицательный) 334.
Пример 147
2-[[4'-[(Диметиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (4) примера 146 и 4-бром-М.М-диметилбензолсульфонамида.
1H ЯМР DMSO-d6: δ 7.95 (d, 2H), 7.83 (d, 2H), 7.77 (d, 1H), 7.73 (s, 1H), 7.21 (d, 1H), 5.14 (q, 1H), 2.69 (s, 6H), 1.51 (d, 3Н).
MS: APCI (отрицательный) 416.
Пример 148
2-[[2'-Хлор-4'-[(диметиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

1) 3-Хлор-4-иодбензолсульфонамид
Раствор нитрита натрия (3,27 г) в воде по каплям добавляли в течение 1 часа к перемешиваемому раствору 3-хлор-4-иоданилина (10,0 г) в смеси THF (120 мл) и концентрированной соляной кислоты (50 мл) при температуре от -5 до -1°С. Затем добавляли хлорид магния (6,39 г) и полученную смесь выливали в перемешиваемый раствор уксусной кислоты (50 мл), насыщенный диоксидом серы и содержащий хлорид меди (2,14 г). После нагревания при 34°С в течение 30 минут смесь выливали в рассол, экстрагировали EtOAc, промывали водным бикарбонатом натрия и рассолом, сушили (MgSO4) и упаривали. Остаток растворяли в THF (100 мл), добавляли аммиак с относительной плотностью 0,880 (100 мл) и перемешивали в течение 2 часов. Смесь разбавляли рассолом, экстрагировали EtOAc, промывали рассолом, сушили (MgSO4) и упаривали. Остаток обрабатывали смесью изогексан/диэтиловый эфир (4:1) и фильтровали, получая соединение, указанное в подзаголовке. Выход 5,67 г.
1H ЯМР DMSO-d6: δ 8.18 (d, 1H), 7.92 (d, 1H), 7.56 (s, 1H), 7.47 (dd, 1H).
2) 3-Хлор-4-иод-N,N-диметилбензолсульфонамид
Гидрид натрия (0,33 г) добавляли к раствору продукта со стадии (1) (1,2 г) в DMF
(25 мл) и перемешивали в течение 20 минут. По каплям добавляли метилиодид (0,5 мл) и затем перемешивали еще в течение 1 часа. Реакционную смесь гасили водой, экстрагировали EtOAc, сушили (MgSO4) и упаривали. Остаток обрабатывали диэтиловым эфиром, получая соединение, указанное в подзаголовке, в виде белого твердого вещества. Выход 0,45 г.
1H ЯМР DMSO-d6: δ 8.05 (d, 1H), 7.82 (d, 1H), 7.31 (dd, 1H), 2.75 (s, 6H).
3) 2-[[2'-Хлор-4'-[(диметиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (2) и продукта со стадии (4) примера 146.
1H ЯМР DMSO-d6: δ 7.86 (t, 1H), 7.75-7.79 (m, 3H), 7.61 (d, 1H), 7.14 (d, 1H), 4.88 (q, 1H), 2.7 (s, 6H), 1.35 (d, 3H).
MS: APCI (отрицательный) 450.
Пример 149
2-[[2'-Фтор-4'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

1) 2-Фтор-4-(метилсульфонил)фениловый эфир трифторметансульфоновой кислоты
2-Фтор-4-(метилсульфонил)фенол (1,44 г) растворяли в DCM (20 мл), добавляли триэтиламин (1,17 мл) с последующим добавлением трифторметансульфонового ангидрида (1,57 мл) и перемешивали в течение 1 часа. Раствор промывали рассолом, сушили (MgSO4) и упаривали, получая соединение, указанное в подзаголовке.
1H ЯМР CDCl3: δ 7.83-7.92 (m, 2H), 7.55-7.61 (m, 1H), 3.11 (s, 3H).
2) 2-[[2'-Фтор-4'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (1) и продукта со стадии (4) примера 146.
1H ЯМР DMSO-d6: δ 7.79-7.9 (m, 3H), 7.74 (dd, 1H), 7.64 (s, 1H), 7.12 (d, 1H), 4.87 (q, 1H), 3.31 (s, 3H), 1.35 (d, 3H).
MS: APCI (отрицательный) 405.
Пример 150
[[2',5-Дихлор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

1) [[[2'5-Дихлор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]метил]бензол
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (2) примера 16 и продукта со стадии (2) примера 145. Выход 1,08 г.
1H ЯМР DMSO-d6: δ 8.09 (d, 1H), 7.94 (dd, 1H), 7.67 (d, 1H), 7.49 (dd, 1H), 7.22-7.34 (m, 7H), 5.14 (s, 2H), 3.35 (s, 3H).
2) [[[2',5-Дихлор-4'-(метилсульфонил)[1,1'-бифенил]-2-ол
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 144 при использовании продукта со стадии (1).
Выход 0,45 г.
1H ЯМР DMSO-d6: δ 10.04 (s, 1H), 8.06 (d, 1H), 7.91 (dd, 1H), 7.63 (d, 1H), 7.32 (dd, 1H), 7.2 (d, 1H), 6.97 (d, 1H), 3.34 (s, 3H).
3) 1,1-Диметилэтиловый эфир [[2',5-Дихлор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты
Соединение, указанное в подзаголовке, получали способом стадии (5) примера 32 при использовании продукта со стадии (2) и трет-бутил-R-лактата. Выход 0,24 г.
1H ЯМР DMSO-d6: δ 8.09 (d, 1H), 7.95 (d, 1H), 7.7 (d, 1H), 7.48 (dd, 1H), 7.33 (d, 1H), 6.98 (d, 1H), 4.85 (уширенный s, 1H), 3.35 (s, 3H), 1.37 (s, 9H), 1.32 (d, 3H).
4) [[2',5-Дихлор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (3). Выход 0,11 г.
1H ЯМР DMSO-d6: δ 8.07 (d, 1H), 7.92 (dd, 1H), 7.81 (s, 1H), 7.42 (dd, 1H), 7.28 (d, 1H), 6.97 (d, 1H), 4.65 (q, 1H), 3,35 (s, 3H), 1.29 (d, 3H).
MS: APCI (отрицательный) 387.
Пример 151
[[5-Хлор-4'-[(диметиламино)сульфонил][1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

1) 2-[5-Хлор-2-(фенилметокси)фенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолан
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 146 при использовании продукта со стадии (2) примера 16. Выход 3,3 г.
1H ЯМР DMSO-d6: δ 7.27-7.64 (m, 7Н), 6.85 (d, 1H), 5.09 (s, 2H), 1.36 (s, 12H).
2) 4-Хлор-2 -(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 146 при использовании продукта со стадии (1). Очищали посредством хроматографии на диоксиде кремния, элюируя смесью 50% EtOAc/изогексан. Выход 1,89г.
1H ЯМР DMSO-d6: δ 7.76-7.79 (s, 1H), 6.79-7.62 (m, 3Н), 1.36 (s, 12H).
3) 1,1-Диметилэтиловый эфир 2-[4-хлор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]-(2S)-пропановой кислоты
Соединение, указанное в подзаголовке, получали способом стадии (5) примера 32 при использовании продукта со стадии (2) трет-бутил R-лактата. Выход 3,5 г. Неочищенное вещество передавали на стадию (4).
4) 2-(2-Бороно-4-хлорфенокси)-(2S)-пропановая кислота
Соединение, указанное в подзаголовке, получали способом стадии (4) примера 146 при использовании продукта со стадии (3). Выход 2,5 г. Неочищенное вещество передавали на стадию (5).
5) [[5-Хлор-4'-[(диметиламино)сульфонил][1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (4) и 4-бром-N,N-диметилбензолсульфонамида и THF в качестве растворителя. Выход 0,068 г.
1H ЯМР DMSO-d6: δ 8.01 (d, 2Н), 7.75 (d, 2Н), 7.3-7.41 (m, 2H), 6.93 (d, 1H), 4.56 (bm, 1H), 2.65 (s, 6H), 1.33 (d, 3H).
MS: APCI (отрицательный) 382.
Пример 152
[[2',5-Дихлор-4'-[(Диметиламино)сульфонил][1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
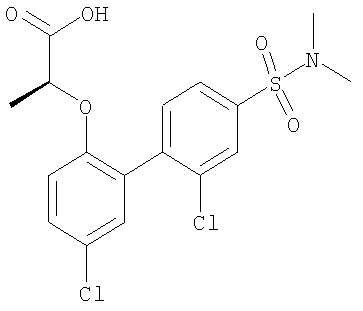
Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (4) примера 151, продукта со стадии (2) примера 148 и метанола в качестве растворителя. Выход 0,08 г.
1H ЯМР DMSO-d6: δ 7.9 (bm, 1H), 7.82 (s, 1H), 7.74 (dd, 1H), 7.4 (dd, 1H), 7.26 (d, 1H), 6.92 (d, 1H), 4.34 (bm, 1H), 2.7 (s, 6H), 1.2 (d, 3H).
MS: APCI (отрицательный) 416.
Пример 153
[(5-Хлор-3'-циано[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (4) примера 151, 3-бромбензонитрила и THF в качестве растворителя.
1H ЯМР DMSO-d6: δ 8.25 (s, 1H), 8.06 (d, 1H), 7.79 (d, 1H), 7.63 (t, 1H), 7.4 (d, 1H), 7.33 (dd, 1H), 6.95 (d, 1H), 4.64 (q, 1H), 1.32 (d, 3H).
MS: APCI (отрицательный) 300.
Пример 154
[[5-Xлop-4'-[(диметилaминo)сульфoнил]-2'-фтop[1,1'-бифeнил]-2-ил]oкcи]-(2S)-пропановая кислота

1) 4-Бром-N,N-диметил-3-фторбензолсульфонамид
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 148 при использовании 4-бром-3-фторбензолсульфонамида. Выход 1,14г.
2) [[5-Хлор-4'-[(диметиламино)сульфонил]-2'-фтор[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (1), продукта со стадии (4) примера 151 и THF в качестве растворителя.
1H ЯМР DMSO-d6: δ 7.94 (t, 1H), 7.58-7.62 (m, 2H), 7.35-7.4 (m, 2H), 6.93 (d, 1H), 4.48 (q, 1H), 2.7 (s, 6H), 1.26 (d, 3H).
MS: ESI (положительный) 402.
Пример 155
[[5-Хлор-4'-(4-морфолинилсульфонил)[1,1'-бифенил]-2-ил]окси]-(23)-пропановая кислота

Смесь продукта со стадии (4) примера 151 (0,126 г), карбоната натрия (0,22 г), 4-[(4-бромфенил)сульфонил]морфолина (0,16 г) и Pd(dppf)Cl2 (0,03 г) в диоксане (10 мл) нагревали с обратным холодильником в течение 4 часов. Смесь упаривали и очищали посредством ВЭЖХ с обращенной фазой (МеСN/водн.NH4Cl). Выход 0,09 г.
1H ЯМР DMSO-d6: δ 8.03 (d, 2H), 7.74 (d, 2H), 7.31-7.39 (m, 2H), 6.93 (d, 1H), 4.55 (m, 1H), 3.65 (m, 2H), 2.92 (m, 2H), 1.34 (d, 3H).
MS: APCI (отрицательный) 426.
Пример 156
[[5-Хлор-2'-фтор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

Соединение, указанное в заголовке, получали способом примера 155 при использовании продукта со стадии (4) примера 151 и продукта со стадии (1) примера 149.
1H ЯМР DMSO-d6: δ 7.81-7.88 (m, 3H), 7.41-7.49 (m, 2H), 7.0 (d, 1H), 4.9 (q, 1 H), 3.3 (s,3H), 1.37 (d,3H).
MS: ESI (отрицательный) 371.
Пример 157
2-[[4'-(1-Азетидинилсульфонил)-5-хлор[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (4) примера 151, 1-[(4-бромфенил)сульфонил]азетидина и THF в качестве растворителя. Выход 0,028 г.
1H ЯМР DMSO-d6: δ 7.97 (d, 2H), 7.82 (d, 2H), 7.39-7.43 (m, 2H), 7.01 (d, 1H), 4.85 (m, 1H), 3.72 (t, 4H), 2.04 (q, 2H), 1.42 (d, 3H).
MS: ESI (отрицательный) 394.
Пример 158
Натриевая соль 2-[[5-Хлор-2'-метил-4'-(1-пирролидинилкарбонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты
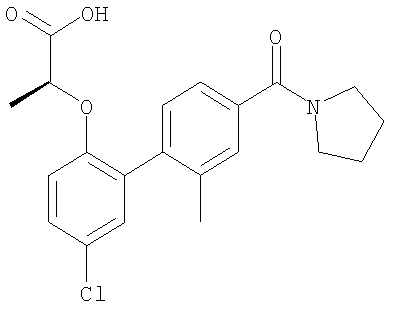
Соединение, указанное в заголовке, получали способом примера 155 при использовании продукта со стадии (4) примера 151 и 1-(4-бром-3-метилбензоил)пирролидина. Выход 0,152 г.
1H ЯМР DMSO-d6: δ 7.2-7.41 (m, 4H), 7.25 (s, 1H), 6.85 (d, 1H), 4.22 (m, 1H), 3.56 (m, 4H), 2.2 (s, 3Н), 1.85 (m, 4H), 1.17 (d, 3Н).
MS: APCI (отрицательный) 388.
Пример 159
2-[(2',4'-Дихлор-5-циано[1,1'-бифенил]-2-ил)окси]-(2S)-пропановая кислота

1) 2-(2-Бром-4-цианофенокси)-(2S)-пропановая кислота
Диэтилазодикарбоксилат (2,12 г) добавляли к перемешиваемому раствору 2-бром-4-цианофенола (2,0 г), метил-R-лактата (1,47 г) и трифенилфосфина (2,65 г) в THF (80 мл). Через 20 часов смесь фильтровали через диоксид кремния, используя смесь изогексан/EtOAc в качестве растворителя, и фильтрат упаривали досуха. Остаток растворяли в DCM (50 мл), обрабатывали TFA (10 мл) и перемешивали в течение 2 часов. Раствор упаривали и остаток распределяли между EtOAc и водным бикарбонатом натрия. Водный слой подкисляли 2 М соляной кислотой, экстрагировали EtOAc, сушили (MgSO4) и упаривали, получая соединение, указанное в подзаголовке.
1H ЯМР DMSO-d6: δ 7.87 (s, 1H), 7.56 (d, 1H), 6.83 (d, 1H), 4.91 (q, 1H), 1.7 (d, 3Н).
MS: APCI (отрицательный) 270.
2) 2-[(2',4'-Дихлор-5-циано[1,1'-бифенил]-2-ил)окси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 16 при использовании продукта со стадии (1) и 2,6-дихлорфенилбороновой кислоты.
1H ЯМР DMSO-d6: δ 7.58-7.78 (m, 4Н), 7.46 (d, 1H), 7.02 (d, 1H), 4.51 (q, 1H), 1.26 (d, 3H).
MS: APCI (отрицательный) 334.
Пример 160
2-[[5-Циано-2'-фтор-4'-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

Соединение, указанное в заголовке, получали способом стадии (3) примера 16 при использовании продукта со стадии (1) примера 159 и 3-цианофенилбороновой кислоты.
1H ЯМР DMSO-d6: δ 7.81-8.04 (m, 4Н), 7.56 (t, 1H), 7.18 (d, 1H), 5.1 (q, 1H), 1.4(d,3H).
MS: APCI (отрицательный) 352.
Пример 161
Натриевая соль 2-[(3'-циано-5-фтор[1,1'-бифенил]-2-ил)окси]-(2S)-пропановой кислоты

1) 1,1-Диметилэтиловый эфир 2-(2-бром-4-фторфенокси)-(2S)-пропановой кислоты
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 159 при использовании 2-бром-4-фторфенола (2,5 г). Выход 3,0 г.
1H ЯМР DMSO-d6: δ 7.28-7.32 (m, 1H), 6.89-6.98 (m, 1H), 6.78-6.83 (m, 1H), 4.56 (q, 1H), 1.62 (d, 3H), 1.4 (s, 9H).
2) 2-(2-Бром-4-фторфенокси)-(2S)-пропановая кислота
Соединение, указанное в подзаголовке, получали способом стадии (4) примера 146 при использовании продукта со стадии (1). Выход 1,2 г. Передавали на стадию (3) без идентификации.
3) Натриевая соль 2-[(3'-циано-5-фтор[1,1'-бифенил]-2-ил)окси]-(2S)-пропановой кислоты
Соединение, указанное в заголовке, получали способом примера 155 при использовании продукта со стадии (2) и 3-цианофенилбороновой кислоты. Продукт растворяли в ацетонитриле, обрабатывали 1 М гидроксидом натрия и упаривали, получая соединение, указанное в заголовке.
1H ЯМР DMSO-d6: δ 8.4 (s, 1H), 8.13 (d, 1H), 7.75 (d, 1H), 7.6 (t, 1H), 6.9-7.2 (m, 3Н), 4.4 (q, 1H), 1.28(d,3H).
MS: APCI (отрицательный) 284.
Пример 162
Натриевая соль 2-[(2',4'-дихлор-5-фтор[1,1'-бифенил]-2-ил)окси]-(2S)-пропановой кислоты

Соединение, указанное в заголовке, получали способом примера 155 при использовании продукта со стадии (2) примера 161 и 2,4-дихлорфенилбороновой кислоты. Продукт растворяли в ацетонитриле, обрабатывали 1 М гидроксидом натрия и упаривали, получая соединение, указанное в заголовке.
1H ЯМР DMSO-d6: δ 7.66-7.72 (m, 2Н), 7.43 (d, 1H), 6.86-7.11 (m, 3Н), 4.18 (q, 1H), 1.2 (d, 3H).
MS: APCI (отрицательный) 327.
Пример 163
2-[[2'-Хлор-5-фтор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота

1) Бензил-2-бром-4-фторфениловый эфир
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 16 при использовании 2-бром-4-фторфенола и ацетона в качестве растворителя. Выход 27,5 г.
1H ЯМР DMSO-d6: δ 7.27-7.49 (m, 6H), 6.82-6.99 (m, 2H), 5.12.
2) [2-(Бензилокси)-5-фторфенил]бороновая кислота
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 16 при использовании продукта со стадии (1). Выход 18,77 г.
1H ЯМР DMSO-d6: δ 7.9 (s, 2H), 7.0-7.5 (m, 8H), 5.14 (s, 2H).
3) 2-[5-Фтор-2-(фенилметокси)фенил]-4,4,5,5-тетраметил-1,3,2-диоксаборолан
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 146 при использовании продукта со стадии (2). Выход 4,1 г.
1H ЯМР DMSO-d6: δ 7.58 (d, 1Н), 7.29-7.4 (m, 3H), 7.26 (s, 1H), 7.04 (dt, 1H), 6.84 (d, 2H), 5.07 (s, 2H), 1.36 (s, 12H).
4) 4-Фтор-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 146 при использовании продукта со стадии (3) и этанола в качестве растворителя.
1H ЯМР DMSO-d6: δ 7.63 (s, 1H), 7,2-7.27 (m, 1H), 7.01-7.08 (m, 1H), 6.8-6.83 (m, 1H), 1.37 (s, 12H).
5) 1,1-Диметилэтиловый эфир 4-фтор-2-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]-(2S)-пропановой кислоты
Соединение, указанное в подзаголовке, получали способом стадии (5) примера 32 при использовании продукта со стадии (4) и терт-бутил-R-лактата. Выход 2,6 г. Неочищенное вещество передавали на стадию (6).
6) 2-[2-Бороно-4-(трифторметил)фенокси]-(2S)-пропановая кислота
Соединение, указанное в подзаголовке, получали способом стадии (4) примера 146 при использовании продукта со стадии (5). Выход 1,65 г.
MS: APCI (отрицательный) 227.
7) 2-[[2'-Хлор-5-фтор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом примера 155 при использовании продукта со стадии (6) и продукта со стадии (2) примера 145.
1H ЯМР DMSO-d6: δ 8.06 (s, 1H), 7.86-7.93 (m, 2H), 7.03-7.23 (m, 2H), 6.9-6.97 (m, 1H), 4.43 (q, 1H), 1.24 (d, 3H).
MS: APCI (отрицательный) 371.
Пример 164
Натриевая соль 2-[[2'-хлор-5-фтор-5'-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты

Соединение, указанное в заголовке, получали способом примера 155 при использовании продукта со стадии (2) примера 161 и 2-бром-1-хлор-4-(трифторметил)бензола. Продукт растворяли в ацетонитриле, обрабатывали 1 М гидроксидом натрия и упаривали, получая соединение, указанное в заголовке. Выход 0,07 г.
1H ЯМР DMSO-d6: δ 8.31 (bs, 1H), 7.68-7.77 (m, 2H), 7.09-7.15 (m, 2H), 6.9-6.93 (m, 1H), 4.25 (q, 1H), 1.21 (d, 3H).
MS: APCI (отрицательный) 361.
Пример 165
[[4'-(Этилсульфонил)-6-метил-5-нитро[1,1'-бифенил]-2-ил]окси]уксусная кислота

1) Метиловый эфир (2-бром-3-метил-4-нитрофенокси)уксусной кислоты
Бром (5,27 г) в уксусной кислоте (3 мл) по каплям добавляли к раствору 3-метил-4-нитрофенола (5,04 г) в уксусной кислоте (43 мл) в течение 45 минут и затем перемешивали в течение еще 1 часа. Растворитель выпаривали, добавляли воду, экстрагировали диэтиловым эфиром, сушили (Na2SO4) и упаривали. Неочищенное вещество растворяли в DMF (10 мл), добавляли карбонат калия (3,79 г) с последующим добавлением метилбромацетата (3,37 мл) и смесь перемешивали при комнатной температуре в течение 30 минут и при 60°С в течение 2 часов. Смесь охлаждали и выливали в смесь EtOAc и воды. Органическую фазу отделяли, промывали водой, водным карбонатом калия и рассолом, сушили (Na2SO4) и упаривали. Остаток перекристаллизовывали из смеси толуол/изогексан. Выход 1,8 г.
1H ЯМР CDCl3: δ 7.86 (d, 1Н), 6.69 (d, 1Н), 4.81 (s, 2H), 3.83 (s, 3H), 2.19 (s, 3Н).
2) Метиловый эфир [[4'-(этилсульфонил)-6-метил-5-нитро[1,1'-бифенил]-2-ил]окси]уксусной кислоты
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании продукта со стадии (1) (1,78 г) и 4-(этилтио)фенилбороновой кислоты (1,6 г). Выход 2,59 г.
1H ЯМР CDCl3: δ 8.02 (d, 1Н), 8.0 (d, 2H), 7.45 (d, 2H), 6.75 (d, 1Н), 4.65 (s, 2H), 3.76 (s, 3Н), 3.2 (q, 2H), 2.25 (s, 3Н), 1.36 (t, 3H).
3) [[4'-(Этилсульфонил)-6-метил-5-нитро[1,1'-бифенил]-2-ил]окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (6) примера 26 при использовании продукта со стадии (2). Выход 0,22 г.
1H ЯМР DMSO-d6: δ 13.16 (bs, 1Н), 8.06 (d, 1Н), 7.97 (d, 2H), 7.57 (d, 2H), 7.12 (d, 1Н), 4.8 (s, 2H), 3.38 (q, 2H), 2.14 (s, 3Н), 1.16 (t, 3Н).
MS: APCI (положительный): 412 (М+МеОН+Н+).
Пример 166
[[5-Хлор-4'-(этилсульфонил)-6-метил[1,1'-бифенил]-2-ил]окси]уксусная кислота

1) Метиловый эфир [[5-амино-4''(этилсульфонил)-6-метил[1,1'-бифенил]-2-ил]окси]уксусной кислоты
10% Pd/C (0,15 г) добавляли к раствору продукта со стадии (2) примера 165 в EtOAc (20 мл) и гидрировали при комнатной температуре и давлении 3 бар (0,3 МПа) в течение 2 часов. Смесь фильтровали через целит и фильтрат упаривали, получая соединение, указанное в подзаголовке. Выход 1,4 г.
1H ЯМР CDCl3: δ 7.95 (d, 2Н), 7.48 (d, 2Н), 6.7 (d, 1H), 6.65 (d, 1H), 4.4 (s, 2H), 3.71 (s, 3Н), 3.51 (bs, 2Н), 3.18 (q, 2Н), 1.88 (s, 3Н), 1.34 (t, 3H).
2) Метиловый эфир [[5-хлор-4'-(этилсульфонил)-6-метил[1,1'-бифенил]-2-ил]окси]уксусной кислоты
Хлорид меди (0,18 г) растворяли в ацетонитриле (6 мл), добавляли изопентиламин (0,24 мл) с последующим добавлением по каплям раствора продукта со стадии (1) в ацетонитриле (6 мл). Смесь перемешивали в течение 12 часов, упаривали и очищали посредством хроматографии на диоксиде кремния, элюируя смесью 30-50% диэтиловый эфир/изогексан. Выход 2,59 г.
1H ЯМР CDCl3: δ 7.97 (d, 2Н), 7.46 (d, 2Н), 7,34 (d, 1H), 6.65 (d, 1H), 4.32 (s, 2Н), 3.73 (s, 3Н), 3.19 (q, 2Н), 2.09 (s, 3Н), 1.35 (t, 3Н).
3) [[5-Хлор-4'-(этилсульфонил)-6-метил[1,1'-бифенил]-2-ил]окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (6) примера 26 при использовании продукта со стадии (2). Очищали посредством ВЭЖХ с обращенной фазой (МеСN/водн.NН4Сl). Выход 0,07 г.
1H ЯМР DMSO-d6: δ 7.94 (d, 2Н), 7.53 (d, 2Н), 7.44 (d, 1H), 6.91 (d, 1H), 4.64 (s, 2Н), 3.36 (q, 2Н), 2.03 (s, 3Н), 1.15 (t, 3Н).
MS: APCI (положительный) 367 (M+MeOH+H+).
Пример 167
[[4'-(Метилсульфонил)-2',5-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота

1) 4-Бром-1-(метилтио)-2-(трифторметил)6ензол
Изопентилнитрит (0,67 мл) по каплям добавляли к раствору 4-бром-2-(трифторметил)анилина (1,2 г) и диметилсульфида (0,45 мл) в ацетонитриле (12 мл). Реакционную смесь медленно нагревали до температуры дефлегмации и затем кипятили с обратным холодильником до тех пор, пока не прекращалось выделение газа. Летучие компоненты выпаривали, остаток абсорбировали на диоксиде кремния и продукт элюировали изогексаном. Выход 0,8 г.
1H ЯМР DMSO-d6: δ 7.59 (dd, 2H), 7.23 (d, 1H), 2.51 (s, 3H).
2) 4,4,5,5-Тетраметил-2-[4-(метилтио)-3-(трифторметил)фенил]-1,3,2-диоксаборолан
Pd2dba3 (0,135 г) и трициклогексилфосфин (0,199 г) растворяли в диоксане (20 мл) и перемешивали в течение 30 минут. Последовательно добавляли ацетат калия (0,867 г), бис(пинаконато)дибор (1,65 г) и продукт со стадии (1) и смесь нагревали при 90°С в течение 3 часов. Реакционную смесь охлаждали, упаривали, распределяли между диэтиловым эфиром и рассолом, разделяли, сушили (Na2SO4) и упаривали. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 10% диэтиловый эфир/изогексан. Выход 0,695 г.
1H ЯМР DMSO-d6: δ 7.31 (d, 2H), 2.53 (s, 3H), 1.3 (s, 12H).
3) 1,1-Диметилэтиловый эфир 2-бром-4-(трифторметил)феноксиуксусной кислоты
Соединение, указанное в заголовке, получали способом стадии (1) примера 1 при использовании 2-бром-4-(трифторметил)фенола.
1H ЯМР DMSO-d6: δ 6.8-7.83 (m, 3H), 4.65 (s, 2H), 1.48 (s, 9H).
4) 1,1-Диметилэтиловый эфир [[4'-(метилтио)-2',5-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты
Соединение, указанное в заголовке, получали способом стадии (2) примера 1 при использовании продуктов со стадий (2) и (3). Выход 0,564 г. Передавали на стадию (5) без идентификации.
5) 1,1-Диметилэтиловый эфир ([4'-(метилсульфонил)-2',5'-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусной кислоты
Продукт со стадии (4) (0,564 г) растворяли в 50% водном ацетоне (10 мл), добавляли бикарбонат натрия (0,94 г) с последующим добавлением раствора оксона (1,5 г) в воде (мл) и перемешивали в течение 3 часов. Реакционную смесь гасили водным метабисульфитом натрия, экстрагировали EtOAc, промывали водным карбонатом калия, сушили (Na2SO4) и упаривали, получая соединение, указанное в подзаголовке. Выход 0,32 г.
1H ЯМР DMSO-d6: δ 8.31 (d, 1H), 8.29 (s, 1H), 8.18 (dd, 1H), 7.83 (s, 1H), 7.81 (d, 1H), 7.32 (d, 1H), 4.9 (s, 2H), 3.36 (s, 2H), 1.41 (s, 9H).
6) [[4'-(Метилсульфонил)-2',5-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (6) примера 26 при использовании продукта со стадии (5). Выход 0,2 г.
1H ЯМР DMSO-d6: δ 8.33 (s, 1H), 8.3 (d, 1H), 8.19 (d, 1H), 7.83 (s, 1H), 7.81 (d, 1H), 7.34 (d, 1H), 4.92 (s, 2H), 3.36 (s, 2H).
MS: APCI (отрицательный) 441.
Пример 168
2-[4-Хлор-2-[4-метил-6-[метил(метилсульфонил)амино]-3-пиридинил]фенокси]-(2S)-пропановая кислота

1) N-(5-Бром-4-метил-2-пиридинил)метансульфонамид
5-Бром-4-метилпиридин-2-амин (1,56 г) растворяли в DCM (40 мл), добавляли триметиламин (1,4 мл) с последующим добавлением метансульфонилхлорида (1,9 г) и смесь перемешивали в течение 20 минут. Раствор промывали водой, сушили (MgSO4) и упаривали. Остаток растворяли в THF, обрабатывали TBAF (тетрабутиламмонийфторидом), перемешивали в течение 16 часов и упаривали. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 27% EtOAc/изогексан. Выход 1,3 г. Передавали на стадию (2) без идентификации.
2) N-(5-Бром-4-метил-2-пиридинил)-N-метилметансульфонамид
Продукт со стадии (1) (2,23 г), карбонат калия (2,33 г) и метилиодид (0,7 мл) перемешивали в DMF (20 мл) в течение 20 часов. Реакционную смесь гасили водой, экстрагировали EtOAc, сушили (MgSO4) и упаривали. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 30% EtOAc/изогексан. Выход 1,5 г. Передавали на стадию (3) без идентификации.
3) 2-[4-Хлор-2-[4-метил-6-[метил(метилсульфонил)амино]-3-пиридинил]фенокси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом примера 155 при использовании продукта со стадии (2) и продукта со стадии (4) примера 151. Выход 0,125 г.
1H ЯМР DMSO-d6: δ 8.18 (s, 1H), 7.26-7.44 (m, 3H), 6.94 (d, 1H), 4.8 (m, 1H), 3.32 (s, 3H), 3.2 (s, 3H), 2.2 (s, 3H), 1.32 (d, 3H).
MS: APCl (отрицательный) 397.
Пример 169
2-[2-[4-Метил-2-[(метилсульфонил)амино]-5-пиримидинил]-4-(трифторметил)фенокси]-(2S)-пропановая кислота

1) N-(5-Бром-4-метил-2-пиримидинил)метансульфонамид калия
Метансульфонилхлорид (0,75 мл) добавляли к раствору 5-бром-4-метил-2-пиримидинамина (1,8 г) в THF (60 мл) с последующим быстрым добавлением по каплям смеси 1 М трет-бутоксид калия/THF (20 мл). Через 30 минут полученный осадок отфильтровывали и сушили. Выход 3,2 г.
1H ЯМР DMSO-d6: δ 8.13 (s, 1H), 2.81 (s, 3H), 2.26 (s, 3H).
2) N-(5-Бром-4-метил-2-пиримидинил)-N-[[2-(триметилсилил)этокси]-метил]метансульфонамид
[2-(Хлорметокси)этил]триметилсилан (0,4 мл) добавляли к раствору продукта со стадии (1) в DMF (10 мл) и перемешивали в течение 20 минут. Смесь выливали в воду, экстрагировали диэтиловым эфиром, промывали рассолом, сушили (MgSO4) и упаривали. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 20% EtOAc/изогексан. Выход 0,53 г.
1H ЯМР DMSO-d6: δ 8.88 (s, 1H), 5.49 (s, 2H), 3.59-3.64 (m, 5H), 2.63 (s, 3Н), 0.9 (t, 2H), 0.0 (t, 9H)
3) 2-[2-[4-Метил-2-[(метилсульфонил)[[2-(триметилсилил)этокси]-метил]амино]-5-пиримидинил]-4-(трифторметил)фенокси]-(2S)-пропановая кислота
Соединение, указанное в заголовке, получали способом стадии (1) примера 144 при использовании продукта со стадии (2) и продукта со стадии (4) примера 146. Передавали на стадию (4) без идентификации.
4) 2-[2-[4-Метил-2-[(метилсульфонил)амино]-5-пиримидинил]-4-(трифторметил)фенокси]-(2S)-пропановая кислота
Продукт со стадии (3) обрабатывали TFA (20 мл) и перемешивали в течение 20 минут. TFA выпаривали и остаток очищали посредством ВЭЖХ с обращенной фазой (СН3СN/водн.ТFА).
1H ЯМР DMSO-d6: δ 8.84 (s, 1H), 7.77 (dd, 2H), 7.65 (d, 1H), 7.14 (d, 5H), 5.04 (q, 1H), 3.4 (s, 3Н), 2.3 (s, 3Н), 1.41 (d, 3Н).
MS: APCI (отрицательный) 418.
Пример 170
[(5-Хлор-3'-циано[1,1'-бифенил]-2-ил)окси]уксусная кислота

1) 5'-Хлор-2'-метокси-(1,1'-бифенил]-3-карбонитрил
Соединение, указанное в подзаголовке, получали способом стадии (2) примера 1 при использовании 3-иодбензонитрила и 5-хлор-2-метоксифенилбороновой кислоты. Выход 0,465 г.
1H ЯМР CDCl3: δ 7.82 (1H, t), 7.71 (1H, dt), 7.62 (1H, dt), 7.51 (1H, t), 7.32 (2H, dd), 7.26 (1H, m), 6.93 (1H, d), 3.81 (3Н, s).
2) 5'-Хлор-2'-гидрокси-[1,1'-бифенил]-3-карбонитрил
Раствор трибромида бора (1 М в дихлорметане, 6 мл) добавляли к перемешиваемому раствору продукта со стадии (1) в дихлорметане (10 мл) при 0°С. Через 15 минут смесь нагревали до комнатной температуры, перемешивай в течение 16 часов, затем выливали на лед. Смесь экстрагировали дихлорметаном, затем этилацетатом, органические слои объединяли, сушили и упаривали при пониженном давлении. Остаток очищали посредством хроматографии на диоксиде кремния, элюируя смесью 30-70% диэтиловый эфир/изогексан. Выход 0,415 г.
1H ЯМР CDCl3: δ 7.83 (1Н, s), 7.75 (1Н, d), 7.68 (1Н, d), 7.58 (1Н, t), 7.25 (2H, m), 6.89 (1H, d), 5.00 (1H, s).
3) 1,1-Диметилэтиловый эфир [(5-хлор-3'-циано[1,1'-бифенил]-2-ил)окси]уксусной кислоты
Соединение, указанное в подзаголовке, получали способом стадии (1) примера 1 при использовании продукта со стадии (2). Выход 0,60 г.
1H ЯМР CDCl3: δ 7.90 (1Н, s), 7.82 (1Н, d), 7.63 (1Н, d), 7.53 (1Н, td), 7.28 (2H, m), 6.78 (1Н, d), 4.52 (2H, s), 1.47 (10Н, s).
4) [(5-Хлор-3'-циано[1,1'-бифенил]-2-ил)окси]уксусная кислота
Соединение, указанное в заголовке, получали способом стадии (3) примера 1 при использовании продукта со стадии (3). Выход 0,265 г.
1H ЯМР DMSO-d6: δ 13.12 (1Н, s), 8.08 (1Н, s), 7.94 (1Н, d), 7.82 (1Н, d), 7.64 (1Н, t), 7.43 (2H, m), 7.10 (1Н, d), 4.78 (2H, s).
MS: APCI (отрицательный): 286.
Фармакологические данные
Анализ связывания лигандов
[3H]PGD2 приобретали у Perkin Elmer Life Sciences с удельной активностью 100-210 Ки/ммоль. Все другие химические вещества были аналитической степени чистоты.
Клетки НЕК (эмбриональные клетки почек человека), экспрессирующие rhCRTh2/Gα16, поддерживали стандартным образом на DMEM (модифицированной по способу Дульбекко среде Игла), содержащей 10% фетальную телячью сыворотку (HyClone), 1 мг/мл генетицина, 2 мМ L-глутамина и 1% заменимых аминокислот. Для получения мембран прикрепленные к субстрату трансфицированные НЕК клетки выращивали до конфлюэнтности в фабриках двухслойных тканевых культур (Fisher, каталоговый номер ТКТ-170-070Е). Максимальные уровни экспрессии рецепторов вызывали посредством добавления 500 мМ бутирата натрия в течение последних 18 часов культивирования. Прикрепленные к субстрату клетки однократно промывали фосфатно-солевым буферным раствором (PBS, 50 мл на клеточную фабрику) и отделяли посредством добавления 50 мл ледяного буфера для гомогенизации мембран [20 мМ HEPES (рН 7,4), 0,1 мМ дитиотреитол, 1 мМ ЭДТА, 0,1 мМ фенилметилсульфонилфторид и 100 мкг/мл бацитрацина] на клеточную фабрику. Клетки осаждали посредством центрифугирования при 220×g в течение 10 минут при 4°С, ресуспендировали в половине первоначального объема свежего буфера для гомогенизации мембран и разрушали, используя гомогенизатор Polytron, в течение 2×20 секунд, поддерживая пробирку на льду в течение всего времени. Неразрушенные клетки удаляли посредством центрифугирования при 220×g в течение 10 минут при 4°С, а фракцию мембран осаждали посредством центрифугирования при 90000×g в течение 30 минут при 4°С. Конечный осадок ресуспендировали в 4 мл буфера для гомогенизации мембран на используемую клеточную фабрику и определяли содержание белка. Мембраны хранили при -80°С в подходящих аликвотах.
Все анализы проводили в 96-луночных белых планшетах NBS с прозрачным дном Corning (Fisher). Перед анализом мембраны клеток НЕК, содержащие CRTh2, наносили на SPA PVT WGA шарики (Amersham). Для нанесения мембраны инкубировали с шариками с типичной нагрузкой 25 мкг мембранного белка на мг шариков при 4°С с постоянным перемешиванием в течение ночи. (Оптимальные наносимые концентрации определяли для каждой партии мембран.) Шарики осаждали посредством центрифугирования (800×g в течение 7 минут при 4°С), однократно промывали буфером для анализа (50 мМ HEPES рН 7,4, содержащий 5 мМ хлорида магния) и в конце ресуспендировали в буфере для анализа при концентрации шариков 10 мг/мл.
Каждый анализ включал 20 мкл 6,25 нМ [3H]PGD2, 20 мкл SPA шариков, насыщенных мембранами, оба в буфере для анализа, и 10 мкл раствора соединения или 13,14-дигидро-15-кетопростагландин D2 (DK-PGD2, для определения неспецифического связывания, Cayman chemical company). Соединения и DK-PGD2 растворяли в DMSO и разбавляли тем же растворителем до 100-кратной требуемой конечной концентрации. Добавляли буфер для анализа, получая конечную концентрацию 10% DMSO (соединения находились теперь в 10-кратной требуемой конечной концентрации), и именно этот раствор добавляли в планшет для анализа. Планшет для анализа инкубировали при комнатной температуре в течение 2 часов и подсчитывали на жидкостном сцинтилляционном счетчике Wallac Microbeta (1 минута на лунку).
Соединения формулы (I) обладают величиной IC50 менее (<) 10 мкМ.
В частности, соединение из примера 9 имеет pIC50=7,4, соединение из примера 25 имеет plC50=8,0, а соединение из примера 133 имеет plC50=8,2.
Дополнительные данные по активности заявленных соединений
Реферат
Изобретение относится к новым замещенным феноксиуксусным кислотам (I), в которых: Х представляет собой галоген, циано, нитро или С1-4алкил, который замещен одним или более чем одним атомом галогена; Y выбран из водорода, галогена или C1-С6алкила, Z представляет собой фенил, нафтил или кольцо А, где А представляет собой шестичленное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, или может представлять собой 6,6- или 6,5-конденсированный бицикл, содержащий один атом О, N или S, или может представлять собой 6,5-конденсированный бицикл, содержащий два атома О, причем фенил, нафтил или кольца А все, возможно, замещены одним или более чем одним заместителем, независимо выбранным из галогена, CN, ОН, нитро, COR9, CO2R6, SO2R9, OR9, SR9, SO2NR10R11, CONR10R11, NR10R11, NHSO2R9, NR9SO2R9, NR6CO2R6, NR9COR9, ! NR6CONR4R5, NR6SO2NR4R5, фенила или C1-6алкила, причем последняя группа, возможно, замещена одним или более чем одним заместителем, независимо выбранным из галогена; R1 и R2 независимо представляют собой атом водорода или С1-6алкильную группу, R4 и R5 независимо представляют собой водород, С3-С7циклоалкил или C1-6алкил, R6 представляет собой атом водорода или C1-6алкил; R8 представляет собой С1-4алкил; R9 представляет собой C1-6алкил, возможно, замещенный одним или более чем одним заместителем, независимо выбранным из галогена или фенила; R10 и R11 независимо представляют собой фенил, 5-членное ароматическое кольцо, содержащее два гетероатома, выбранных из N или S, водород, ! С3-С7циклоалкил или C1-6алкил, причем последние две группы, возможно, замещены одним или более чем одним заместителем, независимо выбранным из галогена или фенила; или R10 и R11 вместе с атомом азота, к которому они пр�
Формула

в котором X представляет собой галоген, циано, нитро или С1-4алкил, который замещен одним или более чем одним атомом галогена;
Y выбран из водорода, галогена или C1-С6алкила;
Z представляет собой фенил, нафтил или кольцо А, где А представляет собой шестичленное гетероциклическое ароматическое кольцо, содержащее один или два атома азота, или может представлять собой 6,6- или 6,5-конденсированный бицикл, содержащий один атом О, N или S, или может представлять собой 6,5-конденсированный бицикл, содержащий два атома О, причем фенил, нафтил или кольца А все возможно замещены одним или более чем одним заместителем, независимо выбранным из галогена, CN, ОН, нитро, COR9, CO2R6, SO2R9, OR9, SR9, SO2NR10R11, CONR10R11, NR10R11, NHSO2R9, NR9SO2R9, NR6CO2R6, NR9COR9, NR6CONR4R5, NR6SO2NR4R5, фенила или C1-6алкила, причем последняя группа возможно замещена одним или более чем одним заместителем, независимо выбранным из галогена;
R1 и R2 независимо представляют собой атом водорода или С1-6алкильную группу;
R4 и R5 независимо представляют собой водород, С3-С7циклоалкил или С1-6алкил;
R6 представляет собой атом водорода или C1-С6алкил;
R8 представляет собой С1-4алкил;
R9 представляет собой С1-6алкил, возможно замещенный одним или более чем одним заместителем, независимо выбранным из галогена или фенила;
R10 и R11 независимо представляют собой фенил, 5-членное ароматическое кольцо, содержащее два гетероатома, выбранных из N или S, водород, С3-С7циклоалкил или
С1-6алкил, причем последние две группы возможно замещены одним или более чем одним заместителем, независимо выбранным из галогена или фенила;
или
R10 и R11 вместе с атомом азота, к которому они присоединены, могут образовывать 3-8-членное насыщенное гетероциклическое кольцо, возможно содержащее один атом или более чем один атом, выбранный из О, S(O)n (где n=0, 1 или 2), NR8,
при условии, что соединение не представляет собой следующие соединения:


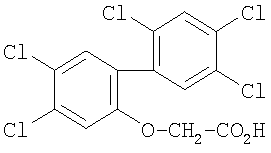




{[5-хлор-4'-(этилтио)бифенил-2-ил]окси}уксусной кислоты,
{[5-хлор-4'-(этилсульфонил)бифенил-2-ил]окси}уксусной кислоты,
[(4',5-дихлорбифенил-2-ил)окси]уксусной кислоты,
[(5-хлор-4'-цианобифенил-2-ил)окси]уксусной кислоты,
[(5-хлор-4'-метоксибифенил-2-ил)окси]уксусной кислоты,
(4-хлор-2-хинолин-8-илфенокси)уксусной кислоты,
[(5-хлор-3',4'-диметоксибифенил-2-ил)окси]уксусной кислоты,
2'-(карбоксиметокси)-5'-хлорбифенил-4-карбоновой кислоты,
{[5-хлор-4'-(метилсульфонил)бифенил-2-ил]окси}уксусной кислоты,
{[5-хлор-4'-(этилсульфонил)-2'-метилбифенил-2-ил]окси}уксусной кислоты,
{[4'-(метилтио)-5-(трифторметил)бифенил-2-ил]окси}уксусной кислоты,
{[4'-(метилсульфонил)-5-(трифторметил)бифенил-2-ил]окси}уксусной кислоты,
{[4'-(этилсульфонил)-2'-метил-5-(трифторметил)бифенил-2-ил]окси} уксусной кислоты,
(4-хлор-2-пиримидин-5-илфенокси)уксусной кислоты,
{2-[5-(аминосульфонил)пиридин-2-ил]-4-хлорфенокси} уксусной кислоты,
трифторацетата[2-(2-аминопиримидин-5-ил)-4-хлорфенокси]уксусной кислоты,
[4-хлор-2-(4-метил-2-морфолин-4-илпиримидин-5-ил)фенокси]уксусной кислоты,
{4-хлор-2-[2-(диметиламино)пиримидин-5-ил]фенокси}уксусной кислоты,
[4-хлор-2-(2-морфолин-4-илпиримидин-5-ил)фенокси]уксусной кислоты,
{4-хлор-2-[2-(метиламино)пиримидин-5-ил]фенокси}уксусной кислоты,
{2-[2-(бензиламино)пиримидин-5-ил]-4-хлорфенокси}уксусной кислоты,
[4-хлор-2-(2-пиперидин-1-илпиримидин-5-ил)фенокси]уксусной кислоты,
(4-хлор-2-{2-[метил(метилсульфонил)амино]пиримидин-5-ил}фенокси)уксусной кислоты,
[[2',5-дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-хлор-4'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-хлор-4'-(этилсульфонил)-2'-фтор[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(этилсульфонил)-2'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-хлор-4'-(этилсульфонил)-2'-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
2-[[5-хлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]-пропановой кислоты,
2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2R)-пропановой кислоты,
2-[[2',5-дихлор-4'-(этилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-хлор-4'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-2-метил-пропановой кислоты,
2-[[4'-(этилсульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-бутановой кислоты,
[4-хлор-2-[2-[(метилсульфонил)(фенилметил)амино]-5-пиримидинил]фенокси]-уксусной кислоты,
[4-хлор-2-[2-[(этилсульфонил)(фенилметил)амино]-5-пиримидинил]фенокси]-уксусной кислоты,
[2-[2-[ацетил(фенилметил)амино]-5-пиримидинил]-4-хлорфенокси]-уксусной кислоты,
[[4'-(этилсульфонил)-5-фтор-2'-метил[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(этилсульфонил)-4,5-дифтор-2'-метил[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(этилсульфонил)-3,5-дифтор-2'-метил[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(2-амино-5-метил-3-пиридинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-амино-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-амино-2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-хлор-4'-гидрокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(2,4-диметокси-5-пиримидинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',5-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-фтор-2'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-циано-2'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-хлор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',5'-диметил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-хлор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-фтор-6'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-фтор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(этиламино)карбонил]амино]-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-метил-4'-[[(метиламино)карбонил]амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(циклопропиламино)карбонил]амино]-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-метил-4'-[[(пропиламино)карбонил]амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',4'-диметил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-фтор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(аминокарбонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-фтор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',5'-дифтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5'-(аминосульфонил)-2'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-циано-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-хлор-2'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',5'-дифтор-4'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-фтор-5'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-фтор-4'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-метокси-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(аминосульфонил)-2',5'-дифтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-бензо[b]тиен-3-ил-4-(трифторметил)фенокси]-уксусной кислоты,
[2-(2-бензофуранил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-хлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-(1-метилэтил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3',4'-дифтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(1,3-бензодиоксол-5-ил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-этил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-фтор-5-(трифторметил)[1,1':4',1''-терфенил]-2-ил]окси]-уксусной кислоты,
[[4'-(трифторметокси)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2',3'-дихлор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(1,1-диметилэтил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(6-метокси-2-нафталинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-(этилтио)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-ацетил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(2-хлор-5-метил-4-пиридинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[5'-(аминосульфонил)-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(8-хинолинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[3'-циано-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-[4-метил-6-[метил(метилсульфонил)амино]-3-пиридинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[[2'-метил-5'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
3-метилового эфира 2'-(карбоксиметокси)-5'-(трифторметил)-[1,1'-бифенил]-3-карбоновой кислоты,
2-метилового эфира 2'-(карбоксиметокси)-5'-(трифторметил)-[1,1'-бифенил]-2-карбоновой кислоты,
[[5-(трифторметил)[1,1':4',1''-терфенил]-2-ил]окси]-уксусной кислоты,
[[3'-фтор-2',4'-диметил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-нитро-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-хлор-2'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-(трифторметил)[1,1':3',1''-терфенил]-2-ил]окси]-уксусной кислоты,
4-метилового эфира 2'-(карбоксиметокси)-5'-(трифторметил)-[1,1'-бифенил]-4-карбоновой кислоты,
[[4'-нитро-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-(трифторметил)-3'-[(трифторметил)тио][1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-(трифторметил)-4'-[(трифторметил)тио][1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-метил-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(3-пиридинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[2'-фтор-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[2'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-метокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-(этилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[3'-пропокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-пропокси-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(2-амино-4-метил-5-пиримидинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-циано-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4',5-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-(2-нафталинил)-4-(трифторметил)фенокси]-уксусной кислоты,
[[4'-(1-пирролидинилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил] окси]-уксусной кислоты,
[[4'-[(диметиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(фенилметил)амино]сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(2,2,2-трифторэтил)амино]сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[[(5-метил-2-тиазолил)амино]сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(фениламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(диэтиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(циклопропиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(аминосульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(метиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-[(4-метил-1-пиперазинил)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[2-[4-метил-2-(5-метил-1,1-диоксидо-1,2,5-тиадиазолидин-2-ил)-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[4-метил-2-[метил(метилсульфонил)амино]-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
аммониевой соли [2-[2-(1,1-диоксидо-2-изотиазолидинил)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[2-(3-гидрокси-1-азетидинил)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[4-метил-2-(4-метил-1-пиперазинил)-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[4-метил-2-(1-пирролидинил)-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[2-(диметиламино)-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[5-метил-2-[метил(метилсульфонил)амино]-4-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[2-[2-[[(диметиламино)сульфонил]амино]-4-метил-5-пиримидинил]-4-(трифторметил)фенокси]-уксусной кислоты,
[[2'-хлор-4'-[(метоксикарбонил)амино]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
2-[[2'-хлор-4'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S')-пропановой кислоты,
2-[[3'-циано-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[4'-[(диметиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-хлор-4'-[(диметиламино)сульфонил]-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-фтор-4'-(метилсульфонил)-5-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[2',5-дихлор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[5-хлор-4'-[(диметиламино)сульфонил][1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[2',5-дихлор-4'-[(диметиламино)сульфонил][1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[(5-хлор-3'-циано[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[5-хлор-4'-[(диметиламино)сульфонил]-2'-фтор [1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[5-хлор-4'-(4-морфолинилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[5-хлор-2'-фтор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[4'-(1-азетидинилсульфонил)-5-хлор[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[5-хлор-2'-метил-4-(1-пирролидинилкарбонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[(2',4'-дихлор-5-циано[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[5-циано-2'-фтор-4'-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
натриевой соли 2-[(3'-циано-5-фтор[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
натриевой соли 2-[(2',4'-дихлор-5-фтор[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-хлор-5-фтор-4'-(метилсульфонил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
2-[[2'-хлор-5-фтор-5'-(трифторметил)[1,1'-бифенил]-2-ил]окси]-(2S)-пропановой кислоты,
[[4'-(этилсульфонил)-6-метил-5-нитро[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[5-хлор-4'-(этилсульфонил)-6-метил[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
[[4'-(метилсульфонил)-2',5-бис(трифторметил)[1,1'-бифенил]-2-ил]окси]-уксусной кислоты,
2-[4-хлор-2-[4-метил-6-[метил(метилсульфонил)амино]-3-пиридинил]фенокси]-(2S)-пропановой кислоты,
2-[2-[4-метил-2-[(метилсульфонил)амино]-5-пиримидинил]-4-(трифторметил)фенокси]-(2S)-пропановой кислоты,
[(5-хлор-3'-циано[1,1'-бифенил]-2-ил)окси]-уксусной кислоты
и их фармацевтически приемлемых солей.
Документы, цитированные в отчёте о поиске
2,5-дизамещенные тетрагидрофураны или тетрагидротиофены, фармацевтическая композиция на их основе и способы лечения

Комментарии