Соединения и фармацевтическая композиция - RU2091369C1
Код документа: RU2091369C1
Чертежи

Описание
Изобретение относится к новым производным арил- и гетероарилвинилена, к способу их получения, к содержащим их фармацевтическим композициям и к применению их в качестве терапевтических средств.
Данное изобретение
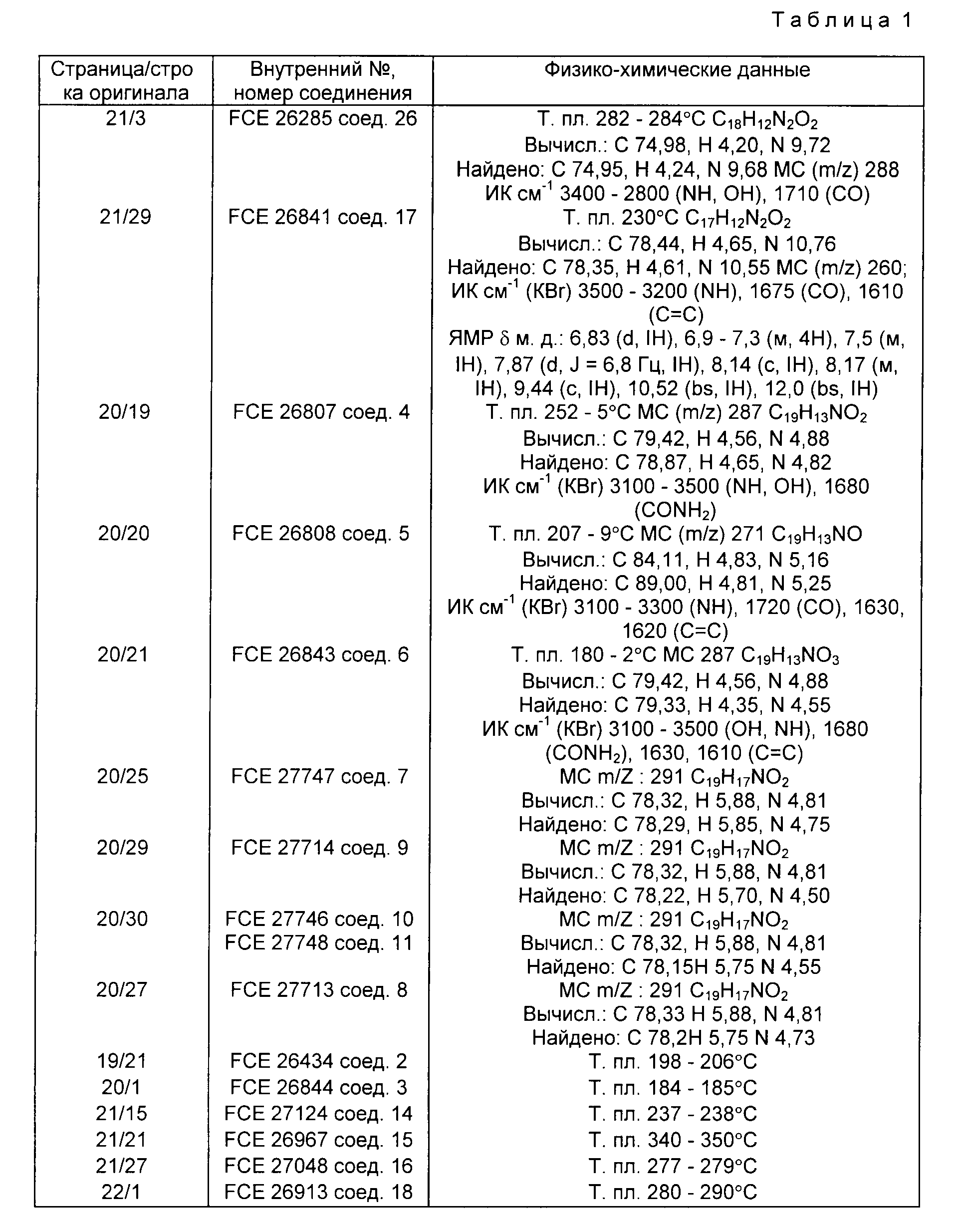
обеспечивает соединения, представляемые следующей общей формулой (I)
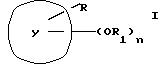
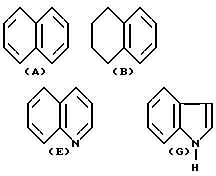
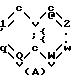
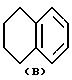
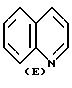
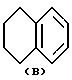
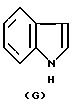
где Y это бициклическая система, выбранная из (A), (B), (E) и (G)
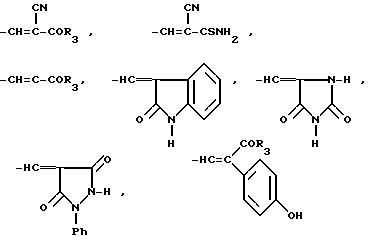
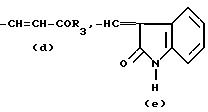
R это группа формулы (a), (c), (d), (e), (f), (g), (i) или (j)

в которой R3- это OH или NH2, а Ph обозначает фенил, R1 это водород или C2-C6-алканоил, и n равно 0, 1 или 2, или их фармацевтически-приемлемые соли, причем каждый из заместителей R и OR1 может независимо располагаться либо на арильном, либо на гетероарильном остатке бициклической системы (A), (E) и (G), тогда как в бициклической кольцевой системе (B) замещенным может быть только бензольный остаток, и с дополнительным условием, что (i), когда Y является кольцевой системой (A), R отличается от группы (a) или (d), определенных выше, (ii), когда одновременно Y является кольцевой системой (B), а R является группой (d), как определено выше, в которой R3 это OH, то n отлично от нуля, (iii), когда одновременно Y является кольцевой системой (G) и R является группой (e), как определено выше, связанной с индольным кольцом в положении 2 или 3, то n отлично от нуля, и (IV), когда одновременно Y является кольцевой системой (E), R является группой (d), как определено выше, в которой R3 это OH, связанный с хинолиновым кольцом (E) в положении 2, и группа (OR1)n, в которой R1 это водород или C1-C6-алкил и n равно 1, связана с хинолиновым кольцом (E) в положении 8, то R2 отличен от водорода.
Данное изобретение охватывает также все возможные изомеры, стереоизомеры, в частности, Z и E изомеры и их смеси, а также метаболиты и предшественники метаболитов, или биопредшественники (иначе называемые про-лекарства), соединений формулы (I).
Заместитель R предпочтительно присоединяется в положении 1 или 2 кольцевой системы (A) и (B), в положении 5 или 8 кольцевой системы (E) и в положении 3 или 7 кольцевой системы (G).
В случае, когда Y бициклическая кольцевая система соответствует определению (A) или (E), группы -OR1 предпочтительно связаны с тем же бензольным остатком, что и группа R.
В кольцевых системах (A) и (B) заместитель -OR1 предпочтительно присоединяется в положении 1, 2, 3, 4, 5 или 8, в частности, в положении 1, 2 или 3 или 4. В кольцевой системе (E) заместитель -OR1 предпочтительно присоединяется в положении 3, 4, 5, 6, 7 или 8, в частности, в положении 5, 6, 7 или 8. В кольцевой системе (G) заместитель -OR1предпочтительно присоединяется в положении 3, 4, 5, 6 или 7, в частности, в положении 4, 5, 6 или 7. Конечно, в кольцевых системах (A) -(G) в одном и том же положении может присоединяться только один из заместителей R и -OR1.
В случае, когда n равно 2 или 3, группы -OR1 могут быть одинаковыми или различными.
Алкильные группы, а также алкильные остатки в алканоильных группах, могут представлять собой разветвленную или прямую алкильную цепь. Алкильная группа C1-C6 предпочтительно представляет собой алкильную группу -C1-C4, например, метил, этил, пропил, изо-пропил, бутил, втор-бутил или трет-бутил, в частности, это метил или этил. Алканоильная группа C2-C6 предпочтительно это алканоильная группа C2 -C4, в частности, это ацетил, пропионил или бутирил.
Фармацевтически приемлемые соли соединений по данному изобретению включает соли присоединения с кислотами, с минеральными, например, такими, как азотная, хлористоводородная, бромистоводородная, серная, хлорная и фосфорная кислоты, или с органическими, например, с уксусной, пропионовой, гликолевой, молочной, щавелевой, малоновой, малеиновой, яблочной, винной, лимонной, бензойной, коричной, миндальной и салициловой кислотами, а также соли с неорганическими основаниями, например, щелочных металлов, в частности, натрия или калия, или щелочно-земельных металлов, в частности, кальция или магния, либо соли с органическими основаниями, например, с алкиламинами, в частности, с триэтиламином.
Как уже
говорилось, данное изобретение включает также
фармацевтически приемлемые био-предшественники (иначе называемые про-лекарствами) соединений формулы (I), т.е. соединения, формула которых отличается от
вышеприведенной формулы (I), но которые, тем
не менее, при введении в организм человека in vivo превращаются, непосредственно или косвенно, в соединение формулы (I). Предпочтительными соединениями по
данному изобретению являются формулы (I), у
которых Y представляет собой моноциклическую или био-циклическую кольцевую систему, выбранную из ряда (A)-(G), R это группа формулы (a), (с), (d), (e), (i)
или (j), в соответствии с данным выше
определением;
R1 это водород или алканоил C2-C4, и
n, как определено выше, а также их фармацевтически
приемлемые соли.
Более
предпочтительными соединениями согласно данному изобретению являются соединения формулы (1), в которой
Y это бициклическая кольцевая система формулы (А),
(B) или (E) в соответствии с данным
выше определением;
R это группа формула (a), (d), (e), (i) или (j), как определено выше;
R1 это водород;
n это ноль или 1, а
также фармацевтически приемлемые их
соли.
Конкретными примерами соединений согласно данному изобретению являются следующие соединения, которые могут представлять собой либо
индивидуальные Z-или B-диастереомеры, либо Z,
E смеси, указанных диастереомеров:
2-циано-3-(2-гидроксинафтил-1)акриламид,
2-циано-3-(3-гидроксинафтил-1)акриламид,
2-циано-3-(4-гидроксинафт-1-ил)акриламид,
2-циано-3-(1-гидроксинафт-2-ил)акриламид,
2-циано-3-(3-гидроксинафт-2-ил)акриламид,
2-циано-3-(4-гидроксинафт-2-ил)акриламид,
2-циано-3-(2-гидроксинафт-1-ил)акриловая
кислота,
2-циано-3-(3-гидроксинафт-1-ил)акриловая кислота,
2-циано-3-(4-гидроксинафт-1-ил)акриловая кислота,
2-циано-3-(1-гидроксинафт-2-ил)акриловая кислота,
2-циано-3-(3-гидроксинафт-2-ил)акриловая кислота,
2-циано-3-(4-гидроксинафт-2-ил)акриловая кислота,
2-циано-3-(2-гидроксинафт-1-ил)тиоакриламид,
2-циано-3-(3-гидроксинафт-1-ил)тиоакриламид,
2-циано-3-(4-гидроксинафт-1-ил)тиоакриламид,
2-циано-3-(1-гидроксинафт-2-ил)тиоакриламид,
2-циано-3-(8-гидроксинафт-2-ил)тиоакриламид,
2-циано-3-(4-гидроксинафт-2-ил)тиоакриламид,
2-(4-гидроксефенил)-3-(нафт-1-ил)акриламид;
2-(4-гидроксифенил)-3-(нафт-2-ил)акриламид;
2-(4-гидроксифенил)-3-(нафт-1-ил)акриловая кислота;
2-(4-гидроксифенил)-3-(нафт-2-ил)акриловая кислота;
2-циано-3-(2-гидрокси-5,
6,7,8-тетрагидронафт-1-ил)акриламид;
2-циано-3-(3-гидрокси-5,6,7,8-тетрагидронафт-1-ил)акриламид;
2-циано-3-(4-гидрокси-5,6,7,8-тетрагидронафт-1-ил)акриламид;
2-циано-3-(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриламид;
2-циано-3-(3-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриламид;
2-циано-3-(4-гидрокси-5,6,7,8-тетгаридронафт-2-ил)акриламид;
2-циано-3-(2-гидрокси-5,6,7,8-тетрагидронафт-1-ил)акриловая кислота;
2-циано-3-(3-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)акриловая кислота;
2-циано-3-(4-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)акриловая кислота;
2-циано-3-(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриловая кислота;
2-циано-3-(3-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриловая кислота;
2-циано-3-(4-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриловая кислота;
2-циано-3-(2-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)тиоакриламид;
2-циано-3-(3-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)тиоакриламид;
2-циано-3-(4-гидрокси-5,6,7,8-тетрагидронафт-1-ил)тиоакриамид;
2-циано-3-(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)тиоакриламид;
2-циано-3-(3-гидрокси-5,6,7,8,-тетрагидронафт-2-ил)тиоакриламид;
2-циано-3-(4-гидрокси-5,6,7,
8-тетрагидронафт-2-ил)тиоакриламид;
2-(4-гидроксифенил)-3-(5,6,7,
8-тетрагидронафт-1-ил)акриламид;
2-(4-гидроксифенил)-3-(5,6,7,8-тетрагидронафт-2-ил)акриламид;
2-(4-гидроксифенил)-3-(5,6,7,8-тетрагидронафт-1-ил)акриловая кислота;
2-циано-3-(3-гидроксихинолин-2-ил)акриламид;
2-циано-3-(4-гидроксихинолин-2-ил)акриламид;
2-циано-3-(2-гидроксихинолин-3-ил)акриламид;
2-циано-3-(4-гидроксихинолин-3-ил)акриламид;
2-циано-3-(2-гидроксихинолин-4-ил)акриламид;
2-циано-3-(3-гидроксихинолин-4-ил)акриламид;
2-циано-3-(3-гидроксихинолин-2-ил)акриловая кислота;
2-циано-3-(4-гидроксихинолин-2-ил)акриловая кислота;
2-циано-3-(2-гидроксихинолин-3-ил)акриловая кислота;
2-циано-3-(4-гидроксихинолин-3-ил)акриловая кислота;
2-циано-3-(2-гидроксихинолин-4-ил)акриловая кислота;
2-циано-3-(3-гидроксихинолин-4-ил)акриловая кислота;
2-циано-3-(3-гидроксихинолин-2-ил)тиоакриламид;
2-циано-3-(4-гидроксихинолин-2-ил)тиоакриламид;
2-(4-гидроксифенил)-3-(5,
6,7,8-тетрагидронафт-2-ил)-акриловая кислота;
2-циано-3-(2-гидроксихинолин-3-ил)тиоакриламид;
2-циано-3-(4-гидроксихинолин-3-ил)тиоакриламид;
2-циано-3-(2-гидроксихинолин-4-ил)тиоакриламид;
2-циано-3-(3-гидроксихинолин-4-ил)тиоакриламид;
2-(4-гидроксифенил)-3-(хинолин-2-ил)акриламид;
2-(4-гидроксифенил)-3-(хинолин-4-ил)акриламид;
2-(4-гидроксифенил)-3-(хинолин-4-ил)акриламид;
2-(4-гидроксифенил)-3-(хинолин-2-ил)акриловая кислота;
2-(4-гидроксифенил)-3-(хинолин-3-ил)акриловая кислота;
2-(4-гидроксифенил)-3-(хинолин-4-ил)акриловая кислота;
3-[(3-гидрокси-1-нафтил)метилен]-2-оксиндол;
3-[(4-гидрокси-1-нафтил)метилен]-2-оксиндол;
3-[(1-гидрокси-2-нафтил)метилен]-2-оксиндол;
3-[(4-гидрокси-2-нафтил)метилен]-2-оксиндол;
3-[(3-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)метилен]-2-оксиндол;
3-[(4-гидрокси-5,6,
7,8-тетрагидронафт-1-ил)метилен]-2-оксиндол;
3-[(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)метилен]-2-оксиндол;
3-[(4-гидрокси-5,6,7,8-тетрагидронафт-2-ил)метилен]-2-оксиндол;
3-[(7-гидроксихинолин-5-ил)метилен]-2-оксиндол;
3-[(8-гидроксихинолин-5-ил)метилен]-2-оксиндол;
3-[(7-гидроксихинолин-6-ил)метилен]-2-оксиндол;
3-[(8-гидроксихинолин-6-ил)метилен]-2-оксиндол;
а также, в случае необходимости, их фармацевтически приемлемые соли.
Соединения согласно данному изобретению, а также их
фармацевтически приемлемые соли можно получить способом, включающим конденсацию альдегида формулы (II)
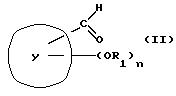
где Y, R1 и n, такие как определено выше, с соединением формулы (a'), (c'), (d'), (e'), (f'), (g'), (i') или (j'), соответственно.

где R3 и Ph такие, как определено выше, и, если требуется, превращение соединения формулы (I) в другое соединение формулы (I), и/или, если требуется, превращение соединения формулы(I) в его фармацевтически приемлемую соль, и/или, если требуется, превращение соли в свободное соединение, и/или, если требуется, разделение смеси изомеров соединения формулы (I) на индивидуальные изомеры. Взаимодействие соединения формулы (II) с соединением формулы (a'), (c'), (d'), (e'), (f'), (g') или (i') представляет собой аналогичный процесс, который можно осуществлять в соответствии с известными методами, как будет описано ниже; предпочтительно в присутствии основного катализатора, например пиридина, пиперидина, диметиламина, либо подходящего гидроксида или алкоксида щелочного металла.
Например, реакцию соединения формулы (II) с соединением формулы (a'), (c'), (e'), (f') или (g') можно проводить, соответственно, в условиях протекания реакций Кневенагеля, как они описаны, например, у J.Jones b Organic Reactions 15, 204 (1967). Подходящими катализаторами являются органические основания, такие как пиридин, пиперидин или диэтиламин. Конденсацию можно проводить в инертном органическом растворителе, например, в пиридине, этаноле, металоне, бензоле или диоксане, при температурах приблизительно в диапазоне от 0 до 100oC. В предпочтительном варианте реакцию проводят в теплом этанольном растворе в присутствии пиперидинового катализатора.
Реакцию между соединением формулы (II) и соединением формулы (d') можно проводить можно проводить по способу Кневенагеля, описанному выше, но в особых условиях. В частности, применяются более высокие температуры ввиду того, что в процессе конденсации происходит также некарбоксилирование. Например, конденсацию можно проводить в среде органического основания, такого как пиридин (который одновременно является и растворителем, и катализатором), при температуре приблизительно от 50 до 140oC.
Реакцию между соединением формулы (II) и соединением формулы (i') можно осуществлять в соответствии с описанием R.T. Buchles et al, J.Am. Chem. Soc. 73, 4972 (1951). По этому методу взаимодействуют эквимолярные количества ароматического альдегида и финилацетильного производного в 3-5 моль-эквивалентах уксусного ангидрида в присутствии примерно 1 моль-эквивалента триэтиламина, в интервале температур приблизительно от 100 до 140oC.
Соединение формулы (II) можно превратить в другое соединение формулы (I) по известным способам. Например, можно, используя хорошо известные в органической химии методы, осуществлять де-этерификацию соединения формулы (I), в котором один или более заместителей R1 представляют собой алкил C1-C6, так чтобы получилось соединение формулы (I), у которого один или более заместителей представляют собой водород. В случае метил-фенольного эфира можно осуществить расщепление с помощью, например, трибромида бора, согласно описанию J.E.N. mcOncie, Tetrahedron 24, 2289 (1968). Рекомендуется использовать около 1 моль трибромида бора на каждую эфирную группу, при одном дополнительном моле реагента на каждую группу, в состав которой входит обладающий потенциальной основностью азот или кислород. Реакцию можно проводить в инертном органическом растворителе, таком как метиленхлорид, пентан или бензол, в инертной атмосфере, например в азоте, в интервале температур приблизительно от -78oC до комнатной.
Ацилирование соединения формулы (I), в котором один или более заместителей R1 представляют собой водород, в результате чего получается соответствующее соединение формулы (I), в котором один или более заместителей R1 представляет собой группу алканоила C2-C6, можно осуществить путем взаимодействия его с реакционноспособным производным подходящей карбоновой кислоты, например, ангидридом или галогенидом, в присутствии основного агента, в интервале температур приблизительно от 0 до 50oC. В предпочтительном исполнении ацилирование осуществляют путем реакции с соответствующим ангидридом в присутствии органического основания, например, пиридина. Аналогичным образом можно провести, согласно известным способам, превращение соединения формулы (I), в котором R это группа формулы

Возможное образование соли соединения формулы (I), а также превращение соли в свободное соединение и разделение смеси изомеров на индивидуальные изомеры можно проводить обычными способами.
Например, разделить смесь геометрических изомеров, в частности, цис- и транс-изомеров, можно дробной кристаллизацией из подходящего растворителя или хроматографией колоночной или жидкостной высокого давления.
Соединения формулы (II) можно получить известными способами из
соединений формулы (III)
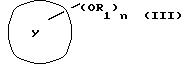
где Y, R1 и n как определено выше.
Можно, например, обработать фенольное соединение формулы (III) хлороформом и гидроксидами щелочных металлов в водном или водно-спиртовом растворе в соответствии с хорошо известным способом Раймера-Тимана. В случае, когда исходным веществом является ароматический метиловый эфир, можно применять способ, описанный N. S. Narasimhan et al, b Tetrahedron 31, 1005 (1975). Соответственно, метиловый эфир формулы (III) образует соединение с литием при взаимодействии с бутиллитием в эфире в реакторе с дефлегматором. В результате обработки металлоорганического соединения N-метилформанилидом получается формильное производное. Соединения формулы известны или могут быть получены из известных соединений известными способами.
Фармакология
Соединения согласно данному изобретению
обладают особой
способностью ингибировать активность тирозинкиназы. В связи с этим они могут оказаться полезными для лечения рака и других патологических пролиферативных состояний.
Проведенные недавно исследования молекулярной основы трансформации в неоплазмы позволили идентифицировать семейство генов, называемых онкогенами, ненормальная экспрессия которых вызывает образование опухоли.
Например, РНК вирусов опухоли обладают такой последовательностью онкогенов, экспрессия которой определяет превращение инфицированных клеток в неоплазму. Некоторые из их кодируемых онкогенами протеинов, такие как pp60V-src, p70gag-yes, p130gag-fps и p70gag-fgr, проявляют активность протеинтирозинкиназы, то есть катализируют перенос γ -фосфата от аденозин-трифосфата (АТФ) к тирозиновым остаткам на протеиновом субстрате. В нормальных клетках активность тирозинкиназы проявляют некоторые рецепторы факторов роста, например, PDGF, EGF, a-TGF и инсулин. Связывание фактора роста (СГ) активирует автофосфорилирование тирозинкиназы рецептора и фосфорилирование ближайших молекул на тирозине.
Полагают, следовательно, что фосфорилирование этих рецепторов тирозинкиназы играет важную роль в трансдукции сигнала, и что основной функцией активности тирозинкиназы в нормальных клетках является регулирование роста клетки. Нарушение этой активности в результате действия кодируемой онкогенами тирозинкиназы, которая либо производится в избытке, и/или обладает измененной субстратоспецифичностью, может привести к потере контроля роста и/или к неопластической трансформации. Соответственно, специфичный ингибитор тирозинкиназ может оказаться полезным при исследовании механизма канцерогенеза, пролиферации и дифференциации и может оказаться эффективным средством предупреждения и хемотерапии рака и других патологических состояний пролиферации. Тирозинспецифичная активность протеинкиназы этих соединений доказывает, например, их активность in vitro, описанных B. Ferguson et al в J. Biol. Chem. 1985, 260, 3652.
Используемый фермент представляет собой тирозинкиназу Абельсона p60v-abl. Его получают и выделяют по модифицированному методу B. Ferguson et al (ibidem). В качестве субстрата использовали α--казеин или (Yal5)-ангиотензин. Ингибитор предварительно термостатируют с ферментом в течение 5 мин при 25oC. Реакцию проводят в следующих условиях: 100 мМ MOPS-буфера, 10 мМ MgCl2, 2μM (γ -32P) АТФ (6 Ci/ммоль), 1 мг/мл α-казеина [альтернативным субстратом является (Yal5)-ангиотензин] и 7,5 mг/мл фермента в общем объеме 30 mл и при pH 7,0.
Реакционную смесь термостатируют при 25oC в течение 10 мин. Осаждение белка под действием трихлоруксусной кислоты сопровождается быстрой фильтрацией и количественной оценкой фосфорилированного субстрата с помощью сцинциляционной жидкости. В альтернативном варианте реакционную смесь подвергают электрофорезу в среде додецилсульфат натрия/полиакриламид и измеряют фосфорилированный субстрат с помощью авторадиографии или подсчетом количества P32 в вырезанном пятне.
Ввиду высокой активности и низкой токсичности соединения согласно данному изобретению можно без опасения использовать в медицине.
Обнаружено, например, что приблизительная острая токсичность (LD50) соединений данного изобретения, определяемая на мышах путем одноразового введения увеличивающихся доз и измерения на седьмой день после обработки, оказалась пренебрежимо малой.
Соединения согласно данному изобретению можно вводить в виде разнообразных дозированных форм, например, перорально, в виде таблеток, капсул, таблеток с сахарным или пленочным покрытием, жидких растворов или суспензий; радикально, в виде суппозиториев; парентерально, например, внутримышечно или путем внутривенных инъекций или впрыскиваний; либо местно.
Дозировка зависит от возраста, веса, состояния пациента и способа введения; например, при пероральном введении взрослому человеку дозировка может колебаться приблизительно от 10 до 150-200 мг на дозу, причем 1-5 раз в день.
Конечно, эти рекомендации по дозировке можно изменять для получения оптимального терапевтического эффекта.
Данное изобретение включает фармацевтические композиции, в состав которых входят соединение по данному изобретению в сочетании с подходящим эксципиентом (который может служить носителем или разбавителем).
Фармацевтические композиции, в состав которых входят соединения по данному изобретению, обычно получают традиционными методами и вводят в подходящей в фармацевтическом отношении форме.
Например, твердая форма может содержать вместе с активным соединением разбавители, например, лактозу, декстрозу, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазки, например, кремнезем, тальк, стеариновую кислоту, стеарат магния или кальция, и/или полиэтиленгликоли; связующее, например, крахмал, гуммиарабик, желатин, метилцеллюлозу, карбоксиметилцеллюлозу, или поливинилпирролидон; дезинтегранты, например, крахмал, альгиновую кислоту, альгинаты или крахмал-гликолят натрия, шипучие смеси; красители; подслащивающие добавки; смачивающие добавки, такие как лецитин, полисорбаты, лаурилсульфаты; и, наконец, нетоксичные и фармакологически инертные вещества, применяемые в фармацевтических формулах. Указанные фармацевтические препараты можно производить известными способами, например, смешиванием, гранулированием, таблетированием с нанесением сахарного или пленочного покрытия.
Жидкие дисперсии для перорального употребления могут представлять собой, например, сиропы, эмульсии и суспензии.
Сироп может содержать в качестве носителя, например, сахарозу или сахарозу в смеси с глицерином и/или маннитом, и/или сорбитом. В состав суспензий и эмульсий может входить в качестве носителя, например, натуральная камедь, агар, альгинат натрия, пектин, метилцеллюлоза, карбоксиметилцеллюлоза или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут включать вместе с активным соединением фармацевтически приемлемый носитель, например, масло какао, полиэтиленгликоль, эфир жирной кислоты и полиоксиэтилен-сорбитана в качестве поверхностно активной добавки или лецитин.
Композиции для местного применения, например, кремы, лосьоны или пасты, можно приготовить смешиванием активного ингредиента с обычным маслянистым или эмульгирующим эксципиентом.
Пример 1.
2-циано-3-(3-гидроксихинолин-5-ил)акриламид (FCE 26283, соединение I) [I, Y Е, R a, R1 R2 H, n 1, R3 NH2]
Раствор
5-формил-8-гидроксихинолина (173 мг, 1 ммоль), цианоацетамида (92 мг, 1,1 ммоль) и пиперидина (60 мг, 0,7 ммоль) в абсолютном этаноле (20 мл) нагревали в
течение 4 ч при 50oC. Реакционную
смесь охладили до 0-5oC, отфильтровали осадок, остаток промыли охлаждаемым льдом этанолом, а затем высушили под вакуумом.
Таким образом получили указанное в названии чистое соединение с выходом 70% (167 г). Соединение более высокой чистоты получают кристаллизацией из этанола, температура плавления 275oC.
C13H9N3
O2
Рассчитано: C 65,27, H 3,79, N 17,58.
Найдено: C 65,15, H 3,65, N 17,49.
MC v/z 239
ИК см-1 (KBr): 3100-3600 (NH, OH), 2200
(CN), 1690 (CONH2), 1610, 1590, 1560, 1510 (C=C).
По вышеописанной методике могут быть получены следующие соединения:
2-циано-3-(2-гидроксинафт-1-ил)акриламид, (FCE
26434, соединение 2)
2-циано-3-(3-гидроксинафт-2-ил)акриламид,
2-циано-3-(4-гидроксинафт-1-ил)акриламид,
2-циано-3-(1-гидроксинафт-2-ил)акриламид, (FCE 26844, соединение
3)
2-циано-3-(3-гидроксинафт-2-ил)акриламид,
2-циано-3-(4-гидроксинафт-2-ил)акриламид,
2-циано-3-(2-гидрокси-5,6,7,8-тетрагидронафт-1-ил)акриламид,
2-циано-2-(3-гидрокси-5,6,7,8-тетрагидронафт-1-ил)акриламид,
2-циано-3-(4-гидрокси-5,6,7,8-тетрагидронафт-1-ил)акриламид,
2-циано-3-(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриламид,
2-циано-3-(3-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриламид,
2-циано-3-(4-гидрокси-5,6,7,
8-тетрагидронафт-2-ил)акриламид,
2-циано-3-(3-гидроксихинолин-2-ил)акриламид,
2-циано-3-(4-гидроксихинолин-2-ил)акриламид,
2-циано-3-(2-гидроксихинолин-3-ил)акриламид,
2-циано-3-(4-гидроксихинолин-3-ил)акриламид,
2-циано-3-(2-гидроксихинолин-4-ил)акриламид,
2-циано-3-(3-гидроксихинолин-4-ил)акриламид,
3-[(1-нафтил)метилен]-2-оксиндол,
3-[(2-гидрокси-1-нафтил)метилен]-2-оксиндол,
3-[(3-гидрокси-1-нафтил)метилен]-2-оксиндол,
3-[(4-гидрокси-1-нафтил)метилен]-2-оксиндол (FCE
26807, соединение 4),
3-[(2-нафтил)метилен]-2-оксиндол (FCE 26808, соединение 5),
3-[(1-гидрокси-2-нафтил)метилен]-2-оксиндол (FCE 26843, соединение 6),
3-[3-гидрокси-2-нафтил)метилен]-2-оксиндол,
3-[4-гидрокси-2-нафтил)метилен]-2-оксиндол,
3-[(5,6,7,8-тетрагидронафт-1-ил)метилен]-2-оксиндол,
3-[(2-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)метилен] -2-оксиндол (FCE 27747, соединение 7)
3-[(3-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)метилен]-2-оксиндол,
3-[(4-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)метилен] -2-оксиндол, (FCE 27713, соединение 8)
3-[(5,6,7,
8-тетрагидронафт-2-ил)метилен]-2-оксиндол,
3-[(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)метилен]
-2-оксиндол, (FCE 27714, соединение 9),
3-[(3-гидрокси-5,6,7,
8-тетрагидронафт-2-ил)метилен] -2-оксиндол, E изомер: FCE 27746, соединение 10,
Z изомер: FCE 27748, соединение II
3-[(4-гидрокси-5,6,7,8-тетрагидронафт-2-ил)метилен-]-2-оксиндол,
3[(хинолин-5-ил)метилен]-2-оксиндол,
3-[(6-гидроксихинолин-5-ил)метилен]-2-оксиндол,
3-[(7-гидроксихинолин-5-ил)метилен]-2-оксиндол,
3-[(8-гидроксихинолин-5-ил)метилен] -2-оксиндол, (FCE 26285, соединение 26)
3-[(хинолин-6-ил)метилен]-2-оксиндол,
3[(5-гидроксихинолин-6-ил)метилен]-2-оксиндол,
3-[(7-гидроксихинолин-6-ил)метилен]-2-оксиндол,
3-[(8-гидроксихинолин-6-ил)метилен]-2-оксиндол,
3-[(1,4-дигидрокси-5,6,7,
8-тетрагидронафт-2-ил)метилен] -2-оксиндол (E изомер: FCE
26806, 12, Z изомер: FCE 27846, соединение 13)
C19H17NO3
Рассчитано: C 74,25, H 5,58, N 4,
56.
Найдено: C 74,01, H 5,74, N 4,48.
МС m/z: 307
ИК см-1 (KBr): 3500-3100 (OH, NH), 1670 (CO), 1605 (C=C)
3-[(хинолин-2-ил)метилен]-2-оксиндол (FCE 27124, соединение 14)
C18H12N2O
Рассчитано: C 79,39, H 4,44, N 10,29.
Найдено: C 79,29, H 4,45, N 10,25.
МС m/z: 272
ИК см-2 (KBr): 3180 (NH), 1710
(CO), 1620-1595-1505 (C=C, C=N).
3-[(4-гидроксихинолин-2-ил)метилен] -2-оксиндол (FCE
26967, соединение 15)
C18H12N2O2
Рассчитано: C 74,98, H 4,20, N 9,72.
Найдено: C 74,66, H 4,25, N 9,38.
МС m/z: 288
ИК см-1 (KBr): 3430
(OH, NH), 1675 (CO), 1630 (C=C),
1595-1580-1530-1515 (аром.).
3-[(хинолин-4-ил)метилен]-2-оксиндол (FCE 27048, соединение 16)
3-[(3-индолил)метилен]-2-оксиндол (FCE 26841, соединение 17)
т.пл.
230oC
C17H12N2O
Рассчитано: C 78,44, H 4,65, N 10,
76.
Найдено: C 78,35, H 4,61, N 10,55.
МС (m/z): 260
ИК см-1 (KBr): 3500-3200 (NH), 1675 (CO), 1610 (C=C)
ЯМР d м. д. 6,83 (д, 1H), 6,9-7,3
(м, 4H), 7,5 (м, 1H), 7,87 (д, J=6,8 Гц, 1H), 8,14 (c, 1H), 8,17 (м, 1H), 9,44 (c, 1H),
10,52 (широкий с, 1H), 12,0 (широкий сн, 1H).
C18H12N2O
Рассчитано: C 79,39, H 4,44, N 10,29.
3-[(хинолин-3-ил)метилен[-2-оксиндол (FCE 26913, соединение 18)
C18H12N2O
Рассчитано: C
79,39, H 4,44 N, 10,29.
Найдено: C 79,20, H 4, 71, N 10,14.
МС m/z: 272
ИК см-1 (KBr): 3500-3100 (NH), 1695 (CO), 1620-1580-1500 (C=C, C=N)
4-[(индол-3-ил)метилен]-1-фенилпиразолидин-3,5-дион,
C18H13B3O2
Рассчитано: C 71,27, H 4,32, N 13,85.
Найдено: C 71,05, H 4,33, N 13,64.
МС m/z: 303
ИК см-1 (KBr): 3600-3100 (NH), 1705-1650 (CONH), 1600-1580-1500 (аром.) и
5-[(индол-3-ил)метилен]гидантоин
C12H9N3O2
Рассчитано:
C 63,43, H 3,99, N 18,49.
Найдено: C 63,20, H 3,71, N 18,31.
МС m/z: 227
ИК см-1 (KBr): 3600-3100 (NH), 1740-1700-1650 (CONH), 1620-1580-1530 (C=
C)
Пример 2.
2-циано-3-(2-гидроксинафт-1-ил)тиоакриламид (FCE 26627, соединение 19) [I, Y=A, R=c,
R1=R2=H, n=1]
Смесь 2-гидрокси-1-нафтальдегина
(172 мг, 1 ммоль), 2-цианотиоацетамида (110 мг, 0,2 ммоль), N,N-диэтиламиноэтанола (23 мг, 0,2 ммоль) и 15 мл этанола
перемешивали в течение 30 мин в атмосфере азота при нагревании с обратным
холодильником. Затем смесь охладили, осадок отфильтровали, промыли ледяным этанолом высушили в вакуумной печи. Таким образом
получили почти чистое указанное соединение с выходом 85% (1080 мг). После
перекристаллизации из этанола получили очень чистые образцы.
C14H10N2OS
Рассчитано: C 66,12, H 3,96, N 11,01, S 12,61.
Найдено: C 66,05, H 3,85, N 10,95, S 1255.
МС m/z: 254
ИК см-1 (KBr): 3300-2500 (H, OH), 2020
(CN), 1640 (C-N, N-H), 1600-1560-1510 (C=C).
По
вышеописанной методике можно получить следующие соединения;
2-циано-3-(3-гидроксинафт-1-ил)тиоакриламид,
2-циано-3-(4-гидроксинафт-1-ил)тиоакриламид,
2-циано-3-(1-гидроксинафт-2-ил)тиоакриламид,
2-циано-3-(3-гидроксинафт-2-ил)тиоакриламид,
2-циано-3-(4-гидроксинафт-2-ил)тиоакриламид,
2-циано-3-(2-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)тиоакриламид,
2-циано-3-(3-гидрокси-5,6,7,8-тетрагидронафт-2-ил)тиоакриламид,
2-циано-3-(4-гидрокси-5,6,7,8-тетрагидронафт-1-ил)тиоакриламид,
2-циано-3-(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)тиоакриламид,
2-циано-3-(3-гидрокси-5,6,7,
8-тетрагидронафт-2-ил)тиоакриламид,
2-циано-3-(4-гидрокси-5,6,7,
8-тетрагидронафт-2-ил)тиоакриламид,
2-циано-3-(3-гидроксихинолин-2-ил)тиоакриламид,
2-циано-3-(4-гидроксихинолин-2-ил)тиоакриламид,
2-циано-3-(2-гидроксихинолин-3-ил)тиоакриламид,
2-циано-3-(4-гидроксихинолин-3-ил)тиоакриламид,
2-циано-3-(2-гидроксихинолин-4-ил)тиоакриламид,
2-циано-3-(3-гидроксихинолин-4-ил)тиоакриламид и
2-циано-3-(8-гидроксихинолин-5-ил)тиоакриламид (FCE 26968, соединение 20)
C13H9N3OS
Ррассчитано: C 61,16, H 3,55, N 16,46.
Найдено: C 60,99, H 3,59, N 16,26.
МС m/z: 255
ИК см-1
(KBr): 3440 (OH), 3330-3180 (H), 2220 (C), 1650 (H),
1610-1570-1510 (C=N).
Пример 3.
2-циано-3-(1-гидроксинафт-2-ил)акриловая кислота
[I, Y=A, R a, R1=R2=H, R3=OH, n=1]
К
смеси 1-гидрокси-2-нафтальдегида (172 мг, 1 ммоль) и цианоуксусной кислоты (85 мг, 1 ммоль) в сухом диоксане (2 мл) добавляют по каплям
пиперидин (42 мг, 0,5 ммоль) при температуре 0-5oC.
Смесь выдерживают в течение ночи при комнатной температуре. Отфильтровывают образовавшиеся кристаллы и перекристаллизуют их из
хлороформа. В результате получают 200 мг чистого соединения, названного в
заглавии, что соответствует 90% выходу.
C14H8NO2
Рассчитано: C 75,
33 H 4,06 N 6,28
Найдено: C 75,20 H 3,95 N 6,15
МС m/z:
223
ИК см-1 (KBr): 3300-2500 (COOH), (OH), 2200 (CN), 1690 (COOH), 1600-1560-1510 (C=C).
Следуя вышеописанной методике и выбирая в качестве исходного
соответствующее альдегидное производное, можно получить следующие соединения:
2-циано-3-(2-гидроксинафт-1-ил)акриловая кислота,
2-цикло-3-(3-гидроксинафт-1-ил)акриловая кислота,
2-циано-3-(4-гидроксинафт-1-ил)акриловая кислота,
2-циано-3-(3-гидроксинафт-2-ил)акриловая кислота,
2-циано-3-(4-гидроксинафт-2-ил)акриловая кислота,
2-циано-3-(2-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриловая кислота,
2-циано-3-(3-гидрокси-5,6,7,8-тетрагидронафт-1-ил)акриловая
кислота.
2-циано-3-(4-гидрокси-5,6,7,
8-тетрагидронафт-1-ил)акриловая кислота,
2-циано-3-(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриловая кислота,
2-циано-3-(3-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриловая кислота,
2-циано-3-(4-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриловая кислота,
2-циано-3-(3-гидроксихинолин-2-ил)акриловая
кислота,
2-циано-3-(4-гидроксихинолин-2-ил)акриловая кислота,
2-циано-2-(2-гидроксихинолин-3-ил)акриловая кислота,
2-циано-3-(4-гидроксихинолин-3-ил)акриловая кислота,
2-циано-3-(2-гидроксихинолин-4-ил)акриловая кислота,
2-циано-3-(3-гидроксихинолин-4-ил)акриловая кислота,
Пример 4.
3-(1-гидрокси-5,6,7,
8-тетрагидронафт-2-ил)акриловая кислота (I, Y=B, R= i, R1= R2=H, R3=OH, n=1)
Смесь 1-гидрокси-5,6,7,8-тетрагидро-2-нафтальдегида (176 мг, 1 ммоль), малоновой
кислоты (208 мг, 2 ммоль), пиперидина (85 мг, 1 ммоль) и пиридина (1 мл) нагревали при
100oC в течение 3 ч и с орошением в течение 1/2 ч. Затем смесь охладили и вылили на лед, смешанный с
хлористоводородной кислотой. Осадившийся материал отделили фильтрацией, а затем
перекристаллизовали из этанола, что дало названное соединение в чистом виде с выходом 80% (174 мг).
C13H14O3
Рассчитано: C 71,54 H 6,46
Найдено: C 71,35 H 6,30
МС m/z: 218
ИК см-1 (KBr): 3320-2500 (COOH, OH), 1690 (COOH),
1640 (C=C)
Пример 5.
2-(4-гидроксифенил)-3-(нафт-2-ил)акриловая кислота (FCE 26437, соединение 21)
(I, Y=A, R2=H, R3=OH, n=ноль)
Смесь, состоящую из 2-нафтальдегида (156 мг, 1
ммоль), 4-гидроксифенилуксусной кислоты (152 мг, 1 ммоль), триэтиламина (101 мг, 1 ммоль) и уксусного ангидрида (510 мг, 5 ммоль), нагревали в течение 5
ч при 100oC.
После охлаждения смесь обработали разбавленной хлористоводородной кислотой, а затем экстрагировали этилацетатом. Органический слой отделили и реэкстрагировали разбавленным раствором гидроксида натрия. Отделили водную фазу и осадили сырой продукт действием хлористоводородной кислоты. Чистое соединение получают кристаллизацией из изопропанола с выходом 60% (174 мг).
C19
H14O3
Рассчитано: C 78,60 H 4,86
Найдено: C 78,69 H 4,89
МС m/z: 290.
ИК см-1 (KBr): 6000-2500 (OH, COOH), 1680 (COOH), 1600, 1585, 1510 (C= C).
Аналогичным способом могут быть получены следующие соединения:
2-(4-Гидроксифенил)-3-(хинолин-3-ил)акриловая кислота
(FCE 26458, соединение 22)
C18H13NO3
Рассчитано: C 74,21 H 4,50 N 4,81
Найдено: C 73,85 H 4,37 N 1,53
МС m/z: 291.
ИК см-1 (KBr): 3380
(OH), 3100-1800 (COOH) 1670 (COOH), 1605, 1580, 1510 (C=C)
2-(4-гидроксифенил)-3-(нафт-1-ил)акриловая кислота,
2-(4-гидроксифенил)-3-(5,6,7,8-тетрагидронафт-1-ил)акриловая кислота,
2-(4-гидроксифенил)-3-(5,6,7,
8-тетрагидронафт-2-ил)акриловая кислота,
2-(4-гидроксифенил)-3-(хинолин-2-ил)акриловая кислота и
2-(4-гидроксифенил)-3-(хинолин-4-ил)акриловая
кислота.
Пример 6.
2-(4-Гидроксифенил)-3-(нафт-2-ил)-акриламид (FCE 26438, соединение 23)
(I, Y A, R i, R2=H1, R3 NH2, n ноль)
Нагревали в
течение 5 ч при 100oC смесь 2-нафтальдегида (156 мг, 1 ммоль), 4-гидроксифенилуксусной кислоты (152 мг, 1 ммоль), триэтиламина (101 мг, 1 ммоль) и
уксусного ангидрида (510 мг, 5 ммоль).
После охлаждения смесь обрабатывали разбавленной холористоводородной кислотой, а затем провели экстракцию этилацетатом. Органический слой экстрагировали
раствором гидроксида натрия. После отделения
водной фазы осадили сырую карбоновую кислоту действием хлористоводородной кислоты.
Сырую карбоновую кислоту превратили в хлорангидрид посредством обработки тионилхлоридом (1190 мг, 10 ммоль) в кипящем бензоле (5 мл) в течение 2 ч. После выпаривания досуха под вакуумом сырой хлорангидрид превратили в амид по реакции с разбавлением гидроксидом аммония при комнатной температуре в течение 1 ч. В результате фильтрации, промывания и сушки под вакуумом получили сырой продукт. Кристаллизация из изопропана дала названное соединение в чистом виде с выходом 50% (145 мг).
C19H15NO2
Рассчитано: C 78,87 H 5,23 N 4,84
Найдено C 78,71 H 5,09 N 4,65
МС m/Z: 289
ИК см-1 (KBr): 3600-3100
(OH, NH), 1650 (CONH), 1610, 1560, 1510 (C=C)
Вышеописанным способом можно получить следующие соединения:
2-(4-гидроксифенил)-3-(хинолин-3-ил)акриламид
C18H14N2O2
Рассчитано: C 74,47 H 4,86 N 9,65
Найдено: C 74,32 H 4,71 N 9,51
МС m/Z: 290
ИК см-1 (KBr): 3450, 3320 (NH),
3500-2300 (OH), 1665 (CONH), 1615, 1565, 1510, 1490 (C=C, C=N),
2-(4-гидроксифенил)-3-(нафт-1-ил)акриламид,
2-(4-гидроксифенил)-3-(5,6,7,8-тетрагидронафт-1-ил)акриламид,
2-(4-гидроксифенил)-3-(5,6,7,8-тетрагидронафт-2-ил)акриламид,
2-(4-гидроксифенил)-3-(хинолин-2-ил)акриламид и
2-(4-гидроксифенил)-3-(хинолин-4-ил)акриламид.
Пример 7.
2-(4-Гидроксифенил)-3-(нафт-2-ил)акрилонитрил (FCE 26436, соединение 25).
(I, Y A, R j, R2 H, n ноль)
К раствору 2-нафтальдегида (156 мг, 1
ммоль) и 4-гидроксибензилцианида (133 мг, 1 ммоль) в сухом этаноле (2 мл) добавили отдельными порциями при охлаждении этоксид натрия
(204 мг, 2 ммоль) и выдерживали полученный раствор в течение 96 ч
при комнатной температуре. Затем раствор вылили на смесь льда и разбавленной хлористоводородной кислоты. Образовавшийся осадок
отфильтровали, промыли, охлажденным льдом водным этанолом и высушили в
вакуумной печи. Таким образом получили названное соединение в чистом виде с выходом 80% (217 мг).
C19
H13NO
Рассчитано: C 84,11 H 4,83 N 5,16
Найдено: C 83,91 H 4,87 N 4,86
МС m/Z: 271
ИК см-1 (KBr): 3340 (OH), 2220 (CN), 1605, 1510 (C=C).
Пример 8.
2-Циано-3-(1-гидрокси-5,6,7,
8-тетрагидронафт-2-ил)акриламид
(I, Y B, R a, R1=R2=H, R3=NH2, n 1)
Исходным веществом в данном примере де-этерификации является
2-ацино-3-(1-метокси-5,6,7,8-тетрагидронафт-2-ил)акриламид, который можно получить по описанной в примере 1 методике.
К перемешиваемому раствору 2-циано-3-(1-метокси-5,6,7, 8-тетрагидронафт-2-ил)акриламида (256 мг, 1 ммоль) в безводном дихлормтане (10 мл) добавили при -78oC в атмосфере азота в течение 10 мин 1,0 М раствор трибромида бора в дихлорметане (3 мл, 3 ммоль). Полученную смесь перемешивали еще в течение 1 ч при -78oC, а затем оставили нагреваться до комнатной температуры. После перемешивания в течение 1,5 ч при 20-25oC смесь охладили до -10oC, а затем закалили, добавляя по каплям воду (10 мл) в течение 10 мин. После добавления этилацетата (10 мл) отделили органический слой, промывали его водой, высушили над Na2SO4 досуха под вакуумом. Остаток кристаллизовали из этанола, что дало 169 мг названного соединения в чистом виде (выход 70%).
C14H14
N2O2
Рассчитано: C 69,40 H 5,82 N 11,56
Найдено: C 69,20 H 5,85 N 11,41
МС m/z: 242
ИК см-1(KBr): 3500-3100 (NH, OH), 2210 (CN),
1685 (CONH2), 1610, 1590, 1560
По вышеописанной методике из соответствующих фенольных метильных эфиров можно получить
соединения, упомянутые в примерах 1, 2 и 3.
Пример 9.
2-циано-3-(1-ацетокси-5,6,7,8-тетрагидронафт-2-ил)акриламид
[I, Y B, R a, R1 COCH3,
R3=NH2, n 1]
Исходным
материалом для этого примера на ацилирование является 2-циано-3-(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриламид, который может быть получен по
описанной в примере 1 методике.
К охлажденному раствору 2-циано-3-(1-гидрокси-5,6,7,8-тетрагидронафт-2-ил)акриламид (242 мг, 1 ммоль) в сухом пиридине (0,5 мл) добавили уксусный ангидрид (240 мг, 2 ммоль) и выдерживали смесь в течение ночи при 0-5oC. После чего смесь сконцентрировали под вакуумом, остаток растворили в дихлорметане, органический слой промыли водой, а затем выпарили при пониженном давлении. Сырой продукт перекристаллизовывали из смеси хлороформ/метанол и получили в чистом виде названное соединение с выходом 90% (256 мг).
C16H16N2O3
Рассчитано: C 67,59 H 5,67 N 9,85
Найдено: C 67,41 H 5,45 N 9,71
МС m/z: 284
ИК см-1 (KBr): 3300-3200
(NH), 2200 (CN), 1750 (CH3COO), 1690
(CONH2), 1610, 1590, 1560.
По вышеописанной методике можно превратить фенолы, полученные в примерах 1-9, в соответствующие алканоильные производные C2-C6.
Пример 10.
Таблетки, каждая весом 0,150 г, содержащие по 25 мг активного вещества, можно приготовить следующим
образом:
композиция (на 10000
таблеток):
2-циано-3-(1-гидроксинафт-2-ил)акриламид 250 г
Лактоза 800 г
Кукурузный крахмал 415 г
Порошок талька 30 г
Стеарат магния 5 г
Смешивают
2-циано-3-(1-гидроксинафт-2-ил)акриламид, лактозу и половину кукурузного крахмала; смесь затем пропускают через сито с ячейками 0,5 мм. Готовят суспензию
кукурузного крахмала (10 г) в теплой воде (90
мл) и используют полученную пасту для гранулированного порошка. Гранулы сушат, измельчают на сите с ячейками 1,4 мм, после чего добавляют оставшееся
количество крахмала, тальк и стеарат магния,
тщательно перемешивают и превращают в таблетки.
Пример 11.
Можно изготовить капсулы, каждая весит 0,200 г и содержит 20 мг активного вещества.
Композиция на 500 капсул:
2-циано-3-(3-гидроксинафт-2-ил)акриламид 10 г
Лактоза 80 г
Кукурузный крахмал 5 г
Стеарат магния 5
г
Этот состав расфасовали в
твердые желатиновые капсулы, состоящие из двух частей, причем в каждой капсуле содержалось 0,200 г композиции.
Пример 12.
Капсулы,
каждая по 0,5 г, содержащие по 50
мг активного вещества, могут быть приготовлены:
Состав для 200 капсул, г:
3-[(1,4-дигидрокси-5,6,7,8-тетрагидронафт-2-ил)метилен]-2-оксиндол 10
Лактоза 80
Кукурузный крахмал 5
Стеарат магния 5
Эта препаративная форма инкапсулируется в твердые желатиновые капсулы из двух частей при содержании в каждой капсуле 0,
5 г.
Пример 13.
С помощью обычной фармацевтической методики могут быть получены суппозитории следующего состава, г:
3-[(1,4-дигидрокси-5,6,7,
8-тетрагидронафт-2-ил)метилен]-2-оксиндол 0,10
Лецитин 0,07
Масло-какао 0,83
Пример 14.
Таблетки, каждая весом 150 мг, содержащие по 50 мг активного
вещества, могут быть получены следующим образом:
Состав для 1000 таблеток, г:
3-[(хинолин-2-ил)метилен]-2-оксиндол 500
Лактоза 710
Кукурузный крахмал 237,5
Порошок талька 37,5
Стеарат магния 15
3-[(Хинолин-2-ил)метилен] -2-оксиндол, лактозу и половину кукурузного крахмала смешивают, затем смесь продавливают через сито с 0,5 мм
отверстиями. Кукурузный крахмал (18 мг) суспендируют в теплой воде (180 мл). Полученную пасту используют для гранулирования порошка. Гранулы сушат, дробят на сите с размером отверстий 1,4 мм,
добавляют оставшееся количество крахмала, талька и стеарата магния, тщательно смешивают и массу таблетируют при использовании пресса диаметром 8 мм.
Физико-химические данные представлены в табл.1.
Пример 12.
Данные биологической активности
Представительная группа соединений (1) испытывалась in vitro на активность ингибирования
тирозин-киназы по методике Фергюсона, описанной в J. Biol. Chem. 1985, 260, 3652 (см. стр. 16 описания).
Были получены следующие результаты, представленные в табл.2.
Реферат
Область использования: в фармацевтической
промышленности. Сущность изобретения: новые соединения общей формулы:
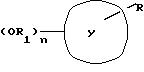
где Y - нафтил, тетрагидронафтил, хинолил, индолил, R - группа формулы:
или их фармацевтически приемлемые соли, а также фармацевтическая композиция, проявляющая ингибирующее действие в отношении тиразин-киназы, включающая фармацевтически приемлемый носитель или разбавитель и активный комопнент - соединение формулы 1 в эффективном количестве. 3 с. и 2 з.п. ф-лы, 2 табл.
Формула
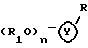
где Y бициклическая система, выбранная из A, B, E и G

R группа формул a, c, d, e, f, g или i
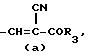
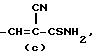
3,
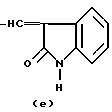
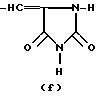
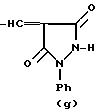
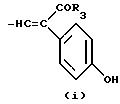
где R3 -OH или NH2;
Ph фенил;
R1 водород;
n 0, 1 или 2,
или их фармацевтически приемлемые соли, причем каждый из заместителей R и OR1 может независимо располагаться либо на арильном, либо на гетероарильном остатке бициклической системы A, E и G, тогда как в бициклической кольцевой системе B замещенным может быть только бензольный остаток и при дополнительном условии, что i когда Y является кольцом A, R отличается от группы a или d, указанной выше, ii когда одновременно Y является кольцевой системой B и R является группой d, как определено выше, в которой R3 OH, то n отлично от нуля; и iii когда одновременно Y является кольцевой системой G и R является группой e, как определено выше, связанной с индольным кольцом в положении 2 или 3, то n отлично от нуля.
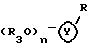
где Y бициклическая система, выбранная из A, B, E и G
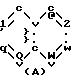

R группа формулы a, c, d, e, g, f или i
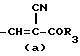
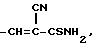
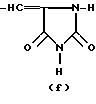
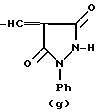

где R3 OH или NH2;
Ph фенил;
R1 водород;
n 0, 1 или 2,
или его фармацевтически приемлемая соль, причем каждый из заместителей R и OR1 может независимо располагаться либо на арильном, либо на гетероарильном остатке бициклической системы A, E и G, тогда как в бициклической кольцевой системе B замещенным может быть только бензольный остаток при дополнительном условии, указанном в п.1 формулы.

Комментарии