Способ обнаружения или выделения/получения циркулирующей опухолевой клетки, использующий метод пролиферации клеток - RU2707083C1
Код документа: RU2707083C1
Чертежи















Описание
Область техники
[0001] Данное изобретение относится к способу обнаружения или выделения/получения циркулирующей опухолевой клетки (circulating tumor cell, СТС) и циркулирующей опухолевой стволовой клетки (circulating tumor stem cell, CTSC), которые являются опухолевыми (раковыми) клетками, которые проникают в биологическую ткань человека, т.е. в циркулирующую биологическую жидкость, типичным примером которой является периферическая кровь, или в циркулирующую биологическую жидкость из различных органов, включая костный мозг, селезенку и т.п., через эту биологическую жидкость, и, в частности, относится к описанию способа обнаружения или выделения/получения циркулирующей опухолевой клетки (СТС) и циркулирующей опухолевой стволовой клетки (CTSC), который способен надежно и стабильно обнаруживать или выделять/получать циркулирующую опухолевую клетку и циркулирующую опухолевую стволовую клетку, присутствующую в следовых количествах в циркулирующей биологической жидкости, такой как кровь или лимфа, даже в состоянии, когда тип рака опухолевых клеток еще не может быть определен, и в состоянии, когда опухолевые клетки присутствуют в следовых количествах в циркулирующей биологической жидкости организма (в описании ниже циркулирующая опухолевая клетка (СТС) и циркулирующая опухолевая стволовая клетка (CTSC) вместе называются «циркулирующей опухолевой клеткой (СТС)», за исключением случаев, когда они должны быть описаны по отдельности, и термин «циркулирующая опухолевая клетка (СТС)» также включает термин «циркулирующая стволовая опухолевая клетка (CTSC)»).
Предпосылки изобретения
[0002] Раковые заболевания имеют высокий уровень смертности от различных болезней в развитых странах. В частности, в Японии, хотя в статистике и наблюдается тенденция к снижению, например, скорректированных по возрасту показателей заболеваемости и смертности, вклад от старения населения или от хронических заболеваний, таких как сахарный диабет, в развитие рака или в показатели смертности является очень большим. В настоящее время каждый второй человек по стохастическим причинам заболевает раком, а каждый третий человек оказывается в чрезвычайно опасной ситуации и умирает от рака (оценка основана на методике Wum LM et al., Estimating lifetime and age-conditional probabilities of developing cancer, Lifetime Data Anal., 1998, 4: 169-186).
[0003] Между тем, в целях борьбы с раковыми заболеваниями, прогресс в лечении различных видов рака достигается путем сосредоточения основных усилий на разработке методик его лечения. Прогресс хирургической терапии, химиотерапии и лучевой терапии как трех основных способов лечения рака, а также иммунотерапии и т.д., которым уделялось основное внимание в последние годы, принес достаточно хорошие результаты. Тем не менее, послеоперационные рецидивы, метастазирование в региональные лимфатические узлы, дистальные метастазы и т.д. все еще недостаточно контролируются, и принятие срочных мер по борьбе с этими явлениями становится все более актуальным. Кроме того, в последние годы были обнаружены случаи, когда послеоперационные рецидивы и метастазы имеют место, даже если раковые ткани были успешно удалены, а также стало известно, что наличие раковых стволовых клеток является очень важным фактором развития послеоперационного рецидива и метастаза (Breast Cancer Res Treat 2010, 124: 403-412; New Engl. J Med 2004, 351: 781-791; Clin Cancer Res 2008, 14: 6302-6309; и J. Clin Oncol 2008, 26: 3213-3221). Кроме того, стало очевидно, что СТС, циркулирующие в организме, находятся в центре механизма этого рецидивирования и метастазирования (Clin Cancer Res 2008, 14: 7004-7010; и Proc (Bayl Univ Med Cent) 2008, 21: 127-132).
[0004] Раковые клетки или ткани (далее в данном документе обозначаются как злокачественные опухоли, включая лейкемию), которые развились в тканях человека in vivo или более того, в различных органах в организме, формируют опухолевые ткани в месте первичного поражения (месте развития рака), за исключением лейкемии, путем связывания пролиферирующих раковых клеток посредством адгезивных факторов. Тем не менее, раковые клетки высвобождаются из места первичного поражения, не оставаясь в нем, из-за аномалии или исчезновения адгезивных факторов, вызывают деградацию соединительной ткани, сосудов и стенок лимфатических сосудов, окружающих раковые клетки и проникают в кровь или лимфу. Раковые клетки, которые проникли в биологическую жидкость, циркулируют в виде циркулирующих опухолевых клеток (СТС) в организме вместе с кровью или лимфой, которые циркулируют в организме. СТС переносятся в другие ткани или органы при циркуляции крови и т.п., например, при их выдавливании из сосудов и т.п. в эти ткани или органы, вновь синтезируют адгезивные факторы и образуют колонию, формируя метастатическое поражение. Циркуляция этих СТС в организме и формирование метастатического поражения рассматриваются как механизм метастазирования рака и считаются вовлеченными в рецидивирование и метастазирование рака.
[0005] При постановке диагноза или лечении рака раннее получение информации об обнаружении или патологическом состоянии рака, который развился в месте первичного поражения, до метастазирования рака в другие ткани или органы, является очень важным фактором для эффективного проведения диагностики или лечения рака, предоставляющим полезные сведения для предотвращения метастазирования рака в другие ткани или органы. Анализу СТС, как средству для этого, было уделено соответствующее внимание как очень важному фактору. Кроме того, анализ СТС считается также важным для прогнозирования рецидива рака или для оценки эффекта лечения рака. Сообщалось также, что это средство эффективно для предварительного прогнозирования или оценки эффекта лечения.
[0006] Тем не менее, уровень присутствия СТС, циркулирующих в крови, очень низок, а период полужизни раковых клеток, циркулирующих в крови, является коротким промежутком времени, от 1 до 24 часов. Поэтому обнаружение СТС, присутствующих в циркулирующей биологической жидкости организма является очень сложной задачей. Например, выделение СТС из периферической крови является неэффективным. Что касается СТС, то в 2012 году было опубликовано сообщение о 19 объектах совместных исследований во всем мире (J Translational-Medicine 2012, 10: 138: 1-20), в котором также сообщалось, что только 1/108 мононуклеарных клеток крови, т.е. только одна клетка из 100 мл крови, могут быть выделены. Вероятность наличия 50 клеток в пересчете на взрослого человека с массой организма 60 кг является очень низкой, даже если их собрать из всего общего количества, т.е. приблизительно из 5 л (5000 мл) периферической крови, и даже в этом случае, можно выделить лишь очень небольшое количество СТС.Этот факт был главным препятствием в исследованиях СТС (J Translational-Medicine 2012, 10: 138: 1-20).
[0007] В последние годы произошло усовершенствование методик обнаружения или измерения СТС; чувствительность обнаружения или точность измерений улучшились за счет более совершенных методик обнаружения или измерения. Стало возможным с большей точностью обнаруживать всего лишь несколько раковых клеток среди 100000-100000000 мононуклеарных клеток крови. Кроме того, этот вид исследования был признан исследованием, которое дает клиническую информацию, такую как предварительный прогноз или оценку эффекта лечения метастатического рака, такого как рак молочной железы, колоректальный рак или рак предстательной железы. Кроме того, FDA (Food and Drug Administration; Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) США признало клиническую полезность СТС в случаях рака молочной железы, колоректального рака и рака предстательной железы и их использование в качестве in vitro диагностики было соответствующим образом одобрено. Тем не менее, существующие в настоящее время методики обнаружения или измерения СТС имеют веские основания для того, чтобы стать методиками обнаружения или измерения, ограниченными конкретной СТС, например, когда предполагаемые раковые клетки уже были определены. Методика обнаружения или измерения СТС, которая может быть применена к широкому спектру раковых клеток, до сих пор не была найдена.
[0008] Способ иммуномагнитного выделения/обнаружения известен как широко используемый в настоящее время способ обнаружения СТС (Proc. Natl. Acad. Sci, USA, 95: 4589-4594, 1998; WO 99/41613; и японская нерассмотренная заявка на патент (перевод заявки РСТ) № 2002-503814). В этом способе магнитные частицы, иммобилизирующие моноклональное антитело против молекулы адгезии эпителиальных клеток (ЕрСАМ, «CD326») эпителиальных раковых клеток, используются для связывания молекулы адгезии эпителиальных клеток (ЕрСАМ) СТС в качестве мишени в образце и для обогащения магнитно меченных СТС путем магнитной конденсации, с последующим обнаружением СТС, содержащихся в образце в следовых количествах. С помощью этого способа иммуномагнитного выдел ения/обнаружения раскрываются различные методы обнаружения СТС.
[0009] Например, в публикации WO 2007/133465 (публикация японской нерассмотренной заявки на патент (перевод заявки РСТ) № 2009-537021) раскрывается способ быстрого и точного обнаружения дефицитных СТС в крови путем мечения СТС, полученных из биологической жидкости, иммуномагнитными частицами с флуорофором и получения меченых клеток путем сканирования изображения двумерно распределенных СТС посредством методики визуализации в режиме временной задержки и накопления сигнала (time-delayed integrating, TDI) с представленным в ней гомогенизатором лазерного излучения и аппаратом для него. Кроме того, в публикациях японских нерассмотренных заявок на патент №№ 2007-178193 и 2012-103077 раскрыт способ обнаружения гена во флуоресцирующе окрашенных клетках одновременно с подсчетом числа флуоресцирующе окрашенных клеток путем флуоресцентного окрашивания раковых клеток, захваченных магнитными частицами, иммобилизированных за счет связывания специфического антитела с поверхностным антигеном эпителиальных клеток (ЕрСАМ), с флуоресцентно меченным антителом против поверхностного антигена эпителиальных клеток (цитокератина), отличающегося от поверхностного антигена, и подсчетом числа флуоресцентно меченных клеток в сочетании с окрашиванием клеточных ядер с использованием флуоресцентно меченного ДНК-зонда, который гибридизуется с онкогеном в соответствии с флуоресцентной гибридизацией in situ (FISH).
[0010] Кроме того, в публикации японской нерассмотренной заявки на патент № 2014-105159 раскрыт способ обнаружения или количественного анализа СТС с жизнеспособностью клеток, поддерживаемых путем конденсации СТС, с использованием магнитных частиц с иммобилизированным моноклональным антителом (первым антителом) против молекулы адгезии эпителиальных клеток человеческого происхождения (ЕрСАМ), флуоресцентно меченным моноклональным антителом против ЕрСАМ (вторым антителом), которое специфически распознает другой эпитоп, а также способ окрашивания ядер клеток (процедура перебора и анализа интактных СТС: iCeap). В публикации японской нерассмотренной заявки на патент № 2014-112094 раскрывается способ идентификации и характеризации СТС, использующий маркер цитокератин (cytokeratin, СК), который является маркером эпителиальных клеток, и второй маркер, который является цитологическим красителем, который идентифицирует СТС по морфологии, размеру или соотношению ядра и цитоплазмы, такой как краситель Райта-Гимзы.
[0011] Кроме того, в публикации японской нерассмотренной заявки на патент № 2014-39480 для обнаружения ЕрСАМ-отрицательных СТС раскрыт способ обнаружения сигнала, полученного на урокиназа-специфическом субстрате и выделения и извлечения СТС путем предоставления поверхности культуры, содержащей урокиназа (urokinase-type plasminogen activator: uPA; урокиназный активатор плазминогена) - специфический флуоресцентный субстрат и посева образца крови на поверхность культуры с последующей инкубацией. Как упоминалось выше, для различных способов обнаружения СТС, использующих клеточный маркер (специфический антиген на клеточной поверхности) СТС, моноклональное антитело, специфически связывающееся с клеточным антигеном и т.п., уже было раскрыто в отношении обнаружения СТС к настоящему моменту. Тем не менее, эти методики обнаружения или измерения СТС имеют ограничение, которое заключается в том, что они применимы в случае, когда целевой рак, такой как рак молочной железы, колоректальный рак или рак предстательной железы, уже определен. Таким образом, методика эффективного обнаружения или измерения раковых СТС даже для широкого диапазона раков в случае, когда раковые клетки-мишени не могут быть определены, еще не найдена.
[0012] С другой стороны, способы обнаружения СТС без использования клеточного маркера (специфического антигена на поверхности клеток) СТС, моноклонального антитела, специфически связывающегося с клеточным антигеном и т.п., также раскрыты как способы обнаружения или измерения СТС. Например, в публикации японской нерассмотренной заявки на патент № 2011-163830 раскрыт способ обнаружения или измерения СТС путем тщательного выполнения процессов конденсации СТС из крови, окрашивания СТС и промывки в одном устройстве с использованием микрожидкостного устройства, способного захватывать СТС, содержащиеся в образце крови, с помощью избирательного по размеру микрополостного массива с мелкими сквозными отверстиями для захвата СТС, в котором контролируются размер пор, число отверстий и геометрия, и быстро подсчитывать СТС под автоматическим флуоресцентным микроскопом и т.п. Кроме того, в публикации японской, нерассмотренной заявки на патент № 2013-36818 раскрыт способ контактирования биологической жидкости, содержащей опухолевые клетки, с материалом для выделения клеток крови, состоящим из нетканого материала, изготовленного из полиэфирного волокна, полипропиленового волокна и т.п., имеющего плотность от 2,0×104 до 1,9×105 и диаметр волокна от 1 мкм до 15 мкм, для захвата опухолевых клеток, лейкоцитов и тромбоцитов и выделения или извлечения фракции, богатой захваченными опухолевыми клетками, из биологической жидкости с использованием раствора для выделения, состоящего из физиологического раствора, буферного раствора, декстрана и т.д.
[0013] Кроме того, в публикации японской нерассмотренной заявки на патент № 2014-224800 раскрыт способ выделения СТС и т.д. посредством предоставления корпуса и крышки, которые ограничивают пространство между ними, и это пространство формирует разделительный элемент, который отделяет область входа и область выхода из пространства; при этом разделительный элемент образует канал вместе с поверхностью пространства и отделяет СТС, которые являются более крупными частицами, от клеток крови, которые являются более мелкими частицами, за счет того, что позволяет более мелким частицам проходить через канал и удерживает более крупные частицы от прохождения через канал, как это делают частицы, которые проходят через канал. Эти способы выделения или обнаружения СТС физически разделяют или обнаруживают СТС, присутствующие в биологической жидкости и не используют клеточный маркер (специфический антиген на поверхности клеток) СТС, моноклональное антитело, специфически связывающееся с клеточным антигеном, и т.п. Поэтому эти способы применимы для выделения или обнаружения СТС рака, даже если предполагаемые раковые клетки еще не могут быть определены как рак. К сожалению, представляется затруднительным надежно выделить или обнаружить СТС, присутствующие на уровне следовых количеств в жидкости организма, способами, описанными выше.
[0014] Получение раковых клеток, включая СТС, является незаменимым фактором для исследований рака, в частности, для диагностики или прогнозной оценки на основе генного анализа рака, выбора эффективной химиотерапии рака и т.д. Кроме того, получение раковых клеток является ключевой методикой для разработки вакцин для иммунотерапии рака, а также для разработки вакцин в персонализированной медицине. Кроме того, в персонализированной медицине для подхода к лечению путем адоптивного переноса клеток СТС также необходимы в качестве стимулирующего фактора для индукции клеток-киллеров, ответственных за собственный специфический цитотоксический ответ пациента на рак, или в качестве аутологичных раковых клеток-мишеней при измерении цитотоксичности индуцированных клеток-киллеров. Кроме того, получение раковых стволовых клеток, присутствие которых в последние годы стало восприниматься как фактор послеоперационного рецидива и метастазирования, обеспечивает революционные средства для исследований раковых стволовых клеток и разработок методик их контроля, которые настоятельно необходимы в настоящее время.
[0015] Для получения раковых клеток в медицинской практике до сих пор существовали только способы, обладающие определенными рисками, такие как биопсия, получение из операционных материалов, операции, высокоинвазивные для организмов, а также увеличение или распространение метастазов. Таким образом, разработка способа выделения/получения СТС безопасно, удобно и за короткое время, например, из периферической крови, избегая этих рисков, вносит большой вклад в фундаментальные исследования и клинические исследования рака. Таким образом, выделение/получение СТС имеет важное значение.
[0016] Хотя прошло 50 или более лет с тех пор, как обнаружилось, что метастазы рака, как правило, возникают гематогенным, а не лимфогенным образом (Cancer Res. 11, 648-651, 1951; и CANCER JULY-AUGUST, Vol. 13: 674-676, 1960), способ стабильного сбора раковых клеток из периферической крови до сих пор не был разработан. Как описано выше, способы обнаружения или амплификации с помощью антитела следового количества фрагмента клетки, произошедшего из раковой клетки, присутствующей в периферической крови и изучения наличия или отсутствия рака известны как способы для конкретных объектов. Тем не менее, эти способы являются средствами, применимыми только к раковым клеткам, для которых целевое вещество, которое связывается с антителом, уже определено. Таким образом, они являются средствами, неприменимыми к раковым клеткам, свободное вещество которых неизвестно. То же самое справедливо и для способов амплификации фрагмента гена, полученного из раковой клетки, с помощью ПЦР и изучения наличия или отсутствия рака. В частности, эти способы оценивают наличие или отсутствие раковых клеток путем амплификации уже выявленного сегмента гена. Их слабое место заключается в том, что эти способы не используют неизвестный ген и не могут применяться для злокачественным образом трансформированных клеток. Между тем, для получения раковых клеток возможна биопсия или способ, инвазивный для организмов, для сбора из операционных материалов, в качестве способа преодоления этого недостатка. Тем не менее, такое получение раковых клеток не является этически приемлемым, потому что сбор из метастатического поражения может привести к дальнейшему распространению раковых клеток, хотя биопсия или хирургический сбор из места первичного поражения возможны и приемлемы. Более того, невозможно бороться с раком на ранней стадии, если тип рака еще не определен.
[0017] Обнаружение или выделение/получение раковых клеток путем обнаружения или выделения/получения СТС имеет очень важное значение для нужд медицинской практики для обнаружения или выделения/получения раковых клеток, как упомянуто выше. Тем не менее, способ надежного и стабильного обнаружения или выделения/получения СТС или CTSC, присутствующих в следовых количествах в биологической циркулирующей жидкости организма, такой как кровь или лимфа, даже в состоянии, когда тип рака опухолевых клеток не может быть определен, до сих пор не был разработан в нынешних условиях. Таким образом, очень важный вызов базовому или клиническому подходу к раку заключается в разработке способа безопасного, удобного, надежного и стабильного обнаружения или выделения/получения СТС или CTSC, присутствующих в следовых количествах, из биологической циркулирующей жидкости, такой как кровь или лимфа, например, из крови, такой как периферическая кровь, даже в отношении раковых клеток, тип рака которых еще не определен.
Документы уровня техники
Патентные документы
[0018]
Патентный документ 1: Публикация японской нерассмотренной заявки на патент №2007-178193
Патентный документ 2: Публикация японской нерассмотренной заявки на патент №2011-163830
Патентный документ 3: Публикация японской нерассмотренной заявки на патент №2012-103077
Патентный документ 4: Публикация японской нерассмотренной заявки на патент №2013-36818
Патентный документ 5: Публикация японской нерассмотренной заявки на патент №2014-39480
Патентный документ 6: Публикация японской нерассмотренной заявки на патент №2014-105159
Патентный документ 7: Публикация японской нерассмотренной заявки на патент №2014-112094
Патентный документ 8: Публикация японской нерассмотренной заявки на патент №2014-224800
Патентный документ 9: Японская нерассмотренная заявка на патент (перевод заявки РСТ) №2002-503814
Патентный документ 10: Японская нерассмотренная заявка на патент
(перевод заявки РСТ) №2009-537021
Патентный документ 11: WO 99/41613
Патентный документ 12: WO 2007/133465
Непатентные документы
[0019]
Непатентный документ 1: Estimated using the method by Wum LM et al., Estimating lifetime and age-conditional probabilities of developing cancer, Lifetime Data Anal., 1998, 4: 169-186
Непатентный документ 2: Breast Cancer Res Treat 2010, 124: 403-412
Непатентный документ 3: 403-412; New Engl. J Med 2004, 351: 781-791
Непатентный документ 4: 2008, 14; Clin Cancer Res 2008, 14: 6302-6309
Непатентный документ 5: J. Clin Oncol 2008, 26: 3213-3221
Непатентный документ 6: 2008, 14; Clin Cancer Res 2008, 14: 7004-7010 Непатентный документ 7: Proc (Bayl Univ Med Cent) 2008, 21: 127-132
Непатентный документ 8: J Translational-medicine 2012, 10: 138: 1-20
Непатентный документ 9: Proc. Natl. Acad. Sci, USA, 95: 4589-4594, 1998
Непатентный документ 10: Cancer Res. 11, 648-651, 1951
Непатентный документ 11: CANCER JULY-AUGUST, Vol. 13: 674-676, 1960
Сущность изобретения
Задача, которую должно решить изобретение
[0020] Задачей данного изобретения является разработка способа обнаружения или выделения/получения СТС и/или CTSC, который способен надежно и стабильно обнаруживать или выделять/получать СТС (циркулирующую опухолевую клетку) и CTSC (циркулирующую опухолевую стволовую клетку), присутствующую в следовых количествах в биологической циркулирующей жидкости организма, такой как кровь или лимфа, даже в состоянии, когда раковый тип опухолевых клеток еще не может быть определен, и в состоянии, когда опухолевые клетки присутствуют в следовых количествах в биологической циркулирующей жидкости организма.
Средства решения указанных проблем
[0021] Для решения задачи автор данного изобретения провел тщательные исследования способа обнаружения или выделения/получения СТС и CTSC, который способен надежно и стабильно обнаруживать или выделять/получать СТС и CTSC, присутствующие в следовых количествах в биологической циркулирующей жидкости организма, таких как кровь или лимфа, даже в состоянии, когда раковый тип опухолевых клеток еще не может быть определен, и в состоянии, когда опухолевые клетки присутствуют в следовых количествах в биологической циркулирующей жидкости организма, и в ходе этого исследования создал данное изобретение, обнаружив, что в способе обнаружения или выделения/получения СТС и/или CTSC, СТС и/или CTSC, редко присутствующие в образце, могут быть амплифицированы и надежно и стабильно обнаружены или выделены/получены путем обеспечения этапа обнаружения или разделения/получения с этапом пролиферации СТС и/или CTSC с использованием культуральной среды, состоящей из бессывороточной культуральной среды для СТС и/или CTSC (циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки).
[0022] В частности, данное изобретение представляет собой способ обнаружения или выделения/получения СТС и/или CTSC из биологической циркулирующей жидкости организма с использованием метода клеточной пролиферации, включающий следующие этапы обработки с (1) по (4):
(1) первый этап предварительной обработки образца биологической циркулирующей жидкости организма для получения фазы мононуклеарных клеток;
(2) второй этап получения луночного планшета, в который введена культуральная среда, содержащая бессывороточную ростовую среду для СТС и/или CTSC, и посева в него мононуклеарных клеток, полученных на первом этапе, с последующей инкубацией;
(3) третий этап удаления культуральной среды из лунки планшета, полученного путем инкубации на втором этапе; а также
(4) четвертый этап обнаружения или выделения/получения адгезивной опухолевой клетки, прикрепленной к лунке планшета после третьего этапа.
[0023] С помощью способа обнаружения или выделения/получения СТС и/или CTSC с использованием метода клеточной пролиферации в соответствии с данным изобретением СТС и/или CTSC, редко присутствующие в образце, таком, как биологическая циркулирующая жидкость организма, могут быть амплифицированы и надежно и стабильно обнаружены или выделены/получены. Способ обнаружения или выделения/получения СТС и/или CTSC в соответствии с данным изобретением может быть осуществлен с биологической циркулирующей жидкостью организма в качестве образца. Примеры образца биологической циркулирующей жидкости организма могут включать образец периферической крови в качестве образца, который можно использовать наиболее легко и эффективно.
[0024] В способе обнаружения или выделения/получения СТС и/или CTSC в соответствии с данным изобретением этап получения фазы мононуклеарных клеток из биологической циркулирующей жидкости организма, который является первым этапом, включает предварительную обработку образца биологической циркулирующей жидкости организма, и ее примеры могут включать обработку для удаления жидких компонентов и неклеточных компонентов крови и т.п., содержащихся в биологической циркулирующей жидкости организма.
[0025] В способе обнаружения или выделения/получения СТС и/или CTSC в соответствии с данным изобретением, второй этап посева и инкубации мононуклеарных клеток, полученных на первом этапе, состоит в получении луночного планшета, в который была введена культуральная среда, содержащая бессывороточную ростовую среду для СТС и/или CTSC, и посеве мононуклеарных клеток, полученных на первом этапе, с последующей инкубацией. Примеры культуральной среды, содержащей бессывороточную ростовую среду для СТС и/или CTSC, могут включать культуральную среду на основе AIM-V, которая является бессывороточной культуральной средой для клеточной пролиферации. Применение культуральной среды позволяет СТС и/или CTSC пролиферировать в течение короткого периода на этапе инкубации в способе обнаружения или выделения/получения СТС и/или CTSC в биологической циркулирующей жидкости организма с использованием способа клеточной пролиферации и позволяет СТС и/или CTSC, присутствующим в следовых количествах в образце, пролиферировать или быть амплифицированными и надежно и стабильно обнаруженными или выделенными/полученными. В качестве культуральной среды на основе AIM-V может быть использована среда AIM-V или культуральная среда, в которой к культуральной среде AIM-V добавлен один или более из компонентов, выбранных из аутологичной сыворотки субъекта, полученной от здорового индивидуума АВ-сыворотки и пальмитиновой кислоты или ее соли. Условия инкубации на втором этапе могут быть соответствующим образом установлены как совместимые условия в отношении температуры пролиферации и периода пролиферации. Инкубацию можно проводить наиболее подходящим образом при 37°С и в течение периода от 3 до 7 дней, что соответствует стандартным условиям температуры пролиферации и периода пролиферации. Кроме того, условия инкубации на втором этапе могут быть условиями в инкубаторе, доведенном до 5% CO2.
[0026] Конкретно, в качестве культуральной среды, содержащей бессывороточную ростовую среду для СТС и/или CTSC, используемой в способе обнаружения или выделения/получения СТС и/или CTSC в соответствии с данным изобретением, могут использовать культуральную среду на основе AIM-V. В качестве культуральной среды на основе AIM-V могут использовать культуральную среду AIM-V как основную культуральную среду. При использовании культуральной среды, в которой к культуральной среде AIM-V добавлен один или более из компонентов, выбранных среди аутологичной сыворотки субъекта, полученной от здорового индивидуума АВ-сыворотки и пальмитиновой кислоты или ее соли, эффект индуцирования СТС может быть усилен и может быть получен эффект более эффективного и стабильного обнаружения или выделения СТС и/или CTSC. В частности, пальмитиновая кислота или ее соль могут быть упомянуты в качестве добавочного компонента, который позволяет безопасно и стабильно обнаруживать или разделять СТС и/или CTSC.
[0027] В способе обнаружения или выделения/получения СТС и/или CTSC в соответствии с данным изобретением третий этап удаления культуральной среды из лунки планшета, полученного путем инкубации на втором этапе, состоит из обработки для удаления культуральной среды с помощью подходящих средств из культур, полученных путем инкубации в течение заданного времени в луночном планшете. В способе обнаружения или выделения/получения СТС и/или CTSC в соответствии с данным изобретением четвертый этап обнаружения или выделения/получения адгезивной опухолевой клетки, прикрепленной к лунке планшета после третьего этапа, состоит в прямом обнаружении адгезивной опухолевой клетки, прикрепленной к лунке планшета, с использованием средств для обнаружения, таких как микроскопическое исследование, окрашивание красителем или окрашивание типа «антиген - антитело», или в отделении адгезивной опухолевой клетки, прикрепленной к лунке планшета и получении ее в качестве раковой клетки для различных способов обнаружения.
[0028] Описывается предпосылка создания способа обнаружения или выделения/получения СТС и/или CTSC в соответствии с данным изобретением. Для надежного и стабильного обнаружения или выделения/получения СТС и/или CTSC, присутствующих в следовых количествах в биологической циркулирующей жидкости организма, необходимо вызывать за короткий период эффективную пролиферацию и амплификацию СТС и/или CTSC, присутствующих в следовых количествах в образце. Кроме того, проблемой для создания способа обнаружения или выделения/получения СТС и/или CTSC, использующего метод клеточной пролиферации, является поиск бессывороточной ростовой среды для СТС и/или CTSC, которая позволит пролиферировать СТС и CTSC. Соответственно, автор данного изобретения проводил тщательные исследования для достижения цели данного изобретения и в ходе этого курса сравнивал культуральную среду AIM-V (AIM-V) в качестве бессывороточной ростовой среды с культуральной средой RPMI-1640 (RPMI-1640), которая является стандартной культуральной средой для мононуклеарных клеток периферической крови в отношении выделения и получения СТС. В частности, автор данного изобретения добавлял 5% фетальной бычьей сыворотки (fetal bovine serum, FBS) или аутологичной сыворотки (autologous serum, AS) периферической крови донора к каждой из этих культуральных сред при культивировании и изучал наличие или отсутствие и влияние культуральных сред на выделение и получение СТС. В результате было продемонстрировано, что AIM-V может быть использована для выделения и получения СТС и/или CTSC; и добавление AS усиливает ее действие.
[0029] На основании результатов, полученных с использованием культуральных сред, описанных выше, различные кандидаты, LPS (липополисахарид), ConA, PHA, IL-1α (интерлейкин 1α) и IL-1β (интерлейкин 1β), включая пальмитиновую кислоту, также были изучены в качестве новых факторов для выделения/получения СТС, и был проведен поиск наиболее безопасного и эффективного фактора, который бы позволил избежать увеличения нагрузки на пациентов, возникающей при заборе аутологичной сыворотки и устранить влияние изменения компонентов сыворотки при болезненных состояниях у субъектов. Хотя в ходе данного исследования LPS также демонстрировал СТС-индуцирующий эффект, он представляет собой вещество, обладающее очень высокой токсичностью, и поэтому был признан неуместным в качестве реагента по соображениям безопасности в свете различных целей исследования и развития методик клинического применения после выделения СТС, и был исключен из последующих экспериментов. В результате было продемонстрировано, что для получения СТС пальмитиновая кислота является очень полезной в качестве нового фактора, который может безопасно и стабильно диспергировать СТС, даже если аутологичная сыворотка, которая является нестабильным фактором с точки зрения ее наличия или свойств (носитель вируса, который не должен заражать других и т.д.), устраняется. В заключение, автор данного изобретения продемонстрировал, что культуральная среда AIM-V или культуральная среда, в которой к культуральной среде AIM-V добавлен один или более из компонентов, выбранных из аутологичной сыворотки субъекта, полученной от здорового индивидуума АВ-сыворотки и пальмитиновой кислоты или ее соли, в частности, культуральная среда, в которую добавлена пальмитиновая кислота или ее соль, может быть использована для стабильного выделения СТС, что завершает данное изобретение.
[0030] В частности, данное изобретение обеспечивает наличие следующих элементов:
[1] Способ обнаружения или выделения/получения циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки из биологической циркулирующей жидкости организма, включающий следующие этапы обработки с (1) по (4):
(1) первый этап предварительной обработки образца биологической циркулирующей жидкости организма для получения фазы мононуклеарных клеток;
(2) второй этап получения луночного планшета, в который введена культуральная среда, содержащая бессывороточную ростовую среду для циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки, и посева в него мононуклеарных клеток, полученных на первом этапе, с последующей инкубацией;
(3) третий этап удаления культуральной среды из лунки планшета, полученного путем инкубации на втором этапе; а также
(4) четвертый этап обнаружения или выделения/получения адгезивной опухолевой клетки, прикрепленной к лунке планшета после третьего этапа.
[2] Способ обнаружения или выделения/получения циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки из биологической циркулирующей жидкости организма согласно пункту [1], приведенному выше, где на втором этапе культуральная среда, содержащая бессывороточную ростовую среду для циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки, для посева и инкубации мононуклеарных клеток, полученных на первом этапе, представляет собой культуральную среду на основе AIM-V.
[3] Способ обнаружения или выделения/получения циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки из биологической циркулирующей жидкости организма согласно пунктам [1] или [2], приведенным выше, в котором на втором этапе культуральная среда на основе AIM-V для посева и инкубации мононуклеарных клеток, полученных на первом этапе, представляет собой культуральную среду AIM-V или культуральную среду, в которой к культуральной среде AIM-V добавлен один или более из компонентов, выбранных из аутологичной сыворотки субъекта, полученной от здорового индивидуума АВ-сыворотки и пальмитиновой кислоты или ее соли.
[4] Способ обнаружения или выделения/получения циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки из биологической циркулирующей жидкости организма согласно любому из пунктов [1]-[3], приведенных выше, где образец биологической циркулирующей жидкости организма представляет собой образец периферической крови.
[5] Способ обнаружения или выделения/получения циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки из биологической циркулирующей жидкости организма по любому из пунктов [1]-[3], приведенных выше, где предварительная обработка образца биологической циркулирующей жидкости организма на первом этапе представляет собой удаление жидкого компонента и неклеточного компонента, содержащегося в биологической циркулирующей жидкости организма.
[6] Способ обнаружения или выделения/получения циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки из биологической циркулирующей жидкости организма по любому из пунктов [1]-[5] выше, где инкубацию на втором этапе выполняют при 37°С и в течение периода от 3 до 7 дней в качестве стандартных условий температуры пролиферации и периода пролиферации.
[7] Способ обнаружения или выделения/получения циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки из биологической циркулирующей жидкости организма согласно пункту [6] выше, где инкубацию на втором этапе проводят в инкубаторе, доведенном до 5% CO2.
Технический результат изобретения
[0031] Данное изобретение обеспечивает способ обнаружения или выделения/получения СТС, который способен надежно и стабильно обнаруживать или выделять/получать циркулирующую опухолевую клетку и циркулирующую опухолевую стволовую клетку, присутствующую в следовых количествах в биологической циркулирующей жидкости организма, такой, как кровь или лимфа, даже в состоянии, когда тип рака опухолевых клеток еще не может быть определен, и в состоянии, когда опухолевые клетки присутствуют в следовых количествах в биологической циркулирующей жидкости организма. Способ обнаружения или выделения/получения СТС в соответствии с данным изобретением позволяет обнаруживать или разделять не только СТС, но и CTSC, и обеспечивает средства, которые могут быть использованы для основного определения рака или клинического подхода к нему.
[0032] В частности, эффективное и стабильное выделение СТС, обеспечиваемое данным изобретением, предоставляет возможность осуществления революционного прогресса в исследовании рака. Раковые клетки или, более того, CTSC до сих пор не могут быть эффективно и стабильно обнаружены, отделены или выделены из периферической крови и т.п. Это стало основной причиной задержки в исследованиях СТС. В свете этого, методика согласно данному изобретению обеспечила основу для радикального продвижения исследований СТС. Данное изобретение позволяет провести фундаментальные или клинические исследования СТС и, как можно ожидать, даст начало разработке методики контроля СТС.
[0033] При условии, что основные исследования, использующие данное изобретение, будут продолжены, можно генетически изучить аспекты цитологического разнообразия СТС на уровне вещества такого субъекта как ген. Это открывает перспективу разработки новых лекарств, связанных с контролем пролиферации и иммунологически новых лекарств, таких как цитоцидные антитела против СТС. Кроме того, это клинически позволяет делать сравнение с классификацией стадий раковых больных, сравнение с гистологической классификацией и, далее, поиск корреляции с различными полученными индексами. Кроме того, можно ожидать, что будет создана прочная научная основа даже для первой в мире диагностики, лечения или анализа и оценки прогноза, потому что также может быть выяснена связь с эффектом лечения и т.д. Таким образом, данное изобретение вносит очень большой вклад в исследования и разработки, такие как базовое определение рака или клинический подход к его лечению.
Краткое описание графических материалов
[0034]
На фиг. 1 изображена диаграмма, показывающая результаты (фотографию) микроскопического наблюдения, полученные при получении СТС с тестовым использованием культуральной среды AIM-V и культуральной среды RPMI-1640 в качестве культуральной среды при выборе эффективной культуральной среды для получения раковых клеток (СТС). На фигуре (1-а) показаны результаты получения СТС с использованием культуральной среды AIM-V, а на фигуре (1-b) показаны результаты получения СТС в случае использования культуральной среды RPMI-1640.
На фиг. 2 показано микроскопическое изображение СТС, полученное при культивировании как результат «наблюдения морфологических изменений в СТС, полученных при культивировании с использованием только культуральной среды AIM-V» при проверке подтверждения морфологического изменения в раковых клетках (СТС), полученных в культуральной среде для пролиферации СТС в Примерах согласно данному изобретению. На фиг. (2-а) и (2-b) показаны результаты изучения СТС от разных пациентов (микроскопические фотографии раковых клеток (СТС) от разных пациентов).
Фиг. 3 представляет собой микроскопическое изображение СТС, полученных путем культивирования, как результат «наблюдения морфологических изменений в СТС, полученных путем культивирования с использованием культуральной среды AIM-V, дополненной пальмитиновой кислотой (× 1 конц.),» при проверке подтверждения морфологических изменений в раковых клетках (СТС), полученных в культуральной среде для пролиферации СТС в Примерах данного изобретения. На фиг. (3-а) и (3-b) показаны результаты изучения СТС от разных пациентов (микроскопические фотографии раковых клеток (СТС) от разных пациентов).
Фиг. 4 представляет собой микроскопическое изображение СТС, полученных путем культивирования, как результаты «наблюдения морфологических изменений в СТС, полученных путем культивирования с использованием культуральной среды AIM-V, дополненной пальмитиновой кислотой (× 4 конц.)» при проверке подтверждения морфологических изменений в раковых клетках (СТС), полученных в культуральной среде для пролиферации СТС в Примерах данного изобретения. На фиг. (4-а) и (4-b) показаны результаты изучения СТС от разных пациентов (микроскопические фотографии раковых клеток (СТС) от разных пациентов).
Фиг. 5 представляет собой микроскопическое изображение СТС, полученных путем культивирования, как результаты «наблюдения морфологических изменений в СТС, полученных путем культивирования с использованием культуральной среды AIM-V + 5% аутологичной сыворотки» при проверке подтверждения морфологических изменений в раковых клетках (СТС), полученных в культуральной среде для пролиферации СТС в Примерах данного изобретения. На фиг. (5-а) и (5-b) показаны результаты изучения СТС от разных пациентов (микроскопические фотографии раковых клеток (СТС) от разных пациентов).
Фиг. 6 представляет собой микроскопическое изображение СТС, полученных путем культивирования, как результаты «наблюдения морфологических изменений в СТС, полученных путем культивирования с использованием культуральной среды AIM-V + 5% аутологичной сыворотки+пальмитиновая кислота (× 1 конц.)» при проверке подтверждения морфологических изменений в раковых клетках (СТС), полученных в культуральной среде для пролиферации СТС в Примерах данного изобретения. На фиг. (6-а) и (6-b) показаны результаты изучения СТС от разных пациентов (микроскопические фотографии раковых клеток (СТС) от разных пациентов).
Фиг. 7 представляет собой микроскопическое изображение СТС, полученных путем культивирования, как результаты «наблюдения морфологических изменений в СТС, полученных путем культивирования с использованием культуральной среды в условиях AIM-V + 5% аутологичной сыворотки + пальмитиновая кислота (× 4 конц.)» при проверке подтверждения морфологических изменений в раковых клетках (СТС), полученных в культуральной среде для пролиферации СТС в Примерах данного изобретения. На фиг. (7-а) и (7-b) показаны результаты изучения СТС от разных пациентов (микроскопические фотографии раковых клеток (СТС) от разных пациентов).
Фиг. 8 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента К.Н. (Gastric Са.: рак желудка, liver meta.: метастазы в печени) в «подтверждении и идентификации СТС с использованием мембранного антигена CD44» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 9 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента Т.K. (Tongue Са.: рак языка) в «подтверждении и идентификации СТС с использованием мембранного антигена CD44» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 10 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента К.Н. (Gastric Са.: рак желудка, liver meta.: метастазы в печени) в «подтверждении и идентификации СТС с использованием мембранного антигена CD44» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 11 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента Т.К. (Tongue Са.: рак языка) в «подтверждении и идентификации СТС с использованием мембранного антигена CD44» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 12 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента S.K. (Kerato-cystic Са.: кератокистозный рак) в «подтверждении и идентификации СТС с использованием мембранного антигена CD44» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 13 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента S.O. (Lung Са.: рак легкого) в «подтверждении и идентификации СТС с использованием мембранного антигена CD44» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 14 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента H.Y. (Breast Са.: рак молочной железы) в «подтверждении и идентификации СТС с использованием мембранного антигена CD44» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 15 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента Y.H. (Lung Са.: рак легкого) в «подтверждении и идентификации СТС с использованием мембранного антигена CD44» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 16 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента H.Y. (Breast Са.: рак молочной железы) в «подтверждении и идентификации СТС с использованием мембранного антигена CD45» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
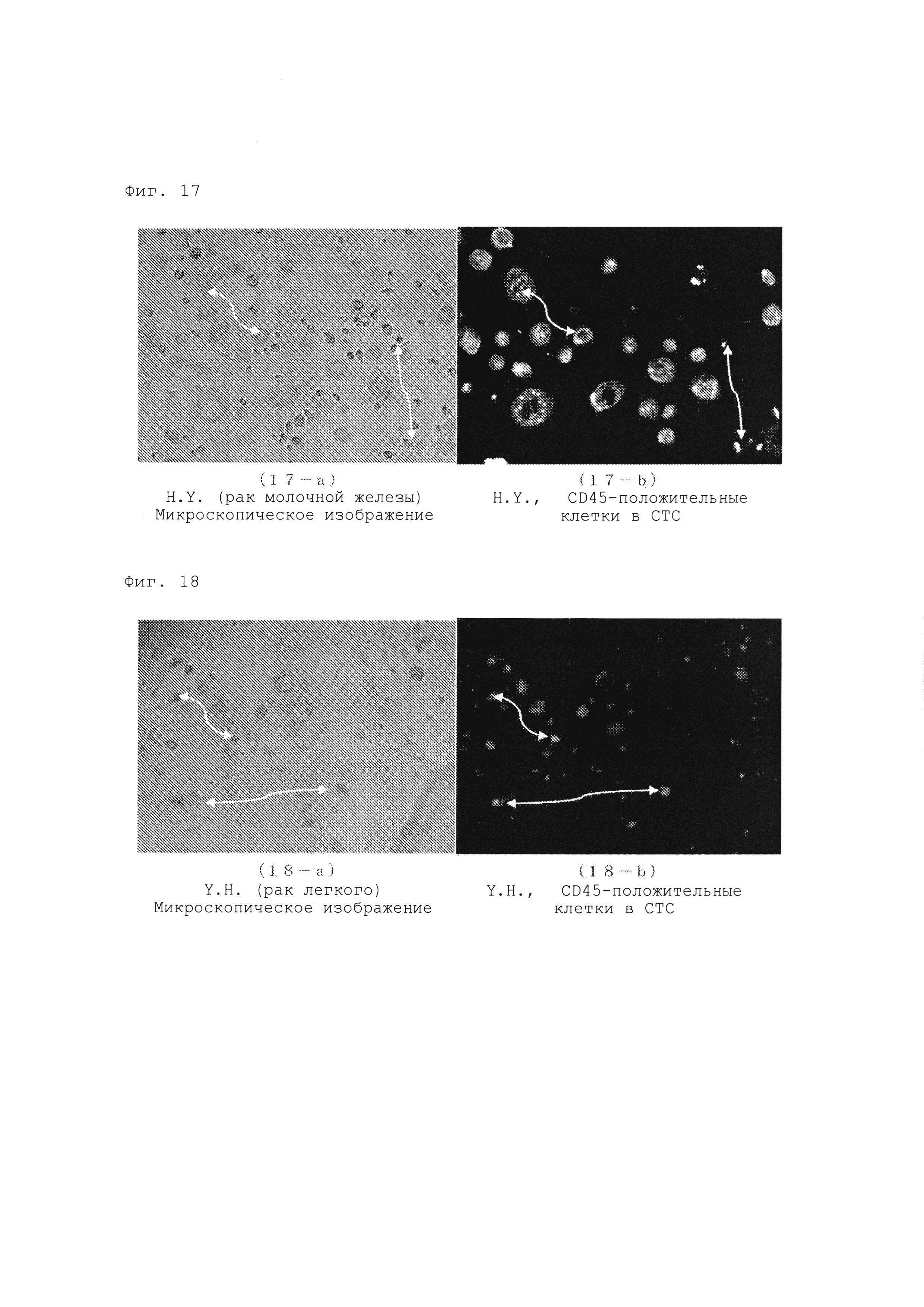
Фиг. 17 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента H.Y. (Breast Са.: рак молочной железы) в «подтверждении и идентификации СТС с использованием мембранного антигена CD45» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 18 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента Y.H. (Lung Са.: рак легкого) в «подтверждении и идентификации СТС с использованием мембранного антигена CD45» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 19 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента G.N. (Breast Са.: рак молочной железы, multiple meta.: множественные метастазы) в «подтверждении и идентификации СТС с использованием мембранного антигена CD47» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 20 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента S.K. (Kerato-cystic Са.: кератокистозный рак) в «подтверждении и идентификации СТС с использованием мембранного антигена CD47» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 21 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента S.O. (Lung Са.: рак легкого) в «подтверждении и идентификации СТС с использованием мембранного антигена CD47» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 22 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента H.Y. (Breast Са.: рак молочной железы) в «подтверждении и идентификации СТС с использованием мембранного антигена CD47» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 23 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента Y.H. (Lung Са.: рак легкого) в «подтверждении и идентификации СТС с использованием мембранного антигена CD47» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 24 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента H.Y. (Breast Са.: рак молочной железы) в «подтверждении и идентификации СТС с использованием мембранного антигена СКП» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 25 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента Y.H. (Lung Са.: рак легкого) в «подтверждении и идентификации СТС с использованием мембранного антигена CKII» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 26 представляет собой микроскопическую фотографию (а) и флуоресцентную микроскопическую фотографию (b) СТС, выделенных и полученных от пациента H.Y. (Breast Са.: рак молочной железы) в «подтверждении и идентификации СТС с использованием мембранного антигена ЕрСАМ» при проверке подтверждения и идентификации с использованием клеточного мембранного антигена СТС, выделенных и полученных из периферической крови пациента в Примерах данного изобретения.
Фиг. 27 представляет собой микроскопическое фотографическое изображение (изображение, полученное без флуоресцентного излучения) клеток, оставшихся в группе трансплантации СТС, и их микроскопическую фотографию с флуоресцентным антителом (изображение, полученное с флуоресцентным излучением) с использованием мембранного антигена CD45 в "тесте подтверждения онкогенности или долгосрочной выживаемости СТС у голых мышей» в Примерах данного изобретения. На фиг.(27-а) и (27-b) показаны микроскопическая фотография (контроль) и микроскопическая фотография с флуоресцентным антителом (изображение, полученное с флуоресцентным излучением), соответственно, клеток, оставшихся в группе трансплантации СТС, в случае, когда СТС (HY-1), выделенные из образца от пациента HY, были трансплантированы мыши «Nude 1-1».
Фиг. 28 представляет собой микроскопическое фотографическое изображение (изображение, полученное без флуоресцентного излучения) клеток, оставшихся в группе трансплантации СТС, и их микроскопическую фотографию с флуоресцентным антителом (изображение, полученное с флуоресцентным излучением) с использованием мембранного антигена CD45 в "тесте подтверждения онкогенности или долгосрочной выживаемости СТС у голых мышей» в Примерах данного изобретения. На фиг. (28-а) и (28-b) показаны микроскопическая фотография (контроль) и микроскопическая фотография с флуоресцентным антителом (изображение, полученное с флуоресцентным излучением), соответственно, клеток, оставшихся в группе трансплантации СТС, в случае, когда СТС (KH-1), выделенные из образца от пациента K.Н., были трансплантированы мыши «Nude 1-2».
Фиг. 29 представляет собой микроскопическое фотографическое изображение (изображение, полученное без флуоресцентного излучения) клеток, оставшихся в группе трансплантации СТС, и микроскопическую фотографию с флуоресцентным антителом (изображение, полученное с флуоресцентным излучением) с использованием мембранного антигена CD45 в "тесте подтверждения онкогенности или долгосрочной выживаемости СТС у голых мышей» в Примерах данного изобретения. На фиг. (29-а) и (29-b) показаны микроскопическая фотография (контроль) и микроскопическая фотография с флуоресцентным антителом (изображение, полученное с флуоресцентным излучением), соответственно, клеток, оставшихся в группе трансплантации СТС, в случае, когда СТС (HY-1), выделенные из образца от пациента H.Y., были трансплантированы мыши «Nude 2-1».
Фиг. 30 представляет собой микроскопическое фотографическое изображение (изображение, полученное без флуоресцентного излучения) клеток, оставшихся в группе трансплантации СТС, и микроскопическую фотографию с флуоресцентным антителом (изображение, полученное с флуоресцентным излучением) с использованием мембранного антигена CD45 в "тесте подтверждения онкогенности или долгосрочной выживаемости СТС у голых мышей» в Примерах данного изобретения. На фиг. (30-а) и (30-b) показаны микроскопическая фотография (контроль) и микроскопическая фотография с флуоресцентным антителом (изображение, полученное с флуоресцентным излучением), соответственно, клеток, оставшихся в группе трансплантации СТС, в случае, когда СТС (KH-1), выделенные из образца от пациента K.Н., были трансплантированы мыши «Nude 2-2».
Фиг. 31 представляет собой микроскопическое фотографическое изображение (а) и микроскопическую фотографию с флуоресцентным антителом (b) с использованием мембранного антигена CD45 в качестве «клеток нормальной ткани тонкой кишки» от голых мышей из контрольной группы без трансплантации СТС в "тесте подтверждения онкогенности или долгосрочной выживаемости СТС у голых мышей» в Примерах данного изобретения.
Фиг. 32 представляет собой фотографию, показывающую микроскопическое изображение, полученное без флуорохромного окрашивания, и изображение CD47-положительных клеток, полученное с флуорохромным окрашиванием, результаты пролиферации и получения клеток СТС с использованием стабильной линии раковых клеток (UTC-8) в качестве образца, и последующее обнаружение CD47-положительных клеток с использованием антигена клеточной мембраны CD47 в тесте обнаружения (I) CD47-положительных клеток (CTSC) с использованием стабильной линии раковых клеток (UTC-8). На фиг. 32 (32-а) показано микроскопическое изображение, полученное без флуорохромного окрашивания, а на (32-b) показано изображение CD47-положительных клеток, полученное с флуорохромным окрашиванием.
Фиг. 33 представляет собой фотографию, показывающую микроскопическое изображение, полученное без флуорохромного окрашивания, и изображение CD47-положительных клеток, полученное с флуорохромным окрашиванием, результаты пролиферации и получения клеток СТС с использованием стабильной линии раковых клеток (UTC-8) в качестве образца, и последующее обнаружение CD47-положительных клеток с использованием антигена клеточной мембраны CD47 в тесте обнаружения (II) CD47-положительных клеток (CTSC) с использованием стабильной линии раковых клеток (UTC-8). На фиг. 33 (33-а) показано микроскопическое изображение, полученное без флуорохромного окрашивания, а на (33-b) показано изображение CD47-положительных клеток, полученное с флуорохромным окрашиванием.
Осуществление изобретения
[0035] Данное изобретение обеспечивает способ обнаружения или выделения/получения СТС и/или CTSC из биологической циркулирующей жидкости организма с использованием способа клеточной пролиферации, включающий следующие этапы с (1) по (4):
(1) первый этап предварительной обработки образца биологической циркулирующей жидкости организма для получения фазы мононуклеарных клеток;
(2) второй этап получения луночного планшета, в который введена культуральная среда, содержащая бессывороточную ростовую среду для СТС и/или CTSC, и посева в него мононуклеарных клеток, полученных на первом этапе, с последующей инкубацией;
(3) третий этап удаления культуральной среды, из лунки планшета, полученного путем инкубации на втором этапе; а также
(4) четвертый этап обнаружения или выделения/получения адгезивной опухолевой клетки, прикрепленной к лунке планшета после третьего этапа.
[0036] Способ обнаружения или выделения/получения СТС и/или CTSC в соответствии с данным изобретением может быть осуществлен с биологической циркулирующей жидкостью организма в качестве образца. Примеры образца биологической циркулирующей жидкости организма могут включать образец периферической крови в качестве образца, который можно использовать наиболее легко и эффективно. Что касается сбора образца биологической циркулирующей жидкости организма для обнаружения или выделения/получения СТС и/или CTSC, то орган, выделенный из кровотока, и биологическая жидкость в организме не могут находиться у одного индивидуума. Можно выделить СТС и/или CTSC из каждого органа, даже если присутствие рака в нем невозможно предсказать макроскопически. Например, СТС человеческого происхождения были успешно выделены путем подкожной или внутрикожной пересадки СТС человеческого происхождения на спину голых мышей, вырезания селезенки через 3 месяца и выполнения операции выделения из периферической крови.
[0037] В способе обнаружения или выделения/получения СТС и/или CTSC из биологической циркулирующей жидкости организма в соответствии с данным изобретением первый этап состоит из этапа предварительной обработки образца из биологической циркулирующей жидкости для получения фазы мононуклеарных клеток. Этот этап включает предварительную обработку образца биологической циркулирующей жидкости, и ее примеры могут включать обработку для удаления жидкого компонента и неклеточного компонента крови и т.п., содержащегося в биологической циркулирующей жидкости организма. Обработка для удаления жидкого компонента и неклеточного компонента крови и т.п., содержащихся в биологической циркулирующей жидкости организма, конкретно не ограничена, и поэтому может быть использован общеизвестный способ. Примеры этой обработки образца крови включают способ выделения и удаления эритроцитов и лейкоцитов в крови путем центрифугирования (способ центрифугирования), способ выделения и удаления эритроцитов и лейкоцитов в крови с использованием плотности клеток (способ центрифугирования в градиенте плотности) и способ выделения клеток крови с использованием разницы в размере клеток (способ разделения с использованием фильтра). Особенно предпочтительные примеры данного способа могут включать способ центрифугирования в градиенте плотности. В этом случае, в частности, могут быть использованы условия обработки согласно способу центрифугирования в градиенте плотности Ficoll-Isopaque.
[0038] В способе обнаружения или выделения/получения СТС и/или CTSC из биологической циркулирующей жидкости организма в соответствии с данным изобретением культуральная среда на основе AIM-V может быть использована в качестве культуральной среды, содержащей бессывороточную ростовую среду для СТС и/или CTSC, используемых в инкубации на втором этапе. Культуральная среда AIM-V является одной из культуральных сред, разработанных для пролиферации Т-клеток и т.п. Сама культуральная среда может быть заготовлена из коммерчески доступных продуктов. Далее описан второй этап способа обнаружения или выделения/получения СТС и/или CTSC из биологической циркулирующей жидкости организма в соответствии с данным изобретением. Второй этап состоит из этапа получения луночного планшета, в который введена культуральная среда на основе AIM-V, которая является бессывороточной ростовой средой для пролиферации клеток, и посева в него мононуклеарных клеток, полученных на первом этапе, с последующей инкубацией. В качестве культуральной среды на основе AIM-V может быть использована среда AIM-V или культуральная среда, в которой к культуральной среде AIM-V добавлен один или более из компонентов, выбранных среди аутологичной сыворотки субъекта, полученной от здорового индивидуума АВ-сыворотки и пальмитиновой кислоты или ее соли. Условия инкубации на втором этапе могут быть заданы соответствующим образом в зависимости от ситуации. Предпочтительно, инкубация может быть проведена в условиях инкубатора при 5% CO2 и 37°С и в течение периода от 3 до 7 дней. Особенно предпочтительно, инкубация может быть проведена в условиях инкубатора при температуре культивирования и в течение периода культивирования, которые составляют 5% CO2, 37°С и 7 дней.
[0039] В способе обнаружения или выделения/получения СТС и/или CTSC из биологической циркулирующей жидкости организма в соответствии с данным изобретением третий этап состоит из этапа удаления культуральной среды из лунки планшета, полученного путем инкубации на втором этапе. Удаление культуральной среды из лунки планшета может быть осуществлено с помощью соответствующих средств.
[0040] В способе обнаружения или выделения/получения СТС и/или CTSC из биологической циркулирующей жидкости организма в соответствии с данным изобретением четвертый этап состоит из этапа обнаружения или выделения/получения адгезивной опухолевой клетки, прикрепленной к лунке планшета после третьего этапа. На четвертом этапе адгезивная опухолевая клетка, прикрепленная к лунке планшета, может быть подвергнута непосредственно обнаружению с помощью средств обнаружения, таких как микроскопическое исследование, окрашивание красителями или окрашивание антигеном или антителом. Кроме того, адгезивная опухолевая клетка, прикрепленная к лунке планшета, может быть выделена и получена как раковая клетка для различных обнаружений.
[0041] В способе обнаружения или выделения/получения СТС и/или CTSC из биологической циркулирующей жидкости тела в соответствии с данным изобретением раковые клетки, выделенные/полученные таким образом, могут быть предоставлены в качестве образцов раковых клеток для исследования рака, клинического применения и т.д., такого, как диагностика рака, лечение или анализ и оценка прогноза.
[0042] Клетки, выделенные и полученные в соответствии с данным изобретением, могут быть распознаны как раковые клетки путем выбора множества подходящих критериев из приведенных ниже и их подтверждения. Например, решение может быть принято путем выбора критериев из (1)-(5), (7) и (9).
[0043] Критерии подтверждения
(1) Не наблюдается никакого феномена контактного ингибирования.
(2) Показана способность формировать колонию в мягком агаре (этот способ является способом, применяемым к плавающим клеткам).
(3) Под микроскопом видны аномальные морфология и объем хромосом по сравнению с объемом клеток.
(4) Показана способность к делению, превышающая приблизительно в 50 раз предел Хейфлика, который, по сообщениям, является пределом числа делений в посеваемой культуре нормальных человеческих клеток, т.е. показана способность посеваемой культуры к постоянной пролиферации или иммортализации в течение примерно полугода или дольше, если клетки делятся два-три раза в неделю.
Генетически или серологически
(5) Антигены, такие как CD44, CD45, CD47, CKII и ЕрСАМ, уже обнаруженные в качестве маркеров клеточной поверхности раковых стволовых клеток (CTSC), определяются по одному или в комбинации.
(6) Культуральная среда клеток демонстрирует положительный ответ по меньшей мере на один или более из 24 типов маркеров, как правило, обозначенных как опухолевые маркеры, такие как SCC для плоскоклеточного рака головы и шеи или рака пищевода, СА125 для рака легкого, СА15-3 для рака молочной железы, AFP и СЕА для рака легкого, CEA и СА19-9 для рака поджелудочной железы и СА19-9 для колоректального рака, по сравнению с контрольной группой.
(7) Когда тотальная РНК очищена из клеток и подвергается анализу генов, достоверно наблюдается экспрессия генов, связанных с раком, и генов стволовых клеток рака.
Для наблюдения онкогенности полученных клеток
(8) Когда ДНК очищена из выделенных и полученных раковых клеток и переносится в клетки NIH3T3, феномен контактного ингибирования клеток NIH3T3 исчезает и наблюдается морфологическая экспрессия признаков раковых клеток.
(9) Когда клетки трансплантируют иммунодефицитным голым мышам или SCID-мышам, трансплантированные клетки проявляют онкогенность. Кроме того, когда пролиферированные ткани рекультивируют, клетки ткани пролиферируют.
[0044] Как раскрыто выше, например, СТС, эффективно выделенные или обнаруженные в периферической крови способом согласно данному изобретению, которые могут быть наиболее легко использованы в качестве представителя человеческой биологической ткани, могут быть использованы с результатами выделения или обнаружения в качестве показателя для сравнительной оценки эффекта до и после проведения терапии рака и могут способствовать оценке прогноза. Кроме того, способ согласно данному изобретению позволил выделять/получать СТС с высокой эффективностью и тем самым может способствовать разработке новых методик лечения и т.д., таких как разработка лекарственных препаратов и т.п., эффективных для лечения рака. В частности, данное изобретение позволило выделять/получать СТС с высокой эффективностью при любом раке или неуточненном раке и, таким образом, не только делает возможным раннее обнаружение рака или анализ или оценку прогноза, но также может установить показатель для оценки до и после лечения на основании тенденций в количестве или морфологии стабильно получаемых СТС в целях содействия разработке лекарственных препаратов, контролирующих СТС, или разработке способов лечения. Кроме того, СТС можно использовать в качестве материала для создания стабильной основы в базовых или клинических исследованиях СТС.
[0045] Далее данное изобретение будет более подробно раскрыто со ссылкой на Примеры. Тем не менее, данное изобретение не ограничено этими Примерами.
Пример 1
[0046] Экспериментальный способ:
Примеры данного изобретения следуют за экспериментальными способами, приведенными ниже. В частности, все экспериментальные образцы (периферическая кровь от разных пациентов с раком, которые сдали кровь) были асептически обработаны с помощью процедур, приведенных ниже. В случае, когда инфекции, вызванные различными вирусами, такими как HBV и HCV, были обнаружены заранее в соответствии с информацией от каждого сотрудничающего объекта, обработку проводили отдельно от неинфицированной группы, и надлежащая утилизация медицинских отходов проводилась специалистами по утилизации медицинских отходов.
[0047] Сбор образцов: сбор крови
1. Был предоставлен одноразовый 30 мл шприц для сбора крови, содержащий соответствующее количество антикоагулянта гепарина натрия (0,05 мл), и был предоставлен одноразовый 30 мл шприц для сбора крови для получения сыворотки, не содержащий гепарина натрия. Эти шприцы были соответствующим образом соединены со вставными портами трехходового крана L-типа 180°, в то время как соответствующая игла-бабочка с калибром 18, 21 или 24 была соединена с сосудом для подготовки к сбору крови. На каждый образец было собрано 30 мл крови, и далее была проведена операция по выделению.
[0048] Очистка образца: выделение клеток крови
2. Чтобы собрать сыворотку, шприц для сбора крови с иглой, помещенной на нее, помещали в инкубатор с 5% CO2 и температурой 37°С на 1 час, а затем центрифугировали со скоростью 3000 об/мин (800 g) при 4°С в течение 30 минут. Надосадочную жидкость собирали как аутологичную сыворотку (autologous serum, AS) и хранили при 4°С.
3. Между тем, пробирку для сбора крови с гепарином, предназначенную для выделения мононуклеарных клеток периферической крови (peripheral blood mononuclear cells, PBMC), тщательно перемешивали, катая пробирку для сбора крови после сбора крови. Затем для снижения вязкости крови в нее добавляли равное количество (-)PBS и перемешивали. Затем аликвоту объемом 5 мл медленно выливали на верхнюю поверхность F/I в каждую пробирку объемом 15 мл, в которую предварительно вносили 5 мл агента для центрифугирования в градиенте плотности Ficoll-Isopaque (F/I), таким образом, чтобы не смешивать с F/I. Пробирку оставляли в вертикальном положении. Центрифугировали со скоростью 3000 об/мин (1710 g) при 4°C в течение 30 минут, чтобы получить слой мононуклеарных клеток на границе между F/I и плазмой. РВМС собирали путем аспирации и добавляли (-)PBS, а затем центрифугировали со скоростью 1200 об/мин (270 g) при 4°С в течение 15 минут.Эту операцию повторяли дважды. После удаления надосадочной жидкости добавляли культуральную среду (RPMI-1640 или AIM-V), подходящую для запланированных экспериментальных условий, и эту смесь использовали в следующих экспериментах.
[0049] Инкубация в культуральной среде
4. Полученные РВМС доводили до плотности 1×104 клеток/100 мкл. В экспериментальном условии по 3 лунки на группу на основании экспериментальной схемы вводили РВМС по 1×104/100 мкл (/лунка/96-луночный планшет или 1×104/25 мкл/лунка/384-луночный планшет) в каждую лунку 96-луночного планшета (производства BD Falcon/Becton, Dickinson and Company, 96 Well, Clear, Tissue Culture Treated Plate, Flat Bottom) или 384-луночного планшета (производства BD Falcon/Becton, Dickinson and Company, 384 Well, Clear, Tissue Culture Treated Plate, Flat Bottom) и заканчивали посев клеток. В случае только культуральной среды в лунку дополнительно вводили 100 мкл культуральной среды. Что касается группы с 5% AS или групп с использованием различных добавок (LPS, IL-1α, IL-1β и пальмитиновой кислоты), брали 100 мкл каждого раствора и вводили таким образом, чтобы распределение концентраций выполнялось в соответствии со схемой. Общее количество культуральной среды устанавливали равным 200 мкл/лунка, а статическое культивирование проводили при 37°С в течение заданного времени в инкубаторе в условиях 5% CO2 для начала эксперимента.
[0050] Удаление культуральной среды: обнаружение адгезивных клеток
5. Спустя неделю после начала культивирования культуральную среду удаляли путем аспирации из каждой лунки, в которые затем вводили по 100 мкл (-)PBS и удаляли после того, как внутренняя часть лунки была хорошо промыта. Эту операцию повторяли дважды. Затем снова вводили 100 мкл (-)PBS, и в каждой лунке оценивали фракцию нормальных РВМС среди адгезивных клеток по их морфологическим признакам (размеру, форме, топологии внутриклеточных гранул и т.д.) под микроскопом с последующим подсчетом.
После подсчета числа клеток в трех лунках на каждую группу рассчитывали их среднее значение и стандартное отклонение (среднее значение ±SE). [Эти эксперименты проводили множество раз для одного и того же пациента и т.д. в течение примерно 2 лет. Несмотря на изменение стадии заболевания (стадии I-IV) или состояния заболевания (тенденции к ухудшению или улучшению), данные подтвердили, что клетки всегда имеют воспроизводимую реакцию на лекарственный препарат и демонстрируют идентичную тенденцию в целом до тех пор, пока рак присутствует, хотя наблюдается уменьшение числа СТС. Таким образом, эти данные были приняты в качестве официальных данных (см. различные данные). Также было выявлено, что обнаружение адгезивных раковых клеток при такой обработке приводило к одной или менее СТС у пациентов на стадии рака, которые считались вылеченными, как само собой разумеющееся. Кроме того, адгезивные клетки не были обнаружены у людей, которые оказались здоровыми.]
[0051] Обнаружение CTSC путем флуоресцентного окрашивания
6. Адгезивные клетки, полученные путем предварительной обработки, связывали со специфическими антителами против указанных поверхностных антигенов СТС (CTSC), включая CD44, CD45, CD47, CKII, ЕрСАМ, затем окрашивали FITC-меченым вторичным антителом и наблюдали под флуоресцентным микроскопом. В результате было продемонстрировано, что адгезивные клетки, полученные при этой обработке, представляют собой СТС (CTSC) (см. изображения, полученные с помощью окрашивания).
[0052] Исследование индуцирующего влияния используемого лекарственного препарата
7. Были установлены различные условия культивирования, а также изучены СТС (CTSC)-индуцирующие влияния используемых лекарственных препаратов. Каждая концентрация лекарственного препарата и т.д. раскрыты в таблицах, касающихся результатов.
[0053] (1) «Исследование культуральной среды и добавочного препарата - I»
Что касается культуральной среды для выделения/получения СТС, то культуральную среду AIM-V (далее называемую AIM-V) в качестве культуральной бессывороточной среды сравнивали с эталоном, которым является культуральная среда RPMI-1640 (далее называемая RPMI-1640), которая является стандартной культуральной средой для мононуклеарных клеток периферической крови. В частности, к каждой из этих культуральных сред для культивирования добавляли 5% фетальной бычьей сыворотки (FBS), аутологичную сыворотку (AS) донорской периферической крови или сыворотку АВ-типа, и изучали наличие или отсутствие и влияние культуральных сред на разделение и получение СТС. В результате было продемонстрировано, что AIM-V может быть использована для выделения СТС; AS дополнительно усиливает ее действие; влияние сыворотки АВ-типа было немного более слабым, чем у сыворотки AS; и т.п.
[0054] (2) «Исследование культуральной среды и добавочного препарата - II»
На основании результатов, полученных с использованием сред для культивирования, раскрытых выше, различные кандидаты на добавочные компоненты (LPS, ConA, PHA, IL-1α и IL-1β), включая пальмитиновую кислоту, также были изучены в качестве новых факторов для выделения/получения СТС, и был проведен поиск наиболее безопасного и эффективного фактора, чтобы избежать увеличения нагрузки на пациентов, возникающей при заборе аутологичной сыворотки, устранить влияние изменения компонентов сыворотки при болезненных состояниях у субъектов, и устранить существенную нестабильность, вызываемую сывороткой АВ-типа, такую как неопределенность в отношении того, действительно ли это сыворотка от пациента, имеющего рак. Хотя в ходе данного исследования LPS также демонстрировал СТС-индуцирующее влияние, он представляет собой вещество, обладающее очень высокой токсичностью, и поэтому был признан неуместным в качестве реагента по соображениям безопасности в свете различных целей исследования и развития методик клинического применения после выделения СТС, и был исключен из последующих экспериментов. В результате было подтверждено, что культуральная среда AIM-V и добавление пальмитиновой кислоты имеют наилучшие последствия для стабильной изоляции СТС.
[0055] Образец, подлежащий анализу
8. В экспериментах данного изобретения в качестве образцов для анализа использовали образцы от пациентов с неизлечимой стадией рака языка, злокачественной опухоли нижней челюсти, злокачественной лимфомы, рака молочной железы, рака легкого, рака желудка, рака предстательной железы, саркомы матки и т.п., предоставленные больницами.
Пример 2
[0056] Анализ для выбора (I) эффективной культуральной среды для получения раковых клеток (СТС)
[0057] Культурная среда, подлежащая анализу
Следующие культуральные среды были предоставлены и использовались в качестве культуральной среды, подлежащей анализу.
(1) RPMI-1640 + 5% FBS
(2) RPMI-1640 + 5% Auto Serum (аутологичной сыворотки)
(3) AIM-V (только бессывороточная культуральная среда)
(4) AIM-V + 5% FBS
(5) AIM-V + 5% Auto Serum (аутологичной сыворотки)
[0058] Экспериментальный способ
Каждую культуральную среду анализировали на эффективность получения раковой клетки (СТС) (точность обнаружения раковой клетки) в соответствии с экспериментальным способом, раскрытым в Примере 1, с использованием сред для культивирования, раскрытых выше.
[0059] Анализ 1: Исследование СТС-индуцирующей способности с использованием RPMI-1640
RPMI-1640 использовали в качестве культуральной среды, и использовали ее в качестве обычной культуральной среды. Культуральную среду разделяли на группу с добавлением фетальной бычьей сыворотки (fetal bovine serum, FBS) и группу с добавлением аутологичной сыворотки (Auto Serum). Образцы, собранные от 6 пациентов с раком, изучали на наличие или отсутствие СТС-индуцирующей способности.
[0060] Результаты
Результаты представлены в Таблице 1. Как показано в таблице, что касается культуральной среды RPMI-1640, то не было заметной разницы в эффективности получения раковых клеток между группой с добавлением аутологичной сывороткой и группой с добавлением FBS, и эффективность получения была низкой в обеих группах.
[0061]
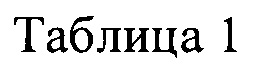

[0062] Анализ 2: Исследование СТС-индуцирующей способности с использованием RPMI-1640 и пальмитиновой кислоты
RPMI-1640, дополненную пальмитиновой кислотой, использовали в качестве культуральной среды, и использовали ее в качестве обычной культуральной среды. Культуральную среду разделяли на группу с добавлением фетальной бычьей сыворотки (fetal bovine serum, FBS) и группу с добавлением аутологичной сыворотки (Auto Serum). Образцы, собранные от 6 пациентов с раком, изучали на наличие или отсутствие СТС-индуцирующей способности.
[0063] Результаты
Результаты представлены в Таблице 2. Как показано в таблице, в отношении культуральной среды RPMI-1640, дополненной пальмитиновой кислотой, не было отмечено заметной разницы в эффективности получения раковых клеток между группой, дополненной аутологичной сывороткой, и группой, дополненной FBS, за исключением (*), и эффективность получения была низкой в обеих группах.
[0064]


[0065] Анализ 3: Исследование СТС-индуцирующей способности с использованием RPMI-1640 и AIM-V
Присутствие или отсутствие СТС-индуцирующей способности сравнивали для культуральной среды RPMI-1640 и культуральной среды AIM-V. RPMI-1640 разделяли на 2 группы: группу с добавлением фетальной бычьей сыворотки (FBS) и группу с добавлением аутологичной сыворотки (Auto Serum). Образцы, собранные от 6 пациентов с раком, изучали на наличие или отсутствие СТС-индуцирующей способности.
[0066] Результаты
Результаты представлены в Таблице 3. Как показано в таблице, культуральная среда AIM-V проявляла, в одиночку без сыворотки, высокую эффективность получения раковых клеток по сравнению с любой другой культуральной средой, в которой к культуральной среде RPMI-1640 добавляли фетальную бычью сыворотку (FBS) или аутологичную сыворотку (Auto Serum).
[0067]


[0068] Анализ 4: Исследование СТС-индуцирующей способности культуральной среды, в которой FBS был добавлен к культуральной среде AIM-V
Присутствие или отсутствие СТС-индуцирующей способности изучали в условиях, когда в культуральную среду AIM-V добавляли фетальную бычью сыворотку (FBS).
[0069] Результаты
Результаты представлены в Таблице 4. Как показано в таблице, группа с культуральной средой AIM-V, дополненной фетальной бычьей сывороткой (FBS), демонстрировала высокую эффективность получения раковых клеток, хотя среди источников клеток, полученных от пациентов, наблюдалась значительная разница в эффективности получения раковых клеток.
[0070]

[0071] Анализ 5: Исследование СТС-индуцирующей способности культуральной среды, в которой к культуральной среде AIM-V, дополненной FBS, добавляли пальмитиновую кислоту
Как правило, использовали культуральную среду, в которой фетальную бычью сыворотку (FBS) добавляли к культуральной среде AIM-V. Была создана группа с культуральной средой, дополненной пальмитиновой кислотой. СТС-индуцирующую способность сравнивали для этой группы и для группы, не дополненной пальмитиновой кислотой.
[0072] Результаты
Результаты представлены в Таблице 5. Как показано в таблице, разница в эффективности выхода СТС наблюдалась среди пациентов в группе, не дополненной пальмитиновой кислотой, как в случае анализа 4. Было подтверждено, что добавление пальмитиновой кислоты (группа с добавлением пальмитиновой кислоты) улучшало и повышало эффективность получения СТС даже из источников клеток, полученных от пациентов, которые были источниками с низкой эффективностью получения СТС в группе, не дополненной пальмитиновой кислотой.
[0073]

[0074] Анализ 6. Исследование СТС-индуцирующей способности культуральной среды AIM-V и культуральной среды AIM-V, дополненной аутологичной сывороткой (Auto Serum)
Была подготовлена группа с культуральной средой AIM-V и группа с AIM-V, дополненной аутологичной сывороткой пациента (Auto Serum). СТС-индуцирующую способность сравнивали для обеих культуральных сред.
[0075] Результаты
Результаты представлены в Таблице 6. Как показано в таблице, в отношении группы с AIM-V, дополненной аутологичной сывороткой пациента (Auto Serum), эффективность получения СТС была улучшена для большинства источников клеток, полученных от пациентов, за исключением случая с (*). Во всех случаях наблюдалась высокая эффективность получения СТС.
[0076]

[0077] Анализ 7. Исследование СТС-индуцирующей способности культуральной среды, в которой к культуральной среде AIM-V, дополненной аутологичной сывороткой (Auto Serum), добавляли пальмитиновую кислоту
В качестве общей культуральной среды использовали культуральную среду, в которой в культуральную среду AIM-V добавляли аутологичную сыворотку пациента (Auto Serum). Была создана группа с культуральной средой, дополненной пальмитиновой кислотой. СТС-индуцирующую способность сравнивали для этой группы и для группы, не дополненной пальмитиновой кислотой.
[0078] Результаты
Результаты представлены в Таблице 7. Как показано в таблице, в группе с культуральной средой, в которой в культуральную среду AIM-V была добавлена аутологичная сыворотка пациента (Auto Serum), были продемонстрированы две противоположные тенденции в эффективности выхода СТС между группой с добавлением пальмитиновой кислоты и группой без добавления пальмитиновой кислоты. В частности, добавление пальмитиновой кислоты демонстрировало тенденцию к снижению для источников клеток, полученных от пациентов, которые были источниками с высокой эффективностью выхода СТС без добавления пальмитиновой кислоты. С другой стороны, при добавлении пальмитиновой кислоты наблюдалось повышение эффективности получения СТС для источников клеток, полученных от пациентов, которые были источниками с низкой эффективностью получения СТС без добавления пальмитиновой кислоты.
[0079]

[0080] Наблюдение под флуоресцентным микроскопом
Результаты (фотография) наблюдения под флуоресцентным микроскопом, полученные в тестах выхода СТС с использованием культуральной среды AIM-V и культуральной среды RPMI-1640, изученных в анализах 1 и 2, раскрытых выше, показаны на фиг.1. На фигуре (1-а) показаны результаты получения СТС с использованием культуральной среды AIM-V, а на фигуре (1-b) показаны результаты получения СТС в случае использования культуральной среды RPMI-1640. В случае использования культуральной среды AIM-V наблюдалось большое число клеток СТС и проявлялась СТС-индуцирующая способность. В случае использования культуральной среды RPMI-1640 клеток СТС не наблюдалось.
[0081] Комплексная оценка
Из результатов анализов, упомянутых выше, был сделан следующий вывод.
(i) В обеих группах - только с RPMI-1640 и с RPMI-1640 + 5% Auto Serum (аутологичной сыворотки) - СТС невозможно было индуцировать, выделить или получить на уровне 0,1% или более от числа посеянных мононуклеарных клеток периферической крови (РВМС) (1×104 клеток/лунка).
(ii) Что касается только AIM-V, СТС можно было индуцировать, выделить или получить в диапазоне от 0,1 до 0,2% от посеянных мононуклеарных клеток периферической крови (РВМС).
(iii) В группе с дополненной AIM-V + 5% Auto Serum (аутологичной сыворотки) скорость получения СТС была увеличена до 2,2-2,7%, что было в 14-20 раз больше, чем в случае использования только AIM-V.
(iv) Когда RPMI-1640 добавляли к AIM-V в соотношении 50%, скорость получения СТС снижалась до тех же %, что и в группе с дополненной RPMI-1640 + 5% Auto Serum (аутологичной сыворотки).
(v) Тенденция (iv), описанная выше, также наблюдалась при добавлении 25% RPMI-1640 и добавлении 12,5% RPMI-1640, и никакого эффекта повышения получения СТС не наблюдалось.
Из результатов этого анализа было подтверждено, что: AIM-V может быть использована в качестве культуральной среды, используемой при индукции, разделении или получении СТС; и эффект получения СТС может быть усилен путем добавления аутологичной сыворотки (AS) к культуральной среде.
Пример 3
[0082] Анализ для выбора (II) эффективной культуральной среды для получения раковых клеток (СТС) - влияние добавки
[0083] Культурная среда, подлежащая анализу
Следующие культуральные среды были предоставлены и использовались в качестве культуральных сред, подлежащих анализу.
(1) AIM-V (бессывороточная культуральная среда)
(2) AS (Auto Serum: аутологичная сыворотка)
(3) LPS (липополисахарид)
(4) IL-1α (интерлейкин 1α)
(5) IL-1β (интерлейкин 1β)
(6) Пальмитиновая кислота
[0084] Экспериментальный способ
Полученные мононуклеарные клетки периферической крови (peripheral blood mononuclear cells, РВМС) от ракового пациента сеяли в каждую лунку в соответствии с экспериментальным способом, описанным в Примере 1, с использованием описанных выше культуральных сред для анализа влияния добавки в каждую культуральную среду на эффективность получения раковых клеток (СТС) (точность обнаружения раковых клеток).
[0085] Анализ 8. Влияние добавления LPS в культуральную среду AIM-V
Культуральную среду AIM-V (AIM-V: группа А) использовали в качестве основы. Была создана группа, в которую добавили AS (аутологичную сыворотку) (AIM-V + AS: группа В), а также группы, в которые добавляли LPS (липополисахарид) в базовой концентрации 1 конц. (группы Е и F) или в каждой концентрации от 0,1 конц. до 100 конц. (группы GH и GD). Затем среди этих групп был изучен СТС-изолирующий эффект.
[0086] Результаты
Результаты представлены в Таблице 8. Как показано в таблице, что касается групп с культуральной средой AIM-V, дополненной LPS, более высокий эффект наблюдался в группе с небольшим количеством добавленного LPS, чем в группе только с AIM-V, тогда как эффективность выделения СТС была резко уменьшена в группе с AIM-V + AS, дополненной LPS, при любой концентрации LPS.
[0087]

[0088] Анализ 9: Влияние добавления IL-1α в культуральную среду AIM-V
Культуральную среду AIM-V (AIM-V: группа А) использовали в качестве основы. Была создана группа, в которую добавили AS (аутологичную сыворотку) (AIM-V + AS: группа В), а также группы, в которые добавляли IL-1α (интерлейкин 1α) в базовой концентрации 1 конц. (группы Е и F) или в каждой концентрации от 0,1 конц. до 100 конц. (группы GH и GD). Затем среди этих групп был изучен СТС-изолирующий эффект.
[0089] Результаты
Результаты представлены в Таблице 9. Как показано в таблице, в отношении групп с культуральной средой AIM-V, дополненной IL-1α, наблюдался только эффект, эквивалентный или меньший, чем у AIM-V в одиночку, независимо от большего или меньшего количества добавленного IL-1α (группы С, Е и G). Эффективность выделения СТС снижалась в группе AIM-V + AS, дополненной IL-1α, при любой концентрации IL-1α по сравнению с группами без дополнений.
[0090]

[0091] Анализ 10. Влияние добавления IL-1β в культуральную среду AIM-V
Культуральную среду AIM-V (AIM-V: группа А) использовали в качестве основы. Была создана группа, в которую добавили AS (аутологичную сыворотку) (AIM-V + AS: группа В), а также группы, в которые добавляли IL-1β (интерлейкин 1β) в базовой концентрации 1 конц. (группы Е и F) или в каждой концентрации от 0,1 конц. до 100 конц. (группы GH и GD). Затем среди этих групп был изучен СТС-изолирующий эффект.
[0092] Результаты
Результаты представлены в Таблице 10. Как показано в таблице, в отношении групп с культуральной средой AIM-V, дополненной IL-1β, наблюдался только эффект, эквивалентный или слегка повышенный, чем у AIM-V в одиночку, в соответствии с количеством добавленного IL-1β (группы С, Е и G). Эффективность получения СТС, которая была бы эквивалентна эффективности в группе без добавок, наблюдалась только в группе AIM-V + AS с добавлением IL-1β при любой концентрации IL-1β.
[0093]

[0094] Анализ 11. Влияние добавления пальмитиновой кислоты в культуральную среду AIM-V
Культуральную среду AIM-V (AIM-V: группа А) использовали в качестве основы. Была создана группа, в которую добавили AS (аутологичную сыворотку) (AIM-V + AS: группа В), а также группы, в которые добавляли пальмитиновую кислоту в базовой концентрации 1 конц. (группы G и Н) или в каждой концентрации от 0,25 конц. до 4 конц. (группы KL, IJ, GH, EF и CD). Затем среди этих групп был изучен СТС-изолирующий эффект.
[0095] Результаты
Результаты представлены в Таблице 11. Как показано в таблице, в отношении групп с культуральной средой AIM-V, дополненной пальмитиновой кислотой, было подтверждено повышение эффективности выхода СТС в 2-3 раза по сравнению с группами без добавления, почти независимо от количества добавленной пальмитиновой кислоты (группы С, Е, G, I и K). Зависимости от концентрации не наблюдалось, и эффективность получения СТС, которая была бы эквивалентна или снижена по сравнению с эффективностью в группе без добавок, наблюдалась только в группе AIM-V + AS с добавлением пальмитиновой кислоты при любой концентрации пальмитиновой кислоты.
[0096]
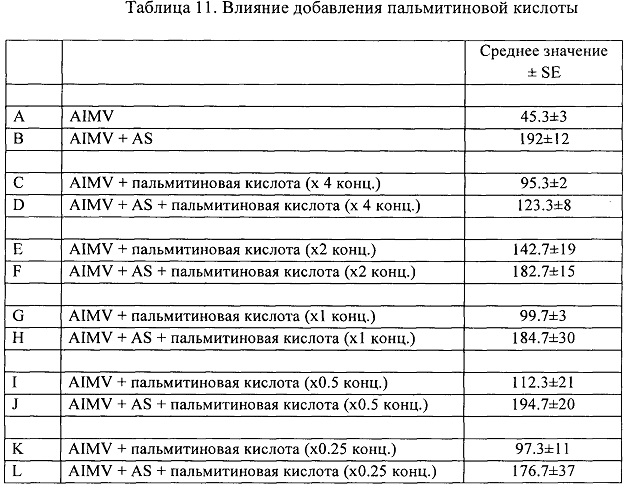
[0097] Комплексная оценка
Из результатов анализов, упомянутых выше, был сделан следующий вывод: в результате изучения усиления эффекта СТС-получения путем добавления дополнительного компонента к культуральной среде AIM-V, изучения различных кандидатов добавочных компонентов (LPS, ConA, РНА, IL-1α и IL-1β), включая пальмитиновую кислоту, в качестве новых факторов для выделения/получения СТС, и проведения поиска наиболее безопасного и наиболее эффективного фактора, было подтверждено, что добавление пальмитиновой кислоты к культуральной среде AIM-V имеет наилучшие последствия для стабильного выделения СТС. Хотя в ходе данного исследования LPS также демонстрировал СТС-индуцирующее влияние, LPS представляет собой вещество, обладающее очень высокой токсичностью, и поэтому был признан неуместным в качестве реагента по соображениям безопасности в свете различных целей исследования и развития методик клинического применения после выделения СТС, и был исключен из последующих экспериментов.
Пример 4
[0098] Подтверждение морфологических изменений в раковых клетках (СТС), полученных в культуральной среде для пролиферации СТС
Используя способ теста из Примера 1, морфологическое изменение в раковых клетках (СТС), полученное с использованием культуральной среды для пролиферации СТС в Примере 2, было исследовано на основе микроскопических изображений. Микроскопические фотографии показаны на фиг. 2-7. На каждой фигуре (фигура а) и (фигура b) показаны результаты изучения СТС от разных пациентов (микроскопические фотографии раковых клеток (СТС) от разных пациентов) по морфологическим признакам СТС в условиях культивирования эксперимента по пролиферации клеток СТС, т.е. в таких условиях культивирования, как культуральная среда для пролиферации и наличие или отсутствие и концентрация сыворотки или фактора, такого как пальмитиновая кислота. Эксперимент был направлен на изучение наличия или отсутствия экспрессии морфологической разницы в клетках СТС в зависимости от разницы между условиями пролиферации, и (а) и (b) были предназначены для проверки того, что даже полученные от разных пациентов СТС демонстрируют одну и ту же морфологию клеток в одних и тех же культуральных условиях.
[0099] Концентрация пальмитиновой кислоты в культуральной среде, подлежащая анализу, согласно таблице 12 ниже.
[0100]

[0101] 1. Наблюдение за морфологическими изменениями в СТС, полученных при культивировании с использованием только культуральной среды AIM
Флуоресцентное микроскопическое изображение СТС, полученных при культивировании с использованием только культуральной среды AIM-V, показано на фиг. 2 (2-a; 2-b). В морфологии клеток СТС, полученных при культивировании с использованием только культуральной среды AIM-V, аномальный размер или сильно окрашенная часть не были особенно замечены в ядрах или гранулярных компонентах в цитоплазме.
[0102] 2. Наблюдение за морфологическими изменениями в СТС, полученных при культивировании с использованием культуральной среды AIM-V, дополненной пальмитиновой кислотой (× 1 конц.)
Флуоресцентное микроскопическое изображение СТС, полученных при культивировании с использованием культуральной среды AIM-V, дополненной пальмитиновой кислотой (+ пальмитиновая кислота (концентрация ×1)), показано на фиг. 3 (3-а, 3-b). В морфологии клеток СТС, полученных при культивировании с использованием культуральной среды AIM-V, дополненной пальмитиновой кислотой (+пальмитиновая кислота (концентрация ×1)), увеличение в размерах или сильно окрашенная часть не были особенно замечены в ядрах или гранулярных компонентах в цитоплазме, хотя наблюдалось небольшое увеличение ядерных компонентов по сравнению с группой без добавления пальмитиновой кислоты.
[0103] 3. Наблюдение за морфологическими изменениями в СТС, полученных при культивировании с использованием культуральной среды AIM-V, дополненной пальмитиновой кислотой (× 4 конц.)
Флуоресцентное микроскопическое изображение СТС, полученных при культивировании с использованием культуральной среды AIM-V, дополненной пальмитиновой кислотой (+ пальмитиновая кислота (концентрация ×4)), показано на фиг. 4 (4-а, 4-b). В морфологии клеток СТС, полученных при культивировании с использованием культуральной среды AIM-V, дополненной пальмитиновой кислотой (+ пальмитиновая кислота (концентрация ×4)), наблюдались тенденции к увеличению в размерах и слиянию клеток (фиг. 4-b), и в ядерных или гранулярных компонентах в цитоплазме наблюдалось заметное повышение или сильное окрашивание в ядерных компонентах или в ядрах или в гранулярных компонентах в цитоплазме, по сравнению с группой без добавления пальмитиновой кислоты, (фиг. 2-а; 2-b) или группой с добавлением (× 1 концентрация) (фиг. 3-а; 3-b).
[0104] 4. Наблюдение за морфологическими изменениями в СТС, полученных при культивировании с использованием культуральной среды AIM + 5% аутологичной сыворотки
Флуоресцентное микроскопическое изображение СТС, полученных при культивировании с использованием культуральной среды AIM-V + 5% аутологичной сыворотки, показано на фиг. 5 (5-а; 5-b). В морфологии клеток СТС, полученных при культивировании с использованием культуральной среды AIM-V + 5% аутологичной сыворотки, аномальный размер или сильно окрашенная часть не были особенно замечены в клетках или в ядрах или в гранулярных компонентах в цитоплазме.
[0105] 5. Наблюдение за морфологическими изменениями в СТС, полученных при культивировании с использованием культуральной среды в условиях AIM-V + 5% аутологичной сыворотки+пальмитиновая кислота (концентрация ×1)
Флуоресцентное микроскопическое изображение СТС, полученных при культивировании с использованием культуральной среды AIM-V + 5% аутологичной сыворотки + пальмитиновая кислота (концентрация ×1), показано на фиг. 6 (6-а; 6-b). В морфологии клеток СТС, полученных при культивировании с использованием культуральной среды AIM-V + 5% аутологичной сыворотки + пальмитиновая кислота (концентрация ×1),аномальный размер или сильно окрашенная часть не были особенно замечены в клетках или в ядрах или в гранулярных компонентах в цитоплазме.
[0106] 6. Наблюдение за морфологическими изменениями в СТС, полученных при культивировании с использованием культуральной среды в условиях AIM-V + 5% аутологичной сыворотки+пальмитиновая кислота (концентрация ×4)
Флуоресцентное микроскопическое изображение СТС, полученных при культивировании с использованием культуральной среды AIM-V + 5% аутологичной сыворотки + пальмитиновая кислота (концентрация ×4),показано на фиг. 7 (7-а; 7-b). В морфологии клеток СТС, полученных при культивировании с использованием культуральной среды AIM-V + 5% аутологичной сыворотки + пальмитиновая кислота (концентрация ×4),наблюдались тенденции к увеличению в размерах и слиянию клеток (фиг. 7-а), и в ядерных или гранулярных компонентах в цитоплазме наблюдалось заметное повышение или сильное окрашивание в ядерных компонентах или в гранулярных компонентах в цитоплазме, по сравнению с группой без добавления пальмитиновой кислоты (фиг. 5-а; 5-b) или группой с добавлением в ×1 концентрации (фиг. 6-а; 6-b). Считается, что это морфологическое изменение увеличивает аномальную пролиферацию ядер, субклеточных органелл, митохондрий, которые играют ведущую роль в производстве энергии и т.д. за счет пролиферации или активации клеток СТС в условиях культуральной среды с пальмитиновой кислотой (концентрация ×4). В результате считается, что в микроскопических изображениях увеличиваются нуклеиновые кислоты или внутриклеточные гранулы, а ядра или цитоплазма дополнительно препятствуют светопроницаемости, поэтому наблюдается сильное окрашивание.
[0107] Комплексная оценка
Из результатов анализов морфологических изменений в СТС (CTSC), упомянутых выше, был сделан следующий вывод: было подтверждено, что: СТС могут быть надежно и эффективно получены путем пролиферации и получения СТС с использованием культуральной среды AIM-V или ростовой среды для СТС, в которой к культуральной среде добавляют дополнительный компонент, такой как аутологичная сыворотка и/или пальмитиновая кислота; и в этом отношении можно вызывать пролиферацию и получать СТС, не вызывая морфологических изменений в морфологии клеток. В частности, в случае пролиферации и получения СТС (CTSC) для подтверждения свойств или характеристик СТС важно, что в морфологии полученных клеток не возникает искусственных изменений. Таким образом, требуется способ, который может обеспечить стабильную пролиферацию и получение СТС в условиях, которые не вызывает особых изменений в морфологии или характере СТС. Из результатов экспериментов, раскрытых выше, было подтверждено, что указанный способ может удовлетворять требованиям и обеспечивать надежную пролиферацию и получение СТС (CTSC).
Пример 5
[0108] Подтверждение и идентификация с использованием клеточного мембранного антигена полученных СТС
Как показано в примерах ниже, СТС, выделенные и полученные из периферической крови каждого пациента, подтверждали и идентифицировали путем флуоресцентного окрашивания антителами с использованием каждого из антигенов CD44, CD45, CD47, CKII и ЕрСАМ на поверхности мембраны. На фотографии каждой фигуры касательно результатов каждого анализа каждая фигура а) показывает микроскопическое фотографическое изображение СТС, а каждая фигура b) показывает флуоресцентное микроскопическое фотографическое изображение окрашивания с использованием поверхностного мембранного антигена.
[0109] Способ окрашивания антигена
В способе окрашивания антигена образцы готовили, окрашивали, микроскопически исследовали, наблюдали и фотографировали в соответствии со следующими процедурами с использованием метки FITIC (флуоресцеина изотиоцианат).
[0110] I. Приготовление различных выделенных клеток периферической крови и окрашивание антигена FITC-меченным первичным антителом
(1) Ферментативная обработка прикрепленных клеток (начинать с этапа (4) для неприкрепленных клеток).
(2) Обработка трипсин-EDTA.
(3) Добавление среды RPMI, дополненной 5% FBS, к отдельной группе клеток, прекращение ферментативной реакции и аспирация.
(4) Центрифугирование (от 1200 до 1500 об/мин, 4°С, 7 мин).
(5) Промывка и перемешивание вихревым способом с (-)PBS под холодным хранением при 4°С и центрифугирование ×2.
(6) Подсчет числа клеток и перенос по: 1×106 клеток/100 мкл/пробирка.
(7) Алюминиевую фольгу обертывали вокруг каждой пробирки с клетками для защиты от света и помещали пробирку на 30 минут под холодным хранением при 4°С для снижения метаболической активности клеток (ингибирования подвижности или передвижения поверхностного антигена внутри или снаружи клеточной мембраны).
(8) Добавление антитела: 1 мкг/2 мкл/1×106 осажденных клеток (группа клеток, выделенных из среды) и окрашивание в течение 1 часа под холодным хранением при 4°С и с защитой от света.
(9) Промывка и перемешивание вихревым способом с (-)PBS под холодным хранением при 4°С и центрифугирование ×2: разделение путем центрифугирования (от 1200 до 1500 об/мин, 4°С, 7 мин).
(10) К клеткам добавляли соответствующее количество (-)PBS, затем наносили на предметное стекло или планшет и подвергали микроскопическому исследованию.
(11) Наблюдение и фотографирование под флуоресцентным микроскопом.
[0111] II. Приготовление различных выделенных из периферической крови клеток и окрашивание первичным антителом против каждого антигена и последующее окрашивание антигена FITC-меченным вторичным антителом
(1) Ферментативная обработка прикрепленных клеток (начинать с этапа (4) для неприкрепленных клеток).
(2) Обработка трипсин-EDTA.
(3) Добавление среды RPMI, дополненной 5% FBS, к отдельной группе клеток, прекращение ферментативной реакции и аспирация.
(4) Центрифугирование (от 1200 до 1500 об/мин, 4°С, 7 мин).
(5) Промывка и перемешивание вихревым способом с (-)PBS под холодным хранением при 4°С и центрифугирование ×2.
(6) Подсчет числа клеток и перенос по 1×106 клеток/100 мкл/пробирка.
(7) Алюминиевую фольгу обертывали вокруг каждой пробирки с клетками для защиты от света и помещали пробирку на 30 минут под холодным хранением при 4°С для снижения метаболической активности клеток (ингибирования подвижности или передвижения поверхностного антигена внутри или снаружи клеточной мембраны).
(8) Добавление первичного антитела: 1 мкг/2 мкл/1×106 осажденных клеток (группа клеток, выделенных из среды) и окрашивание в течение 1 часа под холодным хранением при 4°С и с защитой от света.
(9) Промывка и перемешивание вихревым способом с (-)PBS под холодным хранением при 4°С и центрифугирование ×2: разделение путем центрифугирования (от 1200 до 1500 об/мин, 4°С, 7 мин).
(10) Добавление вторичного антитела: 1 мкг/2 мкл/1×106 осажденных клеток (группа клеток, выделенных из среды) и окрашивание в течение 1 часа под холодным хранением при 4°С и с защитой от света.
(11) Промывка и перемешивание вихревым способом с (-)PBS под холодным хранением при 4°С и центрифугирование ×2: разделение путем центрифугирования (от 1200 до 1500 об/мин, 4°С, 7 мин).
(12) К клеткам добавляли соответствующее количество (-)PBS, затем наносили на предметное стекло или планшет и подвергали микроскопическому исследованию.
(13) Наблюдение и фотографирование под флуоресцентным микроскопом.
Пример 6
[0112] Подтверждение и идентификация СТС с использованием мембранного антигена CD44
СТС, полученные из периферической крови каждого пациента посредством способа из Примера 1, подтверждали и идентифицировали с использованием мембранного антигена CD44 для СТС.
[0113] Подтверждение и идентификация (I) СТС с использованием мембранного антигена CD44
Микроскопические фотографические изображения СТС, полученные из периферической крови от трех пациентов: (1) K.H. (Gastric Са.: рак желудка, liver meta.: метастазы в печени), (2) Т.K. (Tongue Са.: рак языка), и (3) K.Н. (Gastric Са.: рак желудка, liver meta.: метастазы в печени), и их микроскопические фотографии с флуоресцентным антителом с использованием мембранного антигена CD44 показаны на фиг. 8-10. Фиг. с 8-b по 10-b показывают микроскопические фотографические изображения, а фиг. с 8-b по 10-b показывают микроскопические фотографии с флуоресцентным антителом. Как показано на фотографиях, СТС, полученные от пациентов с (1) по (3), раскрытых выше, не демонстрируют окрашивание CD44.
[0114] Подтверждение и идентификация (II) СТС с использованием мембранного антигена CD44
Микроскопические фотографические изображения СТС, полученные из периферической крови от трех пациентов: (1) Т.K. (Tongue Са.: рак языка), и (2) S.K. (Kerato-cystic Са.: кератокистозный рак), и (3) S.O. (Gastric Са.: рак желудка), и их микроскопические фотографии с флуоресцентным антителом с использованием мембранного антигена CD44 показаны на фиг. 11-13. Фигуры с 12-а по 13-а показывают микроскопические фотографические изображения, а фигуры с 12-b по 13-b показывают микроскопические фотографии с флуоресцентным антителом. Как показано на фотографиях фиг. 12 и 13, СТС, полученные от пациентов (2) и (3), описанных выше, демонстрировали окрашивание CD44, а микроскопическое фотографическое изображение и микроскопическая фотография с флуоресцентным антителом согласовывались друг с другом, подтверждая, что полученные СТС были СТС раковых заболеваний, указанных выше.
[0115] Подтверждение и идентификация (III) СТС с использованием мембранного антигена CD44
Микроскопические фотографические изображения СТС, полученные из периферической крови от двух пациентов: (1) H.Y. (Breast Са.: рак молочной железы) и (2) Y.H. (Lung Са.: рак легкого), и их микроскопические фотографии с флуоресцентным антителом с использованием мембранного антигена CD44 показаны на фиг. 14 и 15. Фигуры 14-а и 15-а показывают микроскопические фотографические изображения, а фиг. 14-b и 15-b показывают микроскопические фотографии с флуоресцентным антителом. Как показано на фотографиях (фиг. 14 и 15), СТС, полученные от пациентов (1) и (2), раскрытых выше, демонстрировали окрашивание CD44, а микроскопическое фотографическое изображение и микроскопическая фотография с флуоресцентным антителом согласовывались друг с другом, подтверждая, что полученные СТС были СТС раковых заболеваний, указанных выше.
Пример 7
[0116] Подтверждение и идентификация СТС с использованием мембранного антигена CD45
СТС, полученные из периферической крови каждого пациента посредством способа из Примера 1, подтверждали и идентифицировали с использованием мембранного антигена CD45 для СТС.
[0117] Микроскопические фотографические изображения СТС, полученные из периферической крови от двух пациентов: (1) H.Y. (Breast Са.: рак молочной железы) и (2) Y.H. (Lung Са.: рак легкого), и их микроскопические фотографии с флуоресцентным антителом с использованием мембранного антигена CD45 показаны на фиг. 16-18. Фигуры с 16-а по 18-а показывают микроскопические фотографические изображения, а фигуры с 16-b по 18-b показывают микроскопические фотографии с флуоресцентным антителом. Как показано на фотографиях фигур с 16 по 18, СТС, полученные от пациентов (1) и (2), указанных выше, демонстрировали окрашивание CD45, а микроскопическое фотографическое изображение и микроскопическая фотография с флуоресцентным антителом согласовывались друг с другом, подтверждая, что полученные СТС были СТС раковых заболеваний, указанных выше. На микроскопических фотографиях СТС (CTSC) присутствие клеток CTSC обозначено стрелкой. В каждой группе фотографий (фотографии с 1 по 3: фиг. 16-18) показано, что подавляющее большинство клеток среди СТС (CTSC), которые видны на левых микроскопических фотографиях, представляют собой CD45-положительные CTSC-клетки, как видно на правых флуоресцентных микроскопических изображениях. Как показано двусторонней стрелкой, очевидно, что эти CD45-положительные CTSC-клетки имеют различие в морфологии и размере и не являются клетками, которые можно различить по одному показателю.
Пример 8
[0118] Подтверждение и идентификация СТС с использованием мембранного антигена CD47
СТС, полученные из периферической крови каждого пациента посредством способа из Примера 1, подтверждали и идентифицировали с использованием мембранного антигена CD47 для СТС.
[0119] Микроскопические фотографические изображения СТС, полученные из периферической крови от пяти пациентов: (1) G.N. (Breast Са.: рак молочной железы, multiple meta.: множественные метастазы), (2) S.K. (Kerato-cystic Са.: кератокистозный рак), (3) S.O. (Lung Са.: рак легкого), (4) H.Y. (Breast Са.: рак молочной железы) и (5) Y.H. (Lung Са.: рак легкого), и их микроскопические фотографии с флуоресцентным антителом с использованием мембранного антигена CD47 показаны на фиг. 19-23. Фигуры с 19-а по 23-а показывают микроскопические фотографические изображения, а фигуры с 19-b по 23-b показывают микроскопические фотографии с флуоресцентным антителом. Как показано на фотографиях (фиг. с 19 по 23), СТС, полученные от пациентов с (1) по (5), описанных выше, демонстрировали окрашивание CD47, а микроскопическое фотографическое изображение и микроскопическая фотография с флуоресцентным антителом согласовывались друг с другом, подтверждая, что полученные СТС были СТС раковых заболеваний, раскрытых выше. На фотографии каждой фигуры стрелки показывают CD47-положительные CTSC. CTSC, обозначенные белыми стрелками, представляют собой CD47-положительные CTSC среди раковых клеток, пролиферирующих и культивируемых как СТС (CTSC), показывая, что клетки наблюдаются независимо от размера или морфологии. В частности, было подтверждено, что CD47-положительные CTSC не являются клетками, имеющими определенную морфологию или размер, а имеют вариации.
Пример 9
[0120] Подтверждение и идентификация СТС с использованием мембранного антигена CKII
СТС, полученные из периферической крови каждого пациента посредством способа из Примера 1, подтверждали и идентифицировали с использованием мембранного антигена СКП для СТС.
[0121] Микроскопические фотографические изображения СТС, полученные из периферической крови от двух пациентов: (1) H.Y. (Breast Са.: рак молочной железы) и (2) Y.H. (Lung Са.: рак легкого), и их микроскопические фотографии с флуоресцентным антителом с использованием мембранного антигена CKII показаны на фиг. 24 и 25. Фигуры 24-а и 25-а показывают микроскопические фотографические изображения, а фиг. 24-b и 25-b показывают микроскопические фотографии с флуоресцентным антителом. Как показано на фотографиях (фиг. 24 и 25), СТС, полученные от пациентов (1) и (2), указанных выше, демонстрировали окрашивание CKII, а микроскопическое фотографическое изображение и микроскопическая фотография с флуоресцентным антителом согласовывались друг с другом, подтверждая, что полученные СТС были СТС раковых заболеваний, указанных выше.
Пример 10
[0122] Подтверждение и идентификация СТС с использованием мембранного антигена ЕрСАМ
СТС, полученные из периферической крови каждого пациента посредством способа из Примера 1, подтверждали и идентифицировали с использованием мембранного антигена ЕрСАМ для СТС.
[0123] Микроскопическое фотографическое изображение СТС, полученное из периферической крови пациента: (1) H.Y. (Lung Са.: рак легкого), и их микроскопическая фотография с флуоресцентным антителом с использованием мембранного антигена ЕрСАМ показаны на фиг. 26. Фигура 26-а показывает микроскопическое фотографическое изображение, а фигура 26-b показывает микроскопическую фотографию с флуоресцентным антителом. Как показано на фотографиях (фиг. 26), среди СТС, полученных от пациента, указанного выше, наблюдалось только очень небольшое число клеток, экспрессирующих ЕрСАМ на своей клеточной мембране.
Пример 11
[0124] Исследование онкогенности или долгосрочной выживаемости СТС у голых мышей
Для изучения того, будут ли СТС, полученные из периферической крови пациента посредством способа из Примера 1, сохранять функции СТС-клеток, была подтверждена онкогенность или долгосрочная выживаемость полученных СТС.
[0125] Способ анализа
СТС, выделенные из образца от пациента H.Y. (Breast Са.: рак молочной железы): CTC-HY-1 (HY-1) и СТС, выделенные от пациента K.Н. (Gastric Са.: рак желудка, liver meta.: метастазы в печени): СТС-KH-1 (KH-1) были разделены на две экспериментальные группы: «экспериментальная группа А» и «экспериментальная группа В». СТС, пролиферированные, разделенные и собранные от пациентов, были трансплантированы, как указано ниже.
Экспериментальная группа А: Двум голым мышам (Nude 1-1, Nude 1-2) подкожно трансплантировали на спину 1×106 клеток: СТС (HY-1) мыши «Nude 1-1» и СТС (KH-1) мыши «Nude 1-2», и изучали наличие или отсутствие онкогенности в течение периода наблюдения, составляющего 3 месяца. По завершении этого периода у голых мышей забирали периферическую кровь и селезенку и проводили выделение и культивирование СТС. С помощью флуоресцентного антитела с использованием нефлуоресцентного эмиссионного изображения (контроль) и мембранного поверхностного антигена CD45 окрашивали пролиферированные клетки, оставшиеся в группах трансплантации СТС, и выжившие клетки подтверждали как трансплантированные СТС.
Экспериментальная группа В: Двум голым мышам (Nude 2-1; Nude 2-2) подкожно трансплантировали на спину 1×106 клеток: СТС (HY-1) мыши «Nude 2-1» и СТС (KH-1) мыши «Nude 2-2», и такое же количество клеток, как указано выше, трансплантировали внутрибрюшинно. Как и в случае экспериментальной группы А, пролиферированные клетки, оставшиеся в группах трансплантации СТС, окрашивали, и выжившие клетки подтверждали как трансплантированные СТС.
[0126] Результаты
Микроскопические фотографические изображения
(нефлуоресцентные эмиссионные изображения) клеток, оставшихся в группах трансплантации СТС, и их микроскопические фотографии с флуоресцентным антителом (флуоресцентные эмиссионные изображения) с использованием мембранного антигена CD45 показаны на фиг. 27-30, при этом на фиг. (27-а) и (27-b) показаны микроскопическая фотография (контроль) и микроскопическая фотография с флуоресцентным антителом (флуоресцентное эмиссионное изображение), соответственно, клеток, оставшихся в группе трансплантации СТС, в случае, когда СТС (HY-1) трансплантировали мыши «Nude 1-1», а фигуры (28-а) и (28-b) показывают микроскопическую фотографию (контроль) и микроскопическую фотографию с флуоресцентным антителом (флуоресцентное эмиссионное изображение), соответственно, клеток, оставшихся в группе трансплантации СТС, в случае, когда СТС (KH-1) трансплантировали мыши «Nude 1-2». На фиг. (29-а) и (29-b) показаны микроскопическая фотография (контроль) и микроскопическая фотография с флуоресцентным антителом (флуоресцентное эмиссионное изображение), соответственно, клеток, оставшихся в группе трансплантации СТС, в случае, когда СТС (HY-1) трансплантировали мыши «Nude 2-1», а фигуры (30-а) и (30-b) показывают микроскопическую фотографию (контроль) и микроскопическую фотографию с флуоресцентным антителом (флуоресцентное эмиссионное изображение), соответственно, клеток, оставшихся в группе трансплантации СТС, в случае, когда СТС (KH-1) трансплантировали мыши «Nude 2-2». Как показано на фотографиях (фиг. 27-30), клетки, оставшиеся в группах трансплантации СТС, демонстрировали окрашивание мембранным антигеном CD45, что согласуется с микроскопическим фотографическим изображением, подтверждая, что клетки, оставшиеся в группах трансплантации СТС, представляли собой СТС раковых заболевания, раскрытых выше. В качестве эталона показаны микроскопическое фотографическое изображение (31-а) клеток нормальной ткани тонкой кишки и флуоресцентное микроскопическое фотографическое изображение (31-b) этих клеток при окрашивании CD45. Как видно на фиг. 31, клетки нормальной ткани тонкой кишки не демонстрировали окрашивание CD45.
Пример 12
[0127] Обнаружение (I) CD47-положительных клеток (CTSC) с использованием стабильной линии раковых клеток (UTC-8)
Существующую стабильную линию раковых клеток (UTC-8: Международный патентный депозитарий организмов, National Institute of Technology and Evaluation, депозит №: FERM BP-08611) использовали для анализа обнаружения CD47-положительных клеток (CTSC) для стабильной линии раковых клеток.
[0128] Способ анализа
Клетки СТС подвергали пролифериации и получали посредством способа из Примера 1 с использованием стабильной линии раковых клеток (UTC-8) в качестве образца, а затем CD47-положительные клетки обнаруживали с использованием клеточного мембранного антигена CD47. Результаты показаны в виде микроскопического изображения, полученного без флуорохромного окрашивания, и изображения CD47-положительных клеток, полученного с флуорохромным окрашиванием.
[0129] Результаты представлены на фиг. 32. На фиг. 32 (32-а) показано микроскопическое изображение без флуорохромного окрашивания, а на (32-b) показано изображение CD47-положительных клеток, полученное с флуорохромным окрашиванием. На фигурах толстые стрелки (=>) показывают CD47-положительные CTSC, а двусторонние стрелки (←→) показывают раковые клетки СТС, отличающиеся как размером, так и морфологией от CD47-отрицательных клеток. В результате очень небольшое число CD47-положительных CTSC наблюдалось в подавляющем большинстве раковых клеток, перевиваемых в течение более чем 20 лет, как видно в этом микроскопическом поле (× 200). Было также показано, что большинство раковых клеток являются клетками, морфологически имеющими круглую или веретенообразную форму или форму, подобную им, или неправильную форму, которая не имеет ни вертикальной, ни двусторонней симметрии. С другой стороны, было обнаружено, что форма CD47-положительных CTSC является уникальной формой с нерегулярными выпячиваниями подобно дендритным клеткам.
Пример 13
[0130] Обнаружение (II) CD47-положительных клеток (CTSC) с использованием стабильной линии раковых клеток (UTC-8)
Существующую стабильную линию раковых клеток (UTC-8: FERM ВР-08611) снова использовали для анализа обнаружения CD47-положительных клеток (CTSC) для стабильной линии раковых клеток, как в случае примера 12.
[0131] Способ анализа
Клетки СТС подвергали пролиферации и получали посредством способа из Примера 1 с использованием стабильной линии раковых клеток (UTC-8) в качестве образца, а затем CD47-положительные клетки обнаруживали с использованием клеточного мембранного антигена CD47, как в случае примера 12. Результаты показаны в виде микроскопического изображения, полученного без флуорохромного окрашивания, и изображения CD47-положительных клеток, полученного с флуорохромным окрашиванием.
[0132] Результаты представлены на фиг. 33. На фиг. 33 (33-а) показано микроскопическое изображение, полученное без флуорохромного окрашивания, а на (33-b) показано изображение CD47-положительных клеток, полученное с флуорохромным окрашиванием. На фигурах толстые стрелки (=>) показывают CD47-положительные CTSC, а двусторонние стрелки (←→) показывают раковые клетки СТС, отличающиеся как размером, так и морфологией от CD47-отрицательных клеток. В результате был получен результат, аналогичный результату, полученному в примере 12. Конкретно, очень небольшое число CD47-положительных CTSC наблюдалось в стабильной линии раковых клеток (UTC-8), как видно в этом микроскопическом поле (×200). Было также показано, что большинство раковых клеток являются клетками, морфологически имеющими круглую или веретенообразную форму или форму, подобную им, или неправильную форму, которая не имеет ни вертикальной, ни двусторонней симметрии. С другой стороны, было обнаружено, что форма CD47-положительных CTSC является уникальной формой с нерегулярными выпячиваниями подобно дендритным клеткам. Морфологические особенности были четко подтверждены.
Промышленная применимость
[0133] Данное изобретение обеспечивает способ обнаружения или выделения/получения СТС, который способен надежно и стабильно обнаруживать или выделять/получать циркулирующую опухолевую клетку и циркулирующую опухолевую стволовую клетку, присутствующую в следовых количествах в биологической циркулирующей жидкости организма, такой как кровь или лимфа, даже в состоянии, когда тип рака опухолевых клеток еще не может быть определен, и в состоянии, когда опухолевые клетки присутствуют в следовых количествах в биологической циркулирующей жидкости организма. Способ обнаружения или выделения/получения СТС в соответствии с данным изобретением позволяет обнаруживать или разделять не только СТС, но и CTSC, и обеспечивает средства, которые могут быть использованы для основного определения рака или клинического подхода к нему.
Реферат
Изобретение относится к медицине, а именно к способу обнаружения циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки из биологической циркулирующей жидкости организма. Способ включает этап предварительной обработки образца биологической циркулирующей жидкости организма для получения фазы мононуклеарных клеток, в котором предварительная обработка образца биологической циркулирующей жидкости организма с удалением жидкого компонента и неклеточного компонента, содержащегося в биологической циркулирующей жидкости организма; этап получения луночного планшета, в который введена культуральная среда, содержащая бессывороточную ростовую среду для циркулирующей опухолевой клетки и/или циркулирующей опухолевой стволовой клетки, и посева в него мононуклеарных клеток, полученных на первом этапе, с последующей инкубацией; этап удаления культуральной среды из лунки планшета, полученного путем инкубации на втором этапе; а также этап обнаружения адгезивной опухолевой клетки, прикрепленной к лунке планшета после третьего этапа. Вышеописанный способ позволяет надежно и стабильно обнаруживать или выделять/получать циркулирующую опухолевую клетку и циркулирующую опухолевую стволовую клетку, присутствующую в следовых количествах в биологической циркулирующей жидкости организма. 5 з.п. ф-лы, 33 ил., 12 табл., 13 пр.

Комментарии