Синтез полусинтетических производных природных лютеина и астаксантина - RU2702005C1
Код документа: RU2702005C1
Чертежи
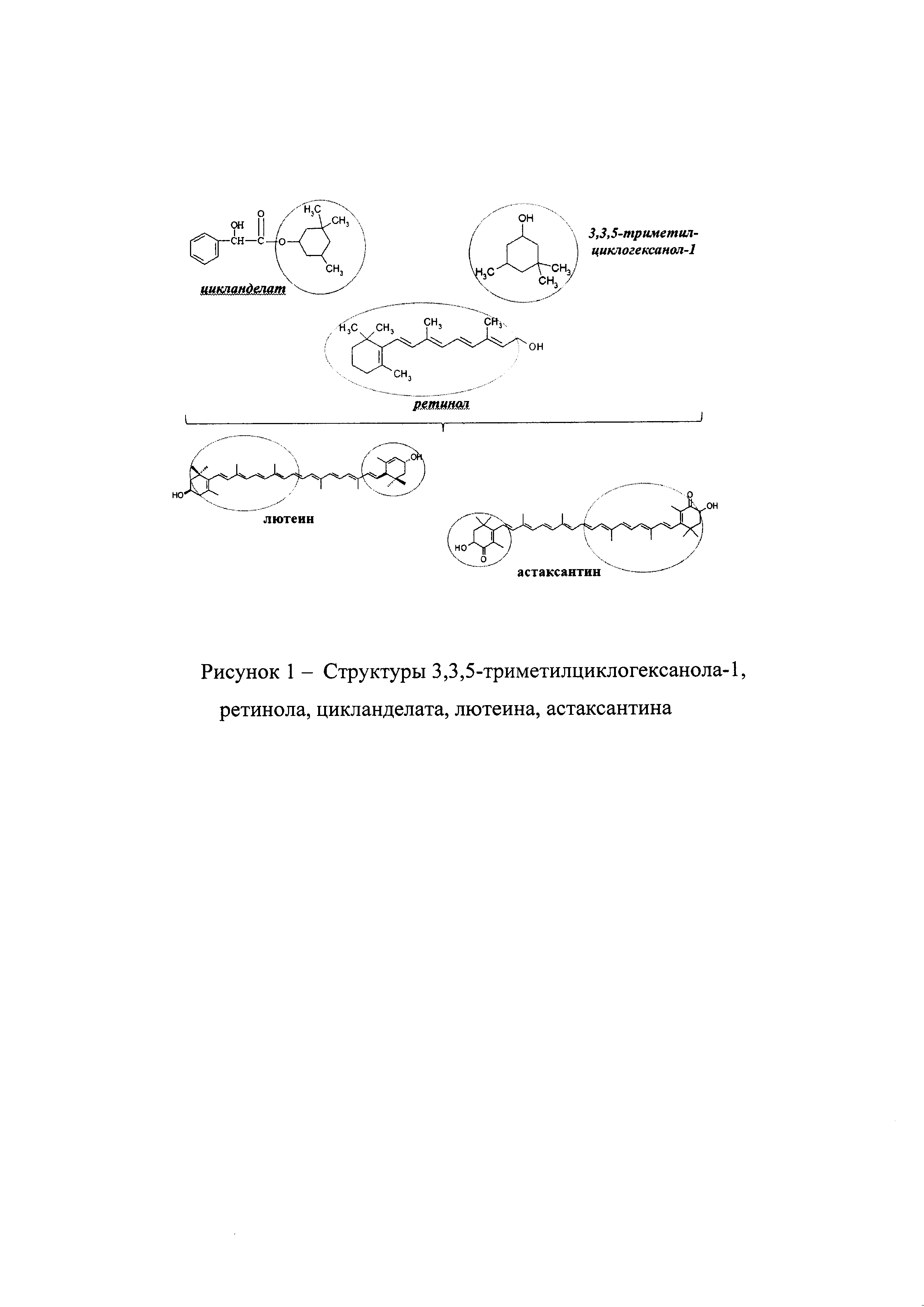
Описание
Изобретение относится к фармации, в частности, к химико-фармацевтической отрасли и касается способа получения новых полусинтетических производных лютеина и астаксантина и может использоваться для получения лекарственных препаратов на основе этих соединений.
В периодической научной литературе отсутствуют данные по получению полусинтетических производных лютеина и астаксантина.
При этом существуют публикации, посвященные получению полностью синтетических каротиноидов, повторяющих, по мнению авторов, их активный молекулярный центр [Recent progress in the synthesis of butenolide carotenoids and retinoids / Masayoshi Ito // Pure & Appl. Chem., 199. - Vol. 63. - N. 1. - P. 13-22, https://iupac.org/publications].
Вместе с тем к активно разрабатываемому фармацевтическому направлению можно отнести получение полусинтетических продуктов на основе других природных биологически активных веществ (БАВ), например, тритерпеноидов лупанового ряда [Производные бетуленола как перспективные анти-ВИЧ агенты / А.З. Абышев, Р.А. Абышев, В.X. Нгуен, В.А. Морозова // Медицинский академический журнал, 2013. - Т. 13, - №2. - С. 15-32], алкалоидов [Синтез аналогов алкалоидов, содержащих изоксазольные и изотиазольные фрагменты / Дикусар Е.А., Петкевич С.К., Клецков А.В., Кадуцкий А.П., Козлов Н.Г., Поткин В.И. // Фенольные соединения: свойства, активность, инновации: сб. науч. ст., Москва, 14-19 мая 2018 г. С. 47-49], терпенофенолов [Синтез новых гетероциклических соединений на основе терпенофенолов / Попова С.А., Чукичева И.Ю. // Фенольные соединения: свойства, активность, инновации: сб. науч. тр., Москва, 14-19 мая 2018 г. - С. 133-135; Новые перспективы полусинтетических терпенофенолов / Чукичева И.Ю., Буравлёв Е.В., Дворникова И.А., Федорова И.В., Щукина О.В., Кучин А.В. // Фенольные соединения: свойства, активность, инновации: сб. науч. ст., Москва, 14-19 мая 2018 г. С. 190-192], флавоноидов [Современные тенденции создания лекарственных средств на основе флавоноидов / Тюкавкина Н.А., Селиванова И.А., Терехов Р.П. // Фенольные соединения: свойства, активность, инновации: сб. науч. ст., Москва, 14-19 мая 2018 г. С. 526-532; Rutin derivatives obtained by transesterification reactions catalyzed by Novozym 435: Antioxidant properties and absence of toxicity in mammalian cells / Anete Souza Mecenas, Camila Rodrigues


Идея получения сложных эфиров ксантофиллов, в частности лютеина и астаксантина, с активностью в отношении периферических сосудов возникла в результате анализа структуры вазодилататора цикланделата, обладающего прямым действием на гладкую мускулатуру сосудов (Рис. 1). В частности, при получении цикланделата в качестве спирта был использован 3,3,5-триметилциклогексанол-1 [United States Patent 2,707,193, 1955, https://www.drugbank, United States Patent: 3,663,597, 1972; https://www.drugbank.ca/drugs; United States Patent: 3,673,239, 1972, https://www.drugbank.ca/drugs], обладающий прямым действием на гладкую мускулатуру сосудов, т.е. папавериноподобным действием в отношении периферических сосудов.
Экспериментальный успех получения сложных эфиров лютеина и астаксантина был спрогнозирован и обоснован положительным результатом в рамках исследования, описанного в патенте [United States Patent: 7,566,795, 2009 http://patft.uspto.gov], авторы которого получили сложные эфиры ретинола, соединения родственного каротиноидам, с линолевой кислотой и ее производных, пальмитиновой, олеиновой, липолевой, пимелиновой (гептандиовой) и другими кислотами.
Впервые получение цикланделата описано в патенте [United States Patent 2,707,193, 1955 https://www.drugbank]. При этом 50 г миндальной кислоты (смесь d-, l-изомеров) нагревают в течение 6 часов при приблизительно 100°С с 50 г 3,3,5-триметилциклогексанол (смесь цис- и транс-изомера), пропуская через реакционную смесь газообразный хлороводород, затем продукт реакции выливают в воду. После нейтрализации бикарбонатом калия сложный эфир экстрагируют эфиром. Эфирную фракцию сушат сульфатом натрия, эфир отгоняют и остаток перегоняют в вакууме, 3,3,5-триметилциклогексиловый эфир миндальной кислоты получают с выходом около 70%. Необходимо отметить, что согласно описанию патента, авторами проводилось получение сложных эфиров миндальной кислоты со следующими спиртами: 3,3,5-триметилциклогексанолом-1, метанолом, этанолом, пропанолом-1, бутанолом-2, 2-метилбутанолом-1, бензиловым спиртом, папаверином и др. Сложный эфир миндальной кислоты с 3,3,5-триметилциклогексанолом-1 показал наиболее выраженную спазмолитическую активность.
В 1972 в США зарегистрирован патент, [United States Patent: 3,673,239, 1972 https://www.drugbank], в котором согласно описанию 142 г 3,3,5-триметилциклогексанола (1,0 моль), 76 грамм миндальной кислоты (0,5 моль), 126 г толуола (1,37 моль), 2,0 г порошка цинка и 2 г 35% водный раствор соляной кислоты загружали в реакционную смесь и реакцию этерификации проводили при 110-130°С в течение 1 часа. В течение периода реакции 18 г 35% водного раствора хлористоводородной кислоты добавляли по каплям до получения водорода в реакционной системе. Затем продукт выдерживали при 130°С в течение примерно 2 часов. После охлаждения, не прореагировавший цинковый порошок отфильтровывали, и фильтрат промывали 5% водным раствором карбоната натрия и воды. Толуол и не прореагировавший 3,3,5-триметилциклогексанол отгоняли при пониженном давлении. Выход продукта составил 84,5% в расчете на миндальную кислоту. В патенте описано 13 примеров получения цикланделата, отличающихся использованием разных металлов: цинка, олова, магния, никеля, свинца и их сочетаний; временем введения в реакционную систему кислоты и металла; органическим растворителем (бензол и толуол) и его количеством. Получение цикланделата по реакции этерификации проводилось при нагревании до температуры выше 100°С. Кроме того, в патенте [United States Patent: 3,663,597, 1972 https://www.drugbank] описан способ дополнительной очистки цикланделата, получаемого по патенту [United States Patent: 3,673,239, 1972 https://www.drugbank].
Классическая реакция этерификации протекает в водной фазе и наиболее полно и быстро в присутствии металлов и сильных кислот, например, концентрированной серной или хлористоводородной кислот. Другим обязательным и необходимым условием протекания реакции этерификации является нагревание более 50°С, а в некоторых случаях свыше 100°С. Очевидно, что получение сложных эфиров ксантофиллов требует адаптации этих традиционных условии протекания реакции этерификации, что, в первую очередь, обусловлено особенностями растворимости ксантофиллов: они не растворимы в воде и растворимы в неполярных органических растворителях. Другим немаловажным фактором является температурный - проведение реакции с ксантофиллами при температурах свыше 50°С приведет к разрушению полиеновой цепи. Реакция этерификации является каталитической, а использование в этом качестве металлов и кислот приведет к выделению водорода. Одновременное присутствие в реакционной системе ксантофиллов и водорода, вызовет частичное или полное гидрирование полиеновой цепи ксантофилла и, как следствие, потерю каротиноидной структуры.
В связи с выше сказанным, по нашему мнению, является перспективным использование в качестве катализаторов реакции этерификации ксантофиллов биокатализаторов, которые позволяют проводить реакции этерификации в среде органических растворителей [Enzymatic esterification of oleic acid and propanol by Novozym435 / Sawittree Mulaleea, Karnjana Senab, and Muenduen Phisalaphong // Applied Mechanics and Materials, 2015. - Vol. 705. - P. 29-33; Ферментативный катализ в неводных средах / Гамаюрова B.C., Зиновьева М.Е. // Бутлеровские сообщения, 2011. - Т. 25. - №7. - С. 87-95], в более мягких условия [Основные аспекты использования липаз для получения биодизеля (обзор) / А.В. Гарабаджиу, В.А. Галынкин, М.М. Карасев, Г.В. Козлов, Т.Б. Лисицкая // ИЗвестия Санкт-Петербургского государственного технологического института (технического университета), 2010. - №7 (33). - С. 63-67] и с большим практическим выходом продукта реакции [Solvent free lipase catalyzed synthesis of butyl caprylate / Meera T Sose, Sneha R Bansode, Virendra K Rathod // J. Chem. Sci., 2017. - Vol. 129. - №11. - P. 1755-1760; High Enantioselective Novozym 435-Catalyzed Esterification of (R,S)-Flurbiprofen Monitored with a Chiral Stationary Phase / Tomasz
За прототип был принят способ получения сложных эфиров ретинола - родственного каротиноидам соединения [United States Patent: 7,566,795, 2009 http://patft.uspto.gov]. Согласно описанию сложные эфиры ретинола получали, используя в качестве растворителей диизопропиловый эфир, трет-бутилметиловый эфир, тетрагидрофуран и их смеси; бензол, толуол, ксилол, гексан, гептан,
циклогексан, лимонен, дихлорметан, дихлорэтан, дибромэтан, тетрахлорэтилен, хлорбензол и их смеси; ацетонитрил, диметилформамид, диметилсульфоксид и их смесей. Температура реакционной среды составляет от 20 до 100°С. Время протекания реакции от 1-2 часов до 19-23 часов. В качестве ферментагых катализаторов авторы использовали липазу, фосфолипазу или эстеразу, при этом предпочтительнее использовать липазы, в частности, коммерческие липазы иммобилизированные на носителях, а именно Lipase PS, Lipase PS-C, Lipase PS-D, Lipoprime 50T, Lipozyme TL IM или Novozyme 435. Анализ полученных сложных эфиров проводили методом ВЭЖХ.
Заявляемое изобретение ставит своей целью синтез полусинтетических производных индивидуальных природных каротиноидов, в частности, сложных эфиров:
лютеина и бензойной кислоты,
лютеина и n-метилбензойной кислоты (n-толуиловой кислоты),
лютеина и никотиновой кислоты,
лютеина и миндальной кислоты,
астаксантина и бензойной кислоты,
астаксантина и n-метилбензойной кислоты (n-толуиловой кислоты),
астаксантина и никотиновой кислоты,
астаксантина и миндальной кислоты (таблица 1).
Существенными отличительными признаками изобретения являются следующие особенности:
сложные эфиры получены на основе природных ксантофиллов лютеина и астаксантина, которые использованы как спиртосоставляющая сложных эфиров;
сложные эфиры получены с применением бензойной, n-метилбензойной (n-толуиловой), никотиновой кислот;
реакция этерификации проводится без доступа света, с целью предотвращения деструкции ксантофиллов;
время реакции - 6 часов;
скорость перемешивания - 30 об/мин, смена направления перемешивания через 10 мин;
температуры процесса не должна превышать 37°С;
высушивание полученных соединений при комнатной температуре над безводным сульфатом натрия, предохраняя от действия света;
установление структуры полученных эфиров проведено - методом масс-спектрометрии (carL001: 777 (М, 100%), 655 (35), 519 (17), 105 (61); carL002: 779 (М, 100%), 656 (33), 520 (15), 107 (62); carL003: 805 (М, 100%), 669 (36), 533 (17), 119 (60); carL004: 837 (М, 100%), 703 (49), 685 (35), 549 (20), 135 (52), 107 (47); carA001: 805 (М, 100%), 683 (40), 533 (16), 105 (63); carA002: 807 (М, 100%), 684 (39), 534 (17), 106 (62); carA003: 833 (М, 100%), 697 (40), 547 (18), 119 (61); carA004: 865 (М, 100%), 847 (43), 731 (48), 713 (36), 563 (20), 135 (51), 107 (49)).
Предлагаемый способ включает следующие стадии:
1) эквимолярные навески ксантофилла (или лютеина, или астаксантина) и кислоты (или бензойной, или n-метилбензойной, или никотиновой, или миндальной) растворяют в 50 мл толуола;
2) полученные растворы помещают в химический реактор, предварительно защищенный от воздействия света (оборачивание черной бумагой или другое);
3) в реакционную среду вносят катализатор Новозим 435 (Novozyme 435) (кат. № L4777 Sigma-Aldrich);
4) реакционную среду нагревают до 37°С;
5) время протекания реакции 6 часов, скорость перемешивания 30 об/мин, смена направления перемешивания через 10 мин;
6) по истечении 6 часов пробу раствора анализируют методом ВЭЖХ, определяя количественное содержание продуктов реакции и остаточное содержание исходных компонентов;
7) раствор, содержащий продукты реакции и остаточные количества реагентов, пропускают через колонку заполненную алюминия оксидом 2,5 г, собирая вторую окрашенную фракцию;
8) раствор промывают спиртом этиловым 95% и водой;
9) упаривают в роторном испарителе;
10) высушивают при комнатной температуре над безводным сульфатом натрия, предохраняя от действия света
11) полученные вещества запаивают в ампулы темного стекла.
Пример получения сложных эфиров лютеина и астаксантина с бензойной кислотой: 0,57 г лютеина или 0,60 г астаксантина (около 0,001 моль), 2,4 г (около 0,002 моль) бензойной кислоты (кат. №242381 Sigma-Aldrich), 50 мл толуола, 1,0 г Novozyme 435 (кат. № L4777 Sigma-Aldrich) помещали в реактор, предварительно обернув его черной бумагой, для предотвращения попадания света, и продували азотом. Температура реакционной среды - 37°С, время протекания реакции - 6 часов, скорость перемешивания - 30 об/мин, смена направления перемешивания через 10 мин.
Полученный раствор анализировали методом ВЭЖХ в следующих условиях: колонка Develosil С30 150 мм×4,6 мм, подвижная фаза: ацетонитрил - хлороформ - метанол (80:18:2), детектирование 445 нм. Время удерживания лютеина - 4,2 мин, carL001 - 6,7 мин, астаксантина - 3,4 мин, carA001 - 5,9 мин. Установлено, что образуется эфир лютеина в количестве 61,3%, астаксантина 58,5%, дальнейшее проведение реакции в течение суток не приводило к значимому увеличению продукта.
Полученный раствор пропускали через колонку заполненную алюминия оксидом 2,5 г диаметр 1 см, собирая вторую окрашенную фракцию.
Затем раствор промывали спиртом этиловым 95% и водой, далее упаривали в роторном испарителе и высушивали над безводным сульфатом натрия при комнатной температуре, предохраняя от действия света, полученные вещества хранят в ампулах темного стекла.
Предлагаемый способ синтеза полусинтетических производных природных лютеина и астаксантина не требует сложного и дорогостоящего технического оснащения, позволяет получать сложные эфиры лютеина и астаксантина, которые могут в дальнейшем быть использованы для разработки новых оригинальных лекарственных средств.

Реферат
Изобретение относится к фармации, в частности к химико-фармацевтической отрасли, и касается способа получения новых полусинтетических производных лютеина и астаксантина и может использоваться для получения лекарственных препаратов на основе этих соединений. Описан синтез полусинтетических производных индивидуальных природных каротиноидов, в частности сложных эфиров лютеина и бензойной кислоты, лютеина и n-метилбензойной кислоты (n-толуиловой кислоты), лютеина и никотиновой кислоты, лютеина и миндальной кислоты, астаксантина и бензойной кислоты, астаксантина и n-метилбензойной кислоты (n-толуиловой кислоты), астаксантина и никотиновой кислоты, астаксантина и миндальной кислоты. Способ синтеза сложных эфиров лютеина и астаксантина проводят в присутствии биокатализатора Новозима 435. Синтез полусинтетических производных природных лютеина и астаксантина не требует сложного и дорогостоящего технического оснащения, позволяет получать сложные эфиры лютеина и астаксантина, которые в дальнейшем используют для разработки новых лекарственных средств. 1 ил., 1 табл., 8 пр.

Комментарии