Способ получения метакриловой кислоты или сложных эфиров мeтакриловой кислоты - RU2491346C9
Код документа: RU2491346C9
Чертежи










































Описание
Настоящее изобретение относится к способу производства метакриловой кислоты или сложных эфиров метакриловой кислоты, а также к способу производства полиметакриловой кислоты или сложных эфиров полиметакриловой кислоты.
Метакриловая кислота - важный промежуточный продукт, находящий, в особенности в форме своих алкиловых эфиров, применение при получении полимеризатов. Известное производное метакриловой кислоты - это, например, метиловый эфир метакриловой кислоты. Объем годового производства метилового эфира метакриловой кислоты составляет в настоящее время около 1,5 миллиона тонн. Эфиры полиметакриловой кислоты - это основные компоненты в области пластмасс, которые можно применять различными способами.
Коммерческое производство метакриловой кислоты обычно ведут способом гетерогенного двухэтапного окисления в газовой фазе 4-атомных соединений углерода, как то: бутилена, изобутилена, бутана, изобутана, трет-бутилового спирта или метакролеина на твердых мультиметаллических оксидных массах в качестве катализатора. Получаемую при этом газовую смесь продукции, которая, кроме метакриловой кислоты, содержит еще и множество побочных продуктов, затем либо подвергают полной конденсации с получением водного раствора метакриловой кислоты, либо абсорбируют в надлежащей смеси растворителей. После этого обычно следует очистка полученных таким образом продуктов жидкой фазы путем дистилляции, кристаллизации, экстракции или путем сочетания этих мер. Помимо каталитического окисления 4-атомных соединений углерода в газовой фазе метакриловую кислоту можно также синтезировать путем каталитической окислительной дегидрогенизации изомасляной кислоты, как это описано, например, в европейской заявке на патент EP-A-0356315. Еще одну возможность производства метакриловой кислоты предлагает так называемый «процесс АЦГ», в котором проводят реакцию ацетонциангидрина и серной кислоты с образованием в качестве промежуточного продукта метакриламида, который затем подвергается дальнейшей реакции с водой с образованием метакриловой кислоты. Очистку полученной таким образом метакриловой кислоты проводят затем методом дистилляции. Этот способ, например, описан в европейской заявке на патент EP-A-1359137.
Недостаток этих обычных способов производства метакриловой кислоты состоит в числе прочего в том, что как при производстве самой метакриловой кислоты, так и на последующих этапах очистки методом дистилляции, по причине выраженной склонности метакриловой кислоты к полимеризации и ввиду температурной нагрузки на этапах процесса, формируются димеры или олигомеры, что связано не только с дополнительными затратами на очистку, но и со снижением выхода.
Задача настоящего изобретения состоит в том, чтобы избавиться от недостатков, имеющихся на нынешнем техническом уровне.
В частности, задача изобретения состояла в том, чтобы предложить способ производства метакриловой кислоты, содержащий по возможности минимальное количество этапов с термической нагрузкой метакриловой кислоты.
Этот способ должен также давать возможность получать метакриловую кислоту из возобновляемых ресурсов, в особенности из углеводов и/или из глицерина.
Вклад в решение указанных в начале задач вносит способ производства метакриловой кислоты или сложных эфиров метакриловой кислоты, включающий в себя этапы:
IA) Синтез 3-гидроксиизомасляной кислоты способом, включающим в себя этап создания контакта клетки, генетически модифицированной по сравнению с ее диким типом таким образом, что она синтезирует больше 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты, чем этот дикий тип, с питательной средой, содержащей в качестве источника углерода углеводы, глицерин, двуокись углерода, метан, метанол, L-валин или L-глутамат, в условиях, в которых из источника углерода образуются 3-гидроксиизомасляная кислота или полигидроксиалканоаты на основе 3-гидроксиизомасляной кислоты, а также, при необходимости, отделения 3-гидроксиизомасляной кислоты от питательной среды, а также, при необходимости, нейтрализации 3-гидроксиизомасляной кислоты, причем предпочтительно, чтобы начальным продуктом синтеза 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе гидроксиизомасляной кислоты был метилмалоновый полуальдегид или 3-гидроксиизобутирил-кофермент A;
IB) Дегидратации 3-гидроксиизомасляной кислоты с образованием метакриловой кислоты, а также, при необходимости, этерификации метакриловой кислоты.
Если синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты происходит с метилмалоновым полуальдегидом в качестве начального продукта, то также предпочтителен синтез с образованием в качестве промежуточного продукта сукцинил-кофермента A, пропионил-кофермента A или акрилоил-кофермента A, особо предпочтительно - сукцинил-кофермента A. Если синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты происходит с 3-гидроксиизобутирил-коферментом A в качестве начального продукта, то также предпочтителен синтез с образованием в качестве промежуточного продукта изобутирил-кофермента A или 3-гидроксибутирил-кофермента A, особо предпочтительно - 3-гидроксибутирил-кофермента A.
В настоящем тексте термин «начальный продукт» применяют для обозначения химического соединения, которое можно ферментативным путем преобразовать в 3-гидроксиизомасляную кислоту за один этап реакции, а термин «промежуточный продукт» применяют для обозначения химического соединения, которое нельзя ферментативным путем преобразовать в 3-гидроксиизомасляную кислоту всего за один этап реакции.
Термин "3-гидроксиизомасляная кислота" в том значении, в котором его применяют в настоящем тексте, всегда означает соответствующую карбоновую кислоту с 4 атомами углерода в той форме, в которой ее получают после синтеза соответствующими микроорганизмами в зависимости от значения pH. Таким образом, термин всегда охватывает чистую кислотную форму (3-гидроксиизомасляную кислоту), чистую основную форму (3-гидроксиизобутират), а также смеси протонированной и депротонированной форм кислоты. Кроме того, термин "3-гидроксиизомасляная кислота" в принципе включает в себя как (R), так и (S)-стереоизомеры, причем (S)-стереоизомер особо предпочтителен.
Формулировка «синтезирует больше 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты, чем этот дикий тип» касается также того случая, когда дикий тип генетически модифицированной клетки вообще не способен синтезировать 3-гидроксиизомасляную кислоту или полигидроксиалканоаты на основе 3-гидроксиизомасляной кислоты, по крайней мере - не способен синтезировать заметные (регистрируемые) количества этих соединений, и возможность синтеза заметных количеств этих компонентов возникает только после генетической модификации.
Под «диким типом» клетки предпочтительно подразумевают клетку, геном которой пребывает в естественном состоянии, сформированном эволюцией. Этот термин применяют как в отношении всей клетки, так и в отношении отдельных генов. Поэтому в понятие «дикий тип», в частности, не включают такие клетки или такие гены, генетические последовательности которых были хотя бы частично изменены человеком с помощью рекомбинантных методов.
Затем из 3-гидроксиизомасляной кислоты можно с помощью щадящей реакции дегидратации получить метакриловую кислоту. В случае полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты возможна изоляция содержащихся в клетках везикул, наполненных этими полигидроксиалканоатами, а затем расщепление полимеров с получением 3-гидроксиизомасляной кислоты, которую затем можно подвергнуть дегидратации с получением метакриловой кислоты.
При этом согласно изобретению предпочтительно, чтобы генетически модифицированная клетка, применяемая при реализации способа согласно изобретению, была модифицирована таким образом, чтобы в течение заданного временного интервала, предпочтительно в течение 2 часов, более предпочтительно - в течение 8 часов, а крайне предпочтительно - в течение 24 часов, она синтезировала по меньшей мере в 2 раза, особенно предпочтительно - по меньшей мере в 10 раз, еще более предпочтительно - по меньшей мере в 100 раз, сверх того еще более предпочтительно - по меньшей мере в 1000 раз, а наиболее предпочтительно - по меньшей мере в 10000 раз больше 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты, чем клетки дикого типа. Определять прирост синтеза продукции можно, например, культивируя клетки, применяемые при реализации способа согласно изобретению, и клетки дикого типа отдельно друг от друга в надлежащей питательной среде в одинаковых условиях (идентичная плотность клеток, одинаковая питательная среда, одинаковые условия в культуре) в течение определенного промежутка времени, а затем определяя в питательной среде количество конечного продукта (3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты).
Клетки, применяемые при реализации способа согласно изобретению, могут быть прокариотическими или эукариотическими. Это могут быть клетки млекопитающих (как, например, клетки человека), растительные клетки или микроорганизмы, как то: дрожжи, грибы или бактерии, причем особо предпочтительны микроорганизмы, а наиболее предпочтительны бактерии и дрожжи.
Из бактерий, дрожжей или грибов особо удобно применять те бактерии, дрожжи или грибы, которые депонированы в Германском собрании микроорганизмов и клеточных культур ГмбХ (DSMZ), в Брауншнвейге, Германия, в виде штаммов бактерий, дрожжей или грибов. Пригодные к использованию согласно изобретению бактерии относятся к родам, перечисленным по адресу http://www.dsmz.de/species/bacteria.htm
Пригодные к использованию согласно изобретению дрожжи относятся к родам, перечисленным по адресу http://www.dsmz.de/species/yeasts.htm
а грибы, пригодные к применению согласно изобретению - это таковые, перечисленные по адресу http://www.dsmz.de/species/fungi.htm
Особо предпочтительные согласно изобретению клетки - это таковые родов Corynebacterium, Brevibacterium, Bacillus, Acinetobacter, Lactobacillus, Lactococcus, Candida, Pichia, Kluveromyces, Saccharomyces, Escherichia, Zymomonas, Yarrowia, Methylobacterium, Ralstonia, Pseudomonas, Burkholderia и Clostridium, причем особо предпочтительны Brevibacterium flavum, Brevibacterium lactofermentum, Escherichia coli, Saccharomyces cerevisiae, Kluveromyces lactis, Candida blankii, Candida rugosa, Corynebacterium glutamicum, Corynebacterium efficiens, Zymonomas mobilis, Yarrowia lipolytica, Methylobacterium extorquens, Ralstonia eutropha, insbesondere Ralstonia eutropha H16, Rhodospirillum rubrum, Rhodobacter sphaeroides, Paracoccus versutus, Pseudomonas aeroginosa, Acinetobacter calcoaceticus и Pichia pastoris.
В первом из вариантов выполнения способа согласно изобретению применяют клетки, в которых синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты происходит с метилмалоновым полуальдегидом в качестве начального продукта.
В первой особенной форме исполнения этого первого варианта способа согласно изобретению предпочтительно проводить синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты с образованием сукцинил-кофермента А в качестве промежуточного продукта, причем целесообразно, чтобы в качестве источника углерода генетически модифицированная клетка, применяемая в этой форме исполнения первого варианта способа согласно изобретению, использовала углеводы, глицерин или глутамат.
При этом в связи с первой особенной формой исполнения первого варианта способа согласно изобретению может быть целесообразно, чтобы генетически модифицированная клетка, применяемая в этой форме исполнения способа согласно изобретению, обладала повышенной по сравнению со своим диким типом активностью фермента E1, который катализирует преобразование сукцинил-кофермента А в метилмалонил-кофермент А (см. Фиг.1).
Формулировка "повышенная активность фермента" в том смысле, в котором ее используют в связи с ферментом E1, а в последующем изложении - в связи с ферментами E2 и т.д., подразумевает предпочтительно повышенную внутриклеточную активность.
Нижеследующее изложение относительно повышения активности ферментов в клетках касаются как повышения активности фермента E1, так и всех поименованных ниже ферментов, активность которых можно при необходимости повысить.
В принципе, повышения ферментативной активности можно достичь, увеличивая количество копий генетической последовательности или генетических последовательностей, которые кодируют фермент, применяя сильный промотор или используя ген или аллель, кодирующие соответствующий фермент с повышенной активностью, а также при необходимости сочетая эти меры. Клетки, генетически модифицированные согласно изобретению, создают, например, путем трансформации, трансдукции, конъюгации или сочетания этих методов с вектором, который содержит желательный ген, аллель этого гена или их части, и вектор, дающий возможность экспрессии гена. Гетерологической экспрессии добиваются, в частности, путем интеграции гена или аллелей в хромосому клетки или в вектор с внехромосомной репликацией.
Обзор возможностей для повышения ферментативной активности в клетках на примере пируваткарбоксилазы представлен в немецкой заявке на патент DE-A-10031999, которая настоящим введена как ссылка, и содержание публикации которой в отношении возможностей для повышения ферментативной активности в клетках образует составную часть изложения настоящего изобретения.
Экспрессию вышепоименованных и всех приведенных ниже ферментов или генов можно продемонстрировать с помощью одномерного или двухмерного разделения белков в геле с последующим оптическим определением концентрации белка в геле с помощью соответствующего аналитического программного обеспечения. Если повышение ферментативной активности основано исключительно на повышении экспрессии соответствующего гена, то количественное определение повышения ферментативной активности возможно простым образом, путем сравнения результатов одномерного или двухмерного разделения белков в геле у дикого типа и у генетически модифицированной клетки. Известный метод подготовки белковых гелей коринеформных бактерий и идентификации белков - это метод, описанный Hermann et al. (Electrophoresis, 22: 1712.23 (2001). Также можно анализировать концентрацию белков путем гибридизации с использованием вестерн-блоттинга с антителом, специфичным для подлежащего определению белка (Sambrook et al., Molecular Cloning: a laboratory manual, 2nd Ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. USA, 1989) и последующей оптической оценки с помощью соответствующего программного обеспечения для измерения концентрации (Lohaus и Меуег (1989) Biospektrum, 5:32-39; Lottspeich (1999), Angewandte Chemie 111: 2630-2647). Активность ДНК-связывающих белков можно измерять методом сдвига полос ДНК (DNA Band Shift Assays, также известен как задержка в геле) (Wilson et al. (2001) Journal of Bacteriology, 183: 2151-2155). Действие ДНК-связывающих белков на экспрессию других генов можно продемонстрировать с помощью подробно описанных методов количественного анализа с генами-репортерами (Sambrook et al., Molecular Cloning: a laboratory manual, 2nd Ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. USA, 1989). Внутриклеточную ферментативную активность можно определять различными методами, которые также описаны (Donahue et al. (2000) Journal of Bacteriology 182 (19): 5624-5627; Ray et al. (2000) Journal of Bacteriology 182 (8): 2277-2284; Freedberg et al. (1973) Journal of Bacteriology 115(3): 816-823). Если в нижеследующем изложении не указаны конкретные методы определения активности конкретного фермента, то определение повышения ферментативной активности и определение ее снижения предпочтительно проводили методами, описанными в Hermann et al., Electophoresis, 22: 1712-23 (2001), Lohaus et al., Biospektrum 532-39(1998), Lottspeich, Angewandte Chemie 111:2630-2647 (1999) и в Wilson et al., Journal of Bacteriology 183: 2151-2155 (2001).
Если повышение ферментативной активности вызвано мутацией эндогенного гена, то такие мутации можно либо вызвать ненаправленным (неспецифическим) путем классическими методами, как, например, облучением ультрафиолетовым светом или использованием мутагенных химикатов, либо целенаправленно - методами генной инженерии, как то, проводя делеции, инсерции и/или замену нуклеотидов. Посредством этих мутаций получают генетически модифицированные клетки. Также особо предпочтительные мутантные формы ферментов - это, в частности, такие ферменты, которые не подвержены ингибированию по принципу обратной связи или по крайней мере подвержены ей в меньшей степени по сравнению с диким типом фермента.
Если повышение ферментативной активности вызывают ростом экспрессии фермента, то для этого, например, увеличивают количество копий соответствующих генов или вызывают мутацию области промотора или регуляции или участка связывания рибосом, находящегося в последовательности перед структурным геном. Так же действуют кассеты экспрессии, которые встраивают перед структурным геном. Кроме того, с помощью индуцируемых промоторов можно повышать экспрессию в произвольный момент времени. Помимо этого, к гену фермента можно в качестве регуляторных последовательностей добавить так называемые «энхансеры», которые также вызывают повышение экспрессии гена благодаря более интенсивному взаимодействию между РНК-полимеразой и ДНК. Экспрессию улучшают также меры по продлению срока жизни маточной РНК. Кроме того, воспрепятствование распаду белка-фермента также повышает ферментативную активность. Гены или генетические конструкции при этом располагают либо в плазмидах с различным количеством копий, либо встраивают их в хромосому и амплифицируют. В качестве альтернативы можно добиться избыточной экспрессии надлежащих генов, изменяя состав среды и условия культивации. Инструкции к этому специалист может найти в числе прочего в Martin et al. (Bio/Technology 5, 137-146 (1987)), в Guerrero et al. (Gene 138, 35-41 (1994)), Tsuchiya и Morinaga (Bio/Technology 6, 428-430 (1988)), в Eikmanns et al. (Gene 102, 93-98 (1991)), в европейской заявке ЕР-А-0472869, в патенте США US 4,601,893, в Schwarzer и Punier (Bio/Technology 9, 84-87 (1991), в Reinscheid et al. (Applied and Environmental Microbiology 60, 126-132 (1994)), в LaBarre et al. (Journal of Bacteriology 175, 1001-1007 (1993)), в международной заявке WO-A-96/15246, в Malumbres et al. (Gene 134, 15-24 (1993), в японской заявке JP-А-10-229891, в Jensen и Hammer (Biotechnology and Bioengineering 58, 191-195 (1998)) и в известных учебных руководствах по генетике и молекулярной биологии. Так же, как и мутации, описанные выше меры ведут к образованию генетически модифицированных клеток.
Для повышения экспрессии определенных генов используют, например, эписомальные плазмиды. Особо удобно использовать плазмиды, репликация которых проходит в коринеформных бактериях. Многие известные плазмидные векторы, как, например, pZ1 (Menkel et al., Applied and Environmental Microbiology 64: 549-554 (1989)), pEKEx1 (Eikmanns et al., Gene 107: 69-74 (1991)) или pHS2-1 (Sonnen et al., Gene 107: 69-74 (1991)), имеют в своей основе криптические плазмиды pHM1519, pBL1 или pGA1. Равным образом можно применять другие плазмидные векторы, например, те, которые основаны на pCG4 (US 4,489,160), или pNG2 (Serwold-Davis et al., FEMS Microbiology Letters 66:119-124(1990)), или pAG1 (US 5,158,891).
Кроме того, можно использовать такие плазмидные векторы, с помощью которых возможна работа по методу генетической амплификации путем интеграции в хромосому, как это было, например, описано Reinscheid et al. (Applied and Environmental Microbiology 60: 126-132 (1994)) для дупликации или амплификации оперона hom-thrB. В этом методе из полного гена клонируют плазмидный вектор, способный реплицироваться в хозяине (обычно Escherichia coli), однако, не в Corynebacterium glutamicum. В качестве векторов можно использовать, например, pSUP301 (Simon et al., Bio/Technology 1:784-791 (1983)), pK18mob или pK19mob (Schäfer et al., Gene 145: 69-73 (1994)), pGEM-T (Promega Corporation, Madison, Wisconsin, USA), pCR2.1-TOPO (Shuman, Journal of Biological Chemistry 269: 32678-84(1994)), pCR®Blunt (Invitrogen, Groningen, Niederlande), pEM1 (Schrumpf et al., Journal of Bacteriology 173: 4510-4516)) или pBGS8 (Spratt et al., Gene 41:337-342 (1986)). Затем плазмидный вектор, содержащий подлежащий амплификации ген, переносят в нужный штамм Corynebacterium glutamicum методом конъюгации или трансформации. Метод конъюгации описан, например, в Schäfer et al., Applied and Environmental Microbiology 60:756-759 (1994). Методы трансформации описаны, например, в Thierbach et al., Applied Microbiology and Biotechnology 29: 356-362 (1988), Dunican и Shivnan, Bio/Technology 7: 1067-1070 (1989) и Tauch et al., FEMS Microbiology Letters 123:343-347 (1994). После гомологической рекомбинации с помощью кроссинговера итоговый штамм содержит по меньшей мере две копии надлежащего гена.
Под приведенной выше и используемой в нижеследующем изложении формулировкой «повышенная по сравнению с диким типом активность фермента Ex» всегда подразумевают активность фермента Ex, повышенную по меньшей мере в 2 раза, особенно предпочтительно - по меньшей мере в 10 раз, еще более предпочтительно - по меньшей мере в 100 раз, сверх того еще более предпочтительно - по меньшей мере в 1000 раз, а наиболее предпочтительно - по меньшей мере в 10000 раз. Кроме того, под генетически модифицированная клеткой, применяемой при реализации способа согласно изобретению, у которой имеется «повышенная по сравнению с диким типом активность фермента Ex», в частности, подразумевают клетку, дикий тип которой не обладает активностью этого фермента Ex, или не обладает ею в достаточной для регистрации степени, и которая лишь после повышения активности фермента, например, путем избыточной экспрессии демонстрирует достаточную для регистрации активность этого фермента Ex. В этом контексте под понятием «избыточная экспрессия» или под применяемым в последующем изложении понятием «повышение экспрессии» подразумевают также и случай, когда исходная клетка, например, клетка дикого типа, не обладает активностью этого фермента Ex, или не обладает ею в достаточной для регистрации степени и лишь после применения рекомбинантных технологий демонстрирует достаточную для регистрации активность фермента Ex.
Под используемой ниже формулировкой «пониженная по сравнению с диким типом активность фермента Ex», соответственно, предпочтительно подразумевают активность, составляющей по меньшей мере 0,5, особенно предпочтительно - по меньшей мере 0,1, еще более предпочтительно - по меньшей мере 0,01, сверх того еще более предпочтительно - по меньшей мере 0,001, а наиболее предпочтительно - по меньшей мере 0,0001 от исходной. Снижение активности определенного фермента можно обеспечить, например, целенаправленной мутацией, добавлением конкурентных или неконкурентных ингибиторов или иными известными специалисту мерами по снижению экспрессии определенного фермента.
Фермент E1, катализирующий преобразование сукцинил-кофермента A в метилмалонил-кофермент А, предпочтительно представляет собой метилмалонил-кофермент A-мутазу (ЕС 5.4.99.2). Этот фермент кодируют гены, предпочтительно выбранные из группы, состоящей из mut, mutA, mutB, sbm, sbmA, sbmB, sbm5, bhbA, mcmA, mcmA1, mcmA2, mcmB, mcm1, mcm2, mcm3, icmA, meaA1 и meaA2. Нуклеотидные последовательности этих генов представлены, например, в "Kyoto Encyclopedia of Genes and Genomes" (базе данных KEGG), в базах данных Национального центра биотехнологической информации (NCBI) Национальной медицинской библиотеки (Bethesda, MD, USA) или в базе данных Европейских молекулярно-биологических лабораторий (EMBL, Гейдельберг, Германия или Кембридж, Великобритания).
Согласно особо предпочтительно форме исполнения первого варианта способа согласно изобретению фермент Е1 представляет собой метилмалонил-кофермент A-мутазу из Corynebacterium glutamicum ATCC 13032, кодируемую последовательностью ДНК № последовательности 01 и имеющую последовательность аминокислот № последовательности 02.
Кроме того, согласно первому альтернативному варианту способа согласно изобретению, где применяют генетически модифицированную клетку, в которой синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты идет с сукцинил-коферментом А в качестве промежуточного продукта и метилмалоновым полуальдегидом в качестве начального продукта, предпочтительно, чтобы клетка, при необходимости в дополнение к повышенной активности фермента E1, имела повышенную активность по меньшей мере одного из следующих ферментов Е2-Е4 (см. Фиг.2):
- фермента E2, катализирующего преобразование метилмалонил-кофермента A в метилмалонат;
- фермента Е3, катализирующего преобразование метилмалоната в метилмалоновый полуальдегид;
- фермента Е4, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксиизомасляную кислоту.
Наиболее предпочтительные согласно изобретению клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: Е2, Е3, Е4, Е2Е3, Е2Е4, Е3Е4, Е2Е3Е4, причем наиболее предпочтительны Е2Е3Е4. Кроме того, возможно также, что один фермент катализирует по меньшей мере два из описанных выше этапов реакции. Так, например, возможно применение фермента, который обладает активностью как фермента E2, так и фермента Е3 (и таким образом катализирует преобразование метилмалонил-кофермента A непосредственно в метилмалоновый полуальдегид), как, например, метилмалонил-кофермент A-редуктазы из Sulfolobus tokodaii, кодируемую последовательностью ДНК Seq.-ID.-Nr. 03 и имеющую последовательность аминокислот Seq.-ID.-Nr. 04, либо же фермента, обладающего активностью всех трех ферментов Е2, Е3 и Е4, как то: малонил-кофермент A-редуктазы из Chloroflexus aurantiacus (Hügler et al., Journal of Bacteriology 184, страницы 2.404-2.410, 2002).
В этом контексте предпочтительны следующие ферменты:
E2 метилмалонил-кофермент A-гидролаза (ЕС 3.1.2.17),
Е3 альдегид-дегидрогеназа (ЕС 1.2.1.3) или альдегид-оксидаза (ЕС 1.2.3.1)
и
Е4 3-гидроксиизобутират-дегидрогеназа (ЕС 1.1.1.31) или 3-гидроксиацил-кофермент A-дегидрогеназа (ЕС 1.1.1.35).
Предпочтительно, чтобы ген, кодирующий фермент E2, представлял собой ген аох1. Метилмалонил-кофермент A-гидролаза из печени крысы описана, например, в Kovachy et al., "Recognition, isolation, and characterization of rat liver D-methylmalonyl coenzyme A hydrolase", J.Biol. Chem. 258(1983), стр.11.415-11.421.
Предпочтительно, чтобы ген, кодирующий фермент Е3, был выбран из группы, состоящей из aldh2, aldh3a1, aldh3a2, aldh1b1, aldh9a1, aldh7a1, aldh1a4, aldh1a1, aldh1a2, mgc80785, mgc83352, mgc89020, dmel-CG31075, cg3752, cg9629, alh-9, alh-1, alh-2, f508.35, t7023.15, f15l1.19, tT17F15.130, ald1, ald2, ald4, ald5, ald6, acl044Wp, adr417wp, msc7, tb06.5F5.780, aIdH, puuC, putA, aldA, badH, alkH, pcD, rsp1591, rs01031, exaC, acoD, dhaL, pchA, aldB, dhaS, betB, ywdH, ycbD, aldX, aldY, aldA1, aldA2, aldC, pcd, cgl0546, cgl2668, cgl2796, scg11A.05, sci30A.27c, sce9.27c, sck13.05c, sc5H4.03, thcA, gabD2, aIkH, aIdH, aldH1, aldY1, aldY2, aldY3, aldY4, aldY5, aldY6, aldY7 и aldhT.
Надлежащие гены для фермента E4 выбирают из группы, состоящей из hibadh, cg15093, cg15093, cg4747, mwL2.23, t13k14.90, f19b15.150, hibA, ygbJ, mmsB, mmsB, garR, tsar, mmsB-1, mmsB-2, yfjR, ykwC, ywjF, hibD, glxR, SCM1.40c, hibD, ehhahd, hadh2, hadhsc, hsd17B4, loc488110, had, mgC81885, hadh2-prov, cg3415, cg7113, ech-1, ech-8, ech-9, ard-1, yfcX, fadB, faoA, fadB2x, hbd-1, hbd-2, hbd-3, hbd-4, hbd-5, hbd-6, hbd-7, hbd-8, hbd-9, hbd-10, fadJ, rs04421, rs02946, rs05766, bbsD, bbsC, fadB1, fadB2, fadB5, hbdA, pimF, fabJ-1, fabJ, scbac19f3.11, sci35.13, scbac8d1.10c, sc5f2a.15, sc6a5.38, fadC2, fadC4, fadC5, fadC6, had и рааН. Прочие пригодные к применению 3-гидроксиизобутират-дегидрогеназы описаны, например, в Bannerjee et al. (1970), J.Biol. Chem, 245, стр.1.828-1.835, Steele et al. (1992), J. Biol. Chem., 267, стр.13.585-13.592, Harris et al. (1988), J. Biol. Chem., 263, стр.327-331, Harris et al., Biochim. Biophys. Acta, 1645 (1), стр.89-95, Hawes et al. (2000), Methods Enzymol., 324, стр.218-228, Harris et al., J. Biol. Chem., 275 (49), стр.38.780-38.786, Rougraff et al. (1988), J. Biol. Chem., 263(1), стр.327-331, Robinson et al., J. Biol. Chem., 225, стр.511-521, Hawes et al. (1995), Biochemistry, 34, стр.4.231-4.237, Hasegawa J. (1981), Agric. Biol. Chem., 45, стр.2.805-2814, Hawes et al. (1996), FEBS Lett., 389, стр.263-267, Hawes et al. (1996), Enzymology and Molecular Biology of Carbonyl Metabolism, Plenum Press, New York, стр.395-402, Adams et al. (1994), Structure, 2, стр.651-668, Zhang et al. (1999), Biochemistry, 38, стр.11.231-11.238, Mirny et al., (1999), J. Mol. Biol., 291, стр.177-196 и Lokanath et al. (2005), J Mol Biol. Содержание этих публикаций настоящим введено как ссылка и образует составную часть изложения настоящего изобретения.
Нуклеотидные последовательности этих генов, а также прочих генов для ферментов E2-E4 содержатся в т.ч. в базе данных KEGG, базе данных NCBI или в базе данных EMBL
Согласно особо предпочтительной форме этого альтернативного варианта способа по изобретению, где применяют генетически модифицированную клетку, применяемая в форме исполнения, в которой синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты идет с метилмалоновым полуальдегидом в качестве начального продукта, а в качестве промежуточного продукта - с сукцинил-коферментом A, предпочтительно применять для преобразования метилмалонил-кофермента A в метилмалоновый полуальдегид малонил-кофермент A-редуктазу из Sulfolobus tokodaii, кодируемую последовательностью ДНК №03 и имеющую последовательность аминокислот №04. Согласно другой особо предпочтительной форме этого варианта для преобразования метилмалонил-кофермента A в 3-гидроксиизомасляную кислоту применяют малонил-кофермент A-редуктазу из Chloroflexus aurantiacus (Hügler et al., Journal of Bacteriology 184, Seiten 2.404-2.410, 2002).
Кроме того, в связи с этой первой альтернативой особенной формы исполнения первого варианта способа согласно изобретению предпочтительно, чтобы применяемая согласно этой форме исполнения генетически модифицированная клетка обладала сниженной по сравнению со своим диким типом активностью фермента Е5, который преобразует метилмалоновый полуальдегид в пропионил-кофермент A, причем этот фермент предпочтительно представляет собой дегидрогеназу метилмалонового полуальдегида (ЕС 1.2.1.27).
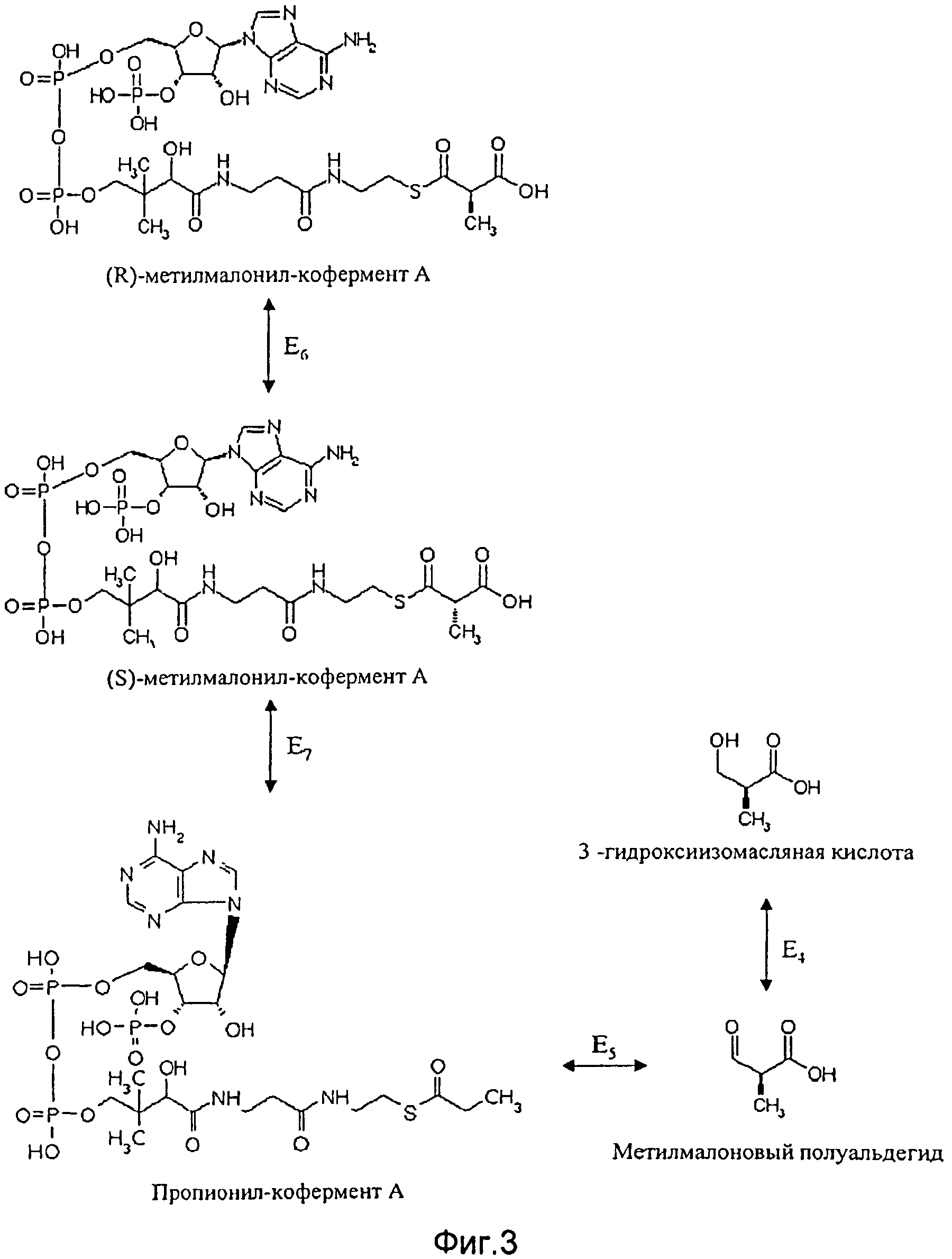
Согласно второму альтернативному варианту способа согласно изобретению, где применяют генетически модифицированную клетку, в которой синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты идет с метилмалоновым полуальдегидом в качестве начального продукта, а в качестве промежуточного продукта - сукцинил-кофермента A, предпочтительно, чтобы клетка, при необходимости в дополнение к повышенной активности фермента E1, имела повышенную активность по меньшей мере одного из следующих ферментов Е4-E7 (см. Фиг.3):
- фермента Е6, катализирующего преобразование (R)-метилмалонил-кофермента A в (S)-метилмалонил-кофермент А;
- фермента Е7, катализирующего преобразование (S)-метилмалонил-кофермента A в пропионил-кофермент А;
- фермента E5, катализирующего преобразование пропионил-кофермента A в метилмалоновый полуальдегид;
- фермента Е4, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксиизомасляную кислоту.
Наиболее предпочтительно согласно изобретению применяют клетки, у которых повышена активность следующих ферментов или сочетаний ферментов: E4, E5, E6, E7, E4E5, E4E6, E4E7, E5E6, E5E7, E6E7, E4E5E6, E4E5E7, E4E6E7, E5E6E7 и E4E5E6E7, причем наиболее предпочтительно сочетание E4E5E6E7.
В этом контексте предпочтительны следующие ферменты:
E6 метилмалонил-кофермент А-эпимераза (ЕС 5.1.99.1),
E7 метилмалонил-кофермент А-декарбоксилаза (ЕС 4.1.1.41),
E5 дегидрогеназа метилмалонового полуальдегида (ЕС 1.2.1.27) и
E4 3-гидроксиизобутират-дегидрогеназа (ЕС 1.1.1.31) или 3-гидроксиацил-коферментА-дегидрогеназа (ЕС 1.1.1.35).
Предпочтительные ферменты Е4 при этом те, которые уже были описаны выше в связи с первым вариантом первой предпочтительной формы исполнения способа согласно изобретению.
Предпочтительно, чтобы ген, кодирующий фермент Е6, представлял собой ген mcee. Пригодная к применению метилмалонил-кофермент A-декарбоксилаза (фермент Е7) описана, например, Benning et al. в Biochemistry, Vol.39 (2000), Seiten 4.630-4.639.
Надлежащие гены для фермента E5 предпочтительно выбирают из группы, состоящей из aldh6a1, cg17896, t22c12.10, ald6, putA1, mmsA, mmsA-1, mmsA-2, mmsA-3, mmsA-4, msdA, ioIA и ioIAB.
Надлежащие гены для фермента Е7 предпочтительно выбирают из группы, состоящей из mmdA, bcc, oadB, oadB2, oadB3, SC1C2.16, SC1G7.10, pccB1, accA2, mmdB, mmdC и ррсВ.
Нуклеотидные последовательности генов для ферментов Е5, Е6 и Е7 содержатся в т.ч. в базе данных KEGG.
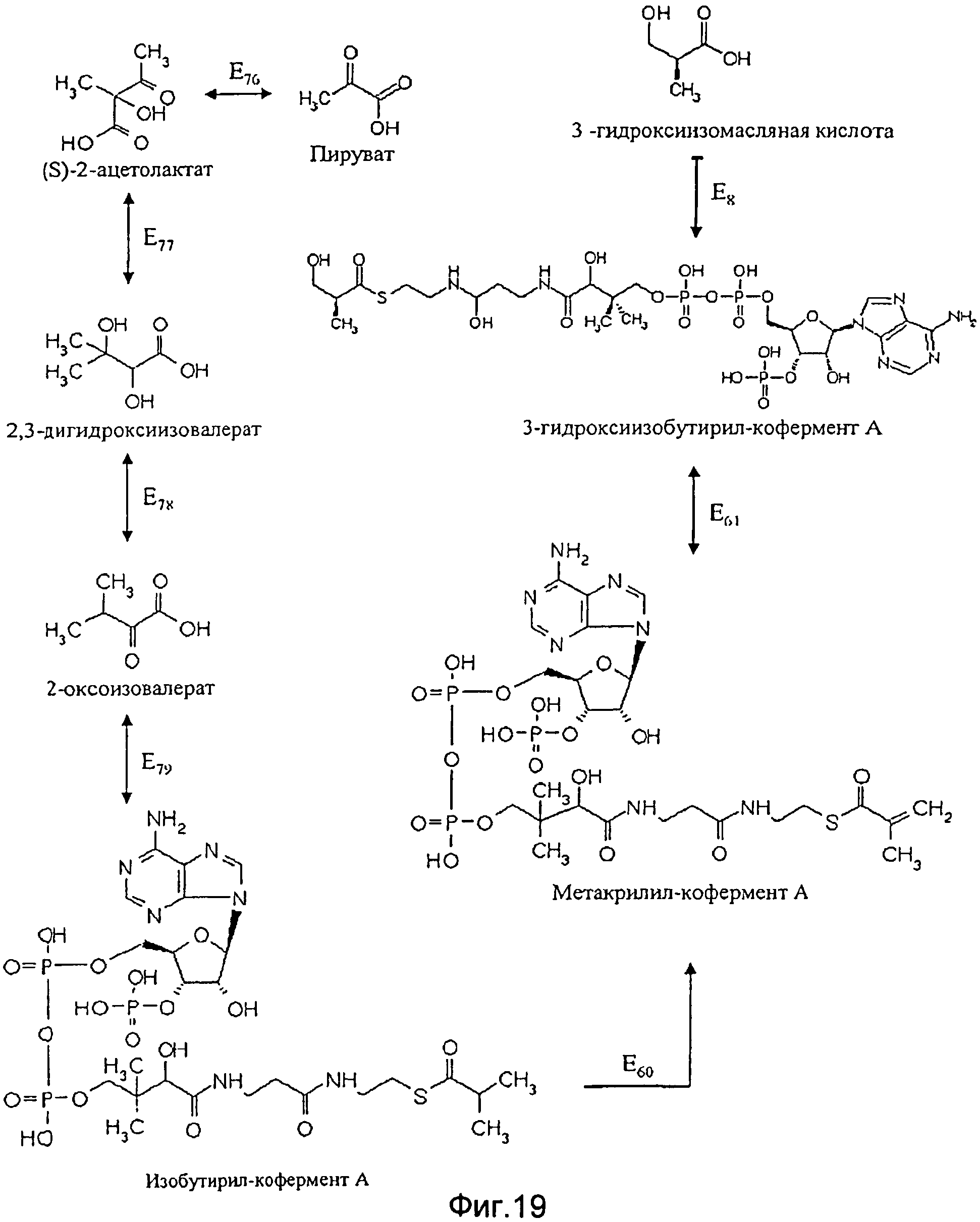
Согласно третьему альтернативному варианту способа согласно изобретению, где применяют генетически модифицированную клетку, в которой синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты идет с метилмалоновым полуальдегидом в качестве начального продукта, а в качестве промежуточного продукта - сукцинил-кофермента A, предпочтительно, чтобы клетка, при необходимости в дополнение к повышенной активности фермента E1, имела повышенную активность по меньшей мере одного из следующих ферментов Е4, E5 и Е7 (см. Фиг.4):
- фермента Е7, катализирующего преобразование метилмалонил-кофермента А в пропионил-кофермент А;
- фермента E5, катализирующего преобразование пропионил-кофермента А в метилмалоновый полуальдегид;
- фермента Е4, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксиизомасляную кислоту.
В основном этот путь схож со вторым вариантом первой предпочтительной формы исполнения способа согласно изобретению, но в отличие от второго варианта синтез пропионил-СоА осуществляют непосредственно из метилмалонил-кофермента А. Предпочтительные ферменты и гены для ферментов Е4, E5 и Е7 - это те же гены или ферменты, которые уже были поименованы выше в связи со вторым вариантом.
Кроме того, согласно первой особой форме исполнения способа согласно изобретению (и также согласно всем приведенным ниже формам исполнения) может быть предпочтительно применять генетически модифицированную клетку, способную преобразовывать синтезированную 3-гидроксиизомасляную кислоту в полигидроксиалканоат. Такие полигидроксиалканоаты откладываются внутри клеток многих микроорганизмов в форме гранул с сильным светопреломлением. В этом контексте особенно предпочтительно, чтобы применяемая при реализации способа согласно изобретению генетически модифицированная клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из, а предпочтительно обоих, следующих ферментов E8 и E9 (см. Фиг.5):
- фермента Е8, катализирующего преобразование 3-гидроксиизомасляной кислоты в 3-гидроксиизобутирил-кофермент А;
- фермента E9, катализирующего преобразование 3-гидроксиизобутирил-коферментаА в полигидроксиалканоат на основе3-гидроксиизомасляной кислоты.
В этом контексте предпочтительны следующие ферменты:
Е83-гидроксиизобутирил-СоА-гидролаза (ЕС 3.1.2.4) и
Е9полигидроксиалканоат-синтаза.
Как уже изложено выше, в первой предпочтительной форме исполнения способа согласно изобретению 3-гидроксиизомасляная кислота или полигидроксиалканоаты на основе 3-гидроксиизомасляной кислоты синтезируют сукцинил-кофермента А в качестве промежуточного продукта и метилмалонового полуальдегида как начального продукта. При этом может быть в принципе целесообразно, помимо воздействия на активность вышепоименованных ферментов E1-E9, также оказывать воздействие на активность тех ферментов, которые вызывают повышение формирования сукцинил-кофермента А в клетке.
Если согласно первой особенной форме исполнения первого варианта способа согласно изобретению синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоата на основе 3-гидроксиизомасляной кислоты идет с сукцинил-коферментом А в качестве промежуточного продукта и метилмалоновым полуальдегидом в качестве начального продукта из углеводов и глицерина, то в соответствии с особым вариантом вышеописанного первого, второго или третьего альтернативного варианта согласно изобретению предпочтительно, чтобы применяемая генетически модифицированная клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из, а предпочтительно обоих, следующих ферментов Е10 и Е11 (см. Фиг.6):
- фермента Е10, катализирующего преобразование фосфоенолпирувата в оксалоацетат;
- фермента Е11, катализирующего преобразование пирувата в оксалоацетат.
В этом контексте предпочтительны следующие ферменты:
Е10фосфоенолпируват-карбоксилаза (ЕС 4.1.1.31) и
Е11пируват-карбоксилаза (ЕС 6.4.1.1).
Предпочтительно, чтобы фермент Е10 кодировали гены, выбранные из группы, включающей в себя f12m16.21, f14n22.13, k15m2.8, ppc, clpA, pepC, сарР, сg11585, pepC, pck, ppc и рссА, причем особо предпочтителен ген ppc. Предпочтительные согласно изобретению фосфоенолпируват-карбоксилазы описаны, в частности, в патентах США US 4,757,009, US 4,980,285, US 5,573,945, US 6,872,553 и US 6,599,732. Содержание этих публикаций в отношении фосфоенолпируват-карбоксилаз настоящим введено как ссылка и образует составную часть изложения настоящего изобретения.
Предпочтительно, чтобы фермент Е11 кодировали гены, выбранные из группы, включающей в себя рс, рсх, cg1516, cg1516, pyc-1, pyc-2, aar162Cp, pyr1, ассС-2, pycA, русА2, рса, cgl0689, рус, русВ, ассС, oadA, acc и ассС1, причем особо предпочтителен ген pyc. Предпочтительные согласно изобретению пируват-карбоксилазы описаны, в частности, также в патентах США US 6,455,284, US 6,171,833, US 6,884,606, US 6,403,351, US 6,852,516 и US 6,861,246. Кроме того, согласно изобретению также особо предпочтительна пируват-карбоксилаза, описанная в "A novel methodology employing Corynebacterium glutamicum genome information to generate a new L-lysine-producing mutant", Ohnishi J et al., Applied Microbiology and Biotechnology, Vol.58 (2), стр.217-223 (2002).
Нуклеотидные последовательности подходящих генов ферментов Е10 и Е11 содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Чтобы с промежуточного этапа оксалоацетата перейти к сукцинил-коферменту А, который затем через метилмалонил-кофермент А с помощью трех названных в начале вариантов можно преобразовать в 3-гидроксиизомасляную кислоту, есть несколько возможностей.
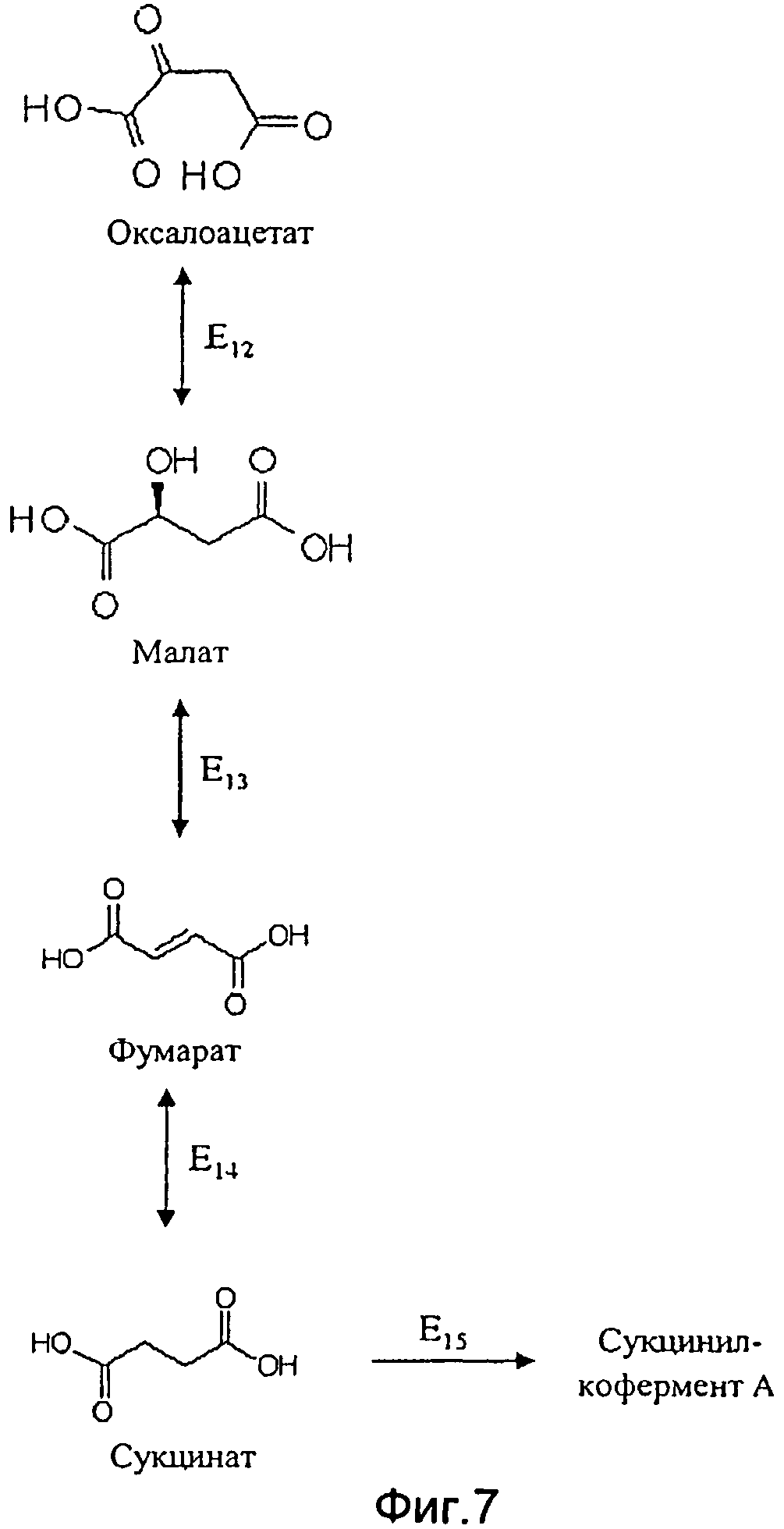
Первый путь предусматривает образование в качестве промежуточного продукта фумарат. В этом случае согласно первой особой вариации вышеописанных первого, второго или третьего альтернативного варианта способа согласно изобретению, где применяют генетически модифицированную клетку, в которой в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - сукцинил-кофермент А, предпочтительно, чтобы клетка, при необходимости в дополнение к повышенной активности фермента Е10 или Е11, имела повышенную активность по меньшей мере одного из следующих ферментов E12-Е15 (см. Фиг.7):
- фермента E12, катализирующего преобразование оксалоацетата в малат;
- фермента Е13, катализирующего преобразование малата в фумарат;
- фермента E14, катализирующего преобразование фумарата в сукцинат;
- фермента E15, катализирующего преобразование сукцината в сукцинил-кофермент А.
Наиболее предпочтительные согласно изобретению клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: E12, Е13, Е14, E15, Е12Е13, E12E14, E12E15, Е13Е14, Е13Е15, E14E15, E12E13E14, E12E13E15, E12E14E15, E13E14E15, Е12Е13Е14Е15, причем наиболее предпочтительно сочетание E12E13E14E15.
В этом контексте предпочтительны следующие ферменты:
E12 малат-дегидрогеназа (ЕС 1.1.1.37) или малат-хинон оксидоредуктаза (1.1.99.16),
Е13 фумарат-гидратаза (ЕС 4.2.1.2),
Е14 сукцинат-дегидрогеназа (ЕС 1.3.99.1 или ЕС 1.3.5.1) или сукцинатхинон оксидоредуктаза (1.3.5.1) и
E15 сукцинат-кофермент А-лигаза (ЕС 6.2.1.4 или ЕС 6.2.1.5).
Предпочтительно, чтобы фермент E12 кодировали гены, выбранные из группы, включающей в себя mdh1, mdh2, mor1, cg10748, cg10749, cg5362, mdh-1, f46e10.10, f19p19.13, f12m16.14, t30l20.4, k15m2.16, f1p2.70, f17i14.150, mnl12.18, mik19.17, mdh3, adl164cp, adr152cp, adr252wp, mdhA, mdhC, mdhB, ybiC, mdh, yiaK, ybiC, allD, citH, yjmC, citH, cgl2380, ldh, sqdB, mqo, yojH, mqoA, mqoB, mqo1, mqo2, mqo3, mqo4 и cgl2001, причем особо предпочтительны ген mqo и ген mdh.
Предпочтительно, чтобы фермент Е13 кодировали гены, выбранные из группы, включающей в себя fh, fh1, sc4094, sc4095, t30b22.19, k3k7.11, acr013Cp, fum1, fum2, fum3, fum4, fumH, fumA, fumB, fumC, fumd, fumC2, fum, ttdA, ttdB, fumB-alpha, fumB-beta, citG, citB, fumX, fum-1 и fum-2, причем особо предпочтителен ген fum.
Предпочтительно, чтобы фермент E14 кодировали гены, выбранные из группы, включающей в себя sdh1, sdh2, sdh3, sdh4, sdh5, sdh6, osm1, osm2, sdhA, sdhB, sdhC, sdhD, frdA, frdB, frdC, frdD, ifcA-1, ifcA-2, sdhB-1, sdhB-2, frdC2, cgl0370, cgl0371, cgl0372, scm 10.10 с, scm10.11c, scm10.12c, sc5g8.25c, sc5g8.26c, scbac-31e11.02c, scbac31e11.02c, sc4b10.10c, sdhA2, sdhB2, sdhA1, sdhB1, qcrB2, sdhA3, sdhB3, frdB1 и frdB2, причем особо предпочтительны гены sdhA, sdhB и sdhC.
Предпочтительно, чтобы фермент E15 кодировали гены, выбранные из группы, включающей в себя suclg1, suclg2, loc434885, cg10622, dmel-CG6255, f11a3.3, f8l15.30, mkd15.11, Isc1, Isc2, ael211wp, afr134cp, scsA, scsB, sucC и sucD.
Нуклеотидные последовательности подходящих генов ферментов E12-E15 также содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Если повышена активность одного или нескольких из ферментов E12-E15, может также оказаться целесообразным, чтобы клетка обладала сниженной по сравнению со своим диким типом активностью одного из ферментов от E16 до Е23:
- фермента Е16, катализирующего преобразование оксалоацетата в цитрат;
- фермента Е17, катализирующего преобразование малата в оксалоацетат;
фермента E18, катализирующего преобразование сукцинил-кофермента А в сукцинат;
фермента Е19, катализирующего преобразование оксалоацетата в фосфоенолпируват;
фермента Е20, катализирующего преобразование оксалоацетата в пируват;
фермента E21, катализирующего преобразование оксалоацетата в аспартат;
фермента Е22, катализирующего преобразование малата в пируват;
фермента Е23, катализирующего преобразование пирувата в ацетат.
Наиболее предпочтительные согласно изобретению клетки - это те, у которых понижена активность следующих ферментов или сочетаний ферментов: Е16, Е17, E18, Е19, Е20, Е21, и E16E17E18E19E20E21E22E23.
В этом контексте предпочтительны следующие ферменты:
E16 цитрат-синтаза (ЕС 2.3.3.1 или ЕС 2.3.3.8),
E17 малат-оксидаза (ЕС 1.1.3.3),
E18 сукцинил-СоА-гидролаза (ЕС 3.1.2.3),
Е19 фосфоенолпируват-карбоксикиназа (ЕС 4.1.1.49 или 4.1.1.32),
Е20 оксалоацетат-декарбоксилаза (ЕС 4.1.1.3),
E21 аспартат-трансаминаза (ЕС 2.6.1.1),
Е22 малат-дегидрогеназа (ЕС 1.1.1.38, ЕС 1.1.1.39 или ЕС 1.1.1.40),
Е23 пируват-дегидрогеназа (ЕС 1.2.1.51).
Предпочтительно, чтобы фермент Е16 кодировали гены, выбранные из группы, включающей в себя glt, cs, csl, cg3861, cts-1, f7f19.21, f4i1.16, t20n10.90, t20n10.100, t209.80, cit1, cit2, cit3, aar004cp, agr002wp, cshA, gltA, citZ, cit, prpC, cisY, cis, mmgD, citA, gltA1, gltA2, gltA3, cgl0829, prpC1, scd10.20, citA1, citA2, citA3, acly, cg8322, f5e6.2, k7jJ8.14 и citE, причем наиболее предпочтителен gltA.
Предпочтительно, чтобы фермент E19 кодировали гены, выбранные из группы, включающей в себя pckA, pck1, pck2, cg10924, cg17725, cg17725, pckG, ppcK, cgl2863, pck и 2sck36.02.
Предпочтительно, чтобы фермент Е20 кодировали гены, выбранные из группы, включающей в себя oadA, oadB, oadC, oadG, oag3, eda, dcoA, oadA1, oadA2, русВ и mmdB.
Предпочтительно, чтобы фермент E21 кодировали гены, выбранные из группы, включающей в себя myn8.7, glt1, adr290wp, gltB, gltD, glt1, gls1, gltA, glt, glxD, gltD1, gltD2, gdh2, agl040Cp, gdhA1, gdhA, gdhA2, gluD, gluD1, gluD2, rocG, ypcA, gudB, t11i18.2, t2i1.150, mrg7.13, f19c24.7, gdh, gdh1, gdh2, gdh3, got1, got2, cg4233, cg8430, f23n19.17, f13j11.16, t26c19.9, f7f1.18, F10N7.200, t16l1.170, f15n18.110, t20d1.70, aat1, aat2, abl038wp, afr211cp, agx1, bna4, aatA, aatB, ybdL, aspC, yfbQ, aat, avtA1, avtA2, tyrB, avtA, avtB, argD1, argD2, aspB1, aspB2, аsрВ3, aspB, aspC1, aspC2, aspC3, aspC4, RS05143, aspAT, ywfG, yhdR, argD, mtnV, alaT, hisC, avtA1, avtA2, avtA3, cgl0240, cgl1103, cgl2599, cgl2844, 2sck36.07c, sc9e12.21, sc2h4.04c, tyrB, gtp, gtp1, gtp2, cg1640, f20d23.34, f26f24.16, f24j13.15, t10d10.20 и agr085wp, причем особо предпочтительны aspC, aatA, gdh, gudB, gdhA, gItB и gItD.
Предпочтительно, чтобы фермент E21 кодировали гены, выбранные из группы, включающей в себя myn8.7, glt1, adr290wp, gltB, gltD, glt1, gls1, gltA, glt, glxD, gltD1, gltD2, gdh2, agl040Cp, gdhA1, gdhA, gdhA2, gluD, gluD1, gluD2, rocG, ypcA,
Предпочтительно, чтобы фермент Е22 кодировали гены, выбранные из группы, включающей в себя me, me1, me2, me3, mae, mae1, mae2, sfcA, sfcA1, maeA, maeB, tme, yqkJ, ywkA, yqkJ, malS, ytsJ, mleA, mleS, mez, sce59.10c, 2sc7g11.23, malS1, malS2, dme, maeB1, maeB2, mdh, mdh1, mdh2, dmel_cg10120, dmel_cg10120, dmel-cg5889, f19k16.27, f6f22.7, t22p22.60, f18a17.1, mod1, tme, mao, cgl3007, malS и malE.
Предпочтительно, чтобы фермент Е23 кодировали гены, выбранные из группы, включающей в себя me, me1, me2, me3, mae, mae1, mae2, sfcA, sfcA1, maeA, maeB, tme, yqkJ, ywkA, yqkJ, malS, ytsJ, mleA, mleS, mez, sce59.10c, 2sc7g11.23, malS1, malS2, dme, maeB1, maeB2, mdh, mdh1, mdh2, dmel_cg10120, dmel_cg10120, dmel_cg5889, f19k16.27, f6f22.7, t22p22.60, f18a17.1, mod1, tme, mao, cgl3007, malS и malE.
Кроме того, согласно изобретению в том случае, когда повышенное производство сукцинил-кофермента А в клетке проходит по одному из описанных ранее путей (оксалоацетат → малат → фумарат → сукцинил-кофермент А), предпочтительно, чтобы в клетке было целенаправленно повышено производство восстановительных эквивалентов.
Возможность повышения восстановительных эквивалентов состоит в том, чтобы интенсифицировать окислительный пентозофосфатный путь. В этом контексте особо предпочтительно, чтобы была повышена активность глюкозо-6-фосфат-дегидрогеназы (ЕС 1.1.1.49) и/или 6-фосфоглюконат-дегидрогеназы (ЕС 1.1.1.44), которые предпочтительно кодируются геном gnd, и при этом одновременно был ингибирован гликолиз, например, путем ослабления активности глюкозо-6-фосфат-изомеразы, как это описано в международной заявке WO-A-01/07626. Помимо целенаправленной интенсификации пентозофосфатного пути или вместо таковой может также быть предпочтительно создать восстановительные эквиваленты посредством того, чтобы предоставить клеткам в качестве источника углерода этанол и способствовать преобразованию в клетках этанола в ацетальдегид с помощью алкоголь-дегидрогеназ (ЕС 1.1.1.1, ЕС 1.1.1.2, ЕС 1.1.1.71 или ЕС 1.1.99.8) и дальнейшее преобразование ацетальдегида в ацетил-кофермент А с помощью ацетальдегид-дегидрогеназ (ЕС 1.2.1.10). Надлежащие гены для алкоголь-дегидрогеназ и ацетальдегид-дегидрогеназ также содержатся в известных специалисту генетических базах данных, как то: базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Второй путь преобразования оксалоацетата в сукцинил-кофермент А включает в себя в качестве промежуточного продукта цитрат. В этом случае согласно второй особой вариации вышеописанного первого, второго или третьего альтернативного варианта способа согласно изобретению предпочтительно применять генетически модифицированную клетку, которая, при необходимости в дополнение к повышенной активности фермента Е10 или Е11, имела бы повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов Е13-E16 и Е24-Е26 (см. Фиг.8):
- фермента Е16, катализирующего преобразование оксалоацетата в цитрат;
- фермента Е24, катализирующего преобразование цитрата в изоцитрат;
- фермента Е25, катализирующего преобразование изоцитрата в глиоксалат и сукцинат;
- фермента Е26, катализирующего преобразование глиоксалата в малат;
- фермента Е13, катализирующего преобразование малата в фумарат;
- фермента Е14, катализирующего преобразование фумарата в сукцинат;
- фермента E15, катализирующего преобразование сукцината в сукцинил-кофермент А.
Наиболее предпочтительные согласно изобретению клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: E13, Е14, E15, E16, Е24, Е25, Е26, Е13Е14, Е13Е15, Е13Е16, Е13Е24, Е13Е25, Е13Е26, E14E15, E14E16, E14E24, E14E25, E14E26, E15E16, E15E24, E15E25, E15E26 и E13E14E15E16 E24E25E26, причем наиболее предпочтительно сочетание E13E14E15E16E24E25E26.
В этом контексте предпочтительны следующие ферменты:
E13 фумарат-гидратаза (ЕС 4.2.1.2),
Е14 сукцинат-дегидрогеназа (ЕС 1.3.99.1 или ЕС 1.3.5.1) или сукцинатхинон оксидоредуктаза (1.3.5.1),
E15 сукцинат-кофермент А-лигаза (ЕС 6.2.1.4 или ЕС 6.2.1.5),
Е16 цитрат-синтаза (ЕС 2.3.3.1 или ЕС 2.3.3.8),
Е24 аконитат-гидратаза (ЕС 4.2.1.3),
Е25 изоцитрат-лиаза (ЕС 4.1.3.1) и
Е26 малат-синтаза (ЕС 2.3.3.9).
Предпочтительные гены для ферментов E13-E16 - это те, которые уже были описаны в связи с первым путем преобразования оксалоацетата в сукцинил-кофермент А.
Предпочтительно, чтобы фермент Е24 кодировали гены, выбранные из группы, включающей в себя асо1, асо2, ratireb, dmel-CG4706, dmel-CG4900, dmel-cg6342, cg9244, t3p4.5, f10m23.310, f4b14.100, adl032Wp, afr629wp, acnA, acnB, acnC, acnD, rpfA, acnA1, acnA2, acnM, citB, leuC, cgl1540, sacA, can, и асо, причем особо предпочтительны acnA и acnB.
Предпочтительно, чтобы фермент Е25 кодировали гены, выбранные из группы, включающей в себя msd21.4, icl1, icl2, adl066cp, agl057wp, aceA, icl, aceAa, aceAb, cgl0097 и cgl2331, причем особо предпочтителен асеА. Согласно предпочтительной форме исполнения предпочтительны те гены, которые кодируют дерегулированную на генном или белковом уровне изоцитрат-лиазу.
Предпочтительно, чтобы фермент Е26 кодировали гены, выбранные из группы, включающей в себя med24.5, mlsS1, acr268cp, masA, glcB, aceB, mis, glcB-1, glcB-2, cgl2329, masZ, aceB1, aceB2 и mas, причем особо предпочтителен ген aceB.
В этом случае нуклеотидные последовательности подходящих генов ферментов Е24-Е26 также содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Если получению оксалоацетата из фосфоенолпирувата или из пирувата способствует повышение активности фермента Е10 или Е11, то сукцинат, получаемый в дополнение к глиоксалату при расщеплении изоцитрата изоцитрат-лиазой, также можно использовать для образования сукцинил-кофермента А. Кроме того, при следовании по этому второму пути от оксалоацетата к сукцинату может оказаться целесообразным снизить активность фермента E27, который катализирует преобразование изоцитрата в 2-оксоглутарат, и который предпочтительно представляет собой изоцитрат-дегидрогеназу (ЕС 1.1.1.41 или ЕС 1.1.1.42). Изоцитрат-дегидрогеназа предпочтительно представляет собой фермент, который кодируется геном, выбранным из группы, включающей в себя idh1, idh2, cg7176, cg7176, cg7176, f20d21.16, f12p19.10, t15n1.80, idp1, idp2, idp3, aal022Wp, aer061Cp, idhC, idhM, icdA, led, idh, icd1, icd2, leuB, citC, citC, cgl0664, leuB2, idh3A, idg3B, idh3G, cg12233, dmel-CG5028, dmel-CG6439, f6p23.14, f23e12.180, f8d20.160, f12e4.20, adl223wp и afr137cp, причем особо предпочтительны icdA и citC.
Третий путь преобразования оксалоацетата в сукцинил-кофермент А включает в себя в качестве промежуточного продукта 2-оксоглутарат.В этом случае согласно третьей особой вариации вышеописанного первого, второго или третьего альтернативного варианта способа согласно изобретению предпочтительно применять генетически модифицированную клетку, которая, при необходимости в дополнение к повышенной активности фермента Е10 или Е11, имела бы повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов Е16, Е24, E27 и Е28 (см. Фиг.9):
- фермента E16, катализирующего преобразование оксалоацетата в цитрат;
- фермента Е24, катализирующего преобразование цитрата в изоцитрат;
- фермента Е27, катализирующего преобразование изоцитрата в 2-оксоглутарат;
- фермента Е28, катализирующего преобразование 2-оксоглутарата в сукцинил-кофермент А.
Наиболее предпочтительные согласно изобретению клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: E16, E24, E27, E28, E16E24, Е16Е27, Е16Е28, Е24Е27, E24E28, E27E28, E16E24E27, E16E24E28, Е24Е27Е28 и E16E24E27E28, причем сочетание E16E24E27E28 наиболее предпочтительно.
В этом контексте предпочтительны следующие ферменты:
E16 цитрат-синтаза (ЕС 2.3.3.1 или ЕС 2.3.3.8),
E24 аконитат-гидратаза (ЕС 4.2.1.3),
Е27 изоцитрат-дегидрогеназа (ЕС 1.1.1.41 или ЕС 1.1.1.42) и
Е28 2-оксоглутарат-синтаза (ЕС 1.2.7.3).
Предпочтительные гены для ферментов Е16, Е24 и E27 - это те, которые уже были описаны в связи с первым и вторым путями преобразования оксалоацетата в сукцинил-кофермент А.
Предпочтительно, чтобы фермент Е28 кодировали гены, выбранные из группы, включающей в себя korA, korB, kor D, korA1, korA2, korB1, korB2, oorA, oorB, oorC, oorD, oforA, oforB, porA, porB, porA1, porA2, роrАЗ, porA4, porG, porG1, porG2, porB1, porB2, роrВЗ, SCD20.12c, SCD20.13c, SCAH 10.34 с, SCAH 10.35 с, korG, orA, orB, korG1 и korG2. Кроме того, Е28 может также представлять собой дегидрогеназный комплекс из нескольких субъединиц, имеющих различные уровни ферментативной активности. В частности, возможен дегидрогеназный комплекс, включающий в себя оксоглутарат-дегидрогеназу (ЕС 1.2.4.2), дигидролипоил-дегидрогеназу (ЕС 1.8.1.4) и сукцинил-трансферазу остатка дигидролипоиллизина (ЕС 2.3.1.61). При этом предпочтительно, чтобы оксоглутаратдегидрогеназу (ЕС 1.2.4.2) кодировали гены, выбранные из группы, включающей в себя ogdh, ghdhl, loc239017, mgc68800, mgc80496, cg11661, t22e16.70, mpA24.10, kgd1, aer374cp, sucA, odhA, kgdA и cgl1129, причем особо предпочтительны sucA и odhA. Предпочтительно, чтобы дигидролипоил-дегидрогеназу (ЕС 1.8.1.4) кодировали гены, выбранные из группы, включающей в себя dld, dld-prov, dldh, cg7430, t2j15.6, k14a17.6, at3g17240, mgd8.7lpd1, afr512wp, dld1, Ipd, tb03.26j7.650, tb04.3m17.450, tb927.8.7380, tb08.10k10.200, IpdA, IpdG, IpdV, Ipd3, acoD, IpdAI, IpdA2, IpdA3, odhL, pdhD, pdhD1, pdhD2, pdhD3, pdhD42, IpdAchI, lpdAch2, IpdAc, acoL, bfmbC, bkdD, cgl0366, cgl0688, scm1.17c, pdhL, sck13.11, lpdB2 и dld1, причем особо предпочтителен Ipd. При этом предпочтительно, чтобы сукцинил-трансферазу остатка дигидролипоиллизина (ЕС 2.3.1.61) кодировали гены, выбранные из группы, включающей в себя dist, dist-prov, mgc89125, dmel_CG5214, f10m23.250, k13p22.8, kgd2agl200wp, kgd2, odhB, sucB, aceF, kgdB, sucB1, sucB2, pdhC, dIaT, kgd, sc5F7.20 и sc4B10.24 с, причем особо предпочтительны гены sucB и odhB.
Нуклеотидные последовательности надлежащих генов фермента E28 или вышепоименованных субъединиц фермента Е28 также содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL
В качестве субстратов-предшественников для вышеописанных путей от оксалоацетата к сукцинил-коферменту А применяют фосфоенолпируват или пируват. В связи с этим может также оказаться предпочтительно проводить генетическую модификацию клеток так, чтобы из углеводов и/или из глицерина они могли получать особо большие количества пирувата или фосфоенолпирувата.
Если клетки могут употреблять глицерин как источник питания, то предпочтительно, чтобы применяемая при реализации способа согласно изобретению генетически модифицированная клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из, а предпочтительно всех, следующих ферментов Е29-E42:
- фермента Е29, облегчающего диффузию глицерина внутрь клетки,
- фермента Е30, катализирующего преобразование глицерина в глицерин-3-фосфат,
- фермента Е31, катализирующего преобразование глицерин-3-фосфата в дигидроксиацетонфосфат,
фермента Е32, катализирующего перенос серы на акцептор серы тиоредоксин 1,
фермента Е33, катализирующего гидролиз фосфолипидов с образованием спиртов и глицерина,
фермента Е34, катализирующего транспорт глицерин-3-фосфата в клетку в обмен на фосфат;
фермента Е35, катализирующего преобразование дигидроксиацетонфосфата в глицеринальдегид-3-фосфат,
- фермента Е36, катализирующего преобразование глицеринальдегид-3-фосфата в бифосфоглицерат,
- фермента Е37, катализирующего преобразование 1,3-бифосфоглицерата в 3-фосфоглицерат,
- фермента Е38, катализирующего преобразование 3-фосфоглицерата в 2-фосфоглицерат,
- фермента Е39, катализирующего преобразование 2-фосфоглицерата в фосфоенолпируват;
- фермента Е40, катализирующего преобразование фосфоенолпирувата в пируват;
- фермента Е41, катализирующего преобразование глицерина в дигидроксиацетон;
- фермента Е42, катализирующего преобразование дигидроксиацетона в дигидроксиацетонфосфат.
Наиболее предпочтительные согласно изобретению клетки - это те, у которых понижена активность следующих ферментов или сочетаний ферментов: Е29, Е30, Е31, Е32, Е33, Е34, Е35, Е36, Е37, Е38, Е39, Е40, E41, E42, Е29Е30, Е29Е31, Е29Е32, Е29Е33, Е29Е34, Е29Е35, Е29Е36, Е29Е37, Е29Е38, Е29Е39, Е29Е40, Е29Е41, Е29Е42, Е30Е31, Е30Е32, Е30Е33, Е30Е34, Е30Е35, Е30Е36, Е30Е37, Е30Е38, Е30Е39, Е30Е40, Е30Е41, Е30Е42, Е31Е32, Е31Е33, Е31Е34, Е31Е35, Е31Е36, Е31Е37, Е31Е38, Е31Е39, Е31Е40, Е31Е41, Е31Е42, Е32Е33, Е32Е34, Е32Е35, Е32Е36, Е32Е37, Е32Е38, Е32Е39, Е32Е40, Е32Е41, Е32Е42, Е33Е34, Е33Е35, Е33Е36, Е33Е37, Е33Е38, Е33Е39, Е33Е40, Е34Е41, Е33Е42, Е34Е35, Е34Е36, Е34Е47, Е34Е38, Е34Е39, Е34Е40, E34E41, Е34Е42, Е35Е36, Е35Е37, Е35Е38, Е35Е39, Е35Е40, E35E41, E35E42, Е36Е37, Е36Е38, Е36Е39, Е36Е40, Е36Е41, Е36Е42, Е37Е38, Е37Е39, Е37Е40, Е37Е41, Е37Е42, Е38Е39, Е39Е40, Е39Е41, Е39Е42, Е40Е41, Е40Е42, Е41Е42 и Е29Е30Е31Е32Е33Е34Е35Е36Е37Е38Е39Е40Е41Е42.
В этом контексте в частности предпочтительны следующие ферменты:
Е29 акваглицеропорин (способствующий транспорту глицерина), предпочтительно кодируемый геном glpF,
Е30 глицеринкиназа (ЕС 2.7.1.30), предпочтительно кодируемая геном glpK,
Е31 глицерин-3-фосфат-дегидрогеназа (ЕС 1.1.99.5), предпочтительно ФАД-зависимая глицерин-3-фосфат-дегидрогеназа, причем предпочтительно, чтобы глицерин-3-фосфат-дегидрогеназу кодировал ген glpA, ген glpB, ген glpC или ген glpD, особо предпочтительно - ген glpD,
Е32 сульфотрансфераза, кодируемая геном glpE,
Е33 глицерин-фосфодиэстераза (ЕС 3.1.4.46), предпочтительно кодируемая геном glpQ,
Е34 глицерин-3-фосфат-пермеаза, предпочтительно кодируемая геном glpT,
Е35 триозофосфат-изомераза (ЕС 5.3.1.1),
Е36глицеральдегид-3-фосфат-дегидрогеназа (ЕС 1.2.1.12),
E37 фосфоглицерат-киназа (ЕС 2.7.2.3),
Е38 фосфоглицерат-мутаза (ЕС 5.4.2.1),
E39 енолаза (ЕС 4.2.1.11),
Е40 пируват-киназа (ЕС 2.7.1.40),
Е41 глицерин-дегидрогеназа (ЕС 1.1.1.6), предпочтительно кодируемая геном gldA, и
Е42 дигидроксиацетон-киназа (ЕС 2.7.1.29), предпочтительно кодируемая геном dhaK.
Генетические последовательности вышепоименованных ферментов также содержатся в известных специалисту генетических базах данных, в частности, в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Кроме того, кодирующий глицеральдегид-3-фосфат-дегидрогеназу ген gap (Eikmanns (1992), Journal of Bacteriology 174: 6076-6086), кодирующий триозофосфат-изомеразу ген tpi (Eikmanns (1992), Journal of Bacteriology 174: 6076-6086) и кодирующий 3-фосфоглицерат-киназу ген pgk (Eikmanns (1992), Journal of Bacteriology 174: 6076-6086) известны также и из других источников.
С помощью известных генов ферментов Е29-Е42, применяя технологии, описанные вначале в связи с ферментом E1 (мутация фермента или повышение экспрессии фермента), можно создавать генетически модифицированные клетки, в которых повышена активность по меньшей мере одного, предпочтительно - по меньшей мере двух, еще более предпочтительно - по меньшей мере трех, а наиболее предпочтительно - всех ферментов Е29-Е42. Эти клетки возможно культивировать в присутствии глицерина как единственного источника углерода (либо же в сочетании с углеводами в качестве дополнительного источника углерода).
Помимо повышения активности одного или нескольких из ферментов Е29-Е42, если клетка в состоянии использовать глицерин в качестве источника углерода, может оказаться целесообразным, чтобы в клетке, используемой при реализации способа согласно изобретению, имела место гетерологическая экспримация следующих генов:
гена glpG или гена 3925,
гена glpX,
гена dhaR, гена ycgU или гена b1201
гена fsa, гена mipB, гена ybiZ или гена В0825
гена talC, гена fsaB, гена yijG или гена b3946.
Нуклеотидные последовательности этих генов также содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Если клетки могут употреблять углеводы как источник питания, то предпочтительно, чтобы клетка, используемая при реализации способа согласно изобретению, имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из, а предпочтительно всех, следующих ферментов Е43-Е45 и Е36-Е40:
- фермента Е43, катализирующего преобразование α-D-глюкозо-6-фосфата в β-D-фруктозо-6-фосфат,
- фермента Е44, катализирующего преобразование β-D-фуктозо-6-фосфата в β-D-фруктозо-1,6-бисфосфат,
- фермента E45, катализирующего преобразование β-D-фуктозо-1,6-бисфосфата в глицеринальдегид-3-фосфат и дигидроксиацетонфосфат,
- фермента Е36, катализирующего преобразование глицеринальдегид-3-фосфата в бифосфоглицерат,
- фермента Е37, катализирующего преобразование 1,3-бифосфоглицерата в 3-фосфоглицерат,
- фермента Е38, катализирующего преобразование 3-фосфоглицерата в 2-фосфоглицерат,
- фермента Е39, катализирующего преобразование 2-фосфоглицерата в фосфоенолпируват, и
- фермента Е40, катализирующего преобразование фосфоенолпирувата в пируват.
Наиболее предпочтительные согласно изобретению генетически модифицированные клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: Е36, Е37, Е38, Е39, Е40, Е43, Е44, Е45, Е36Е37, Е36Е38, Е36Е39, Е36Е40, Е36Е43, Е36Е44, Е36Е45, Е37Е38, Е37Е39, Е37Е40, Е37Е43, Е37Е44, Е37Е45, Е38Е39, Е38Е40, Е38Е43, Е38Е44, Е38Е45, Е39Е40, E39E43, Е39Е44, Е39Е45, Е40Е43, Е40Е44, Е40Е45, Е43Е44, Е43Е45, Е44Е45 и Е36Е37Е38Е39Е40Е43Е44Е45.
В этом контексте в частности предпочтительны следующие ферменты:
Е43 глюкозо-6-фосфат-изомераза (ЕС 5.3.1.9),
Е44 6-фосфофрукто-киназа (ЕС 2.7.1.11),
Е45 фруктозо-бисфосфат-альдолаза (ЕС 4.1.2.13),
Е36глицеральдегид-3-фосфат-дегидрогеназа (ЕС 1.2.1.12),
Е37 фосфоглицерат-киназа (ЕС 2.7.2.3),
Е38 фосфоглицерат-мутаза (ЕС 5.4.2.1),
Е39 енолаза (ЕС 4.2.1.11) и
Е40 пируват-киназа (ЕС 2.7.1.40).
Нуклеотидные последовательности этих генов также содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Кроме того, если клетка в состоянии использовать в углеводы качестве источника углерода, предпочтительно помимо повышения активности вышеупомянутых ферментов Е43-E45 и Е36-E40 способствовать также поступлению в клетки глюкозы, например, путем повышения активности ферментов системы фосфотрансферазы в особенности тех ферментов, которые кодируются генами ptsl, ptsH и ptsM, или интенсификацией глюкокиназы, которую предпочтительно кодирует ген (ЕС 2.7.1.2), glk. В этом контексте дана, в частности, ссылка на патенты США US 6,680,187, US 6,818,432, US 6,913,910 и US 6,884,614, содержание публикации которых в отношении возможностей для повышенного экспримирования генов der ptsl, ptsH, ptsM и glk настоящим введено как ссылка и образует составную часть изложения настоящего изобретения. В случае углеводов как источника углерода может быть выгодно целенаправленно способствовать интенсификации пентозофосфатного пути, например, повышая активность глюкозо-6-фосфат-дегидрогеназы (ЕС 1.1.1.49) и 6-фосфоглюконат-дегидрогеназы (ЕС 1.1.1.44), которая предпочтительно кодируется геном gnd, и при этом одновременно ингибировать гликолиз, например, путем ослабления активности глюкозо-6-фосфат-изомеразы, как это описано в международной заявке WO-A-01/07626.
Если клетки синтезируют 3-гидроксиизомасляную кислоту или полигидроксиалканоаты на основе 3-гидроксиизомасляной кислоты согласно особому варианту способа по изобретению, где используют генетически модифицированную клетку, в которой в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта сукцинил-кофермент А, с образованием в качестве других промежуточных продуктов оксалоацетата и пирувата, может также оказаться целесообразно снизить в клетке активность по меньшей мере одного из следующих ферментов, а предпочтительно - всех:
- фермента, катализирующего преобразование оксалоацетата в фосфоенолпируват, например, фосфоенолпируват-карбоксикиназы (ЕС 4.1.1.49) (см. также немецкую заявку на патент DE-A-19950409),
- фермента, катализирующего преобразование пирувата в ацетат, например, пируват-оксидазы (ЕС 1.2.2.2) (см. также германскую заявку DE-A-19951975),
- фермента, катализирующего преобразование α-D-глюкозо-6-фосфата в β-D-фруктозо-6-фосфат (см. также патентную заявку США US 09/396,478),
- фермента, катализирующего преобразование пирувата в лактат, как, например, I-лактат-дегидрогеназы (ЕС 1.1.1.27) или лактат-малат-трансгидрогеназы (ЕС 1.1.99.7),
- фермента, катализирующего преобразование пирувата в ацетил-кофермент А, как, например, пируват-дегидрогеназы (ЕС 1.2.1.51),
- фермента, катализирующего преобразование пирувата в ацетилфосфат, как, например, пируват-оксидазы (ЕС 1.2.3.3),
- фермента, катализирующего преобразование пирувата в ацетат, как, например, пируват-дегидрогеназы (ЕС 1.2.2.2),
- фермента, катализирующего преобразование пирувата в фосфоенолпируват, как, например, фосфоенолпируват-синтазы (ЕС 2.7.9.2) или пируват-фосфат-дикиназы (ЕС 2.7.9.1),
фермента, катализирующего преобразование пирувата в аланин, как, например, аланин-трансаминазы (2.6.1.2) или аланиновой трансаминазы кетокислот (ЕС 2.6.1.12), и/или
фермента, преобразующего пируват в ацетолактат, как, например, синтазы ацетогидроксикислот (ЕС 2.2.1.6).
Особо предпочтительные согласно изобретению клетки, которые синтезируют 3-гидроксиизомасляную кислоту или полигидроксиалканоаты на основе 3-гидроксиизомасляной кислоты с образованием в качестве промежуточного продукта сукцинил-кофермента А, используя углеводы в качестве источника углерода, и в которых может быть повышена активность одного или нескольких из поименованных выше ферментов, в частности, активность одного из ферментов E1-Е45, а сверх того предпочтительно - активность ферментов E1, E1E2E3E4, E1E4E5E6E7 или/и E1E4E5E7 - это микроорганизмы, описанные Bennett et al., Metab. Eng. (2005), 7 (3), стр.229-239, Bennett et al., Biotechnol. Bioeng. (2005), 90 (6), стр.775-779, Bennett et al., Biotechnol. Prog. (2005), 21 (2), стр.358-365, Bennett et al. (2005), Appl. Microbiol. Biotechnol., 67(4), стр.515-523, Vemuri et al. (2002), Applied and Environmental Microbiology 68 (4), стр.1.715-1.727 и в патенте США US 6,455,284.
Если согласно первой особенной форме исполнения способа согласно изобретению синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоата на основе 3-гидроксиизомасляной кислоты идет с сукцинил-коферментом А в качестве промежуточного продукта и L-глутаматом в качестве источника углерода, то согласно еще одной особой форме исполнения способа согласно изобретению, где применяют генетически модифицированную клетку, в которой метилмалоновый полуальдегид образуется в качестве начального продукта, а в качестве промежуточного продукта - сукцинил-кофермент А, согласно изобретению также предпочтительно, чтобы применяемая клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из, а предпочтительно обоих следующих ферментов Е28 и Е46 (см. Фиг.10):
- фермента Е46, катализирующего преобразование L-глутамата в 2-оксоглутарат;
- фермента E28, катализирующего преобразование 2-оксоглутарата в сукцинил-кофермент А.
В этом контексте предпочтительны следующие ферменты:
Е46 глутамат-синтаза (ЕС 1.4.1.13 или ЕС 1.4.1.14), глутамат-дегидрогеназа (ЕС 1.4.1.2, ЕС 1.4.1.3 или ЕС 1.4.1.4) или аспартат-трансаминаза (ЕС 2.6.1.1 или ЕС 2.6.1.2) и
Е28 2-оксоглутарат-синтаза (ЕС 1.2.7.3).
В качестве фермента Е28 предпочтительны те, которые уже были названы в качестве предпочтительных ферментов Е28.
Предпочтительно, чтобы фермент Е46 кодировали гены, выбранные из группы, включающей в себя myn8., glt1, adr290wp, gltB, gltD, yeiT, aegA, ygfT, gltD-1, gltD-2, glt1, glt2, gls1, gltA, glt, glxD, gItA, yerD, cgl0184, cgl0185, sc3c9.12, gdh1, gdh2, agl40cp, gdhA, gdhA1, gdhA2, gluD, rocG, ypcA, gudB, gluD, gdhA, gdhA2, gdh, gdhA-1, gdhA2-2, gdhA-3, gluD1, gluD2, glud1-prov, glud1a, t11l18.2, t2l1.150, mrg7.13, got1, got2, caspat, got2-prov, xr406-prov, 406-prov, cg4233, cg4233, cg8430, cg8430, f23n19.17, f13j11.16, t26c19.9, f7f1.18, f10n7.200, t16l1.170, f15n18.110, t20d1.70, aat, aat1, aat2, abl038wp, afr211cp, agx1, bnA4, aatA, aatB, ybdL, aspC, yfbQ, ydcR, avtA2, aspC-1, aspC-2, aspC-3, aspC-4, aspB, aspB-1, aspB-2, aspB-3, aspB-4, argD1, argD2, aatAc, ywfG, mtnV, alaT, avtA1, avtA2, avtA3, cgl0240, cgl1103,cgl2599, cgl2844, dapC, 2sck36.07c, sc9e12.21, sc2h4.04c, aspB1, aspB2, аsрВЗ, tyrB, gpt, gpt1, gpt2, mgc82097, cg1640, c32f10.8, f20d23.34, f26f24.16, f24j13.15, t10d10.20 или agrwp.
Нуклеотидные последовательности этих генов также содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Согласно второй особенной форме исполнения способа согласно изобретению, в котором применяют генетически модифицированную клетку, где синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты происходит с образованием метилмалонового полуальдегида в качестве начального продукта, предпочтительно, чтобы синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоата на основе 3-гидроксиизомасляной кислоты шел с образованием пропионил-кофермента А в качестве промежуточного продукта, причем в качестве источника углерода клетка использовала бы углеводы, глицерин, метан или метанол. При этом имеются различные пути перехода от пропионил-кофермента А к 3-гидроксиизомасляной кислоте или полигидроксиалканоатам на основе 3-гидроксиизомасляной кислоты.
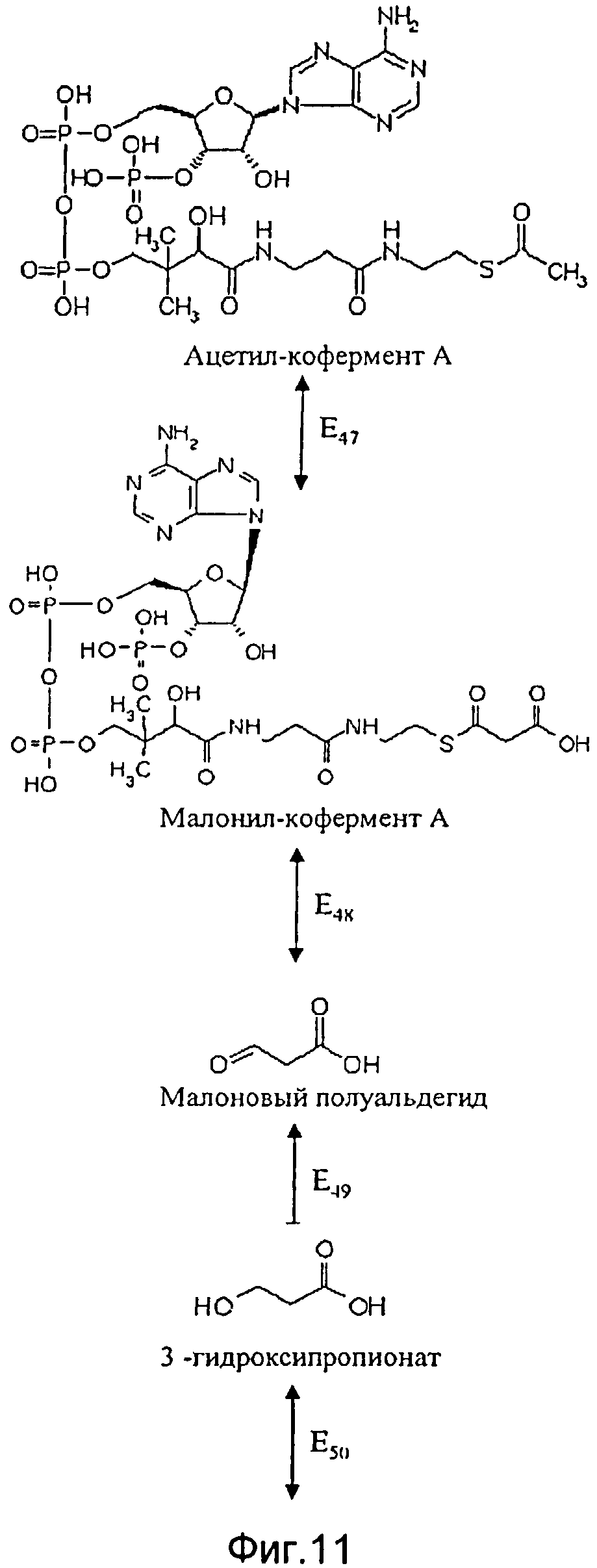
Согласно первому альтернативному варианту этой второй особой формы исполнения способа согласно изобретению синтез промежуточного продукта пропионил-кофермента А идет через ацетил-кофермент А в качестве дополнительного промежуточного продукта. В этом контексте особенно предпочтительно, чтобы используемая генетически модифицированная клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов Е4, E5 и Е47-E52 (см. фигуры 11 и 12):
фермента Е47, катализирующего преобразование ацетил-кофермента А в малонил-кофермент А;
- фермента Е48, катализирующего преобразование малонил-кофермента А в метилмалоновый полуальдегид;
фермента Е49, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксипропионат;
фермента E50, катализирующего преобразование 3-гидроксипропионата в 3-гидроксипропионил-кофермент А;
фермента E51, катализирующего преобразование 3-гидроксипропионил-кофермента А в акрилоил-кофермент А;
фермента Е52, катализирующего преобразование акрилоил-кофермента А в пропионил-кофермент А;
фермента E5, катализирующего преобразование пропионил-кофермента А в метилмалоновый полуальдегид;
- фермента Е4, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксиизобутират.
Наиболее предпочтительные согласно изобретению генетически модифицированные клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: Е47, Е48, Е49, Е50, E51, Е52, Е4, Е5 и E47E48E49E50E51E52E4E5.
Кроме того, в этом контексте в частности предпочтительны следующие ферменты:
Е4 3-гидроксиизобутират-дегидрогеназа (ЕС 1.1.1.31) или 3-гидроксиацил-кофермент А-дегидрогеназа (ЕС 1.1.1.35),
Е5 дегидрогеназа метилмалонового полуальдегида (ЕС 1.2.1.27),
Е47 малонил-кофермент А-декарбоксилаза (ЕС 4.1.1.9), малонил-кофермент А-трансфераза (ЕС 2.8.3.3), метилмалонил-кофермент А-карбокситрансфераза (ЕС 2.1.3.1) или ацетил-кофермент А-карбоксилаза (ЕС 6.4.1.2),
Е48 дегидрогеназа малонового полуальдегида (ЕС 1.2.1.18).
Е49 3-гидроксипропионат-дегидрогеназа (ЕС 1.1.1.59),
Е50 3-гидроксиизобутирил-СоА-гидролаза (ЕС 3.1.2.4) и
E51 еноил-кофермент А-гидратаза (ЕС 4.2.1.17) и
Е52 ацил-кофермент А-дегидрогеназа (ЕС 1.3.99.3).
Предпочтительные гены для ферментов Е4 и E5 - это те, которые уже были описаны выше в связи с первой особенной формой исполнения клетки согласно изобретению.
Предпочтительно, чтобы фермент Е47 кодировали гены, выбранные из группы, включающей в себя mlycd, t19b17.4, tb08.2904.110, matA, acac, асаса, acacb, f5j5.21, f15c21.2, t8p21.5, acc1, aar071wp, accA, accB, accC, accD, accC1, accC2, mmdA, fabG, accD1, accD2, accD3, cgl0831, accBC, dtsR1, accDA, scc24.16c и cgl1327, причем особо предпочтительны accA, accC и accD.
Предпочтительно, чтобы ген, кодирующий фермент Е48, представлял собой ген ioID.
Предпочтительно, чтобы фермент Е51 кодировали гены, выбранные из группы, включающей в себя echS1, ehhadh, hadha, echsl-prov, cg4389, cg4389, cg6543, cg6984, cg8778, ech-1, ech-2, ech-3, ech-4, ech-5, ech-6, ech-7, FCAALL.314, fcaall.21, fox2, eci1, eci2, paaF, paaG, yfcX, fadB, faoA, rpfF, phaA, phaB, echA1, echA2, echA3, echA4, echA5, echA6, echA7, echA8, echA9, echA9, echA10, echA11, echA12, echA13, echA14, echA15, echA16, echA17, echA18, echA19, echA20, echA21, fad-1, fad-2, fad-3, dcaE, hcaA, fadJ, rsp0671, rsp0035, rsp0648, rsp0647, rs03234, rs03271, rs04421, rs04419, rs02820, rs02946, paaG1, paaG2, paaG3, ech, pksH, ydbS, eccH1, eccH2, pimF, fabJ1, fabJ2, caiD2, ysiB, yngF, yusL, fucA, cgl0919, scf41.23, scd10.16, sck13.22, scp8.07c, stbac16h6.14, sc5f2a.15, sc6a5.38, hbd-1, hbd-2, hdb-3, hdb-4, hdb-5, hdb-6, hdb-7, hdb-8, hdb-9, hdb-10, fad-1, fad-2, fad-3, fad-4, fad-5, paaF-1, paaF-2, paaF-3, paaF-4, paaF-5, paaF-6, paaF-7 и crt.
Предпочтительно, чтобы фермент Е52 кодировали гены, выбранные из группы, включающей в себя acadl, acadm, acad10, acad11, acadm-prov, acadl-prov, mgc81873, cg12262, cg4703, cg4860, f3e22.5, afl213wp, acdC, fadE13, acd-1, acd-2, acd-3, acd-4, acd-5, acd-6, acd-7, acd-8, acd-9, acd-10, acd-11, acd-12, acd, fadE1, fadE2, fadE3, fadE4, fadE5, fadE6, fadE7, fadE13, fadE14, fadE15, fadE16, fadE17, fadE18, fadE19, fadE20, fadE21, fadE22, fadE23, fadE26, fadE27, fadE30, fadE31, fadE33, fadE35, fadE38, fadE45, fadE, caiA, aidB, RSp0036, RS03588, mmgC, acdA-3, bcd, acdA, acdH1, acdH2, acdH3, aidB, acdl и acdH.
Нуклеотидные последовательности надлежащих генов для ферментов Е47-E52, а в частности, для ферментов Е49 и E50, содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Согласно второму альтернативному варианту этой второй особой формы исполнения способа согласно изобретению синтез промежуточного продукта пропионил-кофермента А идет также через ацетил-кофермент А в качестве дополнительного промежуточного продукта, но согласно этому альтернативному варианту преобразование пропионил-кофермента А в метилмалоновый полуальдегид идет не прямо, а через метилмалонил-кофермент А. В этом контексте особенно предпочтительно, чтобы используемая генетически модифицированная клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов Е4, E5, Е6, Е7 и E47-Е52 (см. фигуры 13 и 14):
- фермента E47, катализирующего преобразование ацетил-кофермента А в малонил-кофермент А;
- фермента Е48, катализирующего преобразование малонил-кофермента А в метилмалоновый полуальдегид;
фермента Е49, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксипропионат;
фермента Е50, катализирующего преобразование 3-гидроксипропионата в 3-гидроксипропионил-кофермент А;
фермента E51, катализирующего преобразование 3-гидроксипропионил-кофермента А в акрилоил-кофермент А;
фермента E52, катализирующего преобразование акрилоил-кофермента А в пропионил-кофермент А;
фермента Е7, катализирующего преобразование метилмалонил-кофермента А в (S)-метилмалонил-кофермент А;
фермента Е6, катализирующего преобразование (S)-метилмалонил-кофермента А в (R)-метилмалонил-кофермент А;
фермента Е2, катализирующего преобразование (R)-метилмалонил-кофермента А в метилмалонат;
фермента Е3, катализирующего преобразование метилмалоната в метилмалоновый полуальдегид;
фермента Е4, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксиизобутират.
Наиболее предпочтительные согласно изобретению генетически модифицированные клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: Е2, Е3, Е4, Е6, Е7, Е47, Е48, Е49, E50, Е51, Е52 и Е2Е3Е4Е6Е7Е47Е48Е49Е50Е51Е52.
Предпочтительные ферменты и гены этих ферментов - это те же гены или ферменты, которые уже были поименованы выше в связи с ферментами Е2-Е4, Е6, Е7 и Е47-Е52.
Согласно третьему альтернативному варианту этой второй особой формы исполнения способа согласно изобретению синтез промежуточного продукта пропионил-кофермента А идет также через ацетил-кофермент А в качестве дополнительного промежуточного продукта, причем согласно этому альтернативному варианту преобразование пропионил-кофермента А в метилмалоновый полуальдегид также идет не прямо, а через (R)-метилмалонил-кофермент А (и не через (S)-метилмалонил-кофермент А). В этом контексте особенно предпочтительно, чтобы используемая генетически модифицированная клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов Е2-Е4, E7 и Е47-E52 (см. фигуры 15 и 16):
- фермента Е47, катализирующего преобразование ацетил-кофермента А в малонил-кофермент А;
- фермента Е48, катализирующего преобразование малонил-кофермента А в метилмалоновый полуальдегид;
фермента Е49, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксипропионат;
фермента E50, катализирующего преобразование 3-гидроксипропионата в 3-гидроксипропионил-кофермент А;
фермента E51, катализирующего преобразование 3-гидроксипропионил-кофермента А в акрилоил-кофермент А;
фермента E52, катализирующего преобразование акрилоил-кофермента А в пропионил-кофермент А;
фермента Е7, катализирующего преобразование пропионил-кофермента А в метилмалонил-кофермент А;
фермента Е2, катализирующего преобразование метилмалонил-кофермента А в метилмалонат;
фермента Е3, катализирующего преобразование метилмалоната в метилмалоновый полуальдегид;
фермента Е4, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксиизобутират.
Наиболее предпочтительные согласно изобретению генетически модифицированные клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: Е2, Е3, Е4, Е7, Е47, Е48, Е49, Е50, Е51, E52 и Е2Е3Е4Е7Е47Е48Е49Е50Е51Е52.
Предпочтительные ферменты и гены этих ферментов - это опять же гены и ферменты, которые уже были поименованы выше в связи с ферментами Е2-Е4, Е7 И Е47-Е52.
Согласно четвертому альтернативному варианту второй особой формы исполнения способа согласно изобретению синтез промежуточного продукта пропионил-кофермента А идет также через ацетил-кофермент А в качестве дополнительного промежуточного продукта, но согласно этому альтернативному варианту в качестве еще одного промежуточного продукта образуется ацетоацетил-кофермент А. В этом контексте может быть предпочтительно, чтобы используемая генетически модифицированная клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов Е8 и Е53-E61:
- фермента Е53, катализирующего преобразование ацетил-кофермента А в ацетоацетил-кофермент А;
- фермента Е54, катализирующего преобразование ацетоацетил-кофермента А в 3-гидроксибутаноил-кофермент А;
фермента E55, катализирующего преобразование 3-гидроксибутаноил-кофермента А в кротонил-кофермент А;
фермента Е56, катализирующего преобразование кротонил-кофермента А в бутирил-кофермент А;
фермента E57, катализирующего преобразование бутирил-кофермента А в этилмалонил-кофермент А;
фермента E58, катализирующего преобразование этилмалонил-кофермента А в метилсукцинил-кофермент А;
фермента Е59, катализирующего преобразование метилсукцинил-кофермента А в изобутирил-кофермент А;
фермента Е60, катализирующего преобразование изобутирил-кофермента А в метакрилил-кофермент А;
фермента Е61, катализирующего преобразование метакрилил-кофермента А в 3-гидроксиизобутирил-коферментА;
фермента Е8, катализирующего преобразование 3-гидроксиизомасляной кислоты в 3-гидроксиизобутирил-кофермент А.
Наиболее предпочтительные согласно изобретению генетически модифицированные клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: Е8, Е53, Е54, E55, E56, E57, E58, E59, Е60, Е61 и Е8Е53Е54Е55Е56Е57Е58Е59Е60Е61.
Этот метаболический путь и участвующие в этом метаболическом пути ферменты описаны, например, в Korotkova et al., Journal of Bacteriology (2002), стр.1.750-1.758.
Согласно пятому альтернативному варианту второй особой формы исполнения способа согласно изобретению синтез промежуточного продукта пропионил-кофермента А идет опять же через ацетил-кофермент А в качестве дополнительного промежуточного продукта, но согласно этому варианту в качестве еще одного промежуточного продукта образуется также ацетоацетил-кофермент А, причем в этом случае из кротонил-кофермента А прямо синтезируется этилмалонил-кофермент А. В этом контексте может быть предпочтительно, чтобы клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов Е8 и E53-Е55, Е58 и Е62-E65 (см. Фиг.17):
- фермента Е53, катализирующего преобразование мономеров ацетил-кофермента А в ацетоацетил-кофермент А;
- фермента E54, катализирующего преобразование ацетоацетил-кофермента А в 3-гидроксибутирил-кофермент А;
- фермента E55, катализирующего преобразование 3-гидроксибутирил-кофермента А в кротонил-кофермент А;
- фермента Е62, катализирующего преобразование кротонил-кофермента А в этилмалонил-кофермент А;
- фермента E58, катализирующего преобразование этилмалонил-кофермента А в метилсукцинил-кофермент А;
- фермента Е63, катализирующего преобразование метилсукцинил-кофермента А в мезаконил-кофермент А;
- фермента Е64, катализирующего преобразование мезаконил-кофермента А в β-метилмалил-кофермент А;
- фермента E65, катализирующего преобразование β-метилмалил-кофермента А в глиоксилат и пропионил-кофермент А.
Из пропионил-кофермента А затем возможно описанным выше путем (повышение активности одного или нескольких из ферментов Е7, Е2, Е3 и Е4, повышение активности одного или нескольких из ферментов Е7, Е6, Е2, Е3 и Е4 или повышение активности одного или обоих ферментов Е4 и E5) синтезировать 3-гидроксиизомасляную кислоту.
В этом контексте предпочтительны следующие ферменты:
Е53 β-кетотиолаза (ЕС 2.3.1.9),
Е54 ацетоацетил-кофермент А-редуктаза (ЕС 1.1.1.36),
Е55 еноил-кофермент А-гидратаза (ЕС 4.2.1.17),
Е62 кротонил-кофермент А-декарбоксилаза,
E58 этилмалонил-кофермент А-мутаза (ЕС 5.4.99.2),
Е63 метилсукцинил-кофермент А-дегидрогеназа,
Е64 мезаконил-кофермент А-гидратаза и
Е65 β-метилмалил/L-малил-кофермент А-лиаза.
Предпочтительно, чтобы фермент Е53 кодировали гены, выбранные из группы, состоящей из acat1, acat2, loc484063, loc489421, mgc69098, mgc81403, mgc81256, mgc83664, kat-1, erg10, ygeF, atoB, fadAx, phbA-1, phbA-2, atoB-2, pcaF, pcaF-2, phb-A, bktB, phaA, tioL, thlA, fadA, paaJ, phbAf, pimB, mmgA, yhfS, thi, vraB, th1, mvaC, thiL, paaJ, fadA3, fadA4, fadA5, fadA6, cgl12392, catF, sc8f4.03, thiL1, thiL2, acaB1, acaB2, асаВ3, асаВ4, причем особо предпочтительны acat1, acat2, atoB и phbA, а также соответствующий ген из Rhodobacter sphaeroides.
Предпочтительно, чтобы фермент Е54 кодировали гены, выбранные из группы, состоящей из phbB, fabG, phbN1, phbB2 или cgl12444, причем особо предпочтительны phbB, а также соответствующий ген из Rhodobacter sphaeroides.
Предпочтительно, чтобы фермент E55 кодировали гены, выбранные из группы, состоящей из echS1, ehhadh, hadha, echsl-prov, cg4389, cg4389, cg6543, cg6984, cg8778, ech-1, ech-2, ech-3, ech-4, ech-5, ech-6, ech-7, FCAALL.314, fcaall.21, fox2, eci1, eci2, paaF, paaG, yfcX, fadB, faoA, rpfF, phaA, phaB, echA1, echA2, echA3, echA4, echA5, echA6, echA7, echA8, echA9, echA9, echA10, echA11, echA12, echA13, echA14, echA15, echA16, echA17, echA18, echA19, echA20, echA21, fad-1, fad-2, fad-3, dcaE, hcaA, fadJ, rsp0671, rsp0035, rsp0648, rsp0647, rs03234, rs03271, rs04421, rs04419, rs02820, rs02946, paaG1, paaG2, paaG3, ech, pksH, ydbS, eccH1, eccH2, pimF, fabJ1, fabJ2, caiD2, ysiB, yngF, yusL, fucA, cgl0919, scf41.23, scd10.16, sck13.22, scp8.07c, stbac16h6.14, sc5f2a.15, sc6a5.38, hbd-1, hbd-2, hdb-3, hdb-4, hdb-5, hdb-6, hdb-7, hdb-8, hdb-9, hdb-10, fad-1, fad-2, fad-3, fad-4, fad-5, paaF-1, paaF-2, paaF-3, paaF-4, paaF-5, paaF-6, paaF-7 и crt, причем особо предпочтителен соответствующий ген из Rhodobacter sphaeroides.
Надлежащие гены для фермента E58 предпочтительно выбираются из группы, состоящей из mut, mutA, mutB, sbm, sbmA, sbmB, sbm5, bhbA, mcmA, mcmA1, mcmA2, mcmB, mcm1, mcm2, mcm3, icmA, meaA1 и meaA2, причем в этом случае также особо предпочтителен соответствующий ген из Rhodobacter sphaeroides.
В качестве фермента Е62 предпочтительно применять фермент из Rhodobacter sphaeroides, кодируемый последовательностью ДНК SEQ. ID.-Nr.05 и имеющий последовательность аминокислот SEQ. ID.-Nr. 06.
Предпочтительные гены для ферментов Е63, Е64 и E65 - это, в частности, гены этих ферментов из Rhodobacter sphaeroides.
Прочие примеры нуклеотидных последовательностей вышеприведенных генов в числе прочего содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Как уже изложено выше, в первом альтернативном варианте втором предпочтительной формы исполнения способа согласно изобретению синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты идет с образованием пропионил-кофермента А и ацетил-кофермента А в качестве промежуточных продуктов. При этом может быть в принципе целесообразно, помимо воздействия на активность вышепоименованных ферментов Е2-Е8 и Е47-Е65, также оказывать воздействие на активность тех ферментов, которые вызывают повышение формирования ацетил-кофермента А в клетке.
Если синтез 3-гидроксимасляной кислоты идет с использованием углеводов или глицерина в качестве источника углерода, то может оказаться предпочтительно, чтобы в клетке была повышена активность фермента Е66, который катализирует преобразование пирувата в ацетил-кофермент А. Этот фермент Е66 предпочтительно представляет собой пируват-дегидрогеназу (ЕС 1.2.1.51).
Если синтез 3-гидроксимасляной кислоты идет из источников углерода C1, например, из метана или метанола, то может также быть предпочтительно, чтобы клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов Е67-E71:
- фермента Е67, катализирующего преобразование метана в метанол;
фермента Е68, катализирующего преобразование метанола в формальдегид;
фермента Е69, катализирующего преобразование формальдегида в 5,10-метилентетрагидрофолат;
фермента Е70, катализирующего преобразование 5,10-метилентетрагидрофолата в 5-метилентетрагидрофолат;
фермента Е71, катализирующего преобразование 5-метилентетрагидрофолата в ацетил-кофермент А.
В этом контексте предпочтительны следующие ферменты:
Е67метан-монооксигеназа (ЕС 1.14.13.25),
Е68метанол-дегидрогеназа (ЕС 1.1.1.244),
Е69дегидрогеназа метилмалонового полуальдегида (ЕС 1.2.1.27),
Е70метилен-тетрагидрофолат-редуктаза (ЕС 1.5.1.20),
Е71углерод-монооксид-дегидрогеназа (ЕС 1.2.99.2).
Нуклеотидные последовательности подходящих генов ферментов Е63-Е67 содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
Согласно второй особенной форме исполнения способа согласно изобретению, в котором применяют генетически модифицированную клетку, где синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты идет с образованием метилмалонового полуальдегида в качестве начального продукта, предпочтительно, чтобы синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоата на основе 3-гидроксиизомасляной кислоты шел с образованием акрилоил-кофермента А в качестве промежуточного продукта, причем в качестве источника углерода клетка использовала бы углеводы, глицерин или глутамат.
В связи с третьей особенной формой исполнения способа согласно изобретению, в частности, предпочтительно, чтобы применяемая генетически модифицированная клетка имела повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов Е2-Е4, Е62, Е72 и Е73 (см. Фиг.18):
- фермента Е72, катализирующего преобразование бета-аланина в бета-аланил-кофермент А;
- фермента Е73, катализирующего преобразование бета-аланил-кофермента А в акрилил-кофермент А;
- фермента Е62, катализирующего преобразование акрилил-кофермента А в метилмалонил-кофермент А (или преобразование кротонил-кофермента А в этилмалонил-кофермент А);
- фермента Е2, катализирующего преобразование метилмалонил-кофермента А в метилмалонат;
- фермента Е3, катализирующего преобразование метилмалоната в метилмалоновый полуальдегид;
- фермента Е4, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксиизомасляную кислоту.
Наиболее предпочтительные согласно изобретению клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: Е62Е2, Е62Е3, Е62Е4, Е62Е2Е3 и Е72Е73Е62Е2Е3Е4. В связи с четвертой особенной формой исполнения способа согласно изобретению может также быть целесообразно применять генетически модифицированную клетку, в которой повышена экспрессия фермента, способного катализировать по меньшей мере два из вышеописанных этапов реакции. Так, например, можно использовать фермент, обладающий как активностью фермента E2, так и активностью фермента Е3, как, например, малонил-кофермент А-редуктазу из Sulfolobus tokodaii, кодируемую последовательностью ДНК №03 и имеющую последовательность аминокислот SEQ. ID.-Nr. 04. Кроме того, в связи с четвертной особенной формой исполнения клетки согласно изобретению также возможно, в принципе, применять клетку, которая уже в состоянии синтезировать особо большие количества акрилил-кофермента А.
В этом контексте предпочтительны следующие ферменты:
Е72 кофермент А-трансфераза (ЕС 2.8.3.1) или кофермент А-синтетаза, предпочтительно кофермент А-трансфераза,
Е73 бета-аланил-кофермент-А-аммоний-лизаза (ЕС 4.3.1.6),
Е62 кротонил-кофермент А-декарбоксилаза,
Е2 метилмалонил-кофермент А-гидролаза (ЕС 3.1.2.17),
Е3 альдегид-дегидрогеназа (ЕС 1.2.1.3) или альдегид-оксидаза (ЕС 1.2.3.1) и
Е4 3-гидроксиизобутират-дегидрогеназа (ЕС 1.1.1.31) или 3-гидроксиацил-кофермент А-дегидрогеназа (ЕС 1.1.1.35).
Предпочтительные ферменты Е72 с СоА-трансферазной активностью - это таковые из Megasphaera elsdenii, Clostridium propionicum, Clostridium kluyveri, а также из Eschehchia Coli. В качестве примера для последовательности ДНК, кодирующей СоА-трансферазу, здесь следует упомянуть последовательность из Megasphaera elsdenii, указанную в международной заявке WO-A-03/062173 под номером SEQ ID Nr: 24. Кроме того, предпочтительные ферменты - это те варианты Со- трансферазы, которые описаны в международной заявке WO-A-03/062173.
Подходящие ферменты Е73 с активностью лизазы бета-аланил-кофермент-А-аммония - это, например, таковые из Clostridium propionicum. Последовательности ДНК, кодирующие такой фермент, можно, например, получить из Clostridium propionicum, как описано в примере 10 международной заявки WO-A-03/062173. Последовательность ДНК, кодирующая лизазу бета-аланил-кофермент-А-аммония из Clostridium propionicum, приведена в международной заявке WO-A-03/062173 под SEQ ID Nr: 22.
В качестве фермента Е62 опять же предпочтительно применять кротонил-кофермент А-декарбоксилазу из Rhodobacter sphaeroides, кодируемый последовательностью ДНК SEQ. ID.-Nr. 05 и имеющий последовательность аминокислот SEQ. ID.-Nr. 06. Этот фермент в состоянии преобразовывать не только кротонил-кофермент А в этилмалонил-кофермент А, но и акрилил-кофермент А в метилмалонил-кофермент А.
Надлежащие гены для ферментов Е2-Е4 уже были упомянуты в связи с первым вариантом способа согласно изобретению, причем в связи со вторым вариантом также особо предпочтительно использовать в качестве гена для фермента Е3 описанный ранее ген из Sulfolobus tokodaii.
В соответствии с особо предпочтительным вариантом третьей особенной формы исполнения способа согласно изобретению применяют генетически модифицированную клетку, имеющую по сравнению со своим диким типом повышенную активность по меньшей мере ферментов Е2 и Е62, либо же ферментов Е2, Е3 и Е62, причем фермент Е2, либо же ферменты Е2 и Е3 кодируются последовательностью ДНК, соответствующей SEQ. ID.-Nr. 03, а фермент Е62 кодируется последовательностью ДНК, соответствующей SEQ. ID.-Nr. 05. В этом контексте предпочтительно достигать повышения активности обоих этих ферментов, повышая в клетке экспрессию полипептидов с последовательностями SEQ. ID.-Nr. 04 и 06, либо же последовательности аминокислот, совпадающих с последовательностями SEQ. ID.-Nr. 04 либо же 06 по меньшей мере на 50%, предпочтительно - по меньшей мере на 55%, еще более предпочтительно - по меньшей мере на 60%, сверх того предпочтительно - по меньшей мере на 65%, а наиболее предпочтительно - по меньшей мере на 70%. При этом возможны либо интеграция обеих последовательностей ДНК в геном клетки, либо же их нахождение в векторе внутри клетки.
В связи с вышеописанной третьей особенной формой исполнения способа согласно изобретению может сверх того быть целесообразно, чтобы помимо повышения активности фермента Е62 и/или активности фермента Е2 либо же ферментов Е2 и Е3, применяемая генетически модифицированная клетка обладала еще по меньшей мере одним из следующих свойств, а предпочтительно обоими:
- повышенной по сравнению со своим диким типом активностью фермента E11, катализирующего преобразование пирувата в оксалоацетат, или фермента Е74, катализирующего преобразование фосфоенолпирувата в оксалоацетат, предпочтительно, однако, фермента Е11, катализирующего преобразование пирувата в оксалоацетат, а также
- повышенной активностью фермента Е75, катализирующего преобразование аспартата в бета-аланин.
Фермент E11 представляет собой предпочтительно карбоксилазу, особо предпочтительно - пируват-карбоксилазу (номер в ЕС 6.4.1.1), которая катализирует преобразование пирувата в оксалоацетат. Кроме того, также особо предпочтительная в этом контексте пируват-карбоксилаза описана в "A novel methodology employing Corynebacterium glutamicum genome information to generate a new L-lysine-producing mutant.", Ohnishi J et al., Applied Microbiology and Biotechnology, Vol.58 (2), стр.217-223 (2002). При этой мутации аминокислота пролин в положении 458 заменена серином. Содержание этой публикации в отношении возможностей создания мутантных форм пируват-карбоксилазы настоящим введено как ссылка и образует составную часть изложения настоящего изобретения.
Фермент Е75 предпочтительно представляет собой декарбоксилазу, особо предпочтительно - глутамат-декарбоксилазу или аспартат-декарсбоксилазу, причем особо предпочтительна I-аспартат-1-декарбоксилаза (номер в ЕС 4.1.1.11), которую кодирует ген panD. Аспартат-декарбоксилаза катализирует преобразование аспартата в бета-аланин. Гены аспартат-декарбоксилазы (гены panD), в том числе из Eschenchia coli (FEMS Microbiology Letters, 143, стр.247-252 (1996)), "Photorhabdus luminescens subsp. Laumondii, Mycobacteiium bovis subsp. Bovis"), а также из множества других микроорганизмов, уже клонировали и секвенировали. В частности, последовательность нуклеотидов гена panD из Corynebacterium glutamicum описана в немецкой заявке на патент DE-A-19855313. В принципе, возможно применение генов panD любого происхождения, безразлично - из бактерий, дрожжей или грибов. Кроме того, можно применять все аллели гена panD, в частности, также и те, которые получаются ввиду вырожденности генетического кода или из-за «осмысленных», не меняющих смысла мутаций (sense mutations). Кроме аспартат-декарбоксилазы из Corynebacterium glutamicum согласно изобретению особо предпочтительна аспартат-декарбоксилаза из мутантной Eschenchia coli-DV9 (Vallari и Rock, Journal of Bacteriology, 164, стр.136-142 (1985)). Содержание этих публикаций в отношении вышеописанных мутантов настоящим введено как ссылка и образует составную часть изложения настоящего изобретения. Создание рекомбинантных клеток, в которых повышена как активность пируват-карбоксилазы, так и активность аспартат-декарбоксилазы, описано в немецкой заявке на патент DE-A-102005048818.
Согласно второму варианту клетки согласно изобретению синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты происходит с 3-гидроксиизобутирил-коферментом А в качестве исходного продукта.
Если при реализации способа согласно изобретению применяют клетку, в которой синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты согласно второму варианту идет с образованием 3-гидроксиизобутирил-кофермента А в качестве начального продукта, то согласно первой особой форме исполнения предпочтительно, чтобы синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоата на основе 3-гидроксиизомасляной кислоты шел с образованием изобутирил-кофермента А в качестве промежуточного продукта, причем в качестве источника углерода клетка использовала бы углеводы, глицерин, или L-валин.
Если в качестве источника углерода используют углеводы или глицерин, то согласно первому альтернативному варианту этой первой особенной формы исполнения второго варианта способа по изобретению, предпочтительно применять генетически модифицированную клетку, которая имеет повышенную по сравнению со своим диким типом активность по меньшей мере одного из следующих ферментов E76-Е79, Е60, Е61 и Е8 (см. Фиг.19):
- фермента E76, катализирующего преобразование пирувата в 2-ацетолактат;
- фермента Е77, катализирующего преобразование 2-ацетолактата в 2,3-дигидроксиизовалерат;
фермента E78, катализирующего преобразование 2,3-дигидроксиизовалерата в 2-оксоизовалерат;
фермента Е79, катализирующего преобразование 2-оксоизовалерата в изобутирил-кофермент А;
фермента Е60, катализирующего преобразование изобутирил-кофермента А в метакрилил-кофермент А;
фермента Е61, катализирующего преобразование метакрилил-кофермента А в 3-гидроксиизобутирил-кофермент А;
фермента Е8, катализирующего преобразование 3-гидроксиизомасляной кислоты в 3-гидроксиизобутирил-кофермент А.
Наиболее предпочтительные согласно изобретению генетически модифицированные клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: Е8, Е60, E61, E76, E77, E78, E79 и Е8Е60Е61Е76Е77Е78Е79.
В этом контексте предпочтительны следующие ферменты:
Е8 3-гидроксиизобутирил-СоА-гидролаза (ЕС 3.1.2.4),
E76 ацетолактат-синтаза (ЕС 2.2.1.6),
Е77 дигидроксиизовалерат-дегидрогеназа (ЕС 1.1.1.86),
E78 2,3-дигидроксиизовалерат-дегидратаза (ЕС 4.2.1.9),
Е79 2-оксоизовалерат-дегидрогеназа (ЕС 1.2.1.25 или ЕС 1.2.4.4),
Е60 ацил-кофермент А-дегидрогеназа (ЕС 1.3.99.3), бутирил-кофермент А-дегидрогеназа (ЕС 1.3.99.2) или 2-метилацил-кофермент А-дегидрогеназа (ЕС 1.3.99.12), и
E61 еноил-кофермент А-гидратаза (ЕС 4.2.1.17)
Предпочтительные ферменты Е8, Е60 и E61 - это те, которые уже были описаны выше.
Предпочтительно, чтобы фермент E76 кодировали гены, выбранные из группы, включающей в себя ilvbl, t8p19.70, ilv1, ilv2, ilv6, aal021wp, ael305cp, ilvl, ilvH, ilvN, ilvB, ilvM, ilvG, ilvN, budB, ilvN-1, ilvN-2, atrC, ilvX, iolD, budB, aIsS, ilvK, ilvB1, ilvB2, ilvB3, ilvN1, ilvN2, cgl1271, cgl1272, iolD и scc57A.40c.
Предпочтительно, чтобы фермент Е77 кодировали гены, выбранные из группы, включающей в себя f14p22.200, ilv5, acl198Wp, ilvC, iIvY, ilvC-1, ilvC-2, ilvC-3 и cgl1273, причем наиболее предпочтителен ген ilvC.
Предпочтительно, чтобы фермент E78 кодировали гены, выбранные из группы, включающей в себя f14o13.18, ilv3, acl117wp, ilvD, cgl1268, ilvD1 и ilvD2, причем наиболее предпочтителен ilvD.
Если источником углерода служит L-валин, то согласно второй вариации первой особенной формы исполнения второго альтернативного варианта способа согласно изобретению, где применяют генетически модифицированную клетку, в которой синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоата на основе 3-гидроксиизомасляной кислоты идет с изобутирил-коферментом А в качестве промежуточного продукта и 3-гидроксиизобутирил-коферментом А в качестве начального продукта, то предпочтительно, чтобы применяемая клетка имела по сравнению со своим диким типом повышенную активность по меньшей мере одного из следующих ферментов Е79, E80, Е60, E61 и Е8 (см. Фиг.20):
- фермента Е80, катализирующего преобразование L-валина в 2-оксоизовалерат;
фермента E79, катализирующего преобразование 2-оксоизовалерата в изобутирил-кофермент А;
фермента Е60, катализирующего преобразование изобутирил-кофермента А в метакрилил-кофермент А;
фермента Е61, катализирующего преобразование метакрилил-кофермента А в 3-гидроксиизобутирил-кофермент А;
фермента E8, катализирующего преобразование 3-гидроксиизомасляной кислоты в 3-гидроксиизобутирил-кофермент А.
Наиболее предпочтительные согласно изобретению генетически модифицированные клетки - это те, у которых повышена активность следующих ферментов или сочетаний ферментов: Е8, Е60, E61, Е79, Е80 и Е8Е60Е61Е79Е80.
В этом контексте предпочтительны следующие ферменты:
Е8 3-гидроксиизобутирил-СоА-гидролаза (ЕС 3.1.2.4),
Е60 ацил-кофермент А-дегидрогеназа (ЕС 1.3.99.3), бутирил-кофермент А-дегидрогеназа (ЕС 1.3.99.2) или 2-метилацил-кофермент А-дегидрогеназа (ЕС 1.3.99.12),
E61 еноил-кофермент А-гидратаза (ЕС 4.2.1.17),
Е79 2-оксоизовалерат-дегидрогеназа (ЕС 1.2.1.25 или ЕС 1.2.4.4), и
Е80 Трансфераза аминокислоты (ЕС 2.6.1.42).
Предпочтительные ферменты Е8, E60, E61 и Е79 - это те, которые уже были описаны выше.
Предпочтительно, чтобы фермент Е80 кодировали гены, выбранные из группы, включающей в себя bcat1, bcat2, 12711.8, t27i1.9, f2j10.5, f2j10.4, t12h1.16, mmb12.20, t9c5.3, mpa24.13, bat1, bat2, adl384wp, eca39, bcaA, ilvE, ilvE1, ilvE2, ilvE3, ywaA, ybgE, bcaT и cgl2204, причем особо предпочтителен ilvE.
Нуклеотидные последовательности надлежащих генов фермента Е80 содержатся в базе данных KEGG, базе данных NCBI или в базе данных EMBL.
В связи с этим вторым альтернативным вариантом первой особенной формы исполнения второго варианта способа согласно изобретению может также быть целесообразно применять генетически модифицированную клетку, в которой снижена активность фермента Е4, катализирующего преобразование метилмалонового полуальдегида в 3-гидроксиизомасляную кислоту, причем этот фермент Е4 предпочтительно представляет собой 3-гидроксиизобутират-дегидрогеназу (ЕС 1.1.1.31) или 3-гидроксиацил-кофермент А-дегидрогеназу (ЕС 1.1.1.35).
Кроме того, согласно второй вариации первой особенной формы исполнения второго альтернативного варианта способа согласно изобретению, где применяют генетически модифицированную клетку, в которой синтез 3-гидроксиизомасляной кислоты или полигидроксиалканоата на основе 3-гидроксиизомасляной кислоты идет с изобутирил-коферментом А в качестве промежуточного продукта и 3-гидроксиизобутирил-коферментом А в качестве начального продукта, а в качестве источника углерода используют L-валин, может быть предпочтительно использовать клетки, которые уже в состоянии синтезировать большие количества L-валина. В частности, здесь можно использовать те клетки, которые были описаны Blombach et al. в Applied Environmental Microbiology, Vol.73 (7) (2007), Seiten 2.079-2.084.
Согласно особенной форме исполнения способа согласно изобретению также предпочтительно, чтобы в генетически модифицированной клетке была по сравнению с диким типом повышена экспрессия гена glb0. Кроме того, при некоторых обстоятельствах может оказаться предпочтительно, чтобы у генетически модифицированной клетки по сравнению с диким типом была понижена активность транспортного белка цитрата, кодируемого геном dctA или citP.
Используемую при реализации способа согласно изобретению генетически модифицированную клетку целесообразно получать посредством способа, включающего в себя этап повышения активности по меньшей мере одного из описанных выше ферментов, предпочтительно - одного или нескольких из следующих ферментов:
- E1-Е4,
- Е1, Е4, Е5, Е6 и Е7,
- E1, Е4, E5, и Е7,
- Е4, Е5 и Е47-Е52,
- E2-Е4, Е6, Е7 и Е47-Е52,
- Е2-Е4, Е7 И Е47-Е52,
- Е8 и Е53-E61,
- Е8, Е53-Е55, Е58 и Е62-Е64,
- Е2-Е3, Е62, Е72 и Е73,
- Е8, Е60, Е61 и E76-Е79 либо же
- Е8, Е60, Е61, Е79 и Е80
- внутри клетки, причем повышение активности ферментов предпочтительно осуществляют с помощью описанного выше способа.
На этапе IA) способа согласно изобретению обеспечивать контакт генетически модифицированных клеток согласно изобретению с питательной средой и таким образом культивировать их в целях производства 3-гидроксиизобутирата или полигидроксиалканоатов на основе 3-гидроксиизобутирата можно непрерывным или прерывистым образом, способом batch (порционное культивирование), или способом fed-batch (способ с подпиткой), или repeated-fed-batch (способ с повторяющейся подпиткой). Применим также полунепрерывный способ, который описан в британской заявке GB-A-1009370. Обзор известных способов культивации приведен в учебнике Chmiel ("Bioprozesstechnik 1. Einfuhrung in die Bioverfahrenstechnik", Gustav Fischer Verlag, Stuttgart, 1991) или в учебнике Storhas ("Bioreaktoren und pehphere Einrichtungen", Vieweg Verlag, Braunschweig/Wiesbaden, 1994).
Подлежащая применению среда культивирования должна соответствующим образом удовлетворять потребностям конкретного штамма. Описания сред культивации для различных микроорганизмов содержатся в руководстве "Manual of Methods for General Bacteriology" Американского общества бактериологии (Washington D. С., USA, 1981).
В качестве источника углерода можно применять углеводы, например глюкозу, сахарозу, лактозу, фруктозу, мальтозу, мелассу, крахмал или целлюлозу, масла и жиры, например соевое масло, подсолнечное масло, арахисовое масло и кокосовый жир, жирные кислоты, например пальмитиновую кислоту, стеариновую кислоту и линолевую кислоту, спирты, например глицерин и метанол, углеводороды, например, метан, аминокислоты, например L-глутамат или L-валин, или органические кислоты, например уксусную кислоту. Эти вещества можно применять по отдельности или в смеси. Особо предпочтительно применение углеводов, в особенности моносахаридов, олигосахаридов или полисахаридов, как это описано в патентах США US 6,01,494 и US 6,136,576, Сахаров C5 (пентоз) или глицерина.
В качестве источника углерода можно использовать содержащие азот органические соединения, например, пептоны, дрожжевой экстракт, мясной экстракт, солодовый экстракт, жидкий кукурузный экстракт, муку соевых бобов и мочевину, или неорганические соединения, например, сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Источники азота можно применять по отдельности или в смеси.
В качестве источников фосфора можно использовать фосфорную кислоту, дигидрофосфат калия или гидрофосфат калия, либо же соответствующие натриевые соли. Кроме того, среда культивации должна содержать соли металлов, например, сульфат магния или сульфат железа, которые необходимы для роста. Наконец, в дополнение к указанным выше веществам возможно применение факторов роста, как то: аминокислот и витаминов. Сверх того, к среде культивации можно добавлять подходящие предшественники. Указанные компоненты можно либо вводить в культуру одним объемом, либо надлежащим образом добавлять во время культивации.
Для контроля pH культуры применяют известным образом основные соединения, как то: гидроксид натрия, гидроксид калия, аммиак или аммиачную воду, либо кислые соединения, например, фосфорную кислоту или серную кислоту. Чтобы держать под контролем ценообразование, можно применять пеногасители, например, полигликолевые эфиры жирных кислот. Для поддержания стабильности плазмид в среду можно добавлять вещества избирательного действия, например, антибиотики. Для поддержания аэробных условий в культуру вводят кислород или содержащие кислород газовые смеси, например, воздух. Температура культуры обычно составляет от 20°С до 45°С, а предпочтительно - от 25°С до 40°С. В частности, в случае применения клеток, способных перерабатывать в качестве субстрата глицерин, может быть предпочтительно использовать для этого клетки, описанные в патенте США US 6,803,218. При этом возможна культивация клеток при температурах в пределах от 40 до 100°С.
Очистку 3-гидроксиизомасляной кислоты (отделение ее от питательного раствора) предпочтительно проводить непрерывным способом, причем в этом контексте также предпочтительно проводить непрерывным образом и сам синтез 3-гидроксиизомасляной кислоты путем ферментации, так что весь процесс - от синтеза 3-гидроксиизомасляной кислоты до ее отделения от ферментационного бульона - может идти непрерывно. Для непрерывного отделения синтезированной 3-гидроксиизомасляной кислоты от ферментационного бульона этот бульон непрерывно проводят через устройство для отделения используемых при ферментации микроорганизмов, предпочтительно - через фильтр с размером исключения от 20 до 200 кДа, в котором происходит отделение твердой фазы от жидкой. Возможно также применение центрифуги, подходящего устройства для седиментации или сочетания этих устройств, причем особо предпочтительно сначала отделить по меньшей мере часть микроорганизмов седиментацией, а затем направить частично очищенный от микроорганизмов ферментационный бульон на ультрафильтрацию или на устройство для центрифугирования.
Продукт ферментации, обогащенный в отношении содержания 3-гидроксиизомасляной кислоты, после отделения микроорганизмов направляют в разделительную установку, предпочтительно многоступенчатую. В этой разделительной установке предусмотрено несколько последовательно подключенных этапов разделения, с каждого из которых выходят обратные трубопроводы, возвращающиеся в бак ферментации. Кроме того, с каждого этапа разделения имеются отводы наружу. Отдельные этапы разделения могут работать на принципах электродиализа, обратного осмоса, ультрафильтрации или нанофильтрации. Как правило, отдельные этапы разделения представляют собой мембранные разделительные устройства. Конкретные этапы разделения выбирают в зависимости от вида и объема побочных продуктов брожения и остатков субстрата.
Помимо отделения 3-гидроксиизомасляной кислоты посредством электродиализа, обратного осмоса, ультрафильтрации или нанофильтрации, в процессе которого в качестве конечного продукта получают водный раствор 3-гидроксиизомасляной кислоты, получать 3-гидроксиизомасляную кислоту можно, отделяя ее методом экстракции от очищенного от микроорганизмов ферментационного раствора, причем в этом случае в конечном итоге можно получить чистую 3-гидроксиизомасляную кислоту. Для отделения 3-гидроксиизомасляной кислоты методом экстракции в ферментационный раствор с целью образования аммониевой соли 3-гидроксиизомасляной кислоты можно, например, добавить соединения аммония или амины. Затем эту аммониевую соль можно отделить от ферментационного раствора, для чего добавляют органический экстрагент, а затем нагревают полученную таким образом смесь, благодаря чему аммониевая соль накапливается в органической фазе. Из этой фазы 3-гидроксиизомасляную кислоту можно изолировать, например, путем дальнейших этапов экстракции, получая чистую 3-гидроксиизомасляную кислоту. Подробности касательно этого способа разделения содержатся в международной заявке WO-A-02/090312, которая настоящим введена как ссылка, и содержание публикации которой в отношении отделения гидроксикарбоновых кислот от ферментационных растворов образует составную часть изложения настоящего изобретения.
В зависимости от способа отделения 3-гидроксиизомасляной кислоты от ферментационного раствора получают либо водный раствор 3-гидроксиизомасляной кислоты, содержащий 2-90 мас.%, предпочтительно 7,5-50 мас.%, а особо предпочтительно 10-25 мас.% 3-гидроксиизомасляной кислоты, либо же чистую 3-гидроксиизомасляную кислоту.
Кроме того, 3-гидроксиизомасляную кислоту, изготовленную на этапе IA) способа согласно изобретению, перед очисткой, во время или после таковой, можно также нейтрализовывать, причем для этого возможно применение оснований, как, например, гидроксида кальция или гидроксида натрия.
На этапе способа IB) способа согласно изобретению проводят дегидратацию 3-гидроксиизомасляной кислоты с образованием метакриловой кислоты, причем для этого можно применять либо изолированную из ферментационного раствора чистую 3-гидроксиизомасляную кислоту, либо выделенный при обработке ферментационного раствора водный раствор 3-гидроксиизомасляной кислоты, и причем последнюю при необходимости до дегидратации дополнительно концентрируют, например, дистилляцией, при необходимости - в присутствии надлежащего средства, способствующего разделению.
В принципе, дегидратацию можно проводить в жидкой или в газовой фазе. Кроме того, согласно изобретению предпочтительно проводить дегидратацию в присутствии катализатора, причем вид используемого катализатора зависит от того, проводят ли реакцию в газовой фазе или в жидкой.
В качестве катализаторов дегидратации можно использовать как кислые, так и щелочные катализаторы. Кислые катализаторы предпочтительны, в частности, ввиду низкой склонности к формированию олигомеров. Катализатор дегидратации можно применять как в качестве гомогенного, так и гетерогенного катализатора. Если катализатор дегидратации представлен в форме гетерогенного катализатора, то предпочтительно, чтобы катализатор дегидратации находился в контакте с носителем х. В качестве носителя х можно использовать все твердые вещества, которые специалист сочтет пригодными для этого. В связи с этим предпочтительно, чтобы эти вещества имели достаточный объем пор, обеспечивающий хорошее связывание с катализатором дегидратации и поглощение его. Кроме того, предпочтительны значения общего объема пор согласно DIN 66133 в пределах от 0,01 до 3 мл/г, а значения общего объема пор в пределах от 0,1 до 1,5 мл/г - особо предпочтительны. Кроме того, предпочтительно, чтобы годные к применению в качестве носителей х твердые вещества обладали удельной площадью поверхности в пределах от 0,001 до 1000 м2/г, предпочтительно - в пределах от 0,005 до 450 м2/г а еще более предпочтительно - в пределах от 0,01 до 300 м2/г, по результатам испытания BET согласно DIN 66131. Во-первых, в качестве носителя для катализатора дегидратации можно применять засыпку, имеющую средний размер частиц в пределах от 0,1 до 40 мм, предпочтительно - в пределах от 1 до 10 мм, а еще более предпочтительно - в пределах от 1,5 до 5 мм. Кроме того, носителем может служить стенка реактора дегидратации. Сверх того, носитель сам по себе может быть кислым или основным, а также возможно нанесение кислого или основного катализатора дегидратации на инертный носитель. Из технологий нанесения следует, в частности, упомянуть погружение или импрегнацию либо же введение в матрикс-носитель.
В качества носителей х, которые также могут обладать свойствами катализатора дегидратации, особо удобно применять натуральные или синтетические силикатные материалы, как то: морденит, монтмориллонит, кислые цеолиты, загруженные одноосновными, двухосновными или многоосновными неорганическими кислотами, в особенности фосфорной кислотой, или кислыми солями неорганических кислот носители, например, оксиды или силикаты, как то: Al2O3, TiO2; оксиды или смеси оксидов, например, γ-Al2O3 и смеси оксидов ZnO-Al2O3 гетерополикислот.
Форме исполнения согласно изобретению соответствует ситуация, когда носитель х по меньшей мере частично состоит из соединения со свойствами оксида. Такие соединения со свойствами оксида должны включать в себя по меньшей мере один из элементов Si, Ti, Zr, Al, P или сочетание по меньшей мере двух из них. Ввиду своих кислых или основных качеств такие носители сами в состоянии служить катализаторами дегидратации. Класс соединений, предпочтительных как в качестве носителя х, так и в качестве катализатора дегидратации, включает в себя оксиды кремния/алюминия/фосфора. Основные вещества, предпочтительные как в качестве катализатора дегидратации, так и в качестве носителя х, включают в себя щелочные металлы, щелочноземельные металлы, лантан, лантаноиды или сочетание по меньшей мере двух таковых в форме оксидов. Такие кислые или основные катализаторы дегидратации предлагают на рынке как Degussa AG, так и Südchemie AG. Еще один класс представляют собой ионообменники. Они также могут иметь как основную, так и кислую форму.
В качестве гомогенных катализаторов дегидратации можно использовать, в частности, неорганические кислоты, предпочтительно кислоты, содержащие фосфор, а еще более предпочтительно - фосфорную кислоту. Эти неорганические кислоты можно иммобилизовать на носителе х путем погружения или импрегнации.
Применение гетерогенных катализаторов дало наиболее благоприятные результаты при дегидратации в газовой фазе. При проведении дегидратации в жидкой фазе, однако, применяют как гомогенные, так и гетерогенные катализаторы дегидратации.
Кроме того, при реализации способа согласно изобретению предпочтительно применять катализатор дегидратации, показатель Н0 которого находится в пределах от +1 до -10, предпочтительно - в пределах от +2 до -8,2, а еще более предпочтительно при дегидратации в жидкой фазе - в пределах от +2 до -3, а при дегидратации в газовой фазе - в пределах от -3 до -8,2. Показатель Н0 означает кислотную функцию по Hämmert, его определяют так называемым аминным титрованием и применением индикаторов, либо же через поглощение газообразного основания (см. "Studies in Surface Science and Catalytics", Vol.51, 1989: "New solid Acids and Bases, their catalytic Properties", K. Tannabe et al.)
В соответствии с особой формой исполнения способа согласно изобретению в качестве кислого твердого катализатора используют пористый носитель, контактирующий с неорганической кислотой, предпочтительно с фосфорной кислотой, или с суперкислотами, как, например, с сульфатированным или фосфатированным оксидом циркония, в основе которого предпочтительно на 90 мас.%, сверх того -предпочтительно на 95 мас.%, а наиболее предпочтительно на 99 мас.% лежит оксид кремния, наиболее целесообразно - SiO2. Обеспечение контакта пористого носителя с неорганической кислотой обеспечивают предпочтительно путем импрегнации носителя кислотой, причем носитель контактирует с количеством кислоты, предпочтительно находящимся в пределах от 10 до 70 мас.%, особо предпочтительно в пределах от 20 до 60 мас.%, а еще более предпочтительно в пределах от 30 до 50 мас.%, от общей массы носителя, после чего проводят сушку. После сушки носитель нагревают для фиксации неорганической кислоты, предпочтительно до температуры, лежащей в пределах от 300 до 600°С, еще более предпочтительно в пределах от 400 до 500°С.
В соответствии с особой формой исполнения способа согласно изобретению дегидратацию проводят в газовой фазе. При этом возможно применение обычной аппаратуры, известной специалисту по реакциям в газовой фазе, например, реакторы в виде труб. Особо предпочтительно применение теплообменников в виде пучка труб, а также реакторов, которые в качестве теплообменников содержат «термические пластины». В соответствии с одной из форм исполнения дегидратации в газовой фазе чистую 3-гидроксиизомасляную кислоту вводят в реактор, содержащий один из вышепоименованных катализаторов в твердом слое. В соответствии с другой формой исполнения в реактор вводят 3-гидроксиизомасляную кислоту в форме водного раствора, содержащего от 2 до 80 мас.%, особо предпочтительно - от 5 до 50 мас.%, а еще более предпочтительно - от 10 до 25 мас.% 3-гидроксиизомасляной кислоты, в каждом случае от общей массы водного раствора. Показатели давления и температуры внутри реактора подбирают так, чтобы 3-гидроксиизомасляная кислота или водный раствор при вхождении их в реактор находились в газообразном состоянии. Дегидратацию в газовой фазе предпочтительно проводить при температуре, находящейся в пределах от 200 до 400°С, особо предпочтительно - от 250 до 350°С. Давление внутри реактора при дегидратации в газовой фазе находится предпочтительно в пределах от 0,1 до 50 бар, особо предпочтительно в пределах от 0,2 до 10 бар, а наиболее предпочтительно в пределах от 0,5 до 5 бар.
Количество введенной в реактор 3-гидроксиизомасляной кислоты при дегидратации в газовой фазе предпочтительно находится в пределах от 10 до 100 об.%, особо предпочтительно в пределах от 20 до 100 об.%, а наиболее предпочтительно в пределах от 30 до 100 об.%.
В соответствии с другой особой формой исполнения способа согласно изобретению дегидратацию проводят в жидкой фазе. Дегидратацию в жидкой фазе также можно проводить во всех известных специалисту аппаратах, в которых жидкость можно нагреть до желательной температуры реакции, причем в аппаратуре можно создать давление, достаточное, чтобы при желательной температуре поддерживать компоненты реакции в жидком состоянии.
В соответствии с особой формой исполнения способа согласно изобретению способ дегидратации в жидкой фазе включает первый этап, на котором в реактор вводят чистую 3-гидроксиизомасляную кислоту или водный раствор 3-гидроксиизомасляной кислоты, содержащий от 5 до 100 мас.%, особо предпочтительно - от 20 до 100 мас.%, а наиболее предпочтительно - от 50 до 100 мас.% 3-гидроксиизомасляной кислоты от общей массы водного раствора. Показатели давления и температуры внутри реактора подбирают так, чтобы 3-гидроксиизомасляная кислота или водный раствор при вхождении их в реактор находились в жидком состоянии. В соответствии с особой формой исполнения способа согласно изобретению, при котором дегидратацию проводят в жидкой фазе, 3-гидроксиизомасляную кислоту или водный раствор 3-гидроксиизомасляной кислоты проводят внутри реактора через твердый слой катализатора так, чтобы жидкая фаза орошала поверхность частиц катализатора. Такой способ работы можно, например, реализовать в реакторе с орошаемым слоем.
Дегидратацию в жидкой фазе предпочтительно проводить при температуре, находящейся в пределах от 200 до 350°С, особо предпочтительно - от 250 до 300°С. Давление внутри реактора при дегидратации в жидкой фазе находится предпочтительно в пределах от 1 до 50 бар, особо предпочтительно в пределах от 2 до 10 бар, а наиболее предпочтительно в пределах от 3 до 10 бар.
Катализ дегидратации как при дегидратации в газовой фазе, так и при дегидратации в жидкой фазе может быть гомогенным или гетерогенным.
В случае гомогенного катализа сначала устанавливают контакт катализатора, который в этом случае предпочтительно представляет собой неорганическую кислоту, например, фосфорную или серную кислоту, с 3-гидроксиизомасляной кислотой или водным раствором, содержащим 3-гидроксиизомасляную кислоту. Затем полученный таким образом состав вводят в реактор и преобразуют в метакриловую кислоту в желательных условиях давления и температуры. Также допустимо введение неорганической кислоты в реактор независимо от 3-гидроксиизомасляной кислоты или водного раствора. В этом случае у реактора имеются по меньшей мере два подводящих трубопровода - один для 3-гидроксиизомасляной кислоты или водного раствора, содержащего 3-гидроксиизомасляную кислоту, и один для катализатора. Если дегидратацию проводят в жидкой фазе в реакторе с орошаемым слоем, то предпочтительно вводить катализатор в верхнюю часть реактора вместе с 3-гидроксиизомасляной кислотой или водным раствором, содержащим 3-гидроксиизомасляную кислоту.
В случае гетерогенного катализа катализатор находится в реакционном пространстве в форме твердого субстрата, например, в форме засыпки твердого слоя, в форме покрытых катализатором пластин, предпочтительно - термических пластин, расположенных во внутреннем пространстве реактора, либо же в форме катализаторного покрытия стенок реактора. Возможные формы реакторов описаны, например, в немецких заявках на патент DE-A-19848208, DE-A-10019381 и в европейской заявке на патент EP-A-I 234612. В случае гетерогенного катализа в качестве катализаторов предпочтительны находившиеся в контакте с неорганическими кислотами (предпочтительно импрегнированные ими) пористые носители. В этом случае устанавливают контакт 3-гидроксиизомасляной кислоты или водного раствора, содержащего 3-гидроксиизомасляную кислоту, находящихся в парообразной или жидкой форме, с поверхностью твердого материала катализатора.
В соответствии с особо предпочтительной формой исполнения способа согласно изобретению дегидратацию 3-гидроксиизомасляной кислоты в жидкой фазе проводят под давлением, находящимся в пределах от 200 до 500 мбар, при температуре в пределах от 200 до 230°С и в присутствии ионов щелочных металлов в качестве катализатора.
В качестве реакционной смеси, выходящей по итогам дегидратации, получают либо водный раствор метакриловой кислоты, не содержащий компонентов катализатора (его получают в случае дегидратации с гетерогенным катализом), либо же водный раствор метакриловой кислоты, включающий в себя катализатор (его получают в случае дегидратации с гомогенным катализом). Кроме того, водный раствор метакриловой кислоты может находиться в жидком состоянии (если дегидратация прошла в жидкой фазе) или в газообразном (если дегидратация прошла в газовой фазе).
Полученный таким образом раствор метакриловой кислоты можно в соответствии с особой формой исполнения способа согласно изобретению при необходимости без дальнейшей обработки направлять на этерификацию. При этом при нагреве обеспечивают контакт раствора метакриловой кислоты с соответствующими спиртами, например, метанолом, этанолом, 1-пропанолом, 2-пропанолом или 1-бутанолом, а также с надлежащими известными специалисту катализаторами этерификации, как, например, концентрированными кислотами, и таким образом преобразуют метакриловую кислоту в соответствующий сложный эфир. Может, однако, оказаться целесообразным перед этерификацией провести очистку метакриловой кислоты, причем для очистки можно использовать любой известный специалисту способ, который обычно находит применение для очистки загрязненной (мет)акриловой кислоты, полученной каталитическим окислением пропилена в газовой фазе.
Если дегидратацию провели в газовой фазе, то предпочтительно сначала сконденсировать метакриловую кислоту с получением водного раствора метакриловой кислоты. При этом, в принципе, можно использовать все известные специалисту способы конденсации, например, фракционированную конденсацию, как это описано в международных заявках WO-A-2004/035514, WO-A-03/014172 или в европейской заявке на патент ЕР-А-ЕР 1163201, либо же полную конденсацию, как это описано в европейской заявке на патент ЕР-А-0695736. Также допустимо в целях по возможности полной абсорбции метакриловой кислоты добавлять при конденсации дополнительный растворитель, в частности, воду.
Полученный после конденсации водный раствор метакриловой кислоты или же такой раствор, полученный в случае дегидратации в жидкой фазе, можно на дальнейших этапах очистки освободить от воды и прочих примесей. При этом сначала можно удалить воду путем азеотропной перегонки с использованием вспомогательных средств разделения, как это описано, например, в немецкой заявке на патент DE-A-19853064. Также возможно применение высококипящих растворителей для поглощения метакриловой кислоты, как это изложено, например, в европейской заявке на патент ЕР-А-0974574. Помимо этих дистилляционных процессов для удаления воды можно также использовать мембраны, как это предложено, например, в немецкой заявке на патент DE-A-4401405. Кроме того, возможна очистка полученного после конденсации или дегидратации в жидкой фазе водного раствора метакриловой кислоты методом кристаллизации.
Метакриловую кислоту, полученную после удаления воды, можно дополнительно очистить на дальнейших этапах процесса. Так, еще имеющиеся высококипящие примеси можно удалить на дополнительных этапах дистилляции. Особо предпочтительно, однако, очищать метакриловую кислоту, полученную после удаления воды, методом кристаллизации, как это описано, например, в немецкой заявке на патент DE-A-10149353.
Полученную таким образом очищенную метакриловую кислоту можно затем при необходимости подвергнуть этерификации.
Вклад в решение указанных в начале задач вносит, кроме того, способ получения метакриловой кислоты или эфиров метакриловой кислоты, включающий в себя этапы:
IIA) получение полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты с помощью описанного выше способа,
IIB) расщепления полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты с получением 3-гидроксиизомасляной кислоты, а также - при необходимости - нейтрализации 3-гидроксиизомасляной кислоты и/или очистки 3-гидроксиизомасляной кислоты,
IIC) дегидратация 3-гидроксиизомасляной кислоты с образованием метакриловой кислоты, а также, при необходимости, этерификации метакрилата или метакриловой кислоты.
Вклад в решение указанных в начале задач вносит, кроме того, способ получения полиметакриловой кислоты или эфиров полиметакриловой кислоты, включающий в себя этапы:
IIIA) синтез 3-гидроксиизомасляной кислоты посредством способа, описанного ранее,
IIIB) радикальная полимеризация метакриловой кислоты,
причем при необходимости до или после радикальной полимеризации возможна по меньшей мере частичная этерификация карбоксильных групп метакриловой кислоты.
Ниже следует пояснение настоящего изобретения на основе иллюстраций и примеров, которые не ограничивают изобретение.
На фигуре 1 показано преобразование сукцинил-кофермента А в метилмалонил-кофермент А, катализируемое ферментом E1.
На фигуре 2 показано катализируемое ферментами от E2 до Е4 преобразование метилмалонил-кофермента А в 3-гидроксиизомасляную кислоту согласно первому альтернативному варианту способа по изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - сукцинил-кофермент А.
На фигуре 3 показано катализируемое ферментами Е4, Е6 и Е7 преобразование (R)-метилмалонил-кофермента А в 3-гидроксиизомасляную кислоту согласно второму альтернативному варианту способа по изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - сукцинил-кофермент А.
На фигуре 4 показано катализируемое ферментами Е4, E5 и Е7 преобразование метилмалонил-кофермента А в 3-гидроксиизомасляную кислоту согласно третьему альтернативному варианту способа по изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - сукцинил-кофермент А.
На фигуре 5 показано катализируемое ферментами Е8 и Е9 преобразование 3-гидроксиизомасляной кислоты в полигидроксиалканоат.
На фигуре 6 показано катализируемое ферментами Е10 или Е11 преобразование фосфоенолпирувата, или соответственно пирувата, в оксалоацетат согласно особенной вариации первого, второго или третьего альтернативного варианта способа по изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта-сукцинил-кофермент А.
На фигуре 7 показано катализируемое ферментами от E12 до E15 преобразование оксалоацетата в сукцинил-кофермент А согласно особенной вариации первого, второго или третьего альтернативного варианта способа по изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - сукцинил-кофермент А.
На фигуре 8 показано катализируемое ферментами от Е13 до E16 и от Е24 до Е26 преобразование оксалоацетата в сукцинил-кофермент А согласно второй особенной вариации первого, второго или третьего альтернативного варианта способа согласно изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта -сукцинил-кофермент А.
На фигуре 9 показано катализируемое ферментами от E16, Е24, Е26 и Е28 преобразование оксалоацетата в сукцинил-кофермент А согласно третьей особенной вариации первого, второго или третьего альтернативного варианта способа согласно изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - сукцинил-кофермент А.
На фигуре 10 показано катализируемое ферментами Е46 и Е28 преобразование оксалоацетата в сукцинил-кофермент А согласно еще одной особенной вариации первого, второго или третьего альтернативного варианта способа согласно изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - сукцинил-кофермент А.
На фигурах 11 и 12 показано катализируемое ферментами Е4, E5 и Е47-E52 преобразование ацетил-кофермента А в 3-гидроксиизомасляную кислоту согласно первому альтернативному варианту второй особой формы исполнения способа согласно изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - пропионил-кофермент А.
На фигурах 13 и 14 показано катализируемое ферментами Е2-Е4, Е6, Е7 и Е47-Е52 преобразование пропионил-кофермента А в 3-гидроксиизомасляную кислоту согласно второму альтернативному варианту второй особой формы исполнения способа согласно изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - пропионил-кофермент А.
На фигурах 15 и 16 показано катализируемое ферментами E2-Е4, Е7 и Е47-Е52 преобразование пропионил-кофермента А в 3-гидроксиизомасляную кислоту согласно третьему альтернативному варианту второй особой формы исполнения способа согласно изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - пропионил-кофермент А.
На фигуре 17 показано катализируемое ферментами E53-E55, E58 и Е62-Е65 преобразование двух молекул ацетил-кофермента А в глиоксалат и пропионил-кофермент А согласно пятому альтернативному варианту второй особой формы исполнения способа согласно изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - пропионил-кофермент А.
На фигуре 18 показано катализируемое ферментами Е2-Е4, Е62, Е72 и Е73 преобразование бета-аланина в 3-гидроксиизомасляную кислоту согласно третьей особой форме исполнения способа согласно изобретению, где применяют генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется метилмалоновый полуальдегид, а в качестве промежуточного продукта - акрилил-кофермент А.
На фигуре 19 показано катализируемое ферментами E76-E79, E60, E61 и Е8 преобразование пирувата в 3-гидроксиизомасляную кислоту согласно первой альтернативной вариации первой особой формы исполнения второго варианта способа согласно изобретению, использующего генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется 3-гидроксиизобутирил-кофермент А, а в качестве промежуточного продукта - изобутирил-кофермент А.
На фигуре 20 показано катализируемое ферментами E8, E60, E61, Е79 и Е80 преобразование L-валина в 3-гидроксиизомасляную кислоту согласно второй альтернативной вариации первой особой формы исполнения второго варианта способа согласно изобретению, использующего генетически модифицированную клетку, в которой при синтезе 3-гидроксиизомасляной кислоты или полигидроксиалканоатов на основе 3-гидроксиизомасляной кислоты в качестве начального продукта образуется 3-гидроксиизобутирил-коферментА, а в качестве промежуточного продукта - изобутирил-кофермент А.
На фигуре 21 показана плазмида рЕKЕх2МСМ cgl из примера 3.
На фигуре 22 показан вектор pGA4_3HIBDH из примера 3.
На фигуре 23 показан вектор pGA5_MMCoAR_3HIBDH из примера 3.
На фигуре 24 показан вектор рЕСХТ99А из примера 3.
На фигуре 25 показан вектор pECXT99A_MMCoAR_3HIBDH из примера 3.
На фигуре 26 показано ионохроматографическое подтверждение образования 3-гидроксиизомасляной кислоты с помощью рекомбинантных клеток в примере 3.
На фигуре 27 представлено ионохроматографическое подтверждение того, что пик, представленный на фигуре 26, соответствует 3-гидроксиизомасляной кислоте.
Примеры
Пример 1
Следует иллюстрация изобретения на основании примера 1 с рекомбинантной клеткой, которая способна синтезировать 3-гидроксиизомасляную кислоту с изобутирил-коферментом А в качестве промежуточного продукта и 3-гидроксиизобутирил-коферментом А в качестве начального продукта, используя в качестве источника углерода L-валин. Согласно изобретению эту клетку можно применять для синтеза метакриловой кислоты. Для этого в Е. coli BL21 (DE3) обеспечили повышенную экспрессию ферментов ЕС 2.6.1.42 и ЕС 1.2.4.4 (оба из Pseudomonas aeruginosa), а также кластера, включающего в себя три фермента ЕС 1.3.99.12, ЕС 4.2.1.17 и ЕС 3.1.2.4 (из Acinetobacter calcoaceticus).
При этом кодирование фермента ЕС 1.2.4.4 осуществляет ген с последовательностями ДНК соответственно № последовательности 07 и 08 (субъединицы α и β), а кодирование фермента ЕС 2.6.1.42 осуществляет ген с последовательностью ДНК соответственно №последовательности 09. Кодирование фермента ЕС 1.3.99.12 осуществляет ген с последовательностью ДНК согласно № последовательности 10, фермента ЕС 4.2.1.17 - ген с последовательностью ДНК согласно № последовательности 11, а фермента ЕС 3.1.2.4 - ген с последовательностью ДНК согласно № последовательности 12.
1. Организмы, плазмиды и олигонуклеотиды
Для создания этой рекомбинантной клетки применили следующие штаммы бактерий, векторы, геномную ДНК и олигонуклеотиды:
2. Амплификация фрагментов ПЦР 1.2.4.4 (2.313 тыс. пар оснований) и 2.6.1.42 (958 пар оснований)
Сначала фрагменты 1.2.4.4 и 2.6.1.42 подвергли амплификации посредством ПЦР с помощью указанных в таблице 4 праймеров с последовательностями от SEQ.-ID-Nr. 15 до SEQ.-ID-Nr. 18, основываясь на всей ДНК из Pseudomonas aeroginosa.
3. Слияние вектора pCDF-Duet-1 и фрагмента ПЦР 2.6.1.42 (958 пар оснований)
Вектор pCDFDuet-1 (обладающий резистентностью к стрептомицину/спектиномицину), так же как и фрагмент ПЦ 2.6.1.42, режут с помощью EcoRI/SalI и полученные обрезки в течение ночи связывают лигазой Т4. Получают вектор pCDFDuet::2.6.1.42.
4. Клонирование фрагментов ПЦР в вектор PCR2.1-TOPO
Изготовление клонирующего вектора, включающего фрагмент 2.6.1.42 или фрагмент 1.2.4.4, с применением вектора pCR2.1-TOPO осуществили согласно данным производителя. С помощью полученных таким образом клонирующих векторов pCR2.1-TOPO::1.2.4.4 и pCR2.1-TOPO::2.6.1.42 преобразовали клетки E. coli DH5α. Поскольку векторы pCR2.1-TOPO обладают резистентностью к канамицину и ампициллину, плакировку выполнили на 2 платы AXI и KXI (20 и 40 мкл). Плазмиды полученных клонов выделили и провели их слияние:
pCR2.1-TOPO::1.2.4.4BgIII+KpnI Размер фрагмента - 2313 пар оснований
pCR2.1-TOPO::2.6.1.42EcoRI+SalI Размер фрагмента - 958 пар оснований
В каждом случае провели элюцию фрагментов из геля и очистили их набором Qiagen QIAquick (согласно инструкции)
5. Получение вектора pCDFDuet:2.6.1.42-1.2.4.4
Проводят слияние вектора pCDFDuet:2.6.1.42 и вектора pCR2.1-TOPO:: 1.2.4.4 с помощью BgIII/KpnI. Затем осуществляют связывание pCDFDuet::2.6.1.42 (BgIII/KpnI) с pCR2.1-TOPO::1.2.4.4 с получением вектора pCDFDuet::2.6.1.42-1.2.4.4. С помощью этого клонирующего вектора также провели трансформацию клеток Е. coli DH5α. Провели выделение плазмид. Плазмид pCDFDuet::2.6.1.42-1.2.4.4 имеет последовательность ДНК, соответствующую SEQ.-ID-Nr. 19.
6. Клонирование кластера валина из Acinetobacter calcoaceticus (V-ClusAca)
Штамм АТСС 33304 Acinetobacter calcoaceticus культивировали для изоляции всей ДНК (агар или среда НН). Изоляцию всей ДНК проводили с помощью набора DNEasy производства Qiagen (L1 и L2) способом, включающим следующие этапы: i) центрифугирование 1 мл культуры, ii) добавление к порции 200 мкл H2O, iii) нагрев до 95°С в течение 10 мин, iv) центрифугирование (10 мин, 13000 об/мин), а также v) отбор супернатанта для ПЦР.
Для амплификации кластера валина из A. calcoaceticus провели ПЦР с помощью указанных в таблице 4 праймеров с последовательностями SEQ.-ID-Nr. 13 и SEQ.-ID-Nr. 14 (по инструкции изготовителя, с полимеразами Pfu либо Taq).
Продукты ПЦР подвергли очистке и согласно инструкции соединили в плазмид pET101/D-TOPO и ввели в Е. coli DH5α. Получили плазмид pET101/D-TOPO::V-ClusterAca. Плазмид pET101/D-TOPO::V-ClusterAca имеет последовательность ДНК, соответствующую SEQ.-ID-Nr. 20.
7. Получение рекомбинантной клетки, синтезирующей 3-гидроксиизомасляную кислоту из L-валина
E. coli BL21 (DE3) преобразовали с помощью плазмид pET101/D-TOPO::V-ClusterAca и pCDF-Duet::2.6.1.42-1.2.4.4 (выкладка на среду LB-Spec./Amp).
Полученные клетки были в состоянии преобразовывать L-валин в 3-гидроксиизомасляную кислоту в питательной среде, содержащей L-валин. Напротив, дикий тип клеток (Е.coli BL21 (DE3)) в такой питательной среде 3-гидроксиизомасляную кислоту в заметных количествах синтезировать не мог.
Пример 2
В этом примере изолируют ДНК гена, и реализуют повышенную экспрессию гена в Е. coli. ДНК кодирует фермент, имеющую активность как фермента Е2, так и фермента Е3.
1. Разведение и сбор Sulfolobus tokodaii
Sulfolobus tokodaii выращивали в малом объеме культуры (40-200 мл) при 75°С и со значением pH 3,0, со встряхиванием (150 об/мин). За ростом наблюдали с использование метода фотометрии, путем измерения оптической плотности при длине волны 578 нм (OD578нм). Использовали модифицированную среду Sulfolobus (модификация согласно Brock et al., Archives of Microbiology 84, стр.54-68, 1972; Suzuki et al., Extremophiles, 6, стр.39-44, 2002). В качестве источника энергии и углерода использовали казаминокислоты, экстракт дрожжей и глюкозу. Среда состояла из следующих компонентов: основная среда, маточный раствор глюкозы, маточный раствор железа и маточный раствор микроэлементов. Сбор клеток проводили при OD578нм, равной 0,3-0,5 (экспоненциальная фаза).
Центрифугирование проводили в центрифуге Sorvall (ротор SS34) в течение 15 мин при 9000 об/мин. Клеточный осадок непосредственно применяли для экстракции ДНК.
Основная среда. KH2PO4 (0,28 г/л), (NH4)2SO4 (1,3 г/л), MgSO4×7 Н2О (0,25 г/л), CaCl2×6 H2O (0,07 г/л), экстракт дрожжей (1 г/л) и казаминокислоты (1 г/л). Перед автоклавированием значение pH довели до 3,0 с помощью H2SO4.
Маточный раствор глюкозы (100-кратный). Глюкоза (100 г/л). Раствор подвергали стерильной фильтрации.
Маточный раствор железа (1000-кратный). FeCl3×6H2O (20 г/л). Раствор подвергали стерильной фильтрации.
Маточный раствор микроэлементов (1000-кратный). MnCl2×4H2O (1,8 г/л), Na2B4O7×10H2O (4,5 г/л), ZnSO4×7H2O (220 мг/л), CuCl2×2H2O (50 мг/л), Na2MoO4×2H2O (30 мг/л), VOSO4×5H2O (30 мг/л), CoCl2×6H2O (8,4 мг/л). Отдельные компоненты последовательно растворяли в дистиллированной H2O, доводили значение pH до 3,0 с помощью HCl и подвергали раствор стерильной фильтрации.
2. Изоляция геномной ДНК из S. tokodaii
Изоляцию геномной ДНК проводили по методу Murray и Thompson (Nucleic Acid Research, 8, стр.4.321-4.325, 1980). Для этого навеску в 10-50 мг (масса во влажном состоянии) свежесобранных клеток поместили в реакционный сосуд емкостью 1,5 мл производства Eppendorf и ресуспендировали ее в 570 мл буферного раствора трис-ЭДТА (10 мМ трис/HCl (pH 8,0), 1 мМ NaЭДТА). Добавили 30 мкл 10%-ного (масса/объем) раствора СДС (додецилсульфата натрия) и 3 мкл протеиназы К (20 мкг/мкл) и инкубировали в течение 1 ч при 52°С. Затем добавили 100 мкл раствора 5М NaCl и 80 мкл подогретого раствора 10% (масса/объем) цетил-триметиламмоний-бромида (ЦТАБ) (10% (масса/объем) ЦТАБ в 0,7 М NaCl). По прошествии 10 мин инкубации при 65°С комплексы из ЦТАБ, фрагментов клеточной стенки и белков экстрагировали с помощью 780 мкл смеси хлороформа и изоамилового спирта (24: 1 (об/об)) и центрифугировали в течение 15 мин при 14000 об/мин. Верхнюю водную фазу перенесли в новый реакционный сосуд производства Eppendorf и повторили экстракцию. После освобождения водной фазы от пигментов на нее наслоили 400 мкл 100%-ного изопропанола. Осторожным перемешиванием обеих фаз добились преципитации хромосомной ДНК в пограничном слое. ДНК отобрали с помощью вытянутой пастеровской пипетки и отмыли в 200 мкл 70%-ного этанола. После повторного центрифугирования (5 мин, 14000 об/мин) супернатант удалили отсосом, ДНК высушили в течение 2 часов при комнатной температуре, а затем растворили в 100 мкл буферного раствора трис-ЭДТА.
3. Амплификация гена малонил-кофермент А-редуктазы
Для целенаправленной амплификации гена малонил-СоА-редукатзы, содержащегося в геномной ДНК Sulfolobus tokodaii, полученной в примере 2, применили полимеразную цепную реакцию (ПЦР) (Mullis et al., Cold Spring Harbor Symp. Quant. Biol., 51, стр.263-273, 1986). Ее провели в термосайклере (Biometra, Геттинген).
Применяли препаративную ПЦР с использованием полимеразы Pfu (Pfunds, Genaxxon). Полимераза Pfu имеет функцию 3'-5' экзонуклеазы (для "контрольного чтения").
Использовали следующие праймеры:
5'-ATTATCCCATGGGGAGAACATTAAAAGC-3' ("прямой праймер"; подчеркнуто пересечение NcoI; SEQ.-ID-Nr.21) и
5'-CGGGATCCTTACTTTTCAATATATCC-3' ("обратный праймер"; подчеркнуто пересечение BamHI; SEQ.-ID-Nr.22)
Для ПЦР применяли указанный в приведенной ниже таблице 5 реакционный состав. ПЦР проводили как реакцию с «горячим стартом», т.е., реакционный состав перед добавлением полимеразы Pfu инкубировали 2 мин при 95°С. Затем последовали 30 циклов по 1 минуте при 95°С, 1 минуте при 45°С и 5 минуте при 72°С, после чего был проведен последний этап продолжительностью 30 секунд при 45°С, 15 минут при 72°С, завершенный паузой при 6°С.
Получили фрагмент гена длиной 1,1 тыс.пар оснований.
4. Клонирование гена малонил-косрермент А-редуктазы
Для клонирования гена малонил-кофермент А-редуктазы из Sulfolobus tokodaii ген, прошедший амплификацию в примере 3, подвергли неспецифическому клонированию с использованием набора "pCR T7 Торо ТА Expression Kit" (Invitrogen, Карлсруэ) в вектор pCR Т7/СТ-Торо (Invitrogen, Карлсруэ). Клонирование выполняли согласно данным производителя.
Для изоляции плазмидной ДНК из 5 мл культур клеток трансформированной Е. coli TOP 10F', прошедших культивацию в течение ночи, подготовили плазмидную ДНК с помощью набора "QIAprep Spin Plasmid Miniprep Kit" производства Qiagen (Гильден) согласно данным изготовителя.
5. Создание экспрессирующего вектора
Для создания экспрессирующего вектора, включающего ген малонил-кофермент А-редуктазы, изолированный клонирующий вектор, полученный в примере 4, подвергают рестрикционному слиянию с помощью рестриктирующих ферментов Ncol и BamHl. Для этого 25-27 мкл плазмидной ДНК (экспрессирующий вектор рТгс99А или вектор pCR Т7/СТ-Торо со встроенным геном малонил-кофермент А-редуктазы) тщательно смешивают с 5 мкл реакционного буферного раствора в 10-кратной концентрации и 2-3 мкл рестриктирующего фермента (10 Ед/мкл; Fermentas, Санкт-Леон-Рот). Объем реакционного состава доводят дистиллированной водой до 50 мкл и инкубируют в течение 5 часов при температуре, указанной изготовителем. Перед дальнейшим использованием проводят осаждение этанолом. Для этого ДНК смешивают с 3 объемными частями 100%-ного этанола и 0,1 объемной части натриевого ацетатного буферного раствора 3 М (pH 5,3) и инкубируют в течение 2 часов или ночи при -80°С [???]. После этапа центрифугирования (20 мин, 14000 об/мин, 4°С, настольная центрифуга Eppendorf) осторожно отбирают супернатант и отмывают ДНК 3 объемными частями 70%-ного (об./об.) этанола. После инкубации при комнатной температуре в течение 10 мин проводят повторное центрифугирование (10 мин, 14000 об/мин, 4°С, настольная центрифуга Eppendorf) и удаляют супернатант. ДНК сушат при комнатной температуре в течение 1 часа, а затем растворяют в желательном объеме H2O или трис-ЭДТА-буферного раствора (10 мМ трис/HCl (pH 8,0), 1 мМ NaЭДТА).
Затем для удаления 5'-фосфатных групп линеаризованного двухцепочечного вектора применяют щелочную фосфатазу. Таким образом повышают эффективность клонирования, поскольку препятствуют обратной лигации вектора. Для дефосфорилирования вектора применяли щелочную фосфатазу из кишки теленка.
Дефосфорилирование проводили в том же буферном растворе, что и рестриктивное слияние. 50 мкл реакционного состава смешали с 1,5 мкл CIAP (Calf Intestine Alkaline Phosphatase, щелочной фосфатазы кишки теленка) (1Ед/мкл; Fermentas, Санкт-Леон-Рот) и инкубировали 30 мин при 37°С. Перед дальнейшим применением разрезанного и прошедшего дефосфорилирование вектора осуществили осаждение этанолом, как это описано выше.
Связывание инсертной ДНК с экспрессирующим вектором проводят с использованием Т4 ДНК-лигазы, причем плазмидную ДНК и инсертную ДНК применяют в молярном соотношении 1:3-1:6.
Маточные растворы:
Провести стерильную фильтрацию, хранить при комнатной температуре.
Объем порции реакционного состава равнялся 50 мкл. Объединяют плазмидную ДНК (2-10 мкл), инсертную ДНК (2-20 мкл), 5 мкл буферного раствора связывания с ДТЭ (50 мМ) и соответствующее количество стерильной дистиллированной воды, смешивают вихревым способом (вортекс), подвергают краткому центрифугированию, а затем инкубируют 5 мин при 45°С. Состав охлаждали на льду. Добавили 5 мкл 5 мМ АТФ и 1,5 мкл Т4 ДНК-лигазы (1 Ед/мкл; Fermentas; Санкт-Леон-Рот) и перемешали состав. Связывание проходило в течение ночи при 16°С.
Состав для связывания сразу применяли для преобразования клеток с соответствующими химическими качествами.
6. Трансформация клеток Е. Coli экспрессирующим вектором
Из одной колонии клеток Е. coli Rosetta 2 за ночь вырастили 5 мл культуры. На следующее утро 0,5-1,0 мл этой культуры привили 50 мл среды LB (Sambrook et al., "Molecular Cloning: A Laboratory Manual", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989). По прошествии 1,5-2 ч инкубации (37°С, встряхивание (180 об/мин)) была достигнута OD578нм 0,6. Клетки охладили на льду в течение 10 мин, а затем центрифугировали 5 мин при 5000 об/мин и 4°С (ротор GSA, центрифуга Sorvall). Супернатант выбросили, а клеточный осадок ресуспендировали в 2,7 мл холодного раствора 0,1 М CaCl2. После добавления 2,3 мл стерильного глицерина концентрацией 50% (об./об.) порции (по 300 мкл) клеточной суспензии распределили по реакционным сосудам емкостью 1,5 мл производства Eppendorf. Клетки, несущие необходимую способность (компетенцию), сразу заморозили в жидком азоте, а затем хранили при -80°С.
Для преобразования клеток аликвоту (300 мкл) клеток с соответствующей компетенцией оттаяли на льду и добавили к ней 25 мкл состава связывания. Состав осторожно перемешали и инкубировали на льду в течение 30 мин. После теплового шока (42°С, 1 мин) снова инкубировали на льду в течение 5 мин. Затем добавили 800 мкл среды LB (Sambrook et al., 1989) и встряхивали клетки в течение 1 ч при 37°С (Thermomixer, Eppendorf 5436). Перед нанесением мазка состава на среду LB концентрацию состава повысили. Для этого его центрифугировали в течение 1 мин при 10000 об/мин, удалили 750 мкл супернатанта, а клеточный осадок подвергли повторному созданию суспензии. Из этого концентрированного состава нанесли 50 мкл, 100 мкл и 200 мкл на пластины LB (Sambrook et al., 1989) с 100 мкг/мл ампициллина, и инкубировали их в течение ночи при 37°С в нагревательном шкафу. Пластины ополаскивали 1 мл среды LB. Затем этой клеточной суспензией привили 150 мл среды LB (с 100 мкг/мл ампициллина) в конической колбе с дефлектором емкостью 500 мл. Рост культур проходил при 37°С и 180 об/мин. Повышенную экспрессию осуществляли индукцией промотора в рТгс99А путем добавления 0,5 М ИПТГ (изопропил-β-D-тиогалактопиранозида) при OD578нм, равной 0,6. Прошедшие индукцию культуры инкубировали в течение 3 ч в указанных условиях, а затем собрали по достижении OD578нм = 2,7.
7. Доказательство ферментативной активности
Полученный в примере 6 штамм Е. coli пропустили через клеточную мельницу. Раздробленные клетки в течение 15 мин нагрели до 85°С. При этом тепловом осаждении ферменты, не обладающие термоустойчивостью, коагулируют и выпадают в осадок. Поскольку белок-продукт устойчив к нагреву, он остается в надосадочной жидкости. Для измерения активности малонил-кофермент А-редуктазы супернатант разбавили в соотношении 1:50 трис-магниевым буферным раствором (50 мМ трис/Cl, 1 мМ MgCl2, pH 8,1). К 500 мкл буферного раствора HIPS (100 мМ 2-(4-(2-Гидроксиэтил)-1-пиперазинил)-этансульфоновой кислоты/NaOH, 5 мМ MgCl2, 1 мМ дитиоэритритола), содержавшего 0,5 мМ НАДФ-Н, пипеткой добавили 30 мкл разбавленного или неразбавленного (для доказательства активности метилмалонил-кофермент А-редуктазы) супернатанта.
В первой порции реакцию запустили добавлением малонил-кофермента А, причем конечная концентрация составляла 0.5 мМ. Определяли снижение поглощения НАДФ-Н при длине волны 365 нм. Значение активности фермента составило 15,5 мкмоль/мин/мг белка (15,5 Ед/мг).
Во второй порции реакцию запустили добавлением метилмалонил-кофермента А (фирма Fluka, артикул №67767), причем конечная концентрация составляла 2,0 мМ. Определяли снижение поглощения НАДФ-Н. Полученное значение активности фермента составило 0,24 мкмоль/мин/мг белка (0,24 Ед/мг).
Из этих результатов следует, что полипептид, который кодирует ДНК, соответствующая SEQ.-ID-Nr. 03, катализирует как преобразование малонил-СоА, так и метилмалонил-СоА.
На моль использованного малонил-СоА или метилмалонил-СоА было окислено 1 моль НАДФ-Н. Из этого можно заключить, что ферментативная реакция ведет к образованию соответствующего полуальдегида.
Пример 3
Также ниже следует пояснение настоящего изобретения на третьем примере - на примере синтеза метакриловой кислоты посредством рекомбинантной клетки, способной синтезировать 3-гидроксиизомасляную кислоту, используя в качестве источника углерода глюкозу и получая метилмалоновый полуальдегид в качестве начального продукта. Для этого в С.glutamicum ATCC13032 осуществили в числе прочего повышенную экспрессию ферментов метилмалонил-кофермент А-мутазы (E1) и 3-гидроксиизобутират-дегидрогеназы (Е4).
1. Клонирование генов NCgl1470, NCgl1471 и NCgl1472 (АТФаза транспортной системы аргинина/орнитина. мутаза метилмалонил-кофермента А и мутаза метилмалонил-кофермента A, N-терминальный домен/субъединица) в рЕКЕ×2. конструкция рЕКЕ×2МСМ cgl
Для работы с ДНК использовали стандартные технологии, описанные в книге Sambrook, J. et al. (1989), "Molecular Cloning: a laboratory manual", 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York. Амплификацию ДНК проводили с помощью ДНК-полимеразы SAWADY Pwo (Peqlab Biotechnologie, Эрланген, Германия) или ДНК-полимеразы Platinum Pfx (Invitrogen, Карлсруэ, Германия). Если не указано иное, полимеразы применяли в соответствии с указаниями производителя. Олигонуклеотиды для амплификации с помощью ПЦР и введения точек рестрикции получили от фирмы MWG-Biotech (Эберсберг, Германия). Сконструированные штаммы обнаруживали с помощью ПЦР в колонии посредством полимеразы Taq Polymerase READYMIX fSigma, Тауфкирхен, Германия), а также подготовкой плазмид. Очистку и получение фрагментов ДНК проводили с помощью набора MinElute Gel Extraction Kit (Quiagen, Гильден, Германия) согласно данным изготовителя. Плазмидную ДНК выделяли с помощью набора Qiaprep spin Miniprep Kit (Quiagen, Гильден, Германия). Все сконструированные плазмиды верифицировали рестрикционным анализом с последующим секвенированием.
Для сооружения pEKEx2MCM_cgl использовали вектор рЕКЕх2 (Kleinertz et al., 1991 Gene 102:93), который позволяет осуществлять транскрипцию клонированных генов под контролем промотера tac, индуцируемого изопропил-β-D-тиогалактопиранозидом (IPTG), и репрессорной системы lac (laclq). Фрагмент ДНК размером 5,2 kb (тыс.пар оснований), кодирующий гены NCgl1470, NCgl1471 и NCgl1472, амплифицировали с помощью следующих олигонуклеотидов и ДНК из Corynebacterium glutamicum ATCC13032 в качестве шаблона:
pcg1859-57_прямой (SEQ.-ID-Nr.23):
5'-cggtcaacaaggagatatagataTGACTGATCTCACAAAGACTGC-3,
и
pcg1859-59_обратный (SEQ.-ID-Nr.24):
5'-cTTAGGCTTTGTCGAACGCCTCC-3'.
(Большими буквами выделены последовательности, комплементарные геномным).
Дополнительно в амплификаты ввели точки рестрикции (подчеркнуты) и места связывания рибосом (ааггаг) за 8 нуклеотидов до стартового кодона. При этом изначальный стартовый кодон ТТГ заменили на АТГ. ПЦР-амплификат фосфорилировали с помощью полинуклеотидкиназы (Roche, Базель, Швейцария) и тупым концом клонировали в точку Smal вектора pUC19 (Yanisch-Perron et al., 1985, Gene 33:103-19). Идентичность и правильность инсерта размером 5,2kb подтвердили секвенированием. Затем из производного pUC19 выделили фрагмент размером 5,2 kb как фрагмент Sa/I и произвели лигацию в точку Sa/I вектора pEKE×2. Основываясь на рестрикционном слиянии, выбрали плазмиды правильной ориентации и обозначили один из них как рЕКЕх2МСМ cgl. Полученный плазмид показан на фигуре 21.
2. Клонирование 3-гидроксиизобутират-дегидрогиназы из Thermus thermophilus в рЕКЕх2, конструирование рЕС-ХТ99А MMCoAR 3HIBDH
Ген 3-гидроксиизобутират-дегидрогиназы (3HIBDH) из Thermus thermophilus (TTHA0237) синтезировали, учитывая использование кодонов С.glutamicum. Оптимизированный по использованию кодонов ген (SEQ.-ID-Nr 25) синтезировали в вектор pGA4 (pGA4_3HIBDH, фигура 22). Благодаря слиянию вектора pGA4_3HIBDH с эндонуклеазами Kpnl и Ecl13611 ген 3HIBDH удалось связать с линеаризованными рестрикционными ферментами BamHI (с последующей реакцией дополнения) и Kpnl вектором pGA5_MMCoAR - вектором, который уже содержит последовательность, происходящую от мутазы метилмалонил-кофермента А из Sulfolobus tokodaii, под функциональным контролем экспрессии со стороны промотора Т7. Полученный вектор pGA5_MMCoAR_3HIBDH представлен на фигуре 23.
Из вектора pGA5_MMCoAR_3HIBDH путем слияния с Kpnl и Ecl13611 инсерт с метилмалонил-кофермент А-редуктазой и 3HIBDH клонировали в линеаризованный путем слияния с рестрикционными эндонуклеазами BamHI (с последующей реакцией дополнения) и Kpnl вектор-цель рЕСХТ99А (№ доступа: AY219684, фигура 24); полученный вектор - pECXT99A_MMCoAR_3HIBDH, фигура 25.
3. Изготовление клеток С.glutamicum, трансформированных генами рЕКЕх2МСМ cgl и рЕС-ХТ99А 3HIBDH varllMMCoAR.
Изготовление обладающих компетенцией клеток С.glutamicum АТСС13032 осуществляли так, как это описано у Tauch et al. (Curr Microbiol. 2002,45:362-367). ДНК из pEKEx2MCM_cgl и рЕС-XT99A_3HIBDH_varllMMCoAR ввели методом электропорации, а селекцию трансформированных клеток провели на сердечно-мозговом агаре фирмы Merck (Дармштадт, Германия) с добавлением 50 мг/л канамицина и 5 мг/л тетрациклина (Liebl et al. FEMS Microbiol Lett., 1989, 53:299-303). Из трансформированных клеток выделили плазмидную ДНК и охарактеризовали последнюю методом рестрикционного слияния. Таким образом получили С.glutamicum pEKEx2MCM_cgl/pEC-XT99A_3HIBDH_varllMMCoAR.
4. Культивация и синтез 3-гидроксиизомасляной кислоты
Единичную колонию С.glutamicum pEKEx2MCM_cgl/pEC-XT99A_3HIBDH_varllMMCoAR привили на 25 мл полной среды, содержащей 15 мкг/л канамицина и 5 мкг/л тетрациклина, и инкубировали в течение ночи при 30°С и 200 об./мин. В качестве контроля выращивали дикий тип без антибиотиков.
Культуры центрифугировали (10 мин, 4°С, 5292 × g) и отмыли соляным раствором (0,9% NaCl). Клетки ресуспендировали в 25 мл (в колбах емкостью 250 мл) среды GCXII с антибиотиками (15 мкг/л канамицина и 5 мкг/л тетрациклина). Провели индукцию несущего плазмиды штамма раствором 0,5 мМ (12,5 мкл маточного раствора 1 М) IPTG.
Минимальная среда CGXII (по Keilhauer et al., J Bacteriol. 1993, 175:5595-5603):
Соли растворили примерно в 800 мл бидистиллированной воды и с помощью КОН довели pH до 7. Для этого добавили около 20-25 пластинок КОН, а затем титровали 10N КОН до pH 7. Затем объем среды бидистиллированной водой довели до 900 мг и подвергли автоклавированию.
После автоклавирования добавили 1 мл раствора солей микроэлементов.
Раствор солей микроэлементов:
Соли растворяют в 100 мл деионизированной H2O и при этом подкисляют HCl (pH по бумажной полоске около 1). Затем раствор подвергают стерильной фильтрации.
К среде добавили 100 мл 50%-ной глюкозы (итоговая концентрация 5%); для получения итоговой концентрации 4% добавляют 80 мл 50%-ной глюкозы и 20 мл стерильной бидистиллированной воды.
К среде добавили 1 мл биотина (20 мг/100 мл), 60 мкг/л кофермента В12 (по прошествии 7 ч), 0,1 мМ пропионата (по прошествии 22 ч) и раствор солей микроэлементов.
По прошествии 27 часов в пробе удалось методом ионной хроматографии (Metrohm Compact IC 761 с автоматическим пробоотборником, подвижная фаза: 8 мМ NaOH; колонка: Dionex AS15 4×250 мм + предколонка AG15 4×50 мм; температура колонки: 25°С, поток: 1,4 мл/мин; детектор: Leitfahigkeit; объем впрыскивания 10: мкл; продолжительность элюции: 30 мин) определить 6 мг/л 3-гидроксиизомасляной кислоты (фигура 26). Идентификацию 3-гидроксиизомасляной кислоты подтвердили добавлением химически чистой 3-гидроксиизомасляной кислоты (30 мг/л, фигура 27).
5. Дегидратация 3-гидроксиизомасляной кислоты до метакрилата
К 5 мл раствора 3-гидроксиизомасляной кислоты (0,2 г/л), изготовленной согласно вышеприведенному примеру 4, добавили NaOH (0,06 мг). Раствор, перемешивая и охлаждая обратным холодильником, инкубировали при 185-195°С в вакууме (300 Торр). На протяжении 5 ч каждый час добавляли еще по 0,5 мг 3-гидроксиизомасляной кислоты в 5 мл. Для воспрепятствования полимеризации метакрилата раствор содержит 0,4 масс.% пара-метоксифенола. После инкубации в течение 24 ч реакцию завершили. Преобразование 3-гидроксиизомасляной кислоты в метакрилат составило более 90%. Метакриловую кислоту отделяют от реакционной среды дистилляцией.
Пример 4
Также ниже следует пояснение настоящего изобретения на четвертом примере - на примере синтеза метакриловой кислоты посредством рекомбинантной клетки Е.Coli, способной синтезировать 3-гидроксиизомасляную кислоту, получая в качестве начального продукта метилмалоновый полуальдегид, а в качестве промежуточного продукта - акрилоил-кофермент А.
Для преобразования источника углерода глицерина в 3-гидроксиизомасляную кислоту с помощью рекомбинантных клеток Е. coli в ряд экспрессионных плазмидов клонировали гены семи различных ферментов. Для этого применяли векторы Duet (Merck, Германия). Они представляют собой систему из четырех экспрессирующих векторов, которые совместимы друг с другом, а кроме того характеризуются различными маркерами резистентности к антибиотикам.
1. В частности, для преобразования глицерина в 3-гидроксиизомасляную кислоту клонировали гены, кодирующие следующие конкретные ферменты:
a) Глицерин-дегидратазу (ЕС 4.2.1.30)(ГД) из Klebsiella pneumoniae. Фермент катализирует аденозилкобаламин-зависимую дегидратацию глицерина до 3-ГПА (3-гидроксипропионового альдегида). Он состоит из 3 субъединиц (ГД-альфа, ГД-бета и ГД-гамма), кодируемых в K.pneumoniae тремя генами (gtdA, gIdB и gIdC) в одном опероне.
b) Фактор реактивации из K. pneumoniae. Поскольку глицерин инактивирует аденозилкобаламин-зависимые глицерин-дегидратазы, для преобразования глицерина в 3-ГПА необходима активность реактивирующего фактора. Фактор реактивации глицерин-дегидратазы из K. pneumoniae кодируют гены gdrA и gdrB.
c) Альдегид-дегидрогеназа AIdH из Е.coli. Для преобразования 3-ГПА в 3-гидроксипропионовую кислоту (3-ГП) провели амплификацию гена E. coli aldH.
d) Пропионил-кофермент А-синтаза (Pcs) из Chloroflexus aurantiacus (ее кодирует ген pcs). Пропионил-кофермент А-синтаза катализирует преобразование 3-ГП в Пропионил-кофермент А. Это трифункциональный фермент, содержащий три функциональных домена. Домен ацил-кофермент А-синтетазы (ACS) катализирует активацию от 3-ГП до 3-гидроксипропионил-СоА. Затем следует дегидратация до акрилил-СоА, катализируемая доменом еноил-СоА гидратазы (ЕСН) гена pcs. Наконец, домен еноил-СоА редуктазы (ECR) гена pcs катализирует NADPH-зависимое восстановление акрилил-СоА до пропионил-СоА. Для описанных здесь целей, однако, эта реакция значения не имеет, поскольку в нашем случае промежуточный продукт акрилил-СоА немедленно подвергается дальнейшему преобразованию следующим ферментом (кротонил-СоА карбоксилазой/редуктазой, см. ниже).
e) Кротонил-кофермент А карбоксилаза/редуктаза (фермент Е62)(Ccr) из Rhodobacter sphaeroides (ее кодирует ген ccR). Основная активность Ccr состоит в восстановительном карбоксилировании кротонил-кофермента А до этилмалонил-СоА. Фермент, однако, обладает широким спектром специфичности к субстратам и очень эффективно преобразует акрилил-кофермент А в метилмалонил-кофермент А.
f) Малонил-СоА редуктаза (Mcr, Е2 и Е3) из Sulfolobus tokodaii (ее кодирует ген mcr). Mcr предпочтительно катализирует NADPH-зависимое восстановление малонил-кофермента А до малонового полуальдегида. Она, однако, обладает также дополнительной активностью, субстратом которой является метилмалонил-кофермент А, и преобразует его в метилмалоновый полуальдегид.
g) 3-гидроксиизобутират-дегидрогеназа (Е4)(3-ГИБ-ДГ) из Thermus thennophilus (кодируемая геном MmsB). Этот фермент катализирует NADPH-зависимое обратимое преобразование метилмалонового полуальдегида в 3-гидроксиизомасляную кислоту (3-ГИБ).
2. Ниже подробно описана стратегия клонирования для гетерологической повышенной экспрессии вышеописанных ферментов.
а) Конструирование плазмиды pACYCDuet-KpGDRF для повышенной экспрессии фактора реактивации глицерин-дегидратазы (GDRF).
Сначала посредством ПЦР провели амплификацию генов gdrA Ссиноним ORF4) и gdrB (синоним ORF2b), кодирующих две субъединицы GDRF из К. pneumoniae. В качестве матрикса применяли хромосомальную ДНК штамма К. pneumoniae DSM2026.
Для амплификации gdrA применяли следующие олигонуклеотиды:
orf4fw(SEQ.-ID-Nr26):
5'-TGAAGATCCTAGGAGGTTTAAACATATGCCGTTAATAGCCGGGA
TTG-3'
orf4Salrv (SEQ.-ID-Nr. 27):
5'-TATATAGTCGACTTAATTCGCCTGACCGGCCAG-3';
(подчеркнута последовательность распознавания Sa/I).
Для амплификации gdrB применяли следующие олигонуклеотиды:
orf2bPcifw (SEQ.-ID-Nr. 28):
5'-TATATAACATGTCGCTTTCACCGCCAGGC-3'
(подчеркнута последовательность распознавания PciI).
orf2brv (SEQ.-ID-Nr. 29):
5'-CATATGTTTAAACCTCCTAGGATCTTCAGTTTCTCTCACTTAACGGCAGG-3').
Полученные продукты ПЦР затем объединили друг с другом посредством перекрестной ПЦР.
Для этого использовали следующие олигонуклеотиды:
orf2bNcofw (SEQ.-ID-Nr. 30):
(5'-TATATACCATGGCGCTTTCACCGCCAGGC-3'
(подчеркнута последовательность распознавания NcoI).
orf4Salrv (SEQ.-ID-Nr. 31):
5'-TATATAGTCGACTTAATTCGCCTGACCGGCCAG-3'
(подчеркнута последовательность распознавания Sa/I)
Полученный методом ПЦР продукт (2.220 пар оснований) очистили с помощью набора для очистки QIAquick от Qiagen, Гильден, в соответствии с указаниями производителя и связали его с вектором pCR-BluntII-TOPO, получив вектор pCR-BluntII-Topo-KpGDRF. Лигацию и последующую трансформацию в клетках Е. coli осуществляют в соответствии с указаниями изготовителя - Invitrogen Corporation, Карлсбад (набор Zero Blunt ТОРО PCR Cloning Kit).
Затем последовательность GDRF вырезали из вектора путем слияния pCR-BluntII-Topo-KpGDRF с PciI и Sa/I и связали с разрезанным Ncol и Sa/I дуэтным экспрессирующим вектором pACYC с получением pACYCDuet-KpGDRF (6.142 пар оснований).
b) Конструирование плазмиды pAS50_Ec_aldH для повышенной экспрессии глицерин-дегидратазы (ГД) K. pneumoniae и альдегид-дегидрогеназы aIdH Е. coli.
Три субъединицы ГД K. pneumoniae естественным образом организованы в один оперон (гены gIdA, gIdB и gIdC). Провели их амплификацию методом ПЦР, причем в качестве матрицы снова использовали хромосомную ДНК K. pneumoniae DSM2026.
Для амплификации применяли следующие олигонуклеотиды:
KpGDNdefw (SEQ.-ID-Nr. 32):
5'-TATATACATATGAAAAGATCAAAACGATTTGCAGTACTGG-3'
(подчеркнута последовательность распознавания NdeI).
KpGDSalrv (SEQ.-ID-Nr. 33);
5'-TATATAGTCGACTTAGCTTCCTTTACGCAGCTTATGC-3'
(подчеркнута последовательность распознавания Sa/I)
Амплификат связали с вектором pCR-Bluntll-TOPO, получив вектор pCR-BluntII-Topo-KpGD. Лигацию и последующую трансформацию в клетках E. coli осуществляли в соответствии с указаниями изготовителя - Invitrogen Corporation, Карлсбад (набор Zero Blunt TOPO PCR Cloning Kit).
Кодирующий ГД фрагмент с помощью XbaI (затупленного методом fill in по Кленову) и NdeI вырезали из вектора pCR-Bluntll-Topo-KpGD и связали с разрезанным посредством NdeI и EcoRV дуэтным экспрессирующим вектором рЕТ, получив плазмиду pAS50 (8161 пар оснований).
Затем провели амплификацию гена aIdH из Е. coli. Для этого в качестве шаблона использовали хромосомную ДНК Е. coli K12, а в качестве праймера - следующие олигонуклеотиды:
1228_ald_fp (SEQ.-ID-Nr. 34):
5'-AAAACATATGAATTTTCATCATCTGGCTTACTGG-3'
(подчеркнута последовательность распознавания NdeI) и
1228_ald_rp (SEQ.-ID-Nr. 35):
(5'-AAAACATATGTATATTTCCTTCTTTCAGGCCTCCAGGCTTATCCAGATG-3')
(подчеркнута последовательность распознавания NdeI).
После ПЦР амплификат очистили прохождением через гель, а затем ввели слиянием с NdeI в точку NdeI плазмиды pAS50 и получили при этом плазмиды pAS50_Ec_aldH (9.666 пар оснований).
с) Конструирование плазмиды pCDFDuet-1_Rs_ccR_Cau_pcs для повышенной экспрессии пропионил-коферментА-синтазы (pcs) из Chloroflexus aurantiacus, а также кротон ил-кофермент А карбоксилазы/редуктазы (CCR) из Rhodobacter sphaeroides.
Для гетерологической экспрессии в Е. coli и очистки CCR ген клонировали в экспрессирующий вектор pET3d с получением плазмиды рТЕ13: Ген R. sphaeroides ccr подвергли амплификации посредством ПЦР с применением следующих олигонуклеотидов:
ccr-fw (SEQ.-ID-Nr.36):
5'-GGAGGCAACCATGGCCCTCGACGTGCAGAG-3'
(подчеркнута последовательность распознавания NcoI) и
ccr-rev (SEQ.-ID-Nr. 37):
5'-GAGACTTGCGGATCCCTCCGATCAGGCCTTGC-3'
(подчеркнута последовательность распознавания BamHI),
причем в качестве шаблона применяли хромосомную ДНК штамма R. sphaeroides 2.4.1 (DSMZ 158). Продукт ПЦР как фрагмент NcoI/BamHI связали с разрезанным с помощью NcoI/BamHI вектором pET3d (Merck, Германия), причем получили плазмидурТЕ13.
Из рТЕ13 переклонировали ген ссг как фрагмент NcoI/BamHI в точки резки NcoI/BamHI плазмида pCDFDuet-1 (Merck, Германия), причем получили плазмиду pCDFDuet-1_Rs_ccr.
Затем провели амплификацию гена pcs С.aurantiacus с олигонуклеотидами
1228_Cau_pcs_fp(71) (SEQ.-ID-Nr. 38):
5'-AAAACATATGATCGACACTGCGCCCCTTGC-3'
(подчеркнута последовательность распознавания Ndel) и
1228_Cau_pcs_fp(74) (SEQ.-ID-Nr. 39):
5'-AAGACGTCCTACCGCTCGCCGGCCGTCC-3'
(подчеркнута последовательность распознавания AatII).
причем в качестве шаблона применяли хромосомную ДНК штамма C.aurantiacus OK-70-fl (DSM 636). После очистки экстракцией в геле амплификат связали посредством объединения с NdeI/AatII с соответствующим образом разрезанным вектором pCDFDuet-1_Rs_ccr, причем получили плазмид pCDFDuet-1_Rs_ccR_Cau_pcs (10472 bp).
d) Конструирование плазмиды pCOLADuet_St_mcr_oCg_Tth_HIBDH_oCg для избыточной экспрессии малонил-СоА редуктазы (Mcr) из Sulfolobus tokodaii, a также 3-гидроксиизобутират-дегидрогеназы (3-ГИБ-ДГ) из Thermus thennophilus
Сначала посредством синтеза гена изготовили вариант гена S. tokodaii mcr (St_mcr_oCg), измененный так, чтобы получить возможность использовать кодоны Corynebacten'um glutamicum. Синтез проводили на фирме GeneArt, Германия, а искусственный ген St_mcr_oCg был представлен в форме плазмида pGA4_MMCoAR_ST (идентификационный № последовательности 40). pGA4_MMCoAR_ST DNA использовали как шаблон ПЦР, чтобы провести амплификацию искусственного гена St_mcr_oCg со следующими олигонуклеотидами:
1228_MMCoAR_fp (SEQ.-ID-Nr. 41):
5'-AACCATGGGCCGCACCCTGAAGG-3' (подчеркнута последовательность распознавания NcoI) и
1228_MMCoAR_rp (SEQ.-ID-Nr. 42):
5'-AAGGATCCTTACTTTTCGATGTAGCCCTTTTCC-3' (подчеркнута последовательность распознавания BamHI),
После очистки экстракцией в геле амплификат объединили с NcoI/BamHI и ввели в соответствующие точки связывания плазмида pCOLADuet_1 (Merck, Германия), причем получили плазмиду pCOLADuet_St_mcr_oCg.
Методом синтеза гена также изготовили вариант гена MmsB (кодирует 3-ГИБ-ДГ) Т. thermophilus, измененный так, чтобы получить возможность использовать кодоны Corynebactenum glutamicum (GeneArt, Германия), в форме плазмиды pGA4_3HIBDH_TT (SEQ.-ID-Nr. 43).
pGA4_3HIBDH_TT использовали как шаблон ПЦР, чтобы провести амплификацию гена Tth_HIBDH_oCg с олигонуклеотидами
1228_Tth_HIBDH_fp (SEQ.-ID-Nr. 44):
5'-AAAACATATGGAAAAGGTGGCATTCATCG-3'
(подчеркнута последовательность распознавания Ndel) и
1228_Tth_HIBDH_rp (SEQ.-ID-Nr. 45):
5'-AAAAGATCTTTAGCGGATTTCCACACCGCC-3'
(подчеркнута последовательность распознавания Bg/II).
После экстракции в геле амплификат разрезали с помощью NdeI/Bg/II и ввели в точки разреза NdeI/BgIII плазмида pCOLADuet_St_mcr_oCg, причем получили плазмид pCOLADuet_St_mcr_oCg_Tth_HIBDH_oCg (5.620 пар оснований).
е) Затем четыре плазмиды - pACYCDuet-KpGDRF, pAS50_Ec_aIdh, pCDFDuet-1_Rs_ccR_Cau_pcs и pCOLADuet_St_mcr_oCg_Tth_HIBDH_oCg - в соответствии с протоколом производителя совместно трансформировали в коммерческие клетки Е. coli BL21 (DE3), (Merck, Германия), обладающие химической компетентностью. Селекцию проводили на агаре Лурия-Бертани, в который добавили ампициллин (25 мкг/мл), хлорамфеникол (17 мкг/мл), канамицин (15 мкг/мл) и стрептомицин (25 мкг/мл).
f) Индукция экспрессирующих плазмид в Е. coli
Описанные выше в разделе е) штаммы E. coli, несущие плазмиды, культивировали в модифицированной среде М9 (6,8 г/л Na2HPO4×2H2O; 3 г/л KH2PO4; 0,5 г/л NaCl; 1 г/л NH4Cl; 1,25 г/л экстракта дрожжей; 1%об./об. глицерина; 15 мг/л CaCl2×2H2O; 250 мг/л MgSO4×7H2O; 1% об./об. витаминного раствора Gibco MEM; 41,9 г/л N-морфолин-пропансульфоновой кислоты). В среду добавили ампициллин (25 мкг/мл), хлорамфеникол (17 мкг/мл), канамицин (15 мкг/мл) и стрептомицин (25 мкг/мл). Всю культивацию (предварительные и основные культуры) осуществляли на встряхивающем устройстве с подогревом при 37°С. Сначала штаммы культивировали в 5 мл среды в течение ночи. Затем 20 мл среды в колбе с дефлектором емкостью 100 мл привили ночной культурой в соотношении 1:20 и продолжили культивацию. По достижении OD600 около 0,8 добавили 6 мкМ кобаламина и 1 мкМ IPTG и инкубировали в течение еще 4 часов. В этот момент отбирали 2,5 мл клеточной суспензии и хранили ее до анализа при - 20°С.
g) Качественное и количественное определение 3-ГИБ проводили методом ионной хроматографии и детектирования по электропроводности. Для этого оттаивали пробы объемом 2,5 мл при комнатной температуре и центрифугировали их (10 мин 13200 об./мин). Супернатант очищали с помощью шприцевого фильтра (размер пор 0,44 мкм). Измерение проводили на Metrohm Compact IC 761 с автоматическим пробоотборником. Подвижная фаза: 8 мМ NaOH. колонка: Dionex AS15 4×250 мм, предколонка АГ15 4×50 мм. Температура колонки: 25°С. Скорость потока: 1,4 мл/мин. Объем впрыскивания: 10 мкл.
h) Дегидратация 3-гидроксиизомасляной кислоты до метакрилата
К 5 мл концентрированного раствора 3-гидроксиизомасляной кислоты (0,2 г/л), изготовленной согласно способу, описанному в f), перемешивая, добавили NaOH (0,06 мг). Раствор, перемешивая и охлаждая с обратным холодильником, инкубировали при 185-195°С в вакууме (300 Торр). На протяжении 5 ч каждый час добавляли еще по 0,5 мг 3-гидроксиизомасляной кислоты в 5 мл. Для воспрепятствования полимеризации метакрилата раствор содержит 0,4 масс.% параметоксифенола. После инкубации в течение 24 ч реакцию завершили. Преобразование 3-гидроксиизомасляной кислоты в метакрилат составило более 90%. Метакриловую кислоту отделяют от реакционной среды дистилляцией.
Реферат
Изобретение относится к биохимии и представляет собой способ получения метакриловой кислоты или сложных эфиров метакриловой кислоты. Способ включает следующие этапы: 1А) синтез 3-гидроксиизомасляной кислоты путем контактирования бактериальной клетки, которая обладает повышенной по сравнению со своим диким типом активностью ферментов метилмалонил-кофермента А-мутазы и 3-гидроксиизобутират-дегидрогеназы, с питательной средой, содержащей в качестве источника углерода содержащий глюкозу сахар, в условиях, в которых из источника углерода через метилмалоновый полуальдегид образуется 3-гидроксиизомасляная кислота, при необходимости, отделение образовавшейся 3-гидроксиизомасляной кислоты от питательной среды, а также, при необходимости, нейтрализацию 3-гидроксиизомасляной кислоты, 1В) дегидратацию 3-гидроксиизомасляной кислоты с образованием метакриловой кислоты, а также, при необходимости, этерификацию метакриловой кислоты. Изобретение позволяет упростить способ получения метакриловой кислоты или сложных эфиров метакриловой кислоты. 27 ил., 4 пр., 5 табл.

Комментарии