Полипептиды, обладающие антимикробной активностью, и полинуклеотиды, кодирующие их - RU2415150C2
Код документа: RU2415150C2
Чертежи














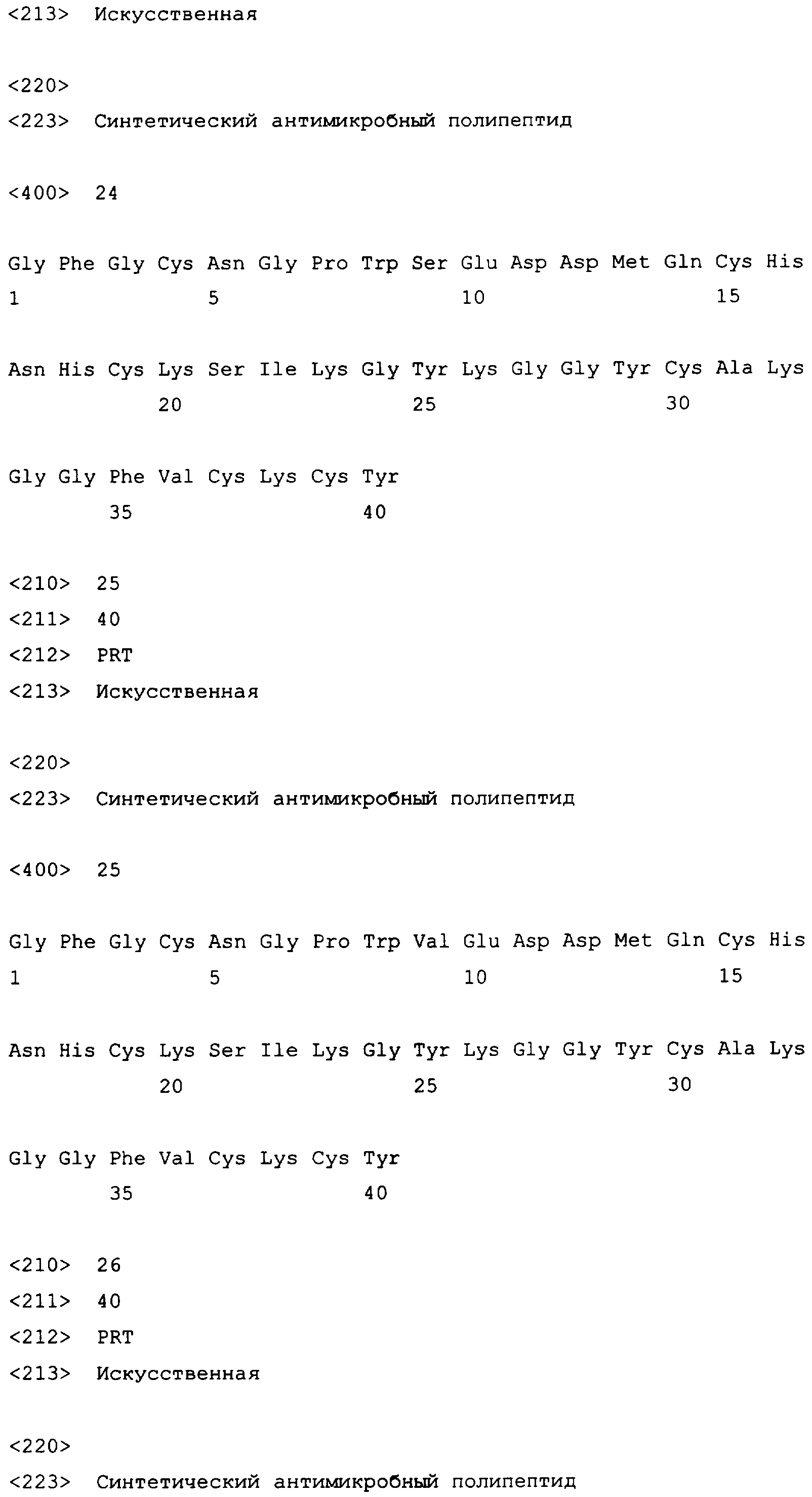



































































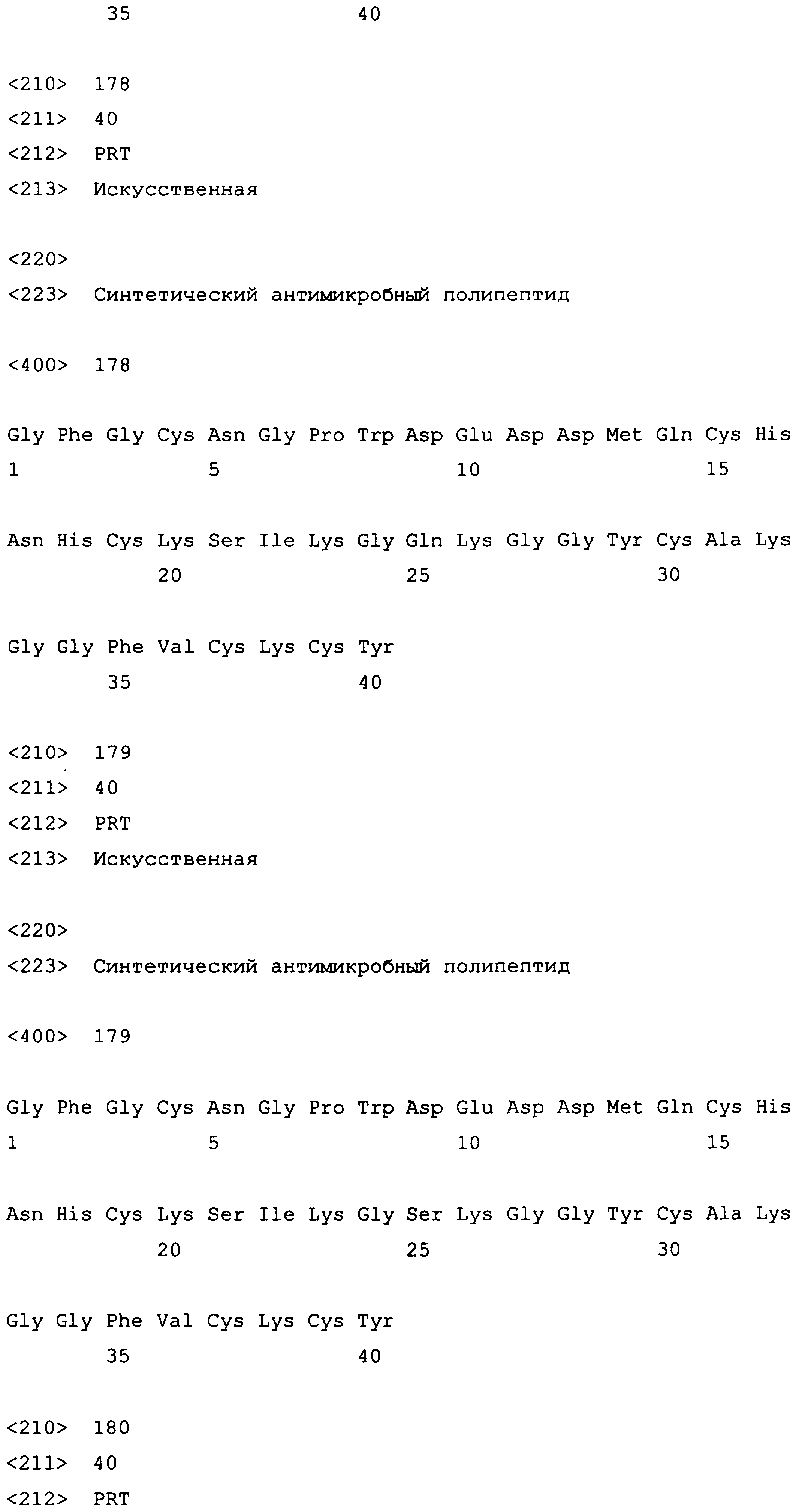






















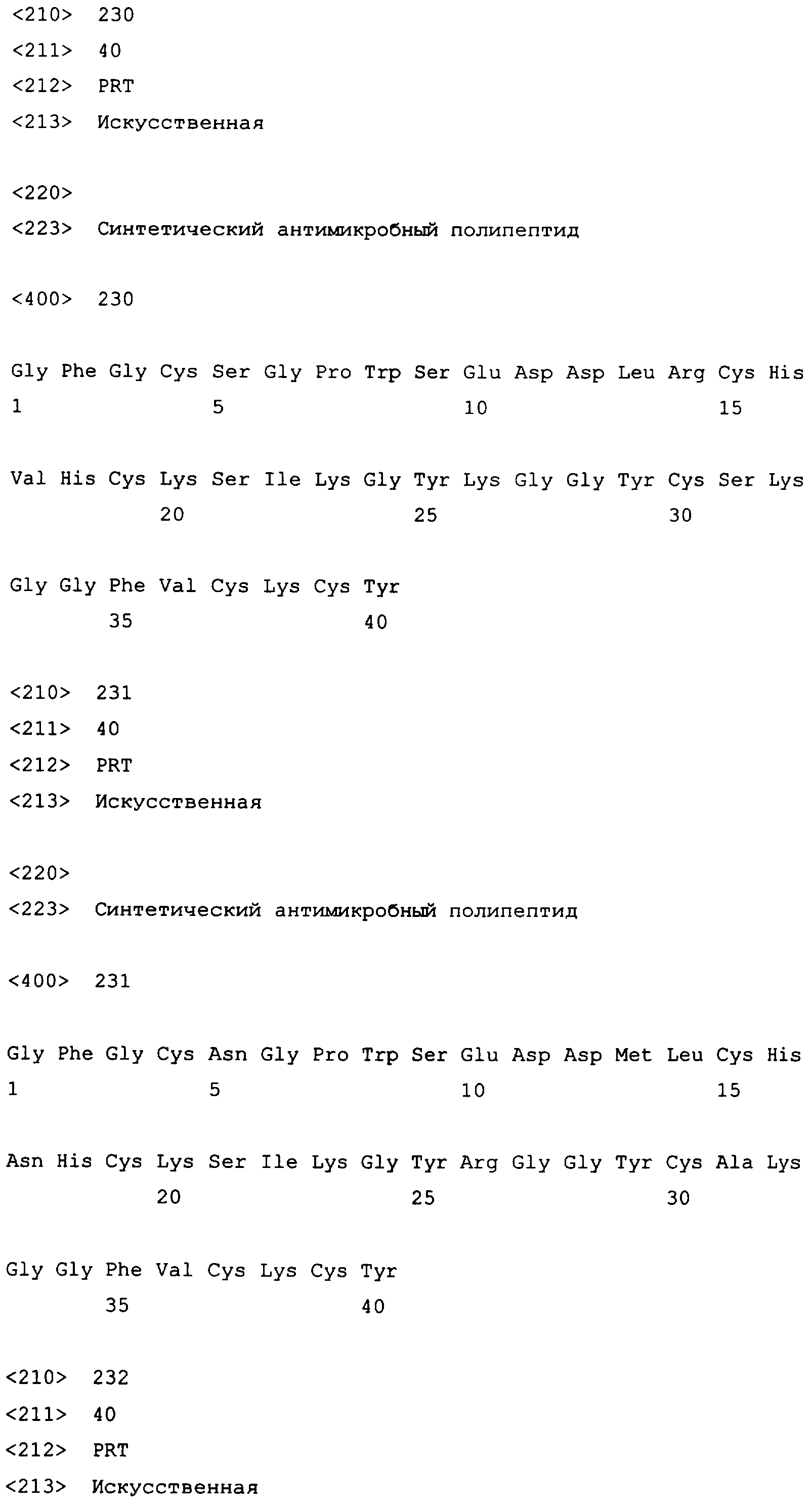



















Описание
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к выделенным полипептидам, обладающим антимикробной активностью, и к выделенным полинуклеотидам, кодирующим эти полипептиды. Изобретение также относится к конструкциям нуклеиновых кислот, векторам и клеткам-хозяевам, содержащим эти полинуклеотиды, а также к способам получения и применения этих полипептидов.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является получение полипептидов, обладающих улучшенной антимикробной активностью. Эти полипептиды могут проявлять сниженную гемолитическую активность и/или сниженную цитотоксичность. Эти полипептиды также могут демонстрировать пониженную чувствительность к катионам, таким как Ca2+, Mg2+, Na+. Эти полипептиды также могут демонстрировать спектр антимикробного действия, отличный от SEQ ID NO:1.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к полипептиду, обладающему антимикробной активностью, который содержит аминокислотную последовательность, предпочтительно состоит из аминокислотной последовательности, которая по меньшей мере на 80% идентична аминокислотам с 1 по 40 аминокислотной последовательности:
G-X1-G-C-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-C-H-X12-X13-C-X14-X15-X16-X17-X18-X19-X20-G-G-X21-C-X22-X23-X24-X25-X26-X27-C-X28-C-X29;
где
X1=F, L, W или I; предпочтительно X1=F;
X2=N, R, Q, V, G, S, A, K, L, M, D, H или Y; предпочтительно X2=N, R, Q, V, G, S, A, K или Y;
X3=G, R, A или K; предпочтительно X3=G;
X4=P, A, L, V, K или R; предпочтительно X4=P, K или R;
X5=W или R;
X6=D, A, G, K, L, T, N, F, H, M, P, Q, S, C, I, R, V или Y; предпочтительно X6=D, A, G, K, L, T, N, F, H, M, P, Q, S, V или Y;
X7=E, G, A, L, C, Q или S; предпочтительно X7=E, G или S;
X8=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M, A, C или R; предпочтительно X8=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M или R;
X9=D или P; предпочтительно X9=D;
X10=M, R, S, V, A, F, G, L, T, Y, W, E или K; предпочтительно X10=M, R, S, V, G, Y, L, F, T, W или K;
X11=Q, R, L, F, G, H, S, A, C, I, K, M, P, T, V, W или Y; предпочтительно X11=Q, R, L, F, G, H, S, K или Y;
X12=N, R, I, Y, V, K, T, Q, S, F, A, W, E или H;
X13=H, A, F, Q, T, V или L; предпочтительно X13=H или L;
X14=K, Q или R; предпочтительно X14=K или R;
X15=S, A, V, N или F;
X16=I, L, M, T, W или V; предпочтительно X16=I, L или V;
X17=K, T или R;
X18=G, H, K, A, P, F, I, Q, R, S, T, Y или N; предпочтительно X18=G, H, R, K или N;
X19=Y, H, K, L, M, N, Q, S, V или R; предпочтительно X19=Y или R;
X20=K, F, H, T, C или R; предпочтительно X20=K или R;
X21=Y, F, R, A, H, L, M, S или W; предпочтительно X21=Y, F, R или W;
X22=A, K, N, Q, T, E, H, I, R, S, V, G или Y; предпочтительно X22=A, K, N, Q, T, S или Y;
X23=K, R или T; предпочтительно X23=K или R;
X24=G, K, Q, E, N, S, T, A или R; предпочтительно X24=G, K, Q, A или R;
X25=G, K, H, W или R; предпочтительно X25=G, K или R;
X26=F, A, H, I, M, V, W, R или L; предпочтительно X26=F или L;
X27=V, L, M, I, K, Q, R или T; предпочтительно X27=V, L, M или T;
X28=K, H, N или R; предпочтительно X28=K или R;
X29=Y, I, YRCG или YR; предпочтительно X29=Y или YR;
и идентичность которой менее 100% аминокислотам с 1 по 40 SEQ ID NO:1.
Настоящее изобретение также относится к конструкциям нуклеиновых кислот, рекомбинантным векторам экспрессии и рекомбинантным клеткам-хозяевам, содержащим эти полинуклеотиды.
Настоящее изобретение также относится к способам получения таких полинуклеотидов, обладающих антимикробной активностью, включающим в себя (a) культивирование рекомбинантной клетки-хозяина, которая содержит конструкцию нуклеиновой кислоты, содержащую полинуклеотид, кодирующий этот полипептид в условиях, способствующих продукции этого полипептида; и (b) извлечение этого полипептида.
Настоящее изобретение также относится к способам применения полипептидов по изобретению.
ОПРЕДЕЛЕНИЯ
Антимикробная активность: термин «антимикробная активность» здесь определяется как активность, способная уничтожать или подавлять рост микробных клеток. В контексте настоящего изобретения термин «антимикробная» означает, что имеет место бактерицидный, и/или бактериостатический, и/или фунгицидный, и/или фунгистатический эффект, и/или вирулицидный эффект, где под термином «бактерицидный» подразумевается способность уничтожать бактериальные клетки. Под термином «бактериостатический» подразумевается способность подавлять бактериальный рост, то есть подавление роста бактериальных клеток. Под термином «фунгицидный» подразумевается способность уничтожать клетки грибов. Под термином «фунгистатический» подразумевается способность подавлять рост грибов, то есть подавлять рост клеток грибов. Под термином «вирулицидный» подразумевается способность инактивировать вирусы. Термин «микробные клетки» означает клетки бактерий или грибов (в том числе дрожжей).
В контексте настоящего изобретения термин «подавление роста микробных клеток» означает, что клетки не находятся в состоянии роста, то есть, что они не способны размножаться.
Для целей настоящего изобретения антимикробную активность можно определить в соответствии со способом, описанным Lehrer et al., Journal of Immunological Methods, Vol. 137 (2) pp. 167-174 (1991). Альтернативно, антимикробную активность можно определить в соответствии с руководствами NCCLS (Национального комитета по клиническим и лабораторным стандартам) от CLSI (Институт клинических и лабораторных стандартов; ранее известный как Национальный комитет по клиническим и лабораторным стандартам).
Полипептиды с антимикробной активностью могут обладать способностью снижать число живых клеток Escherichia coli (DSM 1576) до 1/100 через 24 часа (предпочтительно через 12 часов, более предпочтительно через 8 часов, более предпочтительно через 4 часа, более предпочтительно через 2 часа, наиболее предпочтительно через 1 час, и, в частности, через 30 минут) инкубации при 20°C в водном растворе 25% (мас./мас.); предпочтительно в водном растворе 10% (мас./мас.); более предпочтительно в водном растворе 5% (мас./мас.); еще более предпочтительно в водном растворе 1% (мас./мас.); наиболее предпочтительно в водном растворе 0,5% (мас./мас.); и, в частности, в водном растворе 0,1% (мас./мас.) полипептидов, обладающих антимикробной активностью.
Полипептиды с антимикробной активностью также могут обладать способностью подавлять разрастание Escherichia coli (DSM 1576) в течение 24 часов при 25°C в ростовом субстрате для микробных клеток, при добавлении в концентрации 1000 ppm (частей на миллион); предпочтительно при добавлении в концентрации 500 ppm; более предпочтительно при добавлении в концентрации 250 ppm; еще более предпочтительно при добавлении в концентрации 100 ppm; наиболее предпочтительно при добавлении в концентрации 50 ppm; и, в особенности, при добавлении в концентрации 25 ppm.
Полипептиды с антимикробной активностью могут обладать способностью снижать количество живых клеток Bacillus subtilis (ATCC 6633) до 1/100 через 24 часа (предпочтительно через 12 часов, более предпочтительно через 8 часов, более предпочтительно через 4 часа, более предпочтительно через 2 часа, наиболее предпочтительно через 1 час, и, в особенности, через 30 минут) инкубации при 20°C в водном растворе 25% (мас./мас.); предпочтительно в водном растворе 10% (мас./мас.); более предпочтительно в водном растворе 5% (мас./мас.); еще более предпочтительно в водном растворе 1% (мас./мас.); наиболее предпочтительно в водном растворе 0,5% (мас./мас.); и, в особенности, в водном растворе 0,1% (мас./мас.) полипептидов, обладающих антимикробной активностью.
Полипептиды с антимикробной активностью также обладают способностью подавлять разрастание Bacillus subtilis (ATCC 6633) в течение 24 часов при 25°C в ростовом субстрате для микробных клеток, при добавлении в концентрации 1000 ppm; предпочтительно при добавлении в концентрации 500 ppm; более предпочтительно при добавлении в концентрации 250 ppm; еще более предпочтительно при добавлении в концентрации 100 ppm; наиболее предпочтительно при добавлении в концентрации 50 ppm; и, в особенности, при добавлении в концентрации 25 ppm.
Полипептиды по настоящему изобретению имеют по меньшей мере 20%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, еще более предпочтительно по меньшей мере 90%, наиболее предпочтительно по меньшей мере 95%, и даже еще более предпочтительно по меньшей мере 100% антимикробную активностью полипептида, состоящего из последовательности аминокислот, показанной в виде аминокислот с 1 по 40 любой из последовательностей с SEQ ID NO:3 по SEQ ID NO:225 или любой из последовательностей с SEQ ID NO:226 по SEQ ID NO:251, или любой из последовательностей с SEQ ID NO:252 по SEQ ID NO:274.
Дефенсин: используемый здесь термин «дефенсин» относится к полипептидам, определяемым специалистом в данной области как принадлежащие к антимикробным пептидам класса дефенсинов. Для определения, является ли полипептид по изобретению дефенсином, аминокислотную последовательность предпочтительно сравнивают с профилями скрытой марковской модели (HMM профили) базы данных PFAM, используя широкодоступное программное обеспечение HMMER (смотри Пример 7).
PFAM семейства дефенсинов включают в себя Дефенсин_1 или «дефенсин млекопитающих» (регистрационный номер PF00323), Дефенсин_2 или «дефенсин членистоногих» (регистрационный номер PF01097), Дефенсин_бета или «бета-дефенсин» (регистрационный номер PF00711), Дефенсин_пропеп или «пропептид дефенсина» (регистрационный номер PF00879) и гамма-тионин или «семейство гамма-тионина» (регистрационный номер PF00304).
Дефенсины могут принадлежать классу альфа-дефенсинов, классу бета-дефенсинов, классу тета-дефенсинов, классам дефенсинов насекомых или членистоногих, или классу дефенсинов растений.
В варианте осуществления изобретения аминокислотная последовательность дефенсина по изобретению включает в себя 4, 5, 6, 7 или 8 остатков цистеина, предпочтительно 4, 5 или 6 остатков цистеина, более предпочтительно 4 или 6 остатков цистеина, и наиболее предпочтительно 6 остатков цистеина.
Дефенсины также могут быть синтетическими дефенсинами, имеющими общие характерные признаки дефенсина любого класса.
Примеры таких дефенсинов включают в себя, но не только, α-дефенсин HNP-1 (нейтрофильный пептид человека) HNP-2 и HNP-3; β-дефенсин-12, дрозомицин, гелиомицин, γ1-пуротионин, дефенсин А насекомых и дефенсины, описанные в заявках PCT WO 99/53053, WO 02/06324, WO 02/085934, PCT/DK2005/000725, PCT/DK2005/000735 и PCT/DK2006/000155.
Выделенный полипептид: используемый здесь термин «выделенный полипептид» относится к полипептиду, который является чистым по меньшей мере на 20%, предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 60%, еще более предпочтительно по меньшей мере на 80%, наиболее предпочтительно по меньшей мере на 90%, и даже еще более предпочтительно по меньшей мере на 95%, по данным SDS-PAGE.
По существу чистый полипептид: термин «по существу чистый полипептид» здесь означает полипептидный препарат, который максимально содержит 10%, предпочтительно максимально 8%, более предпочтительно максимально 6%, более предпочтительно максимально 5%, более предпочтительно максимально 4%, максимально 3%, еще более предпочтительно максимально 2%, наиболее предпочтительно максимально 1%, даже еще более предпочтительно максимально 0,5% по массе другого полипептидного вещества, с которым он нативно связан. То есть, следовательно, предпочтительно, чтобы по существу чистый полипептид был чистым по меньшей мере на 92%, предпочтительно по меньшей мере на 94%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98%, еще более предпочтительно по меньшей мере на 99%, наиболее предпочтительно по меньшей мере на 99,5%, даже еще более предпочтительно на 100% по массе всего полипептидного вещества, присутствующего в препарате.
Полипептиды по настоящему изобретению предпочтительно находятся по существу в чистой форме. В частности, предпочтительно, чтобы полипептиды были в «преимущественно чистой форме», т.е. чтобы полипептидный препарат был преимущественно свободным от других полипептидных веществ, с которыми он нативно связан. Это можно осуществить, например, путем получения полипептида с помощью хорошо известных рекомбинантных способов или классических способов очистки.
Здесь термин «по существу чистый полипептид» является синонимом терминам «выделенный полипептид» и «полипептид в выделенной форме».
Вариант: термин «вариант» здесь определяется как антимикробный полипептид, содержащий одно или несколько изменений, таких как замены, вставки, делеции и/или усечения одного или нескольких определенных аминокислотных остатков в одном или нескольких определенных положениях полипептида.
Нумерация вариантов: в настоящем изобретении в вариантах антимикробных полипептидов используется определенная нумерация положений аминокислотных остатков. Например, путем выравнивания аминокислотных последовательностей известных антимикробных полипептидов, любому аминокислотному остатку возможно присвоить номер положения аминокислоты в антимикробном полипептиде.
Используя систему нумерации, которая берет начало из аминокислотной последовательности антимикробного полипептида, представленной в SEQ ID NO:1, выровненную с аминокислотной последовательностью ряда других антимикробных полипептидов, возможно указать положение аминокислотного остатка в антимикробном полипептиде в областях структурной гомологии.
Многочисленные выравнивания последовательностей белков могут быть сделаны, например, с использованием «Clustal W» (Thompson, J.D., Higgins, D.G. and Gibson, T.J., 1994, CLUSTAL W: Improving the sensitivity of progressive multiple sequence alignment through sequence weighting, positions-specific gap penalties and weight matrix choice, Nucleic Acids Research 22: 4673-4680). Многочисленные выравнивания последовательностей ДНК могут быть сделаны с использованием выравнивания белка в качестве матрицы, заменяя аминокислоты соответствующего кодона из ДНК последовательности.
Алгоритмы попарного сравнения последовательностей, принятые повсеместно, приспособлены для выявления совпадений между белковыми последовательностями, которые не отклоняются от участка идентичности последовательности приблизительно на 20-30% (Doolittle, 1992, Protein Sci. 1: 191-200; Brenner et al., 1998, Proc. Natl. Acad. Sci. USA 95, 6073-6078). Однако истинно гомологичные белки с одинаковой укладкой и сходными биологическими функциями зачастую отклонялись к участку, где традиционным, основанным на последовательностях, сравнением не удается обнаружить их родство (Lindahl and Elofsson, 2000, J. Mol. Biol. 295: 613-615). Большая точность поиска, основанного на последовательностях, может быть достигнута с использованием программ поиска, в которых используются вероятностные представления семейств белка (профили) для поисковых баз данных. Например, в программе PSI-BLAST профили генерируются через повторяющийся процесс поиска по базе данных, и эта программа способна выявлять отдаленные гомологи (Atschul et al., 1997, Nucleic Acids Res. 25: 3389-3402). Еще большая точность может быть достигнута, если семейство или суперсемейство для белка, представляющего интерес, имеет одного или нескольких типичных представителей в базах данных белковых структур. В таких программах, как GenTHREADER (Jones 1999, J. Mol. Biol. 287: 797-815; McGuffin and Jones, 2003, Bioinformatics 19: 874-881), используется информация из целого ряда источников (PSI-BLAST, прогнозирование вторичной структуры, профили структурных выравниваний и потенциалы сольватации) в качестве вводимых данных в нейросеть, которая прогнозирует структурную укладку для заданной последовательности. Подобным образом способ по Gough et al., 2000, J. Mol. Biol. 313: 903-919 может быть использован для выравнивания последовательности неизвестной структуры с моделями суперсемейств, которые находятся в базе данных SCOP. Эти выравнивания в свою очередь могут быть использованы для генерации гомологичных моделей для белка, представляющего интерес, и такие модели для точности можно оценивать с использованием разнообразных инструментов, разработанных для этой цели.
Для выведения и получения структурных выравниваний белков известной структуры доступно несколько инструментов и ресурсов. Например, суперсемейства белков SCOP сруктурно выравнивали, и эти выравнивания открыты для доступа и могут быть загружены. Эти выравнивания могут быть использованы для прогноза структурно и функционально соответствующих аминокислотных остатков в белках в пределах одного и того же структурного суперсемейства. Эта информация, помимо информации, полученной от моделирования гомологов и поиска по профилю, может быть использована для прогнозирования, какие остатки должны мутировать при перемещении мутаций, представляющих интерес, от одного белка к близкому или отдаленному гомологу.
В описании различных вариантов антимикробных полипептидов по настоящему изобретению описанная ниже номенклатура приспособлена для простоты приведения ссылки. Во всех случаях используется принятая IUPAC однобуквенная или трехбуквенная аббревиатура аминокислоты.
Для аминокислотной замены используется следующая номенклатура: исходная аминокислота, положение, замещенная аминокислота (аминокислоты). Соответственно, замена треонина аланином в положении 226 обозначается как «T226A»; а замена тирозина на тирозин и аргинин в положении 40 (фактически добавление аргинина после тирозина) обозначается как «Y40YR». Множественные мутации разделяются дополнительными знаками («+»), например, «G205R + S411F», представляя мутации в положениях 205 и 411 замены глицина (G) аргинином (R) и серина (S) фенилаланином (F) соответственно.
Родительский антимикробный полипептид: используемый здесь термин «родительский» антимикробный полипептид означает антимикробный полипептид, с которым были произведены модификации, например замена (замены), вставка (вставки), делеция (делеции) и/или усечение (усечения) для получения вариантов антимикробного полипептида по настоящему изобретению. Этот термин также относится к полипептиду, с которым вариант сравнивают или выравнивают. Родительский полипептид может быть природным (дикого типа) или это может быть даже его вариантом, полученным любым подходящим способом. Например, родительский белок может быть вариантом природного полипептида, аминокислотная последовательность которого была модифицирована или изменена. Родительский полипептид также может быть аллельным вариантом, который представляет собой полипептид, кодируемый любой из двух или нескольких альтернативных форм гена, занимающего тот же хромосомный локус.
Идентичность: родство между двумя аминокислотными последовательностями или между двумя нуклеотидными последовательностями описывается критерием «идентичность».
Для целей настоящего изобретения степень идентичности между двумя аминокислотными последовательностями определяется с использованием программы FASTA, включенной в версии 2.0x программного пакета FASTA (смотри W. R. Pearson и D. J. Lipman (1988), «Improved Tools for Biological Sequence Analysis», PNAS 85:2444-2448; и W. R. Pearson (1990) «Rapid and Sensitive Sequence Comparison with FASTP and FASTA», Methods in Enzymology 183:63-98). Используемая матрица выставления баллов представляла собой BLOSUM50, штраф за разрыв составлял -12, штраф за продолжение делеции составлял -2.
Степень идентичности между двумя нуклеотидными последовательностями определяется с использованием того же алгоритма и программного обеспечения, которые описаны выше. Используемая матрица баллов представляла собой матрицу идентичности, штраф за разрыв составлял -16, а штраф за продолжение делеции составлял -4.
Альтернативно, выравнивание двух аминокислотных последовательностей определяется с помощью программы Needle из пакета EMBOSS (http://emboss.org) версии 2.8.0. Программа Needle обеспечивает выполнение алгоритма глобального выравнивания, описанного у Needleman, S. B. и Wunsch, C. D. (1970) J. Mol. Biol. 48, 443-453. Используемая матрица замен представляла собой BLOSUM62, штраф на внесение делеции составляет 10, и штраф на продолжение делеции составляет 0,5. Степень идентичности между аминокислотной последовательностью по настоящему изобретению (такой как аминокислоты с 1 по 40 SEQ ID NO:1) и другой аминокислотной последовательностью вычисляют как число точных соответствий в выравнивании двух последовательностей, разделенное на длину (число аминокислотных остатков) последовательности по настоящему изобретению; или, альтернативно, выходные данные программы Needle, отмеченные «наиболее длинной идентичностью», используют как процент идентичности и вычисляют следующим образом: (идентичные остатки × 100)/(длина выравнивания - число разрывов в выравнивании). Результаты выражают в процентах идентичности.
Полипептидный фрагмент: термин «полипептидный фрагмент» определяется здесь как полипептид, имеющий одну или несколько аминокислот, удаленных с амино- и/или карбоксильного конца SEQ ID NO:2 или последовательностей, гомологичных ей, где этот фрагмент обладает антимикробной активностью.
Субпоследовательность: термин «субпоследовательность» определяется здесь как нуклеотидная последовательность, имеющая один или несколько нуклеотидов, удаленных с 5' и/или 3' конца SEQ ID NO:1 или последовательности, гомологичной ей, где эта субпоследовательность кодирует полипептидный фрагмент, обладающий антимикробной активностью.
Аллельный вариант: термин «аллельный вариант» здесь обозначает любую из двух или более альтернативных форм гена, занимающего тот же хромосомный локус. Аллельный вариант возникает в природе посредством мутации и может в результате приводить к полиморфизму в пределах популяций. Мутации генов могут быть молчащими (без изменения кодируемого полипептида) или могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельным вариантом полипептида является полипептид, кодируемый аллельным вариантом гена.
По существу чистый полинуклеотид: используемый здесь термин «по существу чистый полинуклеотид» относится к полинуклеотидному препарату, свободному от других посторонних или нежелательных нуклеотидов и в форме, подходящей для использования в системах получения генно-инженерных белков. Следовательно, по существу чистый полинуклеотид максимально содержит 10%, предпочтительно максимально 8%, более предпочтительно максимально 6%, более предпочтительно максимально 5%, более предпочтительно максимально 4%, более предпочтительно максимально 3%, еще более предпочтительно максимально 2%, наиболее предпочтительно максимально 1%, даже еще более предпочтительно максимально 0,5% по массе другого полинуклеотидного вещества, с которым он нативно связан. По существу чистый полинуклеотид, однако, может включать в себя встречающиеся в природе 5' и 3' нетранслируемые области, такие как промоторы и терминаторы. Предпочтительно, чтобы по существу чистый полинуклеотид был чистым по меньшей мере на 90%, предпочтительно по меньшей мере на 92%, более предпочтительно по меньшей мере на 94%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 97%, еще более предпочтительно по меньшей мере на 98%, наиболее предпочтительно по меньшей мере на 99%, даже еще более предпочтительно по меньшей мере на 99,5% по массе. Полинуклеотиды по настоящему изобретению предпочтительно находятся по существу в чистой форме. В частности, предпочтительно, чтобы полинуклеотиды, описанные здесь, находились в «преимущественно чистой форме», то есть, чтобы полинуклеотидный препарат был по существу свободным от другого полинуклеотидного вещества, с которым он нативно связан. Здесь термин «по существу чистый полинуклеотид» является синонимом терминам «выделенный полинуклеотид» и «полинуклеотид в изолированной форме». Полинуклеотиды могут быть геномными, кДНК, РНК, полусинтетического происхождения или представлять собой любую их комбинацию.
кДНК: термин «кДНК» здесь определяется как молекула ДНК, которая может быть получена путем обратной транскрипции из зрелой, сплайсированной молекулы мРНК из эукариотической клетки. кДНК лишена последовательностей интронов, которые обычно присутствуют в соответствующей геномной ДНК. Исходный, первичный РНК транскрипт является предшественником мРНК, который процессируется серией стадий до того, как предстанет в виде зрелой сплайсированной мРНК. Эти стадии включают в себя удаление интронных последовательностей, с помощью процесса, называемого сплайсингом. кДНК, полученная из мРНК, следовательно, лишена каких-либо интронных последовательностей.
Конструкция нуклеиновой кислоты: используемый здесь термин «конструкция нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты, либо одно-, либо двухцепочечной, которая выделена из природного гена или которая модифицирована, чтобы содержать сегменты нуклеиновых кислот, таким образом, что иначе она не существовала бы в природе. Термин «конструкция нуклеиновой кислоты» является синонимом термину «экспрессионная кассета», когда конструкция нуклеиновой кислоты содержит контрольные последовательности, необходимые для экспрессии кодирующей последовательности по настоящему изобретению.
Контрольная последовательность: термин «контрольная последовательность» определен здесь для включения всех компонентов, которые необходимы или являются благоприятными для экспрессии полинуклеотида, кодирующего полипептид по настоящему изобретению. Каждая контрольная последовательность может быть нативной или чужеродной для нуклеотидной последовательности, кодирующей этот полипептид. Такие контрольные последовательности включают в себя, но не только, лидерную последовательность, последовательность полиаденилирования, последовательность пропептида, промоторную, сигнальную пептидную последовательность и терминатор транскрипции. Минимально контрольные последовательности включают в себя промотор и стоп-сигналы транскрипции и трансляции. Контрольные последовательности могут быть снабжены линкерами с целью введения специфических сайтов рестрикции, облегчающих лигирование контрольных последовательностей с кодирующей областью нуклеотидной последовательности, кодирующей полипептид.
Оперативно связанный: термин «оперативно связанный» здесь означает конфигурацию, в которой контрольная последовательность расположена в соответствующем положении относительно кодирующей полинуклеотидной последовательности, таким образом, что контрольная последовательность направляет экспрессию кодирующей последовательности полипептида.
Кодирующая последовательность: при использовании здесь термин «кодирующая последовательность» означает нуклеотидную последовательность, которая непосредственно определяет аминокислотную последовательность ее белкового продукта. Границы кодирующей последовательности в основном определяются открытой рамкой считывания, которая обычно начинается стартовым кодоном ATG или альтернативными стартовыми кодонами, такими как GTG и TTG. Кодирующая последовательность может представлять собой ДНК, кДНК или рекомбинантную нуклеотидную последовательность.
Экспрессия: термин «экспрессия» включает в себя любую стадию, вовлеченную в продукцию полипептида, включая, но не ограничиваясь, транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
Вектор экспрессии: термин «вектор экспрессии» здесь определяется как линейная или кольцевая молекула ДНК, которая содержит полинуклеотид, кодирующий полипептид по изобретению и которая оперативно связана с дополнительными нуклеотидами, которые обеспечивают ее экспрессию.
Клетка-хозяин: используемый здесь термин «клетка-хозяин» включает в себя клетки любого типа, которые поддаются трансформации, трансфекции, трансдукции и подобному конструкцией нуклеиновой кислоты, содержащей полинуклеотид по настоящему изобретению.
Модификация: термин «модификация» здесь означает любую химическую модификацию полипептида, состоящего из аминокислот с 1 по 40 любой из последовательностей с SEQ ID NO:2 - SEQ ID NO: 225, или любой из последовательностей с SEQ ID NO:226 по SEQ ID NO:251, или любой из последовательностей с SEQ ID NO:252 по SEQ ID NO:274, а также генетические манипуляции с ДНК, кодирующей этот полипептид. Модификация (модификации) могут представлять собой замену (замены), делецию (делеции) и/или вставку (вставки) аминокислот(ы), а также замену (замены) в боковой цепи (боковых цепях) аминокислот; или использование неприродных аминокислот со сходными характеристиками в аминокислотной последовательности. В частности, модификация (модификации) могут представлять собой амидирования, например амидирование С-конца.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Полипептиды, обладающие антимикробной активностью
В первом аспекте настоящее изобретение относится к полипептиду, обладающему антимикробной активностью, который содержит, предпочтительно, состоит из аминокислотной последовательности, которая по меньшей мере на 70% идентична (предпочтительно по меньшей мере на 80% идентична, более предпочтительно по меньшей мере на 85% идентична, еще более предпочтительно по меньшей мере на 90% идентична, еще более предпочтительно по меньшей мере на 95% идентична, наиболее предпочтительно на 97% идентична, и, в частности на 100% идентична) аминокислотам с 1 по 40 аминокислотной последовательности (I):
G-X1-G-C-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-C-H-X12-X13-C-X14-X15-X16-X17-X18-X19-X20-G-G-X21-C-X22-X23-X24-X25-X26-X27-C-X28-C-X29;
где
X1=F, L, W или I; предпочтительно X1=F;
X2=N, R, Q, V, G, S, A, K, L, M, D, H или Y; предпочтительно X2=N, R, Q, V, G, S, A, K или Y; более предпочтительно X2=N, R, S или G;
X3=G, R, A или K; предпочтительно X3=G;
X4=P, A, L, V, K или R; предпочтительно X4=P, K или R;
X5=W или R;
X6=D, A, G, K, L, T, N, F, H, M, P, Q, S, C, I, R, V или Y; предпочтительно X6=D, A, G, K, L, T, N, F, H, M, P, Q, S, V или Y; более предпочтительно X6=D, S, A, G или N;
X7=E, G, A, L, C, Q или S; предпочтительно X7=E, G или S;
X8=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M, A, C или R; предпочтительно X8=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M или R; более предпочтительно X8=D, G или N;
X9=D или P; предпочтительно X9=D;
X10=M, R, S, V, A, F, G, L, T, Y, W, E или K; предпочтительно X10=M, R, S, V, G, Y, L, F, T, W или K; более предпочтительно X10=M, L, G или V;
X11=Q, R, L, F, G, H, S, A, C, I, K, M, P, T, V, W или Y; предпочтительно X11=Q, R, L, F, G, H, S, K или Y; более предпочтительно X11=Q, K, R или F;
X12=N, R, I, Y, V, K, T, Q, S, F, A, W, E или H; более предпочтительно X12=N, R, V или Q;
X13=H, A, F, Q, T, V или L; предпочтительно X13=H или L;
X14=K, Q или R; предпочтительно X14=K или R;
X15=S, A, V, N или F;
X16=I, L, M, T, W или V; предпочтительно X16=I, L или V;
X17=K, T или R;
X18=G, H, K, A, P, F, I, Q, R, S, T, Y или N; предпочтительно X18=G, H, R, K или N; более предпочтительно X18=G или R;
X19=Y, H, K, L, M, N, Q, S, V или R; предпочтительно X19=Y или R;
X20=K, F, H, T, C или R; предпочтительно X20=K или R;
X21=Y, F, R, A, H, L, M, S или W; предпочтительно X21=Y, F, R или W;
X22=A, K, N, Q, T, E, H, I, R, S, V, G или Y; предпочтительно X22=A, K, N, Q, T, S или Y; более предпочтительно X22=A, S или T;
X23=K, R или T; предпочтительно X23=K или R;
X24=G, K, Q, E, N, S, T, A или R; предпочтительно X24=G, K, Q, A или R; более предпочтительно X24=G или A;
X25=G, K, H, W или R; предпочтительно X25=G, K или R;
X26=F, A, H, I, M, V, W, R или L; предпочтительно X26=F или L;
X27=V, L, M, I, K, Q, R или T; предпочтительно X27=V, L, M или T; более предпочтительно X27=V или L;
X28=K, H, N или R; предпочтительно X28=K или R;
X29=Y, I, YRCG или YR; предпочтительно X29=Y или YR;
и которая менее чем на 100% идентична аминокислотам с 1 по 40 SEQ ID NO:1.
В варианте осуществления полипептид по изобретению представляет собой полипептид, обладающий антимикробной активностью, который содержит, предпочтительно, состоит из аминокислотной последовательности, которая имеет по меньшей мере 70% идентичность (предпочтительно по меньшей мере 80% идентичность, более предпочтительно по меньшей мере 85% идентичность, еще более предпочтительно по меньшей мере 90% идентичность, еще более предпочтительно по меньшей мере 95% идентичность, наиболее предпочтительно 97% идентичность, и в частности 100% идентичность) аминокислотам с 1 по 40 аминокислотной последовательности (II):
G-F-G-C-X1-G-X2-X3-X4-X5-X6-D-X7-X8-C-H-X9-X10-C-X11-S-X12-X13-X14-X15-X16-G-G-X17-C-X18-K-X19-X20-X21-X22-C-K-C-X23;
где
X1=N, R, Q, V, G, S, A, K или Y; предпочтительно X1=N, R, S или G;
X2=P, K или R;
X3=W или R;
X4=D, A, G, K, L, T, N, F, H, M, P, Q, S, V или Y; предпочтительно X4=D, S, A, G или N;
X5=E, G или S;
X6=D, F, G, N, V, Y, H, K, L, P, S, T, W, I, M или R; предпочтительно X6=D, G или N;
X7=M, R, S, V, G, Y, L, F, T, W или K; предпочтительно X7=M, L, G или V;
X8=Q, R, L, F, G, H, S, K или Y; предпочтительно X8=Q, K, R или F;
X9=N, R, I, Y, V, K, T, S, Q или H; предпочтительно X9=N, R, V или Q;
X10=H или L;
X11=K или R;
X12=I, L или V;
X13=K или R;
X14=G, H, R, K или N; предпочтительно X14=G или R;
X15=Y или R;
X16=K или R;
X17=Y, F, R или W;
X18=A, K, N, Q, T, S или Y; предпочтительно X18=A, S или T;
X19=G, K, Q, A или R; предпочтительно X19=G или A;
X20=G, K или R;
X21=F или L;
X22=V, L, M или T; предпочтительно X22=V или L;
X23=Y или YR;
и которая имеет менее 100% идентичность аминокислотам с 1 по 40 SEQ ID NO:1.
В другом варианте осуществления аминокислотная последовательность (I) и/или (II) имеет 1, 2, 3, 4, 5, 6, 7 или 8 аминокислотных отличий по сравнению с аминокислотной последовательностью SEQ ID NO:1. Предпочтительно 1, 2, 3, 4, 5 или 6; более предпочтительно 1, 2, 3, 4 или 5; еще более предпочтительно 1, 2, 3 или 4; еще более предпочтительно 1, 2 или 3; и наиболее предпочтительно 1 или 2 аминокислотных отличий по сравнению с аминокислотной последовательностью SEQ ID NO:1.
В другом варианте осуществления аминокислотная последовательность (I) и/или (II) имеет по меньшей мере 60% идентичность с аминокислотами с 1 по 40 SEQ ID NO:1, предпочтительно по меньшей мере 65% идентичность, по меньшей мере 70% идентичность, по меньшей мере 75% идентичность, по меньшей мере 80% идентичность, по меньшей мере 85% идентичность, по меньшей мере 90% идентичность, или по меньшей мере 95% идентичность с аминокислотами с 1 по 40 SEQ ID NO:1.
В другом варианте осуществления аминокислотная последовательность (I) и/или (II) имеет 0, 1, 2, 3, 4 или 5 вставок, предпочтительно 0, 1, 2 или 3 вставки, более предпочтительно 0, 1 или 2 вставки; и 0, 1, 2, 3, 4 или 5 делеций, предпочтительно 0, 1, 2 или 3 делеции, более предпочтительно 0, 1 или 2 делеции, по сравнению с SEQ ID NO:1, или любой из SEQ ID NO:3 - SEQ ID NO:225, или любой из SEQ ID NO:226 - SEQ ID NO:251, или любой из SEQ ID NO:252 - SEQ ID NO:274.
В другом варианте осуществления полипептид по изобретению содержит, предпочтительно, состоит из аминокислотной последовательности, которая по меньшей мере на 60% идентична (предпочтительно на 70% идентична, более предпочтительно на 80% идентична, еще более предпочтительно на 85% идентична, еще более предпочтительно на 90% идентична, еще более предпочтительно на 95% идентична, и наиболее предпочтительно на 100% идентична) аминокислотам с 1 по 40 любой из SEQ ID NO:3 - SEQ ID NO:225, или любой из SEQ ID NO:226 - SEQ ID NO:251, или любой из SEQ ID NO:252 - SEQ ID NO:274, предпочтительно любой из SEQ ID NO:3 - SEQ ID NO:117, или любой из SEQ ID NO:226 - SEQ ID NO:251, или любой из SEQ ID NO:252 - SEQ ID NO:274.
Термин «любая из SEQ ID NO:3 - SEQ ID NO:117» означает SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45, SEQ ID NO:46, SEQ ID NO:47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:56, SEQ ID NO:57, SEQ ID NO:58, SEQ ID NO:59, SEQ ID NO:60, SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72, SEQ ID NO:73, SEQ ID NO:74, SEQ ID NO:75, SEQ ID NO:76, SEQ ID NO:77, SEQ ID NO:78, SEQ ID NO:79, SEQ ID NO:80, SEQ ID NO:81, SEQ ID NO:82, SEQ ID NO:83, SEQ ID NO:84, SEQ ID NO:85, SEQ ID NO:86, SEQ ID NO:87, SEQ ID NO:88, SEQ ID NO:89, SEQ ID NO:90, SEQ ID NO:91, SEQ ID NO:92, SEQ ID NO:93, SEQ ID NO:94, SEQ ID NO:95, SEQ ID NO:96, SEQ ID NO:97, SEQ ID NO:98, SEQ ID NO:99, SEQ ID NO:100, SEQ ID NO:101, SEQ ID NO:102, SEQ ID NO:103, SEQ ID NO:104, SEQ ID NO:105, SEQ ID NO:106, SEQ ID NO:107, SEQ ID NO:108, SEQ ID NO:109, SEQ ID NO:110, SEQ ID NO:111, SEQ ID NO:112, SEQ ID NO:113, SEQ ID NO:114, SEQ ID NO:115, SEQ ID NO:116 или SEQ ID NO:117.
Термин «любая из SEQ ID NO:118 - SEQ ID NO:225» означает любую из SEQ ID NO:118, SEQ ID NO:119, SEQ ID NO:120, SEQ ID NO:121, SEQ ID NO:122, SEQ ID NO:123, SEQ ID NO:124, SEQ ID NO:125, SEQ ID NO:126, SEQ ID NO:127, SEQ ID NO:128, SEQ ID NO:129, SEQ ID NO:130, SEQ ID NO:131, SEQ ID NO:132, SEQ ID NO:133, SEQ ID NO:134, SEQ ID NO:135, SEQ ID NO:136, SEQ ID NO:137, SEQ ID NO:138, SEQ ID NO:139, SEQ ID NO:140, SEQ ID NO:141, SEQ ID NO:142, SEQ ID NO:143, SEQ ID NO:144, SEQ ID NO:145, SEQ ID NO:146, SEQ ID NO:147, SEQ ID NO:148, SEQ ID NO:149, SEQ ID NO:150, SEQ ID NO:151, SEQ ID NO:152, SEQ ID NO:153, SEQ ID NO:154, SEQ ID NO:155, SEQ ID NO:156, SEQ ID NO:157, SEQ ID NO:158, SEQ ID NO:159, SEQ ID NO:160, SEQ ID NO:161, SEQ ID NO:162, SEQ ID NO:163, SEQ ID NO:164, SEQ ID NO:165, SEQ ID NO:166, SEQ ID NO:167, SEQ ID NO:168, SEQ ID NO:169, SEQ ID NO:170, SEQ ID NO:171, SEQ ID NO:172, SEQ ID NO:173, SEQ ID NO:174, SEQ ID NO:175, SEQ ID NO:176, SEQ ID NO:177, SEQ ID NO:178, SEQ ID NO:179, SEQ ID NO:180, SEQ ID NO:181, SEQ ID NO:182, SEQ ID NO:183, SEQ ID NO:184, SEQ ID NO:185, SEQ ID NO:186, SEQ ID NO:187, SEQ ID NO:188, SEQ ID NO:189, SEQ ID NO:190, SEQ ID NO:191, SEQ ID NO:192, SEQ ID NO:193, SEQ ID NO:194, SEQ ID NO:195, SEQ ID NO:196, SEQ ID NO:197, SEQ ID NO:198, SEQ ID NO:199, SEQ ID NO:200, SEQ ID NO:201, SEQ ID NO:202, SEQ ID NO:203, SEQ ID NO:204, SEQ ID NO:205, SEQ ID NO:206, SEQ ID NO:207, SEQ ID NO:208, SEQ ID NO:209, SEQ ID NO:210, SEQ ID NO:211, SEQ ID NO:212, SEQ ID NO:213, SEQ ID NO:214, SEQ ID NO:215, SEQ ID NO:216, SEQ ID NO:217, SEQ ID NO:218, SEQ ID NO:219, SEQ ID NO:220, SEQ ID NO:221, SEQ ID NO:222, SEQ ID NO:223, SEQ ID NO:224 или SEQ ID NO:225.
Термин «любая из SEQ ID NO:226 - SEQ ID NO:251» означает любую из SEQ ID NO:226, SEQ ID NO:227, SEQ ID NO:228, SEQ ID NO:229, SEQ ID NO:230, SEQ ID NO:231, SEQ ID NO:232, SEQ ID NO:233, SEQ ID NO:234, SEQ ID NO:235, SEQ ID NO:236, SEQ ID NO:237, SEQ ID NO:238, SEQ ID NO:239, SEQ ID NO:240, SEQ ID NO:241, SEQ ID NO:242, SEQ ID NO:243, SEQ ID NO:244, SEQ ID NO:245, SEQ ID NO:246, SEQ ID NO:247, SEQ ID NO:248, SEQ ID NO:249, SEQ ID NO:250 или SEQ ID NO:251.
Термин «любая из SEQ ID NO:252 - SEQ ID NO:274» означает любую из SEQ ID NO:252, SEQ ID NO:253, SEQ ID NO:254, SEQ ID NO:255, SEQ ID NO:256, SEQ ID NO:257, SEQ ID NO:258, SEQ ID NO:259, SEQ ID NO:260, SEQ ID NO:261, SEQ ID NO:262, SEQ ID NO:263, SEQ ID NO:264, SEQ ID NO:265, SEQ ID NO:266, SEQ ID NO:267, SEQ ID NO:268, SEQ ID NO:269, SEQ ID NO:270, SEQ ID NO:271, SEQ ID NO:272, SEQ ID NO:273 или SEQ ID NO:274.
Термин «любая из SEQ ID NO:3 - SEQ ID NO:225» означает любую из последовательностей с SEQ ID NO:3 по SEQ ID NO:117 или любую из последовательностей с SEQ ID NO:118 по SEQ ID NO:225.
Термин «любая из SEQ ID NO:2 - SEQ ID NO:225» означает SEQ ID NO:2 или любую из последовательностей с SEQ ID NO:3 по SEQ ID NO:225.
Аминокислоты, составляющие полипептиды по изобретению, могут быть выбраны независимо из D или L форм. Предпочтительно полипептид по изобретению представляет собой полипептид дефенсина; более предпочтительно альфа-дефенсин, бета-дефенсин или дефенсин насекомого (членистоногого).
Полипептиды по изобретению могут демонстрировать более высокую или, по меньшей мере, равную, предпочтительно более высокую, антимикробную активность по сравнению с полипептидом SEQ ID NO:1, определенную в виде Минимальной ингибирующей концентрации (МИК), в отношении Stahylococcus carnosus ATCC51365, Stahylococcus aureus ATCC29213 или Stahylococcus aureus ATCC25923 в соответствии с руководствами NCCLS/CLSI, протокол M7-A6, vol. 20, No. 2: Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically.
В одном варианте осуществления настоящее изобретение относится к искусственным вариантам, содержащим консервативную замену, делецию и/или вставку одной или более аминокислот любой из последовательностей с SEQ ID NO:2 по SEQ ID NO:225, или любой из последовательностей с SEQ ID NO:226 по SEQ ID NO:251, или любой из последовательностей с SEQ ID NO:252 по SEQ ID NO:274. Предпочтительно, аминокислотные изменения являются незначительными по своей природе, то есть консервативные аминокислотные замены или вставки, которые существенным образом не влияют на укладку и/или активность белка; небольшие делеции, обычно от одной примерно до 10 аминокислот; небольшие удлинения на амино- или карбоксильном конце, такие как аминоконцевой остаток метионина; небольшой линкерный пептид примерно до 20-25 остатков; или небольшое удлинение, которое облегчает очистку, путем изменения суммарного заряда или другой функции, например, полигистидиновый тракт, антигенный эпитоп или связывающий домен.
Примеры консервативных замен находятся в пределах группы основных аминокислот (аргинин, лизин и гистидин), кислых аминокислот (глутаминовая кислота и аспарагиновая кислота), полярных аминокислот (глутамин и аспарагин), гидрофобных аминокислот (лейцин, изолейцин и валин), ароматических аминокислот (фенилаланин, триптофан и тирозин) и небольших аминокислот (глицин, аланин, серин, треонин и метионин). Аминокислотные замены, которые в основном не изменяют специфическую активность, известны в уровне техники и описаны, например, H. Neurath и R.L. Hill, 1979, In, The Proteins, Academic Press, New York. Наиболее часто встречающиеся замены представляют собой Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly.
Помимо 20 основных аминокислот, неосновные аминокислоты (такие как 4-гидроксипролин, 6-N-метиллизин, 2-аминоизомасляная кислота и альфа-метилсерин) могут быть заменены аминокислотными остатками полипептида дикого типа. Ограниченное число неконсервативных аминокислот, аминокислот, которые не кодируются генетическим кодом, и неприродных аминокислот может быть заменено аминокислотными остатками. «Неприродные аминокислоты» были модифицированы после синтеза белка и/или имеют химическую структуру в их боковой цепи (боковых цепях), отличную от химической структуры основных аминокислот. Неприродные аминокислоты могут быть химически синтезированы, и, предпочтительно, являются коммерчески доступными, и включают в себя пипеколиновую кислоту, тиазолидинкарбоновую кислоту, дегидропролин, 3- и 4-метилпролин и 3,3-диметилпролин.
Альтернативно, аминокислотные изменения представляют собой изменения такой природы, что изменяются физико-химические свойства полипептидов. Например, аминокислотные изменения могут улучшать термостабильность полипептида, изменять специфичность к субстрату, изменять оптимум рН и подобное.
Незаменимые аминокислоты в родительском полипептиде могут быть идентифицированы в соответствии с известными в уровне техники способами, такими как сайт-направленный мутагенез или сканирование мутагенеза аланина (Cunningham and Wells, 1989, Science 244: 1081-1085). В последнем способе в каждый остаток в молекуле вводят единичные аланиновые мутации и полученную в результате мутантную молекулу тестируют на биологическую активность (т.е. антимикробную активность) для идентификации аминокислотных остатков, которые являются определяющими для активности этой молекулы. Смотри, также, Hilton et al., 1996, J. Biol. Chem. 271: 4699-4708. Биологическое взаимодействие также можно определить физическим анализом структуры, определяемым такими методиками, как ядерно-магнитный резонанс, кристаллография, электронная дифракция или фотоаффинное мечение, совместно с мутацией предполагаемого участка контакта аминокислот. Смотри, например, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, J. Mol. Biol. 224: 899-904; Wlodaver et al., 1992, FEBS Lett. 309:59-64. Идентичности незаменимых аминокислот также можно прогнозировать на основе анализа идентичностей с полипептидами, родственными полипептиду по изобретению.
Единичные или множественные аминокислотные замены могут быть сделаны и протестированы с использованием известных способов мутагенеза, рекомбинации и/или перестановки с последующей релевантной процедурой скрининга, например, таких, как описано у Reidhaar-Olson и Sauer, 1988, Science 241: 53-57; Bowie и Sauer, 1989, Proc. Natl. Acad. Sci. USA 86: 2152-2156; WO 95/17413; или WO 95/22625. Другие способы, которые могут быть использованы, включают в себя ПЦР с внесением ошибок, фаговый дисплей (например, Lowman et al., 1991, Biochem. 30:10832-10837; патент США № 5223409; WO 92/06204) и мутагенез, направленный на определенный участок (Derbyshire et al., 1986, Gene 46:145; Ner et al., 1988, DNA 7:127).
Методы мутагенеза/перестановки можно объединить с высокопроизводительными автоматизированными методами скрининга для направления активности клонированных, подверженных мутагенезу полипептидов, экспрессируемых клетками-хозяевами. Подверженные мутагенезу молекулы ДНК, которые кодируют активные полипептиды, можно извлекать из клеток-хозяев и проводить быстрый сиквенс, используя стандартные методы уровня техники. Эти методы позволяют быстро определить значимость индивидуальных аминокислотных остатков в полипептиде, представляющем интерес, и их можно применять у полипептидов неизвестной структуры.
Общее число аминокислотных замен, делеций и/или вставок аминокислот с 1 по 40 любой из последовательностей с SEQ ID NO:2 по SEQ ID NO:225, или любой из последовательностей с SEQ ID NO:226 по SEQ ID NO:251, или любой из последовательностей с SEQ ID NO:252 по SEQ ID NO:274 составляет 10, предпочтительно 9, более предпочтительно 8, более предпочтительно 7, более предпочтительно максимально 6, более предпочтительно максимально 5, более предпочтительно 4, еще более предпочтительно 3, наиболее предпочтительно 2, даже еще более предпочтительно 1.
В другом аспекте настоящее изобретение относится к варианту родительского антимикробного полипептида, родительский антимикробный полипептид имеет по меньшей мере 60% идентичность аминокислотной последовательности SEQ ID NO:1, где вариант обладает антимикробной активностью и содержит замену в одном или нескольких положениях и где эти замены выбраны из:
F2L, F2W или F2I;
N5R, N5Q, N5V, N5G, N5S, N5A, N5K, N5L, N5M, N5D, N5H или N5Y;
G6R, G6A или G6K;
P7A, P7L, P7V, P7K или P7R;
W8R;
D9A, D9G, D9K, D9L, D9T, D9N, D9F, D9H, D9M, D9P, D9Q, D9S, D9C, D9I, D9R, D9V или D9Y;
E10G, E10A, E10L, E10C, E10Q или E10S;
D11F, D11G, D11N, D11V, D11Y, D11H, D11K, D11L, D11P, D11S, D11T, D11W, D11I, D11M, D11A, D11C или D11R;
D12P;
M13R, M13S, M13V, M13A, M13F, M13G, M13L, M13T, M13Y, M13W, M13E или M13K;
Q14R, Q14L, Q14F, Q14G, Q14H, Q14S, Q14A, Q14C, Q14I, Q14K, Q14M, Q14P, Q14T, Q14V, Q14W или Q14Y;
N17R, N17I, N17Y, N17V, N17K, N17T, N17S, N17Q, N17F, N17A, N17W, N17E или N17H;
H18A, H18F, H18Q, H18T, H18V или H18L;
K20Q или K20R;
S21A, S21V, S21N или S21F;
I22L, I22M, I22T, I22W или I22V;
K23R или K23T;
G24H, G24K, G24A, G24P, G24F, G24I, G24Q, G24R, G24S, G24T, G24Y или G24N;
Y25H, Y25K, Y25L, Y25M, Y25N, Y25Q, Y25S, Y25V или Y25R;
K26F, K26H, K26T, K26C или K26R;
Y29F, Y29R, Y29A, Y29H, Y29L, Y29M, Y29S или Y29W;
A31K, A31N, A31Q, A31T, A31E, A31H, A31I, A31R, A31S, A31V, A31G или A31Y;
K32R или K32T;
G33K, G33Q, G33E, G33N, G33S, G33T, G33A или G33R;
G34K, G34H, G34W или G34R;
F35A, F35H, F35I, F35M, F35V, F35W, F35R или F35L;
V36L, V36M, V36I, V36K, V36Q, V36R или V36T;
K38H, K38N или K38R; и
Y40I, Y40YRCG или Y40YR.
Предпочтительно родительский антимикробный полипептид имеет по меньшей мере 70% идентичность, более предпочтительно по меньшей мере 80% идентичность, еще более предпочтительно по меньшей мере 90% идентичность и наиболее предпочтительно 95% идентичность с аминокислотной последовательностью SEQ ID NO:1. В частности родительский антимикробный полипептид может быть идентичным аминокислотной последовательности SEQ ID NO:1.
В одном варианте осуществления родительский антимикробный полипептид представляет собой полипептид дефенсина; более предпочтительно альфа-дефенсин, бета-дефенсин или дефенсин насекомого (членистоногого). Предпочтительно родительская аминокислотная последовательность проявляет антимикробную активность.
В другом варианте осуществления родительский антимикробный полипептид имеет 1, 2, 3, 4, 5, 6, 7 или 8 аминокислотных отличий от аминокислотной последовательности SEQ ID NO:1. Предпочтительно 1, 2, 3, 4, 5 или 6; более предпочтительно 1, 2, 3, 4 или 5; еще более предпочтительно 1, 2, 3 или 4; еще более предпочтительно 1, 2 или 3; и наиболее предпочтительно 1 или 2 аминокислоты отличаются от аминокислотной последовательности SEQ ID NO:1.
N-концевое удлинение
N-концевое удлинение полипептидов по изобретению подходящим образом может состоять из 1-50 аминокислот, предпочтительно 2-20 аминокислот, в особенности 3-15 аминокислот. В одном варианте осуществления N-концевое удлинение пептида не содержит Arg (R). В другом варианте осуществления N-концевое удлинение содержит kex2 или kex2-подобный сайт расщепления, который будет дополнительно определен ниже. В предпочтительном варианте осуществления N-концевое удлинение представляет собой пептид, содержащий, по меньшей мере два Glu (E) и/или Asp (D) аминокислотных остатка, например, N-концевое удлинение, содержащее одну из следующих последовательностей: EAE, EE, DE и DD.
Сайты Kex2
Сайты Kex2 (смотри, например, Methods in Enzymology Vol 185, ed. D. Goeddel, Academic Press Inc. (1990), San Diego, CA, “Gene Expression Technology”) и kex2-подобные сайты представляют собой двухосновные участки распознавания (т.е. сайты расщепления), находящиеся между участком, кодирующим пропептид, и зрелой областью некоторых белков.
Было показано, что вставка сайта kex2 или kex2-подобного сайта в определенных случаях улучшает коррекцию процессинга эндопептидаз в сайте расщепления пропептида, приводя в результате к повышению уровней секреции белка.
В контексте изобретения вставка kex2 или kex2-подобного сайта в результате приводит к возможности получить расщепление в определенном положении N-концевого удлинения, с получением в результате антимикробного полипептида, удлиненного по сравнению с аминокислотами с 1 по 40 любой из последовательностей с SEQ ID NO:2 по SEQ ID NO:225, или любой из последовательностей с SEQ ID NO:226 по SEQ ID NO:251, или любой из последовательностей с SEQ ID NO:252 по SEQ ID NO:274.
Слитые полипептиды
Полипептиды по настоящему изобретению также включают в себя слитые полипептиды или расщепляемые слитые полипептиды, в которых другой полипептид слит на N-конце или C-конце полипептида по изобретению, или его фрагментом. Слитый полипептид получают путем слияния нуклеотидной последовательности (или ее части), кодирующей другой полипептид с нуклеотидной последовательностью (или ее частью) по настоящему изобретению. Технологии получения слитых полипептидов известны в уровне техники и включают в себя лигирование последовательностей, кодирующих полипептиды, таким образом, чтобы они находились в рамке, и чтобы экспрессия слитого полипептида находилась под контролем одного и того же промотора (промоторов) и терминатора.
Источники полипептидов, обладающих антимикробной активностью
Полипептид по настоящему изобретению может быть получен из микроорганизмов любого рода. Для целей настоящего изобретения используемый здесь термин «получен из» применительно к заданному источнику будет означать, что полипептид, кодируемый нуклеотидной последовательностью, продуцируется этим источником или штаммом, в который эта нуклеотидная последовательность из этого источника была встроена. В предпочтительном аспекте полипептид, полученный из заданного источника, секретируется внеклеточно.
Полипептид по настоящему изобретению может представлять собой бактериальный полипептид. Например, полипептид может представлять собой полипептид грамположительных бактерий, например, полипептид Bacillus, например, полипептид Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus coagulans, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus stearothermophilus, Bacillus subtilis или Bacillus thuringiensis; или полипептид Streptomyces, например, полипептид Streptomyces lividans или Streptomyces murinus; или полипептид грамотрицательных бактерий, например, полипептид E. coli или Pseudomonas sp.
Полипептид по настоящему изобретению также может представлять собой полипептид грибов и, более предпочтительно, полипептид дрожжей, например, полипептид Candida, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia; или более предпочтительно полипептид нитчатых грибов, например, полипептид Acremonium, Aspergillus, Aureobasidium, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Piromyces, Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium или Trichoderma.
В предпочтительном аспекте полипептид представляет собой полипептид Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis, или Saccharomyces oviformis, обладающий антимикробной активностью.
В другом предпочтительном аспекте полипептид представляет собой полипептид Aspergillus aculeatus, Aspergillus awamori, Aspergillus fumigatus, Aspergillus foetidus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides, Fusarium venenatum, Humicola insolens, Humicola lanuginosa, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei или Trichoderma viride.
Будет понятно, что в отношении перечисленных выше видов изобретение охватывает как совершенные, так и несовершенные стадии, и другие таксономические эквиваленты, например анаморфы, независимо от названия вида, под которым они известны. Специалистам в данной области будет легко распознать идентичность соответствующих эквивалентов.
Штаммы этих видов общедоступны в целом ряде коллекций культур, таких как American Type Culture Collection (ATCC), Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSM), Centraalbureau Voor Schimmelcultures (CBS) и Agricultural Research Service Patent Culture Collection, Northern Regional Research Center (NRRL).
Полипептиды по настоящему изобретению также включают в себя слитые полипептиды или расщепляемые слитые полипептиды, в которых другой полипептид является слитым на N-конце или на C-конце полипептида или его фрагмента. Слитый полипептид получают путем слияния нуклеотидной последовательности (или ее части), кодирующей другой белок, с нуклеотидной последовательностью по настоящему изобретению (или ее частью). Методики получения слитых полипептидов известны в уровне техники и включают в себя лигирование последовательностей, кодирующих полипептиды, так, чтобы они находились в рамке и чтобы экспрессия слитого полипептида находилась под контролем одного и того же промотора (промоторов) и терминатора.
Полинуклеотиды
Настоящее изобретение также относится к полинуклеотидам, имеющим нуклеотидную последовательность, которая кодирует полипептид по изобретению. В частности, настоящее изобретение относится к полинуклеотидам, состоящим из нуклеотидной последовательности, которая кодирует полипептид по изобретению. Вследствие вырожденности генетического кода специалисту будет легко установить, что может быть получено несколько нуклеотидных последовательностей, кодирующих каждый из полипептидов по изобретению. Из уровня техники хорошо известно, какие нуклеотиды составляют кодоны, кодирующие аминокислоты полипептидов по изобретению.
Настоящее изобретение также относится к полинуклеотидам, которые кодируют фрагменты аминокислотной последовательности, показанной как любая из последовательностей с SEQ ID NO:2 по SEQ ID NO:225, или любая из последовательностей с SEQ ID NO:226 по SEQ ID NO:251, или любая из последовательностей с SEQ ID NO:252 по SEQ ID NO:274, которые обладают антимикробной активностью. Субпоследовательность полинуклеотидов представляет собой нуклеотидную последовательность, где один или несколько нуклеотидов с 5' и/или 3' конца были удалены.
Нуклеотидная последовательность может быть получена стандартными процедурами клонирования, используемыми в генной инженерии для перемещения нуклеотидной последовательности из одного положения в другой участок, где она будет репродуцирована. Процедуры клонирования могут предусматривать удаление и выделение желаемого фрагмента, содержащего нуклеотидную последовательность, кодирующую полипептид, вставку этого фрагмента в векторную молекулу и включение рекомбинантного вектора в клетку-хозяина, где будут реплицироваться многочисленные копии или клоны этой нуклеотидной последовательности. Нуклеотидная последовательность может быть геномной, кДНК, РНК, полусинтетической, синтетического происхождения или представлять собой любую их комбинацию.
Модификация нуклеотидной последовательности, кодирующей полипептид по настоящему изобретению, может быть необходимой для синтеза полипептида, который содержит аминокислотную последовательность, которая имеет по меньшей мере одну замену, делецию и/или вставку по сравнению с аминокислотами с 1 по 40 любой из последовательностей с SEQ ID NO:2 по SEQ ID NO:225, или любой из последовательностей с SEQ ID NO:226 по SEQ ID NO:251, или любой из последовательностей с SEQ ID NO:252 по SEQ ID NO:274. Эти искусственные варианты могут отличаться по некоторым способам конструирования от полипептида, выделенного из его природного источника, например варианты, которые отличаются по специфической активности, термостабильности, оптимуму рН или подобному.
Специалистам в данной области будет очевидно, что такие замены могут быть сделаны вне областей, критических для функции молекулы, и все же в результате приведут к активному полипептиду. Аминокислотные остатки, необходимые для активности полипептида, кодируемого выделенным полинуклеотидом по изобретению, и, следовательно, предпочтительно не подвергаемые заменам, могут быть идентифицированы в соответствии с процедурами, известными в уровне техники, такими как сайт-направленный мутагенез или сканирующий аланином мутагенез (смотри, например, Cunningham, Wells, 1989, Science 244: 1081-1085). В последней методике мутации вводят в каждый положительно заряженный остаток в молекуле, и полученные в результате мутантные молекулы тестируют на антимикробную активность для идентификации аминокислотных остатков, которые являются значимыми для активности этой молекулы. Участки взаимодействия также можно определить с помощью анализа трехмерной структуры, установленной такими способами, как ядерный магнитный резонанс, кристаллография или фотоаффинное мечение (смотри, напрмер, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, Journal of Molecular Biology 224: 899-904; Wlodaver et al., 1992, FEBS Letters 309: 59-64).
Кроме того, нуклеотидная последовательность, кодирующая полипептид по настоящему изобретению, может быть модифицирована путем введения нуклеотидных замен, которые не дают начало другой аминокислотной последовательности полипептида, кодируемого этой полипептидной последовательностью, но которая соответствует кодону, используемому организмом-хозяином, предназначенным для получения антимикробного полипептида.
Конструкции нуклеиновой кислоты
Настоящее изобретение также относится к конструкциям нуклеиновой кислоты, содержащим выделенный полинуклеотид по настоящему изобретению, оперативно связанный с одной или несколькими контрольными последовательностями, которые направляют экспрессию кодирующей последовательности в подходящей клетке-хозяине в условиях, совместимых с контрольными последовательностями.
Для обеспечения экспрессии полипептида с выделенным полинуклеотидом, кодирующим полипептид по настоящему изобретению, можно проводить манипуляции различными путями. Манипуляции с полинуклеотидной последовательностью до ее вставки в вектор могут быть желательны или необходимы, в зависимости от вектора экспрессии. Методики модификации полинуклеотидных последовательностей, используя способы рекомбинантных ДНК, хорошо известны в уровне техники.
Контрольная последовательность может представлять собой соответствующую промоторную последовательность, нуклеотидную последовательность, которую распознает клетка-хозяин для экспрессии полинуклеотида, кодирующего полипептид по настоящему изобретению. Промоторная последовательность содержит последовательности контроля транскрипции, которые опосредуют экспрессию полипептида. Промотор может представлять собой любую нуклеотидную последовательность, которая проявляет транскрипционную активность в выбранной клетке-хозяине, в том числе мутантные, усеченные и гибридные промоторы, и может быть получен из генов, кодирующих внеклеточные и внутриклеточные полипептиды, либо гомологичные, либо гетерологичные клетке-хозяину.
Примерами подходящих промоторов для направления транскрипции конструкций нуклеиновых кислот по настоящему изобретению, особенно в бактериальной клетке-хозяине, являются промоторы, полученных из lac оперона E. coli, гена агаразы Streptomyces coelicolor(dagA), гена левансахаразы Bacillus subtilis(sacB), гена альфа-амилазы Bacillus licheniformis(amyL), гена мальтогенной амилазы Bacillus stearothermophilus(amyM), гена альфа-амилазы Bacillus amyloliquefaciens(amyQ), гена пенициллиназы Bacillus licheniformis(penP), генов xylA и xylB Bacillus subtilis, и гена бета-лактамазы прокариот (Villa-Kamaroff et al., 1978, Proceedings of the National Academy of Sciences USA 75: 3727-3731), а также tac промотор (DeBoer et al., 1983, Proceedings of the National Academy of Sciences USA 80: 21-25). Дополнительные промоторы описаны в «Useful proteins from recombinant bacteria» в Scientific American, 1980, 242: 74-94; и в Sambrook et al., 1989, supra.
Примерами подходящих промоторов для направления транскрипции конструкций нуклеиновой кислоты по настоящему изобретению в клетке-хозяине, представляющей собой нитчатый гриб, являются промоторы, полученные из генов амилазы TAKA Aspergillus oryzae, аспарагиновой протеиназы Rhizomucor miehei, нейтральной альфа-амилазы Aspergillus niger, стабильной кислой альфа-амилазы Aspergillus niger, глюкоамилазы Aspergillus niger или Aspergillus awamori(glaA), липазы Rhizomucor miehei, щелочной протеазы Aspergillus oryzae, триозофосфатизомеразы Aspergillus oryzae, ацетамидазы Aspergillus nidulans, амилоглюкозидазы Fusarium venenatum (WO 00/56900), Fusarium venenatum Daria (WO 00/56900), Fusarium venenatum Quinn (WO 00/56900), трипсин-подобной протеазы Fusarium oxysporum (WO 96/00787), бета-глюкозидазы Trichoderma reesei, целлобиогидролазы I Trichoderma reesei, эндоглюканазы I Trichoderma reesei, эндоглюканазы II Trichoderma reesei, эндоглюканазы III Trichoderma reesei, эндоглюканазы IV Trichoderma reesei, эндоглюканазы V Trichoderma reesei, ксиланазы I Trichoderma reesei, ксиланазы II Trichoderma reesei, бета-ксилозидазы Trichoderma reesei, а также промотор NA2-tpi (гибрид промоторов из генов нейтральной альфа-амилазы Aspergillus niger и триозофосфатизомеразы Aspergillus oryzae); и их мутантные, усеченные и гибридные промоторы.
В дрожжевом хозяине подходящие промоторы получают из генов энолазы Saccharomyces cerevisiae (ENO-1), галактокиназы Saccharomyces cerevisiae (GAL1), алкогольдегидрогеназы /глицеральдегид-3-фосфатдегидрогеназы (ADH1,ADH2/GAP) Saccharomyces cerevisiae, триозофосфатизомеразы (TPI) Saccharomyces cerevisiae, металлотионина (CUP1) Saccharomyces cerevisiae, и 3-фосфоглицераткиназы Saccharomyces cerevisiae. Другие подходящие промоторы для дрожжевых клеток-хозяев описаны Romanos et al., 1992, Yeast 8: 423-488.
Контрольная последовательность также может быть подходящей последовательностью для терминации транскрипции, последовательностью, распознаваемой клеткой-хозяином для остановки транскрипции. Терминаторная последовательность оперативно связана с 3' концом нуклеотидной последовательности, кодирующей полипептид. Любой терминатор, который является функционально активным в выбранной клетке-хозяине, может быть использован в настоящем изобретении.
Предпочтительные терминаторы для клеток-хозяев, представляющих собой нитчатые грибы, получены из генов TAKA амилазы Aspergillus oryzae, глюкоамилазы Aspergillus niger, антранилатсинтазы Aspergillus nidulans, альфа-глюкозидазы Aspergillus niger и трипсин-подобной протеазы Fusarium oxysporum.
Предпочтительные терминаторы для дрожжевых клеток-хозяев получают из генов энолазы Saccharomyces cerevisiae, цитохрома С (CYC1) Saccharomyces cerevisiae и глицеральдегид-3-фосфатдегидрогеназы Saccharomyces cerevisiae. Другие подходящие терминаторы для дрожжевых клеток-хозяев описаны Romanos et al., 1992, supra.
Контрольная последовательность также может быть подходящей лидерной последовательностью, нетранслируемой областью мРНК, которая является важной для трансляции клеткой-хозяином. Лидерная последовательность оперативно связана с 5' концом нуклеотидной последовательности, кодирующей полипептид. Любая лидерная последовательность, которая является функционально активной в выбранной клетке-хозяине, может быть использована в настоящем изобретении.
Предпочтительные лидеры для клеток-хозяев, представляющих собой нитчатые грибы, получают из генов TAKA амилазы Aspergillus oryzae и триозофосфатизомеразы Aspergillus nidulans.
Подходящие лидеры для дрожжевых клеток-хозяев получают из генов энолазы (ENO-1) Saccharomyces cerevisiae, 3-фосфоглицераткиназы Saccharomyces cerevisiae, альфа-фактора Saccharomyces cerevisiae и алкогольдегидрогеназы/глицеральдегид-3-фосфатдегидрогеназы (ADH2/GAP) Saccharomyces cerevisiae.
Контрольная последовательность также может быть последовательностью полиаденилирования, последовательностью, оперативно связанной с 3' концом нуклеотидной последовательности и которая при транскрипции распознается клеткой-хозяином как сигнал к добавлению остатков полиаденозина к транскрибируемой мРНК. Любая последовательность полиаденилирования, которая функционально активна в выбранной клетке-хозяине, может быть использована в настоящем изобретении.
Предпочтительные последовательности полиаденилирования для клеток-хозяев, представляющих собой нитчатые грибы, получают из генов TAKA амилазы Aspergillus oryzae, глюкоамилазы Aspergillus niger, антранилатсинтазы Aspergillus nidulans, трипсин-подобной протеазы Fusarium oxysporum и альфа-глюкозидазы Aspergillus niger.
Подходящие последовательности полиаденилирования для дрожжевых клеток-хозяев описаны у Guo и Sherman, 1995, Molecular Cellular Biology 15: 5983-5990.
Контрольная последовательность также может быть областью, кодирующей сигнальный пептид, которая кодирует аминокислотную последовательность, связанную с аминоконцом полипептида, и направляет кодируемый полипептид по секреторному клеточному пути. 5' конец кодирующей нуклеотидной последовательности может по природе содержать область, кодирующую сигнальный пептид, естественным образом связанную в трансляционной рамке считывания с сегментом кодирующей области, который кодирует секретируемый полипептид. Альтернативно, 5' конец кодирующей последовательности может содержать область, кодирующую сигнальный пептид, чужеродный для этой кодирующей последовательности. Область, кодирующая чужеродный сигнальный пептид, может быть необходима в тех случаях, когда кодирующая последовательность по природе не содержит области, кодирующей сигнальный пептид. Альтернативно, область, кодирующая чужеродный сигнальный пептид, может просто заменять природную область, кодирующую сигнальный пептид для усиления секреции этого полипептида. Однако любая область, кодирующая сигнальный пептид, которая направляет экспрессированный полипептид по секреторному пути выбранной клетки-хозяина, может быть использована в настоящем изобретении.
Эффективные области, кодирующие сигнальные пептиды бактериальных клеток-хозяев, представляют собой кодирующие области сигнальных пептидов, полученные из генов мальтогенной амилазы NCIB 11837 Bacillus, альфа-амилазы Bacillus stearothermophilus, субтилизина Bacillus licheniformis, бета-лактамазы Bacillus licheniformis, нейтральных протеаз (nprT, nprS, nprM)Bacillus stearothermophilus и Bacillus subtilis prsA. Дополнительные сигнальные пептиды описаны у Simonen и Palva, 1993, Microbiological Reviews 57: 109-137.
Эффективные кодирующие области сигнальных пептидов для клеток-хозяев, представляющих собой нитчатые грибы, представляют собой кодирующие области сигнальных пептидов, полученные из генов TAKA амилазы Aspergillus oryzae, нейтральной амилазы Aspergillus niger, глюкоамилазы Aspergillus niger, аспарагиновой протеиназы Rhizomucor miehei, целлюлазы Humicola insolens и липазы Humicola lanuginosa.
Подходящие сигнальные пептиды для дрожжевых клеток-хозяев получают из генов альфа-фактора Saccharomyces cerevisiae и инвертазы Saccharomyces cerevisiae. Другие подходящие кодирующие области сигнальных пептидов описаны у Romanos et al., 1992, supra.
Контрольная последовательность также может быть областью, кодирующей пропептид, которая кодирует аминокислотную последовательность, расположенную на аминоконце полипептида. Полученный в результате полипептид известен как профермент или прополипептид (или, в некоторых случаях, зимоген). Прополипептид в основном является неактивным и может быть преобразован в зрелый активный полипептид каталитическим или аутокаталитическим расщеплением пропептида из прополипептида. Область, кодирующая пропептид, может быть получена из генов щелочной фосфатазы (aprE) Bacillus subtilis, нейтральной протеазы (nprT)Bacillus subtilis, альфа-фактора Saccharomyces cerevisiae, аспарагиновой протеиназы Rhizomucor miehei и лакказы Myceliophthora thermophila (WO 95/33836).
В тех случаях, когда на аминоконце полипептида присутствуют и сигнальный пептид, и участки пропептида, участок пропептида располагается вслед за аминоконцом полипептида, а область сигнального пептида располагается вслед за аминоконцом области пропептида.
Также может быть желательным добавить регуляторные последовательности, которые дают возможность регулировать экспрессию полипептида относительно роста клетки-хозяина. Примерами регуляторных систем являются системы, которые вызывают включение или выключение экспрессии гена в ответ на химические или физические стимулы, в том числе в присутствии регуляторного соединения. Регуляторые системы в системах прокариот включают в себя операторные системы lac, tac и trp. У дрожжей может быть использована система ADH2 или GAL1. У нитчатых грибов в качестве регуляторных последовательностей могут быть использованы промотор TAKA альфа-амилазы, промотор глюкоамилазы Aspergillus niger и промотор глюкоамилазы Aspergillus oryzae. Другие примеры регуляторных последовательностей представляют собой последовательности, которые обеспечивают амплификацию гена. В эукариотических системах они включают в себя ген дигидрофолатредуктазы, который амплифицируется в присутствии метотрексата, и гены металлотионеина, которые амплифицируются тяжелыми металлами. В этих случаях нуклеотидная последовательность, кодирующая полипептид, была бы оперативно связана с регуляторной последовательностью.
Векторы экспрессии
Настоящее изобретение также относится к рекомбинантным векторам экспрессии, содержащим полинуклеотид по настоящему изобретению, промотор и стоп-сигналы транскрипции и трансляции. Различные нуклеиновые кислоты и контрольные последовательности, описанные выше, могут быть соединены вместе для получения рекомбинантного вектора экспрессии, который может включать в себя один или несколько походящих сайтов рестрикции для возможности вставки или замены нуклеотидной последовательности, кодирующей полипептид, в таких сайтах. Альтернативно, нуклеотидная последовательность по настоящему изобретению может быть экспрессирована путем вставки нуклеотидной последовательности или конструкции нуклеиновой кислоты, содержащей эту последовательность, в соответствующий вектор для экспрессии. При создании вектора экспрессии кодирующая последовательность располагается в векторе таким образом, что кодирующая последовательность оперативно связана с соответствующими контрольными последовательностями для экспрессии.
Рекомбинантным вектором экспрессии может быть любой вектор (например, плазмида или вирус), который подходит для методов рекомбинантной ДНК и который может осуществлять экспрессию нуклеотидной последовательности. Выбор вектора обычно будет зависеть от совместимости вектора с клеткой-хозяином, в которую вводится вектор. Векторы могут быть линейными или замкнутыми кольцевыми плазмидами.
Вектор может быть автономно реплицирующимся вектором, т.е. вектором, который существует как экстрахромосомный, репликация которого не зависит от хромосомной репликации, например плазмида, экстрахромосомный элемент, минихромосома или искусственная хромосома. Вектор может содержать любые средства для обеспечения саморепликации. Альтернативно вектор может представлять собой вектор, который при введении в клетку-хозяина интегрируется в геном и реплицируется вместе с хромосомой (хромосомами), в которую он был интегрирован. Кроме того, может быть использован единичный вектор или плазмида, или два, или более векторов или плазмид, которые вместе содержат общую ДНК, вводимую в геном клетки-хозяина, или транспозон.
Векторы по настоящему изобретению предпочтительно содержат один или несколько селектируемых маркеров, которые позволяют легко отбирать трансформированные клетки. Селектируемый маркер представляет собой ген, продукт которого обеспечивает биоцидную или вирусную резистентность, резистентность к тяжелым металлам, прототрофию для ауксотрофов и подобное.
Примеры бактериальных селектируемых маркеров представляют собой гены dalBacillus subtilis или Bacillus licheniformis, или маркеры, которые придают устойчивость к антибиотикам, например резистентность к ампициллину, канамицину, хлорамфениколу или тетрациклину. Подходящие маркеры для дрожжевых клеток-хозяев представляют собой ADE2, HIS3, LEU2, LYS2, MET3, TRP1 и URA3. Селектируемые маркеры для использования в клетках-хозяевах, представляющих собой нитчатые грибы, включают в себя, но не ограничиваются, amdS (ацетамидаза), argB (орнитинкарбамоилтрансфераза), bar (фосфинотрицинацетилтрансфераза), hph (гидромицинфосфотрансфераза), niaD (нитратредуктаза), pyrG (оротидин-5'-фосфатдекарбоксилаза), sC (сульфатаденилтрансфераза) и trpC (антранилатсинтаза), а также их эквиваленты. В клетках Aspergillus предпочтительно использовать гены amdS и pyrGAspergillus nidulans или Aspergillus oryzae и ген barStreptomyces hygroscopicus.
Векторы по настоящему изобретению предпочтительно содержат элемент(ы), позволяющий(е) вектору интегрироваться в геном клетки-хозяина или автономно реплицироваться в клетке независимо от генома.
Для интеграции в геном клетки-хозяина, вектор может основываться на полинуклеотидной последовательности, кодирующей полипептид, или любом другом элементе вектора для интеграции в геном, путем гомологичной или негомологичной рекомбинации. Альтернативно вектор может содержать дополнительные нуклеотидные последовательности для направления интеграции путем гомологичной рекомбинации в геном клетки-хозяина в определенное положение (положения) в хромосоме (хромосомах). Для повышения вероятности интеграции в определенное положение интеграционные элементы предпочтительно должны содержать достаточное количество нуклеиновых кислот, например от 100 до 10000 пар оснований, предпочтительно от 400 до 10000 пар оснований и наиболее предпочтительно от 800 до 10000 пар оснований, которые имеют высокую степень идентичности с соответствующей целевой последовательностью, для усиления вероятности гомологичной рекомбинации. Интеграционные элементы могут представлять собой любую последовательность, которая является гомологичной целевой последовательности в геноме клетки-хозяина. Более того, интеграционные элементы могут быть некодирующими или кодирующими нуклеотидными последовательностями. С другой стороны, вектор может быть интегрирован в геном клетки-хозяина путем негомологичной рекомбинации.
Для автономной репликации вектор может дополнительно содержать репликатор, обеспечивающий автономную репликацию вектора в рассматриваемой клетке-хозяине. Репликатор может представлять собой любой плазмидный репликатор, опосредующий автономную репликацию, который функционирует в клетке. Термин «репликатор (оридгиин репликации)» или «плазмидный репликатор» здесь определяется как нуклеотидная последовательность, обеспечивающая репликацию плазмиды или вектора in vivo.
Примеры бактериальных репликаторов представляют собой репликаторы плазмид pBR322, pUC19, pACYC177 и pACYC184 обеспечивающие репликацию в E. coli, и pUB110, pE194, pTA1060 и pAMβ1, обеспечивающие репликацию в Bacillus.
Примеры репликаторов для использования в дрожжевых клетках-хозяевах представляют собой 2 микронные репликаторы, ARS1, ARS4, комбинацию ARS1 и CEN3, и комбинацию ARS4 и CEN6.
Примеры репликаторов, применяемых в клетках нитчатых грибов, представляют собой AMA1 и ANS1 (Gems et al., 1991, Gene 98:61-67; Cullen et al., 1987, Nucleic Acids Research 15: 9163-9175; WO 00/24883). Выделение гена AMA1 и конструирование плазмид или векторов, содержащих этот ген, можно осуществить в соответствии со способами, описанными в WO 00/24883.
Для усиления образования генного продукта в клетку-хозяина можно вставить более одной копии полинуклеотида по настоящему изобретению. Увеличение числа копий полинуклеотида может быть получено путем интеграции по меньшей мере одной дополнительной копии этой последовательности в геном клетки-хозяина, или включая амплифицируемый селектируемый маркерный ген с полинуклеотидом, где клетки, содержащие амплифицированные копии селектируемого маркерного гена, и, посредством этого, дополнительные копии полинуклеотида, могут быть выбраны для культивирования клеток в присутствии соответствующего селектируемого агента.
Процедуры, используемые для лигирования элементов, описанных выше для конструирования рекомбинантных векторов экспрессии по настоящему изобретению, хорошо известны специалистам в данной области (смотри, например, Sambrook et al., 1989, supra).
Клетки-хозяева
Настоящее изобретение также относится к рекомбинантным клеткам-хозяевам, содержащим полинуклеотид по настоящему изобретению, которые преимущественно используют в рекомбинантном получении полипептидов. Вектор, содержащий полинуклеотид по настоящему изобретению, вводят в клетку-хозяина таким образом, чтобы вектор сохранялся как хромосомный интегрант или как самореплицирующийся экстрахромосомный вектор, описанный ранее. Термин «клетка-хозяин» охватывает любое потомство родительской клетки, не являющееся идентичным родительской клетке вследствие мутаций, которые происходят во время репликации. Выбор клетки-хозяина в большой степени будет зависеть от гена, кодирующего полипептид, и его источника.
Клетка-хозяин может представлять собой одноклеточный микроорганизм, например прокариот, или неодноклеточный микроорганизм, например эукариот.
Подходящими одноклеточными микроорганизмами являются бактериальные клетки, такие как грамположительные бактерии, в том числе, но не только, клетка Bacillus, например, Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus stearothermophilus, Bacillus subtilis, и Bacillus thuringiensis; или клетка Streptomyces, например, Streptomyces lividans и Streptomyces murinus, или грамотрицательные бактерии, такие как E. coli и Pseudomonas sp. В предпочтительном аспекте, бактериальная клетка-хозяин представляет собой клетку Bacillus lentus, Bacillus licheniformis, Bacillus stearothermophilus или Bacillus subtilis. В другом предпочтительном аспекте клетка Bacillus представляет собой алкалофильные клетки Bacillus.
Введение вектора в бактериальную клетку-хозяина можно, например, осуществить путем трансформации протопласта (смотри, например, Chang and Cohen, 1979, Molecular General Genetics 168: 111-115), с использованием компетентных клеток (смотри, например, Young and Spizizin, 1961, Journal of Bacteriology 81: 823-829, или Dubnau and Davidoff-Abelson, 1971, Journal of Molecular Biology 56: 209-221), электропорацией (смотри, например, Shigekawa and Dower, 1988, Biotechniques 6: 742-751), или конъюгацией (смотри, например, Koehler and Thorne, 1987, Journal of Bacteriology 169: 5771-5278).
Клетка-хозяин также может быть эукариотической, например клеткой млекопитающего, насекомого, растения или гриба.
В предпочтительном аспекте клетка-хозяин представляет собой клетку гриба. «Грибы» здесь включают в себя типы Ascomycota, Basidiomycota, Chytridiomycota и Zygomycota (по определению Hawksworth et al., In, Ainsworth and Bisby's Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK), а также Oomycota (цитируемый у Hawksworth et al., 1995, supra, страница 171) и все грибы митоспоры (Hawksworth et al., 1995, supra).
В более предпочтительном аспекте грибной клеткой-хозяином является дрожжевая клетка. «Дрожжи» здесь включают в себя аспорогенные дрожжи (Endomycetales), базидиа-спорогенные дрожжи и дрожжи, принадлежащие классу несовершенных грибов (Бластомицеты). Поскольку классификация дрожжевых грибов может в будущем измениться, для целей этого изобретения дрожжевые грибы будут определяться, как описано в Biology and Activities of Yeast (Skinner, F.A., Passmore, S.M., and Davenport, R.R., eds, Soc. App. Bacteriol. Symposium Series No. 9, 1980).
В еще более предпочтительном аспекте дрожжевая клетка-хозяин представляет собой клетку Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia.
В наиболее предпочтительном аспекте дрожжевая клетка-хозяин представляет собой клетку Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis или Saccharomyces oviformis. В другом наиболее предпочтительном аспекте дрожжевая клетка-хозяин представляет собой клетку Kluyveromyces lactis. В другом наиболее предпочтительном аспекте дрожжевая клетка представляет собой клетку Yarrowia lipolytica.
В другом, более предпочтительном аспекте грибная клетка-хозяин представляет собой клетку нитчатого гриба. «Нитчатые грибы» включают в себя все нитчатые формы отдела Eumycota и Oomycota (по определению Hawksworth et al., 1995, supra). Нитчатые грибы в основном характеризуются мицелиальной стенкой, состоящей из хитина, целлюлозы, глюкана, хитозана, маннана и других сложных полисахаридов. Вегетативный рост представляет собой рост путем удлинения гиф, а катаболизм углерода является облигатно аэробным. Напротив, вегетативный рост дрожжевых грибов, таких как Saccharomyces cerevisiae, представляет собой рост путем отпочковывания одноклеточного слоевища, а катаболизм углерода может быть ферментативным.
В еще более предпочтительном аспекте клеткой-хозяином, представляющей собой нитчатый гриб, является клетка Acremonium, Aspergillus, Aureobasidium, Bjerkandera, Ceriporiopsis, Coprinus, Coriolus, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Phanerochaete, Phlebia, Piromyces, Pleurotus, Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trametes или Trichoderma.
В наиболее предпочтительном аспекте клеткой-хозяином, представляющей собой нитчатый гриб, является клетка Aspergillus awamori, Aspergillus fumigatus, Aspergillus foetidus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger или Aspergillus oryzae. В другом наиболее предпочтительном аспекте клеткой-хозяином, представляющей собой нитчатый гриб, является клетка Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides, или Fusarium venenatum. В другом, наиболее предпочтительном аспекте, клеткой-хозяином, представляющей собой нитчатый гриб, является клетка Bjerkandera adusta, Ceriporiopsis aneirina, Ceriporiopsis aneirina, Ceriporiopsis caregiea, Ceriporiopsis gilvescens, Ceriporiopsis pannocinta, Ceriporiopsis rivulosa, Ceriporiopsis subrufa, или Ceriporiopsis subvermispora, Coprinus cinereus, Coriolus hirsutus, Humicola insolens, Humicola lanuginosa, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Phanerochaete chrysosporium, Phlebia radiata, Pleurotus eryngii, Thielavia terrestris, Trametes villosa, Trametes versicolor, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei, или клетка штамма Trichoderma viride.
Клетки грибов могут быть трансформированы способом, включающим образование протопласта, трансформацию протопластов и регенерацию клеточной стенки известным способом. Подходящие способы трансформации клеток-хозяев Aspergillus и Trichoderma описаны в EP 238 023 и Yelton et al., 1984, Proceedings of the National Academy of Sciences USA 81: 1470-1474. Подходящие способ трансформации видов Fusarium описаны у Malardier et al., 1989, Gene 78: 147-156, и в WO 96/00787. Дрожжевые грибы могут быть трансформированы с использованием способов, описанных Becker и Guarente, In Abelson, J.N. и Simon, M.I., editors, Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, Volume 194, pp 182-187, Academic Press, Inc., New York; Ito et al., 1983, Journal of Bacteriology 153: 163; и Hinnen et al., 1978, Proceedings of the National Academy of Sciences USA 75: 1920.
Способы получения
Настоящее изобретение также относится к способам получения полипептида по настоящему изобретению, включающим (a) культивирование клетки, дикий тип которой способен продуцировать этот полипептид, в условиях, благоприятных для продукции этого полипептида; и (b) извлечение этого полипептида.
Настоящее изобретение также относится к способам получения полипептида по настоящему изобретению, включающим (a) культивирование клетки-хозяина в условиях, благоприятных для продукции этого полипептида; и (b) извлечение этого полипептида.
В способах получения по настоящему изобретению клетки культивируют в питательной среде, подходящей для продукции полипептида, используя способы, хорошо известные в данной области. Например, клетки можно культивировать встряхиванием культуральных флаконов, и маломасштабным или крупномасштабным ферментированием (в том числе непрерывным, периодическим, с подпиткой или твердофазными ферментациями) в лабораторных или промышленных ферментаторах, проводимым в подходящей среде и в условиях, обеспечивающих экспрессию и/или выделение полипептида. Культивирование происходит в подходящей питательной среде, содержащей источники углерода и азота и неорганические соли, с использованием методик, известных в данной области. Подходящие среды доступны от коммерческих поставщиков или могут быть приготовлены в соответствии с опубликованными прописями (например, в каталогах Американской коллекции типовых культур). Если полипептид секретируется в питательную среду, полипептид можно извлекать непосредственно из среды. Если полипептид не секретируется, его можно извлечь из клеточных лизатов.
Полипептиды можно детектировать способами, известными из уровня техники, специфичными для полипептидов. Эти способы детекции могут включать в себя использование специфичных антител. Например, для оценки активности полипептида можно использовать описанный здесь анализ антимикробной активности.
Полученный в результате полипептид можно извлечь с использованием способов, известных из уровня техники. Например, полипептид можно извлечь из питательной среды с помощью известных методик, в том числе, но не только, центрифугированием, фильтрацией, экстракцией, распылительной сушкой, выпариванием или преципитацией.
Полипептиды по настоящему изобретению могут быть очищены различными способами, известными в уровне техники, в том числе, но не только, хроматографией (например, ионобменной, аффинной, гидрофобной, хроматофокусированием и гель-фильтрацией), электрофоретическими способами (например, препаративным изоэлектрофокусированием), путем проведения дифференциальной растворимости (например, преципитация сульфатом аммония), SDS-PAGE, или экстракцией (смотри, например, Protein Purification, J.-C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989).
Растения
Настоящее изобретение относится к трансгенному растению, части растения или клетке растения, которые были трансформированы нуклеотидной последовательностью, кодирующей полипептид, обладающей атимикробной активностью в соответствии с настоящим изобретением, таким образом, чтобы полипептид экспрессировался и продуцировался в извлекаемых количествах. Полипептид можно извлекать из растения или части растения. Альтернативно, растение или часть растения, содержащее рекомбинантный полипептид, может быть использовано как таковое для улучшения качества пищевого продукта или корма, например, улучшая пищевую ценность, вкусовые качества и реологические свойства или для разрушения фактора, препятствующего усвоению питательных веществ.
Трансгенное растение может быть двудольным (двудольное растение) или однодольным (однодольное растение). Примерами однодольных растений являются травы, такие как луговая трава (мятлик, мятлик луговой), кормовая трава, такая как овсянница, лолиум, трава умеренной зоны, такая как агростис и злаковые, например пшеница, овес, рожь, ячмень, рис, сорго и маис (кукуруза).
Примерами двудольных растений являются табак, бобовые, такие как люпин, картофель, сахарная свекла, горох, фасоль и соя, и крестоцветные растения (семейство Крестоцветные), такие как цветная капуста, семенной рапс и близкородственный организм-модель Arabidopsis thaliana.
Примеры частей растения представляют собой стебель, каллюс, листья, корень, плоды, семена и клубни, а также отдельные ткани, содержащие эти части, например эпидермис, мезофилл, паренхима, сосудистые ткани, меристема. Особые компартменты клеток растений, такие как хлоропласты, апопласты, митохондрии, вакуоли, пероксисомы и цитоплазма, также рассматриваются как части растения. Более того, любая растительная клетка вне зависимости от тканевого происхождения считается частью растения. Подобным образом, части растения, такие как специфические ткани и клетки, выделенные для облегчения использования изобретения, также считаются частями растения, например завязи, эндоспермы, алейрон и семенные оболочки.
В объем настоящего изобретения также включены потомки таких растений, частей растений и клеток растений.
Трансгенное растение или клетка растения, экспрессирующее полипептид по настоящему изобретению, может быть сконструировано в соответствии со способами, известными в уровне техники. Вкратце, растение или клетку растения конструируют путем внедрения одной или нескольких экспрессионных конструкций, кодирующих полипептид по настоящему изобретению, в геном растения-хозяина и репродукции полученного в результате модифицированного растения или части растения в трансгенное растение или клетку растения.
Экспрессионная конструкция представляет собой подходящую конструкцию нуклеиновой кислоты, которая содержит полинуклеотид, кодирующий полипептид по настоящему изобретению, оперативно связанный с соответствующими регуляторными последовательностями, необходимыми для экспрессии нуклеотидной последовательности в выбранном растении или части растения. Кроме того, экспрессионная конструкция может содержать селектируемый маркер, пригодный для идентификации клеток-хозяев, в которые была интегрирована экспрессионная конструкция, и ДНК последовательности, необходимые для введения этой конструкции в данное растение (последнее зависит от используемого способа введения ДНК).
Выбор регуляторных последовательностей, таких как промоторные и терминаторные последовательности, и, необязательно, сигнальные или транзитные последовательности, проводят, например, на основе того, когда, где и как желательно, чтобы экспрессировался этот полипептид. Например, экспрессия гена, кодирующего полипептид по настоящему изобретению, может быть конститутивной или индуцибельной, или может быть эволюционно-специфичной, специфичной для стадии, или ткани, а продукт этого гена может быть нацелен на специфическую ткань или часть растения, такую как семена или листья. Регуляторные последовательности, например, описаны у Tague et al., 1988, Plant Physiology 86: 506.
Для конститутивной экспрессии может быть использован промотор 35S-CaMV, убихитина маиса 1 и актина риса 1 (Franck et al., 1980, Cell 21: 285-294, Christensen et al., 1992, Plant Mo. Biol. 18: 675-689; Zhang et al., 1991, Plant Cell 3: 1155-1165). Органспецифичными промоторами могут быть, например, промоторы из запасающих тканей, таких как семена, клубни картофеля и плоды (Edwards & Coruzzi, 1990, Ann. Rev. Genet. 24: 275-303), или из тканей - приемников притекающих метаболитов, например, меристемы (Ito et al., 1994, Plant Mol. Biol. 24: 863-878), семяспецифичный промотор, такой как глютелиновый, проламиновый, глобулиновый или альбуминовый промотор из риса (Wu et al., 1998, Plant and Cell Physiology 39: 885-889), промотор Vicia faba из легумина B4 и неизвестный ген белка семян из Vicia faba (Conrad et al., 1998, Journal of Plant Physiology 152: 708-711), промотор белка масляного тельца семян (Chen et al., 1998, Plant and Cell Physiology 39: 935-941), промотор запасного белка napA, промотор из Brassica napus, или любой другой семяспецифичный промотор, известный в уровне техники, например, описанный в WO 91/14772. Более того, промотор может быть промотором, специфичным для листьев, например промотор rbcs из риса или томата (Kyozuka et al., 1993, Plant Physiology 102: 991-1000, промотор гена аденинметилтрансферазы вируса хлореллы (Mitra and Higgins, 1994, Plant Molecular Biology 26: 85-93), или промотор гена aldP риса (Kagaya et al., 1995, Molecular and General Genetics 248: 668-674), или раневой индуцибельный промотор, такой как промотор pin2 картофеля (Xu et al., 1993, Plant Molecular Biology 22: 573-588). Аналогичным образом, промотор может индуцироваться путем абиотической обработки, такой как температура, засуха или изменения солености почвы, или индуцирован веществами, применяемыми экзогенно, которые активируют промотор, например, этанол, оэстрогены, растительные гормоны, такие как этилен, абсцизовая кислота и гиббереллиновая кислота, и тяжелые металлы.
Энхансерный элемент промотора также может быть использован для достижения более высокой экспрессии полипептида по настоящему изобретению в растении. Например, энхансерный элемент промотора может представлять собой интрон, который расположен между промотором и нуклеотидной последовательностью, кодирующей полипептид по настоящему изобретению. Например, Xu et al., 1993, supra, описывает применение первого интрона гена актина 1 риса для усиления экспрессии.
Ген маркера селекции и другие части экспрессионной конструкции могут быть выбраны из доступных в этой области.
Конструкцию нуклеиновой кислоты вводят в геном растения в соответствии с обычными методиками, известными в уровне техники, включая трансформацию, опосредованную Agrobacterium, трансформацию, опосредованную вирусом, микроинъекции, бомбардировку частицами, биолистическую трансформацию и электропорацию (Gasser et al., 1990, Science 244: 1293; Potrykus, 1990, Bio/Technology 8: 535; Shimamoto et al., 1989, Nature 338: 274).
В настоящее время перенос генов, опосредованный Agrobacterium, является методом выбора для получения трансгенных двудольных растений (для обзора смотри Hooykas and Schilperoort, 1992, Plant Molecular Biology 19: 15-38) и его также можно использовать для трансформации однодольных растений, хотя для этих растений часто используются другие способы трансформации. В настоящее время методом выбора для получения трансгенных однодольных растений является бомбардировка частицами (микроскопическими частицами золота или частицами вольфрама, покрытыми трансформирующей ДНК) зародышевых каллюсов или развивающихся завязей (Christou, 1992, Plant Journal 2: 275-281; Shimamoto, 1994, Current Opinion Biotechnology 5: 158-162; Vasil et al., 1992, Bio/Technology 10: 667-674). Альтернативный способ трансформации однодольных растений основан на трансформации протопласта, описанный Omirulleh et al., 1993, Plant Molecular Biology 21: 415-428.
После трансформации отбирают трансформанты со встроенной экспрессионной конструкцей и регенерируют в целые растения в соответствии со способами, хорошо известными в этой области. Зачастую процедуру трансформации проводят для селективной элиминации выбранных генов либо во время регенерации, либо в последующих генерациях, используя, например, котрансформацию с двумя отдельными конструкциями T-ДНК или сайт-специфичное удаление выбранного гена с помощью специфической рекомбиназы.
Настоящее изобретение также относится к способам получения полипептида по настоящему изобретению, включающим (a) культивирование трансгенного растения или клетки растения, содержащего полинуклеотид, кодирующий полипептид, обладающий антимикробной активностью, по настоящему изобретению в условиях, благоприятных для продукции этого полипептида; и (b) извлечение этого полипептида.
Композиции
Настоящее изобретение также относится к композициям, таким как фармацевтические композиции, содержащим полипептид по настоящему изобретению. Предпочтительно, композиции обогащены таким полипептидом. Термин «обогащены» указывает на то, что антимикробная активность композиции была усилена, например с фактором обогащения 1,1.
Дополнительно композиции могут содержать другой фармацевтически активный агент, например дополнительный биоцидный или биостатический агент, такой как другой антимикробный полипептид, демонстрирующий антимикробную активность, описанную выше. Биоцидный агент может быть антибиотиком, известным из уровня техники. Классы антибиотиков включают в себя пенициллины, например, пенициллин G, пенициллин V, метициллин, оксациллин, карбенициллин, нафциллин, ампициллин, и т.д.; пенициллины в комбинации с ингибиторами бета-лактамазы, цефалоспорины, например, цефаклор, цефазолин, цефуроксим, моксалактам и т.д.; карбапенемы; монобактамы; аминогликозиды; тетрациклины; макролиды; линкомицины; полимиксины; сульфонамиды; хинолоны; клорамфеникал; метронидазол; спектиномицин; триметоприм; ванкомицин; и т.д. Биоцидный агент также может быть антимикотическим средством, включая полиены, например, амфотерицин В, нистатин; 5-флукозин; и азолы, например, миконазол, кетоконазол, итраконазол и флуконазол.
В одном варианте осуществления биоцидное средство представляет собой неферментное химическое вещество. В другом варианте осуществления биоцидное средство представляет собой неполипептидное химическое вещество.
Композиции могут содержать подходящее вещество-носитель. Композиции также могут содержать подходящее средство доставки, способное доставлять антимикробные полипептиды по изобретению в желаемое место, в тех случаях, когда композиции используют в качестве лекарственного средства.
Полипептидные композиции могут быть получены в соответствии со способами, известными в этой области, и могут быть в форме жидкой или сухой композиции. Например, полипептидная композиция может быть в виде гранулята или микрогранулята. Полипептид, включенный в композицию, можно стабилизировать в соответствии со способами, известными в этой области.
Ниже приведены примеры предпочтительного применения полипептидных композиций по изобретению. Дозу полипептидной композиции по изобретению и другие условия, при которых используется эта композиция, можно определить на основе способов, известных в этой области.
Способы и применение
Настоящее изобретение также относится к способам применения полипептидов, обладающих антимикробной активностью. Антимикробные полипептиды обычно применимы в любом месте, подвергаемом заражению бактериями, грибами, дрожжевыми грибами или водорослями. Обычно эти места находятся в водных системах, таких как системы подачи охлаждающей воды, стоки банно-прачечного хозяйства, масляные системы, такие как смазочно-охлаждающие масла, смазочные материалы, месторождения нефти и подобное, где необходимо уничтожение микроорганизмов или где необходимо контролировать их рост. Однако настоящее изобретение может быть использовано во всех областях, в которых применимы известные антимикробные композиции, таких как защита древесины, латекса, адгезивных веществ, клея, бумаги, картона, текстиля, кожи, пластиков, уплотнителей и кормов.
Другие применения включают в себя консервирование пищевых продуктов, напитков, косметических средств, таких как лосьоны, кремы, гели, мази, мыла, шампуни, кондиционеры, антиперспиранты, дезодоранты, полоскания для полости рта, изделия для контактных линз, ферментативных составов или компонентов пищевых продуктов.
Таким образом, антимикробные полипептиды по изобретению могут применяться в качестве дезинфицирующего средства, например, при лечении инфекции глаз или полости рта, кожных инфекций; в антиперспирантах или дезодорантах; для очистки и дезинфекции контактных линз и зубов (уход за полостью рта).
В основном считается, что антимикробные полипептиды по настоящему изобретению применимы для очищения, дезинфекции или подавления роста микроорганизмов на любой поверхности. Примеры поверхностей, с которыми преимущественно контактируют антимикробные полипептиды по изобретению, представляют собой поверхности технологического оборудования, используемого, например, на маслодельнях, химических или фармацевтических производственных предприятиях, в системах очистки воды, на нефтеперерабатывающих заводах, заводах по переработке бумаги, в водоочистных сооружениях и стояках водяного охлаждения. Антимикробные полипептиды по изобретению следует использовать в количестве, которое является эффективным для очистки, дезинфекции или подавления роста микроорганизмов на данной поверхности.
Антимикробные полипептиды по изобретению дополнительно могут быть использованы для очистки поверхностей и кухонных принадлежностей на заводах пищевой промышленности в любом месте, где готовят или подают пищу, например в больницах, санаториях и ресторанах.
Также можно использовать в качестве консерванта или дезинфицирующего средства в водоэмульсионных красках.
Изобретение также относится к применению антимикробного полипептида или композиции по изобретению в качестве лекарственного средства. Дополнительно антимикробный полипептид или композицию по изобретению также можно использовать для производства лекарственного средства для контроля или борьбы с микроорганизмами, такими как грибы или бактерии, предпочтительно грамположительные бактерии.
Композиция и антимикробный полипептид по изобретению могут быть использованы в качестве антимикробного лечебного или профилактического средства в ветеринарии или у людей. Таким образом, композицию и антимикробный полипептид по изобретению можно использовать в получении ветеринарных лечебных или профилактических средств, или лечебных, или профилактических средств для людей, для лечения микробных инфекций, таких как бактериальные или грибковые инфекции, предпочтительно грамположительные бактериальные инфекции. В частности микробные инфекции могут ассоциироваться с заболеваниями легких, в том числе, но не только, туберкулезом, пневмонией и кистозным фиброзом; и заболеваниями, передающимися половым путем, в том числе, но не только, гонореей и хламидиозом.
Композиция по изобретению содержит эффективное количество антимикробного полипептида по изобретению.
При использовании здесь термин «эффективное количество» означает количество антимикробных полипептидов по изобретению, которого достаточно для подавления роста данных микроорганизмов.
Изобретение также относится к композициям для заживления ран, или к таким продуктам, как бинты, медицинские устройства, например, таким как катетеры, и, дополнительно, к продуктам для ухода за волосами против перхоти, таким как шампуни.
Композиции антимикробных полипептидов по изобретению вводят в организм-хозяин, страдающий от микробной инфекции или предрасположенный к ней. Введение может быть местным, локализованным или системным, в зависимости от конкретного микроорганизма, предпочтительно оно будет локализованным. В основном доза антимикробных полипептидов будет достаточной для уменьшения популяции микроорганизмов по меньшей мере примерно на 50%, обычно по меньшей мере примерно на 1 log, и, может быть, на 2 или более логарифмов гибели. Композиции по настоящему изобретению вводят в дозе, которая уменьшает популяцию микроорганизмов, сводя к минимуму любые побочные эффекты. Считается, что для применения in vivo композицию будут получать и применять под руководством лечащего врача. Антимикробные полипептиды по изобретению в частности подходят для уничтожения грамотрицательных бактерий, в том числе Pseudomonas aeruginosa и Chlamydia trachomatis; и грамположительных бактерий, в том числе стрептококков, таких как Streptococcus pneumonia, S. uberis, S. hyointestinalis, S. pyogenes и S. agalactiae; и стафилококков, таких как Staphylococcus aureus, S. epidermidis, S. simulans, S. xylosus и S. carnosus.
Композиции антимикробных полипептидов по изобретению можно вводить в организм-хозяин, стадающий от микробной инфекции легких, или подверженный такой инфекции, например пневмонией; или микробной инфекцией ран, такой как бактериальная раневая инфекция.
Композиции антимикробных полипептидов по изобретению также можно вводить в организм-хозяин, страдающий кожной инфекцией, или подверженный такой инфекции, например, акнэ, атопический дерматит или себорейный дерматит; предпочтительно кожная инфекция представляет собой бактериальную кожную инфекцию, например, вызванную Staphylococcus epidermidis, Staphylococcus aureus, Propionibacterium acnes, Pityrosporum ovale или Malassezia furfur.
Антимикробные полипептиды по изобретению также пригодны для in vitro композиции для уничтожения микроорганизмов, в частности, где нежелательно введение доз обычных антибиотиков. Например, антимикробные полипептиды по изобретению можно добавлять к продуктам питания для животных и/или людей; или их можно включать в качестве добавки для культур клеток in vitro, для предотвращения чрезмерного роста микроорганизмов в тканевой культуре.
Восприимчивость конкретного микроорганизма к уничтожению антимикробными полипептидами по изобретению можно установить тестированием in vitro, как подробно описано в экспериментальной части. Обычно культуру микроорганизма объединяют с антимикробным полипептидом в различных концентрациях на период времени, достаточный для осуществления действия белка, обычно примерно от одного часа до одного дня. Затем подсчитывают жизнеспособые микроорганизмы и определяют уровень гибели.
Микроорганизмы, представляющие интерес, включают в себя, но не только, грамотрицательные бактерии, например: Citrobacter sp.; Enterobacter sp.; Escherichia sp., e.g. E. coli; Klebsiella sp.; Morganella sp.; Proteus sp.; Providencia sp.; Salmonella sp., e.g. S. typhi, S. typhimurium; Serratia sp.; Shigella sp.; Pseudomonas sp., e.g. P. aeruginosa; Yersinia sp., e.g. Y. pestis, Y. pseudotuberculosis, Y. enterocolitica; Franciscella sp.; Pasturella sp.; Vibrio sp., e.g. V. cholerae, V. parahemolyticus; Campylobacter sp., e.g. C. jejuni; Haemophilus sp., e.g. H. influenzae, H. ducreyi; Bordetella sp., e.g. B. pertussis, B. bronchiseptica, B. parapertussis; Brucella sp., Neisseria sp., e.g. N. gonorrhoeae, N. meningitidis, и т.д. Другие бактерии, представляющие интерес, включают в себя Legionella sp., например, L. pneumophila; Listeria sp., например, L. monocytogenes; Mycoplasma sp., например, M. hominis, M. pneumoniae; Mycobacterium sp., например, M. tuberculosis, M. leprae; Treponema sp., например, T. pallidum; Borrelia sp., например, B. burgdorferi; Leptospirae sp.; Rickettsia sp., например, R. rickettsii, R. typhi; Chlamydia sp., например, C. trachomatis, C. pneumoniae, C. psittaci; Helicobacter sp., например, H. pylori, и т.д.
Небактериальные патогены, представляющие интерес, включают в себя грибковые и протозойные патогены, например, Plasmodia sp., например, P. falciparum, Trypanosoma sp., например, T. brucei; шистосомы; Entaemoeba sp., Cryptococcus sp., Candida sp., например, C. albicans; и т.д.
Могут быть использованы различные способы введения. Полипептидную композицию можно вводить перорально или вводить внутрисосудно, подкожно, перитонеально, аэрозолем, в глаза, внутрь мочевого пузыря, местно и т.д. Например, способы введения ингаляционным путем хорошо известны в этой области. Доза терапевтической композиции может варьировать в широких пределах в зависимости от конкретного вводимого антимикробного полипептида, природы заболевания, частоты введения, способа введения, клиренса этого вещества из организма-хозяина и подобного. Начальная доза может быть больше, с последующими меньшими поддерживающими дозами. Дозу можно вводить так редко, как раз в неделю или раз в две недели, или разделить на более мелкие дозы и вводить один или несколько раз в день, два раза в неделю и т.д. для поддержания уровня эффективной дозы. Во многих случаях, пероральное введение требуется в более высокой дозе, чем при внутривенном введении. Амидные связи, а также амино- и карбоксильные концы, могут быть модифицированы для большей стабильности при пероральном введении. Например, карбоксильные концы могут быть амидированы.
Составы
Соединения по этому изобретению могут быть включены в различные составы для терапевтического применения. Более конкретно соединения по настоящему изобретению могут быть составлены в фармацевтические композиции путем объединения с соответствующими фармацевтически приемлемыми носителями или разбавителями и могут быть составлены в препараты в твердой, полутвердой, жидкой или газообразной формах, например таблетки, капсулы, порошки, гранулы, мази, кремы, пены, растворы, суппозитории, инъекционные растворы, ингаляционные средства, гели, микросферы, лосьоны и аэрозоли. По существу введение соединений может осуществляться различными путями, в том числе пероральным, буккальным, ректальным, парентеральным, внутрибрюшинным, внутрикожным, чрескожным, интратекальным и т.д. Антимикробные полипептиды по изобретению после введения могут быть системными или могут быть локализованы путем применения имплантата или других составов, которые действуют для задержки активной дозы в месте имплантации.
В одном варианте осуществления состав для местного применения содержит хелатирующий агент, который снижает эффективную концентрацию двухвалентных катионов, особенно кальция и магния. Например, могут быть включены такие агенты, как цитрат, EGTA или EDTA, где цитрат является предпочтительным. Концентрация цитрата обычно будет составлять примерно от 1 до 10 мМ.
Соединения по настоящему изобретению можно вводить отдельно, в комбинации друг с другом или они могут использоваться в комбинации с другими известными соединениями (например, перфорином, противовоспалительными средствами, антибиотиками и т.д.). В фармацевтических лекарственных формах соединения можно вводить в форме их фармацевтически приемлемых солей. Следующие способы и эксципиенты главным образом приведены в качестве примера и не являются ограничивающими каким-либо образом.
Для пероральных препаратов соединения можно использовать отдельно или в комбинации с соответствующими добавками для изготовления таблеток, порошков, гранул или капсул, например, с обычными добавками, такими как лактоза, манит, кукурузный крахмал или картофельный крахмал; со связующими веществами, такими как кристаллическая целлюлоза, производные целлюлозы, камедь, кукурузный крахмал или желатины; с дезинтергирующими агентами, такими как кукурузный крахмал, картофельный крахмал или карбоксиметилцеллюлоза натрия; со смазывающими веществами, такими как тальк или стеарат магния; и при необходимости с разбавителями, буферными агентами, увлажняющими веществами консервантами и ароматизаторами.
Соединения могут быть составлены в препараты для инъекций путем растворения, суспендирования или эмульгирования их в водном или неводном растворителе, таком как растительные или другие подобные масла, глицериды синтетических алифатических кислот, сложные эфиры высших алифатических кислот или пропиленгликоль; и при необходимости с обычными добавками, такими как солюбилизаторы, изотонические агенты, суспендирующие агенты, эмульгирующие агенты, стабилизаторы и консерванты.
Соединения могут быть использованы в аэрозольных составах для введения ингаляционным путем. Соединения по настоящему изобретению можно поместить в находящиеся под давлением приемлемые пропелленты, такие как дихлордифторметан, пропан, азот и подобное.
Соединения могут быть использованы в виде лосьонов, например, для профилактики инфицирования ожогов, путем составления с обычными добавками, такими как солюбилизаторы, изотонические агенты, суспендирующие агенты, эмульгирующие агенты, стабилизаторы и консерваты.
Кроме того, соединения могут быть изготовлены в форме суппозиториев путем перемешивания с различными основами, такими как эмульгирующие основы или водорастворимые основы. Соединения по настоящему изобретению можно вводить ректально посредством суппозитория. Суппозиторий может содержать носители, такие как масло какао, твердые полиэтиленгликоли и полиэтиленгликоли, которые плавятся при температуре тела, оставаясь твердыми при комнатной температуре.
Могут быть представлены единичные дозированные формы для перорального или ректального введения, такие как сиропы, эликсиры и суспензии, где каждая единичная доза, например, чайная ложка, столовая ложка, таблетка или суппозиторий, содержит заранее определенное количество композиции, содержащей одно или несколько соединений по настоящему изобретению. Подобным образом, единичные дозированные формы для инъекции или внутривенного введения могут содержать соединение по настоящему изобретению в композиции в виде раствора в стерильной воде, физиологическом растворе или другом фармацевтически приемлемом носителе.
Имплантаты для составов замедленного высвобождения хорошо известны в уровне техники. Имплантаты составляют в виде микросфер, плиток и подобного с биоразлагаемыми или небиоразлагаемыми полимерами. Например, полимеры молочной кислоты и/или гликолевой кислоты образуют полимер, поддающийся эрозии, который хорошо переносится организмом. Имплантат, содержащий антимикробные полипептиды по изобретению, располагают вблизи места инъекции, таким образом, что местная концентрация активного агента повышена по сравнению с концентрацией в остальном организме.
Используемый здесь термин «единичная дозированная форма» относится к физически дискретным единицам, подходящим в качестве однократных доз для людей и животных, каждая единица содержит заранее определенное количество соединений по настоящему изобретению, рассчитанное в количестве, достаточном для получения желаемого эффекта в объединении с фармацевтически приемлемым разбавителем, носителем или наполнителем. Характеристики единичных дозированных форм по настоящему изобретению зависят от конкретного используемого соединения, и достигаемого эффекта, и фармакодинамических параметров, связанных с этим соединением, в организме.
Фармацевтически приемлемые эксципиенты, такие как наполнители, адъюванты, носители или разбавители, являются общедоступными. Кроме того, фармацевтически приемлемые вспомогательные вещества, такие как регуляторы рН и буферные агенты, регуляторы тоничности, стабилизаторы, увлажняющие агенты и подобные, являются общедоступными.
Обычные дозы для системного ввдения находятся в диапазоне от 0,1 пг до 100 миллиграмм на кг массы тела пациента. Обычной дозой может быть одна таблетка, которую принимают от двух до шести раз ежедневно, или касула однократного высвобождения, или таблетка, которую принимают один раз в день, и содержащую пропорционально более высокое содержание активного ингрединента. Эффект высвобождения во времени может быть получен с помощью материалов капсулы, которые растворяются при различных значениях рН, с помощью капсул медленного высвыбождения под действием осмотического давления, или с помощью любых других известных способов контролируемого высвыбождения.
Специалистам будет понятно, что уровни доз могут варьировать в зависимости от конкретного соединения, тяжести симптомов и предрасположенности пациента побочным эффектам. Некоторые конкретные соединения являются более эффективными, чем другие. Предпочтительные дозы для заданного соединения легко определяются специалистами в данной области целым рядом способов. Предпочтительным способом является определение физиологической эффективности заданного соединения.
Способом, представляющим интерес, является применение липосом в качестве системы доставки. Липосомы объединяются с клетками сайта-мишени и доставляют содержимое полости внутриклеточно. Липосомы удерживают в контакте с клетками в течение времени, достаточного для слияния, используя различные способы для поддержания контакта, такие как выделение, связующие вещества и подобное. В одном аспекте изобретения липосомы создают в виде аэрозоля для введения в легкие. Липосомы могут быть получены с очищенными белками или пептидами, которые опосредуют слияние мембран, такими как вирус Сендай или вирус гриппа, и т.д. Липиды могут представлять собой любую подходящую комбинацию известных липосомобразующих липидов, в том числе катионных и цвиттер-ионных липидов, таких как фосфатидилхолин. Остальные липиды, как правило, будут нейтральными или кислыми липидами, такими как холестерин, фосфатидилсерин, фосфатидилглицерин и подобными.
Для получения липосом может быть использована методика, описанная Kato et al. (1991) J. Biol. Chem. 266:3361. Вкратце, липиды и состав полости, содержащей пептиды, объединяют в соответствующей водной среде, обычно в солевой среде, где общее количество твердых примесей будет находиться в интервале примерно 1-10 массовых процентов. После интенсивного встряхивания в течение коротких периодов времени, примерно от 5 до 60 сек, пробирку располагают на теплой водяной бане, примерно от 25 до 40°C и этот цикл повторяют примерно от 5 до 10 раз. Затем на композицию воздействуют ультразвуком в течение подходящего периода времени, в основном примерно от 1-10 сек, и дополнительно композицию можно перемешать интенсивным встряхиванием. Затем увеличивают объем, путем добавления водной среды, главным образом, увеличивая объем примерно в 1-2 раза с последующим встряхиванием и охлаждением. Этот способ позволяет включать в просвет молекулы высокой молекулярной массы.
Составы с другими активными агентами
Для использования в представленных способах антимикробные полипептиды по изобретению можно составлять в композицию с другими фармацевтически активными агентами, в частности с другими антимикробными агентами. Другие агенты, представляющие интерес, включают целый ряд антибиотиков, известных в уровне техники. Классы антибиотиков включают пенициллины, например пенициллин G, пенициллин V, метициллин, оксациллин, карбенициллин, нафциллин, ампициллин, и т.д.; пенициллины в комбинации с ингибиторами бета-лактамазы, цефалоспорины, например цефаклор, цефазолин, цефуроксим, моксалактам, и т.д.; карбапенемы; монобактамы; аминогликозиды; тетрациклины; макролиды; линкомицины; полимиксины; сульфонамиды; хинолоны; хлорамфеникал; метронидазол; спектиномицин; триметоприм; ванкомицин; и т.д.
Также можно использовать антимикотические агенты, в том числе полиены, например амфотерицин B, нистатин; 5-флукозин; и азолы, например, миконазол, кетоконазол, итраконазол и флуконазол. Противотуберкулезные лекарственные средства включают в себя изониазид, этамбутол, стрептомицин и рифампин. В состав композиции антимикробных полипептидов по изобретению могут быть включены цитокины, например, интерферон гамма, фактор некроза опухоли альфа, интерлейкин 12 и т.д.
Синтез in vitro
Антимикробные пептиды по изобретению можно получить путем синтеза in vitro, используя обычные способы, известные в этой области. Коммерчески доступна различная аппаратура для синтеза, например автоматические синтезаторы Applied Biosystems Inc., Beckman, и т.д. При использовании синтезаторов природные аминокислоты могут быть замещены неприродными аминокислотами, в частности, D-изомерами (или D-формами) например, D-аланин и D-изолейцин, диастереоизомеры, боковыми цепями различной длины и функциональной активности, и подобным. Конкретная последовательность и способ получения будут определяться удобством, экономическими характеристиками, желаемой чистотой и подобным.
Химическое связывание может быть предусмотрено для различных пептидов или белков, содержащих подходящие для связывания функциональные группы, такие как аминогруппы для амидов, или образования замещенных аминов, например, восстановительное аминирование, тиольные группы для тиоэфира или образования дисульфида, карбоксильные группы для образования амидов и подобное.
При необходимости во время синтеза или во время экспрессии в пептид можно вводить различные группы, которые обеспечивают связывание с другими молекулами или поверхностью. Следовательно, для получения тиоэфиров можно использовать цистеины, гистидины для связывания в комплекс с ионом металла, карбоксильные группы для образования амидов или сложных эфиров, аминогруппы для образования амидов и подобное.
Полипептиды также можно выделить и очистить в соответствии с обычными способами рекомбинантного синтеза. Может быть получен лизат экспрессирующего организма-хозяина и лизат может быть очищен с использованием ВЭЖХ, гель-хроматографии, гель-электрофореза, аффинной хроматографии или другими способами очистки. В своем большинстве используемые композиции будут содержать по меньшей мере 20% по массе желаемого продукта, чаще по меньшей мере примерно 75% по массе, предпочтительно по меньшей мере примерно 95% по массе, а для терапевтических целей, обычно по меньшей мере примерно 99,5% по массе, по сравнению с примесями, связанными со способом получения продукта и его очистки. Обычно процентные соотношения будут основаны на общем количестве белка.
Корм для животных
Настоящее изобретение также относится к способам использования полипептидов, обладающих антимикробной активностью, в корме для животных, а также к кормовым композициям и кормовым добавкам, содержащим антимикробные полипептиды по изобретению.
Термин «животное» включает в себя всех животных, в том числе людей. Примерами животных являются нежвачные и жвачные, такие как коровы, овцы и лошади. В частном варианте осуществления животное представляет собой нежвачное животное. Нежвачные животные включают в себя одножелудочных животных, например, свиней или кабанов (включая, но не только, поросят, подрощенных поросят и свиноматок); домашнюю птицу, такую как индюки и цыплята (включая, но не ограничиваясь, броллерных цыплят, кур-несушек); молодых телят; и рыбу (в том числе, но не только, лосось).
Термин «корм» или «кормовая композиция» означает любую композицию, препарат, смесь или композицию, подходящую или предназначенную для потребления животным.
В применении по изобретению антимикробный полипептид можно давать животному до или одновременно с рационом питания. Последнее является предпочтительным.
В конкретном варианте осуществления антимикробный полипептид в форме, в которой его добавляют к корму или при включении в кормовую добавку, ясно выражен. «Ясно выраженный» означает, что препарат антимикробного полипептида имеет по меньшей мере 50% чистоту по определению методом гель-хроматогафии (смотри Пример 12 WO 01/58275). В других конкретных вариантах осуществления препарат антимикробного полипептида имеет по меньшей мере 60, 70, 80, 85, 88, 90, 92, 94 или по меньшей мере 95% чистоту, определенную этим способом.
Хорошо очищенный препарат антимикробного полипептида является предпочтительным. Например, намного легче правильно дозировать в корме антимикробный полипептид, который по существу свободен от мешающих или загрязняющих других антимикробных пептидов. Термин правильная доза относится в частности к цели получения непротиворечивых и стабильных результатов и возможности оптимизации дозы, исходя из желаемого эффекта.
Для использования в корме для животных, однако, антимикробный полипептид не должен быть таким чистым; он может содержать, например, другие ферменты, в этом случае это можно было назвать препаратом антимикробного полипептида.
Препарат антимикробного полипептида может быть (a) добавлен непосредственно в корм (или использован непосредственно в процессе обработки растительных белков) или (b) он может быть использован в получении одной или нескольких промежуточных композиций, таких как кормовые добавки или заранее приготовленные смеси, которые впоследствии добавляют к корму (или используют в процессе обработки). Степень чистоты, описанная выше, относится к чистоте исходного препарата антимикробного полипептида, используемого в соответствии с (а) или (b), выше.
Хотя их не так легко получить, препараты антимикробного полипептида с чистотой этого порядка в частности получают с использованием рекомбинантных способов получения, в то время когда антимикробный полипептид получают традиционными способами ферментирования, они подвергаются гораздо большим изменениям от партии к партии.
Такой препарат антимикробного полипептида можно, разумеется, смешивать с другими ферментами.
Используемый здесь термин «растительные белки» относится к любому соединению, композиции, препарату или смеси, которая содержит по меньшей мере один белок, полученный из растительной культуры, или происходящий из нее, в том числе модифицированные белки и белки-производные. В отдельных вариантах осуществления белковая составляющая растительных белков по меньшей мере 10, 20, 30, 40, 50 или 60% (мас./мас.).
Растительные белки могут быть получены из источников растительных белков, таких как бобовые и зерновые, например вещества из растений семейств Fabaceae (Leguminosae), Cruciferaceae, Chenopodiaceae и Poaceae, такие как мука из соевых бобов, мука из люпина и мука из семян рапса.
В особом варианте осуществления источник растительных белков представляет собой вещество из одного или нескольких растений семейства Fabaceae, например сои, люпина, гороха или бобов.
В другом частном варианте осуществления источник растительных белков представляет собой вещество из одного или нескольких растений семейства Chenopodiaceae, например свеклы, сахарной свеклы, шпината или квиноя.
Другими примерами источников растительных белков являются семена рапса и капуста.
Соя является предпочтительным источником растительного белка.
Другими примерами источников растительных белков являются зерновые, такие как ячмень, пшеница, рожь, овес, маис (кукуруза), рис и сорго.
Антимикробный полипептид можно добавлять к корму в любой форме, как относительно чистый антимикробный полипептид, или в смеси с другими компонентами, предназначенными для добавления к корму для животных, т.е. в форме добавки к корму для животных, например так называемых заранее приготовленных смесей для корма для животных.
В дополнительном аспекте настоящее изобретение относится к композициям для использования в корме для животных, например кормах для животных и добавок в корм для животных, например заранее приготовленные смеси.
Помимо антимикробного полипептида по изобретению добавки в корм для животных в соответствии с изобретением содержат по меньшей мере один жирорастворимый витамин и/или по меньшей мере один водорастворимый витамин, и/или по меньшей мере один микроэлемент, и/или по меньшей мере один макроэлемент.
Кроме того, необязательно, ингредиенты кормовых добавок представляют собой красители, ароматизаторы, стабилизаторы и/или по меньшей мере один другой фермент, выбранный из фитаз EC 3.1.3.8 или 3.1.3.26; ксиланаз EC 3.2.1.8; галактаназ EC 3.2.1.89; и/или бета-глюканаз EC 3.2.1.4.
В особом варианте осуществления другие ферменты хорошо определены (как опредено выше для препаратов антимикробных полипептидов).
Примерами других антимикробных пептидов (АМП) являются CAP18, Лейкоцин A, Тритрптицин, Протегрин-1, Танатин, Дефенсин, Овиспирин, например, Новиспирин (Robert Lehrer, 2000), и варианты или их фрагмены, которые сохраняют антимикробную активность.
Примерами других противогрибковых полипептидов (ПГП) являются полипептиды Aspergillus giganteus и Aspergillus niger, а также их варианты и фрагменты, которые сохраняют противогрибковую активность, описанные в WO 94/01459 и WO 02/090384.
Обычно жиро- и водорастворимые витамины, а также микроэлементы из части так называемой заранее приготовленной смеси предназначены для добавления в корм, тогда как макроэлементы обычно добавляют к корму по отдельности. Любая из композиций этих типов при обогащении антимикробным полипептидом по изобретению представляет собой добавку к корму для животного в соответствии с изобретением.
В особом варианте осуществления добавка к корму для животного в соответствии с изобретением предназначена для включения (или ее необходимо включать) в рацион питания животных или корм в количествах от 0,01 до 10,0%; более конкретно от 0,05 до 5,0%; или от 0,2 до 1,0% (% означает г добавки на 100 г корма). То же, в частности, для заранее приготовленных смесей.
Следующее представляет собой неисключительный перечень примеров этих компонентов:
Примерами жирорастворимых витаминов являются витамин А, витамин D3, витамин E и витамин K, например, витамин K3.
Примерами водорастворимых витаминов являются витамин B12, биотин и холин, витамин B1, витамин B2, витамин B6, ниацин, фолиевая кислота и пантотенат, например, Ca-D-пантотенат.
Примерами микроэлементов являются марганец, цинк, железо, медь, йод, селен и кобальт.
Примерами макроэлементов являются кальций, фосфор и натрий.
Потребности в питательных веществах этих компонентов (на примере индейки и поросят/свиней) перечислены в Таблице А заявки WO 01/58275. Потребность в питательных веществах означает, что эти компоненты должны быть представлены в рационе питания в указанных концентрациях.
В альтернативе добавка к корму для животного в соответствии с изобретением содержит по меньшей мере один из индивидуальных компонентов, определенных в Таблице А заявки WO 01/58275. По меньшей мере один означает любой из, один или несколько из, один, или два, или три, или четыре и так далее вплоть до всех тринадцати или всех пятнадцати индивидуальных компонентов. Более конкретно, по меньшей мере один индивидуальный компонент включен в добавку по изобретению в таком количестве, которое обеспечивает концентрацию в корме в диапазоне, указанном в колонке четыре или в колонке пять, или в колонке шесть Таблицы А.
Настоящее изобретение также относится к кормовым композициям для животных. Кормовые композиции для животных или рационы питания имеют относительно высокое содержание белка. Рационы питания индеек и свиней можно охарактеризовать, как указано в Таблице B заявки WO 01/58275, колонки 2-3. Рационы питания для рыб можно охарактеризовать, как указано в колонке 4 этой Таблицы B. Кроме того, содержание сырого жира в таких рационах питания для рыб обычно составляет 200-310 г/кг.
Содержание сырого белка в кормовой композиции для животных в соответствии с изобретением составляет 50-800 г/кг, и, кроме того, она содержит по меньшей мере один антимикробный полипептид, заявленный здесь.
Дополнительно или альтернативно (для содержания сырого белка, указанного выше), метаболическая энергия кормовой композиции для животных в соответствии с изобретением составляет 10-30 МДж/кг; и/или содержание кальция составляет 0,1-200 г/кг; и/или содержание доступного фосфора составляет 0,1-200 г/кг; и/или содержание метионина составляет 0,1-100 г/кг; и/или содержание метионина плюс цистеина составляет 0,1-150 г/кг; и/или содержание лизина составляет 0,5-50 г/кг.
В конкретных вариантах осуществления содержание метаболической энергии, сырого белка, кальция, фосфора, метионина, метионина плюс цистеина и/или лизина находится в любом из диапазонов 2, 3, 4 или 5 Таблицы B заявки WO 01/58275 (R. 2-5).
Сырой белок рассчитывают как азот (N) умноженный на коэффициент 6,25, т.е. Сырой белок (г/кг) = N (г/кг)×6,25. Содержание азота определяют методом Кьельдаля (A.O.A.C., 1984, Official Methods of Analysis 14th ed., Association of Official Analytical Chemists, Washington DC).
Метаболическую энергию можно вычислить, исходя из публикации NRC: Nutrient requirements in swine, ninth revised edition 1988, subcommittee on swine nutrition, committee on animal nutrition, board of agriculture, national research council. National Academy Press, Washington, D.C., pp. 2-6, и European Table of Energy Values for Poultry Feed-stuffs, Spelderholt centre for poultry research and extension, 7361 DA Beekbergen, The Netherlands. Grafisch bedrijf Ponsen & looijen bv, Wageningen. ISBN 90-71463-12-5.
Содержание кальция в рационе питания, доступного фосфора и аминокислот в полном рационе питания животного, рассчитывают по пищевым таблицам, таким как Veevoedertabel 1997, gegevens over chemische samenstelling, verteerbaarheid en voederwaarde van voedermiddelen, Central Veevoederbureau, Runderweg 6, 8219 pk Lelystad. ISBN 90-72839-13-7.
В конкретном варианте осуществления кормовая композиция для животных в соответствии с изобретением содержит по меньшей мере один растительный белок или один источник белка, как определено выше.
В других конкретных вариантах осуществления кормовая композиция для животных в соответствии с изобретением содержит 0-80% маиса; и/или 0-80% сорго; и/или 0-70% пшеницы; и/или 0-70% ячменя; и/или 0-30% овса; и/или 0-40% муки соевых бобов; и/или 0-10% рыбной кормовой муки; и/или 0-20% молочной сыворотки.
Рацион питания для животных, например, можно получать в виде мешанки (непеллетированного) или пеллетированного корма. Обычно молотые корма смешивают и добавляют достаточные количества необходимых витаминов и минералов в соответствии с характеристиками рассматриваемых разновидностей. Ферменты можно добавлять в виде твердых или жидких ферментных композиций. Например, твердую ферментную композицию обычно добавляют до или во время стадии смешивания; а жидкий ферментный препарат обычно добавляют после стадии пеллетирования. Фермент также может быть включен в кормовую добавку или заранее приготовленную смесь.
Конечная концентрация фермента в рационе находится в интервале 0,01-200 мг ферментного белка на кг рациона, например, в интервале 5-30 мг ферментного белка на кг рациона животного.
Антибактериальный полипептид можно вводить в одном или нескольких следующих количествах (диапазонах доз): 0,01-200; или 0,01-100; или 0,05-100; или 0,05-50; или 0,10-10 - все эти диапазоны даны в мг белка антимикробного полипептида на кг корма (частей на миллион).
Для определения мг белка антимикробного полипептида на кг корма, антимикробный полипептид очищают от кормовой композиции, и специфичную активность очищенного антимикробного полипептида определяют с использованием соответствующего анализа (смотри ниже антимикробную активность, субстраты и исследования). Антимикробную активность кормовой композиции, как таковую, также определяют с использованием того же исследования, и на основе этих двух определений рассчитывают дозу в мг белка антимикробного полипептида на кг корма.
Те же самые принципы применяются для определения мг белка антимикробного полипептида в кормовых добавках. Разумеется, если доступен образец антимикробного полипептида, используемого для получения кормовой добавки или корма, специфическую активность определяют из этого образца (нет необходимости очищать антимикробный полипептид от кормовой композиции или добавки).
Настоящее изобретение дополнительно описывается следующими примерами, которые не следует интерпретировать как ограничивающие объем изобретения.
ПРИМЕРЫ
Химические реактивы, используемые в качестве буферов и субстратов, являются коммерчески доступными продуктами, по меньшей мере чистыми для анализа.
ПРИМЕР 1
Оценка минимальной эффективной концентрации
Три антимикробных полипептида, которые представляют собой варианты SEQ ID NO:1, были протестированы на антимикробную активность. Исследование Минимальной Эффективной Концентрации (МЭК, выраженной в мкг/мл) в отношении различных микроорганизмов проводили с использованием трех мутантов плектазина, Y40YR, N17R и Y25R по протоколу, описанному в книге Methods in Molecular Biology, vol 78, Antibacterial peptide protocol William M. Shafer, Human Press.
Мутант плектазина «Y40YR» получали путем добавления остатка аргинина к концу аминокислотной последовательности плектазина.
Результаты показали улучшенную активность всех трех антимикробных полипептидов по сравнению с плектазином дикого типа (SEQ ID NO:1) в отношении бактерий Bacillus subtilis, Micrococcus luteus и Staphylococcus epidermidis.
ПРИМЕР 2
Оценка антимикробной активности
Ряд антимикробных полипептидов, которые представляют собой варианты SEQ ID NO:1 (плектазин), был протестирован на антимикробную активность посредством экспрессии их в S. cerevisae и скрининга супернатанта дрожжевых трансформантов на антимикробную активность в отношении Staphylococcus carnosus ATCC51365.
Ростовую среду и растворы получали, как описано в публикации Sambrook, Fritsch and Maniatis (1989), Molecular cloning, Cold Spring Harbour, Laboratory Press, New York.
Радиальную диффузию проводили, как описано в публикации Methods in Molecular Biology, vol 78, Antibacterial peptide protocol, William M. Shafer, Human Press.
200-300 колоний дрожжевых трансформантов помещали на круглые чашки диаметром 14 см, содержащие 25 мл ростовой среды SC, дополненной 1,5% галактозы, 0,5% глюкозы и 1,5% агарозы. Чашки инкубировали в течение трех часов при комнатной температуре, сверху наносили 25 мл той же ростовой среды и оставляли для роста в течение трех дней при 30 градусах Цельсия.
Затем на чашки сверху наносили 25 мл ростовой среды LB, содержащей 1,5% агарозы и 105 клеток индикаторного штамма Staphylococcus carnosus и инкубировали при 30 градусах Цельсия в течение ночи для роста бактериальных клеток. На следующий день чашки окрашивали с использованием 1,5 мM MTT для облегчения визуализации зон просветления.
Дрожжевые колонии, создающие зоны просветления переносили в микротитровальные планшеты, содержащие 200 мкл ростовой среды SC, дополненной 2% глюкозой и ампициллином (100 мг/л). Такие планшеты, обозначенные «эталонными планшетами», инкубировали в течение 2 дней при 30 градусах Цельсия с колебаниями при 450 об/мин для роста дрожжей.
10 мкл ростовой среды SC из каждой лунки этих эталонных планшетов переносили в новые микротитровальные планшеты, содержащие 200 мкл ростовой среды SC с 1,5% галактозы и 0,5% глюкозы. Эти планшеты назвали дочерними планшетами и инкубировали в течение 3 дней при 30 градусах Цельсия с колебаниями при 450 об/мин для роста дрожжей и синтеза пептида.
Наконец проводили радиальную диффузию (RDA) по протоколу, описанному в публикации Methods in Molecular Biology для анализа и количественного определения антимикробной активности дрожжевых супернатантов в отношении S. carnosus.
Вкратце, 30 мл минимальной среды нижнего слоя, содержащей 1% агарозы и 5x105 КОЕ/мл S. carnosus, выливали в лоток Оmnitray (Nunc, 242811). Планшет Nunc TSP (#445497) сразу же вставляли в этот лоток для получения 96-луночного планшета. Как только среда затвердела, планшет TSP убирали и 10 мкл образцов дрожжевого супернатанта наносили на лунки. Планшеты инкубировали 3 часа при 37 градусах Цельсия и сверху наносили 15 мл агаровой ростовой среды LB. Наконец, планшеты инкубировали в течение ночи при 37 градусах Цельсия и окрашивали с использованием 1,5 мM MTT для визуализации зон просветления.
Проводили осмотр и измерение зон просветления на планшетах. Соответствующие колонии дрожжевых клеток, которые привели к появлению зон просветления того же размера или большего, чем клоны, кодирующие плектазин дикого типа, собирали с эталонных планшетов и переносили на агаровые чашки, содержащие ростовую среду SC с 2% глюкозы и ампициллином (100 мг/л). Эти чашки инкубировали в течение еще 2 дней при 30 градусах Цельсия для обеспечения роста дрожжевых клеток. После этого, проводили ПЦР колоний с последующим сиквенсом для идентификации аминокислотных изменений в последовательности плектазина.
Мутации и соответствующие антимикробные активности, относительно активности плектазина, приведены в Таблице 2. Активность 2 соответствует активности плектазина. Активность 3 лучше активности плектазина, а 1 - хуже, чем у плектазина.
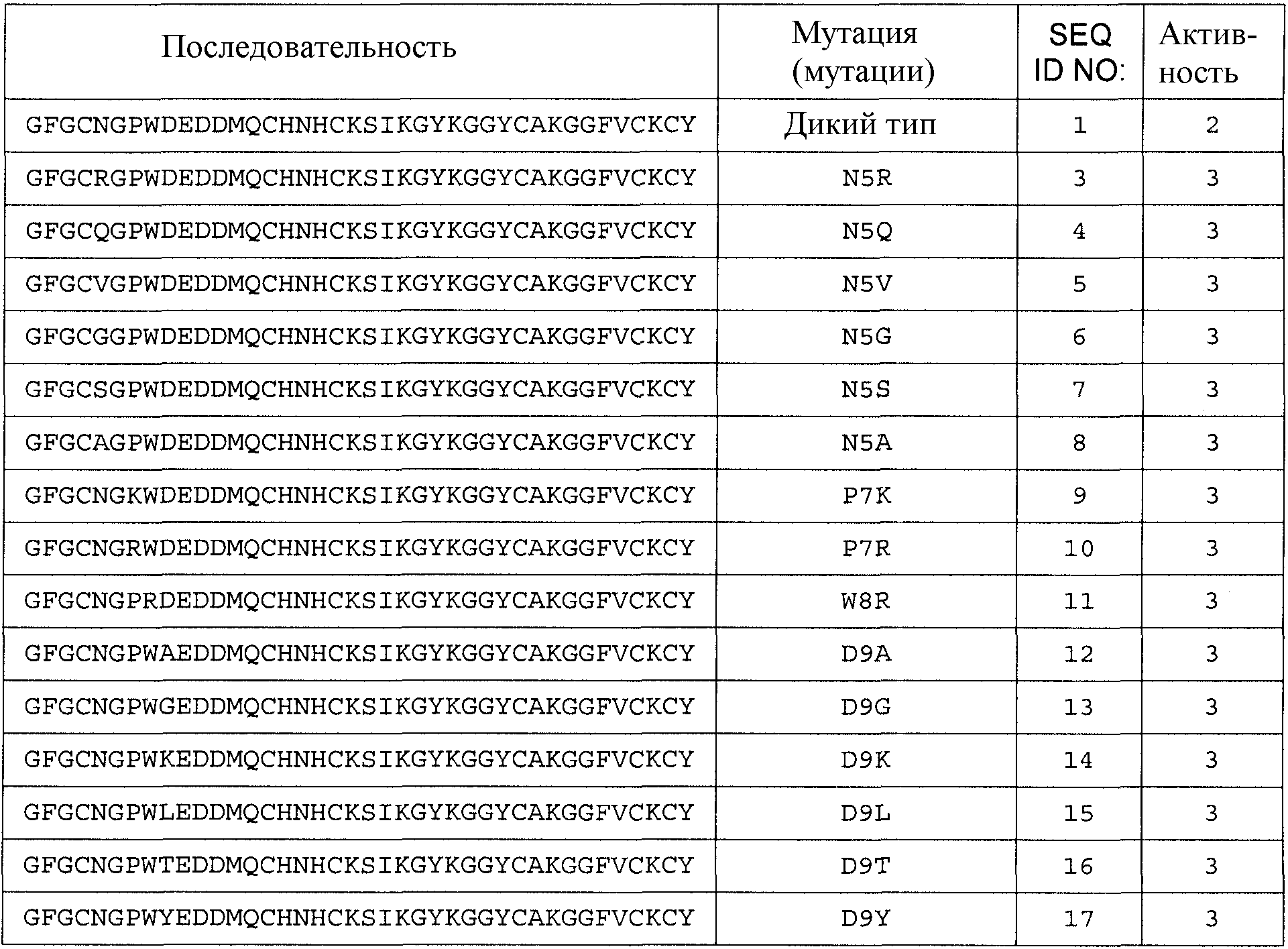
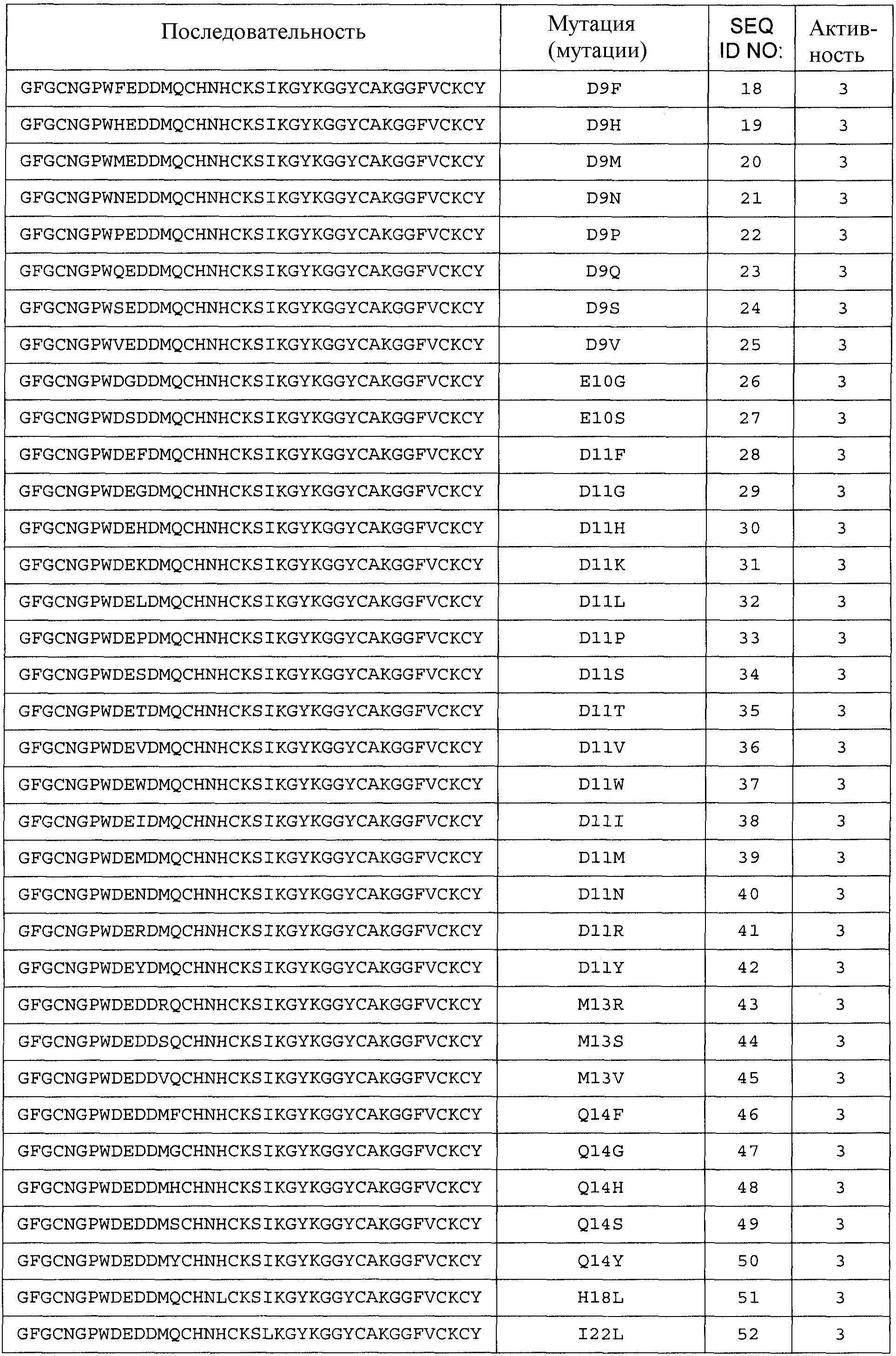
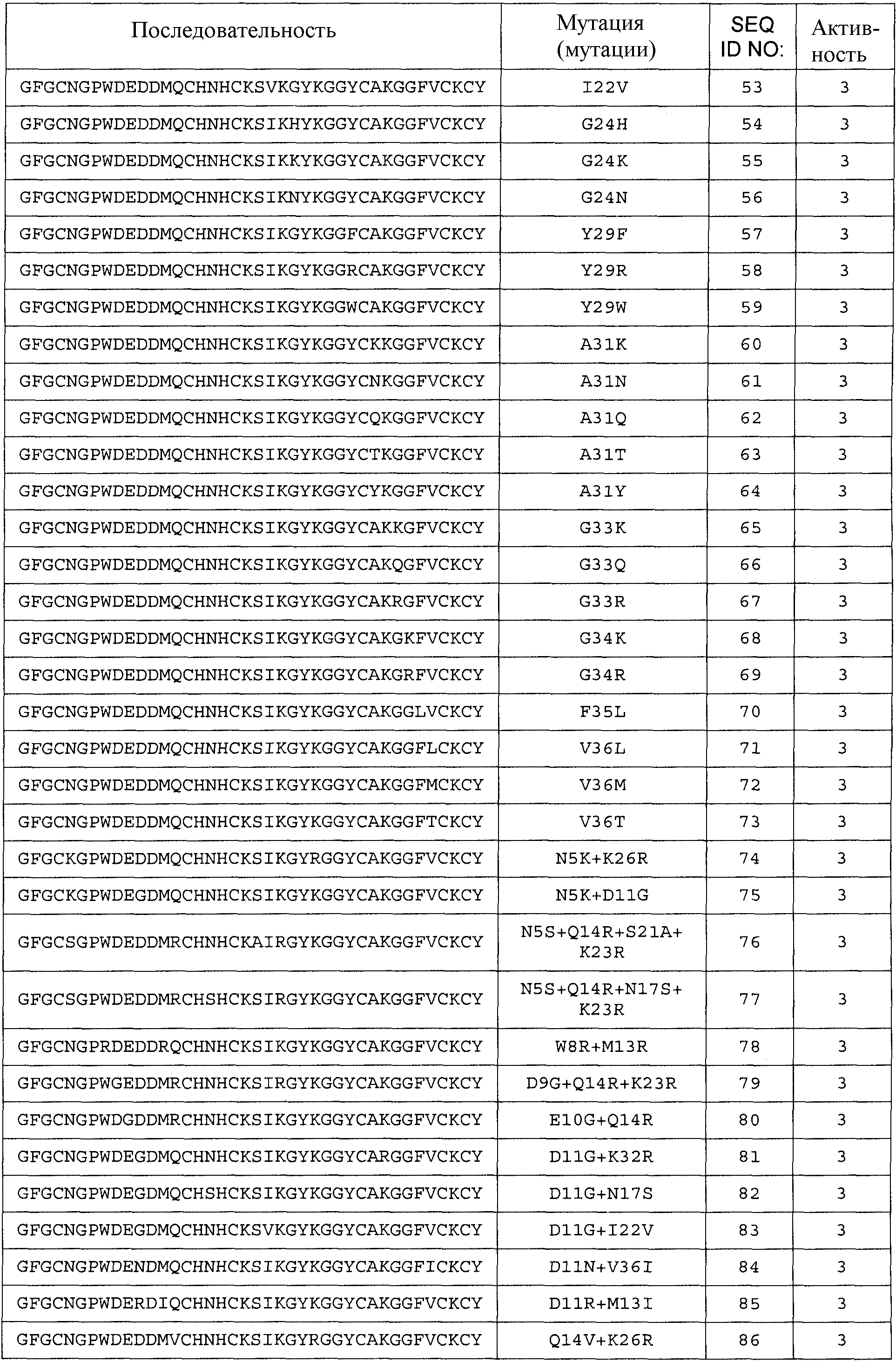
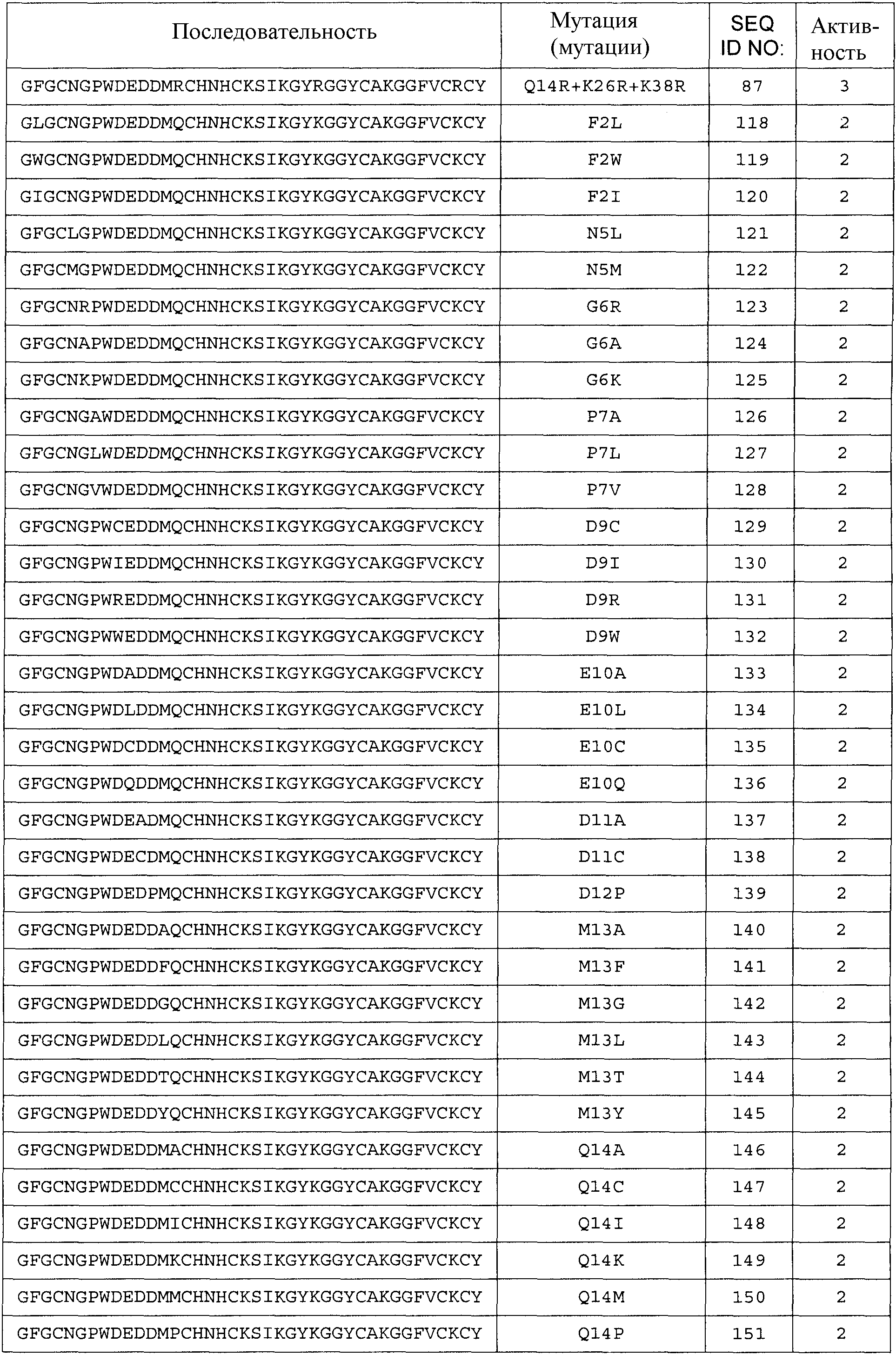
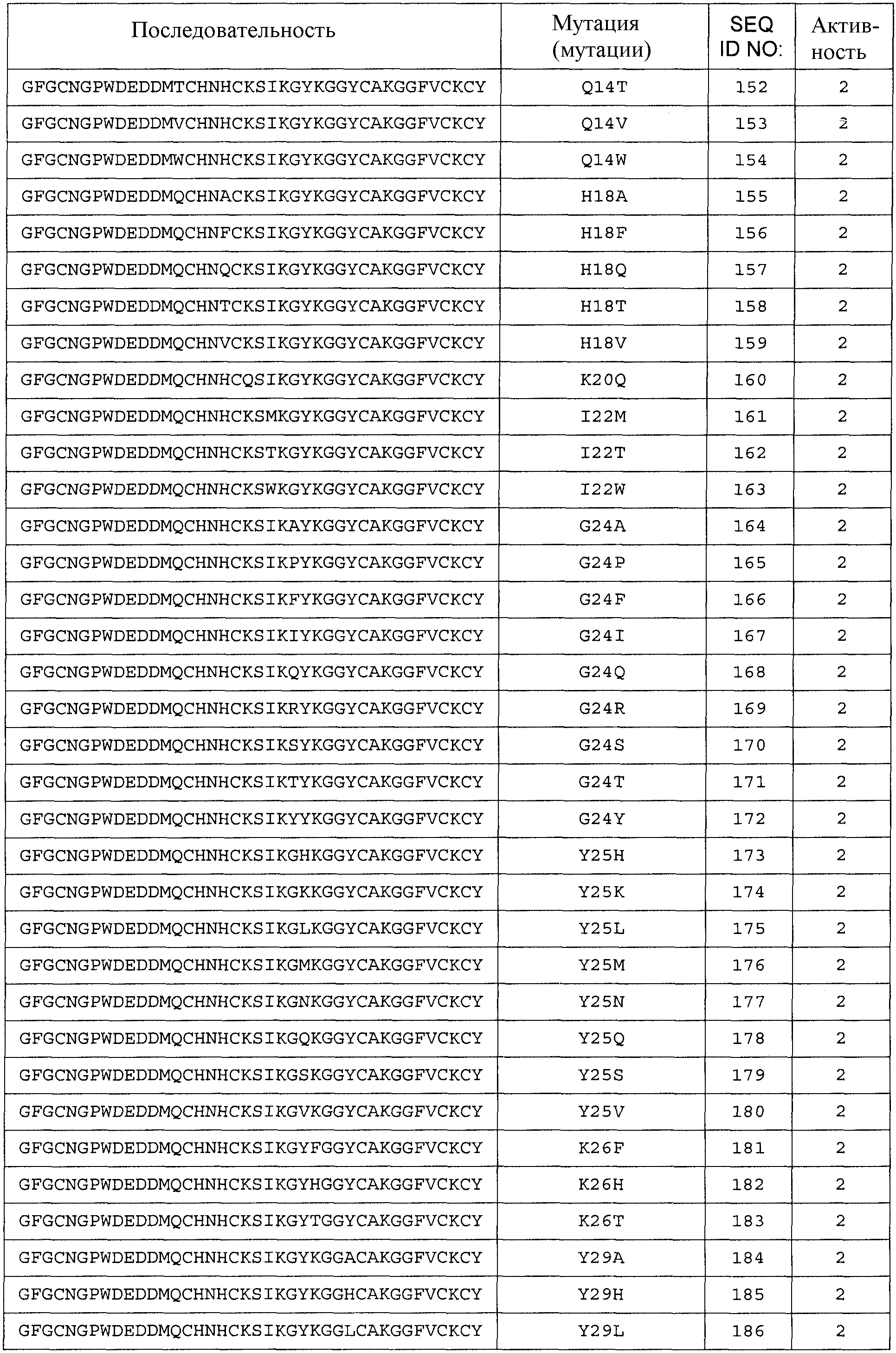

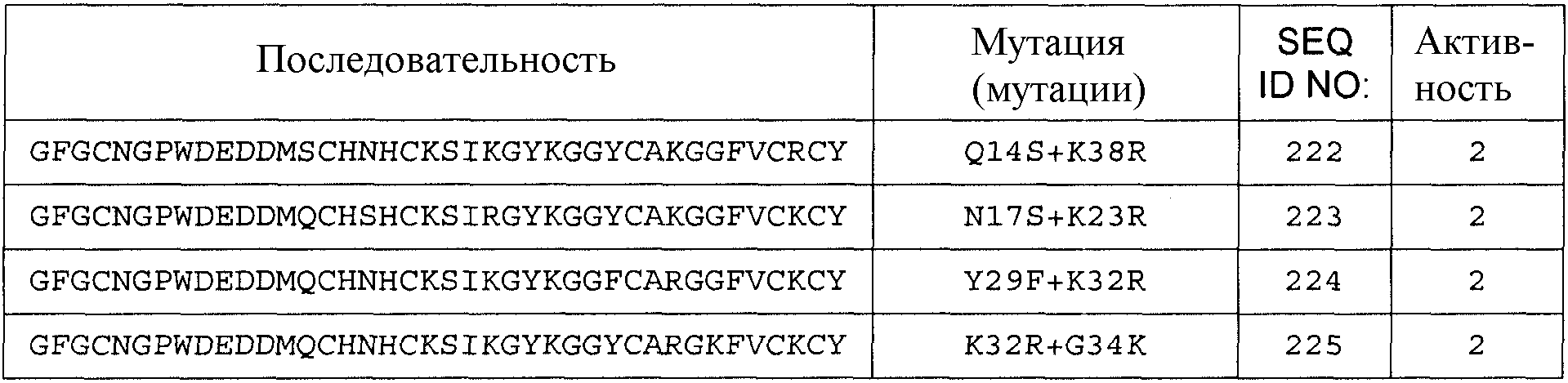
ПРИМЕР 3
Идентификация антимикробных пептидов с улучшенной антимикробной активностью
Ряд антимикробных полипептидов, которые являются вариантами SEQ ID NO:1, был протестирован в исследовании TAPS. TAPS можно использовать для идентификации новых или улучшенных генов, кодирующих пептиды, которые могут уничтожать или подавлять рост клеток-мишеней (смотри заявку PCT WO 2004/033715). Исследование TAPS, аббревиатура для TransActing Peptide System, основано на наличии чувствительного организма-хозяина, продуцирующего пептид, с последующим скринингом на его активность в trans-положении в отношении индикаторного штамма. Преимущество этой системы основано на том, что антимикробный пептид экспрессируется в грамотрицательных бактериях E. coli и за его антимикробной активностью можно наблюдать на различных микроорганизмах, в том числе грамотрицательных, грамположительных или грибах. Кроме того, TAPS дает возможность подуцировать правильно уложенные АМП, содержащие дисульфидные связи, в клетках-хозяевах, тем самым сохраняя их антимикробную активность.
Для TAPS подхода требуется, первое, чтобы экспрессия пептида находилась под контролем индуцибельного промотора с жесткой регуляцией, поскольку клетки-хозяева являются чувствительными к пептиду, когда продуцируют его. Во-вторых, продуцированный пептид должен высвобождаться в среду, так чтобы он мог взаимодействовать с организмом-мишенью.
TAPS скрининг можно проводить либо в твердой, либо в жидкой среде. На твердой среде плазмидную библиотеку изначально вводят в клетки-хозяева E. coli. Важно, чтобы трансформанты культивировались на поверхности целлюлозно-ацетатного фильтра, расположенного на ростовой среде LB без индуктора (арабинозы) во избежание экспрессии антимикробного пептида и, следовательно, подавления роста. На следующей стадии фильтр, содержащий колонии, переносят на ростовую среду LB, содержащую индуктор (0,1% арабинозу) для обеспечения синтеза пептидов. После этого штамм-мишень, например, S. carnosus, сверху наносят на чашку и оставляют расти в течение 12-16 часов при 37 градусах Цельсия. Наконец проводят визуальный осмотр клеток-хозяев, способных уменьшать пролиферацию клеток-мишеней и нуклеотидную последовательность, кодирующую антимикробный пептид, извлекают из клеток-хозяев. Анализ последовательности ДНК этих вариантов проводят для выявления природы этого пептида.
Как указывалось выше, TAPS скрининг также можно проводить с использованием жидкой среды. Для этой процедуры требуется использование робототехники для анализа огромного числа клонов. В этой системе клетки-хозяева E. coli оригами трансформируют с использованием плазмидной библиотеки и адсорбируют на среде LB+0,2% глюкозой+ампициллин (200 мг/л). Независимые колонии затем инокулируют в 96 или 384-луночные планшеты, содержащие 200 мкл среды TB + ампициллин (200 мг/л) и культивируют в течение ночи при 37 градусах Цельсия. Эти культуры затем реплицируют с помощью робота и выращивают до фазы экспоненциального роста перед добавлением индуктора (0,1% арабинозы) для запуска пептидного синтеза. Следующая стадия состоит в гидролизе клеток с тем, чтобы пептид высвобождался в среду, с помощью гидролиза горячей кислотой. Эта обработка состоит в добавлении 1 М фосфатно-натриевого буфера pH 2,3 до получения конечного рН приблизительно 2,3 и инкубировании культур в течение ночи при 80 градусах Цельсия. На следующий день аликвоту 25 мкл гидролизованных культур используют для проведения теста на активность в отношении желаемых организмов-мишеней. Проводимый тест на активность представлял собой радиальную диффузию (РД), где аликвоту гидролизованной культуры добавляли к агарозной среде, инокулированной штаммом-мишенью, S. carnosus. РД, полученные в результате скрининга чашек, содержащих зоны просветления, соответствующие клонам, демонстрирующим антимикробную активность, идентифицировали без труда. Измерения диаметра зон просветления проводили для количественного определения силы антимикробной активности этих пептидов.
Антимикробная активность (в отношении Staphylococcus carnosus) протестированных вариантов плектазина, измеренная с помощью TAPS анализа, представлена в таблице 3. Антимикробная активность соответствует размеру зоны просветеления и классицировалась следующим образом: 4>3>2>1; где 4 лучше, чем 1, а активность дикого типа соответствует 1.
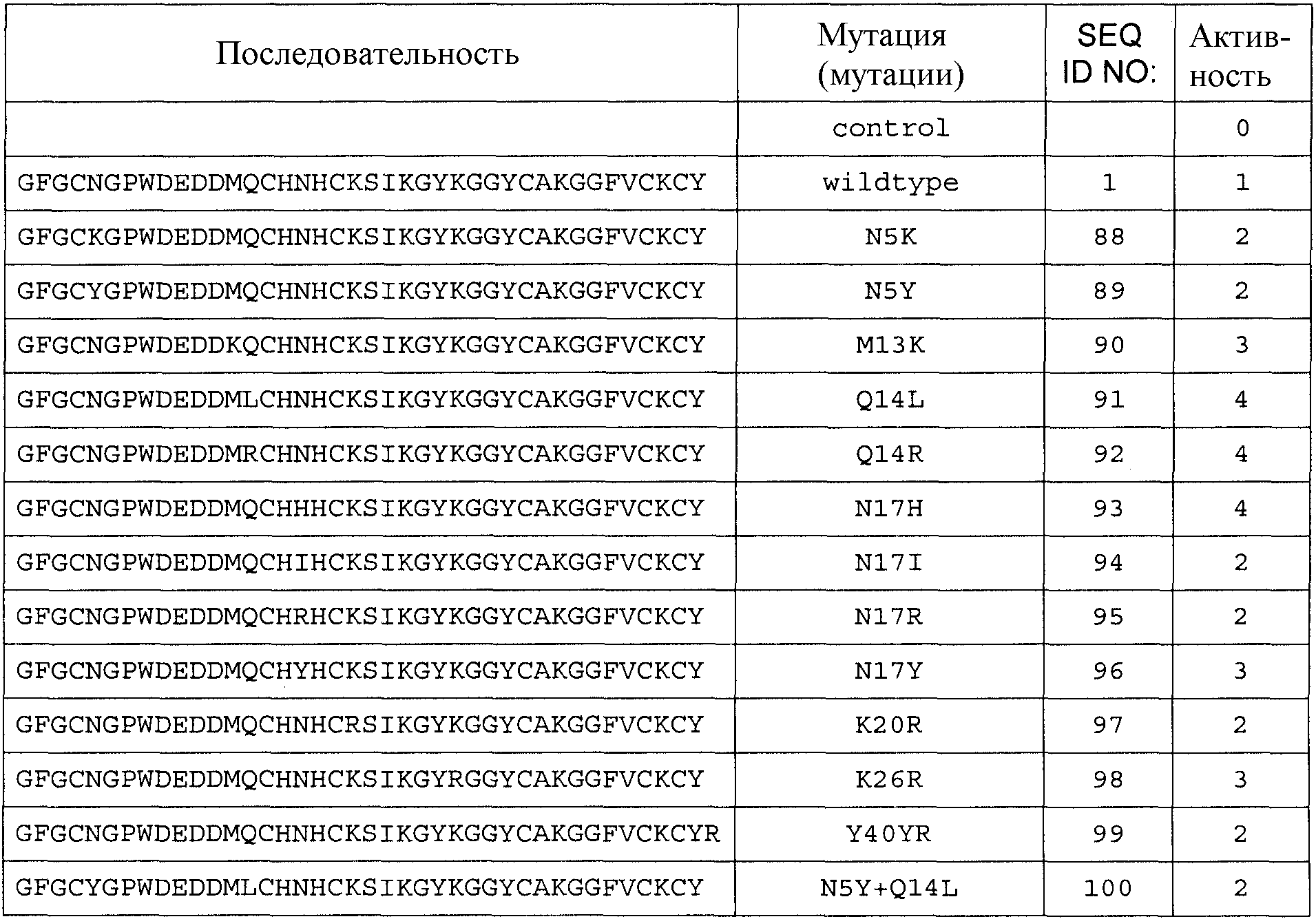
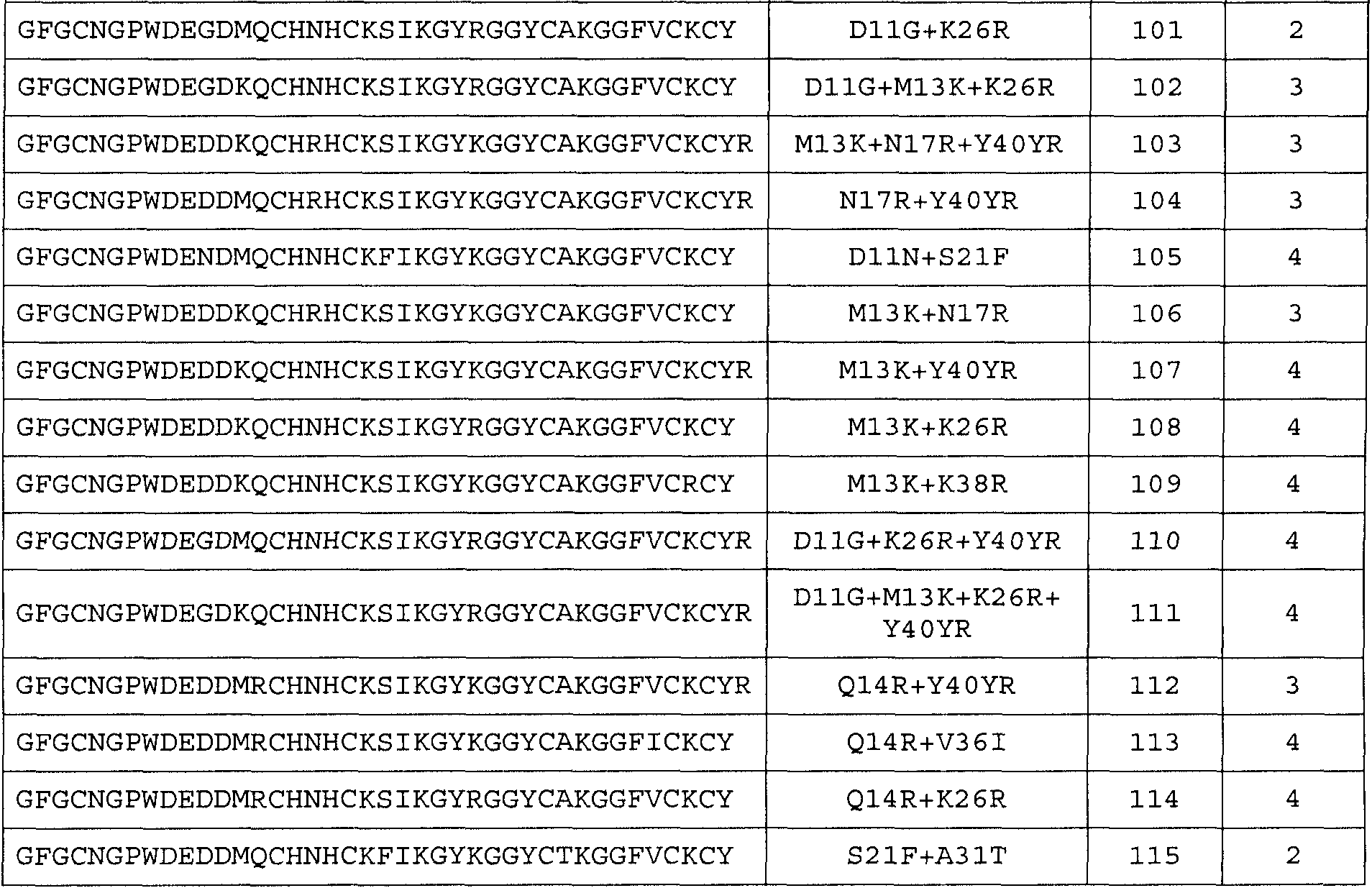
ПРИМЕР 4
Оценка антимикробной активности
Плектазин дикого типа (SEQ ID NO:1) и пять вариантов плектазина, которые показали улучшенную активность в TAPS методе и/или в системе дрожжевых клеток, экспрессировали и очищали. Минимальную Ингибирующую концентрацию (МИК, мкг/мл) определяли для тестирования их антимикробной активности в соответствии с руководствами NCCLS (Институт по клиническим и лабораторным стандартам, ранее известный как Национальный комитет по клиническим и лабораторным стандартам).
Результаты показали, что все варианты плектазина имели улучшенную активность по сравнению с плектазином дикого типа, в отношении Stapylococcus aureus, Micrococcus luteus и Bacillus subtilis.
ПРИМЕР 5
Оценка антимикробной активности
Плектазин дикого типа (SEQ ID NO:1) и несколько вариантов плектазина экспрессировали и очищали. Минимальную Ингибирующую Концентрацию (МИК) определяли для тестирования их антимикробной активности в соответствии с руководствами NCCLS от CLSI (Институт по клиническим и лабораторным стандартам, ранее известный как Национальный комитет по клиническим и лабораторным стандартам).
Пептиды тестировали в отношении следующих штаммов:
A: Staphylococcus aureus, ATCC 29213;
B: Staphylococcus aureus, ATCC 25923;
C: Staphylococcus aureus, ATCC 29737;
D: Staphylococcus aureus, MRSA ST5 (2001), мультирезистентный клинический изолят от человека из Statens Serum Institut, Denmark;
E: Staphylococcus aureus, MRSA ST80 (2003), мультирезистентный клинический изолят от человека из Statens Serum Institut, Denmark.
Все значения МИК представляют среднее значение двух независимых экспериментов; и все результаты в Таблице 5 выражены относительно дикого типа плектазина:
0:>100% МИК плектазина дикого типа;
1:80-100% МИК плектазина дикого типа;
2:50-80% МИК плектазина дикого типа;
3:<50% МИК плектазина дикого типа.
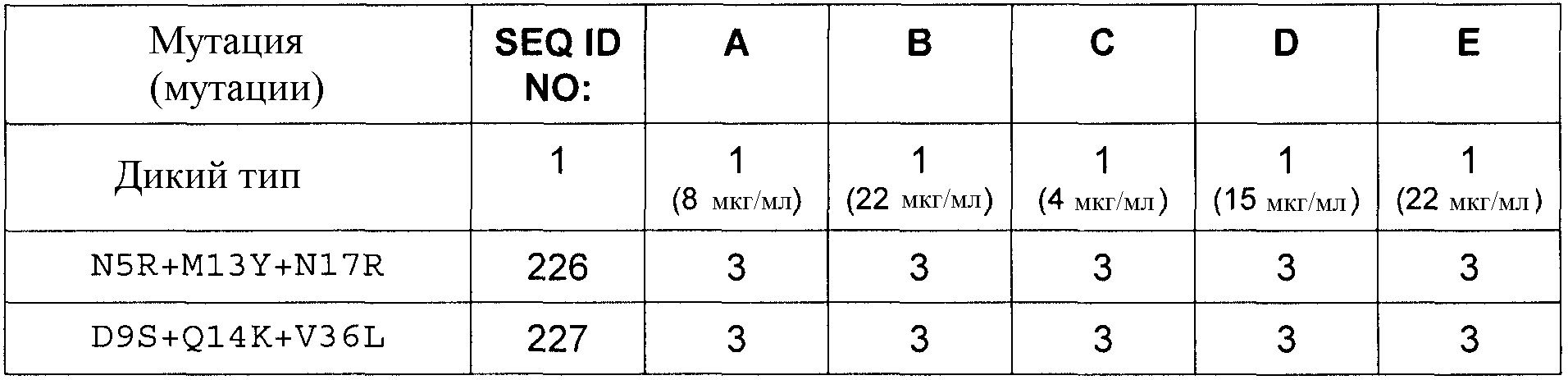
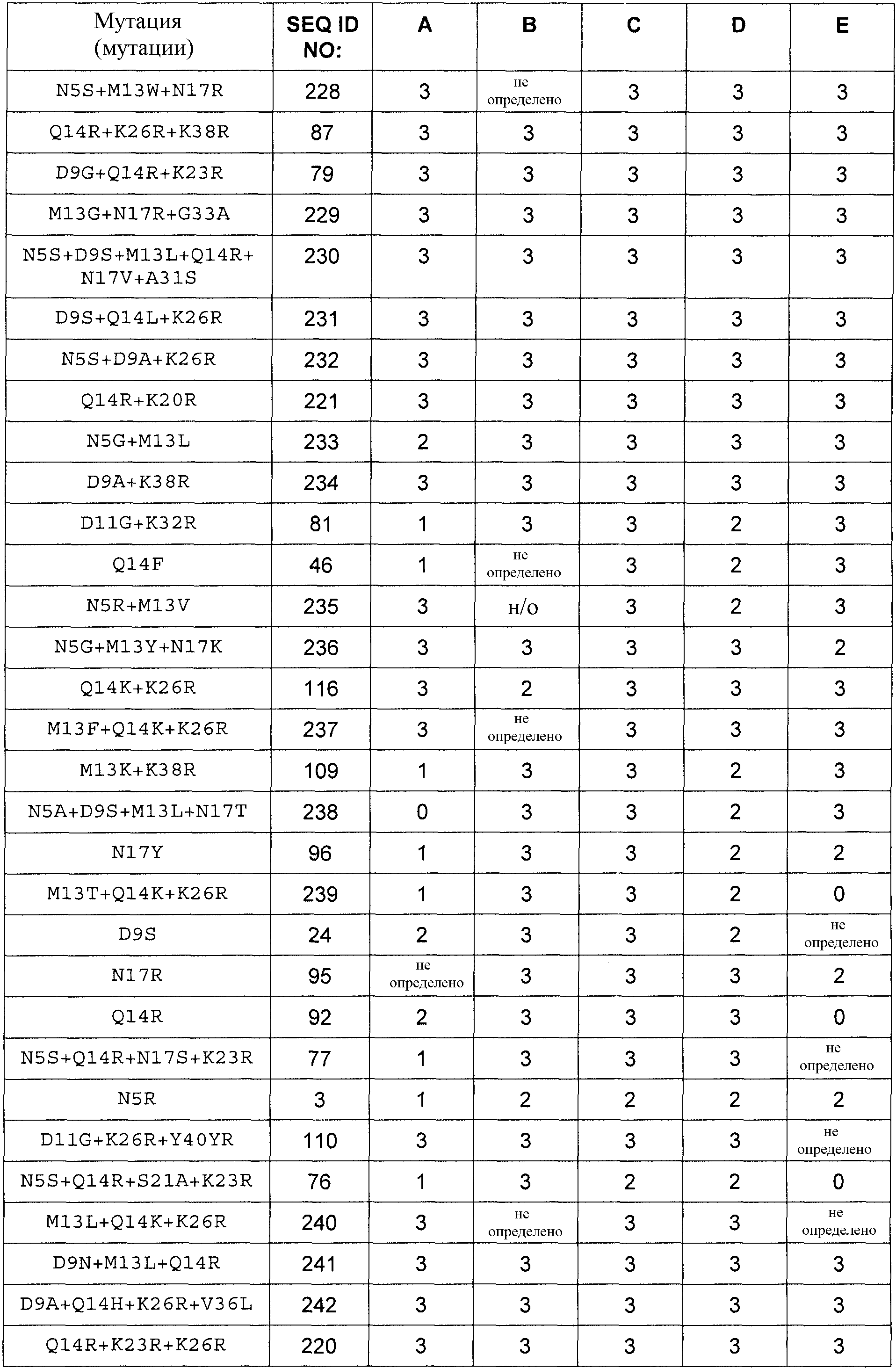
ПРИМЕР 6
Оценка антимикробной активности
Большое количество антимикробных пептидов было протестировано в отношении набора из 6 различных штаммов Staphylococcus aureus, перечисленных ниже:
Staphylococcus aureus, ATCC29213, MSSA, NCCLS эталонный штамм;
Staphylococcus aureus, ATCC25923, MSSA, NCCLS эталонный штамм;
Staphylococcus aureus, ATCC29737, MSSA;
Staphylococcus aureus, E33235, MSSA;
Staphylococcus aureus, 698-01, MRSA ST5, Str, Kan, Oxa;
Staphylococcus aureus, 566-03, MRSA ST80, Oxa, Tet, Fus, Kan.
S. aureus E33235, S. aureus 698-01 и S. aureus 566-03 доступны от Statens Serum Institut, Denmark.
Стафилококки подвергали воздействию пептида в следующих концентрациях: 32; 16; 8; 4; 2; 1; 0,5; 0,25; 0,13; 0,6; и 0,03 мкг/мл. Все пептиды очищали, количественно определяли с помощью ВЭЖХ и концентрированные пептиды (>160 мкг/мл) разбавляли до концентрации 160 мкг/мл в пептидном разбавляющем буфере (0,1% BSA, 0,01% уксусной кислоты).
Определение МИК в основном проводили, как описано в руководствах NCCLS/CLSI, используя caMHB. МИК считывали через 18-24 часа инкубации при 37°C и записывали наряду с КОЕ в таблице, приведенной ниже.
Общее число 95 антимикробных пептидов по изобретению оценивали в двух испытаниях в отношении 6 бактериальных штаммов, описанных выше.
В большинстве двойных определений (93%), МИК варьировала <2 раза. Средние значения МИК приведены в таблице ниже. Если МИК была выше 32 мкг/мл, для вычисления среднего использовали значение 64.
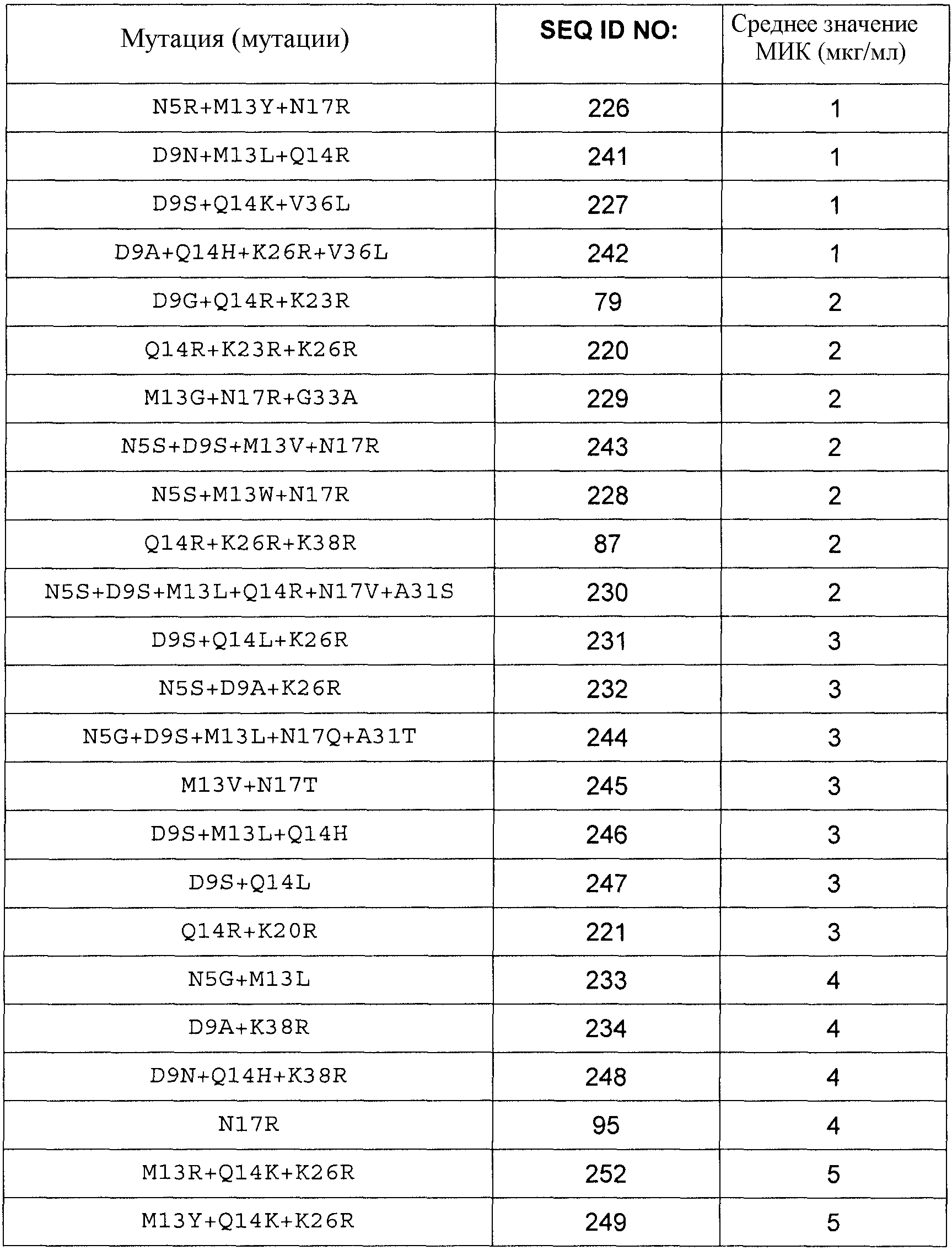
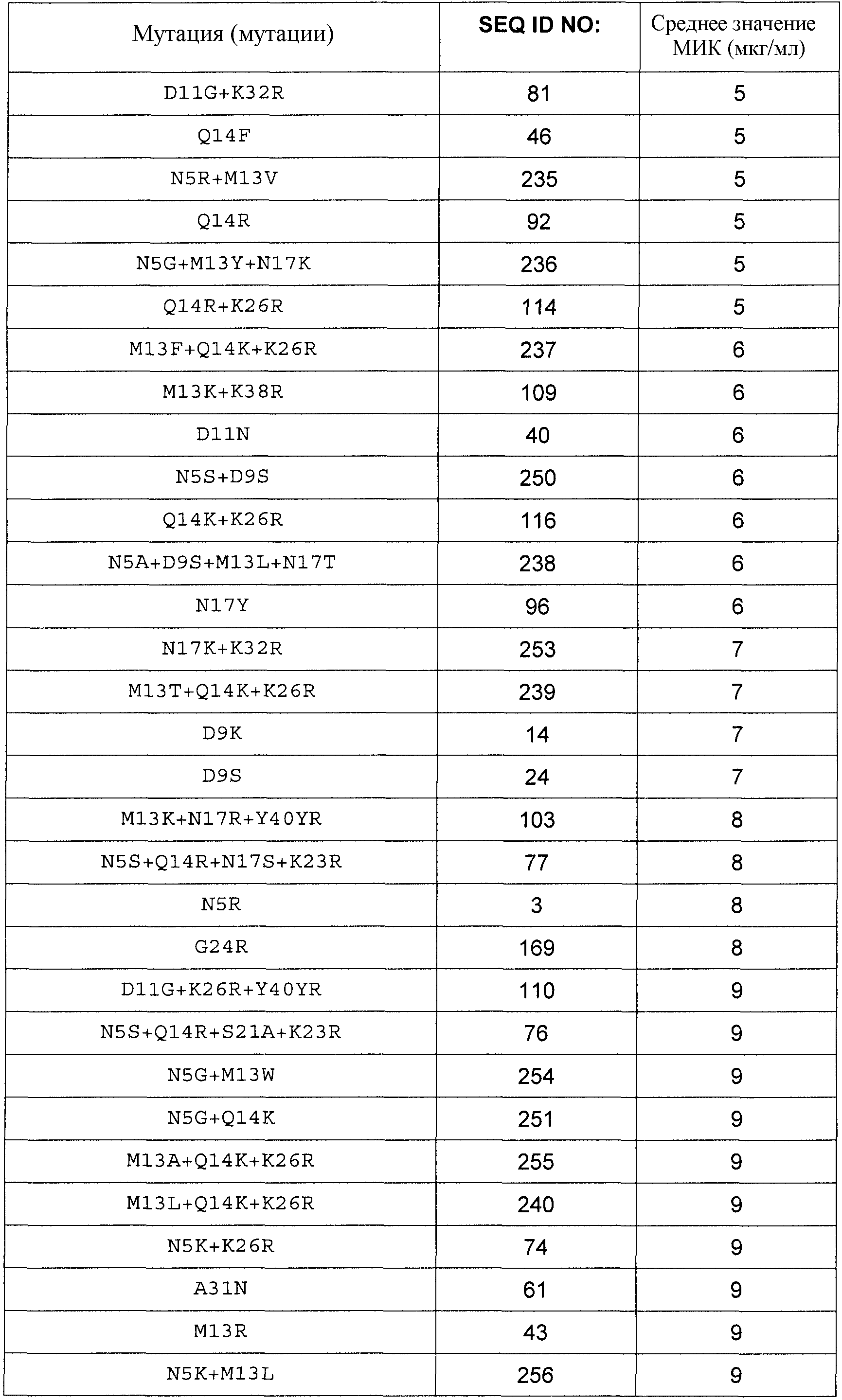
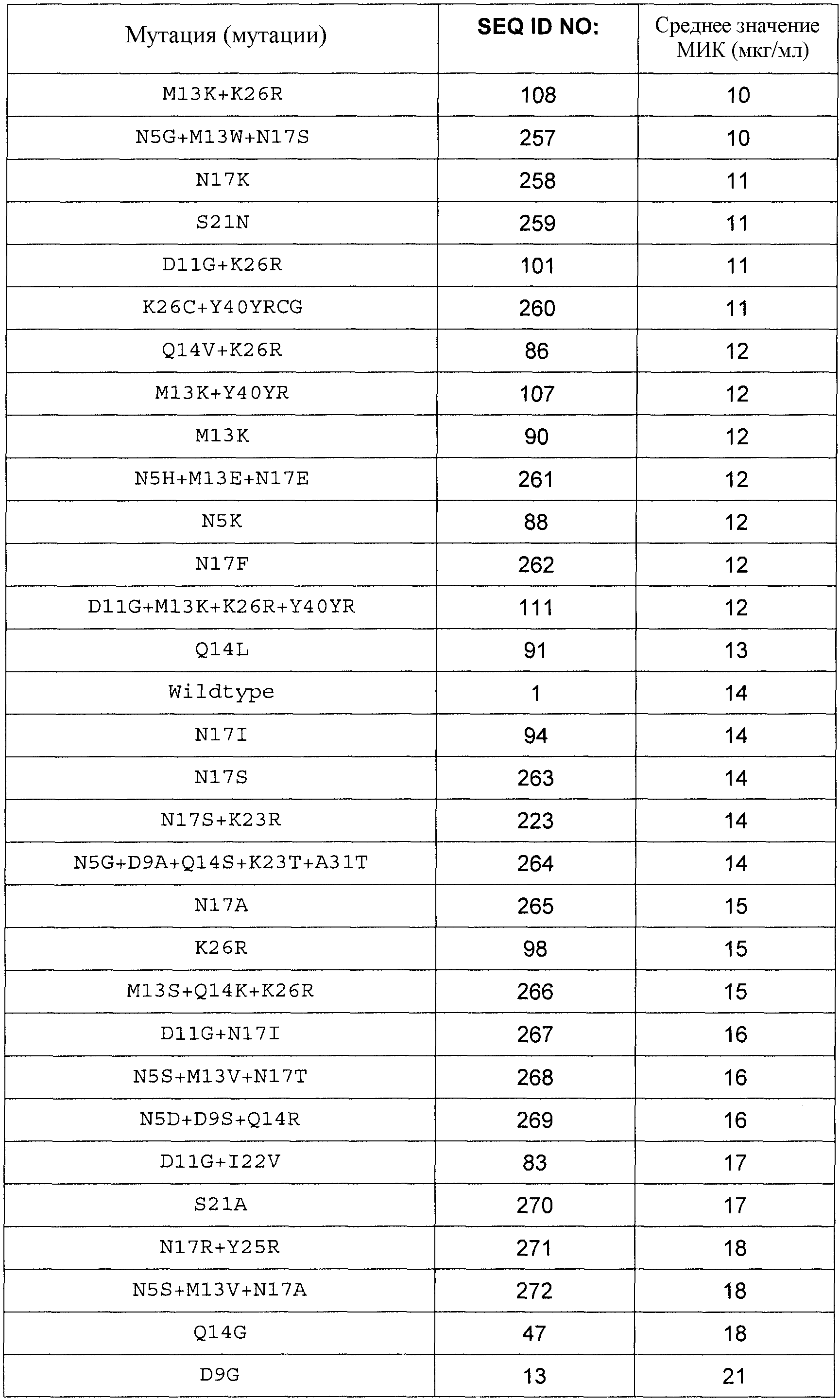
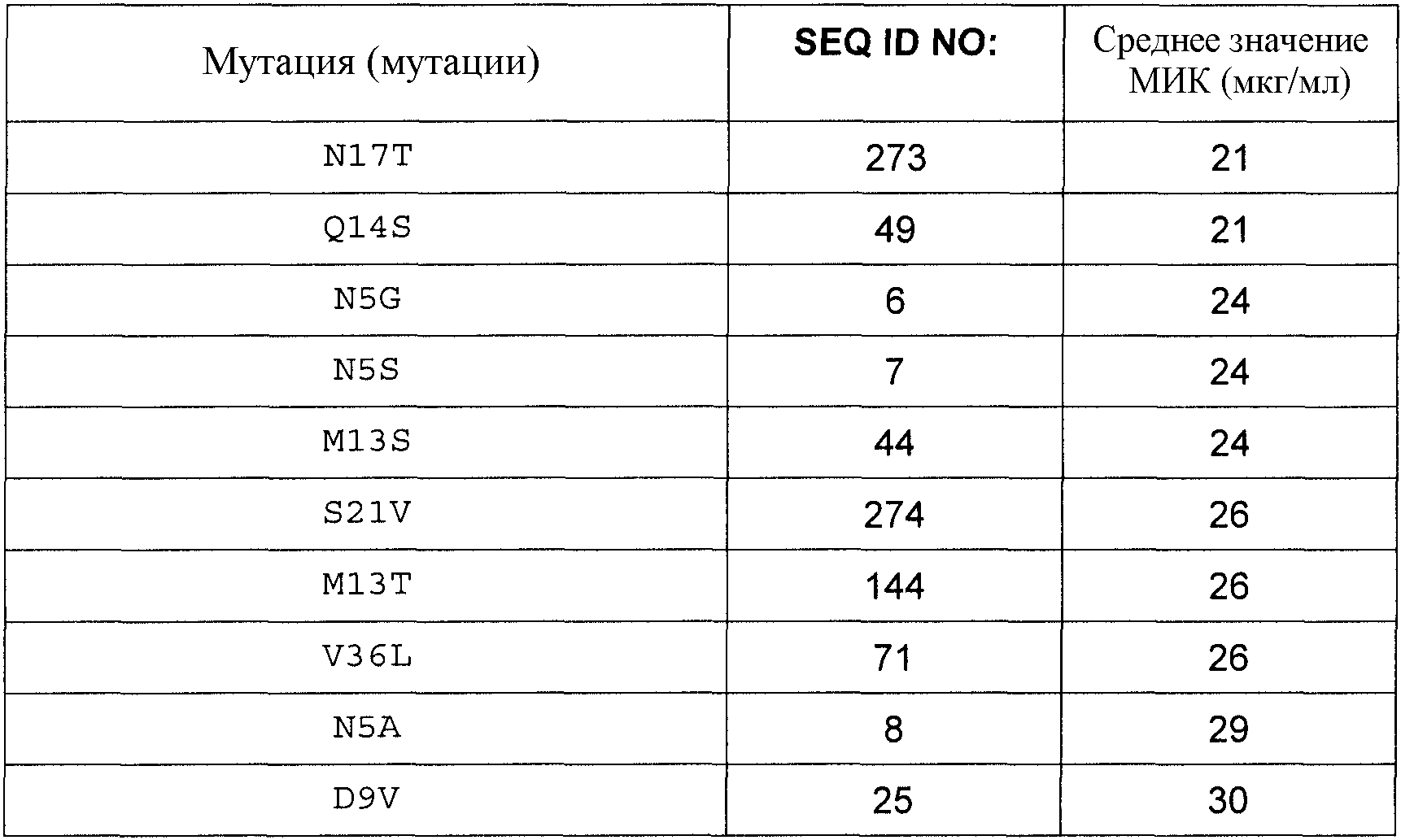
ПРИМЕР 7
Использование файлов HMM базы данных PFAM для идентификации дефенсина
Анализ последовательностей с помощью профилей скрытой марковской модели (профили HMM) можно проводить либо «online» в Интернете, либо локально на компьютере, используя хорошо известный, имеющийся в свободном доступе, пакет программ HMMER. Текущей версией является HMMER 2.3.2 октября 2003.
Профили HMM могут быть получены из хорошо известной базы данных PFAM. Текущей версией является PFAM 16.0 от ноября 2004. Обе базы данных, HMMER и PFAM, доступны для всех компьютерных платформ, например, от Washington University in St. Louis (USA), School of Medicine (http://pfam.wustl.edu and http://hmmer.wustl.edu).
Если запрос аминокислотной последовательности или ее фрагмента принадлежит одному из следующих пяти семействам PFAM, аминокислотная последовательность представляет собой дефенсин по настоящему изобретению:
- Дефенсин_бета или «Бета-Дефенсин», регистрационный номер: PF00711;
- Дефенсин_пропеп или «Пропептид Дефенсина», регистрационный номер: PF00879;
- Дефенсин_1 или «Дефенсин млекопитающих», регистрационный номер: PF00323;
- Дефенсин_2 или «Дефенсин Членистоногих», регистрационный номер: PF01097;
- Гамма-тионин или «Семейство гамма-тионинов», регистрационный номер: PF00304.
Аминокислотная последовательность принадлежит семейству PFAM в соответствии с настоящим изобретением, если она генерирует величину E, которая больше 0,1, и количество баллов, которое больше или равно нулю, при использовании базы данных PFAM online, или когда локально используют программу hmmpfam (из пакета программ HMMER).
Когда анализ последовательности проводят локально с использованием программы hmmpfam, необходимо получить (загрузить) профили HMM из базы данных PFAM. Для каждого семейства существует два профиля; xxx_ls.hmm для универсального поиска и xxx_fs.hmm для локального поиска («xxx» - название семейства). В общей сложности получается десять профилей для пяти семейств, упомянутых выше.
Эти десять профилей можно использовать индивидуально или объединенными (присоединенными) в единый профиль (используя текстовый редактор - профили представляют собой файлы ASCII), которые можно назвать, например, defensin.hmm. Запрос аминокислотной последовательности затем можно задать, используя следующую командную строку:
hmmpfam -E 0.1 defensin.hmm sequence_file
где «sequence_file» представляет собой файл с запросом аминокислотной последовательности в любом формате, распознаваемом пакетом программ HMMER.
Если количество баллов больше или равно нулю (0,0), а величина E больше 0,1, запрошенная аминокислотная последовательность представляет собой дефенсин по настоящему изобретению.
База данных PFAM дополнительно описана у Bateman et al. (2004) «The Pfam Protein Families Database», Nucleic Acids Research, Vol. 32 (Database Issue) pp. D138-D141.
Реферат
Изобретение относится к выделенным полипептидам, обладающим антимикробной активностью, и выделенным полинуклеотидам, кодирующим эти полипептиды, а также к конструкциям нуклеиновой кислоты, векторам и клеткам-хозяевам, содержащим указанные полинуклеотиды. Антимикробная активность полученных полипептидов позволяет применять их в ветеринарии и медицине, а также в кормопроизводстве. 12 н. и 4 з.п. ф-лы, 6 табл.
Формула
и которая имеет идентичность менее 100% аминокислотам с 1 по 40 последовательности SEQ ID NO: 1.

Комментарии