Композиции и способы синтеза 5-(n-защищенного триптаминкарбоксамида)-2'-дезоксиуридинфосфорамидита для включения в нуклеиновую кислоту - RU2750989C2
Код документа: RU2750989C2
Чертежи





Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Данная заявка заявляет приоритет по предварительной заявке США № 62/308132, поданной 14 марта 2016 года, содержание которой включено в данный документ во всей своей полноте посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Данное изобретение относиться к области модифицированных оснований, нуклеотидов и амидофосфитов, включая улучшенные способы синтеза, и олигонуклеотидов, содержащих модифицированные нуклеотиды.
уровень техники
[0003] Химически модифицированный нуклеотид, TrpdU (и его 2'-модифицированные аналоги), который содержит в боковой цепи 3-(2-аминоэтил)-индол, полезен, например, при разработке высокоаффинных аптамеров для целевых аналитов, таких как белки. Индольное кольцо TrpdU обогащено электронами и поляризуемо, что может способствовать образованию вторичной структуры и комплементарных гидрофобных поверхностей раздела с целевыми аналитами. На сегодняшний день, TrpdU не применялся так же, как и другие модифицированные нуклеотиды в качестве амидофосфитного реагента в твердофазном синтезе олигонуклеотидов, и поэтому его использование было ограничено.
[0004] В данной области техники существует потребность в улучшенном амидофосфите TrpU и улучшенных способах получения амидофосфита TrpU.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] В некоторых вариантах реализации изобретения предложено соединение, имеющее структуру

В некоторых вариантах реализации изобретения R1 выбран из трет-бутила, 1,1-диметилпропила; 1,1-диметилбутила; 2-хлорфенила; 2-цианофенила; 1-метилциклопентила; и 1-метилциклогексила. В некоторых вариантах реализации изобретения X1 и Х2 каждый независимо выбран из метокси и водорода. В некоторых вариантах реализации изобретения X3 выбран из метокси, фтора, водорода и трет-бутилдиметилсилилокси.
[0006] В некоторых вариантах реализации изобретения R1 представляет собой трет-бутил. В некоторых вариантах реализации изобретения, R1 представляет собой 1,1-диметилпропил. В некоторых вариантах реализации изобретения R1 представляет собой 1,1-диметилбутил; 2-хлорфенил. В некоторых вариантах реализации изобретения, R1 представляет собой 2-цианофенил. В некоторых вариантах реализации изобретения R1 представляет собой 1-метилциклопентил. В некоторых вариантах реализации изобретения, R1 представляет собой 1-метилциклогексил. В некоторых вариантах реализации изобретения, X1 и Х2 представляет собой метокси. В некоторых вариантах реализации изобретения, X3 представляет собой водород. В некоторых вариантах реализации изобретения, X3 представляет собой метокси. В некоторых вариантах реализации изобретения, X3 представляет собой фтор. В некоторых вариантах реализации изобретения, X3 представляет собой трет-бутилдиметилсилилокси.
[0007] В некоторых вариантах реализации изобретения, соединение, предложенное в данном документе, выбрано из:







и его солей.
[0008] В некоторых вариантах реализации изобретения предложено соединение, имеющее структуру

В некоторых вариантах реализации изобретения, R1 выбран из трет-бутила, 1,1-диметилпропила; 1,1-диметилбутила; 2-хлорфенила; 2-цианофенила; 1-метилциклопентила; и 1-метилциклогексила. В некоторых вариантах реализации изобретения, X1 и Х2 каждый независимо выбран из метокси и водорода. В некоторых вариантах реализации изобретения, X3 выбран из метокси, фтора, водорода и трет-бутилдиметилсилилокси.
[0009] В некоторых вариантах реализации изобретения, R1 представляет собой трет-бутил. В некоторых вариантах реализации изобретения, R1 представляет собой 1,1-диметилпропил. В некоторых вариантах реализации изобретения, R1 представляет собой 1,1-диметилбутил; 2-хлорфенил. В некоторых вариантах реализации изобретения, R1 представляет собой 2-цианофенил. В некоторых вариантах реализации изобретения, R1 представляет собой 1-метилциклопентил. В некоторых вариантах реализации изобретения, R1 представляет собой 1-метилциклогексил. В некоторых вариантах реализации изобретения, X1 и Х2 представляет собой метокси. В некоторых вариантах реализации изобретения, X3 представляет собой водород. В некоторых вариантах реализации изобретения, X3 представляет собой метокси. В некоторых вариантах реализации изобретения, X3 представляет собой фтор. В некоторых вариантах реализации изобретения, X3 представляет собой трет-бутилдиметилсилилокси.
[0010] В некоторых вариантах реализации изобретения, соединение выбрано из:




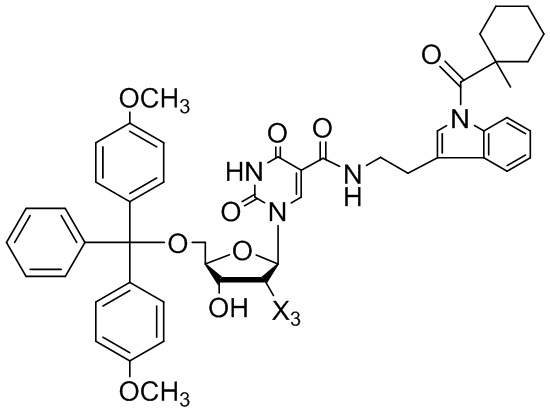


[0011] В некоторых вариантах реализации изобретения предложено соединение, имеющее структуру:

[0012] В некоторых вариантах реализации изобретения, соединение имеет структуру, выбранную из:







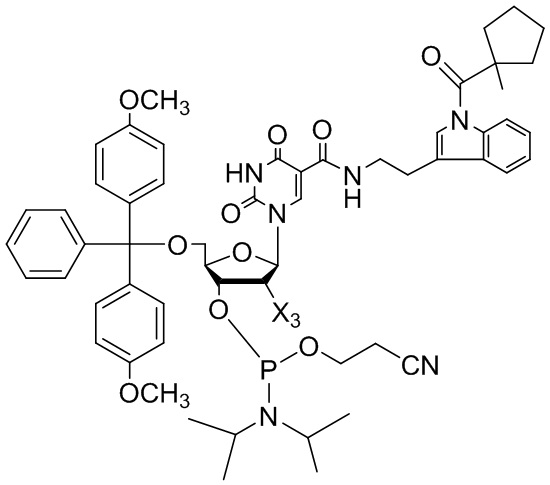
[0013] В некоторых вариантах реализации изобретения предложено соединение, имеющее структуру:

[0014] В некоторых вариантах реализации изобретения, соединение имеет структуру, выбранную из:







[0015] В некоторых вариантах реализации изобретения предложены способы получения соединения, имеющего структуру:
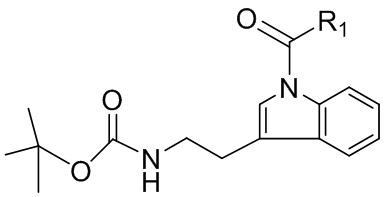
В некоторых вариантах реализации изобретения, R1 выбран из трет-бутила, 1,1-диметилпропила; 1,1-диметилбутила; 2-хлорфенила; 2-цианофенила; 1-метилциклопентила; и 1-метилциклогексила. В некоторых вариантах реализации изобретения, R1 представляет собой трет-бутил. В некоторых вариантах реализации изобретения, R1 представляет собой 1,1-диметилпропил. В некоторых вариантах реализации изобретения, R1 представляет собой 1,1-диметилбутил; 2-хлорфенил. В некоторых вариантах реализации изобретения, R1 представляет собой 2-цианофенил. В некоторых вариантах реализации изобретения, R1 представляет собой 1-метилциклопентил. В некоторых вариантах реализации изобретения, R1 представляет собой 1-метилциклогексил. В некоторых вариантах реализации изобретения, способ включает приведение в контакт N-α-BOC-триптамина с хлорангидридом кислоты, выбранным из пивалоилхлорида, 2,2-диметилбутироилхлорида, 2,2-диметилвалероилхлорида, 1-метилциклопентан-1-карбонилхлорида, 1-метилциклогексан-1-карбонилхлорида, 2-хлорбензоилхлорида и 2-цианобензоилхлорида. В некоторых вариантах реализации изобретения, R1 представляет собой трет-бутил, и где хлорангидрид кислоты представляет собой пивалоилхлорид. В некоторых вариантах реализации изобретения, R1 представляет собой 1,1-диметилпропил, а хлорангидрид кислоты представляет собой 2,2-диметилбутироилхлорид. В некоторых вариантах реализации изобретения, R1 представляет собой 1,1-диметилбутил, а хлорангидрид кислоты представляет собой 2,2-диметилвалероилхлорид. В некоторых вариантах реализации изобретения, R1 представляет собой 2-хлорфенил, а хлорангидрид кислоты представляет собой 2-хлорбензоилхлорид. В некоторых вариантах реализации изобретения, R1 представляет собой 2-цианофенил, а хлорангидрид кислоты представляет собой 2-цианобензоилхлорид. В некоторых вариантах реализации изобретения, R1 представляет собой 1-метилциклопентил, а хлорангидрид кислоты представляет собой 1-метилциклопентан-1-карбонилхлорид. В некоторых вариантах реализации изобретения, R1 представляет собой 1-метилциклогексила, а хлорангидрид кислоты представляет собой 1-метилциклогексан-1-карбонилхлорид.
[0016] В некоторых вариантах реализации изобретения, предложен способ получения соединения, выбранного из







[0017] В некоторых вариантах реализации изобретения предложен способ получения соединения, имеющего структуру:

В некоторых вариантах реализации изобретения, R1 выбран из трет-бутила, 1,1-диметилпропила; 1,1-диметилбутила; 2-хлорфенила; 2-цианофенила; 1-метилциклопентила; и 1-метилциклогексила. В некоторых вариантах реализации изобретения, способ включает приведение в контакт соединения

[0018] В некоторых вариантах реализации изобретения, предложен способ получения соединения, выбранного из:







[0019] В некоторых вариантах реализации изобретения, способ дополнительно включает приведение в контакт N-α-BOC-триптамина с хлорангидридом кислоты, выбранным из пивалоилхлорида, 2,2-диметилбутироилхлорида, 2,2-диметилвалероилхлорида, 1-метилциклопентан-1-карбонилхлорида, 1-метилциклогексан-1-карбонилхлорида, 2-хлорбензоилхлорида и 2-цианобензоилхлорида, с образованием соединения

[0020] В некоторых вариантах реализации изобретения предложен способ получения соединения, имеющего структуру:

В некоторых вариантах реализации изобретения, R1 выбран из трет-бутила, 1,1-диметилпропила; 1,1-диметилбутила; 2-хлорфенила; 2-цианофенила; 1-метилциклопентила; и 1-метилциклогексила. В некоторых вариантах реализации изобретения, X1 и Х2 каждый независимо выбран из метокси и водорода. В некоторых вариантах реализации изобретения, X3 выбран из метокси, фтора, водорода и трет-бутилдиметилсилилокси. В некоторых вариантах реализации изобретения предложен способ, включающий приведение в контакт соединения

с 5'-O-DMT-5-(2,2,2-трифторэтилоксикарбонил)-2'-дезоксиуридином (TFEdU).
[0021] В некоторых вариантах реализации изобретения, предложен способ получения соединения, выбранного из:







[0022] В некоторых вариантах реализации изобретения, способ дополнительно включает приведение в контакт соединения

с трифторуксусной кислотой с образованием соединения

В некоторых вариантах реализации изобретения, способ дополнительно включает приведение в контакт N-α-BOC-триптамина с хлорангидридом кислоты, выбранным из пивалоилхлорида, 2,2-диметилбутироилхлорида, 2,2-диметилвалероилхлорида, 1-метилциклопентан-1-карбонилхлорида, 1-метилциклогексан-1-карбонилхлорида, 2-хлорбензоилхлорида и 2-цианобензоилхлорида, с образованием соединения

[0023] В некоторых вариантах реализации изобретения предложен способ получения соединения, имеющего структуру:

В некоторых вариантах реализации изобретения, R1 выбран из трет-бутила, 1,1-диметилпропила; 1,1-диметилбутила; 2-хлорфенила; 2-цианофенила; 1-метилциклопентила; и 1-метилциклогексила. В некоторых вариантах реализации изобретения, X1 и Х2 каждый независимо выбран из метокси и водорода. В некоторых вариантах реализации изобретения, X3 выбран из метокси, фтора, водорода и трет-бутилдиметилсилилокси. В некоторых вариантах реализации изобретения, способ включает приведение в контакт соединения

[0024] В некоторых вариантах реализации изобретения, способ включает приведение в контакт соединения


В некоторых вариантах реализации изобретения, способ включает приведение в контакт соединения


В некоторых вариантах реализации изобретения, способ включает приведение в контакт N-α-BOC-триптамина с хлорангидридом кислоты, выбранным из пивалоилхлорида, 2,2-диметилбутироилхлорида, 2,2-диметилвалероилхлорида, 1-метилциклопентан-1-карбонилхлорида, 1-метилциклогексан-1-карбонилхлорида, 2-хлорбензоилхлорида и 2-цианобензоилхлорида, с образованием соединения

[0025] В некоторых вариантах реализации изобретения, предложен способ получения соединения, выбранное из:







[0026] В некоторых вариантах реализации изобретения предложен способ получения соединения, имеющего структуру:

где
R1 выбран из трет-бутила, 1,1-диметилпропила; 1,1-диметилбутила; 2-хлорфенила; 2-цианофенила; 1-метилциклопентила; и 1-метилциклогексила;
X1 и Х2 каждый независимо выбран из метокси и водорода;
X3 выбран из метокси, фтора, водорода и трет-бутилдиметилсилилокси;
включающий стадии:
a) приведение в контакт N-α-BOC-триптамина с хлорангидридом кислоты, выбранным из пивалоилхлорида, 2,2-диметилбутироилхлорида, 2,2-диметилвалероилхлорида, 1-метилциклопентан-1-карбонилхлорида, 1-метилциклогексан-1-карбонилхлорида, 2-хлорбензоилхлорида и 2-цианобензоилхлорида, с образованием соединения

b) приведение в контакт соединения

образованием соединения

c) приведение в контакт соединения

(TFEdU) с образованием соединения

d) приведение в контакт соединения

[0027] В некоторых вариантах реализации изобретения, предложен способ получения соединения, выбранного из:







[0028] В некоторых вариантах реализации изобретения, предложены олигонуклеотиды, содержащие по меньшей мере один защищенный нуклеотид TrpU, причем по меньшей мере один защищенный нуклеотид TrpU в олигонуклеотиде имеет структуру:

В некоторых вариантах реализации изобретения, R1 выбран из трет-бутила, 1,1-диметилпропила; 1,1-диметилбутила; 2-хлорфенила; 2-цианофенила; 1-метилциклопентила; и 1-метилциклогексила. В некоторых вариантах реализации изобретения, X3 выбран из метокси, фтора, водорода и трет-бутилдиметилсилилокси. В некоторых вариантах реализации изобретения, X4 выбран из OH, -OR, -SR и -Z-P(Z')(Zʺ)O-R, где Z, Z' и Zʺ каждый независимо выбран из O и S, и R представляет собой соседний нуклеотид в олигонуклеотиде. В некоторых вариантах реализации изобретения, X5 выбран из -O-ss, -OR, -SR и -Z-P(Z')(Zʺ)O-R, где ss представляет собой твердую подложку, Z, Z' и Zʺ каждый независимо выбран из O и S, и R представляет собой соседний нуклеотид в олигонуклеотиде. В некоторых вариантах реализации изобретения, твердая подложка представляет собой стекло с заданным размером пор (CPG). В некоторых вариантах реализации изобретения, Z' представляет собой S, а Zʺ представляет собой O. В некоторых вариантах реализации изобретения, Z' и Zʺ представляют собой О.
[0029] В некоторых вариантах реализации изобретения предложен способ получения олигонуклеотида, содержащего по меньшей мере один нуклеотид TrpU, включающий включение по меньшей мере одного нуклеотида, имеющего структуру:


КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0030] Фигура 1. Структура TrpdU.
[0031] Фигура 2. Схема синтеза N-1-защищенных триптаминовых соединений.
[0032] Фигура 3. Миграция ацильной группы в защищенный триптамин после удаления BOC.
[0033] Фигура 4. ВЭЖХ-профили аптамеров, синтезированных с использованием цианоэтил-N,N-диизопропиламидофосфита piv-TrpdU (CEP), незащищенных TrpdU CEP и NapdU CEP.
[0034] Фигура 5. Схема синтеза трифторацетата N-1- piv -триптамина.
[0035] Фигура 6. Схема синтеза piv-TrpdU цианоэтил-N,N-диизопропиламидофосфита (CEP).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0036] Если не указано иное, технические термины используются согласно обычному использованию. Определения общих терминов в молекулярной биологии можно найти в Benjamin Lewin, Genes V, опубликованной Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, опубликованной Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); и Robert A. Meyers (ed.), Molecular Biology and Biotechnology: a Comprehensive Desk Reference, published by VCH Publisherс, Inc., 1995 (ISBN 1-56081-569-8).
[0037] Если не указано иное, все технические и научные термины, используемые в данном документе, имеют те же значения, которое обычно понимаются специалистом в данной области техники, к которому относится данное изобретение. Слова в единственном числе означают также и множественное число, если контекст явно не подразумевает иное. «Состоит из A или B» означает включение A или B, или A и B. Далее следует понимать, что все размеры основания или размеры аминокислот, и все молекулярные массы или значения молекулярной массы, указанные для нуклеиновых кислот или полипептидов, являются приблизительными, и приведены для описания.
[0038] Кроме того, диапазоны, приведенные в данном документе, понимаются как сокращенные для всех значений в пределах указанного диапазона. Например, диапазон от 1 до 50 понимается как включающий любое число, комбинацию чисел или субдиапазон из группы, состоящей из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 (а также его дробные значения, если контекст явно не подразумевает иное). Любой диапазон концентраций, процентный диапазон, диапазон соотношений или диапазон чисел следует понимать, как включающий значение любого целого числа в пределах указанного диапазона и, в случае, если это необходимо, его дробные значения (например, одна десятая и одна сотая целого числа), если не указано иное. Кроме того, любой диапазон целых чисел, указанный в данном документе, относящийся к любому физическому признаку, такому как полимерные субъединицы, размер или толщина, следует понимать, как включающий любое целое число в пределах указанного диапазона, если не указано иное. Термин «около» или «состоящий в основном из», в контексте данного документа, означает ±20% от указанного диапазона, значения или структуры, если не указано иное. Термины «включать» и «содержать», в контексте данного документа, являются неограничивающими терминами и используются как синонимы.
[0039] Хотя способы и материалы, аналогичные или эквивалентные описанным в данном документе, могут быть использованы в практике или испытании данного изобретения, ниже описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в данном документе, включены в качестве ссылки во всей своей полноте. В случае противоречий, данный документ, включая объяснения терминов, будет иметь преимущественное право. Кроме того, материалы, способы и примеры являются иллюстративными и не предназначены для ограничения.
[0040] Термин «нуклеотид», в контексте данного документа, относится к рибонуклеотиду или дезоксирибонуклеотиду, или его модифицированной форме, а также к его аналогу. Нуклеотиды включают типы, которые включают пурины (например, аденин, гипоксантин, гуанин и их производные и аналоги), а также пиримидины (например, цитозин, урацил, тимин и их производные и аналоги).
[0041] Термин «TrpU», в контексте данного документа, используется, как правило, для обозначения уридилильных нуклеотидов, содержащих N-(3-индол-2-этил)-карбоксамидную функциональную группу в 5-позиции. Использование термина «TrpU» не предназначено для ограничения в отношении 2'-положения рибозы, и данный термин должен толковаться как включающий, но не ограничиваясь этим, нуклеотиды, содержащие -H, -OH, -OMe или -F в положении 2', если не указан конкретный 2'-фрагмент. Термин «TrpdU» обычно относится к нуклеотиду TrpU, содержащему 2'-H.
[0042] Термин «нуклеиновая кислота», «олигонуклеотид» и «полинуклеотид», в контексте данного документа, используются взаимозаменяемо для обозначения полимера нуклеотидов и включают ДНК, РНК, гибриды ДНК/РНК и модификации данных видов нуклеиновых кислот, олигонуклеотидов и полинуклеотидов, в которые включено присоединение различных структур или фрагментов к нуклеотидным единицам в любом положении. Термины «полинуклеотид», «олигонуклеотид» и «нуклеиновая кислота» включают двух- или одноцепочечные молекулы, а также тройные спиральные молекулы. Нуклеиновая кислота, олигонуклеотид и полинуклеотид являются более широкими терминами, чем термин аптамер, и, таким образом, термины нуклеиновая кислота, олигонуклеотид и полинуклеотид включают полимеры нуклеотидов, которые являются аптамерами, но термины нуклеиновая кислота, олигонуклеотид и полинуклеотид не ограничены аптамерами.
[0043] Термин «по меньшей мере один нуклеотид», в контексте данного документа, относящийся к модификациям нуклеиновой кислоты, относится к одному, нескольким или всем нуклеотидам в нуклеиновой кислоте, что указывает на то, что любое или все включения любого или всех А, С, T, G или U в нуклеиновой кислоте могут быть или не могут быть модифицированы.
[0044] Термин «амидофосфит», в контексте данного документа, представляет собой нуклеотид, содержащий группу

[0045] Термин «твердофазный синтез», в контексте данного документа, относится к твердофазному синтезу олигонуклеотида с использованием химии амидофосфитов, если специально не указано иное.
Соединения
[0046] Данное изобретение предлагает соединения, проиллюстрированные в Таблице А, а также их соли, и способы получения и использования данных соединений.
Таблица A: Соединения по данному изобретению
[0047] X3 в структурах в Таблице A может, в некоторых вариантах реализации изобретения, быть выбранным из метокси, фтора, водорода и трет-бутилдиметилсилилокси. В некоторых вариантах реализации изобретения, соединения 1-7 в Таблице A могут быть использованы в твердофазном синтезе олигонуклеотидов для получения олигонуклеотидов, содержащих один или более нуклеотидов TrpU. Также в данном документе представлены соединения, содержащие структуру, выбранную из соединений 8-14, где 3' углерод рибозы соединен с твердой фазой, такой как контролируемое пористое стекло, через линкерный фрагмент. В некоторых вариантах реализации изобретения, 3' углерод рибозы соединен с твердой фазой через линкерный фрагмент, выбранный из сукцината, дигликолята и алкиламино.
[0048] Соединения в Таблице A могут быть синтезированы, в некоторых вариантах реализации изобретения, используя описанные в данном документе способы, приведенные в данном документе в Примерах.
Соли
[0049] Может быть целесообразным или желательным получить, очистить и/или обработать соответствующую соль соединения.
[0050] Например, если соединение является анионным или имеет функциональную группу, которая может быть анионной (например, -COOH может быть -COO-), тогда соль может быть образована с подходящим катионом. Примеры подходящих неорганических катионов включают, но не ограничиваются ими, ионы щелочных металлов, такие как Na+ и K+, катионы щелочноземельных металлов, такие как Ca2+ и Mg2+, и другие катионы, такие как Al+3. Примеры подходящих органических катионов включают, но не ограничиваются ими, ион аммония (т.е., NH4+) и замещенные ионы аммония (например, NH3RX+, NH2RX2+, NHRX3+, NRX4+). Примерами некоторых подходящих замещенных ионов аммония являются те, которые получены из: этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперизина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислот, таких как лизин и аргинин. Примером обычного иона четвертичного аммония является N(CH3)4+.
[0051] Если соединение является катионным или имеет функциональную группу, которая может быть катионной (например, -NH2 может быть -NH3+), тогда соль может быть образована с подходящим анионом. Примеры подходящих неорганических анионов включают, но не ограничиваются ими, производные следующих неорганических кислот: соляной, бромистоводородной, иодистоводородной, серной, сернистой, азотистой, азотной, фосфорной и фосфористой.
[0052] Примеры подходящих органических анионов включают, но не ограничиваются ими, анионы, полученные из следующих органических кислот: 2-ацетилоксибензойной, уксусной, аскорбиновой, аспарагиновой, бензойной, камфорсульфоновой, коричной, лимонной, этилендиаминтетрауксусной, этандисульфоновой, этансульфоновой, фумаровой, глюцептоновая, глюконовой, глутаминовой, гликолевой, гидроксималеиновой, гидроксинафталинкарбоновой, изэтионовой, молочной, лактобионной, лауриновой, малеиновой, яблочной, метансульфоновой, муциновой, олеиновой, щавелевой, пальмитиновой, памовой, пантотеновой, фенилуксусной, фенилсульфоновой, пропионовой, пировиноградной, салициловой, стеариновой, янтарной, сульфаниловой, винной, толуолсульфоновой и валериановой. Примеры подходящих полимерных органических анионов включают, но не ограничиваются ими, анионы, полученные из следующих полимерных кислот: дубильной кислоты, карбоксиметилцеллюлозы.
[0053] Если не указано иное, ссылка на конкретное соединение также включает его солевые формы.
Модифицированные олигонуклеотиды
[0054] Термины «модифицировать», «модифицированный», «модификация» и любые их вариации при использовании в отношении олигонуклеотида, в контексте данного документа, означают, что по меньшей мере одно из четырех составляющих нуклеотидных оснований (то есть A, G, T/U и C) олигонуклеотида является аналогом или сложным эфиром встречающегося в природе нуклеотида. В некоторых вариантах реализации изобретения, модифицированный нуклеотид обеспечивает устойчивость к олигонуклеотид нуклеазе. Дополнительные модификации могут включать модификации скелета, метилированиe, необычные комбинации спаривания оснований, таких как основания - изоцитидин и изогуанидин, и тому подобное. Модификации могут также включать 3' и 5' модификации, такии как кэппирование. Другие модификации могут включать замещение одного или более из встречающихся в природе нуклеотидов аналоговыми, межнуклеотидными модификациями, такими как, например, незаряженными связями (например, метилфосфонаты, фосфортриэфиры, фосфоамидаты, карбаматы и т.д.) и заряженными связями (например, фосфоротиоаты, фосфородитиоаты и т.д.), интеркаляторами (например, акридином, псораленом и т.д.), хелаторами (например, металлами, радиоактивными металлами, борoм, е металлам окислителями и т.д.), алкиляторами и модифицированными связями (например, альфа-аномерными нуклеиновыми кислотaми и т.д.). Кроме того, любая из гидроксильных групп, обычно присутствующих в углеводном фрагменте нуклеотида, может быть заменена фосфонатной группой или фосфатной группой; защищена стандартными защитными группами; или активирована для получения дополнительных связей с дополнительными нуклеотидами или твердой подложкой. 5' и 3'-концевые ОН-группы могут быть фосфорилированы или замещены аминами, фрагментами органической блокирующей группой от около 1 до около 20 атомов углерода, полимерами полиэтиленгликоля (ПЭГ) в одном варианте реализации изобретения в пределах от около 10 до около 80 кДа, ПЭГ полимеры в другом варианте реализации изобретения в диапазоне от около 20 до около 60 кДа или другие гидрофильные или гидрофобные биологические, или синтетические полимеры.
[0055] Полинуклеотиды также могут содержать аналогичные формы углеводов рибозы или дезоксирибозы, которые обычно известны в данной области техники, включая 2'-O-метил, 2'-O-аллил, 2'-O-этил, 2'-O-пропил, 2'-O-CH2CH2OCH3, 2'-фтор, 2'-NH2 или 2'-азидо, карбоциклические углеводы аналоги, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или лизосы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и аналоги с абазиловым нуклеозидом, такие как метилрибозид. Как отмечается в данном документе, одна или более фосфодиэфирных связей могут быть заменены альтернативными связывающими группами. Данные альтернативные связывающие группы включают варианты реализации изобретения, в которых фосфат замещен P (O) S («тиоат»), P (S) S («дитиоат»), (O) NRX2 («амидат»), P (O) RX, P (O) ORX', CO или CH2 («формацеталь»), в котором каждый RX или RX' независимо представляют собой H или замещенный, или незамещенный алкил (C1-C20), необязательно содержащий простой эфир (-O-), арил, алкенил, циклоалкил, циклоалкенил или аралкил. Не все связи в полинуклеотиде должны быть одинаковыми. Замещение аналогичных форм сахаров, пуринов и пиримидинов может быть выгодным при создании конечного продукта, например, как альтернативные каркасные структуры, такие как полиамидная структура.
[0056] Полинуклеотиды также могут содержать аналогичные формы карбоциклических аналогов сахара, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликзосы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и аналоги абазидных нуклеозидов, такие как метилрибозид.
[0057] Если присутствует, модификация нуклеотидной структуры может быть осуществлена до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, путем конъюгации с меченым компонентом.
Получение олигонуклеотидов
[0058] Автоматизированный синтез олигодезоксинуклеозидов является обычной практикой во многих лабораториях (см., например, Matteucci, MD and Carutherс, M.H., (1990) J. Am. Chem. Soc., 103:3185-3191, содержание которой включено в данное описание посредством ссылки во всей своей полноте). Синтез олигорибонуклеозидов также хорошо известен (см., например, Scaringe, S.A., et al., (1990) Nucleic Acids Res. 18:5433-5441, содержание которой включено в данное описание посредством ссылки во всей своей полноте). Как отмечается в данном документе, амидофосфиты полезны для включения модифицированного нуклеозида в олигонуклеотид путем химического синтеза, и трифосфаты полезны для включения модифицированного нуклеозида в олигонуклеотид путем ферментативного синтеза. (См., например, Vaught, J. D. et al. (2004) J. Am. Chem. Soc., 126:11231-11237; Vaught, J. V., et al. (2010) J. Am. Chem. Soc. 132, 4141-4151; Gait, M. J. ʺOligonucleotide Synthesis a practical approachʺ (1984) IRL Press (Oxford, UK); Herdewijn, P. ʺOligonucleotide Synthesisʺ (2005) (Humana Press, Totowa, N.J. (каждая из которых включена в данное описание посредством ссылки во всей своей полноте).
[0059] В некоторых вариантах реализации изобретения, предлагаемые в данном документе соединения и, в частности, соединения 1-7 из Таблицы А, могут использоваться в стандартных способах синтеза олигонуклеотидов амидофосфитов, включая автоматизированные способы с использованием коммерчески доступных установок для синтеза. После синтеза защитную группу на нуклеотиде TrpU удаляют стандартными методами снятия защиты, такими как трет-BuNH2/MeOH/H2O и MeNH2 (газ).
[0060] В некоторых вариантах реализации изобретения, использование соединений, представленных в данном документе, таких как соединения 1-7 из Таблицы А, в синтезе олигонуклеотидов, улучшает выход желаемого олигонуклеотидного продукта. Например, как описано в Примере 4, использование Piv-TrpdU CEP вместо незащищенного TrpdU CEP улучшает выход 51-мерного олигонуклеотида, содержащего 13 TrpdU нуклеотидов в около 1,7 раза. См. Таблицу 10. Для более длинных олигонуклеотидов выход может быть увеличен в 2 раза или более. См. Таблицу 11.
ПРИМЕРЫ
[0061] Следующие примеры представлены для более полной иллюстрации некоторых вариантов реализации данного изобретения. Однако они ни в коей мере не должны истолковываться как ограничивающие широкий объем данного изобретения. Специалисты в данной области техники могут легко принять основополагающие принципы данного изобретения для разработки различных соединений, не выходя за пределы сущности данного изобретения.
Пример 1: Исследование защитных групп триптамина
[0062] Для определения реакционной способности различных сульфонил- и ацилзащитных групп в стандартных условиях снятия защиты с олигонуклеотидов использовали модельную систему. Соединение, N-α-трет-бутоксикарбонилтриптамин (Фиг. 2, (1)), использовали в качестве модели для TrpdU. Различные N-1 производные могут быть легко синтезированы обработкой (1) трет-бутоксидом калия (1,1 экв.) в тетрагидрофуране (ТГФ) с последующим добавлением соответствующего сульфонила или ацилхлорида или ангидрида (1,0 экв.) (Фиг. 2). См. Cole, D. C., et al., J. Med. Chem., 50(23), 5535-5538, 2007. Полученные производные N-1 (таблица 1) очищали кристаллизацией, хроматографией или использовали непосредственно в снятии защитных групп.
Таблица 1. Реагенты для синтеза N-1-защищенных аналогов a-BOC-триптамина.
*Chuit, C., et al., Tetrahedron, 36(16), 2305-10, 1980; Kudo, Noriaki, K., et al.,Chem & Pharm Bull.44(4), 699-702, 1996; Hoffamn, W. F., et al., J. Med. Chem., 29(5), 842-52, 1986.
**Takahashi, Y., et al., Synthetic Communicationс, 19(11-12), 1945-54, 1989; Fathi, B., et al., Helvetica Chimica Acta, 85(7), 2083-2088, 2002.
[0063] Условия снятия защиты были основаны на двух протоколах: трет-бутиламин и гидроксид аммония при 37°C. Для растворения соединений гидрофобной модели, к реагентам для снятия защитных групп добавляли метанол (Таблица 2). Образцы каждой реакции снятия защитных групп при 37°C анализировали через 1, 4 и 24 часа. В некоторых случаях, субстраты также поддавались снятию защитных групп в условии воздействия 70°С в течение 24 часов.
Таблица 2. Стандартные условия для удаления защитных групп с олигонуклеотидов
[0064] Целевая скорость щелочного расщепления защитных групп в модельной системе определялась с помощью математической модели. Предполагалось, что снятие защитных групп будет следовать кинетике псевдо-первого порядка в присутствии избыточного основания. Минимально приемлемая скорость определялась как 99,9% расщепления в течение 24 часов. Предпочтительная скорость реакции дает больше разницы для изменчивости и определяется как расщепление 99,9% через 12 часов. Исходя из этих критериев, желаемая защитная группа будет расщепляться на 25-44% в течение 1 часа и на 68-90% через 4 часа и на >/=99,9% через 24 часа.
[0065] Реакции снятия защитных групп контролировали с помощью классической тонкослойной хроматографии (ТСХ) на пластинах с силикагелем, элюируя 25% этилацетата/75% гексана. Было обнаружено, что наиболее точной технологией визуализации тонкослойной хроматографии является щелочной раствор перманганатна. Окрашивание йодом может привести к завышеному кажущемуся количеству незащищенного индола, в то время как визуализация УФ-излучением может привести к завышеному кажущемуся количеству защищенных N-1 ацильных производных.
[0066] Сначала изучались сульфонильные защитные группы. Были синтезированы три производных, представляющие ряд структур и реакционных способностей: трифторметансульфонил (трифлил); метансульфонил (мезил); и бензолсульфонил (безил) (таблица 1). Было обнаружено, что все три сульфонильные производных полностью стабильны (0% расщепления) при условиях снятия защитных групп олигонуклеотидов (таблица 3). Был сделан вывод, что агрессивные щелочные условия (NaOH+нагрев), описанные в литературе для расщепления N-1-индолсульфонилзащитных групп, необходимы, и даже высокореактивная трифторметансульфонильная (Tf) группа стабильна в более мягких условиях снятия защиты олигонуклеотида.
[0067] Набор из 16 ацильных аналогов (4 арила и 12 алкила) синтезировали из BOC-триптамина и соответствующего хлорангидрида. 16 хлорангидридов были получены коммерческим путем или синтезированы из коммерчески доступной карбоновой кислоты путем реакции с тионилхлоридом или синтезированы de novo в 2-3 стадии (таблица 1).
[0068] Ацильные защитные группы показали широкий диапазон реакционной способности в щелочных условиях снятия защиты. Четыре арилалкильных производных показали широкий диапазон реакционной способности (табл. 4). Незамещенная бензоильная группа была слишком реакционноспособной и полностью расщеплялась менее чем через 1 час, тогда как 2,4,6-тризамещенные аналоги, Mes и Tcb, были слишком стабильными и не показали обнаруживаемого расщепления в стандартных условиях. Между этими противоположностями умеренно-затрудненный 2-метилбензоильный (Tol) аналог, соответствовал желаемым уровням расщепления. Для дальнейшей оценки была выбрана Tol группа.
Таблица 3. Процент снятия защитной сульфонильнной группы («Слишком медленно»).
Таблица 4. Процентное снятие защиты арилацильных групп («оптимально»=Tol).
[0069] Ни одна из 12 алкилацильных защитных групп не достигла желаемой целевой скорости. Установлено, что аналоги были либо слишком реактивно способными (таблица 5), либо слишком стабильными (таблица 6). Было обнаружено, что небольшие структурные изменения резко изменяют скорость щелочного расщепления. Например, диметилэтилацетил (Dmb реагирует быстро, тогда как диэтилметилацетил (Meb) реагиует слишком медленно.
[0070] Ни один из слишком стабильных аналогов (Таблица 5) не рассматривался для дальнейшего изучения, поскольку неполное снятие защитных групп неприемлемо для синтеза олигонуклеотидов.
[0071] Пять аналогов оказалось в группе с высокой скоростью гидролиза (таблица 5) с примерно эквивалентной реакционной способностью: Piv, Mcp, Mch, Dmv и Dmb. Все показали ~90% расщепления в течение 1 часа и 100% расщепления в течение 4 часов, что было быстрее, чем желаемые целевые показатели. Тем не менее для дальнейшей оценки были отобраны Piv и Dmb.
[0072] Таким образом, исходная модель N-α-BOC-триптамина позволила идентифицировать три возможные защитные группы N-1: Tol, Dmb и Piv. Три группы отображали диапазон реакционной способности в отношении щелочных условий снятия защиты SOS: Piv > Dmb > Tol.
Таблица 5. Процент снятия алкилацильных защитых групп («слишком быстро»)
Таблица 6. Процент снятияалкилацильных защитых групп («слишком медленно»)
Пример 2: Использование выбранных защитных групп в TrpU
[0073] После удаления N-α-BOC-группы наблюдали различную реакционную способность трех защитных групп N-1 (Piv> Dmb> Tol) и превращения в форму свободного основания. Защищенное N-1 свободное основание нестабильно, так как ацильная группа N-1 (ароматический амин) мигрирует в N-a (первичный алкиламин), который образует более сильную амидную связь (Фиг. 4). Данная авто-деструктивная перегруппировка аналогична стандартному щелочному снятию защиты.
[0074] Три аналога, Piv> Dmb> Tol, обрабатывали трифторуксусной кислотой в дихлорметане для расщепления N-α-BOC защитной группы. Реакции гасили 5%-ным раствором карбоната натрия и N-1-защищенные триптамин-свободные основания экстрагировали изопропилацетатом. Испытание на стабильность проводили путем нагревания экстрактов свободного основания (~100 мМ) при 70°С в течение ночи. Было обнаружено, что соединение Piv полностью расщеплено, соединение Dmb было расщеплено на ~50% и соединение Tol было на <5% расщеплено. Аналогичная степень расщепления наблюдалась, когда экстракты упаривали на роторном испарителе и чистые амины выдерживались в течение ночи при комнатной температуре. Было обнаружено, что экстракты стабильны при хранении в морозильной камере.
[0075] Затем три хита (Tol, Dmb, Piv) превращали в соответствующие 5'-DMT-2'-дезоксиуридин-5-карбоксамиды путем удаления группы BOC и конденсации защищенных N-1 триптаминов с помощью 5'-O-DMT- 5- (2,2,2-трифторэтилоксикарбонил) -2'-дезоксиуридина (TFEdU) с получением N-1 защищенных нуклеозидов TrpdU: Tol-TrpdU, Dmb-TrpdU и Piv-TrpdU. Чтобы свести к минимуму саморасщепление аминов, TFEdU добавляли непосредственно к высушенным экстрактам из реакции снятия защиты ВОС перед упариванием на роторном испарителе. Было обнаружено, что при использовании этого способа преобладает желаемый путь реакции, в результате чего получают чистые 5'-DMT-2'-дезоксиуридин-5-карбоксамиды, которые очищают хроматографией на силикагеле.
[0076] Затем данные нуклеозиды были оценены в типовых тестах щелочного снятия защитных групп (таблица 7). Было обнаружено, что расщепление ацильных защитных групп Tol и Dmb было медленнее в нуклеозидных соединениях TrpdU, чем в исходной модели BOC-триптамина (таблица 6).
Таблица 7. Процентное снятие защитных групп N-1-защищенных нуклеозидов TrpdU.
Пример 3: Синтез Piv-TrpdU CEP
[0077] Был разработан эффективный трехстадийный способ получения боковой цепи N-1-Piv-триптамина (в виде стабильной соли трифторацетата [ТФК]), который включает три кристаллических промежуточных продукта и не требует очистки хроматографией. Затем соль ТФК соединяли с TFEdU. Полный процесс показан на Фигурах 5 и 6.
[0078] N-α-BOC-триптамин. Разработан способ получения N-α-BOC-триптамина, который позволяет избежать очистки с помощью хроматографии на силикагеле. Использование изопропилацетата в качестве растворителя позволяет продукту кристаллизоваться непосредственно из реакционной смеси. См. Фигуру 5.
[0079] Исходное вещество, триптамин, представляет собой гранулированное кристаллическое твердое вещество, бледно-оранжевого или светло-коричневого цвета, в настоящее время коммерчески доступное от Alfa Aesar (продукт A11116). Коричневый, пахнущий экскрементами триптамин следует перекристаллизовать перед использованием. BOC-ангидрид (ди-трет-бутилдикарбонат, продукт 205249) и все другие растворители и реагенты были приобретены у Sigma-Aldrich и использованы в том виде, в каком были получены.
[0080] В 1 л круглодонную колбу с механическим перемешиванием загружали триптамин (49,32 г, 308 ммоль) и изопропилацетат (200 мл). Смесь быстро перемешивали при пропускании аргона и в течение 30 минут по каплям добавляли раствор ди-трет-бутилдикарбоната (70,53 г, 323 ммоль) в изопропилацетате (100 мл). После добавления 40 мл начал активно выделяться газ и все твердые вещества растворялись на последнем этапе добавления, с получением желтого раствора. Перемешивание продолжали еще 30 минут, и с помощью ТСХ подтвердили израсходование исходного триптамина (SG60, 10% MeOH/90% дихлорметан, Rf (SM)=0,1, Rf (продукт)=0,8).
[0081] Раствор фильтровали для удаления песка и пыли. Фильтрат (~395 г) упаривали на роторном испарителе до ~250 г, а теплый (40°С) раствор медленно разбавляли смесью изомеров гексана (~220 мл) до начала помутнения. В раствор вносили 10 мг затравки подлинного продукта и сразу же кристаллизовали. Суспензию выдерживали при перемешивании в течение 1 часа при комнатной температуре и 1 час на льду, затем фильтровали и промывали 25% изо-PrOAc/75% смесью изомеров гексана (75 мл). Отфильтрованный осадок промывали смесью изомеров гексана (100 мл) и сушили в вакууме, получая N-α-BOC-триптамин в виде белого кристаллического твердого вещества (т.пл. 86-88°C), 61,75 г, выход 77%.
[0082] N-α-BOC-N-1-триметилацетил-триптамин. Основываясь на работе Cole, DC, et al., J. Med.Chem., 50 (23), 5535-5538, 2007, первоначально в качестве основания использовали трет-бутоксид калия в ТГФ и растворителя для реакции, но было получено ~5% побочного продукта полярного димера (точная структура не определена), который трудно было удалить кристаллизацией. Были опробованы несколько комбинаций растворителей и оснований, которые показали, что образование побочного димерного продукта можно избежать, используя трет-бутоксид натрия в диэтиловом эфире. В конце небольшими порциями добавляли триметилацетилхлорид для титрования аниона N-1 без образования полиацилированных побочных продуктов. См. Фигуру 5.
[0083] В сухую заполненную аргоном 1-литровую круглодонную колбу с большой магнитной мешалкой (1,5ʺ) загружали N-α-ВОС-триптамин (28,63 г, 110 ммоль) и порошкообразный трет-бутоксид натрия (11,63 г, 121 ммоль, предостережение: пыль, раздражающе действующая на организм). Диэтиловый эфир (безводный, 400 мл) добавляли с помощью канюли под аргоном, а перемешивание в течение 10 мин давало однородную, мелоподобную суспензию. Помещали откалиброванную капельную воронку, загружали раствор триметилацетилхлорида (14,6 г, 121 ммоль, 110% в теории) в диэтиловом эфире (~50 мл) при общем объеме 60 мл. Суспензию охлаждали на льду и быстро перемешивали, когда большую часть раствора хлорангидрида (54,5 мл, 110 ммоль, 100% теория) добавляли по каплям в течение ~ 40 мин. Раствор перемешивали еще 20 мин и отбирали образец для ТСХ [0,2 мл аликвота в 1 мл дихлорметана] (SG60, 25% этилацетата/75% смеси изомеров гексана, Rf (SM)=0,2, Rf (продукт)=0,4). Если обнаруживалось исходное вещество (>1%), то добавляли соответствующую дополнительную порцию раствора хлорангидрида (1-10%, как указано в ТСХ-анализе) и перемешивание продолжали в течение 1 часа.
[0084] Реакцию гасили 5%-ным раствором бикарбоната натрия (200 мл) и изопропилацетатом (100 мл). Органический слой промывали насыщенным раствором NaCl (50 мл), сушили над MgSO4, фильтровали и выпаривали досуха в вакууме, получая коричневое твердое вещество (~37 г). Данный неочищенный продукт перекристаллизовывали из горячего раствора изопропилацетата (74 мл) и смеси изомеров гексана (296 мл). При охлаждении до ~35°С в перемешиваемый раствор вносили подлинный продукт (50 мг) и сразу кристаллизовали. Суспензию быстро перемешивали 1 час при комнатной температуре и 1 час на льду. Суспензию фильтровали, промывали порцией фильтрата (30 мл), а затем осадок промывали смесью изомеров гексана (60 мл) и сушили в вакууме. N-α-BOC-N-1-триметилацетилтриптамин получали в виде белого до не совсем белого кристаллического твердого вещества (т.пл. 95-97°C), 30,7 г, выход 81%.
[0085] Если необходимо, продукт может быть повторно очищен путем дополнительных перекристаллизаций из изопропилацетата (2 мл/г) и смеси изомеров гексана (8 мл/г).
[0086] N-1-триметилацетилтриптаминтрифторацетат. Данная соль представляет собой белое кристаллическое твердое вещество, которое легко фильтруется и промывается, и является стабильным и негигроскопичным. Соль кристаллизовали непосредственно из реакционной смеси. См. Фигуру 5.
[0087] В 500 мл круглодонную колбу устанавливали адаптер Кляйзена и масляный барботер, сконфигурированный для медленного продувания свободного пространства аргоном. Это облегчает удаление газообразного изобутилена из реакционной смеси и уменьшает образование побочных продуктов.
[0088] В 500 мл круглодонную колбу (сконфигурированную, как указано выше), с большой магнитной мешалкой, загружали N-α-BOC-N-1-триметилацетилтриптамин (30,0 г, 87,1 ммоль), растворенный в безводном дихлорметане (90 мл), и добавляли трифторуксусную кислоту (53 мл, 693 ммоль, 8 экв.). Раствор быстро перемешивали и наблюдали образование изобутиленового газа, проходящего через счетчик пузырьков, наполненый маслом. Через 1 час в смеси начали образовываться кристаллы, а ТСХ анализ показал, что исходное вещество полностью израсходовано (SG60, 25% этилацетата/75% смеси изомеров гексана, Rf (SM)=0,4, RF (продукт)=0). Диетиловый эфир (~ 275 мл) добавляли по каплям к хорошо перемешанной смеси, заставляя ее загустеть, и полученную суспензию быстро перемешивали в течение 1 часа при комнатной температуре. Осадок со стенок сбивали с помощью мешалки, а суспензию фильтровали и промывали диэтиловым эфиром (100 мл). Осадок тщательно промывали диэтиловым эфиром (100 мл) и сушили в вакууме, получая трифторацетат N-1-триметилацетилтриптамина в виде белого кристаллического порошка (т.пл. 150-152°С), 30,0 г, выход 96%.
[0089] Соль трифторацетат N-1-триметилацетилтриптамин не является существенно гигроскопичной и может быть перенесена при температуре окружающей среды в защищенной от света в плотно закрытой таре. тесты на стабильность показали, что соль была стабильной при 70°С в течение десяти дней в закрытом флаконе. Для длительного хранения (>1 месяц) в качестве меры предосторожности может использоваться хранение в замороженном или охлажденном состоянии.
[0090] Краткое изложение характеристик1H-ЯМР некоторых триптаминовых соединений показано в Таблице 8.
[0001]
Таблица 8. Результаты 1H-ЯМР для соединений триптамина (м.д vs ТМС)


[0091] 5'-O-(4,4'-Диметокситритил)-5-[N-(((N-1-триметиацетил)-3-индол)-2-этил)карбоксамид]-2-дезоксиуридин (Piv-TrpdU). В 200 мл круглодонную колбу загружали 5'-O-DMT-5-(2,2,2-трифторэтилоксикарбонил)-2'-дезоксиуридин (TFEdU, технически чистый около 90%, 13,1 г, 20 ммоль без учета поправки) и соль трифторацетат N-1-триметилацетилтрипатамина (9,23 г, 26 ммоль, 1,3 экв.). С помощью шприца добавляли безводный ацетонитрил (104 мл) с последующим добавлением триэтиламина (5,6 мл, 40 ммоль, 2,0 экв.). Полученный оранжевый раствор нагревали в атмосфере аргона при 60°С в течение 24 часов. Отбирали 0,1 мл аликвоты и разбавляли дихлорметаном для ТСХ анализа (SG60, элюент: 1: 1 ацетон: гексан). См. Фигура 6. Если исходное вещество TFEdU все еще обнаруживается (> 1%), то добавляют соответствующую порцию (1-5%) дополнительного трифторацетата N-1-триметилацетилтрипатамина и продолжали нагревание. В случае, если TFEdU израсходывалось (<1%), реакционную смесь выпаривали до пены на роторе. Пену вновь растворяли (~ 33 г) в дихлорметане (30 мл) для хроматографии.
[0092] Флюоресцентную колонку с силикагелем 4"Д x 6"В промывали 2/2/96 TEA/MeOH/ДХМ (4 л), затем промывали 2/98 MeOH/ДХМ (2 л). Неочищенный продукт наносили и элюировали смесью 1/99 MeOH/ДХМ (2 л) с последующим добавлением 2/98 MeOH/ДХМ. Фракции (250 мл) собирали и объединяли фракции 8-19, получая нуклеозид piv-TrpdU в виде бледно-желтого твердого вещества, 14,8 г (выход 66%). Влажное твердое вещество обрабатывали под аргоном, чтобы минимизировать пожелтение.

[0093] 1H-ЯМР (CD3CN, 300 МГц): δ 8.76 (1H, т, J=6 Гц, CONHCH2), 8,54 (с, 1H, H-6), 8,41 (1H, уш.д., J=8 Гц, I-7), 7,73 (1H, уш.с., I-2), 7.60 (1H, дт, J=8,1 Гц, I-4), 6,81-7,43 (15H, м, тритил и I-5 и I-6, перекрывающиеся), 6,09 (1H, т, J=6,5 Гц, H-1'), 4,24-4,28 (1H, м, H-3'), 3,98 (1H, кв., J=4 Гц, H-4'), 3,701 (3H, с, MeO), 3,700 (3H, с, MeO'), 3,62-3,69 (2H, м, CH2- α), 3,25-3,27 (2H, м, H-5' и H-5ʺ), 2,95 (2H, т, J=6,8 Гц, CH2-β), 2,18-2,34 (2H, м, H-2' и H-2ʺ), 1,41 (9H, с, Piv).
[0094] 13C-ЯМР (CD3CN, 100 МГц, 33xC): δ 177,0, 163,0, 161,8, 158,6, 149,5, 145,6, 145,1, 137,1, 135,8, 130,1, 129,5, 128,0, 127,9, 126,8, 125,0, 123,8, 123,2, 118,7, 118,6, 117,0, 113,1, 105,7, 86,3, 86,2, 71,0, 63,6, 54,8, 40,9, 40,2, 38,3, 27,8, 24,8.
[0095] Масс-спектр [M-H]-: рассчитано для C46H48N4O9: 800,91; экспериментальное: 799,3.
[0096] 5'-O-(4,4'-Диметокситритил)-5-[N-((N-1-триметиацетил)-3-индол)-2-этил)карбоксамид]-2'-дезоксиуридин-3'-O-(N,N-диизопропил-O-2-цианоэтиламидофосфит (Piv-TrpdU CEP). Все растворители для хроматографии дезоксигенировали путем барботирования аргоном с использованием тонкой газовой дисперсионной трубки. В ходе подготовки к реакции колонку с силикагелем с 6"Д x 6"В пропускали 2/30/68 Et3N/смеси изомеров гексана/EtOAc (8 л), и затем промывали 30/70 смесью изомеров гексана/EtOAc (4 л). Готовили и дегазировали дополнительный 30/70 элюент (16 л).
[0097] В сухую круглодонную колбу под аргоном помещали Piv-TrpdU (41,3 г, 51,5 ммоль), безводный дихлорметан (83 мл), 2-цианоэтил-N,N,N',N'-тетраизопропиламидофосфит (18,0 мл, 56,7 ммоль, 1,1 экв.) и, наконец, порошок пиридинтрифторацетата (10,95 г, 56,7 ммоль, 1,1 экв.). Смесь быстро перемешивали, получая желтый раствор, и через 30 минут отбирали аликвоту для ТСХ анализа (SG60, элюент: 1/1 EtOAc/гексан), который показал, что исходное вещество было израсходовано и образовывалось два неполярных продукта. См. Фигура 6.
[0098] Полную реакционную смесь наносили на подготовленную флэш-колонку и элюировали 30/70 смесью изомеров гексана/ EtOAc, собирая 10×0,5 л, затем 10×1 л фракций в наполненные аргоном, закрытых бутылках. Продукт (два диастереомера) собирали из объединенных фракций 8-17, которые выпаривали в атмосфере аргона, фильтровали и промывали безводным ACN (2×500 мл). Сушка в высоком вакууме давала Piv-TrpdU CEP в виде не совсем белой пены (42,9 г, выход 83%).

[0099] 1H-ЯМР (CD3CN, 300 МГц) δ 9,61 (1H, уш.с., NH-3), 8,73/8,72 (1 H, 2 уш.т., J=5,6/5,6 Гц, CONHCH2), 8,58/8,56 (1H, 2с, H-6), 8,43/8,41 (1H, 2 уш.д., J=8 Гц, Индол-7), 7,74 (1H, уш.с., Индол-2), 7,60 (1H, уш.д., J=8 Гц, Индол-4), 6,83-7,45 (15 H, м, 13xтритил и Индол-5 и Индол-6, перекрывающиеся), 6,11/6,09 (1H, 2 т, J=6,6/6,6 Гц), 3,72 (3H, с, OMe), 4,38-4,47 (1H, м, H-3'), 4,12-4,15 (1H, м, H-4'), 3,71 (3H, с, OMe'), 3,51-3,76 (6H, м, CONHCH2, 2 x Me2CH, CH2CH2CN, перекрывающиеся), 3,29-3,35 (2H, м, H-5' и H-5ʺ), 2,50/2,61 (2H, 2 т, J=6/6 Гц, CH2CN), 2,27-2,54 (2H, м, H-2' и H-2ʺ), 1,41 (9H, с, Piv), 1,01-1,16 (12H, м, 2 x [CH3]2CH).
[00100] 31P-ЯМР (CD3CN, 161 МГц) δ 148,12, 148,09.
[00101] Дополнительное краткое изложение аналитических данных и досье опытной серии трех аналогов CEP с N-1-защищенным-TrpdU приведены в таблице 9.
Таблица 9. Досье опытной серии для N-1-защищенных-TrpdU CEP-аналогов
Пример 4: Использование выбранных защитных групп в амидофосфитах TrpdU
[00102] Три защищенных аналога N-1, Tol-TrpdU, Dmb-TrpdU и Piv-TrpdU, были превращены в цианоэтил-N, N-диизопропиламидофосфиты (CEP), по существу, как обсуждалось выше, и их использование оценивали в твердофазном синтезе олигонуклеотидов.
[00103] Все три защищенные TrpdU CEP хорошо показали свою эффективность в твердофазном синтезе олигонуклеотидов, но Tol-TrpdU проявлял неполное снятие защитных групп в некоторых случаях в соответствии с модельной системой нуклеозидов (таблица 7). С Dmb-TrpdU и Piv-TrpdU были полностью сняты защитные группы при всех стандартных условиях (трет-BuNH2/MeOH/H2O, MeNH2 (газ)).
[00104] Аптамеры, имеющие одну и ту же нуклеотидную последовательность, синтезировали либо с помощью Piv-TrpdU CEP, исходного незащищенного TrpdU CEP или NapdU CEP (положительный контроль, таблица 10), причем каждый модифицированный dU занимал положение U в последовательности. Аптамер представляет собой 51-мер, имеющий остатки положения 13 dU.
Таблица 10: Аптамеры, синтезированные с использованием Piv-TrpdU, TrpdU и NapdU
[00105] На Фигуре 4 показаны результаты для трех аптамеров, в которые включены либо Piv-TrpdU, TrpdU, и NapdU. Незащищенный TrpdU CEP дает широкий пик со многими побочными продуктами раннего и позднего элюирования. Piv-TrpdU CEP дает особенно чистый профиль с узкой пиковой шириной, сравнимый с контрольным аптамером, имеющим NappU CEP.
[00106] CEP Piv-TrpdU использовался для синтеза шести разных аптамеров, чтобы продемонстрировать улучшение выхода с использованием нового амидофосфита по сравнению с незащищенным TrpdU. Первые четыре аптамера в таблице 11 (аптамеры 1-4) были синтезированы на синтезаторе MerMade (AME Bioscience) в масштабе 1 мкмоль с использованием стандартных условий и ранее приводили к низким выходам с использованием незащищенного TrpdU. Пятый аптамер в таблице 11 (аптамер 5) был синтезирован на синтезаторе ABI, используя стандартные условия рабочего процесса и снятия защиты, и показал приемлемые выходы с незащищенным TrpdU. Шестой аптамер (Аптамер 6) был синтезирован на синтезаторе ABI с использованием стандартных условий рабочего процесса и снятия защиты и ранее приводил к низким выходам с использованием незащищенного TrpdU.
[0001] В таблице 11 показаны результаты этого эксперимента.
Таблица 11: Выходы синтеза (% полной длины SOMAmer) с использованием Piv-TrpdU и TrpdU
[00107] Использование Piv-TrpdU CEP в синтезе олигонуклеотидов для аптамеров 1-4 и 6 увеличивало выход синтеза аптамеров до примерно 250-300% по сравнению c выходом синтеза аптамера с незащищенным TrpdU. Использование CEP Piv-TrpdU в синтезе олигонуклеотидов для аптамера 5 увеличило выход синтеза на около 25% по сравнению с выходом синтеза аптамера с незащищенным TrpdU. Таким образом, в то время как разные синтезаторы могут обеспечить разные выходы, общая тенденция заключается в том, что использование Piv-TrpdU CEP улучшает выход олигонуклеотидов по сравнению с использованием незащищенного TrpdU.
Реферат
Изобретение относится к соединению, имеющему представленную структуру, или его соли; где R1выбран из трет-бутила, 1,1-диметилпропила; 1,1-иметилбутила; 2-хлорфенила; 2-цианофенила; 1-метилциклопентила; и 1-метилциклогексила; X1и Х2каждый независимо выбран из метокси и водорода; X3выбран из метокси, фтора, водорода и трет-бутилдиметилсилилокси. Также описаны способы получения представленных соединений и промежуточные соединения, используемые в указанных способах. Кроме того, представлен олигонуклеотид на их основе. Технический результат: предложены новые соединения и олигонуклеотиды, эффективные для получения аптамеров, а также эффективные способы их получения. 11 н. и 32 з.п. ф-лы, 4 пр., 12 табл., 6 ил.
Формула


































































Комментарии