Композиции и способы длительного применения соединения для прироста массы тела - RU2680410C1
Код документа: RU2680410C1
Чертежи



Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Для данной заявки испрашивается приоритет в соответствии с 35 U.S.C. 119(e) по Предварительной патентной заявке США регистрационный № 62/108902, поданной 28 января 2015 г. и озаглавленной ʺКомпозиции и способы длительного применения соединения для прироста массы телаʺ, которая полностью включена в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее раскрытие относится к соединению для прироста массы тела и способам его длительного применения для регулирования массы тела у животных. В частности, рассматриваемое раскрытие направлено на новое применение соединения для прироста массы тела для потенциального индуцирования увеличенного поглощения пищи, роста сухой мускулатуры и увеличенного прироста массы тела у животных, страдающих от хронической утраты аппетита или других хронических недомоганий или расстройств, которые вызывают снижение массы тела, слабость и/или истощение, в течение периодов, равных восьми дням или более.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Подобно людям, домашние животные и сельскохозяйственные животные могут страдать от хронической утраты аппетита и других расстройств, которые могут приводить к потере сухой мускулатуры, невозможности участия в физической активности, снижению массы тела и другим нежелательным конечным результатам для домашнего животного и владельца. Например, домашние животные и/или сельскохозяйственные животные, проходящие курс химиотерапии, или страдающие от злокачественного новообразования, болезни сердца или хронической болезни почек, могут страдать от хронической утраты аппетита, снижения массы тела, общей слабости и/или кахексии. Кроме того, состояния или повреждения, индуцирующие хроническую утрату аппетита, снижение массы тела, общую слабость и/или кахексию, могут быть по меньшей мере частично обостряться вследствие того, что диеты этих животных содержат меньше калорий, витаминов, минералов, белка и других необходимых питательных компонентов, что обусловлено уменьшением поглощения пищи. В результате, эти животные могут проявлять уменьшение сухой мускулатуры, общую слабость, включающую ослабленную иммунную систему, возможное появление у животных восприимчивости к инфекциям.
Кроме того, хотя общее увеличение потребления пищи могло бы быть полезным для животных, важно, чтобы у этих животных не происходило значительного увеличения отложения жировой ткани. Соответственно, было бы желательно иметь композицию и способ применения композиции для регулирования снижения массы тела, в то же время не индуцируя значительное увеличение жировой ткани. До настоящего времени отсутствовали разрешенные к применению ветеринарные активные фармацевтические ингредиенты для лечения хронической утраты аппетита, нежелательного снижения массы тела, общей слабости, утомляемости и других родственных повреждений, осложнений и недомоганий. По существу, желательно иметь соединение или терапию для применения при регулировании массы тела у животных, включающих домашних животных и сельскохозяйственных животных.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее раскрытие относится к композициям и способам длительного применения соединения для прироста массы тела. Например, соединение для прироста массы тела может содержать агонист грелина, как, например, в композиции, содержащей капроморелин, и может вводиться одному или нескольким домашним животным (например, собакам, кошкам или лошадям) или сельскохозяйственным животным в терапевтически эффективном количестве в течение периода, равного по меньшей мере 8 дням, для лечения снижения массы тела. Авторы настоящего изобретения неожиданно установили, что средний процент изменений массы тела статистически значимо увеличивался в сравнении с плацебо после периода введения капроморелина в течение по меньшей мере 8 дней, как, например, по меньшей мере 15 дней, или по меньшей мере 21 дня. Вкратце, введение капроморелин-содержащей лекарственной формы в течение по меньшей мере 8 дней приводит к неожиданному, удивительному и статистически значимому увеличению прироста массы тела в сравнении с таким же введением в течение только 7 дней или менее, и согласующемуся с исходным уровнем клинически значимых маркеров активности лекарственного средства после 4 дней лечения, включая IGF-1.
Композиция, содержащая капроморелин, может вводиться домашнему животному или сельскохозяйственному животному, нуждающимся в лечении, посредством разнообразия различных путей, включающих путь через ротовую полость или внутривенное введение, и может вводиться по меньшей мере однократно или дважды в день во время курса лечения.
Как раскрыто в настоящем описании, композиция, содержащая капроморелин, может включать дозу от приблизительно 0,5 миллиграммов до 60 миллиграммов капроморелина на килограмм массы тела животного в день. Соединение может содержаться в пилюле или жидкости и может быть ароматизировано, чтобы маскировать какой-либо неприятный или горький вкус. Кроме того, композиция, содержащая капроморелин, может вводиться домашним животным или сельскохозяйственным животным в сочетании со схемой химиотерапии для лечения злокачественного новообразования, чтобы по меньшей мере частично предотвратить, ингибировать, регулировать и/или облегчить снижение массы тела, ассоциированное с химиотерапией.
Конкретно, настоящее раскрытие предоставляет способ увеличения сухой мышечной массы, увеличения прироста массы тела, и ослабления снижения массы тела у животного, не являющегося человеком, посредством перорального введения терапевтически эффективной дозы композиции капроморелина в течение периода, равного по меньшей мере 8 дням, которая может дополнительно включать один или несколько ароматизаторов или средств, корригирующих вкус и запах лекарственного средства. Терапевтически эффективная доза композиции капроморелина может индуцировать у нуждающихся в этом животного, не являющегося человеком, или сельскохозяйственного животного потребление более высоких количеств пищи относительно ʺпациентовʺ, не принимающих композицию с капроморелином. Композиция капроморелина может включать дозу от приблизительно 0,5 миллиграммов до 60 миллиграммов капроморелина на килограмм массы тела животного, не являющегося человеком, в день. Кроме того, композиция капроморелина может вводиться животному, не являющемуся человеком, в сочетании со схемой химиотерапии для лечения злокачественного новообразования, чтобы по меньшей мере частично предотвратить, ингибировать, контролировать и/или облегчать снижение массы тела, ассоциированное с химиотерапией.
Также в настоящем описании предоставлен способ лечения животного, не являющегося человеком, со снижением массы тела. Способ может включать определение того, что животное, не являющееся человеком, испытывает снижение массы тела, и введение по меньшей мере одной ежедневной дозы композиции, содержащей капроморелин, животному, не являющемуся человеком, в течение периода, равного по меньшей мере 8 дням. Способ может дополнительно предоставить получение маркера эффекта лекарственного средства (например, потребления пищи, массы тела, сухой мышечной массы и т.д.) или образца от животного, не являющегося человеком, и измерение количества по меньшей мере одного маркера эффекта лекарственного средства (например, уровней инсулиноподобного фактора роста, гормона роста, кортизола и т.д.) в образце. Например, доза композиции, содержащей капроморелин, может быть увеличена, чтобы соответственно увеличить количество инсулиноподобного фактора роста-1 в образце. Доза композиции, содержащей капроморелин, может быть уменьшена, чтобы соответственно уменьшить количество кортизола в образце. Кроме того, образец может содержать образец крови, плазмы или сыворотки от животного, не являющегося человеком.
Настоящее раскрытие также предоставляет другой способ лечения снижения массы тела у домашнего животного или сельскохозяйственного животного. Способ может включать определение того, что домашнее животное или сельскохозяйственное животное испытывает снижение массы тела, и введение по меньшей мере одной ежедневной дозы композиции, содержащей капроморелин животному с использованием шприца в течение периода, равного по меньшей мере 8 дням. Способ может дополнительно включать оценку одного или нескольких маркеров животного, которые ассоциированы со снижением массы тела, и регулирование дозы композиции, содержащей капроморелин, с учетом оценки одного или нескольких маркеров. Фармацевтическая композиция может вводиться домашнему животному по меньшей мере однократно или дважды в день. Композиция может включать дозу от приблизительно 0,5 миллиграммов до приблизительно 60 миллиграммов капроморелина на килограмм массы тела домашнего животного в день. Кроме того, один или несколько маркеров могут включать массу тела домашнего животного или поглощение пищи домашним животным. Кроме того, композиция может вводиться домашнему животному или сельскохозяйственному животному посредством по меньшей мере одного из следующих путей введения: перорального, внутривенного, внутримышечного, подкожного или внутрибрюшинного.
В другом аспекте, настоящее раскрытие также предоставляет способ лечения снижения массы тела у домашнего животного или сельскохозяйственного животного. Способ включает в себя введение терапевтически эффективного количества композиции, содержащей капроморелин, нуждающемуся в этом домашнему животному или сельскохозяйственному животному по меньшей мере один раз в день в течение периода, равного по меньшей мере 30 дням, как, например, по меньшей мере 90 дням. Композиция, содержащая капроморелин, содержит дозу от приблизительно 0,5 миллиграммов до приблизительно 7,5 миллиграммов капроморелина на килограмм массы тела домашнего животного или сельскохозяйственного животного в день. Домашнее животное или сельскохозяйственное животное выбирают из собак, кошек или лошадей.
В еще одном другом аспекте, настоящее раскрытие предоставляет способ увеличения сухой мышечной массы, ослабления снижения массы тела и увеличения прироста массы тела у животного, не являющегося человеком. Способ включает в себя пероральное введение терапевтически эффективной дозы композиции капроморелина нуждающемуся в этом животному, не являющемуся человеком, по меньшей мере один раз в день в течение периода, равного по меньшей мере 30 дням, как, например, по меньшей мере 90 дням. Композиция капроморелина содержит один или несколько ароматизаторов или маскирующих средств, включающих в себя по меньшей мере одно средство, выбранное из группы, состоящей из тауматина, сукралозы, неотама, сахарината натрия, неогесперидина дигидрохалкона, ребаудиозида A, стевиол-гликозида, лакрицы, глицирризиновой кислоты, моноаммония глицирризината, сахарозы, глюкозы, фруктозы, мальтодекстрина, сорбитола, мальтитола, изомальта, глицерина и ваниль-содержащей композиции. Композиция капроморелина содержит дозу от приблизительно 0,5 миллиграммов до приблизительно 7,5 миллиграммов капроморелина на килограмм массы тела животного, не являющегося человеком, в день. Терапевтически эффективная доза композиции капроморелина вызывает у животного потребление более высокого количества пищи; и животное, не являющееся человеком, выбирают из собак, кошек, лошадей или сельскохозяйственных животных.
В других аспектах настоящее раскрытие предоставляет способ лечения снижения массы тела у животного, не являющегося человеком, включающий в себя стадии: определения того, что животное, не являющееся человеком, испытывает снижение массы тела; введения по меньшей мере одной дозы композиции, содержащей капроморелин, животному, не являющемуся человеком, по меньшей мере один раз в день в течение периода, равного по меньшей мере 30 дням, как например, по меньшей мере 90 дням; получение образца, содержащего образец крови, плазмы или сыворотки от животного, не являющегося человеком; измерение количества по меньшей мере одного маркера эффекта лекарственного средства в образце, маркера, содержащего по меньшей мере один маркер из инсулиноподобного фактора роста-1, кортизола, гормона роста и/или капроморелина; и регулирования дозы композиции, содержащей капроморелин, с учетом количества маркера в образце. Доза композиции, содержащей капроморелин, содержит дозу от приблизительно 0,5 миллиграммов до приблизительно 7,5 миллиграммов капроморелина на килограмм массы тела животного, не являющегося человеком, в день.
В еще других аспектах, настоящее раскрытие предоставляет способ лечения снижения массы тела у по меньшей мере одного из домашних животных и сельскохозяйственных животных, включающий в себя стадии: определения того, что домашнее животное или сельскохозяйственное животное испытывает снижение массы тела; введения по меньшей мере одной ежедневной дозы композиции, содержащей капроморелин, домашнему животному или сельскохозяйственному животному по меньшей мере один раз в день в течение периода, равного по меньшей мере 30 дням, как например, по меньшей мере 90 дням; оценку одного или нескольких маркеров у домашнего животного или сельскохозяйственного животного, которые ассоциированы со снижением массы тела, маркеров, отражающих изменение массы тела домашнего животного или сельскохозяйственного животного, изменение поглощения пищи домашним животным или сельскохозяйственным животным, и изменение сухой мышечной массы; и регулирования дозы композиции, содержащей капроморелин, с учетом оценки одного или нескольких маркеров.
В еще других аспектах, настоящее раскрытие предоставляет способ лечения снижения массы тела у домашнего животного или сельскохозяйственного животного, включающий в себя: пероральное введение фармацевтической композиции, содержащей капроморелин, по меньшей мере один раз в день нуждающемуся в этом домашнему животному или сельскохозяйственному животному в течение периода, равного по меньшей мере 30 дням, как например, по меньшей мере 90 дням; и определение эффективности фармацевтической композиции посредством наблюдения одного или нескольких маркеров домашнего животного или сельскохозяйственного животного, маркеров, включающих в себя по меньшей мере один маркер из массы тела домашнего животного и поглощения пищи домашним животным или сельскохозяйственным животным. Фармацевтическая композиция содержит дозу от приблизительно 0,5 миллиграммов до 7,5 миллиграммов капроморелина на килограмм массы тела домашнего животного или сельскохозяйственного животного в день.
В еще других аспектах, настоящее раскрытие предоставляет способ лечения снижения массы тела у животного, не являющегося человеком, включающий в себя: предоставление емкости, содержащей фармацевтическую композицию, которая включает капроморелин; отбор приблизительно одной дозы фармацевтической композиции из емкости; и введение фармацевтической композиции с использованием шприца нуждающемуся в этом животному, не являющемуся человеком, по меньшей мере один раз в день в течение периода, равного по меньшей мере 30 дням, как например, по меньшей мере 90 дням.
Дополнительно, настоящее раскрытие предоставляет способ регулирования снижения массы тела у кошек с хронической болезнью почек. Способ включает в себя введение терапевтически эффективного количества композиции, содержащей капроморелин, кошке, у которой диагностирована хроническая болезнь почек, и, которая нуждается в лечении, по меньшей мере один раз в день в течение периода, равного по меньшей мере 30 дням. Композиция, содержащая капроморелин, содержит от приблизительно 0,5 миллиграммов до приблизительно 7,5 миллиграммов капроморелина на килограмм массы тела кошки в день.
Настоящее раскрытие также предоставляет способ лечения кахексии, такой как сердечная кахексия, у животных, не являющихся человеком, таких как домашние животные или сельскохозяйственные животные. Способ включает в себя введение терапевтически эффективного количества композиции, содержащей капроморелин, животному, не являющемуся человеком, с диагностированной кахексией (такой как сердечная кахексия) и нуждающемуся в лечении, по меньшей мере один раз в день в течение периода, равного по меньшей мере 30 дням. Композиция, содержащая капроморелин, содержит от приблизительно 0,5 миллиграммов до приблизительно 7,5 миллиграммов капроморелина на килограмм массы тела кошки в день.
Если не определено иначе, все технические и научные термины, используемые в настоящем описании, имеют такое же значение, которое является понятным специалисту в области техники, к которой принадлежит это изобретение во время подачи заявки. При конкретном определении, определение, предоставленное в настоящем описании, имеет приоритет над каким-либо словарным или внешним определением. Дополнительно, если по контексту не требуется иначе, термины в единственном числе будут включать множественные значения, и термины во множественном числе будут включать форму единственного числа. В настоящем описании, применение ʺилиʺ означает ʺи/илиʺ, если не утверждается иначе. Все патенты и публикации, упоминаемые в настоящем описании, включены посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
В дополнение к иллюстративным аспектам и вариантам осуществления, описанным выше, дополнительные аспекты и варианты осуществления станут очевидными при ссылке на чертежи и изучении следующих описаний.
ФИГ. 1 отображает среднее потребление пищи в граммах с течением времени при исследовании титрования дозы у кошек, как описано в Примере 2. Среднее потребление пищи сравнивают для доз плацебо и капроморелина (AT-002) при 1 мг/кг, 2 мг/кг и 3 мг/кг.
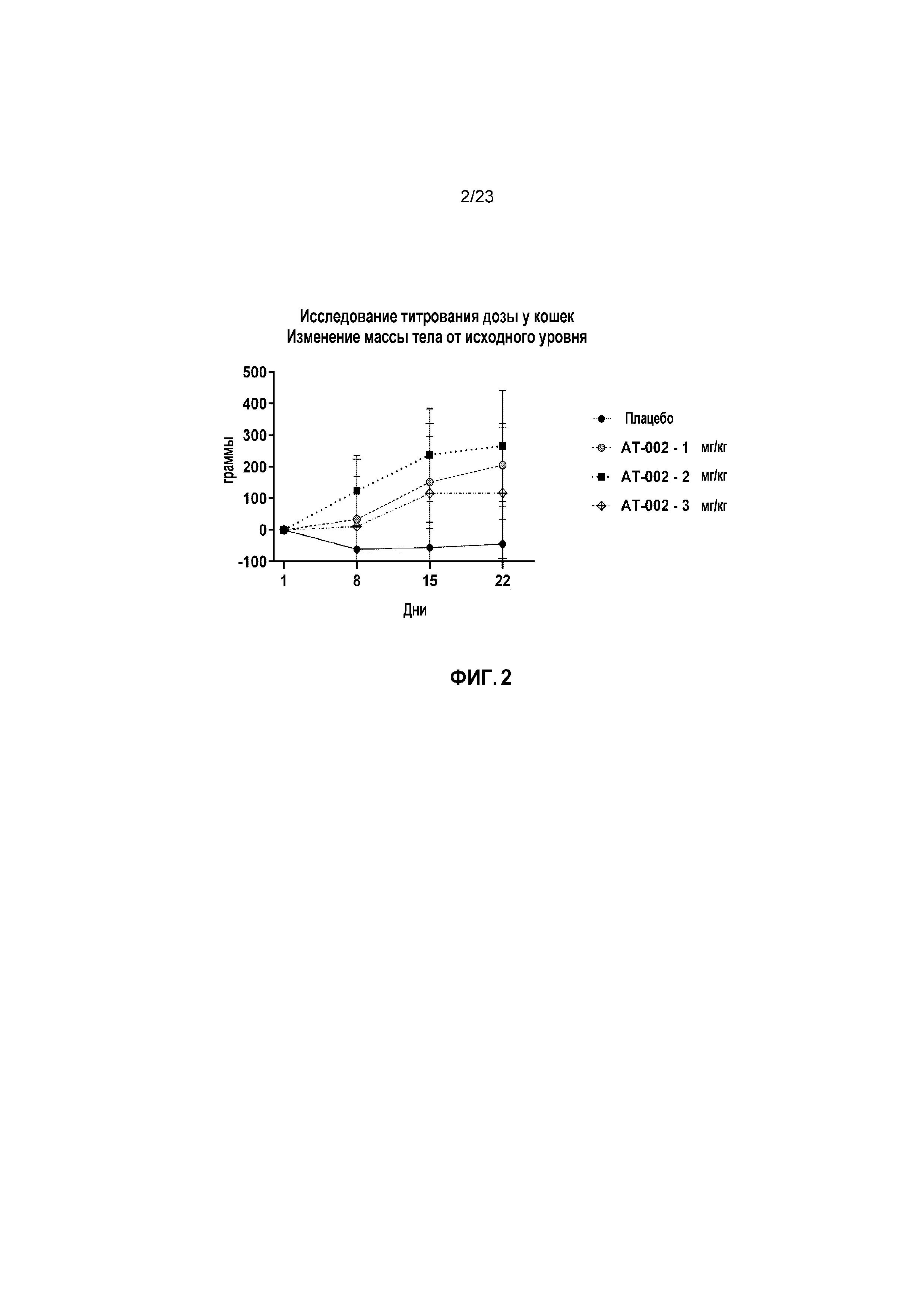
ФИГ. 2 отображает изменение массы тела относительно исходного уровня в граммах с течением времени при исследовании титрования дозы у кошек, как описано в Примере 2. Изменения массы тела сравнивают для доз плацебо и капроморелина (AT-002) при 1 мг/кг, 2 мг/кг и 3 мг/кг.
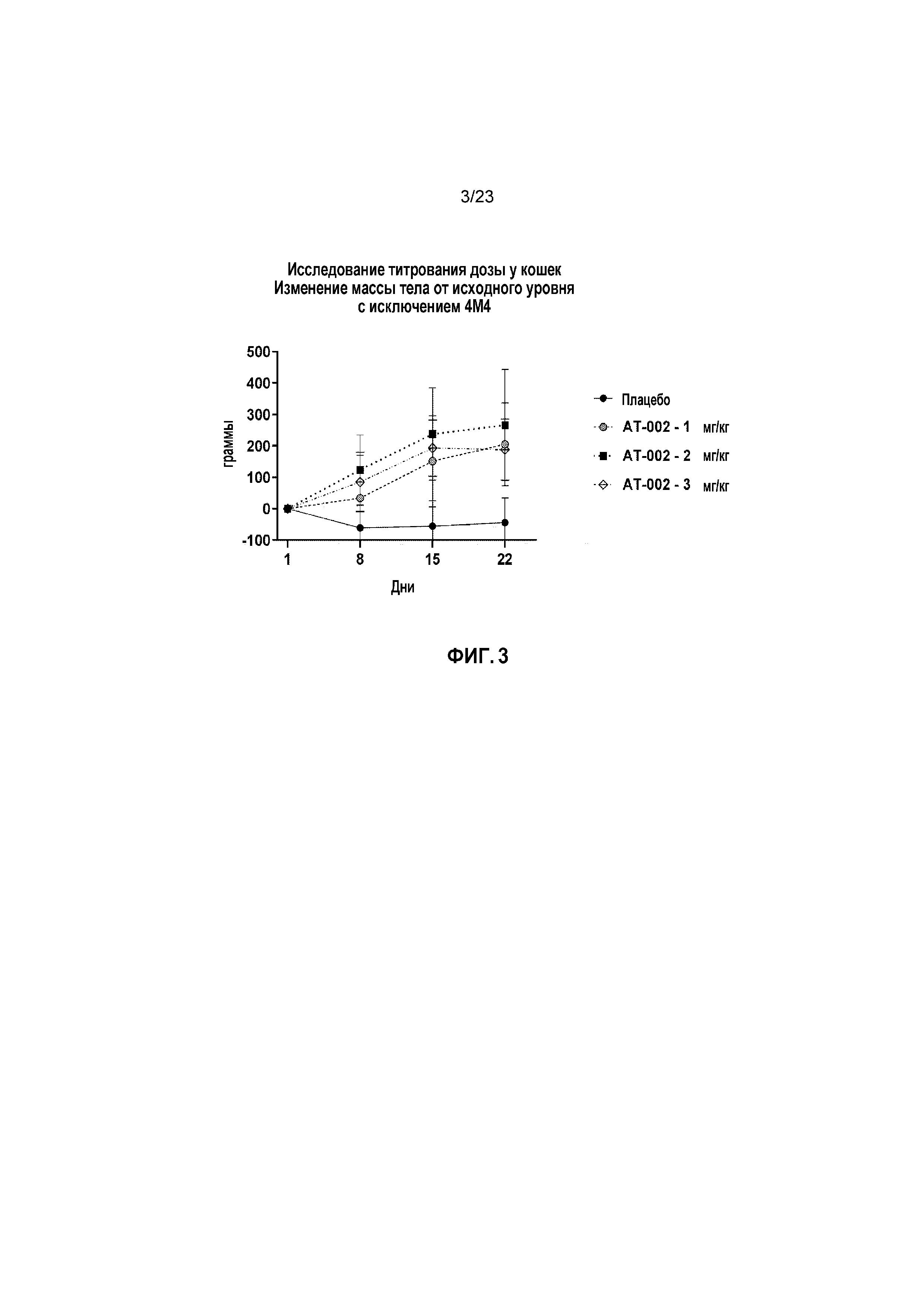
ФИГ. 3 отображает изменение массы тела относительно исходного уровня в граммах с течением времени при исследовании титрования дозы у кошек, как описано в Примере 2 и как показано на ФИГ. 2, но при исключении кошки 4M4 из анализа.
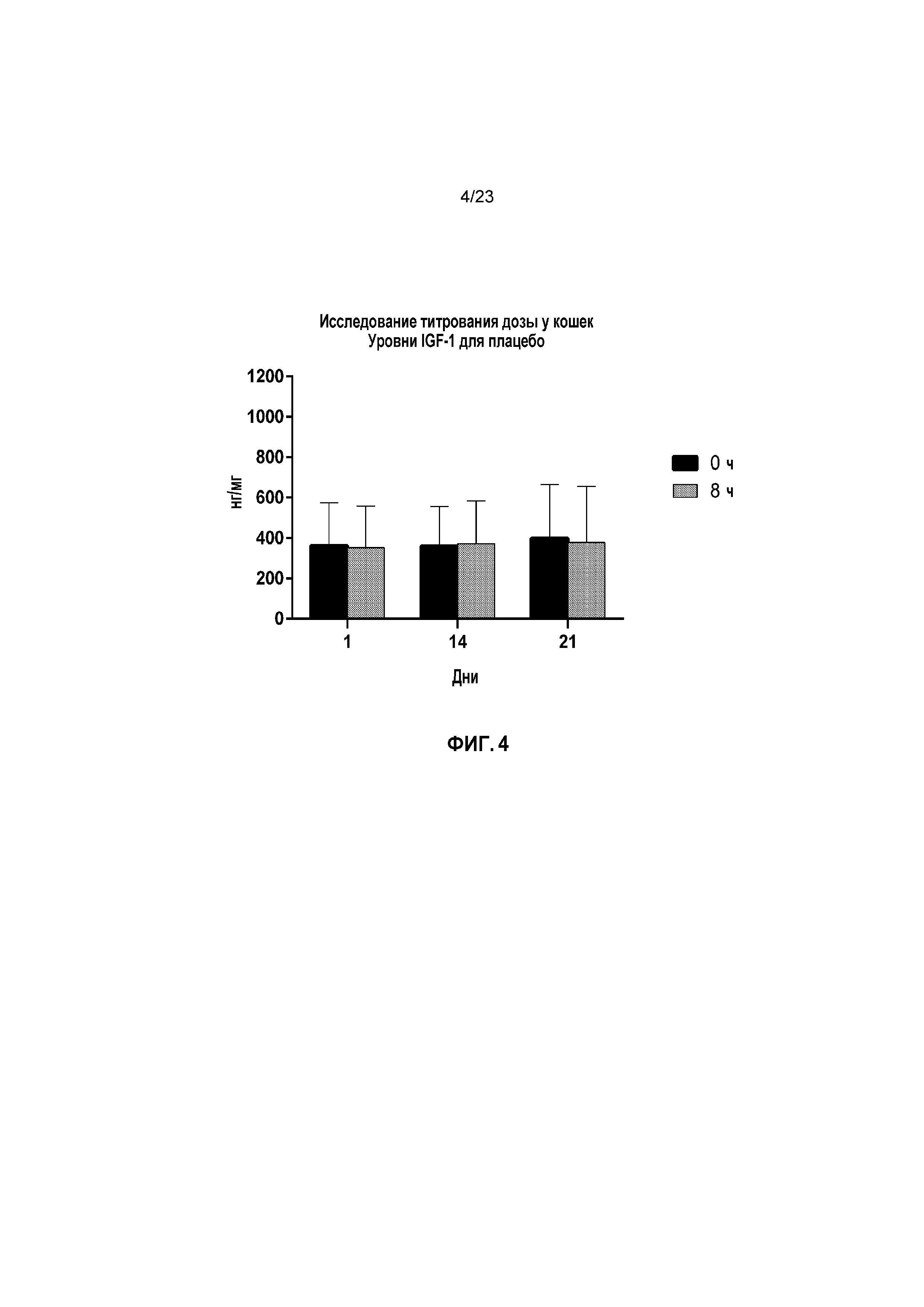
ФИГ. 4 отображает для Группы 1 (плацебо) уровни инсулиноподобного фактора роста 1 (IGF-1) в нг/мл при часах 0 и 8 для Дней 1, 14 и 21 при исследовании титрования дозы у кошек, как описано в Примере 2.
ФИГ. 5 отображает для Группы 2 (1 мг/кг капроморелина) уровни инсулиноподобного фактора роста 1 (IGF-1) в нг/мл при часах 0 и 8 для Дней 1, 14 и 21 при исследовании титрования дозы у кошек, как описано в Примере 2.
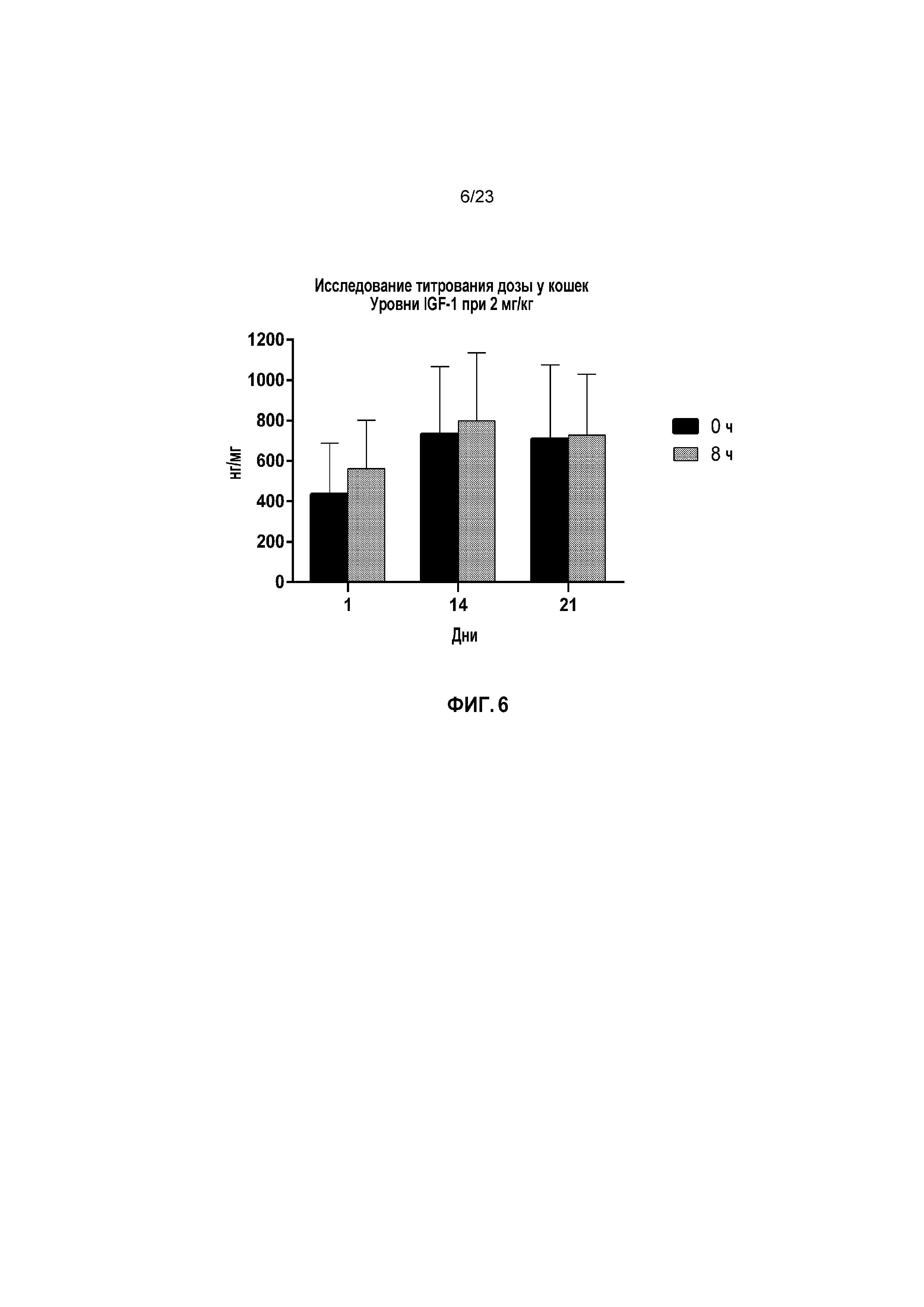
ФИГ. 6 отображает для Группы 3 (2 мг/кг капроморелина) уровни инсулиноподобного фактора роста 1 (IGF-1) в нг/мл при часах 0 и 8 для Дней 1, 14 и 21 при исследовании титрования дозы у кошек, как описано в Примере 2.
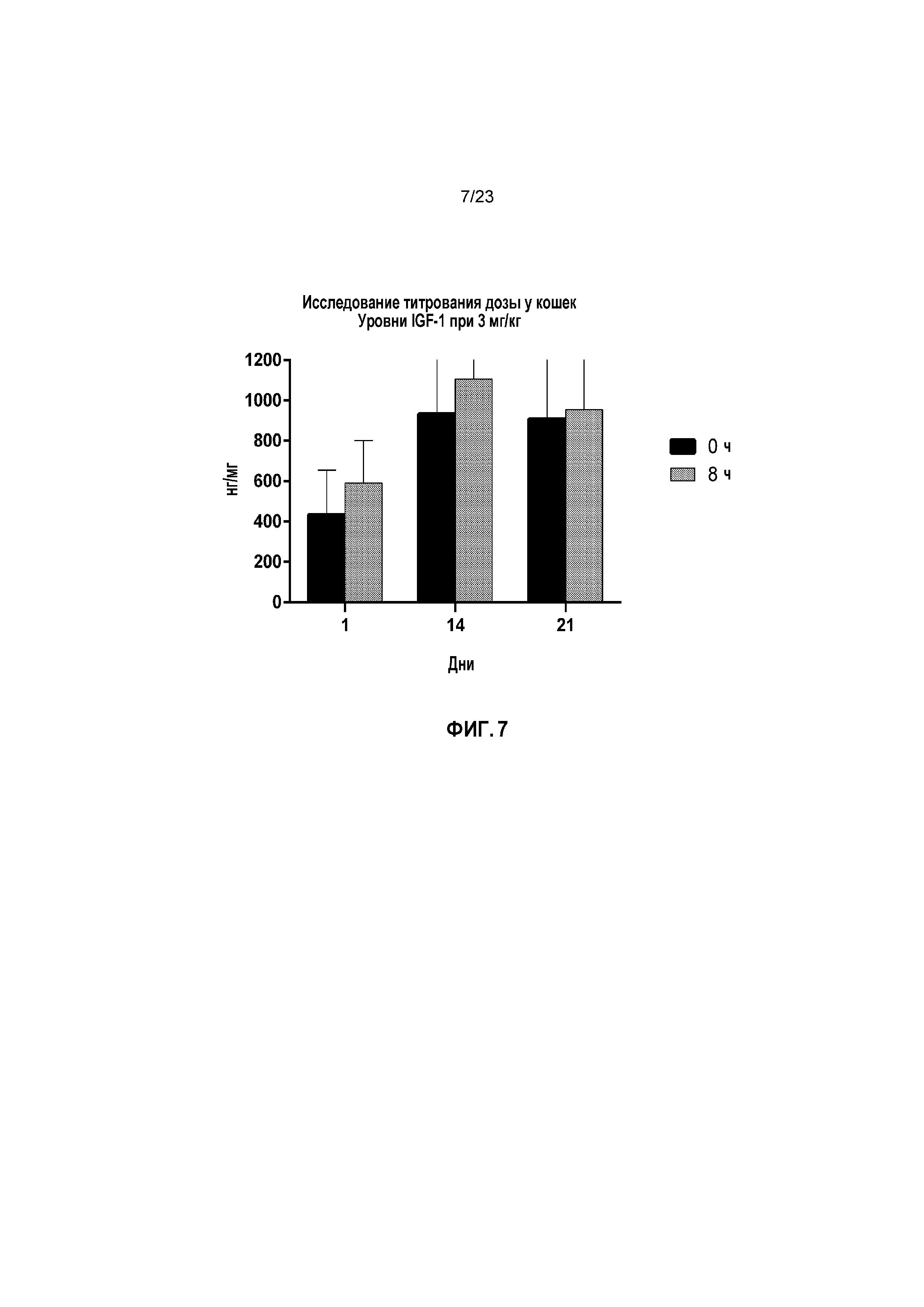
ФИГ. 7 отображает для Группы 4 (3 мг/кг капроморелина) уровни инсулиноподобного фактора роста 1 (IGF-1) в нг/мл при часах 0 и 8 для Дней 1, 14 и 21 при исследовании титрования дозы у кошек, как описано в Примере 2.
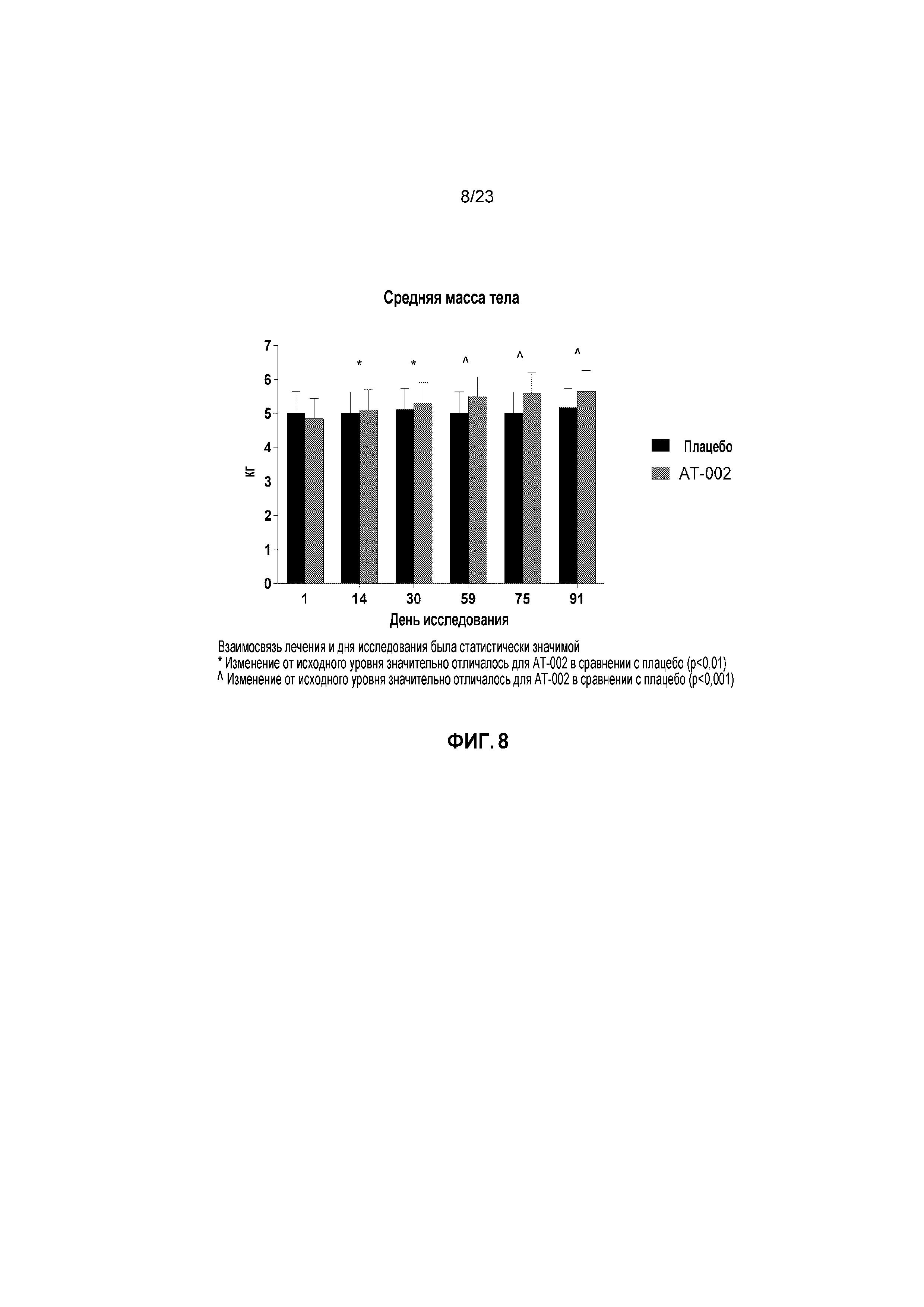
ФИГ. 8 отображает среднюю массу тела с течением времени у кошек, получавших лечение плацебо и капроморелином (AT-002), как описано в Примере 3. Взаимосвязь лечения и дня исследования была статистически значимой (p < 0,0001). Звездочка (*) указывает на то, что изменение от исходного уровня для капроморелина существенно отличалось при сравнении с плацебо (p < 0,01). Карат (^) указывает на то, что изменение от исходного уровня для капроморелина существенно отличалось при сравнении с плацебо (p < 0,0001).
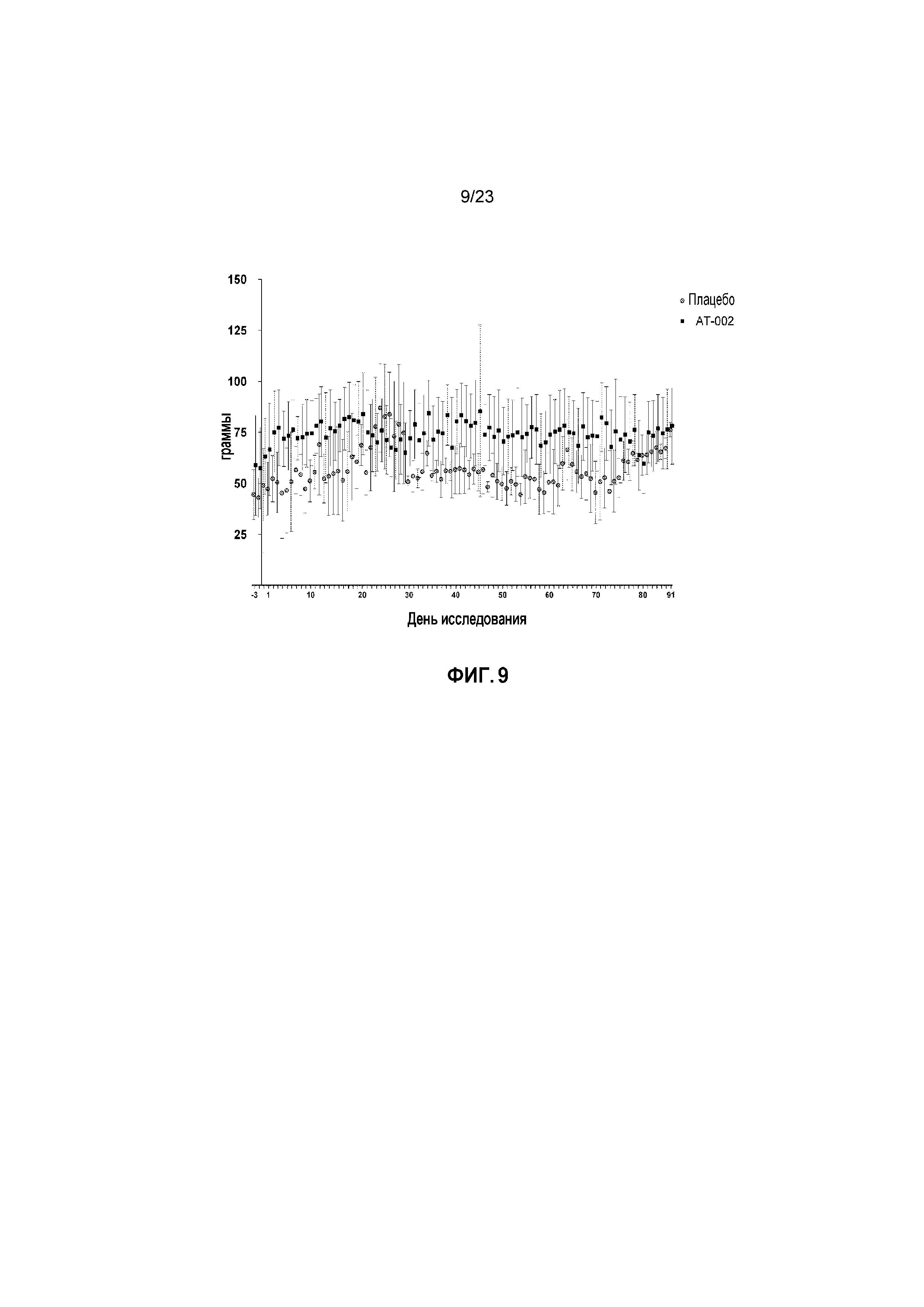
ФИГ. 9 отображает потребления пищи в граммах с течением времени для кошек, получавших лечение плацебо и капроморелином, как описано в Примере 3.
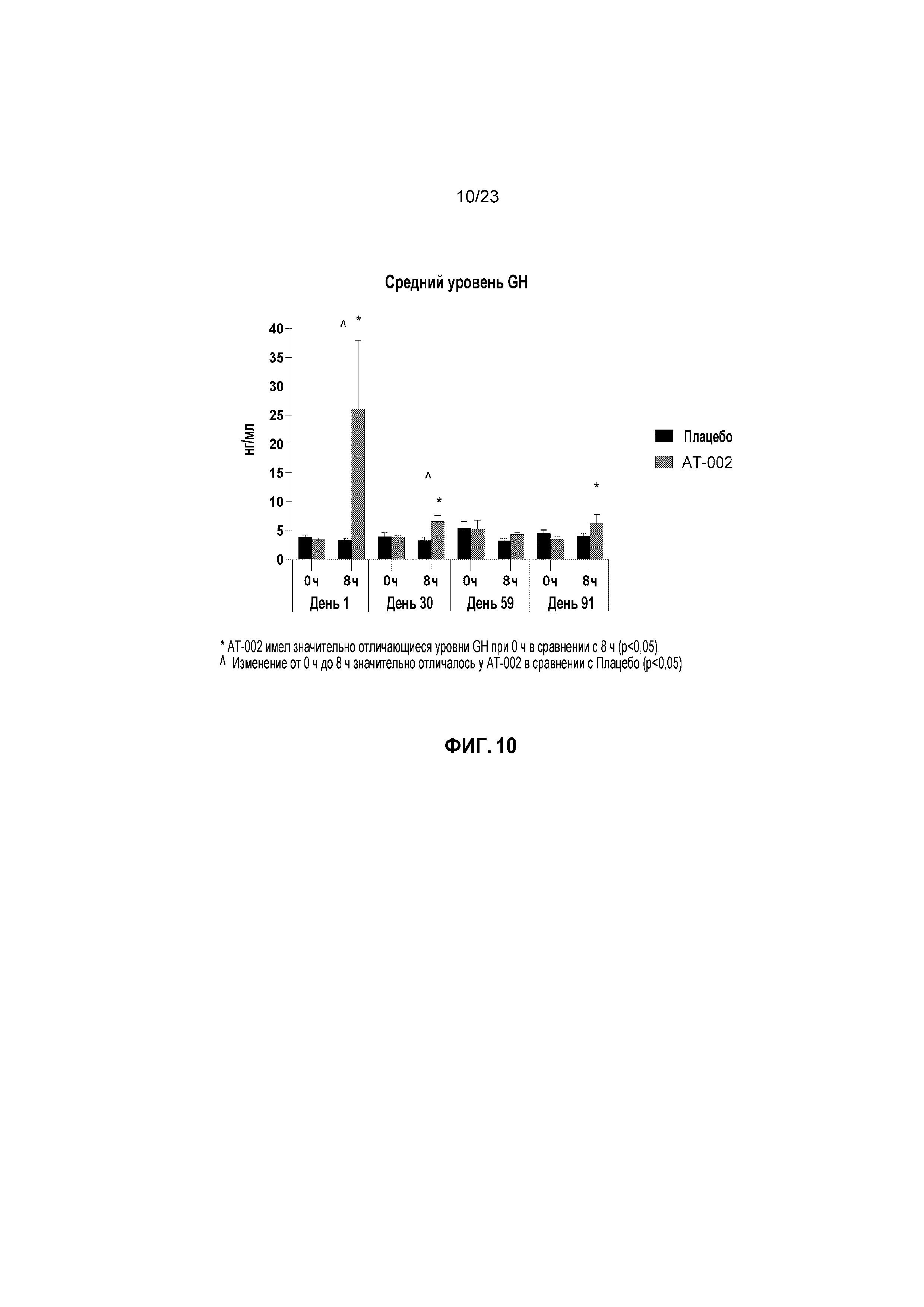
ФИГ. 10 отображает средние уровни гормона роста (GH) в нг/мл с течением времени для кошек, получавших лечение плацебо и капроморелином, как описано в Примере 3. Звездочка (*) указывает, что кошки, получающие лечение капроморелином, имели значительно отличающийся GH при 0 часах в сравнении с 8 часами (p < 0,05). Карат (^) указывает, что изменение от 0 часов до 8 часов было существенно отличающимся для капроморелина при сравнении с плацебо (p < 0,05).
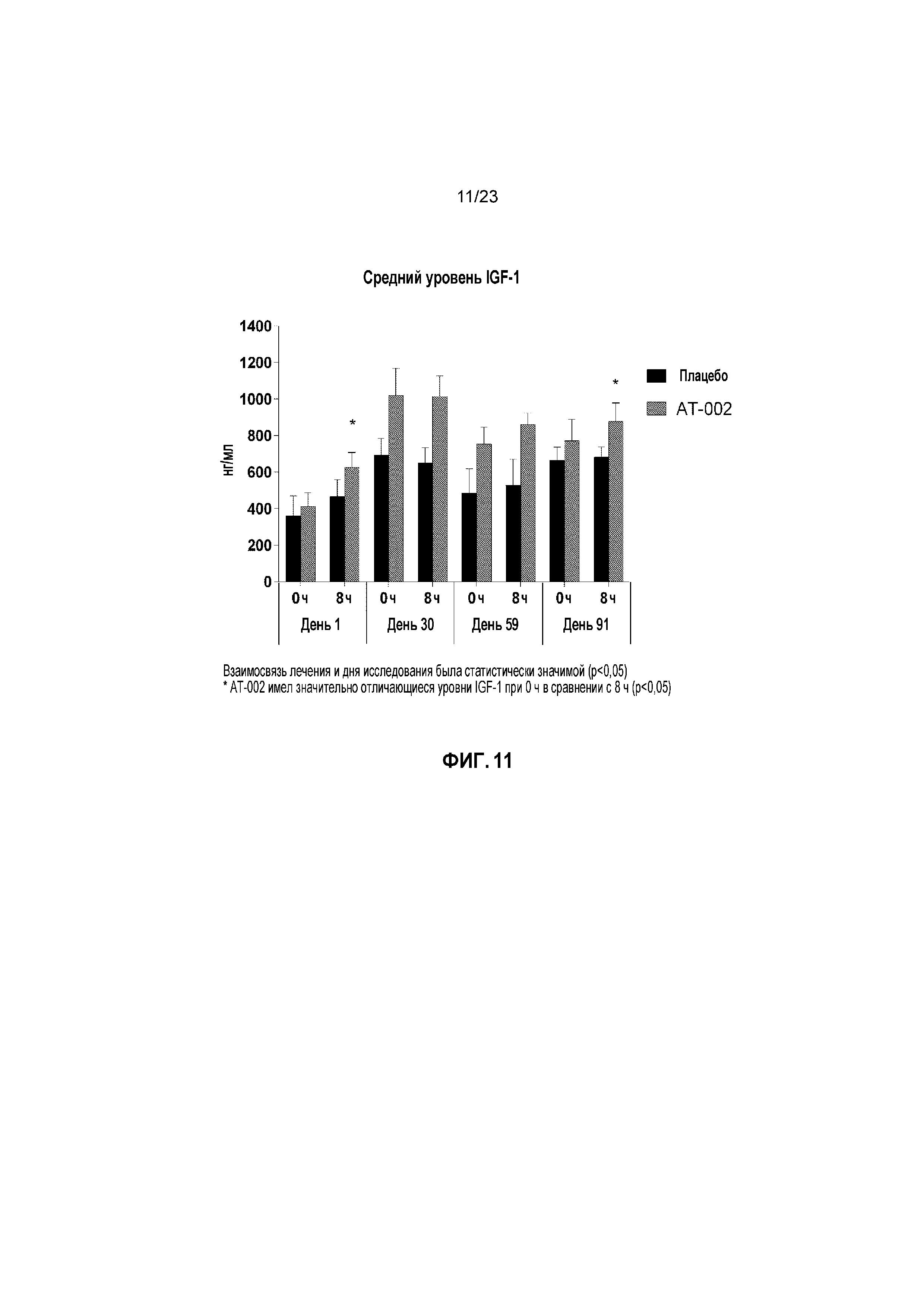
ФИГ. 11 отображает средние уровни инсулиноподобного фактора роста-1 (IGF-1) в нг/мл с течением времени для кошек, получавших лечение плацебо и капроморелином, как описано в Примере 3. Взаимосвязь лечения и дня исследования была статистически значимой (p < 0,05). Звездочка (*) указывает, что кошки, получающие лечение капроморелином, имели значительно отличающийся IGF-1 при 0 часов в сравнении с 8 часами (p < 0,05).
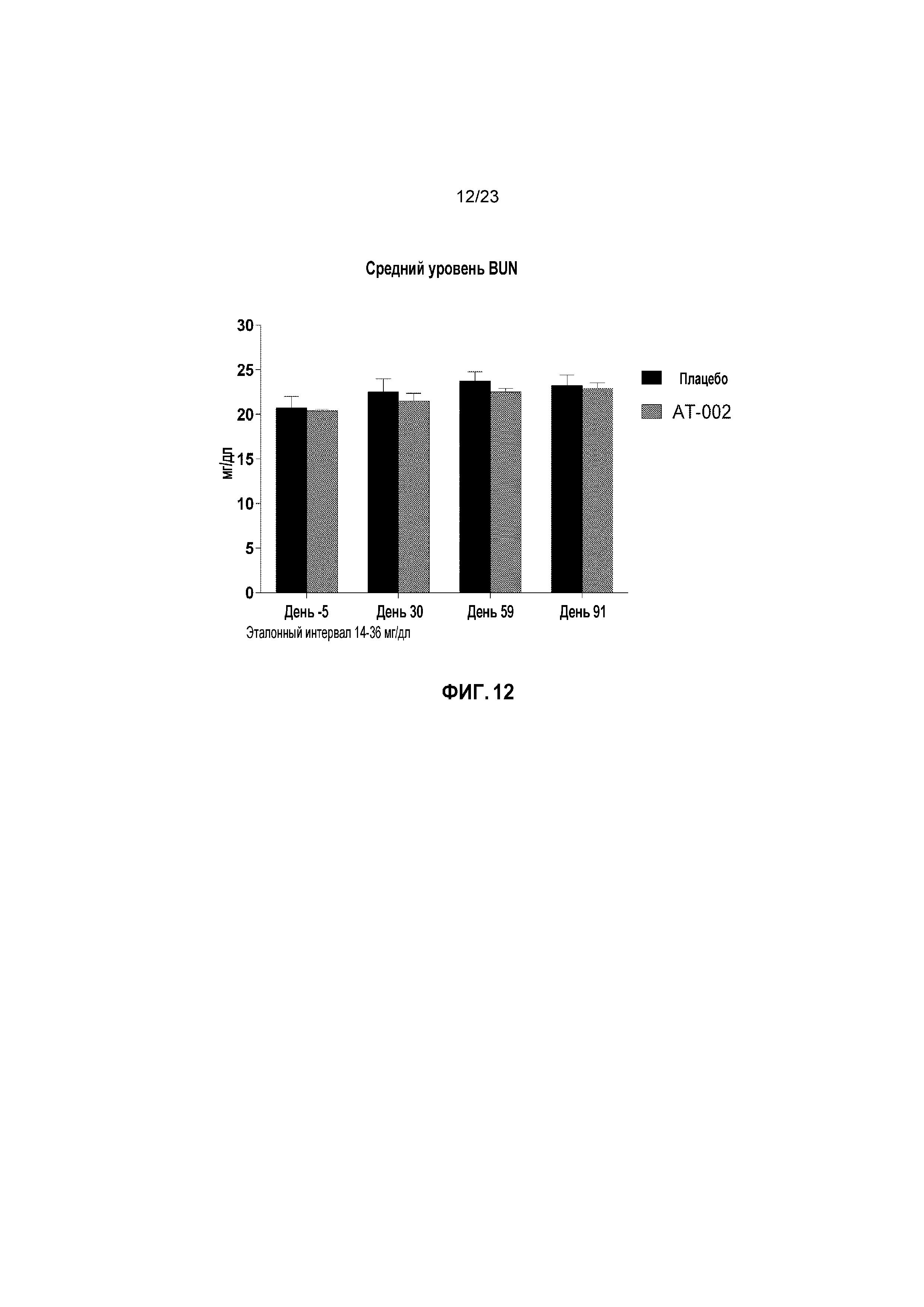
ФИГ. 12 отображает средние уровни остаточного азота мочевины в крови (BUN) в мг/дл с течением времени для кошек, получавших лечение плацебо и капроморелином, как описано в Примере 3. Эталонный интервал составлял от 14 мг/дл до 36 мг/дл.
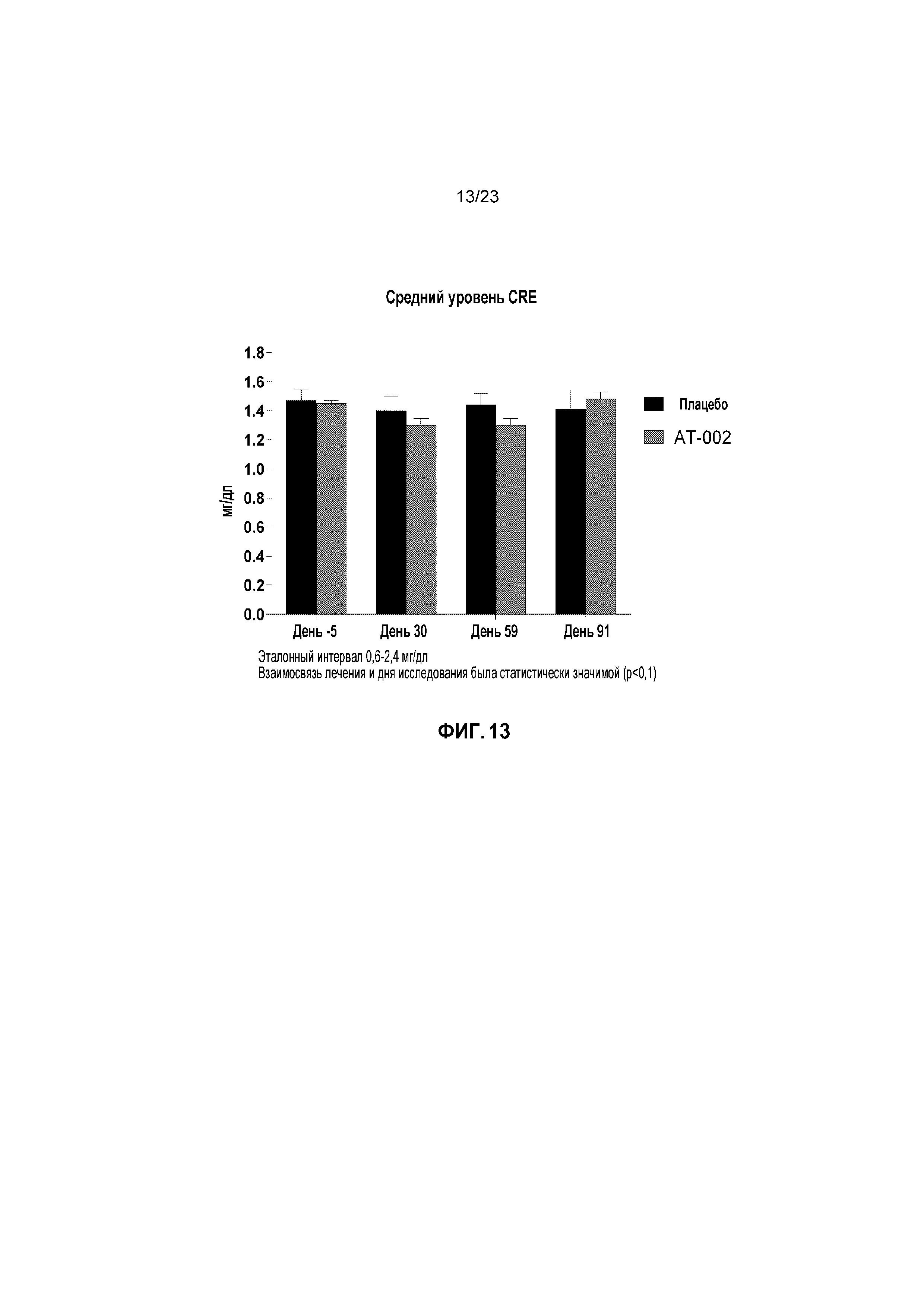
ФИГ. 13 отображает средние уровни креатинина (CRE) с течением времени для кошек, получавших лечение плацебо и капроморелином, как описано в Примере 3. Эталонный интервал (нормальный уровень) составлял от 0,6 мг/дл до 2,4 мг/дл. Взаимосвязь лечения и дня исследования была статистически значимой (p < 0,1).
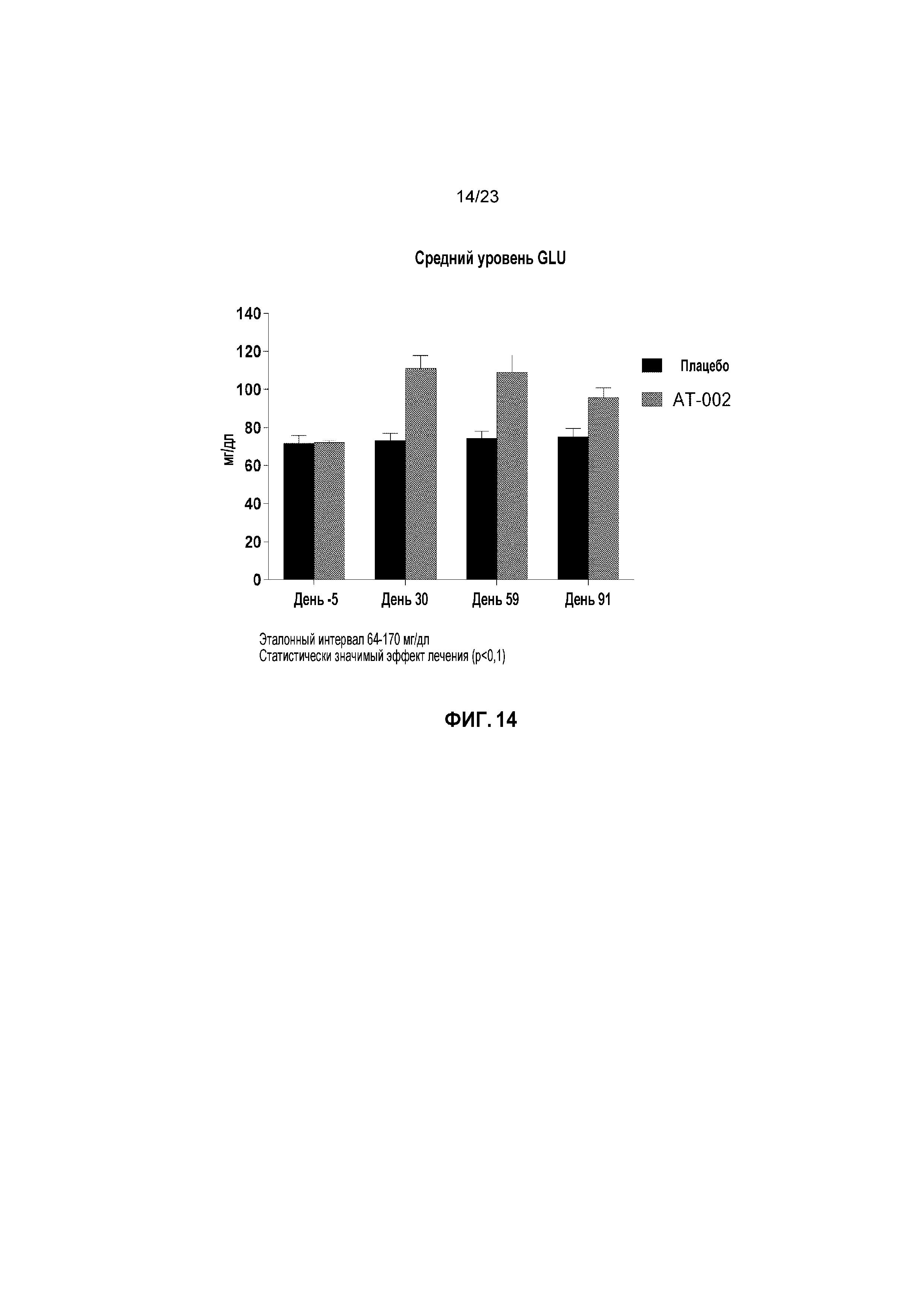
ФИГ. 14 отображает средние уровни глюкозы (GLU) с течением времени для кошек, получавших лечение плацебо и капроморелином, как описано в Примере 3. Эталонный интервал (нормальный уровень) составлял от 64 мг/дл до 170 мг/дл. Данные указывают на статистически значимый эффект лечения (p < 0,1).
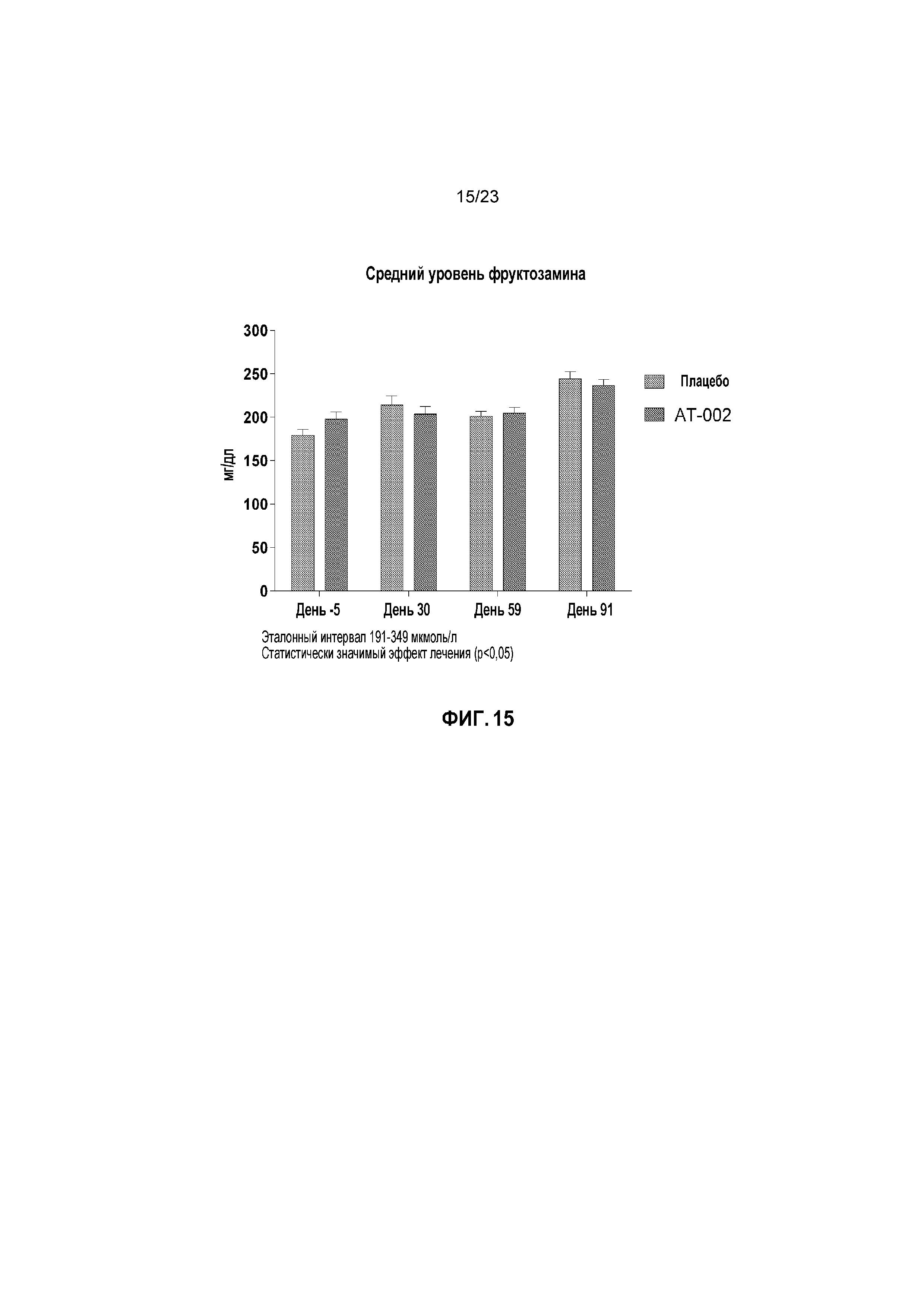
ФИГ. 15 отображает средние уровни фруктозамина с течением времени для кошек, получавших лечение плацебо и капроморелином, как описано в Примере 3. Эталонный интервал (нормальный уровень) составлял от 191 мкмоль/л до 349 мкмоль/л. Данные указывают на статистически значимый эффект лечения (p < 0,1).
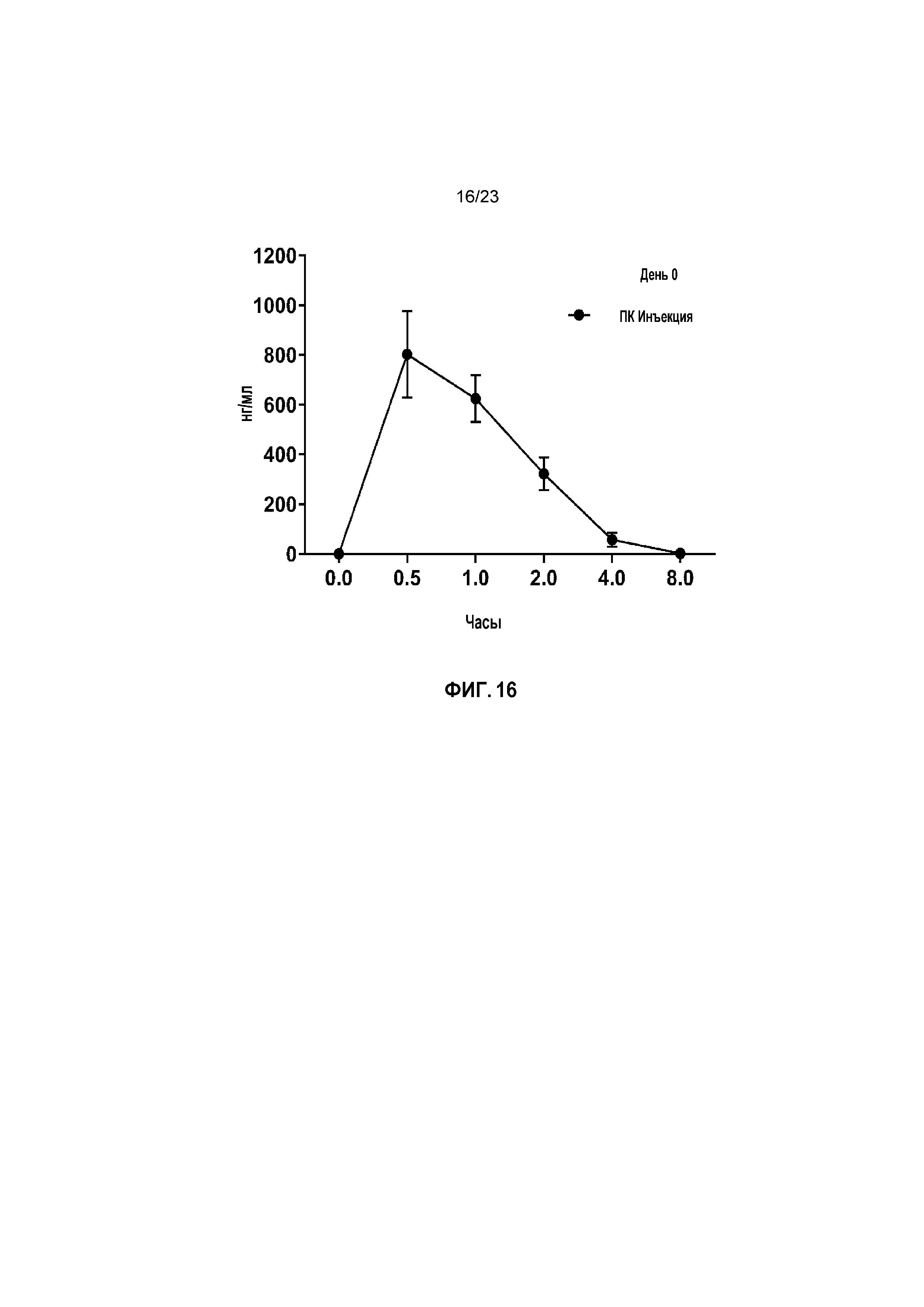
ФИГ. 16 показывает средние сывороточные уровни капроморелина в День 1 при исследовании титрования дозы у кошек.
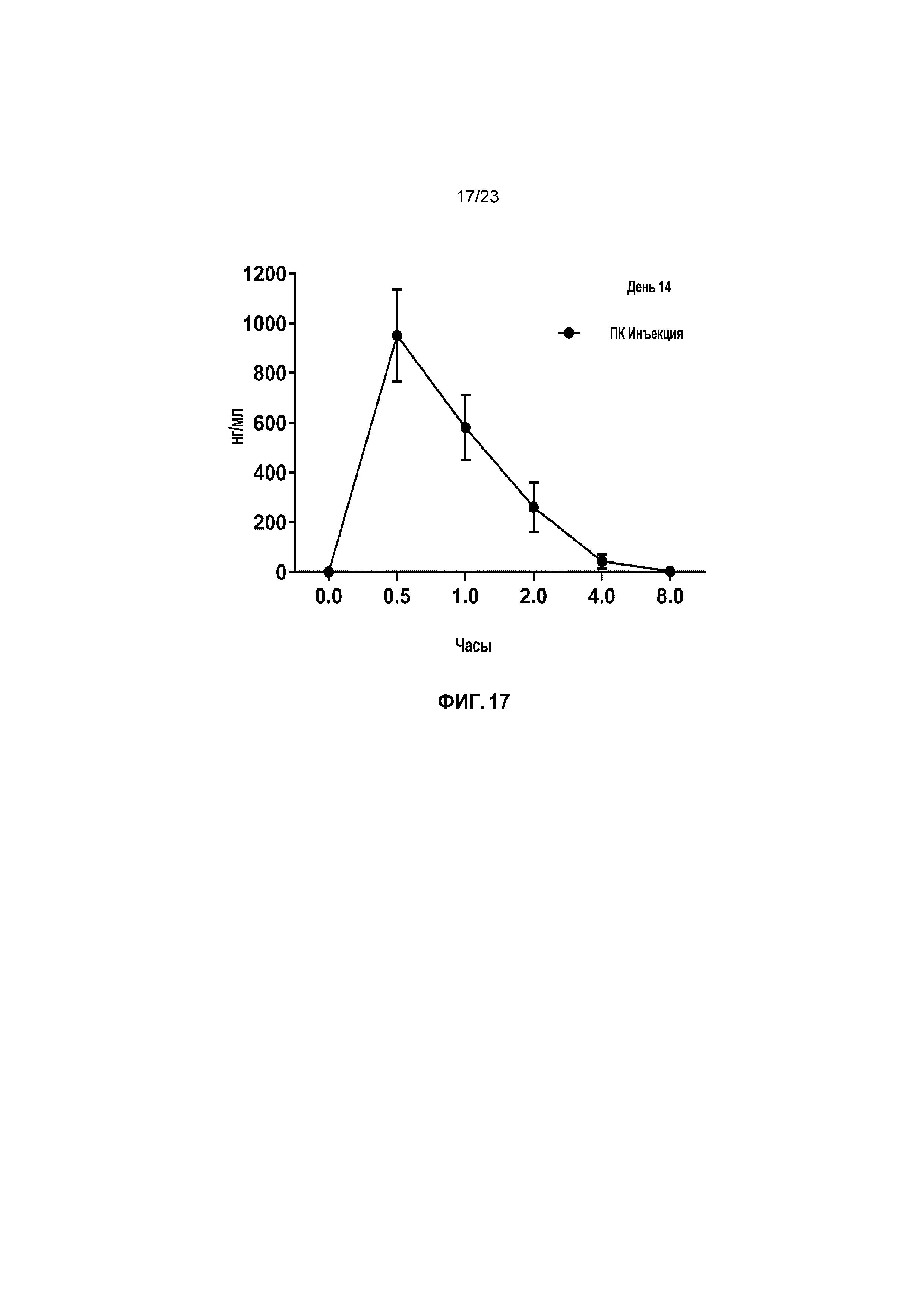
ФИГ. 17 показывает средние сывороточные уровни капроморелина в День 13 при исследовании титрования дозы у кошек.
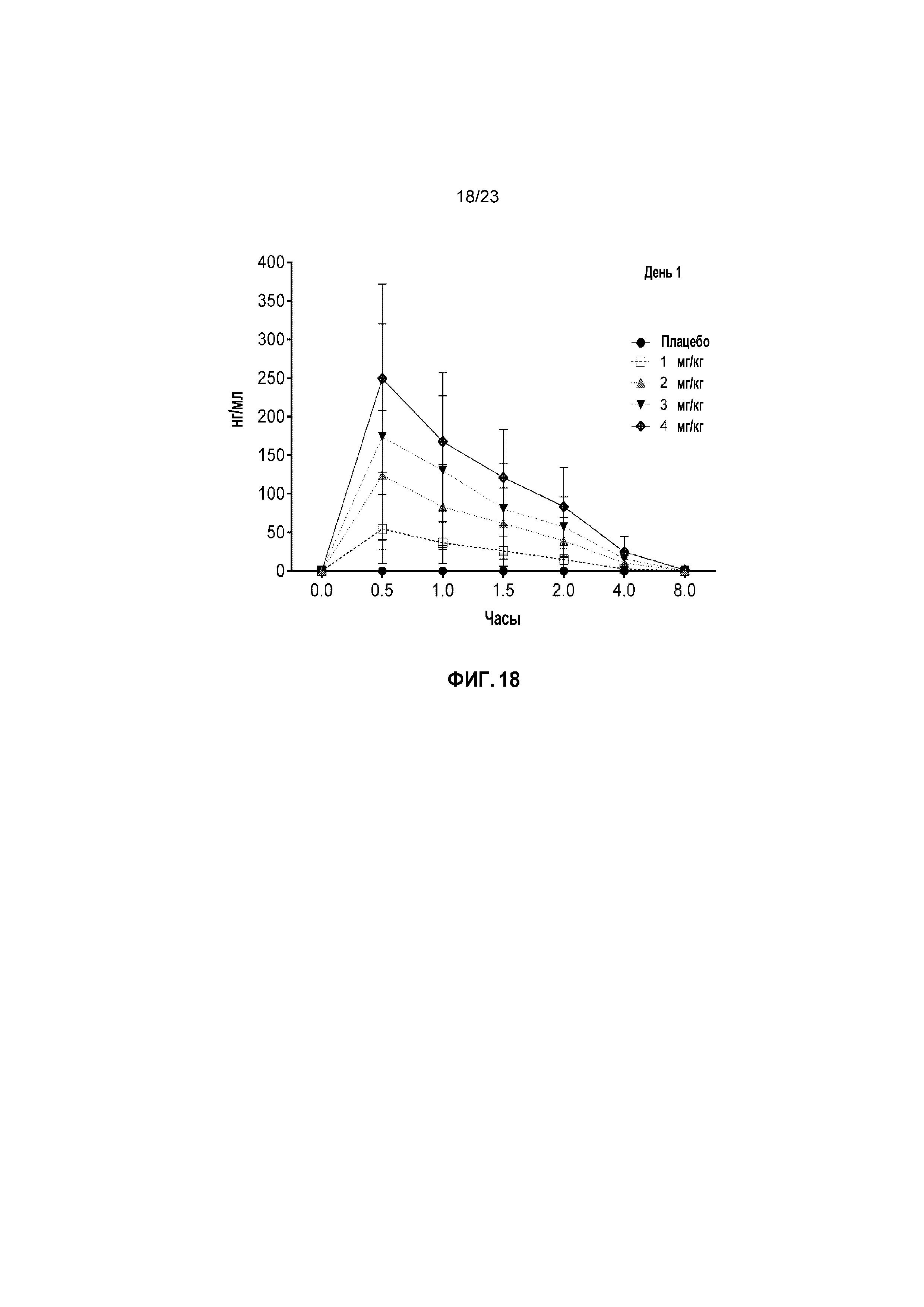
ФИГ. 18 показывает средние сывороточные уровни капроморелина по результатам исследования титрования дозы у кошек в День 1.
ФИГ. 19 показывает средние сывороточные уровни капроморелина по результатам исследования титрования дозы у кошек в День 10.
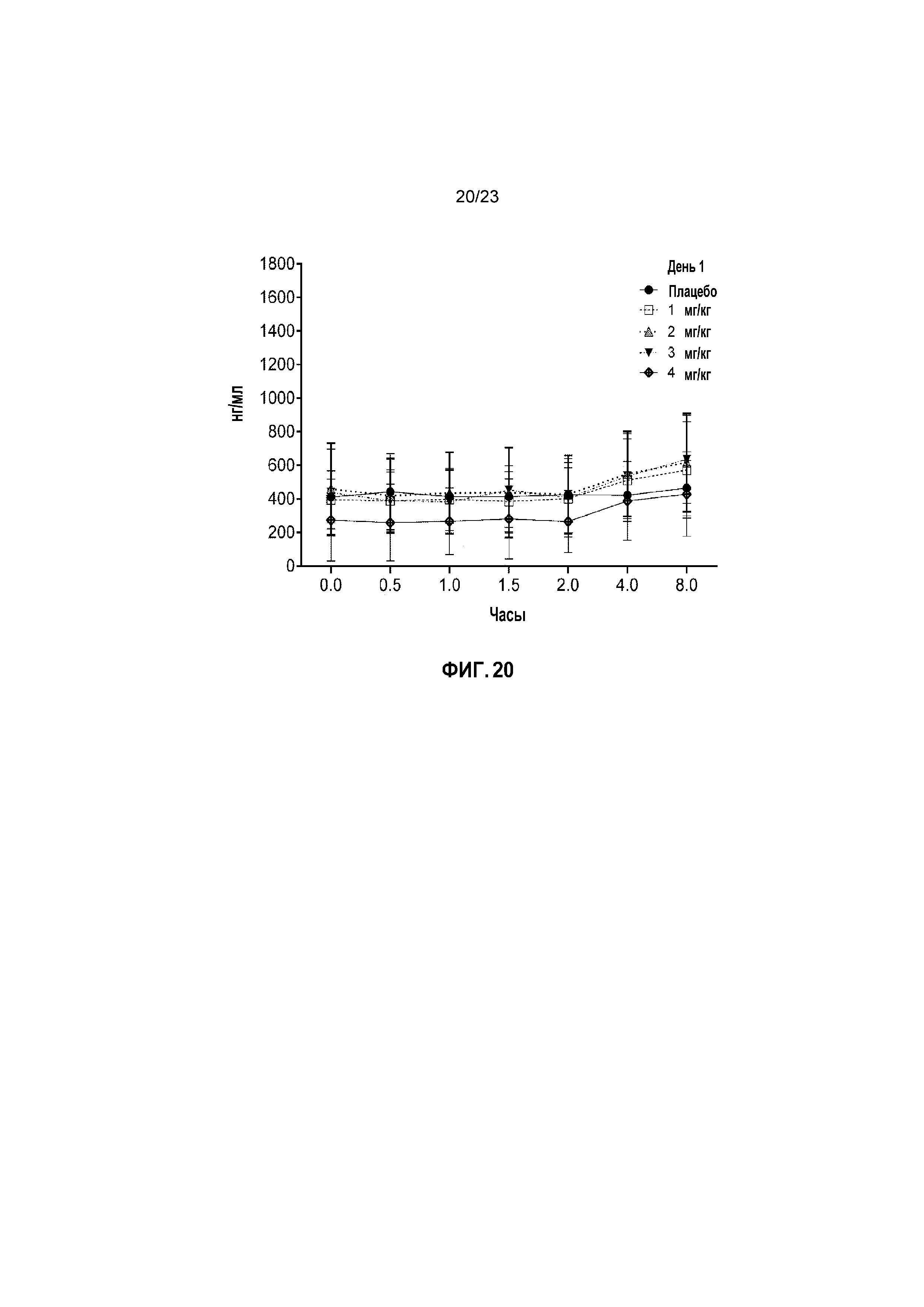
ФИГ. 20 показывает средние сывороточные уровни капроморелина у кошек с моделированной в лаборатории ХБП в День 0 пилотного исследования безопасности.
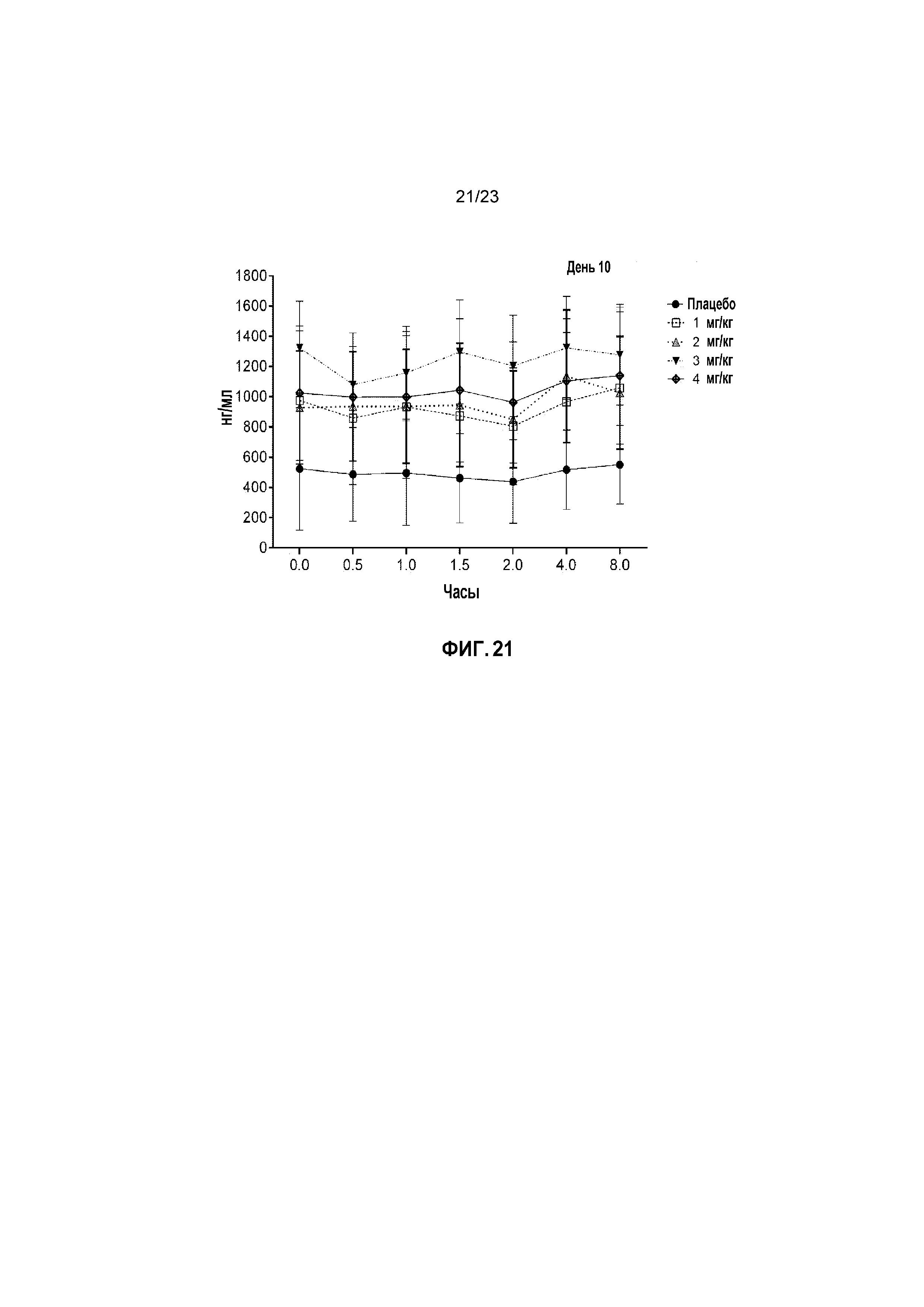
ФИГ. 21 показывает средние сывороточные уровни капроморелина у кошек с моделированной в лаборатории ХБП в День 13 пилотного исследования безопасности.
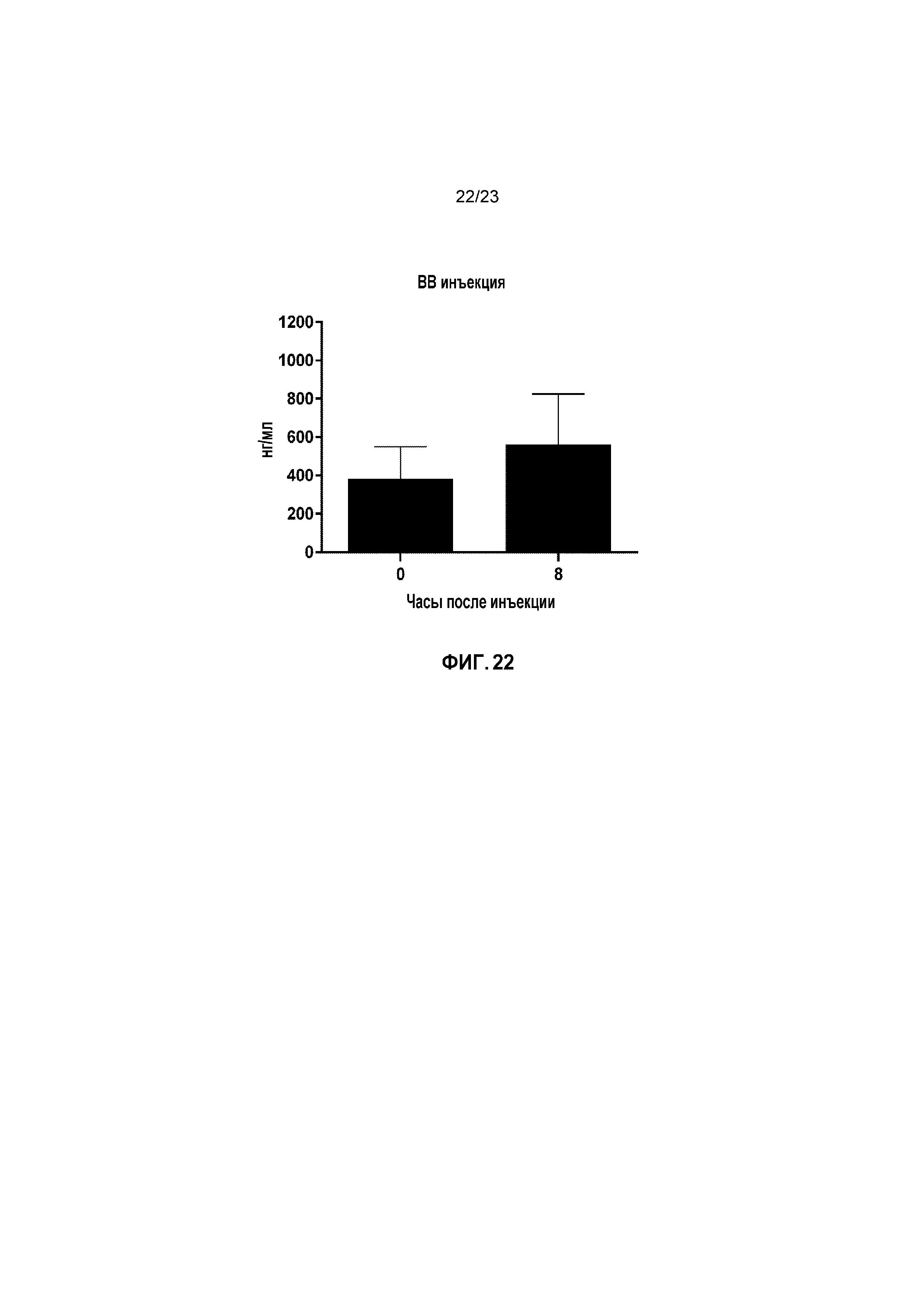
ФИГ. 22 показывает средние сывороточные уровни IGF-1 (нг/мл) у кошек с моделированной в лаборатории ХБП в День 0 пилотного исследования безопасности.
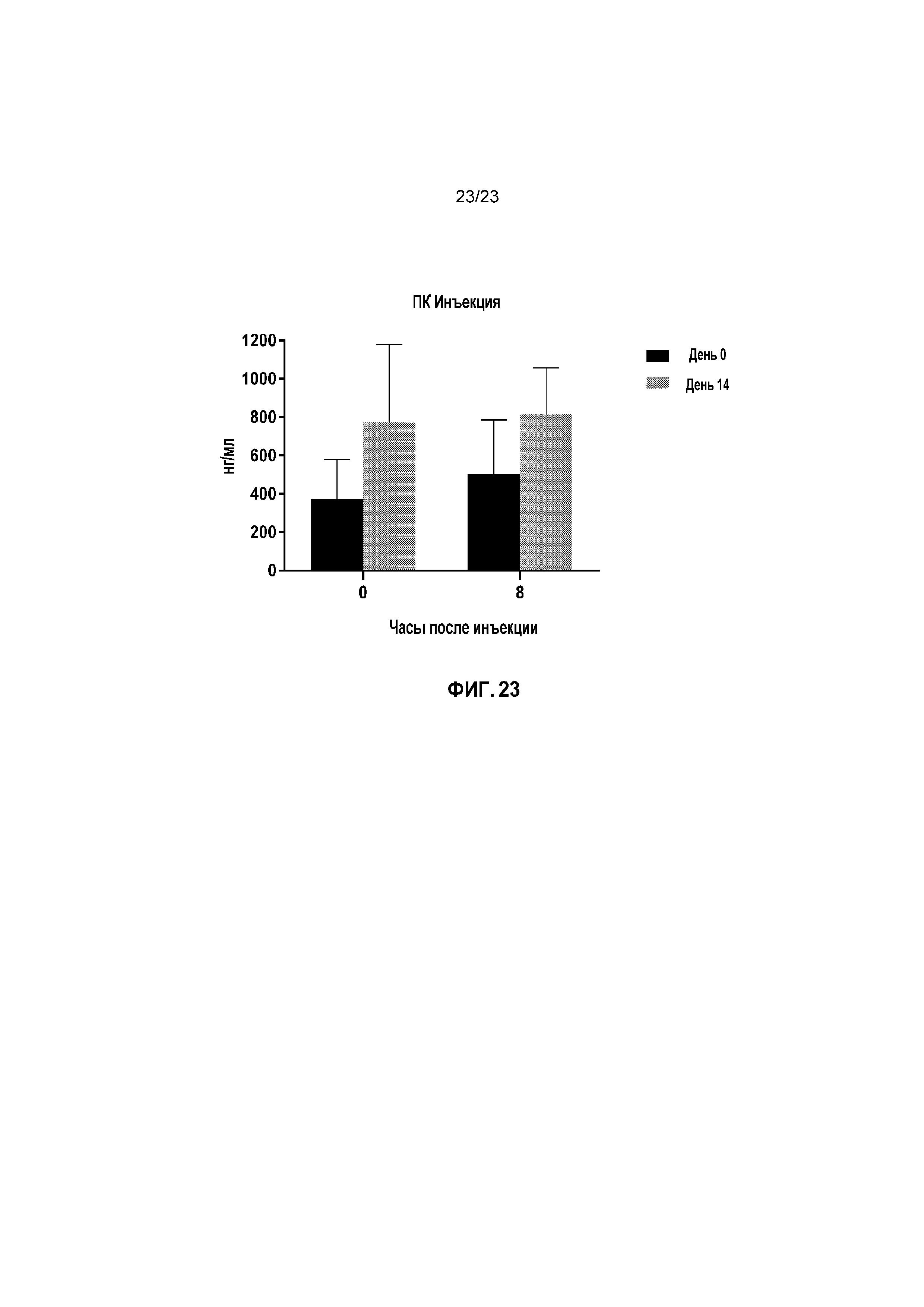
ФИГ. 23 показывает средние сывороточные уровни IGF-1 (нг/мл) у кошек с моделированной в лаборатории ХБП в День 13 пилотного исследования безопасности.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Способы и композиции, предоставленные в настоящем описании, могут применяться для лечения, предотвращения, ослабления и/или регулирования снижения массы тела у животных, включающих домашних животных, сельскохозяйственных животных, разнообразных млекопитающих и видов птиц. Сами по себе при введении этим животным, композиции могут индуцировать продуцирование одной или нескольких молекул, которые могут вызывать у домашнего животного чувство голода, в особенности, в течение периода лечения, равного по меньшей мере 8 дням. Кроме того, без связи с теорией, введение композиций животным может также индуцировать одну или несколько молекул, которые увеличивают сухую мышечную массу, таким образом, что пища, потребляемая в результате возросшего чувства голода, может применяться при построении сухой мускулатуры вместо отложения в жировой ткани.
Композиции могут содержать агонист грелина, такой как капроморелин, и могут включать в себя по меньшей мере один ароматизатор или одно средство, корригирующее вкус и запах лекарственного средства. Дополнительно, настоящее раскрытие основано, по меньшей мере частично, на том открытии, что при лечении, домашние животные и сельскохозяйственные животные, страдающие от снижения массы тела, которые получают одну или несколько доз композиции в течение по меньшей мере 8 дней, проявляют статистически значимую увеличенную массу тела, увеличенное потребление пищи и увеличенные сывороточные уровни одного или нескольких значимых белков и/или других молекул, таких как, но не ограниченных перечисленными, инсулиноподобный фактор роста-1 (в настоящем описании ʺIGF-1ʺ), гормон роста (в настоящем описании ʺGHʺ) и/или кортизол. Конкретно, введение лекарственной формы, содержащей капроморелин, в течение по меньшей мере 8 дней приводит к неожиданному, удивительному и статистически значимому увеличению прироста массы тела в сравнении с таким же введением в течение лишь 7 дней или менее, и согласуется с исходным уровнем клинически значимых маркеров через 4 дня, включающих сывороточный IGF-1.
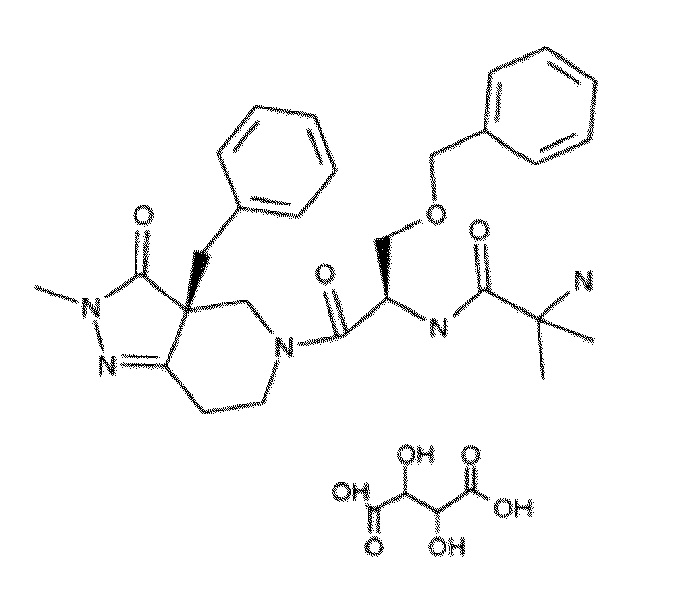
Композиции для регулирования хронического снижения массы тела или увеличения прироста массы тела могут включать капроморелин, который включает рацематы, полиморфы, сольваты, энантиомеры, соли и любое другое подходящее фармацевтически приемлемое производное капроморелина. Капроморелин также известен как N-[(2R)-1-[(3aR)-2-метил-3-оксо-3a-(фенилметил)-6,7-дигидро-4H-пиразоло[4,3-c]пиридин-5-ил]-1-оксо-3-(фенилметокси)пропан-2-ил]-2-амино-2-метилпропанамида L-тартрат. Кроме того, капроморелин имеет следующую химическую структуру:
У некоторых домашних животных и сельскохозяйственных животных, грелин представляет собой гормон, продуцируемый в основном в железистом желудке и других частях пищеварительного тракта, и является эндогенным лигандом рецептора грелина, который является также известным рецептором стимулятора секреции гормона роста (GHS-R). Без связи с теорией, GHS-R могут экспрессироваться в множестве тканей, включая неврологические ткани, такие как, но не ограничиваясь перечисленным, гипофиз и гипоталамус. Грелин проявляет относительно короткий период полужизни (например, приблизительно десять минут) в крови животных, включающих домашних животных и сельскохозяйственных животных, и начинает накапливаться в крови вскоре после приема пищи. Соответственно, чем длиннее период времени от последнего приема пищи животным, тем выше концентрация грелина в крови. Кроме того, как только достаточные количества грелина связываются с GHS-R в гипоталамусе, животные начинают чувствовать голод, который стимулирует поглощение пищи.
В дополнение к связыванию с GHS-R в гипоталамусе, циркулирующий грелин может также связываться с GHS-R в гипофизе, чтобы стимулировать высвобождение GH. Кроме того, и без намерения быть связанным с теорией, в дополнение к высвобождению GH, происходящему от связывания грелина с GHS-Rs в гипофизе, животные естественным образом секретируют GH при циркадном ритме. Несмотря на то, что это естественное высвобождение имеет место на протяжении всей жизни животного, величина высвобождения выбросов GH снижается по мере протекания жизни животного. Высвобожденный GH может циркулировать в домашнем животном, что может индуцировать продуцирование и секрецию IGF-1 в кровообращение. Увеличение уровней циркулирующего IGF-1 может индуцировать рост сухой мускулатуры, который может коррелировать с увеличенной силой, выносливостью и здоровьем. Кроме того, кроме индуцирования выработки GH, грелин может также индуцировать выработку кортизола, который, как было показано, увеличивает вероятность отложения жира в жировой ткани.
При введении животному, такому как домашнее животное или сельскохозяйственное животное, капроморелин может функционировать как агонист GHS-R для регулирования хронической утраты аппетита, снижения массы тела, анорексии и/или кахексии. В частности, капроморелин может применяться для лечения кахексии, такой как сердечная кахексия. Конкретно, введение капроморелина может индуцировать стимуляцию аппетита и секрецию GH, особенно, при введении в течение по меньшей мере 8 дней. В отличие от эндогенного грелина, капроморелин обычно проявляет более длительный период полужизни в кровообращении, и в отличие от экзогенного грелина, капроморелин является биологически активным при пероральном введении.
Композиция капроморелина может перорально вводиться животным и вызывать биологические эффекты стимулирования аппетита, поглощения пищи, высвобождения GH и т.д. Как более подробно обсуждается ниже, композиции капроморелина могут также вводиться другими путями (например, внутривенно, внутрибрюшинно, внутримышечно, интратекально, подкожно и любым другим подходящим путем введения).
Кроме того, в дополнение к капроморелину или вместо него, по меньшей мере несколько из фармацевтических композиций могут также включать другие подобные грелину соединения (например, агонисты GHS-R) для лечения и/или по меньшей мере частичного ослабления хронического снижения массы тела. Например, по меньшей мере несколько из подобных грелину, не являющихся капроморелином соединений, могут аналогично связываться с GHS-R, чтобы индуцировать чувство голода и стимулировать поглощение пищи у животных, которые принимают эти соединения. Эти соединения могут являться любыми другими подходящими агонистами, которые связывают GHS-R.
Фармакологический механизм действия капроморелина действует аналогично механизму действия грелина. Например, после введения, капроморелин связывается с GHS-R, рецептором, сочетанным с G-белком, который может активировать протеинкиназу C и стимулировать высвобождение GH из гипофиза, что может приводить к повышению циркулирующего GH. Не будучи связанным с теорией, GH может затем вызывать высвобождение IGF-1, который может индуцировать отрицательную обратную связь с гипофизом, таким образом, снижая или ингибируя высвобождение GH. Как указано ранее, IGF-1 также действует для увеличения сухой массы тела. Кроме того, введение капроморелина может восполнить снижение естественного высвобождения GH в течение жизни животного. Кроме того, отрицательная обратная связь, возникающая вследствие циркулирующего IGF-1, может также снижать уровни циркулирующего кортизола, таким образом, по меньшей мере частично уменьшая вероятность увеличенного отложения в жировой ткани.
Как правило, период введения для капроморелина может и будет варьировать. Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение по меньшей мере 8 дней. Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение приблизительно 8 дней, в течение приблизительно 9 дней, в течение приблизительно 10 дней, в течение приблизительно 11 дней, в течение приблизительно 12 дней, в течение приблизительно 13 дней, в течение приблизительно 14 дней, в течение приблизительно 15 дней, в течение приблизительно 16 дней, в течение приблизительно 17 дней, в течение приблизительно 18 дней, в течение приблизительно 19 дней, в течение приблизительно 20 дней, в течение приблизительно 21 дня, в течение приблизительно 22 дней, в течение приблизительно 23 дней, в течение приблизительно 24 дней, в течение приблизительно 25 дней, в течение приблизительно 26 дней, в течение приблизительно 27 дней, в течение приблизительно 28 дней, в течение приблизительно 29 дней, в течение приблизительно 30 дней, в течение приблизительно 31 дня, в течение приблизительно 32 дней, в течение приблизительно 33 дней, в течение приблизительно 34 дней, в течение приблизительно 35 дней, в течение приблизительно 36 дней, в течение приблизительно 37 дней, в течение приблизительно 38 дней, в течение приблизительно 39 дней, в течение приблизительно 40 дней, в течение приблизительно 41 дня, в течение приблизительно 42 дней, в течение приблизительно 43 дней, в течение приблизительно 44 дней, в течение приблизительно 45 дней, в течение приблизительно 60 дней, в течение приблизительно 75 дней, в течение приблизительно 90 дней, в течение приблизительно 120 дней, в течение приблизительно 150 дней, в течение приблизительно 180 дней, в течение приблизительно 210 дней, в течение приблизительно 240 дней, в течение приблизительно 270 дней, в течение приблизительно 300 дней, в течение приблизительно 330 дней, в течение приблизительно 360 дней или в течение приблизительно 365 дней.
Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение от приблизительно 8 дней до приблизительно 365 дней. Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение по меньшей мере 14 дней. Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение по меньшей мере 21 дня. Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение по меньшей мере 30 дней. Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение по меньшей мере 90 дней.
Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение менее, чем 365 дней. Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение менее, чем 90 дней. Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение менее, чем 30 дней. Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение менее, чем 21 день.
Капроморелин может быть предоставлен в концентрации, подходящей для лечения нуждающегося в лечении животного, не являющегося человеком, в течение приблизительно 1 месяца, приблизительно 2 месяцев, приблизительно 3 месяцев, приблизительно 4 месяцев, приблизительно 5 месяцев, приблизительно 6 месяцев, приблизительно 7 месяцев, приблизительно 8 месяцев, приблизительно 9 месяцев, приблизительно 10 месяцев, приблизительно 11 месяцев, приблизительно 12 месяцев, приблизительно 13 месяцев, приблизительно 14 месяцев, приблизительно 15 месяцев, приблизительно 16 месяцев, приблизительно 17 месяцев, приблизительно 18 месяцев, приблизительно 19 месяцев, приблизительно 20 месяцев, приблизительно 21 месяца, приблизительно 22 месяцев, приблизительно 23 месяцев или приблизительно 24 месяцев.
Капроморелин может быть включен в состав композиции для прироста массы тела при одной или нескольких концентрациях. Капроморелин может быть по меньшей мере частично растворен в водном растворителе (например, деионизированной и/или очищенной воде). Например, концентрация капроморелина в композиции для прироста массы тела может находиться в интервале от приблизительно 0,01 миллиграммов капроморелина на килограмм массы тела животного (далее в настоящем описании ʺмг/кгʺ) до приблизительно 75 мг/кг. Удивительным является, что введение капроморелина при высоких дозах (например, более, чем 40 мг/кг) ежедневно в течение целого года приводило к благоприятной токсикологии.
Например, концентрация капроморелина может находиться в интервале от приблизительно 0,1 мг/кг до приблизительно 7,5 мг/кг. Интервал концентрации капроморелина может находиться в интервале от приблизительно 1 мг/кг до приблизительно 60 мг/кг. Альтернативно, интервал концентрации капроморелина может находиться от приблизительно 0,5 мг/кг до приблизительно 7,5 мг/кг. Интервал концентрации капроморелина может находиться от приблизительно 0,75 мг/кг до приблизительно 6 мг/кг.
Посредством дополнительного примера, концентрация капроморелина может быть равна по меньшей мере одной концентрации из 0,75 мг/кг, 1,0 мг/кг, 2,0 мг/кг, 3,0 мг/кг, 4,0 мг/кг, 5,0 мг/кг, 6,0 мг/кг, и любым концентрациям между ними. Интервал концентрации капроморелина может находиться от приблизительно 2 мг/кг до приблизительно 6 мг/кг. Альтернативно, интервал концентрации капроморелина может находиться от приблизительно 3 мг/кг до приблизительно 4,5 мг/кг. Концентрация капроморелина может быть равной приблизительно 2 мг/кг. Также, концентрация капроморелина может быть равной приблизительно 3 мг/кг.
Число ежедневных введений композиции, содержащей капроморелин, нуждающемуся в этом животному может и будет варьировать. Терапевтически эффективное количество композиции, содержащей капроморелин, вводят домашнему животному или сельскохозяйственному животному по меньшей мере один раз в день. Терапевтически эффективное количество композиции, содержащей капроморелин, вводят домашнему животному или сельскохозяйственному животному по меньшей мере дважды в день. Альтернативно, терапевтически эффективное количество композиции, содержащей капроморелин, вводят домашнему животному или сельскохозяйственному животному по меньшей мере трижды в день.
Капроморелин может быть по меньшей мере частично растворен в водном растворителе, и фармацевтическая композиция может включать в себя другие неактивные ингредиенты, такие как консерванты, эмульгирующие и/или загущающие средства, подсластители, ароматизаторы и/или средства, корригирующие вкус и запах лекарственного средства.
Кроме того, концентрация капроморелина в композиции для прироста массы тела может по меньшей мере частично зависеть от пути введения и/или числа введений в заранее заданном периоде времени композиции домашним животным или сельскохозяйственным животным. Например, могут быть составлены одна или несколько лекарственных форм композиции для инъекционного введения. В результате, капроморелин в композиции может быть доставлен непосредственно в кровообращение (например, посредством внутривенного введения), таким образом, обходя необходимость всасывания в пищеварительном тракте. Соответственно, более высокие количества капроморелина могут достигнуть желательных мишеней (например, GHS-R) относительно пероральных лекарственных форм, приводя к более низкой необходимой концентрации капроморелина в стерильном инъекционном варианте.
Композиция для прироста массы тела может перорально вводиться один или несколько раз в день. Например, композиция может вводиться в виде раствора, твердого вещества или предпочтительной вязкой жидкой лекарственной формы. Соответственно, чем большее количество раз в день композицию вводят домашним животным, тем меньшее количество капроморелина требуется для получения желательных результатов.
Лишь для примера, дозирование животных может быть разделено на множество схем лечения, в зависимости от тяжести показаний у животного. Животные могут получать схему дозирования по 1 мг/кг, 2 мг/кг, 3 мг/кг, 4,5 мг/кг или 6 мг/кг. Животное может быть кошкой, и кошка может получать схему дозирования по 2 мг/кг. В особенности, животное может быть собакой, и собака может получать схему дозирования по 3 мг/кг.
Кроме того, некоторые из этих схем дозирования могут включать использование твердых или жидких лекарственных форм. Некоторые животные (например, собаки) могут получать одну или несколько твердых пероральных лекарственных форм, таких как композиция для прироста массы тела, составленная для введения посредством капсул, гелевых капсул, гелеподобных жидкостей (т.е., вязких жидкостей), пилюль, таблеток в виде капсул, таблеток или других твердых, жидких или распыленных форм. Капсулы или другие формы могут включать различные концентрации капроморелина, чтобы сделать возможным дозирование животных с множеством масс тела (т.е., поскольку дозирование капроморелина по меньшей мере частично зависит от массы тела животного).
Исключительно для примера, капсулы могут быть изготовлены с концентрацией капроморелина, равной 20 мг на капсулу, 35 мг на капсулу и 75 мг на капсулу. В результате, различные комбинации капсул могут вводиться животным, нуждающимся в лечении, для обеспечения необходимой дозы капроморелина животному. Исключительно для примера, для животного, имеющего массу приблизительно 15 кг, и находящегося на схеме лечения 3 мг/кг будет требоваться приблизительно 45 мг капроморелина на дозу. Соответственно, животное может получать две капсулы по 20 мг для обеспечения дозы капроморелина, которая близка к 45 мг (т.е., между 5 и 10 миллиграммами желательной дозы в расчете от массы тела животного или в интервале дозирования). Другие животные других размеров и находящиеся на других схемах лечения могут аналогично подвергаться лечению с обеспечением эффективного количества капроморелина.
Кроме того, композиция для прироста массы тела может включать в себя жидкие пероральные лекарственные формы, которые могут применяться аналогично указанной выше твердой пероральной лекарственной форме. Например, жидкие лекарственные формы могут быть получены, чтобы содержать следующие концентрации капроморелина в жидкой лекарственной форме: 20 мг/мл, 30 мг/мл, 40 мг/мл или 60 мг/мл. Жидкая лекарственная форма может содержать 30 мг/мл капроморелина.
Аналогично твердым лекарственным формам, обсуждаемым выше, могут применяться различные концентрации жидкой лекарственной формы, чтобы обеспечить дозирование животных с множеством масс тела. В результате, различные объемы различных растворов могут вводиться животным для обеспечения требуемой дозы капроморелина. Исключительно для примера, для животного, имеющего массу приблизительно равную 15 кг, и находящегося на схеме лечения с 3 мг/кг, будет требоваться приблизительно 45 мг капроморелина на дозу. Соответственно, животное может получать приблизительно 2,3 мл раствора с 20 мг/мл или 1,1 мл раствора с 40 мг/мл для обеспечения дозы капроморелина, которая близка к 45 мг. Аналогично, если то же самое животное находилось на схеме лечения с 4,5 мг/кг, животное могло получать 2,3 мл раствора с 30 мг/мл или 1,1 мл раствора с 60 мг/мл для обеспечения дозы капроморелина, близкой к 67,5 мг (т.е., дозы, которое животное с массой тела 15 кг должно получать по этой схеме лечения). Другие животные других размеров и находящиеся на других схемах лечения могут подвергаться лечению аналогично, для обеспечения эффективным количеством капроморелина.
Композиция для прироста массы тела может вводиться с использованием любого одного из множества путей введения. Композиция для прироста массы тела может вводиться перорально, парентерально и/или местно.
Композиция для прироста массы тела может быть составлена для перорального введения в жидкой и/или твердой лекарственной форме таким образом, что композиция может вводиться с использованием по меньшей мере одной формы из спрея, пилюли, таблетки, таблетки в виде капсулы или иной схемы жидкостного введения.
Композиция может быть составлена для введения посредством подкожного, внутрикожного, внутривенного, внутримышечного, внутричерепного, внутрибрюшинного или интратекального введения (например, посредством инъекции или распределяющего композицию насоса).
Композиция может быть составлена для чрескожного и/или трансмукозального введения (например, посредством буккальной пленки).
Кроме того, композиция для прироста массы тела может вводиться интраназально или в форме одного или нескольких суппозиториев.
Композиция для прироста массы тела может вводиться посредством введения в пищу, потребляемую нуждающимся в лечении домашним животным или сельскохозяйственным животным.
Композиция для прироста массы тела может быть составлена для любого другого подходящего пути введения, известного в области техники.
Лишь в качестве примера, композиция может храниться в одной или нескольких емкостях (например, стерильной бутыли), из которой индивидуум (например, ветеринар и/или ответственный за уход/собственник животного) может забрать композицию для прироста массы тела. К примеру, с использованием шприца индивидуум может забрать приблизительно одну дозу композиции (например, приблизительно пять миллилитров) из емкости для введения животному.
Индивидуум может зафиксировать животное и поместить шприц внутрь рта животного (например, задний угол рта рядом со спинкой языка). После готовности, индивидуум может надавить шток шприца, чтобы вытеснить композицию в рот/полость рта животного таким образом, чтобы животное проглотило композицию. В результате размещения шприца рядом с задней поверхностью рта, животное будет почти непреднамеренно глотать композицию, так что некоторая часть композиции или вся композиция попадет в пищеварительный тракт животного.
До и/или после отбора дозы композиции для прироста массы тела из емкости, игла может быть прикреплена к шприцу, и доза может вводиться животному посредством любого из ранее указанных путей введения.
Композиция для индуцирования увеличения массы тела может включать в себя лекарственную форму в твердой дозировке, так что композиция может даваться в других формах (например, пилюлях, таблетках в виде капсул, таблетках и т.д.) с пищей или без пищи.
Композиция для прироста массы тела может быть предоставлена индивидууму в лекарственной форме ʺготовой к применениюʺ. Например, композиция может быть предоставлена в емкости таким образом, что индивидууму не требуется делать каких-либо дополнительных добавлений в емкость или обрабатывать композицию каким-либо образом, чтобы приготовить композицию для введения животному.
Композиция для прироста массы тела может быть предоставлена в лекарственной форме в виде эмульгированной жидкости или суспензии таким образом, что одно или несколько дополнительных соединений, эксципиентов, других веществ или стадий подготовки могут при необходимости добавляться или выполняться для приготовления композиции для введения животному.
Композиция может включать один или несколько фармацевтически приемлемых эксципиентов. Некоторые примеры возможных эксципиентов включают разбавители, связующие средства, наполнители, буферные средства, средства-модификаторы рН, разрыхлители, диспергаторы, стабилизаторы, консерванты и/или окрашивающие средства. Количество и типы эксципиентов могут быть выбраны в соответствии с известными принципами фармацевтической науки.
Композиция может включать в себя один или несколько ароматизаторов и/или одно или несколько средств, корригирующих вкус и запах лекарственного средства.
Композиция может иметь неприятный или нежелательный вкус и запах, так, что одно или несколько дополнительных соединений могут быть добавлены для увеличения вкусовой привлекательности.
Композиция для прироста массы тела, которая может быть составлена для перорального введения, может включать один или несколько из следующих ароматизаторов и/или одно или несколько из следующих средств, корригирующих вкус и запах лекарственного средства (например, подсластитель): сукралоза; дисперсия лакрицы, производные лакрицы и экстракт лакрицы (Глицирризиновая кислота/ глицирризинат моноаммония); MagnaSweet®; смесь сахарината натрия и Неогесперидина дигидрохалкона (Optisweet™ SD), 97:3 (м/м) смесь сахарозы и мальтодекстрина (Di-Pac®), 7% тауматина (подсластителя), смешанного с неактивным мальтодекстрином (Тауматин T200X), чистый тауматин (Talin-Pure), ребаудиозид из экстракта стевии (стевиол-гликозиды), неотам, и/или полиолы (спиртосахара), такие как сорбитол, мальтитол, изомальт, ксилитол и глицерин.
Как применяют в настоящем описании ʺMagnaSweet®ʺ относится к композиции, состоящей по существу из одного или нескольких подсластителей, выбранных из группы, состоящей из Глицирризиновой кислоты (GA), глицирризината моноаммония (MAG), ребаудиозида A и глицерина. MagnaSweet® может состоять по существу из глицирризиновой кислоты (GA), глицирризината моноаммония (MAG), ребаудиозида A и глицерина. MagnaSweet® может состоять по существу из Глицирризиновой кислоты (GA), глицирризината моноаммония (MAG) и глицерина. MagnaSweet® может содержать от приблизительно 0,5% до приблизительно 25% GA/MAG, от приблизительно 0% до приблизительно 15% ребаудиозида A, и от приблизительно 75% до приблизительно 99,5% глицерина. MagnaSweet® может содержать от приблизительно 1,5% до приблизительно 17% GA/MAG, от приблизительно 0% до приблизительно 7,5% ребаудиозида A и от приблизительно 83% до приблизительно 91% глицерина. MagnaSweet® может содержать приблизительно 1,5% GA/MAG, приблизительно 7,5% ребаудиозида A и приблизительно 91% глицерина. MagnaSweet® может содержать приблизительно 9% GA/MAG и приблизительно 91% глицерина. MagnaSweet® может содержать приблизительно 17% GA/MAG и приблизительно 83% глицерина.
В частности, некоторые сахаросодержащие подсластители, такие как вещества, содержащие сахарозу, сахароза, глюкоза, фруктоза и мальтодекстрин, могут по меньшей мере частично разрушать капроморелин в композиции. Соответственно, следует избегать высоких концентраций некоторых сахаросодержащих подсластителей.
Кроме того, ароматизаторы и/или средства, корригирующие вкус и запах лекарственного средства, могут включать в себя композицию, содержащую аромат ванили, такой как, но не ограниченный перечисленными, этилванилин, ванилин (ванилин-RHD), аромат природной ванили (ванилин-Merck), аромат ванили, идентичный природному (ваниль-TG-старый), и подходящие растворители (например, этанол и/или вода).
Ароматизаторы и/или средства, корригирующие вкус и запах лекарственного средства, могут представлять собой один или несколько средств, выбранных из ароматов курицы, бекона, говядины, свинины, печени, рыбы, меда, карамели и банана.
Ароматизаторы или маскирующие средства могут включать в себя по меньшей мере одно средство из тауматина, сукралозы, неотама, сахарината натрия, Неогесперидина дигидрохалкона, ребаудиозида A, стевиол-гликозида, лакрицы, Глицирризиновой кислоты, глицирризината моноаммония, сахарозы, глюкозы, фруктозы, мальтодекстрина, сорбитола, мальтитола, изомальта, глицерина, и ванильсодержащей композиции.
Ароматизаторы и/или средства, корригирующие вкус и запах лекарственного средства, могут иметь процент массы на конечный объем композиции для прироста массы тела от приблизительно 50% до приблизительно 0,001%, в зависимости от выбранного средства.
Ароматизаторы и/или средства, корригирующие вкус и запах лекарственного средства, могут иметь процент массы на конечный объем композиции для прироста массы тела от приблизительно 40% до приблизительно 0,01%, в зависимости от выбранного средства.
Ароматизаторы и/или средства, корригирующие вкус и запах лекарственного средства, могут иметь процент массы на конечный объем композиции для прироста массы тела от приблизительно 30% до приблизительно 0,01%, в зависимости от выбранного средства.
Композиция для прироста массы тела может включать один или несколько неактивных ингредиентов, которые могут функционировать, чтобы стабилизировать или забуферить композицию, функционировать в качестве эмульгатора или загустителя для по меньшей мере одного или нескольких компонентов композиции, функционировать в качестве несущей среды, функционировать в качестве замещающего вещества для сахарозы, функционировать в качестве растворителя и могут функционировать для выполнения любой другой желательной роли. Например, композиция для прироста массы тела может включать одно или несколько из следующих веществ: лимонная кислота, цитрат натрия, хлорид натрия; консерванты, такие как метил-4-гидроксибензоатная соль и пропил-4-гидроксибензоатная соль; неосорб, сорбитол, мальтитол, пропиленгликоль, глицерин из растительного сырья, поливинилпирролидон (Коллидон™ 90F), ксантановая камедь, Плуриол-E3350®, полиэтиленгликоль, очищенная/деионизированная вода, макроголглицерина гидроксистеарат, метилцеллюлоза и пропиленгликоль.
Композиция для прироста массы тела может включать один или несколько физиологически приемлемых носителей, таких как гидрофильные растворители, гидрофобные растворители, например вода для инъекций (WFI), глицерин, и пропиленгликоль, буферы, такие как цитратный, ацетатный и фосфатный.
Неактивные ингредиенты могут иметь процент массы на конечный объем композиции для прироста массы тела от приблизительно 80% до приблизительно 0,001%, в зависимости от выбранного средства.
Неактивные ингредиенты могут иметь процент массы на конечный объем композиции для прироста массы тела от приблизительно 40% до приблизительно 0,01%, в зависимости от выбранного средства.
Неактивные ингредиенты могут иметь процент массы на конечный объем композиции для прироста массы тела от приблизительно 25% и приблизительно 0,01%, в зависимости от выбранного средства.
Композиция для прироста массы тела может включать следующую базовую лекарственную форму в растворе.
Таблица 1: Представительные интервалы для компонентов в композиции для прироста массы тела.
Кроме того, следующие комбинации веществ, растворов, композиций и/или соединений могут добавляться к базовой лекарственной форме, раскрытой выше, для образования одной или нескольких композиций для прироста массы тела для введения для лечения снижения массы тела, как показано в Таблицах 2, 3 и 4.
Таблица 2: Номера лекарственных форм 1-12 композиции для прироста массы тела.
Таблица 3: Несколько вариаций лекарственной формы Номер 9
*Каждое вещество приведено в виде процента массы тела на объем общей композиции. Сорбитол и мальтитол являются взаимозаменяемыми в лекарственных формах.
Таблица 4: Несколько вариаций лекарственных форм Номер 4 и Номер 6.
*Каждое вещество приведено в виде процента массы тела на объем общей композиции. Сорбитол и мальтитол являются взаимозаменяемыми в лекарственных формах.
Композиции могут применяться в сочетании с одной другой схемой лечения, которая может индуцировать снижение массы тела.
Например, композиции могут вводиться животным (например, домашним животным и/или сельскохозяйственным животным) в качестве части схемы химиотерапевтического или лучевого лечения. Специалист в этой области техники сможет понять, что схемы химиотерапевтического или лучевого лечения могут вызывать значительную утрату аппетита, снижение массы тела, слабость, атрофию мышечной ткани, кахексии (такие как сердечная кахексия), или другие негативные побочные эффекты, которые могут по меньшей мере частично улучшаться или подавляться дополнительным потреблением пищи и/или увеличением сухой мышечной массы. Соответственно, введение терапевтически эффективных количеств композиций, содержащих капроморелин, может индуцировать поглощение пищи, приводя посредством этого к приросту массы тела и увеличению сухой мышечной массы. В результате, животные могут иметь больше энергии для жизнедеятельности и преодоления схемы лечения.
Кроме того, композиции могут вводиться животным, страдающим от других состояний, при которых требуется неаппетитная пища. Например, некоторым животным с диагностированной хронической болезнью почек (ХБП) назначают специализированную диету для улучшения этого состояния. Однако, некоторые животные не находят специализированную пищевую диету аппетитной, и, в результате, не потребляют достаточной специализированной пищевой диеты для лечения хронической болезни почек или для жизнеобеспечения. Соответственно, некоторые животные могут получать терапевтически эффективные количества композиции для прироста массы тела, содержащей капроморелин, для стимуляции голода и индуцирования потребления специализированной пищевой диеты, особенно в течение периода, равного по меньшей мере 8 дням, например, по меньшей мере 30 дням, по меньшей мере 45 дням, или по меньшей мере 90 дням. В результате, хроническую болезнь почек можно лучше контролировать специализированной пищевой диетой, и животное может потреблять достаточно калорий для комфортного существования.
У кошек, страдающих от ХБП, снижение массы тела является обычным. Анорексия (полная потеря аппетита) может иметь место у кошек с ХБП, особенно, по мере прогрессирования заболевания, но наиболее частыми являются гипорексия (пониженный аппетит) или дизорексия (изменения в пищевых предпочтениях или в особенностях поглощения пищи). Любое изменение аппетита может способствовать снижению массы тела и атрофии мышечной ткани. У людей, снижение массы тела и атрофия мышечной ткани у пациентов с ХБП также отрицательно воздействует на силу и иммунную функцию, и может способствовать заболеваемости и смертности в этой популяции. Поскольку безболезненное умерщвление является опцией для владельцев кошек, пониженный или измененный аппетит может косвенно способствовать смертности, поскольку аппетит является для владельцев критерием оценки качества жизни их животного и, таким образом, является основным фактором при принятии решения о безболезненном умерщвлении. Напротив, увеличенный аппетит и поддерживаемая или увеличенная масса тела является положительным признаком для ветеринаров и владельцев. Возросший аппетит может стимулировать соблюдение ветеринарной диеты, разработанной для кошек с ХБП, что может снижать почечный вторичный гиперпаратиреоз, минимизировать обусловленные уремией эпизоды и относящуюся к ХБП смертность и увеличить выживаемость.
Несмотря на то, что снижение массы тела является общим клиническим признаком у кошек с ХБП, детали и схемы снижения массы тела редко исследуются. Одно ретроспективное исследование методом ʺслучай-контрольʺ кошек с ХБП в сравнении с совпадающей по возрасту контрольной группой (n=1230/группу) показало, что кошки с ХБП наиболее вероятно классифицируются как худые по сравнению с контролями. В том же исследовании, пониженный аппетит также значительно более часто наблюдали у кошек с ХБП как до, так и во время постановки диагноза ХБП по сравнению с контролями. В этой популяции кошек масса тела была значительно ниже у кошек с ХБП (средняя=4,0, интервал 1,6-11,7 кг) по сравнению с контролями (средняя=4,8, интервал 1,4-130,2 кг) во время постановки диагноза но, что более важно, кошки с ХБП также теряли значительно больше массы тела в течение 6-12 месяцев до диагностики. Кошки с ХБП теряли в среднем 10,8% массы тела, в то время как здоровые контроли имели среднее снижение массы тела, равное только 2,1% (p < 0,001). Среднее снижение массы тела у кошек с ХБП было приблизительно 5-кратным по отношению к контролям при расчете процентного снижения массы тела, позволяя предположить, что ʺболее высокая потеря массы тела в группе с болезнью была, вероятно, ассоциирована с развитием ХБП в большей степени, чем просто с эффектом старенияʺ.
В то время как эти данные подтверждают общее наблюдение, что кошки с ХБП являются худыми и уже потеряли массу тела при постановке диагноза ХБП, протекание со временем и прогрессирование снижения массы тела до и после постановки диагноза не подвергались тщательной оценке в каком-либо опубликованном исследовательском отчете. В недавнем времени, данные, полученные из медицинской документации для большой группы кошек с ХБП, указывают, что снижение массы тела начинается задолго до постановки диагноза ХБП и быстро прогрессирует после постановки диагноза. Кошки с ХБП, для которых была доступной стадия по классификации Международной группы по проблемам почек (IRIS) соответствовали условиям включения в анализ. Только те кошки, для которых были доступны данные по возрасту, дате диагностики ХБП и измерениям масса тела в течение 3 лет до и после постановки диагноза, были включены в анализ. Оценке были подвергнуты всего 569 кошек (55,5% самок с удаленными яичниками и 44,5% кастрированных самцов) со средним возрастом при постановке диагноза, равным 14,5 ± 2,8 лет. При постановке диагноза кошки были распределены по категориям Стадии 1 [n=34 (6%)], Стадии 2 [n=345 (61%)], Стадии 3 [n=141 (25%)], и Стадии 4 [n=49 (9%)] IRIS. Средняя масса тела при постановке диагноза составляла 40,2 кг (интервал, 1,6-9,9 кг).
Кошки теряли, в среднем, 8,9% массы тела в течение 12 месяцев перед постановкой диагноза, и снижение массы тела уже имело место в течение 3 лет перед постановкой диагноза ХБП и прогрессирующе возрастало с течением времени. Показатель снижения массы тела был даже выше у более старых кошек с ХБП. Кошки с этими данными анализа ниже средней массы тела (40,2 кг) при постановке диагноза имели значительно более короткое время выживания по сравнению с кошками с массой тела >40,2 кг при постановке диагноза (p < 0,0001). Также, как и при исследовании кошек с застойной сердечной недостаточностью, существовала U-образная ассоциация выживаемости с массой тела в этой популяции кошек с ХБП; то есть, выживаемость была самой короткой у кошек для категорий с самой низкой и самой высокой массой тела, с наиболее длинной выживаемостью для кошек с умеренной массой тела.
Таким образом, снижение массы тела может быть обнаружено по меньшей мере за три года до постановки диагноза ХБП у кошек и прогрессирующе возрастает с течением времени. Кошки с более низкой массой тела имели более короткое время выживаемости, означая, что тщательный мониторинг может обнаружить снижение массы тела и возможно ХБП на более ранней стадии. Это позволило бы проводить более ранее вмешательство для этих кошек, которые уже имеют снижение массы тела, стимулировать кошек к еде, чтобы увеличить массу тела до нормальных уровней и возможно оказать благоприятное воздействие на здоровье этих кошек.
Композиции могут применяться для лечения общего состояния снижения массы тела. Например, некоторые животные, по неизвестным причинам, испытывать снижение массы тела, которое, как прежде упоминалось, может приводить к слабости, кахексии (такой как сердечная кахексия), сонливости и другим неприятным результатам. После постановки диагноза снижения массы тела специалистом в этой области техники, таким как ветеринар, животные могут получать одну или несколько терапевтически эффективных доз композиции, содержащей капроморелин, для увеличения потребления пищи и сухой мышечной массы. В результате, домашние животные могут испытывать здоровый прирост массы тела, приводящий к улучшенному качеству жизни.
Композиция может применяться для увеличения сухой мышечной массы. Например, может быть желательным увеличить сухую мышечную массу у некоторых животных (например, сельскохозяйственных животных, таких как коровы или свиньи). Соответственно, композиция может вводиться в терапевтически эффективном количестве в одной или нескольких дозах для увеличения сухой мышечной массы без необходимости лечить снижение массы тела.
Схема лечения утраты аппетита с использованием регулирующей композиции может по меньшей мере частично регулироваться во время курса лечения. Например, после постановки такого диагноза, как перенесение снижения массы тела (например, независимо от причины), количество композиции, предполагаемое как терапевтически эффективное, может вводиться животному (например, перорально, внутривенно и т.д.). После предварительно заданного периода времени, (например, приблизительно через восемь часов после первого введения композиции и приблизительно через семь дней позже), лаборант, ветеринар, или любой другой подходящий индивидуум может забрать образец (например, образец сыворотки) у животного для измерения количества одного или нескольких маркеров в образце.
Образцы могут быть забраны при любых других подходящих временных отметках, известных специалистам в этой области техники, которые соответствовали бы измерению одного или нескольких маркеров эффекта лекарственного средства. Например, маркеры могут включать по меньшей мере один из IGF-1, GH, капроморелина и/или кортизола. В результате получения информации о количествах одного или нескольких этих маркеров, доза композиции может регулироваться с учетом количеств маркеров в образце. Соответственно, эффективность композиции может быть определена и регулироваться во время прохождения лечения. Например, если количество IGF-1 в образце не является достаточно высоким, доза композиции может быть увеличена посредством увеличения концентрации капроморелина или количества капроморелина, вводимого домашнему животному. Напротив, если количество кортизола в образце является слишком высоким, что может приводить к увеличенному отложению в жировой ткани, дозовый интервал композиции может быть уменьшен либо посредством уменьшения концентрации капроморелина или количества капроморелина, вводимого домашнему животному.
Приведенная выше схема лечения может осуществляться без забора образца крови. Например, после введения одной или нескольких терапевтически эффективных доз животному (например, через приблизительно семь дней получения лечения), другие маркеры снижения массы тела могут быть измерены для оценки эффективности схемы лечения. Эти маркеры могут включать изменение массы тела (например, продолжающееся снижение массы тела, прирост массы тела, стабилизацию снижения массы тела), изменение поглощения пищи (например, увеличение поглощение пищи относительно периода времени до лечения), и/или измерение изменения сухой мышечной массы (например, балльная оценка показателя сухой мышечный массы животного для оценки роста сухой мускулатуры). В результате, животное не проходит через инвазивный забор образца крови, и индивидуумы, проводящие мониторинг схемы лечения, могут, соответственно, подбирать дозу для схемы лечения.
Несмотря на то, что изобретение, описанное в настоящем описании, подвержено различным модификациям и альтернативным итерациям, его конкретные варианты осуществления были очень подробно описаны выше. Следует понимать, однако, что подробное описание рассматриваемой композиции не предназначено для ограничения изобретения конкретными раскрытыми вариантами осуществления. Скорее, следует понимать, что изобретение предназначено для охвата всех модификаций, эквивалентов и альтернатив, попадающих в пределы объема притязаний и соответствующих идее изобретения, как определено редакцией формулы изобретения.
ОПРЕДЕЛЕНИЯ
Как используют в настоящем описании, термины ʺприблизительноʺ и ʺпримерноʺ означают то, что значение находится в пределах статистически значимого интервала. Такой интервал может типично находиться в пределах 20%, еще более типично в пределах 10% и даже более типично в пределах 5% от данного значения или интервала. Допустимая вариация, охватываемая терминами ʺприблизительноʺ и ʺпримерноʺ, зависит от конкретной исследуемой системы и может быть легко оценена рядовым специалистом в этой области.
Как используют в настоящем описании, термин ʺживотноеʺ обозначает животных, не являющихся людьми, таких как ʺсельскохозяйственные животныеʺ и ʺдомашние животныеʺ.
Как используют в настоящем описании, термин ʺсельскохозяйственные животныеʺ включает крупный рогатый скот, овец, свиней, домашних птиц (например, кур, индеек, перепелок и т.д.), коз, лам и других подобных животных.
Как используют в настоящем описании, термин ʺчʺ обозначает часы.
Как используют в настоящем описании, термин ʺкомпозицияʺ применяется к любому твердому объекту, полутвердой или жидкой композиции, разработанной для содержания конкретного предварительно заданного количества (дозы) некоторого ингредиента, например, активного фармацевтического ингредиента, как было указано ранее и как обсуждается ниже. Подходящие композиции могут представлять собой системы доставки фармацевтического лекарственного средства, включая системы для перорального введения, буккального введения, ректального введения, местного или чресслизистого введения, или подкожные имплантаты или другие имплантируемые системы доставки лекарственных средств; или композиции для доставки минералов, витаминов и других питательных компонентов, средств для ухода за полостью рта, ароматизаторов, средств, корригирующих вкус и запах лекарственного средства и т.п. Композиции, как правило, могут быть жидкими, однако они могут содержать твердые или полутвердые компоненты. Как правило, дозированная форма является перорально вводимой системой для доставки фармацевтически активного ингредиента в пищеварительный тракт домашнего животного.
Как используют в настоящем описании, термин ʺмг/кгʺ обозначает миллиграммы композиции на килограмм массы тела.
Как используют в настоящем описании, термин ʺлечениеʺ или ʺпрохождение леченияʺ состояния, такого как хроническая утрата аппетита или снижение массы тела, включает ингибирование существующего состояния или остановку его развитие; или ослабление или вызывание регрессии состояния. Термин ʺпредупреждениеʺ или ʺпредотвращениеʺ состояния, такого как хроническая утрата аппетита, снижение массы тела или кахексия, включает по существу блокировку или ингибирование развития или роста состояния до его начала.
Как используют в настоящем описании, термин ʺживотноеʺ относится к млекопитающим, в особенности, домашним животным, включающим, но не ограниченным перечисленными, собак, кошек, кроликов, хорьков, лошадей и хомяков.
Домашнее животное может быть собакой. Домашнее животное может быть кошкой. Домашнее животное может быть лошадью.
Как используют в настоящем описании, фраза "терапевтически эффективное количество" относится к количеству, эффективному, при дозировках и в течение периодов времени, необходимых, чтобы достичь желательного терапевтического результата. Терапевтически эффективное количество капроморелина может быть определено специалистом в этой области техники (например, ветеринаром) и может варьировать в соответствии с факторами, такими как клиническое состояние, возраст, пол и масса тела домашнего животного, биодоступностью капроморелина и способностью активного средства (средств) вызывать желательный ответ у домашнего животного. Терапевтически эффективное количество является также количеством, при котором какие-либо токсичные или вредные воздействия активного средства (средств), перевешиваются терапевтически благоприятными эффектами. Терапевтически эффективное количество также охватывает количество, которое является эффективным, при дозировках и в течение периодов времени, необходимых, чтобы достичь желательного результата (например, прироста массы тела посредством добавления сухой мышечной массы).
Как используют в настоящем описании, термин ʺq.s.ʺ означает добавление количества (например, объема или массы) ингредиента до достижения конечного количества (например, объема или массы).
Как используют в настоящем описании, термин ʺм/обʺ обозначает концентрацию вещества, измеренную как массу вещества на объем раствора или композиции.
Следующие примеры предназначены для дополнительного иллюстрирования и объяснения настоящего раскрытия. Раскрытие, следовательно, не должно ограничиваться какими-либо подробностями в этих примерах.
ПРИМЕРЫ
ПРИМЕР 1 - Безопасность капроморелина, вводимого ежедневно собакам породы бигль в течение одного года
В этом исследовании оценивали безопасность капроморелина у собак. Тридцать две собаки породы бигль были рандомизированно разделены на четыре группы (n=4/пол/группа) и получали 0 мг/кг, 0,39 мг/кг, 90,2 мг/кг или 52,4 мг/кг капроморелина (при дозе, рассчитанной по тартратной соли) один раз ежедневно посредством перорального зонда в течение 12 последовательных месяцев. Оценивали параметры безопасности, включающие клинические признаки, потребление пищи, массу тела, клиническую патологию, общий анализ мочи, офтальмологию, электрокардиограмму и показатели жизнедеятельности. Капроморелин, GH и IGF-1 измеряли в образцах плазмы, собранных при различных временных отметках во время исследования. В конце периода дозирования, собак подвергали безболезненному умерщвлению и проводили их вскрытие. Выбранные органы взвешивали, и образцы ткани собирали и обрабатывали для микроскопического исследования.
Капроморелин при ежедневных дозах вплоть до 52,4 мг/кг (приблизительно 17,5-кратная концентрация активного ингредиента от предложенной клинической дозы для собак) в течение 12 месяцев приводил к минимальной токсичности без каких-либо негативных воздействий на потребление пищи, массу телу, результаты исследования глаз, показатели жизнедеятельности или макропатологию. Клинические признаки, относящиеся к капроморелину, были ограничены слюноотделением и жидким стулом, отмечаемым эпизодически во время исследования. Случайные эпизоды рвоты наблюдались и считались не относящимися к лечению. Лечение более высокими дозами ассоциировали с увеличенной частотой покраснения/набухания лап. Одна собака из группы с 52,4 мг/кг погибла, когда капроморелин случайно попал в дыхательные пути во время введения зонда, что было подтверждено результатами вскрытия.
Данные электрокардиограмм указывали на небольшие увеличения в интервале коэффициента изменения давления (PRQ) в группах с 52,4 мг/кг и 90,2 мг/кг через 1-2 часа после дозирования. Однако в сердце не наблюдали никаких гистологических повреждений. В целом, параметры клинической патологии и общего анализа мочи находились в пределах интервалов для нормы или не имели взаимосвязи доза/время. Однако, небольшие снижения эритроцитов, гемоглобина и гематокрита по-видимому не являлись клинически значимыми в группе с 52,4 мг/кг.
Сывороточные уровни холестерина, липопротеинов высокой плотности (HDL) и щелочной фосфатазы статистически значимо увеличивались в группе с 52,4 мг/кг по сравнению с плацебо и индивидуальными значениями у животных, имеющими тенденцию приближения к верхнему уровню или немного выше эталонного интервала для нормы. Были отмечены увеличенные абсолютные массы печени у собак, подвергаемых лечению дозой капроморелина, равной 52,4 мг/кг. Незначительное увеличение гепатоклеточной цитоплазматической вакуолизации наблюдали во всех группах лечения капроморелином. Плазменные уровни капроморелина возрастающие при увеличении дозы, были аналогичными в Дни 90, 181 и 349, указывая на отсутствие накопления лекарственного средства, и отсутствовали различия, относящиеся к полу. Плазменные уровни GH возрастали незначительно, как ожидалось, в Дни 1, 170 и 351 после лечения капроморелином. Ответная реакция GH регулировалась физиологической отрицательной обратной связью, таким образом, величина ответной реакции GH на лечение капроморелином снижалась с течением времени. Плазменные уровни IGF-1 возрастали после лечения капроморелином, и увеличенные уровни поддерживались с течением времени, что подтверждалось анализом плазмы, собранной в Дни -1, 1, 7, 14, 21, 28, 62, 121, 170 и 351.
Результаты этого исследования продемонстрировали, что капроморелин хорошо переносился собаками, получавшими дозу до 52,4 мг/кг в течение 12 месяцев. Дополнительно, это исследование указывает на ожидаемые широкие пределы безопасности для капроморелина, так как высокая доза равна приблизительно 17,5-кратной предполагаемой клинической дозе.
ПРИМЕР 2 - Эффективность действия капроморелина у кошек в течение 21 дня
Тридцать две кошки (16 кастрированных самцов, 16 самок) были разделены на 4 лечебные группы, включающие 4 животных каждого пола на группу. Кошки проходили акклиматизацию к окружающим условиям исследования в течение 10 дней до начала исследования. Все кошки получали пероральную дозу плацебо (Группа 1) или капроморелина (30 мг/мл перорального раствора, Лекарственная форма 9, описанная выше) при 1 мг/кг (Группа 2), 2 мг/кг (Группа 3) или 3 мг/кг (Группа 4), в течение 21 дня, с началом дозирования в День 1. Физический осмотр проводили в День -10 и наблюдение общего состояния здоровья проходили ежедневно. Массу тела оценивали в дни -10, -8, -1, 1, 8, 15 и 22. Кошек кормили приблизительно через 1 час после приема дозы. Доступный для приобретения сухой корм для кошек (300 г) обеспечивали в течение 5 часов и затем удаляли, и рассчитывали количество потребляемой пищи (г) на кошку. В Дни 1, 14 и 21, образцы крови забирали для введения ежедневной дозы и через 8 часов после приема дозы, и сыворотку обрабатывали для измерения уровней IGF-1.
В День 12, двух исследуемых животных (по одному самцу из каждой Группы 1 и Группы 4) удалили по причинам, не относящимся к исследованию, и их не включали в анализ данных. Кошка 4M4 в группе с 3 мг/кг потеряла значительную массу в течение первых 8 дней лечения, но затем у нее проявился обратный эффект и она начала обратно прибавлять массу. Статистический анализ прироста массы тела проводили с включением и без включения данных для этой кошки (4M4).
Во всех лечебных группах наблюдали увеличение среднего потребления пищи от исходного периода (среднее значение для Дней -3, -2 и -1) по сравнению с периодом исследования (среднее значение для Дня 1 - Дня 21). При ссылке на ФИГ. 1, кошки, принимавшие плацебо (Группа 1), имели увеличение среднего поглощения пищи, равное 10,83%, по отношению к исходному уровню, в то время как три группы с капроморелином (Группы 2, 3 и 4) имели средние значения увеличения поглощение пищи по отношению к исходному уровню, равные 25,32%, 45,67% и 29,59%, соответственно, причем только Группа 3 показала статистически значимое (p < 0,01) увеличение потребления пищи в сравнении с группой плацебо.
При анализе средних значений потребления пищи, было установлено, что суммарный эффект лечения для интервалов от Дня 1 вплоть до Дня 21 (p=0,0066), Дня 1 вплоть до Дня 7 (p=0,0004) и Дня 8 вплоть до Дня 14 (p=0,0164) являлся статистически значимым. Для интервала от Дня 1 вплоть до Дня 7 было установлено, что попарные сравнения статистически значимо отличались для каждой активной группы в сравнении с группой плацебо (группа с 1 мг/кг (p=0,0418); группа с 2 мг/кг (p=0,0002); и группа с 3 мг/кг (p=0,0022)). Для интервала от Дня 1 вплоть до Дня 21, было установлено, что только группа с 2 мг/кг (среднее=45,67%, p=0,0019) статистически значимо отличалась от плацебо (среднее=10,83%). Было установлено, что группа с 2 мг/кг (среднее=54,42%, p=0,0052) также статистически значимо отличалась от плацебо для интервала от Дня 8 вплоть до Дня 14.
Со ссылкой на ФИГ. 2 и 3, средняя масса тела для лечебных групп с капроморелином увеличивались во время 21-дневного периода воздействия. Группы 2, 3 и 4 имели увеличения, равные 5,41%, 6,61% и 3,92%, соответственно, в то время как группа с плацебо потеряла небольшое количество массы (минус 1,11%). Статистически значимые различия с плацебо (p < 0,05) для среднего изменения процента массы тела наблюдали для Группы 3 во всех трех временных точках, при измерении с увеличением, равным 30,23%, 5,97% и 6,61% в дни 8, 15 и 22, соответственно. Удивительно, что Группа 2 имела средние проценты изменений массы тела, которые статистически значимо увеличивались (p < 0,05) в сравнении с плацебо в День 15 (40,24%) и День 22 (5,41%), но не в День 8.
Взаимосвязь лечения и пола не являлась статистически значимой (p>0,05) либо для потребления пищи или прироста массы тела, указывая на то, что эффект лечения был аналогичным у самцов и самок кошек.
Со ссылкой на ФИГ. 4-7, в Группе 1 уровни IGF-1 оставались на исходных уровнях на протяжении всего исследования. В День 1, групповые средние сывороточные уровни IGF-1 увеличивались за период 0 до 8 часов после приема дозы на 46,69%, 29,38% и 36,77% для Групп 2, 3 и 4, соответственно. В День 14, уровни IGF-1 поддерживались на более высоком уровне при часе 0. Следовательно, групповое среднее увеличение сывороточных уровней IGF-1 снижалось в период от 0 до 8 часов после приема дозы (170,27%, 9,00% и 18,56% для Групп 2, 3 и 4, соответственно). В День 21, тенденция к более низкому ответу IGF-1 продолжалась, по мере того как групповые средние уровни IGF-1 возрастали в период от 0 до 8 часов после приема дозы на 9,81%, 2,68% и 5,17% для Групп 2, 3 и 4, соответственно. Более низкие увеличения уровней IGF-1 после лечения капроморелином в День 14 и День 21 были обусловлены тем фактом, что ко Дню 14 имелось устойчивое повышение IGF-1, являющееся результатом повторного ежедневного лечения капроморелином.
В итоге, капроморелин увеличивал поглощение пищи, инициировал прирост массы тела и вызывал устойчивое увеличение уровней IGF-1 у лабораторных кошек.
ПРИМЕР 3 - Безопасность ежедневного приема капроморелина у кошек в течение 91 дня при пероральной дозе в 6 мг/кг
Это контролируемое исследование включало две лечебные группы с 4 взрослыми кошками, принимающими плацебо (Группа 1) и 8 взрослыми кошками, принимающими капроморелин (Лекарственная форма #9, описанная выше) (Группа 2) в течение 91 последовательных дней. Всем кошкам предлагали пищу ежедневно в течение 6-часового периода после Дня 11 фазы акклиматизации. Всех кошек взвешивали в дни -11, -1, 1, 14, 30, 59, 75 и 91. В дни 1-91, животным перорально вводили капроморелин один раз ежедневно посредством шприца при уровнях дозы, равных 0 или 6 мг/кг. Через один час после приема дозы, всем кошкам предлагали пищу в течение 6-часового периода. Представляющие интерес переменные включали прирост/снижение массы тела, потребление пищи, клиническую патологию и анализ сыворотки на предмет IGF-1 и GH.
В дни 1, 30, 59 и 91, образцы крови забирали перед ежедневным введением дозы и через 8 часов после приема дозы и обрабатывали для получения сыворотки для анализа уровней IGF-1 и GH. Гематологические параметры включали количество лейкоцитов (WBC), гемоглобин (HgB), количество эритроцитов (RBC), количество тромбоцитов (PLT), морфологию тромбоцитов, гематокрит (HCT), среднюю величину объема эритроцитов (MCV), средний корпускулярный гемоглобин (MCH), дифференциал WBC, морфологию RBC и WBC, концентрацию среднего корпускулярного гемоглобина (MCHC), ретикулоциты и мазок крови. Измеряемые химические параметры сыворотки включали альбумин (ALB), креатинкиназу (CK), отношение альбумин/глобулин (A\G), глобулин (GLOB), щелочную фосфатазу (ALP), глюкозу (GLU), фруктозамин, аланинаминотрансферазу (ALT), остаточный азот мочевины в крови (BUN), фосфор (PHOS), кальций (Ca), калий (K), хлорид (Cl), натрий (Na), холестерин (CHOL), общий белок (TP), креатинин (CRE), общий билирубин (TBIL), отношение BUN/креатинин и отношение натрий/калий.
Образцы мочи собирали посредством цистоцентеза и/или сбором в лотки/поддоны от всех кошек на общий анализ мочи. Перед сбором крови, все животные были лишены пищи по меньшей мере 8 часов. Измеряемые параметры общего анализа мочи включали удельный вес (SG), pH (PH), цвет (COL), прозрачность (CLAR), кровь (BLO), белок (UPRO), билирубин (UBIL), глюкозу (UGLU), кетоны (KET) и микроскопическое исследование осаждений на RBC/hpf, WBC/hpf, бактерии (BACT), эпителиальные клетки, слизь, цилиндры и кристаллы.
Во время исследования, наиболее частыми клиническими наблюдениями были гиперсаливация (птализм), причмокивание губами, тошнота и тряска головы. Эти данные были видны немедленно после приема дозы и они обычно проявлялись в пределах пяти минут. Никаких других наблюдений аномального общего состояния здоровья или клинических наблюдений не наблюдали.
В целом, у всех животных поддерживалась или увеличивалась масса тела в течение периода воздействия (расчет массы тела от Дня 1 до Дня 91). Средние значения массы тела для животных-самцов в Группе 2 (капроморелина) умеренно увеличивались, в то время как у животных самцов в Группе 1 (плацебо) значения оставались относительно неизменными. Средние значения массы тела для животных-самок в Группе 2 немного увеличивались по сравнению с животными-самками в Группе 1.
Кошки, получавшие капроморелин, явным образом прибавляли массу тела (ФИГ. 8). Контрольные кошки, получавшие плацебо, поддерживали постоянную массу тела во время исследования. Было установлено, что эффект лечения с позиций взаимосвязи лечения и дня исследования был статистически значимым (p < 0,0001). Изменения от исходного уровня (День 1) были статистически значимыми между лечебными группами в День 14 (p=0,0026), День 30 (p=0,0005), День 59 (p < 0,0001), День 75 (p < 0,0001) и День 91 (p < 0,0001). Средние изменения для капроморелина составляли 00,26, 0,46, 0,64, 0,73 и 0,80 кг в Дни 14, 30, 59, 75 и 91, соответственно. Для плацебо средние изменения были равны 0,00, 0,11, 0,00, 0,00 и 0,16 кг в Дни 14, 30, 59, 75 и 91, соответственно. Для анализа показателя изменения массы тела, эффект лечения был статистически достоверным (p=0,0011). Средний показатель изменения был равен 0,0086 для капроморелина и был равен 0,0010 для группы плацебо (фактор 8,6).
Кошки, получавшие капроморелин, увеличили потребление пищи по сравнению с кошками, получавшие плацебо (ФИГ. 9, P-значение=0,0909). Это потребление пищи не проявляло тенденции к высокой статистической достоверности. Несомненно, лечение капроморелином при дозе, равной 6 мг/кг не оказывало отрицательного воздействия на потребление пищи у кошек. Во время исследования (Дни от -11 до 90), потребление пищи рассчитывали ежедневно для всех животных. Во время периода акклиматизации исходный уровень значений потребления пищи рассчитывали, используя среднее значение от Дней -3 - -1 для всех животных. Для потребления пищи, p-значение эффекта лечения было равно 0,0909. (День 83 и День 84 не были включены в анализ, поскольку кормление не соответствовало другим дням.) Среднее изменение от исходного уровня составляло 14,95 граммов для капроморелина и 11,84 граммов для плацебо. Для анализа показателя изменения, p-значение эффекта лечения было равно 0,0565. Средний показатель изменения был равен 10,2396 для капроморелина и был равен 0,9590 для группы плацебо. Показатель, равный единице, указывает на то, что в каждый День потреблялся еще один грамм пищи. Поскольку показатель, наблюдаемый у кошек, получавших капроморелин, превышает единицу, в каждый День потреблялось немного более одного грамма пищи.
Данные показывают, что у кошек, получавших капроморелин, GH увеличивался после лечения по сравнению с контролями с плацебо (ФИГ. 10). Увеличение GH было очень выраженным в первый День приема капроморелина. Увеличение GH снижалось по мере прогрессирования ежедневного приема капроморелина на протяжении Дней 30, 59 и 91, указывая на отрицательную обратную связь с гормональным механизмом, вызывающим секрецию GH.
Данные показывают, что у кошек, получавших капроморелин, IGF-1 увеличивался после лечения по сравнению с контролями с плацебо (ФИГ. 11). Увеличение IGF-1 становилось продолжительным по мере того, как продолжался ежедневный прием капроморелина. Продолжительное увеличение IGF-1 достигало пика в День 30 и затем уменьшалось с течением времени.
Уровни BUN (мг/дл) имели тенденцию к небольшому увеличению у большинства кошек от периода акклиматизации до Дня 91 (ФИГ. 12). Уровни BUN были аналогичными для контрольных кошек и кошек, получавших капроморелин. Все наблюдаемые значения находились в пределах эталонного интервала для нормы. Уровни креатинина (мг/дл) имели тенденцию к выравниванию у большинства кошек от периода акклиматизации до Дня 91 (ФИГ. 13). Уровни креатинина были аналогичными для контрольных кошек и кошек, получавших капроморелин. Все наблюдаемые значения находились в пределах эталонного интервала для нормы. Поскольку BUN и креатинин являются параметрами для мониторинга потенциальной хронической болезни почек, тенденции, отмеченные в этом исследовании, являются обнадеживающими, так как они не указывают на то, что кошки, получавшие капроморелин, отличаются от кошек, получавших плацебо.
В целом, статистически значимые различия параметров безопасности клинической патологии не являлись клинически существенными. Сывороточные уровни глюкозы увеличивались в группе капроморелина в сравнении с группой плацебо, и с течением времени наблюдали тенденцию к их увеличению (ФИГ. 14). Никакие значения для глюкозы не превышали эталонный интервал для нормы. Фруктозамин является параметром, используемым при мониторинге хронической гипергликемии. Относящиеся к капроморелину тенденции изменения уровня фруктозамина не наблюдали (ФИГ. 15). Никакие значения фруктозамина не превышали эталонный интервал для нормы. Уровни глюкозы в моче были отрицательными, за исключением следовых количеств у одной кошки, получавшей капроморелин, и одной кошки, получавшей плацебо. Очевидно, что у кошек, получавших капроморелин, хроническая гипергликемия отсутствовала.
В итоге, масса тела значительно увеличивалась в группе капроморелина по сравнению с плацебо. Потребление пищи достигло статистической значимости, причем группа капроморелина потребляла больше пищи, чем группа плацебо. Лечение капроморелином вызывало увеличение GH, которое затем приводило к продолжительному увеличению сывороточных уровней IGF-1. Для некоторых химических параметров сыворотки и гематологических параметров, статистически значимые изменения отмечали по отношению к исходному уровню до Дня 30/59/91, и были установлены суммарные эффекты лечения. Глюкоза увеличивалась с течением времени в группе капроморелина, но никакие значения не превышали эталонный интервал. Сопровождающее увеличение фруктозамина не наблюдали. Статистически значимые различия по параметрам клинической патологии не являлись клинически существенными.
ПРИМЕР 4-90-дневное клиническое исследование безопасности и эффективности капроморелина у кошек
В этом двойном маскированном, рандомизированном, с плацебо-контролем, многоцентровом, подтверждающим концепцию полевом исследовании проводили проверку гипотезы о том, что капроморелин будет поддерживать или увеличивать массу тела, улучшать балльную оценку физического состояния, улучшать балльную оценку состояния мускулатуры, улучшать аппетит и/или улучшать качество жизни у кошек. Во многих исследовательских центрах следовали единому протоколу исследования. Кошки, допущенные для включения в исследование, принимали дозировку лекарственной формы либо капроморелина или плацебо, равную 2 мг/кг массы тела, один раз ежедневно в течение 90 ± 3 дней.
Кошки, имеющие хозяев, любого возраста, любых массы тела, породы или пола, с удаленными яичниками/кастрированные, с документированным снижением массы тела в течение предшествующих 6 месяцев могли быть включены в исследование. Мероприятия во время скрининга включали физический осмотр, измерения ректальной температуры, оценку сердечно-сосудистой системы, частоты сердечных сокращений, дыхательной системы, интенсивности дыхания, желудочно-кишечного тракта, массы тела, периферических лимфатических узлов, осанки, времени повторного заполнения слизистых мембран/капилляров скелетно-мышечной системы, мочеполовой системы, глаз, состояния гидратации, ушей, внешний вид шерстяного покрова, полости рта, кожи и неврологической системы. Переменные эффективности включают массу тела, состояние организма, состояние мускулатуры, оценки аппетита владельцем и качества жизни.
Балльная оценка физического состояния (BCS) и балльная оценка состояния мускулатуры (MCS) определяется ветеринаром в День 0, День 14 ± 1, День 30 ± 2, День 60 ± 3 и День 90 ± 3 или при последнем посещении исследования (т.е. раннем выходе). Химические параметры сыворотки, измеряемые в образцах крови, взятых в День 0, День 30 ± 2, День 60 ± 3 и День 90 ± 3 или при последнем посещении исследования, включают: альбумин, креатинкиназу (CPK), отношение альбумин/глобулин, глобулин, щелочную фосфатазу, глюкозу, аланинаминотрансферазу, остаточный азот мочевины в крови (BUN), фосфор, кальций, калий, хлорид, натрий, холестерин, общий белок, креатинин, общий билирубин, отношение BUN/креатинин и отношение натрий/калий. Гематологические параметры, измеряемые в День 0, День 30 ± 2, День 60 ± 3 и День 90 ± 3 или при последнем посещении исследования, включают: количество лейкоцитов (WBC), гемоглобин (HGB), количество эритроцитов (RBC), фруктозамин, количество тромбоцитов, морфологию тромбоцитов, гематокрит (HCT), среднюю величину объема эритроцитов (MCV), средний корпускулярный гемоглобин (MCH), дифференциал WBC, морфологию RBC и WBC и среднюю концентрацию корпускулярного гемоглобина (MCHC). Образцы мочи собирают в День 0 и День 90 ± 3 или при последнем посещении исследования перед измерением массы тела, и тестируют на удельный вес, pH, цвет, прозрачность, кровь, белок, билирубин, глюкозу, кетоны, и микроскопическое исследование осаждений на RBC/hpf, WBC/hpf, бактерии, эпителиальные клетки, слизь, цилиндры и кристаллы.
Каждая кошка оценивается владельцем на предмет качества жизни и аппетита в День 0, День 30 ± 2, День 60 ± 3 и День 90 ± 3 или при последнем посещении исследования (т.е. раннем выходе). Для каждого конечного момента непрерывной оценки эффективности рассчитывают изменения от Дня 0 до Дня 14, Дня 30, Дня 60 и Дня 90. Для массы тела, определяют различные критерии успеха (такие как поддержание массы тела, 2% увеличение или более, 3% увеличение или более и т.д.). Безопасность оценивают на основании оценки неблагоприятных явлений, физического осмотра, сывороточных уровней IGF-1, и химических параметров сыворотки, гематологии и параметров общего анализа мочи.
Оценку анализа безопасности проводили на популяции, которая включает всех кошек, которые были рандомизированы и получали по меньшей мере одну дозу исследуемого лекарственного средства (популяции безопасности). Анализ переменных эффективности будет проводиться на основании протокола популяции (PP). Популяция PP будет представлять собой подтип популяции безопасности, и будет включать в себя всех кошек, которые завершили дозированием и имеют соответствующие записи результатов исследования. Неблагоприятное явление определяют как любое наблюдение у кошек, которое является неблагоприятным и непреднамеренным и происходит после применения капроморелина или плацебо, независимо от того считается ли оно относящимся к продукту. В День 30 ± 2, День 60 ± 3 и День 90 ± 3 или при последнем посещении исследования (т.е. раннем выходе), если лабораторный результат находится вне эталонного интервала и считается клинически значимым (неблагоприятным и непреднамеренным), эти результаты будут изложены как неблагоприятное явление.
ПРИМЕР 5 - Двухнедельное исследование токсичности при пероральном приеме у кошек
В этом исследовании определяли безопасность капроморелина при пероральном введении кошкам. Группам из 3 самцов и 3 самок (n=6/группу) кошек смешанной породы давали капроморелин в виде пероральных капсул один раз ежедневно при дозах, равных 9, 15, 30 и 60 мг/кг в течение 14 последовательных дней. Аналогичной группе давали микрокристаллическую целлюлозу в качестве контроля плацебо. У всех животных ежедневно наблюдали клинические признаки и проводили оценку потребления пищи с регистрацией массы тела за 7 дней до дозирования и повторно при безболезненном умерщвлении. Другие измерения включали периодические оценки клинической патологии, оценки гематологии, химических параметров сыворотки и общего анализа мочи. После периода дозирования кошек безболезненно умерщвляли и вскрывали.
Пероральное введение капроморелина у кошек хорошо переносилось. Клинические признаки, относящиеся к капроморелину, ограничивались кошками в лечебных группах с 30 и 60 мг/кг и состояли из рвоты, спорадического слюноотделения и летаргии/депрессии. Изменения клинической патологии наблюдали только эпизодически в группах дозирования от 15 до 60 мг/кг и ограничивались увеличениями глюкозы в сыворотке и моче. Эти изменения были отнесены к фармакологическим действиям стимулятора секреции GH, и/или стрессовой реакции, ассоциированной с забором крови, но не к прямому токсикологическому эффекту капроморелина. Лечение AT-002 не было ассоциировано с какими-либо аномальными результатами при вскрытии, как на макро-, так и микроскопическом уровне. Средние абсолютные и относительные значения массы печени увеличивались у самок из лечебных групп с 30 и 60 мг/кг, и средние значения массы печени увеличивались у самцов при всех дозировках. Вследствие отсутствия соответствующих аномальных микроскопических данных, эти изменения массы печени не считались токсичными.
На основании наблюдаемых клинических признаков, для этого исследования был определен уровень, при котором не наблюдают неблагоприятных явлений (NOAEL), равный 15 мг/кг/день. Относящиеся к лечению неблагоприятные явления были ограничены депрессией и желудочно-кишечной системой и наблюдались только в группах дозирования с 30 мг/кг и 60 мг/кг. Так как уровень дозы, равный 30 мг/кг, в 15 раз превышает уровень предполагаемой клинически эффективной дозы для капроморелина, ожидают, что введение капроморелина будет хорошо переноситься у кошек.
ПРИМЕР 6 - Лабораторное исследование с титрованием дозы
В этом исследовании определяли режим дозирования перорального раствора капроморелина, который обеспечивает увеличенное поглощение пищи и прирост массы тела и сопутствующий желательный профиль сывороточных уровней IGF-1. Лабораторные взрослые кошки содержались индивидуально и были разделены на пять групп (3/пол/группа; n=6/группа). Кошек дозировали один раз ежедневно в течение 10 последовательных дней либо плацебо, 1 мг/кг AT-002, 2 мг/кг AT-002, 3 мг/кг AT-002 или 4 мг/кг AT-002. Тестируемое изделие представляло собой ароматизированный раствор лекарственной формы очень похожий на конечную лекарственную форму. Направления исследования обобщены в Таблице 5.
Таблица 5: Направления исследования.
Процент изменения потребления пищи от исходного уровня (среднее значение для Дня -3, Дня -2, и Дня -1) по сравнению с периодом лечения (среднее значение от Дня 1 вплоть до Дня 10) был рассчитан для каждой кошки, и обобщен в Таблице 6. Средний процент изменения от исходного уровня до периода лечения для группы плацебо увеличился на 13,0%. Группа с 4 мг/кг проявляла средний процент увеличения потребления пищи от периода исходного уровня до периода лечения, который был статистически значимым в сравнении с группой плацебо.
Таблица 6: Потребление пищи
Изменение массы тела в процентах от Дня -1 в сравнении с Днем 10 рассчитывали для каждой кошки, и обобщали в Таблице 7. Среднее процентное изменение для группы плацебо было равно -0,35%, указывая на снижение массы. Группа с 2 мг/кг AT-002 и группа с 3 мг/кг AT-002 проявляли статистически значимый средний процент увеличения масса тела в сравнении с группой плацебо. Группа с 4 мг/кг AT-002 приближалась к статистической достоверности (p=0,0502)
Таблица 7: Масса тела
Капроморелин хорошо всасывался у кошек. Максимальные сывороточные концентрации, как правило, наблюдали в пределах 30 мин после приема дозы. Как ожидалось, лечение капроморелином при 4 мг/кг имело профиль сыворотки с наивысшими уровнями. В целом, концентрация капроморелина во всех группах, принимавших AT-002, падала до очень низких уровней через 8 часов после приема дозы. Кроме того, измеряемые концентрации капроморелина не обнаруживались или были очень низкими в образцах часа 0 в День 10 у кошек, получавших AT-002. Признаков накопления капроморелина в сыворотке не наблюдали (ФИГ. 16 и 17).
Изменения сывороточных уровней IGF-1, отнесенные к тестируемому изделию, наблюдали у самцов и самок после дозирования в дни 1 и 10. Сывороточный профиль IGF-1 в группе плацебо оставался устойчивым на исходном уровне в дни 1 и 10. Первоначальная ответная реакция IGF-1 (увеличение) имела место через приблизительно 4 часа после приема AT-002 и достигала своего максимального относительно устойчивого уровня через 8 часов после приема дозы в дни 1 и 10. Уровни IGF-1 были повышенными по сравнению с контролями, продолжительным образом, в течение предшествующего 24-часового периода в День 10. Величина продолжительного повышения IGF-1 была наибольшей после дозирования 3 мг/кг в сравнении с другими дозовыми группами (ФИГ. 18 и 19).
Лечение AT-002 в течение 10 дней увеличивало среднее потребление пищи и массу тела в сравнении с группой плацебо. Группа с 2 мг/кг АТ-002 и группа с 3 мг/кг AT-002 проявляли наилучшее увеличение прироста массы тела. Капроморелин хорошо всасывался из ароматизированного раствора лекарственной формы, что приводило в результате к уровням лекарственного средства в сыворотке, достаточного для стимуляции явного увеличения сывороточного GH, что доказывает желательные продолжительные сывороточные уровни IGF-1. Уровни IGF-1 проявляли продолжительное увеличение в течение 24-часового периода у проходящих лечение животных ко Дню 10 во всех лечебных группах с AT-002.
В целом, однократное в день дозирование AT-002 было достаточным, чтобы приводить к 24 часам повышенных уровней IGF-1 после приема дозы, желательного профиля для подавления сверхстимуляции GH и кортизола.
ПРИМЕР 7 - Лабораторное исследование титрования дозы у кошек
В этом исследовании тестировали эффективность пероральной лекарственной формы AT-002 у лабораторных кошек для выбора дозы, которая вызывала бы увеличенные поглощение пищи и прирост массы тела. В этом исследовании изучали эффекты перорального раствора капроморелина у кошек с дозированием при 1 мг/кг, 2 мг/кг или 3 мг/кг по сравнению с плацебо (n=8/группу) в течение 21 дня. Потребление пищи измеряли каждый день от Дня -10 вплоть до Дня 21. Для каждой кошки, исходный уровень потребления пищи рассчитывали как среднее значение для Дней -3, -2 и -1. Процент изменения от исходного уровня до периода лечения рассчитывали как 100 x (период лечения минус исходный уровень)/исходный уровень. Массу тела измеряли в День 1, День 8, День 15 и День 22. Массу тела определяли как значение, полученное в День 1 (до лечения).
Средний процент изменения от исходного уровня (от Дня -3 до Дня -1) до периода лечения (от Дня 1 до Дня 21) потребления пищи для каждой лечебной группы приведен в Таблице 8. Группа плацебо показала увеличение 10,8%. В группах 2, 3 и 4 увеличение составило 25,3%, 45,7% и 29,6% соответственно (p=0,0066 для всех лечебных групп в сравнении с группой плацебо).
Таблица 8: Потребление пищи
Средний процент изменения массы тела от исходного уровня (Дня 1) до Дня 22 для каждой лечебной группы представлен в таблице ниже. Наблюдали статистически значимые увеличения массы тела при сравнении каждой из трех групп с AT-002 с группой плацебо (p=0,0103 для всех лечебных групп в сравнении с группой плацебо).
Таблица 9: Масса тела
В то время как лечение с использованием 1 мг/кг показало увеличение среднего потребления пищи, оно не было статистически значимым в сравнении с плацебо. Следовательно, группа лечения с 2 мг/кг, которая показала статистически значимое увеличение потребления пищи и массы тела по сравнению с кошками, получавшими плацебо, была выбрана для предлагаемой клинической дозы у кошек.
Исследования Примера 6 и настоящего Примера 7 характеризуют, что однократная ежедневная доза является эффективной между 2 мг/кг и 3 мг/кг у здоровых лабораторных кошек. С учетом того, что капроморелин имеет широкий предел безопасности у кошек в трех пилотных исследованиях, был выбран режим постоянной дозы, равной 2 мг/кг SID. Эти два исследования проводили согласно принципам GLP. Центр тестирования строго выполнял соответствующие исследования по протоколу и их применимому стандарту проведения методик. Однако компонент QA отсутствовал, так что эти исследования не были GLP.
ПРИМЕР 8 - Пилотное исследование безопасности на лабораторных кошках с модельной ХБП
В этом исследовании пытались определить фармакокинетический профиль капроморелина в сыворотке кошек с нарушенной функцией почек, чтобы установить, происходит ли накопление капроморелина в сыворотке через 14 дней лечения, и проводить наблюдение за кошками с целью выявления каких-либо потенциальных неблагоприятных эффектов от лечения, не наблюдаемых у нормальных кошек. Целевая популяция для перорального раствора капроморелина включала кошек с ХБП. Следовательно, в этом исследовании использовали лабораторных животных с хирургически удаленными значительными частями их почек и, в последующем, нарушенной функцией почек, на что указывали увеличенные сывороточный креатинин и BUN. Этих кошек разрабатывали в качестве модели в Charles River, и их содержали в колонии в центре Баллина, Ирландия.
Шестнадцать кошек с нарушенной функцией почек были включены в исследование и рандомизированы в три группы. Животным, включенным в Группу 1 (n=6), вводили AT-002 один раз в День 0 посредством внутривенного катетера при уровне дозы, равном 0,75 мг/кг на кошку. Животным, включенным в Группу 2 (n=6), вводили AT-002 ежедневно в течение 14 дней посредством подкожной инъекции при уровне дозы, равном 2 мг/кг. Подкожный и внутривенный пути лечения использовали для подтверждения того, что имело место достаточное воздействие лекарственного средства. Животные, включенные в Группу 3 (n=4), служили в качестве необработанных контролей.
Образцы крови забирали для анализа на капроморелин и/или IGF-1 у животных, включенных в Группу 1 в День Исследования 0. Образцы крови также забирали у животных, включенных в Группы 2 и 3 в Дни Исследования -1 и 13 (до дозирования) для гематологического и клинического химического анализа. Аппетит оценивали по поглощению пищи и приросту массы тела. Измерения массы тела проводили в дни -7, -1 (все группы) и в День 13 (только Группы 2 и 3). Поглощение пищи непрерывно регистрировали от Дня -7 до Дня 13 включительно, у животных, включенных в Группы 2 и 3. У животных наблюдали ежедневно клинические признаки.
Фармакокинетические профили кошек после лечения капроморелином (ВВ или ПК) показали воздействие лекарственного средства и отсутствие признаков накопления лекарственного средства (ФИГ. 20 и 21). Капроморелин увеличивал уровни IGF-1 у кошек, принимавших 2 мг/кг AT-002 в День 0 (ФИГ. 22). Это увеличение IGF-1 становилось продолжительным ко Дню 13. В День -1 и День 13, гематологию и клиническую химию регистрировали у кошек в Группе 2 (ПК) и Группе 3 (контроль) для оценки того, был ли какой-либо эффект от лечения капроморелином (ФИГ. 23).
Во всех случаях, где результаты, касающиеся параметров гематологии или клинической химии, находились вне эталонного интервала, отсутствовали клинические признаки болезни, ассоциированные с какой-либо частотой наступления. Параметры вне эталонных интервалов были аналогичными в День -1 и День 13 лишь с минорной вариацией в результатах. Никакая частота наступления не относилась к лечению. Во всех случаях результаты лишь были немного выше или немного ниже эталонного интервала.
От Дня -7 до Дня 13, у всех животных, включенных в Группу 2 (AT-002 при 2 мг/кг/день; подкожно) и Группу 3 (необработанный контроль), снижалась масса тела. Все животные, включенные во все лечебные группы, не потребляли всей их пищи. Наиболее вероятно это было обусловлено тем, что пищу удаляли приблизительно через 4 часа после ее предложения. При отсутствии статистического анализа, даже при малом численном различии, среднее поглощение пищи при сравнении животных, включенных в Группу 2 (AT-002), и животных, включенных в Группу 3 (необработанный контроль), в каждой временной отметке, не отличалось.
AT-002, при введении подкожно кошкам с нарушенной функцией почек, был неспособен стимулировать аппетит, так как не наблюдали какого-либо явного увеличения поглощения пищи или массы тела. Может быть, пероральный путь всасывания требуется для AT-002, чтобы стимулировать аппетит, так как грелин является гормоном, вырабатываемым желудком. Капроморелин приводил к продолжительному увеличению уровней IGF-1 у кошек, подвергавшихся лечению 2 мг/кг AT-002 посредством подкожной инъекции в течение 14 дней.
ПРИМЕР 9 - Безопасность и эффективность ежедневного приема капроморелина у кошек с ХБП в течение 90 дней при пероральной дозе, равной 2 мг/кг
Это исследование было проведено, чтобы подтвердить безопасность и эффективность AT-002 (капроморелина) у кошек в полевых условиях с использованием дозы, равной 2 мг/кг, вводимой один раз ежедневно в течение 90 дней. Целью исследования была проверка гипотезы, что AT-002 будет поддерживать или увеличивать массу тела, улучшать балльную оценку физического состояния (BCS), улучшать балльную оценку состояния мускулатуры (MCS), улучшать аппетит и/или улучшать качества жизни (QoL) у кошек. Это исследование представляло собой двойное маскированное, рандомизированное, плацебо-контролируемое, многоцентровое, для подтвержения концепции, полевое исследование.
В это исследование были включены кошки, у которых диагностировали хроническую болезнь почек (ХБП) и имеющие минимально 6-месячную историю потерю массы тела. Цель включения в исследование представляла собой как минимум 15 оцениваемых случаев в группе AT-002 и 15 оцениваемых случаев в группе Контрольного Продукта (CP; плацебо). Исследователь и весь персонал исследования были маскированы кодом лечения (A или B) и группой лечения (AT-002 или CP). Фармацевт и Владелец оставались неосведомленными о принадлежности к группе лечения (AT-002 или CP).
Кошек лечили с использованием дозировки, равной 2 мг/кг массы тела лекарственной формы AT-002 (AT-002) или плацебо (CP) при том же объеме дозы, что и для AT-002, один раз ежедневно в течение 90±3 дней. День 0 был первым днем дозирования. Кошек оценивали в День 0, День 14±1, День 30±2, День 60±3 и День 90±3. Первичная переменная эффективности представляла собой изменение массы тела от Дня 0 вплоть до Дня 90±3. Вторичные переменные эффективности включали BCS, MCS, оценки аппетита владельцем и оценки QoL владельцем.
После включения в исследование, каждый случай был статистически распределен в группы AT-002 или CP при отношении 1:1. Цель включения в исследование представляла собой по меньшей мере 30 оцениваемых случаев (15 AT-002 и 15 CP) на схему рандомизации исследования для всех центров.
Кошки, включенные в исследование, представляли собой кошек с удаленными яичниками/кастрированных любого возраста и любой породы с документированным в истории болезни снижением массы тела в течение предшествующих 6 месяцев, и поставленным диагнозом хроническая болезнь почек (стадии II, III или IV по IRIS). Кошки, принимавшие лекарственные средства при некоторых устойчивых, хронических состояниях, были включены. Исключенными из исследования были кошки, находящиеся в критическом состоянии или агонирующие, кошки с документированным и нерегулируемым гипертиреозом или воспалительным заболеванием кишечника, кошки, для которых поглощение пищи явллось противопоказанием (т.е. предполагаемый чужеродный объект, операция желудочно-кишечного тракта), кошки с болезнью зубов, достаточно тяжелой, чтобы нарушить поглощение пищи, кошки с диабетом и кошки, получавшие в рассматриваемое время запрещенные медицинские препараты.
Владелец, поддерживающий режим кормления кошки, присутствовал при включении в исследовании. Никакой особенной пищи и никакого особенного режима кормления не требовалось. Вода была доступна ad libitum. Диету кошки регистрировали, и ʺИсторию Диетыʺ заполняли, когда Исследователь проводил собеседование с Владельцем при скрининге/квалификации (День 0), День 30±2, День 60±3 и День 90±3 или при последнем посещении исследования (т.е. раннем выходе из исследования).
Во время исследования, кошек подвергали лечению медицинскими препаратами, которые кошки получали для лечения протекающего, ранее существующего медицинского состояния, которое было хорошо стабилизировано. Противорвотные средства (например, маропитанта цитрат (Cerenia™)) были разрешены для приема во время исследования, если они назначались до начала исследования, и лечение было стабильным (т.е. кошка находилась на схеме лечения без каких-либо изменений в течение минимально 2 дней до Дня 0). Всего 6 кошек получали одну или несколько доз Cerenia до, во время или после исследования.
Никакие парентеральные жидкие среды не были разрешены для приема в интервале приблизительно 12 часов до визита в День 14±1, День 30±2, День 60±3 и День 90±3. Системные кортикостероиды были запрещены в пределах последних 30 дней за исключением кошек, стабилизированных при долговременном лечении. Анаболические стероиды, прогестерон и Эпоген/дарбепоэтин были запрещены в пределах 30 дней от Дня 0. Миртазапин, дронабинол, ципрогептадин и диазепам были запрещены в пределах 7 дней от Дня 0.
Массу тела измеряли в футах до ближайшего разряда десятичной дроби как часть физического осмотра при скрининге/квалификации/в День 0, День 14±1, День 30±2, День 60±3 и День 90±3 и во время любого незапланированного посещения или раннего выхода из исследования.
Балльная оценка физического состояния (BCS) определялась Исследователем/Обследующим ветеринаром в качестве части физического осмотра при скрининге/квалификации (День 0), День 14±1, День 30±2, День 60±3 и День 90±3 или при последнем посещении исследования (т.е. раннем выходе) с использованием следующей 9-балльной шкалы:
1 - Истощенная - Ребра, видимые на короткошерстных кошках; отсутствие пальпируемого жира; сильная набрюшная впадина; поясничные позвонки и крылья тазовых костей легко пальпируются.
2 - Очень худая - Ребра, легко видимые на короткошерстных кошках; проступающие поясничные позвонки с минимальной мышечной массой; выраженная впадина на брюшной полости; отсутствие пальпируемого жира.
3 - Худая - Ребра, легко пальпируемые с минимальным слоем покрывающего жира; выступающие поясничные позвонки; хорошо видимое сужение сзади ребер; минимальный набрюшный жировой слой.
4 - С пониженной массой - Ребра, пальпируемые с минимальным покрывающим жировым слоем; заметное сужение сзади ребер; небольшая набрюшная впадина; отсутствие набрюшной жировой складки.
5 - Идеальная - С правильными пропорциями; наблюдаемое сужение сзади ребер; ребра, пальпируемые с небольшим покрывающим жировым слоем; минимальная набрюшная жировая складка.
6 - С избыточной массой - Ребра, пальпируемые с небольшим избытком покрывающего жира; сужение и набрюшная жировая складка различимые, но не явные; набрюшная впадина отсутствует.
7 - Толстая - Ребра, нелегко пальпируемые с умеренным покрывающим жировым слоем; плохо различимое сужение; явная набрюшное окружное утолщение; умеренная набрюшная жировая складка.
8 - Тучная - Ребра, не пальпируемые с избыточным покрывающим жировым слоем; сужение отсутствует; явное окружение брюшной полости значительной набрюшной жировой складкой; жировые отложения, присутствующие на поясничной области.
9 - Сильно ожиревшая - Ребра, не пальпируемые под тяжелым покрывающим жировым слоем; тяжелые жировые отложения на поясничной области, морде и конечностях; расширение брюшной полости без какого-либо сужения; обширные набрюшные жировые отложения.
MCS определялась Исследователем/Обследующим Ветеринаром в качестве части физического осмотра при скрининге/квалификации (День 0), День 14±1, День 30±2, День 60±3 и День 90±3 или при последнем посещении исследования (т.е. раннем выходе) с использованием следующей 4-балльной шкалы:
3 - Нормальная мышечная масса при пальпации хребта, лопаток, черепа или крыльев тазовых костей
2 - Легкая атрофия мышечной ткани при пальпации хребта, лопаток, черепа или крыльев тазовых костей
1 - Умеренная атрофия мышечной ткани при пальпации хребта, лопаток, черепа или крыльев тазовых костей
0 - Тяжелая атрофия мышечной ткани при пальпации хребта, лопаток, черепа или крыльев тазовых костей
Образцы крови для определения химических параметров сыворотки забирали при скрининге/квалификации/посещении в День 0, День 30±2, День 60±3 и День 90±3 или при последнем посещении исследования (т.е. раннем выходе). Образцы крови анализировали на альбумин, глюкозу, щелочную фосфатазу (ALP), фосфор, аланинаминотрансферазу (ALT), калий, остаточный азот мочевины в крови (BUN), натрий, кальций, общий билирубин, хлорид, общий белок, холестерин, альбумин/глобулин отношение, креатининкиназу (CPK), отношение BUN/креатинин, креатинин, отношение натрий/калий, глобулины, количество лейкоцитов (WBC), количество тромбоцитов, количество эритроцитов (RBC), морфологию тромбоцитов, гемоглобин (HGB), WBC-дифференциал, гематокрит (HCT), морфологию RBC и WBC, среднюю величина объема эритроцитов (MCV), фруктозамин, средний корпускулярный гемоглобин (MCH) и концентрацию среднего корпускулярного гемоглобина (MCHC).
Образцы мочи собирали при скрининге/квалификации/посещениях в День 0, День 30±2, День 60±3 и День 90±3 или при последнем посещении исследования (т.е. раннем выходе). Образцы мочи анализировали на цвет, глюкозу, прозрачность, кетоны, удельный вес, билирубин, pH, кровь, белок и осаждение (микроскопическая оценка).
Образец крови объемом 1 собирали в вакуумную пробирку, не содержащую антикоагулянта при скрининге/квалификации/посещениях в День 0, День 30±2, День 60±3 и День 90±3 или при последнем посещении исследования (т.е. раннем выходе). Образцы крови содержали при комнатной температуре и обеспечивали их свертывание в течение приблизительно 1 часа. Образцы свернувшейся крови центрифугировали в течение приблизительно 15 минут при 3000 об/мин.
Каждая кошка оценивалась на предмет аппетита Владельцем при скрининге/квалификации/посещениях в День 0, День 30±2, День 60±3 и День 90±3 или при последнем посещении исследования (т.е. раннем выходе). Каждая кошка также оценивалась на предмет QoL Владельцем в ветеринарной клинике при скрининге/квалификации/посещениях в День 0, День 30±2, День 60±3 и День 90±3 или при последнем посещении исследования (т.е. раннем выходе).
Кошка представляла собой экспериментальную единицу. Все тесты на статистическую достоверность проводили на двухстороннем альфа-уровне, равном 0,05. Уровень достоверности для переменных безопасности составлял альфа=0,10, двухсторонний. Допущения нормальности остатков исследовали для каждого измерения продолжительного ответа. Если нормальность допущения отклонялась при 1% уровне с использованием метода Шапиро-Вилка, тогда значения ранжировались в порядке возрастания с привязанными значениями с учетом среднего ранга до прохождения статистических моделей. Пропущенные данные не учитывались и только наблюдаемые данные были включены в статистические модели.
Для массы тела проводили сравнение первичной переменной эффективности-среднего процента изменения для группы AT-002 и группы CP. Для группы AT-002, статистически значимые изменения от Дня 0 были установлены для Дня 14 (p=0,0013), Дня 30 (p=0,0007), Дня 60 (p=0,0144) и Дня 90 (p=0,0434). Никаких статистически значимых изменений от Дня 0 не было установлено для группы CP. Это доказывает, что кошки, получавшие лечение AT-002 прибавляли массу тела во время периода лечения, в то время как группа CP не прибавляла массу тела. При сравнении среднего процента изменения массы между группой AT-002 и группой СР, в группе AT-002 показатель был статистически значимо выше в День 30 (p=0,0248), День 60 (p=0,0018) и День 90 (p=0,0093).
Для массы тела вторичная переменная эффективности определяла успешный исход для индивидуальной кошки на основании нескольких вариантов прироста массы тела. Для критериев успешного исхода типа ʺПоддержание или Приростʺ, изменение в процентах от Дня 0 до Дней 14, 30, 60 и 90 не имело статистически значимых различий между группами. Для критериев успешного исхода типа ʺПрирост более чем на 0%ʺ, было установлено, что изменения в процентах от Дня 0 до Дня 14 (p=0,0259), до Дня 30 (p=0,0083), и до Дня 90 (p=0,0178) являются статистически значимо различными и предпочтительными для группы АТ-002. Для критериев успешного исхода типа ʺПрирост более чем на 1%ʺ, в процентах от Дня 0 до Дня 30 (p=0,0178) и до Дня 90 (p=0,0178) являются статистически значимо различными и предпочтительными для группы АТ-002. Для критериев успешного исхода типа ʺ Прирост более чем на 2%ʺ, было установлено, что изменения в процентах от Дня 0 до Дня 14 (p=0,0401) являются статистически значимо различными и предпочтительными для группы АТ-002.
Что касается балльной оценки физического состояния, балльной оценка состояния мускулатуры, оценки владельцем аппетита и параметров качества жизни, то не наблюдали никаких значимых статистических различий. Из трех измеренных параметров качества жизни, средний описательный (ежемесячно) параметр качества жизни параметр показал увеличение (улучшение) в группе плацебо от Дня 0 до Дня 90, но средняя балльная оценка группы, получавшей AT-002, осталась такой же. Это различие было значимым (p=0,0038).
Это исследование продемонстрировало, что AT-002 хорошо переносится у кошек. Принимая во внимание ранее существовавшую болезнь почек, снижение массы тела в течение по меньшей мере предыдущих 6 месяцев, и другие сопутствующие состояния, имеющиеся у этих кошек, можно было ожидать неблагоприятных явлений (AE). Болезнь почек и ее прогрессирующая природа могут объяснять многие наблюдения у кошек, получавших лечение AT-002, включающие изменения клинической патологию, утрату аппетита, дегидратацию, снижение массы тела, и т.д.
О AE сообщали более часто у кошек, получавших лечение AT-002, чем у кошек, получавших плацебо, но никакие из них не были неожиданными, и только 1 из 5 SAE было признано относящимся к лечению AT-002/CP. Ветеринар указал на ʺвероятнуюʺ взаимосвязь лечения AT-002/CP и SAE в виде анорексии, которую ассоциировали с желудочно-кишечным событием. Неясным остается, был ли причиной этого события AT-002 или это было вызвано другим фактором. Многие AE были ассоциированы с ранее существующими состояниями или событиями, не относящимися к исследованию. AE, о которых сообщалось для более чем 10% от общей популяции, представляли собой утрату аппетита, рвоту, увеличенное слюноотделение и диарею/жидкий стул, хотя очевидной была потенциальная взаимосвязь лечения AT-002 только с увеличенным слюноотделением и возможно рвотой. Несколько параметров результатов физического осмотра различались между группами, но ни один из них не был ни клинически значимым, ни относящимся к лечению AT-002. Изменения данных клинической патологии от Дня 0 до окончания посещений при исследовании отмечали более часто у группы АТ-002. Однако, никакие изменения клинической патологии не рассматривались как клинически значимые. Увеличение сывороточных уровней IGF-1 после введения подтверждало, что физиология оси GH/IGF-1 работала, как ожидалось.
Таким образом, результаты этого исследования подтверждают, что постоянный прием AT-002 при дозе, равной 2 мг/кг, один раз ежедневно, хорошо переносится и регулирует поддержание/прирост массы тела у кошек с ХБП, у которых снижается масса тела. Основные первичные и вторичные и переменные эффективности показали статистически значимое превосходство AT-002 по сравнению с плацебо.
ПРИМЕР 11 - Пилотное клиническое полевое исследование
Это плацебо-контролируемое, маскируемое не-GCP исследование было проведено для подтверждения безопасности и эффективности (прироста массы тела) AT-002 (капроморелина) при дозе, равной 2 мг/кг, вводимой один раз ежедневно в течение 90 дней у кошек с ХБП и историей снижения массы тела.
Всего скрининг проходили 42 кошки в 7 ветеринарных клиниках. Из этих 42 кошек, 1 не прошла скрининг, что привело в результате к включению в исследование 41 кошки, которых рандомизировали в 1 из 2 лечебных групп, с пероральным раствором капроморелина (AT-002) или плацебо (CP). Допущенные к участию в исследовании кандидаты включали кошек, которые были представлены в ветеринарную клинику с диагнозом ХБП (стадии II, III или IV по IRIS) и имели документированное снижение массы тела в течение предыдущих 6 месяцев. Тестируемые изделия обеспечивали в виде ароматизированных пероральных растворов, которые вводили перорально один раз ежедневно, начиная в День 0 в течение 90±3 дней, AT-002 при уровне дозы, равной 2 мг/кг, и CP при объеме дозы, эквивалентном AT-002. Исследователь, исследовательский персонал и Владельцы кошек были скрыты при лечении. Кошек повторно оценивали в клинике в День 14±1, День 30±2, День 60±3 и День 90±3.
Основной переменной для определения эффективности была масса тела. Другие измеряемые переменные эффективности включали балльную оценку физического состояния, балльную оценку состояния мускулатуры, оценки качества жизни (неутвержденные) и оценки аппетита владельцем (неутвержденные). Безопасность оценивали посредством физических осмотров, тестирования клинической патологии (гематологии и химических параметров сыворотки), общего анализа мочи, сывороточных уровней IGF-1 и мониторинга неблагоприятных явлений.
Средняя масса тела для группы лечения капроморелином увеличивалась во время 90-дневного периода лечения в сравнении с группой плацебо (p=0,0067) (анализ с использованием PPP1; Таблица 10). Ко Дню 30, средняя масса тела (± SEM) увеличивалась на 3,86% ± 0,85% в группе капроморелина по сравнению с 00,20% ± 0,75% в группе плацебо (P=0,0248). В День 60, средняя масса тела (± SEM) увеличилась на 4,06% ± 1,42% в группе капроморелина по сравнению с -1,14% ± 10,20% в группе плацебо (p=0,0018). В День 90, средняя масса тела (± SEM) увеличилась на 3,59% ± 1,59% в группе капроморелина по сравнению с -0,69% ± 10,23% в группе плацебо (p=0,0093).
Таблица 10: Пилотное клиническое полевое исследование - Масса тела - Сравнение средств лечения
Если успешный исход для индивидуального пациента определяют как ʺподдержание или приростʺ и успешные исходы подсчитывают в лечебной группе, то группа капроморелина включала больше ʺуспеховʺ; однако, группы не отличались существенно в любой День (анализ с использованием PPP2; Таблица 11). Если успешный исход для индивидуального пациента определяют как ʺприрост более 0%ʺ и и успешные исходы подсчитывают в лечебной группе, то группа лечения капроморелином имела значительно больше успешных исходов в сравнении с группой плацебо в День 14 (p=0,0259), День 30 (p=0,0083) и День 90 (p=0,0178) (анализ с использованием PPP2; Таблица 12).
Таблица 11: Пилотное клиническое полевое исследование - Масса тела - Успешный исход, определяемый как поддержание или прирост
Таблица 12: Пилотное клиническое полевое исследование - Масса тела - Успешный исход, определяемый как прирост более 0%
Средняя балльная оценка физического состояния (по шкале от 1 до 9; см. Пример 9) у кошек, получавших капроморелин, увеличивалась незначительно. В то время как средний балл в группе плацебо немного уменьшался, эти различия не являлись статистически значимыми (p=0,4650) (анализ с использованием PPP1).
Средняя балльная оценка состояния мускулатуры (по шкале от 0 до 3; см. Пример 9) увеличивалась в обеих лечебных группах, но увеличение было немного выше в группе капроморелина по сравнению с группой плацебо. Однако, это различие не являлось статистически значимым (p=0,4095) (анализ с использованием PPP1).
Средние описательные балльные оценки качества жизни ежемесячно (по шкале от 1 до 5) для группы плацебо увеличивались во время 90-дневного периода лечения в сравнении с группой капроморелина (p=0,0404) (анализ с использованием PPP1). В День 0 (исходный уровень), средняя описательная балльная оценка качества жизни ежемесячно (± SEM) составляла 3,85 ± 0,19 в группе капроморелина по сравнению с 3,35 ± 0,17 в группе плацебо (p=0,0588). В День 90, изменение средней описательной балльной оценки качества жизни ежемесячно (± SEM) от Дня 0 увеличивалось на 0,76 ± 0,16 в группе плацебо по сравнению с 0,00 ± 0,11 в группе капроморелина (P=0,0038). При этом ежемесячном измерении качество жизни в группе плацебо улучшалось во время исследования, в то время как качество жизни в группе капроморелина оставалось таким же.
Балльные оценки описательной оценки аппетита владельцем, присваиваемые ежемесячно, не изменялись значительно для группы капроморелина в сравнении с группой плацебо в День 30 (p=0,7300), День 60 (p=0,1446) или День 90 (p=0,8518) (анализ с использованием PPP1).
Средние уровни IGF-1 на исходном уровне в группе капроморелина были более низкими, чем у кошек в группе плацебо, но вследствие изменчивости это различие не являлось статистически значимым. Средние сывороточные уровни IGF-1 для группы капроморелина увеличивались по отношению к исходному уровню в сравнении с группой плацебо во время 90-дневного периода лечения (p=0,0202) (анализ с использованием PPP1; Таблица 13). В День 30, средние (± SEM) сывороточные уровни IGF-1 увеличивались по отношению к исходному уровню (День 0) на 274,60 нг/мл ± 49,06 нг/мл в группе капроморелина по сравнению с 28,62 нг/мл ± 43,46 нг/мл в группе плацебо (p=0,0030).
Таблица 13: Пилотное клиническое экспериментальное исследование - Сывороточные уровни IGF-1
Наблюдения безопасности включали мониторинг неблагоприятных явлений и измерение параметров клинической патологии (химические параметры сыворотки, гематология и общий анализ мочи). Это исследование продемонстрировало, что капроморелин хорошо переносился у кошек. Принимая во внимание ранее существовавшую болезнь почек, снижение массы тела в течение по меньшей мере предыдущих 6 месяцев, и другие сопутствующие состояния, имеющиеся у этих кошек, можно было ожидать неблагоприятных явлений (AE). Болезнь почек и ее прогрессирующая природа могут объяснять многие наблюдения у кошек, получавших лечение капроморелином, включающие изменения клинической патологию, утрату аппетита, дегидратацию, снижение массы тела, и т.д. О AE сообщали более часто у кошек, получавших лечение AT-002, чем у кошек, получавших плацебо, но никакие из них не были неожиданными и только 1 из 5 SAE было признано относящимся к лечению AT-002/CP. Ветеринар указывал на ʺвероятнуюʺ взаимосвязь лечения AT-002/CP и SAE в виде анорексии, которую ассоциировали с желудочно-кишечным событием. Неясным остается, был ли причиной этого события AT-002 или это было вызвано другим фактором. Многие AE были ассоциированы с ранее существующими состояниями или событиями, не относящимися к исследованию. AE, о которых сообщалось для более чем 10% от общей популяции, представляли собой утрату аппетита, рвоту, увеличенное слюноотделение и диарею/жидкий стул, хотя очевидной была потенциальная взаимосвязь лечения AT-002 только с увеличенным слюноотделением и возможно рвотой. Несколько параметров результатов физического осмотра различались между группами, но ни один из них не был ни клинически значимым, ни относящимся к лечению AT-002. Изменения данных клинической патологии от Дня 0 до окончания посещений при исследовании отмечали более часто у группы АТ-002. Однако, никакие изменения клинической патологии не рассматривались как клинически значимые. Увеличение сывороточных уровней IGF-1 после введения подтверждало, что физиология оси GH/IGF-1 работала, как ожидалось.
Если успешный исход у индивидуального пациента определяется как ʺподдержание или приростʺ, то группы не имели значительных различий в любой День. Однако, группа капроморелина имела значительно больше ʺуспеховʺ в сравнении с группой плацебо, и это различие становилось значительным в День 30, День 60 и День 90. Если успешный исход у индивидуального пациента определяется как ʺприрост более 0%ʺ, то группа капроморелина капроморелина имела значительно больше ʺуспеховʺ в сравнении с группой плацебо в День 14 (p=0,0259), День 30 (p=0,0083), и День 90 (p=0,0178).
Балльная оценка физического состояния и балльная оценка состояния мускулатуры показывали тенденцию к увеличению для группы, обработанной капроморелином, в сравнении с группой плацебо от Дня 0 до Дня 90. Эти тенденции не были статистически значимыми.
Сывороточные уровни IGF-1 увеличивались статистически значимо по отношению к исходному уровню во время обработки в группе капроморелина в сравнении с группой плацебо. В День 30, увеличение сывороточных уровней IGF-1 для группы капроморелина в сравнении с группой плацебо было статистически значимым, но в пределах интервала физиологической нормы. В Дни 60 и 90, тенденции к увеличению сывороточных уровней IGF-1 по отношению к исходному уровню продолжали наблюдать для группы капроморелина в сравнении с группой плацебо; однако, эти тенденции не были статистически различными. Как ожидалось, увеличение сывороточных уровней IGF-1 представляло незначительное увеличение назад к уровням, которые могли бы ожидаться у более молодых кошек.
Таким образом, постоянный прием перорального раствора капроморелина при дозе, равной 2 мг/кг один раз ежедневно хорошо переносится и позволяет регулировать поддержание/прирост массы тела у кошек с ХБП, у которых уменьшалась масса тела. Увеличение массы тела для группы капроморелина в сравнении с группой плацебо было статистически значимым в День 30 и оставалось значительным в День 60 и день 90. При сравнении обработок, увеличение массы тела для группы капроморелина по сравнению с группой плацебо было статистически значимым в День 30 и оставалось значительным в День 60 и День 90. В группе плацебо снижение массы тела происходило от Дня 0 до Дня 90. Профиль безопасности, ассоциированный с капроморелином, был аналогичным к профилю безопасности для плацебо. Измерение массы тела являлось клинически базовым параметром. Прирост массы тела подтверждает улучшение общего состояния для кошек и предоставляет явное клиническое преимущество.
Все композиции и способы, раскрытые и заявленные в настоящем описании могут быть осуществлены и исполнены без излишнего экспериментирования с учетом настоящего раскрытия. В то время, как композиции и способы этого изобретения были описаны с позиций предпочтительных вариантов осуществления, для специалистов в этой области техники будет очевидным, что к композициям и способам, и к стадиям или последовательности стадий способа, описанных в настоящем документе, могут применяться вариации без отступления от идеи, сущности и объема притязаний изобретения. Более конкретно, будет очевидным, что некоторые средства, которые как химически, так и физиологически являются родственными, могут быть заменены на средства, описанные в настоящем документе, и в то же время могут быть достигнуты такие же или аналогичные результаты. Считают, что все такие аналогичные замены и модификации, очевидные для специалистов в этой области техники, охвачены сущностью, объемом притязаний и идеей изобретения, как определено следующей формулой изобретения.
Реферат
Группа изобретений относится к области ветеринарии. Первое изобретение представляет собой способ лечения снижения массы тела домашнего животного, выбранного из собаки, кошки и лошади, включающий пероральное введение композиции, содержащей от 1,0 до 3,0 мг капроморелина на килограмм массы тела животного в день в течение по меньшей мере 30 дней. Также группа изобретений относится к способу увеличения сухой мышечной массы, ослабления снижения массы тела и увеличения прироста массы тела у животного; к четырем вариантам способа лечения снижения массы тела по меньшей мере одного из домашнего животного или сельскохозяйственного животного; и к способу лечения снижения массы тела у кошек с хронической болезнью почек. Группа изобретений обеспечивает повышенный прирост массы тела животного при длительном введении композиции, содержащей капроморелин. 7 н. и 19 з.п. ф-лы, 23 ил., 13 табл., 11 пр.

Комментарии