2-[4'-(2", 6"-диметилфенокси)бензоил]бензойная кислота и способ ее получения - RU2621343C1
Код документа: RU2621343C1
Описание
Изобретение относится к органической химии, а именно к замещенным 2-бензоилбензойным кислотам, конкретно к 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоте (I) и способу ее получения
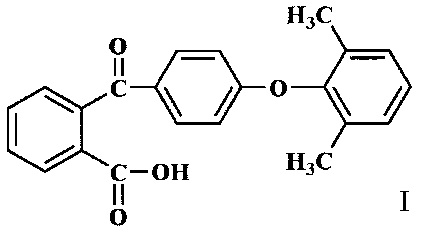
Соединение по изобретению наиболее эффективно может быть использовано в качестве предшественника фталидных мономеров для термо-, тепло- и хемостойких ароматических полимеров.
Заявляемое соединение, его свойства и способ получения в литературе не описаны.
Известны близкие ему по структуре соединения, которые используются в качестве полупродуктов в органическом синтезе.
Так, известна 2-бензоилбензойная кислота (II)

которую синтезируют по реакции Фриделя-Крафтса между фталевым ангидридом и бензолом в присутствии хлористого алюминия [Gallay W., Whitby G.S. Can. J. Res., 1930, 2, 31-34]. Кислоту II используют для получения антрахинона - ценного промежуточного продукта в синтезе антрахиноновых красителей [Горелик М.В. Химия антрахинонов и их производных. -М.: Химия, 1983. - 296 с.].
Также известна 2-(4'-фенилбензоил)бензойная кислота (III),

которую получают взаимодействием фталевого ангидрида с избытком дифенила, выполняющего одновременно роль растворителя, в присутствии хлористого алюминия [Groggins R.H. Ind. Eng. Chem., 1930, 22 (6), 620-625; Ковардаков B.A., Золотухин М.Г., Салазкин С.Н., Рафиков С.Р. Изв. АН СССР, сер. хим., 1983, №4, 941-943]. Кислоту III используют для получения β-фенилантрахинона, а также мономеров для термостойких ароматических полимеров [Рафиков С.Р., Толстиков Г.А., Салазкин С.Н., Золотухин М.И. А.с. СССР SU 734989 (Б.И., 1981, №20, 259); Салазкин С.Н. Высокомол. соед., сер. Б, 2004, №7, 1244-1269].
Наиболее близким структурным аналогом заявляемого соединения является 2-(4'-феноксибензоил)бензойная кислота (IV)

получаемая ацилированием дифенилоксида фталевым ангидридом в сероуглероде в присутствии хлористого алюминия (выход «сырого» продукта около 80%, а чистого - не более 60%) [Kipper Н. Ber., 1905, 38, 2490-2493]. Кислоту IV используют в качестве исходного соединения в синтезе мономеров для термостойких ароматических полимеров [Рафиков С.Р., Толстиков Г.А., Салазкин С.Н., Золотухин М.И. А.с. СССР SU 734989 (Б.И., 1981, №20, 259); Салазкин С.Н. Высокомол. соед., сер. Б, 2004, №7, 1244-1269].
Задачей заявляемого изобретения является расширение ряда 2-бензоилбензойных кислот, используемых в качестве предшественников фталидных мономеров для получения ароматических полимеров с ценными свойствами.
Поставленная задача решается новой 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислотой (I) и способом ее получения, включающим взаимодействие 2-(4'-фторбензоил)бензойной кислоты с 2,6-диметилфенолом в присутствии K2CO3 при нагревании в N,N-диметилацетамиде (ДМАА):

Получить заявляемое соединение I по реакции Фриделя-Крафтса, используемой для всех его аналогов II-IV, крайне проблематично вследствие недоступности необходимого для этого 2,6-диметилдифенилоксида и принципиальной невозможности осуществить его селективное (по незамещенной фенильной группе) ацилирование фталевым ангидридом.
Заявляемый способ получения соединения по изобретению представляет собой нетривиальную реакцию нуклеофильного ароматического замещения фтора в отсутствие катализатора, к тому же стерически затрудненной группой. В качестве субстрата выступает коммерчески доступная 2-(4'-фторбензоил)бензойная кислота, в которой атом фтора в бензольном ядре активирован 2-карбоксибензоильной группой, в качестве нуклеофильного реагента - 2,6-диметилфенолят калия, получаемый in situ из коммерчески доступного 2,6-диметилфенола и K2CO3 при азеотропной отгонке образующейся воды с хлорбензолом. Реакцию проводят в высококипящем N,N-диметилацетамиде в качестве растворителя и получают 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойную кислоту (I) с выходом 77%.
Заявляемое соединение I отличается от своего близкого аналога IV наличием метальных групп в орто-положениях по отношению к простой эфирной связи. Эта особенность придает данной связи повышенную устойчивость к химическим реагентам, что открывает широкие возможности для получения из заявляемой кислоты I органических соединений различного строения, обладающих ценными свойствами.
К таким соединениям можно отнести 3-хлор-3-[4'-(2'',6''-диметилфенокси)фенил]-3H-изобензофуран-1-он (псевдохлорангидрид заявляемой кислоты) формулы V и полиариленфталид VI на его основе.

Осуществление заявляемого изобретения, а также возможность его использования для получения органических соединений с ценными свойствами иллюстрируются конкретными примерами.
Пример 1. Получение 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты (I). Четырехгорлую колбу, снабженную мешалкой, термометром, трубкой для подачи инертного газа и системой для азеотропной отгонки, помещают в масляную баню, продувают аргоном и загружают 20,00 г (0,082 моль) 2-(4'-фторбензоил)бензойной кислоты, 9,99 г (0,082 моль) 2,6-диметилфенола, 14,71 г (0,106 моль) предварительно прокаленного и тщательно измельченного K2CO3, 164 мл N,N-диметилацетамида и 82 мл хлорбензола. Реакционную массу перемешивают в токе аргона при постепенном подъеме температуры масла в бане до 185°С в течение часа. После завершившейся за это время отгонки азеотропной смеси хлорбензол - вода и избытка хлорбензола продолжают перемешивание при кипячении около 16 ч. Затем реакционную массу охлаждают и фильтруют для удаления непрореагировавшего K2CO3 и образовавшегося KF. N,N-Диметилацетамид отгоняют на роторном испарителе, его остатки экстрагируют диэтиловым эфиром. Далее реакционную массу растворяют в 300 мл дистиллированной воды, добавляют активированный уголь и оставляют на час при перемешивании при комнатной температуре. Для удаления угля раствор фильтруют через складчатый фильтр и подкисляют концентрированной соляной кислотой (до рН=1-2). Выпавший продукт отфильтровывают, тщательно промывают водой, сушат при постепенном подъеме температуры от 60 до 120°С в течение 20 ч и перекристаллизовывают из бензола. Получают 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойную кислоту (I) в виде белого твердого вещества (т.пл. 193,0-193,7°С) с выходом 77%.
Вычислено, %: С 76,30; Н 5,20. C22H18O4. Найдено, %: С 76,39; Н 5,14.

1H ЯМР-спектр (d6-ацетон), δ, м.д.: 2,104 (6Н, с, Н21, Н22); 6,822-6,844 (1H, м, Н18); 7,104-7,186 (4Н, м, Н11, Н13, Н17, Н19); 7,410-7,428 (1Н, д, Н4, J=7,3 Гц); 7,635-7,753 (3Н, м, Н3, Н10, Н14); 8,088-8,107 (2Н, м, Н2, Н5).
13С ЯМР-спектр (d6-ацетон), δ, м.д.: 15,435 (С21, С22); 114,26 (С11, С13); 125,69 (С18); 127,53 (С6); 129,19 (С16, С20); 129,31 (С5); 129,41 (С2); 130,09 (С17, С19); 130,84 (С4); 131,54 (С9); 131,69 (С10, С14); 132,36 (С3); 142,62 (С7); 150,51 (С15); 161,40 (С12); 166,29 (С8); 205,35 (С1).
ИК-спектр (KBr): 3436 (сл, νOH), 3065 (сл, νC-H в ароматическом кольце), 2952 (сл, νasCH3), 2853 (сл, νsCH3), 2661, 2549 (сл, колебания ОН-группы), 1688 (оч. с, νCO в карбоксильной группе), 1674 (оч. с, νCO кето-группы), 1600 (оч. с, колебания ароматического кольца), 1586 (с, колебания ароматического кольца), 1241 (оч. с, колебания простой эфирной связи) см-1.
Пример 2. Получение псевдохлорангидрида 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты (V). В колбу, снабженную обратным водяным холодильником, загружают 5,00 г (0,014 моль) 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты (I) и 2,60 мл (0,036 моль) хлористого тионила. Реакционную массу нагревают на масляной бане при 70°С в течение 4 ч, затем отгоняют в вакууме избыток хлористого тионила и получают псевдохлорангидрид V в виде бордовой стеклообразной массы, температура размягчения 146-152°С, практически с количественным выходом.
Вычислено, %: С 72,43; Н 4,66; Cl 9,74. C22H17ClO3. Найдено, %: С 72,39; Н 4,68; Cl 9,66.
ИК-спектр (KBr): 3043 (сл, νC-H в ароматическом кольце), 2952 (сл, νasCH3), 2855 (сл, νsCH3), 1792, 1770 (оч. с, νCO в лактонном цикле, «кристаллическое расщепление»), 1233 (оч. с, колебания простой эфирной связи), 688 (ср, колебания С-Cl) см-1.
Пример 3. Получение полиариленфталида VI. В четырехгорлую колбу, снабженную мешалкой, обратным холодильником, термометром и трубкой для ввода газа, загружают 5,00 г (0,014 моль) псевдохлоргангидрида 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоты, 6,86 мл нитробензола, 0,1 мл (0,78 ммоль) пятихлористой сурьмы и нагревают при перемешивании в токе аргона при 85°С в течение 10 ч. Затем реакционную массу охлаждают и растворяют в хлороформе. Продукт высаждают в метиловый спирт, отфильтровывают, промывают метиловым спиртом и ацетоном и сушат в сушильном шкафу при постепенном подъеме температуры от 60 до 180°С в течение 16 ч. Получают полиариленфталид VI в виде белых волокон с выходом 96%. Приведенная вязкость его раствора в хлороформе ηпр=0,74 дл/г.
Вычислено, %: С 80,49; Н 4,88. С20Н16О3. Найдено, %: С 80,25; Н 4,96.

1Н ЯМР-спектр (CDCl3), δ, м.д.: 2,060 (6Н, с, Н21, Н22); 6,670-6,690 (2Н, м, Н17, Н19); 7,067 (2Н, с, Н11, Н13); 7,164-7,184 (2Н, м, Н10, Н14); 7,258 (1Н, с, Н4); 7,547-7,564 (1H, м, Н2); 7,695-7,712 (1Н, м, Н3); 7,958-7,940 (1H, м, Н5).
13С ЯМР-спектр (CDCl3), δ, м.д.: 16,616 (С21, С22); 91,318 (С1); 114,56 (С11, С13); 124,08 (С2); 125,53 (С6); 126,03 (С4); 127,53 (С16, С20); 129,03 (С10, С14); 129,38 (С5); 131,55 (С17, С19); 133,70 (С18); 134,19 (С3); 137,65 (С9); 150,93 (С15); 152,23 (С7); 157,68 (С12); 169,78 (С8).
ИК-спектр (KBr): 3022 (сл, νC-H в ароматическом кольце), 2955 (сл, νasCH3), 2860 (сл, νsCH3), 1772 (оч. с, νCO в лактонном цикле), 1233 (оч. с, колебания простой эфирной связи) см-1.
Таким образом, получено новое соединение - 2-[4'-(2'',6''-диметилфенокси)бензоил] бензойная кислота - и показана возможность использования его в синтезе фталидного мономера для полиариленфталидов.
Технический результат заявляемого изобретения состоит в создании нового предшественника фталидных мономеров для получения ароматических полимеров с ценными свойствами.
Реферат
Изобретение относится к 2-[4'-(2'',6''-диметилфенокси)бензоил]бензойной кислоте (I), которая может быть использована в качестве полупродукта в синтезе полиариленфталидов c ценными свойствами. Предложен способ получения кислоты I с выходом 77% из 2-(4'-фторбензоил)бензойной кислоты и 2,6-диметилфенола в присутствии KCOпри двухступенчатом нагревании: сначала в смеси N,N-диметилацетамида с хлорбензолом до окончания азеотропной отгонки воды и хлорбензола, затем только в N,N-диметилацетамиде.(I)2 н. и 1 з.п. ф-лы, 3 пр.
Формула


Комментарии