Изобретение относится к усовершенствованному способу получения транс-
этил-1 ,2, 3,4-тетрагидро-6,7-метилен- диокси-5-oKco-l-(3,4,5-триметоксифе-
нил) нафталин-2-карбоксилата, являющегося промежуточным продуктом в
синтезе биологически активного соединения - эпиподофиллотоксина, обладающего
цитотоксической активностью.
СМ
Цель изобретения - повышение выхода целевого продукта и интенсификация процесса.
Точку плавления определяли в аппаратуре Томаса-Хувера- методом замера точки плавления вещества в капилляре
с использованием спектрометра Bruker WM 360 и CDC13. Химические смещения
выражены в f единицах, постоянные JQ связи выражены в Герцах. Резонансные
расщепления спектра обозначали следующим образом: с.-синглет, д. - дублет
, т. - трицлет, к. - квартет, м. с использованием покрытых силикагеле-
вых пластинок (60F-254) и с использованием ультрафиолетовых лучей и/или
паров йода в качестве средств визуализации . Испарительную хроматографию
осуществляли с использованием силика- геля Woelm (32- 63 мкм) и указанных
растворителей. Все испарения раствори телей осуществляли при пониженном дав
лении. Используемый в данном описании термин |:Скеллизольф В|: представляе
собой фракцию нефтяного растворителя и с т.кип. в интервале 60-68 С, состоящег
мультштлет, т.п. - широкий пик, и д.д. 5из н-гексана,и термин простой эфир
дублет дублета. Инфракрасные спектрыозначает простой диэтиловый зфир,есопределяли с помощью спектрофотометрали нет другого пояснения,
модели Бекмана 4240 и были представле- Пример 1. Этил-2-(2,4-метины в обратных сантиметрах. Тонкослой-лендиоксибензоил)-3-(3,4,5-триметонуго
хроматографио (ТСХ) осуществляли 20ксифенил)-циклопроп анкарбоксилат II
В трехгорлую круглодонную однолитровую
колбу, снабженную магнитной мешалкой , капельной воронкой, вводным
патрубком для азота и мембраной, вводят гидрид натрия (8,2 г 0,17 моль,
5-0%-ная дисперсия). Эту дисперсию промывают петролейным эфиром ( мл) и высушивают в азоте. Вводят иодид
триметилсульфоксония (37,7 г 0,17 моль) после чего вводят по каплям обезвоженный
диметилсульфоксид (45 мл) посредством шприца в течение 30 мин. Суспен-
зию перемешивают при комнатной температуре в течение 1,5 ч- и затем в течение
10 мин в условиях непрерывного перемешивания вводят раствор бромида карбэтоксиметилдиметилсулъфония
(41,2 г, 0,18 моль). Молочнообразную белую суспензию затем дополнительно
перемешивают при комнатной температуре в течение 1,5 ч. В виде непрерывного
потока в течение 5 мин пропускают суспензию 3,4,5-триметокси (3У ,4 -мети- лендиоксихалькона Ш) (55,9 г,
0,16 моль) в диметилсульфоксиде (185 мл), и затем данную реакционс использованием покрытых силикагеле- вых пластинок (60F-254) и с использованием
ультрафиолетовых лучей и/или паров йода в качестве средств визуализации . Испарительную хроматографию
осуществляли с использованием силика- геля Woelm (32- 63 мкм) и указанных
растворителей. Все испарения растворителей осуществляли при пониженном давлении
. Используемый в данном описании термин |:Скеллизольф В|: представляет
собой фракцию нефтяного растворителя и с т.кип. в интервале 60-68 С, состоящего
СООС2Н5
5
ную смесь перемешивают при комнатной температуре в течение 17 ч. Эту
реакционную смесь вливают в холодную 0,1 н. соляную кислоту (700 мл) и полученный
смолистый материал отделяют от водного раствора. ТЗодный раствор экстрагируют простым эфиром (диэти-
ловым)( мл) Объединенный экстракт вместе с дополнительным количеством
простого эфира (500 мл) используют для растворения указанного смолистого осадка. Затем эфирный
раствор промывают последовательно водным раствором NaHC03(500 мл,5%) и водой, высушивают (над и
MgSO) и выпаривают, в результате чего получают d изомер целевого соединения
(68,0 г) в виде светло-желтого стекловидного вещества
Спектр 1Н ЯКР данного продукта был идентичен спектру al. -изомера, описанному ранее.
В следующем эксперименте иодид триметилсульфоксония, который использовали
в описанной выше процедуре, в реакционную смесь не вводят, в конечном итоге также получают с/-изомер целевого соединения с высоким выходом . В раствор гидрида натрия (0,67 г
1,4 ммоль) в виде 50%-ной дисперсии, в 10 мл обезвоженного диметилсульфо-
ксида вводят бромид карбэтоксиметил- диметилсульфония (2,98 г 1,2 мМоль),
после чего вводят дополнительно 19 мл диметилсульфоксида. Спустя примерно 75 мин медленно вводят в течение
35 мин раствор,халькона Ш (3,42 г, 1,0 мМолъ) в 21 мл тетрагидрофурана и 4 мл диметилсульфоксида.
Реакционную смесь подвергают обработке таким же образом, как в описанной
выше процедуре, в результате получают о/-изомер целевого соединения с выходом 96%.
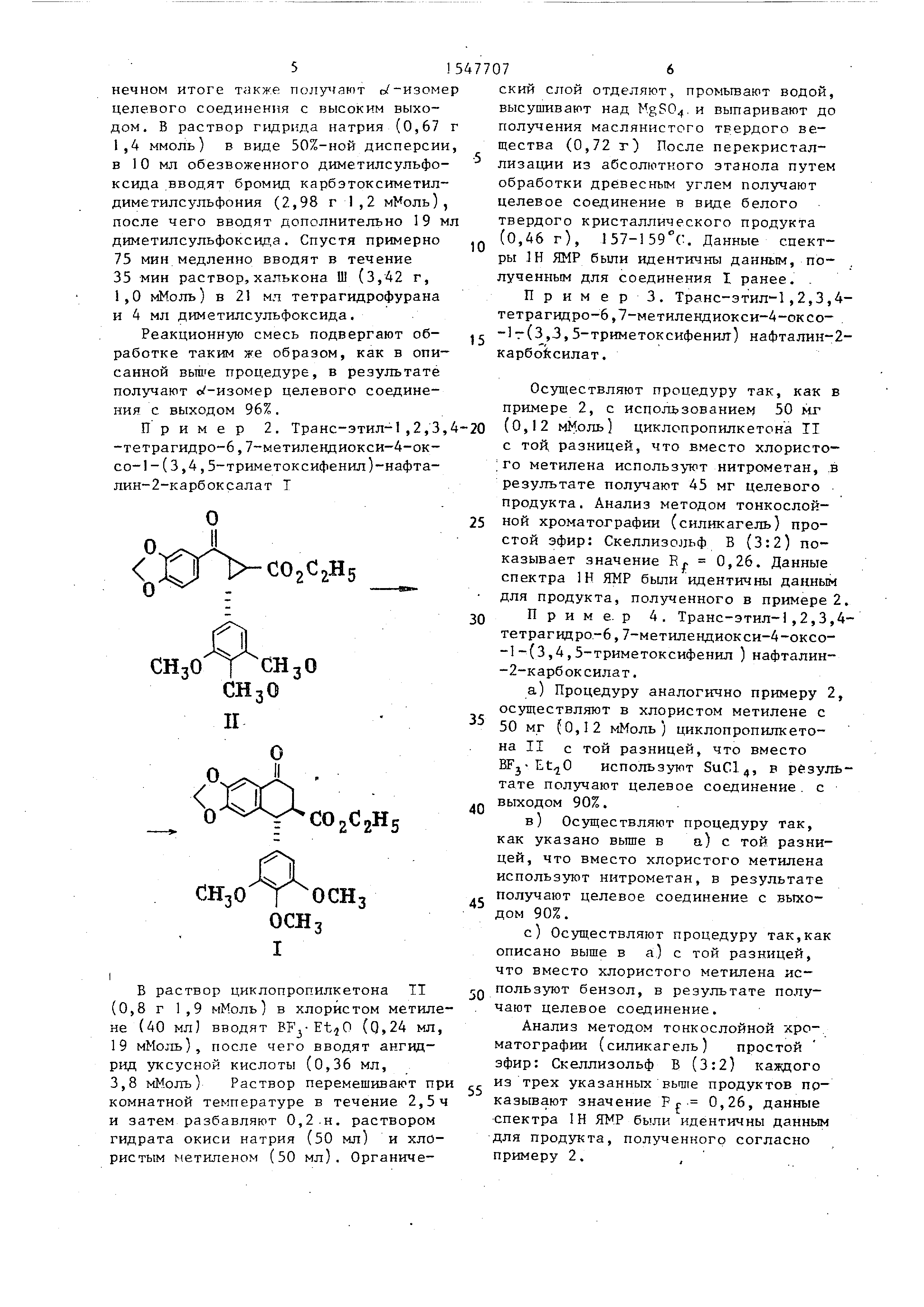
Пример 2. Транс-этил-1,2,3,4 -тетрагидро-6,7-метилендиокси-4-ок-
со-1-(3,4,5-триметоксифенил)-нафта- лин-2-карбоксалат Т
С02С2Н5
С02С2Н5
сн.о
В раствор циклопропилкетона TI (0,8 г 1,9 мМоль) в хлористом метилене (40 мл) вводят BF3-Et O (0,24 мл,
19 мМоль), после чего вводят ангидрид уксусной кислоты (0,36 мл, 3,8 мМолъ) Раствор перемешивают при
комнатной температуре в течение 2,5ч и затем разбавляют 0,2 н. раствором
гидрата окиси натрия (50 мл) и хлористым метиленом (50 мл). Органический слой отделяют, промывают водой, высушивают над MgS04 и выпаривают до
получения маслянистого твердого вещества (0,72 г) После перекристаллизации из абсолютного этанола путем
обработки древесным углем получают целевое соединение в виде белого твердого кристаллического продукта
(0,46 г), 157-159°С. Данные спектры 1Н ЯМР были идентичны данным, полученным для соединения I ранее.
Пример 3. Транс-этил-1,2,3,4- тетрагидро-6,7-метилендиокси-4-оксо-
г -1т(3,3,5-триметоксифения) нафталин-2- карбоксилат.
20
25
30
35
40
45
50
55
Осуществляют проиедуру так, как в примере 2, с использованием 50 мг
(0,12 ) циклопропилкетона II с той, разницей, что вместо хлористого метилена используют нитрометан, в
результате получают 45 мг целевого продукта. Анализ методом тонкослойной
хроматографии (силикагель) простой эфир: Скеллизольф В (3:2) показывает значение R,- 0,26. Данные
спектра 1Н ЯМР были идентичны данным для продукта, полученного в примере 2.
Пример 4. Транс-этил-1,2,3,4- тетрагидро-6,7-метилендиокси-4-оксо-
-1-(3,4,5-триметоксифенил ) нафталин- -2-карбоксилат.
а) Процедуру аналогично примеру 2, осуществляют в хлористом метилене с
50 мг (0,32 мМоль) циклопропилкетона II с той разницей, что вместо
BFj-ЕЦО используют SuCl 4, в результате получают целевое соединение с выходом 90%.
в) Осуществляют процедуру так, как указано выше в а) с той разницей
, что вместо хлористого метилена используют нитрометан, в результате
получают целевое соединение с выходом 90%.
с) Осуществляют процедуру так,как
описано выше в а) с той разницей, что вместо хлористого метилена используют
бензол, в результате получают целевое соединение.
Анализ методом тонкослойной хроматографии (силикагель) простой эфир: Скеллизольф В (3:2) каждого
из трех указанных выше продуктов показывают значение Рг 0,26, данные
спектра IH ЯМР были идентичны данным для продукта, полученного согласно примеру 2.
10
Пример 5. Транс-этил-1,2,3,4-
-тетрагидро-6,7-метилендиокси-4-оксо- -1 -(3,4,5-триметоксифенил)-нафталин- -2-карбоксилат.
Осуществляют процедуру так, как описано в примере 3, с 428 мг
(1,0 мМолъ) циклопропилкетона II и 204 мг (2,0 мМоль) ангидрида уксус-
ной кислоты в 5 мл нит рометана с той разницей, что вместо I эквивалента
BFj-Et 0 используют 0,5 эквивалента BF3-Et20 (71 мг, 0,5 мМоль), в результате получают целевое соединение.
Данные спектра 1Н ЯМР этого продукта j были идентичны данным спектра продукта
, полученного согласно примеру 3.
Пример 6. Транс-этил-1,2,3,4-
-тетрагидро-6,7-метилендиокси-4-ок- со-1-(3,4,5-триметоксифенил)-нафта- 20 лин-2-карбоксилат I.
В раствор циклопропилкетона II (428 мг, 1,0 мМоль) в 5 мл нитрометана
вводят каталитическим активное количество ангидрида уксусной кислоты 25
(10,2 мг, 0,1 мМоль), а затем вводят ВРЙ Et40 (142 мг, J,0 мМоль). Реакционную
смесь перемешивают при комнатной температуре, после чего подвергают жидкостной хроматографии под 30
высоким давлением. Спустя примерно 100 ч реакционную смесь обрабатывают
10 мл 0,2 н. NaOH и разбавляют 5 мл . хлористого метилена. Органическую
фазу отделяют, высушивают и выпарива- 35 ют при пониженном давлении, в результате
получают целевое соединение. Данные спектра IF ЯМР этого продукта были
идентичны данным спектра продукта, полученного согласно примеру 2, за исклк)0
чением того, что в нем обнаружены некоторые примеси.
Предлагаемый способ позволяет повысить выход целевого продукта до 90%
(против 43-57%) и сократить время про-45 цесса с 4-16 дней до 2,5 ч.
Формула изобретения
Способ получения транс-этил-1,2,
3,4-тетрагидро-6,7-метилендиокси-4- -оксо-1-(3,4,5-триметоксифенил) наф- талин-2-карбоксилата формулы
СООС2Н5
снзсгу оенз
осипутем
каталитической циклизаций кислотой Льюиса такой, как или SuCl4, при комнатной температуре
в инертном органическом растворителе циклопропильного соединения формулы
СООС2Н5
Ш30
осиоси
отличающийс я тем, что, с целью повышения выхода целевеЗго продукта
и интенсификации процесса, циклизацию осуществляют в присутствии 0,5-1 эквивалента кислоты Льюиса и
двух эквивалентов ангидрида уксусной кислоты, а в качестве инертного органического
растворителя используют нитрометан, хлористый метилен или бензол.






Комментарии